Синтез 1,3-оксаселеноланнуклеозидов, их активность против вируса иммунодефицита человека и против вируса гепатита-b
Формула / Реферат
1. 1,3-Оксаселеноланнуклеозид формулы
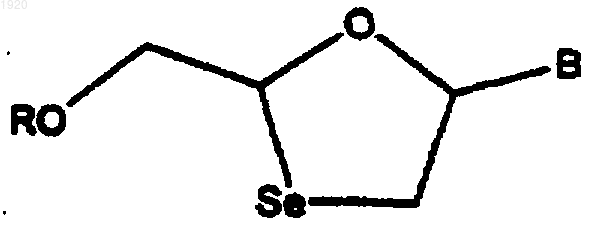
где В обозначает пуриновое или пиримидиновое основание, a R обозначает водород, ацил, моно-, ди- или триэфир фосфорной кислоты стабилизированный фосфат или остаток липида, или их фармацевтически приемлемая соль, где нуклеозиды характеризуются показателем EC50 менее чем 10 микромоль в отношении ВИЧ-инфицированных клеток РВМ.
2. 1,3-Оксаселеноланнуклеозид по п.1, где В обозначает пиримидиновое основание.
3. 1,3-Оксаселеноланнуклеозид по п.1, где В обозначает пуриновое основание.
4. 1,3-Оксаселеноланнуклеозид по пп.2 и 3, где R обозначает водород.
5. 1,3-Оксаселеноланнуклеозид по пп.2 и 3, где R обозначает ацил.
6. 1,3-Оксаселеноланнуклеозид по пп.2 и 3, где R обозначает монофосфат.
7. 1,3-Оксаселеноланнуклеозид по пп.2 и 3, где R обозначает дифосфат.
8. 1,3-Оксаселеноланнуклеозид по пп.2 и 3, где R обозначает трифосфат.
9. 1,3-Оксаселеноланнуклеозид по пп.2 и 3, где R обозначает стабилизированный фосфат.
10. 1,3-Оксаселеноланнуклеозид по пп.2 и 3, где R обозначает остаток липида.
11. 1,3-Оксаселеноланнуклеозид по п.1, где В обозначает цитозин.
12. 1,3-Оксаселеноланнуклеозид по п.1, где В обозначает 5-фторцитозин.
13. 1,3-Оксаселеноланнуклеозид по п.1, где В обозначает гуанин.
14. 1,3-Оксаселеноланнуклеозид по п.1, представляет собой 2-гидрометил-4-(N-5'-цитозин-1'-ил)-1,3-оксаселенолан или его фармацевтически приемлемую соль.
15. 1,3-Оксаселеноланнуклеозид по п.1, представляет собой 2-гидрометил-4-(N-5'-фторцитозин-1'-ил)-1,3-оксаселенолан или его фармацевтически приемлемую соль.
16. 1,3-Оксаселеноланнуклеозид по п.1, представляет собой (-)-b-L-2-гидроксиметил-4-(N-5'-цитозин-1'-ил)-1,3-оксаселенолан в виде выделенного энантиомера или его фармацевтически приемлемую соль.
17. 1,3-Оксаселеноланнуклеозид по п.1, представляет собой (-)-b-L-2-гидроксиметил-4-(N-5'-фторцитозин-1'-ил)-1,3-оксаселенолан в виде выделенного энантиомера или его фармацевтически приемлемую соль.
18. Фармацевтическая композиция для лечения ВИЧ- и ВГБ-инфекций у людей и различных животных, содержащая эффективное количество 1,3-оксаселеноланнуклеозида по п.1 наряду с фармацевтически приемлемым носителем.
19. Фармацевтическая композиция для лечения ВИЧ- и ВГБ-инфекций у людей и различных животных, содержащая эффективное количество 1,3-оксаселеноланнуклеозида по п.2 наряду с фармацевтически приемлемым носителем.
20. Фармацевтическая композиция для лечения ВИЧ- и ВГБ-инфекций у людей и различных животных, содержащая эффективное количество 1,3-оксаселеноланнуклеозида по п.3 наряду с фармацевтически приемлемым носителем.
21. Фармацевтическая композиция для лечения ВИЧ- и ВГБ-инфекций у людей и различных животных, содержащая эффективное количество 1,3-оксаселеноланнуклеозида по любому из пп.4-17 наряду с фармацевтически приемлемым носителем.
22. Способ лечения ВИЧ-инфекции у человека, включающий введение ВИЧ-эффективного количества 1,3-оксаселеноланнуклеозида формулы
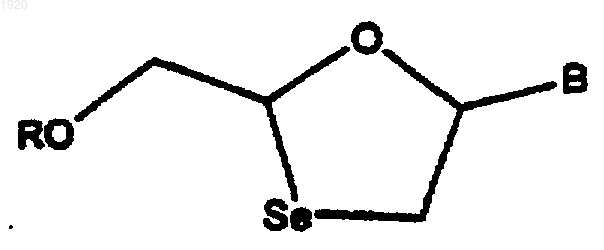
где В обозначает пуриновое или пиримидиновое основание, a R обозначает водород, ацил или эфир фосфорной кислоты или их фармацевтически приемлемую соль, и где нуклеозиды характеризуются показателем EC50 менее чем 10 микромоль в отношении ВИЧ-инфицированных клеток РВМ.
23. Способ лечения ВИЧ-инфекции по п.22, где В обозначает пиримидиновое основание.
24. Способ лечения ВИЧ-инфекции по п.22, где В обозначает пуриновое основание.
25. Способ лечения ВИЧ-инфекции по п.22, где R обозначает водород.
26. Способ лечения ВИЧ-инфекции по п.22, где R обозначает ацил.
27. Способ лечения ВИЧ-инфекции по п.22, где R обозначает монофосфат.
28. Способ лечения ВИЧ-инфекции по п.22, где R обозначает дифосфат.
29. Способ лечения ВИЧ-инфекции по п.22, где R обозначает трифосфат.
30. Способ лечения ВИЧ-инфекции по п.25, где 1,3-оксаселеноланнуклеозид представляет собой 2-гидроксиметил-4-(N-5'-цитозин-1'-ил)-1,3-оксаселенолан или его фармацевтически приемлемую соль.
31. Способ лечения ВИЧ-инфекции по п.26, где 1,3-оксаселеноланнуклеозид представляет собой 2-гидроксиметил-4-(N-5'-фторцитозин-1'-ил)-1,3-оксаселенолан или его фармацевтически приемлемую соль.
32. Способ лечения ВИЧ-инфекции по п.27, где 1,3-оксаселеноланнуклеозид представляет собой (-)-b-L-2-гидроксиметил-4-(N-5'-цитозин-1'-ил)-1,3-оксаселенолан в виде выделенного энантиомера или его фармацевтически приемлемую соль.
33. Способ лечения ВИЧ-инфекции по п.28, где 1,3-оксаселеноланнуклеозид представляет собой (-)-b-L-2-гидроксиметил-4-(N-5'-фторцитозин-1'-ил)-1,3-оксаселенолан в виде выделенного энантиомера или его фармацевтически приемлемую соль.
34. Способ лечения BГБ-инфекции у человека и различных животных, включающий введение ВГБ-эффективного количества 1,3-оксаселеноланнуклеозида формулы
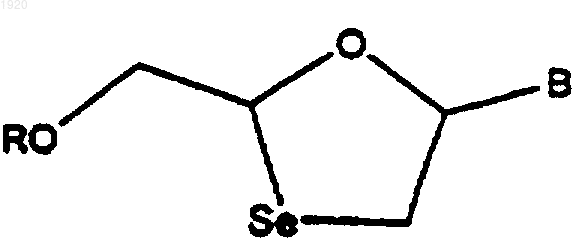
где В обозначает пуриновое или пиримидиновое основание, a R обозначает водород, ацил или эфир фосфорной кислоты, или его фармацевтически приемлемую соль в форме рацемата или выделенного энантиомера.
35. Способ лечения ВГБ-инфекции по п.34, где В обозначает пиримидиновое основание.
36. Способ лечения ВГБ-инфекции по п.34, где В обозначает пуриновое основание.
37. Способ лечения ВГБ-инфекции по п.34, где R обозначает водород.
38. Способ лечения ВГБ-инфекции по п.34, где R обозначает ацил.
39. Способ лечения ВГБ-инфекции по п.34, где R обозначает монофосфат.
40. Способ лечения ВГБ-инфекции по п.34, где R обозначает дифосфат.
41. Способ лечения ВГБ-инфекции по п.34, где R обозначает трифосфат.
42. Способ лечения ВГБ-инфекции по п.34, где 1,3-оксаселеноланнуклеозид представляет собой 2-гидроксиметил-4-(N-5'-цитозин-1'-ил)-1,3-оксаселенолан или его фармацевтически приемлемую соль.
43. Способ лечения ВГБ-инфекции по п.34, где 1,3-оксаселеноланнуклеозид представляет собой 2-гидроксиметил-4-(N-5'-фторцитозин-1'-ил)-1,3-оксаселенолан или его фармацевтически приемлемую соль.
44. Способ лечения ВГБ-инфекции по п.34, где 1,3-оксаселеноланнуклеозид представляет собой (-)-b-L-2-гидроксиметил-4-(N-5'-цитозин-1'-ил)-1,3-оксаселенолан в виде выделенного энантиомера или его фармацевтически приемлемую соль.
45. Способ лечения ВГБ-инфекции по п.34, где 1,3-оксаселеноланнуклеозид представляет собой (-)-b-L-2-гидроксиметил-4-(N-5'-фторцитозин-1'-ил)-1,3-оксаселенолан в виде выделенного энантиомера или его фармацевтически приемлемую соль.
46. Применение 1,3-оксаселеноланнуклеозидов по п.1 и их фармацевтически приемлемых производных и солей для получения лекарственного средства для лечения ВИЧ- или ВГБ-инфекции.
47. Применение 1,3-оксаселеноланнуклеозидов по п.1 и их фармацевтически приемлемых производных и солей для лечения вирусных инфекций путем введения в сочетании или при чередовании с другим антивирусным средством.
Текст
1 Предпосылки изобретения Настоящее изобретение относится к области синтеза нуклеозидов и конкретно направлено на 1,3-оксаселеноланнуклеозиды и их фармацевтическое применение, включающие их композиции и способ приготовления. В 1981 году синдром приобретенного иммунодефицита (СПИД) был определен как заболевание, которое в значительной степени нарушает иммунную систему человека и которое практически без исключений приводит к смерти. В 1983 году была определена этиология СПИДа, в основе которой находится вирус иммунодефицита человека - ВИЧ. В 1985 году было сообщено, что синтетический нуклеозид 3'-азидо-3'-дезокситимидин(AZT) подавляет репликацию вируса иммунодефицита человека. Затем была подтверждена эффективность в отношении ВИЧ ряда других синтетических нуклеозидов, включая 2',3'дидезоксиинозин (DDI), 2',3'-дидезоксицитидин(D4T) и (1S,4R)-4-[2-амино-6-циклопропиламино)-9 Н-пурин-9-ил]-2-циклопентен-1-метанолсукцинат ("159U89"). В целом, после внутриклеточного фосфорилирования с участием клеточных киназ с образованием 5'-трифосфата эти синтетические нуклеозиды инкорпорируются в виде необычных нуклеотидов в растущую цепь вирусной ДНК, обусловливая тем самым терминацию цепи из-за отсутствия 3'-гидроксильной группы. Также они могут либо ингибировать активность вирусной обратной транскриптазы,либо активность ДНКполимеразы. Успешность подавления репликации ВИЧin vivo или in vitro различными синтетическими нуклеозидами позволила ряду исследователей сконструировать и протестировать нуклеозиды,которые замещают гетероатом на атом углерода в положении 3' в составе нуклеозида. Норбек с соавт. (Norbeck et al., 1989, Tetrahedron Lett., 30[46], 6246) представил, что -1-[(2,4)-2(гидроксиметил)-4-диоксоланил]тимин (обозначенный как []-диоксолан-Т) проявляет активность средней степени в отношении ВИЧ(EC50=20 мкМ в клетках АТН 8) и не является токсичным для незараженных контрольных клеток в концентрации 200 мкМ. Заявка на европейский патент 0337713 и патент США 5041449, представленный фирмой BioChemPCT/US 93/08044 представляют очищенные D-1,3-диоксоланилнуклеозиды, предназначенные для лечения ВИЧ-инфекции. РСТ представляет применение очищенных -D-1,3-диоксоланилнуклеозидов для лечения ВИЧ-инфекции.(-)-(2S,4S)-1-(2-гидроксиметил-1,3-диоксолан-4 ил)цитозин применим для лечения опухолей и других случаев аномальной пролиферации клеток. Патент США 5047407 и заявка на европейский патент 0382526 (в обоих случаях выполнены BioChem Inc.) представляют наличие антивирусной активности у ряда рацемических 2-замещенных-5-замещенных 1,3-оксатиолан-нуклеозидов, а также сообщают в конкретном варианте, что рацемическая смесь 2 гидроксиметил-5-(цитозин-1-ил)-1,3-оксатиолана (обозначаемого далее как ВСН-189) обладает примерно равной активностью в отношении ВИЧ, что и AZT, характеризуясь при этом меньшим уровнем токсичности. Патент США 5539116, авторы Liotta et al., представляет (-)энантиомер ВСН-189, известный как 3 ТС, который в настоящее время используется в практике лечения ВИЧ-инфекции у человека в Соединенных Штатах Америки. Также было представлено, что цис-2 гидроксиметил-5-(5-фторцитозин-1-ил)-1,3 оксатиолан ("FTC") обладает активностью против ВИЧ: Schinazi et al., November 1992, "Selective inhibition of human immunodeficiency viruses"Antimicrobial Agents and Chemotherapy", pp. 2423-2431; также см. патент США 5210085,патент США 5204466, заявки на международный патент WO 91/11186 и WO 92/14743. Другой вирус, который вызывает серьезную проблему со здоровьем человека, - это вирус гепатита-В (далее обозначаемый как ВГБ). ВГБ уступает только курительному табаку как причина рака у человека. Механизм, определяющий индукцию рака при заражении ВГБ,пока не выяснен. Предполагается, что он может напрямую опосредовать развитие опухоли или же косвенно вызывать развитие опухоли через механизмы индукции хронических воспалений,цирроза и регенерации клеток, ассоциированных с заражением этим вирусом. После двух-шести месяцев инкубационного периода, в течение которых пораженный субъект не подозревает о заражении, ВГБинфекция может приводить к острому гепатиту и поражению печени, которые обусловливают боли в области брюшной полости, желтуху и повышение уровня некоторых ферментов в крови. ВГБ может обусловливать молниеносное развитие быстро прогрессирующего гепатита,часто фатальную форму заболевания, при которой разрушаются массивные области печени. Обычно от острого гепатита пациентов вылечивают. Однако в некоторых случаях высокие уровни вирусного антигена персистируют в крови в течение протяженного или даже неопределенного периода времени, обусловливая тем самым хроническую инфекцию. Хрониче 3 ские инфекции могут приводить к хроническому персистирующему гепатиту. Наиболее часто пациенты, у которых имеется хроническая персистирующая ВГБ-инфекция, отмечаются в развивающихся странах. По состоянию на середину 1991 года только в Азии насчитывалось 225 миллионов носителей хронической ВГБинфекции, а в мире в целом число носителей оценивалось в 300 миллионов человек. Хронический персистирующий гепатит может обусловливать утомляемость, цирроз печени и гепатоклеточную карциному, являющуюся первичным раком печени. В индустриальных западных странах к группе повышенного риска по ВГБ-инфекции относятся те лица, которые контактируют с ВГБ-носителями или соответствующими пробами крови. Эпидемиология ВГБ в значительной степени сходна с таковой у синдрома приобретенного иммунодефицита, что объясняет, в частности, то, почему ВГБ-инфекция часто встречается у пациентов со СПИДом или СПИД-подобными комплексами. Однако ВГБ более заразен в сравнении с ВИЧ. И FTC, и 3 ТС проявляют активность против ВГБ: см. Furman et al., December 1992, "TheBiol. Chem., 267(20), 13938-13942. Полученная на основе сыворотки крови человека вакцина была создана для иммунизации пациентов против ВГБ. Однако позднее вакцины также были созданы с применением технологий генной инженерии, которые в настоящее время нашли широкое применение. К сожалению, вакцины не в состоянии помочь тем, кто уже инфицирован вирусом ВГБ. Ежедневное введение -интерферона, полученного в виде генно-инженерного белка, является многообещающим, однако такое лечение оказывается успешным только примерно в одном случае из трех. Кроме того, интерферон не может применяться перорально. С учетом того, что 1,3-диоксолан- и 1,3 оксатиоланнуклеозиды обладают перспективной антивирусной и противоопухолевой активностью, представлялось интересным синтезировать класс изостерических соединений - 1,3 оксаселеноланнуклеозидов - с точки зрения поиска нуклеозидов, представляющих биологический интерес. Несмотря на свое структурное сходство с замещенными по 3'-гетероатому нуклеозидами, синтез 1,3-оксаселеноланнуклеозидов был трудным из-за проблем с конструированием оксаселеноланового кольца. Скорее всего, именно этим объясняется то, что, повидимому, об 1,3-оксаселеноланнуклеозидах никогда ранее не сообщалось. 4 В свете того факта, что синдром приобретенного иммунодефицита, СПИД-родственный комплекс и вирусный гепатит В достигли уровня эпидемий во всем мире и обладают трагическим эффектом для зараженного пациента, сохраняется насущная необходимость в разработке новых эффективных лекарственных средств для лечения этих заболеваний. Соответственно, объектом настоящего изобретения является представление способа и композиции для лечения ВИЧ-инфицированных пациентов. Другим объектом настоящего изобретения является представление способа и композиции для лечения пациентов или каких-либо животных, инфицированных ВГБ. Еще одним вариантом настоящего изобретения является представление 1,3-оксаселеноланилнуклеозидов и фармацевтических композиций, включающих 1,3-оксаселеноланилнуклеозиды. Сущность изобретения Представляются способ и композиция для лечения ВИЧ- и ВГБ-инфекций у человека и различных животных, включающие введение эффективного количества 1,3-оксаселеноланнуклеозида или его фармацевтически приемлемой соли, произвольно с фармацевтически приемлемым носителем. В одном из вариантов 1,3-оксаселеноланнуклеозид имеет такую формулу: где В - пуриновое или пиримидиновое основание, a R - водород, ацил или эфиры фосфорной кислоты, включая фосфорные моно-, ди- и триэфиры. В другом варианте 1,3-оксаселеноланилнуклеозид представляется в виде липофильного или гидрофильного пролекарства, что более подробно рассматривается ниже. В другом варианте атом селена в составе молекулы окислен. Предпочтительными 1,3-оксаселеноланилнуклеозидами являются те, которые проявляют активность против ВИЧ или ВГБ в концентрации, которая не превышает 5 мкмоль, а наиболее предпочтительно приблизительно 1 мкмоль или менее в тесте in vitro, таком, которые подробно описаны в настоящей заявке. Для лечения ВИЧ и ВГБ также предпочтительно,чтобы 1,3-оксаселеноланилнуклеозид характеризовался показателем токсичности IC50 в тестеin vitro, таком, которые описаны в данном тексте, на уровне выше 50 мкмоль, а более предпочтительно на уровне приблизительно 100 ммоль или более. 1,3-Оксаселеноланнуклеозид является преимущественно либо -L-нуклеозидом, либо -Dнуклеозидом в виде выделенного энантиомера. В одном из вариантов нуклеозидом являтся -Lили -D-нуклеозид в существенно очищенной форме, т.е. обеспечивается существенное отсут 5 ствие соответствующих -L-или -D-нуклеозидов. Предпочтительными соединениями являются 2-гидроксиметил-4-(N-5'-цитозин-1'-ил)1,3-оксаселенолан и 2-гидроксиметил-4-(N-5'фторцитозин-1'-ил)-1,3-оксаселенолан. Было установлено, что отдельный (-)L-энантиомер этих нуклеозидов оказывается более активным в сравнении с его -D-вариантами. Однако, (+)энантиомеры этих соединений нетоксичны в отношении клеток СЕМ. В другом варианте активное соединение или его производные, или соли могут быть введены в сочетании или в чередовании с другим антивирусным средством, таким как иное антиВИЧ средство или анти-ВГБ средство, в соответствии с описанным в разделе IV. В целом, в ходе альтернационной терапии эффективные дозировки каждого средства вводят серийно, в то время как в комбинирующей терапии эффективные дозировки двух или большего числа средств вводят вместе. Дозировки зависят от уровня поглощения, темпа инактивации и уровня экскреции лекарственного средства в организме, равно как и от других факторов, известных специалистам в данной области техники. Необходимо отметить, что величины дозировок могут также варьироваться в зависимости от тяжести состояния, подвергаемого лечению. Также должно быть понятным, что в отношении конкретного пациента специфические дозировки и рекомендации могут быть скорректированы во времени в соответствии с индивидуальными потребностями и профессиональным уровнем специалиста, проводящего лечение с применением данных композиций. Соединения также могут быть использованы для лечения заболеваний, вызываемых вирусом инфекционной анемии лошадей (EIAV),вирусом иммунодефицита кошачьих и вируса иммунодефицита обезьян (Wang S., MontelaroVet. Immunol. Immunopathol, 35, 155-166). Краткое описание чертежей Фиг. 1 показывает процесс получения 1,3 оксаселеноланилнуклеозида в соответствии с настоящим изобретением, так как это описано в примере 1. Фиг. 2 показывает процесс получения -Dи -L-форм 1,3-оксаселеноланилнуклеозидов в 6 соответствии с настоящим изобретением, как описано в примере 3. Фиг. 3 представляет рентгенографию кристаллической структуры [2-(1'R,2'S,5'R)-метил(5-он-1,3-оксаселенолан)]-L-карбоксилата. Фиг. 4 показывает структуры энантиомеров (+)Se-ddC, (-)Se-ddC, (+)Se-FddC и(-)Se-FddC. Подробное описание изобретения По использованию в данном тексте понятие "выделенный энантиомер" обозначает нуклеозидную композицию, которая включает, по крайней мере приблизительно, 95-100%, а более предпочтительно - свыше 97% отдельного энантиомера данного нуклеозида. Термин "существенно очищенная форма" обозначает нуклеозидную композицию одного энантиомера, которая включает не более чем примерно 5% (весовые проценты) другого энантиомера, более предпочтительно не более примерно 2%, а наиболее предпочтительно менее чем примерно 1% (весовые проценты). Термин "пуриновое или пиримидиновое основание" включает, тем самым не ограничиваясь, N6-алилпурины, N6-ацилпурины, N6 бензилпурин, N6-галопурин, N6-винилпурин, N6 ацетиленпурин, N6-ацилпурин, N6-гидроксиалкилпурин, N6-тиоалкилпурин, N2-алкилпурины, N4-алкилпиримидины, N4-ацилпиримидины,N4-бензилпурин,N4-гилопиримидины,N44 винилпиримидины,N -ацетиленпиримидины,N4-ацилпиримидины,N4-гидроксиалкилпири 6 мидины, N -тиоалкилпиримидины, тимин, цитозин, 6-азапиримидин, включая 6-азацитозин, 2 и (или) 4-меркаптопиримидин, урацил, С 5 алкилпиримидины, С 5-бензилпиримидины, C5 гaлoпиpимидины, C5-винилпиpимидин, С 5 ацетиленпиримидин, С 5-aцилпиpимидин, C5 гидpoкcиaлкилпypин, C5-aмидoпиримидин, С 5C5 цианопиримидин,C5-нитpoпиpимидин,2 2aминoпиримидин, N -алкилпурины, N -aлкил-6 тиoпypины, 5-азацитидинил, 5-азаурацилил,тразолопиридинил, имидазолопиридинил, пирролопиримидинил и пиразолопиримидинил. Активные группы кислорода и азота в основании могут быть защищены, если это является необходимым или желательным. Подходящие защитные группы хорошо известны специалистам в данной области техники: они включают триметилсилил, диметилгексилсилил, t-бутилдиметилсилил и t-бутилдифенилсилил, тритил,алкильные группы, ацильные группы, такие как ацетил и пропионил, метансульфонил и ртолуолсульфонил. Предпочтительными основаниями являются цитозин, 5-фторцитозин, урацил, тимин, аденин, гуанин, ксантин, 2,6 диаминопурин, 6-аминопурин и 6-хлорпурин. По использованию в данном тексте термин"алкил", за исключением специально оговариваемых случаев, обозначает насыщенную прямую, разветвленную или циклическую первич 7 ную, вторичную или третичную цепочку атомов углерода, обычно от C1 до C18 и конкретно включает метил, этил, пропил, изопропил, бутил, изобутил, t-бутил, пентил, циклопентил,изопентил, неопентил, гексил, изогексил, циклогексил, циклогексилметил, 3-метилпентил,2,2-диметилбутил и 2,3-диметилбутил. Произвольно алкильная группа может быть замещена одной или большим числом составляющих, выбираемых из группы, включающей гидроксил,аминогруппу, алкиламин, ариламин, алкокси,арилокси, нитрогруппу, цианогруппу, сульфокислоту, сульфат, фосфокислоту, фосфат или фосфонат, как незащищенную, так и, если необходимо, защищенную в соответствии с хорошо известным в данной области техники, так, как,например, описано у Greene et al., 1991, "Protective Groups in Organic Synthesis", J. WileySons, 2d ed. (включено в виде библиографической ссылки). Термин "низший алкил" по использованию в данном тексте, если это не оговаривается отдельно, обозначает насыщенные прямые или разветвленные углеродные цепи C1-C4. Термин "защищенный" по использованию в данном тексте, если это не оговаривается специально, обозначает группу, присоединенную к атому кислорода, азота или фосфора с целью предотвращения их участия в других реакциях или для иных целей. Значительное число разнообразных защитных групп для атомов кислорода и азота хорошо известно специалистам в данной области техники - органическом синтезе. Термин "арил" по использованию в данном тексте, если это дополнительно не оговаривается, обозначает фенил, бифенил или нафтил, а предпочтительно - фенил. Арильная группа может быть произвольно замещена одной или большим числом составляющих, выбираемых из группы, включающей гидроксил, галоген, алкил, алкенил, алкинил, алкарил, аралкил, аминогруппу, алкиламин, алкокси, арилокси, нитрогруппу, цианогруппу, сульфокислоту, сульфат,фосфокислоту, фосфат или фосфонат, как незащищенную, так и, если необходимо, защищенную в соответствии с хорошо известным в данной области техники, так, как, например, описано у Greene et al., 1991, "Protective Groups in Organic Synthesis", J. WileySons, 2d ed. Термин "алкарил" или "алкиларил" обозначает алкильную группу, включающую арильную составляющую. Термин "аралкил" или "арилалкил" обозначает арильную группу, включающую алкильную составляющую. Термин "галоген" по использованию в данном тексте включает хлор, бром, йод или фтор. Термин "ацил" обозначает составляющую,имеющую формулу -C(O)R', где R' - алкил, арил,алкарил, аралкил, гетероароматическая группа,алкоксиалкил, включая метоксиметил; арилал 001920"отщепляемая группа" обозначает функциональную группу, которая отщепляется от молекулы, к которой она была присоединена при создании подходящих условий. Термин "аминокислота" включает естественно встречающиеся и синтетические аминокислоты и включает, не исчерпываясь этим,аланил, валинил, лейцинил, изолейцинил, пролинил, фенилаланинил, триптофанил, метионинил, глицинил, серинил, треонинил, цистеинил,тирозинил, аспарагинил, глутаминил, аспартоил, глутароил, лизинил, аргининил и гистидинил. Термин "гетероарил" или "гетероароматическая группа" по использованию в данном тексте обозначает ароматическую составляющую,включая, по крайней мере, один атом серы, кислорода или азота в составе ароматического кольца. Не ограничивающими примерами к ним относятся фурил, пиридил, пиримидил, тиенил,изотиазолил, имидазолил, тетразолил, пиразинил, бензофуранил, бензотиофенил, хинолил,изохинолил, бензотиенил, изобензофурил, пиразолил, индолил, изоиндолил, бензимидазолил,пуринил, карбазолил, оксазолил, тиазолил, изотиазолил, 1,2,4-тиадиазолил, изооксазолил, пирролил, хиназолинил, пиридазинил, пиразинил,циннолинил, фталазинил, хиноксалинил, ксантинил, гипоксантинил и птеридинил. Функциональные группы кислорода и азота в составе гетероциклического основания могут быть защищены в случае, если это является необходимым или желательным. Подходящие защитные группы хорошо известны специалистам в данной области техники и включают триметилсилил, диметилгексилсилил, t-бутилдиметилсилил и t-бутилдифенилсилил, тритил или замещенный тритил, алкильные группы, ацильные группы, такие как ацетил и пропионил, метансульфонил и р-толуолсульфонил. Термин "липофильное пролекарство" обозначает 1,3-оксаселеноланилнуклеозид, который включает ковалентно присоединенную составляющую, которая может быть отщеплена по 5'гидроксильному положению, в результате чего нуклеозид становится более липофильным по сравнению с исходным нуклеозидом, имеющим 5'-гидроксильную группу. Термин "гидрофильное пролекарство" обозначает 1,3-оксаселеноланилнуклеозид, который включает ковалентно присоединенную составляющую по 5'-гидроксильному положению, в результате чего нуклеозид становится более гидрофильным по сравнению с исходным нуклеозидом, имеющим 5'-гидроксильную группу. 9 Настоящее изобретение в соответствии с описанным представляет способ и композицию для лечения заболеваний человека и различных животных, вызываемых ВИЧ- и ВГБинфекциями и другими болезнетворными вирусами, воспроизводящимися по тому же типу,включающий введение эффективного количества 1,3-оксаселеноланилнуклеозида, его фармацевтически приемлемого производного, включая 1,3-оксаселеноланилнуклеозид с 5'-отщепляемой группой, включая ацилированное и фосфорилированное производное или его фармацевтически приемлемую соль, произвольно в составе фармацевтически приемлемого носителя. Соединения по настоящему изобретению либо сами проявляют антивирусную активность,такую как активность против ВИЧ-1, против ВИЧ-2, против ВГБ или против вируса иммунодефицита обезьян (ВИО), либо могут метаболизироваться в соединение, которое проявит такую антивирусную активность. Представляемые соединения или их фармацевтически приемлемые производные, или соли, или фармацевтически приемлемые препараты, включающие эти соединения, применимы для профилактики и лечения заболеваний, вызываемых ВИЧ-инфекцией, и других родственных состояний, таких как СПИД-подобный комплекс (ARC), персистентная генерализованная лимфаденопатия (PGL), СПИД-связанное неврологическое состояние, позитивные по антителам к ВИЧ и ВИЧ-позитивные состояния,саркома Калоши, пурпурная тромбоцитопения и условно-патогенные инфекции. Кроме того,данные соединения или препараты могут быть применены профилактически с целью предотвращения или замедления развития клинических симптомов у пациентов, у которых отмечаются антитела к ВИЧ или они позитивны по присутствию антигена ВИЧ, или у тех, кто имел контакт с ВИЧ. Данное соединение или его фармацевтически приемлемое производное, или соль, или фармацевтически приемлемые препараты,включающие соединение или производные, или соли, также применимы для предотвращения и лечения заболеваний, обусловливаемых ВГБинфекцией, и других родственных состояний,таких как позитивность по антителам к ВГБ и позитивность по ВГБ, обусловливаемое ВГБ хроническое воспаление печени, цирроз, острый гепатит, фульминантный гепатит, хронический персистентный гепатит и утомляемость. Эти соединения или препараты также могут быть использованы профилактически с целью предотвращения или замедления развития клинических симптомов у пациентов, у которых отмечаются антитела к ВГБ или они позитивны по присутствию антигена ВГБ, или у тех, кто имел контакт с ВГБ. Соединение может быть конвертировано в фармацевтически приемлемый эфир путем ре 001920 10 акции с подходящим этерифицирующим агентом, например, галогенангидридами или ангидридами. Соединение или его фармацевтически приемлемое производное могут быть конвертированы в фармацевтически приемлемую соль стандартными путями, например, путем обработки подходящей щелочью. Эфир или соль данного соединения могут быть конвертированы в исходное соединение, например, путем гидролиза. Суммируя сказанное, настоящее изобретение включает следующие элементы:(а) 1,3-оксаселеноланнуклеозиды, определенные выше, и их фармацевтически приемлемые производные и соли;(b) 1,3-оксаселеноланнуклеозиды и их фармацевтически приемлемые производные и соли для применения в медицинской практике,например, для лечения или профилактики заболеваний, вызываемых ВИЧ- и ВГБ-инфекциями;(c) применение 1,3-оксаселеноланнуклеозидов и фармацевтически приемлемых производных и солей в производстве медикаментов,предназначенных для лечения заболеваний, вызываемых ВИЧ- и ВГБ-инфекциями;(d) фармацевтические препараты, включающие 1,3-оксаселеноланнуклеозиды или их фармацевтически приемлемые производное или соль вместе с фармацевтически приемлемым носителем или растворителем и(e) применение 1,3-оксаселеноланилнуклеозидов для лечения вирусных инфекций путем введения в сочетании или чередовании с другим антивирусным агентом.I. Активное соединение и его физиологически приемлемые производные и соли. Активными соединениями, представляемыми настоящим изобретением, являются 1,3 оксаселеноланнуклеозиды, находящиеся в форме рацемата или отдельных энантиомеров. Активное соединение может быть введено в виде любого производного, которое по введению реципиенту способно прямо или косвенно обеспечивать появление исходного вещества или же обладает его активностью. Не служащими ограничением примерами являются фармацевтически приемлемые соли (также обозначаемые как "физиологически приемлемые соли") и 5'- и N4-пиримидин- или N6-пурин- ацетилированные или алкилированные производные активного соединения (также обозначаемые как"физиологически активные производные"). В одном из вариантов ацильная группа - это эфир карбоновой кислоты, в котором некарбонильная составляющая эфирной группы выбирается из группы, включающей прямой, разветвленный или циклический алкил или низший алкил, алкоксиалкил, включая метоксиметил, аралкил,включая бензил, арилоксиалкил, такой как феноксиметил, арил, включая фенил, произвольно замещенный галогеном, С 1-С 4-алкилом или С 1 С 4-алкоксигруппой, сульфонатный эфир, такой 11 как алкил- или аралкилсульфонил, включая метансульфонил, фосфат, включая, но тем самым не ограничиваясь, моно-, ди- или трифосфат,тритил или монометокситритил, замещенный бензил, триалкилсилил (например, диметил-5 бутилсилил) или дифенилметилсилил. Арильные группы эфиров произвольно могут включать фенильную группу. Модификации активного соединения и особенно по N4-пиримидинилу или N6-пурину и 5'-O-положениям могут влиять на биологическую доступность и скорость метаболизма активного соединения, что тем самым дает возможность контролировать доставку организму активного соединения. Кроме того, модификации могут влиять на антивирусную активность соединения, в ряде случаев повышая эту активность по сравнению с исходным соединением. Этот эффект может быть легко протестирован путем получения производного и анализа его антивирусной активности в соответствии с описанными в данном тексте методами или другими методами, известными в данной области техники. Нуклеотидные пролекарства Любой из описанных в данном тексте нуклеотидов может быть введен в качестве нуклеотидного пролекарства с целью повышения активности, биологической доступности, стабильности или какого-либо иного изменения свойств конкретного нуклеозида. Известен ряд лигандов нуклеотидных пролекарств. В целом, алкилирование, ацилирование или иные липофильные модификации моно-, ди- или трифосфата в составе нуклеозида обусловливают повышение стабильности нуклеотида. Примерами замещающих групп, которые могут заменять один или большее число атомов водорода в фосфатной составляющей, являются алкил, арил, стероиды, углеводы, включая сахара, 1,2 диацилглицерин и спирты. Многие из них описаны: R. JonesN. Bischofberger, 1995, AntiviralRes., 27, 1-17. Любые из них могут быть использованы в сочетании с представляемыми нуклеозидами с целью достижения желаемого эффекта. В одном из вариантов 1,3-оксаселеноланилнуклеозид представляется в виде 5'-гидроксильного липофильного пролекарства. Не служащими ограничением примерами патентов США, которые представляют подходящие липофильные замещающие группы, которые могут быть ковалентно встроены в состав нуклеозида,предпочтительно по положению 5'-ОН в составе этого нуклеозида, или липофильные препараты,являются патенты США 5149794 (22 сентября 1992 г.:Yatvin et al.), 5194654 (16 марта 1993 г.: Hostetler et al.), 5223263 (29 июня 1993 г.: Hostetler et al.), 5256641 (26 октября 1993 г.: 12 5543391 (6 августа 1996 г.: Yatvin et al.) и 5554728 (10 сентября 1996 г.: Basava et al.): все они включены в данный текст в виде библиографических ссылок. Зарубежные патентные заявки, в которых представляются липофильные замещающие группы, которые могут быть присоединены к 1,3-оксаселеноланилнуклеозидам по настоящему изобретению, или липофильные препараты,включают WO 89/02733, WO 90/00555, WO 91/16920, WO 91/18914, WO 93/00910, WO 94/26273, WO 96/15132, европейские патенты 0350287 и 93917054.4 и WO 91/19721. Дополнительными, не служащими ограничением примерами производных 1,3-оксаселеноланилнуклеозидов являются те, которые содержат замещающие группы в соответствии с нижеследующими публикациями. Эти измененные 1,3-оксаселеноланилнуклеозиды могут быть использованы для анализа в соответствии с описанным здесь или другими методами антивирусной активности, включая активность против ВИЧ или ВГБ. Но D.H.W., 1973, "Distribution oftheir antileukemic activities", Chem. Pharm. Bull.,36, 209-217. Одной из предпочтительных фосфатных групп в пролекарствах является S-aцилS-тиoэтилoвaя группа, также обозначаемая какII. Получение активных соединений. Получение 1,3-оксаселеноланилнуклеозидов до настоящего времени не удавалось из-за трудностей, обусловливаемых конструированием 1,3-оксаселеноланового кольца. Процесс получения такого кольца представляется в настоящем изобретении. Один из вариантов этого процесса проиллюстрирован на фиг. 1. Также представляется процесс получения выделенных(т.е. 2R,5S) нуклеозидов. Один из примеров такого процесса проиллюстрирован на фиг. 2. На фиг. 1 показана схема нумерации соединений,применяемая в примерах. Пример 1. Получение 1,3-оксаселеноланового кольца. Селеноцианат был получен по методу Кирби. На первом этапе проводили реакцию этилбромацетата (BrCH2CO2Et) с селенилацетатом калия в спирте с образованием селеноцианата 2. С целью конструирования лактона 5 изначально была предпринята попытка восстановить селеноцианат 2 с использованием NaBH4 и гидролизовать полученный в результате эфир водным раствором едкого натра с образованием селенолуксусной кислоты, которая может быть использована для конструирования системы 17 оксаселеноланового кольца 5. Однако селенолуксусная кислота разлагается в ходе подкисления соляной кислотой при рН=2. Было сообщено о том, что селенолы могут быть легко окислены кислородом воздуха с образованием стабильных димеров, которые можно снова восстановить в селенолы с помощью Н 3 РО 2. Было установлено, что восстановление бис(селеноуксусной кислоты) в селенол, равно как и циклизация могут иметь место в одноэтапной реакции без образования промежуточных соединений. Соответственно, димер 3 был получен с выходом на уровне 81% путем нагревания 1 с обратным холодильником с KSeCN в этиловом спирте в течение 1 часа с последующим восстановлением NaBH4 при 0 С в течение 20-30 мин. Проводя сравнение с недавно опубликованными данными по процедуре получения диселенидов,данный метод имеет преимущества, связанные с более мягкими условиями реакции, более высоким выходом и большей простотой работы. Лактон 5 был затем получен с 33%-ным выходом путем гидролиза 3 с обратным холодильником с водным раствором уксусной кислоты(50%) в течение 24 ч с последующим восстановлением селенолуксусной кислоты с помощью Н 3 РО 2, которую конденсировали in situ с 2-бензоилоксицетальдегидом в присутствии Н 3 РО 2 в атмосфере азота. В связи с необходимостью воcстановления лактона 5 было установлено,что DIBAL-H может избирательно восстанавливать лактон по отношению к эфиру в ТГФ, в то время как в толуоле такая избирательность не проявляется. Соответственно, ацетат сахара 7 был получен восстановлением 5 с помощьюDIBAL-H в ТГФ с последующим ацетилированием in situ с помощью уксусного ангидрида. Конденсирование ацетата 7 без этапа очистки с силилированными основаниями в присутствии хлорида олова или TMSOTf позволило получить неразделимую смесь - и -изомеров 8 а и 8b. Удаление защитной бензоильной группы из состава 8 а и 8b метиламином или аммиаком в метаноле приводит к получению конечных нуклеозидов в виде /-смеси. -Цитозин был получен путем повторяющейся рекристаллизации /-смеси из MeOH/Et2O и затем метанола, в то время как -цитозин 9 а был получен с помощью ВЭЖХ-разделения материнского раствора (C18-колонка, 20%-ный метанол в воде). Нуклеозиды - и -5-фтор-цитозина были получены путем хроматографического разделения/-смеси в силикагеле. Структура синтезированных селеноланнуклеозидов была подтверждена с применением элементного анализа, 1 Н и 13C-NMR (ЯМР - ядерно-магнитного резонанса). Стереохимический анализ был осуществлен на основании экспериментов 2D-NOESY, в которых была выявлена корреляция между 2'-Н и 5'Н -изомера 9b, в то время как у -изомера 10b такая корреляция отсутствовала. Также стерео 001920 18 химические оценки были подтверждены на основании сильнопольного химического сдвига (в ЯМР) 2'-Н в составе 9 а и 9b в сравнении с таковыми у 10 а и 10b вследствие дезэкранирования гетероциклическими основаниями. Стереохимия Благодаря хиральности атомов углерода 1' и 4' в составе 1,3-оксаселеноланиловой составляющей нуклеозида, их неводородные замещающие группы (соответственно пуриновые/пиримидиновые основания и группыCHOR) могут иметь либо цис-положение (с той же стороны), либо транс-положение (по другую сторону) по отношению к кольцу сахара. Таким образом, четыре оптических изомера представлены следующими конфигурациями (принимая ориентацию сахарной составляющей в горизонтальной плоскости с расположением атома кислорода позади ее): "цис" (обе группы находятся"сверху", что соответствует конфигурации естественно встречающихся нуклеозидов), "цис"(обе группы расположены "снизу": такая конфигурация является "неестественной"), "транс"(замещающая группа С 2' находится "снизу", а замещающая группа С 4' - "сверху"). "Dнуклеозиды" - это цис-нуклеозиды в их естественной конфигурации, а "L-нуклеозиды" - это цис-нуклеозиды в их "неестественной" конфигурации. Энантиомеры 1,3-оксаселеноланилнуклеозида были получены двумя путями: разделение с помощью хиральной (стереоселективной) хроматографии нуклеозида в соответствии с описанным в примере 2 и путем фракционированной кристаллизации L-ментоловых диастереомеров 1,3-оксаселенолана с последующей конденсацией растворенного 1,3-оксаселеноланилнуклеозида с желательным основанием в присутствии кислоты Льюиса, которая не способна рацемизовать оксаселенолановое кольцо. Пример 2. Разделение -D- и -Lэнантиомеров 2-гидроксиметил-4-(N-5'-цитозин 1'-ил)-1,3-оксаселенолана и 2-гидроксиметил-4(N-5'-фторцитозин-1'-ил)-1,3-оксаселенолана с помощью хиральной хроматографии. 2-гидроксиметил-4-(N-5'-цитозин-1'-ил)1,3-оксаселенолан и 2-гидроксиметил-4-(N-5'фторцитозин-1'-ил)-1,3-оксаселенолан разделяли с помощью хиральной хроматографии. Соединение в форме рацемата ( 2 мг) растворили в минимальном количестве ( 400 мкл) метанола (ВЭЖХ-чистоты). Для разделения были использованы следующие условия: водная ВЭЖХсистема; колонка - Chiralpak AS 4,6 х 250 мм; подвижная фаза - 2-пропанол; скорость потока 0,80 мл/мин; детектор - УФ-260 нм; барботажный газ - гелий; скорость барботажа - 25 мл/мин на сольвентную емкость; инъецируемое количество 20 мкл раствора за один раз; время удер 19 живания - 5,50 минут для (-)-(2S,5R)L-2',3'дидезокси-3'-селеноцитидина; 6,92 мин для (+)(2R,5S)D-2',3'-дидезокси-3'-селеноцитидина; 5,97 минут для (-)-(2S,5R)L-2',3'-дидезокси-5 фтор-3'-селеноцитидина; 9,62 минут для (+)(2R,5S)D-2',3'-дидезокси-5-фтор-3'-селеноцитидина. Оптическая чистота разделенных соединений превышала 95%. Пример 3. Разделение -D- и -Lэнантиомеров 1,3-оксаселеноланиловых промежуточных продуктов конверсии диастереомеров с последующим разделением диастереомеров с помощью фракционированной кристаллизации.(-)-L-Ментолкарбоксиаль. К смеси (-)-L-ментола (30 г, 0,2 моль) и глиоксиловой кислоты (36,8 г, 0,4 моль) в толуоле (1 л) добавляли р-ТsОН (5 г) и реакционную смесь перемешивали при 100 С в течение 3 ч. По окончании реакции р-ТsОН нейтрализовали Еt3N и выпаривали досуха. Остаток растворили с хлороформом (500 мл), промывали водой(3 раза по 500 мл), собирали органический слой,высушивали над Na2SO4 и выпаривали. Масляную фракцию кристаллизовали из петролейного эфира с получением (-)-L-ментолкарбоксиаля в виде белых кристаллов - 20 г (выход 50%): точка плавления - 82 С; 1H-ЯМР (хлороформ)(м.д.) 9,40 (с, 1 Н,СНО), 4,78 (дт, J=4,45, 11 Гц, 1 Н, 1-Н) , 0,752,03 (ср., 19 Н), 13 С-ЯМР (хлороформ)(м.д.) 184,41, 170,22, 87,13, 46,79, 40,40, 34,00, 31,42,26,11, 23,28, 21,94, 20,68, 16,15; аналитический расчет для С 12 Н 20 О 3: С - 67,89; Н - 9,50; найдено: С - 67,65; Н -9,67. Мол. масса: т/е 212,3 (М+).(SеСН 2 СООН)2 (4,15 г, 15 ммоль) и реакционную смесь аккуратно нагревали до 100 С в атмосфере аргона при перемешивании. В течение одного часа по каплям добавляли фосфорноватистую кислоту (50%-ный водный раствор, 2,7 мл). Затем реакционную смесь подвергали нагреванию с обратным холодильником еще в течение 1 ч при мощном перемешивании в атмосфере аргона. Реакционную смесь выпаривали до 20 мл, растворили в EtOAc (250 мл) и промывали водой (трижды по 500 мл). Отбирали органический слой, высушивали над Na2SO4 и выпаривали. Остаток очищали хроматографически на силикагелевых колонках с использованием смеси EtOAc/Hex (1:10, объемное соотношение) в качестве элюента с получением 11 в качестве твердого вещества - 3,9 г (77,6%). В результате кристаллизации реакционной смеси из гексана при комнатной температуре позволило получить 11 соединение в виде бесцветных игольчатых кристаллов: точка плавления 106,5 С;J=21,17 Гц, 1 Н, 4'-На), 0,75-2,03 (ср., 19 Н); 13 С ЯМР (хлороформ)(м.д.) 173,97,168,67, 76,88, 63,84, 47,07, 40,46, 34,02, 31,38,26,07, 23,23, 22,65, 21,93, 20,71, 16,11. Аналитический расчет для C14H22O4Se: С 50,45; Н 6,65; найдено: С 50,65; Н 6,62; Мол. масса: m/e 333 (М+). Материнский кристаллизующий раствор приJ=19,35 Гц, 1 Н, 4'-Нa), 0,75-2,03 (ср., 19 Н); 13 С ЯМР (хлороформ)(м.д.) 173,98,168,63, 76,15, 63,76, 46,95, 39,88, 34,01, 31,32,26,22, 23,24, 22,98, 21,94, 20,74, 16,14; аналитический расчет для C14H22O4Se: С -50,45; Н - 6,65; найдено: С - 50,47; Н - 6,63; Мол. масса: m/e 333(М+). 1L-(2'-Гидроксиметил-1',3'-оксаселенолан-5'-ил)-5-фторцитозин 15 и 1L-(2'-гидроксиметил-1',3'-оксаселенолан-5'-ил)-5-фторцитозин 16. К раствору три-трет-бутоксиалюмогидрида лития (6 ммоль, 6 мл 1 М раствора в ТГФ) раствор лактона 11 (1 г, 3,33 ммоль) в 5 мл ТГФ добавляли по каплям при 10 С в течение одного часа при перемешивании в атмосфере аргона. Затем медленно добавляли уксусный ангидрид(2 г, 20 ммоль) при перемешивании при -5-0 С. Реакционную смесь дополнительно перемешивали в течение одного часа, растворили в EtOAc(100 мл), промывали водой (3 х 100 мл), высушивали над Na2SO4 и выпаривали досуха с получением неочищенного 5'-ацетата 13. Ацетат сахара 13 растворили в CH2Cl2 (5 мл) и медленно добавляли к сиалилированному 5-фторцитозину,полученному путем перемешивания смеси 5 фторцитозина (0,34 г, 2,63 ммоль), 2,4,6 коллидина (0,8 мл, 6,61 ммоль) и третбутилдиметилсилилтрифторметансульфоната(1,32 г, 5,08 ммоль) в течение одного часа в атмосфере аргона. К полученной в результате смеси добавляли йодтриметилсилан (0,35 г, 1,75 ммоль), перемешивали при комнатной температуре в течение 18 ч, растворили в хлороформеNа 2SO4 и выпаривали досуха. Полученный остаток очищали с помощью тонкослойной хроматографии на силикагеле с использованием хлороформа в качестве элюента с получением неочищенного твердого вещества 13 (0,15 г, выход 11,2%). 1(ср, 1 Н, 5'-Н), 6,14 (ср., 1 Н, 2'-Н), 4,79 (ср., 1 Н,1-Н), 3,66 (ср., 2 Н, 6'-Наb). Раствор вещества 14 (0,15 г, 0,33 ммоль) в ТГФ (10 мл) при комнатной температуре выдерживали в атмосфере аргона в течение одного часа. Реакционную смесь перемешивали дополнительно в течение 1 ч, добавляли МеОН (5 мл) и полученную в результате смесь направляли в короткую колонку с силикагелем. Колонку элюировали смесью EtOAc/Hex/MeOH (1:1:1; объемное соотношение, 100 мл). Элюент упаривали досуха и полученное твердое вещество очищали на силикагеле с использованием смеси хлороформа/этанола (20:1; объемное соотношение) в качестве элюента с получением смеси L-15 и -L-нуклеозидов 16 в виде белого твердого вещества - 0,033 г (выход 34%). Смесь повторно разделяли на колонке с силикагелем, с использованием для элюции смеси четырех растворителей EtOAc/Hex/CHCl3/EtOH (5:5:2:1; объемное соотношение). 1L-(2'-Гидроксиметил-1',3'-оксаселенолан-5'-ил)-5-фторцитозин 15. Белое твердое вещество (0,01 г, выход 10,2%); точка плавления - 186-189 С (из метанола); []25D=-55,69 (конц. 0,35 метанол); УФH ЯМР (ДМСО-d6)(м.д.) 8,07 (д, J=7,1 Гц, 1 Н, 6-Н), 7,92, 7,67 (2 х шир. с, 2 Н, NH2, D2O,обмениваемые), 6,06 (т, J=2,96 Гц, 1-Н, 5'-Н),5,42 (т, J=4,82 Гц, 1 Н, 2'-Н), 5,34 (т, J=5,68 Гц,1 Н, ОН, D2O, обмениваемый), 3,81 (ср., 1 Н, 6'На), 3,68 (ср., 1 Н, 6'-Нb), 3,39 (дд, J=4,84 Гц, 1 Н,4'-Нb), 3,08 (дд, J=8,11 Гц, 1 Н, 4'-На); 13 С ЯМР (ДМСО-d6)(м.д.) 157,7 (С=0),153,3 (4-С), 137,6 (6-С), 135,2 (5-С), 88,3 (5'-С),78,2 (2'-С), 64,0 (6'-С), 28,9 (4'-С). Аналитический расчет для С 8 Н 10 О 3N3FSе: С 32,67; Н 3,43; N 14,29; найдено: С 32,62; Н 3,51; N 14,41. Мол. масса: m/е 295 (М+). 1L-(2'-Гидроксиметил-1',3'-оксаселенолан-5'-ил)-5-фторцитозин 16. Белое твердое вещество (0,013 г, выход 13,2%); точка плавления - 193-195 С (из метанола); []25D=+84,20 (конц. 0,26, метанол); УФ 22 С ЯМР (ДМСО-d6)(м.д.) 157,8 (С=0),153,2 (4-С), 137,3 (6-С), 134,9 (5-С), 88,6 (5'-С),80,9 (2'-С), 65,5 (6'-С), 29,4 (4'-С). Аналитический расчет для C8H10O3N3FSe: С 32,67; Н 3,43; N 14,29; найдено: С 32,59; Н 3,49; N 14,20. Мол. масса: m/е 295 (М+). Синтез нуклеозидов 8 и 9 проводится тем же путем из лактона 3 (1 г, 3,33 ммоль) с получением 1D-(2'-гидроксиметил-1',3'-оксаселенолан-5'-ил)-5-фторцитозин 8. Белое твердое вещество (0,007 г, выход 8,5%); точка плавления(ДMCO-d6)(м.д.) 157,7 (С=0), 153,3 (4-С),137,6 (6-С), 135,2 (5-С), 88,3 (5'-С), 78,2 (2'-С),64,0 (6'-С), 28,9 (4'-С). Аналитический расчет для С 8 Н 10 О 3N3FSе: С 32,67; Н 3,43; N 14,29; найдено: С 32,57; Н 3,39; N 14,35. Мол. масса: m/е 295 (М+). 1D-(2'-Гидроксиметил-1',3'-оксаселенолан-5'-ил)-5-фторцитозин 9. Белое твердое вещество (0,01 г, выход 10%); точка плавления - 193-195 С (из метанола); []25 =-85,49 (конц. 0,31, метанол); УФ (Н 2O): mах 279,5 нм ( 7644, рН=7),287,5 нм ( 9067, рН=2); 281,0 нм ( 6983,рН=11). 1H ЯМР (ДМСО-d6)(м.д.) 7,91 (д, J=7,1 Гц, 1 Н, 6-Н), 7,88, 7,63 (2 х шир. с, SH, NH2, D2O,обмениваемые), 6,35 (т, J=4,95 Гц, 1 Н, 5'-Н),5,63 (дд, J=4,83 Гц, 1 Н, 2'-Н), 5,28 (т, J=5,67 Гц,1 Н, ОН, D2O, обмениваемый), 3,70 (ср., 1 Н, 6'На); 13 С ЯМР (ДМСО-d6)(м.д.) 157,8 (С=0),153,2 (4-С), 137,3 (6-С), 134,9 (5-С), 88,6 (5'-С),80,9 (2'-С), 65,5 (6'-С), 29,4 (4'-С). Аналитический расчет для C8H10O3N3FSe: С 32,67; Н 3,43; N 14,29; найдено: С 32,67; Н 3,48; N 14,47. Мол. масса: m/е 295 (М+). Таблица 1 представляет данные по разделению (+)Se-FddC, (-)Se-FddC, (+)SeFddC, (-)Se-FddC и (-)Se-ddC и проводит сравнение времени удерживания и длины волн поглощения этих соединений и (-)FТС и (+)-FTC. 13 Таблица 1. Результаты разделения Время удерживания Длина волны поглощения,(мин) нм 4,8 247,3; 285,1 7,7 247,3; 285,1 4,8 247,3; 285,1 6,6 247,3; 285,1 4,7 242,6; 285,1 6,9 242,6; 285,1 9,5 242,6; 270,9 11,9 242,6; 270,9 н/о 242,6; 270,9 н/о 242,6; 270,9 Таблица 2 представляет индексы разрешения и разделения соединений в хроматографической колонке ChiralPak AS. Индекс разделения определен как время удержания второго элюированного изомера за вычетом латентного времени в расчете на разницу между временем удержания первого элюированного изомера и латентным временем. Индекс разрешения определен как удвоенная разница времени удержания изомеров (+) и (-) в расчете на ширину бэнда в двух пиках. Таблица 2. Сравнение разделений на ChiralPak AS Условия проведения хроматографии: подвижная фаза - 2-пропанол: вводили 100 мкт в 10 мкл метанола; УФ-выявление при 254 нм; скорость потока - в мл/минa Индекс разделения = (время удержания второго элюированного изомера - латентное время)/(время удержания первого элюированного изомера - латентное время).b Индекс разрешения = 2 х [разница времени удержания изомеров (+) и (-)]/(ширина бэнда в двух пиках). Таблица 3 показывает влияние различных соотношений растворителей и скорости потока на хиральные пары в рацематах -Se-ddC. Соединение Таблица 3. Влияние различных соотношений растворителей и скоростей потока на хиральные пары в рацематах -Se-ddC Соотношение Скорость потока Площадь первого элюированного Время удержания Разрешение Rs этанол/гексан(мл/мин) первого пика (мин) пика (мкВс х 107) 100:0 0,8 1,25 1,25 4,65 50:50 0,8 1,48 1,13 6,06 40:60 0,8 1,76 1,11 7,21 30:70 0,8 2,05 1,08 9,71 30:70 1,0 1,98 0,88 7,83 30:70 1,4 1,90 0,64 5,59 20:80 1,4 2,12 0,61 9,78 40:60 0,6 1,75 1,46 9,53 Моно-, ди- и трифосфатные производные активных нуклеозидов могут быть получены в соответствии с описанными методами. Монофосфат может быть получен в соответствии с процедурой Imai et al., 1969, J. Org. Chem., 34(6), 1547-1550. Дифосфат может быть получен в соответствии с процедурой Davisson et al., 1987,J. Org. Chem., 52 (9), 1794-1801. Трифосфат может быть получен в соответствии с процедуройIII. Комбинированная и чередовательная терапия. Было установлено, что после продолжительного применения для лечения антивирусно го средства могут появляться резистентные к лекарствам варианты ВИЧ и ВГБ. Резистентность к лекарствам обычно происходит в результате мутаций в гене, который кодирует фермент, участвующий в жизненном цикле вируса: наиболее типично для ВИЧ - в гене обратной транскриптазы, протеазы или ДНКполимеразы, а в случае ВГБ - ДНК-полимеразы. Недавно было продемонстрировано, что эффективность применения лекарственного средства против ВИЧ-инфекции может быть удлинена,обеспечена или восстановлена введением соединения в сочетании или в чередовании со вторым, а возможно и третьим антивирусным соединением, что индуцирует другую мутацию 25 по сравнению с той, которую индуцирует исходное лекарственное средство. С другой стороны,фармакокинетические,биодистрибутивные и иные параметры лекарства могут быть изменены с помощью такой комбинированной или чередовательной (альтернационной) терапии. В целом, комбинированная терапия обычно имеет преимущества перед чередовательной терапией благодаря тому, что она индуцирует множественные одновременные стрессовые воздействия на конкретный вирус. В одном из вариантов второе антивирусное средство для лечения ВИЧ-инфекции может быть ингибитором обратной транскриптазы(ИОТ), который может являться либо синтетическим нуклеозидом (Н-ИОТ) или не являющимся нуклеозидом соединением (НН-ИОТ). В другом варианте в случае с ВИЧ второе (или третье) антивирусное средство может быть протеазным ингибитором. В других вариантах второе (или третье) соединение может быть пирофосфатным аналогом или химерным связывающим ингибитором. Сводные данные по резистентности in vitro и in vivo для ряда антивирусных соединений можно найти у Шинаци с соавт. (Schinazi et al., 1996, "Mutations in retroviralMedical Press). Предпочтительные соединения для комбинационной или чередовательной терапии для лечения ВИЧ-инфекции включают FTC -)энантиомер или рацемат), L-FMAU, интерферон, -D-диоксоланилгуанин (DXG), -Dдиоксоланил-2,6-диаминопурин (DAPD), и -Dдиоксоланил-6-хлорпурин (АСР), фамцикловир,пенцикловир,BMS-200475,bis-bom-PMEA(адельфовир, дипивоксил), лобукавир, ганцикловир и рибаварин. Предпочтительными примерами антивирусных средств, которые могут быть использованы в сочетании или для чередования с соединениями, которые представляются в настоящем изобретении для лечения ВИЧ-инфекции, включают 2-гидроксиметил-5-(5-фторцитозин-1-ил)1,3-оксатиолан (FTC), (-)-энантиомер 2-гидроксиметил-5-(цитозин-1-ил)-1,3-оксатиолан(3 ТС), карбовир, ацикловир, интерферон, AZT,DDI, DDC, D4T, CS-92 (3'-азидо-2',3-дидезокси 5-метилцитидин) и -D-диоксоланнуклеозиды,такие как -D-диоксоланилгуанин (DXG), -Dдиоксоланил-6-хлорпурин (АСР) и МКС-442 (6 бензил-1-(этоксиметил)-5-изопропилурацил). Предпочтительные протеазные ингибиторы включают криксован (Merck), нельфиновир(Roche) и DMP-450 (DuPont Merck). Не служащими ограничением примерами соединений, которые могут быть введены в сочетании или в чередовании с одним из любых 1,3-оксаселеноленилнуклеозидов,являются(BioMega/Boehringer-Ingelheim); ВМ+51.0836 - тиазолоизоиндолиноновое производное; BMS-186318 - аминодиоловое производное ингибитора протеазы вируса ВИЧ-1(Roche); ddI - 2',3'-дидезоксиинозин (BristolMyers-Squibb); DMP-266 - 1,4-дигидро-2 Н-3,1 бензоксазин-2-он; DMP-450 - [4R-(4-а,5-а,6-b,7b)]-гексагидро-5,6-бис(гидрокси)-1,3-бис(3 амино)фенил]метил)-4,7-бис(фенилметил)-2 Н 1,3-диазепин-2-он-бисмезилат (Avid); DXG (-)D-диоксолангуанозин (Triangle); EBU-dM 5-этил-1-этоксиметил-6-(3,5-диметилбензил) урацил; E-EBU - 5-этил-1-этоксиметил-6 бензилурацил; DS - декстрансульфат; Е-EPSeU 1-(этоксиметил)-(6-фенилселенил)-5-этилурацил; E-EPU - 1-(этоксиметил)-(6-фенилтио)-5 этилурацил; FTC - -2',3'-дидезокси-5-фтор-3'тиацитидин (Triangle); HBY097 - S-4 изопропоксикарбонил-6-метокси-3-(метилтиометил) 3,4-дигидрохиноксалин-2(1 Н)-тион; НЕРТ - 1-[2-(гидроксиэтокси)метил]6-(фенилтио)тимин; ВИЧ-1 - вирус иммунодефицита человека 1-го типа; JM2763 - 1,1'-(1,3 пропандиил)-бис-1,4,8,11-тетраазациклотетрадекан (Johnson Matthey); JM3100 - 1,1'-[1,4 фенилен-бис-(метилен)]-бис-1,4,8,11-тетраазациклотетрадекан (Johnson Matthey); KNI-272 трипептид, включающий (2S,3S)-3-амино-2 гидрокси-4-фенилбутировую кислоту; L-697593 5-этил-6-метил-3-(2-фталимидоэтил)пиридин 2(1 Н)-он; L-735524 - гидроксиаминопентанамид(Gilead); РМРА - (R)-9-(2-фосфонилметоксипропил)аденин (Gilead); Ro 31-8959 - гидроксиэтиламиновое производное ингибитора протеазы ВИЧ-1 (Roche); RPI-312 - ингибитор пептидилпротеазы, 1-[(3S)-3-(nбензилоксикарбонил)-1-аспаргинил)-амино-2-гидрокси-4-фенилбутирил]-n-третбутил-1-пролинамид; 2720 - 6 хлор-3,3-диметил-4-(изопропенилоксикарбонил)-3,4-дигидрохиноксалин-2(1 Н)-тион;SC52151 - ингибитор изостерической протеазы гидроксиэтилмочевины (Searle); SC-55389A ингибитор изостерической протеазы гидроксиэтилмочевины (Searle); TIBO R82150 - (+)-(5S)4,5,6,7-тетрагидро-5-метил-6-(3-метил-2-бутенил)имидазо[4,5,1-jk]-[1,4]-бензодиазепин 2(1H)-тион (Janssen); TIBO 82913 - (+)-(5S)4,5,6,7-тетрагидро-9-хлор-5-метил-6-(3-метил-2 бутенил)-имидазо[4,5,1-jk]-[1,4]-бензодиазепин 2(1H)-тион (Janssen);- N-[4-хлор-3-(3-метил-2-бутенилокси)фенил]-2 метил-3-фуранкарботиоамид; UC-82 - N-[4 хлор-3-(3-метил-2-бутенилокси)фенил]-2-метил 3-тиофенкарботиоамид; VB 11328 - гидроксиэтилсульфонамид ингибитора протеазы (Vertex);VS-478 - гидроксиэтилсульфонамид ингибитора протеазы (Vertex); ХМ-323 - цикломочевой ингибитор протеазы (Dupont Merck).IV. Способность 1,3-оксаселеноланилнуклеозидов подавлять репликацию ВИЧ и ВГБ. Способность нуклеозидов подавлять ВИЧ может быть определена с помощью различных экспериментальных методик. Использованная в данном случае методика, подробно описанная ниже, позволяет измерять уровень подавления репликации вирусов в стимулированных фитогемагглютинином (ФГА) моноядерных клетках периферической крови человека (РВМ), зараженных вирусом ВИЧ-1 штамма LAV. Количество образующегося вируса определяется с по 001920 28 мощью измерения уровня кодируемой вирусным геномом обратной транскриптазы. Количество вырабатываемого фермента пропорционально количеству образующегося вируса. Пример 4. Анти-ВИЧ активность 1,3 оксаселеноланилнуклеозидов. По анти-ВИЧ активности были тестированы 2-гидроксиметил-4-(N-5'-цитозин-1'-ил)-1,3 оксаселенолан и 2-гидроксиметил-4-(N-5'фторцитозин-1'-ил)-1,3-оксаселенолан. Трехдневные стимулированные фитогемагглютинином клетки РВМ (1 млн. клеток на 1 мл), выделенные у доноров, которые при серологическом анализе были негативны по вирусам ВИЧ-1 и гепатита-В, инфицировали ВИЧ-1(штамм LAV) в концентрации приблизительно в 100 раз превышающей 50% инфекционную дозу в тканевой культуре (TICD50) на 1 мл и культивировали в присутствии или отсутствии антивирусных соединений с различными концентрациями. Примерно через 1 ч после инфицирования среду с тестируемым соединением (двукратно по отношению к конечной концентрации в среде) или не содержащую соединение, добавляли в колбы (5 мл; конечный объем - 10 мл). В качестве позитивного контроля использовали AZT. Клетки подвергали заражению вирусом(примерно 2 х 105 ед/мл, по данным теста на обратную транскриптазу) и затем помещали в углекислотный инкубатор. Вирус ВИЧ-1 (штаммLAV) был получен из Центра по контролю за заболеваемостью Атланты, штат Джорджия(США). Методы, использовавшиеся для культивирования клеток РВМС, сбора вируса и определения активности обратной транскриптазы соответствовали тем, которые описаны уMcDougal et al., 1985, J. Immunol. Methods, 76,171-183 и Spira et al., 1987, J. Clin. Methods, 25,97-99, за исключением того, что в среду не включали фунгизон (см. Schinazi et al., 1988,Antimicrob. Agents Chemotherapy, 32, 1784-1787; тоже, 34, 1061-1067 (1990. На 6-й день клетки и надосадочную фракцию переносили в 15 мл пробирку и центрифугировали при 900 g в течение 10 мин. Пять мл надосадочной фракции удаляли и вирус концентрировали центрифугированием при 40000 об/мин в течение 30 мин (центрифуга Beckman 70,1-Ti). Солюбилизованный вирусный осадок тестировали для определения уровней обратной транскриптазы. Полученные результаты выражали в ед. на мл тестируемого супернатанта. Вирусы из меньших объемов надосадочных фракций (1 мл) также могут быть концентрированы центрифугированием до солюбилизации и определения уровней обратной транскриптазы. Среднюю эффективную концентрацию(EC50) определяли по методу "среднего эффекта" (Antimicrob. Agents Chemotherapy, 30, 491498, 1986). Вкратце, процент подавления вируса, определяемый путем измерения уровня об 29 ратной транскриптазы, соотносили с микромолярными концентрациями тестируемого соединения. Величина ЕС 50-концентрация соединения, при которой имело место 50%-ное подавление роста вирусов. Стимулированные митогеном неинфицированные клетки РВМ человека (3,8 х 105 клеток/мл) культивировали в присутствии или отсутствии лекарственного средства при тех же условиях, которые были использованы в тестировании антивирусной активности, описанном выше. Клетки подсчитывали через 6 дней с использованием гемоцитометра и методом исключения с трипановым синим в соответствии с описанным у Schinazi et al., 1982, AntimicrobialAgents Chemotherapy, 22(3), 499. Величина IC50 концентрация соединения, которая подавляет нормальный рост клеток на 50%. Таблица 4 показывает значения EC50 (концентрации нуклеозида, которые подавляют репликацию вируса на 50% в клетках РВМ, определенные с учетом 10%-ной ошибки) и величиныIC50 (концентрации нуклеозида, которые подавляют на 50% рост стимулированных митогеном неинфицированных клеток РВМ человека, клеток СЕМ и клеток Vero) для 2-гидроксиметил-4(N-5'-цитозин-1'-ил)-1,3-оксаселенолана и 2 гидроксиметил-4-(N-5'-фторцитозин-1'-ил)-1,3 оксаселенолана. Таблица 4. Анти-ВИЧ активность оксаселеноланнуклеозидов Анти-ВИЧ активность в клетках Токсичность (IC50, мкM) для клеток РВМ (ЕС 50, мкМ) РВМ СЕМ Таблица 5 показывает уровень чистоты,величины ЕС 50 (мкМ), величины ЕС 90 (мкМ) и величины IC50 в клетках РВМС для рацематаSe-ddC, его отдельных изомеров (+) и (-), рацемата -Se-FddC и его отдельных изомеров (+) и Таблица 5. Анти-ВИЧ активность и цитотоксичность рацематов и энантиомеров оксаленоланцитозиновых нуклеозидов ЕС 90, мкМ-Se-FddC 100 Анти-ВИЧ активность -Se-ddC, его отдельных изомеров (+) и (-), а также -Se-FddC и его отдельных изомеров (+) и (-) была также протестирована в клетках РВМ, инфицированных вирусом ВИЧ, который характеризуется мутацией в 184-м кодоне гена обратной транскриптазы. Результаты этого теста приведены в таблице 6. Как видно из нее, рацемат и изомер(-)Se-ddC проявляют существенную активность по отношению к мутантному вирусу. Таблица 6. Влияние оксаселеноланцитозиновых нуклеозидов на клонированный M184 ВИЧ-1 Соединение Энантиомер Чистота, % Вирус-Se-FddC 96 Примечание: FI (степень увеличения) ЕС 90 = отношение EC50 для клонированного вируса к ЕС 50 для вируса xxBRU. Пример 5. Анти-ВИЧ активность 1,3 оксаселеноланилнуклеозидов. Способность активных соединений подавлять рост вируса в культивируемых клетках 2.2.15 (клетки HepG2, трансформированные вирионами гепатита) может быть оценена так,как это подробно описано ниже. Принцип и описание такого теста для выявления антивирусных проявлений в данной культуральной системе и анализ ДНК ВГБ был описан (KorbaMilman, 1991, Antiviral Res., 15,217). Оценки антивирусного влияния проводят в двух раздельных клеточных пассажах. Все лун 31 ки на всех планшетах засевают при одинаковой плотности и в одно и то же время. Из-за врожденной изменчивости уровней внутриклеточной и внеклеточной ДНК гепатита-В, лишь величины подавления, превышающие в 3,5 раза (для ДНК вирусного вириона) или в 3 раза (для репликационных интермедиатов ДНК ВГБ) по отношению к средним уровням этих ДНК-форм вируса в неподвергавшихся дополнительному воздействию клетках будут статистически достоверными (Р 0,05). Уровни интеграции ДНК ВГБ в каждом клеточном препарате ДНК (которые остаются постоянными в расчете на 1 клетку благодаря выбранной схеме эксперимента) используют для расчета внутриклеточных форм ДНК ВГБ, что тем самым обеспечивает уверенность в одинаковом количестве клеточной ДНК, сравниваемой при сопоставлении отдельных образцов. Типичные значения внеклеточной вирионной ДНК ВГБ в неподвергающихся воздействию клетках варьируются от 50 до 150 пкг/мл культуральной среды (в среднем приблизительно 76 пкг/мл). Внутриклеточные репликационные интермедиаты ДНК ВГБ в неподвергающихся воздействию клетках варьируются от 50 до 100 пкг/мкг клеточной ДНК (в среднем 74 пкг/мкг клеточной ДНК). В целом, подавление уровней внутриклеточной ДНК ВГБ в результате обработки клеток антивирусными соединениями менее выражено и происходит с меньшей скоростью по сравнению с подавлением уровней вирионной ДНК ВГБ (KorbaMilman,1991, Antiviral Res., 15, 217). Подход, с помощью которого в данном эксперименте проводился гибридизационный анализ, который показал эквивалентность приблизительно 1,0 пкг внутриклеточной ДНК ВГБ двум-трем копиям вирусного генома на 1 клетку, а 1,0 пкг/мл внеклеточной ДНК ВГБ - 300 тысячам вирусных частиц на 1 мл. Анализ токсичности может быть проведен с целью выяснения того, обусловлено ли любое из наблюдаемых антивирусных проявлений принципиальным влиянием на жизнеспособность клеток. Одним из методов, который может быть в данном случае применен, является измерение поглощения нейтрального красного красителя, являющегося стандартным и широко применяемым в тестах на клеточную жизнеспособность в различных системах "вирус-хозяин",включая вирусы ВГБ и ВИЧ. Анализ токсичности проводят на 96-луночных плоскодонных планшетах для тканевого культивирования. Клетки для анализа токсичности культивируют и обрабатывают тестируемыми соединениями таким же образом, как это подробно описано ниже для оценок антивирусной активности. Каждое соединение тестировали в четырех концентрациях, в каждом случае - в трех повторностях (лунки "А", "В" и "С"). Уровень поглощения нейтрального красного красителя использо 001920 32 вали в качестве меры относительного уровня токсичности. Для количественного анализа использовали показатели поглощения внедрившегося в клетки красителя при 510 нм (Asin). Значения для тестируемых соединений представлены в виде процентных долей от величины Asin в 9 отдельных культурах, не подвергавшихся воздействию клеток, выращиваемых на одном и том же 96-луночном планшете. Пример 6. Применение 1,3-оксаселеноланилнуклеозидов для лечения аномальной пролиферации клеток. Некоторые из описанных в данном тексте 1,3-оксаселеноланилнуклеозидов могут быть применены для лечения аномальной пролиферации клеток, включая опухоли вообще и раковые опухоли, в частности. Уровень антипролиферационной активности может быть легко оценен путем тестирования соединения в соответствии с процедурой, описанной ниже для клеток СЕМ, или с использованием тестов на других опухолевых или пролиферативных клеточных линиях. Клетки СЕМ являются лимфомными клетками человека (Т-лимфобластоидная клеточная линия, которая доступна из Американской коллекции типовых культур в Роквилле, штат Мэриленд, США). Токсичность соединения в отношении клеток СЕМ дает информацию, отражающую активность соединения в отношении опухолей. Токсичность определяют как индекс IC50, выраженный в микромолях. Индекс IC50 обозначает ту концентрацию тестируемого соединения, которая подавляет рост опухолевых клеток в культуре на 50%. Чем ниже величина IC50, тем более активно конкретное соединение в качестве противоопухолевого агента. В целом, 1,3-оксаселеноланилнуклеозид проявляет противоопухолевую активность и может быть применен для лечения аномальной пролиферации клеток, если он проявляет токсичность в отношении клеток СЕМ или других иммортализованных опухолевых клеточных линий на уровне менее 10 микромолей, более предпочтительно менее приблизительно 5 микромолей, а наиболее предпочтительно на уровне менее 1 микромоля. Растворы лекарственного средства, включая циклогексимид, взятый в качестве позитивного контроля, используют в трех повторностях в 50 мкл питательной среды в удвоенной конечной концентрации с последующим уравновешиванием при 37 С в углекислотном (5%) инкубаторе. Клетки, находящиеся на логарифмической фазе роста, добавляют в 50 мкл культуральной среды до конечной концентрации 2500 клеток на лунку (СЕМ и SK-MEL-28), 5000 клеток на лунку (MNAN, MDA-MB-435S, SKMES-1, DU145, LNCaP) или 10000 клеток на лунку (PC-3,MCF-7) и инкубируют в течение 3 дней (DU145, PC-3, MNAN), 4 дней (MCF-7, SK-MEL-28,СЕМ) или 5 дней (SKMES-1, MDA-MB-435S,LNCaP) при 37 С в условиях атмосферы воздуха 33 с 5% углекислого газа. Контрольные лунки включают только культуральную среду ("чистые") и клетки в культуральной среде без лекарственного агента. После периода роста в каждую лунку добавляют по 15 мкл раствора красителя из набора реактивов для титрования клетокCell Titer 96 kit (Promega, Madison, WI) и планшеты инкубируют в течение 8 ч при 37 С в углекислотном (5%) инкубаторе. Затем добавляют останавливающий раствор из того же набора реактивов (Cell Titer 96 kit: Promega) и инкубируют в течение 4-8 ч в том же инкубаторе. Величины поглощения определяют при 570 нм с пропусками лунок, содержащих только культуральную среду, с использованием планшетаридера Biotek Biokinetics (Biotek, Winooski, VT). Подсчитывают средний уровень подавления роста в сравнении с не подвергавшимся обработке контролем. С использованием метода Чоу-Талалаи определяют величины IC50, IC90,коэффициент регрессии и угловой коэффициентIV. Приготовление фармацевтических композиций. Пациенты, страдающие от любого из описанных в настоящем тексте заболеваний, включая ВИЧ- и ВГБ-инфекции, или характеризующиеся аномальной пролиферацией клеток, могут быть подвергнуты лечению путем введения эффективного количества 1,3-оксаселеноланилнуклеозида, произвольно в фармацевтически приемлемом носителе или растворителе. Активные компоненты могут быть введены любым подходящим способом, например, перорально,парентерально, внутривенно, внутрикожно,подкожно или местно, в жидкой или твердой форме. Активное соединение включают в фармацевтически приемлемый носитель или растворитель в количестве, достаточном для доставки пациенту терапевтически эффективного количества соединения, предназначенного для подавления репликации вирусов in vivo, в первую очередь, репликации вирусов ВИЧ и ВГБ, без проявления серьезных токсических последствий у таких пациентов. Понятие "ингибирующее количество" обозначает такое количество активного компонента, которого достаточно для достижения ингибирующего эффекта, который может быть оценен, например, методом как один из описанных здесь тестов. Предпочтительная доза соединения для применения в обозначенных выше условиях должна находиться в пределах от 1 до 50 мг на 1 кг веса тела пациента, предпочтительно от 1 до 20 мг/кг в день, а в более общем плане - от 0,1 до примерно 100 мг на 1 кг веса тела пациента в день. Эффективные дозировки для фармацевтически приемлемых производных препаратов 34 могут быть определены исходя из веса предназначенного для введения исходного нуклеозида в этом препарате. Если производный препарат характеризуется собственной активностью, то эффективные дозировки могут быть определены так, как это описано выше для производного препарата, или с помощью других подходов,известных специалистам в данной области техники. Соединение вводят стандартными дозами или любыми другими подходящими формами дозировки, включая, но тем самым не ограничиваясь, дозировочные единицы (стандартные дозы), содержащие от 7 до 3000 мг, предпочтительно от 70 до 1400 мг активного компонента. Обычно стандартным для перорального введения является использование единичных дозировок по 50-1000 мг. В идеале активный компонент должен вводиться таким образом, чтобы достигался пик концентрации в плазме крови примерно от 0,2 до 70 мкМ, предпочтительно примерно от 1,0 до 10 мкМ. Этого можно добиться, например, путем внутривенных инъекций 0,1-5%-ного раствора активного компонента, произвольно в солевом растворе, или путем введения активного компонента в виде болюса. Концентрация активного компонента в лекарственной композиции должна зависеть от уровней поглощения, инактивации в оpганизме и экскреции лекарственного средства, а также от других факторов, известных специалистам в данной области техники. Необходимо отметить,что величины дозировок также будут варьироваться в зависимости от тяжести состояния. Также должно быть понятно, что для конкретного пациента может быть разработан индивидуальный режим дозировок в течение того периода времени, кoгда требуется учет индивидуальных потребностей, и исходя из профессиональных оценок врача, назначающего введение данных композиций, а также должно быть понятно, что приведенный в данном тексте диапазон концентраций является лишь примером и,соответственно, не претендует на ограничение масштаба или практики применения композиций, представляемых настоящим изобретением. Активный компонент может быть введен однократно или может быть разделен на серию меньших доз, которые вводят на протяжении какого-либо периода времени. Предпочтительным путем введения активного соединения является пероральный путь. Композиции для перорального введения в принципе должны содержать инертный растворитель либо съедобный носитель. Они могут быть упакованы в желатиновые капсулы или спрессованы в таблетки. Для целей перорального терапевтического применения активное соединение может быть соединено с наполнителем и применено в форме таблеток, капсул или пастилок. Как компоненты композиций, могут быть вклю 35 чены фармацевтически совместимые агенты и(или) адъюванты. Таблетки, драже, капсулы, пастилки и подобное могут содержать любой из следующих ингредиентов или соединений сходной природы: связывающий компонент, такой как микрокристаллическая целлюлоза, смола трагаканта или желатин; наполнитель, такой как крахмал или лактоза; дезинтегрирующий компонент,такой как альгиновая кислота, примогель или кукурузный крахмал; лубрикант, такой как стеарат магния или стеротес; скользящее вещество, такое как коллоидный раствор двуокиси кремния; подслащивающий компонент, такой как сахароза или сахарин; или ароматизатор,такой как перечная мята, метилсалицилат или экстракт цитрусовых. В случае, когда единицей дозировки является капсула, она может, в дополнение к обозначенным выше компонентам,содержать жидкий носитель, такой как масло. Кроме того, стандартные дозы могут содержать различные иные материалы, которые бы модифицировали ее физическое состояние, например, покрытие сахаром, шеллаком или другими съедобными ингредиентами. Соединение может быть введено в виде компонента бальзама, суспензии, сиропа, облатки, жевательной резины и подобного. Сироп, в дополнение к активным компонентам, может включать сахарозу (как подслащивающий компонент) и некоторые консерванты, красители и ароматизаторы. Соединение по настоящему изобретению или его фармацевтически приемлемые производные или соли также могут быть смешаны с другими активными компонентами, которые не нарушают их желательную активность, или с компонентами, усиливающими желательную функцию, такими как антибиотики, противогрибковые препараты, противовоспалительные средства, протеазные ингибиторы или другие нуклеозидные или не являющиеся нуклеозидами антивирусные агенты, которые более подробно обсуждались в данном тексте выше. Растворы или суспензии, применяемые для парентерального, внутрикожного, подкожного или местного введения, могут включать следующие компоненты: стерильный растворитель, такой как вода для инъекций, солевой раствор, стойкие масла, полиэтиленгликоль, глицерин, пропиленгликоль или другие синтетические растворители; противобактериальные агенты, такие как бензиловый спирт или метил-парабен; антиокислители, такие как аскорбиновая кислота или бисульфит натрия; деминерализирующий компонент, такой как этилендиаминтетрауксусная кислота; буферы, такие как ацетатный, цитратный или фосфатный; и изотонические компоненты, такие как хлорид натрия или декстроза. Исходный препарат может быть помещен в ампулы, одноразовые шприцы или ампулы с 36 серийными дозами, изготовленные из стекла или пластика. При внутривенном введении предпочтительными носителями являются физиологический раствор или фосфатный буфер. В предпочтительном варианте активные соединения объединяют с носителями, которые бы защищали данное соединение от быстрого удаления из организма, например, в форме,обеспечивающей регулируемый выход препарата, включая имплантаты и микрокапсульные системы. Могут быть использованы биологически разрушаемые, биологически совместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген,полиортоэфиры и полимеризованная молочная кислота. Способы приготовления таких препаратов хорошо известны специалистам в данной области техники. Материалы также могут быть приобретены в Alza Corporation на коммерческой основе. Липосомные суспензии (включая липосомы с моноклональными антителами к вирусным антигенам, нацеленные на инфицированные клетки, также являются целесообразными в качестве фармацевтически приемлемых носителей. Они могут быть приготовлены в соответствии со способами, известными специалистам в данной области техники, например, в соответствии с описанным в патенте США 4522811(включен в данный текст путем цитирования). Например, липосомные препараты могут быть приготовлены путем растворения подходящих липидов, таких как стеароилфосфатидилэтаноламин, стеароилфосфатидилхолин, арахадоилфосфатидилхолин и холестерин, в неорганическом растворителе, который затем упаривают до получения тонкой пленки высушенного липида на поверхности контейнера. Водный раствор активного компонента или его монофосфатного,дифосфатного и (или) трифосфатного производного затем вносят в этот контейнер. Затем контейнер вручную вращают для освобождения липидного материала от стенок контейнера и диспергирования липидных агрегатов, тем самым образуя липосомную суспензию. Настоящее изобретение было описано со ссылками на его предпочтительные варианты. Изменения и модификации настоящего изобретения могут быть очевидны для специалистов в данной области техники, исходя из предшествующего подробного описания настоящего изобретения. Подразумевается, что все такие изменения и модификации должны быть включены в объем настоящего изобретения. где В обозначает пуриновое или пиримидиновое основание, a R обозначает водород, ацил, моно-,ди- или триэфир фосфорной кислоты стабилизированный фосфат или остаток липида, или их фармацевтически приемлемая соль, где нуклеозиды характеризуются показателем EC50 менее чем 10 микромоль в отношении ВИЧинфицированных клеток РВМ. 2. 1,3-Оксаселеноланнуклеозид по п.1, где В обозначает пиримидиновое основание. 3. 1,3-Оксаселеноланнуклеозид по п.1, где В обозначает пуриновое основание. 4. 1,3-Оксаселеноланнуклеозид по пп.2 и 3,где R обозначает водород. 5. 1,3-Оксаселеноланнуклеозид по пп.2 и 3,где R обозначает ацил. 6. 1,3-Оксаселеноланнуклеозид по пп.2 и 3,где R обозначает монофосфат. 7. 1,3-Оксаселеноланнуклеозид по пп.2 и 3,где R обозначает дифосфат. 8. 1,3-Оксаселеноланнуклеозид по пп.2 и 3,где R обозначает трифосфат. 9. 1,3-Оксаселеноланнуклеозид по пп.2 и 3,где R обозначает стабилизированный фосфат. 10. 1,3-Оксаселеноланнуклеозид по пп.2 и 3, где R обозначает остаток липида. 11. 1,3-Оксаселеноланнуклеозид по п.1, где В обозначает цитозин. 12. 1,3-Оксаселеноланнуклеозид по п.1, где В обозначает 5-фторцитозин. 13. 1,3-Оксаселеноланнуклеозид по п.1, где В обозначает гуанин. 14. 1,3-Оксаселеноланнуклеозид по п.1,представляет собой 2-гидрометил-4-(N-5'-цитозин-1'-ил)-1,3-оксаселенолан или его фармацевтически приемлемую соль. 15. 1,3-Оксаселеноланнуклеозид по п.1,представляет собой 2-гидрометил-4-(N-5'-фторцитозин-1'-ил)-1,3-оксаселенолан или его фармацевтически приемлемую соль. 16. 1,3-Оксаселеноланнуклеозид по п.1,представляет собой (-)L-2-гидроксиметил-4(N-5'-цитозин-1'-ил)-1,3-оксаселенолан в виде выделенного энантиомера или его фармацевтически приемлемую соль. 17. 1,3-Оксаселеноланнуклеозид по п.1,представляет собой (-)L-2-гидроксиметил-4(N-5'-фторцитозин-1'-ил)-1,3-оксаселенолан в виде выделенного энантиомера или его фармацевтически приемлемую соль. 18. Фармацевтическая композиция для лечения ВИЧ- и ВГБ-инфекций у людей и различных животных, содержащая эффективное количество 1,3-оксаселеноланнуклеозида по п.1 наряду с фармацевтически приемлемым носителем. 38 19. Фармацевтическая композиция для лечения ВИЧ- и ВГБ-инфекций у людей и различных животных, содержащая эффективное количество 1,3-оксаселеноланнуклеозида по п.2 наряду с фармацевтически приемлемым носителем. 20. Фармацевтическая композиция для лечения ВИЧ- и ВГБ-инфекций у людей и различных животных, содержащая эффективное количество 1,3-оксаселеноланнуклеозида по п.3 наряду с фармацевтически приемлемым носителем. 21. Фармацевтическая композиция для лечения ВИЧ- и ВГБ-инфекций у людей и различных животных, содержащая эффективное количество 1,3-оксаселеноланнуклеозида по любому из пп.4-17 наряду с фармацевтически приемлемым носителем. 22. Способ лечения ВИЧ-инфекции у человека, включающий введение ВИЧ-эффективного количества 1,3-оксаселеноланнуклеозида формулы где В обозначает пуриновое или пиримидиновое основание, a R обозначает водород, ацил или эфир фосфорной кислоты или их фармацевтически приемлемую соль, и где нуклеозиды характеризуются показателем EC50 менее чем 10 микромоль в отношении ВИЧ-инфицированных клеток РВМ. 23. Способ лечения ВИЧ-инфекции по п.22, где В обозначает пиримидиновое основание. 24. Способ лечения ВИЧ-инфекции по п.22, где В обозначает пуриновое основание. 25. Способ лечения ВИЧ-инфекции по п.22, где R обозначает водород. 26. Способ лечения ВИЧ-инфекции по п.22, где R обозначает ацил. 27. Способ лечения ВИЧ-инфекции по п.22, где R обозначает монофосфат. 28. Способ лечения ВИЧ-инфекции по п.22, где R обозначает дифосфат. 29. Способ лечения ВИЧ-инфекции по п.22, где R обозначает трифосфат. 30. Способ лечения ВИЧ-инфекции по п.25, где 1,3-оксаселеноланнуклеозид представляет собой 2-гидроксиметил-4-(N-5'-цитозин-1'ил)-1,3-оксаселенолан или его фармацевтически приемлемую соль. 31. Способ лечения ВИЧ-инфекции по п.26, где 1,3-оксаселеноланнуклеозид представляет собой 2-гидроксиметил-4-(N-5'-фторцитозин-1'-ил)-1,3-оксаселенолан или его фармацевтически приемлемую соль. 32. Способ лечения ВИЧ-инфекции по п.27, где 1,3-оксаселеноланнуклеозид представляет собой (-)L-2-гидроксиметил-4-(N-5'цитозин-1'-ил)-1,3-оксаселенолан в виде выде 39 ленного энантиомера или его фармацевтически приемлемую соль. 33. Способ лечения ВИЧ-инфекции по п. 28, где 1,3-оксаселеноланнуклеозид представляет собой (-)L-2-гидроксиметил-4-(N-5'-фторцитозин-1'-ил)-1,3-оксаселенолан в виде выделенного энантиомера или его фармацевтически приемлемую соль. 34. Способ лечения BГБ-инфекции у человека и различных животных, включающий введение ВГБ-эффективного количества 1,3 оксаселеноланнуклеозида формулы где В обозначает пуриновое или пиримидиновое основание, a R обозначает водород, ацил или эфир фосфорной кислоты, или его фармацевтически приемлемую соль в форме рацемата или выделенного энантиомера. 35. Способ лечения ВГБ-инфекции по п.34,где В обозначает пиримидиновое основание. 36. Способ лечения ВГБ-инфекции по п.34,где В обозначает пуриновое основание. 37. Способ лечения ВГБ-инфекции по п.34,где R обозначает водород. 38. Способ лечения ВГБ-инфекции по п.34,где R обозначает ацил. 39. Способ лечения ВГБ-инфекции по п.34,где R обозначает монофосфат. 40. Способ лечения ВГБ-инфекции по п.34,где R обозначает дифосфат. 41. Способ лечения ВГБ-инфекции по п.34,где R обозначает трифосфат. 40 42. Способ лечения ВГБ-инфекции по п.34,где 1,3-оксаселеноланнуклеозид представляет собой 2-гидроксиметил-4-(N-5'-цитозин-1'-ил)1,3-оксаселенолан или его фармацевтически приемлемую соль. 43. Способ лечения ВГБ-инфекции по п.34,где 1,3-оксаселеноланнуклеозид представляет собой 2-гидроксиметил-4-(N-5'-фторцитозин-1'ил)-1,3-оксаселенолан или его фармацевтически приемлемую соль. 44. Способ лечения ВГБ-инфекции по п.34,где 1,3-оксаселеноланнуклеозид представляет собой (-)L-2-гидроксиметил-4-(N-5'-цитозин 1'-ил)-1,3-оксаселенолан в виде выделенного энантиомера или его фармацевтически приемлемую соль. 45. Способ лечения ВГБ-инфекции по п.34,где 1,3-оксаселеноланнуклеозид представляет собой (-)L-2-гидроксиметил-4-(N-5'-фторцитозин-1'-ил)-1,3-оксаселенолан в виде выделенного энантиомера или его фармацевтически приемлемую соль. 46. Применение 1,3-оксаселеноланнуклеозидов по п.1 и их фармацевтически приемлемых производных и солей для получения лекарственного средства для лечения ВИЧ- или ВГБинфекции. 47. Применение 1,3-оксаселеноланнуклеозидов по п.1 и их фармацевтически приемлемых производных и солей для лечения вирусных инфекций путем введения в сочетании или при чередовании с другим антивирусным средством.
МПК / Метки
МПК: A61P 31/12, C07D 421/04, C07F 9/09, A61K 31/505
Метки: вируса, 1,3-оксаселеноланнуклеозидов, человека, активность, гепатита-b, иммунодефицита, против, синтез
Код ссылки
<a href="https://eas.patents.su/22-1920-sintez-13-oksaselenolannukleozidov-ih-aktivnost-protiv-virusa-immunodeficita-cheloveka-i-protiv-virusa-gepatita-b.html" rel="bookmark" title="База патентов Евразийского Союза">Синтез 1,3-оксаселеноланнуклеозидов, их активность против вируса иммунодефицита человека и против вируса гепатита-b</a>












