Новые производные 1,3-дигидро-2н-индол-2-она и их применение в качестве лигандов рецепторов аргинин-вазопрессина v1b и v1a
Номер патента: 4628
Опубликовано: 24.06.2004
Авторы: Серрадель-Ле Галь Клодин, Тоннерр Бернар, Ваньон Жан, Ру Ришар
Формула / Реферат
1. Соединение формулы
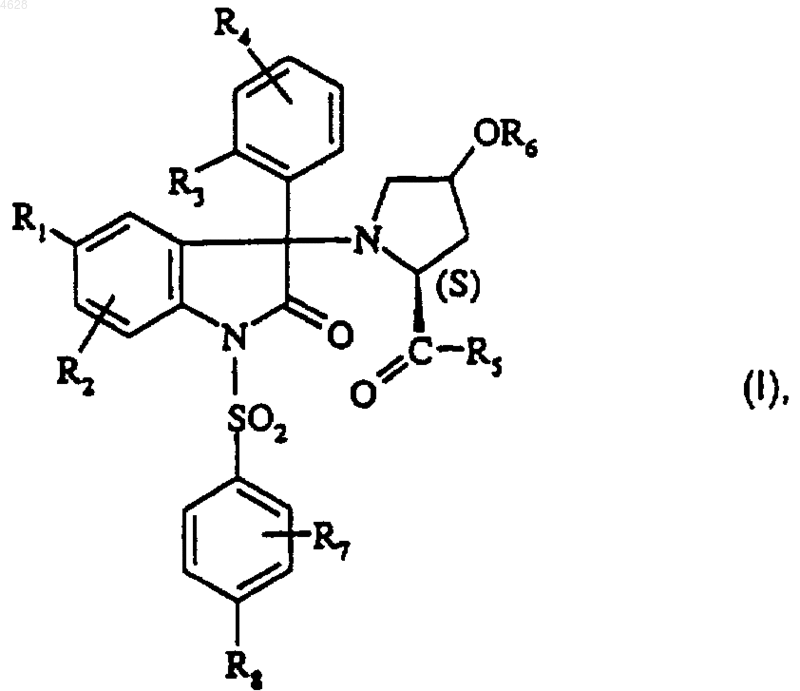
где R1 представляет собой атом галогена; (C1-C4)алкил; (C1-C4)алкокси; трифторметильный радикал; трифторметокси радикал;
R2 представляет собой атом водорода; атом галогена; (C1-C4)алкил; (C1-C4)алкокси; трифторметильный радикал;
или R2 находится в положении -6-индол-2-онового кольца и R1 и R2 вместе представляют собой двухвалентный триметиленовый радикал;
R3 представляет собой атом галогена; гидроксил; (C1-C2)алкил; (C1-C2)алкокси; трифторметокси радикал;
R4 представляет собой атом водорода; атом галогена; (C1-C2)алкил; (C1-C2)алкокси;
или R4 находится в положении -3-фенила и R3 и R4 вместе представляют собой метилендиокси радикал;
R5 представляет собой этиламиногруппу; диметиламиногруппу; азетидин-1-ильный радикал; (C1-C2)алкокси;
R6 представляет собой атом водорода; (C1-C4)алкил; группу -(CH2)n-CO-R9; группу -CO-(CH2)n-NR10R11;
R7 представляет собой (C1-C4)алкокси;
R8 представляет собой (C1-C4)алкокси;
R9 представляет собой гидроксил; (C1-C4) алкокси; гуппу -NR12R13;
R10 и R11, каждый независимо, представляет собой (C1-C4)алкил;
или R10 и R11 вместе с атомом азота, к которому они присоединены, образуют гетероциклический радикал, выбранный из азетидин-1-ила, пирролидин-1-ила, пиперид-1-ила, пиперазин-1-ила, морфолин-4-ила или тиоморфолин-4-ила;
R12 представляет собой водород или (C1-C4)алкил;
R13 представляет собой (C1-C4)алкил; группу -C(CH3)2CH2OH; группу -C(CH3)(CH2OH)2; группу -C(CH2OH)3;
или R12 и R13, вместе с атомом азота, к которому они присоединены, образуют гетероциклический радикал, выбранный из азетидин-1-ила, пирролидин-1-ила, пиперид-1-ила, пиперазин-1-ила, морфолин-4-ила или тиоморфолин-4-ила;
n равен 1 или 2;
его сольваты и/или гидраты и его возможные соли минеральных или органических кислот.
2. Соединение по п.1 в виде оптически чистых изомеров.
3. Соединение по п.2 формулы
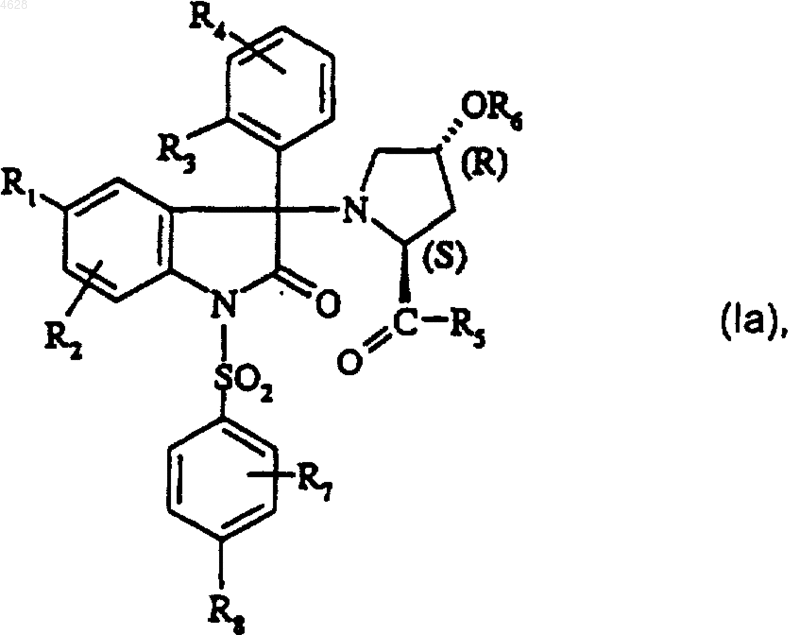
где
атом углерода, несущий заместитель OR6, имеет (R)-конфигурацию, а атом углерода в положении 3 индол-2-она имеет либо (R)-конфигурацию, либо (S)-конфигурацию.
4. Соединение по п.3 в виде левовращающего изомера.
5. Соединение по п.4 формулы (Ia), где
R1 представляет собой атом хлора, метильный радикал или трифторметокси радикал;
R2 представляет собой атом водорода или находится в положении -6-индол-2-она и представляет собой атом хлора, метильный радикал, метокси радикал или трифторметильный радикал;
R3 представляет собой атом хлора, атом фтора, метокси радикал или этокси радикал;
R4 представляет собой атом водорода или находится в положении -3- или -4-фенила и представляет собой атом фтора или метокси радикал;
или R4 находится в положении -3-фенила и, вместе с R3, представляет собой метилендиокси радикал;
R5 представляет собой диметиламино радикал или метокси радикал;
R6 представляет собой атом водорода; метильный радикал; этильный радикал; трет-бутилоксикарбонилметильный радикал; карбоксиметильный радикал; [[2-гидрокси-1-(гидроксиметил)-1-метилэтил]амино]карбонилметильный радикал; (1-пиперазинил)карбонилметильный радикал; (4-морфолинил)карбонилметильный радикал; 3-(4-морфолинил)пропаноильный радикал;
R7 находится в положении -2-фенила и представляет собой метокси радикал;
R8 представляет собой метокси радикал;
и его соли минеральных или органических кислот и их сольваты и/или гидраты.
6. Соединение по п.5, выбранное из
(2S,4R)-1-[5-хлор-1-[(2,4-диметоксифенил)сульфонил]-3-(2-метоксифенил)-2-оксо-2,3-дигидро-1H-индол-3-ил]-4-гидрокси-N,N-диметил-2-пирролидинкарбоксамида, левовращающего изомера;
(2S,4R)-1-[5-хлор-1-[(2,4-диметоксифенил)сульфонил]-3-(2-метоксифенил)-2-оксо-2,3-дигидро-1H-индол-3-ил]-4-метокси-N,N-диметил-2-пирролидинкарбоксамида, левовращающего изомера;
(2S,4R)-1-[5-хлор-3-(2-хлорфенил)-1-[(2,4-диметоксифенил)сульфонил]-2-оксо-2,3-дигидро-1H-индол-3-ил]-4-гидрокси-N,N-диметил-2-пирролидинкарбоксамида, левовращающего изомера;
(2S,4R)-1-[5-хлор-3-(2-хлорфенил)-1-[(2,4-диметоксифенил)сульфонил]-6-метокси-2-оксо-2,3-дигидро-1H-индол-3-ил]-4-метокси-N,N-диметил-2-пирролидинкарбоксамида, левовращающего изомера;
(2S,4R)-1-[5-хлор-1-[(3,4-диметоксифенил)сульфонил]-3-(2-метоксифенил)-2-оксо-2,3-дигидро-1H-индол-3-ил]-4-гидрокси-N,N-диметил-2-пирролидинкарбоксамида, левовращающего изомера;
метил-(2S,4R)-1-[5-хлор-3-(2-метоксифенил)-1-[(3,4-диметоксифенил)сульфонил]-2-оксо-2,3-дигидро-1H-индол-3-ил]-4-гидрокси-2-пирролидинкарбоксилата, левовращающего изомера;
(2S,4R)-1-[5-метил-1-[(2,4-диметоксифенил)сульфонил]-3-(2-метоксифенил)-2-оксо-2,3-дигидро-1H-индол-3-ил]-4-гидрокси-N,N-диметил-2-пирролидинкарбоксамида, левовращающего изомера;
(2S,4R)-1-[5-хлор-1-[(2,4-диметоксифенил)сульфонил]-3-(2-метоксифенил)-2-оксо-2,3-дигидро-1H-индол-3-ил]-2-(азетидин-1-илкарбонил)-4-гидроксипирролидинкарбоксамида, левовращающего изомера;
(2S,4R)-1-[5-трифторметокси-1-[(2,4-диметоксифенил)сульфонил]-3-(2-метоксифенил)-2-оксо-2,3-дигидро-1H-индол-3-ил]-4-гидрокси-N,N-диметил-2-пирролидинкарбоксамида, левовращающего изомера;
(2S,4R)-1-[5-хлор-1-[(2,4-диметоксифенил)сульфонил]-3-(2-метоксифенил)-6-метил-2-оксо-2,3-дигидро-1H-индол-3-ил]-4-гидрокси-N,N-диметил-2-пирролидинкарбоксамида, левовращающего изомера;
(2S,4R)-1-[3-(2-хлорфенил)-1-[(2,4-диметоксифенил)сульфонил]-5,6-диметил-2-оксо-2,3-дигидро-1H-индол-3-ил]-4-гидрокси-N,N-диметил-2-пирролидинкарбоксамида, левовращающего изомера;
(2S,4R)-1-[5-хлор-1-[(2,4-диметоксифенил)сульфонил]-3-(2,3-диметоксифенил)-2-оксо-2,3-дигидро-1H-индол-3-ил]-4-метокси-N,N-диметил-2-пирролидинкарбоксамида, левовращающего изомера;
(2S,4R)-1-[5-хлор-1-[(2,4-диметоксифенил)сульфонил]-3-(2-метоксифенил)-6-трифторметил-2-оксо-2,3-дигидро-1H-индол-3-ил]-4-метокси-N,N-диметил-2-пирролидинкарбоксамида, левовращающего изомера;
(2S,4R)-1-[6-хлор-1-[(2,4-диметоксифенил)сульфонил]-3-(2-метоксифенил)-5-метил-2-оксо-2,3-дигидро-1H-индол-3-ил]-4-метокси-N,N-диметил-2-пирролидинкарбоксамида, левовращающего изомера;
(2S,4R)-1-[5-хлор-1-[(2,4-диметоксифенил)сульфонил]-3-(2-метоксифенил)-2-оксо-2,3-дигидро-1H-индол-3-ил]-4-этокси-N,N-диметил-2-пирролидинкарбоксамида, левовращающего изомера;
(2S,4R)-1-[5-хлор-1-[(2,4-диметоксифенил)сульфонил]-3-(2,3-диметоксифенил)-2-оксо-2,3-дигидро-1H-индол-3-ил]-4-гидрокси-N,N-диметил-2-пирролидинкарбоксамида, левовращающего изомера;
(2S,4R)-1-[5,6-дихлор-3-(2-хлорфенил)-1-[(2,4-диметоксифенил)сульфонил]-2-оксо-2,3-дигидро-1H-индол-3-ил]-4-гидрокси-N,N-диметил-2-пирролидинкарбоксамида, левовращающего изомера;
метил-(2S,4R)-1-[5-хлор-1-[(2,4-диметоксифенил)сульфонил]-3-(2-метоксифенил)-2-оксо-2,3-дигидро-1H-индол-3-ил]-4-метокси-2-пирролидинкарбоксилата, левовращающего изомера;
метил-(2S,4R)-1-[5-хлор-1-[(2,4-диметоксифенил)сульфонил]-3-(2-метоксифенил)-6-метил-2-оксо-2,3-дигидро-1H-индол-3-ил]-4-метокси-2-пирролидинкарбоксилатр, левовращающего изомера;
(2S,4R)-1-[5-хлор-1-[(2,4-диметоксифенил)сульфонил]-3-(2-этоксифенил)-2-оксо-2,3-дигидро-1H-индол-3-ил]-4-гидрокси-N,N-диметил-2-пирролидинкарбоксамида, левовращающего изомера;
(2S,4R)-1-[5-хлор-1-[(2,4-диметоксифенил)сульфонил]-3-(2,3-дифторфенил)-2-оксо-2,3-дигидро-1H-индол-3-ил]-4-гидрокси-N,N-диметил-2-пирролидинкарбоксамида, левовращающего изомера;
(2S,4R)-1-[5-хлор-1-[(2,4-диметоксифенил)сульфонил]-3-(2,4-диметоксифенил)-2-оксо-2,3-дигидро-1H-индол-3-ил]-4-гидрокси-N,N-диметил-2-пирролидинкарбоксамида, левовращающего изомера;
(2S,4R)-1-[5-хлор-1-[(2,4-диметоксифенил)сульфонил]-3-(1,3-бензодиоксол-4-ил)-2-оксо-2,3-дигидро-1H-индол-3-ил]-4-гидрокси-N,N-диметил-2-пирролидинкарбоксамида, левовращающего изомера;
(2S,4R)-1-[5,6-дихлор-1-[(2,4-диметоксифенил)сульфонил]-3-(2-метоксифенил)-2-оксо-2,3-дигидро-1H-индол-3-ил]-4-гидрокси-N,N-диметил-2-пирролидинкарбоксамида, левовращающего изомера;
трет-бутил-2-[[(3R,5S)-1-[5-хлор-1-[(2,4-диметоксифенил)сульфонил]-3-(2-метоксифенил)-2-оксо-2,3-дигидро-1H-индол-3-ил]-5-[(диметиламино)карбонил]-3-пирролидинил] окси]ацетата, левовращающего изомера;
2-[[(3R,5S)-1-[5-хлор-1-[(2,4-диметоксифенил)сульфонил]-3-(2-метоксифенил)-2-оксо-2,3-дигидро-1H-индол-3-ил]-5-[(диметиламино)карбонил]-3-пирролидинил]окси]уксусной кислоты, левовращающего изомера;
(2S,4R)-1-[5-хлор-1-[(2,4-диметоксифенил)сульфонил]-3-(2-метоксифенил)-2-оксо-2,3-дигидро-1H-индол-3-ил]-4-[2-[[2-гидрокси-1-(гидроксиметил)-1-метилэтил]амино]-2-оксоэтокси]-N,N-диметил-2-пирролидинкарбоксамида, левовращающего изомера;
(2S,4R)-1-[5-хлор-1-[(2,4-диметоксифенил) сульфонил]-3-(2-метоксифенил)-2-оксо-2,3-дигидро-1H-индол-3-ил]-N,N-диметил-4-[2-оксо-2-(1-пиперазинил)этокси]-2-пирролидинкарбоксамида, левовращающего изомера;
(2S,4R)-1-[[(2,4-диметоксифенил)сульфонил]-3-(2-метоксифенил)-2-оксо-2,3-дигидро-1H-индол-3-ил]-N,N-диметил-4-[2-оксо-(4-морфолинил)этокси]-2-пирролидинкарбоксамида, левовращающего изомера;
(3R,5S)-1-[5-хлор-1-[(2,4-диметоксифенил)сульфонил]-3-(2-метоксифенил)-2-оксо-2,3-дигидро-1H-индол-3-ил]-5-[(диметиламино)карбонил]-3-пирролидинил-3-(4-морфолинил)пропаноата, левовращающего изомера;
а также их возможных солей минеральных или органических кислот и их сольватов и/или гидратов.
7. Способ получения соединений формулы (I) по п.1, их возможных солей минеральных или органических кислот и их сольватов и/или гидратов, отличающийся тем, что соединение формулы
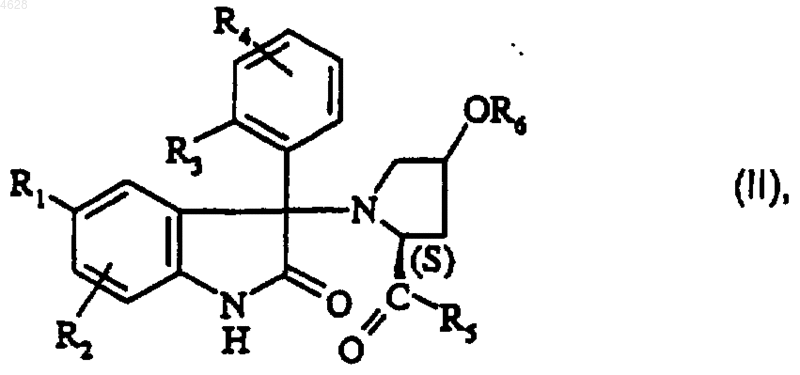
где R1, R2, R3, R4, R5 и R6 являются такими, как определено для соединения формулы (I) в п.1, подвергают взаимодействию с галогенидом формулы
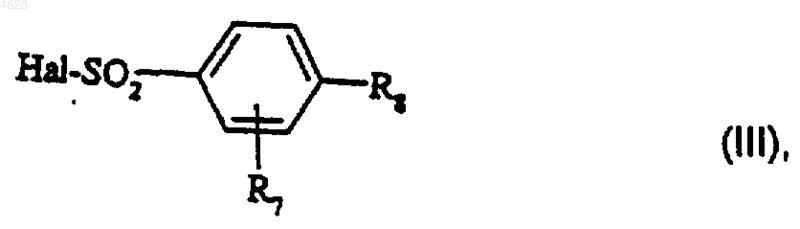
где R7 и R8 являются такими, как определено для соединения формулы (I) в п.1, и Hal представляет собой атом галогена, в присутствии основания.
8. Соединение формулы
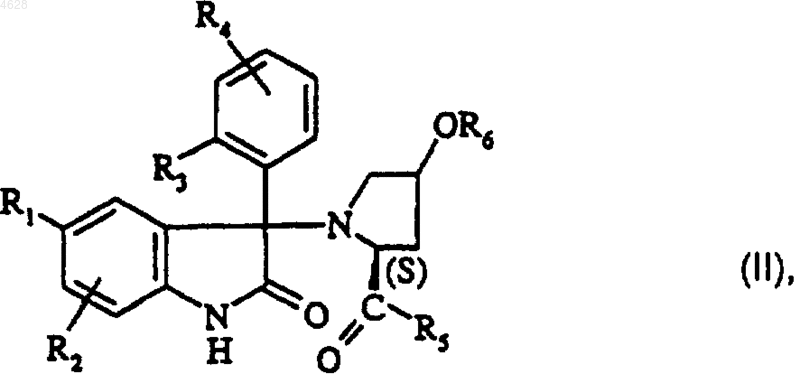
где R1 представляет собой атом галогена; (C1-C4)алкил; (C1-C4)алкокси; трифторметильный радикал; трифторметокси радикал;
R2 представляет собой атом водорода; атом галогена; (C1-C4)алкил; (C1-C4)алкокси; трифторметильный радикал;
или R2 находится в положении -6- индол-2-онового кольца и R1 и R2 вместе представляют собой двухвалентный триметиленовый радикал;
R3 представляет собой атом галогена; гидроксил; (C1-C4)алкил; (C1-C2)алкокси; трифторметокси радикал;
R4 представляет собой атом водорода; атом галогена; (C1-C4)алкил; (C1-C2)алкокси;
или R4 находится в положении -3- фенила и R3 и R4 вместе представляют собой метилендиокси радикал;
R5 представляет собой этиламиногруппу; диметиламиногруппу; азетидин-1-ильный радикал; (C1-C2)алкокси;
R6 представляет собой атом водорода; (C1-C4)алкил; группу -(CH2)n-CO-R9; группу -CO-(CH2)n-NR10R11;
R9 представляет собой гидроксил; (C1-C4) алкокси; группу -NR12R13;
R10 и R11, каждый независимо, представляет собой (C1-C4)алкил
или R10 и R11 вместе с атомом азота, к которому они присоединены, образуют гетероциклический радикал, выбранный из азетидин-1-ила, пирролидин-1-ила, пиперид-1-ила, пиперазин-1-ила, морфолин-4-ила или тиоморфолин-4-ила;
R12 представляет собой водород или (C1-C4)алкил;
R13 представляет собой (C1-C4)алкил; группу -C(CH3)2CH2OH; группу
-C(CH3)(CH2OH)2; группу -C(CH2OH)3
или R12 и R13, вместе с атомом азота, к которому они присоединены, образуют гетероциклический радикал, выбранный из азетидин-1-ила, пирролидин-1-ила, пиперид-1-ила, пиперазин-1-ила, морфолин-4-ила или тиоморфолин-4-ила;
n равен 1 или 2;
и его соли минеральных или органических кислот в виде оптически чистого изомера или в виде смеси диастереоизомеров.
9. Фармацевтическая композиция, содержащая в качестве активного начала соединение по любому из пп.1-6, его фармацевтически приемлемые соли минеральных или органических кислот и их фармацевтически приемлемые сольваты и/или гидраты.
10. Применение соединения по любому из пп.1-6, его фармацевтически приемлемых солей минеральных или органических кислот и их фармацевтически приемлемых сольватов и/или гидратов для изготовления лекарственных продуктов, предназначенных для лечения любой патологии, в которую вовлечены V1b-рецепторы или и V1b-, и V1a-рецепторы аргинин-вазопрессина.
11. Лекарство, отличающееся тем, что оно включает в качестве активного начала соединение формулы I по любому из пп.1-6.
Текст
1 Настоящее изобретение относится к новым производным 1,3-дигидро-2 Н-индол-2-она, к процессу их получения и к фармацевтическим композициям, содержащим их. Соединения по настоящему изобретению обладают аффинностью и селективностью по отношению к V1b-рецепторам или по отношению и к V1b-, и к V1a-рецепторам аргининвазопрессина (AVP).AVP представляет собой гормон, который известен по его антидиуретическому эффекту и его действию в регулировании артериального давления. Он стимулирует несколько типов рецепторов: V1 (V1a, V1b), V2. Эти рецепторы локализованы, в частности, в печени, сосудах (коронарных, почечных и сосудах головного мозга),тромбоцитах, почках, матке, надпочечниках,поджелудочной железе, центральной нервной системе и гипофизе. Таким образом, AVP оказывает влияние на сердечно-сосудистую систему, печень, поджелудочную железу, вызывает антидиуретический эффект и агрегацию тромбоцитов и воздействует на центральную и периферическую нервную систему и на область матки. Локализация различных рецепторов описана в: S. Jard et al., Vasopressin and oxytocin receptors: an overview, in Progress in Endocrinology;H. Imura and K. Shizurne ed., Experta Medica,Amsterdam, 1988, 1183-1188; а также в следующих статьях: J. Lab. Clin. Med., 1989, 114, (6),617-632; и Pharmacol. Rev., 1991, 43(1), 73-108. В частности, V1a-рецепторы AVP локализованы во многих периферических органах и в мозге. Они были клонированы у крыс и человека, и они регулируют большинство известных эффектов AVP: агрегацию тромбоцитов; сокращения матки; сокращение кровеносных сосудов; секрецию альдостерона, кортизола, CRF (кортикотропин-высвобождающего фактора) и адренокортикотропного гормона (АКТГ); печеночный гликогенолиз; клеточную пролиферацию и основные эффекты AVP, связанные с центральной нервной системой (гипотермия, память и так далее).V1b-рецепторы первоначально были идентифицированы в аденогипофизе различных видов животных (крыс, свиней, коров, овец и так далее), в том числе у человека (S. Jard et al., Mol.De Keyser et al., FEBS Letters, 1994, 356, 215220), у которых они стимулируют высвобождение адренокортикотропного гормона посредством AVP и усиливают действие CRF на высвобождение АКТГ (G.E. Gillies et al., Nature, 1982,299, 355). В гипоталамусе V1b-рецепторы также индуцируют непосредственное высвобождениеCRF (Neuroendocrinology, 1994, 60, 503-508) и в этих многих отношениях вовлечены в стрессовые ситуации.situ, ПЦР [полимеразная цепная реакция] и так далее) показано повсеместное присутствие этих рецепторов во многих центральных тканях (в частности, в мозге, гипоталамусе и аденогипофизе) и периферических тканях (почке, поджелудочной железе, надпочечниках, сердце, легких, кишечнике, желудке, печени, брыжейке,мочевом пузыре, тимусе, селезенке, матке, сетчатке, щитовидной железе и так далее) и в некоторых опухолях (гипофизарных, легочных и так далее), подтверждая важную биологическую и/или патологическую роль этих рецепторов и потенциальное вовлечение во многие заболевания. Например, исследования показали, что у крыс AVP регулирует эндокринную поджелудочную железу посредством V1b-рецепторов,стимулируя секрецию инсулина и глюкагона (В.Lee et al., Am. J. Physiol. 269 (Endocrinol. Metab. 32): E1095-E1100, 1995) или выработку катехоламинов в мозговом веществе надпочечника,которое является областью локального синтезаAVP (Е. Grazzini et al., Endocrinology, 1996,137(a), 3906-3914). Таким образом, считают, что в последней ткани через эти рецепторы AVP играет ключевую роль в некоторых типах феохромоцитом надпочечников, которые секретируют AVP и тем самым индуцируют непрерывную выработку катехоламинов, которые являются причиной гипертензии, и которые являются устойчивыми к антагонистам ангиотензин-IIрецептора и к ингибиторам превращения фермента. Кора надпочечников также богата V1aрецепторами, вовлекаемыми в выработку глюкокортикоидов и минералокортикоидов (альдостерона и кортизола). Через эти рецепторы AVP(циркулируемый или локально синтезированный) может индуцировать выработку альдостерона с эффективностью, которая сравнима с эффективностью ангиотензина II (G. Guillon etal., Endocrinology, 1995, 136(3), 1285-1295). Кортизол является мощным регулятором продуцирования АКТГ, гормона стресса. Последние исследования также показали,что надпочечники способны к непосредственному высвобождению CRF и/или АКТГ через активирование V1b-и/или V1a-рецепторов, которые имеются на медуллярных клетках (G. Mazzocchi et al., Peptides, 1997, 18(2), 191-195; E.V1b-рецепторы также рассматривают в качестве метки для АКТГ-секретирующих опухо 3 лей, таких как некоторые опухоли гипофиза,некоторые бронхиальные карциномы (МКРЛ[мелкоклеточный рак легкого]), карциномы поджелудочной железы, надпочечников и щитовидной железы, индуцирующих в некоторых случаях синдром Кушинга (J. Bertherat et al.,Eur. J. Endocrinol., 1996, 135. 173; G. A. Wittert etal., Lancet, 1990, 335, 991-994; G. Dickstein et al.,J. Clin. Endocrinol. Metab., 1996, 81 (8), 29342941). Что касается V1a-рецепторов, то они являются более специфичной меткой мелкоклеточного рака легкого (МКРЛ) (P.J. Woll et al.,Biochem. Biophys. Res. Commun., 1989, 164(1). 66-73). Таким образом, соединения по настоящему изобретению являются очевидными диагностическими средствами и предлагают новый терапевтический подход в пролиферации и обнаружении этих опухолей даже на ранней стадии (радиоактивное мечение; SPECT [однофотонная эмиссионная компьютерная томография]; PET scan [сканирующая позитронноэмиссионная томография]). Избыточное присутствие переносчика V1bрецептора в желудке и кишечнике подтверждает вовлечение AVP через этот рецептор в высвобождение желудочно-кишечных гормонов, таких как холецистокинин, гастрин или секретин(Т. Sugimoto et al., Molecular cloning and functional expression of V1b receptor gene, Neurohypophysis: Recent Progress of Vasopressin and Oxytocin Research; T. Saito, K. Kurokawa and S. Yoshida ed., Elvesier Science, 1995, 409-413). Производные 1,3-дигидро-2H-индол-2-она описаны в некоторых заявках на патент в качестве лигандов рецепторов аргинин-вазопрессина и/или лигандов рецепторов окситоцина: заявки на патент WO 93/15051, ЕР-А-0 636608, ЕР-А-0 636609, WO 95/18105, WO 97/15556 и WO 98/25901. До настоящего времени не было известно непептидное соединение, обладающее аффинностью и селективностью по отношению к V1bрецепторам или одновременно по отношению и к V1b-, и к V1a-рецепторам аргинин-вазопрессина. Теперь найдены новые производные 1,3 дигидро-2H-индол-2-она, которые обладают аффинностью и селективностью по отношению к V1b-рецепторам или по отношению и к V1b-, и к V1 а-рецепторам аргинин-вазопрессина. Эти соединения можно применять для изготовления лекарственных продуктов, которые полезны в лечении или предупреждении любой патологии, в которую вовлечены аргининвазопрессин и/или V1b-рецепторы, или и V1bрецепторы, и V1a-рецепторы, в частности, в лечении или предупреждении болезней сердечнососудистой системы, например гипертензии; центральной нервной системы, например стресса, тревоги, обессивно-компульсивного расстройства и панических атак; почечной системы; желудочной системы, а также в лечении 4 мелкоклеточного рака легкого; ожирения; диабета II типа; инсулинорезистентности; гипертриглицеридемии; атеросклероза; синдрома Кушинга; любой патологии вследствие стресса и хронических стрессовых состояний. Таким образом, в соответствии с одним из аспектов данного изобретения, одной из задач настоящего изобретения являются соединения формулыR1 представляет собой атом галогена; (С 1 С 4)алкил; (С 1-С 4)алкокси; трифторметильный радикал; трифторметокси радикал;R2 представляет собой атом водорода; атом галогена; (С 1-С 4)алкил; (С 1-С 4)алкокси; трифторметильный радикал; или R2 находится в положении -6- индол-2 онового кольца, и R1 и R2 вместе представляют собой двухвалентный триметиленовый радикал;R3 представляет собой атом галогена; гидроксил; (С 1-С 2)алкил; (С 1-С 2)алкокси; трифторметокси радикал;R4 представляет собой атом водорода; атом галогена; (С 1-С 2)алкил; (С 1-С 2)алкокси; или R4 находится в положении -3- фенила, и R3 и R4 вместе представляют собой метилендиокси радикал;R6 представляет собой атом водорода; (С 1 С 4)алкил; группу -(CH2)n-CO-R9; группу -CO(CH2)n-NR10R11;R12 представляет собой водород или (С 1 С 4)алкил;n равен 1 или 2; а также их сольваты и/или гидраты и их возможные соли минеральных или органических кислот. Термин "атом галогена" означает атом хлора, брома, фтора или йода. Термины "алкил" и "алкокси" означают линейный или разветвленный алкильный радикал или алкокси радикал, соответственно. Соединения формулы (I) содержат по меньшей мере 3 ассиметрических атома углерода, атом углерода, несущий заместитель COR5,имеет (S)-конфигурацию, и атом углерода, несущий заместитель OR6, имеет либо (R)конфигурацию, либо (S)-конфигурацию. Оптически чистые изомеры соединений формулы (I) и их смеси во всех соотношениях входят в объем данного изобретения. Соли обычно получают из фармацевтически приемлемых кислот, но соли других кислот,которые полезны для очистки или выделения соединений формулы (I), также входят в объем данного изобретения. Например, фармацевтически приемлемыми солями соединений формулы(I) являются гидрохлорид, гидробромид, сульфат, гидросульфат, дигидрофосфат, метансульфонат, бензолсульфонат, нафталинсульфонат,пара-толуолсульфонат, малеат, фумарат, сукцинат, цитрат, ацетат, глюконат или оксалат. Согласно настоящему изобретению предпочтительными соединениями формулы (I) являются соединения, гдеR1 представляет собой атом галогена; (С 1 С 4)алкил; трифторметильный радикал; трифторметокси радикал;R2 представляет собой атом водорода; атом галогена; (С 1-С 4)алкил; (C1-С 4)алкокси; трифторметильный радикал; или R2 находится в положении -6- индол-2 онового кольца, и R1 и R2 вместе представляют собой двухвалентный триметиленовый радикал;R3 представляет собой атом галогена; гидроксил; (С 1-С 2)алкокси;R4 представляет собой атом водорода; атом галогена; (С 1-С 2)алкил; (C1-С 2)алкокси; или R4 находится в положении -3- фенила,и R3 и R4 вместе представляют собой метилендиокси радикал;R6 представляет собой атом водорода; (С 1 С 4)алкил;R8 представляет собой (С 1-С 4)алкокси; а также их сольваты и/или гидраты и их возможные соли минеральных или органических кислот. Согласно настоящему изобретению соединения формулы (I), где R1 представляет собой 6 атом хлора, метильный радикал или трифторметокси радикал, являются предпочтительными. Согласно настоящему изобретению соединения формулы (I), где R2 представляет собой атом водорода или находится в положении -6 индол-2-она и представляет собой атом хлора,метильный радикал, метокси радикал или трифторметокси радикал, являются предпочтительными. Согласно настоящему изобретению соединения формулы (I), где R3 представляет собой атом хлора, атом фтора, метокси радикал, этокси радикал или трифторметокси радикал, являются предпочтительными. Согласно настоящему изобретению соединения формулы (I), где R4 представляет собой атом водорода или находится в положении -3 или -4-фенила и представляет собой атом фтора или метокси радикал; или R4 находится в положении -3- фенила и, вместе с R3, представляет собой метилендиокси радикал, являются предпочтительными. Согласно настоящему изобретению соединения формулы (I), где R5 представляет собой диметиламиногруппу, азетидин-1-ильный радикал или метокси радикал, являются предпочтительными. Согласно настоящему изобретению соединения формулы (I), где R6 представляет собой атом галогена, метильный радикал, этильный радикал, трет-бутоксикарбонилметильный радикал, карбоксиметильный радикал, 2-гидрокси-1-(гидроксиметил)-1-метилэтил]амино] карбонилметильный радикал, (1-пиперазинил) карбонилметильный радикал, (4-морфолинил)- карбонилметильный радикал или 3-(4-морфолинил)пропаноильный радикал, являются предпочтительными. Согласно настоящему изобретению соединения формулы (I), где R7 находится в положении -2- или -3- фенила и представляет собой метокси радикал, являются предпочтительными. Согласно настоящему изобретению соединения формулы (I), где R8 представляет собой метокси радикал, являются предпочтительными. Согласно настоящему изобретению соединения формулы (I) в виде оптически чистых изомеров являются предпочтительными. Особенно предпочтительными являются оптически чистые изомеры соединений формулы где R1, R2, R3, R4, R5, R6, R7 и R8 являются такими, как определено для соединения формулы (I),атом углерода, несущий заместитель OR6, имеет(R)конфигурацию, либо (S)-конфигурацию. Левовращающий изомер соединений формулы (Iа) является более предпочтительным. Наиболее предпочтительными являются левовращающие изомеры соединений формулыR1 представляет собой атом хлора, метильный радикал или трифторметокси радикал;R2 представляет собой атом водорода или находится в положении -6- индол-2-она и представляет собой атом хлора, метильный радикал,метокси радикал или трифторметильный радикал;R3 представляет собой атом хлора, атом фтора, метокси радикал или этокси радикал;R4 представляет собой атом водорода или находится в положении -3- или -4- фенила и представляет собой атом фтора или метокси радикал; или R4 находится в положении -3- фенила и, вместе с R3, представляет собой метилендиокси радикал;R5 представляет собой диметиламино радикал или метокси радикал;R6 представляет собой атом водорода; метильный радикал; этильный радикал; третбутилоксикарбонилметильный радикал; карбоксиметильный радикал; 2-гидрокси-1-(гидроксиметил)-1-метилэтил]амино]карбонилметильный радикал; (1-пиперазинил)карбонилметильный радикал; (4-морфолинил)карбонилметильный радикал; 3-(4-морфолинил)пропаноильный радикал;R7 находится в положении -2-фенила и представляет собой метокси радикал;R8 представляет собой метокси радикал; а также их соли минеральных или органических кислот, и их сольваты и/или гидраты. Наиболее предпочтительными являются следующие соединения: -(2S,4R)-1-[5-xлop-1[(2,4-димeтoкcифeнил)cyльфoнил]-3-(2-мeтoкcифeнил)-2-оксо-2,3-дигидро-1H-индол-3-ил]-4 гидрокси-N,N-диметил-2-пирролидинкарбоксамид, левовращающий изомер;(3R,5S)-1-[5-хлор-1-[(2,4-диметоксифенил) сульфонил]-3-(2-метоксифенил)-2-оксо-2,3 дигидро-1 Н-индол-3-ил]-5-[(диметиламино) карбонил]-3-пирролидинил 3-(4-морфолинил) пропаноат, левовращающий изомер; а также их возможные соли минеральных или органических кислот и их сольваты и/или гидраты. В соответствии с другим аспектом изобретения задачей настоящего изобретения является способ получения соединений формулы (I), их возможных солей минеральных или органических кислот и их сольватов и/или гидратов, отличающийся тем, что соединение формулы где R1, R2, R3, R4, R5 и R6 являются такими, как определено для соединения формулы (I), подвергают взаимодействию с галогенидом формулы где R7 и R8 являются такими, как определено для соединения формулы (I), и Hal представляет собой атом галогена, в присутствии основания. Соединение формулы (I) возможно превращают в его соль минеральных или органических кислот. Реакцию осуществляют в присутствии сильного основания, например, гидрида металла, такого как гидрид натрия, или алкоголята щелочного металла, такого как трет-бутилат калия, в безводном растворителе, таком какN,N-диметилформамид или тетрагидрофуран, и при температуре между -70 и +60 С. Реакцию предпочтительно осуществляют с использованием соединения формулы (III), где Hal = Cl. Соединение формулы (I), где R6 представляет собой (С 1-С 4)алкил, также может быть получено путем осуществления взаимодействия соединения формулы (I), где R6 представляет собой водород, с (С 1-С 4)алкилгалогенидом в присутствии основания, такого как гидрид металла, в инертном растворителе, таком как N,Nдиметилформамид или тетрагидрофуран, в соответствии с традиционными способами. Соединение формулы (I), где R6 представляет собой группу -(СН 2)n-СО-R9, где R9 представляет собой гидроксил, предпочтительно получают путем гидролиза соединения формулы (I), где R6 представляет собой группу 11 кислота или соляная кислота, в растворителе,таком как дихлорметан или диоксан, и при температуре от 0 С до комнатной температуры. Соединение формулы (I), где R6 представляет собой группу -(СН 2)n-СО-R9, где R9 представляет собой группу -NR12R13, предпочтительно получают путем осуществления взаимодействия соединения формулы (I), где R9 представляет собой гидроксил, с амином формулыH-NR12R13 в соответствии с традиционными способами пептидного сочетания. Полученные таким образом соединения формулы (I) могут быть затем отделены от реакционной среды и очищены традиционными способами, например, путем кристаллизации или хроматографии. Полученные таким образом соединения формулы (I) выделяют в виде свободного основания или в виде соли в соответствии с традиционными методиками. Если соединения формулы (I) получают в виде свободного основания, то солеобразование осуществляют путем обработки выбранной кислотой в органическом растворителе. Путем обработки свободного основания, растворенного, например, в эфире, таком как диэтиловый эфир, или в спирте, таком как 2-пропанол, или в ацетоне, или в дихлорметане, или в этилацетате,или в ацетонитриле, раствором выбранной кислоты в одном из вышеупомянутых растворителей, получают соответствующую соль, которую выделяют в соответствии с традиционными методиками. Таким образом получают, например, гидрохлорид, гидробромид, сульфат, трифторацетат, гидросульфат, дигидрофосфат, метансульфонат, оксалат, малеат, сукцинат, фумарат, 2 нафталинсульфонат, бензолсульфонат, ларатолуолсульфонат, глюконат, цитрат или ацетат. После завершения реакции соединения формулы (I) могут быть выделены в виде их соли, например гидрохлорида или оксалата; в этом случае, если необходимо, свободное основание может быть получено путем нейтрализации указанной соли минеральным или органическим основанием, таким как гидроксид натрия или триэтиламин, или карбонатом либо бикарбонатом щелочного металла, таким как карбонат либо бикарбонат натрия или калия. Соединения формулы (II) получают путем осуществления взаимодействия соединения 3 галоген-1,3-дигидро-2 Н-индол-2-она формулы где R1, R2, R3 и R4 являются такими, как определено для соединения формулы (I), и Hal представляет собой атом галогена, предпочтительно хлора или брома, с соединением формулы где R5 и R6 являются такими, как определено для соединения формулы (I). Реакцию проводят в присутствии основания, такого как диизопропилэтиламин или триэтиламин, в инертном растворителе, таком как дихлорметан или тетрагидрофуран, или в смеси этих растворителей, и при температуре от комнатной температуры до температуры дефлегмации растворителя. Соединения формулы (III) являются известными, или их получают известными способами, такими как способы, раскрытые в ЕР-В-0 469984 и WO 95/18105. Например, соединения формулы (III) могут быть получены путем галогенирования соответствующих бензолсульфоновых кислот или их солей, например их натриевых или калиевых солей. Реакцию проводят в присутствии галогенирующего агента, такого как оксихлорид фосфора, тионилхлорид, хлорид фосфора (III), бромид фосфора (III) или хлорид фосфора (V), без растворителя или в инертном растворителе, таком как галогензамещенный углеводород или N,N-диметилформамид, и при температуре от -10 до 200 С. 2,4-Диметоксибензолсульфонилхлорид получают согласно J. Am. Chem. Soc, 1952, 74,2008. 3,4-Диметоксибензолсульфонилхлорид имеется в продаже или его получают согласно J.Med. Chem., 1977, 20(10), 1235-1239. Соединения формулы (IV) являются известными, и их получают согласно известным способам, таким как способы, раскрытые в WO 95/18105. Например, соединение формулы: где R1, R2, R3 и R4 являются такими, как определено для соединения формулы (I), превращают в соединение формулы (IV), где Hal = Cl, путем воздействия тионилхлорида в присутствии основания, такого как пиридин, в инертном растворителе, таком как дихлорметан, и при температуре от 0 С до комнатной температуры. Согласно другому примеру, для получения соединений формулы (IV), соединение формулы где R1, R2, R3 и R4 являются такими, как определено для соединения формулы (I), превращают в соединение формулы (IV) посредством галогенирующего агента, такого как бром, в соответствии со способом, раскрытым в Farm. Zh. 13 Соединения формулы (VI) являются известными, и их получают согласно известным способом, таким как способы, раскрытые в WO 95/18105. Например, соединение формулы (VI) получают путем осуществления взаимодействия производного 1 Н-индол-2,3-диона формулы(С 1-С 2)алкокси с R4 в положении -3- или -6- фенила, R2 является отличным от атома галогена, иR1 является таким, как определено для соединения формулы (I), могут быть получены следующим способом, описанным на схеме 1. Схема 1 где R1 и R2 являются такими, как определено для соединения формулы (I), с магнийорганическим производным формулы где R3 и R4 являются такими, как определено для соединения формулы (I), и Hal представляет собой атом галогена, предпочтительно брома или йода, в инертном растворителе, таком как тетрагидрофуран или диэтиловый эфир. Также можно получить соединение формулы (VI), где R3 является таким, как определено для соединения формулы (I), и R4, который является отличным от водорода, находится в положении -3- или -6- фенила, путем осуществления взаимодействия соединения формулы: где R3 является таким, как определено для соединения формулы (I), и R4 находится в положении -2- или -5- фенила, с производным лития,таким как н-бутиллитий, а полученное таким образом литиевое промежуточное соединение затем подвергают взаимодействию с соединением формулы (VIII). Реакцию проводят в растворителе, таком как диэтиловый эфир, тетрагидрофуран или гексан, или в смеси этих растворителей при температуре от -70 С до комнатной температуры. Производные 1 Н-индол-2,3-диона (VIII) имеются в продаже, или их получают согласно способам, раскрытым в Tetrahedron Letters,1998, 39, 7679-7682; Tetrahedron Letters, 1994,35, 7303-7306; J. Org. Chem., 1977, 42(8), 13441348; J. Org. Chem., 1952, 17, 149-156; J. Am.Chemistry, A.R. Katritzky and A.J. Boulton, Academic Press, New York, 1975,18, 2-58. Магнийорганические производные (IX) получают традиционными способами, которые хорошо известны специалистам в данной области техники. Соединения формулы (XVII) являются известными, или их получают известными способами. Соединение формулы (VI) также может быть получено путем окисления кислородом воздуха соединения формулы (VII) в присутствии основания, такого как гидрид натрия, и в присутствии диметилдисульфида.(X) сначала подвергают взаимодействию с производным лития, таким как н-бутиллитий, в отсутствие или в присутствии основания, такого как N,N,N',N'-тетраметилендиамин, и полученное таким образом литиевое промежуточное соединение затем подвергают взаимодействию с диэтилоксалатом с получением соединения формулы (XI). Реакцию проводят в инертном растворителе, таком как диэтиловый эфир, тетрагидрофуран или гексан, или в смеси этих растворителей и при температуре от -70 С до комнатной температуры. На стадии b1 соединение формулы (XII) сначала подвергают взаимодействию с двумя эквивалентами производного лития, такого как трет-бутиллитий, и полученное таким образом литиевое промежуточное соединение затем подвергают взаимодействию с соединением формулы (XI) с получением ожидаемого соединения формулы (VI). Реакцию проводят в инертном растворителе, таком как диэтиловый эфир, тетрагидрофуран или пентан, или в смеси этих растворителей и при температуре от -70 С до комнатной температуры. Соединения формулы (X) имеются в продаже, или их синтезируют согласно традиционным способам. Соединения формулы (XII) получают путем осуществления взаимодействия соответствующих производных анилина с ди-третбутилдикарбонатом согласно традиционным способам. Соединения формулы (VII) являются известными, и их получают согласно известным способам, таким как способы, раскрытые в WO 95/18105 или в J. Org. Chem., 1968, 33, 16401643. 15 Соединения формулы (V), где R5 представляет собой (С 1-С 2)алкокси, и R6 = Н, имеются в продаже. Соединения формулы (V), где R5 представляет собой (С 1-С 2)алкокси, и R6 = (С 1-С 4) алкил, являются известными, или их получают известными способами, такими как способы,раскрытые в J. Med. Chem., 1988, 31, 875-885,начиная с (2S,4R)- или (2S,4S)-4-гидроксипирролидин-2-карбоновой кислоты с защищенным атомом азота пирролидина. Соединения формулы (V), где R5 представляет собой этиламино- или диметиламиногруппу либо азетидин-1-ильный радикал, и R6 = Н или (С 1-С 4)алкил, получают согласно схеме 2,приведенной ниже, где Рr представляет собойN-защитную группу, в частности бензилоксикарбонил или трет-бутоксикарбонил. Схема 2 На стадии а 2 схемы 2 атом азота 4(R)- или 4(S)-гидрокси-(S)-пролина защищают согласно традиционным способам с получением соединения формулы (XIII). Кислоту (XIII) на стадии b2 подвергают взаимодействию с этиламином, диметиламином или азетидином согласно традиционным способам пептидного сочетания с образованием соединения (XIV), у которого удаляют защитную группу согласно известным способам с образованием соединения формулы (V), где R6 = Н. На стадии d2 соединение (XIV) можно подвергнуть взаимодействию с (C1-С 4) алкилгалогенидом в присутствии основания, такого как гидрид металла, или карбоната щелочного металла либо карбоната щелочно-земельного металла, такого как K2 СО 3 или Cs2CO3, в инертном растворителе, таком как тетрагидрофуран илиN,N-диметилформамид, и при температуре от 0 С до температуры дефлегмации растворителя с образованием соединения (XV). Также взаимодействие соединения (XIV) с 16 условиях межфазного катализа в присутствии основания, такого как гидроксид щелочного металла, например гидроксид натрия, и катализатора фазового переноса, такого как соль замещенного четвертичного аммониевого основания, например гидросульфат тетрабутиламмония, в инертном растворителе, таком как дихлорметан или бензол, в виде смеси с водой. Удаление N-защитной группы с соединения (XV) приводит на стадии e2 к образованию соединений формулы (V), где R6 = (С 1-С 4)алкил. Альтернативно, на стадии f2 гидроксильную группу соединения (XIII) алкилируют путем осуществления взаимодействия с (С 1-С 4) алкилгалогенидом в условиях стадии d2, а полученную таким образом кислоту (XVI) на стадииg2 подвергают взаимодействию с этиламином,диметиламином или азетидином согласно традиционным способам пептидного сочетания с образованием соединения (XV).(2S,4R)- и (2S,4S)-4-гидроксипирролидин 2-карбоновые кислоты имеются в продаже. Соединения формулы (V), где R5 представляет собой этиламиногруппу, диметиламиногруппу, азетидин-1-ильный радикал или (С 1 С 2)алкокси, и R6 = -(CH2)n-CO-R9, где n равен 1 или 2, и R9 представляет собой (С 1-С 4)алкокси,получают согласно схеме 3, приведенной ниже,где Рr представляет собой N-защитную фуппу, в частности бензилоксикарбонил или тpeтбутоксикарбонил. Схема 3Hal-(CH2)n-COR9, где Hal представляет собой атом галогена, предпочтительно хлора или брома, n равен 1 или 2, и R9 представляет собой (С 1 С 4)алкокси. Реакцию проводят в условиях, описанных выше для стадии d2 схемы 2, с образованием соединения (XIX). Удаление N-защитной группы с соединения (XIX) приводит на стадии b3 к образованию ожидаемых соединений (V). Соединения формулы (V), где R5 является таким, как определено для соединения формулыR9 представляет собой гидроксил, получают путем кислотного гидролиза соединения формулы(XIX), где R9 представляет собой тpeт-бутокси,и Рг представляет собой бензилоксикарбонил. Реакцию проводят с использованием сильной кислоты, такой как трифторуксусная кислота или соляная кислота, в растворителе, таком как дихлорметан или диоксан, и при температуре от 0 С до комнатной температуры. Удаление Nзащитной группы согласно традиционным спо 17 собам приводит к образованию ожидаемых соединений (V). Соединения формулы (V), где R5 является таким, как определено для соединения формулыR9 представляет собой группу -NR12R13, получают путем осуществления взаимодействия соответствующего соединения, где R9 представляет собой гидроксил, и атом азота пирролидина является защищенным, с амином HNR12R13 согласно традиционным способам пептидного сочетания. Удаление N-защитной группы согласно традиционным способам приводит к образованию ожидаемых соединений (V). Соединения формулы (V), где R5 представляет собой этиламиногруппу, диметиламиногруппу, азетидин-1-ильный радикал или (С 1 С 2)алкокси, и R6 = -CO-(CH2)n-NR10R11, где n равен 1 или 2, a R10 и R11 являются такими, как определено для соединения формулы (I), получают согласно cхеме 4, приведенной ниже, где Рr представляет собой N-защитную группу, в частности бензилоксикарбонил или третбутоксикарбонил. Схема 4(XVIII) подвергают взаимодействию с соединением формулы Наl-СО-(СН 2)n-Наl', где Hal и Наl' каждый независимо представляет собой атом галогена, предпочтительно хлора или брома, и n равен 1 или 2. Реакцию проводят в присутствии основания, такого как триэтиламин или диизопропилэтиламин, в растворителе, таком как дихлорметан или тетрагидрофуран, и при температуре от 0 С до температуры дефлегмации растворителя. На стадии b4 осуществление взаимодействия полученного таким образом соединения(XX) с соединением формулы HNR10R11 приводит к образованию соединения формулы (XXI). Реакцию проводят в присутствии основания,такого как триэтиламин или N,N-диизопропилэтиламин, или с использованием избытка соединения HNR10R11, в растворителе, таком как дихлорметан или тетрагидрофуран, и при температуре от 0 С до температуры дефлегмации растворителя. Удаление N-защитной группы с соединения (XXI) приводит на стадии с 4 к образованию ожидаемого соединения формулы (V). В частности, соединение формулы (V), где 18 может быть получено согласно схеме 5, приведенной ниже, где Рr представляет собой Nзащитную группу, в частности бензилоксикарбонил или трет-бутоксикарбонил. Схема 5(XVIII) подвергают взаимодействию с хлорангидридом акриловой кислоты в условиях, описанных выше для стадии а 4 схемы 4, с образованием соединения формулы (XXII). На стадии b5 взаимодействие соединения(XXIII). Реакцию проводят в присутствии хлорида железа(III) в растворителе, таком как дихлорметан, и при температуре от комнатной температуры до температуры дефлегмации растворителя. Удаление N-защитной группы с соединения (XXIII) приводит на стадии с 5 к образованию ожидаемого соединения формулы (V). Если требуется получить оптически чистое соединение формулы (I), то оптически чистое соединение формулы (II) предпочтительно подвергают взаимодействию с соединением формулы (III) согласно способу по настоящему изобретению. Оптически чистые соединения формулы(II) получают путем осуществления взаимодействия рацемического соединения формулы (IV) с оптически чистым соединением формулы (V),с последующим разделением смеси диастереоизомеров согласно традиционным способам, например, путем кристаллизации или хроматографии. Альтернативно, смесь диастереоизомеров соединения формулы (II) может быть подвергнута взаимодействию с соединением формулы(III), и полученная таким образом смесь диастереоизомеров соединения формулы (I) может быть разделена. Во время любой из стадий получения соединений формулы (I) или промежуточных соединений формулы (II), (IV), (V) или (VI), может быть необходимо и/или желательно защищать реакционноспособные или чувствительные функциональные группы, такие как аминогруппа, гидроксильная или карбоксильная группы,которые присутствуют в любой из описанных молекул. Такую защиту можно осуществлять с использованием традиционных защитных групп, таких как группы, описанные в ProtectiveP.G.M. Wuts, published by John WileySons,1991; или в Protective Groups, Kocienski P.J.,1994, Georg Thieme Verlag. Удаление защитных групп можно проводить на подходящей последующей стадии с использованием способов,известных специалистам в данной области техники, которые не оказывают влияния на остальные части описанных молекул. Возможно, используемыми N-защитными группами являются традиционные N-защитные группы, хорошо известные специалистам в данной области техники, такие как, например, тpeтбутоксикарбонильная, флуоренилметоксикарбонильная, бензильная, бензгидрилиденовая или бензилоксикарбонильная группа. Соединения формулы (II) являются новыми и входят в объем настоящего изобретения. Таким образом, согласно другому аспекту данного изобретения задачей изобретения являются соединения формулыR1 представляет собой атом галогена; (С 1 С 4)алкил; (С 1-С 4)алкокси; трифторметильный радикал; трифторметокси радикал;R2 представляет собой атом водорода; атом галогена; (С 1-С 4)алкил; (С 1-С 4)алкокси; трифторметильный радикал; или R2 находится в положении -6- индол-2 онового кольца, и R1 и R2 вместе представляют собой двухвалентный триметиленовый радикал;R3 представляет собой атом галогена; гидроксил; (С 1-С 2)алкил; (С 1-С 2)алкокси; трифторметокси радикал;R4 представляет собой атом водорода; атом галогена; (С 1-С 2)алкил; (С 1-С 2)алкокси; или R4 находится в положении -3- фенила,и R3 и R4 вместе представляют собой метилендиокси радикал;R6 представляет собой атом водорода; (С 1 С 4)алкил; группу -(CH2)n-CO-R9; группу -CO(CH2)n-NR10R11;R10 и R11 каждый независимо представляет собой (С 1-С 4)алкил; или R10 и R11, вместе с атомом азота, к которому они присоединены, образуют гетероциклический радикал, выбранный из азетидин-1 ила, пирролидин-1-ила, пиперид-1-ила, пиперазин-1-ила, морфолин-4-ила или тиоморфолин-4 ила;R12 представляет собой водород или (С 1 С 4)алкил;(СН 2 ОН)2; группу -С(СН 2 ОН)3; или R12 и R13, вместе с атомом азота, к которому они присоединены, образуют гетероциклический радикал, выбранный из: азетидин-1 ила, пирролидин-1-ила, пиперид-1-ила, пиперазин-1-ила, морфолин-4-ила или тиоморфолин-4 ила; n равен 1 или 2; а также их соли минеральных или органических кислот, в виде оптически чистых изомеров или в виде смеси диастереоизомеров. Соли соединений формулы (II) включают в себя соли минеральных или органических кислот, которые позволяют осуществить подходящее разделение или кристаллизацию соединений формулы (II), такие как гидрохлорид,гидробромид, оксалат, малеат, сукцинат, фумарат, цитрат или ацетат. Соединения формулы (I), упомянутые выше, также включают в себя соединения, в которых один или более чем один атом водорода или атом углерода замещены их радиоактивными изотопами, например тритием или углеродом 14. Такие меченые соединения полезны в исследованиях метаболизма или фармакокинетики, в биохимических анализах в качестве лигандов рецепторов. Соединения по данному изобретению были подвергнуты биохимическим исследованиям. Аффинность соединений формулы (I) по данному изобретению к V1b-рецепторам аргинин-вазопрессина определяли in vitro с использованием метода, описанного Y. De Keyser et al.,Febs Letters, 1994, 356, 215-220. Этот метод заключается в изучении in vitro вытеснения меченного тритием аргинин-вазопрессина ([3H]AVP), с Vib-рецепторов, которые присутствуют на крысиных или человеческих аденогипофизарных препаратах или препаратах клеточных мембран, несущих V1b-рецепторы. Концентрации соединений по данному изобретению, которые ингибируют 50% (IC50) связывания меченного тритием аргинин-вазопрессина, являются низкими и находятся в пределах от 10-6 до 10-9 М, в частности от 10-7 до 10-9 М. Аффинность соединений формулы (I) по данному изобретению к V1a-рецепторам аргинин-вазопрессина определяли in vitro с использованием метода, описанного М. Thibonnier etal., J. Biol. Chem., 1994, 269, 3304-3310. Этот метод заключается в изучении in vitro вытеснения меченного тритием аргинин-вазопрессина([3H]-AVP), с V1 а-рецепторов, которые присутствуют на крысиных или человеческих клеточных или мембранных препаратах, несущих V1 арецепторы. Среди соединений формулы (I), некоторые также обладают аффинностью к V1 арецепторам аргинин-вазопрессина со значения 21 ми IC50, находящимися в пределах от 10-6 до 10-9 М, в частности от 10-7 до 10-8 М. Также была изучена аффинность соединений формулы (I) по данному изобретению к V2 рецепторам вазопрессина (метод, описанный М.Birnbaumer et al., Nature (Lond.), 1992, 357, 333335). Изученные соединения обладали невысокой аффинностью или не обладали аффинностью к V2-рецепторам. Соединения по настоящему изобретению являются особенно активными началами фармацевтических композиций, токсичность которых совместима с их применением в качестве лекарственных продуктов. Согласно другому аспекту настоящее изобретение относится к применению соединений формулы (I) или их фармацевтически приемлемых соли, сольвата и/или гидрата для изготовления лекарственных продуктов, предназначенных для лечения любой патологии, в которую вовлечены аргинин-вазопрессин и/или его V1bрецепторы, или его и V1b-рецепторы, и V1aрецепторы. Согласно другому аспекту настоящее изобретение относится к применению соединений формулы (I) или их фармацевтически приемлемых соли, сольвата и/или гидрата для изготовления лекарственных продуктов, предназначенных для лечения патологий сердечно-сосудистой системы, центральной нервной системы, почечной системы или желудочной системы, а также мелкоклеточного рака легкого,ожирения, диабета II типа, инсулинорезистентности, гипертриглицеридемии, атеросклероза,синдрома Кушинга, всех патологий, связанных со стрессом, и хронических стрессовых состояний. Таким образом, соединения по данному изобретению можно применять у человека или животных для лечения или предупреждения различных вазопрессинзависимых заболеваний,таких как сердечно-сосудистые заболевания,например гипертензия, легочная гипертензия,сердечная недостаточность, инфаркт миокарда или коронарный вазоспазм, в частности, у курящих, болезнь Рейно, нестабильная стенокардия или РТСА (подкожная транслюминальная коронарная ангиопластика), сердечная ишемия,расстройства гемостаза; заболевания центральной нервной системы, такие как мигрень, церебральный вазоспазм, внутримозговое кровоизлияние, отек мозга, депрессия, тревога,стресс, обессивно-компульсивное расстройство,панические атаки, психотические состояния и нарушения памяти, например; заболевания почечной системы, такие как почечный вазоспазм,некроз коркового вещества почки, нефрогенный несахарный диабет; заболевания желудочной системы, такие как вазоспазм желудка, цирроз печени, язвы, рвотная патология, например тошнота, в том числе тошнота, вызванная химиотерапией и морской болезнью; диабетиче 004628 22 ская нефропатия. Соединения по данному изобретению также можно применять при лечении расстройств сексуального поведения; у женщин соединения по данному изобретению можно применять для лечения дисменореи или преждевременных родов. Соединения по данному изобретению также можно применять при лечении мелкоклеточного рака легких; гипонатриемических энцефалопатии; легочного синдрома,болезни Меньера; глаукомы, катаракт; ожирения; диабета II типа; атеросклероза; синдрома Кушинга; инсулинорезистентности; гипертриглицеридемии; при послеоперационном лечении,в частности после операции в брюшной полости. Соединения по данному изобретению также можно применять для лечения или предупреждения всех патологий, связанных со стрессом,таких как усталость и ее синдромы, АКТГзависимые расстройства, сердечные расстройства, боль, изменения в опорожнении желудка,фекальные выделения (колит, синдром раздраженной толстой кишки, болезнь Крона), секреция кислоты, гипергликемия, иммуносупрессия,воспалительные процессы (ревматоидный артрит и остеоартрит), разнообразные инфекции,злокачественные новообразования, астма, псориаз, аллергии и различные психоневрологические расстройства, такие как нервная анорексия,булимия, расстройства настроения, депрессия,тревога, расстройства сна, панические атаки,фобии, навязчивое состояние, нарушения восприятия боли (фибромиалгия), нейродегенеративные заболевания (болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона), зависимость от веществ, геморрагический стресс,мышечные спазмы и гипогликемия. Соединения по данному изобретению также можно применять для лечения или предупреждения хронических стрессовых состояний, таких как иммунодепрессия, нарушения способности к воспроизведению потомства и дисфункции системы гипоталамус-гипофиз-надпочечники. Соединения по данному изобретению также можно применять в качестве психостимуляторов, вызывая рост в самосознании и в эмоциональной реакции по отношению к окружающей среде и, кроме того, облегчая адаптацию. Соединения формулы (I), упомянутые выше, или их фармацевтически приемлемые соль,сольват и/или гидрат можно применять в суточных дозах от 0,01 до 100 мг на килограмм массы тела млекопитающего, которое лечат, предпочтительно в суточных дозах от 0,1 до 50 мг/кг. Для человека доза предпочтительно находится в пределах от 0,1 до 4000 мг в сутки, более предпочтительно от 0,5 до 1000 мг в зависимости от возраста человека, которого лечат, или типа лечения: профилактическое или целебное. Для применения в качестве лекарственных продуктов соединения формулы (I) обычно вводят в единицах дозировки. Указанные единицы 23 дозировки предпочтительно приготавливают в фармацевтических композициях, в которых активное начало смешивают с одним или более чем одним фармацевтическим эксципиентом. Таким образом, согласно другому аспекту настоящее изобретение относится к фармацевтическим композициям, содержащим в качестве активного начала соединение формулы (I) или его фармацевтически приемлемые соль, сольват и/или гидрат. В фармацевтических композициях по настоящему изобретению для перорального, подъязычного, ингаляционного, подкожного, внутримышечного, внутривенного, трансдермального, местного или ректального введения активные начала можно вводить животным и людям в стандартных лекарственных формах, смешанные с обычными фармацевтическими носителями. Подходящие стандартные лекарственные формы введения включают в себя пероральные формы, такие как таблетки, гелевые капсулы,порошки, гранулы и растворы или суспензии для перорального введения, формы для подъязычного и буккального введения, аэрозоли,формы для местного введения, имплантанты,формы для подкожного, внутримышечного,внутривенного, интраназального или внутриглазного введения и формы для ректального введения. Когда твердую композицию приготавливают в форме таблеток или гелевых капсул, то к активному началу, которое может быть тонко измельченным или не измельченным, добавляют смесь фармацевтических эксципиентов, которая может состоять из разбавителей, таких как, например, лактоза, микрокристаллическая целлюлоза, крахмал, гидрофосфат кальция, связывающих агентов, таких как, например, поливинилпирролидон или гидроксипропилметилцеллюлоза, разрыхлителей, таких как поперечносшитый поливинилпирролидон или поперечносшитая карбоксиметилцеллюлоза, агентов,повышающих текучесть, таких как диоксид кремния, тальк, смазывающих агентов, таких как стеарат магния, стеариновая кислота, глицерилтрибегенат или стеарилфумарат натрия. К фармацевтическому препарату могут быть добавлены смачивающие агенты или поверхностно-активные вещества, такие как лаурилсульфат натрия, полисорбат 80 или полоксамер 188. Таблетки могут быть приготовлены различными методиками, путем непосредственного таблетирования, сухого гранулирования, влажного гранулирования или сплавления. Таблетки могут быть простые или с сахарным покрытием (например, покрытые сахарозой), либо покрытые различными полимерами или другими подходящими материалами. Таблетки могут быть с непосредственным,отсроченным или пролонгированным высвобождением посредством создания полимерных 24 матриц или посредством использования специфических полимеров в пленочном покрытии. Гелевые капсулы могут быть твердыми или мягкими, с пленочным покрытием либо покрытые другим образом, так чтобы обладать непосредственным, пролонгированным или отсроченным действием (например, посредством энтеросолюбильной формы). Они могут содержать не только твердый препарат, приготовленный, как упомянуто выше для таблеток, но также жидкие или полутвердые препараты. Препарат в форме сиропа или эликсира может содержать активное начало вместе с подсластителем, предпочтительно бескалорийным подсластителем, метилпарабеном или пропилпарабеном в качестве антисептика, а также корригентом и подходящим красителем. Диспергируемые в воде порошки или гранулы могут содержать активное начало в виде смеси с диспергирующими, смачивающими или суспендирующими агентами, такими как поливинилпирролидон, а также с подсластителями или усилителями вкусо-ароматических свойств. Для ректального введения применяют суппозитории, которые приготавливают со связывающими агентами, плавящимися при ректальной температуре, например, какао-масло или полиэтиленгликоли. Водные суспензии, изотонические солевые растворы или стерильные растворы для инъекций, которые содержат фармакологически совместимые диспергирующие и/или солюбилизирующие агенты, например пропиленгликоль,применяют для парентерального, интраназального или внутриглазного введения. Таким образом, для приготовления водного раствора для внутривенной инъекции, можно применять сорастворитель, такой как, например,спирт, такой как этанол, или гликоль, такой как полиэтиленгликоль или пропиленгликоль, и гидрофильное поверхностно-активное вещество,такое как полисорбат 80 или полоксамер 188. Для приготовления масляного раствора для внутримышечной инъекции активное начало можно растворить в триглицериде или эфире глицерина. Для местного введения можно применять крема, мази, гели, глазные капли и спреи. Для трансдермального введения можно применять многослойные пластыри или пластыри с резервуаром, в котором активное начало может находиться в спиртовом растворе, и спреи. Для ингаляционного введения применяют аэрозоль, содержащий, например, сорбитантриолеат или олеиновую кислоту, а также трихлорфторметан, дихлорфторметан, дихлортетрафторэтан, заменители фреонов или любой другой биологически совместимый газообразный пропеллент; также можно применять систему, содержащую активное начало в отдельно 25 сти или в комбинации с эксципиентом, в форме порошка. Активное начало также может быть в виде комплекса с циклодекстрином, например, циклодекстрином или 2-гидроксипропил-циклодекстрином. Активное начало также может быть приготовлено в форме микрокапсул или микросфер,возможно с одним или более чем одним носителем или добавкой. Среди форм с пролонгированным высвобождением, которые полезны в случае длительных лечений, возможно применение имплантатов. Они могут быть приготовлены в форме масляной суспензии или в форме суспензии микросфер в изотонической среде. В каждой единице дозировки активное начало формулы (I) присутствует в количествах,соответствующих предусмотренным суточным дозам. Обычно каждая единица дозировки подходящим образом задается в соответствии с дозой и путем планируемого введения, например,таблетки, гелевые капсулы и тому подобное,саше, ампулы, сиропы и тому подобное, а также капли содержат от 0,1 до 1000 мг активного начала, предпочтительно от 0,5 до 250 мг, которые следует вводить от одного до четырех раз в сутки. Хотя эти дозы являются примерами обычных ситуаций, могут быть особенные случаи, в которых подходящими являются более высокие или более низкие дозы, и такие дозы также входят в объем данного изобретения. В соответствии с обычной практикой, дозу, подходящую для каждого пациента, определяет врач в соответствии со способом введения, возрастом, массой и реакцией указанного пациента. Композиции по настоящему изобретению могут содержать, вместе с соединениями формулы (I) или их фармацевтически приемлемыми солью, сольватом и/или гидратом, другие активные начала, которые могут быть полезными при лечении упомянутых выше расстройств или заболеваний. Таким образом, задачей настоящего изобретения также являются фармацевтические композиции, содержащие несколько активных начал в комбинации, одним из которых является соединение по данному изобретению. Таким образом, согласно настоящему изобретению могут быть приготовлены фармацевтические композиции, содержащие соединение по данному изобретению, объединенное с соединением,воздействующим наCRFрецепторы. Соединения по данному изобретению также можно применять для приготовления композиций для использования в ветеринарии. Подготовительные стадии и примеры, которые следуют ниже, иллюстрируют изобретение, однако не ограничивая его. 26 Следующие сокращения использованы в подготовительных стадиях и в примерах: эфир: диэтиловый эфир; изоэфир: диизопропиловый эфир; ДМФА: N,N-диметилформамид; ТГФ: тетрагидрофуран; ДХМ: дихлорметан; ЕtOАс: этилацетат; ДИПЭА: диизопропилэтиламин; ТФУ: трифторуксусная кислота; Воc: трет-бутоксикарбонил;PS-трисамин: трис-(2-аминоэтил)аминполистирол 1%, сшитый поперечными связями с дивинилбензолом, содержащий 3,62 миллимоль аминных функциональных групп на грамм смолы от Argonaut Technology; т.пл.: температура плавления; КТ: комнатная температура; т.кип.: температура кипения; ВЭЖХ: высокоэффективная жидкостная хроматография. Спектры протонного магнитного резонанса(1 Н ЯМР) регистрировали при 200 МГц в ДМСО-d6, используя пик для ДМСО-d6 в качестве стандарта. Химические сдвигивыражены в миллионных долях (ррm). Наблюдаемые сигналы обозначены следующим образом: s: синглет; bs: широкий синглет; d: дублет; dd: сдвоенный дублет; t: триплет; q: квартет; m: нерасщепленный пик; mt: мультиплет. Масс-спектры показывают величину МН+. Подготовительные стадии Получение соединений формулы (IV) Подготовительная стадия 1.1. 3,5-Дихлор 3-(2-метоксифенил)-1,3-дигидро-2H-индол-2-он.Hal = Cl. А) 5-Хлор-3-гидрокси-3-(2-метоксифенил)1,3-дигидро-2 Н-индол-2-он. Это соединение получают в соответствии с методикой, описанной в WO 95/18105. Раствор 2-метоксифенилмагнийбромида приготавливают из 16 г магния в 35 мл эфира и раствора 124 г 1-бром-2-метоксибензола в 175 мл эфира. Этот раствор добавляют по каплям в атмосфере аргона к предварительно охлажденной в ледяной бане смеси 30 г 5-хлор-1H-индол-2,3-диона в 250 мл ТГФ и затем смесь оставляют перемешиваться, давая возможность нагреться до КТ. После перемешивания при КТ в течение одного часа реакционную смесь медленно вливают в насыщенный раствор NH4Cl и под вакуумом выпаривают ТГФ. Образовавшийся осадок отделяют центрифугированием и промывают изоэфиром. Получают 42 г ожидаемого продукта и используют на следующей стадии без дальнейшей очистки. 27 Б) 3,5-Дихлор-3-(2-метоксифенил)-1,3 дигидро-2 Н-индол-2-он. Это соединение получают в соответствии с методикой, описанной в WO 95/18105. Смесь 12,71 г соединения, полученного на предыдущей стадии, в 105 мл ДХМ охлаждают до 0 С и добавляют 5,3 мл пиридина, а затем 4,9 мл тионилхлорида. После перемешивания в течение 30 мин к реакционной смеси добавляют воду и под вакуумом выпаривают ДХМ. Образовавшийся осадок отделяют центрифугированием и промывают три раза водой, затем три раза изоэфиром и сушат. Получают 13,66 г ожидаемого продукта и используют без дальнейшей очистки. Подготовительная стадия 1.2. 3-Бром-5 хлор-3-(2-хлорфенил)-1,3-дигидро-2H-индол-2 он.Br. Это соединение получают в соответствии с методиками, описанными в WO 95/18105 на стадиях А), В) и С) подготовительной стадии 2. Подготовительная стадия 1.3. 3-Хлор-5 метил-3-(2-метоксифенил)-1,3-дигидро-2 Н-индол-2-он.Hal = Cl. А) 5-Метил-3-гидрокси-3-(2-метоксифенил)-1,3-дигидро-2H-индол-2-он. Раствор 2-метоксифенилмагнийбромида получают из 6,8 г магния в 15 мл ТГФ и раствора 52,5 г 1-бром-2-метоксибензола в 75 мл ТГФ. Этот раствор добавляют по каплям при КТ в атмосфере аргона к смеси 8,9 г 5-метил-1Hиндол-2,3-диона в 80 мл ТГФ и затем кипятят с обратным холодильником в течение 3 ч. После охлаждения до КТ к реакционной смеси добавляют насыщенный раствор NH4Cl, полученную смесь три раза экстрагируют EtOAc, и объединенные органические фазы дважды промывают водой и насыщенным раствором NaCl, сушат над Na2SO4 и частично концентрируют растворитель. Образовавшийся осадок отделяют центрифугированием с получением 9 г ожидаемого продукта. Б) 3-Хлор-5-метил-3-(2-метоксифенил)1,3-дигидро-2 Н-индол-2-он. Смесь 2 г соединения, полученного на предыдущей стадии, в 15 мл ДХМ охлаждают до 0 С и добавляют 0,82 мл пиридина, а затем 0,76 мл тионилхлорида. После перемешивания в течение 20 мин к реакционной смеси добавляют воду и под вакуумом выпаривают ДХМ. Водную фазу экстрагируют EtOAc, органическую фазу промывают водой, насыщенным растворомNaCl, сушат над Na2SO4 и под вакуумом выпаривают растворитель. После кристаллизации из смеси ДХМ/изоэфир получают 1,5 г ожидаемого продукта.Hal = Cl. А) 3-Гидрокси-3-(2-метоксифенил)-5-трифторметокси-1,3-дигидро-2 Н-индол-2-он. Раствор 2-метоксифенилмагнийбромида получают из 1,9 г магния в 4 мл эфира и раствора 14,54 г 1-бром-2-метоксибензола в 21 мл эфира. Этот раствор добавляют по каплям в атмосфере аргона к предварительно охлажденной в ледяной бане смеси 5 г 5-трифторметокси-1 Ниндол-2,3-диона в 26 мл ТГФ, и затем кипятят при температуре дефлегмации эфира в течение 1 ч 30 мин и оставляют охлаждаться до КТ. Реакционную смесь медленно вливают в насыщенный раствор NH4Cl и экстрагируют ЕtOАс, органическую фазу промывают 5%-ным раствором K2 СО 3, водой и насыщенным растворомNaCl и сушат над Na2SO4 и под вакуумом выпаривают растворитель. Получают 2,8 г ожидаемого продукта. Б) 3-Хлор-3-(2-метоксифенил)-5-трифторметокси-1,3-дигидро-2H-индол-2-он. Смесь 2 г соединения, полученного на предыдущей стадии, в 20 мл ДХМ охлаждают до 0 С, добавляют 0,7 г пиридина, а затем 1,05 г тионилхлорида и смесь перемешивают в течение 15 мин. Реакционную смесь концентрируют до объема 10 мл, и этот раствор в таком виде используют на подготовительных стадиях 3.9. и 3.10. Подготовительная стадия 1.5. 3,5-Дихлор 3-(2-метоксифенил)-6-метил-1,3-дигидро-2 Ниндол-2-он.(IV): R1 = Cl; R2 = 6-СН 3; R3 = ОСН 3; R4 = Н; Hal = Cl. А) Этил-2-(2-метоксифенил)-2-оксоацетат. Раствор 27 г 1-бром-2-метоксибензола в 270 мл эфира охлаждают до -70 С в атмосфере аргона, добавляют по каплям 90 мл 1,6 М раствора н-бутиллития в пентане и затем смесь перемешивают в течение 45 мин. Быстро добавляют 78 мл диэтилоксалата и смесь перемешивают, давая возможность нагреться до КТ. После перемешивания при КТ в течение 1 ч, к реакционной смеси добавляют насыщенный раствор NH4Cl, фазы разделяют расслаиванием,водную фазу экстрагируют эфиром, объединенные органические фазы промывают водой, насыщенным раствором NaCl и сушат над Na2SO4 и под вакуумом выпаривают растворители. Избыток диэтилоксалата удаляют перегонкой под вакуумом (т. кип. = 87 С при 2000 Па). Полученный продукт подвергают хроматографии на силикагеле, элюируя смесью ДХМ/гексан(50/50; об/об), а затем ДХМ. Полученный продукт очищают перегонкой под вакуумом. Получают 13 г ожидаемого продукта; т. кип. = 110 С при 3 Па. 29 Б) 5-Хлор-3-гидрокси-3-(2-метоксифенил)6-метил-1,3-дигидро-2 Н-индол-2-он. а) трет-Бутил-4-хлор-3-метилфенилкарбамат. Смесь 10 г 4-хлор-3-метиланилина и 15,26 г ди-трет-бутилдикарбоната в 50 мл диоксана перемешивают при КТ в течение 24 ч. Реакционную смесь концентрируют под вакуумом, и остаток подвергают хроматографии на силикагеле, элюируя градиентом смеси ДХМ/гексан от(50/50; об/об) до (70/30; об/об). Получают 5,6 г ожидаемого продукта и используют без дальнейшей очистки. б) Раствор 5 г трет-бутил-4-хлор-3-метилфенилкарбамата в 45 мл эфира охлаждают до-70 С в атмосфере аргона, добавляют по каплям 30 мл 1,5 М раствора трет-бутиллития в пентане,смесь перемешивают в течение 1 ч, давая возможность нагреться до -10 С, и перемешивают при -10 С в течение 1 ч 45 мин. Реакционную смесь охлаждают до -70 С, по каплям добавляют раствор 5 г соединения, полученного на стадии А, в 25 мл ТГФ, и смесь перемешивают в течение 1 ч, давая возможность нагреться до 30 С, и затем перемешивают в течение ночи,давая возможность нагреться до КТ. К реакционной смеси добавляют насыщенный растворNH4Cl, выпаривают ТГФ, полученную водную фазу три раза экстрагируют ЕtOАс, органическую фазу промывают водой, насыщенным раствором NaCl и сушат над Na2SO4, частично выпаривают растворитель, а кристаллический продукт отделяют центрифугированием. Получают 2,6 г ожидаемого продукта; т.пл. = 254-256 С. В) 3,5-Дихлор-3-(2-метоксифенил)-6-метил-1,3-дигидро-2 Н-индол-2-он. Смесь 1,25 г соединения, полученного на стадии Б, в 20 мл ДХМ охлаждают до 0 С, добавляют 0,51 мл пиридина, а затем 0,47 мл тионилхлорида, и, после достижения комнатной температуры, смесь перемешивают в течение 1 ч. К реакционной смеси добавляют воду и ДХМ,и после разделения фаз расслаиванием органическую фазу промывают четыре раза водой, сушат над Na2SO4 и концентрируют под вакуумом до объема 20 мл, и этот раствор в таком виде используют на подготовительных стадиях 3.11 и 3.12 или 3.31. Подготовительная стадия 1.6. 3-Хлор-3-(2 хлорфенил)-5,6-диметил-1,3-дигидро-2H-индол 2-он.D,L-2-хлорминдальной кислоты в 250 мл 1,2 дихлорбензола нагревают при 227 С в течение 7 ч, удаляя образовавшуюся воду с помощью аппарата Дина-Старка. Реакционную смесь концентрируют под вакуумом до половины ее объема и оставляют кристаллизоваться при КТ. Об 004628 30 разовавшийся кристаллический продукт отделяют центрифугированием и промывают изоэфиром. Получают 89,42 г ожидаемого продукта, образец которого перекристаллизовывают из смеси ДХМ/изоэфир; т.пл. = 172-173 С. Б) 3-(2-Хлорфенил)-5,6-диметил-1,3-дигидроиндол-2-он. 100 мл 95%-ной серной кислоты охлаждают до -10 С, по каплям в течение 30 мин добавляют 12 мл дымящей серной кислоты (65%-ного олеума) и смесь перемешивают, давая возможность нагреться до температуры +10 С. Смесь снова охлаждают до 0 С, порциями в течение 10 мин добавляют 23,8 г соединения, полученного на предыдущей стадии, и полученную смесь перемешивают, давая возможность температуре увеличиться, при этом температура стабилизируется при 29 С. После перемешивания при КТ в течение 2 ч реакционную смесь выливают на лед и образовавшийся осадок отделяют центрифугированием. Осадок растворяют в 1000 мл ДХМ и 200 мл ТГФ, рН доводят до 2 путем добавления твердого K2 СО 3, смесь фильтруют и под вакуумом концентрируют фильтрат. Остаток подвергают хроматографии на силикагеле,элюируя градиентом смеси ДХМ/ЕtOАс/ТГФ отB) 3-(2-Хлорфенил)-3-гидрокси-5,6-диметил-1,3-дигидроиндол-2-он. К раствору 4 г соединения, полученного на предыдущей стадии, в 70 мл ТГФ, добавляют при КТ в атмосфере аргона 0,65 г 60%-ного гидрида натрия в масле. После прекращения выделения газа добавляют 1,7 мл диметилдисульфида и через реакционную смесь при КТ в течение 4 ч барботируют воздух. Реакционную смесь вливают в воду, под вакуумом концентрируют ТГФ, водную фазу экстрагируют ЕtOАс, органическую фазу промывают водой, насыщенным раствором NaCl и сушат над Na2SO4, под вакуумом частично концентрируют растворитель и образовавшийся кристаллический продукт отделяют центрифугированием. Получают 3,3 г ожидаемого продукта; т.пл. = 251-253 С. Г) 3-Хлор-3-(2-хлорфенил)-5,6-диметил 1,3-дигидро-2 Н-индол-2-он. Суспензию 1 г соединения, полученного на предыдущей стадии, в 7 мл ДХМ охлаждают до 0 С, добавляют 0,4 мл пиридина, а затем 0,37 мл тионилхлорида, и смесь перемешивают в течение 30 мин. Реакционную смесь разбавляют путем добавления 30 мл ДХМ, органическую фазу промывают 20 мл воды, сушат над Na2SO4 и под вакуумом при температуре ниже 40 С частично концентрируют растворитель. Этот раствор в таком виде используют на подготовительных стадиях 3.13. и 3.14. Подготовительная стадия 1.7. 3,5-Дихлор-3-(2,3-диметоксифенил)-1,3 дигидро-2 Н-индол-2-он.(IV): R1 = Cl; R2 = Н; R3 = ОСН 3; R4 = 3 ОСН 3; Hal = Cl. А) Этил-2-(2,3-диметоксифенил)-2-оксоацетат. Смесь 27,6 г 1,2-диметоксибензола в 160 мл эфира охлаждают до -40 С, добавляют по каплям 250 мл 1,6 М раствора н-бутиллития в гексане и затем смесь перемешивают в течение 24 ч, давая возможность нагреться до КТ. Реакционную смесь охлаждают до -20 С, быстро добавляют 136 мл диэтилоксалата и смесь перемешивают, давая возможность нагреться до КТ. После перемешивания при КТ в течение 30 мин,реакционную смесь вливают в насыщенный раствор NH4Cl, фазы разделяют расслаиванием,водную фазу экстрагируют эфиром, объединенные органические фазы промывают два раза водой и сушат над Na2SO4 и под вакуумом выпаривают растворители. Избыток диэтилоксалата удаляют перегонкой под вакуумом (т. кип. = 90 С при 2400 Па). Полученный неочищенный продукт подвергают хроматографии на силикагеле, элюируя смесью гептан/изоэфир (90/10; об/об). Получают 25 г ожидаемого продукта и используют на следующей стадии без дальнейшей очистки. Б) 5-Хлор-3-гидрокси-3-(2,3-диметоксифенил)-1,3-дигидро-2 Н-индол-2-он. а) трет-Бутил-4-хлорфенилкарбамат. Смесь 12,7 г 4-хлоранилина и 22 г ди-третбутилдикарбоната в 60 мл диоксана перемешивают при КТ в течение 24 ч. Реакционную смесь концентрируют под вакуумом, остаток переносят в пентан, и образовавшийся осадок отделяют центрифугированием и сушат. Получают 22,5 г ожидаемого продукта. б) Смесь 11,4 г трет-бутил-4-хлорфенилкарбамата в 100 мл эфира охлаждают до -40 С,в атмосфере сухого азота, добавляют по каплям 80 мл 1,5 М раствора трет-бутиллития в пентане и смесь перемешивают при -20 С в течение 3 ч. Реакционную смесь охлаждают до -40 С, в течение одного часа добавляют раствор 14 г соединения, полученного на стадии А, в 50 мл ТГФ, и смесь перемешивают при КТ в течение 4 суток. Реакционную смесь вливают в насыщенный раствор NH4Cl, образовавшийся осадок отделяют центрифугированием и сушат. Получают 10,2 г ожидаемого продукта и используют на следующей стадии без дальнейшей очистки. В) 3,5-Дихлор-3-(2,3-диметоксифенил)-1,3 дигидро-2 Н-индол-2-он. К смеси 2 г соединения, полученного на стадии Б, в 50 мл ДХМ, при КТ добавляют 0,8 мл пиридина и затем 1,2 мл тионилхлорида и смесь перемешивают до полного растворения. Реакционную смесь промывают 1 н. растворомHCl и затем два раза водой и сушат над Na2SO4,и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле,элюируя смесью ДХМ/ЕtOАс (95/5; об/об). По 004628 32 лучают 1,2 г ожидаемого продукта и используют без дальнейшей очистки. Подготовительная стадия 1.8. 3,5-Дихлор 3-(2-метоксифенил)-6-трифторметил-1,3-дигидро-2 Н-индол-2-он.(IV): R1 = Cl; R2 = 6-CF3; R3 = ОСН 3; R4 = Н; Hal = Cl. А) 5-Хлор-3-гидрокси-3-(2-метоксифенил)6-трифторметил-1,3-дигидро-2H-индол-2-он. а) трет-Бутил-4-хлор-3-трифторметилфенилкарбамат. Это соединение получают в соответствии с методикой, описанной на стадии Б а) подготовительной стадии 1.5, из 4-хлор-3-трифторметиланилина и ди-трет-бутилдикарбоната в диоксане. Ожидаемый продукт получают в виде масла, которое затвердевает; т.пл. = 90 С. б) Раствор 4 г трет-бутил-4-хлор-3 трифторметилфенилкарбамата в 30 мл эфира охлаждают до -70 С, в атмосфере аргона, по каплям добавляют 22 мл 1,5 М раствора третбутиллития в пентане и смесь перемешивают в течение 1 ч, давая возможность нагреться до температуры -10 С, и перемешивают при -10 С в течение 2 ч 30 мин. Реакционную смесь охлаждают до -70 С, по каплям добавляют раствор 3,05 г соединения, полученного на стадии А подготовительной стадии 1.5, в 15 мл ТГФ, и смесь перемешивают в течение 1 ч, давая возможность нагреться до температуры -30 С, и затем в течение 16 ч, давая возможность нагреться до КТ. К реакционной смеси добавляют насыщенный раствор NH4Cl, эфир, и ТГФ выпаривают, полученную водную фазу экстрагируют ЕtOАс, органическую фазу промывают водой,насыщенным раствором NaCl и сушат надNa2SO4, и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле, элюируя ДХМ и затем смесью ДХМ/ЕtOАс (90/10; об/об). После кристаллизации из смеси изоэфир/гексан получают 1,48 г ожидаемого продукта; т.пл. = 230-231 С. Б) 3,5-Дихлор-3-(2-метоксифенил)-6-трифторметил-1,3-дигидро-2 Н-индол-2-он. Суспензию 1,3 г соединения, полученного на стадии А, в 8 мл ДХМ охлаждают до 0 С,добавляют 0,43 мл пиридина и затем 0,4 мл тионилхлорида и смесь перемешивают в течение 15 мин. Реакционную смесь три раза промывают водой, органическую фазу сушат над Na2SO4, и частично под вакуумом выпаривают растворитель до объема 10 мл. Этот раствор в таком виде используют на подготовительных стадиях 3.17 и 3.18. Подготовительная стадия 1.9. 3,5-Дихлор 3-(2-хлорфенил)-6-метокси-1,3-дигидро-2Hиндол-2-он.Hal = Cl. А) 4-Хлор-3-метоксианилин. Смесь 36 г 2-хлор-5-нитроанизола и никеля Raney в 150 мл МеОН и 200 мл ТГФ гидри 33 руют в аппарате Парра в течение 4 ч при 35 С и давлении 0,1283 МПа (1,3 бар). Катализатор отфильтровывают на Celite и под вакуумом концентрируют фильтрат. Получают 28 г ожидаемого продукта и используют без дальнейшей очистки. Б) Амид N-(4-хлор-3-метоксифенил)-D,L2-хлорминдальной кислоты. Смесь 28 г соединения, полученного на предыдущей стадии, и 33,13 г D,L-2-хлорминдальной кислоты в 128 мл 1,2-дихлорбензола нагревают при 230 С в течение 4 ч, удаляя образовавшуюся воду с помощью аппарата ДинаСтарка. Реакционную смесь частично концентрируют под вакуумом и оставляют кристаллизоваться. Образовавшийся кристаллический продукт отделяют центрифугированием и промывают изоэфиром. Получают 40 г ожидаемого продукта. В) 5-Хлор-3-(2-хлорфенил)-6-метокси-1,3 дигидро-2H-индол-2-он. 40 г соединения, полученного на предыдущей стадии, быстро добавляют к 550 г полифосфорной кислоты, затем смесь нагревают при 60 С в течение 8 ч и оставляют перемешиваться в течение ночи, давая возможность охладиться до КТ. К реакционной смеси добавляют ледяную воду и образовавшийся осадок отделяют центрифугированием и промывают водой. Осадок переносят в ЕtOАс и, после суспендирования, полученный белый продукт отделяют центрифугированием и промывают изоэфиром. Получают 17,2 г ожидаемого продукта; т.пл. = 243247 С. Г) 5-Хлор-3-(2-хлорфенил)-3-гидрокси-6 метокси-1,3-дигидро-2 Н-индол-2-он. 2,56 г 60%-ного гидрида натрия в масле добавляют при КТ в атмосфере аргона к раствору 17,2 г соединения, полученного на предыдущей стадии, в 220 мл ТГФ. После прекращения выделения газа добавляют 6,85 г диметилдисульфида, через реакционную смесь барботируют воздух и смесь перемешивают при КТ в течение 72 ч. К реакционной смеси добавляют воду, под вакуумом выпаривают ТГФ, остающуюся водную фазу экстрагируют ЕtOАс, органическую фазу промывают водой, насыщенным раствором NaCl и сушат над Na2SO4, и под вакуумом выпаривают растворитель. Полученный продукт растворяют в ДХМ, частично концентрируют растворитель, продукт оставляют кристаллизоваться, и образовавшийся кристаллический продукт отделяют центрифугированием. Получают 6 г ожидаемого продукта; т.пл. = 237240 С. Д) 3,5-Дихлор-3-(2-хлорфенил)-6-метокси 1,3-дигидро-2 Н-индол-2-он. Суспензию 1,5 г соединения, полученного на предыдущей стадии, в 20 мл ДХМ охлаждают в ледяной бане, добавляют 0,375 мл пиридина и затем 0,33 мл тионилхлорида и смесь перемешивают в течение 30 мин. После окончания 34 реакции получают суспензию ожидаемого продукта, который осаждается в ДХМ, и эту суспензию непосредственно используют на подготовительных стадиях 3.19 и 3.20. Подготовительная стадия 1.10. 3,6-Дихлор 3-(2-метоксифенил)-5-метил-1,3-дигидро-2Hиндол-2-он.H; Hal = Cl. А) 6-Хлор-5-метил-3-метилтио-1,3-дигидро-2H-индол-2-он и 4-хлор-5-метил-3-метилтио 1,3-дигидро-2H-индол-2-он. В 320 мл ДХМ, охлажденного до -70 С,вводят 8,5 мл хлора, а затем в течение 20 мин при -70 С добавляют раствор 24 мл этилметилтиоацетата в 60 мл ДХМ, и смесь перемешивают при -70 С в течение 15 мин. Затем в течение 30 мин при -70 С добавляют раствор 52,64 г 3 хлор-4-метиланилина в 100 мл ДХМ и перемешивают при -70 С в течение 1 ч 45 мин. Наконец, добавляют 41,3 мл триэтиламина при -70 С и смесь перемешивают в течение 1 ч, давая возможность нагреться до КТ. Реакционную смесь промывают водой два раза по 250 мл, органическую фазу сушат над MgSO4, и под вакуумом выпаривают растворитель. Остаток переносят в смесь 600 мл эфира и 130 мл 2 н. раствора HCl и перемешивают при КТ в течение 72 ч. Нерастворимый продукт отфильтровывают, фазы фильтрата оставляют разделяться путем расслаивания, органическую фазу промывают два раза водой и сушат над MgSO4, и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле, элюируя ДХМ и затем смесью ДХМ/ЕtOАс (85/15; об/об). Полученную смесь повторно подвергают хроматографии на силикагеле, элюируя ДХМ и затем смесью ДХМ/ЕtOАс (95/5; об/об). Разделяют два изомера: получают 1,16 г менее полярного изомера,который представляет собой 6-хлор-5-метил-3 метилтио-1,3-дигидро-2H-индол-2-он,получают 0,72 г более полярного изомера,который представляет собой 4-хлор-5-метил-3 метилтио-1,3-дигидро-2 Н-индол-2-он. Б) 6-Хлор-5-метил-1 Н-индол-2,3-дион. Смесь 1,16 г 6-хлор-5-метил-3-метилтио 1,3-дигидро-2H-индол-2-она, полученного на предыдущей стадии, и 0,681 г N-хлорсукцинимида в 100 мл четыреххлористого углерода кипятят с обратным холодильником в течение 1 ч. Реакционную смесь концентрируют под вакуумом и остаток переносят в смесь 80 мл ТГФ и 20 мл воды и затем кипятят с обратным холодильником в течение 16 ч. ТГФ выпаривают под вакуумом, остающуюся водную фазу экстрагируют EtOAc, органическую фазу промывают водой, насыщенным раствором NaCl и сушат надNa2SO4 и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле, элюируя ДХМ и затем градиентом 35 смеси ДХМ/ЕtOАс до (85/15; об/об). Получают 0,793 г ожидаемого продукта; т.пл. = 264 С. В) 6-Хлор-3-гидрокси-3-(2-метоксифенил)5-метил-1,3-дигидро-2 Н-индол-2-он. Раствор 2-метоксифенилмагнийбромида получают из 0,687 г магния в 1,5 мл эфира и раствора 5,35 г 1-бром-2-метоксибензола в 7,55 мл эфира. Этот раствор добавляют по каплям в атмосфере аргона к предварительно охлажденной в ледяной бане смеси 1,4 г соединения, полученного на предыдущей стадии, в 14 мл ТГФ,и затем смесь перемешивают, давая возможность нагреться до КТ. После перемешивания при КТ в течение 1 ч, реакционную смесь медленно вливают в насыщенный раствор NH4Cl,под вакуумом выпаривают ТГФ, водную фазу экстрагируют EtOAc, органическую фазу промывают водой, насыщенным раствором NaCl и сушат над Na2SO4, и под вакуумом выпариваютEtOAc. Остаток подвергают хроматографии на силикагеле, элюируя ДХМ и затем смесью ДХМ/МеОН (98/2; об/об). После кристаллизации из смеси ТГФ/МеОН получают 1,6 г ожидаемого продукта; т.пл. = 266 С. Г) 3,6-Дихлор-3-(2-метоксифенил)-5 метил-1,3-дигидро-2 Н-индол-2-он. Суспензию 2,5 г соединения, полученного на предыдущей стадии, в 15 мл ДХМ охлаждают в ледяной бане, добавляют 1 мл пиридина и затем 1,09 мл тионилхлорида и смесь перемешивают в течение 2 ч. Реакционную смесь частично концентрируют под вакуумом до объема 10 мл, и этот раствор в таком виде используют на подготовительных стадиях 3.21 и 3.22. Подготовительная стадия 1.11. 3-Бром-5,6 дихлор-3-(2-хлорфенил)-1,3-дигидро-2H-индол 2-он.= Br. Это соединение получают в соответствии с методикой, описанной в WO 95/18105 на стадиях А), Б) и В) подготовительной стадии 72. Подготовительная стадия 1.12. 3,5-Дихлор 3-(2-этоксифенил)-1,3-дигидро-2 Н-индол-2-он.A) 1-Бром-2-этоксибензол. Смесь 17,5 г 2-бромфенола, 66 мл диэтилсульфата и 170 мл 10%-ного раствора NaOH кипятят с обратным холодильником в течение 2 ч. После охлаждения до КТ реакционную смесь экстрагируют ЕtOАс, органическую фазу промывают 2 н. раствором NaOH и сушат надNa2SO4, и под вакуумом выпаривают растворитель. Получают 19,6 г ожидаемого продукта. Б) 5-Хлор-3-(2-этоксифенил)-3-гидрокси 1,3-дигидро-2H-индол-2-он. Раствор 2-этоксифенилмагнийбромида получают из 2,2 г магния в 10 мл эфира и раствора 16,5 г соединения, полученного на предыдущей стадии, в 40 мл эфира. Этот раствор добавляют по каплям в атмосфере азота к смеси 5 г 5-хлор-1 Н-индол-2,3 004628 36 диона в 20 мл ТГФ, поддерживая температуру реакционной среды ниже 35 С. После перемешивания при КТ в течение 2 ч, реакционную смесь вливают в 200 мл 2 н. раствора HCl, смесь экстрагируют ЕtOАс, органическую фазу сушат над Na2SO4, и под вакуумом выпаривают растворители. Остаток переносят в горячий изоэфир и оставляют кристаллизоваться. Образовавшийся кристаллический продукт отделяют центрифугированием, промывают изоэфиром и сушат. Получают 5,7 г ожидаемого продукта; т.пл. = 251 С.B) 3,5-Дихлор-3-(2-этоксифенил)-1,3 дигидро-2 Н-индол-2-он. К смеси 3 г соединения, полученного на предыдущей стадии, и 2 мл пиридина в 50 мл ДХМ добавляют при КТ 1 мл тионилхлорида, и смесь перемешивают при КТ в течение 1 ч. Реакционную смесь подвергают хроматографии на силикагеле, элюируя ДХМ. После кристаллизации из изоэфира получают 2,4 г ожидаемого продукта; т.пл. = 198 С. Подготовительная стадия 1.13. 3,5-Дихлор 3-(2-трифторметоксифенил)-1,3-дигидро-2 Ниндол-2-он.Hal = Cl. А) 5-Хлор-3-гидрокси-3-(2-трифторметоксифенил)-1,3-дигидро-2 Н-индол-2-он. Раствор 25 г 1-бром-2-трифторметоксибензола в 130 мл эфира добавляют по каплям к смеси 2,8 г магния в 20 мл эфира, и поддерживают процесс дефлегмации, как только он начнется. После окончания добавления смесь кипятят с обратным холодильником в течение 1 ч. Затем при температуре ниже 40 С добавляют смесь 7,5 г 5-хлор-1H-индол-2,3-диона в 100 мл ТГФ и кипятят с обратным холодильником в течение 1 ч. После охлаждения до КТ реакционную смесь вливают в смесь лед/концентрированная соляная кислота, полученную смесь экстрагируют ЕtOАс, органическую фазу промывают водой, 1 н. раствором NaOH и сушат надNa2SO4, и под вакуумом выпаривают растворитель. После кристаллизации из смеси ДХМ/изоэфир (20/80; об/об) получают 6,5 г ожидаемого продукта; т.пл. = 214 С. Б) 3,5-Дихлор-3-(2-трифторметоксифенил)-1,3-дигидро-2H-индол-2-он. К смеси 2,7 г соединения, полученного на предыдущей стадии, и 1 мл пиридина в 20 мл ДХМ добавляют при температуре ниже 20 С 0,7 мл тионилхлорида, и смесь перемешивают в течение 1 ч. Реакционную смесь два раза промывают водой, органическую фазу сушат надNa2SO4, и под вакуумом выпаривают растворитель. После кристаллизации из изоэфира получают 1,8 г ожидаемого продукта; т.пл. = 185 С. Подготовительная стадия 1.14. 3,5-Дихлор 3-(2,3-дифторфенил)-1,3-дигидро-2 Н-индол-2 он. А) 5-Хлор-3-(2,3-дифторфенил)-3-гидрокси-1,3-дигидро-2 Н-индол-2-он. Раствор 5,6 г 1,2-дифторбензола в 50 мл эфира охлаждают до -10 С, добавляют по каплям 31 мл 1,6 М раствора н-бутиллития в гексане и смесь перемешивают при -10 С в течение 2 ч. Реакционную смесь охлаждают до -50 С, добавляют раствор 4 г 5-хлор-1 Н-индол-2,3-диона в 40 мл ТГФ и полученную смесь перемешивают в течение 12 ч, давая возможность нагреться до КТ. Реакционную смесь вливают в смесь концентрированная соляная кислота/лед/ вода, полученную смесь экстрагируют ЕtOАс, органическую фазу промывают 1 н. раствором NaOH,водой и сушат над Na2SO4, и под вакуумом выпаривают растворитель. После кристаллизации из изоэфира получают 2,8 г ожидаемого продукта; т.пл. = 248 С. Б) 3,5-Дихлор-3-(2,3-дифторфенил)-1,3 дигидро-2 Н-индол-2-он. К смеси 2,8 г соединения, полученного на предыдущей стадии, и 1 мл пиридина в 30 мл ДХМ добавляют 0,9 мл тионилхлорида, и смесь перемешивают при КТ в течение 1 ч. Реакционную смесь промывают два раза водой и сушат над Na2SO4, и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле, элюируя ДХМ. Получают 0,9 г ожидаемого продукта. Подготовительная стадия 1.15. 3,5-Дихлор 3-(2,4-диметоксифенил)-1,3-дигидро-2 Н-индол 2-он.(IV): R1 = Cl; R2 = H; R3 = OCH3; R4 = 4OCH3; Hal = Cl. А) 5-Хлор-3-гидрокси-3-(2,4-диметоксифенил)-1,3-дигидро-2 Н-индол-2-он. Раствор 2,4-диметоксифенилмагнийбромида получают из 2,2 г магния в 10 мл ТГФ и раствора 18 г 1-бром-2,4-диметоксибензола в 40 мл эфира. Этот раствор добавляют по каплям к смеси 5 г 5-хлор-1H-индол-2,3-диона в 50 мл ТГФ при температуре 30 С, и затем смесь кипятят с обратным холодильником в течение 2 ч. Реакционную смесь охлаждают до КТ и вливают в насыщенный раствор NH4Cl, эту смесь экстрагируют ЕtOАс, органическую фазу промывают водой и сушат над Na2SO4, и под вакуумом выпаривают растворитель. После кристаллизации из горячего изоэфира получают 7,2 г ожидаемого продукта. Б) 3,5-Дихлор-3-(2,4-диметоксифенил)-1,3 дигидро-2H-индол-2-он. Смесь 2,5 г соединения, полученного на предыдущей стадии, и 0,6 мл пиридина в 20 мл ДХМ охлаждают до температуры ниже 10 С,добавляют по каплям 0,6 мл тионилхлорида, и смесь перемешивают в течение 15 мин. Реакционную смесь промывают два раза водой и сушат над Na2SO4, и под вакуумом выпаривают растворитель. Получают ожидаемый продукт и в 38 этом виде используют на подготовительных стадиях 3.38. и 3.39. Подготовительная стадия 1.16. 3,5-Дихлор 3-(1,3-бензодиоксол-4-ил)-1,3-дигидро-2 Ниндол-2-он.(IV): R1 = Cl; R2 = Н; R3 + R4 = 2,3-O-CH2O; Hal = Cl. А) 4-Бром-1,3-бензодиоксол. Это соединение получают в соответствии со способом, описанным в Tetrahedron Lett.,1995, 36, 6413-6414. Б) 5-Хлор-3-(1,3-бензодиоксол-4-ил)-3 гидрокси-1,3-дигидро-2 Н-индол-2-он. Раствор 1,3-бензодиоксол-4-илмагнийбромида получают из 0,85 г магния в 10 мл ТГФ и раствора 6,7 г соединения, полученного на предыдущей стадии, в 40 мл ТГФ. Этот раствор добавляют по каплям при температуре ниже 40 С к смеси 3 г 5-хлор-1 Н-индол-2,3-диона в 50 мл ТГФ и затем полученную смесь перемешивают в течение 1 ч. Реакционную смесь вливают в насыщенный раствор NH4Cl, полученную смесь экстрагируют EtOAc, органическую фазу промывают водой и сушат над Na2SO4, и под вакуумом выпаривают растворитель. После кристаллизации из ДХМ получают 1,12 г ожидаемого продукта; т.пл. = 271 С. В) 3,5-Дихлор-3-(1,3-бензодиоксол-4-ил)1,3-дигидро-2 Н-индол-2-он. К смеси 1,1 г соединения, полученного на предыдущей стадии, и 0,4 мл пиридина в 20 мл ДХМ, при температуре ниже 25 С добавляют 0,3 мл тионилхлорида, и смесь перемешивают в течение 30 мин. Реакционную смесь промывают два раза водой, органическую фазу сушат надNa2SO4, и под вакуумом выпаривают растворитель. После кристаллизации из ДХМ получают 0,62 г ожидаемого продукта; т.пл. = 241 С. Подготовительная стадия 1.17. 3,5,6 Трихлор-3-(2-метоксифенил)-1,3-дигидро-2 Ниндол-2-он.Hal = Cl. А) 5,6-Дихлор-1 Н-индол-2,3-дион. Это соединение получают в соответствии с методикой, описанной в J. Am. Chem. Soc., 1946,68, 2697-2703 или в соответствии с методикой,описанной в J. Org. Chem., 1952, 17, 149-156. Б) 5,6-Дихлор-3-гидрокси-3-(2-метоксифенил)-1,3-дигидро-2 Н-индол-2-он. К суспензии 0,72 г магния в 15 мл эфира,содержащей несколько кристаллов йода, добавляют по каплям 5,57 г 1-бром-2-метоксибензола,и поддерживают процесс дефлегмации, как только он начнется. После окончания добавления смесь кипятят с обратным холодильником в течение 2 ч. Затем добавляют суспензию 2,7 г 5,6-дихлор-1 Н-индол-2,3-диона в 30 мл ТГФ и эту смесь кипятят с обратным холодильником в течение 30 мин. После охлаждения до КТ реакционную смесь вливают в смесь вода/лед/концентрированная HCl, полученную смесь экстра 39 гируют ЕtOАс, органическую фазу сушат надNa2SO4, и под вакуумом выпаривают растворитель. Остаток суспендируют в горячем изоэфире и образовавшийся осадок отделяют центрифугированием и промывают эфиром. Получают 3 г ожидаемого продукта. В) 3,5,6-Трихлор-3-(2-метоксифенил)-1,3 дигидро-2 Н-индол-2-он. Суспензию 1,5 г соединения, полученного на предыдущей стадии, в 30 мл ДХМ охлаждают в ледяной бане, и добавляют 0,56 мл пиридина, а затем 0,5 мл тионилхлорида. После перемешивания при КТ в течение 1 ч, реакционную смесь разбавляют путем добавления ДХМ,органическую фазу промывают водой до нейтрального значения рН и сушат над Na2SO4, и под вакуумом выпаривают растворитель. Получают 1,5 г ожидаемого продукта в виде пены,который используется в этом виде. Получение соединений формулы (V) Подготовительная стадия 2.1. а) Гидрохлорид (2S,4R)-4-гидрокси-N,Nдиметил-2-пирролидинкарбоксамида.(2S,4R)-1-(трет-Бутоксикарбонил)-4 гидрокси-N,N-диметил-2-пирролидинкарбоксамид. Смесь 11,2 г (2S,4R)-1-(трет-бутоксикарбонил)-4-гидрокси-2-пирролидинкарбоновой кислоты в 50 мл ДХМ охлаждают до 0 С, добавляют 8,45 мл ДИПЭА и затем 21,2 г ВОР и полученную смесь перемешивают в течение 10 мин. Затем посредством барботирования добавляют газообразный диметиламин и смесь перемешивают при КТ в течение 3 ч. Реакционную смесь частично концентрируют под вакуумом до объема 20 мл и отфильтровывают нерастворимый материал. Фильтрат подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (94/6; об/об), и полученный продукт повторно подвергают хроматографии на оксиде алюминия, элюируя смесью ДХМ/МеОН(96/4; об/об). Получают 11,1 г ожидаемого продукта. Б) Гидрохлорид (2S,4R)-4-гидрокси-N,Nдиметил-2-пирролидин-карбоксамида. Смесь 6,9 г соединения, полученного на предыдущей стадии, в 69 мл 4 н. раствора HCl в эфире перемешивают при КТ в течение 2 ч. Реакционную смесь концентрируют под вакуумом,остаток переносят в эфир и под вакуумом выпаривают растворитель, повторяя этот процесс несколько раз. Получают 4 г ожидаемого продукта. Подготовительная стадия 2.1. б) Трифторацетат (2S,4R)-4-гидрокси-N,Nдиметил-2-пирролидинкарбоксамида.(V), CF3COOH: R5 = N(CH3)2; R6 = H. Раствор 2,1 г соединения, полученного на стадии А подготовительной стадии 2.1 а) в 5 мл ДХМ охлаждают до 0 С, добавляют 10 мл трифторуксусной кислоты и эту смесь переме 004628 40 шивают при КТ в течение 2 ч. Реакционную смесь концентрируют под вакуумом, остаток переносят в ДХМ и под вакуумом выпаривают растворитель, повторяя этот процесс нескольку раз. Получают ожидаемый продукт и непосредственно используют на подготовительных стадиях 3.1 и 3.2. Подготовительная стадия 2.2. (2S, 4R)-2(Азетидин-1-илкарбонил)-4-гидроксипирролидин.DCC, и полученную смесь перемешивают при КТ в течение 10 мин. Реакционную смесь охлаждают до 0 С, добавляют 2 г азетидина и эту смесь перемешивают в течение 12 ч, давая возможность нагреться до КТ. Образовавшийся осадок отфильтровывают, фильтрат два раза промывают насыщенным раствором Na2CO3,органическую фазу сушат над Na2SO4, и под вакуумом выпаривают растворитель. Полученное масло подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (95/5; об/об). Получают 2,1 г ожидаемого продукта. Б) (2S, 4R)-2-(Азетидин-1-илкарбонил)-4 гидроксипирролидин. 1,8 г продукта, полученного на предыдущей стадии, и 0,58 г 10%-ного палладия на угле в 80 мл ЕtOН гидрируют при КТ и атмосферном давлении в течение ночи. Катализатор отфильтровывают на Celite и под вакуумом концентрируют фильтрат. Получают 0,9 г ожидаемого продукта. Подготовительная стадия 2.3. Гидрохлорид(2S,4R)-1-(трет-Бутоксикарбонил)-4 метокси-N,N-диметил-2-пирролидинкарбоксамид. Раствор 6,5 г соединения, полученного на стадии А подготовительной стадии 2.1 а), в 70 мл ТГФ охлаждают до 0 С, порциями добавляют 1,2 г 60%-ного гидрида натрия в масле и смесь перемешивают в течение 30 мин при 0 С. Затем по каплям добавляют раствор 2,35 мл метилйодида в 10 мл ТГФ и смесь перемешивают в течение 2 ч, давая возможность нагреться до КТ. Добавляют 5 капель воды и реакционную смесь нейтрализуют путем добавления концентрированной HCl, и концентрируют под вакуумом. Остаточное количество воды удаляют азеотропной перегонкой, добавляя бензол, и полученную смесь концентрируют под вакуумом. Остаток подвергают хроматографии на 41 силикагеле, элюируя смесью ДХМ/МеОН (96/4; об/об). Получают 6,1 г ожидаемого продукта. Б) Гидрохлорид (2S,4R)-4-метокси-N,Nдиметил-2-пирролидинкарбоксамида. Смесь 6,1 г соединения, полученного на предыдущей стадии, и 65 мл 4 н. раствора HCl в эфире перемешивают в течение 2 ч. Реакционную смесь концентрируют под вакуумом, остаток переносят в ДХМ и под вакуумом выпаривают растворитель, повторяя этот процесс несколько раз. Получают 4,45 г ожидаемого продукта. Подготовительная стадия 2.4. Трифторацетат (2S,4R)-4-этокси-N,N-диметил-2-пирролидинкарбоксамида.(2S,4R)-1-(трет-Бутоксикарбонил)-4 этокси-2-пирролидинкарбоновая кислота. К раствору 5 г (2S,4R)-1-(трет-бутоксикарбонил)-4-гидрокси-2-пирролидинкарбоновой кислоты в 100 мл ТГФ в атмосфере азота добавляют 1,72 г 60%-ного гидрида натрия в масле, и смесь перемешивают в течение 45 мин при КТ. Затем добавляют 3,27 этилйодида, смесь кипятят с обратным холодильником в течение 3 ч и перемешивают в течение 18 ч, давая возможность охладиться до КТ. Реакционную смесь концентрируют под вакуумом, остаток переносят в 5%-ный раствор KHSO4 и экстрагируют ЕtOАс, органическую фазу сушат над Na2SO4, и под вакуумом выпаривают растворитель. Получают 4,5 г ожидаемого продукта в виде масла. Б)(2S,4R)-1-(трет-Бутоксикарбонил)-4 этокси-N,N-диметил-2-пирролидинкарбоксамид. К раствору 4,5 г соединения, полученного на предыдущей стадии, в 100 мл ДХМ добавляют 3,5 г триэтиламина и затем 7,6 г ВОР и эту смесь перемешивают в течение 15 мин при КТ. Затем посредством барботирования добавляют газообразный диметиламин и смесь перемешивают при КТ в течение 3 ч. Реакционную смесь концентрируют под вакуумом, остаток экстрагируют ЕtOАс, органическую фазу промывают 5%-ным раствором Na2CO3, 5%-ным растворомKHSO4 и сушат над Na2SO4, и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (95/5; об/об). Получают 2 г ожидаемого продукта в виде масла.B) Трифторацетат (2S,4R)-4-этокси-N,Nдиметил-2-пирролидинкарбоксамида. Раствор 2 г соединения, полученного на предыдущей стадии, в 10 мл ДХМ охлаждают до 0 С, добавляют 10 мл трифторуксусной кислоты и смесь перемешивают при КТ в течение 2 ч. Реакционную смесь концентрируют под вакуумом, остаток переносят в ДХМ и под вакуумом выпаривают растворитель, повторяя этот процесс несколько раз. Получают 2 г ожидаемого продукта.(2S,4S)-1-(трет-Бутоксикарбонил)-4 гидрокси-2-пирролидинкарбоновая кислота. К смеси 4 г (2S, 4S)-4-гидроксипирролидин-2-карбоновой кислоты в 50 мл 10%-ного раствора триэтиламина в метаноле добавляют 13,2 г ди-трет-бутилдикарбоната, и затем смесь кипятят с обратным холодильником в течение 45 мин. Реакционную смесь концентрируют под вакуумом, остаток переносят в 40 мл воды и подкисляют до значения рН = 2 путем добавления раствора концентрированной HCl, полученную смесь экстрагируют ЕtOАс, органическую фазу сушат над Na2SO4, и под вакуумом выпаривают растворитель. Получают 7,5 г ожидаемого продукта. Б)(2S,4S)-1-(трет-Бутоксикарбонил)-4 гидрокси-N,N-диметил-2-пирролидинкарбоксамид. Смесь 7,5 г соединения, полученного на предыдущей стадии, в 100 мл ДХМ охлаждают до 4 С, добавляют 5,7 мл ДИПЭА и затем 14,4 г ВОР и эту смесь перемешивают при 4 С в течение 30 мин. Затем посредством барботирования в течение 10 мин добавляют газообразный диметиламин и смесь перемешивают при КТ в течение 3 ч. Реакционную смесь концентрируют под вакуумом, остаток экстрагируют ЕtOАс,органическую фазу промывают 5%-ным раствором KHSO4, 5%-ным раствором Nа 2 СО 3, насыщенным раствором NaCl и сушат над Na2SO4, и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле,элюируя смесью ДХМ/МеОН (93/7; об/об). Получают 2,4 г ожидаемого продукта.B) Гидрохлорид (2S,4S)-4-гидрокси-N,Nдиметил-2-пирролидинкарбоксамида. Смесь 2,4 г соединения, полученного на предыдущей стадии, в 15 мл 4 н. раствора HCl в диоксане перемешивают при 4 С в течение 2 ч. Реакционную смесь концентрируют под вакуумом и без нагревания, остаток переносят в эфир и образовавшийся осадок отделяют центрифугированием. Получают 0,9 г ожидаемого продукта. Подготовительная стадия 2.6. трет-Бутил 2-(3R,5S)-5-[(диметиламино)карбонил]-3 пирролидинил]окси]ацетат.A) (2S,4R)-1-(Бензилоксикарбонил)-4-гидрокси-N,N-диметил-2-пирролидинкарбоксамид. Смесь 15 г (2S,4R)-1-(бензилоксикарбонил)-4-гидрокси-2-пирролидинкарбоновой кислоты, 7,64 г НОВТ и 11,65 г DCC в 250 мл ДХМ перемешивают при КТ в течение 1 ч. Реакционную смесь охлаждают на ледяной бане,добавляют посредством барботирования в течение 10 мин газообразный диметиламин и эту смесь перемешивают при КТ в течение 3 ч. Не 43 растворимый материал отфильтровывают и под вакуумом концентрируют фильтрат. Остаток переносят в насыщенный раствор Na2CO3 и экстрагируют ДХМ, органическую фазу сушат надNa2SO4, и под вакуумом выпаривают растворитель. Получают 13 г ожидаемого продукта в виде масла. Б) трет-Бутил-2-(3R,5S)-1-[(бензилоксикарбонил)-5-[(диметиламино)карбонил]-3-пирролидинил]окси]ацетат. Смесь 5 г соединения, полученного на предыдущей стадии, и 3 г гидросульфата тетрабутиламмония в 100 мл бензола охлаждают до 0 С, добавляют 50 мл 50%-ного водного раствора NaOH, а затем по каплям 5 г третбутилбромацетата, и эту смесь интенсивно перемешивают в течение 30 мин. Реакционную смесь разбавляют смесью бензол/ДХМ, фазы разделяют расслаиванием, органическую фазу сушат над Nа 2SO4, и под вакуумом выпаривают растворители. Остаток подвергают хроматографии на силикагеле, элюируя EtOAc. Получают 6,3 г ожидаемого продукта в виде масла.B) трет-Бутил-2-(3R,5S)-5-[(диметиламино)карбонил]-3-пирролидинил]окси]ацетат. Смесь 6,3 г соединения, полученного на предыдущей стадии, и 0,7 г 10%-ного палладия на угле в 200 мл EtOAc гидрируют при КТ и атмосферном давлении в течение 3 ч. Катализатор отфильтровывают на целите и под вакуумом концентрируют фильтрат до половины его объема. Получают раствор ожидаемого продукта,который используют на подготовительных стадиях 3.43 и 3.44. Подготовительная стадия 2.7. (3R,5S)-5[(Диметиламино)карбонил]-3-пирролидин 3-(4 морфолинил)пропионат.A) Бензил-(2S,4R)-4-(акрилоилокси)-2[(диметиламино)карбонил]-1-пирролидинкарбоксилат. Смесь 5 г соединения, полученного на стадии А подготовительной стадии 2.6, и 2,31 г триэтиламина в 100 мл ДХМ охлаждают до 0 С,добавляют по каплям 1,6 мл хлорангидрида акриловой кислоты и смесь перемешивают при 0 С в течение 2 ч. Реакционную смесь промывают водой и сушат над Na2SO4, и под вакуумом выпаривают растворитель. Получают 5,5 г ожидаемого продукта в виде масла. Б) Бензил-(2S,4R)-2-[(диметиламино) карбонил]-4-3-(4-морфолинил)пропаноил] окси]1-пирролидинкарбоксилат. К раствору 5,5 г соединения, полученного на предыдущей стадии, в 100 мл ДХМ добавляют 0,265 г хлорного железа и затем 2,13 г морфолина, и смесь перемешивают при КТ в течение 18 ч. Реакционную смесь промывают насыщенным раствором Na2SO4, фазы разделяют расслаиванием, органическую фазу сушат надNa2SO4, и под вакуумом выпаривают раствори 004628 44 тель. Остаток подвергают хроматографии на силикагеле, элюируя ДХМ и затем смесью ДХМ/МеОН (94/6; об/об). Получают 4,5 г ожидаемого продукта в виде масла.B) (3R,5S)-5-[(Диметиламино)карбонил]-3 пирролидин 3-(4-морфолинил)пропионат. Смесь 4,2 г соединения, полученного на предыдущей стадии, и 0,45 г 10%-ного палладия на угле в 200 мл EtOAc гидрируют при КТ и атмосферном давлении в течение 3 ч. Катализатор отфильтровывают на целите и под вакуумом концентрируют фильтрат до половины его объема. Получают раствор ожидаемого продукта,который используют в этом виде на подготовительной стадии 3.45. Получение соединений формулы (II). Подготовительные стадии 3.1 и 3.2. (2S,4R)-1-[5-Хлор-3-(2-метоксифенил)-2-оксо-2,3 дигидро-1 Н-индол-3-ил]-4-гидрокси-N,Nдиметил-2-пирролидинкарбоксамид, изомер А и изомер Б.= N(CH3)2; R6 = Н. Соединение, полученное на подготовительной стадии 2.1 б), растворяют в 5 мл ДХМ,добавляют 1,62 г триэтиламина, а затем суспензию 2,2 г соединения, полученного на Подготовительной стадии 1.1, в 2 мл ТГФ, и эту смесь перемешивают при КТ в течение 6 ч. Затем в течение периода 24 ч при перемешивании добавляют триэтиламин в количестве 3 х 0,8 г. После окончания реакции наблюдают обильное образование осадка. Образовавшийся осадок отделяют центрифугированием и переносят в смесь, состоящую из 5%-ного раствора K2 СО 3 и 100 мл ЕtOАс, содержащего 10 мл МеОН, органическую фазу промывают 5%-ным растворомK2 СО 3, насыщенным раствором NaCl и сушат над Na2SO4, и растворители частично выпаривают под вакуумом. Образовавшийся осадок отделяют центрифугированием с получением 0,875 г изомера А. Маточные растворы после центрифугирования объединяют и подвергают хроматографии на оксиде алюминия, элюируя градиентом смеси ДХМ/МеОН от (96/4; об/об) до (95/5; об/об). Разделяют два изомера: менее полярный, изомер А: соединение подготовительной стадии 3.1, получая дополнительные 0,359 г; т.пл. = 265-268 С.D25 = +180 (с = 0,16; хлороформ); более полярный, изомер Б: соединение подготовительной стадии 3.2, которое перекристаллизовывают из смеси ДХМ/изоэфир с получением 0,72 г, содержащих 0,15 моль изоэфира;N(CH3)2; R6 = H. 0,8 г соединения, полученного на подготовительной стадии 2.1 а), и затем 3,5 мл ДИПЭА добавляют при КТ к смеси 3 г соединения, полученного на подготовительной стадии 1.2, в 50 мл ДХМ, и эту смесь перемешивают при КТ в течение 12 ч. Реакционную смесь концентрируют под вакуумом, остаток экстрагируют ЕtOАс,органическую фазу промывают 5%-ным раствором K2 СО 3, водой три раза, насыщенным раствором NaCl и сушат над Na2SO4, и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (95/5; об/об). Разделяют два изомера: менее полярный, изомер А: соединение подготовительной стадии 3.3, которое повторно подвергают хроматографии на оксиде алюминия, элюируя смесью ДХМ/МеОН (95/5; об/об) с получением 0,182 г.D25 = +235,3 (с = 0,15; хлороформ); более полярный, изомер Б: соединение подготовительной стадии 3.4, которое повторно подвергают хроматографии на оксиде алюминия, элюируя смесью ДХМ/МеОН (95/5; об/об). После кристаллизации из смеси ДХМ/изоэфир получают 0,68 г; т.пл. = 266-267 С.R5 = N(CH3)2; R6 = Н. 3,5 мл ДИПЭА и затем 1 г соединения, полученного на подготовительной стадии 2.1 а),добавляют к смеси 1,5 г соединения, полученного на подготовительной стадии 1.3, в 15 мл ДХМ и 3 мл ТГФ, и эту смесь перемешивают при КТ в течение 5 ч. Реакционную смесь концентрируют под вакуумом, остаток экстрагируют ЕtOАс, органическую фазу промывают 5%ным раствором K2 СО 3, водой три раза, насыщенным раствором NaCl и сушат над Na2SO4, и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле,элюируя смесью ДХМ/МеОН (96/4; об/об). Разделяют два изомера: менее полярный, изомер А: соединение подготовительной стадии 3.5, которое кристаллизуют из смеси ДХМ/изоэфир. Получают 0,183 г; т.пл. = 257-258 С.D25 = +151,6 (с = 0,122; хлороформ); более полярный, изомер Б: соединение подготовительной стадии 3.6, которое повторно подвергают хроматографии на оксиде алюминия, элюируя смесью ДХМ/МеОН (97/3; об/об). Получают 0,498 г, которые используют без дальнейшей очистки.(2S, 4R)-1-[5-Хлор-3-(2-метоксифенил)-2 оксо-2,3-дигидро-1 Н-индол-3-ил]-2-(азетидин-1 илкарбонил)-4-гидроксипирролидин, изомер А и изомер Б К раствору 0,9 г соединения, полученного на подготовительной стадии 2.2, в 15 мл ДХМ,добавляют 1,82 г соединения, полученного на подготовительной стадии 1.1, и затем 2 мл ДИПЭА, и эту смесь нагревают при 40 С в течение 3 ч. Реакционную смесь концентрируют под вакуумом, остаток переносят в 5%-ный растворK2 СО 3 и три раза экстрагируют ЕtOАс, объединенные органические фазы промывают водой,насыщенным раствором NaCl и сушат надNa2SO4, и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на оксиде алюминия, элюируя смесью ДХМ/МеОН(96/4; об/об). Разделяют два изомера: менее полярный, изомер А: соединение подготовительной стадии 3.7, которое перекристаллизовывают из изоэфира с получением 0,243 г; т.пл. = 270-271 С.D25 = +169,5 (с = 0,115; хлороформ); более полярный, изомер Б: соединение подготовительной стадии 3.8, с получением 0,716 г, которые используют без дальнейшей очистки. Подготовительные стадии 3.9 и 3.10.R5 = N(CH3)2; R6 = Н. К раствору соединения, полученного на подготовительной стадии 1.4, в ДХМ, добавляют 4 мл ДИПЭА и затем 1,26 г соединения, полученного на подготовительной стадии 2.1 а), и эту смесь перемешивают при КТ в течение 4 ч. Реакционную смесь концентрируют под вакуумом, остаток экстрагируют EtOAc, органическую фазу промывают 5%-ным растворомNaCl и сушат над Na2SO4, и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на оксиде алюминия, элюируя ДХМ и затем градиентом смеси ДХМ/МеОН вплоть до (95,5/4,5; об/об). Разделяют два изомера: менее полярный, изомер А: соединение подготовительной стадии 3.9, которое кристаллизуют из изоэфира с получением 0,09 г; т.пл. = 231-233 С.D25 = +152 (с = 0,123; хлороформ); более полярный, изомер Б: соединение подготовительной стадии 3.10, с получением 0,323 г; т.пл. = 219-220 С.(II): R, = Cl; R2 = 6-СН 3; R3 = ОСН 3; FU = Н; R5 = N(CH3)2; R6 = Н. Раствор соединения, полученного на подготовительной стадии 1.5, в ДХМ, охлаждают до 0 С, добавляют 2,25 мл ДИПЭА, а затем 0,83 г соединения, полученного на подготовительной стадии 2.1 а), и эту смесь перемешивают в течение 12 ч, давая возможность нагреться до КТ. Реакционную смесь концентрируют под вакуумом, остаток экстрагируют ЕtOАс, органическую фазу промывают 5%-ным растворомK2 СО 3, водой, насыщенным раствором NaCl и сушат над Na2SO4, и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле,элюируя смесью ДХМ/МеОН (95/5; об/об). Разделяют два изомера: менее полярный, изомер А: соединение подготовительной стадии 3.11, которое кристаллизуют из изоэфира с получением 0,139 г; т.пл. = 260-261 С.D 25 = +162,5 (с = 0,144; хлороформ); более полярный, изомер Б: соединение подготовительной стадии 3.12, с получением 0,606 г, которые используют без дальнейшей очистки. Подготовительные стадии 3.13 и 3.14.R5 = N(CH3)2; R6 = Н. Раствор соединения, полученного на подготовительной стадии 1.6, в ДХМ, охлаждают до 0 С, добавляют 0,6 мл ДИПЭА, а затем 0,7 г соединения, полученного на подготовительной стадии 2.1 а), и эту смесь перемешивают в течение ночи, давая возможность нагреться до КТ. Реакционную смесь концентрируют под вакуумом, остаток переносят в 5%-ный растворK2 СО 3 и экстрагируют ЕtOАс, органическую фазу сушат над Na2SO4, и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (95/5; об/об). Разделяют два изомера: менее полярный, изомер А: соединение подготовительной стадии 3.13. более полярный, изомер Б: соединение подготовительной стадии 3.14, с получением 0,363 г в виде масла, которое используют без дальнейшей очистки. Подготовительные стадии 3.15 и 3.16.(II): R1 = Cl; R2 = Н; R3 = ОСН 3; R4 = 3 ОСН 3; R5 = N(CH3)2; R6 = СН 3. К раствору 1,1 г соединения, полученного на подготовительной стадии 1.7, в 20 мл ДХМ,добавляют 1,71 мл ДИПЭА и затем 0,75 г соединения, полученного на подготовительной стадии 2.3, и эту смесь перемешивают при КТ в течение 3 ч. Реакционную смесь концентрируют под вакуумом, остаток экстрагируют ЕtOАс,органическую фазу промывают 5%-ным раствором K2 СО 3, водой два раза, насыщенным раствором NaCl и сушат над Na2SO4, и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на оксиде алюминия,элюируя градиентом смеси ДХМ/МеОН от(98,5/1,5; об/об) до (98/2; об/об). Разделяют два изомера: менее полярный, изомер А: соединение Подготовительной стадии 3.15, с получением 0,32 г; более полярный, изомер Б: соединение подготовительной стадии 3.16, которое перекристаллизовывают из изоэфира с получением 0,49 г; т.пл. = 235-237 С.R5 = N(CH3)2; R6 = CH3. К раствору соединения, полученного на подготовительной стадии 1.8, в 10 мл ДХМ, добавляют 2,5 мл ДИПЭА и 0,870 г соединения,полученного на подготовительной стадии 2.3, и эту смесь перемешивают при КТ в течение 10 ч. Реакционную смесь концентрируют под вакуумом, остаток экстрагируют ЕtOАс, органическую фазу промывают 5%-ным растворомNaCl и сушат над Na2SO4, и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на оксиде алюминия, элюируя градиентом смеси ДХМ/МеОН (98,5/1,5; об/об). Разделяют два изомера: менее полярный, изомер А: соединение Подготовительной стадии 3.17, которое кристаллизуют из ДХМ с получением 0,23 г; т.пл. = 291-293 С.D25 = +131,6 (с = 0,12; хлороформ); более полярный, изомер Б: соединение Подготовительной стадии 3.18, которое осаждают из гексана с получением 0,44 г; т.пл. = 138-140 С.R5 = N(CH3)2; R6 = CH3. К суспензии соединения, полученного на подготовительной стадии 1.9, в ДХМ, добавляют в атмосфере аргона 1,5 г соединения, полученного на подготовительной стадии 2.3, а затем добавляют по каплям раствор 1,8 г ДИПЭА в 2 мл ДХМ, и смесь перемешивают при КТ в течение 2 ч. Реакционную смесь концентрируют под вакуумом, остаток переносят в 5%-ный раствор K2 СО 3 и экстрагируют ЕtOАс, органическую фазу промывают водой, насыщенным раствором NaCl и сушат над Na2SO4, частично концентрируют ЕtOАс и образовавшийся осадок оставляют кристаллизоваться, а затем его отделяют центрифугированием. Выделяют изомер: изомер А: соединение подготовительной стадии 3.19, с получением 0,581 г; т.пл. = 249250 С.D25 = +202,5 (с = 0,12; хлороформ). Фильтраты подвергают хроматографии на оксиде алюминия, элюируя смесью ДХМ/МеОН(98/2; об/об). Выделяют другой изомер: более полярный, изомер Б: соединение подготовительной стадии 3.20, с получением 0,519 г после кристаллизации из смеси ДХМ/ЕtOАс; т.пл. = 243-244 С.R5 = N(CH3)2; R6 = СН 3. К раствору соединения, полученного на подготовительной стадии 1.10, в ДХМ, добавляют 5,5 мл ДИПЭА и затем 1,85 г соединения,полученного на подготовительной стадии 2.3, и смесь перемешивают при КТ в течение 12 ч. Реакционную смесь концентрируют под вакуумом, остаток экстрагируют ЕtOАс, органическую фазу промывают 5%-ным растворомNaCl и сушат над Na2SO4, и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на оксиде алюминия, элюируя смесью ДХМ/МеОН от (99/1; об/об) до (98/2; об/об). Разделяют два изомера: менее полярный, изомер А: соединение подготовительной стадии 3.21, с получением 0,7 г после кристаллизации из изоэфира; т.пл. = 264 С.D25 = +183 (с = 0,1; хлороформ); более полярный, изомер Б: соединение Подготовительной стадии 3.22, с получением 1,275 г после кристаллизации из изоэфира; т.пл.= N(CH3)2; R6 = -СН 2 СН 3. Смесь 2,15 г соединения, полученного на подготовительной стадии 1.1,2 г соединения,полученного на подготовительной стадии 2.4, и 1,4 г триэтиламина в 50 мл ТГФ перемешивают при КТ в течение 48 ч. Реакционную смесь концентрируют под вакуумом, остаток переносят в воду и экстрагируют ДХМ, органическую фазу сушат над Na2SO4, и под вакуумом выпаривают растворитель. Остаток переносят в смесь ДХМ/ЕtOАс (50/50; об/об), нагревают до температуры дефлегмации и оставляют стоять. Образовавшийся осадок отделяют центрифугированием и выделяют: изомер А: соединение подготовительной стадии 3.23, с получением 1,1 г; т.пл. = 236 С.D25 = +109 (с = 0,22; хлороформ); Фильтраты после центрифугирования подвергают хроматографии на силикагеле, элюируя смесью ЕtOАс/МеОН от (97/3; об/об), и выделяют другой изомер: более полярный, изомер Б: соединение подготовительной стадии 3.24, с получением 1 г.(II): R1 = Cl; R2 = Н; R3 = ОСН 3; R4 = 3 ОСН 3; R5 = N(CH3)2; R6 = H. К раствору 1,6 г соединения, полученного на подготовительной стадии 1.7, в 10 мл ДХМ,добавляют при КТ 2,5 мл ДИПЭА и затем 1 г соединения, полученного на подготовительной стадии 2.1 а), и смесь перемешивают при КТ в течение 48 ч. Образовавшийся осадок, соответствующий приведенному ниже изомеру А, отделяют центрифугированием. Фильтрат концентрируют под вакуумом, остаток экстрагируют ЕtOАс, органическую фазу промывают 5%-ным раствором K2 СО 3, водой, насыщенным раствором NaCl и сушат над Na2SO4, и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле, элюируя градиентом смеси ДХМ/МеОН от (99/1; об/об) до(93/7; об/об). Разделяют два изомера: менее полярный, изомер А: соединение подготовительной стадии 3.25, которое перекристаллизовывают вместе с первой порцией,указанной выше, из смеси ДХМ/изоэфир; т.пл. = 261-263 С.D25 = +119,3 (с = 0,135; хлороформ); более полярный, изомер Б: соединение Подготовительной стадии 3.26, которое пере 51 кристаллизовывают из смеси ДХМ/изоэфир с получением 0,94 г; т.пл. = 167-169 С.N(CH3)2; R6 = H. К смеси 0,8 г соединения, полученного на подготовительной стадии 2.1 а), в 15 мл ДХМ,добавляют при КТ 1,6 г соединения, полученного на подготовительной стадии 1.11, и затем 2,13 мл ДИПЭА, и смесь перемешивают при КТ в течение 15 мин. Реакционную смесь концентрируют под вакуумом, остаток экстрагируют ЕtOАс, органическую фазу промывают 5%-ным раствором K2 СО 3, водой, насыщенным раствором NaCl и сушат над Na2SO4, и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (95/5; об/об). Разделяют два изомера: менее полярный, изомер А: соединение подготовительной стадии 3.27, которое кристаллизуют из изоэфира с получением 0,08 г; т.пл.260 С.D25+219,4 (с = 0,103; хлороформ); более полярный, изомер Б: соединение Подготовительной стадии 3.28, с получением 0,661 г, которые используют без дальнейшей очистки. Подготовительные стадии 3.29 и 3.30. Метил-(2S,4R)-1-[5-хлор-3-(2-метоксифенил)-2-оксо-2,3-дигидро-1H-индол-3-ил]-4 гидрокси-2-пирролидинкарбоксилат, изомер А и изомер Б.= ОСН 3; R6 = Н. К смеси 1,4 г соединения, полученного на подготовительной стадии 1.1, в 20 мл ДХМ, добавляют при КТ 4 мл ДИПЭА и затем 1,64 г гидрохлорида метил-(2S,4R)-4-гидрокси-2 пирролидинкарбоксилата, и смесь перемешивают при КТ в течение 12 ч. Реакционную смесь концентрируют под вакуумом, остаток экстрагируют ЕtOАс, органическую фазу промывают 5%-ным раствором K2 СО 3, водой, насыщенным раствором NaCl и сушат над сульфатом натрия,и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле,элюируя смесью ДХМ/МеОН (97/3; об/об). Разделяют два изомера: менее полярный изомер, изомер А: соединение подготовительной стадии 3.29, с получением 0,3 г; т.пл. = 234-235 С.D25 = +143,3 (с = 0,136; хлороформ); более полярный изомер, изомер Б: соединение Подготовительной стадии 3.30, которое 52 перекристаллизовывают из смеси ДХМ/изоэфир/гексан с получением 1,1 г.R5 = ОСН 3; R6 = Н. Раствор соединения, полученного на подготовительной стадии 1.5, в ДХМ, концентрируют под вакуумом, остаток переносят в смесь 20 мл ТГФ и 10 мл ДХМ, добавляют при КТ 0,715 г гидрохлорида метил-(2S,4R)-4-гидрокси 2-пирролидинкарбоксилата, а затем 0,8 г триэтиламина, и смесь перемешивают при КТ в течение 48 ч. Реакционную смесь концентрируют под вакуумом, остаток экстрагируют ДХМ,органическую фазу промывают водой и сушат над Na2SO4, и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле, элюируя смесью ДХМ/ ЕtOАс= N(CH3)2; R6 = Н. Смесь 4,6 г соединения, полученного на подготовительной стадии 2.5, в 50 мл ДХМ, охлаждают до 4 С, добавляют 2,7 г соединения,полученного на подготовительной стадии 1.1, и затем 5 мл триэтиламина, и смесь перемешивают при КТ в течение 48 ч. Реакционную смесь концентрируют под вакуумом, остаток экстрагируют ЕtOАс, органическую фазу промывают 5%-ным раствором Na2CO3, насыщенным раствором NaCl и сушат над Na2SO4, и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на оксиде алюминия,элюируя смесью ДХМ/МеОН (98/2; об/об). Получают 1,6 г смеси двух диастерео-меров. Подготовительная стадия 3.33.R5 = N(CH3)2; R6 = Н. К раствору 2 г соединения, полученного на подготовительной стадии 1.12, в 20 мл ДХМ,добавляют 1,38 г соединения, полученного на подготовительной стадии 2.1 а), и затем 1,46 г ДИПЭА, и смесь перемешивают при КТ в течение 12 ч. Реакционную смесь концентрируют под вакуумом, остаток экстрагируют ЕtOАс,органическую фазу промывают 5%-ным раствором K2 СО 3 и сушат над Na2SO4, и под вакуумом 53 выпаривают растворитель. Остаток подвергают хроматографии на оксиде алюминия, элюируя смесью ДХМ/МеОН (95/5; об/об). Разделяют два диастереоизомера, и более полярное соединение собирают и повторно подвергают хроматографии на силикагеле, элюируя смесью ДХМ/ ЕtOАс (60/40; об/об) и затем ДХМ/МеОН (94/6; об/об). Получают 0,726 г ожидаемого продукта. Подготовительные стадии 3.34 и 3.35.N(CH3)2; R6 = Н. Смесь 1,6 г соединения, полученного на подготовительной стадии 1.13, 0,8 г соединения,полученного на подготовительной стадии 2.1 а),и 1 мл ДИПЭА в 20 мл ДХМ перемешивают при КТ в течение 24 ч. Образовавшийся осадок, соответствующий изомеру А, который является менее полярным соединением на силикагеле,ДХМ/МеОН (98/2; об/об) (соединение подготовительной стадии 3.34), отделяют центрифугированием. Фильтраты после центрифугирования выдерживают при 0 С в течение 48 ч и образовавшийся осадок, также соответствующий изомеру А, отделяют центрифугированием. Фильтраты после центрифугирования промывают водой, органическую фазу сушат над Na2SO4, и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле,элюируя смесью ДХМ/МеОН (98/2; об/об). Выделяют другой изомер: более полярный, изомер Б: соединение подготовительной стадии 3.35, с получением 0,2 г. Подготовительные стадии 3.36 и 3.37.N(CH3)2; R6 = H. Смесь 0,4 г соединения, полученного на подготовительной стадии 1.14, 0,3 г соединения,полученного на подготовительной стадии 2.1 а),и 0,45 г ДИПЭА в 20 мл ДХМ перемешивают при КТ в течение 2 ч. Образовавшийся осадок,соответствующий изомеру А, который является менее полярным соединением на оксиде алюминия, ДХМ/МеОН (98/2; об/об) (соединение подготовительной стадии 3.36), отделяют центрифугированием. Фильтраты после центрифугирования концентрируют под вакуумом, остаток переносят в смесь ЕtOАс/ацетон, и полученную смесь оставляют в холодных условиях в течение 12 ч, а осадок, также соответствующий изомеру А, отделяют центрифугированием. Фильтраты после центрифугирования промывают водой, органическую фазу сушат надNa2SO4, и под вакуумом выпаривают раствори 004628 54 тель. Остаток подвергают хроматографии на оксиде алюминия, элюируя смесью ДХМ/МеОН(98/2; об/об). Выделяют другой изомер: более полярный, изомер Б: соединение подготовительной стадии 3.37, с получением 0,1 г.(II): R1 = Cl; R2 = Н; R3 = ОСН 3; R4 = 4 ОСН 3; R5 = N(CH3)2; R6 = Н. К раствору соединения, полученного на подготовительной стадии 1.15, и 1 мл триэтиламина в 20 мл ДХМ, добавляют 1,5 г соединения,полученного на подготовительной стадии 2.1 а),и эту смесь перемешивают при КТ в течение 1 ч. Реакционную смесь два раза промывают водой,органическую фазу сушат над Na2SO4, и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на оксиде алюминия, элюируя ДХМ и затем смесью ДХМ/МеОН(98/2; об/об). Разделяют два изомера: менее полярный, изомер А: соединение подготовительной стадии 3.38; более полярный, изомер Б: соединение подготовительной стадии 3.39, с получением 0,26 г.R5 = N(CH3)2; R6 = H. Смесь 1,7 г соединения, полученного на подготовительной стадии 1.16, 0,9 г соединения,полученного на подготовительной стадии 2.1 а),и 1 мл ДИПЭА в 20 мл ДХМ перемешивают при КТ в течение 2 ч. Реакционную смесь промывают водой, органическую фазу сушат надNa2SO4, и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на оксиде алюминия, элюируя смесью ДХМ/МеОН(97/3; об/об). Разделяют два диастереоизомера и собирают более полярное соединение. Получают 0,42 г ожидаемого продукта.R5 = N(CH3)2; R6 = H. Смесь 1,57 г соединения, полученного на подготовительной стадии 1.17, 1,45 г соединения, полученного на подготовительной стадии 55 2.1 а) и 0,8 мл ДИПЭА в 15 мл ДХМ перемешивают при КТ в течение 1 ч 30 мин. Образовавшийся осадок, соответствующий изомеру А,который является менее полярным соединением на силикагеле, ДХМ/МеОН (94/6; об/об), отделяют центрифугированием. Фильтраты после центрифугирования концентрируют под вакуумом, остаток экстрагируют ЕtOАс, органическую фазу промывают 5%-ным растворомK2 СО 3, водой, насыщенным раствором NaCl и сушат над Na2SO4, и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле, элюируя смесью ДХМ/ МеОН (94/6; об/об). Разделяют два изомера: менее полярный, изомер А: соединение подготовительной стадии 3.41, которое кристаллизуют из смеси изоэфир/МеОН с получением 0,295 г; т.пл. = 261-262 С;D25 = +113,8 (с = 0,12; хлороформ); более полярный, изомер Б: соединение подготовительной стадии 3.42, с получением 0,74 г. Подготовительные стадии 3.43 и 3.44. трет-Бутил-2-(3R,5S)-1-[5-хлор-3-(2-метоксифенил)-2-оксо-2,3-дигидро-1H-индол-3-ил]-5[(диметиламино)карбонил)-3-пирролидинил] окси]ацетат, изомер А и изомер Б.N(CH3)2; R6 = -CH2COOC(CH3)3. К раствору соединения, полученного на подготовительной стадии 2.6, добавляют 200 мл ТГФ, 1,87 г триэтиламина и затем 4,5 г соединения, полученного на подготовительной стадии 1.1, и смесь кипятят с обратным холодильником в течение 48 ч. Продукт концентрируют под вакуумом и остаток подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН(96/4; об/об). Разделяют два изомера: менее полярный, изомер А: соединение подготовительной стадии 3.43 с получением 1 г; более полярный, изомер Б: соединение подготовительной стадии 3.44, с получением 3 г в виде масла;D25 = -154 (с = 0,37; хлороформ). Подготовительная стадия 3.45. (3R,5S)-1[5-Хлор-3-(2-метоксифенил)-2-оксо-2,3-дигидро-1 Н-индол-3-ил]-5-[(диметиламино)карбонил]-3-пирролидинил 3-(4-морфолинил)пропаноат, смесь двух диастереоизомеров К раствору соединения, полученного на подготовительной стадии 2.7, в EtOAc, добавляют раствор 3 г соединения, полученного на подготовительной стадии 1.1, в 100 мл ТГФ, и смесь перемешивают при КТ в течение 4 суток. Реакционную смесь концентрируют под вакуумом, остаток экстрагируют ЕtOАс, органическую фазу промывают водой и сушат надNa2SO4, и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (92/8;N(CH3)2; R6 = Н; R7 = 2-ОСН 3; R8 = ОСН 3. Смесь 0,67 г соединения, полученного на подготовительной стадии 3.2 (изомер Б), в 10 мл ДМФА охлаждают до 0 С в атмосфере аргона,добавляют 0,069 г 60%-ного гидрида натрия в масле и смесь перемешивают до прекращения выделения газа. Затем добавляют 0,404 г 2,4 диметоксибензолсульфонилхлорида и смесь перемешивают при КТ в течение 3 ч. Реакционную смесь вливают в 5%-ный раствор K2 СО 3 и экстрагируют EtOAc, органическую фазу промывают водой, насыщенным раствором NaCl и сушат над Na2SO4, и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на оксиде алюминия, элюируя смесью ДХМ/МеОН (99/1; об/об). После кристаллизации из смеси ДХМ/изоэфир получают 0,565 г ожидаемого продукта.N(CH3)2; R6 = Н; R7 = 2-ОСН 3; R8 = ОСН 3. К раствору 0,559 г соединения, полученного в примере 1, в 6 мл ДМФА, добавляют при КТ и в атмосфере аргона 0,04 г 60%-ного гидрида натрия в масле, и перемешивание продолжают до прекращения выделения газа. Затем добавляют 0,11 мл метилйодида и смесь перемешивают при КТ в течение 24 ч. Добавляют дополнительные 0,04 г 60%-ного гидрида натрия в масле, а затем 0,33 мл метилйодида при перемешивании при КТ в течение 3 суток. Реакционную смесь вливают в воду и экстрагируют ЕtOАс, органическую фазу промывают водой,насыщенным раствором NaCl и сушат надNa2SO4, и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (98/2; об/об). После кристаллизации из смеси ДХМ/изоэфир получают 0,082 г ожидаемого продукта; т.пл. = 189-191 С. Пример 3. (2S,4R)-1-[5-Хлор-3-(2-хлорфенил)-1-[(2,4-диметоксифенил)сульфонил]-2-оксо-2,3-дигидро-1 Н-индол-3-ил]-4-гидрокси-N,Nдиметил-2-пирролидинкарбоксамид,левовращающий изомерN(CH3)2; R6 = H; R7 = 2-OCH3; R8 = OCH3. Смесь 0,567 г соединения, полученного на подготовительной стадии 3.4 (изомер Б), в 5,5 мл ДМФА охлаждают до 0 С в атмосфере аргона, добавляют 0,062 г 60%-ного гидрида натрия в масле и смесь перемешивают в течение 10 мин. Затем добавляют 0,338 г 2,4 диметоксибензолсульфонилхлорида и смесь перемешивают при КТ в течение 3 ч. К реакционной смеси добавляют воду, полученную смесь три раза экстрагируют ЕtOАс, объединенные органические фазы промывают насыщенным раствором NaCl и сушат над Na2SO4, и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле,элюируя смесью ДХМ/МеОН (98/2; об/об). После кристаллизации из изоэфира получают 0,647 г ожидаемого продукта; т.пл. = 254-256 С.R5 = N(CH3)2; R6 = Н; R7 = 2-ОСН 3; R8 = ОСН 3. К суспензии 0,719 г соединения, полученного на подготовительной стадии 3.20 (изомер Б), в 7 мл ДМФА, добавляют при КТ в атмосфере аргона 0,072 г 60%-ного гидрида натрия в масле и смесь перемешивают до прекращения выделения газа. Затем добавляют 0,390 г 2,4 диметоксибензолсульфонилхлорида и смесь перемешивают при КТ в течение 3 ч. Реакционную смесь вливают в 5%-ный раствор K2 СО 3 и экстрагируют ЕtOАс и затем ДХМ, органические фазы по отдельности промывают водой,сушат над Na2SO4 и объединяют, и под вакуумом частично концентрируют растворители до точки кристаллизации. Образовавшийся осадок отделяют центрифугированием с получением 0,735 г ожидаемого продукта; т.пл. = 283-288 С.N(CH3)2; R6 = Н; R7 = 2-ОСН 3; R8 = ОСН 3. Раствор 0,043 г соединения, полученного на подготовительной стадии 3.2 (изомер Б), в 1 мл ТГФ охлаждают до -30 С в атмосфере азота,добавляют раствор 0,22 г трет-бутилата калия в 1 мл ТГФ и смесь перемешивают в течение 15 мин, давая возможность нагреться до температуры 0 С. Затем при перемешивании добавляют 0,035 г 2,4-диметоксибензолсульфонилхлорида в 1 мл ТГФ, давая возможность нагреться до КТ, и затем смесь нагревают при 58 30 С в течение 2 ч 15 мин. Добавляют 0,1 г PSтрисамина и смесь перемешивают при КТ в течение 1 ч 15 мин. При перемешивании добавляют 1 мл ДХМ и 1 мл воды, затем водную фазу удаляют фильтрованием через фильтр WhatmanFT 5.0PTFE и под вакуумом концентрируют органическую фазу. Остаток подвергают хроматографии на силикагеле, элюируя ДХМ, затем смесью ДХМ/ ЕtOАс от (90/10; об/об) до (70/30; об/об) и, наконец, смесью ДХМ/МеОН от (99/1; об/об) до (96/4; об/об). Получают 0,026 г ожидаемого продукта. МН+ = 629. Пример 6. Метил-(2S,4R)-1-[5-хлор-3-(2 метоксифенил)-1-[(3,4-диметоксифенил)сульфонил]-2-оксо-2,3-дигидро-1H-индол-3-ил]-4 гидрокси-2-пирролидинкарбоксилат, левовращающий изомер.(I): R1 = Cl; R2 = Н; R3 = ОСН 3; R4 = Н; R5 = ОСН 3; R6 = Н; R7 = 3-ОСН 3; R8 = ОСН 3. Смесь 0,477 г соединения, полученного на подготовительной стадии 3.30 (изомер Б), в 4,7 мл ДМФА охлаждают до 0 С в атмосфере аргона, добавляют 0,055 г 60%-ного гидрида натрия в масле и смесь перемешивают в течение 10 мин. Затем добавляют 0,297 г 3,4 диметоксибензолсульфонилхлорида и смесь перемешивают при КТ в течение 3 ч 30 мин. К реакционной смеси добавляют воду, полученную смесь три раза экстрагируют ЕtOАс, объединенные органические фазы промывают водой,насыщенным раствором NaCl и сушат надNa2SO4, и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле, элюируя смесью ДХМ/ МеОН (97/3; об/об). После кристаллизации из смеси ДХМ/изоэфир получают 0,3 г ожидаемого продукта.N(CH3)2; R6 = Н; R7 = 2-ОСН 3; R8 = ОСН 3. Смесь 0,82 г соединения, полученного на подготовительной стадии 3.32 (смесь диастереоизомеров), в 5 мл ДМФА охлаждают до 4 С в атмосфере азота, добавляют 0,076 г 60%-ного гидрида натрия в масле и смесь перемешивают при 4 С в течение 30 мин. Затем добавляют 0,451 г 2,4-диметоксибензолсульфонилхлорида и смесь перемешивают при КТ в течение 3 ч. К реакционной смеси добавляют 50 мл воды, полученную смесь экстрагируют EtOAc, органическую фазу промывают 5%-ным растворомNa2CO3, насыщенным раствором NaCl и сушат над Na2SO4, и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии 59 на оксиде алюминия, элюируя смесью ДХМ/МеОН (99,2/0,8; об/об). Разделяют два диастереоизомера: менее полярный: соединение примера 7; 0,122 г которого собирают после кристаллизации из гексана; т.пл. = 151 С;D25 = -154 (с = 0,1; хлороформ); более полярный, соединение примера 8,которое получают после кристаллизации из смеси ДХМ/изоэфир; т.пл. = 283 С;D25 = +140 (с = 0,1; хлороформ). Следуя методикам, описанным в примерах,упомянутых выше, начиная с соединений формулы (II), описанных в подготовительных стадиях 3, и 2,4-диметоксибензолсульфонилхлорида, получают соединения по данному изобретению, объединенные в приведенной ниже табл. I. 60 а) Это соединение получают в соответствии с методикой, описанной в примере 3, начиная с соединения, полученного на подготовительной стадии 3.6, изомер Б. Продукт подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (97/3; об/об). б) Это соединение получают в соответствии с методикой, описанной в примере 3, начиная с соединения, полученного на подготовительной стадии 3.8, изомер Б. Продукт подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (96/4; об/об). в) Это соединение получают в соответствии с методикой, описанной в примере 3, начиная с соединения, полученного на подготовительной стадии 3.10, изомер Б. Продукт подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (96/4; об/об). г) Это соединение получают в соответствии с методикой, описанной в примере 3, начиная с соединения, полученного на подготовительной стадии 3.12, изомер Б. Продукт подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (96/4; об/об). д) Это соединение получают в соответствии с методикой, описанной в примере 1, начиная с соединения, полученного на подготовительной стадии 3.14, изомер Б. Продукт подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (98,5/1,5; об/об). е) Это соединение получают в соответствии с методикой, описанной в примере 1, начиная с соединения, полученного на подготовительной стадии 3.16, изомер Б. Продукт подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (98,5/1,5; об/об). ж) Это соединение получают в соответствии с методикой, описанной в примере 1, начиная с соединения, полученного на подготовительной стадии 3.18, изомер Б. Продукт подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (98/2; об/об). з) Это соединение получают в соответствии с методикой, описанной в примере 1, начиная с соединения, полученного на подготовительной стадии 3.22, изомер Б. Продукт подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (98,5/1,5; об/об). и) Это соединение получают в соответствии с методикой, описанной в примере 3, начиная с соединения, полученного на подготовительной стадии 3.24, изомер Б. Продукт подвергают хроматографии на силикагеле, элюируя смесью ДХМ/ЕtOАс (80/20; об/об). к) Это соединение получают в соответствии с методикой, описанной в примере 3, начиная с соединения, полученного на подготовительной стадии 3.26, изомер Б. Продукт подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (91/9; об/об).
МПК / Метки
МПК: A61K 31/404, C07D 403/04, A61P 43/00
Метки: применение, 1,3-дигидро-2н-индол-2-она, рецепторов, качестве, новые, лигандов, аргинин-вазопрессина, производные
Код ссылки
<a href="https://eas.patents.su/30-4628-novye-proizvodnye-13-digidro-2n-indol-2-ona-i-ih-primenenie-v-kachestve-ligandov-receptorov-arginin-vazopressina-v1b-i-v1a.html" rel="bookmark" title="База патентов Евразийского Союза">Новые производные 1,3-дигидро-2н-индол-2-она и их применение в качестве лигандов рецепторов аргинин-вазопрессина v1b и v1a</a>
Предыдущий патент: Фармацевтические композиции фибринолитического агента
Следующий патент: Штаммы дрожжей, лишенные ацетил-соа-прегненолон-ацетилтрансферазной активности, и способы окисления стеринов и стероидов при их использовании
Случайный патент: Композиция для предотвращения контактного дерматита, содержащая ее защитная пленка и способ предотвращения контактного дерматита












