Сульфонилпроизводные в качестве новых ингибиторов гистон-деацетилазы
Номер патента: 6707
Опубликовано: 24.02.2006
Авторы: Вердонк Марк Густаф Селин, Понселе Виржини Софи, Ван Брандт Свен Францискус Анна, Дяткин Алексей Борисович, Ван Эмелен Кристоф, Артс Янине, Ван Хьюсден Джимми Арнольд Вивиан, Бакс Лео Якобус Йозеф, Пилатт Изабелль Ноэлль Констанс, Мерпул Ливен, Де Винтер Ханс Луи Йос
Формула / Реферат
1. Соединение формулы (I)
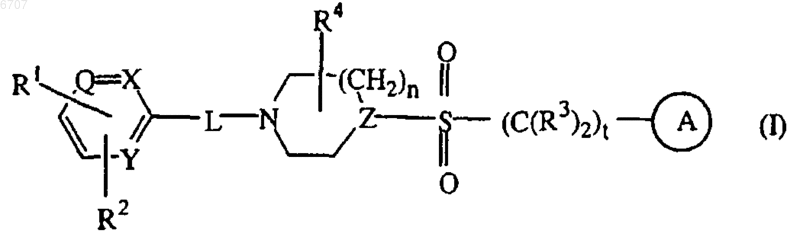
его N-оксидные формы, его фармацевтически приемлемые соли добавления кислот и его стереохимически изомерные формы,
где n равно 0, 1, 2 или 3 и, если n равно 0, то имеется в виду прямая связь;
t равно 0, 1, 2, 3 или 4, и если t равно 0, то имеется в виду прямая связь;
каждый Q представляет собой азот или 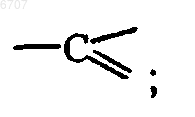
каждый X представляет собой азот или 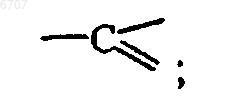
каждый Y представляет собой азот или 
каждый Z представляет собой азот или 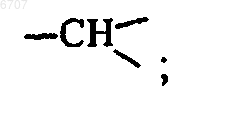
R1 представляет собой -C(O)NR7R8, -N(H)C(O)R9, -C(O)-C1-6алкандиилSR9, -NR10C(O)N(OH)R9, -NR10C(O)C1-6алкандиилSR9, -NR10C(O)C=N(OH)R9 или другую Zn-хелатообразующую группу,
где R7 и R8, каждый независимо, выбран из водорода, гидрокси, C1-6алкила, гидроксиC1-6алкила, аминоC1-6алкила или аминоарила;
R9 независимо выбран из водорода, C1-6алкила, C1-6алкилкарбонила, арилC1-6алкила, C1-6алкилпиразинила, пиридинона, пирролидинона или метилимидазолила;
R10 независимо выбран из водорода или C1-6алкила;
R2 представляет собой водород, галоген, гидрокси, амино, нитро, C1-6алкил, C1-6алкилокси, трифторметил, ди(C1-6алкил)амино, гидроксиамино или нафталенилсульфонилпиразинил;
-L- представляет собой прямую связь или бивалентный радикал, выбранный из C1-6алкандиила, амино, карбонила или аминокарбонила;
каждый R3 независимо представляет собой атом водорода и
один атом водорода может быть замещен заместителем, выбранным из арила;
R4 представляет собой водород, гидрокси, амино, гидроксиC1-6алкил, C1-6алкил, C1-6алкилокси, арилC1-6алкил, аминокарбонил, гидроксикарбонил, аминоC1-6алкил, аминокарбонилC1-6алкил, гидроксикарбонилC1-6алкил, гидроксиаминокарбонил, C1-6алкилоксикарбонил, C1-6алкиламиноC1-6алкил или ди(C1-6алкил)аминоC1-6алкил;
 представляет собой радикал, выбранный из
представляет собой радикал, выбранный из
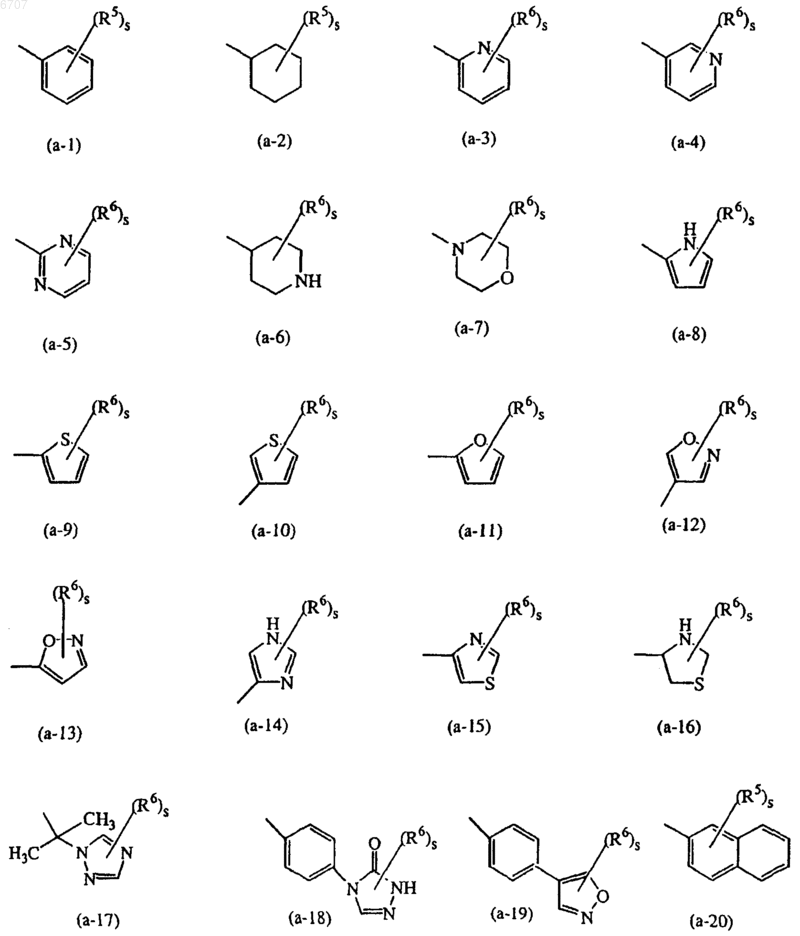
где каждый s независимо представляет собой 0, 1, 2, 3, 4 или 5 ;
каждый R5 и R6 независимо выбраны из водорода; галогена; гидрокси; амино; нитро; тригалогенC1-6алкила; тригалогенC1-6алкилокси; C1-6алкила; C1-6алкила, замещенного арилом и C3-10циклоалкилом; C1-6алкилокси; C1-6алкилоксиC1-6алкилокси; C1-6алкилкарбонила; C1-6алкилоксикарбонила; C1-6алкилсульфонила; цианоC1-6алкила; гидроксиC1-6алкила; гидроксиC1-6алкилокси; гидроксиC1-6алкиламино; аминоC1-6алкилокси; ди(C1-6алкил)аминокарбонила; ди(гидроксиC1-6алкил)амино; (арил)(C1-6алкил)амино; ди(C1-6алкил)аминоC1-6алкилокси; ди(C1-6алкил)аминоC1-6алкиламино; ди(C1-6алкил)аминоC1-6алкиламиноC1-6алкила; арилсульфонила; арилсульфониламино; арилокси; арилоксиC1-6алкила; арилC2-6алкендиила; ди(C1-6алкил)амино; ди(C1-6алкил)аминоC1-6алкила; ди(C1-6алкил)амино(C1-6алкил)амино; ди(C1-6алкил)амино(C1-6алкил)аминоC1-6алкила; ди(C1-6алкил)аминоC1-6алкил(C1-6алкил)амино; ди(C1-6алкил)аминоC1-6алкил(C1-6алкил)аминоC1-6алкила; аминосульфониламино(C1-6алкил)амино; аминосульфониламино(C1-6алкил)аминоC1-6алкила; ди(C1-6алкил)аминосульфониламино(C1-6алкил)амино; ди(C1-6алкил)аминосульфониламино (C1-6алкил)аминоC1-6алкила; циано; тиофенила; тиофенила, замещенного ди(C1-6алкил)аминоC1-6алкил(C1-6алкил)аминоC1-6алкилом, ди(C1-6алкил)аминоC1-6алкилом, C1-6алкилпиперазинилC1-6алкилом, гидроксиC1-6алкилпиперазинилC1-6алкилом, гидроксиC1-6алкилоксиC1-6алкилпиперазинилC1-6алкилом, ди(C1-6алкил)аминосульфонилпиперазинилC1-6алкилом, C1-6алкилоксипиперидинилом, C1-6алкилоксипиперидинилC1-6алкилом, морфолинилC1-6алкилом, гидроксиC1-6алкил(C1-6алкил)аминоC1-6алкилом или ди(гидроксиC1-6алкил)аминоC1-6алкилом; фуранила; фуранила, замещенного гидроксиC1-6алкилом; бензофуранила; имидазолила; оксазолила; оксазолила, замещенного арилом и C1-6алкилом; C1-6алкилтриазолила; тетразолила; пирролидинила; пирролила; пиперидинилC1-6алкилокси; морфолинила; C1-6алкилморфолинила; морфолинилC1-6алкилокси; морфолинилC1-6алкила; морфолинилC1-6алкиламино; морфолинилC1-6алкиламиноC1-6алкила; пиперазинила; C1-6алкилпиперазинила; C1-6алкилпиперазинилC1-6алкилокси; пиперазинилC1-6алкила; нафталенилсульфонилпиперазинила; нафталенилсульфонилпиперидинила; нафталенилсульфонила; C1-6 алкилпиперазинилC1-6алкила; C1-6алкилпиперазинилC1-6алкиламино; C1-6алкилпиперазинилC1-6алкиламиноC1-6алкила; C1-6алкилпиперазинилсульфонила; аминосульфонилпиперазинилC1-6алкилокси; аминосульфонилпиперазинил; аминосульфонилпиперазинилC1-6алкила; ди(C1-6алкил)аминосульфонилпиперазинила; ди(C1-6алкил)аминосульфонилпиперазинилC1-6алкила; гидроксиC1-6алкилпиперазинила; гидроксиC1-6алкилпиперазинилC1-6алкила; C1-6алкилоксипиперидинила; C1-6алкилоксипиперидинилC1-6алкила; пиперидиниламиноC1-6алкиламино; пиперидиниламиноC1-6алкиламиноC1-6алкила; (C1-6алкилпиперидинил)(гидроксиC1-6алкил)аминоC1-6алкиламино; (C1-6алкилпиперидинил) (гидроксиC1-6алкил)аминоC1-6алкиламиноC1-6алкила; гидроксиC1-6алкилоксиC1-6алкилпиперазинила; гидроксиC1-6алкилоксиC1-6алкилпиперазинилC1-6алкила; (гидроксиC1-6 алкил)(C1-6алкил)амино; (гидроксиC1-6алкил)(C1-6алкил)аминоC1-6алкила; гидроксиC1-6алкиламиноC1-6алкила; ди(гидроксиC1-6алкил)аминоC1-6алкила; пирролидинилC1-6алкила; пирролидинилC1-6алкилокси; пиразолила; тиопиразолила; пиразолила, замещенного двумя заместителями, выбранными из C1-6алкила или тригалогенC1-6алкила; пиридинила; пиридинила, замещенного C1-6алкилокси, арилокси или арилом; пиримидинила; тетрагидропиримидинилпиперазинила; тетрагидропиримидинилпиперазинилC1-6алкила; хинолинила; индола; фенила; фенила, замещенного одним, двумя или тремя заместителями, независимо выбранными из галогена, амино, нитро, C1-6алкила, C1-6алкилокёш, гидроксиC1-4алкила, трифторметила, трифторметилокси, гидроксиC1-4алкилокси, C1-4алкилсульфонила, C1-4алкилоксиC1-4алкилокси, C1-4алкилоксикарбонила, аминоC1-4алкилокси, ди(C1-4алкил)аминоC1-4алкилокси, ди(C1-4алкил)амино, ди(C1-4алкил)аминокарбонила, ди(C1-4алкил)аминоC1-4алкила, ди(C1-4алкил)аминоC1-4алкиламиноC1-4алкила, ди(C1-4алкил)амино(C1-4алкил)амино, ди(C1-4алкил)амино(C1-4алкил)аминоC1-4алкила, ди(C1-4алкил)аминоC1-4алкил(C1-4алкил)амино, ди(C1-4алкил)аминоC1-4алкил (C1-4алкил)аминоC1-4алкила, аминосульфониламино(C1-4алкил)амино, аминосульфониламино(C1-4алкил)аминоC1-4алкила, ди(C1-4алкил)аминосульфониламино(C1-4алкил)амино, ди(C1-4алкил)аминосульфониламино(C1-4алкил)аминоC1-6алкила, циано, пиперидинилC1-4алкилокси, пирролидинилC1-4алкилокси, аминосульфонилпиперазинила, аминосульфонилпиперазинилC1-4алкила, ди(C1-4алкил)аминосульфонилпиперазинила, ди(C1-4алкил)аминосульфонилпиперазинилC1-4алкила, гидроксиC1-4алкилпиперазинила,
гидроксиC1-4алкилпиперазинилC1-4алкила, C1-4алкилоксипиперидинила, C1-4алкилоксипиперидинилC1-4алкила, гидроксиC1-4алкилоксиC1-4алкилпиперазинила, гидроксиC1-4алкилоксиC1-4алкилпиперазинилC1-4алкила, (гидроксиC1-4алкил)(C1-4алкил)амино, (гидроксиC1-4алкил)(C1-4алкил)аминоC1-4алкила, ди(гидроксиC1-4алкил)амино, ди(гидроксиC1-4алкил)аминоC1-4алкила, фуранила, фуранила, замещенного -CH=CH-CH=CH-, пирролидинилC1-4алкила, пирролидинилC1-4алкилокси, морфолинила, морфолинилC1-4алкилокси, морфолинилC1-4алкила, морфолинилC1-4алкиламино, морфолинилC1-4алкиламиноC1-4алкила, пиперазинила, C1-4алкилпиперазинила, C1-4алкилпиперазинилC1-4алкилокси, пиперазинилC1-4алкила, C1-4алкилпиперазинилC1-4алкила, C1-4алкилпиперазинилC1-4алкиламино, C1-4алкилпиперазинилC1-4алкиламиноC1-6алкила, тетрагидропиримидинилпиперазинила, тетрагидропиримидинилпиперазинилC1-4алкила, пиперидиниламиноC1-4алкиламино, пиперидиниламиноC1-4алкиламиноC1-4алкила, (C1-4алкилпиперидинил)(гидроксиC1-4алкил)аминоC1-4алкиламино, (C1-4алкилпиперидинил)(гидроксиC1-4алкил)аминоC1-4алкиламиноC1-4алкила, пиридинилC1-4алкилокси, гидроксиC1-4алкиламино, гидроксиC1-4алкиламиноC1-4алкила, ди(C1-4алкил)аминоC1-4алкиламино, аминотиадиазолила, аминосульфонилпиперазинилC1-4алкилокси или тиофенилC1-4алкиламино;
может быть присоединена с помощью метиленового, этиленового или пропиленового мостка центральная группа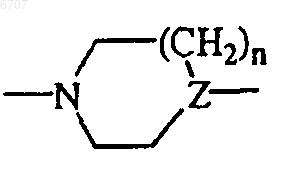 (то есть с образованием бициклической группы);
(то есть с образованием бициклической группы);
каждый R5 и R6 может быть помещен на азот при замене водорода;
арил в вышеуказанном представляет собой фенил или фенил, замещенный одним или несколькими заместителями, каждый независимо выбран из галогена, C1-6алкила, C1-6алкилокси, трифторметила, циано или гидроксикарбонила.
2. Соединение по п.1,
где R7 и R8, каждый независимо, выбран из водорода, гидрокси, гидроксиC1-6алкила, аминоC1-6алкила или аминоарила;
R2 представляет собой водород, галоген, гидрокси, амино, нитро, C1-6алкил, C1-6алкилокси, трифторметил, гидроксиамино или нафталенилсульфонилпиразинил;
R4 представляет собой водород, гидрокси, амино, гидроксиC1-6алкил, C1-6алкилокси, арилC1-6алкил, аминокарбонил, гидроксикарбонил, аминоC1-6алкил, аминокарбонилC1-6алкил, гидроксикарбонилC1-6алкил, гидроксиаминокарбонил, C1-6алкилоксикарбонил, C1-6алкиламиноC1-6алкил или ди(C1-6алкил)аминоC1-6алкил;
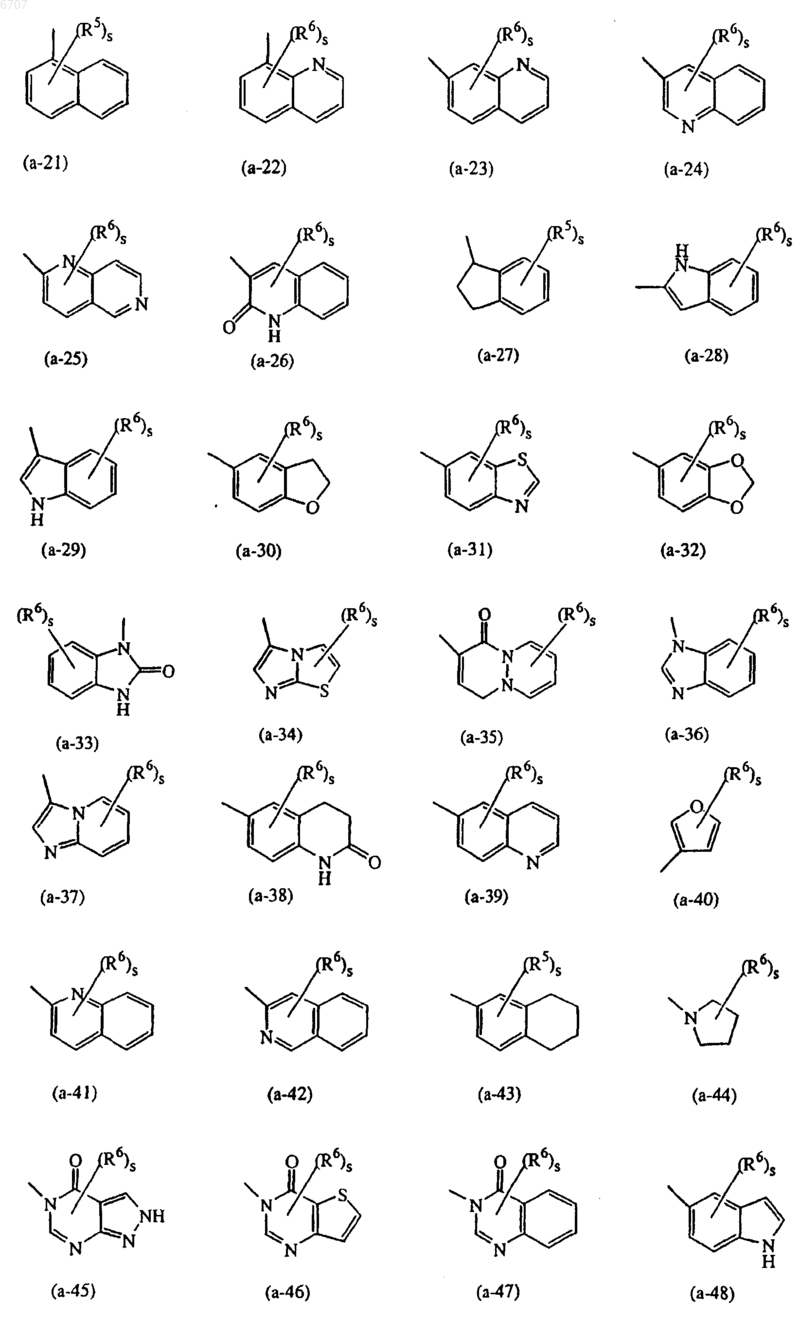
 представляет собой радикал, выбранный из (a-1), (a-2), (a-3), (a-4), (a-5), (a-6), (a-7), (a-8), (a-9), (a-10), (a-11), (a-12), (a-13), (a-14), (a-15), (a-16), (a-17), (a-18), (a-19), (a-20), (a-21), (a-22), (a-23), (a-24), (a-25), (a-26) , (a-27), (a-28), (a-29), (a-30), (a-31), (a-32), (a-33), (a-34), (a-35), (a-36), (a-37), (a-38), (a-39), (a-40), (a-41), (a-42) (a-43) или (a-44);
представляет собой радикал, выбранный из (a-1), (a-2), (a-3), (a-4), (a-5), (a-6), (a-7), (a-8), (a-9), (a-10), (a-11), (a-12), (a-13), (a-14), (a-15), (a-16), (a-17), (a-18), (a-19), (a-20), (a-21), (a-22), (a-23), (a-24), (a-25), (a-26) , (a-27), (a-28), (a-29), (a-30), (a-31), (a-32), (a-33), (a-34), (a-35), (a-36), (a-37), (a-38), (a-39), (a-40), (a-41), (a-42) (a-43) или (a-44);
каждый R5 и R6 независимо выбраны из водорода; галогена; гидрокси; амино; нитро; тригалогенC1-6алкила; тригалогенC1-6алкилокси; C1-6алкила; C1-6алкилокси; C1-6алкилоксиC1-6алкилокси; C1-6алкилкарбонила; C1-6алкилсульфонила; цианоC1-6алкила; гидроксиC1-6алкила; гидроксиC1-6алкилокси; гидроксиC1-6алкиламино; аминоC1-6алкилокси; ди(C1-6алкил)аминокарбонила; ди(гидроксиC1-6алкил)амино; ди(C1-6алкил)аминоC1-6алкилокси; ди(C1-6алкил)аминоC1-6алкиламино; арилсульфонила; арилсульфониламино; арилокси; арилC2-6алкендиила; ди(C1-6алкил)амино; циано; тиофенила; тиофенила, замещенного ди(C1-6алкил)аминоC1-6алкил(C1-6алкил)аминоC1-6алкилом, ди(C1-6алкил)аминоC1-6алкилом, C1-6алкилпиперазинилC1-6алкилом или ди(гидроксиC1-6алкил)аминоC1-6алкилом; фуранила; имидазолила; C1-6алкилтриазолила; тетразолила; пиперидинилC1-6алкилокси; морфолинила; C1-6алкилморфолинила; морфолинилC1-6алкилокси; морфолинилC1-6алкила; C1-6алкилпиперазинилC1-6алкилокси; C1-6алкилпиперазинилC1-6алкила; C1-6алкилпиперазинилсульфонила; аминосульфонилпиперазинилC1-6алкилокси; аминосульфонилпиперазинила; аминосульфонилпиперазинилC1-6алкила; ди(C1-6алкил)аминосульфонилпиперазинила; ди(C1-6алкил)аминосульфонилпиперазинилC1-6алкила; гидроксиC1-6алкилпиперазинила; гидроксиC1-6алкилпиперазинилC1-6алкила; C1-6алкилоксипиперидинила; C1-6алкилоксипиперидинилC1-6алкила; гидроксиC1-6алкилоксиC1-6алкилпиперазинила; гидроксиC1-6алкилоксиC1-6алкилпиперазинилC1-6алкила; (гидроксиC1-6алкил)(C1-6алкил)амино; (гидроксиC1-6алкил)(C1-6алкил)аминоC1-6алкила; пирролидинилC1-6алкилокси; пиразолила; тиопиразолила; пиразолила, замещенного двумя заместителями, выбранными из C1-6алкила или тригалогенC1-6алкила; пиридинила; пиридинила, замещенного C1-6алкилокси или арила; пиримидинила; хинолинила; фенила; фенила, замещенного одним, двумя или тремя заместителями, независимо выбранными из галогена, амино, C1-6алкила, C1-6алкилокси, гидроксиC1-4алкила, трифторметила, трифторметилокси, гидроксиC1-4алкилокси, C1-4алкилоксиC1-4алкилокси, аминоC1-4алкилокси, ди(C1-4алкил)аминоC1-4алкилокси,
ди(C1-4алкил)амино, пиперидинилC1-4алкилокси, пирролидинилC1-4алкилокси, аминосульфонилпиперазиниыр, аминосульфонилпиперазинилC1-4алкила, ди(C1-4алкил) аминосульфонилпиперазинила, ди(C1-4алкил) аминосульфонилпиперазинилC1-4алкила, гидроксиC1-4алкилпиперазинила, гидроксиC1-4алкилпиперазинилC1-4алкила, C1-4алкилоксипиперидинила, C1-4алкилоксипиперидинилC1-4алкила, гидроксиC1-4алкилоксиC1-4алкилпиперазинила, гидроксиC1-4алкилоксиC1-4алкилпиперазинилC1-4алкила, (гидроксиC1-4алкил)(C1-4алкил)амино, (гидроксиC1-4алкил)(C1-4алкил)аминоC1-4алкила, пирролидинилC1-4алкилокси, морфолинилC1-4алкилокси, морфолинилC1-4алкила, C1-4алкилпиперазинилC1-4алкилокси, C1-4алкилпиперазинилC1-4алкила, гидроксиC1-4алкиламино, ди(гидроксиC1-4алкил)амино, ди(C1-4алкил)аминоC1-4алкиламино, аминотиадиазолила, аминосульфонилпиперазинилC1-4алкилокси или тиофенилC1-4алкиламино.
3. Соединение по п.1,
где t равно 0;
R1 представляет собой -C(O)NR7R8, -C(O)-C1-6алкендиилSR9, -NR10C(O)N(OH)R9, -NR10C(O)C1-6алкандиилSR9, -NR10C(O)C=N(OH)R9 или другую Zn-хелатирующую группу,
где каждый R7 и R8 независимо выбран из водорода, гидрокси, гидроксиC1-6алкила или аминоC1-6алкила;
R2 представляет собой водород, галоген, гидрокси, амино, нитро, C1-6алкил, C1-6алкилокси, трифторметил или ди(C1-6 алкил)амино;
-L- представляет собой прямую связь или бивалентный радикал, выбранный из C1-6алкандиила, амино или карбонила;
R4 представляет собой водород, гидрокси, амино, гидроксиC1-6алкил, C1-6алкил, C1-6алкилокси, арилC1-6алкил, аминокарбонил, аминоC1-6алкил, C1-6алкиламиноC1-6алкил или ди(C1-6алкил)аминоC1-6алкил;
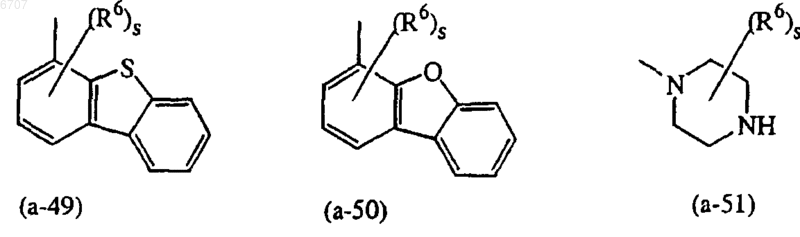
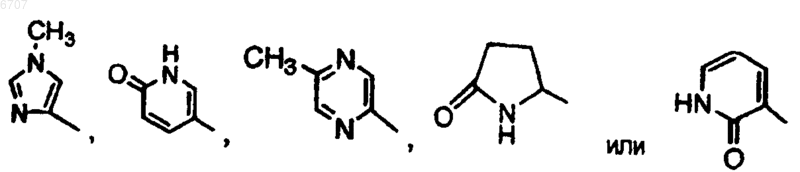
 представляет собой радикал, выбранный из (a-1), (a-3), (a-4), (a-5), (a-6), (a-7), (a-8), (a-9), (a-10), (a-11) , (a-12), (a-13), (a-14), (a-15), (a-16), (a-17), (a-18), (a-19), (a-20), (a-21), (a-22), (a-23), (a-24), (a-25), (a-26), (a-28), (a-29), (a-30), (a-31), (a-32), (a-33), (a-34), (a-35), (a-36), (a-37), (a-38), (a-39), (a-40), (a-41), (a-42), (a-44), (a-45), (a-46), (a-47), (a-48) или (a-51);
представляет собой радикал, выбранный из (a-1), (a-3), (a-4), (a-5), (a-6), (a-7), (a-8), (a-9), (a-10), (a-11) , (a-12), (a-13), (a-14), (a-15), (a-16), (a-17), (a-18), (a-19), (a-20), (a-21), (a-22), (a-23), (a-24), (a-25), (a-26), (a-28), (a-29), (a-30), (a-31), (a-32), (a-33), (a-34), (a-35), (a-36), (a-37), (a-38), (a-39), (a-40), (a-41), (a-42), (a-44), (a-45), (a-46), (a-47), (a-48) или (a-51);
каждый s независимо представляет собой 0, 1, 2, 3 или 4;
R5 представляет собой водород; галоген; гидрокси; амино; нитро; тригалогенC1-6алкил; тригалогенC1-6алкилокси; C1-6алкил; C1-6алкилокси; C1-6алкилкарбонил; C1-6алкилоксикарбонил; C1-6алкилсульфонил; гидроксиC1-6алкил; арилокси; ди(C1-6алкил)амино; циано; тиофенил; фуранил; фуранил замещенный гидроксиC1-6алкилом; бензофуранил; имидазолил; оксазолил; оксазолил, замещенный арилом и C1-6алкилом; C1-6алкилтриазолил; тетразолил; пирролидинил; пирролил; морфолинил; C1-6алкилморфолинил; пиперазинил; C1-6алкилпиперазинил; гидроксиC1-6алкилпиперазинил; C1-6алкилоксипиперидинил; пиразолил; пиразолил, замещенный одним или двумя заместителями, выбранными из C1-6алкила или тригалогенC1-6алкила; пиридинил; пиридинил, замещенный C1-6алкилокси, арилокси или арилом; пиримидинил; хинолинил; индол; фенил; или фенил, замещенный одним или двумя заместителями, независимо выбранными из галогена, C1-6алкила, C1-6алкилокси или трифторметила;
R6 представляет собой водород; галоген; гидрокси; амино; нитро; тригалогенC1-6алкил; тригалогенC1-6алкилокси; C1-6алкил; C1-6алкилокси; C1-6алкилкарбонил; C1-6алкилоксикарбонил; C1-6алкилсульфонил; гидроксиC1-6алкил; арилокси; ди(C1-6алкил)амино; циано; пиридинил; фенил; или фенил, замещенный одним или двумя заместителями, независимо выбранными из галогена, C1-6алкила, C1-6алкилокси или трифторметила; или также может быть присоединена с помощью этиленового мостика центральная 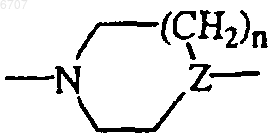 группа (то есть с образованием бициклической группы).
группа (то есть с образованием бициклической группы).
4. Соединение по п.1,
где n равно 1 или 2; t равно 0, 1 или 2;
каждый Z представляет собой азот;
R10 представляет собой водород;
R2 представляет собой водород; нитро, C1-6алкилокси, трифторметил, ди(C1-6алкил)амино, гидроксиамино или нафталенилсульфонилпиразинил;
-L- представляет собой прямую связь или бивалентный радикал, выбранный из C1-6алкандиила, карбонила или аминокарбонила;
каждый R3 представляет собой атом водорода;
R4 представляет собой водород, гидроксиC1-6алкил, аминокарбонил, гидроксиаминокарбонил или ди(C1-6алкил)аминоC1-6алкил;
 представляет собой радикал, выбранный из (a-1), (a-7), (a-9), (a-10), (a-12), (a-14), (a-19), (a-20), (a-21), (a-22), (a-23), (a-30), (a-34), (a-49) или (a-50);
представляет собой радикал, выбранный из (a-1), (a-7), (a-9), (a-10), (a-12), (a-14), (a-19), (a-20), (a-21), (a-22), (a-23), (a-30), (a-34), (a-49) или (a-50);
каждый s независимо представляет собой 0, 1, 2 или 5;
каждый R5 и R6 независимо выбран из водорода; галогена; тригалогенC1-6алкила; тригалогенC1-6алкилокси; C1-6алкила; C1-6алкилокси; C1-6алкилсульфонила; (арил)(C1-6алкил)амино; арилсульфонила; арилокси; арилC2-6алкендиила; ди(C1-6алкил)амино; тиофенила; тиофенила, замещенного ди(C1-6алкил)аминоC1-6алкил(C1-6алкил)аминоC1-6алкилом, ди(C1-6алкил)аминоC1-6алкила, C1-6алкилпиперазинилC1-6алкила, гидроксиC1-6алкилпиперазинилC1-6алкила, гидроксиC1-6алкилоксиC1-6алкилпиперазинилC1-6алкила, ди(C1-6алкил)аминосульфонилпиперазинилC1-6алкила; C1-6алкилоксипиперидинилC1-6алкила, морфолинилC1-6алкила, гидроксиC1-6алкил(C1-6алкил)аминоC1-6алкила или ди(гидроксиC1-6алкил)аминоC1-6алкила; фуранила; оксазолила; пирролила; пиразолила; пиридинила; пиридинила, замещенногоC1-6алкилокси; хинолинила; индолила; фенила; фенила, замещенного одним, двумя или тремя заместителями, независимо выбранными из галогена, амино, C1-6алкила, C1-6алкилокси, гидроксиC1-4алкила, трифторметила, трифторметилокси, ди(C1-4алкил)аминоC1-4алкилокси, ди(C1-4алкил)амино, ди(C1-4алкил)аминоC1-4алкила, ди(C1-4алкил)аминоC1-4алкил(C1-4алкил)амино; ди(C1-4алкил)аминоC1-4алкил(C1-4алкил)аминоC1-4алкила, гидроксиC1-4алкилпиперазинилC1-4алкила, гидроксиC1-4алкилоксиC1-4алкилпиперазинилC1-4алкила, ди(гидроксиC1-4алкил)аминоC1-4алкила, пирролидинилC1-4алкила, пирролидинилC1-4алкилокси, морфолинилC1-4алкилокси, морфолинилC1-4 алкила, C1-4алкилпиперазинилC1-4алкила или также может быть присоединена с помощью метиленового мостика центральная 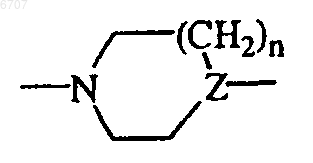 группа (то есть с образованием бициклической группы).
группа (то есть с образованием бициклической группы).
5. Соединение по любому из пп.1 и 4,
где n равно 1 или 2;
t равно 0 или 2;
каждый Z представляет собой азот;
R10 представляет собой водород;
R2 представляет собой водород, нитро, C1-6алкилокси, трифторметил, ди(C1-6алкил) амино, гидроксиамино или нафталенилсульфонилпиразинил;
-L- представляет собой прямую связь или бивалентный радикал, выбранный из C1-6алкандиила, карбонила или аминокарбонила;
каждый R3 представляет собой атом водорода;
R4 представляет собой водород, гидроксиC1-6алкил, аминокарбонил, гидроксиаминокарбонил или ди(C1-6алкил)аминоC1-6алкил;
 представляет собой радикал, выбранный из (a-1), (a-7), (a-9), (a-10), (a-12), (a-14), (a-19), (a-20), (a-21), (a-22), (a-23), (a-30), (a-34), (a-49) или (a-50);
представляет собой радикал, выбранный из (a-1), (a-7), (a-9), (a-10), (a-12), (a-14), (a-19), (a-20), (a-21), (a-22), (a-23), (a-30), (a-34), (a-49) или (a-50);
каждый s независимо представляет собой 0, 1, 2 или 5;
каждый R5 и R6 независимо выбран из водорода; галогена; нитро; тригалогенC1-6алкила; тригалогенC1-6алкилокси; C1-6алкила; C1-6алкилокси; C1-6алкилсульфонила; (арил)(C1-6алкил)амино; арилсульфонила; арилокси; арилC2-6алкендиила; ди(C1-6алкил)амино; тиофенила; тиофенила, замещенного ди(C1-6алкил)аминоC1-6алкил(C1-6алкил)аминоC1-6алкилом, ди(C1-6алкил)аминоC1-6алкилом, C1-6алкилпиперазинилC1-6алкилом, гидроксиC1-6алкилпиперазинилC1-6алкилом, гидроксиC1-6алкилоксиC1-6алкилпиперазинилC1-6алкилом, ди(C1-6алкил)аминосульфонилпиперазинилC1-6алкилом; C1-6алкилоксипиперидинилC1-6алкилом, морфолинилC1-6алкилом, гидроксиC1-6алкил (C1-6алкил)аминоC1-6алкилом или ди(гидроксиC1-6алкил)аминоC1-6алкилом; фуранила; оксазолила; пирролила; пиразолила; пиридинила; пиридинила, замещенного C1-6алкилокси; хинолинила; индолила; фенила; фенила, замещенного одним, двумя или тремя заместителями, независимо выбранными из галогена, амино, C1-6алкила, C1-6алкилокси, гидроксиC1-4алкила, трифторметила, трифторметилокси, ди(C1-4алкил)аминоC1-4алкилокси, ди(C1-4алкил)амино, ди(C1-4алкил)аминоC1-4алкила, ди(C1-4алкил)аминоC1-4алкил (C1-4алкил)амино; ди(C1-4алкил)аминоC1-4алкил(C1-4алкил)аминоC1-4алкила, гидроксиC1-4алкилпиперазинилC1-4алкила, гидроксиC1-4алкилоксиC1-4алкилпиперазинилC1-4алкила, ди(гидроксиC1-4алкил)аминоC1-4алкила, пирролидинилC1-4алкила, пирролидинилC1-4алкилокси, морфолинилC1-4алкилокси, морфолинилC1-4алкила, C1-4алкилпиперазинилC1-4алкила или также может быть присоединена центральная 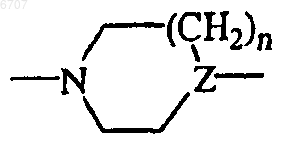 группа (то есть с образованием бициклической группы) метиленовым мостиком.
группа (то есть с образованием бициклической группы) метиленовым мостиком.
6. Соединение по пп.1, 4 и 5,
где n равно 1;
t равно 0;
каждый Z представляет собой азот;
R1 представляет собой -C(O)NH(OH);
R2 представляет собой водород;
-L- представляет собой прямую связь;
каждый R3 представляет собой атом водорода;
R4 представляет собой водород;
 представляет собой радикал, выбранный из группы (a-1) или (a-20);
представляет собой радикал, выбранный из группы (a-1) или (a-20);
каждый s независимо представляет собой 0 или 1;
каждый R5 и R6 независимо выбран из водорода; тиофенила; тиофенила, замещенного ди(C1-6алкил)аминоC1-6алкилом или C1-6алкилпиперазинилC1-6алкилом; фуранила; фенила; фенила, замещенного одним заместителем, независимо выбранным из ди(C1-4алкил)аминоC1-4алкилокси, ди(C1-4алкил)амино, ди(C1-4алкил)аминоC1-4алкила, ди(C1-4алкил)аминоC1-4алкил(C1-4алкил)аминоC1-4алкила, пирролидинилC1-4алкила, пирролидинилC1-4алкилокси или C1-4алкилпиперазинилC1-4алкила.
7. Соединение по п.1, 4, 5 и 6, выбранное из соединений No. 6, No. 100, No. 104, No. 128, No. 144, No. 124, No. 154, No. 125, No. 157, No. 156, No. 159, No. 163, No. 164, No. 168, No. 169, No. 127, No. 171, No. 170, No. 172 и No. 173.
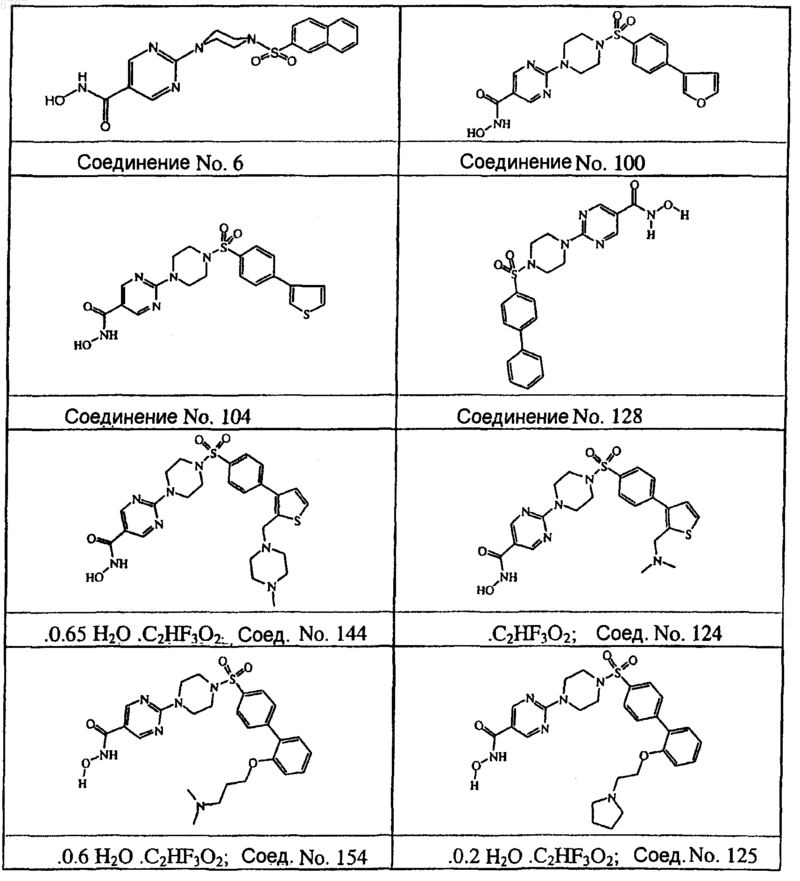
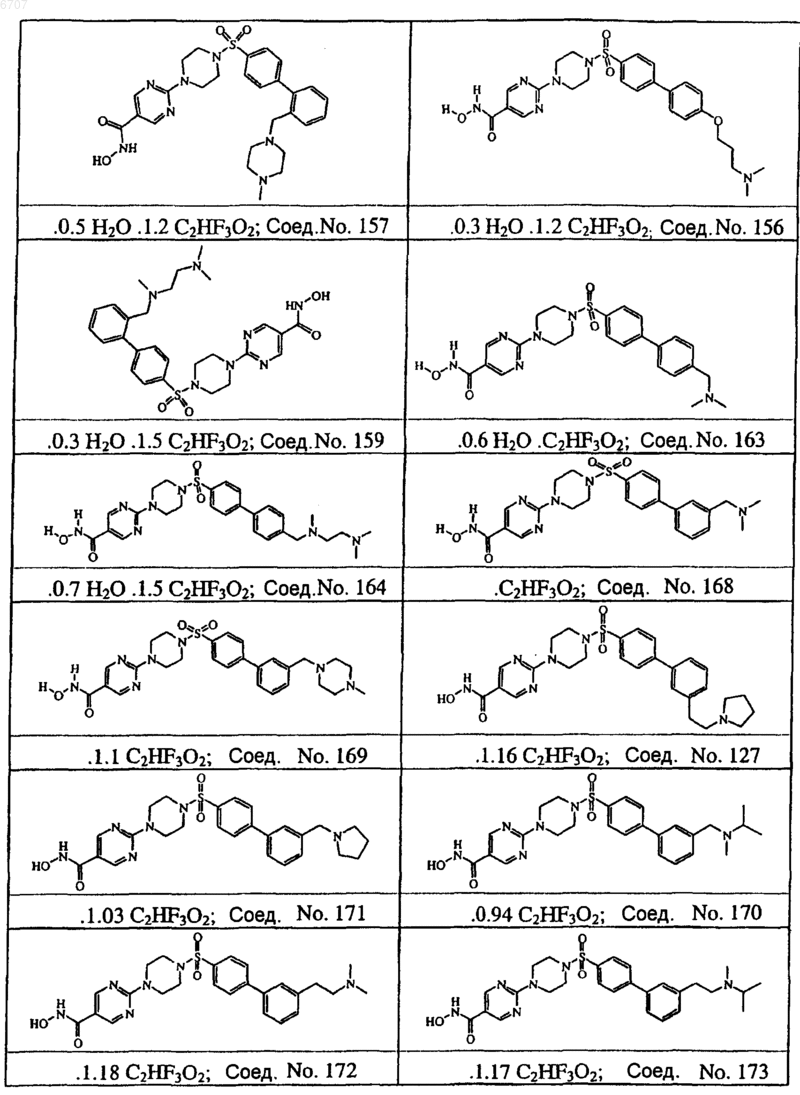
8. Соединение по пп.1-7, где соединением является соединение No 6.
9. Фармацевтическая композиция, содержащая фармацевтически приемлемые носители и в качестве активного ингредиента терапевтически эффективное количество соединения по пп.1-8.
10. Способ получения фармацевтической композиции по п.9, где фармацевтически приемлемые носители и соединение по пп.1-8 тщательно смешивают.
11. Применение соединения по любому из пп.1-8 в качестве лекарственного препарата.
12. Применение соединения по любому из пп.1-8 для производства лекарственного препарата для лечения пролиферативных заболеваний.
13. Способ получения соединения по п.1, заключающийся во взаимодействии промежуточного соединения формулы (II) с соответствующей кислотой, такой как, например, трифторуксусная кислота, с получением гидроксамовой кислоты формулы (I-a), где R1 представляет собой -C(O)NH(OH)
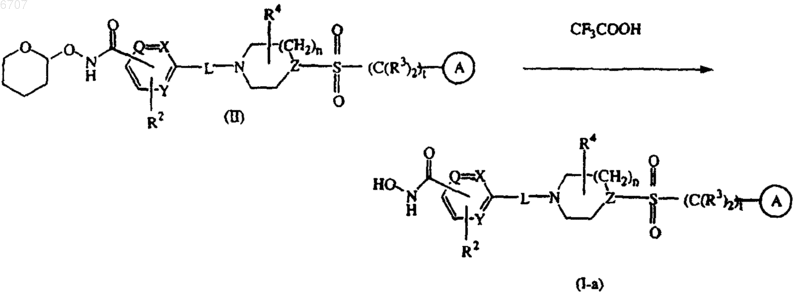
14. Способ получения соединения по п.1, заключающийся в каталитическом гидрировании промежуточного соединения (VI) водородом в присутствии катализатора, такого как, например, палладий на угле (10%), с образованием гидроксамовой кислоты формулы (I-a), где R1 представляет собой -C(O)NH(OH)

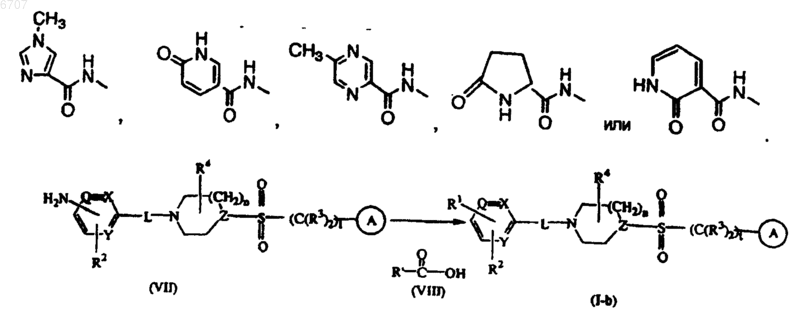
15. Способ получения соединения по п.1, заключающийся во взаимодействии промежуточного соединения формулы (VII) с промежуточным соединением формулы (VIII), где R' представляет
в присутствии моногидрохлорида N'-(этилкарбонимидоил)-N,N-диметил-1,3-пропандиамина (EDC) и гидроксибензотриазола (HOBT), с получением соединения формулы (1-b), где R' представляет собой
16. Способ определения или идентификации HDAC в биологическом образце, содержащем обнаруживаемую или измеряемую структуру комплекса между меченным соединением, определенным в п.1, и HDAC.
17. Сочетание противоопухолевых агентов и ингибитора HDAC по любому из пп.1-8.
Текст
006707 Данное изобретение относится к соединениям, ингибирующим ферментную активность гистондеацетилазы (HDAC). Кроме того, изобретение относится к способу получения этих соединений, к содержащим их композициям, а также к их in vitro и in vivo использованию для ингибирования HDAC и к лекарственному средству, например, к лекарственному средству для ингибирования пролиферативных состояний, таких как рак и псориаз. Во всех эукариотических клетках геномная ДНК в хроматине связана с гистонами с образованием нуклеосом. Каждая нуклеосома состоит из белкового октамера, полученного из двух копий каждого гистона Н 2 А, Н 2 В, Н 3 и Н 4. ДНК наматывается вокруг такого белкового ядра путем взаимодействия основных аминокислот гистонов и отрицательно заряженных фосфатных групп ДНК. Наиболее частой посттрансляционной модификацией таких ядерных гистонов является обратимое ацетилирование аминогрупп консервативных, основных N-концевых лизиновых остатков. Устойчивое состояние ацетилирования гистонов определяется динамическим равновесием между конкурирующими гистонацетилтрансферазой(ами) и гистон-деацетилазой(ами), здесь называемой HDAC. Ацетилирование и деацетилирование гистонов долгое время связывали с транскрипционным контролем. Недавнее клонирование генов, кодирующих различные типы гистон-ацетилтрансферазы и гистон-деацетилазы, дало вероятное объяснение взаимосвязи между ацетилированием гистонов и транскрипционным контролем. Обратимое ацетилирование гистонов может быть результатом перестройки хроматина и по существу является контролирующим механизмом генной транскрипции. Вообще, гиперацетилирование гистонов способствует генной экспрессии, тогда как деацетилирование гистонов связано с подавлением транскрипции. Было показано, что гистон-ацетилтрансферазы взаимодействуют как транскрипционные ко-активаторы,тогда как гистон-деацетилазы связаны с путями, подавляющими транскрипцию. Динамическое равновесие между ацетилированием и деацетилированием является основой нормального клеточного роста. Ингибирование гистон-деацетилазы приводит к остановке клеточного цикла,клеточной дифференциации, апоптозу и реверсии трансформированного фенотипа. В связи с этим, ингибиторы HDAC могут иметь большой терапевтический эффект в лечении заболеваний или состояний, связанных с клеточной пролиферацией (Marks et al., Nature Reviews: Cancer 1: 194-202, 2001). Изучение ингибиторов гистон-деацетилазы (HDAC) показало, что эти ферменты действительно играют важную роль в клеточной пролиферации и дифференциации. Ингибитор трихостатин A (TSA) блокирует клеточный цикл как на G1, так и на G2 фазе, вызывая реверсию трасформированного фенотипа различных клеточных линий и индуцируя дифференциацию клеток лейкемии Френда и других клеток. Сообщалось, что TSA (и субероиланилид-гидроксаминовая кислота SAHA) ингибирует рост клеток, вызывая окончательную дифференциацию и предотвращая образование опухолей у мыши (Finnin et al.,Nature, 401: 188-193, 1999). Также сообщалось, что трихостатин А эффективен при лечении фиброзов, например фиброза печени и цирроза печени. (Geerts et al., европейская патентная заявка ЕР 0827742, опубликована 11 марта, 1998 г.). В патентной заявке WO 01/38322, опубликованной 31 мая 2001 г., кроме прочих, описаны ингибиторы гистон-деацетилазы общей формулы Cy-L1-Ar-Y1-C (О)-NH-Z, композиции и способы лечения заболеваний и состояний, связанных с клеточной пролиферацией. В патентной заявке WO 01/70675, опубликованной 27 сентября 2001 г., описаны ингибиторы гистон-деацетилазы формулы Cy-S(O)2NH-Y3-W, и также описаны композиции и способы лечения заболеваний и состояний, связанных с клеточной пролиферации. Задачей, требующей решения, является создание ингибиторов гистон-деацетилазы с высокой ферментативной активностью, а также обладающих полезными свойствами, такими как клеточная активность и повышенная биоактивность, предпочтительно, пероральная биоактивность, и не имеющих или имеющих незначительные побочные эффекты. Новые соединения по настоящему изобретению удовлетворяют вышеуказанным требованиям. Соединения отличаются от соединений предшествующего уровня техники структурой. Соединения по настоящему изобретению имеют высокую ингибирующую активность в отношении фермента гистон-деацетилазы in vitro. Соединения по настоящему изобретению обладают полезными свойствами относительно клеточной активности и избирательные свойства в отношении ингибирования клеточного цикла как G1, так и G2 контрольных точек (способность индуцировать р 21). Соединения по настоящему изобретению демонстрируют хорошую метаболическую стабильность и высокую биодоступность и, более конкретно, они обладают биодоступностью при пероральном применении. Кроме того,соединения по настоящему изобретению имеют низкую аффинность в отношении ферментов Р 4 50, что снижает риск неблагоприятных лекарственных взаимодействий, также обеспечивая значительную безопасность препарату. Данное изобретение относится к соединениям формулы (I)-1 006707 к их N-оксидным формами, к их фармацевтически приемлемым солям добавления кислот и к их стереохимическим изомерным формам, где n равно 0, 1, 2 или 3, и если n равно 0, то имеется в виду прямая связь;t равно 0, 1, 2, 3 или 4 и, если t равно 0, то имеется в виду прямая связь; каждый Q представляет собой азот или каждый X представляет собой азот или каждый Y представляет собой азот или каждый Z представляет собой азот илиR9 независимо выбран из водорода, C1-6 алкила, C1-6 алкилкарбонила, арилC1-6 алкила, C1-6 алкилпиразинила, пиридинона, пирролидинона или метилимидазолила;R10 независимо выбран из водорода или C1-6 алкила;-L- представляет собой прямую связь или бивалентный радикал, выбранный из C1-6 алкандиила,амино, карбонила или аминокарбонила; каждый R3 независимо представляет собой атом водорода, и один атом водорода может быть замещен заместителем, выбранным из арила; где каждый s независимо представляет собой 0, 1, 2, 3, 4 или 5; каждый R5 и R6 независимо выбраны из водорода; галогена; гидрокси; амино; нитро; тригалогенC1-6 алкила; тригалогенC1-6 алкилокси; C1-6 алкила; C1-6 алкила, замещенного арилом и С 3-10 циклоалкилом; C1-6 алкилокси; C1-6 алкилоксиC1-6 алкилокси; C1-6 алкилкарбонила; C1-6 алкилоксикарбонила; C1-6 алкилсульфонила; цианоC1-6 алкила; гидроксиC1-6 алкила; гидроксиC1-6 алкилокси; гидроксиC1-6 алкиламино; аминоC1-6 алкилокси; ди(C1-6 алкил)аминокарбонила; ди(гидроксиC1-6 алкил)амино; (арил)(C1-6 алкил)амино; ди(C1-6 алкил)аминоC1-6 алкилокси; ди(C1-6 алкил)аминоC1-6 алкиламино; ди(C1-6 алкил) аминоC1-6 алкиламиноC1-6 алкила; арилсульфонила; арилсульфониламино; арилокси; арилоксиC1-6 алкила; арилС 2-6 алкендиила; ди(C1-6 алкил)амино; ди(C1-6 алкил)аминоC1-6 алкила; ди(C1-6 алкил)амино(C1-6 алкил)амино; ди(C1-6 алкил) амино(C1-6 алкил)аминоC1-6 алкила; ди(C1-6 алкил)аминоC1-6 алкил(C1-6 алкил)амино; ди (C1-6 алкил)аминоC1-6 алкил(C1-6 алкил)аминоC1-6 алкила; аминосульфониламино(C1-6 алкил)амино; аминосульфониламиноC1-6 алкилтриазолила; тетразолила; пирролидинила; пирролила; пиперидинилC1-6 алкилокси; морфолинила; C1-6 алкилморфолинила; морфолинилC1-6 алкилокси; морфолинилC1-6 алкила; морфолинилC1-6 алкиламино; морфолинилC1-6 алкиламиноC1-6 алкила; пиперазинила; C1-6 алкилпиперазинила; С 1-6-алкилпиперазинил C1-6 алкилокси; пиперазинилC1-6 алкила; нафталенилсульфонилпиперазинила; нафталенилсульфонилпиперидинила; нафталенилсульфонила; C1-6 алкилпиперазинилC1-6 алкила; C1-6 алкилпипе-3 006707 разинилC1-6 алкиламино; C1-6 алкилпиперазинилC1-6 алкиламиноC1-6 алкила; C1-6 алкилпиперазинилсульфонила; аминосульфонилпиперазинилC1-6 алкилокси; аминосульфонилпиперазинил; аминосульфонилпиперазинилC1-6 алкила; ди(C1-6 алкил)аминосульфонилпиперазинила; ди (C1-6 алкил)аминосульфонилпиперазинилC1-6 алкила; гидроксиC1-6 алкилпиперазинила; гидроксиC1-6 алкилпиперазинилC1-6 алкила; C1-6 алкилоксипиперидинила; C1-6 алкилоксипиперидинилC1-6 алкила; пиперидиниламиноC1-6 алкиламино; пиперидиниламиноC1-6 алкиламиноC1-6 алкила; (C1-6 алкилпиперидинил) (гидроксиC1-6 алкил) аминоC1-6 алкиламино; (C1-6 алкилпиперидинил) (гидроксиC1-6 алкил)аминоC1-6 алкиламиноC1-6 алкила; гидроксиC1-6 алкилоксиC1-6 алкилпиперазинила; гидроксиC1-6 алкилоксиC1-6 алкилпиперазинилC1-6 алкила; (гидроксиC1-6 алкил)(C1-6 алкил)амино; (гидроксиC1-6 алкил)(C1-6 алкил)аминоC1-6 алкила; гидроксиC1-6 алкиламиноC1-6 алкила; ди (гидроксиC1-6 алкил)аминоC1-6 алкила; пирролидинилC1-6 алкила; пирролидинилC1-6 алкилокси; пиразолила; тиопиразолила; пиразолила, замещенного двумя заместителями, выбранными из C1-6 алкила или тригалогенC1-6 алкила; пиридинила; пиридинила, замещенного C1-6 алкилокси, арилокси или арилом; пиримидинила; тетрагидропиримидинилпиперазинила; тетрагидропиримидинилпиперазинилC1-6 алкила; хинолинила; индолила; фенила; фенила, замещенного одним, двумя или тремя заместителями, независимо выбранными из галогена, амино, нитро, C1-6 алкила, C1-6 алкилокси, гидроксиС 1-4 алкила, трифторметила, трифторметилокси, гидроксиС 1-4 лкилокси, С 1-4 лкилсульфонила, С 1-4 алкилоксиС 1-4 алкилокси, С 1-4 алкилоксикарбонила, амино С 1-4 алкилокси, ди(С 1-4 алкил)аминоС 1-4 алкилокси, ди(С 1-4 алкил)амино, ди(С 1-4 алкил)аминокарбонила, ди(С 1-4 алкил)аминоС 1-4 алкила, ди(С 1-4 алкил)аминоС 1-4 алкиламиноС 1-4 алкила,ди(С 1-4 алкил)амино(С 1-4 алкил) амино, ди(С 1-4 алкил)амино(С 1-4 алкил)аминоС 1-4 алкила, ди(С 1-4 алкил)аминоС 1-4 алкил(С 1-4 алкил)амино, ди(С 1-4 алкил)аминоС 1-4 алкил(С 1-4 алкил)аминоС 1-4 алкила, аминосульфониламино(С 1-4 алкил)амино, аминосульфониламино(С 1-4 алкил)аминоС 1-4 алкила, ди(С 1-4 алкил)аминосульфониламино(С 1-4 алкил)амино, ди(С 1-4 алкил)аминосульфониламино(С 1-4 алкил)аминоC1-6 алкила, циано, пиперидинилС 1-4 алкилокси, пирролидинилС 1-4 алкилокси, аминосульфонилпиперазинила, аминосульфонилпиперазинилС 1-4 алкила, ди(С 1-4 алкил)аминосульфонилпиперазинила, ди(С 1-4 алкил)аминосульфонилпиперазинилС 1-4 алкила, гидрокси С 1-4 алкилпиперазинила, гидроксиС 1-4 алкилпиперазинилС 1-4 алкила, С 1-4 алкилоксипиперидинила, С 1-4 алкилоксипиперидинилС 1-4 алкила, гидроксиС 1-4 алкилоксиС 1-4 алкилпиперазинила, гидроксиС 1-4 алкилокси С 1-4 алкилпиперазинилС 1-4 алкила, (гидроксиС 1-4 алкил)(С 1-4 алкил)амино,(гидроксиС 1-4 алкил)(С 1-4 алкил) аминоС 1-4 алкила, ди (гидроксиС 1-4 алкил)амино, ди(гидроксиС 1-4 алкил) аминоС 1-4 алкила, фуранила, фуранила, замещенного -СН=СН-СН=СН-, пирролидинилС 1-4 алкила, пирролидинилС 1-4 алкилокси, морфолинила, морфолинилС 1-4 алкилокси, морфолинилС 1-4 алкила, морфолинил С 1-4 алкиламино, морфолинилС 1-4 алкиламиноС 1-4 алкила, пиперазинила, С 1-4 алкилпиперазинила, С 1-4 алкилпиперазинилС 1-4 алкилокси, пиперазинилС 1-4 алкила, С 1-4 алкилпиперазинилС 1-4 алкила, С 1-4 алкилпиперазинилС 1-4 алкиламино, С 1-4 алкилпиперазинилС 1-4 алкиламиноC1-6 алкила, тетрагидропиримидинилпиперазинила, тетрагидропиримидинилпиперазинилС 1-4 алкила, пиперидиниламиноС 1-4 алкиламино, пиперидиниламиноС 1-4 алкиламиноС 1-4 алкила, (С 1-4 алкилпиперидинил)(гидроксиС 1-4 алкил)аминоС 1-4 алкиламино,(С 1-4 алкилпиперидинил)(гидроксиС 1-4 алкил)аминоС 1-4 алкиламино С 1-4 алкила, пиридинилС 1-4 алкилокси,гидроксиС 1-4 алкиламино, гидроксиС 1-4 алкиламиноС 1-4 алкила, ди(С 1-4 алкил)аминоС 1-4 алкиламино, аминотиадиазолила, аминосульфонилпиперазинилС 1-4 алкилокси или тиофенилС 1-4 алкиламино или также может быть присоединена центральная группа (то есть, с образованием бициклической группы) метиленовым, этиленовым или пропиленовым мостиком; каждый R5 и R6 могут быть помещены на азот при замене водорода; арил в вышеуказанном представляет собой фенил или фенил, замещенный одним или несколькими заместителями, каждый независимо выбран из галогена, С 1-4 алкила, C1-4 алкилокси, трифторметила, циано или гидроксикарбонила. Термин ингибитор гистон-деацетилазы определяет соединение, которое способно взаимодействовать с гистон-деацетилазой и ингибировать ее активность, более конкретно, его ферментивную активность. Ингибирование ферментативной активности гистон-деацетилазы обозначает снижение способности гистон-деацетилазы удалять ацетильную группу с гистона. Предпочтительно, такое ингибирование является специфичным, то есть ингибитор гистон-деацетилазы снижает способность гистон-деацетилазы удалять ацетильную группу с гистона при концентрации, которая ниже концентрации ингибитора, требуемого для возникновения некоего другого, несвязанного с ним биологического эффекта. Как используется в вышеуказанных определениях и ниже, галоген обычно относится к фтору, хлору, брому и йоду; С 1-4 алкил определен как прямая и разветвленная цепь насыщенных углеводородных радикалов, содержащая от 1 до 4 атомов углерода, таких как, например, метил, этил, пропил, бутил, 1 метилэтил, 2-метилпропил и тому подобное; C1-4 алкил включает в себя С 1-4 алкил и высшие его гомологи,содержащие от 5 до 6 углеродных атомов таких как, например, пентил, 2-метилбутил, гексил, 2 метилпентил и тому подобное; С 1-4 алкандиил определен как бивалентная прямая и разветвленная цепь насыщенных углеводородных радикалов, содержащая от 1 до 6 углеродных атомов, таких как, например,метилен, 1,2-этандиил, 1,3-пропандиил, 1,4-бутандиил, 1,5-пентандиил, 1,6-гександиил, и его разветвленные изомеры, такие как, 2-метилпентандиил, 3-метилпентандиил, 2,2-диметилбутандиил, 2,3-диме-4 006707 тилбутандиил и тому подобное; тригалогенC1-6 алкил определен как C1-6 алкил, содержащий три одинаковых или различных галоген заместителей, например, трифторметил; С 2-6 алкендиил определен как бивалентная прямая и разветвленная цепь углеводородных радикалов, содержащая одну двойную связь и содержащая от 2 до 6 углеродных атомов, такая как, например, этендиил, 2-пропендиил, 3-бутендиил, 2 пентендиил, 3-пентендиил, 3-метил-2-бутендиил и тому подобное; арил определен как фенил и фенил замещен одним или несколькими заместителями, независимо выбранными из галогена, C1-6 алкила, C1-6 алкилокси или трифторметила, циано, гидроксикарбонила; аминоарил определен как арил, замещенный амино; и С 3-10 циклоалкил включает в себя циклические углеводородные группы, содержащие от 3 до 10 углеродов, такие как циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил, циклогептил, циклооктил и тому подобное. Термин еще одна Zn-хелатирующая группа относится к группе, которая способна взаимодействовать с Zn-ионом, который может присутствовать в сайте связывания фермента. Фармацевтически приемлемые соли добавления включают в себя фармацевтически приемлемые соли добавления кислот и фармацевтически приемлемые соли добавления оснований. Под фармацевтически приемлемыми солями добавления кислот, как указано ранее, понимают терапевтически активные нетоксические соли добавления кислот, которые способны образовывать соединения формулы (I). Соединения формулы (I), которые имеют основные свойства, могут быть преобразованы в их фармацевтически приемлемые соли добавления кислот путем обработки указанной основной формы соответствующей кислотой. Соответствующие кислоты включают в себя, например, неорганические кислоты, такие как галогенводородные кислоты, например, хлористо-водородная или бромисто-водородная кислота; серная; азотная; фосфорная и тому подобные кислоты; или органические кислоты, такие как, например,уксусная, трифторуксусная, пропановая, гидроксиуксусная, молочная, пировиноградная, щавелевая, малоновая, янтарная (то есть, бутандиовая кислота), малеиновая, фумаровая, маликовая, винная, лимонная,метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, салициловая, п-аминосалициловая, памовая и тому подобные кислоты. Соединения формулы (I), которые обладают кислотными свойствами, могут быть преобразованы в их фармцевтически приемлемые соли добавления оснований обработкой указанной кислотной формы подходящим органическим или неорганическим основанием. Подходящие основные соли включают в себя, например, соли аммония, соли щелочных или щелочно-земельных металлов, например, соли лития,натрия, калия, магния, кальция и тому подобное, соли органических оснований, например, бензатин, Nметил-D-глюкамин, гидрабамин, и соли аминокислот, таких как, например, аргинин, лизин и тому подобное. Термин соли добавления кислот или оснований включают в себя гидраты и формы добавления растворителей, которые способны образовывать соединения формулы (I). Примерами таких форм являются, например, гидраты, алкоголяты и тому подобное. Термин стереохимические изомерные формы соединений формулы (I), как используется здесь,относится ко всем возможным соединениям, состоящим из тех же атомов, соединенных в той же последовательности связывания, но имеющим отличные трехмерные структуры, являющиеся неравноценными, которые могут иметь соединения формулы (I). Если не указано или обозначено иное, химическое название соединения охватывает смесь всех возможных стереохимических изомерных форм, которые может иметь указанное соединение. Указанная смесь может содержать все диастереомеры и/или энантиомеры основной молекулярной структуры указанного соединения. Все стереохимические изомерные формы соединений формулы (I), как в чистой форме, так и в смеси друг с другом входят в состав настоящего изобретения. Под N-оксидными формами соединений формулы (I) подразумевают те соединения формулы (I),где один или несколько атомов азота окислены до так называемого N-оксида, особенно те N-оксиды, гдеN-окислены один или несколько азотов пиперидина, пиперазина или пиридазинила. Некоторые соединения формулы (I) могут также находиться в своих таутомерных формах. Такие формы, хотя и не показаны на вышепредставленной формуле, входят в состав настоящего изобретения. Всякий раз, используя термин соединения формулы (I), понимают, что он включает в себя также фармацевтически приемлемые соли добавления и все стереоизомерные формы. Как используется здесь, термины гистон-деацетилаза и HDAC относятся к любому из ферментов семейства ферментов, удаляемых ацетильные группы с -аминогрупп лизиновых остатков на Nконце гистона. Если в контексте не указанно иначе, под термином гистон понимают любой гистоновый белок, включая H1, Н 2 А, Н 2 В, Н 3, Н 4, и Н 5, любого вида. Белки HDAC человека или продукты генов включают, но ими не ограничиваются, HDAC-1, HDAC-2, HDAC-3, HDAC-4, HDAC-5, HDAC-6,HDAC-7, HDAC-8, HDAC-9 и HDAC-10. Гистон-деацетилаза также может быть получена из протозойного или грибкового источника. Первая группа интересующих соединений состоит из соединений формулы (I), где используется одно или несколько нижеприведенных ограничений:f) -L- представляет собой прямую связь или бивалентный радикал, выбранный из C1-6 алкандиила,карбонила или аминокарбонила;g) каждый R3 независимо представляет собой атом водорода;h) R4 представляет собой водород, гидроксиC1-6 алкил, аминокарбонил, гидроксиаминокарбонил или ди (C1-6 алкил) аминоC1-6 алкил; представляет собой радикал, выбранный из (а-1), (а-7), (а-9), (а-10), (а-12), (а-14), (а-19),i)j) каждый s независимо представляет собой 0, 1, 2 или 5;k) каждый R5 и R6 независимо выбраны из водорода; галогена; нитро; тригалогенC1-6 алкила; тригалогенC1-6 алкилокси; C1-6 алкила; C1-6 алкилокси; C1-6 алкилсульфонила; (арил)(C1-6 алкил)амино; арилсульфонила; арилокси; арилС 2-6 алкендиила; ди(C1-6 алкил)амино; тиофенила; тиофенила, замещенного ди(C1-6 алкил)аминоC1-6 алкил(C1-6 алкил)аминоC1-6 алкилом, ди(C1-6 алкил)аминоC1-6 алкилом, C1-6 алкилпиперазинилC1-6 алкилом, гидроксиC1-6 алкилпиперазинилC1-6 алкилом, гидроксиC1-6 алкилоксиC1-6 алкилпиперазинилC1-6 алкилом, ди(C1-6 алкил)аминосульфонилпиперазинилC1-6 алкилом, C1-6 алкилоксипиперидинилC1-6 алкилом, морфолинC1-6 алкилом, гидроксиC1-6 алкил(C1-6 алкил)аминоC1-6 алкилом или ди (гидроксиC1-6 алкил)аминоC1-6 алкилом; фуранила; оксазолила; пирролила; пиразолила; пиридинила; пиридинила, замещенного C1-6 алкилокси; хинолинила; индолила; фенила; фенила, замещенного одним, двумя или тремя заместителями, независимо выбранными из галогена, амино, C1-6 алкила, C1-6 алкилокси, гидроксиС 1-4 алкила, трифторметила, трифторметилокси, ди(С 1-4 алкил)аминоС 1-4 алкилокси, ди(С 1-4 алкил)амино, ди(С 1-4 алкил)аминоС 1-4 алкила, ди(С 1-4 алкил)аминоС 1-4 алкил(C1-4 алкил)амино, ди(С 1-4 алкил)амино С 1-4 алкил (С 1-4 алкил) аминоС 1-4 алкила, гидроксиС 1-4 алкилпиперазинилС 1-4 алкила, гидроксиС 1-4 алкилокси С 1-4 алкилпиперазинилС 1-4 алкила, ди(гидроксиС 1-4 алкил)аминоС 1-4 алкила, пирролидинилС 1-4 алкила, пирролидинилС 1-4 алкилокси, морфолинилС 1-4 алкилокси, морфолинилС 1-4 алкила, С 1-4 алкилпиперазинилС 1-4 алкила или также может быть присоединена центральная группа (то есть, с образованием бициклической группы) метиленовым мостиком. Вторая группа интересующих соединений состоит из соединений формулы (I), где используется одно или несколько нижеприведенных ограничений:f) -L- представляет собой прямую связь;g) каждый R3 представляет собой атом водорода;j) каждый s независимо представляет собой 0, 1, 2 или 5;k) каждый R5 и R6 независимо выбран из водорода; галогена; тригалогенC1-6 алкила; тригалогенC1-6 алкилокси; C1-6 алкила; C1-6 алкилокси; арилС 2-6 алкендиила; ди(C1-6 алкил)амино; тиофенила; тиофенила,замещенного ди(C1-6 алкил)аминоC1-6 алкил(C1-6 алкил)аминоC1-6 алкилом, ди(C1-6 алкил)аминоC1-6 алкилом,C1-6 алкилпиперазинилC1-6 алкилом, гидроксиC1-6 алкилпиперазинилC1-6 алкилом, гидроксиC1-6 алкилоксиC1-6 алкилпиперазинилC1-6 алкилом, C1-6 алкилоксипиперидинилC1-6 алкилом, морфолинилC1-6 алкилом,гидроксиC1-6 алкилом(C1-6 алкил)аминоC1-6 алкилом или ди(гидроксиC1-6 алкил)аминоC1-6 алкилом; фуранила; оксазолила; пиразолила; пиридинила; пиридинила, замещенного C1-6 алкилокси; хинолинила; индолила; фенила; фенила, замещенного одним, двумя или тремя заместителями, независимо выбранными из галогена, амино, C1-6 алкила, C1-6 алкилокси, гидроксиС 1-4 алкила, трифторметила, трифторметилокси, ди разинилС 1-4 алкила или также может быть присоединена центральная группа (то есть, с образованиембициклической группы) метиленовым мостиком. Третья группа интересующих соединений состоит из соединений формулы (I), где используется одно или несколько нижеприведенных ограничений:f) -L- представляет собой прямую связь;g) каждый R3 представляет собой атом водорода; h) R4 представляет собой водород; представляет собой радикал, выбранный из (а-1) или (а-20);j) каждый s независимо представляет собой 0 или 1;k) каждый R5 и R6 независимо выбран из водорода; тиофенила; тиофенила, замещенного ди (C1-6 алкил)аминоC1-6 алкилом или C1-6 алкилпиперазинилC1-6 алкилом; фуранила; фенила; фенила, замещенного одним заместителем, независимо выбранным из ди(С 1-4 алкил)аминоС 1-4 алкилокси, ди(С 1-4 алкил)амино,ди(С 1-4 алкил)аминоС 1-4 алкила, ди(С 1-4 алкил)аминоС 1-4 алкил(С 1-4 алкил)аминоС 1-4 алкила, пирролидинил С 1-4 алкила, пирролидинилС 1-4 алкилокси или С 1-4 алкилпиперазинилС 1-4 алкила. Четвертая группа интересующих соединений состоит из таких соединений формулы (I), где R1 представляет собой -C(O)NH(OH), и -L- представляет собой прямую связь. Пятая группа интересующих соединений состоит из таких соединений формулы (I), где R1 представляет собой -С(О)NH(ОН), R2 представляет собой водород, и -L- представляет собой прямую связь. Шестая группа интересующих соединений состоит из таких соединений формулы (I), где используется одно или несколько нижеприведенных ограничений:b) R1 представляет собой -C(O)NR7R8, -С(О)-C1-6aлкaндиилSR9, -NR10C(О)N(ОН)R9, -NR10C(О)C1-6 алкандиилSR9, -NR10C(О)C=N(ОН) R9 или другую Zn-xeлатирующую группу, где каждый R7 и R8 независимо выбран из водорода, гидрокси, гидроксиC1-6 алкила или аминоC1-6 алкила;d) -L- представляет собой прямую связь или бивалентный радикал, выбранный из C1-6 алкандиила,амино или карбонила;g) каждый s независимо представляет собой 0, 1, 2, 3 или 4;h) R5 представляет собой водород; галоген; гидрокси; амино; нитро; тригалогенC1-6 алкил; тригалогенC1-6 алкилокси; C1-6 алкил; C1-6 алкилокси; C1-6 алкилкарбонил; C1-6 алкилоксикарбонил; C1-6 алкилсульфонил; гидроксиC1-6 алкил; арилокси; ди(C1-6 алкил)амино; циано; тиофенил; фуранил; фуранил, замещенный гидроксиC1-6 алкилом; бензофуранил; имидазолил; оксазолил; оксазолил, замещенный арилом и C1-6 алкилом; C1-6 алкилтриазолил; тетразолил; пирролидинил; пирролил; морфолинил; C1-6 алкилморфолинил; пиперазинил; C1-6 алкилпиперазинил; гидроксиC1-6 алкилпиперазинил; C1-6 алкилоксипиперидинил; пиразолил; пиразолил, замещенный одним или двумя заместителями, выбранными из C1-6 алкила или тригалогенC1-6 алкила; пиридинил; пиридинил, замещенный C1-6 алкилокси, арилокси или арилом; пиримидинил; хинолинил; индол; фенил; или фенил, замещенный одним или двумя заместителями, независимо выбранными из галогена, C1-6 алкила, C1-6 алкилокси или трифторметила;i) R6 представляет собой водород; галоген; гидрокси; амино; нитро; тригалогенC1-6 алкил; тригалогенC1-6 алкилокси; C1-6 алкил; C1-6 алкилокси; C1-6 алкилкарбонил; C1-6 алкилоксикарбонил; C1-6 алкилсульфонил; гидроксиC1-6 алкил; арилокси; ди(C1-6 алкил)амино; циано; пиридинил; фенил; или фенил, замещенный одним или двумя заместителями, независимо выбранными из галогена, C1-6 алкила, C1-6 алкилокси или трифторметила;j) также с помощью этиленового мостика может быть присоединена центральная группа(то есть, с образованием бициклической группы). Седьмая интересующая группа соединений состоит из соединений формулы (I), где используется одно или несколько нижеприведенных ограничений:b) R2 представляет собой водород, галоген, гидрокси, амино, нитро, C1-6 алкил, C1-6 алкилокси, трифторметил, гидроксиамино или нафталенилсульфонилпиразинил; с) R4 представляет собой водород, гидрокси, амино, гидроксиC1-6 алкил, C1-6 алкилокси, арилC1-6 алкил, аминокарбонил, гидроксикарбонил, аминоC1-6 алкил, аминокарбонилC1-6 алкил, гидроксикарбонилC16 алкил, гидроксиаминокарбонил, C1-6 алкилоксикарбонил, C1-6 алкиламиноC1-6 алкил или ди (C1-6 алкил) аминоC1-6 алкил; представляет собой радикал, выбранный из (а-1), (а-2), (а-3), (а-4), (а-5), (а-6), (а-7), (аd) 8), (а-9), (а-10), (а-11), (а-12), (а-13), (а-14), (а-15), (а-16), (а-17), (а-18), (а-19), (а-20), (а-21), (а-22), (а-23),(а-24), (а-25), (а-26), (а-27), (а-28), (а-29), (а-30), (а-31), (а-32), (а-33), (а-34), (а-35), (а-36), (а-37), (а-38), (а 39), (а-40), (а-41), (а-42) (а-43) или (а-44); е) каждый R5 и R6 независимо выбраны из водорода; галогена; гидрокси; амино; нитро; тригалогенC1-6 алкила; тригалогенC1-6 алкилокси; C1-6 алкила; C1-6 алкилокси; C1-6 алкилоксиC1-6 алкилокси; C1-6 алкилкарбонила; C1-6 алкилсульфонила; цианоC1-6 алкила; гидроксиC1-6 алкила; гидроксиC1-6 алкилокси; гидроксиC1-6 алкиламино; аминоC1-6 алкилокси; ди (C1-6 алкил)аминокарбонила; ди(гидроксиC1-6 алкил)амино; ди(C1-6 алкил)аминоC1-6 алкилокси; ди(C1-6 алкил)аминоC1-6 алкиламино; арилсульфонила; арилсульфониламино; арилокси; арилС 2-6 алкендиила; ди(C1-6 алкил)амино; циано; тиофенила; тиофенила, замещенного ди(C1-6 алкил)аминоC1-6 алкил(C1-6 алкил)аминоC1-6 алкилом, ди(C1-6 алкил)аминоC1-6 алкилом, C1-6 алкилпиперазинилC1-6 алкилом или ди(гидроксиC1-6 алкил)аминоC1-6 алкилом; фуранила; имидазолила; C1-6 алкилтриазолила; тетразолила; пиперидинилC1-6 алкилокси; морфолинила; C1-6 алкилморфолинила; морфолинилC1-6 алкил)(C1-6 алкил)амино; (гидроксиC1-6 алкил)(C1-6 алкил)аминоC1-6 алкила; пирролидинилC1-6 алкилокси; пиразолила; тиопиразолила; пиразолила, замещенного двумя заместителями, выбранными из C1-6 алкила или тригалогенC1-6 алкила; пиридинила; пиридинила, замещенного C1-6 алкилокси или арилом; пиримидинила; хинолинила; фенила; фенила, замещенного одним, двумя или тремя заместителями, независимо выбранными из галогена, амино, C1-6 алкила, C1-6 алкилокси, гидроксиС 1-4 алкила, трифторметила,трифторметилокси, гидроксиС 1-4 алкилокси, С 1-4 алкилоксиС 1-4 алкилокси, аминоС 1-4 алкилокси, ди(С 1-4 алкил)аминоС 1-4 алкилокси, ди(С 1-4 алкил)амино, пиперидинилС 1-4 алкилокси, пирролидинилС 1-4 алкилокси,аминосульфонилпиперазинила, аминосульфонилпиперазинилС 1-4 алкила, ди (С 1-4 алкил)аминосульфонилпиперазинила, ди(С 1-4 алкил)аминосульфонилпиперазинилС 1-4 алкила, гидроксиС 1-4 алкилпиперазинила, гидроксиС 1-4 алкилпиперазинилС 1-4 алкила, С 1-4 алкилоксипиперидинила, С 1-4 алкоксипиперидинил С 1-4 алкила, гидроксиС 1-4 алкилоксиС 1-4 алкилпиперазинила, гидроксиС 1-4 алкоксиС 1-4 алкилпиперазинилС 1-4 алкила, (гидроксиС 1-4 алкил)(С 1-4 алкил)амино, (гидроксиС 1-4 алкил)(С 1-4 алкил)аминоС 1-4 алкила, пирролидинилС 1-4 алкилокси, морфолинилС 1-4 алкилокси, морфолинилС 1-4 алкила, С 1-4 алкилпиперазинилС 14 алкокси, С 1-4 алкилпиперазинилС 1-4 алкила, гидроксиС 1-4 алкиламино, ди (гидроксиС 1-4 алкил) амино, ди(С 1-4 алкил)аминоС 1-4 алкиламино, аминотиадиазолила, аминосульфонилпиперазинилС 1-4 алкилокси или тиофенилС 1-4 алкиламино. Группа предпочтительных соединений состоит из таких соединений формулы (I), где каждый R7 и 8R независимо выбран из водорода, гидрокси, гидроксиC1-6 алкила, аминоC1-6 алкила или аминоарила;(а-23), (а-24), (а-25), (а-26), (а-27), (а-28), (а-29), (а-30), (а-31), (а-32), (а-33), (а-34), (а-35), (а-36), (а-37), (а 38), (а-39), (а-40), (а-41), (а-42) (а-43) или (а-44); каждый R5 и R6 независимо выбраны из водорода; галогена; гидрокси; амино; нитро; тригалогенC1-6 алкила; тригалогенC1-6 алкилокси; C1-6 алкила; C1-6 алкокси; C1-6 алкилоксиC1-6 алкилокси; C1-6 алкилкарбонила; C1-6 алкилсульфонила; цианоC1-6 алкила; гидроксиC1-6 алкила; гидроксиC1-6 алкилокси; гидроксиC1-6 алкиламино; аминоC1-6 алкилокси; ди(C1-6 алкил)аминокарбонила; ди(гидроксиC1-6 алкил)амино; ди(C1-6 алкил)аминоC1-6 алкилокси; ди(C1-6 алкил)аминоC1-6 алкиламино; арилсульфонила; арилсульфониламино; арилокси; арилС 2-6 алкендиила; ди(C1-6 алкил)амино; циано; тиофенила; тиофенила, замещенного ди(C1-6 алкил)аминоC1-6 алкил(C1-6 алкил)аминоC1-6 алкилом, ди(C1-6 алкил)аминоC1-6 алкилом, C1-6 алкилпиперазинилC1-6 алкилом или ди(гидроксиC1-6 алкил)аминоC1-6 алкилом; фуранила; имидазолила; C1-6 алкилтриазолила; тетразолила; пиперидинилC1-6 алкилокси; морфолинила; C1-6 алкилморфолинила; морфолинилC1-6 алкилокси; морфолинилC1-6 алкила; C1-6 алкилпиперазинилC1-6 алкилокси; C1-6 алкилпиперазинилC1-6 алкила; C1-6 алкилпиперазинилсульфонила; аминосульфонилпиперазинилC1-6 алкилокси; аминосульфонилпиди(C1-6 алкил)аминосульфонилпиперазинила; перазинила; аминосульфонилпиперазинилC1-6 алкила; ди(C1-6 алкил)аминосульфонилпиперазинилC1-6 алкила; гидроксиC1-6 алкилпиперазинила; гидроксиC1-6 алкилпиперазинилC1-6 алкила; C1-6 алкилоксипиперидинила; C1-6 алкилоксипиперидинилC1-6 алкила; гидроксиC1-6 алкоксиC1-6 алкилпиперазинила; гидроксиC1-6 алкилоксиC1-6 алкилпиперазинилC1-6 алкила; (гидрокси С 1-6 алкил)(C1-6 алкил)амино; (гидроксиC1-6 алкил)(C1-6 алкил)аминоC1-6 алкила; пирролидинилC1-6 алкилокси; пиразолила; тиопиразолила; пиразолила, замещенного двумя заместителями, выбранными из C1-6 алкила или тригалогенC1-6 алкила; пиридинила; пиридинила, замещенного C1-6 алкилокси или арилом; пиримидинила; хинолинила; фенила; фенила, замещенного одним, двумя или тремя заместителями, независимо выбранными из галогена, амино, C1-6 алкила, C1-6 алкокси, гидроксиС 1-4 алкила, трифторметила,трифторметилокси, гидроксиС 1-4 алкилокси, С 1-4 алкилоксиС 1-4 алкилокси, аминоС 1-4 алкилокси, ди(С 1-4 алкил)амино С 1-4 алкокси, ди (С 1-4 алкил)амино, пиперидинилС 1-4 алкилокси, пирролидинилС 1-4 алкилокси,аминосульфонилпиперазинила, аминосульфонилпиперазинилС 1-4 алкила, ди(С 1-4 алкил)аминосульфонилпиперазинила, ди(С 1-4 алкил)аминосульфонилпиперазинилС 1-4 алкила, гидроксиС 1-4 алкилпиперазинила,гидрокси С 1-4 алкилпиперазинилС 1-4 алкила, С 1-4 алкилоксипиперидинила, С 1-4 алкилоксипиперидинилС 1-4 алкила, гидроксиС 1-4 алкилоксиС 1-4 алкилпиперазинила, гидроксиС 1-4 алкоксиС 1-4 алкилпиперазинилС 1-4 алкила, (гидроксиС 1-4 алкил)(С 1-4 алкил)амино, (гидроксиС 1-4 алкил)(С 1-4 алкил)аминоС 1-4 алкила, пирролидинилС 1-4 алкилокси, морфолинилС 1-4 алкилокси, морфолинилС 1-4 алкила, С 1-4 алкилпиперазинилС 1-4 алкилокси, С 1-4 алкилпиперазинилС 1-4 алкила, гидроксиС 1-4 алкиламино, ди(гидроксиС 1-4 алкил)амино, ди(С 1-4 алкил)аминоС 1-4 алкиламино, аминотиадиазолила, аминосульфонилпиперазинилС 1-4 алкилокси или тиофенилС 1-4 алкиламино. Другая группа предпочтительных соединений состоит из таких соединений формулы (I), гдеaлкaндиилSR9, -NR10C(О)C=N(ОН)R9 или другую Zn-хелатирующую группу, где каждый R7 и R8 независимо выбран из водорода, гидрокси, гидроксиC1-6 алкила, или аминоC1-6 алкила;-L- представляет собой прямую связь или бивалентный радикал, выбранный из C1-6 алкандиила,амино или карбонила;R4 представляет собой водород, гидрокси, амино, гидроксиC1-6 алкил, C1-6 алкил, C1-6 алкилокси,арилC1-6 алкил, аминокарбонил, аминоC1-6 алкил, C1-6 алкиламиноC1-6 алкил или ди(C1-6 алкил)аминоC1-6 алкил; представляет собой радикал, выбранный из (а-1), (а-3), (а-4), (а-5), (а-6), (а-7), (а-8), (а-9),(а-10), (а-11), (а-12), (а-13), (а-14), (а-15), (а-16), (а-17), (а-18), (а-19), (а-20), (а-21), (а-22), (а-23), (а-24), (а 25), (а-26), (а-28), (а-29), (а-30), (а-31), (а-32), (а-33), (а-34), (а-35), (а-36), (а-37), (а-38), (а-39), (а-40), (а 41), (а-42), (а-44), (а-45), (а-46), (а-47), (а-48) или (а-51); каждый s независимо представляет собой 0, 1, 2, 3 или 4;C1-6 алкилтриазолил; тетразолил; пирролидинил; пирролил; морфолинил; C1-6 алкилморфолинил; пиперазинил; C1-6 алкилпиперазинил; гидроксиC1-6 алкилпиперазинил; C1-6 алкилоксипиперидинил; пиразолил; пиразолил, замещенный одним или двумя заместителями, выбранными из C1-6 алкила или тригалогенC1-6 алкила; пиридинил; пиридинил, замещенный C1-6 алкилокси, арилокси или арилом; пиримидинил; хинолинил; индол; фенил; или фенил, замещенный одним или двумя заместителями, независимо выбранными из галогена, C1-6 алкила, C1-6 алкилокси или трифторметила;R6 представляет собой водород; галоген; гидрокси; амино; нитро; тригалогенC1-6 алкил; тригалогенC1-6 алкилокси; C1-6 алкил; C1-6 алкилокси; C1-6 алкилкарбонил; C1-6 алкилоксикарбонил; C1-6 алкилсульфонил; гидроксиC1-6 алкил; арилокси; ди (C1-6 алкил)амино; циано; пиридинил; фенил; или фенил, замещенный одним или двумя заместителями, независимо выбранными из галогена, C1-6 алкила, C1-6 алкилокси или трифторметила; или также может быть присоединен с помощью этиленового мостика центральная группа (то есть, с образованием бициклической группы). Еще более предпочтительная группа соединений состоит из таких соединений формулы (I), где n равно 1 или 2; t равно 0, 1 или 2; каждый Z представляет собой азот; R10 представляет собой водород; R2 представляет собой водород, нитро, C1-6 алкилокси, трифторметил, ди(C1-6 алкил)амино, гидроксиамино или нафталенилсульфонилпиразинил; -L- представляет собой прямую связь или бивалентный радикал,выбранный из C1-6 алкандиила, карбонила или аминокарбонила; каждый R3 представляет собой атом водорода; R4 представляет собой водород, гидроксиC1-6 алкил, аминокарбонил, гидроксиаминокарбонил или ди (C1-6 алкил) аминоC1-6 алкил; представляет собой радикал, выбранный из (а-1), (а-7), (а-9), (а 10), (а-12), (а-14), (а-19), (а-20), (а-21), (а-22), (а-23), (а-30), (а-34), (а-49) или (а-50); каждый s независимо представляет собой 0, 1, 2 или 5; каждый R5 и R6 независимо выбран из водорода; галогена; нитро; тригалогенC1-6 алкила; тригалогенC1-6 алкилокси; C1-6 алкила; C1-6 алкилокси; C1-6 алкилсульфонила; (арил)(C1-6 алкил)амино; арилсульфонила; арилокси; арилС 2-6 алкендиила; ди(C1-6 алкил)амино; тиофенила; тиофенила, замещенного ди(C1-6 алкил) аминоC1-6 алкил(C1-6 алкил)аминоC1-6 алкилом, ди(C1-6 алкил)аминоC1-6 алкилом, C1-6 алкилпиперазинилC1-6 алкилом, гидроксиC1-6 алкилпиперазинилC1-6 алкилом, гидроксиC1-6 алкилоксиC1-6 алкилпиперазинилC1-6 алкилом, ди(C1-6 алкил)аминосульфонилпиперазинилC1-6 алкилом, C1-6 алкилоксипиперидинилC1-6 алкилом, морфолинилC1-6 алкилом, гидроксиC1-6 алкил(C1-6 алкил)аминоC1-6 алкилом или ди(гидроксиC1-6 алкил)аминоC1-6 алкилом; фуранила; оксазолила; пирролила; пиразолила; пиридинила; пиридинила, замещенного C1-6 алкилокси; хинолинила; индолила; фенила; фенила, замещенного одним, двумя или тремя заместителями, независимо выбранными из галогена, амино, C1-6 алкила, C1-6 алкилокси, гидроксиС 1-4 алкила, трифторметила, трифторметилокси, ди(С 1-4 алкил)аминоС 1-4 алкилокси, ди (С 1-4 алкил) амино, ди (С 1-4 алкил)аминоС 1-4 алкила, ди(С 1-4 алкил)аминоС 1-4 алкил(С 1-4 алкил) амино, ди(С 1-4 алкил)аминоС 1-4 алкил(С 1-4 алкил)аминоС 1-4 алкила, гидроксиС 1-4 алкилпиперазинилС 1-4 алкила, гидроксиС 1-4 алкилоксиС 1-4 алкилпиперазинилС 1-4 алкила, ди(гидроксиС 1-4 алкил) аминоС 1-4 алкила, пирролидинилС 1-4 алкила, пирролидинилС 1-4 алкилокси, морфолинилС 1-4 алкилокси, морфолинилС 1-4 алкила, С 1-4 алилпиперазинилС 1-4 алкила или также может быть присоединен с помощью метиленового мостика центральная группа (то есть, с образованием бициклической группы). Группа еще более предпочтительных соединений состоит из таких соединений формулы (I), где n равно 1 или 2; t равно 0 или 2; каждый Z представляет собой азот; R1 представляет собой -C(O)NH(OH);R2 представляет собой водород; -L- представляет собой прямую связь; каждый R3 представляет собой атом водорода;R4 представляет собой водород; представляет собой радикал, выбранный из (а-1), (а-9), (а-19), (а-20), (а-21), (а-22), (а 23), (а-49) или (а-50); каждый s независимо представляет собой 0, 1, 2 или 5; каждый R5 и R6 независимо выбран из водорода; галогена; тригалогенC1-6 алкила; тригалогенC1-6 алкилокси; C1-6 алкила; C1-6 алкилокси; арилС 2-6 алкендиила; ди (C1-6 алкил)амино; тиофенила; тиофенила, замещенного ди(C1-6 алкил)аминоC1-6 алкил (C1-6 алкил)аминоC1-6 алкилом, ди(C1-6 алкил)аминоC1-6 алкила, C1-6 алкилпиперазинилC1-6 алкила, гидроксиC1-6 алкилпиперазинилC1-6 алкила, гидроксиC1-6 алкилоксиC1-6 алкилпиперазинилC1-6 алкила, C1-6 алкилоксипиперидинилC1-6 алкила, морфолинилC1-6 алкила, гидроксиC1-6 алкил(C1-6 алкил)аминоC1-6 алкила,или ди(гидроксиC1-6 алкил)аминоC1-6 алкила; фуранила; оксазолила; пиразолила; пиридинила; пиридинила, замещенного C1-6 алкилокси; хинолинила; индолила; фенила; фенила, замещенного одним, двумя или тремя заместителями, независимо выбранными из галогена, амино, C1-6 алкила, C1-6 алкилокси, гидроксиС 1-4 алкила, трифторметила, трифторметилокси, ди(С 1-4 алкил)аминоС 1-4 алкилокси, ди(С 1-4 алкил)амино, ди(С 1-4 алкил)аминоС 1-4 алкила, ди(С 1-4 алкил)аминоС 1-4 алкил(С 1-4 алкил)аминоС 1-4 алкила, гидроксиС 1-4 алкилпиперазинилС 1-4 алкила, гидроксиС 1-4 алкилоксиС 1-4 алкилпиперазинилС 1-4 алкила, ди(гидроксиС 1-4 алкил)аминоС 1-4 алкила, пирролидинилС 1-4 алкила, пирролидинилС 1-4 алкилокси, морфолинилС 1-4 алкилокси, морфолинилС 1-4 алкила, С 1-4 алкилпиперазинилС 1-4 алкила или также может быть присоединена с помощью метиленового мостика центральная группы).- 10006707 Группа еще более предпочтительных соединений состоит из таких соединений формулы (I), где n равно 1; t равно 0; каждый Z представляет собой азот; R1 представляет собой -C(O)NH(OH); R2 представляет собой водород; -L- представляет собой прямую связь; каждый R3 представляет собой атом водорода;R4 представляет собой водород; представляет собой радикал, выбранный из группы (а-1) или (а 20); каждый s независимо представляет собой 0 или 1; каждый R5 и R6 независимо выбран из водорода; тиофенила; тиофенила, замещенного ди(C1-6 алкил) аминоC1-6 алкилом или C1-6 алкилпиперазинилC1-6 алкилом; фуранила; фенила; фенила, замещенного одним заместителем, независимо выбранным из ди(С 1-4 алкил)аминоС 1-4 алкилокси, ди(С 1-4 алкил)амино, ди(С 1-4 алкил)аминоС 1-4 алкила, ди(С 1-4 алкил)аминоС 1-4 алкил(С 1-4 алкил)аминоС 1-4 алкила, пирролидинилС 1-4 алкила, пирролидинилС 1-4 алкилокси или С 1-4 алкилпиперазинилС 1-4 алкила. Наиболее предпочтительными соединениями являются соединения No. 6, No. 100, No. 104, No. 128,No. 144, No. 124, No. 154, No. 125, No. 157, No. 156, No. 159, No. 163, No. 164, No. 168, No. 169, No. 127,No. 171, No. 170, No. 172 и No. 173. Наиболее предпочтительным соединением является соединение No. 6 соединение 6 Соединения формулы (I) и их фармацевтически приемлемые соли и N-оксиды и их стереохимические изомерные формы могут быть получены обычными способами. К этим способам относятся общие пути синтеза, например: 1 а) гидроксамовые кислоты формулы(I), где R1 представляет собой -C(O)NH(OH), указанные соединения были обозначены как соединения формулы (1-а) , могут быть получены путем взаимодействия промежуточного соединения формулы (II) с соотвествующей кислотой, такой как например, трифторуксусная кислота. Указанное взаимодействие осуществляют в соответствующем растворителе, таком как, например, метанол.- 12006707 1b) промежуточные соединения формулы (II) могут быть получены путем взаимодействия промежуточного соединения формулы (III) с промежуточным соединением формулы (IV) в присутствии соответствующих агентов, таких как N'-(этилкарбонимидоил)-N, N-диметил-1,3-пропандиамин, моногидрохлорид (EDC) и 1-гидрокси-1 Н-бензотриазол (НОВТ). Взаимодействие может осуществляться в подходящем растворителе, таком как смесь ДХМ и ТГФ. 1 с) промежуточные соединения формулы (III) могут быть получены путем взаимодействия промежуточного соединения формулы (V) с соответствующим основанием, таким как NaOH в присутствии подходящего растворителя, такого как этанол. 2) Гидроксамовые кислоты формулы (I), где R1 представляет собой -C(O)NH(OH), указанные соединения здесь обозначены как соединения формулы (1-а), также могут быть получены каталитическим гидрированием промежуточного соединения формулы (VI) водородом в присутствии катализатора, такого как, например, палладий на угле (10%). Указанное взаимодействие проводят в соответствующем растворителе, таком как, например, диметилформамид (ДМФ) или ТГФ. Альтернативно, эти соединения могут быть получены путем взаимодействия промежуточного соединения формулы (VI) с циклогексадиеном в присутствии катализатора, такого как, например палладий на угле (10%). Указанное взаимодействие осуществляют в соответствующем растворителе, таком как, например, 1-пропанол. указанные соединения обозначены здесь как соединения формулы (I-b), могут быть получены путем взаимодействия промежуточного соединения формулы (VII) с промежуточным соединением формулы в присутствии N'-(этилкарбонимидоил)-N,N-диметил-1,3-пропандиамина, моногидрохлорида (EDC) и гидроксибензотриазола (НОВТ). Указанное взаимодействие осуществляют в соответствующем растворителе, таком как, например, смесь дихлорметана (ДХМ) и ТГФ. Соединения формулы (I) могут также быть легко получены способами твердофазного синтеза. Как правило, способы твердофазного синтеза включают в себя взаимодействие промежуточного соединения в синтезе с полимерной основой. Это промежуточное соединение на полимерной основе затем можно проводить через некоторое число стадий синтеза. После каждой стадии, полимер фильтровали и промывали несколько раз различными растворителями для удаления примесей. На каждой стадии полимер может отделяться для взаимодействия с различными промежуточными веществами следующей стадии, что таким образом позволяет синтезировать большое количество соединений. После последней стадии способа, полимер обрабатывают агентом, или обрабатывают для отщепления полимера от образца. Более подробное описание способов, используемых в твердофазном синтезе, приведено, например, в TheCombinatorial Index (В. Bunin, Academic Press) и Novabiochem's 1999 CataloguePeptide Synthesis Handbook (Novabiochem AG, Switzerland), которые приведены здесь в качестве ссылки. Соединения формулы (I) и некоторые промежуточные соединения могут иметь по крайней мере один стерический центр в своей структуре. Этот стерический центр может быть в R или S конфигурации. Соединения формулы (I), полученные как описано в способах выше, обычно являются рацемическими смесями энантиомеров, которые могут быть отделены друг от друга нижеследующим способом разделения, хорошо известным в данной области. Рацемические соединения формулы (I) могут быть преобразованы в соответствующие диастереомерные соли путем взаимодействия с подходящей хиральной кислотой. Указанные диастереомерные соли затем разделяли, например, путем селективной или фракционной кристаллизации, и энантиомеры выделяли с помощью щелочи. Альтернативный способ разделения энантиомерных форм соединений формулы (I) включает в себя жидкую хроматографию с использованием хиральной стационарной фазы. Указанные чистые стереохимические изомерные формы могут быть получены из соответствующих чистых стереохимически изомерных форм соответствующих исходных продуктов, при условии, что взаимодействие проводят стереоспецифически. Предпочтительно,когда необходимы конкретные стереоизомеры, указанное соединение должно быть синтезировано стереоспецифическими способами получения. В этих способах преимущественно используются энантиомерно чистые исходные продукты. Соединения формулы (I), фармацевтически приемлемые соли добавления кислот и их стереоизомерные формы обладают полезными фармакологическими свойствами, так как они обладают ингибиторным эффектом в отношении гистон-деацетилазы (HDAC). Данное изобретение относится к способу ингибирования патологического роста клеток, включая трансформированные клетки, путем введения эффективного количества соединения по данному изобретению. Патологический рост клеток относится к росту клеток, который не зависит от нормальных регуляторных механизмов (например, потеря контактного ингибирования). Способ включает в себя ингибирование опухолевого роста, как непосредственно останавку роста, окончательную дифференцировку и/или апоптоз опухолевых клеток, так и опосредованно, ингибируя неоваскуляцию опухолей. Данное изобретение также относится к способу ингибирования опухолевого роста путем введения эффективного количества соединения по настоящему изобретению субъекту, например, млекопитающему (и, более предпочтительно, человеку) при необходимости такого лечения. В частности, данное изобретение относится к способу ингибирования роста опухолей путем введения эффективного количества соединения по настоящему изобретению. Примеры опухолей, которые могут быть ингибированы, но ими не ограничиваются, включат в себя рак легкого (например, аденокарцинома, и в том числе немелкоклеточный рак легких), различные типы рака поджелудочной железы (например, карцинома поджелудочной железы, такая как, например экзокринная карцинома поджелудочной железы), различные типы рака пря- 14006707 мой кишки (например, колоректальные карциномы, такие как, например, аденокарционома прямой кишки и аденома прямой кишки), рак простаты, включая запущенное заболевание, гематопоэтические опухоли лимфоидной линии (например, острая лимфоцитарная лейкемия, В-клеточная лимфома, лимфома Беркита), миелоидная лейкемия (например, острая миеломная лейкемия (АМЛ, фолликулярный рак щитовидной железы, миелодиспластический синдром (MDS), опухоли мезинхимального происхождения(например, фибросаркома и рабдомиосаркома), меланома, тератокарцинома, нейробластома, глиома,доброкачественная опухоль кожи (например, кератоакантома), карцинома молочной железы (например,запущенный рак молочной железы), карцинома почки, карцинома яичника, карцинома мочевого пузыря и эпидермальная карцинома. Соединение по данному изобретению может быть использовано для других терапевтических целей,например:a) для сенсибилизации опухолей для радиотерапии путем введения соединения по данному изобретению перед, во время или после облучения опухоли при лечении опухоли;b) для лечения артропатий и остеопатологических состояний, таких как ревматоидный артрит, остеоартрит, юнешеский артрит, подагра, полиартрит, артрир при псориазе, анкилозирующий спондилит и системную красную волчанку;c) для ингибирования пролиферации гладких мышечных клеток, включая заболевания, связанные с пролиферацией сосудов, атеросклероз и рестеноз;d) для лечения воспалительных состояний и кожных заболеваний, таких как язвенный колит, болезнь Крона, аллергический ринит, реакция трансплантат против хозяина, конъюктивит, астма, ARDSe) для лечения эндометриоза, фиброза матки, дисфункции, сопровождающейся маточными кровотечениями и гиперплазии эндометрия;f) для лечения васкуляризации тканей глаза, включая васкулопатию, затрагивающую сосуды сетчатки и сосудистой оболочки глаза;g) для лечения сердечной дисфункции;h) для ингибирования иммуносупрессивных состояний, таких как лечение ВИЧ инфекции;i) для лечения почечной дисфункции;j) для лечения эндокринных заболеваний;k) дли ингибирования дисфункции глюконеогенеза;l) для лечения нейропатологии, например, болезни Паркинсона или нейропатологии, которая приводит к расстройству когнитивной функции, например, болезни Альцгеймера или нервных заболеваний,связанных с полиглютамином;m) для ингибирования нейромышечной патологии, например, амилотрофического латерального склероза;n) для лечения спинальной мышечной атрофии;o) для лечения других патологических состояний, которые поддаются лечению путем потенцирования генной экспрессии;p) для усиления генной терапии. Следовательно, настоящее изобретение включает в себя соединения формулы (I) для использования в качестве лекарственного препарата, а также для использования этих соединений формулы (I) для получения лекарственного препарата для лечения одного или нескольких вышеуказанных состояний. Соединения формулы (I), их фармацевтически приемлемые соли добавления кислот и стереоизомерные формы могут иметь полезные диагностические свойства, поэтому они могут использоваться для определения или идентификации HDAC в биологическом образце, содержащем обнаруживаемое или измеряемое образование комплекса между меченным соединением и HDAC. В способах обнаружения или идентификации могут использоваться соединения, которые метят метками, такими как радиоизотопы, ферменты, флуоресцентными веществами, светящимися веществами и тому подобное. Примеры радиоизотопов включают в себя 125I, 131I, 3 Н и 14 С. Ферменты, которые могут быть детектированы, обычно получают путем конъюгации соответствующего субстрата, который, в свою очередь, катализирует детектируемое взаимодействие. Примеры таких ферментов включают в себя, например, бета-галактозидазу, бета-глюкозидазу, щелочную фосфотазу, пероксидазу и малатдегидрогеназу,предпочтительно, пероксидазу хрена. Светящиеся вещества включают в себя, например, люминол, производные люминола, луциферин, экворин и люциферазу. Биологическими примерами, которые могут быть определены, являются ткани или жидкости организма. Примеры жидкостей организма включают в себя цереброспинальную жидкость, кровь, плазму,сыворотку крови, мочу, мокроту, слюну и тому подобное.- 15006707 Ввиду эффективности их фармакологических свойств могут быть получены композиции содержащие соединения по данному изобретению, в виде различных фармакологических форм для различных целей введения. Для получения фармацевтических композиций по данному изобретению эффективное количество определенного соединения в форме соли добавления основания или кислоты, в виде активного ингредиента, объединяли в виде тщательно перемешанной смеси с фармацевтически приемлемым носителем, где носитель может принимать большое разнообразие форм в зависимости от формы желательного препарата для введения. Эти фармацевтические композиции желательны в виде стандартной лекарственной формы, подходящей, предпочтительно, для перорального, ректального, чрескожного введения или введения парентеральной инъекцией. Например, при получении композиции в виде лекарственной формы для перорального применения может использоваться любая обычно используемая фармацевтическая среда, такая как, например, вода, гликоли, масла, спирты и тому подобное, в случае жидких препаратов для перорального применения, таких как суспензии, сиропы, эликсиры и растворы; или твердые носители, такие как различные крахмалы, сахара, каолин, смазывающее вещество, связующие вещества, разрыхляющие агенты и тому подобное, в случае порошков, пилюль, капсул и таблеток. Из-за простоты введения таблетки и капсулы являются наиболее эффективной лекарственной формой для перорального применения, в этом случае, понятно, используются твердые фармацевтические носители. Для парентеральных композиций, носитель обычно включает в себя стерильную воду, по крайней мере, в большинстве случаев, однако парентеральные композиции могут включать в себя другие ингредиенты, облегчающие растворение. Могут быть получены растворы для инъекционного введения,где носитель включает в себя солевой раствор, раствор глюкозы или смесь солевого раствора и раствора глюкозы. Также могут быть получены суспензии для инъекционного введения, и в этом случае могут использоваться соответствующие жидкие носители, суспендирующие агенты и тому подобное. В композициях, подходящих для подкожного введения, носитель, необязательно, включает в себя агент, улучающий проникновение, и/или подходящий смачивающий агент, необязательно, объединенный с подходящими адъювантами любой природы в небольших пропорциях, где адъюванты не вызывают значительного вредного действия на кожу. Указанные адъюванты могут улучшать введение в кожу и/или могут быть полезными для получения желаемых композиций. Эти композиции могут вводиться различными путями, например, в виде чрезкожного пластыря, непосредственно или в виде мази. Особенно предпочтительно получение вышеуказанных фармацевтических композиций в виде лекарственной формы, которую просто вводить, и с одинаковым дозированием. Дозированная лекарственная форма, как используется в подобном описании и формуле изобретения, здесь относится к физически дискретной единичной форме, подходящей для однократного дозирования, каждая доза содержит заранее определенное количество активного ингредиента, рассчитанного для получения желаемого терапевтического эффекта, в смеси с необходимым фармацевтическим носителем. Примеры таких лекарственных форм включают в себя таблетки (включая рифленные или покрытые таблетки), капсулы, пилюли,порошки в пачках, облатки, растворы или суспензии для инъекций, форма объемом чайной ложки, форма объемом столовой ложки, и тому подобное, и их разделяемые дробные дозы. Специалист в данной области сможет легко определить эффективное количество на основании результатов исследований, приведенных далее. Обычно полагают, что терапевтически эффективное количество составляет от 0,005 до 100 мг/кг массы тела и, в частности, от 0,005 до 10 мг/кг массы тела. Может быть уместным введение необходимой дозы в виде двух, трех, четырех или более субдоз с соответствующими интервалами в течение дня. Указанные субдозы могут быть получены в виде единичной лекарственной формы, например, содержащей от 0,5 до 500 мг и, в частности, от 10 мг до 500 мг активного ингредиента на лекарственную формы. Еще одним аспектом настоящего изобретения является сочетание HDAC-ингибитора с другим противоопухолевым агентом, особенно для использования в качестве лекарственного средства, более конкретно, для лечения рака или связанных с ним заболеваний. Для лечения вышеуказанных состояний, соединения по данному изобретению могут эффективно использоваться в сочетании с одним или несколькими другими лекарственными агентами, более конкретно, с другими противоопухолевыми агентами. Примеры противоопухолевых агентов включают в себя: координационные соединения платины, например, цисплатин, карбоплатин или оксалиплатин; таксановые соединения, например, паклитаксел или доцетаксел; ингибиторы топоизомеразы I, такие как соединения камптотецина, например, иринотекан или топотекан; ингибиторы топоизомеразы II, такие как противоопухолевые производные подофиллотоксина, например, этопосид или тенипосид; противоопухолевые алкалоиды барвинка, например,винбластин, винкристин или винорелбин; противоопухолевые нуклеозидные производные, например, 5-фторурацил, гемцитабин или капецитабин;- 16006707 алкилирующие агенты, такие как азотистый иприт или нитрозомочевина, например циклофосфамид, хлорамбуцил, кармустин или ломустин; противоопухолевые производные антрациклина, например даунорубицин, доксорубицин, идарубицин или митоксатрон; антитела HER2, например трастузумаб; антагонисты рецептора эстрогена или селективные модуляторы рецептора эстрогена, например, тамоксифен, торемифен, дролоксифен, фаслодекс или ралоксифен; ингибиторы ароматазы, такие как эксеместан, анастрозол, летразол и ворозол; агенты дифференциации, такие как ретиноиды, витамин D и агенты, блокирующие метаболизм ретиновой кислоты (RAMBA), например, аккутан; инигибиторы ДНК-метилтрансферазы, например азацитидин; ингибиторы киназы, например флавоперидол, иматиниб мезилат или гефитиниб; ингибиторы фарнестилтрансферазы или другие ингибиторы HDAC. Использующийся здесь термин координационное соединение платины обозначает любое координационное соединение платины, ингибирующее рост опухолевых клеток, в котором платина находится в форме иона. Термин таксановые соединения обозначает класс соединений, имеющих таксановую кольцевую систему и имеющих отношение или получаемых из экстрактов определенных видов тиса (Taxus). Использующийся здесь термин ингибиторы топоизомеразы обозначает ферменты, которые способны изменять топологию ДНК в эукариотических клетках. Они необходимы для важнейших функций клетки и клеточной пролиферации. У эукариотических клеток существует два класса топоизомераз, называемых тип I и тип II. Топоизомераза I представляет собой мономерный фермент с молекулярной массой приблизительно равной 100000. Фермент присоединяется к ДНК и вносит временный разрыв на одной из нитей, разматывает двойную спираль (или дает ей возможность размататься) и перед отрывом от нити ДНК соединяет разрыв. Топоизомераза II имеет сходный механизм действия, который включает в себя образование разрывов нити ДНК или образование свободных радикалов. Использующийся здесь термин соединения камптотецина обозначает соединения, которые имеют отношение или получают из маточного камптотецинового соединения, который представляет собой водорастворимый алкалоид, полученный из китайского дерева Camptothecin acuminata и индийского дереваNothapodytes foetida. Использующийся здесь термин соединения подофиллотоксина обозначают соединения, которые имеют отношение или получают из маточного подофиллотоксина, который экстрагируют из мандрагоры. Использующийся здесь термин противоопухолевые алкалоиды барвинка обозначают соединения,которые имеют отношение или получают из экстрактов барвинка малого (Vinca rosea). Термин алкилирующие агенты включает в себя разнообразную группу химических соединений,общим свойством которых является способность при физиологических условиях предоставлять алкильные группы для обеспечения биологической жизнеспособности макромолекул, таких как ДНК. Что касается наиболее важных агентов, таких как азотистый иприт и нитрозомочевина, то активные алкилирующие группы образуются in vivo после реакций разложения комплекса, некоторые из которых являются ферментативными. Наиболее важными фармакологическими эффектами алкилирующих агентов являются эффекты, затрагивающие главные механизмы, связанные с клеточной пролиферацией, в частности,синтезом ДНК и клеточным делением. Способность алкилирующих агентов влиять на функцию ДНК и интегрировать в быстро пролиферирующие ткани дает основание для их терапевтического применения и для использования их разнообразных токсических свойств. Термин противоопухолевые производные антрациклина включают в себя антибиотики, полученные из грибов Strep, peuticus var. caesius, и их производные, характеризующиеся тем, что имеют структуру тетрациклинового кольца с редким сахаром, дауносамином, присоединенным с помощью гликозидной связи. Было показано, что амплификации белка рецептора 2 эпидермального фактора роста (HER 2) в первичной карциноме молочной железы связана с плохим клиническим прогнозом у некоторых пациентов. Трастузумаб представляет собой высокоочищенные рекомбинантные гуманизированные моноклональные JgGl каппа-антитела, производные ДНК, которые с высокой аффинностью присоединяются и взаимодействуют с внеклеточным доменом рецептора HER2. Многие виды рака молочных желез имеют рецепторы эстрогена и рост этих опухолей может быть стимулирован экстрогенами. Использующиеся термины антагонисты рецептора эстрогена и селективные модуляторы рецептора эстрогена обозначают конкурентные ингибиторы эстрадиола, присоединяющиеся к рецептору эстрогена (ER). Селективные модуляторы рецептора эстрогена, которые присоединяются к ER, вызывают изменения трехмерной структуры рецептора, ингибируя его присоединение к эстроген ответственным элементом (ERE) на ДНК. У женщин в постклимактерическом периоде главным источником циркулирующего эстрогена являются адренальные и овариальны андрогены (андростендион и тестостерон), которые преобразуются до- 17006707 эстрогенов (эстрон и эстрадиол) с помощью ароматазного фермента в периферических тканях. Производное эстрагена, ингибируя или инактивируя ароматазу, является эффективным и селективным средством для лечения у некоторых пациентов с гормоно-зависимым раком молочной железы в постклимактерическом периоде. Использующийся здесь термин антиэстрогенный агент включает в себя не только антагонисты рецептора эстрогена и селективные модуляторы рецептора эстрогена, но и ингибиторы ароматазы, как описано выше. Термин агенты дифференциации включают в себя соединения, которые могут различными путями ингибировать клеточную пролиферацию и индуцировать дифференциацию. Известно, что витамин D и ретиноиды играют основную роль в регуляции роста и дифференциации большого количество нормальных и малигнизированных типов клеток. Агенты, блокирующие метаболизм ретиноевой кислоты(RAMBA), увеличивают уровни эндогенной ретиноевой кислоты, ингибируя катаболизм ретиноевой кислоты, опосредованный цитохромом Р 450. Изменения метилирования ДНК являются одними из наиболее частых отклонений при неоплазиях у человека. Гиперметилирование промоторов определенных генов обычно связано с инактивацией этих генов. Под термином ингибиторы ДНК-метилтрансферазы понимают соединения, которые взаимодействуют путем фармакологического ингибирования ДНК-метилтрансферазы и реактивируют экспрессию генов, супрессирующих опухоль. Термин ингибиторы киназы включают в себя эффективные ингибиторы киназ, которые вовлечены в последовательность клеточного цикла и программируют клеточную смерть (апоптоз). Под термином ингибиторы фарнезилтрансферазы понимают соединения, которые были созданы для предотвращения фарнезилирования Ras и других внутриклеточных белков. Было показано, что они влияют на пролиферацию и жизнеспособность малигнизированных клеток. Термин другие ингибиторы HDAC включают в себя, но ими не ограничиваются: жирные кислоты с короткой цепью, например, бутират, 4-фенилбутират или вальпроевую кислоту; гидроксаминовую кислоту, например, субероиланилид гидроксамовую кислоту (SAHA), биарилгидроксамат А-161906, бициклические арил-N-гидроксикарбоксамиды, пироксамид, CG-1521, PXD-101,сульфонамид гидроксамовая кислота, LAQ-824, трихостатин A (TSA), оксамфлатин, скриптаид, мкарбокси коричневая кислота, бисгидроксамовая кислота или аналог трапоксин-гидроксамовой кислоты; циклические тетрапептиды, например, трапоксин, апидицин или депсипептид; бензамиды, например, MS-275 или CI-994, или депудецин. Для лечения злокачественных новообразований, соединений по настоящему изобретению могут вводиться пациенту, как указано выше, в сочетании с облучением. Облучение подразумевает ионизирующую излучение и, в частности, гамма-излучение, особенно излучаемое линейными ускорителями или радионуклидами, которые используются в настоящее время. Облучение опухоли радионуклидами может быть наружным или внутренним. Настоящее изобретение также относится к сочетанию в соответствии с данным изобретением противоопухолевого агента и ингибитора HDAC по данному изобретению. Настоящее изобретение также относится к сочетанию в соответствии с данным изобретением для использования в терапии, например, для ингибирования роста опухолевых клеток. Настоящее изобретение также относится к сочетаниям в соответствии с данным изобретением для ингибирования роста опухолевых клеток. Настоящее изобретение также относится к способу ингибирования роста опухолевых клеток у больного человека, который включает в себя введение больному эффективного количества сочетания по данному изобретению. Кроме того, данное изобретение относится к способу ингибирования патологического роста клеток,включая трансформированных клеток, путем введения эффективного количества сочетания по данному изобретению. Дополнительный медицинский агент и ингибитор HDAC могут вводиться одновременно (например,раздельно или одной композицией) или раздельно в любом порядке. В последнем случае, два соединения могут вводиться в течение периода, в количестве и способом, достаточными для обеспечения достигаемого эффективного или синергетического действия. Понятно, что предпочтительный способ и порядок введения, соответствующее дозируемое количество и режим введения каждого компонента сочетания будет зависеть от конкретного вводимого дополнительного медицинского агента и ингибитора HDAC, их пути введения, от конкретной опухоли, на которую воздействуют, и от конкретного субъекта, которому требуется лечение. Наилучший способ и последовательность введения, дозируемое количество и режим введения может быть легко определен специалистом в данной области, используя обычные способы и принимая во внимание представленную здесь информацию. Координационное соединение платины преимущественно вводят в дозе от 1 до 500 мг на квадратный метр (мг/м 2) области на поверхности тела, например, 50-400 мг/м 2, в частности, для циспластина в дозе около 75 мг/м 2 и для карбоплатина в дозе около 300 мг/м 2 на курс лечения.- 18006707 Таксановое соединение преимущественно вводят в дозе 50-400 мг на квадратный метр (мг/м 2) области на поверхности тела, например, 75-250 мг/м 2, в частности, для паклитакселя в дозе около 175-250 мг/м 2 и для доцетакселя в дозе около 75-150 мг/м 2 на курс лечения. Соединение камптотецина преимущественно вводят в дозе 0,1-400 мг на квадратный метр (мг/м 2) области на поверхности тела, например, 1-300 мг/м 2, в частности, для иринотекана в дозе около 100-350 мг/м 2 и для топотекана в дозе около 1-2 мг/м 2 на курс лечения. Противоопухолевое производное подофиллотоксина преимущественно вводят в дозе 30-300 мг на квадратный метр (мг/м 2) области на поверхности тела, например, 50-250 мг/м 2, в частности, для этопозида в дозе около 35-100 мг/м и для тенипозида в дозе около 50-250 мг/м 2 на курс лечения. Противоопухолевые алкалоиды барвинка преимущественно вводят в дозе 2-30 мг на квадратный метр (мг/м 2) области на поверхности тела, например в дозе около 3-12 мг/м 2, в частности, для винкристина в дозе около 1-2 мг/м 2 и для винорелбина в дозе около 10-30 мг/м 2 на курс лечения. Противоопухолевое нуклеозидное производное преимущественно вводят в дозе 200-2500 мг на квадратный метр (мг/м 2) области на поверхности тела, например, 700-1500 мг/м 2, в частности, для 5-FU в дозе около 200-500 мг/м 2 и для гемцитабина в дозе около 800-1200 мг/м 2 и для капецитабина в дозе около 1000-2500 мг/м 2 на курс лечения. Алкилирующие агенты, такие как азотистый иприт и нитрозомочевина, преимущественно вводят в дозе 100-500 мг на квадратный метр (мг/м 2) области на поверхности тела, например, 120-200 мг/м 2, в частности, для циклофосфамида в дозе около 100-500 мг/м 2, для хлорамбуцила в дозе около 0,1-0,2 мг/кг,для кармустина в дозе около 150-200 мг/м 2 и для ломустина в дозе около 100-150 мг/м 2 на курс лечения. Противоопухолевое производное антрациклина преимущественно вводят в дозе 10-75 мг на квадратный метр (мг/м 2) области на поверхности тела, например, 15-60 мг/м 2, в частности, для доксорубицина в дозе около 40-75 мг/м 2, для даунорубицина в дозе около 25-45 мг/м 2, и для идарубицина в дозе около 10-15 мг/м 2 на курс лечения. Трастузумаб преимущественно вводят в дозе 1-5 мг на квадратный метр (мг/м 2) области на поверхности тела, предпочтительно, 2-4 мг/м 2 на курс лечения. Антиэстрогенный агент преимущественно вводят в дозе около 1-100 мг в день в зависимости от конкретного агента и условий лечения. Тамоксифен преимущественно вводят перорально в дозе 5-50 мг,предпочтительно, 10-20 мг дважды в день, терапию проводят в течение достаточного времени для достижения и поддержания терапевтического эффекта. Торемифен преимущественно вводят перорально в дозе 60 мг один раз в день, терапию проводят в течение достаточного времени для достижения и поддержания терапевтического эффекта. Анастрозол преимущественно вводят перорально в дозе около 1 мг один раз в день. Дролоксифен преимущественно вводят перорально в дозе около 20-100 мг один раз в день. Ралоксифен преимущественно вводят перорально в дозе около 60 мг один раз в день. Эксеместан преимущественно вводят перорально в дозе около 25 мг один раз в день. Эти дозы могут вводиться, например, одним, двумя, тремя или несколькими курсами лечения, который может повторяться, например, каждые 7, 14, 21 или 28 дней. Ввиду их эффективных фармакологических свойств, компоненты комбинаций в соответствии с изобретением, то есть дополнительный медицинский агент и ингибитор HDAC могут быть получены в виде фармацевтических форм для целей введения. Компоненты могут входить в состав индивидуальных фармацевтических композиций или в состав одной фармацевтической композиции, содержащей оба компонента. Следовательно, настоящее изобретение также относится к фармацевтической композиции, содержащей дополнительный медицинский агент и ингибитор HDAC вместе с одним или несколькими терапевтическими носителями. Настоящее изобретение также относится к сочетанию в соответствии с данным изобретением в форме фармацевтической композиции, содержащей противоопухолевый агент и ингибитор HDAC по данному изобретению вместе с одним или несколькими фармацевтическими носителями. Кроме того, настоящее изобретение относится к использованию сочетания по данному изобретению при производстве фармацевтической композиции для ингибирования роста опухолевых клеток. Настоящее изобретение также относится к продукту, содержащему, во-первых, активный ингредиент ингибитор HDAC по данному изобретению и, во вторых, активный ингредиент противоопухолевый агент, в виде объединенного препарат для одновременного, отдельного или последовательного использования для лечения пациентов, страдающих различными видами злокачественных опухолей. Экспериментальная часть Нижеследующие примеры даны в иллюстративных целях. Далее АММС обозначает 3-[2-(N,N-диэтил-N-метиламино)этил]-7-метокси-4-метилкумарин,BFC обозначает бензилокситрифторметилкумарин, BINAP обозначает 2,2'-бис(дифенилфосфино)1,1'-бинафтил, Вос обозначает третичный бутоксикарбонил, BuLi обозначает н-бутиллитий, ВТЕАС обозначает хлорид бензилтриэтиламмония, BSA обозначает эмбриональную бычью сыворотку,ДХМ обозначает дихлорметан, DIC обозначает диизопропилкарбодиимид, DIEA обозначает диизопропилэтиламин, DIPE обозначает диизопропиловый эфир, DMAP обозначает диметиламинопи- 19006707 ридин, ДМФ обозначает диметилформамид, DMSO обозначает диметилсульфоксид, EDC обозначает N'-(этилкарбонимидоил)-N,N-диметил-1,3-пропандиамин, моногидрохлорид, EDTA обозначает этилендиаминтетрауксусную кислоту, EtOAc обозначает этилацетат, Fmoc обозначает флуоренилметоксикарбонил, Hepes обозначает 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновую кислоту, НОАс обозначает уксусную кислоту, МеОН обозначает метанол, МТТ обозначает бромид 3-(4,5 диметилтиазол-2-ил)-2,5-дифенил-2 Н-тетразолия, NMP обозначает N-метилпирролидинон, PBS обозначает забуференный фосфатом физиологический раствор, PyBop обозначает гексафторфосфат бензотриазол-1-илокси-трис-пирролидинофосфония, PyBrOP обозначает гексафторфосфат бром-триспирролидинофосфония, ТЭА обозначает триэтиламин, ТФУ обозначает трифторуксусную кислоту,TIS обозначает триизопропилсилан, ТГФ обозначает тетрагидрофуран и ТГП обозначает тетрагидропиранил и TMSOTf обозначает триметилсилил трифлат. Extrelut является продуктом MerckKgaA, Darmstadt, Germany, и представляет собой короткую колонку, содержащую диатомную землю.Flashtube является продуктом Trikonex и представляет собой полиэтиленовую пробирку в упаковке с 8,0 г силикагеля, содержащего флуоресцентный индикатор. А. Получение промежуточных соединений. Пример А 1. а) Смесь 4-(гексагидро-1 Н-1,4-диазепин-1-ил)бензойной кислоты, гидрохлорида этилового эфира(1:2) (0,01 моль) и 2-нафталенесульфонил хлорида (0,011 моль) в ДХМ р. а. (150 мл) перемешивали при комнатной температуре. Добавляли NаНСО 3 (насыщенный водный раствор, 50 мл), и реакционную смесь перемешивали в течение 4 ч при комнатной температуре. Слои разделяли. Органический слой сушили,фильтровали, и растворитель упаривали. Остаток растирали в порошок с 2-пропанолом, отфильтровывали и сушили с получением 4,5 г (количественный выход) этилового эфира 4-[гексагидро-4-(2 нафталенилсульфонил)-1 Н-1,4-диазепин-1-ил]бензойной кислоты (промежуточное вещество 1).b) Смесь промежуточного вещества 1 (0,0091 моль) в 35% HCl (10 мл) и 1,4-диоксана (30 мл) перемешивали и кипятили с обратным холодильником в течение 24 ч, затем охлаждали и полученный осадок отфильтровывали, промывали диоксаном и сушили. Часть (0,9 г) остатка (3,9 г, 96%) перекристаллизовывали из этанола небольшим количеством ДМФ, отфильтровывали и сушили с получением 0,43 г 4[гексагидро-4-(2-нафталенилсульфонил)-1 Н-1,4-диазепин-1-ил]бензойной кислоты (промежуточное вещество 2). с) Смесь промежуточного вещества 2 (0,0067 моль), О-(фенилметил)гидроксиламина, гидрохлорида(2 экв, 0,0134 моль), 4-метилморфолина (4 экв, 0,027 моль) и DMAP (0,5 г) в ДХМ р. а. (200 мл) перемешивали при комнатной температуре. Добавляли DIC (2 экв, 0,0134 моль), и реакционную смесь перемешивали в течение 2 ч при комнатной температуре. Растворитель упаривали. Остаток растирали в порошок с этанолом, отфильтровывали и сушили. Остаток очищали через силикагель на стеклянном фильтре(элюент: ДХМ/МеОН 99/1). Желаемые фракции собирали, и растворитель упаривали. Остаток растирали в порошок с ДХМ (30 мл), отфильтровывали и сушили с получением 1,9 г (55%) 4-[гексагидро-4-(2 нафталенилсульфонил)-1 Н-1,4-диазепин-1-ил]-N-(фенилметокси)бензамида (промежуточное вещество 3). Пример А 2. а) Смесь 4-(4-карбоксифенил)-1-пиперазинкарбоновой кислоты, 1-(1,1-диметилэтил) эфира (0,032 моль), гидрохлорида О-(фенилметил)гидроксиламина (0,064 моль), DMAP (0,03 моль) в ДХМ р. а. (250 мл) и ТЭА (14 мл) перемешивали при комнатной температуре. Добавляли DIC (0,064 моль). Реакционную смесь перемешивали при комнатной температуре в течение 8 ч, затем промывали водой, HCl (0,5 н.) и водой. Отделенный органический слой сушили (MgSO4), фильтровали, и растворитель упаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: ДХМ/МеОН 98/2). Желаемые фракции собирали, и растворитель упаривали с получением 13,7 г 4-[4-(фенилметокси)амино]карбонил]фенил]-1-пиперазинкарбоновой кислоты, 1,1-диметилэтилового эфира (промежуточное вещество 4).b) Смесь промежуточного вещества 4 (0,0137 моль) в TFA (57 мл) и ДХМ (300 мл) перемешивали при комнатной температуре в течение 2 ч. Растворитель упаривали. Остаток выливали в воду/ДХМ и алкализировали с помощью NH4OH. Отделенный водный водный слой насыщали NaCl и экстрагировали ДХМ. Объединенный органический слой сушили (MgSO4), фильтровали, и растворитель упаривали. Остаток суспендировали в DIPE. Осадок отфильтровывали и сушили с получением 1,6 г (37,6%) N(фенилметокси)-4-(1-пиперазинил)бензамида (промежуточное вещество 5).c) Смесь промежуточного вещества 5 (0,011 моль) в ДХМ (150 мл) и ТЭА (1-75 моль) перемешивали при комнатной температуре. 2-нафталенесульфонил хлорид (0,013 моль) растворяли в ДХМ(10 мл) и по каплям добавляли к реакционной смеси. Реакционную смесь перемешивали при комнатной температуре в течение 30 мин, и затем промывали водой. Отделенный органический слой сушили (MgSO4) , фильтровали, и растворитель упаривали. Остаток суспендировали в DIPE. Осадок отфильтровывали и сушили с получением 3,6 г 4-[4-(2-нафталенилсульфонил)-1-пиперазинил]-N-(фенилметокси)бензамида (промежуточное вещество 6).- 20006707 Пример A3. Смесь 1-(2-нафталенилсульфонил)-4-(4-нитрофенил)пиперазина (7,5 ммоль) в ТГФ (150 мл) гидрировали при 50 С, используя в качестве катализатора Pd/C 10% (1 г) в присутствии раствора тиофена (0,5 мл). После поглощения H2 (3 экв.), катализатор отфильтровывали и фильтрат упаривали. Остаток кристаллизовали из 2-пропанола. Образовавшийся осадок отфильтровывали, промывали 2-пропанолом и сушили (55 С, вакуум) с выходом 2,39 г (87%) 1-(4-аминофенил)-4-(2-нафталенилсульфонил)пиперазина (промежуточное вещество 7). Пример А 4.a) 60% NaH (0,0217 моль) порциями добавляли при комнатной температуре к раствору 1-(2 нафталенесульфонил)пиперазина (0,011 моль) в ТГФ(50 мл) в потоке N2. Смесь перемешивали при комнатной температуре в течение 1 ч, затем охлаждали до 0 С. Быстро добавляли раствор 2(метилсульфонил)-5-пиримидинкарбоновой кислоты, этилового эфира (0,014 моль) в ТГФ (30 мл). Смесь перемешивали при комнатной температуре в течение 2 ч, выливали в воду и экстрагировали EtOAc. Органический слой разделяли, сушили (MgSO4) , фильтровали, и растворитель упаривали. Остаток выливали в диэтиловый эфир. Осадок отфильтровывали и сушили с получением 3,92 г (84%) этилового эфира 2[4-(2-нафталенилсульфонил)-1-пиперазинил]-5-пиримидинкарбоновой кислоты (промежуточное вещество 8), точка плавления 260 С.b) Смесь промежуточного вещества 8 (0,0011 моль) и гидроксида калия (4,7 ммоль) в этаноле (5 мл) перемешивали и кипятили с обратным холодильником в течение 24 ч, затем охлаждали, выливали в ледяную воду и подкисляли с помощью 6 н. HCl. Смесь частично упаривали и охлаждали. Осадок фильтровали, промывали водой и сушили с получением 0,47 г (100%) 2-[4-(2-нафталенилсульфонил)-1 пиперазинил]-5-пиримидинкарбоновой кислоты (промежуточное вещество 9), точка плавления 260 С.c) Добавляли ТЭА (0,0011 моль), EDC (0,0011 моль), 1-гидроксибензотриазол (1,1 ммоль) и О(тетрагидро-2 Н-пиран-2-ил)гидроксиламин (0,0011 моль) при комнатной температуре к раствору промежуточного вещества 9 (8 моль) в ДХМ/ТГФ (50/50) (20 мл) в потоке N2. Смесь перемешивали в течение 24 ч, затем выливали в ледяную воду и экстрагировали EtOAc. Органический слой разделяли, сушили(MgSO4), фильтровали, и растворитель упаривали. Остаток (0,56 г) очищали колоночной хроматографией на силикагеле (элюент: ДХМ 100 до ДХМ/МеОН 90/10; 5 мкм) . Чистые фракции собирали, и растворитель упаривали. Остаток (0,417 г) очищали колоночной хроматографией на силикагеле (злюент: ДХМ/МеОН/NH4 ОН 92/8/1; 15-40 мкм). Чистые фракции собирали, и растворитель упаривали с получением 0,293 г (69%) 2-[4-(2-нафталенилсульфонил)-1-пиперазинил]-N-[(тетрагидро-2 Н-пиран-2-ил)окси]5-пиримидинкарбоксамида (промежуточное вещество 10), точка плавления 198 С. Пример А 5. а) Получение промежуточного соединения 11 Смесь 1-(2-нафталенилсульфонил)пиперазина (1 экв; 37 ммоль), 3-(бромометил)бензойной кислоты,метилового эфира (0,00037 моль) и морфолинометилполистерола 2% DVB (0,2 г, Novabiochem 01-640171, 200-400 меш, загрузка 3,2-3,8 ммоль/г) в ДМФ, р. а. (5 мл) перемешивали в течение ночи (20 ч) при 100 С. Реакционную смесь фильтровали. Полимер промывали ДМФ. Растворитель упаривали при 80 С в слабой струе N2. Остаток очищали колоночной хроматографией (элюент: CH2Cl2/EtOAc 1/1). Фракционные продукты собирали с выходом 0,044 г промежуточного вещества 11. промежуточного соединения 12 Смесь промежуточного вещества 11 (1 ммоль) в ТГФ р. а. (3 мл) и 1 н. NaOH (1 мл) перемешивали в течение ночи при 60 С. Добавляли 1 н. HCl (1 мл). Добавляли ДХМ (10 мл), и реакционную смесь фильтровали через Extrelut NT (поставщик: Merck). Фильтрат (органический слой) упаривали с получением 0,036 г промежуточного вещества 12. с)(1,1 экв), затем ТЭА (1,2 экв), затем 1-гидрокси-1 Н-бензотриазол (1,1 экв), затем О-(тетрагидро-2 Нпиран-2-ил)гидроксиламин (1,3 экв). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Добавляли воду (2 мл), и реакционную смесь перемешивали в течение 15 мин. Добавляли ДХМ (10 мл) и смесь сушили через Extrelut NT (поставщик: Merck). Органический слой разделяли, и растворитель упаривали при 50 С в потоке N2. Остаток очищали флэш-хроматографией на колонке сFlashtube 2008 (поставщик Trikonex) (элюент: EtOAc). Фракции продукта собирали (отсекали) и затем элюировали ДХМ/МеОН 90/10). Фракции продукта собирали, и растворитель упаривали при 50 С в потоке N2 с выходом 0,025 г промежуточного вещества 13. Пример А 6. а) Получение(9,6 ммоль) в этаноле (100 мл) гидрировали при комнатной температуре, используя в качестве катализатора 10% Pd/C (1 г). После поглощения Н 2 (1 экв), катализатор отфильтровывали через дикалит, и фильтрат упаривали с получением 3 г промежуточного вещества 14. промежуточного соединения 15 Смесь промежуточного вещества 14 (9,6 ммоль) и ТЭА (0,012 моль) в ДХМ (100 мл) перемешивали при комнатной температуре. Порциями добавляли 2-нафталенесульфонил хлорид (9,6 ммоль) при комнатной температуре. Реакционную смесь перемешивали в течение 30 мин при комнатной температуре,затем промывали водой, сушили (MgSO4), фильтровали, и растворитель упаривали. Остаток кристаллизовали из DIPE/CH3CN, отфильтровывали и сушили с получением 3,02 г (67,4%) промежуточного вещества 15, точка плавления 182 С. с) Получение промежуточного соединения 16 Смесь промежуточного вещества 15 (2 ммоль) в NaOH в (30 мл), ТГФ (80 мл) и МеОН (20 мл) перемешивали в течение 20 ч при комнатной температуре. Смесь нейтрализовали 1 н. HCl (30 мл). Смесь разбавляли водой (100 мл), и затем экстрагировали три раза ДХМ. Органический слой разделяли, сушили промежуточного соединения 17 Смесь промежуточного вещества 16 (0,23 ммоль), О-(тетрагидро-2 Н-пиран-2-ил)гидроксиламина- 22006707 перемешивали при комнатной температуре. Добавляли EDC (0,00025 моль), и реакционную смесь перемешивали в течение выходных при комнатной температуре. Реакционную смесь промывали водой, сушили (MgSO4), фильтровали, и растворитель упаривали с получением промежуточного вещества 17. Пример А 7 а) Получение(0,5 моль). После поглощения Н 2 (3 экв.), катализатор отфильтровывали и фильтрат упаривали. Остаток кристаллизовали из 2-пропанола. Полученный осадок отфильтровывали, промывали 2-пропанолом и сушили (55 С, вакуум) с выходом 2,39 г (87%) промежуточного вещества 18. промежуточного соединения 19 Добавляли О-(тетрагидро-2 Н-пиран-2-ил)гидроксиламин (8,5 ммоль) при комнатной температуре к смеси -оксо-бензолпропановой кислоты (7,8 ммоль) в пиридине (12 мл) и этаноле (23 мл). Смесь перемешивали при комнатной температуре в течение 1 ч. Растворитель упаривали досуха. Остаток (2,6 г) очищали колоночной хроматографией на силикагеле (элюент: ДХМ/МеОН/NH4 ОН 85/15/1 70/30/3; 15-40 мкм). Чистые фракции собирали, и растворитель упаривали с получением 1,7 г (83%) промежуточного вещества 19. с) ПолучениеEDC (1,3 моль) добавляли при комнатной температуре к смеси промежуточного вещества 18 (1,1 ммоль), (промежуточное вещество 19) (1,3 ммоль) и гидрата 1-гидроксибензотриазола (1,3 ммоль) в ДХМ/ТГФ (8 мл) в потоке N2. Смесь перемешивали при комнатной температуре в течение ночи. Добавляли 10% K2 СО 3. Смесь экстрагировали ДХМ. Органический слой разделяли, сушили (MgSO4), фильтровали, и растворитель упаривали досуха. Остаток (0,9 г) очищали колоночной хроматографией на силикагеле (элюент: циклогексан/EtOAc 65/35; 15-35 мкм). Чистые фракции собирали, и растворитель упаривали. Остаток (0,35 г, 52%) кристаллизовали из CH3CN. Осадок отфильтровывали и сушили с получением 0,3 г (45%) промежуточного вещества 20, точка плавления 213 С. Пример А 8. а) ПолучениеNа 2 СO3 (11 ммоль) в диметилацетамиде (5 мл) перемешивали при 14 0 С в течение 24 ч. Добавляли 1-(4 фторфенил)этанон (4 ммоль). Смесь перемешивали при 140 С в течение 48 ч, затем охлаждали, выливали в ледяную воду и экстрагировали EtOAc. Органический слой промывали водой, сушили (MgSO4) ,фильтровали, и растворитель упаривали. Остаток (3,5 г) очищали колоночной хроматографией на силикагеле (элюент: циклогексан/EtOAc 65/35; 15-35 мкм). Чистые фракции собирали, и растворитель упари- 23006707 вали. Остаток (0,95 г, 34%) кристаллизовали из ацетонитрила. Осадок отфильтровывали и сушили с получением 0,8 г промежуточного вещества 21, точка плавления 218 С. промежуточное соединение 22 Раствор промежуточного вещества 21 (2,2 ммоль) в трихлорметане (15 мл) добавляли при комнатной температуре к смеси CuBr2 (3,7 ммоль) в EtOAc (25 мл). Смесь перемешивали при 50 С в течение 12 ч, затем охлаждали до комнатной температуры, выливали в воду и экстрагировали EtOAc. Органический слой разделяли, сушили (MgSO4), фильтровали, и растворитель упаривали с получением 1 г (96%) промежуточного вещества 22. Пример А 9. а) Получение промежуточное соединение 23 Смесь 1-(2-нафталенилсульфонил)пиперазина (3,6 ммоль), 4-фтор-2-(трифторметил)бензойной кислоты, этилового эфира (7,2 ммоль) и Na2CO3 (7,2 ммоль) в диметилацетамиде (10 мл) перемешивали при 140 С в течение 20 ч, затем охлаждали до комнатной температуры, выливали в ледяную воду и экстрагировали EtOAc. Органический слой промывали водой, сушили (MgSO4), фильтровали, и растворитель упаривали. Остаток (2,93 г) очищали колоночной хроматографией на силикагеле (элюент: циклогексан/EtOAc 75/35; 15-40 мкм). Чистые фракции собирали, и растворитель упаривали. Остаток(1,8 г) кристаллизовали из диэтилового эфира. Осадок отфильтровывали и сушили с получением 1,265 г промежуточного вещества 23 (71%), точка плавления 122 С. промежуточного соединения 24 Смесь промежуточного вещества 23 (3,4 ммоль) и KОН (0,017 моль) в этаноле (15 мл) перемешивали и кипятили с обратным холодильником в течение 24 ч, выливали в ледяную воду и подкисляли с помощью 3 н. HCl. Осадок фильтровали, промывали водой/диэтиловым эфиром и сушили с получением 1,255 г (80%) промежуточного вещества 24, точка плавления 194 С. с) Получение промежуточного соединения 25 Добавляли ТЭА (1,4 ммоль), EDC (1,4 ммоль), гидрат 1-гидроксибензотриазола (1,4 ммоль), затем О-(тетрагидро-2 Н-пиран-2-ил)гидроксиламин (1,4 ммоль) при 12 С к раствору (промежуточное вещество 24) (1 ммоль) в ДХМ/ТГФ 50/50 (20 мл) в потоке N2. Смесь перемешивали при комнатной температуре в течение 24 ч, выливали в ледяную воду и экстрагировали ДХМ. Органический слой разделяли, сушили(MgSO4), фильтровали, и растворитель упаривали. Остаток кристаллизовали из ДХМ/диэтилового эфира. Осадок отфильтровывали и сушили с получением 0,48 г (79%) промежуточного вещества 25, точка плавления 192 С. Пример А 10. а) Получение. промежуточного соединения 26 Порциями добавляли 60% NaH (15 ммоль) при комнатной температуре к смеси 1-(2-нафталенилсульфонил)пиперазина (7,5 ммоль) в ТГФ (35 мл). Смесь перемешивали при комнатной температуре в течение 1 ч и 30 мин в потоке N2. По каплям добавляли раствор 4-хлор-2-(метилсульфонил)-5- пиримидинкарбоновой кислоты, этилового эфира (9,8 ммоль) в ТГФ (35 мл). Смесь перемешивали при комнатной температуре в течение 3 ч и 30 мин, выливали в ледяную воду и экстрагировали EtOAc. Органический слой разделяли, сушили (MgSO4), фильтровали, и растворитель упаривали. Остаток (4,6 г) очищали колоночной хроматографией на силикагеле (элюент: циклогексан/EtOAc от 80/20 до 20/80; 15-40 мкм). Три фракции собирали, и растворитель упаривали. Одну из этих фракций использовали в следующей стадии с получением 0,48 г (14%) промежуточного вещества 26, точка плавления 123 С. промежуточного соединения 27 Смесь промежуточного вещества 26 (0,8 ммоль) и KОН (4,2 ммоль) в этаноле (10 мл) перемешивали и кипятили с обратным холодильником в течение 24 ч, затем охлаждали до комнатной температуры, выливали в ледяную воду и подкисляли с помощью 6 н. HCl. Осадок фильтровали, промывали водой/диэтиловым эфиром и сушили с получением 0,33 г (93%) промежуточного вещества 27, точка плавления 244 С. с) Получение промежуточного соединения 28 К раствору (промежуточное вещество 27) (0,6 ммоль) в ДХМ/ТГФ (10 мл) добавляли ТЭА (0,8 ммоль), гидрат 1-гидроксибензотриазола (0,8 ммоль), EDC (0,8 ммоль) затем 0-(тетрагидро-2 Н-пиран-2 ил)гидроксиламин (0,8 ммоль) при комнатной температуре в потоке N2. Смесь перемешивали при комнатной температуре в течение 24 ч, выливали в ледяную воду и экстрагировали ДХМ. Органический слой разделяли, сушили (MgSO4), фильтровали, и растворитель упаривали. Остаток (0,47 г) очищали колоночной хроматографией на силикагеле (элюент: DCM/MeOH/NH4OH 98/2/0,1; 15-40 мкм). Чистые фракции собирали, и растворитель упаривали с получением 0,18 г (53%) промежуточного вещества 28,точка плавления 80 С. Пример A11. а) Получение промежуточного соединения 29 1-(Фенилметил)пиперазин (0,125 моль) растворяли в ацетонитриле (200 мл). Добавляли K2 СО 3 (0,34 моль). По каплям добавляли раствор этилового эфира 2-(метилсульфонил)-5-пиримидинкарбоновой кислоты (0,161 моль) в ацетонитриле(200 мл). Смесь перемешивали при комнатной температуре в течение 2 ч, затем разбавляли ДХМ (1000 мл) и промывали водой. Органический слой разделяли, сушили(MgSO4), фильтровали, и растворитель упаривали. Остаток очищали колоночной хроматографией на силикагеле (ДХМ/МеОН 98/2). Чистые фракции собирали, и растворитель упаривали. Остаток сушили в вакууме при 50 С, с выходом 33,6 г (82,5%) промежуточного вещества 29. промежуточного соединения 30 Смесь промежуточного вещества 29 (0,03 моль) в этаноле (250 мл) гидрировали при 50 С, используя в качестве катализатора 10% Pd/C (2 г). После поглощения Н 2 (1 экв), катализатор отфильтровывали через дикалит, и фильтрат упаривали на Rotovap. Остаток очищали колоночной хроматографией на силикагеле (элюент: ДХМ/ (МеОН/NH3) 90/10). Фракции продукта собирали, и растворитель упаривали с получением 6,8 г ( 96%) промежуточного вещества 30. с) Получение промежуточного соединения 31 К раствору промежуточного вещества 30 (0,029 моль) в ДХМ (150 мл) добавляли ТЭА (0,038 моль). Добавляли 2-нафталенсульфонил хлорид (0,032 моль), и реакционную смесь перемешивали в течение ночи при комнатной температуре. Затем смесь промывали водой. Органический слой разделяли, промывали водой, сушили (MgSO4), фильтровали, и растворитель упаривали. Остаток кристаллизовали из промежуточного соединения 32 Смесь промежуточного вещества 31 (0,017 моль) в ТГФ (250 мл), 1 н. NaOH (250 мл) и МеОН (50 мл) перемешивали в течение 5 ч при комнатной температуре. Добавляли 1 н. HCl (250 мл), и смесь перемешивали в течение 45 мин при комнатной температуре. Осадок отфильтровывали и сушили (вакуум,60 С, в течение ночи), с выходом 6,0 г (89%) промежуточного вещества 32, точка плавления 260 С. е) ПолучениеEDC (0,018 моль). Добавляли ТЭА (0,020 моль). Добавляли 1-гидрокси-1 Н-бензотриазол (0,018 моль),затем О-(тетрагидро-2 Н-пиран-2-ил)гидроксиламин (0,018 моль). Реакционную смесь перемешивали в течение 6 ч при комнатной температуре, и затем дважды промывали водой и добавляли ДХМ. Органический слой разделяли, сушили (MgSO4), фильтровали, и растворитель упаривали. Остаток суспендировали в кипятили с СН 3 СN, затем перемешивали в течение ночи при комнатной температуре. Полученный остаток отфильтровывали, промывали CH3CN, и сушили (вакуум; 50 С), с выходом 6,1 г (82%) промежуточного вещества 33, точка плавления 198 С. Пример А 12. а) Получение(6,5 ммоль) добавляли при комнатной температуре к раствору 4-(1 пиперазинилсульфонил)морфолина (3,2 ммоль) в ТГФ (15 мл) в потоке N2. Смесь перемешивали в течение 1 ч, затем охлаждали до 0 С. Добавляли раствор 2-(метилсульфонил)-5-пиримидинкарбоновой кислоты, этилового эфира (4,2 ммоль) в ТГФ (9 мл). Смесь перемешивали в течение 2 ч, выливали в ледяную воду. Осадок отфильтровывали и сушили. Остаток (0,665 г) выливали в диэтиловый эфир. Осадок отфильтровывали и сушили. Фильтрат упаривали и объединяли с осадком с получением 0,408 г промежуточного вещества 34. промежуточного соединения 35 Смесь промежуточного вещества 34 (1 ммоль) и LiOH Н 2 О (3,1 ммоль) в ТГФ (6 мл) и воде (6 мл) перемешивали и кипятили с обратным холодильником в течение 24 ч, затем охлаждали. Растворитель упаривали. Смесь подкисляли с помощью 3 н. HCl. Добавляли EtOAc. Смесь фильтровали через целит. Органический слой экстрагировали EtOAc. Органический слой разделяли, сушили (MgSO4), фильтровали, и растворитель упаривали с получением 0,139 г промежуточного вещества 35. с) Получение промежуточного соединения 36 Гидрат 1-гидроксибензотриазола (0,5 ммоль) и EDC(0,5 ммоль) добавляли при 10 С к раствору промежуточного вещества 35 (0,3 ммоль) и ТЭА (0,5 ммоль) в ТГФ/ДХМ (6 мл) в потоке N2. Смесь перемешивали в течение 1 ч. Добавляли О-(тетрагидро-2 Н-пиран-2-ил)гидроксиламина (0,5 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. Добавляли лед и воду. Смесь экстрагировали ДХМ. Органический слой разделяли, сушили (MgSO4), фильтровали, и растворитель упаривали. Остаток(0,259 г) очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/iPrOH/NH4OH 98/2/0,2; 10 мкм). Чистые фракции собирали, и растворитель упаривали с получением 0,024 г промежуточного соединения 36. Пример А 13 а) Получение промежуточного соединения 37 Промежуточное вещество 30 (114 ммоль) перемешивали в 800 мл ДХМ, добавляли ТЭА (180 ммоль), порциями добавляли 4-йодбензолсульфонил хлорид (149 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Добавляли ДХМ (1000 мл) и воду (300 мл). Органический слой экстрагировали, разделяли и сушили (MgSO4), фильтровали, и растворитель упаривали. Продукт (сырой) суспендировали в кипящем ацетонитриле, оставляли охлаждаться до комнатной температуры и фильтровали. Продукт сушили в вакуум при 50 С, с выходом 51,4 г (89,5%) промежуточного вещества 37. промежуточного соединения 38 Раствор промежуточного вещества 37 (0,1 ммоль) и карбонат цезия (0,15 ммоль) в ДМФ (2 мл) добавляли к раствору (3-метоксифенил)борной кислоты (0,149 ммоль) в ДМФ (1 мл). Реакционную смесь трясли в атмосфере N2 в течение 2 мин. Добавляли палладий (II) ацетат (0,02 ммоль) и 1,3 бис(дифенилфосфино)пропан (0,02 ммоль). Реакционную смесь трясли при 80 С в течение 4 ч и затем оставляли охлаждаться до комнатной температуры. Растворитель упаривали в вакууме при 80 С. Остаток- 27006707 растворяли в ДХМ (20 мл) и МеОН (2 мл), и затем промывали 3 мл 10% Nа 2 СO3 в воде. Реакционную смесь сушили над Extrelut NT (поставщик: Merck) и концентрировали при 50 С в потоке N2. Продукт очищали колоночной хроматографией на силикагеле. Чистые фракции собирали, и растворитель упаривали и сушили при 50 С в струе N2 с выходом промежуточного вещества 38. с) ПолучениеNaOH (1,5 ммоль). Смесь перемешивали в течение ночи при комнатной температуре. Добавляли смесьHCl (1,5 мл) и 10-20 мл ТГФ. Реакционную смесь сушили Extrelut NT (поставщик: Merck). Растворитель упаривали (60 С, струя N2). Добавляли толуол. Растворитель упаривали в вакууме при 70 С. Снова добавляли толуол. Растворитель упаривали при 80 С в вакууме с выходом 16 мг (100%) промежуточного вещества 39. промежуточного соединения 40 Раствор 1-гидроксибензотриазола (0,1 ммоль), EDC (0,1 ммоль) и ТЭА (0,12 ммоль) в ДХМ (3 мл) и ТГФ (4 мл) добавляли к (промежуточное вещество 39) (0,1 ммоль). Реакционную смесь перемешивали в течение 5 мин при комнатной температуре. Добавляли О-(тетрагидро-2 Н-пиран-2-ил)гидроксиламин (0,1 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Добавляли воду(3 мл) и ДХМ (10 мл). Реакционную смесь сушили. Реакционную смесь концентрировали в атмосфере N2 при 60 С. Остаток растворяли в ДХМ(5 мл) и аккуратно трясли в течение 4 часов с 150 мг метилизоцианат-полистирола 2% DVB 200-400 меш, загрузка 1,4-1,8 ммоль/г (поставщик: Novabiochem 01-64-0169) с получением избытка О-(тетрагидро-2 Н-пиран-2-ил)гидроксиламина. Смесь фильтровали, полимер дважды промывали ДХМ (2 мл). Смесь концентрировали при 40 С в атмосфере N2 и затем очищали колоночной хроматографией (элюент 50% EtOAc/ДХМ). Чистые фракции собирали, и растворитель упаривали с получением промежуточного вещества 40. Пример А 14. Получение промежуточного соединения 41 Смесь 3, 6-дихлорпиридазина (0,0034 моль) и 1-(2-нафталенилсульфонил)-пиперазин (0,0034 моль) в ДМФ (2 мл) перемешивали при 110 С в течение 4 ч, затем охлаждали до комнатной температуры и выливали в EtOAc/H2O. Смесь отфильтровывали. Фильтрат экстрагировали. Органический слой промывали водой, сушили (MgSO4), фильтровали, и растворитель упаривали. Остаток (0,85 г) очищали колоночной хроматографией на силикагеле(20-45, мкл) (элюент: циклогексан/EtOAc 90/10). Чистые фракции собирали, и растворитель упаривали (0,56 г, 42%). Данную фракцию кристаллизовали из диэтилового эфира. Осадок отфильтровывали и сушили с получением 0,178 г (14%) промежуточного соединения 41, точка плавления 213 С. Пример А 15. а) Получение- 28006707 Раствор хлорида 2-нафталенсульфонила (0,0066 моль) в ДХМ (15 мл) по каплям добавляли при 0 С к смеси 2,5-диазабицикло[2,2,1]гептан-2-карбоновой кислоты, 1,1-диметилэтилового эфира, (1S, 4S)(0,0051 моль) и ТЭА (0,0098 моль) в ДХМ(15 мл). Смесь перемешивали при комнатной температуре в течение 12 ч, выливали в ледяную воду и экстрагировали ДХМ. Органический слой промывали 10% карбонатом калия, сушили (MgSO4), фильтровали, и растворитель упаривали. Остаток кристаллизовали из диэтилового эфира. Осадок отфильтровывали и сушили с получением 2,05 г (85%) промежуточного соединения 42 (S, S), точка плавления 129 С. промежуточного соединения 43 Смесь промежуточного соединения 42 (S, S) (0,0049 моль) в 6 н. HCl (20 мл) и ТГФ (5 мл) перемешивали при 80 С в течение 12 ч, затем охлаждали до комнатной температуры, выливали в ледяную воду,подщелачивали NH4OH и экстрагировали ДХМ. Органический слой разделяли, сушили (MgSO4), фильтровали, и растворитель упаривали. Остаток (1,4 г) кристаллизовали из диэтилового эфира. Осадок отфильтровывали и сушили с получением 0,5 г (36%) промежуточного соединения 43 (S, S), точка плавления 159 С. с) Получение промежуточного соединения 44 Гидрид натрия 60% (0,0051 моль) добавляли при 0 С к смеси промежуточного соединения 43 (S, S)(0,0034 моль) в ТГФ (20 мл) в потоке N2. Смесь перемешивали в течение 1 ч. Раствор этилового эфира 2(метилсульфонил)-5-пиримидинкарбоновой кислоты (0,0045 моль) в ТГФ (10 мл) по каплям добавляли при 0 С. Смесь перемешивали при комнатной температуре в течение 2 ч и выливали в ледяную воду. Добавляли EtOAc. Смесь фильтровали, промывали диэтиловым эфиром и сушили с получением 0,4 г промежуточного соединения 44 (S, S), точка плавления 212 С. Фильтрат экстрагировали. Органический слой промывали водой, сушили (MgSO4), фильтровали, и растворитель упаривали. Остаток (1,7 г) очищали колоночной хроматографией на силикагеле (15-35 мкм) (элюент: циклогексан/EtOAc 60/40). Чистые фракции собирали, и растворитель упаривали с выходом 1 г (66%) промежуточного соединения 44(S, S) натриевая соль промежуточного соединения 45 Смесь промежуточного соединения 44 (S, S) (0,0021 моль) и гидроксида натрия (0,0042 моль) вEtOH (40 мл) перемешивали и кипятили с обратным холодильником в течение 12 ч, затем охлаждали. Осадок фильтровали, промывали дизтиловым эфиром и сушили с получением 0,56 г (62%) промежуточного соединения 45. Na (S, S) . е) ПолучениеEDC (0,0017 моль) и ДХМ (20 мл) добавляли при комнатной температуре к смеси промежуточного соединения 45 (0,0013 моль), O-(тетрагидро-2 Н-пиран-2-ил)гидроксиламина (0,0017 моль) и 1 гидроксибензотриазола (0,0017 моль) в ТГФ (20 моль). Смесь перемешивали при комнатной температуре в течение 12 ч, выливали в воду и экстрагировали ДХМ. Органический слой отделяли, сушили (MgSO4),- 29006707 фильтровали, и растворитель упаривали. Остаток (0,8 г) очищали колоночной хроматографией на силикагеле (15-40 мкм) (элюент: ДХМ/МеОН 90,5/0,5). Чистые фракции собирали, и растворитель упаривали. Остаток (0,43 г, 66%) кристаллизовали из диэтилового эфира/DIPE. Осадок отфильтровывали и сушили с получением 0,36 г промежуточного соединения 46 (S, S), точка плавления 176 С. Пример А 16. а) Получение промежуточного соединения 47 Смесь промежуточного соединения 26 (0,001 моль), N-метил-метанамина, гидрохлорида (0,0015 моль) и карбоната калия (0,003 моль) в ацетонитриле (10 мл) перемешивали при 80 С в течение 24 ч, затем охлаждали, выливали в ледяную воду и экстрагировали ДХМ. Органический слой разделяли, сушили промежуточного соединения 48 Смесь промежуточного соединения 47 (0,0008 моль) и гидроксида натрия (0,0019 моль) в EtOH (10 мл) перемешивали и кипятили с обратным холодильником в течение 24 ч, затем охлаждали до комнатной температуры, выливали в ледяную воду, подкисляли с помощью 3 н. HCl и экстрагировали EtOAc. Органический слой разделяли, сушили (MgSO4), фильтровали, и растворитель упаривали с получением 0,25 г(67%) промежуточного соединения 48. Данный продукт непосредственно использовали в следующей стадии реакции. с) Получение промежуточного соединения 49 К раствору промежуточного соединения 48 (0,0005 моль) и ТЭА (0,0007 моль) в ТГФ/ДХМ (6 мл) добавляли 1-гидроксибензотриазол (0,0007 моль) и EDC (0,0007 моль) при комнатной температуре. Смесь перемешивали в течение 30 мин. Добавляли O-(тетрагидро-2 Н-пиран-2-ил)гидроксиламин(0,0007 моль). Смесь перемешивали при комнатной температуре в течение 24 ч, выливали в ледяную воду. Смесь экстрагировали EtOAc. Органический слой разделяли, сушили (MgSO4), фильтровали, и растворитель упаривали. Остаток (0,48 г) очищали колоночной хроматографией на силикагеле(10 мкм)(элюент: ДХМ/МеОН 98/2). Чистые фракции собирали, и растворитель упаривали. Остаток (0,127 г) кристаллизовали из диэтилового эфира. Осадок отфильтровывали и сушили с получением 0,12 г (40%) промежуточного соединения 49, точка плавления 118 С. Пример А 17. а) Получение промежуточного соединения 50 Гидрид натрия (0,0181 моль) добавляли при комнатной температуре к раствору 1-(2-нафталенилсульфонил)пиперазина (0,009 моль) в ТГФ (15 мл) в потоке N2. Смесь перемешивали в течение 1 ч, затем охлаждали до 0 С. Добавляли раствор метилового эфира 5-хлорпиразинкарбоновой кислоты (0,0136
МПК / Метки
МПК: C07D 261/10, C07D 215/36, C07D 295/22, C07D 239/42, C07D 333/34, C07D 409/04, C07D 207/28, C07D 213/82, C07D 241/24, C07D 307/79, C07D 233/84
Метки: новых, качестве, ингибиторов, гистон-деацетилазы, сульфонилпроизводные
Код ссылки
<a href="https://eas.patents.su/30-6707-sulfonilproizvodnye-v-kachestve-novyh-ingibitorov-giston-deacetilazy.html" rel="bookmark" title="База патентов Евразийского Союза">Сульфонилпроизводные в качестве новых ингибиторов гистон-деацетилазы</a>
Предыдущий патент: Производные n-аминоимидазола, ингибирующие вич
Следующий патент: Производные 3-азабицикло (3.1.0) гексана в качестве антагонистов опиоидного рецептора
Случайный патент: Противовоспалительная и анальгетическая композиция для местного применения в области опорно-двигательного аппарата животного












