Применение ингибиторов протеазы вируса иммунодефицита человека (вич) для блокирования миграции клеток и/или инвазии, инфильтрации тканей и отека при лечении связанных с этим заболеваний
Формула / Реферат
1. Применение ингибитора протеазы ВИЧ для получения медикамента для лечения опухоли у первого пациента, причем указанный медикамент предназначен для введения в суточной дозе, которая ниже обычно применяемой суточной дозы ингибитора протеазы ВИЧ, вводимой для лечения инфекции ВИЧ у ВИЧ-инфицированного пациента.
2. Применение ингибитора протеазы ВИЧ для получения медикамента для блокирования роста опухоли у первого пациента, причем указанный медикамент предназначен для введения в суточной дозе, которая ниже обычно применяемой суточной дозы ингибитора протеазы ВИЧ, вводимой для лечения инфекции ВИЧ у ВИЧ-инфицированного пациента.
3. Применение по любому из пп.1 и 2, где указанный первый пациент не является ВИЧ-инфицированным.
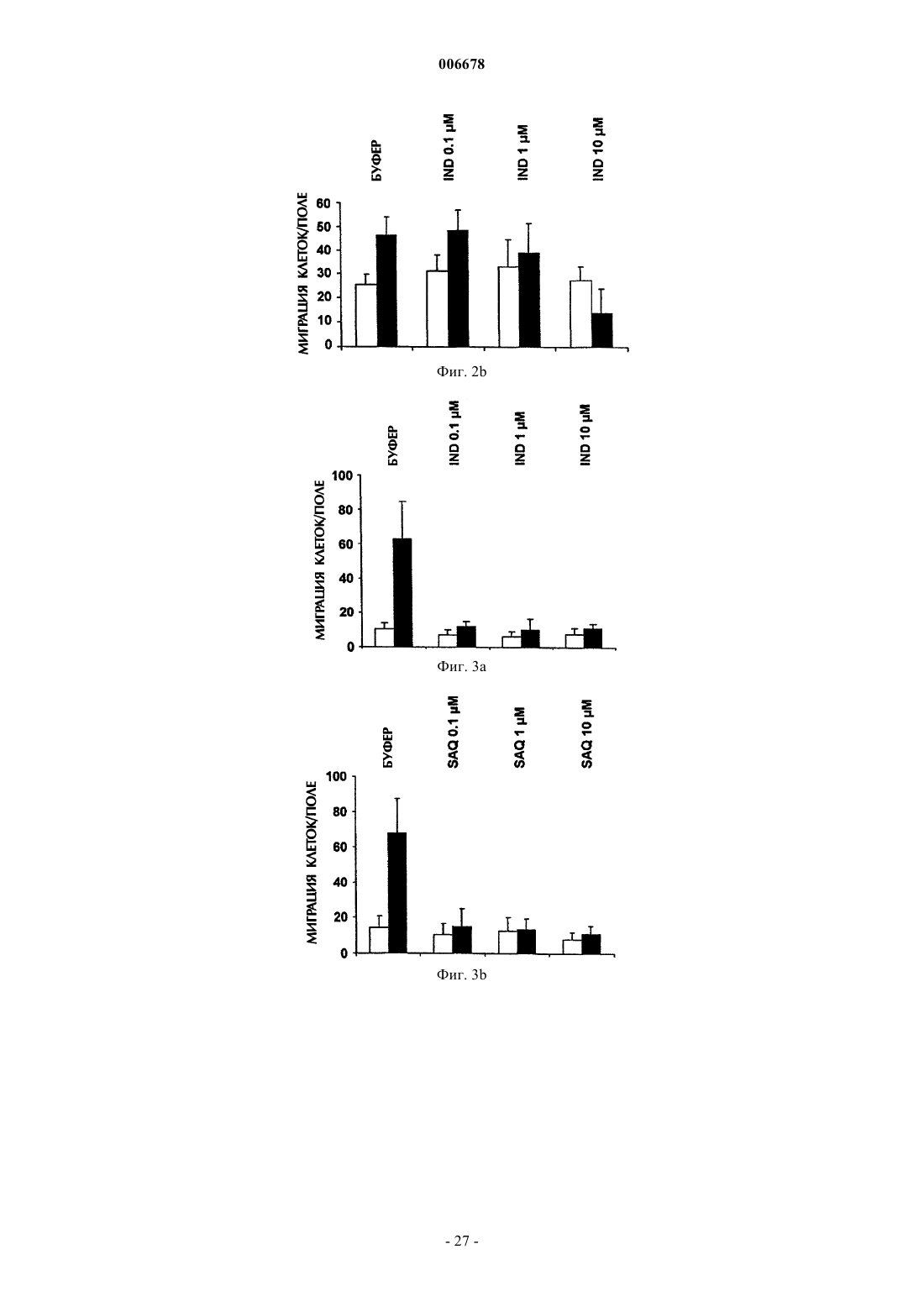
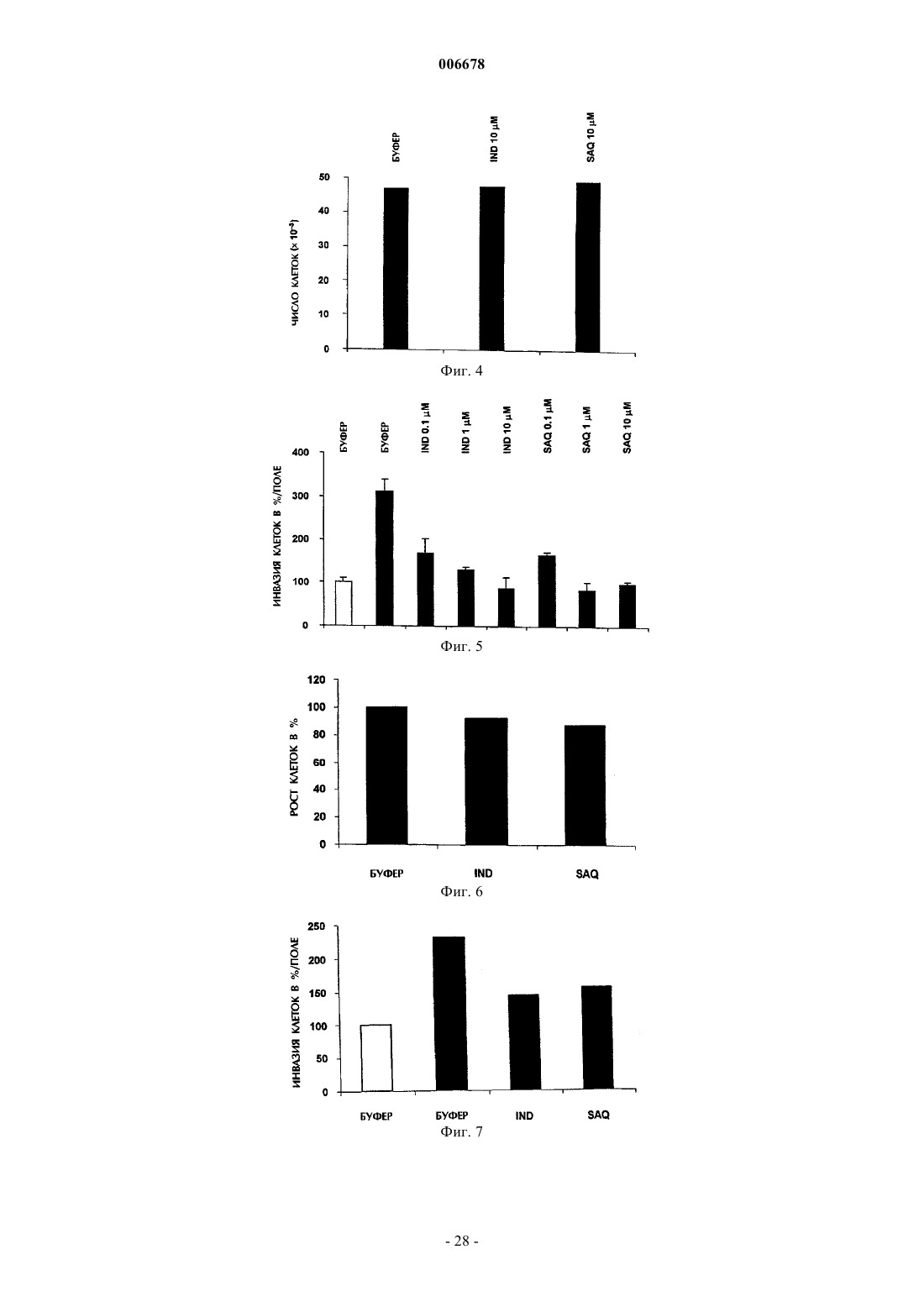
4. Применение по любому из пп.1-3, где указанный ингибитор протеазы ВИЧ при по меньшей мере одной из концентраций 0,1, 1 или 10 мкМ ингибирует миграцию или инвазию эндотелиальных клеток и клеток саркомы Капоши в ответ на 50 нг/мл bFGF при анализе в камере Бойдена.
5. Применение по любому из пп.1-4, где указанный ингибитор протеазы ВИЧ при по меньшей мере одной из концентраций 0,1, 1 или 10 мкМ ингибирует образование цитокинов клетками саркомы Капоши.
6. Применение по любому из пп.1-5, где указанный ингибитор протеазы ВИЧ в дозе, соответствующей полной дозе, двойной или половинной дозе ингибитора протеазы ВИЧ, применяемой ежедневно для ВИЧ-инфицированных пациентов, ингибирует ангиогенез у мышей, индуцируемый bFGF.
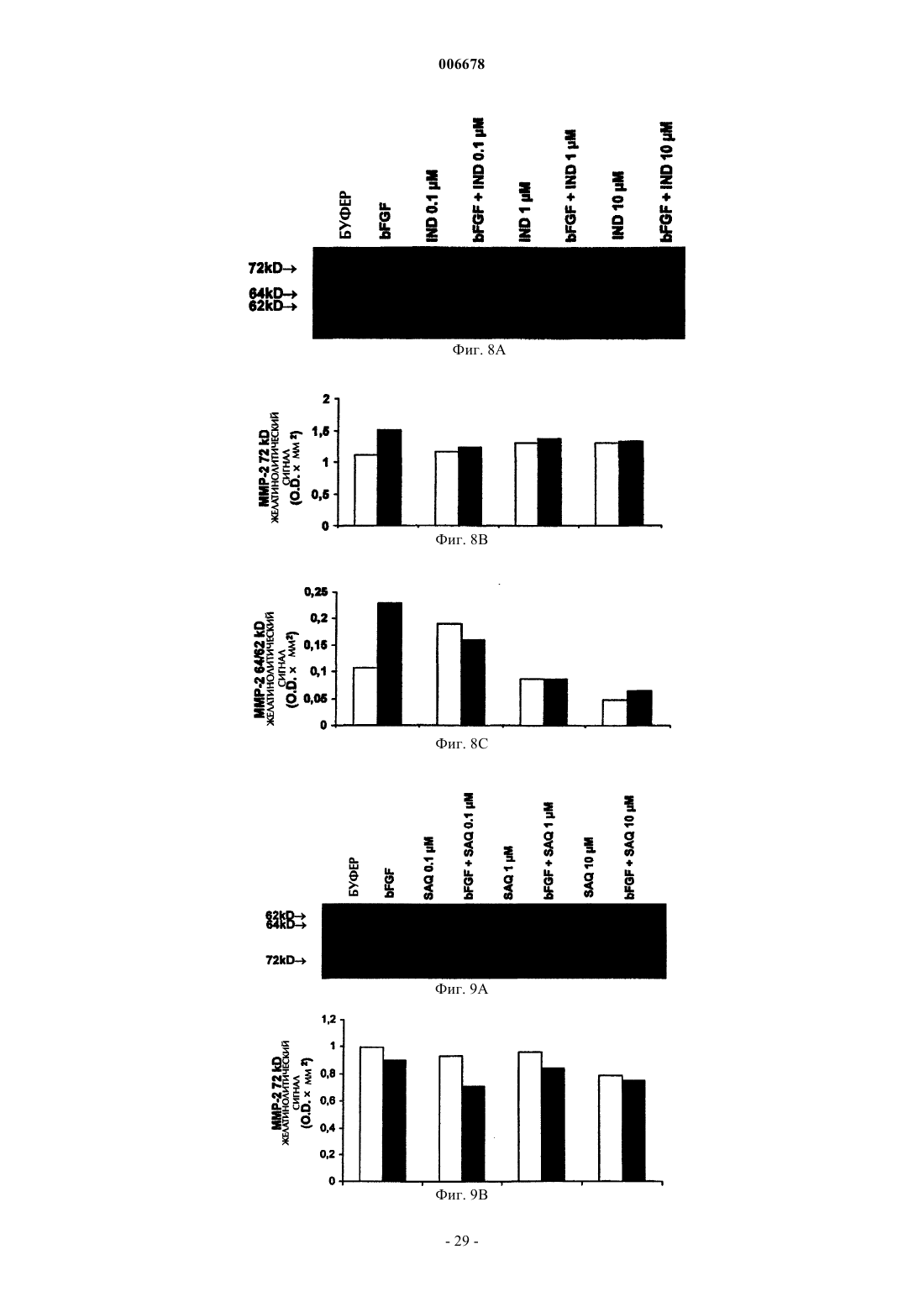
7. Применение по любому из пп.1-6, где указанный ингибитор протеазы ВИЧ при по меньшей мере одной из концентраций 0,1, 1 или 10 мкМ ингибирует активацию ММР-2 в культивируемых эндотелиальных клетках пупочной вены человека, инкубируемых в присутствии 0,1 мкг/мл bFGF.
8. Применение по любому из пп.1-7, где указанным ингибитором протеазы ВИЧ является индинавир или его производное.
9. Применение по п.8, где вводимая суточная доза составляет 600 мг.
10. Применение по п.8, где вводимая суточная доза составляет 1200 мг.
11. Применение по любому из пп.1-7, где указанным ингибитором протеазы ВИЧ является саквинавир или его производное.
12. Применение по п.11, где вводимая суточная доза составляет 900 мг.
13. Применение по п.8, где вводимая суточная доза составляет 1800 мг.
14. Применение по любому из пп.1-7, в котором указанный ингибитор протеазы ВИЧ выбран из числа следующих соединений: индинавира, саквинавира, ритонавира, нельфинавира, ампренавира и лопинавира, их производных и их смесей.
15. Применение по п.14, в котором указанный ингибитор протеазы ВИЧ представляет собой комбинацию индинавира и нельфинавира.
16. Применение по любому из пп.1-15, в котором опухоль представляет собой саркому Капоши.
17. Применение по любому из пп.1-15, в котором опухоль представляет собой опухоль мягких тканей или опухоль хряща, кости или крови.
18. Применение по любому из пп.1-15, в котором опухоль представляет собой злокачественную опухоль.
19. Применение по любому из пп.1, 2, 4-15 и 18, в котором опухоль представляет собой опухоль эндотелиальных клеток, опухоль клеток легкого, опухоль клеток молочной железы, гепатокарциному или лейкоз, и где первый пациент не является ВИЧ-инфицированным.
20. Применение по любому из пп.1, 2, 4-15 и 18, в котором опухоль представляет собой миеломоноцитарный лейкоз или Т-клеточный лейкоз, и где первый пациент не является ВИЧ-инфицированным.
21. Применение по любому из пп.1-20, в котором указанный медикамент дополнительно предназначен для достижения регрессии указанной опухоли.
22. Применение по любому из пп.1-20, в котором указанный медикамент предназначен для ингибирования метастазов.
23. Применение по любому из пп.1-22, в котором указанный медикамент дополнительно предназначен для ингибирования отека.
24. Применение по любому из пп.1-23, в котором указанный медикамент предназначен для введения вместе с противовоспалительным, антиангиогенным или противоопухолевым лекарственным средством.
25. Применение по любому из пп.1-24, в котором указанный медикамент предназначен для перорального, внутривенного, внутримышечного, подкожного, интрадермального, внутрибрюшинного, интратекального, интраплеврального, внутриматочного, трансмукозального, интраректального, интравагинального или чрескожного введения.
26. Применение по любому из пп.1-24, в котором указанный медикамент предназначен для внутриочагового введения.
27. Применение индинавира или его производного для получения медикамента для лечения опухоли у пациента.
28. Применение индинавира или его производного для получения медикамента для лечения воспалительного заболевания или аутоиммунного заболевания у пациента.
29. Применение индинавира или его производного для получения медикамента для блокирования роста опухоли у пациента.
30. Применение по любому из пп.27-29, где указанный пациент не является ВИЧ-инфицированным.
31. Применение по любому из пп.27-30, в котором указанный медикамент предназначен для введения в суточной дозе, которая ниже обычно применяемой суточной дозы индинавира, вводимой для лечения инфекции ВИЧ у ВИЧ-инфицированного пациента.
32. Применение по любому из пп.27-30, в котором указанный медикамент предназначен для введения в суточной дозе, которая равна или выше обычно применяемой суточной дозы индинавира, вводимой для лечения инфекции ВИЧ у ВИЧ-инфицированного пациента.
33. Применение по любому из пп.27-32, в котором указанный медикамент предназначен для введения суточной дозы индинавира или его производного 2400 или 4800 мг.
34. Применение по любому из пп.27, 29 и 30-33, в котором указанная опухоль представляет собой саркому Капоши.
35. Применение по любому из пп.27, 29 и 30-33, в котором указанная опухоль представляет собой опухоль мягких тканей или опухоль хряща, кости или крови.
36. Применение по любому из пп.27, 29 и 30-33, в котором указанная опухоль представляет собой злокачественную опухоль.
37. Применение по любому из пп.27, 29 и 30-33, в котором указанная опухоль представляет собой опухоль эндотелиальных клеток, опухоль клеток легкого, опухоль клеток молочной железы, гепатокарциному или лейкоз, и где указанный первый пациент не является ВИЧ-инфицированным.
38. Применение по любому из пп.27, 29 и 30-33, в котором указанная опухоль представляет собой миеломоноцитарный лейкоз или Т-клеточный лейкоз, и где первый пациент не является ВИЧ-инфицированным.
39. Применение по любому из пп.27, 29, 30-33 и 34-38, в котором указанный медикамент дополнительно предназначен для достижения регрессии опухоли.
40. Применение по любому из пп.27, 29, 30-33 и 34-38, в котором указанный медикамент предназначен для ингибирования метастазов.
41. Применение по любому из пп.27-39, в котором указанный медикамент дополнительно предназначен для ингибирования отека.
42. Применение по любому из пп.30-33, в котором указанный медикамент дополнительно предназначен для лечения воспалительного заболевания.
43. Применение по п.42, в котором указанное воспалительное заболевание представляет собой хроническое воспаление, связанное с аллергией и с вирусными, бактериальными или паразитическими возбудителями инфекций, или полицентрическую болезнь Кастлмана.
44. Применение по любому из пп.30-33, в котором указанный медикамент предназначен для лечения аутоиммунного заболевания.
45. Применение по п.44, в котором указанное аутоиммунное заболевание представляет собой системную красную волчанку, склеродерму, ревматоидный артрит, псориаз, тиреоидит, язвенный ректоколит, болезнь Крона, синдром Goodpasture, системный васкулит, синдром Шегрена или первичный билиарный цирроз.
46. Применение по любому из пп.27-45, дополнительно включающее нельфинавир для получения медикамента.
47. Применение по любому из пп.27-46, в котором указанный медикамент предназначен для введения вместе с противовоспалительным, антиангиогенным или противоопухолевым лекарственным средством.
48. Применение по любому из пп.27-47, в котором указанный медикамент предназначен фыя перорального, внутривенного, внутримышечного, подкожного, интрадермального, внутрибрюшинного, интратекального, интраплеврального, внутриматочного, трансмукозального, интраректального, интравагинального или чрескожного введения.
49. Применение по любому из пп.27-47, в котором указанный медикамент предназначен для внутриочагового введения.
Текст
006678 Область техники, к которой относится изобретение Настоящее изобретение касается применения ингибиторов протеазы вируса иммунодефицита человека (ВИЧ) для подавления инвазии тканей нормальными и/или неопластическими клетками, для лечения связанных с этим заболеваний, таких как саркома Калоши, раковые опухоли, ангиопролиферативные, воспалительные или аутоиммунные заболевания, связанные либо не связанные с заражением ВИЧ. Уровень техники Ингибиторы протеазы вируса ВИЧ - это соединения, обладающие известным антиретровирусным действием, которое описано, к примеру, в Deeks et al. (Deeks et al., 1997). Они применяются при лечении ВИЧ-инфекций у лиц, страдающих синдромом приобретенного иммунодефицита (СПИД), выполняя функцию подавления созревания вируса и блокирования его репликации (Deeks et al., 1997). В настоящем описании ингибиторы протеазы вируса ВИЧ также обозначаются в дальнейшем как ИПВИЧ. Саркома Капоши (KS) - это раковая опухоль, связанная с заражением герпесвирусом 8 человека(HHV8), которая особенно часто встречается у лиц, инфицированных вирусом ВИЧ (СПИД-KS) (Ensoliand Strzl, 1998). KS также наблюдается у лиц, не инфицированных ВИЧ, особенно в бассейне Средиземного моря и в Италии (классическая KS), в Африке (эндемическая KS) и у лиц после трансплантации органов, подвергаемых терапии иммунодепрессантами (ятрогенная KS) (Ensoli and Strzl, 1998). Нарушение регуляции иммунной системы, по-видимому, является необходимым условием возникновения KS у лиц, инфицированных HHV8 (Ensoli and Strzl, 1998). Различными авторами описано уменьшение встречаемости KS и лимфомы (International Collaboration on HIV and Cancer, 2000) или регрессию KS (Lebbe et al., 1998; Cattelan et al., 1999) у пациентов, инфицированных ВИЧ и подвергавшихся лечению комбинированными антиретровирусными препаратами,содержащими по меньшей мере один ИПВИЧ (Deeks et al., 1997). KS - это сосудистая опухоль, характеризующаяся ангиогенезом сосудистых клеток и инфильтрацией клеток воспаления, которая особенно часто встречается у гомосексуальных и бисексуальных мужчин, инфицированных ВИЧ одновременно сHHV-8 (Ensoli and Strzl, 1998). Образование пораженных участков опосредовано цитокинами и хемокинами, обладающими ангиогенным, пролиферативным, отекообразующим, хемотактическим и воспалительным действием. Эти цитокины вырабатываются клетками KS, активированными эндотелиальными клетками и клетками иммунной системы, инфильтрирующими ткани (Ensoli et al., 1989; Ensoli et al.,1994a; Ensoli et al., 1994b; Fiorelli et al., 1995; Samaniego et al., 1995; Samaniego et al., 1997; Samaniego etal., 1998; Barillari et al., 1999a). Из числа ангиогенных факторов основной фактор роста фибробластов(bFGF) экспрессирован на высоком уровне в очагах KS и является наиболее важным аутокринным и паракринным фактором для роста KS и ангиогенеза (Ensoli et al., 1989; Ensoli et al., 1994a; Ensoli et al.,1994b; Samaniego et al., 1995; Fiorelli et al., 1995; Samaniego et al., 1997; Samaniego et al., 1998; Barillari etal., 1999a). Так, антитела или антисмысловые олигомеры, направленные против bFGF, блокируют и ангиогенез, и возникновение KS-подобных поражений, индуцируемых при инокуляции первичных клетокKS мышам nude, и рост клеток KS in vitro (Ensoli et al., 1989; Ensoli et al., 1994b; Barillari et al., 1999 в). И наоборот, инокуляция bFGF мышам nude способствует возникновению KS-подобных ангиопролиферативных очагов (Ensoli et al., 1994 а; Samaniego et al., 1998; Barillari et al., 1999a), встречаемость и агрессивность которых повышаются белком Tat вируса ВИЧ-1, который способен имитировать действие белков внеклеточного матрикса. В частности, действие Tat на KS требует присутствия bFGF или воспалительных цитокинов, которые в свою очередь индуцируют в эндотелиальных клетках и клетках KS выработку bFGF и экспрессию интегринов, действующих как рецепторы Tat (Ensoli et al., 1990; Barillari et al.,1992; Barillari et al., 1993; Ensoli et al., 1994a; Albini et al, 1995; Fiorelli et al., 1995; Fiorelli et al., 1998; Fiorelli et al., 1999; Barillari et al., 1999a and 1999b). Другой индуктор роста, ангиогенеза и сосудистой проницаемости, присутствующий в KS, - это фактор роста сосудистого эндотелия (VEGF), который совместно с bFGF участвует в ангиогенезе и отечности KS (Samaniego et al., 1998). Другие факторы, присутствующие в KS и совместно участвующие в ее возникновении, - это интерлейкины IL-1 и IL-6, фактор некроза опухолей TNF-, интерферон IFN-, колониестимулирующий фактор гранулоцитов/макрофагов(GM-CSF), фактор роста из тромбоцитов (PDGF), онкостатин М и хемокины (RANTES, MIP-l, MIP-1 и другие) (Ensoli and Strzl, 1998). В частности, такие воспалительные цитокины, как IL-1, IL-6, TNF- иIFN-, индуцируют в клетках KS и эндотелиальных клетках продукцию bFGF и VEGF, вызывают приобретение эндотелиальными клетками фенотипа клеток KS и ангиогенности in vivo, индуцируют очаги KS у мышей (Samaniego et al., 1995; Fiorelli et al., 1995; Fiorelli et al., 1998; Barillari et al., 1999a). Как и VEGF,наряду со стимулированием роста KS, bFGF способен активировать все процессы, необходимые для ангиогенеза. В свою очередь, ангиогенез имеет принципиальное значение для роста опухолей и образования метастазов, для нераковых ангиопролиферативных заболеваний, и зачастую является важным компонентом хронических воспалительных заболеваний (Carmeliet and Jain, 2000). Кроме того, хемокины,вырабатываемые активироваными эндотелиальными клетками, клетками KS и клетками воспаления, инфильтрирующими ткани, такие как RANTES, MIP-1, MIP-1, IL-8, МСР-1 и другие, оказывают непрямые ангиогенные эффекты и действуют как хемоаттрактанты для клеток воспаления, вызывая этим дальнейшее пополнение и инфильтацию клеток воспаления и иммунной системы (инфицированных или нет-1 006678 вирусом HHV-8) в ткани и пораженные участки (Ensoli and Strzl, 1998). В этом плане при ангиогенезе,инфильтрации тканей клетками воспаления и отеках требуется разрушение базальной мембраны сосудов и/или внеклеточного матрикса специфичными протеазами, что создает условия для направленной миграции клеток в периваскулярном пространстве (инвазия и миграция эндотелиальных клеток или клеток воспаления/иммунной системы) или способствует утечке жидкости из кровотока (Carmeliet and Jain,2000). Кроме того, при ангиогенезе необходима и третья стадия, состоящая в пролиферации эндотелиальных клеток. В частности, разрушение базальной мембраны сосудов и интерстициальной ткани опосредовано матричными металлопротеазами (ММП). Сами ММП необходимы для роста опухолей и метастазов, для инфильтрации тканей клетками воспаления и для возникновения отека (Stetler-Stevenson, 1999). В частности, инфильтрация тканей клетками воспаления играет важную роль в раковых, воспалительных и аутоиммунных заболеваниях, так как эти клетки вырабатывают факторы, включая ангиогенные факторы и воспалительные цитокины, которые обладают паракринным действием на соседние клетки. Из числа ММП для ангиогенеза необходима ММП-2, которая индуцируется bFGF и сильно экспрессирована в первичных очагах KS и в других неоплазиях (Ensoli et al., 1994 а; Barillari et al., 1999b; Stetler-Stevenson,1999), тогда как ММП-9 наиболее важна как медиатор инфильтрации моноцитов и лимфоцитов в тканях. Ингибирование миграции, инвазии или пролиферации эндотелиальных клеток либо активности ММП-2,ММП-9 или других ММП способно блокировать ангиогенез и является логическим основанием антиангиогенной и противоопухолевой терапии, применяемой в настоящее время (Stetler-Stevenson, 1999; Koivunen et al., 1999; Carmeliet and Jain, 2000). Более того, местная и системная концентрация и/или активность ММП проявляет значительные колебания при некоторых патологических состояниях, включая инфекции, множественный склероз, воспалительные заболевания, иммунологические и раковые заболевания (Fujimoto et al., 1993; Leppert D et al., 1998; Leppert et al., 2000), и поэтому может быть использована для диагностики, прогнозирования и лечения этих заболеваний. Меньшую встречаемость и регрессию KS, наблюдавшиеся у лиц, инфицированных ВИЧ и подвергавшихся лечению ИПВИЧ (Lebbe et al., 1998; Cattelan et al., 1999; International Collaboration on HIV andCancer, 2000), связывали со способностью этого препарата ингибировать репликацию ВИЧ и, как следствие этого, выработку и выделение вирусом ВИЧ-1 белка Tat, сильного фактора прогрессирования KS(Ensoli et al., 1990; Ensoli et al., 1994a; Barillari et al., 1999a; Barillari et al., 1999b). Кроме того, посредством восстановления числа и функции специфических цитотоксических Т-лимфоцитов и активности нормальных клеток-киллеров применение ИПВИЧ повышает защитную иммунную реакцию против вирусаHHV-8, который считается возбудителем KS (Ensoli and Strzl, 1998). Так, у пациентов, получавших ИПВИЧ, проявлялось снижение числа и ВИЧ (Deeks et al., 1997), и HHV-8, и вновь появлялись иммунологические ответы на HHV-8 (Blum et al., 1997; Rizzieri et al., 1997; Lebbe et al., 1998; Osman et al., 1999; Sirianni et al., 1999; Sirianni et al., 2000; Wang et al., 2000). В этой связи недавно были получены данные о том, что ИПВИЧ модулирует функцию дендритных клеток и презентацию антигена (Andre et al., 1998; Gruber et al., 2001), уменьшая активацию Т-клеток и продукцию воспалительных цитокинов также и в отсутствие ВИЧ (Tovo, AIDS 2000; Ledru et al., 2000). Кроме того, один из ИПВИЧ, а именно ритонавир, как оказалось, оказывает сильное влияние на активность протеасом, что ведет к изменению процессинга и презентации антигенного эпитопа главным комплексом гистосовместимости (МНС) класса I (Andre et al., PNAS 1998; патентная заявка WO 99/63998). Эти данные свидетельствуют о том, что ИПВИЧ может обладать свойствами иммуномодулятора (Andreet al., PNAS 1998; Tovo, AIDS 2000; патентная заявка WO 99/63998; патентная заявка WO 0033654). Более того, поскольку известно, что протеасомы также участвуют в ангиогенезе (Oikawa et al., 1998), эти данные предполагают, что ИПВИЧ может влиять и на ангиогенез. Кроме того, полученные недавно данные показывают, что ИПВИЧ обладает свойствами модулятора некоторых клеточных процессов, включая активацию, выживание и пролиферацию клеток (патентная заявка WO 99/63998; патентная заявкаWO 0033654). На основании этих данных высказывалось предположение, что ингибиторы протеаз,включая ИПВИЧ, ингибиторы протеасом, ингибиторы микробных и вирусных протеаз, ингибиторы цистеиновых или сериновых протеаз, могут быть использованы для модуляции клеточных реакций и метаболизма при лечении ряда заболеваний человека путем воздействия на эти клеточные реакции. В отличие от этого, мы предположили, что ИПВИЧ может оказывать прямые и специфические эффекты на инвазию клеток и проницаемость сосудов вследствие его действия на ферменты или молекулы,участвующие в этих процессах, а именно молекулы, не связанные с клеточными протеасомами типа (но не исключительно) ММП. Таким образом, уменьшение встречаемости и регрессия KS, наблюдавшиеся у лиц, получавших ИПВИЧ, может быть обусловлена ингибированием ИПВИЧ инвазии эндотелиальных клеток и клеток KS, инфильтрации тканей клетками воспаления и/или иммунной системы и возникновения отека. Следует отметить, что такие эффект ИПВИЧ нельзя было предвидеть на основании существующих исследований. Так, все эти исследования сходятся в том, что приписывают снижение встречаемости и регрессию KS у лиц, получавших ИПВИЧ, ингибированию ВИЧ-инфекции с последующим уменьшением экспрессии белка Tat, восстановлению иммунной системы и последующему исчезновениюHHV8 из крови или пораженных участков, либо иммуномодуляторному действию ИПВИЧ (Blum et al.,-2 006678 1997; Rizzieri et al., 1997; Lebbe et al., 1998; De Milito et al., 1999; Cattelan et al., 1999; Osman et al., 1999;Sirianni et al., 1999; Sirianni et al., 2000; Wang et al., 2000; патентные заявки WO 99/63998 и WO 0033654). Напротив, предполагаемые нами эффекты никогда не были описаны или изучены до того. Раскрытие изобретения Объектом настоящего изобретения является применение ингибиторов протеазы вируса ВИЧ (ИПВИЧ) для блокирования миграции и/или инвазии нормальных и неопластических клеток воспаления или иммунной системы, инфильтрации тканей и/или возникновения отека посредством ингибирования или модуляции таких молекул и протеолитических ферментов (но не исключительно), как ММП, при лечении всех заболеваний, патогенез которых связан с такими процессами, включая раковые опухоли, нераковые ангиопролиферативные заболевания, воспалительные или аутоиммунные заболевания. Следующим объектом изобретения является способ блокирования миграции и/или инвазии нормальных и неопластических клеток воспаления или иммунной системы, инфильтрации тканей и/или возникновения отека посредством ингибирования или модуляции таких молекул и протеолитических ферментов (но не исключительно), как ММП, что достигается применением ингибиторов протеазы вируса ВИЧ (ИПВИЧ). Следующим объектом настоящего изобретения является применение ингибиторов протеазы вируса ВИЧ (ИПВИЧ) для получения лекарственных препаратов, обладающих способностью к блокированию миграции и/или инвазии клеток и инфильтрации тканей посредством ингибирования таких молекул и протеолитических ферментов (но не исключительно), как ММП, чтобы оказывать антиангиогенное действие при лечении раковых опухолей и нераковых ангиопролиферативных заболеваний у лиц, инфицированных или не инфицированных вирусом ВИЧ. Следующим объектом изобретения является применение ингибиторов протеазы вируса ВИЧ (ИПВИЧ) для блокирования инвазии раковых клеток у лиц, инфицированных или не инфицированных вирусом ВИЧ. Следующим объектом изобретения является применение ингибиторов протеазы вируса ВИЧ (ИПВИЧ) для получения лекарственных препаратов, обладающих противоотечной активностью и способных блокировать инфильтрацию тканей клетками воспаления и иммунной системы при лечении воспалительных и аутоиммунных заболеваний у лиц, инфицированных или не инфицированных вирусом ВИЧ. Следующим объектом изобретения является применение ингибиторов протеазы вируса ВИЧ (ИПВИЧ) для получения лекарственных препаратов для лечения саркомы Капоши у лиц, инфицированных или не инфицированных вирусом ВИЧ. Следующим объектом изобретения является применение ингибиторов протеазы вируса ВИЧ (ИПВИЧ) для получения лекарственных препаратов, обладающих способностью к блокированию миграции и/или инвазии клеток и инфильтрации тканей посредством ингибирования таких молекул и протеолитических ферментов (но не исключительно), как ММП, чтобы оказывать антиангиогенное, противоопухолевое, противоотечное и/или противовоспалительное действие при лечении саркомы Капоши, раковых опухолей и нераковых ангиопролиферативных, воспалительных и аутоиммунных заболеваний у лиц,инфицированных вирусом ВИЧ. Следующим объектом изобретения является применение в вышеуказанных целях соединений, известных как Crixivan (индинавир) фирмы Merck, Sharp and Dohme; Invirase или Fortovase (саквинавир) фирмы Roche; Novir (ритонавир) фирмы Abbott Laboratories; Viracept (нельфинавир) фирмыRoche; Agenerase (ампренавир) фирмы Glaxo Wellcome; Kaletra (лопинавир и ритонавир) фирмы Abbott Laboratories. Следующим объектом изобретения является применение ингибиторов протеазы вируса ВИЧ (ИПВИЧ) и вышеперечисленных соединений при вышеуказанных показаниях в комбинации друг с другом и/или вместе с противовоспалительными, антиангиогенными или противораковыми препаратами. Следующим объектом изобретения является применение химических аналогов или производных ингибиторов протеазы ВИЧ (ИПВИЧ), перечисленных выше, обладающих способностью к блокированию инвазии нормальных и неопластических клеток воспаления или иммунной системы и инфильтрации тканей вследствие ингибирования таких молекул и протеолитических ферментов (но не исключительно),как ММП, и поэтому обладающих антиангиогенной, противоопухолевой, противоотечной и противовоспалительной активностью, поодиночке или в комбинации друг с другом и/или вместе с противовоспалительными, антиангиогенными или противоопухолевыми препаратами. Другие объекты изобретения станут понятными из следующего подробного описания изобретения. Краткое описание чертежей Фиг. 1 (панели А и В). Индинавир и саквинавир не оказывают влияния на базальную или bFGFиндуцированную пролиферацию первичных макрососудистых (пупковая вена) эндотелиальных клеток. Панель А: влияние индинавира на базальную или bFGF-индуцированную пролиферацию клеток. Панель В: влияние саквинавира на базальную или bFGF-индуцированную пролиферацию клеток. Фиг. 2 (панели А и В). Индинавир и саквинавир ингибируют миграцию макрососудистых (пупковая вена) эндотелиальных клеток в ответ на bFGF. Панель А: влияние индинавира на миграцию клеток. Панель В: влияние саквинавира на миграцию клеток.-3 006678 Фиг. 3 (панели А и В). Индинавир и саквинавир ингибируют инвазию макрососудистых (пупковая вена) эндотелиальных клеток в ответ на bFGF. Панель А: влияние индинавира на инвазию клеток. Панель В: влияние саквинавира на инвазию клеток. Фиг. 4. Индинавир и саквинавир не влияют на пролиферацию микрососудистых (дермальных) эндотелиальных клеток в ответ на bFGF. Фиг. 5. Индинавир и саквинавир ингибируют инвазию микрососудистых (дермальных) эндотелиальных клеток в ответ на bFGF. Фиг. 6. Индинавир и саквинавир не влияют на пролиферацию гладкомышечных клеток в ответ наbFGF. Фиг. 7. Индинавир и саквинавир ингибируют инвазию гладкомышечных клеток в ответ на bFGF. Фиг. 8 (панели А, В и С). Индинавир блокирует активацию ММП-2. Панель А: желатинолитическая активность, соответствующая латентной ММП-2 (72 кД), преактивной ММП-2 (64 кД) или активной ММП-2 (62 кД), в супернатантах из эндотелиальных клеток, обработанных или не обработанных bFGF в присутствии или в отсутствие индинавира. Панель В: денситометрическое определение латентной ММП 2. Панель С: денситометрическое определение преактивной и активной форм ММП-2. Фиг. 9 (панели А, В и С). Саквинавир блокирует активацию ММП-2. Панель А: желатинолитическая активность, соответствующая латентной ММП-2 (72 кД), преактивной ММП-2 (64 кД) или активной ММП-2 (62 кД), в супернатантах из эндотелиальных клеток, обработанных или не обработанных bFGF в присутствии или в отсутствие саквинавира. Панель В: денситометрическое определение латентной ММП-2. Панель С: денситометрическое определение преактивной и активной форм ММП-2. Фиг. 10. Индинавир и саквинавир блокируют аутопротеолитическое превращение пре-ММП 2 в активную форму. Фиг. 11 (панели А и В). Саквинавир блокирует продукцию казеин-специфичных ММП в эндотелиальных клетках. Панель А: зимография казеина в супернатантах из эндотелиальных клеток, обработанных bFGF или ТРА в присутствии или в отсутствие саквинавира в течение 8 ч. Панель В: зимография казеина в супернатантах из эндотелиальных клеток, обработанных bFGF или ТРА в присутствии или в отсутствие саквинавира в течение 8 ч. Фиг. 12 [(1) (панели a-d) и (2) (панели a-h)]. Индинавир и саквинавир ингибируют индуцированноеbFGF образование ангиопролиферативных очагов у мышей nude. А) панель а: места инъекций у репрезентативных мышей, получавших физраствор и инокулированных только матригелем; панель b: места инъекций у репрезентативных мышей, получавших физраствор и инокулированных bFGF в матригеле; панель с: места инъекций у репрезентативных мышей, получавших индинавир и инокулированных bFGF в матригеле; панель d: места инъекций у репрезентативных мышей, получавших саквинавир и инокулированных bFGF в матригеле. В) панели а и b: микроскопия мест инъекций у репрезентативных мышей,получавших физраствор и инокулированных только матригелем (панель а: увеличение х 100, панель b: увеличение х 100); панели c и d: микроскопия мест инъекций у репрезентативных мышей, получавших физраствор и инокулированных bFGF в матригеле (панель с: увеличение x100, панель d: увеличениеx100); панели е и f: микроскопия мест инъекций у репрезентативных мышей, получавших индинавир и инокулированных bFGF в матригеле (панель е: увеличение x100, панель f: увеличение x100); панели g иh: микроскопия мест инъекций у репрезентативных мышей, получавших саквинавир и инокулированныхbFGF в матригеле (панель g: увеличение x100, панель h: увеличение x100). Фиг. 13 (панели А и В). Индинавир и саквинавир ингибируют способность к инвазии у клеток KS. Панель А: влияние индинавира на инвазию клеток. Панель В: влияние саквинавира на инвазию клеток. Фиг. 14. Индинавир и саквинавир не влияют на пролиферацию гибридных клеток эндотелия/легочной карциномы (Ea-hy 926). Фиг. 15. Индинавир и саквинавир ингибируют способность к инвазии у гибридных клеток эндотелия/ легочной карциномы (Ea-hy 926). Фиг. 16. Индинавир и саквинавир не влияют на пролиферацию клеток гепатокарциномы (SK-Hep-1). Фиг. 17. Индинавир и саквинавир ингибируют способность к инвазии у клеток гепатокарциномы(SK-Hep-1). Фиг. 18. Индинавир и саквинавир не влияют на пролиферацию клеток легочной карциномы (А 549). Фиг. 19. Индинавир и саквинавир ингибируют способность к инвазии у клеток легочной карциномы(А 549). Фиг. 20. Индинавир и саквинавир не влияют на пролиферацию клеток карциномы молочной железы(MDA-MB-468). Фиг. 21. Индинавир и саквинавир ингибируют способность к инвазии у клеток карциномы молочной железы (MDA-MB-468). Фиг. 22. Индинавир и саквинавир ингибируют способность к инвазии у клеток миеломоноцитарной лейкемии (U937). Фиг. 23 (панели а, b, с, d, e и f). Индинавир и саквинавир ингибируют образование KS-подобных очагов, вызванное инокуляцией клеток KS у мышей nude. Панели а и b: микроскопия места инъекции клеток KS у репрезентативной мыши, получавшей физраствор (панель а: увеличение х 100, панель b: уве-4 006678 личение x400). Панели c и d: микроскопия места инъекции клеток KS у репрезентативной мыши, получавшей индинавир (панель с: увеличение х 250, панель d: увеличение x400). Панели е и f: микроскопия места инъекции клеток KS у репрезентативной мыши, получавшей саквинавир (панель е: увеличение х 250, панель f: увеличение х 400). Фиг. 24. Индинавир и саквинавир способствуют регрессии KS-подобных очагов, вызванных инокуляцией клеток KS у мышей nude. Фиг. 25. Индинавир и саквинавир способствуют регрессии опухолевых ангиогенных очагов, вызванных инокуляцией гибридных клеток эндотелия/легочной карциномы (Ea-hy 926) у мышей nude. Фиг. 26. Индинавир и саквинавир ингибируют образование опухолевых очагов, вызванное инокуляцией клеток гепатокарциномы (SK-Hep-1) у мышей nude. Фиг. 27. Индинавир и саквинавир ингибируют образование KS-подобных очагов, вызванное инокуляцией клеток легочной карциномы (А 549) у мышей nude. Фиг. 28. Индинавир и саквинавир ингибируют образование опухолевых очагов, вызванное инокуляцией клеток карциномы молочной железы (MDA-MB-468) у мышей nude. Фиг. 29. Индинавир и саквинавир ингибируют образование опухолевых очагов, вызванное инокуляцией клеток миеломоноцитарной лейкемии (U937) у мышей nude. Фиг. 30. Индинавир и саквинавир ингибируют образование опухолевых очагов, вызванное инокуляцией клеток Т-клеточной лейкемии (Jurkat) у мышей nude. Фиг. 31. Индинавир и саквинавир блокируют сосудистую проницаемость и отеки, вызванные инокуляцией клеток KS у мышей nude. Фиг. 32 (панели А и В). Индинавир и саквинавир блокируют продукцию воспалительных цитокинов типа IL-6 клетками KS. Панель А: влияние индинавира на продукцию цитокинов. Панель В: влияние саквинавира на продукцию цитокинов. Осуществление изобретения Перед описанием основной части изобретения приводим следующие определения. Инвазия клеток - процесс, посредством которого клетки мигрируют в ткань или базальную мембрану вследствие разрушения внеклеточного матрикса или базальной мембраны протеолитическими ферментами. Инфильтрация ткани - локализация клеток в ткани после их миграции из отдаленных мест вследствие инвазии клеток. Отек - утечка жидкости из кровеносных или лимфатических сосудов вследствие активности инфильтрирующих или резидентных клеток, выделяющих факторы, изменяющие проницаемость капиллярного эндотелия и структуру базальной мембраны под действием протеаз, в том числе матричных металлопротеаз. Внеклеточный матрикс - материал, вырабатываемый клетками и заполняющий межклеточное пространство, который имеется в непостоянном количестве во всех тканях. Базальная мембрана - белковая структура, вырабатываемая клетками, находящимися под нормальным эндотелием или эпителием, и отделяющая их от подлежащей ткани. Матричные металлопротеазы - эндопептидазы, способные расщепить практически любой компонент внеклеточного матрикса, которые подразделяются на коллагеназы, желатиназы, стромелизины и матрилизины. Недавно было описано уменьшение встречаемости или регрессия KS у пациентов, инфицированных ВИЧ-1 и подвергавшихся лечению высокоактивными антиретровирусными препаратами (HAART), содержащими по меньшей мере один ИПВИЧ, такой как индинавир или саквинавир (Lebbe et al., 1998;Cattelan et al., 1999; International Collaboration on HIV and Cancer, 2000). Эти эффекты приписывали блокированию репликации вируса ВИЧ, блокированию репликации вируса HHV8 и/или восстановлению эффективных иммунных реакций против HHV-8 и ВИЧ (Blum et al., 1997; Rizzieri et al, 1997; Lebbe et al.,1998; De Milito et al., 1999; Cattelan et al., 1999; Osman et al., 1999; Sirianni et al., 1999; Sirianni et al, 2000;Wang et al., 2000). С другой стороны, наши прошлые и недавние исследования свидетельствуют, что цитокины, факторы роста и ангиогенные факторы (особенно bFGF), вырабатываемые клетками KS, эндотелиальными клетками и клетками иммунной системы, опосредуют образование очагов KS, а инвазия эндотелиальных клеток и клеток KS, инфильтрация тканей этими клетками, клетками воспаления и клетками иммунной системы, возникновение отека и активация или увеличение продукции ММП являются ключом к возникновению и росту очагов KS (Ensoli et al., 1989; Ensoli et al., 1994a; Fiorelli et al., 1995;Samaniego et al., 1995; Samaniego et al., 1997; Ensoli and Strzl, 1998; Fiorelli et al., 1998; Samaniego et al.,1998; Barillari et al., 1999a; Barillari et al., 1999b; Fiorelli et al., 1999). Так, вопреки устоявшимся взглядам в научном сообществе, мы высказали гипотезу, что регрессия KS у лиц со СПИДом-KS, подвергавшихся лечению ИПВИЧ, обусловлена прямым действием ИПВИЧ на инвазию клеток, инфильтрацию тканей и отек вследствие эффектов на молекулы и ферменты, участвующие в этих процессах и отличные от протеасом. Используя модели in vitro, мы показали, что индинавир и саквинавир в тех же концентрациях,что и в плазме подвергавшихся лечению пациентов, блокируют миграцию и инвазию первичных макрососудистых или микрососудистых эндотелиальных клеток и лимфоидных клеток или клеток твердых-5 006678 опухолей, не оказывая влияния на рост этих клеток. Далее, мы показали, что эти ИПВИЧи ингибируют активацию фермента, называемого ММП-2, или увеличение продукции разрушающих казеин ММП. Ферменты класса металлопротеаз (ММП) необходимы для подвижности клеток (миграции и инвазии) или сосудистой проницаемости, а тем самым и для ангиогенеза, отечности и роста и инвазии опухолей(Carmeliet and Jain, 2000). В соответствии с этими данными мы показали, что индинавир и саквинавир блокируют возникновение KS-подобных ангиопролиферативных очагов, вызываемое инокуляцией bFGF,bFGF в комбинации с VEGF или первичных клеток KS человека, у мышей nude, и ангиогенез, индуцированный bFGF или VEGF в оболочке хориоаллантоиса (ОХА) кур. Далее, мы показали, что индинавир и саквинавир блокируют рост опухолей, индуцированных у мышей nude инокулированием лимфоидных клеток и клеток твердых опухолей человека. Наконец, мы показали, что ИПВИЧи блокируют сосудистую проницаемость и отек, вызванные клетками KS у мышей nude. Кроме того, они ингибируют продукцию цитокинов клетками KS. Эти цитокины не только вызывают очаги KS, но и обладают воспалительным действием (Ensoli et al., 1989; Barillari et al., 1992; Samaniego et al., 1995; Fiorelli et al., 1995;Barillari et al., 1999a), a некоторые из них также вызывают полицентрическую болезнь Кастлмана (MCD) и лимфомы (Tosato et al., 1993; Peterson and Frizzera, 1993; Ramsay et al., 1994; Asou et al., 1998). Таким образом, эти данные свидетельствуют, что эффект ИПВИЧ на KS и на лимфомы обусловлен прямым блокированием ММП, миграции и инвазии эндотелиальных и опухолевых клеток, что оказывает ингибирующее действие на ангиогенез и отеки и лежит в основе ингибирования образования пораженных участков и уменьшения встречаемости опухолей, наблюдавшихся на мышиной модели и/или у лиц,подвергавшихся лечению ИПВИЧ. Однако эти эффекты не обусловлены ингибированием пролиферации нормальных или неопластических клеток. Следует подчеркнуть, что эти терапевтические эффекты были получены в отсутствие ВИЧ и HHV8, тем самым исключая, что эти эффекты ИПВИЧ могли быть опосредованы такими эффектами ИПВИЧ на ВИЧ и/или HHV8. Таким образом, наши исследования показывают, что ИПВИЧ может применяться для модуляции соответствующих биологических процессов или для лечения патологических состояний с участием миграции клеток и инвазии, инфильтрации тканей и активности ММП. В частности, открытие того, что ингибиторы протеазы ВИЧ являются мощными блокаторами инвазии клеток и инфильтрации тканей, и того, что они блокируют активность клеточных металлопротеаз, участвующих в этих процессах, открывает совершенно новую область для модуляции и лечения всех биологических процессов и патологических состояний, связанных с вышеуказанными клеточными реакциями и функциями, включая ангиогенез, нераковые ангиопролиферативные патологии, KS, опухоли, воспалительные и аутоиммунные заболевания как у ВИЧ-инфицированных, так и у неинфицированных лиц. Таким образом, все соединения, проявляющие активность ингибиторов протеазы вируса ВИЧ (которые для краткости обозначаются как ИПВИЧ), и близкие им или происходящие из них, попадают в область действия настоящего изобретения. В этом отношении, как примеры таких соединений в настоящем изобретении указаны индинавир, саквинавир, ритонавир, нельфинавир, ампренавир и лопинавир. Соединения ИПВИЧ могут применяться следующим образом у ВИЧ-инфицированных и неинфицированных лиц:- для блокирования миграции эндотелиальных клеток с терапевтическим антиангиогенным, антиKS и противоопухолевым эффектом;- для блокирования миграции опухолевых клеток с терапевтическим анти-KS и противоопухолевым эффектом;- для блокирования инвазии эндотелиальных клеток с терапевтическим антиангиогенным, анти-KS и противоопухолевым эффектом;- для блокирования инвазии опухолевых клеток с терапевтическим анти-KS и противоопухолевым эффектом;- для блокирования миграции клеток воспаления с терапевтическим противовоспалительным, антиаутоиммунным, антиангиогенным, анти-KS и противоопухолевым эффектом;- для блокирования инфильтрации тканей клетками воспаления с терапевтическим противовоспалительным, антиаутоиммунным, антиангиогенным, анти-KS и противоопухолевым эффектом;- для блокирования инфильтрации тканей клетками иммунной системы с терапевтическим противовоспалительным и антиаутоиммунным эффектом;- для блокирования ММП, включая ММП-2, стромелизины, матрилизины и другие протеазы или молекулы, участвующие в миграции и инвазии клеток; блокирования ферментов, активирующих ММП и другие протеазы или молекулы, участвующие в миграции и инвазии клеток; блокирования тромбоспондина и других молекул, участвующих в миграции и инвазии клеток;- для блокирования ММП, включая ММП-2, стромелизины, матрилизины и другие протеазы или молекулы, участвующие в ангиогенезе (Carmeliet, Nature 2000);- для блокирования тромбоспондина и других молекул, участвующих в ангиогенезе;- для блокирования ММП, включая ММП-2, стромелизины, матрилизины и другие протеазы или молекулы, участвующие в миграции клеток воспаления и клеток иммунной системы и инфильтрации тканей;- для блокирования ММП, включая ММП-2 и другие протеазы или молекулы, участвующие в росте и метастазировании опухолей;- для блокирования активности bFGF с терапевтическим антиангиогенным, противоопухолевым,анти-KS эффектом;- для блокирования активности VEGF с терапевтическим антиангиогенным, противоопухолевым,анти-KS, противоотечным эффектом;- для блокирования активности комбинации bFGF и VEGF с терапевтическим антиангиогенным,противоопухолевым, анти-KS, противоотечным эффектом;- для блокирования активности Tat, одного или в присутствии bFGF, с терапевтическим антиангиогенным, противоопухолевым, анти-KS, противоотечным эффектом;- для блокирования сосудистой проницаемости и отеков, связанных с ангиогенезом;- для блокирования сосудистой проницаемости и отеков, связанных с опухолями;- для блокирования сосудистой проницаемости и отеков, связанных с KS;- для блокирования сосудистой проницаемости и отеков, связанных с воспалением;- для блокирования продукции воспалительных цитокинов с терапевтическим противовоспалительным эффектом;- для блокирования продукции цитокинов с терапевтическим противоотечным эффектом;- для блокирования продукции цитокинов с терапевтическим антиангиогенным эффектом;- для блокирования продукции цитокинов с терапевтическим анти-KS эффектом;- для блокирования продукции цитокинов с терапевтическим противоопухолевым эффектом;- для терапии нераковых ангиопролиферативных заболеваний (глаз, почек, сосудистой системы,кожи), например, диабетической ретинопатии, ретролентальной фиброплазии, трахомы, сосудистой глаукомы, псориаза, аллергического и неаллергического воспаления, атеросклероза, келоидов;- для терапии доброкачественных и злокачественных опухолей мягких тканей, хрящей, костей и крови;- для терапии аутоиммунных заболеваний вообще, в частности системной красной волчанки, склеродермы, ревматоидного артрита, псориаза, тиреоидита, язвенного ректоколита и болезни Крона, синдрома Goodpasture, системного васкулита, синдрома Шегрена, первичного билиарного цирроза;- для терапии воспалительных заболеваний, в частности хронических воспалений, связанных с аллергией и с вирусными, бактериальными или паразитными возбудителями заболеваний, включая полицентрическую болезнь Кастлмана. Для вышеуказанных применений показаны вообще все соединения, проявляющие активность ингибирования протеазы вируса ВИЧ, и особенно показаны соединения под названиями индинавир, саквинавир, ритонавир, нельфинавир, ампренавир и лопинавир, а также близкие им или происходящие из них,поодиночке или в комбинации друг с другом и/или в комбинации с другими препаратами. При этом фармацевтические композиции для применения в соответствии с настоящим изобретением могут быть составлены стандартным образом, используя один или несколько физиологически приемлемых носителей, включая наполнители и вспомогательные вещества, облегчающие преобразование активных соединений в препараты, которые могут иметь фармацевтическое применение. Такие фармацевтические композиции могут быть получены уже известным способом, например, при помощи стандартных процессов смешивания, растворения, гранулирования, изготовления драже, растирания в порошок,эмульгирования, инкапсулирования, включения и лиофилизации. Правильная рецептура зависит от выбранного способа применения. Фармацевтические композиции также могут включать подходящие твердые или гелеобразные носители или наполнители. Примеры таких носителей или наполнителей включают карбонат кальция, фосфат кальция, различные сахара, крахмал, производные целлюлозы, желатин и такие полимеры, как полиэтиленгликоль, но не ограничиваются ими. Химические аналоги и/или производные и/или соли известных ИПВИЧ, указанные в настоящем описании, поодиночке или в комбинации друг с другом и/или вместе с другими препаратами, адъювантами, носителями или наполнителями, рассматриваются как попадающие в область действия настоящего изобретения. ИПВИЧ по изобретению можно вводить путем перорального, внутривенного, внутримышечного,подкожного, интрадермального, внутрибрюшинного, интратекального, интраплеврального, внутриматочного, интравагинального, местного интраректального, трансмукозального, внутриочагового или чрескожного введения при всех показаниях, перечисленных выше. Дозы и способы применения зависят от типа заболевания, подлежащего лечению. В частности, предусматриваются дозы, меньшие, равные или большие, чем дозы, обычно применяющиеся при лечении ВИЧ-инфицированных пациентов. Например,-7 006678 эти дозы составляют: для индинавира - примерно 600 мг/день, 1200 мг/день, 2400 мг/день или 4800 мг/день; для саквинавира - примерно 900 мг/день, 1800 мг/день, 3600 мг/день или 7200 мг/день. Приведенные ниже примеры, которые также относятся к прилагаемым фигурам и таблицам, можно использовать для проверки нашей гипотезы. Мы использовали два ИПВИЧа, индинавир и саквинавир,которые связывали с регрессией KS у получавших их пациентов (Lebbe et al., 1998; Cattelan et al., 1999), они близки по структуре, но имеют химические группировки, специально разработанные для оптимизации их действия. Изучали действие этих двух ИПВИЧ на моделях ангиогенеза, вызванного bFGF и/илиSamaniego et al., 1995; Fiorelli et al., 1995; Samaniego et al., 1997; Samaniego et al., 1998; Barillari et al.,1999a; Sgadari et al., 2000), на рост опухолей, индуцированный клеточными линиями лимфоидных клеток или твердых опухолей in vivo, и на клеточные линии лимфоидных клеток или твердых опухолей in vitro. Следующие примеры и фигуры приводятся для иллюстрации изобретения и их не следует рассматривать, как ограничивающие область действия изобретения. Материалы и методы/Подробное описание чертежей Фиг. 1. Индинавир и саквинавир не оказывают влияния на базальную или bFGF-индуцированную пролиферацию первичных макрососудистых (пупковая вена) эндотелиальных клеток. Панель А: влияние индинавира на базальную или bFGF-индуцированную пролиферацию первичных макрососудистых (пупковая вена) эндотелиальных клеток. Панель В: влияние саквинавира на базальную или bFGFиндуцированную пролиферацию первичных макрососудистых (пупковая вена) эндотелиальных клеток. На рисунке представлены результаты по пролиферации, выраженные как число клеток после 5 дней инкубации с bFGF в буфере PBS (черные столбики) или без bFGF (только PBS, белые столбики) в присутствии и в отсутствие 0,1, 1 или 10 мкМ индинавира (IND) или саквинавира (SAQ) либо предназначенного для них буфера (Buffer). Эндотелиальные клетки человека из пупковой вены (HUVEC, BioWhittaker, Verviers, Бельгия) засевали в 3 повторах (1,5x104 клеток/лунку) на планшеты из 12 лунок,предварительно покрытые желатином. На следующий день клетки инкубировали 4 ч в среде без сыворотки и культивировали в среде RPMI 1640 (Life Technologies, Eragny, Франция) с добавлением 10% эмбриональной телячьей сыворотки (FBS) вместе с bFGF в буфере PBS (10 нг/мл) или в одном PBS. Среду,bFGF, буфер PBS, индинавир, саквинавир и буфер для ИПВИЧ заменяли через 3 дня. После 5 дней культивирования проводили подсчет клеток после окрашивания трипановым синим, как описано ранее (Ensoli et al., 1990; Ensoli et al., 1994b). Во всех опытах in vitro индинавир или саквинавир в виде очищенного порошка (Merck, Sharp and Dohme и Roche, соответственно) ресуспендировали в дистиллированной воде. Препараты оказались свободными от эндотоксинов при тестировании с помощью LAL (Associated ofCape Code Inc., Falmouth, MA). Фиг. 2 и 3. Индинавир и саквинавир ингибируют индуцируемую bFGF миграцию и инвазию первичных макрососудистых (пупковая вена) эндотелиальных клеток. На фиг. 2 представлены результаты по миграции. На фиг. 3 представлены результаты по инвазии. Оба определения проводились на эндотелиальных клетках. Результаты выражали как число клеток/лунку, совершивших миграцию (фиг. 2) или инвазию (фиг. 3) в ответ на bFGF в буфере PBS (черные столбики) или в ответ на один PBS (белые столбики) в присутствии 0,1, 1 или 10 мкМ индинавира (IND) или саквинавира (SAQ) либо предназначенного для них буфера (Buffer). Панели А: влияние индинавира на индуцируемую bFGF миграцию (фиг. 2) или инвазию (фиг. 3) первичных макрососудистых (пупковая вена) эндотелиальных клеток. Панели В: влияние саквинавира на индуцируемую bFGF миграцию (фиг. 2) или инвазию (фиг. 3) первичных макрососудистых (пупковая вена) эндотелиальных клеток. Оба определения проводили с помощью камеры Бойдена, разделенной на два отсека поликарбонатными фильтрами с порами размером 12 мкм (Nucleoprobe, Cabin John, MD), покрытыми колагеном IV(Collaborative Biomedical Products) для миграции или коллагеном IV вместе с матригелем для инвазии,как описано ранее (Barillari et al., 1999b). Клетки HUVEC культивировали 5-6 дней в присутствии серийных разведений индинавира или саквинавира либо в предназначенном для них буфере. Клетки собирали,ресуспендировали в среде без сыворотки, содержащей 0,01% BSA, и помещали в верхний отсек камеры Бойдена в двух повторах (2x105 клеток/лунку) в присутствии индинавира или саквинавира либо предназначенного для них буфера. В нижний отсек вносили bFGF (50 нг/лунку) в качестве хемоаттрактанта в среде, содержащей 0,01% BSA. После 5 ч (миграция) или 6 ч (инвазия) инкубации оставшиеся на верхней поверхности фильтров клетки удаляли механическим способом, а совершившие миграцию клетки на нижней поверхности фиксировали в метаноле и окрашивали толуидиновым синим (Sigma Chemical Co.,St. Louis, МО). Подсчитывали число клеток в 5-10 выбранных случайным образом полях зрения микроскопа на фильтре, как описано ранее (Barillari et al., 1999b). Фиг. 4. Индинавир и саквинавир не влияют на пролиферацию микрососудистых (дермальных) эндотелиальных клеток в ответ на bFGF. На рисунке представлены результаты по пролиферации, выраженные как число дермальных микрососудистых эндотелиальных клеток после 5 дней инкубации с bFGF в присутствии 10 мкМ индинавира(IND) или саквинавира (SAQ) либо предназначенного для них буфера (Buffer). Дермальные микрососу-8 006678 дистые эндотелиальные клетки человека (H-DMVEC, Bio-Whittaker) засевали в 3 повторах (2x104 клеток/лунку) в покрытые желатином 12-луночные планшеты и культивировали в среде RPMI 1640 с добавлением 10% FBS при постоянном присутствии bFGF (10 нг/мл), чтобы предупредить апоптоз, происходящий через 24-48 ч после истощения этого фактора. Среду, bFGF, буфер PBS, индинавир, саквинавир(10 мкМ) и буфер для ИПВИЧ заменяли через 3 дня. После 5 дней культивирования проводили подсчет клеток методом исключения красителя трипанового синего, как описано выше. Данные из поставленных в двух повторах опытов выражали как число клеток H-DMVEC, выросших в ответ на bFGF в присутствии индинавира или саквинавира либо буфера для ИПВИЧ. Фиг. 5. Индинавир и саквинавир ингибируют инвазию микрососудистых (дермальных) эндотелиальных клеток в ответ на bFGF. На рисунке представлены результаты по инвазии клеток, полученные на клетках Н-DMVEC. Данные выражали как средний процент и стандартное отклонение (SD) клеток, совершивших инвазию в ответ на bFGF в буфере PBSили на один PBSв присутствии индинавира (IND) или саквинавира(SAQ) либо буфера для ИПВИЧ (Buffer). Фоновую инвазию в отсутствие bFGF принимали за 100%. Представлены данные из поставленных в трех повторах опытов с помощью камеры Бойдена, проводившихся как описано выше для клеток HUVEC. Блокирование инвазии клеток H-DMVEC было статистически достоверным при 10 мМ индинавира и при 1 и 10 мМ саквинавира (р 0,05). Фиг. 6 и 7. Индинавир и саквинавир ингибируют инвазию, но не пролиферацию гладкомышечных клеток в ответ на bFGF. На фиг. 6 представлены результаты по росту клеток, а на фиг. 7 - по инвазии клеток, полученные на гладкомышечных клетках. Определения в основном проводились, как описано в подписях к фиг. 1 и 3. Данные выражали как число или процент клеток, выросших или совершивших инвазию в ответ на bFGF в буфере PBSили на один PBSв присутствии индинавира (IND) или саквинавира (SAQ) либо буфера для ИПВИЧ (Buffer), как указано. Индуцированный bFGF рост клеток в отсутствие ИПВИЧ или фоновую инвазию в отсутствие bFGF принимали за 100%. Представлены данные из поставленных в двух повторах опытов (средние значения). Фиг. 8 и 9. Индинавир и саквинавир блокируют превращение латентной ММП-2 в активную форму. Фигура 8: влияние индинавира на активацию ММП-2. Панель А: зимографическое определение, проведенное на концентрированных супернатантах из клеток HUVEC, стимулированных bFGF в буфере PBS(черные столбики) или в одном только PBS (Buffer, белые столбики) и культивированных в течение 24 ч в присутствии 0,1,1 или 10 мкМ индинавира (IND) либо предназначенного для него буфера. Стрелками отмечено положение зон, лишенных красителя вследствие желатинолитической активности, соответствующей латентной форме (72 кД), преактивной форме (64 кД) или активной форме (62 кД) ММП-2. Панель В: денситометрическое определение лишенных красителя зон, соответствующих желатинолитической активности латентной формы в 72 кД. Панель С: денситометрическое определение лишенных красителя зон, соответствующих желатинолитической активности пре-ММП-2 (64 кД) и активной формы(62 кД) ММП-2, выделяемых клетками. Результаты выражали в виде оптической плотности лишенных красителя зон. Фиг. 9: влияние саквинавира на активацию ММП-2. Панель А: зимографическое определение, проведенное на концентрированных супернатантах из клеток HUVEC, стимулированных bFGF в буфере PBS (черные столбики) или в одном только PBS (Buffer, белые столбики) и культивированных в течение 24 ч в присутствии 0,1, 1 или 10 мкМ саквинавира (SAQ) либо предназначенного для него буфера. Стрелками отмечено положение зон, лишенных красителя вследствие желатинолитической активности, соответствующей латентной форме (72 кД), преактивной форме (64 кД) или активной форме (62 кД) ММП-2. Панель В: денситометрическое определение лишенных красителя зон, соответствующих желатинолитической активности латентной формы в 72 кД. Панель С: денситометрическое определение лишенных красителя зон, соответствующих желатинолитической активности пре-ММП-2 (64 кД) и активной формы (62 кД) ММП-2, выделяемых клетками. Результаты выражали в виде оптической плотности лишенных красителя зон. Клетки HUVEC культивировали в течение 24 ч в среде RPMI 1640 с добавлением 10% FBS в присутствии серийных разведений индинавира или саквинавира либо в предназначенном для них буфере, в отсутствие или в присутствии bFGF (100 нг/мл). Клетки затем промывали дважды средой без сыворотки и инкубировали всю ночь в среде без сыворотки при той же концентрации ИПВИЧ. Затем получали супернатанты клеточных культур и концентрировали с помощью Centricon-10 (Amicon, Bedford, MA). Концентрацию белка определяли по методу Брэдфорда (Bio-Rad, Hercules, CA), используя BSA в качестве стандарта. После этого равные количества (5 мкг) белка растворяли в 5-кратном буфере для зимографии(0,4 М трис-HCl, рН 6,8, 5% SDS, 20% глицерина и 0,03% бромфенолового синего) и наносили на полиакриламидный гель с 9% SDS, содержащий 1 мг/мл желатина. После электрофореза гели инкубировали 1 ч в 2,5% (об/об) Triton Х-100 для удаления SDS, а затем в энзиматическом буфере (50 мМ трис-HCl, рН 7,5,200 мМ NaCl, 5 мМ СаСl2, 0,02% Brij-35) в течение ночи при 37 С, как описано ранее (Kleiner et al.,1993). Затем гели окрашивали 2,5% Кумасси голубым G-250 и отмывали от красителя в 30% метаноле и 10% уксусной кислоте. После этого проводили количественную денситометрию лишенных красителя зонMulti-Analyst (Bio-Rad). Фиг. 10. Индинавир и саквинавир блокируют аутопротеолитическое превращение пре-ММП-2 в активную форму. На рисунке представлено зимографическое определение, проведенное на супернатантах из клеток HUVEC, стимулированных форболовым эфиром (12-О-тетрадеканоилфорбол-13-ацетат) (ТРА)(50 нМ) или в предназначенном для него буфере (Buffer). Стрелками отмечено положение зон, лишенных красителя вследствие желатинолитической активности, соответствующей латентной форме (про-ММП 2,72 кД), преактивной форме (пре-ММП 2, 64 кД) или активной форме (активный ММП 2, 62 кД) ММП-2. Клетки HUVEC культивировали в течение 24 ч в среде RPMI 1640 с добавлением 10% FBS. Перед определением клетки промывали дважды средой без сыворотки и инкубировали в течение ночи в среде без сыворотки, содержащей 0,01% бычьего сывороточного альбумина (BSA) в присутствии 10 мМ индинавира или саквинавира либо предназначенного для них буфера. Затем клетки инкубировали в течение 8 ч в среде, содержащей 0,01% BSA, 10 мМ индинавира или саквинавира, ТРА либо предназначенный для него буфер. После этого порции клеточных супернатантов анализировали на активность ММП-2 при помощи зимографии в геле, как описано выше. В качестве контроля использовали линию раковых клеток НТ 1080, секретирующих большое количество ММП-2. Как видно из рисунка, обработка клеток HUVEC ТРА индуцировала превращение про-ММП 2 в пре-ММП 2 и активную форму ММП-2. Однако в присутствии индинавира или саквинавира относительная интенсивность зоны активной формы ММП-2 уменьшалась по сравнению с пре-ММП 2, что свидетельствует о блокировании аутопротеолитической активации пре-ММП 2 в активную форму как индинавиром, так и саквинавиром. Индинавир также ингибировал общее количество ММП-2, выделяемой клетками в присутствии ТРА. Количество взятого для анализа супернатанта нормализировали по общему числу клеток. Фиг. 11. Саквинавир блокирует продукцию разрушающих казеин ММП эндотелиальными клетками. Клетки HUVEC выращивали и обрабатывали, как описано на фиг. 10, за исключением того, что после инкубации в течение ночи в отсутствие сыворотки клетки культивировали в присутствии ТРА (50 нМ), различных концентраций bFGF (0,1 или 1 мкг/мл) в буфере PBS, в одном PBS (Buffer) в присутствии саквинавира (SAQ) или предназначенного для него буфера (buffer). После этого порции клеточных супернатантов, нормализированные по общему числу клеток, анализировали на активность ММП при помощи зимографии в геле, как описано выше, в гелях, содержащих казеин (2 мг/мл) вместо желатина. Панель А: зимография казеина, проведенная на клеточных супернатантах, полученных после 8 ч культивирования в присутствии ТРА или bFGF. Панель В: зимография казеина, проведенная на клеточных супернатантах, полученных после 24 ч культивирования в присутствии ТРА или bFGF. Казеин специфически расщепляется стромелизинами ММП-3, ММП-10, ММП-11 и матрилизином ММП-7 (Whittaker and Ayscough, 2001). Это ведет к появлению лишенных красителя зон вследствие наличия казеинолитической активности в клеточных супернатантах. Как видно из рисунка, в отсутствие саквинавираbFGF индуцирует дозозависимым образом выделение казеин-разрушающей активности, которая была максимальной у клеток, обработанных ТРА. Однако саквинавир (10 мкМ) ингибировал выделение этой активности, вызванное bFGF или ТРА, о чем свидетельствует уменьшение интенсивности казеинолитических зон. Фиг. 12. Индинавир и саквинавир блокируют индуцированное bFGF образование KS-подобных ангиогенных очагов у мышей nude.(А) панель а: макроскопия мест инъекций у мышей, которым вводили с двух сторон буфер(PBS/0,1% BSA) в матригеле и давали физраствор; панель b: макроскопия мест инъекций у мышей, которым вводили с двух сторон bFGF (1 мкг) в матригеле и давали физраствор; панель с: макроскопия мест инъекций у мышей, которым вводили с двух сторон bFGF (1 мкг) в матригеле и давали индинавир (1,4 мг/день); панель d: макроскопия мест инъекций у мышей, которым вводили с двух сторон bFGF (1 мкг) в матригеле и давали саквинавир (1 мг/день). (В) панель а: микроскопия окрашенного НЕ места инокуляции у репрезентативной мыши, которой вводили буфер и давали физраствор (увеличение x100); панель b: микроскопия окрашенного НЕ места инокуляции у репрезентативной мыши, которой вводили буфер и давали физраствор (увеличение x400); панель с: микроскопия окрашенного НЕ места инокуляции у репрезентативной мыши, которой вводили bFGF и давали физраствор (увеличение x100); панель d: микроскопия окрашенного НЕ места инокуляции у репрезентативной мыши, которой вводили bFGF и давали физраствор (увеличение х 400); панель е: микроскопия окрашенного НЕ места инокуляции у репрезентативной мыши, которой вводили bFGF и давали индинавир (увеличение x100); панель f: микроскопия окрашенного НЕ места инокуляции у репрезентативной мыши, которой вводили bFGF и давали индинавир (увеличение х 400); панель g: микроскопия окрашенного НЕ места инокуляции у репрезентативной мыши, которой вводили bFGF и давали саквинавир (увеличение x100); панель h: микроскопия окрашенного НЕ места инокуляции у репрезентативной мыши, которой вводили bFGF и давали саквинавир (увеличение x400). Эксперименты проводили, как описано в подписи к табл. 1. Фиг. 13. Индинавир и саквинавир ингибируют способность к инвазии у клеток KS. Панель А: влияние индинавира на инвазию двух линий клеток KS (KS3, KS8). Панель В: влияние саквинавира на инвазию двух линий клеток KS (KS8, KS12).- 10006678 На рисунке представлены результаты по инвазии, полученные на трех различных линиях первичных клеток KS (KS3, KS8, KS12), культивировавшихся в течение 5-6 дней в присутствии индинавира или саквинавира либо предназначенного для них буфера (контроль). Оба препарата ингибировали способность клеток KS к инвазии мембраны из матригеля дозозависимым образом. В частности, оба ИПВИЧа ингибировали инвазию по сравнению с тем, что наблюдалось у контрольных клеток KS (р 0,05). Определения проводились, как описано на фиг. 3. Вкратце, клетки KS культивировали в течение 5-6 дней в присутствии индинавира или саквинавира (1 мкМ) либо предназначенного для них буфера (физраствор). Клетки собирали и засевали в двух повторах (5x105 в культуральной среде, содержащей 0,05%BSA) в верхний отсек камеры Бойдена, всегда в присутствии ИПВИЧ или буфера. В нижний отсек вносили bFGF (20 нг/мл) в качестве хемоаттрактанта. Через 6 ч клетки, проникшие в матригелевую мембрану, окрашивали и подсчитывали, как описано в подписи к фиг. 3. Фиг. 14 и 15. Индинавир и саквинавир ингибируют инвазию, но не пролиферацию гибридных клеток эндотелия/ легочной карциномы (Ea-hy 926). На фиг. 14 представлены результаты по росту клеток, полученные на клетках Ea-hy 926, гибрида между клетками H-UVEC и легочной аденокарциномы человека (Edgell et al., 1983), у которого сохраняется большая часть маркеров эндотелиальных клеток и который применяется в качестве модели ангиогенной опухоли (Albini et al., 1995; Albini et al., 1996; Cai et al., 1999). Результаты выражали как число клеток через 5 дней после добавления 1 мкМ индинавира (IND) или саквинавира (SAQ)по сравнению с буфером для ИПВИЧ(Buffer). Определения проводились в основном, как описано в подписи к фиг. 1. Никаких факторов роста не добавляли к клеткам Ea-hy 926, так как они продуцируют факторы, способствующие росту клеток аутокринным путем (Edgell et al., 1983; Albini et al., PNAS 1995; Albini et al.,Nat Med 1996). На фиг. 15 представлены результаты по инвазии, выраженные как число совершивших инвазию клеток/поле в ответ на bFGF в присутствии 1 мкМ индинавира (IND) или саквинавира (SAQ)по сравнению с буфером для ИПВИЧ(Buffer). Определения проводились в основном как описано в подписи к фиг. 3. Приведены средние значения и интервалы отклонений из двух независимых экспериментов, проводившихся по двум повторам. Блокирование инвазии клеток Ea-hy 926 под действием саквинавира было статистически достоверным (р 0,05). Фиг. 16. Индинавир и саквинавир не влияют на пролиферацию клеток гепатокарциномы (SK-Hep1). Представлены результаты репрезентативного опыта по росту клеток, проведенного на клетках гепатокарциномы. Клетки гепатокарциномы человека (SK-Hep-1 из АТСС) засевали в трех повторах (8x104 клеток/лунку) в 12-луночные планшеты. На следующий день, после 6 ч голодания в лишенной сыворотки среде, клетки инкубировали в культуральной среде, содержащей 10% эмбриональной телячьей сыворотки (FBS), в присутствии 10 мкМ индинавира (IND) или саквинавира (SAQ) либо предназначенного для них буфера (PBS). Среду, содержащую индинавир, саквинавир или буфер, заменяли через каждые 2 дня. После 4 дней культивирования проводили подсчет клеток по окрашиванию красителем трипановым синим, как описано ранее (Ensoli et al., 1990; Ensoli et al., 1994b). Во всех опытах in vitro ИПВИЧи в виде свободного от эндотоксинов очищенного порошка (любезно предоставленные Merck, SharpDohme иRoche) ресуспендировали в дистиллированной воде. Определения повторяли как минимум 3 раза. Фиг. 17. Индинавир и саквинавир ингибируют способность к инвазии у клеток гепатокарциномы(SK-Hep-1) в ответ на bFGF. Приведены усредненные показатели совершивших инвазию клеток SK-Hep-1 из двух отдельных экспериментов, выраженные как среднее число совершивших инвазию клеток в ответ на bFGF (черные столбики) или на предназначенный для него буфер (белые столбики) в присутствии 0,1, 1 или 10 мкМ индинавира (IND) или саквинавира (SAQ) либо предназначенного для них буфера (Buffer). Определения инвазии проводились в камере Бойдена. Поликарбонатные фильтры (размер пор 8 мкм, Nucleoprobe,Cabin John, MD) покрывали сначала колагеном IV, а затем матригелем (Collaborative BiomedicalProducts), как описано ранее (Barillari et al., 1999b). Клетки SK-Hep-1 культивировали 5 дней в присутствии серийных разведений индинавира или саквинавира (0,1 мкМ, 1 мкМ, 10 мкМ) либо в предназначенном для них буфере. Засевали по 2x105 клеток в двух повторах в верхний отсек камеры Бойдена в 0,1%BSA, содержащем возрастающие концентрации индинавира или саквинавира либо предназначенный для них буфер. В нижний отсек вносили рекомбинантный bFGF человека (50 нг/мл) в качестве хемоаттрактанта. После 5 ч инкубации оставшиеся на верхней поверхности фильтров клетки удаляли механическим способом, а совершившие инвазию клетки на нижней поверхности фильтров фиксировали в этаноле и окрашивали толуидиновым синим (Sigma Chemical Co., St. Louis, МО). Подсчитывали число клеток в 10 выбранных случайным образом полях зрения светового микроскопа на фильтре, как описано ранее (Barillari et al., 1999b). Фиг. 18. Индинавир и саквинавир не влияют на пролиферацию клеток легочной карциномы (А 549). Представлены результаты репрезентативного опыта по росту клеток, проведенного на клетках легочной карциномы. Клетки легочной карциномы человека (А 549 из АТСС) засевали в трех повторах(8x104 клеток/лунку) в 12-луночные планшеты. На следующий день после 6 ч голодания в лишенной сыворотки среде, клетки инкубировали в культуральной среде, содержащей 10% эмбриональной телячьей- 11006678 сыворотки (FBS), в присутствии 10 мкМ индинавира (IND) или саквинавира (SAQ) либо предназначенного для них буфера (Buffer). Среду, содержащую индинавир, саквинавир или буфер, заменяли через каждые 2 дня. После 4 дней культивирования проводили подсчет клеток по окрашиванию красителем трипановым синим, как описано ранее (Ensoli et al., 1990; Ensoli et al., 1994b). Во всех опытах in vitro ИПВИЧи в виде свободного от эндотоксинов очищенного порошка (любезно предоставленные Merck,SharpDohme и Roche) ресуспендировали в дистиллированной воде. Определения повторяли как минимум 3 раза. Фиг. 19. Индинавир и саквинавир ингибируют способность к инвазии у клеток легочной карциномы(А 549) в ответ на bFGF. Приведены усредненные показатели совершивших инвазию клеток легочной карциномы А 549 из двух отдельных экспериментов, выраженные как среднее число совершивших инвазию клеток в ответ наbFGF (черные столбики) или на предназначенный для него буфер (белые столбики) в присутствии 0,1, 1 или 10 мкМ индинавира (IND) или саквинавира (SAQ) либо предназначенного для них буфера (Buffer). Определения инвазии проводили в камере Бойдена. Поликарбонатные фильтры (размер пор 12 мкм, Nucleoprobe, Cabin John, MD) покрывали сначала колагеном IV, а затем матригелем (Collaborative Biomedical Products), как описано ранее (Barillari et al., 1999b). Клетки А 549 культивировали 5 дней в присутствии серийных разведений индинавира или саквинавира (0,1 мкМ, 1 мкМ, 10 мкМ) либо в предназначенном для них буфере. Засевали по 2x105 клеток в двух повторах в верхний отсек камеры Бойдена в 0,1%BSA, содержащем возрастающие концентрации индинавира или саквинавира либо предназначенный для них буфер. В нижний отсек вносили рекомбинантный bFGF человека (50 нг/мл) в качестве хемоаттрактанта. После 5 ч инкубации оставшиеся на верхней поверхности фильтров клетки удаляли механическим способом, а совершившие инвазию клетки на нижней поверхности фильтров фиксировали в этаноле и окрашивали толуидиновым синим (Sigma Chemical Co., St. Louis, МО). Подсчитывали число клеток в 10 выбранных случайным образом полях зрения светового микроскопа на фильтре, как описано ранее (Barillari et al., 1999b). Фиг. 20. Индинавир и саквинавир не влияют на пролиферацию клеток карциномы молочной железы(MDA-MB-468). Представлены результаты репрезентативного опыта по росту клеток, проведенного на клетках карциномы молочной железы. Клетки карциномы молочной железы человека (MDA-MB-468 из АТСС) засевали в трех повторах (8x104 клеток/лунку) в 12-луночные планшеты. На следующий день, после 6 ч голодания в лишенной сыворотки среде, клетки инкубировали в культуральной среде, содержащей 10% эмбриональной телячьей сыворотки (FBS), в присутствии 10 мкМ индинавира (IND) или саквинавира(SAQ) либо предназначенного для них буфера (Buffer). Среду, содержащую индинавир, саквинавир или буфер, заменяли через каждые 2 дня. После 4 дней культивирования проводили подсчет клеток по окрашиванию красителем трипановым синим, как описано ранее (Ensoli et al., 1990; Ensoli et al., 1994b). Во всех опытах in vitro ИПВИЧи в виде свободного от эндотоксинов очищенного порошка (любезно предоставленные Merck, SharpDohme и Roche) ресуспендировали в дистиллированной воде. Определения повторяли как минимум 3 раза. Фиг. 21. Индинавир и саквинавир ингибируют способность к инвазии у клеток карциномы молочной железы (MDA-MB-468) в ответ на bFGF. Представлены результаты репрезентативного опыта по инвазии, проведенного на клетках карциномы молочной железы MDA-MB-468. Данные выражали как среднее число совершивших инвазию клеток в ответ на bFGF (черные столбики) или на предназначенный для него буфер (белые столбики) в присутствии 0,1, 1 или 10 мкМ индинавира (IND) или саквинавира (SAQ) либо предназначенного для них буфера (Buffer). Определения инвазии проводили в камере Бойдена. Поликарбонатные фильтры (размер пор 8 мкм, Nucleoprobe, Cabin John, MD) покрывали сначала колагеном IV, а затем матригелем (CollaborativeBiomedical Products), как описано ранее (Barillari et al., 1999b). Клетки карциномы молочной железы(MDA-MB-468) культивировали 5 дней в присутствии серийных разведений индинавира или саквинавира (0,1 мкМ, 1 мкМ, 10 мкМ) либо в предназначенном для них буфере. Засевали по 2x105 клеток в двух повторах в верхний отсек камеры Бойдена в 0,1% BSA, содержащем возрастающие концентрации индинавира или саквинавира либо предназначенный для них буфер. В нижний отсек вносили рекомбинантный bFGF человека (50 нг/мл) в качестве хемоаттрактанта. После 5 ч инкубации оставшиеся на верхней поверхности фильтров клетки удаляли механическим способом, а совершившие инвазию клетки на нижней поверхности фильтров фиксировали в этаноле и окрашивали холуидиновым синим (Sigma ChemicalCo., St. Louis, МО). Подсчитывали число клеток в 10 выбранных случайным образом полях зрения светового микроскопа на фильтре, как описано ранее (Barillari et al., 1999b). Определения повторяли по два раза. Фиг. 22. Индинавир и саквинавир ингибируют способность к инвазии у клеток миеломоноцитарной лейкемии (U937) в ответ на bFGF. Представлены результаты репрезентативного опыта по инвазии, проведенного на клетках миеломоноцитарной лейкемии U937. Данные выражали как среднее число совершивших инвазию клеток в ответ на bFGF (черные столбики) или на предназначенный для него буфер (белые столбики) в присутствии 1- 12006678 или 10 мкМ саквинавира либо предназначенного для них буфера (Buffer). Близкие результаты были получены также при обработке клеток 1 или 10 мкМ индинавиром (данные не приводятся). Определения инвазии проводили в камере Бойдена. Поликарбонатные фильтры (размер пор 5 мкм, Nucleoprobe, CabinJohn, MD) покрывали сначала колагеном IV, а затем матригелем (Collaborative Biomedical Products), как описано ранее (Barillari et al., 1999b). Клетки миеломоноцитарной лейкемии U937 культивировали 4 дня в присутствии серийных разведений индинавира или саквинавира (1 мкМ, 10 мкМ) либо в предназначенном для них буфере. Засевали по 8x105 клеток в двух повторах в верхний отсек камеры Бойдена в 0,1%BSA, содержащем возрастающие концентрации индинавира или саквинавира либо предназначенный для них буфер. В нижний отсек вносили рекомбинантный bFGF человека (50 нг/мл) в качестве хемоаттрактанта. После 4 ч инкубации оставшиеся на верхней поверхности фильтров клетки удаляли механическим способом, а совершившие инвазию клетки на нижней поверхности фильтров фиксировали в этаноле и окрашивали толуидиновым синим (Sigma Chemical Co., St. Louis, MO). Подсчитывали число клеток в 10 выбранных случайным образом полях зрения светового микроскопа на фильтре, как описано ранее (Barillari et al., 1999b). Определения повторяли по два раза. Фиг. 23. Индинавир и саквинавир ингибируют образование KS-подобных очагов, вызванное инокуляцией клеток KS у мышей nude. Мышам nude инокулировали клетки KS (3x106), чтобы вызвать образование ангиопролиферативныхKS-подобных очагов, или предназначенный для них буфер (контроль), и вводили индинавир, саквинавир или физраствор в соответствии с дозами и процедурами, описанными в подписи к фиг. 12, начиная за 2 дня до инокуляции клеток. Во время забоя обследовали места инокуляции на присутствие макроскопических ангиопролиферативных очагов, как описано в подписях к фиг. 12 и табл. 5. Панель а: микроскопия центральной зоны окрашенного НЕ места инокуляции клеток KS у репрезентативной мыши, получавшей физраствор (увеличение х 100); панель b: микроскопия центральной зоны окрашенного НЕ места инокуляции клеток KS у репрезентативной мыши, получавшей физраствор(увеличение х 400); панель с: микроскопия центральной зоны окрашенного НЕ места инокуляции клеток KS у репрезентативной мыши, получавшей индинавир (увеличение х 250); панель d: микроскопия центральной зоны окрашенного НЕ места инокуляции клеток KS у репрезентативной мыши, получавшей индинавир (увеличение х 400); панель е: микроскопия центральной зоны окрашенного НЕ места инокуляции клеток KS у репрезентативной мыши, получавшей саквинавир (увеличение x250); панель f: микроскопия центральной зоны окрашенного НЕ места инокуляции клеток KS у репрезентативной мыши, получавшей саквинавир (увеличение х 400). Эксперименты проводились, как описано в подписи к табл. 5. Фиг. 24. Индинавир и саквинавир способствуют регрессии KS-подобных очагов, вызванных инокуляцией клеток KS у мышей nude. Индинавир и саквинавир могут способствовать регрессии KS и без предварительного введения лекарственных препаратов. Мышам nude инокулировали клетки KS (клетки линии KS12, 3x106), чтобы вызвать образование ангиопролиферативных KS-подобных очагов, или предназначенный для них буфер(контроль), и в тот же день начинали вводить индинавир, саквинавир или физраствор через желудочный зонд в соответствии с дозами, описанными в подписи к табл. 5. Введение продолжали 5 дней до самого забоя. Приведен средний размер пораженных участков (см 2) в месте инъекции, который определяли ежедневно с помощью штангенциркуля и рассчитывали как произведение двух основных диаметров очага. Фиг. 25. Индинавир и саквинавир способствуют регрессии опухолевых ангиогенных очагов, вызванных инокуляцией гибридных клеток эндотелия/ легочной карциномы (Ea-hy 926) у мышей nude. Чтобы убедиться, что индинавир и саквинавир способствуют регресии не только KS, но и других опухолей без предварительного введения лекарственных препаратов, в опытах in vivo использовали клетки Ea-hy 926, гибрида между клетками H-UVEC и легочной аденокарциномы человека (Edgell et al.,1983), у которого сохраняется большая часть маркеров эндотелиальных клеток и который применяется в качестве модели ангиогенной опухоли (Albini et al., 1995; Albini et al., 1996; Cai et al., 1999). Мьппам инокулировали подкожно в нижнюю часть спины клетки Ea-hy 926 (3x106 клеток/ животное в 0,2 мл RPMI 1640 с 10% FBS) или предназначенную для них среду, которые смешивали с 0,2 мл лишенного факторов роста матригеля (BD Biosciences, Bedford, MA) перед инокуляцией, как описано выше. В тот же день животным начинали вводить индинавир, саквинавир или физраствор через желудочный зонд в соответствии с дозами, описанными в подписи к фиг. 24. Введение продолжали 5 дней до самого забоя. Ежедневно определяли размер очагов поражения в месте инъекции с помощью штангенциркуля. Затем рассчитывали площадь поверхности очагов как произведение двух основных диаметров очага. Приведен средний размер (см 2) очагов в месте инъекции. Фиг. 26. Индинавир и саквинавир ингибируют образование опухолевых очагов, вызванное инокуляцией клеток гепатокарциномы (SK-Hep-1) у мышей nude. Индинавир и саквинавир также эффективно блокируют рост опухолей, вызванных клетками гепатокарциномы in vivo. Опухоли индуцировали путем инокуляции мышам nude (10 животных/группу) клеток гепатокарциномы (линия клеток SK-Hep-1, полученная из АТСС, по 5x106 клеток) и животные ежедневно получали индинавир, саквинавир или физраствор, как изложено в подписи к фиг. 23. За 24 ч до- 13006678 инъекции клеток мыши получали сублетальную дозу облучения (400 G) для того, чтобы повысить прививаемость опухолей. Введение ИПВИЧ или физраствора продолжали до самого забоя. Ежедневно определяли размер очагов поражения в месте инъекции с помощью штангенциркуля. Затем рассчитывали площадь поверхности очагов как произведение двух основных диаметров очага. Приведен средний размер (см 2) очагов в месте инъекции. Фиг. 27. Индинавир и саквинавир ингибируют образование KS-подобных очагов, вызванное инокуляцией клеток легочной карциномы (А 549) у мышей nude. Индинавир и саквинавир также эффективно блокируют рост опухолей, вызванных клетками легочной карциномы in vivo. Опухоли индуцировали путем инокуляции облученным мышам nude (10 животных на группу) клеток легочной карциномы (линия клеток А 549, полученная из АТСС, по 5 х 106 клеток) и животные ежедневно получали индинавир, саквинавир или физраствор, как изложено в подписи к фиг. 23. Введение ИПВИЧ или физраствора продолжали до самого забоя. Ежедневно определяли размер очагов поражения в месте инъекции с помощью штангенциркуля. Затем рассчитывали площадь поверхности очагов как произведение двух основных диаметров очага. Приведен средний размер (см 2) очагов в месте инъекции. Фиг. 28. Индинавир и саквинавир ингибируют образование опухолевых очагов, вызванное инокуляцией клеток карциномы молочной железы (MDA-MB-468) у мышей nude. Индинавир и саквинавир также эффективно блокируют рост опухолей, вызванных клетками карциномы молочной железы in vivo. Опухоли индуцировали путем инокуляции облученным мышам nude (10 животных на группу) клеток карциномы молочной железы (линия клеток MDA-MB-468, полученная из АТСС, по 5 х 106 клеток) и животные ежедневно получали индинавир, саквинавир или физраствор, как изложено в подписи к фиг. 23. Введение ИПВИЧ или физраствора продолжали до самого забоя. Ежедневно определяли размер очагов поражения в месте инъекции с помощью штангенциркуля. Затем рассчитывали площадь поверхности очагов как произведение двух основных диаметров очага. Приведен средний размер (см ) очагов в месте инъекции. Фиг. 29. Индинавир и саквинавир ингибируют образование опухолевых очагов, вызванное инокуляцией клеток миеломоноцитарной лейкемии (U937) у мышей nude. Индинавир и саквинавир также эффективно блокируют рост опухолей, вызванных клетками карциномы миеломоноцитарной лейкемии in vivo. Опухоли индуцировали путем инокуляции облученным мышам nude (10 животных/группу) клеток миеломоноцитарной лейкемии (линия клеток U937, полученная из АТСС, по 5x106 клеток в 0,2 мл культуральной среды) и животные ежедневно получали индинавир, саквинавир или физраствор, как изложено в подписи к фиг. 23. Введение ИПВИЧ или физраствора продолжали до самого забоя. Ежедневно определяли размер очагов поражения в месте инъекции с помощью штангенциркуля. Затем рассчитывали площадь поверхности очагов как произведение двух основных диаметров очага. Приведен средний размер (см 2) очагов в месте инъекции. Фиг. 30. Индинавир и саквинавир ингибируют образование опухолевых очагов, вызванное инокуляцией клеток Т-клеточной лейкемии (Jurkat) у мышей nude. Индинавир и саквинавир также эффективно блокируют рост опухолей, вызванных клетками карциномы Т-клеточной лейкемии in vivo. Опухоли индуцировали путем инокуляции облученным мышамnude (10 животных на группу) клеток лейкемии (линия клеток Jurkat, полученная из АТСС, по 20x106 клеток) и животные ежедневно получали индинавир, саквинавир или физраствор, как изложено в подписи к фиг. 23. Введение ИПВИЧ или физраствора продолжали до самого забоя. Ежедневно определяли размер очагов поражения в месте инъекции с помощью штангенциркуля. Затем рассчитывали площадь поверхности очагов как произведение двух основных диаметров очага. Приведен средний размер (см 2) очагов в месте инъекции. Фиг. 31. Индинавир и саквинавир блокируют сосудистую проницаемость и отеки, вызванные инокуляцией клеток KS у мышей nude. Мышам nude вводили индинавир, саквинавир или физраствор (saline) на протяжении 2 дней при тех же дозах и процедурах, что описаны ранее. На 3-й день им вводили пириламин (80 мкг в 100 мкл физраствора, 4 мг/кг, Sigma), чтобы избежать влияния гистамина, выделяющегося при инокуляции, и сразу после этого вводили в вену 100 мкл красителя Evans blue (5 мг/мл в физрастворе), а затем инокулировали подкожно клетки KS (3x106 клеток/мышь), культивированные in vitro в присутствии индинавира, саквинавира (1 мкМ) или буфера в 0,2 мл матригеля. В качестве контроля каждому животному вводили контралатерально такой же объем буфера и матригеля. Через 18 ч животных забивали и измеряли количество проникшего из кровотока красителя в месте инокуляции клеток KS по двум наибольшим перпендикулярным диаметрам с помощью шаблона. Количество проникшего из кровотока красителя также определяли путем снятия кожи из места инокуляции и измерения на спектрофотометре после экстракции формамидом в течение 24 ч при 56 С (Nakamura et al., 1992). Количество проникшего из кровотока красителя рассчитывали, вычитая оптическую плотность, измеренную в контрольном участке. Как видно из рисунка, введение индинавира или саквинавира уменьшало количество проникшего из кровотока красителя на 39,8% (р 0,05) и 44,5% (р 0,01), соответственно, при измерении на спектрофотометре, а при измерении с помощью шаблона - на 43,5 и 47,5%, соответственно.- 14006678 Фиг. 32. Индинавир и саквинавир блокируют продукцию цитокинов клетками KS in vitro. Панель А: количество IL-6 в супернатанте из клеток KS, культивированных в отсутствие (buffer) или в присутствии индинавира (IND). Панель В: количество IL-6 в супернатанте из клеток KS, культивированных в отсутствие (buffer) или в присутствии саквинавира (SAQ). Клетки засевали в 6-луночные планшеты и культивировали 5 дней, как описано (Ensoli et al., 1990),в непрерывном присутствии индинавира или саквинавира в концентрации 0,1, 1 и 10 мкМ или предназначенного для них буфера. На 5-й день культуральную среду заменяли средой без сыворотки, содержащей бычий сывороточный альбумин (0,05% вес/об) в присутствии индинавира или саквинавира в указанных концентрациях. После 24 ч инкубации супернатанты культур тестировали методом ELISA (RDSystems, Minneapolis, MN, США) для определения количества IL-6 в среде. Количество IL-6 выражали в пг/мл супернатанта. Такие же определения проводились в отношении bFGF, VEGF, IL-1 и IL-1 с помощью коммерческих наборов для ELISA. Как индинавир, так и саквинавир уменьшали продукциюbFGF, VEGF, IL-1, IL-1 и IL-6. Пример 1. Чтобы проверить, какие процессы, необходимые для возникновения KS, ингибируются индинавиром или саквинавиром, проводили анализ пролиферации, миграции и инвазии в ответ на bFGF первичных макрососудистых эндотелиальных клеток человека из пупковой вены, культивированных в присутствии и в отсутствие серийных разведений индинавира или саквинавира. Используемые концентрации ИПВИЧ были такими же, как в плазме подвергавшихся лечению пациентов (Deeks et al., 1997). Как показывает фиг. 1, ИПВИЧи не оказывали влияния на базальную или bFGF-индуцированную пролиферацию макрососудистых эндотелиальных клеток при всех концентрациях. Аналогичным образом, не отмечалось влияния индинавира или саквинавира на выживаемость макрососудистых эндотелиальных клеток. Наоборот, оба ИПВИЧа ингибировали миграцию (фиг. 2) и полностью блокировали инвазию макрососудистых эндотелиальных клеток (фиг. 3), стимулируемую bFGF при всех концентрациях. Такие же результаты были получены с первичными дермальными микрососудистыми эндотелиальными клетками человека (фиг. 4 и 5) или с первичными гладкомышечными клетками человека (фиг. 6 и 7). Пример 2. Миграция и инвазия эндотелиальных клеток опосредованы протеолитической активностью активных ММП, разрушающих базальную мембрану сосудов, способствуя миграции и инвазии эндотелиальных клеток, которые необходимы для образования новых сосудов (Stetler-Stevenson, 1999). ММП выделяются эндотелиальными клетками в виде проферментов-зимогенов. Чтобы проверить, влияет ли индинавир или саквинавир на активность ММП в эндотелиальных клетках, проводили эксперименты по измерению желатинолитической активности при помощи зимограмм желатина и казеина (Kleiner et al.,1993). В частности, ММП-2 является ключом к ангиогенезу, росту опухолей и инвазии. Зимоген ММП-2(латентный ММП-2, 72 кД) подвергается протеолитической активации на поверхности клетки до форм в 64/62 кД посредством сложного механизма, в котором участвуют другие протеазы (Stetler-Stevenson,1999). Индинавир или саквинавир (фиг. 8 и 9, соответственно) оказывали минимальное влияние или вовсе не влияли на синтез ММП-2, тогда как оба эти ИПВИЧи блокировали активацию ММП-2 дозозависимым образом (фиг. 8 и 9). Эти эффекты наблюдались после 24 ч инкубации клеток при таких концентрациях ИПВИЧ, как и в плазме подвергавшихся лечению пациентов (Deeks et al, 1997). Сходные эффекты наблюдались после 5 дней инкубации с ИПВИЧ. Для анализа стадий, связанных с ингибированием ИПВИЧ активации ММП-2, эндотелиальные клетки активировали с помощью форболовых эфиров, которые, как известно, очень активно стимулируют превращение ММП-2 в активную форму. Как видно из фиг. 10, эти опыты показали, что оба ИПВИЧи действуют путем ингибирования аутопротеолитического превращения ММП-2 в активную форму (62 кД) (Stetler-Stevenson, 1999). Однако точный механизм, посредством которого индинавир или саквинавир ингибирует превращение латентной ММП-2 в активную форму, еще не установлен. Так, не обнаружено гомологии между последовательностью активного сайта протеазы ВИЧ и ММП-2 или других ММП. Однако была обнаружена гомология с аминокислотной последовательностью каталитического сайта протеазы ВИЧ у тромбоспондина, который, как известно, способен как активировать, так и ингибировать ММП и/или ангиогенез (Bein and Simons, 2000; Taraboletti etal., 2000). Это свидетельствует о том, что ИПВИЧ может влиять на активацию ММП или инвазию клеток путем взаимодействия с тромбоспондином. Для изучения эффектов индинавира и саквинавира на другие ММП проводили зимографию казеина с эндотелиальными клетками, обработанными bFGF или ТРА в присутствии или в отсутствие ИПВИЧ. Эти эксперименты показали, что саквинавир способен ингибировать синтез казеин-специфичных ММП,индуцированный bFGF или ТРА (фиг. 11). Поскольку ММП являются ключом к миграции и инвазии клеток, эти результаты означают, что индинавир и саквинавир ингибируют миграцию и инвазию клеток через ингибирование ММП. Даже если мишенью индинавира или саквинавира могут быть и другие протеазы или молекулы, участвующие в инвазии клеток, ММП-2 и казеин-специфичные ММП представляют собой ключевые примеры такого эффекта.- 15006678 Пример 3. Было показано, что ММП-2 индуцируется bFGF и другими ангиогенными факторами (Ensoli et al.,1994a; Barillari et al., 1999b; Stetler-Stevenson, 1999), и что bFGF, как и ММП-2, экспрессируется в очагахKS (Ensoli et al., 1989; Ensoli et al., 1994a; Samaniego et al., 1998). Более того, известно, что ингибирование активности bFGF или ММП, особенно ММП-2, блокирует ангиогенез, образование очагов KS и рост опухолей вообще (Ensoli et al., 1989; Ensoli et al., 1994a; Ensoli et al., 1994b; Stetler-Stevenson, 1999; Koivunen et al., 1999; Carmeliet and Jain, 2000). С другой стороны, для ангиогенеза необходима инвазия клеток как в нормальных тканях, так и в опухолях. Эти данные означают, что ингибирование инвазии клеток и ММП индинавиром и саквинавиром должно вести к блокировке ангиогенеза. Поэтому исследовали эффекты индинавира и саквинавира на ангиогенез, индуцируемый bFGF и/или VEGF, на мышах nude и на оболочке хориоаллантоиса (ОХА). Мышам nude вводили индинавир (1,4 мг/день), саквинавир (1 мг/день) или физраствор (отрицательный контроль) через желудочный зонд один раз в день на протяжении 2 дней (Kleiner et al., 1993). Затем мышам инокулировали bFGF или предназначенный для него буфер в присутствии матригеля (Kleiner et al., 1993; Ensoli et al., 1994a; Samaniego et al., 1998; Barillari et al., 1999a). Введение индинавира, саквинавира или физраствора проводили ежедневно на протяжении следующих 5 дней. Затем мышей забивали и делали макроскопию и микроскопию мест инокуляции на присутствие KS-подобных ангиопролиферативных очагов (Kleiner et al.,1993; Ensoli et al., 1994a; Samaniego et al., 1998; Barillari et al., 1999a). В соответствии с прежними результатами(Ensoli et al., 1994a; Samaniego et al., 1998; Barillari et al., 1999a), инокуляция 1 мкг bFGF вызывала образование ангиопролиферативных очагов у 71% не получавших препараты мышей (табл. 1 и фиг. 12(1. Напротив, введение индинавира или саквинавира уменьшало процент мышей, у которых образовались очаги, до 28 и 25%,соответственно (табл. 1 и фиг. 12(1. На фиг. 12(1) приведен пример этих результатов. Введение индинавира или саквинавира полностью блокировало образование пораженных очагов или сильно уменьшало их размеры. Микроскопия мест инокуляции у мышей, получавших индинавир или саквинавир, показала заметное снижение ангиогенеза и инфильтрации клеток по сравнению с мышами, которым инокулировали bFGF, но не вводили ИПВИЧ (фиг. 12(2. В случае полной регрессии гистологическая картина тканей была близка или идентична той, что наблюдалась у мышей, получавших только буфер (отрицательный контроль) (фиг. 12(2. Это подтвердилось при окрашивании с помощью антител к FVIII или CD31 и измерении при помощью компьютерного анализа (табл. 1). Так, площадь очагов, положительных по маркерам эндотелиальных клеток,снижалась почти на 70% у получавших ИПВИЧ мышей по сравнению с не получавшими их контролями (р 0,001) (табл. 1). Поскольку VEGF действует синергично с bFGF в индуцировании ангиогенеза и образовании KSподобных очагов, мышам (6 животных на группу) также инокулировали субоптимальные дозы bFGF (0,1 мкг) в комбинации с VEGF (1 мкг), как делали ранее при изучении их синергичного действия (Samaniegoet al., 1998), и вводили ИПВИЧ как указано выше. Комбинированное введение двух факторов вызывало образование очагов поражения у 83% не получавших препараты мышей, однако индинавир или саквинавир снижали образование очагов до 33% и 17% (р 0,05 для саквинавира) у получавших их мышей, соответственно (табл. 2). Таким образом, оба ИПВИЧа ингибируют ангиогенез и образование KS-подобных очагов, индуцированное синергичным действием bFGF в комбинации с VEGF у мышей nude. Эти результаты означают, что ИПВИЧи оказывают прямое антиангиогенное действие. Для подтверждения того, что ИПВИЧи обладают прямыми антиангиогенными эффектами, использовали метод ОХА, который является общепринятым методом in vivo для измерения ангиогенеза (Ribattiet al., 1996). Как показывает табл. 3, индинавир или саквинавир блокировали bFGF-индуцированный ангиогенез до 42 и 19% от уровня контроля на bFGF и до 36 и 11% от уровня контроля на VEGF, соответственно (р 0,05). Примечательно, что блокирование bFGF-индуцированного ангиогенеза обоими ИПВИЧ было сравнимо с тем, что наблюдалось с таксолом, цитотоксическим препаратом, обладающим противоопухолевой и антиангиогенной активностью, который применяется при лечении KS и твердых опухолей(Sgadari et al., 2000) (табл. 3). Эти данные подтверждают, что ингибирование ИПВИЧ миграции и инвазии микрососудистых и макрососудистых эндотелиальных клеток, инвазии гладкомышечных клеток и активности ММП ведет к подавлению ангиогенеза in vivo. Пример 4. Клетки KS - это трансдифференцированные клетки эндотелиального происхождения с активированным фенотипом, которые экспрессируют и bFGF, и VEGF, и ММП (Ensoli et al., 1989; Ensoli et al.,1990; Ensoli et al., 1994a; обзор в Ensoli and Strzl, 1998). Эти данные, следовательно, означают, что ИПВИЧи могут оказывать на клетки KS действие, близкое их действию на эндотелиальные и гладкомышечные клетки и обладать способностью к ингибированию инвазии клеток KS. Соответственно, были проведены опыты по адгезии, пролиферации, миграции и инвазии, культивируя клетки KS в присутствии индинавира или саквинавира в концентрациях от 0,01 мкМ до 1 мкМ на протяжении 5-7 дней. Как показывает табл. 4, индинавир или саквинавир не ингибирует способность клеток KS к адгезии на субстрате из фибронектина. Аналогично, обработка клеток KS индинавиром или саквинавиром в течение 7 дней не- 16006678 влияла на пролиферацию клеток при измерении подсчетом жизнеспособных клеток по исключению красителя трипанового синего (табл. 4). Чтобы определить, влияют ли ИПВИЧи на способность клеток KS к миграции и инвазии базальной мембраны в ответ ангиогенные факторы, клетки KS, обработанные на протяжении 5 дней индинавиром или саквинавиром (0,01-1 мкМ), помещали в верхний отсек камеры Бойдена в постоянном присутствии ИПВИЧ, a bFGF вносили в нижний отсек в качестве хемоаттрактанта. Как показывает табл. 4, ни индинавир, ни саквинавир не оказывали влияния на миграцию клеток KS. В отличие от этого, оба препарата ингибировали способность клеток KS к инвазии субстрата из матригеля дозозависимым образом. В частности, оба ИПВИЧа ингибируют инвазию клеток KS на 30-40% (р 0,05) (табл. 4 и фиг. 13). Эти данные означают, что механизм, лежащий в основе эффектов ИПВИЧ на инвазию клеток в ответ на хемотактические сигналы, включая, к примеру, ингибирование ММП, вероятнее всего, действует на многие типы клеток, включая раковые клетки. Пример 5. Для проверки того, способны ли ИПВИЧи к специфическому ингибированию инвазии раковых клеток, были поставлены эксперименты по пролиферации и инвазии клеток на линиях раковых клеток из опухолей различного происхождения. В частности, исследовали следующие линии клеток: Ea-hy 926,происходящие из гибрида между клетками H-UVEC и легочной карциномы человека (Edgell et al., PNAS 1983), клетки гепатокарциномы (SK-Hep-1), клетки легочной карциномы (А 549), клетки аденокарциномы молочной железы (MDA-MB-468) и клетки миеломоноцитарной лейкемии (U937). Индинавир или саквинавир не оказывали значительного влияния на пролиферацию этих линий клеток (фиг. 14, 16, 18, 20). Напротив, оба ИПВИЧа значительно ингибировали инвазию раковых клеток при тех же концентрациях,что и в сыворотке получавших препараты пациентов (фиг. 15, 17, 19, 21, 22). Следовательно, эти данные означают, что способность ИПВИЧ к ингибированию инвазии нормальных и неопластических клеток лежит в основе механизма, общего для всех клеток, а именно блокирования молекул и ферментов, участвующих в миграции и инвазии клеток, включая, в частности, ММП. Пример 6. Эти результаты означают, что, несмотря на отсутствие влияния на пролиферацию раковых клеток,ИПВИЧ могут обладать способностью к ингибированию роста опухолей путем избирательного блокирования инвазии раковых клеток и ангиогенеза опухолей, которые необходимы для возникновения опухолей, инфильтрации опухолей и метастазирования (Carmeliet et al., 2000). Соответственно, были поставлены опыты in vivo, чтобы установить, способны ли ИПВИЧи ингибировать рост на ксенотрансплантатных моделях раковых опухолей, включая линии раковых клеток, использовавшиеся в опытах in vitro. Во-первых, исследовали эффекты индинавира или саквинавира на образование KS-подобных очагов, вызванных инокуляцией первичных клеток KS человека у мышей nude, модели in vivo, широко применяемой в доклинических испытаниях эффективности лечения KS (Ensoli et al., 1994b; Koivunen et al.,1999; Sgadari et al., 2000). Эти ангиопролиферативные очаги имеют преходящий характер, происходят из мышей и возникают в ответ на цитокины, такие как bFGF и VEGF, IL-1, IL-6 и другие, выделяемые клетками KS (Ensoli et al., 1989; Ensoli et al., 1994a; Ensoli et al., 1994b; Fiorelli et al., 1995; Samaniego et al.,1995; Samaniego et al., 1997; Sgadari et al., 2000). Действительно, по крайней мере в начальной фазе, KS является реактивным ангиопролиферативным заболеванием, а не настоящим новообразованием (Ensoliand Strzl, 1998). Животных подвергали тем же процедурам и дозам индинавира или саквинавира, что применялись в экспериментах, описанных выше. Как показывает табл. 5, инокуляция клеток KS вызывала появление KS-подобных очагов у 100% животных. Введение индинавира или саквинавира уменьшало процент мышей, у которых возникали KS-подобные очаги, до 43 и 25%, соответственно. При макроскопии очаги были ярко-красными и сильно васкуляризованными у не получавших препараты мышей, но меньшими, бледными и в стадии регрессии у получавших ИПВИЧ животных. Аналогично, очаги у не получавших препараты мышей проявляли сильную неоваскуляризацию, инфильтрацию веретенообразных клеток, отек и транссудацию эритроцитов (фиг. 23). Напротив, у получавших ИПВИЧ мышей проявлялась большая некротическая зона на месте инъекции клеток, охватывающая до 85% общей площади очага, и заметное уменьшение новообразованных сосудов и инфильтрации веретенообразных клеток,которые в основном ограничивались периферией зоны некроза/регрессии (фиг. 23). Чтобы установить, способны ли ИПВИЧи также вызывать регрессию KS без предварительного введения препаратов, были поставлены эксперименты по введению мышам ИПВИЧ во время инокуляции клеток KS. Как показывает фиг. 24, очаги KS проявляют медленную регрессию со временем, однако у получавших ИПВИЧ мышей регрессия протекала намного быстрее и ко времени забоя площадь поверхности очагов была близка или идентична таковой у отрицательных контролей (р 0,001). Белок Tat вируса ВИЧ повышает частоту и агрессивность KS у лиц, инфицированных ВИЧ-1 (Ensoliet al., 1994a). Это обусловлено тем, что Tat индуцирует адгезию, миграцию, инвазию и пролиферацию эндотелиальных клеток и клеток KS. В самом деле, Tat синергично усиливает эффекты bFGF на ангиогенез и на KS (Ensoli et al., 1994 а; Barillari et al., 1999a и 1999b). Однако Tat требует присутствия bFGF или воспалительных цитокинов для оказания действия на KS, так как они повышают экспрессию рецепторовTat на поверхности клеток и в тканях (Barillari et al., 1992; Barillari et al., 1993; Albini et al., 1995; Fiorelli etal., 1995; Fiorelli et al., 1999; Barillari et al., 1999a; Barillari et al., 1999b). Соответственно, чтобы проверить, ингибируют ли ИПВИЧи эффекты Tat в комбинации с bFGF на ангиогенез и на KS, мышам nude инокулировали клетки линии ЕА-hy 926. Эта линия клеток происходит из гибрида между клетками H-UVEC и легочной аденокарциномы человека (Edgell et al., PNAS 1983),сохраняет большую часть маркеров эндотелиальных клеток и применяется в качестве модели ангиогенной опухоли (Albini et al., Nat Med 1996; Albini et al., PNAS 1995; Cai et al., Lab Invest 1999). ИПВИЧи начинали вводить мышам nude за 2 дня до инокуляции раковых клеток. Как показывает табл. 7, опухоли возникали у 83% не получавших препараты мышей, но только у 33 и 25% мышей, соответственно, получавших индинавир или саквинавир (р 0,05). Аналогично, площадь поверхности опухолей снижалась у мышей, получавших оба ИПВИЧа (р 0,05), достигая размера отрицательных контролей (табл. 7). Остаточные опухоли у получавших препараты животных проявляли сильное уменьшение и роста опухолей, и ангиогенеза по данным гистологии и по окрашиванию с помощью антител к FVIII-RA или CD31, по сравнению с контролями (р 0,001) (табл. 7). Ингибирование роста опухолей также наблюдалось и без предварительного введения препаратов (фиг. 25). Действительно, у этих животных размер поверхности опухолей ко времени забоя уменьшался более чем на 50% по сравнению с не получавшими препаратов контролями (р 0,001) (фиг. 25). Таким образом, ИПВИЧи ингибируют рост in vivo на модели ангиогенной опухоли путем прямого блокирования инвазии раковых клеток и ангиогенеза, несмотря на отсутствие эффекта на пролиферацию клеток EA-hy 926. Пример 8. Чтобы установить, способны ли ИПВИЧи ингибировать рост злокачественных твердых и лимфоидных опухолей, мышам nude инокулировали клетки гепатокарциномы (SK-Hep-1), клетки легочной карциномы (А 549), клетки аденокарциномы молочной железы (MDA-MB-468), клетки миеломоноцитарной лейкемии (U937) и клетки Т-лимфоцитарной лейкемии (Jurkat). Рост всех этих ксенотрансплантатных опухолей значительно ингибировался как индинавиром, так и саквинавиром, несмотря на отсутствие эффекта ИПВИЧ на пролиферацию этих линий клеток (фиг. 26-30). Таким образом, эти данные указывают,что блокирование инвазии раковых и эндотелиальных клеток вследствие ингибирования ИПВИЧ активности ММП несет ответственность за эффекты этих препаратов на рост опухолей. Пример 9. Поскольку ММП участвуют в сосудистой проницаемости и образовании отека (Carmeliet et al., 2000), которые являются важными клиническими признаками ангиогенеза, KS, опухолей и воспалительных заболеваний,были поставлены эксперименты по сосудистой проницаемости у мышей nude, инокулированных клетками KS. Эти клетки вызывают отеки, так как они продуцируют цитокины с отекообразующим действием, включаяVEGF, bFGF (в комбинации с VEGF), IL-1, IL-6 и другие. Мышам nude вводили индинавир, саквинавир или физраствор на протяжении 2 дней при тех же дозах и процедурах, что описаны в примере 6, вводили в вену краситель Evans blue, a затем инокулировали клетки KS, культивированные in vitro в присутствии индинавира или саквинавира (1 мкМ) или предназначенного для них буфера. Через 12 ч животных забивали и измеряли окрашенную зону в месте инокуляции клеток KS с помощью штангенциркуля, а проникший из кровотока краситель экстрагировали из ткани формамидом и измеряли спектрофотометрически (Nakamura, Science 1992). Как видно из фиг. 31, введение индинавира или саквинавира уменьшало количество проникшего из кровотока красителя на 39,8% (р,05) и 44,5% (р 0,01), соответственно, и площадь окрашенной зоны на 43,5 и 47,5%, соответственно(фиг. 31). Пример 10. Клетки KS секретируют цитокины, обладающие воспалительным, отекообразующим, ангиогенным и пролиферативным действием с аутокринными и паракринными эффектами (Ensoli and Strzl, 1998). Эти факторы опосредуют все процессы, необходимые для образования KS-подобных очагов (ангиогенез,пролиферация и инвазия клеток, воспалительная инфильтрация, отек), и сосудистую проницаемость и отеки, вызываемые клетками KS у мышей nude. Чтобы установить эффекты индинавира и саквинавира на продукцию цитокинов, клетки KS культивировали в присутствии или в отсутствие серийных разведений индинавира или саквинавира. Определяли содержание bFGF, VEGF, IL-1 и IL-6 с помощью иммуноферментных тестов в супернатантах клеток KS после 24 ч культивирования в отсутствие сыворотки и в непрерывном присутствии этих двух ИПВИЧ методом ELISA. Индинавир и саквинавир ингибировали продукцию IL-1, IL-1 и IL-6 клетками KS. Как пример этих эффектов, на фиг. 32 представлено ингибирование IL-6, типичного воспалительного цитокина, вырабатываемого клетками KS и эндотелиальными клетками, а также лимфоцитами и моноцитами крови и тканей, который также обладает ангиогенным действием (Mateo et al., 1994; Cohen et al., 1996). Кроме того, IL-6 играет ключевую роль в полицентрической болезни Кастлмана и росте лимфом (Tosato et al., 1993; Peterson and Frizzera, 1993; Asou et al.,1998; Ramsay et al., 1994), еще одного типа опухолей, частота возникновения которого снижается у пациентов, получавших ИПВИЧ (International Collaboration on HIV and Cancer, 2000).- 18006678 Обсуждение Эти результаты показывают, что ИПВИЧи оказывают специфическое ингибирующее действие на миграцию клеток и/или инвазию, но не на пролиферацию клеток. По-видимому, эти эффекты обусловлены механизмом, общим для многих типов первичных и раковых клеток различного происхождения и направленным на ключевые молекулы, участвующие в миграции и инвазии клеток, но не связанные с протеасомами. Так, наши исследования показывают, что эффекты ИПВИЧ связаны с ингибированием активации или продукции ММП и могут затрагивать и другие молекулы, участвующие в метаболизме ММП, например, тромбоспондин. Вследствие этих активностей ИПВИЧи способны блокировать несколько клеточных процессов, требующих миграции клеток, инвазии и/или активности ММП, включая ангиогенез, сосудистую проницаемость, образование отека и рост таких реактивных гипертрофических опухолей, как KS, или злокачественных твердых или лимфоидных новообразований. Поскольку миграция клеток воспаления и иммунной системы также требует инвазии клеток и активности ММП, наши данные указывают, что ИПВИЧи могут ингибировать инфильтрацию тканей клетками при воспалительных или иммунных реакциях. Кроме того, ИПВИЧи ингибируют продукцию цитокинов и других факторов, опосредующих возникновение KS и рост других опухолей и связанную с этим воспалительную инфильтрацию. ИПВИЧи также обладают противовоспалительным действием, так как они снижают продукцию таких цитокинов, как IL-6, IL-1 и другие цитокины, участвующие в воспалении, а также присутствующие в очагах KS у человека и мышей. Те же самые воспалительные цитокины способны индуцировать продукцию ангиогенных факторов (bFGF, VEGF), а также обладают ангиогенным действием in vivo(Barillari et al., 1992; Samaniego et al., 1995; Fiorelli et al., 1995; Samaniego et al., 1997; Samaniego et al.,1998; Fiorelli et al., 1998; Fiorelli et al., 1999; Barillari et al., 1999a). В частности, IL-6 играет ключевую роль в полицентрической болезни Кастлмана и росте лимфом (Tosato et al., 1993; Peterson and Frizzera,1993; Ramsay et al., 1994; Asou et al., 1998). ИПВИЧи связываются в активном сайте протеазы ВИЧ, принадлежащей к семейству аспартиловых протеаз. Недавно было показано, что эти препараты способны ингибировать аспартиловую протеазу грибов (Cassone et al., 1999). Однако ни одна из известных протеаз, участвующих в миграции клеток и инвазии, не является аспартиловой протеазой, и не обнаружено гомологии в последовательности между активным сайтом протеазы ВИЧ и протеаз, участвующих в этих процессах, за исключением тромбоспондина. Следовательно, те эффекты на миграцию клеток, инвазию и ММП, которые мы показали, были полностью непредсказуемы и не могли быть предвидены. В самом деле, хотя в некоторых исследованиях предполагалось, что ИПВИЧи оказывают влияние на клеточный метаболизм, протеасомы и иммунитет (Deeks et al., 1997; Andre et al., 1998; Weichold et al.,1999; Ledru et al., 2000; Tovo, 2000; патентные заявки WO 99/63998 и WO 0033654), мы показали, что ИПВИЧи оказывают прямое антиангиогенное, противоопухолевое, противоотечное и противовоспалительное действие, которые не связаны с известными аспартиловыми протеазами, протеасомами или эффектами ИПВИЧ на репликацию ВИЧ или HHV-8. В самом деле, используемые в настоящем исследовании модели пролиферации клеток, миграции, инвазии, ангиогенеза, KS и опухолей свободны от возбудителей инфекций. Близкие результаты были получены как с индинавиром, так и саквинавиром, которые обладают такой же структурой, как и другие ИПВИЧ, хотя химические заместители и специфичны для каждого препарата. Так что эти данные означают, что те активности ИПВИЧ, которые мы открыли у индинавира и саквинавира, являются общим свойством для всех ИПВИЧ, что согласуется с общими эффектами различных ИПВИЧ, наблюдавшимися у получавших их лиц (Lebbe et al., 1998; Cattelan et al., 1999; International Collaboration on HIV and Cancer, 2000). Вышеуказанные эффекты ИПВИЧ наблюдаются при тех же концентрациях, что и в плазме получавших их пациентов, которые хорошо переносятся этими лицами. Также не наблюдалось никаких токсических эффектов индинавира или саквинавира in vitro или у мышей. Хотя прежние данные показывали,что ИПВИЧи ингибируют протеасомы и что ингибирование протеасом индуцирует запрограммированную гибель клеток у пролиферирующих эндотелиальных клеток (Andre et al., 1998; Hannes et al., 2000), в наших опытах индинавир и саквинавир не проявляли влияния на выживаемость клеток или рост эндотелиальных клеток, гладкомышечных клеток и раковых клеток. Напротив, они избирательно ингибировали миграцию клеток и инвазию, свидетельствуя, что ИПВИЧи не повреждают уже существующие сосуды или ткани. Поскольку подвижность клеток и ангиогенез необходимы не только для возникновения KS,но и для роста и метастазирования опухолей (Carmeliet and Jain, 2000; Stetler-Stevenson, 1999), описанные до сих пор результаты указывают, что ИПВИЧи являются перспективными антиангиогенными и противоопухолевыми препаратами. Кроме того, эти же результаты показывают, что ИПВИЧи блокируют сосудистую проницаемость и воспаление, индуцируемые воспалительными цитокинами и факторами сосудистой проницаемости, а также продукцию цитокинов, играющих ключевую роль в полицентрической болезни Кастлмана и в росте лимфом (Tosato et al., 1993; Peterson and Frizzera, 1993; Ramsay et al., 1994;Asou et al., 1998). Следовательно, ИПВИЧ и близкие им препараты или их производные могли бы применяться для блокирования ангиогенеза, роста, инвазии и метастазирования твердых опухолей и рака крови, отека и воспаления, таким образом, они могли бы с успехом применяться при лечении KS, опухолей,- 19006678 ангиопролиферативных заболеваний, воспалительных и аутоиммунных заболеваний как у ВИЧотрицательных, так и у ВИЧ-инфицированных лиц. Таблица 1. Индинавир и саквинавир блокируют индуцированные bFGF ангиогенные KS-подобные очаги у мышей nude Мышам nude инокулировали bFGF (1 мкг), чтобы индуцировать образование KS-подобных ангиопролиферативных очагов, или предназначенный для него буфер (контроль) и вводили индинавир, саквинавир или физраствор. Во время забоя обследовали места инокуляции для проверки наличия макроскопических ангиопролиферативных очагов и подвергали микроскопии после окрашивания гематоксилином+ эозином (НЕ) или замораживали для гистохимического анализа маркеров эндотелиальных клеток FVIII-RA и CD31. В таблице указано число мышей, у которых возникли очаги, относительно числа инокулированных мышей, и процент (%) мышей, у которых возникли очаги. Уменьшение числа KSподобных очагов у получавших препараты животных было статистически достоверным (стандартный критерий для отношений, р 0,05). Ангиогенез анализировали путем определения площади ткани, проявляющей окрашивание на FVIII-RA и CD31. Приведены в процентах [среднеестандартное отклонение(SD)] площади очагов, проявляющих окрашивание на FVIII-RA и CD31, которые определяли как описано ниже. Снижение экспрессии FVIII-RA и CD31 в остаточных очагах у получавших ИПВИЧ животных было статистически достоверным (р 0,001). Для проведения этих экспериментов in vivo использовали те же рецептуры индинавира (Merck,SharpDohme Ltd., Haarlem, NL) или саквинавира (Roche, Hertfordshire, GB), что и у ВИЧинфицированных пациентов, растворяли их в физрастворе и вводили мышам nude (Balb/c nu/nu, самки,Charles River, Calco, Италия, возраст 5-6 недель) через желудочный зонд. Для проверки на токсичность индинавир и саквинавир вводили ежедневно на протяжении 8 дней в дозах 35, 70 или 17,5 мг/кг/день либо 18, 36 или 9 мг/кг/день, соответственно, в объеме 0,4 мл. Эти дозы соответствуют полной дозе,двойной дозе или половине дозы ИПВИЧ, соответственно, вводимых ежедневно ВИЧ-инфицированным пациентам (Deeks et al., 1997). При этих дозах не наблюдалось токсичности для органов или системной токсичности. Мышам вводили 70 мг/кг/день индинавира (что соответствует 1,4 мг/день) или 36 мг/кг/день саквинавира (что соответствует 1 мг/день) один раз в день на протяжении 7 дней, начиная за 2 дня до инокуляции bFGF. Контрольным животным вводили такой же объем физраствора. На третий день мышам инокулировали подкожно на уровне нижней четверти спины 1 мкг рекомбинантного bFGF(Roche, Mannheim, Германия) в 0,2 мл фосфатного буфера (PBS) с 0,1% бычьего сывороточного альбумина (BSA) или предназначенный для него буфер, которые смешивали с 0,2 мл матригеля (CollaborativeBiomedical Products, Bedford, MA) перед инокуляцией, как описано ранее (Ensoli et al., 1994a). Через 4 дня мышей забивали и обследовали места инокуляции для проверки наличия макроскопических KSподобных ангиопролиферативных очагов, а срезы тканей подвергали гистологическому исследованию после окрашивания НЕ. Для иммуногистохимического анализа замороженные срезы тканей фиксировали холодным ацетоном и окрашивали при помощи кроличьих поликлональных антител к FVIII-RA человека (Dako, Glostrup, Дания) в разведении 1:2000 или крысиных моноклональных антител к CD31 мышей (BD Biosciences в разведении 1:1000). Получали цифровые изображения (увеличение x200) с помощью цветной телекамеры CCD (Zeiss) и анализировали, делая снимки 4-9 полей зрения микроскопа(около 0,15 мм 2 на 1 поле), соответствующих целому гистологическому срезу. Окрашивание измеряли количественно с помощью программы анализа изображений KS300 (Zeiss) и выражали в процентах окрашенной поверхности от общей площади ткани. Таблица 2. Индинавир и саквинавир ингибируют образование ангиогенных KS-подобных очагов,индуцированных bFGF вместе с VEGFVEGF в матригеле и вводили индинавир, саквинавир или физраствор, как определено в подписи к табл. 1. После забоя обследовали места инокуляции на наличие макроскопических ангиопролиферативных очагов,окрашивали ткани НЕ и проводили микроскопию. В таблице приведено число мышей, у которых образовались очаги, относительно общего числа инокулированных мышей, и процент (%) мышей, у которых образовались очаги. Число мышей, у которых образовались ангиогенные KS-подобные очаги, уменьшалось после введения как индинавира, так и саквинавира (стандартный критерий для отношений, р 0,05). Таблица 3. Эффекты индинавира и саквинавира на ангиогенез, индуцированный bFGF или VEGF,при определении на оболочке хориоаллантоиса (ОХА) Определения на ОХА проводили при помощи кусочков стерильного губчатого желатина (GelfoamUpjohn Co., Kalamazoo, MI) объемом 1 мм 3, пропитанных bFGF или VEGF (1 мкг или 100 нг, соответственно) в 5 мкл PBS, а также буфером, ИПВИЧ (10 мкМ) или таксолом (250 нМ) (Bristol-Myers Squibb Co.,Princeton, NJ), как описано (Ribatti et al., Int. J. Dev. Biol. 1996). ОХА обследовали ежедневно вплоть до 12-го дня под стереомикроскопом Olympus SZX9. Получали изображения (1024x1024 пикселя) с расстояния 2 мм от края губки с помощью охлаждаемой телекамеры CCD Hamamatsu ORCA (HamamatsuPhotonics Italia, Arese, Италия). Количество сосудов определяли с помощью программы анализа изображений ImageProPlus 4.0 (Media Cybernetics, Silver Spring, MD) на 3 выбранных случайным образом участках из 1 яйца (1 мм 3). Результаты выражали как среднее число сосудов/мм 2SD из указанного числа ОХА на каждое экспериментальное условие. Использовали дозы индинавира, саквинавира или таксола, близкие концентрациям препаратов в плазме получавших их пациентов (Sonnichsen D.S.Relling M.V., Clin. Pharmacokinet. 1994; Deeks S.G. et al., JAMA 1997). Введение индинавира, саквинавира или таксола не было связано с токсичностью и не влияло на фоновую васкуляризацию ОХА (данные не приводятся). Ингибирование образования сосудов индинавиром или саквинавиром было статистически достоверным (критерииANOVA и Student-Newman-Keuls, p0,05). Таблица 4. Эффекты индинавира и саквинавира на клетки KS in vitro Увеличение показателя по сравнению с контролем (раз)р 0,05 н/о, определение не проводилось Адгезию, пролиферацию, миграцию и инвазию определяли, культивируя клетки KS в присутствии индинавира или саквинавира в концентрациях от 0,01 до 1 мкМ в течение 5-7 дней. Индинавир или саквинавир не ингибировали способность клеток KS к адгезии на субстрате из фибронектина. Аналогичным образом обработка клеток KS индинавиром или саквинавиром в течение 7 дней не влияла на пролиферацию клеток при измерении по исключению красителя трипанового синего. Ни индинавир, ни саквинавир не оказывали влияния на миграцию клеток KS. Напротив, оба препарата ингибировали способность клеток KS к инвазии мембраны из матригеля дозозависимым образом (р 0,05). Определения миграции и инвазии проводились в основном, как описано в подписях к фиг. 2 и 3. Клетки KS, культивированные в течение 5 дней в присутствии индинавира или саквинавира (0,01-1 мкМ) или предназначенного для них буфера, помещали в верхний отсек камеры Бойдена в присутствии ИПВИЧ, а в нижний отсек вносили bFGF в качестве хемоаттрактанта.- 21006678 Таблица 5. Эффекты индинавира и саквинавира на ангиопролиферативные KS-подобные очаги, индуцированные инокуляцией клеток KS, у мышей nude Мышам nude инокулировали клетки KS (3x106), чтобы вызвать образование ангиопролиферативныхKS-подобных очагов, или предназначенный для них буфер (контроль), и вводили индинавир, саквинавир или физраствор в соответствии с дозами и процедурами, описанными в подписи к табл. 1, начиная за 2 дня до инокуляции клеток и вплоть до забоя через 5 дней. Во время забоя обследовали места инокуляции для проверки на наличие макроскопических ангиопролиферативных KS-подобных очагов, как описано в подписи к табл. 1. В таблице приведено число мышей, у которых образовались очаги, относительно общего числа инокулированных мышей, и процент (%) мышей, у которых образовались очаги. Уменьшение образования ангиогенных KS-подобных очагов у получавших ИПВИЧ животных было статистически достоверным (стандартный критерий для отношений, р 0,001). Гистологическая картина мест инокуляции представлена на фиг. 23. Таблица 6. Индинавир и саквинавир блокируют образование ангиопролиферативных KS-подобных очагов, индуцированных инокуляцией bFGF вместе с белком Tat вируса ВИЧ, у мышей nude. Мышам nude инокулировали bFGF (1 мкг) вместе с Tat (10 мкг), чтобы вызвать образование KSподобных ангиопролиферативных очагов, или предназначенный для них буфер (контроль), и вводили индинавир, саквинавир или физраствор. Во время забоя обследовали места инокуляции для проверки на наличие макроскопических ангиопролиферативных очагов. В таблице приведено число мышей, у которых образовались очаги, относительно общего числа инокулированных мышей, и процент (%) мышей, у которых образовались очаги. Мышам вводили индинавир и саквинавир в соответствии с процедурами и дозами, описанными в табл. 1, на протяжении 7 дней, начиная за 2 дня до инокуляции bFGF и Tat. Контрольным животным вводили такой же объем физраствора. На третий день мышам инокулировали подкожно на уровне нижней четверти спины 1 мкг рекомбинантного bFGF и 10 мкг белка Tat вируса ВИЧ в 0,2 мл PBS с 0,1% BSA или предназначенный для них буфер, которые смешивали с 0,2 мл матригеля перед инокуляцией, как описано ранее (Ensoli et al., Nature 1994). Через 4 дня мышей забивали и обследовали места инокуляции для проверки наличия макроскопических KS-подобных ангиопролиферативных очагов, а срезы тканей подвергали микроскопии после окрашивания гематоксилином/эозином. Таблица 7. Индинавир и саквинавир ингибируют возникновение ангиогенных опухолей, индуцированных инокуляцией клеток EA-hy 926, у мышей nude Мышам nude инокулировали подкожно клетки EA-hy 926 (по 3x106 клеток) (см. подпись к фиг. 25) и вводили через желудочный зонд индинавир, саквинавир или физраствор, начиная за 2 дня до инокуляции клеток, как описано выше (см. подпись к табл. 1). Мышей забивали через 5-6 дней после инокуляции клеток и измеряли очаги поражения в местах инокуляции с помощью штангенциркуля, а также подвергали микроскопии после окрашивания НЕ или иммуногистохимическому анализу. Уменьшение образования ангиогенных опухолевых очагов у получавших ИПВИЧ животных было статистически достоверным (стандартный критерий для отношений, р 0,05). Опухолевый ангиогенез анализировали после иммуногистохимического окрашивания на маркеры FVIII-RA или CD31, как описано в подписи к табл. 1. Приведена площадь поверхности очага (см 2SD) и площадь окрашенной опухолевой ткани в процентах( SD) при измерении с помощью программы анализа изображений KS300 (Zeiss) (см. методы). Размеры остаточных очагов в местах инокуляции уменьшались у мышей, получавших индинавир или саквинавир(р 0,05), и проявлялось снижение экспрессии как FVIII, так и CD31 (р 0,001). БиблиографияWeichold F.F. et al., J. Hum. Virol. 2,261 (1999). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение ингибитора протеазы ВИЧ для получения медикамента для лечения опухоли у первого пациента, причем указанный медикамент предназначен для введения в суточной дозе, которая ниже обычно применяемой суточной дозы ингибитора протеазы ВИЧ, вводимой для лечения инфекции ВИЧ у ВИЧ-инфицированного пациента. 2. Применение ингибитора протеазы ВИЧ для получения медикамента для блокирования роста опухоли у первого пациента, причем указанный медикамент предназначен для введения в суточной дозе,которая ниже обычно применяемой суточной дозы ингибитора протеазы ВИЧ, вводимой для лечения инфекции ВИЧ у ВИЧ-инфицированного пациента. 3. Применение по любому из пп.1 и 2, где указанный первый пациент не является ВИЧинфицированным. 4. Применение по любому из пп.1-3, где указанный ингибитор протеазы ВИЧ по меньшей мере при одной из концентраций 0,1, 1 или 10 мкМ ингибирует миграцию или инвазию эндотелиальных клеток и клеток саркомы Капоши в ответ на 50 нг/мл bFGF при анализе в камере Бойдена. 5. Применение по любому из пп.1-4, где указанный ингибитор протеазы ВИЧ при по меньшей мере одной из концентраций 0,1, 1 или 10 мкМ ингибирует образование цитокинов клетками саркомы Капоши. 6. Применение по любому из пп.1-5, где указанный ингибитор протеазы ВИЧ в дозе, соответствующей полной дозе, двойной или половинной дозе ингибитора протеазы ВИЧ, применяемой ежедневно для ВИЧ-инфицированных пациентов, ингибирует ангиогенез у мышей, индуцируемый bFGF. 7. Применение по любому из пп.1-6, где указанный ингибитор протеазы ВИЧ при по меньшей мере одной из концентраций 0,1, 1 или 10 мкМ ингибирует активацию ММР-2 в культивируемых эндотелиальных клетках пупочной вены человека, инкубируемых в присутствии 0,1 мкг/мл bFGF. 8. Применение по любому из пп.1-7, где указанным ингибитором протеазы ВИЧ является индинавир или его производное. 9. Применение по п.8, где вводимая суточная доза составляет 600 мг. 10. Применение по п.8, где вводимая суточная доза составляет 1200 мг. 11. Применение по любому из пп.1-7, где указанным ингибитором протеазы ВИЧ является саквинавир или его производное. 12. Применение по п.11, где вводимая суточная доза составляет 900 мг. 13. Применение по п.8, где вводимая суточная доза составляет 1800 мг. 14. Применение по любому из пп.1-7, в котором указанный ингибитор протеазы ВИЧ выбран из числа следующих соединений: индинавира, саквинавира, ритонавира, нельфинавира, ампренавира и лопинавира, их производных и их смесей. 15. Применение по п.14, в котором указанный ингибитор протеазы ВИЧ представляет собой комбинацию индинавира и нельфинавира. 16. Применение по любому из пп.1-15, в котором опухоль представляет собой саркому Капоши. 17. Применение по любому из пп.1-15, в котором опухоль представляет собой опухоль мягких тканей или опухоль хряща, кости или крови. 18. Применение по любому из пп.1-15, в котором опухоль представляет собой злокачественную опухоль. 19. Применение по любому из пп.1, 2, 4-15 и 18, в котором опухоль представляет собой опухоль эндотелиальных клеток, опухоль клеток легкого, опухоль клеток молочной железы, гепатокарциному или лейкоз, и где первый пациент не является ВИЧ-инфицированным. 20. Применение по любому из пп.1, 2, 4-15 и 18, в котором опухоль представляет собой миеломоноцитарный лейкоз или Т-клеточный лейкоз, и где первый пациент не является ВИЧ-инфицированным. 21. Применение по любому из пп.1-20, в котором указанный медикамент дополнительно предназначен для достижения регрессии указанной опухоли. 22. Применение по любому из пп.1-20, в котором указанный медикамент предназначен для ингибирования метастазов. 23. Применение по любому из пп.1-22, в котором указанный медикамент дополнительно предназначен для ингибирования отека. 24. Применение по любому из пп.1-23, в котором указанный медикамент предназначен для введения вместе с противовоспалительным, антиангиогенным или противоопухолевым лекарственным средством. 25. Применение по любому из пп.1-24, в котором указанный медикамент предназначен для перорального, внутривенного, внутримышечного, подкожного, интрадермального, внутрибрюшинного, ин- 24006678 тратекального, интраплеврального, внутриматочного, трансмукозального, интраректального, интравагинального или чрескожного введения. 26. Применение по любому из пп.1-24, в котором указанный медикамент предназначен для внутриочагового введения. 27. Применение индинавира или его производного для получения медикамента для лечения опухоли у пациента. 28. Применение индинавира или его производного для получения медикамента для лечения воспалительного заболевания или аутоиммунного заболевания у пациента. 29. Применение индинавира или его производного для получения медикамента для блокирования роста опухоли у пациента. 30. Применение по любому из пп.27-29, где указанный пациент не является ВИЧ-инфицированным. 31. Применение по любому из пп.27-30, в котором указанный медикамент предназначен для введения в суточной дозе, которая ниже обычно применяемой суточной дозы индинавира, вводимой для лечения инфекции ВИЧ у ВИЧ-инфицированного пациента. 32. Применение по любому из пп.27-30, в котором указанный медикамент предназначен для введения в суточной дозе, которая равна или выше обычно применяемой суточной дозы индинавира, вводимой для лечения инфекции ВИЧ у ВИЧ-инфицированного пациента. 33. Применение по любому из пп.27-32, в котором указанный медикамент предназначен для введения суточной дозы индинавира или его производного 2400 или 4800 мг. 34. Применение по любому из пп.27, 29 и 30-33, в котором указанная опухоль представляет собой саркому Капоши. 35. Применение по любому из пп.27, 29 и 30-33, в котором указанная опухоль представляет собой опухоль мягких тканей или опухоль хряща, кости или крови. 36. Применение по любому из пп.27, 29 и 30-33, в котором указанная опухоль представляет собой злокачественную опухоль. 37. Применение по любому из пп.27, 29 и 30-33, в котором указанная опухоль представляет собой опухоль эндотелиальных клеток, опухоль клеток легкого, опухоль клеток молочной железы, гепатокарциному или лейкоз, и где указанный первый пациент не является ВИЧ-инфицированным. 38. Применение по любому из пп.27, 29 и 30-33, в котором указанная опухоль представляет собой миеломоноцитарный лейкоз или Т-клеточный лейкоз, и где первый пациент не является ВИЧинфицированным. 39. Применение по любому из пп.27, 29, 30-33 и 34-38, в котором указанный медикамент дополнительно предназначен для достижения регрессии опухоли. 40. Применение по любому из пп.27, 29, 30-33 и 34-38, в котором указанный медикамент предназначен для ингибирования метастазов. 41. Применение по любому из пп.27-39, в котором указанный медикамент дополнительно предназначен для ингибирования отека. 42. Применение по любому из пп.30-33, в котором указанный медикамент дополнительно предназначен для лечения воспалительного заболевания. 43. Применение по п.42, в котором указанное воспалительное заболевание представляет собой хроническое воспаление, связанное с аллергией и с вирусными, бактериальными или паразитическими возбудителями инфекций, или полицентрическую болезнь Кастлмана. 44. Применение по любому из пп.30-33, в котором указанный медикамент предназначен для лечения аутоиммунного заболевания. 45. Применение по п.44, в котором указанное аутоиммунное заболевание представляет собой системную красную волчанку, склеродерму, ревматоидный артрит, псориаз, тиреоидит, язвенный ректоколит, болезнь Крона, синдром Goodpasture, системный васкулит, синдром Шегрена или первичный билиарный цирроз. 46. Применение по любому из пп.27-45, дополнительно включающее нельфинавир для получения медикамента. 47. Применение по любому из пп.27-46, в котором указанный медикамент предназначен для введения вместе с противовоспалительным, антиангиогенным или противоопухолевым лекарственным средством. 48. Применение по любому из пп.27-47, в котором указанный медикамент предназначен для перорального, внутривенного, внутримышечного, подкожного, интрадермального, внутрибрюшинного, интратекального, интраплеврального, внутриматочного, трансмукозального, интраректального, интравагинального или чрескожного введения. 49. Применение по любому из пп.27-47, в котором указанный медикамент предназначен для внутриочагового введения.
МПК / Метки
МПК: A61P 37/06, A61P 37/08, A61K 38/55, A61P 17/06, A61K 31/496, A61P 1/00, A61K 31/00, A61K 31/4725, A61P 9/10, A61P 35/00
Метки: вич, человека, заболеваний, протеазы, вируса, ингибиторов, отека, миграции, иммунодефицита, инфильтрации, применение, блокирования, связанных, клеток, тканей, этим, инвазии, лечении
Код ссылки
<a href="https://eas.patents.su/30-6678-primenenie-ingibitorov-proteazy-virusa-immunodeficita-cheloveka-vich-dlya-blokirovaniya-migracii-kletok-i-ili-invazii-infiltracii-tkanejj-i-oteka-pri-lechenii-svyazannyh-s-etim-zab.html" rel="bookmark" title="База патентов Евразийского Союза">Применение ингибиторов протеазы вируса иммунодефицита человека (вич) для блокирования миграции клеток и/или инвазии, инфильтрации тканей и отека при лечении связанных с этим заболеваний</a>