Производные цианопирролидина
Номер патента: 6204
Опубликовано: 27.10.2005
Авторы: Камео Казуя, Фукусима Хироси, Хиратате Акира, Такахаси Масато
Формула / Реферат
1. Производное цианопирролидина, представленное формулой (1)
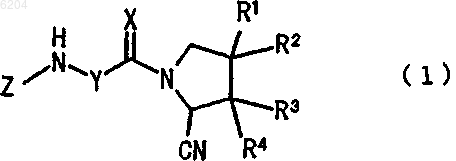
[где R1 представляет атом галогена, гидроксильную группу, алкоксигруппу, имеющую от 1 до 5 атомов углерода, или алкильную группу, имеющую от 1 до 5 атомов углерода,
R2 представляет атом водорода или атом галогена,
R3 и R4 представляют, каждый, атом водорода, атом галогена или гидроксильную группу,
X представляет атом кислорода,
Y представляет -CR5R6- или циклопентилен,
[где R5 и R6 являются одинаковыми или разными и каждый представляет атом водорода или алкильную группу, имеющую от 1 до 10 атомов углерода, которая, необязательно, замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из -NHCO-(CH2)m-бензилоксикарбонил (где m равно целому числу от 1 до 5) и -OR14 (где R14 представляет образующую цепь алкильную группу, имеющую от 1 до 5 атомов углерода, или бензильную группу)] и
Z представляет атом водорода или алкильную группу, имеющую от 1 до 10 атомов углерода, которая необязательно замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из гидроксильной группы, гидроксиалкильной группы, имеющей от 1 до 5 атомов углерода, фенильной группы, которая может быть замещена по меньшей мере одной алкоксигруппой, имеющей от 1 до 4 атомов углерода, -NH-пиридильной группы, которая может быть замещена по меньшей мере одним заместителем, выбранным из цианогруппы, нитрогруппы, атома галогена и аминокарбонильной группы, и -OR14 (где R14 представляет образующую цепь алкильную группу, имеющую от 1 до 5 атомов углерода, или бензильную группу), или
Y и Z вместе с атомом азота, к которому они присоединены, образуют изохинолинильную группу или пирролидильную группу, которая, необязательно, замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из гидроксильной группы, образующей цепь алкильной группы, имеющей от 1 до 5 атомов углерода, и -OR15 (где R15 представляет образующую цепь алкильную группу, имеющую от 1 до 5 атомов углерода, или аминокарбонилметильную группу)]
или его фармацевтически приемлемая соль.
2. Производное цианопирролидина формулы (1) по п.1, где R1 представляет атом фтора или атом хлора, или его фармацевтически приемлемая соль.
3. Производное цианопирролидина формулы (1) по п.1, где R1 представляет атом фтора и R2 представляет атом водорода, или его фармацевтически приемлемая соль.
4. Производное цианопирролидина формулы (1) по п.1, где R1 представляет атом фтора и R2, R3 и R4 каждый представляют атом водорода, или его фармацевтически приемлемая соль.
5. Производное цианопирролидина, представленное формулой (2)
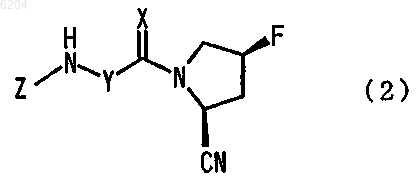
[где X представляет атом кислорода,
Y представляет -CR5R6- или циклопентилен,
[где R5 и R6 являются одинаковыми или разными и каждый представляет атом водорода или алкильную группу, имеющую от 1 до 10 атомов углерода, которая необязательно замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из -NHCO-(CH2)m-бензилоксикарбонил (где m равно целому числу от 1 до 5) и -OR14 (где R14 представляет образующую цепь алкильную группу, имеющую от 1 до 5 атомов углерода, или бензильную группу)], и
Z представляет атом водорода или алкильную группу, имеющую от 1 до 10 атомов углерода, которая необязательно замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из гидроксильной группы, гидроксиалкильной группы, имеющей от 1 до 5 атомов углерода, фенильной группы, которая может быть замещена по меньшей мере одной алкоксигруппой, имеющей от 1 до 4 атомов углерода, -NH-пиридильной группы, которая может быть замещена по меньшей мере одним заместителем, выбранным из цианогруппы, нитрогруппы, атома галогена и аминокарбонильной группы, и -OR14 (где R14 представляет образующую цепь алкильную группу, имеющую от 1 до 5 атомов углерода, или бензильную группу), или
Y и Z вместе с атомом азота, к которому они присоединены, образуют изохинолинильную группу или пирролидильную группу, которая необязательно замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из гидроксильной группы, образующей цепь алкильной группы, имеющей от 1 до 5 атомов углерода, и -OR15 (где R15 представляет образующую цепь алкильную группу, имеющую от 1 до 5атомов углерода, или аминокарбонилметильную группу)]
или его фармацевтически приемлемая соль.
6. Производное цианопирролидина формулы (1) по п.1 или формулы (2) по п.5, где Y представляет -CH2-, или его фармацевтически приемлемая соль.
7. Производное цианопирролидина формулы (1) или (2) по п.6, где Z представляет разветвленную или циклическую алкильную группу, имеющую от 4 до 10 атомов углерода, которая необязательно замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из гидроксильной группы и гидроксиалкильной группы, имеющей от 1 до 5 атомов углерода, или его фармацевтически приемлемая соль.
8. Производное цианопирролидина формулы (1) или (2) по п.6, где Z представляет трет-бутильную группу, (1-гидроксиметил)циклопентильную группу или (2-гидрокси-1,1-диметил)этильную группу, или его фармацевтически приемлемая соль.
9. Производное цианопирролидина формулы (1) по п.1 или формулы (2) по п.5, где Y представляет -CR5R6- (где R5 представляет атом водорода) и Z представляет атом водорода, или его фармацевтически приемлемая соль.
10. Производное цианопирролидина формулы (1) по п.1 или формулы (2) по п.5, где Y представляет -CR5R6- (где R5 представляет атом водорода, R6 представляет разветвленную или циклическую алкильную группу, имеющую от 3 до 6 атомов углерода) и Z представляет атом водорода, или его фармацевтически приемлемая соль.
11. Производное цианопирролидина формулы (1) по п.1 или формулы (2) по п.5, где Y представляет -CH[CH(CH3)2]-, -CH[C(CH3)3]- или -CH[CH(CH3)CH2CH3]- и Z представляет атом водорода, или его фармацевтически приемлемая соль.
12. Фармацевтический препарат, который включает в качестве эффективного ингредиента производное цианопирролидина или его фармацевтически приемлемую соль по любому одному из пп.1-11.
13. Применение фармацевтического препарата по п.12 для профилактики или лечения заболевания или состояния, способного улучшаться ингибированием дипептидилпептидазы IV.
14. Применение по п.13, где заболеванием или состоянием, способным улучшаться ингибированием дипептидилпептидазы IV, является сахарный диабет.
15. Применение по п.13, где заболеванием или состоянием, способным улучшаться ингибированием дипептидилпептидазы IV, является иммунное заболевание.
Текст
006204 Техническая область Настоящее изобретение относится к новым производным цианопирролидина. Предпосылки создания изобретения Дипептидилпептидаза IV (DPP IV) является видом серинпротеаз, которые могут гидролизовать дипептид из пептидной цепи, имеющей пролин или аланин во втором положении от N-конца. DPP IV распределена в различных тканях (включая почки или печень) и плазме и принимает участие в метаболизмах различных физиологически активных пептидов. Недавно было показано, что DPP IV действует на метаболизм подобного глюкагону пептида-1(GLP-1). То есть DPP IV гидролизует дипептид N-концевого His-Ala пептида GLP-1, при этом GLP-1 инактивируется и инактивированный продукт действует в качестве антагониста рецептора GLP-1. Обнаружено, что GLP-1 обладает физиологическими действиями, такими как ускоряющее действие на секрецию инсулина из поджелудочной железы, пролонгирующее действие на время опорожнения желудка или ингибирующее действие на пищеварение. В соответствии с этим, ингибирование DPP IV повышает действие GLP-1, усиливает действие инсулина и улучшает метаболизм глюкозы, следовательно,как предполагается, ингибирование DPP IV является полезным для лечения сахарного диабета типа 2. Кроме того, обнаружено, что DPP IV принимает участие в метаболизме нейропептида Y, который является видом нейропептидов, активации Т-клеток, которые являются иммунокомпететными клетками,адгезии раковых клеток к эндотелию или инвазии вируса ВИЧ в лимфоциты. В соответствии с этим, считается, что ингибирование DPP IV является полезным для лечения иммунных заболеваний и т.д. Кроме того, высокий уровень экспрессии DPP IV обнаружен в фибробластах кожи пациентовлюдей с псориазом, ревматоидным артритом и красным плоским лишаем и высокая активность DPP IV обнаружена у пациентов с доброкачественной гипертрофией простаты. В соответствии с этим, предполагается также, что DPP IV является эффективным при лечении кожных болезней и доброкачественной гипертрофии простаты. Среди ингибирующих DPP IV соединений, которые известны к настоящему времени, имеются соединения, которые замещены атомом фосфора в 2-положении пирролидина (J. Med. Chem., 37, 39693976, 1994), и соединения, которые замещены атомом бора в 2-положении пирролидина (Biochemistry,32, 8723-8731, 1993). Известны также соединения, которые замещены цианогруппой в 2-положении пирролидина (Arch. Biochem. Biophys., 323, 148-152, 1995; Bioorg. Med. Chem. Lett., 6, 1163-1166. 1996; Biochemistry, 38, 11597-11603, 1999), но не имеется сообщений по любым ингибиторам, которые имеют заместитель(и) в 3- или 4-положении производных 2-цианопирролидина. Целью настоящего изобретения являются новые производные цианопирролидина, которые обладают превосходной ингибирующей DPP IV активностью. Описание изобретения В результате продолжительных обширных исследований для достижения вышеуказанной цели авторы настоящего изобретения обнаружили, что некоторые производные цианопирролидина обладают превосходной ингибирующей DPP IV активностью, и, таким образом, настоящее изобретение было выполнено. Один аспект настоящего изобретения относится к соединению, представленному формулой (1) (в дальнейшем называемое соединением настоящего изобретения) где R1 представляет атом галогена, гидроксильную группу, алкоксигруппу, имеющую от 1 до 5 атомов углерода, или алкильную группу, имеющую от 1 до 5 атомов углерода, R2 представляет атом водорода,атом галогена, гидроксильную группу, алкоксигруппу, имеющую от 1 до 5 атомов углерода, или алкильную группу, имеющую от 1 до 5 атомов углерода, или R1 и R2 вместе образуют оксо, гидроксииминогруппу, алкоксииминогруппу, имеющую от 1 до 5 атомов углерода, или алкилиденовую группу, имеющую от 1 до 5 атомов углерода,R3 и R4 представляют, каждый, атом водорода, атом галогена, гидроксильную группу, алкоксигруппу, имеющую от 1 до 5 атомов углерода, или алкильную группу, имеющую от 1 до 5 атомов углерода,или R3 и R4 вместе образуют оксо, гидроксииминогруппу, алкоксииминогруппу, имеющую от 1 до 5 атомов углерода, или алкилиденовую группу, имеющую от 1 до 5 атомов углерода, X представляет атом кислорода или атом серы, Y представляет -CR5R6-, где R5 и R6 являются одинаковыми или разными, и каждый представляет атом водорода; атом галогена; алкильную группу, имеющую от 1 до 10 атомов углерода, которая, необязательно, замещена по меньшей мере одним заместителем, выбранным из группы,состоящей из атома галогена, гидроксильной группы, гидроксиалкильной группы, имеющей от 1 до 5 атомов углерода, карбоксильной группы, меркаптогруппы, алкилтиогруппы, имеющей от 1 до 5 атомов углерода, гуанидильной группы, необязательно замещенной фенильной группы, имидазолильной груп-1 006204 пы, индолильной группы, -NHR11 (где R11 представляет атом водорода, необязательно замещенную фенильную группу, необязательно замещенную пиридильную группу, трет-бутоксикарбонильную группу или бензилоксикарбонильную группу), -CONHR12 (где R12 представляет атом водорода или -(CH2)m-R13,где m равно целому числу от 1 до 5 и R13 представляет атом водорода, метоксикарбонильную группу,этоксикарбонильную группу или бензилоксикарбонильную группу) и -OR14, где R14 представляет образующую цепь алкильную группу, имеющую от 1 до 5 атомов углерода, или бензильную группу; или алкенильную группу, имеющую от 2 до 10 атомов углерода, которая, необязательно, замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы,карбоксильной группы, аминогруппы, аминокарбонильной группы и образующей цепь алкоксигруппы,имеющей от 1 до 5 атомов углерода, или -CR7R8-CR9R10- (где R7, R8, R9 и R10 являются одинаковыми или разными и каждый представляет атом водорода; атом галогена или алкильную группу, имеющую от 1 до 10 атомов углерода, которая, необязательно, замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы, гидроксиалкильной группы,имеющей от 1 до 5 атомов углерода, карбоксильной группы, меркаптогруппы, алкилтиогруппы, имеющей от 1 до 5 атомов углерода, гуанидильной группы, необязательно замещенной фенильной группы,имидазолильной группы, индолильной группы, -NHR11 (где R11 представляет атом водорода, необязательно замещенную фенильную группу, необязательно замещенную пиридильную группу, третбутоксикарбонильную группу или бензилоксикарбонильную группу), -CONHR12, где R12 представляет атом водорода или -(CH2)m-R13 (где m равно целому числу от 1 до 5 и R13 представляет атом водорода, метоксикарбонильную группу, этоксикарбонильную группу или бензилоксикарбонильную группу) и -OR14 (где R14 представляет образующую цепь алкильную группу, имеющую от 1 до 5 атомов углерода, или бензильную группу),или R7 и R9 вместе с атомами углерода, к которым они присоединены, образуют циклоалкильную группу,имеющую от 3 до 8 атомов углерода, которая, необязательно, замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы, карбоксильной группы,аминогруппы, аминокарбонильной группы, образующей цепь алкильной группы, имеющей от 1 до 5 атомов углерода и образующей цепь алкоксигруппы, имеющей от 1 до 5 атомов углерода; циклоалкенильную группу, имеющую от 4 до 8 атомов углерода, которая, необязательно, замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы,карбоксильной группы, аминогруппы, аминокарбонильной группы, образующей цепь алкильной группы,имеющей от 1 до 5 атомов углерода, и образующей цепь алкоксигруппы, имеющей от 1 до 5 атомов углерода; бициклоалкильную группу, имеющую от 5 до 10 атомов углерода, которая, необязательно, замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы, карбоксильной группы, аминогруппы, аминокарбонильной группы, образующей цепь алкильной группы, имеющей от 1 до 5 атомов углерода, и образующей цепь алкоксигруппы, имеющей от 1 до 5 атомов углерода, или бициклоалкенильную группу, имеющую от 5 до 10 атомов углерода, которая,необязательно, замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы, карбоксильной группы, аминогруппы, аминокарбонильной группы, образующей цепь алкильной группы, имеющей от 1 до 5 атомов углерода, и образующей цепь алкоксигруппы, имеющей от 1 до 5 атомов углерода, иZ представляет атом водорода или алкильную группу, имеющую от 1 до 10 атомов углерода, которая, необязательно, замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы, гидроксиалкильной группы, имеющей от 1 до 5 атомов углерода, карбоксильной группы, меркаптогруппы, алкилтиогруппы, имеющей от 1 до 5 атомов углерода,гуанидильной группы, необязательно замещенной фенильной группы, имидазолильной группы, индолильной группы, -NHR11 (где R11 представляет атом водорода, необязательно замещенную фенильную группу, необязательно замещенную пиридильную группу, трет-бутоксикарбонильную группу или бензилоксикарбонильную группу), -CONHR12, где R12 представляет атом водорода или -(СН 2)m-R13 (где m равно целому числу от 1 до 5, и R13 представляет атом водорода, метоксикарбонильную группу, этоксикарбонильную группу или бензилоксикарбонильную группу) и -OR14 (где R14 представляет образующую цепь алкильную группу, имеющую от 1 до 5 атомов углерода, или бензильную группу),или Y и Z вместе с атомом азота, к которому они присоединены, образуют циклическую аминогруппу, имеющую от 2 до 10 атомов углерода, которая, необязательно, замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы, аминогруппы, образующей цепь алкильной группы, имеющей от 1 до 5 атомов углерода, и -OR15 (где R15 представляет образующую цепь алкильную группу, имеющую от 1 до 5 атомов углерода, аминокарбонилметильную группу или бензильную группу) или его фармацевтически приемлемой соли. Лучший способ осуществления изобретения Другой аспект настоящего изобретения относится к производному цианопирролидина формулы (1),где R1 представляет атом галогена, гидроксильную группу, алкоксигруппу, имеющую от 1 до 5 атомов углерода, или алкильную группу, имеющую от 1 до 5 атомов углерода, и R2, R3 и R4 представляют, каждый, атом водорода, атом галогена, гидроксильную группу, алкоксигруппу, имеющую от 1 до 5 атомов-2 006204 углерода, или алкильную группу, имеющую от 1 до 5 атомов углерода, или его фармацевтически приемлемой соли. Еще один аспект настоящего изобретения относится к производному цианопирролидина формулы(1), где R1 представляет атом фтора или атом хлора, или его фармацевтически приемлемой соли. Следующий аспект настоящего изобретения относится к производному цианопирролидина формулы (1), где R1 представляет атом фтора и R2 представляет атом водорода, или его фармацевтически приемлемой соли. Еще один аспект настоящего изобретения относится к производному цианопирролидина формулы(1), где R1 представляет атом фтора и R2, R3 и R4 представляют, каждый, атом водорода, или его фармацевтически приемлемой соли. Еще один аспект настоящего изобретения относится к производному цианопирролидина, представленному формулой (2) где X, Y и Z имеют указанные выше значения, или его фармацевтически приемлемой соли. Еще один аспект настоящего изобретения относится к производному цианопирролидина формулы(1) или (2), где X представляет атом кислорода, или его фармацевтически приемлемой соли. Еще один аспект настоящего изобретения относится к производному цианопирролидина формулы(1) или (2), где Y представляет -СН 2-, или его фармацевтически приемлемой соли. Еще один аспект настоящего изобретения относится к производному цианопирролидина формулы(1) или (2), где Y представляет -СН 2- и Z представляет разветвленную или циклическую алкильную группу, имеющую от 4 до 10 атомов углерода, которая, необязательно, замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из гидроксильной группы и гидроксиалкильной группы,имеющей от 1 до 5 атомов углерода, или его фармацевтически приемлемой соли. Еще один аспект настоящего изобретения относится к производному цианопирролидина формулы(1) или (2), где Y представляет -СН 2- и Z представляет трет-бутильную группу, (1 гидроксиметил)циклопентильную группу или (2-гидрокси-1,1-диметил)этильную группу, или его фармацевтически приемлемой соли. Еще один аспект настоящего изобретения относится к производному цианопирролидина формулы(1) или (2), где Y представляет -CR5R6- (где R5 представляет атом водорода) и Z представляет атом водорода, или его фармацевтически приемлемой соли. Еще один аспект настоящего изобретения относится к производному цианопирролидина формулы(1) или (2), где Y представляет -CR5R6- (где R5 представляет атом водорода, R6 представляет разветвленную или циклическую алкильную группу, имеющую от 3 до 6 атомов углерода) и Z представляет атом водорода, или его фармацевтически приемлемой соли. Еще один аспект настоящего изобретения относится к производному цианопирролидина формулы(1) или (2), где Y представляет -СН[СН(СН 3)2]-, -СН[С(СН 3)3]- или -СН[СН(СН 3)СН 2 СН 3]-и Z представляет атом водорода, или его фармацевтически приемлемой соли. Еще один аспект настоящего изобретения относится к фармацевтическому препарату, который включает в качестве эффективного ингредиента вышеуказанное производное цианопирролидина или его фармацевтически приемлемую соль. Еще один аспект настоящего изобретения относится к вышеуказанному фармацевтическому препарату для профилактики или лечения заболевания или состояния, которое можно улучшить ингибированием дипептидилпептидазы IV. Еще один аспект настоящего изобретения относится к вышеуказанному фармацевтическому препарату, где заболеванием или состоянием, которое можно улучшить ингибированием дипептидилпептидазы IV, является сахарный диабет. Еще один аспект настоящего изобретения относится к вышеуказанному фармацевтическому препарату, где заболеванием или состоянием, которое можно улучшить ингибированием дипептидилпептидазы IV, является иммунное заболевание. В настоящем изобретении термин цепь означает неразветвленную или разветвленную цепь. Атом галогена означает атом фтора, атом хлора, атом брома или атом иода. Алкоксигруппа, имеющая от 1 до 5 атомов углерода, означает неразветвленную, разветвленную или циклическую алкоксигруппу, примерами которой являются метоксигруппа, этоксигруппа, пропоксигруппа, изопропоксигруппа, бутоксигруппа, изобутоксигруппа, трет-бутоксигруппа, циклопропилметоксигруппа, пентилоксигруппа и изопентилоксигруппа. Алкильная группа, имеющая от 1 до 5 атомов углерода, означает неразветвленную, разветвленную или циклическую алкильную группу, примерами которой являются метильная группа, этильная группа,пропильная группа, изопропильная группа, циклопропильная группа, бутильная группа, изобутильная-3 006204 группа, втор-бутильная группа, трет-бутильная группа, циклобутильная группа, циклопропилметильная группа, пентильная группа, изопентильная группа, циклопентильная группа, циклобутилметильная группа и 1-этилпропильная группа. Алкоксииминогруппа, имеющая от 1 до 5 атомов углерода, означает иминогруппу, замещенную неразветвленной, разветвленной или циклической алкоксигруппой, и примерами ее являются метоксииминогруппа, этоксииминогруппа, пропоксииминогруппа, изопропоксииминогруппа, бутоксииминогруппа,изобутоксииминогруппа, трет-бутоксииминогруппа, циклопропилметоксииминогруппа, пентилоксииминогруппа и изопентилоксииминогруппа. Алкилиденовая группа, имеющая от 1 до 5 атомов углерода, означает неразветвленную, разветвленную или циклическую алкилиденовую группу и примерами ее являются метиленовая группа, этилиденовая группа, пропилиденовая группа, изопропилиденовая группа, бутилиденовая группа, изобутилиденовая группа, циклопропилметиленовая группа и пентилиденовая группа. Алкильная группа, имеющая от 1 до 10 атомов углерода, которая, необязательно, замещена, означает неразветвленную, разветвленную или циклическую алкильную группу, имеющую от 1 до 10 атомов углерода, которая является замещенной или незамещенной и примерами которой являются метильная группа, этильная группа, пропильная группа, изопропильная группа, бутильная группа, изобутильная группа, втор-бутильная группа, трет-бутильная группа, пентильная группа, изопентильная группа, гексильная группа, гептильная группа, октильная группа, нонильная группа, децильная группа, циклоалкильную группу, имеющую от 3 до 10 атомов углерода (например, циклопропильную группу, циклобутильную группу, циклопентильную группу, циклобутилметильную группу, циклогексильную группу,циклогептильную группу или циклооктильную группу), циклоалкенильную группу, имеющую от 4 до 8 атомов углерода (например, циклобутенильную группу, циклопентенильную группу, циклогексенильную группу, циклогептенильную группу или циклооктенильную группу), бициклоалкильную группу, имеющую от 5 до 10 атомов углерода, которая, необязательно, замещена (например, бициклопентильную группу, бициклогексильную группу, бициклогептильную группу, бициклооктильную группу, бициклононильную группу или бициклодецильную группу), бициклоалкенильную группу, имеющую от 5 до 10 атомов углерода, которая, необязательно, замещена (например, бициклопентенильную группу, бициклогексенильную группу, бициклогептенильную группу, бициклооктенильную группу, бициклононенильную группу или бициклодеценильную группу), мостиковую циклическую углеводородную группу (например, адамантильную группу, борнильную группу, норборнильную группу, пинанильную группу, туйиловую группу, кариловую группу или камфаниловую группу) и алкильную группу, атом водорода которой замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена,гидроксильной группы, гидроксиалкильной группы, имеющей от 1 до 5 атомов углерода, карбоксильной группы, меркаптогруппы, алкилтиогруппы, имеющей от 1 до 5 атомов углерода, гуанидильной группы,необязательно замещенной фенильной группы, имидазолильной группы, индолильной группы, -NHR11(где R11 представляет атом, водорода, необязательно замещенную фенильную группу, необязательно замещенную пиридильную группу, трет-бутоксикарбонильную группу или бензилоксикарбонильную группу) , -CONHR12, где R12 представляет атом водорода или -(CH2)m-R13 (где m равно целому числу от 1 до 5 и R13 представляет атом водорода, метоксикарбонильную группу, этоксикарбонильную группу или бензилоксикарбонильную группу) и -OR14 (где R14 представляет неразветвленную или разветвленную алкильную группу, имеющую от 1 до 5 атомов углерода, или бензильную группу). Примерами замещенной фенильной группы необязательно замещенной фенильной группы являются фенильная группа, замещенная по меньшей мере одним заместителем, выбранным из группы, состоящей из гидроксильной группы и неразветвленной или разветвленной алкоксигруппы, имеющей от 1 до 5 атомов углерода (например, 4-гидроксифенильная группа или 3,4-диметоксифенильная группа). Примерами замещенной пиридильной группы необязательно замещенной пиридильной группы (например, пиридин-2-ильной группы) являются пиридильная группа, замещенная по меньшей мере одним заместителем, выбранным из группы, состоящей из цианогруппы, нитрогруппы, атома галогена и аминокарбонильной группы (например, 5-цианопиридин-2-ильная группа, 5-нитропиридин-2-ильная группа,хлорпиридин-2-ильная группа или 5-аминокарбонилпиридин-2-ильная группа). Примерами гидроксиалкильной группы, имеющей от 1 до 5 атомов углерода, являются гидроксиметильная группа, 1-гидроксиэтильная группа, 2-гидроксиэтильная группа, 1-гидроксипропильная группа,2-гидроксипропильная группа, 3-гидроксипропильная группа, 1-(гидроксиметил)этильная группа, 1 гидрокси-1-метилэтильная группа, 4-гидроксибутильная группа и 5-гидроксипентильная группа. Примерами алкилтиогруппы, имеющей от 1 до 5 атомов углерода, являются метилтиогруппа, этилтиогруппа, пропилтиогруппа, изопропилтиогруппа, бутилтиогруппа, трет-бутилтиогруппа и пентилтиогруппа. Алкенильная группа, имеющая от 2 до 10 атомов углерода, которая, необязательно, замещена, означает неразветвленную, разветвленную или циклическую алкенильную группу, имеющую от 2 до 10 атомов углерода, которая является замещенной или незамещенной и примерами которой являются алкенильные группы (например, винильная группа, аллильная группа, пропенильная группа, изопропенильная группа, бутенильная группа, изобутенильная группа, пентенильная группа, гексенильная группа, геп-4 006204 тенильная группа, октенильная группа, циклопентенильная группа или циклогексенильная группа) и алкенильная группа, атом водорода которой заменен по меньшей мере одной группой, выбранной из группы, состоящей из атома галогена, гидроксильной группы, карбоксильной группы, аминогруппы, аминокарбонильной группы и неразветвленной или разветвленной алкоксигруппы, имеющей от 1 до 5 атомов углерода. Циклоалкильная группа, имеющая от 3 до 8 атомов углерода, которая является необязательно замещенной, означает циклоалкильную группу, которая является замещенной или незамещенной, и примерами которой являются циклоалкильная группа (например, циклопропильная группа, циклобутильная группа, циклопентильная группа, циклогексильная группа, циклогептильная группа или циклооктильная группа) и циклоалкильная группа, атом водорода которой замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы, карбоксильной группы, аминогруппы, аминокарбонильной группы, неразветвленной или разветвленной алкильной группы,имеющей от 1 до 5 атомов углерода, и неразветвленной или разветвленной алкоксигруппы, имеющей от 1 до 5 атомов углерода. Циклоалкенильная группа, имеющая от 4 до 8 атомов углерода, которая является необязательно замещенной, означает циклоалкенильную группу, которая является замещенной или незамещенной, и примерами которой являются циклоалкенильная группа (например, циклобутенильная группа, циклопентенильная группа, циклогексенильная группа, циклогептенильная группа или циклооктенильная группа) и циклоалкенильная группа, атом водорода которой замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы, карбоксильной группы, аминогруппы, аминокарбонильной группы, неразветвленной или разветвленной алкильной группы, имеющей от 1 до 5 атомов углерода, и неразветвленной или разветвленной алкоксигруппы, имеющей от 1 до 5 атомов углерода. Бициклоалкильная группа, имеющая от 5 до 10 атомов углерода, которая является необязательно замещенной,означает бициклоалкильную группу, которая является замещенной или незамещенной, и примерами которой являются бициклоалкильная группа (например, бициклопентильная группа, бициклогексильная группа, бициклогептильная группа, бициклооктильная группа, бициклононильная группа или бициклодецильная группа) и бициклоалкильная группа, атом водорода которой замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы,карбоксильной группы, аминогруппы, аминокарбонильной группы, неразветвленной или разветвленной алкильной группы, имеющей от 1 до 5 атомов углерода, и неразветвленной или разветвленной алкоксигруппы, имеющей от 1 до 5 атомов углерода. Бициклоалкенильная группа, имеющая от 5 до 10 атомов углерода, которая является необязательно замещенной, означает бициклоалкенильную группу, которая является замещенной или незамещенной, и примерами которой являются бициклоалкенильные группы (например, бициклопентенильная группа,бициклогексенильная группа, бициклогептенильная группа, бициклооктенильная группа, бициклононенильная группа или бициклодеценильная группа) и бициклоалкенильная группа, атом водорода которой замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена,гидроксильной группы, карбоксильной группы, аминогруппы, аминокарбонильной группы, неразветвленной или разветвленной алкильной группы, имеющей от 1 до 5 атомов углерода, и неразветвленной или разветвленной алкоксигруппы, имеющей от 1 до 5 атомов углерода. Циклическая аминогруппа, имеющая от 2 до 10 атомов углерода, которая является необязательно замещенной, означает циклическую аминогруппу, которая имеет по меньшей мере один атом азота и имеет, необязательно по меньшей мере один атом кислорода и атом серы в кольце, и является замещенной или незамещенной и примерами которой являются циклическая аминогруппа (например, азиридильная группа, азетидильная группа, пирролидильная группа, имидазолидильная группа, оксазолидильная группа, тиазолидильная группа, пиперидильная группа, морфолинильная группа, азабициклогептильная группа или азабициклооктильная группа), циклическая аминогруппа, которая конденсирована с кольцом бензола или кольцом пиридина, и циклическая аминогруппа (включая группы, которые являются конденсированными с кольцом бензола или кольцом пиридина), атом водорода которой замещен, по меньшей мере, одной группой, выбранной из группы, состоящей из атома галогена, гидроксильной группы,аминогруппы, неразветвленной или разветвленной алкильной группы, имеющей от 1 до 5 атомов углерода, и -OR15 (где R15 представляет неразветвленную или разветвленную алкильную группу, имеющую от 1 до 5 атомов углерода, аминокарбонилметильную группу или бензильную группу). Примерами фармацевтически приемлемой соли являются соли с минеральными кислотами, такими как серная кислота, хлористо-водородная кислота, бромисто-водородная кислота или фосфорная кислота, и соли с органическими кислотами, такими как уксусная кислота, щавелевая кислота, молочная кислота, винная кислота, фумаровая кислота, малеиновая кислота, трифторуксусная кислота или метансульфоновая кислота. Предпочтительными соединениями настоящего изобретения являются следующие соединения:-5 006204 С точки зрения активности по ингибированию DPP IV, R1 предпочтительно представляет атом галогена и, особенно предпочтительно, атом фтора. R2, предпочтительно, представляет атом водорода или атом галогена и, особенно предпочтительно, атом водорода. В формуле (1) или (2) , когда Y представляет -СН 2-, Z представляет, предпочтительно, алкильную группу, имеющую от 1 до 10 атомов углерода, которая является, необязательно, замещенной, по меньшей мере, одним заместителем, выбранным из группы, состоящей из гидроксильной группы, алкоксигруппы,имеющей от 1 до 5 атомов углерода, гидроксиалкильной группы, имеющей от 1 до 5 атомов углерода,необязательно замещенной фенильной группы и -NHR11 (где R11 представляет необязательно замещенную пиридильную группу). В этом случае Z предпочтительно представляет разветвленную или циклическую алкильную группу, имеющую от 4 до 10 атомов углерода, которая необязательно замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из гидроксильной группы, гидроксиалкильной группы, имеющей от 1 до 5 атомов углерода, и алкоксигруппы, имеющей от 1 до 5 атомов углерода, и, особенно предпочтительно, разветвленную алкильную группу, имеющую от 4 до 10 атомов углерода, которая, необязательно, является замещенной по меньшей мере одним заместителем, выбранным из группы, состоящей из гидроксильной группы и гидроксиалкильной группы, имеющей от 1 до 5 атомов углерода, циклоалкильную группу, имеющую от 4 до 10 атомов углерода, или адамантильную группу, и наиболее предпочтительно, трет-бутильную группу, (1-гидроксиметил)циклопентильную группу или (2-гидрокси-1,1-диметилэтильную группу. В формуле (1) или (2) предпочтительно, чтобы, когда Y представляет -CR5R6- (где R5 представляет атом водорода, R6 представляет необязательно замещенную алкильную группу, имеющую от 1 до 10 атомов углерода) или -CR7R8-CR9R10- (где R8 и R10 представляют, каждый, водород и R7 и R9 вместе с атомами углерода, к которым они присоединены, образуют циклоалкильную группу, имеющую от 3 до 8 атомов углерода), Z представлял Н или -СН 3. В этом случае далее предпочтительно, чтобы, когда Y представляет -CR5R6-, где R5 представляет атом водорода, R6 представляет разветвленную или циклическую алкильную группу, имеющую от 3 до 6 атомов углерода, которая, необязательно, замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из гидроксильной группы и -OR14 (где R14 представляет неразветвленную или разветвленную алкильную группу, имеющую от 1 до 5 атомов углерода, или бензильную группу), Z представлял атом водорода. Далее предпочтительно, чтобы, когда Y представляет -CR5R6- (где R5 представляет атом водорода и R6 представляет разветвленную или циклическую алкильную группу, имеющую от 3 до 6 атомов углерода), Z представлял атом водорода, и, особенно предпочтительно, чтобы, когда Y представляет -СН[СН(СН 3)2]-, -СН[С(СН 3)3] - или -СН[СН(СН 3)СН 2 СН 3]-, Z представлял атом водорода. В формуле (1) или (2) предпочтительными примерами необязательно замещенной циклической аминогруппы, имеющей от 2 до 10 атомов углерода, которая образована Y и Z вместе с атомом азота, к которому они присоединены, являются пирролидильная группа, пиперидильная группа и циклическая аминогруппа, которая образована конденсацией пирролидильной группы или пиперидильной группы с кольцом бензола, и предпочтительный заместитель ее включает гидроксильную группу или -OR15 (гдеR15 имеет указанные выше значения). Соединения настоящего изобретения могут ингибировать дипептидилпептидазу IV и, следовательно, они повышают активность инсулина, повышают метаболизм глюкозы и могут содействовать ингибированию метаболизма нейропептида Y, ингибированию активности Т-клеток, ингибированию адгезии раковых клеток к эндотелию и профилактике инвазии вирусов ВИЧ в лимфоциты. В соответствии с этим, настоящее изобретение относится к фармацевтическому препарату для профилактики или лечения заболеваний или состояний, которые можно улучшить ингибированием дипептидилпептидазы IV, например, сахарного диабета (особенно типа 2), иммунных заболеваний, артрита,ожирения, остеопороза, состояний толерантности к глюкозе, доброкачественной гипертрофии простаты или кожных болезней. Фармацевтический препарат для иммунных заболеваний включает иммуносупрессоры для трансплантации тканей, например ингибиторы высвобождения цитокина при различных аутоиммунных заболеваниях, таких как воспалительный энтерит, рассеянный склероз или хронический ревматоидный артрит (RA), лекарственные средства, полезные для профилактики или лечения СПИДа вследствие предотвращения инвазии ВИЧ в Т-клетки, лекарственные средства для предотвращения образования метастаз,особенно, предотвращения образования метастаз рака молочной железы или простаты в легкие. Фармацевтический препарат настоящего изобретения можно вводить системно или местно, пероральным или парентеральным, например, ректальным, подкожным, внутримышечным, внутривенным или подкожным способом. Для использования соединения настоящего изобретения в виде фармацевтического препарата любую лекарственную форму можно должным образом выбрать, при необходимости, из твердых композиций, жидких композиций и других композиций. Фармацевтический препарат настоящего изобретения можно получить смешиванием соединения настоящего изобретения с фармацевтически приемлемыми носителями. В частности, таблетки, пилюли, капсулы, гранулы, порошки, тонкоизмельченные порошки,растворы, эмульсии, суспензии или инъекции можно получить добавлением подходящих эксципиентов,-6 006204 наполнителей, связующих, дезинтеграторов, агентов для образования покрытий, сахарных агентов для образования покрытия, регуляторов рН, солюбилизирующих агентов или водных или неводных растворителей в соответствии с общепринятыми способами получения фармацевтических препаратов. Эксципиенты и наполнители включают лактозу, стеарат магния, крахмал, тальк, желатин, агар, пектин, аравийскую камедь, оливковое масло, кунжутное масло, масло какао, этиленгликоль и другие общепринятые вещества. Кроме того, соединения настоящего изобретения можно изготовить в форме соединения включения с -, - или -циклодекстрином или метилированным циклодекстрином. Доза соединения настоящего изобретения изменяется в зависимости от заболевания, состояния,массы тела, возраста, пола, пути введения, но доза для взрослого человека, предпочтительно, составляет приблизительно от 1 до приблизительно 1000 мг/кг массы теладень для перорального введения, и, особенно предпочтительно, приблизительно от 10 до приблизительно 200 мг/кг массы теладень, ее можно вводить однократно или в виде разделенной общей дозы. Соединения формулы (I) можно получить общими способами получения. Общий способ получения Схема реакций 1 где X, Y, Z, R1, R2, R3 и R4 имеют указанные выше значения, Ra представляет цианогруппу, аминокарбонильную группу или алкоксикарбонильную группу и Rb представляет защитную группу аминогруппы. Удаление защитной группы можно проводить способом, описанным в Protective Groups in OrganicSynthesis by Theodora W. Greene and Peter G. M. Wuts. Например, соединение, у которого Rb представляет группу, которую нужно удалить кислотой (например, трет-бутоксикарбонильную группу, тритильную группу или о-нитробензолсульфенильную группу), можно освободить от защитной группы с использованием кислоты, такой как хлористоводородная кислота, серная кислота, трифторуксусная кислота, п-толуолсульфоновая кислота или метансульфоновая кислота. В этом случае удаление защитной группы можно проводить с использованием кислоты, которую разбавляют или растворяют в органическом растворителе или воде. Реакцию можно проводить при температуре от -50 до 50 С. Примерами органического растворителя является этанол, метанол, тетрагидрофуран, N,N-диметилформамид, дихлорметан, хлороформ и 1,2-дихлорэтан. Кроме того,например, соединение, у которого Rb представляет группу, которую нужно удалить гидрогенолизом (например, бензилоксикарбонильную группу), можно удалить гидрогенолизом с использованием металлического катализатора (например, палладия). Растворитель, который используют, включает инертный в реакции растворитель (например, этанол, метанол, тетрагидрофуран или этилацетат). Реакцию можно проводить при температуре от 0 до 100 С. Кроме того, данное взаимодействие можно также проводить с использованием газообразного водорода или с использованием комбинации реагентов (например, муравьиная кислота-формиат аммония). В качестве другого примера, соединение, у которого Rb представляет защитную группу, которую нужно удалить основанием (например, флуоренилоксикарбонильная группа), можно освободить от защитной группы с использованием основания (например, диэтиламина,пиперидина, аммиака, гидроксида натрия или карбоната калия). Эти основания можно использовать непосредственно или после разбавления, растворения или суспендирования в растворителе. В этом случае примерами растворителя, который используют, являются вода, этанол, метанол, тетрагидрофуран, N,Nдиметилформамид, дихлорметан, хлороформ и 1,2-дихлорэтан. Реакцию можно проводить при температуре от 0 до 100 С. Кроме того, соединение, у которого Rb представляет группу, которую нужно удалить металлическим катализатором (например, аллилоксикарбонильную группу), можно удалить с использованием, например, тетракис(трифенилфосфин)палладия в качестве катализатора или реагента в инертном в реакции растворителе (например, дихлорметане, хлороформе или тетрагидрофуране). Реакцию можно проводить при температуре от 0 до 100 С. Схема реакций 2 где X, Y, Z, R1, R2, R3, R4 и Ra имеют указанные выше значения и Rc представляет уходящую группу (например, атом галогена или сульфонилоксигруппу) или группу, способную превратиться в уходящую группу.-7 006204 Например, соединение, в котором Rc представляет уходящую группу (например, атом хлора, атом брома, атом иода, метансульфонилоксигруппу или п-толуолсульфонилоксигруппу) , можно подвергнуть реакции замещения с использованием первичного амина (Z-NH2) (например, этиламина, изопропиламина, трет-бутиламина, бензиламина, замещенного бензиламина, фенетиламина, замещенного фенетиламина или 2-(замещенный пиридиламино)этиламина). В этом случае амин можно использовать в избыточном количестве или, в альтернативном случае, основание можно добавить дополнительно. Примерами основания, которое можно добавить, являются амин (например, триэтиламин или диизопропилэтиламин) или неорганическое основание (например, карбонат калия). Если необходимо, для ускорения реакции можно добавить, например, иодид натрия. Растворитель для реакции включает инертный в реакции растворитель, такой как N,N-диметилформамид, тетрагидрофуран, диоксан, дихлорметан или хлороформ. Реакцию можно проводить при температуре от 0 до 100 С. Примером группы, представленной Rc и способной превратиться в уходящую группу, является гидроксильная группа, в этом случае вышеуказанную реакцию можно проводить после хлорирования,бромирования, иодирования, метансульфонирования, п-толуолсульфонирования или тому подобное. Примерами хлорирования является способ с использованием тетрахлорида углерода и трифенилфосфина, способ с использованием тионилхлорида или оксихлорида фосфора и способ замены уходящей группы на хлорид лития или тому подобное после образования уходящей группы с тозилхлоридом и т.д. Эти реакции можно проводить с использованием инертного в реакции растворителя, такого как тетрагидрофуран, диоксан, дихлорметан, хлороформ или N,N-диметилформамид, при температуре от -50 до 100 С. Примером бромирования является способ с использованием тетрабромида углерода и трифенилфосфина. Эту реакцию можно проводить с использованием инертного в реакции растворителя, такого как тетрагидрофуран, диоксан, дихлорметан, хлороформ или N,N-диметилформамид, при температуре от -50 до 50 С. Примером иодирования является способ с использованием иода, трифенилфосфина и имидазола. Эту реакцию можно проводить с использованием инертного в реакции растворителя, такого как тетрагидрофуран, диоксан, дихлорметан, хлороформ или N,N-диметилформамид, при температуре от -50 до 100 С. Каждую из рекций метансульфонирования и п-толуолсульфонирования проводят способом с использованием метансульфонилхлорида и п-толуолсульфонилхлорида, соответственно. В этих случаях можно, необязательно, добавить подходящее основание. Примерами основания, которое нужно добавить,являются амин (например, триэтиламин или диизопропилэтиламин) и неорганическое основание (например, карбонат калия). В качестве растворителя реакции можно использовать инертный в реакции растворитель (например, N,N-диметилформамид, тетрагидрофуран, диоксан, дихлорметан, хлороформ или 1,2 дихлорэтан) и реакцию можно проводить при температуре от -50 до 50 С. Схема реакций 3 где X, Y, Z, R1, R2, R3, R4, Ra, Rb и Rc имеют указанные выше значения. Например, соединение, у которого Rc представляет уходящую группу (например, атом хлора, атом брома, атом иода, метансульфонилоксигруппу или п-толуолсульфонилоксигруппу), можно подвергнуть реакции замещения с использованием соединения, представленного Z-NH-Rb (где Z и Rb имеют указанные выше значения). В этом случае в качестве основания можно использовать, например, гидрид натрия,трет-бутоксид калия, н-бутиллитий или диизопропиламин лития. В качестве растворителя можно использовать N,N-диметилформамид, тетрагидрофуран или диоксан. Реакцию можно проводить при температуре от -50 до 50 С. Примером группы, представленной Rc, способной превратиться в уходящую группу, является гидроксильная группа. В этом случае вышеуказанную реакцию можно проводить после хлорирования, бромирования, иодирования, метансульфонирования или п-толуолсульфонирования, как иллюстрировано в схеме реакций 2. Схема реакций 4 где X, Y, Z, R1, R2, R3, R4 и Ra имеют указанные выше значения, и Rd представляет уходящую группу,такую как атом галогена или сульфонилоксигруппа. Когда используют Z-Rd, аминогруппу соединения можно подвергнуть реакции с Z-Rd для получения целевого соединения. Например, соединение, у которого Rd представляет атом хлора, атом брома,-8 006204 атом иода, метансульфонилоксигруппу, п-толуолсульфонилоксигруппу или тому подобное, можно подвергнуть реакции с аминогруппой соединения в присутствии подходящего основания. Примерами основания, которое нужно добавить, являются амины (например, триэтиламин или диизопропилэтиламин) и неорганические основания (например, карбонат калия). Примерами растворителя для реакции являютсяN,N-диметилформамид, тетрагидрофуран и диоксан. Реакцию можно проводить при температуре от 0 до 100 С. Кроме того, когда Z=O (альдегидное или кетоновое соединение), реакцию можно проводить с использованием первичной аминогруппы вещества в условиях подходящего способа восстановления. Способ восстановления, который нужно использовать, включает гидрирование с использованием восстановителя (например, боргидрида натрия или цианоборгидрида натрия) или палладия. Примерами растворителя, который нужно использовать, являются инертные в реакции растворители (например, этанол, метанол, тетрагидрофуран, диоксан или вода). Реакцию можно проводить при температуре от -20 до 100 С. Схема реакций 5 где X, Y, Z, R1, R2, R3, R4, Ra, Rb и Rd имеют указанные выше значения. Защищенную аминогруппу соединения подвергают реакции с Z-Rd для получения целевого соединения. В этом случае реакцию можно проводить добавлением подходящего основания, примерами которого являются гидрид натрия, трет-бутоксид калия, н-бутиллитий и диизопропиламид лития. Примерами растворителя для реакции являются N,N-диметилформамид, тетрагидрофуран и диоксан. Реакцию можно проводить при температуре от -50 до 50 С. Схема реакций 6 где Re представляет -С(=Х)-Y-NH-Z, -С (=Х)-Y-N (Rb)-Z, -С(=Х)-Y-Rc или Rb и R1, R2, R3, R4, X, Y, Z, Rb и Rc имеют указанные выше значения. Аминокарбонильную группу можно превратить в цианогруппу общей дегидратацией, примером которой является способ с использованием трифторуксусного ангидрида. Растворитель, который нужно использовать здесь, включает растворитель, инертный в реакции, такой как дихлорметан, хлороформ,1,2-дихлорэтан, тетрагидрофуран, диоксан или N,N-диметилформамид. В этом случае, если необходимо,можно использовать основание (например, триэтиламин, диизопропилэтиламин, бикарбонат натрия или карбонат калия). Реакцию можно проводить при температуре от -50 до 50 С. Другим примером является способ с использованием оксихлорида фосфора. В этом случае растворитель, который нужно использовать здесь, включает дихлорметан, хлороформ, 1,2-дихлорэтан, тетрагидрофуран, диоксан или пиридин. Их можно использовать по отдельности или в виде комбинации по меньшей мере двух таких растворителей. Данную реакцию можно проводить с добавлением имидазола и т.д. при температуре от -50 до 50 С. Еще одним примером является способ с использованием цианурхлорида и N,N-диметилформамида. В этом случае растворитель, который нужно использовать здесь, включает дихлорметан, хлороформ, 1,2 дихлорэтан, тетрагидрофуран, диоксан или пиридин. Их можно использовать по отдельности или в виде комбинации, по меньшей мере, двух таких растворителей. Данную реакцию можно проводить при температуре от -50 до 50 С. Схема реакций 7R1, R2, R3, R4, соответственно, или группами, способными превратиться в R1, R2, R3, R4, соответственно. Примером модификации кольца пирролидина является превращение заместителя(ей). Например,соединение, у которого один из Rla, R2a, R3a и R4a представляет гидроксильную группу, подвергают галогенированию, получая при этом фторсоединение, хлорсоединение или бромсоединение или тому подоб-9 006204 ное. Подробно, примерами фторирования являются способы с использованием трифторида диэтиламиносеры, трифторида диметилсеры и т.д. Эти реакции начинают при температуре от -78 С до комнатной температуры и проводят с поддержанием температуры от комнатной температуры до 50 С с использованием инертного в реакции растворителя, такого как тетрагидрофуран, диоксан, дихлорметан, хлороформ,1,2-дихлорэтан или толуол. Другим примером фторирования является способ превращения гидроксильной группы в уходящую группу с последующим превращением в атом фтора. Превращение в уходящую группу проводят таким же способом, как иллюстрируется в схеме реакций 2. После превращения в уходящую группу способ превращения в атом фтора включает способы взаимодействия с фторидом тетрабутиламмония, фторидом цезия или тому подобное. Эти способы можно проводить с использованием инертного в реакции растворителя, такого как тетрагидрофуран, диоксан, дихлорметан, хлороформ, N,Nдиметилформамид или вода, при температуре от -50 до 100 С. Примерами хлорирования являются способ с использованием тетрахлорида углерода и трифенилфосфина, способ с использованием тионилхлорида и оксихлорида фосфора и способ превращения в уходящую группу с использованием тозилхлорида и т.д. и заменой ее хлоридом лития и т.д. Эти реакции можно проводить с использованием инертного в реакции растворителя, такого как тетрагидрофуран, диоксан, дихлорметан, хлороформ и N,N-диметилформамид, при температуре от -50 до 100 С. Еще одним примером является способ стерической инверсии гидроксильной группы, примером которого является реакция Мицунобу. В этой реакции гидроксильную группу подвергают взаимодействию с диэтилазодикарбоксилатом, трифенилфосфином и карбоновой кислотой, такой как уксусная кислота, с получением стерически инвертированного сложного эфира, который затем гидролизуют с образованием инвертированной гидроксильной группы. Эту реакцию проводят с использованием инертного в реакции растворителя, такого как тетрагидрофуран, диоксан, дихлорметан, хлороформ или N,Nдиметилформамид, при температуре от -50 до 50 С. Соединение, у которого R1 и R2 или R3 и R4 вместе образуют оксо, можно синтезировать окислением с использованием соединения, у которого один из Rla, R2a, R3a и R4a представляет гидроксильную группу. Примерами способов окисления являются способ с использованием хроматного окислителя (например, хлорхромата пиридиния или дихромата пиридиния) и способ окисления ДМСО с использованием активирующих агентов (например, диметилсульфоксида и оксалилхлорида). Например, реакцию с использованием хлорхромата пиридиния можно проводить с использованием инертного в реакции растворителя, такого как дихлорметан, хлороформ, N,N-диметилформамид, тетрагидрофуран или диоксан,при температуре от 0 до 50 С. Схема реакций 8 где R1, R2, R3, R4, Re и Ra имеют значения, указанные выше. Производное 1 Н-пирролидина или его соль подвергают конденсации с получением амидного соединения, тиоамидного соединения или карбаматного соединения. Например, амидирование можно проводить с использованием ацилгалогенида (например, ацилхлорида или ацилбромида) в инертном в реакции растворителе, таком как дихлорметан, хлороформ, 1,2-дихлорэтан, тетрагидрофуран, диоксан, толуол или этилацетат. В этом случае можно использовать основание, примерами которого являются амины(например, триэтиламин или диизопропилэтиламин), соли органических кислот (например, 2 этилгексаноат натрия или 2-этилгексаноат калия) и неорганические основания (например, карбонат калия). Эти реакции можно проводить при температуре от -50 до 100 С. Иначе, амидирование можно проводить с использованием активирующего сложного эфира, такого как 1-бензотриазолиловый эфир или сукцинимидиловый эфир, в растворителе для реакции (например, дихлорметане, хлороформе, 1,2 дихлорэтане, N,N-диметилформамиде, тетрагидрофуране, диоксане, толуоле или этилацетате). Реакцию можно проводить при температуре от -50 до 50 С. Еще одно амидирование можно проводить с использованием карбоновой кислоты и конденсирующего агента для дегидратации. Примерами конденсирующего агента для дегидратации являются гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида, дициклогексилкарбодиимид, дифенилфосфорилазид и карбонилдиимидазол. Если необходимо, можно использовать активирующий агент (например, 1 гидроксибензотриазол или гидроксисукцинимид). Примерами растворителя для реакции являются дихлорметан, хлороформ, 1,2-дихлорметан, N,N-диметилформамид, тетрагидрофуран, диоксан, толуол и этилацетат. В этом случае можно использовать основание, примерами которого являются амины (например, триэтиламин или диизопропилэтиламин), соли органических кислот (например, 2-этилгексаноат натрия или 2-этилгексаноат калия) и неорганические основания (например, карбонат калия). Реакцию можно проводить при температуре от -50 до 50 С.- 10006204 Кроме того, амидирование можно проводить, например, с использованием смешанного ангидрида кислот, полученного из карбоновой кислоты и хлоркарбоксилатного эфира. Растворитель для реакции включает инертные в реакции растворители, такие как тетрагидрофуран, диоксан, дихлорметан, хлороформ, N,N-диметилформамид, толуол или этилацетат. В этом случае можно использовать основание,примерами которого являются амины (например, триэтиламин или диизопропилэтиламин), соли органических кислот (например, 2-этилгексаноат натрия или 2-этилгексаноат калия) и неорганические основания (например, карбонат калия). Реакцию можно проводить при температуре от -50 до 50 С. Защиту аминогруппы можно проводить с использованием ди-трет-бутилдикарбоксилата, бензилоксикарбонилхлорида или флуоренилметоксикарбонилхлорида в присутствии подходящего основания. Примерами основания являются амины (например, триэтиламин или диизопропилэтиламин) и неорганические основания (например, карбонат калия). Растворители для этих реакций включают инертные для реакции растворители, такие как тетрагидрофуран, диоксан, дихлорметан, хлороформ, N,Nдиметилформамид, толуол, этилацетат или вода. Эти реакции можно проводить при температуре от -50 до 50 С. Схема реакций 9 где R1, R2, R3, R4 и Re имеют значения, указанные выше, и Rf представляет атом водорода, низшую алкильную группу, бензильную группу, аллильную группу и т.д. Способом получения является превращение карбоксильной группы, ее соли или ее эфира в аминокарбонильную группу. Когда используют соединение, у которого COORf представляет карбоксильную группу или ее соль, для синтеза можно использовать аммиак в обычных условиях амидирования. Примером амидирования является способ превращения карбоксильной группы или ее соли в хлорангидрид кислоты с использованием тионилхлорида, оксихлорида фосфора или оксалилхлорида с последующей конденсацией с аммиаком. Примерами растворителя в этих реакциях являются инертные в реакции растворители, такие как тетрагидрофуран, диоксан, дихлорметан, хлороформ, 1,2-дихлорэтан, N,Nдиметилформамид, толуол или этилацетат. Эти реакции можно проводить при температуре от -50 до 50 С. Другим примером амидирования является способ с использованием конденсирующего агента для дегидратации и аммиака. В этой реакции используют конденсирующий агент, такой как гидрохлорид 1 этил-3-(3-диметиламинопропил)карбодиимида, дициклогексилкарбодиимид, дифенилфосфорилазид или карбонилдиимидазол. Если необходимо, можно добавить активирующий агент (например, 1 гидроксибензотриазол или гидроксисукцинимид). Примерами растворителя в этих реакциях являются инертные в реакции растворители, такие как тетрагидрофуран, диоксан, дихлорметан, хлороформ, 1,2 дихлорэтан, N,N-диметилформамид, толуол, этилацетат или ацетонитрил. Эти реакции можно проводить при температуре от -50 до 50 С. Еще одним примером амидирования является способ с использованием смешанного ангидрида кислот (полученного из карбоновой кислоты и хлоркарбонатного эфира) и аммиака. Примерами растворителя в реакции являются инертные в реакции растворители, такие как тетрагидрофуран, диоксан, дихлорметан, хлороформ, 1,2-дихлорэтан, N,N-диметилформамид, толуол или этилацетат. Эти реакции можно проводить при температуре от -50 до 50 С. Превращение COORf (который является сложным эфиром) соединения в аминокарбонильную группу можно проводить прямой реакцией с аммиаком или можно проводить превращением эфира в карбоновую кислоту или ее соль с последующим превращением карбоновой кислоты в аминокарбонильную группу по вышеуказанному способу. Превращение эфира в карбоновую кислоту или ее соль проводят по способу, описанному в Protective Groups in Organic Synthesis by Theodora W. Greene and Peter G.M. Wuts. Превращение прямой реакцией с аммиаком проводят с использованием газообразного аммиака или водного аммиака в растворителе (например, воде, метаноле, этаноле, тетрагидрофуране, диоксане,дихлорметане, хлороформе, N,N-диметилформамиде или толуоле) или без растворителя при температуре от 0 до 100 С и, если необходимо, с герметизацией для предотвращения испарения аммиака.Rb (которая является защитной группой аминогруппы) можно удалить, например, способом, описанным в схеме реакций 1. Образовавшийся амин можно получить в виде основания или соли с кислотой. Примерами подходящей кислоты, которую нужно использовать, являются хлористо-водородная кислота, серная кислота, трифторуксусная кислота, п-толуолсульфоновая кислота, метансульфоновая кислота и уксусная кислота. Настоящее изобретение иллюстрируется более подробно следующими ссылочными примерами,примерами и экспериментами, однако изобретение не ограничивается ими. Ссылочный пример 1. Синтез (2S,4S)-1-(трет-бутоксикарбонил)-4-фторпирролидин-2-карбоновой кислоты В соответствии с Tetrahedron Letter 39(10), 1169-1172 (1998), указанное в заголовке соединение (4,5 г),которое является соединением примера 1(1), получают из метил-(2S,4R)-1-(трет-бутоксикарбонил)-4 гидроксипирролидин-2-карбоксилата (6,8 г) в две стадии. Ссылочный пример 2. Синтез (2S,4R)-1-(трет-бутоксикарбонил)-4-фторпирролидин-2-карбоновой кислоты В соответствии с Tetrahedron Letter 39(10), 1169-1172 (1998), указанное в заголовке соединение (370 мг) , которое является соединением примера 3(1), получают из метил-(2S,4S)-1-(трет-бутоксикарбонил)4-гидроксипирролидин-2-карбоксилата (500 мг) в две стадии. Ссылочный пример 3. Синтез(2S,4R)-2-(аминокарбонил)-1-(трет-бутоксикарбонил)-4 гидроксипирролидина В диоксане (50 мл) суспендируют (2S,4R)-1-(трет-бутоксикарбонил)-4-гидроксипирролидин-2 карбоновую кислоту (2,31 г) и моногидрат 1-гидроксибензотриазола (1,51 г) и затем при охлаждении льдом добавляют гидрохлорид 1-(3,3-диметиламинопропил)-3-этилкарбодиимида (2,11 г) и 25% водный аммиак (0,68 мл). Температуру постепенно повышают до комнатной температуры и затем смесь перемешивают на протяжении ночи. Реакционный раствор концентрируют при пониженном давлении и образовавшийся остаток очищают колоночной хроматографией на силикагеле (проявляющий агент; хлороформ:метанол=100:3-100:7), получая при этом указанное в заголовке соединение (2,19 г) в виде бесцветного порошка. Пример 1. Синтез гидрохлорида (2S,4S)-1-[(2S,3S)-2-амино-3-метилпентаноил]-2-циано-4 фторпирролидина(1) Синтез (2S,4S)-2-(аминокарбонил)-1-(трет-бутоксикарбонил)-4-фторпирролидина В ацетонитриле (50 мл) растворяют (2S,4S)-1-(трет-бутоксикарбонил)-4-фторпирролидин-2-карбоновую кислоту (4,5 г), полученную в ссылочном примере 1, затем при охлаждении льдом добавляют моногидрат 1 гидроксибензотриазола (3,6 г) и гидрохлорид 1-(3,3-диметиламинопропил)-3-этилкарбодиимида (4,5 г). Температуру постепенно повышают и затем смесь перемешивают при комнатной температуре на протяжении ночи. Реакционный раствор снова охлаждают льдом, добавляют 25% водный аммиак (5 мл) и перемешивание продолжают при охлаждении льдом в течение 30 мин, затем при комнатной температуре в течение 30 мин. К реакционному раствору добавляют ацетонитрил (50 мл) и нерастворимое вещество удаляют фильтрованием. Фильтрат концентрируют при пониженном давлении и очищают колоночной хроматографией на силикагеле (проявляющий растворитель; гексан:этилацетат=4:1-1:5). К образовавшемуся остатку добавляют гексан, получая при этом указанное в заголовке соединение (4,2 г) в виде бесцветного порошка. МС (ESI положит.) m/z: 255 ([M+Na]+), (ESI отрицат.) m/z: 231 ( [М-Н]-).(2) Синтез гидрохлорида (2S,4S)-2-(аминокарбонил)-4-фторпирролидина В смеси 4 М хлористо-водородная кислота - диоксан (45 мл) суспендируют (2S,4S)-2(аминокарбонил)-1-(трет-бутоксикарбонил)-4-фторпирролидин (4,2 г) и после перемешивания при комнатной температуре в течение 2 ч реакционный раствор концентрируют при пониженном давлении. К остатку добавляют толуол (50 мл) с последующим дальнейшим концентрированием при пониженном давлении. Это повторяют 3 раза, получая при этом указанное в заголовке соединение (3,1 г) в виде бесцветного порошка. Этот промежуточный продукт используют для следующей реакции без очистки.(3) Синтез (2S,4S)-2-(аминокарбонил)-1-[(2S,3S)-2-(флуоренилметоксикарбониламино)-3-метилпентаноил]-4-фторпирролидина В смеси тетрагидрофуран (40 мл) - N,N-диметилформамид (10 мл) растворяют гидрохлорид (2S,4S)2-(аминокарбонил)-4-фторпирролидина (2,4 г) и (2S,3S)-2-(флуоренилметоксикарбониламино)-3 метилпентановую кислоту (5,1 г) и затем при охлаждении льдом добавляют моногидрат 1 гидроксибензотриазола (2,6 г), гидрохлорид 1-(3,3-диметиламинопропил)-3-этилкарбодиимида (3,3 г)- 12006204 идиизопропилэтиламин (2,5 мл), и температуру постепенно повышают с последующим перемешиванием при комнатной температуре в течение ночи. Раствор концентрируют при пониженном давлении и к образовавшемуся остатку добавляют воду. Образовавшийся порошок отфильтровывают и очищают колоночной хроматографией на силикагеле (проявляющий растворитель; гексан:этилацетат=4:1-1:4), получая при этом указанное в заголовке соединение (6,9 г) в виде бледно-желтого аморфного вещества. МС (ESI положит.) m/z: 490 ([M+Na]+). 4) Синтез (2S,4S)-2-циано-l-[(2S,3S)-2-(флуоренилметоксикарбониламино)-3-метилпентаноил]-4 фторпирролидина В тетрагидрофуране (70 мл) растворяют (2S,4S)-2-(аминокарбонил)-1-[(2S,3S)-2-(флуоренилметоксикарбониламино)-3-метилпентаноил]-4-фторпирролидин (6,9 г) и при охлаждении льдом добавляют трифторуксусный ангидрид (4,0 мл) с последующим перемешиванием при охлаждении льдом в течение 1,5 ч. Реакционную смесь концентрируют при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель; гексан:этилацетат=8:1-3:2), получая при этом указанное в заголовке соединение (6,2 г) в виде бледно-желтого аморфного вещества. МС (ESI положит.) m/z: 472 ([M+Na]+).(2S,4S)-2-циано-1-[(2S,3S)-2-(флуоренилметоксикарбониламино)-3-метилпентаноил]-4-фторпирролидин (6,2 г) и после добавления диэтиламина (10 мл) перемешивание продолжают при охлаждении льдом в течение 30 мин и затем при комнатной температуре в течение 5 ч. Раствор концентрируют при пониженном давлении, и остаток растворяют в смеси диэтилового эфира (100 мл), тетрагидрофурана (50 мл) и хлороформа (50 мл) и затем при охлаждении льдом добавляют смесь 4 М хлористо-водородная кислота - диоксан (4,0 мл). Образовавшуюся соль отфильтровывают и промывают диэтиловым эфиром. Образовавшийся порошок очищают колоночной хроматографией на силикагеле (проявляющий растворитель; хлороформ : метанол: 25% водный аммиак= 40:1:0,1-25:1:0,1). Образовавшийся остаток растворяют в хлороформе и после добавления при охлаждении льдом смеси 4 М хлористо-водородная кислота - диоксан (4,0 мл) образовавшуюся соль отфильтровывают, промывают хлороформом и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (2,9 г) в виде бесцветного порошка. МС (ESI положит.) m/z: 258 ([М+Н)]+, 250 ([M+Na]+), (ESI отрицат.) m/z: 262 ([M+Cl]-). 1 Н-ЯМР (ДМСО-d6, 500 МГц) ; 8,59 (3H, ш.с), 5,54 (1 Н, ш.д, J=52,l Гц), 5,06 (1 Н, д, J=9,4 Гц), 4,073,77 (3H, м), 2,55-2,34 (2 Н, м), 1,88 (1 Н, м), 1,61 (1 Н, м), 1,17 (1 Н, м), 0,94 (3H, д, J=6,7 Гц), 0,88 (3H, т,J=7,3 Гц). Пример 2. Синтез гидробромида (2S,4S)-1-[(2S,3S)-2-амино-3-метилпентаноил]-2-циано-4-фторпирролидина В этаноле (1 мл) растворяют (2S,4S)-1-[(2S,3S)-2-амино-3-метилпентаноил]-2-циано-4-фторпирролидин (0,5 г), полученный в примере 1, и раствор добавляют к охлажденному льдом раствору в этаноле(2 мл) 48% бромисто-водородную кислоту (0,26 мл). Далее добавляют этанол (2 мл) и пентан (3 мл) и смесь перемешивают и осажденные кристаллы отфильтровывают. Образовавшиеся кристаллы растворяют в метаноле (1,75 мл) и добавляют к охлажденному льдом 2-пропанолу (14 мл). К этому добавляют пентан (3,5 мл) с последующим перемешиванием. Осажденные кристаллы отфильтровывают, получая при этом указанное в заголовке соединение (0,28 г) в виде бесцветного порошка. Анализ: вычислено для C11H18FN3OHBr: С, 42,87; Н, 6,21; N, 13,63; Вr, 25,93; F, 6,16. Найдено: С,42,98; Н, 6,26; N, 13,54; Вr, 25,85; F, 6,15. Пример 3. Синтез гидрохлорида (2S,4R)-1-[(2S,3S)-2-амино-3-метилпентаноил]-2-циано-4 фторпирролидина(1) Синтез (2S,4R)-2-(аминокарбонил)-1-(трет-бутоксикарбонил)-4-фторпирролидина По способу, аналогичному способу примера 1(1), указанное в заголовке соединение (270 мг) получают в виде бесцветного смолистого вещества из (2S,4R)-1-(трет-бутоксикарбонил)-4-фторпирролидин 2-карбоновой кислоты (370 мг), полученной в ссылочном примере 2. МС (ESI положит.) m/z: 255 ([M+Na]+), (ESI отрицат.) m/z: 231 ([M-H]-).(2) Синтез (2S,4R)-2-(аминокарбонил)-1-[(2S,3S)-2-(флуоренилметоксикарбониламино)-3-метилпентаноил]-4-фторпирролидина В смеси 4 М хлористо-водородная кислота - диоксан (3 мл) суспендируют (2S,4R)-2(аминокарбонил)-1-(трет-бутоксикарбонил)-4-фторпирролидин (260 мг) и после перемешивания при комнатной температуре в течение 2 ч реакционный раствор концентрируют при пониженном давлении. К остатку добавляют хлороформ (10 мл) с последующим дальнейшим концентрированием при пониженном давлении. Процедуру повторяют 3 раза. Образовавшийся остаток,(2S,3S)-2(флуоренилметоксикарбониламино)-3-метилпентановую кислоту (400 мг), растворяют в N,Nдиметилформамиде (5 мл) и затем при охлаждении льдом добавляют моногидрат 1 гидроксибензотриазола (210 мг), гидрохлорид 1-(3,3-диметиламинопропил)-3-этилкарбодиимида (260- 13006204 мг) и диизопропилэтиламин (0,20 мл). Температуру постепенно повышают, и затем смесь перемешивают при комнатной температуре на протяжении ночи. Реакционную смесь растворяют в воде и экстрагируют этилацетатом. Органическую фазу промывают последовательно 0,1 М водным раствором хлористоводородной кислоты и насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия и после удаления осушающего агента фильтрованием концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат=1:1-1:4), получая при этом указанное в заголовке соединение (450 мг) бесцветного аморфного вещества. МС (ESI положит.) m/z: 490 ([M+Na]+).(3) Синтез (2S,4R)-2-циано-l-[(2S,3S)-2-(флуоренилметоксикарбониламино)-3-метилпентаноил]-4 фтopпирролидина По способу, аналогичному способу примера 1(4), указанное в заголовке соединение (330 мг) получают в виде бледно-желтого аморфного вещества из (2S,4R)-2-(аминокарбонил)-1-[(2S,3S)-2(флуоренилметоксикарбониламино)-3-метилпентаноил]-4-фторпирролидина (440 мг). МС (ESI положит.) m/z: 472 ([M+Na]+).(4) Синтез гидрохлорида (2S,4R)-1-[(2S,3S)-2-амино-3-метилпентаноил]-2-циано-4-фторпирролидина По способу, аналогичному способу примера 1(5), указанное в заголовке соединение (60 мг) получают в виде бесцветного порошка из (2S,4R)-2-циано-1-[(2S,3S)-2-(флуоренилметоксикарбониламино)-3 метилпентаноил]-4-фторпирролидина (320 мг). МС (ESI положит.) m/z: 228 ([М+Н)]+, 250 ([M+Na]+), (ESI отрицат.) m/z: 262 ([M+Cl]-). Пример 4. Синтез малеата (2S,4S)-2-циано-1-[2-[(5-нитропиридин-2-ил)амино]этиламино]ацетил-4-фторпирролидина(1) Синтез (2S,4S)-2-(аминокарбонил)-1-бромацетил-4-фторпирролидина В тетрагидрофуране (10 мл) суспендируют гидрохлорид (2S,4S)-2-аминокарбонил-4 фторпирролидина (650 мг), полученного в примере 1(2), затем при охлаждении льдом добавляют 2 этилгексаноат калия (1,6 г) с последующим перемешиванием в течение часа. При охлаждении льдом добавляют бромацетилбромид (0,37 мл) и перемешивание продолжают с охлаждением льдом в течение 30 мин и при комнатной температуре в течение часа. К реакционному раствору добавляют смесь хлороформ-метанол (10:1, 50 мл) с последующим перемешиванием при комнатной температуре в течение 15 мин. Осажденную соль отфильтровывают, и фильтрат концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель; хлороформметанол=40:1-35:1), получая при этом указанное в заголовке соединение (570 мг) в виде белого аморфного вещества. МС (ESI положит.) m/z: 275 ([M+Na]+), 277 ([M+Na]+).(2S,4S)-2-(аминокарбонил)-1-бромацетил-4 фторпирролидин (560 мг) и затем при охлаждении льдом добавляют трифторуксусный ангидрид (0,62 мл) с последующим перемешиванием при охлаждении льдом в течение часа. Реакционный раствор концентрируют при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле(проявляющий растворитель; хлороформ:метанол=50:1-30:1), получая при этом указанное в заголовке соединение (540 мг) в виде бесцветного твердого вещества. МС (ESI положит.) m/z: 257 ([M+Na]+), 259 ([M+Na]+).(3) Синтез малеата (2S,4S)-2-циано-1-[2-[(5-нитропиридин-2-ил)амино]этиламино]ацетил-4 фторпирролидина В тетрагидрофуране (10 мл) растворяют 2-(2-аминоэтиламино)-5-нитропиридин (580 мг) и затем при охлаждении льдом добавляют раствор (2,5 мл) в тетрагидрофуране (2S,4S)-1-бромацетил-2-циано-4 фторпирролидина (250 мг). Температуру постепенно повышают и затем смесь перемешивают при комнатной температуре на протяжении ночи. Раствор концентрируют при пониженном давлении и образовавшийся остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель; хлороформ:метанол=50:1-25:1). Образовавшийся остаток растворяют в этаноле (1 мл) и затем добавляют раствор (1 мл) в этаноле малеиновой кислоты (52 мг). К реакционному раствору добавляют диэтиловый эфир и после удаления супернатанта осадок промывают диэтиловым эфиром. Остаток сушат при пониженном давлении, получая при этом указанное в заголовке соединение (160 мг) в виде желтого порошка. МС (ESI положит.) m/z: 337 ([М+Н)]+, 359 ([M+Na]+), (ESI отрицат.) m/z: 335 ([М-Н]-). Пример 5. Синтез малеата (2S,4S)-2-циано-1-[2-[(5-цианопиридин-2-ил)амино]этиламино]ацетил-4 фторпирролидина По способу, аналогичному способу примера 4(3), указанное в заголовке соединение (70 мг) получают в виде бесцветного порошка из 2-(2-аминоэтиламино)-5-цианопиридина (520 мг) и (2S,4S)-1 бромацетил-2-циано-4-фторпирролидина (250 мг). МС (ESI положит.) m/z: 317 ([М+Н)]+, 339 ([M+Na]+), (ESI отрицат.) m/z: 315 ([М-Н]-).(1) Синтез метил-(2S,4R)-1-(трет-бутоксикарбонил)-4-метоксипирролидин-2-карбоксилата В смеси N,N-диметилформамид (4 мл) дихлорметан (1 мл) растворяют метил-(2S,4R)-1-(третбутоксикарбонил)-4-гидоксипирролидин-2-карбоксилат (400 мл) и метилиодид (0,12 мл) и затем при охлаждении льдом добавляют 65% гидрид натрия (маслянистый, 60 мг). Температуру постепенно повышают до комнатной температуры, и затем смесь перемешивают на протяжении ночи. Реакционную смесь растворяют в насыщенном водном растворе бикарбоната натрия и экстрагируют этилацетатом. Органическую фазу последовательно промывают 5% водным раствором тиосульфата натрия и насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия и после удаления осушающего агента концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель; гексан:этилацетат=8:1-4:1), получая при этом указанное в заголовке соединение (330 мг) в виде бесцветного маслянистого вещества. МС (ESI положит.) m/z: 282 ([M+Na]+).(2) Синтез (2S,4R)-1-(трет-бутоксикарбонил)-4-метоксипирролидин-2-карбоновой кислоты В ацетонитриле (3 мл) растворяют метил-(2S,4R)-1-(трет-бутоксикарбонил)-4-метоксипирролидин 2-карбоксилат (330 мг), при охлаждении добавляют 1 М водный раствор гидроксида лития (1,5 мл) и перемешивание продолжают при охлаждении льдом в течение 30 мин и затем при комнатной температуре в течение 2 ч. Далее добавляют 1 М водный раствор гидроксида лития (0,8 мл) с последующим перемешиванием при комнатной температуре в течение часа. Реакционный раствор растворяют в насыщенном водном растворе хлорида натрия и после подкисления раствора 1 М водным раствором хлористоводородной кислоты (4 мл) экстрагируют этилацетатом. Органическую фазу промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия и после удаления осушающего агента фильтрованием концентрируют при пониженном давлении, получая при этом указанное в заголовке соединение в виде бесцветного смолистого вещества. Этот промежуточный продукт используют для следующей реакции без очистки.(3) Синтез (2S,4R)-2-(аминокарбонил)-1-(трет-бутоксикарбонил)-4-метоксипирролидина По способу, аналогичному способу примера 1(1), указанное в заголовке соединение (260 мг) получают в виде бесцветного смолистого вещества из (2S,4R)-1-(трет-бутоксикарбонил)-4 метоксипирролидин-2-карбоновой кислоты (330 мг). МС (ESI положит.) m/z: 267 ([M+Na]+), (ESI отрицат.) m/z: 243 ([М-Н]-).(4) Синтез (2S,4R)-2-(аминокарбонил)-1-[(2S,3S)-2-(флуоренилметоксикарбониламино)-3-метилпентаноил]-4-метоксипирролидина По способу, аналогичному способу примера 3(2), указанное в заголовке соединение (400 мг) получают в виде бесцветного аморфного вещества из (2S,4R)-2-(аминокарбонил)-1-(трет-бутоксикарбонил)-4 метоксипирролидина (250 мг). МС (ESI положит.) m/z: 502 ([M+Na]+).(5) Синтез (2S,4R)-2-циано-l-[(2S,3S)-2-(флуоренилметоксикарбониламино)-3-метилпентаноил]-4 метоксипирролидина По способу, аналогичному способу примера 1(4), указанное в заголовке соединение (260 мг) получают в виде бледно-желтого аморфного вещества из (2S,4R)-2-(аминокарбонил)-1-[(2S,3S)-2(флуоренилметоксикарбониламино)-3-метилпентаноил]-4-метоксипирролидина (390 мг). МС (ESI положит.) m/z: 484 ([M+Na]+).(6) Синтез гидрохлорида (2S,4R)-1-[(2S,3S)-2-амино-3-метилпентаноил]-2-циано-4-метоксипирролидина По способу, аналогичному способу примера 1(5), указанное в заголовке соединение (70 мг) получают в виде бесцветного порошка из (2S,4R)-2-циано-l-[(2S,3S)-2-(флуоренилметоксикарбониламино)-3 метилпентаноил]-4-метоксипирролидина (250 мг). МС (ESI положит.) m/z: 240 ([М+Н)]+, 262 ([M+Na]+), (ESI отрицат.) m/z: 274 ([М+Сl]-). Пример 7. Синтез гидрохлорида (2S,4S)-1-[(2S,3S)-2-амино-3-метилпентаноил]-2-циано-4 метоксипирролидина(1) Синтез метил-(2S,4S)-1-(трет-бутоксикарбонил)-4-метоксипирролидин-2-карбоксилата По способу, аналогичному способу примера 6(1), указанное в заголовке соединение (360 мг) получают в виде бесцветного маслянистого вещества из метил-(2S,4S)-1-(трет-бутоксикарбонил)-4 гидроксипирролидин-2-карбоксилата (400 мг). МС (ESI положит.) m/z: 282 ([M+Na]+).(2) Синтез (2S,4S)-1-(трет-бутоксикарбонил)-4-метоксипирролидин-2-карбоновой кислоты По способу, аналогичному способу примера 6(2), указанное в заголовке соединение (310 мг) получают в виде бесцветного твердого вещества из метил-(2S,4S)-1-(трет-бутоксикарбонил)-4 метоксипирролидин-2-карбоксилата (350 мг). Этот промежуточный продукт используют в следующей реакции без очистки.(3) Синтез (2S,4S)-2-(аминокарбонил)-1-(трет-бутоксикарбонил)-4-метоксипирролидина По способу, аналогичному способу примера 1(1), указанное в заголовке соединение (290 мг) получают в виде бесцветного смолистого вещества из (2S,4S)-1-(трет-бутоксикарбонил)-4 метоксипирролидин-2-карбоновой кислоты (310 мг). МС (ESI положит.) m/z: 267 ([M+Na]+), (ESI отрицат.) m/z: 243 ( [M-H]-).(4) Синтез (2S,4S)-2-(аминокарбонил)-1-[(2S,3S)-2-(флуоренилметоксикарбониламино)-3-метилпентаноил]-4-метоксипирролидина По способу, аналогичному способу примера 3(2), указанное в заголовке соединение (450 мг) получают в виде бесцветного аморфного вещества из (2S,4S)-2-(аминокарбонил)-1-(трет-бутоксикарбонил)-4 метоксипирролидина (280 мг). МС (ESI положит.) m/z: 502 ([M+Na]+).(5) Синтез (2S,4S)-2-циано-1-[(2S,3S)-2-(флуоренилметоксикарбониламино)-3-метилпентаноил]-4 метоксипирролидина По способу, аналогичному способу примера 1(4), указанное в заголовке соединение (330 мг) получают в виде бледно-желтого аморфного вещества из (2S,4S)-2-(аминокарбонил)-1-[(2S,3S)-2(флуоренилметоксикарбониламино)-3-метилпентаноил]-4-метоксипирролидина (440 мг). МС (ESI положит.) m/z: 484 ([M+Na]+).(6) Синтез гидрохлорида (2S,4S)-1-[(2S,3S)-2-амино-3-метилпентаноил]-2-циано-4-метоксипирролидина По способу, аналогичному способу примера 1(5), указанное в заголовке соединение (150 мг) получают в виде бесцветного порошка из (2S,4S)-2-циано-1-[(2S,3S)-2-(флуоренилметоксикарбониламино)-3 метилпентаноил]-4-метоксипирролидина (250 мг). МС (ESI положит.) m/z: 240 ([М+Н)]+, 262 ([M+Na]+), (ESI отрицат.) m/z: 274 ([M+Cl]-). Пример 8. Синтез гидрохлорида (2S,4R)-1-[(2S,3S)-2-амино-3-метилпентаноил]-2-циано-4 гидроксипирролидина(1) Синтез (2S,4R)-2-(аминокарбонил)-1-[(2S,3S)-2-(флуоренилметоксикарбониламино)-3-метилпентаноил]-4-гидроксипирролидина По способу, аналогичному способу примера 3(2), указанное в заголовке соединение (1,30 г) получают в виде бесцветного аморфного вещества из (2S,4R)-1-(трет-бутоксикарбонил)-2-(аминокарбонил)-4 гидроксипирролидина (0,96 г). МС (ESI положит.) m/z: 488 ([M+Na]+).(2S,4R)-2-(аминокарбонил)-1-[(2S,3S)-2(флуоренилметоксикарбониламино)-3-метилпентаноил]-4-гидроксипирролидин (1,06 г) и при охлаждении льдом добавляют трифторуксусный ангидрид (0,72 мл). После перемешивания при такой же температуре в течение часа реакционный раствор концентрируют при пониженном давлении. К образовавшемуся остатку добавляют метанол (10 мл) и концентрируют при пониженном давлении. Эту процедуру повторяют еще раз, затем добавляют метанол (10 мл) с последующим перемешиванием на протяжении ночи. Реакционный раствор концентрируют при пониженном давлении и образовавшийся остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель; гексан:этилацетат=1:3),получая при этом указанное в заголовке соединение (0,69 г) в виде бесцветного аморфного вещества. МС (ESI положит.) m/z: 470 ([M+Na]+).(3) Синтез гидрохлорида (2S,4R)-1-[(2S,3S)-2-амино-3-метилпентаноил]-2-циано-4-гидроксипирролидина По способу, аналогичному способу примера 1(5), указанное в заголовке соединение (41 мг) получают в виде бесцветного порошка , из (2S,4R)-2-циано-l-[(2S,3S)-Z(флуоренилметоксикарбониламино)-3-метилпентаноил]-4-гидроксипирролидина (151 мг). МС (ESI положит.) m/z: 248 ([M+Na]+), (ESI отрицат.) m/z: 260 ( [M+Cl]-). Пример 9. Синтез гидрохлорида(1) Синтез (2S,4S)-4-ацетокси-2-циано-1-[(2S,3S)-2-(флуоренилметоксикарбониламино)-3-метилпентаноил]пирролидина В тетрагидрофуране (5 мл) растворяют (2S,4R)-2-циано-1-[(2S,3S)-2-(флуоренилметоксикарбониламино)3-метилпентаноил]-4-гидроксипирролидин (200 мг), полученный в примере 8(2), и трифенилфосфин (258 мг) и затем при охлаждении льдом добавляют уксусную кислоту (0,05 мл) и диэтилазодикарбоксилат (40% раствор в толуоле, 0,47 мл). Температуру повышают до комнатной температуры и затем смесь перемешивают на протяжении ночи. Реакционный раствор концентрируют при пониженном давлении, и образовавшийся остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель; гексан:этилацетат=3:2-1:1), получая при этом указанное в заголовке соединение (135 мг) в виде бесцветного аморфного вещества. МС(2) Синтез гидрохлорида (2S,4S)-1-[(2S,3S)-2-амино-3-метилпентаноил]-2-циано-4-гидроксипирролидина В метаноле (1,6 мл) растворяют (2S,4S)-4-ацетокси-2-циано-1-[(2S,3S)-2-(флуоренилметоксикарбониламино)-3-метилпентаноил]пирролидин (115 мг) и затем при комнатной температуре добавляют диэтиламин (0,4 мл) с последующим перемешиванием при такой же температуре в течение 9 ч. По методике очистки, подобной процедуре примера 1(5), указанное в заголовке соединение (28 мг) получают в виде бесцветного аморфного вещества. МС (ESI положит.) m/z: 226 ([М+Н)]+, 248 ([M+Na]+), (ESI отрицат.) m/z: 260 ([М+Сl]-). Пример 10. Синтез гидрохлорида (2S,4S)-1-[(2S,3S)-2-амино-3-метилпентаноил]-4-хлор-2-цианопирролидина(1) Синтез (2S,4S)-4-хлор-2-циано-1-[(2S,3S)-2-(флуоренилметоксикарбониламино)-3-метилпентаноил]пирролидина В смеси дихлорметан (2 мл) - тетрахлорид углерода (2 мл) растворяют (2S,4R)-2-циано-1-[(2S,3S)-2(флуоренилметоксикарбониламино)-3-метилпентаноил]-4-гидроксипирролидин (200 мг), полученный в примере 8(2), и затем добавляют трифенилфосфин (234 мг) с последующим перемешиванием при комнатной температуре на протяжении ночи. К реакционному раствору добавляют этанол (0,5 мл) с последующим перемешиванием при комнатной температуре в течение 4 ч. Реакционный раствор концентрируют при пониженном давлении и образовавшийся остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель; гексан:этилацетат=1:1-2:3), получая при этом указанное в заголовке соединение (126 мг) в виде бесцветного аморфного вещества. МС (ESI положит.) m/z: 488 ([M+Na]+).(2) Синтез гидрохлорида (2S,4S)-1-[(2S,3S)-2-амино-3-метилпентаноил]-4-хлор-2-цианопирролидина По способу, аналогичному способу примера 1(5), указанное в заголовке соединение (32 мг) получают в виде бесцветного порошка из(2S,4R)-2-(аминокарбонил)-1-[(2S,3S)-2-(трет-бутоксикарбониламино)-3-метилпентаноил]-4-гидроксипирролидина По способу, аналогичному способу примера 3(2), указанное в заголовке соединение (260 мг) получают в виде бесцветного аморфного вещества из (2S,4R)-2-(аминокарбонил)-1-(трет-бутоксикарбонил)-4 гидроксипирролидина (276 мг), полученного- в ссылочном примере 3, и (2S,3S)-2-(третбутоксикарбониламино)-3-метилпентановой кислоты (290 мг). МС (ESI положит.) m/z: 366 ([M+Na]+), (ESI отрицат.) m/z: 342 ( [М-Н]-).(2S,4R)-2-(аминокарбонил)-1-[(2S,3S)-2-(третбутоксикарбониламино)-3-метилпентаноил]-4-гидроксипирролидин (250 мг) и затем добавляют молекулярные сита 4 А (1,5 г), хлорхромат пиридиния (235 мг) и уксусную кислоту (0,07 мл) с последующим перемешиванием при комнатной температуре в течение 2 ч. Реакционный раствор непосредственно очищают колоночной хроматографией на силикагеле (проявляющий растворитель; гексан:этилацетат=1:11:3), получая при этом указанное в заголовке соединение (180 мг) в виде коричневого аморфного соединения. МС (ESI положит.) m/z: 364 ([M+Na]+), (ESI отрицат.) m/z: 340 ([М-Н]-).(2S)-2-(аминокарбонил)-1-[(2S,3S)-2-(третбутоксикарбониламино)-3-метилпентаноил]-4-оксопирролидин (168 мг) и после охлаждения льдом добавляют трифторуксусный ангидрид (0,21 мл) и диизопропилэтиламин (0,51 мл) с последующим перемешиванием при охлаждении льдом в течение часа. Реакционный раствор разбавляют этилацетатом (100 мл) и промывают последовательно водой, 10% водным раствором бисульфата калия, водой, насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия и органическую фазу сушат над безводным сульфатом магния. После удаления осушающего агента фильтрованием растворитель выпаривают при пониженном давлении, получая при этом указанное в заголовке соединение (17 4 мг) в виде коричневого аморфного вещества. МС (ESI положит.) m/z: 346 ([M+Na]+), (ESI отрицат.) m/z: 322 ([М-Н]-).(4) Синтез трифторацетата (2S)-1-[(2S,3S)-2-амино-3-метилпентаноил]-2-циано-4-оксопирролидина В охлажденной льдом трифторуксусной кислоте (0,5 мл) растворяют (2S)-1-[(2S,3S)-2-(третбутоксикарбониламино)-3-метилпентаноил]-2-циано-4-оксопирролидин (91 мг) и после перемешивания при комнатной температуре в течение 20 мин растворитель выпаривают при пониженном давлении. К остатку добавляют диизопропиловый эфир (10 мл) и отстоявшуюся жидкость удаляют. К остатку снова- 17006204 добавляют диизопропиловый эфир (10 мл) и нерастворимое вещество отфильтровывают, получая при этом указанное в заголовке соединение (76 мг) в виде коричневого твердого вещества. МС (ESI положит.) m/z: 246 ([M+Na]+). Пример 12. Синтез (2S,3S)-1-[(2S,3S)-2-амино-3-метилпентаноил]-2-циано-3-гидроксипирролидина(1) Синтез (2S,3S)-2-(аминокарбонил)-1-(трет-бутоксикарбонил)-3-гидроксипирролидина По способу, аналогичному способу ссылочного примера 3, указанное в заголовке соединение (3,19 г) получают в виде бесцветного твердого вещества из (2S,3S)-1-(трет-бутоксикарбонил)-3-гидроксипирролидин 2-карбоновой кислоты (3,47 г).(2) Синтез гидрохлорида (2S,3S)-2-(аминокарбонил)-3-гидроксипирролидина По способу, аналогичному способу ссылочного примера 1(2), указанное в заголовке соединение получают из (2S,3S)-2-(аминокарбонил)-1-(трет-бутоксикарбонил)-3-гидроксипирролидина (1,11 г). Этот промежуточный продукт используют для следующей реакции без очистки.(3) Синтез (2S,3S)-2-(аминокарбонил)-1-[(2S,3S)-2-(флуоренилметоксикарбониламино)-3-метилпентаноил]-3- гидроксипирролидина В дихлорметане (20 мл) суспендируют (2S,3S)-2-(флуоренилметоксикарбониламино)-3-метилпентановую кислоту (1,87 г) и затем добавляют тионилхлорид (3,81 мл) с последующим кипячением с обратным холодильником в течение 20 мин. Растворитель выпаривают при пониженном давлении, к остатку добавляют толуол (20 мл) и растворитель выпаривают при пониженном давлении. Эту процедуру повторяют еще раз, получая при этом неочищенный хлорангидрид кислоты. В N,N-диметилформамиде (20 мл) растворяют гидрохлорид(2S,3S)-2-(аминокарбонил)-3-гидроксипирролидина, полученный выше в (2), и добавляют диизопропилэтиламин (1,00 мл) с последующим охлаждением льдом. К этому раствору добавляют по каплям раствор(10 мл) в N,N-диметилформамиде ранее образовавшегося хлорангидрида кислоты с последующим перемешиванием с охлаждением льдом в течение 20 мин. Реакционный раствор разбавляют этилацетатом(100 мл) и последовательно промывают насыщенным водным раствором хлорида натрия, насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия и органическую фазу сушат над безводным сульфатом магния. После удаления осушающего агента фильтрованием растворитель выпаривают при пониженном давлении и образовавшийся остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель; хлороформ:метанол=100:2-100:5), получая при этом указанное в заголовке соединение (1,08 г) в виде бесцветного аморфного вещества. МС (ESI положит.) m/z: 488 ([M+Na]+).(4) Синтез (2S,3S)-2-циано-l-[(2S,3S)-2-(флуоренилметоксикарбониламино)-3-метилпентаноил]-3 гидроксипирролидина По способу, аналогичному способу примера 8(2), указанное в заголовке соединение (795 мг) получают в виде бесцветного аморфного вещества из (2S,3S)-2-(аминокарбонил)-1-[(2S,3S)-2(флуоренилметоксикарбониламино)-3-метилпентаноил]-3-гидроксипирролидина (920 мг). МС (ESI положит.) m/z: 470 ([M+Na]+).(5) Синтез (2S,3S)-1-[(2S,3S)-2-амино-3-метилпентаноил]-2-циано-3-гидроксипирролидина В метаноле (1,8 мл) растворяют (2S,3S)-2-циано-1-[(2S,3S)-2-(флуоренилметоксикарбониламино)-3 метилпентаноил]-3-гидроксипирролидин (415 мг) и затем добавляют диэтиламин (0,4 мл) с последующим перемешиванием при комнатной температуре в течение 4 ч. Раствор концентрируют при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель; хлороформ : метанол : 25% водный раствор аммиака = 40:1:0,1-25:1:0,1), получая при этом указанное в заголовке соединение (185 мг) в виде бесцветного маслянистого вещества. МС (ESI положит.) m/z: 248 ([M+Na]+). Пример 13. Синтез трифторацетата (2S,3R)-1-[(2S,3S)-2-амино-3-метилпентаноил]-2-циано-3 фторпирролидина(2S,3S)-l-[(2S,3S)-2-(трет-бутоксикарбониламино)-3-метилпентаноил]-2-циано-3 гидроксипирролидина В дихлорметане (5 мл) растворяют (2S,3S)-1-[(2S,3S)-2-амино-3-метилпентаноил]-2-циано-3 гидроксипирролидин (170 мг), полученный в примере 12(5), и затем при охлаждении льдом добавляют ди-трет-бутилдикарбоксилат (198 мг) и диизопропилэтиламин (0,158 мл) с последующим выдерживанием смеси при 5 С в течение 2 дней. Раствор концентрируют при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель; гексан:этилацетат=1:1),получая при этом указанное в заголовке соединение (173 мг) в виде бесцветного аморфного вещества. МС (ESI положит.) m/z: 348 ([M+Na]+), (ESI отрицат.) m/z: 324 ( [М-Н]-).(2S,3R)-l-[(2S,3S)-2-(трет-бутоксикарбониламино)-3-метилпентаноил]-2-циано-3 фторпирролидина По способу, аналогичному способу примера 54, указанное в заголовке соединение (65 мг) получают в виде бесцветного аморфного вещества из (2S,3S)-1-[(2S,3S)-2-(трет-бутоксикарбониламино)-3 метилпентаноил]-2-циано-3-гидроксипирролидина (168 мг).(2S,3R)-1-[(2S,3S)-2-амино-3-метилпентаноил]-2-циано-3-фторпирролидина По способу, аналогичному способу примера 11(4), указанное в заголовке соединение (32 мг) получают в виде желтого порошка из (2S,3R)-1-[(2S,3S)-2-(трет-бутоксикарбониламино)-3-метилпентаноил]2-циано-3-фторпирролидина (62 мг). МС (ESI положит.) m/z: 250 ([M+Na]+). Пример 14. Синтез гидрохлорида (2S)-1-[(2S,3S)-2-амино-3-метилпентаноил]-2-циано-4,4 дифторпирролидина(1) Синтез (2S)-2-(аминокарбонил)-1-(трет-бутоксикарбонил)-4,4-дифторпирролидина По способу, аналогичному способу примера 1(1), указанное в заголовке соединение (2,8 г) получают в виде бесцветного порошка из (2S)-1-(трет-бутоксикарбонил)-4,4-дифторпирролидин-2-карбоновой кислоты (3,2 г). МС (ESI положит.) m/z: 273 ([M+Na]+), (ESI отрицат.) m/z: 249 ( [М-Н]-) .(2) Синтез гидрохлорида (2S)-2-(аминокарбонил)-4,4-дифторпирролидина По способу, аналогичному способу примера 1(2), указанное в заголовке соединение (3,9 г) получают в виде бесцветного порошка из (2S)-2-(аминокарбонил)-1-(трет-бутоксикарбонил)-4,4 дифторпирролидина (5,4 г). МС (ESI положит.) m/z: 149 ( [M-H]-), 185 ([М+Сl]-).(3) Синтез (2S)-2-(аминокарбонил)-1-[(2S,3S)-2-(трет-бутоксикарбониламино)-3-метилпентаноил]4,4-дифторпирролидина По способу, аналогичному способу примера 1(3), указанное в заголовке соединение (1,0 г) получают в виде бесцветного аморфного вещества из гидрохлорида (2S)-2-(аминокарбонил)-4,4-дифторпирролидина (0,56 г) и (2S,3S)-2-(трет-бутоксикарбониламино)-3-метилпентановой кислоты (0,70 г). МС (ESI положит.) m/z: 38 6 ([M+Na]+), (ESI отрицат.) m/z: 362 ([М-Н]-).(2S)-1-[(2S,3S)-2-(трет-бутоксикарбониламино)-3-метилпентаноил]-2-циано-4,4 дифторпирролидина В N,N-диметилформамиде (2,5 мл) растворяют (2S)-2-(аминокарбонил)-1-[(2S,3S)-2-(третбутоксикарбониламино)-3-метилпентаноил]-4,4-дифторпирролидин (0,90 г) и затем добавляют цианурхлорид (0,28 г) с последующим перемешиванием при комнатной температуре в течение часа. Реакционный раствор растворяют в воде и экстрагируют этилацетатом. Органическую фазу последовательно промывают насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. Осушающий агент удаляют фильтрованием, и фильтрат концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель; гексан:этилацетат=20:1-4:1), получая при этом указанное в заголовке соединение (0,76 г) в виде бесцветного аморфного вещества. МС (ESI положит.) m/z: 368 ([M+Na]+), (ESI отрицат.) m/z:. 344 ([М-Н]-).(0,56 г) добавляют 2 М водный раствор хлористо-водородной кислоты (12 мл) с последующим перемешиванием при комнатной температуре на протяжении ночи. К раствору добавляют дополнительно 2 М водный раствор хлористо-водородной кислоты (6 мл) и после перемешивания при комнатной температуре на протяжении ночи водный раствор промывают этилацетатом. К водной фазе добавляют 1 М водный раствора гидроксида натрия (35 мл) и избыточное количество хлорида натрия и после перемешивания смесь растворяют в насыщенном водном растворе бикарбоната натрия и экстрагируют этилацетатом. Органическую фазу промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. После удаления осушающего агента фильтрованием фильтрат концентрируют при пониженном давлении, получая при этом (2S)-1-[(2S,3S)-2-амино-3-метилпентаноил]-2-циано-4,4-дифторпирролидин, который затем растворяют в диэтиловом эфире (20 мл) с последующим добавлением при охлаждении льдом 4 М хлористо-водородной кислоты (раствор в этилацетате, 0,50 мл). Осажденное нерастворимое вещество отфильтровывают, получая при этом указанное в заголовке соединение (0,37 г) в виде бесцветного порошка. МС (ESI положит.) m/z: 246 ([М+Н)]+), 268 ([M+Na]+), (ESI отрицат.) m/z: 244 ([М-Н)-], 280 ([М+Сl]-). Пример 15. Синтез гидрохлорида(1) Синтез (2S,4S)-2-(аминокарбонил)-1-[(2S)-2-(трет-бутоксикарбониламино)-3-метилбутаноил]-4 фторпирролидина По способу, аналогичному способу примера 1(3), указанное в заголовке соединение (4,22 г) получают в виде бесцветного аморфного вещества из гидрохлорида (2S,4S)-2-(аминокарбонил)-4 фторпирролидина (2,33 г) и (2S)-2-(трет-бутоксикарбониламино)-3-метилбутановой кислоты (3,00 г).(1,35 г) с последующим перемешиванием при комнатной температуре в течение часа. Реакционный раствор растворяют в воде и экстрагируют этилацетатом. Органическую фазу промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. После удаления осушающего агента фильтрованием фильтрат концентрируют при пониженном давлении, получая при этом указанное в заголовке соединение (3,49 г) в виде бесцветного твердого вещества.(3) Синтез гидрохлорида (2S,4S)-1-[(2S)-2-амино-3-метилбутаноил]-2-циано-4-фторпирролидина В метаноле (11 мл) растворяют (2S,4S)-1-[(2S)-2-(трет-бутоксикарбониламино) -3-метилбутаноил]2-циано-4-фторпирролидин (1,70 г) и после охлаждении льдом добавляют 4 М водный раствор хлористоводородной кислоты (11 мл). Температуру повышают до комнатной температуры и затем смесь перемешивают на протяжении ночи. Метанол выпаривают при пониженном давлении и образовавшийся водный раствор промывают этилацетатом. К водной фазе добавляют 4 М водный раствор (12 мл) гидроксида натрия и хлорид натрия и после экстракции этилацетатом органическую фазу промывают насыщенным водным раствором хлорида натрия. Образовавшуюся водную фазу сушат над безводным сульфатом натрия, осушающий агент удаляют фильтрованием и фильтрат концентрируют при пониженном давлении,получая при этом (2S,4S)-1-[(2S)-2-амино-3-метилбутаноил]-2-циано-4-фторпирролидин (0,80 г) в виде бесцветного твердого вещества, аликвоту (0,60 г) которого затем растворяют в метаноле и добавляют к раствору (22 мл) в диизопропиловом эфире 4 М хлористо-водородной кислоты (раствор этилацетата, 0,77 мл) при охлаждении льдом. Раствор перемешивают при комнатной температуре в течение часа, и осажденное нерастворимое вещество отфильтровывают, получая при этом указанное в заголовке соединение(2S,4S)-2-(аминокарбонил)-1-[(2S,3R)-2-(трет-бутоксикарбониламино)-3-метоксибутаноил]-4-фторпирролидина По способу, аналогичному способу примера 1(3), указанное в заголовке соединение (2,28 г) получают в виде бесцветного аморфного вещества из гидрохлорида (2S,4S)-2-(аминокарбонил)-4-фторпирролидина (1,18 г) и (2S,3R)-2-(трет-бутоксикарбониламино)-3-метоксибутановой кислоты (1,63 г). МС (ESI положит.) m/z: 370 ([M+Na]+), (ESI отрицат.) m/z: 346 ([М-Н]-).(2S,4S)-l-[(2S,3R)-2-(трет-бутоксикарбониламино)-3-метоксибутаноил]-2-циано-4 фторпирролидина По способу, аналогичному способу примера 15(2), указанное в заголовке соединение (1,96 г) получают в виде бесцветного твердого вещества из (2S,4S)-2-(аминокарбонил)-1-[(2S,3R)-2-(третбутоксикарбониламино)-3-метоксибутаноил]-4-фторпирролидина (2,17 г). МС (ESI положит.) m/z: 352 ([M+Na]+), (ESI отрицат.) m/z: 328 ([М-Н]-).(3) Синтез гидрохлорида (2S,4S)-1-[(2S,3R)-2-амино-3-метоксибутаноил]-2-циано-4-фторпирролидина По способу, аналогичному способу примера 15(3), указанное в заголовке соединение (0,61 г) получают в виде бесцветного порошка из (2S,4S)-1-[(2S,3R)-2-(трет-бутоксикарбониламино)-3 метоксибутаноил]-2-циано-4-фторпирролидина (1,82 г). МС (ESI положит.) m/z: 230 ([М+Н]+), 252 ([M+Na]+), (ESI отрицат.) m/z: 264 ([M+Cl]-). Пример 17. Синтез гидрохлорида (2S,4S)-1-[(2S)-2-амино-3,3-диметилбутаноил]-2-циано-4-фторпирролидина(1) Синтез (2S,4S)-2-(аминокарбонил)-1-[(2S)-2-(трет-бутоксикарбониламино)-3,3-диметилбутаноил]-4 фторпирролидина По способу, аналогичному способу примера 1(3), указанное в заголовке соединение (4,14 г) получают в виде бесцветного аморфного вещества из гидрохлорида (2S,4S)-2-(аминокарбонил)-4 фторпирролидина (2,00 г) и (2S)-2-(трет-бутоксикарбониламино)-3,3-диметилбутановой кислоты (2,74 г). МС (ESI положит.) m/z: 368 ([M+Na]+), (ESI отрицат.) m/z: 344 ( [M-H]-).(2S,4S)-1-[(2S)-2-(трет-бутоксикарбониламино)-3,3-диметилбутаноил]-2-циано-4 фторпирролидина По способу, аналогичному способу примера 15(2), указанное в заголовке соединение (2,90 г) получают в виде бесцветного твердого вещества из (2S,4S)-2-(аминокарбонил)-1-[(2S)-2-(третбутоксикарбониламино) -3,3-диметилбутаноил]-4-фторпирролидина (4,10 г). МС (ESI положит.) m/z: 350 ([M+Na]+), (ESI отрицат.) m/z: 326 ( [М-Н]-).(3) Синтез гидрохлорида (2S,4S)-1-[(2S)-2-амино-3,3-диметилбутаноил]-2-циано-4-фторпирролидина По способу, аналогичному способу примера 15(3), (2S,4S)-1-[(2S)-2-амино-3,3-диметилбутаноил]-2 циано-4-фторпирролидин (2,25 г) получают из (2S,4S)-1-[(2S)-2-(трет-бутоксикарбониламино)-3,3 диметилбутаноил]-2-циано-4-фторпирролидина (3,71 г). Из аликвоты (0,80 г) образовавшегося продукта затем получают указанное в заголовке соединение (0,92 г). МС (ESI положит.) m/z: 250 ([M+Na]+), (ESI отрицат.) m/z: 262 ([M+Cl]-). 1H-ЯМР (ДМСО-d6, 500 МГц) ; 8,54 (3H, ш.с), 5,55 (1 Н, ш.д, J=51,5 Гц), 5,07 (1 Н, д, J=9,8 Гц), 4,153,93 (2 Н, м), 3,79 (1 Н, с), 2,55-2,32 (2 Н, м), 1,05 (9 Н, с). Пример 18. Синтез моногидрата гидробромида (2S,4S)-1-[(2S)-2-амино-3,3-диметилбутаноил]-2 циано-4-фторпирролидина В метаноле (6 мл) растворяют (2S,4S)-1-[(2S)-2-амино-3,3-диметилбутаноил]-2-циано-4 фторпирролидин (0,25 г), полученный в примере 17, и затем добавляют к охлажденной льдом смеси 48% бромисто-водородной кислоты (0,14 мл) и диизопропилового эфира (9 мл). Далее добавляют диизопропиловый эфир (5 мл) с последующим перемешиванием. Осажденные кристаллы отфильтровывают и образовавшиеся кристаллы растворяют в метаноле (1,5 мл), добавляют к охлажденному льдом изопропилацетату (17 мл) и перемешивают. Осажденные кристаллы отфильтровывают, получая при этом указанное в заголовке соединение (0,20 г) в виде бесцветного порошка. Анализ: вычислено для C11H18FN3OHBrН 2 О: С, 40,50; Н, 6,49; N, 12,88; Вr, 24,49; F, 5,82. Найдено: С, 40,57; Н, 6,44; N, 13,02; Вr, 24,52; F, 5,83. Пример 19. Синтез гидрохлорида (2S,4S)-1-[(2S,3R)-2-амино-3-метилпентаноил]-2-циано-4 фторпирролидина(2S,4S)-2-(аминокарбонил)-1-[(2S,3R)-2-(трет-бутоксикарбониламино)-3-метилпентаноил]-4-фторпирролидина По способу, аналогичному способу примера 1(3), указанное в заголовке соединение (1,30 г) получают в виде бесцветного аморфного вещества из гидрохлорида (2S,4S)-2-(аминокарбонил)-4 фторпирролидина (0,67 г) и полугидрата (2S,3R)-2-(трет-бутоксикарбониламино)-3-метилпентановой кислоты (0,96 г). МС (ESI положит.) m/z: 368 ([M+Na]+), (ESI отрицат.) m/z: 344 ( [М-Н]-).(2S,4S)-l-[(2S,3R)-2-(трет-бутоксикарбониламино)-3-метилпентаноил]-2-циано-4 фторпирролидина По способу, аналогичному способу примера 15 (2), указанное в заголовке соединение (1,15 г) получают в виде бесцветного аморфного вещества из (2S,4S)-2-(аминокарбонил)-1-[(2S,3R)-2-(третбутоксикарбониламино)-3-метилпентаноил]-4-фторпирролидина (1,23 г). МС (ESI положит.) m/z: 350 ([M+Na]+) , (ESI отрицат.) m/z: 326 ([М-Н]-).(3) Синтез гидрохлорида (2S,4S)-1-[(2S,3R)-2-амино-3-метилпентаноил]-2-циано-4-фторпирролидина По способу, аналогичному способу примера 15 (3), указанное в заголовке соединение (0,29 г) получают из(1) Синтез (2S,4S)-2-(аминокарбонил)-1-[(2S,3S)-2-(трет-бутоксикарбониламино)-3-метилпентаноил]-4 фторпирролидина По способу, аналогичному способу примера 1(3), указанное в заголовке соединение (0,99 г) получают в виде бесцветного аморфного вещества из гидрохлорида (2S,4S)-2-(аминокарбонил)-4 фторпирролидина (0,51 г) и (2S,3S)-2-(трет-бутоксикарбониламино)-3-метилпентановой кислоты (0,69 г). МС (ESI положит.) m/z: 368 ([M+Na]+), (ESI отрицат.) m/z: 344 ([М-Н]-).(2S,4S)-l-[(2S,3S-2-(трет-бутоксикарбониламино)-3-метилпентаноил]-2-циано-4 фторпирролидина По способу, аналогичному способу примера 15(2), указанное в заголовке соединение (0,83 г) получают в виде бесцветного аморфного вещества из (2S,4S)-2-(аминокарбонил)-1-[(2S,3S)-2-(третбутоксикарбониламино)-3-метилпентаноил]-4-фторпирролидина (0,84 г). МС (ESI положит.) m/z: 350 ([M+Na]+), (ESI отрицат.) m/z: 326 ( [M-H]-).(3) Синтез гидрохлорида (2S,4S)-1-[(2S,3S)-2-амино-3-метилпентаноил]-2-циано-4-фторпирролидина По способу, аналогичному способу примера 15(3), указанное в заголовке соединение (0,14 г), которое является идентичным с соединением, полученным в примере 1, получают из (2S,4S)-1-[(2S, 3S)-2(трет-бутоксикарбониламино)-3-метилпентаноил]-2-циано-4-фторпирролидина (0,35 г). Пример 21. Синтез гидрохлорида (2S,4S)-1-(трет-бутиламино)ацетил-2-циано-4-фторпирролидина В тетрагидрофуране (10 мл) растворяют трет-бутиламин (0,47 г) и при охлаждении льдом добавляют раствор (3 мл) в тетрагидрофуране (2S,4S)-1-бромацетил-2-циано-4-фторпирролидина (0,30 г). Температуру постепенно повышают и после перемешивания при комнатной температуре на протяжении но- 21006204 чи раствор концентрируют при пониженном давлении. К образовавшемуся остатку добавляют насыщенный водный раствор бикарбоната натрия с последующей экстракцией хлороформом. Органическую фазу промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия и,после удаления осушающего агента фильтрованием, фильтрат концентрируют при пониженном давлении. Образовавшийся остаток суспендируют в диэтиловом эфире и нерастворимое вещество отфильтровывают, получая при этом (2S,4S)-1-(трет-бутиламино)ацетил-2-циано-4-фторпирролидин (0,26 г) в виде бесцветного порошка, аликвоту (0,25 г) которого затем добавляют к охлажденному льдом раствору в диэтиловом эфире 4 М хлористо-водородной кислоты (раствор этилацетата, 0,3 мл) с последующим перемешиванием при комнатной температуре в течение часа. Нерастворимое вещество отфильтровывают,получая при этом указанное в заголовке соединение (0,28 г) в виде бесцветного порошка. МС (ESI положит.) m/z: 228 ([М+Н)]+, 250 ([M+Na]+), (ESI отрицат.) m/z: 226 ([М-Н]-), 262 ([М+Сl]-). 1H-ЯМР (ДMCO-d6, 500 МГц) ; 9,10 (2 Н, ш.с), 5,56 (1 Н, ш.д, J=52,9 Гц), 5,09-5,06 (1 Н, м) , 4,16 (1 Н,дд, J=24,4, 12,5 Гц), 4,12 (1 Н, д, J=16,5 Гц), 3,88 (1 Н, д, J=16,5 Гц), 3,86 (1 Н, ддд, J=39,9, 12,5, 3,3 Гц),2,54-2,40 (2 Н, м), 1,33 (9 Н, с). Пример 22. Синтез гидрохлорида (2S,4S)-2-циано-4-фтор-1-(изопропиламино)ацетилпирролидина По способу, аналогичному способу примера 21, указанное в заголовке соединение (0,16 г) получают в виде бесцветного порошка из изопропиламина (0,65 г) и (2S,4S)-1-бромацетил-2-циано-4 фторпирролидина (0,50 г). МС (ESI положит.) m/z: 214 ([М+Н)]+, 236 ([M+Na]+), (ESI отрицат.) m/z: 212 ([М-Н]-) , 248 ( [М+Сl]-). Пример 23. Синтез гидрохлорида (2S,4S)-2-циано-1-(циклопропиламино)ацетил-4-фторпирролидина По способу, аналогичному способу примера 21, указанное в заголовке соединение (0,28 г) получают в виде бесцветного порошка из циклопропиламина (0,86 г) и (2S,4S)-1-бромацетил-2-циано-4 фторпирролидина (0,71 г). МС (ESI положит.) m/z: 212 ([М+Н)]+, 234 ([M+Na]+ ), (ESI отрицат.) m/z: 246 ([M+Cl]-). Пример 24. Синтез гидрохлорида (2S,4S)-2-циано-1-(циклобутиламино)ацетил-4-фторпирролидина По способу, аналогичному способу примера 21, указанное в заголовке соединение (0,31 г) получают в виде бесцветного порошка из циклобутиламина (1,07 г) и (2S,4S)-1-бромацетил-2-циано-4 фторпирролидина (0,71 г). МС (ESI положит.) m/z: 226 ([М+Н)]+, 248 ([M+Na]+), (ESI отрицат.) m/z: 260 ([M+Cl]-). Пример 25. Синтез гидрохлорида (2S,4S)-2-циано-1-(циклопентиламино)ацетил-4-фторпирролидина По способу, аналогичному способу примера 21, указанное в заголовке соединение (0,58 г) получают в виде бесцветного порошка из циклопентиламина (1,28 г) и (2S,4S)-1-бромацетил-2-циано-4 фторпирролидина (0,71 г). МС (ESI положит.) m/z: 240 ([М+Н)]+, 262 ([M+Na]+), (ESI отрицат.) m/z: 274 ([M+Cl]-). Пример 26. Синтез гидрохлорида (2S,4S)-2-циано-4-фтор-1-[(1-гидроксиметил)циклопентиламино]ацетилпирролидина По способу, аналогичному способу примера 21, указанное в заголовке соединение (0,51 г) получают в виде бесцветного порошка из (1-гидроксиметил)циклопентиламина (0,59 г) и (2S,4S)-1-бромацетил-2 циано-4-фторпирролидина (0,60 г). МС (ESI положит.) m/z: 292 ([M+Na]+), (ESI отрицат.) m/z: 268 ([М-Н]-), 304 ([M+Cl]-). 1 Н-ЯМР (ДMCO-d6, 500 МГц) ; 8,99 (2 Н, ш.с), 5,68 (1 Н, ш.с), 5,55 (1 Н, ш.д, J=52,4 Гц), 5,08-5,05 (1 Н, м),4,17 (1 Н, ш.д, J=16,5 Гц), 4,09 (1 Н, дд, J=23,l, 12,2 Гц), 3,98 (1 Н, ш.д, J=16,5 Гц), 3,82 (1 Н, ддд, J=39,3, 12,3, 3,1 Гц), 3,51 и 3,48 (2 Н, АВ кв, J=12,5 Гц), 2,56-2,36 (2 Н, м) , 1,86-1,68 (6 Н, м), 1,59-1,48 (2 Н, м). Пример 27. Синтез гидрохлорида (2S,4S)-2-циано-4-фтор-1-(3-изопропоксипропиламино)ацетилпирролидина В тетрагидрофуране (15 мл) растворяют 3-изопропоксипропиламин (1,1 г) и затем при охлаждении льдом добавляют раствор (5 мл) в тетрагидрофуране (2S,4S)-1-бромацетил-2-циано-4-фторпирролидина(0,45 г). Температуру постепенно повышают и затем смесь перемешивают при комнатной температуре на протяжении ночи. Раствор концентрируют при пониженном давлении и растворяют в хлороформе, и органическую фазу промывают последовательно насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. Осушающий агент удаляют фильтрованием и фильтрат концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (проявляющий агент; хлороформ:метанол=50:1-25:1). Образовавшийся остаток растворяют в диэтиловом эфире (5 мл) и добавляют к раствору (40 мл) в диэтиловом эфире 4 М хлористо-водородной кислоты (раствор этилацетата, 0,33 мл) при охлаждении льдом. Осажденное нерастворимое вещество отфильтровывают и промывают диэтиловым эфиром, получая при этом указанное в заголовке соединение (0,32 г) в виде бесцветного порошка. МС (ESI положит.) m/z: 272 ([М+Н)]+, 294 ([M+Na]+), (ESI отрицат.) m/z: 270 ([М-Н]-), 306 ([М+Сl]-).- 22006204 Пример 28. Синтез гидрохлорида (2S,4S)-2-циано-1-(циклооктиламино)ацетил-4-фторпирролидина По способу, аналогичному способу примера 27, указанное в заголовке соединение (0,29 г) получают в виде бесцветного порошка из циклооктиламина (1,1 г) и (2S,4S)-1-бромацетил-2-циано-4 фторпирролидина (0,45 г). МС (ESI положит.) m/z: 282 ([М+Н)]+, 304 ([M+Na]+), (ESI отрицат.) m/z: 280 ([М-Н]-), 316 ([М+Сl]-). Пример 29. Синтез гидрохлорида (2S,4S)-2-циано-1-[2-(3,4-диметоксифенил)этиламино]ацетил-4 фторпирролидина По способу, аналогичному способу примера 27, указанное в заголовке соединение (0,24 г) получают в виде бесцветного порошка из 2-(3,4-диметоксифенил)этиламина (0,5 г) и (2S,4S)-1-бромацетил-2 циано-4-фторпирролидина (0,25 г). МС (ESI положит.) m/z: 336 ([М+Н)]+, 358 ([M+Na]+), (ESI отрицат.) m/z: 334 ([М-Н]-), 370 ( [М+Сl]-). Пример 30. Синтез гидрохлорида(2S,4S)-2-циано-4-фтор-1-[(1-метоксиметил-1 метил)этиламино]ацетилпирролидина В смеси тетрагидрофурана (7,5 мл) и этанола (2,5 мл) растворяют гидрохлорид (1-метоксиметил-1 метил)этиламина (0,74 г) и после нейтрализации добавлением диизопропиламина (0,92 мл) при охлаждении льдом добавляют (2S,4S)-1-бромацетил-2-циано-4-фторпиррролидин (0,62 г). После перемешивания с охлаждением льдом в течение часа температуру повышают до комнатной температуры, и затем смесь перемешивают в течение 2 дней. После обработки способом, аналогичным способу примера 21, указанное в заголовке соединение (0,07 г) получают в виде бесцветного порошка. МС (ESI положит.) m/z: 258 ([М+Н)]+, 280 ([M+Na]+), (ESI отрицат.) m/z: 292 ([M+Cl]-). Пример 31. Синтез гидрохлорида(2S,4S)-2-циано-4-фтор-1-[(2-гидрокси-1,1-диметил)этиламино]ацетилпирролидина По способу, аналогичному способу примера 21, указанное в заголовке соединение (0,62 г) получают в виде бледно-розового порошка из 2-амино-2-метил-1-пропанола (0,71 г) и (2S,4S)-1-бромацетил-2 циано-4-фторпирролидина (0,54 г). МС (ESI положит.) m/z: 244 ([М+Н)]+, 266 ([M+Na]+), (ESI отрицат.) m/z: 242 ([М-Н]-), 278 ([M+Cl]-). Пример 32. Синтез гидрохлорида (2S,4S)-1-(2-адамантиламино)ацетил-2-циано-4-фторпирролидина По способу, аналогичному способу примера 27, указанное в заголовке соединение (0,23 г) получают в виде бесцветного порошка из 2-адамантанамина (0,4 г) и (2S,4S)-1-бромацетил-2-циано-4 фторпирролидина (0,25 г). МС (ESI положит.) m/z: 306 ([М+Н)]+, 328 ([M+Na]+), (ESI отрицат.) m/z: 306 ([М-Н]-), 340 ([M+Cl]-). Пример 33. Синтез гидрохлорида(2S,4S)-2-циано-4-фтор-1-(1-гидрокси-3-адамантиламино)ацетилпирролидина По способу, аналогичному способу примера 27, указанное в заголовке соединение (0,42 г) получают в виде бесцветного порошка из 3-амино-1-адамантанола (0,70 г) и (2S,4S)-1-бромацетил-2-циано-4 фторпирролидина (0,47 г). МС (ESI положит.) m/z: 322 ([М+Н)]+, 344 ([M+Na]+), (ESI отрицат.) m/z: 320 ( [M-H]-), 356 ([M+Cl]-). Пример 34. Синтез гидрохлорида (2S,4S)-2-циано-4-фтор-1-(1-гидрокси-4-адамантиламино)ацетилпирролидина В смеси тетрагидрофуран (10 мл) - этанол (5 мл) растворяют 4-амино-1-адамантанол (0,5 г) и при охлаждении льдом добавляют (2S,4S)-1-бромацетил-2-циано-4-фторпирролидин (0,45 г). Температуру постепенно повышают и затем смесь перемешивают при комнатной температуре на протяжении ночи. Раствор растворяют в насыщенном водном растворе бикарбоната натрия и экстрагируют этилацетатом. Органическую фазу промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия, осушающий агент удаляют фильтрованием и фильтрат концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель; хлороформ : метанол : 25% водный раствор аммиака = 40:1:0,1-10:1:0,1). Образовавшийся остаток растворяют в этилацетате (5 мл) и при охлаждении льдом добавляют 4 М хлористоводородную кислоту (раствор в этилацетате, 0,30 мл). Осажденное нерастворимое вещество отфильтровывают и промывают этилацетатом, получая при этом указанное в заголовке соединение (0,27 г) в виде бесцветного порошка. МС (ESI положит.) m/z: 322 ([М+Н]+), 344 ([M+Na]+), (ESI отрицат.) m/z: 356 ([M+Cl]-). Пример 35. Синтез гидрохлорида (2S,4S)-2-циано-4-фтор-1-(1-метокси-3-адамантиламино)ацетилпирролидина По способу, аналогичному способу примера 34, (2S,4S)-2-циано-4-фтор-1-(1-метокси-3 адамантиламино)ацетилпирролидин (0,23 г) получают из 1-метокси-3-адамантанамина (0,17 г) и (2S,4S)1-бромацетил-2-циано-4-фторпирролидина (0,17 г). Аликвоту (0,22 г) этого продукта растворяют в этилацетате (4 мл) и затем добавляют 4 М хлористоводородную кислоту (раствор в этилацетате, 0,20 мл). К раствору добавляют диэтиловый эфир (8 мл) и осажденное нерастворимое вещество отфильтровывают, получая при этом указанное в заголовке соединение (0,10 г) в виде бесцветного порошка. МС (ESI положит.) m/z: 336 ([М+Н]+), 358 ([M+Na]+), (ESI отрицат.) m/z: 370 ([М+Сl]-).- 23006204 Пример 36. Синтез гидрохлорида (2S,4S)-1-(1-адамантиламино)ацетил-2-циано-4-фторпирролидина По способу, аналогичному способу примера 35, указанное в заголовке соединение (0,15 г) получают в виде бесцветного порошка из 1-адамантанамина (0,45 г) и (2S,4S)-1-бромацетил-2-циано-4 фторпирролидина (0,235 г). МС (ESI положит.) m/z: 306 ([М+Н]+), 328 ([M+Na]+), (ESI отрицат.) m/z: 340 ([M+Cl]-). Пример 37. Синтез дигидрохлорида (2S,4S)-1-[2-[(5-хлорпиридин-2-ил)амино]этиламино]ацетил-2 циано-4-фторпирролидина(1) Синтез (2S,4S)-1-[N-(трет-бутоксикарбонил)-2-[(5-хлорпиридин-2-ил)амино]этиламино]ацетил 2-циано-4-фторпирролидина В этаноле (15 мл) растворяют 2-(2-аминоэтиламино)-5-хлорпиридин (1,54 г) и затем при охлаждении льдом добавляют раствор (15 мл) в тетрагидрофуране (2S,4S)-1-бромацетил-2-циано-4 фторпирролидина (0,71 г) с последующим перемешиванием при охлаждении льдом в течение 10 мин и затем при комнатной температуре в течение 30 мин. Раствор снова охлаждают льдом и добавляют раствор (10 мл) в тетрагидрофуране ди-трет-бутилдикарбоната (1,96 г) и диизопропилэтиламина (0,52 мл). Температуру повышают и затем смесь перемешивают с последующим перемешиванием при комнатной температуре в течение часа. Растворитель выпаривают при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель; гексан:этилацетат=2:1-только этилацетат), получая при этом указанное в заголовке соединение (1,07 г) в виде бесцветного аморфного вещества. МС (ESI положит.) m/z: 448 ([M+Na]+), (ESI отрицат.) m/z: 424 ([М-Н]-).(2) Синтез дигидрохлорида (2S,4S)-1-[2-[(5-хлорпиридин-2-ил)амино]этиламино]ацетил-2-циано-4 фторпирролидина В 1,4-диоксане (2,5 мл) растворяют (2S,4S)-1-[N-(трет-бутоксикарбонил)-2-[(5-хлорпиридин-2 ил)амино]этиламино]ацетил-2-циано-4-фторпирролидин (1,02 г) и при охлаждении льдом добавляют 4 М хлористо-водородную кислоту (раствор в 1,4-диоксане, 7,5 мл) с последующим перемешиванием при охлаждении льдом в течение часа. К реакционному раствору добавляют толуол (30 мл) и нерастворимое вещество отфильтровывают. Образовавшийся порошок растворяют в метаноле (2 мл), добавляют к толуолу (50 мл) и перемешивают при комнатной температуре. Осажденное нерастворимое вещество отфильтровывают, получая при этом указанное в заголовке соединение (0,75 г) в виде бесцветного порошка. МС (ESI положит.) m/z: 326 ([М+Н)]+, 348 ([M+Na]+), (ESI отрицат.) m/z: 324 ([М-Н]-), 360 ([М+Сl]-). Пример 38. Синтез дигидрохлорида (2S,4S)-2-циано-4-фтор-1-[2-[(пиридин-2-ил)амино]этиламино]ацетилпирролидина(2S,4S)-1-[N-(трет-бутоксикарбонил)-2-[(пиридин-2-ил)амино]этиламино]ацетил-2 циано-4-фторпирролидина По способу, аналогичному способу примера 37(1), указанное в заголовке соединение (0,60 г) получают в виде бесцветного аморфного вещества из 2-(2-аминоэтиламино)пиридина (0,82 г) и (2S,4S)-1 бромацетил-2-циано-4-фторпирролидина (0,71 г). МС (ESI положит.) m/z: 414 ([M+Na]+), (ESI отрицат.) m/z: 390 ( [M-H]-).(2S,4S)-2-циано-4-фтор-1-[2-[(пиридин-2-ил)амино]этиламино]ацетилпирролидина По способу, аналогичному способу примера 37(2), указанное в заголовке соединение (0,27 г) получают в виде бесцветного порошка из (2S,4S)-1-[N-(трет-бутоксикарбонил)-2-[(пиридин-2 ил)амино]этиламино]ацетил-2-циано-4-фторпирролидина (0,54 г). МС (ESI положит.) m/z: 292 ([М+Н)]+, 314 ([M+Na]+), (ESI отрицат.) m/z: 290 ([М-Н]-), 326 ( [M+Cl]-). Пример 39. Синтез дигидрохлорида (2S,4S)-1-[2-[(5-аминокарбонилпиридин-2-ил)амино]этиламино]ацетил-2 циано-4-фторпирролидина(1) Синтез (2S,4S)-1-[N-(трет-бутоксикарбонил)-2-[(5-аминокарбонилпиридин-2-ил)амино]этиламино]ацетил-2-циано-4-фторпирролидина По способу, аналогичному способу примера 37(1), указанное в заголовке соединение (0,36 г) получают в виде бесцветного аморфного вещества из 2-(2-аминоэтиламино)-5-аминокарбонилпиридина (1,08 г) и (2S,4S)-1-бромацетил-2-циано-4-фторпирролидина (0,71 г). МС (ESI положит.) m/z: 457 ([M+Na]+), (ESI отрицат.) m/z: 433 ([М-Н]-).(2) Синтез дигидрохлорида (2S,4S)-1-[2-[(5-аминокарбонилпиридин-2-ил)амино]этиламино]ацетил 2-циано-4-фторпирролидина По способу, аналогичному способу примера 37(2), указанное в заголовке соединение (0,26 г) получают в виде светло-розового порошка из(1) Синтез (2S,4S)-2-(аминокарбонил)-1-(2S)-2-флуоренилметоксикарбониламино)-2-циклогексил]ацетил]-4-фторпирролидина По способу, аналогичному способу примера 1(3), указанное в заголовке соединение (0,88 г) получают в виде бесцветного аморфного вещества из гидрохлорида (2S,4S)-2-(аминокарбонил)-4 фторпирролидина (0,30 г) и [(2S)-2-флуоренилметоксикарбониламино-2-циклогексил]уксусной кислоты(2) Синтез (2S,4S)-2-циано-1-(2S)-2-флуоренилметоксикарбониламино-2-циклогексил]ацетил]-4 фторпирролидина По способу, аналогичному способу примера 1(4), указанное в заголовке соединение (0,76 г) получают в виде бесцветного аморфного вещества из (2S,4S)-2-(аминокарбонил)-1-(2S)-2 флуоренилметоксикарбониламино)-2-циклогексил]ацетил]-4-фторпирролидина (0,86 г). МС (ESI положит.) m/z: 498 ([M+Na]+).(2S,4S)-l-(2S)-2-амино-2-циклогексил]ацетил]-2-циано-4 фторпирролидина По способу, аналогичному способу примера 1(5), указанное в заголовке соединение (0,27 г) получают в виде бесцветного порошка из (2S,4S)-2-циано-1-(2S)-2-флуоренилметоксикарбониламино-2 циклогексил]ацетил]-4-фторпирролидина (0,73 г). МС (ESI положит.) m/z: 254 ([М+Н)]+, 276 ([M+Na]+), (ESI отрицат.) m/z: 252([М-Н]-), 288 ([М+Сl]-). Пример 41. Синтез гидрохлорида (2S,4S)-1-[(2S)-2-амино-4-5-(бензилоксикарбонил)пентиламино]карбонил]бутаноил]-2-циано-4-фторпирролидина По способу, аналогичному способу примера 40, указанное в заголовке соединение (0,16 г) получают в виде бесцветного аморфного вещества из гидрохлорида (2S,4S)-2-(аминокарбонил)-4-фторпирролидина(1) Синтез (2S,4S)-2-(аминокарбонил)-1-(2S)-2-(трет-бутоксикарбониламино)-6-бензилоксикарбониламино]гексаноил]-4-фторпирролидина В диметилформамиде (5 мл) растворяют гидрохлорид (2S,4S)-2-(аминокарбонил)-4 фторпирролидина (0,30 г) и (2S)-2-трет-бутоксикарбониламино-6-[бензилоксикарбониламино]гексаноата гидроксисукцинимида (0,71 г) и затем добавляют диизопропиламин (0,26 мл) с последующим перемешиванием при комнатной температуре на протяжении ночи. Обработкой способом, аналогичным способу примера 1(3), указанное в заголовке соединение (0,69 г) получают в виде бесцветного аморфного вещества. МС (ESI положит.) m/z: 517 ([M+Na]+), (ESI отрицат.) m/z: 493 ([М-Н]-).(2S,4S)-l-(2S)-2-(трет-бутоксикарбониламино)-6-бензилоксикарбониламино]гексаноил]-2-циано-4-фторпирролидина По способу, аналогичному способу примера 1(4), указанное в заголовке соединение (0,36 г) получают в виде бесцветного аморфного вещества из (2S,4S)-2-(аминокарбонил)-1-(2S)-2-(третбутоксикарбониламино)-6-бензилоксикарбониламино]гексаноил]-4-фторпирролидина (0,65 г). МС (ESI положит.) m/z: 499 ([M+Na]+), (ESI отрицат.) m/z: 475 ([M-H]-).(3) Синтез гидрохлорида (2S,4S)-1-(2S)-2-амино-6-бензилоксикарбониламино]гексаноил]-2-циано 4-фторпирролидина В 1,4-диоксане (2,0 мл) растворяют (2S,4S)-1- (2S)-2-(трет-бутоксикарбониламино)-6- бензилоксикарбониламино]гексаноил]-2-циано-4-фторпирролидин (0,34 г) и затем добавляют 4 М хлористоводородную кислоту (раствор в 1,4-диоксане, 2,0 мл) с последующим перемешиванием при комнатной температуре в течение 2,5 ч. Раствор концентрируют при пониженном давлении, и образовавшийся остаток растворяют добавлением 2-пропанола (3,0 мл) и метанола (1,0 мл) и затем добавляют изопропиловый эфир (10 мл). Раствор перемешивают при комнатной температуре в течение 0,5 ч, осажденное нерастворимое вещество отфильтровывают, получая при этом указанное в заголовке соединение (0,27 г) в виде бесцветного порошка. МС (ESI положит.) m/z: 377 ([М+Н)]+, 399 ([M+Na]+), (ESI отрицат.) m/z: 375 ([М-Н]-), 411 ([М+Сl]-). Пример 43. Синтез гидрохлорида (2S,4S)-2-циано-4-фтор-1-(2S,3S)-3-метил-2-метиламино]пентаноил]пирролидина(1) Синтез (2S,4S)-2-(аминокарбонил)-1-[(2S,3S)-2-[N-(трет-бутоксикарбонил)-N-метил]амино-3 метилпентаноил]-4-фторпирролидина По способу, аналогичному способу примера 1(3), указанное в заголовке соединение (1,35 г) получают в виде бесцветного аморфного вещества из гидрохлорида (2S,4S)-2-(аминокарбонил)-4- 25006204 фторпирролидина (0,67 г) и (2S,3S)-2-[N-(трет-бутоксикарбонил)-N-метил]амино-3-метилпентановой кислоты (0,98 г). МС (ESI положит.) m/z: 382 ([M+Na]+), (ESI отрицат.) m/z: 358 ([М-Н]-).(2) Синтез (2S,4S)-l-[(2S,3S)-2-[N-(трет-бутоксикарбонил)-N-метил]амино-3-метилпентаноил]-2 циано-4-фторпирролидина По способу, аналогичному способу примера 15(2), указанное в заголовке соединение (0,89 г) получают в виде бесцветного аморфного вещества из (2S,4S)-2-(аминокарбонил)-1-[(2S,3S)-2-[N-третбутоксикарбонил)-N-метил]амино-3-метилпентаноил]-4-фторпирролидина (1,32 г). МС (ESI положит.) m/z: 364 ([M+Na]+), (ESI отрицат.) m/z: 340 ([М-Н]-).(2S,4S)-2-циано-4-фтор-1-(2S,3S)-3-метил-2-метиламино]пентаноил]пирролидина По способу, аналогичному способу примера 15(3), указанное в заголовке соединение (0,053 г) получают в виде бесцветного порошка из (2S,4S)-1-[(2S,3S)-2-[N-(трет-бутоксикарбонил)-N-метил]амино-3 метилпентаноил]-2-циано-4-фторпирролидина (0,10 г). МС (ESI положит.) m/z: 242 ([М+Н)]+, 264 ([M+Na]+), (ESI отрицат.) m/z: 276 ([М-Н]-). Пример 44. Синтез гидрохлорида (2S,4S)-1-(2S,3R)-2-амино-3-(трет-бутокси)]бутаноил]-2-циано 4-фторпирролидина(1) Синтез (2S,4S)-1-(трет-бутоксикарбонил)-2-циано-4-фторпирролидина По способу, аналогичному способу примера 15(2), указанное в заголовке соединение (9,23 г) получают в виде бесцветного порошка из (2S,4S)-2-(аминокарбонил)-1-(трет-бутоксикарбонил)-4 фторпирролидина (10,0 г). МС (ESI положит.) m/z: 237 ([M+Na]+).(2) Синтез гидрохлорида (2S,4S)-2-циано-4-фторпирролидина По способу, аналогичному способу примера 15(3), указанное в заголовке соединение (5,76 г) получают в виде бледно-розового порошка из (2S,4S)-1-(трет-бутоксикарбонил)-2-циано-4-фторпирролидина(3) Синтез (2S,4S)-2-циано-l-(2S,3R)-2-флуоренилметоксикарбониламино-3-(трет-бутокси)]бутаноил]-4-фторпирролидина По способу, аналогичному способу примера 1(3), указанное в заголовке соединение (0,87 г) получают в виде бесцветного аморфного вещества из гидрохлорида (2S,4S)-2-циано-4-фторпирролидина (0,30 г) и [(2S,3R)-2-флуоренилметоксикарбониламино-3-(трет-бутокси)]бутановой кислоты (0,80 г). МС (ESI положит.) m/z: 516 ([M+Na]+).(4) Синтез гидрохлорида (2S,4S)-1-(2S,3R)-2-амино-3-(трет-бутокси)]бутаноил]-2-циано-4 фторпирролидина По способу, аналогичному способу примера 1(5), указанное в заголовке соединение (0,28 г) получают в виде бесцветного порошка из (2S,4S)-2-циано-l-(2S,3R)-2-флуоренилметоксикарбониламино-3(трет-бутокси)]бутаноил]-4-фторпирролидина (0,71 г). МС (ESI положит.) m/z: 272 ([М+Н]+), 294 ([M+Na]+), (ESI отрицат.) m/z: 306 ([M+Cl]-). Пример 45. Синтез гидрохлорида (2S,4S)-2-циано-4-фтор-1-(3S)-1,2,3,4-тетрагидроизохинолин-3 ил]карбонил]пирролидина(1) Синтез (2S,4S)-1-[(3S)-2-(трет-бутоксикарбонил)-1,2,3,4-тетрагидроизохинолин-3-ил]карбонил 2-циано-4-фторпирролидина По способу, аналогичному способу примера 1(3), указанное в заголовке соединение (0,83 г) получают в виде светло-коричневого порошка из гидрохлорида (2S,4S)-2-циано-4-фторпирролидина (0,69 г) и(2S,4S)-2-циано-4-фтор-1-(3S)-1,2,3,4-тетрагидроизохинолин-3 ил]карбонил]пирролидина В этаноле (6 мл) суспендируют (2S,4S)-1-[(3S)-2-(трет-бутоксикарбонил)-1,2,3,4-тетрагидроизохинолин-3-ил]карбонил-2-циано-4-фторпирролидин (0,30 г) и после охлаждения льдом добавляют 6 М водный раствор хлористо-водородной кислоты (3 мл). Температуру постепенно повышают до комнатной температуры и затем смесь перемешивают на протяжении ночи. Далее добавляют метанол (6 мл) и 6 М водный раствор хлористо-водородной кислоты (3 мл) с последующим перемешиванием при комнатной температуре в течение дня. Растворитель концентрируют при пониженном давлении и образовавшийся остаток промывают диэтиловым эфиром, растворяют в метаноле (2 мл) и добавляют по каплям к этилацетату (10 мл). К раствору добавляют диэтиловый эфир (10 мл) и осажденное нерастворимое вещество отфильтровывают и промывают смесью этилацетат-диэтиловый эфир (1:1), получая при этом указанное в заголовке соединение (0,19 г) в виде бледно-коричневого порошка. МС (ESI положит.) m/z: 274 ([М+Н)]+, 296 ([M+Na]+), (ESI отрицат.) m/z: 272 ( [М-Н]-), 308 ([М+Сl]-).(1) Синтез (2S,4S)-1-[(3S)-2-(трет-бутоксикарбонил)-7-гидрокси-1,2,3,4-тетрагидроизохинолин-3 ил]карбонил-2-циано-4-фторпирролидина По способу, аналогичному способу примера 1(3), указанное в заголовке соединение (2,81 г) получают в виде бесцветного аморфного вещества из гидрохлорида (2S,4S)-2-циано-4-фторпирролидина (1,54 г) и (3S)-2-(трет-бутоксикарбонил)-7-гидрокси-1,2,3,4-тетрагидроизохинолин-3-карбоновой кислоты(2) Синтез гидрохлорида (2S,4S)-2-циано-4-фтор-1-(3S)-7-гидрокси-1,2,3,4-тетрагидроизохинолин 3-ил]карбонил]пирролидина По способу, аналогичному способу примера 45(2), указанное в заголовке соединение (0,12 г) получают в виде светло-коричневого порошка из (2S,4S)-1-[(3S)-2-(трет-бутоксикарбонил)-7-гидрокси 1,2,3,4-тетрагидроизохинолин-3-ил]карбонил-2-циано-4-фторпирролидина (0,30 г). МС (ESI положит.) m/z: 290 ([М+Н)]+, 312 ([M+Na]+), (ESI отрицат.) m/z: 288 ( [М-Н]-), 324 ([М+Сl]-). Пример 47. Синтез гидрохлорида (2S,4S)-2-циано-4-фтор-1-(3S)-7-метокси-1,2,3,4-тетрагидроизохинолин-3-ил]карбонил]пирролидина(1) Синтез (2S,4S)-1-[(3S)-2-(трет-бутоксикарбонил)-7-метокси-1,2,3,4-тетрагидроизохинолин-3 ил]карбонил-2-циано-4-фторпирролидина В N,N-диметилформамиде (5 мл) растворяют (2S,4S)-1-[ (3S)-2-(трет-бутоксикарбонил)-7-гидрокси 1,2,3,4-тетрагидроизохинолин-3-ил]карбонил-2-циано-4-фторпирролидин (0,63 г) и затем добавляют метилиодид (0,15 мл) и карбонат калия (0,25 г) с последующим перемешиванием при комнатной температуре на протяжении ночи. Реакционный раствор растворяют в воде и экстрагируют этилацетатом. Органическую фазу промывают последовательно 0,5 М водным раствором хлористо-водородной кислоты,насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия. После сушки над безводным сульфатом натрия осушающий агент отделяют фильтрованием, и фильтрат концентрируют при пониженном давлении. Остаток промывают диизопропиловым эфиром, получая при этом указанное в заголовке соединение (0,42 г) в виде бледно-желтого порошка. МС (ESI положит.) m/z: 426 ([M+Na]+), (ESI отрицат.) m/z: 402 ([М-Н]-).(2) Синтез гидрохлорида (2S,4S)-2-циано-4-фтор-1-(3S)-7-метокси-1,2,3,4-тетрагидроизохинолин 3-ил]карбонил]пирролидина По способу, аналогичному способу примера 45(2), указанное в заголовке соединение (0,12 г) получают в виде светло-коричневого порошка из (2S,4S)-1-[(3S)-2-(трет-бутоксикарбонил)-7-метокси-1,2,3,4 тетрагидроизохинолин-3-ил] карбонил-2-циано-4-фторпирролидина (0,30 г). МС (ESI положит.) m/z: 304 ([М+Н]+), 326 ([M+Na]+), (ESI отрицат.) m/z: 338 ([M+Cl]-). Пример 48. Синтез гидрохлорида(1) Синтез (2S,4S)-1-[(3S)-2-(трет-бутоксикарбонил)-7-аминокарбонилметокси-1,2,3,4-тетрагидроизохинолин-3-ил] карбонил-2-циано-4-фторпирролидина По способу, аналогичному способу примера 47 (1), указанное в заголовке соединение (0,55 г) получают в виде бесцветного порошка из (2S,4S)-1-[(3S)-2-(трет-бутоксикарбонил)-7-гидрокси-1,2,3,4 тетрагидроизохинолин-3-ил]карбонил-2-циано-4-фторпирролидина (0,60 г) и бромацетамида (0,32 г). МС (ESI положит.) m/z: 469 ([M+Na]+), (ESI отрицат.) m/z: 445 ([М-Н]-).(2S,4S)-1-[(3S)-2-(трет-бутоксикарбонил)-7 аминокарбонилметокси-1,2,3,4-тетрагидроизохинолин-3-ил]карбонил-2-циано-4-фторпирролидин (0,30 г) и затем при охлаждении льдом добавляют 4 М хлористо-водородную кислоту (раствор в этилацетате,12 мл) с последующим перемешиванием при охлаждении льдом в течение 15 мин и затем при комнатной температуре в течение часа. Добавляют этилацетат (12 мл), образовавшееся нерастворимое вещество отфильтровывают и промывают этилацетатом, получая при этом бледно-желтый порошок. Образовавшийся порошок затем суспендируют в этаноле (5 мл), перемешивают при комнатной температуре в течение часа, отфильтровывают и промывают этанолом, получая при этом указанное в заголовке соединение(1) Синтез (3S)-2-(трет-бутоксикарбонил)-б,7-диметокси-1,2,3,4-тетрагидроизохинолин-3-карбоновой кислоты В тетрагидрофуране (6 мл) суспендируют п-толуолсульфонат (3S)-6,7-диметокси-1,2,3,4 тетрагидроизохинолин-3-карбоксилата (0,50 г) и затем при комнатной температуре добавляют насыщенный водный раствор бикарбоната натрия (3 мл) с последующим перемешиванием при комнатной темпе- 27006204 ратуре до тех пор, пока больше не образуются пузырьки. Раствор охлаждают на ледяной бане, добавляют ди-трет-бутилдикарбонат (0,31 мл), температуру постепенно повышают и затем смесь перемешивают при комнатной температуре на протяжении ночи. Добавляют 1 М водный раствор хлористо-водородной кислоты (5 мл) и избыточное количество хлорида натрия с последующей экстракцией этилацетатом. Органическую фазу промывают насыщенным водным раствором хлорида натрия и, после сушки над безводным сульфатом натрия, осушающий агент удаляют фильтрованием и фильтрат концентрируют при пониженном давлении. Остаток промывают смесью гексан-диизопропиловый эфир, получая при этом указанное в заголовке соединение (0,38 г) в виде бледно-желтого порошка. МС (ESI положит.) m/z: 360 ([M+Na]+), (ESI отрицат.) m/z: 336 ([M-H]-).(2) Синтез (2S,4S)-1-(3S)-2-(трет-бутоксикарбонил)-6,7-диметокси-1,2,3,4-тетрагидроизохинолин 3-ил]карбонил-2-циано-4-фтopпирролидина По способу, аналогичному способу примера 1(3), указанное в заголовке соединение (0,34 г) получают в виде бесцветного порошка из гидрохлорида (2S,4S)-2-циано-4-фторпирролидина (0,15 г) и (3S)-2(трет-бутоксикарбонил)-6,7-диметокси-1,2,3,4-тетрагидроизохинолин-3-карбоновой кислоты (0,34 г). МС (ESI положит.) m/z: 456 ([M+Na]+).(3) Синтез гидрохлорида (2S,4S)-2-циано-1-[(3S)-6,7-диметокси-1,2,3,4-тетрагидроизохинолин-3 ил]карбонил-4-фторпирролидина По способу, аналогичному способу примера 45(2), указанное в заголовке соединение (0,20 г) получают в виде светло-желтого порошка из (2S,4S)-1-[(3S)-2-(трет-бутоксикарбонил)-6,7-диметокси-1,2,3,4 тетрагидроизохинолин-3-ил]карбонил-2-циано-4-фторпирролидина (0,30 г). МС (ESI положит.) m/z: 334 ([М+Н]+), 356 ([M+Na]+), (ESI отрицат.) m/z: 368 ([M+Cl]-). Пример 50. Синтез гидрохлорида (2S,4S)-1-(2S,3R)-2-амино-3-бензилокси]бутаноил]-2-циано-4 фторпирролидина(1) Синтез (2S,4S)-l-[ [ (2S,3R)-2-(трет-бутоксикарбониламино)-3-бензилокси]бутаноил]-2-циано-4 фторпирролидина По способу, аналогичному способу примера 1(3), указанное в заголовке соединение (0,81 г) получают в виде светло-коричневого аморфного вещества из гидрохлорида (2S,4S)-2-циано-4 фторпирролидина (0,30 г) и [ (2S,3R)-2-(трет-бутоксикарбониламино)-3-бензилокси]бутановой кислоты(2S,4S)-1-(2S,3R)-2-амино-3-бензилокси]бутаноил]-2-циано-4 фторпирролидина По способу, аналогичному способу примера 48(2), указанное в заголовке соединение (0,34 г) получают в виде коричневого порошка из (2S,4S)-1-(2S,3R)-2-(трет-бутоксикарбониламино)-3 бензилокси]бутаноил]-2-циано-4-фторпирролидина (0,49 г). МС (ESI положит.) m/z: 306 ([М+Н]+), 328 ([M+Na]+), (ESI отрицат.) m/z: 340 ([M+Cl]-). Пример 51. Синтез гидрохлорида(1) Синтез (2S,4S)-2-(аминокарбонил)-1-[(2S)-1-(трет-бутоксикарбонил)пирролидин-2-ил]карбонил 4-фторпирролидина По способу, аналогичному способу примера 1(3), указанное в заголовке соединение (0,88 г) получают в виде бесцветного аморфного вещества из гидрохлорида (2S,4S)-2-аминокарбонил-4 фторпирролидина (0,50 г) и (2S)-1-(трет-бутоксикарбонил)-2-пирролидинкарбоновой кислоты (0,64 г). МС (ESI положит.) m/z: 352 ([M+Na]+), (ESI отрицат.) m/z: 328 ([М-Н]-).(2S,4S)-1-[(2S)-1-(трет-бутоксикарбонил)пирролидин-2-ил]карбонил-2-циано-4 фторпирролидина По способу, аналогичному способу примера 11(3), указанное в заголовке соединение (0,65 г) получают в виде бесцветного твердого вещества из (2S,4S)-2-(аминокарбонил)-1-[(2S)-1-(третбутоксикарбонил)пирролидин-2-ил]карбонил-4-фторпирролидина (0,80 г). МС (ESI положит.) m/z: 334 ([M+Na]+).(раствор в диоксане, 15 мл) с последующим перемешиванием при комнатной температуре в течение 3,5 ч. После выпаривания растворителя к остатку добавляют диизопропиловый эфир (15 мл) с последующим перемешиванием. Осажденное нерастворимое вещество отфильтровывают, получая при этом указанное в заголовке соединение (0,53 г) в виде бледно-оранжевого твердого вещества. МС (ESI положит.) m/z: 212 ([М+Н]+), 234 ([M+Na]+), (ESI отрицат.) m/z: 246 ([M+Cl]-).(1) Синтез (2S,4S)-l-[(цис-2-(трет-бутоксикарбониламино)циклопентан-1-ил)карбонил]-2-циано-4 фторпирролидина Неочищенный продукт, который получают из гидрохлорида (2S,4S)-2-циано-4-фторпирролидина(0,30 г) и цис-2-(трет-бутоксикарбониламино)циклопентан-1-карбоновой кислоты (0,50 г) по способу,аналогично способу примера 1(3), разделяют колоночной хроматографией на силикагеле (проявляющий растворитель; гексан:этилацетат=4:1-3:2), получая при этом два диастереоизомера указанного в заголовке соединения, менее полярный компонент (0,25 г) в виде бесцветного порошка и более полярный компонент (0,27 г) в виде бесцветного порошка. Менее полярный компонент: ТСХ на силикагеле, Rf:0,17 (проявляющий агент; гексан:этилацетат=1:1), МС (ESI положит.) m/z: 348 ([M+Na]+), (ESI отрицат.) m/z: 324 ([М-Н]-). Более полярный компонент: ТСХ на силикагеле, Rf:0,10 (проявляющий агент; гексан:этилацетат=1:1), МС (ESI положит.) m/z: 348 ([M+Na]+), (ESI отрицат.) m/z: 324 ([М-Н]-).(2S,4S)-1-[(цис-2-аминоциклопентан-1-ил)карбонил]-2-циано-4 фторпирролидина По способу, аналогичному способу примера 48(2), указанное в заголовке соединение (0,060 г) получают в виде бесцветного порошка из менее полярного 2S,4S)-1-[(цис-2-(третбутоксикарбониламино)циклопентан-1-ил)карбонил]-2-циано-4-фторпирролидина (0,10 г), полученного в примере 52(1). МС (ESI положит.) m/z: 226 ([М+Н]+), 248 ([M+Na]+), (ESI отрицат.) m/z: 260 ([M+Cl]-). Пример 53. Синтез гидрохлорида (2S,4S)-1-[(цис-2-аминоциклопентан-1-ил)карбонил]-2-циано-4 фторпирролидина По способу, аналогичному способу примера 48(2), указанное в заголовке соединение (0,067 г) получают в виде бесцветного порошка из более полярного 2S,4S)-1-[(цис-2-третбутоксикарбониламино)циклопентан-1-ил)карбонил]-2-циано-4-фторпирролидина (0,10 г), полученного в примере 52(1). МС (ESI положит.) m/z: 266 ([М+Н]+), 248 ([M+Na]+), (ESI отрицат.) m/z: 260 ([M+Cl]-). Пример 54. Синтез (2S, 4S)-2-(аминокарбонил)-1-(трет-бутоксикарбонил)-4-фторпирролидина В дихлорметане (20 мл) суспендируют (2S,4R)-2-(аминокарбонил)-1-(трет-бутоксикарбонил)-4 гидроксипирролидин (2,0 г), полученный в ссылочном примере 3, и по каплям добавляют трифторид диэтиламиносеры (2,3 мл) при охлаждении (-78 С) на бане сухой лед-ацетон. Температуру постепенно повышают до комнатной температуры, и затем смесь перемешивают в течение 6 ч. Реакционную смесь растворяют в насыщенном водном растворе бикарбоната натрия и экстрагируют этилацетатом. Органическую фазу последовательно промывают насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. После удаления осушающего агента фильтрованием фильтрат концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (проявляющий агент; гексан:этилацетат=4:1=1:5), получая при этом указанное в заголовке соединение (300 мг) в виде бесцветного твердого вещества. МС (ESI положит.) m/z: 255 ([M+Na]+), (ESI отрицат.) m/z: 231 ([М-Н]-). Результаты масс-спектроскопии высокого разрешения соединений в вышеуказанных примерах показаны в следующей таблице.
МПК / Метки
МПК: A61P 43/00, A61K 31/401, C07D 207/16
Метки: цианопирролидина, производные
Код ссылки
<a href="https://eas.patents.su/30-6204-proizvodnye-cianopirrolidina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные цианопирролидина</a>
Предыдущий патент: Гетероарильные производные, их получение и применение
Следующий патент: 1-арил-или 1-алкилсульфонилгетероциклилбензазолы в качестве лигандов 5-гидрокситриптамина-6
Случайный патент: Способ получения подгузника типа трусов одноразового использования












