Производные 2,3-бензодиазепина и фармацевтические композиции, содержащие эти производные в качестве активного ингредиента
Номер патента: 5867
Опубликовано: 30.06.2005
Авторы: Мартонне Марко Бернадетт, Грефф Зольтан, Сабо Геза, Шимиг Дьюла, Леваи Дьердь, Гиглер Габор, Линг Иштван, Сенаши Габор, Вег Миклош, Баркоци Йожеф, Харшинг Ласло Габор, Раткаи Зольтан
Формула / Реферат
1. Производное 2,3-бензодиазепина формулы I
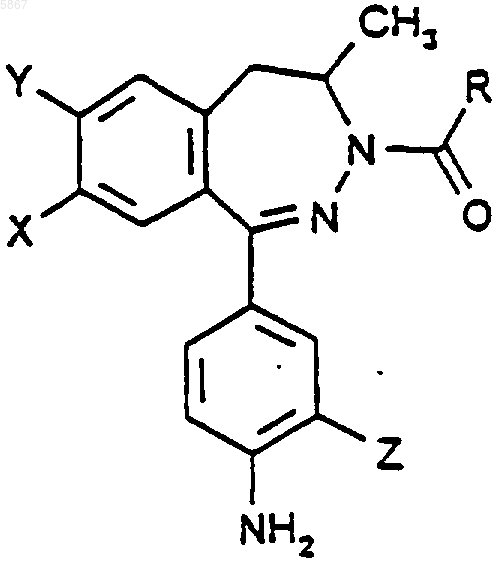
где X - водород, хлор или метоксигруппа,
Y - водород или галоген,
Z - метил или хлор,
R - C1-4 алкил или группа формулы -NR1R2,
где R1 и R2, независимо, представляют собой водород, C1-4 алкил, C1-4 алкоксил или C3-6 циклоалкил,
и его фармацевтически приемлемые соли с кислотами.
2. Производное 2,3-бензодиазепина по п.1,
где X - хлор,
Y - водород, хлор или бром,
R - C1-4 алкил,
Z - определен в п.1,
и его фармацевтически приемлемые соли с кислотами.
3. Производное 2,3-бензодиазепина по п.2,
где Y - водород или хлор,
R - метил,
X и Z такие, как указано в п.2,
и его фармацевтически приемлемые соли с кислотами.
4. Фармацевтическая композиция, содержащая производное 2,3-бензодиазепина формулы I по п.1, где X, Y, Z и R такие, как указано в п.1, или его фармацевтически приемлемую соль в качестве активного ингредиента в смеси с обычными носителями.
5. Фармацевтическая композиция по п.4, содержащая в качестве активного ингредиента производное 2,3-бензодиазепина формулы I, где X, Y, Z и R такие, как указано в п.2, или его фармацевтически приемлемую соль.
6. Фармацевтическая композиция по п.5, содержащая в качестве активного ингредиента производное 2,3-бензодиазепина формулы I, где X, Y, Z и R такие, как указано в п.3, или его фармацевтически приемлемую соль.
7. Применение производного 2,3-бензодиазепина формулы I по п.1, где X, Y, Z и R такие, как указано в п.1, или его фармацевтически приемлемой соли с кислотами для изготовления фармацевтической композиции, обладающей успокоительным действием или подходящей для лечения симптомов с сопутствующей острой и хронической нейродегенерацией, особенно болезни Паркинсона, болезни Альцгеймера, амиотрофического рассеянного склероза, паралича, черепно-мозговых травм, при эпилепсии и шизофрении, при спазмах, рвоте, мигрени, нарушениях мочеиспускания, а также для облегчения симптомов медицинской депривации.
8. Способ лечения заболеваний и симптомов, охарактеризованных в п.7, в соответствии с которым пациентам, нуждающимся в таком лечении, вводят терапевтически эффективное количество производного 2,3-бензодиазепина формулы I, где X, Y, Z и R такие, как указано в п.1, или его фармацевтически приемлемой соли с кислотами.
Текст
005867 Область изобретения Изобретение касается новых производных 2,3-бензодиазепина и фармацевтических композиций,содержащих эти производные в качестве активного ингредиента. За счет неконкурентного антагонизма по отношению к АМРА рецепторам новые соединения обладают противоспазматическим, расслабляющим мышцы и нейропротекторным действиями. Предпосылки изобретения Главным стимулирующим медиатором центральной нервной системы является глутаминовая кислота. Ее рецепторы можно разделить на две группы: ионотропные (т.е. рецепторы, связанные с ионным каналом) и метаботропные. Ионотропные рецепторы принимают участие почти в каждом процессе центральной нервной системы: обучении, в любом виде памяти, в процессах, сопровождающихся острой и хронической нейродегенерацией (или разрушением клеток). Они также играют роль в болевом ощущении, моторной функции, рефлексе мочеиспускания и сердечно-сосудистом гомеостазе. Существует два типа ионотропных стимулирующих рецепторов: рецепторы N-метил-D-аспарагиновой кислоты (NMDA) и АМРА/каинатные рецепторы. Последние ответственны, в первую очередь, за так называемые быстрые синаптические процессы, тогда как рецепторы NMDA регулируют медленные синаптические процессы, подготовленные быстрыми синаптическими процессами. Таким образом, антагонисты АМРА/каинатных рецепторов могут иметь непрямое влияние на функцию рецепторов NMDA. Следовательно, ряд процессов центральной нервной системы и всего организма могут регулироваться антагонистами АМРА/каинатных рецепторов. Существует два типа антагонистов АМРА/каинатных рецепторов: конкурентные и неконкурентные. Из-за различного характера ингибирования неконкурентные антогонисты предпочтительнее конкурентных. Первым представителем неконкурентных антагонистов был 1-(4-аминофенил)-4-метил-7,8-метилендиокси-5 Н-2,3-бензодиазепин, синтезированный около 15 лет назад. Со времени открытия этого соединения было получено множество 2,3-бензодиазепинов, обладающих неконкурентным действием на АМРА/каинатные рецепторы [Donevan, S.D. et al., J. Pharmacol. Exp. Ther., 271, 25-29 (1994); Vizi, E.S. et al.,CNS Drug Reviews, 2, 91-126 (1996)]. Терапевтическое применение 2,3-бензодиазепинов - неконкурентных антагонистов АМРА/каинатных рецепторов - чрезвычайно разнообразно. Они могут быть использованы как нейропротекторы при различных острых и хронических заболеваниях, сопровождающихся нейродегенерацией (болезни Паркинсона, Альцгеймера, параличе и т.д.), более того, для облегчения множества симптомов, например при эпилепсии, спазмах, болях, рвоте, шизофрении, мигрени, а также в качестве успокоительного средства[Tarnawa, I. and Vizi, E.S., Restorative Neurol. Neurosci., 13, 41-57 (1998)]. В венгерской заявке на патентР 9700688 и соответствующем патенте GB2 311 779 описаны,среди прочих, производные 1-(4-аминофенил)-3-алканоил-4-метил-3 Н-2,3-бензодиазепина, которые могли бы содержать также и хлор в положениях 7 и/или 8. Известные соединения обладают миорелаксантным, противоспазматическим и нейропротекторным действиями и могут применяться для лечения нервных и психических нарушений. Перечень соединений, указанный в упомянутом патенте, включает 2,3-бензодиазепины, в которых фенил в положении 1 содержит, кроме 4-аминогруппы, галоген или C1-4 алкильную группу в положении 3. Однако такие соединения не раскрыты в примерах и ни их данные, ни их биологическая активность описаны не были. В наших опытах было обнаружено, что после введения указанных соединений животным при метаболизме, в первую очередь, ацетилируются 4-аминогруппа и 1-фенил (далее в тексте N-ацетилирование). За счет N-ацетилирования терапевтический эффект данных соединений снижен. Так как люди могут принадлежать к фенотипу с быстрым или медленным ацетилированием, определить подходящую терапевтическую дозу нелегко. Поэтому цель данного изобретения - найти производные 2,3-бензодиазепинов с пониженной скоростью ацетилирования, так как в этом случае оба фенотипа можно лечить практически одинаковой дозой препарата. Сущность изобретения Мы установили, что поставленная задача достигается получением новых производных 2,3 бензодиазепина формулыZ - метил или хлор,R - C1-4 алкил или группа формулы -NR1R2,где R1 и R2 представляют, независимо, водород, C1-4 алкил, C1-4 алкоксил или С 3-6 циклоалкил,и их фармацевтически приемлемых солей с кислотами. Описание предпочтительных реализаций Удивительно, что задача данного изобретения была достигнута получением соединений, в которых 1-фенил содержит метил или хлор в орто-положении по отношению к 4-аминогруппе, поскольку ортозамещение значительно снижает скорость N-ацетилирования. За счет пространственно затрудненного Nацетилирования некоторые из эффектов новых соединений проявляются сильнее и длительнее по сравнению с известным веществом в опытах на животных. Наши предположения подтверждаются последующими экспериментами, в которых в качестве известных веществ сравнения использовались упомянутые ниже соединения формулы I и соответствующие 1-(4-аминофенильные) аналоги: 1=соединение примера 1, т.е. 3-ацетил-1-(4-амино-3-метилфенил)-4,5-дигидро-8-хлор-4-метил-3 Н 2,3-бензодиазепин,1 а=1-(4-аминофенильный) аналог, т.е. 3-ацетил-1-(4-аминофенил)-4,5-дигидро-8-хлор-4-метил-3 Н 2,3-бензодиазепин,2=соединение примера 2, т.е. 1-(4-амино-3-метилфенил)-4,5-дигидро-8-хлор-4-метил-3-пропионил 3 Н-2,3-бензодиазепин,2 а=1-(4-аминофенильный) аналог, или 1-(4-аминофенил)-4,5-дигидро-8-хлор-4-метил-3-пропионил 3 Н-2,3-бензодиазепин,3=соединение примера 3, т.е. 3-ацетил-1-(4-амино-3-хлорфенил)-4,5-дигидро-8-хлор-4-метил-3 Н 2,3-бензодиазепин,3 а=1-(4-аминофенильный) аналог, т.е. 3-ацетил-1-(4-аминофенил)-4,5-дигидро-8-хлор-4-метил-3 Н 2,3-бензодиазепин,4=соединение примера 4, т.е. 3-ацетил-1-(4-амино-3-метилфенил)-4,5-дигидро-7,8-дихлор-4-метил 3 Н-2,3-бензодиазепин,4 а=1-(4-аминофенильный) аналог, или 3-ацетил-1-(4-аминофенил)-4,5-дигидро-7,8-дихлор-4-метил 3 Н-2,3-бензодиазепин,5=соединение примера 5, т.е. 1-(4-амино-3-метилфенил)-4,5-дигидро-7,8-дихлор-4-метил-3-пропионил-3 Н-2,3-бензодиазепин,5 а=1-(4-аминофенильный) аналог, т.е. 1-(4-аминофенил)-4,5-дигидро-7,8-дихлор-4-метил-3-пропионил-3 Н-2,3-бензодиазепин. Снижение скорости N-ацетилирования за счет орто-замещения Срезы печени крыс породы Вистар инкубировали в насыщенном кислородом растворе КребсаРингера при 37 С в присутствии 50 М исследуемого производного 2,3-бензодиазепина. Аликвоты объемом 0,5 мл отбирали в начале опыта, затем через 30 и 60 мин. Белки плазмы осаждали хлорной кислотой и, после обработки щелочью, производные 2,3-бензодиазепина экстрагировали хлороформом. Экстаркты упаривали досуха, остаток растворяли в соответствующем элюенте. Производные 2,3 бензодиазепина и их N-ацетильные метаболиты определяли высокоэффективной жидкостной хроматографией (Beckman System Gold HPLC, колонка С-18 с обращенной фазой), используя УФ-детектор (на частоте 240 нм). Для эффективного разделения использовались различные элюенты. В случае соединения, указанного в примере 1, и соответствующего 1-(4-аминофенильного) аналога элюент содержал 2 мМ 50% гептофтормасляной кислоты, 25% метанола и 25% ацетонитрила. Для соединения примера 3 и соответствующего 1-(4-аминофенильного) аналога элюент состоял из смеси 2 мМ 50% гептафтормасляной кислоты, 20% метанола и 30% ацетонитрила. Для соединения примера 4 и соответствующего 1-(4 аминофенильного) аналога - из смеси 2 мМ 50% гептаформасляной кислоты и 50% ацетонитрила. Доля N-ацетильного метаболита пробы, взятой в определенный момент времени, вычисляли делением площади пика метаболита, умноженного на 100%, на сумму площадей пиков определяемого производного 2,3-бензодиазепина и этого метаболита. Полученные результаты представлены в табл. 1, где указаны концентрации метаболита в начале определения, через 30 и 60 мин. Таблица 1 Соединение (пример ) Время инкубации, мин Содержание N-ацетильного метаболита, % 1 0 0 1 30 2 1 60 6 1 а 0 0 1 а 30 18 1 а 60 31 3 0 0 3 30 1 Из табл. 1 видно, что исследованные соединения формулы I практически не подверглись N-ацетилированию в течение 1 ч, в отличие от соответствующих 1-(4-аминофенильных) аналогов, в которых количество N-ацетильного метаболита составляет, в общем, 31% за 1 ч. Так, присутствие метильной группы или хлора в орто-положении к аминогруппе значительно ингибирует N-ацетилирование. Нейропротекторное действие в присутствии хлорида марганца на модели полной церебральной ишемии у мышей Исследование проводили на группах по 10 самцов мыши линии NMRI весом 20-25 г. Исследуемые вещества растворяли в смеси из 5 об.ч. 5 М соляной кислоты и 95 частей воды, рН доводили до 3, добавляя 1 М водный раствор гидроксида натрия. Полученный раствор был введен в брюшную полость в дозе 10 мл/кг. Каждое вещество испытывали 4 раза, последовательно увеличивая дозу; последней (контрольной) группе вводили растворитель. Через 30 мин всем крысам внутривенно вводили насыщенный раствор хлорида магния в дозе 5 мл/кг. Инъекция вызвала немедленную остановку сердца и полную церебральную ишемию. Увеличение времени выживания (т.е. времени с момента введения хлорида магния до остановки дыхания) считали мерой нейропротекторного эффекта по Веrgа et al. [Веrgа, Р. et al., Синергические взаимодействия пирацетама и дигидроэргокристина в некоторых моделях церебральной гипоксии и ишемии животных, Arzneim.-Forsch., 36, 1314-1320 (1986)]. Изменения времени выживания, в процентах, вычисляли по сравнению со временем жизни в контрольной группе и на основании полученных величин определяли дозу, увеличивающую выживание на 50%, методом линейного регрессионного анализа. Результаты представлены в табл. 2. Таблица 2 Соединение (пример ) РD50, мг/кг 1 4,6 1 а 10,4 4 9,0 4 а 11,0 5 12,3 5 а 14,6 Из таблицы видно, что величина PD50 исследуемых соединений формулы I ниже, чем у соответствующих 1-(4-аминофенильных) аналогов. Это означает, что заместитель в орто-положении по отношению к аминогруппе усиливает нейропротекторный эффект данных соединений. Продолжительность действия в организме крыс,определенная по снижению внутренней температуры тела За неделю до испытаний 6 самцов крыс породы Вистар анестезировали введением пентобарбиталаом натрия 5-этил-5-(1-метилбутил)барбитурата натрия, 60 мг/кг, внутрибрюшинно. В брюшную полость животных путем стерильной хирургической операции имплантировали дистанционные передатчики типаTL11M2C50-PXT или TA10TA-F40 (Data Sciences International, St. Paul, Minnesota, USA). Это позволило провести длительный мониторинг внутренней температуры тела. После имплантации мышам вводили антибиотик (бензатинбензилпенициллин в дозе 1 мл/кг в.м.). [Химическое название бензатинбензилпенициллина: [2S-(2,5,6)]-3,3-диметил-7-оксо-6-[(феноксиацетил)амино]-4-тиа-1-азабицикло[3,2,0]гептан 2-карбоновая кислота.] Животных содержали изолированно в пластиковых клетках для крыс типа 2, с доступом к пище и водопроводной воде. Исследуемые вещества растворяли в 5 объемах 5 М соляной кислоты и 95 объемах воды, рН доводили до 3 добавлением 1 М раствора гидроксида натрия. Полученный раствор был введен в брюшную полость в дозе 10 мл/кг. Радиосигналы, излучаемые передатчиками, улавливали приемниками типа RLA1000 или RLA2000,которые помещали под клетками. Данные накапливали и сохраняли с помощью компьютерной системы обработки данных Dataquest IV. Компьютер был настроен на определение температуры тела в течение 10 с каждой второй минуты. Средние величины за периоды в 30 мин в течение всего дня вычисляли с помощью функции сортировки программы Dataquest IV. Чтобы исключить биологически нереализуемые-3 005867 значения, в процессе оценки устанавливали верхние и нижние пределы. Индивидуальные температурные кривые были усреднены для 6 животных. Максимальный эффект (МЭ) был измерен по наибольшему снижению температуры тела по сравнению с последним (контрольным) значением перед введением препарата. Полученные значения МЭ сведены в табл. 3. С помощью средних значений определяли длительность действия (Д) соединений. Это промежуток времени от введения препарата до возвращения температуры тела к контрольной величине. Таблица 3 Соединение (пример ) МЭ, С 1 Из данных табл. 3 и 4 видно, что максимальное снижение температуры тела больше, а действие длительней у соединений с заместителем в орто-положении по отношению к аминогруппе. Это означает, что эффект соединений, соответствующих формуле I, сильнее и длительнее эффекта известных соединений. Соединения формулы I обладают противоспазматическим, миорелаксантным и нейропротекторным действиями и потенциально могут быть использованы для лечения или профилактики любой болезни или симптома, при которых желательно ингибирование стимулирующих рецепторов аминокислот. Так,соединения данного изобретения могут с успехом применяться во всех случаях, где эффективны неконкурентные антагонисты АМРА/каинатных рецепторов типа 2,3-бензодиазепинов (расстройства с сопутствующей острой и хронической нейродегенерацией, особенно болезнь Паркинсона, болезнь Альцгеймера, амиотрофический рассеянный склероз, паралич, черепно-мозговая травма), кроме того, для устранения ряда симптомов, например при эпилепсии, шизофрении, спазмах, болях, рвоте, мигрени, нарушениях мочеиспускания, а также для облегчения симптомов медицинской депривации. В описании и формуле изобретения под галогеном подразумевается фтор, хлор, бром или йод,предпочтительней хлор. Под C1-4 алкильной группой подразумеваются метильная, этильная, изопропильная, н-пропильная,н-бутильная, втор-бутильная или трет-бутильная группы, предпочтительней метильная или этильная группа. Под C1-4 алкоксильной группой подразумеваются метокси-, этокси-, изопропилокси-, н-пропилоксиили н-бутилоксигруппы, предпочтительней метоксигруппа. Под С 3-6 циклоалкильной группой подразумеваются, главным образом, циклопропильная, циклопентильная или циклогексильная группа. Под фармацевтически приемлемыми солями производных 2,3-бензодиазепина с формулой I подразумеваются нетоксичные соли, образованные данными соединениями с неорганическими (соляной, бромисто-водородной, серной, фосфорной и т.д.) или органическими кислотами (муравьиной, уксусной, фумаровой, молочной, винной, янтарной, лимонной, бензолсульфокислотой, толуолсульфокислотой и т.д.). Из-за имеющегося хирального центра соединения формулы I могут быть представлены в форме оптически-активных изомеров и их смесей. При наличии определенных заместителей в них может проявляться геометрическая изомерия или таутомерия. Изобретение включает все изомеры производных 2,3 бензодиазепина и их смеси. Предпочтительными производными 2,3-бензодиазепина формулы I являются производные со следующими заместителями: Х - хлор,Y - водород, хлор или бром,R - C1-4 алкил,Z - метил или хлор,а также их фармацевтически приемлемые соли с кислотами. Особенно предпочтительны производные формулы I, в которых-4 005867 Х - хлор,Y - водород или хлор,R - метил,Z - метил или хлор,а также их фармацевтически приемлемые соли с кислотами. Соединения формулы I могут быть получены по методике, описанной в венгерской заявке на патентР 9700688. Соответственно, соединение формулы I, в котором аминогруппа замещена на нитрогруппу,восстанавливается таким же образом, например в присутствии хлорида олова(II), дитионита натрия или каталитическим гидрированием на никеле Ренея, палладии или платине, c использованием газообразного водорода, гидразина, водного гидразина, муравьиной кислоты, формиата триалкиламмония или натрия в качестве источника водорода. Кроме того, изобретение относится к фармацевтическим композициям, содержащим в качестве активного ингредиента производные 2,3-бензодиазепина формулы I и их фармацевтически приемлемые соли с кислотами в смеси с одним и более стандартным носителем. Фармацевтическая композиция данного изобретения содержит, в общем, от 0,1 до 95 мас.%, предпочтительней от 1 до 50 и более предпочтительно от 5 до 30 мас.% активного ингредиента. Фармацевтическая композиция данного изобретения может быть как твердой, так и жидкой и подходит для перорального, парентерального, ректального или местного применения. Твердые фармацевтические композиции перорального назначения могут быть в форме порошков,капсул, таблеток, таблеток в оболочке, микрокапсул и т.д. и включать в качестве носителей связующие компоненты (желатин, сорбит, поливинилпирролидон и т.д.), наполнители (лактозу, глюкозу, крахмал,фосфат кальция и т.д.), вспомогательные вещества (стеарат магния, тальк, полиэтиленгликоль, силикагель и т.д) и смачиватели (лаурилсульфат натрия и т.д.). Жидкие фармацевтические композиции перорального назначения могут быть в форме растворов,суспензий или эмульсий и включать в качестве носителей суспендирующие компоненты (желатин, карбоксиметилцеллюлозу и т.д.), эмульгаторы (моноолеат сорбита и т.д.), растворители (воду, масла, глицерин, пропиленгликоль, этанол и т.д.) и консерванты (метил-п-гидроксибензоат и т.д.). Фармацевтические композиции парентерального назначения представляют собой стерильные растворы активного ингредиента. Указанные выше лекарственные формы, так же, как и другие известные формы, описаны, например,в Remington's Pharmaceutical Sciences 18th Edition, Mack Publishing Co., Easton, USA (1990). Фармацевтическая композиция, как правило, дозирована. Обычная ежедневная доза для взрослых соединения формулы I или его фармацевтически приемлемой соли составляет от 0,1 до 1000 мг на кг веса тела. Ежедневная доза может назначаться на 1 и более приемов. Оптимальная дозировка зависит от многих факторов и определяется врачом. Фармацевтическую композицию получают смешиванием соединения с формулой I или его фармацевтически пригодной соли с одним или несколькими носителями по известной методике. Полезные методики описаны в литературе, например в вышеупомянутой книге Remington's Pharmaceutical Sciences. Предпочтительная фармацевтическая композиция данного изобретения содержит производное 2,3 бензодиазепина формулы I, где Х - хлор,Y - водород, хлор или бром,R - C1-4 алкил,Z - метил или хлор,или его фармацевтически приемлемую соль в качестве активного ингредиента. Активным ингредиентом особенно предпочтительной фармацевтической композиции данного изобретения является производное 2,3-бензодиазепина формулы I, где Х - хлор,Y - водород или хлор,R - метил,Z - метил или хлор,или его фармацевтически приемлемая соль. Изобретение также относится к применению соединений формулы I и их солей, подходящих для изготовления фармацевтической композиции с успокоительным действием или для лечения симптомов с сопутствующей острой и хронической нейродегенерацией, в особенности болезни Паркинсона, болезни Альцгеймера, амиотрофического рассеянного склероза, паралича, черепно-мозговых травм, эпилепсии,шизофрении, при спазмах, болях, рвоте, мигрени, нарушениях мочеиспускания, а также для облегчения послеоперационной реабилитации. Данное изобретение также относится к способу лечения вышеуказанных болезней и симптомов, в соответствии с которым пациенту вводят эффективное количество производного 2,3-бензодиазепина формулы I или его фармацевтически приемлемые соли, назначаемые больным. Данное изобретение дополнительно иллюстрируется следующими примерами.-5 005867 Пример 1. -3-Ацетил-1-(4-амино-3-метилфенил)-4,5-дигидро-8-хлор-4-метил-3 Н-2,3-бензодиазепин. 3,7 г (10 ммоль) -3-ацетил-4,5-дигидро-8-хлор-4-метил-1-(3-метил-4-нитрофенил)-3 Н-2,3-бензодиазепина растворяли в 75 см 3 метанола и 38 см 3 хлористого метилена, добавляли 3,0 г влажного никеля Ренея и, при интенсивном перемешивании, 1,7 см 3 (35 ммоль) 98%-ого гидразингидрата. Реакционную смесь перемешивали еще 45 мин, катализатор отфильтровывали, промывали хлористым метиленом,фильтрат упаривали и остаток растирали с 50 см 3 воды до получения твердого осадка. Сырой продукт очищали на колонке с силикагелем смесью этилацетата и гексана, затем перекристаллизовывали из этанола. Получено 1,67 г (49%) данного соединения в виде бледно-желтой твердой массы с Тпл 180-182 С. Элементный анализ: С 19 Н 20 СlN3 О (М 341,844). Вычислено: С 66,76%, Н 5,90%, N 12,29%, Cl 10,37%. Найдено: С 66,77%, Н 5,92%, N 12,13%, Cl 10,13%. 1(д, J=6,4 Гц, 3 Н). 13 С-ЯМР (CDCl3):172,14, 169,21, 148,14, 138,46, 135,83, 132,35, 131,43, 130,27, 129,24, 128,72,125,45, 121,79, 114,03, 60,47, 38,28, 22,60, 18,32, 17,32. Пример 2. -1-(4-Aмино-3-метилфенил)-4,5-дигидро-8-хлор-4-метил-3-пропионил-3 Н-2,3-бензодиазепин. 3,86 г (10 ммоль) -4,5-дигидро-8-хлор-4-метил-1-(3-метил-4-нитрофенил)-3-пропионил-3 Н-2,3 бензодиазепина растворяли в 80 см 3 метанола и 13 см 3 хлористого метилена, добавляли 3,0 г влажного никеля Ренея и, при интенсивном перемешивании, 1,7 см 3 (35 ммоль) 98%-ого гидразингидрата. Реакционную смесь перемешивали еще 45 мин, катализатор отфильтровывали, промывали хлористым метиленом, фильтрат упаривали и остаток растирали с 50 см 3 воды до получения твердого осадка. Сырой продукт очищали на колонке с силикагелем смесью этилацетата и гексана, затем перекристаллизовывали из ацетонитрила. Получено 1,99 г (56%) данного соединения в виде твердой массы кремового цвета с Тпл 152-154 С. 1(д, J=6,4 Гц, 3 Н), 1,04 (т, J=7,5 Гц, 3 Н). 13 С-ЯМР (CDCl3):172,46, 172,20, 154,48, 148,11, 138,54, 135,94, 132,27, 131,39, 130,19, 129,36,128,19, 128,60, 125,48, 121,76, 114,03, 60,58, 38,29, 27,90, 18,34, 17,33, 8,77. Пример 3. -3-Ацетил-1-(4-амино-3-хлорфенил)-4,5-дигидро-8-хлор-4-метил-3 Н-2,3-бензодиазепин. 3,93 г (10 ммоль) -3-ацетил-4,5-дигидро-8-хлор-1-(3-хлор-4-нитрофенил)-4-метил-3 Н-2,3-бензодиазепина растворяли в 30 см 3 метанола и 30 см 3 хлористого метилена, добавляли 3,0 г влажного никеля Ренея и, при интенсивном перемешивании, 1,7 см 3 (35 ммоль) 98%-ого гидразингидрата. Реакционную смесь перемешивали еще 45 мин, катализатор отфильтровывали, промывали хлористым метиленом,фильтрат упаривали и остаток растирали с 50 см 3 воды до получения твердого осадка. Сырой продукт очищали на колонке с силикагелем смесью этилацетата и гексана, затем перекристаллизовывали из смеси этилацетат-гексан. Получено 1,03 г (30%) данного соединения в виде желтой твердой массы с Тпл 143144 С. Элементный анализ: C18H17ClN3O (M 362,262). Вычислено: С 59,68%, Н 4,73%, N 11,60%, Cl 19,57%. Найдено: С 59,09%, Н 4,85%, N 11,24%, Cl 19,11%. 1H-ЯМР (CDCl3):7,65 (д, J=1,9 Гц, 1 Н), 7,35 (м, 2 Н), 7,23 (д, J=8,2 Гц, 1 Н), 7,11 (д, J=2,1 Гц, 1 Н),6,78 (д, J=8,4 Гц, 1 Н), 5,23 (м, 1 Н), 4,44 (с, 2 Н), 2,83 (дд, J1=5,1 Гц, J2=13,9 Гц, 1 Н), 2,66 (дд, J1=11,4 Гц,J2=13,8 Гц, 1 Н), 2,06 (с, 3 Н), 1,26 (д, J=6,4 Гц, 3 Н). 13 С-ЯМР (CDCl3):169,88, 168,02, 145,71, 138,52, 135,15, 132,54, 130,47, 130,37, 129,69, 129,27,128,69, 126,81, 119,01, 114,88, 60,31, 38,21 ,22,68, 18,44. Пример 4. -3-Ацетил-1-(4-амино-3-метилфенил)-4,5-дигидро-7,8-дихлор-4-метил-3 Н-2,3-бензодиазепин. 4,06 г (10 ммоль) -3-ацетил-4,5-дигидро-7,8-дихлор-4-метил-1-(3-метил-4-нитрофенил)-4-метил 3 Н-2,3-бензодиазепина растворяли в 55 см 3 метанола и 55 см 3 хлористого метилена, добавляли 3,0 г влажного никеля Ренея и, при интенсивном перемешивании, 1,7 см 3 (35 ммоль) 98%-ого гидразингидрата. Реакционную смесь перемешивали еще 45 мин, катализатор отфильтровывали, промывали хлористым метиленом, фильтрат упаривали и остаток растирали с 50 см 3 воды до получения твердого осадка. Сырой продукт очищали на колонке с силикагелем смесью этилацетата и гексана, затем перекристаллизовывали из смеси этилацетат-гексан. Получено 3,27 г (87%) данного соединения в виде желтой твердой массы с Тпл 127-129 С. Элементный анализ: С 19 Н 19 Сl2N3 О (М 376,289). Вычислено: С 60,65%, Н 5,09%, N 11,17%, Cl 18,84%. Найдено: С 59,74%, Н 5,07%. N 10,98%, Cl 18,62%.H-ЯМР (CDCl3):7,45 (с, 1 Н), 7,39 (с, 1 Н), 7,28 (дд, J1=2,0 Гц, J2=8,2 Гц, 1 Н), 7,22 (с, 1 Н), 6,77 (д,J=8,3 Гц, 1 Н), 5,23 (м, 1 Н), 4,02 (с, 2 Н), 2,77 (дд, J1=5,5 Гц, J2=13,8 Гц, 1 Н), 2,65 (дд, J1=11,8 Гц, J2=13,5 Гц,1 Н), 2,20 (с, 3 Н), 2,03 (с, 3 Н), 1,29 (д, J=6,4 Гц, 3 Н). 13 С-ЯМР (CDCl3):169,40, 148,25, 139,93, 134,23, 134,08, 131,42, 130,73, 130,56, 129,93, 129,15,125,24, 121,86, 114,09, 60,07, 38,10, 22,60, 13,80, 17,32. Пример 5. -1-(4-Aмино-3-метилфенил)-4,5-дигидро-7,8-дихлор-4-метил-3-пропионил-3 Н-2,3-бензодиазепин. 4,2 г (10 ммоль) -4,5-дигидро-7,8-дихлор-4-метил-1-(3-метил-4-нитрофенил)-3-пропионил-3 Н 2,3-бензодиазепина растворяли в 40 см 3 метанола и 40 см 3 хлористого метилена, добавляли 3,0 г влажного никеля Ренея и, при интенсивном перемешивании, 1,7 см 3 (35 ммоль) 98%-ого гидразингидрата. Реакционную смесь перемешивали еще 45 мин, катализатор отфильтровывали, промывали хлористым метиленом, фильтрат упаривали и остаток растирали с 50 см 3 воды до получения твердого осадка. Сырой продукт очищали на колонке с силикагелем смесью этилацетата и гексана, затем перекристаллизовывали из ацетонитрила. Получено 1,99 г (56%) данного соединения в виде бледно-желтой твердой массы с Тпл 106-108 С. Элементный анализ: С 20 Н 21Cl2N3 О (М 390,316). Вычислено: С 61,55%, Н 5,42%, N 10,77%, Cl 18,17%. Найдено: С 60,68%, Н 5,52%, N 10,47%, Cl 17,90%. 1H-ЯМР (CDCl3):7,45 (д. J=1,1 Гц, 1 Н), 7,39 (с, 1 Н), 7,28 (дд, J1=2,1 Гц, J2=8,3 Гц, 1 Н), 7,21 (с, 1 Н),6,67 (д, J=8,3 Гц, 1 Н), 5,22 (м, 1 Н), 4,02 (с, 2 Н), 2,77 (дд, J1=5,6 Гц, J2=13,8 Гц, 1 Н), 2,64 (дд, J1=11,9 Гц,J2=13,6 Гц, 1 Н), 2,47 (м, 1 Н), 2,20 (м, 1 Н), 2,20 (м, 1 Н), 2,20 (с, 3 Н), 1,30 (д, J=6,4 Гц, 3 Н), 1,04 (т, J=7,5 Гц,3 Н). 13 С-ЯМР (CDCl3):172,63, 171,10, 148,22, 140,02, 134,20, 131,40, 130,66, 130,44, 129,90, 129,12,125,28, 121,86, 114,10, 60,21, 38,12, 27,92, 18,32, 17,34, 8,77. Пример 6. -3-Ацетил-1-(4-амино-3-хлорфенил)-4,5-дигидро-7,8-дихлор-4-метил-3 Н-2,3-бензодиазепин. 4,26 г (10 ммоль) -3-ацетил-4,5-дигидро-7,8-дихлор-4-метил-1-(3-хлор-4-нитрофенил)-4-метил 3 Н-2,3-бензодиазепина растворяли в 40 см 3 метанола и 40 см 3 хлористого метилена, добавляли 3,0 г влажного никеля Ренея и, при интенсивном перемешивании, 1,7 см 3 (35 ммоль) 98%-ого гидразингидрата. Реакционную смесь перемешивали еще 45 мин, катализатор отфильтровывали, промывали хлористым метиленом, фильтрат упаривали и остаток растирали с 50 см 3 воды до получения твердого осадка. Сырой продукт перекристаллизовывали из ацетонитрила. Получено 2,8 г (71%) данного соединения в виде массы с Тпл 127-129 С. Элементный анализ: С 18 Н 16 Сl2N3 О (М 396,707). Вычислено: С 54,50%, Н 4,07%, N 10,59%, Cl 26,81%. Найдено: С 54,26%, Н 4,14%, N 10,48%, Cl 26,28%. 1H-ЯМР (CDCl3):7,62 (д, J=1,9 Гц, 1 Н), 7,39 (с, 1 Н), 7,32 (дд, J1=2,0 Гц, J2=8,4 Гц, 1 Н), 7,22 (с, 1 Н),6,77 (д, J=8,4 Гц, 1 Н), 5,25 (м, 1 Н), 4,48 (с, 2 Н), 2,82 (дд, J1=5,1 Гц, J2=13,9 Гц, 1 Н), 2,66 (дд, J1=11,2 Гц,J2=13,8 Гц, 1 Н), 2,07 (с, 3 Н), 1,25 (д, J=6,4 Гц, 3 Н). 13 С-ЯМР (CDCl3):170,03, 166,60, 145,80, 139,93, 134,45, 133,34, 130,88, 130,52, 130,29, 130,18,129,17, 126,53, 119,00, 114,88, 59,79, 37,99, 22,68, 18,42. Пример 7. -3-Ацетил-1-(4-амино-3-метилфенил)-4,5-дигидро-4-метил-8-метокси-3 Н-2,3-бензодиазепин. 4,46 г (10 ммоль) -3-ацетил-7-бром-4,5-дигидро-1-(3-метил-4-нитрофенил)-4-метил-8-метокси 3 Н-2,3-бензодиазепина растворяли в 190 см 3 метилцеллозольва, добавляли 2,1 г (15 ммоль) карбоната калия, 1,8 г 10%-ого палладия на угле и, при интенсивном перемешивании, 1,95 см 3 (40 ммоль) 98%-ого гидразингидрата. Реакционную смесь перемешивали 1 ч при 100 С, катализатор отфильтровывали,фильтрат упаривали и остаток растирали с 50 см 3 воды до получения твердого осадка. Сырой продукт очищали на колонке с силикагелем смесью этилацетата и гексана, затем перекристаллизовывали из ацетонитрила. Получено 1,6 г (47%) данного соединения в виде окрашенной твердой массы с Тпл 169-171 С. Элементный анализ: C20H23N3O2 (M 337,425). Вычислено: С 71,19%, Н 6,87%, N 12,45%. Найдено: С 71,69%, Н 6,74%, N 12,34%. 1H-ЯМР (CDCl3):7,51 (с, 1 Н), 7,33 (дд, J1=1,8 Гц, J2=8,1 Гц, 1 Н), 7,19 (д, J=8,4 Гц, 1 Н), 6,91 (дд,J1=2,9 Гц, J2=8,4 Гц, 1 Н), 6,65 (д, J=8,1 Гц, 1 Н), 6,65 (д, J=2,6 Гц, 1 Н), 5,18 (м, 1 Н), 3,97 (с, 2 Н), 2,72 (м,1 Н), 2,61 (м, 1 Н), 2,19 (с, 3 Н), 2,01 (с, 3 Н), 1,31 (д, J=6,6 Гц, 3 Н). 13 С-ЯМР (CDCl3):168,89, 158,06, 147,91, 135,19, 132,25, 131,59, 129,36, 129,02, 125,98, 121,67,115,67, 114,79, 114,00, 60,69, 55,49, 38,03, 22,59, 18,32, 17,29. Пример 8. -3-Ацетил-1-(4-амино-3-хлорфенил)-4,5-дигидро-4-метил-8-метокси-3 Н-2,3-бензодиазепин. 4,66 г (10 ммоль) -3-ацетил-7-бром-4,5-дигидро-1-(3-хлор-4-нитрофенил)-4-метил-8-метокси-3 Н 2,3-бензодиазепина растворяли в 190 см 3 метилцеллозольва, добавляли 2,1 г (15 ммоль) карбоната калия,1,8 г 10%-ого палладия на угле и, при интенсивном перемешивании, 1,95 см 3 (40 ммоль) 98%-ого гидразингидрата. Реакционную смесь перемешивали 0,5 ч при 90 С, катализатор отфильтровывали, фильтрат-7 005867 упаривали и остаток растирали с 50 см 3 воды до получения твердого осадка. Сырой продукт очищали на колонке с силикагелем смесью этилацетата и гексана, затем перекристаллизовывали из этанола. Получено 1,1 г (30%) данного соединения в виде белой твердой массы с Тпл 152-155 С. Элементный анализ: С 19 Н 20N3O2 (М 357,840). Вычислено: С 63,77%, Н 5,63%, N 11,74%; Cl 9,91%. Найдено: С 63,70%, Н 5,61%, N 11,51%, Cl 9,86%. 1H-ЯМР (CDCl3):7,67 (д, J=1,8 Гц, 1 Н), 7,41 (дд, J1=1,8 Гц, J2=8,1 Гц, 1 Н), 7,20 (д. J=8,4 Гц, 1 Н),6,93 (дд, J1=2,6 Гц, J2=8,1 Гц, 1 Н), 6,77 (д, J=8,4 Гц, 1 Н), 6,64 (д, J=2,9 Гц, 1 Н), 5,20 (м, 1 Н), 4,46 (с, 2 Н),3,75 (с, 3 Н), 2,80 (дд, J1=5,1 Гц, J2=13,9 Гц, 1 Н), 2,63 (дд, J1=5,1 Гц, J2=13,9 Гц, 1 Н), 2,63 (дд, J1=11,7 Гц,J2=13,9 Гц, 1 Н), 2,05 (с, 3 Н), 1,29 (д, J=6,2 Гц, 3 Н). 13 С-ЯМР (CDCl3):158,12, 145,56, 134,48, 132,25, 130,55, 129,38, 129,28, 118,86, 115,84, 114,80,114,68, 60,66, 55,49, 37,91, 22,67, 18,42. Пример 9. -3-Ацетил-1-(4-амино-3-метилфенил)-4,5-дигидро-7-хлор-4-метил-3 Н-2,3-бензодиазепин. 3,7 г (10 ммоль) -3-ацетил-4,5-дигидро-7-хлор-1-(3-метил-4-нитрофенил)-4-метил-3 Н-2,3-бензодиазепина растворяли в 80 см 3 метанола и 33 см 3 хлористого метилена, добавляли 3,0 г влажного никеля Ренея и, при интенсивном перемешивании, 1,7 см 3 (35 ммоль) 98%-ого гидразингидрата. Реакционную смесь перемешивали еще 45 мин, катализатор отфильтровывали, промывали хлористым метиленом,фильтрат упаривали и остаток растирали с 50 см 3 воды до получения твердого осадка. Сырой продукт перекристаллизовывали из смеси (1:2) этилацетата и гексана. Получено 2,88 г (84%) данного соединения в виде желтой твердой массы с Тпл 200-205 С. Элементный анализ: C19H20ClN3O (M 341,844). Вычислено: С 66,76%, Н 5,90%, N 12,29%, Cl 10,37%. Найдено: С 65,63%, Н 6,07%, N 12,03%, Cl 10,58%. 1(д, J=6,3 Гц, 3 Н). 13 С-ЯМР (СDСl3):172,54, 169,11, 148,08, 141,85, 136,09, 132,62, 131,54, 130,32, 129,16, 128,22,126,63, 125,68, 121,69, 114,00, 60,30, 38,67, 22,55, 18,34, 17,29. Пример 10. -3-Ацетил-1-(4-амино-3-хлорфенил)-7-бром-4,5-дигидро-4-метил-8-метокси-3 Н-2,3 бензодиазепин. 4,66 г (10 ммоль) -3-ацетил-7-бром-4,5-дигидро-1-(3-хлор-4-нитрофенил)-4-метил-8-метокси-3 Н 2,3-бензодиазепина растворяли в 45 см 3 метанола и 45 см 3 хлористого метилена, добавляли 3,0 г влажного никеля Ренея и, при интенсивном перемешивании, 1,7 см 3 (35 ммоль) 98%-ого гидразингидрата. Реакционную смесь перемешивали еще 45 мин, катализатор отфильтровывали, промывали хлористым метиленом, фильтрат упаривали и остаток растирали с 50 см 3 воды до получения твердого осадка. Сырой продукт очищали кипячением в ацетонитриле. Получено 3,52 г (81%) данного соединения в виде белой твердой массы с Тпл 235-237 С. Элементный анализ: С 19 Н 19 ВrClN3 О 2 (М 436,740). Вычислено: С 52,25%, Н 4,39%, N 9,62%, Hlg(Cl) 18,17%. Найдено: С 51,04%, Н 4,34%, N 9,39%, Hlg(Cl) 16,16%. 1 где Х - водород, хлор или метоксигруппа,Y - водород или галоген,Z - метил или хлор,R - C1-4 алкил или группа формулы -NR1R2,-8 005867 где R1 и R2, независимо, представляют собой водород, C1-4 алкил, C1-4 алкоксил или С 3-6 циклоалкил,и его фармацевтически приемлемые соли с кислотами. 2. Производное 2,3-бензодиазепина по п.1,где Х - хлор,Y - водород, хлор или бром,R - C1-4 алкил,Z - определен в п.1,и его фармацевтически приемлемые соли с кислотами. 3. Производное 2,3-бензодиазепина по п.2,где Y - водород или хлор,R - метил,Х и Z такие, как указано в п.2,и его фармацевтически приемлемые соли с кислотами. 4. Фармацевтическая композиция, содержащая производное 2,3-бензодиазепина формулы I по п.1,где X, Y, Z и R такие, как указано в п.1, или его фармацевтически приемлемую соль в качестве активного ингредиента в смеси с обычными носителями. 5. Фармацевтическая композиция по п.4, содержащая в качестве активного ингредиента производное 2,3-бензодиазепина формулы I, где X, Y, Z и R такие, как указано в п.2, или его фармацевтически приемлемую соль. 6. Фармацевтическая композиция по п.5, содержащая в качестве активного ингредиента производное 2,3-бензодиазепина формулы I, где X, Y, Z и R такие, как указано в п.3, или его фармацевтически приемлемую соль. 7. Применение производного 2,3-бензодиазепина формулы I по п.1, где X, Y, Z и R такие, как указано в п.1, или его фармацевтически приемлемой соли с кислотами для изготовления фармацевтической композиции, обладающей успокоительным действием или подходящей для лечения симптомов с сопутствующей острой и хронической нейродегенерацией, особенно болезни Паркинсона, болезни Альцгеймера, амиотрофического рассеянного склероза, паралича, черепно-мозговых травм, при эпилепсии и шизофрении, при спазмах, рвоте, мигрени, нарушениях мочеиспускания, а также для облегчения симптомов медицинской депривации. 8. Способ лечения заболеваний и симптомов, охарактеризованных в п.7, в соответствии с которым пациентам, нуждающимся в таком лечении, вводят терапевтически эффективное количество производного 2,3-бензодиазепина формулы I, где X, Y, Z и R такие, как указано в п.1, или его фармацевтически приемлемой соли с кислотами.
МПК / Метки
МПК: A61K 31/551, C07D 243/02, A61P 25/00
Метки: 2,3-бензодиазепина, производные, фармацевтические, эти, ингредиента, качестве, содержащие, активного, композиции
Код ссылки
<a href="https://eas.patents.su/10-5867-proizvodnye-23-benzodiazepina-i-farmacevticheskie-kompozicii-soderzhashhie-eti-proizvodnye-v-kachestve-aktivnogo-ingredienta.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 2,3-бензодиазепина и фармацевтические композиции, содержащие эти производные в качестве активного ингредиента</a>
Предыдущий патент: Лекарственная форма с регулируемым высвобождением активного ингредиента
Следующий патент: Контейнер для внутривенного раствора линезолида
Случайный патент: Средство противогистаминного антиаллергического действия и способ его получения












