Производные 8-замещенного-1,3,8-триазаспиро [4.5]декан-4-она.
Номер патента: 1357
Опубликовано: 26.02.2001
Авторы: Женк Франсуа, Рёвер Стефан, Адам Гео, Монсма Фредерик, Галлей Гуидо, Вихманн Йюрген, Чесура Андреа
Формула / Реферат
1. Соединения общей формулы
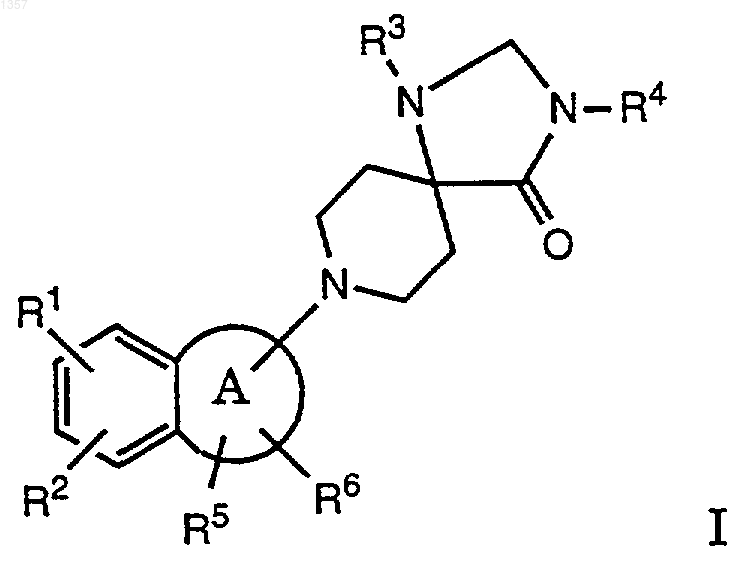
где
R1 и R2 каждый независимо друг от друга обозначает водород, C1-C6алкил, C1-C6алкокси или галоген;
R3 обозначает фенил, необязательно замещенный C1-C6алкилом, CF3, C1-C6 алкоксигруппой или галогеном; и
R4 обозначает водород, C1-C6алкил, C1-C6 алкенил, -С(О)- C1-C6алкил, -С(О)-фенил, C1-C6 алкил-С(О)-фенил, C1-C6алкилен-С(О)О- C1-C6 алкил, C1-C6алкантриилди-С(О)О- C1-C6алкил, гидрокси- C1-C6алкил, C1-C6алкил-О- C1-C6 алкил, C1-C6алкил-СН(ОН)CF3, фенил или бензил;
R5 и R6 каждый независимо друг от друга обозначает водород, фенил, C1-C6алкил или ди C1-C6алкил или могут вместе образовывать фенильное кольцо и
R5 и один из R1 или R2 могут вместе образовывать насыщенное или ненасыщенное 6-членное кольцо;
A обозначает 4-7-членное насыщенное кольцо, которое может содержать гетероатом, такой, как О или S;
и их фармацевтически приемлемые кислотно-аддитивные соли.
2. Соединение по п.1, в котором R1 и R2 обозначают галоген.
3. Соединение по п.2, а именно, (-)-8-(5,8-дихлор-1,2,3,4-тетрагидронафтил-2)-1-фенил-1,3,8-триазаспиро[4.5]декан-4-он.
4. Соединение по п.1, в котором один из радикалов R1 и R2 обозначает водород, а другой обозначает галоген.
5. Соединение по п.4, представляющее собой 8-(8-хлор-1,2,3,4-тетрагидронафтил-2)-1-фенил-1,3,8-триазаспиро[4.5]декан-4-он.
6. Соединение по п.1, в котором R1 и R2 обозначают водород.
7. Соединения по п.6, представляющее собой 1-фенил-8-(1,2,3,4-тетрагидронафтил-1)-1,3, 8-триазаспиро[4.5]декан-4-он и 8-индан-1-ил-1-фенил-1,3,8-триазаспиро[4.5]декан-4-он.
8. Соединение по п.1, в котором R5 и один из радикалов R1 или R2 вместе образуют насыщенное 6-членное кольцо.
9. Соединения по п.8, представляющее собой (RS)-8-(аценафтен-1-ил)-1-фенил-1,3,8-триазаспиро[4.5]декан-4-он, (RS)-8-(аценафтен-1-ил)-3-метил-1-фенил-1,3,8-триазаспиро[4.5] декан-4-он, (RS)-8-(2,3-дигидро-1Н-фенален-1-ил)-1-фенил-1,3,8-триазаспиро[4.5]декан-4-он, (R)-8-(аценафтен-1-ил)-1-фенил-1,3,8-триазаспиро[4.5]декан-4-он, 8-(2,3,3a,4,5,6-гексагидро-1Н-фенален-1-ил)-1-фенил-1,3,8-триазаспиро [4.5]декан-4-он и (RS)-8-(5-метил-1,2,3,4-тетра-гидронафталин-1-ил)-1-фенил-1,3,8-триазаспиро [4.5]декан-4-он.
10. Лекарственное средство, содержащее одно или несколько соединений по любому из пп.1-9 или его фармацевтически приемлемую соль, для лечения связанных с рецептором орфанина FQ (OFQ-рецептором) заболеваний, которые включают психиатрические, неврологические и физиологические расстройства, такие как страх и расстройства, обусловленные стрессом, депрессия, травма, потеря памяти вследствие болезни Альцгеймера или других деменций, эпилепсия и конвульсии, острые и/или хронические болезненные состояния и синдромы отмены наркотических лекарств, нарушения контроля водного баланса, экскреции Na+, артериального кровяного давления и нарушения, связанные с питанием, такие как ожирение.
Текст
1 Настоящее изобретение относится к соединениям формулыR1 и R2 каждый независимо друг от друга обозначает водород, (низш.)алкил, (низш.)алкокси или галоген;R5 и R6 каждый независимо друг от друга обозначает водород, фенил, (низш.)алкил или ди(низш.)алкил или могут вместе образовывать фенильное кольцо иR5 и один из R1 или R2 могут вместе образовывать насыщенное или ненасыщенное 6 членное кольцо;A обозначает 4-7-членное насыщенное кольцо, которое может содержать гетероатом,такой, как О или S; и к их фармацевтически приемлемым кислотно-аддитивным солям. Соединения формулы I и их соли отличаются ценными терапевтическими свойствами. Неожиданно было обнаружено, что соединения по настоящему изобретению являются агонистами и/или антагонистами OFQ-рецептора. Следовательно, они могут быть использованы при лечении психиатрических, неврологических и физиологических расстройств, прежде всего для облегчения симптомов страха и расстройств, обусловленных стрессом, депрессии,травмы, потери памяти вследствие болезни Альцгеймера или других деменций, эпилепсии и конвульсий, острых и/или хронических болезненных состояний, синдромов отмены наркотических лекарств, нарушений контроля водного баланса, экскреции Na+, артериального кровяного давления и нарушений, связанных с питанием, таких, как ожирение, причем область применения предложенных соединений не ограничена только перечисленными расстройствами. Орфанин FQ (OFQ), пептид, состоящий из семнадцати аминокислот (F-G-G-F-T-G-A-R-KS-A-R-K-L-A-N-Q), был выделен из головного мозга крысы и представляет собой естественный лиганд для рецептора (OFQ-R), соединенного с G-протеином, который обнаружен в высоких концентрациях в ткани головного мозга.OFQ проявляет агонистическое действие по отношению к OFQ-R как в опытах in vitro,так и in vivo. У Julius (Nature, 377, 476, [1995]) описано открытие OFQ, при этом отмечается, что последовательность этого пептида имеет наибольшее сходство с таковой динорфина A, известного эндогенного лиганда для опиоидных рецепторов. OFQ ингибирует аденилатциклазу в культуре клеток CHO(LC 132+) и индуцирует гипералгезию при интрацеребровентрикулярном введении мышам. Полученные результаты свидетельствуют о том, что этот гептадекапептид является эндогенным агонистом рецептора LC 132 и вероятно обладает проноцицептивными свойствами. В указанной публикации говорится далее, что при интрацеребровентрикулярном введении мышам OFQ замедляет двигательную активность и индуцирует гипералгезию. Было сделано заключение, что OFQ может действовать как мозговой нейромедиатор, модулирующий ноцицептивную и двигательную реакцию. Согласно настоящему изобретению предлагаются соединения формулы I и их фармацевтически приемлемые аддитивные соли, рацемические смеси и соответствующие им энантиомеры, способы получения вышеуказанных соединений, лекарственные средства, которые их содержат, и способы их изготовления, а также применение вышеуказанных соединений для лечения или предотвращения заболеваний, прежде всего заболеваний и расстройств указанных выше типов, или для изготовления соответствующих лекарств. Ниже приведены определения общих понятий, используемых в настоящем описании,которые применяются независимо от того,встречаются рассматриваемые понятия по отдельности или в комбинации. В контексте настоящего описания понятие(низш.)алкил обозначает алкильную группу с прямой или разветвленной цепью, содержащую от 1 до 6 атомов углерода, например, метил,этил, пропил, изопропил, н-бутил, изобутил, 2 бутил, трет-бутил. Понятие галоген обозначает хлор, йод,фтор или бром. Понятие (низш.)алкокси обозначает группу, в которой алкильные фрагменты имеют указанные выше значения и которая присоединяется через атом кислорода. Понятие фармацевтически приемлемые кислотно-аддитивные соли включает соли с неорганическими и органическими кислотами,такими, как соляная кислота, азотная кислота,серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, пара-толуолсульфоновая кислота и т.п. 3 Примерами предпочтительных соединений являются таковые, в которых R1 и/или R2 обозначают водород или хлор, например следующие соединения:[4.5]декан-4-он. Примерами предпочтительных соединений являются также соединения, в которых R5 и один из радикалов R1 или R2 вместе образуют насыщенное 6-членное кольцо, например следующие соединения:(RS)-8-(5-метил-1,2,3,4-тетрагидронафталин-1-ил)-1-фенил-1,3,8-триазаспиро[4.5]декан 4-он. Соединения по настоящему изобретению формулы I и их фармацевтически приемлемые соли могут быть получены методами, хорошо известными в данной области техники, например, описанными ниже способами, которые включают: а) гидрирование двойной связи в соединении формулы в котором R1-R6 имеют значения, указанные выше, и A обозначает 4-7-членное частично ненасыщенное кольцо, которое может содержать гетероатом, такой, как О или S, с получением соединения формулы I, или б) алкилирование, бензилирование или ацилирование соединения формулы I, в которомR4 обозначает водород, с получением соединения фомулы I, в котором R4 обозначает 4 в) восстановительное аминирование соединения формулы в котором A и R1-R6 имеют значения, указанные выше, или г) превращение рацемической смеси в ее энантиомерные компоненты с получением оптически чистых соединений, и д) при необходимости превращение полученного соединения формулы I в фармацевтически приемлемую кислотно-аддитивную соль. В соответствии с вариантом а) способа соединение формулы II может быть гидрировано обычным способом, например, с помощью гидридов металлов, таких, как борогидрид, цианборогидрид натрия, или с помощью триэтилсилана в протонных растворителях, например, в метаноле или этаноле, и/или в присутствии протонных реагентов типа трифторуксусной кислоты в метиленхлориде. Эту реакцию обычно проводят при комнатной температуре. Другим методом является гидрирование в присутствии, по крайней мере, одного катализатора для гидрирования, такого, как палладий на угле, платина или рутений, в инертном растворителе, например, в метаноле, этаноле или этилацетате или в их смесях. Эту реакцию проводят при давлении 1-1000 атм и при температуре 25250 С. В соответствии с вариантом б) способа соединение формулы I, в котором R4 обозначает водород, может быть алкилировано, бензилировано или ацилировано обычным способом, например, в присутствии соответствующего алкил-, бензил- или ацилгалогенида, такого, как метилйодид, аллилбромид, бензилбромид, этилбромид, ацетилхлорид, метилбромацетат и т.п. Эту реакцию проводят в присутствии гидрида металла, такого, как гидрид натрия, при температуре приблизительно 60-100 С. Восстановительное аминирование кетосоединения формулы III амином формулы IV в соответствии с вариантом в) способа проводят обычным методом в растворителе, таком, как тетрагидрофуран (ТГФ), метанол или этанол, 5 или в смеси ТГФ с пригодным спиртом и в присутствии восстановителя, такого, как Naцианборогидрид. Другой метод описан в J. Org. Chem., 55,2552-54, 1990. В соответствии с этим вариантом реакцию проводят путем взаимодействия амина с кетоном в присутствии TI-(IV)-изопропоксида и Na-цианборогидрида. Образование соли в соответствии с вариантом д) способа проводят при комнатной температуре в соответствии с методами, хорошо известными специалистам в данной области техники. Могут рассматриваться не только соли неорганических кислот, но и соли органических кислот. Примерами таких солей являются гидрохлориды, гидробромиды, сульфаты, нитраты,цитраты, ацетаты, малеаты, сукцинаты, метансульфонаты, пара-толуолсульфонаты и т.п. Соединения, используемые в качестве исходных продуктов, могут быть получены, например, в соответствии с реакционными схемами 1 и 2 и с примерами aa-av. Кроме того, исходные продукты для синтеза соединения, описанного в примере 44, могут быть получены в соответствии с методом,изложенным в J. Org. Chem., 1995, 60, 4324-4330 и в J. Med. Chem., 1996, 39, 3169. Схема 1 где заместители имеют указанные выше значения. Схема 2 где заместители имеют указанные выше значения. Соединение формулы II получают обработкой соответствующего кетона формулы III вторичным амином, получая после потери воды енамин. Эта реакция является обратимой, поэтому вода должна быть удалена азеотропным путем или с помощью осушителя. Эту реакцию проводят в инертном растворителе, таком, как бензол или толуол, и в присутствии кислого 6 катализатора типа пара-толуолсульфоновой кислоты или серной кислоты, или в альтернативном варианте с помощью осушителя, например,с помощью молекулярных сит при температуре приблизительно 80-120 С. Вышеуказанные соединения формулы II также могут быть получены перемешиванием компонентов в инертном растворителе, таком,как гексан, бензол или 1,2-дихлорэтан при комнатной температуре или при температурах, повышенных до 80 С, в присутствии, например,тетрахлорида титана в качестве кислоты Льюиса и осушителя. Соединения формулы I могут быть получены в соответствии с вариантом а) способа. В соответствии с реакционной схемой 2 получают соединения формулы IIa. Соединение формулы V растворяют в инертном растворителе, таком, как метанол, этанол, вода или их смеси, и кипятят с обратным холодильником в присутствии NH2OH и NaOAc. Полученный оксим растворяют в инертном растворителе, таком, как диэтиловый эфир. После взаимодействия сNaNO2 в воде в присутствии H2SO4 получают соединение формулы VI. Это соединение растворяют в инертном растворителе, таком, как ацетонитрил, и перемешивают вместе с соответствующим соединением формулы IV и с молекулярными ситами, получая соединение формулы IIa. Затем путем гидрирования в соответствии с вариантом а) способа может быть получено соединение формулы Ia. Кетоны или альдегиды формул III и V и соединения формулы IV являются известными соединениями или могут быть получены хорошо известными методами. Как указывалось ранее, соединения формулы I и их фармацевтически приемлемые аддитивные соли обладают ценными фармакодинамическими свойствами. Было обнаружено,что соединения по настоящему изобретению являются агонистами и/или антагонистамиOFQ-рецептора и оказывают положительное действие при смоделированных на животных психиатрических, неврологических и физиологических расстройствах, таких, как страх, расстройства, обусловленные стрессом, депрессия,травма, потеря памяти вследствие болезни Альцгеймера или других деменций, эпилепсия и конвульсии, острые и/или хронические болезненные состояния, синдромы отмены наркотических лекарств, нарушения контроля водного баланса, экскреции Na+, артериального кровяного давления и нарушения, связанные с питанием, такие, как ожирение. Соединения исследовали в соответствии с приведенными ниже тестами. 7 Методы оценки связывания OFQ-R Культура клеток Клетки линии HEK-293, адаптированные к росту в суспензии (293s), культивировали в HLсреде с добавлением 2%-ной ФБС. Клетки подвергали трансфекции кДНК OFQ-рецептора крысы (LC132) (FEBS Lett., 347, 284-288, 1994),клонировали в векторе экспрессии pCEP4 (фирма Invitrogen, SanDiego, CA, США), используя липофектин (фирма Life Technologies, Bethesda,MD, США). Подвергнутые трансфекции клетки селектировали в присутствии гигромицина(1000 ед/мл) (фирма Calbiochem, SanDiego, CA,США). Пул устойчивых клеток тестировали на способность экспрессировать OFQ-R путем связывания с [3H]-OFQ (фирма Amersham PLC,Buckinghamshire, Англия). Эти клетки (293sOFQ-R) размножали до получения крупномасштабной культуры и получения мембран. Получение мембран Клетки линии 293s-OFQ-R собирали центрифугированием, трижды промывали забуференным фосфатом физиологическим раствором(ЗФР) перед повторным суспендированием в буфере А (50 мМ трис-HCl, рН 7,8, 5 мМ MgCl2,1 мМ EGTA) и разрушением с помощью тканевого гомогенизатора (30 с, установка 4, модельPt 20, фирма Kinematica, Kriens-Lucern, Швейцария). Общую мембранную фракцию получали центрифугированием при 49000 хg и при 4 С. Этот процесс повторяли дважды и дебрис ресуспендировали в буфере А. Аликвотные количества хранили при -70 С и определяли концентрации протеина, используя реагент BCAProtein Assay Reagent (фирма Pierce, Rockford,IL), следуя рекомендациям производителя. Оценки связывания Исследования конкурентного связывания[3H]-OFQ проводили с использованием 77 мкг протеина мембраны в конечном анализируемом объеме 0,5 мл буфера А с добавлением 0,1%ного БСА (бычий сывороточный альбумин) и 0,01%-ного бацитрацина (фирма BoehringerMannheim, Mannheim, Германия) в течение 1 ч при комнатной температуре. Для определения неспецифического связывания использовали 50 нМ немеченого OFQ. Опыты прекращали фильтрацией через фильтры типа Whatman(фирма Sigma) в течение 1 ч. Фильтры шестикратно промывали 1 мл охлажденного на льду 50 мМ трис-HCl, рН 7,5. Оставшуюся радиоактивность подсчитывали с помощью микропланшетного сцинтилляционного счетчика типаPackard Top-Count после добавления 40 мкл сцинтилляционной жидкости Microscint 40(фирма Canberra Packard). Воздействия соединений определяли с использованием, по край 001357IC50 определяли путем аппроксимации кривой и эти значения переводили в значения Ki с помощью метода Cheng и Prusoff, Biochem.Pharmacol., 22, 3099, 1973. Сродство к OFQ-рецептору, выраженное в виде pKi, находится в пределах от 6,6 до 9,6. Например, значения pKi соединений из примеров 8 и 15 составляют 7,9 и 8,0 соответственно. Пример 8. 3-Бензил-8-(5,8-дихлор-1,2,3,4 тетрагидронафтил-2)-1-фенил-1,3,8-триазаспиро[4.5]декан-4-он. Пример 15. 3-Ацетил-8-(5,8-дихлор-1,2,3,4-тетрагидронафтил-2)-1-фенил-1,3,8-триазаспиро[4.5]декан-4-он. Соединения формулы I, а также их фармацевтически приемлемые кислотно-аддитивные соли могут использоваться в качестве лекарств,например, в форме фармацевтических композиций. Фармацевтические композиции могут применяться орально, например, в форме таблеток,таблеток с покрытием, драже, желатиновых капсул с твердым и мягким покрытием, растворов, эмульсий или суспензий. Кроме того, введение можно осуществлять ректально, например, в форме суппозиториев, или парентерально, например, в форме растворов для инъекции. Соединения формулы I, а также их фармацевтически приемлемые кислотно-аддитивные соли могут быть подвергнуты обработке фармацевтически инертными неорганическими или органическими эксципиентами с получением таблеток, таблеток с покрытием, драже и желатиновых капсул с твердым покрытием. В качестве таких эксципиентов, например, для таблеток, драже и желатиновых капсул с твердым покрытием, могут применяться лактоза, кукурузный крахмал или его производные, тальк,стеариновая кислота или ее соли и т.д. Пригодными эксципиентами для желатиновых капсул с мягким покрытием являются,например, растительные масла, воски, жиры,полутвердые и жидкие полиолы и т.д. Пригодными эксципиентами для приготовления растворов и сиропов являются, например, вода, полиолы, сахароза, инвертированный сахар, глюкоза и т.д. Пригодными эксципиентами для приготовления растворов для инъекции являются,например, вода, спирты, полиолы, глицерин,растительные масла и т.д. Пригодными эксципиентами для суппозиториев являются, например, естественные или гидрогенизированные масла, воски, жиры, полужидкие или жидкие полиолы и т.д. Кроме того, фармацевтические композиции могут содержать консерванты, солюбилизаторы, стабилизаторы, смачивающие агенты,эмульгаторы, подслащивающие вещества, красители, корригенты, соли для изменения осмо 9 тического давления, буферы, маскирующие агенты или антиоксиданты. Они также могут содержать еще и другие терапевтически полезные вещества. Доза может варьироваться в широких пределах и, как очевидно, должна подбираться в соответствии с индивидуальными требованиями в каждом конкретном случае. В целом, в случае орального применения суточная доза для пациента может составлять от приблизительно 10 до 1000 мг соединения формулы I, хотя верхний предел также может быть превышен в случае,когда это показано. Ниже настоящее изобретение проиллюстрировано на примерах, которые не направлены на его ограничение. Все температуры указаны в градусах Цельсия. Пример 1. Гидрохлорид 8-(6-хлор-1,2,3,4 тетрагидронафтил-2)-1-фенил-1,3,8-триазаспиро[4.5]декан-4-она. 6-Хлор-2-тетралон (22,7 ммоля) растворяли в толуоле (210 мл). Добавляли 1-фенил-1,3,8 триазаспиро[4.5]декан-4-он (22,7 ммоля) и молекулярные сита (10 г) и смесь кипятили с обратным холодильником в течение 6 ч. После охлаждения молекулярные сита удаляли фильтрацией и промывали метиленхлоридом. После упаривания фильтрата получали остаток, который растворяли в ТГФ (90 мл) и метаноле (10 мл). К раствору добавляли цианборогидрид натрия (22,7 ммоля) и доводили значение рН до 4. Смесь перемешивали в течение 4 ч при комнатной температуре. Добавляли этилацетат и органическую фазу промывали 2 н. раствором гидроксида натрия и соляным раствором. Органическую фазу концентрировали и хроматографировали на силикагеле (этилацетат). После добавления HCl в этаноле к раствору продукта в этилацетате/этаноле получали гидрохлорид 8(6-хлор-1,2,3,4-тетрагидронафтил-2)-1-фенил 1,3,8-триазаспиро[4.5]декан-4-она (4,0 г, 41%) в виде бесцветного твердого вещества, tпл 288290 С. Пример 2. Гидрохлорид 8-(8-хлор-1,2,3,4 тетрагидронафтил-2)-1-фенил-1,3,8-триазаспиро[4.5]декан-4-она. Указанное в заголовке соединение (tпл 286290 С) получали в соответствии с общим способом из примера 1 из 8-хлор-2-тетралона и 1 фенил-1,3,8-триазаспиро[4.5]декан-4-она. Пример 3. Гидрохлорид 8-(5,8-дихлор-1,2,3,4-тетрагидронафтил-2)-1-фенил-1,3,8-триазаспиро[4.5]декан-4-она. Указанное в заголовке соединение (tпл 290293 С) получали в соответствии с общим способом из примера 1 из 5,8-дихлор-2-тетралона и 1 фенил-1,3,8-триазаспиро[4.5]декан-4-она. Пример 4. Гидрохлорид 8-(6-хлор-1,2,3,4 тетрагидронафтил-2)-3-метил-1-фенил-1,3,8 триазаспиро[4.5]декан-4-она. 10 Суспензию гидрохлорида 8-(6-хлор 1,2,3,4-тетрагидронафтил-2)-1-фенил-1,3,8 триазаспиро[4.5]декан-4-она (0,47 ммоля) и гидрида натрия (60 мг, 60%) в ДМФ перемешивали в течение 30 мин при 80 С. Добавляли метилйодид (40 мл, 0,47 ммоля) и перемешивание продолжали в течение еще 30 мин. Смесь охлаждали, добавляли этилацетат (100 мл) и промывали раствором бикарбоната натрия и соляным раствором (по 50 мл каждого раствора). Водные фазы экстрагировали этилацетатом, органические фазы объединяли, сушили над сульфатом натрия и упаривали. После добавления HCl в этаноле к раствору остатка в этилацетате получали гидрохлорид 8-(6-хлор-1,2,3,4-тетрагидронафтил-2)-3-метил-1-фенил-1,3,8-триазаспиро[4.5]декан-4-она (0,17 г, 82%) в виде бесцветного твердого вещества, tпл 250 С и МС:[tпл 250 С и МС: m/e=410,4 (М+Н+)] получали в соответствии с общим способом из примера 4 из 8-(8-хлор-1,2,3,4-тетрагидро-2-нафтил)-1 фенил-1,3,8-триазаспиро[4.5]декан-4-она и метилйодида. Пример 6. Гидрохлорид 8-(5,8-дихлор 1,2,3,4-тетрагидронафтил-2)-3-метил-1-фенил 1,3,8-триазаспиро[4.5]декан-4-она. Указанное в заголовке соединение[tпл 250 С и МС: m/e=444,7, 446,6 (М+Н+)] получали в соответствии с общим способом из примера 4 из 8-(5,8-дихлор-1,2,3,4-тетрагидро-2 нафтил)-1-фенил-1,3,8-триазаспиро[4.5]декан-4 она и метилйодида. Пример 7. Гидрохлорид 3-аллил-8-(5,8 дихлор-1,2,3,4-тетрагидронафтил-2)-1-фенил 1,3,8-триазаспиро[4.5]декан-4-она. Указанное в заголовке соединение[tпл 250 С и МС: m/e=470,4, 472,4 (М+Н+)] получали в соответствии с общим способом из примера 4 из 8-(5,8-дихлор-1,2,3,4-тетрагидро-2 нафтил)-1-фенил-1,3,8-триазаспиро[4.5]декан-4 она и аллилбромида. Пример 8. Гидрохлорид 3-бензил-8-(5,8 дихлор-1,2,3,4-тетрагидронафтил-2)-1-фенил 1,3,8-триазаспиро[4.5]декан-4-она. Указанное в заголовке соединение[tпл 250 С и МС: m/e=520,3, 522,3 (М+Н+)] получали в соответствии с общим способом из примера 4 из 8-(5,8-дихлор-1,2,3,4-тетрагидро-2 нафтил)-1-фенил-1,3,8-триазаспиро[4.5]декан-4 она и бензилбромида. Пример 9. Гидрохлорид 8-(5,8-дихлор 1,2,3,4-тетрагидронафтил-2)-3-этил-1-фенил 1,3,8-триазаспиро[4.5]декан-4-она. Указанное в заголовке соединение[tпл 250 С и МС: m/e=458,3, 460,3 (М+Н+)] по 11 лучали в соответствии с общим способом из примера 4 из 8-(5,8-дихлор-1,2,3,4-тетрагидро-2 нафтил)-1-фенил-1,3,8-триазаспиро[4.5]декан-4 она и этилбромида. Пример 10. Гидрохлорид 1-фенил-8-(1,2,3,4-тетрагидронафтил-2)-1,3,8-триазаспиро[tпл 250 С и МС: m/e=362,3 (М+Н+)] получали в соответствии с общим способом из примера 1 из 2-тетралона и 1-фенил-1,3,8-триазаспиро(2,98 ммоля) растворяли в простом эфире (6 мл) и добавляли раствор нитрита натрия (5 ммолей) в 2,5 мл воды. Раствор перемешивали в течение 1 ч в атмосфере инертого газа (Ar). Затем добавляли 1 н. H2SO4 (5 мл) и раствор перемешивали в течение 3 ч. Органическую фазу отделяли и промывали дважды 5 мл NaHCO3. Водную фазу промывали 5 мл простого эфира. После упаривания объединенных органических фаз получали остаток, который растворяли в ацетонитриле(10 мл) и к этому раствору добавляли при 0 С суспензию 1-фенил-1,3,8-триазаспиро[4.5] декан-4-она (11,9 ммоля) в ацетонитриле (30 мл). Смесь и молекулярные сита (10 г) перемешивали в течение приблизительно 40 ч при комнатной температуре в атмосфере инертого газа(Ar). Органическую фазу концентрировали и промывали дважды ацетонитрилом (20 мл). После упаривания фильтрата остаток растворяли в ТГФ (90 мл) и этаноле (10 мл). К раствору добавляли цианборогидрид натрия (190 мг) и значение рН доводили до 4 (HCl/EtOH). Смесь перемешивали в течение 105 мин при комнатной температуре. После упаривания и очистки (как описано в примере 1) получали гидрохлорид 1 фенил-8-(1,2,3,4-тетрагидро-1-нафтил)-1,3,8 триазаспиро[4.5]декан-4-она, tпл 250 С и МС:[tпл 250 С и МС: m/e=396,2, 398,2 (М+Н+)] получали в соответствии с общим способом из примера 1 из 7-хлор-2-тетралона и 1-фенил 1,3,8-триазаспиро[4.5]декан-4-она. Пример 13. Гидрохлорид 8-(5-хлор-1,2,3,4 тетрагидронафтил-2)-1-фенил-1,3,8-триазаспиро[tпл 250 С и МС: m/e=396,4, 398,4 (М+Н+)] получали в соответствии с общим способом из примера 1 из 5-хлор-2-тетралона и 1-фенил 1,3,8-триазаспиро[4.5]декан-4-она.[tпл 250 С и МС: m/e=389 (М+)] получали в соответствии с общим способом из примера 1 из 5,7-диметил-2-тетралона и 1-фенил-1,3,8 триазаспиро[4.5]декан-4-она. Пример 15. Гидрохлорид 3-ацетил-8-(5,8 дихлор-1,2,3,4-тетрагидронафтил-2)-1-фенил 1,3,8-триазаспиро[4.5]декан-4-она. Указанное в заголовке соединение[tпл 250 С и МС: m/e=472,3, 474,4 (М+Н+)] получали в соответствии с общим способом из примера 4 из 8-(5,8-дихлор-1,2,3,4-тетрагидро-2 нафтил)-1-фенил-1,3,8-триазаспиро[4.5]декан-4 она и ацетилхлорида. Пример 16. Гидрохлорид метилового эфира [8-(5,8-дихлор-1,2,3,4-тетрагидронафтил-2)4-оксо-1-фенил-1,3,8-триазаспиро[4.5]дец-3 ил]уксусной кислоты. Указанное в заголовке соединение (tпл 185187 С) получали в соответствии с общим способом из примера 4 из 8-(5,8-дихлор-1,2,3,4 тетрагидро-2-нафтил)-1-фенил-1,3,8-триазаспиро[4.5]декан-4-она и метилбромацетата. Пример 17. Гидрохлорид (-)-8-(5,8-дихлор 1,2,3,4-тетрагидронафтил-2)-1-фенил-1,3,8 триазаспиро[4.5]декан-4-она. Указанное в заголовке соединение[]20D=-54,9] получали из 8-(5,8-дихлор-1,2,3,4 тетрагидро-2-нафтил)-1-фенил-1,3,8-триазаспиро[4.5]декан-4-она путем совместной кристаллизации с (+)-2,2'-(1,1'-бинафтил) фосфорной кислотой. Пример 18. Гидрохлорид[]20D=+53,2] получали из 8-(5,8-дихлор 1,2,3,4-тетрагидро-2-нафтил)-1-фенил-1,3,8 триазаспиро[4.5]декан-4-она путем совместной кристаллизации с (-)-2,2'-(1,1'-бинафтил)фосфорной кислотой. Пример 19. Гидрохлорид (RS)-3-бензоил 8-(5,8-дихлор-1,2,3,4-тетрагидронафталин-2-ил)1-фенил-1,3,8-триазаспиро[4.5]декан-4-она (1:1) Указанное в заголовке соединение [tпл 220 С (разл.)] получали в соответствии с общим способом из примера 4 из гидрохлорида 8-(5,8 дихлор-1,2,3,4-тетрагидро-2-нафтил)-1-фенил 1,3,8-триазаспиро[4.5]декан-4-она и бензоилхлорида. Пример 20. Гидрохлорид диметилового эфира (RS)-2-[8-(5,8-дихлор-1,2,3,4-тетрагидронафталин-2-ил)-4-оксо-1-фенил-1,3,8-триазаспиро[4.5]дец-3-ил]малоновой кислоты (1:1). 13 Указанное в заголовке соединение [tпл 191192 С (разл.)] получали в соответствии с общим способом из примера 4 из гидрохлорида 8-(5,8 дихлор-1,2,3,4-тетрагидро-2-нафтил)-1-фенил 1,3,8-триазаспиро[4.5]декан-4-она и диметилброммалоната. Пример 21. Гидрохлорид (RS)-8-(8-хлор 1,2,3,4-тетрагидронафталин-2-ил)-3-(2-оксо-2 фенилэтил)-1-фенил-1,3,8-триазаспиро[4.5] декан-4-она (1:1). Указанное в заголовке соединение[tпл 250 С и МС: m/e=514,3 (М+Н+)] получали в соответствии с общим способом из примера 4 из гидрохлорида 8-(8-хлор-1,2,3,4-тетрагидро-2 нафтил)-1-фенил-1,3,8-триазаспиро[4.5]декан-4 она и фенацилбромида. Пример 22. Гидрохлорид (RS)-8-(5,8-диметил-1,2,3,4-тетрагидронафталин-2-ил)-1-фенил 1,3,8-триазаспиро[4.5]декан-4-она (1:1). Указанное в заголовке соединение[tпл 250 С и МС: m/e=390,5 (М+Н+)] получали в соответствии с общим способом из примера 1 из 3,4-дигидро-5,8-диметил-1(2 Н)-нафталинона и 1-фенил-1,3,8-триазаспиро[4.5]декан-4-она. Пример 23. Гидрохлорид (RS)-8-(8-хлор 1,2,3,4-тетрагидронафталин-2-ил)-3-(2-гидроксиэтил)-1-фенил-1,3,8-триазаспиро[4.5]декан 4-она (1:1). Указанное в заголовке соединение [tпл 244 С (разл.) и МС: m/e=439 (М+)] получали в соответствии с общим способом из примера 4 из гидрохлорида 8-(8-хлор-1,2,3,4-тетрагидро-2 нафтил)-1-фенил-1,3,8-триазаспиро[4.5]декан-4 она и 2-хлорэтокситриметилсилана (удаление защитной группы in situ). Пример 24. Гидрохлорид (RS)-8-(8-хлор 1,2,3,4-тетрагидронафталин-2-ил)-3-метоксиметил-1-фенил-1,3,8-триазаспиро[4.5]декан-4-она[tпл 227-229 С (разл.) и МС: m/e=440,6 (М+Н+)] получали в соответствии с общим способом из примера 4 из гидрохлорида 8-(8-хлор-1,2,3,4 тетрагидро-2-нафтил)-1-фенил-1,3,8 триазаспиро[4.5]декан-4-она и хлорметилметилового эфира. Пример 25. Гидрохлорид смеси 1-фенил-8[(R)- и -[(S)-1,2,3,4-тетрагидронафталин-2-ил)3[(S)-4,4,4-трифтор-3-гидроксибутил]-1,3,8 триазаспиро[4.5]декан-4-она (1:1). Указанное в заголовке соединение[tпл 245 С (разл.) и МС: m/e=488,5 (М+Н+)] получали в соответствии с общим способом из примера 4 из гидрохлорида 8-(1,2,3,4-тетрагидро-2-нафтил)-1-фенил-1,3,8-триазаспиро[4.5] декан-4-она и (S)-1-(4-метилбензолсульфонат)4,4,4-трифтор-1,3 бутандиола. Пример 26. Гидрохлорид (RS)-8-индан-1 ил-1-фенил-1,3,8-триазаспиро[4.5]декан-4-она[tпл 250 С и МС: m/e=348,4 (М+Н+)] получали в соответствии с общим способом из примера 11 из оксима 2,3-дигидро-1 Н-инден-1-она и 1 фенил-1,3,8-триазаспиро[4.5]декан-4-она. Пример 27. Гидрохлорид смеси 1-фенил-8[(R)- и -[(S)-1,2,3,4-тетрагидронафталин-2-ил)3[(R)-4,4,4-трифтор-3-гидроксибутил]-1,3,8 триазаспиро[4.5]декан-4-она (1:1). Указанное в заголовке соединение[tпл 246 С (разл.) и МС: m/e=488,5 (М+Н+)] получали в соответствии с общим способом из примера 4 из гидрохлорида 8-(1,2,3,4 тетрагидро-2-нафтил)-1-фенил-1,3,8 триазаспиро[4.5]декан-4-она и[tпл 235 С и МС: m/e=350,4 (М+Н+)] получали в соответствии с общим способом из примера 1 из 3(2 Н)-бензофуранона и 1-фенил-1,3,8 триазаспиро[4.5]декан-4-она. Пример 29. Гидрохлорид (RS)-8-(8-бром 1,2,3,4-тетрагидронафталин-2-ил)-1-фенил 1,3,8-триазаспиро[4.5]декан-4-она (1:1). Указанное в заголовке соединение(М+Н+)] получали в соответствии с общим способом из примера 1 из 8-бром-3,4-дигидро 2(1 Н)-нафталинона и 1-фенил-1,3,8 триазаспиро[4.5]декан-4-она. Пример 30. Гидрохлорид смеси (1RS,3RS)и[tпл 250 С и МС: m/e=424,4 (М+Н+)] получали в соответствии с общим способом из примера 1 из 2,3-дигидро-3-фенил-1 Н-инден-1-она и 1-фенил 1,3,8-триазаспиро[4.5]декан-4-она. Пример 31. Гидрохлорид смеси (1:1) (1RS,3RS)- и -(1RS,3SR)-8-(3-метилиндан-1-ил)-1 фенил-1,3,8-триазаспиро[4.5]декан-4-она. Указанное в заголовке соединение[tпл 244-246 С (разл.) и МС: m/e=361 (М+)] получали в соответствии с общим способом из примера 1 из 2,3-дигидро-3-метил-1 Н-инден-1 она и 1-фенил-1,3,8-триазаспиро[4.5]декан-4 она. Пример 32. Гидрохлорид 8-индан-2-ил-1 фенил-1,3,8-триазаспиро[4.5]декан-4-она (1:1). Указанное в заголовке соединение[tпл 250 С и МС: m/e=348,4 (М+Н+)] получали в соответствии с общим способом из примера 1 из 1,3-дигидро-2 Н-инден-2-она и 1-фенил-1,3,8 триазаспиро[4.5]декан-4-она.[4.5]декан-4-она (1:1). Указанное в заголовке соединение [tпл 250 С и МС: m/e=390,2 (М+Н+)] получали в соответствии с общим способом из примера 1 из оксима 2,3-дигидро-3,3,6-триметил-1 Н-инден-1 она и 1-фенил-1,3,8-триазаспиро[4.5]декан-4 она. Пример 34. Гидрохлорид (RS)-1-фенил-8(6,7,8,9-тетрагидро-5 Н-бензоциклогептен-5-ил)1,3,8-триазаспиро[4.5]декан-4-она (1:1). 6,7,8,9-Тетрагидро-5 Н-бензоциклогептен 5-он (3,1 ммоля) растворяли в ТГФ (10 мл). Добавляли 1-фенил-1,3,8-триазаспиро[4.5]декан-4 он (3,1 ммоля) и тетраизопропил-орто-титанат(3,1 ммоля) и смесь перемешивали в течение 22 ч при комнатной температуре. После упаривания получали остаток, который растворяли в этаноле (5 мл). К раствору добавляли цианборогидрид натрия (2,1 ммоля) и смесь перемешивали в течение 2 дней при комнатной температуре. Добавляли воду, осадок удаляли фильтарцией через целит (Celite) и промывали этанолом. Фильтрат сушили над Na2SO4 и концентрировали. После хроматографии на силикагеле (этилацетат/гексан, 50:50) получали требуемый продукт, который кристаллизовали из метиленхлорида/этанола в виде его HCl-соли. Таким путем получили 0,1 г (8%) гидрохлорида (RS)-1 фенил-8-(6,7,8,9-тетрагидро-5 Н-бензоциклогептен-5-ил)-1,3,8-триазаспиро[4.5]декан-4-она(1:1) в виде бесцветного твердого вещества,tпл 250 С и МС: m/e=376,4 (М+Н+). Пример 35. Гидрохлорид (RS)-8-(5-хлор 1,2,3,4-тетрагидронафталин-1-ил)-1-фенил 1,3,8-триазаспиро[4.5]декан-4-она (1:1). Указанное в заголовке соединение[tпл 250 С и МС: m/e=396,2 (М+Н+)] получали в соответствии с общим способом из примера 11 из оксима 5-хлор-3,4-дигидро-1(2 Н)-нафталинона и 1-фенил-1,3,8-триазаспиро[4.5]декан-4 она. Пример 36. Гидрохлорид (RS)-8-(7-фтор 1,2,3,4-тетрагидронафталин-1-ил)-1-фенил 1,3,8-триазаспиро[4.5]декан-4-она (1:1). Указанное в заголовке соединение[tпл 250 С и МС: m/e=380,3 (М+Н+)] получали в соответствии с общим способом из примера 11 из оксима 7-фтор-3,4-дигидро-1(2 Н)нафталинона и 1-фенил-1,3,8 триазаспиро[4.5]декан-4-она. Пример 37. Гидрохлорид (RS)-8-(5-хлориндан-1-ил)-1-фенил-1,3,8-триазаспиро[4.5] декан-4-она (1:1). Указанное в заголовке соединение[tпл 250 С и МС: m/e=382,2 (М+Н+)] получали в соответствии с общим способом из примера 34 из 5-хлор-2,3-дигидро-1 Н-инден-1-она и 1 фенил-1,3,8-триазаспиро[4.5]декан-4-она.[tпл 250 С и МС: m/e=414,2 (М+Н+)] получали в соответствии с общим способом из примера 11 из оксима 7-хлор-5-фтор-3,4-дигидро-1(2 Н)нафталинона и 1-фенил-1,3,8-триазаспиро[4.5] декан-4-она. Пример 39. Гидрохлорид (RS)-8-(4-метилиндан-1-ил)-1-фенил-1,3,8-триазаспиро[4.5] декан-4-она (1:1). Указанное в заголовке соединение[tпл 250 С и МС: m/e=362,2 (М+Н+)] получали в соответствии с общим способом из примера 34 из 2,3-дигидро-4-метил-1 Н-инден-1-она и 1 фенил-1,3,8-триазаспиро[4.5]декан-4-она. Пример 40. Гидрохлорид 8-индан-2-ил-3 метил-1-фенил-1,3,8-триазаспиро[4.5]декан-4 она (1:1). Указанное в заголовке соединение[tпл 250 С и МС: m/e=362,2 (М+Н+)] получали в соответствии с общим способом из примера 4 из гидрохлорида 8-индан-2-ил-1-фенил-1,3,8 триазаспиро[4.5]декан-4-она и метилйодида[tпл 250 С и МС: m/e=396,2 (М+Н+)] получали в соответствии с общим способом из примера 11 из оксима 7-хлор-3,4-дигидро-1(2 Н)нафталинона и 1-фенил-1,3,8-триазаспиро[4.5] декан-4-она. Пример 42. Гидрохлорид 3-метил-1-фенил 8-(1,2,3,4-тетрагидронафталин-1-ил)-1,3,8 триазаспиро[4.5]декан-4-она (1:1). Указанное в заголовке соединение (tпл 232234 С) получали в соответствии с общим способом из примера 4 из гидрохлорида 1-фенил-8(1,2,3,4-тетрагидронафтил-1)-1,3,8-триазаспиро[4.5]декан-4-она (1:1) и метилйодида. Пример 43. Гидрохлорид (RS)-8-индан-1 ил-3-метил-1-фенил-1,3,8-триазаспиро[4.5] декан-4-она (1:1). Указанное в заголовке соединение [tпл 200203 С и МС: m/e=362,2 (М+Н+)] получали в соответствии с общим способом из примера 4 из гидрохлорида (RS)-8-индан-1-ил-1-фенил-1,3,8 триазаспиро[4.5]декан-4-она (1:1) и метилйодида. Пример 44. Гидрохлорид (R)-8-индан-1-ил 1-фенил-1,3,8-триазаспиро[4.5]декан-4-она (1:1). Амид (R)-1-индан-1-ил-4-фениламинопиперидин-4-карбоновой кислоты (2,9 ммоля),суспендированный в формамиде (15 мл), перемешивали в течение 2 ч при 200 С. Смесь охлаждали, сливали на холодную воду (150 мл) и экстрагировали метиленхлоридом. Органиче 17 ские фазы объединяли, сушили над сульфатом натрия и концентрировали, получая смесь (R)-8 индан-1-ил-1-фенил-1,3,8-триазаспиро[4.5] декан-4-она и (R)-8-индан-1-ил-1-фенил-1,3,8 триазаспиро[4.5]дец-2-ен-4-она. Эту смесь растворяли в метаноле (60 мл) и добавляли борогидрид натрия (4,2 ммоля). Смесь перемешивали в течение 1 ч при 60 С, охлаждали и концентрировали. К остатку добавляли насыщенный раствор хлорида аммония и метиленхлорид. Водную фазу экстрагировали метиленхлоридом. Органические фазы объединяли, сушили над сульфатом натрия и концентрировали. После хроматографии на силикагеле (метиленхлорид/метанол, 98:2) получали требуемый продукт. Этот продукт кристаллизовали из этилацетата/этанола в виде его HCl-соли. Таким путем получили 0,27 г (24%) гидрохлорида (R)-8 индан-1-ил-1-фенил-1,3,8-триазаспиро[4.5] декан-4-она (1:1), tпл 250 С и МС: m/e=348,4(М+Н+). Пример 45. (RS)-8-(6-хлортиохроман-4 ил)-1-фенил-1,3,8-триазаспиро[4.5]декан-4-он. Указанное в заголовке соединение [tпл 164166 С (разл.) и МС: m/e=414,2 (М+Н+)] получали в соответствии с общим способом из примера 11 из оксима 6-хлор-2,3-дигидро-4 Н-1 бензотиопиран-4-она и 1-фенил-1,3,8 триазаспиро[4.5]декан-4-она. Пример 46. Гидрохлорид (RS)-8-(6-метокси-1,2,3,4-тетрагидронафталин-1-ил)-1-фенил 1,3,8-триазаспиро[4.5]декан-4-она (1:1). Указанное в заголовке соединение [tпл 235236 С и МС: m/e=392,2 (М+Н+)] получали в соответствии с общим способом из примера 11 из оксима 3,4-дигидро-6-метокси-1(2 Н)-нафталинона и 1-фенил-1,3,8-триазаспиро[4.5]декан-4 она. Пример 47. Гидрохлорид (RS)-8-(5-метокси-1,2,3,4-тетрагидронафталин-1-ил)-1-фенил 1,3,8-триазаспиро[4.5]декан-4-она (1:1) Указанное в заголовке соединение[tпл 250 С и МС: m/e=392,3 (М+Н+)] получали в соответствии с общим способом из примера 11 из оксима 3,4-дигидро-5-метокси-1(2 Н)-нафталинона и 1-фенил-1,3,8-триазаспиро[4.5]декан 4-она. Пример 48. Гидрохлорид (S)-8-индан-1-ил 1-фенил-1,3,8-триазаспиро[4.5]декан-4-она (1:1). Указанное в заголовке соединение[tпл 250 С (разл.) и МС: m/e=348,4 (М+Н+)] получали в соответствии с общим способом из примера 44 из амида (S)-1-индан-1-ил-4 фениламинопиперидин-4-карбоновой кислоты. Пример 49. Гидрохлорид (RS)-8-(6-хлор 1,2,3,4-тетрагидронафталин-1-ил)-1-фенил 1,3,8-триазаспиро[4.5]декан-4-она (1:1). Указанное в заголовке соединение[tпл 250 С и МС: m/e=396,2 (М+Н+)] получали в соответствии с общим способом из примера 11[tпл 250 С и МС: m/e=376,3 (М+Н+)] получали в соответствии с общим способом из примера 1 из 5,6,8,9-тетрагидро-7 Н-бензоциклогептен-7-она и 1-фенил-1,3,8-триазаспиро[4.5]декан-4-она. Пример 51. Гидрохлорид (RS)-8-(6-фторхроман-4-ил)-1-фенил-1,3,8-триазаспиро[4.5] декан-4-она (1:1). Указанное в заголовке соединение[tпл 250 С и МС: m/e=382,2 (М+Н+)] получали в соответствии с общим способом из примера 11 из оксима 6-фтор-2,3-дигидро-4 Н-бензопиран-4 она и 1-фенил-1,3,8-триазаспиро[4.5]декан-4 она. Пример 52. Гидрохлорид (RS)-8-(6-хлорхроман-4-ил)-1-фенил-1,3,8-триазаспиро[4.5] декан-4-она (1:1). Указанное в заголовке соединение[tпл 250 С и МС: m/e=398,2 (М+Н+)] получали в соответствии с общим способом из примера 11 из оксима 6-хлор-2,3-дигидро-4 Н-бензопиран-4 она и 1-фенил-1,3,8-триазаспиро[4.5]декан-4 она. Пример 53. Гидрохлорид[tпл 250 С и МС: m/e=362,2 (М+Н+)] получали в соответствии с общим способом из примера 44 из амида[tпл 250 С и МС: m/e=362,2 (М+Н+)] получали в соответствии с общим способом из примера 44 из амида(S)-4-фениламино-1-(1,2,3,4 тетрагидронафталин-1-ил)пиперидин-4 карбоновой кислоты. Пример 55. Гидрохлорид (RS)-8-(4-хлориндан-1-ил)-1-фенил-1,3,8-триазаспиро[4.5] декан-4-она (1:1). Указанное в заголовке соединение в виде белого твердого вещества [tпл 230 С и МС:m/e=382,2 (М+Н+)] получали в соответствии с общим способом из примера 34 из 4-хлориндан 1-она и 1-фенил-1,3,8-триазаспиро[4.5]декан-4 она. Пример 56. Гидрохлорид (RS)-8-(хроман 4-ил)-1-фенил-1,3,8-триазаспиро[4.5]декан-4 она (1:1). 19 Указанное в заголовке соединение в виде белого твердого вещества [tпл 240 С (разл.) и МС: m/e=363 (М+)] получали в соответствии с общим способом из примера 11 из оксима 4 хроманона и 1-фенил-1,3,8-триазаспиро[4.5] декан-4-она. Пример 57. Гидрохлорид (RS)-8-(5-метоксииндан-1-ил)-1-фенил-1,3,8-триазаспиро[4.5] декан-4-она (1:1). Указанное в заголовке соединение в виде белого твердого вещества [tпл 220 С и МС:m/e=378,3 (М+Н+)] получали в соответствии с общим способом из примера 34 из 5 метоксииндан-1-она и 1-фенил-1,3,8-триазаспиро[4.5]декан-4-она. Пример 58. Гидрохлорид (RS)-8-(4-метоксииндан-1-ил)-1-фенил-1,3,8-триазаспиро[4.5] декан-4-она (1:1). Указанное в заголовке соединение в виде твердого вещества светло-желтого цвета[tпл 220 С и МС: m/e=378,3 (М+Н+)] получали в соответствии с общим способом из примера 34 из 4-метоксииндан-1-она и 1-фенил-1,3,8 триазаспиро[4.5]декан-4-она. Пример 59. Гидрохлорид (RS)-8-(аценафтен-1-ил)-1-фенил-1,3,8-триазаспиро[4.5]декан 4-она (1:1). Указанное в заголовке соединение в виде твердого вещества светло-желтого цвета[tпл 220 С и МС: m/e=384,3 (М+Н+)] получали в соответствии с общим способом из примера 34 из 2 Н-аценафтилен-1-она и 1-фенил-1,3,8 триазаспиро[4.5]декан-4-она. Пример 60. Гидрохлорид (RS)-8-(5-метоксииндан-1-ил)-1-фенил-1,3,8-триазаспиро[4.5] декан-4-она (1:1). Указанное в заголовке соединение в виде твердого вещества светло-желтого цвета[tпл 220 С и МС: m/e=378,3 (М+Н+)] получали в соответствии с общим способом из примера 34 из 5-метоксииндан-1-она и 1-фенил-1,3,8 триазаспиро[4.5]декан-4-она. Пример 61. Гидрохлорид (RS)-8-(5-изопропилиндан-1-ил)-1-фенил-1,3,8 триазаспиро[4.5]декан-4-она (1:1). Указанное в заголовке соединение в виде беловатого твердого вещества [tпл 220 С и МС:m/e=390,2 (М+Н+)] получали в соответствии с общим способом из примера 34 из 5 изопропилиндан-1-она и 1-фенил-1,3,8 триазаспиро[4.5]декан-4-она. Пример 62. Гидрохлорид 8-(3-фенил-1,2,3,4-тетрагидронафталин-1-ил)-1-фенил-1,3,8 триазаспиро[4.5]декан-4-она (смесь диаст. рацематов) (1:1). Указанное в заголовке соединение в виде белого твердого вещества [tпл 203 С и МС:m/e=438,3 (М+Н+)] получали в соответствии с общим способом из примера 11 из оксима 3 001357 20 фенил-3,4-дигидро-1(2 Н)-нафталинона и 1 фенил-1,3,8-триазаспиро[4.5]декан-4-она. Пример 63. Гидрохлорид (RS)-8-(7-метокси-1,2,3,4-тетрагидронафталин-1-ил)-1-фенил 1,3,8-триазаспиро[4.5]декан-4-она (1:1). Указанное в заголовке соединение в виде белого твердого вещества [tпл 220 С и МС:m/e=392,2 (М+Н+)] получали в соответствии с общим способом из примера 11 из оксима 7 метокси-3,4-дигидро-1(2 Н)-нафталинона и 1 фенил-1,3,8-триазаспиро[4.5]декан-4-она. Пример 64. Гидрохлорид (RS)-8-(аценафтен-1-ил)-1-фенил-1,3,8-триазаспиро[4.5]декан 4-она (1:1). Указанное в заголовке соединение в виде твердого вещества светло-коричневого цвета[tпл 185 С (разл.) и МС: m/e=398,3 (М+Н+)] получали в соответствии с общим способом из примера 4 из гидрохлорида (RS)-8-(аценафтен 1-ил)-1-фенил-1,3,8-триазаспиро[4.5]декан-4 она и метилйодида. Пример 65. Гидрохлорид 8-(6,7-дигидро 5 Н-дибензо[a,c]циклогептен-6-ил)-1-фенил 1,3,8-триазаспиро[4.5]декан-4-она (1:1). Указанное в заголовке соединение в виде белого твердого вещества [tпл 220 С и МС:m/e=424,3 (М+Н+)] получали в соответствии с общим способом из примера 1 из 5,7 дигидродибензо[a,c]циклогептен-6-она и 1 фенил-1,3,8-триазаспиро[4.5]декан-4-она. Пример 66. Гидрохлорид 8-(1,2,2a,3,4,5 гексагидроаценафтилен-1-ил)-1-фенил-1,3,8 триазаспиро[4.5]декан-4-она (смесь диаст. рацематов) (1:1). Указанное в заголовке соединение в виде твердого вещества светло-коричневого цвета [tпл 293 С (разл.) и МС: m/e=388,2 (М+Н+)] получали в соответствии с общим способом из примера 34 из 2a,3,4,5-тетрагидро-2 Н-аценафтилен-1 она и 1-фенил-1,3,8-триазаспиро[4.5]декан-4 она. Пример 67. Гидрохлорид (RS)-8-(2,3-дигидро-1 Н-фенален)-1-фенил-1,3,8-триазаспиро[4.5]декан-4-она (1:1). Указанное в заголовке соединение в виде твердого вещества светло-коричневого цвета [tпл 251 С и МС: m/e=398,3 (М+Н+)] получали в соответствии с общими способами из примеров aa и 44 из 4-фениламино-1-(2,3-дигидро-1 Нфенален-1-ил)пиперидин-4-карбонитрила без выделения промежуточного амида. Пример 68. Гидрохлорид (S)-8-(аценафтен 1-ил)-1-фенил-1,3,8-триазаспиро[4.5]декан-4 она (1:1). Указанное в заголовке соединение в виде твердого вещества светло-коричневого цвета [tпл 253 С и МС: m/e=384,3 (М+Н+)] получали в соответствии с общими способами из примеров aa и 44 из (S)-4-фениламино-1-(аценафтен-1 21 ил)пиперидин-4-карбонитрила без выделения промежуточного амида. Пример 69. Гидрохлорид (R)-8-(аценафтен-1-ил)-1-фенил-1,3,8-триазаспиро[4.5]декан 4-она (1:1). Указанное в заголовке соединение в виде белого твердого вещества [tпл 270 С и МС:m/e=384,3 (М+Н+)] получали в соответствии с общими способами из примеров aa и 44 из (R)4-фениламино-1-(аценафтен-1-ил)пиперидин-4 карбонитрила без выделения промежуточного амида. Пример 70. Гидрохлорид 8-(2,3,3a,4,5,6 гексагидро-1 Н-фенален-1-ил)-1-фенил-1,3,8 триазаспиро[4.5]декан-4-она (1:1). Указанное в заголовке соединение в виде белого твердого вещества [tпл 246 С и МС:m/e=402,4 (М+Н+)] получали в соответствии с общим способом из примера 11 из оксима 2,3,3a,4,5,6-гексагидрофенален-1-она и 1-фенил 1,3,8-триазаспиро[4.5]декан-4-она. Пример 71. Гидрохлорид 8-(флуорен-9 ил)-1-фенил-1,3,8-триазаспиро[4.5]декан-4-она(1:1). Указанное в заголовке соединение в виде белого твердого вещества [tпл 285 С и МС:m/e=396,1 (М+Н+)] получали в соответствии с общими способами из примеров aa и 44 из 4 фениламино-1-(флуорен-9-ил)пиперидин-4 карбонитрила без выделения промежуточного амида. Пример 72. Гидрохлорид (RS)-8-(5-метил 1,2,3,4-тетрагидронафталин-1-ил)-1-фенил 1,3,8-триазаспиро[4.5]декан-4-она (1:1). Указанное в заголовке соединение[tпл 250 С и МС: m/e=376,3 (М+Н+)] получали в соответствии с общим способом из примера 11 из оксима 5-метил-3,4-дигидро-1(2 Н)-нафталинона и 1-фенил-1,3,8-триазаспиро[4.5]декан-4 она. Пример 73. Гидрохлорид (RS)-8-(аценафтен-1-ил)-1-(3-хлорфенил)-1,3,8-триазаспиро[4.5]декан-4-она (1:1). Указанное в заголовке соединение в виде белого твердого вещества [tпл 272 С и МС:m/e=418,2 (М+Н+)] получали в соответствии с общими способами из примеров aa и 44 из (RS)1-(аценафтен-1-ил)-4-(3-хлорфениламино) пиперидин-4-карбонитрила без выделения промежуточного амида. Пример 74. Гидрохлорид (RS)-8-(аценафтен-1-ил)-1-(метатолил)-1,3,8-триазаспиро[4.5] декан-4-она (1:1). Указанное в заголовке соединение в виде белого твердого вещества [tпл 268 С и МС:m/e=398,3 (М+Н+)] получали в соответствии с общими способами из примеров aa и 44 из (RS)1-(аценафтен-1-ил)-4-(метатолиламино) пиперидин-4-карбонитрила без выделения промежуточного амида. 22 Пример 75. Гидрохлорид (RS)-8-(аценафтен-1-ил)-1-(паратолил)-1,3,8-триазаспиро[4.5] декан-4-она (1:1). Указанное в заголовке соединение в виде белого твердого вещества [tпл 266 С и МС:m/e=398,3 (М+Н+)] получали в соответствии с общими способами из примеров aa и 44 из (RS)1-(аценафтен-1-ил)-4-(пара-толиламино) пиперидин-4-карбонитрила без выделения промежуточного амида. Пример 76. Гидрохлорид (RS)-8-(аценафтен-1-ил)-1-(3-метоксифенил)-1,3,8-триазаспиро[4.5]декан-4-она (1:1). Указанное в заголовке соединение в виде белого твердого вещества [tпл 274 С и МС:m/e=414,2 (М+Н+)] получали в соответствии с общими способами из примеров aa и 44 из (RS)1-(аценафтен-1-ил)-4-(3-метоксифениламино) пиперидин-4-карбонитрила без выделения промежуточного амида. Пример 77. Гидрохлорид (RS)-8-(аценафтен-1-ил)-1-(4-метоксифенил)-1,3,8-триазаспиро[4.5]декан-4-она (1:1). Указанное в заголовке соединение в виде белого твердого вещества [tпл 262 С и МС:m/e=414,2 (М+Н+)] получали в соответствии с общими способами из примеров aa и 44 из (RS)1-(аценафтен-1-ил)-4-(4-метоксифениламино) пиперидин-4-карбонитрила без выделения промежуточного амида. Синтез промежуточных продуктов Пример aa. Амид (S)-1-индан-1-ил-4-фениламинопиперидин-4-карбоновой кислоты.(S)-1-Индан-1-ил-4-фениламинопиперидин-4-карбонитрил (27 ммолей) добавляли по каплям при комнатной температуре к смеси уксусного ангидрида и муравьиной кислоты (по 40 мл каждого вещества). Смесь перемешивали в течение 16 ч при комнатной температуре. Добавляли раствор гидроксида натрия (рН=7) и смесь экстрагировали этилацетатом. Органические фазы объединяли, сушили над сульфатом натрия и концентрировали. После хроматографии на силикагеле (этилацетат) получали формилированный амин, который растворяли в трет-бутаноле (60 мл). Добавляли аммиак (28%ный, 10 мл), воду (10 мл) и раствор перекиси водорода (33%-ный в воде, 5 мл). Смесь перемешивали в течение 2,5 ч при комнатной температуре, реакцию прекращали, добавляя холодную воду (50 мл), и экстрагировали метиленхлоридом. Органические фазы объединяли, сушили над сульфатом натрия и концентрировали. После хроматографии на силикагеле (метиленхлорид/метанол, 98:2) получали требуемый продукт в виде твердого вещества. Таким путем получили 1,0 г (11%) амида (S)-1-индан-1-ил-4 фениламинопиперидин-4-карбоновой кислоты,tпл 194-195 С и МС: m/e=336,2 (М+Н+). Пример ab. (S)-1-Индан-1-ил-4-фениламинопиперидин-4-карбонитрил.(31 ммоль) растворяли в уксусной кислоте (28 мл). Добавляли анилин (33 ммоля) и триметилсилилцианид (31 ммоль) и смесь перемешивали в течение 45 мин при комнатной температуре. Реакционную смесь сливали на холодный раствор аммиака (вода/28% аммиака, 50 мл/30 мл). Значение рН раствора доводили до 10 и экстрагировали метиленхлоридом. Органические фазы объединяли, сушили над сульфатом натрия и концентрировали. После кристаллизации из диэтилового эфира получали требуемый продукт в виде твердого вещества. Таким путем получили 8,1 г (80%) (S)-1-индан-1-ил-4-фениламинопиперидин-4-карбонитрила, tпл 157-160 С и МС:(3,7 ммоля) и йодид 1-этил-1-метил-4 оксопиперидиния (56 ммолей), растворенные в воде (30 мл), и смесь кипятили с обратным холодильником в течение 30 мин. Добавляли воду,этанол удаляли в вакууме и остаток экстрагировали этилацетатом. Органические фазы объединяли, сушили над сульфатом натрия и концентрировали. После хроматографии на силикагеле(этилацетат) получали требуемый продукт в виде масла. Таким путем получили 7,1 г (90%)m/e=216,4 (М+Н+). Пример ad. Амид (R)-1-Индан-1-ил-4-фениламинопиперидин-4-карбоновой кислоты. Указанное в заголовке соединение [tпл 193195 С и МС: m/e=336,2 (М+Н+)] получали в соответствии с общим способом из примера aa из(R)-1-индан-1-ил-4-фениламинопиперидин-4 карбонитрила. Пример af. (R)-1-Индан-1-ил-4-фениламинопиперидин-4-карбонитрил. Указанное в заголовке соединение [tпл 158159 С и МС: m/e=318,3 (М+Н+)] получали в соответствии с общим способом из примера ab изm/e=216,4 (М+Н+)] получали в соответствии с общим способом из примера aс из (R)-1 аминоиндана и йодида 1-этил-1-метил-4 оксопиперидиния. Пример ah. Амид (R)-4-фениламино-1-(1,2,3,4-тетрагидронафталин-1-ил)пиперидин-4 карбоновой кислоты. Указанное в заголовке соединение [tпл 182184 С и МС: m/e=350,3 (М+Н+)] получали в соответствии с общим способом из примера aa из(R)-1,2,3,4-тетрагидро-1-нафтиламин (16 ммолей) растворяли в этаноле (30 мл). Добавляли карбонат калия (9,3 ммоля) и йодид 1-этил-1 метил-4-оксопиперидиния (23 ммоля), растворенные в воде (30 мл), и смесь кипятили с обратным холодильником в течение 1 ч. Добавляли воду, этанол удаляли в вакууме и остаток экстрагировали этилацетатом. Органические фазы объединяли, сушили над сульфатом натрия и концентрировали. После хроматографии на силикагеле (этилацетат) получали (R)-1(1,2,3,4-тетрагидронафталин-1-ил)пиперидин-4 он, который растворяли в уксусной кислоте (11 мл). Добавляли анилин (14 ммолей) и триметилсилилцианид (13 ммолей) и смесь перемешивали в течение 1,5 ч при комнатной температуре. Реакционную смесь сливали на холодный раствор аммиака (вода/28% аммиак, 70 мл/30 мл). Значение рН раствора доводили до 10 и экстрагировали метиленхлоридом. Органические фазы объединяли, сушили над сульфатом натрия и концентрировали. После кристаллизации из диэтилового эфира получали требуемый продукт в виде твердого вещества. Таким путем получили 8,1 г (80%) (R)-4-фениламино-1-(1,2,3,4 тетрагидронафталин-1-ил)пиперидин-4 карбонитрила, tпл 152-153 С и МС: m/e=332,3(М+Н+). Пример aj. Амид (S)-4-фениламино-1-(1,2,3,4-тетрагидронафталин-1-ил)пиперидин-4 карбоновой кислоты. Указанное в заголовке соединение [tпл 186187 С и МС: m/e=350,3 (М+Н+)] получали в соответствии с общим способом из примера aa из(S)-4-фениламино-1-(1,2,3,4-тетрагидронафталин-1-ил)пиперидин-4-карбонитрила. Пример ak. (S)-4-Фениламино-1-(1,2,3,4 тетрагидронафталин-1-ил)пиперидин-4 карбонитрил. Указанное в заголовке соединение [tпл 152153 С и МС: m/e=332,3 (М+Н+)] получали в соответствии с общим способом из примера ai из(S)-1,2,3,4-тетрагидронафтиламина. Пример al. (RS)-2,3-Дигидро-1 Н-фенален 1-иламин. К смеси, содержащей 2,3-дигидрофенален 1-он (1,32 г, 7,24 ммоля), гидрохлорид гидроксиламина (0,85 г, 12,2 ммоля) и воду (6 мл),при перемешивании добавляли по каплям при 75 С MeOH (7,5 мл), а затем раствор ацетата натрия (2,58 г, 19,0 ммолей) в воде (4 мл). Перемешивание продолжали в течение 1,5 ч, добавляли воду (20 мл) и после охлаждения (ледяная баня) твердый продукт собирали фильтрацией. После сушки в вакууме неочищенный продукт растворяли в 3,5 н. NH3/MeOH (100 мл) и гидрировали в присутствии никеля Ренея (0,5 г, промытый в MeOH) при комнатной темпера 25 туре в течение 17 ч. Катализатор отфильтровывали, раствор упаривали в вакууме и остаток очищали с помощью колоночной хроматографии на силикагеле (дихлорметан/МеОН, 9:1),получая (RS)-2,3-дигидро-1 Н-фенален-1-иламин(0,95 г) в виде масла коричневого цвета. Пример am. (RS)-1-(2,3-дигидро-1 Н-фенален-1-ил)пиперидин-4-он. Указанное в заголовке соединение в виде масла коричневого цвета получали в соответствии с общим способом из примера ac из (RS)2,3-дигидро-1 Н-фенален-1-иламина и йодида 1 этил-1-метил-4-оксопиперидиния. Пример an. (RS)-4-фениламино-1-(2,3-дигидро-1 Н-фенален-1-ил)пиперидин-4-карбонитрил. Указанное в заголовке соединение в виде масла светло-коричневого цвета получали в соответствии с общим способом из примера ab из(RS)-1-(2,3-дигидро-1 Н-фенален-1-ил)пиперидин-4-она. Пример ao. (R)-Аценафтен-1-иламин. К охлажденному (0 С) раствору (S)аценафтенола (1,74 г, 10,2 ммоля) и дифенилфосфорилазида в толуоле (17,5 ммоля) добавляли при перемешивании ДБУ (1,86 мл, 12,3 ммоля) и перемешивание продолжали при комнатной температуре в течение 20 ч. Реакционную смесь экстрагировали толуолом (2 х 50 мл), объединенные органические фазы промывали водой, сушили (MgSO4) и упаривали в вакууме. Неочищенный продукт растворяли в EtOH (120 мл) и гидрировали при комнатной температуре в присутствии PtO2 (0,24 г). Катализатор отфильтровывали, раствор упаривали в вакууме и остаток очищали с помощью колоночной хроматографии на силикагеле (дихлорметан/МеОН,9:1), получая (R)-аценафтен-1-иламин (1,56 г) в виде масла розового цвета, МС: m/e=169 (М+). Пример ap. (S)-аценафтен-1-иламин. Указанное в заголовке соединение в виде масла светло-желтого цвета [МС: m/e=169 (М+)] получали в соответствии с общим способом из примера aо из (R)-аценафтенола. Пример aq. (R)-1-(Аценафтен-1-ил)пиперидин-4-он. Указанное в заголовке соединение в виде масла красно-коричневого цветаm/e=252,2 (М+Н+)] получали в соответствии с общим способом из примера aс из (R)аценафтен-1-иламина и йодида 1-этил-1-метил 4-оксопиперидиния. Пример ar. (S)-1-(Аценафтен-1-ил)пиперидин-4-он. Указанное в заголовке соединение в виде масла красно-коричневого цветаm/e=252,2 (М+Н+)] получали в соответствии с общим способом из примера aс из (S)аценафтен-1-иламина и йодида 1-этил-1-метил 4-оксопиперидиния.(М+Н+)] получали в соответствии с общим способом из примера ab из (R)-1-(аценафтен-1 ил)пиперидин-4-она. Пример at. (S)-4-Фениламино-1-(аценафтен-1-ил)пиперидин-4-карбонитрил. Указанное в заголовке соединение в виде масла светло-желтого цвета [МС: m/e=354,3(М+Н+)] получали в соответствии с общим способом из примера ab из (S)-1-(аценафтен-1 ил)пиперидин-4-она. Пример au. 1-(Флуорен-9-ил)пиперидин-4 он. Указанное в заголовке соединение в виде твердого вещества красно-коричневого цвета[tпл 135 С и МС: m/e=263 (М+)] получали в соответствии с общим способом из примера aс из флуорен-9-иламина и йодида 1-этил-1-метил-4 оксопиперидиния. Пример av. 4-Фениламино-1-(флуорен-9 ил)пиперидин-4-карбонитрил. Указанное в заголовке соединение в виде твердого вещества белого цвета [tпл 165 С и МС:m/e=366,1 (М+Н+)] получали в соответствии с общим способом из примера ab из 1-(флуорен-9 ил)пиперидин-4-она. Пример aw. (RS)-1-(аценафтен-1-ил)-4-(3 хлорфениламино)пиперидин-4-карбонитрил. Указанное в заголовке соединение в виде пены светло-коричневого цвета [МС: m/e=388,1(М+Н+)] получали в соответствии с общим способом из примера ab из 3-хлоранилина и (RS)-1(аценафтен-1-ил)пиперидин-4-она. Пример aх. (RS)-1-(Аценафтен-1-ил)-4(метатолиламино)пиперидин-4-карбонитрил. Указанное в заголовке соединение в виде пены светло-коричневого цвета [МС: m/e=368,2(М+Н+)] получали в соответствии с общим способом из примера ab из метатолуидина и (RS)-1(аценафтен-1-ил)пиперидин-4-она. Пример ay. (RS)-1-(Аценафтен-1-ил)-4-(3 метоксифениламино)пиперидин-4-карбонитрил. Указанное в заголовке соединение в виде пены светло-коричневого цвета [МС: m/e=384,2(М+Н+)] получали в соответствии с общим способом из примера ab из 3-метоксианилина и(М+Н+)] получали в соответствии с общим способом из примера ab из 4-метоксианилина и(М+Н+)] получали в соответствии с общим способом из примера ab из паратолуидина и (RS)-1(аценафтен-1-ил)пиперидин-4-она. Пример А. Таблетки следующего состава изготавливают обычным способом: мг/таблетка Дйствующее вещество 5 Лактоза 45 Кукурузный крахмал 15 Микрокристаллическая целлюлоза 34 Стеарат магния 1 Масса таблетки 100 Пример Б. Капсулы следующего состава изготавливают нижеописанным способом: мг/капсула Действующее вещество 10 Лактоза 155 Кукурузный крахмал 30 Тальк 5 Масса наполнителя капсулы 200 Действующее вещество, лактозу и кукурузный крахмал сначала смешивают в миксере,а затем в измельчающей машине. Смесь возвращают в миксер, добавляют тальк и тщательно перемешивают. С помощью автоматического устройства заполняют смесью капсулы с твердым желатиновым покрытием. Пример В. Суппозитории следующего состава изготавливают нижеописанным способом: мг/суппозиторий Действующее вещество 15 Инертная основа суппозитория 1285 Всего 1300 Инертную основу суппозитория расплавляют в стеклянном или стальном сосуде, тщательно перемешивают и охлаждают до 45 С. После этого к ней добавляют тонкоизмельченное действующее вещество и перемешивают до его полного диспергирования. Смесь заливают в формы соответствующего размера, дают охладиться, затем суппозитории вынимают из форм и упаковывают по отдельности в вощеную бумагу или металлическую фольгу. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения общей формулыR1 и R2 каждый независимо друг от друга обозначает водород, C1-C6 алкил, C1-C6 алкокси или галоген;R5 и R6 каждый независимо друг от друга обозначает водород, фенил, C1-C6 алкил или диC1-C6 алкил или могут вместе образовывать фенильное кольцо иR5 и один из R1 или R2 могут вместе образовывать насыщенное или ненасыщенное 6 членное кольцо;A обозначает 4-7-членное насыщенное кольцо, которое может содержать гетероатом,такой, как О или S; и их фармацевтически приемлемые кислотно-аддитивные соли. 2. Соединение по п.1, в котором R1 и R2 обозначают галоген. 3. Соединение по п.2, а именно, (-)-8-(5,8 дихлор-1,2,3,4-тетрагидронафтил-2)-1-фенил 1,3,8-триазаспиро[4.5]декан-4-он. 4. Соединение по п.1, в котором один из радикалов R1 и R2 обозначает водород, а другой обозначает галоген. 5. Соединение по п.4, представляющее собой 8-(8-хлор-1,2,3,4-тетрагидронафтил-2)-1 фенил-1,3,8-триазаспиро[4.5]декан-4-он. 6. Соединение по п.1, в котором R1 и R2 обозначают водород. 7. Соединения по п.6, представляющее собой 1-фенил-8-(1,2,3,4-тетрагидронафтил-1)-1,3,8-триазаспиро[4.5]декан-4-он и 8-индан-1-ил-1 фенил-1,3,8-триазаспиро[4.5]декан-4-он. 8. Соединение по п.1, в котором R5 и один из радикалов R1 или R2 вместе образуют насыщенное 6-членное кольцо. 9. Соединения по п.8, представляющее собой[4.5]декан-4-он. 10. Лекарственное средство, содержащее одно или несколько соединений по любому из пп.1-9 или его фармацевтически приемлемую соль, для лечения связанных с рецептором орфанина FQ (OFQ-рецептором) заболеваний, ко 29 торые включают психиатрические, неврологические и физиологические расстройства, такие как страх и расстройства, обусловленные стрессом, депрессия, травма, потеря памяти вследствие болезни Альцгеймера или других деменций,эпилепсия и конвульсии, острые и/или хрониче 30 ские болезненные состояния и синдромы отмены наркотических лекарств, нарушения контроля водного баланса, экскреции Na+, артериального кровяного давления и нарушения, связанные с питанием, такие как ожирение.
МПК / Метки
МПК: A61P 3/04, A61K 31/435, C07D 471/10
Метки: 4.5]декан-4-она, производные, 8-замещенного-1,3,8-триазаспиро
Код ссылки
<a href="https://eas.patents.su/16-1357-proizvodnye-8-zameshhennogo-138-triazaspiro-45dekan-4-ona.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 8-замещенного-1,3,8-триазаспиро [4.5]декан-4-она.</a>












