1-арил-или 1-алкилсульфонилгетероциклилбензазолы в качестве лигандов 5-гидрокситриптамина-6
Формула / Реферат
1. Соединение формулы I
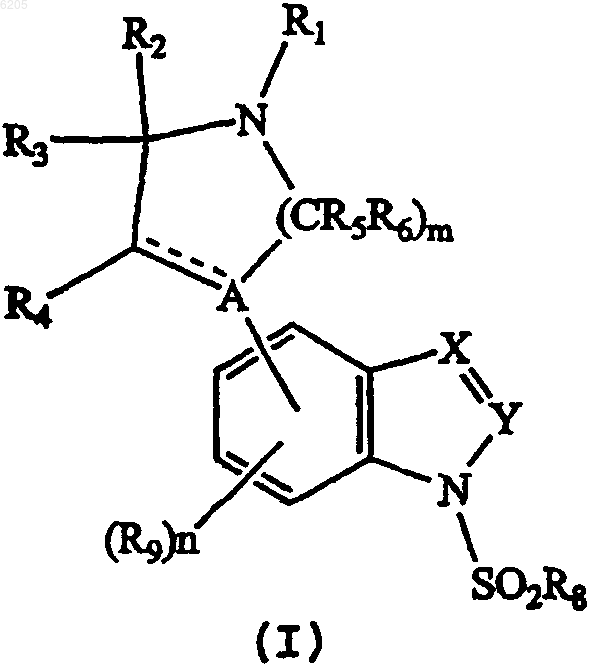
где A представляет N;
X представляет CR11 или N;
Y представляет CR7 или N при условии, что если X представляет N, то Y должен представлять CR7;
R1 представляет H, C1-C6алкилкарбонильную, C1-C6алкильную или C5-C7циклогетероалкильную группу, каждая из которых является необязательно замещенной;
каждый из R2, R3, R4, R5 и R6 независимо представляет H;
m означает целое число 2 или 3;
n означает 0;
каждый из R7 и R11 независимо представляет H, галоген или C1-C6алкильную, фенильную, нафтильную, гетероарильную или C1-C6алкоксигруппу, каждая из которых является необязательно замещенной;
R8 представляет необязательно замещенную фенильную или нафтильную или необязательно замещенную гетероарильную группу, состоящую из 5-10 кольцевых членов; и
R9 представляет H, галоген или C1-C6алкильную, C1-C6алкокси-, C2-C6алкенильную, фенильную или нафтильную или гетероарильную группу, состоящую из 5-10 кольцевых членов, и каждая из которых является необязательно замещенной;
- - - - означает простую связь или двойную связь,
или его фармацевтически приемлемая соль, при условии, когда X и Y представляют собой CH, R1 является метилом, тогда R8 должен быть отличным от фенила.
2. Соединение по п.1, где m равно 2.
3. Соединение по п.1 или 2, где R8 представляет необязательно замещенную фенильную группу.
4. Соединение по любому из пп.1-3, где R2, R3, R4, R5 и R6 представляют H.
5. Соединение по любому из пп.1-4, где R1 представляет H или C1-C6алкильную или C5-C7циклогетероалкильную группу, каждая из которых является необязательно замещенной.
6. Соединение по п.1, выбранное из группы, состоящей из
1-(фенилсульфонил)-4-пиперазин-1-ил-1H-индола;
1-[(2-бромфенил)сульфонил]-4-пиперазин-1-ил-1H-индола;
1-[(6-хлоримидазо[2,1-b][1,3]тиазол-5-ил)сульфонил]-4-пиперазин-1-ил-1H-индола;
1-[(3,4-диметоксифенил)сульфонил]-4-пиперазин-1-ил-1H-индола;
1-[(5-хлор-3-метил-1-бензотиен-2-ил)сульфонил]-4-пиперазин-1-ил-1H-индола;
1-[(4-бромфенил)сульфонил]-4-пиперазин-1-ил-1H-индола;
1-[(5-бромтиен-2-ил)сульфонил]-4-пиперазин-1-ил-1H-индола;
1-[(4,5-дихлортиен-2-ил)сульфонил]-4-пиперазин-1-ил-1H-индола;
метиловый эфир 4-[(4-пиперазин-1-ил-1H-индол)сульфонил]фенила;
4-пиперазин-1-ил-1-{[4-(трифторметокси)фенил]сульфонил}-1H-индола;
4-(4-бензилпиперазин-1-ил)-1-(фенилсульфонил)-1H-индола;
4-(4-бензилпиперазин-1-ил)-1-[(2-бромфенил)сульфонил]-1H-индола;
4-(4-бензилпиперазин-1-ил)-1-[(6-хлоримидазо[2,1-b][1,3]тиазол-5-ил)сульфонил]-1H-индола;
4-(4-бензилпиперазин-1-ил)-1-[(3,4-диметоксифенил)сульфонил]-1H-индола;
4-[4-(3-метоксибензил)пиперазин-1-ил]1-(фенилсульфонил)-1H-индола;
1-(фенилсульфонил)-4-[4-(пиридин-4-илметил)пиперазин-1-ил]-1H-индола;
1-(фенилсульфонил)-4-[4-(пиридин-3-илметил)пиперазин-1-ил]-1H-индола;
1-[(2-бромфенил)сульфонил]-4-[4-(3-метоксибензил)пиперазин-1-ил]-1H-индола;
1-[(2-бромфенил)сульфонил]-4-[4-(пиридин-4-ил-метил)пиперазин-1-ил]-1H-индола;
1-[(2-бромфенил)сульфонил]-4-[4-(пиридин-3-ил-метил)пиперазин-1-ил]-1H-индола;
1-(фенилсульфонил)-5-пиперазин-1-ил-1H-индазола;
1-(фенилсульфонил)-6-пиперазин-1-ил-1H-индазола;
1-[(2-бромфенил)сульфонил]-6-пиперазин-1-ил-1H-индазола;
1-[(4-бромфенил)сульфонил]-5-пиперазин-1-ил-1H-индазола;
1-[(4-бромфенил)сульфонил]-6-пиперазин-1-ил-1H-индазола;
1-[(5-бромтиен-2-ил)сульфонил]-5-пиперазин-1-ил-1H-индазола;
1-[(5-бромтиен-2-ил)сульфонил]-6-пиперазин-1-ил-1H-индазола;
1-[(4-фторфенил)сульфонил]-5-пиперазин-1-ил-1H-индазола;
1-[(4-фторфенил)сульфонил]-6-пиперазин-1-ил-1H-индазола;
метиловый эфир 4-[(5-пиперазин-1-ил-1H-индазол)-1-ил-сульфонил]фенила;
1-фенилсульфонил-4-(4-пропилпиперазин-1-ил)-1H-индазола;
1-фенилсульфонил-4-пиперазин-1-ил-1H-индазола;
1-фенилсульфонил-4-(4-фенетилпиперазин-1-ил)-1H-индазола;
1-фенилсульфонил-4-[4-(3-фенилпропил)пиперазин-1-ил]-1H-индазола,
и их фармацевтически приемлемых солей.
7. Способ лечения расстройства центральной нервной системы, ассоциированного с 5-HT6-рецептором или индуцированного этим рецептором, у пациента, нуждающегося в этом, где указанный способ предусматривает введение пациенту терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли по любому из пп.1-6.
8. Способ по п.7, где указанным расстройством является нарушение двигательных функций, тревожные состояния или нарушение познавательной способности.
9. Способ по п.7, где указанным расстройством является шизофрения или депрессия.
10. Способ по п.8, где указанным нарушением познавательной способности является нейродегенеративное расстройство.
11. Способ по п.10, где указанным нейродегенеративным расстройством является болезнь Альцгеймера или болезнь Паркинсона.
12. Фармацевтическая композиция, включающая фармацевтически приемлемый носитель и соединение формулы I или его фармацевтически приемлемую соль по любому из пп.1-6.
13. Способ получения соединения формулы I
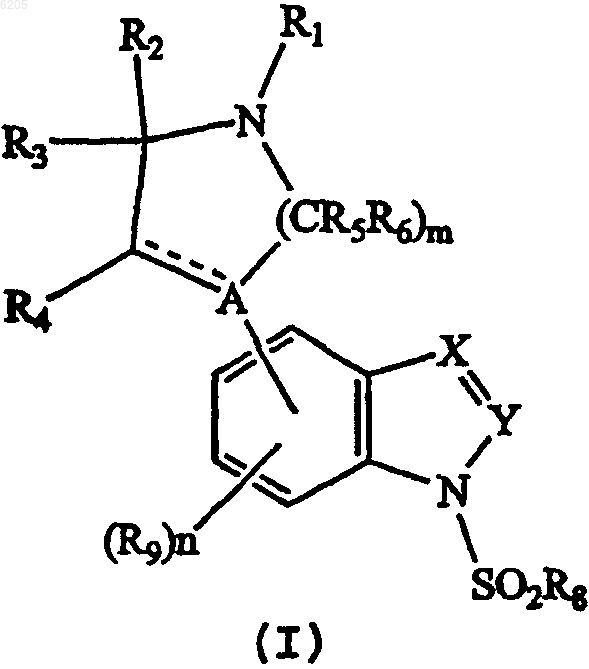
где A представляет N;
X представляет CR11 или N;
Y представляет CR7 или N при условии, что если X представляет N, то Y должен представлять CR7;
R1 представляет H, C1-C6алкилкарбонильную, C1-C6алкильную или C5-C7циклогетероалкильную группу, каждая из которых является необязательно замещенной;
каждый из R2, R3, R4, R5 и R6 независимо представляет H;
m означает целое число 2 или 3;
n означает 0;
каждый из R7 и R11 независимо представляет H, галоген или C1-C6алкильную, фенильную или нафтильную, гетероарильную или C1-C6алкоксигруппу, каждая из которых является необязательно замещенной;
R8 представляет необязательно замещенную фенильную или нафтильную или необязательно замещенную гетероарильную группу, состоящую из 5-10 кольцевых членов; и
R9 представляет H, галоген или C1-C6алкильную, C1-C6алкокси-, C2-C6алкенильную, фенильную или нафтильную или гетероарильную группу, состоящую из 5-10 кольцевых членов, и каждая из которых является необязательно замещенной;
- - - - означает простую связь или двойную связь, при условии, что когда X и Y представляют собой CH, R1 является метилом, тогда R8 должен быть отличным от незамещенного фенила,
включающий взаимодействие соединения формулы
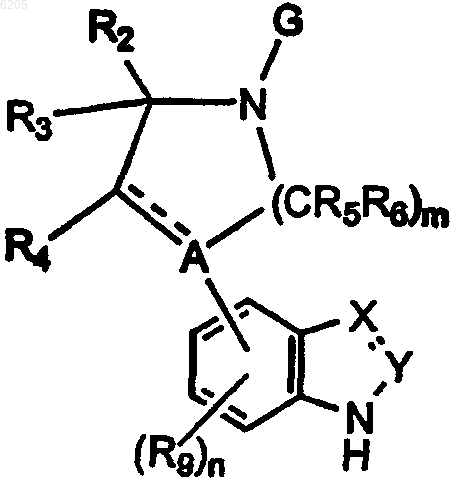
где B представляет собой R1 или G;
пунктирная линия, n, m, R1, R2, R3, R4, R5, R6, R9, X, Y и A определены выше, а G представляет защитную группу, с сульфонилирующим агентом, содержащим группу
R8SO2-,
где R8 определен выше, в присутствии основания и, если необходимо, удаление защитной группы G с получением соединения формулы I,
с последующим, если необходимо, взаимодействием соединения формулы I, где R1 представляет водород, с соединением формулы
R1-L,
где R1 определен выше (за исключением водорода), а L представляет подходящую уходящую группу, например галоген или SMe, в присутствии основания с получением соответствующего соединения формулы I;
и, в случае необходимости, превращение соединения формулы (I), имеющего реакционноспособную группу-заместитель, в другое соединение формулы I.
Текст
006205 Настоящее изобретение относится к 1-арил- или 1-алкилсульфонилгетероциклилбензазолам, используемым в качестве лигандов 5-гидрокситриптамина-6, к способам их получения, к фармацевтическим композициям, содержащим эти лиганды, и к способам лечения с использованием указанных композиций. Соединения, способные образовывать лиганды рецептора 5-НТ 6, могут быть использованы для лечения ряда расстройств центральной нервной системы, таких как тревожные состояния, депрессия, эпилепсия, компульсивные навязчивые состояния, мигрень, расстройства познавательной способности, нарушение сна, нарушение питания, приступ паники, расстройства, вызываемые прекращением приема лекарственных средств (синдром отмены), шизофрения или некоторые расстройства желудочнокишечного тракта, такие как синдром раздражения кишечника. Было предпринято множество попыток охарактеризовать недавно идентифицированный 5 НТ-6-рецептор и его возможную роль в нейропсихических и нейродегенеративных функциях. Для этой цели были проведены серьезные исследования для поиска новых соединений, обладающих аффинностью связывания с 5 НТ-6-рецептором, а особенно потенциально эффективных терапевтических агентов. Поэтому задачей настоящего изобретения является получение соединений, которые могут быть использованы в качестве терапевтических агентов для лечения ряда состояний, ассоциированных или индуцированных 5 НТ-6-рецептором. Другой задачей настоящего изобретения является разработка способов и композиций, которые могут быть использованы для лечения психозов (например, шизофрении, тревожных состояний или депрессии), нарушения двигательных функций (например, болезни Паркинсона), тревожных состояний, депрессии, компульсивных навязчивых состояний, расстройств, связанных с дефицитом внимания, или любого состояния, которое, как известно, ассоциируется или индуцируется 5 НТ-6-рецептором. Эти и другие задачи и отличительные признаки настоящего изобретения будут более очевидны из приведенного ниже подробного описания изобретения. Краткое описание изобретения Настоящее изобретение относится к соединению формулы IR1 представляет Н, C1-С 6 алкилкарбонильную, C1-С 6 алкильную или С 5-С 7 циклогетероалкильную группу, каждая из которых является необязательно замещенной; каждый из R2, R3, R4, R5 и R6 независимо представляет Н,m означает целое число 2 или 3;n означает 0; каждый из R7 и R11 независимо представляет Н, галоген или C1-С 6 алкильную, фенильную, нафтильную, гетероарильную или C1-С 6 алкоксигруппу, каждая из которых является необязательно замещенной;R8 представляет необязательно замещенную фенильную или нафтильную или необязательно замещенную гетероарильную группу, состоящую из 5-10 кольцевых членов, иR9 представляет Н, галоген или C1-С 6 алкильную, C1-С 6 алкокси-, С 2-С 6 алкенильную, фенильную или нафтильную или гетероарильную группу, состоящую из 5-10 кольцевых членов, и каждая из которых является необязательно замещенной;- - - - означает простую связь или двойную связь,или его фармацевтически приемлемой соли, при условии, что когда Х и Y представляют собой СН,R1 является метилом, тогда R8 должен быть отличным от фенила. Настоящее изобретение также относится к способам и композициям, используемым для лечения расстройств центральной нервной системы. Подробное описание изобретения Рецептор для 5-гидрокситриптамина-6 (5-НТ 6-рецептор) является одним из рецепторов, который был совсем недавно идентифицирован путем молекулярного клонирования. Способность этого рецептора связываться со многими терапевтическими соединениями, используемыми в психиатрии, а также вызывающее интерес распределение этого рецептора в головном мозге являются серьезным стимулом к получению новых соединений, способных взаимодействовать с указанным рецептором или воздействовать на него. В настоящее время не известны какие-либо абсолютно селективные агонисты. Было пред-1 006205 принято множество попыток выяснить возможную роль 5 НТ-6-рецептора в психических процессах, в нарушении познавательной способности, двигательной функции и ее регуляции, в расстройствах памяти,настроения и т.п. Для этой цели, помимо исследований 5 НТ-6-рецептора, были проведены основательные исследования для поиска соединений, обладающих аффинностью связывания с 5 НТ-6-рецептором, а также возможных терапевтических агентов для лечения расстройств центральной нервной системы. Неожиданно было обнаружено, что 1-алкил- или 1-арилсульфонилгетероциклилбензазолы формулыI обладают аффинностью по отношению к 5-НТ 6, а также значительной селективностью по отношению к конкретному подтипу. Преимущество указанных бензазолов формулы I заключается в том, что они являются эффективными терапевтическими агентами, которые могут быть использованы для лечения расстройств центральной нервной системы, ассоциированных с 5 НТ-6-рецептором или индуцируемых этим рецептором. В соответствии с этим настоящее изобретение относится к 1-алкил- или 1-арилсульфонилгетероциклилбензазольным соединениям формулы IR1 представляет Н, C1-С 6 алкилкарбонильную, C1-С 6 алкильную или С 5-С 7 циклогетероалкильную группу, каждая из которых является необязательно замещенной; каждый из R2, R3, R4, R5 и R6 независимо представляет Н,m означает целое число 2 или 3;n означает 0; каждый из R7 и R11 независимо представляет Н, галоген или C1-С 6 алкильную, фенильную, нафтильную, гетероарильную или C1-С 6 алкоксигруппу, каждая из которых является необязательно замещенной;R8 представляет необязательно замещенную фенильную или нафтильную или необязательно замещенную гетероарильную группу, состоящую из 5-10 кольцевых членов, иR9 представляет Н, галоген или C1-С 6 алкильную, C1-С 6 алкокси-, С 2-С 6 алкенильную, фенильную или нафтильную или гетероарильную группу, состоящую из 5-10 кольцевых членов, и каждая из которых является необязательно замещенной;- - - - означает простую связь или двойную связь,или их фармацевтически приемлемой соли, при условии, что когда Х и Y представляют собой СН,R1 является метилом, тогда R8 должен быть отличным от фенила. Используемый в настоящем описании и в формуле изобретения термин галоген означает Br, Cl, I или F; термин арил означает фенил или нафтил. Термин циклогетероалкил означает 5-7-членную циклоалкильную циклическую систему, содержащую 1 или 2 гетероатома, которые могут быть одинаковыми или различными и выбраны из N, NR, О или S, и необязательно содержащую одну двойную связь,где R представляет водород или необязательный заместитель, такой как заместитель, проиллюстрированный в настоящей заявке. Примерами циклогетероалкильных циклических систем, входящих в определенный здесь термин, являются нижеследующие кольца, где Y представляет NR, О или S Аналогичным образом, используемый в настоящем описании и в формуле изобретения термин гетероарил означает 5-10-членную ароматическую циклическую систему, содержащую 1, 2 или 3 гетероатома, которые могут быть одинаковыми или различными и выбраны из азота, кислорода и серы. Такими гетероарильными циклическими системами являются пирролил, азолил, оксазолил, тиазолил, имидазолил, фурил, тиенил, хинолинил, изохинолинил, индолинил, бензотиенил, бензофуранил, бензизоксазолил и т.п.; термин галогеналкил означает группу CnH2n+1, имеющую от 1 до 2n+1 атомов галогена, которые могут быть одинаковыми или различными; а термин галогеналкокси означает группу OCnH2n+1, имеющую от 1 до 2n+1 атомов галогена, которые могут быть одинаковыми или различными.-2 006205 Если используемые в настоящем описании и в формуле изобретения термины, такие как C1-С 6 алкил, С 2-С 6 алкенил, C2-С 6 алкинил, C3-С 7 циклоалкил, циклогетероалкил, арил или гетероарил, определены как необязательно замещенные группы, то эти необязательно присутствующие группы-заместители могут представлять собой один или несколько таких заместителей, которые обычно используются для получения фармацевтических соединений или для модификации этих соединений так, чтобы они оказывали влияние на структуру/активность, стойкость, абсорбцию, стабильность или другие ценные свойства. Конкретными примерами таких заместителей являются атомы галогена, нитро-, циано-, тиоцианато-, цианато-, гидроксильная, алкильная, галогеналкильная, алкокси-, галогеналкокси-, амино-, алкиламино-, диалкиламино-, формильная, алкоксикарбонильная, карбоксильная, алканоильная, алкилтио-, алкилсульфинильная, алкилсульфонильная, карбамоильная, алкиламидо-, фенильная, фенокси-, бензильная, бензилокси-, гетероарильная, циклогетероалкильная или циклоалкильная группы, а предпочтительно атомы галогена или низшие алкильные группы. В основном, могут присутствовать 0-3 заместителей. Если любой из вышеуказанных заместителей представляет или содержит алкильную группу-заместитель,то эта группа может быть прямой или разветвленной и может содержать вплоть до 12, предпочтительно до 6, а более предпочтительно до 4 атомов углерода. Каждый из радикалов А, X, Y, R1, R2, R3, R4, R5, R6, R7, R11, R8, R9, R10 может представлять собой группы, которые необязательно замещены описанными здесь заместителями. Примерами радикалов формулы (I) являются все нижеуказанные группы или любая комбинации из нижеследующих групп, где А представляет N; Х представляет N или CR11, где R11 определен или проиллюстрирован в настоящем описании (например, CR11 представляет СН, фенил, нафтил, С-галоген, С(C1-С 6 алкил), С(O-C1-С 6 алкил), где алкильная, или фенильная, или нафтильная группы могут быть замещены одной или несколькими нижеследующими группами, которые могут быть одинаковыми или различными, такими как галоген, нитро-,циано-, тиоцианато-, цианато-, гидроксильная, C1-С 6 алкильная, C1-С 6 алкокси-, галогенC1-С 6 алкокси-,галогенC1-С 6 алкильная,амино-,C1-С 6 алкиламино-,ди-C1-С 6 алкиламино-,формильная,С 2 С 7 алкоксикарбонильная, карбоксильная, С 2-С 7 алканоильная, C1-С 6 алкилтио-, C1-С 6 алкилсульфинильная,C1-С 6 алкилсульфонильная, карбамоильная, C1-С 6 алкиламидо-, фенильная, фенокси-, бензильная, бензилокси-, гетероарильная,циклогетероалкильная или С 5-С 7 циклоалкильная группы);Y представляет N или CR7, где R7 определен или проиллюстрирован в настоящем описании (например,CR7 представляет СН, фенил, нафтил, С-галоген, С(C1-С 6 алкил), С(O-C1-С 6 алкил), где алкильная или фенильная,нафтильная группы могут быть замещены одной или несколькими нижеследующими группами, которые могут быть одинаковыми или различными, такими как галоген, нитро-, циано-, тиоцианато-, цианато-, гидроксильная,C1-С 6 алкильная, C1-С 6 алкокси, галогенC1-С 6 алкокси-, галогенC1-С 6 алкильная, амино-, C1-С 6 алкиламино-, диC1-С 6 алкиламино-, формильная, С 2-С 7 алкоксикарбонильная, карбоксильная, С 2-С 7 алканоильная, C1-С 6 алкилтио-,C1-С 6 алкилсульфинильная, C1-С 6 алкилсульфонильная, карбамоильная, C1-С 6 алкиламидо-, фенильная, фенокси-, бензильная, бензилокси-, гетероарильная, циклогетероалкильная или С 5-С 7 циклоалкильная группы);R1 представляет Н, C1-С 6 алкилкарбонильную или C1-С 6 алкильную или 5-7-членную циклогетероалкильную группу, каждая из которых необязательно замещена одной или несколькими нижеследующими группами, которые могут быть одинаковыми или различными, такими как галоген, нитро-, циано-, тиоцианато-, цианато-, гидроксильная, C1-С 6 алкильная, C1-С 6 алкокси, галогенC1-С 6 алкокси-, галогенC1-С 6 алкильная, амино-, C1-С 6 алкиламино-, ди-(C1-С 6 алкил)амино-, формильная, С 2-С 7 алкоксикарбонильная,карбоксильная, С 2-С 7 алканоильная, C1-С 6 алкилтио-, C1-С 6 алкилсульфинильная, C1-С 6 алкилсульфонильная, карбамоильная, C1-С 6 алкиламидо-, фенильная, фенокси-, бензильная, бензилокси-, гетероарильная,циклогетероалкильная или С 5-С 7 циклоалкильная группы; причем указанные фенильная, фенокси-, бензильная, бензилоксигруппы необязательно замещены одной или несколькими нижеследующими группами, которые могут быть одинаковыми или различными, такими как галоген, нитро-, циано-, тиоцианато-,цианато-, гидроксил, C1-С 6 алкил, C1-С 6 алкокси-, галогенC1-С 6 алкокси-, галогенC1-С 6 алкил, амино-, C1 С 6 алкиламино-, ди-(C1-С 6 алкил)амино-, формил, С 2-С 7 алкоксикарбонил, карбоксил, С 2-С 7 алканоил, C1 С 6 алкилтио-, C1-С 6 алкилсульфинил, C1-С 6 алкилсульфонил, карбамоил, C1-С 6 алкиламидо; каждый из R2, R3, R4, R5 и R6 является Н; каждый из R7 и R11 независимо выбран из Н, галогена, фенильной или нафтильной группы, гетероарила,C1-С 6 алкила или O-C1-С 6 алкила, где каждая из алкильной, фенильной или нафтильной или гетероарильной групп может быть замещена одной или несколькими нижеследующими группами, которые могут быть одинаковыми или различными, такими как галоген, нитро-, циано-, тиоцианато-, цианато-, гидроксильная, C1-С 6 алкильная, C1-С 6 алкокси-, галогенC1-С 6aлкокси-, галогенC1-С 6 алкильная, амино-, C1-С 6 алкиламино-, ди-C1 С 6 алкиламино-, формильная, С 2-С 7 алкоксикарбонильная, карбоксильная, С 2-С 7 алканоильная, C1-С 6 алкилтио-,C1-С 6 алкилсульфинильная, C1-С 6 алкилсульфонильная, карбамоильная, C1-С 6 алкиламидо, фенильная, фенокси-, бензильная, бензилокси-, гетероарильная, циклогетероалкильная или С 5-С 7 циклоалкильная группы;R8 представляет C1-С 6 алкил, арил или гетероарил, где каждая из алкильной, арильной или гетероарильной групп может быть замещена одной или несколькими нижеследующими группами, которые мо-3 006205 гут быть одинаковыми или различными, такими как галоген, нитро-, циано-, тиоцианато-, цианато-, гидроксильная, C1-С 6 алкильная, C1-С 6 алкокси-, галогенC1-С 6 алкокси-, галогенC1-С 6 алкильная, амино-, C1 С 6 алкиламино-, ди-C1-С 6 алкиламино-, формильная, С 2-С 7 алкоксикарбонильная, карбоксильная, С 2-С 7 алканоильная, C1-С 6 алкилтио-, C1-С 6 алкилсульфинильная, C1-С 6 алкилсульфонильная, карбамоильная, C1 С 6 алкиламидо-, фенильная, фенокси-, бензильная, бензилокси-, гетероарильная, циклогетероалкильная или С 5-С 7 циклоалкильная группы; причем указанные фенильная, фенокси-, бензильная и бензилоксигруппы необязательно замещены одной или несколькими нижеследующими группами, которые могут быть одинаковыми или различными, такими как галоген, нитро-, циано-, тиоцианато-, цианато-, гидроксил, C1-С 6 алкил, C1-С 6 алкокси-, галогенC1-С 6 алкокси-, галогенC1-С 6 алкил, амино-, C1-С 6 алкиламино-,ди-(C1-С 6 алкил)амино-, формил, С 2-С 7 алкоксикарбонил, карбоксил, С 2-С 7 алканоил, C1-С 6 алкилтио-, C1 С 6 алкилсульфинил, C1-С 6 алкилсульфонил, карбамоил, C1-С 6 алкиламидо-;R9 представляет Н, галоген, фенил или нафтил, гетероарил, C2-С 6 алкенил, C1-С 6 алкил или O-C1-С 6 алкил, где каждая из алкенильной, алкильной, фенильной или нафтильной или гетероарильной групп может быть замещена одной или несколькими нижеследующими группами, которые могут быть одинаковыми или различными, такими как галоген, нитро-, циано-, тиоцианато-, цианато-, гидроксильная, C1-С 6 алкильная,C1-С 6 алкокси-, галогенC1-С 6 алкокси, галогенC1-С 6 алкильная, амино-, C1-С 6 алкиламино-, ди-C1-С 6 алкиламино-, формильная, С 2-С 7 алкоксикарбонильная, карбоксильная, С 2-С 7 алканоильная, C1-С 6 алкилтио, C1 С 6 алкилсульфинильная, C1-С 6 алкилсульфонильная, карбамоильная, C1-С 6 алкиламидо-, фенильная, фенокси-, бензильная, бензилокси-, гетероарильная, циклогетероалкильная или C5-С 7 циклоалкильная группы. Более конкретно, каждый из независимых примеров указанных радикалов в формуле (I) имеет следующие значения: А может представлять N, Х может представлять N или СН.R1 может представлять Н, (C1-С 6 алкил)карбонил, C5-С 7 циклогетероалкил, имеющий 1 или 2 атома азота на кольце, или C1-С 6 алкильную, фенилC1-С 6aлкильную, пиридилC1-С 6 алкильную, тиенилC1-С 6 алкильную группу, каждая из которых необязательно замещена одной или несколькими нижеследующими группами, которые могут быть одинаковыми или различными, такими как галоген, нитро-, циано-, тиоцианато-, цианато-,гидроксильная, C1-С 6 алкильная, C1-С 6 алкокси-, галогенC1-С 6 алкокси-, галогенC1-С 6 алкильная, амино-, C1-С 6 алкиламино-, ди-(C1-С 6 алкил)амино-, формильная, С 2-С 7 алкоксикарбонильная, карбоксильная, С 2-С 7 алканоильная, C1-С 6 алкилтио-, C1-С 6 алкилсульфинильная, C1-С 6 алкилсульфонильная, карбамоильная, C1-С 6 алкиламидо-,фенильная, фенокси-, бензильная, бензилокси-, циклогетероалкильная или С 5-С 7 циклоалкильная группы. Каждый из R2, R3, R4, R5 и R6 представляет Н.R8 может представлять фенил или нафтил или моно- или бициклический гетероарил, состоящий из 6-10 атомов углерода, или гетероарил, состоящий из 5-10 кольцевых членов и имеющий 1-3 гетероатома,выбранных из О, N и S, где фенильная, или нафтильная, или гетероарильная группы могут быть замещены одной или несколькими нижеследующими группами, которые могут быть одинаковыми или различными, такими как галоген, нитро-, циано-, тиоцианато-, цианато-, гидроксильная, C1-С 6 алкильная, C1 С 6 алкокси-, галогенC1-С 6 алкокси-, галогенC1-С 6 алкильная, амино-, C1-С 6 алкиламино-, ди-C1-С 6 алкиламино-, формильная, С 2-С 7 алкоксикарбонильная, карбоксильная, С 2-С 7 алканоильная, C1-С 6 алкилтио-, C1 С 6 алкилсульфинильная, C1-С 6 алкилсульфонильная, карбамоильная, C1-С 6 алкиламидо-, фенильная, фенокси-, бензильная, бензилокси-, циклогетероалкильная или C5-C7 циклоалкильная группы.R10 может представлять Н, ОН или O-C1-С 6 алкил. Другими примерами R1 являются водород, C1-С 6 алкил (например, пропил); (C1-С 6 алкил)-СО- (например,ацетил); бензил; фенетил; фенпропил; пиридилметил (например, 3- или 4-пиридилметил); тиенилметил; бензоил(C1-С 4)алкил, фенокси(C1-С 4)алкил и 4,5-дигидро-1 Н-имидазолил; где указанные группы могут быть замещены одним или несколькими заместителями, которые являются одинаковыми или различными, такими как заместители, выбранные из галогена (например, 2-хлор-5-тиенилметила, 2-(п-фторфенокси)этила, пфторбензоилпропила); нитро- (например, 3-нитробензила) или (C1-С 6)алкокси- (например, 3-метоксибензила). Другими примерами R8 являются фенильная, нафтильная и гетероарильная группы, определенные выше, такие как тиенил (например, тиен-2-ил), бензотиенил (например, бензотиен-2-ил), имидазо[2,1b]тиазолил, бензотиазолил, бензофуразанил, бензотиадиазолил, изоксазолил, имидазолил и пиразолил(например, пиразол-4-ил); где каждая из указанных групп может быть замещена одним или несколькими заместителями (например, 1-3), которые являются одинаковыми или различными, такими как заместители, выбранные из галогена, C1-С 4 алкокси-, C1-С 4 алкила, C1-С 4 галогеналкила, C1-С 4 галогеналкокси-, C1 С 4 алкиламино-, ди-(C1-С 4 алкил)амино- и амино-. Так, например, m может быть равен 2 и 3. R5 и R6 могут представлять, например, водород. R2, R3 иR5 могут также представлять водород. n может быть, например, равно 0. А может представлять, например, -N-, -СН- или -С(ОН)-. Фармацевтически приемлемыми солями могут быть любые кислотно-аддитивные соли, образованные соединением формулы I и фармацевтически приемлемой кислотой, такой как фосфорная, серная,-4 006205 хлористо-водородная, бромисто-водородная, лимонная, малеиновая, янтарная, фумаровая, уксусная, молочная, азотная, сульфоновая, п-толуолсульфоновая, метансульфоновая кислота или т.п. Предпочтительными соединениями настоящего изобретения являются соединения формулы I, где А представляет N, а m равно 2. Предпочтительными также являются соединения формулы I, где R8 представляет необязательно замещенную фенильную группу, a R1 представляет Н или C1-С 6 алкильную или С 5-С 7 циклогетероалкильную группу, каждая из которых является необязательно замещенной. Другими предпочтительными соединениями настоящего изобретения являются соединения формулы I, где R2, R3,R4, R5 и R6 представляют Н, а n равно 0. Более предпочтительными соединениями настоящего изобретения являются соединения формулы I,где А представляет N, m равно 2, а R1 представляет Н или C1-С 4 алкильную или С 5-С 7 циклогетероалкильную группу, каждая из которых является необязательно замещенной. Другой группой более предпочтительных соединений настоящего изобретения являются соединения формулы I, где А представляет N, m равно 2,R1 представляет Н или C1-С 4 алкильную или С 5-С 7 циклогетероалкильную группу, каждая из которых является необязательно замещенной; a R8 представляет необязательно замещенную фенильную группу. Предпочтительными соединениями настоящего изобретения являются 1-(фенилсульфонил)-4-пиперазин-1-ил-1 Н-индол; 1-[(2-бромфенил)сульфонил]-4-пиперазин-1-ил-1 Н-индол; 1-[(6-хлоримидазо[2,1-b][1,3]тиазол-5-ил)сульфонил]-4-пиперазин-1-ил-1 Н-индол; 1-[(3,4-диметоксифенил)сульфонил]-4-пиперазин-1-ил-1 Н-индол; 1-[(5-хлор-3-метил-1-бензотиен-2-ил)сульфонил]-4-пиперазин-1-ил-1H-индол; 1-[(4-бромфенил)сульфонил]-4-пиперазин-1-ил-1 Н-индол; 1-[(5-бромтиен-2-ил)сульфонил]-4-пиперазин-1-ил-1 Н-индол; 1-[(4,5-дихлортиен-2-ил)сульфонил]-4-пиперазин-1-ил-1 Н-индол; метиловый эфир 4-[(4-пиперазин-1-ил-1 Н-индол-1-ил)сульфонил]фенила; 4-пиперазин-1-ил-1-[4-(трифторметокси)фенил]сульфонил-1 Н-индол; 4-(4-бензилпиперазин-1-ил)-1-(фенилсульфонил)-1H-индол; 4-(4-бензилпиперазин-1-ил)-1-[(2-бромфенил)сульфонил]-1 Н-индол; 4-(4-бензилпиперазин-1-ил)-1-[(6-хлоримидазо[2,1-b][1,3]тиазол-5-ил)сульфонил]-1H-индол; 4-(4-бензилпиперазин-1-ил)-1-[(3,4-диметоксифенил)сульфонил]-1 Н-индол; 4-[4-(3-метоксибензил)пиперазин-1-ил]-1-(фенилсульфонил)-1H-индол; 1-(фенилсульфонил)-4-[4-(пиридин-4-илметил)пиперазин-1-ил]-1H-индол; 1-(фенилсульфонил)-4-[4-(пиридин-3-илметил)пиперазин-1-ил]-1H-индол; 1-[(2-бромфенил)сульфонил]-4-[4-(3-метоксибензил)пиперазин-1-ил]-1H-индол; 1-[(2-бромфенил)сульфонил]-4-[4-(пиридин-4-ил-метил)пиперазин-1-ил]-1H-индол; 1-[(2-бромфенил)сульфонил]-4-[4-(пиридин-3-ил-метил)пиперазин-1-ил]-1H-индол; 1-(фенилсульфонил)-5-пиперазин-1-ил-1 Н-индазол; 1-(фенилсульфонил)-6-пиперазин-1-ил-1 Н-индазол; 1-[(2-бромфенил)сульфонил]-6-пиперазин-1-ил-1 Н-индазол; 1-[(4-бромфенил)сульфонил]-5-пиперазин-1-ил-1 Н-индазол; 1-[(4-бромфенил)сульфонил]-6-пиперазин-1-ил-1H-индазол; 1-[(5-бромтиен-2-ил)сульфонил]-5-пиперазин-1-ил-1 Н-индазол; 1-[(5-бромтиен-2-ил)сульфонил]-6-пиперазин-1-ил-1 Н-индазол; 1-[(4-фторфенил)сульфонил]-5-пиперазин-1-ил-1 Н-индазол; 1-[(4-фторфенил)сульфонил]-6-пиперазин-1-ил-1 Н-индазол; метиловый эфир 4-[(5-пиперазин-1-ил-1 Н-индазол)-1-ил-сульфонил]фенила; 1-фенилсульфонил-4-(4-пропилпиперазин-1-ил)-1H-индазол; 1-фенилсульфонил-4-пиперазин-1-ил-1 Н-индазол; 1-фенилсульфонил-4-(4-фенетилпиперазин-1-ил)-1H-индазол; 1-фенилсульфонил-4-[4-(3-фенилпропил)пиперазин-1-ил]-1 Н-индазол,и их фармацевтически приемлемые соли. Настоящее изобретение также относится к способам получения соединений формулы I, включающим одну из следующий стадий:R8SO2-,где R8 определен выше, и, если необходимо, удаление защитной группы G, с получением соединения формулы I, где R1 представляет водород; илиR8SO2-,где R8 определен выше, с получением соединения формулы (I),или(iii) взаимодействие соединения формулы I, где R1 представляет водород, с соединением формулыR1-L,где R1 определен выше (за исключением водорода), a L представляет подходящую уходящую группу,например галоген или SMe, с получением соответствующего соединения формулы I; или(iv) алкилирование соединения формулы (I), где А представляет CR10, где R10 представляет ОН, с алкилирующим агентом, содержащим группу Ra, где Ra представляет необязательно замещенный алкил,с получением соединения формулы (I), где R10 представляет необязательно замещенный алкокси; или(v) превращение соединения формулы (I), имеющего реакционноспособную группу-заместитель, в другое соединение формулы I. Что касается способов (i) и (ii), то сульфонилирование может быть, в основном, осуществлено в присутствии основания, например, гидрида натрия, с использованием сульфонилирующего агента, такого как сульфонилхлорид формулыR8SO2Cl,где R8 определен выше, с последующим удалением защитной группы в случае способа (i). Способ (iii) может быть, в основном, осуществлен с использованием алкилирующего или ацилирующего агента с соответствующей уходящей группой L, такого как соединение формулыR1 hal,где R1 представляет необязательно замещенный алкил или алканоил, а hal представляет галоген, такой как хлор. Что касается способа (iv), то указанное алкилирование может быть, в основном, осуществлено в присутствии основания, например NaH, а если необходимо, то в присутствии растворителя с использованием алкилирующего агента, такого как алкилгалогенид. Способы превращения реакционноспособных групп-заместителей в соединениях формулы I в другие группы-заместители хорошо известны специалистам. Так, например, бензильные группы могут быть удалены и заменены водородом. Ацетиламиногруппы могут быть превращены в аминогруппы путем гидролиза. В любой из описанных здесь реакций, перед осуществлением этих реакций реакционноспособные группы-заместители или соответствующие положения в молекуле могут быть защищены посредством использования защитных групп, которые являются инертными по отношению к данным реакционным условиям, а затем, после осуществления реакции, указанные защитные группы могут быть удалены. Более конкретно, соединения настоящего изобретения могут быть получены с использованием стандартных методов синтеза и, если необходимо, с использованием стандартной техники разделения и выделения. Так, например, 4-(пиперазин-1-ил)индольные соединения формулы II могут быть легко получены путем каталитического гидрирования 4-нитроиндольного предшественника формулы III с получением соответствующего 4-аминоиндола формулы IV и последующего взаимодействия указанного индола формулы IV с бис-алкилирующим агентом, таким как бис(2-хлорэтил)амин, с получением нужного промежуточного соединения формулы II. Эта реакция проиллюстрирована на реакционной схеме I. Промежуточное соединение формулы II может быть затем превращено в соединение формулы I, где А представляет N, m равно 2, R1 представляет Н; R2, R3 и R4 представляют Н; - - - - представляет простую связь, а гетероциклильная группа находится в 4-положении, посредством взаимодействия промежуточного соединения формулы II с защитной группой G, например ди-трет-бутилдикарбонатом, которая используется для защиты атома N пиперазинового основания, в результате чего получают соединение формулы V, которое затем подвергают взаимодействию с основанием, таким как NaH и сульфонилхлоридR8SO2Cl, с получением защищенного 4-(пиперазин-1-ил)-1-(замещенный сульфонил)индола и с последующим удалением защитной группы указанного индола, в результате чего получают нужное соединение формулы Iа. В результате взаимодействия указанного соединения формулы Iа с реагентом R1-Hal, где R1 определен выше, a Hal представляет Сl, Вr или I, в присутствии основания получают соединения формулы Ib, где R1 не является Н. Эта последовательность реакций проиллюстрирована на реакционной схеме II. Реакционная схема II Соответствующие соединения настоящего изобретения, где А представляет CR10, могут быть получены, например, путем литиирования защищенного 4-броминдола формулы IV, где G представляет бензил, и замещения литиевой группы циклическим кетоном, таким как N-защищенный-4-пиперидон, с получением промежуточного гидроксисоединения формулы VII, которое может быть затем дегидратировано и сульфонилировано вышеописанным способом с получением защищенного соединения формулыVIII. После каталитического гидрирования и одновременного снятия защиты с указанного соединения формулы VIII получают соединения формулы I, где - - - - представляет простую связь (формула Id). Эта последовательность реакций проиллюстрирована на реакционной схеме III. Реакционная схема III-7 006205 Эти и другие описанные в литературе процедуры могут быть использованы для получения соединений формулы I настоящего изобретения. Использование 5-, 6- или 7-галогениндольного, -галогениндазольного или -галогенбензимидазольного субстрата в качестве исходного материала и использование, в основном, тех же самых процедур, которые были проиллюстрированы на вышепривиденных реакционных схемах I, II и III, позволяет получить соответствующие соединения формулы I, где гетероциклическая группа находится в 5-, 6- или 7-положении, а Х или Y представляют N. Соединение настоящего изобретения формулы I может быть преимущественно использовано для лечения расстройств центральной нервной системы, ассоциированных с 5-НТ 6-рецептором или вызываемых эти рецептором, таких как нарушение двигательных функций, расстройство настроения, психические расстройства, нарушения познавательной способности, нейродегенеративные расстройства или т.п. В соответствии с этим настоящее изобретение относится к способу лечения расстройств центральной нервной системы (ЦНС), ассоциированных с 5 НТ-6-рецептором или индуцированных этим рецептором,у пациента, нуждающегося в этом, где указанный способ предусматривает введение пациенту терапевтически эффективного количества соединения формулы I, описанного выше. Указанные соединения могут быть введены перорально или парентерально либо другим известным способом, который обычно применяется для эффективного введения терапевтического агента пациенту, нуждающемуся в этом. Терапевтически эффективное количество, вводимое для лечения конкретного расстройства ЦНС,может варьироваться в зависимости от конкретного(ых) условия(и) применяемого лечения, от массы,возраста и характера ответа данного пациента, а также от тяжести заболевания, оценки лечащего врача и т.п. В общих чертах, эффективные суточные количества для перорального введения могут составлять примерно 0,01-1,000 мг/кг, предпочтительно примерно 0,5-500 мг/кг, а эффективные суточные количества для парентерального введения могут составлять примерно 0,1-100 мг/кг, предпочтительно примерно 0,5-50 мг/кг. На практике, соединения настоящего изобретения вводят в твердой или в жидкой форме, в чистом виде или в комбинации с одним или несколькими стандартными фармацевтическими носителями или наполнителями. В соответствии с этим настоящее изобретение относится к фармацевтической композиции, которая содержит фармацевтически приемлемый носитель и эффективное количество соединения формулы I, описанного выше. Твердые носители, подходящие для использования в композиции настоящего изобретения, представляют собой одно или несколько веществ, которые могут действовать как ароматизирующие агенты,замасливатели, солюбилизаторы, суспендирующие агенты, наполнители, агенты, усиливающие скольжение, технологические добавки для облегчения прессования, связующие вещества, агенты, способствующие дезинтегрированию таблетки, и инкапсулирующие материалы. В порошках указанным носителем может быть тонкоизмельченное твердое вещество, которое смешивают с тонкоизмельченным соединением формулы I. Для изготовления таблеток соединение формулы I смешивают с носителем, обладающим свойствами, необходимыми для прессования, в соответствующих соотношениях, и эту смесь прессуют с получением нужной формы и размера. Указанные порошки и таблетки могут содержать до 99 мас.% соединения формулы I. Твердыми носителями, подходящими для использования в композиции настоящего изобретения, являются фосфат кальция, стеарат магния, тальк, сахара, лактоза, декстрин, крахмал, желатин, целлюлоза, метилцеллюлоза, натрийсодержащая карбоксиметилцеллюлоза, поливинилпирролидин,низкоплавкие воски и ионообменные смолы. Для приготовления растворов, суспензий, эмульсий, сиропов и эликсиров в композиции настоящего изобретения может быть использован любой фармацевтически приемлемый жидкий носитель. Соединения формулы I могут быть растворены или суспендированы в фармацевтически приемлемом жидком носителе, таком как вода, органический растворитель или фармацевтически приемлемое масло или жир или их смеси. Указанная жидкая композиция может содержать любые другие подходящие фармацевтические добавки, такие как солюбилизаторы, эмульгаторы, буферы, консерванты, подсластители, ароматизирующие агенты, суспендирующие агенты, загустители, красители, регуляторы вязкости, стабилизаторы, регуляторы осмотического давления и т.п. Примерами жидких носителей, подходящих для перорального и парентерального введения, являются вода (в частности, вода, содержащая вышеуказанные добавки, например производные целлюлозы, предпочтительно раствор натрийсодержащей карбоксиметилцеллюлозы), спирты (включая одноатомные спирты и многоатомные спирты, например гликоли) или их производные, или масла (например, фракционированное кокосовое масло и арахисовое масло). Для парентерального введения указанным носителем может быть маслянистый сложный эфир, такой как этилолеат или изопропилмиристат. Композиции настоящего изобретения, которые представляют собой стерильные растворы или суспензии, являются подходящими для внутримышечной, внутрибрюшинной или подкожной инъекции. Стерильные растворы могут быть также введены внутривенно. Композиции настоящего изобретения,подходящие для перорального введения, могут быть изготовлены в форме либо жидкой, либо твердой композиции. Для лучшего понимания и для более наглядной иллюстрации настоящего изобретения ниже приводятся конкретные примеры его осуществления. Указанные примеры представлены лишь в иллюстратив-8 006205 ных целях и никоим образом не должны рассматриваться как ограничение объема и сущности настоящего изобретения. Если это не оговорено особо, то все части даны по массе. Термины ВЭЖХ и ЯМР означают высокоэффективную жидкостную хроматография и ядерный магнитный резонанс, соответственно. Пример 1. Получение гидрохлорида 1-(фенилсульфонил)-4-пиперазин-1-ил-1 Н-индола.NaOH (0,8 г, 20 ммоль) в 40% диоксане перемешивали при комнатной температуре в течение 10 ч и обрабатывали водой. Реакционную смесь экстрагировали этилацетатом. Экстракты объединяли, сушили над Na2SO4 и концентрировали в вакууме, в результате чего получали трет-бутил-4-(1 Н-индол-4 ил)пиперазин-1-карбоксилат в виде бесцветного твердого вещества, т.пл. 137 С, как было идентифицировано с помощью масс-спектрометрии и элементного анализа. Часть трет-бутил-4-(1 Н-индол-4-ил)пиперазин-1-карбоксилата (1,05 г, 3,5 ммоль) добавляли к суспензии NaH (3,8 ммоль) в тетрагидрофуране при 0C в атмосфере N2. Полученную смесь перемешивали в течение 0,5 ч, обрабатывали бензолсульфонилхлоридом (0,616 г, 3,5 ммоль), перемешивали в течение 16 ч и обрабатывали водой. Водную реакционную смесь экстрагировали этилацетатом. Экстракты объединяли, сушили над Na2SO4 и концентрировали в вакууме с получением остатка. Этот остаток хроматографировали (SiO2, СН 2 Сl2) с получением трет-бутил-4-(1-фенилсульфонил(1 Н-индол-4-ил)пиперазин-1 карбоксилата в виде светло-желтого твердого вещества, 1,25 г, (выход 81%), т.пл. 64-65 С, как было идентифицировано с помощью масс-спектрального и элементного анализов. Часть трет-бутил-4-(1-бензолсульфонил-1 Н-индол-4-ил)пиперазин-1-карбоксилата (0,85 г) перемешивали в смеси 4 н НСl и диоксана при комнатной температуре в течение 2 ч и фильтровали. Осадок на фильтре сушили с получением указанного в заголовке продукта в виде белого твердого вещества, 0,64 г(выход 99%), т.пл. 60 С, как было идентифицировано с помощью масс-спектрального анализа и ЯМРанализа. Примеры 2-13. Получение гидрохлорида 1-(арилсульфонил-4-пиперазин-1-ил)-1 Н-индола. С использованием, в основном, той же самой процедуры, которая была описана в примере 1, и с использованием соответствующего арилсульфонилхлорида получали соединения, перечисленные ниже в табл. 1, которые были идентифицированы с помощью ВЭЖХ и масс-спектрального анализа. Таблица 1 1 Условия ЖХМС: Hewlett Packard 1100 MSD; колонка YMC ODS-AM 2,0 мм x 50 мм 5 мкм при 23 С; инъекция 3 мкл; растворитель А: 0,02% TFA/вода; растворитель В: 0,02% TFA/ацетонитрил; градиент: время 0: 95% А; 0,3 мин: 95% А; 4,7 мин: 10% А, 4,9 мин: 95% А; а затем 1 мин. Скорость потока 1,5 мл/мин; детекция: 254 нм DAD; положительный режим сканирования API-ES 150-700; фрагментатор, 70 мВ. Раствор 1-(фенилсульфонил)-4-пиперазин-1-ил-1 Н-индола (71 мг, 0,18 ммоль) в диоксане обрабатывали гидроиодидом 2-метилтио-2-имидазолина (52,7 мг, 0,22 ммоль) и N,N-диизопропилэтиламином С использованием, в основном, той же самой процедуры, которая была описана в примере 1, и с использованием соответствующего 1-(арилсульфонил)индольного субстрата получали соединения, перечисленные ниже в табл. 2, которые были идентифицированы с помощью ВЭЖХ и масс-спектрального анализа. Условия ЖХ-МС: аналогичны условиям для табл. 1. Раствор 1-(фенилсульфонил)-4-пиперазин-1-ил-1 Н-индола (71 мг, 0,18 ммоль) в тетрагидрофуране последовательно обрабатывали бензилбромидом (21 мкл) и триэтиламином (75 мкл), встряхивали при комнатной температуре в течение 16 ч и концентрировали в вакууме с получением остатка. Остаток очищали с помощью ОФ-ВЭЖХ с получением указанного в заголовке продукта, 37 мг, идентифицированного с помощью ВЭЖХ и масс-спектрального анализа (2,81 мин; 432 М+Н) в ЖХМС-условиях, описанных в табл. 1. Примеры 20-53. Получение 4-гетероарил-1-арилсульфонилиндольных соединений. С использованием, в основном, той же самой процедуры, которая была описана в примере 19, и с использованием соответствующего 4-(пиперазин-1-ил)-1-(арилсульфонил)индольного субстрата и соответствующего арил-, алкил- или ацилгалогенида получали соединения, перечисленные ниже в табл. 3,которые были идентифицированы с помощью ВЭЖХ и масс-спектрального анализа. Таблица 3 Условия ЖХ-МС: аналогичны условиям для табл. 1. Суспензию 4-бромбензимидазола (42 ммоль), гомопиперазина (256 ммоль) и NaOt-Bu (59 ммоль) в сухом о-ксилоле в атмосфере N2 обрабатывали каталитическим количеством Рd(ОСОСН 3)2 Р(t-Вu)3 (P/Pd=4),нагревали при 120 С в течение 3 ч, охлаждали до комнатной температуры и разбавляли водой. Водную смесь экстрагировали этилацетатом. Экстракты объединяли, сушили над MgSO4 и концентрировали в вакууме с получением остатка. Остаток очищали флеш-хроматографией и получали 4-(гомопиперазин-1-ил)бензимидазол. Смесь 4-(гомопиперазин-1-ил)бензимидазола (4,3 г, 20 ммоль), ди-трет-бутилдикарбоната (4,8 г, 22 ммоль) и NaOH (0,8 г, 20 ммоль) в 40% водном диоксане перемешивали при комнатной температуре в течение 10 ч и разбавляли водой. Водную смесь экстрагировали этилацетатом. Экстракты объединяли, сушили над Na2SO4 и концентрировали в вакууме с получением трет-бутил-4-(бензимидазол-4-ил)гомопиперазин-1-карбоксилата. Суспензию NaH (3,8 ммоль) в тетрагидрофуране при 0 С в атмосфере N2 обрабатывали трет-бутил-4(бензимидазол-4-ил)гомопиперазин-1-карбоксилатом (1,1 г, 3,5 ммоль), перемешивали в течение 0,5 ч, а затем обрабатывали бензолсульфонилхлоридом (0,616 г, 3,5 ммоль), перемешивали в течение 16 ч при комнатной температуре и разбавляли водой. Водную смесь экстрагировали этилацетатом. Экстракты объединяли, сушили над Na2SO4 и концентрировали в вакууме с получением остатка. Остаток очищали флеш-хроматографией с получением трет-бутил-(4-(1-фенилсульфонил)бензимидазол-4-ил)гомопиперазин-1-карбоксилата. Смесь полученного таким образом карбоксилата в 4 н НСl и диоксане перемешивали при комнатной температуре в течение 2 ч и фильтровали. Осадок на фильтре промывали этилацетатом и сушили в вакууме с получением указанного в заголовке продукта. Пример 56. Получение 4-(4-бензилпиперазин-1-ил)-1H-индазола. Перемешиваемый раствор 4-бензил-1-(3-фтор-2-карбоксифенил)пиперазина (5,96 г, 20,0 ммоль) в диметилсульфоксиде (10 мл) и гидразине (10 мл) нагревали при 95 С в атмосфере азота в течение 4 дней. Охлажденную реакционную смесь разбавляли эфиром и промывали смесью воды и насыщенного водного бикарбоната натрия. Затем органический слой последовательно промывали водой и насыщенным раствором соли, сушили над МgSO4 и концентрировали в вакууме с получением остатка. Остаток хроматографировали с использованием этилацетата в качестве элюента. Полученное масло снова концентрировали из эфира с получением белой пены, которую перемешивали в течение ночи со смесью гексан/эфир. Полученный белый порошок выделяли вакуумной фильтрацией и промывали гексаном с получением 3,11 г указанного в заголовке соединения (выход 53%), идентифицированного с помощью Н-ЯМР. Раствор 4-(4-бензилпиперазин-1-ил)-1H-индазола (2,34 г, 8,00 ммоль) в сухом диметилформамиде обрабатывали 0,48 г непромытого 60% NaH в минеральном масле (12,0 ммоль NaH). После перемешивания в атмосфере азота в течение 15 мин реакционную смесь обрабатывали бензолсульфонилхлоридом(1,53 мл, 12,0 ммоль), перемешивали в течение 24 ч при комнатной температуре, обрабатывали насыщенным водным NаНСО 3 и водой, а затем экстрагировали эфиром. Органический слой последовательно промывали водой и насыщенным раствором соли, сушили над МgSO4 и концентрировали в вакууме с получением остатка. Остаток очищали флеш-хроматографией на силикагеле с использованием смеси этилацетат:гексан, 1:1, в качестве элюента, и получали свободный амин указанного в заголовке соединения в виде масла (3,14 г, 91%). Часть этого масла (432 мг, 1,0 ммоль) растворяли в эфире и обрабатывали 1,0 М НСl в эфире (1,1 мл, 1,1 ммоль). Полученное твердое вещество фильтровали, промывали эфиром и сушили в вакууме с получением указанного в заголовке соединения в виде светло-коричневатого твердого вещества, т.пл. 208-209 С, идентифицированного с помощью Н-ЯМР и масс-спектрального анализа. Пример 58. Получение гидрохлорида 1-(фенилсульфонил)-4-(1-пиперазинил)-1 Н-индазола. Раствор 1-фенилсульфонил-4-(4-бензилпиперазин-1-ил)-1 Н-индазола (433 мг, 1,0 ммоль) в 1,2-дихлорэтане обрабатывали 1-хлорэтилхлорформиатом (0,27 мл, 2,5 ммоль), кипятили с обратным холодильником в течение 2 ч и концентрировали в вакууме. Полученный остаток кипятили с обратным холодильником в метаноле в течение 1,5 ч, охлаждали, концентрировали в вакууме и снова концентрировали из эфира. Полученное коричневатое твердое вещество растирали с эфиром и кристаллизовали из горячего этанола с получением указанного в заголовке соединения в виде коричневатого твердого вещества, 237 мг Смесь 1-фенилсульфонил-4-пиперазин-1-ил-1H-индазола (190 мг, 0,50 ммоль) и K2 СО 3 (138 мг,1,0 ммоль) в сухом ацетонитриле обрабатывали фенетилбромидом (0,55 мл, 2,0 ммоль), кипятили с обратным холодильником в атмосфере азота в течение 8,5 ч, обрабатывали водой и экстрагировали метиленхлоридом. Объединенные экстракты сушили над МgSO4, хроматографировали на колонке SCX (VarianSCX Меgа Bond Elut, 5 г), элюируя этилацетатом для удаления неосновного органического материала, а затем смесью триэтиламин:этилацетат, 1:99, и после концентрирования получали свободный амин указанного в заголовке соединения в виде слегка желтоватого масла (198 мг, 89%). Это масло растворяли в эфире с небольшим количеством этанола для облегчения растворимости и обрабатывали 1,0 М НСl в эфире. Раствор концентрировали в вакууме и полученное коричневатое твердое вещество обрабатывали эфиром и подвергали вакуумной фильтрации с получением указанного в заголовке соединения в виде светло-коричневатого твердого вещества, 209 мг (выход 87%), т.пл. 230-232 С (с разлож.), идентифицированного с помощью Н-ЯМР и масс-спектрального анализа. С использованием, в основном, той же самой процедуры, которая была описана в примерах 56-59, и с использованием соответствующего индазольного субстрата и соответствующего арил-, алкил- или ацилгалогенида или арилсульфонилхлорида получали соединения, перечисленные ниже в табл. 4, которые были идентифицированы с помощью ЯМР и масс-спектрального анализа. Таблица 4 Раствор 5-аминоиндола (6,23 г, 47 ммоль), гидрохлорида бис(2-хлорэтил)амина (16,8 г, 96 ммоль) и триэтиламина (19 мл, 141 ммоль) в бутаноле нагревали при 100 С в течение 8 ч, охлаждали до комнатной температуры и концентрировали в вакууме с получением 9,46 г 5-пиперазин-1-ил-1 Н-индола. Раствор указанного индола в ацетоне и воде обрабатывали ди-трет-бутилдикарбонатом (11,3 г, 47 ммоль) и карбонатом калия (13 г, 96 ммоль). Смесь перемешивали при комнатной температуре в течение ночи,ацетон выпаривали и оставшуюся водную фазу экстрагировали этилацетатом. Экстракты сушили надMgSO4 и концентрировали в вакууме с получением остатка. Этот остаток очищали флеш-хроматографией с получением трет-бутилового эфира 4-(1 Н-индол-5-ил)пиперазин-1-карбоновой кислоты.- 15006205 Раствор указанного сложного эфира (60 мг, 0,2 ммоль) в тетрагидрофуране обрабатывали гидридом натрия (30 мг, 0,5 ммоль) а затем N-ацетилсульфонилхлоридом (25 мкл, 0,2 ммоль), встряхивали при комнатной температуре в течение 16 ч и концентрировали в вакууме с получением трет-бутилового эфира 4-[1-(4-ацетиламинофенилсульфонил)-1 Н-индол-5-ил]пиперазин-1-карбоновой кислоты. Полученный таким образом сложный эфир растворяли в метаноле, обрабатывали концентрированной соляной кислотой (100 мкл), встряхивали при 60 С в течение 2 ч и концентрировали в вакууме с получением остатка. Остаток очищали ВЭЖХ с получением указанного в заголовке соединения, 15 мг,идентифицированного с помощью ВЭЖХ и масс-спектрального анализа (к.т., 2,37 мин, М+Н 357). Примеры 74-102. Получение пиперазинил-1-арилсульфонилбензимидазольных и индольных соединений. С использованием, в основном, той же самой процедуры, которая была описана в примере 73, и с использованием соответствующего аминоиндольного или аминобензимидазольного субстрата и подходящих арилсульфонилхлоридных реагентов получали соединения, перечисленные ниже в табл. 5, которые были идентифицированы с помощью ВЭЖХ и масс-спектрального анализа. Таблица 5- 16006205 Пример 103. Сравнительная оценка аффинности связывания тестируемых соединений с 5-НТ 6. Аффинность тестируемых соединений в отношении связывания с рецептором серотонина 5-НТ 6 оценивали следующим образом. Культивированные клетки Hela, экспрессирующие человеческие клонированные 5-НТ 6-рецепторы, собирали и центрифугировали при низкой скорости (1000 хg) в течение 10,0 мин для удаления культуральной среды. Собранные клетки суспендировали в половине объема свежеприготовленного забуференного фосфатом физиологического раствора и снова центрифугировали при той же самой скорости. Эту процедуру повторяли. Затем собранные клетки гомогенизировали в 10 объемах 50 мМ Трис-НСl (рН 7,4) и 0,5 мМ EDTA. Гомогенат центрифугировали при 40000 хg в течение 30,0 мин и осадок собирали. Полученный осадок ресуспендировали в 10 объемах буфера Трис-НСl и снова центрифугировали при той же самой скорости. Конечный осадок суспендировали в небольшом объеме буфера Трис-НСl и определяли содержание белка в аликвотах ткани объемом 10-25 мкл. В методе, описанномLowry et al., J. Biol. Chem., 193:265 (1951), использовали альбумин бычьей сыворотки в качестве стандарта. Объем суспендированных клеточных мембран корректировали и получали концентрацию белка в ткани, составляющую 1,0 мг/мл суспензии. Полученную суспензию мембран (концентрированную до 10 кратного уменьшения объема) разделяли на аликвоты объемом 1,0 мл и хранили при -70 С до их последующего использования в экспериментах по связыванию. Эксперименты по связыванию осуществляли в 96-луночном микротитрационном планшете в полном объеме 200 мкл. В каждую лунку добавляли следующую смесь: 80,0 мкл буфера для инкубирования, приготовленного в 50 мМ буфере Трис-НСl (рН 7,4), содержащем 10,0 мМ MgCl2 и 0,5 мМ EDTA, и 20 мкл[3H]-LSD (S.A., 86,0 Ки/ммоль, поставляемого от Amersham Life Science), 3,0 нМ. Константа диссоциации, КD, для [3H]LSD на человеческом серотониновом 5-НТ 6-рецепторе составляла 2,9 нМ, как было определено по насыщению связывания с использованием возрастающих концентраций [3H]LSD. Реакцию инициировали путем конечного добавления 100,0 мкл тканевой суспензии. Неспецифическое связывание измеряли в присутствии 10,0 мкм метиотепина. Тестируемые соединения добавляли в объеме 20,0 мкл. Реакцию проводили в темноте в течение 120 мин при комнатной температуре, после чего комплекс связанный лиганд-рецептор отфильтровывали на 96-луночном универсальном планшет-фильтре с использованием сборника Packard Filtermate 196. Связанный комплекс, оставшийся на фильтровальном диске, сушили на воздухе и после добавления в каждую неглубокую лунку 40,0 мкл сцинтиллятораMicroscint-20 измеряли радиоактивность на приборе Packard TopCount, снабженном детектором с шестью фотоумножителями. Универсальный планшет-фильтр подвергали термозапаиванию и радиоактивность подсчитывали на приборе PackardTopCount, при этом уровень включения трития составлял 31,0%. Специфическое связывание 5-НТ 6-рецептора определяли как общую радиоактивность связанного комплекса минус количество связанного материала в присутствии 10,0 мкм немеченого метиотепина. Связывание в присутствии различных концентраций тестируемого соединения выражали как процент от специфического связывания в отсутствие тестируемого соединения. По полученным данным была построена кривая зависимости log % связывания от log концентрации тестируемого соединения. В результате нелинейного регрессионного анализа исходных данных, проводимого на компьютере с использованием программы Prism, были получены величины IC50 и Ki для тестируемых соединений с доверительными пределами 95%. С использованием исходных данных была построена кривая линейной регрессии,по которой определяли значение IC50, а значение Ki определяли исходя из следующего уравнения:Ki=IC50/(1+L/KD) где L представляет концентрацию используемого радиоактивного лиганда, а KD представляет константу диссоциации лиганда для данного рецептора, и обе эти величины были выражены в нМ. С использованием этого анализа определяли указанные ниже величины Ki и эти величины сравнивали с величинами, полученными для репрезентативных соединений, которые, как было продемонстрировано, связываются с 5-НТ 6-рецептором. Результаты представлены ниже в табл. 6. Как можно видеть из представленных выше результатов, соединения настоящего изобретения обладают высокой степенью аффинности по отношению к подтипу рецептора серотонина 5-НТ 6. Хотя два из сравнительных соединений (клозапин и метиотепин) имеют аналогичную аффинность по отношению к 5-НТ 6-рецептору, однако, они не обладают селективностью, которой обладают соединения настоящего- 18006205 изобретения. Представленные выше примеры продемонстрировали, что селективность соединений настоящего изобретения по отношению к 5-НТ 6-рецептору в 50 раз превышает аффинность этих соединений по отношению к 5-НТ 7-рецептору. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы IR1 представляет Н, C1-С 6 алкилкарбонильную, C1-С 6 алкильную или C5-С 7 циклогетероалкильную группу, каждая из которых является необязательно замещенной; каждый из R2, R3, R4, R5 и R6 независимо представляет Н;m означает целое число 2 или 3;n означает 0; каждый из R7 и R11 независимо представляет Н, галоген или C1-С 6 алкильную, фенильную, нафтильную, гетероарильную или C1-С 6 алкоксигруппу, каждая из которых является необязательно замещенной;R8 представляет необязательно замещенную фенильную или нафтильную или необязательно замещенную гетероарильную группу, состоящую из 5-10 кольцевых членов; иR9 представляет Н, галоген или C1-С 6 алкильную, C1-С 6 алкокси-, C2-С 6 алкенильную, фенильную или нафтильную или гетероарильную группу, состоящую из 5-10 кольцевых членов, и каждая из которых является необязательно замещенной;- - - - означает простую связь или двойную связь,или его фармацевтически приемлемая соль, при условии, когда Х и Y представляют собой СН, R1 является метилом, тогда R8 должен быть отличным от фенила. 2. Соединение по п.1, где m равно 2. 3. Соединение по п.1 или 2, где R8 представляет необязательно замещенную фенильную группу. 4. Соединение по любому из пп.1-3, где R2, R3, R4, R5 и R6 представляют Н. 5. Соединение по любому из пп.1-4, где R1 представляет Н или C1-С 6 алкильную или С 5-C7 циклогетероалкильную группу, каждая из которых является необязательно замещенной. 6. Соединение по п.1, выбранное из группы, состоящей из 1-(фенилсульфонил)-4-пиперазин-1-ил-1 Н-индола; 1-[(2-бромфенил)сульфонил]-4-пиперазин-1-ил-1 Н-индола; 1-[(6-хлоримидазо[2,1-b][1,3]тиазол-5-ил)сульфонил]-4-пиперазин-1-ил-1H-индола; 1-[(3,4-диметоксифенил)сульфонил]-4-пиперазин-1-ил-1 Н-индола; 1-[(5-хлор-3-метил-1-бензотиен-2-ил)сульфонил]-4-пиперазин-1-ил-1H-индола; 1-[(4-бромфенил)сульфонил]-4-пиперазин-1-ил-1 Н-индола; 1-[(5-бромтиен-2-ил)сульфонил]-4-пиперазин-1-ил-1 Н-индола; 1-[(4,5-дихлортиен-2-ил)сульфонил]-4-пиперазин-1-ил-1 Н-индола; метиловый эфир 4-[(4-пиперазин-1-ил-1 Н-индол)сульфонил]фенила; 4-пиперазин-1-ил-1-[4-(трифторметокси)фенил]сульфонил-1 Н-индола; 4-(4-бензилпиперазин-1-ил)-1-(фенилсульфонил)-1H-индола; 4-(4-бензилпиперазин-1-ил)-1-[(2-бромфенил)сульфонил]-1 Н-индола; 4-(4-бензилпиперазин-1-ил)-1-[(6-хлоримидазо[2,1-b][1,3]тиазол-5-ил)сульфонил]-1H-индола; 4-(4-бензилпиперазин-1-ил)-1-[(3,4-диметоксифенил)сульфонил]-1H-индола; 4-[4-(3-метоксибензил)пиперазин-1-ил]-1-(фенилсульфонил)-1H-индола; 1-(фенилсульфонил)-4-[4-(пиридин-4-илметил)пиперазин-1-ил]-1H-индола; 1-(фенилсульфонил)-4-[4-(пиридин-3-илметил)пиперазин-1-ил]-1H-индола; 1-[(2-бромфенил)сульфонил]-4-[4-(3-метоксибензил)пиперазин-1-ил]-1H-индола; 1-[(2-бромфенил)сульфонил]-4-[4-(пиридин-4-ил-метил)пиперазин-1-ил]-1H-индола; 1-[(2-бромфенил)сульфонил]-4-[4-(пиридин-3-ил-метил)пиперазин-1-ил]-1H-индола; 1-(фенилсульфонил)-5-пиперазин-1-ил-1 Н-индазола; 1-(фенилсульфонил)-6-пиперазин-1-ил-1 Н-индазола;- 19006205 1-[(2-бромфенил)сульфонил]-6-пиперазин-1-ил-1 Н-индазола; 1-[(4-бромфенил)сульфонил]-5-пиперазин-1-ил-1 Н-индазола; 1-[(4-бромфенил)сульфонил]-6-пиперазин-1-ил-1 Н-индазола; 1-[(5-бромтиен-2-ил)сульфонил]-5-пиперазин-1-ил-1 Н-индазола; 1-[(5-бромтиен-2-ил)сульфонил]-6-пиперазин-1-ил-1 Н-индазола; 1-[(4-фторфенил)сульфонил]-5-пиперазин-1-ил-1 Н-индазола; 1-[(4-фторфенил)сульфонил]-6-пиперазин-1-ил-1 Н-индазола; метиловый эфир 4-[(5-пиперазин-1-ил-1 Н-индазол)-1-ил-сульфонил]фенила; 1-фенилсульфонил-4-(4-пропилпиперазин-1-ил)-1H-индазола; 1-фенилсульфонил-4-пиперазин-1-ил-1H-индазола; 1-фенилсульфонил-4-(4-фенетилпиперазин-1-ил)-1H-индазола; 1-фенилсульфонил-4-[4-(3-фенилпропил)пиперазин-1-ил]-1 Н-индазола,и их фармацевтически приемлемых солей. 7. Способ лечения расстройства центральной нервной системы, ассоциированного с 5-НТ 6-рецептором или индуцированного этим рецептором, у пациента, нуждающегося в этом, где указанный способ предусматривает введение пациенту терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли по любому из пп.1-6. 8. Способ по п.7, где указанным расстройством является нарушение двигательных функций, тревожные состояния или нарушение познавательной способности. 9. Способ по п.7, где указанным расстройством является шизофрения или депрессия. 10. Способ по п.8, где указанным нарушением познавательной способности является нейродегенеративное расстройство. 11. Способ по п.10, где указанным нейродегенеративным расстройством является болезнь Альцгеймера или болезнь Паркинсона. 12. Фармацевтическая композиция, включающая фармацевтически приемлемый носитель и соединение формулы I или его фармацевтически приемлемую соль по любому из пп.1-6. 13. Способ получения соединения формулы IR1 представляет Н, C1-С 6 алкилкарбонильную, C1-С 6 алкильную или С 5-С 7 циклогетероалкильную группу, каждая из которых является необязательно замещенной; каждый из R2, R3, R4, R5 и R6 независимо представляет Н;m означает целое число 2 или 3;n означает 0; каждый из R7 и R11 независимо представляет Н, галоген или C1-С 6 алкильную, фенильную или нафтильную, гетероарильную или C1-С 6 алкоксигруппу, каждая из которых является необязательно замещенной;R8 представляет необязательно замещенную фенильную или нафтильную или необязательно замещенную гетероарильную группу, состоящую из 5-10 кольцевых членов; иR9 представляет Н, галоген или C1-С 6 алкильную, C1-С 6 алкокси-, C2-С 6aлкенильную, фенильную или нафтильную или гетероарильную группу, состоящую из 5-10 кольцевых членов, и каждая из которых является необязательно замещенной;- - - - означает простую связь или двойную связь, при условии, что когда Х и Y представляют собой СН, R1 является метилом, тогда R8 должен быть отличным от незамещенного фенила,включающий взаимодействие соединения формулыR8SO2-,где R8 определен выше, в присутствии основания и, если необходимо, удаление защитной группы G с получением соединения формулы I,с последующим, если необходимо, взаимодействием соединения формулы I, где R1 представляет водород, с соединением формулыR1-L,где R1 определен выше (за исключением водорода), a L представляет подходящую уходящую группу,например галоген или SMe, в присутствии основания с получением соответствующего соединения формулы I; и, в случае необходимости, превращение соединения формулы (I), имеющего реакционноспособную группу-заместитель, в другое соединение формулы I.
МПК / Метки
МПК: A61P 43/00, C07D 209/08, A61K 31/395
Метки: качестве, 1-арил-или, 1-алкилсульфонилгетероциклилбензазолы, 5-гидрокситриптамина-6, лигандов
Код ссылки
<a href="https://eas.patents.su/22-6205-1-aril-ili-1-alkilsulfonilgeterociklilbenzazoly-v-kachestve-ligandov-5-gidroksitriptamina-6.html" rel="bookmark" title="База патентов Евразийского Союза">1-арил-или 1-алкилсульфонилгетероциклилбензазолы в качестве лигандов 5-гидрокситриптамина-6</a>
Предыдущий патент: Производные цианопирролидина
Следующий патент: Противоопухолевые производные эктейнасцидина
Случайный патент: Лифт












