Производные 3-азабицикло[3.1.0]гексана в качестве лигандов опиатных рецепторов
Номер патента: 4672
Опубликовано: 24.06.2004
Авторы: Петтман Алан Джон, Крук Роберт Джеймс, Банкс Бернард Джозеф, Ланн Грэм, Гибсон Стивен Пол
Формула / Реферат
1. Вещество, которое представляет собой соединение формулы I
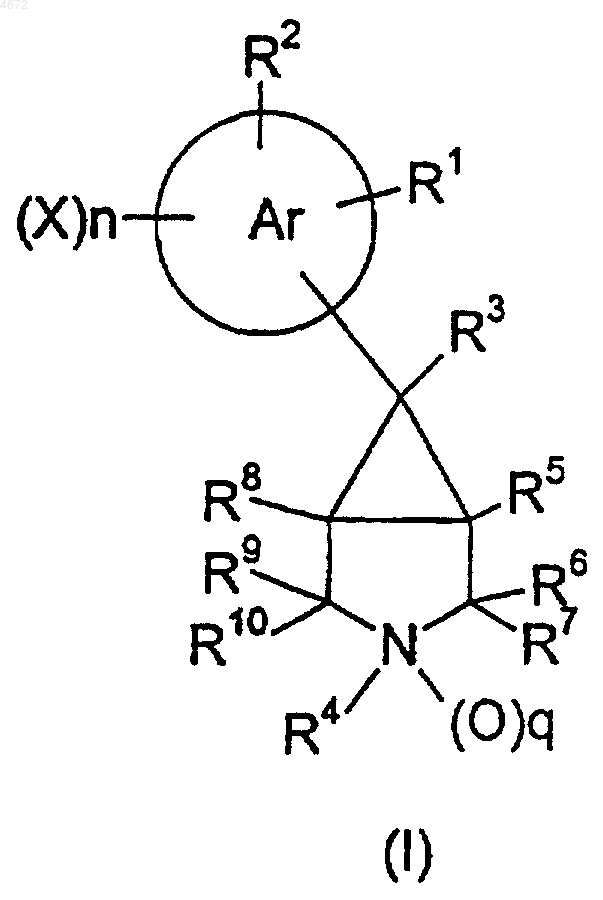
где кольцо "Ar" представляет собой фенил или 6-членное гетероарильное кольцо;
R1, взятый в отдельности, представляет собой H, галоген, NH2, NY2WY1, Het1 или OE,
Y2 представляет собой H,
W представляет собой SO2 или C(O)O,
Y1 представляет собой C1-10алкил (возможно замещенный одним или более чем одним заместителем, независимо выбранным из галогена, OH, C1-4алкокси, CONH2, C1-6алкоксикарбонила, NH2, арила или фталимидила), Het1, арил (возможно замещенный одним или более чем одним заместителем, независимо выбранным из C1-4алкила и галогена), NH2, N(C1-6алкил)2 или NH(C1-6алкил),
Het1 представляет собой гетероциклическую группу, содержащую до 4 гетероатомов, выбранных из N, O и S, которая может включать в себя до 3 колец (предпочтительно гетероарильную группу, возможно бензо- или пиридоконденсированный гетероарил), возможно замещенную одним или более чем одним C1-6 алкильным заместителем,
и в случае, если атом S присутствует в кольце, он может присутствовать как часть -S-, S(O)- или -S(O2)- группы, а атомы углерода в кольце могут присутствовать как часть карбонильной группировки;
E представляет собой H,
R2, взятый в отдельности, представляет собой H или галоген;
или R1 и R2, когда они присоединены к соседним атомам углерода, могут быть взяты вместе с атомами углерода, к которым они присоединены, и могут представлять собой Het1a;
Het1a представляет собой гетероциклическую группу, содержащую до 4 гетероатомов, выбранных из N, O и S, которая может включать в себя до 3 колец (и предпочтительно представляет собой возможно бензоконденсированное 5-7-членное гетероциклическое кольцо), и эта группа возможно замещена C1-4галогеноалкилом,
и в случае, если атом S присутствует в кольце, он может присутствовать как часть -S-, S(O)- или -S(O2)-группы,
R3 представляет собой CN или C1-6алкил (возможно замещенный одним или более чем одним галогеном, OH, C1-6алкокси, C1-6алканоилокси и/или NY2WY1),
R4 представляет собой C1-10алкил, C3-10алкенил или C3-10алкинил, причем каждая из этих групп присоединена к атому N через sp3 атом углерода и возможно замещена одним или более чем одним OH, CN, галогеном, C1-6алкокси (который возможно замещен арилом), арилокси (который возможно замещен одним или более чем одним галогеном, C1-6алкилом (который возможно замещен одним или более чем одним галогеном) и/или C1-4алкокси), C1-6алкоксикарбонилом, C2-6алканоилокси, C3-8циклоалкилом, C3-8циклоалкилокси, C4-9циклоалканоилом, арилом (который возможно замещен одним или более чем одним галогеном, C1-6алкилом (который возможно замещен одним или более чем одним CN и/или галогеном), C1-4алкокси, OH и/или NY2WY1), гетероциклом (который возможно бензоконденсирован и возможно замещен одним или более чем одним галогеном, C1-6 алкилом, C1-4алкокси и/или =O), гетероциклилокси (возможно замещенным одним или более чем одним C1-6алкилом или =O), адамантилом или ZBNR14R15,
Z представляет собой CO группу,
B представляет собой (CH2)p,
R14 и R15, каждый независимо, представляют собой H, C1-10алкил, C3-8циклоалкил или гетероарил,
R5 и R8 представляют собой H,
R6, R7, R9 и R10 представляют собой H,
X представляет собой галоген,
n равно 0, 1 или 2;
p равно 0;
q равно 0;
"гетероарил" представляет собой ароматическое кольцо, содержащее до четырех гетероатомов, независимо выбранных из N, O и S, и в случае, если атом S присутствует в кольце, он может присутствовать как часть -S-, S(O)- или -S(O)2- группы, которая может быть связана с остальной частью соединения через любой(ые) доступный(ые) атом(ы);
"гетероцикл" представляет собой группу, включающую в себя 1, 2 или 3 кольца, которая содержит до 4 кольцевых гетероатомов, выбранных из N, O и S, и до 18 кольцевых атомов углерода;
"арил", в том числе в определении "арилокси" и т. д., означает группу, содержащую фенильное кольцо, которая может включать в себя дополнительное карбоциклическое кольцо, конденсированное с указанным фенильным кольцом, и которая может быть связана с остальной частью соединения через любой(ые) доступный(ые) атом(ы) (примеры таких групп включают нафтил, инданил и т.д.);
группы "алкил", "алкенил" и "алкинил" могут быть нормальными или разветвленными, если позволяет число атомов углерода;
группы "циклоалкил" могут быть полициклическими, если позволяет число атомов углерода;
либо его фармацевтически или ветеринарно приемлемое производное или пролекарство.
2. Вещество по п.1, где кольцо "Ar" представляет собой фенил или пиридил.
3. Вещество по любому из пп.1 и 2, где R1, взятый в отдельности, представляет собой OH, галоген, NH2, NY2WY1 или Het1.
4. Вещество по любому из пп.1-3, где R2, взятый в отдельности, представляет собой H.
5. Вещество по п.1 или 2, где R1 и R2, взятые вместе с атомами углерода, к которым они присоединены, представляют собой возможно бензоконденсированное 5-7-членное гетероарильное кольцо, возможно замещенное C1-4галогеноалкилом.
6. Вещество по любому из пп.1-5, где X представляет собой Cl.
7. Вещество по любому из пп.1-6, где n равно 0 и q равно 0.
8. Вещество по любому из пп.1-7, где R3 представляет собой CN или C1-6алкил (возможно замещенный одним или более чем одним галогеном, OH, C1-6алкокси, C2-6алканоилокси и/или NY2WY1).
9. Вещество по любому из пп.1-8, где R4 представляет собой C1-10алкил, C3-10алкенил или C3-10алкинил, причем каждая из этих групп связана с атомом N через sp3 атом углерода, причем каждая из них возможно замещена C3-8циклоалкилом, арилом (который возможно замещен одним или более чем одним метилом, этилом, галогеном, CH2CN, CF3, NHSO2CH3, OH, метокси), возможно бензо-конденсированным гетероарилом (который возможно замещен одним или более чем одним метилом, галогеном, метокси, =O), OH, арилокси (который возможно замещен одним или более чем одним метилом, галогеном, CF3, метокси), CN, C1-6алкокси, C3-8циклоалкилокси, CONH(C3-8циклоалкил), адамантилом или (возможно бензоконденсированным) гетероарилокси (который возможно замещен одним или более чем одним метилом, =O).
10. Вещество по любому из пп.1-9, где кольцо "Ar" представляет собой группу формулы
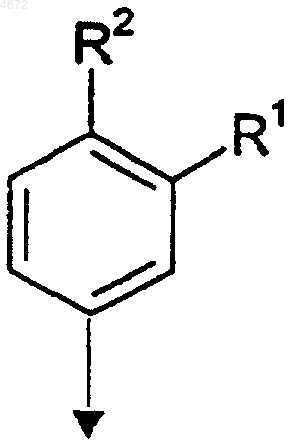
11. Вещество по любому из пп.1-10, где R3 представляет собой H, CH3, C2H5, изо-C3H7, н-C3H7 или CH2OCH3.
12. Вещество по любому из пп.1-4 и 6-11, где R1 представляет собой OH, I, Cl, NH2, возможно бензоконденсированный гетероарил, NHSO2Y1 или NHCO2Y1.
13. Вещество по любому из пп.1-12, где R4 представляет собой н-гексил, 3-фенилпропил, 3-фенилоксипропил, 3-циклогексилпропил, 5-метилгексил, 2-фенилоксиэтшы, (4-цианометил)бензил, 2-циклогексилоксиэтил, 2-бензилоксиэтил, 3-циклогексилпроп-2-ен-1-ил, 2-(циклогексилкарбонил)этил, 3-(2-метилфенил)пропил, 3-фенилпроп-2-ен-1-ил, 2-(индол-3-ил)этил, 3-циклогексил-3-гидроксипропил, (индан-2-ил)метил, 3-(4-фторфенил)пропил, 3-(тиен-2-ил) пропил, 3-(тиен-3-ил)пропил, 3-(пирид-2-ил)пропил, 3-(3-метилтиен-2-ил)пропил, 3-(тиен-2-ил)проп-2-ен-1-ил, 3-(тиен-3-ил)проп-2-ен-1-ил, 3-(пирид-2-ил)проп-2-ен-1-ил, 3-(3-метилтиен-2-ил)проп-2-ен-1-ил, 3-(3-метилпирид-2-ил) проп-2-ен-1-ил или 3-(2-метоксифенил)пропил.
14. Вещество по любому из пп.1, 2, 5-11 и 13, где R1 и R2, взятые вместе с атомами углерода, к которым они присоединены, представляют собой 5-членную гетероарильную группировку, возможно замещенную C1-4галогеноалкилом.
15. Вещество по любому из пп.1-14, где R3 представляет собой CH3 или C2H5.
16. Вещество по любому из пп.1-4, 6-13 и 15, где R1, взятый в отдельности, представляет собой OH, I, Cl, NH2, 1,2,3-триазолил, 1,2,4-триазолил, имидазол-2-ил, пиридин-2-ил, тиен-2-ил, имидазол-4-ил, бензимидазол-2-ил, NHSO2 (C1-6алкил), NHSO2(C1-6алкил, замещенный метокси, CONH2, OH, CO2(C2-6алкил), фталимидо, NH2 или галогеном), NHSO2NH2, NHSO2NH(C1-6алкил), NHSO2N(C1-6алкил)2, NHCO(C1-6алкил) или NHCO2(C1-6алкил).
17. Вещество по п.16, где R1 представляет собой OH, NHSO2CH3, NHSO2C2H5, NHSO2(н-C3H7), NHSO2(изо-C3H7), NHSO2(н-C4H7), NHSO2 NH(изо-C3H7), NHSO2(N-метилимидазол-4-ил), NHSO2(CH2)2OCH3, NHSO2(CH2)2OH, 1,2,4-триазолил или имидазол-2-ил.
18. Вещество по п.17, где R1 представляет собой OH, NHSO2CH3, NHSO2C2H5 или имидазол-2-ил.
19. Вещество по п.14, где R1 и R2, взятые вместе с атомами углерода, к которым они присоединены, представляют собой имидазольную группу, возможно 2-замещенную CF3.
20. Вещество по любому из пп.1-19, где R4 представляет собой н-гексил, 3-фенилпропил, (4-цианометил)бензил, 2-бензилоксиэтил, 3-циклогексилпроп-2-ен-1-ил, 2-(индол-3-ил)этил, 3-(2-метилфенил)пропил, 3-(4-фторфенил)пропил, 3-(пирид-2-ил)пропил, 3-фенилпроп-2-ен-1-ил, 3-циклогексил-3-гидроксипропил, 3-(тиен-2-ил) пропил, 3-(тиен-3-ил)пропил, 3-(3-метилтиен-2-ил)пропил, 3-(тиен-2-ил)проп-2-ен-1-ил, 3-(тиен-3-ил)проп-2-ен-1-ил, 3-(пирид-2-ил)проп-2-ен-1-ил, 3-(3-метилтиен-2-ил)проп-2-ен-1-ил, 3-(6-метилпирид-2-ил)проп-2-ен-1-ил или 3-(2-метоксифенил)пропил.
21. Вещество по п.1, которое имеет следующую относительную стереохимическую конфигурацию:
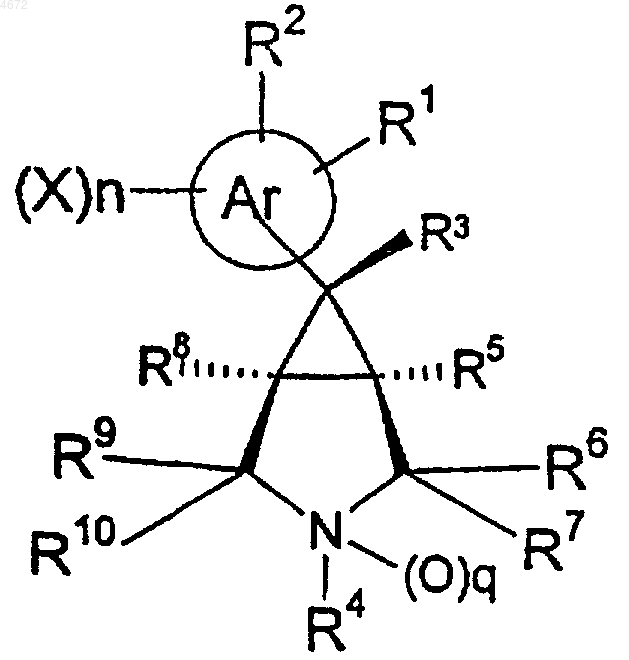
22. Соединение по п.1, выбранное из
(1) N-{3-[6-метил-3-(3-фенилпропил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(2) соли ацетат N-{3-[6-метил-3-(3-фенилпропил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(3) N-{3-[6-метил-3-(3-фенилпропил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}-1-этансульфонамида;
(4) N-{3-[3-(3-циклогексилпропил)-6-метил-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(5) N-{3-[3-(3-циклогексилпропил)-6-метил-3-азабицикло[3.1.0]гекс-6-ил]фенил}-1-этансульфонамида;
(6) N-[3-(3-гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)фенил]метансульфонамида;
(7) N-[3-(3-гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)фенил]-1-этансульфонамида;
(8) N-[3-(3-гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)фенил]-1-пропансульфонамида;
(9) N-[3-(3-гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)фенил]-3-пиридинсульфонамида;
(10) соли ацетат N-{3-[6-этил-3-(3-фенилпропил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(11) соли ацетат N-{3-[6-этил-3-(3-фенилпропил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}-1-этансульфонамида;
(12) N-[3-(6-этил-3-гексил-3-азабицикло [3.1.0]гекс-6-ил)фенил]метансульфонамида;
(13) N-[3-(6-этил-3-гексил-3-азабицикло [3.1.0]гекс-6-ил)фенил]-1-этансульфонамида;
(14) N-[3-(3-{3-фенилпропил}-3-азабицикло[3.1.0]гекс-6-ил)фенил]метансульфонамида;
(15) 3-гексил-6-фенил-3-азабицикло[3.1.0] гексана;
(16) соли ацетат N-{3-[6-метил-3-(3-фенилпропил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}бензолсульфонамида;
(17) соли ацетат N,N-диметил-N'-{3-[6-метил-3-(3-фенилпропил)-3-азабицикло[3.1.0] гекс-6-ил]фенил}сульфамида;
(18) соли ацетат N-{3-[6-метил-3-(3-фенилпропил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}пропансульфонамида;
(19) соли ацетат N-{3-[6-метил-3-(3-фенилпропил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}-3,5-диметил-4-изоксазолсульфонамида;
(20) N-{3-[6-метил-3-(3-фенилпропил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}-2-метокси-1-этансульфонамида;
(21) соли ацетат N-{3-[6-метил-3-(3-фенилпропил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}(фенил)метансульфонамида;
(22) N-[3-(3-бензил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)фенил]метансульфонамида;
(23) 6-метил-3-(3-фенилпропил)-6-[3-(1H-1,2,3-триазол-5-ил)фенил]-3-азабицикло[3.1.0]гексана;
(24) 3-гексил-6-метил-6-[3-(1H-1,2,3-триазол-5-ил)фенил]-3-азабицикло[3.1.0]гексана;
(25) 3-гексил-6-метил-6-[3-(4H-1,2,4-триазол-3-ил)фенил]-3-азабицикло[3.1.0]гексана;
(26) 3-гексил-6-[3-(1H-имидазол-2-ил)фенил]-6-метил-3-азабицикло[3.1.0]гексана;
(27) 5-(3-гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)-1H-бензимидазола;
(28) 5-(3-гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)-2-(трифторметил)-1H-бензимидазола;
(29) N-[3-(3-гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)фенил]-2-метилбензолсульфонамида;
(30) 2-хлор-N-[3-(3-гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)фенил]бензолсульфонамида;
(31) 4-хлор-N-[3-(3-гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)фенил]бензолсульфонамида;
(32) N-[3-(3-гексил-6-метил-3-азабицикло [3.1.0]гекс-6-ил)фенил]-N'-изопропилсульфамида;
(33) N-[3-(3-гексил-6-метил-3-азабицикло [3.1.0]гекс-6-ил)фенил]-1-бутансульфонамида;
(34) N-[3-(3-гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)фенил]-1-метил-1H-имидазол-4-сульфонамида;
(35) N-[3-(3-гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)фенил]-2,1,3-бензоксадиазол-4-сульфонамида;
(36) N-{3-[6-метил-3-(5-метилгексил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(37) N-[3-(6-метил-3-фенетил-3-азабицикло[3.1.0]гекс-6-ил)фенил]метансульфонамида;
(38) N-{3-[6-метил-3-(2-феноксиэтил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(39) 2-{[3-(3-гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)анилино]сульфонил}ацетамида;
(40) N-[3-(3-гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)фенил]-2-метокси-1-этансульфонамида;
(41) этилового эфира 2-{[3-(3-гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)анилино]сульфонил}уксусной кислоты;
(42) N-[3-(3-гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)фенил]-2-пропансульфонамида;
(43) N-{3-[3-(5-цианопентил)-6-метил-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(44) N-{3-[6-метил-3-(4,4,4-трифторбутил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(45) N-{3-[6-метил-3-(3-феноксипропил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(46) N-[3-(3-гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)фенил]-5-изохинолинсульфонамида;
(47) N-[3-(3-гексил-6-изопропил-3-азабицикло[3.1.0]гекс-6-ил)фенил]метансульфонамида;
(48) N-[3-(3-гексил-6-пропил-3-азабицикло[3.1.0]гекс-6-ил)фенил]метансульфонамида;
(49) 3-гексил-6-метил-6-[3-(2-пиридил)фенил]-3-азабицикло[3.1.0]гексана;
(50) 3-гексил-6-метил-6-[3-(2-тиенил)фенил]-3-азабицикло[3.1.0]гексана;
(51) 6-(3-хлорфенил)-3-гексил-6-метил-3-азабицикло[3.1.0]гексана;
(52) 3-гексил-6-[3-(1H-имидазол-5-ил)фенил]-6-метил-3-азабицикло[3.1.0]гексана;
(53) 3-бензил-6-метил-6-(3-пиридинил)-3-азабицикло[3.1.0]гексана;
(54) 3-гексил-6-метил-6-(3-пиридинил)-3-азабицикло[3.1.0]гексана;
(55) 6-метил-3-(3-фенилпропил)-6-(3-пиридинил)-3-азабицикло[3.1.0]гексана;
(56) N-[3-(3-аллил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)фенил]метансульфонамида;
N-[3-(3-гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)фенил]-2-гидрокси-1-этансульфонамида;
(58) N-{3-[3-(2-бутоксиэтил)-6-метил-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(59) N-{3-[6-метил-3-(3-метилфенетил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(60) N-(3-{3-[2-(4-фторфенокси)этил]-6-метил-3-азабицикло[3.1,0]гекс-6-ил}фенил)метансульфонамида;
(61) N-{3-[3-(5-гексенил)-6-метил-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(62) N-(3-{3-[4-(цианометил)бензил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(63) N-{3-[3-(4-фторфенетил)-6-метил-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(64) N-{3-[3-(2-хлорфенетил)-6-метил-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(65) N-(3-{3-[2-(2-хлорфенокси)этил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(66) N-(3-{6-метил-3-[2-(2-метилфенокси) этил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(67) N-(3-{3-[2-(циклогексилокси)этил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(68) N-(3-{3-[2-(бензилокси)этил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(69) N-(3-{3-[(E)-3-циклогексил-2-пропенил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(70) N-{3-[6-метил-3-(3,4,4-трифтор-3-бутенил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(71) N-{3-[6-метил-3-(3-фенил-2-пропинил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(72) 2-[3-(3-гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)фенил]-1H-бензимидазола;
(73) 2-(1,3-диоксо-1,3-2H-изоиндол-2-ил)-N-[3-(3-гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)фенил]-1-этансульфонамида;
(74) 2-амино-N-[3-(3-гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)фенил]-1-этансульфонамида;
(75) N-[3-(3-гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)фенил]сульфамида;
(76) 3-(3-гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)фенола;
(77) трифтор-N-[3-(3-гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)фенил]метансульфонамида;
(78) 2,2,2-трифтор-N-[3-(3-гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)фенил]-1-этансульфонамида;
(79) 3-[6-метил-3-(3-фенилпропил)-3-азабицикло[3.1.0]гекс-6-ил]фенола;
(80) N-(3-{6-метил-3-[3-(3-метилфенил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(81) N-{3-[3-(4-этилбензил)-6-метил-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(82) N-(3-{3-[(E)-2-гексенил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(83) N-циклогексил-2-(6-метил-6-{3-[(метилсульфонил)амино]фенил}-3-азабицикло[3.1.0]гекс-6-ил)ацетамида;
(84) N-{3-[3-(3-циклогексил-3-оксопропил)-6-метил-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(85) N-(3-{3-[2-(1-адамантил)этил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(86) 6-(3-йодфенил)-6-метил-3-(3-фенилпропил)-3-азабицикло[3.1.0]гексана;
(87) 3-[6-метил-3-(3-фенилпропил)-3-азабицикло[3.1.0]гекс-6-ил]бензонитрила;
(88) N-{3-[3-(3-гидроксипропил)-6-метил-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(89) N-(3-{6-метил-3-[(E)-3-фенил-2-пропенил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(90) N-{3-[3-(3-циклогексил-3-гидроксипропил)-6-метил-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(91) экзо-N-{3-[3-гексил-6-(гидроксиметил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(92) экзо-N-{3-[3-гексил-6-(метоксиметил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(93) N-{3-[3-гексил-6-(2,2,2-трифторэтил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(94) экзо-N-[3-(6-циано-3-гексил-3-азабицикло[3.1.0]гекс-6-ил)фенил]метансульфонамида;
(95) N-[3-гексил-6-{3-[(метилсульфонил)амино]фенил}-3-азабицикло[3.1.0]гекс-6-ил]метилацетамида;
(96) {6-[3-(ацетиламино)фенил]-3-гексил-3-азабицикло[3.1.0]гекс-6-ил}метилацетата;
(97) N-(3-{3-[2-(1H-индол-3-ил)этил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(98) N-(3-{6-метил-3-[4-(трифторметил)фенетил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(99) N-{3-[3-(2,3-дигидро-1H-инден-2-илметил)-6-метил-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(100) N-(3-{3-[2-(1-бензотиофен-3-ил)этил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(101) N-(3-{6-метил-3-[2-(1-метил-1H-индол-3-ил)этил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(102) N-(3-{3-[3-(4-фторфенил)пропил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(103) N-(3-{3-[3-(3,4-дихлорфенил)пропил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(104) N-(3-{3-[3-(1,3-бензодиоксол-5-ил)пропил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(105) N-(3-{3-[2-(5-хлор-3-тиенил)этил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(106) N-{3-[6-метил-3-(3-метил-3-фенилбутил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(107) N-(3-{3-[3-(1H-индол-3-ил)пропил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(108) N-(3-{6-метил-3-[3-(4-пиридинил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(109) N-(3-{6-метил-3-[2-(2-нафтил)этил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(110) N-[3-(6-метил-3-{4-[(метилсульфонил)амино]фенетил}-3-азабицикло[3.1.0]гекс-6-ил)фенил]метансульфонамида;
(111) N-[2,4-дихлор-5-(3-гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)фенил]метансульфонамида;
(112) N-[2,4-дихлор-3-(3-гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)фенил]метансульфонамида;
(113) N-(3-{6-метил-3-[3-(2-тиенил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(114) N-(3-{6-метил-3-[3-(3-тиенил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(115) (3-гексил-6-{3-[(метоксикарбонил)амино]фенил}-3-азабицикло[3.1.0]гекс-6-ил)метилметилкарбоната;
(116) N-{3-[3-(1-бензофуран-2-илметил)-6-метил-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(117) N-(3-{3-[3-(5-фтор-3-метил-1H-индол-2-ил)пропил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(118) N-(3-{6-метил-3-[3-(2-пиридинил)пропил]-3-азабицикло[3.1.0]гекс-8-ил}фенил)метансульфонамида;
(119) N-(3-{6-метил-3-[3-(3-метил-2-тиенил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(120) N-(3-{3-[3-(4-метоксифенил)пропил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(121) N-(3-{3-[3-(2-хлорфенил)пропил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)ме-
тансульфонамида;
(122) N-(3-{6-метил-3-[(E)-3-(3-тиенил)-2-пропенил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(123) N-(3-{6-метил-3-[(E)-3-(2-тиенил)-2-пропенил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(124) N-(3-{6-метил-3-[(E)-3-(3-метил-2-тиенил)-2-пропенил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(125) N-(2-{3-гексил-6-метил-3-азабицикло [3.1.0]гекс-6-ил}фенил)метансульфонамида;
(126) соли гидрохлорид N-(3-{6-метил-3-(3-фенилпропил)-3-азабицикло[3.1.0]гекс-6-ил} фенил)метансульфонамида;
(127) соли бензолсульфонат N-(3-{6-метил-3-(3-фенилпропил)-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(128) соли паратолуолсульфонат N-(3-{6-метил-3-(3-фенилпропил)-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(129) соли L-тартрат N-(3-{6-метил-3-(3-фенилпропил)-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(130) соли сукциэрт N-(3-{6-метил-3-(3-фенилпропил)-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(136) N-(3-{6-метил-3-[(E)-3-(2-пиридинил)-2-пропенил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(137) N-(3-{6-метил-3-[(E)-3-(2-хинолинил)-2-пропенил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(138) N-(3-{3-[3-(1,3-бензотиазол-2-ил)пропил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(139) N-(3-{6-метил-3-[(E)-3-(6-метил-2-пиридинил)-2-пропенил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(140) N-[3-(6-метил-3-{(E)-3-[2-(трифторметил)фенил]-2-пропенил}-3-азабицикло[3.1.0]гекс-6-ил)фенил]метансульфонамида;
(141) N-(3-{3-[3-(2,6-дихлорфенил)пропил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(142) N-{3-[6-метил-3-(4-фенилбутил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(143) N-(3-{3-[3-(2-метоксифенил)пропил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида и
(144) N-{3-[3-(1-бензотиофен-2-илметил)-6-метил-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида и их солей.
23. Соединение по п.22, выбранное из
(1) N-{3-[6-метил-3-(3-фенилпропил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(5) N-{3-[3-(3-циклогексилпропил)-6-метил-3-азабицикло[3.1.0]гекс-6-ил]фенил}-1-этансульфонамида;
(6) N-[3-(3-гексил-6-метил-3-азабицикло [3.1.0]гекс-6-ил)фенил]метансульфонамида;
(10) N-{3-[6-этил-3-(3-фенилпропил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}-1-метансульфонамида;
(11) N-{3-[6-этил-3-(3-фенилпропил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}-1-этансульфо-
намида;
(12) N-[3-(6-этил-3-гексил-3-азабицикло [3.1.0]гекс-6-ил)фенил]метансульфонамида;
(13) N-[3-(6-этил-3-гексил-3-азабицикло [3.1.0]гекс-6-ил)фенил]-1-этансульфонамида;
(18) N-{3-[6-метил-3-(3-фенилпропил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}пропансульфонамида;
(20) N-{3-[6-метил-3-(3-фенилпропил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}-2-метокси-1-этансульфонамида;
(25) 3-гексил-6-метил-6-[3-(4H-1,2,4-триазол-3-ил)фенил]-3-азабицикло[3.1.0]гексана;
(26) 3-гексил-6-[3-(1H-имидазол-2-ил)фенил]-6-метил-3-азабицикло[3.1.0]гексана;
(27) 5-(3-гексил-6-метил-3-азабицикло [3.1.0]гекс-6-ил)-1H-бензимидазола;
(28) 5-(3-гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)-2-(трифторметил)-1H-бензимидазола;
(32) N-[3-(3-гексил-6-метил-3-азабицикло [3.1.0]гекс-6-ил)фенил]-N'-изопропилсульфамида;
(33) N-[3-(3-гексил-6-метил-3-азабицикло [3.1.0]гекс-6-ил)фенил]-1-бутансульфонамида;
(34) N-[3-(3-гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)фенил]-1-метил-1H-имидазол-4-сульфонамида;
(36) N-{3-[6-метил-3-(5-метилгексил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(38) N-{3-[6-метил-3-(2-феноксиэтил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(40) N-[3-(3-гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)фенил]-2-метокси-1-этансульфонамида;
(42) N-[3-(3-гексил-6-метил-3-азабицикло [3.1.0]гекс-6-ил)фенил]-2-пропансульфонамида;
(45) N-{3-[6-метил-3-(3-феноксипропил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(47) N-[3-(3-гексил-6-изопропил-3-азабицикло[3.1.0]гекс-6-ил)фенил]метансульфонамида;
(48) N-[3-(3-гексил-6-пропил-3-азабицикло [3.1.0]гекс-6-ил)фенил]метансульфонамида;
N-[3-(3-гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)фенил]-2-гидрокси-1-этансульфонамида;
(62) N-(3-{3-[4-(цианометил)бензил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(67) N-(3-{3-[2-(циклогексилокси)этил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(68) N-(3-{3-[2-(бензилокси)этил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(69) N-(3-{3-[(E)-3-циклогексил-2-пропенил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(76) 3-(3-гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)фенола;
(79) 3-[6-метил-3-(3-фенилпропил)-3-азабицикло[3.1.0]гекс-6-ил]фенола;
(80) N-(3-{6-метил-3-[3-(3-метилфенил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(84) N-{3-[3-(3-циклогексил-3-оксопропил)-6-метил-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(88) N-{3-[3-(3-гидроксипропил)-6-метил-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(90) N-{3-[3-(3-циклогексил-3-гидроксипропил)-6-метил-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(92) экзо-N-{3-[3-гексил-6-(метоксиметил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(97) N-(3-{3-[2-(1H-индол-3-ил)этил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(99) N-{3-[3-(2,3-дигидро-1H-инден-2-илметил)-6-метил-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(102) N-(3-{3-[3-(4-фторфенил)пропил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(113) N-(3-{6-метил-3-[3-(2-тиенил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(114) N-(3-{6-метил-3-[3-(3-тиенил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(118) N-(3-{6-метил-3-[3-(2-пиридинил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(119) N-(3-{6-метил-3-[3-(3-метил-2-тиенил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(122) N-(3-{6-метил-3-[(E)-3-(3-тиенил)-2-пропенил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(123) N-(3-{6-метил-3-[(E)-3-(2-тиенил)-2-пропенил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(124) N-(3-{6-метил-3-[(E)-3-(3-метил-2-тиенил)-2-пропенил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(136) N-(3-{6-метил-3-[(E)-3-(2-пиридинил)-2-пропенил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(139) N-(3-{6-метил-3-[(E)-3-(6-метил-2-пиридинил)-2-пропенил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида и
(143) N-(3-{3-[3-(2-метоксифенил)пропил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида
и их солей.
24. Соединение по п.23, выбранное из
(1) N-{3-[6-метил-3-(3-фенилпропил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(5) N-{3-[3-(3-циклогексилпропил)-6-метил-3-азабицикло[3.1.0]гекс-6-ил]фенил}-1-этансульфонамида;
(10) N-{3-[6-этил-3-(3-фенилпропил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(12) N-[3-(6-этил-3-гексил-3-азабицикло [3.1.0]гекс-6-ил)фенил]метансульфонамида;
(13) N-[3-(6-этил-3-гексил-3-азабицикло [3.1.0]гекс-6-ил)фенил]-1-этансульфонамида;
(26) 3-гексил-6-[3-(1H-имидазол-2-ил)фенил]-6-метил-3-азабицикло[3.1.0]гексана;
(28) 5-(3-гексил-6-метил-3-азабицикло [3.1.0]гекс-6-ил)-2-(трифторметил)-1H-бензимидазола;
(36) N-{3-[6-метил-3-(5-метилгексил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(40) N-[3-(3-гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)фенил]-2-метокси-1-этансульфонамида;
(45) N-{3-[6-метил-3-(3-феноксипропил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(47) N-[3-(3-гексил-6-изопропил-3-азабицикло[3.1.0]гекс-6-ил)фенил]метансульфонамида;
(48) N-[3-(3-гексил-6-пропил-3-азабицикло [3.1.0]гекс-6-ил)фенил]метансульфонамида;
(62) N-(3-{3-[4-(цианометил)бензил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(68) N-(3-{3-[2-(бензилокси)этил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(69) N-(3-{3-[(E)-3-циклогексил-2-пропенил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(79) 3-[6-метил-3-(3-фенилпропил)-3-азабицикло[3.1.0]гекс-6-ил]фенола;
(80) N-(3-{6-метил-3-[3-(3-метилфенил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(84) N-{3-[3-(3-циклогексил-3-оксопропил)-6-метил-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(88) N-{3-[3-(3-гидроксипропил)-6-метил-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(90) N-{3-[3-(3-циклогексил-3-гидроксипропил)-6-метил-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(97) N-(3-{3-[2-(1H-индол-3-ил)этил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(99) N-{3-[3-(2,3-дигидро-1H-инден-2-илметил)-6-метил-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(102) N-(3-{3-[3-(4-фторфенил)пропил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(113) N-(3-{6-метил-3-[3-(2-тиенил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(114) N-(3-{6-метил-3-[3-(3-тиенил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(118) N-(3-{6-метил-3-[3-(2-пиридинил) пропил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(119) N-(3-{6-метил-3-[3-(3-метил-2-тиенил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(122) N-(3-{6-метил-3-[(E)-3-(3-тиенил)-2-пропенил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(123) N-(3-{6-метил-3-[(E)-3-(2-тиенил)-2-пропенил]-3-азабицикло[3.1.0]гекс-6-ил}фенил) метансульфонамида;
(124) N-(3-{6-метил-3-[(E)-3-(3-метил-2-тиенил)-2-пропенил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(136) N-(3-{6-метил-3-[(E)-3-(2-пиридинил)-2-пропенил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(139) N-(3-{6-метил-3-[(E)-3-(6-метил-2-пиридинил)-2-пропенил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида и
(143) N-(3-{3-[3-(2-метоксифенил)пропил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида
и их солей.
25. Соединение по п.24, выбранное из
(1) N-{3-[6-метил-3-(3-фенилпропил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(10) N-{3-[6-этил-3-(3-фенилпропил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(12) N-[3-(6-этил-3-гексил-3-азабицикло[3.1.0]гекс-6-ил)фенил]метансульфонамида;
(13) N-[3-(6-этил-3-гексил-3-азабицикло[3.1.0]гекс-6-ил]фенил}-1-этансульфонамида;
(26) 3-гексил-6-[3-(1H-имидазол-2-ил)фенил]-6-метил-3-азабицикло[3.1.0]гексана;
(28) 5-(3-гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)-2-(трифторметил)-1H-бензимидазола;
(62) N-(3-{3-[4-(цианометил)бензил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(68) N-(3-{3-[2-(бензилокси)этил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(69) N-(3-{3-[(E)-3-циклогексил-2-пропенил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(79) 3-[6-метил-3-(3-фенилпропил)-3-азабицикло[3.1.0]гекс-6-ил]фенола;
(80) N-(3-{6-метил-3-[3-(3-метилфенил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(84) N-{3-[3-(3-циклогексил-3-оксопропил)-6-метил-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(88) N-{3-[3-(3-гидроксипропил)-6-метил-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(90) N-{3-[3-(3-циклогексил-3-гидроксипропил)-6-метил-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(97) N-(3-{3-[2-(1H-индол-3-ил)этил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(102) N-(3-{3-[3-(4-фторфенил)пропил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(113) N-(3-{6-метил-3-[3-(2-тиенил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(114) N-(3-{6-метил-3-[3-(3-тиенил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(118) N-(3-{6-метил-3-[3-(2-пиридинил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(119) N-(3-{6-метил-3-[3-(3-метил-2-тиенил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(123) N-(3-{6-метил-3-[(E)-3-(2-тиенил)-2-пропенил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(124) N-(3-{6-метил-3-[(E)-3-(3-метил-2-тиенил)-2-пропенил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(136) N-(3-{6-метил-3-[(E)-3-(2-пиридинил)-2-пропенил]-3-азабииикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(139) N-(3-{6-метил-3-[(E)-3-(6-метил-2-пиридинил)-2-пропенил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(143) N-(3-{3-[3-(2-метоксифенил)пропил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида
и их солей.
26. Соединение по п.25, выбранное из
(1) N-{3-[6-метил-3-(3-фенилпропил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(10) N-{3-[6-этил-3-(3-фенилпропил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамида;
(26) 3-гексил-6-[3-(1H-имидазол-2-ил)фенил]-6-метил-3-азабицикло[3.1.0]гексана;
(79) 3-[6-метил-3-(3-фенилпропил)-3-азабицикло[3.1.0]гекс-6-ил]фенола;
(97) N-(3-{3-[2-(1H-индол-3-ил)этил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(102) N-(3-{3-[3-(4-фторфенил)пропил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(118) N-(3-{6-метил-3-[3-(2-пиридинил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида;
(139) N-(3-{6-метил-3-[(E)-3-(6-метил-2-пиридинил)-2-пропенил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида и
(143) N-(3-{3-[3-(2-метоксифенил)пропил]-6-метил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамида
и их солей.
27. Фармацевтическая или ветеринарная композиция, содержащая вещество по любому из пп.1-26 и фармацевтически или ветеринарно приемлемый носитель.
28. Применение вещества по любому из пп.1-26 в медицине.
29. Применение вещества по любому из пп.1-26 в производстве лекарства для лечения заболевания или состояния, опосредованного опиатными рецепторами.
30. Способ лечения состояния, опосредованного опиатным рецептором или рецепторами, при котором вводят терапевтически эффективное количество вещества по любому из пп.1-26.
31. Способ получения вещества по п.1, при котором
для соединений формулы I, где q равно 0, а R1 представляет собой NY2WY1, соединение формулы II
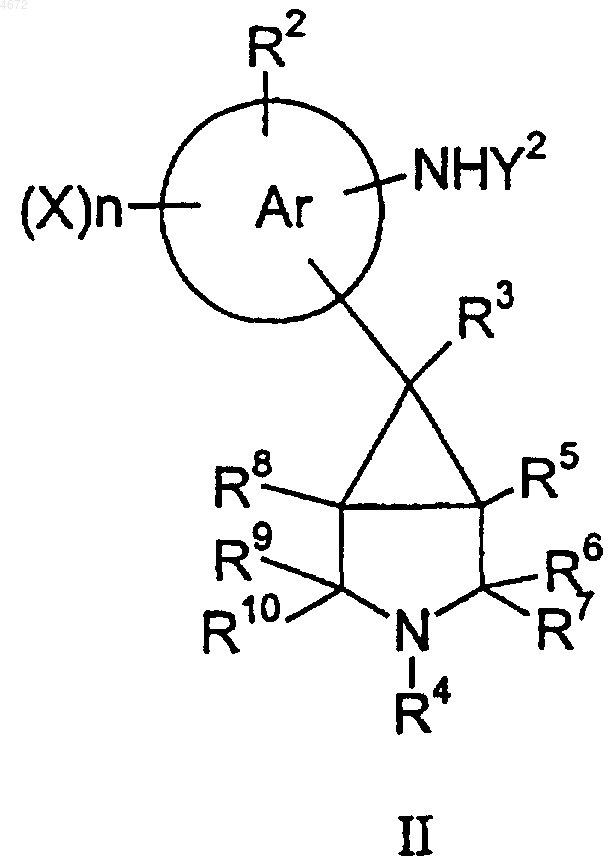
подвергают взаимодействию с соединением формулы III,
Z1-WY1 III,
где Z1 представляет собой подходящую уходящую группу, такую как галоген или Y1SO2O-, и при желании или при необходимости превращают полученное соединение формулы I в фармацевтически или ветеринарно приемлемое производное, или наоборот.
32. Способ получения вещества по п.1, при котором
для соединений формулы I, где q равно 0, а R6 и R7 оба представляют собой H, соединение формулы IV
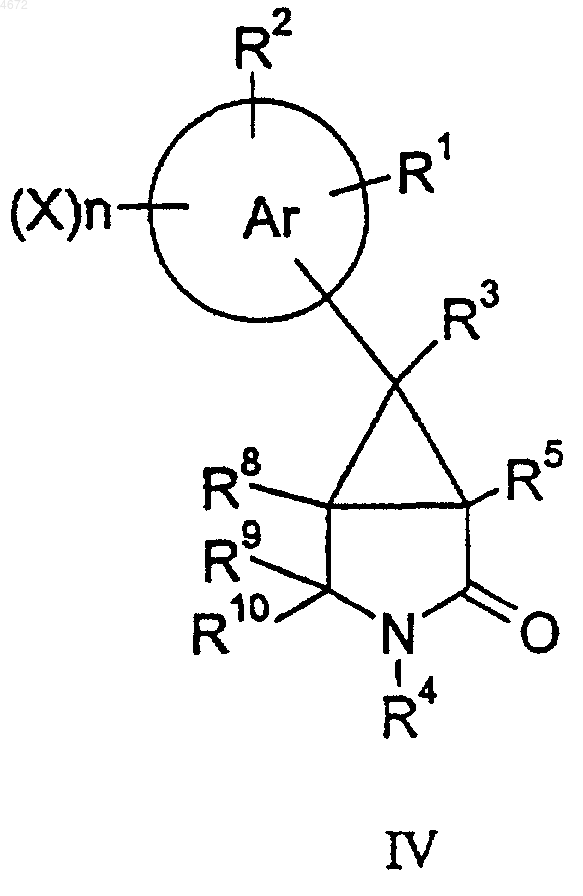
восстанавливают с использованием подходящего восстановителя и при желании или при необходимости превращают полученное соединение формулы I в фармацевтически или ветеринарно приемлемое производное, или наоборот.
33. Способ получения вещества по п.1, при котором
для соединений формулы I, где q равно 0, а R9 и R10 оба представляют собой H, соединение формулы V
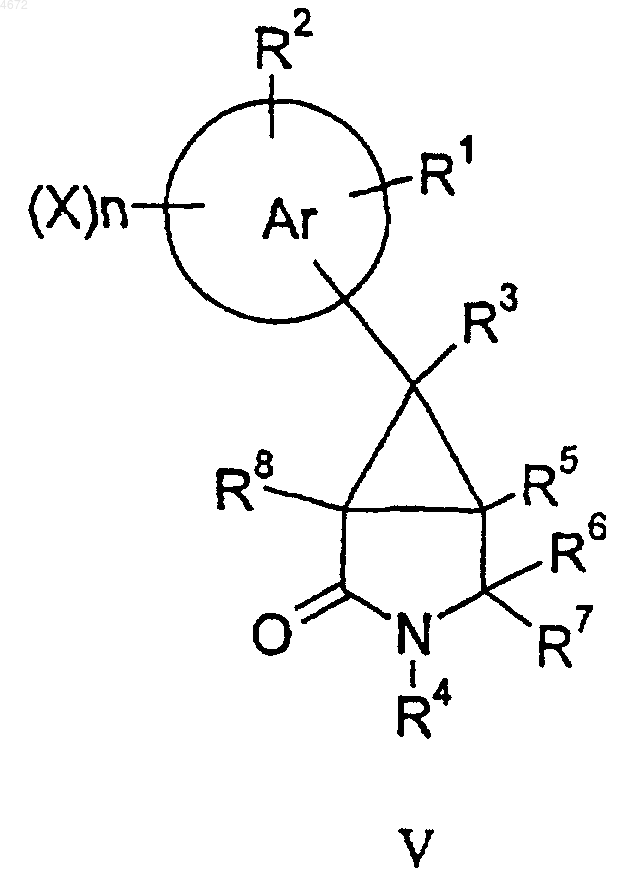
восстанавливают с использованием подходящего восстановителя и при желании или при необходимости превращают полученное соединение формулы I в фармацевтически или ветеринарно приемлемое производное, или наоборот.
34. Способ получения вещества по п.1, при котором
для соединений формулы I, где q равно 0, а R1 и R2 присоединены к соседним атомам углерода и взятые вместе с атомами углерода, к которым они присоединены, представляют собой Het1a, причем Het1a представляет собой имидазологруппу, соответствующее соединение формулы VI

подвергают взаимодействию с соединением формулы VII
RyCO2H VII,
где Ry представляет собой H или любой возможный заместитель на Het1a (как он определен выше), предпочтительно H или C1-4 галогеноалкил, и при желании или при необходимости превращают полученное соединение формулы I в фармацевтически или ветеринарно приемлемое производное, или наоборот.
35. Способ получения вещества по п.1, при котором
для соединений формулы I, гдх q равно 0, соединение формулы VIII
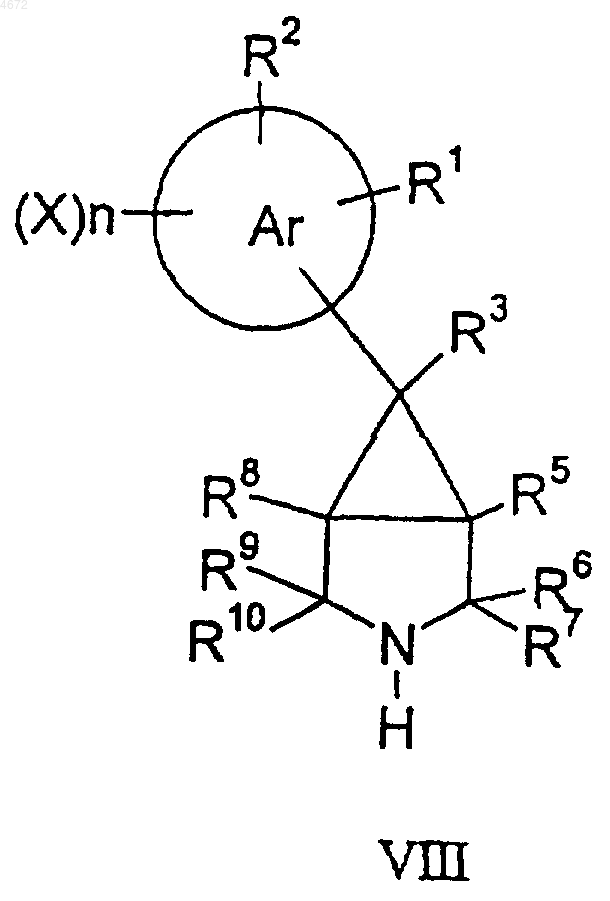
подвергают взаимодействию с соединением формулы IX
R4-Lg IX,
где Lg представляет собой уходящую группу и при желании или при необходимости превращают полученное соединение формулы I в фармацевтически или ветеринарно приемлемое производное, или наоборот.
36. Способ получения вещества по п.1, при котором
для соединений формулы I, где q равно 0, а R6, R7, R9 и R10 все представляют собой H, соединение формулы X
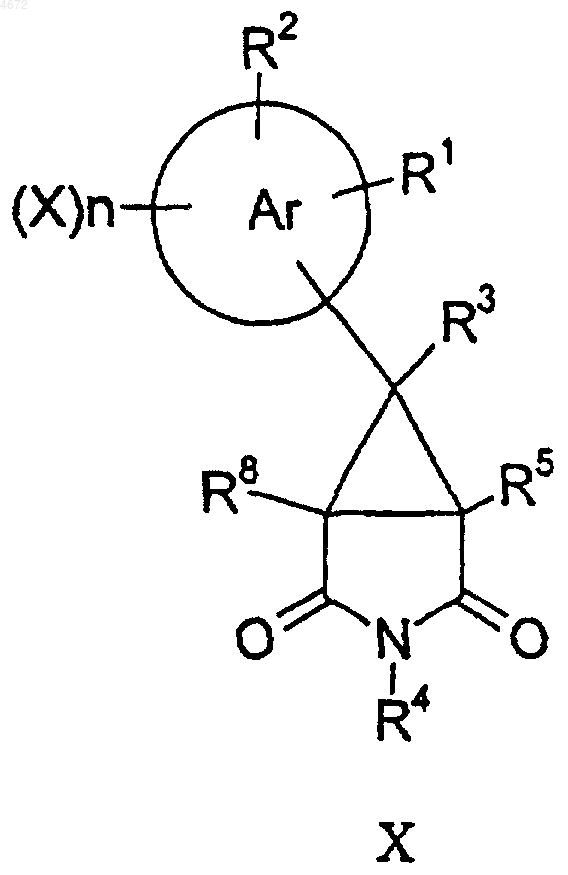
восстанавливают подходящим восстановителем и при желании или при необходимости превращают полученное соединение формулы I в фармацевтически или ветеринарно приемлемое производное, или наоборот.
37. Способ получения вещества по п.1, при котором
для соединений формулы I, где q равно 0, а R1 представляет собой OH, соединение формулы II, где Y2 представляет собой H, как определено выше, подвергают взаимодействию с фтороборной кислотой и изоамилнитритом и при желании или при необходимости превращают полученное соединение формулы I в фармацевтически или ветеринарно приемлемое производное, или наоборот.
38. Способ получения вещества по п.1, при котором
для соединений формулы I, где q равно 0, а R1 представляет собой Cl, соединение формулы II, где Y2 представляет собой H, как определено выше, подвергают взаимодействию с нитритом натрия в присутствии разбавленной кислоты, после чего осуществляют взаимодействие с хлоридом меди (I) в присутствии концентрированной кислоты и при желании или при необходимости превращают полученное соединение формулы I в фармацевтически или ветеринарно приемлемое производное, или наоборот.
39. Способ получения вещества по п.1, при котором
для соединений формулы I, где q равно 0, соответствующее соединение формулы XXXI
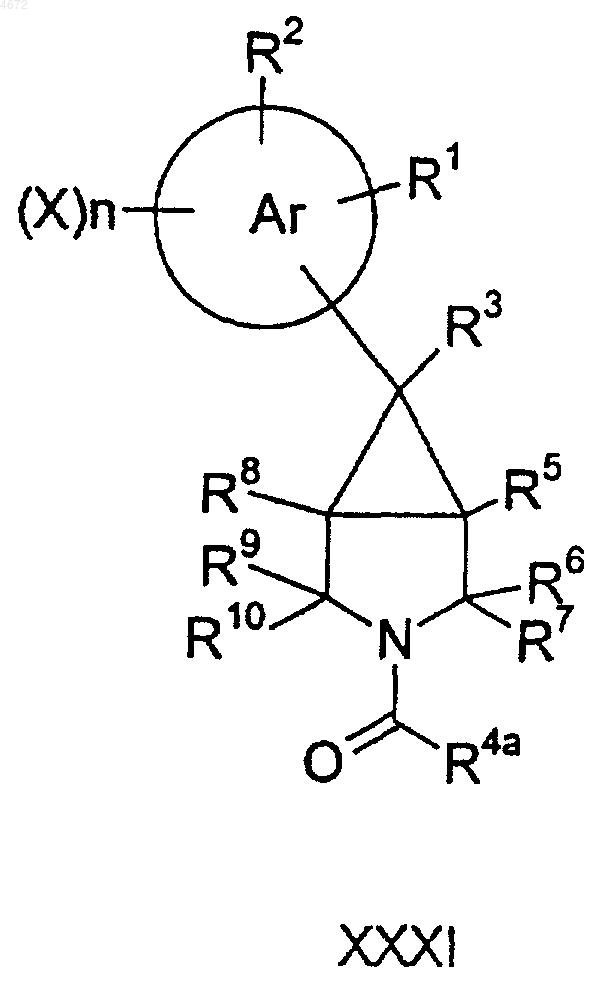
где R4aCH2 имеет такое же значение, как и R4, который определен выше, восстанавливают и при желании или при необходимости превращают полученное соединение формулы I в фармацевтически или ветеринарно приемлемое производное, или наоборот.
40. Соединение формулы II, как оно определено в п. 31.
41. Соединение формулы IV, как оно определено в п. 32.
42. Соединение формулы V, как оно определено в п. 33
43. Соединение формулы VI, как оно определено в п. 34.
44. Соединение формулы VIII, как оно определено в п. 35.
45. Соединение формулы X, как оно определено в п.36, при условии, что это соединение не является 3,6-диметил-6-фенилазабицикло [3.1.0]гексан-2,4-дионом.
46. Соединение формулы XI или XII
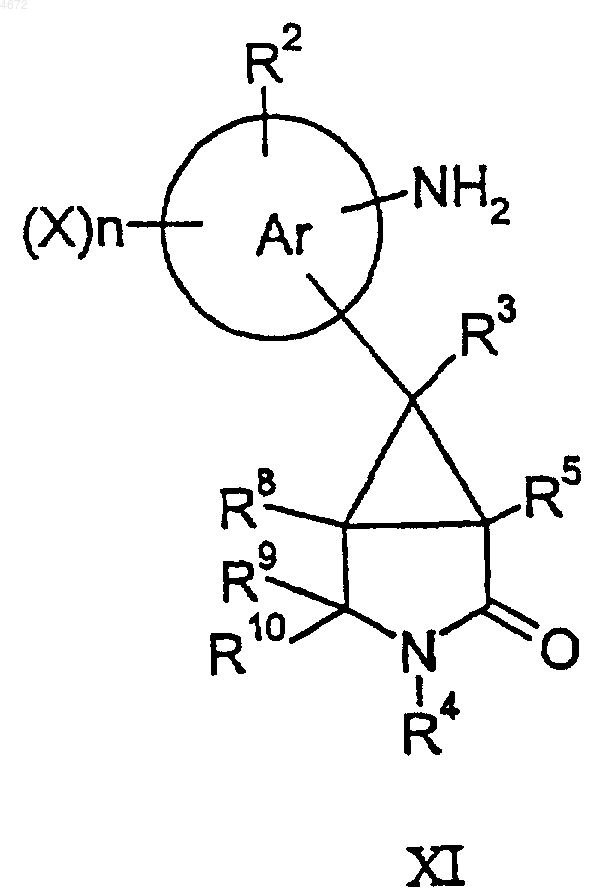
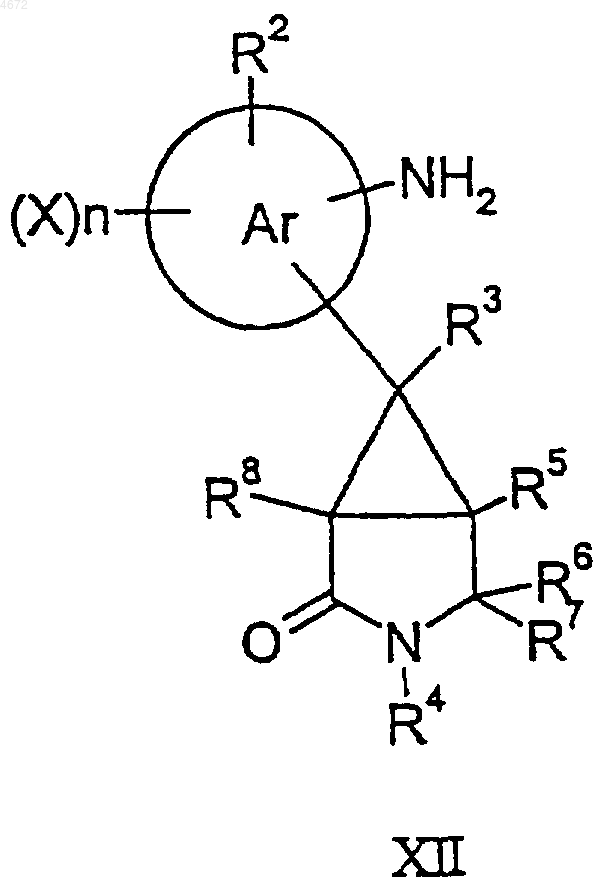
где заместители являются такими, как определено в п.1.
47. Соединение формулы XIII или XIV
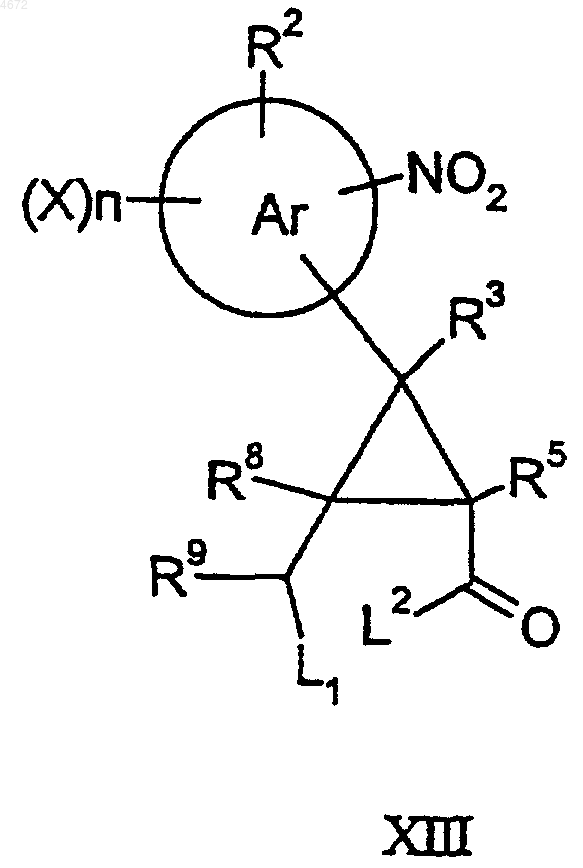
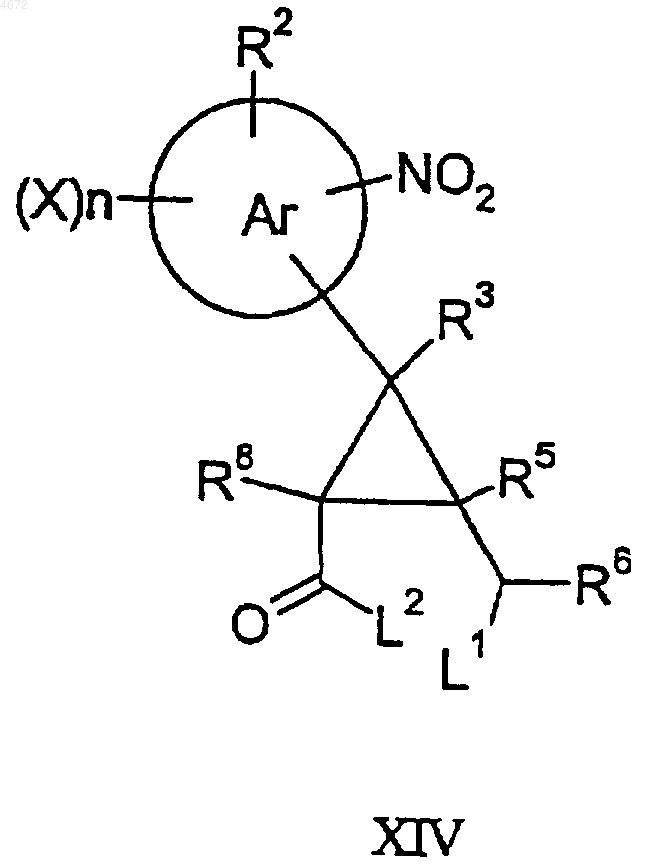
где L1 представляет собой уходящую группу [такую как галогено (например хлоро или бромо)], L2 представляет собой уходящую группу (такую как C1-3алкокси), а другие заместители являются такими, как определено в п.1.
48. Соединение формулы XXI или XXII,
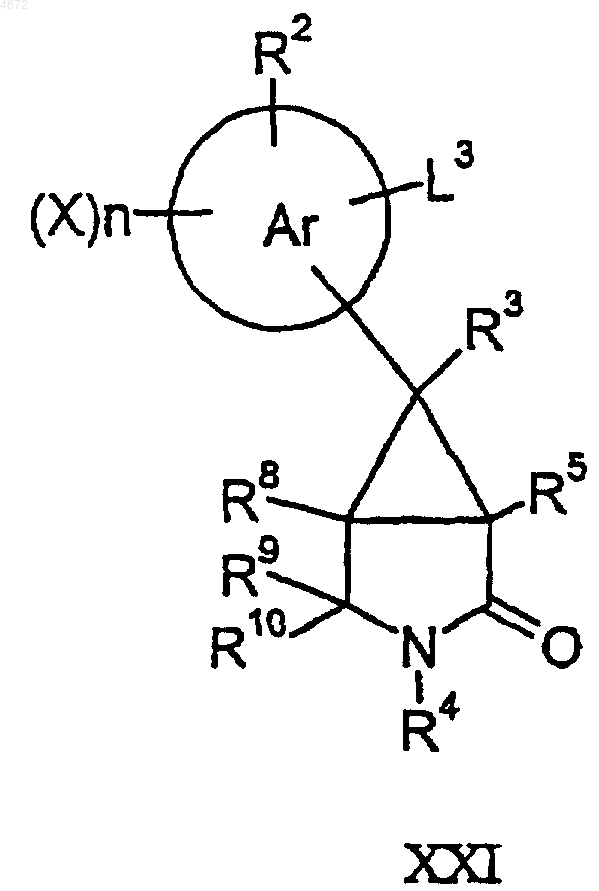
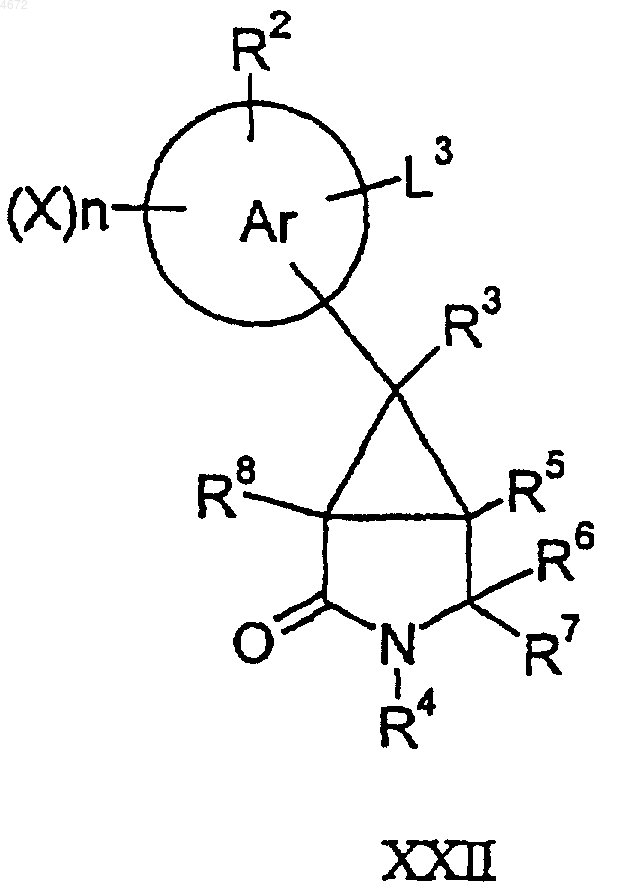
где L3 представляет собой группу, которая способна вступать в реакции превращения функциональных групп (например циано) с использованием стандартных методов замещения или превращения функциональных групп, а другие заместители являются такими, как определено в п.1.
49. Соединение формулы XXIII или XXIV
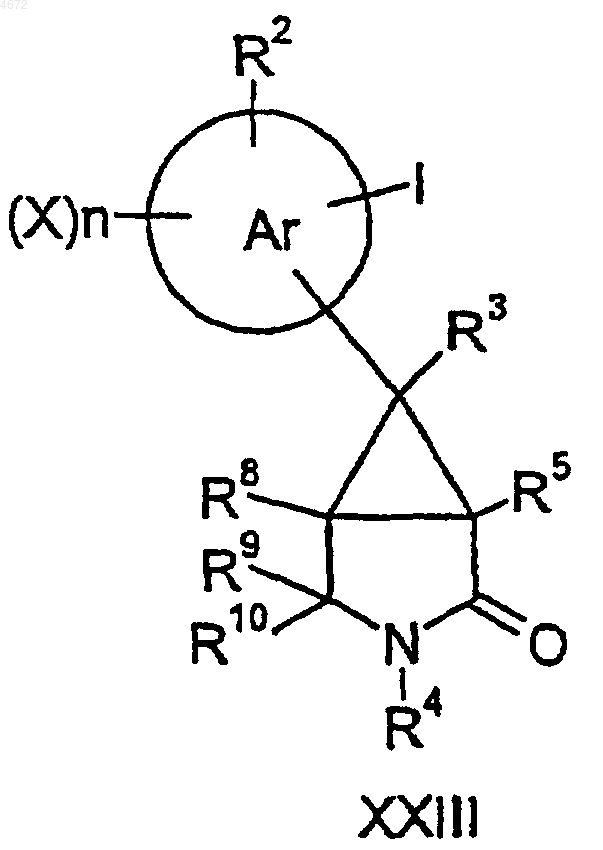
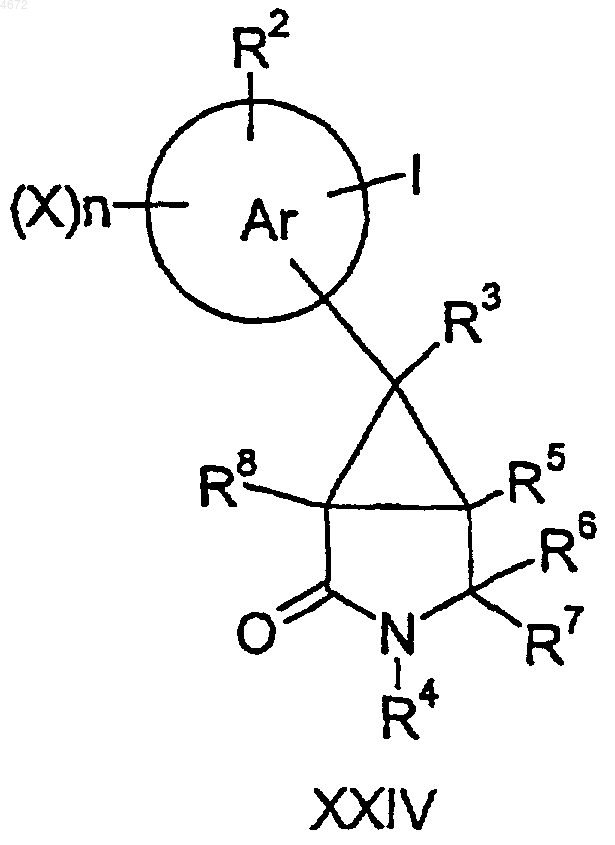
где заместители являются такими, как определено в п.1.
50. Соединение формулы XXV
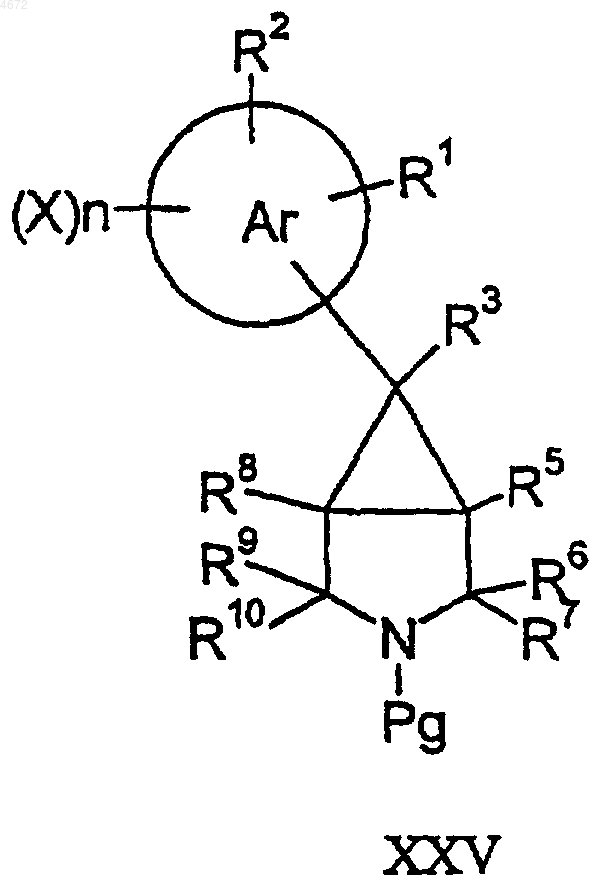
где Pg представляет собой защитную группу азота, а другие заместители являются такими, как определено в п.1.
51. Соединение формулы XXIXa
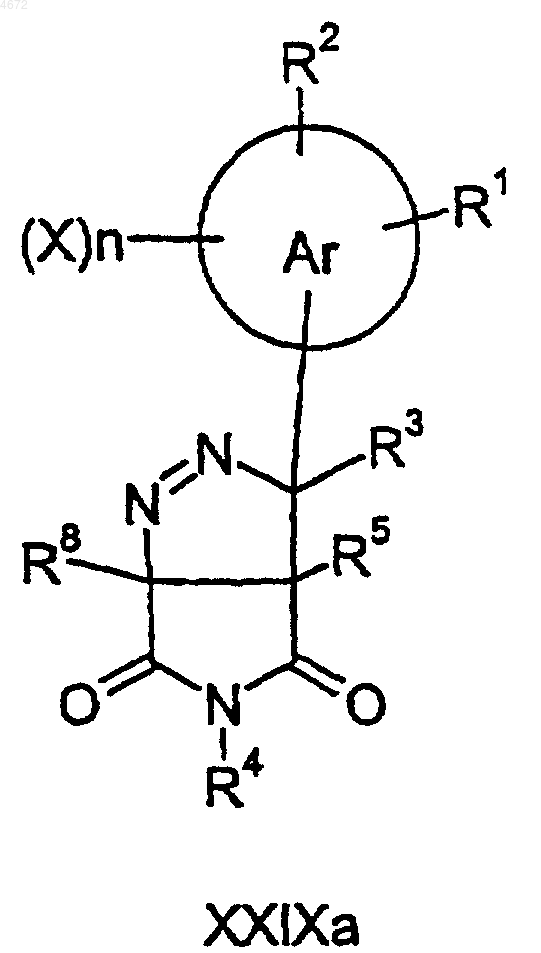
где заместители являются такими, как определено в п.1, при условии, что это соединение не является 1,6-диметил-6-фенил-6,7-дигидро-6H-пиразоло[5,4-c]сукцинимидом.
52. Соединение формулы XXX
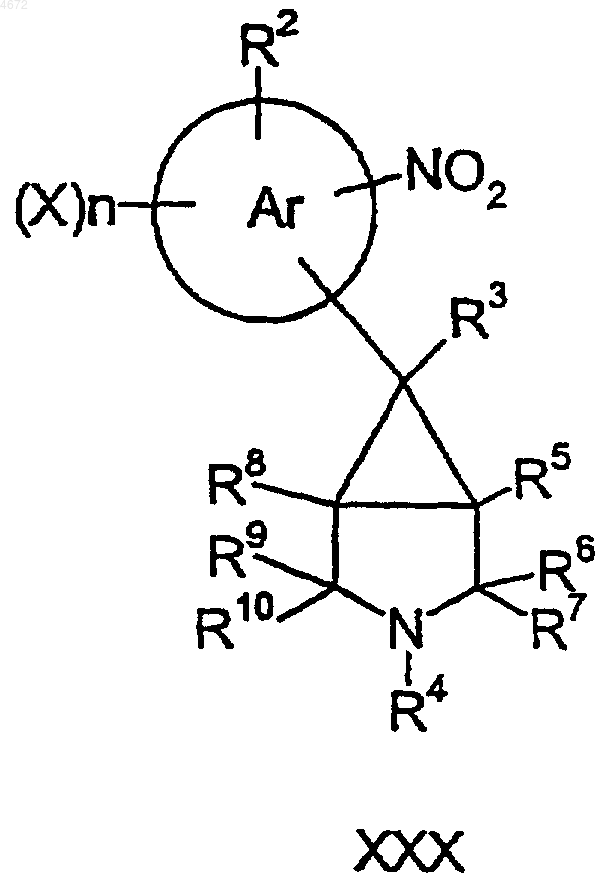
где заместители являются такими, как определено в п.1.
53. Соединение формулы XXXI, как оно определено в п.39.
Текст
1 Данное изобретение относится к фармацевтически полезным соединениям, в частности к соединениям, которые связываются с опиатными рецепторами (например с опиоидными рецепторами мю, дельта и каппа). Очевидно, что соединения, которые связываются с такими рецепторами, полезны в лечении заболеваний,модулируемых опиатными рецепторами, например синдрома раздраженного кишечника; констипации; тошноты; рвоты; и зудящих дерматозов, таких как аллергический дерматит и атопия, у животных и людей. Соединения, которые связываются с опиатными рецепторами,показаны также для лечения пищевых расстройств, передозировки опиатов, депрессии,пристрастия к курению и алкоголю, половой дисфункции, шока, удара, повреждения спинного мозга и травмы головы. Существует особая потребность в усовершенствовании лечения зуда. Зуд, или чесотка,является общим дерматологическим симптомом, который может вызывать значительный дистресс как у людей, так и у животных. Зуд часто связан с воспалительными кожными заболеваниями, которые могут быть вызваны реакциями повышенной чувствительности, включая реакции на укусы насекомых, такие как укусы блох, и на аллергены окружающей среды, такие как домашний пылевой клещ или пыльца; бактериальными или грибковыми инфекциями кожи; или эктопаразитарными инфекциями. Существующие терапии, которые используют в лечении зуда, включают в себя применение кортикостероидов и антигистаминных средств. Однако известно, что обе эти терапии имеют нежелательные побочные эффекты. Другие терапии, которые применяли, включают в себя применение диетических добавок незаменимых жирных кислот, хотя у них есть недостатки - они медленно действуют и обладают лишь ограниченной эффективностью против аллергических дерматитов. Используют также различные мягчительные средства, такие как мягкий парафин, глицерин и ланолин, но с ограниченным успехом. Таким образом, существует постоянная потребность в альтернативных и/или улучшенных терапиях зуда. Некоторые соединения на основе 4 арилпиперидина описаны, среди прочего, в Европейских патентных заявках ЕР 287339, ЕР 506468 в качестве антагонистов опиоидов. Кроме того, в Международной патентной заявкеWO 95/15327 раскрыты азабициклоалкановые производные, полезные в качестве нейролептических агентов. Согласно изобретению предложено вещество, которое представляет собой соединение формулы I, 004672 где кольцо Аr представляет собой фенил или 6-членное гетероарильное кольцо;R1, взятый в отдельности, представляет собой Н, галоген, NH2, NY2WY1, Het1 или ОЕ,Y2 представляет собой Н,W представляет собой SO2 или С(O)O,Y1 представляет собой C1-10 алкил (возможно замещенный одним или более чем одним заместителем, независимо выбранным из галогена, ОН, С 1-4 алкокси, СОNН 2, C1-6 алкоксикарбонила, NH2, арила или фталимидила), Het1,арил (возможно замещенный одним или более чем одним заместителем, независимо выбранным из С 1-4 алкила и галогена), NH2, N(С 1-6 алкил)2 или NH(C1-6 алкил),Het1 представляет собой гетероциклическую группу, содержащую до 4 гетероатомов,выбранных из N, О и S, которая может включать в себя до 3 колец (предпочтительно гетероарильную группу, возможно бензо- или пиридоконденсированный гетероарил), возможно замещенную одним или более чем одним C1-6 алкильным заместителем,и в случае, если атом S присутствует в кольце, он может присутствовать как часть -S-,S(O)- или -S(O2)- группы, а атомы углерода в кольце могут присутствовать как часть карбонильной группировки; Е представляет собой Н,R2, взятый в отдельности, представляет собой Н или галоген; или R1 и R2, когда они присоединены к соседним атомам углерода, могут быть взяты вместе с атомами углерода, к которым они присоединены, и могут представлять собой Het1a;Het1a представляет собой гетероциклическую группу, содержащую до 4 гетероатомов,выбранных из N, О и S, которая может включать в себя до 3 колец (и предпочтительно представляет собой возможно бензоконденсированное 57-членное гетероциклическое кольцо), и эта группа возможно замещена С 1-4 галогеноалкилом,и в случае, если атом S присутствует в кольце, он может присутствовать как часть -S-,S(O)- или -S(O2)- группы,R3 представляет собой CN или C1-6 алкил(возможно замещенный одним или более чем одним галогеном, ОН, С 1-6 алкокси, С 1-6 алканоилокси и/или NY2WY1),R4 представляет собой C1-10 алкил, С 3-10 алкенил или С 3-10 алкинил, причем каждая из этих групп присоединена к атому N через sp3 атом углерода и возможно замещена одним или более(который возможно замещен одним или более чем одним галогеном, C1-6 алкилом (который возможно замещен одним или более чем одним галогеном) и/или С 1-4 алкокси), C1-6 алкоксикарбонилом, С 2-6 алканоилокси, С 3-8 циклоалкилом,С 3-8 циклоалкилокси, С 4-9 циклоалканоилом, арилом (который возможно замещен одним или более чем одним галогеном, C1-6 алкилом (который возможно замещен одним или более чем одним CN и/или галогеном), С 1-4 алкокси, ОН и/или NY2WY1), гетероциклом (который возможно бензо-конденсирован и возможно замещен одним или более чем одним галогеном, С 1-6 алкилом, С 1-4 алкокси и/или =O), гетероциклилокси (возможно замещенным одним или более чем одним С 1-6 алкилом или =O), адамантилом или ZBNR14R15,Z представляет собой СО группу,В представляет собой (CH2)p,R14 и R15, каждый независимо, представляют собой Н, С 1-10 алкил, С 3-8 циклоалкил или гетероарил,R5 и R8 представляют собой Н,R6, R7, R9 и R10 представляют собой Н,Х представляет собой галоген,n равно 0, 1 или 2; р равно 0;q равно 0; гетероарил представляет собой ароматическое кольцо, содержащее до четырех гетероатомов, независимо выбранных из N, О и S, и в случае, если атом S присутствует в кольце, он может присутствовать как часть -S-, S(O)- или-S(O)2- группы, которая может быть связана с остальной частью соединения через любой(ые) доступный(ые) атом(ы); гетероцикл представляет собой группу,включающую в себя 1, 2 или 3 кольца, которая содержит до 4 кольцевых гетероатомов, выбранных из N, О и S, и до 18 кольцевых атомов углерода; арил, в том числе в определении арилокси и т. д., означает группу, содержащую фенильное кольцо, которая может включать в себя дополнительное карбоциклическое кольцо,конденсированное с указанным фенильным кольцом, и которая может быть связана с остальной частью соединения через любой(ые) доступный(ые) атом(ы) (примеры таких групп включают нафтил, инданил и т.д.); группы алкил, алкенил и алкинил могут быть нормальными или разветвленными,если позволяет число атомов углерода; группы циклоалкил могут быть полициклическими, если позволяет число атомов углерода; либо его фармацевтически или ветеринарно приемлемое производное или пролекарство. Если присутствует конденсированная гетероциклическая группа, то она может быть 4 присоединена к остальной части соединения через любой(ые) доступный(ые) атом(ы). Группы галогеноалкил, галогеноалкокси и тому подобные могут содержать более чем один атом галогена и, например, могут быть пергалогенированными. Некоторые соединения по изобретению могут существовать в одной или более чем одной геометрической и/или стереоизомерной форме. Настоящее изобретение охватывает все такие индивидуальные изомеры и их соли и пролекарства. Некоторые соединения по настоящему изобретению могут существовать в более чем одной таутомерной форме. Аналогичным образом, некоторые соединения по изобретению могут иметь цвиттерионные формы. Следует иметь в виду, что изобретение охватывает все такие таутомеры, цвиттерионы и их производные. Фармацевтически приемлемые соли соединений формулы (I) включают соли присоединения кислот и соли с основаниями. Подходящие соли присоединения кислот образуются из кислот, которые образуют нетоксичные соли,и их примерами являются соли гидрохлорид,гидробромид, гидройодид, сульфат, гидросульфат, нитрат, фосфат, гидрофосфат, ацетат, малеат, фумарат, лактат, тартрат, цитрат, глюконат,сукцинат, бензоат, метансульфонат, бензолсульфонат и пара-толуолсульфонат. Подходящие соли с основаниями образуются из оснований, которые образуют нетоксичные соли, и их примерами являются соли алюминия, кальция,лития, магния, калия, натрия, цинка и диэтаноламинные соли. Обзор по подходящим солям см. в Berge et al., J. Pharm. Sci., 66, 1-19 (1977). Специалистам в данной области техники очевидно, что некоторые защищенные производные соединений формулы (I), которые могут быть получены до конечной стадии удаления защиты, могут не обладать фармакологической активностью как таковые, но в некоторых случаях после введения внутрь или на поверхность тела они могут подвергаться превращениям,например в результате метаболизма, с образованием соединений формулы (I), которые являются фармакологически активными. Такие производные включены в термин пролекарство. Кроме того, специалистам в данной области очевидно, что некоторые группировки, известные специалистам в данной области как прогруппировки, например как описано в Designof Progrugs by H. Bundgaard (Elsevier) 1985,можно поместить на соответствующие функциональные группы, когда такие функциональные группы присутствуют в соединениях формулы (I), также с образованием пролекарства. Кроме того, некоторые соединения формулы I могут действовать в качестве пролекарств других соединений формулы I. Все защищенные производные и пролекарства соединений формулы I включены в объем изобретения. 5 Предпочтительно, кольцо Аr представляет собой фенил или пиридил. Более предпочтительно, кольцо Аr представляет собой группу формулыNHCO2(C1-6 алкил). Еще более предпочтительно, R1 представляет собой ОН, NНSO2 СН 3, NHSO2C2H5,NНSO2(н-С 3 Н 7), NHSO2(изо-С 3 Н 7), NHSO2(нС 4H7), NНSO2NH(изо-С 3 Н 7), NHSO2(N-метилиNHSO2 мидазол-4-ил),NHSO2(CH2)2OCH3,(CH2)2OH, 1,2,4-триазолил или имидазол-2-ил. Наиболее предпочтительно, R1 представляет собой ОН, NНSO2 СН 3, NHSO2C2H5 или имидазол-2-ил. Предпочтительно, R2, взятый в отдельности, представляет собой H. Предпочтительно, R1 и R2, взятые вместе с атомами углерода, к которым они присоединены, представляют собой возможно бензоконденсированное 5-7-членное гетероарильное кольцо, возможно замещенное С 1-4 галогеноалкилом. Более предпочтительно, R1 и R2, взятые вместе с атомами углерода, к которым они присоединены, представляют собой 5-членную гетероарильную группировку, возможно замещенную С 1-4 галогеноалкилом. Еще более предпочтительно, R1 и R2, взятые вместе с атомами углерода, к которым они присоединены, представляют собой имидазольную группу, возможно 2-замещенную СF3. Предпочтительно Х представляет собой Сl. Предпочтительно n равно 0. Предпочтительно q равно 0. Предпочтительно R3 представляет собойCN или С 1-6 алкил (возможно замещенный одним или более чем одним галогеном, ОН, C1-6 алкокси, С 2-6 алканоилокси и/или NY2WY1). Более предпочтительно R3 представляет собой Н, СН 3, C2H5, изо-С 3 Н 7, н-С 3H7 или СН 2 ОСН 3. 6 Наиболее предпочтительно R3 представляет собой СН 3. Предпочтительно R4 представляет собой С 1-10 алкил, С 3-10 алкенил или С 3-10 алкинил, причем каждая из этих групп связана с атомом N через sp3 атом углерода, причем каждая из них возможно замещена С 3-8 циклоалкилом, арилом(который возможно замещен одним или более чем одним метилом, этилом, галогеном, CH2CN,СF3, NНSO2 СН 3, ОН, метокси), возможно бензоконденсированным гетероарилом (который возможно замещен одним или более чем одним метилом, галогеном, метокси, =O), ОН, арилокси (который возможно замещен одним или более чем одним метилом, галогеном, СF3, метокси), CN, C1-6 алкокси, С 3-8 циклоалкилокси,СОNН(С 3-8 циклоалкил), адамантилом или (возможно бензо-конденсированным) гетероарилокси (который возможно замещен одним или более чем одним метилом, =O). Более предпочтительно, R4 представляет собой н-гексил, 3-фенилпропил, 3-фенилоксипропил, 3-циклогексилпропил, 5-метилгексил,2-фенилоксиэтил, (4-цианометил)бензил, 2 циклогексилоксиэтил, 2-бензилоксиэтил, 3 циклогексилпроп-2-ен-1-ил, 2-(циклогексилкарбонил)этил, 3-(2-метилфенил)пропил, 3-фенилпроп-2-ен-1-ил, 2-(индол-3-ил)этил, 3-циклогексил-3-гидроксипропил, (индан-2-ил)метил, 3-(4 фторфенил)пропил, 3-(тиен-2-ил)пропил, 3(тиен-3-ил)пропил, 3-(пирид-2-ил)пропил, 3-(3 метилтиен-2-ил)пропил, 3-(тиен-2-ил)проп-2-ен 1-ил, 3-(тиен-3-ил)проп-2-ен-1-ил, 3-(пирид-2 ил)проп-2-ен-1-ил, 3-(3-метилтиен-2-ил)проп-2 ен-1-ил, 3-(3-метилпирид-2-ил)проп-2-ен-1-ил или 3-(2-метоксифенил)пропил. Еще более предпочтительно, R4 представляет собой н-гексил, 3-фенилпропил, (4 цианометил)бензил, 2-бензилоксиэтил, 3-циклогексилпроп-2-ен-1-ил, 2-(индол-3-ил)этил, 3-(2 метилфенил)пропил, 3-(4-фторфенил)пропил, 3(пирид-2-ил)пропил, 3-фенилпроп-2-ен-1-ил, 3 циклогексил-3-гидроксипропил, 3-(тиен-2-ил) пропил, 3-(тиен-3-ил)пропил, 3-(3-метилтиен-2 ил)пропил,3-(тиен-2-ил)проп-2-ен-1-ил,3(тиен-3-ил)проп-2-ен-1-ил, 3-(пирид-2-ил)проп 2-ен-1-ил, 3-(3-метилтиен-2-ил)проп-2-ен-1-ил,3-(6-метилпирид-2-ил)проп-2-ен-1-ил или 3-(2 метоксифенил)пропил. Предпочтительными являются вещества, в которых кольцо Ar, R1, R2, R3, R4, R5, R6, R7,R8, R9, R10, q и (Х)n имеют значения, которые подробно описаны в приведенных ниже примерах, т.е. соединения примеров 1-130 и 136-144:(144) N-3-[3-(1-бензотиофен-2-илметил)6-метил-3-азабицикло[3.1.0]гекс-6-ил]фенил метансульфонамид; и их соли. Более предпочтительными являются соединения примеров 1, 5, 6, 10-13, 18, 20, 25-28,32-34, 36, 38, 40, 42, 45, 47, 48, 57, 62, 67-69, 76,79, 80, 84, 88, 90, 92, 97, 99, 102, 113, 114, 118,119, 122-124, 136, 139 и 143 и их соли и пролекарства:(143) N-(3-3-[3-(2-метоксифенил)пропил]6-метил-3-азабицикло[3.1.0]гекс-6-илфенил) метансульфонамид; и их соли. Особенно предпочтительными являются соединения примеров 1, 5, 10, 12, 13, 26, 28, 36,40, 45, 47, 48, 62, 68, 69, 79, 80, 84, 88, 90, 97, 99,102, 113, 118, 114, 119, 122-124, 136, 139 и 143 и их соли и пролекарства: 17 и их соли. Еще более предпочтительными являются соединения примеров 1, 10, 12, 13, 26, 28, 62, 68,69, 79, 80, 84, 88, 90, 97, 102, 113, 114, 118, 119,123, 124, 136, 139 и 143 и их соли и пролекарства:(143) N-(3-3-[3-(2-метоксифенил)пропил]6-метил-3-азабицикло[3.1.0]гекс-6-илфенил) метансульфонамид; и их соли. Наиболее предпочтительными являются соединения примеров 1, 10, 26, 79, 97, 102, 118,139 и 143 и их соли и пролекарства:(143) N-(3-3-[3-(2-метоксифенил)пропил]6-метил-3-азабицикло[3.1.0]гекс-6-илфенил) метансульфонамид; и и их соли. Согласно изобретению также предложены способы получения соединений и солей по изобретению, которые описаны ниже и в разделах Примеры и Подготовительные примеры. Для специалиста в данной области очевидно, что соединения по изобретению можно получить способами, иными чем способы, описанные здесь, путем адаптации описанных здесь способов и/или адаптации способов, известных в данной области техники, например в области техники, описанной здесь, или используя стандартные руководства, такие какComprehensive Organic Transformations A Guide to Functional Group Transformations,R.C. Larock, VCH (1989 или более поздние издания), 19Advanced Organic Chemistry - Reactions,Mechanisms and Structure, J. March, WileyInterscience (3rd или более поздние издания),Organic Synthesis - The Disconnection Approach, S. Warren (Wiley), (1982 или более поздние издания),Designing Organic Syntheses, S. Warren(Wiley) (1983 или более поздние издания),Guidebook To Organic Synthesis, R.K.Mackie and D.M. Smith (Longman) (1982 или более поздние издания),а также приведенные в них ссылки, в качестве руководства. Понятно, что способы превращений, упомянутые здесь, являются лишь примерами, и их можно осуществлять во множестве различных последовательностей, чтобы можно было эффективно синтезировать желаемые соединения. Специалист в области химии должен использовать свое мнение и свой опыт относительно наиболее эффективной последовательности реакций для синтеза данного целевого соединения. Например, можно добавлять заместители к другим промежуточным соединениям и/или проводить химические превращения других промежуточных соединений, чем соединения,упомянутые здесь ниже в связи с конкретной реакцией. Это будет зависеть, среди прочего, от таких факторов, как природа других функциональных групп, присутствующих в конкретном субстрате, доступность ключевых промежуточных соединений и стратегия защитных групп(если таковая имеется), которую следует выбрать. Ясно, что тип задействованной химической реакции будет влиять на выбор реагента,который используют на указанных стадиях синтеза, на необходимость и тип защитных групп,которые используют, и на последовательность выполнения синтеза. Методики можно адаптировать подходящим образом к реактивам, реагентам и другим параметрам реакции по правилам, которые будут очевидны специалисту в данной области из стандартных руководств и примеров, приведенных здесь ниже. Для специалиста в данной области очевидно, что возможно нужно будет защищать функциональные группы и удалять защиту во время синтеза соединения по изобретению. Этого можно достичь общепринятыми способами, например как описано в Protective Groups in Organic Synthesis by T.W. Greene and P.G.M.Wuts, John WileySons Inc (1999) и в приведенных там ссылках. Функциональные группы,которые может быть желательным защищать,включают оксо, гидрокси, амино и карбоксильную группу. Подходящие защитные группы для оксо включают ацетали, кетали (например этиленкетали) и дитианы. Подходящие защитные группы для гидрокси включают триалкилсилильные и диарилалкилсилильные группы (например трет-бутилдиметилсилил, трет-бутилдифенилсилил или триметилсилил) и тетрагидро 004672 20 пиранил. Подходящие защитные группы для амино включают в себя трет-бутилоксикарбонил, 9-фторенилметоксикарбонил или бензилоксикарбонил. Подходящие группы для карбоксильной группы включают С 1-6 алкил или бензилэфирную группу. В приведенных ниже способах, если не указано иное, заместители являются такими, как определено выше относительно соединений формулы (I). Согласно изобретению предложен способ(а) получения соединений формулы I, как они определены выше, либо их фармацевтически или ветеринарно приемлемых производных, при котором: для соединений формулы I, где q равно 0, aZ1-WY1 1 где Z представляет собой подходящую уходящую группу, такую как галоген или Y1SO2O- и,при желании или при необходимости, превращают полученное соединение формулы I в фармацевтически или ветеринарно приемлемое производное, или наоборот. Предложен также способ (б) получения соединений формулы I, как они определены выше,либо их фармацевтически или ветеринарно приемлемых производных, при котором для соединений формулы I, где q равно 0, аR6 и R7 оба представляют собой Н, соединение формулы IV восстанавливают с использованием подходящего восстановителя и, при желании или при необходимости, превращают полученное соединение формулы I в фармацевтически или ветеринарно приемлемое производное, или наоборот. Предложен также способ (в) получения соединений формулы I, как они определены выше,либо их фармацевтически или ветеринарно приемлемых производных, при котором для соединений формулы I, где q равно 0, aR9 и R10 оба представляют собой Н, соединение формулы V восстанавливают с использованием подходящего восстановителя и, при желании или при необходимости, превращают полученное соединение формулы I в фармацевтически или ветеринарно приемлемое производное, или наоборот. Предложен также способ (г) получения соединений формулы I, как они определены выше,либо их фармацевтически или ветеринарно приемлемых производных, при котором для соединений формулы I, где q равно 0, аR1 и R2 присоединены к соседним атомам углерода и, взятые вместе с атомами углерода, к которым они присоединены, представляют собойHet1a, причем Het1a представляет собой имидазологруппу, соответствующее соединение формулы VIy где R представляет собой Н или любой возможный заместитель на Het1a (как он определен выше), предпочтительно Н или С 1-4 галогеноалкил и, при желании или при необходимости,превращают полученное соединение формулы I в фармацевтически или ветеринарно приемлемое производное, или наоборот. Предложен также способ (д) получения соединений формулы I, как они определены выше,либо их фармацевтически или ветеринарно приемлемых производных, при котором для соединений формулы I, где q равно 0,соединение формулы VIII подвергают взаимодействию с соединением формулы IX,R4-Lg IX где Lg представляет собой уходящую группу и,при желании или при необходимости, превращают полученное соединение формулы I в фармацевтически или ветеринарно приемлемое производное, или наоборот. 22 Предложен также способ (е) получения соединений формулы I, как они определены выше,либо их фармацевтически или ветеринарно приемлемых производных, при котором для соединений формулы I, где q равно 0, aR6, R7, R9 и R10 все представляют собой Н, соединение формулы Х восстанавливают подходящим восстановителем и, при желании или при необходимости, превращают полученное соединение формулы I в фармацевтически или ветеринарно приемлемое производное, или наоборот. Предложен также способ (ж) получения соединений формулы I, как они определены выше, либо их фармацевтически или ветеринарно приемлемых производных, при котором для соединений формулы I, где q равно 0, a R1 представляет собой ОН, соединение формулы II, гдеY2 представляет собой Н, как определено выше,подвергают взаимодействию с фтороборной кислотой и изоамилнитритом и, при желании или при необходимости, превращают полученное соединение формулы I в фармацевтически или ветеринарно приемлемое производное, или наоборот. Предложен также способ (з) получения соединений формулы I, как они определены выше,либо их фармацевтически или ветеринарно приемлемых производных, при котором для соединений формулы I, где q равно 0, а R1 представляет собой Сl, соединение формулы II, где Y2 представляет собой Н, как определено выше,подвергают взаимодействию с нитритом натрия в присутствии разбавленной кислоты, после чего осуществляют взаимодействие с хлоридом меди (I) в присутствии концентрированной кислоты и, при желании или при необходимости,превращают полученное соединение формулы I в фармацевтически или ветеринарно приемлемое производное, или наоборот. Предложен также способ (к) получения соединений формулы I, как они определены выше,либо их фармацевтически или ветеринарно приемлемых производных, при котором для соединений формулы I, где q равно 0, соответствующее соединение формулы XXXI 23 где R4aCH2 имеет такое же значение, как и R4,который определен выше, восстанавливают и,при желании или при необходимости, превращают полученное соединение формулы I в фармацевтически или ветеринарно приемлемое производное, или наоборот. В способе (а) реакцию можно проводить при температуре между 0 С и комнатной температурой в присутствии подходящего основания(например пиридина) и подходящего органического растворителя (например дихлорметана). Соединения формулы II могут быть получены восстановлением соответствующего соединения формулы XI или формулы XII, в присутствии подходящего восстановителя,такого как алюмогидрид лития. Эту реакцию можно проводить при температуре между комнатной температурой и температурой дефлегмации в присутствии подходящего растворителя(например тетрагидрофурана). Соединения формулы XI и XII могут быть получены восстановлением соответствующих нитросоединений в условиях, которые хорошо известны специалистам в данной области (например с использованием H2/Ni Ренея или в присутствии CaCl2 и железного порошка, в присутствии подходящей системы растворителей(например ЕtOН, EtOAc и/или вода. Специалисту в данной области ясно, что при получении соединения формулы II, где Y2 представляет собой Н, из такого соответствующего нитросоединения две вышеупомянутые стадии восстановления могут быть осуществлены на одной и той же стадии или последовательно в любом порядке. Указанные соответствующие нитросоединения могут быть получены взаимодействием соединения формулы XII или формулы XIV, где как подходит где L1 представляет собой подходящую уходящую группу [такую как галогено (например хлоро или бромо)], L2 представляет собой подходящую уходящую группу (такую как C1-3 алкокси), a R3 является таким, как определено выше, с соединением формулы XV,XV 24 Эту реакцию можно проводить при температуре между комнатной температурой и температурой дефлегмации в присутствии подходящего основания (например NаНСО 3) и подходящего органического растворителя (например диметилформамида), или при более высокой температуре (например между 50 и 200 С,предпочтительно между 100 и 160 С) в присутствии чистого соединения формулы XV. Соединения формулы XIII и XIV могут быть получены в соответствии со стандартными методиками. Например, соединения формулыXIII и XIV могут быть получены взаимодействием соответствующего соединения формулыXIX где L2 является таким, как определено выше. Эту реакцию можно проводить при комнатной температуре в присутствии подходящего катализатора [например Rh2(OAc)4] и подходящего непротонного органического растворителя (например дихлорметана). Соединения формулы XVI и формулыXVII имеются в продаже, либо их можно получить, используя известные методики. Соединения формулы XVI и формулы XVII могут быть получены, например, из соответствующих соединений формулы XX, например путем проведения реакции Виттига с использованием подходящего донора нуклеофильной группы RO2C-CR5H- или RO2C-CR8H(где R представляет собой низший (напримерC1-3)алкил), где как подходит, в условиях, которые хорошо известны специалистам в данной области. Группу- CO2R полученного соединения можно превратить в соответствующую группу СH2L1, используя стандартные методики (например восстановление эфира до первичного спирта и превращение последнего в алкилгалогенид) в условиях, которые хорошо известны специалистам в данной области. В способах (б) и (в) подходящие восстановители включают алюмогидрид лития. Эту реакцию можно проводить при температуре между комнатной температурой и температурой 25 дефлегмации в присутствии подходящего растворителя (например тетрагидрофурана). Соединения формулы II могут быть получены восстановлением соответствующего соединения формулы XXX, по аналогии со стадиями способа, упомянутыми выше. Соединения формулы IV и V могут быть получены соответственно из соединений формулы XXI и XXII, где L3 представляет собой группу, которая способна вступать в реакции превращения функциональных групп (например циано) с использованием стандартных методик замещения или превращения функциональных групп. Например:(1) Соединения формулы IV и V, где R1 представляет собой 1,2,4-триазол-3-ил, могут быть получены взаимодействием соответствующего соединения формулы XXI или XXII,где L3 представляет собой -CN, с HCl (газ) в присутствии подходящего низшего алкилового спирта (например этанола), например при температуре между 0 С и комнатной температурой,с последующим взаимодействием полученного промежуточного соединения с гидразидом муравьиной кислоты (например при температуре дефлегмации в присутствии или в отсутствие подходящего органического растворителя (например метанола) с последующим, если необходимо, удалением растворителя и нагреванием полученного остатка до высокой температуры(2) Соединения формулы IV и V, где R1 представляет собой имидазол-2-ил, могут быть получены взаимодействием соответствующего соединения формулы XXI или XXII, где L3 представляет собой -CN, с НСl (газ) в присутствии подходящего низшего алкилового спирта(например этанола), например при температуре между 0 С и комнатной температурой, с последующим взаимодействием полученного промежуточного соединения с аминоацетальдегида диалкилацеталем (например диметилацеталем)(например при температуре около температуры(3) Соединения формулы IV и V, где R1 представляет собой 1,2,3-триазол-5-ил, могут быть получены взаимодействием соответствующего соединения формулы XXI или XXII,где L3 представляет собой -CN, с диазометаном или его защищенным (например триалкилсилилом) производным, например при температуре между 0 С и комнатной температурой, в присутствии подходящего основания (например нBuLi) и, возможно, подходящего органического растворителя (например ТГФ) с последующим удалением защитной группы, когда необходимо.(4) Соединения формулы IV и V, где R1 представляет собой бензимидазол-2-ил, могут быть получены взаимодействием соответствующего соединения формулы XXI или XXII,где L3 представляет собой C=N(OEt), с 1,2 диаминобензолом. Эту реакцию можно проводить в растворителе, таком как метанол, при повышенной температуре (такой как температура дефлегмации растворителя). В подготовительных примерах 81 и т.д. приведены дополнительные подробности. Соединения формулы IV и V, где R1 представляет собой Het1, могут быть получены также из соединений формулы XI и XII соответственно согласно нижеследующей схеме: где Het1 определен выше. Дополнительные подробности можно найти в подготовительных примерах 67, 68 и т. д. ниже. Соединения формулы XXI и XXII могут быть получены аналогично способам, описанным здесь, например способам, описанным здесь выше для получения соединений формулы Другие соединения формулы (IV) и (V) могут быть получены по аналогии со способами, описанными здесь (например по аналогии со способами, описанными здесь выше для получения соединений формулы XI и XII (и особенно соответствующего нитросоединения. В способе (г) реакцию можно проводить путем нагревания с обратным холодильником в присутствии или в отсутствие подходящего органического растворителя. 27 Соединения формулы VI могут быть получены с использованием известных методик. Например, соединения формулы VI могут быть получены путем нитрования (по 4-положению) соответствующего 3-аминобензольного соединения (соединения формулы II), причем это последнее соединение можно активировать путем превращения 3-аминогруппы в 3-амидогруппу с последующим гидролизом амида и восстановлением 4-нитробензольного соединения. Все эти реакции можно проводить, используя методики,хорошо знакомые специалистам в данной области и проиллюстрированные в подготовительных примерах 45-48 и т.д. ниже. В способе (д) подходящие уходящие группы, которые может представлять собой Lg,включают галоген, такой как бром, или сульфонатную группу, такую как тозилат. Эту реакцию можно проводить в растворителе, который не оказывает вредного воздействия на реакцию(например в диметилформамиде), при повышенной температуре (например 50 С) в присутствии основания (например гидрокарбоната натрия). Возможно можно добавлять катализатор,такой как йодид натрия. Соединения формулы VIII могут быть получены из соединений формулы XXV, где Рg представляет собой подходящую защитную группу. Подходящие защитные группы включают аллил, который можно удалить, используя палладиевый(0) катализатор и N,Nдиметилбарбитуровую кислоту (см. подготовительный пример 53 и т.д. ниже). Соединения формулы XXV можно получить, используя способы, аналогичные способам, описанным здесь для получения соединений формулы I. В способе (е) подходящие восстановители включают алюмогидрид лития. Эту реакцию можно проводить в растворителе, который не оказывает вредного воздействия на реакцию(например в тетрагидрофуране), при повышенной температуре (например при температуре дефлегмации растворителя). Соединения формулы Х могут быть получены взаимодействием соединения формулыXXVI с соединением формулы XXVII в присутствии окислителя. Подходящие окислители включают диоксид марганца. Эту реакцию можно проводить в растворителе, который не оказывает вредного воздействия на реакцию(например в диоксане), при повышенной температуре, такой как температура дефлегмации 28 растворителя (например см. подготовительный пример получения 77 и т.д. ниже). Промежуточные соединения XXIXa выделяют, используя подходящие условия (например см. подготовительный пример 58). Соединения формулы XXVI могут быть получены из соединений формулы XXVIII взаимодействием соответствующего кетона с моногидратом гидразина, используя известные методики (и как описано в подготовительном примере 76 и т.д. ниже). Способ (е) особенно полезен, когда Аr представляет собой возможно бензоконденсированное 6-членное гетероарильное кольцо. Подобную методологию можно использовать для получения соединений формулы II: нитросоединение-предшественник можно получить из соединения формулы XX, как оно определено выше, используя стадии, описанные выше (см.,например, подготовительные примеры 57-61 и т.д.). В способе (ж) реакцию можно проводить в растворителе, который не оказывает вредного воздействия на реакцию (например в этаноле),сначала при температуре ниже комнатной температуры, а затем при повышенной температуре(в примерах 79 и т.д. приведены дополнительные подробности). В способе (з) подходящие кислоты включают разбавленную водную соляную кислоту и концентрированную соляную кислоту соответственно. Эту реакцию можно проводить при температуре около комнатной температуры,заканчивая при повышенной температуре (например 90 С). В примере 51 приведены дополнительные подробности. В способе (к) соединение формулы XXXI может быть получено путем ацилирования соединения формулы VIII, как оно определено выше, ацилирующим агентом формулы R4aCOLg, где Lg представляет собой подходящую уходящую группу, как определено выше по отношению к (д), и включает галоген, (алкил, галогеноалкил или арил)сульфонат, OCOR4a (то есть ангидрид кислоты) и тому подобное, хорошо известные практикующим специалистам. См. 29 например условия, использованные для подготовительного примера 47. Для специалистов очевидно, что соединения формулы I можно превратить в другие соединения формулы I, используя известные методики. Например, соединения формулы I, гдеY1 представляет собой алкоксикарбонил, можно превратить в соединения, где Y1 представляет собой алкил, который замещен ОН, путем восстановления с использованием LiAlH4 (в примере 57 приведены дополнительные подробности). Подобным образом, промежуточные соединения можно взаимно превращать, используя известные методики (см. например подготовительный пример 85). Промежуточные соединения, такие как соединения формул III, XV, XVIII, XIX, XX, VII,IX, XXVI, XXVII и XXVIII, и их производные,если их нет в продаже или они не описаны ниже, можно получить либо по аналогии со способами, описанными здесь, либо по традиционными способами синтеза в соответствии со стандартными методиками из легко доступных исходных материалов с использованием подходящих реагентов и реакционных условий. Согласно изобретению также предложены промежуточные соединения формул II, IV, V,VI, VIII, X, XI, XII, XIII, XIV, XXI, XXII, XXIII,XXIV, XXV, XXIXa, XXX, XXXI, как они определены выше. При желании или при необходимости, соединение формулы (I) можно превратить в его фармацевтически приемлемую соль, обычно путем смешивания вместе растворов соединения формулы (I) и желаемой кислоты или основания, где как подходит. Эту соль можно осадить из раствора и собрать фильтрацией, либо ее можно собрать другими способами, например выпариванием растворителя. Оба типа соли можно также образовать или взаимно превращать по методикам с использованием ионообменных смол. Соединения по изобретению можно очистить общепринятыми способами, например разделения диастереомеров можно достичь традиционными способами, например фракционной кристаллизацией, хроматографией или высокоэффективной жидкостной хроматографией(ВЭЖХ) стереоизомерной смеси соединения формулы (I) или его соли. Индивидуальный энантиомер соединения формулы (I) также можно получить из соответствующего оптически чистого промежуточного соединения либо разделением, таким как ВЭЖХ соответствующего рацемата с использованием подходящей хиральной стационарной фазы, либо фракционной кристаллизацией диастереомерных солей,образованных взаимодействием соответствующего рацемата с подходящим оптически активным основанием или подходящей оптически активной кислотой. 30 Соединения по изобретению обладают фармакологической активностью у животных,особенно у млекопитающих, включая людей. Следовательно, они показаны в качестве фармацевтических препаратов и, в частности, для применения в качестве лекарств для животных. Согласно изобретению предложена фармацевтическая или ветеринарная композиция,содержащая вещество по изобретению и фармацевтически или ветеринарно приемлемый носитель. Согласно изобретению предложено также применение вещества по изобретению в медицине. Согласно изобретению предложено также применение вещества по изобретению в производстве лекарств для лечения заболевания или состояния, опосредованного опиатными рецепторами. Согласно изобретению предложен также способ лечения состояния, опосредованного опиатным рецептором или рецепторами, при котором вводят терапевтически эффективное количество вещества по изобретению. Под термином лечение авторы изобретения понимают как терапевтическое (лечебное), так и профилактическое лечение. Обнаружено, что вещества по изобретению полезны в лечении заболеваний и состояний,опосредованных опиатными рецепторами, таких как синдром раздраженного кишечника; констипация; тошнота; рвота; зуд; пищевые расстройства; передозировка опиатов; депрессия; пристрастие к курению и алкоголю; половая дисфункция; шок; удар; повреждение спинного мозга и/или травма головы; и состояний, характеризующихся наличием зуда как симптома. Предполагается, что соединения по изобретению пригодны для терапевтического или профилактического лечения зудящих дерматозов, включая аллергический дерматит и атопию,у животных и людей. Другие заболевания и состояния, которые можно упомянуть, включают контактный дерматит, псориаз, экзему и укусы насекомых. Соединения по изобретению обычно следует вводить перорально или любым парентеральным путем в форме фармацевтических препаратов, содержащих активный ингредиент,возможно в форме нетоксичной соли присоединения органической или неорганической кислоты или основания в фармацевтически приемлемой лекарственной форме. В зависимости от расстройства и от пациента, которого нужно лечить, а также от пути введения композиции можно вводить в варьирующих дозах (см. ниже). Хотя соединения по изобретению можно вводить сами по себе, предпочтительно использовать эти соединения в виде фармацевтического или ветеринарного препарата, содержащего фармацевтически или ветеринарно приемлемый 31 носитель, разбавитель или эксципиент и соединение по изобретению. Носитель, разбавитель или эксципиент выбирают с учетом назначенного пути введения и стандартной фармацевтической и/или ветеринарной практики. Фармацевтические композиции, содержащие соединения по изобретению, могут содержать от 0,1 процента по массе до 90,0 процентов по массе активного ингредиента. Способы, которыми можно вводить соединения для ветеринарного применения, включают пероральное введение посредством капсулы,болюса, таблетки или вливания, местное введение в виде мази, обливания, точечного нанесения, погружения, спрея, пены, шампуня, ошейника или порошкообразного препарата, либо,альтернативно, их можно вводить инъекцией(например подкожно, внутримышечно или внутривенно) или в виде имплантата. Такие препараты могут быть приготовлены традиционным способом в соответствии со стандартной ветеринарной практикой. Препараты будут варьировать с учетом массы активного соединения, содержащегося в них, в зависимости от вида животного, которое нужно лечить, тяжести и типа инфекции и массы тела животного. Для парентерального, местного и перорального введения типичные диапазоны доз активного ингредиента составляют от 0,01 до 100 мг на кг массы тела животного. Предпочтительно этот диапазон составляет от 0,1 до 10 мг на кг. В любом случае, врач-практик или специалист в данной области способен определить дозировку, которая будет наиболее подходящей для индивидуального пациента, и которая может варьировать в зависимости от вида, возраста, массы и реакции конкретного пациента. Вышеуказанные дозировки являются примерными для среднего случая. Разумеется, могут быть индивидуальные случаи, когда предпочтительны более высокие или более низкие диапазоны дозировки, и таковые входят в объем данного изобретения. Относительно ветеринарного применения,соединения по изобретению имеют особое значение для лечения зуда у домашних животных,таких как кошки, собаки и лошади. Для лечения животных соединения по изобретению можно вводить с кормом животного,и для этого назначения можно приготовить концентрированную кормовую добавку или премикс для смешивания с обычным кормом животного. Для применения у людей соединения по изобретению вводят в виде фармацевтического препарата, содержащего активный ингредиент вместе с фармацевтически приемлемым разбавителем или носителем. Такие композиции включают в себя традиционные препараты в виде таблетки, капсулы и мази, которые изго 004672 32 тавливают в соответствии со стандартной фармацевтической практикой. Соединения по изобретению можно вводить либо одни, либо в комбинации с одним или более чем одним агентом, используемым для лечения или профилактики заболевания или для ослабления или подавления симптомов. Примеры таких агентов (которые приведены как иллюстрация, и их не следует истолковывать как ограничивающие) включают антипаразитарные агенты, например фипронил, люфенурон, имидаклоприд, авермектины (например абамектин,ивермектин, дорамектин), милбемицины, органофосфаты, пиретроиды; антигистаминные средства, например хлорфенирамин, тримепразин, дифенгидрамин, доксиламин; противогрибковые средства, например флуконазол, кетоконазол, итраконазол, гризеофульвин, амфотерицин В; антибактериальные средства, например энрофлаксацин, марбофлоксацин, ампициллин,амоксициллин; противовоспалительные средства, например преднизолон, бетаметазон, дексаметазон, карпрофен, кетопрофен; диетические добавки, например гамма-линолевая кислота; а также мягчительные средства. Для специалиста в данной области также очевидно, что соединения по изобретению можно принимать в виде разовой дозы или по мере необходимости (то есть когда необходимо или желательно). Соединения по изобретению обладают преимуществом в том, что при лечении пациентов-людей и/или животных они могут быть более эффективными, менее токсичными, иметь более широкий диапазон активности, быть более действенными, давать меньше побочных эффектов, легче всасываться или обладать другими полезными фармакологическими свойствами по сравнению с соединениями, известными в уровне техники. Биологическую активность соединений по настоящему изобретению определяли следующим методом тестирования. Биологический тест Обнаружено, что соединения по настоящему изобретению проявляют активность в трех анализах на связывание опиоидных рецепторов,избирательных в отношении опиоидных рецепторов мю, каппа и дельта, в головном мозге собаки. Эти анализы проводили по следующей методике. В качестве источника ткани головного мозга собаки использовали выращенных в лаборатории гончих собак. Животных умерщвляли,извлекали их головной мозг и отбрасывали мозжечок. Остальную мозговую ткань резали на небольшие кусочки массой примерно 3 г и гомогенизировали в 50 мМ Трис-буфере, рН 7,4,при 4 С, используя гомогенизатор ткани Kinematica Polytron. Полученный гомогенат центрифугировали при 48400 х g в течение 10 мин и отбрасывали супернатант. Остаток ресуспенди 33 ровали в Трис-буфере и инкубировали при 37 С в течение 10 мин. Стадии центрифугирования,ресуспендирования и инкубации повторяли еще два раза, и конечный остаток ресуспендировали в трис-буфере и хранили при -80 С. Мембранный материал, полученный таким образом,можно хранить до использования в течение периода до четырех недель. Для анализов мю, каппа и дельта возрастающие концентрации экспериментального соединения (от 5 х 10-12 до 10-5 М), трис-буфер и 3 Н лиганд (мю = [D-Аla2, N-Ме-Рhe4, Gly-оl5] энкефалин, DAMGO; каппа = U-69,593; дельта = энкефалин, [D-pen2,5] DPDPE) объединяли в пробирках из полистирола. Реакцию инициировали добавлением ткани, и смесь инкубировали при комнатной температуре в течение 90 мин. Реакцию останавливали быстрым фильтрованием, используя Brandel Cell Harvester, через фильтры из стекловолокна Betaplate GF/A,предварительно смоченные в буфере 50 мМ трис, рН 7,4, 0,1% полиэтиленимин. Затем фильтры промывали три раза по 0,5 мл охлажденного во льду трис-буфера, рН 7,4. Для анализов мю и дельта промытые фильтры помещали в пакеты и добавляли сцинтиллятор Starscint,для анализа каппа использовали твердый сцинтиллятор Meltilex b/HS. Пакеты, содержащие фильтры и сцинтиллятор, запаивали и считывали бета-счетчиком Betaplate 1204. Для каждого экспериментального соединения выполняли дублированные образцы, и полученные данные анализировали, используя программное обеспечение для анализа ИК 50 вGraphpad Prism. Значения Ki вычисляли, используя Graphpad Prism, согласно следующей формуле: Кi=ИК 50/1+[3 Н лиганд]/КD где ИК 50 представляет собой концентрацию, при которой 50% 3 Н лиганда замещено тестируемым соединением, а КD представляет собой константу диссоциации для 3 Н лиганда в сайте рецептора. Биологическая активность Определили значения Ki некоторых соединений по настоящему изобретению в анализах на связывание опиоидных рецепторов и обнаружили, что соединения примеров 1, 6, 8, 14-16,19 и 21-24 имеют значения Кi 4000 нМ или меньше для -рецептора. Предполагается, что способы, использованные в следующих примерах, дают соединения, имеющие относительную стереохимическую конфигурацию, показанную ниже, и такие соединения являются предпочтительными: 34 где R1-4 и (Х)n являются такими, как определено выше. Изобретение иллюстрируется следующими примерами и подготовительными примерами, в которых могут быть использованы следующие сокращения: АДХИ = химическая ионизация при атмосферном давлении; ДМФ = диметилформамид; ДМСО = диметилсульфоксид; с (в отношении времени) = сутки;n-BuOH = н-бутанол; ОДС = октадецилсилил; ТГФ = тетрагидрофуран; ТР = термораспыление. Точки плавления определяли, используя прибор для определения точек плавления Gallenkamp, и не корректировали. Спектральные данные ядерного магнитного резонанса (ЯМР) относятся к 1H, и их получали, используя спектрометр Varian Unity 300 или 400, причем измеренные химические сдвиги (б) согласуются с предполагаемыми структурами. Масс-спектральные (МС) данные получали на спектрометре Fisons Instruments Trio 1000, или Fisons Instruments Trio 1000 ADCI, или Finnigan Navigator MS, или Micromass Platform LC. Цитированные вычисленные и измеренные ионы относятся к изотопному составу наименьшей массы. Комнатная температура означает температуру от 20 до 25 С. Масс-спектрометр, который используют в качестве детектора на аналитической ВЭЖХ-МС системе, представляет собой Micromass VG Platform II, работающий на программном обеспечении Masslynx/Openlynx. Эта система может прокачивать положительный и отрицательный ион с пробами либо электрорапылением, либо АДХИ и калибруется на 1972 Да; она собирает полные данные в виде диодной матрицы от 190 нм до 600 нм. ВЭЖХ означает высокоэффективную жидкостную хроматографию. Используемые условия ВЭЖХ были следующими: Условие 1: колонка Rainin Dynamax, 8 мкм ОДС, 24 х 300 мм, температура колонки 40 С, скорость потока 45 мл/мин, элюирование смесью метанол:вода (70:30), УФ обнаружение продукта при 246 нм. Условие 2: колонка Rainin Dynamax, 5 мкм ОДС, 21,6 х 250 мм, температура колонки 40 С, скорость потока 5 мл/мин, элюирование смесью ацетонитрил:вода (50:50), УФ обнаружение продукта при 246 нм. 35 Условие 3: колонка Rainin Dynamax, 8 мкм ОДС, 41 х 250 мм, температура колонки 40 С, скорость потока 45 мл/мин, элюирование смесью ацетонитрил:буфер 0,1 М водный ацетат аммония (50:50), УФ обнаружение продукта при 235 нм. Условие 4: колонкаMagellan, 5 мкм силикагель C18, 21,2 х 150 мм,температура колонки 40 С, скорость потока 20 мл/мин, градиентное элюирование смесью ацетонитрил:буфер 0,1 М водный ацетат аммония(от 30:70 до 95:5 за 10 мин), УФ обнаружение продукта при 220 нм. Условие 5: колонкаMagellan, 5 мкм ОДС, 21,2 х 150 мм, температура колонки 40 С, скорость потока 20 мл/мин,градиентное элюирование смесью ацетонитрил:буфер 0,1 М водный ацетат аммония (от 5:95 до 95:5 за 20 мин), УФ обнаружение продукта при 215 нм. Условие 6: колонкаMagellan, 5 мкм силикагель C18, 4,6 х 150 мм,температура колонки 40 С, скорость потока 1 мл/мин, градиентное элюирование смесью ацетонитрил:0,1 М водная гептансульфоновая кислота (от 10:90 до 90:10 в течение 30 мин), УФ обнаружение продукта при 220 нм. Условие 7: колонкаMagellan, 5 мкм силикагель С 18, 21,2 х 150 мм,температура колонки 40 С, скорость потока 20 мл/мин, градиентное элюирование смесью ацетонитрил:буфер 0.05 М водный ацетат аммония(50:50 в течение 15 мин, затем от 50:50 до 90:10 за 5 мин), УФ обнаружение продукта при 220 нм. Условие 8: колонкаMagellan, 5 мкм силикагель C18, 21,2 х 150 мм,температура колонки 40 С, скорость потока 20 мл/мин, градиентное элюирование смесью ацетонитрил:буфер 0,1 М водный ацетат аммония(от 15:85 до 85:15), УФ обнаружение продукта при 220 нм. Условие 9: колонкаMagellan, 5 мкм ОДС, 10 х 150 мм, температура колонки 40 С, скорость потока 5 мл/мин,градиентное элюирование смесью ацетонитрил:буфер 0,1 М водный ацетат аммония (от 5:95 до 30:70 за 5 мин, затем 30:70 в течение еще 20 мин), УФ обнаружение продукта при 225 нм. Условие 10: колонкаMagellan, 5 мкм силикагель С 18, 21,2 х 150 мм,температура колонки 40 С, скорость потока 20 мл/мин, градиентное элюирование смесью ацетонитрил.-буфер 0,1 М водный ацетат аммония(от 5:95 до 40:60 за 5 мин, затем 40:60 в течение еще 25 мин), УФ обнаружение продукта при 210 нм. Условие 11: колонкаMagellan, 5 мкм ОДС, 10 х 150 мм, температура колонки 40 С, скорость потока 5 мл/мин,градиентное элюирование смесью ацетонит 004672 36 рил:вода (от 5:95 до 55:45 за 5 мин), УФ обнаружение продукта при 210 нм. Азабициклы в форме свободного основания могли быть получены, например, из гидрохлоридных или ацетатных солей следующим образом. Соль (0,3 ммоль) растворяли в дихлорметане (20 мл) и промывали насыщенным водным раствором гидрокарбоната натрия (20 мл). Основную смесь разделяли, и водный слой экстрагировали дихлорметаном (2 х 20 мл). Объединенные органические экстракты высушивали(Nа 2SO4) и концентрировали в вакууме с получением свободного основания. Картридж ТФЭ относится к картриджу твердофазной экстракции. Они имеются в продаже от Varian (Mega Bond Elut) или Isolute. Пример 1. N-3-[6-Метил-3-(3-фенилпропил)-3-азабицикло[3.1.0]гекс-6-ил]фенилметансульфонамид К раствору 3-[6-метил-3-(3-фенилпропил)3-азабицикло[3.1.0]гекс-6-ил]фениламина (подготовительный пример 8, 28 мг, 0,09 ммоль) в дихлорметане (2 мл) при 0 С в атмосфере азота добавляли пиридин (20 мкл, 0,24 ммоль), а затем метансульфонилхлорид (25 мкл, 37 мг, 0,32 ммоль) за 5 мин. Этой смеси давали нагреться до комнатной температуры, а затем перемешивали в течение 2 ч. Эту смесь концентрировали в вакууме, и остаток очищали колоночной хроматографией на силикагеле (5 г), элюируя смесью 80:20:1 этилацетат:гексан:раствором аммиака (0,880). Фракции, содержащие продукт,объединяли и концентрировали в вакууме с получением указанного в заголовке соединения в виде бесцветного масла (18 мг, 52%). ЯМР (СDCl3) : 1.56 (s, 3H), 1.77 (m, 4H),2.48 (t, 2H), 2.66 (t, 2H), 2.80 (d, 2 Н), 3.01 (s, 3H),3.05 (d, 2H), 7.01 (d, 1H), 7.14-7.3 (m, 6H). МС (термораспыление): m/z [MH+] 385,4; С 22 Н 28N2SO2 + H требует 385,2. Пример 2. Соль ацетат N-3-[6-метил-3-(3 фенилпропил)-3-азабицикло[3.1.0]гекс-6-ил] фенилметансульфонамида.(пример 1, 260 мг, 0,67 ммоль) очищали дополнительно препаративной ВЭЖХ (условие 3). В результате объединения и упаривания чистых фракций получили указанное в заголовке соединение в виде белого твердого вещества (87 мг). Тпл. 116-117 С. ЯМР (СD3OD) : 1.45 (s, 3H), 1.93 (m, 5H),2.09 (s, 2H), 2.67 (t, 2H), 2.86 (t, 2 Н), 2.93 (s, 3H), 37 3.05 (d, 2H), 3.46 (d, 2H), 7.04 (m, 2H), 7.10-7.33 К раствору 3-[6-метил-3-(3-фенилпропил)3-азабицикло[3.1.0]гекс-6-ил]фениламина (подготовительный пример 8, 110 мг, 0,36 ммоль) в дихлорметане (4 мл) при 0 С в атмосфере азота добавляли пиридин (56 мкл, 0,72 ммоль), а затем этансульфонилхлорид (67 мкл, 92 мг, 0,72 ммоль) по каплям в течение 5 мин. Этой смеси давали нагреться до комнатной температуры и перемешивали в течение 16 ч. Добавляли дополнительное количество пиридина (56 мкл,0,72 ммоль) и этансульфонилхлорида (67 мкл,92 мг, 0,72 ммоль), и эту смесь перемешивали в течение 2 ч. Сырую смесь очищали колоночной хроматографией на силикагеле (40 г), элюируя смесью 80:20:1 этилацетат:гексан:раствор аммиака (0,880). Фракции, содержащие продукт,объединяли и концентрировали в вакууме с получением указанного в заголовке соединения в виде бесцветного масла (48 мг, 34%). ЯМР (CDCl3) : 1.39 (t, 3H), 1.57 (s, 3H),1.76 (m, 4H), 2.48 (t, 2H), 2.66 (t, 2H), 2.80 (d,2H), 3.04 (d, 2H), 3.12 (q, 3H), 6.97-7.11 (m, 3H),7.11-7.33 (m, 6H). МС (термораспыление): m/z(подготовительный пример 10, 25 мг, 0,08 ммоль) в дихлорметане (2 мл) при 0 С в атмосфере азота добавляли пиридин (20 мкл, 0,24 ммоль), а затем метансульфонилхлорид (25 мкл,37 мг, 0,32 ммоль) по каплям в течение 5 мин. Этой смеси давали нагреться до комнатной температуры и перемешивали в течение 90 мин. Добавляли дополнительное количество метансульфонилхлорида (10 мкл, 15 мг, 0,13 ммоль),и эту смесь перемешивали в течение 1 ч. Эту смесь концентрировали в вакууме, и остаток очищали колоночной хроматографией на сили 004672(подготовительный пример 10, 25 мг, 0,08 ммоль) в дихлорметане (2 мл) при 0 С в атмосфере азота добавляли пиридин (20 мкл, 0,24 ммоль), а затем этансульфонилхлорид (25 мкл,34 мг, 0,26 ммоль) по каплям в течение 5 мин. Этой смеси давали нагреться до комнатной температуры и перемешивали в течение 1,5 ч. Добавляли дополнительное количество этансульфонилхлорида (25 мкл, 34 мг, 0,26 ммоль), и эту смесь перемешивали в течение 2 ч. Эту смесь концентрировали в вакууме, и остаток очищали колоночной хроматографией на силикагеле (5 г), элюируя смесью 80:20:1 этилацетат:гексан: раствор аммиака (0,880). Фракции, содержащие продукт, объединяли и концентрировали в вакууме с получением указанного в заголовке соединения в виде бледно-желтого масла (21 мг,65%). ЯМР (CDCl3) : 0.90 (m, 2H), 1.06-1.31 (m,6H), 1.37 (t, 3H), 1.44 (m, 2H), 1.51 (s, 3H), 1.601.76 (m, 7H), 2.43 (t, 2H), 2.83 (d, 2H), 2.98 (d,2H), 3.13 (q, 2H), 6.98-7.10 (m, 3H), 7.24 (t, 1H). МС (термораспыление): m/z [MH+] 405,6; С 23H36N2SO2 + Н требует 405,3. Пример 6. N-[3-(3-Гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)фенил]метансульфонамид(подготовительный пример 12, 200 мг, 0,735 ммоль) в ди 39 хлорметане (5 мл) при комнатной температуре добавляли пиридин (0,15 мл, 1,84 ммоль), а затем метансульфонилхлорид (0,11 мл, 158 мг,1,38 ммоль) по каплям в течение 5 мин. Эту смесь перемешивали в течение 48 ч, концентрировали в вакууме, и остаток очищали колоночной хроматографией на силикагеле (10 г), элюируя смесью 90:10:1 этилацетат:метанол:раствор аммиака (0,880), затем 80:20:1 этилацетат: метанол:раствор аммиака (0,880). Фракции, содержащие продукт, объединяли и концентрировали в вакууме с получением указанного в заголовке соединения в виде бледно-желтого масла (212 мг, 82%). ЯМР (СDСl3) : 0.90 (t, 3H), 1.28 (m, 6H),1.47 (s, 3H), 1.54 (m, 2H), 1.90 (s, 2 Н), 2.60 (t,2H), 2.97 (d, 2H), 3.00 (s, 3H), 3.15 (m, 2H), 7.02(подготовительный пример 12, 200 мг, 0,735 ммоль) в дихлорметане (5 мл) при комнатной температуре добавляли пиридин (0,15 мл, 1,84 ммоль), а затем этансульфонилхлорид (0,131 мл, 177 мг,1,38 ммоль) по каплям в течение 5 мин. Эту смесь перемешивали в течение 48 ч, концентрировали в вакууме, и остаток очищали колоночной хроматографией на силикагеле (10 г), элюируя этилацетатом, а затем смесью 90:10:1 этилацетат:метанол:раствор аммиака (0,880). Фракции, содержащие продукт, объединяли и концентрировали в вакууме с получением указанного в заголовке соединения в виде бледножелтого масла (140 мг, 52%). ЯМР (СDСl3) : 0.90 (t, 3H), 1.28 (m, 6H),1.34 (t, 3H), 1.47 (s, 3H), 1.55 (m, 2H), 1.90 (s,2H), 2.63 (m, 2H), 2.97 (m, 2H), 3.11 (q, 2H), 3.20(подготовительный пример 12, 200 мг, 0,735 ммоль) в дихлорметане (5 мл) при комнатной температуре добавляли пиридин (0,15 мл, 1,84 ммоль), а затем пропансульфонилхлорид (0,16 мл, 202 мг,1,42 ммоль) по каплям в течение 5 мин. Эту смесь перемешивали в течение 48 ч, концентрировали в вакууме, и остаток очищали колоночной хроматографией на силикагеле (10 г), элюируя этилацетатом, а затем смесью 90:10:1 этилацетат:метанол:раствор аммиака (0,880). Фракции, содержащие продукт, объединяли и концентрировали в вакууме с получением указанного в заголовке соединения в виде бледножелтого масла (40 мг, 14%). ЯМР (CDCl3) : 0.90 (t, 3H), 1.02 (t, 3H),1.30 (m, 6H), 1.46 (m, 2H), 1.50 (s, 3H), 1.77 (s,2H), 1.87 (m, 2H), 2.47 (t, 2H), 2.87 (m, 2H), 2.933.07 (m, 4H), 6.97-7.09 (m, 3H), 7.22 (m, 1H). МС (термораспыление): m/z [MH+] 379,2; К раствору 3-(3-гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)фениламина (подготовительный пример 12, 220 мг, 0,809 ммоль) в дихлорметане (5 мл) при комнатной температуре добавляли пиридин (0,196 мл, 2,42 ммоль), а затем 3-пиридинсульфонилхлорид (198 мг, 1,21 ммоль) по каплям в течение 5 мин. Эту смесь перемешивали в течение 48 ч, концентрировали в вакууме, и остаток очищали колоночной хроматографией на силикагеле (10 г), элюируя этилацетатом, а затем смесью 90:10:1 этилацетат:метанол:раствор аммиака (0,880). Фракции,содержащие продукт, объединяли и концентрировали в вакууме с получением указанного в заголовке соединения в виде бледно-оранжевого масла (200 мг, 60%). ЯМР (CDCl3) : 0.89 (t, 3H), 1.30 (m, 6H),1.40 (s, 3H), 1.52 (m, 2H), 1.77 (s, 2H), 2.58 (t,2H), 2.91 (d, 2H), 3.11 (m, 2H), 6.91-7.04 (m, 3H),7.13 (t, 1H), 7.35 (m, 1 Н), 8.06 (d, 1H), 8.73 (d,1H), 8.94 (s, 1H). МС (термораспыление): m/z [MH+] 414,2; С 23 Н 31N3SO2 + Н требует 414,2. Пример 10. Соль ацетат N-3-[6-этил-3-(3 фенилпропил)-3-азабицикло[3.1.0]гекс-6-ил]фенил-1-метансульфонамида К раствору 3-[6-этил-3-(3-фенилпропил)-3 азабицикло[3.1.0]гекс-6-ил]фениламина (подготовительный пример 18, 500 мг, 1,56 ммоль) в дихлорметане (20 мл) при 0 С в атмосфере азота добавляли пиридин (0,20 мл, 2,6 ммоль), а затем метансульфонилхлорид (0,20 мл, 300 мг, 2,6 ммоль) по каплям в течение 5 мин. Этой смеси давали нагреться до комнатной температуры и перемешивали в течение 18 ч. Эту смесь концентрировали в вакууме, и остаток очищали колоночной хроматографией на силикагеле (25 г), элюируя смесью 70:30:1 этилацетат:гексан: раствор аммиака (0,880). Фракции, содержащие продукт, объединяли и концентрировали в вакууме с получением указанного в заголовке соединения в виде бледно-желтого масла. Его дополнительно очищали препаративной ВЭЖХ(условие 3). Объединением и упариванием чистых фракций получили указанное в заголовке соединение в виде белого твердого вещества К раствору 3-[6-этил-3-(3-фенилпропил)-3 азабицикло[3.1.0]гекс-6-ил]фениламина (подготовительный пример 18, 500 мг, 1,56 ммоль) в дихлорметане (20 мл) при 0 С в атмосфере азота добавляли пиридин (0,20 мл, 2,6 ммоль), а затем этансульфонилхлорид (0,20 мл, 0,27 г, 2,1 ммоль) по каплям в течение 5 мин. Этой смеси давали нагреться до комнатной температуры и перемешивали в течение 18 ч. Эту смесь концентрировали в вакууме, и остаток очищали колоночной хроматографией на силикагеле (25 г), элюируя смесью 50:50:1 этилацетат:гексан: раствор аммиака (0,880). Фракции, содержащие продукт, объединяли и концентрировали в вакууме с получением указанного в заголовке соединения в виде бледно-желтого масла. Его до 004672 42 полнительно очищали препаративной ВЭЖХ(условие 3). Объединением и упариванием чистых фракций получили указанное в заголовке соединение в виде белого твердого вещества(подготовительный пример 20, 500 мг, 1,56 ммоль) в пиридине (5 мл) при 0 С в атмосфере азота добавляли метансульфонилхлорид (0,20 мл, 0,30 г, 2,6 ммоль) по каплям в течение 5 мин. Этой смеси давали нагреться до комнатной температуры и перемешивали в течение 18 ч. Эту смесь концентрировали в вакууме, и остаток очищали колоночной хроматографией на силикагеле (25 г),элюируя смесью 50:50:1 этилацетат:гексан:раствор аммиака (0,880). Фракции,содержащие продукт, объединяли и концентрировали в вакууме с получением указанного в заголовке соединения в виде бледно-желтого масла (180 мг, 33%). ЯМР (СDСl3) : 0.85 (m, 6H), 1.27 (m, 6H),1.44 (m, 2H), 1.77 (m, 2H), 1.94 (q, 2H), 2.43 (m,2H), 2.81 (m, 2H), 2.98 (m, 2H), 2.99 (s, 3H), 7.007.13 (m, 3H), 7.24 (t, 1 Н). МС (электрораспыление): m/z [МН+] 365,1; С 20 Н 32N2O2S + Н требует 365,2. Пример 13. N-[3-(6-Этил-3-гексил-3-азабицикло[3.1.0]гекс-6-ил)фенил)-1-этансульфонамид. К раствору 3-(6-этил-3-гексил-3-азабицикло[3.1.0]гекс-6-ил)фениламина (подготовительный пример 20, 500 мг, 1,56 ммоль) в пиридине (5 мл) при 0 С в атмосфере азота добавляли этансульфонилхлорид (0,25 мл, 0,34 г, 2,6 ммоль) по каплям в течение 5 мин. Этой смеси давали нагреться до комнатной температуры и перемешивали в течение 18 ч. Эту смесь концентрировали в вакууме, и остаток очищали колоночной хроматографией на силикагеле (25 К раствору 3-[3-(3-фенилпропил)-3-азабицикло [3.1.0]гекс-6-ил]фениламина (подготовительный пример 25, 34 мг, 0,11 ммоль) в дихлорметане (2 мл) при 0 С в атмосфере азота добавляли пиридин (20 мкл, 0,24 ммоль), а затем метансульфонилхлорид (13 мг, 10 мкл, 0,11 ммоль). Этой смеси давали нагреться до комнатной температуры и перемешивали в течение 1,5 ч. Эту смесь концентрировали в вакууме, и остаток очищали колоночной хроматографией на силикагеле (5 г), элюируя смесью 80:20:1 этилацетат:гексан:раствор аммиака (0,880). Фракции, содержащие продукт, объединяли и концентрировали в вакууме с получением указанного в заголовке соединения в виде бледножелтого масла (29 мг, 71%). ЯМР (СDСl3) : 1.66 (s, 2 Н), 1.80 (m, 2 Н),2.26 (s, 1H), 2.41 (d, 2H), 2.47 (t, 2H), 2.65 (t, 2H),3.00 (s, 3H), 3.19 (d, 2H), 6.85 (d, 1H), 6.90 (s,1H), 6.98 (d, 1H), 7.20 (m, 4H), 7.29 (m, 2H)[3.1.0]гексан-2-она (подготовительный пример 27, 40 мг, 0,15 ммоль) в безводном тетрагидрофуране (2 мл) при комнатной температуре в атмосфере азота добавляли по каплям раствор алюмогидрида лития 1,0 М в тетрагидрофуране(0,3 мл, 0,3 ммоль), а затем эту смесь нагревали до 60 С в течение 4 ч, охлаждали и перемеши 004672 44 вали при комнатной температуре в течение 64 ч. Осторожно добавляли воду (30 мл), а затем эту смесь экстрагировали этилацетатом (2 х 25 мл). Объединенные экстракты промывали водой (30 мл), высушивали (Nа 2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле (1,5 г),элюируя смесью 80:20:1 этилацетат:гексан:раствор аммиака (0,880). Фракции, содержащие продукт, объединяли и концентрировали в вакууме с получением указанного в заголовке соединения в виде бледно-желтого масла (14 мг,38%). ЯМР (CDCl3) : 0.90 (t, 3H), 1.30 (m, 6 Н),1.44 (m, 2H), 1.65 (s, 2H), 2.16 (t, 1H), 2.42 (m,4 Н), 3.19 (d, 2H), 7.04 (d, 2H), 7.12 (m, 1H), 7.24 К раствору 3-[6-метил-3-(3-фенилпропил)3-азабицикло[3.1.0]гекс-6-ил]фениламина (подготовительный пример 8, 200 мг, 0,65 ммоль) в пиридине (2 мл) в атмосфере азота при 0 С добавляли бензолсульфонилхлорид (172 мг, 0,98 ммоль), а затем эту смесь перемешивали при комнатной температуре в течение 16 ч. Добавляли воду (5 мл) и дихлорметан (5 мл), и эту смесь перемешивали в течение 30 мин. Органическую фазу дополнительно промывали водой(МgSO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле (10 г), элюируя смесью 20:80:1 этилацетат:гексан:раствор аммиака(0,880), а затем 50:50:1 этилацетат:гексан:раствор аммиака (0,880). Фракции, содержащие продукт, объединяли и концентрировали в вакууме. Остаток дополнительно очищали препаративной ВЭЖХ (условие 4). В результате объединения и упаривания соответствующих фракций получили указанное в заголовке соединение в виде бледно-коричневого твердого вещества К раствору 3-[6-метил-3-(3-фенилпропил)3-азабицикло[3.1.0]гекс-6-ил]фениламина (подготовительный пример 8, 200 мг, 0,65 ммоль) в пиридине (2 мл) в атмосфере азота при 0 С добавляли диметилсульфамоилхлорид (140 мг,0,98 ммоль), а затем эту смесь перемешивали при комнатной температуре в течение 16 ч. Добавляли воду (5 мл) и дихлорметан (5 мл), и эту смесь перемешивали в течение 30 мин. Органическую фазу дополнительно промывали водой(MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле (10 г), элюируя смесью этилацетат:гексан:раствор аммиака (0,880),(20:80:1, а затем 50:50:1). Фракции, содержащие продукт, объединяли и концентрировали в вакууме. Остаток дополнительно очищали препаративной ВЭЖХ (условие 4). В результате объединения и упаривания соответствующих фракций получили указанное в заголовке соединение в виде бледно-коричневого твердого вещества К раствору 3-[6-метил-3-(3-фенилпропил)3-азабицикло[3.1.0]гекс-6-ил]фениламина (подготовительный пример 8, 200 мг, 0,65 ммоль) в пиридине (2 мл) в атмосфере азота при 0 С добавляли н-пропансульфонилхлорид (140 мг, 0,98 ммоль), а затем эту смесь перемешивали при комнатной температуре в течение 16 ч. Добавляли воду (5 мл) и дихлорметан (5 мл), и эту смесь перемешивали в течение 30 мин. Органическую фазу дополнительно промывали водой(MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле (10 г), элюируя смесью этилацетат:гексан:раствор аммиака (0,880),(20:80:1, а затем 50:50:1). Фракции, содержащие продукт, объединяли и концентрировали в вакууме. Остаток дополнительно очищали препаративной ВЭЖХ (условие 4). В результате объединения и упаривания соответствующих фракций получили указанное в заголовке соединение в виде бледно-коричневого твердого вещества К раствору 3-[6-метил-3-(3-фенилпропил)3-азабицикло[3.1.0]гекс-6-ил]фениламина (подготовительный пример 8, 200 мг, 0,65 ммоль) в пиридине (2 мл) в атмосфере азота при 0 С добавляли 3,5-диметилизоксазолсульфонилхлорид(190 мг, 0,98 ммоль), а затем эту смесь перемешивали при комнатной температуре в течение 16 ч. Добавляли воду (5 мл) и дихлорметан (5 мл), и эту смесь перемешивали в течение 10 мин. Органическую фазу дополнительно промывали водой (5 мл), отделяли, высушивали(MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле (10 г), элюируя смесью этилацетат:гексан:раствор аммиака (0,880),(20:80:1, а затем 60:40:1). Фракции, содержащие продукт, объединяли и концентрировали в вакууме. Остаток дополнительно очищали препаративной ВЭЖХ (условие 4). В результате объединения и упаривания соответствующих фракций получили указанное в заголовке соединение в виде бледно-коричневого твердого вещества К раствору 3-[6-метил-3-(3-фенилпропил)3-азабицикло[3.1.0]гекс-6-ил]фениламина (подготовительный пример 8, 200 мг, 0,65 ммоль) в пиридине (2 мл) в атмосфере азота при 0 С добавляли 2-метокси-1-этансульфонилхлорид (J.Chem. Soc., 1968, 2895; 155 мг, 0,98 ммоль), а затем эту смесь перемешивали при комнатной температуре в течение 16 ч. Добавляли воду (5 мл) и дихлорметан (5 мл), и эту смесь перемешивали в течение 10 мин. Органическую фазу дополнительно промывали водой (5 мл), отделяли, высушивали (МgSO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле (10 г),элюируя смесью этилацетат:гексан:раствор аммиака (0,880), (20:80:1, а затем 60:40:1). Фракции, содержащие продукт, объединяли и концентрировали в вакууме. Остаток дополнительно очищали препаративной ВЭЖХ (условие 4). В результате объединения и упаривания соответствующих фракций получили указанное в заголовке соединение в виде бледнокоричневого твердого вещества (3 мг, 1%). ЯМР (CDCl3) : 1.55 (s, 3H), 1.82 (m, 4 Н),2.55 (m, 2H), 2.66 (t, 2H), 2.80-3.05 (br.m, 4 Н),3.23 (t, 2H), 3.42 (s, 3H), 3.84 (t, 2H), 7.00-7.33 К раствору 3-[6-метил-3-(3-фенилпропил)3-азабицикло[3.1.0]гекс-6-ил]фениламина (подготовительный пример 8, 200 мг, 0,65 ммоль) в пиридине (2 мл) в атмосфере азота при 0 С добавляли -толуолсульфонилхлорид (186 мг, 0,98 ммоль), а затем эту смесь перемешивали при комнатной температуре в течение 16 ч. Добавляли воду (5 мл) и дихлорметан (5 мл), и эту смесь перемешивали в течение 10 мин. Органическую фазу дополнительно промывали водой 48 очищали колоночной хроматографией на силикагеле (10 г), элюируя смесью этилацетат:гексан:раствор аммиака (0,880), (20:80:1, а затем 60:40:1). Фракции, содержащие продукт,объединяли и концентрировали в вакууме. Остаток дополнительно очищали препаративной ВЭЖХ (условие 4). В результате объединения и упаривания соответствующих фракций получили указанное в заголовке соединение в виде бледно-коричневого твердого вещества (3 мг,1%). ЯМР (CDCl3) : 1.48 (s, 3H), 1.87 (m, 4H),2.06 (s, 3H), 2.65 (m, 4H), 2.96 (d, 2 Н), 3.16 (br.d,2H), 4.32 (s, 2H), 6.93-7.06 (m, 3H), 7.14-7.40 (m,11H). МС (электрораспыление): m/z [MH+] 461,3; С 28 Н 32N2O2S + Н требует 461,2. Пример 22. N-[3-(3-Бензил-6-метил-3 азабицикло[3.1.0]гекс-6-ил)фенил]метансульфонамид. К раствору 3-(3-бензил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)фениламина (подготовительный пример 30, 1,58 г, 5,68 ммоль) в пиридине (10 мл) в атмосфере азота при 0 С добавляли по каплям метансульфонилхлорид (0,66 мл, 8,52 ммоль), и эту смесь перемешивали в течение 14 ч при комнатной температуре. Пиридин выпаривали в вакууме, и остаток распределяли между дихлорметаном (50 мл) и разбавленным водным раствором гидрокарбоната натрия (1 М, 50 мл). Слои разделяли, и органический слой высушивали (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле (60 г), элюируя смесью этилацетат:гексан (5:95), а затем этилацетат:гексан:триэтиламин (5:95:0,1,увеличивая до 80:20:0,1). Соответствующие фракции объединяли и концентрировали в вакууме с получением указанного в заголовке соединения в виде не совсем белого твердого вещества (1 г, 50%). Тпл. 117-118 С. ЯМР (СDСl3) : 1.62 (s, 3H), 1.77 (s, 2H),2.83 (d, 2H), 3.00 (s, 3H), 3.07 (d, 2 Н), 3.68 (s,2H), 6.27 (br.s, 1H), 7.01 (d, 1 Н), 7.08 (m, 2H),7.24-7.33 (m, 6H). МС (термораспыление): m/z [MH+] 356,9; С 20H24N2O2S + Н требует 357,2. Пример 23. 6-Метил-3-(3-фенилпропил)-6[3-(1 Н-1,2,3-триазол-5-ил)фенил]-3-азабицикло[3.1.0]гексан-2-она (подготовительный пример 41, 32 мг, 0,087 ммоль) в тетрагидрофуране (2 мл) при комнатной температуре по каплям в течение нескольких мин добавляли алюмогидрид лития (0,43 мл, 0,43 ммоль, 1,0 М в ТГФ). Эту смесь перемешивали при комнатной температуре в течение 6 ч, а затем гасили осторожным добавлением 2 н. гидроксида натрия (0,5 мл) при 0 С. Затем добавляли избыток твердого гидрокарбоната натрия и этилацетат (5 мл), и эту смесь быстро перемешивали в течение 30 мин, а затем фильтровали через целит, промывая этилацетатом. Растворитель выпаривали в вакууме, и сырой остаток очищали колоночной хроматографией на силикагеле, элюируя смесью сначала смесью гексан:этилацетат (1:1), а затем гексан:этилацетат:раствор аммиака(10:90:1), с получением указанного в заголовке соединения в виде бесцветного масла (15,0 мг,48%). ЯМР (CDCl3) : 1.38 (s, 3H), 1.79-1.90 (m,4 Н), 2.50 (t, 2H), 2.65 (t, 2H), 2.84 (m, 2H), 3.03 К раствору 3-гексил-6-метил-6-[3-(1H1,2,3-триазол-5-ил)фенил]-3-азабицикло[3.1.0] гексан-2-она (подготовительный пример 40, 2,88 ммоль) в тетрагидрофуране (25 мл) при 0 С добавляли по каплям алюмогидрид лития (5,8 мл,5,76 ммоль, 1,0 М в ТГФ) в течение нескольких мин. Эту смесь перемешивали при комнатной температуре в течение 2 ч, а затем гасили осторожным добавлением 2 н. гидроксида натрия (3 мл) при 0 С. Затем добавляли этилацетат (15 мл), и эту смесь быстро перемешивали в течение 30 мин, а затем фильтровали через целит,промывая этилацетатом. Растворитель выпаривали в вакууме, и сырой остаток очищали колоночной хроматографией на силикагеле, элюируя К раствору 3-гексил-6-метил-6-[3-(4 Н 1,2,4-триазол-3-ил)фенил]-3-азабицикло[3.1.0] гексан-2-она (подготовительный пример 43, 220 мг, 0,65 ммоль) в тетрагидрофуране (5 мл) при комнатной температуре добавляли по каплям алюмогидрид лития (1,3 мл, 1,30 ммоль, 1,0 М в ТГФ) в течение нескольких мин. Затем эту смесь нагревали с обратным холодильником в течение 2 ч, а затем охлаждали до 0 С. Осторожно добавляли 2 н. гидроксид натрия (1,0 мл) с последующим добавлением этилацетата (10 мл), и эту смесь быстро перемешивали в течение 30 мин, а затем фильтровали через целит. Фильтрат концентрировали в вакууме, и остаток очищали колоночной хроматографией на силикагеле, элюируя смесью этилацетат:метанол: раствор аммиака (0,880) (80:20:1), с получением соединения, указанного в заголовке (190 мг,90%), в виде бесцветного масла. ЯМР (CDCl3) : 0.82-0.92 (m, 3H), 1.25-1.38 К раствору 3-гексил-6-[3-(1 Н-имидазол-2 ил)фенил]-6-метил-3-азабицикло[3.1.0]гексан-2 она (подготовительный пример 44, 190 мг, 0,56 ммоль) в тетрагидрофуране (5 мл) при комнатной температуре добавляли по каплям алюмо 51 гидрид лития (1,1 мл, 1,12 ммоль, 1,0 М в ТГФ) в течение нескольких мин. Эту смесь нагревали с обратным холодильником в течение 1 ч, а затем охлаждали до 0 С. Осторожно добавляли 2 н. гидроксид натрия (1,0 мл) с последующим добавлением этилацетата (10 мл), и эту смесь быстро перемешивали в течение 30 мин, а затем фильтровали через целит. Фильтрат концентрировали в вакууме, и остаток очищали колоночной хроматографией на силикагеле, элюируя смесью этилацетат:метанол:раствор аммиака(0,880) (90:10:1), с получением соединения, указанного в заголовке (140 мг, 74%), в виде белого твердого вещества. ЯМР (СDСl3) : 0.85-0.95 (m, 3H), 1.24-1.36 Раствор 2-амино-4-(3-гексил-6-метил-3 азабицикло[3.1.0]гекс-6-ил)фениламина (подготовительный пример 48, 112 мг, 0,39 ммоль) в муравьиной кислоте (2,0 мл) нагревали с обратным холодильником в течение 1 ч. Эту смесь охлаждали, разбавляли водой (3 мл), и 5 н. гидроксидом натрия доводили рН до 10. Водный слой экстрагировали диэтиловым эфиром (3 х 5 мл) и этилацетатом (2 х 5 мл). Объединенные органические слои высушивали (МgSO4),фильтровали, и растворитель удаляли в вакууме. Сырой остаток очищали колоночной хроматографией на силикагеле, элюируя этилацетатом, а затем смесью этилацетат:метанол:раствор аммиака (0,880) (80:20:1), с получением соединения, указанного в заголовке (46 мг, 40%), в виде бесцветного масла. ЯМР (CDCl3) : 0.85-0.95 (m, 3H), 1.22-1.56 Раствор 2-амино-4-(3-гексил-6-метил-3 азабицикло[3.1.0]гекс-6-ил)фениламина (подготовительный пример 48, 99,0 мг, 0,345 ммоль) в трифторуксусной кислоте (2,0 мл) нагревали с обратным холодильником в течение 1 ч. Эту смесь охлаждали, и растворитель удаляли в вакууме. Остаток суспендировали в 2 н. гидроксиде натрия (5 мл), и водный слой экстрагировали диэтиловым эфиром (3 х 5 мл). Объединенные органические слои высушивали (МgSO4),фильтровали и концентрировали в вакууме. Сырой остаток очищали колоночной хроматографией на силикагеле, элюируя этилацетатом, с получением соединения, указанного в заголовке[3.1.0]гекс-6-ил)фениламина (подготовительный пример 12, 0,10 г, 0,37 ммоль) в пиридине (5 мл), охлажденный при 0 С, обрабатывали 2 метилбензолсульфонилхлоридом (0,08 г, 0,44 ммоль). Эту реакционную смесь перемешивали при комнатной температуре в течение 3 ч, добавляли воду (30 мл), и продукт экстрагировали диэтиловым эфиром (30 млх 3). Объединенные органические экстракты высушивали (Na2SO4),а затем концентрировали в вакууме. Сырые продукты очищали препаративной ВЭЖХ (условие 5) с получением ацетатной соли в виде коричневой смолы (30 мг, 20%). ЯМР (CDCl3, отобранные данные для ацетатной соли) : 0.9 (m, 3H), 1.1-1.2 (m, 9H), 1.6 Указанное в заголовке соединение получали способом примера 29, заменяя 2-метилбензолсульфонилхлорид 2-хлорбензолсульфонилхлоридом (90 мг, 0,44 ммоль) с получением светло-коричневой смолы (30 мг, 18%). ЯМР (CDCl3, отобранные данные для ацетатной соли) : 0.9 (m, 3H), 1.1-1.2 (m, 9H), 1.6[3.1.0]гекс-6-ил)фениламина (подготовительный пример 12, 0,10 г, 0,37 ммоль) в пиридине (5 мл), охлажденный при 0 С, обрабатывали 4 хлорбензолсульфонилхлоридом (90 мг, 0,44 ммоль). Эту реакционную смесь перемешивали при комнатной температуре в течение 3 ч, добавляли воду (30 мл), и продукт экстрагировали диэтиловым эфиром (30 млх 3). Объединенные органические экстракты высушивали (Na2SO4),а затем концентрировали в вакууме. Сырые продукты очищали препаративной ВЭЖХ (условие 5). Полученную ацетатную соль превращали в основание насыщенным водным раствором гидрокарбоната натрия (20 мл) и экстрагировали дихлорметаном (2 х 20 мл). Объединенные органические экстракты высушивали(Na2SO4) и концентрировали в вакууме с получением бесцветного масла (20 мг, 13%). ЯМР (CDCl3, отобранные данные для свободного основания) : 0.85 (m, 3H), 1.2-1.35 (m,6 Н), 1.4 (s, 3H), 1.7 (m, 2H), 2.5 (m, 2H), 2.9 (m,2H), 6.8 (d, 1H), 6.9 (s, 1H), 7.0 (d, 1H), 7.1 (t,1H), 7.4 (d, 2H), 7.65 (d, 2H). МС (ЭР): m/z (MH+) 447,3; C24H31ClN2O2S Указанное в заголовке соединение получали способом примера 31, заменяя 4-хлорбензолсульфонилхлорид 2-[(хлорсульфонил)амино] пропаном (подготовительный пример 49, 70 мг,0,44 ммоль), с получением бесцветного масла(20 мг, 14%). ЯМР (СDСl3, отобранные данные для ацетатной соли) : 0.85 (m, 3H), 1.15 (d, 6H), 1.2-1.4 Указанное в заголовке соединение получали способом примера 31, заменяя 4-хлорбензолсульфонилхлорид 1-бутансульфонилхлоридом (69 мг, 0,44 ммоль), с получением бесцветного масла (20 мг, 14%). МС (ЭР): m/z (МH+) 393,3; C22H36N2O2S + Н требует 393,3. Аналитическая ВЭЖХ чистота: 95%, время задержки 17,6 мин (условие 6). Пример 34. N-[3-(3-Гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)фенил]-1-метил-1Hимидазол-4-сульфонамид.[3.1.0]гекс-6-ил)фениламина (подготовительный пример 12, 0,10 г, 0,37 ммоль) в пиридине (5 мл), охлажденный при 0 С, обрабатывали 1 метил-1 Н-имидазол-4-сульфонилхлоридом (0,08 г, 0,44 ммоль). Эту реакционную смесь перемешивали при комнатной температуре в течение 3 ч, добавляли воду (30 мл), и продукт экстрагировали дихлорметаном (30 млх 3). Объединенные органические экстракты высушивали(Na2SO4), а затем концентрировали в вакууме. Сырые продукты очищали препаративной ВЭЖХ (условие 5). Полученную ацетатную соль превращали в основание насыщенным вод 55 ным раствором гидрокарбоната натрия (20 мл) и экстрагировали дихлорметаном (2 х 20 мл). Объединенные органические экстракты высушивали(Na2SО 4) и концентрировали в вакууме с получением беловатого твердого вещества (30 мг,20%). ЯМР (СDСl3, отобранные данные для свободного основания) : 0.9 (t, 3H), 1.2-1.35 (m,6H), 1.4 (s, 3H), 1.65 (m, 2H), 2.45 (m, 2 Н), 2.8[3.1.0]гекс-6-ил)фениламина (подготовительный пример 12, 0,10 г, 0,37 ммоль) в пиридине (5 мл), охлажденный при 0 С, обрабатывали 2,1,3 бензоксадиазол-4-сульфонилхлоридом (0,1 г,0,44 ммоль). Эту реакционную смесь перемешивали при комнатной температуре в течение 3 ч,добавляли воду (30 мл), и продукт экстрагировали диэтиловым эфиром (30 млх 3). Объединенные органические экстракты высушивали(Na2SO4), а затем концентрировали в вакууме. Сырые продукты очищали препаративной ВЭЖХ (условие 1) с получением ацетатной соли в виде беловатой смолы (14 мг, 8%). ЯМР (CDCl3, отобранные данные для ацетатной соли) : 0.85 (t, 3H), 1.2-1.30 (m, 6H), 1.35 К раствору гидрохлоридной соли N-[3-(6 метил-3-азабицикло[3.1.0]гекс-6-ил)фенил]метансульфонамида (подготовительный пример 53, 57 мг, 0,18 ммоль) в N,N-диметилформамиде(2 мл) добавляли раствор гидрокарбоната натрия (63 мг, 0,75 ммоль) и 1-бром-5-метилгексан(37 мг, 0,20 ммоль). Эту реакционную смесь нагревали в течение 30 ч при 50 С, а затем охлаждали до комнатной температуры. Добавляли диэтиловый эфир (5 мл) с последующим добавлением воды (10 мл), органические экстракты отделяли, и водный слой промывали дополнительно диэтиловым эфиром (2 х 5 мл). Объединенные органические экстракты высушивали(Na2SO4) и концентрировали в вакууме. Остатки очищали флэш-хроматографией на Картридже ТФЭ, содержащем силикагель (5 г), элюируя смесью дихлорметаном: этанолом: 0,880 аммиаком (200:8:1) с получением продукта в виде масла (32 мг, 49%). ЯМР (CDCl3, отобранные данные для свободного основания) : 0.85 (d, 6 Н), 1.15-1.6 (m,8H), 1.5 (s, 3H), 1.75 (m, 2H), 2.5 (m, 2 Н), 2.8-3.0 К раствору соли гидрохлорида N-[3-(6 метил-3-азабицикло[3.1.0]гекс-6-ил)фенил]метансульфонамида (подготовительный пример 53, 68 мг, 0,23 ммоль) в N,N-диметилформамиде(2 мл) добавляли раствор гидрокарбоната натрия (76 мг, 0,90 ммоль) и (2-бромэтил)бензол(46 мг, 0,25 ммоль). Эту реакционную смесь нагревали в течение 17 ч при 50 С, а затем охлаждали до комнатной температуры. Добавляли диэтиловый эфир (5 мл) с последующим добавлением воды (10 мл), органические экстракты отделяли, и водный слой промывали дополнительно диэтиловым эфиром (3 х 6 мл). Объединенные органические экстракты высушивали над (Na2SO4) и концентрировали в вакууме. Остатки очищали флэш-хроматографией на картридже ТФЭ, содержащем силикагель (5 г),элюируя смесью дихлорметан:этанол:0,880 аммиак (200:8:1), с получением продукта в виде бледно-желтого масла (35 мг, 41%). ЯМР (СDCl3, отобранные данные для свободного основания) : 1.6 (s,3H), 1.8 (m, 2H),2.75-2.85 (m, 4H), 2.9-3.1 (m, 7H), 6.9-7.1 (m,3H), 7.15-7.3 (m, 6H). МС (ЭР): m/z (MH+) 371,0; C21H26N2O2S + Н требует 371,2. Пример 38. N-3-[6-Метил-3-(2-феноксиэтил)-3-азабицикло[3.1.0]гекс-6-ил]фенилметансульфонамид К раствору гидрохлоридной соли N-[3-(6 метил-3-азабицикло[3.1.0]гекс-6-ил)фенил]метансульфонамида (подготовительный пример 53, 57 мг, 0,18 ммоль) в N,N-диметилформамиде(2 мл) добавляли раствор гидрокарбоната натрия (63 мг, 0,75 ммоль) и 2-(бромэтокси)бензол(42 мг, 0,20 ммоль). Эту реакционную смесь нагревали в течение 30 ч при 50 С, а затем охлаждали до комнатной температуры. Добавляли диэтиловый эфир (5 мл) с последующим добавлением воды (10 мл), органические экстракты отделяли, и водный слой промывали дополнительно диэтиловым эфиром (2 х 5 мл). Объединенные органические экстракты высушивали над (Nа 2SO4) и концентрировали в вакууме. Остатки очищали флэш-хроматографией на картридже ТФЭ, содержащем силикагель (5 г),элюируя смесью дихлорметан:этанол:0,880 аммиак (200:8:1), с получением продукта в виде масла (41 мг, 59%). ЯМР (CDCl3, отобранные данные для свободного основания) : 1.5 (s, 3H), 1.8 (m, 2H),2.9-3.1 (m, 9 Н), 4.05 (m, 2H), 6.85-6.95 (m, 3H),7.0-7.1 (m, 3H), 7.2-7.35 (m, 3H). МС (ЭР): m/z (MH+) 387,3; C21H26N2O3S + Н требует 387,2. Пример 39. 2-[3-(3-Гексил-6-метил-3 азабицикло[3.1.0]гекс-6-ил)анилино]сульфонилацетамид Раствор этилового эфира 2-[3-(3-гексил-6 метил-3-азабицикло[3.1.0]гекс-6-ил)анилино] сульфонилуксусной кислоты (пример 41, 0,13 г, 0,38 ммоль) в аммиаке (2 М в метаноле, 3,0 мл, 1,5 ммоль) нагревали до 60 С в течение 12 ч в запаянной трубке. Эту смесь охлаждали, концентрировали в вакууме, а затем очищали хроматографией на силикагеле, элюируя смесью метанол:этилацетат (2:98), с получением продукта в виде бледно-желтой пены (80 мг, 53%). ЯМР (CDCl3, отобранные данные для свободного основания) : 0.9 (m, 3H), 1.25-1.4 (m,6 Н), 1.4-1.5 (m, 5 Н), 1.8 (m, 2 Н), 2.5 (m, 2 Н),2.85-3.0 (m, 4H), 3.85 (s, 2H), 5.8 (br, 1H), 6.3 (br,1H), 7.1-7.25 (m, 4H). МС (ЭР): m/z (MH+) 394,4; С 20 Н 31N3O3S + Н требует 394,2.Kronieczny, J. Am. Chem. Soc., 1992, 114 (5),1743; 0,96 г, 0,60 ммоль). Эту реакционную смесь перемешивали при комнатной температуре в течение 16 ч, а затем концентрировали в вакууме. Сырой остаток очищали хроматографией на силикагеле, элюируя смесью этилацетат:2 М аммиак в метаноле (99:1). ЯМР (CDCl3, отобранные данные для свободного основания) : 0.9 (m, 3H), 1.2-1.4 (m,6 Н), 1.45 (m, 2 Н), 1.5 (s, 3H), 1.8 (m, 2 Н), 2.4 (m,2 Н), 2.8 (m, 2H), 3.0 (m, 2H), 3.2 (m, 2H), 3.4 (s,3H), 3.8 (m, 2H), 6.95-7.15 (m, 3H), 7.25 (m, 1H). МС (ЭР): m/z (МН+) 395,2; C21H34N2O3S + К раствору 3-(3-гексил-6-метил-3-азабицикло[3.1.0]гекс-6-ил)фениламина (подготовительный пример 12, 0,50 г, 1,84 ммоль) в дихлорметане (5,0 мл) добавляли пиридин (0,27 мл) в дихлорметане (2,5 мл) и этиловый эфир (2 хлорсульфонил)уксусной кислоты (J.E. Oliver,A.B. DeMilo, Synthesis, 1975, 321; 0,48 г, 2,5 ммоль). Эту реакционную смесь перемешивали при комнатной температуре в течение 8 ч, добавляли насыщенный водный раствор гидрокарбоната натрия (10 мл), органические экстракты отделяли, и водный слой дополнительно экстрагировали дихлорметаном (2 х 10 мл). Объединенные органические слои высушивали(МgSO4) и концентрировали в вакууме. Сырые экстракты очищали хроматографией на силикагеле, элюируя смесью этилацетатгексан (10:1), с получением бесцветного масла, которое затвердевало при охлаждении (0,70 г, 91%). ЯМР (СDСl3, отобранные данные для свободного основания) : 0.85 (m, 3H), 1.2-1.4 (m, 59 9 Н), 1.4 (m, 2 Н), 1.5 (s, 3H), 1.7 (m, 2H), 2.4 (m,2H), 2.8 (m, 2H), 3.0 (m, 2H), 3.85 (s, 2H), 4.25 (q,2H), 7.05-7.2 (m, 4H). МС (ЭР): m/z (MH+) 423,2; C22H34N2O4S +[3.1.0]гекс-6-ил)фениламина (подготовительный пример 12, 0,75 г, 0,28 ммоль) в пиридине (1,5 мл), охлажденный при 0 С, обрабатывали 2 пропансульфонилхлоридом (0,05 г, 0,33 ммоль). Эту реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Эту реакционную смесь концентрировали в вакууме, и сырой остаток красного цвета очищали хроматографией на силикагеле (5 г), элюируя смесью гексан:этилацетат:0,880 аммиак (50:50:0,5), с получением продукта в виде светло-желтой смолы (15 мг, 14%). ЯМР (СDСl3, отобранные данные для свободного основания) : 0.9 (t, 3H), 1.05-1.15 (m,12H), 1.2-1.35 (m, 5H), 1.8 (m, 2H), 2.5 (m, 2H),2.8 (m, 2H), 3.0 (m, 2 Н), 3.2 (m, 1H), 6.95-7.1 (m,2H), 7.15-7.25 (m, 2H). МС (ЭР): m/z (MH+) 379,4; C21H34N2O2S + Н требует 379,2. Пример 43. N-3-[3-(5-Цианопентил)-6 метил-3-азабицикло[3.1.0]гекс-6-ил]фенилметансульфонамид К раствору гидрохлоридной соли N-[3-(6 метил-3-азабицикло[3.1.0]гекс-6-ил)фенил]метансульфонамида (подготовительный пример 53, 57 мг, 0,18 ммоль) в N,N-диметилформамиде(2 мл) добавляли раствор гидрокарбоната натрия (63 мг, 0,75 ммоль) и 6-бромгексаннитрил(36 мг, 0,20 ммоль). Эту реакционную смесь нагревали в течение 30 ч при 50 С, а затем охлаждали до комнатной температуры. Добавляли диэтиловый эфир (5 мл) с последующим добавлением воды (10 мл), органические экстракты отделяли, и водный слой промывали дополнительно диэтиловым эфиром (2 х 5 мл). Объединенные органические экстракты высушивали(32 мг, 49%). ЯМР (СDСl3, отобранные данные для свободного основания) : 1.4-1.6 (m, 7H), 1.7 (m,2H), 1.8 (m, 2H), 2.3 (m, 2H), 2.5 (m, 2H), 2.8 (m,2H), 2.9-3.0 (m, 5 Н), 6.95-7.1 (m, 3H), 7.25 (t,1H). МС (ЭР): m/z (MH+) 362,2; С 19H27N3O2S + Н требует 362,2. Пример 44. N-3-[6-Метил-3-(4,4,4-трифторбутил)-3-азабицикло[3.1.0]гекс-6-ил]фенилметансульфонамид К раствору гидрохлоридной соли N-[3-(6 метил-3-азабицикло[3.1.0]гекс-6-ил)фенил]метансульфонамида (подготовительный пример 53, 57 мг, 0,18 ммоль) в N,N-диметилформамиде(2 мл) добавляли раствор гидрокарбоната натрия (63 мг, 0,75 ммоль) и 4-бром-1,1,1 трифторбутан (40 мг, 0,20 ммоль). Эту реакционную смесь нагревали в течение 30 ч при 50 С,а затем добавляли дополнительное количество 4-бром-1,1,1-трифторбутана (20 мг, 0,10 ммоль). Эту реакционную смесь охлаждали до комнатной температуры, добавляли диэтиловый эфир(5 мл) с последующим добавлением воды (10 мл), органические экстракты отделяли, и водный слой промывали дополнительно диэтиловым эфиром (2 х 5 мл). Объединенные органические экстракты высушивали (Na2SO4) и концентрировали в вакууме. Остатки очищали флэшхроматографией на картридже ТФЭ, содержащем силикагель (5 г), элюируя смесью дихлорметан:этанол:0,880 аммиак (200:8:1), с получением продукта в виде масла (29 мг, 43%). ЯМР (СDСl3, отобранные данные для свободного основания) : 1.5 (s, 3H), 1.65-2.85 (m,4H), 2.15 (m, 2H), 2.6 (m, 2H), 2.8-3.1 (m, 4H), 3.0 К раствору гидрохлоридной соли N-[3-(6 метил-3-азабицикло[3.1.0]гекс-6-ил)фенил]метансульфонамида (подготовительный пример
МПК / Метки
МПК: C07D 209/52, A61P 17/02, A61K 31/40
Метки: лигандов, 3-азабицикло[3.1.0]гексана, опиатных, производные, качестве, рецепторов
Код ссылки
<a href="https://eas.patents.su/30-4672-proizvodnye-3-azabiciklo310geksana-v-kachestve-ligandov-opiatnyh-receptorov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 3-азабицикло[3.1.0]гексана в качестве лигандов опиатных рецепторов</a>
Предыдущий патент: Голографический лазерный сканер модульной конструкции
Следующий патент: Непептидильные ингибиторы vla-4-зависимого связывания клеток, применяемые при лечении воспалительных, аутоимунных и респираторных заболеваний
Случайный патент: Система для гидрирования тетрагалогенида кремния и кремния в тригалогенсилан












