Производные триазолопиридазина в качестве лигандов для гамк рецепторов
Номер патента: 2755
Опубликовано: 29.08.2002
Авторы: Харрисон Тимоти, Мэйдин Эндрю, Скотт Гейл, Гвиблин Александер Ричард, Мур Кевин Вилльям, Кастро Пинейро Хосе Луис, Расселл Майкл Джеффри Нейл, Стрит Лесли Джозеф, Карлинг Вилльям Роберт, Коллинз Ян Джеймс
Формула / Реферат
1. Соединение формулы I или его фармацевтически приемлемая соль
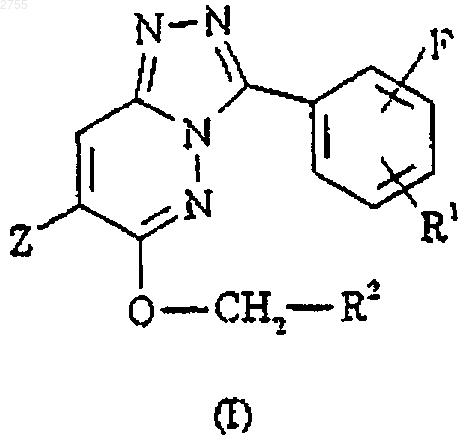
где Z представляет собой трифторметил, 2-метилпропил, 2,2-диметилпропил, 3-метилбутил, 1-фторбут-3-енил, циклобутил, 1-метилциклобутил, 1-фторциклобутил, 3-фторциклобутил, 3,3-дифторциклобутил, 3-гидроксициклобутил, 3-бензилоксициклобутил, 3-оксоциклобутил, 1-метилциклогексил, 4,4-дифтор-1-метилциклогексил, циклопентилметил, 4-фторциклогекс-3-енил, 3-фторфенил, тетрагидрофур-2-ил, пирролидин-1-ил, 4-метилтетрагидропиран-4-ил или тиен-2-ил;
R1 представляет собой водород или фтор и
R2 представляет собой метилизоксазолил, метилпиразолил, метилимидазолил, бензимидазолил или метилтриазолил; при условии, что если Z представляет собой 1-метилциклобутил, R1 является водородом, а R2 представляет собой 1-метил-1Н-1,2,4-триазол-3-ил или 2-метил-2Н-1,2,4-триазол-3-ил, тогда атом фтора не находится в положении 2 фенильного кольца.
2. Соединение по п.1, где Z представляет собой циклобутил.
3. Соединение по п.1 или 2, где R2 представляет собой циклическую структуру (а), (b), (с), (d), (е), (f) или (g)
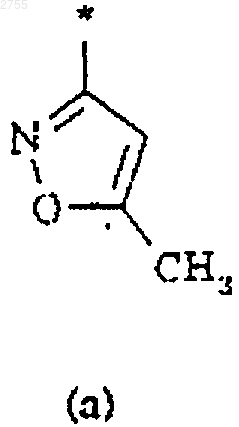
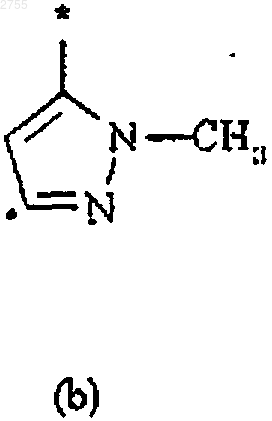
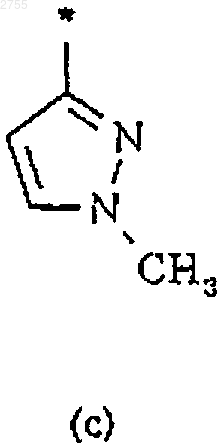


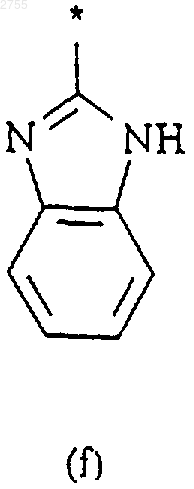
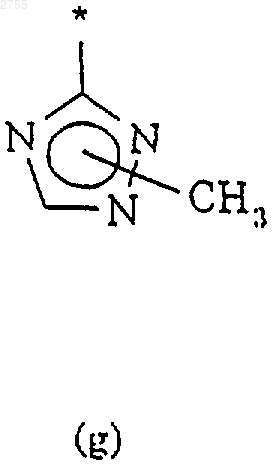
где звездочка * означает место присоединения кольца к остальной части молекулы.
4. Соединение по п.3, где R2 представляет собой кольцевую структуру (g) по п.3.
5. Соединение по п.1, представленное формулой IIА или его фармацевтически приемлемая соль
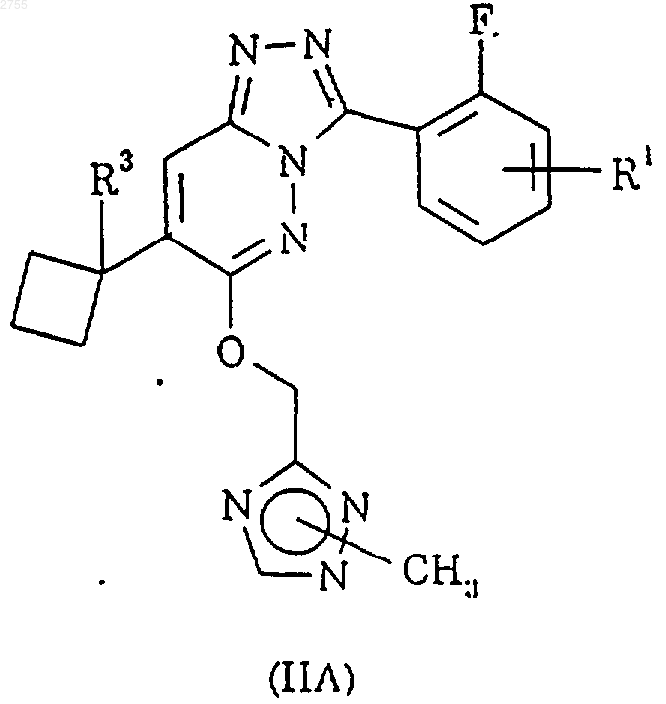
где R1 определен в п.1; а R3 представляет водород или фтор.
6. Соединение по п.1, представленное формулой IIB или его фармацевтически приемлемая соль
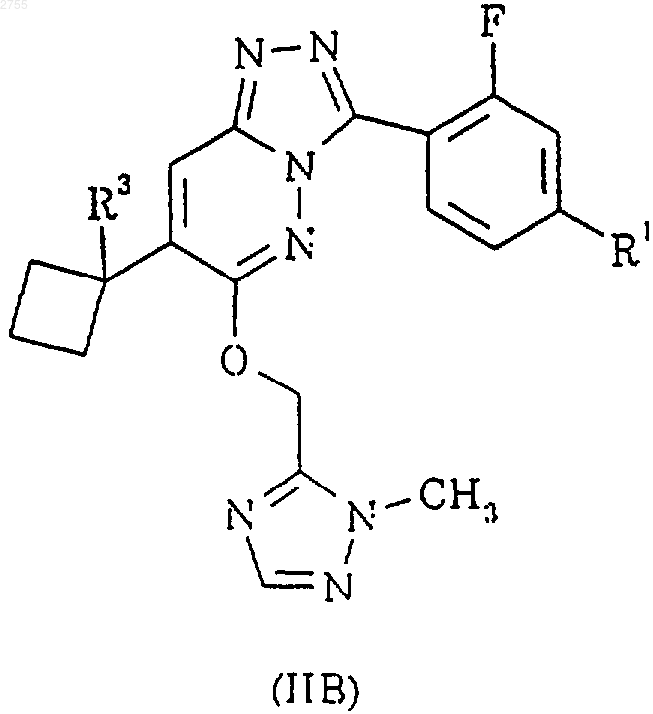
где R1 определен в п.1; а R3 определен в п.5.
7. Соединение по п.5 или 6, где R3 представляет собой водород.
8. Соединение, выбранное из группы, включающей
7-циклобутил-3-(2-фторфенил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
7-циклобутил-3-(2-фторфенил)-6-(1-метил-1Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
7-циклобутил-3-(3-фторфенил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
7-циклобутил-3-(4-фторфенил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
7-циклобутил-3-(2,4-дифторфенил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
7-циклобутил-3-(3,5-дифторфенил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
3-(2,4-дифторфенил)-7-(1-метилциклобутил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
7-циклобутил-3-(3,4-дифторфенил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
7-циклобутил-3-(2,3-дифторфенил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
7-циклобутил-3-(2,6-дифторфенил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
7-циклобутил-3-(2,5-дифторфенил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
3-(2,4-дифторфенил)-7-(1-метилциклогексил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
3-(2,4-дифторфенил)-7-(1-метилциклогексил)-6-(1-метил-1Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
7-циклобутил-3-(2-фторфенил)-6-(1-метил-1Н-пиразол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
7-циклобутил-3-(2-фторфенил)-6-(5-метилизоксазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
7-циклобутил-3-(2-фторфенил)-6-(1-метил-1Н-имидазол-2-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
7-циклобутил-3-(2-фторфенил)-6-(4-метил-4Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло [4,3-b]пиридазин;
3-(2-фторфенил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-7-(тиен-2-ил)-1,2,4-триазоло[4,3-b]пиридазин;
3-(2,4-дифторфенил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-7-(тиен-2-ил)-1,2,4-триазоло[4,3-b]пиридазин;
6-(1Н-бензимидазол-2-илметокси)-7-циклобутил-3-(2,4-дифторфенил)-1,2,4-триазоло[4,3-b]пиридазин;
3-(2,4-дифторфенил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-7-(пирролидин-1-ил)-1,2,4-триазоло[4,3-b]пиридазин;
3-(2,4-дифторфенил)-6-(1-метил-1Н-1,2,4-триазол-3-илметокси)-7-(пирролидин-1-ил)-1,2,4-триазоло[4,3-b]пиридазин;
3-(2-фторфенил)-6-(1-метил-1Н-1,2,4-триазол-3-илметокси)-7-(пирролидин-1-ил)-1,2,4-триазоло[4,3-b]пиридазин;
7-циклобутил-3-(2-фторфенил)-6-(1-метил-1Н-имидазол-4-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
7-(1-фторциклобутил)-3-(2-фторфенил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
7-циклобутил-3-(2-фторфенил)-6-(2-метил-2Н-пиразол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин
и их фармацевтически приемлемые соли.
9. Соединение, выбранное из группы, включающей
7-(2,2-диметилпропил)-3-(2-фторфенил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
3-(2-фторфенил)-7-(2-метилпропил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
3-(2-фторфенил)-7-(3-метилбутил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
7-циклопентилметил-3-(2-фторфенил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
7-(3-бензилоксициклобутил)-3-(2-фторфенил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
3-(2-фторфенил)-7-(3-гидроксициклобутил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло-[4,3-b]пиридазин;
7-(1-фторбут-3-енил)-3-(2-фторфенил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
7-(3-фторциклобутил)-3-(2-фторфенил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
3-(2-фторфенил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-7-трифторметил-1,2,4-триазоло[4,3-b]пиридазин
и их фармацевтически приемлемые соли.
10. Соединение, выбранное из группы, включающей
3-(2-фторфенил)-7-(4-метилтетрагидропиран-4-ил)-6-(2-метил-2Н-1,2,4-триазол-3-ил-метокси)-1,2,4-триазоло[4,3-b]пиридазин;
3-(2-фторфенил)-7-(4-метилтетрагидропиран-4-ил)-6-(1-метил-1Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
7-(4,4-дифтор-1-метилциклогексил)-3-(2-фторфенил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
7-(4-фтор-1-метилциклогекс-3-енил)-3-(2-фторфенил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
7-(4,4-дифтор-1-метилциклогексил)-3-(2-фторфенил)-6-(1-метил-1Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
3-(2-фторфенил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-7-(3-оксоциклобутил)-1,2,4-триазоло[4,3-b]пиридазин;
7-(3,3-дифторциклобутил)-3-(2-фторфенил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
3-(2-фторфенил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-7-(тетрагидрофур-2-ил)-1,2,4-триазоло[4,3-b]пиридазин;
1-(3-фторфенил)-3-(2-фторфенил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин
и их фармацевтически приемлемые соли.
11. Фармацевтическая композиция, включающая соединение формулы I по п.1 или его фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым носителем.
12. Применение соединения по любому из пп.1-10 для производства медикамента для лечения и/или профилактики состояния тревоги.
13. Применение соединения по любому из пп.1-10 для производсттр медикамента для лечения и/или профилактики судорог.
14.Способ получения соединения по п.1, отличающийся тем, что включает взаимодействие соединения формулы III с соединением формулы IV
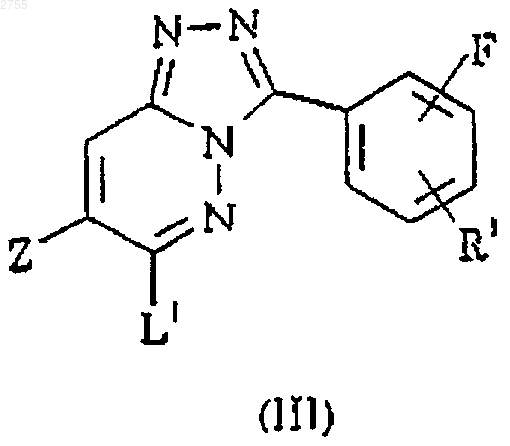
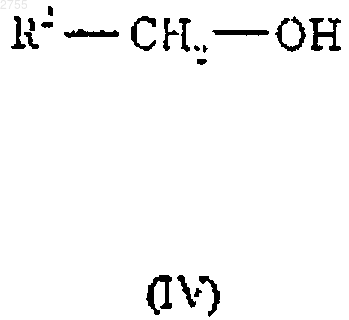
где Z, R1 и R2 определены в п.1, L1 представляет собой подходящую уходящую группу.
15. Способ лечения и/или профилактики состояния тревоги, включающий введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы I, указанной в п.1, или его фармацевтически приемлемой соли.
16. Способ лечения и/или профилактики судорог, включающий введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы I, указанной в п.1, или его фармацевтически приемлемой соли.
17. Соединение по п.1, которое представляет собой 7-циклобутил-3-(2,6-дифторфенил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин.
18. Фармацевтическая композиция по п.11 для лечения и/или профилактики состояния тревоги, отличающаяся тем, что в качестве соединения формулы I она содержит 7-циклобутил-3-(2,6-дифторфенил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин.
19. Применение по п.12, где соединение формулы I представляет собой 7-циклобутил-3-(2,6-дифторфенил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин.
20. Способ по п.15, отличающийся тем, что в качестве соединения формулы I вводят 7-циклобутил-3-(2,6-дифторфенил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин.
Текст
1 Данное изобретение относится к классу замещенных производных триазолопиридазина и их применению в терапии. В частности, данное изобретение касается замещенных 1,2,4 триазоло[4,3-b]пиридазина, которые являются лигандами для ГАМК рецепторов, поэтому могут использоваться при лечении нарушенных психических состояний. Рецепторы для главного подавляющего нейротрансмиттера - гамма-аминомасляной кислоты (ГАМК) делятся на два основных класса:(1) ГАМКA рецепторы, которые являются членами подкласса ионных каналов с лигандным затвором, и (2) ГАМКB рецепторы, которые могут быть членами подкласса рецептора, связанного с G-белком. С тех пор, как были клонированы первые сДНК, кодирующие субъединицы индивидуальных ГАМКA рецепторов, число известных их членов в семействе млекопитающих возросло и включает, по меньшей мере,шестьсубъединиц, четыресубъединицы,трисубъединицы, однусубъединицу, однусубъединицу и двесубъединицы. Несмотря на то, что знание о множестве генного семейства ГАМКA рецепторов представляет собой гигантский шаг вперед в наших представлениях об этом ионном канале с лигандным затвором, взгляды на степень разнообразия подтипов до сих пор находятся на ранних стадиях. Было отмечено, чтосубъединица,субъединица исубъединица составляют минимальный набор для формирования полностью функционального ГАМКA рецептора, экспрессируемого транзиционно трансфектирующими сДНК в клетках. Как указывалось выше, ,исубъединицы также существуют, однако, присутствуют в популяциях ГАМКA рецепторов лишь в незначительной степени. Исследования размеров рецептора и наблюдения с помощью электронной микроскопии привели к выводу, что также как и другие члены семейства ионных каналов с лигандным затвором ГАМКA рецепторы существуют в пентамерной форме. Выбор, по меньшей мере, однойсубъединицы, однойсубъединицы и однойсубъединицы из набора, состоящего из семнадцати единиц, допускает возможность существования более 10 000 пентамерных комбинаций субъединиц. Более того, этот расчет учитывает дополнительные перестановки, которые могут быть возможны, если расположение субъединиц вокруг ионного канала не имеет никаких ограничений (т.е. возможны 120 вариантов рецептора, состоящего из пяти различных субъединиц). Реально существующие комбинации подтипов рецептора включают, среди множества других, 122, 22/32, 32/3, 21,532/3, 62, 6, 4. Комбинации подтипов, содержащие субъединицу 1, присутствуют в большинстве областей мозга, и полага 002755 2 ют, что у крысы на их долю приходится более 40% ГАМКA рецепторов. Комбинации подтипов, содержащие субъединицы 2 и 3, у крысы, как полагают, составляют примерно 25% и 17% ГАМКA рецепторов соответственно. Комбинации подтипов, содержащие субъединицу 5, преимущественно выраженные в гипокампусе и кортикальном слое, и полагают, что у крысы составляют примерно 4% ГАМКA рецепторов. Характерным свойством всех известных ГАМКA рецепторов является присутствие ряда модуляторных сайтов, одним из которых является сайт, связывающий бензодиазипин (BZ). Сайт, связывающий бензодиазипин, является наиболее изученным из модуляторных сайтов ГАМКA рецептора, а также сайтом, посредством которого анксиолитики, такие как диазепам и темазепам, проявляют свое действие. До клонирования генного семейства ГАМКA рецептора,связывающий бензодиазипин, был на основе исследовании связывания радиолиганда традиционно разделен на два подтипа: BZ1 и BZ2. Было показано, что подтип BZ1 фармакологически эквивалентен ГАМКA рецептору, включающему субъединицу 1 в комбинации с субъединицамии 2. Это - наиболее распространенный подтип ГАМКA рецептора, и полагается,что он составляет практически половину всех ГАМКA рецепторов мозга. Двумя другими основными представителями являются подтипы 22 и 32/3. Вместе они образуют примерно еще 35% всего набора ГАМКA рецепторов. Фармакологически эта комбинациям, по-видимому, ведет себя аналогично подтипу BZ2, что определено ранее по связыванию радиолиганда, хотя подтип BZ2 также может включать некоторые комбинации,содержащие подтипы 5. Физиологическая роль указанных подтипов до сих пор неясна, поскольку не известны достаточно селективные агонисты или антагонисты. Теперь предполагается, что агенты, действующие как BZ-агонисты подтипов 12,32 или 32, будут обладать требуемыми анксиолитическими свойствами. Соединения,являющиеся модуляторами сайта ГАМКAрецептора, связывающего бензодиазепин, и действующие как BZ-агонисты, в дальнейшем называются агонистами ГАМКA рецептора. 1 Селективные агонисты ГАМКA рецептора - альпидем и зольпидем, применяются в клинической практике в качестве снотворных средств; полагается, что, по крайней мере, частично седативное действие известных анксиолитиков,которые влияют на сайт, связывающий BZ1,осуществляется через ГАМКA рецепторы, содержащие субъединицу 1. Соответственно принимая во внимание, что агонисты ГАМКA рецепторов, взаимодействуют предпочтительнее с субъединицами 2 и/или 3, чем с 1, они 3 будут эффективны при лечении беспокойств с пониженной склонностью вызывать седативный эффект. Также, агенты, являющиеся антагонистами или обратными агонистами 1, могут использоваться для обращения седативного или гипнотического действия, вызванного агонистами 1. Соединения по данному изобретению, будучи селективными лигандами ГАМКA рецепторов, используются при лечении и/или профилактике большого числа расстройств центральной нервной системы. Такие расстройства включают беспокойства, такие как паника, сопровождаемая или не сопровождаемая боязнью открытых пространств, боязнь открытых пространств без паники, боязнь животных и другие фобии, включая социальные фобии, болезненнокомпульсивное расстройство, стресс, включая пост-травматический и острый стресс, и генерализованные или индуцированные веществами состояния тревоги; неврозы; припадки; мигрень; депрессивные или биполярные растройства,например, однократная или повторяющаяся депрессия, дистимическое расстройство, маниакальное биполярное I или биполярное II расстройства и циклотимическое расстройство; психозы, включая шизофрению; разрушение нервной системы, возникающее вследствие церебральной ишемии; дефицит внимания, вызванный сверхактивностью; и расстройства циркадного (биологического) ритма, например,у субъектов, страдающих замедленной реакцией или сдвигом в рабочем ритме. Другие расстройства, при которых лиганды ГАМКA рецепторов могут оказывать благотворное действие, включают боль или болевые ощущения; рвоту, включая острую, продолжительную и повторяющуюся рвоту, в частности,рвоту, вызванную химиотерапией или радиацией, равно как послеоперационную тошноту и рвоту; расстройства аппетита, включая нервическую анорексию и нервическую булимию; предменструальный синдром; мышечный спазм или спастичность, например, у парализованных больных; и потерю слуха. Селективные лиганды ГАМКA рецепторов также могут быть эффективны при предварительном введении перед анестезией или процедурами, такими как эндоскопия, включая гастроскопию. В DE-A-2741763 и пат. США 4260755,4260756 и 4654343 описаны различные классы 1,2,4-триазоло[4,3-b]пиридазиновых производных, которые могут быть использованы в качестве анксиолитиков. Соединения, описанные вDE-A-2741763 и пат. США 4260755 и 4654343,имеют фенильный заместитель в положении 6 триазолопиридазиновой кольцевой системы. В то же время, соединения, описанные в пат. США 4260756, имеют гетероарильные остатки в положениях 6 и 8. Однако ни в одной из указанных публикаций не содержится описания или 4 упоминания о 1,2,4-триазоло[4,3-b]пиридазиновых производных, в которых заместитель в положении 6 присоединен непосредственно через атом кислорода. ЕР-А-0085840 и ЕР-А-0134946 описывают родственные серии 1,2,4-триазоло[3,4-]фталазиновых производных, которые обладают анксиолитическим действием. Однако в любой из указанных публикаций не содержится ни описания, ни упоминания о замещении бензофрагмента триазолофталазинового кольца какойлибо иной функциональности. Данное изобретение предоставляет класс триазолопиридазиновых производных, обладающих требуемыми свойствами связывания с различными подтипами ГАМКA рецепторов. Соединения согласно данному изобретению как лиганды имеют хорошее сродство к субъединицам 1 и/или 3 ГАМКА рецепторов человека. Соединения по данному изобретению могут взаимодействовать более предпочтительно с субъединицами 2 и/или 3, чем с субъединицей 1. Желательно, чтобы соединения по данному изобретению проявляли функциональную селективность применительно к селективному влиянию на субъединицами 2 и/или 3 по сравнению с субъединицей 1. Соединения по данному изобретению, являясь лигандами рецептора подтипа ГАМКA,имеют связывающее сродство (Кi) к субъединицам 2 и/или 3, измеряемое в опыте, приводимом ниже, порядка 100 нМ или ниже, обычно 50 нМ или ниже, а в идеале 10 нМ или ниже. Соединения согласно данному изобретению могут обладать, по меньшей мере, двукратным, обычно, по меньшей мере, пятикратным, а преимущественно, по меньшей мере, десятикратным селективным сродством к субъединицам 2 и/или 3 по сравнению с субъединицей 1. Однако соединения, не обладающие селективностью связывающего сродства к субъединицам 2 и/или 3 по сравнению с субъединицей 1 также охватываются данным изобретением; желательно, чтобы такие соединения проявляли функциональную селективность применительно к селективному влиянию на субъединицы 2 и/или 3 по сравнению с субъединицей 1. Кроме того, соединения по данному изобретению обладают интересными фармакокинетическими свойствами, особенно в смысле повышенной биологической доступности при пероральном введении. Данное изобретение предоставляет соединение формулы I или его фамацевтически приемлемую сольR1 представляет собой водород или фтор; иR2 представляет собой метилизоксазолил,метилпиразолил, метилимидазолил, бензимидазолил или метилтриазолил; при условии, если Z представляет собой 1-метилциклобутил, R1 является водородом, а R2 представляет собой 1 метил-1 Н-1,2,4-триазол-3-ил или 2-метил-2 Н 1,2,4-триазол-3-ил, тогда атом фтора не находится в положении 2 фенильного кольца. Некоторые соединения по данному изобретению охватываются общим объемом одновременно рассматриваемой международной патентной заявки PCT/GB 97/01946, опубликованной 5 февраля 1998 как WO 98/04559. Однако здесь не дается конкретного раскрытия соединений, соответствующих соединениям формулыI, определенной выше. Данное изобретение также касается соединения формулы I, изображенной выше, или его фармацевтически приемлемой соли, где Z представляет собой трифторметил, 2-метилпропил,2,2-диметилпропил, 3-метилбутил, 1-фторбут-3 енил, циклобутил, 1-метилциклобутил, 1 фторциклобутил, 3-фторциклобутил, 3-гидроксициклобутил, 3-бензилоксициклобутил, 1 метилциклогексил, циклопентилметил, пирролидин-1-ил или тиен-2-ил; аR1 и R2 определены выше; при условии, если Z представляет собой 1 метилциклобутил, R1 является водородом, а R2 представляет собой 1-метил-1 Н-1,2,4-триазол-3 ил или 2-метил-2 Н-1,2,4-триазол-3-ил, тогда атом фтора не находится в положении 2 фенильного кольца. Данное изобретение далее касается соединения формулы I, изображенной выше, или его фармацевтически приемлемой соли, где Z представляет собой циклобутил, 1-метилциклобутил,1-фторциклобутил, 1-метилциклогексил, пирролидин-1-ил или тиен-2-ил; аR1 и R2 определены выше; при условии, если Z представляет собой 1 метилциклобутил, R1 является водородом, а R2 представляет собой 1-метил-1 Н-1,2,4-триазол-3 ил или 2-метил-2 Н-1,2,4-триазол-3-ил, то атом фтора не находится в положении 2 фенильного кольца. Для применения в медицине соли соединения формулы I должны быть фармацевтически приемлемыми солями. Однако другие соли могут использоваться для получения соединений 6 по данному изобретению или их фармацевтически приемлемых солей. Подходящие фармацевтически приемлемые соли соединений по данному изобретению включают аддитивные соли кислот, которые могут быть получены, например, смешением раствора соединения по данному изобретению с раствором фармацевтически приемлемой кислоты, такой как хлористоводородная кислота, серная кислота, метансульфоновая кислота, фумаровая кислота, малеиновая кислота, янтарная кислота, уксусная кислота, бензойная кислота, щавелевая кислота,лимонная кислота, винная кислота, угольная кислота или фосфорная кислота. В соединениях вышеприведенной формулы I заместитель Z предпочтительно представляет собой циклобутил. Заместитель R2 предпочтительно представляет собой кольцо формулы (а), (b), (с), (d),(е), (f) или (g) где звездочкаозначает место присоединения кольца к остальной части молекулы. Предпочтительно, заместитель R2 представлен структурой (g), изображенной выше. Там, где это допустимо, соединения формулы I, указанной выше, имеют атом фтора в положении 2 фенильного кольца. Предпочтительный подкласс соединений по данному изобретению представлен соединениями формулы (IIА) и их фармацевтически приемлемыми солямиR3 представляет собой водород или фтор. Обычно R3 представляет собой водород. Предпочтительно группу соединений вышеуказанной формулы (IIА) представляют соединения формулы (IIB) и их фармацевтически приемлемые соли где R1 и R3 определены выше. Конкретные соединения, охватываемые данным изобретением включают: 7-циклобутил-3-(2-фторфенил)-6-(2-метил 2 Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло 7-(4,4-дифтор-1-метилциклогексил)-3-(2 фторфенил)-6-(2-метил-2 Н-1,2,4-триазол-3 илметокси)-1,2,4-триазоло[4,3-b]пиридазин; 7-(4-фтор-1-метилциклогекс-3-енил)-3-(2 фторфенил)-6-(2-метил-2 Н-1,2,4-триазол-3 илметокси)-1,2,4-триазоло[4,3-b]пиридазин; 7-(4,4-дифтор-1-метилциклогексил)-3-(2 фторфенил)-6-(1-метил-1H-1,2,4-триазол-3 илметокси)-1,2,4-триазоло[4,3-b]пиридазин; 3-(2-фторфенил)-6-(2-метил-2 Н-1,2,4 триазол-3-илметокси)-7-(3-оксоциклобутил)1,2,4-триазоло[4,3-b]пиридазин; 7-(3,3-дифторциклобутил)-3-(2-фторфенил)-6-(2-метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин; 3-(2-фторфенил)-6-(2-метил-2 Н-1,2,4 триазол-3-илметокси)-7-(тетрагидрофур-2-ил)1,2,4-триазоло[4,3-b]пиридазин; 1-(3-фторфенил)-3-(2-фторфенил)-6-(2 метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4 триазоло[4,3-b]пиридазин и их фармацевтически приемлемые соли. Данное изобретение также касается способа лечения и/или профилактики тревоги, который включает введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы I, указанной выше, или его фармацевтически приемлемой соли. Далее, данное изобретение относится к способу лечения и/или профилактики судорог(например, у пациентов, страдающих эпилепсией или подобным растройством), который включает введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы I, указанной выше, или его фармацевтически приемлемой соли. Связывающее сродство (Ki) соединений по данному изобретению к субъединице 3 ГДМКA рацептора человека принимается равным измеренному в испытании, которое будет описано ниже. Связывающее сродство (Ki) соединений по данному изобретению к субъединице 3 в идеале меньше или равно 10 нМ, предпочтительно меньше или равно 2 нМ, а более предпочтительно меньше или равно 1 нМ. Соединения по данному изобретению в идеале должны извлекать, по меньшей мере,40%, предпочтительно, по меньшей мере, 50%, а еще более предпочтительно, по меньшей мере,60% потенцирования отклика ГАМК ЕС 20 в стабильно трансфектируемых рекомбинантных клеточных линиях, выражающих субъединицу 3 ГАМКA рацептора человека. Кроме того,соединения по данному изобретению в идеале должны извлекать не более 30%, предпочтительно не более 20%, а еще более предпочтительно не более 10% потенцирования отклика ГАМК ЕС 20 в стабильно трансфектируемых рекомбинантных клеточных линиях, характеризующих субъединицу 1. ГАМКA рацептора человека. 10 Потенцирование отклика ГАМК ЕС 20 в стабильно трансфектируемых рекомбинантных клеточных линиях, экспрессирующих субъединицы 3 и 1 ГАМКA рацептора человека, могут быть измерены с помощью способа, аналогичного методике, описанной в Wafford et al.,Mol. Pharmcol., 1996, 50, 670-678. Способ может быть соответствующим образом реализован с использованием культур стабильно трансфектируемых эурокатических клеток, обычно - стабильно трансфектируемых Ltk-фибробластов мыши. Соединения по данному изобретению проявляют анксиолитическое действие, что может быть показано на примере положительного отклика в тестах каскадного положительного лабиринта и обусловленного угнетения при питье(cf. Dawson et al., Psychopharmacology, 1995,121, 109-117). Кроме того, соединения по данному изобретению не оказывают существенного седативного действия, что может быть подтверждено соответствующими результатами, полученными из теста отклика чувствительностиet al., J. Psychopharmacol., 1996, 10, 206-213). Соединения по данному изобретению также могут проявлять противосудорожное действие. Это может быть показано на примере способности блокировать приступы, индуцируемые пентилентетразолом у крыс и мышей в соответствии с методикой, аналогично описанной Brislow et al. в J. Pharmacol, Exp. Ther., 1996, 279,492-501. В целях проявления их влияния на поведение, соединения по данному изобретению в идеале должны проникать в мозг; иными словами, эти соединения должны быть способны преодолевать так называемый гематоэнцефалический барьер. Предпочтительно, соединения по данному изобретению должны быть способны проявлять свое благотворное терапевтическое воздействие при введении пероральным путем. Данное изобретение также касается фармацевтических композиций, включающих одно или несколько соединений по данному изобретению в сочетании с фармацевтически приемлемым носителем. Предпочтительно, эти композиции находятся в дозированных формах, таких как таблетки, пилюли, капсулы, порошки, гранулы, стерильные растворы или суспензии для парентерального введения, мерные аэрозоли или жидкие спреи, капли, ампулы, автоинъекционные устройства или суппозитории; для перорального, парентерального, назального, ректального введения или введения под язык или для введения путем ингаляции или инсуффляции. Для приготовления твердых композиции,таких как таблетки, основной активный ингредиент смешивают с фармацевтическим носителем, например, такими общепринятыми ингредиентами для таблетирования, как кукурузный крахмал, лактоза, сахароза, сорбит, тальк, стеа 11 риновая кислота, стеарат магния, дикальцийфосфат или смолы, и другими фармацевтическими разбавителями, например, водой, для получения твердой предварительно составленной композиции, содержащей гомогенную смесь соединения по данному изобретению или его фармацевтически приемлемую соль. Применяемый к этим предварительно составленным композициям термин гомогенная означает, что активный ингредиент распределен равномерно по всей композиции таким образом, что композиция может быть легко разделена на равные эффективные дозированные формы, такие как таблетки, пилюли и капсулы. Эту предварительно составленную композицию затем разделяют на равные эффективные дозированные формы указанных выше типов, содержащие от 0,1 до 500 мг активного ингредиента по данному изобретению. Типичные дозированные формы содержат от 1 до 100 мг, например 1, 2, 5, 10, 25,50 или 100 мг активного ингредиента. Таблетки или пилюли данной новой композиции могут быть покрыты оболочкой или защищены иным образом для получения дозированной формы,обладающей преимуществом длительного действия. Например, таблетка или пилюля может включать внутренний дозированный и внешний дозированный компоненты, последний находится в форме оболочки по отношению к первому. Эти два компонента могут быть разделены энтеральным слоем, который служит для того,чтобы противостоять разрушению в желудке, и позволяет внутреннему компоненту целиком переходить в двенадцатиперстную кишку или задерживает его высвобождение. Для такого энтерального слоя или покрытия могут быть использованы разнообразные вещества, причем такие вещества включают ряд полимерных кислот и смеси полимерных кислот с такими веществами как шеллак, цетиловый спирт или ацетат целлюлозы. Жидкие формы, в которых могут выпускаться новые композиции по данному изобретению, предназначенные для перорального введения или в виде инъекций, могут включать водные растворы, подходящим образом ароматизированные сиропы, водные или масляные суспензии, ароматизированные эмульсии в пищевых маслах, таких как хлопковое масло, кунжутное масло, кокосовое масло или арахисовое масло, равно как и эликсиры и тому подобные фармацевтические формы. Подходящие диспергирующие или суспендирующие агенты для водных суспензий включают синтетические или натуральные смолы, такие как трагант, аравийская камедь, альгинат, декстрин, натриевая соль карбоксиметилцеллюлозы,метилцеллюлоза,поливинилпирролидон или желатин. При лечении беспокойства подходящий уровень дозировки составляет от 0,01 до 250 мг/кг в день, предпочтительно от 0,05 до 100 мг/кг в день, особенно предпочтительно от 0,05 12 до 5 мг/кг в день. Соединения могут вводиться в режиме от 1 до 4 раз в день. Соединения формулы I, определенной выше, могут быть получены способом, который включает взаимодействие соединения формулы где Z, R1 и R2 определены выше, a L1 представляет собой подходящую уходящую группу. Уходящая группа L1 обычно является атомом галогена, особенно - хлора. Реакцию между соединениями III и IV, как правило проводят при перемешивании реагирующих веществ в подходящем растворителе,обычно N,N-диметилформамиде или тетрагидрофуране, в присутствии сильного основания,такого как гидрид натрия, бис(триметилсилил) амид лития или бис(триметилсилил)амид калия. Промежуточные соединения приведенной выше формулы III могут быть получены по реакции соединения формулы V с эквимолярным количеством гидразинового производного формулы VI где Z, R1 и L1 определены выше, а L2 представляет собой подходящую уходящую группу; при необходимости, с последующим разделением образующейся смеси изомеров общепринятыми способами. Уходящая группа L2 обычно является атомом галогена, особенно - хлора. В промежуточных соединениях формулы V уходящие группыL1 и L2 могут быть одинаковыми или различными, но обычно они одинаковы, предпочтительно обе являются атомами хлора. Реакцию между соединениями V и VI обычно проводят при нагревании реагирующих веществ в присутствии доноров протона, таких как гидрохлорид триэтиламина, как правило,при кипении с обратным холодильником в инертном растворителе, таком как ксилол или 1,4-диоксан. 13 Альтернативно, промежуточные соединения вышеприведенной формулы III могут быть получены при взаимодействии гидразинового производного формулы VII с альдегидным производным формулы VIII где Z, R1 и L1 определены выше; с последующей циклизацией полученного таким образом промежуточного основания Шиффа. Реакцию между соединениями VII и VIII обычно проводят в кислых условиях, например в присутствии минеральной кислоты, такой как хлористо-водородная кислота. Циклизация промежуточно образующегося основания Шиффа может затем быть проведена путем обработки хлоридом железа (III) в подходящем растворителе, таком как этанол, при повышенной температуре, обычно в диапазоне 60-70 С. Промежуточные соединения приведенной выше формулы VII могут быть получены по реакции соответствующего соединения формулы V, определенной выше, с гидразингидратом,как правило, в 1,4-диоксане при температуре кипения растворителя с обратным холодильником; при необходимости - с последующим разделением образующейся смеси изомеров с применением общепринятых средств. В альтернативном способе промежуточные соединения приведенной ранее формулы III могут быть получены по реакции гидразинового соединения формулы VII, как указано выше, с соединением формулы IX где R1 определен выше, a Q представляет собой карбоксилатный остаток; с последующей циклизацией полученного таким образом гидразинового производного формулы X: где Z, R1 и L1 определены выше. Подходящие значения реакционноспособного карбоксилатного заместителя Q включают сложные эфиры, например, C1-4 алкиловые сложные эфиры; ангидриды кислот,например,смешанные ангидриды 14 золы. Обычно Q представляет собой остаток хлорангидрида кислоты. Реакцию между соединениями VII и IX обычно проводят в основных условиях, например, в присутствии триэтиламина, как правило в инертном растворителе, таком как диэтиловый эфир, обычно, при температуре, близкой к 0 С. Циклизация полученного соединения формулы Х может быть затем осуществлена обработкой 1,2-дибром-1,1,2,2-тетрахлорэтаном и трифенилфосфином, в присутствии основания, такого,как триэтиламин, предпочтительно в инертном растворителе, таком как ацетонитрил, и обычно при температуре, близкой к 0 С. Как указывалось выше, реакция между соединением V и гидразингидратом или соединением VI обычно приводит к смеси изомерных продуктов, в зависимости от того, замещает ли атом азота в гидразине уходящую группу L1 илиL2. Так, кроме целевого продукта формулы III в некотором количестве обычно получают изомерное соединение, в котором заместитель Z присоединен по положению 8; аналогичное происходит и для соединения VII. Для этой реакции в общем случае необходимо разделение полученной смеси изомеров с помощью общепринятых способов, таких как хроматография. В другом способе соединение формулы I,как определено выше, может быть получено способом, который включает взаимодействие соединения формулы XI (или его 1,2,4 триазоло[4,3-b]пиридазин-6-он таутомера) с соединением формулы XII где Z, R1 и R2 определены выше, а L3 представляет собой подходящую уходящую группу. Уходящая группа L3 обычно является атомом галогена, как правило - хлором или бромом. Реакцию между соединениями XI и XII обычно проводят при перемешивании реагентов в подходящем растворителе, как правило - N,Nдиметилформамиде, в присутствии сильного основания, такого как гидрид натрия. Промежуточные соединения приведенной выше формулы XI могут быть получены при взаимодействии соединения формулы III, как указано выше, с гидроксидом щелочного металла, например, гидроксидом натрия. Реакция обычно происходит в инертном растворителе,таком как водный 1,4-диоксан, в идеале - при температуре кипения растворителя с обратным холодильником. Далее, соединения определенной ранее формулы I могут быть получены способом, который включает реакцию соединения формулы 16 бой 1-фторциклобутил, могут быть получены способом, включающим взаимодействие соединения формулы XVII где Z, R1 и R2 определены выше; в присутствии нитрата серебра и персульфата аммония. Реакцию обычно проводят в подходящем растворителе, например, в воде или водном ацетонитриле; необязательно в кислотных условиях, например, с использованием серной кислоты, как правило, при повышенной температуре. Промежуточные соединения формулы XIII соответствуют соединениям определенной ранее формулы I, где Z является атомом водорода,и поэтому могут быть получены способами,аналогичными описанным выше для получения соответствующих соединений формулы I. В соответствии со следующей процедурой соединения определенной выше формулы I могут быть получены по способу, включающем взаимодействие соединения формулы XIV с соединением формулы XV где Z, R1 и R2 определены выше, М представляет собой -В(ОН)2 или -Sn (Аlk)3, где каждый Alk представляет собой C1-6-алкильную группу,обычно - н-бутил, a L4 представляет собой подходящую уходящую группу; в присутствии катализатора переходного металла. Уходящей группой L4 обычно является атом галогена, например, брома. Подходящий катализатор переходного металла для использования в реакции между соединениями XIV и XV, включает дихлорбис(трифенилфосфин) палладий (0). Реакция между соединениями XIV и XV обычно происходит в инертном растворителе,таком как N,N-диметилформамид, как правило,при повышенной температуре. Промежуточные соединения формулы XIV могут быть получены по реакции соединения формулы IV, указанной выше, с соединением формулы XVI где Z, L1 и L4 определены выше; в условиях,аналогичных описанным для реакции между соединениями III и IV. В соответствии с еще одной процедурой соединения формулы I, где Z представляет со где R1 и R2 определены выше; с фторирующим агентом. Подобным образом, соединения формулы I, где Z представляет собой 3-фторциклобутил или 1-фторбут-3-енил или их смесь, могут быть получены способом, включающим взаимодействие соединения формулы XVIII где R1 и R2 определены выше; с фторирующим агентом. В том случае, если образуется смесь продуктов, ее индивидуальные компоненты могут быть выделены общепринятыми методами,включая хроматографию. Подобным образом, соединения формулыI, где Z представляет собой 3,3-дифторциклобутил, могут быть получены способом, включающим взаимодействие соответствующего соединения, где Z представляет собой 3-оксоциклобутил, с фторирующим агентом. Подходящим фторирующим агентом для использования в указанных выше реакциях является трифторид диэтиламиносеры (ТДАС), в случае которого реакция может быть легко проведена при перемешивании реагирующих веществ в инертном растворителе, таком как дихлорметан, обычно при температуре в районеXVII могут быть получены по реакции соединения формулы IV, приведенной выше, с соединением формулы XIX где R1 и L1 определены выше; в условиях, аналогичных описанным выше для реакции между соединениями III и IV. Промежуточные соединения формулыXIX, в свою очередь, могут быть получены по реакции циклобутанона с соединением формулы где R1 и L1 определены выше, a Alk представляет собой C1-6-алкил, обычно - метил. Реакцию обычно проводят, обрабатывая реагенты источником фтора, например, каталитическим количеством дифтортрифенилстанната тетрабутиламмония, как правило, в инертном растворителе, таком как тетрагидрофуран. Промежуточные соединения формулы XX соответствуют соединениям приведенной выше формулы III, где Z является -Si(Alk)3, a, следовательно, они могут быть получены способами,аналогичными описанным выше для получения соответствующих соединений формулы III. Соединения приведенной выше формулыI, где Z представляет собой 3-гидроксициклобутил) могут быть получены гидрогенолизом соединения формулы XXI где R1 и R2 определены выше. Реакцию обычно проводят гидрированием с переносом, который включает контактирование соединения XXI с катализатором гидрирования в присутствии донора водорода. Подходящим катализатором гидрирования является палладий на углероде, в идеале - 10% палладий на углероде. Подходящим донором водорода является формиат аммония, в случае которого реакцию преимущественно проводят в муравьиной кислоте. Кроме того, соединения приведенной выше формулы I могут быть получены способом,включающим взаимодействие соединения формулы XXII с соединением формулы XXIII где Z, R1 и R2 определены выше, L5 представляет собой подходящую уходящую группу, а Е представляет собой -В(ОН)2 или остаток цинкорганического реагента; в присутствии катализатора переходного металла. Уходящая группа L5 обычно является атомом галогена, например, брома или иода. Если Е представляет собой -В(ОН)2, то катализатором переходного металла для исполь 002755 18 зования в реакции между соединениями XXII иXXIII обычно является тетракис(трифенилфосфин)палладий (0), а реакцию проводят при повышенной температуре в присутствии фосфата калия в растворителе, таком как N,N-диметилформамид. Если Е представляет собой остаток цинкорганического реагента, то промежуточное соединение XXIII обычно получают по реакции иодпроизводного Z-I с цинковой пылью, как правило, в присутствии 1,2-дибромэтана и растворителя, такого как N,N-диметилформамид. В этом случае катализатором переходного металла для использования в реакции между соединениями XXII и XXIII в идеале является трис(дибензилиденацетон)дипалладий (0), а реакцию проводят в присутствии три-2-фурилфосфина и растворителя, такого как N,N-диметилформамид. Соединения вышеприведенной формулыXXI (соответствующие соединениям формулы I,где Z представляет собой 3-бензилоксициклобутил) могут быть получены подобным образом по реакции соединения формулы XXII, определенной выше, с соединением формулы XXIV где Е определен выше; в присутствии катализатора переходного металла, в условиях, аналогичных описанным выше для реакции между соединениями XXII и XXIII. Промежуточные соединения формулыXXII могут быть получены по реакции соединения вышеуказанной формулы IV с соединением формулы XXV где R1, L1 и L5 определены выше; в условиях,аналогичных описанным выше для реакции между соединениями III и IV. Промежуточные соединения формулыXXV могут быть получены обработкой их подходящего предшественника формулы XX, указанной выше, источником фтора, например, дифтортрифенилстаннатом тетрабутиламмония или (триметил)дифторидом трис(диметиламино) серы, в присутствии реагента, содержащего L5,например 1,2-дибромтетрафторэтана или 1,2 дииодэтана. Соединения определенной выше формулыI, где Z представляет собой трифторметил, могут быть получены способом, который включает взаимодействие соединения формулы XXII; приведенной выше, с иодтрифторметаном. 19 Реакцию обычно проводят в присутствии порошкообразной меди, как правило, в запаянной трубке при повышенной температуре, например, при температуре около 80 С. Промежуточные соединения приведенной выше формулы IV могут быть получены способом, описанным в ЕР-A-0421210, или способами, аналогичными этому. В том случае, если исходные вещества формулы V, VI, VIII, IX, XII, XV, XVI и XXIV не являются товарными продуктами, они могут быть получены способами, аналогичными описанным в прилагаемых примерах или стандартными способами, хорошо известными из уровня техники. Во время любой из вышеуказанных последовательностей синтеза может быть необходимо и/или желательно защищать чувствительные или активные группы в каждой молекуле, которой это касается. Это может быть достигнуто введением принятых защитных групп, таких как описанные в Protective Groups in Organic Synthesis, John WileySons 1991. Защитные группы могут быть сняты на соответствующей стадии с использованием способов, известных из уровня техники. Нижеследующие примеры иллюстрируют получение соединений по данному изобретению. Соединения по данному изобретению сильно ингибируют связывание [3 Н]-флумазенила с сайтом ГАМКA рецепторов человека, связывающим бензодиазепин, и содержащих подгруппы 2 или 3, стабильно экспрессируемые в Ltk-клетках. РеагентыФосфатный забуференный физиологический раствор (ФБР,РВS)Буфер для исследований: 10 мМ КН 2 РО 4,100 мМ КСl, рН 7,4 при комнатной температуре.[3H]-Флумазенил (18 нМ для клеток 132, 18 нМ для клеток 232, 10 нМ для клеток 332) в буфере для исследований.Флунитразепам 100 мкМ в буфере для исследованийКлетки, ресуспендированные в буфере для исследований (1 лоток на 10 мл). Выращивание клеток Супернатант отделяют от клеток. Прибавляют приблизительно 20 мл ФБР. Клетки соскабливают и помещают в пробирку центрифуги объемом 50 мл. Процедуру повторяют еще с 10 мл ФБР, чтобы удостовериться, что большинство клеток удалено. Клетки осаждают центрифугированием в течение 20 мин при 3000 об/мин в настольной центрифуге, после чего при необходимости замораживают. Осадок ресуспендируют в 10 мл буфера на лоток (25 см х 25 см) клеток. 20 Испытание Может быть проведено в глубоких 96 луночных планшетах или в пробирках. Каждая пробирка содержит:300 мкл буфера для исследований.50 мкл [3 Н]-Флумазенила (конечная концентрация для клеток 132 1.8 нМ, для клеток 232 1.8 нМ, для клеток 332 1.0).50 мкл буфера или растворителяносителя (например, 10% ДМСО), если соединения растворяются в 10% ДМСО (общ.); тестовое соединение или флунитразепам (для определения неспецифического связывания) в конечной концентрации 10 мкМ.100 мкл клеток. Пробы инкубируют 1 ч при 40 С, затем отфильтровывают, используя по выбору клеточный харвестер Tomtec или Brandel, на фильтрах GF/B с последующей промывкой 3 х 3 мл холодного буфера для исследований. Фильтры высушивают и производят подсчет методом жидкостного сцинтилляционного подсчета. Ожидаемые значения общего связывания равны 3000-4000 dpm (распад в минуту) общего числа отсчетов и менее 200 dpm для неспецифического связывания при использовании жидкостного сцинтилляционного подсчета, или 1500-2000dpm общего числа отсчетов и менее 200 dpm для неспецифического связывания при подсчете с использованием твердого сцинцилляционного индикатора meltilex. Параметры связывания определяют регрессионным анализом по нелинейному методу наименьших квадратов, из которого для каждого опыта может быть вычислена константа ингибирования. Соединения из прилагаемых примеров были протестированы в вышеописанном испытании, и было найдено, что все они обладают значениями Ki для замещения [3 Н]-Флумазенила из 2 и/или 3 субъединицы ГАМКA рецептора человека от 100 нМ и ниже. Пример 1. 7-Циклобутил-3-(2-фторфенил)6-(2-метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4 триазоло[4,3-b]пиридазин. а) 3,6-Дихлор-4-циклобутилпиридазин. Концентрированную серную кислоту (53,6 мл, 1,0 моль) осторожно прибавляют к перемешиваемой суспензии 3,6-дихлорпиридазина(50,0 г, 0,34 моль) в воде (1,25 л). Перед прибавлением циклобутанкарбоновой кислоты (35,3 мл, 0,37 моль) эту смесь нагревают до 70 С(внутренняя температура). Затем в течение примерно одной минуты добавляют раствор нитрата серебра (11,4 г, 0,07 моль) в воде (20 мл). Это делает реакционную смесь по виду похожей на молоко. Затем в течение 20-30 мин прибавляют раствор персульфата аммония (230 г, 1,0 моль) в воде (0,63 л). Внутренняя температура повышается примерно до 85 С. Во время прибавления продукт образуется в виде липкого осадка. По завершении прибавления реакционную смесь 21 перемешивают еще 5 мин, после чего дают ей охладиться до комнатной температуры. Затем смесь выливают на лед и подщелачивают концентрированным водным аммиаком, если требуется, прибавляют еще лед, чтобы температура не превышала 10 С. Водный слой экстрагируют дихлорметаном (трижды). Объединенные экстракты сушат (MgSO4), фильтруют и упаривают. Получают 55,7 г (82%) указанного в заголовке соединения в виде масла. Данные 1H ЯМР(CDCl3) показывают загрязненность, примерно 5%, 4,5-дициклобутильным соединением. Однако данное вещество используют без дальнейшей очистки. Характеристики: 1H ЯМР (360 МГц,ДМСО-d6)1.79-1.90 (1 Н, м), 2.00-2.09 (1H, м),2.18-2.30 (1 Н, м), 2.33-2.40 (2 Н, м), 3.63-3.72[МН]+, 205 [МН]+, 207 [МН]+. б) 6-Хлор-7-циклобутил-3-(2-фторфенил)1,2,4-триазоло[4,3-b]пиридазин. Смесь полученного выше 3,6-дихлор-4 циклобутилпиридазина (3,0 г, 14,7 ммоль), 2 фторбензгидразида (3,0 г, 19,5 ммоль) и гидрохлорида триэтиламина (3,0 г, 21,8 ммоль) в пксилоле (50 мл) перемешивают и нагревают при температуре кипения с обратным холодильником в токе азота в течение 20 ч. После охлаждения летучие примеси удаляют в вакууме. Остаток обрабатывают дихлорметаном и водой. Водный слой подщелачивают добавлением твердого карбоната калия. На этой стадии отфильтровывают некоторое количество темных нерастворимых примесей. Водный слой далее экстрагируют дихлорметаном (дважды). Объединенные экстракты сушат (MgSO4), профильтровывают и упаривают. Остаток очищают хроматографией на силикагеле, элюируя смесью 20%30% этилацетат/дихлорметан. Получают 2.2 г (49%) указанного в заголовке светлокоричневого твердого вещества. Характеристики: 1 Н ЯМР (250 МГц,СDСl3)1.85-2.08 (1 Н м), 2.08-2.30 (3 Н, м),2.38-2.64 (2 Н, м), 3.62-3.84 (1H, м), 7.19-7.46[МН]+. в) 7-Циклобутил-3-(2-фторфенил)-6-(2 метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4 триазоло[4,3-b]пиридазин. К раствору (2-метил-2 Н-1,2,4-триазол-3 ил) метанола (0,123 г, 1,09 ммоль) (полученному с пользованием условий, изложенных в ЕР-А 421210) в ДМФА (15 мл) прибавляют гидрид натрия (0,044 г 60% дисперсии в масле, 1,1 моль экв.), и 30 мин перемешивают реакционную смесь при комнатной температуре. После этого продукт предыдущей стадии (0,3 г, 0,99 ммоль) прибавляют в виде раствора в ДМФА (15 мл) и реакционную смесь перемешивают при комнатной температуре 2 ч. Реакционную смесь раз 002755 22 бавляют водой (100 мл), а водный слой экстрагируют дихлорметаном (4 х 100 мл). Объединенные экстракты сушат (Na2SO4), профильтровывают и упаривают. Остаток очищают хроматографией на силикагеле, используя 2% МеОН в дихлорметане в качестве элюента. Получают 0,294 г (78%) указанного в заголовке вещества. Характеристики: 1H ЯМР (250 МГц,CDCl3)1.8-2-2.00 (1H, м), 2.00-2,26 (3 Н, м),2.26-2.48 (2 Н, м), 3.53-3.70 (1H, м), 3.84 (3 Н, с),5.47 (2 Н, с), 7.22-7.42 (2 Н, м), 7.50-7.64 (1H, м),7.76-7.96 (3 Н, м); Масс-спектр (ES+) m/e 380 [МН]+; Анализ,Найдено: С, 60.21; Н, 4,77; N, 25,66%; Вычислено (C19H18FN7O) : С 60,15; Н 4,78; N 25,84%. Пример 2. 7-Циклобутил-3-(2-фторфенил)6-(1-метил-1H-1,2,4-триазол-3-илметокси)-1,2,4 триазоло[4,3-b]пиридазин. Данное соединение получают, используя способы, описанные в примере 1 (стадии а), б) и в) из (1-метил-1 Н-1,2,4-триазол-3-ил)метанола(2 Н, с), 7.41-7.51 (2 Н, м), 7.62-7.70 (1H, м), 7.968.03 (1H, м), 8.14 (1H, с), 8.50 (1 Н, с); Масс-спектр (ES+) m/e 380 [МН]+. Пример 3. 7-Циклобутил-3-(3-фторфенил)6-(2-метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4 триазоло[4,3-b]пиридазин. Данное соединение получают, используя способы, описанные в примере 1 (стадии а), б) и в), используя 3-фторбензгидразид вместо 2 фторбензгидразида на стадии б). Характеристики: 1H ЯМР (250 МГц,ДМСО-d6)1.74-1.90 (1 Н, м), 1.94-2.12 (1H, м),2.12-2.36 (4 Н, м), 3.51-3.69 (1H, м), 3.93 (3 Н, с),5.70 (2 Н, с), 7.36-7.47 (2 Н, м), 7.62-7.72 (1H, м),8.00 (1H, с), 8,14-8.32 (3 Н, м); Масс-спектр (ES+)m/e 380 [МН]+. Пример 4. 7-Циклобутил-3-(4-фторфенил)6-(2-метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4 триазоло[4,3-b]пиридазин. Данное соединение получают, используя способы, описанные в примере 1 (стадии а), б) и в), используя 4-фторбензгидразид вместо 2 фторбензгидразида на стадии в). Характеристики: 1 Н ЯМР (250 МГц,ДМСО-d6)1.98-2.12 (1H, м), 2.18-2.32 (1H, м),2.32-2.55 (4 Н, м), 3.72-3.90 (1H, м), 4.17 (3 Н, с),5.90 (2 Н, с), 7.62-7.76 (2 Н, м), 8.27 (1H, с), 8.40 23 в), используя 2,4-дифторбензгидразида вместо 2-фторбензгидразида на стадии в). Характеристики указанного в заглавии соединения: 1 Н ЯМР (250 МГц, ДМСО-d6)1.721.90 (1H, м), 1.90-2.12 (1H, м), 2.12-2.36 (4 Н, м),3.50-3.68 (1H, м), 3.82 (3 Н, с), 5.50 (2 Н, с), 7.307.42 (1H, м), 7.52-7,64 (1H, м), 7.93-8.12 (2 Н, м),8.20 (1H, с); Масс-спектр (ES+) m/e 398 [МН]+. Пример 6. 7-Циклобутил-3-(3,5-дифторфенил)-6-(2-метил-2 Н-1,2,4-триазол-3-илметокси)1,2,4-триазоло[4,3-b]пиридазин. а) 3-Хлор-4-циклобутил-6-гидразинопиридазин. 3,6-Дихлор-4-циклобутилпиридазин (10 г,0.049 моль) и гидразингидрат (14 мл, 0.30 моль) 24 ч нагревают при кипении с обратным холодильником в диоксане (125 мл). После охлаждения целевой изомер кристаллизуют из реакционной смеси и отделяют фильтрованием. Получают 4,8 г (49%). 1 Н ЯМР (250 МГц, ДМСО-d6)1.68-1.86(1H, ушир); Масс-спектр (ES+) m/e 198 [МН]+,200 [МН]+. б) N-(6-Хлор-5-циклобутилпиридазин-3 ил)-N'-(3,5-дифторбензилиден)гидразин. 3-Хлор-4-циклобутил-6-гидразинопиридазин (0,502 г, 2,53 ммоль) и 3,5-дифторбензальдегид (285 мл, 2,78 ммоль) перемешивают в 0,2 М хлористо-водородной кислоте (10 мл) в течение 2 ч. Продукт отделяют фильтрованием и высушивают. Выход 0.81 г (99%). Массспектр (ES+) m/e 323 [МН]+, 325 [МН]+. в) 6-Хлор-7-циклобутил-3-(3,5-дифторфенил)-1,2,4-триазоло[4,3-b]пиридазин. Хлорид железа (3,423 г, 12,66 ммоль) в этаноле (15 мл) по каплям прибавляют к раствору N-(6-хлор-5-циклобутилпиридазии-3-ил)-N'(3,5-дифторбензилиден)гидразина (0,816 г, 2,53 ммоль) в этаноле (35 мл) и нагревают при 70 С. Через 3 ч реакционную смесь обрабатывают дихлорметаном (250 мл) и насыщенным раствором соли (250 мл). Органическую фазу сушат(MgSO4), отфильтровывают и упаривают. Остаток очищают хроматографией на силикагеле,элюируя смесями этилацетата с гексаном, чтобы получить указанное в заголовке пиридазиновое соединение. Выход 0,51 г (63%). 1 24 натрия (0,035 г 60% дисперсии в масле, 1,1 ммоль экв.) и реакционную смесь перемешивают при комнатной температуре 30 мин. После этого прибавляют продукт предыдущей стадии(15 мл), реакционную смесь перемешивают при комнатной температуре 2 ч. Реакционную смесь разбавляют водой (100 мл), водный слой экстрагируют дихлорметаном (4 х 100 мл). Объединенные экстракты сушат (Na2SO4), фильтруют и упаривают. Остаток очищают хроматографией на силикагеле с использованием в качестве элюента 3% МеОН в дихлорметане. Получают 0,120 г (38%) целевого продукта. 1(1 Н, м), 4.01 (3 Н, с), 5.64 (2 Н, с), 6,92-7,01 (1 Н,м), 7,90 (1 Н, с), 7.94 (1 Н, с), 8.03-8,12 (2 Н, м); Масс-спектр (ES+) m/e 398 [МН]+. Пример 7. 3-(2,4-Дифторфенил)-7-(1 метилциклобутил)-6-(2-метил-2 Н-1,2,4-триазол 3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин. Данное соединение получают с применением способов, описанных в примере 1 стадия а), используя 1-метилциклобутанкарбоновую кислоту (Journal of Organometallic Chemistry,1988, 352, 263-272) вместо циклобутанкарбоновой кислоты, и примере 6 стадии а), б), в) и г),используя 2,4-дифторбензальдегид вместо 3,5 дифторбензальдегида на стадии б). Характеристики указанного в заголовке соединения: 1(ES+) m/e 412 [МН]+. Пример 8. 7-Циклобутил-3-(3,4-дифторфенил)-6-(2-метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин. Данное соединение получают с применением способов, описанных в примере 1 стадия а) и примере 6 стадии а), б), в) и г), используя 3,4-дифторбензальдегид вместо 3,5-дифторбензальдегида на стадии б). Характеристики указанного в заголовке соединения: 1H ЯМР (360 МГц, СDСl3)1.862.00 (1 Н, м), 2.06-2,24 (3 Н, м), 2.30-2.46 (2 Н, м),3.57-3.70 (1H, м), 4.00 (3 Н, с), 5.62 (2 Н, с), 7.327.40 (1H, м), 7.90 (1H, с), 7.96 (1 Н, с), 8.20-8.80(1 Н, м), 8.32-8.40 (1H, м); Масс-спектр (ES+) m/е 398 [МН]+. Пример 9. 7-Циклобутил-3-(2,3-дифторфенил)-6-(2-метил-2 Н-1,2,4-триазол-3-илметокси)1,2,4-триазоло[4,3-b]пиридазин. Данное соединение получают с применением способов, описанных в примере 1 стадия а) и примере 6 стадии а), б), в) и г), используя 2,3-дифторбензальдегид вместо 3,5-дифторбензальдегида на стадии б). Характеристики указанного в заголовке соединения: 1H ЯМР (360 МГц, CDCl3)1.86 25 1.98 (1H, м), 2.04-2.24 (3 Н, м), 2.30-2.44 (2 Н, м),3.58-3.70 (1H, м), 3.90 (3 Н, с), 5.50 (2 Н, с), 7.267.34 (1H, м), 7.34-7.46 (1H, м), 7.62-7.80 (1H, м),7.88 (1H, с), 7.92 (1H, с); Масс-спектр (ES+) m/е 398 [МН]+ Пример 10. 7-Циклобутил-3-(2,6-дифторфенил)-6-(2-метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин. Данное соединение получают с применением способов, описанных в примере 1 стадия а) и примере 6 стадии а), б), в) и г), используя 2,6-дифторбензальдегид вместо 3,5-дифторбензальдегида на стадии б). Характеристики указанного в заголовке соединения: 1H ЯМР (360 МГц, CDCl3)1.861.96 (1H, м), 2.04-2.24 (3 Н, м), 2.30-2.42 (2 Н, м),3.56-3.68 (1H, м), 3.84 (3 Н, с), 5.42 (2 Н, с), 7.087.16 (2 Н, м), 7.55-7.60 (1H, м), 7.88 (2 Н, м); Масс-спектр (ES+) m/е 398 [МН]+. Пример 11. 7-Циклобутил-3-(2,5-дифторфенил)-6-(2-метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин. Данное соединение получают с применением способов, описанных в примере 1 стадия а) и примере 6 стадии а), б), в) и г), используя 2,5-дифторбензальдегид вместо 3,5 дифторбензальдегида на стадии б). Характеристики указанного в заголовке соединения: 1(1H, м), 3.90 (3 Н, с), 5.48 (2 Н, с), 7.20-7.30 (2 Н,м), 7.60-7.68 (1H, м), 7.88 (1H, с), 7.92 (1H, с); Масс-спектр (ES+) m/е 398 [МН]+. Пример 12. 3-(2,4-Дифторфенил)-7-(1-метилциклогексил)-6-(2-метил-2 Н-1,2,4-триазол-3 илметокси)-1,2,4-триазоло[4,3-b]пиридазин. а) 3,6-Дихлор-4-(1-метилциклогексил)пиридазин. Концентрированную серную кислоту (10,7 мл, 0,2 моль) прибавляют к раствору 3,6 дихлорпиридазина (10 г, 67 ммоль) в воде (250 мл). Перед прибавлением 1-метилциклогексанкарбоновой кислоты (9,67 г, 68 ммоль) эту смесь нагревают до 70 С. Затем в течение 1 мин прибавляют нитрат серебра (2,3 г, 13,5 ммоль) в воде (5 мл), после чего в течение 20 мин вносят персульфат аммония (45,6 г, 0,2 моль) в воде (95 мл). По завершении прибавления реакционную массу перемешивают еще 5 мин, а затем дают ей остыть до комнатной температуры. Смесь охлаждают до 0 С (баня ледвода) и подщелачивают концентрированным водным раствором аммиака (внутренняя температура 10 С). Водную фазу экстрагируют дихлорметаном (3 х 350 мл), объединенные экстракты промывают насыщенным раствором соли (350 мл), сушат (MgSO4), профильтровывают и упаривают. Остаток очищают хроматографией на окиси кремния, используя в качестве элюента 26 05% этилацетат в дихлорметане. Получают целевой продукт (5.93 г): 1 Н ЯМР (250 МГц, CDCl3)1.33-1.74 (6 Н,м), 1.43 (3 Н, с), 1.80-1.96 (2 Н, м), 1.97-2.12 (2 Н,м), 7.49 (1H, с); Масс-спектр (ES+) m/e 249[МН]+, 247 [MH]+ , 245[МН]+. б) 6-Хлор-3-(2,4-дифторфенил)-7-(1-метилциклогексил)-1,2,4-триазоло[4,3-b]пиридазин. Смесь 3,6-дихлор-4-(1-метилциклогексил) пиридазина (1,29 г, 5,27 ммоль), гидразида 2,4 дифторбензойной кислоты (1,72 г, 10 ммоль) и гидрохлорида триэтиламина (1,09 г, 7,9 ммоль) в п-ксилоле (5 мл) перемешивают и нагревают при температуре кипения с обратным холодильником 24 ч. После охлаждения летучие примеси удаляют в вакууме, остаток обрабатывают дихлорметаном (100 мл), водой (100 мл) и NaHCO3(100 мл). Нерастворимые твердые примеси отделяют фильтрацией. Слои разделяют, водный слой далее экстрагируют дихлорметаном (2 х 100 мл). Объединенные органические экстракты сушат (МgSO4), профильтровывают и упаривают. Остаток очищают хроматографией на окиси кремния, используя в качестве элюента 025% этилацетат в дихлорметане. Получают целевой продукт (0.74 г): 1H ЯМР (250 МГц, CDCl3)1.34-1.74 (6 Н, м), 1.50(3 Н, с), 1.90-2.15 (4 Н, м), 7.01-7.14 (2 Н, м), 7.877.98 (1 Н, м), 8.18 (1H, с); Масс-спектр (ES+) m/e 365 [МН]+, 363 [МН]+. в) 3-(2,4-Дифторфенил)-7-(1-метилциклогексил)-6-(2-метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин. Гидрид натрия (60% дисперсия в масле, 13 мг, 0,33 ммоль) прибавляют к перемешиваемому раствору (2-метил-2 Н-1,2,4-триазол-3-ил) метанола (полученного с использованием условий, описанных в ЕР-А-421210) (37 мг, 0,33 ммоль) в безводном N,N-диметилформамиде (5 мл) при комнатной температуре в атмосфере азота. Эту смесь перемешивают 30 мин и прибавляют 6-хлор-3-(2,4-дифторфенил)-7-(1-метилциклогексил)-1,2,4-триазоло[4,3-b]пиридазин (100 мг, 0,275 ммоль) в N,Nдиметилформамиде (3 мл), и смесь перемешивают еще 60 мин. Реакцию гасят водой (20 мл) и дополнительно перемешивают 60 мин. Выпавший осадок отделяют фильтрацией и промывают водой. Твердое вещество растворяют в дихлорметане (20 мл), профильтровывают и упаривают. Остаток перекристаллизовывают из смеси этилацетат - гексан. Получают указанное в заголовке соединение (38 мг). Т.пл. 196 С; 1 27 Пример 13. 3-(2,4-Дифторфенил)-7-(1-метилциклогексил)-6-(1-метил-1 Н-1,2,4-триазол-3 илметокси)-1,2,4-триазоло[4,3-b]пиридазин. Данное соединение получают с применением способа, описанного в примере 12 стадия в),используя(2 Н, м), 3.93 (3 Н, с), 5.44 (2 Н, с), 6.99-7.11 (2 Н,м), 7.96 (1 Н, с), 7.97-8.03 (1 Н, м), 8.04 (1 Н, с); Масс-спектр (ES+) m/е 440 [МН]+; Анализ, найдено: С 60,48; Н 5,08; N 22,39%. Вычислено: C22H23F2N7O: С 60,13; Н 5,27; N 22,31%. Пример 14. 7-Циклобутил-3-(2-фторфенил)-6-(1-метил-1 Н-пиразол-3-илметокси)-1,2,4 триазоло[4,3-b]пиридазин. Данное соединение получают с применением способа, описанного в примере 1 стадия в), используя (1-метил-7-пиразол-3-ил)метанол,полученный с использованием условий, описанных в ЕР-А-91130) вместо (2-метил-2 Н-1,2,4 триазол-3-ил)метанола. Характеристики указанного в заголовке соединения: Т.пл. 184-186 С; 1H ЯМР (360 МГц,ДМСО)1.80 (1 Н, м), 1.99 (1H, м), 2.18 (4 Н, м),3.55 (1H, м), 3.82 (3 Н, с), 5.23 (2 Н, с), 6.25 (1H,с), 7,44-7.51 (2 Н, м), 7.65 (2 Н, м), 7.99 (1H, м),8.18 (1H, с); Масс-спектр (ES+) m/е 379 [МН]+; Анализ, найдено: С 62,81; Н 4,69; N 21,68%. Вычислено: C20H19FN6O0,2 Н 2O: С 62,88; Н 5,12; N 22,00%. Пример 15. 7-Циклобутил-3-(2-фторфенил)-6-(5-метилизоксазол-3-илметокси)-1,2,4 триазоло[4,3-b]пиридазин. Данное соединение получают с применением способа, описанного в примере 1 стадия в), используя (5-метилизоксазол-3-ил)метанол вместо (2-метил-2 Н-1,2,4-триазол-3-ил)метанола. Характеристики указанного в заголовке соединения: Т. пл. 150 С; 1 Н ЯМР (360 МГц,СDСl3)1.92 (1H, м), 2.16 (3 Н, м), 2.40 (2 Н, м),2.44 (3 Н, с), 3.63 (1H, м), 5.36 (2 Н, с), 6.01 (1H,с), 7.25-7.36 (2 Н, м), 7.55 (1H, м), 7.82 (1H, с),7.89 (1H, м); Масс-спектр (ES+) m/e 380 [МН]+; Анализ, найдено: С 62,99; Н 4,74; N 18,09%. Вычислено: C20H18FN5O: С 63,32; Н 4,74; N 18,46 %. Пример 16. 7-Циклобутил-3-(2-фторфенил)-6-(1-метил-1 Н-имидазол-2-илметокси)1,2,4-триазоло[4,3-b]пиридазин. Данное соединение получают с применением способа, описанного в примере 1 стадия в), используя (1-метил-1 Н-имидазол-2-ил)метанол вместо (2-метил-2 Н-1,2,4-триазол-3-ил) ме 002755H ЯМР (360 МГц, CDCl3);1.89 (1H, м),2.10 (3 Н, м), 2.32 (2 Н, м), 3.61 (1H, м), 3.65 (3 Н,с), 5.40 (2 Н, с), 6.94 (1H, с), 7.06 (1H, с), 7.267.36 (2 Н, м), 7,55 (1H, м), 7.82 (1H, с), 7.92 (1H,м); Масс-спектр (ES+) m/e 379 [МН]+. Пример 17. 7-Циклобутил-3-(2-фторфенил)-6-(4-метил-4 Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин. Данное соединение получают с применением способа, описанного в примере 1 стадия в), используя (4-метил-4 Н-1,2,4-триазол-3-ил) метанол вместо (2-метил-2 Н-1,2,4-триазол-3-ил) метанола. Характеристики указанного в заголовке соединения: Т.пл. 228 С; 1 ЯМР (360 МГц, CDCl3)1.91 (1H, м), 2.10(ES+) m/e 380 [МН]+; Анализ, найдено: С 59,70; Н 4,74; N 25,50%. Вычислено: C19H18FN6O: С 60,15; Н 4,78; N 25,84%. Пример 18. 3-(2-Фторфенил)-6-(2-метил 2 Н-1,2,4-триаэол-3-илметокси)-7-(тиен-2-ил)1,2,4-триазоло[4,3-b]пиридазин 0,9 гидрат. а) 4-Бром-1,2-дигидропиридазин-3,6-дион. Гидразингидрат (28 мл, 576 ммоль) по каплям прибавляют к перемешиваемому раствору броммалеинового ангидрида (100 г, 565 ммоль) в ТГФ (1 л), охлаждаемому на ледяной бане таким образом, чтобы внутренняя температура не превышала 10 С. После окончания прибавления гидразина смесь кипятят с обратным холодильником 18 ч. Растворитель удаляют выпариванием, остаток сушат азеотропной перегонкой с толуолом. Остаток растирают и промывают диэтиловым эфиром, получая 83 г (77%) указанного в заголовке соединения в виде оранжевого твердого вещества. 1[МН]+. Данное вещество используют без дальнейшей очистки. б) 3,6-Дихлор-4-(тиен-2-ил)пиридазин. Смесь 4-бром-1,2-дигидропиридазин-3,6 диона (9 г, 47 ммоль), 2-тиофенбороновой кислоты (7 г, 55 ммоль), карбоната натрия (11,7 г,110 ммоль) и тетракис(трифенилфосфин)палладия (0) (5 г) в диметилэтаноламине (250 мл) и воде (100 мл) дегазируют, продувают азотом и нагревают при температуре кипения с обратным холодильником 18 ч. Растворители удаляют выпариванием, остаток азеотропно перегоняют с толуолом. Полученное твердое вещество разбавляют смесью дихлорметана (20 мл) и хлорокиси фосфора (70 мл) и нагревают при кипении с обратным холодильником 4 ч. Реакционную смесь охлаждают, медленно выливают в ледяную воду, подщелачивают водным раствором 29 гидрокарбоната натрия и экстрагируют дихлорметаном. Органический слой сушат (Na2SO4),профильтровывают и концентрируют. Сушка,колоночная флэш-хроматография при элюировании смесью 30% этилацетат - гексан дает 1,18 г (11%) указанного в заголовке соединения в виде оранжевого твердого вещества. 1 ЯMP (360 МГц, СDСl3)7.24 (1 Н, дд, J= 5 и 4 Гц), 7.65-7.68 (2 Н, м), 7.80 (1H, дд, J=4 и 1 Гц); Масс-спектр (ES+) m/e 231 [МН]+, 235(0,5 г, 2,1 ммоль), полученного выше, 2 фторбензгидразида (0,66 г, 4,3 ммоль) и гидрохлорида триэтиламина (0,59 г, 4,3 ммоль) в пксилоле (10 мл) перемешивают и нагревают при температуре кипения с обратным холодильником в атмосфере азота 30 ч. После охлаждения летучие примеси удаляют в вакууме. Остаток очищают от части примесей хроматографией на силикагеле, элюируя смесью 5066100% этилацетат - гексан. Получают 0,19 г (26%) указанного в заголовке соединения в виде желтого твердого вещества. Масс-спектр (ES+) m/е 331[МН]+, 333 [МН]+. Вещество используют без дальнейшей очистки. г) 3-(2-Фторфенил)-6-(2-метил-2 Н-1,2,4 триазол-3-илметокси)-7-(тиен-2-ил)-1,2,4-триазоло[4,3-b]пиридазин 0,9 гидрат. К раствору (2-метил-2 Н-1,2,4-триазол-3 илметокси)-7-(тиен-2-ил)метанола (0,11 г, 1,0 ммоль) (полученного с использованием условий, описанных в ЕР-А-421210) в ДМФА (5 мл) прибавляют гидрид натрия (0,04 г 60% дисперсии в масле, 1 моль экв.) и реакционную смесь перемешивают при комнатной температуре 30 мин. По прошествии этого времени прибавляют 6-хлор-3-(2-фторфенил)-7-(тиен-2-ил)-1,2,4 триазоло[4,3-b]пиридазин (0,19 г, 0,57 ммоль) и реакционную смесь перемешивают при комнатной температуре 18 ч. Реакционную смесь разбавляют водой (70 мл), осадок отделяют. Твердое вещество очищают путем кипячения в этилацетате и выделяют 0,01 г (12%) указанного в заголовке соединения в виде желтого твердого вещества. 1 Н ЯМР (360 МГц, ДМСО-d6)3.83 (3 Н,с), 5.64 (2 Н, с), 7.24 (1H, дд, J= 4 и 4 Гц), 7.447.55 (2 Н, м), 7.66-7.71 (1 Н, м), 7.82 (1H, д, J= 5 Гц), 7.96-8.01 (3 Н, м), 8.23 (1H, с); Масс-спектр(ES+) m/e 408 [МН]+; Анализ, найдено: С 53,81; Н 3,62; N 23,42%. Вычислено C19H14FN7OS0,9(Н 2 О): С 53,87; Н 3,76; N 23,14%. Т.пл. 189-190 С. Пример 19. 3-(2,4-Дифторфенил)-6-(2-метил-2 Н-1,2,4-триазол-3-илметокси)-7-(тиен-2 ил)-1,2,4-триазоло[4,3-b]пиридазин. Данное соединение получают так же, как и в примере 18 стадии а), б), в) и г), за исключе 002755 30 нием того, что на стадии в) используют 2,4 дифторбензгидразид вместо 2-фторбензгидразида. Указанное в заголовке соединение выделяют в виде желтого твердого вещества (0,01 г). 1a) 7-Циклобутил-3-(2,4-дифторфенил)-6-[1(2-триметилсиланилэтоксиметил)-1 Н-бензимидазол-2-илметокси]-1,2,4-триазоло[4,3-b]пиридазин. Данное соединение получают так же, как и в примере 1 стадии а), б) и в), используя 2,4 дифторбензгидразид на стадии б) вместо 2 фтopбeнзгидpaзидa, и [1-(2-триметилсиланилэтоксиметил)-1 Н-бензимидазол-2-ил]метанол(3 Н, м), 7,59 (1 Н, м), 7.45 (2 Н, м), 7,14 (2 Н, м),5.74 (2 Н, с), 5.65 (2 Н, с), 3.71 (1 Н, м), 3.59 (2 Н,т), 1.90-2.46 (6 Н, м), 0.93 (2 Н, т), 0.00 (9 Н, м); Масс-спектр (ES+) m/e 563 [MH]+. б) 6-(1 Н-Бензимидазол-2-илметокси)-7 циклобутил-3-(2,4-дифторфенил)-1,2,4 триазоло[4,3-b]пиридазин. Раствор 7-циклобутил-3-(2,4-дифторфенил)-6-[1-(2-триметилсиланилэтоксиметил)-1 Нбензимидазол-2-илметокси]-1,2,4-триазоло[4,3b] пиридазина (187 мг, 0,333 ммоль) в 5 М хлористо-водородной кислоте (10 мл) и этаноле (4 мл) нагревают и оставляют на ночь при 80 С,затем упаривают в вакууме для удаления растворителей. Прибавляют насыщенный раствор карбоната калия, затем смесь разбавляют водой,фильтруют, а оставшееся твердое вещество сначала промывают водой, а затем эфиром, после чего высушивают. Остаток очищают флэшхроматографией на силикагеле, используя этилацетат в качестве элюента. Получают 60 мг 31 нагревают до 100 С в атмосфере азота в течение 16 ч. После охлаждения избыток хлорокиси фосфора отгоняют в вакууме. Остаток азеотропно перегоняют с толуолом (дважды), после чего переносят в смесь дихлорметан - вода. Смесь осторожно подщелачивают гидрокарбонатом натрия (твердый). При необходимости для получения двух прозрачных слоев смесь еще разбавляют. Разделяют оба слоя и водный слой экстрагируют дихлорметаном (трижды). Объединенные экстракты сушат (Nа 2SO4), профильтровывают и упаривают. Остаток очищают хроматографией на силикагеле, элюируя дихлорметаном. Получают 5.0 г (42%) указанного в заголовке пиридазина в виде бесцветного твердого вещества. 1 Н ЯМР (250 МГц, CDCl3)7.68 (ушир. с); Масс-спектр (ES+) m/е 230[МН]+, 228 [МН]+. б) 3,6-Дихлор-4-(пирролидин-1-ил)пиридазин. Пирролидин (3,36 мл, 40 ммоль) прибавляют к перемешиваемому раствору/суспензии 4 бром-3,6-дихлорпиридазина (8,3 г, 36 ммоль) и карбоната калия (13,8 г, 0,1 моль) в сухом ДМФА (100 мл) при комнатной температуре в атмосфере азота. Смесь перемешивают 16 ч при комнатной температуре, а затем - при 60 С в течение 3 ч. Реакционную смесь выливают в воду (250 мл). Водную часть экстрагируют этилацетатом (трижды). Объединенные экстракты сушат (MgSO4), профильтровывают и упаривают. Остаток очищают хроматографией на силикагеле, элюируя смесью 0,5% метанол - дихлорметан. Получают 7,2 г (92%) указанного в заголовке пиридазина в виде бесцветного масла. 1(7,2 г, 33 ммоль) и гидразингидрат (9,96 г, 0,2 моль) нагревают при температуре кипения с обратным холодильником в диоксане (130 мл) в течение 6 ч. После охлаждения целевой изомер кристаллизуют из реакционной смеси и отделяют фильтрацией (4,1 г, 58%). 1 Н ЯМР (250 МГц, ДМСО-d6)1.79-1.84(30 мл) в течение 2 ч. Выпавший в осадок имин отделяют фильтрацией и высушивают. Получают 1,37 г (92%). Масс-спектр (ES+) m/e 338 32 д) 6-Хлор-3-(2,4-дифторфенил)-7-(пирролидин-1-ил)-1,2,4-триазоло[4,3-b]пиридазин. Хлорид железа (4,74 г, 17,5 ммоль) в этаноле (30 мл) по каплям прибавляют к раствору имина предыдущей стадии (1,06 г, 3,5 ммоль) в этаноле (60 мл) и нагревают при 60 С. После 6 ч выдержки реакционную смесь распределяют между дихлорметаном (250 мл) и насыщенным раствором соли (250 мл). Органическую фазу сушат (MgSO4), профильтровывают и упаривают. Остаток очищают хроматографией на силикагеле, элюируя смесями этилацетат/гексан. Получают 0,7 г (66%) указанного в заголовке пиридазина. 1H ЯМР (250 МГц, CDCl3)2.022.08 (4 Н, м), 3.53-3.58 (4 Н, м), 6.98-7.09 (2 Н, м),7.46-7.56 (1 Н, м), 7.81-7.92 (1 Н, м); Масс-спектр(ЕS+) m/e 336 [МН]+, 338 [МН]+. е) 3-(2,4-Дифторфенил)-6-(2-метил-2 Н 1,2,4-триазол-3-илметокси)-7-(пирролидин-1 ил)-1,2,4-триазоло[4,3-b]пиридазин. Гидрид натрия (60% дисперсия в масле, 16 мг, 0,41 ммоль) при комнатной температуре прибавляют к раствору (2-метил-2 Н-1,2,4 триазол-3-ил)метанола (полученного с использованием условий, описанных в ЕР-А-421210)(0,38 мг, 0,33 ммоль) в безводном ДМФА (2 мл). Через 1 ч при комнатной температуре прибавляют раствор 6-хлор-3-(2,4-дифторфенил)-7(пирролидин-1-ил)-1,2,4-триазоло[4,3-b]пиридазина (102 мг, 0,30 ммоль) и реакционную смесь перемешивают 18 ч. Остаток распределяют между дихлорметаном и водой. Водный слой далее экстрагируют дихлорметаном (2 х 100 мл). Объединенные экстракты сушат (Nа 2SO4), профильтровывают и упаривают. Остаток очищают хроматографией на силикагеле, элюируя смесью 0-2% этилацетат - метанол. Получают 42 мг(30%) указанного в заголовке пиридазина. 1 Н ЯМР (250 МГц, CDCl3)1.73-1.78 (4 Н,м), 3.51-3.55 (4 Н, м), 3.93 (3 Н, с), 5.40 (2 Н, с),6.65 (1H, с), 6.95-7.03 (2 Н, м), 7.92-7.94 (1H, м),8.04 (1H, с); Масс-спектр (ES+) m/e 413 [МН]+. Пример 22. 3-(2,4-Дифторфенил)-6-(1-метил-1 Н-1,2,4-триазол-3-илметокси)-7-(пирролидин-1-ил)-1,2,4-триазоло[4,3-b]пиридазин. Данное соединение получают также, как и в примере 21 стадия е), используя (1-метил-1 Н 1,2,4-триазол-3-ил)метанол (ЕР-А-421210) вместоH ЯМР (250 МГц, CDCl3)1.95-2.00 (4 Н,м), 3.46-3.52 (4 Н, м), 3.86 (3 Н, с), 5.47 (2 Н, с),6.70 (1H, с), 6.95-7.11 (2 Н, м), 7.78-7.87 (1H, м),7.90 (1H, с); Масс-спектр (ЕS+) m/e 413 [МН]+. Пример 23. 3-(2-Фторфенил)-6-(1-метил 1 Н-1,2,4-триазол-3-илметокси)-7-(пирролидин 1-ил)-1,2,4-триазоло[4,3-b]пиридазин. Получают способом, аналогичным указанному в примере 21 стадии г), д) и е), используя 2-фторбензальдегид вместо 2,4-дифторбензаль 33 дегида на стадии г) и (1-метил-1 Н-1,2,4-триазол 3-ил)метанол (ЕР-А-421210) вместо (2-метил 2 Н-1,2,4-триазол-3-ил)метанола на стадии е). Получают указанный в заголовке пиридазин. 1H ЯМР (250 МГц, CDCl3)2.06-2.20 (4 Н,м), 3.68-3.74 (4 Н, м), 4,00-(3 Н, с), 5.72 (2 Н, с),7.07 (1H, с), 7.60-7.70 (2 Н, м), 7.81-7.87 (1H, м),8.05-8.11 (1H, м), 8.17 (1H, с); Масс-спектр (ES+) m/e 395 [Н]+. Пример 24. 7-Циклобутил-3-(2-фторфенил)-6-(1-метил-1 Н-имидазол-4-илметокси)1,2,4-триазоло[4,3-b]пиридазин. Данное соединение получают способом,описанным в примере 1 стадия в), используя (1 метил-1H-имидазол-4-ил)метанол вместо (2 метил-2 Н-1,2,4-триазол-3-ил)метанола. Характеристики указанного в заголовке соединения: т.пл. 176 С, 1H ЯМР (360 МГц,CDCl3)1.87 (1H, м), 2.10 (3 Н, м), 2.36 (2 Н, м),3.59 (1H, м), 3.64 (3 Н, с), 5.28 (2 Н, с), 6.82 (1H,с), 7.26-7.36 (2 Н, м), 7.39 (1 Н, с), 7.53 (1H, м),7.76 (1H, с), 7.92 (1 Н, м); Масс-спектр (ES+) m/е 379 [MH]+. Пример 25. 7-(1-Фторциклобутил)-3-(2 фторфенил)-6-(2-метил-2 Н-1,2,4-триазол-3 илметокси)-1,2,4-триазоло[4,3-b]пиридазин. а) 3-Хлор-6-гидразино-4-(триметилсилил) пиридазин. К раствору 3,6-дихлор-4-(триметилсилил) пиридазина (9,67 г, 43,7 ммоль) (Turck et al. ,J.Heterocycl. Chem., 1990, 27, 1377, полученного с использованием способа, описанного Trecourtet al., J, Heterocycl. Chem., 1995, 32 1057) в 1,0 М растворе гидразина в ТГФ (131 мл, 131 ммоль) прибавляют N,N-диизопропилэтиламин (7,5 мл,43,8 ммоль) и смесь перемешивают 68 ч при температуре кипения с обратным холодильником в атмосфере азота. Смеси дают охладиться,прибавляют силикагель, а растворитель выпаривают в вакууме. Остаток затем очищают флэшхроматографией (силикагель, 5% MeOH/H ЯМР (360 МГц, CDCl3)0.39 (9 Н, с),3.96 (2 Н, ушир, с), 6.24 (1 Н, ушир. с), 7.08 (1 Н,с). б) 3-Хлор-6-[2-(2-фторбензоил)гидразино]4-(триметилсилил) пиридазин. К перемешиваемой смеси 3-хлор-6-гидразино-4-(триметилсилил)пиридазина (6,34 г, 29,3 ммоль) и безводного триэтиламина (4,9 мл, 35,2 ммоль) в безводном диэтиловом эфире (100 мл),охлажденной до -4 С, по каплям в атмосфере азота в течение 13 мин прибавляют 2 фторбензоилхлорид (3,5 мл, 29.4 ммоль), поддерживая температуру ниже 5 С. Густую смесь затем перемешивают 30 мин при 0-5 С, затем реакцию гасят безводным метанолом (1 мл). Смесь разбавляют гексаном (100 мл) и фильт 002755 34 руют. Собранное твердое вещество промывают диэтиловым эфиром (2 х 25 мл), а затем водой(100 мл), растворяют в дихлорметане (300 мл) и метаноле (20 мл), промывают насыщенным водным NaCl (100 мл), сушат (Na2SO4) и упаривают в вакууме. Получают 9,72 г (98%) указанного в заголовке соединения в виде светлокоричневого твердого вещества. 1(1H, т, J= 7.6 Гц), 7.55 (1 Н, м), 8.00 (1H, ушир. с), 8.07 (1H, тд, J= 7.7 и 1.8 Гц), 9.19 (1H, ушир. с); Масс-спектр (ES+) m/e 339/341 [МН]+,217/219 [М-COC6H4F+2H]+. в) 6-Хлор-3-(2-фторфенил)-7-(триметилсилил)-1,2,4-триазоло[4,3-b]пиридазин. К перемешиваемой смеси 3-хлор-6-[2-(2 фторбензоил)гидразино]-4-(триметилсилил) пиридазина (9,72 г, 28,7 ммоль) и 1,2 дибромтетрахлорэтана(18,68 г, 57,4 ммоль) в безводном ацетонитриле (170 мл), охлажденной до -1 С, в атмосфере азота в течение 21 мин порциями вносят твердый трифенилфосфин(30,10 мл, 115 ммоль), поддерживая температуру ниже 5 С. Смесь затем перемешивают 10 мин при 2 С, после чего в течение 18 мин по каплям прибавляют безводный триэтиламин (32,0 мл,230 ммоль), поддерживая температуру ниже 6 С. Затем смесь в атмосфере азота перемешивают при 0-3 С в течение 85 мин. Затем смесь разбавляют дихлорметаном (150 мл) и промывают водой (200 мл). Органический слой сушат(Na2SO4) и упаривают в вакууме. Остаток очищают флэш-хроматографией (силикагель, 2040% EtOAc/гексан). Получают 7,67 г (83%) указанного в заголовке соединения в виде белого твердого вещества. 1 Н ЯМР (360 МГц, CDCl3)0.48 (9 Н, с),7.30 (1H, дд, J= 10.1 и 8.8 Гц), 7.36 (1H, тд, J= 7.6 и 1.1 Гц), 7.58 (1H, м), 7.90 (1H, тд, J= 7.3 и 1.8 Гц), 8.30 (1H, с); Масс-спектр (ES+) m/e 321/323 [МН]+. г) 6-Хлор-3-(фторфенил)-7-(1-гидроксициклобутил)-1,2,4-триазоло[4,3-b]пиридазин. К перемешиваемому раствору 6-хлор-3-(2 фторфенил)-7-(триметилсилил)-1,2,4-триазоло[4,3-b]пиридазина (1,04 г, 3,24 ммоль) в безводном ТГФ (15 мл) в атмосфере азота прибавляют циклобутанон (1,21 мл, 16,2 ммоль), а затем дифтортрифенил-станнат тетрабутиламмония(0,410 г, 0,650 ммоль). Содержимое колбы упаривают, колбу четыре раза продувают азотом,после чего перемешивают при комнатной температуре 5,75 ч. Затем добавляют еще 0,403 г(0,639 ммоль) дифтортрифенилстанната тетрабутиламмония, а смесь перемешивают далее в течение 36 ч. Смесь обрабатывают дихлорметаном (75 мл) и водой (75 мл). Водный слой далее экстрагируют дихлорметаном (2 х 50 мл), объединенные органические экстракты сушат(Na2SO4) и упаривают в вакууме. Остаток очи 35 щают флэш-хроматографией (силикагель, 70100% EtOAc/гексан). Получают 0,2634 г (26%) указанного в заголовке соединения в виде кремового твердого вещества. 1(1H, с); Масс-спектр (ES+) m/e 319/321 [МН]+, 249. д) 7-(1-Фторциклобутил)-3-(2-фторфенил)6-(2-метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4 триазоло[4,3-b]пиридазин. К перемешиваемому раствору (2-метил 2 Н-1,2,4-триазол-3-ил) метанола (0,2206 г, 1,95 ммоль) в безводном ДМФА (6 мл) в атмосфере азота прибавляют гидрид натрия (60% дисперсия в масле, 77,7 мг, 1,94 ммоль), и смесь перемешивают при комнатной температуре 20 мин. Затем смесь охлаждают на водяной бане со льдом и в течение 5 мин по каплям прибавляют раствор 6-хлор-3-(фторфенил)-7-(1-гидроксициклобутил)-1,2,4-триазоло[4,3-b]пиридазина(0,2573 г, 0,807 ммоль) в безводном ДМФА (5 мл). Смесь перемешивают 20 мин в атмосфере азота, затем выливают в смесь насыщенного водного NH4Cl (50 мл), насыщенного водногоNaCl (25 мл) и дихлорметана (75 мл). Водный слой далее экстрагируют дихлорметаном (2 х 50 мл), объединенные органические экстракты сушат (Na2SO4) и упаривают в вакууме. Остаток очищают флэш-хроматографией (силикагель, 35% MeOH/CH2Cl2). Получают 0,2793 г 3-(2 фторфенил)-7-(1-гидроксициклобутил)-6-(2 метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4 триазоло[4,3-b]пиридазина (содержащего приблизительно 20% исходного (2-метил-2 Н-1,2,4 триазол-3-ил)метанола) в виде бесцветного твердого вещества. 1[МН]+, 114. К перемешиваемому раствору указанного выше вещества (0,2094 г) в безводном дихлорметане (10 мл), охлажденному до -78 С, в атмосфере азота по каплям прибавляют трифторид диэтиламиносеры (ТДАС) (77,0 мл, 0,582 ммоль) и смесь перемешивают при температуре ниже -70 С. По каплям прибавляют еще (ТДАС)(2 х 77,0 мл, 0,582 ммоль и 40 мл, 0,303 моль) соответственно через 40, 70 и 110 мин. Смесь далее перемешивают при температуре ниже-70 С еще 40 мин затем обрабатывают насыщенным NаНСО 3 (20 мл) и дихлорметаном (40 мл). Водный слой экстрагируют дихлорметаном (2 х 30 мл), а объединенные органические экстракты сушат (Na2SO4) и упаривают в вакууме. Остаток очищают флэш-хроматографией(силикагель, 2% MeOH/CH2Cl2). Получают 0,1249 г (52%) указанного в заголовке соединения в виде белого твердого вещества. Т.пл 154162 С (СН 2 Сl2-ЕtOАс-гексан); 1(ES+) m/e 398 [МН]+, 378 [M-HF+H]. Анализ, найдено: С 57,61; Н 4,18; N 24,47%. Вычислено: C19H17F2N7O: С 57,43; Н 4,31; N 24,67%. Пример 26. 7-Циклобутил-3-(2-фторфенил)-6-(2-метил-2 Н-пиразол-3-илметокси)-1,2,4 триазоло[4,3-b]пиридазин. Данное соединение получают способом,аналогичным указанному в примере 1 стадия в),используяa) 7-Бром-6-хлор-3-(2-фторфенил)-1,2,4 триазоло[4,3-b]пиридазин. Дифтортрифенилстаннат тетрабутиламмония (6,8 г, 10,8 ммоль) прибавляют к суспензии 6-хлор-3-(2-фторфенил)-7-(триметилсилил)1,2,4-триазоло[4,3-b]пиридазина (3,17 г, 9,88 ммоль), приготовленного как в примере 25 стадия в) и 1,2-дибромтетрафторэтана (6,0 мл, 50 ммоль) в безводном ТГФ (75 мл), и смесь перемешивают 18 ч при комнатной температуре в атмосфере азота. Смесь разбавляют дихлорметаном (100 мл), фильтруют, а фильтрат концентрируют. Колоночная флэш-хроматография на силикагеле с элюированием смесью 50-100%[МН]+. б) 7-Бром-3-(2-фторфенил)-6-(2-метил-2 Н 1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b] пиридазин. Раствор бис(триметилсилил)амида калия в толуоле (16,8 мл, 0,5 М, 8,4 ммоль) при комнатной температуре в атмосфере азота прибавляют к перемешиваемому раствору 2-метил-2 Н-1,2,4 37 триазол-3-ил)метанола (0,95 г, 8,4 ммоль) в безводном ТГФ (30 мл). Через 20 мин суспензию охлаждают до 0 С и по каплям прибавляют суспензию 7-бром-6-хлор-3-(2-фторфенил)-1,2,4 триазоло[4,3-b] пиридазина (2,28 г, 6,96 ммоль) в безводном ТГФ (100 мл). Смесь перемешивают 3 ч при 0 С, после чего выливают в ледяную воду (400 мл), разбавляют насыщенным водным хлоридом аммония (100 мл) и экстрагируют смесью дихлорметан-метанол (9:1, 3 х 100 мл). Экстракты сушат (Nа 2SO4), профильтровывают и концентрируют. Колоночная флэш-хроматография на силикагеле с элюированием смесью 3% метанол-дихлорметан дает 1.45 г (52%) 7 бром-3-(2-фторфенил)-6-(2-метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазина в виде желтого твердого вещества. 1H ЯМР (360 МГц, CDCl3)3.95 (3 Н, с),5.54 (2 Н, с), 7.28 (1 Н, дд, J=10 и 10 Гц), 7.37 (1 Н,ддд, J= 8, 8 и 1 Гц), 7.57-7,63 (1 Н, м), 7.86 (1H,ддд, J= 8, 8 и 2 Гц), 7.90 (1 Н, с), 8.41 (1H, с); Масс-спектр (ES+) m/e 404/406 [МН]+. в) 7-(2,2-Диметилпропил)-3-(2-фторфенил)-6-(2-метил-2 Н-1,2,4-триазол-3-илметокси)1,2,4-триазоло[4,3-b]пиридазин. 1,2-Дибромэтан (0,03 мл, 10 мол.%) прибавляют к перемешиваемой суспензии промытой кислотой цинковой пыли (0,45 г 7,0 ммоль) в безводном ДМФА (3 мл) в атмосфере азота при 50 С. Через 5 мин прибавляют неопентилиодид (1,0 мл, 75 ммоль). Смесь перемешивают 2,5 ч до получения серо-зеленого молокообразно-го раствора. Смесь 7-бром-3-(2 фторфенил)-6-(2-метил-2 Н-1,2,4-триазол-3 илметокси)-1,2,4-триазоло[4,3-b]пиридазина(0,35 г, 0,866 ммоль), три-2-фурилфосфина (0,08 г, 40 мол.%) и трис(дибензилиденацетон) дипалладия (0) (0,04 г, 5 мол.%) в безводном ДМФА (2 мл) перемешивают в атмосфере азота при 50 С в течение 15 мин, после чего прибавляют через шприц раствор цинкорганического реагента. Через 2,5 ч смесь охлаждают, выливают в воду (100 мл) и экстрагируют дихлорметаном (2 х 50 мл). Экстракты сушат (Na2SO4),профильтровывают и концентрируют. Колоночная флэш-хроматография на силикагеле с элюированием смесью 2% метанол/дихлорметан дает коричневое твердое вещество, которое перекристаллизовывают из смеси этилацетатдиэтиловый эфир. Получают 0,199 г (58%) 7(2,2-диметилпропил)-3-(2-фторфенил)-6-(2 метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4 триазоло[4,3-b]пиридазина в виде порошка бежевого цвета. 1 38 Масс-спектр (ES+) m/e 396 [МН]+; Анализ,найдено: С 59,66; Н 5,69; N 24,41%. Вычислено,С 20H22FN7 О.0.4 H2O: С 59.66; Н 5.71; N 24.35%. Пример 28. 3-(2-Фторфенил)-7-(2-метилпропил)-6-(2-метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин. Данное соединение получают способом,аналогичным указанному в примере 27 стадия в), используя 1-иод-2-метилпропан вместо неопентилиодида. Характеристики указанного в заголовке соединения: Т.пл. 134-136 С (EtOAc); 1(ЕS+) m/е 382 [МН]+; Анализ, найдено: С 59,66; Н 5,39; N 25,56%. Вычислено, С 19 Н 20FN7 О: С 59,83; Н 5,29; N 24,71% Пример 29. 3-(2-Фторфенил)-7-(3-метилбутил)-6-(2-метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин. Данное соединение получают способом,аналогичным указанному в примере 27 стадия в), используя 1-иод-3-метилбутан вместо неопентилиодида. Характеристики указанного в заголовке соединения: т.пл. 103-105 С (EtOAc); 1(1H, с); Масс-спектр (ES+) m/e 396 [МН]+; Анализ, найдено: С 60,56; Н 5,61%. Вычислено: C20H22FN7O: С 60,75; Н 5,61%. Пример 30. 7-Циклопентилметил-3-(2 фторфенил)-6-(2-метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин. а) 3-(2-Фторфенил)-7-иод-6-(2-метил-2 Нтриазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин. Раствор 6-хлор-3-(2-фторфенил)-7-(триметилсилил)-1,2,4-триазоло[4,3-b]пиридазина (5,0 г, 15,6 ммоль), полученный как и в примере 25 стадия в), и 1,2-дииодэтана (14 г, 50 ммоль) в безводном ТГФ (150 мл) при комнатной температуре в атмосфере азота прибавляют через канюлю к перемешиваемой суспензии (триметилсилил)дифторида трис(диметиламино) серы (5,0 г, 18 ммоль) в безводном ТГФ (200 мл). Через 18 ч смесь разбавляют дихлорметаном (400 мл) и последовательно промывают водой (300 мл) и насыщенным раствором соли(200 мл). Органический слой сушат (Na2SO4),профильтровывают и концентрируют. Колоночная флэш-хроматография на силикагеле с элюированием смесью 3% метанол/дихлорметан дает неочищенный 6-хлор-3-(2-фторфенил)-7-иод 1,2,4-триазоло[4,3-b]пиридазин (3,54 г) в виде темно-коричневого твердого вещества. Его под 39 вергают обработкам, описанным в примере 27 стадия б), получая 1,32 г (19% на двух стадиях) 3-(2-фторфенил)-7-иод-6-(2-метил-2 Н-1,2,4 триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазина в виде желтого твердого вещества. 1H ЯМР (360 МГц CDCl3)3.97 (3 Н, с),5.51 (2 Н, с), 7.28 (1 Н, дд, J= 8 и 8 Гц), 7.37 (1 Н,дд, J= 8 и 8 Гц), 7.56-7.64 (1 Н, м), 7.86 (1H, ддд,J= 7, 7 и 1 Гц), 7.90 (1 Н, с), 8.68 (1H, с); Массспектр (ES+) m/e 452 [МН]+. б) 7-Циклопентилметил-3-(2-фторфенил)6-(2-метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4 триазоло[4,3-b]пиридазин. Данное соединение получают способом,аналогичным указанному в примере 27 стадия в), используя циклопентилметилиодид вместо неопентилиодида и 3-(2-фторфенил)-7-иод-6-(2 метил-2 Н)-1,2,4-триазоло[4,3-b]пиридазин вместо 7-бром-3-(2-фторфенил)-6-(2-метил-2 Н)-1,2,4-триазоло[4,3-b]пиридазина. Характеристики указанного в заголовке соединения: т.пл. 135137 С; 1 Н ЯМР (360 МГц, CDCl3)1.18-1.28 (2 Н,м), 1.36-1.74 (4 Н, м), 1.76-1.86 (2 Н, м), 2.16-2.28(1 Н, с); Масс-спектр (ЕS+) m/e 382 [МН]+; Анализ, найдено: С 60.86; Н 5.38%. Вычислено,C21H22FN7O.0,4 Н 2 О: С 60,83; Н 5,54%. Пример 31. 7-(3-Бензилоксициклобутил)-3(2-фторфенил)-6-(2-метил-2 Н-1,2,4-триазол-3 илметокси)-1,2,4-триазоло[4,3-b]пиридазин. а) Цис-3-бензилокси-1-гидроксициклобутан. Смесь 3-бензилоксициклобутан-1-она (0.92 г, 5.22 ммоль) (Ogura et al., Bull. Chem Soc. Jpn.,1984, 57, 1637-1642) и боргидрида натрия (0,20 г, 5,29 ммоль) в этаноле (15 мл) перемешивают 3,5 ч при комнатной температуре. Смесь фильтруют, промывают этанолом, а фильтрат концентрируют. Фильтрование через пробку окиси кремния при элюировании этилацетатом дает 0,854 г (92%) цис-3-бензилокси-1-гидроксициклобутана в виде бесцветного масла. 1H ЯМР (250 МГц, CDCl3)1.75-2.00 (2 Н,м), 2.65-2.79 (2 Н, м), 3.62 (1 Н, квинт, J= 7 Гц),3.90 (1 Н, ушир. квинт, J= 7 Гц), 4.41 (2 Н, с),7.23-7.47 (5 Н, м). б) Цис-3-бензилокси-1-метансульфонилоксициклобутан. Метансульфонилхлорид (0,44 мл, 5,7 ммоль) при 0 С в атмосфере азота по каплям прибавляют к перемешиваемому раствору цис 3-бензилокси-1-гидроксициклобутана (0,85 г,4,77 ммоль) и триэтиламина (1,0 мл, 7,2 ммоль) в сухом дихлорметане (15 мл). Белую суспензию 1,5 ч перемешивают при 0 С, затем выливают в воду (50 мл) и экстрагируют дихлорметаном (2 х 30 мл). Экстракты сушат (Na2SO4),профильтровывают и концентрируют. Получен 002755 40 ное масло фильтруют через пробку силикагеля при элюировании этилацетатом. Получают 1,27 г (100%) цис-3-бензилокси-1-метансульфонилоксициклобутана в виде желтого масла. 1 Н ЯМР (250 МГц CDCl3)2.26-2.39 (2 Н,м), 2.77-2.91 (2 Н, м), 2.97 (3 Н, с), 3.74 (1 Н,квинт, J= 7 Гц), 4.42 (2 Н, с), 4.68 (1 Н, квинт, J= 7 Гц), 7.26-7.42 (5 Н, м). в) Транс-3-бензилокси-1-иодциклобутан. Раствор цис-3-бензилокси-1-метансульфонилоксициклобутана (1,25 г, 4,8 ммоль) и иодида натрия (2,16 г, 14,4 ммоль) в безводном ацетоне (20 мл) кипятят с обратным холодильником в атмосфере азота 3,5 дня. Смесь охлаждают и разбавляют диэтиловым эфиром (150 мл). Суспензию отфильтровывают, а фильтрат концентрируют. Остаток растворяют в этилацетате и профильтровывают через пробку силикагеля с элюированием этилацетатом. Получают транс 3-бензилокси-1-иодциклобутан (1,19 г, 86%) в виде оранжевого масла. 1H ЯМР (250 МГц, CDCl3)2.54-2.65 (2 Н,м), 2.94-3.04 (2 Н, м), 3.85-4.06 (2 Н, м), 4.40 (2 Н,с), 7.26-7.38 (5 Н, м). г) 7-(3-Бензилоксициклобутил)-3-(2-фторфенил)-6-(2-метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин. Данное соединение получают способом,аналогичным указанному в примере 27 стадия в), используя транс-3-бензилокси-1-иодциклобутан вместо неопентилиодида. Соединение выделяют с помощью препаративной тонкослойной хроматографии, элюируя смесью 5% метанолдихлорметан, а затем повторной препаративной тонкослойной хроматографии, элюируя смесью 2% этанол-этилацетат, и обработкой диэтиловым эфиром. Получают смесь транс- и цис-изомеров в соотношении 2.3:1. 1(0,04 г, 0,082 ммоль), избытка формиата аммония (1,0 г), муравьиной кислоты (1 мл) и 10% палладия на углероде (0,10 г) 18 ч перемешивают при 60 С в атмосфере азота, затем охлаждают и концентрируют. Остаток разбавляют дихлорметаном (20 мл) и промывают насыщенным раствором соли (20 мл). Органический слой сушат (Na2SO4), профильтровывают и концентрируют. Препаративная тонкослойная хроматография на силикагеле с элюированием смесью 10% метанолдихлорметан дает 0,016 г (40%) 7 41(3-бензилоксициклобутил)-3-(2-фторфенил)-6(2-метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4 триазоло[4,3-b]пиридазина и 0,009 г (28%) 3-(2 фторфенил)-7-(3-гидроксициклобутил)-6-(2 метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4 триазоло[4,3-b]пиридазина в виде белого твердого вещества как смесь транс- и цис-изомеров в соотношении 3:1. 1(1H, м), 7.54-7.60 (1H, м), 7.82-7.96 (3 Н, м); Масс-спектр (ES+) m/е 396 [МН]+. Примеры 33 и 34. 7-(1-Фторбут-3-енил)-3(2-фторфенил)-6-(2-метил-2-Н-1,2,4-триазол-3 илметокси)-1,2,4-триазоло[4,3-b]пиридазин и 7(3-фторциклобутил)-3-(2-фторфенил)-6-(2-метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин. Трифторид диэтиламиносеры (0,025 мл,0,17 ммоль) при -78 С в атмосфере азота по каплям прибавляют к перемешиваемому раствору 3-(2-фторфенил)-7-(3-гидроксициклобутил)-6(2-метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4 триазоло[4,3-b]пиридазина (0,033 г, 0,083 ммоль) в сухом дихлорметане (3 мл). Через 3,5 ч при -78 С добавляют еще трифторид диэтиламиносеры (0,025 мл, 0,17 ммоль). Смесь перемешивают при -78 С еще 1,25 ч, после чего в течение 10 мин нагревают до 0 С и гасят реакцию прибавлением метанола (2 мл). Смесь разбавляют водой (20 мл) и экстрагируют дихлорметаном (2 х 20 мл). Экстракты сушат (Na2SO4),профильтровывают и концентрируют. Препаративная тонкослойная хроматография на силикагеле с элюированием смесью 5% метанолдихлорметан дает два продукта. Менее полярный является 7-(1-фторбут-3-енил)-3-(2 фторфенил)-6-(2-метил-2 Н-1,2,4-триазол-3 илметокси)-1,2,4-триазоло[4,3-b]пиридазином(1H, м), 7.84 (1H, дд, J= 8 и 8 Гц), 7.80 (1H, с),8.15 (1H, с); Масс-спектр (ES+) m/e 398 [МН]+. Более полярный является 7-(3-фторциклобутил)-3-(2-фторфенил)-6-(2-метил-2 Н 1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b] пиридазином (0.0014 г, 4%) в виде смеси транси цис-изомеров в соотношении 1:1. 1 42 Пример 35. 3-(2-Фторфенил)-6-(2-метил 2 Н-1,2,4-триазол-3-илметокси)-7-трифторметил 1,2,4-триазоло[4,3-b]пиридазин. Иодтрифторметан (2,0 г, 10 ммоль) барботируют через раствор 7-бром-3-(2-фторфенил)6-(2-метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4 триазоло [4,3-b]пиридазина (0,10 г, 025 ммоль) в сухом ДМФА (2 мл) при комнатной температуре до тех пор, пока не будет растворено требуемое количество газа. Прибавляют медный порошок (0,16 г, 2,5 ммоль) и смесь перемешивают 18 ч в запаянной трубке при 80 С. Смесь охлаждают, разбавляют дихлорметаном (50 мл) и фильтруют. Фильтрат промывают водой (50 мл), затем сушат (Na2SO4), профильтровывают и концентрируют. Препаративная тонкослойная хроматография с элюированием смесью 3% метанолдихлорметан дает 0,0061 г (6%) 3-(2 фторфенил)-6-(2-метил-2 Н-1,2,4-триазол-3 илметокси)-7-трифторметил-1,2,4-триазоло[4,3b]пиридазина в виде светло-желтого твердого вещества. Т.пл. 123-126 С. 1[МН]+. Пример 36. 3-(2-Фторфенил)-7-(4-метилтетрагидропиран-4-ил)-6-(2-метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин. а) 4-Метилтетрагидропиран-4-карбоновая кислота. н-Бутиллитий (21,1 мл, 33,8 ммоль, 1,6 М в смеси гексанов) в течение 10 мин по каплям прибавляют к перемешиваемому раствору диизопропиламина (4,7 мл, 33,8 ммоль) в безводном тетрагидрофуране (40 мл) в атмосфере азота при температуре ниже 10 С. После прибавления добавляют тетрагидропиран-4-карбоновую кислоту (J. Am. Chem. Soc., 1993, 115, 8407) в безводном тетрагидрофуране (20 мл) в атмосфере азота при температуре ниже 5 С. Смесь перемешивают при комнатной температуре в течение часа, после чего по каплям прибавляют метилиодид (2,4 мл, 38,4 ммоль) при температуре ниже 5 С. Полученный раствор перемешивают 30 мин при температуре ниже 5 С, дают нагреться до комнатной температуры и перемешивают далее в течение 3,5 дней. Растворитель упаривают, остаток растворяют в дихлорметане(100 мл) и прибавляют 2 н. хлористо-водородной кислоты (100 мл). Водный слой экстрагируют дихлорметаном (3 х 100 мл), а объединенные органические слои промывают водой (100 мл),насыщенным раствором соли (100 мл), сушат(MgSO4), профильтровывают и упаривают. Получают 1.4 г указанного в заголовке продукта используемого на последующей стадии без очистки. 43 Характеристики указанного соединения 1H ЯМР (250 МГц, CDCl3)1.00 (3 Н, с), 1.47-1.58(2 Н, м), 2.06-2.11 (2 Н, м), 3.49-3.60 (2 Н, м), 3.783.86 (2 Н, м). б) 3-(2-Фторфенил)-7-(4-метилтетрагидропиран-4-ил)-6-(2-метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин. Данное соединение получат способом, указанным в примере 1 стадии а), б) и в), используя 4-метилтетрагидропиран-4-карбоновую кислоту вместо циклобутанкарбоновой кислоты на стадии а). Характеристики указанного в заголовке соединения: т.пл. 191 С. 1[МН]+; Анализ, найдено: С 59,40; Н 5,11; N 23,13%. Вычислено, C21H22FN7O2: С 59,57; Н 5,24, N 23,15%. Пример 37. 3-(2-Фторфенил)-7-(4-метилтетрагидропиран-4-ил)-6-(1-метил-1 Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин. Данное соединение получают способом,указанным в примере 1 стадии а), б) и в), используя 4-метилтетрагидропиран-4-карбоновую кислоту (полученную с использованием условий, описанных в примере 36, стадия а вместо циклобутанкарбоновой кислоты на стадии а) и[4,3-b]пиридазин и 7-(4-фтор-1-метилциклогекс 3-енил)-3-(2-фторфенил)-6-(2-метил-2 Н-1,2,4 триазол-3-илметокси)-1,2,4-триазоло [4,3-b] пиридазин. а) 3,6-Дихлор-4-(1-метил-4-оксоциклогексил)пиридазин. Данное соединение получают способом,указанным в примере 1 стадия а), используя 1 метил-4-оксоциклогексанкарбоновую кислоту(1 Н, с); Масс-спектр (ES+) m/е 261 [МН]+. б) 3,6-Дихлор-4-(4,4-дифтор-1-метилциклогексил)пиридазин и 3,6-дихлор-4-(4-фтор-1 метилциклогекс-3-енил)пиридазин. Раствор трифторида диэтиламиносеры (1.2 мл, 9.13 ммоль) в безводном дихлорметане (60 мл) в атмосфере азота при -78 С прибавляют к раствору 3,6-дихлор-4-(1-метил-4-оксоциклогексил)пиридазина (1,8 г, 4,15 ммоль:) в безводном дихлорметане (140 мл) в атмосфере азота при-78 С. Реакционной смеси медленно дают нагреться до комнатной температуры и перемешивают 5,5 дней. Реакционную смесь выливают в смесь насыщенного бикарбоната натрия и льда(250 мл), разделяют, и водный слой экстрагируют дихлорметаном (2 х 50 мл), органические слои объединяют, промывают насыщенным раствором соли (250 мл), сушат (МgSO4), профильтровывают и упаривают. Получают технический продукт, который очищают хроматографией на силикагеле, элюируя смесью 0%20% этилацетат-гексан. Получают 0,82 г (70%) указанного в заголовке вещества в виде смеси в соотношении 2.7:1. Характеристики указанного в заголовке соединения: 1 Н ЯМР (360 МГц, CDCl3)1.50(2.2 Н, с), 1.54 (0.8 Н, с), 1.84-2.79 (7.3 Н, м), 5.205.29 (0.2 Н, м), 7.38 (0.2 Н, с), 7.46 (0.8 Н, с); Масс-спектр (ES+) m/e 282 [MH]+ и 262 [МН]+ в) 7-(4,4-Дифтор-1-метилциклогексил)-3(2-фторфенил)-6-(2-метил-2 Н-1,2,4-триазол-3 илметокси)-1,2,4-триазоло[4,3-b]пиридазин и 7(4-фтор-1-метилциклогекс-3-енил)-3-(2-фторфенил)-6-(2-метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b] пиридазин. Данные соединения получают способом,указанным в примере 1 стадии б) и в), используя смесь 3,6-дихлор-4-(4,4-дифтор-1-метилциклогексил)пиридазина и 3,6-дихлор-4-(4-фтор-1 метилциклогекс-3-енил)пиридазина вместо 3,6 дихлор-4-циклобутилпиридазина на стадии б). Соединения разделяют с помощью ВЭЖХ. Характеристики 7-(4,4-дифтор-1-метилциклогексил)-3-(2-фторфенил)-6-(2-метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b] пиридазина: т.пл. 135 С; 1(1 Н, с); Масс-спектр (ES+) m/е 438 [МН]+. Пример 40. 7-(4,4-Дифтор-1-метилциклогексил)-3-(2-фторфенил)-6-(1-метил-1 Н-1,2,4 триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин. Данное соединение получают способом,описанным в примере 38 стадии а), б) и в), используя (1-метил-1 Н-1,2,4-триазол-3-ил)метанол(2 Н, м), 3.92 (3 Н, с), 5.45 (2 Н, с), 7.24-7.35 (2 Н,м), 7.51-7.56 (1 Н, м), 7.94 (1 Н, с), 7.97 (1 Н, м),8.04 (1 Н, с); Масс-спектр (ES+) m/е 458 [МН]+; Анализ, найдено: С 57,84; Н 4,75; N 21,02%. Вычислено C22H22F3N7O: С 57,76; Н 4,85; N 21,43%. Пример 41. 3-(2-Фторфенил)-6-(2-метил 2 Н-1,2,4-триазол-3-илметокси)-7-(3-оксоциклобутил)-1,2,4-триазоло[4,3-b]пиридазин. а) 7-(3-Бензилоксоциклобутил)-6-хлор-3(2-фторфенил)-1,2,4-триазоло[4,3-b]пиридазин. Данное соединение получают способом,аналогичным приведенному в примере 1 стадии а) и б), используя 3-бензилоксициклобутанкарбоновую кислоту (Collect. Czech. Chem. Соmmun., 1982, 47, 2440) вместо циклобутанкарбоновой кислоты. Характеристики указанного в заголовке соединения: 1 Н ЯМР (360 МГц, СDСl3), цис и транс-изомеры присутствуют в соотношении 58:1,2.06-2.51 (2 Н, м), 2.63-2.91 (2 Н, м), 3.133.25 (1 Н, м), 3.81-4.25 (1 Н, м), 4.50 (2 Н, с), 7.287.36 (7 Н, м), 7.54-7.61 (1 Н, м), 7.88 (1H, м), 7.97 и 8.03 (1 Н, 2 с); Масс-спектр (ES+) m/e 409[MH]+. б) 7-(3-Бензилоксициклобутил)-3-(2-фторфенил)-1,2,4-триазоло [4,3-b]пиридизин-6-он. 4 н. Раствор гидроксида натрия (3 мл, 12 ммоль) прибавляют к раствору 7-(3-бензилоксоциклобутил)-6-хлор-3-(2-фторфенил)-1,2,4-триазоло[4,3-b]пиридазина (0,98 г, 2,4 ммоль) в 1,4 диоксане (30 мл) и воде (8 мл) и нагревают при температуре кипения с обратным холодильником 18 ч. Растворитель упаривают, остаток растворяют в диэтиловом эфире (50 мл) и воде (50 мл) и отделяют. Водный слой подкисляют до рН 2 2 н. хлористо-водородной кислотой, а полученное твердое вещество отделяют фильтрацией, промывают водой (50 мл), а затем - диэтиловым эфиром (50 мл) и высушивают в вакууме при 100 С в течение 18 ч. Характеристики указанного в заголовке соединения: 1(1,034 г, 16,4 ммоль) в метаноле (40 мл). Раствор продувают азотом и прибавляют 10% палладий на углероде (0,3 г). Полученный раствор перемешивают 2 ч в атмосфере азота при 60 С. Реакционную массу охлаждают, профильтровывают и концентрируют в вакууме. Остаток очищают хроматографией на окиси кремния с использованием в качестве элюента смеси 0-10% метанол-дихлорметан. Получают целевой продукт в виде белого твердого вещества. Характеристики указанного в заголовке соединения 1H ЯМР (360 МГц ДМСО) цис- и транс-изомеры присутствуют в соотношении 5.5:1,1.89-1.98 (1.7 Н, м), 2.21-2.29 (0.3 Н, м),2.40-2.48 (0.3 Н, м), 2.55-2.65 (1.7 Н, м), 2.88-3.00(1 Н, м), 7.97 (0.85 Н, с), 8.12 (0.15 Н, с); Массспектр (ES+) m/e 301 [М]+. г) 3-(2-Фторфенил)-7-(3-оксоциклобутил)1,2,4-триазоло[4,3-b] пиридазин-6-он. 8 н. Хромовую кислоту по каплям прибавляют к раствору 3-(2-фторфенил)-7-(3-гидроксициклобутил)-1,2,4-триазоло[4,3-b]пиридазин-6 она (0,36 г, 1,2 ммоль) в ацетоне (50 мл) до тех пор, пока не будет наблюдаться ее избыток (неисчезающее красное окрашивание). Реакционную массу перемешивают 2 ч, затем прибавляют изопропанол до тех пор, пока не будет наблюдаться неисчезающее голубое окрашивание и не будет избытка хромовой кислоты. Прибавляют воду (50 мл), водный слой экстрагируют этилацетатом (4 х 50 мл), органические слои объединяют, промывают насыщенным раствором соли (50 мл), сушат (MgSO4), профильтровывают и концентрируют. Получают целевой продукт в виде белого твердого вещества. Характеристики указанного в заголовке соединения: 1H ЯМР (360 МГц, ДМСО)3.41(0,23 г, 0,7 ммоль) в безводном N,Nдиметилформамиде (5 мл), нагревают при 80 С в атмосфере азота в течение 0,5 ч. Перед прибавлением моногидрохлорида 5-хлорметил 1-метил-1 Н-1,2,4-триазола(полученного с использованием условий, описанных в ЕР-А 170073) (0,14 г, 0,85 ммоль) раствору дают охладиться. Реакционную смесь затем нагревают при 80 С в атмосфере азота в течение 18 ч. Раствору дают остыть, концентрируют, а остаток очищают хроматографией на окиси кремния, используя в качестве элюента смесь 0-5% метанол-дихлорметан. Получают целевой продукт в виде белого твердого вещества. Характеристики указанного в заголовке соединения: 1(0,074 мл, 0,56 ммоль) в безводном дихлорметане (6 мл) при -78 С в атмосфере азота прибавляют к раствору 3-(2-фторфенил)-6-(2-метил 2 Н-триазол-3-илметокси)-7-(3-оксоциклобутил)1,2,4-триазоло[4,3-b]пиридазина (0,1 г, 0,254 ммоль) в безводном дихлорметане (14 мл) в атмосфере азота при -78 С. Реакционной смеси медленно дают нагреться до комнатной температуры и перемешивают 4 дня. Реакция не доходит до завершения, поэтому при -78 С прибавляют еще 0,037 мл трифторида диэтиламиносеры (0,28 ммоль). Через последующих 2 дня при комнатной температуре в реакционной смеси все еще остается исходный продукт. Поэтому добавляют при -78 С еще 0,074 мл трифторида диэтиламиносеры (0,56 ммоль). Таким образом,за 10-дневный период вносят 5,5 эквивалентов трифторида диэтиламиносеры. Этот раствор добавляют к насыщенному раствору гидрокарбоната натрия со льдом (25 мл), разделяют слои,водный слой экстрагируют дихлорметаном (2 х 25 мл), органические слои объединяют, промывают насыщенным раствором соли (25 мл), сушат (MgSO4), профильтровывают и упаривают. Остаток очищают хроматографией на силикагеле, элюируя смесью 0%5% метанол-дихлорметан и перекристаллизовывают из смеси этилацетат/изогексан. Получают указанное в заголовке соединение в виде светло-оранжевого твердого вещества. Характеристики указанного в заголовке соединения: т.пл. 178 С; 1[МН]+; Анализ, найдено: С 55,55; Н 3,99; N 23,37%. Вычислено С 19 Н 16F3N7O: С 54,94; Н 3,88; N, 23,60%. Пример 43. 3-(2-Фторфенил)-6-(2-метил 2 Н-1,2,4-триазол-3-илметокси)-7-(тетрагидрофур-2-ил)-1,2,4-триазоло[4,3-b]пиридазин. Данное соединение получают способом,описанным в примере 1 стадии а), б) и в), используя тетрагидро-2-фуроевую кислоту вместо циклобутанкарбоновой кислоты на стадии а). Характеристики указанного в заголовке соединения: т.пл. 136-139 С; 1H ЯМР (360 МГц,CDCl3)1.77 (1 Н, м), 1.98 (2 Н, м), 2.42 (1 Н, м),3.82 (3 Н, с), 3.98 (1 Н, кв, J= 7.1 и 15.4 Гц), 4.15(74,1 мг, 0,339 ммоль) и тетракис(трифенилфосфин)палладия (0) (11,5 мг, 0,00995 ммоль) в безводном ДМФА (3 мл) дегазируют упариванием и заполнением колбы азотом, которое производят 4 раза, нагревают 14,5 ч при 100 С в атмосфере азота. Смесь обрабатывают этилацетатом (20 мл) и насыщенным раствором соли(15 мл). Водный слой далее экстрагируют этилацетатом (2 х 20 мл), а объединенные органические экстракты упаривают в вакууме. Остаток очищают флэш-хроматографией (силикагель,2% MeOH/CH2Cl2). Получают 18,1 мг (35%) указанного в заголовке соединения в виде белого твердого вещества. Т.пл. 204-206 С (СН 2 Сl2 ЕtOАс-гексан),1m/e 420 [MH]+. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы I или его фармацевтически приемлемая сольR1 представляет собой водород или фтор иR2 представляет собой метилизоксазолил,метилпиразолил, метилимидазолил, бензимидазолил или метилтриазолил; при условии, что если Z представляет собой 1-метилциклобутил,R1 является водородом, а R2 представляет собой 1-метил-1 Н-1,2,4-триазол-3-ил или 2-метил-2 Н 1,2,4-триазол-3-ил, тогда атом фтора не находится в положении 2 фенильного кольца. 2. Соединение по п.1, где Z представляет собой циклобутил. 3. Соединение по п.1 или 2, где R2 представляет собой циклическую структуру (а), (b),(с), (d), (е), (f) или (g) где звездочкаозначает место присоединения кольца к остальной части молекулы. 4. Соединение по п.3, где R2 представляет собой кольцевую структуру (g) по п.3. 5. Соединение по п.1, представленное формулой IIА или его фармацевтически приемлемая сольR3 представляет водород или фтор. 6. Соединение по п.1, представленное формулой IIB или его фармацевтически приемлемая соль[4,3-b]пиридазин; 3-(2,4-дифторфенил)-6-(2-метил-2 Н-1,2,4 триазол-3-илметокси)-7-(пирролидин-1-ил)1,2,4-триазоло[4,3-b]пиридазин; 3-(2,4-дифторфенил)-6-(1-метил-1 Н-1,2,4 триазол-3-илметокси)-7-(пирролидин-1-ил)1,2,4-триазоло[4,3-b]пиридазин; 3-(2-фторфенил)-6-(1-метил-1 Н-1,2,4-триазол-3-илметокси)-7-(пирролидин-1-ил)-1,2,4 триазоло[4,3-b]пиридазин; 7-циклобутил-3-(2-фторфенил)-6-(1-метил 1 Н-имидазол-4-илметокси)-1,2,4-триазоло[4,3b]пиридазин; 7-(1-фторциклобутил)-3-(2-фторфенил)-6(2-метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4 триазоло[4,3-b]пиридазин; 7-циклобутил-3-(2-фторфенил)-6-(2-метил 2 Н-пиразол-3-илметокси)-1,2,4-триазоло[4,3-b] пиридазин и их фармацевтически приемлемые соли. 9. Соединение, выбранное из группы,включающей 7-(2,2-диметилпропил)-3-(2-фторфенил)-6(2-метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4 триазоло[4,3-b]пиридазин; 3-(2-фторфенил)-7-(2-метилпропил)-6-(2 метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4 триазоло[4,3-b]пиридазин; 3-(2-фторфенил)-7-(3-метилбутил)-6-(2 метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4 триазоло[4,3-b]пиридазин; 7-циклопентилметил-3-(2-фторфенил)-6(2-метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4 триазоло[4,3-b]пиридазин; 7-(3-бензилоксициклобутил)-3-(2-фторфенил)-6-(2-метил-2 Н-1,2,4-триазол-3-илметокси)1,2,4-триазоло[4,3-b]пиридазин; 3-(2-фторфенил)-7-(3-гидроксициклобутил)-6-(2-метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло-[4,3-b]пиридазин; 7-(1-фторбут-3-енил)-3-(2-фторфенил)-6(2-метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4 триазоло[4,3-b]пиридазин; 7-(3-фторциклобутил)-3-(2-фторфенил)-6(2-метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4 триазоло[4,3-b]пиридазин; 3-(2-фторфенил)-6-(2-метил-2 Н-1,2,4 триазол-3-илметокси)-7-трифторметил-1,2,4 триазоло[4,3-b]пиридазин и их фармацевтически приемлемые соли. 52 10. Соединение, выбранное из группы,включающей 3-(2-фторфенил)-7-(4-метилтетрагидропиран-4-ил)-6-(2-метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин; 3-(2-фторфенил)-7-(4-метилтетрагидропиран-4-ил)-6-(1-метил-1 Н-1,2,4-триазол-3 илметокси)-1,2,4-триазоло[4,3-b]пиридазин; 7-(4,4-дифтор-1-метилциклогексил)-3-(2 фторфенил)-6-(2-метил-2 Н-1,2,4-триазол-3 илметокси)-1,2,4-триазоло[4,3-b]пиридазин; 7-(4-фтор-1-метилциклогекс-3-енил)-3-(2 фторфенил)-6-(2-метил-2 Н-1,2,4-триазол-3 илметокси)-1,2,4-триазоло[4,3-b]пиридазин; 7-(4,4-дифтор-1-метилциклогексил)-3-(2 фторфенил)-6-(1-метил-1 Н-1,2,4-триазол-3 илметокси)-1,2,4-триазоло[4,3-b]пиридазин; 3-(2-фторфенил)-6-(2-метил-2 Н-1,2,4 триазол-3-илметокси)-7-(3-оксоциклобутил)1,2,4-триазоло[4,3-b]пиридазин; 7-(3,3-дифторциклобутил)-3-(2-фторфенил)-6-(2-метил-2 Н-1,2,4-триазол-3-илметокси)1,2,4-триазоло[4,3-b]пиридазин; 3-(2-фторфенил)-6-(2-метил-2 Н-1,2,4 триазол-3-илметокси)-7-(тетрагидрофур-2-ил)1,2,4-триазоло[4,3-b]пиридазин; 1-(3-фторфенил)-3-(2-фторфенил)-6-(2 метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4 триазоло[4,3-b]пиридазин и их фармацевтически приемлемые соли. 11. Фармацевтическая композиция, включающая соединение формулы I по п.1 или его фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым носителем. 12. Применение соединения по любому из пп.1-10 для производства медикамента для лечения и/или профилактики состояния тревоги. 13. Применение соединения по любому из пп.1-10 для производства медикамента для лечения и/или профилактики судорог. 14.Способ получения соединения по п.1,отличающийся тем, что включает взаимодействие соединения формулы III с соединением формулы IV где Z, R1 и R2 определены в п.1, L1 представляет собой подходящую уходящую группу. 15. Способ лечения и/или профилактики состояния тревоги, включающий введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы I,указанной в п.1, или его фармацевтически приемлемой соли. 16. Способ лечения и/или профилактики судорог, включающий введение пациенту, нуждающемуся в таком лечении, эффективного ко 53 личества соединения формулы I, указанной в п.1, или его фармацевтически приемлемой соли. 17. Соединение по п.1, которое представляет собой 7-циклобутил-3-(2,6-дифторфенил)6-(2-метил-2 Н-1,2,4-триазол-3-илметокси)-1,2,4 триазоло[4,3-b]пиридазин. 18. Фармацевтическая композиция по п.11 для лечения и/или профилактики состояния тревоги, отличающаяся тем, что в качестве соединения формулы I она содержит 7-циклобутил-3 54(2,6-дифторфенил)-6-(2-метил-2 Н-1,2,4-триазол 3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин. 19. Применение по п.12, где соединение формулы I представляет собой 7-циклобутил-3(2,6-дифторфенил)-6-(2-метил-2 Н-1,2,4-триазол 3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин. 20. Способ по п.15, отличающийся тем, что в качестве соединения формулы I вводят 7 циклобутил-3-(2,6-дифторфенил)-6-(2-метил 2 Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло
МПК / Метки
МПК: C07D 487/04, A61P 25/08, A61K 31/5025
Метки: гамк, производные, рецепторов, триазолопиридазина, лигандов, качестве
Код ссылки
<a href="https://eas.patents.su/28-2755-proizvodnye-triazolopiridazina-v-kachestve-ligandov-dlya-gamk-receptorov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные триазолопиридазина в качестве лигандов для гамк рецепторов</a>
Предыдущий патент: Устойчивые жидкие составы интерферона
Следующий патент: Пестицидная композиция в форме растворимых в воде гранул
Случайный патент: Способ и система для сушки и термической обработки материалов












