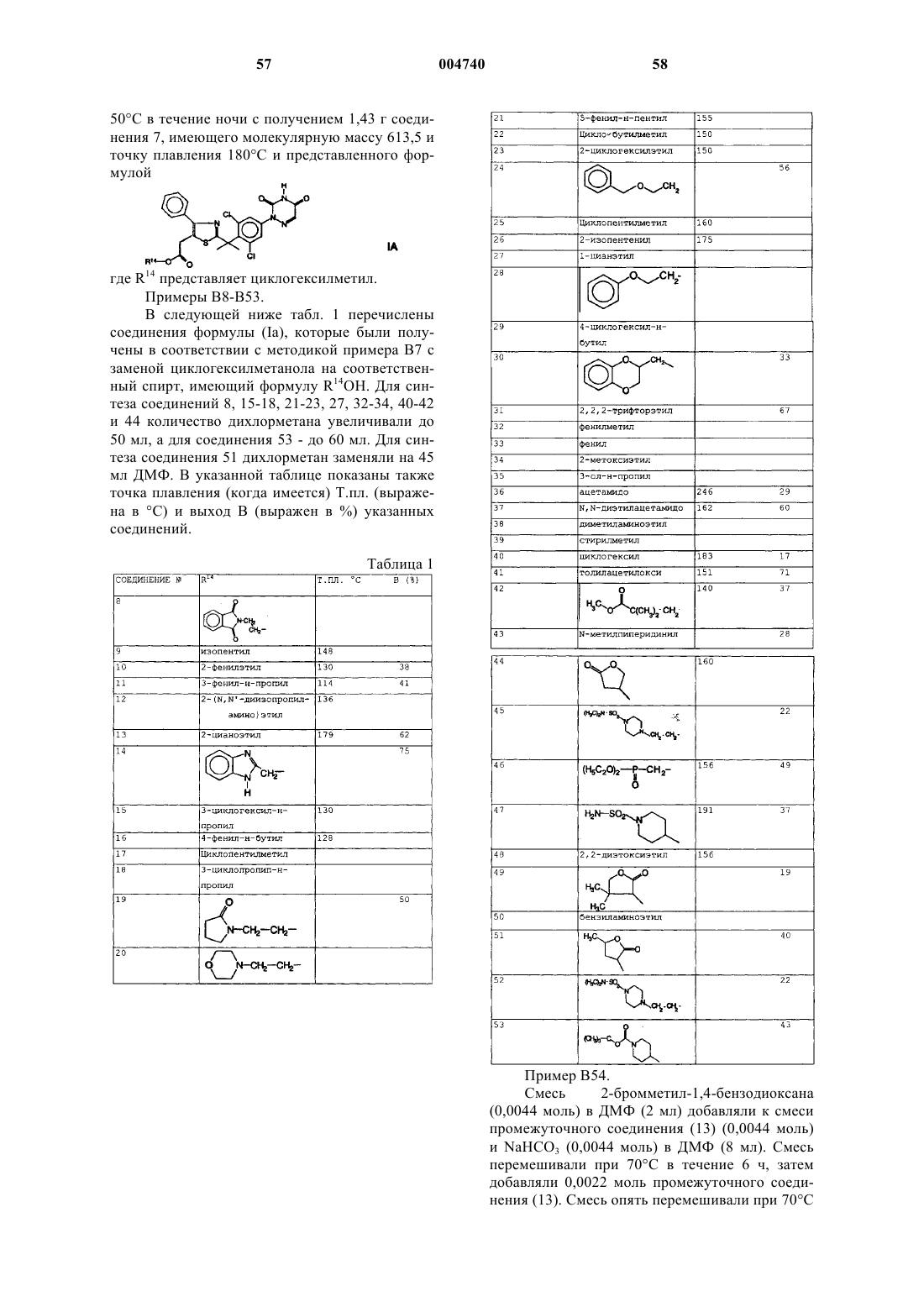
Интерлейкин-5 ингибирующие производные 6-азаурацила
Номер патента: 4740
Опубликовано: 26.08.2004
Авторы: Дерос Фредерик Дирк, Лякрамп Жан Фернан Арман, Фортэн Жером Мишель Клод, Кусеманс Эрвин, Фрейн Эдди Жан Эдгар
Формула / Реферат
1. Соединение, имеющее формулу
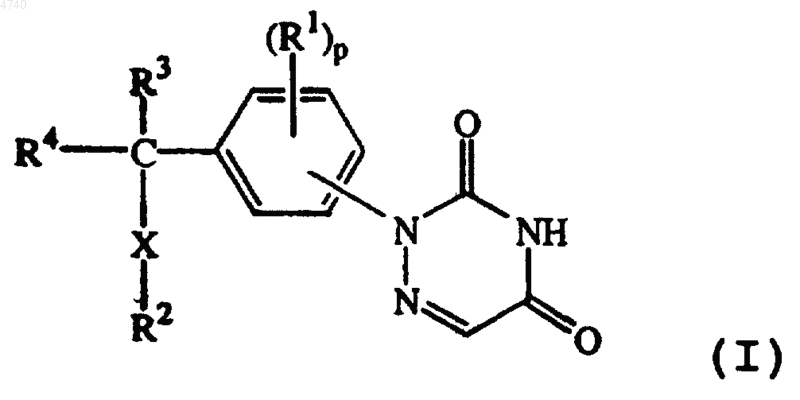
его N-оксиды, фармацевтически приемлемые аддитивные соли и стереохимически изомерные формы, где
p представляет целое число, являющееся 0, 1 или 2;
X представляет прямую связь;
Y представляет O, S, NR5 или S(O)2;
каждый R1 независимо представляет хлор или трифторметил;
R2 представляет Het1;
R3 представляет водород, C1-6алкил или C3-7циклоалкил;
R4 представляет водород, C1-6алкил или C3-7циклоалкил;
каждый R6 независимо представляет аминосульфонил, моно- или ди(C1-4алкил)аминосульфонил, Het6сульфонил;
каждый R11 независимо выбран из фенила, C(=O)-O-R14, C(=O)-S-R14 или C(=O)-NH-R14;
каждый R14 независимо представляет водород; C1-20ацил или C1-20алкилC1-20ацил (имеющий неразветвленную или разветвленную насыщенную или ненасыщенную углеводородную цепь с 1-20 углеродными атомами), необязательно замещенный одним или несколькими заместителями, выбранными из гидрокси, меркапто, гидроксиC1-4алкила, меркаптоC1-4алкила, NR17R18, арила, моно- или ди-(C1-4алкил)амино, циано и Het5; C1-20алкил, необязательно замещенный одним или несколькими заместителями, выбранными из гидрокси, галогена, меркапто, C1-4алкилоксиC1-4алкилокси, меркаптоC1-4алкила, NR17R18, арила, моно- или ди(C1-4алкил)амино, циано, Het5, C1-4алкилоксикарбонила, арилC1-4алкилоксикарбонила, арилC1-4алкилокси, арилC1-4алкилтиокарбонила, арилC1-4алкилтио, Het5C1-4алкилокси, арилC1-4алкилтио, C3-7циклоалкила и Het5C1-4алкилтио, C3-20алкенил, необязательно замещенный фенилом; C3-20 алкинил;
C3-7циклоалкил, необязательно замещенный одним или несколькими заместителями, выбранными из гидрокси, меркапто, галогена, меркаптоC1-4алкила и гидроксиC1-4алкила; Het5 или фенил или R14 представляет радикал, имеющий любую из следующих формул:
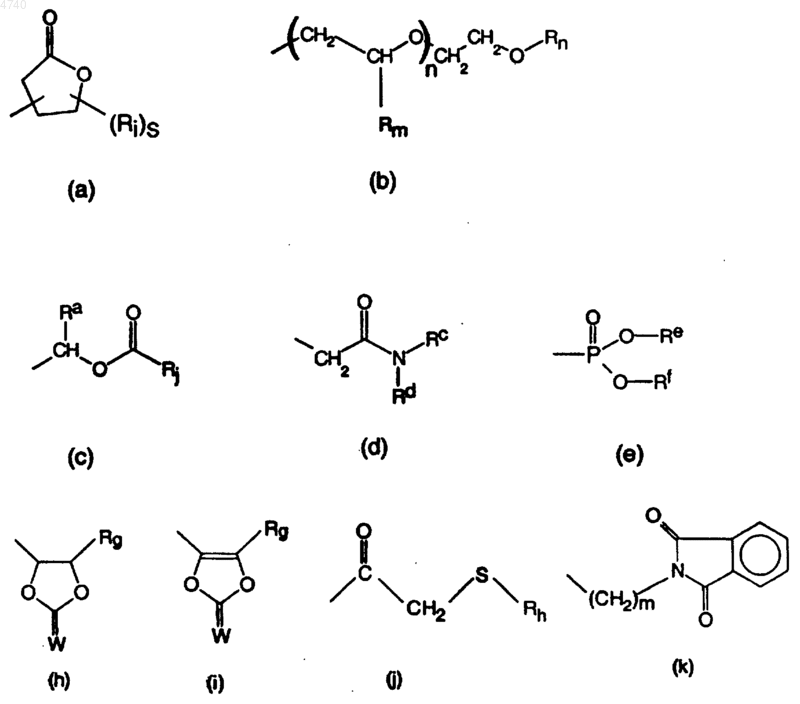
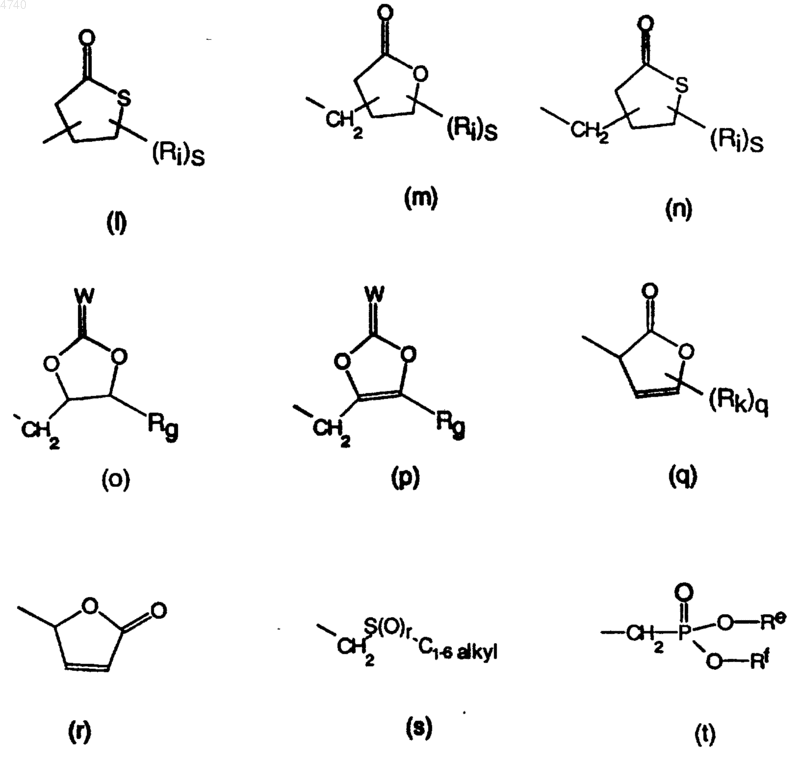
где m равно 1-4, n равно 0-5, q равно 0-2, r равно 0-2, s равно 0-4;
Rb выбран из водорода, C1-6алкила, фенила, C3-7циклоалкила, C1-4алкилоксиC1-6алкила и C1-4 алкил-Y-C1-4алкила;
Ra, Rc, Rd, Re и Rf независимо выбраны каждый из водорода, C1-6алкила, фенила и C3-7 циклоалкила или Re и Rf вместе могут образовывать -CH2-CH2-, -CH2-CH2-CH2- или -CH2-CH2-CH2-CH2-;
Rg, Rh и Rk независимо представляют каждый водород или C1-4алкил;
Ri выбран из гидрокси, C3-7циклоалкила и C1-4алкила или два Ri вместе могут образовывать -CH2-CH2-, -CH2-CH2-CH2- или -CH2-CH2-CH2-CH2- (что обеспечивает построение спирорадикала);
Rj выбран из -O-Rb; C1-6алкила, необязательно замещенного фенилом или C3-7циклоалкилом; фенила; C3-7циклоалкила, необязательно замещенного C1-4алкилокси, и моно- или ди(C1-4алкил)амино;
Rm представляет водород или C1-4алкилокси;
Rn представляет водород, C1-4алкил, C3-7циклоалкил, фенил или фенилC1-4алкил; и
W представляет O или S;
каждый Z независимо представляет O или S;
R17 и R18 независимо выбраны каждый из водорода, C1-6алкила, необязательно замещенного одним или несколькими заместителями, независимо выбранными из гидрокси, меркапто, арила, моно- или ди(C1-4алкил)амино, C1-4алкилокси и пиридинила; C1-4алкилоксикарбонила; арила; C1-4алкилкарбонила; C1-4алкилтиокарбонила;
арилкарбонила; арилтиокарбонила; ариламинокарбонила; ариламинотиокарбонила; C3-7 циклоалкила; C1-4алкандиил-C(=O)-Z-C1-6алкила; -C(=O)-Z-C1-6алкила; -Y-C1-4алкандиил-C(=O)-Z-C1-6алкила и R6;
арил представляет фенил;
Het1 представляет тиазолил, пиридинил или оксадиазолил;
причем каждый из указанных гетероциклов независимо дизамещен фенилом и или i) R11 или ii) C1-4алкила, замещенного R11; где R11 является группой -C(=O)-O-R14;
Het5 представляет гетероцикл, выбранный из пирролила, пирролинила, имидазолила, имидазолинила, пиразолила, пиразолинила, триазолила, тетразолила, фуранила, тетрагидрофуранила, тиенила,тиоланила, диоксоланила, оксазолила, оксазолинила, изоксазолила, тиазолила, тиазолинила, изотиазолила, тиадиазолила, оксадиазолила, пиридинила, пиримидинила, пиразинила, пиранила, пиридазинила, пиридазинила, пиролидинила, пиперидинила, пиперазинила, морфолинила, тиоморфолинила, тетрагидропиранила, диоксанила, дитианила, тритианила, триазинила, бензотиенила, изобензотиенила, бензофуранила, изобензофуранила, бензотиазолила, бензоксазолила, бензодиоканила, индолила, изоиндолила, индолинила, пуринила, 1H-пиразоло[3,4-d]пиримидинила, бензимидазолила, хинолила, изохинолила, циннолинила, фталазинила, хиназолинила, хиноксалинила, тиазолопиридинила, оксазолопиридинила и имидазо[2,1-b]тиазолила; причем каждый из указанных гетероциклов независимо может, но необязательно, быть замещен, где возможно, одним, двумя или тремя или четырьмя заместителями, независимо выбранными каждый из карбонила, C1-4алкила, C(=O)-Z-C1-6 алкила и R6;
Het6 представляет пирролидинил;
при условии, что
R14 отличен от водорода, C1-4алкила, C3-7 циклоалкила, аминокарбонилметилена, моно- или ди(C1-4алкил)аминокарбонилметилена в случае, если R11 представляет собой C(=O)-O-R14.
2. Соединение по п.1, в котором
R3 представляет водород, метил, этил, пропил или циклогексил;
R4 представляет водород или метил;
каждый R14 независимо представляет дигидрофуранил, C5-20алкил, C3-20алкенил, полигалогенC1-6алкил, Het5, радикал формулы (a) или C1-20алкил, замещенный одним или более заместителями, выбранными из фенила, C1-4алкиламино группы, цианогруппы, Het5, гидрокси и C3-7циклоалкил;
R17 и R18, каждый независимо, представляет водород или фенил и
Het5 представляет пиперидинил или пиперазинил, необязательно замещенный C1-4алкилом, сульфонамидо или R6.
3. Соединение по любому из п.1, в котором 6-азаурацильный фрагмент находится в пара-положении относительно углеродного атома, несущего заместители -X-R2, R3 и R4.
4. Соединение по любому из п.1, в котором Het1 представляет тиазолил.
5. Соединение по любому из п.1, в котором R3 и R4 оба представляют метил и X-R2 представляет Het1.
6. Соединение по любому из п.1, в котором p равно 1 или 2 и каждый R1 представляет хлор.
7. Соединеэшх по любому из п.1, в котором R3 и R4 оба представляют метил, -X-R2 представляет необязательно замещенный 2-тиазолил или 3-оксадиазолил, 6-азаурацильный фрагмент находится в пара-положении относительно углеродного атома, несущего заместители -X-R2, R3 и R4, и p=2, причем оба заместителя R1 представляют собой хлор, находящийся в орто-положении относительно углеродного атома, несущего заместители -X-R2, R3 и R4.
8. Соединение по п.7, в котором -X-R2 является дизамещенным фенилом и либо (i) R11, где R11 представляет группу формулы -C(=O)-Z-R14, где Z представляет O и R14 представляет C1-20алкил, замещенный гидрокси или Het5, где Het5 представляет пиперазинил, замещенный Het6сульфонилом, или R14 представляет радикал формулы (a), в котором Rj представляет C1-6алкил и s=2, либо (ii) C1-4алкилом, замещенным R11, где R11 представляет группу формулы -C(=O)-Z-R14, где Z представляет O и R14 представляет радикал формулы (a), в котором Rj представляет C1-6алкил и s=2.
9. Соединения по п.1, выбранные из соединений представленных ниже формул (A), (B), (C) и (D):
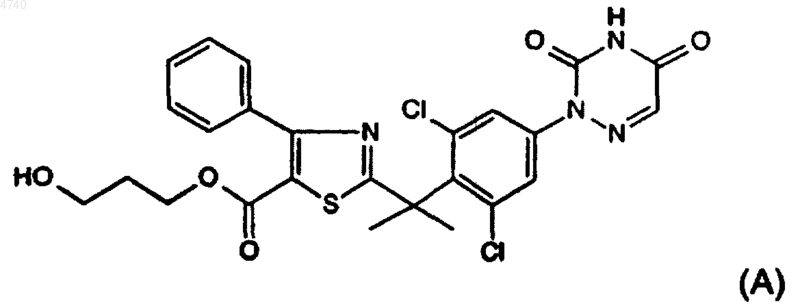
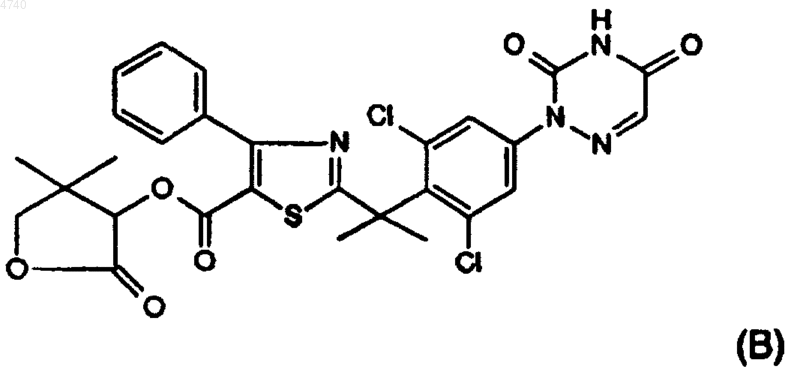
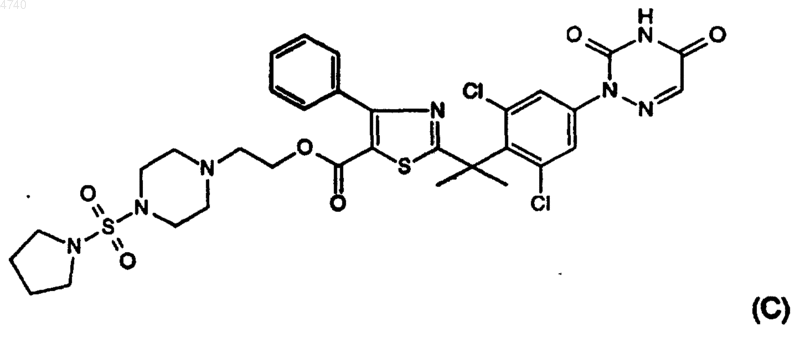
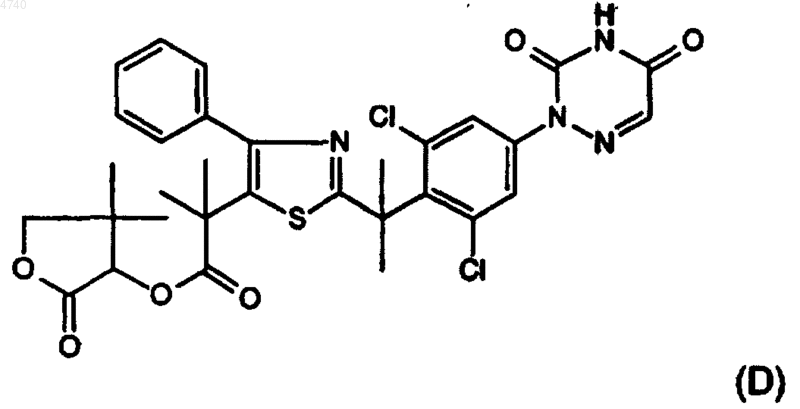
10. Композиция, содержащая фармацевтически приемлемый носитель и в качестве активного компонента терапевтически эффективное количество соединения по п.1.
11. Способ получения композиции по п.10, в котором фармацевтически приемлемый носитель тщательно смешивают с терапевтически эффективным количеством соединения по п.1.
12. Соединение по любому из пп.1-9 для применения в качестве лекарственного средства.
13. Применение соединения по любому из пп.1-9 для изготовления лекарственного средства для лечения эозинофилзависимых воспалительных заболеваний.
14. Способ получения соединения по п.1, включающий стадию взаимодействия промежуточного соединения формулы (II),
где W1 представляет подходящую уходящую группу, с подходящим реагентом формулы (III), необязательно в реакционноинертном растворителе и необязательно в присутствии основания, при температуре в пределах между -70шC и температурой образования флегмы;
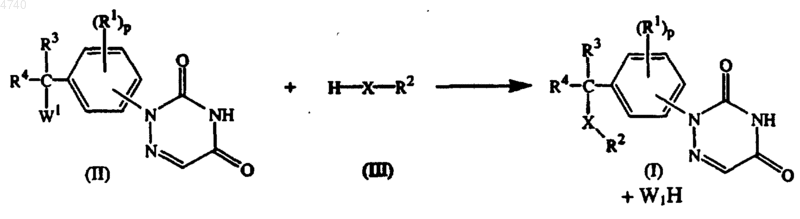
где R1, R2, R3, R4, p и X - такие, как определенные в п.1 и, если требуется, преобразование соединений формулы (I) друг в друга известными в данной области методами преобразования, а также, если требуется, преобразование соединений формулы (I) в терапевтически активную нетоксичную кислотно-аддитивную соль путем обработки кислотой или в терапевтически активную нетоксичную основно-аддитивную соль путем обработки основанием или, наоборот, преобразование кислотно-аддитивной соли в свободное основание путем обработки щелочью или преобразование основно-аддитивной соли в свободную кислоту путем обработки кислотой;
и, кроме того, если требуется, получение его стереохимически изомерных форм или N-оксидов.
15. Способ получения соединения по п.1, включающий стадию отщепления группы E триазиндиона формулы (V)

где E представляет подходящую электроноакцепторную группу и R1, R2, R3, R4, X и p - такие, как определенные в п.1; и, если требуется, преобразование соединений формулы (I) друг в друга известными в данной области методами преобразования, а также, если требуется, преобразование соединений формулы (I) в терапевтически активную нетоксичную кислотно-аддитивную соль путем обработки кислотой или в терапевтически активную нетоксичную основно-аддитивную соль путем обработки основанием или, наоборот, преобразование кислотно-аддитивной соли в свободное основание путем обработки щелочью или преобразование основно-аддитивной соли в свободную кислоту путем обработки кислотой;
и, кроме того, если требуется, получение его стереохимически изомерных форм или N-оксидов.
16. Способ маркировки рецептора, содержащий стадии
a) радиоизотопного мечения соединения по п.1,
b) введения указанного меченого радиоизотопом соединения в биологический материал,
c) обнаружения эмиссии от меченого соединения.
17. Способ получения изображения органа, отличающийся тем, что вводят достаточное количество меченого радиоизотопом соединения формулы (I) в подходящей композиции и обнаружением эмиссии от радиоактивного соединения.
Текст
1 Настоящее изобретение относится к ингибирующим ИЛ-5 (IL-5) производным 6 азаурацила, пригодным для лечения эозинофилзависимых воспалительных заболеваний, к способам и промежуточным соединениям для их получения и к фармацевтическим композициям,содержащим указанные производные. Кроме того, настоящее изобретение относится к применению указанных производных в качестве лекарственного средства и к способам мечения рецептора или визуализации органа с использованием указанных производных. Приток эозинофильных лейкоцитов, приводящий к последующему повреждению тканей,является важным патогенным событием при бронхиальной астме и аллергических заболеваниях. Цитокин интерлейкин-5 (ИЛ-5), вырабатываемый главным образом Т-лимфоцитами в виде гликопротеина, вызывает дифференцировку эозинофилов в костном мозге и подготавливает эозинофилы к активации в периферической крови и поддерживает их существование в тканях. Как таковой, ИЛ-5 играет решающую роль в процессе эозинофильного воспаления. Поэтому возможность снижения продукции, активации и/или продолжительности существования эозинофилов с помощью ингибиторов продукции ИЛ-5 дает терапевтический метод лечения бронхиальной астмы и аллергических заболеваний, таких как атопический дерматит, аллергический ринит, аллергический конъюнктивит и другие эозинофилзависимые воспалительные заболевания. Единственными лекарственными средствами, уже давно используемыми для лечения с заметной эффективностью бронхиальной астмы и атопического дерматита, являются стероиды,которые сильно угнетают продукцию ИЛ-5 invitro, но они вызывают различные серьезные побочные реакции, такие как диабет, гипертензия и катаракты. Поэтому было бы желательным найти нестероидные соединения, способные ингибировать продукцию ИЛ-5 в Тклетках человека и имеющие незначительные побочные реакции или не имеющие их. В патенте США 4631278 раскрыты арил-4-(4,5-дигидро-3,5-диоксо-1,2,4-триазин 2(3 Н)-ил)бензолацетонитрилы, а в патенте США 4767760 - 2-(замещенный фенил)-1,2,4 триазин-3,5(2 Н, 4 Н) дионы, которые все обладают антипротозойной, в частности, антикокцидийной активностью. В ЕР 831088 раскрыты 1,2,4-триазин-3,5-дионы как антикокцидийные средства. В WO 99/02505 раскрыты производные 6-азаурацила, которые оказались мощными ингибиторами продукции ИЛ-5. Настоящее изобретение прежде всего относится к соединениям, имеющим формулу их N-оксидам, фармацевтически приемлемым аддитивным солям и стереохимически изомерным формам, где р представляет целое число, являющееся 0,1, 2, 3 или 4;X представляет О, S, NR5 или прямую связь или -X-R2 вместе могут представлять циано;R2 представляет Het1, С 3-7 циклоалкил, необязательно замещенный С(=O)-Z-R14, C1-6 алкил или C1-6 алкил, замещенный одним или двумя заместителями, выбранными из С(=O)-Z-R14,гидрокси, меркапто, циано, амино, моно- или ди(С 1-4 алкил)амино, C1-6 алкилокси, необязательно замещенного C(=O)-Z-R14, C1-6 алкилтио, необязательно замещенного C(=O)-Z-R14, C1-6 алкилсульфонилокси, С 3-7 циклоалкила, необязательно замещенного С(=O)-Z-R14, арила, арилокси,арилтио, Het1, Hetloкcи и Неt1 тио; а если Х представляет О, S, NR5, то R2 может также представлять аминотиокарбонил, С 1-4 алкилкарбонил,необязательно замещенный C(=O)-Z-R14, C14 алкилтиокарбонил, необязательно замещенныйR5 представляет водород или С 1-4 алкил; каждый R6 независимо представляетC1-6 алкилсульфонил, аминосульфонил, пиперидинилсульфонил, моно- или ди(С 1-4 алкил)аминосульфонил, моно- или ди(бензил)аминосульфонил,полигалоген-C1-6 алкилсульфонил,C1-6 алкилсульфинил, фенилС 1-4 алкилсульфонил,пиперазинилсульфонил,аминопиперидинилсульфонил,пиперидиниламиносульфонил,N-C1-4aлкил-N-пипepидинилaминocyльфoнил,Y-R14, моно- или ди(С 1-4 алкил)аминоС 1-4 алкилсульфонил, Het6cyльфoнил или С 3-7 циклоалкилсульфонил; каждый R7 и каждый R8 независимо выбраны из водорода, C1-4 алкила, гидроксиС 1-4 алкила, меркаптоС 1-4 алкила, дигидроксиС 1-4 алкила, арила, арилС 1-4 алкила, С 1-4 алкилоксиС 1-4 алкила, C1-4 алкилкарбонила, С 1-4 алкилтиокарбонила,арилкарбонила,арилтиокарбонила, 3R9 и R10 независимо выбраны каждый из водорода, С 1-4 алкила, гидроксиС 1-4 алкила, меркаптоС 1-4 алкила, дигидроксиС 1-4 алкила, фенила,фенилС 1-4 алкила,С 1-4 алкилоксиС 1-4 алкила,С 1-4 алкилкарбонила, арилкарбонила, Het3 кapбoнилa, Het3 тиoкapбoнилa, моно- или ди(С 1-4 алкил)аминоС 1-4 алкила,ариламинокарбонила,ариламинотиокарбонила, Неt3 аминокарбонила,Нet3 аминотиокарбонила, С 3-7 циклоалкила, пиридинилС 1-4 алкила, С 1-4 алкандиил-С(=O)-Z-R14,-C(=O)-Z-R14,-Y-С 1-4 алкандиил-С(=O)-Z-R14,3 4 6 каждый R11 независимо выбран из гидрокси,меркапто, циано, нитро, галогена, тригалогенметила, С 1-4 алкилокси, необязательно замещенного С(=O)-Z-R14, C1-6 алкилтио, необязательно замещенного С(=O)-Z-R14, формила, тригалогенС 1-4 алкилсульфонилокси,R6,NR7R8,15 16 14C(=O)NR R , -С(=O)-Z-R , -Y-С 1-4 алкандиилС(=O)-Z-R14, арила, арилокси, арилкарбонила,арилтиокарбонила, С 3-7 циклоалкила, необязательно замещенного С(=O)-Z-R14, С 1-7 циклоалкилокси, необязательно замещенного C(=O)Z-R14, С 3-7 циклоалкилтио, необязательно замещенного C(=O)-Z-R14, фталимид-2-ила, Het3,Het4, C(=O)Het3, С(=O)С 1-4 алкила, необязательно замещенного одним или несколькими заместителями, независимо выбранными из гидрокси,меркапто, галогена и фенила;R12 и R13 независимо выбраны каждый из водорода, С 1-4 алкила, гидроксиС 1-4 алкила, меркаптоС 1-4 алкила, дигидроксиС 1-4 алкила, фенила,фенилС 1-4 алкила,С 1-4 алкилоксиС 1-4 алкила,С 1-4 алкилкарбонила, арилкарбонила, моно- или ди(С 1-4 алкил)аминоС 1-4 алкила, ариламинокарбонила, ариламинотиокарбонила, С 3-7 циклоалкила,пиридинилС 1-4 алкила, С 1-4 алкандиил-С(=O)-ZR14, -С(=O)-Z-R14, -Y-C1-4-алкандиил-С(=O)-ZR14 и R6; или R12 и R13, взятые вместе с атомом азота, к которому они присоединены, образуют радикал формулыC1-20 ацил или С 1-20 алкилС 1-20 ацил (имеющий неразветвленную или разветвленную насыщенную или ненасыщенную углеводородную цепь с 1-20 углеродными атомами), необязательно замещенный одним или несколькими заместителями, выбранными из гидрокси, меркапто, гидроксиС 1-4 алкила, меркаптоС 1-4 алкила, NR17R18,арила, моно- или ди-(С 1-4 алкил)амино, циано иHet5; C1-20 алкил, необязательно замещенный одним или несколькими заместителями, выбранными из гидрокси, галогена, меркапто,С 1-4 алкилоксиС 1-4 алкилокси, меркаптоС 1-4 алкила, NR17R18, арила, моно- или ди(С 1-4 алкил) амино, циано, Het5, С 1-4 алкилоксикарбонила,арилС 1-4 алкилоксикарбонила,арилС 1-4 алкилокси, арилС 1-4 алкилтиокарбонила, арилС 1-4 алкилтио, Het5C1-4aлкилoкcи, арилС 1-4 алкилтио, С 35 7 циклоалкила и Het C1-4 алкилтио; С 3-20 алкенил,необязательно замещенный фенилом; С 3-20 алкинил; С 3-7 циклоалкил, необязательно замещенный одним или несколькими заместителями, выбранными из гидрокси, меркапто,галогена, меркаптоС 1-4 алкила и гидроксиС 1-4 алкила; Het5 или фенил или R14 представляет радикал, имеющий любую из следующих формул:Ra, Rc, Rd, Re и Rf независимо выбраны каждый из водорода, C1-6 алкила, фенила и С 3-7 циклоалкила или Re и Rf вместе могут образовыватьRg, Rh и Rk независимо представляют каждый водород или C1-4 алкил;Ri выбран из гидрокси, С 3-7 циклоалкила и С 1-4 алкила или два Ri вместе могут образовывать -СН 2-СН 2-, -СH2-СН 2-СН 2- или -СН 2-СН 2 СН 2-СН 2- (что обеспечивает построение спирорадикала);Rj выбран из -O-Rb; C1-6 алкила, необязательно замещенного фенилом или С 3-7 циклоалкилом; фенила; С 3-7 циклоалкила, необязательно замещенного С 1-4 алкилокси, и моно- или ди(С 1-4 алкил)амино;Rm представляет водород или С 1-4 алкилокси;Rn представляет водород, С 1-4 алкил,С 3-7 циклоалкил, фенил или фенилС 1-4 алкил; и-Z-R14 вместе образуют радикал формулыR15 и R16 независимо выбраны каждый из водорода; С 1-4 алкила, необязательно замещенного одним или несколькими заместителями,независимо выбранными из гидрокси, меркапто,арила, моно- или ди(С 1-4 алкил)амино и пиридинила; С 1-4 алкилокси; арила; -С(=O)-Z-R14; арилкарбонила; арилтиокарбонила; ариламинокарбонила; ариламинотиокарбонила; аминокарбонилметилена; моно- или ди(С 1-4 алкил) аминокарбонилметилена; Нet3 аминокарбонила; Неt3 аминотиокарбонила; пиридинилС 1-4 алкила; Het3 и R6; или R15 и R16, взятые вместе с атомом азота, к которому они присоединены, образуют радикал формулыR17 и R18 независимо выбраны каждый из водорода, C1-6 алкила, необязательно замещенного одним или несколькими заместителями, независимо выбранными из гидрокси, меркапто,арила, моно- или ди(С 1-4 алкил)амино, С 1-4 алкилокси и пиридинила; С 1-4 алкилоксикарбонила; арила; С 1-4 алкилкарбонила; С 1-4 алкилтиокарбонила; арилкарбонила; арилтиокарбонила; ариламинокарбонила; ариламинотиокарбонила; С 3-7 циклоалкила; С 1-4 алкандиил-С(=O)-Z-C1-6 ал 004740 6 кила; -С(=O)-Z-C1-6 алкила; -Y-С 1-4 алкандиилС(=O)-Z-C1-6 алкила и R6; арил представляет фенил, необязательно замещенный одним, двумя или тремя заместителями, независимо выбранными каждый из нитро, азидо, циано, галогена, гидрокси, меркапто, С 1-4 алкила, С 3-7 циклоалкила, С 1-4 алкилокси, С 1-4 алкилтио, формила, полигалогенС 1-4 алкила, NR9R10, C(=O)NR9R10, C(=O)-Z-R14, R6, -OR6, фенила, Het3, C(=O)Het3 и С 1-4 алкила, замещенного одним или несколькими заместителями, независимо выбранными каждый из галогена, гидрокси, меркапто, С 1-4 алкилокси, С 1-4 алкилтио, C(=O)-Z-R14, -Y-C1-4 алкандиил-С(=O)-ZR14, Het3 или NR9R10;Het1 представляет трехчленный, четырехчленный, пятичленный или шестичленный ароматический или неароматический моноциклический или полициклический гетероцикл, содержащий один или несколько, предпочтительно один-четыре, гетероатомов, предпочтительно выбранных из азота, кислорода, серы и фосфора, или конденсированную полициклическую кольцевую систему, включающую такой гетероцикл (такую, как, например, конденсированный бензогетероцикл); неограничивающие примеры таких гетероциклов включают, например,пирролил, пирролинил, имидазолил, имидазолинил, пиразолил, пиразолинил, триазолил, тетразолил, фуранил, тетрагидрофуранил, тиенил,тиоланил, диоксоланил, оксазолил, оксазолинил,изоксазолил, тиазолил, тиазолинил, изотиазолил, тиадиазолил, оксадиазолил, пиридинил,пиримидинил, пиразинил, пиранил, пиридазинил, пирролидинил, пиперидинил, пиперазинил,морфолинил, тиоморфолинил, диоксанил, дитианил, тритианил, триазинил, бензотиенил,изобензотиенил, бензофуранил, изобензофуранил, бензотиазолил, бензоксазолил, бензодиоксанил, индолил, изоиндолил, индолинил, пуринил, 1H-пиразоло[3,4-d]пиримидинил, бензимидазолил, хинолил, изохинолил, циннолинил,фталазинил, хиназолинил, хиноксалинил, тиазолопиридинил, оксазолопиридинил и имидазо[2,1-b]тиазолил; причем каждый из указанных гетероциклов независимо может, но необязательно, быть замещен одним или, где возможно,двумя или тремя заместителями, независимо выбранными каждый из Het2, R11 и С 1-4 алкила,необязательно замещенного одним или, где возможно, двумя или тремя заместителями, независимо выбранными каждый из Het2 и R11;Het2 представляет трехчленный, четырехчленный, пятичленный или шестичленный ароматический или не ароматический моноциклический или полициклический гетероцикл, содержащий один или несколько, предпочтительно один-четыре, гетероатомов, предпочтительно выбранных из азота, кислорода, серы и фосфора, или конденсированную полициклическую кольцевую систему, включающую такой гетероцикл (такую, как, например, конденсирован 7 ный бензогетероцикл); неограничивающие примеры таких гетероциклов включают, например,пирролил, пирролинил, имидазолил, имидазолинил, пиразолил, пиразолинил, триазолил, тетразолил, фуранил, тетрагидрофуранил, тиенил,тиоланил, диоксоланил, оксазолил, оксазолинил,изоксазолил, тиазолил, тиазолинил, изотиазолил, тиадиазолил, оксадиазолил, пиридинил,пиримидинил, пиразинил, пиранил, пиридазинил, диоксанил, дитианил, тритианил, триазинил, бензотиенил, изобензотиенил, бензофуранил, изобензофуранил, бензотиазолил, бензоксазолил, индолил, изоиндолил, индолинил, пуринил, 1H-пиразоло[3,4-d,]пиримидинил, бензимидазолил, хинолил, изохинолил, циннолинил, фталазинил, хиназолинил, хиноксалинил,тиазолопиридинил, оксазолопиридинил и имидазо[2,1-b]тиазолил; причем каждый из указанных гетероциклов независимо может, но необязательно, быть замещен одним или, где возможно, двумя или тремя заместителями, независимо выбранными каждый из Het4, R11 и С 1-4 алкила,необязательно замещенного одним или, где возможно, двумя или тремя заместителями, независимо выбранными каждый из Het4 и R11;Het3 представляет трехчленный, четырехчленный, пятичленный или шестичленный ароматический или не ароматический моноциклический гетероцикл, содержащий один или несколько, предпочтительно один-четыре, гетероатомов, предпочтительно выбранных из азота,кислорода, серы и фосфора; неограничивающие примеры таких гетероциклов включают, например, пирролидинил, пиперидинил, пиперазинил,морфолинил, тиоморфолинил, диоксоланил и тетрагидропиранил; причем каждый из указанных моноциклических гетероциклов независимо может, но необязательно, быть замещен, где возможно, одним, двумя, тремя или четырьмя заместителями, независимо выбранными каждый из гидрокси, С 1-4 алкила, С 1-4 алкилокси,С 1-4 алкилкарбонила, пиперидинила, NR12R13,С(=O)-Z-R14, R6 и С 1-4 алкила, замещенного одним или двумя заместителями, независимо выбранными из гидрокси, карбонилС 1-4 алкилокси,фенила, С(=O)-Z-R14, -Y-С 1-4 алкандиил-С(=O)Z-R14, R6 и NR12R13;Het4 представляет трехчленный, четырехчленный, пятичленный или шестичленный ароматический или неароматический моноциклический гетероцикл, содержащий один или несколько, предпочтительно один-четыре, гетероатомов, предпочтительно выбранных из азота,кислорода, серы и фосфора; неограничивающие примеры таких гетероциклов включают, например, пирролил, имидазолил, пиразолил, триазолил, тетразолил, фуранил, тиенил, оксазолил,изоксазолил, тиазолил, изотиазолил, тиадиазолил, оксадиазолил, пиридинил, пиримидинил,пиразинил, пиранил, пиридазинил и триазинил;Het5 представляет трехчленный, четырехчленный, пятичленный или шестичленный аро 004740 8 матический или неароматический моноциклический или полициклический гетероцикл, содержащий один или несколько, предпочтительно один-четыре, гетероатомов, предпочтительно выбранных из азота, кислорода, серы и фосфора, или конденсированную полициклическую кольцевую систему, включающую такой гетероцикл (такую, как, например, конденсированный бензогетероцикл); неограничивающие примеры таких гетероциклов включают, например,пирролил, пирролинил, имидазолил, имидазолинил, пиразолил, пиразолинил, триазолил, тетразолил, фуранил, тетрагидрофуранил, тиенил,тиоланил, диоксоланил, оксазолил, оксазолинил,изоксазолил, тиазолил, тиазолинил, изотиазолил, тиадиазолил, оксадиазолил, пиридинил,пиримидинил, пиразинил, пиранил, пиридазинил, пирролидинил, пиперидинил, пиперазинил,морфолинил, тиоморфолинил, тетрагидропиранил, диоксанил, дитианил, тритианил, триазинил, бензотиенил, изобензотиенил, бензофуранил, изобензофуранил, бензотиазолил, бензоксазолил, бензодиоксанил, индолил, изоиндолил,индолинил, пуринил, 1H-пиразоло[3,4-d]пиримидинил, бензимидазолил, хинолил, изохинолил, циннолинил, фталазинил, хиназолинил,хиноксалинил, тиазолопиридинил, оксазолопиридинил и имидазо[2,1-b]тиазолил; причем каждый из указанных гетероциклов независимо может, но необязательно, быть замещен, где возможно, одним, двумя, тремя или четырьмя заместителями, независимо выбранными каждый из гидрокси, меркапто, карбонила, С 1-4 алкила, С 1-4 алкилокси, C1-4 алкилтио, С 1-4 алкилкарбонила, пиперидинила, NR17R18, C(=O)-Z-C1-6 алкила, R6, сульфонамидо и С 1-4 алкила, замещенного одним или двумя заместителями, независимо выбранными из гидрокси, C1-4 алкилокси, меркапто, С 1-4 алкилтио, фенила,С(=O)-Z-C1-6 алкила, -Y-С 1-4 алкандиил-С(=O)-ZC1-6 алкила, R6 и NR17R18;Het6 представляет трехчленный, четырехчленный, пятичленный или шестичленный ароматический или неароматический моноциклический гетероцикл, содержащий один или несколько, предпочтительно один-четыре, гетероатомов, предпочтительно выбранных из азота,кислорода, серы и фосфора; неограничивающие примеры таких гетероциклов включают, например, пирролидинил, пиперидинил, азаридинил,пиразолинил, и пиролинил; причем указанный гетероцикл может, но необязательно, быть замещен одним или, где возможно, двумя или тремя заместителями, независимо выбранными каждый из Het2, R11 и С 1-4 алкила, необязательно замещенного одним или несколькими заместителями, независимо выбранными из Het2 и R11; но при условиях, чтоR15 и R16 отличны от аминокарбонила, С 1-4 алкилкарбонилоксиС 1-4 алкилкарбонила, гидроксиС 1-4 алкилкарбонила или C1-4 алкилоксикарбонилкарбонила; и арил отличен от фенила, замещенногоHet3 отличен от моноциклического гетероцикла, замещенного C(=O)-O-R19 и/или С 1-4 алкилом, замещенным C(=O)-O-R19 и/или Y-C1-4 алкандиилС(=O)-O-R19; и в каждом из вышеприведенных условийR19 определяется как водород, С 1-4 алкил,С 3-7 циклоалкил, аминокарбонилметилен или моно- или ди(С 1-4 алкил)аминокарбонилметилен; и причем указанное соединение, имеющее формулу (I), содержит по крайней мере один фрагмент C(=O)-Z-R14. При использовании в предшествующих определениях и далее:- термин галоген означает фтор, хлор,бром и иод;- термин С 1-4 алкил означает неразветвленные и разветвленные насыщенные углеводородные радикалы, имеющие от 1 до 4 углеродных атомов, такие, как, например, метил, этил,пропил, бутил, 1-метилэтил, 2-метилпропил,2,2-диметилэтил и тому подобное;- термин С 3-20 алкенил означает неразветвленные и разветвленные углеводородные радикалы, содержащие одну двойную связь и имеющие 3-20 углеродных атомов, такие, как,например, 2-пропенил, 3-бутенил, 2-бутенил, 2 пентенил, 3-пентенил, 3-метил-2-бутенил, 3 004740 10 гексенил и тому подобное, причем углеродный атом указанного С 3-20 алкенила, соединенный с остальной частью молекулы, является предпочтительно насыщенным;- термин С 3-20 алкинил означает неразветвленные и разветвленные углеводородные радикалы, содержащие одну тройную связь и имеющие 3-20 углеродных атомов, такие, как,например, 2-пропинил, 3-бутинил, 2-бутинил, 2 пентинил, 3-пентинил, 3-метил-2-бутинил, 3 гексинил и тому подобное, причем углеродный атом указанного С 3-20 алкинила, соединенный с остальной частью молекулы, является предпочтительно насыщенным;- термин полигалогенС 1-4 алкил определяется как полигалогензамещенный С 1-4 алкил, в частности C1-4 алкил, замещенный 1-6 атомами галогена, а более конкретно дифтор- или трифторметил;- термин полигалогенС 1-6 алкил определяется как полигалогензамещенный C1-6 алкил;- термин полигалогенС 1-20 алкил определяется как полигалогензамещенный С 1-20 алкил;- термин С 1-4 алкандиил означает двухвалентные неразветвленные или разветвленные алкандиильные радикалы, имеющие от 1 до 4 углеродных атомов, такие как, например, метилен,1,2-этандиил,1,3-пропандиил,1,4 бутандиил и тому подобное;- термин С 2-6 алкандиил означает двухвалентные неразветвленные или разветвленные алкандиильные радикалы, имеющие от 2 до 6 углеродных атомов, такие как, например, 1,2 этандиил, 1,3-пропандиил, 1,4-бутандиил, 1,5 пентандиил, 1,6-гександиил и тому подобное.Het1, Het2, Het3, Het4 и Het5 охватывают все возможные изомерные формы гетероциклов,указанных в вышеприведенных определениях,например пирролил включает также 2 Нпирролил; триазолил включает 1,2,4-триазолил и 1,3,4-триазолил; оксадиазолил включает 1,2,3 оксадиазолил,1,2,4-оксадиазолил,1,2,5 оксадиазолил, 1,3,4-оксадиазолил; тиадиазолил включает 1,2,3-тиадиазолил, 1,2,4-тиадиазолил,1,2,5-тиадиазолил, 1,3,4-тиадиазолил; пиранил включает 2 Н-пиранил и 4 Н-пиранил. Гетероциклы, представленные Het1, Het2,3Het , Het4 и Het5, могут быть присоединены к остальной части молекулы формулы (I) через любой подходящий атом углерода или гетероатом в кольце. Так, например, когда гетероцикл представляет собой имидазолил, это могут быть 1-имидазолил, 2-имидазолил, 4-имидазолил и 5 имидазолил; когда им является тиазолил, это могут быть 2-тиазолил, 4-тиазолил и 5-тиазолил; когда он представляет собой триазолил, это могут быть 1,2,4-триазол-1-ил, 1,2,4-триазол-3-ил,1,2,4-триазол-5-ил, 1,3,4-триазол-1-ил и 1,3,4 триазол-2-ил; когда он представляет собой бензотиазолил, это могут быть 2-бензотиазолил, 4 бензотиазолил,5-бензотиазолил,6 бензотиазолил и 7-бензотиазолил. С 1-20 ацил произведен от: уксусной кислоты пропионовой кислоты масляной кислоты валериановой кисл. гексановой кислоты гептановой кислоты октановой кислоты нонановой кислоты декановой кислоты ундекановой кислоты лауриновой кислоты тридекановой кислоты миристиновой кислоты пентадекановой кисл. пальмитиновой кисл. гептадекановой кисл. стеариновой кислоты олеиновой кислоты линолевой кислоты линоленовой кислоты нонадекановой кисл. эйкозановой кислоты Указанные выше фармацевтически приемлемые аддитивные соли представляют собой формы терапевтически активных нетоксичных кислотно-аддитивных солей, которые соединения формулы (I) способны образовывать. Их удобно получать путем обработки основной формы такими подходящими кислотами, как неорганические кислоты, например, галогеноводородные кислоты, например, хлороводородная, бромоводородная и тому подобное; серная кислота; азотная кислота; фосфорная кислота и тому подобное; или органические кислоты, например уксусная, пропановая, гидроксиуксусная, 2-гидроксипропановая, 2-оксопропановая, этандиовая, пропандиовая, бутандиовая, 2 бутендиовая, 2-бутендиовая, 2-гидроксибутандиовая, 2,3-дигидроксибутандиовая, 2-гидрокси 1,2,3-пропантрикарбоновая, метансульфоновая,этансульфоновая,бензолсульфоновая,4 метилбензолсульфоновая,циклогексансульфаминовая, 2-гидроксибензойная, 4-амино-2 гидроксибензойная и тому подобное. Наоборот,солевую форму можно преобразовать обработкой щелочью в форму свободного основания. Соединения формулы (I), которые содержат кислотные протоны, могут быть преобразованы в их терапевтически активные нетоксичные аддитивные соли металлов или аминов путем обработки подходящими органическими и неорганическими основаниями. Подходящие формы основных солей содержат, например,аммонийные соли, соли щелочных и щелочноземельных металлов, например литиевые, натриевые, калиевые, магниевые, кальциевые соли и тому подобное, соли с органическими основаниями, например, соли бензатина, N-метил-Dглюкамина,2-амино-2-(гидроксиметил)-1,3 пропандиола, гидрабамина, и соли с существующими в природе аминокислотами, такими,как, например, аргинин, лизин и тому подобное. Наоборот, солевая форма может быть преобра 12 зована путем обработки кислотой в форму свободной кислоты. Термин аддитивные соли охватывает также гидраты и сольвентно-аддитивные формы таких солей, которые соединения формулы (I) могут образовывать. Примерами таких форм являются, например, гидраты, алкоголяты и тому подобное.N-Оксидные формы соединений по настоящему изобретению включают соединения формулы (I), где один или несколько атомов азота окислены до так называемого N-оксида. Например, могут быть N-окислены один или несколько атомов азота любого из гетероциклов Het1, Het2, Het3, Het4 и Het5. Некоторые из соединений формулы (I) могут также существовать в таутомерных формах. Предполагается, что такие формы, хотя явно и не представленные в указанной формуле, входят в объем настоящего изобретения. Например,гидроксизамещенный триазиновый фрагмент может также существовать в виде соответствующего триазинонового фрагмента, а гидроксизамещенный пиримидиновый фрагмент может также существовать в виде соответствующего пиримидинонового фрагмента. Термин стереохимически изомерные формы, использованный выше, охватывает все возможные стереоизомерные формы, в которых могут существовать соединения формулы (I). Если не указано иное, химическое обозначение соединений означает смесь всех возможных стереохимически изомерных форм, при этом указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. В частности, стереогенные центры могут иметь R- или S-конфигурацию, использованную здесь в соответствии с номенклатурой Chemical Abstracts. Стереохимически изомерные формы соединений формулы (I) безусловно должны быть включены в объем настоящего изобретения. Соединения формулы (I) и некоторые из промежуточных соединений по настоящему изобретению содержат один или несколько асимметрических углеродных атомов. Чистые и смешанные стереохимически изомерные формы также входят в объем настоящего изобретения. При любом использовании ниже термин соединения формулы (I) означает, что он включает также их N-оксидные формы, фармацевтически приемлемые аддитивные соли и стереохимически изомерные формы. Интересной группой соединений являются те соединения формулы (I), в которых 6 азаурацильный фрагмент присоединен к фенильному кольцу в пара- или мета-положении относительно углеродного атома, несущего заместители -X-R2, R3 и R4, предпочтительно в пара-положении. Другая интересная группа содержит те соединения формулы (I), в которых применены одно или несколько следующих ограничений: 13 р равно 0, 1 или 2; Х представляет S, NR5 или прямую связь,более предпочтительно прямую связь; каждый R1 независимо представляет галоген, полигалогенС 1-6 алкил, C1-6 алкил, C1-6 алкилокси или арил, предпочтительно хлор или трифторметил, более предпочтительно хлор; по крайней мере один фрагмент С(=O)-Z-R14 в соединении формулы (I) находится в R2;R2 представляет Het1 или C1-6 алкил, замещенный одним или двумя заместителями, выбранными из гидрокси, циано, амино, моно- или ди(С 1-4 алкил)амино, C(=O)-Z-R14, C1-6 алкилокси,необязательно замещенного C(=O)-Z-R14, C1-6 алкилсульфонилокси, С 3-7-циклоалкила, необязательно замещенного С(=O)-Z-R14, арила, арилокси, арилтио, Het1, Неt1 окси и Неt1 тио; а если Х представляет О, S или NR5, то R2 может также представлять аминотиокарбонил, С 1-4 алкилкарбонил, необязательно замещенный С(=O)-ZR14, C1-4 алкилтиокарбонил, необязательно замещенный С(=O)-Z-R14, арилкарбонил, арилтиокарбонил, Неt1 карбонил или Неt1 тиокарбонил; более предпочтительно R2 представляет 1R4 представляет водород или метил, более предпочтительно метил;R7 и R8 независимо представляют каждый водород, С 1-4 алкил, Het3 или R6;R9 и R10 независимо представляют каждый водород, С 1-4 алкилоксиС 1-4 алкил, С 1-4 алкилкарбонил, аминокарбонил, Неt3 карбонил, Het3 или R6;-C(=O)-NH-R14, причем каждый R11 независимо выбран из гидрокси, меркапто, циано, нитро,галогена, тригалогенметила, С 1-4 алкилокси, необязательно замещенного С(=O)-Z-R14, C1-4 алкилтио, необязательно замещенного C(=O)-ZR14, формила, тригалогенС 1-4 алкилсульфонилокси, R6, NR7R8, C(=O)NR15R16, -С(=O)-Z-R14,-Y-С 1-4 алкандиил-С(=O)-Z-R14, арила, арилокси,арилкарбонила, арилтиокарбонила, С 3-7 циклоалкила, необязательно замещенного C(=O)-ZR14, С 3-7 циклоалкилокси, необязательно замещенного С(=O)-Z-R14, С 3-7 циклоалкилтио, необязательно замещенного C(=O)-Z-R14, фталимид-2-ила, Het3, C(=O)Het3, С(=O)С 1-4 алкила,необязательно замещенного одним или несколь 004740 14 кими заместителями, независимо выбранными из гидрокси, меркапто, галогена и фенила;R14 представляет дигидрофуранил, С 5-20 алкил, С 3-20 алкенил, полигалогенС 1-6 алкил, Het5,радикал формулы (а) или С 1-20 алкил, замещенный одним или несколькими заместителями,выбранными из фенила, С 1-4 алкиламино, циано,Het1, Het5, гидрокси и С 3-7 циклоалкила, более предпочтительно радикал формулы (а), в котором Rj представляет C1-6 алкил и s=2, или С 1-20 алкил, замещенный гидрокси или Het5;R17 и R18 независимо представляют каждый водород или фенил; арил представляет фенил, необязательно замещенный одним, двумя или тремя заместителями, независимо выбранными каждый из нитро,циано,галогена,гидрокси,С 1-4 алкила, С 3-7 циклоалкила, С 1-4 алкилокси,формила,полигалогенС 1-4 алкила,NR9R10,9 10 14 6C(=O)NR R , C(=O)-O-R , -O-R , фенила,C(=O)Het3 и С 1-4 алкила, замещенного одним или несколькими заместителями, независимо выбранными каждый из галогена, гидрокси,С 1-4 алкилокси, С(=O)-Z-R14, Het3 и NR9R10;Het1 представляет моноциклический гетероцикл, выбранный из пирролила, имидазолила,пиразолила, триазолила, тетразолила, фуранила,тиенила, оксазолила, изоксазолила, тиазолила,изотиазолила, тиадиазолила, оксадиазолила,пиридинила, пиримидинила, пиразинила, пиранила, пиридазинила и триазинила, в частности имидазолил, оксадиазолил, тиазолил, пиримидинил или пиридинил, причем каждый из указанных моноциклических гетероциклов независимо может, но необязательно, быть замещен одним или, где возможно, двумя или тремя заместителями, независимо выбранными каждый из Het2, R11 и С 1-4 алкила, необязательно замещенного Het2 или R11; более предпочтительноHet1 представляет имидазолил, оксадиазолил,тиазолил или пиридинил, особенно тиазолил,причем каждый независимо и необязательно замещенный одним или, где возможно, двумя или тремя заместителями, независимо выбранными каждый из Het2, R11 и С 1-4 алкила, необязательно замещенного Het2 или R11, более предпочтительно двумя заместителями, независимо выбранными каждый из R11 и С 1-4 алкила, замещенного R11;Het2 представляет ароматический гетероцикл, в частности фуранил, тиенил, пиридинил или бензотиенил, причем каждый из указанных ароматических гетероциклов независимо может,но необязательно, быть замещен одним или, где возможно, двумя или тремя заместителями, независимо выбранными каждый из R11 иHet3 представляет пиперидинил, пиперазинил, морфолинил или тетрагидропиранил, каждый независимо и необязательно замещенный,где возможно, одним, двумя, тремя или четырьмя заместителями, независимо выбранными 15 каждый из гидрокси, С 1-4 алкила, C1-4 алкилкарбонила, пиперидинила и С 1-4 алкила, замещенного одним или двумя заместителями, независимо выбранными из гидрокси, C1-4 алкилокси и фенила;Het5 представляет пиперидинил или пиперазинил, необязательно замещенный С 1-4 алкилом, сульфонамидо или R6, более предпочтительно R6;Het6 представляет пирролидинил. Примечательными соединениями являются те соединения формулы (I), в которых р=2 и оба заместителя R1 представляют собой хлор, причем является более предпочтительным, когда оба заместителя находятся в орто-положениях относительно углеродного атома, несущего заместители -X-R2, R3 и R4. Другими примечательными соединениями являются те соединения формулы (I), в которых 6-азаурацильный фрагмент находится в параположении относительно углеродного атома,несущего заместители -X-R2, R3 и R4, и р=2,причем оба заместителя R1 представляют собой хлор, находящийся в орто-положении относительно углеродного атома, несущего заместители -X-R2, R3 и R4. И еще одними примечательными соединениями являются те соединения формулы (I), в которых Х представляет прямую связь и R2 представляет моноциклический гетероцикл,выбранный из пирролила, имидазолила, пиразолила, триазолила, тетразолила, фуранила, тиенила, оксазолила, изоксазолила, тиазолила, изотиазолила, тиадиазолила, оксадиазолила, пиридинила, пиримидинила, пиразинила, пиранила,пиридазинила и триазинила, в частности имидазолил, оксадиазолил, тиазолил, пиримидинил или пиридинил, причем каждый из указанных моноциклических гетероциклов независимо может, но необязательно, быть замещен одним или, где возможно, двумя или тремя заместителями, независимо выбранными каждый из Het2,R11 и С 1-4 алкила, необязательно замещенногоHet2 или R11; более предпочтительно R2 представляет необязательно замещенный тиазолил,пиридинил или оксадиазолил. Предпочтительными соединениями являются те соединения формулы (I), в которых R3 иR4 представляют оба метил, а -X-R2 представляет Het1, причем Het1 предпочтительно представляет необязательно замещенный тиазолил, пиридинил или оксадиазолил. Более предпочтительными соединениями являются те соединения формулы (1), в которыхR3 и R4 представляют оба метил, -X-R2 представляет необязательно замещенный 2-тиазолил или 3-оксадиазолил, 6-азаурацильный фрагмент находится в пара-положении относительно углеродного атома, несущего заместители -X-R2,R3 и R4, и р=2, причем оба заместителя R1 представляют собой хлор, находящийся в орто 004740 16 положении относительно углеродного атома,несущего заместители -X-R2, R3 и R4. Особенно предпочтительными такими соединениями являются те, в которых -X-R2 является дизамещенным фенилом и либо (i) R11, где R11 представляет группу формулы -С(=O)-Z-R14, где Z представляет О и R14 представляет С 1-20 алкил,замещенный гидрокси или Het5, особенно, гдеHet5 представляет пиперазинил, замещенный Нet6 сульфонилом, особенно где Het6 представляет пирролидинил, или R14 представляет радикал формулы (а), в котором Rj представляет-С(=O)-Z-R14, где Z представляет О и R14 представляет радикал формулы (а), в котором Rj представляет C1-6 алкил и s=2. Особенно предпочтительными соединениями являются соединения формул (А), (В),(С) и (D), показанных ниже: Примеры соединений формулы (I) включают также соединения формулы (I'), где р, X,Y, R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12,R13, R14, n, m, Ra, Rb, Rc, Rd, Re, Rf, Rg, Rh, R15,R16, Z, арил, Het1, Het2, Het3, Het4 при использовании в связи с соединениями формулы (I') имеют значения, определенные ниже. Настоящее изобретение относится к соединениям формулы их N-оксидам, фармацевтически приемлемым аддитивным солям и стереохимически изомерным формам, где р представляет целое число, являющееся 0,1, 2, 3 или 4; 17 Х представляет О, S, NR5 или прямую связь или -X-R2 вместе могут представлять циано;R2 представляет Het1, С 3-7 циклоалкил, необязательно замещенный C(=O)-Z-R14, C1-6 алкил или C1-6 алкил, замещенный одним или двумя заместителями, выбранными из С(=O)-Z-R14,гидрокси, меркапто, циано, амино, моно- или ди(С 1-4 алкил)амино, С 1-6 алкилокси, необязательно замещенного C(=O)-Z-R14, C1-6 алкилсульфонилокси, С 3-7 циклоалкила, необязательно замещенного C(=O)-Z-R14, арила, арилокси, арилтио,Het1, Неt1 окси и Het1 тио; а если Х представляет О, S, NR5, то R2 может также представлять аминотиокарбонил,С 1-4 алкилкарбонил, необязательно замещенныйR5 представляет водород или С 1-4 алкил; каждый R6 независимо представляетC1-6 алкилсульфонил, аминосульфонил, моноили ди(С 1-4 алкил)аминосульфонил, моно- или ди(бензил)аминосульфонил, полигалоген-С 1-6 алкилсульфонил, C1-6 алкилсульфонил, фенил С 1-4 алкилсульфонил,пиперазинилсульфонил,аминопиперидинилсульфонил, пиперидиниламиносульфонил, N-C1-4-aлкил-N-пипepидинилaминocyльфoнил или моно- или ди(С 1-4 алкил)аминоС 1-4 алкилсульфонил; каждый R7 и каждый R8 независимо выбраны из водорода, C1-4 алкила, гидроксиС 1-4 алкила, дигидроксиС 1-4 алкила, арила, арилС 1-4 алкила, С 1-4 алкилоксиС 1-4 алкила, С 1-4 алкилкарбонила, арилкарбонила, Нet3 карбонила, моно- или ди(C1-4-алкил) аминоС 1-4 алкила, ариламинокарбонила, ариламинотиокарбонила, Нet3 аминокарбонила, Нet3 аминотиокарбонила, С 3-7 циклоалкила, пиридинилС 1-4 алкила, С 1-4 алкандиилС(=O)-Z-R14, -С(=O)-Z-R14, -Y-С 14 алкандиилС(=O)-Z-R14, Het3 и R6;R9 и R10 независимо выбраны каждый из водорода, С 1-4 алкила, гидроксиС 1-4 алкила, дигидроксиС 1-4 алкила, фенила, фенилС 1-4 алкила,С 1-4 алкилоксиС 1-4 алкила,С 1-4 алкилкарбонила,фенилкарбонила, Нet3 карбонила, моно- или ди(С 1-4 алкил)аминоС 1-4 алкила, фениламинокарбонила, фениламинотиокарбонила, Het3aминoкapбoнилa, Het3-аминотиокарбонила, С 3-7 цикло 004740 18 алкила, пиридинилС 1-4 алкила, C1-4-алкандиилС(=O)-Z-R14, -С(=O)-Z-R14, -Y-С 1-4 алкандиилС(=O)-Z-R14, Het3 и R6; каждый R11 независимо выбран из гидрокси, меркапто, циано, нитро, галогена, тригалогенметила, С 1-4 алкилокси, необязательно замещенного С(=O)-Z-R14, формила, тригалоген С 1-4 алкилсульфонилокси,R6,NR7R8,l5 16 14R12 и R13 независимо выбраны каждый из водорода, С 1-4 алкила, гидроксиС 1-4 алкила, дигидроксиС 1-4 алкила, фенила, фенилС 1-4 алкила,С 1-4 алкилоксиС 1-4 алкила,С 1-4 алкилкарбонила,фенилкарбонила, моно- или ди(С 1-4 алкил)аминоС 1-4 алкила, фениламинокарбонила, фениламинотиокарбонила, С 3-7 циклоалкила, пиридинилС 1-4 алкила,C1-4 алкандиил-С(=O)-Z-R14,14R6; каждый R14 независимо представляет С 1-4 алкил, замещенный одним или несколькими заместителями, выбранными из фенила, ди-С 1-4 алкиламино, циано, Het1 и С 3-7 циклоалкила, водород, C1-20 ацил (имеющий неразветвленную или разветвленную насыщенную или ненасыщенную углеводородную цепь с 1-20 углеродными атомами), C1-20 алкил, С 3-7 циклоалкил, полигалогенС 1-20 алкил или радикал формулыRa, Rb, Rc, Rd, Re и Rf независимо представляют каждый водород, C1-6 алкил или С 3-7 циклоалкил; илиRe и Rf вместе могут образовывать -СН 2 СН 2-, СН 2-СН 2-СН 2- или СН 2-СН 2-СН 2-СН 2-; или радикал формулыRg и Rh независимо представляют каждый С 1-4 алкил; каждый Z независимо представляет О, S,NH, -CH2-O- или -CH2-S-, посредством чего-Z-R14 вместе образуют радикал формулыR15 и R16 независимо выбраны каждый из дигидроксиС 1-4 алкила, арила, арилС 1-4 алкила,С 1-4 алкилоксиС 1-4 алкила, -С(=O)-Z-R14, арилкарбонила, моно- или ди(С 1-4 алкил)аминоС 1-4 алкила, ариламинокарбонила, ариламинотиокарбонила, Het3aминoкapбoнилa, Het3 аминотиокарбонила, пиридинилС 1-4 алкила, Het3 или R6; аминокарбонилметилена или моно- или ди(С 1-4 алкил)аминокарбонилметилена; арил представляет фенил, необязательно замещенный одним, двумя или тремя заместителями, независимо выбранными каждый из нитро, азидо, циано, галогена, гидрокси, С 1-4 алкила, С 3-7 циклоалкила, С 1-4 алкилокси, формила,полигалогенС 1-4 алкила, NR9R10, C(=O)NR9R10,С(=O)-Z-R14, R6, -O-R6, фенила, Het3, C(=O)Het3 и C1-4 алкила, замещенного одним или несколькими заместителями, независимо выбранными каждый из галогена, гидрокси, С 1-4 алкилокси,-Y-С 1-4 алкандиил-С(=O)-Z-R14,С(=O)-Z-R14,3 9 10[2,1-b]тиазолила; причем каждый из указанных гетероциклов независимо может, но необязательно, быть замещен одним или, где возможно,двумя или тремя заместителями, независимо выбранными каждый из Het2, R11 и C1-4 алкила,необязательно замещенного одним или двумя заместителями, независимо выбранными из Het2 и R11; 20 ла, хинолила, изохинолила, цинно-линила, фталазинила, хиназолинила, хиноксалинила, тиазолопиридинила,оксазолопиридинила и имидазо[2,1-b]тиазолила; причем каждый из указанных гетероциклов независимо может, но необязательно, быть замещен одним или, где возможно, двумя или тремя заместителями, независимо выбранными каждый из R11 и С 1-4 алкила, необязательно замещенного одним или двумя заместителями, независимо выбранными из R11;Het3 представляет моноциклический гетероцикл, выбранный из пирролидинила, пиперидинила, пиперазинила, морфолинила, тиоморфолинила, и тетрагидропиранила; причем каждый из указанных моноциклических гетероциклов независимо может, но необязательно,быть замещен, где возможно, одним, двумя,тремя или четырьмя заместителями, независимо выбранными каждый из гидрокси, С 1-4 алкила,С 1-4 алкилокси, С 1-4 алкилкарбонила, пиперидинила, NR12R13, C(=O)-Z-R14, R6 и С 1-4 алкила, замещенного одним или двумя заместителями,независимо выбранными из гидрокси, С 1-4 алкилокси, фенила, C(=O)-Z-R14, -Y-С 1-4 алкандиилС(=O)-Z-R14, R6 и NR12R13;R15 и R16 отличны от аминокарбонила, С 1-4 алкилкарбонилоксиС 1-4 алкилкарбонила, гидроксиС 1-4 алкилкарбонила или C1-4 алкилоксикарбонилкарбонила; и арил отличен от фенила, замещенного С(=O)-O-R14, C(=O)NH2, С(=O)NНС 1-4 алкилом,С(=O)NНС 3-7 циклоалкилом и/или С 1-4 алкилом,замещенным C(=O)-O-R14 или Y-С 1-4 алкандиилС(=O)-O-R14; иHet3 отличен от моноциклического гетероцикла, замещенного С(=O)-O-R14 и/или С 1-4 алкилом, замещенным C(=O)-O-R14 и/или Y-C1-4 алкандиил-(=O)-O-R14; и указанное соединение формулы (I), содержит по крайней мере, один фрагмент -С(=O)-ZR14. Интересной группой соединений являются те соединения формулы (I'), в которых 6 азаурацильный фрагмент присоединен к фенильному кольцу в пара- или мета-положении относительно углеродного атома, несущего заместители -X-R2, R3 и R4, предпочтительно в пара-положении. Другие соединения по настоящему изобретению включают те соединения формулы (I'), в которых применены одно или несколько следующих ограничений: р равно 0, 1 или 2; Х представляет S, NR5 или прямую связь,более предпочтительно NH или прямую связь; каждый R1 независимо представляет галоген, полигалогенС 1-6 алкил, C1-6 алкил, C1-6 алкилокси или арил, предпочтительно хлор или трифторметил, более предпочтительно хлор;R2 представляет Het1 или C1-6 алкил, замещенный одним или двумя заместителями, выбранными из гидрокси, циано, амино, моно- или ди(С 1-4 алкил)амино, С(=O)-Z-R14, C1-6 алкилокси,необязательно замещенного C(=O)-Z-R14, C1-6 алкилсульфонилокси, С 3-7 циклоалкила, необязательно замещенного С(=O)-Z-R14, арила, арилокси, арилтио, Het1, Неt1 окси и Неt1 тио; а если Х представляет О, S или NR5, то R2 может также представлять аминотиокарбонил, С 1-4 алкилкарбонил, необязательно замещенный C(=O)-ZR14, С 1-4 алкилтиокарбонил, необязательно замещенный C(=O)-Z-R14, арилкарбонил, арилтиокарбонил, Het1 кapбoнил или Неt1 тиокарбо-нил; в частности R2 представляет Het1, или в случае,когда Х представляет NH, R2 может также представлять аминотиокарбонил или Неt1 карбонил;R4 представляет водород или метил, предпочтительно метил;R7 и R8 независимо представляют каждый водород, С 1-4 алкил, Het3 или R6;R9 и R10 независимо представляют каждый водород, С 1-4 алкилоксиС 1-4 алкил, С 1-4 алкилкарбонил, аминокарбонил, Нet3 карбонил, Het3 илиR14 представляет дигидрофуранил, С 5-20 алкил, С 1-4 алкил, замещенный одним или несколь 004740 22 кими заместителями, выбранными из фенила,С 1-4 алкиламино, циано, Het1 и С 3-7 циклоалкила; арил представляет фенил, необязательно замещенный одним, двумя или тремя заместителями, независимо выбранными каждый из нитро, циано, галогена, гидрокси, С 1-4 алкила,С 3-7 циклоалкила, С 1-4 алкилокси, формила, полигалогенС 1-4 алкила, NR9R10, C(=O)NR9R10, C(=O)O-R14, -O-R6, фенила, C(=O)Het3 и С 1-4 алкила,замещенного одним или несколькими заместителями, независимо выбранными каждый из галогена, гидрокси, С 1-4 алкилокси, С(=O)-Z-R14,Het3 и NR9R10;Het1 представляет моноциклический гетероцикл, выбранный из пирролила, имидазолила,пиразолила, триазолила, тетразолила, фуранила,тиенила, оксазолила, изоксазолила, тиазолила,изотиазолила, тиадиазолила, оксадиазолила,пиридинила, пиримидинила, пиразинила, пиранила, пиридазинила и триазинила, в частности имидазолил, оксадиазолил, тиазолил, пиримидинил или пиридинил, причем каждый из указанных моноциклических гетероциклов независимо может, но необязательно, быть замещен одним или, где возможно, двумя или тремя заместителями, независимо выбранными каждый из Het2, R11 и С 1-4 алкила, необязательно замещенного Het2 или R11; предпочтительно Het1 представляет имидазолил, оксадиазолил, тиазолил или пиридинил, причем каждый независимо и необязательно замещенный одним или, где возможно, двумя или тремя заместителями, независимо выбранными каждый из Het2, R11 и С 1-4 алкила, необязательно замещенного Het2 илиHet2 представляет ароматический гетероцикл, в частности фуранил, тиенил, пиридинил или бензотиенил, причем каждый из указанных ароматических гетероциклов независимо может,но необязательно, быть замещен одним или, где возможно, двумя или тремя заместителями, независимо выбранными каждый из R11 и C1-4 алкила;Het3 представляет пиперидинил, пиперазинил, морфолинил и тетрагидропиранил, каждый независимо и необязательно замещенный, где возможно, одним, двумя, тремя или четырьмя заместителями, независимо выбранными каждый из гидрокси, С 1-4 алкила, C1-4 алкилкарбонила, пиперидинила и С 1-4 алкила, замещенного одним или двумя заместителями, независимо выбранными из гидрокси, C1-4 алкилокси и фенила;Het4 представляет тиенил. Особыми соединениями являются те соединения формулы (I'), в которых р=2 и оба заместителя R1 представляют собой хлор, причем является более предпочтительным, когда оба заместителя находятся в орто-положениях относительно углеродного атома, несущего заместители -X-R2, R3 и R4. 23 Примечательными соединениями являются те соединения формулы (I'), в которых 6 азаурацильный фрагмент находится в параположении относительно углеродного атома,несущего заместители -X-R2, R3 и R4, и р=2,причем оба заместителя R1 представляют собой хлор, находящийся в орто-положении относительно углеродного атома, несущего заместители -X-R2, R3 и R4. Другими примечательными соединениями являются те соединения формулы (I'), в которых Х представляет прямую связь и R2 представляет моноциклический гетероцикл, выбранный из пирролила, имидазолила, пиразолила, триазолила, тетразолила, фуранила, тиенила, оксазолила,изоксазолила, тиазолила, изотиазолила, тиадиазолила, оксадиазолила, пиридинила, пиримидинила, пиразинила, пиранила, пиридазинила и триазинила, в частности имидазолил, оксадиазолил, тиазолил, пиримидинил или пиридинил,причем каждый из указанных моноциклических гетероциклов независимо может, но необязательно, быть замещен одним или, где возможно,двумя или тремя заместителями, независимо выбранными каждый из Het2, R11 и С 1-4 алкила,необязательно замещенного Het2 или R11; в частности R2 представляет необязательно замещенный тиазолил, пиридинил или оксадиазолил. Предпочтительными соединениями являются те соединения формулы (I'), в которых R3 иR4 представляют оба метил, a -X-R2 представляет Het1, причем Het1 предпочтительно представляет необязательно замещенный тиазолил, пиридинил или оксадиазолил. Более предпочтительными соединениями являются те соединения формулы (I'), в которыхR3 и R4 представляют оба метил, -X-R2 представляет необязательно замещенный 2-тиазолил или 3-оксадиазолил, 6-азаурацильный фрагмент находится в пара-положении относительно углеродного атома, несущего заместители -X-R2,R3 и R4, и р=2, причем оба заместителя R1 представляют собой хлор, находящийся в ортоположении относительно углеродного атома,несущего заместители -X-R2, R3 и R4. Примеры соединений формулы (I) включают также соединения формулы (I"), где р, X,Y, R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12,R13, R14, m, n, q, r, s, Ra, Rb, Rc, Rd, Re, Rf, Rg, Rh,Rk, Ri, Rj, Rm, Rn, R15, R16, R17, R18, Z, арил, Het1,Het2, Het3, Het4, Het5 при использовании в связи с соединениями формулы (I") имеют значения,определенные ниже. Настоящее изобретение относится к соединениям формулы 24 их N-оксидам, фармацевтически приемлемым аддитивным солям и стереохимически изомерным формам, где р представляет целое число, являющееся 0,1, 2, 3 или 4;X представляет О, S, NR5 или прямую связь или -X-R2 вместе могут представлять циано;R2 представляет Het1, С 3-7 циклоалкил, необязательно замещенный С(=O)-Z-R14, C1-6 алкил или C1-6 алкил, замещенный одним или двумя заместителями, выбранными из С(=O)-Z-R14,гидрокси, циано, амино, моно- или ди(С 1-4 алкил)амино, C1-6 алкилокси, необязательно замещенного C(=O)-Z-R14, С 1-6 алкилсульфонилокси,С 3-7-циклоалкила, необязательно замещенного С(=O)-Z-R14, арила, арилокси, арилтио, Het1,Неt1 окси и Het1 тио; а если Х представляет О, S,NR5, то R2 может также представлять аминотиокарбонил, C1-4 алкилкарбонил, необязательно замещенный C(=O)-Z-R14, C1-4 алкилтиокарбонил, необязательно замещенный С(=O)-Z-R14,арилкарбонил, арилтиокарбонил, Неt1 карбонил или Hetlтиoкapбoнил;R5 представляет водород или С 1-4 алкил; каждый R6 независимо представляет C1-6 алкилсульфонил, аминосульфонил, пиперидинилсульфонил, моно- или ди(С 1-4 алкил)аминосульфонил, моно- или ди(бензил) аминосульфонил, полигалоген-C1-6 алкилсульфонил, C1-6 алкилсульфинил, фенилС 1-4 алкилсульфонил, пиперазинилсульфонил, аминопиперидинилсульфонил, пиперидиниламиносульфонил, N-С 1-4 алкил-N-пиперидиниламиносульфонил или моно- или ди(С 1-4 алкил)аминоС 1-4 алкилсульфонил; каждый R7 и каждый R8 независимо выбраны из водорода, C1-4 алкила, гидроксиС 1-4 алкила, дигидроксиС 1-4 алкила, арила, арилC1-4 алкила,С 1-4 алкилоксиС 1-4 алкила,С 1-4 алкилкарбонила, арилкарбонила, Het3 кapбoнилa, моно- или ди(C1-4-алкил)аминоС 1-4 алкила, ариламинокарбонила,ариламинотиокарбонила,Het3aминoкapбoнилa, Нet3 аминотиокарбонила,С 3-7 циклоалкила, пиридинилС 1-4 алкила, C1-4 алкандиил-С(=O)-Z-R14, -С(=O)-Z-R14, -Y-С 14 алкандиил-С(=O)-Z-R14, Het3, Het4 и R6; или R7 иR9 и R10 независимо выбраны каждый из водорода, С 1-4 алкила, гидроксиС 1-4 алкила, дигидроксиС 1-4 алкила, фенила, фенилС 1-4 алкила,С 1-4 алкилоксиС 1-4 алкила,С 1-4 алкилкарбонила,фенилкарбонила, Нet3 карбонила, моно- или ди(С 1-4 алкил)аминоС 1-4 алкила, фениламинокарбонила, фениламинотиокарбонила, Нet3 аминокарбонила, Het3aминoтиoкapбoнилa, С 3-7 циклоалкила, пиридинилС 1-4 алкила, C1-4 алкандиилС(=O)-Z-R14, -С(=O)-Z-R14, -Y-С 1-4 алкандиилС(=O)-Z-R14, Het3, Het4 и R6; или R9 и R10, взятые вместе с атомом азота, к которому они присоединены, образуют радикал формулы каждый R11 независимо выбран из гидрокси, меркапто, циано, нитро, галогена, тригалогенметила, С 1-4 алкилокси, необязательно замещенного С(=O)-Z-R14, формила, тригалогенС 1-4 алкилсульфонилокси, R6, NR7R8, C(=O)NR15R16,-С(=O)-Z-R14,-Y-С 1-4 алкандиил-C(=O)-Z-R14,арила, арилокси, арилкарбонила, С 3-7 циклоалкила, необязательно замещенного C(=O)-ZR14, С 3-7 циклоалкилокси, необязательно замещенного C(=O)-Z-R14, фталимид-2-ила, Het3 иR12 и R13 независимо выбраны каждый из водорода, С 1-4 алкила, гидроксиС 1-4 алкила, дигидроксиС 1-4 алкила, фенила, фенилС 1-4 алкила,С 1-4 алкилоксиС 1-4 алкила,С 1-4 алкилкарбонила,фенилкарбонила, моно- или ди(С 1-4 алкил)аминоС 1-4 алкила, фениламинокарбонила, фениламинотиокарбонила, С 3-7 циклоалкила, пиридинилС 1-4 алкила,C1-4 алкандиил-С(=O)-Z-R14,14 каждый R14 независимо представляет водород; С 1-20 ацил (имеющий неразветвленную или разветвленную насыщенную или ненасыщенную углеводородную цепь с 1-20 углеродными атомами), C1-20 алкил, С 3-20 алкенил, необязательно замещенный фенилом, С 3-20 алкинил, С 3-7 циклоалкил, полигалогенС 1-20 алкил, Het5, фенил илиC1-20 алкил, замещенный одним или несколькими заместителями, выбранными из гидрокси,NR17R18, фенила, моно- или ди(С 1-4 алкил)амино, циано, Het5, С 1-4 алкилоксикарбонила,фенилС 1-4 алкилоксикарбонила и С 3-7 циклоалкила, или R14 представляет радикал формулыRa, Rb, Rc, Rd, Re и Rf независимо представляют каждый водород, C1-6 алкил, фенил или С 3-7 циклоалкил; илиRe и Rf вместе могут образовывать -СН 2 СН 2-, -СН 2-СН 2-СН 2-или -СН 2-СН 2-СН 2-СН 2-;Rg, Rh и Rk независимо представляют каждый водород или C1-4 алкил;Rm представляет водород или С 1-4 алкилокси и Rn представляет водород, С 1-4 алкил,С 3-7 циклоалкил, фенил или фенилС 1-4 алкил; каждый Z независимо представляет О, S,NH, -CH2-O- или -СН 2-S-, посредством чего-Z-R14 вместе образуют радикал формулыR15 и R16 независимо выбраны каждый из водорода, С 1-4 алкила, гидроксиС 1-4 алкила, дигидроксиС 1-4 алкила, арила, арилС 1-4 алкила, С 1-4 алкилоксиС 1-4 алкила, -С(=O)-Z-R14, арилкарбонила, моно- или ди(С 1-4 алкил)аминоС 1-4 алкила,ариламинокарбонила, ариламинотиокарбонила,аминокарбонилметилена, моно- или ди(C1-4 27 алкил)аминокарбонилметилена,Het3aминoкapбoнилa, Het3aминoтиoкapбoнила; пиридинилС 1-4 алкила; Het3 или R6; или R15 и R16,взятые вместе с атомом азота, к которому они присоединены, образуют радикал формулыR17 и R18 независимо выбраны каждый из водорода, С 1-4 алкила, гидроксиС 1-4 алкила, дигидроксиС 1-4 алкила, фенила, фенилС 1-4 алкила,С 1-4 алкилоксиС 1-4 алкила,С 1-4 алкилкарбонила,фенилкарбонила, моно- или ди(С 1-4 алкил)аминоС 1-4 алкила, фениламинокарбонила, фениламинотиокарбонила С 3-7 циклоалкила, пиридинилС 1-4 алкила,С 1-4 алкандиил-С(=O)-Z-C1-6 алкила, -С(=O)-Z-C1-6 алкила, -Y-C1-4 алкандиилС(=O)-Z-C1-6 алкила и R6; арил представляет фенил, необязательно замещенный одним, двумя или тремя заместителями, независимо выбранными каждый из нитро, азидо, циано, галогена, гидрокси, С 1-4 алкила, С 3-7 циклоалкила, С 1-4 алкилокси, формила,полигалогенС 1-4 алкила, NR9R10, C(=O)NR9R10,C(=O)-Z-R14, R6, -O-R6, фенила, Het3, C(=O)Het3 и С 1-4 алкила, замещенного одним или несколькими заместителями, независимо выбранными каждый из галогена, гидрокси, -С 1-4 алкилокси,C(=O)-Z-R14,-Y-С 1-4 алкандиил-С(=O)-Z-R14,3 9 10Het1 представляет гетероцикл, выбранный из пирролила, пирролинила, имидазолила, имидазолинила, пиразолила, пиразолинила, триазолила, тетразолила, фуранила, тетрагидрофуранила, тиенила, тиоланила, диоксоланила, оксазолила, оксазолинила, изоксазолила, тиазолила,тиазолинила, изотиазолила, тиадиазолила, оксадиазолила, пиридинила, пиримидинила, пиразинила, пиранила, пиридазинила, пирролидинила,пиперидинила, пиперазинила, морфолинила,тиоморфолинила, диоксанила, дитианила, тритианила, триазинила, бензотиенила, изобензотиенила, бензофуранила, изобензофуранила,бензотиазолила,бензоксазолила,бензодиоксанила, индолила, изоиндолила, индолинила, пуринила, 1H-пиразоло[3,4-d]пиримидинила,бензимидазолила, хинолила, изохинолила, циннолинила, фталазинила, хиназолинила, хиноксалинила, тиазолопиридинила, оксазолопиридинила и имидазо[2,1-b]тиазолила; причем каждый из указанных гетероциклов независимо может, но необязательно, быть замещен одним или, где возможно, двумя или тремя заместителями, независимо выбранными каждый из Het2,R11 и С 1-4 алкила, необязательно замещенного одним или двумя заместителями, независимо выбранными из Het2 и R11; 28 нила, тиенила, тиоланила, диоксоланила, оксазолила, оксазолинила, изоксазолила, тиазолила,тиазолинила, изотиазолила, тиадиазолила, оксадиазолила, пиридинила, пиримидинила, пиразинила, пиранила, пиридазинила, диоксанила, дитианила, тритианила, триазинила, бензотиенила,изобензотиенила,бензофуранила,изобензофуранила, бензотиазолила, бензоксазолила, индолила, изоиндолила, индолинила, пуринила, 1H-пиразоло[3,4-d]пиримидинила, бензимидазолила, хинолила, изохинолила, циннолинила, фталазинила, хиназолинила, хиноксалинила, тиазолопиридинила, оксазолопиридинила и имидазо[2,1-b]тиазолила; причем каждый из указанных гетероциклов независимо может, но необязательно, быть замещен одним или, где возможно, двумя или тремя заместителями, независимо выбранными каждый из Het4, R11 и С 1-4 алкила, необязательно замещенного одним или двумя заместителями, независимо выбранными из Het4 и R11;Het3 представляет моноциклический гетероцикл, выбранный из пирролидинила, пиперидинила, пиперазинила, морфолинила, тиоморфолинила, и тетрагидропиранила; причем каждый из указанных моноциклических гетероциклов независимо может, но необязательно,быть замещен, где возможно, одним, двумя,тремя или четырьмя заместителями, независимо выбранными каждый из гидрокси, С 1-4 алкила,С 1-4 алкилокси, С 1-4 алкилкарбонила, пиперидинила, NR12R13, С(=С)-Z-R14, R6 и С 1-4 алкила, замещенного одним или двумя заместителями,независимо выбранными из гидрокси, С 1-4 алкилокси, фенила, С(=O)-Z-R14, -Y-С 1-4 алкандиилС(=O)-Z-R14, R6 и NR12R13;Het5 представляет гетероцикл, выбранный из пирролила, пирролинила, имидазолила, имидазолинила, пиразолила, пиразолинила, триазолила, тетразолила, фуранила, тетрагидрофуранила, тиенила, тиоланила, диоксоланила, оксазолила, оксазолинила, изоксазолила, тиазолила,тиазолинила, изотиазолила, тиадиазолила, оксадиазолила, пиридинила, пиримидинила, пиразинила, пиранила, пиридазинила, пирролидинила,пиперидинила, пиперазинила, морфолинила,тиоморфолинила, тетрагидропиранила, диоксанила, дитианила, тритианила, триазинила, бензотиенила, изобензотиенила, бензофуранила,изобензофуранила, бензотиазолила, бензоксазолила, бензодиоксанила, индолила, изоиндолила,индолинила,пуринила,1H-пиразоло[3,4d]пиримидинила, бензимидазолила, хинолила,изохинолила, циннолинила, фталазинила, хиназолинила, хиноксалинила, тиазолопиридинила, 29 оксазолопиридинила и имидазо[2,1-b]тиазолила; причем каждый из указанных гетероциклов независимо может, но необязательно, быть замещен одним или, где возможно, двумя или тремя заместителями, независимо выбранными каждый из гидрокси, С 1-4 алкила, С 1-4 алкилокси,C1-4 алкилкарбонила, пиперидинила, NR17R18,С(=O)-Z-C1-6 алкила, R6, сульфонамидо и С 1-4 алкила, замещенного одним или двумя заместителями, независимо выбранными из гидрокси,С 1-4 алкилокси, фенила, С(=O)-Z-C1-6 алкила, -YС 1-4 алкандиил-С(=O)-Z-C1-6 алкила, R6 и NR17R18; но при условиях, чтоR15 и R16 отличны от аминокарбонила, С 1-4 алкилкарбонилоксиС 1-4 алкилкарбонила, гидроксиС 1-4 алкилкарбонила или C1-4 алкилоксикарбонилкарбонила; и арил отличен от фенила, замещенногоHet3 отличен от моноциклического гетероцикла, замещенного C(=O)-O-R19 и/или С 1-4 алкилом, замещенным C(=O)-O-R19 и/или Y-C1-4 алкандиил-(=O)-O-R19; и в каждом из вышеприведенных условийR19 определяется как водород, С 1-4 алкил, С 3-7 циклоалкил, аминокарбонилметилен или моноили ди(С 1-4 алкил)аминокарбонилметилен; и причем указанное соединение, имеющее формулу (I), содержит, по крайней мере, один фрагмент C(=O)-Z-R14. Интересной группой соединений являются те соединения формулы (I"), в которых 6 азаурацильный фрагмент присоединен к фенильному кольцу в пара- или мета-положении относительно углеродного атома, несущего заместители -X-R2, R3 и R4, предпочтительно в пара-положении. Другие интересные группы содержат те соединения формулы (I"), в которых применены одно или несколько следующих ограничений: р равно 0, 1 или 2; Х представляет S, NR5 или прямую связь,более предпочтительно прямую связь; 30 каждый R1 независимо представляет галоген, полигалогенС 1-6 алкил, C1-6 алкил, C1-6 алкилокси или арил, предпочтительно хлор или трифторметил, более предпочтительно хлор; по крайней мере один фрагмент C(=O)-ZR14 в соединении формулы (I") находится в R2;R2 представляет Het1 или C1-6 алкил, замещенный одним или двумя заместителями, выбранными из гидрокси, циано, амино, моно- или ди(С 1-4 алкил)амино, С(=O)-Z-R14, C1-6 алкилокси,необязательно замещенного C(=O)-Z-R14, C1-6 алкилсульфонилокси, С 3-7 циклоалкила, необязательно замещенного С(=O)-Z-R14, арила, арилокси, арилтио, Het1, Неt1 окси и Неt1 тио; а если Х представляет О, S или NR5, то R2 может также представлять аминотиокарбонил, С 1-4 алкилкарбонил, необязательно замещенный C(=O)-ZR14, C1-4 алкилтиокарбонил, необязательно замещенный C(=O)-Z-R14, арилкарбонил, арилтиокарбонил, Het1 кapбoнил или Het1 тиoкapбoнил; более предпочтительно R2 представляет 1R4 представляет водород или метил, более предпочтительно метил;R7 и R8 независимо представляют каждый водород, С 1-4 алкил, Het3 или R6;R9 и R10 независимо представляют каждый водород, С 1-4 алкилоксиС 1-4 алкил, С 1-4 алкилкарбонил, аминокарбонил, Нet3 карбонил, Het3 или R6;R14 представляет дигидрофуранил, С 5-20 алкил, С 3-20 алкенил, полигалогенС 1-6 алкил, Het5 или С 1-20 алкил, замещенный одним или несколькими заместителями, выбранными из фенила, С 1-4 алкиламино, циано, Het1, гидрокси и С 3-7 циклоалкила;R17 и R18 независимо представляют каждый водород или фенил; арил представляет фенил, необязательно замещенный одним, двумя или тремя заместителями, независимо выбранными каждый из нитро, циано, галогена, гидрокси, С 1-4 алкила,С 3-7 циклоалкила, С 1-4 алкилокси, формила, полигалогенС 1-4 алкила, NR9R10, C(=O)NR9R10, C(=O)O-R14, -O-R6, фенила, C(=O)Het3 и С 1-4 алкила,замещенного одним или несколькими заместителями, независимо выбранными каждый из галогена, гидрокси, С 1-4 алкилокси, С(=O)-Z-R14,Het3 и NR9R10;Het1 представляет моноциклический гетероцикл, выбранный из пирролила, имидазолила,пиразолила, триазолила, тетразолила, фуранила,тиенила, оксазолила, изоксазолила, тиазолила,изотиазолила, тиадиазолила, оксадиазолила,пиридинила, пиримидинила, пиразинила, пиранила, пиридазинила и триазинила, в частности имидазолил, оксадиазолил, тиазолил, пиримидинил или пиридинил, причем каждый из указанных моноциклических гетероциклов независимо может, но необязательно, быть замещен одним или, где возможно, двумя или тремя заместителями, независимо выбранными каждый из Het2, R11 и С 1-4 алкила, необязательно замещенного Het2 или R11; более предпочтительноHet1 представляет имидазолил, оксадиазолил,тиазолил или пиридинил, каждый независимо и необязательно замещенный одним или, где возможно, двумя или тремя заместителями, независимо выбранными каждый из Het2, R11 и С 1-4 алкила, необязательно замещенного Het2 или R11;Het2 представляет ароматический гетероцикл, в частности фуранил, тиенил, пиридинил или бензотиенил, причем каждый из указанных ароматических гетероциклов независимо может,но необязательно, быть замещен одним или, где возможно, двумя или тремя заместителями, независимо выбранными каждый из R11 и C1-4 алкила;Het3 представляет пиперидинил, пиперазинил, морфолинил или тетрагидропиранил, каждый независимо и необязательно замещенный,где возможно, одним, двумя, тремя или четырьмя заместителями, независимо выбранными каждый из гидрокси, С 1-4 алкила, C1-4 алкилкарбонила, пиперидинила и С 1-4 алкила, замещенного одним или двумя заместителями, независимо выбранными из гидрокси, С 1-4 алкилокси и фенила;Het5 представляет пиперидинил или пиперазинил, необязательно замещенный С 1-4 алкилом или сульфонамидо. Особыми соединениями являются те соединения формулы (I"), в которых р=2 и оба заместителя R1 представляют собой хлор, причем является более предпочтительным, когда оба заместителя находятся в орто-положениях относительно углеродного атома, несущего заместители -X-R2, R3 и R4. Примечательными соединениями являются те соединения формулы (I"), в которых 6 азаурацильный фрагмент находится в параположении относительно углеродного атома,несущего заместители -X-R2, R3 и R4, и р=2,причем оба заместителя R1 представляют собой хлор, находящийся в орто-положении относительно углеродного атома, несущего заместители -X-R2, R3 и R4. Другими примечательными соединениями являются те соединения формулы (I"), в которых Х представляет прямую связь и R2 пред 004740 32 ставляет моноциклический гетероцикл, выбранный из пирролила, имидазолила, пиразолила,триазолила, тетразолила, фуранила, тиенила,оксазолила, изоксазолила, тиазолила, изотиазолила, тиадиазолила, оксадиазолила, пиридинила,пиримидинила, пиразинила, пиранила, пиридазинила и триазинила, в частности имидазолил,оксадиазолил, тиазолил, пиримидинил или пиридинил, причем каждый из указанных моноциклических гетероциклов независимо может,но необязательно, быть замещен одним или, где возможно, двумя или тремя заместителями, независимо выбранными каждый из Het2, R11 и С 1-4 алкила, необязательно замещенного Het2 илиR11; более предпочтительно R2 представляет необязательно замещенный тиазолил, пиридинил или оксадиазолил. Предпочтительными соединениями являются те соединения формулы (I"), в которых R3 и R4 представляют оба метил, а -X-R2 представляет Het1, причем Het1 предпочтительно представляет необязательно замещенный тиазолил,пиридинил или оксадиазолил. Более предпочтительными соединениями являются те соединения формулы (I"), в которых R3 и R4 представляют оба метил, -X-R2 представляет необязательно замещенный 2 тиазолил или 3-оксадиазолил, 6-азаурацильный фрагмент находится в пара-положении относительно углеродного атома, несущего заместители -X-R2, R3 и R4, и р=2, причем оба заместителяR1 представляют собой хлор, находящийся в орто-положении относительно углеродного атома, несущего заместители -X-R2, R3 и R4. Для упрощения структурных представлений соединений формулы (I) группа будет представлена ниже символом D. Соединения формулы (I) обычно могут быть получены осуществлением ряда реакций,включающих стадию взаимодействия промежуточного соединения формулы (II), где W1 представляет подходящую уходящую группу, такую,как, например, атом хлора, с подходящим реагентом формулы (III). Указанная реакция может быть осуществлена в инертном для реакции растворителе, таком как, например, ацетонитрил, N,Nдиметилформамид, уксусная кислота, тетрагидрофуран, этанол или их смесь. Когда же реагент формулы (III) действует как растворитель, дополнительный инертный растворитель не нужен. Реакцию осуществляют, хотя это и не обязательно, в присутствии основания, такого как,например, 1,8-диазабицикло[5.4.0]ундец-7-ен, 33 бикарбонат натрия, метанолат натрия и тому подобное. Подходящие температуры реакции находятся в пределах между -70 С и температурой кипения при нагревании с обратным холодильником. В этом и последующих получениях продукты реакции могут быть выделены из реакционной среды и, если это необходимо, дополнительно очищены в соответствии с методиками, общеизвестными в данной области техники, такими, как, например, экстракция, кристаллизация, дистилляция, растирание и хроматография. Некоторые соединения и промежуточные продукты по настоящему изобретению могут быть получены согласно или аналогично методикам, описанным в ЕР-А-0170316, ЕР-А 0232932 и W099/02505. В соответствии с другим вариантом, например, соединения формулы (I) могут обычно быть получены путем циклизации промежуточного соединения формулы (IV), где L представляет подходящую уходящую группу, такую как,например, C1-6 алкилокси или галоген, и Е представляет подходящую электронопритягивающую группу, такую как, например, сложно эфирная, амидная, цианидная, C1-6 алкилсульфонилокси и подобные группы, и отщепления группы Е полученного в результате триазиндиона формулы (V). Циклизация может быть подходящим образом осуществлена путем кипячения с обратным холодильником промежуточного соединения (IV) в кислотной среде, такой как уксусная кислота, и в присутствии основания, такого как, например, ацетат калия. В зависимости от ее природы группа Е может быть отщеплена с использованием различных известных в данной области методов отщепления. Например, когда группа Е представляет собой амидную или циано группу, она может быть гидролизована до карбоксильной группы путем, например, кипячения с обратным холодильником промежуточного соединения,несущего группу Е, в хлороводородной и уксусной кислотах. Полученное при этом промежуточное соединение может быть затем подвергнуто дополнительному взаимодействию с меркаптоуксусной кислотой или ее функциональным производным с получением соединения формулы (I). Указанную реакцию обычно осуществляют при повышенных температурах вплоть до температуры кипения при нагревании с обратным холодильником. Подходящий способ получения промежуточных соединений формулы (IV) заключается в осуществлении взаимодействия промежуточного соединения формулы (VI) с нитратом натрия или его функциональным производным в кислотной среде, такой как, например, хлороводородная кислота в уксусной кислоте, а предпочтительно в той же самой реакционной смеси,затем осуществлении взаимодействия полученного в результате промежуточного соединения с реагентом формулы (VII), где L и Е - такие же,как определенные выше, в присутствии основания, такого как, например, ацетат натрия. Интересной подгруппой в объеме настоящего изобретения являются те соединения формулы (I), в которых -X-R2 представляет необязательно замещенный 2-тиазолильный фрагмент(I-а. Необязательно замещенный 2 тиазолильный фрагмент может быть введен в соединения формулы (I-а) на различных стадиях процесса получения. Например, представленная ниже схема 1 иллюстрирует три возможных пути получения соединений формулы (I-a). Схема 1 Первый путь включает осуществление взаимодействия содержащего цианогруппу фрагмента в промежуточном соединении фор 35 мулы (VIII) с газообразным Н 2S в подходящем растворителе, таком как, например, пиридин, и в присутствии основания, такого как, например,триэтиламин, с получением в качестве промежуточного соединения соответствующего тиоамида формулы (IХ-а). Указанный тиоамид может быть затем подвергнут циклизации с промежуточным соединением (XII), где W представляет подходящую уходящую группу, такую как, например,галоген, например, бром, в подходящем растворителе, таком как, например, этанол. Аминогруппа в полученном производном 2-тиазолила формулы (IX-b) может быть затем дополнительно подвергнута описанному выше воздействию с образованием 6-азаурацильного кольца, в результате чего получают соединение формулы (Ia). Второй путь получения соединений формулы (I-a) включает сначала защиту аминогруппы в промежуточном соединении формулы(VIII) путем введения подходящей защитной группы Р, такой как, например, алкилкарбонильная группа, с использованием методов защиты, известных в данной области. В случае,когда Р представляет алкилкарбонильную группу, промежуточные соединения формулы (VII) могут быть подвергнуты взаимодействию с соответствующим ангидридом формулы алкилС(=O)-O-С(=O)-алкил в подходящем растворителе, таком как, например, толуол. Полученное при этом промежуточное соединение формулы(Х-а) может быть затем дополнительно подвергнуто воздействию в соответствии с первым путем, описанным выше. На конечной стадии образование 6-азаурацильного кольца может быть инициировано после удаления защиты у аминогруппы с использованием известных методов защиты. В примере, когда Р представляет алкилкарбонильную группу, снятие защиты с промежуточных соединений формулы (Х-с) может быть осуществлено в подходящем растворителе, таком как, например, этанол, в присутствии кислоты, такой как, например, хлороводородная кислота. Третий путь включает сначала образование 6-азаурацильного кольца так, как описано выше,но с использованием в качестве исходного соединения промежуточного соединения формулы(VIII), и затем осуществление взаимодействия полученного при этом промежуточного соединения формулы (ХI-а) с H2S и последующего взаимодействия тиоамида формулы (XI-b) с промежуточным соединением формулы (XII),как описано в первом пути, с получением в конечном счете соединения формулы (I-a). Другой интересной подгруппой в пределах настоящего изобретения являются те соединения формулы (I), в которых -X-R2 представляет необязательно замещенный 1,2,4-оксадиазол-3 ильный фрагмент, указанные соединения представлены формулой (I-b-1). Необязательно за 004740 36 мещенный 1,2,4-оксадиазол-3-ильный фрагмент может быть введен на такой же стадии процесса, как показано для производных 2-тиазолила на схеме 1. Например, аналогично одному из трех путей, показанных на схеме 1, соединения формулы (I-b-1) могут быть получены путем осуществления воздействия на промежуточное соединение формулы (VIII) так, как показано на схеме 2. Схема 2 На указанной схеме 2 цианогруппу промежуточного соединения формулы (VIII) подвергают взаимодействию с гидроксиламином или его функциональным производным в подходящем растворителе, таком как, например, метанол, в присутствии основания, такого как, например, метанолат натрия. Полученное при этом промежуточное соединение формулы(ХIII-а) подвергают затем взаимодействию с промежуточным соединением формулы (XIV),где W представляет подходящую уходящую группу, такую как, например, галоген, например, хлор, в подходящем растворителе, таком как, например, дихлорметан, и в присутствии основания, такого как, например, N,N-(1 метилэтил) этанамин. Затем полученное промежуточное соединение формулы (XIII-b) подвергают циклизации с образованием производного 3-оксадиазолила формулы (XIII-с). Аминогруппа в промежуточных соединениях формулы(XIII-c) может быть далее преобразована в 6 азаурацильное кольцо, как описано выше. Еще одной интересной подгруппой соединений в пределах настоящего изобретения являются те соединения формулы (I), в которых X-R2 представляет необязательно замещенный 1,3,4-оксадиазол-2-ильный фрагмент, указанные соединения представлены формулой (I-b-2). Например, соединения формулы (I-b-2) могут быть получены так, как показано на схеме 3. Схема 3 37 Нитрильный фрагмент в промежуточном соединении формулы (XV) преобразуют в фрагмент карбоновой кислоты, используя известные методы. Например, нитрильное производное можно нагревать с обратным холодильником в смеси серной и уксусной кислот в воде. Производное карбоновой кислоты формулы(XVI-a) может быть затем подвергнуто взаимодействию с хлорирующим агентом, таким как,например, тионилхлорид, с получением производного ацилхлорида формулы (XVI-b). Далее ацилхлорид может быть подвергнут взаимодействию с производным гидразина формулы(XVII) в подходящем растворителе, таком как,например, дихлорметан, и в присутствии основания,такого как,например,N,N-(1 метилэтил)этанамин. Затем полученное промежуточное соединение формулы (XVI-c) может быть подвергнуто циклизации до 1,2,4 оксадиазол-2-ильного производного формулы(XVI-d) в присутствии фосфорилхлорида. На конечной стадии перед образованием 6 азаурацильного кольца, как описано выше, нитрогруппу в промежуточных соединениях формулы (XVI-e) восстанавливают до аминогруппы, используя известные в данной области методы восстановления, такие как, например, восстановление нитрогруппы водородом в метаноле и в присутствии катализатора, такого как никель Ренея. И еще одной интересной подгруппой соединений в объеме настоящего изобретения являются те соединения формулы (I), в которых-X-R2 представляет -NH-R2, указанные соединения представлены формулой (I-c-1). На схеме 4 показан подходящий путь получения соединений формулы (I-c-1). Схема 4 На показанной схеме цианогруппу промежуточного соединения формулы (ХI-а) гидролизуют до соответствующего амида, используя известные в данной области методы, такие как,например, гидролиз в присутствии уксусной и серной кислот. Полученный при этом амид в промежуточных соединениях формулы (XVIIIa) может быть преобразован в амин с использованием (диацетокси-иод)бензола или его функционального производного в подходящем растворителе, таком как, например, смесь воды и ацетонитрила. Аминное производное формулы(XVIII-b) может быть затем подвергнуто взаимодействию с гексафторфосфатом бензотриазол-1-илокситрис(диметиламино)фосфония, как описано в Tetrahedron Letters14 (1975) стр. 1219-1222, с получением соединения или его функционального производного, такого, как,например, изотиоцианат, в подходящем растворителе, таком как, например, тетрагидрофуран.(VIII) могут быть получены так, как показано на схеме 5. Схема 5(XX) могут быть подвергнуты взаимодействию друг с другом в подходящем растворителе, таком как, например, диметилсульфоксид, в присутствии основания, такого как, например, гидроксид натрия, с получением промежуточного соединения формулы (XV-а). Нитрогруппа в промежуточных соединениях формулы (XV-a) может быть либо сразу же восстановлена до аминогруппы, с использованием известных в данной области методов восстановления, таких как, например, восстановление нитрогруппы водородом в метаноле и в присутствии катализатора, такого как никель Ренея, либо может быть сначала, до ее восстановления, подвергнута взаимодействию с промежуточным соединением формулы R4'-W, где R4' одинаков с R4, но отличен от водорода, a W представляет подходящую уходящую группу, такую как, например,галоген, например иод, в подходящем растворителе,таком как,например,N,Nдиметилформамид, и в присутствии подходящего основания, такого как, например, гидрид натрия. Соединения формулы (I) можно также преобразовать одно в другое, следуя известным в данной области методикам преобразования функциональных групп, таким как, например,те, что указаны в WO 9902505, и те, что описаны ниже в качестве примеров в экспериментальной части. В частности, соединения формулы (I), содержащие по крайней мере один фрагмент -С(=O)-Z-R14, представленный символомR2, где Z представляет О или S и R14 отличен от водорода, можно успешно получить путем осуществления взаимодействия соединения формулы (XXI), содержащего соответствующий фрагмент -C(=O)-Z-H, с подходящим реагентом формулы (XXII), где W2 представляет подходящую уходящую группу, согласно следующей схеме: 39 Например, первый способ такого получения заключается в осуществлении взаимодействия соединения формулы (XXI), содержащего соответствующий фрагмент -С(=O)-Z-H, с галогенидом, предпочтительно бромидом, имеющим формулу Br-R14, в реакционно-инертном растворителе, таком как определенный выше, и в присутствии гидрокарбоната натрия. Указанную реакцию проводят при температуре ниже температуры кипения используемого растворителя и, например, в течение периода времени примерно от 2 до 18 ч, когда в качестве растворителя используют диметилформамид. Второй способ такого получения заключается в осуществлении взаимодействия соединения формулыR14-OH, в реакционно-инертном растворителе,таком как определенный выше, и в присутствии 1,1'-карбонилбис-1 Н-имидазола, необязательно смешанного с 1,8-диаза-7-бицикло(5.4.0)ундеценом. При использовании метиленхлорида в качестве растворителя реакцию можно проводить при комнатной температуре в течение нескольких часов. Настоящее изобретение касается также новых соединений формулы: где R20 и R21 независимо выбраны каждый из водорода или C1-20 алкила или R20 и R21, взятые вместе с углеродным атомом, к которому они присоединены, образуют циклоалкильный радикал. Указанные новые соединения пригодны для получения соединений формулы (I), когдаHet5 представляет пиперазин, замещенный сульфонамидо. Указанные промежуточные соединения формулы (XXIII) могут быть получены путем осуществления взаимодействия N,Nдиметил-1-пиперазинсульфонамида с оксидом алкилена в реакционно-инертном растворителе,таком как метанол и/или метиленхлорид. Подходящие оксиды алкилена для этой цели включают, например, оксид этилена, оксид пропилена, оксид 1,2-бутилена, оксид циклогексилена и тому подобное. Настоящее изобретение касается также новых соединений формул которые являются промежуточными соединениями, пригодными для получения некоторых из соединений формулы (I). Соединения формулы (I) могут быть также преобразованы в соответствующие N-оксидные формы известными в данной области методами преобразования трехвалентного азота в его N 004740 40 оксидную форму. Указанная реакция Nокисления может быть проведена путем осуществления взаимодействия исходного соединения формулы (I) с 3-фенил-2-(фенилсульфонил) оксазиридином или с подходящим органическим или неорганическим пероксидом. Подходящие неорганические пероксиды включают, например, пероксид водорода, пероксиды щелочных или щелочно-земельных металлов, например пероксид натрия, пероксид калия; подходящие органические пероксиды могут включать перкислоты, такие как, например, бензолкарбоперкислота или галогензамещенная бензолкарбоперкислота, например 3-хлорбензолкарбоперкислота, пералкановые кислоты, например перуксусная кислота, алкилгидропероксиды,например трет-бутилгидропероксид. Подходящими растворителями являются, например, вода, низшие алканолы, например этанол и тому подобное, углеводороды, например толуол, кетоны, например 2-бутанон, галогенированные углеводороды, например дихлорметан, и смеси указанных растворителей. Применяя известные в данной области методы, можно получить чистые стереохимически изомерные формы соединений формулы (I). Диастереомеры можно разделить физическими методами, такими как селективная кристаллизация и хроматографические методы, например,противоточное распределение, жидкостная хроматография и тому подобное. Некоторые из соединений формулы (I) и некоторые из промежуточных соединений по настоящему изобретению могут содержать асимметрический углеродный атом. Применяя известные в данной области методы, можно получить чистые стереохимически изомерные формы указанных соединений и промежуточных соединений. Например, диастереомеры можно разделить физическими методами, такими как селективная кристаллизация и хроматографические методы, например, противоточное распределение, жидкостная хроматография и подобные методы. Энантиомеры можно получить из рацемических смесей, сначала преобразуя указанные рацемические смеси подходящими средствами разделения, такими как, например, хиральные кислоты, в смеси диастереомерных солей или соединений, а затем физически разделяя указанные смеси диастереомерных солей или соединений путем, например, селективной кристаллизации или хроматографическими методами, например, жидкостной хроматографией и подобными методами, и наконец преобразуя указанные разделенные диастереомерные соли или соединения в соответствующие энантиомеры. Чистые стереохимически изомерные формы можно также получить из чистых стереохимически изомерных форм подходящих промежуточных соединений и исходных материалов при условии, что реакции вмешательства происходят стереорегулярно. 41 Альтернативный способ разделения энантиомерных форм соединений формулы (I) и промежуточных соединений заключается в жидкостной хроматографии, в частности в жидкостной хроматографии с использованием хиральной неподвижной фазы. Некоторые из промежуточных соединений и исходные материалы, используемые в описанных выше процессах, являются известными соединениями и могут быть коммерчески доступны или могут быть получены известными в данной области методами. ИЛ-5, известный также как эозинофильный дифференцирующий фактор (EDF) или эозинофильный колониестимулирующий фактор(Eo-CSF) является основным фактором продолжительности существования и дифференцировки эозинофилов и потому, как полагают, является главным участником при инфильтрации эозинофилов в ткани. Существуют вполне достаточные доказательства, что приток эозинофилов является важным патогенным событием при бронхиальной астме и аллергических заболеваниях, таких как хейлит, синдром раздраженного кишечника, экзема, крапивница, васкулит, вульвит, винтерфит, атопический дерматит, поллиноз, аллергический ринит и аллергический конъюнктивит; и других воспалительных заболеваниях, таких как эозинофильный синдром,аллергический ангиит, эозинофильный фасцит,эозинофильная пневмония, PIE синдром, идиопатическая эозинофилия, эозинофильная миалгия, болезнь Крона, язвенный колит и подобные заболевания. Соединения по настоящему изобретению также ингибируют продукцию других хемокинов, таких как моноцитарный хемотакси-ческий белок-1 и -3 (МСР-1 и МСР-3). Известно, что МСР-1 притягивает как Т-клетки, в которых в основном происходит выработка ИЛ-5, так и моноциты, которые, как известно, действуют синергически с эозинофилами (Carr et al. , 1994,Immunology, 91, 3652-3656). МСР-3 также играет, как известно, главную роль в аллергическом воспалении, мобилизуя и активируя базофильные и эозинофильные лейкоциты (Baggiolini etal., 1994, Immunology Today, 15(3), 127-133). Соединения по настоящему изобретению не оказывают никакого эффекта или оказывают незначительный эффект на продукцию других хемокинов, таких, как ИЛ-1, ИЛ-2, ИЛ-3, ИЛ-4,ИЛ-6, ИЛ-10, -интерферон (IFN-) и гранулоцитано-макрофагальный колониестимулирующий фактор (GM-CSF), что указывает на то, что предлагаемые ингибиторы ИЛ-5 не являются иммуносупрессорами широкого спектра действия. Избирательный ингибирующий эффект на хемокины соединений по настоящему изобретению можно продемонстрировать путем определения in vitro содержания хемокинов в крови человека. Наблюдения in vivo, такие как инги 004740Ascaris, снижение продукции сыворточного белка ИЛ-5 и экспрессии мРНК селезеночного ИЛ-5, вызываемой антителом анти-СD-3 у мышей, и ингибирование вызванного аллергеном или Sephadex легочного притока эозинофилов у морской свинки, свидетельствуют о полезности предлагаемых соединений в лечении эозинофилзависимых воспалительных заболеваний. Предлагаемые ингибиторы продукции ИЛ 5 являются особенно подходящими для введения путем ингаляции. Промежуточные соединения формулы (ХIа) являются интересными промежуточными соединениями. Они не только особенно пригодны в качестве промежуточных соединений для получения соединений формулы (I), но и обладают ценной фармакологической активностью. Благодаря указанным выше фармакологическим свойствам соединения формулы (I) могут быть использованы в качестве лекарственного средства. В частности, предлагаемые соединения могут быть использованы для изготовления лекарственного средства для лечения эозинофилзависимых воспалительных заболеваний, указанных выше, а более конкретно бронхиальной астмы, атопического дерматита,аллергического ринита и аллергического конъюнктивита. Ввиду полезности соединений формулы (I) предлагается способ лечения теплокровных животных, включая людей, страдающих эозинофилзависимыми воспалительными заболеваниями, в частности бронхиальной астмой, атопическим дерматитом, аллергическим ринитом и аллергическим конъюнктивитом. Указанный способ заключается в системном или местном введении эффективного количества соединения формулы (I), его N-оксидной формы, фармацевтически приемлемой аддитивной соли или возможной стереомерной формы теплокровным животным, включая людей. В соответствии с настоящим изобретением предлагаются также композиции для лечения эозинофилзависимых воспалительных заболеваний, содержащие терапевтически эффективное количество соединения формулы (I) и фармацевтически приемлемый носитель или разбавитель. Для получения фармацевтических композиций по настоящему изобретению терапевтически эффективное количество определенного соединения в основной форме или в форме аддитивной соли в качестве активного компонента хорошо смешивают с фармацевтически приемлемым носителем в самой разной форме в зависимости от необходимой для введения формы препарата. Указанные фармацевтические композиции желательно использовать в дозированной лекарственной форме, пригодной, предпочтительно, для системного введения, такого, как 43 парентеральное введение, или местного введения, такого как введение путем ингаляции,впрыскивания в нос или тому подобного. Указанные композиции можно применять в виде аэрозоля, например, распыляемого пропеллентом, таким как азот, диоксид углерода, фреон,или без пропеллента с использованием насоса,капель, лосьонов или полутвердой композиции,такой как загущенная композиция, которая может быть нанесена тампоном. В частности,удобны для применения такие полутвердые композиции, как кремы, желе, мази и тому подобное. Особенно удобно изготавливать указанные фармацевтические композиции в виде дозированной лекарственной формы для облегчения введения и единообразия дозирования. Термин дозированная лекарственная форма при использовании в данном описании и в пунктах формулы изобретения относится к физически раздельным единичным формам, пригодным для применения в виде разовых доз, причем каждая единичная форма содержит заданное количество активного компонента, рассчитанное для создания требуемого терапевтического эффекта,в сочетании с требуемым фармацевтическим носителем. Примерами таких дозированных лекарственных форм являются таблетки (включая таблетки с бороздками или с покрытием),капсулы, пилюли, пакетики с порошком, облатки, растворы или суспензии для инъекции, полные чайные ложки, полные столовые ложки и тому подобное, и их отделнные кратные величины. Чтобы повысить растворимость и/или стабильность соединений формулы (I) в фармацевтических композициях, может быть целесообразным использовать -, - или -циклодекстрины или их производные. Повысить растворимость и/или стабильность соединений формулы(I) в фармацевтических композициях могут так же сорастворители, такие как спирты. Очевидно, что для получения водных композиций более подходящими являются аддитивные соли предлагаемых соединений вследствие их повышенной растворимости в воде. Подходящими циклодекстринами являются -, - или -циклодекстрины или их простые эфиры и смешанные простые эфиры, в которых одна или несколько гидроксигрупп ангидроглюкозных звеньев циклодекстрина являются замещенными C1-6 алкилом, в частности метилом, этилом или изопропилом, например, неупорядоченно метилированный -ЦД; гидроксиС 1-6 алкилом, в частности гидроксиэтилом,гидроксипропилом или гидроксибутилом; карбокси-С 1-6 алкилом, в частности карбоксиметилом или карбоксиэтилом; C1-6 алкилкарбонилом,в частности ацетилом; C1-6 алкилоксикарбонилС 1-6 алкилом или карбоксиС 1-6 алкилокси С 1-6 алкилом, в частности карбоксиметоксипро 004740 44 пилом или карбоксиэтоксипропилом; C1-6 алкилкарбонилоксиС 1-6 алкилом, в частности, 2 ацетилоксипропилом. Особенно примечательными как комплексообразователи и/или солюбилизаторы являются -ЦД, неупорядоченно метилированный -ЦД, 2,6-диметилЦД, 2 гидроксиэтилЦД, 2-гидроксиэтилЦД, 2 гидроксипропилЦД и (2-карбоксиметокси) пропилЦД и особенно 2-гидроксипропил-ЦД (2-НРЦД). Термин смешанный простой эфир означает производные циклодекстрина, в которых,по крайней мере, две гидрокси группы циклодекстрина этерифицированы разными группами,такими как, например, гидроксипропил и гидроксиэтил. Среднее молярное замещение (M.S.) используют как меру среднего числа моль структурных единиц алкокси на моль ангидроглюкозы. Значение M.S. может быть определено различными методами анализа, предпочтительно измерено с помощью масс-спектрометра,и находится в пределах от 0,125 до 10. Средняя степень замещения (D.S) относится к среднему числу замещенных гидроксилов на единицу ангидроглюкозы. Значение D.S. может быть определено различными методами анализа, предпочтительно измерено с помощью масс-спектрометра, и находится в пределах от 0,125 до 3. Благодаря их высокой степени избирательности как ингибиторов ИЛ-5 соединения формулы (I), определенные выше, пригодны также для маркировки или идентификации рецепторов. Для этой цели соединения по настоящему изобретению нужно метить, в частности,заменяя, частично или полностью, один или несколько атомов в молекуле их радиоактивными изотопами. Примерами интересных меченых соединений являются те соединения, которые имеют, по крайней мере, один галоген, представляющий собой радиоактивный изотоп иода,брома или фтора, или те соединения, которые имеют, по крайней мере, один атом 11 С или атом трития. Одна конкретная группа состоит из тех соединений формулы (I), в которых R1 представляет радиоактивный атом галогена. В принципе,любое соединение формулы (I), содержащее атом галогена, годится для мечения радиоизотопом путем замены атома галогена любым подходящим изотопом. Подходящими галогенными дио-изотопами для этой цели являются радиоактивные иодиды, например, 122I, 123I, 125I,131I, радиоактивные бромиды, например, 75 Вr,76 Вr, 77Br и 82Br, и радиоактивные фториды, например, 18F. Введение радиоактивного атома галогена может быть осуществлено с использованием подходящей реакции, обмена или любой из описанных ниже процедур получения галогенных производных формулы (I). 45 Другим интересным видом мечения радиоактивным изотопом является замещение углеродного атома 11C-атомом или замещение атома водорода атомом трития. Таким образом, указанные меченые радиоизотопом соединения формулы (I) могут быть использованы в процессе, в частности, маркировки рецепторных участков в биологическом материале. Указанный процесс содержит стадии(а) радиоизотопного мечения соединения формулы (I), (b) введения указанного меченого соединения в биологический материал и затем (с) обнаружения эмиссии от меченого соединения. Термин биологический материал означает любой вид материала, который имеет биологическое происхождение. Более конкретно этот термин относится к образцам тканей, плазме или жидкостям организма, а также к животным, в частности теплокровным животным, или частям животных, таким как органы. Меченые радиоизотопами соединения формулы (I) полезны также как средства для рентгеноскопического исследования того, способно ли испытуемое соединение занимать определенный рецепторный участок или связываться с ним. Степень, в которой испытуемое соединение будет вытеснять соединение формулы (I) с такого конкретного рецепторного участка, будет показывать способность испытуемого соединения действовать как агонист, антагонист или смешанный агонист/антагонист указанного рецептора. При использовании в исследовании in vivo меченые радиоизотопом соединения вводят в подходящей композиции животному и обнаруживают местонахождение указанных меченых соединений, используя методы визуализации,такие как, например, одиночных фотонов эмиссионная компьютерная томография (SPECT) или позитронная эмиссионная томография(PET) и тому подобное. Указанным образом можно обнаруживать распределение конкретных рецепторных участков по всему организму и можно визуализировать органы, содержащие указанные рецепторные участки, пользуясь указанными выше методами визуализации. Указанный способ визуализации органа путем введения меченого радиоизотопом соединения формулы (I) и обнаружения эмиссии от радиоактивного соединения тоже составляет часть настоящего изобретения. В общем, предполагается, что терапевтически эффективное суточное количество будет составлять от 0,01 мг/кг до 50 мг/кг массы тела,в частности от 0,05 мг/кг до 10 мг/кг массы тела. Способ лечения может также включать введение активного компонента по схеме два или четыре приема в сутки. Экспериментальная часть В описанных ниже примерах "DMSO" означает диметилсульфоксид (ДМСО), "RT" означает комнатную температуру, "DMF" означаетN,N-диметилформамид (ДМФ) , "EtOAc" означает этилацетат, "DIPE" означает диизопропиловый эфир (ДИПЭ) и "THF" означает тетрагидрофуран (ТГФ). А. Получение промежуточных соединений. Пример А 1. а) Смесь 2-хлорпропионитрила (0,2 моль) и 1,3-дихлор-5-нитробензола (0,2 моль) в ДМСО(50 мл) добавляли по каплям при комнатной температуре к раствору NaOH (1 моль) в ДМСО(150 мл), поддерживая при этом температуру ниже 30 С. Смесь перемешивали при комнатной температуре в течение 1 ч, затем выливали на лед и подкисляли НСl. Осадок отфильтровывали, промывали Н 2 О и растворяли в CH2Cl2. Органический раствор промывали H2O, сушили,фильтровали и выпаривали растворитель. Остаток очищали колоночной хроматографией на силикагеле= 70/30). Собирали чистые фракции и выпаривали растворитель, получив в результате 19,5 г (40%)b) NaH 80% (0,0918 моль) добавляли порциями при 0 С в потоке N2 к раствору промежуточного соединения (1) (0,0612 моль) в ДМФ(100 мл). Смесь перемешивали при 0 С в потокеN2 в течение 1 ч. Добавляли по каплям при 0 С СН 3I (0,0918 моль). Смесь перемешивали при 50 С в течение 12 ч, затем выливали на лед и экстрагировали EtOAc. Органический слой отделяли, промывали H2O, сушили, фильтровали и выпаривали из него растворитель с получением 17,1 г 2,6-дихлор-,-диметил-4-нитробензолацетонитрила (промежуточное соединение 2).c) Смесь промежуточного соединения (2)(0,066 моль) в СН 3 ОН (200 мл) гидрировали при комнатной температуре при давлении 3 бар (200 кПа) в течение 1 ч с использованием никеля Ренея (15 г) в качестве катализатора. После поглощения Н 2 катализатор отфильтровывали через целит, промывали СН 3 ОН и фильтрат выпаривали с получением 17,1 г 4-амино-2,6-дихлор,-диметил-бензолацетонитрила (промежуточное соединение 3). Пример А 2. Раствор NaNO2 (0,36 моль) в H2O (50 мл) добавляли к раствору промежуточного соединения (3) (0,34 моль) в уксусной кислоте (700 мл) и HCl (102 мл) и перемешивали при 10 С. Реакционную смесь перемешивали 80 мин при 10 С. Добавляли порошкообразную смесь ацетата натрия (1,02 моль) и диэтил(1,3-диоксо-1,3 пропандиил)бискарбамата (0,374 моль) и реакционную смесь перемешивали 40 мин. Реакционную смесь выливали на раздробленный лед. Осадок отфильтровывали, промывали водой,растворяли в СН 2 Сl2 и разделяли слои. Органический слой сушили, фильтровали и выпаривали из него растворитель с получением 138,5 гb) Раствор промежуточного соединения (4)(0,28 моль) и ацетата калия (0,28 моль) в уксусной кислоте (1000 мл) перемешивали и нагревали с обратным холодильником в течение 3 ч. Реакционную смесь, содержавшую этил 2-[3,5-дихлор-4-(1-циано-1-метилэтил)фенил]2,3,4,5-тетрагидро-3,5-диоксо-1,2,4-триазин-6 ил]карбонил]карбамат (промежуточное соединение 5) использовали как таковую на следующей стадии.c) Промежуточное соединение (5) (неочищенная реакционная смесь) обрабатывали НСl 36% (0,84 моль). Реакционную смесь перемешивали и нагревали с обратным холодильником в течение 4 ч, после чего перемешивали при комнатной температуре с субботы до понедельника. Реакционную смесь выливали на раздробленный лед и полученную смесь экстрагировали СН 2 Сl2. Отделенный органический слой сушили, фильтровали и выпаривали из него растворитель с получением 111,6 г 2-[3,5-дихлор-4-(1 циано-1-метилэтил)фенил]-2,3,4,5-тетрагидро 3,5-диоксо-1,2,4-триазин-6-карбоновой кислоты(6) (0,28 моль) в меркаптоуксусной кислоте (250 мл) перемешивали 4 ч при 100 С, после чего давали ей остыть до комнатной температуры и перемешивали в течение ночи. Реакционную смесь выливали на раздробленный лед и полученную смесь экстрагировали CH2Cl2. Отделенный органический слой сушили, фильтровали и выпаривали из него растворитель. Добавляли толуол и смесь азеотропировали на роторном испарителе. Остаток очищали хроматографией на короткой колонке с силикагелем (элюент: СН 2 Сl2/СН 3 ОН 98/2). Чистые фракции собирали и выпаривали растворитель. Остаток перемешивали в ДИПЭ, отфильтровывали, промывали ДИПЭ и затем высушивали с получением 36,8e) Раствор промежуточного соединения (7)(0,315 моль) в пиридине (500 мл) перемешивали и нагревали до 80 С. Через этот раствор барботировали Н 2S в течение 24 ч при 80 С. Прекращали ввод газообразного Н 2S и реакционную смесь перемешивали с субботы до понедельника при комнатной температуре. Выпаривали растворитель. Добавляли 500 мл смеси (9:1) СН 2 Сl2/СН 3 ОН, после чего полученную смесь вливали в 2 н. HCl (1000 мл) при 0 С и перемешивали 10 мин. Осадок отфильтровывали и высушивали, получив в результате 23,2 г (64%) 2,6-дихлор-4-(4,5-дигидро-3,5-диоксо 004740 1,2,4)триазин-2(3H)-ил-,-диметилбензолэтантиоамида (промежуточное соединение 8). Пример A3. В атмосфере азота раствор промежуточного соединения (8) (0,0125 моль) и соединения формулы(0,0157 моль) в этаноле (60 мл) и ДМФ (30 мл; высушен над молекулярными ситами) перемешивали 6,5 ч при 60 С, а затем в течение ночи при комнатной температуре. Выпаривали растворитель. Остаток растворяли в воде (100 мл) и полученную смесь экстрагировали CH2Cl2 (100 мл). Отделенный органический слой сушили(МgSO4), фильтровали и выпаривали из него растворитель, после чего выпаривали совместно с толуолом. Остаток (13 г) очищали флашхроматографией на силикагеле (элюент: СН 2 Сl2/СН 3 ОН 100/0, затем 99/1 и в конце 98/2). Требуемые фракции собирали и выпаривали растворитель. Добавляли толуол и смесь азеотропировали на роторном испарителе. Остаток(6,5 г) кристаллизовали из CH3CN. Осадок отфильтровывали, промывали СН 3 СN и ДИПЭ и затем высушивали в вакууме при 50 С с получением 3,17 г (46,5%) этил-2-[1-[2,6-дихлор-4(4,5-дигидро-3,5-диоксо-1,2,4-триазин-2(3 Н)ил)фенил]-1-метилэтил]-4-фенил-5-тиазолацетата (промежуточное соединение 9), имеющего точку плавления 148 С. Пример А 4. Смесь промежуточного соединения (9)(0,00183 моль) 1 н. NaOH (0,0055 моль) в СН 3 ОН (25 мл) и ТГФ (25 мл) перемешивали в течение ночи при комнатной температуре. Реакционную смесь подкисляли 1 н. НСl (8 мл) и полученный продукт растворяли в EtOAc. Органический слой промывали рассолом, сушили,фильтровали и выпаривали из него растворитель. Остаток кристаллизовали из СН 3 СN. Осадок отфильтровывали, промывали ДИПЭ и высушивали с получением 0,8 г (79%) 2-[1-[2,6 дихлор-4-(4,5-дигидро-3,5-диоксо-1,2,4-триазин 2(3H)-ил)фенил]-1-метилэтил]-4-фенил-5 тиазолуксусной кислоты (промежуточное соединение 10). Пример А 5. Сначала раствор брома (0,02 моль) вCH2Cl2 (20 мл) добавляли по каплям при 10 С в потоке азота к смеси соединения, имеющего формулу(0,0227 моль) в CH2Cl2 (50 мл). Смесь перемешивали при 10 С в течение 1 ч. ДобавлялиH2O и твердый К 2 СО 3. Органический слой отделяли, сушили (MgSO4), фильтровали и выпаривали из него растворитель. Реакцию осуществляли 4 раза, используя одинаковые количества и-бромоксобензолпропаноата. Смесь промежуточного соединения (8) (0,0119 моль), 1,1-диметилэтил бромоксобензолпропаноата (0,0137 моль) и К 2 СО 3 (0,0357 моль) в СН 2 СN (55 мл) перемешивали при комнатной температуре в течение 3,5 ч. Добавляли лед и EtOAc. Смесь подкисляли 3 н. HCl. Органический слой отделяли, сушили (MgSO4), фильтровали и выпаривали из него растворитель. Продукт использовали без дальнейшей очистки, получив 8 г промежуточного соединения 11, имеющего формулу Пример А 6. Промежуточное соединение (11) (0,0119 моль) и трет-бутанол (24 г) перемешивали и нагревали с обратным холодильником в течение 2 ч. Смесь доводили до комнатной температуры. Выпаривали растворитель. Остаток растворяли в CH2Cl2. Органический раствор промывалиH2O, сушили (МgSO4), фильтровали и выпаривали из него растворитель. Остаток (7,8 г) очищали колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/СН 3 ОН 99/1; 15-40 мкм). Две фракции собирали и выпаривали из них растворители, получив в результате 2,66 г (фракция 1) и 0,7 г (фракция 2) соответственно. Фракцию 2 очищали колоночной хроматографией (элюент: СН 3 ОН/NH4Oас, 0,5%, 80/20; колонка: HYPERSIL С 18, 3 мкм). Чистые фракции собирали и выпаривали растворитель с получением 0,45 г промежуточного соединения 12, имеющего точку плавления 130 С и представленного формулой Пример А 7. Промежуточное соединение 12 (0,00465 моль) добавляли порциями при 0 С-10 С к трифторуксусной кислоте (35 мл). Смесь перемешивали при комнатной температуре в течение 3 ч и вливали в H2O. Осадок отфильтровывали,промывали Н 2 О и растворяли в CH2Cl2. Органический слой отделяли, сушили (MgSO4), фильтровали и выпаривали из него растворитель. Остаток (2,4 г) очищали колоночной хроматографией на силикагеле(элюент: СН 2 Сl2/СН 3 ОН/NH4OН 97/3/0,2; 15-40 мкм). Чистые фракции собирали и выпаривали растворитель. Остаток кристаллизовали из СН 3 СN. Осадок отфильтровывали и высушивали с получением 1,16 г промежуточного соединения 13, 004740 50 имеющего точку плавления 232 С и представленного формулой(0,0159 моль) добавляли порциями при комнатной температуре в потоке азота к раствору промежуточного соединения (13) (0,00795 моль) в ДМФ(60 мл). Смесь перемешивали при комнатной температуре в течение ночи. Через смесь барботировали H2S в течение 1 ч. Смесь перемешивали 1 ч при комнатной температуре, вливали в насыщенный раствор NaCl и дважды экстрагировали CH2Cl2. Объединенный органический слой сушили (MgSO4), фильтровали и выпаривали из него растворитель. Полученное промежуточное соединение 14, представленное формулой использовали без дальнейшей очистки. Пример А 9. Смесь промежуточного соединения (8)(0,0237 моль) в этаноле (60 мл) и ДМФ (40 мл) перемешивали при 60 С в течение 4 ч. Выпаривали растворитель. Добавляли EtOAc. Органический раствор промывали 3 раза Н 2O, сушили(MgSO4), фильтровали и выпаривали из него растворитель. Остаток (11,2 г) очищали колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/СН 3 ОН 98/2; 15-40 мкм). Требуемые фракции собирали и выпаривали растворитель с получением 4,2 г (47%) продукта, часть которого (1,5 г) кристаллизовали из петролейного эфира и ДИПЭ. Осадок отфильтровывали и высушивали с получением 1,15 г промежуточного соединения 15, имеющего точку плавления 126 С и представленного формулой Пример А 10. Смесь промежуточного соединения (15)(30 мл) и ТГФ (30 мл) перемешивали при комнатной температуре в течение 12 ч, выливали на лед, подкисляли НСl и экстрагировали EtOAc. 51 Органический слой отделяли, сушили (MgSO4),фильтровали и выпаривали из него растворитель. Остаток (2,2 г) очищали колоночной хроматографией на силикагелеCH2Cl2/CH3OH/NH4OH 95/5/0,1; 15-40 мкм). Чистые фракции собирали и выпаривали растворитель с получением 1,5 г (64%) продукта,часть которого (1 г) кристаллизовали из диэтилового эфира. Осадок отфильтровывали и высушивали с получением 0,5 г промежуточного соединения 16, имеющего точку плавления 192 С и представленного формулойa) NaOCH3 30% (0,592 моль) добавляли к раствору гидроксиламингидрохлорида (0,1085 моль) в СН 3 ОН (200 мл) и смесь перемешивали при комнатной температуре. Смесь перемешивали 10 мин. Промежуточное соединение (3)(0,0542 моль) добавляли порциями и полученную реакционную смесь перемешивали и нагревали с обратным холодильником в течение ночи. Выпаривали растворитель. Остаток распределяли между CH2Cl2 и водой. Органический слой отделяли, сушили, фильтровали и выпаривали из него растворитель. Остаток перемешивали в ДИПЭ, отфильтровывали, промывали ДИПЭ и высушивали с получением 3,7 г (26%) 4-амино-2,6-дихлор-N'-гидрокси-,-диметилбензолэтанимидамида (промежуточное соединение 17).N,N-бис(метилэтил)этанамина (0,0339 моль) в CH2Cl2 (190 мл) перемешивали при 15 С. Добавляли по каплям раствор 2-метилбензоилхлорида (0,0323 моль) вCH2Cl2 (10 мл) и полученную реакционную смесь перемешивали один час. Добавляли воду. Органический слой отделяли, сушили, фильтровали и выпаривали из него растворитель. Добавляли толуол и смесь азеотропировали на роторном испарителе с получением 13,0 г [1 амино-2-(4-амино-2,6-дихлорфенил)-2 метилпропилиденил]амино-2-метилбензоата(18) (0,0323 моль) и паратолуолсульфоновой кислоты (0,0323 моль) в ДМСО (100 мл) перемешивали 30 мин при 150 С. Реакционную смесь охлаждали. Добавляли воду и полученную смесь экстрагировали толуолом. Отделенный органический слой сушили, фильтровали и выпаривали из него растворитель. Остаток очищали на короткой колонке хроматографией на силикагеле (элюент: CH2Cl2). Требуемые фракции собирали и выпаривали растворитель. Концентрат выпаривали совместно с EtOAc, полу 004740(0,0906 моль) в уксусной кислоте (100 мл) перемешивали при 0 С. Добавляли по каплям при 0 С раствор NaNO2 (0,032 моль) в воде (10 мл). Реакционную смесь перемешивали 1 ч при 0 С. Добавляли порциями порошкообразную смесь ацетата натрия (0,0906 моль) и диэтил(1,3 диоксо-1,3-пропандиил)бискарбамата 0,0332 моль). Смеси давали согреться до комнатной температуры и перемешивали в течение 1 ч. Добавляли воду и полученную смесь экстрагировали CH2Cl2. Отделенный органический слой сушили, фильтровали и выпаривали из него растворитель с получением диэтил N,N'-[2-3,5 дихлор-4-[1-[5-(2-метилфенил)-1,2,4 оксадиазол-3-ил]-1-метилэтил]фенил] гидразоно]-1,3-диоксо-1,3-пропандиил]дикарбамата(20) (0,0302 моль) и ацетата натрия (0,0302 моль) в уксусной кислоте (200 мл) перемешивали и нагревали с обратным холодильником в течение 3 ч. Реакционную смесь вливали в воду и полученную смесь экстрагировали CH2Cl2. Отделенный органический слой сушили, фильтровали и выпаривали из него растворитель. Добавляли толуол и смесь азеотропировали на роторном испарителе с получением этил-2-[3,5 дихлор-4-[1-[5-(2-метилфенил)-1,2,4 оксадиазол-3-ил]-1-метилэтил]фенил]-2,3,4,5 тетрагидро-3,5-диоксо-1,2,4-триазин-6 ил]карбонил]карбамата (промежуточное соединение 21).f) Смесь промежуточного соединения (21)(0,0302 моль) в HCl 36% (10 мл) и уксусной кислоте (200 мл) перемешивали и нагревали с обратным холодильником в течение ночи. Реакционную смесь выливали на раздробленный лед и полученную смесь экстрагировали CH2Cl2. Отделенный органический слой сушили, фильтровали и выпаривали из него растворитель с получением 16,3 г 2-[3,5-дихлор-4-[1-[5-(2-метилфенил)-1,2,4-оксадиазол-3-ил]-1-метилэтил]фенил]-2,3,4,5-тетрагидро-3,5-диоксо-1,2,4-триазин-6-карбоновой кислоты (промежуточное соединение 22). Пример А 12. Смесь промежуточного соединения (22)(0,0133 моль) в меркаптоуксусной кислоте (7 мл) перемешивали при 175 С в течение 2 ч. Смесь охлаждали, вливали в ледяную воду,подщелачивали К 2 СО 3 и экстрагировали EtOAc. Органический слой отделяли, промывали Н 2 О,сушили, фильтровали и выпаривали из него растворитель. Остаток очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH 99/1). Чистые фракции собирали и вы 53 паривали растворитель с получением 2,2 г (36%) промежуточного соединения 23, представленного формулой Пример А 13. Смесь промежуточного соединения (23)(0,0011 моль) 1-бром-2,5-пирролиндиона (0,0011 моль) и дибензоилпероксида (каталитическое количество) в ССl4 (30 мл) перемешивали и нагревали с обратным холодильником в течение 3 ч. Давали смеси остыть до комнатной температуры. Смесь фильтровали через диатомовую землю, коммерчески доступную под торговым знаком Дикалит (Dicalite), при этом фильтрат содержал 2-[4-[1-[5-[2-(бромметил) фенил]1,2,4-оксадиазол-3-ил]-1-метилэтил]-3,5 дихлорфенил]-1,2,4-триазин-3,5(2 Н, 4 Н)-дион(промежуточное соединение 24). Пример А 14. Раствор промежуточного соединения (24)(0,017 моль) и KCN (0,034 моль) в этаноле (100 мл) и H2O (30 мл) перемешивали 8 часов при 60 С. Выпаривали при пониженном давлении растворитель. Остаток растворяли в CH2Cl2,затем промывали водой, сушили (МgSO4),фильтровали и выпаривали из него растворитель с получением 8,2 г промежуточного соединения 25, представленного формулой Пример А 15. Раствор промежуточного соединения (25)(0,017 моль) в НОАс (50 мл) перемешивали и нагревали с обратным холодильником в течение 2 ч. Реакционную смесь выливали в ледяную воду и полученный осадок отфильтровывали,промывали и затем растворяли в CH2Cl2. Органический раствор сушили, фильтровали и выпаривали из него растворитель. Остаток очищали на силикагеле на стеклянном фильтре (элюент:CH2Cl2/CH3OH 95/5). Требуемые фракции собирали и выпаривали растворитель. Остаток очищали высокоэффективной жидкостной хроматографией на RP BDS Нуреrprep С 18 (100 А, 8 мкм; градиентное элюирование (0,5% NH4OAc в водe/CH3CN 90/10) /СН 3 ОН/СН 3 СN). Чистые фракции собирали и выпаривали растворитель. Остаток перемешивали в гексане, отфильтровывали и высушивали в вакууме при 60 С с получением 0,084 г промежуточного соединения 26,представленного формулой 54 Пример А 16. Раствор промежуточного соединения (26)(0/0014 моль) в SOCl2 (15 мл) перемешивали и нагревали с обратным холодильником в течение 1 ч. Выпаривали при пониженном давленииSOCl2. Добавляли толуол и смесь азеотропировали на роторном испарителе с получением 100% промежуточного соединения 27, представленного формулой В. Получение целевых соединений Пример В 1. Смесь 3-бромдигидро-2(3H)-фуранона(0,0081 моль) в ДМФ (16 мл) добавляли по каплям при комнатной температуре к смеси промежуточного соединения (10) (0,00773 моль) иNaHCO3 (0,0081 моль) в ДМФ (30 мл). Смесь перемешивали при 70 С в течение 5 ч и доводили до комнатной температуры. Добавляли H2O и насыщенный раствор NaCl. Смесь экстрагировали EtOAc. Органический слой отделяли, сушили (МgSO4), фильтровали и выпаривали из него растворитель. Остаток (5 г) очищали колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/СН 3 ОН 98/2; 15-40 мкм). Чистые фракции собирали и выпаривали растворитель. Остаток растворяли в ДИПЭ. Осадок отфильтровывали и высушивали с получением 1,24 г соединения 1, имеющего точку плавления 72 С и представленного формулой Пример В 2. Раствор 1-бромпентадекана (0,0051 моль) в ДМФ (18 мл) добавляли по каплям при комнатной температуре к смеси промежуточного соединения (10) (0,00483 моль) и NаНСО 3 (0,0051 моль) в ДМФ (10 мл). Смесь перемешивали при 70 С в течение 5 ч и при 45 С в течение ночи,после чего доводили ее до комнатной температуры. Добавляли Н 2O и NaCl. Смесь экстрагировали EtOAc. Органический слой отделяли,промывали насыщенным раствором NaCl, сушили (МgSO4), фильтровали и выпаривали из него растворитель. Остаток (3,8 г) очищали колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/СН 3 ОН 98/2; 15-40 мкм). Чистые фракции собирали и выпаривали растворитель с получением 0,49 г соединения 2, имеющего точку плавления 80 С и представленного формулой(0,0073 моль) в ДМФ (12 мл) добавляли по каплям при комнатной температуре к смеси промежуточного соединения (13) (0,00695 моль) иNаНСО 3 (0,0073 моль) в ДМФ (22 мл). Смесь перемешивали при 70 С в течение 2,5 ч, доводили до комнатной температуры и вливали в Н 2 О. Осадок отфильтровывали и растворяли в СН 2 Сl2. Органический слой отделяли, промывали водой, сушили (MgSO4), фильтровали и выпаривали из него растворитель. Остаток (5,4 г) очищали колоночной хроматографией на силикагеле (элюент; СН 2 Сl2/СН 3 ОН 98/2; 15-40 мкм). Требуемые фракции собирали и выпаривали растворитель. Остаток кристаллизовали из СН 3 СN, диэтилового эфира и ДИПЭ. Осадок отфильтровывали и высушивали. Выход: 1,3 г. Эту фракцию перекристаллизовывали из смеси СН 3 СN, 2-пропанон и диэтиловый эфир. Осадок отфильтровывали и высушивали с получением 0,89 г соединения 3, имеющего точку плавления 208 С и представленного формулойNаНСО 3 (0,00835 моль) добавляли по каплям при 5 С в потоке азота к смеси промежуточного соединения (14) (0,00795 моль) в ДМФ(22 мл). Затем добавляли по каплям раствор 3 бромдигидро-2(3H)-фуранона (0,00835 моль) в ДМФ (12 мл). Смесь доводили до комнатной температуры и перемешивали при комнатной температуре в течение 30 мин, после чего вливали в воду и насыщенный раствор NaCl. Добавляли небольшое количество 3 н. HCl. Осадок отфильтровывали и растворяли в CH2Cl2. Органический слой отделяли, сушили (MgSO4),фильтровали и выпаривали из него растворитель. Остаток (5,1 г) очищали колоночной хроматографией на силикагеле(элюент: СН 2 Сl2/СН 3 ОН 98,5/1,5; 15-40 мкм). Чистые фракции собирали и выпаривали растворитель. Остаток кристаллизовали из смеси СН 3 СN, диэтиловый эфир и ДИПЭ. Осадок отфильтровывали и высушивали. Остаток перекристаллизовывали из смеси СН 3 СN, диэтиловый эфир и ДИПЭ. Осадок отфильтровывали и высушивали с получением 0,85 г соединения 4, имеющего точку плавления 212 С и представленного формулой(0,00172 моль) в ДМФ (5 мл) добавляли по каплям при комнатной температуре к смеси проме 004740NаНСО 3 (0,00172 моль) в ДМФ (5 мл). Смесь перемешивали при 70 С в течение 5 ч, вливали в воду и насыщенный раствор NaCl и экстрагировали EtOAc. Органический слой отделяли, промывали несколько раз водой, сушили (МgSO4),фильтровали и выпаривали из него растворитель. Остаток (1,2 г) очищали колоночной хроматографией на силикагелеCH2Cl2/CH3OH 98/2; 15-40 мкм). Требуемые фракции собирали и выпаривали растворитель. Остаток опять очищали колоночной хроматографией на силикагеле (элюент:СН 2 Сl2/2 пропанол 97/3; 15-40 мкм). Требуемые фракции собирали и выпаривали растворитель с получением 0,13 г соединения 5, имеющего точку плавления 110 С и представленного формулой Пример В 6. Раствор промежуточного соединения (27)(15 мл) перемешивали и нагревали с обратным холодильником в течение одного часа. Выпаривали при пониженном давлении растворитель. Остаток растворяли в CH2Cl2, промывали водой,сушили (МgSO4) фильтровали и выпаривали из него растворитель. Остаток очищали высокоэффективной жидкостной хроматографией на Hyperprep C18 (элюент:(0,5% NH4OAc в Н 2O/СН 3 СN 90/10)/СН 3 СN (0 мин) 80/20, (44 мин) 20/80, (57-61 мин) 0/100). Требуемые фракции собирали и выпаривали растворитель. Остаток перемешивали в гексане, отфильтровывали, промывали и высушивали в вакууме при 60 С с получением 0,059 г соединения 6, имеющего точку плавления 157 С и представленного формулой Пример В 7. Смесь промежуточного соединения (10)(0,00387 моль) и 1,1'-карбонилбис-1 Н-имидазола (0,0058 моль) в дихлорметане (40 мл) перемешивали при комнатной температуре в течение 90 мин, после чего добавляли циклогексилметанол (0,0058 моль). Смесь перемешивали при комнатной температуре в течение ночи,разбавляли СН 2 Сl2 и промывали два раза водным раствором NaCl. Органический слой отделяли, сушили (МgSO4), фильтровали и выпаривали из него растворитель. Остаток очищали колоночной хроматографией на силикагеле(элюент: CH2Cl2/EtOAc 50/50). Чистые фракции собирали и выпаривали растворитель. Остаток кристаллизовали из EtOAc. Осадок отфильтровывали, промывали ДИПЭ и высушивали при 50 С в течение ночи с получением 1,43 г соединения 7, имеющего молекулярную массу 613,5 и точку плавления 180 С и представленного формулой где R14 представляет циклогексилметил. Примеры В 8-В 53. В следующей ниже табл. 1 перечислены соединения формулы (Iа), которые были получены в соответствии с методикой примера В 7 с заменой циклогексилметанола на соответственный спирт, имеющий формулу R14OH. Для синтеза соединений 8, 15-18, 21-23, 27, 32-34, 40-42 и 44 количество дихлорметана увеличивали до 50 мл, а для соединения 53 - до 60 мл. Для синтеза соединения 51 дихлорметан заменяли на 45 мл ДМФ. В указанной таблице показаны также точка плавления (когда имеется) Т.пл. (выражена в С) и выход В (выражен в %) указанных соединений. Таблица 1(0,0044 моль) в ДМФ (2 мл) добавляли к смеси промежуточного соединения (13) (0,0044 моль) и NaHCO3 (0,0044 моль) в ДМФ (8 мл). Смесь перемешивали при 70 С в течение 6 ч, затем добавляли 0,0022 моль промежуточного соединения (13). Смесь опять перемешивали при 70 С 59 в течение ночи, затем вливали в воду, подкисляли HCl (3 н.), экстрагировали EtOAc и промывали водой. Органический слой отделяли, сушили,фильтровали и выпаривали из него растворитель. Остаток (3,9 г) очищали колоночной хроматографией на силикагеле (элюент:CH2Cl2/CH3OH 99/1; 15-40 мкм). Чистые фракции собирали и выпаривали растворитель. Остаток (1,2 г) кристаллизовали из СН 3 СN/ДИПЭ. Осадок отфильтровывали и высушивали с получением 0,57 г соединения 54, имевшего молекулярную массу 651,5, идентифицированного в табл. 2 ниже, где Т.пл. и В означают то же, что и табл. 1, и представленного формулой где R14 представляет Пример В 55. Смесь бром-1-фенил-2-этана (0,0065 моль),промежуточного соединения (13) (0,0050 моль) и NаНСО 3 (0,0050 моль) в ДМФ (10 мл) перемешивали при 70 С в течение 12 ч, затем выливали на лед, подкисляли НСl (3 н.) до рН 5, экстрагировали EtOAc и промывали несколько раз водой. Органический слой отделяли, сушили(MgSO4), фильтровали и выпаривали из него растворитель. Остаток (3,2 г) очищали колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/СН 3 ОН 99/1; 70-200 мкм). Чистые фракции собирали и выпаривали растворитель. Остаток (0,6 г) кристаллизовали из смеси диэтиловый эфир/ДИПЭ. Осадок отфильтровывали и высушивали с получением 0,42 г соединения 55 формулы (IB), имевшего молекулярную массу 607,5 и идентифицированного в табл. 2 ниже. Пример В 56. Смесь фенилбромметана (0,0065 моль),промежуточного соединения (13) (0,0050 моль) и NaHCO3 (0,0050 моль) в ДМФ (10 мл) перемешивали при 70 С в течение 12 ч, затем охлаждали и выливали на лед. Осадок отфильтровывали, промывали водой и выпаривали растворитель. Остаток растворяли в HCl (разбавленная),затем в воде. Органический слой отделяли, сушили (МgSO4), фильтровали и выпаривали из него растворитель. Остаток (3,0 г) очищали колоночной хроматографией на силикагеле (элюент:СН 2 Сl2/СН 3 ОН 99,5/0,5; 70-200 мкм). Чистые фракции собирали и выпаривали растворитель. Остаток (0,9 г) кристаллизовали из смеси диэтиловый эфир/ДИПЭ. Осадок отфильтровывали и высушивали с получением 0,51 г соединения 56 формулы (IB), имевшего молекулярную массу 593,5 и идентифицированного в табл. 2 ниже. Пример В 57. Смесь трет-бутилбромацетата (0,0060 моль), промежуточного соединения (13) (0,0050(MgSO4), фильтровали и выпаривали из него растворитель. Остаток (3,0 г) очищали колоночной хроматографией на силикагеле (элюент:CH2Cl2; 70-200 мкм). Две фракции собирали и выпаривали из них растворитель. Первую фракцию (0,9 г) кристаллизовали из ДИПЭ. Осадок отфильтровывали и высушивали с получением 0,53 г соединения 57 формулы (IB), имевшего молекулярную массу 617,5 и идентифицированного в табл. 2 ниже. Пример В 58. Смесь циклопропилбромметана (0,0040 моль) в ДМФ (10 мл) добавляли по каплям при комнатной температуре к смеси промежуточного соединения (13) (0,0040 моль) и NaHCO3(0,0040 моль) в ДМФ (10 мл). Смесь перемешивали при 70 С в течение 5 ч, выливали на лед,медленно нейтрализовали HCl (3 н.) и экстрагировали EtOAc и промывали водой. Органический слой отделяли, сушили (MgSO4), фильтровали и выпаривали из него растворитель. Остаток (2,8 г) очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/EtOAc 92/8; 15-40 мкм; CH3CN/NH4Ac 1%, 60/40, 10 мкм). Чистые фракции собирали и выпаривали растворитель с получением 0,34 г соединения 58 формулы (IB), имевшего молекулярную массу 557,5 и идентифицированного в табл. 2 ниже. Пример В 59. Смесь хлор-1-диметиламино-2-этана(10 мл) перемешивали при комнатной температуре в течение 30 мин. Добавляли порциями промежуточное соединение (13) (0,0050 моль). Смесь перемешивали при 70 С в течение ночи,охлаждали, вливали в воду и нейтрализовалиHCl (3 н.). Осадок отфильтровывали, промывали водой и растворяли в CH2Cl2. Органический слой отделяли, сушили (МgSO4), фильтровали и выпаривали из него растворитель. Остаток (2,4 г) очищали колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/СН 3 ОН 94/6; 15-40 мкм). Чистые фракции собирали и выпаривали растворитель с получением 0,58 г соединения 59, имевшего молекулярную массу 574,5 и идентифицированного в табл. 2 ниже. Пример В 60. Смесь 1-хлорэтилэтилкарбоната (0,0065 моль), промежуточного соединения (13) (0,0050 моль), NaHCO3 (0,0050 моль) и иодида калия
МПК / Метки
МПК: A61P 11/06, C07D 417/10, A61K 31/53
Метки: 6-азаурацила, производные, ингибирующие, интерлейкин-5
Код ссылки
<a href="https://eas.patents.su/30-4740-interlejjkin-5-ingibiruyushhie-proizvodnye-6-azauracila.html" rel="bookmark" title="База патентов Евразийского Союза">Интерлейкин-5 ингибирующие производные 6-азаурацила</a>
Следующий патент: Способ получения &alpha, &beta – ненасыщенной алкеноатной смолы
Случайный патент: Комплекс динамической защиты военной техники. комплекс динамической защиты башни.