Пептидные аналоги и миметики, подходящие для применения in vivo при лечении заболеваний, связанных с аномальной укладкой белков в амилоидные или амилоидподобные отложения, или их патологические предшественники, обогащенные &beta-складками
Формула / Реферат
1. Ингибиторный пептид, способный ингибировать образование b -складчатой структуры в амилоидном b -пептиде, представляющий собой аналог ингибиторного пептида болезни Альцгеймера iAb 5, состоящий из 5 остатков (SEQ ID NO:1 Leu-Pro-Phe-Phe-Asp), сконструированный путем химической модификации SEQ ID NO:1, при этом указанная химическая модификация достигается с помощью способа, выбранного из группы, состоящей из изменения N- и C-концов указанного ингибиторного пептида болезни Альцгеймера iAb 5; замены по меньшей мере одного остатка указанного ингибиторного пептида болезни Альцгеймера iAb 5 на a -аминоизомасляную кислоту (Aib); метилирования a -углеродного атома по меньшей мере одного остатка указанного ингибиторного пептида болезни Альцгеймера iAb 5; замены по меньшей мере одного L-энантиомерного остатка указанного ингибиторного пептида болезни Альцгеймера iAb 5 на D-энантиомерный остаток, проведения циклизации "голова-к-хвосту" указанного ингибиторного пептида болезни Альцгеймера iAb 5, замены амидных связей в указанном ингибиторном пептиде болезни Альцгеймера iAb 5 на заменитель амидной связи и их сочетаний.
2. Ингибиторный пептид по п.1, отличающийся тем, что указанное изменение N- и C-концов указанного ингибиторного пептида болезни Альцгеймера iAb 5 достигается с помощью способа, выбранного из ацетилирования, амидирования, дезаминирования, алкоголизации и их сочетаний.
3. Ингибиторный пептид по п. 2, отличающийся тем, что указанный ингибиторный пептид выбран из группы, состоящей из

4. Ингибиторный пептид по п.3, отличающийся тем, что указанный ингибиторный пептид представляет собой ac-Leu Pro Phe Phe Asp-am.
5. Ингибиторный пептид по п.1, отличающийся тем, что указанный ингибиторный пептид выбран из группы, состоящей из


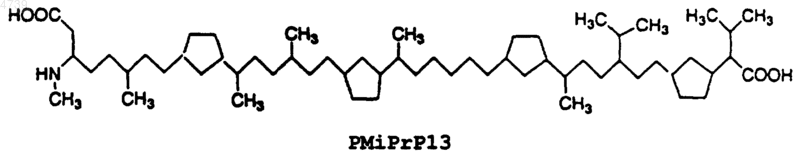
6. Ингибиторный пептид по п.1, отличающийся тем, что указанный ингибиторный пептид характеризуется следующей структурой:
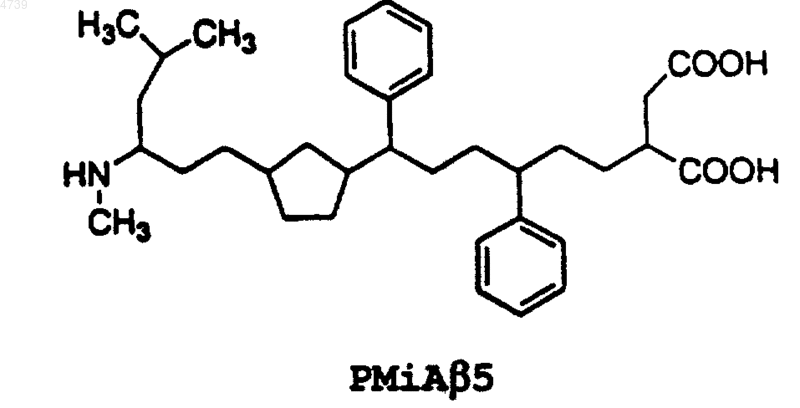
7. Ингибиторный пептид, способный ингибировать конформационные изменения в прионовом белке PrP, связанном с амилоидозом, представляющий собой аналог прионового ингибиторного пептида iPrP13, состоящий из 13 остатков (SEQ ID NO:2 Asp Ala Pro Ala Ala Pro Ala Gly Pro Ala Val Pro Val), сконструированный путем химической модификации SEQ ID NO:2, при этом указанная химическая модификация достигается с помощью способа, выбранного из группы, состоящей из изменения N- и C-концов указанного прионового ингибиторного пептида iPrP13; замены по меньшей мере одного остатка указанного прионового ингибиторного пептида iPrP13 на a -аминоизомасляную кислоту (Aib); метилирования a -углеродного атома по меньшей мере одного остатка указанного прионового ингибиторного пептида iPrP13; замены по меньшей мере одного L-энантиомерного остатка указанного прионового ингибиторного пептида iPrP13 на D-энантиомерный остаток, проведения циклизации "голова-к-хвосту" указанного прионового ингибиторного пептида iPrP13, замены амидных связей в указанном прионовом ингибиторном пептиде iPrP13 на заменитель амидной связи и их сочетаний.
8. Ингибиторный пептид по п.7, отличающийся тем, что указанное изменение N- и C-концов указанного прионового ингибиторного пептида iPrP13 достигается с помощью способа, выбранного из ацетилирования, амидирования, дезаминирования, алкоголизации и их сочетаний.
9. Ингибиторный пептид по п.8, отличающийся тем, что указанный ингибиторный пептид выбран из группы, состоящей из

10. Ингибиторный пептид по п.7, отличающийся тем, что указанный ингибиторный пептид выбран из группы, состоящей из


11. Ингибиторный пептид по п.7, отличающийся тем, что указанный ингибиторный пептид характеризуется следующей структурой:
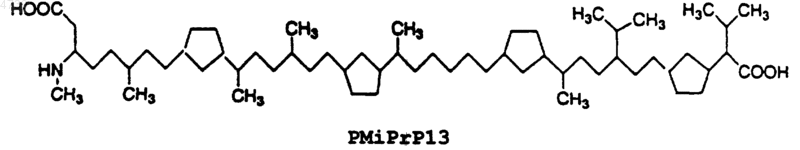
12. Способ уменьшения образования амилоидных или амилоидподобных отложений, включающего аномальную укладку амилоидного b -пептида в b -складчатую структуру, или уменьшения количества указанного амилоидного b -пептида, который уже сформировался в b -складчатую структуру, включающий контактирование указанного амилоидного b -пептида, либо до, либо после его аномальной укладки в b -складчатую структуру с эффективным количеством пептида по п.1.
13. Способ уменьшения образования амилоидных или амилоидподобных отложений, включающего конформационные изменения в прионовом белке Pr, или уменьшения количества указанного прионового белка Pr, который уже сформировался в амилоидные или амилоидподобные отложения, включающий контактирование указанного прионового белка Pr, либо до, либо после указанных конформационных изменений, приводящих к образованию амилоидных отложений с эффективным количеством пептида по п.7.
14. Способ уменьшения образования амилоидных или амилоидподобных отложений путем введения ингибиторного пептида, выбранного из группы, состоящей из
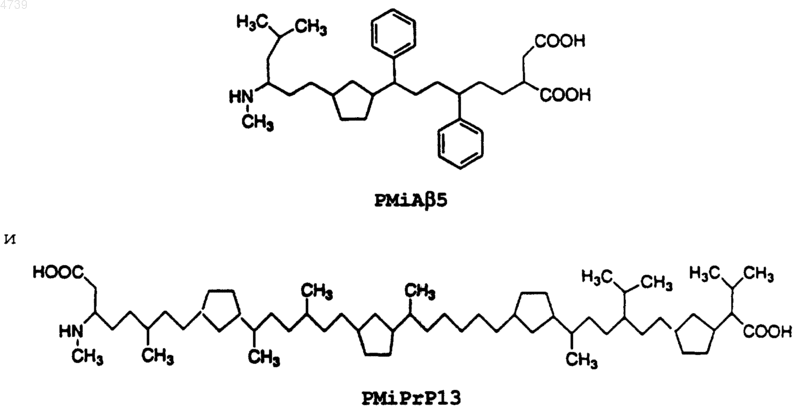
15. Фармацевтическая композиция, включающая ингибиторный пептид, ингибирующий образование b -складчатой структуры в амилоидном b -пептиде, и фармацевтически приемлемый носитель или наполнитель, при этом указанный ингибиторный пептид представляет собой аналог ингибиторного пептида болезни Альцгеймера iAb 5, состоящий из 5 остатков (SEQ ID NO:1 Leu-Pro-Phe-Phe-Asp), сконструированный путем химической модификации SEQ ID NO:1, при этом указанная химическая модификация достигается с помощью способа, выбранного из группы, состоящей из изменения N- и C-концов указанного ингибиторного пептида болезни Альцгеймера iAb 5; замены по меньшей мере одного остатка указанного ингибиторного пептида болезни Альцгеймера iAb 5 на a -аминоизомасляную кислоту (Aib); метилирования a -углеродного атома по меньшей мере одного остатка указанного ингибиторного пептида болезни Альцгеймера iAb 5; замены по меньшей мере одного L-энантиомерного остатка указанного ингибиторного пептида болезни Альцгеймера iAb 5 на D-энантиомерный остаток, проведения циклизации "голова-к-хвосту" указанного ингибиторного пептида болезни Альцгеймера iAb 5, замены амидных связей в указанном ингибиторном пептиде болезни Альцгеймера iAb 5 на заменитель амидной связи и их сочетаний.
16. Фармацевтическая композиция по п.15, отличающаяся тем, что указанный ингибиторный пептид выбран из группы, состоящей из

17. Фармацевтическая композиция по п.15, отличающаяся тем, что указанный ингибиторный пептид представляет собой ac-Leu Pro Phe Phe Asp-am.
18. Фармацевтическая композиция по п.15, отличающаяся тем, что указанный ингибиторный пептид выбран из группы, состоящей из


19. Фармацевтическая композиция по п.15, отличающаяся тем, что указанный ингибиторный пептид характеризуется следующей структурой:
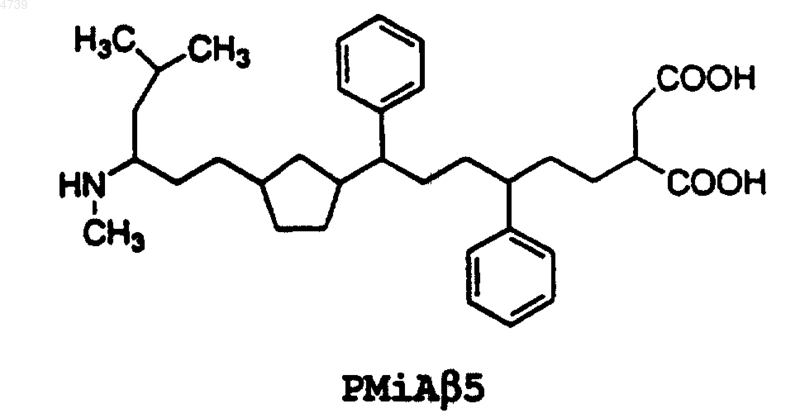
20. Фармацевтическая композиция, включающая ингибиторный пептид, ингибирующий конформационные изменения в прионовом белке PrP, связанном с амилоидозом, и фармацевтически приемлемый носитель или наполнитель, при этом указанный ингибиторный пептид представляет собой аналог прионового ингибиторного пептида iPrP13, состоящий из 13 остатков (SEQ ID NO:2 Asp Ala Pro Ala Ala Pro Ala Gly Pro Ala Val Pro Val), сконструированный путем химической модификации SEQ ID NO:2, при этом указанная химическая модификация достигается с помощью способа, выбранного из группы, состоящей из изменения N- и C-концов указанного прионового ингибиторного пептида iPrP13; замены по меньшей мере одного остатка указанного прионового ингибиторного пептида iPrP13 на a b -аминоизомасляную кислоту (Aib); метилирования a -углеродного атома по меньшей мере одного остатка указанного прионового ингибиторного пептида iPrP13; замены по меньшей мере одного L-энантиомерного остатка указанного прионового ингибиторного пептида iPrP13 на D-энантиомерный остаток, проведения циклизации "голова-к-хвосту" указанного прионового ингибиторного пептида iPrP13, замены амидных связей в указанном прионовом ингибиторном пептиде iPrP13 на заменитель амидной связи и их сочетаний.
21. Фармацевтическая композиция по п.20, отличающаяся тем, что указанный ингибиторный пептид выбран из группы, состоящей из

22. Фармацевтическая композиция по п.20, отличающаяся тем, что указанный ингибиторный пептид выбран из группы, состоящей из


23. Фармацевтическая композиция по п.20, отличающаяся тем, что указанный ингибиторный пептид характеризуется следующей структурой:
Текст
1 Данная заявка заявляет приоритет по отношению к предварительной заявке США 60/163911, поданной 5 ноября 1999. Предпосылки создания изобретения Область изобретения Настоящее изобретение относится к пептидным аналогам и пептидомиметикам пептидов, нарушающих -складчатую структуру,подходящим для применения in vivo при лечении млекопитающих с заболеваниями, связанными с изменением конформации белков, такими как болезнь Альцгеймера и болезнь, ассоциированная с прионами. Более конкретно, настоящее изобретение направлено на новые пептидные аналоги и миметики, фармацевтические композиции, содержащие один из таких пептидных аналогов или миметиков, или их смесь,а также на способы профилактики, лечения или диагностики нарушений или заболеваний, связанных с аномальной укладкой белков в амилоидные или амилоидподобные отложения, или их предшественники, обладающие патологической-складчатой структурой. Описание предшествующего уровня техники Было накоплено большое количество данных, указывающих на то, что некоторые из несхожих по характеру заболеваний имеют одну и ту же молекулярную основу, т.е. изменение конформации белков (Thomas et al., Trends Biochem. Sci. 20: 456-459, 1995; Soto, J. Mol. Med. 77: 412-418, 1999). Данные заболевания, связанные с изменением конформации белков, включают болезнь Альцгеймера, ассоциированные с прионами нарушения, системный амилоидоз,серпин-дефицитные нарушения, болезнь Хантингтона и боковой амиотрофический склероз(Soto, 1999, указано выше). Отличительным событием при заболеваниях, связанных с изменением конформации белков, является изменение вторичной и третичной структуры нормального белка без изменения первичной структуры. Белок с модифицированной конформацией может участвовать в развитии заболевания благодаря непосредственной токсической активности, утрате биологической функции белка с нормальной укладкой или дефектной транспортировке(Thomas et al., 1995, указано выше). В случаях,когда белок является токсичным, он обычно самоассоциируется, и происходит его отложение в виде амилоидных фибрилл в разных органах, индуцируя повреждение ткани (Thomas etBiol. 6: 11-17, 1996; Soto, 1999, указано выше). Болезнь Альцгеймера (БА) представляет собой истощающее нейродегенеративное состояние, характеризующееся утратой кратковременной памяти, дезориентацией и нарушением способности рассуждать и мыслить. БА является наиболее распространенной формой слабоумия у людей пожилого возраста. Подсчитано, что более двадцати пяти миллионов чело 004739 2 век во всем мире в разной степени поражены БА(Teplow, Amyloid 5: 121-142, 1998). Отличительным событием при БА является отложение нерастворимых белковых агрегатов, известных как амилоид, в паренхиме мозга и стенках сосудов мозга. Основным компонентом амилоида является гидрофобный пептид массой 4,3 кДа,называемый амилоидный бета-пептид (А), который кодируется на хромосоме 21 как часть гораздо более длинного белка-предшественника(АРР) (Selkoe, Science 275: 630-631, 1997). Генетические, биохимические и нейропатологические данные, накопленные за последние 10 лет,позволяют с уверенностью предположить, что амилоид играет важную роль в раннем патогенезе БА и, возможно, запускает механизм заболевания (Soto et al., J. Neurochem. 63: 1191-1198,1994; Selkoe, 1997, указано выше; Teplow, 1998,указано выше; Sisodia and Price, FASEB J. 9: 366-370, 1995; Soto, Mol. Med. Today 5: 343-350,1999). Амилоид является общим термином, описывающим фибриллярные агрегаты, которые имеют единый структурный мотив, т.е. (складчатую конформацию (Serpell et al., CellMol. Life Sci. 53: 887, 1997; Sipe, Ann. Rev. Biochem. 61: 947-975, 1992). Данные агрегаты имеют характерные цветовые свойства, включая способность испускать зеленый с двойным лучепреломлением свет после окрашивания конгокрасным, и способность связывать флюорохром,тиофлавин S (Sipe, 1992, указано выше; Ghiso etal., Mol. Neurobiol. 8: 49-64, 1994). Существует более 12 человеческих заболеваний различной этиологии, характеризующихся внеклеточным отложением амилоида в разных тканях, которое приводит к разрушению клетки, дисфункции органов и смерти. Среди заболеваний, включающих амилоидоз, можно выделить болезнь Альцгеймера, связанные с прионами нарушения(известные также, как инфекционная губчатая энцефалопатия) и системный амилоидоз (табл. 1). Амилоидные фрагменты обычно состоят из протеолитических фрагментов нормальных или мутантных генных продуктов. Существует свыше 16 разных белков (табл. 1), участвующих в амилоидных отложениях в различных тканях(Ghiso et al., 1994, указано выше). Образование амилоида, по существу, является проблемой укладки белка, в результате чего растворимые пептиды, имеющие в основном случайную укладку, становятся агрегированными, принимая (-складчатую конформацию(Kelly, 1996, указано выше; Soto, 1999, указано выше). Образование амилоида протекает при участии гидрофобных взаимодействий между конформационно измененными амилоидогенными промежуточными соединениями, которые посредством пептидных взаимодействий организуются в -складчатую структуру. Гидрофобность является важным фактором для индукции 3 взаимодействия мономеров, приводящего к агрегации, тогда как -складчатая конформация может определять расположение агрегатов в амилоидных фибриллах. При попытке ингибировать образование амилоидных фибрилл два указанных свойства разделяли путем конструирования коротких синтетических пептидов, обладающих гомологией последовательности и такой же степенью гидрофобности, как у пептидного домена, участвующего в конформационном изменении, но имеющих очень низкую склонность к формированию -складчатой конформации (называемых пептиды, разрушающиеet al., 1998, указано выше). Цель состоит в конструировании пептида, обладающего способностью специфично связываться с амилоидогенным пептидом, образуя комплекс, который стабилизирует физиологическую конформацию и дестабилизирует аномальную конформацию пептида (Soto et al., 1999, указано выше). Таблица 1. Заболевания, связанные с амилоидозом и белковым компонентом амилоидных фибрилл Пептиды, разрушающие -складки, до настоящего времени конструировали для блокировки конформационных изменений, происходящих как в A, так и в белке приона (РrР), которые участвуют в патогенезе болезни Альцгеймера и болезни, ассоциированной с прионами, соответственно. В предшествующем уровне техники ранее было показано, что пептиды, разрушающие -складки, из 11 и 5 остатков (а именно iA1 и iA5, соответственно), гомологичные центральной гидрофобной области А,ингибируют конформационные изменения в пептидах, приводящие к образованию амилоида,а также растворяют ранее образованные фиб 004739Med. 4: 822-826, 1998). Кроме того, пептид из 5 остатков способен предотвращать гибель нейронов, индуцированную образованием олигомерных А структур, обогащенных складками, в экспериментах с клеточными культурами (Soto et al., 1998, указано выше). Кроме того, в предшествующем уровне техники на крысиной модели амилоидоза, индуцированного интрацеребральной инъекцией А 1-42, было показано, что совместные инъекции пептида из 5 остатков, разрушающего -складки, уменьшают накопление в мозгу А и полностью блокируют отложение фибриллярных амилоидподобных бляшек в мозгу крысы (Soto et al., 1998,указано выше). Наконец, пептид, разрушающий-складки, введенный через восемь дней после инъекции А, способен разрушать in vivo фибриллы, ранее образовавшиеся в мозгу крысы,что приводит к уменьшению размера амилоидных отложений (Sigurdsson, Frangione, Soto,представленная на рассмотрение рукопись). Интересно, что удаление амилоида под действием пептида, разрушающего -складки, возвращает в прежнее состояние связанное с ним церебральное гистологическое повреждение, включая сжатие нейронов и активацию микроглии. Пептиды, разрушающие -складки, также конструировались для предотвращения и возвращения в прежнее состояние конформационных изменений, вызванных прионами (РrР). На основе тех же принципов и при использовании в качестве матрицы последовательности РrР (114122), в предшествующем уровне техники было показано, что, если синтезировали набор пептидов, разрушающих -складки, наибольшей активностью обладал пептид из 13 остатков(iPrP13) (Soto, 1999, указано выше). Для тестирования ингибиторной активности использовали несколько анализов in vivo и in vitro на клеточных культурах, и результаты отчетливо продемонстрировали, что можно не только предотвратить превращение PrPcPrPsc, но и, что более интересно, возвратить инфекционный конформационный вариант структуры PrPsc в биохимическое и структурное состояние, подобное PrPc (Soto et al., представленная на рассмотрение рукопись). Короткие пептиды широко применялись в медицине в качестве лекарственных средств(Rao et al., С. Basava and G.M. Anantharamaiah,eds. Boston: Birkhauser, pp. 181-198, 1994). Однако разработка пептидных лекарственных средств является в значительной степени ограниченной из-за их недостаточной биодоступности при пероральном применении и короткой продолжительности действия, являющейся результатом ферментативной деградации in vivo 5 годы в получении пептидных аналогов (таких как псевдопептиды и пептидомиметики) с более низкой восприимчивостью к протеолизу, увеличивает вероятность получения полезных лекарственных средств, структурно родственных исходным пептидам (Fauchere and Thurieau, 1992,указано выше). Улучшение устойчивости пептида к протеазам не только увеличивает период полужизни соединения в кровотоке, но также повышает его способность к транспортировке или абсорбции на различных уровнях, включая абсорбцию в кишечнике и проникновение через гематоэнцефалический барьер, так как транспорт и абсорбция в высокой степи зависят от времени контакта мембран или барьеров с биоактивными образцами (Fauchere and Thurieau,1992, указано выше). Краткое содержание изобретния Настоящее изобретение предоставляет ингибиторный пептид, способный ингибировать образование -складчатой структуры в амилоидном -пептиде, причем ингибиторный пептид представляет собой пептидный аналог, разрушающий -складки, сконструированный путем химической модификации пептида, разрушающего -складки, способного ингибировать образование -складчатой структуры в амилоидном-пептиде. Пептид подвергают химическому изменению путем: (1) модификаций N- и С-концов пептида; (2) замен боковых цепей, которые могут включать аминокислотные замещения; (3) модификации по -углеродному атому, включающей метилирование, алкилирование и дегидрирование; (4) изменения хиральности путем замены D-остатка на L-остаток; (5) циклизаций голова-к-хвосту; и (6) введения замещений в амидной связи, т.е. замена атомов, участвующих в образовании пептидной (или амидной) связи. Настоящее изобретение также включает ингибиторный пептид, способный ингибировать конформационные изменения в белке прионов РrР, связанном с амилоидозом, причем ингибиторный пептид представляет собой пептидный аналог, разрушающий -складки, конструированный путем химической модификации пептида, разрушающего -складки, способного ингибировать конформационные изменения в белке прионов РrР, связанном с амилоидозом. Кроме того, настоящее изобретение включает пептидомиметик следующей структуры: В другом воплощении пептидомиметик имеет следующую структуру: В еще одном воплощении пептидомиметик имеет следующую структуру: Настоящее изобретение также включает способ профилактики, лечения или диагностики нарушений или заболеваний, связанных с аномальной укладкой белков в амилоидные или амилоидподобные отложения или их предшественники, обладающие патологической бетаскладчатой структурой. Краткое описание чертежей На фиг. 1 представлено схематическое изображение пептидной связи и потенциальные участки-мишени для пептидных модификаций. На фиг. 2 представлен график, изображающий фармакокинетику пептидного ингибитора амилоидоза Альцгеймера из 11 остатков(поел. RDLPFYPVPID), разрушающего (3 складки, в его природной L-конфигурации и в неприродной D-форме. На фиг. 3 А и 3 В представлены трехмерные структуры пептидов, разрушающих -складки,при болезни Альцгеймера и болезни, ассоциированной с прионами, iA5 и iPrP13, соответственно. На фиг. 4 А и 4 В представлены графики,демонстрирующие биодоступность и стабильность iA5 и Ac-iA5-Am, соответственно, во времени. На фиг. 5 А представлено графическое сравнение А 1-40, инкубированного с разными другими пептидами. На фиг.5 В представлена зависимость образования амилоида от концентрации Ac-iA5Am. На фиг. 5 С представлена зависимость образования амилоида от концентрации iA5. На фиг. 6 показана модель с 83% распада отложений в области желудочка и 30% распада амилоидной бляшки в миндалине. Подробное описание изобретения В настоящем изобретении биодоступность и стабильность ингибиторного пептида улучшают путем химической модификации исходного пептида с получением более стабильного производного при применении in vivo, которое предпочтительно вводят перорально. Ингибиторный пептид способен ингибировать образование -складчатой структуры у амилоидного пептида. Более того, ингибиторный пептид представляет собой пептидный аналог, разру 7 шающий -складки, сконструированный путем химической модификации пептида, разрушающего -складки, способного ингибировать образование -складчатой структуры у амилоидного-пептида. Данное изобретение также включает ингибиторный пептид, способный ингибировать конформационные изменения в прионовом белке РrР, связанном с амилоидозом, где ингибиторный пептид представляет собой пептидный аналог, разрушающий -складки, сконструированный путем химической модификации пептида, разрушающего -складки, и способный ингибировать конформационные изменения в прионовом белке РrР, связанном с амилоидозом. На фиг. 1 показан общий пептидный скелет, на котором указаны возможные мишени для химических модификаций. Возможные мишени включают следующие: (1) модификацииb); (2) изменения боковой цепи (мишень с), которые обычно включают аминокислотные замены; (3) модификацию по -углеродному атому(мишень d), включающую метилирование, алкилирование и дегидрирование; (4) изменения хиральности путем замены D-остатка на Lостаток; (5) циклизации голова-к-хвосту; и (6) введение замещений в амидной связи (мишень е), т.е. замена атомов, участвующих в образовании пептидной (или амидной) связи. Последние производные известны как псевдопептиды или заменители амидной связи. Природные пептиды обычно разрушаются в результате согласованного действия специализированных эндопептидаз и неспецифических экзопептидаз. Эндопептидазы зачастую присутствуют в тканях и клеточных компартментах и превращают пептид в два или более неактивных фрагмента. Экзопептидазы, как правило, присутствуют в крови и периферических органах и осуществляют распад интактных пептидов или их фрагментов на составляющие их аминокислоты, внося тем самым вклад в исчезновение пептидов из кровотока. Экзопептидазы распознают свободные амино- или карбоксильные группы в пептидах. Следовательно, модификация данных групп часто снижает или устраняет экзопептидазную деградацию. Циклизация пептида голова-к-хвосту приводит к отсутствию свободных концевых групп и, следовательно,также минимизирует расщепление экзопептидазами. С другой стороны, эндопептидазы распознают атомы, участвующие в образовании амидной связи. Таким образом, замены в амидной связи значительно уменьшают разрушение под действием эндопептидаз. То же самое обычно происходит при модификации по углеродному атому. Так как большинство (если не все) экзо- и эндопротеаз являются стереоспецифическими, замещения природных L-аминокислот D-стереоизомерами приводит к очевид 004739 8 ному увеличению стабильности пептида. Наконец, пептидомиметики обычно являются полностью устойчивыми к протеолитической деградации и часто могут быть введены перорально. Аналоги, разрушающие -складки, полученные путем химических модификаций лидерных пептидов Модификации, начиная с пептида из 5 остатков, ингибирующего болезнь АльцгеймераAla Gly Pro Ala Val Pro Val), осуществляют как описано ниже. Пептиды, использующиеся в настоящем изобретении, синтезируют, используя стандартные методики, раскрытые Bergmann etN-концевое ацетилирование или дезаминирование обеспечивает защиту от расщепления под действием ряда аминопептидаз, тогда как наличие С-концевой карбоксильной группы,замещенной амидами или спиртами, предотвращает расщепление некоторыми карбоксипептидазами, включая карбоксипептидазы А и В. Измененные пептидные последовательности,включающие указанные модификации, представлены ниже, где ас обозначает ацетилирование, am обозначает амидирование, des обозначает дезаминирование, и alс обозначает алкоголизацию. Ингибиторы болезни Альцгеймера:b) Изменения боковой цепи. Присутствие неприродных аминокислот обычно увеличивает стабильность пептида. Кроме гого по меньшей мере одна из данных аминокислот (-аминоизомасляная кислота илиAib) определяет значительное напряжение у сконструированных пептидов, уменьшая их конформационную подвижность. В частности,включение Aib в -складчатую модель пептидов вызывает полное разрушение данной структуры. Активность Aib, блокирующая образование складок, сравнима с активностью природного остатка пролина, использующегося в пептиде в качестве блокатора образования -складок, или даже превышает ее. Следовательно, введениеAib предположительно повышает одновременно стабильность пептида и его ингибиторную активность. Ингибиторы болезни Альцгеймера: Ингибиторы болезни, ассоциированной с прионами: с) Модификации по -углеродному атому. Наиболее часто используемой модификацией по -углеродному атому, применяющейся для улучшения стабильности пептида, является-метилирование. Кроме того, было показано,что замещение атома водорода, связанного с углеродным атомом Phe, Val или Leu, благоприятствует принятию -изогнутой конформации и в значительной степени не способствует образованию -складчатых структур. В соответствии с настоящим изобретением метилирование указанных остатков в ингибиторных пептидах предположительно увеличивает стабильность и активность. Ингибиторы болезни Альцгеймера:d) Изменения хиральности. Замена природного L-остатка на D-энантиомеры сильно повышает устойчивость к протеолитической деградации. Увеличение стабильности в результате введения D-остатка уже было показано для пептида из 11 остатков, разрушающего -складки (iA1). Исследования invivo показали, что пептид, несущий природную последовательность, быстро разрушается в плазме крысы. Действительно, приблизительно 90% iA1 разрушалось в течение нескольких минут после внутривенного введения. Наоборот, производное iA1, содержащее все остатки в D-форме, фактически не разрушалось в плазме в течение 15 мин после инъекции. Для осуществления детекции пептид подвергали радиоактивному йодированию с помощью стандартных методов. Стабильность пептидов оценивали после в.в. введения болюсов крысам путем осаждения трихлоруксусной кислотой. Количественное определение интактных пептидов также проводили с помощью хроматографии на бумаге. Таким образом, пептиды iA5 и iPrP13 (фиг. 3 А и 3 В, соответственно), содержащие толькоD-остатки, а также пептиды, содержащие Dостатки только в N- и С-концевых участках для предотвращения экзопептидазной деградации,включены в соединения данного изобретения. В добавление к вышесказанному D-остаток ис 004739 10 пользовали после каждой пролиновой аминокислоты, так как было опубликовано, что часто расщепление эндопептидазой происходит по участку, расположенному после указанного остатка, под действием фермента, известного как пролилэндопептидаза. Ингибиторы болезни Альцгеймера: Обозначения аминокислот, начинающиеся с маленькой буквы, относятся к D-остаткам. е) Циклические пептиды. Конформационно напряженные циклические пептиды представляют собой более хорошие опытные образцы лекарственных средств,чем линейные пептиды, благодаря их уменьшенной конформационной подвижности и улучшенной устойчивости к расщеплению экзопептидазами. Для превращения линейной последовательности в циклическую структуру использовали две альтернативные стратегии. Одна состоит во введении цистеинового остатка для достижения циклизации через образование дисульфидного мостика, а другая представляет собой стратегию присоединения боковой цепи,включающую циклизацию голова-к-хвосту на смоле. Чтобы избежать модификаций пептидной последовательности, используют последний подход. Пептиды, разрушающие -складчатую структуру, содержат идеальные последовательности для облегчения макроциклизации, так как пролин, благодаря его способности инициировать повороты и петли, является составной частью многих встречающихся в природе или синтезированных искусственно циклических пептидов. Ингибиторы болезни Альцгеймера: Ингибиторы болезни, ассоциированной с прионами:f) Псевдопептиды. Псевдопептиды или заменители амидной связи относятся к пептидам, содержащим химические модификации некоторых (или всех) пептидных связей. Замены амидной связи обычно обозначают, сохраняя обозначение аминокислоты в соответствии с боковой цепью и описывая изменения, которые происходят среди углеродных атомов, с помощью номенклатуры,известной как "пси-брекет (psi-bracket)". Например, термин А 1 а[CH2CH2]Gly относится к фрагменту NH2CH(СН 3)СН 2 СН 2 СН 2 СО 2 Н. Некоторые заменители амидной связи описаны ниже в табл. 2. 11 Таблица 2. Некоторые заменители амидной связи и их свойства Некоторые из них обнаружены в природных аналогах пептидов (такие как [СНОН],[CSNH], [СOO]), тогда как другие были синтезированы искусственно. Введение заменителей амидной связи не только уменьшает деградацию пептидов, но также может значительно изменить некоторые из биохимических свойств пептидов, особенно конформационную подвижность и гидрофобность. Возможно, увеличение конформационной подвижности оказывает благоприятный эффект на связывание ингибитора со связывающими участками А и РrР. С другой стороны, так как взаимодействие между амилоидогенными белками и ингибиторами, повидимому, в значительной степени зависит от гидрофобных взаимодействий, возможно, повышение гидрофобности в результате замены амидной связи может увеличивать сродство и,следовательно, эффективность ингибиторов. Кроме того, повышенная гидрофобность может также увеличивать транспорт пептида через мембраны и, таким образом, улучшать барьерную проницаемость (гематоэнцефалического барьера и кишечного барьера). Следовательно,для синтеза псевдопептидов используют замену амидной связи, такую как [CH2CH2] и[CH2S], посредством чего увеличивают подвижность и гидрофобность. Для предотвращения экзопротеазной деградации замене подвергают амидные связи, расположенные в конце пептида и после каждого из остатков пролина,так как было описано, что обычно участки эндопептидазного расщепления под действием фермента, известного как пролилэндопептидаза,располагаются после указанного остатка. Дополнительные амидные связи, которые должны быть защищены, определяют путем экспериментальных исследований, включающих анализ деградации пептидов, разрушающих -складки,в плазме и ткани. Ингибиторы болезни Альцгеймера: Ингибиторы болезни, ассоциированной с прионами: 12 Рассматривая свойства пептидных лекарственных средств, имеющихся в продаже или находящихся в настоящее время на стадии разработки, можно видеть, что большая часть пептидов, устойчивых к протеолизу, включает сочетание нескольких типов вышеописанных модификаций. Данный вывод приобретает смысл в свете данных, указывающих на участие многих различных ферментов в деградации пептидов. Следующие структуры содержат сочетания разных типов химических модификаций: Ингибиторы болезни Альцгеймера: 13 Другим подходом к улучшению стабильности, который также может привести к образованию активных соединений при пероральном введении, является получение пептидомиметика. Пептидомиметик представляет собой молекулу, которая имитирует биологическую активность пептидов, но по химической природе не является пептидом. Термин пептидомиметик иногда используют для описания молекул, которые по природе частично являются пептидами, таких как псевдопептиды, полупептиды или пептоиды, но строгое определение и определение, использующееся в настоящей заявке, относятся к органической молекуле, которая вообще не содержит каких-либо пептидных связей. Пептидомиметики не являются производными исходного пептида, а предпочтительно их химически синтезируют de novo, пытаясь имитировать структурные и функциональные свойства пептида. Для рационального конструирования пептидомиметиков необходимы достаточный уровень знаний фармакофорных групп, отвечающих за активность, и подробная структурная информация о пептиде. Целью является воссоздание пространственного положения фармакоактивных групп при использовании несущей их органической матрицы. Выбор матрицы является важным, и следует принимать во внимание размер и подвижность, основываясь на конформационной модели пептида. Пептидомиметики, сконструированные для имитации свойств пептида, разрушающего складки Для рационального конструирования пептидомиметиков необходимы достаточный уровень знаний химических групп, отвечающих за активность, и подробная структурная информация о пептиде. Целью является воссоздание положения фармакоактивных групп при использовании несущей их органической матрицы. Выбор матрицы является важным, и следует принимать во внимание размер и подвижность, основываясь на конформационной модели пептида. В результате исследования активности различных последовательностей, разрушающих складки, несущих единичные аминокислотные замены, были определены остатки, играющие ключевую роль при ингибировании. Кроме того,либо моделировали, либо устанавливали экспериментально трехмерную структуру пептидов,разрушающих -складки при болезни Альцгеймера или болезни, ассоциированной с прионами(фиг. 3 А и 3 В). Ингибитор А фибриллогенеза,содержащий 5 остатков, моделировали, исходя из принципа минимума энергии и метода MonteICM. Структуру 13-остаточного ингибитора конформационных изменений в прионовых белках экспериментально рассчитывали с помощью 2D-ЯМР. 14 Существуют многочисленные подходы к конструированию и синтезу пептидомиметиков,как описано в последних обзорах Joachim Gante и Iwao Ojima et al., которые включены в данное описание в качестве ссылки. Пептидомиметики, приведенные ниже,представляют следующий аспект данного изобретения. Ингибиторы болезни Альцгеймера Последний ингибитор (PMiPrP5) является более короткой и простой для синтеза версией,которая содержит химически активные группы и является аналогом пептида из 5 остатков, разрушающего -складки при прионовом заболевании. В качестве способа профилактики или лечения нарушения или заболевания, связанного с амилоидными или амилоидподобными отложениями, или их патологическими предшественниками, обогащенными -складчатой структурой, соединение настоящего изобретения вводят в эффективном количестве субъекту, нуждающемуся в нем, где субъект может быть человеком или животным. Подобным образом способ диагностики таких нарушений или заболеваний также включает введение сконструированного соединения в количестве, достаточном для визуализации его связывания с фибрильными отложениями или их предшественниками с помощью хорошо известных методов визуализации. В данном документе термин "профилактика" состояния, такого как болезнь Альцгеймера или другие амилоидозные нарушения, у субъекта включает введение соединения в соответствии с настоящим изобретением до клинического начала заболевания. "Лечение" включает введение защитного соединения после клинического начала заболевания. Например, успешное введение соединения настоящего изобретения после развития нарушения или заболевания включает "лечение" заболевания. Настоящее изобретение может применяться для лечения людей, а также с ветеринарными целями на животных. Соединение настоящего изобретения может быть введено любым способом, обеспечивающим достижение предполагаемой цели, 15 предпочтительно, перорально. Например, введение может осуществляться рядом различных парентеральных путей, включая, без ограничения, подкожный, внутривенный, внутрикожный,внутримышечный, интраперитонеальный, интрацеребральный, интраназальный, пероральный, чрезкожный или щечный пути. Парентеральное введение может проводиться путем инъекции болюса или путем постепенного вливания в течение промежутка времени. Типичный режим для профилактики, подавления или лечения состояния, связанного с амилоидными или амилоидподобными отложениями, включает: или (1) введение эффективного количества соединения в одной или двух дозах, содержащих высокую концентрацию, находящуюся в интервале от 0,5 до 10 мг, более предпочтительно, от 0,5 до 5 мг, или (2) введение эффективного количества соединения в повторяющихся дозах, содержащих более низкие концентрации, находящиеся в интервале 1010000 мкг, более предпочтительно 50-500 мкг, в течение периода времени от нескольких месяцев до нескольких лет. Понятно, что вводимая доза зависит от возраста, пола, состояния здоровья и веса реципиента, вида сопутствующего лечения, если такое имеет место, повторяемости лечения и природы желаемого эффекта. Общая доза, необходимая для каждого лечения, может быть введена в виде повторяющихся доз или в виде однократной дозы. Под "эффективным количеством" понимают концентрацию соединения, которая способна замедлять или ингибировать образование амилоидных или амилоидподобных отложений, или их патологических -складчатых предшественников, или растворять ранее образованные фибрильные отложения. Такие концентрации могут определяться специалистами в данной области в рабочем порядке. Специалистам в данной области также понятно, что дозировка может зависеть от стабильности вводимого соединения. Для менее стабильного соединения может требоваться введение множества доз. Препараты для парентерального введения включают стерильные водные или неводные растворы, суспензии и эмульсии, которые могут содержать вспомогательные агенты или эксципиенты, известные в данной области. Такие фармацевтические композиции, как таблетки и капсулы, также могут быть получены в соответствии с обычными методами. Фармацевтические композиции, включающие соединение данного изобретения,включают все композиции, в которых соединение содержится в количестве, эффективном для достижения предполагаемой цели. Кроме того,фармацевтические композиции могут содержать подходящие фармацевтически приемлемые носители, включающие эксципиенты и вспомогательные вещества, которые облегчают перера 004739 16 ботку активных соединений в препаратах, которые могут использоваться фармацевтически. Подходящие фармацевтически приемлемые среды хорошо известны в данной области и описаны, например, в Gennaro, Alfonso, Ed.,Remington's Pharmaceutical Sciences, 18th Edition 1990, Mack Publishing Co., Easton, PA, стандартном руководстве по данной области. Фармацевтически приемлемые среды могут быть выбраны в рабочем порядке в соответствии со способом введения, растворимостью и стабильностью соединения. Например, композиции для внутривенного введения могут включать стерильные водные растворы, которые также могут содержать буферы, разбавители и другие подходящие добавки. Подходящие композиции для парентерального введения включают водные растворы активных соединений в водорастворимой форме,например, в виде водорастворимых солей. Кроме того, может быть введена суспензия активного соединения в виде соответствующих масляных суспензий для инъекций. Подходящие липофильные растворители или среды включают жирные масла, например кунжутное масло, или синтетические эфиры жирных кислот, например, этилолеат или триглицериды. Водные суспензии для инъекций, которые могут содержать вещества, увеличивающие вязкость суспензии,включают, например карбоксиметилцеллюлозу натрия, сорбит и/или декстран. Необязательно суспензия также может содержать стабилизаторы. Нарушения или заболевания, связанные с аномальной укладкой белков в амилоидные или амилоидподобные отложения, или в патологические предшественники таких отложений, обогащенные -складками, подлежащие лечению или профилактике путем введения фармацевтической композиции данного изобретения, включают, не ограничиваясь ими, болезнь Альцгеймера, FAF, синдром Дауна, другие связанные с амилоидозом нарушения, ассоциированные с прионами болезни, такие как куру, болезнь Крейтцфельдта-Якоба (CJD), синдром Герстмана-Страуслета-Шейнкера (Gerstmann-StraussletScheinker Syndrome (GSS, нейродегенеративные заболевания человека, ассоциированные с прионами, а также связанные с прионами заболевания животных, такие как почесуха, губчатая энцефалопатия, трансмиссивная энцефалопатия норок и хроническая истощающая болезнь мулов, оленей и лосей. Примеры Одним из главных недостатков применения пептидов в качестве лекарственных средств является их быстрая протеолитическая деградация в биологических жидкостях и тканях. В экспериментах in vitro iA5 (поcл. LPFFD, также обозначаемая в данном описании, как LeuProPhePheAsp) разрушается очень быстро после 17 инкубации in vitro со свежей человеческой плазмой. Как показано на фиг. 4 А, пятьдесят процентов пептида iA5 в присутствии плазмы исчезает в течение приблизительно 5 мин. Так как невозможно идентифицировать какие-либо метаболические фрагменты, полученные в результате протеолитического расщепления, вероятно, деградация в основном происходит под действием неспецифических экзопептидаз. Данный вывод подтверждается тем фактом, что защита амино-и карбоксиконцевых групп пептида ацетилированием и амидированием, соответственно, (с образованием Ac-iA5-Am, также обозначаемого в данном описании, как Ac-LeuProPhePheAsp-Am) значительно увеличивает стабильность пептида in vitro. Как показано на фиг. 4B, модифицированный пептид настоящего изобретения с защищенными концами (Ac-iA5Am) остается стабильным в человеческой плазме в течение периода, превышающего 24 ч.(Модифицированный пептид также медленно метаболизируется in vitro в микросомах печени человека и крысы, в которых через один час инкубации при 37 С 81,5% и 76,3% пептида остается интактным в человеческом и крысином тканевом гомогенате, соответственно.) Дополнительные исследования in vitro показали, что Ac-iA5-Am имеет такую же активность при ингибировании образования амилоида, как и iA5 (см. фиг.5 А), и эффект имеет такую же дозозависимость, как активность немодифицированного пептида, как показано на фиг.5 В и 5 С. Возвращаясь к фиг.5 А, можно видеть, что модификация N-конца с помощью Воc также позволяет сохранить in vitro активность,проявляемую iA5, тогда как некоторые неродственные пептиды (СР 1: VHVSEEGTEPA, СР 2:GYLTVAAVFRG, CP10: ISEVKMDAEF) или короткие фрагменты А (такие как А 18-21,А 1-16) в той же концентрации не оказывают влияния на фибриллогенез или слегка повышают образование амилоида путем включения в фибриллы. Для того, чтобы оценить эффект Ac-iA5Am in vivo, используют крысиную модель, в которой амилоидоз индуцируют интрацеребральной инъекцией неагрегированного А-42. По истечении некоторого времени пептид агрегирует в крысином мозгу, приводя к образованию одиночного амилоидподобного отложения в месте инъекции. Данные повреждения имеют такие же окрашивающие (двойное лучепреломление с конго-красным и связывание тиофлавина S) и светопропускающие (фибриллярная структура при электронной микроскопии) свойства, что и амилоидные бляшки при болезни Альцгеймера, и вызывают некоторое повреждение мозга, подобное наблюдаемому при БА,включая обширное сжатие нейронов, астроцитоз и активацию микроглии. С помощью данной модели авторами изобретения было показано, 004739 что совместная инъекция незащищенного iA5 и А 1-42 вызывает 50% ингибирование образования амилоидных бляшек, а и.ц. (интрацеребральная) инъекция iA5 животным, уже содержащим амилоидные бляшки, вызывает растворение 67% ранее образованных отложений(Sigurdsson, E.M., Permanne, В., Soto, С, Wisniewski, T.Frangione, В. (2000) In vivo disassembly of amyloid- deposits in rat brain. J. Neuropath. Exp. Neurol. 59: 11-17). В предыдущих экспериментах незащищенный пептид вводили непосредственно в участок мозга, в котором находился амилоид. В настоящем эксперименте амилоид-5 пептид вводят в миндалевидное тело крыс. Через 7 дней, время, необходимое для полного завершения образования амилоидных отложений, 100 мкл раствора, содержащего 13 мг/мл Ac-iA5-Am, вливали в течение трех недель, используя инфузионный насос ALZET,соединенный с боковым желудочком. Животных умерщвляли, и мозг анализировали на присутствие амилоидных отложений иммуногистохимическим методом. В данной модели компактную амилоидную бляшку получали в участке (миндалевидное тело), в котором находился раствор, содержащий А 1-42, а также несколько амилоидных отложений меньшего размера наблюдали на протяжении пути канюли в участках, расположенных ближе к желудочку (фиг. 6,левая панель). Результаты показывают, что инфузия пептида вызывает растворение 30% ранее образованной амилоидной бляшки и 83% отложений, расположенных вблизи желудочка (фиг. 6). Экспериментальные методы Анализы стабильности пептидов in vitro Пептиды получают в виде раствора в воде с концентрацией 1 мкг/мл. 20 мкл пептидного раствора разбавляют в 80 мкл свежей человеческой плазмы. Раствор инкубируют при 37 С в течение разных периодов времени, и реакцию останавливают путем добавления полного набора протеазных ингибиторов. Основную массу белков плазмы (но не пептиды) осаждают холодным метанолом (смесь/МеОН 4/5, об./об.) в течение одного часа при -20 С. Выпавшие в осадок белки осаждают центрифугированием(10000 g, 10 мин, 4 С). Супернатант, содержащий пептид, концентрируют в 5 раз под вакуумом и разделяют на обращеннофазовой ВЭЖХ. Измеряют область пика, соответствующего интактному пептиду, и сравнивают с площадью пика, соответствующего эквивалентному образцу, инкубированному без плазмы. Анализы активности in vitro Образование амилоида количественно оценивают по эмиссии флуоресценции тиофлавином Т (ТhТ), связанным с амилоидными фибриллами. Аликвоты раствора А с концентрацией 0,5 мг/мл, приготовленного в 0,1 М Tris, pH 7,4, инкубируют 7 дней при 37 С в отсутствие или присутствии различных концентраций iA5 и его производных. В конце инкубационного периода добавляют 50 мМ глицин, рН 9,2, и 2 мкМ Тh в конечного объема 2 мл. Флюоресценцию измеряют при длине волны возбуждения 435 нм и длине волны испускания 485 нм на флуоресцентном спектрометре Perkin Elmer,модель LS50B.In vivo исследования с использованием животной модели церебрального АР отложения В момент получения возраст самцов крысFisher-344 составляет 3-4 месяца, а вес 250-300 г. Животных помещают в клетки по 2, содержат при 12-часовом цикле чередования света и темноты с доступом к пище и воде ad libitum и приучают к новой среде в течение 2-3 недель перед хирургической операцией. Хирургическую операцию проводят под анестезией пентобарбиталом натрия (50 мг/кг, и.п.). Анестезированным животным подкожно вводят сульфат атропина(0,4 мг/кг) и натриевую соль ампициллина (50 мг/кг). А 1-42 растворяют в диметилсульфоксиде (DMSO) и затем разбавляют водой до получения 16,7% DMSO. Животное получает двустороннюю инъекцию 5,0 нмоль А 1-42 в каждую миндалину, которую осуществляют с помощью стереотаксического инструмента Kopf с полотном резца, установленным на 3,3 мм ниже межушной линии. Инъекционные координаты,измеряемые от темени и поверхности черепа(АР -3,0, ML4,6 DV -8,8) эмпирически определяли на основе атласа Паксиноса (Paxinos) и Ватсона (Watson). Объем 3,0 мкл вводят в течение 6 мин (скорость потока 0,5 мкл/мин) с помощью микрошприцевого насоса СМА/100. Канюлю оставляют in situ в течение 2 мин после инъекции, затем ее извлекают на 0,2 мм и оставляют на 3 мин, и через 5 мин канюлю медленно удаляют. После хирургической операции животных помещают на подушку с подогревом до восстановления у них установочного рефлекса. Для оценки эффекта Ac-5-Am животных подвергают второй хирургической операции через неделю после первой, при которой инфузионный насос ALZET соединяют с желудочком мозга, следуя указаниям производителя. Общее количество 1,3 мг пептида в 100 мкл PBS/10%DMSO доставляют в боковой желудочек в течение 3 недель. По прошествии данного периода времени животных умерщвляли избыточной дозой пентобарбитала натрия (150 мг/кг, и.п.),вливаемого через аорту. Для гистологического анализа вырезают последовательные коронарные сегменты (40 мкм) мозга, помещают в этиленгликолевый криопротектор и хранят при-20 С до окрашивания. Сегменты ткани окрашивают антителами против А 1-42, как описано в Soto, С, Sigursson, E., Morelli, L., Kumar, R.A.,Castano, E.M. and Frangione, В. (1998) -sheettherapy. Nature med. 4: 822-826. Для определения размера амилоидных отложений используют систему визуального анализа. Данные анализируют с помощью двухходового ANOVA с последующим тестированием по Newman-Keuls с множеством диапазонов для post hoc сравнений. Общее количество отложений в мозгу анализируют, используя непарный t-тест, с двойной выборкой. Имея теперь полное описание данного изобретения, специалисты в данной области могут оценить, что такие эксперименты могут быть проведены в широком интервале эквивалентных параметров, концентраций и условий без отклонения от сущности и объема данного изобретения и без надлежащих экспериментов. Так как данное изобретение было описано на примере его конкретных воплощений, следует понимать, что оно может быть подвергнуто дополнительным модификациям. Данная заявка предназначена для охвата любых вариаций,применений или приспособлений изобретений при соблюдении в общих чертах принципов данного изобретения и включает такие отклонения от данного описания, как возникающие в пределах известной или привычной практики в данной области, к которой относится данное изобретение, и как те, которые могут применяться к существенным признакам, описанным выше,как следует из объема прилагающейся формулы. Все ссылки, цитируемые в данном описании, включая журнальные статьи или рефераты,опубликованные или соответствующие патентные заявки США или других стран, или любые другие ссылки, полностью включены в данное описание, включая все данные, таблицы, цифры и текст, представленные в цитируемых ссылках. Дополнительно полное содержание цитируемых ссылок в объеме ссылок, цитируемых в данном описании,также полностью включено в качестве ссылки. Ссылки на известные стадии способа, общепринятые стадии способов, известные или общепринятые способы никоим образом не позволяют допустить, что любой аспект, описание или воплощение настоящего изобретения раскрыты, подразумеваются или предполагаются в родственной области. Настоящее описание конкретных воплощений таким образом отражает общую природу изобретения, что другие лица могут, приложив знания в области навыков в данной области(включая содержание цитируемых здесь ссылок), легко модифицировать и/или адаптировать для различных применений данные конкретные воплощения без излишнего экспериментирования и отступления от общей концепции настоящего изобретения. Следовательно, подразумевается, что такие адаптации и модификации находятся в пределах значения и диапазона эквивалентов раскрытых воплощений, основанных на указаниях и руководстве, представленных здесь. Следует понимать, что фразеология или терми 21 нология в данном документе служит цели описания, а не ограничения, так что терминологию или фразеологию настоящего описания следует интерпретировать квалифицированному специалисту в данной области в свете указаний и руководства, представленных в данном документе, в сочетании со знаниями рядового специалиста в данной области. Список последовательностей 22 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Ингибиторный пептид, способный ингибировать образование -складчатой структуры в амилоидном -пептиде, представляющий собой аналог ингибиторного пептида болезни Альцгеймера iA5, состоящий из 5 остатков (SEQ IDNO:1 Leu-Pro-Phe-Phe-Asp), сконструированный путем химической модификации SEQ ID NO:1,при этом указанная химическая модификация достигается с помощью способа, выбранного из группы, состоящей из изменения N- и С-концов указанного ингибиторного пептида болезни Альцгеймера iA5; замены по меньшей мере одного остатка указанного ингибиторного пептида болезни Альцгеймера iA5 на аминоизомасляную кислоту (Aib); метилирования -углеродного атома по меньшей мере одного остатка указанного ингибиторного пептида болезни Альцгеймера iA5; замены по меньшей мере одного L-энантиомерного остатка указанного ингибиторного пептида болезни Альцгеймера iA5 на D-энантиомерный остаток, проведения циклизации "голова-к-хвосту" указанного ингибиторного пептида болезни АльцгеймераiA5, замены амидных связей в указанном ингибиторном пептиде болезни Альцгеймера iA5 на заменитель амидной связи и их сочетаний. 2. Ингибиторный пептид по п.1, отличающийся тем, что указанное изменение N- и Сконцов указанного ингибиторного пептида болезни Альцгеймера iA5 достигается с помощью способа, выбранного из ацетилирования,амидирования, дезаминирования, алкоголизации и их сочетаний. 3. Ингибиторный пептид по п. 2, отличающийся тем, что указанный ингибиторный пептид выбран из группы, состоящей из 4. Ингибиторный пептид по п.3, отличающийся тем, что указанный ингибиторный пептид представляет собой ас-Leu Pro Phe Phe Aspam. 5. Ингибиторный пептид по п.1, отличающийся тем, что указанный ингибиторный пептид выбран из группы, состоящей из 24 остаток, проведения циклизации "голова-кхвосту" указанного прионового ингибиторного пептида iPrP13, замены амидных связей в указанном прионовом ингибиторном пептидеiPrP13 на заменитель амидной связи и их сочетаний. 8. Ингибиторный пептид по п.7, отличающийся тем, что указанное изменение N- и Сконцов указанного прионового ингибиторного пептида iPrP13 достигается с помощью способа,выбранного из ацетилирования, амидирования,дезаминирования, алкоголизации и их сочетаний. 9. Ингибиторный пептид по п.8, отличающийся тем, что указанный ингибиторный пептид выбран из группы, состоящей из 10. Ингибиторный пептид по п.7, отличающийся тем, что указанный ингибиторный пептид выбран из группы, состоящей из 6. Ингибиторный пептид по п.1, отличающийся тем, что указанный ингибиторный пептид характеризуется следующей структурой: 7. Ингибиторный пептид, способный ингибировать конформационные изменения в прионовом белке РrР, связанном с амилоидозом,представляющий собой аналог прионового ингибиторного пептида iPrP13, состоящий из 13 остатков (SEQ ID NO:2 Asp Ala Pro Ala Ala ProAla Gly Pro Ala Val Pro Val), сконструированный путем химической модификации SEQ IDNO:2, при этом указанная химическая модификация достигается с помощью способа, выбранного из группы, состоящей из изменения N- и Сконцов указанного прионового ингибиторного пептида iPrP13; замены по меньшей мере одного остатка указанного прионового ингибиторного пептида iPrP13 на -аминоизомасляную кислоту(Aib); метилирования -углеродного атома по меньшей мере одного остатка указанного прионового ингибиторного пептида iPrP13; замены по меньшей мере одного L-энантиомерного остатка указанного прионового ингибиторного пептида iPrP13 на D-энантиомерный 25 11. Ингибиторный пептид по п.7, отличающийся тем, что указанный ингибиторный пептид характеризуется следующей структурой: 12. Способ уменьшения образования амилоидных или амилоидподобных отложений,включающего аномальную укладку амилоидного -пептида в -складчатую структуру, или уменьшения количества указанного амилоидного -пептида, который уже сформировался в бета-складчатую структуру, включающий контактирование указанного амилоидного пептида, либо до, либо после его аномальной укладки в -складчатую структуру с эффективным количеством пептида по п.1. 13. Способ уменьшения образования амилоидных или амилоидподобных отложений,включающего конформационные изменения в прионовом белке Рr, или уменьшения количества указанного прионового белка Рr, который уже сформировался в амилоидные или амилоидподобные отложения, включающий контактирование указанного прионового белка Рr, либо до, либо после указанных конформационных изменений, приводящих к образованию амилоидных отложений с эффективным количеством пептида по п.7. 14. Способ уменьшения образования амилоидных или амилоидподобных отложений путем введения ингибиторного пептида, выбранного из группы, состоящей из 15. Фармацевтическая композиция, включающая ингибиторный пептид, ингибирующий образование -складчатой структуры в амилоидном -пептиде, и фармацевтически приемлемый носитель или наполнитель, при этом указанный ингибиторный пептид представляет собой аналог ингибиторного пептида болезни Альцгеймера iA5, состоящий из 5 остатков(SEQ ID NO:1 Leu-Pro-Phe-Phe-Asp), сконструированный путем химической модификации SEQID NO:1, при этом указанная химическая модификация достигается с помощью способа, выбранного из группы, состоящей из изменения Nи С-концов указанного ингибиторного пептида болезни Альцгеймера iA5; замены по меньшей мере одного остатка указанного ингибиторного пептида болезни Альцгеймера iA5 на аминоизомасляную кислоту (Aib); метилирова 004739 26 ния -углеродного атома по меньшей мере одного остатка указанного ингибиторного пептида болезни Альцгеймера iA5; замены по меньшей мере одного L-энантиомерного остатка указанного ингибиторного пептида болезни Альцгеймера iA5 на D-энантиомерный остаток, проведения циклизации "голова-к-хвосту" указанного ингибиторного пептида болезни АльцгеймераiA5, замены амидных связей в указанном ингибиторном пептиде болезни Альцгеймера iA5 на заменитель амидной связи и их сочетаний. 16. Фармацевтическая композиция по п.15,отличающаяся тем, что указанный ингибиторный пептид выбран из группы, состоящей из 17. Фармацевтическая композиция по п.15,отличающаяся тем, что указанный ингибиторный пептид представляет собой ас-Leu Pro PhePhe Asp-am. 18. Фармацевтическая композиция по п.15,отличающаяся тем, что указанный ингибиторный пептид выбран из группы, состоящей из 19. Фармацевтическая композиция по п.15,отличающаяся тем, что указанный ингибитор 27 ный пептид характеризуется следующей структурой: 20. Фармацевтическая композиция, включающая ингибиторный пептид, ингибирующий конформационные изменения в прионовом белке РrР, связанном с амилоидозом, и фармацевтически приемлемый носитель или наполнитель, при этом указанный ингибиторный пептид представляет собой аналог прионового ингибиторного пептида iPrP13, состоящий из 13 остатков (SEQ ID NO:2 Asp Ala Pro Ala Ala Pro AlaGly Pro Ala Val Pro Val), сконструированный путем химической модификации SEQ ID NO:2,при этом указанная химическая модификация достигается с помощью способа, выбранного из группы, состоящей из изменения N- и С-концов указанного прионового ингибиторного пептидаiPrP13; замены по меньшей мере одного остатка указанного прионового ингибиторного пептидаiPrP13 на -аминоизомасляную кислоту (Aib); метилирования aaa-углеродного атома по меньшей мере одного остатка указанного прионового ингибиторного пептида iPrP13; замены по меньшей мере одного L-энантиомерного остатка указанного прионового ингибиторного пептидаiPrP13 на D-энантиомерный остаток, проведения циклизации "голова-к-хвосту" указанного прионового ингибиторного пептида iPrP13, замены амидных связей в указанном прионовом ингибиторном пептиде iPrP13 на заменитель амидной связи и их сочетаний. 21. Фармацевтическая композиция по п.20,отличающаяся тем, что указанный ингибиторный пептид выбран из группы, состоящей из 22. Фармацевтическая композиция по п.20,отличающаяся тем, что указанный ингибиторный пептид выбран из группы, состоящей из 23. Фармацевтическая композиция по п.20,отличающаяся тем, что указанный ингибиторный пептид характеризуется следующей структурой:
МПК / Метки
МПК: A01N 37/18, A61K 38/00, C07K 14/00, A61P 25/28
Метки: амилоидподобные, укладкой, аналоги, beta-складками, отложения, миметики, обогащенные, лечении, патологические, подходящие, амилоидные, пептидные, заболеваний, связанных, предшественники, белков, применения, аномальной
Код ссылки
<a href="https://eas.patents.su/16-4739-peptidnye-analogi-i-mimetiki-podhodyashhie-dlya-primeneniya-in-vivo-pri-lechenii-zabolevanijj-svyazannyh-s-anomalnojj-ukladkojj-belkov-v-amiloidnye-ili-amiloidpodobnye-otlozheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Пептидные аналоги и миметики, подходящие для применения in vivo при лечении заболеваний, связанных с аномальной укладкой белков в амилоидные или амилоидподобные отложения, или их патологические предшественники, обогащенные &beta-складками</a>
Предыдущий патент: Новые циклобутаиндолкарбоксамидные производные, способ их получения и содержащие их фармацевтические композиции
Следующий патент: Интерлейкин-5 ингибирующие производные 6-азаурацила
Случайный патент: Система управления игрой, блок карты и сервер управления игрой












