Способ получения &alpha, &beta – ненасыщенной алкеноатной смолы
Номер патента: 4741
Опубликовано: 26.08.2004
Авторы: Мейсон Хелен Дж., Салвино Джозеф М., Мортон Джордж К., Лабадиньер Ришар Ф.
Формула / Реферат
1. Способ получения a ,b -ненасыщенной алкеноатной смолы формулы
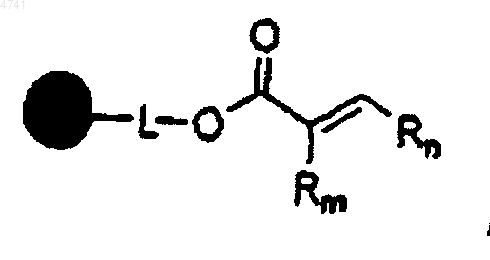
где  представляет твердый носитель;
представляет твердый носитель;
L отсутствует или представляет связывающую группу;
Rm представляет H или алифатическую группу и
Rn представляет алифатическую или ароматическую группу,
включающий
(a) обработку смеси, содержащейся в реакционном сосуде, первого растворителя и полимерной фосфонацетокси-смолы формулы
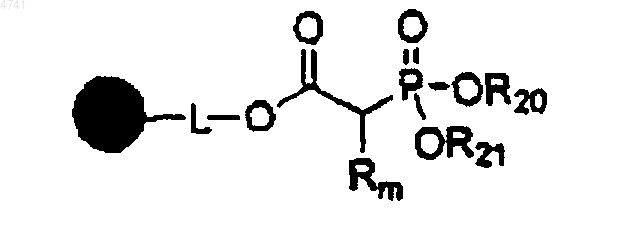
избытком основания;
(b) сливание растворителя из реакционного сосуда и
(c) добавление раствора альдегида формулы RnCHO в менее полярном втором растворителе.
2. Способ по п.1, отличающийся тем, что L представляет связывающую группу формулы
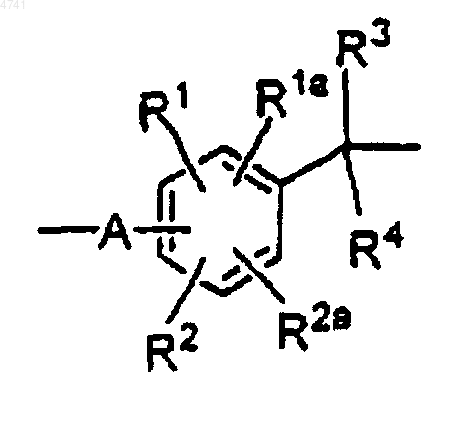
где A отсутствует или представляет группу формулы -X1-Z-, где X1 представляет -CHR- или -CHR-Y-(CH2)n-, где R представляет H, алкил, фенил или фенил, замещенный -H, алкилом, алкокси, галогеном, нитрилом или -NO2,
Y представляет -O- или -NH-,
n представляет целое число от 1 до 6 и
Z представляет -O- или -NH-;
R1, R1a, R2 и R2a независимо представляют заместители кольца и
R3 и R4 независимо представляют -H, алкил, фенил или фенил, замещенный одним или несколькими заместителями, выбранными из алкила, алкокси, галогена, нитрила и -NO2;
или один из R1 и R2, взятый вместе с одним из R3 и R4 и атомами углерода, с которыми они связаны, определяют связывающую группу формулы
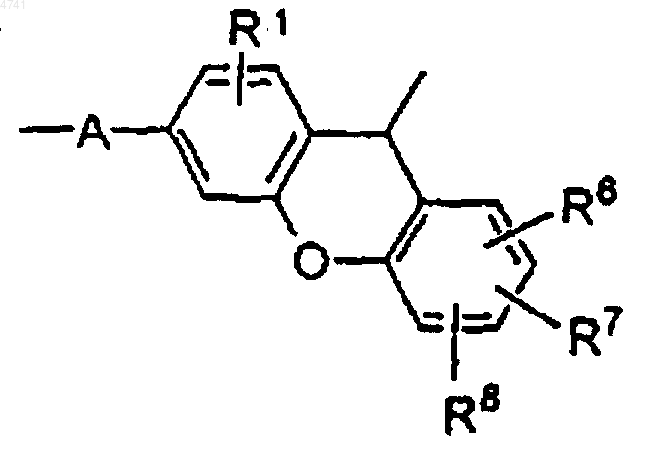
где R1 представляют -H, алкил, алкокси, галоген, нитрил или -NO2 и
R6, R7 и R8 независимо выбирают из -H, алкила, алкокси, галогена, нитрила или -NO2-.
Текст
1 Данное изобретение представляет собой частичное продолжение заявки на международный патент PCT/US 97/23920, поданной 17 декабря 1997, в которой заявляется практическая полезность заявки на патент США 60/032,453, поданной 19 декабря 1996, и заявки на патент США 60/033,881, поданной 24 декабря 1996; а также является частичным продолжением заявки на патент США 08/928,943, поданной 23 февраля 1998, которая в свою очередь является продолжением заявки на международный патент PCT/US 97/00264, поданной 2 января 1997. Данное изобретение относится к способам твердофазного синтеза альдегида, кетона, оксима, амина, гидроксамовой кислоты, ,ненасыщенной карбоновой кислоты и альдегидных соединений и к используемым для этого полимерным гидроксиламиновым смолам. Методики твердофазного синтеза, в которых реагент иммобилизован на полимерном материале, который является инертным к используемым реагентам и условиям реакций, а также нерастворимым в используемой реакционной среде, представляют собой важное синтетическое средство для получения амидов, пептидов и гидроксамовых кислот. Твердофазный пептидный синтез раскрыт в J.M. Stewart andApproach (Твердофазный синтез пептидов: практический подход), IRL Press at Oxford University Press (Oxford, 1989). Применение твердофазного синтеза для получения непептидных молекул описано в Leznoff, С.С, Асе. Chem.Res., 11, 327-333 (1978). Ряд полимерных реагентов нашел применение в синтезе для преобразования простых функциональных групп. Смотри A. Akelah andReagents, Polymer supported Catalysts, and Polymer Supported Coupling Reactions (Реагенты на полимерном носителе, катализаторы на полимерном носителе и реагенты присоединения на полимерном носителе), в Preparative Chemistryusing Supported Reagents, Pierre Laszlo, ed., Academic Press, Inc., 193-212 (1987). Использование полимерных реагентов в реакциях окисления раскрыто в J.M.J. Frechet et al., J. Org. Chem., 43,2618 (1978) и G. Cainelli et al., J. Am. Chem. Soa.,98, 6737 (1976). Применение полимерных реагентов в реакциях галогенирования описано вPolym. J., 13, 73, (1977). Применение полимерных реагентов в реакциях эпоксидирования описано в J.M.J. Frechet et al., Macromolecules, 8,130 (1975) и С. R. Harrison et al., J. Chem. Soc.Chem. Commun., 1009 (1974). Применение полимерных реагентов в реакциях ацилирования раскрыто в M.В. Shambhu et al., Tet. Lett., 1627Commun., 619 (1974). Применение полимерных реагентов в реакциях Виттига описано в S.V.McKinley et al., J. Chem. Soc. Chem. Commun. 134 (1972). Полимерные реагенты также нашли широкое применение в комбинаторном синтезе и для получения комбинаторных библиотек. Смотри,F. Balkenhohl et al., Angew. Chem. Int. Ed. Engl.,35, 2288-2337 (1996) и L.A. Thompson et al.,Chem. Rev., 96, 555-600 (1996). Преимуществом полимерных реагентов является легкость отделения от низкомолекулярных исходных реагентов или продуктов реакции с помощью фильтрования или селективного осаждения. Полимерный реагент в избытке может использоваться также для осуществления быстрых и с количественным выходом реакций,как, например, в случаях ацилирования, или можно использовать большой избыток реагентов для смещения равновесия реакции в направлении образования продукта, по существу, с количественной конверсией продукта, как, например, в твердофазном синтезе пептидов. Дополнительное преимущество реагентов и катализаторов на носителе заключается в том, что их можно рециркулировать, и то, что они легко поддаются способам автоматизации. Кроме того, аналоги на носителе токсичных и пахучих реагентов более безопасны для применения. В заявке PСТ WO 96/26223 описан синтез соединений гидроксамовой кислоты с использованием твердофазного гидроксиламинового субстрата.Prasad et al. описал O-метилгидроксиламинполистирольную смолу в J. Steroid Biochem., 18,257-261 (1983). Связанные со смолой Beйнреб (Weinreb)подобные амиды описаны Fehrentz et al., Tet.Wipf et al., J. Org. Chem., 1997, 62, 1586 и Johnson et al., Tetrahedron Lett., 1995, 36, 9253. Данное изобретение относится к способу получения ,-ненасыщенной алкеноатной смолы формулыL отсутствует или представляет связывающую группу;Rm представляет H или алифатическую группу иRn представляет алифатическую или ароматическую группу,включающему(а) обработку смеси в реакционном сосуде первого растворителя и полимерной фосфонацетоксисмолой формулы(b) сливание растворителя из реакционного сосуда и(c) добавление раствора альдегида формулы RnCHO в менее полярном втором растворителе. Определение терминов Как использовано выше, а также по всему описанию изобретения, следует понимать, что следующие термины, если не указано другого,имеют следующие значения."Твердый носитель" означает субстрат, который является инертным по отношению к описанным здесь реагентам и условиям реакции, а также по существу он является нерастворимым в используемых средах. Примеры твердых носителей включают неорганические субстраты,такие как кизельгур, силикагель и стекло с контролируемым размером пор; органические полимеры, включая полистирол, содержащий 12% сополимера стирола и дивинилбензола(форма геля) и 20-40% сополимера стирола дивинилбензола (макропористая форма), полипропилен, полиэтиленгликоль, полиакриламид,целлюлозу и тому подобные; и композитные неорганические/полимерные композиции, такие как полиакриламид, нанесенный на матрицу частиц кизельгура. Смотри, J.M. Stewart and J.D.Young, Solid Phase Peptide Synthesis, 2nd Ed.,Pierce Chemical Co (Chicago, IL, 1984). Твердый носитель в данном описании обычно обозначен как Кроме того "твердый носитель" включает твердый носитель, как определено выше, который соединен со вторым инертным носителем,таким как пины (штифты), описанные в Техническом справочнике Multipin SPOC, ChironTechnologies (1995) и имеющихся там ссылках,которые содержат съемную головку на основе полиэтилена или полипропилена с привитым аминофункционализированным метакрилатным сополимером и инертный штырь. Кроме того, "твердый носитель" включает полимерные носители, такие как полиэтиленгликолевые носители, описанные Janda et al.,Proc. Natl. Acad. Sci. USA, 92, 6419-6423 (1995) 4 и S. Brenner, WO 95/16918, которые растворимы во многих растворителях, но могут быть осаждены при добавлении осаждающего растворителя. В дополнение, "твердый носитель" включает полимерные носители, как описано выше,содержащие один или несколько атомов фтора. Полимерные носители, содержащие один или несколько атомов фтора получают полимеризацией с использованием известных в данной области способов, для того, чтобы ввести один или несколько фторсодержащих мономеров в твердый носитель. Примеры подходящих фторсодержащих мономеров включают 4-фторстирол, 4-трифторметилстирол, 2-фтор-4-винилбензилхлорид и тому подобные. Полимерные носители, содержащие один или несколько атомов фтора, легко получают, например, сополимеризацией смесей 4-фторстирола, стирола, 1,4 дивинилбензола и 4-винилбензилхлорида. Подробное описание способа синтеза фторированных смол дано в PCT/US 98/26512, поданной 14 декабря 1998, и включено в данное описание в качестве ссылки. Твердые носители, содержащие один или несколько атомов фтора, могут быть обозначены в данном описании как"Полимерная гидроксиламиновая смола" означает твердый носитель, как определено выше, который химически модифицирован известными в данной области методами с целью введения множества гидроксиламиновых групп(-ОNН 2) или защищенных гидроксиламиновых групп (-ONHP). Гидроксиламиновые группы или защищенные гидроксиламиновые группы ковалентно связаны непосредственно с твердым носителем или присоединены к твердому носителю посредством ковалентных связей через связывающую группу. Полимерные гидроксиламиновые смолы в соответствии с аспектом способа данного изобретения обозначены здесь как где представляет собой твердый носитель, как определено в данном описании, L отсутствует или представляет собой связывающую группу, а Р представляет собой защитную группу амина."Связывающая группа" или "линкер" означает группу, посредством которой амино- или аминометильная группа может быть ковалентно связана с твердым носителем. Связывающая группа обычно инертна к описанным в данном изобретении реагентам и условиям реакции."Защитная группа амина" означает легко удаляемую группу, которая известна в данной 5 области для защиты аминогруппы от нежелательного взаимодействия в процессе синтеза и может быть селективно удалена. Применение Nзащитных групп хорошо известно в данной области для защиты групп против нежелательных взаимодействий в процессе синтеза и известны многие такие защитные группы, см., например,Т.Н. Greene and P.G.M. Wuts. Protective GroupsN-защитные группы представляют собой ацил,включая формил, ацетил, хлорацетил, трихлорацетил, о-нитрофенилацетил, о-нитрофеноксиацетил, трифторацетил, ацетоацетил, 4-хлорбутирил, изобутирил, о-нитроциннамоил, пиколиноил, ацилизотиоцианат, аминокапроил, бензоил и тому подобные, и ацилокси, включая метоксикарбонил, 9-флуоренилметоксикарбонил,2,2,2-трифторэтоксикарбонил,2-триметилсилилэтоксикарбонил, винилоксикарбонил, аллилоксикарбонил, трет-бутилоксикарбонил (ВОС),1,1-диметилпропинилоксикарбонил, бензилоксикарбонил (CBZ), п-нитрофенилсульфинил, пнитробензилоксикарбонил, 2,4-дихлорбензилоксикарбонил, аллилоксикарбонил (Alloc) и тому подобные."кислотная защитная группа" означает легко удаляемую группу, которая известна в данной области для защиты карбоксильной группы(-СО 2 Н) от нежелательного взаимодействия в процессе синтеза и удаляется селективно. Применение защитных групп карбоновой кислоты хорошо известно в данной области и известны многие такие защитные группы, см., например,Т.Н. Greene and P.G.M. Wuts, Protective GroupsSons, New York (1991), которые включены в данное описание в качестве ссылки. Примеры защитных групп карбоновых кислот включают сложные эфиры, такие как метоксиметил, метилтиометил, тетрагидропиранил, бензилоксиметил, замещенный и незамещенный фенацил,2,2,2-трихлорэтил, трет-бутил, циннамил, замещенный и незамещенный бензил, триметилсилил, аллил и тому подобные, и амиды и гидразиды, включая N,N-диметил, 7-нитроиндолил,гидразид, N-фенилгидразид и тому подобные. Особенно предпочтительными защитными группами карбоновых кислот являются третбутил и бензил."Защитная группа гидроксила" означает легко удаляемую группу, которая известна в данной области для защиты гидроксильной группы от нежелательного взаимодействия в процессе синтеза и удаляется селективно. Применение защитных групп гидроксила хорошо известно в данной области и известны многие такие защитные группы,см., например, Т.Н. Greene and P.G.M. Wuts, Protective Groups in Organic Synthesis, 2nd edition, John 6 ны в данное описание в качестве ссылки. Примеры защитных групп гидроксила включают простые эфиры, такие как метиловый, замещенные метиловые простые эфиры, такие как метоксиметиловый (MOM), метилтиометиловый (МТМ), 2 метоксиэтоксиметиловый (MEM), бис(2-хлорэтокси)метиловый, тетрагидропираниловый (ТНР),тетрагидротиопираниловый, 4-метокситетрагидропираниловый, 4-метокситетрагидротиопираниловый, тетрагидрофураниловый, тетрагидротиофураниловый и тому подобные, замещенные этиловые простые эфиры, такие как 1-этоксиэтиловый, 1-метил-1-метоксиэтиловый, 2-(фенилселенил)этиловый, трет-бутиловый, аллиловый,бензиловый, о-нитробензиловый, трифенилметиловый, а-нафтилдифенилметиловый, п-метоксифенилдифенилметиловый, 9-(9-фенил-10-оксо)антраниловый (тритилон) и тому подобные, силиловые простые эфиры, такие как триметилсилиловый"Аминокислота" означает аминокислоту,выбранную из группы, состоящей из природных и неприродных аминокислот, как определено в данном описании."Неприродная аминокислота" означает аминокислоту, для которой не имеется кодона нуклеиновой кислоты. Примеры неприродных аминокислот включают, например, D-изомеры природных -аминокислот, как указано выше; аминобутановую кислоту (Aib), 3-аминоизобутановую кислоту (bAib), норвалин (Nva), Ala, 2-аминоадипиновую кислоту (Aad), 3-аминоадипиновую кислоту (bAad), 2-аминобутановую кислоту (Abu), -аминобутановую кислоту (Gaba), 6-аминокапроновую кислоту (Аср),2,4-диаминобутановую кислоту (Dbu), -аминопимелиновую кислоту, триметилсилил-Ala 7 аминокислоты; N-алкилированные аминокислоты, такие как N-метилглицин (MeGly), Nэтилглицин (EtGly) и N-этиласпарагин (EtAsp); и аминокислоты, в которых -углерод связан с двумя заместителями боковой цепи."Эквивалентная аминокислота" означает аминокислоту, которая может быть замещена на другую аминокислоту в пептиде согласно изобретению, без какой-либо явной потери функции. При таких изменениях замещения подобных аминокислот проводят на основе относительного подобия заместителей боковой цепи,например, с точки зрения размера, заряда, гидрофильности, гидропрохождения и гидрофобности, как здесь описано."Пептид" или "полипептид" означает полимер, в котором мономеры представляют собой остатки природных или неприродных аминокислот, связанных вместе посредством амидных связей. Термин "пептидная основная цепь" означает ряд амидных связей, которыми соединены остатки аминокислот. Термин "остаток аминокислоты" означает отдельные звенья аминокислот, введенных в пептиды или полипептиды."Алифатический" означает радикал, полученный из неароматической С-Н связи при удалении атома водорода. Алифатический радикал может быть дополнительно замещен дополнительными алифатическими или ароматическими радикалами, определенными в данном описании. Представителями алифатических групп являются алкил, алкенил, алкинил, циклоалкил,циклоалкенил, гетероциклил, гетероцикленил,аралкенил, аралкилоксиалкил, аралкилоксикарбонилалкил, аралкил, аралкинил, аралкилоксиалкенил, гетероаралкенил, гетероаралкил,гетероаралкилоксиалкенил, гетероаралкилоксиалкил, гетероаралкинил, конденсированный арилциклоалкил, конденсированный гетероарилциклоалкил, конденсированный арилциклоалкенил, конденсированный гетероарилциклоалкенил, конденсированный арилгетероциклил, конденсированный гетероарилгетероциклил, конденсированный арилгетероцикленил,конденсированный гетероарилгетероцикленил и тому подобные. "Алифатический", как это использовано в данном описании, также включает остаточные некарбоксильные части природных и неприродных аминокислот, как они определены в данном описании."Ароматический" означает радикал, полученный из ароматической С-Н связи при удалении атома водорода. Ароматический радикал включает как арильные, так и гетероарильные кольца, как определено в данном описании. Арильное или гетероарильное кольцо может быть дополнительно замещено дополнительными алифатическими или ароматическими радикалами, как определено в данном описании. Представителями ароматических групп являют 004741"Кислотная биоизостера" означает группу,которая имеет химическое и физическое сходство, приводящее к подобным биологическим свойствам (см. Lipinski, Annual Reports in Medicinal Chemistry, 1986, 21, p.283 "BioisosterismTo New Drug Design (Применение биоизостеризма для создания новых лекарственных средств)"; Zhao, Huaxue Tongbao, 1995, p. 34-38Lead Compounds In Drug Design (Биоизостерическая замена и конструирование соединений свинца в создании лекарственных средств)";Electronic Distributions In Bioisosteres" (Теоретические исследования, используемые при разработке лекарственных средств: ab initio Электронные распределения в биоизостерах). Примеры подходящих кислотных биоизостер включают"Ацил" означает Н-СО- или алкил-СОгруппу, где алкильная группа является такой,как определено в данном описании. Предпочтительные ацилы содержат низший алкил. Примеры ацильных групп включают формил, ацетил,пропаноил, 2-метилпропаноил, бутаноил и пальмитоил."Алкенил" означает линейную или разветвленную алифатическую углеводородную группу, содержащую от 2 до около 15 атомов углерода, которая содержит по крайней мере одну углерод-углеродную двойную связь. Предпочтительные алкенильные группы содержат от 2 до примерно 12 атомов углерода; более предпочтительные алкенильные группы имеют от 2 до примерно 4 атомов углерода. Алкенильная 9 группа необязательно замещена одной или несколькими алкильными группами, как определено в данном описании. Представителями алкенильных групп являются этенил, пропенил, нбутенил, изобутенил, 3-метилбут-2-енил, нпентенил, гептенил, октенил, циклогексилбутенил и деценил."Алкенилокси" означает группу алкенилO-, где алкенильная группа является такой, как определено в данном описании. Примеры алкенилоксигрупп включают аллилокси или 3 бутенилокси."Алкокси" означает группу алкил-О-, где алкильная группа является такой, как определено в данном описании. Примеры алкоксигрупп включают метокси, этокси, н-пропокси, изопропокси, н-бутокси, гептокси и тому подобные."Алкоксиалкиленил" означает группу алкил-О-алкилен-, где алкил и алкилен такие, как определено в данном описании. Представителями алкоксиалкильных групп являются метоксиэтил, этоксиметил, н-бутоксиметил и циклопентилметилоксиэтил."Алкоксиалкокси" означает группу алкилО-алкиленил-О-. Примеры алкоксиалкокси включают метоксиметокси, метоксиэтокси,этоксиэтокси и тому подобные."Алкоксикарбонил" означает сложноэфирную группу, т.е. группу алкил-O-СО-, где алкил является таким, как определено в данном описании. Представителями алкоксикарбонильных групп являются метоксикарбонил, этоксикарбонил, трет-бутоксикарбонил и тому подобные."Алкоксикарбонилалкил" означает алкилO-СО-алкиленовую группу, где алкил и алкилен являются такими, как определено в данном описании. Представителями алкоксикарбонилалкилов являются метоксикарбонилметил и этоксикарбонилметил, метоксикарбонилэтил и тому подобные."Алкил" означает алифатическую углеводородную группу, которая может быть линейной или разветвленной и имеет примерно от 1 до 20 атомов углерода в цепи. Предпочтительные алкильные группы имеют примерно от 1 до 12 атомов углерода в цепи. Под разветвленной группой подразумевается, что один или несколько низших алкильных групп, таких как метил, этил или пропил, присоединено к линейной алкильной цепи. "Низший алкил" означает,что в цепи, которая может быть линейной или разветвленной, имеется примерно от 1 до 4 атомов углерода. Алкил необязательно замещен одним или несколькими "заместителями алкильной группы", которые могут быть одинаковыми или различными и включают галоген,циклоалкил, гидрокси, алкокси, амино, карбамоил, ациламино, ароиламино, карбокси, алкоксикарбонил, аралкилоксикарбонил или гетероаралкилоксикарбонил. Примеры алкильных групп включают метил, трифторметил, цикло 004741"Алкилен" означает линейную или разветвленную двухвалентную углеводородную цепь, содержащую примерно от 1 до 6 атомов углерода. Алкилен необязательно замещен одним или несколькими "заместителями алкиленовой группы", которые могут быть одинаковыми или различными и включают галоген,циклоалкил, гидрокси, алкокси, карбамоил, карбокси, циано, арил, гетероарил или оксо. Алкилен необязательно может быть прерванным, то есть его атом углерода замещен на -O-,-S(O)m (где m равен 0-2), фенилен или -NR'- (гдеR' представляет низший алкил). Предпочтительными алкиленовыми группами являются низшие алкиленовые группы, имеющие от 1 до примерно 4 атомов углерода. Представителями алкиленовых групп являются метилен, этилен и тому подобные."Алкенилен" означает линейную или разветвленную двухвалентную углеводородную цепь, содержащую по крайней мере одну углерод-углеродную двойную связь. Алкенилен необязательно замещен одним или несколькими"заместителями алкиленовой группы", как определено в данном описании. Алкенилен необязательно может быть прерванным, то есть его атом углерода замещен на -О-, -S(O)m (где m равен 0-2), фенилен или -NR'- (где R' представляет низший алкил). Примеры алкенилена включают"Алкинилен" означает линейную или разветвленную двухвалентную углеводородную цепь, содержащую по крайней мере одну углерод-углеродную тройную связь. Алкинилен необязательно замещен одним или несколькими"заместителями алкиленовой группы", как определено в данном описании. Алкинилен необязательно может быть прерванным, то есть его атом углерода замещен на -О-, -S(O)m (где m равен 0-2), фенилен или -NR'- (где R' представляет низший алкил). Примеры алкинилена включают -СНСН, -СНСН-СН 2-, -СНСНСН(СН 3)- и тому подобные."Алкилсульфинил" означает алкил-SOгруппу, где алкильная группа определена выше. Предпочтительными алкилсульфинильными группами являются те, в которых алкильная группа представляет собой низший алкил."Алкилсульфонил" означает алкил-SO2 группу, где алкильная группа определена выше. Предпочтительными алкилсульфонильными группами являются группы, алкильная группа которых представляет собой низший алкил. 11 определена выше. Предпочтительными алкилсульфонилкарбамоильными группами являются те, в которых алкильная группа представляет собой низший алкил."Алкилтио" означает алкил-S-группу, где алкильная группа определена в данном описании. Предпочтительными алкилтиогруппами являются те, в которых алкильная группа представляет собой низший алкил. Представителями алкилтиогрупп являются метилтио, этилтио,изопропилтио, гептилтио и тому подобные."Алкинил" означает линейную или разветвленную алифатическую углеводородную группу, включающую от 2 до примерно 15 атомов углерода, которая содержит по крайней мере одну углерод-углеродную тройную связь. Предпочтительные алкинильные группы содержат от 2 до примерно 12 атомов углерода. Более предпочтительные алкинильные группы содержат от 2 до примерно 4 атомов углерода. Низший алкинил означает алкинил, содержащий от 2 до примерно 4 атомов углерода. Алкинильная группа может быть замещена одним или несколькими заместителями алкильной группы,как определено в данном описании. Представителями алкинильных групп являются этинил,пропинил, н-бутинил, 2-бутинил, 3-метилбутинил, н-пентинил, гептинил, октинил, децинил и тому подобные."Алкинилокси" означает алкинил-Oгруппу, где алкинильная группа определена выше. Представителями алкинилоксигрупп являются пропинилокси, 3-бутинилокси и тому подобные."Амидино" или "амидин" означает группу формулы где R25 представляет водород; R27O2C, где R27 представляет водород, алкил, аралкил или гетероаралкил; R27O-; R27C(O)-; циано; алкил; нитро или амино, a R26 выбирают из водорода, алкила,аралкила и гетероаралкила."Амино" означает группу формулы Y1Y2N-,где Y1 и Y2 независимо представляют водород,ацил или алкил или Y1 и Y2, взятые вместе с атомом N, через который Y1 и Y2 связаны, образуют 4-7-членный азагетероциклил. Представителями аминогруппы являются амино (H2N-),метиламино, диметиламино, диэтиламино и тому подобные."Аминоалкил" означает аминоалкиленовую группу, где амино и алкилен определены в данном описании. Представителями аминоалкильных групп являются аминометил, аминоэтил, диметиламинометил и тому подобные. 12 содержат низший алкениленовый фрагмент. Представителем аралкенильной группы является 2-фенетенил."Аралкилокси" означает аралкил-Огруппу, где аралкил определен в данном описании. Представителями аралкоксигруппы являются бензилокси, нафт-1-илметокси, нафт-2 илметокси и тому подобные."Аралкилоксиалкил" означает аралкил-Оалкиленгруппу, где аралкил и алкилен определены в данном описании. Представителем аралкилоксиалкильной группы является бензилоксиэтил."Аралкилоксикарбонил" означает аралкилO-СО-группу, где аралкил определен в данном описании. Представителем аралкоксикарбонильной группы является бензилоксикарбонил."Аралкилоксикарбонилалкил" означает аралкоксикарбонилалкилен, где аралкилоксикарбонил и алкилен определены в данном описании. Представителями аралкоксикарбонилалкилов являются бензилоксикарбонилметил, бензилоксикарбонилэтил."Аралкил" означает арилалкиленил. Предпочтительные аралкилы содержат фрагмент низшего алкила. Представителями аралкильных групп являются бензил, 2-фенетил,нафталинметил и тому подобные."Аралкилоксиалкенил" означает аралкилО-алкениленгруппу, где аралкил и алкенилен определены в данном описании. Представителем аралкилоксиалкенильной группы является 3-бензилоксиаллил."Аралкилсульфонил" означает группу аралкил-SO2-, где аралкил определен в данном описании."Аралкилсульфинил" означает группу аралкил-SO-, где аралкил определен в данном описании."Аралкилтио" означает группу аралкил-S-,где аралкил определен в данном описании. Представителем аралкилтиогруппы является бензилтио."Ароил" означает арил-СО-группу, где арил определен в данном описании. Преставителями ароила являются бензоил, нафт-1-оил и нафт-2-оил."Циклоалкил" означает неароматическую моно- или мультициклическую кольцевую систему примерно из 3 до 10 атомов углерода,предпочтительно примерно из 5 до 10 атомов углерода. Предпочтительные циклоалкильные кольца содержат примерно 5-6 кольцевых атомов. Циклоалкил необязательно замещен одним или несколькими "заместителями кольцевой системы", которые могут быть одинаковыми или различными и являются такими, как определено в данном описании, или когда R18 представляет замещенный циклоалкил, циклоалкил,замещенный одним или несколькими (например, 1, 2 или 3) заместителями, выбранными изR24 представляет алкил, циклоалкил, циклоалкенил, гетероциклоалкил, арил, арилалкил, гетероарил или гетероарилалкил. Представителями моноциклического циклоалкила являются циклопентил, циклогексил, циклогептил и тому подобные. Представителями мультициклического циклоалкила являются 1-декалин, норборнил, адамантил и тому подобные. Приставка спиро- перед циклоалкилом означает, что геминальные заместители у атома углерода замещены с образованием 1,1-циклоалкила. "Циклоалкилен" означает двухвалентный циклоалкил,имеющий примерно от 4 до 8 атомов углерода. Предпочтительные циклоалкиленильные группы включают 1,2- 1,3- или 1,4-цис или трансциклогексилен."Циклоалкенил" означает неароматическую моно- или мультициклическую кольцевую систему, содержащую примерно от 3 до 10 атомов углерода, предпочтительно примерно из 5 до 10 атомов углерода, содержащую по крайней мере одну углерод-углеродную двойную связь. Предпочтительные циклоалкиленовые кольца содержат примерно 5-6 кольцевых атомов. Циклоалкенил необязательно замещен одним или несколькими "заместителями кольцевой системы", которые могут быть одинаковыми или различными и являются такими, как определено в данном описании. Представителями моноциклического циклоалкенила являются циклопентенил, циклогексенил, циклогептенил и тому подобные. Представителем мультициклического циклоалкенила является норборниленил. в котором циклокарбамоильная группа состоит из фрагмента оксооксазагетероциклильного кольца и алкиленовая группа является такой,как определено в данном описании. Алкиленовый фрагмент может быть соединен с карбамоилом или через атом углерода, или через атом азота карбамоильного фрагмента. Примером циклокарбамоилалкильной группы является Nоксазолидинилпропил. 14 в котором имидная группа состоит из фрагмента оксодиазагетероциклильного кольца и алкилен является таким, как определено в данном описании. Алкиленовый фрагмент может быть присоединен к карбамоилу либо через атом углерода, либо через атом азота карбомоильного фрагмента. Примером циклоимидилалкильной группы является N-фталимидпропил."Гетероцикленил" означает неароматическую моноциклическую или мультициклическую кольцевую систему, состоящую примерно из 3-10 кольцевых атомов, предпочтительно из примерно 5-10 атомов, в которой один или несколько атомов в кольцевой системе отличны от углерода и являются, например, атомами азота,кислорода или серы, и которая содержит по крайней мере одну углерод-углеродную двойную связь или углерод-азотную двойную связь. Предпочтительные гетероцикленильные кольца содержат от примерно 5 до примерно 6 кольцевых атомов. Приставка "аза", "окса" или "тиа" перед гетероцикленилом означает, что, по крайней мере, атом азота, кислорода или серы, соответственно, присутствует в качестве циклического атома. Гетероцикленил необязательно замещен одним или несколькими заместителями кольцевой системы, где "заместитель кольцевой системы" определен в данном описании. Атомы азота или серы гетероцикленила необязательно окислены до соответствующего N-оксида, Sоксида или S,S-диоксида. Представителями моноциклических азагетероцикленильных групп являются 1,2,3,4-тетрагидропиридин,1,2 дигидропиридил, 1,4-дигидропиридил, 1,2,3,6 тетрагидропиридин, 1,4,5,6-тетрагидропиримидин, 2-пирролинил, 3-пирролинил, 2-имидазолинил, 2-пиразолинил и тому подобные. Представителями оксагетероцикленильных групп являются 3,4-дигидро-2 Н-пиран, дигидрофуранил,фтордигидрофуранил и тому подобные. Представителем мультициклической оксагетероцикленильной группы является 7-оксабицикло[2.2.1] гептенил. Представителями моноциклического тиагетероцикленильного кольца являются дигидротиофенил, дигидротиопиранил и тому подобные."Гетероциклил" означает неароматическую насыщенную моноциклическую или мультициклическую кольцевую систему, состоящую примерно из 3-10 кольцевых атомов, предпочтительно из примерно 5-10 кольцевых атомов, в которой один или несколько атомов в кольцевой системе отличны от углерода и являются, например, атомами азота, кислорода или серы. Предпочтительные гетероциклилы содержат от примерно 5 до примерно 6 кольцевых атомов. Приставка "аза", "окса" или "тиа" перед гетероциклилом означает, что, по крайней мере, атом азота, кислорода или серы, соответственно, присутствует в качестве циклического атома. Гетероциклил необязательно замещен одним или несколькими заместителями кольцевой систе 15 мы, которые могут быть одинаковыми или различными и определены в данном описании, или когда R18 представляет замещенный гетероциклил, то гетероциклил замещен по кольцевым атомам углерода, одним или несколькими (например, 1, 2 или 3) заместителями, выбранными из оксо, циано, CO2R22, CONHCH2CO2R22, арила, арилалкила, алкила или гидроксиалкила, или замещен по кольцевому атому азота заместителем,выбранным изR22 и R24 являются такими, как определено в данном описании. Атомы азота или серы гетероциклила необязательно окислены до соответствующего N-оксида, S-оксида или S,Sдиоксида. Представителями моноциклических гетероциклильных колец являются пиперидил,пирролидинил, пиперазинил, морфолинил, тиоморфолинил, тиазолидинил, 1,3-диоксоланил,1,4-диоксаланил, тетрагидрофуранил, тетрагидротиофенил, тетрагидротиопиранил и тому подобные."Арил" означает ароматическую моноциклическую или мультициклическую кольцевую систему, состоящую примерно из 6-14 атомов углерода, предпочтительно примерно из 6-10 атомов углерода. Арил необязательно замещен одним или несколькими "заместителями кольцевой системы",которые могут быть одинаковыми или различными и являются такими, как определено в данном описании. Представителями арильной группы являются фенил и нафтил."Гетероарил" означает ароматическую моноциклическую или мультициклическую кольцевую систему, состоящую из примерно 5-14 кольцевых атомов, предпочтительно примерно из 5-10 кольцевых атомов, в которой один или несколько атомов в кольцевой системе отличны от углерода и являются, например, азотом, кислородом или серой. Предпочтительные гетероарилы содержат от примерно 5 до примерно 6 кольцевых атомов. "Гетероарил" необязательно замещен одним или несколькими "заместителями кольцевой системы", которые могут быть одинаковыми или различными и являются такими, как определено в данном описании. Приставка "аза", "окса" или "тиа" перед гетероарилом означает, что, по крайней мере, атом азота,кислорода или серы, соответственно, присутствует в качестве циклического атома. Атом азота гетероарила необязательно окислен до соответствующего N-оксида. Представителями гетероарилов являются пиразинил, фуранил, тиенил,пиридил, пиримидинил, изоксазолил, изотиазолил, оксазолил, тиазолил, пиразолил, фуразанил,пирролил, пиразолил, триазолил, 1,2,4-тиадиазолил, пиразинил, пиридазинил, хиноксалинил,фталазинил, имидазо[1,2-а]пиридин, имидазо"Конденсированный арилциклоалкенил" означает радикал, полученный из конденсированного арила и циклоалкенила, определенных в данном описании, путем удаления атома водорода от циклоалкенильной части. Предпочтительными конденсированными арилцилкоалкенилами являются те, где арил представляет фенил, а циклоалкенил состоит из примерно 5-6 кольцевых атомов. Конденсированный арилциклоалкенил необязательно замещен одним или несколькими заместителями кольцевой системы, где "заместитель кольцевой системы" является таким, как определено в данном описании. Представителями конденсированных арилциклоалкенилов являются 1,2-дигидронафтилен, инден и тому подобные, в которых связь с исходным фрагментом осуществляется через неароматический атом углерода."Конденсированный циклоалкениларил" означает радикал, полученный из конденсированного арилциклоалкенила, определенного в данном описании, путем удаления атома водорода от арильной части. Представителями конденсированных циклоалкениларилов являются те, которые описаны здесь в случае конденсированного арилциклоалкенила, за исключением того, что связь с исходным фрагментом осуществляется через ароматический атом углерода."Конденсированный арилциклоалкил" означает радикал, полученный из конденсированного арила и циклоалкила, определенных в данном описании, путем удаления атома водорода от циклоалкильной части. Предпочтительными конденсированными арилциклоалкилами являются те, где арил представляет фенил, а циклоалкил состоит примерно из 5-6 кольцевых атомов. Конденсированный арилциклоалкил необязательно замещен одним или несколькими заместителями кольцевой системы, где "заместители кольцевой системы" определены в данном описании. Представителем конденсированного арилциклоалкила является 1,2,3,4-тетрагидронафтил и тому подобные, в которых связь с исходным фрагментом осуществляется через неароматический атом углерода."Конденсированный циклоалкиларил" означает радикал, полученный из конденсированного арилциклоалкила, определенного в данном описании, путем удаления атома водорода от арильной части. Представителями конденсированных циклоалкиларилов являются соединения, которые описаны в случае конденсированного арилциклоалкильного радикала, за исключением того, что связь с исходным фрагментом осуществляют через ароматический атом углерода."Конденсированный арилгетероцикленил" означает радикал, полученный из конденсиро 17 ванного арила и гетероцикленила, как определено в данном описании, путем удаления водорода из гетероцикленильной части. Предпочтительными конденсированными арилгетероцикленилами являются те, в которых арил представляет фенил, а гетероцикленил состоит примерно из 5-6 кольцевых атомов. Приставка"аза", "окса" или "тиа" перед гетероцикленильной частью конденсированного арилгетероцикленила означает, что, по крайней мере, атом азота, кислорода или серы, соответственно, присутствует в качестве атома кольца. Конденсированный арилгетероцикленил необязательно замещен одним или несколькими заместителями кольцевой системы, где "заместитель кольцевой системы" является таким, как определено в данном описании. Атомы азота или серы гетероцикленильной части конденсированного арилгетероцикленила необязательно окислены до соответствующих N-оксида, S-оксида или S,Sдиоксида. Представителями конденсированных арилгетероцикленилов являются 3 Н-индолинил, 1H-2-оксохинолил, 2 Н-1-оксоизохинолил,1,2-дигидрохинолинил, 3,4-дигидрохинолинил,1,2-дигидроизохинолинил, 3,4-дигидроизохинолинил и тому подобные, в которых связь с исходным фрагментом осуществляется через неароматический атом углерода."Конденсированный гетероциклениларил" означает радикал, полученный из конденсированного арилгетероцикленила, как определено в данном описании, путем удаления атома водорода из арильной части. Представители конденсированных гетероциклениларилов определены в данном описании в случае конденсированного арилгетероцикленильного радикала, за исключением того, что связь с исходным фрагментом осуществляется через ароматический атом углерода."Конденсированный арилгетероциклил" означает радикал, полученный из конденсированного арила и гетероциклила, как определено в данном описании, путем удаления атома водорода из гетероциклильной части. Предпочтительными конденсированными арилгетероциклилами являются те, в которых арил представляет фенил, а гетероциклил состоит примерно из 5-6 кольцевых атомов. Приставка"аза", "окса" или "тиа" перед гетероциклилом означает, что, по крайней мере, атом азота, кислорода или серы, соответственно, присутствует в качестве циклического атома. Конденсированный арилгетероциклил необязательно замещен одним или несколькими заместителями кольцевой системы, где заместитель кольцевой системы является таким, как определено в данном описании. Атомы азота или серы гетероциклильной части конденсированного арилгетероциклила необязательно окислены до соответствующих N-оксида, S-оксида или 3,3-диоксида. Представителями предпочтительных конденсированных арилгетероциклильных кольцевых 18 систем являются фталимид, 1,4-бензодиоксан,индолинил, 1,2,3,4-тетрагидроизохинолин, 1,2,3,4-тетрагидрохинолин, 1 Н-2,3-дигидроизоиндолил, 2,3-дигидробенз[f]изоиндолил, 1,2,3,4-тетрагидробенз[g]изохинолинил и тому подобные,в которых связь с исходным фрагментом осуществляется через неароматический атом углерода."Конденсированный гетероциклиларил" означает радикал, полученный из конденсированного арилгетероциклила, как определено в данном описании, путем удаления атома водорода из гетероциклильной части. Представители предпочтительных конденсированных гетероциклиларильных кольцевых систем определены как в случае конденсированного арилгетероциклила, за исключением того, что связь с исходным фрагментом осуществляется через ароматический атом углерода."Конденсированный гетероарилциклоалкенил" означает радикал, полученный из конденсированного гетероарила и циклоалкенила,как определено в данном описании, путем удаления атома водорода из циклоалкенильной части. Предпочтительными конденсированными гетероарилциклоалкенилами являются те, в которых гетероарил и циклоалкенил каждый содержит примерно 5-6 кольцевых атомов. Приставка "аза", "окса" или "тиа" перед гетероарилом означает, что, по крайней мере, атом азота, кислорода или серы, соответственно, присутствует в качестве циклического атома. Конденсированный гетероарилциклоалкенил необязательно замещен одним или несколькими заместителями кольцевой системы, где заместитель кольцевой системы является таким, как определено в данном описании. Атом азота гетероарильной части конденсированного гетероарилциклоалкенила необязательно окислен до соответствующего N-оксида. Представителями конденсированных гетероарилциклоалкенилов являются 5,6-дигидрохинолил, 5,6-дигидроизохинолил, 5,6-дигидрохиноксалинил, 5,6-дигидрохиназолинил, 4,5-дигидро-1 Н-бензимидазолил, 4,5-дигидробензоксазолил и тому подобные, в которых связь с исходным фрагментом осуществляется через неароматический атом углерода."Конденсированный циклоалкенилгетероарил" означает радикал, полученный из конденсированного гетероарилциклоалкенила, как определено в данном описании, путем удаления атома водорода из гетероарильной части. Представители конденсированных циклоалкенилгетероарилов определены в случае конденсированного гетероарилциклоалкенила, за исключением того, что связь с исходным фрагментом осуществляется через ароматический атом углерода."Конденсированный гетероарилциклоалкил" означает радикал, полученный из конденсированного гетероарила и циклоалкила, как определено в данном описании, путем удаления 19 атома водорода из циклоалкильной части. Предпочтительными конденсированными гетероарилциклоалкилами являются те, в которых гетероарил состоит примерно из 5-6 кольцевых атомов и циклоалкил состоит из примерно 5-6 кольцевых атомов. Приставка "аза", "окса" или"тиа" перед гетероарилом означает, что, по крайней мере, атом азота, кислорода или серы,соответственно, присутствует в качестве циклического атома. Конденсированный гетероарилциклоалкил необязательно замещен одним или несколькими заместителями кольцевой системы, где "заместитель кольцевой системы" является таким, как определено в данном описании. Атом азота гетероарильной части конденсированного гетероарилциклоалкила необязательно окислен до соответствующего N-оксида. Представителями конденсированных гетероарилциклоалкенилов являются 5,6,7,8-тетрагидрохинолинил, 5,6,7,6-тетрагидроизохинолил, 5,6,7,8 тетрагидрохиноксалинил, 5,6,7,8-тетрагидрохиназолил, 4,5,6,7-тетрагидро-1 Н-бензимидазолил,4,5,6,7-тетрагидробензоксазолил, 1 Н-4-окса-1,5 диазанафталин-2-онил,1,3-дигидроимидизол[4,5]пиридин-2-онил и тому подобные, в которых связь с исходным фрагментом осуществляется через неароматический атом углерода."Конденсированный циклоалкилгетероарил" означает радикал, полученный из конденсированного гетероарилциклоалкила, как определено в данном описании, путем удаления атома водорода из гетероарильной части. Представителями конденсированных циклоалкилгетероарилов являются те, которые описаны здесь в случае конденсированного гетероарилциклоалкила, за исключением того, что связь с исходным фрагментом осуществляется через ароматический атом углерода."Конденсированный гетероарилгетероцикленил" означает радикал, полученный из конденсированного гетероарила и гетероцикленила, как определено в данном описании, путем удаления атома водорода из гетероцикленильной части. Предпочтительными конденсированными гетероарилгетероцикленилами являются те, в которых гетероарил состоит примерно из 5-6 кольцевых атомов, и гетероцикленил состоит из примерно 5-6 кольцевых атомов. Приставка "аза", "окса" или "тиа" перед гетероарилом или гетероцикленилом означает, что, по крайней мере, атом азота, кислорода или серы, соответственно, присутствует в качестве циклического атома. Конденсированный гетероарилгетероцикленил необязательно замещен одним или несколькими заместителями кольцевой системы, где заместитель кольцевой системы является таким, как определено в данном описании. Атом азота гетероарильной части конденсированного гетероарилгетероцикленила необязательно окислен до соответствующего Nоксида. Атомы азота или серы гетероцикленильной части конденсированного гетероарил 004741 20 гетероцикленила необязательно окислены до соответствующих N-оксида, S-оксида или S,Sдиоксида. Представителями конденсированных гетероарилгетероцикленилов являются 7,8-дигидро[1,7]нафтиридинил, 1,2-дигидро[2.7]нафтиридинил, 6,7-дигидро-3 Н-имидазо[4.5-с]пиридил, 1,2-дигидро-1,5-нафтиридинил, 1,2-дигидро-1,6-нафтиридинил, 1,2-дигидро-1,7-нафтиридинил, 1,2-дигидро-1,8-нафтиридинил, 1,2 дигидро-2,6-нафтиридинил и тому подобные, в которых связь с исходным фрагментом осуществляется через неароматический атом углерода."Конденсированный гетероцикленилгетероарил" означает радикал, полученный из конденсированного гетероарилгетероцикленила,как определено в данном описании, путем удаления атома водорода из гетероарильной части. Представителями конденсированных гетероцикленилгетероарилов являются те, которые описаны в случае конденсированного гетероарилгетероцикленила, за исключением того, что связь с исходным фрагментом осуществляется через ароматический атом углерода."Конденсированный гетероарилгетероциклил" означает радикал, полученный из конденсированного гетероарила и гетероциклила, как определено в данном описании, путем удаления атома водорода из гетероциклильной части. Предпочтительными конденсированными гетероарилгетероциклилами являются те, в которых гетероарил состоит примерно из 5-6 кольцевых атомов и гетероциклил состоит из примерно 5-6 кольцевых атомов. Приставка "аза", "окса" или"тиа" перед гетероарилом или гетероциклильной частью конденсированного гетероарилгетероциклила означает, что, по крайней мере, атом азота, кислорода или серы, соответственно, присутствует в качестве циклического атома. Конденсированный гетероарилгетероциклил необязательно замещен одним или несколькими заместителями кольцевой системы, где "заместитель кольцевой системы" является таким, как определено в данном описании. Атом азота гетероарильной части конденсированного гетероарилгетероциклила необязательно окислен до соответствующего N-оксида. Атомы азота или серы гетероциклильной части конденсированного гетероарилгетероциклила необязательно окислены до соответствующих N-оксида, Sоксида или S,S-диоксида. Представителями конденсированных гетероарилгетероциклилов являются 2,3-дигидро-1 Н-пиррол[3,4-b]хинолин-2-ил, 1,2,3,4-тетрагидробенз[b][1,7]нафтиридин-2-ил, 1,2,3,4-тетрагидробенз-[b][1,6]нафтиридин-2-ил, 1,2,3,4-тетрагидро-9 Н-пиридо[3,4-b]индол-2-ил, 1,2,3,4-тетрагидро-9 Н-пиридо[1,5]нафтиридинил, 1,2,3,4-тетрагидро[1,6]-нафтиридинил, 1,2,3,4-тетрагидро[1,7]нафтиридинил,1,2,3,4-тетрагидро[1,8]нафтиридинил, 1,2,3,4-тетрагидро[2,6]нафтиридинил и тому подобные, в которых связь с исходным фрагментом осуществляется через неароматический атом углерода."Конденсированный гетероциклилгетероарил" означает радикал, полученный из конденсированного гетероарилгетероциклила, как определено в данном описании, путем удаления атома водорода из гетероарильной части. Представителями конденсированных гетероциклилгетероарилов являются те, которые описаны выше для конденсированного гетероарилгетероциклила, за исключением того, что связь с исходным фрагментом осуществляется через ароматический атом углерода."Аралкинил" означает арилалкиниленовую группу, где арил и алкинилен определены в данном описании. Представителями аралкинильных групп являются фенилацетиленил и 3-фенилбут-2-инил."Арилдиазо" означает арил-N=N-группу,где арил определен в данном описании. Представителями арилдиазогрупп являются фенилдиазо и нафтилдиазо."Арилкарбамоил" означает арил-NHCOгpyппу, где арил определен в данном описании."Бензил" означает фенил-СН 2-группу. Замещенный бензил означает бензильную группу,в которой фенильное кольцо замещено одним или несколькими заместителями кольцевой системы. Примеры бензила включают 4-бромбензил, 4-метоксибензил, 2,4-диметоксибензил и тому подобные.Y1Y2NCO-, где Y1 и Y2 определены в данном описании. Представителями карбамоильных групп являются карбамил (H2NCO-), диметиламинокарбамоил (Ме 2NСО-) и тому подобные."Карбоксиалкил" означает НО(O)С-алкиленовую группу, где алкилен определен в данном описании. Представителями карбоксиалкилов являются карбоксиметил и карбоксиэтил."Циклоалкилокси" означает циклоалкил-Огруппу, где циклоалкил определен в данном описании. Представителями циклоалкилокси группы являются циклопентилокси, циклогексилокси и тому подобные."Гетероаралкенил" означает гетероарилалкениленовую группу, где гетероарил и алкенилен определены в данном описании. Предпочтительные гетероаралкенилы содержат низший алкениленовый фрагмент. Примеры гетероаралкенильных групп включают 4-пиридилвинил, тиенилэтенил, пиридилэтенил, имидазолилэтенил,пиразинилэтенил и тому подобные."Гетероаралкил" означает гетероарилалкиленовую группу, где гетероарил и алкилен определены в данном описании. Предпочтительные гетероаралкилы содержат низшую алкиленовую группу. Представителями гетероаралкильных групп являются тиенилметил, пиридилметил, имидазолилметил, пиразинилметил и тому подобные."Гетероаралкилокси" означает гетероаралкил-О-группу, где гетероаралкил определен в данном описании. Представителем гетероаралкилоксигруппы является 4-пиридилметилокси."Гетероаралкилоксиалкенил" означает гетероаралкил-О-алкениленовую группу, где гетероаралкил и алкенилен определены в данном описании. Представителем гетероаралкилоксиалкенильной группы является 4-пиридилметилоксиаллил."Гетероаралкилоксиалкил" означает гетероаралкил-О-алкиленовую группу, где гетероаралкил и алкилен определены в данном описании. Представителем гетероаралкилоксигруппы является 4-пиридилметилоксиэтил."Гетероаралкинил" означает гетероарилалкиниленовую группу, где гетероарил и алкинилен определены в данном описании. Предпочтительные гетероаралкинилы содержат фрагмент низшего алкила. Представителями гетероаралкинильных групп являются пирид-3 илацетиленил, хинолин-3-илацетиленил, 4 пиридилэтинил и тому подобные."Гетероароил" означает гетероарил-СОгруппу, где гетероарил определен в данном описании. Представителями гетероароильных групп являются тиофеноил, никотиноил, пиррол-2 илкарбонил, пиридиноил и тому подобные."Гетероарилдиазо" означает гетероарилN=N-группу, где гетероарил определен в данном описании."Гетероарилсульфонилкарбамоил" означает гетероарил-SO2-NH-CO-группу, где гетероарил определен в данном описании."Гетероциклилалкил" означает гетероциклилалкиленовую группу, где гетероциклил и алкилен определены в данном описании. Предпочтительные гетероциклилалкилы содержат низший алкиленовый фрагмент. Представителем гетероаралкильной группы является тетрагидропиранилметил."Гетероциклилалкилоксиалкил" означает гетероциклилалкил-О-алкиленовую группу, где гетероциклилалкил и алкилен определены в данном описании. Представителем гетероцик 23 лилалкилоксиалкильной группы является тетрагидропиранилметилоксиметил."Гетероциклилокси" означает гетероциклил-О-группу, где гетероциклил определен в данном описании. Представителями гетероциклилоксигруппы являются хинуклидилокси, пентаметиленсульфидокси, тетрагидропиранилокси, тетрагидротиофенилокси, пирролидинилокси, тетрагидрофуранилокси, 7-оксабицикло[2.2.1]гептанилокси, гидрокситетрагидропиранилокси, гидрокси-7-оксабицикло[2.2.1] гептанилокси и тому подобные."Гидроксиалкил" означает алкильную группу, определенную в данном описании, с одной или несколькими гидроксильными группами. Предпочтительные гидроксиалкилы содержат низший алкил. Представителями гидроксиалкильных групп являются гидроксиметил и 2-гидроксиэтил."Оксо" означает группу формулы С=O"Фенокси" означает фенил-О-группу, где фенильное кольцо необязательно замещено одним или несколькими заместителями кольцевой системы, определенными в данном описании."Фенилен" означает -фенил-группу, где фенильное кольцо необязательно замещено одним или несколькими заместителями кольцевой системы, определенными в данном описании."Фенилтио" означает фенил-S-rpyппу, где фенильное кольцо необязательно замещено одним или несколькими заместителями кольцевой системы, определенными в данном описании."Пиридилокси" означает пиридил-Огруппу, где пиридильное кольцо необязательно замещено одним или несколькими заместителями кольцевой системы, определенными в данном описании."Заместители кольцевой системы" означает заместители, присоединенные к ароматическим или неароматическим кольцевым системам, включая водород, алкил, арил, гетероарил,аралкил, аралкенил, аралкинил, гетероаралкил,гетероаралкенил, гетероаралкинил, гидрокси,гидроксиалкил, алкокси, арилокси, аралкокси,ацил, ароил, галоген, нитро, циано, карбокси,алкоксикарбонил, арилоксикарбонил, аралкоксикарбонил, алкилсульфонил, арилсульфонил,гетероарилсульфонил, алкилсульфинил, арилсульфинил, гетероарилсульфинил, алкилтио,арилтио, нитрил, NO2, гетероарилтио, аралкилтио, гетероаралкилтио, циклоалкил, циклоалкенил, гетероциклил, гетероцикленил, арилдиазо, гетероарилдиазо, амидино, Y1Y2N-,Y1Y2N-алкил-, Y1Y2NСО- или Y1Y2NSO2-, гдеY1 и Y2 независимо представляют водород, алкил, арил и аралкил, или когда заместитель представляет Y1Y2N- или Y1Y2N-алкил-, то один 24 из Y1 и Y2 представляет ацил или ароил, а другой из Y1 и Y2 представляет водород, алкил,арил и аралкил. Когда кольцевая система является насыщенной или частично насыщенной, то"заместитель кольцевой системы" дополнительно включает метилен (Н 2 С=), оксо (O=) и тиоксо(S=). Предпочтительными заместителями кольцевой системы являются водород, CF3, фтор,алкил, алкокси, нитрил или NО 2.Y1Y2NSO2-, где Y1 и Y2 определены выше. Примерами сульфамоильных групп являются сульфамоил (H2NSO2-) и диметилсульфамоил(Me2NSO2-). Предпочтительные варианты осуществления изобретения Способ получения полимерной ,ненасыщенной алкеноатной смолы 54 согласно данному изобретению представлен на схеме. На схеме Rm представляет Н или алифатическую группу, Rn представляет алифатическую или ароматическую группу и R20 и R21 представляют алкил. Rm и Rn могут содержать дополнительные функциональные группы. Понятно, что такие функциональные группы могут быть защищены подходящим образом, чтобы не мешать описанным далее реакциям. Схема Согласно предшествующей схеме, связывание полимерной гидроксисмолы 30 с фосфоно-уксусной кислотой 51 приводит к полимерной фосфоноацетоксисмоле 31. Связывание предпочтительно осуществляют с использованием предварительно полученного симметричного ангидрида (метод i далее) или с использованием ангидрида 2,4-дихлорбензойной кислоты, описанного Sieber P., Tetrahedron Lett., 1987,28, 6147-6150 (метод ii далее).(3 эквив.); пиридин (6 эквив.); ДМФ; 12 ч. После этого осуществляют конденсацию Хорнера-Эммонса полимерной фосфоноацетоксисмолы 31 с альдегидом RnCHO посредством обработки 31 избытком основания, такого как трет-бутоксид калия, бис(триметилсилил) амид калия или бис(триметилсилил)амид лития в органическом растворителе, таком как ТГФ или толуол, при температуре от примерно 0 С до примерно 25 С. Смесь перемешивают или встряхивают в течение достаточного промежут 25 ка времени для количественного образования связанного со смолой аниона, обычно в течение от примерно 15 мин до примерно 2 ч. Затем к смеси добавляют альдегид RnCHO и смесь перемешивают вплоть до трех дней для образования полимерной алкеноатной смолы 32. При особенно предпочтительном получении полимерной алкеноатной смолы 32 полимерную фосфоноацетоксисмолу 31 обрабатывают избытком основания, такого как третбутоксид калия или бис(триметилсилил)амид лития в органическом растворителе, таком как ТГФ при температуре от примерно 0 С до примерно 25 С. Смесь перемешивают или встряхивают в течение достаточного времени для количественного образования связанного со смолой аниона, обычно в течение примерно от 15 мин до примерно 2 ч. Растворитель и избыток основания затем удаляют из реакционного сосуда и добавляют при температуре окружающей среды раствор альдегида в смеси растворителей с меньшей полярностью, включающей растворитель, использованный при образовании связанного со смолой аниона, и второй, менее полярный растворитель, и реакционную смесь перемешивают вплоть до трех дней для образования полимерной алкеноатной смолы 32. Предпочтительными менее полярными растворителями являются алканы, такие как пентан, гексан или гептан, или циклоалканы,такие как циклогексан, циклопентан или циклогептан. Особенно предпочтительная смесь растворителей с меньшей полярностью представляет собой 60% циклогексан - ТГФ. Применение смеси растворителей с меньшей полярностью в конденсации ХорнераЭммонса, как описано выше, имеет ряд преимуществ относительно образования аниона и конденсации с альдегидом с использованием сильного основания в полярном растворителе. Сильное основание требуется для количественного образования связанного со смолой аниона. Однако в реакционных условиях с использованием сильного основания и относительно полярного растворителя связи смолы гидролизуются, приводя к низкому выходу полимерной алкеноатной смолы 32. Однако, сливание растворителя и избытка основания после по существу количественного образования связанного со смолой аниона и добавление раствора альдегида RnCHO в менее полярной смеси растворителей очевидно стабилизирует связи смолы в отношении гидролиза, и вследствие этого приводит к неожиданно высоким выходам полимерной алкеноатной смолы 32. Полимерную алкеноатную смолу 32 можно использовать для дальнейших превращений, как описано на схеме, или ,-ненасыщенная кислота 54 может быть отщеплена от смолы с использованием способов, обычно известных в данной области, например посредством обработки смеси полимерной алкеноатной смолы 53 26 в подходящем органическом растворителе, таком как дихлорметан, дихлорэтан или диоксан,кислотой. Отщепление предпочтительно осуществляют примерно при температуре окружающей среды с использованием смеси растворителей трифторуксусная кислота (ТФУК)дихлорметан в течение примерно 1 ч. Предпочтительные связывающие группы L имеют формулу где А отсутствует или представляет группу формулы -X1-Z-, гдеX1 представляет -CHR- или CHR-Y-CO(СН 2)n-, где R представляет Н, алкил, фенил или фенил, замещенный -Н, алкилом, алкокси, галогеном, нитрилом или -NO2,Y представляет -О- или -NH-,n представляет целое число от 1 до 6 иR', Rla, R2 и R2a независимо представляют заместители кольца иR3 и R4 независимо представляют -Н, алкил, фенил или фенил, замещенный одним или несколькими заместителями, выбранными из алкила, алкокси, галогена, нитрила и -NO2; или один из R1 и R2, взятые вместе с одним 3 из R и R4 и атомами углерода, с которыми они связаны, определяют связывающую группу формулыR6, R7 и R8 независимо выбирают из -Н,алкила, алкокси, галогена, нитрила или -NО 2. Предшествующее будет лучше понятно со ссылкой на следующие примеры, которые представлены для иллюстрации и не предназначены для ограничения объема изобретения. Пример 1. 4-(2',4'-Диметоксифенил-О-метилгидроксиламин)-феноксиметилсополи(стирол-1% дивинилбензол)смола Кислотную смолу Ринка (Rink) (1 г; 0,63 ммоль) оставляют набухать в ДМФ (10 мл) в течение 15 мин при температуре окружающей среды. К суспензии смолы добавляют 27 чего бензолсульфоновую кислоту (19 мг; 0,13 ммоль). Смесь перемешивают с помощью механической мешалки и нагревают при 50 С в течение 5 ч. Затем смесь охлаждают до температуры окружающей среды и дополнительно перемешивают в течение 12 ч, после чего смолу фильтруют и хорошо промывают ДМФ (5 х 25 мл); ДМФ:Н 2 О(70:30; 5 x 25 мл); ТГФ (10 х 25 мл) и диэтиловым эфиром (10 х 25 мл). Смолу затем сушат в течение ночи под высоким вакуумом при 40 С. В ИКспектре наблюдается поглощение карбонила при 1733 см-1, соответствующее фталимидокарбонильной полосе. Элементный анализ: вычислено: 0,28% N. Найдено: 0,26% N. Нагрузка = 0,18 ммоль/г. Смолу оставляют набухать в 20 мл третбутанола в течение 10 мин. К смеси добавляют гидразингидрат (10 мл) и реакционную смесь нагревают при механическом перемешивании при 60 С в течение 12 ч. После этого реакционную смесь охлаждают до температуры окружающей среды. Смолу фильтруют и хорошо промывают ДМФ (10 x 25 мл), ТГФ (10 x 25 мл) и диэтиловым эфиром (10 х 25 мл), затем сушат под высоким вакуумом при 40 С в течение ночи. В ИК-спектр смолы III наблюдается отсутствие карбонильной полосы при 1733 см-1, которая присутствовала в исходном веществе. Элементный анализ: %N найдено = 0,43; 0,42 (соответствует уровню нагрузки 0,3 ммоль/г). Пример 2. 4-(2',4'-диметоксифенил-О-метилгидроксиламин)-феноксиметилсополи(стирол-1% дивинилбензол)смоле (200 мг) дают набухать в ДМФ (3 мл). К этой суспензии при температуре окружающей среды добавляют 3-(4-метоксифенилсульфонил)пропионовую кислоту (610 мг; 2,5 ммоль) и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDCI; 477 мг; 2,5 ммоль). Реакционную смесь встряхивают при температуре окружающей среды с использованием смесителя со встряхиванием в течение 12 ч, после чего смолу фильтруют и хорошо промывают ДМФ:Н 2 О (80:20; 5 x 5 мл), ДМФ (5 х 5 мл), ТГФ (5 х 5 мл) и диэтиловым эфиром (5 x 5 мл). Смолу IV сушат под высоким вакуумом при 40 С в течение 12 ч. В ИК-спектре наблюдается поглощение карбонила при 1675 см-1,соответствующее связанному гидроксамату. Пример 3.(стирол-1% дивинилбензол)смолу (200 мг), полученную как в примере 2, набухают в 3 мл хлористого метилена в течение 10 мин. К смеси по каплям при температуре окружающей среды добавляют трифторуксусную кислоту (ТФУК; 0,3 мл) и полученную смесь встряхивают в течение 30 мин. При добавлении ТФУК смола превращается в темно-синию. Затем смесь фильтруют и промывают двумя порциями по 5 мл хлористого метилена. Фильтрат упаривают с использованием роторного испарителя, получая 20 мг сырого продукта. ЖХ/масс-спектр следов сырой реакционной смеси показал, что площадь целевого продукта превышает 75%. Площадь 3(4-метоксифенилсульфонил)пропионовой кислоты соответствует 6% площади). 1 Н ЯМРcatalog 8090) загружают смолу Ванга (Wang)(ТГФ, 450 мл). Смесь слабо перемешивают в течение примерно 15 мин, затем максимально возможное количество растворителя удаляют через трубку с пористым стеклянным припоем при отсасывании с использованием вакуума. Добавляют свежий ТГФ, а затем трифенилфосфин (15,74 г, 60 ммоль) и N-гидроксифталимид (16,31 г, 100 ммоль). Полученную смесь перемешивают и охлаждают до -5-0 С. Медленно добавляют диизопропилазодикарбоксилат (11,8 мл, 60 ммоль), так чтобы поддерживать температуру при 5 С. По завершении прибавления смеси при перемешивании дают возможность медленно нагреваться до комнатной температуры и перемешивают в течение ночи. Максимально возможное количество реакционного раствора удаляют при отсасывании вакуумом через погруженную трубку, как указано выше. Смолу промывают, загружая N,Nдиметилформамид (ДМФ, 200 мл), перемешивая смесь в течение 3-5 мин, а затем удаляя с отсасыванием максимально возможное количество промывного раствора. Аналогичным образом смолу последовательно промывают дополнительной порцией ДМФ и порциями метанола(дважды), ТГФ (дважды) и метанола (один раз). Порция смолы может быть отобрана для анализа. ИК-спектр 1734 см-1 (С=О). К смоле, оставшейся в реакторе, добавляют ТГФ (400 мл) и 200 мл 40%-ного водного 29 раствора метиламина (2,31 моль). Данную реакционную смесь слабо перемешивают при 40 С в течение 2 ч, затем охлаждают до комнатной температуры (смесь может быть выдержана в течение ночи при данной температуре). Максимально возможное количество реакционного раствора удаляют отсасыванием и смолу промывают группой растворителей, как указано выше. После последней промывки метанолом используют дополнительное количество метанола для отслаивания смолы со дна реактора и выделяют ее фильтрованием. Отфильтрованную смолу сушат при 40 С под вакуумом. Выход 1818,5 г смолы: нагрузка амина 1,02 мэкв./г (на основе потенциометрического титрования суспензии в ТГФ п-толуолсульфоновой кислотой); ИК-спектр (микроскоп) 3316 см-1 (шир. -NH2). Анализ, найдено С, 87,07%; Н, 7,77%; N, 1,58%,что соответствует 1,13 атомов азота/г смолы. Анализ: получение 4-нитрофенилэтангидроксамовой кислоты. Образец высушенной смолы массой 200 мг(прим. 0,2 ммоль) загружают в 5- или 10-мл полимерный реактор (полипропиленовый цилиндр шприца, снабженный полипропиленовым припоем). Смолу оставляют набухать в течение примерно 15 мин в сухом ДМФ, а затем добавляют 115 мг гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDC1, 0,6 ммоль). К этой смеси затем добавляют 4 нитрофенилуксусную кислоту (115 мг, 0,6 ммоль). Реактор закрывают и медленно перемешивают смесь в течение ночи (используют устройство с качающимся основанием). Реакционный раствор удаляют фильтрованием в вакууме (полимерный реактор присоединяют через небольшой резиновый адаптер вакуумной колбы) и смолу промывают несколькими небольшими (2-3 мл) порциями следующих растворителей: ДМФ (4-5 порций), МеОН или 50% водн. ДМФ (3-4 порции), ТГФ (3-4 порции) и МеОН (2-3 порции). Смолу (все еще в шприцевом реакторе) сушат в течение по крайней мере 4 ч под вакуумом при 40 С. К данной высушенной смоле добавляют 2 мл дихлорметана, затем 2 мл трифторуксусной кислоты (ТФУК). Дополнительно, добавляют 20 мл воды (предполагается для снижения образования ангидрида из продукта гидроксамовой кислоты). Смесь оставляют взаимодействовать в течение примерно 1 ч и реакционный раствор сливают во взвешенный приемник. Смолу промывают 1-2 1-мл порциями дихлорметана, после чего 1-2 1-мл порциями толуола. Объединенные фильтраты концентрируют до примерно 2 мл при 30 С, добавляют дополнительно 2 мл толуола и полученный раствор концентрируют досуха под вакуумом (роторный испаритель с последующим использованием вакуумной печи при 30 С. Отметим, что нагревание в присутствии ТФУК промотирует образование "ангидридной" примеси). Остаток взвешивают и ана 004741 30 лизируют на весовой % чистоты (ВЭЖХ с использованием карбоновой кислоты в качестве стандарта фактора чувствительности). Типичные результаты для 4-нитрофенилэтангидроксамовой кислоты: 29-30 мг твердых веществ 60-70 вес.% чистота, 90-97 А% чистота (261 нм); 1 Н ЯМР (СD3OD)8,13 (д, 2 Н), 7,25 (д, 2 Н), 4,85(ушир.с, ОН, NH), 3,55 (с, 2 Н); 13 С ЯМР 169,4,144,3, 131,3, 124,6, 40,2. Это отражает нагрузку/фиксированный химический выход 50-55% из смолы при 1 мэкв/г. Пример 5. Сухую 4-(О-метилгидроксиламин)феноксиметилсополи(стирол-1%-дивинилбензол)смолу (2 г, 1,5 ммоль), полученную как в примере 4,оставляют набухать в ДМФ (8 мл) в течение 10 мин и затем обрабатывают 4-фенилмасляной кислотой и EDC (0,86 г, 4,5 ммоль). Смесь встряхивают в течение 24 ч и фильтруют. Смолу промывают ДМФ, ДМФ/Н 2 О, ДМФ, ТГФ и Et2O и сушат под вакуумом при 40 С получая N-4 фенилбут-1-оил-4-(О-метилгидроксиламин)феноксиметилсополи(стирол-1% дивинилбензол) смолу (2,2 г). ИК-спектр: С=О 1670 см-1. Элементный анализ: вычислено: N, 1,05%. Найдено: Сухую 4-(О-метилгидроксиламин)феноксиметилсополи(стирол-1%-дивинилбензол)смолу (4 г, 3 ммоль), полученную как в примере 4,оставляют набухать в ДМФ (32 мл) в течение 10 мин, затем обрабатывают 4-бром-3-метилбензойной кислотой и EDC (1,725 г, 9 ммоль). Смесь встряхивают в течение 24 ч и фильтруют. Смолу промывают ДМФ, ДМФ/Н 2 О, ДМФ, ТГФ и Et2O и сушат под вакуумом при 40 С, получаяN-(4-бром-3-метилбензоил)-4-(О-метилгидроксиламин)феноксиметилсополи(стирол-1%дивинилбензол)смолу, полученную как в примере 6, суспендируют в 50% ТФУК/СН 2 Сl2 в течение 2 ч. Смолу фильтруют и промывают три раза CH2Cl2, получая N-гидрокси-4-бром-3 31 метилбензамид. ЖХ-масс-спектр: m/z 230/232(0,83 мл; 5,5 ммоль) и смесь перемешивают в течение 2 ч с помощью ручного смесителя. Добавляют бромбензилбромид (4,1 г, 16,425 ммоль) и реакционную смесь интенсивно перемешивают в течение 4 дней. Смолу фильтруют и промывают ДМФ, ДМФ/Н 2 О, ДМФ, ТГФ иEt2O и сушат под вакуумом при 40 С, получая(стирол-1%-дивинилбензол)смолу (0,2 г, 0,6 ммоль/г, 0,12 ммоль) суспендируют в диэтиловом эфире в течение 10 мин и затем охлаждают до 5 С в орбитальном смесителе. Суспензию обрабатывают LiАlН 3 ОМе (0,46 M в диэтиловом эфире, 0,22 мл, 0,1 ммоль) и перемешивают в течение 30 мин при данной температуре. Реакционную смесь гасят добавлением 2 М НС 1(водн.) и встряхивают в течение 30 мин. Добавляют тартрат натрия-калия и смесь встряхивают еще в течение 10 мин Добавляют сульфат натрия и смесь фильтруют через слой силикагеля,тщательно промывая дихлорметаном. Фильтрат концентрируют, получая 4-фенилбутиральдегид. ГХ: площадь = 91%; 1 Н ЯМР (СDСl3)9,75 32 ную смесь перемешивают в течение 18 ч, и затем гасят добавлением 2 М НСl (водн.) (получая приблизительно рН 3). Смесь перемешивают в течение 30 мин. Добавляют сульфат натрия и смесь фильтруют через слой силикагеля, тщательно промывают дихлорметаном и концентрируют, получая 6-фенилгексан-3-он. ГХ-массспектр (ЭУ) площадь = 97,1%, m/z 176,2 (М)+; масс-спектр (EI-LRP) m/z 176 (М)-. ЯМР (300 МГц, CDCl3)1,02 (т, 3 Н), 1,9 (м, 2 Н), 2,4 (м,4 Н), 2,6 (м, 2 Н), 7,2-7,3 (м, 5 Н). Пример 11.N-(4-бром-3-метилбензоил)-4-(О-метилгидроксиламин)феноксиметилсополи(стирол 1%-дивинилбензол)смолу (2,8 г, 2,1 ммоль),полученную как в примере 6, суспендируют в толуоле (27 мл) и смесь перемешивают в течение 10 мин. Добавляют ДБУ (1,6 г, 10,5 ммоль) и смесь перемешивают в течение 2 ч с помощью ручного смесителя. Добавляют хлорбензилбромид (6,47 г, 31,5 ммоль) и реакционную смесь интенсивно перемешивают в течение 3 дней. Смолу фильтруют и промывают ДМФ,ДМФ/Н 2 О, ДМФ, ТГФ и Et2O и сушат под вакуумом при 40 С, получая N-4-хлорбензил-N(4-бром-3-метилбензоил)-4-(О-метилгидроксиламин)феноксиметилсополи(стирол-1%-дивинилбензол)смолу (3 г). ИК-спектр С=O 1644 см-1. Элементный анализ: вычислено: Вr, 4,2%; Сl,1,9%; N, 0,8%. Найдено: Вr, 3,8%; Сl, 2,0%; N,0,9%. Пример 12.N-4-хлорбензил-N-(4-бром-3-метилбензоил)-4-(О-метилгидроксиламин)феноксиметилсополи(стирол-1%-дивинилбензол)смолу, полученную как в примере 11, суспендируют в 50% ТФУК/СН 2 Сl2 в течение 2 ч. Смолу фильтруют и промывают три раза СН 2 Сl2, получая N-(4 хлорбензил)-N-гидрокси-3-метил-4-бромбензамид. ЖХ масс-спектр (H-ISP) m/z 354/356N-4-хлорбензил-N-(4-бром-3-метилбензоил)-4-(О-метилгидроксиламин)феноксиметилсополи(стирол-1%-дивинилбензол)смолу (0,2 г,0,5 ммоль/г, 0,1 ммоль), полученную как в примере 11, суспендируют в диэтиловом эфире в течение 10 мин и затем охлаждают до 5 С в орбиталь 33 ном смесителе. Суспензию обрабатывают LiAlH3OMe (0,46 М в диэтиловом эфире, 0,2 мл,0,092 ммоль) и перемешивают в течение 30 мин при данной температуре. Реакционную смесь гасят добавлением водной 2 М НСl и встряхивают в течение 30 мин. Добавляют тартрат натрия-калия и смесь встряхивают еще в течение 10 мин. Добавляют сульфат натрия и смесь фильтруют через слой силикагеля, тщательно промывая дихлорметаном. Фильтрат концентрируют, получая 4-бром 3-метилбензальдегид. ГХ масс-спектр: EI площадь = 99,5%, m/z 179/199 (Br)[М]+; 1 Н ЯМР(1,0 М в ТГФ, 0,23 мл, 0,23 ммоль). Реакционную смесь перемешивают в течение 18 ч и затем гасят добавлением 2 М водной НСl (получают приблизительно рН 3). Смесь перемешивают в течение 30 мин. Добавляют сульфат натрия и смесь фильтруют через слой силикагеля, тщательно промывая дихлорметаном. Остаток концентрируют, получая 1-(4-бром-3-метилфенил) пропан-1-он. ГХ площадь = 78,7%; масс-спектр 4-(О-метилгидроксиламин)феноксиметилсополи(стирол-1%-дизинилбензол)смолу (1 г,0,73 ммоль) оставляют набухать в ДМФ в течение 10 мин и затем обрабатывают 3-(4 метоксифенил)пропионовой кислотой (0,658 г,3,65 ммоль) и DIC (0,46 г, 3,65 ммоль). Смесь встряхивают в течение 24 ч, затем фильтруют и промывают остаток ДМФ, ДМФ/Н 2 О, ДМФ,ТГФ и Et2O и сушат под вакуумом при 40 С,получая N-3-(4-метоксифенил)пропан-1-оил-4(О-метилгидроксиламин)феноксиметилсополиN-Гидрокси-3-(4-метоксифенил)пропионамид получают взаимодействием N-3-(4-метоксифенил)пропан-1-оил-4-(О-метилгидроксиламин) феноксиметилсополи(стирол-1%-дивинилбензол)смолы с ТФУК, используя методику примера 7. 1 Н ЯМР 300 МГц (CDCl3, CD3OD)2,25 (т,2 Н), 2,78 (т, 2 Н), 3,68 (с, 3 Н), 6,72 (д, 2 Н), 7,04 Указанную смолу получают с использованием способа примера 16, за исключением того,что заменяют 3-(4-метоксифенил)пропионовую кислоту на 4-бромфенилуксусную кислоту. ИКспектр С=О 1713,9 см-1. Элементный анализ: вычислено: Br, 5,8%; N, 1,02%. Найдено: Br,8,29%, 8,18%; N, 0,97%, 0,96%.EDS: Схема рентгеновских расчетов К линия L линия М линия О: 969 1024 С: 2662 3003 Указанную смолу получают с использованием способа примера 16, за исключением того,что заменяют 3-(4-метоксифенил)пропионовую кислоту на 4-бромциннамовую кислоту. ИКспектр: С=О 1671,7 см-1 (широкий). Элементный анализ: вычислено: Br, 5,8%; N 1,02%. Найдено:EDS: Схема рентгеновских расчетов К линия L линия М линия О: 818 1365 С: 4549 5059N-Гидрокси-4-бромциннамамид получают обработкой N-4-бромциннамоил-4-(О-метилгидроксиламин)феноксиметилсополи(стирол-1%дивинилбензол)смолы ТФУК с использованием методики примера 7. ЖХ масс-спектр (H-ISP) Указанную смолу получают с использованием способа примера 16, за исключением того,что заменяют 3-(4-метоксифенил)пропионовую кислоту на 4-хлорбензойную кислоту. ИКспектр: С=O 1678 см-1. Элементный анализ: вычислено: Сl, 2,66%; N, 1,05%. Найдено: Сl,2,39%; N, 1,02%. Пример 22.N-Гидрокси-4-хлорбензамид получают обработкой N-(4-хлорбензоил)-4-(О-метилгидроксиламин)феноксиметилсополи(стирол-1%-дивинилбензол)смолы ТФУК с использованием методики примера 7. ЖХ масс-спектр (H-ISP)N-(4-Хлорбензоил)-4-(О-метилгидроксиламин)феноксиметилсополи(стирол-1%-дивинилбензол)смолу (0,1 г, 0,075 ммоль, 0,75 ммоль/г) суспендируют в толуоле (2 мл) и охлаждают до 5 С. Смесь обрабатывают метилиодидом (1,5 ммоль, 0,21 г, 93 мкл), а затем ДБУ(0,22 мл, 0,228 г, 1,5 ммоль). Реакционную смесь помещают в вихревой смеситель и оставляют нагреваться до температуры окружающей среды. Через несколько минут образуется обильный белый осадок и смесь дополнительно разбавляют толуолом (2 мл). Перемешивание 36 реакционной смеси продолжают в течение 18 ч.N-метил-N-(4-хлорбензоил)-4-(О-метилгидроксиламин)феноксиметилсополи(стирол 1%-дивинилбензол)смолу суспендируют в диэтиловом эфире (0,7 мл) и обрабатывают этилмагнийбромидом (1,0 М в ТГФ, 0,225 мл, 0,225 ммоль). Реакционную смесь перемешивают в течение 18 ч с помощью ручного смесителя и затем гасят добавлением 5% НСl в этаноле. Перемешивание осуществляют еще в течение 30 мин и затем смесь фильтруют через небольшой слой диоксида кремния для удаления неорганического вещества. Фильтрат концентрируют,получая 1-(4-хлорфенил)пропан-1-он. Массспектр (EI-LRP) m/z 168/170 Сl [М-], 169/171 СlN-[3-4-метоксифенил)сульфонил)пропан 1-оилкарбонил]-4-(O-метилгидроксиламин)феноксиметилсополи(стирол-1%-дивинилбензол) смолу получают с использованием способа примера 16, за исключением того, что заменяют добавляемую 3-(4-метоксифенил)пропионовую кислоту на 3-(4-метоксифенилсульфонил)пропионовую кислоту. ИК-спектр С=О 1691,6 см-1N-Гидрокси-3-(4-метоксифенилсульфонил) пропионамид получают обработкой N-[3-4-метоксифенил)сульфонил)пропан-1-оилкарбонил]4-(О-метилгидроксиламин)феноксиметил-сополи(стирол-1%-дивинилбензол)смолы ТФУК с использованием методики примера 7. 1 Н ЯМР (300 МГц, ДМСО-d6)2,25 (т,2 Н), 3,42 (т, 2 Н) 3,85 (с, 3 Н), 7,13 (д, 2 Н), 7,79 37 4-(О-Метилгидроксиламин)феноксиметилсополи(стирол-1% дивинилбензол)смолу (2 г, 2 ммоль) суспендируют в 15 мл дихлорметана и перемешивают с помощью ручного смесителя в течение 10 мин и добавляют 284 мг (383 мкл,2,2 ммоль) диизопропилэтиламина. Смесь встряхивают в течение 30 мин. Добавляют аллилхлорформиат (265 мг, 233 мкл, 2,2 ммоль) и смесь встряхивают в течение ночи. N-Аллилоксикарбонил-4-(О-метилгидроксиламин)феноксиметилсополи(стирол-1% дивинилбензол) смолу промывают 15 мл дихлорметана, ТГФLiАlН 4 (0,62 мл, 3 экв.) и смесь встряхивают при 0 С в течение 30 мин. Добавляют насыщенный раствор KHSO4 (0,5 мл) и 0,3 мл раствора тартрата калия, натрия и смесь встряхивают в течение 30 мин по мере нагревания до комнатной температуры. Избыток Н 2 О высушивают путем добавления сухого Na2SO4 и встряхивания еще в течение 15 мин. Смесь фильтруют при низком давлении азота и промывают еще 3 раза 8 мл дихлорметана с последующим фильтрованием. Фильтрат сушат Na2SO4 и фильтруют дважды через тонкий слой (1 дюйм = 2,54 см) силикагеля 60 для колоночной хроматографии (размер частиц 0,040-0,063 мм) и растворитель удаляют в вакууме, получая индол-2-карбоксальдегид. 1 Н ЯМР (CDCl3)9,84 (1 Н, с), 9,22 (1 Н, ушир.с),7,75 (1 Н, д), 7,14-7,48 (4 Н, м); масс-спектр (EI)(1x), ТГФ/20% Н 2 О (3x), ТГФ (3x), дихлорметаном (3x) и сушат под вакуумом в течение ночи.(стирол-1%-дивинилбензол)смолу встряхивают в 15 мл толуола в течение 10 мин, затем добавляют 0,9 мл (6 ммоль, 6 х избыток) ДБУ и смесь встряхивают в течение 2 ч. Добавляют пбромбензилбромид (1,5 г, 6 ммоль, 6x избыток) и смесь встряхивают в течение 3 дней. Смолу сушат в течение ночи в вакууме. Пример 34. 3,4-диметоксициннамальдегид. Сухую N-4-бромбензил-N-(3,4-диметоксициннамоил)-4-(О-метилгидроксиламин)феноксиметилсополи(стирол-1%-дивинилбензол)смолу набухают в 12 мл сухого ТГФ, встряхивают и охлаждают до 0 С в течение 30 мин. Добавляют LiAlH4 в ТГФ (0,5 мл, 2 эквивалента) и смесь встряхивают при 0 С в течение 30 мин. Добавляют насыщенный водный растворKHSO4 (0,5 мл) и раствор тартрата калия, натрия (0,3 мл) и смесь встряхивают в течение 30 мин по мере нагревания до температуры окружающей среды. Избыток Н 2 О сушат, добавляя сухой Na2SO4 и встряхивая в течение 15 мин. Смесь фильтруют при низком давлении азота,промывают 3 раза 8 мл дихлорметана и фильтруют. Фильтрат дополнительно сушат Na2SO4 и фильтруют через тонкий (1 дюйм = 2,54 см) слой силикагеля 60 для колоночной хроматографии (размер частиц 0,040-0,063 мм) и растворитель удаляют в вакууме, получая 3,4 диметоксициннамальдегид. 1 Н ЯМР (CDCl3)9,65 (1 Н, д), 7,40 (1 Н, д), 7,12 (1 Н, д), 7,06 (1 Н,с), 6,87 (1 Н, д), 6,60 (1 Н, дд), 3,90 (6 Н, с); массспектр (EI): m/z = 193 [М+Н+]. Примеры 35-42. Соединения примеров 35-42 получают из исходного материала требуемой карбоновой кислоты использованием методик примеров 3234. Пример 35. Антраниловый альдегид. 1 Н ЯМР (CDCl3)9,88 (1 Н, с), 7,52-7,58 Смолу Меррифилда (Merrifield) (2 ммоль/г,600 мг, 1,2 ммоль) оставляют набухать в безводном ДМФ (20 мл). Добавляют гидрат 2,3,5,6 тетрафтор-4-гидроксибензойной кислоты (2,28 г, 10 ммоль) и карбонат цезия (3,26 г, 10 ммоль) и реакционную смесь нагревают при 85 С в течение 12 ч при слабом перемешивании. Реакционную смесь фильтруют и 4-карбокси-2,3,5,6 тетрафторфеноксиметилсополи(стирол-1% дивинилбензол)смолу промывают ДМФ (5x), 20%ным водным ДМФ (5 х), ТГФ (5x) и дихлорметаном и сушат в течение ночи в вакууме. ИКспектр (микроскоп, см-1): 1640 (С=O); 19F ЯМР(0,234 мл; 2,2 ммоль) и смесь встряхивают в течение ночи. Смолу осушают и промывают три раза в каждом случае ДХМ, ТГФ и ДХМ и сушат в вакууме. Сухую смолу осталяют набухать в безводном толуоле (18 мл), добавляют ДБУ(1,5 мл; 10 ммоль) и смесь встряхивают в течение 1 ч. Добавляют бензилбромид (1,19 мл; 10 ммоль) и смесь встряхивают в течение 3 дней. Смолу осушают и промывают три раза в каждом случае ДХМ, ДМФ, ТГФ и ДХМ и сушат в течение ночи в вакууме. К смоле добавляют ТГФ(6 мл), ДМСО (6 мл), 0,5 н НСl (2,5 мл), тетракис(трифенилфосфин)палладий(0) (347 мг; 15 мол.%) и морфолин (4,3 мл) и смесь встряхивают в течение ночи. Смолу затем осушают и промывают три раза в каждом случае ДМФ,ТГФ, ДХМ, 0,5% в ДХМ, 0,5% диэтилдитиокарбаматом натрия в ДМФ, ДМФ, ТГФ и ДХМ и затем сушат в вакууме. Образец смолы расщепляют избытком 1:1 ТФУК/ДХМ в течение 1 ч при температуре окружающей среды, затем промывают три раза по 1 мл расщепляющей смеси, упаривают и сушат в вакууме. 1 Н ЯМР(29,0 г, 90 ммоль, 10 экв.) в сухом ДМФ (100 мл) добавляли 4-гидрокси-2-фторацетофенон (6,9 г,4 5 ммоль, 5 экв.) в сухом ДМФ (20 мл). Смесь механически перемешивают при 80 С в течение 24 ч. Раствор охлаждают, промывают раствором ТГФ:1 н НС 1 (3:1, x3), ТГФ:Н 2 О (3:1, x3), ТГФ(0,25 г, 0,37 ммоль) в сухом ТГФ добавляли боргидрид лития (0,93 мл 2,0 М раствора в ТГФ,1,85 ммоль, 5 экв.). Смесь встряхивали при комнатной температуре в течение 4 ч. Смолу фильтровали, промывали ТГФ (x3), ТГФ:Н 2 О(30 мл) при 0 С добавляли диизопропилазодикарбоксилат (1,7 мл, 8,7 ммоль, 3 экв.). Раствор оставляли нагреваться до комнатной температуры в течение примерно 30 мин. Смесь встряхивали в течение 24 ч. Смолу фильтровали, промывали ДМФ (x3), МеОН (x3), ТГФ (x3), ДХМ(С=О) 1737 см-1. 19F (CDCl3) -119 м.д. Теоретическая нагрузка 1,19 ммоль/г. Гидроксифталимидосмолу повторно суспендировали в ТГФ (40 мл) и добавляли метиламин (20 мл 40%-ного вес. раствора в воде). Реакционную смесь нагревали при 40 С в течение 2 ч. Смолу отфильтровывали, промывали ДМФ (x3), МеОН (x3), ТГФ (x3), ДХМ (x3). Смолу сушили в вакууме при 40 С в течение ночи, получая 4-(метил-О-метилгидроксиламин)-2 фторфеноксиметилсополи(стирол-1% дивинилбензол)смолу. ИК-спектр (С=O) исчезает, (N-H) 3380 см-1 широкий. Анализ: найдено: С, 82,62; Н, 7,21; N, 0,60; F, 3,13. d19F (CDCl3) -120 м.д. Теоретическая нагрузка 1,41 ммоль/г.N-(1-Пропиленкарбонил)-4(метил-О-метилгидроксиламин)-2-фторфеноксиметилсополи(стирол-1%-дивинилбензол)смолу повторно суспендировали в сухом толуоле (30 мл) и добавили ДБУ (2,93 мл, 19,6 ммоль, 5 экв.). Реакционную смесь встряхивали в течение 1 ч. Затем добавляли бензилбромид (2,33 мл,19,6 ммоль, 5 экв.). Смолу встряхивали в течение ночи. Далее смолу фильтровали, промывали ТГФ (x3), ТГФ:Н 2 О (3:1, x3), ТГФ (x3), ДХМ Смолу (0,75 г, 0,78 ммоль) суспендировали в 20%-ном растворе пиперидина в ДМФ (10 мл). Смесь встряхивали в течение 2 ч. Раствор фильтровали и промывали ДМФ (5) и NMP (Nметилпирролидон) (x5). Смолу повторно суспендировали в NMP (8 мл) и добавляли имин бензофенона (1,3 мл, 7,8 ммоль, 10 экв.) и уксусную кислоту (0,40 мл, 7,0 ммоль, 9 экв.). Смесь встряхивали в течение ночи. Раствор фильтровали и промывали NMP (x5), СН 2 Сl2 45 К смоле добавляли смесь ТГФ:1 н раствор НСl (2:1, 1,5 мл) и смесь встряхивали в течение 4 ч. Смолу фильтровали и промывали NMP (х 3),DIEA (диизоэтиламин):NMP (1:10, х 3), NMP(х 3), ДХМ (х 3), NMP (x3). Смолу повторно суспендировали в NMP (1 мл) и добавляли 2-нафтойную кислоту (0,086 г,500 ммоль, 10 экв.), HOBt (0,068 г, 500 ммоль,10 экв.) и DIC (0,078 мл, 500 ммоль, 10 экв.). Смесь встряхивали в течение ночи. Смолу фильтровали и промывали NMP (х 3), ДХМ (х 3),ДХМ:МеОН (1:1, x3), МеОН (х 3) и ДХМ (х 3). Добавляли трифторуксусную кислоту (1 мл) и ДХМ (1 мл) и смесь встряхивали в течение 1 ч. Раствор фильтровали во взвешенную пробирку, промывали ДХМ (х 3). Растворитель удаляли в вакууме, получая N-[1-(4-метилфенил)этановая кислота]-2-нафталинкарбоксамид(8 мл) добавляли диэтилфосфонуксусную кислоту (0,71 мл, 4,41 ммоль, 3 экв.), пиридин(0,71 мл, 8,82 ммоль, 6 экв.) и 2,6 дихлорбензоилхлорид (0,63 мл, 4,41 ммоль, 3 экв.). Реакционную смесь встряхивали в течение ночи. Смолу фильтровали, промывали ДМФLiHMDS раствор (0,29 мл 1,0 М раствора в ТГФ,0,29 ммоль, 2,5 экв.). Раствор оставляли нагреваться до комнатной температуры в течение 30 мин. Раствор фильтровали в инертной атмосфере и добавляли п-толуолальдегид (0,033 мл, 0,28 ммоль, 2,4 экв.) в сухом циклогексане (1,5 мл). 46 Реакционную смесь встряхивали в течение ночи. Смолу фильтровали, промывали ДМФ (x3),ТГФ:Н 2 О (3:1, x3), ДХМ (x3), ТГФ (x3) и ДХМ(x3). Смолу сушили в вакууме при 40 С в течение ночи. ИК-спектр (С=О) исчезает, (Р=О) исчезает. Добавляли трифторуксусную кислоту (1 мл) и ДХМ (1 мл) и смесь встряхивали в течение 1 ч. Раствор фильтровали во взвешенную пробирку, смолу промывали ДХМ (х 3). Растворитель удаляли в вакууме, получая 4-метилциннамовую кислоту (0,0201 г, колич.). ЖХмасс-спектр дает 144 [(М-Н 2 О)+, 90%]. Пример 54. Получение N-гидроксифенилацетамида(0,08 г, 0,42 ммоль, 3 экв.). К смеси затем добавляли фенилуксусную кислоту (0,06 г, 0,42 ммоль, 3 экв.). Смесь встряхивали в течение ночи. Смолу фильтровали и промывали ДМФ(x5), ТГФ:Н 2 О (3:1, x5), ТГФ (x3), МеОН (х 3) и ДХМ (х 3). К смоле добавляют ТФУК (1 мл) и ДХМ (1 мл) и смесь встряхивают в течение 1 ч. Смесь фильтруют во взвешенную пробирку и смолу промывают ДХМ (x2) и толуолом (x2). Объединенные фильтраты упаривали в вакууме, получая N-гидроксифенилацетамид (0,0084 г, 39%). ЖХ-масс-спектр дает 151 [М+]. Пример 55. Указанная ниже 4-(1-этанон)-2-(фторфеноксиметил)сополи(стирол-1%-дивинилбензол) смола легко может быть окислена известными способами, как, например, гидроксидом натрия в присутствии йода, полимерное производное карбоновой кислоты (как в Hing et al., J. Am. Пример 56. Указанная ниже смола, являющаяся производным карбоновой кислоты, легко может быть восстановлена с использованием диборана или других восстанавливающих агентов, давая полимерное производное бензилового спирта. 47 Пример 57. Указанная ниже смола, являющаяся производным монофторбензилового спирта, легко может быть превращена в гидроксиаминосмолу в условиях, аналогичных синтезу 4-(метил-Ометилгидроксиламин)-2-фторфеноксиметилсополи(стирол-1% дивинилбензол)смолы в примере 47 выше. К суспензии фторированного хлорметилполистирола (фтор-Меррифилд смола) (5,0 г, 8,0 ммоль, нагрузка смолы 1,60 ммоль/г, 5 вес.% фторстирола) и карбоната цезия (26,1 г, 80 ммоль, 10 экв.) в сухом ДМФ (80 мл) добавляли 4-гидрокси-2-фторацетофенон (6,17 г, 40 ммоль,5 экв.) в сухом ДМФ (20 мл). Смесь механически перемешивали при 80 С в течение 24 ч. Раствор охлаждали, промывали ТГФ:1 н раствор НСl (3:1, x3), ТГФ:Н 2 О (3:1, x3), ТГФ (x3) и ДХМ (x3). 4-(1-Этанон)-2-(фторфеноксиметил)сополи(стирол-1% дивинилбензол-5% 4-фторстирол)смолу сушили в вакууме при 40 С в течение ночи. ИК-спектр (С=O) 1682 см-1. d19F К суспензии 4-(1-этанон)-2-фторфеноксиметил)сополи(стирол-1% дивинилбензол-5% 4 фторстирол)смолы (3,0 г, 4,05 ммоль) в сухом ТГФ (50 мл) добавляли боргидрид лития (10,1 мл 2,0 М раствора в ТГФ, 20,2 ммоль, 5 экв.). Смесь встряхивали при комнатной температуре в течение 2 ч. Смолу фильтровали, промывали ТГФ (х 3), ТГФ:Н 2 О (3:1, x3) , ТГФ (x3) и ДХМ К суспензии 4-(1-гидроксилэтил)-2-фторфеноксиметил)сополи(стирол-1% дивинилбензол-5% 4-фторстирол)смолы (1,5 г, 2,03 ммоль) в сухом ДМФ (20 мл) добавляли диэтилфосфоноуксусную кислоту (0,98 мл, 6,1 ммоль, 3 экв.),пиридин (0,99 мл, 12,2 ммоль, 6 экв.) и 2,6 дихлорбензоилхлорид (0,87 мл, 6,1 ммоль, 3 экв.). Реакционную смесь встряхивали в течение ночи. Смолу фильтровали, промывали ДМФ(стирол-1% дивинилбензол-5% 4-фторстирол) смолы (0,1 г, 0,11 ммоль) в сухом ТГФ (3 мл) при 0 С добавляли раствор LiHMDS (0,55 мл 1,0 М раствора в ТГФ, 0,55 ммоль, 5 экв.). Раствор оставляли нагреваться до комнатной температуры в течение 30 мин. Раствор фильтровали в инертной атмосфере и добавляли п-толуолальдегид (0,08 мл, 0,66 ммоль, 6 экв.) в сухом циклогексане (1,5 мл). Реакционную смесь встряхивали в течение ночи. Смолу фильтровали, промывали ДМФ (х 3), ТГФ:Н 2 О (3:1, x3),ДХМ (х 3), ТГФ (х 3) и ДХМ (х 3). Смолу сушили в вакууме при 40 С в течение ночи. ИК-спектр(С=О) исчезает, (Р=О) исчезает. 19F (ДМФ) -119,-121 м.д. К смоле добавляли трифторуксусную кислоту (1 мл) и ДХМ (1 мл) и смесь встряхивали в течение 1 ч. Раствор фильтровали во взвешенную пробирку, смолу промывали ДХМ (x3). Растворитель удаляли в вакууме, получая 4 метилциннамовую кислоту (17,6 мг, 99%). 1 Н ЯМР (МеОН) 2,35 (3 Н, с), 6,40 (1 Н, д, J = 16 Гц), 49 7,21 (2 Н, д, J = 8 Гц), 7,46 (2 Н, д, J = 8 Гц) , 7,63 К суспензии О-(N-9-флуоренилметоксикарбонилфенилаланин)-4-(гидроксиэтил)-2-(фторфеноксиметил)сополи(стирол-1% дивинилбензол-5% 4-фторстирол)смолы (0,04 г, 0,036 ммоль) добавляли пиперидин в ДМФ (10% раствор, 1 мл). Смесь встряхивали в течение 1 ч. Смесь фильтровали и промывали ДМФ (x5) и NMP (х 5) . ИКспектр (С=О) 1737 см-1. Смолу повторно суспендировали в NMP(С=О) 1668, 1732 см-1. К смеси добавляли трифторуксусную кислоту (1 мл) и ДХМ (1 мл) и смесь встряхивали в течение 1 ч. Раствор фильтровали во взвешенную пробирку, смолу промывали СН 2 Сl2 (x3). Растворитель удаляли в вакууме, получая Fmoc-Gly-Phe-OH (12,2 мг,78%). ЖХ-масс-спектр дает 444 [(М)+, 100%]. Пример 64. 50 ют в 15 мл ДМФ и добавляют Вос-Аlа-ОН (568 мг; 3 ммоль) и EDCI (575,1 мг; 3 ммоль) и смесь встряхивают в течение 16 ч. Смолу осушают и промывают 15 мл ДМФ (2x), ТГФ/20% Н 2 О (3x),ТГФ (3x), ДХМ (3 х) и сушат в вакууме в течение ночи. Сухую смолу оставляют набухать в 12 мл безводного ТГФ в атмосфере азота, встряхивают в течение 10 мин и охлаждают до 0 С в течение 30 мин. Добавляют LAH в ТГФ (0,75 мл; 3 ммоль) и смесь встряхивают при 0 С в течение 30 мин. Добавляют насыщенные растворы KHSO4 (0,5 мл) и K,Na тартрат (0,3 мл) и реакционную смесь встряхивают в течение 20 мин при нагревании до температуры окружающей среды. Избыток воды высушивают, добавляя сухой Na2SO4 и встряхивая в течение 15 мин. Смесь фильтруют при низком давлении азота, промывают три раза по 8 мл ДХМ и фильтруют. Фильтрат дополнительно сушатNa2SO4 и фильтруют с ДХМ через тонкий (1 дюйм = 2,54 см) слой силикагеля 60 для колоночной хроматографии (размер частиц 0,0400,063 мм). Удаление растворителя и высушивание в вакууме дают 44 мг указанного в заголовке соединения.1 Н ЯМР:9,56 (с, 1 Н), 5,10(ушир.с, 1 Н), 4,22 (кв, 1 Н), 1,45 (м, 9 Н), 1,34 (д,3 Н); Масс-спектр (IS): m/z = 173 [М-]. Чистота составляет 90% по 1 Н ЯМР. Примеры 65-69. Следующие соединения получают из подходящих аминокислот в качестве исходного вещества с использованием способа примера 65. Пример 65.(УФ 220) = 90%. Примеры 70-120. Параллельный синтез ряда антраниловых кислотiii) 30% трифторуксусная кислота/дихлорметан; 1 ч; 25 С. Параллельный синтез осуществляют с использованием робототехнического устройства для органического синтеза Tecan Com-bitec. Сорок восемь реакционных сосудов помещают в реакционный блок робототехнического устройства и пипеткой переносят в каждый из реакционных сосудов суспензию соединения этилфосфонатной смолы в ТГФ. Установлено, что для данного синтеза более удобно нагружать фосфонатами смолу в большом масштабе, а затем разделять смолу в реакционном блоке. Робототехническое устройство распределяет безводный ТГФ по реакционным сосудам, а после того, как последние будут установлены на подставке робототехнического устройства на ледяной бане, раствор основания (1,0 молярный в ТГФ). Шестнадцать альдегидов (см. табл. 1) готовят в виде 0,5 молярных растворов в 60%ном циклогексане в ТГФ. Затем реакционный блок вручную переносят в орбитальный смеситель и встряхивают в течение одного часа при комнатной температуре. Затем реакционный блок снова помещают в устройство. После этого из реакционных сосудов сливают жидкость и растворы альдегидов распределяют по соответствующим реакционным сосудам. Реакционный блок затем переносят в орбитальный смеситель и встряхивают в течение 2-3 суток при температуре окружающей среды. Обработка реакций в робототехническом устройстве заключается в осушении реакционных сосудов и промывке смолы ТГФ, 20% водным ДМФ, ДМФ, ТГФ, а затем дихлорметаном. Для удаления всех примесей в матрице смолы требуется всего 21 промывка. Затем отбирают образцы смолы для Фурье-ИК анализа отдельного слоя. Диагностический сдвиг карбонильной группы представляет собой количественный способ определения,прошла ли реакция до конца. Продукты антраниловой кислоты затем отщепляют от смолы с использованием 30%-ной трифторуксусной кислоты (ТФУК) в дихлорметане. ТФУК растворы переносят в предварительно взвешенные тест-трубки, содержащиеся в Benchmate II6 совместимом штативе, 004741 52 имеющем 5x10 позиций для расположения, который был установлен на ярусе робототехнического устройства. Данный формат эффективно соединяет концентрирование образца и взвешивание. Концентрирование образцов осуществляют с использованием концентратора ZymarkTurbovap, в который устанавливается Benchmate II совместимый штатив для эффективного выдувания образцов с помощью азота. Benchmate II совместимый штатив, содержащий целевые образцы, затем помещают в концентратор(Turbovap был несколько модифицирован с использованием покрытия разветвленного трубопровода тефлоном для предотвращения коррозии газовых форсунок). Сорок восемь образцов,каждый из которых содержит приблизительно 3 мл 30% ТФУК в дихлорметане, концентрируют примерно в течение 30 мин. В образцы обычно добавляют порцию метанола в один миллилитр,затем повторно упаривают для того, чтобы гарантировать полное удаление раствора ТФУК. Затем реакционный ряд анализируют с использованием 1 Н ЯМР и ЖХ-масс-спектра (см. табл.1) Таблица 1 Пример 121. Гидроксиамид 3-(3,4-диметоксибензолсульфонил)-5-метилгексановой кислоты. Стадия А. Смолу Ванга (Wang) (20 г, 15 ммоль) оставляют набухать в 300 мл безводного ДМФ в течение 15 мин. Затем добавляют раствор диэтилфосфонуксусной кислоты (8,83 г, 45 ммоль) в 50 мл ДМФ с последующим добавлением пиридина (7,12 г, 90 ммоль) и 2,6-дихлорбензоилхлорида (9,4 г, 45 ммоль). Смесь перемешивают в течение 20 ч при комнатной температуре. Смолу отфильтровывают и промывают последовательно ДМФ (3 х), H2 О (3 х), ДМФ (3 х), ТГФ(10 х) и Et2O (10x) с последующей сушкой в вакууме при 40 С в течение 20 ч. ИК-спектр (микро) и С=О 1738 см-1. Стадия В. Нагруженную смолу со стадии А (1 г, 0,75 ммоль) оставляют набухать в безводном ТГФ (10 мл) в течение 15 мин с последующим добавлением 0,5 М раствора бис(триметилсилил)амида калия в толуоле (4 мл) при 0 С. Смесь оставляют нагреваться до комнатной температуры и встряхивают в течение 30 мин. После этого растворитель над смолой сливают, после чего добавляют безводный циклогексан (10 мл) и изовалеральдегид (0,17 г,2 ммоль). Смесь встряхивают в течение приблизительно 72 ч и обрабатывают, как описано в стадии А. ИК-спектр (микро) u С=О 1718 см-1. Стадия С. К раствору 3,4-диметоксибензолтиола (11,9 г, 7 0 ммоль) в безводном ТГФ 54 мешивают при комнатной температуре в течение 15 мин. Смолу со стадии В (0,25 г, 0,19 ммоль) оставляют набухать в безводном ТГФ (2,5 мл) в течение 15 мин и добавляют 4 мл полученного ранее 1 н тиол/тиолятного исходного раствора. Смесь встряхивают в течение приблизительно 100 ч и обрабатывают, как описано для стадии А. ИК-спектр (микро) u С=O 1732 см-1. Стадия D. Смолу со стадии 3 (0,25 г, 0,19 ммоль) оставляют набухать в 1,4-диоксане (5 мл) в течение 15 мин и добавляют раствор мхлорпероксибензойной кислоты (0,44 г, 2,5 ммоль) в 2 мл 1,4-диоксана. Смесь встряхивают в течение 16 ч и обрабатывают, как описано для стадии А. Стадия Е. Смолу со стадии D (0,25 г, 0,19 ммоль) обрабатывают смесью 1:1 дихлорметан/трифторуксусная кислота (3 мл) в течение 12 ч. Смолу отфильтровывают и промывают дихлорметаном (2x1 мл). Объединенные фильтраты концентрируют в вакууме, получая 3-(3,4 диметоксибензолсульфонил)-5-метилгексановую кислоту (9,8 мг). 1 Н ЯМР (300 МГц,CDCl3)0,85 (д, 3 Н) , 0,92 (д, 3 Н), 1,4 (м, 1 Н),1,6-1,8 (м, 2 Н), 2,55 (дд, 1 Н), 2,9 (дд, 1 Н), 3,65m/z 348 (M+NH4)+, 331 (М+Н)+. Стадия F. Связанную с гидроксиламином смолу Ванга (Wang) (50 мг, 0,037 ммоль) оставляют набухать в безводном ДМФ (1 мл) в течение 15 мин с последующим добавлением гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (30 мг, 0,16 ммоль) и раствора карбоновой кислоты со стадии Е в 1 мл безводного ДМФ. Смесь встряхивают в течение 20 ч и обрабатывают, как описано на стадии А. Стадия G. Смолу со стадии F обрабатывают смесью 1:1 дихлорметан/трифторуксусная кислота (2 мл) в течение 1,5 ч. Смолу отфильтровывают и промывают дихлорметаном (2x1 мл). Объединенные фильтраты концентрируют в вакууме, получая гидроксиамид 3-(3,4 диметоксибензолсульфонил)-5-метилгексановой кислоты (9,8 мг). Масс-спектр (H-isp; LCMS)m/z 363 (M+NH4)+, 346 (М+Н)+. Примеры 122-147. Следующие гидроксамовые соединения синтезированы с использованием подходящих исходных веществ и следуя стадиям данного примера. Пример 122. Гидроксиамид 5-(4-бутоксифенил)-3-(3,4-диметоксибензолсульфонил)пентановой кислоты. Масс-спектр (APCI; LCMS) m/z 466 57 Пример 145. Гидроксиамид 3-(3,4-диметоксибензолсульфонил)-2-этилгексановой кислоты. Модифицированная методика для стадии С. Температура реакции = 60 С, время реакции = 2x20 ч. Масс-спектр (APCI; LCMS) m/z 360 (М+Н)+. Пример 146. Гидроксиамид 3-(3,4-диметоксибензолсульфонил)-2-(3-фенилпропил)гексановой кислоты. Модифицированная методика для стадии С. Температура реакции = 60 С, время реакции(М+Н)+. Пример 147. Гидроксиамид 2-[(3-бензилоксифенил)(3,4-диметоксибензолсульфонил)метил]-5-фенилпентановой кислоты Модифицированная методика для стадии С. Температура реакции = 60 С, время реакции(М+Н)+. Примеры 148-161. Стадия А. Связанную гидроксиламином смолу Ринка (Rink) (0,1 г, 0,031 ммоль) оставляют набухать в безводном ДМФ (1 мл) в течение 15 мин с последующим добавлением гидрохлорида 1-(3-диметиламинопропил)-3-этил-карбодиимида(30 мг, 0,16 ммоль) и раствора подходящей карбоновой кислоты, полученной как в примере 73, стадии А-Е в 1 мл безводного ДМФ. Смесь встряхивают в течение 20 ч и обрабатывают, как описано в примере 73, стадия А. Стадия В. Смолу со стадии А (0,1 г, 0,031 ммоль) обрабатывают смесью 9:1 дихлорметан/трифторуксусная кислота (2 мл) в течение 1 ч. Смолу отфильтровывают и промывают дихлорметаном (2x1 мл). Объединенные фильтраты концентрируют в вакууме, получая следующие гидроксамовые кислоты. Пример 148.(М+Н)+. Пример 150. 3-(3,4-Диметоксибензолсульфонил)-4-гидроксикарбамоилбутиловый сложный эфир метилфенилкарбаминовой кислоты. Масс-спектр (APCI; Контур) m/z 452(М+Н)+-. Пример 151. Бензиловый сложный эфир [3-(3,4-диметоксибензолсульфонил)-4-гидроксикарбамоилбутил]метилкарбаминовой кислоты. 59 Пример 162. Гидроксиамид 2-(3,4-диметоксибензолсульфонил)-[4-(4-фторбензилоксифенил]метил-4-метилпентановой кислоты. Стадия А. Смолу Ванга (Wang) (2 г, 1,5 ммоль) оставляют набухать в 20 мл безводного ДМФ в течение 15 мин. Затем добавляют раствор фосфонуксусной кислоты в ДМФ (1,13 г,4,5 ммоль), после чего пиридин (0,71 г, 9 ммоль) и 2,6-дихлорбензоилхлорид (0,94 г, 4,5 ммоль). Смесь перемешивают в течение 20 ч при комнатной температуре. Смолу отфильтровывают и промывают последовательно ДМФ (3x), H2O(3x), ДМФ (3x), ТГФ (10x) и Et2O (10x) с последующей сушкой в вакууме при 40 С в течение 20 ч. ИК-спектр (микро) u C=O 1730 см-1. Стадия В. Нагруженную смолу со стадии А(0,5 г, 0,375 ммоль) оставляют набухать в безводном ТГФ (5 мл) в течение 15 мин с последующим добавлением 0,5 М раствора бис(триметилсилил) амида калия в толуоле (2 мл) при 0 С. Смесь оставляют нагреваться до комнатной температуры и встряхивают в течение 30 мин. Растворитель сливают до верхней части смолы с последующим добавлением безводного циклогексана (10 мл) и альдегида (0,25 г, 1 ммоль). Смесь встряхивают в течение приблизительно 72 ч и обрабатывают, как описано для стадии А. ИК-спектр (микро) u C=O 1704 см-1. Стадия С. К раствору 3,4-диметоксибензолтиола (11,9 г, 70 ммоль) в безводном ТГФ(54,4 мл) при 0 С добавляют 2,5 М раствор нбутиллития (5,6 мл, 14 ммоль) и раствор перемешивают при комнатной температуре в течение 15 мин. Смолу со стадии 2 (0,2 г, 0,15 ммоль) оставляют набухать в безводном ТГФ (2,5 мл) в течение 15 мин и добавляют 4 мл полученного ранее 1 н тиол/тиолятного исходного раствора. Смесь встряхивают в течение приблизительно 100 ч и обрабатывают, как описано для стадии 1. Присоединение тиола не идет до конца, что подтверждается ИК-спектром (u С=O 1703 см-1). Реакцию доводят до завершения путем повторения вышеуказанной методики дважды. ИКспектр (микро) u C=O 1731 см-1. Стадия D. Смолу со стадии С (0,2 г, 0,15 ммоль) оставляют набухать в диоксане (5 мл) в течение 15 мин и добавляют раствор м-хлорпероксибензойной кислоты (0,44 г, 2,5 ммоль) в 2 мл диоксана. Смесь встряхивают в течение 16 ч и обрабатывают, как описано на стадии 1. Стадия Е. Смолу со стадии D (0,2 г, 0,15 ммоль) обрабатывают смесью 1:1 дихлорметан/трифторуксусная кислота (3 мл) в течение 12 ч. Смолу отфильтровывают и промывают дихлорметаном (2x1 мл). Объединенные фильтраты концентрируют в вакууме, получая 2-(3,4 диметоксибензолсульфонил)-[4-(4-фторбензил) оксифенил]метил-4-метилпентановую кислотуm/z 548 (M+NH4)+, 531 (М+Н)+. Стадия F. Связанную с гидроксиламином смолу Ринка (Rink) (0,1 г, 0,031 ммоль) оставляют набухать в безводном ДМФ (1 мл) в течение 15 мин с последующим добавлением гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (20 мг, 0,1 ммоль) и раствора карбоновой кислоты со стадии 5 в 1 мл безводного ДМФ. Смесь встряхивают в течение 20 ч и обрабатывают, как описано для стадии А. Стадия G. Смолу со стадии F (0,1 г, 0,031 ммоль) обрабатывают смесью 9:1 дихлорметан/ трифторуксусная кислота (2 мл) в течение 1 ч. Смолу отфильтровывают и промывают дихлорметаном (2x1 мл). Объединенные фильтраты концентрируют в вакууме, получая гидроксиамид 2(3,4-диметоксибензолсульфонил)-[4-(4-фторбензилокси)фенил]метил-4-метилпентановой кислоты (2,3 мг). Масс-спектр (H-isp; LCMS) m/z 546(М+Н)+. Примеры 163-183. Следующие гидроксамовые соединения синтезируют с использованием подходящих исходных веществ и следуя стадиям данного примера. Пример 163. Гидроксиамид 3-(3,4-диметоксибензолсульфонил)-7-фенил-2-(4-фенилбутил)гептановой кислоты. Масс-спектр (APCI; LCMS) m/z 554
МПК / Метки
МПК: C07C 45/41, C07D 209/12, C08F 8/00
Метки: ненасыщенной, смолы, beta, способ, alpha, алкеноатной, получения
Код ссылки
<a href="https://eas.patents.su/30-4741-sposob-polucheniya-alpha-beta-nenasyshhennojj-alkenoatnojj-smoly.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения &alpha, &beta – ненасыщенной алкеноатной смолы</a>
Предыдущий патент: Интерлейкин-5 ингибирующие производные 6-азаурацила
Следующий патент: Способ получения циталопрама
Случайный патент: Активирующее ppar соединение и содержащая его фармацевтическая композиция












