Аминопиримидины в качестве ингибиторов сорбитолдегидрогеназы
Номер патента: 4656
Опубликовано: 24.06.2004
Авторы: Марри Джерри Энтони, Земброуски Уильям Джеймс, Чу-Мойер Маргарет Юхуа, Майлари Бэйнавара Лакшман
Формула / Реферат
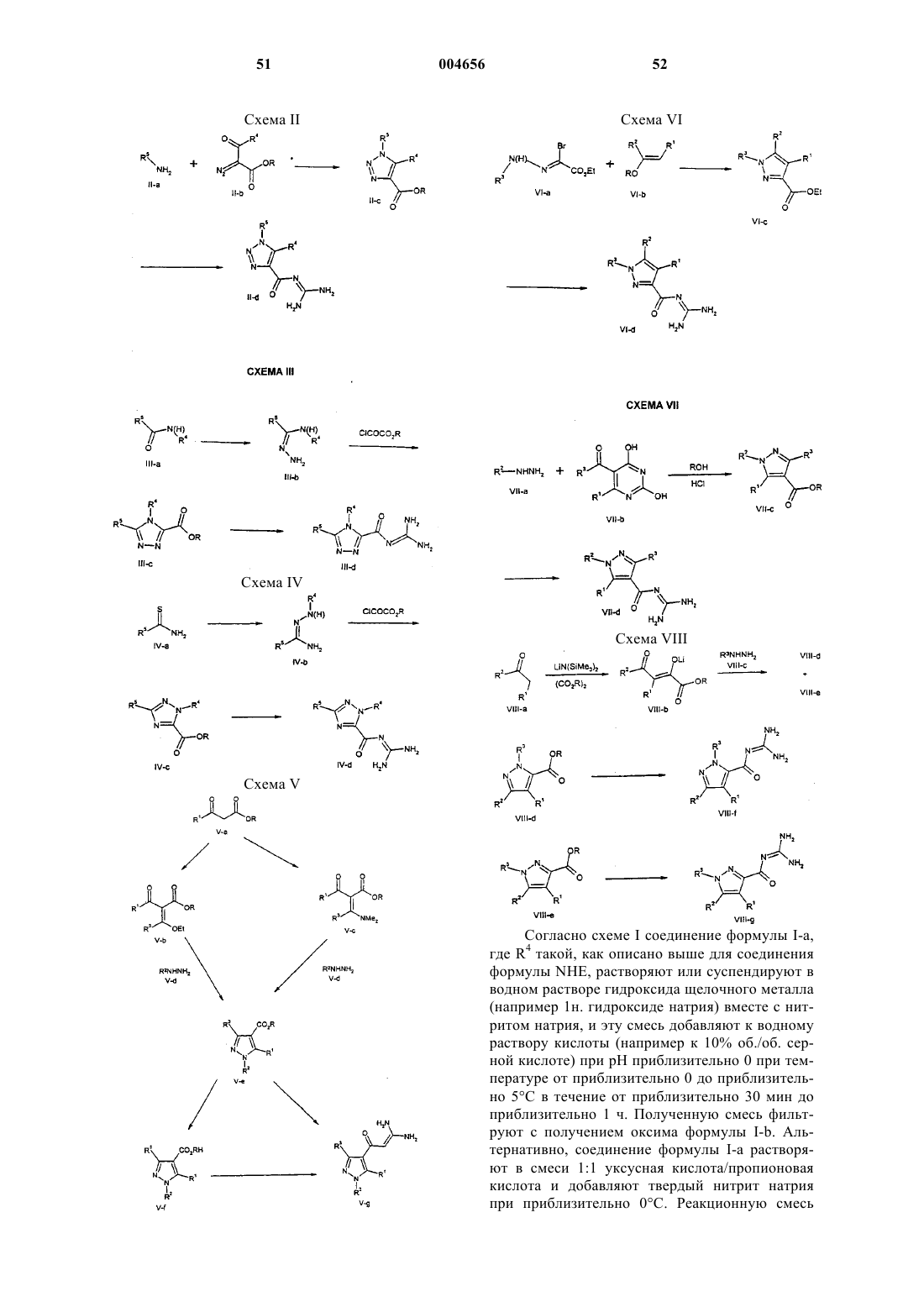
1. Соединение формулы I
его пролекарство или фармацевтически приемлемая соль указанного соединения или указанного пролекарства, где
R1 представляет собой (R)-1-гидроксиэтил;
R2 представляет собой водород;
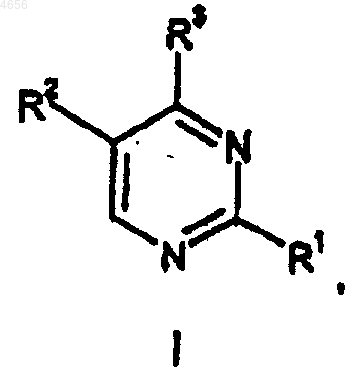
R3 представляет собой радикал формулы
и R9 представляет собой пиримидил или триазинил; указанный пиримидил или триазинил возможно замещен взятыми в количестве до двух гидрокси, (C1-C4)алкилом, (C3-C7)циклоалкилом, (C1-C4)алкокси, гидрокси-(C1-C4)алкилом, (C1-C4)алкокси-(C1-C4)алкиленилом, фенилом, пиперазинилом, который возможно замещен (C1-C4)алкилом, или имидазолилом, который возможно замещен взятым в количестве до двух (C1-C4)алкилом.
2. Соединение по п.1, его пролекарство или фармацевтически приемлемая соль указанного соединения или указанного пролекарства, где R9 представляет собой пиримид-2-ил, возможно замещенный взятыми в количестве до двух (C1-C4)алкилом, гидрокси-(C1-C4)алкилом или (C1-C4)алкокси-(C1-C4)алкилом.
3. Соединение по п.2, его пролекарство или фармацевтически приемлемая соль указанного соединения или указанного пролекарства, где R9 представляет собой 4,6-диметилпиримид-2-ил, 4-метоксиметил-6-метилпиримид-2-ил или 4-гидроксиметил-6-метилпиримид-2-ил.
4. Соединение по п.1, его пролекарство или фармацевтически приемлемая соль указанного соединения или указанного пролекарства, где R9 представляет собой пиримид-4-ил, возможно замещенный взятыми в количестве до двух (C1-C4)алкилпиперазин-1-илом или имидазолилом; и указанный имидазолил возможно замещен взятым в количестве до двух (C1-C4)алкилом.
5. Соединение по п.4, его пролекарство или фармацевтически приемлемая соль указанного соединения или указанного пролекарства, где R9 представляет собой 2-(4-метилпиперазин-1-ил)пиримид-4-ил, 2-(4-этилпиперазин-1-ил)пиримид-4-ил, 2-(4-метилимидазол-1-ил)пиримид-4-ил, 2-(2-метилимидазол-1-ил)пиримид-4-ил, 2-(2,4-диметилимидазол-1-ил)пиримид-4-ил или 2-(4-изопропилпиперазин-1-ил)пиримид-4-ил.
6. Соединение по п.1, его пролекарство или фармацевтически приемлемая соль указанного соединения или указанного пролекарства, где R9 представляет собой триазинил, возможно замещенный взятыми в количестве до двух гидрокси, (C1-C4)алкилом, (C3-C7)циклоалкилом, (C1-C4)алкокси, гидрокси-(C1-C4)алкилом, (C1-C4)алкокси-(C1-C4)алкиленилом, фенилом, пиперазинилом, возможно замещенным (C1-C4)алкилом, или имидазолилом, возможно замещенным взятым в количестве до двух (C1-C4)алкилом.
7. Соединение по п.6, его пролекарство или фармацевтически приемлемая соль указанного соединения или указанного пролекарства, где R9 представляет собой [1,3,5]-триазин-2-ил, возможно замещенный взятыми в количестве до двух (C1-C4)алкилом, (C1-C4)алкокси, гидрокси-(C1-C4)алкилом, (C1-C4)алкилпиперазин-1-илом или фенилом.
8. Соединение по п.7, его пролекарство или фармацевтически приемлемая соль указанного соединения или указанного пролекарства, где R9 представляет собой 4-метил-6-(4-метилпиперазин-1-ил)-[1,3,5]-триазин-2-ил, 4-метокси-6-метил-[1,3,5]-триазин-2-ил, 4,6-диметокси-[1,3,5]-триазин-2-ил, 4-этокси-6-метил-[1,3,5]-триазин-2-ил, 4-изопропокси-6-метил-[1,3,5]-триазин-2-ил, 4-фенил-[1,3,5]-триазин-2-ил, 4-гидроксиметил-6-метокси-[1,3,5]-триазин-2-ил, 4-изопропокси-6-метокси-[1,3,5]-триазин-2-ил, 4-изопропил-[1,3,5]-триазин-2-ил, 4-этил-6-метокси-[1,3,5]-триазин-2-ил, 4-циклопропил-[1,3,5]-триазин-2-ил, 4,6-диметил-[1,3,5]-триазин-2-ил или 4-метил-6-фенил-[1,3,5]-триазин-2-ил.
9. Соединение формулы I

его пролекарство или фармацевтически приемлемая соль указанного соединения или указанного пролекарства, где
R1 представляет собой (R)-1-гидроксиэтил;
R2 представляет собой водород;
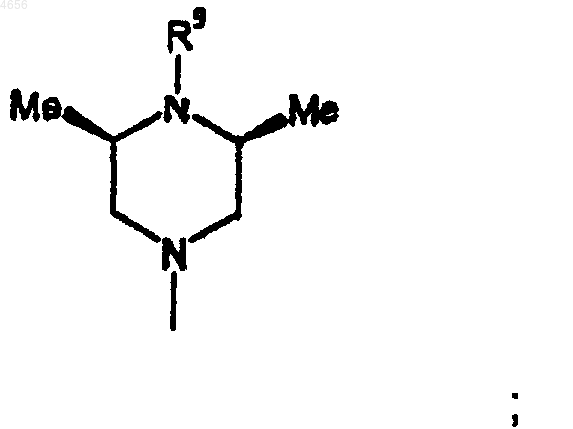
R3 представляет собой радикал формулы
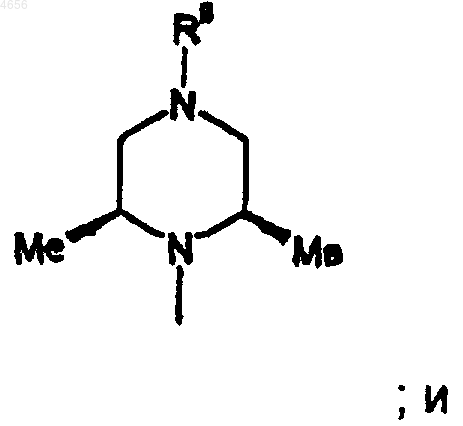
R9 представляет собой пиримидил или триазинил; указанные пиримидил и триазинил возможно замещены взятыми в количестве до двух гидрокси, (C1-C4)алкилом, (C3-C7)циклоалкилом, (C1-C4)алкокси, гидрокси-(C1-C4)алкилом, (C1-C4)алкокси-(C1-C4)алкилом, триазолилом, ацетилом, морфолинилом, (C1-C4)алкилпиперазинилом, фенилом или имидазолилом, возможно замещенным взятым в количестве до двух (C1-C4)алкилом.
10. Соединение по п.9, его пролекарство или фармацевтически приемлемая соль указанного соединения или указанного пролекарства, где R9 представляет собой пиримид-2-ил, возможно замещенный взятыми в количестве до двух (C1-C4)алкилом, гидрокси-(C1-C4)алкилом или триазолилом.
11. Соединение по п.10, его пролекарство или фармацевтически приемлемая соль указанного соединения или указанного пролекарства, где R9 представляет собой 4,6-диметилпиримид-2-ил, 4-гидроксиметил-6-метилпиримид-2-ил или 4-[1,2,4]-триазол-1-илпиримид-2-ил.
12. Соединение по п.9, его пролекарство или фармацевтически приемлемая соль указанного соединения или указанного пролекарства, где R9 представляет собой пиримид-4-ил, возможно замещенный взятыми в количестве до двух (C1-C4)алкилом, гидрокси-(C1-C4)алкилом, ацетилом, морфолинилом, (C1-C4)алкилпиперазинилом, триазолилом или имидазолилом, возможно замещенным взятым в количестве до двух (C1-C4)алкилом.
13. Соединение по п.12, его пролекарство или фармацевтически приемлемая соль указанного соединения или указанного пролекарства, где R9 представляет собой 2,6-диметилпиримид-4-ил, 2-гидроксиметил-6-метилпиримид-4-ил, 2-ацетилпиримид-4-ил, 2-морфолин-4-илпиримид-4-ил, 2-(4-метилпиперазин-1-ил)пиримид-4-ил, 2-[1,2,4]-триазол-1-илпиримид-4-ил, 2-(1S-гидроксиэтил)пиримид-4-ил, 2-(1R-гидроксиэтил)пиримид-4-ил, 2-(4-этилпиперазин-1-ил)пиримид-4-ил, 2-(4-метилимидазол-1-ил)пиримид-4-ил или 2-(2,4-диметилимидазол-1-ил)пиримид-4-ил.
14. Соединение по п.9, его пролекарство или фармацевтически приемлемая соль указанного соединения или указанного пролекарства, где R9 представляет собой триазинил, возможно замещенный взятыми в количестве до двух гидрокси, (C1-C4)алкилом, (C3-C7)циклоалкилом, (C1-C4)алкокси, гидрокси-(C1-C4)алкилом, (C1-C4)алкокси-(C1-C4)алкилом, триазолилом, ацетилом, морфолинилом, (C1-C4)алкилпиперазинилом, фенилом или имидазолилом, возможно замещенным взятым в количестве до двух (C1-C4)алкилом.
15. Соединение по п.14, его пролекарство или фармацевтически приемлемая соль указанного соединения или указанного пролекарства, где R9 представляет собой [1,3,5]-триазин-2-ил, возможно замещенный взятыми в количестве до двух гидрокси, (C1-C4)алкилом, (C3-C7)циклоалкилом, гидрокси-(C1-C4)алкилюь, (C1-C4)алкокси-(C1-C4)алкилом, (C1-C4)алкокси, морфолинилом или фенилом.
16. Соединение по п.15, его пролекарство или фармацевтически приемлемая соль указанного соединения или указанного пролекарства, где R9 представляет собой 4-морфолин-4-ил-[1,3,5]-триазин-2-ил, 4-метокси-6-метил-[1,3,5]-триазин-2-ил, 4,6-диметокси-[1,3,5]-триазин-2-ил, 4-фенил-[1,3,5]-триазин-2-ил, 4-циклопропил-[1,3,5]-триазин-2-ил, 4,6-диметил-[1,3,5]-триазин-2-ил, 4-гидроксиметил-6-фенил-[1,3,5]-триазин-2-ил, 4-метокси-6-метоксиметил-[1,3,5]-триазин-2-ил, 4-метил-[1,3,5]-триазин-2-ил или 4-метоксиметил-6-фенил-[1,3,5]-триазин-2-ил.
17. Соединение по п.16, где R9 представляет собой 4,6-диметил-[1,3,5]-триазин-2-ил.
18. Соединение, выбранное из
1R-(4-{1'-[2-(1R-гидроксиэтил)пиримидин-4-ил]-[4,4']бипиперидинил-1-ил}пиримидин-2-ил)этанола,
фуро[3,2-c]пиридин-2-ил-{4-[2-(1R-гидроксиэтил)пиримидин-4-ил]-3R,5S-диметилпиперазин-1-ил}метанона,
(4-хлорфуро[3,2-c]пиридин-2-ил)-{4-[2-(1R-гидроксиэтил)пиримидин-4-ил]-3R,5S-диметилпиперазин-1-ил}метанона,
{4-[2-(1R-гидроксиэтил)пиримидин-4-ил]-3R,5S-диметилпиперазин-1-ил}-(4-пирролидин-1-илфуро[3,2-c]пиридин-2-ил)метанона,
{4-[2-(1R-гидроксиэтил)пиримидин-4-ил]-3R,5S-диметилпиперазин-1-ил}-(4-морфолин-4-илфуро[3,2-c]пиридин-2-ил)метанона,
{4-[2-(1R-гидроксиэтил)пиримидин-4-ил]-3R,5S-диметилпиперазин-1-ил}имидазо[1,2-a]пиридин-2-ил-метанона,
фуро[3,2-c]пиридин-2-ил-{4-[2-(1R-гидроксиэтил)пиримидин-4-ил]-2R,6S-диметилпиперазин-1-ил}метанона,
4-[2-(1R-гидроксиэтил)пиримидин-4-ил]-2R,6S-диметилпиперазин-1-карбоновой кислоты пиридин-3-илового эфира,
4-[2-(1R-гидроксиэтил)пиримидин-4-ил]-2R,6S-диметилпиперазин-1-карбоновой кислоты 2-метилпиридин-3-илового эфира,
4-[2-(1R-гидроксиэтил)пиримидин-4-ил]-2R,6S-диметилпиперазин-1-карбоновой кислоты 5-хлорпиридин-3-илового эфира,
4-[2-(1R-гидроксиэтил)пиримидин-4-ил]-2R,6S-диметилпиперазин-1-карбоновой кислоты 6-метилпиридин-3-илового эфира,
(E)-1-{4-[2-(1R-гидроксиэтил)пиримидин-4-ил]-2R,6S-диметилпиперазин-1-ил}-3-тиофен-2-ил-пропенона,
1R-{4-[4-(4,6-диметилпиримидин-2-ил)-3R,5S-диметилпиперазин-1-ил]пиримидин-2-ил}этанола,
1R-(4-[4-(4-метоксиметил-6-метилпиримидин-2-ил)-3R,5S-диметилпиперазин-1-ил]пиримидин-2-ил}этанола,
1R-{4-[4-(4-гидроксиметил-6-метилпиримидин-2-ил)-3R,5S-диметилпиперазин-1-ил]пиримидин-2-ил}этанола,
1R-(4-{3R,5S-диметил-4-[2-(4-метилпиперазин-1-ил)пиримидин-4-ил]пиперазин-1-ил}пиримидин-2-ил)этанола,
1R-(4-{4-[2-(4-этилпиперазин-1-ил)пиримидин-4-ил]-3R,5S-диметилпиперазин-1-ил}пиримидин-2-ил)этанола,
1R-(4-{3R,5S-диметил-4-[2-(4-метилимидазол-1-ил)пиримидин-4-ил]пиперазин-1-ил}пиримидин-2-ил)этанола,
1R-(4-{3R,5S-диметил-4-[2-(2-метилимидазол-1-ил)пиримидин-4-ил]пиперазин-1-ил}пиримидин-2-ил)этанола,
1R-(4-{4-[2-(2,4-диметилимидазол-1-ил)пиримидин-4-ил]-3R,5S-диметилпиперазин-1-ил}пиримидин-2-ил)этанола,
1R-(4-{4-[2-(4-изопропилпиперазин-1-ил)пиримидин-4-ил]-3R,5S-диметилпиперазин-1-ил}пиримидин-2-ил)этанола,
1R-(4-{3R,5S-диметил-4-[4-метил-6-(4-метилпиперазин-1-ил)-[1,3,5]триазин-2-ил]пиперазин-1-ил}пиримидин-2-ил)этанола,
1R-{4-[4-(4-метокси-6-метил-[1,3,5]триазин-2-ил)-3R,5S-диметилпиперазин-1-ил]пиримидин-2-ил}этанола,
1R-{4-[4-(4,6-диметокси-[1,3,5]триазин-2-ил)-3R,5S-диметилпиперазин-1-ил]пиримидин-2-ил}этанола,
1R-{4-[4-(4-этокси-6-метил-[1,3,5]триазин-2-ил)-3R,5S-диметилпиперазин-1-ил]пиримидин-2-ил}этанола,
1R-{4-[4-(4-изопропокси-6-метил-[1,3,5]триазин-2-ил)-3R,5S-диметилпиперазин-1-ил]пиримидин-2-ил}этанола,
1R-{4-[3R,5S-диметил-4-(4-фенил-[1,3,5]триазин-2-ил)пиперазин-1-ил]пиримидин-2-ил}этанола,
1R-{4-[4-(4-гидроксиметил-6-метокси-[1,3,5]триазин-2-ил)-3R,5S-диметилпиперазин-1-ил]пиримидин-2-ил}этанола,
1R-{4-[4-(4-изопропокси-6-метокси-[1,3,5]триазин-2-ил)-3R,5S-диметилпиперазин-1-ил]пиримидин-2-ил}этанола,
1R-{4-[4-(4-изопропил-[1,3,5]триазин-2-ил)-3R,5S-диметилпиперазин-1-ил]пиримидин-2-ил}этанола,
1R-{4-[4-(4-этил-6-метокси-[1,3,5]триазин-2-ил)-3R,5S-диметилпиперазин-1-ил]пиримидин-2-ил}этанола,
1R-{4-[4-(4,6-диметилпиримидин-2-ил)-2R,6S-диметилпиперазин-1-ил]пиримидин-2-ил}этанола,
1R-{4-[4-(4-гидроксиметил-6-метилпиримидин-2-ил)-2R,6S-диметилпиперазин-1-ил]пиримидин-2-ил}этанола,
1R-{4-[2R,6S-диметил-4-(4-[1,2,4]триазол-1-илпиримидин-2-ил)пиперазин-1-ил]пиримидин-2-ил}этанола,
1R-{4-[4-(2,6-диметилпиримидин-4-ил)-2R,6S-диметилпиперазин-1-ил]пиримидин-2-ил}этанола,
1R-(4-{4-[2-(1R-гидроксиэтил)пиримидин-4-ил]-2R,6S-диметилпиперазин-1-ил}пиримидин-2-ил)этанола,
1R-{4-[4-(2-гидроксиметил-6-метилпиримидин-4-ил)-2R,6S-диметилпиперазин-1-ил]пиримидин-2-ил}этанола,
1R-(4-{4-[2-(1S-гидроксиэтил)пиримидин-4-ил]-2R,6S-диметилпиперазин-1-ил}пиримидин-2-ил)этанола,
1S-(4-{4-[2-(1R-гидроксиэтил)пиримидин-4-ил]-2R,6S-диметилпиперазин-1-ил}пиримидин-2-ил)этанола,
1-{4-[4-(2-ацетилпиримидин-4-ил)-2R,6S-диметилпиперазин-1-ил]пиримидин-2-ил}этанона,
1RS-(4-{4-[2-(1RS-гидроксиэтил)пиримидин-4-ил]-2R,6S-диметилпиперазин-1-ил}пиримидин-2-ил)этанола,
(4-{4-[2-(1R-гидроксиэтил)пиримидин-4-ил]-3R,5S-диметилпиперазин-1-ил}пиримидин-2-ил)этанона,
1R-{4-[2R,6S-диметил-4-(2-морфолин-4-илпиримидин-4-ил)пиперазин-1-ил]пиримидин-2-ил}этанола,
1R-(4-{2R,6S-диметил-4-[2-(4-метилпиперазин-1-ил)пиримидин-4-ил]пиперазин-1-ил}пиримидин-2-ил)этанола,
1R-{4-[2R,6S-диметил-4-(2-[1,2,4]триазол-1-илпиримидин-4-ил)пиперазин-1-ил]пиримидин-2-ил}этанола,
1R-(4-{4-[2-(1R-гидроксиэтил)пиримидин-4-ил]-2R,6S-диметилпиперазин-1-ил}пиримидин-2-ил)этанола,
1R-(4-{4-[2-(4-этилпиперазин-1-ил)пиримидин-4-ил]-2R,6S-диметилпиперазин-1-ил}пиримидин-2-ил)этанола,
1R-(4-{2R,6S-диметил-4-[2-(4-метилимидазол-1-ил)пиримидин-4-ил]пиперазин-1-ил}пиримидин-2-ил)этанола,
1R-(4-{4-[2-(2,4-диметилимидазол-1-ил)пиримидин-4-ил]-2R,6S-диметилпиперазин-1-ил}пиримидин-2-ил)этанола,
1R-{4-[2R,6S-диметил-4-(4-морфолин-4-ил-[1,3,5]триазин-2-ил)пиперазин-1-ил]пиримидин-2-ил}этанола,
1R-{4-[4-(4-метокси-6-метил-[1,3,5]триазин-2-ил)-2R,6S-диметилпиперазин-1-ил]пиримидин-2-ил}этанола,
1R-{4-[4-(4,6-диметокси-[1,3,5]триазин-2-ил)-2R,6S-диметилпиперазин-1-ил]пиримидин-2-ил}этанола,
1R-{4-[2R,6S-диметил-4-(4-фенил-[1,3,5]триазин-2-ил)пиперазин-1-ил]пиримидин-2-ил}этанола,
1R-{4-[4-(4-гидроксиметил-6-метилпиримидин-2-ил)-3S-метилпиперазин-1-ил]пиримидин-2-ил}этанола,
1R-{4-[4-(2-гидроксиметилпиримидин-4-ил)-3S-метилпиперазин-1-ил]пиримидин-2-ил}этанола,
1R-{4-[4-(2-гидроксиметил-6-метилпиримидин-4-ил)-3S-метилпиперазин-1-ил]пиримидин-2-ил}этанола,
1R-[4-(3S-метил-4-оксазоло[5,4-b]пиридин-2-илпиперазин-1-ил)пиримидин-2-ил]этанола,
1R-[4-(3S-метил-4-оксазоло[4,5-b]пиридин-2-илпиперазин-1-ил)пиримидин-2-ил]этанола,
1R-[4-(3S-метил-4-хиноксалин-2-илпиперазин-1-ил)пиримидин-2-ил]этанола,
1R-{4-[4-(4,6-диметил-[1,3,5]триазин-2-ил)-3R,5S-диметилпиперазин-1-ил]пиримидин-2-ил}этанола,
1R-{4-[3R,5S-диметил-4-(4-метил-6-фенил-[1,3,5]триазин-2-ил)пиперазин-1-ил]пиримидин-2-ил}этанола,
1R-{4-[4-(4-циклопропил-[1,3,5]триазин-2-ил)-3R,5S-диметилпиперазин-1-ил]пиримидин-2-ил}этанола,
1R-{4-[4-(4-циклопропил-[1,3,5]триазин-2-ил)-2R,6S-диметилпиперазин-1-ил]пиримидин-2-ил}этанола,
1R-{4-[4-(4,6-диметил-[1,3,5]триазин-2-ил)-2R,6S-диметилпиперазин-1-ил]пиримидин-2-ил}этанола,
1R-{4-[4-(4-гидроксиметил-6-фенил-[1,3,5]триазин-2-ил)-2R,6S-диметилпиперазин-1-ил]пиримидин-2-ил}этанола,
1R-{4-[4-(4-метокси-6-метоксиметил-[1,3,5]триазин-2-ил)-2R,6S-диметилпиперазин-1-ил]пиримидин-2-ил}этанола,
1R-{4-[2R,6S-диметил-4-(4-метил-[1,3,5]триазин-2-ил)пиперазин-1-ил]пиримидин-2-ил}этанола,
1-{4-[4-(2-ацетилпиримидин-4-ил)-2R*,6S*-диметилпиперазин-1-ил]пиримидин-2-ил}этанона,
1-(4-{4-[2-(1R-гидроксиэтил)пиримидин-4-ил]-2R,6S-диметилпиперазин-1-ил}пиримидин-2-ил)этанона,
1R-{4-[4-(4-метоксиметил-6-фенил-[1,3,5]триазин-2-ил)-2R,6S-диметилпиперазин-1-ил]пиримидин-2-ил}этанола,
(4-{4-[2-(1R-гидроксиэтил)пиримидин-4-ил]-2R,5S-диметилпиперазин-1-ил}пиримидин-2-ил)этанола и
1S-(4-{4-[2-(1R-гидроксиэтил)пиримидин-4-ил]-2R,6S-диметилпиперазин-1-ил}пиримидин-2-ил)этанола.
19. 1R-{4-[4-(4,6-диметил-[1,3,5]триазин-2-ил)-2R,6S-диметилпиперазин-1-ил]пиримидин-2-ил}этанол.
20. Фармацевтическая композиция, содержащая соединение по любому из пп.1-19, его пролекарство или фармацевтически приемлемую соль указанного соединения или указанного пролекарства и фармацевтически приемлемый носитель или разбавитель.
21. Способ ингибирования сорбитолдегидрогеназы у млекопитающего, нуждающегося в таком ингибировании, при котором указанному млекопитающему вводят ингибирующее сорбитолдегидрогеназу количество соединения по любому из пп.1-19, его пролекарства или фармацевтически приемлемой соли указанного соединения или указанного пролекарства.
22. Способ лечения диабета у млекопитающего, страдающего диабетом, при котором указанному млекопитающему вводят эффективное количество соединения по любому из пп.1-19, его пролекарства или фармацевтически приемлемой соли указанного соединения или указанного пролекарства.
23. Способ лечения или предупреждения диабетических осложнений у млекопитающего, при котором указанному млекопитающему вводят эффективное количество соединения по любому из пп.1-19, его пролекарства или фармацевтически приемлемой соли указанного соединения или указанного пролекарства.
24. Способ по п.23, где указанное диабетическое осложнение представляет собой диабетическую нефропатию.
25. Способ по п.23, где указанное диабетическое осложнение представляет собой диабетическую невропатию.
26. Соединение формулы Z
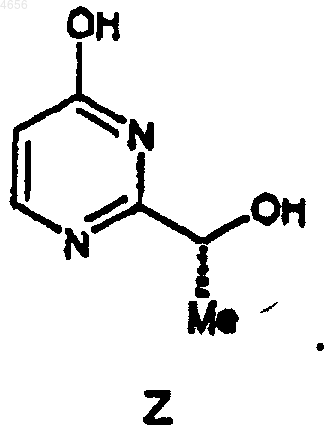
27. Соединение формулы ZZ

где R100 представляет собой (C1-C8)алкил, бензил или фенил, причем указанные бензил и фенил возможно замещены взятыми в количестве до трех галогено или (C1-C4)алкилом.
28. Соединение формулы III
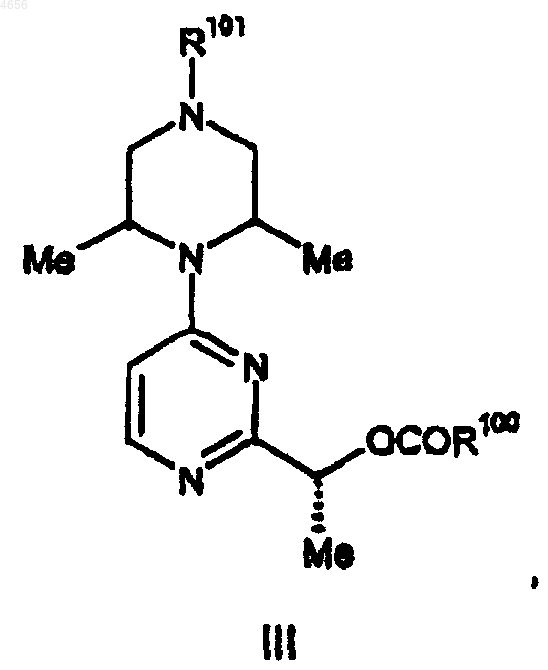
где R100 представляет собой (C1-C8)алкил, бензил или фенил, причем указанные бензил и фенил возможно замещены взятыми в количестве до трех галогено или (C1-C6)алкилом; и
R101 представляет собой водород или подходящую защитную группу для амина.
29. Соединение по п.28, где R100 представляет собой (C1-C4)алкил и R101 представляет собой бензил или трет-бутилоксикарбонил.
30. Соединение по п.29, где R100 представляет собой н-бутил или этил и R101 представляет собой бензил.
31. Соединение по п.29, где R100 представляет собой н-бутил или этил и R101 представляет собой трет-бутилоксикарбонил.
32. Способ получения соединения формулы Z
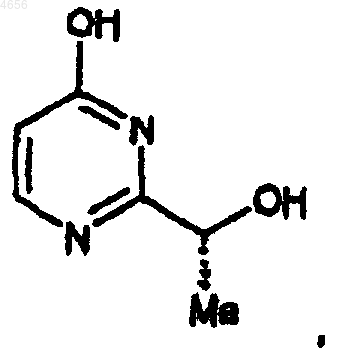
при котором
а) R-(+)-2-гидроксипропионамид подвергают взаимодействию с триэтилоксония тетрафторборатом в реакционно-инертном растворителе в течение промежутка времени от 10 мин до 24 ч при температуре от 0шC до температуры окружающей среды с образованием соответствующего имидата;
б) указанный соответствующий имидат подвергают взаимодействию с безводным аммиаком в реакционно-инертном растворителе в течение промежутка времени от 2 до 24 ч при температуре от 0шC до температуры окружающей среды с образованием R-(+)-2-гидроксипропионамидина гидрохлорида; и
в) указанный R-(+)-2-гидроксипропионамидина гидрохлорид подвергают взаимодействию с натриевой солью этил-3-гидроксиакрилата и подходящим основанием в реакционно-инертном растворителе с образованием указанного соединения формулы Z.
Текст
1 Настоящее изобретение относится к новым производным пиримидина и к применению таких производных и родственных соединений для ингибирования сорбитолдегидрогеназы(SDH), снижения уровней фруктозы или лечения или предупреждения диабетических осложнений, таких как диабетическая невропатия,диабетическая ретинопатия, диабетическая нефропатия, диабетическая кардиомиопатия, диабетическая микроангиопатия и диабетическая макроангиопатия, у млекопитающих. Данное изобретение также относится к фармацевтическим композициям, содержащим такие производные пиримидина и родственные соединения. Данное изобретение также относится к фармацевтическим композициям, содержащим комбинацию ингибитора сорбитолдегидрогеназы формулы I и ингибитора альдозоредуктазы и к применению таких композиций для лечения или предупреждения диабетических осложнений у млекопитающих. Данное изобретение также относится к фармацевтическим композициям,содержащим комбинацию ингибитора сорбитолдегидрогеназы формулы I и ингибитораNHE-1 (натрий-водородного ионного обмена) и к применению таких композиций для уменьшения повреждения тканей, вызванного ишемией,и, в частности, для предупреждения периоперативного миокардиального ишемического повреждения. Было показано [S. Аo et al., Metabolism, 40,77-87 (1991)], что происходит значительное функциональное улучшение в нервах крысдиабетиков (основанное на скорости проводимости нерва) при фармакологическом снижении уровней фруктозы в нервах, и что такое улучшение в большей степени соотносится со снижением уровней фруктозы в нервах, чем со снижением уровней сорбитола в нервах. Об аналогичных результатах сообщали N.Е. Cameron and M.A. Cotter [Diabetic Medicine, 8, Suppl. 1, 35 А-36 А (1991)]. В обоих этих случаях снижение уровней фруктозы в нервах было достигнуто при использовании относительно высоких доз ингибиторов альдозоредуктазы, которые ингибируют образование сорбитола, предшественника фруктозы, из глюкозы через посредство фермента альдозоредуктазы. В патентах США 5138058 и 5215990,которые включены в данное описание изобретения ссылкой, раскрыты соединения формулы где R1, R2, R3, R4 и R5 такие, как описано в этих патентах. Указанные соединения раскрыты как имеющие применение в качестве средств, используемых в скрининге на ингибиторы альдозоредуктазы,благодаря сорбитол 004656 2 аккумулирующей активности указанных соединений. В переуступленных должным образом патентах США 5728704 и 5866578, которые включены в данное описание изобретения ссылкой, раскрыты соединения формулы А где R1- R5 определены так, как описано в этих патентах. В патенте США 5728704 также указано, что активные в отношении сорбитолдегидрогеназы соединения имеют применение в лечении диабетических осложнений. Производные пиримидина формулы I, как они определены ниже, и их фармацевтически приемлемые соли снижают уровни фруктозы в тканях млекопитающих, пораженных диабетом(например, в нервной ткани, почечной ткани или ткани сетчатки), и пригодны для лечения и предупреждения диабетических осложнений,указанных выше. Эти соединения или in vivo их метаболиты являются ингибиторами фермента сорбитолдегидрогеназы, которая катализирует окисление сорбитола до фруктозы. Сущность изобретения Настоящее изобретение относится к соединению формулы I его пролекарству или фармацевтически приемлемой соли указанного соединения или указанного пролекарства, где:R3 представляет собой радикал формулыR9 представляет собой пиримидил или триазинил; указанный пиримидил или триазинил возможно замещен взятыми в количестве до двух гидрокси, (С 1-С 4)алкилом, (С 3-С 7)циклоалкилом, (С 1-С 4)алкокси, гидрокси-(С 1-С 4)алкилом, (С 1-С 4)алкокси-(С 1-С 4)алкиленилом, фенилом, пиперазинилом, который возможно замещен (С 1-С 4)алкилом, или имидазолилом, который возможно замещен взятым в количестве до двух (С 1-С 4)алкилом. Предпочтительной группой соединений формулы I являются те соединения формулы I,их пролекарства или фармацевтически прием 3 лемые соли указанных соединений или указанных пролекарств, где R9 представляет собой пиримид-2-ил, возможно замещенный взятыми в количестве до двух (C1-С 4)алкилом, гидрокси(С 1-С 4)алкилом или (С 1-С 4)алкокси-(С 1-С 4)алкилом. А среди них более предпочтительны соединения, пролекарства или фармацевтически приемлемые соли указанных соединений или указанных пролекарств, где R9 представляет собой 4,6-диметилпиримид-2-ил, 4-метоксиметил-6-метилпиримид-2-ил или 4-гидроксиметил 6-метилпиримид-2-ил. Другой предпочтительной группой соединений формулы I являются те соединения формулы I, их пролекарства или фармацевтически приемлемые соли указанных соединений или указанных пролекарств, где R9 представляет собой пиримид-4-ил, возможно замещенный взятыми в количестве до двух (C1-С 4)алкилпиперазин-1-илом или имидазолилом; и указанный имидазолил возможно замещен взятым в количестве до двух (С 1-С 4)алкилом. А среди них более предпочтительны соединения, пролекарства или фармацевтически приемлемые соли указанных соединений или указанных пролекарств, где R9 представляет собой 2-(4-метилпиперазин-1-ил)-пиримид-4-ил,2-(4-этилпиперазин-1-ил)-пиримид-4-ил, 2-(4 метилимидазол-1-ил)-пиримид-4-ил, 2-(2-метилимидазол-1-ил)-пиримид-4-ил, 2-(2,4-диметилимидазол-1-ил)-пиримид-4-ил или 2-(4-изопропилпиперазин-1-ил)-пиримид-4-ил. Другой предпочтительной группой соединений формулы I являются те соединения формулы I, их пролекарства или фармацевтически приемлемые соли указанных соединений или указанных пролекарств, где R9 представляет собой триазинил, возможно замещенный взятыми в количестве до двух гидрокси, (С 1 С 4)алкилом, (С 3-С 7)циклоалкилом, (С 1-С 4)алкокси, гидрокси-(С 1-С 4)алкилом, (С 1-С 4)алкокси(С 1-С 4)алкиленилом, фенилом, пиперазинилом,возможно замещенным (С 1-С 4)алкилом, или имидазолилом, возможно замещенным взятым в количестве до двух (С 1-С 4)алкилом. А среди них более предпочтительны соединения, пролекарства или фармацевтически приемлемые соли указанных соединений или указанных пролекарств, где R9 представляет собой [1,3,5]-триазин-2-ил, возможно замещенный взятыми в количестве до двух (С 1-С 4)алкилом, (С 1-С 4)алкокси, гидрокси-(С 1-С 4)алкилом,(С 1-С 4)алкилпиперазин-1-илом или фенилом. Наиболее предпочтительными среди вышеуказанных являются соединения, пролекарства или фармацевтически приемлемые соли указанных соединений или указанных пролекарств, где R9 представляет собой 4-метил-6-(4 метилпиперазин-1-ил)-[1,3,5]-триазин-2-ил, 4 метокси-6-метил-[1,3,5]-триазин-2-ил, 4,6-диметокси-[1,3,5]-триазин-2-ил,4-этокси-6-метил 004656[1,3,5]-триазин-2-ил,4-изопропокси-6-метил[1,3,5]-триазин-2-ил, 4-фенил-[1,3,5]-триазин-2 ил, 4-гидроксиметил-6-метокси-[1,3,5]-триазин 2-ил, 4-изопропокси-6-метокси-[1,3,5]-триазин 2-ил, 4-изопропил-[1,3,5]-триазин-2-ил, 4-этил 6-метокси-[1,3,5]-триазин-2-ил, 4-циклопропил[1,3,5]-триазин-2-ил, 4,6-диметил-[1,3,5]-триазин-2-ил или 4-метил-6-фенил-[1,3,5]-триазин-2 ил. Настоящее изобретение также относится к соединению формулы I его пролекарству или фармацевтически приемлемой соли указанного соединения или указанного пролекарства, где:R3 представляет собой радикал формулыR9 представляет собой пиримидил или триазинил; указанные пиримидил и триазинил возможно замещены взятыми в количестве до двух гидрокси, (C1-С 4)алкилом, (С 3-С 7)циклоалкилом, (С 1-С 4)алкокси, гидрокси-(С 1-С 4)алкилом, (C1-С 4)алкокси-(С 1-С 4)алкилом, триазолилом, ацетилом, морфолинилом, (C1-С 4)алкилпиперазинилом, фенилом или имидазолилом,возможно замещенным взятым в количестве до двух (С 1-С 4)алкилом. Предпочтительной группой таких соединений формулы I являются те соединения формулы I, их пролекарства или фармацевтически приемлемые соли указанных соединений или указанных пролекарств, где R9 представляет собой пиримид-2-ил, возможно замещенный взятыми в количестве до двух (C1-С 4)алкилом,гидрокси-(С 1-С 4)алкилом или триазолилом. А среди них более предпочтительны соединения, пролекарства или фармацевтически приемлемые соли указанных соединений или указанных пролекарств, где R9 представляет собой 4,6-диметилпиримид-2-ил, 4-гидроксиметил-6-метилпиримид-2-ил или 4-[1,2,4]-триазол-1 -ил-пиримид-2-ил. Другой предпочтительной группой таких соединений формулы I являются те соединения формулы I, их пролекарства или фармацевтически приемлемые соли указанных соединений или указанных пролекарств, где R9 представляет собой пиримид-4-ил, возможно замещенный взятыми в количестве до двух (С 1-С 4)алкилом,гидрокси-(С 1-С 4)алкилом, ацетилом, морфоли 5 нилом, (С 1-С 4)алкилпиперазинилом, триазолилом или имидазолилом, возможно замещенным взятым в количестве до двух (С 1-С 4)алкилом. А среди них более предпочтительны соединения, пролекарства или фармацевтически приемлемые соли указанных соединений или указанных пролекарств, где R9 представляет собой 2,6-диметилпиримид-4-ил, 2-гидроксиметил-6-метилпиримид-4-ил, 2-ацетилпиримид 4-ил,2-морфолин-4-илпиримид-4-ил,2-(4 метилпиперазин-1-ил)пиримид-4-ил, 2-[1,2,4]триазол-1-илпиримид-4-ил,2-(1S-гидроксиэтил)пиримид-4-ил, 2-(1R-гидроксиэтил)пиримид-4-ил, 2-(4-этилпиперазин-1-ил)пиримид-4 ил, 2-(4-метилимидазол-1-ил)пиримид-4-ил или 2-(2,4-диметилимидазол-1-ил)пиримид-4-ил. Другой предпочтительной группой таких соединений формулы I являются те соединения формулы I, их пролекарства или фармацевтически приемлемые соли указанных соединений или указанных пролекарств, где R9 представляет собой триазинил, возможно замещенный взятыми в количестве до двух гидрокси, (С 1 С 4)алкилом, (С 3-С 7)циклоалкилом, (С 1-С 4)алкокси, гидрокси-(С 1-С 4)алкилом, (С 1-С 4)алкокси(С 1-С 4)алкилом, триазолилом, ацетилом, морфолинилом, (С 1-С 4)алкилпиперазинилом, фенилом или имидазолилом, возможно замещенным взятым в количестве до двух (C1-С 4)алкилом. А среди них более предпочтительны соединения, пролекарства или фармацевтически приемлемые соли указанных соединений или указанных пролекарств, где R9 представляет собой [1,3,5]-триазин-2-ил, возможно замещенный взятыми в количестве до двух гидрокси,(С 1-С 4)алкилом, (С 3-С 7)циклоалкилом, гидрокси-(С 1-С 4)алкилом, (С 1-С 4)алкокси-(С 1-С 4)алкилом, (C1-С 4)алкокси, морфолинилом или фенилом. И еще более предпочтительны соединения,пролекарства или фармацевтически приемлемые соли указанных соединений или указанных пролекарств, где R9 представляет собой 4 морфолин-4-ил-[1,3,5]-триазин-2-ил, 4-метокси 6-метил-[1,3,5]-триазин-2-ил,4,6-диметокси[1,3,5]-триазин-2-ил, 4-фенил-[1,3,5]-триазин-2 ил, 4-циклопропил-[1,3,5]-триазин-2-ил, 4,6 диметил-[1,3,5]-триазин-2-ил, 4-гидроксиметил 6-фенил-[1,3,5]-триазин-2-ил,4-метокси-6 метоксиметил-[1,3,5]-триазин-2-ил,4-метил[1,3,5]-триазин-2-ил или 4-метоксиметил-6 фенил-[1,3,5]-триазин-2-ил. И наиболее предпочтительны соединения,где R9 представляет собой 4,6-диметил-[1,3,5]триазин-2-ил. Настоящее изобретение относится к соединению, выбранному из 1R-(4-1'-[2-(1Rгидроксиэтил)пиримидин-4-ил]-[4,4']бипиперидинил-1-илпиримидин-2-ил)этанола,фуро[3,2-с]пиридин-2-ил-4-[2-(1Rгидроксиэтил)пиримидин-4-ил]-3R,5S-диметилпиперазин-1-илметанона, 004656 8 1R-4-[2R,6S-диметил-4-(2-морфолин-4 илпиримидин-4-ил)пиперазин-1-ил]пиримидин 2-илэтанола,1R-(4-2R,6S-диметил-4-[2-(4-метилпиперазин-1-ил)пиримидин-4-ил]пиперазин-1-ил пиримидин-2-ил)этанола,1R-4-[2R,6S-диметил-4-(2-[1,2,4]триазол 1-илпиримидин-4-ил)пиперазин-1-ил]пиримидин-2-илэтанола,1R-(4-4-[2-(1R-гидроксиэтил)пиримидин 4-ил]-2R,6S-диметилпиперазин-1-илпиримидин-2-ил)этанола,1R-(4-4-[2-(4-этилпиперазин-1-ил)пиримидин-4-ил]-2R,6S-диметилпиперазин-1-ил пиримидин-2-ил)этанола,1R-(4-2R,6S-диметил-4-[2-(4-метилимидазол-1-ил)пиримидин-4-ил]пиперазин-1 илпиримидин-2-ил)этанола,1R-(4-4-[2-(2,4-диметилимидазол-1-ил) пиримидин-4-ил]-2R,6S-диметилпиперазин-1 илпиримидин-2-ил)этанола,1R-4-[2R,6S-диметил-4-(4-морфолин-4 ил-[1,3,5]триазин-2-ил)пиперазин-1-ил]пиримидин-2-илэтанола,1R-4-[4-(4-метокси-6-метил-[1,3,5]триазин-2-ил)-2R,6S-диметилпиперазин-1-ил]пиримидин-2-илэтанола,1R-4-[4-(4,6-диметокси-[1,3,5]триазин-2 ил)-2R,6S-диметилпиперазин-1-ил]пиримидин 2-илэтанола,1R-4-[2R,6S-диметил-4-(4-фенил-[1,3,5] триазин-2-ил)пиперазин-1-ил]пиримидин-2-ил этанола,1R-4-[4-(4-гидроксиметил-6-метилпиримидин-2-ил)-3S-метилпиперазин-1-ил]пиримидин-2-илэтанола,1R-4-[4-(2-гидроксиметилпиримидин-4 ил)-3S-метилпиперазин-1-ил]пиримидин-2-ил этанола,1R-4-[4-(2-гидроксиметил-6-метилпиримидин-4-ил)-3S-метилпиперазин-1-ил] пиримидин-2-илэтанола,1R-[4-(3S-метил-4-оксазоло[5,4-b]пиридин-2-илпиперазин-1-ил)пиримидин-2-ил] этанола,1R-[4-(3S-метил-4-оксазоло[4,5-b]пиридин-2-илпиперазин-1-ил)пиримидин-2-ил] этанола,1R-[4-(3S-метил-4-хиноксалин-2-илпиперазин-1-ил)пиримидин-2-ил]этанола,1R-4-[4-(4,6-диметил-[1,3,5]триазин-2 ил)-3R,5S-диметилпиперазин-1-ил]пиримидин 2-илэтанола,1R-4-[3R,5S-диметил-4-(4-метил-6-фенил[1,3,5]триазин-2-ил)пиперазин-1-ил]пиримидин 2-илэтанола,1R-4-[4-(4-циклопропил-[1,3,5]триазин-2 ил)-3R,5S-диметилпиперазин-1-ил]пиримидин 2-илэтанола,1R-4-[4-(4-циклопропил-[1,3,5]триазин-2 ил)-2R,6S-диметилпиперазин-1-ил]пиримидин 2-илэтанола, 9 1R-4-(4-(4,6-диметил-[1,3,5]триазин-2 ил)-2R,6S-диметилпиперазин-1-ил]пиримидин 2-илэтанола,1R-4-[4-(4-гидроксиметил-6-фенил[1,3,5]триазин-2-ил)-2R,6S-диметилпиперазин 1-ил]пиримидин-2-илэтанола,1R-4-[4-(4-метокси-6-метоксиметил[1,3,5]триазин-2-ил)-2R,6S-диметилпиперазин 1-ил]пиримидин-2-илэтанола,1R-4-[2R,6S-диметил-4-(4-метил[1,3,5]триазин-2-ил)пиперазин-1-ил]пиримидин 2-илэтанола,1-4-[4-(2-ацетилпиримидин-4-ил)2R,6S-диметилпиперазин-1-ил]пиримидин-2 илэтанона,1-(4-4-[2-(1R-гидроксиэтил)пиримидин-4 ил]-2R,6S-диметилпиперазин-1-илпиримидин 2-ил)этанона,1R-4-[4-(4-метоксиметил-6-фенил[1,3,5]триазин-2-ил)-2R,6S-диметилпиперазин 1-ил]пиримидин-2-илэтанола,(4-4-[2-(1R-гидроксиэтил)пиримидин-4 ил]-2R,5S-диметилпиперазин-1-илпиримидин 2-ил)этанола и 1S-(4-4-[2-(1R-гидроксиэтил)пиримидин 4-ил]-2R,6S-диметилпиперазин-1-илпиримидин-2-ил)этанола. Предпочтительным соединением является 1R-4-[4-(4,6-диметил-[1,3,5]триазин-2-ил)2R,6S-диметилпиперазин-1-ил]пиримидин-2 илэтанол. Согласно данному изобретению также предложена фармацевтическая композиция, содержащая одно из вышеуказанных соединений формулы I, его пролекарство или фармацевтически приемлемую соль указанного соединения или указанного пролекарства и фармацевтически приемлемый носитель или разбавитель. Также предложен способ ингибирования сорбитолдегидрогеназы у млекопитающего, нуждающегося в таком ингибировании, при котором указанному млекопитающему вводят ингибирующее сорбитолдегидрогеназу количество соединения формулы I, его пролекарства или фармацевтически приемлемой соли указанного соединения или указанного пролекарства. Способ лечения диабета у млекопитающего, страдающего диабетом, при котором указанному млекопитающему вводят эффективное количество соединения формулы I, его пролекарства или фармацевтически приемлемой соли указанного соединения или указанного пролекарства. Способ лечения или предупреждения диабетических осложнений у млекопитающего, при котором указанному млекопитающему вводят эффективное количество соединения формулы I,его пролекарства или фармацевтически приемлемой соли указанного соединения или указанного пролекарства. Преимущественно указанное диабетическое осложнение представляет собой 10 диабетическую нефропатию или диабетическую невропатию. Настоящее изобретение также относится к соединению формулы Z. где R100 представляет собой (С 1-С 8)алкил, бензил или фенил, причем указанные бензил и фенил возможно замещены взятыми в количестве до трех галогено или (С 1-С 4)алкилом. А также к соединению формулы III где R100 представляет собой (С 1-С 8)алкил, бензил или фенил, причем указанные бензил и фенил возможно замещены взятыми в количестве до трех галогено или (С 1-С 6)алкилом; и R101 представляет собой водород или подходящую защитную группу для амина. Предпочтительно в соединении формулыIII R100 представляет собой (C1-С 4)алкил, и R101 представляет собой бензил или третбутилоксикарбонил. А более предпочтительно соединение формулы III, где R100 представляет собой н-бутил или этил, и R101 представляет собой бензил, либо соединение формулы III, гдеR100 представляет собой н-бутил или этил, и R101 представляет собой трет-бутилоксикарбонил. Предложен также способ получения соединения формулы Z при котором а) R-(+)-2-гидроксипропионамид подвергают взаимодействию с триэтилоксония тетрафторборатом в реакционно-инертном растворителе в течение промежутка времени от 10 мин до 24 ч при температуре от 0 С до температуры окружающей среды с образованием соответствующего имидата; 11 б) указанный соответствующий имидат подвергают взаимодействию с безводным аммиаком в реакционно-инертном растворителе в течение промежутка времени от 2 ч до 24 ч при температуре от 0 С до температуры окружающей среды с образованием R-(+)-2-гидроксипропионамидина гидрохлорида; и в) указанный R-(+)-2-гидроксипропионамидина гидрохлорид подвергают взаимодействию с натриевой солью этил-3-гидроксиакрилата и подходящим основанием в реакционноинертном растворителе с образованием указанного соединения формулы Z. Изобретение также включает в себя меченные радиоактивными изотопами соединения,которые идентичны соединениям, перечисленным в формуле I, за исключением того, что один или более атомов заменены атомом, имеющим атомную массу или массовое число, отличающееся от атомной массы или массового числа,обычно встречающегося в природе. Примерами изотопов, которые можно вводить в соединения по изобретению, являются изотопы водорода,углерода, азота, фосфора, серы, фтора и хлора,такие как 2H, 3H, 13 С, 14C, 15N, 17O, 31P, 32P, 35S,18F и 36Cl соответственно. Соединения по настоящему изобретению, их пролекарства и фармацевтически приемлемые соли указанных соединений или указанных пролекарств, которые содержат вышеупомянутые изотопы и/или другие изотопы других атомов входят в объем данного изобретения. Некоторые меченные радиоактивными изотопами соединения по настоящему изобретению, например соединения, в которые введены радиоактивные изотопы, такие как 3H и 14 С, пригодны для использования в анализах на распределение в тканях лекарственных веществ и/или субстратов. Тритированные,то есть 3H, и углерод-14, то есть 14 С, изотопы особенно предпочтительны вследствие легкости получения и обнаружения. Кроме того, замещение тяжелыми изотопами, такими как дейтерий,то есть 2H, может иметь определенные терапевтические преимущества, благодаря большей метаболической стабильности, например увеличенного in vivo периода полураспада или пониженных требований к дозировке, и, следовательно, в некоторых случаях может быть предпочтительным. Меченные изотопами соединения формулы I по данному изобретению и их пролекарства в общем случае могут быть получены по методикам, описанным на схемах и/или в примерах и подготовительных примерах ниже,с заменой немеченого реагента легкодоступным меченым реагентом. Подразумевается, что термин "уменьшение" включает в себя частичное предупреждение или предупреждение, которое хотя и больше чем предупреждение, которое является результатом в том случае, когда соединение не вводят или когда вводят плацебо, составляет 12 менее 100% по отношению к практически полному предупреждению. Используемый здесь термин "повреждение в результате ишемии" относится к состояниям,напрямую связанным со снижением кровотока к ткани, например из-за тромба или закупорки кровеносных сосудов, которые снабжают кровью ткань субъекта, что приводит, среди прочего, к снижению переноса кислорода к такой ткани, ухудшению функционирования ткани,дисфункции и/или некрозу ткани. Альтернативно, если кровоток или перфузия органа могут быть количественно адекватными, способность переноса кислорода кровью или кровоснабжающей орган средой может быть снижена, например в условиях кислородного голодания,когда снабжение кислородом ткани понижено, и в результате происходит ухудшение функционирования ткани, дисфункция ткани и/или некроз ткани. Используемые здесь термины "лечение","лечить" или "терапия" включают в себя превентативное (например профилактическое) и паллиативное лечение. Термин "фармацевтически приемлемый" означает, что носитель, разбавитель, эксципиенты и/или соли должны быть совместимыми с другими ингредиентами препарата и не должны быть вредными для их реципиента. Выражение "пролекарство" относится к соединениям, которые являются предшественниками лекарственных средств, которые после введения высвобождают лекарственное средство in vivo в результате какого-либо химического или физиологического процесса (например,пролекарство в условиях физиологического рН или под воздействием фермента превращается в желаемую лекарственную форму). Данное изобретение также относится к соединениям, которые являются общими пролекарствами ингибиторов альдозоредуктазы и ингибиторов сорбитолдегидрогеназы. Под общим пролекарством подразумевается соединение,которое содержит два активных компонента, в данном случае ингибитор альдозоредуктазы и ингибитор сорбитолдегидрогеназы, которое после введения расщепляется, высвобождая каждый индивидуальный активный компонент. Такие общие пролекарства ингибитора альдозоредуктазы и ингибитора сорбитолдегидрогеназы образуются в стандартных условиях этерификации, общеизвестных специалистам в данной области техники. Под алкиленом подразумевается насыщенный углеводород (с прямой или разветвленной цепью), в котором атом водорода удален с обоих конечных углеродов. Примерами таких групп(предполагая, что обозначенная длина охватывает конкретный пример) являются метилен,этилен, пропилен, бутилен, пентилен, гексилен,гептилен. 13 Под галогено подразумевается хлоро, бромо, йодо или фторо. Под алкилом подразумевается насыщенный углеводород с прямой цепью или разветвленный насыщенный углеводород. Примерами таких алкильных групп (предполагая, что обозначенная длина охватывает конкретный пример) являются метил, этил, пропил, изопропил,бутил, вторичный бутил, третичный бутил, пентил, изопентил, неопентил, третичный пентил,1-метилбутил, 2-метилбутил, гексил, изогексил,гептил и октил. Под алкокси подразумевается насыщенный алкил с прямой цепью или разветвленный насыщенный алкил, связанный через кислород. Примерами таких алкоксигрупп (предполагая,что обозначенная длина охватывает конкретный пример) являются метокси, этокси, пропокси,изопропокси, бутокси, изобутокси, третбутокси, пентокси, изопентокси, неопентокси,трет-пентокси, гексокси, изогексокси, гептокси и октокси. Очевидно, что если углеводородная циклическая или гетероциклическая группировка может быть связана или иным способом присоединена к обозначенному субстрату по различным атомам кольца без указания конкретной точки присоединения, то имеются в виду все возможные точки - как по атому углерода, так и,например, по трехвалентному атому азота. Например, термин "пиридил" означает 2-, 3- или 4 пиридил, термин "тиенил" означает 2- или 3 тиенил, и так далее. Выражение "фармацевтически приемлемая соль" относится к нетоксичным анионным солям, содержащим такие анионы, как (но не ограничено ими) хлорид, бромид, иодид, сульфат,бисульфат, фосфат, ацетат, малеат, фумарат,оксалат, лактат, тартрат, цитрат, глюконат, метансульфонат и 4-толуолсульфонат. Если имеется более чем одна основная группировка, выражение включает в себя множественные соли(например, ди-соль). Это выражение также относится к нетоксичным катионным солям, таким как (но не ограничено ими) натриевые, калиевые, кальциевые, магниевые, аммониевые или соли протонированного бензатина (N,N'дибензилэтилендиамина), холина, этаниламина,диэтаноламина, этилендиамина, меглюмина (Nметилглюкамина), бенетамина (N-бензилфенетиламина), пиперазина или трометамина (2 амино-2-гидроксиметил-1,3-пропандиола). Используемые здесь выражения "реакционно-инертный растворитель" и "инертный растворитель" относятся к растворителю или к смеси растворителей, которые не взаимодействуют с исходными веществами, реагентами, промежуточными соединениями или продуктами таким образом, чтобы неблагоприятно влиять на выход желаемого продукта. Химикам очевидно, что некоторые соединения формулы I по данному изобретению со 004656 14 держат один или более атомов, которые могут находиться в конкретной стереохимической или геометрической конфигурации, создавая стереоизомеры и конфигурационные изомеры. Все такие изомеры и их смеси включены в данное изобретение. Соединения формулы I могут быть хиральными. В таких случаях предпочтительным является изомер, в котором R1 имеет R конфигурацию. Гидраты соединений формулы I по изобретению также охвачены. Химикам также очевидно, что некоторые соединения формулы I по данному изобретению могут существовать в таутомерной форме, то есть существует положение равновесия между двумя изомерами, которые находятся в быстром равновесии друг с другом. Общеизвестным примером таутомерии является кето-енольная таутомерия, то есть. Примеры соединений, которые могут существовать в виде таутомеров, включают в себя гидроксипиридины, гидроксипиримидины и гидроксихинолины. Другие примеры очевидны специалистам в данной области техники. Все подобные таутомеры и их смеси включены в данное изобретение.DMSO обозначает диметилсульфоксид. THF обозначает тетрагидрофуран. Всякий раз, когда структура циклического радикала показана со связью, изображенной от наружной стороны кольца вовнутрь кольца,специалистам в данной области должно быть понятно, что связь может быть присоединена к любому атому на кольце в доступном месте связывания. Если циклический радикал является бициклическим или трициклическим радикалом, то связь может быть присоединена к любому атому на любом их колец в доступном месте для связывания. Например, представляет любой или все из следующих радикалов: Другие признаки и преимущества будут ясны из описания и формулы изобретения, которые раскрывают данное изобретение. 15 Подробное описание изобретения В общем случае соединения формулы I по настоящему изобретению можно получить способами, которые включают в себя способы, известные в области химии, в частности, в свете представленного здесь описания. Некоторые способы получения соединений формулы I по данному изобретению предложены в качестве дополнительных признаков изобретения и иллюстрируются нижеследующими реакционными схемами. Другие способы описаны в экспериментальном разделе. Схема 1 Соединения формулы 1-3 (то есть формулы I) получают, как показано на cхеме 1, в частности как описано ниже. Соединения формулы 1-3 получают реакцией замещения пиримидина формулы 1-1, гдеLv представляет собой уходящую группу, предпочтительно выбранную из фторо, хлоро, бромо, иодо, тиометила, метилсульфона или OSO2J,где J представляет собой (С 1-С 6)-низший алкил,трифторметил, пентафторэтил, фенил, возможно замещенный взятыми в количестве до трех (С 1 С 4)алкилом, нитро или галогено. Уходящую группу Lv замещают амином формулы 1-2, гдеR3 является таким, как определено выше. Реакцию проводят в присутствии неводного основания, предпочтительно органического амина или неорганического основания. Предпочтительные органические амины включают триэтиламин,пиридин, диметиламинопиридин и N,N'диизопропилэтиламин (основание Хюнига). Предпочтительные неорганические основания включают карбонаты и бикарбонаты щелочных металлов, такие как карбонат натрия или калия и бикарбонат натрия или калия. Особенно предпочтительным неорганическим основанием является карбонат калия. Особенно предпочтительным органическим амином является триэтиламин. Альтернативно, в качестве основания для этой реакции можно использовать избыток реагирующего амина 1-2. Реакцию можно проводить в отсутствии растворителя или в реакционно-инертном растворителе. Используемый здесь термин "реакционно-инертный растворитель" относится к растворителю, который не взаимодействует с исходными веществами, реагентами, промежуточными соединениями или продуктами таким образом, чтобы неблагоприятно влиять на выход целевого продукта. Предпочтительные реакционно-инертные растворители включают водную среду, пиридин, (С 1 004656 16 С 4)спирт, (С 2-С 6)гликоль, галогенуглеводород,алифатический/ароматический углеводород,эфирный растворитель, полярный апротонный растворитель, кетонный растворитель или их комбинации. Время реакции находится в пределах от 15 мин до 3 сут.; температура реакции находится в пределах от 0 С до 180 С. Данную реакцию удобно проводить при температуре дефлегмации используемого растворителя. Данную реакцию предпочтительно проводят при давлении окружающей среды. Используемый здесь термин "давление окружающей среды" относится к давлению в помещении, в котором проводят реакцию. Используемый здесь термин"температура окружающей среды" относится к температуре в помещении, в котором проводят реакцию. Если R1 содержит гидроксигруппу, эта гидроксильная группа может быть защищена или не защищена. Когда гидроксильная группа защищена, защитная группа может представлять собой любую подходящую защитную группу гидроксила. Условия, используемые для удаления таких возможных защитных групп гидроксила, содержащихся в R1 в соединениях формулы 1-3, следующие. Если защитная группа является сложноэфирной группой, удаление таких сложноэфирных защитных групп проводят в щелочных условиях, используя неорганические гидроксиды или карбонаты, предпочтительно гидроксид лития, гидроксид натрия, гидроксид калия или карбонат калия. Реакцию проводят в реакционно-инертном растворителе,предпочтительно спиртовом растворителе. Особенно предпочтительным является метанол или метанол в комбинации с сорастворителями, такими как вода, тетрагидрофуран или диоксан. Время реакции находится в пределах от 15 мин до 24 ч; температура реакции находится в пределах от 0 до 100 С или до температуры дефлегмации используемого(ых) растворителя(ей). Альтернативно, расщепление сложного эфира может быть достигнуто в кислотных условиях. Предпочтительно использовать водную соляную кислоту, обычно от 2 н. до концентрированной, с или без сорастворителя. Если используют сорастворитель, предпочтительными являются диоксан или метанол. Время реакции находится в пределах от 4 ч до 3 сут.; температура реакции находится в пределах от 0 до 60 С. Если защитная группа является алкилэфирной группой, то удаление таких алкилэфирных защитных групп проводят, используя общеизвестные деалкилирующие условия. Например, алкиловый эфир можно расщепить реакцией с трибромидом бора или бромидом диэтилбора в реакционно-инертном растворителе,предпочтительно в галогенуглеводородном растворителе. Для специалиста в данной области очевидно, что буфер, такой как триэтиламин,может способствовать протеканию реакции. Время реакции находится в пределах от 15 мин 17 до 24 ч; температура реакции находится в пределах от 0 до 60 С. В дополнение, бензилэфирную защитную группу можно удалить стандартным гидрогенолизом или гидрогенолизом с переносом, используя палладиевый катализатор,такой как палладий на углероде. Реакцию гидрогенолиза проводят в атмосфере водорода при давлении окружающей среды до 50 фунт/кв.дюйм (344,75 кПа) в реакционноинертном растворителе, предпочтительно метаноле. Источником водорода может быть газообразный водород, формиат аммония или триалкиламмонийформиат или циклогексен. Температура реакции находится в пределах от комнатной температуры до температуры дефлегмации используемого растворителя. Время реакции находится в пределах от 15 мин до 24 ч. Если используют силилэфирную защитную группу, то удаление таких силильноэфирных защитных групп проводят в кислотных условиях, предпочтительно с использованием водной соляной кислоты, такой как 1-6 н. соляная кислота. Удаление защиты можно проводить в присутствии сорастворителя, такого как метанол или тетрагидрофуран. Время реакции находится в пределах от 2 до 48 ч; температура реакции находится в пределах от 0 до 100 С. Альтернативно, силилэфирную защитную группу можно удалить путем фторидопосредованного удаления защиты. В этом случае удаление защиты проводят, используя тетрабутиламмонийфторид или один из множества источников фтороводородной кислоты в реакционноинертном растворителе. Предпочтительно использовать эфирные растворители, такие как диэтиловый эфир, диоксан или тетрагидрофуран, причем тетрагидрофуран особенно предпочтителен. Время реакции находится в пределах от 2 до 48 ч; температура реакции находится в пределах от 0 С до температуры дефлегмации используемого растворителя. Другие способы удаления вышеупомянутых защитных групп хорошо известны специалистам в данной области, либо их можно найти в Green, T.W.; Wuts,P.G.M., Protective groups in Organic Synthesis, 2nded.; John Wiley and Sons Inc.: New York, 1991. В этом источнике информации также можно найти описание других подходящих защитных групп гидроксила и способов их удаления. Способ по cхеме 1 является предпочтительным, когда R3 представляет собой R3k, i, m, n, о, р и q. Так соединения формулы 1-2 подвергают взаимодействию с соединениями формулы 1-1. Соединения формулы 1-2, где R3 представляет собойR3k, i, m, n, о, р и q, имеются в продаже или могут быть получены способами, хорошо известными специалистам в данной области техники. Соединения формулы 2-7 получают как показано на cхеме 2, в частности, как описано ниже. Если R27 представляет собой Н, то этил-1 бензил-3-оксо-4-пиперидинкарбоксилата гидрохлорид, соединение формулы 2-1, имеющееся в продаже от Aldrich, подвергают конденсации с соединениями формулы 2-2 с получением соединений формулы 2-3. Соединения формулы 21, где R27 не представляет собой Н, могут быть получены способами, хорошо известными специалистам в данной области. Реакцию проводят в присутствии избытка основания, в том числе неводных оснований, органических аминов или неорганических оснований. Предпочтительные органические амины включают триэтиламин и пиридин. Предпочтительные неводные основания включают (С 1-С 4)-алкоголяты щелочных металлов. Предпочтительные неорганические основания включают карбонат калия. Реакцию проводят в реакционно-инертном растворителе. Такие предпочтительные растворители включают (С 1-С 4)спирты, ароматические или алифатические углеводороды, полярные апротонные растворители, галогенуглеводороды и эфирные растворители. (С 1-С 4)спирты особенно предпочтительны. Время реакции находится в пределах от 2 ч до 3 сут. Температура реакции находится в пределах от температуры окружающей среды до температуры дефлегмации используемого растворителя. Реакция предпочтительно протекает при давлении окружающей среды, но может быть проведена при давлении до 250 фунт/кв.дюйм (1723,75 кПа). Соединения формулы 2-4 получают из соединений формулы 2-3 путем превращения со 19 единения формулы 2-3 в активированное соединение формулы 2-4, где Lv1 выбрана из фторо,хлоро, бромо, йодо, трифторметансульфоната,(С 1-С 6)алкилсульфоната или фенилсульфоната,причем указанный фенил возможно замещен взятыми в количестве до трех (С 1-С 4)алкилом,галогено или нитро. Эту реакцию выполняют путем взаимодействия соединений формулы 2-3 с хлорирующим агентом, таким как оксихлорид фосфора и/или пентахлорид фосфора, с получением соединений формулы 2-4, где Lv1 представляет собой хлоро. Эту реакцию проводят при давлении окружающей среды в отсутствии растворителя или в реакционно-инертном растворителе, предпочтительно галогенуглеводородном растворителе, при температуре в пределах от температуры окружающей среды до 180 С. В результате обработки полученного таким образом хлорсоединения требуемой минеральной кислотой получают соединение формулы 2-4, где Lv1 представляет собой бромо или йодо. Сульфонат формулы 2-4 получают взаимодействием соединения формулы 2-3 с хлорангидридом или ангидридом сульфоновой кислоты в присутствии органического аминного основания, предпочтительно триэтиламина или пиридина. В некоторых случаях, понятных специалистам, может быть необходимым добавление катализатора в реакционную смесь. В этих случаях предпочтительным катализатором является 4-диметиламинопиридин. Эту реакцию проводят при давлении окружающей среды в реакционно-инертном растворителе, предпочтительно пиридине, галогенуглеводороде, таком как хлороформ, дихлорметан или четыреххлористый углерод, ароматическом или алифатическом углеводороде, эфирном растворителе или их комбинации. Температура реакции находится в пределах от -20 до 100 С; время реакции находится в пределах от 15 мин до 1 сут. Соединения формулы 2-5, где R29 является таким, как определено выше, получают из соединений формулы 2-4 реакцией восстановления или реакцией замещения Lv1 нуклеофилом. Восстановление проводят с использованием восстанавливающего агента, предпочтительно формиата аммония или газообразного водорода,в реакционно-инертном растворителе. Восстановление проводят в присутствии палладиевого катализатора при давлении окружающей среды или при давлении водорода до 50 фунт/кв.дюйм(344,75 кПа). Предпочтительные растворители включают (С 1-С 4)спирты, такие как метанол и этанол, и эфирные растворители, такие как диэтиловый эфир, диоксан и тетрагидрофуран. Реакцию нуклеофильного замещения можно проводить путем прямого добавления нуклеофила или путем предварительного образования нуклеофила отдельно или in situ из предшественника нуклеофила. Предпочтительные нуклеофилы включают алюминийорганический,борорганический, медьорганический, оловоор 004656 20 ганический, цинкорганический реагент или реагент Гриньяра; R29-H; или, если R29 содержит гидроксильную или тиольную группу, анионR29. Термин "органический" в терминах алюминийорганический, борорганический, медьорганический, оловоорганический, цинкорганический относится к органическому радикалу, выбранному из R29. Для специалиста очевидно, что для осуществления реакции в некоторых реакциях замещения могут потребоваться катализаторы на основе переходных металлов. Такие катализаторы на основе переходных металлов,если они требуются, могут включать комплексы палладия(0), палладия(II), никеля(0) и никеля(II). Бис(дифенилфосфинбутан)палладия(II) дихлорид является предпочтительным в качестве такого катализатора. Кроме того, в реакции замещения может потребоваться водное или неводное основание. Такие предпочтительные основания включают карбонат натрия, гидрид натрия, триэтиламин и трет-бутилат натрия. Реакцию проводят при давлении окружающей среды в реакционно-инертном растворителе,таком как галогенуглеводород, ароматический или алифатический углеводород, эфир или полярный апротонный растворитель, или их комбинации. В некоторых случаях в качестве растворителя или сорастворителя используют (С 1 С 4)спирт. Температура реакции находится в пределах от -20 С до температуры дефлегмации используемого растворителя. Время реакции находится в пределах от 1 ч до 3 сут. Соединения формулы 2-6 получают удалением бензильной защитной группы с соединений формулы 2-3 или 2-5. Это превращение выполняют, используя свободное основание или,предпочтительно, предварительно образованный гидрохлорид или подобную соль, в условиях стандартного гидрогенолиза или гидрогенолиза с переносом. Катализаторы, которые можно использовать в реакции гидрогенолиза включают, без ограничений, палладий на углероде,гидроксид палладия на углероде и оксид платины(V). Реакцию проводят в реакционноинертном растворителе, предпочтительно метаноле или этаноле, и температура реакции находится в пределах от комнатной температуры до температуры дефлегмации используемого растворителя. Источником водорода является газообразный водород, формиат аммония, триалкиламмонийформиат или циклогексен. Время реакции находится в пределах от 15 мин до 3 сут. Обычно реакцию проводят при давлении окружающей среды, но можно применять давление водорода до 50 фунт/кв.дюйм (344,75 кПа). Альтернативно, если подходит, бензильную защитную группу удаляют в две стадии путем хлорформиат-индуцированного ацилирующего деалкилирования. Сюда входит реакция с хлорформиатным производным с образованием карбамата и последующее расщепление карбамата. Хотя эту реакцию предпочтительно проводят с 21 использованием 1-хлорэтилхлорформиата и катализатором на основе йодида натрия, для специалистов в данной области очевидно, что в некоторых случаях катализатор не требуется. Реакцию проводят при температуре окружающей среды в реакционно-инертном растворителе, таком как галогенуглеводород, ароматический или алифатический углеводород, кетон,эфир или полярный апротонный растворитель. Температура реакции находится в пределах от-78 С до температуры дефлегмации используемого растворителя; время реакции находится в пределах от 15 мин до 1 сут. Расщепление карбамата, образовавшегося при взаимодействии с 1-хлорэтилхлорформиатом, осуществляют выдерживанием в метаноле или этаноле при давлении окружающей среды с получением соединений формулы 2-6 в виде гидрохлорида. Реакция протекает при температурах от комнатной температуры до температуры дефлегмации используемого растворителя; время реакции находится в пределах от 15 мин до 1 сут. Условия снятия защиты для других карбаматов можно найти в Green, T.W.; Wuts, P.G.M., Protectiveand Sons Inc.: New York, 1991, pp. 315-348. Соединения формулы 2-7 получают реакцией замещения амина 2-6 как показано на cхеме 1, где амин 2-6 эквивалентен R3-NH. Альтернативно, соединения формулы 2-7,где R29 является таким, как определено выше,получают из соединений формулы 2-3, где R29 представляет собой ОН, согласно последовательности, приведенной на cхеме 2 а ниже, где условия такие, как изложено в описании cхемы 2. Схема 2 а 22 Соединения формулы 2-2, которые использованы на приведенных выше cхемах 2 и 2 а,имеются в продаже или их получают способами,хорошо известными специалистам в данной области, такими как описано в March, J. Advanced Соединения формулы 3-5 получают, как показано на приведенной выше cхеме 3, и более конкретно, как описано ниже. Соединения формулы 3-3 получают конденсацией соединения формулы 3-1 с соединением формулы 3-2, где R38 и R39, каждый, представляют собой Н, соединение формулы 3-1 представляет собой 1-бензил-4-пиперидон, который, как известно из Aldrich, имеется в продаже. Соединения формулы 3-2 либо имеются в продаже, либо их можно получить способами,хорошо известными специалистам в данной области, в частности способами, которые описаны в March, J. Advanced Organic Chemistry, 3nd ed.;John Wiley and Sons Inc.: New York, 1985, pp. 499-500. Реакцию проводят при давлении окружающей среды в присутствии вторичного амина. Обычно используют избыток вторичного амина, предпочтительно пирролидина, пиперидина, морфолина или диэтиламина. Особенно предпочтительным вторичным амином является пирролидин. Реакцию проводят в реакционноинертном растворителе, предпочтительно (С 1 С 4)спирте, ароматическом или алифатическом углеводороде, полярном апротонном растворителе, галогенуглеводороде или эфире. Особенно предпочтительным растворителем является этанол. Время реакции находится в пределах от 2 ч до 3 сут.; температура реакции находится в пре 23 делах от температуры окружающей среды до температуры дефлегмации используемого растворителя. Соединения формулы 3-4 получают удалением бензильной защитной группы с соединений формулы 3-3. Это превращение проводят способом, аналогичным способу, изложенному для получения соединений формулы 2-6 выше. Соединения формулы 3-5 получают реакцией замещения амина 3-4, как показано на cхеме 1, где амин 3-4 эквивалентен R3-NH. Схема 3 а Соединения формул 3 а-1 и 3 а-2 получают,как показано на cхеме 3 а, из соединений формулы 3-5. Так, для того чтобы получить соединение 3 а-1, соединение формулы 3-5 восстанавливают традиционным восстанавливающим агентом, таким как, например, боргидрид натрия,алюмогидрид лития или диизобутилалюминийгидрид. Другие восстанавливающие агенты,способные восстанавливать кетон до спирта,хорошо известны специалистам в данной области (например, Larock, R. D. Comprehensive Organic Transformations, VCH Publishers, Inc.: NewYork, 1989, pp. 527-547). Аналогично, соединения формулы 3 а-2 получают из соединений формулы 3-5 восстановлением с использованием восстанавливающего агента, способного полностью восстановить кетон до метиленовой группы. Таким предпочтительным восстанавливающим агентом является комплекс трихлорид алюминия/боран-трет-бутиламин. Другие такие восстанавливающие агенты хорошо известны специалистам в данной области (например из J.Org. Chem. 1989, 54, 4350; Larock, R. D. Comprehensive Organic Transformations, VCH Publishers, Inc.: New York, 1989, pp. 35-37). Для специалистов в данной области очевидно, что превращение 3-5 в 3 а-1 или 3 а-2 можно проводить в разных точках cхемы 3 в зависимости от динамики конкретной системы. Альтернативно, соединения формулы 3-5,где R38 и R39 представляют собой водород, можно получить из 4-пиперидонмоногидрата монохлорида способом, аналогичным способу, который представлен на cхеме 1, где амин 3-6 эквивалентен R3-NH, с получением соединений формулы 3-7. Соединения формулы 3-7 могут быть подвергнуты взаимодействию с соединениями формулы 3-2 способом, аналогичным способу, который описан для синтеза соедине 004656 24 ний формулы 3-3, с получением соединений формулы 3-5. Схема 4 Соединения формулы 4-5 получают согласно cхеме 4 и более конкретно, как описано ниже. Соединения формулы 4-3 получают путем взаимодействия соединения формулы 4-2 с соединением формулы 4-1 или 4-1 а. Соединения формулы 4-1 и 4-1 а получают способами, хорошо известными специалистам в данной области. Когда R32 представляет собой водород, 4-оксопиперидин-1,3-дикарбоновой кислоты 1-третбутилового эфира 3-этиловый эфир подвергают конденсации с соединением формулы 4-2 с получением соединения формулы 4-3. Указанные соединения формулы 4-2 имеются в продаже от широко известных поставщиков, известных из литературы, или их синтезируют в стандартных условиях, хорошо известных специалистам в данной области. Предпочтительные условия получения соединений формулы 4-3 из соединения формулы 4-1, где А представляет собой СО, а В представляет собой NH, или из соединения формулы 4-1 а, где А представляет собойJohn Wiley and Sons Inc.: New York, 1985, p. 1163. Эту реакцию проводят при давлении окружающей среды в реакционно-инертном растворителе. Такие предпочтительные растворители включают водную среду, (С 1-С 4)спирт, ледяную уксусную кислоту, ароматический или алифатический углеводород, полярный апротонный растворитель, углеводород и эфиры или их комбинации. Время реакции находится в пределах от 2 ч до 3 сут.; и температура реакции находится в пределах от температуры окружающей среды до температуры дефлегмации используемого растворителя. Возможная вторая 25 стадия с использованием водного или неводного основания может быть использована в некоторых случаях, которые известны специалистам в данной области. Эту вторую стадию проводят при давлении окружающей среды в реакционноинертном растворителе. Такие предпочтительные растворители включают в себя водную среду, (С 1-С 4)спирт, ледяную уксусную кислоту,ароматический или алифатический углеводород,полярный апротонный растворитель, углеводород и эфиры или их комбинации. Время реакции находится в пределах от 2 ч до 3 сут.; и температура реакции находится в пределах от температуры окружающей среды до температуры дефлегмации используемого растворителя. Соединения формулы 4-3, где В представляет собой СО, а А является N-алкилом, или где В является N-алкилом, а А представляет собой СО, получают алкилированием соединений формулы 4-3, где В представляет собой СО, а А представляет собой NH, или где В представляет собой NH, а А представляет собой СО, соответственно. Анион этих соединений формулы 4-3 образуется при взаимодействии с подходящим основанием. Такие предпочтительные основания включают гидрид натрия и гексаметилдисилазид натрия, хотя можно использовать другие основания, если позволяют условия, что определяется специалистом. Реакцию проводят в реакционно-инертном растворителе, предпочтительно эфире, таком как тетрагидрофуран, диэтиловый эфир, диоксан или диглим, или полярном апротонном растворителе, таком как диметилформамид. Реакция протекает при давлении окружающей среды и при температурах в пределах от -100 С до температуры окружающей среды. Реакционное время составляет от 10 мин до 2 ч. Присоединение (C1-С 4)алкилгалогенидов или (С 1-C4)алкилсульфонатов, таких как мезилат, тозилат или нозилат, к аниону соединения формулы 4-3 протекает при давлении окружающей среды и при температуре в пределах от -20 до 50 С. Реакционное время находится в пределах от 10 мин до 1 сут. Соединения формулы 4-4 получают из соединений формулы 4-3, где А является Nалкилом, а В представляет собой СО, или где А представляет собой СО, а В является Nалкилом, путем катализируемого кислотой удаления защиты Вос-карбамата (Воc-трет-бутоксикарбонил) в стандартных условиях, например,соляная кислота или трифторуксусная кислота в реакционно-инертном растворителе или без растворителя. Такие условия известны специалистам в данной области. Типичные условия описаны в Green, T.W.; Wuts, P.G.M., Protectiveand Sons Inc.: New York, 1991, pp. 327-330. Соединения формулы 4-5 получают реакцией замещения амина 4-4, как показано на cхеме 1, где амин 4-4 эквивалентен R3-NH. Соединения формулы 5-4, где Х представляет собой ковалентную связь, a G, G1, G2, q, R1,R2, R6, R7 и R8 такие, как определено выше, получают согласно приведенной выше Схеме 5 и,в частности, как описано ниже. Соединения формулы 5-3 получают взаимодействием соединения формулы 5-1 с соединением формулы 5-2, где Prt является возможной защитной группой амина, выбранной из бензила и CO2R90, где R90 выбран из (С 1 С 4)алкила, (С 1-С 4)аллила, трихлорэтила и бензила, замещенного взятым в количестве до двухR9 представляет собой Ar1, a Lv3 представляет собой галогено, (C1-С 4)алкилсульфид, (С 1 С 4)алкилсульфон, трифторметансульфонат, (С 1 С 6)алкилсульфонат или фенилсульфонат, где указанный фенил возможно замещен взятыми в количестве до трех галогено, нитро или (С 1 С 4)алкилом, имеются в продаже или их легко получить способами, хорошо известными специалистам в данной области. Например, для получения соединений формулы 5-1, где Lv3 представляет собой хлоро, соединение формулы Аr1-ОН или его Аr1-(=O) таутомер подвергают взаимодействию с хлорирующим агентом, таким как оксихлорид фосфора и/или пентахлорид фосфора. Эту реакцию хлорирования проводят при давлении окружающей среды в отсутствие растворителя или в реакционно-инертном растворителе, предпочтительно галогенуглеводородном растворителе, при температуре в пределах от температуры окружающей среды до 180 С. В результате обработки хлорсоединения требуемой минеральной кислотой получают соединения формулы 5-1, где Lv3 представляет собой бромо или йодо. Соединения формулы 51, где Lv3 представляет собой трифторметансульфонат, (С 1-С 6)алкилсульфонат или фенилсульфонат, получают из соединения формулы Аr1-ОН или его Аr1-(=О) таутомера путем взаимодействия с хлорангидридом или ангидридом сульфоновой кислоты в присутствии основания,предпочтительно органического амина, такого как триэтиламин, N,N'-диизопропилэтиламин, 27 диметиламинопиридин или пиридин. В некоторых случаях, которые очевидны для специалистов в данной области, для осуществления реакции требуется катализатор. В этих случаях предпочтительным катализатором является 4 диметиламинопиридин. Реакцию проводят при давлении окружающей среды в реакционноинертном растворителе, таком как пиридин,углеводород, ароматический или алифатический углеводород, эфир или их комбинации. Температура реакции находится в пределах от-20 до 100 С; время реакции находится в пределах от 15 мин до 1 сут. Соединения формулы 5-1, гдеLv3 представляет собой тиометил, получают взаимодействием соединения формулы Ar1-SH или его Аr1-(=S) таутомера с метилйодидом или диметилсульфатом в присутствии неорганического основания, предпочтительно карбоната калия. Эти реакции проводят при давлении окружающей среды в реакционно-инертном растворителе, предпочтительно эфире или полярном апротонном растворителе. Особенно предпочтительным полярным апротонным растворителем является диметилформамид при температуре в пределах от 0 до 100 С. Соединения формулы 5-1, где Lv3 представляет собой метилсульфон, получают из соединения формулы 5-1, где Lv3 представляет собой тиометил, окислением его согласно методикам, хорошо известным специалистам в данной области, в частности, как изложено в March, J. Advanced OrganicYork, 1985, pp. 1089-1090. Ряд типичных представителей соединений формулы 5-1, которые имеются в продаже или которые можно получить способами, аналогичными способам, известным из литературы,включает в себя 4-хлорпиридин (Aldrich, P.O. 28 и 6-хлор-9 Н-пурин (Aldrich). Другие соединения формулы 5-1 можно получить способами, хорошо известными специалистам в данной области, способами, аналогичными способам,описанным в приведенных выше источниках информации. Соединения формулы 5-3 получают реакцией замещения соединения формулы 5-1 с амином формулы 5-2. Реакцию проводят в присутствии неводного основания, предпочтительно органического амина, такого как пиридин, 4 диметиламинопиридин, триэтиламин или N,N'диизопропилэтиламин; неорганического основания, такого как карбонат или бикарбонат калия или натрия; или алкоголята щелочного металла, такого как трет-бутилат калия. Альтернативно, избыток реагирующего амина 5-2 можно использовать вместо добавления основания. В случаях, когда уходящая группа Lv3 не активирована, или в конкретных случаях, которые очевидны для специалистов в данной области, для осуществления реакции возможно необходимо использовать катализатор на основе переходного металла, такого как палладий(0), палладий(II), никель(0) или никель(II) с лигандами на основе фосфина,такими как 2,2'бис(дифенилфосфин)-1,1'-бинафтилOrg. Chem. 1997, 62, 1568; SynLett 1997, 329. Реакцию можно проводить в отсутствие растворителя или в реакционно-инертном растворителе. Предпочтительные реакционно-инертные растворители включают в себя водную среду,(С 1-С 4)спирт, (С 2-С 6)гликоль, галогенуглеводород, алифатический или ароматический углеводород, эфир, полярный апротонный растворитель, кетон или их комбинации. Время реакции находится в пределах от 15 мин до 3 сут.; температура реакции находится в пределах от 0 С до 180 С или до температуры дефлегмации используемого растворителя. Взаимодействие осуществляют предпочтительно при давлении окружающей среды. В некоторых случаях, которые очевидны для специалистов в данной области, превращение функциональной группы, находящейся в Аr1 соединения формулы 5-3, может быть необходимо для получения соединений формулы 5-4. Это имеет отношение в частности к тем случаям, когда, например, R9 в 5-3 содержит ароматический или гетероароматический галогенид,(C1-С 4)алкилсульфонат или трифлат. Указанные соединения формулы 5-3, где Аr1 содержит до двух заместителей, выбранных из галогенида,(С 1-С 4)алкилсульфоната или трифлата, можно превратить в соединение формулы Аr1, где указанный галогенид, (С 1-С 4)алкилсульфонат или трифлат превращен в другую функциональную группу реакцией восстановления или реакцией замещения указанного галогенида,(С 1 29 С 4)алкилсульфоната или трифлата нуклеофилом. Реакцию восстановления проводят с использованием восстанавливающего агента,предпочтительно формиата аммония или газообразного водорода, в реакционно-инертном растворителе. Восстановление проводят в присутствии палладиевого катализатора при давлении окружающей среды или при давлении водорода до 50 фунт/кв.дюйм (344,75 кПа). Предпочтительные растворители включают (С 1 С 4)спирты, такие как метанол или этанол, и эфирные растворители, такие как диэтиловый эфир, диоксан и тетрагидрофуран. Реакцию нуклеофильного замещения можно проводить путем прямого добавления нуклеофила или путем предварительного образования нуклеофила отдельно или in situ из предшественника нуклеофила. Предпочтительные нуклеофилы включают алюминийорганический, борорганический,медьорганический, оловоорганический, цинкорганический реагент или реагент Гриньяра; R11 оксид или R11-тиоксид; или анилино, где анилино находится в пределах R11. Для специалистов в данной области очевидно, что катализаторы на основе переходных металлов могут потребоваться для осуществления взаимодействия в некоторых реакциях замещения. Когда они требуются, такие катализаторы на основе переходных металлов могут включать комплексы палладия(0), палладия(II), никеля(0) и никеля(II). Бис(дифенилфосфинбутан)палладия(II) дихлорид является предпочтительным в качестве такого катализатора. Дополнительно, для осуществления реакции замещения может быть необходимо водное или неводное основание. Такие предпочтительные основания включают карбонат натрия, гидрид натрия, триэтиламин и третбутилат натрия. Реакцию проводят при давлении окружающей среды в реакционно-инертном растворителе, таком как галогенуглеводород,ароматический или алифатический углеводород,эфир или полярный апротонный растворитель или их комбинации. В некоторых случаях (С 1 С 4)спирт используют как растворитель или сорастворитель. Температура реакции находится в пределах от -20 С до температуры дефлегмации используемого растворителя. Время реакции находится в пределах от 1 ч до 3 сут. Возможные защитные группы, которые могут присутствовать в соединениях формулы 5-3, удаляют способами, изложенными выше,или способами, хорошо известными специалистам в данной области, в частности изложенными в: Green, T.W.; Wuts, P.G.M., Protectiveand Sons Inc.: New York, 1991. Соединения формулы 5-4 получают реакцией замещения амина 5-3, как показано на cхеме 1, где амин 5-3 эквивалентен R3-NH. Ряд представителей аминов формулы 5-3, которые имеются в продаже или которые можно получить по методикам, описанным в литературе, 004656Med. Chem. 1986, 29, 359), 2-пиперазин-1-илхиноксалин (J. Med. Chem. 1981, 24, 93), 1 нафталин-2-ил-пиперазин (Tetrahedron Lett. 1994, 35, 7331) и 1-(3,5-диметилфенил) пиперазин (Tetrahedron Lett. 1994, 35, 7331). Другие соединения формулы 5-3 можно получить способами, хорошо известными специалистам в данной области, или способами, аналогичными способам, описанным в приведенных выше источниках информации. Альтернативно, соединения формулы 5-4 можно получить в результате взаимодействия соединений формулы 5-1 с соединениями формулы 5-5, применяя условия, изложенные выше для получения 5-3. Соединения формулы 5-5 можно получить способом, аналогичным способу, используемому для получения соединений формулы 1-3. Соединения формулы 5-4, где Х представляет собой оксикарбонил, виниленилкарбонил,окси(С 1-С 4)алкиленилкарбонил, (С 1-С 4)алкиленилкарбонил, (С 3-С 4)алкенилкарбонил, тио(С 1 С 4)алкенилкарбонил, виниленилсульфонил или причем карбонил(С 0-С 4)алкиленилкарбонил,указанный окси(С 1-С 4)алкиленилкарбонил, (С 1 С 4)алкиленилкарбонил, (С 3-С 4)алкенилкарбонил и тио(С 1-С 4)алкенилкарбонил в определении X,каждый, возможно и независимо замещены взятыми в количестве до двух (С 1-С 4)алкилом, бензилом или Аr; указанный виниленилсульфонил и указанный виниленилкарбонил в определенииX, каждый, возможно и независимо замещены взятыми в количестве до трех (С 1-С 4)алкилом,бензилом или Аr, также получают согласно приведенной выше cхеме 5 и, в частности, как описано ниже. Соединения формулы 5-4, где Х такой, как определено в непосредственно предыдущем абзаце, получают взаимодействием соединения формулы 5-5 с соединением формулы 5-1, гдеR9 является таким, как определено выше, Х является таким, как определено в непосредственно предыдущем абзаце, и Lv3 представляет собой хлоро. Реакцию проводят в безводных условиях в присутствии неводного основания, которое включает органические амины, такие как триэтиламин, N,N'-диизопропилэтиламин и пиридин и их производные. Реакцию обычно проводят в реакционно-инертном растворителе. Предпочтительные растворители включают галогенуглеводород, алифатический или ароматический углеводород, эфиры, этилацетат, пиридин и их комбинации. Время реакции находится в пределах от 15 мин до 24 ч; температура реакции находится в пределах от 0 до 80 С или до температуры дефлегмации используемого растворителя. Реакции предпочтительно проводят при температуре от 0 С до температуры окру 31 жающей среды и при давлении окружающей среды. Удаление возможных защитных групп проводят как показано на cхеме 1. Соединения формулы 5-4, где Х представляет собой виниленилкарбонил, окси(С 1 С 4)алкиленилкарбонил, (C1-С 4)алкиленилкарбонил, (С 3-С 4)алкенилкарбонил, тио(С 2-С 4)алкенилкарбонил или карбонил(С 0-С 4)алкиленилкарбонил, причем указанный окси(С 1-С 4)алкиленилкарбонил, (С 1-С 4)алкиленилкарбонил, (С 3 и тио(С 2-С 4)алкенилС 4)алкенилкарбонил карбонил в определении X, каждый, возможно и независимо замещены взятыми в количестве до двух (С 1-С 4)алкилом, бензилом или Аr; и указанный виниленилкарбонил в определении Х возможно и независимо замещен взятыми в количестве до трех (С 1-С 4)алкилом, бензилом или Аr, также получают согласно приведенной выше Схеме 5 и, в частности, как описано ниже. Соединения формулы 5-4 получают взаимодействием соединения формулы 5-5 с соединением формулы R9-X-Lv3, где R9 является таким, как определено выше, Х является таким,как определено в непосредственно предыдущем абзаце, и Lv3 представляет собой ОН. Реакцию проводят в присутствии агентов сочетания,предпочтительно дициклогексилкарбодиимида или 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорида, как описано в J. Amer.Chem. Soc. 1996, 118, 4952. Реакцию проводят в реакционно-инертном растворителе. Предпочтительные растворители включают галогенуглеводород, алифатический или ароматический галогенуглеводород и эфиры. Особенно предпочтительные растворители включают дихлорметан и хлороформ. Другие агенты сочетания,которые можно использовать, хорошо известны специалистам в данной области и включают, без ограничений, различные фосфиновые реагенты,этилхлорформиат и N-гидроксисукцинимид. Эти реагенты и методики описаны в "Compendium of Organic Synthetic Methods" (Ed., I. T.Bull. Chem. Soc. Japan, 1971, 44, 1373; Tetrahedron Lett. 1973, 28, 1595; Tetrahedron Lett. 1971,26, 2967 и J. Med. Chem., 1968, 11, 534. Удаление возможных защитных групп проводят как показано на cхеме 1. Соединения формулы 5-4, где Х представляет собой ковалентную связь, и R9 представляет собой (С 3-С 7)циклоалкил или Аr1-(С 1 С 3)алкиленил, также получают согласно приведенной выше cхеме и, в частности, как описано ниже. Соединения формулы 5-4, где Х представляет собой ковалентную связь, и R9 представляет собой (С 3-С 7)циклоалкил или Ar1-(C1C3)aлкилeнил, получают реакцией соединения формулы 5-1, где Х представляет собой ковалентную связь, R9 представляет собой (С 3 004656 32 С 7)циклоалкил или Ar1-(C1-C3)aлкилeнил, и Lv3 представляет собой галогено, метансульфонат,пара-толуолсульфонат или трифторметансульфонат. Реакцию проводят в безводных условиях в присутствии неводного основания,которое включает органические амины, такие как триэтиламин, N,N'-диизопропилэтиламин и пиридин, и их производные. Реакцию обычно проводят в реакционно-инертном растворителе. Предпочтительные растворители для реакции включают галогенуглеводороды, алифатические или ароматические углеводороды, эфиры, этилацетат, пиридин и их комбинации. Время реакции находится в пределах от 15 мин до 24 ч; температура реакции находится в пределах от-20 до 80 С или до температуры дефлегмации используемого растворителя. Реакцию предпочтительно проводят при температуре дефлегмации используемого растворителя и при давлении окружающей среды. Удаление возможных защитных групп проводят, как показано на Соединения формулы 6-5, где G, G1, G2, q,R , R , R6, R7 и R8 такие, как определено выше,получают как показано на приведенной вышеcхеме 6, и, в частности, как описано ниже. Соединения формулы 6-1 получают из амина формулы 5-2, где Prt является возможной защитной группой амина, выбранной из бензила и CO2R90, где R90 выбран из (С 1-С 4)алкила, (С 1 С 4)аллила, трихлорэтила и бензила, замещенного взятым в количестве до двух (С 1-С 4)алкокси. Предпочтительную методику получения соединений формулы 6-1 можно найти в Tetrahedron 33 мулы 6-2b, где R11 и R12 независимо замещены как изложено выше, или соединений формулы 6-2 а, где Lv4 представляет собой например гидрокси, хлоро или диметиламино, с гуанидинами формулы 6-1. Реакцию проводят в присутствии водного или неводного основания, предпочтительно гидроксида калия или натрия, (С 1-С 4)алкоголята калия или натрия, триэтиламина,пиридина, 4-диметиламинопиридина, карбоната калия или натрия или бикарбоната калия или натрия. Реакцию проводят в реакционноинертном растворителе, предпочтительно в водной среде, (С 1-С 4)спирте, (С 2-С 6)диспирте, ароматическом углеводороде, полярном апротонном растворителе или их комбинации. Время реакции находится в пределах от 2 ч до 3 сут.; температура реакции находится в пределах от комнатной температуры до температуры дефлегмации используемого растворителя. Реакция предпочтительно идет при давлении окружающей среды, но ее можно проводить при давлениях до 250 фунт/кв.дюйм (1723,75 кПа). Удаление возможных защитных групп в соединениях формулы 6-3 с получением соединений формулы 6-4 осуществляют, как изложено выше. Соединения формулы 6-5 получают реакцией замещения амина 6-4, как показано на cхеме 1, где амин 6-4 эквивалентен R3-NH. Альтернативно, соединения формулы 6-5,получают из соединений формулы 5-5 путем образования соединения формулы 6-6, или путем взаимодействия с соединениями формулы 6-2 а или 6-2b в условиях, приведенных выше наcхеме 6. Удаление возможных защитных групп проводят, как показано на cхеме 1. Соединения формулы 5-5 получают, как изложено выше. Схема 7 Соединения формулы 7-4, где G3, G4, G5, r,R , R2, R18, R19 и R20 такие, как определено вы 1 34 ше, получают, как показано на cхеме 7, и, в частности, как описано ниже. Соединения формулы 7-1 получают взаимодействием амина формулы 7-0 с фосгеном или эквивалентом фосгена, таким как трифосген. Соединения формулы 7-1, где хлоргруппа замещена имидазолильной группой, также пригодны для этой реакции. Такие соединения получают взаимодействием амина формулы 7-0 с карбонилдиимидазолом. Реакцию проводят в безводных условиях в присутствии неводного основания. Такие предпочтительные основания включают триэтиламин и другие четвертичные амины, пиридин и их производные. Реакцию проводят в реакционно-инертном растворителе при температуре от -78 до 80 С или при температуре дефлегмации используемого растворителя в течение от 15 мин до 24 ч. Предпочтительные растворители для этой реакции включают углеводород, алифатический или ароматический углеводород, эфир, этилацетат, пиридин и их комбинации. Реакцию предпочтительно проводят при температуре от 0 С до температуры окружающей среды и при давлении окружающей среды. Соединения формулы 7-4 получают взаимодействием карбамоилхлоридов формулы 7-1 с аминами формулы 7-3, где R21 и R22 такие, как определено выше. Реакцию можно проводить в отсутствие растворителя или в реакционноинертном растворителе. Такие предпочтительные растворители включают водную среду, (С 1 С 4)спирт, (С 2-С 6)диспирт, ароматический или алифатический углеводород, галогенуглеводород, эфир, полярный апротонный растворитель,кетон, пиридин или их комбинации. Время реакции находится в пределах от 15 мин до 3 сут.; и температура реакции находится в пределах от 0 С до температуры дефлегмации используемого растворителя. Реакцию предпочтительно проводят при давлении окружающей среды. Для специалистов в данной области очевидно, что для осуществления реакции может быть необходимо добавление основания. В этих случаях предпочтительные основания включают гидроксид калия или натрия, триэтиламин и другие четвертичные амины, пиридин и их производные, и неорганические основания, такие как карбонат калия или натрия и бикарбонат калия или натрия. Удаление возможных защитных групп гидроксила, содержащихся в R1, проводят способами, показанными на cхеме 1. Альтернативно, соединения формулы 7-4 получают из соединений формулы 7-0 взаимодействием с изоцианатами формулы 7-6 или с карбамоилхлоридами формулы 7-8. Указанные изоцианаты имеются в продаже, известны из литературы, или их синтезируют в стандартных условиях, известных специалистам в данной области, в частности, как описано в March, J.and Sons Inc.: New York, 1985, pp. 1166. Пред 35 почтительным методом образования таких изоцианатов является перегруппировка Курциуса для подходящего ацилазида. Указанные карбамоилхлориды синтезируют способами, аналогичными способам, описанным для получения соединений формулы 7-1 на cхеме 7. Удаление возможных защитных групп гидроксила, содержащихся в R1, проводят способами, показанными на cхеме 1. Соединения формулы I, содержащие радикал R3c, получают по методике, показанной наcхеме 7, используя соответствующие исходные вещества и реагенты. Схема 8 Соединения формулы 8-5 получают, как показано на cхеме 8 и, в частности, как описано ниже. Соединения формулы 8-2 легко получить из имеющихся в продаже фенетиламинов формулы 8-1 а и формальдегида или альдегида формулы R27-CHO в условиях Пикте-Шпенглера. Реакция Пикте-Шпенглера описана в Chem. Rev. 1995, 95, 1797. Подобный путь до 1,2,3,4 тетрагидроизохинолинов с использованием реакции Бишлера-Напиральского, как она описана в March, J. Advanced Organic Chemistry, 3nd ed.;John Wiley and Sons Inc.: New York, 1985, pp. 495, с последующим стандартным восстановлением образовавшегося имина, также можно использовать. Соединения формулы 8-4 получают из соединений формулы 8-3 путем ароматического электрофильного замещения с использованием подходящего электрофила. Общую информацию по этому типу реакций можно найти вJohn Wiley and Sons Inc.: New York, 1985, pp. 447-511. Соединения формулы 8-2 также получают удалением защитной группы из соединения формулы 8-4. Предпочтительной защитной группой является трифторацетамид, который можно удалить в щелочных условиях, используя неорганические гидроксиды или карбонаты в реакционно-инертном растворителе. Такие подходящие растворители включают (С 1-С 4)спирты 36 и предпочтительно метанол. Возможно, один или более чем один сорастворитель, предпочтительно выбранный из воды, тетрагидрофурана и диоксана, может быть использован. Время реакции находится в пределах от 15 мин до 24 ч; температура реакции находится в пределах от 0 до 100 С или до температуры дефлегмации используемого растворителя или системы растворителей. Данную реакцию предпочтительно проводят при температуре окружающей среды. Другие условия удаления защиты трифторацетамидов и условия удаления защиты для других подходящих защитных групп можно найти вInc.: New York, 1991. Соединения формулы 8-4 получают путем присоединения защитной группы к соединениям формулы 8-2. Предпочтительно, защитной группой является трифторацетамид или третбутоксикарбонил (ВОС). Защитную группу присоединяют взаимодействием соединения формулы 8-2 с трифторацетилхлоридом или дитрет-бутилдикарбонатом или его эквивалентом в присутствии основания, предпочтительно триэтиламина или пиридина. Реакцию проводят в реакционно-инертном растворителе. Такие предпочтительные растворители включают эфиры, такие как тетрагидрофуран, диэтиловый эфир, диоксан или диметоксиэтан; галогенуглеводород, такой как дихлорметан, хлороформ или четыреххлористый углерод; ароматические или алифатические углеводороды, такие как бензол, толуол или гексаны. Время реакции находится в пределах от 15 мин до 3 сут.; температура реакции находится в пределах от 0 С до температуры дефлегмации используемого растворителя. Реакцию предпочтительно проводят при давлении окружающей среды. Другие условия для защиты аминов трифторацетамидными или трет-бутоксикарбонильными группами, а также другие подходящие защитные группы можно найти в Green, T.W.; Wuts, P.G.M., Protective groups in Organic Synthesis, 2nd ed.; JohnWiley and Sons Inc.: New York, 1991. Чтобы получить изохинолины с изменением замещения, производят преобразование заместителей R28 и R29. Предпочтительно, для получения соединений формулы 8-4, где R28 илиR29 такие, как изложено выше, используют катализируемое переходным металлом кросссочетание соединения формулы 8-4, где R28 илиR29 представляет собой бромид или трифлат. Эту реакцию проводят по методикам, хорошо известным специалистам в данной области, в частности, как изложено в Tetrahedron, 1998, 54,263, относительно реакций Стилла и Сузуки и в Асc. Chem. Res. 1998, 31, 805, относительно реакции аминирования Бюхвальда. Соединения формулы 8-5 получают в результате реакции замещения амина 8-2 как по 37 казано на cхеме 1, где амин 8-2 эквивалентен R3NH. Схема 9 Соединения формулы 9-3 получают по общим методикам, показанным на cхеме 2, начиная с этил-1-бензил-4-оксо-3-пиперидинкарбоксилата гидрохлорида (9-1). В некоторых случаях, когда R29 представляет собой Н, в качестве исходного вещества используют N-третбутоксикарбонил-3-(диметиламинометилен)-4 пиперидон (9-2, Chemical Abstracts 121:157661). Схема 10 Соединения формулы 10-6, где R1, R2, R32 и R такие, как определено выше, получают как показано на cхеме 10, и более конкретно, как описано ниже. Соединения формулы 10-2, где R91 представляет собой (С 1-С 4)алкил, получают взаимодействием соединения формулы 10-1, где Cbz представляет собой бензилоксикарбонил, с Oалкилирующим агентом. Предпочтительным соединением формулы 10-1 является бензиловый эфир 3-оксопиперазин-1-карбоновой кислоты. Предпочтительным O-алкилирующим агентом является триэтилоксония тетрафторборат. Реакцию проводят при давлении окружающей среды в реакционно-инертном растворителе. Предпочтительные растворители включают ароматические или алифатические углеводороды, галогенуглеводороды и эфиры. Дихлорметан является особенно предпочтительным. Время реакции находится в пределах от 2 ч до 3 сут.; температура реакции находится в пределах от -100 С до температуры окружающей среды. 38 Соединения формулы 10-4 получают конденсацией соединения формулы 10-2 с соединением формулы 10-3. Указанные соединения формулы 10-3 имеются в продаже, известны из литературы или легко могут быть получены путем стандартного амидирования гидразина и активированной карбоновой кислоты, такой как хлорангидрид карбоновой кислоты. Такие реакции хорошо известны специалистам в данной области. Реакция конденсации предпочтительно протекает при давлении окружающей среды,хотя можно использовать, если необходимо,более высокие значения давления - до 250 фунт/кв.дюйм (1723,75 кПа). Реакцию проводят в реакционно-инертном растворителе, предпочтительно выбранном из (С 1-С 4)спиртов, ароматических или алифатических углеводородов,полярной апротонной среды, галогенуглеводородов и эфиров или их комбинаций. Реакцию проводят при температуре в пределах от температуры окружающей среды до 180 С. Время реакции составляет от 2 ч до 3 сут. Соединения формулы 10-5 получают из соединений формулы 10-4 путем катализированного кислотой Льюиса расщепления или гидрогенолиза Cbz-карбамата в стандартных условиях, которые хорошо известны специалистам в данной области, в частности как изложено в Green, T.W.; Wuts, P.G.M., Protective groupsInc.: New York, 1991, pp. 335-338. Соединения формулы 10-6 получают реакцией замещения амина формулы 10-5 как показано на cхеме 1, где амин 10-5 эквивалентен R3NH. Схема 11 Соединения формулы 11-4, где R1, R2, R36,R , R38, R39 и R40 такие, как определено выше,получают как показано на cхеме 11, и, более конкретно, как описано ниже. Если R38 и R39 являются водородом, 1 бензил-4-пиперидон (3-1), доступный от Aldrich,конденсируют с соединением формулы 11-1,которое либо имеется в продаже, либо могут 37 39 быть получены способами, хорошо известными специалистам в данной области, с получением соединений формулы 11-2. Если R38 и R39 не являются водородом, соединения формулы 3-1 можно получить способами, хорошо известными специалистам в данной области. Реакцию проводят при давлении окружающей среды в отсутствие растворителя или в реакционноинертном растворителе. Предпочтительные растворители включают (С 1-С 4)спирты, ароматические и алифатические углеводороды, полярные апротонные растворители, галогенуглеводороды и эфиры. Время реакции находится в пределах от 2 ч до 3 сут.; температура реакции находится в пределах от температуры окружающей среды до температуры дефлегмации используемого растворителя. Более конкретные условия можно найти в Indian J. Chem. 1976, 14 В, 984 и J. Chem.Soc., Perkin Trans. 1 1984, 2465. Соединения формулы 11-3 получают удалением бензильной защитной группы с соединения формулы 11-2 способом, аналогичным способу, применяемому для получения соединений формулы 2-6, описанных выше. Соединения формулы 11-4 получают реакцией замещения амина 11-3, как описано в cхеме 1, где амин 11-3 эквивалентен R3-H. Схема 12 Соединения формулы 12-3 и 12-3 а, где R17 и R представляют собой (С 1-С 6)алкоксикарбонил, (С 1-С 6)алкилкарбонил, Аr2-карбонил,(С 1-С 6)алкилсульфонил, Аr2-сульфонил или Аr2 сульфинил, получают согласно приведенной выше cхеме 12 и, в частности, как изложено ниже. Соединения формулы 12-3 и 12-3 а, где R17 23 и R такие, как определено в непосредственно предыдущем абзаце, получают конденсацией с соединением формулы 12-2 и 12-2 а, где Lv4 представляет собой соответственно хлоро. Примеры соединений формулы 12-2 и 12-2 а включают (С 1-С 6)алкоксиСОСl, (С 1-С 6)алкилСОСl,Ar2-COCl, (С 1-С 6)алкилSO2 Сl, Ar2-SO2Cl или 40 виях в присутствии неводного основания, который включает органические амины, такие как триэтиламин, N,N'-диизопропилэтиламин, пиридин и их производные. Реакцию проводят в реакционно-инертном растворителе. Предпочтительные растворители для этой реакции включают в себя галогенуглеводород, алифатический или ароматический углеводород, эфиры,этилацетат, пиридин и их комбинации. Время реакции находится в пределах от 15 мин до 24 ч; температура реакции находится в пределах от 0 до 80 С или до температуры дефлегмации используемого растворителя. Реакцию предпочтительно проводят при температуре от 0 С до температуры окружающей среды и при давлении окружающей среды. Удаление возможных защитных групп проводят, как показано на схеме 1. Соединения формулы 12-3 и 12-3 а, где R17 23 и R представляют собой (С 1-С 6)алкилкарбонил или Аr2-карбонил, также получают согласно приведенной выше cхеме 12 и, в частности, как изложено ниже. Соединения формулы 12-3 и 12-3 а, где R17 23 и R представляют собой (С 1-С 6)алкилкарбонил или Аr2-карбонил, получают реакцией конденсации с соединением формулы 12-2 и 12-2 а соответственно, где Lv4 представляет собой гидрокси, в присутствии агентов сочетания, таких как дициклогексилкарбодиимид или 1-(3 диметиламинопропил)-3-этилкарбодиимида гидрохлорид. Реакцию проводят в реакционноинертном растворителе. Предпочтительные растворители включают галогенуглеводород, алифатический/ароматический углеводород и эфиры. Особенно предпочтительные растворители включают дихлорметан и хлороформ. Другие агенты сочетания, которые можно использовать,хорошо известны специалистам в данной области и включают, без ограничений, различные фосфиновые реагенты, этилхлорформиат, и Nгидроксисукцинимид. Удаление возможных защитных групп проводят как описано в cхеме 1. Соединения формулы 12-3, где R17 является (С 1-С 6)алкилом, также получают согласно схеме 12 и, в частности, как описано ниже. Соединения формулы 12-3, где R17 является (С 1-С 6)алкилом, получают взаимодействием соединения формулы 12-1 с соединением формулы 12-2, где R17 является (С 1-С 6)алкилом, иLv4 представляет собой Сl, Вr, I, метансульфонилокси, паратолуолсульфонилокси или трифторметансульфонилокси. Реакцию проводят в безводных условиях в присутствии неводного основания, которое включает органические амины, такие как триэтиламин, основание Хюнига, пиридин и их производные. Реакцию проводят в реакционно-инертном растворителе. Предпочтительные растворители для данной реакции включают галогенуглеводороды, алифатические или ароматические углеводороды, 41 эфиры, этилацетат, пиридин и их комбинации. Время реакции находится в пределах от 15 мин до 24 ч; температура реакции находится в пределах от температуры окружающей среды до 80 С или до температуры дефлегмации используемого растворителя. Реакции предпочтительно проводят при температуре и давлении окружающей среды. Исходные вещества и реагенты для получения вышеописанных соединений также легкодоступны или без труда могут быть синтезированы специалистом в данной области с использованием стандартных методов органического синтеза. Например, многие соединения,использованные здесь, относятся к найденным в природе соединениям, которые имеют большой научный интерес и в которых существует коммерческая потребность, или являются их производными. Соответственно, многие такие соединения имеются в продаже, или о них сообщается в литературе, или их без труда можно получить из других, обычно доступных веществ, способами, о которых сообщается в литературе. Соединения по настоящему изобретению ингибируют образование сорбитолдегидрогеназы и, как таковые, пригодны для лечения диабетических осложнений, включающих, без ограничений, такие осложнения, как диабетическая нефропатия, диабетическая невропатия, диабетическая ретинопатия, диабетическая микроангиопатия, диабетическая макроангиопатия и диабетическая кардиомиопатия. Пригодность соединений по настоящему изобретению в качестве медицинских агентов при лечении заболеваний, которые конкретно приведены здесь, у млекопитающих (например, людей), например диабетических осложнений, таких как диабетическая кардиомиопатия, диабетическая невропатия, диабетическая нефропатия, диабетическая ретинопатия, диабетическая микроангиопатия и диабетическая макроангиопатия, продемонстрирована активностью соединений формулы 1 по данному изобретению в стандартных анализах. Такие анализы также обеспечивают средства, с помощью которых активности соединений формулы 1 по данному изобретению можно сравнить с активностями других известных соединений. Результаты этих сравнений полезны для определения уровней дозировки у млекопитающих, включая человека, для лечения таких заболеваний. Измерение активности в отношении SDH(сорбитолдегидрогеназы) Для этих экспериментов использовали самцов крыс Sprague-Dawley (350-400 г). Диабет индуцировали у некоторых крыс путем инъекции в хвостовую вену стрептозоцина, 85 мг/кг. Через 24 ч 4-м группам крыс-диабетиков давали разовую дозу тестируемого соединения формулы 1 по данному изобретению (от 0,001 до 100 мг/кг) через пероральный зонд. Животных умерщвляли через 4-6 ч после введения дозы и 42 собирали кровь и седалищные нервы. Ткани и клетки подвергали экстракции 6% перхлорной кислотой. Сорбитол в эритроцитах и нервах измеряют модифицированным способом R. S. Clementset al. (Science, 166: 1007-8, 1969). Аликвоты тканевых экстрактов добавляют в анализируемую систему, которая имеет конечные концентрации реагентов 0,033 М глицина, рН 9,4, 800 мМ никотин-адениндинуклеотида и 4 единицы/мл сорбитолдегидрогеназы. После инкубации в течение 30 мин при комнатной температуре флуоресценцию образца определяют на флуоресцентном спектрофотометре с возбуждением при 366 нм и эмиссией при 452 нм. После вычитания соответствующих контролей, количество сорбитола в каждом образце определяют по линейной регрессии стандартов сорбитола, обработанных таким же образом, что и экстракты тканей. Фруктозу определяют модифицированным способом, описанным М. Ameyama, Methods inEnzymology, 89: 20-25 (1982). Феррицианид заменен резазурином. Аликвоты тканевых экстрактов добавляют в анализируемую систему,которая имеет конечные концентрации реагентов 1,2 М лимонной кислоты, рН 4,5, 13 мМ резазурина, 3,3 единиц/мл фруктозодегидрогеназы и 0,068% Triton X-100. После инкубации в течение 60 мин при комнатной температуре флуоресценцию образца определяют на флуоресцентном спектрофотометре с возбуждением при 560 нм и эмиссией при 580 нм. После вычитания соответствующих контролей количество фруктозы в каждом образце определяют по линейной регрессии стандартов фруктозы, обработанных таким же образом, что и экстракты тканей. Активность в отношении SDH измеряют модифицированным способом, описанным U.Gerlach, Methodology of Enzymatic Analyses, edited by H. U. Bergmeyer, 3, 112-117 (1983). Аликвоты сыворотки или мочи добавляют в анализируемую систему, которая имеет конечные концентрации реагентов 0,1 М калий-фосфатного буфера, рН 7,4, 5 мМ NAD (никотинамидадениндинуклеотида), 20 мМ сорбитола и 0,7 единиц/мл сорбитолдегидрогеназы. После инкубации в течение 10 мин при комнатной температуре определяют среднее значение поглощения для образцов при 340 нм. Активность в отношении SDH представляют в виде миллиOD340 единиц/мин (OD340 = оптическая плотность при 340 нм). Любой ингибитор альдозоредуктазы можно использовать в качестве второго соединения(активного агента) по данному изобретению для комбинированной терапии. Термин "ингибитор альдозоредуктазы" относится к соединениям,которые ингибируют биотрансформацию глюкозы в сорбитол, катализируемую ферментом альдозоредуктазой. Такое ингибирование без 43 труда могут определить специалисты в данной области согласно стандартным анализам (J.Sorbitol, an Indicator of Diabetic Control"). Многие ингибиторы альдозоредуктазы описаны и упомянуты ниже, однако иные ингибиторы альдозоредуктазы известны специалистам в данной области. Описания изобретений к патентам США, перечисленным ниже, включены в данное описание изобретения ссылкой. Кроме того,общепринятые химические USAN названия(USAN - Совет по присвоению названий США) или другие обозначения указаны в скобках, если их применяют, вместе со ссылкой на соответствующий источник патентной информации, раскрывающий это соединение. Активность ингибитора альдозоредуктазы в ткани можно определить, измеряя количество ингибитора альдозоредуктазы, которое требуется для снижения уровня сорбитола в ткани (то есть путем ингибирования дальнейшего образования сорбитола вследствие блокирования альдозоредуктазы) и снижения фруктозы в ткани(путем ингибирования образования сорбитола вследствие блокирования альдозоредуктазы и,следовательно, образования фруктозы). Без связи с какой-либо конкретной теорией или механизмом, считается, что ингибитор альдозоредуктазы, ингибируя альдозоредуктазу, предупреждает или уменьшает ишемическое повреждение, как это описано ниже. Соответственно, примеры ингибиторов альдозоредуктазы, используемые в композициях и способах поданному изобретению включают в себя: 1. 3-(4-бром-2-фторбензил)-3,4-дигидро-4 оксо-1-фталазинуксусную кислоту (поналрестат,US 4251528); 2. N[(5-трифторметил)-6-метокси-1-нафталинил]тиоксометил-N-метилглицин (толрестат, US 4600724); 3. 5-[(Z,Е)метилциннамилиден]-4-оксо 2-тиоксо-3-тиазолиденуксусная кислота (эпалрестат, US 4464382, US 4791126, US 4831045); 4. 3-(4-бром-2-фторбензил)-7-хлор-3,4-дигидро-2,4-диоксо-1(2 Н)-хиназолин-уксусная кислота (зенарестат, US 4734419 и 4883800); 5. 2R,4R-6,7-дихлор-4-гидрокси-2-метилхроман-4-уксусная кислота (US 4883410); 6. 2R,4R-6,7-дихлор-6-фтор-4-гидрокси-2 метилхроман-4-уксусная кислота (US 4883410); 7. 3,4-дигидро-2,8-диизопропил-3-оксо-2 Н 1,4-бензоксазин-4-уксусная кислота(US 5447946); и 19. 2-[(4-бром-2-фторфенил)метил]-6 фторспиро[изохинолин-4(1 Н),3'-пирролидин]1,2',3,5'(2 Н)-тетрон (ARI-509, US 5037831). Другие ингибиторы альдозоредуктазы включают в себя соединения, имеющие формулу ARI или их фармацевтически приемлемую соль, гдеR1 в соединении формулы ARI представляет собой гидрокси группу или группу, способную удаляться in vivo с образованием соединения формулы ARI, где R1 представляет собой ОН; и Х и Y в соединении формулы ARI являются одинаковыми или разными и выбраны из водорода, трифторметила, фторо и хлоро. Предпочтительная подгруппа в пределах вышеуказанной группы ингибиторов альдозоредуктазы включает в себя соединения под номерами 1, 2, 3, 4, 5, 6, 9, 10 и 17 и следующие соединения формулы ARI: 20. 3,4-дигидро-3-(5-фторбензотиазол-2 илметил)-4-оксофталазин-1-илуксусная кислота[R1=гидрокси; X=Cl; Y=H]; 28. 3-(5,7-дихлорбензоксазол-2-илметил)3,4-дигидро-4-оксофталазин-1-илуксусная кислота [R1=гидрокси; X=Y=Cl], и 29. зополрестат; 1-фталазинуксусная кислота, 3,4-дигидро-4-оксо-3-5-(трифторметил)2-бензотиазолил]метил]-[R1=гидрокси; Х=трифторметил; Y=H]. В соединениях 20-23 и 29 Z представляет собой S. В соединениях 24-28 Z представляет собой О. Из вышеуказанной подгруппы соединения 20-29 являются более предпочтительными, а соединение 29 является особенно предпочтительным. Особенно предпочтительным ингибитором альдозоредуктазы является 1-фталазинуксусная кислота, 3,4-дигидро-4-оксо-3-5-(трифторметил)-2-бензотиазолил]метил]-. Термин "ацильный радикал от карбоновой кислоты-ингибитора альдозоредуктазы" относится к любому из вышеупомянутых ингибиторов альдозоредуктазы, который содержит группу карбоновой кислоты, в котором эта группа карбоновой кислоты заменена карбонильным радикалом. Соединения-ингибиторы альдозоредуктазы по данному изобретению имеются в продаже или без труда могут быть синтезированы специалистами в данной области с использованием стандартных методов органического синтеза, в частности с учетом описаний изобретений к релевантным патентам. Можно использовать количество ингибитора альдозоредуктазы по данному изобретению, которое эффективно для воздействия по данному изобретению. Типичная эффективная дозировка для ингибиторов альдозоредуктазы по данному изобретению находится в пределах от приблизительно 0,1 до 100 мг/кг/сутки в разовой или разделенных дозах, предпочтительно от 0,1 до 20 мг/кг/сутки в разовой или разделенных дозах. Любой ингибитор натрий-водородного ионного обмена (NHE-1) можно использовать в качестве второго соединения (активного агента) по данному изобретению для комбинированной терапии. Термин "ингибитор NHE-1" относится 46 к соединениям, которые ингибируют транспортную систему натрий/протонного (Na+/H+) обмена и, следовательно, полезны в качестве терапевтического или профилактического агента для заболеваний, вызванных или осложненных ускорением транспортной системы натрий/протонного (Na+/H+) обмена, например сердечно-сосудистых заболеваний [например артериосклероза, гипертензии, аритмии (например ишемической аритмии, аритмии вследствие инфаркта миокарда, миокардиальной потери сознания, миокардиальной дисфункции, аритмии после РТСА (чрескожной катетерной коронаропластики) или после тромболизиса и т.д.),стенокардии, гипертрофии сердца, инфаркта миокарда, сердечной недостаточности (например застойной сердечной недостаточности, острой сердечной недостаточности, гипертрофии сердца и т.д.), рестеноза после РТСА, РТСI, шока (например геморрагического шока, эндотоксинового шока и т.д.)], почечных заболеваний(например сахарного диабета, диабетической нефропатии, ишемической острой почечной недостаточности и т.д.), расстройств органов,связанных с ишемией или ишемической реперфузией [например нарушений, связанных с ишемической реперфузией сердечной мышцы,острой почечной недостаточности, или нарушений, вызванных хирургическим вмешательством, таким как аортокоронарное шунтирование(CABG), хирургические операции на сосудах,трансплантация органов, хирургические операции не на сердце или чрескожная катетерная коронаропластка (РТСА)], цереброваскулярных заболеваний (например, ишемического удара,геморрагического удара и т.д.), цереброишемических расстройств (например, расстройств,связанных с церебральным инфарктом, расстройств, являющихся последствием кровоизлияния в мозг или отка головного мозга. Ингибиторы NHE-1 также можно использовать в качестве агента для защиты миокарда во время аортокоронарного шунтирования (CABG), хирургических операций на сосудах, чрескожной катетерной коронаропластики (РТСА), РТСI,трансплантации органов или хирургических операций не на сердце. Пригодность ингибиторов NHE-1 в качестве терапевтических агентов в лечении заболеваний, таких как подробно описанные здесь заболевания у млекопитающих(например, людей), например защиты миокарда во время хирургического вмешательства или защиты миокарда у пациентов с текущими сердечными или церебральными ишемическими эпизодами, или постоянной кардиозащиты у пациентов с диагностированным коронарным сердечным заболеванием или с риском коронарного сердечного заболевания, сердечной дисфункции или миокардиального удара, продемонстрирована активностью соединений формулы I по данному изобретению в стандартных предклинических анализах на кардиозащиту[см. in vivo анализ, описанный в Klein, H. et al.,Circulation 92:912-917 (1995); анализ на изолированном сердце, описанный в Scholz, W. et al.,Cardiovascular Research 29:260-268 (1995); антиаритмический анализ, описанный в Yasutake Mvitro и in vivo анализах, описанных ниже. Такие анализы также обеспечивают средства, с помощью которых активность соединений формулы I по данному изобретению можно сравнить с активностью других, известных соединений. Результаты этих сравнений полезны для определения уровней дозировки у млекопитающих,включая людей, для лечения таких заболеваний. Ингибиторы NHE-1 раскрыты в патенте США 5698581, в публикации Европейской патентной заявки ЕР 803501 А 1, в публикации Международной патентной заявки WO 94/26709 и PCT/JP/04650, каждая из которых включена в данное описание изобретения ссылкой. Ингибиторы NHE-1, раскрытые в этих документах,пригодны для использования в комбинации по данному изобретению. Указанные ингибиторыNHE-1 могут быть получены, как описано в указанных выше источниках информации. Предпочтительные ингибиторы NHE-1 включают в себя соединения формулы NHE их пролекарство или фармацевтически приемлемую соль указанного соединения или указанного пролекарства, гдеZ в соединении формулы NHE соединен с атомом углерода и представляет собой пятичленное, диаза, диненасыщенное кольцо,имеющее два соседних атома азота, причем указанное кольцо возможно моно-, ди- или тризамещено заместителями в количестве до трех,независимо выбранными из R1, R2 и R3; илиZ в соединении формулы NHE соединен с атомом углерода и представляет собой пятичленное, триаза, диненасыщенное кольцо, причем указанное кольцо возможно моно- или дизамещено заместителями в количестве до двух,независимо выбранными из R4 и R5; где R1, R2, R3, R4 и R5, каждый независимо,в соединении формулы NHE представляют собой водород, гидрокси-(С 1-С 4)алкил, (С 1 С 4)алкил, (С 1-С 4)алкилтио, (С 3-С 4)циклоалкил,(С 3-С 7)циклоалкил(С 1-С 4)алкил, (С 1-С 4)алкокси,(С 1-С 4)алкокси(С 1-С 4)алкил, моно-N- или диN,N-(С 1-С 4)алкилкарбамоил, М или М(С 1 С 4)алкил, причем любая из указанных предыдущих (С 1-С 4)алкильных группировок возможно имеет от одного до девяти атомов фтора; указанный (С 1-С 4)алкил и (С 3-С 4)циклоалкил возможно независимо моно- или ди-замещен гид 004656(С 3-С 4)циклоалкил возможно имеет от одного до семи атомов фтора; где М в соединении формулы NHE представляет собой частично насыщенное, полностью насыщенное или полностью ненасыщенное пяти-восьмичленное кольцо, возможно имеющее от одного до трех гетероатомов, выбранных независимо из кислорода, серы и азота,или бициклическое кольцо, состоящее из двух конденсированных, частично насыщенных,полностью насыщенных или полностью ненасыщенных трех-шестичленных колец, взятых независимо, возможно имеющих от одного до четырех гетероатомов, выбранных независимо из азота, серы и кислорода; указанный М в соединении формулы NHE возможно замещен на одном кольце, если группировка является моноциклической, или на одном или обоих кольцах, если группировка является бициклической, по углероду или азоту заместителями в количестве до трех, независимо выбранными из R6, R7 и R8, причем один из R6,R7 и R8 представляет собой возможно частично насыщенное, полностью насыщенное или полностью ненасыщенное трех-семичленное кольцо, возможно имеющее от одного до трех гетероатомов, независимо выбранных из кислорода,серы и азота, возможно замещенное (С 1 С 4)алкилом, и дополнительно R6, R7 и R8 возможно представляют собой гидрокси, нитро,галогено, (С 1-С 4)алкокси, (С 1-С 4)алкоксикарбонил, (С 1-С 4)алкил, формил, (С 1-С 4)алканоил,(С 1-С 4)алканоилокси,(С 1-С 4)алканоиламино,(С 1-С 4)алкоксикарбониламино, сульфонамидо,(С 1-С 4)алкилсульфонамидо, амино, моно-N- или ди-N,N-(С 1-С 4)алкиламино, карбамоил, моно-Nили ди-N,N-(С 1-С 4)алкилкарбамоил, циано, тиол, (С 1-С 4)алкилтио, (С 1-С 4)алкилсульфинил,(С 1-С 4)алкилсульфонил, моно-N- или ди-N,N(С 1-С 4)алкиламиносульфонил, (С 2-С 4)алкенил,(С 2-С 4)алкинил или (С 5-С 7)циклоалкенил,причем указанные (С 1-С 4)алкокси, (С 1 С 4)алкильный, (С 1-С 7)алканоильный, (С 1-С 4) алкилтио, моно-N- или ди-N,N-(С 1-С 4)алкиламино или (С 3-С 7)циклоалкильный заместителиR6, R7 и R8 независимо возможно монозамещены гидрокси, (С 1-С 4)алкоксикарбонилом,(С 3-С 7)циклоалкилом, (С 1-С 4)алканоилом, (С 1 С 4)алканоиламино, (С 1-С 4)алканоилокси, (С 1 С 4)алкоксикарбониламино, сульфонамидо, (С 1 С 4)алкилсульфонамидо, амино, моно-N- или диN,N-(С 1-С 4)алкиламино, карбамоилом, моно-Nили ди-N,N-(С 1-С 4)алкилкарбамоилом, циано,(C1 тиолом,нитро,(С 1-С 4)алкилтио,С 4)алкилсульфинилом, (С 1-С 4)алкилсульфонилом или моно-N- или ди-N,N-(С 1-С 4)алкиламиносульфонилом, или возможно замещены 49 атомами фтора в количестве от одного до девяти. Особенно предпочтительные ингибиторы[1-(2-хлор-4-метиламиносульфонилфенил)-5-циклопропил-1H-пиразол-4-карбонил] гуанидин,[1-(2,5-дихлорфенил)-5-циклопропил-1 Нпиразол-4-карбонил]гуанидин,[1-(2,3-дихлорфенил)-5-циклопропил-1Hпиразол-4-карбонил]гуанидин,[1-(2-хлор-5-аминокарбонилфенил)-5 циклопропил-1 Н-пиразол-4-карбонил]гуанидин,[1-(2-хлор-5-аминосульфонилфенил)-5 циклопропил-1H-пиразол-4-карбонил]гуанидин,[1-(2-фтор-6-трифторметилфенил)-5 циклопропил-1H-пиразол-4-карбонил]гуанидин,[1-(2-хлор-5-метилсульфонилфенил)-5 циклопропил-1H-пиразол-4-карбонил]гуанидин,[1-(2-хлор-5-диметиламиносульфонилфенил)-5-циклопропил-1H-пиразол-4-карбонил]гуанидин,[1-(2-трифторметил-4-хлорфенил)-5 циклопропил-1H-пиразол-4-карбонил]гуанидин,[1-(2-хлорфенил)-5-метил-1H-пиразол-4 карбонил]гуанидин,[5-метил-1-(2-трифторметилфенил)-1 Нпиразол-4-карбонил]гуанидин,[5-этил-1-фенил-1H-пиразол-4-карбонил] гуанидин,[5-циклопропил-1-(2-трифторметилфенил)1 Н-пиразол-4-карбонил]гуанидин,[5-циклопропил-1-фенил-1 Н-пиразол-4 карбонил]гуанидин,[5-циклопропил-1-(2,6-дихлорфенил)-1Hпиразол-4-карбонил]гуанидин или их фармацевтически приемлемую соль. Предпочтительные и особенно предпочтительные ингибиторы NHE-1, раскрытые в вышеуказанных двух абзацах, могут быть получены способами, изложенными в международной заявке PCT/IB 99/00206 или как изложено ниже,где переменные на нижеследующих схемах и в описании относятся только к соединениямингибиторам NHE-1. Схема I Согласно схеме I соединение формулы I-а,где R4 такой, как описано выше для соединения формулы NНЕ, растворяют или суспендируют в водном растворе гидроксида щелочного металла(например 1 н. гидроксиде натрия) вместе с нитритом натрия, и эту смесь добавляют к водному раствору кислоты (например к 10% об./об. серной кислоте) при рН приблизительно 0 при температуре от приблизительно 0 до приблизительно 5 С в течение от приблизительно 30 мин до приблизительно 1 ч. Полученную смесь фильтруют с получением оксима формулы I-b. Альтернативно, соединение формулы I-а растворяют в смеси 1:1 уксусная кислота/пропионовая кислота и добавляют твердый нитрит натрия при приблизительно 0 С. Реакционную смесь 53 перемешивают при приблизительно 0 С в течение приблизительно 2 ч, затем вливают в ледяную воду и фильтрованием получают оксим формулы I-b. Соединение формулы I-b подвергают взаимодействию с соединением формулы I-с,где R5 такой, как описано выше для соединения формулы NНЕ, в протонном растворителе, таком как этанол, при температуре от приблизительно 50 до приблизительно 110 С в течение от приблизительно 10 мин до 1 ч до образования гидразона формулы I-d. Гидразон формулы I-d циклизуют и гидролизуют до триазола формулы I-е в спиртовом растворителе, таком как 2-этоксиэтанол, в щелочных условиях (например гидроксид калия) при температуре от приблизительно 100 до приблизительно 175 С в течение от приблизительно 1/2 до 2 ч с последующим подкислением с получением триазолкарбоновой кислоты формулыI-е. Кислоту формулы I-е подвергают сочетанию с гуанидином в присутствии подходящего агента сочетания. Подходящим агентом сочетания является агент, который трансформирует карбоновую кислоту в реакционноспособный вид, который образует амидную связь при реакции с амином. Агентом сочетания может быть реагент,который осуществляет эту конденсацию в процессе смешения в одном сосуде вместе с карбоновой кислотой и гуанидином. Примерами реагентов сочетания являются 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлоридгидроксибензотриазол (EDC/HBT), дициклогексилкарбодиимид/гидроксибензотриазол(НВТ), 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин (EEDQ) и диэтилфосфорилцианид. Сочетание происходит в инертном растворителе,предпочтительно апротонном растворителе при температуре от приблизительно -20 до приблизительно 50 С в течение от приблизительно 1 до приблизительно 48 ч, в присутствии избытка гуанидина в качестве основания. Примеры растворителей включают ацетонитрил, дихлорметан, диметилформамид и хлороформ или их смеси. Агентом сочетания также может быть такой агент, который превращает карбоновую кислоту в активированное промежуточное соединение, которое выделяют, и/или оно образуется на первой стадии, и его приводят во взаимодействие с гуанидином на второй стадии. Примерами таких агентов сочетания и активированных промежуточных соединений являются тионилхлорид или оксалилхлорид для образования хлорангидрида, цианурфторид для образования фторангидрида, или алкилхлорформиат, такой как изобутил- или изопропенилхлорформиат,или пропанфосфоновый ангидрид (пропанфосфоновой кислоты ангидрид, РРА) (с четвертичным аммониевым основанием) для образования 54 смешанного ангидрида карбоновой кислоты,или карбонилдиимидазол для образования ацилимидазола. Если агент сочетания представляет собой оксалилхлорид, предпочтительно использовать небольшое количество диметилформамида в качестве сорастворителя с другим растворителем (таким как дихлорметан), чтобы катализировать образование хлорангидрида. Активированное производное кислоты может быть подвергнуто сочетанию с избытком гуанидина путем смешивания в подходящем растворителе вместе с подходящим основанием. Подходящими комбинациями растворитель/ основание являются например дихлорметан,диметилформамид или ацетонитрил или их смеси в присутствии избытка гуанидина в качестве основания. Другие подходящие комбинации растворитель/основание включают в себя воду или (С 1-С 5)спирт или их смеси вместе с сорастворителем, таким как дихлорметан, тетрагидрофуран или диоксан, и основание, такое как гидроксид натрия, калия или лития, в количестве, достаточном, чтобы нейтрализовать кислоту,высвобождающуюся в результате реакции. Использование таких агентов сочетания и целесообразный выбор растворителей и температур известны специалистам в данной области или могут быть легко определены по литературе. Эти и другие примерные условия, пригодные для сочетания карбоновых кислот, описаны вand Biology (ed. E. Gross and J. Meienhofer), vols 1-5 (academic Press, NY 1979-1983). Согласно схеме II первичный амин формулы II-а, где R5 такой, как описано выше для соединения формулы NHE, подвергают взаимодействию с -диазокето-эфиром формулы IIb, где R4 такой, как описано выше для соединения формулы NHE, a R представляет собой низший алкил, в присутствии четыреххлористого титана аналогично способу, описанному вEguchi S. et al. Synthesis 1993, 793, до образования сложного эфира триазолкарбоновой кислоты формулы II-с. Эфир формулы II-с прямо превращают в ацилгуанидин формулы II-d путем взаимодействия с гуанидином в спиртовом растворителе при температуре от приблизительно 60 до приблизительно 110 С, предпочтительно при температуре дефлегмации метанола, в течение периода времени от 8 до 20 ч. Согласно схеме III соединение формулыIII-а, где R4 и R5 такие, как описано выше для соединения формулы NHE, обрабатывают реагентом Лавессона(то есть 2,4-бис(4 метоксифенил)-1,3-дитиа-2,4-дифосфетан-2,4 дисульфидом) в апротонном растворителе, таком как диметоксиэтан, при температуре от приблизительно 20 до приблизительно 120 С в течение приблизительно 1-8 ч. Полученный 55 тиоамид обрабатывают алкилирующим агентом,таким как метилйодид в инертном полярном растворителе, таком как ацетон, приемлемо при температуре окружающей среды в течение от приблизительно 8 ч до приблизительно 48 ч. Полученное соединение подвергают взаимодействию с безводным гидразином в спиртовом растворителе при температуре от приблизительно 0 до приблизительно 25 С в течение приблизительно 1-8 ч с получением соединения формулы III-b (аналогично тому, как описано вDoyle and Kurzer, Synthesis 1974, 583). Соединения формулы III-b обрабатывают моноалкилоксалилхлоридом в апротонном растворителе при температуре от приблизительно 25 до приблизительно 50 С в течение приблизительно 1-8 ч с получением соединения формулыIII-с, представляющего собой сложный эфир карбоновой кислоты, где R представляет собой низший алкил. Сложный эфир формулы III-с прямо связывают с гуанидином в спиртовом растворителе при температуре от приблизительно 60 до приблизительно 110 С, предпочтительно при температуре дефлегмации метанола, в течение периода времени от 8 до 20 ч с получением триазолкарбонилгуанидинов формулы IIId. Согласно cхеме IV соединение формулыIV-a, где R5 такой, как описано выше для соединения формулы NHE, обрабатывают метилйодидом в инертном растворителе, предпочтительно при температуре окружающей среды, в течение от приблизительно 4 до 24 ч. Полученное соединение подвергают взаимодействию с безводным R4-гидразином (где R4 такой, как описано выше для соединения формулы NHE) в спиртовом растворителе при температуре от приблизительно 0 до приблизительно 25 С в течение от приблизительно 1 до 8 ч с получением амидразона формулы IV-b (аналогично тому,как описано в Doyle and Kurzer, Synthesis 1974,583). Соединение формулы IV-b обрабатывают моноалкилоксалилхлоридом в апротонном растворителе при температуре от приблизительно 25 до приблизительно 50 С в течение от приблизительно 1 до 8 ч с получением сложного эфира карбоновой кислоты формулы IV-c, где R представляет собой низший алкил. Сложный эфир формулы IV-c прямо подвергают сочетанию с гуанидином в спиртовом растворителе при температуре от приблизительно 60 до приблизительно 110 С, предпочтительно при температуре дефлегмации метанола, в течение периода времени от 8 до 20 ч с получением триазолкарбонилгуанидинов формулы IV-d. Согласно схеме V соединение формулы Va, где R1 такой, как описано выше для соединения формулы NHE, смешивают с избытком(CH3O)2C(R3)N(CH3)2 (N,N-диметиламиддиметилацеталя), где R3 такой, как описано выше для соединения формулы NHE, возможно в присут 004656 56 ствии кислотного катализатора, такого как паратолуолсульфоновая кислота, при температуре от приблизительно 90 С до приблизительно 110 С в течение от приблизительно одного до приблизительно 2 ч с получением соединения формулыV-c. Соединение формулы V-c подвергают циклизации с использованием соединения формулы V-d, где R2 такой, как описано выше для соединения формулы NHE, в инертном растворителе, таком как этанол, при температуре от приблизительно 20 до приблизительно 30 С в течение от приблизительно 5 мин до приблизительно 1 ч с последующим нагреванием до температуры от приблизительно 70 до приблизительно 110 С в течение от приблизительно 2 до приблизительно 4 ч до образования пиразола формулы V-f. Альтернативно, согласно cхеме V соединение формулы V-a, где R1 такой, как описано выше для соединения формулы NHE, смешивают с триэтилортоэфиром (то есть R3C(ОЕt)3, гдеR3 такой, как описано выше для соединения формулы NHE) и уксусным ангидридом при температуре от приблизительно 120 С до приблизительно 150 С в течение от приблизительно 2 до приблизительно 5 ч с получением соединения формулы V-b. Соединение формулы V-b подвергают циклизации с использованием соединения формулы V-d, где R2 такой, как описано выше для соединения формулы NHE, с образованием пиразола формулы V-e. Пиразол формулы V-e гидролизуют основанием, таким как гидроксид натрия или гидроксид лития, в растворителе, таком как вода и/или метанол и/или THF (тетрагидрофуран),преимущественно при температуре окружающей среды или при повышенной температуре(например, при температуре дефлегмации) в течение от приблизительно 1 до приблизительно 5 ч с получением кислоты формулы V-f. Кислоту формулы V-f подвергают сочетанию с гуанидином в присутствии подходящего агента сочетания, как описано выше для сочетания кислоты формулы I-е и гуанидина. В одном воплощении кислоту формулы V-f активируют тионилхлоридом при температуре от приблизительно 60 до приблизительно 90 С в течение от приблизительно 15 мин до приблизительно 2 ч. Полученный активированный хлорангидрид объединяют с гуанидина гидрохлоридом и неорганическим основанием (например гидроксидом натрия) в безводном тетрагидрофуране и возможно метаноле и/или воде. Раствор нагревают,преимущественно с обратным холодильником, в течение от приблизительно 1 до приблизительно 8 ч с получением соединения формулы V-g. Альтернативно, согласно схеме V соединение формулы V-e можно прямо превратить в соединение формулы V-g несколькими способами. Например, соединение формулы V-e 57 можно нагреть в присутствии избытка гуанидина в полярном протонном растворителе, например метаноле или изопропаноле, при подходящей температуре, преимущественно с обратным холодильником, в течение от приблизительно 1 до приблизительно 72 ч. Это превращение можно также осуществить путем неоднократного удаления растворителя, например удаления этанола или толуола приблизительно четыре раза,из смеси соединения формулы V-e и избытка гуанидина при давлении от приблизительно одного до приблизительно 100 мм рт.ст. (13,33 кПа) и при температуре от приблизительно 25 до приблизительно 95 С. Эту реакцию может осуществить также в отсутствие растворителя путем нагревания смеси соединения формулыV-e и избытка гуанидина при температуре от приблизительно 100 до приблизительно 180 С,возможно при давлении от приблизительно 1(13,33 кПа) в течение от приблизительно 5 мин до приблизительно 8 ч. Согласно схеме VI соединение формулыVI-a, где R3 такой, как описано выше для соединения формулы NHE, подвергают взаимодействию с соединением формулы VI-b, где R1 и R2 такие, как описано выше для соединения формулы NHE, в апротонном растворителе при температуре от приблизительно 0 до приблизительно 25 С в течение от приблизительно 2 до приблизительно 24 ч в присутствии подходящего аминного основания, такого как триэтиламин,до образования соединения формулы VI-c. Полученное соединение формулы VI-c гидролизуют и подвергают сочетанию с гуанидином, используя один из способов, приведенных на предыдущих схемах, например способ с использованием карбонилдиимидазола, с получением соединения формулы VI-d. Согласно схеме VII гидразин формулыVII-a, где R2 такой, как описано выше для соединения формулы NHE, подвергают взаимодействию с соответствующим соединением формулы VII-b до образования пиразольного сложного эфира формулы VII-c, где R представляет собой низший алкил, по методу Bajnati, A.and Hubert-Habart, M. Bull. Soc. Chim. France 1988, 540. Полученный пиразольный сложный эфир превращают в ацилгуанидин формулы VIId, используя методы гидролиза и сочетания,описанные выше. Согласно схеме VIII соединение формулыVIII-a, где R1 и R2 такие, как описано выше для соединения формулы NHE, превращают в литиевую соль формулы VIII-b, где R представляет собой низший алкил, способом, описанным вJ. Het. Chem. 1989, 26, 1389. Литиевую соль формулы VIII-b объединяют с гидразином формулы VIII-c, где R3 такой, как описано выше для соединения формулы NHE, в инертном растворителе, таком как этанол, в присутствии минеральной кислоты, при температуре от приблизи 004656 58 тельно 20 до приблизительно 30 С, в течение от приблизительно 5 мин до приблизительно 1 ч, с последующим нагреванием до температуры от приблизительно 70 до приблизительно 110 С в течение от 2 ч до приблизительно 4 ч с получением как пиразола формулы VIII-d, так и пиразола формулы VIII-e. Пиразолы формул VIII-d иVIII-f и VIII-g соответственно, используя методы гидролиза и сочетания, описанные выше. Некоторые из этих методов, пригодных для получения соединений, описанных здесь, могут требовать защиты периферийных функциональных групп (например, первичного амина, вторичного амина, карбоксила в предшественниках формулы I). Необходимость в такой защите будет варьировать в зависимости от природы периферических функциональных групп и условий получения. Специалисты в данной области без труда должны определить необходимость такой защиты. Использование таких способов защиты/удаления защиты также находится в пределах компетенции специалиста. Общее описание защитных групп и их использования приведено в T.W.Greene, Protective Groups inOrganic Synthesis, John WileySons, New York,1991. Соединения формулы I no настоящему изобретению, когда их используют в комбинации с ингибиторами NHE-1, ингибируют транспортную систему натрий/протонного (Na+/H+) обмена и, следовательно, полезны в качестве терапевтического или профилактического агента для заболеваний, вызванных или осложненных ускорением транспортной системы натрий/протонного (Na+/H+) обмена, например,сердечно-сосудистых заболеваний [например,артериосклероза, гипертензии, аритмии (например, ишемической аритмии, аритмии вследствие инфаркта миокарда, миокардиального удара,миокардиальной дисфункции, аритмии после РТСА или после тромболизиса и т.д.), стенокардии, гипертрофии сердца, инфаркта миокарда,сердечной недостаточности (например, застойной сердечной недостаточности, острой сердечной недостаточности, гипертрофии сердца и т.д.), рестеноза после РТСА, PTCI, шока (например, геморрагического шока, эндотоксинового шока и т.д.)], почечных заболеваний (например, сахарного диабета, диабетической нефропатии, острой ишемической почечной недостаточности и т.д.), расстройств органов, связанных с ишемией или ишемической реперфузией[например, расстройств, связанных с ишемической реперфузией сердечной мышцы, острой почечной недостаточности или нарушений, вызванных хирургическим вмешательством, таким как аортокоронарное шунтирование (CABG),хирургические операции на сосудах, трансплантация органов, хирургические операции не на сердце или чрескожная катетерная коронаропластика (РТСА)], цереброваскулярных заболе 59 ваний (например, ишемического удара, геморрагического удара и т.д.), ишемических расстройств головного мозга (например, расстройств, связанных с церебральным инфарктом, расстройств, являющихся следствием кровоизлияния в мозг или отка головного мозга). Предпочтительно соединения формулы I по настоящему изобретению можно использовать в комбинации с ингибиторами NHE-1 в качестве агентов для защиты миокарда до, во время или после аортокоронарного шунтирования (CABG), хирургических операций на сосудах, чрескожной катетерной коронаропластики(РТСА), трансплантации органов или хирургических операций не на сердце. Предпочтительно соединения формулы I по данному изобретению можно использовать в комбинации с ингибиторами NHE-1 в качестве агентов для защиты миокарда у пациентов с текущими сердечными (острые коронарные синдромы, например инфаркт миокарда или нестабильная стенокардия) или церебральными ишемическими эпизодами (например, удар). Предпочтительно соединения формулы I по настоящему изобретению можно использовать в комбинации с ингибиторами NHE-1 в качестве агентов для постоянной защиты миокарда у пациентов с диагностированным коронарным сердечным заболеванием (например,предшествующим инфарктом миокарда или нестабильной стенокардией) или у пациентов с высоким риском инфаркта миокарда (возраст более 65 лет и два или более чем два фактора риска для коронарного сердечного заболевания). Кроме того, комбинация соединений формулы I по данному изобретению с ингибиторами NHE-1 оказывает сильное ингибирующее воздействие на пролиферацию клеток, например пролиферацию фибробластов и пролиферацию гладкомышечных клеток кровеносных сосудов. По этой причине комбинация соединений формулы I по изобретению с ингибиторами NHE-1 по изобретению является ценным терапевтическим агентом для применения при заболеваниях, при которых пролиферация клеток является первичной или вторичной причиной и, следовательно, может быть использована в качестве антиатеросклеротических агентов или агентов против поздних диабетических осложнений,онкологических заболеваний, фиброзных заболеваний, таких как фиброз легкого, фиброз печени или фиброз почки, гломерулярного нефросклероза, гипертрофии или гиперплазии органов, в частности гиперплазии или гипертрофии простаты, фиброза легкого, диабетических осложнений или рецидивного стеноза после РТСА или заболеваний, вызванных повреждением эндотелиальных клеток. Пригодность комбинации соединений по настоящему изобретению с ингибиторами NHE1 в качестве терапевтических агентов в лечении заболеваний, таких как подробно изложено 60 здесь, у млекопитающих (например, людей),например защиты миокарда во время хирургического вмешательства или защиты миокарда у пациентов с текущими сердечными или церебральными ишемическими эпизодами или постоянной защиты сердца у пациентов с диагностированным коронарным сердечным заболеванием или с риском коронарного сердечного заболевания, сердечной дисфункции или миокардиального удара, продемонстрирована активностью указанной комбинации в стандартных предклинических анализах на кардиозащиту [in vivo анализ, описанный в Klein, H. et al., Circulation 92:912-917 (1995); анализ на изолированном сердце, описанный в Scholz, W. et al., Cardiovascular Research 29:260-268 (1995); антриаритмический анализ, описанный в Yasutake M., et al.,Am. J. Physiol., 36:H2430-H2440 (1994); ЯМР анализ, описанный в Kolke et al., J. Thorac. Cardiovasc. Surg. 112: 765-775 (1996)] и дополнительных in vitro и in vivo анализах, описанных ниже. Такие анализы предусматривают также средства, с помощью которых активность соединений формулы I по данному изобретению можно сравнить с активностью других, известных соединений. Результаты этих сравнений полезны для определения уровней дозировки у млекопитающих, включая человека, для лечения таких заболеваний. Измерение ингибирующей активности в отношении NHE-1 у человека Методики измерения у человека активности NHE-1 и эффективности ингибитора основаны на методиках, опубликованных Watson etNHE-опосредованное восстановление внутриклеточного рН измеряют после внутриклеточного подкисления. Так, фибробласты, стабильно экспрессирующие у человека NHE-1 (Counilion,L. et al., Mol. Pharmacol., 44:1041-1045 (1993,наносят на покрытые коллагеном 96-луночные планшеты (50000 на лунку) и выращивают до слияния в среде для выращивания (DMEM (среда Игла, модифицированная по Дульбекко) с высоким содержанием глюкозы, 10% сыворотка телячьего эмбриона, 50 ЕД/мл пенициллина или стрептомицина). Засеянные планшеты инкубируют в течение 30 мин при 37 С с рНчувствительным флуоресцентным зондомBCECF (5 мкМ; Molecular Probes, Eugene, OR). Клетки с BCECF инкубируют в течение 30 мин при 37 С в среде для нагружения кислотой (70 мМ холинхлорида, 50 мМ NHCl4, 5 мМ KCl, 1 мМ CaCl2, 5 мМ глюкозы, 10 мМ HEPES (N-2 гидроксиэтилпиперазин-N'-2-этансульфоновая кислота), рН 7,5), а затем помещают в Fluorescent Imaging Plate Reader (Molecular Devices,CA). Мониторинг BCECF-флуоресценции осуществляют, используя длины волн возбуждения и эмиссии 485 нм и 525 нм соответственно. Внутриклеточное подкисление инициируют быстрым замещением среды для нагружения
МПК / Метки
МПК: C07D 498/04, A61P 3/10, C07D 471/04, A61K 31/505, C07D 241/44
Метки: аминопиримидины, ингибиторов, сорбитолдегидрогеназы, качестве
Код ссылки
<a href="https://eas.patents.su/30-4656-aminopirimidiny-v-kachestve-ingibitorov-sorbitoldegidrogenazy.html" rel="bookmark" title="База патентов Евразийского Союза">Аминопиримидины в качестве ингибиторов сорбитолдегидрогеназы</a>
Предыдущий патент: Пуриновые производные
Следующий патент: Фармацевтическая композиция на основе обладающих антихолинергическим действием соединений , способ ее получения и применение