Пуриновые производные
Формула / Реферат
1. Соединение формулы
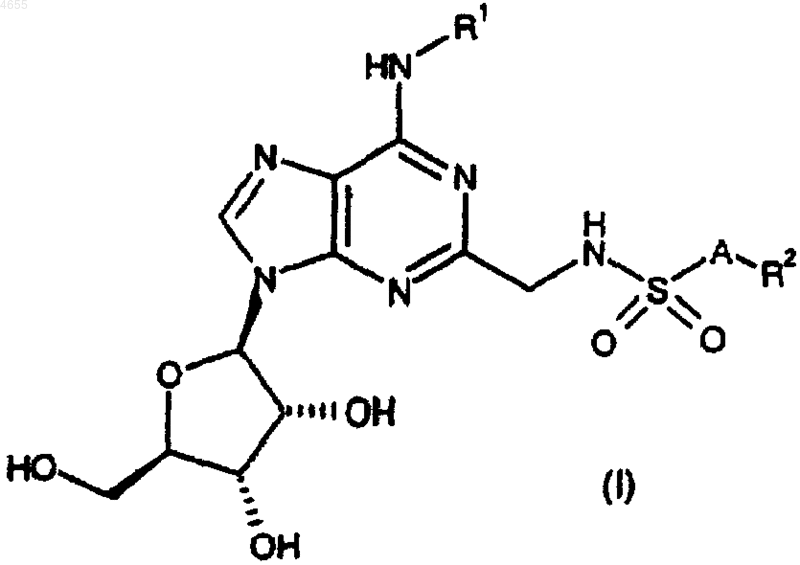
или его фармацевтически приемлемые соль либо сольват, где
R1 представляет собой водород или C1-C6алкил, возможно замещенный 1 или 2 заместителями, каждый из которых независимо выбран из фенила и нафтила, причем указанные фенил и нафтил возможно замещены C1-C6алкилом, C1-C6алкокси, галогено или циано;
A представляет собой связь или C1-C3алкилен;
R2 представляет собой
(1) водород, C1-C6алкил, C3-C7циклоалкил, фенил или нафтил, причем указанные C3-C7циклоалкил, фенил или нафтил возможно замещены C1-C6алкилом, фенилом, C1-C6алкокси-(C1-C6)алкилом, R3R3N-(C1-C6)-алкилом, фтор-(C1-C6)алкилом, фтор-(C1-C6)алкокси, C2-C5алканоилом, галогено, -OR3, циано, -COOR3, C3-C7циклоалкилом, -S(O)mR4, -NR3R3, -SO2NR3R3, -CONR3R3, -NR3COR4 либо -NR3SO2R4, при условии, что R2 не представляет собой водород, когда A представляет собой связь, или
(2) -NR7R8, -OR3, -COOR3, -OCOR4, -SO2R4, -CN, -SO2NR3R3, -NR3COR4 либо -CONR3R3, когда A представляет собой C2-C3алкилен, или
(3) C-связанный 4-11-членный моно- или бициклический гетероцикл, имеющий либо от 1 до 4 кольцевых атомов азота, либо 1 или 2 кольцевых атома азота и 1 кольцевой атом кислорода или 1 кольцевой атом серы, возможно C-замещенный оксо, C1-C6алкокси-(C1-C6)алкилом, R3R3N-(C1-C6)алкилом, фтор-(C1-C6)алкилом, фтор-(C1-C6)алкокси, фтор-(C2-C5)алканоилом, галогено, циано, -OR5, R6, -COR5, -NR5R5, -COOR5, -S(O)mR6, -SO2NR5R5, -CONR5R5, -NR5SO2R6 или -NR5COR6 и возможно N-замещенный C1-C6алкокси-(C1-C6)алкилом, R3R3N-(C2-C6)алкилом, фтор-(C1-C6)алкилом, фтор-(C2-C5)алканоилом, R6, -COR5, -COOR5, -S(O)mR6, -SO2NR5R5 или -CONR5R5;
R3 представляет собой H, C1-C6алкил, C3-C7циклоалкил или фенил;
R4 представляет собой C1-C6алкил, C3-C7циклоалкил или фенил;
R5 представляет собой H, C1-C6алкил, C3-C7циклоалкил, фенил, нафтил или гет;
R6 представляет собой C1-C6алкил, C3-C7циклоалкил, фенил, нафтил или гет;
либо R7 и R8, взятые вместе с атомом азота, к которому они присоединены, представляют собой азетидинил, пирролидинил, пиперидинил, морфолинил, пиперазинил, гомопиперидинил, гомопиперазинил или тетрагидроизохинолинил, причем каждый возможно замещен по кольцевому углеродному атому C1-C6алкилом, C3-C8циклоалкилом, фенилом, C1-C6алкокси-(C1-C6)алкилом, R3R3N-(C1-C6)алкилом, фтор-(C1-C6)алкилом, -CONR3R3, -COOR3 или C2-C5алканоилом и возможно замещен по кольцевому углеродному атому, не являющемуся соседним с кольцевым атомом азота, фтор-(C1-C6)алкокси, галогено, -OR3, циано, -S(O)mR4, -NR3R3, -SO2NR3R3, -NR3COR4 или -NR3SO2R4, и при этом указанные пиперазин-1-ил и гомопиперазин-1-ил возможно замещены по кольцевому атому азота, не присоединенному к A, C1-C6алкилом, фенилом, C1-C6алкокси-(C2-C6)алкилом, R3R3N-(C2-C6)алкилом, фтор-(C1-C6)алкилом, C2-C5алканоилом, -COOR4, C3-C8циклоалкилом, -SO2R4, -SO2NR3R3 или -CONR3R3,
либо R7 представляет собой H, C1-C6алкил, C3-C8циклоалкил, фенил или бензил, а R8 представляет собой H, C1-C6алкил, C3-C8циклоалкил, фенил, бензил, фтор-(C1-C6)алкил, -CONR3R3, -COOR4, C2-C5алканоил или -SO2NR3R3;
m представляет собой 0, 1 или 2; и
"гет", используемый в определениях R5 и R6, означает C-связанный пирролил, имидазолил, триазолил, тиенил, фурил, тиазолил, оксазолил, тиадиазолил, оксадиазолил, пиридинил, пиримидинил, пиридазинил, пиразинил, хинолинил, изохинолинил, бензимидазолил, хиназолинил, фталазинил, бензоксазолил или хиноксалинил, причем каждый возможно замещен C1-C6алкилом, C1-C6алкокси, циано или галогено.
2. Соединение по п.1, где
R1 представляет собой водород или C1-C6алкил, возможно замещенный 1 или 2 заместителями, каждый из которых независимо выбран из фенила и нафтила, причем указанные фенил и нафтил возможно замещены C1-C6алкилом, C1-C6алкокси, галогено или циано;
A представляет собой связь или C1-C3алкилен;
R2 представляет собой
(1) водород, C1-C6алкил, C3-C7циклоалкил, фенил или нафтил, причем указанные C3-C7циклоалкил, фенил или нафтил возможно замещены C1-C6алкилом, фенилом, C1-C6алкокси-(C1-C6)алкилом, амино-(C1-C6)алкилом, фтор-(C1-C6)алкилом, фтор-(C1-C6)алкокси, C2-C5алканоилом, галогено, -OR3, циано, -COOR3, C3-C7циклоалкилом, -S(O)mR4, -NR3R3, -SO2NR3R3, -CONR3R3, -NR3COR4 либо -NR3SO2R4, при условии, что R2 не представляет собой водород, когда A представляет собой связь, или
(2) -NR3R3, -OR3, -COOR3, -OCOR4, -SO2R4, -CN, -SO2NR3R3, -NR3COR4 либо -CONR3R3, когда A представляет собой C2-C3алкилен, или
(3) C-связанный 4-11-членный моно- или бициклический гетероцикл, имеющий либо от 1 до 4 кольцевых атомов азота, либо 1 или 2 кольцевых атома азота и 1 кольцевой атом кислорода или 1 кольцевой атом серы, возможно C-замещенный оксо, C1-C6алкокси-(C1-C6)алкилом, амино-(C1-C6)алкилюь, фтор-(C1-C6)алкилом, фтор-(C1-C6)алкокси, фтор-(C2-C5)алканоилом, галогено, циано, -OR5, R6, -COR5, -NR5R5, -COOR5, -S(O)mR6, -SO2NR5R5, -CONR5R5, -NR5SO2R6 или -NR5COR6 и возможно N-замещенный C1-C6алкокси-(C1-C6)алкилом, амино-(C2-C6)алкилом, фтор-(C1-C6)алкилом, фтор-(C2-C5)алканоилом, R6, -COR5, -COOR5, -S(O)mR6, -SO2NR5R5 или -CONR5R5, или
(4) N-связанный азетидинил, пирролидинил, пиперидинил или пиперазинил, причем каждый возможно C-замещен C1-C6алкилом, фенилом, C1-C6алкокси-(C1-C6)алкилом, амино-(C1-C6)алкилом, фтор-(C1-C6)алкилом, фтор-(C1-C6)алкокси, C2-C5алканоилом, галогено, -OR3, циано, -COOR3, C3-C7циклоалкилом, -S(O)mR4, -NR3R3, -SO2NR3R3, -CONR3R3, -NR3COR4 или -NR3SO2R4 и возможно N-замещен C1-C6алкилом, фенилом, C1-C6алкокси-(C1-C6)алкилом, амино-(C2-C6)алкилом, фтор-(C1-C6)алкилом, C2-C5алканоилом, -COOR3, C3-C7циклоалкилом, -S(O)mR4, -SO2NR3R3 или -CONR3R3, когда A представляет собой C2-C3алкилен;
R3 представляет собой H, C1-C6алкил или фенил;
R4 представляет собой C1-C6алкил или фенил;
R5 представляет собой H, C1-C6алкил, C3-C7циклоалкил, фенил, нафтил или гет;
R6 представляет собой C1-C6алкил, C3-C7циклоалкил, фенил, нафтил или гет;
m представляет собой 0, 1 или 2; и
"гет", используемый в определениях R5 и R6, означает C-связанный пирролил, имидазолил, триазолил, тиенил, фурил, тиазолил, оксазолил, тиадиазолил, оксадиазолил, пиридинил, пиримидинил, пиридазинил, пиразинил, хинолинил, изохинолинил, бензимидазолил, хиназолинил, фталазинил, бензоксазолил или хиноксалинил, причем каждый возможно замещен C1-C6алкилом, C1-C6алкокси, циано или галогено.
3. Соединение по п.1 или 2, где A представляет собой связь.
4. Соединение по п.1 или 2, где A представляет собой C1-C3алкилен.
5. Соединение по п.1, где A представляет собой C2-C3алкилен.
6. Соединение по п.5, где A представляет собой -CH2CH2-.
7. Соединение по любому из пп 1-6, где R2 представляет собой C1-C6алкил или фенил.
8. Соединение по п.7, где R2 представляет собой 2-метилпроп-1-ил или фенил.
9. Соединение по п.5 или 6, где R2 представляет собой -NR7R8.
10. Соединение по п.9, где R7 представляет собой C1-C6алкил и R8 представляет собой C3-C8циклоалкил.
11. Соединение по п.10, где R7 представляет собой проп-2-ил и R8 представляет собой цикпопентил.
12. Соединение по любому из пп.1-11, где R1 представляет собой C1-C6алкил, замещенный 1 или 2 заместителями, каждый из которых независимо выбран из фенила и нафтила.
13. Соединение по п.12, где R1 представляет собой 2-фенилэтил, 2,2-дифенилэтил или 1-нафтилметил.
14. Соединение по п.1, где -A-R2 представляет собой 2-[(2-пропил)(циклопентил)амино]этил, 2-метилпроп-1-ил или фенил.
15. Соединение по п. 1, которое выбрано из группы, состоящей из
N-({9-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)тетрагидро-2-фуранил]-6-[(2,2-дифенилэтил)амино]-9H-пурин-2-ил}метил)-2-метил-1-пропансульфонамида;
N-{[9-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)тетрагидро-2-фуранил]-6-(фенэтиламино)-9H-пурин-2-ил]метил}бензолсульфонамида;
N-({9-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)тетрагидро-2-фуранил]-6-[(1-нафтилметил)амино]-9H-пурин-2-ил}метил)бензолсульфонамида; и
2-[циклопентил(изопропил)амино]-N-({9-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)тетрагидро-2-фуранил]-6-[(2,2-дифенилэтил)амино]-9H-пурин-2-ил}метил)этансульфонамида;
и их фармацевтически приемлемых солей и сольватов.
16. Фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемые соль либо сольват по любому из пп.1-15 вместе с фармацевтически приемлемым эксципиентом, разбавителем или носителем.
17. Применение соединения формулы (I) или его фармацевтически приемлемой соли либо сольвата по любому из пп.1-15 в качестве лекарственного средства.
18. Применение соединения формулы (I) или его фармацевтически приемлемых соли либо сольвата по любому из пп.1-15 для изготовления лекарственного средства для лечения заболевания, при котором показан агонист A2a-рецептора.
19. Применение соединения формулы (I) или его фармацевтически приемлемых соли либо сольвата по любому из пп.1-15 для изготовления противовоспалительного агента.
20. Применение соединения формулы (I) или его фармацевтически приемлемых соли либо сольвата по любому из пп.1-15 для изготовления лекарственного средства для лечения респираторного заболевания.
21. Применение по п.20, где данное заболевание выбрано из группы, состоящей из респираторного дистресс-синдрома взрослых (ARDS), бронхита, хронического бронхита, хронической обструктивной болезни легких, муковисцидоза, астмы, эмфиземы, бронхоэктаза, хронического синусита и ринита.
22. Применение соединения формулы (I) или его фармацевтически приемлемых соли либо сольвата по любому из пп.1-15 для изготовления лекарственного средства для лечения септического шока, мужской эректильной дисфункции, гипертензии, удара, эпилепсии, церебральной ишемии, заболевания периферических сосудов, постишемического реперфузионного повреждения, диабета, ревматоидного артрита, рассеянного склероза, псориаза, аллергического дерматита, экземы, неспецифического язвенного колита, болезни Крона, воспалительного заболевания кишечника, гастрита, связанного с Helicobacter pylori, гастрита, не связанного с Helicobacter pylori, повреждения желудочно-кишечного тракта, индуцированного нестероидными противовоспалительными лекарствами, или психотического расстройства, или для лечения ран.
23. Способ лечения млекопитающего, включая человека, для лечения заболевания, при котором показан агонист A2a-рецептора, при котором указанного млекопитающего лечат эффективным количеством соединения формулы (I) или его фармацевтически приемлемых соли, сольвата либо их композиции по любому из пп.1-15 и 16, соответственно.
24. Способ лечения млекопитающего, включая человека, для лечения воспалительного заболевания, при котором указанного млекопитающего лечат эффективным количеством соединения формулы (I) или его фармацевтически приемлемых соли, сольвата либо их композиции по любому из пп.1-15 и 16, соответственно.
25. Способ лечения млекопитающего, включая человека, для лечения респираторного заболевания, при котором указанного млекопитающего лечат эффективным количеством соединения формулы (I) или его фармацевтически приемлемых соли, сольвата либо их композиции по любому из пп.1-15 и 16, соответственно.
26. Способ по п.25, где данное заболевание выбрано из группы, состоящей из респираторного дистресс-синдрома взрослых (ARDS), бронхита, хронического бронхита, хронической обструктивной болезни легких, муковисцидоза, астмы, эмфиземы, бронхоэктаза, хронического синусита и ринита.
27. Способ лечения млекопитающего, включая человека, для лечения септического шока, мужской эректильной дисфункции, гипертензии, удара, эпилепсии, церебральной ишемии, заболевания периферических сосудов, постишемического реперфузионного повреждения, диабета, ревматоидного артрита, рассеянного склероза, псориаза, аллергического дерматита, экземы, неспецифического язвенного колита, болезни Крона, воспалительного заболевания кишечника, гастрита, связанного с Helicobacter pylori, гастрита, не связанного с Helicobacter pylori, повреждения желудочно-кишечного тракта, индуцированного нестероидными противовоспалительными лекарствами, или психотического расстройства, или для лечения ран, при котором указанного млекопитающего лечат эффективным количеством соединения формулы (I) или его фармацевтически приемлемых соли, сольвата либо их композиции по любому из пп.1-15 и 16, соответственно.
28. Способ получения соединения формулы (I) по п.1 или 2 либо его фармацевтически приемлемых соли или сольвата, при котором снимают защиту с соединения формулы
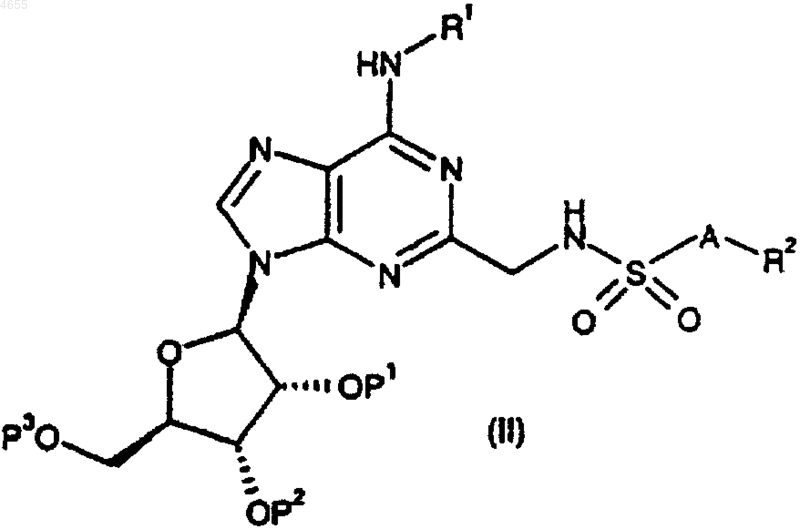
где R1, R2 и A такие, как определено в п.1 или 2, и либо P1, P2 и P3, взятые по отдельности, представляют собой защитные группы, либо P1 и P2, взятые вместе, представляют собой защитную группу, и P3 представляет собой защитную группу, при этом защитные группы удаляют одновременно или последовательно и возможно превращают соединение I в его фармацевтически приемлемую соль.
29. Способ получения соединения формулы (I) по п.1 или 2 либо его фармацевтически приемлемых соли или сольвата, при котором снимают защиту с соединения формулы
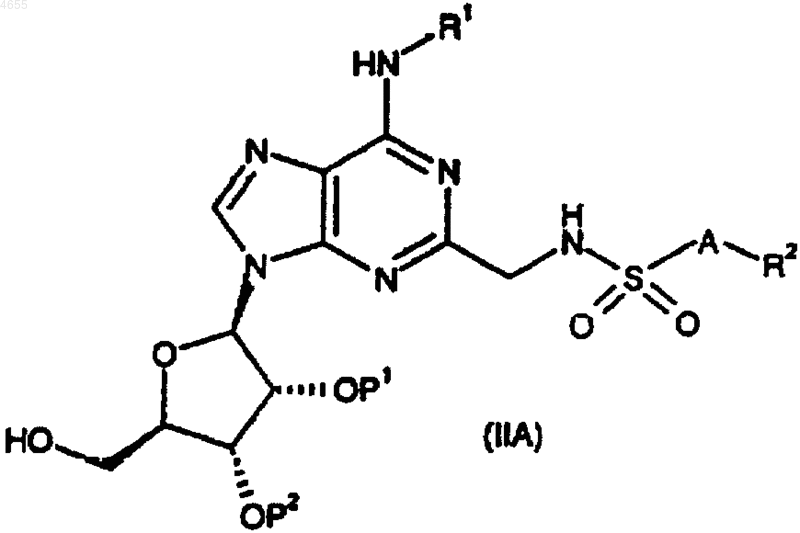
где R1, R2 и A такие, как определено в п.1 или 2, и либо P1 и P2, взятые по отдельности, представляют собой защитные группы, либо P1 и P2, взятые вместе, представляют собой защитную группу, при этом защитные группы P1 и P2, взятые по отдельности, удаляют или одновременно, или последовательно и возможно превращают соединение I в его фармацевтически приемлемую соль.
30. Способ получения соединения формулы (I) по п.1 или 2 либо его фармацевтически приемлемых соли или сольвата, при котором снимают защиту с соединения формулы
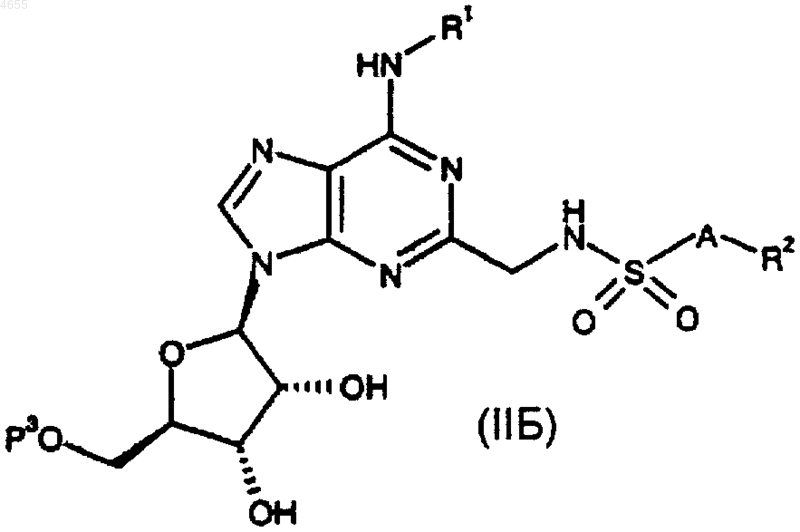
где P3 представляет собой защитную группу, а R1, R2 и A такие, как определено в п.1 или 2, и возможно превращают соединение I в его фармацевтически приемлемую соль.
31. Способ получения соединения формулы (I) по п.1 или 2 либо его фармацевтически приемлемых соли или сольвата, при котором проводят сульфонилирование соединения формулы
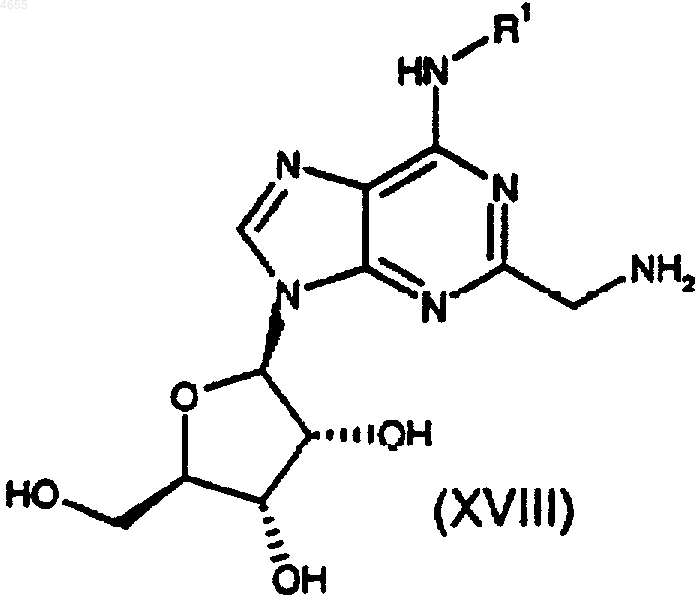
где R1 такой, как определено в п.1 или 2, соединением формулы
R2-A-SO2X (VII),
где X представляет собой уходящую группу, предпочтительно хлоро, а R2 и A такие, как определено в п.1 или 2, и возможно превращают соединение I в его фармацевтически приемлемую соль.
32. Способ получения соединения формулы (I) по п.1, где A представляет собой -CH2CH2-, а R2 представляет собой -NR7R8, либо его фармацевтически приемлемых соли или сольвата, при котором соединения формулы
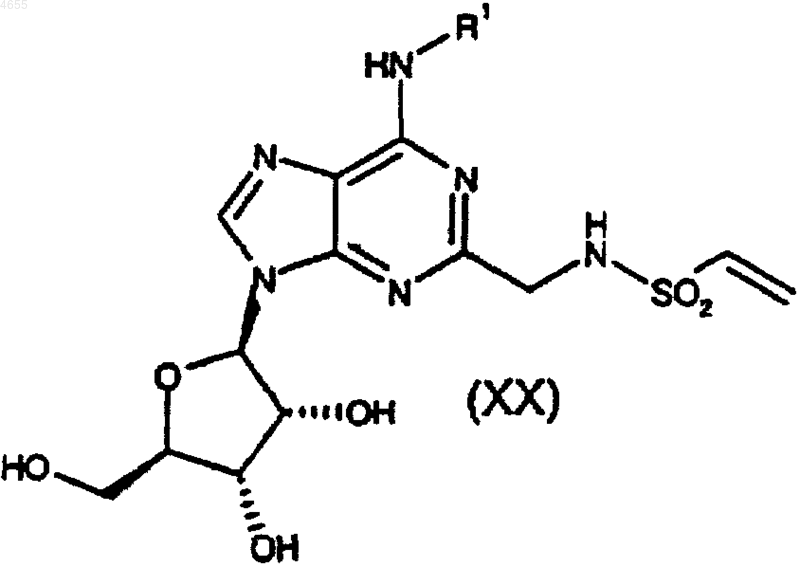
где R1 такой, как определено в п.1, подвергают взаимодействию с соединением формулы
R7R8NH (XXII),
где R7 и R8 такие, как определено в п.1;
причем указанный способ возможно сопровождается превращением соединения формулы (I) в его фармацевтически приемлемую соль.
33. Соединение формулы
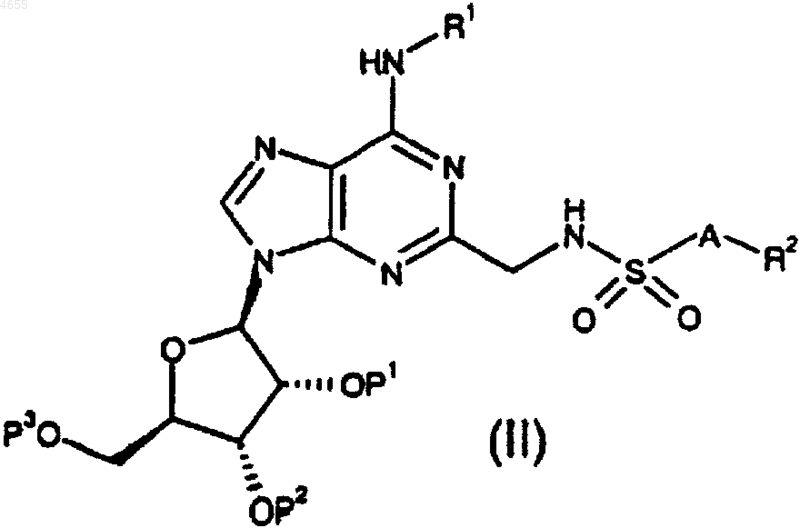
где либо P1, P2 и P3, взятые по отдельности, представляют собой защитные группы, либо P1 и P2, взятые вместе, представляют собой защитную группу и P3 представляет собой защитную группу; или
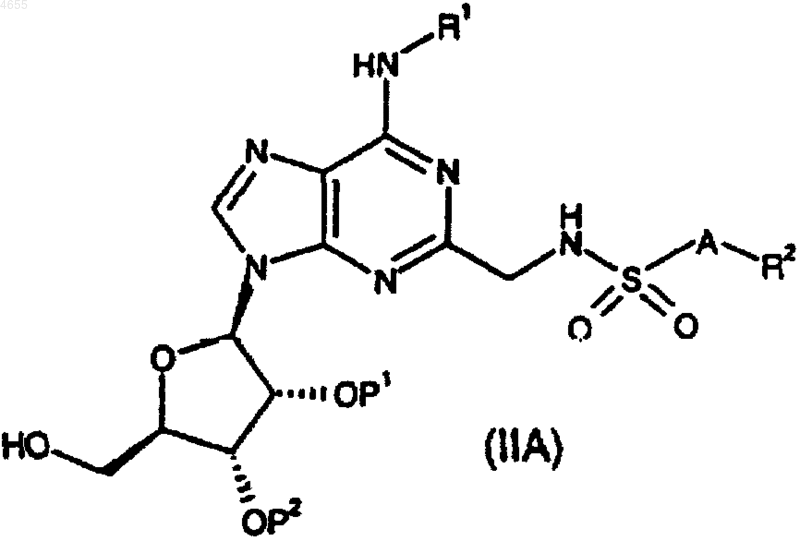
где либо P1 и P2, взятые по отдельности, представляют собой защитные группы, либо P1 и P2, взятые вместе, представляют собой защитную группу; или
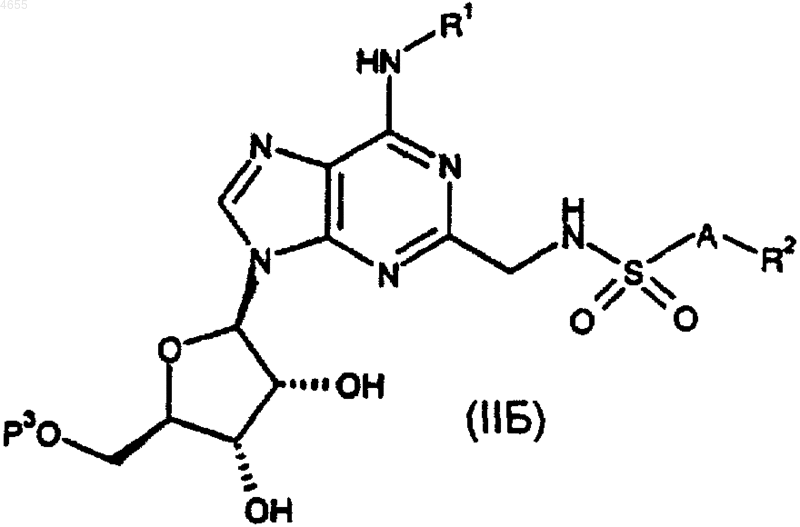
где P3 представляет собой защитную группу; или
причем данные группы R1, R2 и A такие, как определено в п.1 или 2.
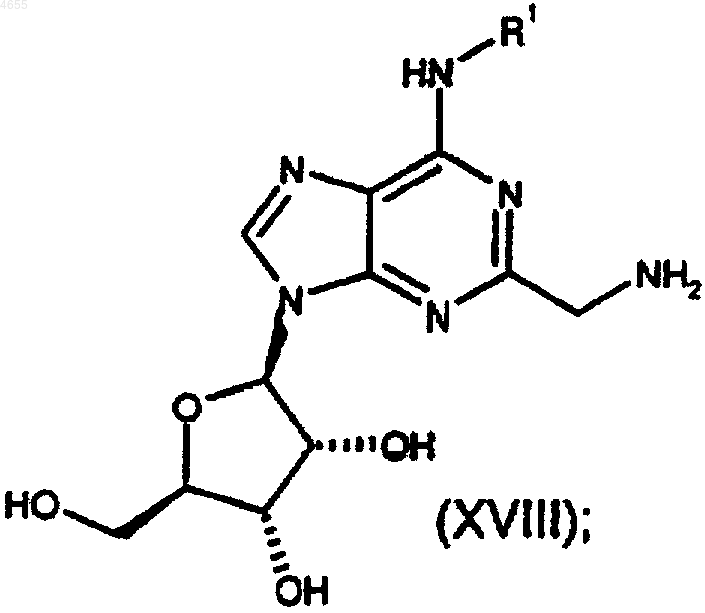
34. Соединение формулы
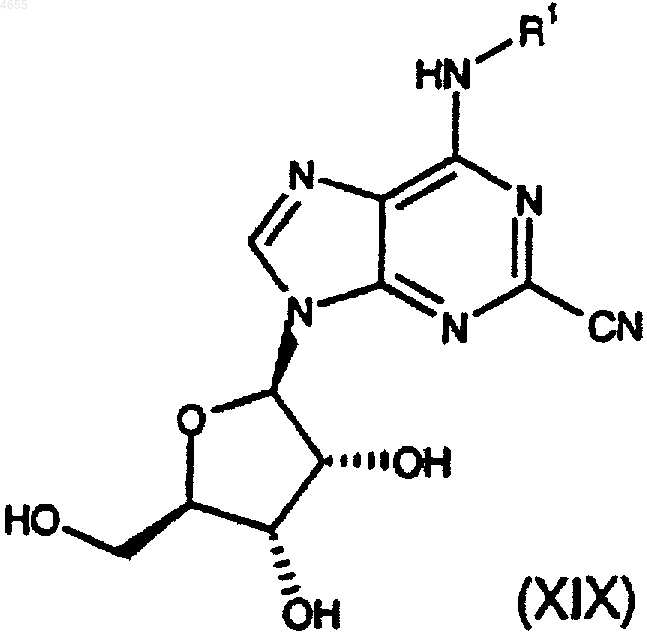
причем группа R1 определена как C1-C6алкил, возможно замещенный 1 или 2 заместителями, каждый из которых независимо выбран из фенила и нафтила, причем указанные фенил и нафтил возможно замещены C1-C6алкилом, C1-C6алкокси, галогено или циано.
35. Соединение формулы
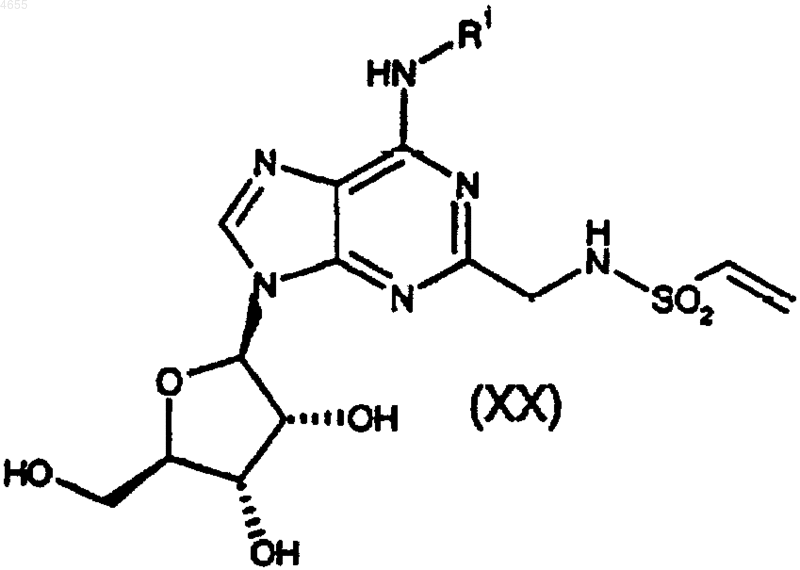
причем данная группа R1 такая, как определено в п.1.
Текст
1 Данное изобретение относится к пуриновым производным. Более конкретно, это изобретение относится к N-[(пурин-2-ил)метил]сульфонамидным производным и к способам получения таких производных, промежуточным соединениям, используемым при получении таких производных, композициям, содержащим такие производные, и к применению таких производных. Данные производные являются селективными, функциональными агонистами аденозинового А 2 а-рецептора человека и могут быть использованы в качестве противовоспалительных агентов при лечении, inter alia, заболеваний дыхательных путей. Аденозин представляет собой широко распространенную молекулу, играющую центральную роль в промежуточном обмене веществ у млекопитающих. Независимо от этого аденозин действует на многочисленные поверхностные рецепторы, что приводит к ряду ответных реакций. Классификация аденозиновых рецепторов показала наличие по меньшей мере четырех подтипов: А 1, А 2 а, А 2b и A3. Сообщалось, что стимуляция аденозиновых А 2-рецепторов на поверхности человеческих нейтрофилов в значительной степени ингибирует ряд функций нейтрофилов. Активированные нейтрофилы могут вызывать повреждения легочной ткани путем высвобождения реакционноспособных форм кислорода, например радикалов супероксид-аниона (O2-), и гранулированных продуктов,например эластазы нейтрофилов человека (human neutrophil elastase, HNE), в числе других воспалительных медиаторов. В дополнение к этому активированные нейтрофилы осуществляют как синтез de novo, так и высвобождение арахидонатных продуктов, таких как лейкотриен B4 (LTB4). LTB4 представляет собой сильнодействующий хемоаттрактант, который пополняет дополнительными нейтрофилами очаг воспаления, в то время как высвобождаемые O2- иHNE неблагоприятно действуют на легочный внеклеточный матрикс. Подтип А 2-рецепторов,опосредующий многие из этих ответов (высвобождения O2- и LTB4/HNE и клеточной адгезии),определен как А 2 а. Подтип А 2 (А 2 а или А 2b),опосредующий другие эффекты, остается неустановленным. Считается, что действие селективного агониста на А 2 а-рецептор оказывает более благоприятное терапевтическое воздействие, чем применение неселективных агонистов аденозинового рецептора, поскольку в моделях на животных и в исследованиях ткани человека показано, что взаимодействие с другими подтипами связано с вредными эффектами в легких. Например, ингаляционное введение провокационной пробы аденозина у астматиков, в отличие от лиц, не страдающих от астмы, вызывает бронхостеноз. Этот ответ, по меньшей мере, частично обусловлен активацией подтипа А 1 рецептора. Активация А 1-рецепторов также способст 004655 2 вует хемотаксису нейтрофилов и адгезии к эндотелиальным клеткам, таким образом способствуя повреждению легких. Более того, многим пациентам с респираторным заболеванием будет показано совместное назначение 2 агонистов, и в исследованиях на животных показано, что негативное взаимодействие между изопреналином и аденозиновыми рецепторами негативно связано с аденилатциклазой. Дегрануляции тучных клеток человека способствует активация аденозиновых А 2b-рецепторов, поэтому селективность через А 2b-рецептор также является благоприятной. В US 5877180 описаны агонисты А 2 а аденозиновых рецепторов, которые представляют собой производные аденозина, замещенные в положении 2 пуринового кольца. Неожиданно оказалось, что настоящие пуриновые производные ингибируют функцию нейтрофилов и являются селективными агонистами аденозинового А 2 а-рецептора. Кроме того, они могут обладать антагонистической активностью в отношении аденозинового А 3 рецептора. Настоящие соединения могут быть использованы для лечения любого заболевания,при котором показан агонист А 2 а-рецептора. Они могут быть использованы для лечения заболевания, в которое вовлечено повреждение ткани, индуцируемое лейкоцитом (например,нейтрофилом, эозинофилом, базофилом, лимфоцитом, макрофагом). Они полезны в качестве противовоспалительных агентов при лечении заболеваний дыхательных путей, таких как респираторный дистресс-синдром взрослых(ARDS), бронхит, хронический бронхит, хроническая обструктивная болезнь легких, муковисцидоз, астма, эмфизема, бронхоэктазия, хронический синусит и ринит. Кроме этого, настоящие соединения могут быть использованы при лечении септического шока, мужской эректильной дисфункции, гипертензии, удара, эпилепсии, церебральной ишемии, заболевания периферических сосудов, постишемического реперфузионного повреждения, диабета, ревматоидного артрита, рассеянного склероза, псориаза,дерматита, аллергического дерматита, экземы,неспецифического язвенного колита, болезни Крона, воспалительного заболевания кишечника, гастрита, связанного с Helicobacter pylori,гастрита, не связанного с Helicobacter pylori,повреждения желудочно-кишечного тракта, индуцированного нестероидными противовоспалительными лекарствами, или психотического расстройства, или для лечения ран. Таким образом, согласно настоящему изобретению предложено соединение формулы или его фармацевтически приемлемые соль или сольват, гдеR1 представляет собой водород или C1 С 6 алкил, возможно замещенный 1 или 2 заместителями, каждый из которых независимо выбран из фенила и нафтила, причем указанные фенил и нафтил возможно замещены C1-С 6 алкилом, C1-С 6 алкокси, галогено или циано; А представляет собой связь или C1-С 3 алкилен;(1) водород, C1-С 6 алкил, С 3-С 7 циклоалкил,фенил или нафтил, причем указанные С 3-С 7 циклоалкил, фенил или нафтил возможно замещены C1-С 6 алкилом, фенилом, С 1-С 6 алкокси(С 1-С 6)алкилом, R3R3N-(C1-C6)алкилом, фтор(С 1-С 6)алкилом, фтор-(С 1-С 6)алкокси, С 2-С 5 алканоилом, галогено, -OR3, циано, -COOR3, С 3 С 7 циклоалкилом, -S(O)mR4, -NR3R3, -SO2NR3R3,-CONR3R3, -NR3COR4 либо -NR3SO2R4, при условии, что R2 не является водородом, когда А представляет собой связь, или(3) С-связанный 4-11-членный моно- или бициклический гетероцикл, имеющий либо от 1 до 4 кольцевых атомов азота, либо 1 или 2 кольцевых атома азота и 1 кольцевой атом кислорода или 1 кольцевой атом серы, возможно Сзамещенный оксо, С 1-С 6 алкокси-(С 1-С 6)алкилом, R3R3N-(С 1-С 6)алкилом, фтор-(С 1-С 6)алкилом, фтор-(С 1-С 6)алкокси, фтор-(С 2-С 5)алканоилом, галогено, циано, -OR5, R6, -COR5,-COOR5,-S(O)mR6,-SO2NR5R5,-NR5R5,5 5 5 6 5 6R6 представляет собой C1-С 6 алкил, С 3 С 7 циклоалкил, фенил, нафтил или гет; либо R7 и R8, взятые вместе с атомом азота, к которому они присоединены, представляют собой азетидинил, пирролидинил, пиперидинил,морфолинил, пиперазинил, гомопиперидинил,гомопиперазинил или тетрагидроизохинолинил,причем каждый возможно замещен по кольце 004655 4 вому углеродному атому C1-С 6 алкилом, С 3 С 8 циклоалкилом, фенилом, С 1-С 6 алкокси-(С 1 С 6)алкилом, R3R3N-(С 1-С 6)алкилом, фтор-(С 1 С 6)алкилом, -СОNR3R3, -COOR3 или С 2 С 5 алканоилом и возможно замещен по кольцевому углеродному атому, не являющемуся соседним с кольцевым атомом азота, фтор-(С 1 С 6)алкокси, галогено, -OR3, циано, -S(O)mR4,-NR3R3, -SO2NR3R3, -NR3 СОR4 или -NR3SO2R4, и при этом указанные пиперазин-1-ил и гомопиперазин-1-ил возможно замещены по кольцевому атому азота, не присоединенному к А, С 1-С 6 алкилом, фенилом, С 1-С 6 алкокси-(С 2-С 6)алкилом, R3R3N-(С 2-С 6)алкилом, фтор-(С 1-С 6)алкилом, С 2-С 5 алканоилом, -COOR4, С 3-С 8 циклоалкилом, -SO2R4, -SO2NR3R3 или -СОNR3R3,либо R7 представляет собой Н, С 1-С 6 алкил,С 3-С 8 циклоалкил, фенил или бензил, а R8 представляет собой Н, С 1-С 6 алкил, С 3-С 8 циклоалкил,фенил, бензил, фтор-(С 1-С 6)алкил, -CONR3R3,-COOR4, С 2-С 5 алканоил или -SО 2NR3R3;R , означает С-связанный пирролил, имидазолил, триазолил, тиенил, фурил, тиазолил, оксазолил, тиадиазолил, оксадиазолил, пиридинил,пиримидинил, пиридазинил, пиразинил, хинолинил, изохинолинил, бензимидазолил, хиназолинил, фталазинил, бензоксазолил или хиноксалинил, причем каждый возможно замещен C1 С 6 алкилом, С 1-С 6 алкокси, циано или галогено. В вышеупомянутых определениях галогено означает фторо, хлоро, бромо или иодо, а алкильные, алкиленовые, алканоильные и алкоксигруппы, содержащие необходимое количество атомов углерода, могут представлять собой неразветвленную или разветвленную цепь. Гетероцикл, как он определен выше для R2 в части (3), может быть ароматическим или полностью либо частично насыщенным. Выражение С-связанный, используемое при определении R2 и гет, означает, что данная группа связана с соседним атомом через кольцевой атом углерода. Примеры алкила включают в себя метил, этил, н-пропил, изопропил, н-бутил,изобутил, втор-бутил и тpeт-бутил. Примеры алкокси включают в себя метокси, этокси, нпропокси, изопропокси, н-бутокси, изобутокси,втop-бутокси и тpeт-бутокси. Примеры алкилена включают в себя метилен, 1,1-этилен, 1,2 этилен, 1,3-пропилен и 1,2-пропилен. Примеры циклоалкила включают в себя циклопропил,циклобутил, циклопентил, циклогексил и циклогептил. Фармацевтически приемлемые соли соединений формулы (I) включают в себя их соли присоединения кислоты и основные соли. Подходящие соли присоединения кислоты образованы из кислот, которые образуют нетоксичные соли, и примерами являются соли гидрохлорид, гидробромид, гидроиодид, сульфат,бисульфат, нитрат, фосфат, кислый фосфат, 5 ацетат, малеат, фумарат, лактат, тартрат, цитрат,глюконат, сукцинат, сахарат, бензоат, метансульфонат, этансульфонат, бензолсульфонат, птолуолсульфонат и памоат. Подходящие основные соли образованы из оснований, которые образуют нетоксичные соли, и примерами являются соли натрия, калия,алюминия, кальция, магния, цинка и диэтаноламина. Для обзора подходящих солей смотриBerge et al. J. Pharm. Sci., 66, 1-19 (1977). Фармацевтически приемлемые сольваты соединений формулы (I) включают в себя их гидраты. Кроме того, в пределы настоящего объема соединений формулы (I) включены их полиморфы. Соединение формулы (I) может содержать один или более чем один дополнительный асимметричный атом углерода и поэтому существовать в двух или более чем двух стереоизомерных формах. Настоящее изобретение включает в себя индивидуальные стереоизомеры соединений формулы (I) вместе с их смесями. Разделение диастереоизомеров может быть достигнуто с помощью традиционных методик,например посредством фракционной кристаллизации, хроматографии или ВЭЖХ стереоизомерной смеси соединения формулы (I) или его подходящей соли либо производного. Кроме того, индивидуальный энантиомер соединения формулы (I) может быть получен из соответствующего оптически чистого промежуточного соединения или разделением, например, посредством ВЭЖХ, соответствующего рацемата с использованием подходящей хиральной стационарной фазы, или посредством фракционной кристаллизации диастереоизомерных солей,образованных путем взаимодействия соответствующего рацемата с подходящими оптически активными кислотой или основанием, как будет целесообразно. Предпочтительно R1 представляет собой С 1-С 6 алкил, возможно замещенный 1 или 2 заместителями, каждый из которых независимо выбран из фенила и нафтила. Предпочтительно R1 представляет собой С 1-С 6 алкил, замещенный 1 или 2 заместителями,каждый из которых независимо выбран из фенила и нафтила. Предпочтительно R1 представляет собой С 1-С 4 алкил, замещенный 1 или 2 заместителями,каждый из которых независимо выбран из фенила и нафтила. Предпочтительно R1 представляет собой С 1-С 2 алкил, замещенный 1 или 2 заместителями,каждый из которых независимо выбран из фенила и нафтила. Предпочтительно R1 представляет собой фенилэтил, дифенилэтил или нафтилметил.-CH2CH2NR7R8. Предпочтительно R7 представляет собой С 1-С 6 алкил. Предпочтительно R7 представляет собой С 1-С 3 алкил. Предпочтительно R7 представляет собой пропил. Предпочтительно R7 представляет собой проп-2-ил. Предпочтительно R8 представляет собой С 3-С 8 циклоалкил. Предпочтительно R8 представляет собой С 3-С 6 циклоалкил. Предпочтительно R8 представляет собой циклопентил. Предпочтительными гетероциклами,включенными в определение R2 в части (3), являются пирролил, имидазолил, триазолил, тиенил, фурил, тиазолил, оксазолил, тиадиазолил,оксадиазолил, пиридинил, пиримидинил, пиридазинил, пиразинил, хинолинил, изохинолинил,бензимидазолил, хиназолинил, фталазинил, бензоксазолил,хиноксалинил,1,2-дигидроизохинолинил, 3,4-дигидроизохинолинил, 1,2,3,4-тетрагидроизохинолинил, азетидинил, пирролидинил, пиперидинил, тетрагидропиранил,тетрагидротиопиранил, морфолинил и пиперазинил. Предпочтительные примеры соединений формулы (I) включают в себя соединения из раздела Примеры (ниже), включая их любые фармацевтически приемлемые соли. Данные соединения формулы (I) могут быть получены традиционными путями, как например с помощью процедур, описанных в общих способах, представленных ниже, или с помощью специфических способов, описанных в разделе Примеры, или, к тому же, с помощью похожих способов. Настоящее изобретение также охватывает эти способы для получения соединений формулы (I) в дополнение к любым новым промежуточным соединениям, используемым в этих способах. В описанных общих 7 способах R1, R2 и А такие, как определено ранее, если не оговорено особо. Все соединения формулы (I) могут быть получены путем снятия защиты с соединения формулы где Р 1, Р 2 и Р 3 представляют собой подходящие защитные группы, которые могут быть одинаковыми или различными, или Р 1 и Р 2 возможно образуют часть одной и той же защитной группы. Примеры подходящих защитных групп будут понятны специалисту [см., например, Protecting Groups in Organic Synthesis (Second Edition), Theodora W. Green and Peter G. M. Wuts,John Wiley and Sons, 1991]. Предпочтительными индивидуальными защитными группами являются силил (замещенный тремя группами, независимо выбранными из арила и алкила), алканоил и ароил. Предпочтительной защитной группой в случае, когда Р 1 и Р 2 образуют часть одной и той же защитной группы, является такая, когда взятые вместе Р 1 и Р 2 представляют собой С 1-С 6 алкилен. В частности, предпочтительными индивидуальными защитными группами являются ацетил и бензоил. Подходящие условия для снятия защиты хорошо известны специалистам [смотри, например ProtectingWiley and Sons, 1991]. В соответствии с типичной методикой, где каждый из Р 1, Р 2 и Р 3 является ацетилом, защитные группы могут быть удалены путем обработки раствора соединения формулы (II) в подходящем растворителе, таком как смесь воды и метанола, основанием, таким как карбонат натрия, обычно при комнатной температуре. Защитные группы Р 1, Р 2 и Р 3 могут быть удалены одновременно за одну стадию или последовательно в любом порядке. Альтернативно, любые две из защитных групп Р 1, Р 2 и Р 3 могут быть удалены одновременно за одну стадию, а остающаяся группа может быть удалена на отдельной стадии, в том или ином порядке. Соединения формулы (II) могут быть получены согласно путям, показанным на схемах 1 и 2, где Х представляет собой уходящую группу, предпочтительно хлоро, а Р 1, Р 2 и Р 3 такие,как определено выше. Как показано на схеме 1, соединения формулы (II) могут быть получены путем взаимодействия соединения формулы (III) с соединением формулы (IV) в соответствии с известными способами. В соответствии с типичной методикой, соединение формулы (III) нагревают сN,O-бис(триметилацетамидом) в инертном растворителе, таком как 1,1,1-трихлорэтан, растворитель удаляют, и раствор остатка в подходящем растворителе, таком как толуол, нагревают,предпочтительно при температуре дефлегмации, с соединением формулы (IV) и триметилсилилтрифлатом. Соединения формулы (IV) могут быть получены гидролизом соединения формулы (V). Обычно соединение формулы (V) 9 растворяют в подходящем растворителе, таком как этанол, и обрабатывают кислотой, такой как соляная кислота. Реакцию предпочтительно осуществляют при температуре от 0 до 100 С,наиболее предпочтительно от 20 до 50 С. Соединения формулы (V) могут быть получены сульфонилированием соединения формулы (VI) соединением формулы (VII). В соответствии с типичной методикой раствор соединения формулы (VI) в подходящем инертном растворителе, таком как дихлорметан, обрабатывают соединением формулы (VII). Возможно может быть добавлен акцептор кислоты, такой как триэтиламин. Соединения формулы (VI) могут быть получены восстановлением соединений формулы (VIII). Восстановление может быть осуществлено с помощью любого подходящего гидридного восстанавливающего агента или посредством гидрирования. В соответствии с типичной методикой раствор соединения формулы (VIII) в подходящем растворителе, таком как этанол, насыщают газообразным аммиаком,обрабатывают соответствующим катализатором гидрирования, таким как катализатор Пелманна(Pearlmann), и создают повышенное давление водорода, предпочтительно приблизительно до 414 кПа (60 ф/кв.дюйм). Соединения формулы(VIII) могут быть получены путем взаимодействия соединения формулы (IX) с источником цианид-аниона, таким как цианид калия. Обычно реакцию осуществляют в таком растворителе, как N,N-диметилформамид, при повышенной температуре. Соединения формулы (IX) могут быть получены окислением соединения формулы (X). В соответствии с типичной методикой водный раствор пероксимоносульфата калия добавляют к раствору соединения формулы (X) и гидрокарбоната натрия в подходящем растворителе, таком как смесь воды и ацетона. Соединения формулы (X) могут быть получены путем замещения хлорида в соединении формулы (XI) с помощью тиометилата. Обычно реакцию осуществляют в полярном растворителе,таком как N,N-диметилформамид, при повышенных температурах и в атмосфере азота. Тиометилат используют в виде соли щелочного металла, такой как тиометилат натрия. Соединения формулы (XI) могут быть получены в результате взаимодействия соединения формулы (XII) с соответствующим первичным амином. Обычно раствор дихлорпурина (XII) в растворителе, таком как изопропиловый спирт,обрабатывают амином и нагревают при температуре дефлегмации. Возможно, может быть добавлен дополнительный акцептор кислоты,такой как дифенилэтиламин. Соединение (XII) может быть получено в результате взаимодействия 2,6-дихлор-9H-пурина (XIII) с дигидропираном в подходящем растворителе, таком как этилацетат, и в присутствии кислотного катализатора, такого как 4-толуолсульфокислота,обычно при повышенной температуре. Как показано на схеме 2, соединения формулы (II) могут быть получены путем сульфонилирования соединения формулы (XIV) соединением формулы (VII). В соответствии с типичной методикой раствор соединения формулы(XIV) в подходящем инертном растворителе,таком как дихлорметан, обрабатывают соединением формулы (VII). Возможно, может быть добавлен акцептор кислоты, такой как триэтиламин. Соединения формулы (XIV) могут быть получены восстановлением соединения формулы (XV). Восстановление может быть осуществлено с помощью любого подходящего гидридного восстанавливающего агента или посредством гидрирования. В соответствии с типичной методикой раствор соединения формулы (XV) в подходящем растворителе, таком как этанол,насыщают газообразным аммиаком, обрабатывают соответствующим катализатором гидрирования, таким как 5%-ный (в/в) палладий на угле,и создают повышенное давление водорода,предпочтительно до 1034 кПа (150 ф/кв.дюйм). Соединения формулы (XV) могут быть получены путем взаимодействия соединения формулы(XVI) с соответствующим первичным амином. Обычно раствор соединения (XVI) в подходящем растворителе, таком как ацетонитрил, обрабатывают амином при комнатной температуре. Возможно может быть добавлен дополнительный акцептор кислоты, такой как дифенилэтиламин. Соединения формулы (XVI) могут быть получены замещением группы иода в соединении формулы (XVII) цианидом. Обычно раствор соединения формулы (XVII) в подходящем растворителе (например, N,N-диметилформамиде) обрабатывают цианидом меди(II) и нагревают, предпочтительно при температуре, превышающей 100 С. Соединения формулы (XVII) известны специалистам в данной об 11 ласти техники (см., например, J. Med. Chem.,1992, 35, 248, где Р 1, Р 2 и Р 3, каждая, представляет собой ацетил). Альтернативно, соединения формулы (I) могут быть получены в соответствии со схемой 3, где Х представляет собой уходящую группу,предпочтительно хлоро, путем сульфонилирования соединения формулы (XVIII) соединением формулы (VII). Схема 3 В соответствии с типичной методикой соединение формулы (XVIII) растворяют (при необходимости с нагреванием) в подходящем растворителе, таком как 1,4-диоксан или тетрагидрофуран, и обрабатывают, обычно при комнатной температуре и в атмосфере азота, сульфонилирующим агентом формулы (VII), возможно в присутствии акцептора кислоты (например, триэтиламина). Соединения формулы(XVIII) могут быть получены восстановлением соединения формулы (XIX). Восстановление может быть осуществлено с помощью любого подходящего гидридного восстанавливающего агента или посредством гидрирования. В соответствии с типичной методикой раствор соединения формулы (XIX) в подходящем растворителе, таком как этанол, насыщают газообразным аммиаком, обрабатывают соответствующим катализатором гидрирования, таким как 5%-ный(в/в) палладий на угле, и создают повышенное давление водорода, предпочтительно до 1034 кПа (150 ф/кв.дюйм). Соединения формулы(XIX) могут быть получены путем снятия защиты с соединения формулы (XV) в соответствии со способами, известными специалистам в данной области техники [смотри, например Protecting Groups in Organic Synthesis (Second Edition), Theodora W. Green and Peter G. M. Wuts,John Wiley and Sons, 1991]. Защитные группы могут быть удалены вместе, в индивидуальном порядке или в любой их комбинации. В типичном примере, когда каждая из Р 1, Р 2 и Р 3 представляет собой ацетил, раствор соединения формулы (XV) в подходящем растворителе, таком как этанол, обрабатывают основанием, та 004655 12 ким как аммиак, при комнатной температуре. В определенных случаях снятие защиты и восстановление соединения формулы (XV) с целью получения соединения формулы (XVIII) удобно проводить одновременно в восстанавливающих условиях. В типичном примере соединение формулы (XV) растворяют в подходящем растворителе, таком как этанол, и раствор насыщают аммиаком перед тем, как обработать соответствующим катализатором гидрирования,таким как палладий на угле, и создать повышенное давление водорода до 1034 кПа (150 ф/кв.дюйм). Соединения формулы (I), в которых А представляет собой -СН 2 СН 2-, a R2 представляет собой NR7R8, также могут быть получены путем, показанным на схеме 4. Схема 4 Как показано на схеме 4, соединения формулы (I), в которых А представляет собой-CH2CH2-, a R2 представляет собой -NR7R8, могут быть получены путем взаимодействия соединения формулы (XX) с соединением формулы(XXII) В соответствии с типичной методикой соединение формулы (XX) и соединение формулы(XXII) смешивают, возможно, в присутствии подходящего растворителя. Предпочтительно реакционную смесь нагревают, наиболее предпочтительно при температуре дефлегмации соединения формулы (XXII). Соединения формулы (XXII) либо имеются в продаже, либо легко могут быть получены с использованием стандартных методик, хорошо известных специалистам в данной области техники (например, восстановительной конденсацией амина с кетоном или альдегидом). Соединения формулы (XX) могут быть получены конденсацией соединения формулы (XVIII) с 2-хлорэтансульфонилхлоридом. В соответствии с типичной методикой раствор соединения формулы (XVIII) и основа 13 ние, предпочтительно основание типа четвертичного амина, такое как триэтиламин, в подходящем растворителе, таком как дихлорметан,обрабатывают 2-хлорэтансульфонилхлоридом. Соединения формулы (XVIII) могут быть получены путем снятия защиты с соединения формулы (XIV), в котором защитные группы Р 1, Р 2 и Р 3 такие, как определено выше. Защитные группы могут быть удалены одновременно или по отдельности в любой их комбинации. Подходящие условия снятия защиты хорошо известны в данной области техники [смотри, напримерWuts, John Wiley and Sons, 1991]. В соответствии с типичной методикой в том случае, когда каждая из Р 1, Р 2 и Р 3 представляет собой ацетил,защитные группы могут быть удалены путем обработки раствора соединения формулы (XIV) в подходящем растворителе, таком как смесь воды и метанола, основанием, таким как карбонат натрия, обычно при комнатной температуре. Соединения формулы (I) также могут быть подвергнуты взаимопревращению с использованием традиционных методик взаимопревращения функциональных групп. Все реакции и (способы) получения новых исходных материалов, используемых в предшествующих способах, являются традиционными,и соответствующие реагенты и условия реакций, равно как и методики выделения желаемых продуктов, будут хорошо известны специалистам со ссылками на литературные прецеденты и разделы Примеры и Подготовительные стадии, приведенные ниже. Фармацевтически приемлемая соль соединения формулы (I) может быть легко получена путем смешивания вместе растворов соединения формулы (I) и желаемой кислоты или основания, как будет целесообразно. Соль может выпадать в осадок из раствора и быть собрана путем фильтрации или извлечена путем выпаривания растворителя. Противовоспалительные свойства соединений формулы (I) демонстрируются по их способности ингибировать функцию нейтрофилов,что проявляется в агонистической активности по отношению к А 2 а-рецептору. Это оценивают путем определения профиля соединения в анализе, в котором измеряют продуцирование супероксидов из нейтрофилов, активированных с помощьюN-формил-метионил-лейцилфенилаланина (fMLP). Нейтрофилы выделяли из периферической крови человека, используя седиментацию в декстране с последующим центрифугированием в Ficoll-Hypaque растворе. Любые контаминирующие количества эритроцитов в осадке гранулоцитов удаляли путем лизиса с помощью охлажденной во льду дистиллированной воды. Продуцирование супероксидов из нейтрофилов индуцировали с помощью fMLP в присутствии затравочной концен 004655 14 трации цитохалазина В. Аденозиндеаминазу вводили в анализ с целью удаления любого эндогенно продуцированного аденозина, который может подавить продуцирование супероксидов. Влияние данного соединения на fMLPиндуцированый ответ регистрировали колориметрически по восстановлению цитохрома С в буфере для анализа. Эффективность соединений оценивали по концентрации, дающей 50% ингибирования (IC50) по сравнению с контрольным ответом на fMLP. Соединения формулы (I) могут быть введены сами по себе, но обычно будут вводиться в смеси с подходящим фармацевтическим эксципиентом, разбавителем или носителем, выбранным с учетом намечаемого пути введения и обычной фармацевтической практики. Например, соединения формулы (I) могут быть введены перорально, трансбуккально или сублингвально в форме таблеток, капсул, вагинальных суппозиториев, эликсиров, растворов или суспензий, которые могут содержать корригенты или красители, для применений с мгновенным, замедленным, продолжительным, импульсным или контролируемым высвобождением. Подобные таблетки могут содержать эксципиенты, такие как микрокристаллическая целлюлоза, лактоза, цитрат натрия, карбонат кальция, двуосновный фосфат кальция и глицин, разрыхлители, такие как крахмал (предпочтительно кукурузный, картофельный или маниоковый крахмал), крахмал гликолят натрия, натриевая соль кроскармелозы и определенные сложные силикаты, и связующие вещества для грануляции, такие как поливинилпирролидон,гидроксипропилметилцеллюлоза(НРМС), гидроксипропилцеллюлоза (НРС), сахароза, желатин или аравийская камедь. Дополнительно, могут быть включены такие смазывающие агенты, как стеарат магния, стеариновая кислота, глицерилбегенат и тальк. Твердые композиции подобного типа могут быть также применены в качестве наполнителей в желатиновых капсулах. Предпочтительные эксципиенты в этом случае включают в себя лактозу, крахмал, целлюлозу, молочный сахар или полиэтиленгликоль высокой молекулярной массы. Для водных суспензий и/или эликсиров соединения формулы (I) могут быть скомбинированы с различными подсластителями или корригентами, окрашивающим веществом или красителями, с эмульгирующими и/или суспендирующими агентами и с разбавителями,такими как вода, этанол, пропиленгликоль или глицерин, и их комбинациями. Кроме того, соединения формулы (I) могут быть введены парентерально, например внутривенно, внутриартериально, внутрибрюшинно,подоболочечно, интравентрикулярно, внутригрудинно, интракраниально, внутримышечно или подкожно, либо они могут быть введены с 15 помощью метода инфузии. Наилучшим образом их используют в форме стерильного водного раствора, который может содержать другие вещества, например достаточное количество солей или глюкозы, чтобы сделать раствор изотоничным крови. Водные растворы при необходимости следует забуферить подходящим образом (предпочтительно до значений рН от 3 до 9). Получение подходящих парентеральных препаратов в стерильных условиях легко достигается с помощью стандартных фармацевтических методик, хорошо известных специалистам в данной области техники. Обычно уровень суточной дозировки соединения формулы (I) при пероральном и парентеральном введении пациентам-людям будет составлять от 0,01 до 100 мг/кг, предпочтительно от 0,1 до 100 мг/кг (в разовой или разделенной дозах). Таким образом, таблетки или капсулы соединения формулы (I) могут содержать от 5 до 500 мг активного соединения для введения за один раз либо за два или более чем два раза за один прием, как будет целесообразно. Так или иначе, врач определит реальную дозировку, которая будет наиболее подходящей для любого индивидуального пациента и будет изменяться в зависимости от возраста, массы и ответной реакции конкретного пациента. Вышеупомянутые дозировки являются примерами среднего случая. Конечно, могут быть отдельные примеры,когда необходимыми оказываются интервалы более высоких или более низких дозировок, и таковые находятся в пределах объема данного изобретения. Кроме того, соединения формулы (I) могут быть введены интраназально или посредством ингаляции, и их удобным образом доставляют в виде ингалятора сухого порошка или аэрозольно-распылительного способа подачи из находящихся под давлением контейнера, насоса, спрея,пульверизатора или небулайзера с использованием или без использования подходящего пропеллента, например дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, гидрофторалкана, такого как 1,1,1,2-тетрафторэтан(HFA 134A [товарный знак]) или 1,1,1,2,3,3,3 гептафторпропан (HFA 227EA [товарный знак]),диоксида углерода или другого подходящего газа. В случае находящегося под давлением аэрозоля стандартная доза может быть определена путем обеспечения клапаном для доставки отмеренного количества. Находящиеся под давлением контейнер, насос, спрей, пульверизатор или небулайзер могут содержать раствор или суспензию активного соединения, например, с использованием смеси этанола и пропеллента в качестве растворителя, которое дополнительно может содержать смазывающее вещество, например сорбиттриолеат. Капсулы и картриджи 16 могут быть приготовлены таким образом, что они содержат порошковую смесь соединения формулы (I) и подходящую порошковую основу, такую как лактоза или крахмал. Препараты в виде аэрозолей или сухих порошков предпочтительно подготавливают таким образом, чтобы каждая отмеренная доза или пшик содержал от 20 до 4000 мкг соединения формулы (I) для доставки пациенту. Суммарная суточная доза из аэрозоля будет лежать в интервале от 20 мкг до 20 мг, и она может быть введена в виде однократной дозы или, более обычно, в виде разделенных в течение дня доз. Альтернативно, соединения формулы (I) могут быть введены в форме суппозитория или пессария, либо они могут быть применены местно в форме лосьона, раствора, крема, мази или присыпки. Кроме того, соединения формулы (I) могут быть введены трансдермально, например путем использования накожного пластыря. Соединения формулы (I) для местного нанесения на кожу могут быть включены в состав препаратов в виде подходящей мази, содержащей активное соединение, суспендированное или растворенное, например, в смеси одного или более чем одного из следующего: вазелинового масла, жидкого вазелина, белого вазелина,пропиленгликоля,полиоксиэтиленполиоксипропиленового соединения, эмульгирующего воска и воды. Альтернативно, они могут быть включены в состав препаратов в виде подходящего лосьона или крема, суспендированного или растворенного, например, в смеси одного или более чем одного из следующего: вазелинового масла, сорбитмоностеарата, полиэтиленгликоля, жидкого парафина, полисорбата 60, цетил-эфирного воска, цетеарилового спирта, 2 октилдодеканола, бензилового спирта и воды. Кроме того, соединения формулы (I) могут быть использованы в комбинации с циклодекстрином. Известно, что циклодекстрины образуют комплексы включения или невключения с молекулами лекарств. Образование комплекса лекарство-циклодекстрин может изменять такие свойства молекулы лекарства, как растворимость, скорость растворения, биодоступность и/или стабильность. Обычно комплексы лекарство-циклодекстрин полезны для большинства лекарственных форм или путей введения. Как альтернатива непосредственному комплексообразованию с лекарством циклодекстрин может быть использован в качестве вспомогательной добавки, например как носитель, разбавитель или солюбилизатор. Как правило, самыми используемыми являются альфа-, бета- и гаммациклодекстрины, и подходящие примеры описаны в WO-A-91/11172, WO-A-94/02518 и WOA-98/55148. Следует понимать, что все ссылки на лечение, данные здесь, включают в себя куративное, паллиативное и профилактическое лечение. 17 Таким образом, согласно данному изобретению предложены(1) соединение формулы (I) или его фармацевтически приемлемые соль либо сольват;(2) способ получения соединения формулы(I) или его фармацевтически приемлемых соли либо сольвата;(3) фармацевтическая композиция, включающая в себя соединение формулы (I) или его фармацевтически приемлемые соль либо сольват вместе с фармацевтически приемлемыми эксципиентом, разбавителем или носителем;(4) соединение формулы (I) или его фармацевтически приемлемые соль, сольват либо их композиция для применения в качестве лекарственного средства;(5) применение соединения формулы (I) или его фармацевтически приемлемых соли,сольвата либо их композиции для изготовления лекарственного средства для лечения заболевания, при котором показан агонист А 2 арецептора;(6) применение соединения формулы (I) или его фармацевтически приемлемых соли,сольвата либо их композиции для изготовления противовоспалительного агента;(7) применение соединения формулы (I) или его фармацевтически приемлемых соли,сольвата либо их композиции для изготовления лекарственного средства для лечения респираторного заболевания;(8) применение как в (7), где данное заболевание выбрано из группы, состоящей из респираторного дистресс-синдрома взрослых(9) применение соединения формулы (I) или его фармацевтически приемлемых соли,сольвата либо их композиции для изготовления лекарственного средства для лечения септического шока, мужской эректильной дисфункции,гипертензии, удара, эпилепсии, церебральной ишемии, заболевания периферических сосудов,постишемического реперфузионного повреждения, диабета, ревматоидного артрита, рассеянного склероза, псориаза, аллергического дерматита, экземы, неспецифического язвенного колита, болезни Крона, воспалительного заболевания кишечника, гастрита, связанного с Helicobacter pylori, гастрита, не связанного c Helicobacterpylori,повреждения желудочнокишечного тракта, индуцированного нестероидными противовоспалительными лекарствами,или психотического расстройства, или для лечения ран;(10) способ лечения млекопитающего,включая человека, для лечения заболевания, при котором показан агонист А 2 а-рецептора, при котором указанного млекопитающего лечат эффективным количеством соединения формулы(I) или его фармацевтически приемлемых соли,сольвата либо их композиции;(11) способ лечения млекопитающего,включая человека, для лечения воспалительного заболевания, при котором указанного млекопитающего лечат эффективным количеством соединения формулы (I) или его фармацевтически приемлемых соли, сольвата либо их композиции;(12) способ лечения млекопитающего,включая человека, для лечения респираторного заболевания, при котором указанного млекопитающего лечат эффективным количеством соединения формулы (I) или его фармацевтически приемлемых соли, сольвата либо их композиции;(13) способ как в (12), где данное заболевание выбрано из группы, состоящей из респираторного дистресс-синдрома взрослых (ARDS),бронхита, хронического бронхита, хронической обструктивной болезни легких, муковисцидоза,астмы, эмфиземы, бронхоэктаза, хронического синусита и ринита;(14) способ лечения млекопитающего,включая человека, для лечения септического шока, мужской эректильной дисфункции, гипертензии, удара, эпилепсии, церебральной ишемии, заболевания периферических сосудов,пост-ишемического реперфузионного повреждения, диабета, ревматоидного артрита, рассеянного склероза, псориаза, аллергического дерматита, экземы, неспецифического язвенного колита, болезни Крона, воспалительного заболевания кишечника, гастрита, связанного с Helicobacter pylori, гастрита, не связанного с Helicobacterpylori,повреждения желудочнокишечного тракта, индуцированного нестероидными противовоспалительными лекарствами,или психотического расстройства, или для лечения ран, при котором указанного млекопитающего лечат эффективным количеством соединения формулы (I) или его фармацевтически приемлемых соли, сольвата либо их композиции; и(15) конкретные новые промежуточные соединения, описанные здесь. Следующие примеры иллюстрируют получение соединений формулы (I). Спектры 1H ядерного магнитного резонанса (ЯМР) во всех случаях согласованы с предполагаемыми структурами. Характеристические химические сдвигиданы в миллионных долях по нисходящей от тетраметилсилана с использованием традиционных сокращений для обозначения основных пиков: например, s синглет; d - дублет; t - триплет; q - квартет; m мультиплет; br - уширенный. Масс-спектры(m/z) регистрировали с применением ионизации термораспылением. Для обычных растворителей использовали следующие сокращения: 19 означает фунты на квадратный дюйм. В тех случаях, когда применяли тонкослойную хроматографию (ТСХ), имеется в виду ТСХ на силикагеле с использованием пластин с силикагелем 60 F254, Rf представляет собой отношение расстояния, пройденного соединением, к расстоянию, пройденному фронтом растворителя на ТСХ-пластинке. Сокращение Ас применяется вместо ацетила, a TBDMS означает тpeтбутилдиметилсилил. Пример 1. N-(9-[(2R,3R,4S,5R)-3,4-Дигидрокси-5-(гидроксиметил)тетрагидро-2-фуранил]-6-[(2,2-дифенилэтил)амино]-9H-пурин-2 илметил)-2-метил-1-пропансульфонамид.(188 мг; 0,26 ммоль) (подготовительная стадия 9) и карбоната натрия (140 мг; 1,32 ммоль) в смеси воды (2 мл) и метанола (10 мл) перемешивали при комнатной температуре в течение 6 ч. Растворитель удаляли при пониженном давлении, и остаток распределяли между этилацетатом и рассолом. Органическую фазу отделяли,и растворитель удаляли при пониженном давлении. Далее остаток очищали с помощью колоночной хроматографии на силикагеле с элюированием градиентной системой, начиная от смеси дихлорметан:метанол:0,88 аммиак (95:5:0,5 по объему), постепенно переходящей к смеси дихлорметан:метанол:0,88 аммиак (90:10:1 по объему), с получением указанного в заголовке соединения (77 мг). 20 Раствор бензолсульфонилхлорида (0,067 г; 0,38 ммоль) в безводном тетрагидрофуране (2 мл) в течение 10 мин при 0 С в атмосфере азота добавляли к перемешиваемому раствору (2R,3R,4S,5R)-2[2-(аминометил)-6-(фенэтиламино)-9 Н-пурин-9 ил]-5-(гидроксиметил)тетрагидро-3,4-фурандиола(0,19 г; 0,48 ммоль) (подготовительная стадия 12) и триэтиламина (0,14 г; 1,39 ммоль) в безводном тетрагидрофуране (10 мл). Смесь перемешивали при 0 С в течение 15 мин. Далее растворитель удаляли при пониженном давлении и остаток азеотропно отгоняли с дихлорметаном (х 3). Остаток очищали с помощью колоночной хроматографии на силикагеле с элюированием смесью дихлорметан:метанол:0,88 аммиак (92:8:0,4 по объему), получая продукт, который растирали с диэтиловым эфиром,фильтровали и сушили с получением указанного в заголовке соединения в виде твердого вещества(0,16 г; 0,37 ммоль) (подготовительная стадия 15) в диоксане (28 мл) осторожно нагревали до получения раствора. Раствор охлаждали до комнатной температуры и обрабатывали триэтиламином (0,12 г; 1,19 ммоль) с последующим добавлением в течение 10 мин раствора бензолсульфонилхлорида (0,060 г; 0,34 ммоль) в диоксане (2 мл). Далее смесь перемешивали при комнатной температуре в течение 30 мин. Растворитель удаляли при пониженном давлении и остаток азеотропно отгоняли с дихлорметаном. Остаток очищали с помощью колоночной хроматографии на силикагеле с элюированием смесью дихлорметан:метанол:0,88 аммиак (92:8:0,4 по объему) с получением указанного в заголовке соединения в виде твердого вещества белого цвета (150 мг). МС: 577 (МН+). 1N-(9-[(2R,3R,4S,5R)-3,4-Дигидрокси-5(гидроксиметил)тетрагидро-2-фуранил]-6-[(2,2 дифенилэтил)амино]-9 Н-пурин-2-илметил)этиленсульфонамид (60 мг; 0,11 ммоль) (подготовительная стадия 16) растворяли в N-изопропилциклопентанамине (2 мл) (подготовительная стадия 17), и реакционную смесь нагревали при температуре дефлегмации в течение 2 ч. Избыток реагента удаляли при пониженном давлении, и остаток распределяли между дихлорметаном (50 мл) и водой (30 мл). Органический слой упаривали и сушили (безводный сульфат магния), и остаток очищали с помощью колоночной хроматографии на силикагеле с элюированием смесью дихлорметан:метанол:аммиакH-ЯМР (CD3OD) : (1 Н, s), 7,35-7,20 (10 Н,m), 6,00-5,95 (1 Н, m), 4,70-4,65 (1 Н, m), 4,554,50 (1 Н, m), 4,35-4,25 (6 Н, m), 4,15 (1 Н, s), 3,903,85 (1 Н, m), 3,75-3,70 (1 Н, m), 3,15-3,10 (2 Н,m), 3,00-2,90 (2 Н, m), 2,90-2,80 (2 Н, m), 1,701,60 (2 Н, m), 1,60-1,50 (2H, m), 1,50-1,40 (2H,m), 1,35-1,15 (2H, m), 0,9-0,85 (6 Н, m). В приведенных далее подготовительных стадиях описывается получение конкретных промежуточных соединений, используемых в предшествующих примерах. Подготовительная стадия 1. 2,6-Дихлор-9 тетрагидро-2 Н-пиран-2-ил-9 Н-пурин. 2,6-Дихлор-9 Н-пурин (20 г; 0,11 моль) и моногидрат 4-толуолсульфоновой кислоты (0,2 г) растворяли в этилацетате (300 мл), смесь нагревали до 50 С и медленно в течение 30 мин добавляли раствор 2,3-дигидропирана (12,6 мл; 0,14 моль) в этилацетате (50 мл). Затем реакционную смесь охлаждали до комнатной температуры, добавляли воду (100 мл) и рН раствора доводили до 7 с помощью насыщенного водного раствора гидрокарбоната натрия. Слои разделяли и органический слой последовательно про 004655 22 мывали водой и рассолом, сушили над безводным сульфатом магния, фильтровали и выпаривали при пониженном давлении. Остаток азеотропно отгоняли из пентана (х 2) с получением указанного в заголовке соединения в виде твердого вещества белого цвета с незначительными примесями (30,9 г). 1(4,75 мл; 0,27 моль) и 2,2-дифенилэтиламином (24,8 г; 0,13 моль) и полученную смесь нагревали при температуре дефлегмации в течение 3 ч. Растворитель удаляли при пониженном давлении и остаток азеотропно отгоняли из этилацетата. Остаток очищали с помощью колоночной хроматографии на силикагеле с элюированием градиентной системой,начиная от смеси этилацетаттексан (40:60 по объему), постепенно переходящей к смеси этилацетаттексан (60:40 по объему), с получением указанного в заголовке соединения в виде пены (49,7 г). 1(подготовительная стадия 2) (49,7 г; 0,11 моль) в безводном N,N-диметилформамиде (200 мл) обрабатывали тиометилатом натрия (10 г; 0,14 моль) и полученную смесь нагревали в атмосфере азота при 100 С в течение 90 мин. Смесь перемешивали при комнатной температуре в течение 72 ч и затем еще раз нагревали до 100 С в течение 2 ч. Реакционную смесь охлаждали и разбавляли водой (1000 мл). Сформировавшуюся суспензию экстрагировали в диэтиловый эфир (х 2). Объединенные органические слои последовательно промывали водой и рассолом, 23 сушили над безводным сульфатом магния,фильтровали и выпаривали при пониженном давлении. Остаток азеотропно отгоняли из диэтилового эфира и затем из пентана с получением указанного в заголовке соединения в виде пены (48,9 г). 1(25 г; 56,2 ммоль) и гидрокарбоната натрия (20 г; 238 ммоль) в ацетоне (1000 мл) и воде (250 мл). Полученную смесь перемешивали при комнатной температуре в течение 24 ч, фильтровали и остаток промывали ацетоном. Ацетон удаляли из фильтрата при пониженном давлении и полученный водный остаток экстрагировали этилацетатом и затем дихлорметаном. Объединенные органические слои промывали рассолом, сушили безводным сульфатом магния,фильтровали и выпаривали при пониженном давлении. Остаток растирали с диэтиловым эфиром, фильтровали, промывали диэтиловым эфиром и пентаном и затем сушили с получением указанного в заголовке соединения в виде твердого вещества белого цвета (20,32 г). 1 24 нидом калия (5,5 г; 84,6 ммоль) и смесь нагревали при 120 С в течение 24 ч в атмосфере азота. Далее смесь охлаждали до комнатной температуры, вливали в воду (1000 мл) и перемешивали еще в течение 1 ч. Полученное твердое вещество медленно отфильтровывали и несколько раз промывали водой. Твердое вещество далее растворяли в дихлорметане и полученный раствор промывали водой, сушили безводным сульфатом магния, фильтровали и выпаривали при пониженном давлении. Остаток дважды азеотропно отгоняли из диэтилового эфира с получением указанного в заголовке соединения в виде масла (17 г). 1 Раствор 6-[(2,2-дифенилэтил)амино]-9 тетрагидро-2 Н-пиран-2-ил-9H-пурин-2-карбонитрила (5,70 г; 13,18 ммоль) (подготовительная стадия 5) в этаноле (200 мл), насыщенном газообразным аммиаком, обрабатывали катализатором Пелманна (Pearlmann) (1,00 г), в герметизированном сосуде создавали повышенное давление водорода 413 кПа (60 ф/кв.дюйм) и перемешивали при комнатной температуре в течение 30 ч. Смесь фильтровали через прокладку изArbocel (товарный знак) и растворитель удаляли при пониженном давлении. Остаток азеотропно отгоняли из дихлорметана (х 2) и далее очищали колоночной хроматографией на силикагеле с элюированием смесью дихлорметан: метанол(95:5 по объему), постепенно меняющейся на смесь дихлорметан: метанол: 0,88 аммиак Раствор N-[2-(аминометил)-9-тетрагидро 2H-пиран-2-ил-9H-пурин-6-ил]-N-(2,2-дифенилэтил)амина (3,70 г; 8,63 ммоль) (подготовительная стадия 6) и триэтиламина (2,20 г; 21,78 ммоль) в безводном дихлорметане (20 мл) обрабатывали 2-метил-1-пропансульфонилхлоридом (1,48 г; 9,46 ммоль), и смесь перемешивали при комнатной температуре в течение 18 ч. Поскольку по данным ТСХ часть исходного материала осталась в реакционной смеси, то добавляли дополнительное количество 2-метил 1-пропансульфонилхлорида (0,2 г; 1,28 ммоль) и смесь перемешивали при комнатной температуре в течение 1 ч. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле с элюированием смесью дихлорметан:метанол (98:2 по объему) с получением указанного в заголовке соединения в виде пены (4,4 г). МС: 549 (МH+). 1 Раствор N-(6-[(2,2-дифенилэтил)амино]9-тетрагидро-2 Н-пиран-2-ил-9 Н-пурин-2 илметил)-2-метил-1-пропансульфонамида (4,30 г; 7,84 ммоль) (подготовительная стадия 7) в этаноле (100 мл) нагревали до 37 С и затем обрабатывали соляной кислотой (2 н; 15 мл). Смесь оставляли при комнатной температуре на 18 ч, после чего кристаллический осадок отфильтровывали, промывали этанолом (10 мл) и сушили с получением указанного в заголовке соединения в виде твердого вещества (3,0 г). 1(1H, br s), 7,37 (4H, d), 7,27 (4 Н, dd), 7,16 (2 Н,dd), 4,56 (1H, t), 4,20-4,40 (4H, m), 2,95 (2 Н, d),2,10 (1H, m), 0,95 (6 Н, d). Подготовительная стадия 9. (2R,3R,4R,5R)-4-(Ацетилокси)-2-[(ацетилокси)метил]-5-(6[(2,2-дифенилэтил)амино]-2-[(изобутилсульфо Суспензию гидрохлорида N-(6-[(2,2 дифенилэтил)амино]-9 Н-пурин-2-илметил)-2 метил-1-пропансульфонамида (подготовительная стадия 8) (0,21 г; 0,42 ммоль) в 1,1,1 трихлорэтане (10 мл) обрабатывали N,Oбис(триметилацетамидом) (0,6 мл; 2,45 ммоль),и смесь нагревали при температуре дефлегмации в течение 2 ч. Растворитель удаляли при пониженном давлении и остаток азеотропно отгоняли с толуолом (х 2). Остаток растворяли в толуоле (10 мл) и обрабатывали -D-рибофуранозо-1,2,3,5-тетраацетатом (0,16 г; 0,50 ммоль) и триметилсилилтрифлатом (0,1 мл; 0,5 ммоль). Далее смесь нагревали при температуре дефлегмации в течение 4 ч. Смесь разбавляют этилацетатом, последовательно промывали насыщенным водным раствором гидрокарбоната натрия и рассолом и выпаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле с элюированием градиентной системой, начиная от смеси дихлорметан:метанол (98:2 по объему), постепенно переходящей к смеси дихлорметан:метанолChem., 1992, 35, 248) (0,5 г; 0,93 ммоль) и цианида меди (II) (0,11 г; 1,23 ммоль) в N,Nдиметилформамиде нагревали при 115C в течение 90 мин. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле с элюированием смесью дихлорметан:этилацетат (4:1 по 27 объему) с получением продукта, который затем последовательно азеотропно отгоняли с дихлорметаном и диэтиловым эфиром с получением указанного в заголовке соединения в виде твердого вещества (0,22 г). МС: 438 (MH+). 1(20 мл) обрабатывали фенэтиламином (0,60 г; 4,96 ммоль) и смесь перемешивали при комнатной температуре в атмосфере азота в течение 2 ч. Растворитель удаляли при пониженном давлении и остаток распределяли между дихлорметаном (75 мл) и водой (20 мл). Органическую фазу отделяли и растворитель удаляли при пониженном давлении. Пену очищали колоночной хроматографией на силикагеле с элюированием смесью дихлорметан:этилацетат (4:1 по объему) с получением продукта, который далее азеотропно отгоняли с диэтиловым эфиром с получением указанного в заголовке соединения в виде пены (2,05 г). МС: 523 (МН+). 1 28 но)-9H-пурин-9-ил]тетрагидро-3-фуранилацетата (1,0 г; 1,91 ммоль) (подготовительная стадия 11) в этаноле (40 мл), насыщенном газообразным аммиаком, обрабатывали 5%-ным (в/в) палладием на угле (0,50 г), в герметизированном сосуде создавали повышенное давление водорода (1034 кПа (150 ф/кв.дюйм и перемешивали при комнатной температуре в течение 18 ч. Поскольку по данным ТСХ часть исходного материала осталась в реакционной смеси, то добавляли дополнительное количество 5%-ного (в/в) палладия на угле (0,25 г) и этанола (20 мл), насыщенного аммиаком; еще раз в герметизированном сосуде создавали повышенное давление водорода (1034 кПа (150 ф/кв.дюйм и перемешивали при комнатной температуре в течение 18 ч. Смесь фильтровали через прокладку изArbocel (товарный знак), и фильтрат выпаривали при пониженном давлении. Остаток азеотропно отгоняли из дихлорметана, затем очищали колоночной хроматографией на силикагеле с элюированием смесью дихлорметан: метанол: 0,88 аммиак (90:10:0,5 по объему) с получением указанного в заголовке соединения в виде твердого вещества белого цвета (340 мг). МС: 401 (МH+). 1(30 мл) оставляли при комнатной температуре на 2 ч, в течение которых происходило медленное образование тонкого осадка. Растворитель удаляли при пониженном давлении и остаток распределяли между дихлорметаном (150 мл) и водой (50 мл). Органическую фазу отделяли и растворитель выпаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле с элюированием смесью дихлорметан:этилацетат (4:1 по объему) с получением продукта, который азеотропно отгоняли(2R,3R,4R,5R)-4-(ацетилокси)-2[(ацетилокси)метил]-5-2-циано-6-[(1-нафтилметил)амино]-9H-пурин-9-илтетрагидро-3-фуранилацетата (3,5 г; 6,27 ммоль) (подготовительная стадия 13) в этаноле (120 мл) насыщали газообразным аммиаком и перемешивали при комнатной температуре в течение 4 дней. Растворитель удаляли при пониженном давлении и остаток растирали с водой (100 мл), фильтровали и сушили с получением указанного в заголовке соединения в виде твердого вещества (2,4 г). МС: 433 (MH+). 1(0,75 г; 1,74 ммоль) (подготовительная стадия 14) в этаноле (30 мл) насыщали газообразным аммиаком, обрабатывали 5%-ным (в/в) палладием на угле (0,50 г), в герметизированном сосуде создавали повышенное давление водорода (1034 кПа (150 ф/кв.дюйм и перемешивали при комнатной температуре в течение 42 ч. Поскольку по данным ТСХ часть исходного материала осталась в реакционной смеси, то добавляли до 004655 30 полнительное количество 5%-ного (в/в) палладия на угле (0,30 г) и этанола (10 мл), насыщенного аммиаком. Еще раз в герметизированном сосуде создавали повышенное давление водорода (1034 кПа (150 ф/кв.дюйм и перемешивали при комнатной температуре в течение 24 ч. Смесь фильтровали через прокладку из Arbocel(товарный знак), и фильтрат выпаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле с элюированием градиентной системой, начиная от смеси дихлорметан:метанол:0,88 аммиак 2-Хлорэтансульфонилхлорид (0,06 мл; 0,58 ммоль) добавляли к раствору (2R,3R,4S,5R)-22-(аминометил)-6-[(2,2-дифенилэтил)амино]9H-пурин-9-ил-5-(гидроксиметил)тетрагидро 3,4-фурандиола (250 мг; 0,52 ммоль) (подготовительная стадия 19) и триэтиламина (0,15 мл; 1,1 ммоль) в дихлорметане (5 мл). Реакционную смесь перемешивали в течение 2 ч при комнатной температуре, затем разбавляли дополнительным количеством дихлорметана (50 мл) и промывали водой (50 мл). Органический слой сушили (безводный, сульфат магния) и растворитель выпаривали с получением остатка, который очищали колоночной хроматографией на силикагеле с элюированием смесью метанол:дихлорметан (1:19 по объему), затем, увеличивая полярность, смесью метанол:дихлорметан (1:9 по объему). Растворитель удаляли при пониженном давлении с получением указанного в заголовке соединения (65 мг) в виде масла. 1 Триацетоксиборгидрид натрия (33,76 г; 0,16 моль) добавляли к раствору циклопентиламина (15 мл; 0,15 моль) в ацетоне (500 мл). Реакционную смесь перемешивали при комнатной температуре в течение 24 ч, затем растворитель удаляли, и реакционную смесь распределяли между этилацетатом (400 мл) и 2 М водным гидроксидом натрия (150 мл). Органический слой отделяли, сушили (безводный сульфат магния) и выпаривали при пониженном давлении с получением указанного в заголовке соединения(10,0 г; 0,03 моль) (смотри WO-A-00/23457) в 1,1,1-трихлорэтане (250 мл). Суспензию нагревали до температуры дефлегмации. Когда весь твердый материал суспензии растворился, реакционную смесь оставили охлаждаться до комнатной температуры, и растворитель удаляли при пониженном давлении. Остаток дважды растворяли в толуоле (50 мл) и растворитель удаляли при пониженном давлении. Затем остаток растворяли в толуоле (100 мл), и добавляли(2R,3R,4R,5S)-4,5-бис(ацетилокси)-2-[(ацетилокси)метил]тетрагидро-3-фуранилацетат (10,3 г; 0,032 моль). Раствор перемешивали при комнатной температуре и аккуратно добавляли триметилсилилтрифторметансульфонат (16 мл; 0,088 моль). Полученный раствор нагревали при температуре дефлегмации в течение 2 ч и затем оставляли охлаждаться до комнатной температуры. Реакционную смесь разбавляли, добавляя этилацетат (100 мл), и затем промывали насыщенным водным гидрокарбонатом натрия (десять порций по 100 мл) и насыщенным водным раствором хлорида натрия (100 мл). Водные экстракты объединяли и промывали этилацетатом (три порции по 100 мл). Объединенные органические слои сушили (безводный сульфат магния) и растворитель удаляли при понижен 004655 32 ном давлении с получением твердого вещества,которое очищали колоночной хроматографией на силикагеле с элюированием смесью дихлорметан:метанол:0,88 концентрированный водный аммиак (97:3:0,5 по объему, постепенно переходящей в 80:20:3 по объему) с получением указанного в заголовке соединения в виде пены (8,5 г). 1 10%-ный (в/в) палладий на угле (200 мг) добавляли к раствору(2R,3R,4R,5R)-4(ацетилокси)-2-[(ацетилокси)метил]-5-2-циано 6-[(2,2-дифенилэтил)амино]-9 Н-пурин-9-ил тетрагидро-3-фуранилацетата (подготовительная стадия 18) (1,9 г; 3,2 ммоль) в этаноле, насыщенном аммиаком (100 мл). Реакционную смесь перемешивали в атмосфере водорода (414 кПа (60 ф/кв.дюйм в течение 16 ч при комнатной температуре. Твердый материал удаляли с помощью фильтрования через Arbocel (товарный знак) и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле с элюированием смесью дихлорметан:метанол:0,88 концентрированный водный аммиак (90:10:1 по объему, постепенно переходящей в 80:20:2 по объему) с получением указанного в заголовке соединения в виде твердого вещества (770 мг). МС: 477 (МН+). 1(8 Н, m), 5,90-5,85 (1 Н, m), 4,75-4,70 (1 Н, m),4,50-4,40 (1 Н, m), 4,30-4,20 (2 Н, m), 4,10 (1 Н,m), 3,90-3,80 (2 Н, m), 3,70-3,65 (1H, m). Фармакологическая активность Все соединения из примеров 1-4 протестированы на противовоспалительную активность,обусловленную их способностью ингибировать функцию нейтрофилов (что указывает на активность в качестве агонистов А 2 а-рецепторов) с помощью метода, описанного на стр. 19, и все они имеют значение IC50 менее 1 мкмоль. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы или его фармацевтически приемлемые соль либо сольват, гдеR1 представляет собой водород или C1-С 6 алкил, возможно замещенный 1 или 2 заместителями, каждый из которых независимо выбран из фенила и нафтила, причем указанные фенил и нафтил возможно замещены C1-С 6 алкилом,C1-С 6 алкокси, галогено или циано; А представляет собой связь или C1-С 3 алкилен;(1) водород, C1-С 6 алкил, C3-С 7 циклоалкил,фенил или нафтил, причем указанные C3-С 7 циклоалкил, фенил или нафтил возможно замещены C1-С 6 алкилом, фенилом, C1-С 6 алкокси(C1-С 6)алкилом, R3R3N-(C1-С 6)-алкилом, фтор(C1-С 6)алкилом, фтор-(C1-С 6)алкокси, C2-С 5 алканоилом, галогено, -OR3, циано, -COOR3, C3 С 7 циклоалкилом, -S(O)mR4, -NR3R3, -SO2NR3R3,-CONR3R3, -NR3COR4 либо -NR3SO2R4, при условии, что R2 не представляет собой водород,когда А представляет собой связь, или(3) С-связанный 4-11-членный моно- или бициклический гетероцикл, имеющий либо от 1 до 4 кольцевых атомов азота, либо 1 или 2 кольцевых атома азота и 1 кольцевой атом кислорода или 1 кольцевой атом серы, возможно Сзамещенный оксо, C1-С 6 алкокси-(C1-С 6)алкилом, R3R3N-(C1-С 6)алкилом, фтор-(С 1-С 6)алкилом, фтор-(C1-С 6)алкокси, фтор-(С 2-С 5)алканоилом, галогено, циано, -OR5, R6, -COR5,-NR5R5,-COOR5,-S(O)mR6,-SO2NR5R5,5 5 5 6 5 6 34 гомопиперазинил или тетрагидроизохинолинил,причем каждый возможно замещен по кольцевому углеродному атому C1-С 6 алкилом, C3 С 8 циклоалкилом, фенилом, C1-С 6 алкокси-(C1 С 6)алкилом, R3R3N-(C1-С 6)алкилом, фтор-(C1 С 6)алкилом, -CONR3R3, -COOR3 или С 2 С 5 алканоилом и возможно замещен по кольцевому углеродному атому, не являющемуся соседним с кольцевым атомом азота, фтор-(C1 С 6)алкокси, галогено, -OR3, циано, -S(O)mR4,-NR3R3, -SO2NR3R3, -NR3COR4 или -NR3SO2R4, и при этом указанные пиперазин-1-ил и гомопиперазин-1-ил возможно замещены по кольцевому атому азота, не присоединенному к А, C1 С 6 алкилом,фенилом,C1-С 6 алкокси-(C2 С 6)алкилом, R3R3N-(C2-С 6)алкилом, фтор-(C1 С 6)алкилом, С 2-С 5 алканоилом, -COOR4, С 3 С 8 циклоалкилом, -SO2R4, -SO2NR3R3 илиR , означает С-связанный пирролил, имидазолил, триазолил, тиенил, фурил, тиазолил, оксазолил, тиадиазолил, оксадиазолил, пиридинил,пиримидинил, пиридазинил, пиразинил, хинолинил, изохинолинил, бензимидазолил, хиназолинил, фталазинил, бензоксазолил или хиноксалинил, причем каждый возможно замещен C1 С 6 алкилом, C1-С 6 алкокси, циано или галогено. 2. Соединение по п.1, гдеR1 представляет собой водород или C1-С 6 алкил, возможно замещенный 1 или 2 заместителями, каждый из которых независимо выбран из фенила и нафтила, причем указанные фенил и нафтил возможно замещены C1-С 6 алкилом,C1-С 6 алкокси, галогено или циано; А представляет собой связь или C1 С 3 алкилен;(1) водород, C1-С 6 алкил, C3-С 7 циклоалкил,фенил или нафтил, причем указанные C3-С 7 циклоалкил, фенил или нафтил возможно замещены C1-С 6 алкилом, фенилом, C1-С 6 алкокси(C1-С 6)алкилом, амино-(C1-С 6)алкилом, фторфтор-(C1-С 6)алкокси,C2(C1-С 6)алкилом,С 5 алканоилом, галогено, -OR3, циано, -COOR3,С 3-С 7 циклоалкилом,-S(O)mR4,-NR3R3,3 3 3 3 3 4-NR3SO2R4, при условии, что R2 не представляет собой водород, когда А представляет собой связь, или(3) С-связанный 4-11-членный моно- или бициклический гетероцикл, имеющий либо от 1 до 4 кольцевых атомов азота, либо 1 или 2 коль 35 цевых атома азота и 1 кольцевой атом кислорода или 1 кольцевой атом серы, возможно Сзамещенный оксо,C1-С 6 алкокси-(C1 С 6)алкилом, амино-(C1-С 6)алкилом, фтор-(C1 С 6)алкилом, фтор-(C1-С 6)алкокси, фтор-(С 2 С 5)алканоилом, галогено, циано, -OR5, R6,-COR5, -NR5R5, -COOR5, -S(O)mR6, -SO2NR5R5,-CONR5R5, -NR5SO2R6 или -NR5COR6 и возможно N-замещенный C1-С 6 алкокси-(C1-С 6)алкилом,амино-(С 2-С 6)алкилом,фтор-(C1-С 6)алкилом,фтор-(C2-С 5)алканоилом, R6, -COR5, -COOR5,-S(O)mR6, -SO2NR5R5 или -CONR5R5, или(4) N-связанный азетидинил, пирролидинил, пиперидинил или пиперазинил, причем каждый возможно С-замещен C1-С 6 алкилом,фенилом, C1-С 6 алкокси-(C1-С 6)алкилом, амино(C1-С 6)алкилом, фтор-(C1-С 6)алкилом, фтор-(C1 С 6)алкокси, С 2-С 5 алканоилом, галогено, -OR3,циано, -COOR3, C3-С 7 циклоалкилом, -S(O)mR4,-NR3R3, -SO2NR3R3, -CONR3R3, -NR3COR4 илиR , означает С-связанный пирролил, имидазолил, триазолил, тиенил, фурил, тиазолил, оксазолил, тиадиазолил, оксадиазолил, пиридинил,пиримидинил, пиридазинил, пиразинил, хинолинил, изохинолинил, бензимидазолил, хиназолинил, фталазинил, бензоксазолил или хиноксалинил, причем каждый возможно замещен C1 С 6 алкилом, C1-С 6 алкокси, циано или галогено. 3. Соединение по п.1 или 2, где А представляет собой связь. 4. Соединение по п.1 или 2, где А представляет собой C1-С 3 алкилен. 5. Соединение по п.1, где А представляет собой С 2-С 3 алкилен. 6. Соединение по п.5, где А представляет собой -СН 2 СН 2-. 7. Соединение по любому из пп 1-6, где R2 представляет собой C1-С 6 алкил или фенил. 8. Соединение по п.7, где R2 представляет собой 2-метилпроп-1-ил или фенил. 9. Соединение по п.5 или 6, где R2 представляет собой -NR7R8. 10. Соединение по п.9, где R7 представляет собой C1-С 6 алкил и R8 представляет собой C3 С 8 циклоалкил. 36 11. Соединение по п.10, где R7 представляет собой проп-2-ил и R8 представляет собой цикпопентил. 12. Соединение по любому из пп.1-11, гдеR1 представляет собой C1-С 6 алкил, замещенный 1 или 2 заместителями, каждый из которых независимо выбран из фенила и нафтила. 13. Соединение по п.12, где R1 представляет собой 2-фенилэтил, 2,2-дифенилэтил или 1 нафтилметил. 14. Соединение по п.1, где -A-R2 представляет собой 2-[(2-пропил)(циклопентил)амино] этил, 2-метилпроп-1-ил или фенил. 15. Соединение по п. 1, которое выбрано из группы, состоящей изN-(9-[(2R,3R,4S,5R)-3,4-дигидрокси-5(гидроксиметил)тетрагидро-2-фуранил]-6-[(1 нафтилметил)амино]-9 Н-пурин-2-илметил)бензолсульфонамида; и 2-[циклопентил(изопропил)амино]-N-(9[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)тетрагидро-2-фуранил]-6-[(2,2-дифенилэтил)амино]-9 Н-пурин-2-илметил)этансульфонамида; и их фармацевтически приемлемых солей и сольватов. 16. Фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемые соль либо сольват по любому из пп.1-15 вместе с фармацевтически приемлемым эксципиентом, разбавителем или носителем. 17. Применение соединения формулы (I) или его фармацевтически приемлемой соли либо сольвата по любому из пп.1-15 в качестве лекарственного средства. 18. Применение соединения формулы (I) или его фармацевтически приемлемых соли либо сольвата по любому из пп.1-15 для изготовления лекарственного средства для лечения заболевания, при котором показан агонист А 2 арецептора. 19. Применение соединения формулы (I) или его фармацевтически приемлемых соли либо сольвата по любому из пп.1-15 для изготовления противовоспалительного агента. 20. Применение соединения формулы (I) или его фармацевтически приемлемых соли либо сольвата по любому из пп.1-15 для изготовления лекарственного средства для лечения респираторного заболевания. 21. Применение по п.20, где данное заболевание выбрано из группы, состоящей из респираторного дистресс-синдрома взрослых(ARDS), бронхита, хронического бронхита,хронической обструктивной болезни легких,муковисцидоза, астмы, эмфиземы, бронхоэктаза, хронического синусита и ринита. 22. Применение соединения формулы (I) или его фармацевтически приемлемых соли либо сольвата по любому из пп.1-15 для изготовления лекарственного средства для лечения септического шока,мужской эректильной дисфункции, гипертензии,удара, эпилепсии, церебральной ишемии, заболевания периферических сосудов, постишемического реперфузионного повреждения, диабета, ревматоидного артрита, рассеянного склероза, псориаза,аллергического дерматита, экземы, неспецифического язвенного колита, болезни Крона, воспалительного заболевания кишечника, гастрита, связанного с Helicobacter pylori, гастрита, не связанного сHelicobacter pylori, повреждения желудочнокишечного тракта, индуцированного нестероидными противовоспалительными лекарствами, или психотического расстройства, или для лечения ран. 23. Способ лечения млекопитающего,включая человека, для лечения заболевания, при котором показан агонист А 2 а-рецептора, при котором указанного млекопитающего лечат эффективным количеством соединения формулы(I) или его фармацевтически приемлемых соли,сольвата либо их композиции по любому из пп.1-15 и 16, соответственно. 24. Способ лечения млекопитающего,включая человека, для лечения воспалительного заболевания, при котором указанного млекопитающего лечат эффективным количеством соединения формулы (I) или его фармацевтически приемлемых соли, сольвата либо их композиции по любому из пп.1-15 и 16, соответственно. 25. Способ лечения млекопитающего,включая человека, для лечения респираторного заболевания, при котором указанного млекопитающего лечат эффективным количеством соединения формулы (I) или его фармацевтически приемлемых соли, сольвата либо их композиции по любому из пп.1-15 и 16, соответственно. 26. Способ по п.25, где данное заболевание выбрано из группы, состоящей из респираторного дистресс-синдрома взрослых (ARDS),бронхита, хронического бронхита, хронической обструктивной болезни легких, муковисцидоза,астмы, эмфиземы, бронхоэктаза, хронического синусита и ринита. 27. Способ лечения млекопитающего,включая человека, для лечения септического шока, мужской эректильной дисфункции, гипертензии, удара, эпилепсии, церебральной ишемии, заболевания периферических сосудов,постишемического реперфузионного повреждения, диабета, ревматоидного артрита, рассеянного склероза, псориаза, аллергического дерматита, экземы, неспецифического язвенного колита, болезни Крона, воспалительного заболевания кишечника, гастрита, связанного с Helicobacter pylori, гастрита, не связанного с Helico 004655pylori,повреждения желудочнокишечного тракта, индуцированного нестероидными противовоспалительными лекарствами,или психотического расстройства, или для лечения ран, при котором указанного млекопитающего лечат эффективным количеством соединения формулы (I) или его фармацевтически приемлемых соли, сольвата либо их композиции по любому из пп.1-15 и 16, соответственно. 28. Способ получения соединения формулы (I) по п.1 или 2 либо его фармацевтически приемлемых соли или сольвата, при котором снимают защиту с соединения формулы где R1, R2 и А такие, как определено в п.1 или 2,и либо Р 1, Р 2 и Р 3, взятые по отдельности, представляют собой защитные группы, либо Р 1 и Р 2,взятые вместе, представляют собой защитную группу, и Р 3 представляет собой защитную группу, при этом защитные группы удаляют одновременно или последовательно и возможно превращают соединение I в его фармацевтически приемлемую соль. 29. Способ получения соединения формулы (I) по п.1 или 2 либо его фармацевтически приемлемых соли или сольвата, при котором снимают защиту с соединения формулы где R1, R2 и А такие, как определено в п.1 или 2,и либо Р 1 и Р 2, взятые по отдельности, представляют собой защитные группы, либо Р 1 и Р 2, взятые вместе, представляют собой защитную группу, при этом защитные группы Р 1 и Р 2, взятые по отдельности, удаляют или одновременно, или последовательно и возможно превращают соединение I в его фармацевтически приемлемую соль. 30. Способ получения соединения формулы (I) по п.1 или 2 либо его фармацевтически приемлемых соли или сольвата, при котором снимают защиту с соединения формулы где Р 3 представляет собой защитную группу, a возможно превращают соединение I в его фармацевтически приемлемую соль. 31. Способ получения соединения формулы(I) по п.1 или 2 либо его фармацевтически приемлемых соли или сольвата, при котором проводят сульфонилирование соединения формулы где либо Р 1 и Р 2, взятые по отдельности, представляют собой защитные группы, либо Р 1 и Р 2,взятые вместе, представляют собой защитную группу; или где R1 такой, как определено в п.1 или 2, соединением формулыR2-A-SO2X где X представляет собой уходящую группу,предпочтительно хлоро, a R2 и А такие, как определено в п.1 или 2, и возможно превращают соединение I в его фармацевтически приемлемую соль. 32. Способ получения соединения формулы (I) по п.1, где А представляет собой-СН 2 СН 2-, а R2 представляет собой -NR7R8, либо его фармацевтически приемлемых соли или сольвата, при котором соединения формулы где Р 3 представляет собой защитную группу; или причем данные группы R1, R2 и А такие, как определено в п.1 или 2. 34. Соединение формулыR7R8NH 7 где R и R8 такие, как определено в п.1; причем указанный способ возможно сопровождается превращением соединения формулы (I) в его фармацевтически приемлемую соль. 33. Соединение формулы причем группа R1 определена как C1-С 6 алкил,возможно замещенный 1 или 2 заместителями,каждый из которых независимо выбран из фенила и нафтила, причем указанные фенил и нафтил возможно замещены C1-С 6 алкилом, C1 С 6 алкокси, галогено или циано. 35. Соединение формулы где либо Р 1, Р 2 и Р 3, взятые по отдельности,представляют собой защитные группы, либо Р 1 и Р 2, взятые вместе, представляют собой защитную группу и Р 3 представляет собой защитную группу; или причем данная группа R1 такая, как определено в п.1.
МПК / Метки
МПК: C07H 19/167, A61P 11/00, A61K 31/70
Метки: пуриновые, производные
Код ссылки
<a href="https://eas.patents.su/21-4655-purinovye-proizvodnye.html" rel="bookmark" title="База патентов Евразийского Союза">Пуриновые производные</a>
Предыдущий патент: Способы получения и промежуточные соединения для получения противораковых соединений
Следующий патент: Аминопиримидины в качестве ингибиторов сорбитолдегидрогеназы
Случайный патент: Способ коррекции вальгусной деформации 1-й плюсневой кости












