Азотсодержащие гетеробициклы в качестве ингибиторов фактора xa
Номер патента: 4515
Опубликовано: 29.04.2004
Авторы: Пинто Дональд Дж.П., Хан Кви, Росси Карен А., Кларк Чарльз Г., Февиг Джон М., Пруитт Джеймс Р., Лэм Патрик Йук Сун, Кван Мими, Каччола Джозеф
Формула / Реферат
1. Соединение общей формулы

содержащее различные конденсированные кольца F, в указанном соединение фрагмент формулы
представлен одной из следующих структур

где Z является N, CR1a или NR3;
L является N или C, при условии, что, когда L является N, Z является N или CR1a и что, когда L является C, Z является NR3;
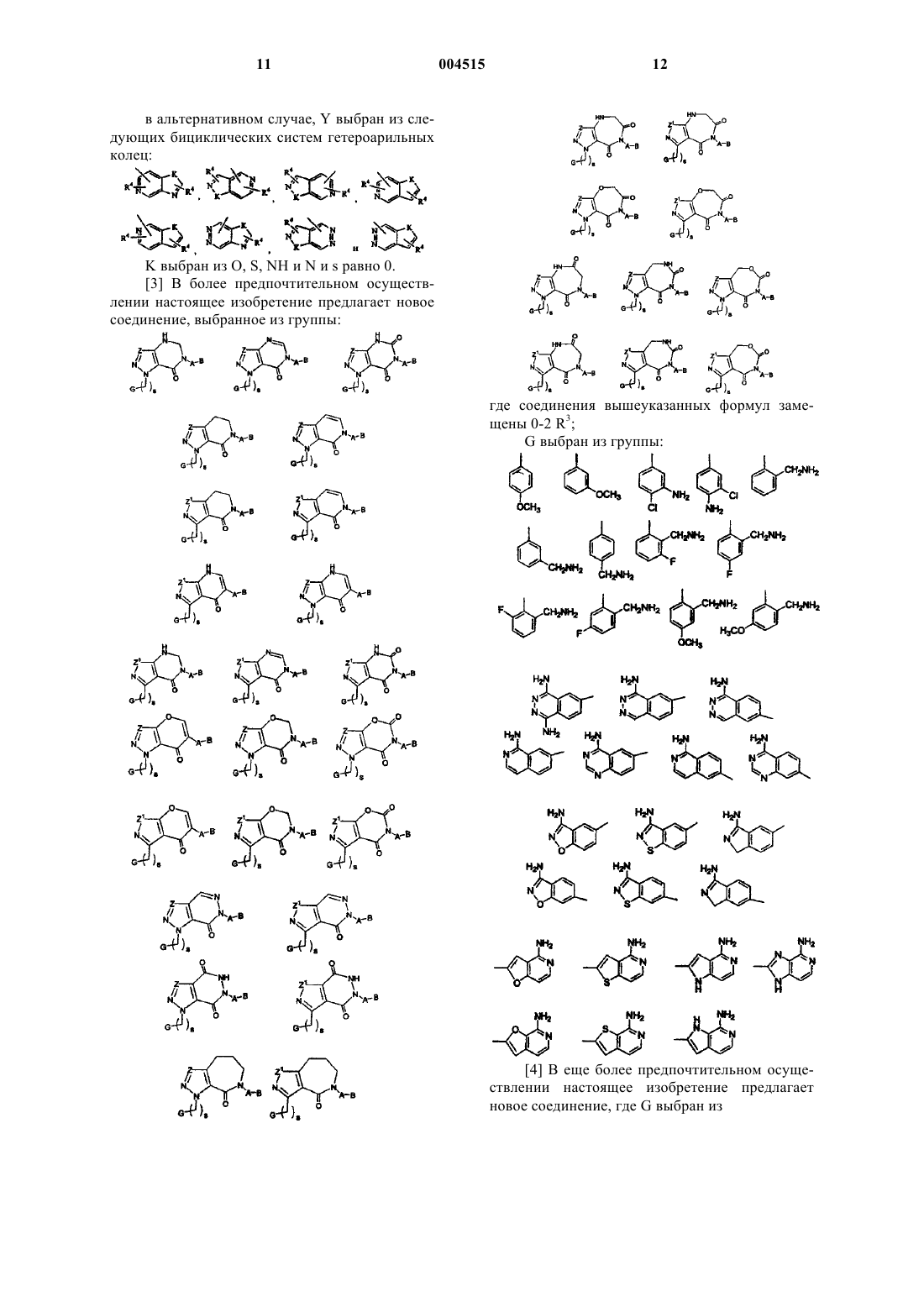
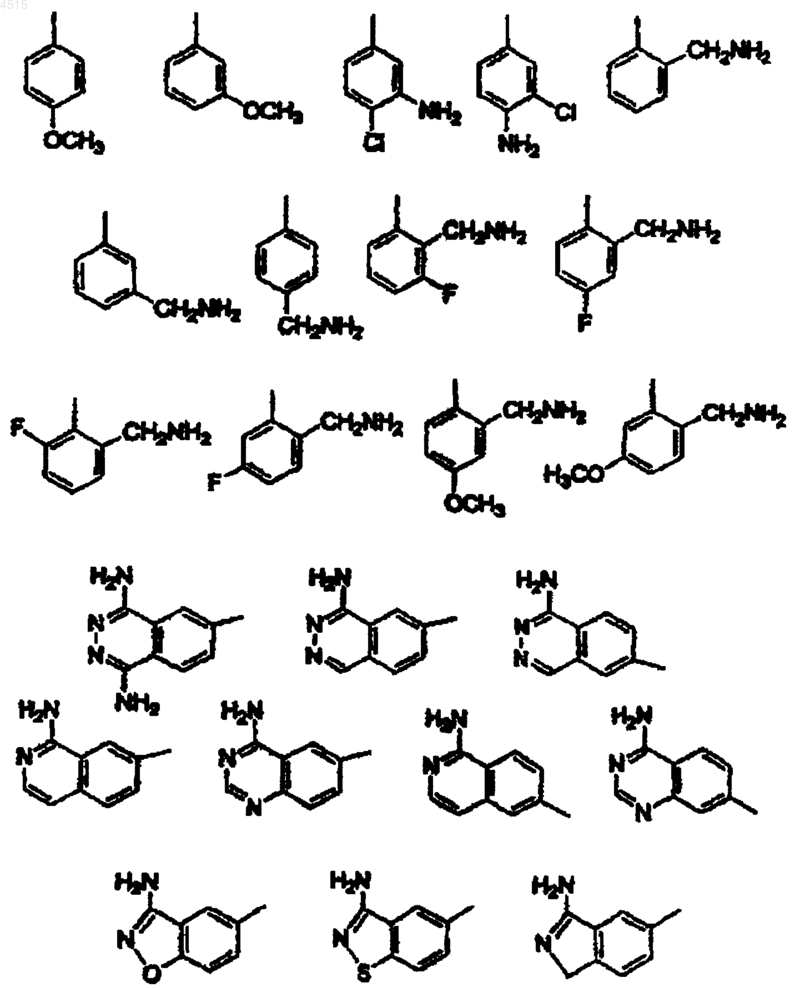
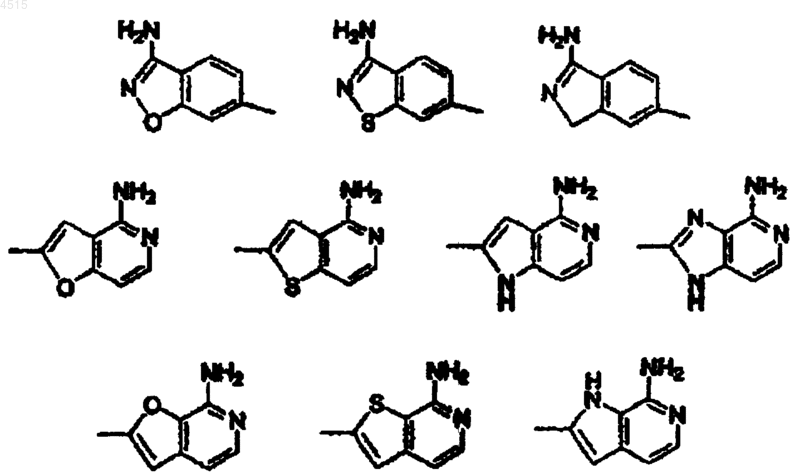
где цикл F выбран из
где соединения вышеуказанных формул замещены 0-2 R3;
G выбран из
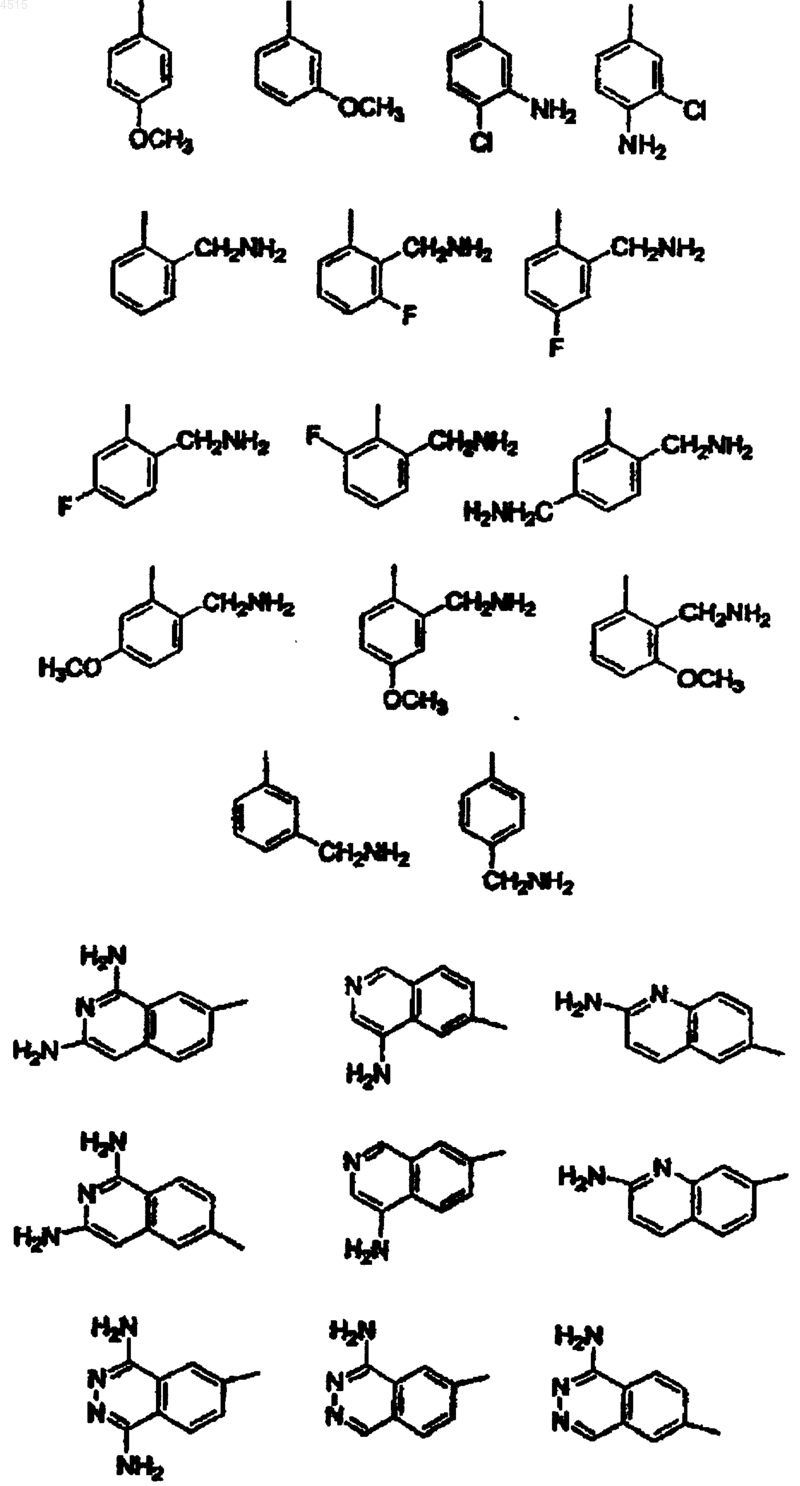
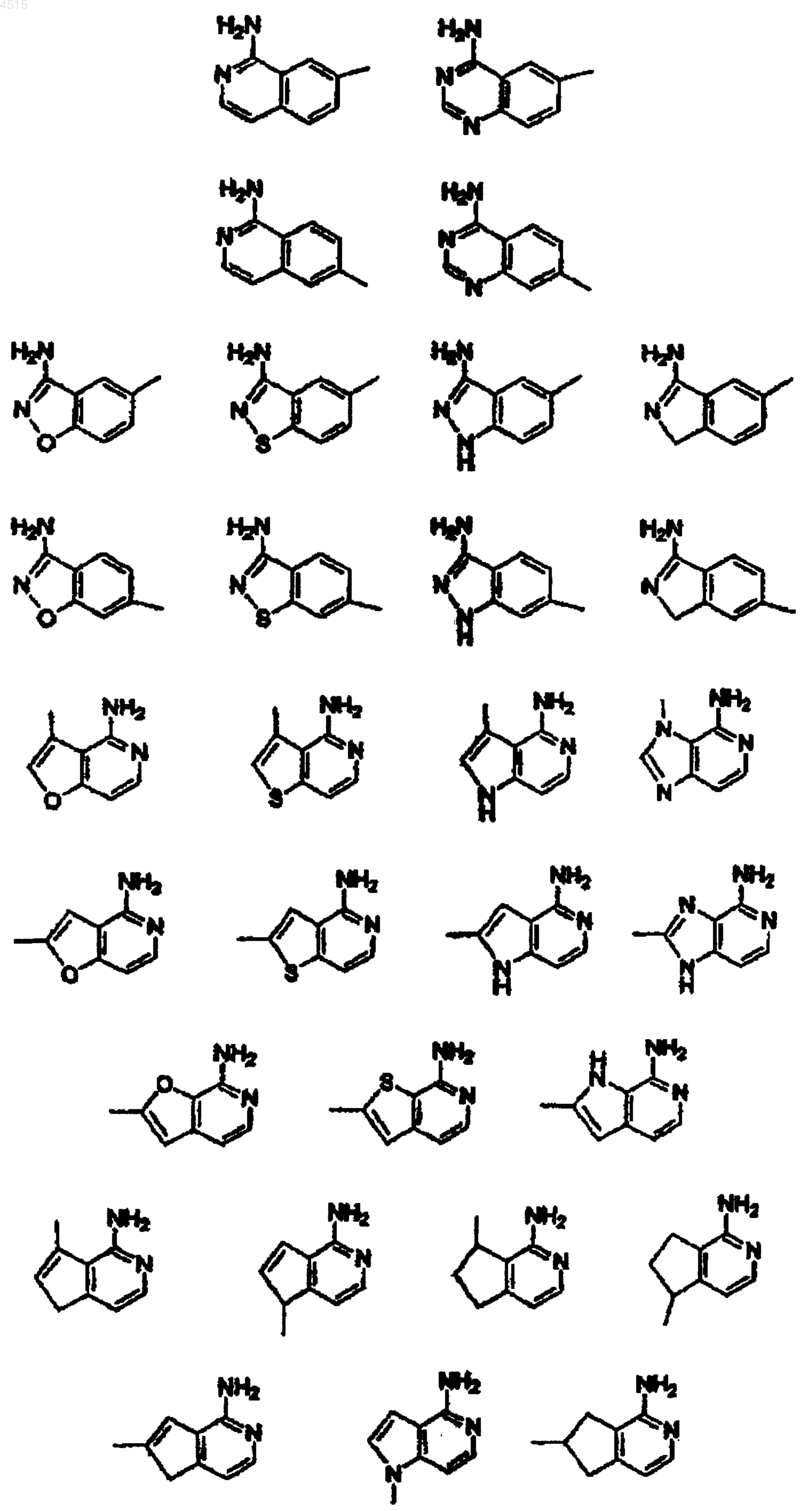
A выбран из одной из следующих карбоциклических и гетероциклических систем, которые замещены 0-2 R4: фенил, пиперидинил, пиперазинил, пиридил, пиримидил, фуранил, морфолинил, тиофенил, пирролил, пирролидинил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил, имидазолил, оксадиазолил, тиадиазолил, триазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил, 1,2,3-триазолил, 1,2,4-триазолил, 1,2,5-триазолил, 1,3,4-триазолил, бензофуранил, бензотиофуранил, индолил, бензимидазолил, бензоксазолил, бензтиазолил, индазолил, бензизоксазолил, бензизотиазолил и изоиндазолил;
B выбран из H, Y и X-Y;
X выбран из C1-4-алкилена, -C(O)-, -C(=NR)-, -CR2(NR2R2a)-, -C(O)CR2R2a-, -CR2R2aC(O)-, -C(O)NR2-, -NR2C(O)-, -C(O)NR2CR2R2a-, -NR2C(O)CR2R2a-, -CR2R2aC(O)NR0-, -CR2R2aNR2C(O)-, -NR2C(O)NR2-, -NR2-, -NR2CR2R2a-, -CR2R2aNR2-, O, -CR2R2aO- и -OCR2R2a-;
Y представляет CH2NR2R2a или CH2CH2NR2R2a;
в альтернативном случае Y выбран из одной из следующих карбоциклических и гетероциклических систем, которые замещены 0-2 R4a:
циклопропил, циклопентил, циклогексил, фенил, пиперидинил, пиперазинил, пиридил, пиримидинил, фуранил, морфолинил, тиофенил, пирролил, пирролидинил, оксазолил, изоксазолил, изоксазолинил, тиазолил, изотиазолил, пиразолил, имидазолил, оксадиазолил, тиадиазолил, триазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил, 1,2,3-триазолил, 1,2,4-триазолил, 1,2,5-триазолил, 1,3,4-триазолил, бензофуранил, бензотиофуранил, индолил, бензимидазолил, бензоксазолил, бензтиазолил, индазолил, бензизоксазолил, бензизотиазолил и изоиндазолил; и
s равно 0,
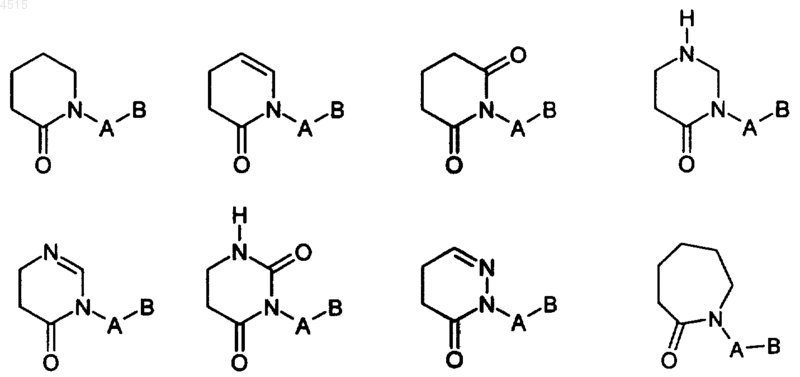
при условии, что если соединение представляет собой 1,4,5,6-тетрагидропиразоло[3,4-c]пиридин-7-он, то Y является азотсодержащим неароматическим геретоциклом, присоединенным через атом азота, где либо
(a) B является X-Y, либо
(b) Y замещен по меньшей мере одним R4a, не являющимся H или алкилом.
2. Соединение по п.1 общей формулы

где Z является N, CR1a или NR3;
L является N или C, при условии, что, когда L является N, Z является N или CR1a и что, когда L является C, Z является NR3;
где цикл F выбран из

где соединения вышеуказанных формул замещены 0-2 R3;
G выбран из
3. Соединение по п.2, где G выбран из
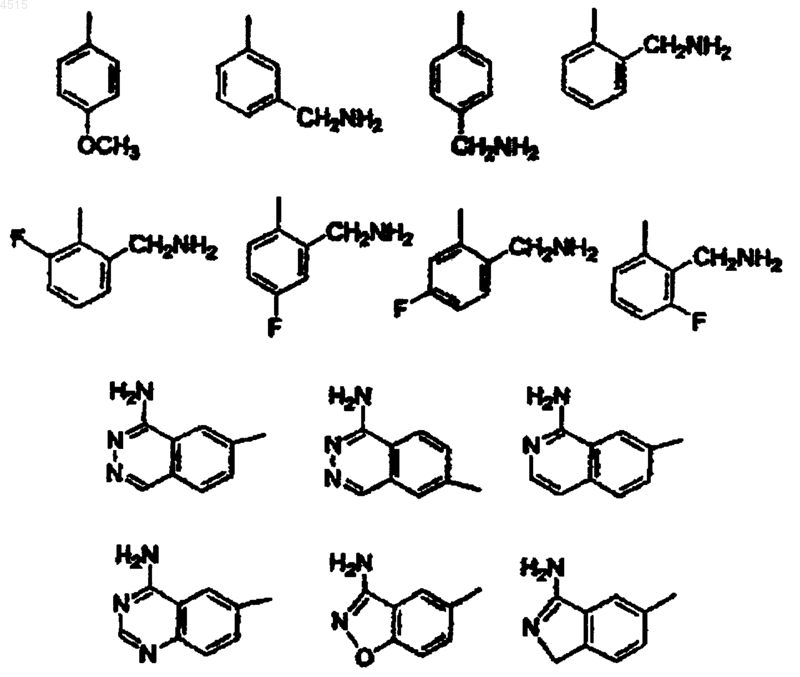
4. Соединение по п.3, где
A выбран из фенила, пиридила и пиримидила и замещен 0-2 R4 и
B выбран из X-Y, фенила, пирролидино, морфолино, 1,2,3-триазолила и имидазолила и замещен 0-1 R4a;
R2 в каждом случае выбран из H, CH3, CH2CH3, циклопропилметила, циклобутила и циклопентила;
R2a в каждом случае представляет H или CH3;
в альтернативном случае R2 и R2a вместе с атомом, к которому они присоединены, связываются с образованием пирролидина, замещенного 0-2 R4b;
R4 в каждом случае выбран из OH, (CH2)rOR2, галогена, C1-4-алкила, (CH2)rNR2R2a и (CF2)rCF3;
R4a выбран из C1-4-алкила, CF3, (CH2)rOR2, (CH2)rNR2NR2a, S(O)pR5, SO2NR2R2a и 1-CF3-тетразол-2-ила;
R4b в каждом случае выбран из H, CH3 и OH;
R5 в каждом случае выбран из CF3, C1-6-алкила, фенила и бензила;
X представляет CH2 или C(O);
Y выбран из пирролидино и морфолино и
r в каждом случае выбран из 0, 1 и 2, при условии, что если соединение представляет собой 1,4,5,6-тетрагидропиразоло[3,4-c]пиридин-7-он, то Y является азотсодержащим неароматическим гетероциклом, присоединенным через атом азота, где либо
(a) B является X-Y, либо
(b) Y замещен по меньшей мере одним R4a, не являющимся H или алкилом.
5. Соединение по п.4, где
A выбран из группы: фенил, 2-пиридил, 3-пиридил, 2-пиримидил, 2-Cl-фенил, 3-Cl-фенил, 2-F-фенил, 3-F-фенил, 2-метилфенил, 2-аминофенил и 2-метоксифенил, и
B выбран из группы: 2-(аминосульфонил)фенил, 2-(метиламиносульфонил)фенил, 1-пирролидинокарбонил, 2-(метилсульфонил)фенил, 2-(N,N-диметиламинометил)фенил, 2-(N-пирролидинилметил)фенил, 1-метил-2-имидазолил, 2-метил-1-имидазолил, 2-(диметиламинометил)-1-имидазолил, 2-(N-(циклопропилметил)аминометил)фенил, 2-(N-(циклобутил)аминометил)фенил, 2-(N-(циклопентил)аминометил)фенил и 2-(N-(3-гидроксипирролидинил)метил)фенил.
6. Соединение по п.1, выбранное из группы, включающей
1-[4-метоксифенил]-3-циано-6-[2'-метилсульфонил-3-фтор[1,1']бифен-4-ил]-1,4-дигидропиразоло[4,3-d]пиримидин-5,7-дион;
1-[4-метоксифенил]-3-(метоксикарбонил)-6-[2'-аминосульфонил-3-фтор[1,1']бифен-4-ил]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он;
1-[4-метоксифенил]-3-(аминокарбонил)-6-[2'-аминосульфонил-3-фтор[1,1']бифен-4-ил]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он;
1-[4-метоксифенил]-3-(метоксикарбонил)-6-[2'-аминосульфонил[1,1']бифен-4-ил]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он;
1-[4-метоксифенил]-6-[2'-аминосульфонил[1,1']бифен-4-ил]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он-3-карбоновая кислота;
1-[4-метоксифенил]-3-(аминокарбонил)-6-[2'-аминосульфонил[1,1']бифен-4-ил]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он;
1-[4-метоксифенил]-3-циано-6-[2'-аминосульфонил[1,1']бифен-4-ил]-1,6-дигидропиразоло[4,3-d]пиримидин -7-он;
1-[4-метоксифенил]-3-(аминометил)-6-[2'-аминосульфонил[1,1']бифен-4-ил]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он;
1-[4-метоксифенил]-3-(этоксикарбонил)-6-[4-(2-метилимидазол-1'-ил)фенил]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он;
1-[4-метоксифенил]-3-(аминокарбонил)-6-[4-(2-метилимидазол-1'-ил)фенил]-1,6-дигидропиразоло[4,3-d]пиримидин-7-юэ;
1-[4-метоксифенил]-3-(этоксикарбонил)-6-[2'-N-пирролидинилметил[1,1']бифен-4-ил]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он;
1-[4-метоксифенил]-3-(этоксикарбонил)-6-[2'-N-пирролидинилметил[1,1']бифен-4-ил]-1,4,5,6-тетрагидропиразоло[4,3-d]пиримидин-7-он;
1-[4-метоксифенил]-3-(аминокарбонил)-6-[2'-N-пирролидинилметил[1,1']бифен-4-ил]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он;
1-[4-метоксифенил]-3-циано-6-[2'-N-пирролидинилметил[1,1']бифен-4-ил]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он;
1-[4-метоксифенил]-3-(этоксикарбонил)-6-[2-фтор-4-(2-диметиламинометилимидазол-1'-ил)фенил]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он;
1-[2-аминометилфенил]-3-(этоксикарбонил)-6-[2'-метилсульфонил[1,1']бифен-4-ил]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он;
1-[3-аминоиминометилфенил]-3-метил-6-[2'-аминосульфонил[1,1']бифен-4-ил]-1,4,5,6-тетрагидропиразоло[3,4-c]пиридин-7-он;
1-[2-аминометилфенил]-3-метил-6-[2'-аминосульфонил[1,1']бифен-4-ил]-1,4,5,6-тетрагидропиразоло[3,4-c]пиридин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-метил-6-[2'-аминосульфонил[1,1']бифен-4-ил]-1,4,5,6-тетрагидропиразоло[3,4-c]пиридин-7-он;
1-[4-метоксифенил]-3-циано-6-[2'-N,N-диметиламинометил[1,1']бифен-4-ил]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он;
1-[4-метоксифенил]-3-циано-5-метил-6-[2'-N,N-диметиламинометил[1,1']бифен-4-ил]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он;
1-[2-аминометилфенил]-3-циано-6-[2'-метилсульфонил-3-фтор[1,1']бифен-4-ил]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он;
1-[4-метоксифенил]-3-трифторметил-4-метил-6-[2'-аминосульфонил[1,1']бифен-4-ил]-1,6-дигидропиразоло[3,4-d]пиридазин-7-он;
1-[4-метоксифенил]-3-трифторметил-4-метил-6-[2'-N-пирролидинилметил[1,1']бифен-4-ил]-1,6-дигидропиразоло[3,4-d]пиридазин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-6-[4-(1-метилимидазол-2'-ил)фенил]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он;
1-[4-метоксифенил]-3-(этоксикарбонил)-6-[2'-гидроксиметил-3-фтор[1,1']бифен-4-ил]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он;
1-[4-метоксифенил]-3-(этоксикарбонил)-6-[2'-N-пирролидинилметил-3-фтор[1,1']бифен-4-ил]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он;
1-[4-метоксифенил]-3-(аминокарбонил)-6-[2'-N-пирролидинилметил-3-фтор[1,1']бифен-4-ил]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он;
1-[4-метоксифенил]-3-(аминокарбонил)-6-[2'-(3-(R)-гидрокси-N-пирролидинилметил)-3-фтор[1,1']бифен-4-ил]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он;
1-[4-метоксифенил]-3-(N-формиламинометил)-6-[2'-метилсульфонил-3-фтор[1,1']бифен-4-ил]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-(этоксикарбонил)-6-[2'-гидроксиметил[1,1']бифен-4-ил]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-(этоксикарбонил)-6-[2'-N-пирролидинилметил[1,1']бифен-4-ил]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он;
1-[4-метоксифенил]-3-трифторметил-7-[2'-метилсульфонил[1,1']бифен-4-ил]-4,5,6,7-тетрагидропиразоло[3,4-c]азепин-8-он;
1-[4-метоксифенил]-3-трифторметил-7-[2'-аминосульфонил-3-фтор[1,1']бифен-4-ил]-4,5,6,7-тетрагидропиразоло[3,4-c]азепин-8-он;
1-[4-метоксифенил]-3-трифторметил-7-[2'-N-пирролидинилметил[1,1']бифен-4-ил]-4,5,6,7-тетрагидропиразоло[3,4-c]азепин-8-он;
1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-7-[2'-N-пирролидинилметил[1,1']бифен-4-ил]-4,5,6,7-тетрагидропиразоло [3,4-c]азепин-8-он;
1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-7-[2'-N-диметиламинометил[1,1']бифен-4-ил]-4,5,6,7-тетрагидропиразоло [3,4-c]азепин-8-он;
1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-7-[2'-N-изопропиламинометил[1,1']бифен-4-ил]-4,5,6,7-тетрагидропиразоло[3,4-c]азепин-8-он;
1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-7-[2'-(3-(R)-гидрокси-N-пирролидинил)метил[1,1']бифен-4-ил]-4,5,6,7-тетрагидропиразоло[3,4-c]азепин-8-он;
1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-7-[2'-(3-(R)-гидрокси-N-пирролидинил)метил-3-фтор[1,1']бифен-4-ил]-4,5,6,7-тетрагидропиразоло[3,4-c]азепин-8-он;
1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-7-[2'-N-пирролидинилметил-3-фтор[1,1']бифен-4-ил]-4,5,6,7-тетрагидропиразоло[3,4-c]азепин-8-он;
1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-7-[2'-N-диметиламинометил-3-фтор[1,1']бифен-4-ил]-4,5,6,7-тетрагидропиразоло[3,4-c]азепин-8-он;
1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-7-[2'-N-изопропиламинометил-3-фтор[1,1']бифен-4-ил]-4,5,6,7-тетрагидропиразоло[3,4-c]азепин-8-он;
1-[4-метоксифенил]-3-трифторметил-7-[4-(2-диметиламинометилимидазол-1'-ил)-3-фторфенил]-4,5,6,7-тетрагидропиразоло[3,4-c]азепин-8-он;
1-[4-метоксифенил]-3-трифторметил-7-[4-(имидазол-1'-ил)-3-фторфенил]-4,5,6,7-тетрагидропиразоло[3,4-c]азепин-8-он;
1-[2-аминометилфенил]-3-трифторметил-7-[2'-метилсульфонил[1,1']бифен-4-ил]-4,5,6,7-тетрагидропиразоло[3,4-c]азепин-8-он;
1-[3-аминобензизоксазол-5'-ил]-3-метил-6-[2'-N-пирролидинилметил[1,1']бифен-4-ил]-1,4,5,6-тетрагидро-7H-пиразоло[3,4-c]пиридин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-метил-6-[2'-(3-(S)-гидрокси-H-пирролидинил)метил[1,1']бифен-4-ил]-1,4,5,6-тетрагидро-7H-пиразоло[3,4-c]пиридин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-метил-6-[2'-N-изопропиламинометил[1,1']бифен-4-ил]-1,4,5,6-тетрагидро-7H-пиразоло[3,4-c]пиридин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-метил-6-[2'-N,N-диметиламинометил[1,1']бифен-4-ил]-1,4,5,6-тетрагидро-7H-пиразоло[3,4-c]пиридин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-метил-6-[2'-метилсульфонил[1,1']бифен-4-ил]-1,4,5,6-тетрагидро-7H-пиразоло[3,4-c]пиридин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-метил-6-[2'-метилсульфонил-3-фтор[1,1']бифен-4-ил]-1,4,5,6-тетрагидро-7H-пиразоло[3,4-c]пиридин-7-он;
1-[2-аминометилфенил]-3-трифторметил-6-[2'-метилсульфонил-3-фтор[1,1']бифен-4-ил]-1,4,5,6-тетрагидропиразоло[3,4-c]пиридин-7-он;
1-[2-аминометилфенил]-3-трифторметил-6-[2'-аминосульфонил-3-фтор[1,1']бифен-4-ил]-1,4,5,6-тетрагидропиразоло[3,4-c]пиридин-7-он;
1-[2-аминометилфенил]-3-трифторметил-6-[2'-метилсульфонил[1,1']бифен-4-ил]-1,4,5,6-тетрагидропиразоло[3,4-c]пиридин-7-он;
1-[2-аминометилфенил]-3-трифторметил-6-[2'-N,N-диметиламинометил-3-фтор[1,1']бифен-4-ил]-1,4,5,6-тетрагидропиразоло[3,4-c]пиридин-7-он;
1-[2-аминометилфенил]-3-трифторметил-6-[2'-(3-(R)-гидрокси-N-пирролидинил)метил-3-фтор[1,1']бифен-4-ил]-1,4,5,6-тетрагидропиразоло [3,4-c]пиридин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-6-[2'-диметиламинометил-3-фтор[1,1']бифен-4-ил]-1,4,5,6-тетрагидропиразоло[3,4-c]пиридин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-6-[2'-(3-(R)-гидрокси-N-пирролидинил)метил-3-фтор[1,1']бифен-4-ил]-1,4,5,6-тетрагидропиразоло[3,4-c]пиридин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-6-[2'-(3-(R)-гидрокси-N-пирролидинил)метил[1,1']бифен-4-ил]-1,4,5,6-тетрагидропиразоло[3,4-c]пиридин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-6-[2'-изопропиламинометил-3-фтор[1,1']бифен-4-ил]-1,4,5,6-тетрагидропиразоло[3,4-c]пиридин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-6-[2'-N-(2-метилимидазол-1-ил)метил-3-фтор[1,1']бифен-4-ил]-1,4,5,6-тетрагидропиразоло[3,4-c]пиридин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-6-[2'-N-пирролидинометил-3-фтор[1,1']бифен-4-ил]-1,4,5,6-тетрагидропиразоло [3,4-c]пиридин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-6-[2'-оксиминометил-3-фтор[1,1']бифен-4-ил]-1,4,5,6-тетрагидропиразоло[3,4-c]пиридин-7-он;
1-[4-метоксифенил]-3-трифторметил-6-[2'-(3-(R)-гидрокси-N-пирролидинил)метил-3-фтор[1,1']бифен-4-ил]-1,4,5,6-тетрагидропиразоло[3,4-c]пиридин-7-он;
1-[3-аминометилфенил]-3-трифторметил-6-[2'-метилсульфонил-3-фтор[1,1']бифен-4-ил]-1,4,5,6-тетрагидропиразоло[3,4-c]пиридин-7-он;
1-[4-метоксифенил]-3-[(имидазол-1-ил)метил]-5-метил-6-[(2'-N-пирролидинилметил[1,1']бифен-4-ил)]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он;
1-[4-метоксифенил]-3-[(тетразол-1-ил)метил]-5-метил-6-[(2'-N-пирролидинилметил[1,1']бифен-4-ил)]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он;
1-[4-метоксифенил]-3-[(тетразол-2-ил)метил]-5-метил-6-[(2'-N-пирролидинилметил[1,1']бифен-4-ил)]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3,5-диметил-6-[(2'-N-диметиламинометил[1,1']бифен-4-ил)]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-метил-6-[(2'-N,N-диметиламинометил[1,1']бифен-4-ил)]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-метил-6-[(2'-N-изопропиламинометил[1,1']бифен-4-ил)]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-метил-6-[2'-(3-(R)-гидрокси-N-пирролидинил)метил[1,1']бифен-4-ил]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-метил-6-[4-(4,5-дигидроимидазол-1'-ил)фенил]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-метил-6-[2'-N-(циклопропилметил)аминометил[1,1']бифен-4-ил]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-метил-6-[(2'-H-пирролидинилметил[1,1']бифен-4-ил)]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-метил-6-[(2'-(N-метил-N-изопропил)аминометил[1,1']бифен-4-ил)]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3,5-диметил-6-[2'-(3-(R)-гидрокси-N-пирролидинил)метил[1,1']бифен-4-ил]-1,6-дигидропиразоло [4,3-d]пиримидин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-6-[2'-(N,N-диметиламинометил[1,1']бифен-4-ил)]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-6-[2'-(N,N-диметиламинометил[1,1']бифен-4-ил)]-1,4,5,6-тетрагидропиразоло[4,3-d]пиримидин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-6-[2'-(3-(R)-гидрокси-N-пирролидинил)метил[1,1']бифен-4-ил]-1,4,5,6-тетрагидропиразоло[4,3-d]пиримидин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-6-[2'-(3-(S)-гидрокси-N-пирролидинил)метил[1,1']бифен-4-ил]-1,4,5,6-тетрагидропиразоло[3,4-c]пиридин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-6-[2'-N-(пирролидинил)метил[1,1']бифен-4-ил]-1,4,5,6-тетрагидропиразоло[3,4-c]пиридин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-6-[2'-N-(морфолино)метил[1,1']бифен-4-ил]-1,4,5,6-тетрагидропиразоло[3,4-c]пиридин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-6-[2'-N,N-диметиламинометил[1,1']бифен-4-ил]-1,4,5,6-тетрагидропиразоло[3,4-c]пиридин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-7-[(3'-N-диметиламинометил)-3-фтор[1,1']бифен-4-ил]-4,5,6,7-тетрагидропиразоло[3,4-c]азепин-8-он;
1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-7-[(3'-N-пирролидинилметил)-3-фтор[1,1']бифен-4-ил]-4,5,6,7-тетрагидропиразоло[3,4-c]азепин-8-он;
1-[4-метоксифенил]-3-трифторметил-7-[(3'-N-пирролидинилметил)[1,1']бифен-4-ил]-4,5,6,7-тетрагидропиразоло[3,4-c]азепин-8-он;
1-[4-метоксифенил]-3-трифторметил-7-[(3'-N-диметиламинометил)[1,1']бифен-4-ил]-4,5,6,7-тетрагидропиразоло[3,4-c]азепин-8-он;
1-[4-метоксифенил]-3-трифторметил-7-[4-бензимидазол-1'-ил-3-фторфенил]-4,5,6,7-тетрагидропиразоло[3,4-c]азепин-8-он;
1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-7-[(2'-N-пирролидинилметил)-3-фтор[1,1']бифен-4-ил]-6,7-дигидропиразоло[3,4-c]азепин-8-он;
1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-7-[(2'-N-диметиламинометил)-3-фтор[1,1']бифен-4-ил]-6,7-дигидропиразоло[3,4-c]азепин-8-он;
1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-7-[(2'-N-(R)-3-гидроксипирролидинилметил)-3-фтор[1,1']бифен-4-ил]-6,7-дигидропиразоло[3,4-c]азепин-8-он;
1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-7-[(2'-N-(R)-3-гидроксипирролидинилметил)[1,1']бифен-4-ил]-6,7-дигидропиразоло[3,4-c]азепин-8-он;
1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-7-[(2'-N-диметиламинометил)[1,1']бифен-4-ил]-6,7-дигидропиразоло[3,4-c]азепин-8-он;
1-[4-метоксифенил]-3-трифторметил-7-[(2'-N-пирролидинилметил)[1,1']бифен-4-ил]-6,7-дигидропиразоло[3,4-c]азепин-8-он;
1-[4-метоксифенил]-3-трифторметил-7-[(2'-N,N-диметиламинометил)[1,1']бифен-4-ил]-6,7-дигидропиразоло[3,4-c]азепин-8-он;
1-[4-метоксифенил]-3-трифторметил-6-[(4-аминометил)фенил]-1,4,5,6-тетрагидропиразоло[3,4-c]пиридин-7-он;
1-[3-аминометилфенил]-3-метил-6-[(2'-N-((3-(3)-гидрокси)пирролидинил)метил[1,1']бифен-4-ил)]-1,4,5,6-тетрагидро-7H-пиразоло[3,4-c]пиридин-7-он;
1-[3-аминометилфенил]-3-метил-6-[(2'-метилсульфонил[1,1']бифен-4-ил)]-1,4,5,6-тетрагидро-7H-пиразоло[3,4-c]пиридин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-метил-6-[(3-фтор-2'-N-(3(S)-гидрокси)пирролидинил)метил[1,1']бифен-4-ил)]-1,4,5,6-тетрагидро-7H-пиразоло[3,4-c]пиридин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-метил-6-[(3-фтор-2'-N-пирролидинилметил[1,1']бифен-4-ил)]-1,4,5,6-тетрагидро-7H-пиразоло[3,4-c]пиридин-7-он;
1-[1-аминоизохинолин-7'-ил]-3-трифторметил-6-[4-(2-метилимидазол-1'-ил)фенил]-1,4,5,6-тетрагидропиразоло[3,4-c]пиридин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-метил-6-[4-(2-метилимидазол-1'-ил)фенил]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-метил-6-[4-(2-(диметиламинометил)имидазол-1'-ил)-2-фторфенил]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-6-[4-(2-(диметиламинометил)имидазол-1'-ил)фенил]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он и
1-[3-аминобензизоксазол-5'-ил]-3-метил-6-[4-(2-(диметиламинометил)имидазол-1'-ил)-2-фторфенил]-1,4,5,6-тетрагидропиразоло[3,4-c]пиридин-7-он,
или его фармацевтически приемлемая соль.
7. Соединение по п.1, выбранное из группы
1-[3-аминобензизоксазол-5'-ил]-3-метил-6-[2'-аминосульфонил-[1,1']-бифен-4-ил]-1,4,5,6-тетрагидропиразоло-[3,4-c]-пиридин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-6-[2'-(3-(R)-гидрокси-N-пирролидинил)метил-[1,1']-бифен-4-ил]-1,4,5,6-тетрагидропиразоло-[3,4-c]-пиридин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-6-[2'-N',N-диметиламинометил-[1,1']-бифен-4-ил]-1,4,5,6-тетрагидропиразоло-[3,4-c]-пиридин-7-он;
1-[2-аминометилфенил]-3-трифторметил-6-[2'-метилсульфонил-[1,1']-бифен-4-ил]-1,4,5,6-тетрагидропиразоло-[3,4-c]-пиридин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-6-[2'-диметиламинометил-3-фтор-[1,1']-бифен-4-ил]-1,4,5,6-тетрагидропиразоло-[3,4-c]-пиридин-7-он;
1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-6-[2'-(3-(R)-гидрокси-N-пирролидинил)метил-3-фтор-[1,1']-бифен-4-ил]-1,4,5,6-тетрагидропиразоло-[3,4-c]-пиридин-7-он и
1-[1-аминоизохинолин-7'-ил]-3-трифторметил-6-[4-(2-метилимидазол-1'-ил)фенил]-1,4,5,6-тетрагидропиразоло-[3,4-c]-пиридин-7-он,
или его фармацевтически приемлемая соль.
8. Соединение по п.7, представляющее собой 1-[3-аминобензизоксазол-5'-ил]-3-метил-6-[2'-аминосульфонил-[1,1']-бифен-4-ил]-1,4,5,6-тетрагидропиразоло-[3,4-c]-пиридин-7-он или его фармацевтически приемлемую соль.
9. Соединение по п.7, представляющее собой 1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-6-[2'-(3-(R)-гидрокси-N-пирролидинил)метил-[1,1']-бифен-4-ил]-1,4,5,6-тетрагидропиразоло-[3,4-c]-пиридин-7-он или его фармацевтически приемлемую соль.
10. Соединение по п.7, представляющее собой 1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-6-[2'-N,N-диметиламинометил-[1,1']-бифен-4-ил]-1,4,5,6-тетрагидропиразоло-[3,4-c]-пиридин-7-он или его фармацевтически приемлемую соль.
11. Соединение по п.7, представляющее собой 1-[2-аминометилфенил]-3-трифторметил-6-[2'-метилсульфонил-[1,1']-бифен-4-ил]-1,4,5,6-тетрагидропиразоло-[3,4-c]-пиридин-7-он или его фармацевтически приемлемую соль.
12. Соединение по п.7, представляющее собой 1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-6-[2'-диметиламинометил-3-фтор-[1,1']-бифен-4-ил]-1,4,5,6-тетрагидропиразоло-[3,4-c]-пиридин-7-он или его фармацевтически приемлемую соль.
13. Соединение по п.7, представляющее собой 1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-6-[2'-(3-(R)-гидрокси-N-пирролидинил)метил-3-фтор-[1,1']-бифен-4-ил]-1,4,5,6-тетрагидропиразоло-[3,4-c]-пиридин-7-он или его фармацевтически приемлемую соль.
14. Соединение по п.7, представляющее собой 1-[1-аминоизохинолин-7'-ил]-3-трифторметил-6-[4-(2-метилимидазол-1'-ил)фенил]-1,4,5,6-тетрагидропиразоло-[3,4-c]-пиридин-7-он или его фармацевтически приемлемую соль.
15. Соединение по п.1 общей формулы
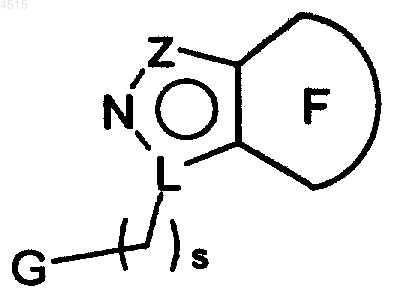
где Z является N, CR1a или NR3;
L является N или C, при условии, что, когда L является N, Z является N или CR1a и что, когда L является C, Z является NR3;
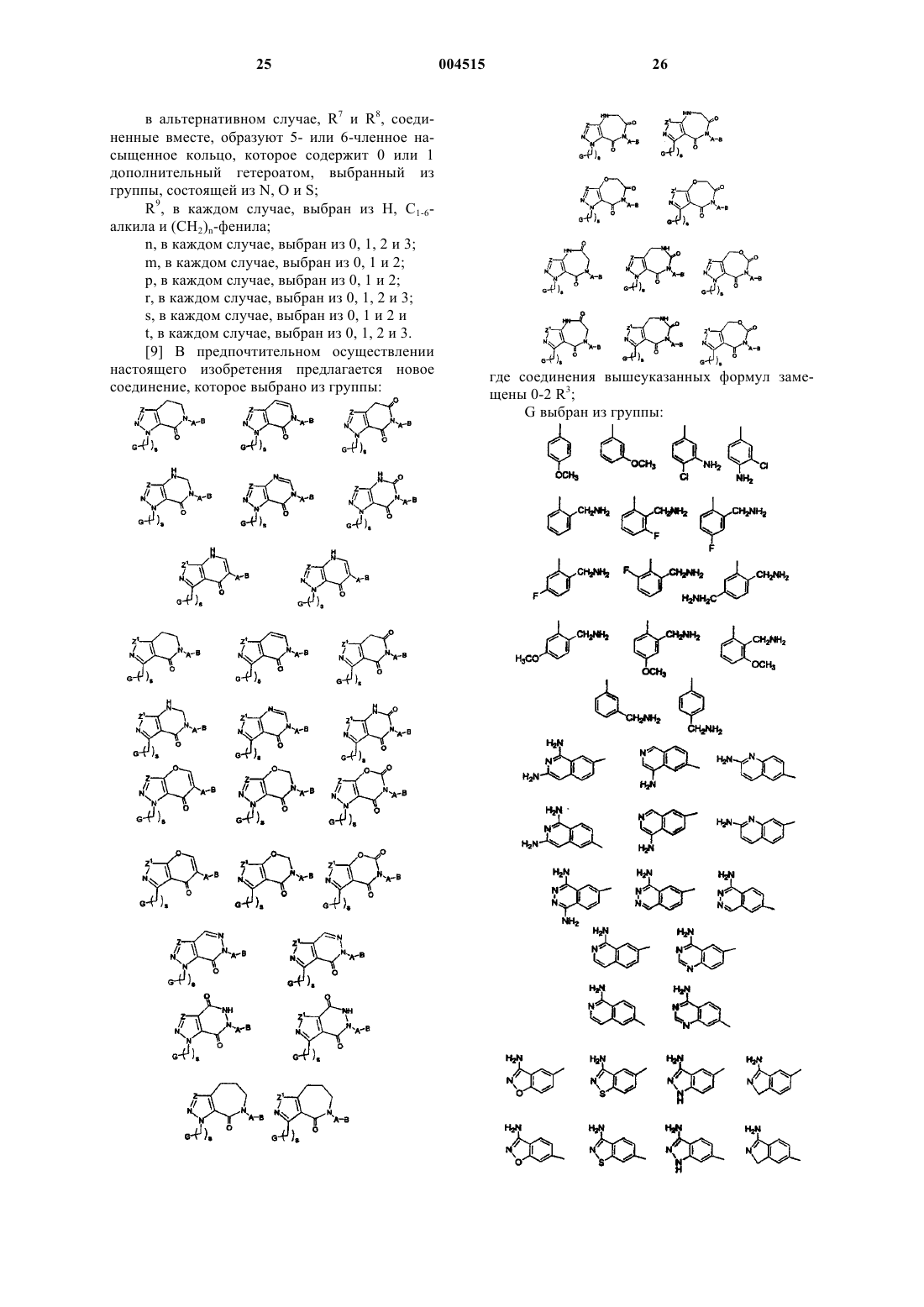
цикл F выбран из
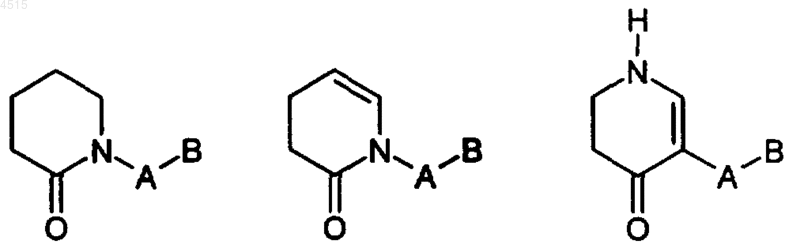
где соединения вышеуказанных формул замещены 0-2 R3;
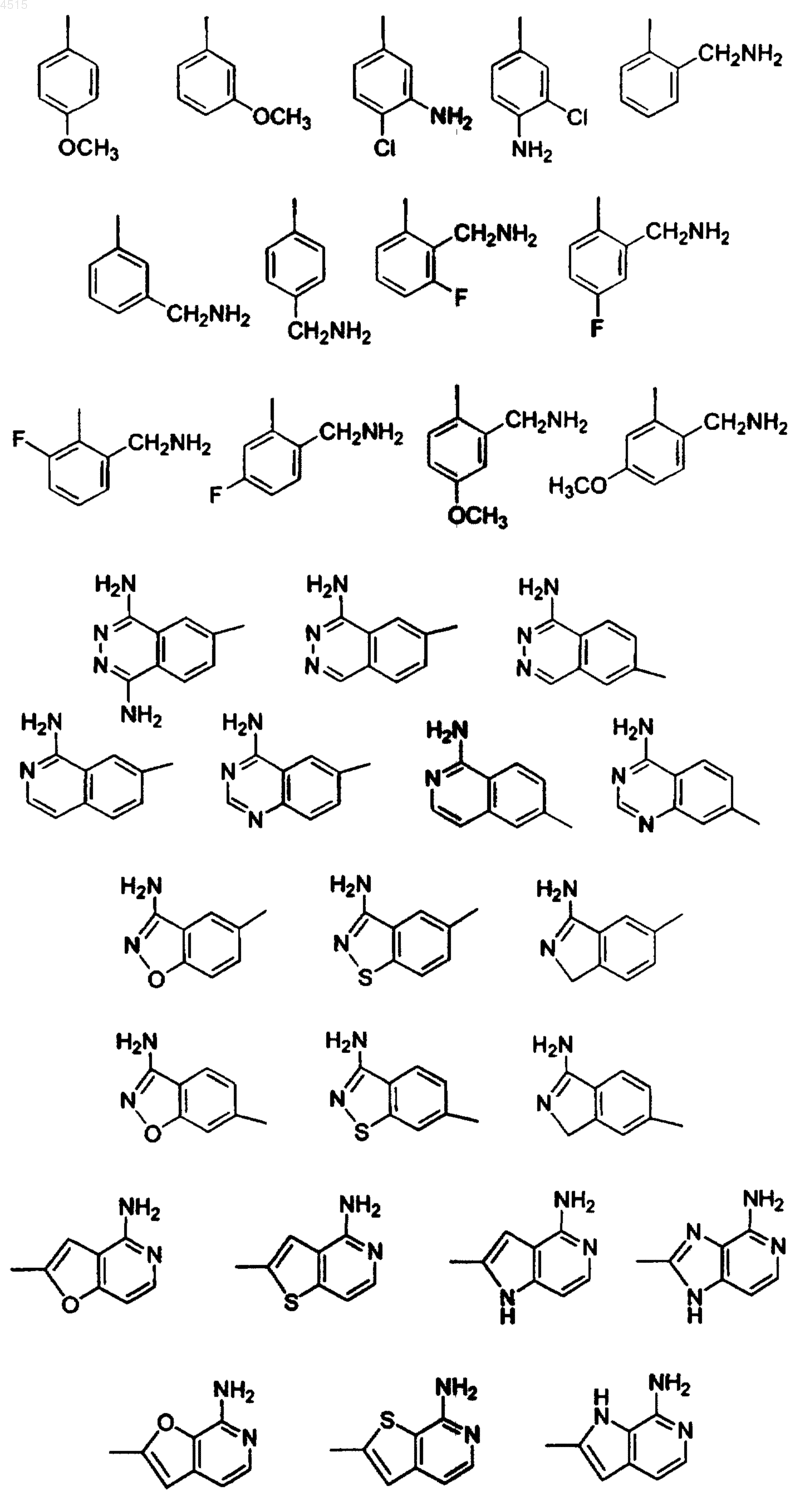
G выбран из
A выбран из фенила, пиридила и пиримидила и замещен 0-2 R4;
B выбран из X-Y, фенила, пирролидино, морфолино, 1,2,3-триазолила и имидазолила и замещен 0-1 R4a;
R2 в каждом случае выбран из H, CH3, CH2CH3, циклопропилметила, циклобутила и циклопентила;
R2a в каждом случае представляет H или CH3;
альтернативно, R2 и R2a вместе с атомом, к которому они присоединены, связываются с образованием пирролидина, замещеннго 0-2 R4b;
R4 в каждом случае выбран из OH, (CH2)rOR2, галогена, C1-4 алкила, (CH2)rNR2R2a и (CF2)rCF3;
R4a выбран из C1-4-алкила, CF3, (CH2)rOR2, (CH2)rNR2a, S(O)pR5, SO2NR2R2a и 1-CF3-тетразол-2-ила;
R4b в каждом случае выбран из H, CH3 и OH;
R5 в каждом случае выбран из CF3, C1-6 алкила, фенила и бензила;
X является CH2 или C(O);
Y выбран из пирролидино и морфолино и
r в каждом случае выбран из 0, 1 и 2;
при условии, что если соединение представляет собой 1,4,5,6-тетрагидропиразоло[3,4-c]пиридин-7-он, то Y является азотсодержащим неароматическим геретоциклом, присоединенным через атом азота, где либо
(a) B является X-Y, либо
(b) Y замещен по меньшей мере одним R4a, не являющимся H или алкилом.
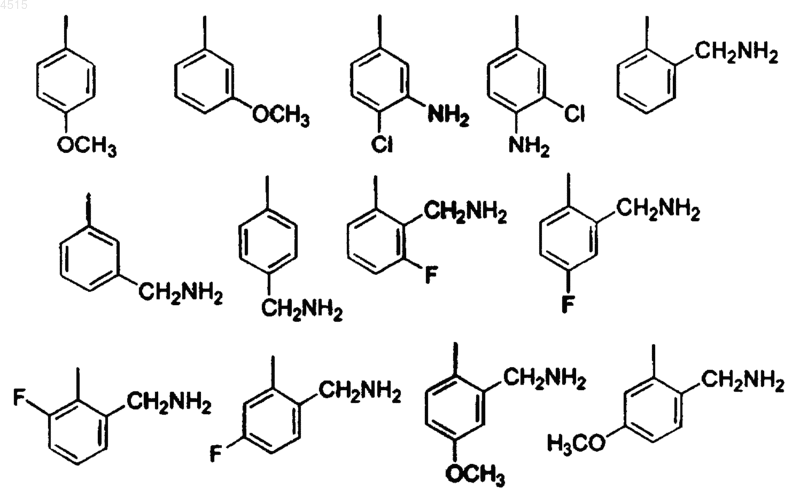
16. Соединение по п.15, где G выбран из
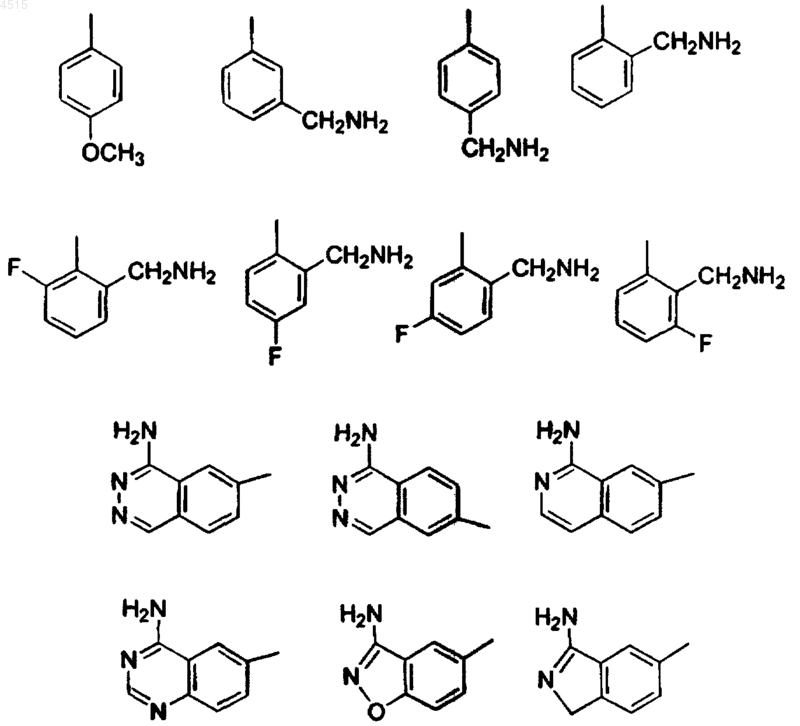
A выбран из группы, включающей фенил, 2-пиридил, 3-пиридил, 2-пиримидил, 2-Cl-фенил, 3-Cl-фенил, 2-F-фенил, 3-F-фенил, 2-метилфенил, 2-аминофенил и 2-метоксифенил; и
B выбран из группы, включающей 2-(аминосульфонил)фенил, 2-(метиламиносульфонил)фенил, 1-пирролидинокарбонил, 2-(метилсульфонил)фенил, 2-(N,N-диметиламинометил)фенил, 2-(N-пирролидинилметил)фенил, 1-метил-2-имидазолил, 2-метил-1-имидазолил, 2-(диметиламинометил)-1-имидазолил, 2-(N-(циклопропилметил)аминометил)фенил, 2-(N-(циклобутил)аминометил)-фенил, 2-(N-(циклопентил)аминометил)фенил и 2-(N-(3-гидроксипирролидинил)метил)фенил.
17. Соединение по п.1 общей формулы
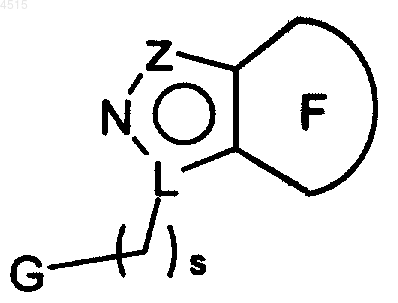
где Z является N, CR1a NR3;
L является N или C, при условии, что, когда L является N, Z является N или CR1a и что, когда L является C, Z является NR3;
цикл F выбран из
где соединения вышеуказанных формул замещены 0-2 R3.
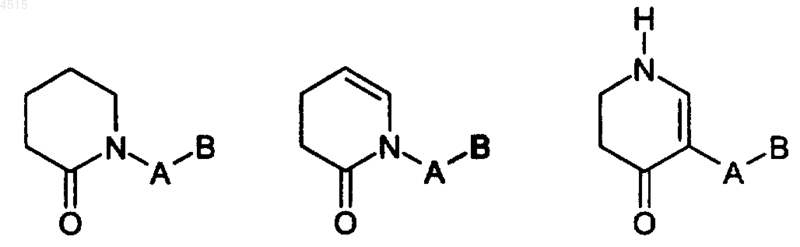
18. Соединение по п.1, где G выбран из
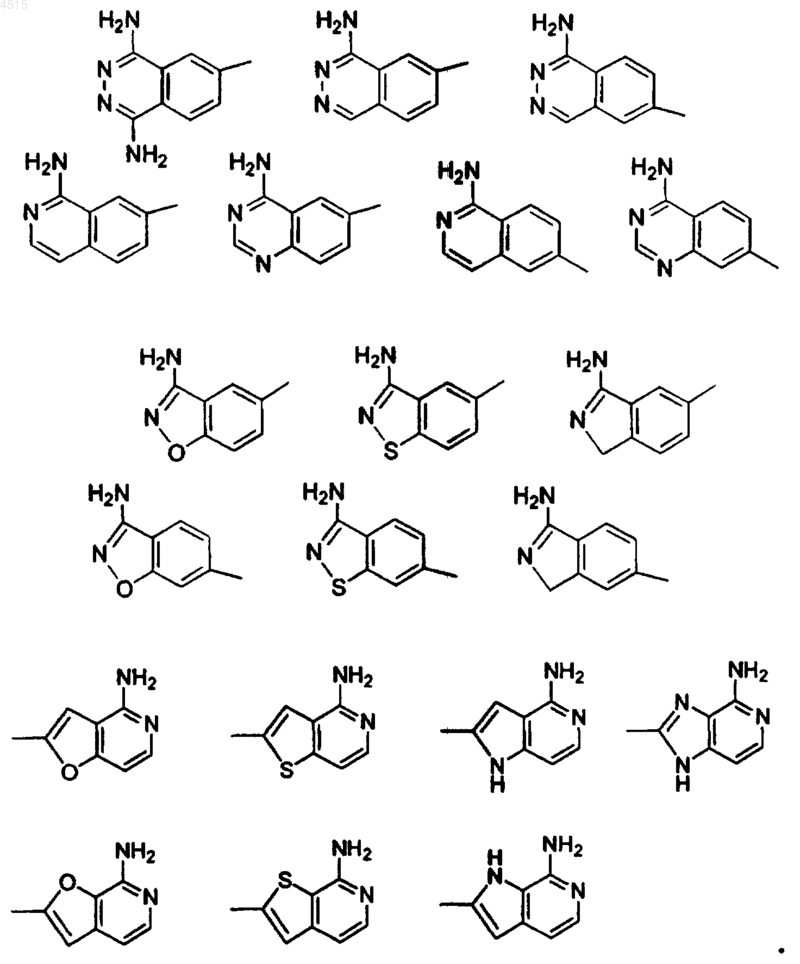
19. Соединение по п.1, где A выбран из фенила, пиридила и пиримидила и замещен 0-2 R4a.
20. Соединение по п.2, где
B выбран из X-Y, фенила, пирролидино, морфолино, 1,2,3-триазолила и имидазолила и замещен 0-1 R4a.
21. Соединение по п.1, где X является CH2 или C(O) и Y выбран из пирролидино и морфолина.
22. Соединение по п.1, где R4 в каждом случае выбран из OH, (CH2)rOR2, галогена, C1-4-алкила, (CH2)rNR2R2a и (CF2)rCF3.
23. Соединение по п.1, где R4a выбран из C1-4-алкила, CF3, (CH2)rOR2, (CH2)rNR2R2a, S(O)pR5, SO2NR2R2a и 1-CF3-тетразол-2-ила.
24. Соединение по п.4, где A выбран из группы, включающей фенил, 2-пиридил, 3-пиридил, 2-пиримидил, 2-Cl-фенил, 3-Cl-фенил, 2-F-фенил, 3-F-фенил, 2-метилфенил, 2-аминофенил и 2-метоксифенил.
25. Соединение по п.4, где B выбран из группы, включающей 2-(аминосульфонил)фенил, 2-(метиламиносульфонил)фенил, 1-пирролидинокарбонил, 2-(метилсульфонил)фенил, 2-(N,N-диметиламинометил)фенил, 2-(N-пирролидинилметил)фенил, 1-метил-2-имидазолил, 2-метил-1-имидазолил, 2-(диметиламинометил)-1-имидазолил, 2-(N-(циклопропилметил)аминометил)фенил, 2-(N-(циклобутил)аминометил)фенил, 2-(N-(циклопентил)аминометил)фенил и 2-(N-(3-гидроксипирролидинил)метил)фенил.
26. Фармацевтические композиции, включающие фармацевтически приемлемый носитель и терапевтически эффективное количество соединения по любому из пп.1-25 или его фармацевтически приемлемой соли.
27. Способ лечения или профилактики тромбоэмболического нарушения, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения по любому из пп.1-25 или его фармацевтически приемлемой соли.
28. Соединение по любому из пп.1-25 для применения в терапии.
29. Применение соединения по любому из пп.1-25 для приготовления лекарственного средства для лечения тромбоэмболического нарушения.
Текст
1 Область изобретения Настоящее изобретение относится, в общем, к азотсодержащим гетеробициклам, которые являются ингибиторами трипсинподобных ферментов серинпротеаз, в частности фактора Ха, фармацевтическим композициям, содержащим те же самые соединения, и способам применения их в качестве антикоагулирующих агентов для лечения и профилактики тромбоэмболических нарушений. Предпосылки создания изобретения В WO 94/20460 описываются являющиеся ингибиторами ангиотензина II соединения следующей формулы: где Х может быть рядом заместителей и Het может быть азотсодержащим гетеробициклом. Однако в WO 94/20460 не предлагается ингибирование фактора Ха или не приводятся примеры соединений, подобных соединениям настоящего изобретения. В WO 96/12720 описываются ингибиторы продуцирования фосфодиэстеразы типа IV и где Х может быть кислородом и R2 и R3 могут иметь различные значения как заместители,включая гетероцикл, гетероциклоалкил и фенил. Однако заявленные в настоящем изобретении соединения не соответствуют соединениям WO 96/12720. Кроме того, WO 96/12720 не предлагает ингибирование фактора Ха. В WO 98/52948 описываются ингибиторы керамидопосредованной сигнальной трансдукции. Одним из типов описанных ингибиторов являются соединения следующей формулы: где Y1 может быть N-R6, R6 может быть незамещенным арилалкилом или незамещенным гетероциклилалкилом и R1 может быть замещенной арильной группой. В WO 98/52948 не упоминается ингибирование фактора Ха или не приводятся соединения, подобные соединениям настоящего изобретения. В патентах США 3365459 и 3340269 иллюстрируются противовоспалительные ингибиторы следующей формулы 2 где А представляет 2-3 атома углерода, Х может быть О и R1 и R3 могут быть замещенными или незамещенными ароматическими группами. Ни в одном из данных патентов, однако, не приводятся в качестве примеров соединения настоящего изобретения. Активированный фактор Ха, основной практической ролью которого является генерация тромбина ограниченным протеолизом протромбина, имеет центральное положение, которое связывает механизмы внутренней и внешней активации в конечном общем пути коагуляции крови. Генерация тромбина, конечной серинпротеазы в процессе образования фибринового сгустка, из его предшественника амплифицируется образованием протромбиназного комплекса (фактора Ха, фактора V, Ca2+ и фосфолипида). Поскольку вычисление проводится на основе того, что из одной молекулы фактора Ха могут генерироваться 138 молекул тромбинаComplex: Probable role of the complex in the amplification of blood coagulation. Thromb. Res. 1979, 25, 617-629), ингибирование фактора Ха может быть более эффективным, чем инактивация тромбина при нарушении системы коагуляции крови. Следовательно, необходимы эффективные и специфические ингибиторы фактора Ха в качестве потенциально ценных терапевтических агентов для лечения тромбоэмболических нарушений. Таким образом, желательно открытие новых ингибиторов фактора Ха. Краткое изложение сущности изобретения В соответствии с этим одной целью настоящего изобретения является предоставление новых азотсодержащих гетеробициклов, которые можно использовать в качестве ингибиторов фактора Ха, или их фармацевтически приемлемых солей или пролекарств. Другой целью настоящего изобретения является предоставление фармацевтических композиций, включающих фармацевтически приемлемый носитель и терапевтически эффективное количество по меньшей мере одного из соединений настоящего изобретения или его фармацевтически приемлемой соли или пролекарства. Другой целью настоящего изобретения является предоставление способа лечения тромбоэмболических нарушений, включающего введение хозяину, нуждающемуся в таком лечении,терапевтически эффективного количества по меньшей мере одного из соединений настоящего изобретения или его фармацевтически приемлемой соли или пролекарства. Другой целью настоящего изобретения является предоставление новых бициклических соединений для использования в терапии. Другой целью настоящего изобретения является применение новых бициклических со 3 единений для изготовления лекарственного средства для лечения тромбоэмболического нарушения. Эти и другие цели, которые станут очевидны в процессе следующего подробного описания, были достигнуты благодаря открытию авторов изобретения, что заявленные в настоящее время бициклические соединения или их фармацевтически приемлемые соли или пролекарства являются эффективными ингибиторами фактора Ха. Подробное описание предпочтительных осуществлений[1] Так, в первом осуществлении настоящее изобретение предлагает новое соединение,выбранное из группы: или его стереоизомер или фармацевтически приемлемую соль, где соединения вышеуказанных формул замещены 0-2 R3;G представляет группу формулы I или II: где кольцо D выбрано из -(СН 2)3-, -(СН 2)4-,-CH2N=CH-, -CH2CH2N=H- и 5-6-членной ароматической системы, содержащей от 0 до 2 гетероатомов, выбранных из группы N, О и S, с условием, что присутствует от 0 до 1 атома О иR выбран из Cl, F, Br, I, ОН, C1-3-алкокси,NH2, NH(C1-3-алкил), N(С 1-3-алкил)2, CH2NH2,СН 2NН(С 1-3-алкил), СН 2N(С 1-3-алкил)2, CH2CH2NH2,СН 2 СН 2NН(С 1-3-алкил) и CH2CH2N(C1-3-алкил)2; в альтернативном случае кольцо D отсутствует; когда кольцо D отсутствует, кольцо Е выбрано из фенила, пиридила, пиримидила, пиразинила и пиридазинила, и кольцо Е замещено R" и R';(=NR7), C(O)NR7R8, (CR8R9)tNR7R8, SH, C1-3 алкил-S, S(O)R3b, S(O)2R3a, S(O)2NR2R2a и ОСF3,R' выбран из Н, F, Cl, Br, I, SR3, CO2R3,NO2, (CH2)tOR3, C1-4-алкила, ОСF3, СF3,C(O)NR7R8 и (CR8R9)tNR7R8; в альтернативном случае R" и R' соединяются с образованием метилендиокси или этилендиокси;R2a, в каждом случае, выбран из СF3, ОН,C1-4-алкокси, C1-6-алкила, бензила, С 3-6-карбоциклического остатка, замещенного 0-2 R4b, и 56-членной гетероциклической системы, содержащей от 1 до 4 гетероатомов, выбранных из группы, состоящей из N, О и S, и замещенной 02 R4b; в альтернативном случае R2 и R2a вместе с атомом, к которому они присоединены, связываются с образованием 5- или 6-членного насыщенного, частично насыщенного или ненасыщенного кольца, замещенного 0-2 R4b и содержащего от 0 до 1 дополнительного гетероатома,выбранного из группы, состоящей из N, О и S;S(CH2)2(CH2)tR1'; в альтернативном случае один R4 представляет 5-6-членный ароматический гетероцикл, содержащий от 1 до 4 гетероатомов, выбранных из группы, состоящей из N, О и S;(СF2)rСF3; в альтернативном случае один R4a представляет 5-6-членный ароматический гетероцикл, содержащий от 1 до 4 гетероатомов, выбранных из группы, состоящей из N, О и S, и замещенный 0-1 R5; 8 которое содержит от 0 до 1 дополнительного гетероатома, выбранного из группы, состоящей из N, О и S;[2] В предпочтительном осуществлении настоящее изобретение предлагает новое соединение, выбранное из группы где соединения вышеуказанных формул замещены 0-2 R3; А выбран из одной из следующих карбоциклических и гетероциклических систем, которые замещены 0-2 R4: фенил, пиперидинил, пиперазинил, пиридил, пиримидил, фуранил, морфолинил, тиофенил, пирролил, пирролидинил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил,имидазолил, оксадиазолил, тиадиазолил, триазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил,1,2,5-оксадиазолил, 1,3,4-оксадиазолил, 1,2,3 тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил, 1,2,3-триазолил, 1,2,4 триазолил, 1,2,5-триазолил, 1,3,4-триазолил,бензофуранил, бензотиофуранил, индолил, бензимидазолил, бензоксазолил, бензтиазолил, индазолил, бензизоксазолил, бензизотиазолил и изоиндазолил; В выбран из: Н, Y и X-Y; Х выбран из C1-4-алкилена, -С(О)-, -C(=NR)-,-CR2(NR2R2a)-, -C(O)CR2R2a-, -CR2R2aC(O)-, -C(O)NR2-,-NR2C(O)-, -C(O)NR2CR2R2a-, -NR2C(O)CR2R2a-,-CR2R2aC(O)NR2-, -CR2R2aNR2C(O)-, -NR2C(O)NR2-,-NR2-, -NR2CR2R2a-, -CR2R2aNR2-, O, -CR2R2aO- иCH2CH2NR R ; в альтернативном случае Y выбран из одной из следующих карбоциклических и гетероциклических систем, которые замещены 0-2 R4a: циклопропил, циклопентил, циклогексил,фенил, пиперидинил, пиперазинил, пиридил,пиримидинил, фуранил, морфолинил, тиофенил,пирролил, пирролидинил, оксазолил, изоксазолил, изоксазолинил, тиазолил, изотиазолил, пиразолил, имидазолил, оксадиазолил, тиадиазолил, триазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5 тиадиазолил, 1,3,4-тиадиазолил, 1,2,3-триазолил, 1,2,4-тpиaзoлил, 1,2,5-триазолил, 1,3,4 триазолил, бензофуранил, бензотиофуранил,индолил, бензимидазолил, бензоксазолил, бензтиазолил, индазолил, бензизоксазолил, бензизотиазолил и изоиндазолил; в альтернативном случае, Y выбран из следующих бициклических систем гетероарильных колец:[3] В более предпочтительном осуществлении настоящее изобретение предлагает новое соединение, выбранное из группы: где соединения вышеуказанных формул замещены 0-2 R3;[4] В еще более предпочтительном осуществлении настоящее изобретение предлагает новое соединение, где G выбран из[5] В еще более предпочтительном осуществлении настоящее изобретение предлагает новое соединение, где А выбран из фенила, пиридила и пиримидила и замещен 0-2 R4; и В выбран из X-Y, фенила, пирролидино,морфолино, 1,2,3-триазолила и имидазолила и замещен 0-1 R4a;Y выбран из пирролидино и морфолино; и[6] В следующем предпочтительном осуществлении настоящее изобретение предлагает новое соединение, у которого: А выбран из группы: фенил, 2-пиридил, 3 пиридил, 2-пиримидил, 2-Сl-фенил, 3-Сl-фенил,2-F-фенил, 3-F-фенил, 2-метилфенил, 2-аминофенил и 2-метоксифенил; и В выбран из группы: 2-(аминосульфонил) фенил, 2-(метиламиносульфонил)фенил, 1-пирролидинокарбонил, 2-(метилсульфонил)фенил,2-(N,N-диметиламинометил)фенил, 2-(N-пирролидинилметил)фенил, 1-метил-2-имидазолил, 2 метил-1-имидазолил, 2-(диметиламинометил)-1 имидазолил, 2-(N-(циклопропилметил)аминометил)фенил,2-(N-(циклобутил)аминометил) фенил, 2-(N-(циклопентил)аминометил)фенил и 2-(N-(3-гидроксипирролидинил)метил)фенил.[7] Еще в одном предпочтительном осуществлении настоящее изобретение предлагает новое соединение, выбранное из группы: 1-[4-метоксифенил]-3-циано-6-[2'-метилсульфонил-3-фтор[1,1']бифен-4-ил]-1,4-дигидропиразоло[4,3-d]пиримидин-5,7-дион; 1-[4-метоксифенил]-3-(метоксикарбонил)6-[2'-аминосульфонил-3-фтор[1,1']бифен-4-ил]1,6-дигидропиразоло[4,3-d]пиримидин-7-он; 1-[4-метоксифенил]-3-(аминокарбонил)-6[2'-аминосульфонил-3-фтор[1,1']бифен-4-ил]1,6-дигидропиразоло[4,3-d]пиpимидин-7-oн; 1-[4-метоксифенил]-3-(метоксикарбонил)6-[2'-аминосульфонил[1,1']бифен-4-ил]-1,6 дигидропиразоло[4,3-d]пиримидин-7-он; 1-[4-метоксифенил]-6-[2'-аминосульфонил 20 фторфенил]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он; 1-[3-аминобензизоксазол-5'-ил]-3-трифторметил-6-[4-(2-(диметиламинометил)имидазол-1'ил)фенил]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он и 1-[3-аминобензизоксазол-5'-ил]-3-метил-6[4-(2-(диметиламинометил)имидазол-1'-ил)-2 фторфенил]-1,4,5,6-тетрагидропиразоло[3,4-с] пиридин-7-он или его фармацевтически приемлемую соль.[8] Так, в другом осуществлении настоящего изобретения предлагается новое соединение, выбранное из группы: 22 или его стереоизомер или его фармацевтически приемлемая соль, где соединения вышеуказанных формул замещены 0-2 R3;G представляет группу формулы I или II: кольцо D выбрано из -(СН 2)3-, -(СН 2)4-,-CH2N=CH-, -CH2CH2N=CH- и 5-6-членной ароматической системы, содержащей от 0 до 2 гетероатомов, выбранных из группы N, О и S, с условием, что присутствует 0 или 1 атом О и S; кольцо D, когда оно присутствует, замещено 0-2 R; Е выбран из фенила, пиридила, пиримидила, пиразинила и пиридазинила, замещенного 01 R;R выбран из Cl, F, Вr, I, ОН, C1-3-алкокси,NH2, NH(C1-3-алкил), N(С 1-3-алкил)2, СН 2NН 2,СН 2NH(С 1-3-алкил), СН 2N(С 1-3-алкил)2, CH2CH2NH2,СН 2 СН 2NН(С 1-3-алкил) и СН 2 СН 2N(С 1-3-алкил)2; в альтернативном случае кольцо D отсутствует; когда кольцо D отсутствует, кольцо Е выбрано из фенила, пиридила, пиримидила, пиразинила и пиридазинила, и кольцо Е замещено R" и R';R' выбран из Н, F, Cl, Br, I, SR3, CO2R3,NO2, (CH2)tOR3, C1-4-алкила, ОСF3, СF3,C(O)NR7R8 и (CR8R9)tNR7R8; в альтернативном случае R" и R' совместно образуют метилендиокси или этилендиокси;R2c, в каждом случае, выбран из СF3, ОН,C1-4-алкокси, C1-6-алкила, бензила, С 3-6-карбоциклического остатка, замещенного 0-2 R4b, и 56-членной карбоциклической системы, содержащей от 1 до 4 гетероатомов, выбранных из группы, состоящей из N, О и S, и замещенного 0-2 R4b; в альтернативном случае, R2 и R2a вместе с атомом, к которому они присоединены, связываются с образованием 5- или 6-членного насыщенного, частично насыщенного или ненасыщенного кольца, замещенного 0-2 R4b и содержащего 0 или 1 дополнительный гетероатом,выбранный из группы, состоящей из N, О и S;[9] В предпочтительном осуществлении настоящего изобретения предлагается новое соединение, которое выбрано из группы: где соединения вышеуказанных формул замещены 0-2 R3; 28 зтиазолил, индазолил, бензизоксазолил, бензизотиазолил и изоиндазолил; в альтернативном случае, Y выбран из следующих бициклических систем гетероарильных колец: А выбран из одной из следующих карбоциклических и гетероциклических систем, которые замещены 0-2 R4: фенил, пиперидинил, пиперазинил, пиридил, пиримидил, фуранил, морфолинил, тиофенил, пирролил, пирролидинил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил,имидазолил, оксадиазолил, тиадиазолил, триазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил,1,2,5-оксадиазолил, 1,3,4-оксадиазолил, 1,2,3 тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил, 1,2,3-триазолил, 1,2,4 триазолил, 1,2,5-триазолил, 1,3,4-триазолил,бензофуранил, бензотиофуранил, индолил, бензимидазолил, бензоксазолил, бензтиазолил, индазолил, бензизоксазолил, бензизотиазолил и изоиндазолил; В выбран из: Н, Y и X-Y; Х выбран из C1-4-алкилена, -С(О)-,-C(=NR)-,-CR2(NR2R2a)-,-С(О)CR2R2a-,2 2a 2 2CH2CH2NR R ; в альтернативном случае, Y выбран из одной из следующих карбоциклических и гетероциклических систем, которые замещены 0-2 R4a: циклопропил, циклопентил, циклогексил,фенил, пиперидинил, пиперазинил, пиридил,пиримидил, фуранил, морфолинил, тиофенил,пирролил, пирролидинил, оксазолил, изоксазолил, изоксазолинил, тиазолил, изотиазолил, пиразолил, имидазолил, оксадиазолил, тиадиазолил, триазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5 тиадиазолил, 1,3,4-тиадиазолил, 1,2,3-триазолил, 1,2,4-триазолил, 1,2,5-триазолил, 1,3,4 триазолил, бензофуранил, бензотиофуранил,индолил, бензимидазолил, бензоксазолил, бен[10] В другом осуществлении настоящее изобретение предлагает новые фармацевтические композиции, включающие фармацевтически приемлемый носитель и терапевтически эффективное количество соединения формулы(I) или его фармацевтически приемлемой соли.[11] В другом осуществлении настоящее изобретение предлагает новый способ лечения или профилактики тромбоэмболического нарушения, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли.[12] В другом осуществлении настоящее изобретение предлагает новые бициклические соединения, как описано выше, для использования в терапии.[13] В другом осуществлении настоящее изобретение предлагает использование новых бициклических соединений, как описано выше,для приготовления лекарственного средства для лечения тромбоэмболического нарушения. Определения Описанные здесь соединения могут иметь асимметричные центры. Соединения настоящего изобретения, содержащие асимметрично замещенный атом, могут быть выделены в оптически активных или рацемических формах. В данной области техники хорошо известно, как получить оптически активные формы, например, разделением рацемических форм или синтезом из оптически активных исходных материалов. Многие геометрические изомеры олефинов, соединений с двойными связями C=N и подобными могут также присутствовать в описанных здесь соединениях, и все такие стабильные изомеры рассматриваются в настоящем изобретении. Описываются геометрические циси транс-изомеры соединений настоящего изобретения, их можно выделить в виде смеси изомеров или в виде разделенных изомерных форм. Подразумеваются все хиральные, диастереомерные, рацемические формы и все геометрические изомерные формы структуры, если конкретно не указывается конкретная стереохимия или изомерная форма. Все способы, использованные для получения соединений настоящего изобретения, считаются частью настоящего изобретения. 29 Термин замещенный, используемый здесь, означает, что любой один или несколько водородов на обозначенном атоме заменены на выбранную из указанных групп, с условием, что не превышается нормальная валентность обозначенного атома и что замещение приводит к образованию стабильного соединения. Когда заместителем является кето (т.е. =O), тогда заменяются 2 водорода на атоме. Кетозаместители не присутствуют на ароматических остатках. Настоящее изобретение предназначается для включения всех изотопов атомов, имеющих место в настоящих соединениях. Изотопы включают атомы, имеющие такой же атомный номер, но другие массовые числа. В качестве общего примера и без ограничения их, изотопы водорода включают тритий и дейтерий. Изотопы углерода включают С-13 и С-14. Когда любое изменяемое значение радикала (например, R6) встречается более, чем один раз, в любой составной части или формуле соединения, его определение в каждом случае не зависит от его определения в любом другом случае. Таким образом, например, если показано, что группа замещена 0-2 R6, то указанная группа может быть необязательно замещена одной или двумя группами R6, и R6 в каждом случае выбраны независимо от определения R6. Кроме того, сочетания заместителей и/или изменяемых значений радикалов допускаются,только если такие сочетания приводят к образованию стабильных соединений. Когда показано, что связь к заместителю пересекает связь, соединяющую два атома в кольце, тогда такой заместитель может связываться с любым атомом кольца. Когда заместитель перечисляется без указания атома, через который такой заместитель связывается с остальной частью соединения данной формулы,тогда такой заместитель может быть связан через любой атом в таком заместителе. Сочетания заместителей и/или изменяемых значений радикалов допускаются, только если такие сочетания приводят к образованию стабильных соединений. Подразумевается, что используемый здесь термин алкил, включает насыщенные алифатические углеводородные группы как с разветвленной, так и неразветвленной цепью, имеющие определенное число атомов углерода. Имеется в виду, что C1-10-алкил включает алкильные группы C1, С 2, С 3, С 4, C5, C6, С 7, С 8, С 9 и С 10. Примеры алкила включают, но не ограничиваются ими, метил, этил, н-пропил, изопропил, н-бутил,втор-бутил, трет-бутил, н-пентил и втор-пентил. Подразумевается, что галогеналкил включает насыщенные алифатические углеводородные группы как с разветвленной, так и неразветвленной цепью, имеющие определенное число атомов углерода и замещенные 1 или несколькими атомами галогена (например, -CvFw, где v 30 геналкила включают, но не ограничиваются ими, трифторметил, трихлорметил, пентафторэтил и пентахлорэтил. Алкокси представляет алкильную группу, как определено выше, с указанным числом атомов углерода, связанную через кислородный мостик. Имеется в виду, чтоC1-10-алкокси включает алкоксигруппы C1, C2,С 3, С 4, C5, С 6, С 7, С 8, С 9 и С 10. Примеры алкокси включают, но не ограничиваются ими, метокси,этокси, н-пропокси, изопропокси, н-бутокси,втор-бутокси, трет-бутокси, н-пентокси и вторпентокси. Подразумевается, что циклоалкил включает насыщенные циклические группы,такие как циклопропил, циклобутил или циклопентил. Имеется в виду, что С 3-7-циклоалкил включает циклоалкильные группы С 3, С 4, C5, С 6 и С 7. Подразумевается, что алкенил включает углеводородные цепи неразветвленного или разветвленного строения и одну или несколько ненасыщенных углерод-углеродных связей, которые могут присутствовать в любом стабильном положении по цепи, такие как этенил и пропенил. Имеется в виду, что С 2-10-алкенил включает алкенильные группы С 2, С 3, С 4, С 5, С 6,С 7, С 8, С 9 и С 10. Подразумевается, что алкинил включает углеводородные цепи неразветвленного или разветвленного строения и одну или несколько тройных углерод-углеродных связей,которые могут присутствовать в любом стабильном положении по цепи, такие как этинил и пропинил. Имеется в виду, что С 2-10-алкинил включает алкинильные группы С 2, С 3, С 4, C5, С 6,С 7, С 8, С 9 и С 10. Используемый здесь термин галоген относится к фтору, хлору, брому и иоду, и противоион используют, чтобы обозначить небольшой, отрицательно заряженный ион, такой как хлорид, бромид, гидроксид, ацетат и сульфат. Подразумевается, что используемый здесь карбоцикл или карбоциклический остаток означает любой стабильный 3-, 4-, 5-, 6- или 7 членный моноцикл или бицикл или 7-, 8-, 9-, 10-,11-, 12- или 13-членный бицикл или трицикл,любой из которых может быть насыщенным,частично насыщенным или ароматическим. Примеры указанных карбоциклов включают, но не ограничиваются ими, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил,адамантил, циклооктил, [3.3.0]бициклооктан,[4.3.0]бициклононан,[4.4.0]бициклодекан,[2.2.2]бициклооктан, флуоренил, фенил, нафтил,инданил, адамантил и тетрагидронафтил. Подразумевается, что используемый здесь термин гетероцикл или гетероциклическая система означает стабильное 5-, 6- или 7 членное моноциклическое или бициклическое или 7-, 8-, 9- или 10-членное бициклическое гетероциклическое кольцо, которое насыщено,частично насыщено или ненасыщено (ароматическое) и которое состоит из атомов углерода и 1, 2, 3 или 4 гетероатомов, независимо, выбран 31 ных из группы, состоящей из N, NH, О и S,включая любую бициклическую группу, в которой любое из вышеуказанных гетероциклических колец конденсировано с кольцом бензола. Гетероатомы азота и серы могут быть, необязательно, окислены. Гетероциклическое кольцо может быть связано со своей боковой группой у любого гетероатома или атома углерода, что приводит к образованию стабильной структуры. Описанные здесь гетероциклические кольца могут быть замещены у атома углерода или азота, если получаемое соединение стабильно. Азот в гетероцикле может быть, необязательно, кватернизован. Когда общее число атомов S и О в гетероцикле превышает 1, то данные гетероатомы, предпочтительно, не являются соседними друг с другом. Предпочтительно, чтобы общее число атомов S и О в гетероцикле было не больше, чем 1. Подразумевается, что используемый здесь термин ароматическая гетероциклическая система или гетероарил означает стабильное 5-, 6- или 7-членное моноциклическое или бициклическое или 7-, 8-, 9- или 10 членное бициклическое гетероциклическое ароматическое кольцо, которое состоит из атомов углерода и 1, 2, 3 или 4 гетероатомов, независимо выбранных из группы, состоящей из N, NH,O и S. Следует отметить, что общее число атомов S и О в ароматическом гетероцикле не превышает 1. Примеры гетероциклов включают, но не ограничиваются ими, акридинил, азоцинил, бензимидазолил, бензофуранил, бензотиофуранил,бензотиофенил, бензоксазолил, бензоксазолинил, бензтиазолил, бензтриазолил, бензтетразолил, бензизоксазолил, бензизотиазолил, бензимидазолинил, карбазолил, 4 аН-карбазолил, карболинил, хроманил, хроменил, циннолинил,декагидрохинолинил, 2 Н,6 Н-1,5,2-дитиазинил,дигидрофуро[2,3-b]тетрагидрофуран, фуранил,фуразанил, имидазолидинил, имидазолинил,имидазолил, 1H-индазолил, индоленил, индолинил, индолизинил, индолил, 3 Н-индолил, изатиноил, изобензофуранил, изохроманил, изоиндазолил, изоиндолинил, изоиндолил, изохинолинил, изотиазолил, изоксазолил, метилендиоксифенил, морфолинил, нафтиридинил, октагидроизохинолинил, оксадиазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил,1,3,4-оксадиазолил, оксазолидинил, оксазолил,оксиндолил, пиримидинил, фенантридинил,фенантролинил, феназинил, фенотиазинил, феноксатинил, феноксазинил, фталазинил, пиперазинил, пиперидинил, пиперидонил, 4-пиперидонил, пиперонил, птеридинил, пуринил, пиранил, пиразинил, пиразолидинил, пиразолинил,пиразолил, пиридазинил, пиридооксазол, пиридоимидазол, пиридотиазол, пиридинил, пиридил, пиримидинил, пирролидинил, пирролинил,2 Н-пирролил, пирролил, хиназолинил, хинолинил, 4 Н-хинолизинил, хиноксалинил, хинуклидинил, тетрагидрофуранил, тетрагидроизохино 004515 32 линил, тетрагидрохинолинил, тетразолил, 6 Н 1,2,5-тиадиазинил, 1,2,3-тиадиазолил, 1,2,4 тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил, тиантренил, тиазолил, тиенил, тиенотиазолил, тиенооксазолил, тиеноимидазолил, тиофенил, триазинил, 1,2,3-триазолил, 1,2,4 триазолил, 1,2,5-триазолил, 1,3,4-триазолил и ксантенил. Включены также соединения с конденсированным кольцом и спиросоединения,содержащие, например, вышеуказанные гетероциклы. Используемый здесь термин фармацевтически приемлемый относится к тем соединениям, материалам, композициям и,или лекарственным формам, которые, исходя из тщательной оценки специалиста-медика, подходят для использования в контакте с тканями человека и животных и не вызывают при этом излишнюю токсичность, раздражение, аллергическую реакцию или другие проблемы или осложнения, соответствующие приемлемому отношению польза/риск. Используемые здесь фармацевтически приемлемые соли относятся к производным описанных соединений, где родительское соединение модифицируют превращением его в соли с кислотами или основаниями. Примеры фармацевтически приемлемых солей включают,но не ограничиваются ими, соли с минеральными или органическими кислотами основных остатков, таких как амины; щелочных или органических солей кислотных остатков, таких как карбоновые кислоты и тому подобное. Фармацевтически приемлемые соли включают общепринятые нетоксичные соли или четвертичные аммониевые соли родительского соединения,образованные, например, из нетоксичных неорганических или органических кислот. Такие общепринятые нетоксичные соли включают,например, соли, полученные из неорганических кислот, таких как хлористовородная, бромистоводородная, серная, сульфаминовая, фосфорная,азотная и тому подобное; и соли, полученные из органических кислот, таких как уксусная, пропионовая, янтарная, гликолевая, стеариновая,молочная, яблочная, винная, лимонная, аскорбиновая, памоевая, малеиновая, гидроксималеиновая, фенилуксусная, глутаминовая, бензойная,салициловая, сульфаниловая, 2-ацетоксибензойная, фумаровая, толуолсульфоновая, метансульфоновая, этандисульфоновая, щавелевая,изэтионовая и тому подобное. Фармацевтически приемлемые соли настоящего изобретения можно синтезировать из родительского соединения, которое содержит основную или кислотную часть, общепринятыми химическими способами. Обычно такие соли можно получить взаимодействием форм свободных кислот или оснований данных соединений со стехиометрическим количеством подходящего основания или кислоты в воде или в органическом растворителе или в смеси последних 33 двух; обычно предпочтительна неводная среда,подобная простому эфиру, этилацетату, этанолу,изопропанолу или ацетонитрилу. Список подходящих кислот можно найти в публикацииRemington's Pharmaceutical Sciences, 17th ed.,Mack Publishing Company, Easton, PA, 1985, p. 1418, описание которой, таким образом, включается здесь в качестве ссылки. Поскольку известно, что пролекарства повышают многочисленные желательные свойства фармацевтических средств (например, растворимость, биологическую доступность, изготовление и т.д.), соединения настоящего изобретения можно доставить в форме пролекарства. Таким образом, настоящее изобретение предназначается для включения пролекарств заявленных в настоящее время соединений, способов доставки их и содержащих их композиций. Подразумевается, что пролекарства включают любые ковалентно связанные носители, которые высвобождают активное родительское лекарственное средство настоящего изобретения invivo, когда такое пролекарство вводят субъектумлекопитающему. Пролекарства настоящего изобретения получают модификацией функциональных групп, присутствующих в соединении,таким способом, чтобы продукты модификации расщеплялись либо при общепринятой манипуляции, либо in vivo, в родительское соединение. Пролекарства включают соединения настоящего изобретения, у которых гидрокси,амино или сульфгидрильная группа связана с любой группой так, что когда пролекарство настоящего изобретения вводят субъекту млекопитающему, она отщепляется с образованием свободной гидроксильной, свободной амино или свободной сульфгидрильной группы,соответственно. Примеры пролекарств включают, но не ограничиваются ими, ацетатное, формиатное и бензоатное производные спиртовых и аминных функциональных групп в соединениях настоящего изобретения. Предпочтительными пролекарствами являются амидиновые пролекарства, у которых D представляет C(=NR7)NH2 или его таутомер C(=NH)NHR7, и R7 выбран из ОН, C1-4-алкокси, С 6-10-арилокси, C1-4-алкоксикарбонила, С 6-10-арилоксикарбонила, C6-10-арилметилкарбонила, С 1-4-алкилкарбонилокси-С 1-4 алкоксикарбонила и С 6-10-арилкарбонилоксиС 1-4-алкоксикарбонила. Более предпочтительны пролекарства, у которых R7 представляет ОН,метокси, этокси, бензилоксикарбонил, метоксикарбонил и метилкарбонилоксиметоксикарбонил. Стабильное соединение и стабильная структура предназначаются для обозначения соединения, которое достаточно устойчиво к выделению в неизмененной форме до пригодной степени чистоты из реакционной смеси и превращению в эффективный терапевтический агент. 34 Замещенный предназначается для обозначения того, что один или несколько водородов на атоме, обозначенном в выражении с использованием замещенный, заменены на выбранную указанную группу(ы), с условием, что не превышается нормальная валентность указанного атома и что замещение приводит к образованию стабильного соединения. Когда заместителем является кетогруппа (т.е. =O), то заменяются 2 водорода на атоме. Терапевтически эффективное количество предназначается для включения количества соединения настоящего изобретения или количества сочетания заявленных соединений, эффективных для ингибирования фактора Ха. Сочетание соединений, предпочтительно, представляет собой синергическое сочетание. Синергия, как описано, например, Chou andTalalay, Adv. Enzyme Regul. 1984, 22:27-55, имеет место, когда действие (в данном случае, ингибирование фактора Ха) соединений при введении в сочетании выше, чем аддитивное действие соединений при введении по отдельности в виде одного агента. В общем, синергическое действие очень четко демонстрируется при субоптимальных концентрациях указанных соединений. Синергия может быть выражена в отношении более низкой токсичности, повышенного антивирусного действия или некоторого другого полезного действия сочетания соединений по сравнению с индивидуальными компонентами. Синтезы Соединения настоящего изобретения можно получить различными способами, известными специалисту в области органического синтеза. Соединения настоящего изобретения можно синтезировать с использованием способов, описанных ниже, вместе с синтетическими способами, известными в области синтеза органической химии, или их вариантов, как принято специалистами в данной области. Предпочтительные способы включают, но не ограничиваются ими, способы, описанные ниже. Реакции проводят в растворителе, подходящем для используемых реагентов и материалов и подходящем для проводимых превращений. Специалистам в области органического синтеза должно быть известно, что функциональные группы, присутствующие в молекуле, должны быть совместимы с предполагаемыми превращениями. Иногда здравый смысл требует модификации последовательности синтетических стадий или выбор одной конкретной схемы способа относительно другой для получения требуемого соединения изобретения. Известно также, что другим основным соображением при планировании любого синтетического пути в этой области является разумный выбор защитной группы, используемой для защиты реакционноспособных функциональных групп, присутствующих в соединениях, описанных в данном изобретении. Авто 35 ритетный обзор, описывающий многие альтернативные способы для подготовленного специалиста, дается Greene и Wuts (Protective Groups InOrganic Synthesis, Wiley and Sons, 1991). Все ссылки, перечисленные здесь, таким образом,включаются здесь во всей их полноте в качестве ссылки. Соединения настоящего изобретения,представленные формулой I, состоят из группыD-E-G-(СН 2)s и группы А-В, присоединенных к ядру [5,6]-или [5,7]-гетеробициклической структуры разнообразного состава. Пятичленным кольцом может быть пиразол, триазол, изоксазол или изотиазол, и это кольцо может быть конденсировано с различными шести- или семичленными кольцами, включающими, но не ограничивающимися ими, пиперидинон, пиридинон, пиримидинон, пиримидиндион, пиранон,диазепинон, диазепиндион. В последующем обсуждении и схемах будут описаны способы синтеза гетеробициклических колец и присоединения к группам G-(CH2)s- и А-В. 4-Аминопиразол-5-карбоксилат V можно использовать в качестве промежуточного продукта для получения многих пиразолконденсированных соединений формулы I, где остаток G-(CH2)s- связан с атомом азота пиразола (схема I) . Данный промежуточный продукт можно получить различными путями из гидразинов I. Гидразины I представляют собой легко доступные исходные материалы. Ароматические гидразины (G представляет арил, s = 0) удобно получают из соответствующего анилина диазотированием его NaNO2 в кислой среде с последующим восстановлением получаемого диазониевого иона подходящим восстанавливающим агентом, причем предпочтительным реагентом является SnCl2. Неароматические гидразины, представленные I, легко получают различными способами, такими как замена подходящего галогенсоединения гидразином или защищенным гидразином с последующим снятием защиты. Конденсация гидразинов I с подходящим полуацеталем или альдегидом с последующим галогенированием NBS или NCS приводит к образованию гидразидоилгалогенидов IX. В альтернативном случае, гидразины I можно ацилировать хлорангидридом кислоты и превратить в гидразидоилгалогениды II обработкой системой тетрагалогенид углерода/трифенилфосфин. Гидразидоилгалогениды II являются универсальными промежуточными продуктами для синтеза пиразолов (Shawali, A.S.; et al., J, Het. Chem. 1980, 17, 833). Галогенид можно заменить на цианид-ион для получения цианида III. Цианосоединения данного типа (гдеG представляет арил и s = 0) можно также получить более непосредственно диазотированием анилина IV с последующей непосредственной реакцией с цианосодержащим активным метиленовым соединением, где R1a может включать различные группы, такие как сложноэфирнаяChem. Soc. Chem. Commun. 1992, 20, 1481). Обработка III бромацетатом в присутствии подходящего основания, такого как карбонат или триалкиламин, приводит к N-алкилированию, последующее замыкание цикла дает 4-аминопиразол-5-карбоксилат V. В альтернативном случае, обработка II нитропируватом в присутствии основания, такого как алкоксид, дает 4 нитропиразол замещением галогенида с последующим замыканием кольца связыванием азота с карбонильной группой. Восстановление нитрогруппы можно выполнить различными восстанавливающими агентами, предпочтительным агентом из которых является SnCl2, чтобы получить 4-аминопиразол-5-карбоксилат V. Гидразидоилгалогенид II можно также подвергнуть взаимодействию со сложным кетоэфиром, гдеR1 представляет защищенный сложный эфир,предпочтительно, 2-фурильный остаток, для получения пиразол-4-карбоксилата VI. Гидролиз сложного эфира, превращение в ацилазид,либо через образование хлорангидрида или ангидрида кислоты, нагревание для образования изоцианата посредством перегруппировки Курциуса и, наконец, обработка водой дают 4 аминопиразол VII. В альтернативном случае,амино можно защитить в виде подходящего карбамата с использованием спирта вместо воды в перегруппировке Курциуса. Когда R' представляет 2-фурил, фуран можно окислительным способом расщепить в различных условиях, например, периодатом натрия с каталитическим трихлоридом рутения или KMnO4 с образованием карбоновой кислоты, которую можно этерифицировать, чтобы получить 4-аминопиразол-5 карбоксилат V. Другой путь к 4-аминопиразолу V включает конденсацию гидразина I с подходящим дикетоном или монозащищенным дикетоном с образованием 3,5-дизамещенного пиразола, у которого 5-заместителем является эфир карбоновой кислоты. При правильном выборе группыG данный пиразол можно селективно нитровать в 4-положении нитрующими агентами, такими как азотная кислота или смесь нитрат аммония/трифторуксусный ангидрид. Восстановление нитрогруппы в различных условиях, таких как хлорид олова (II) или каталитическое гидрирование, дает 4-аминопиразол V. Этот путь получения можно также проводить с использованием дикетона с 2-фурильной группой как латентного карбоксилата, чтобы получить сначала 3,5-дизамещенный пиразол, у которого 5 заместителем является 2-фурильная группа. Окислительное расщепление фурильной группы с образованием карбоксилата, нитрование 4 положения пиразола, этерификация и восстановление нитрогруппы затем дают 4-аминопиразол V. Специалисту в данной области должно быть известно, что выбранный синтети 37 ческий путь для получения V будет зависеть от дополнительной функциональной группы, присутствующей в представляющей интерес молекуле, и выбранный путь может потребовать дополнительных стадий защиты/снятия защиты, а также модификации в последовательности синтетических стадий. Схема I На схеме II показано, как 4-аминопиразол 5-карбоксилат V можно использовать для получения различных структур, описанных формулой I, где остаток А-В соединяется с атомом азота бициклического кольца. 4-Аминогруппу можно защитить в виде подходящего карбамата(см. Greene and Wuts, Protective Groups In Organic Synthesis, Wiley and Sons, 1991) или в виде азидогруппы (NaNO2, кислота, NaN3). В некоторых случаях может отсутствовать необходимость защиты функциональной аминогруппы,как должно быть известно специалисту в данной области. Удаление сложноэфирного защитного остатка включает любой основный гидролиз (R представляет Me, Et), гидрогенолиз (R представляет Вn) или обработку трифторуксусной кислотой (R представляет трет-Вu). Сочетание получаемой кислоты с подходящим аминомH2N-A-B можно выполнить с помощью большого числа способов, известных специалисту в данной области, включая использование дициклогексилкарбодиимида и N,N-диметиламинопиридина, способ смешанного ангидрида, использование реагента ВОР и многие другие. В альтернативном случае, амидную связь можно образовать непосредственно из сложного эфира(R представляет Me, Et) взаимодействием данного эфира с алюминиевым реагентом, полученным из амина H2N-A-B и триметилалюминия. Снятие защиты у аминогруппы, если нужно, дает соединения VIII. Обработка данного аминоамида карбонилдиимидазолом или другим фосгеновым эквивалентом, таким как трифосген, дает пиразолопиримидиндионы IX. В альтернативном случае, аминокарбоксилат V можно превратить в пиразолопиримидиндионыIX в одну стадию нагреванием с подходящим изоцианатом OCN-A-B в присутствии основания, такого как гидрид натрия. Обработка VIII замещенным бромацетилхлоридом или броми 004515 38 дом в присутствии основания, такого как триэтиламин, дает пиразолодиазепиндионы X. Кипячение VIII с обратным холодильником в присутствии муравьиной кислоты дает пиразолопиримидиноны XI (R3 представляет Н). Замещенные производные XI можно получить кипячением VIII с обратным холодильником в присутствии триэтилортоацетата (R3 представляет Me) или других ортоэфиров. Восстановлением XI каталитическим гидрированием, борогидридом натрия в кислой среде или другим восстанавливающим агентом можно получить соединения типа XII. Кроме того, V можно обработать бромацетатом в присутствии основания, такого как карбонат или гидрид натрия, для полученияXIII. Селективный гидролиз любого сложного эфира XIII с последующим стандартным сочетанием с H2N-A-B и последующим нагреванием дает соединения XIV, которые являются региоизомерными с соединениями X. Кислородные аналоги XIV получают превращением аминогруппы V в гидроксильную группу через диазониевый ион. Сочетание с амином H2N-A-B любой из разнообразных процедур дает XV. Oалкилирование XV бромацетатом в присутствии основания, такого как гидрид натрия, приводит к XVI, кислородным аналогам XIV. В случае соединений IX, X, XII и XIV атом азота можно далее функционализировать для получения дополнительных аналогов, например, обработкой метилиодидом в присутствии основания для получения N-метилпроизводных. Схема II 4-Аминопиразол-5-карбоксилат можно использовать для получения производных пиразолопиранона и пиразолопиридинона, у которых остаток А-В связан с атомом углерода бициклического кольца, как показано на схеме III. За процедурой N-защиты V, как описано ранее,может непосредственно следовать превращение остатка сложного эфира в хлорангидрид. Обработка данного хлорангидрида купратом цинка, 39 реагентом, полученным из Вr-СН 2-А-В (А представляет арил), дает кетон XVII после снятия защиты у N. Нагревание XVII с диметилацеталем диметилформамида или ортоэфиром может дать соединения пиразолопиридиноны XVIII. Превращение 4-аминоостатка XVII в гидроксильную группу через диазониевый ион приведет к соединению XIX, которое даст производные пиразолопиранона XX в аналогичных условиях циклизации. В альтернативном случае,обработка хлорангидрида XXI, полученного,как описано выше, где N-PG может представлять защищенный в виде карбамата азот или может представлять аминогруппу, превращенную в азидогруппу, как описано выше, подходящим енамином в присутствии основания, такого как триэтиламин, может дать кетон XXII. Снятие защиты у N с последующим нагреванием дает пиразолопиридиноны XXIII (XVIII, гдеR1 представляет Н). Кроме того, кетон XVII можно получить из цианосоединения III обработкой подходящим бромкетоном в присутствии основания, такого как карбонат или триэтиламин. Требуемый бромкетон легко доступен обработкой подходящего хлорангидрида диазометаном и затем НВr. Специалисту в данной области должно быть известно, что синтез соединений, описанных на схеме III, может требовать дополнительных стадий защиты/снятия защиты или модификации последовательности проведения стадий, в зависимости от дополнительных функциональных групп, присутствующих в представляющих интерес соединениях. Схема III Дополнительные кислородсодержащие бициклические системы можно получить, как показано на схеме IV. 4-Амино-5-карбоксилат V можно превратить в его 4-гидроксипроизводное через диазониевый ион для получения XXIV. Снятие защитной эфирной группы и образование амидной связи с подходящим соединениемH2N-A-B, как описано на схеме II, дает амид 40 можно образовать непосредственно из сложного эфира добавлением алюминиевого реагента,полученного из H2N-A-B и триметилалюминия. 4-Гидроксизаместитель можно легко защитить,если нужно, любой группой из ряда защитных групп, например, трет-бутилдиметилсилиловым эфиром (TBS), и затем снять защиту после образования амидной связи. Обработка гидроксиамида XXV карбонилдиимидазолом или другим фосгеновым эквивалентом, таким как трифосген, может дать бициклическое кольцо XXVI. Нагревание XXV в присутствии параформальдегида и в присутствии подходящей кислоты,такой как п-толуолсульфоновая кислота, даетXXVII (R1 представляет Н). В альтернативном случае, XXV можно обработать дибромметаном в присутствии подходящего основания, такого как карбонат, для получения XXVII (R3 представляет Н). Другие альдегиды и замещенные дибромметаны могут дать замещенные производные XXVII, где R3 не является водородом. Схема IV Дополнительные бициклические системы,в которых остаток А-В замещен у атома углерода, можно получить, как показано на схеме V. После N-защиты 4-аминопиразол-5-карбоксилата V может следовать обработка сложного эфира для получения хлорангидрида или Nметокси-N-метиламида. Присоединение енолята, полученного из RO2CCH2-A-B, и основания,такого как диизопропиламид лития или гексаметилдисилазид лития, дает XXVIII. NМетокси-N-метиламид представляет собой предпочтительный партнер-реагент для такого присоединения, так как данная функциональная группа предотвращает образование продуктов 41 сверхприсоединения. В альтернативном случае,реакцию присоединения енолята можно также проводить со сложным эфиром. Снятие Nзащиты у 4-аминозаместителя позволяет ему циклизоваться с остатком сложного эфира и образовывать пиразолопиперидиндионы XXIX. Обработка остатка сложного эфира XXVIII может привести к образованию XXX, где Х представляет подходящую уходящую группу, такую как остаток соли бромистоводородной кислоты или мезилатный остаток. Для превращения XXVIII в XXX можно использовать различные способы, такие как защита кетона, восстановление сложного эфира в первичный спирт, снятие защиты у кетона и превращение первичного спирта в бромид с использованием СВr4/РРh3 или в мезилат с использованием метансульфонилхлорида и основания,такого как триэтиламин. В альтернативном случае, сложный эфир можно гидролизовать в кислоту, которую можно восстановить до первичного спирта бораном и превратить в уходящую группу, как только что было описано. Снятие Nзащиты высвобождает 4-аминогруппу, которая дает соединения структурыXXXI при нагревании или обработке основанием. Соответствующее кислородное производное также доступно из XXVIII. Снятие N-защиты,диазотирование NaNO2 в кислой среде и обработка серной кислотой дают 4-гидроксипроизводное XXXII. Защита спиртовой функциональной группы, например, в виде простого TBSэфира, с последующим превращением группы сложного эфира, как описано выше, и затем снятием защиты у спиртовой группы даютXXXIII, где Х представляет ОН, можно циклизовать в XXXIV посредством реакции Мицунобу обработкой диэтилазодикарбоксилатом и трифенилфосфином. На схеме VI показано, как получить дополнительные бициклические системы, в которых остаток А-В замещен на атоме углерода и кольцо замещено группой R3. Сложный эфирXXVIII можно превратить в стандартных условиях в N-метокси-N-метиламид XXXV. Добавление подходящего реактива Гриньяра R3MgBr дает кетон, который после снятия N-защиты и нагревания в кислой среде превращается в замещенные пиридоны XXXVI. Восстановление гидридом, например, REDAL, дает пиперидонXXXVII. В альтернативном случае, восстановление N-метокси-N-метиламида диизобутилалюминийгидридом дает альдегид, который может присоединять подходящий реактив Гриньяра R3MgBr с образованием XXXVIII. Превращение спиртовой группы в уходящую группу, например, образованием мезилата взаимодействием с метансульфонилхлоридом и триалкила 004515XXXVIII можно также получить из енаминаXXII схемы III гидролизом в соответствующий альдегид с последующим добавлением подходящего реактива Гриньяра R3MgBr. Схема VI Получение бициклической системы, содержащей семичленное кольцо, в котором остаток А-В связан с атомом углерода, описывается на схеме VII. После N-защиты аминокетонаXVII, где N-PG представляет, предпочтительно,N-защищенный азот, у которого обе NH-группы защищены, например, превращением в азидогруппу, проводят образование енолята кетона под воздействием основания, такого как диизопропиламид лития, и взаимодействие с бромацетатом с образованием XXXIX. Снятие Nзащиты с последующим нагреванием получаемого сложного аминоэфира дает XL. В альтернативном случае, сложный эфир можно до замыкания кольца превратить непосредственными способами в более реакционноспособные соединения, такие как смешанный ангидрид или ангидрид кислоты. Обработка XVII бромацетилбромидом и основанием, таким как триэтиламин, дает ациламин XLI, который можно циклизовать через образование енолята кетона обработкой основанием, таким как диизопропиламид лития. Схема VII Дополнительные содержащие семичленное кольцо бициклические системы можно получить, как показано на схеме VIII. Гидразидоилгалогенид II, полученный, как показано на схеме I, можно циклизовать цианопируватом в присутствии основания, такого как алкоксид,для получения 4-цианопиразола XLII. Снятие эфирной защитной группы и сочетание с H2NA-B, как описано на предыдущих схемах, дают цианоамид XLIII. Восстановление нитрила можно выполнить различными способами, например, каталитическим гидрированием или 43 восстановлением борогидридом натрия в присутствии хлорида кобальта. Циклизация получаемого аминоамида с использованием карбонилдиимидазола или другого фосгенового эквивалента, как описано ранее, дает соединенияXLIV. Для соответствующего соединения, у которого остаток А-В связан с углеродом,сложный эфир XLII можно превратить в Nметокси-N-метиламид, как описано ранее. Обработка данного амида енолятом, полученным из RO2CH2A-B, дает кетон XLV. Каталитическое гидрирование нитрила дает амин, который при нагревании претерпевает циклизацию с образованием XLVI. Кислородсодержащий аналог,соответствующий XLIV, получают из сложного эфира VI, полученного, как описано на схеме I. Группа R' представляет, предпочтительно, 2 фурильный остаток в качестве защищенной карбоновой кислоты. После восстановления группы сложного эфира VI гидридным восстанавливающим агентом, таким как диизобутилалюминийгидрид, следует защита получаемого первичного спирта, например, в виде простого ТВS-эфира. Когда R' представляет 2-фурил,карбоновую кислоту можно освободить от защиты окислением различными реагентами,включающими озон, перманганат калия и периодат натрия в присутствии трихлорида рутения. Сочетание с подходящим H2N-A-B, как описано на предыдущих схемах, дает амидXLVII. Снятие защиты у спирта дает гидроксиамид, который можно циклизовать с использованием карбонилдиимидазола, как описано ранее, для получения соединений XLVIII. Схема VIII Бициклические соединения формулы I, содержащие атом углерода в положении 4 пиразола, получают стратегией [3+2]-циклоприсоединения, как показано на схеме IX (обзор Обработка ненасыщенного лактона ХLIХ,который легко доступен стандартными процедурами, известными специалисту в данной области техники, алюминиевым реагентом, полученным из подходящего амина H2N-A-B и триметилалюминия, дает амид L с разомкнутым кольцом. Превращение первичного спирта в стандартных условиях в подходящую уходящую группу, такую как бромид или мезилат, и выдерживание в основных условиях дают требуемый ненасыщенный лактам LI. Обработка гидразидоилгалогенида II, полученного, как показано на схеме I, где Х представляет Сl или Вr,триэтиламином дает 1,3-диполярный промежуточный продукт LII, который можно подвергнуть [3+2]-циклоприсоединению с олефином LI для получения бициклического пиразолидинаLIII в качестве преобладающего региоизомера. Мягкое окисление такими реагентами, как хлоранил или пероксид никеля, дает пиразолопиперидоны LIV. Дальнейшим окислением, например, с применением DDQ, можно получить ненасыщенные производные LV. Указанные стадии могут быть обратимыми, так что после первоначального полного окисления в LV можно проводить восстановление, такое как каталитическое гидрирование, для получения LIV. Производные кетонов LVII можно получить конденсацией подходящего амина H2N-A-B с циклическим ангидридом LVI. В альтернативном случае, насыщенное производное LVI можно конденсировать с подходящим амином H2N-A-B с последующим окислением в ненасыщенное производное LVII, например, обработкой сис 45 темой LDA/PhSeSePh и затем окислительным элиминированием оксидом селена. Олефин LVII подвергается аналогичному [3+2]циклоприсоединению с образованием пиразолидинового промежуточного продукта, который легко окисляется в производные пиразолопиперидиндионаLVIII различными окисляющими агентами. Описывается также альтернативное получение соединения LIV. Стандартная последовательность алкилирование/ацилирование аминаH2N-A-B дает сложный амидоэфир LIX, который содержит защищенную кетоновую функциональную группу. Для этих превращений,которые известны специалисту в данной области техники, можно использовать различные условия реакции. Снятие защиты у кетона с последующей конденсацией по Дикману в основных условиях дает циклические дикетоамидыLX. Конденсацию LX с подходящим гидразином легко выполняют нагреванием в растворителе, таком как уксусная кислота или этанол, с получением ранее описанного LIV. Производные пиразолопиперидона LXVI(где n равно 1), где 4-заместитель пиразола R1a представляет трифторметильную группу, можно получить способом, описанным на схеме X. Сочетание кислоты LXI с аминами H2N-A-B можно выполнить при различных условиях, например, через образование хлорангидрида, чтобы получить амид LXII. Прямая последовательность, включающая расщепление кольца тетрагидрофурана и внутримолекулярную циклизацию у амидного азота, дает кетолактам LXIII. Данное соединение можно получить также из лактама LXIV введением сернистых заместителей и последующим окислением в кетолактамLXIII. Образование морфолина или относящегося к нему енамина с последующим взаимодействием с трифторуксусной кислотой приводит к трифторацетилированному промежуточному продукту LXV. В альтернативном случае, дихлорирование лактама LXIV при помощи PCl5 или аналогичных реагентов, нагревание с избытком морфолина и относящемуся к нему амина и взаимодействие енамина, полученного данным путем, с трифторуксусным ангидридом также дает трифторацетилированный промежуточный продукт LXV. Данное соединение можно легко конденсировать с подходящим гидразином для получения производных пиразолопиперидона LXVI. Аналогичные химические способы можно использовать для получения [5,7]конденсированных циклических систем (где n равно 2). Ненасыщенные аналоги вышеуказанных соединений можно получить, как показано в нижней части схемы X. Бромирование LXVII,полученного, как описано на схеме IX и верхней части схемы X, дает броманалог LXVIII. Элиминирование НВr обработкой любым из различных оснований, таких как DBU, дает ненасыщенные бициклические аналоги LXIX. До 004515 46 полнительные аналоги можно получить заменой бромида LXVIII любым из большого числа нуклеофилов на основе азота, кислорода и серы. Схема X Дополнительные [5,7]-конденсированные бициклические системы, которые содержат дополнительный гетероатом в семичленном кольце, можно получить, как показано на схеме XI. Соединения LXXI, где Х представляет О или S,можно получить из коммерчески доступного тетрагидро-4 Н-пиран-4-она и тетрагидротиопиран-4-она. Фотоиндуцированная перегруппировка по Шмидту (триизопропилсилил)азидогидрина (Evans, P. A. and Modi, D.P. J. Org.Chem. 1995, 60, 6662-6663), который образуется из тетрагидро-4 Н-пиран-4-она и тетрагидротиопиран-4-она, дает тетрагидро-1,4-оксазепин-5NR, можно получить перегруппировкой по Шмидту гидрохлорида моногидрата 4-пиперидона или защищенного 4-пиперидона (Groves,J. Т. and Chambers, R.R. Jr. J. Am. Chem. Soc. 1984, 106, 630-638) . Сочетание по Ульману лактама с I(Вr)-А-В дает лактам LXXII с остатком А-В. Дихлорирование пентахлоридом фосфора или родственным реагентом дает дихлорированный промежуточный продукт, который может взаимодействовать с морфолином с образованием енамина LXXIII. ВзаимодействиеLXXIII с DMAP и подходящим хлорангидридом или ангидридом кислоты дает промежуточный продукт типа ациленамина LXXIV, который можно конденсировать с подходящим гидразином в уксусной кислоте для получения [5,7]конденсированных бициклических соединений 47 Бициклические соединения формулы I, которые содержат атом углерода в 4-положении пиразола и у которых остаток А-В связан с атомом углерода, также получают стратегией[3+2]-циклоприсоединения, как показано на схеме XII. Ненасыщенные циклические кетоныLXXVI легко доступны стандартными синтетическими способами, известными специалистам в данной области техники. [3+2] Циклоприсоединение с 1,3-диполем, образованным из II,как описано ранее, дает пиразолидиновый промежуточный продукт, который можно легко окислить в пиразолоциклогексанон LXXVII. Введение двойной связи, например, обработкойLDA или PhSeSePh, с последующим окислительным элиминированием оксида селена дает ненасыщенное производное LXXVIII. Введение остатка, такого как защищенный спирт, в ненасыщенный кетон, представленный LXXIX, приводит к пиразолоциклогексанону LXXX после[3+2]циклоприсоединения и последующего окисления. Снятие защиты у спирта и окисление различными реагентами дает пиразолоциклогександион LXXXI. Схема XII Дополнительные бициклические соединения формулы I, содержащие атом углерода в 4 положении пиразола, описываются на схемеXIII. Конденсация гидразидоилгалогенида II со сложным дикетоэфиром в присутствии основания, такого как алкоксид, дает пиразолыLXXXII. Нагревание сложного кетоэфира в присутствии легкодоступных гидразинов A-BNHNH2 дает пиразолопиридазиноны LXXXIII. Для получения пиразолопиридазинонов формулы LXXXIV, где R3 представляет водород, гидразидоилгалогенид II можно циклизовать с фурилкетоэфиром в присутствии алкоксидного основания. Стандартные превращения функциональных групп, включающие восстановление сложного эфира и защиту, окисление фурила и этерификацию, приводит к LXXXV, хотя такая последовательность стадий не обязательна. Специалист в данной области техники способен определить подходящую последовательность стадий и подходящие реагенты для достижения этих превращений. Снятие защиты у 48 спирта и окисление, например, диоксидом марганца, дает сложный альдегидоэфир, который легко образует LXXXVI при нагревании в присутствии гидразина A-B-NHNH2. Подходящее превращение функциональной группы соединения LXXXIV, причем многие из способов превращения доступны, может также дать эфирокислоты LXXXVII. Активация карбоновой кислоты, например, образованием хлорангидрида взаимодействием с оксалилхлоридом, с последующим нагреванием в присутствии гидразина Получение соединений формулы I, где пятичленным кольцом является триазол, выполняют с использованием азидных промежуточных продуктов. Азиды легко подвергаются реакциям [3+2] циклоприсоединения с различными олефинами и алкинами, и применение данной реакции для синтеза триазолконденсированных бициклических соединений формулы I приводится на схеме XIV. Как ранее описано для пиразолконденсированных соединений, 4 амино-1,2,3-триазол-5-карбоксилат XCII, в частности, можно использовать в качестве промежуточного продукта для получения многих триазолконденсированных бициклических систем. Требуемые азиды LXXXIX легко доступны. Алифатические азиды легко получают из соответствующего бромида (с заменой брома на азидную группу) взаимодействием с азидом натрия в растворителях, таких как диметилформамид и диметилсульфоксид. Когда G-(CH2)sпредставляет арилазид (G представляет арил, s равно 0), азиды легко доступны из соответствующего анилина диазотированием его NaNO2 в кислой среде с последующей заменой иона диазония азидом натрия. [3+2] Циклоприсоединение азидов LXXXIX с нитроолефинами ХС (R' представляет Me, 2-фурил) дает триазолы XCI в качестве основного продукта, причем после первоначальной циклизации в триазолиновый 49 промежуточный продукт последний автоокислением превращают в триазоловые продукты(Cailleux, P.; et al. Bull. Soc. Chim. Belg. 1996,105, 45). Указанные реакции можно проводить в кипящем с обратным холодильником бензоле или аналогичных растворителях при подобных температурах. Превращение XCI в 4-амино 1,2,3-триазол-5-карбоксилат XCII происходит непосредственно. Когда R' представляет метил,окисление метильной группы окислителем, таким как KМnО 4, дает карбоновую кислоту, которую можно этерифицировать в соответствующий эфир. Восстановление нитрогруппы любым из различных восстанавливающих агентов, предпочтительно, SnCl2, или каталитическим гидрированием дает XCII. Когда R' представляет 2-фурил, карбоновую кислоту можно освободить от защитной группы различными окисляющими агентами, включающими озон,КМnО 4 и периодат натрия/трихлорид рутения,чтобы получить карбоновую кислоту, которую можно этерифицировать и восстановить, как описано выше, для получения XCII. 4-Гидрокси-1,2,3-триазол-5-карбоксилаты формулыXCIV можно получить через диазониевый ионXCII, как описано для ряда пиразола. Взаимодействие азидов LXXXIX с активными метиленовыми соединениями также иллюстрируются на схеме XIV. ОбработкаLXXXIX циано- или нитропируватами в присутствии основания, такого как алкоксид, дает триазолы XCIII. Производные триазол-4 карбоксилата формулы XCV можно получить обработкой LXXXIX сложным фурилкетоэфиром в присутствии алкоксидного основания. Такие взаимодействия аналогичны взаимодействиям, описанным на схеме I для производных пиразола. Триазолсодержащие бициклические системы, имеющие атом углерода в 4-положении триазола, можно получить реакциейLXXXIX с ненасыщенным лактамом LI или ненасыщенным циклическим кетоном LXXVI. Указанные циклоприсоединения проводят нагреванием в подходящем растворителе, таком как бензол или толуол. Получаемые триазолиновые промежуточные продукты легко окисляют в конденсированные триазолы с использованием хлоранила, пероксида никеля или другого мягкого окислителя с получением XCVI иXCVII, соответственно. Триазоловые промежуточные продукты XCI, XCII, XCIII, XCIV, XCV,XCVI и XCVII можно превратить в конечные триазолсодержащие бициклические соединения,описанные формулой I, по процедурам, описанным для соответствующих производных пиразола на схемах II-XI. Нитрогруппа, присутствующая в XCI и XCIII, может соответствовать остатку N-PG, описанному на схемах II-VIII,или, в альтернативном случае, нитрогруппу можно восстановить в подходящей стадии и 50 далее защитить в виде подходящего карбаматного производного или в виде азидогруппы. Схема XIV Получение соединений формулы I, где пятичленное кольцо является изоксазолом, выполняют, как показано на схеме XV. Гидроксиминоилхлорид XCIX используют в качестве промежуточного продукта получения изоксазолконденсированных соединений. Данный промежуточный продукт легко доступен из подходящих альдегидов XCVIII образованием оксима с гидроксиламином с последующим хлорированием N-хлорсунцинимидом. Обработка XCIX цианоацетатом в присутствии основания, такого как карбонат, приводит к циклизации с образованием 5-аминоизоксазол-4-карбоксилата С. Аминоостаток соединения С можно легко превратить в гидрокси- или цианоостаток с образованием соответствующих производных CI и СII,соответственно, через диазониевый ион, как ранее описано для соединений ряда пиразола и триазола. Изоксазол-5-карбоксилаты формулы CIII можно получить циклизацией XCIX со сложным фуранкетоэфиром. Окисление фурана в остаток карбоновой кислоты выполняют различными окисляющими агентами, как описано ранее. Гидроксииминоилхлорид XCIX можно также обработать основанием, таким как триэтиламин, для получения промежуточного продукта в виде оксида нитрила, который может подвергаться реакциям [3+2] циклоприсоединения с подходящими олефинами или алкинами. Указанные реакции циклоприсоединения являются удобным способом, которым получают бициклические соединения, содержащие атом углерода в 5-положении кольца изоксазола. Например, циклоприсоединение с ненасыщенным лактамом LI приводит к образованию конденсированного изоксазолинового промежуточного 51 продукта, который легко окисляется такими реагентами, как пероксид никеля, хлоранил илиDDQ, с образованием СIV. Циклоприсоединение с ненасыщенным циклическим кетоном и окисление в таких же условиях дают кетоновый аналог CV. Изоксазолконденсированные промежуточные продукты С, CI, СII, CIII, CIV и CV можно превратить в конечные изоксазолсодержащие бициклические соединения, описанные формулой I, по методикам, описанным для соответствующих производных пиразола на схемах II-XI. Схема XV Получение соединений формулы I, где пятичленное кольцо является изотиазолом, выполняют, как показано на схеме XVI. В одном способе получения 5-аминоизотиазол-4-карбоксилатного промежуточного продукта CVIII исходят из легкодоступного хлорангидридаCVI. Конденсация CVI с цианоацетатом в присутствии основания, такого как алкоксид магния, с последующей обработкой аммиаком в спиртовом растворителе дает аминонитрилCVII. Обработка сульфидом водорода в присутствии основания, такого как триэтиламин, дает тиоамид, который может подвергаться окислительной циклизации в CVIII при обработке пероксидом водорода или бромом. Как описано на предыдущих схемах, аминоостаток можно легко превратить в гидроксил- или цианоостаток с образованием соответствующих производныхCIX или СХ, соответственно. Другим полезным промежуточным продуктом для получения производных изотиазола настоящего изобретения является нитрилсульфид CXIII. Данный промежуточный продукт можно удобно получить из гетероцикла CXII,который сам можно получить из амидов CXI 52 либо обработкой хлоркарбонилсульфенилхлоридом, либо обработкой трихлорметансульфенилхлоридом с последующей обработкой гидроксидом натрия. Термолиз гетероцикла CXII дает нитрилсульфид CXIII, который может подвергаться многим из таких же реакций, как соответствующие нитрилоксидные промежуточные продукты. Например, [3+2] циклоприсоединение CXIII с олефинами LI и LXXVI может дать, после последующего мягкого окисления,как описано ранее, изотиазолконденсированные соединения СХIV и CXV, соответственно. Изотиазоловые промежуточные продукты CVIII,CIX, СХ, CXIV и CXV можно превратить в конечные изотиазолсодержащие бициклические соединения, описанные формулой I, по методикам, описанным для соответствующих производных пиразола на схемах II-XI. Схема XVI Формула I описывает также пиразолконденсированные бициклические соединения, у которых группа G-(CH2)s- находится у атома углерода кольца пиразола. Данные соединения можно получить, как показано на схеме XVII. Конденсация хлорангидридов CVI с цианоацетатами в присутствии основания, такого как метоксид магния, дает производное енола, которое превращают в простой эфир енола CXVI (X представляет ОМе) взаимодействием с диазометаном или в хлорпроизводное CXVI (X представляет Сl) взаимодействием с РОСl3. Нагревание с гидразином (R' представляет Н) или замещенным гидразином дает 5-амино-4 карбоксилат CXVII. Аминоостаток CXVII можно превратить в гидроксил- или цианоостаток с образованием CXVIII или CXIX, соответственно, через диазониевый ион, как описано ранее. 53 4-Карбоксилатные производные можно получить конденсацией замещенного гидразина с гемиацеталем или родственным производным,представленным СХХ. Хлорирование или бромирование с использованием NCS или NBS,соответственно, дает гидразидоилгалогенидыCXXI. Взаимодействие CXXI с анионом сложного фурилкетоэфира дает 5-карбоксилатCXXII, фурановый остаток которого можно окислить в остаток карбоновой кислоты способами, описанными ранее. Гидразидоилгалогениды CXXI могут также принимать участие в реакциях [3+2] циклоприсоединения, как описано ранее, образуя, после окисления промежуточных пиразолинов,пиразолконденсированные соединения CXXIII иCXXIV. Промежуточные продукты CXVII,CXVIII, CXIX, CXXII, CXXIII и СХХIV можно превратить в конечные С-связанные пиразолсодержащие бициклические соединения, описанные формулой I, по методикам, описанным для соответствующих N-связанных производных пиразола на схемах II-XI. Схема XVII Бициклические соединения настоящего изобретения, у которых пятичленное кольцо является пирролом и G-содержащая группа связана с атомом углерода, можно получить, как показано на схеме XVIII. Для соединений указанного типа, у которых в 2-положении пиррола должен быть атом азота, 2-аминопиррол CXXVI можно использовать в качестве промежуточного продукта. Данное соединение можно получить конденсацией легко полученных аминокарбонильных соединений CXXV с подходящим цианоацетатом. Данную конденсацию можно проводить в основных условиях или нагреванием с азеотропным удалением воды. 2-Аминопирролы 54 которые являются подходящими промежуточными продуктами для ряда бициклических соединений данного изобретения. Пиррол-2,3 дикарбоксилаты можно также получить из аминокарбонилсоединений CXXV. Присоединение по реакции Михаэля в основных условиях с применением ацетилендикарбоксилатных эфиров с последующим замыканием кольца in situ дает пиррол-2,3-дикарбоксилатный диэфир. Селективным гидролизом одного из эфиров, в типичном случае 2-эфира, получают пиррол-2 карбоновую кислоту CXXVIII. Перегруппировка Курциуса соединения CXXVIII обеспечивает другой путь к 2-аминопирролу CXXVI. Кроме того, карбоновуго кислоту можно восстановить в спирт CXXIX с использованием борана или полученный из нее смешанный ангидрид можно восстановить в указанный спирт борогидридом натрия. По методикам, описанным на схемах IIVI II и схеме XIII, промежуточные продуктыCXXVI, CXXVII, CXXVIII и CXXIX можно превратить в конечные пирролоконденсированные бициклические соединения формулы I. Другие методики, не описанные здесь, также известны специалисту в данной области техники, их можно использовать для получения пирролоконденсированных бициклических соединений формулы I. Схема XVIII Бициклические соединения настоящего изобретения, у которых пятичленным кольцом является фуран и G-содержащая группа связана с атомом углерода, можно получить, как показано на схеме XIX. Для соединений такого типа,где в 2-положении фурила должен быть атом азота, 2-аминофуран CXXXI можно использовать в качестве промежуточного продукта. Данные соединения можно получить аналогично аналогам пиррола, описанным на схеме XVIII. Так, конденсация легко получаемых гидроксикарбонилсоединений СХХХ с подходящим цианоацетатом дает 2-аминофураны CXXXI. Данную конденсацию можно проводить в основных условиях или нагреванием с азеотропным удалением воды. 2-Аминофураны CXXXI можно диазотировать и затем превратить в 2-цианоили 2-гидроксифураны CXXXII, которые являются подходящими промежуточными продуктами для различных бициклических соединений данного изобретения. Фуран-2,3-дикарбокси 55 латы можно также получить из гидроксикарбонилсоединений СХХХ, аналогично аналогам пиррола, описанным на схеме XVIII. По реакции присоединения Михаэля соединения СХХХ с ацетилендикарбоксилатными эфирами в основных условиях с последующим in situ замыканием кольца получают фуран-2,3 дикарбоксилатный диэфир. Селективный гидролиз одного из эфиров, в типичном случае 2 эфира, дает фуран-2-карбоновую кислотуCXXXIII. Перегруппировка по Курциусу соединения CXXXIII обеспечивает другой путь к 2 аминофуранам CXXXI. Кроме того, карбоновую кислоту можно восстановить в спирт CXXXIV с использованием борана или полученный из нее смешанный ангидрид можно восстановить в указанный спирт борогидридом натрия. По методикам, описанным на схемах II-VIII и схемеXIII, промежуточные продукты CXXXI,CXXXII, CXXXIII и CXXXIV можно превратить в конечные фуранконденсированные соединения формулы I. Другие методики, не описанные здесь, также известны специалисту в данной области техники, их можно использовать для получения фуранконденсированных бициклических соединений формулы I. Схема XIX Бициклические соединения настоящего изобретения, у которых пятичленным кольцом является тиофен и G-содержащая группа связана с атомом углерода, можно получить, как показано на схеме XX. Для соединений такого типа, где в 2-положении тиофена должен быть атом азота, 2-аминотиофен CXXXVI можно использовать в качестве промежуточного продукта. Данные соединения можно получить аналогично аналогам пиррола, описанным на схемеXVIII. Так, конденсация легко получаемых меркаптокарбонилсоединений CXXXV с подходящим цианоацетатом дает 2-аминотиофеныCXXXVI. Данную конденсацию можно проводить в основных условиях или нагреванием с азеотропным удалением воды. В альтернативном случае, конденсация цианоацетата с кетоном CXXXVIII дает олефин CXXXIX. В следующей стадии CXXXIX можно превратить в 2 аминотиофены CXXXVI обработкой S8 и основанием, таким как триэтиламин. 2-Аминотиофены CXXXVI можно диазотировать и затем превратить в 2-циано- и 2-гидрокситиофены 56 промежуточными продуктами для различных бициклических соединений данного изобретения. Тиофен-2,3-дикарбоксилаты можно получить из ацетилентиолатов щелочных металловCXL. Данные соединения взаимодействуют с ацетилендикарбоксилатными эфирами по реакции [3+2]циклоприсоединения, образуя тиофен 2,3-дикарбоксилатные диэфиры. Селективный гидролиз одного из эфиров, в типичном случае 2-эфира, дает тиофен-2-карбоновую кислотуCXLI обеспечивает другой путь к 2-аминотиофенам CXXXVI. Кроме того, карбоновую кислоту можно восстановить в спирты CXLII с использованием борана или полученный из нее смешанный ангидрид можно восстановить в указанные спирты борогидридом натрия. По методикам, описанным на схемах II-VIII и схемеXIII, промежуточные продукты CXXXVI,CXXXVII, CXLI и CXLII можно превратить в конечные тиофенконденсированные бициклические соединения формулы I. Другие методики,не описанные здесь, также известны специалисту в данной области техники, их можно использовать для получения тиофенконденсированных бициклических соединений формулы I. Схема XX Бициклические соединения настоящего изобретения, у которых пятичленным кольцом является имидазол и G-содержащая группа связана с атомом азота, можно получить, как показано на схеме XXI. Данные соединения формул от CXLIII до CLXIV, где группа R может быть алкилом, арилом или защитной группой PG,доступны либо из коммерческих источников,либо посредством известного уровня техники и могут быть представлены в общем формулойCLXV. Подходящая защита азота имидазола дает соединения типа CLXVI, которые далее превращают через опосредованное медью (II) сочетание с подходящей А-В-содержащей бороновой кислотой в CLXVII. Последующее удаление имидазолзащитной группы PG дает такие соединения, как CLXVIII. Введение заместителяG-содержащей бороновой кислотой таким образом, чтобы G-группа превратилась в азот имидазола, как изображено формулой CLVIX. А-В-Остатки можно ввести способами, известными специалисту в данной области техники. В следующих публикациях, содержание которых включается здесь в качестве ссылки, описываются и приводятся примеры способов введения А-В-остатков: WO 97/23212, WO 97/30971, WO 97/38984, WO 98/06694, WO 98/01428, WO 98/28269 иWO 98/28282. Другие отличительные признаки изобретения станут более очевидными в процессе последующих описаний примерных осуществлений,которые приводятся для иллюстрации изобретения и не предназначаются для его ограничения. Примеры Пример 1. 1-[4-Метоксифенил]-3-циано-6[2'-метилсульфонил-3-фтор[1,1']бифен-4-ил]1,4-дигидропиразоло[4,3-d]пиримидин-5,7-дион.HCl и затем смесь охлаждают на ледяной бане.(27,61 г, 336,59 ммоль) в 36 мл метанола и 75 мл воды. Сразу образуется тяжелый желтый осадок(29,9 г, 97%), который, выделяют в качестве указанного в заголовке соединения фильтрова 004515(1,22 г, 9,99 ммоль) и карбонат калия (34,52 г,249,79 ммоль) растворяют в N,N-диметилформамиде и нагревают до 100 С в течение нескольких часов. Раствор разбавляют этилацетатом и промывают 4 раза насыщенным раствором соли. Органическую часть сушат надMgSO4, фильтруют через подушку (слой) силикагеля и летучие компоненты удаляют. Указанное в заголовке соединение очищают растворением в горячем диэтиловом эфире и собирают твердое вещество (9,18 г, 34%), которое образуется при охлаждении, фильтрованием. LRMS(1-[4-метоксифенил]-3-циано-4 амино)пиразол-5-карбоксилат (3,36 г, 12,34 ммоль) растворяют в ТФУ и охлаждают до 0 С с последующим добавлением NaNO2 (0,94 г,13,57 ммоль) и затем реакционную смесь перемешивают при такой температуре в течение 45 мин. NaN3 (0,80 г, 12,34 ммоль) растворяют в минимальном количестве воды и добавляют по частям к раствору ТФУ. Раствор оставляют для перемешивания при 0 С в течение 45 мин и медленно добавляют к насыщенному водному раствору NaHCO3. Раствор разбавляют этилацетатом и промывают два раза насыщенным раствором соли. Органическую часть сушат надMgSO4, фильтруют через спрессованный силикагель и летучие компоненты удаляют с получением указанного в заголовке соединения в виде рыжевато-коричневого твердого вещества[1,1']бифен-4-ил]амина (1,00 г, 3,31 ммоль) растворяют в безводном метиленхлориде с последующим добавлением триметилалюминия (9,94 мл, 19,88 ммоль) в виде 2,0 М раствора в толуоле. Раствор перемешивают при комнатной температуре до тех пор, пока не прекратится выделение газа. Добавляют метил (1-[4-метоксифенил]-3-циано-4-азидо)пиразол-5-карбоксилат(0,988 г, 3,31 ммоль) и раствор перемешивают при комнатной температуре в течение ночи и кипятят с обратным холодильником в течение дополнительных 2 ч. Раствору дают возможность охладиться до комнатной температуры и медленно гасят насыщенным раствором хлорида аммония. Реакционную смесь разбавляют этилацетатом и промывают два раза 5% раствором лимонной кислоты. Органическую часть сушат 59 над MgSO4 и фильтруют через спрессованный силикагель. Указанное в заголовке соединение очищают колоночной хроматографией с элюированием смесью 1:1 гексан/этилацетат (0,09 г,5%). LRMS (ES-): 530,1 (М-Н)-. Часть Е. 1-[4-Метоксифенил]-3-циано-4 амино-5-[2'-метилсульфонил-3-фтор[1,1']бифен-4-ил]аминокарбонил]пиразол. 1-[4-Метоксифенил]-3-циано-4-азидо-5-[2'метилсульфонил-3-фтор[1,1']бифен-4-ил]аминокарбонил]пиразол (0,09 г, 0,169 ммоль) растворяют в метаноле с последующим добавлениемSnСl2.2 Н 2 О (0,321 г, 1,69 ммоль) и раствор кипятят с обратным холодильником в течение 1 ч. Летучие компоненты удаляют при пониженном давлении и остаток перемешивают в ТФУ,фильтруют через подушку целита и остаток очищают препаративной хроматографией типа ВЭЖХ с получением указанного в заголовке соединения в виде белого твердого вещества (30 мг, 19%). LRMS (ES+): 506,3 (M+H)+. Часть F. 1-[4-Метоксифенил]-3-циано-6[2'-метилсульфонил-3-фтор[1,1']бифен-4-ил]1,4-дигидропиразоло[4,3-d]пиримидин-5,7-дион. 1-[4-Метоксифенил]-3-циано-4-амино-5[2'-метилсульфонил-3-фтор[1,1']бифен-4-ил] аминокарбонил]пиразол (0,02 г, 0,032 ммоль) растворяют в ТГФ с последующим добавлением карбонилдиимидазола (0,010 г, 0,064 ммоль) и раствор перемешивают при комнатной температуре в течение 48 ч и затем при кипении с обратным холодильником в течение 0,5 ч. Летучие компоненты удаляют при пониженном давлении и продукт очищают препаративной ВЭЖХ (колонка с C18-обращенной фазой, градиентное элюирование смесью Н 2 О/СН 3 СN с 0,5% ТФУ) и лиофилизуют с получением указанного в заголовке соединения примера 1 в виде белого порошка (1,9 мг, 11%). LRMS (ES-): 530,2 (МН)-. Пример 2. 1-[4-Метоксифенил]-3-(метоксикарбонил)-6-[2'-метилсульфонил-3-фтор[1,1'] бифен-4-ил]-1,6-дигидропиразоло[4,3-d]пиримидин-7-он. Часть А. (1-[4-Метоксифенил]-3-циано-4 азидо)пиразол-5-карбоновая кислота. Метил (1-[4-метоксифенил]-3-циано-4-азидо)пиразол-5-карбоксилат (5,9 г, 19,78 ммоль) растворяют в смеси 1:1:1 МеОН/Н 2 О/ТГФ с последующим добавлением NaOH (1,58 г, 39,56 ммоль) и реакционную смесь оставляют для перемешивания при комнатной температуре до тех пор, пока по данным ТСХ не израсходуется весь исходный материал. Раствор подкисляют 10% НСl и продукт экстрагируют этилацетатом. Органический слой промывают два раза насыщенным раствором соли и раствор сушат надMgSO4, фильтруют и летучие компоненты удаляют при пониженном давлении с получением указанного в заголовке соединения в виде рыжевато-коричневого твердого вещества (4,00,71%). LRMS (ES-): 539,0 (M-H-CO2)-. Часть В. 1-[4-Метоксифенил]-3-циано-4 азидо-5-[2-фтор-4-бромфенил)аминокарбонил] пиразол. 1-[4-Метоксифенил]-3-циано-4-азидо)пиразол-5-карбоновую кислоту (4,00 г, 14,07 ммоль) растворяют в CH2Cl2 с последующим добавлением оксалилхлорида (1,84 мл, 21,11 ммоль) и 1 капли ДМФ. Смесь оставляют для перемешивания При комнатной температуре в течение 2 ч. Летучие компоненты удаляют при пониженном давлении и остаток сушат при высоком вакууме в течение 1 ч. Остаток растворяют в CH2Cl2 с последующим добавлениемDMAP (3,44 г, 28,15 ммоль) и 2-фтор-4 броманилина (2,67 г, 14,07 ммоль) и раствор перемешивают в течение ночи при комнатной температуре. Летучие компоненты удаляют в вакууме и продукт очищают растиранием остатка со смесью эфир/гексаны с получением указанного в заголовке соединения (1,50 г, 23%).(1,50 г, 3,28 ммоль) растворяют в МеОН с последующим добавлением дигидрата хлорида олова (II) (6,23 г, 32,88 ммоль) и раствор кипятят с обратным холодильником в течение 2 ч. Раствор растворяют в EtOAc и подщелачивают добавлением 10% раствора NaOH. Органическую часть промывают два раза насыщенным раствором соли и сушат над MgSO4, фильтруют через подушку силикагеля и сушат в вакууме с получением указанного в заголовке соединения(0,55 г, 39%). LRMS (ES+): 463,1 (М+Н)+. Часть D. 1-[4-Метоксифенил]-3-(метоксикарбонил)-6-[2-фтор-4-бромфенил]-1,6-дигидропиразоло [4,3-d]пиримидин-7-он. 1-[4-Метоксифенил]-3-(метоксикарбонил)4-амино-5-[2-фтор-4-бромфенил)аминокарбонил]пиразол (0,55 г, 1,27 ммоль) растворяют в 25 мл 96% муравьиной кислоты и кипятят с обратным холодильником в течение 3 ч. Летучую часть удаляют и остаток растворяют в EtOAc и промывают насыщенным раствором NaHCO3. Органическую часть сушат над MgSO4, фильтруют через спрессованный силикагель и летучие компоненты удаляют с получением указанного в заголовке соединения в виде белого твердого вещества (0,30 г, 50%). LRMS (ES+): 473,1
МПК / Метки
МПК: C07D 487/04, A61K 31/415, C07D 471/04, A61P 7/02
Метки: качестве, фактора, азотсодержащие, гетеробициклы, ингибиторов
Код ссылки
<a href="https://eas.patents.su/30-4515-azotsoderzhashhie-geterobicikly-v-kachestve-ingibitorov-faktora-xa.html" rel="bookmark" title="База патентов Евразийского Союза">Азотсодержащие гетеробициклы в качестве ингибиторов фактора xa</a>
Предыдущий патент: Состав жидкости для обработки скважин и способ гидравлического разрыва угольного пласта
Следующий патент: Способ варки стекла
Случайный патент: Солнечный коллектор