Новые миметики гуанидина в качестве ингибиторов фактора ха
Номер патента: 3210
Опубликовано: 27.02.2003
Авторы: Лэм Патрик Й., Кван Мими Лайфен, Кларк Чарльз Дж., Февиг Джон Мэттью, Пинто Дональд Джозеф Филлип, Хан Кви, Пруитт Джеймс Расселл, Домингез Селия, Ли Ренуа
Формула / Реферат
1. Соединение формулы I
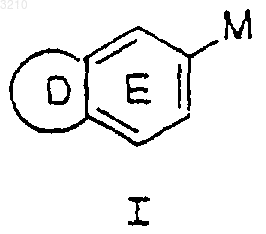
или его стереоизомер или фармацевтически приемлемая соль,
где кольцо D выбрано из -CH2N=CH-, -CH2CH2N=CH-, 5-6-членной ароматической системы, содержащей 0-2 гетероатома, выбранных из группы N, O и S;
кольцо D замещено 0-2 R, при условии, что, когда кольцо D является незамещенным, оно содержит, по меньшей мере, один гетероатом;
кольцо E содержит 0-2 атома N и замещено 0-1 R;
R выбран из группы, включающей Cl, F, Br, I, OH, C1-3 алкокси, NH2, NH(C1-3 алкил), N(C1-3 алкил)2, CH2NH2, CH2NH(C1-3 алкил), CH2N(C1-3 алкил)2, CH2CH2NH2, CH2CH2NH(C1-3 алкил) и CH2CH2N(C1-3 алкил)2;
M выбран из группы
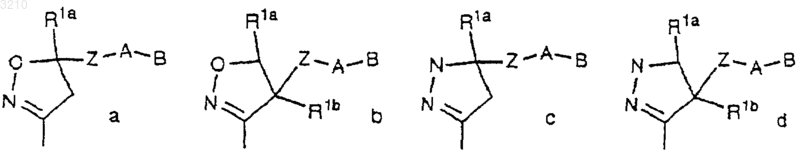
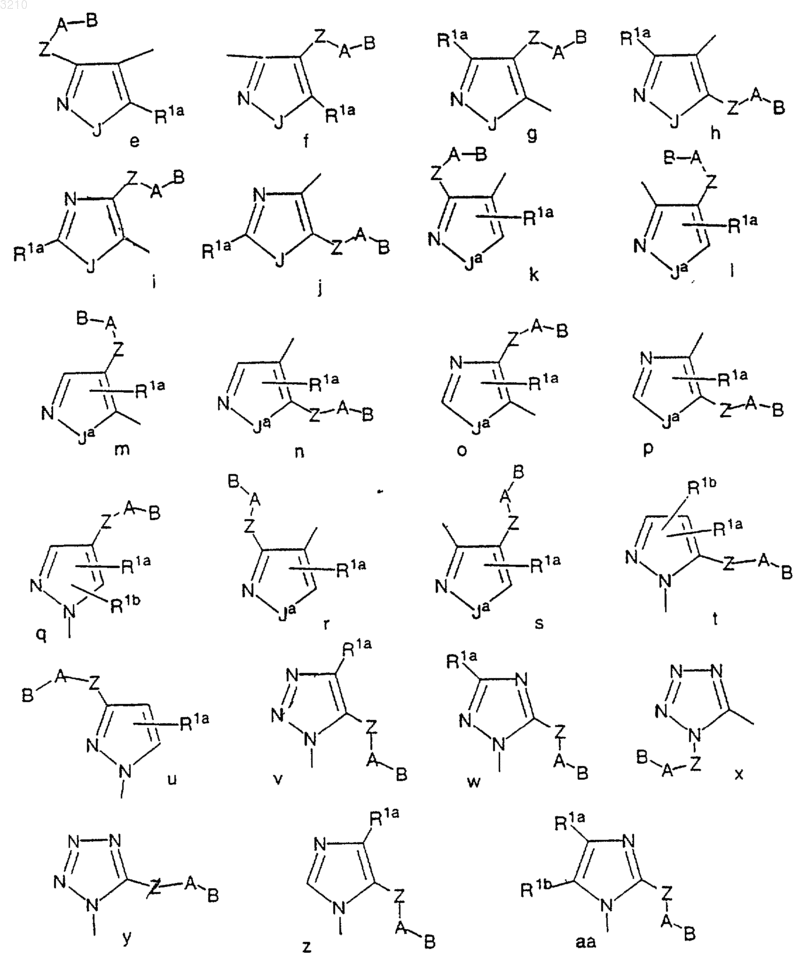
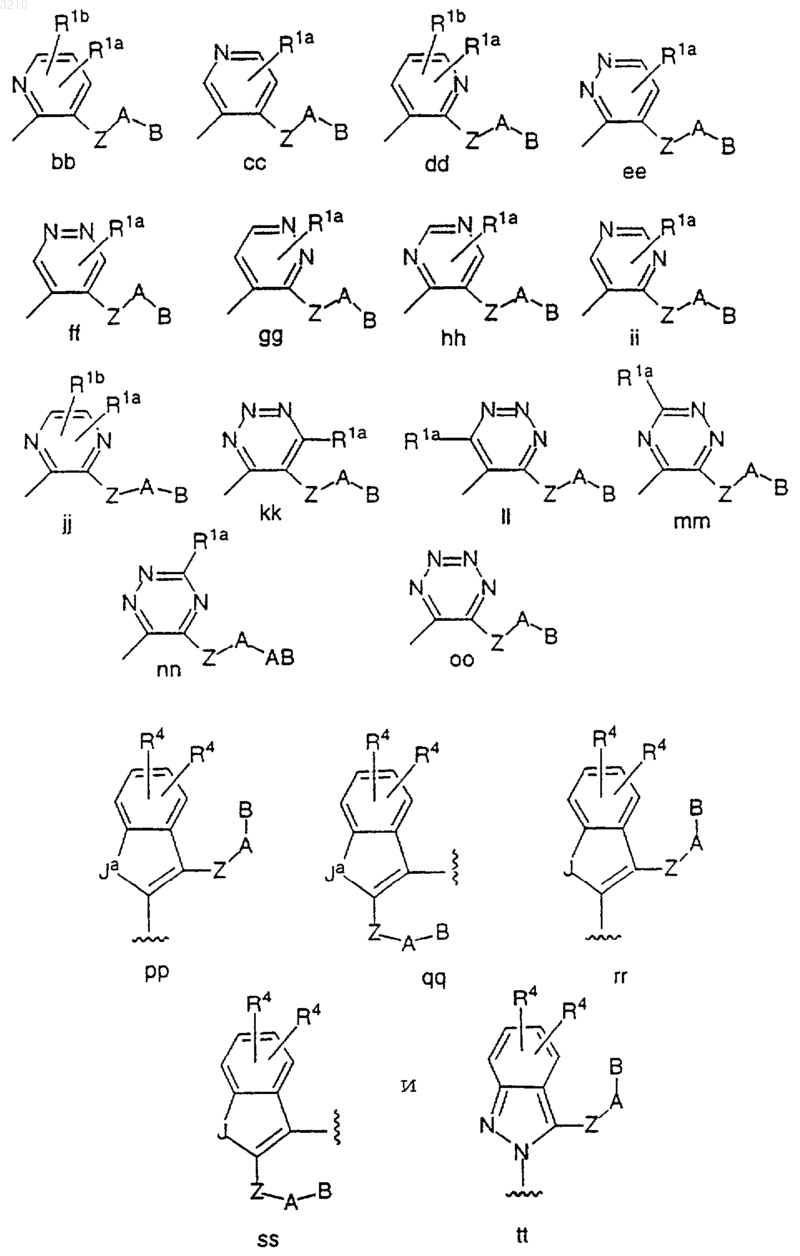
J обозначает O или S;
Ja обозначает NH или NR1a;
Z выбран из связи, C1-C4 алкилена, (CH2)rO(CH2)r, (CH2)rNR3(CH2)r, (CH2)rC(O)(CH2)r, (CH2)rC(O)O(CH2)r, (CH2)rOC(O)(CH2)r, (CH2)rC(O)NR3(CH2)r, (CH2)rNR3C(O)(CH2)r, (CH2)rOC(O)O(CH2)r, (CH2)rOC(O)NR3(CH2)r, (CH2)rNR3C(O)O(CH2)r, (CH2)rNR3C(O)NR3(CH2)r, (CH2)rS(O)p(CH2)r, (CH2)rSO2NR3(CH2)r, (CH2)rNR3SO2(CH2)r и (CH2)rNR3SO2NR3 (CH2)r, при условии, что Z не образует связи N-N, N-O, N-S, NCH2N, NCH2O или NCH2S с кольцом M или группой A;
R1a и R1b независимо отсутствуют или выбраны из -(CH2)r-R1', -CH=CH-R1', NCH2R1", OCH2R1", SCH2R1", NH(CH2)2(CH2)tR1', O(CH2)2(CH2)tR1' и S(CH2)2(CH2)tR1';
альтернативно R1a и R1b, когда они присоединены к соседним атомам углерода, вместе с атомами, к которым они присоединены, образуют 5-8-членное насыщенное, частично насыщенное или ненасыщенное кольцо, замещенное 0-2 R4 и содержащее 0-2 гетероатома, выбранных из группы, состоящей из N, O и S;
альтернативно когда Z представляет собой C(O)NH и R1a присоединен к кольцевому углероду, смежному с Z, тогда R1a представляет собой группу C(O), которая замещает амидный водород Z с образованием циклического имида;
R1' выбран из H, C1-3 алкила, F, Cl, Br, I, -CN, -CHO, (CF2)rCF3, (CH2)rOR2, NR2R2a, C(O)R2c, OC(O)R2, (CF2)rCO2R2c, S(O)pR2b, NR2(CH2)rOR2, CH(=NR2c)NR2R2a, NR2C(O)R2b, NR2C(O)NHR2b, NR2C(O)2R2a, OC(O)NR2aR2b, C(O)NR2R2a, C(O)NR2(CH2)rOR2, SO2NR2R2a, NR2SO2R2b, C3-6 карбоциклического остатка, замещенного 0-2 R4, и 5-10-членной гетероциклической системы, содержащей 1-4 гетероатома, выбранных из группы, состоящей из N, O и S, замещенной 0-2 R4;
R1" выбран из H, CH(CH2OR2)2, C(O)R2c, C(O)NR2R2a, S(O)R2b, S(O)2R2b и SO2NR2R2a;
R2 в каждом случае выбран из H, CF3, C1-6 алкила, бензила, C3-6 карбоциклического остатка, замещенного 0-2 R4b, и 5-6-членной гетероциклической системы, содержащей 1-4 гетероатома, выбранных из группы, состоящей из N, O и S, замещенной 0-2 R4b;
R2a в каждом случае выбран из H, CF3, C1-6 алкила, бензила, фенетила, C3-6 карбоциклического остатка, замещенного 0-2 R4b, и 5-6-членной гетероциклической системы, содержащей 1-4 гетероатома, выбранных из группы, состоящей из N, O и S, замещенной 0-2 R4b;
R2b в каждом случае выбран из CF3, C1-4 алкокси, C1-6 алкила, бензила, C3-6 карбоциклического остатка, замещенного 0-2 R4b, и 5-6-членной гетероциклической системы, содержащей 1-4 гетероатома, выбранных из группы, состоящей из N, O и S, замещенной 0-2 R4b;
R2c в каждом случае выбран из CF3, OH, C1-4 алкокси, C1-6 алкила, бензила, C3-6 карбоциклического остатка, замещенного 0-2 R4b, и 5-6-членной гетероциклической системы, содержащей 1-4 гетероатома, выбранных из группы, состоящей из N, O и S, замещенной 0-2 R4b;
альтернативно R2 и R2a вместе с атомом, к которому они присоединены, объединяются с образованием 5-6-членного насыщенного, частично насыщенного или ненасыщенного кольца, замещенного 0-2 R4b и содержащего 0-1 дополнительных гетероатомов, выбранных из группы, состоящей из N, O и S;
R3 в каждом случае выбран из H, C1-4 алкила и фенила;
R3a в каждом случае выбран из H, C1-4 алкила и фенила;
R3b в каждом случае выбран из H, C1-4 алкила и фенила;
R3c в каждом случае выбран из C1-4 алкила и фенила;
A выбран из C3-10 карбоциклического остатка, замещенного 0-2 R4, и 5-10-членной гетероциклической системы, содержащей 1-4 гетероатома, выбранных из группы, состоящей из N, O и S, замещенной 0-2 R4;
B выбран из H, Y и X-Y;
X выбран из C1-4 алкилена, -CR2(CR2R2b) (CH2)t-, -C(O)-, -C(=NR1")-, -CR2(NR1''R2)-, -CR2(OR2)-, - CR2(SR2)-, -C(O)CR2R2a-, -CR2R2aC(O)-, -S(O)p-, -S(O)pCR2R2a-, -CR2R2aS(O)p-, -S(O)2NR2-, -NR2S(O)2-, -NR2S(O)2CR2R2a-, -CR2R2aS(O)2NR2-, -NR2S(O)2NR2-, -C(O)NR2-, -NR2C(O)-, -C(O)NR2CR2R2a-, -NR2C(O)CR2R2a-, -CR2R2aC(O)NR2-, -CR2R2aNR2C(O)-, -NR2C(O)O-, -OC(O)NR2-, -NR2C(O)NR2-, -NR2-, -NR2CR2R2a-, -CR2R2aNR2-, O, -CR2R2aO- и -OCR2R2a-;
Y выбран из (CH2)rNR2R2a, при условии, что X-Y не образуют связи N-N, O-N или S-N, C3-10 карбоциклического остатка, замещенного 0-2 R4a, и 5-10-членной гетероциклической системы, содержащей 1-4 гетероатома, выбранных из группы, состоящей из N, O и S, замещенной 0-2 R4a;
R4 в каждом случае выбран из H, =O, (CH2)rOR2, F, Cl, Br, I, C1-4 алкила, -CN, NO2, (CH2)rNR2R2a, (CH2)rC(O)R2c, NR2C(O)R2b, C(O)NR2R2a, NR2C(O)NR2R2a, CH(=NR2)NR2R2a, CH(=NS(O)2R5)NR2R2a, NHC(=NR2)NR2R2a, C(O)NHC(=NR2)NR2R2a, SO2NR2R2a, NR2SO2NR2R2a, NR2SO2-C1-4 алкила, NR2SO2R5, S(O)pR5, (CF2)rCF3, NCH2R1", OCH2R1", SCH2R1", N(CH2)2(CH2)tR1', O(CH2)2(CH2)tR1' и S(CH2)2(CH2)tR1';
альтернативно один из R4 представляет собой 5-6-членный ароматический гетероцикл, содержащий 1-4 гетероатома, выбранных из группы, состоящей из N, O и S;
при условии, что если B представляет собой H, то R4 является иным, чем тетразол, C(O)-алкокси и C(O)NR2R2a;
R4a в каждом случае выбран из H, =O, (CH2)rOR2, (CH2)r-F, (CH2)r-Br, (CH2)r-Cl, I, C1-4 алкила, -CN, NO2, (CH2)rNR2R2a, (CH2)rNR2R2b, (CH2)rC(O)R2c, NR2C(O)R2b, C(O)NR2R2a, C(O)NH(CH2)2NR2R2a, NR2C(O)NR2R2a, CH(=NR2)NR2R2a, NHC(=NR2)NR2R2a, SO2NR2R2a, NR2SO2NR2R2a, NR2SO2-C1-4 алкила, C(O)NHSO2-C1-4 алкила, NR2SO2R5, S(O)pR5 и (CF2)rCF3;
альтернативно один из R4a представляет собой 5-6-членный ароматический гетероцикл, содержащий 1-4 гетероатома, выбранных из группы, состоящей из N, O и S, и замещенный 0-1 R5;
R4b в каждом случае выбран из H, =O, (CH2)rOR3, F, Cl, Br, I, C1-4 алкила, -CN, NO2, (CH2)rNR3R3a, (CH2)rC(O)R3, (CH2)rC(O)OR3c, NR3C(O)R3a, C(O)NR3R3a, NR3C(O)NR3R3a, CH(=NR3)NR3R3a, NH3C(=NR3)NR3R3a, SO2NR3R3a, NR3SO2NR3R3a, NR3SO2-C1-4 алкила, NR3SO2CF3, NR3SO2-фенила, S(O)pCF3, S(O)p-C1-4 алкила, S(O)p-фенила и (CF2)rCF3;
R5 в каждом случае выбран из CF3, C1-6 алкила, фенила, замещенного 0-2 R6, и бензила, замещенного 0-2 R6;
R6 в каждом случае выбран из H, OH, (CH2)rOR2, F, Cl, Br, I, C1-4 алкила, -CN, NO2, (CH2)rNR2R2a, (CH2)rC(O)R2b, NR2C(O)R2b, NR2C(O)NR2R2a, CH(=NH)NH2, NHC(=NH)NH2, SO2NR2R2a, NR2SO2NR2R2a и NR2SO2-C1-4 алкила;
n выбран из 0, 1, 2 и 3;
m выбран из 0, 1 и 2;
p выбран из 0, 1 и 2;
r выбран из 0, 1, 2 и 3;
s выбран из 0, 1 и 2 и
t выбран из 0 и 1,
при условии что, когда
(а) кольцо D представляет фуран, тиофен, пиррол, изоксазол, изотиазол или пиразол, тогда Z не является связью;
(в) A представляет бензофуран, бензотиофен, индол, бензизоксазол, бензизотиазол или индазол, тогда
(1) кольцо M является пиразолом или
(2) Z не является связью или C1-C4 алкиленом.
2. Соединение по п.1, где D-E выбран из группы
1-аминоизохинолин-7-ил; 1,3-диаминоизохинолин-7-ил; 1,4-диаминоизохинолин-7-ил; 1,5-диаминоизохинолин-7-ил; 1,6-диаминоизохинолин-7-ил; 1-амино-3-гидроксиизохинолин-7-ил; 1-амино-4-гидроксиизохинолин-7-ил; 1-амино-5-гидроксиизохинолин-7-ил; 1-амино-6-гидроксиизохинолин-7-ил; 1-амино-3-метоксиизохинолин-7-ил; 1-амино-4-метоксиизохинолин-7-ил; 1-амино-5-метоксиизохинолин-7-ил; 1-амино-6-метоксиизохинолин-7-ил; 1-гидроксиизохинолин-7-ил; 4-аминохиназол-6-ил; 2,4-диаминохиназол-6-ил; 4,7-диаминохиназол-6-ил; 4,8-диаминохиназол-6-ил; 1-аминофталаз-7-ил; 1,4-диаминофталаз-7-ил; 1,5-диаминофталаз-7-ил; 1,6-диаминофталаз-7-ил; 4-аминоптерид-6-ил; 2,4-диаминоптерид-6-ил; 4,6-диаминоптерид-6-ил; 8-амино-1,7-нафтирид-2-ил; 6,8-диамино-1,7-нафтирид-2-ил; 5,8-диамино-1,7-нафтирид-2-ил; 4,8-диамино-1,7-нафтирид-2-ил; 3,8-диамино-1,7-нафтирид-2-ил; 5-амино-2,6-нафтирид-3-ил; 5,7-диамино-2,6-нафтирид-3-ил; 5,8-диамино-2,6-нафтирид-3-ил; 1,5-диамино-2,6-нафтирид-3-ил; 5-амино-1,6-нафтирид-3-ил; 5,7-диамино-1,6-нафтирид-3-ил; 5,8-диамино-1,6-нафтирид-3-ил; 2,5-диамино-1,6-нафтирид-3-ил; 3-аминоиндазол-5-ил; 3-гидроксииндазол-5-ил; 3-аминобензизоксазол-5-ил; 3-гидроксибензизоксазол-5-ил; 3-аминобензизотиазол-5-ил; 3-гидроксибензизотиазол-5-ил; 1-амино-3,4-дигидроизохинолин-7-ил и 1-аминоизоиндол-6-ил;
M выбран из группы
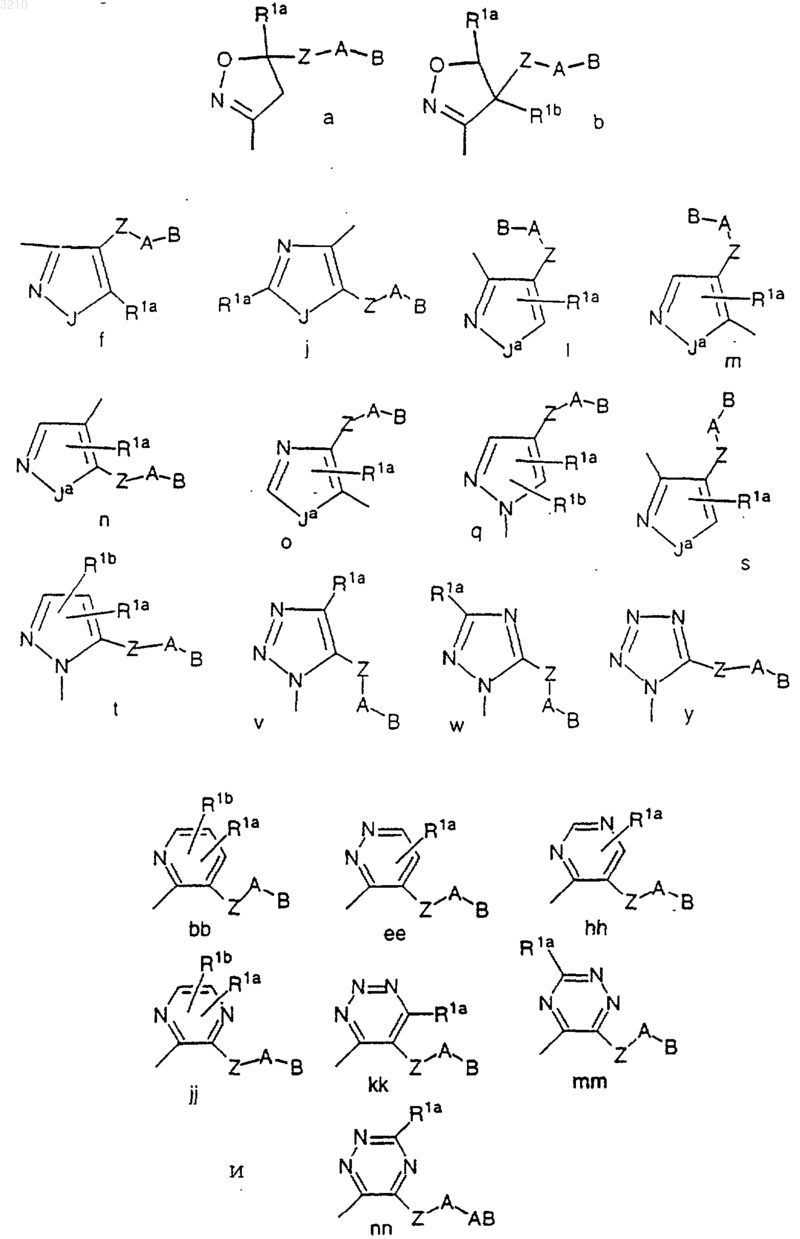
Z выбран из (CH2)rC(O)(CH2)r, (CH2)rC(O)O(CH2)r, (CH2)rC(O)NR3(CH2)r, (CH2)rS(O)p(CH2)r и (CH2)rSO2NR3(CH2)r; и
Y выбран из одной из следующих карбоциклических и гетероциклических систем, которые замещены 0-2 R4a: фенил, пиперидинил, пиперазинил, пиридил, пиримидил, фуранил, морфолинил, тиофенил, пирролил, пирролидинил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил, имидазолил, оксадиазол, тиадиазол, триазол, 1,2,3-оксадиазол, 1,2,4-оксадиазол, 1,2,5-оксадиазол, 1,3,4-оксадиазол, 1,2,3-тиадиазол, 1,2,4-тиадиазол, 1,2,5-тиадиазол, 1,3,4-тиадиазол, 1,2,3-триазол, 1,2,4-триазол, 1,2,5-триазол, 1,3,4-триазол, бензофуран, бензотиофуран, индол, бензимидазол, бензоксазол, бензтиазол, индазол, бензизоксазол, бензизотиазол и изоиндазол;
Y может быть также выбран из следующих бициклических гетероарильных кольцевых систем:
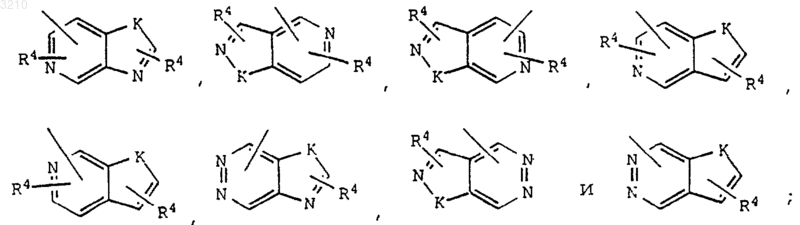
K выбран из O, S, NH и N.
3. Соединение по п.2,
где D-E выбран из группы: 1-аминоизохинолин-7-ил; 1,3-диаминоизохинолин-7-ил; 1,4-диаминоизохинолин-7-ил; 1,5-диаминоизохинолин-7-ил; 1,6-диаминоизохинолин-7-ил; 1-гидроксиизохинолин-7-ил; 4-аминохиназол-6-ил; 2,4-диаминохиназол-6-ил; 4,7-диаминохиназол-6-ил; 4,8-диаминохиназол-6-ил; 1-аминофталаз-7-ил; 1,4-диаминофталаз-7-ил; 1,5-диаминофталаз-7-ил; 1,6-диаминофталаз-7-ил; 4-аминоптерид-6-ил; 8-амино-1,7-нафтирид-2-ил; 5-амино-1,6-нафтирид-3-ил; 5-амино-2,6-нафтирид-3-ил; 3-аминобензизоксазол-5-ил; 3-аминобензизотиазол-5-ил; 1-амино-3,4-дигидроизохинолин-7-ил и 1-аминоизоиндол-6-ил;
M выбран из группы
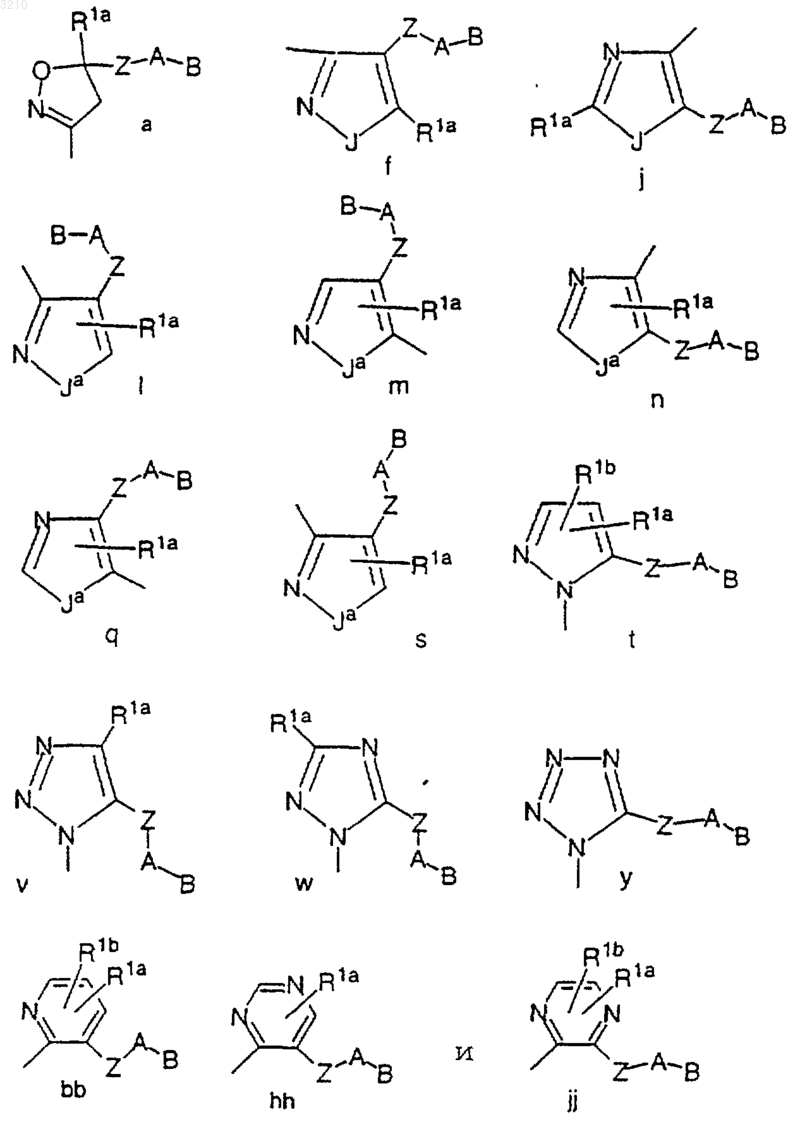
Z выбран из (CH2)rC(O)(CH2)r и (CH2)rC(O)NR3(CH2)r; и
Y выбран из одной из следующих карбоциклических и гетероциклических систем, которые замещены 0-2 R4a: фенил, пиперидинил, пиперазинил, пиридил, пиримидил, фуранил, морфолинил, тиофенил, пирролил, пирролидинил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил, имидазолил, оксадиазол, тиадиазол, триазол, 1,2,3-оксадиазол, 1,2,4-оксадиазол, 1,2,5-оксадиазол, 1,3,4-оксадиазол, 1,2,3-тиадиазол, 1,2,4-тиадиазол, 1,2,5-тиадиазол, 1,3,4-тиадиазол, 1,2,3-триазол, 1,2,4-триазол, 1,2,5-триазол, 1,3,4-триазол, бензофуран, бензотиофуран, индол, бензимидазол, бензоксазол, бензтиазол, индазол, бензизоксазол, бензизотиазол и изоиндазол.
4. Соединение по п.3,
где D-E выбран из группы: 1-аминоизохинолин-7-ил; 1,3-диаминоизохинолин-7-ил; 1,4-диаминоизохинолин-7-ил; 1,5-диаминоизохинолин-7-ил; 1,6-диаминоизохинолин-7-ил; 1-аминофталаз-7-ил; 1,4-диаминофталаз-7-ил; 1,5-диаминофталаз-7-ил; 1,6-диаминофталаз-7-ил; 4-аминоптерид-6-ил; 8-амино-1,7-нафтирид-2-ил; 5-амино-1,6-нафтирид-3-ил; 5-амино-2,6-нафтирид-3-ил; 3-аминобензизоксазол-5-ил; 1-амино-3,4-дигидроизохинолин-7-ил и 1-аминоизоиндол-6-ил;
M выбран из группы
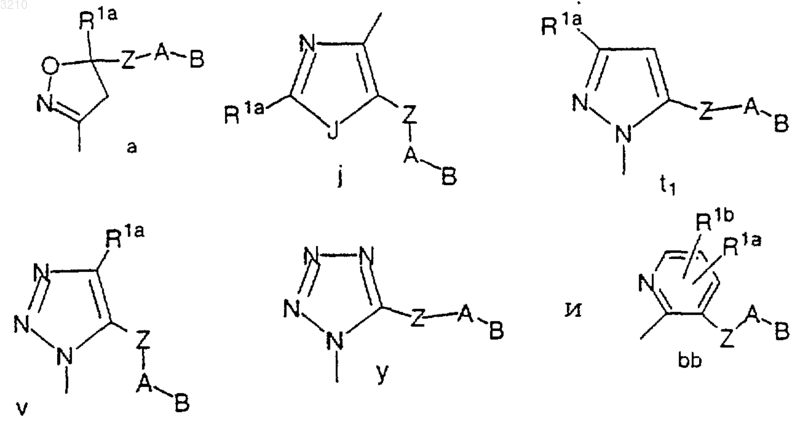
A выбран из C5-6 карбоциклического остатка, замещенного 0-2 R4, и 5-6-членной гетероциклической системы, содержащей 1-4 гетероатома, выбранных из группы, состоящей из N, O и S, замещенной 0-2 R4;
Y выбран из одной из следующих карбоциклических и гетероциклических систем, которые замещены 0-2 R4a: фенил, пиперидинил, пиперазинил, пиридил, пиримидил, фуранил, морфолинил, тиофенил, пирролил, пирролидинил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил, имидазолил, бензимидазолил, оксадиазол, тиадиазол, триазол, 1,2,3-оксадиазол, 1,2,4-оксадиазол, 1,2,5-оксадиазол, 1,3,4-оксадиазол, 1,2,3-тиадиазол, 1,2,4-тиадиазол, 1,2,5-тиадиазол, 1,3,4-тиадиазол, 1,2,3-триазол, 1,2,4-триазол, 1,2,5-триазол и 1,3,4-триазол;
R2 в каждом случае выбран из H, CF3, C1-6 алкила, бензила, C5-6 карбоциклического остатка, замещенного 0-2 R4b, и 5-6-членной гетероциклической системы, содержащей 1-4 гетероатома, выбранных из группы, состоящей из N, O и S, замещенной 0-2 R4b;
R2a в каждом случае выбран из H, CF3, C1-6 алкила, бензила, фенетила, C5-6 карбоциклического остатка, замещенного 0-2 R4b, и 5-6-членной гетероциклической системы, содержащей 1-4 гетероатома, выбранных из группы, состоящей из N, O и S, замещенной 0-2 R4b;
R2b в каждом случае выбран из CF3, C1-4 алкокси, C1-6 алкила, бензила, C5-6 карбоциклического остатка, замещенного 0-2 R4b, и 5-6-членной гетероциклической системы, содержащей 1-4 гетероатома, выбранных из группы, состоящей из N, O и S, замещенной 0-2 R4b;
R2c в каждом случае выбран из CF3, OH, C1-4 алкокси, C1-6 алкила, бензила, C5-6 карбоциклического остатка, замещенного 0-2 R4b, и 5-6-членной гетероциклической системы, содержащей 1-4 гетероатома, выбранных из группы, состоящей из N, O и S, замещенной 0-2 R4b;
альтернативно R2 и R2a вместе с атомом, к которому они присоединены, объединяются с образованием 5-6-членного кольца, выбранного из имидазолила, морфолино, пиперазинила, пиридила и пирролидинила, замещенного 0-2 R4b;
R4 в каждом случае выбран из H, =O, OR2, CH2OR2, F, Cl, C1-4 алкила, NR2R2a, CH2NR2R2a, C(O)R2c, CH2C(O)R2c, C(O)NR2R2a, CH(=NR2)NR2R2a, CH(=NS(O)2R5)NR2R2a, SO2NR2R2a, NR2SO2-C1-4 алкила, S(O)2R5 и CF3,
при условии, что, если B представляет собой H, то R4 является иным, чем тетразол, C(O)-алкокси и C(O)NR2R2a;
R4a в каждом случае выбран из H, =O, (CH2)rOR2, F, Cl, C1-4 алкила, NR2R2a, CH2NR2R2a, NR2R2b, CH2NR2R2b, (CH2)rC(O)R2c, NR2C(O)R2b, C(O)NR2R2a, C(O)NH(CH2)2NR2R2a, NR2C(O)NR2R2a, SO2NR2R2a, S(O)2R5 и CF3; и
R4b в каждом случае выбран из H, =O, (CH2)rOR3, F, Cl, C1-4 алкила, NR3R3a, CH2NR3R3a, C(O)R3, CH2C(O)R3, C(O)OR3c, C(O)NR3R3a, CH(=NR3)NR3R3a, SO2NR3R3a, NR3SO2-C1-4 алкила, NR3SO2CF3, NR3SO2-фенила, S(O)2CF3, S(O)2-C1-4 алкила, S(O)2-фенила и CF3.
5. Соединение по п.4,
где D-E выбран из группы: 1-аминоизохинолин-7-ил; 1,3-диаминоизохинолин-7-ил; 1,4-диаминоизохинолин-7-ил; 1,5-диаминоизохинолин-7-ил; 1,6-диаминоизохинолин-7-ил; 8-амино-1,7-нафтирид-2-ил; 5-амино-1,6-нафтирид-3-ил; 5-амино-2,6-нафтирид-3-ил; 3-аминобензизоксазол-5-ил; 1-амино-3,4-дигидроизохинолин-7-ил и 1-аминоизоиндол-6-ил.
6. Соединение по п.1, выбранное из группы соединений
1-(1'-аминоизохинол-7'-ил)-3-метил-5-[(2'-аминосульфонил-[1,1']-бифен-4-ил)карбониламино]пиразол;
1-(1'-аминоизохинол-7'-ил)-3-метил-5-[(2'-метилсульфонил-[1,1']-бифен-4-ил)карбониламино]пиразол;
1-(4'-аминоизохинол-7'-ил)-3-метил-5-[(2'-аминосульфонил-[1,1']-бифен-4-ил)карбониламино]пиразол;
1-(изохинол-7'-ил)-3-метил-5-[(2'-аминосульфонил-[1,1']-бифен-4-ил)карбониламино]пиразол;
3-(1'-аминоизохинол-7'-ил)-5-[(2'-аминосульфонил-[1,1']-бифен-4-ил)карбониламино]-5-метилизоксазолин;
3-(изохинол-5'-ил)-5-[(2'-аминосульфонил-[1,1']-бифен-4-ил)карбониламино]-5-метилизоксазолин;
3-(изохинол-7'-ил)-5-[(2'-аминосульфонил-[1,1']-бифен-4-ил)карбониламино]-5-метилизоксазолин;
3-(2'-аминобензимидазол-5'-ил)-5-[(2'-аминосульфонил-[1,1']-бифен-4-ил)аминокарбонил]-5-метилизоксазолин;
3-(3'-аминоиндазол-5'-ил)-5-[(2'-аминосульфонил-[1,1']-бифен-4-ил)аминокарбонил]-5-метилизоксазолин;
3-(3'-аминобензизоксазол-5'-ил)-5-[(2'-аминосульфонил-[1,1']-бифен-4-ил)аминокарбонил]-5-метилизоксазолин;
1-(3'-аминобензизоксазол-5'-ил)-3-метил-5-[(2'-аминосульфонил-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
3-(1-аминоизохинол-7-ил)-4-[(2'-аминосульфонил-[1,1']-бифен-4-ил)аминокарбонил]-1,2,3-триазол;
3-(4-аминоизохинол-7-ил)-4-[(2'-аминосульфонил-[1,1']-бифен-4-ил)аминокарбонил]-1,2,3-триазол;
3-(изохинол-7-ил)-4-[(2'-аминосульфонил-[1,1']-бифен-4-ил)аминокарбонил]-1,2,3-триазол;
1-(хинол-2-илметил)-3-метил-5-[(2'-аминосульфонил-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(хинол-2-ил)-3-метил-5-[(2'-аминосульфонил-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(3'-аминоиндазол-5'-ил)-3-метил-5-[(2'-аминосульфонил-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(3-аминоиндазол-5-ил)-3-метил-5-[(2'-аминосульфонил-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-метил-5-[(2'-аминосульфонил(фенил)пирид-2-ил)аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-метил-5-[(изохинол-7-ил)аминокарбонил]пиразол;
1-(1'-аминоизохинол-7'-ил)-3-этил-5-[(2'-аминосульфонил-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(1'-аминоизохинол-7'-ил)-3-изопропил-5-[(2'-аминосульфонил-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(2',4'-диаминохиназол-6'-ил)-3-метил-5-[(2'-аминосульфонил-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(4'-аминохиназол-6'-ил)-3-метил-5-[(2'-аминосульфонил-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(1'-аминоизохинол-7'-ил)-3-метил-5-[4-(N-пирролидинилкарбонил)фениламинокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[(2'-метилсульфонил-3-фтор-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(1'-аминофталазин-7'-ил)-3-метил-5-[(2'-аминосульфонил-[1,1']-бифен-4-ил)карбониламино]пиразол;
3-(3'-аминобензизоксазол-5'-ил)-5-[[5-[(2'-аминосульфонил)фенил]пирид-2-ил]аминокарбонил]-5-(метилсульфониламинометил)изоксазолин;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[(2-фтор-4-морфолинофенил)аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[[4-(2'-изопропилимидазол-1'-ил)фенил]аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[[4-(2'-этилимидазол-1'-ил)фенил]аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[[4-[(2'-диметиламинометил)имидазол-1'-ил]фенил]аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[[4-[(2'-метоксиметил)имидазол-1'-ил]фенил]аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[[4-[(2'-диметиламинометил)имидазол-1'-ил]-2-фторфенил]аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[[2-метокси-4-(2'-метилимидазол-1'-ил)фенил]аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[[4-(2'-изопропилимидазол-1'-ил)-2-фторфенил]аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[[4-(2'-этилимидазол-1'-ил)-2-фторфенил]аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-этил-5-[[4-(2'-этилимидазол-1'-ил)-2-фторфенил]аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-этил-5-[[4-[(2'-метоксиметил)имидазол-1'-ил]фенил]аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-этил-5-[[4-[(2'-диметиламинометил)имидазол-1'-ил]фенил]аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-этил-5-[[4-[(2'-метил)бензимидазол-1'-ил]фенил]аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-этил-5-[(2'-этилимидазол-1'-илфенил)аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-этил-5-[[4-(2'-этилимидазол-1'-ил)-2,5-дифторфенил]аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-этил-5-[(2-фтор-4-морфолинофенил)аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-этил-5-[(2'-изопропилимидазол-1'-илфенил)аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-этил-5-[[4-(2'-метилимидазол-1'-ил)-2-фторфенил]аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-этил-5-[(2'-аминосульфонил-3-амино-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-этил-5-[(2'-аминосульфонил-3-нитро-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-этил-5-[[4-(2'-метилимидазол-1'-ил)фенил]аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-этил-5-[[2-диметил-4-(N-пирролидинокарбонил)фенил]аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-этил-5-[[2-пирролидино-4-(N-пирролидинокарбонил)фенил]аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-этил-5-[[2-фтор-4-(N-пирролидинокарбонил)фенил]аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-этил-5-[(2'-аминосульфонил-3-фтор-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-этил-5-[[5-[(2-метилсульфонил)фенил]пиримид-2-ил]аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-этил-5-[[(2'-метилсульфонил)-3-фтор-[1,1']-бифен-4-ил]аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-этил-5-[[5-[(2'-аминосульфонил)фенил]пирид-2-ил]аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-5-[[(2'-метилсульфонил)-3-фтор-[1,1']-бифен-4-ил]аминокарбонил]тетразол;
1-(3'-аминобензизоксазол-5'-ил)-5-[[4-(2'-метилимидазол-1'-ил)фенил]аминокарбонил]тетразол;
1-(3'-аминобензизоксазол-5'-ил)-5-[(2'-аминосульфонил-[1,1']-бифен-4-ил)аминокарбонил]тетразол;
1-(3'-аминобензизоксазол-5'-ил)-5-[(2-фтор-4-(N-пирролидинокарбонил)фенил)аминокарбонил]тетразол;
1-(3'-аминобензизоксазол-5'-ил)-5-[(2-(N-пирролидино)-4-(N-пирролидинокарбонил)фенил)аминокарбонил]тетразол;
1-(1'-аминоизохинол-7'-ил)-5-[[(2'-аминосульфонил)-3-фтор-[1,1']-бифен-4-ил]аминокарбонил]тетразол;
1-(1'-аминоизохинол-7'-ил)-5-[[(2'-метилсульфонил)-3-фтор-[1,1']-бифен-4-ил]аминокарбонил]тетразол;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[[(2'-аминосульфонилфенил)пиримидин-2-ил]аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[4-[(2'-метилимидазол-1'-ил)фенил]аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[4-[(2'-метилимидазол-1'-ил)-2-фторфенил]аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[4-[(1'-метилимидазол-2'-ил)-2-фторфенил]аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[4-[(2'-аминоимидазол-1'-ил)фенил]аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[(2'-диметиламинометил-3-фтор-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
этил 1-(3'-аминобензизоксазол-5'-ил)-5-[(2'-аминосульфонил-3-фтор-[1,1']-бифен-4-ил)аминокарбонил]пиразол-3-карбоксилат;
1-(3'-аминобензизоксазол-5'-ил)-5-[(2'-аминосульфонил-3-фтор-[1,1']-бифен-4-ил)аминокарбонил]пиразол-3-карбоновая кислота;
1-(3'-аминобензизоксазол-5'-ил)-5-[(2'-аминосульфонил-3-фтор-[1,1']-бифен-4-ил)аминокарбонил]пиразол-3-карбоксамид;
этил 1-(3'-аминобензизоксазол-5'-ил)-5-[(2'-метилсульфонил-3-фтор-[1,1']-бифен-4-ил)аминокарбонил]пиразол-3-карбоксилат;
1-(3'-аминобензизоксазол-5'-ил)-5-[(2'-метилсульфонил-3-фтор-[1,1']-бифен-4-ил)аминокарбонил]пиразол-3-карбоновая кислота;
1-(3'-аминобензизоксазол-5'-ил)-3-(гидроксиметил)-5-[(2'-метилсульфонил-3-фтор-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-[диметиламинометил]-5-[(2'-метилсульфонил-3-фтор-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
этил 1-(3'-аминобензизоксазол-5'-ил)-5-[(2'-метилсульфонил-3-фтор-[1,1']-бифен-4-ил)аминокарбонил]пиразол-4-карбоксилат;
1-(3'-аминобензизоксазол-5'-ил)-5-[(2'-метилсульфонил-3-фтор-[1,1']-бифен-4-ил)аминокарбонил]пиразол-4-карбоновая кислота;
1-(1',2',3',4'-тетрагидроизохинол-7'-ил)-3-метил-5-[(2'-аминосульфонил-[1,1']-бифен-4-ил)карбониламино]пиразол;
1-(1'-аминоизохинол-7'-ил)-3-[(2'-метиламиносульфонил-[1,1']-бифен-4-ил)карбониламино]-5-метилпиразол;
1-(4'-аминoизoxинoл-7'-ил)-3-метил-5-[(2'-метилсульфонил-[1,1']-бифен-4-ил)карбониламино]пиразол;
1-(1'-аминоизохинол-7'-ил)-3-трифторметил-5-[(2'-метилсульфонил-[1,1']-бифен-4-ил)карбониламино]пиразол;
1-(1'-аминоизохинол-7'-ил)-3-трифторметил-5-[(2-фтор-4-(N-пирролидинокарбонил)фенил)карбониламино]пиразол;
1-(1'-аминоизохинол-7'-ил)-3-трифторметил-5-[(2'-метилсульфонил-3-фтор-[1,1']-бифен-4-ил)карбониламино]пиразол;
1-(1'-аминоизохинол-7'-ил)-3-трифторметил-5-[(2'-аминосульфонил-[1,1']-бифен-4-ил)карбониламино]пиразол;
1-(1'-аминоизохинол-7'-ил)-3-трифторметил-5-[(2'-аминосульфонил-3-фтор-[1,1']-бифен-4-ил)карбониламино]пиразол;
1-(1'-аминоизохинол-7'-ил)-3-трифторметил-5-[(5-(2'-метилсульфонилфенил)пирид-2-ил)карбониламино]пиразол;
1-(1'-аминоизохинол-7'-ил)-3-метил-5-[(2'-аминосульфонил-3-фтор-[1,1']-бифен-4-ил)карбониламино]пиразол;
1-(1'-аминоизохинол-7'-ил)-3-метил-5-[(2'-метилсульфонил-3-фтор-[1,1']-бифен-4-ил)карбониламино]пиразол;
1-(1'-аминоизохинол-7'-ил)-3-трифторметил-5-[(2'-аминосульфонил-3-хлор-[1,1']-бифен-4-ил)карбониламино]пиразол;
1-(1'-аминоизохинол-7'-ил)-3-трифторметил-5-[(2'-аминосульфонил-3-метил-[1,1']-бифен-4-ил)карбониламино]пиразол;
1-(1'-аминоизохинол-7'-ил)-3-трифторметил-5-[(2'-метиламиносульфонил-[1,1']-бифен-4-ил)карбониламино]пиразол;
1-(1'-аминоизохинол-7'-ил)-3-этил-5-[(2'-метиламиносульфонил-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(1'-аминоизохинол-7'-ил)-3-этил-5-[(2'-метилсульфонил-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(1'-аминоизохинол-7'-ил)-3-пропил-5-[(2'-аминосульфонил-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(1'-аминоизохинол-7'-ил)-3-пропил-5-[(2'-метиламиносульфонил-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(1'-аминоизохинол-7'-ил)-3-пропил-5-[(2'-метилсульфонил-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(1'-аминоизохинол-7'-ил)-3-этил-5-[(2'-аминосульфонил-3-фтор-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(1'-аминоизохинол-7'-ил)-3-этил-5-[(2'-метилсульфонил-3-фтор-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(1'-аминоизохинол-7'-ил)-3-этил-5-[4-(N-пирролидинокарбонил-1-ил)фениламинокарбонил]пиразол;
1-(1'-аминоизохинол-7'-ил)-3-трифторметил-5-[4-(имидазол-1'-ил)фениламинокарбонил]пиразол;
1-(1'-аминоизохинол-7'-ил)-3-трифторметил-5-[3-фтор-4-(2-метилимидазол-1'-ил)фениламинокарбонил]пиразол;
1-(1'-аминоизохинол-7'-ил)-3-трифторметил-5-[4-(2-метилимидазол-1'-ил)фениламинокарбонил]пиразол;
1-(1'-аминоизохинол-7'-ил)-3-трифторметил-5-[2-фтор-4-(2-мeтилимидaзoл-1'-ил)фениламинокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-метил-5-[(2'-метилсульфонил-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[(2'-аминосульфонил-3-фтор-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[2-фтор-4-(N-пирролидинокарбонил)фениламинокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[(5-(2'-аминосульфонилфенил)пирид-2-ил)аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[(5-(2'-метилсульфонилфенил)пиримид-2-ил)аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-метил-5-[(4-(пирид-3'-ил)фенил)аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[[4-(пирид-3'-ил)-3-фторфенил]аминокарбонил]пиразол;
1-(3'-аминоиндазол-5'-ил)-3-трифторметил-5-[(2'-аминосульфонил-3-фтор-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(3'-аминоиндазол-5'-ил)-3-трифторметил-5-[(2'-метилсульфонил-3-фтор-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(3'-аминоиндазол-5'-ил)-3-трифторметил-5-[2-фтор-4-(N-пирролидинокарбонил)фениламинокарбонил]пиразол;
1-(3'-аминоиндазол-5'-ил)-3-метил-5-[(4-(пирид-3'-ил)фенил)аминокарбонил]пиразол;
1-[3'-аминоиндазол-5'-ил)-3-трифторметил-5-[[4-(пирид-3'-ил)-3-фторфенил]аминокарбонил]пиразол;
1-(3'-аминометилнафт-2'-ил)-3-трифторметил-5-[(2'-метилсульфонил-3-фтор-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[(3-фтор-2'-гидроксиметил-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[(3-фтор-2'-метиламинометил-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[(2'-бромметил-3-фтор-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[(3-фтор-2'-пиридинийметил-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[(2'-аминометил-3-фтор-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[(3-фтор-2'-N-пирролидинилметил-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[(3-фтор-2'-имидазол-1"-ил-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[((2'-(4''-тpeт-бутоксикарбонил)пиперазин-1"-илметил)-3-фтор-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[((2'-(N,N-диметиламино)пиридинийметил)-3-фтор-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[(3-фтор-2'-пиперазин-1"-илметил-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[(3-фтор-2'-N-метилморфолинийметил-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(3'-аминoбeнзизoкcaзoл-5'-ил)-3-трифторметил-5-[(3-фтор-2'-морфолинометил-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[(3-фтор-2'-(N-метил-N-метоксиамино)-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-5-[(2'-метилсульфонил-3-фтор-[1,1']-бифен-4-ил)аминокарбонил]триазол;
1-(3'-аминобензизоксазол-5'-ил)-5-[(2'-аминосульфонил-3-фтор-[1,1']-бифен-4-ил)аминокарбонил]триазол;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[(2'-метиламиносульфонил-3-фтор-[1,1']-бифен-4-ил)аминокарбонил]пиразол;
1-(3'-аминобензизоксазол-5'-ил)-5-[(2'-диметиламинометил-3-фтор-[1,1']-бифен-4-ил)аминокарбонил]тетразол;
1-(3'-аминобензизоксазол-5'-ил)-3-этил-5-[(2'-диметиламинометил-3-фтор-[1,1']-бифен-4-ил)аминокарбонил]пиразол; и
1-(3'-аминобензизоксазол-5'-ил)-3-этил-5-[[4'-(2''-диметиламинометилимидазол-1"-ил)-2'-фторфенил]аминокарбонил]пиразол;
или его фармацевтически приемлемая соль.
7. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и терапевтически эффективное количество соединения по одному из пп.1-6 или его фармацевтически приемлемой соли.
8. Применение соединения по одному из пп.1-6 или его фармацевтически приемлемой соли в качестве терапевтического средства.
9. Соединение по п.1, где соединение выбрано из
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[[4-[(2'-диметиламинометил)имидазол-1'-ил]-2-фторфенил]аминокарбонил]-пиразола;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[4-((2'-метилимидазол-1'-ил)-2-фторфенил)аминокарбонил]пиразола;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[4-((1'-метилимидазол-2'-ил)-2-фторфенил)аминокарбонил]пиразола;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[(2'-диметиламинометил-3-фтор-[1,1']-бифен-4-ил)аминокарбонил]-пиразола;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[2-фтор-4-(N-пирролидинокарбонил)фениламинокарбонил]пиразола;
1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[(3-фтор-2'-N-пирролидинометил-[1,1']-бифен-4-ил)аминокарбонил]пиразола;
или их фармацевтически приемлемых солей.
10. Соединение по п.9, где соединение представляет собой 1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[[4-[(2'-диметиламинометил)имидазол-1'-ил]-2-фторфенил]аминокарбонил]пиразол или его фармацевтически приемлемую соль.
11. Соединение по п.9, где соединение представляет собой 1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[4-((2'-метилимидазол-1'-ил)-2-фторфенил)аминокарбонил]пиразол или его фармацевтически приемлемую соль.
12. Соединение по п.9, где соединение представляет собой 1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[4-((1'-метилимидазол-2'-ил)-2-фторфенил)аминокарбонил]пиразол или его фармацевтически приемлемую соль.
13. Соединение по п.9, где соединение представляет собой 1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[(2'-диметиламинометил-3-фтор-[1,1']-бифен-4-ил)аминокарбонил]пиразол или его фармацевтически приемлемую соль.
14. Соединение по п.9, где соединение представляет собой 1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[2-фтор-4-(N-пирролидинокарбонил)фениламинокарбонил]пиразол или его фармацевтически приемлемую соль.
15. Соединение по п.9, где соединение представляет собой 1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[(3-фтор-2'-N-пирролидинилметил[1,1']-бифен-4-ил)аминокарбонил]пиразол или его фармацевтически приемлемую соль.
16. Соединение по п.9, где фармацевтически приемлемая соль выбрана из соли хлористо-водородной кислоты, соли бромисто-водородной кислоты, соли серной кислоты, соли фосфорной кислоты, соли уксусной кислоты, соли янтарной кислоты, соли гликолевой кислоты, соли стеариновой кислоты, соли молочной кислоты, соли яблочной кислоты, соли винной кислоты, соли лимонной кислоты, соли аскорбиновой кислоты, соли малеиновой кислоты, соли фумаровой кислоты, соли толуолсульфокислоты, соли метансульфокислоты и соли щавелевой кислоты.
17. Соединение формулы I
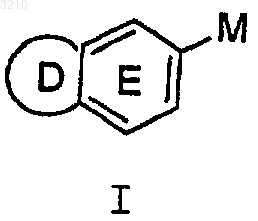
или его стереоизомер или фармацевтически приемлемая соль,
где кольцо D представляет собой 5-членную ароматическую систему, содержащую 1-2 гетероатома, выбранных из группы, состоящей из N, O и S;
при этом кольцо D является замещенным 0-2 R;
кольцо E содержит 0-2 атома N и является замещенным 0-1 R;
R выбран из Cl, F, Br, I, OH, C1-3 алкокси, NH2, NH(C1-3 алкил), N (C1-3 алкил)2, CH2NH2, CH2NH(C1-3 алкил), CH2N(C1-3 алкил)2, CH2CH2NH2, CH2CH2NH(C1-3 алкил) и CH2CH2N(C1-3 алкил)2;
M представляет
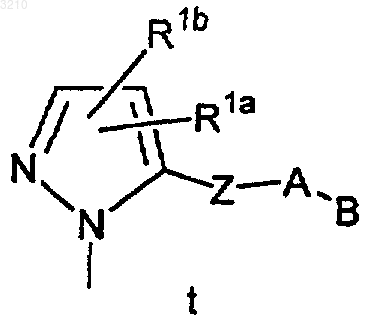
Z выбран из группы, включающей связь, C1-4 алкилен, (CH2)rO(CH2)r, (CH2)rNR3(CH2)r, (CH2)rC(O)(CH2)r, (CH2)rC(O)O(CH2)r, (CH2)rOC(O)(CH2)r, (CH2)rC(O)NR3(CH2)r, (CH2)rNR3C(O)(CH2)r, (CH2)rOC(O)O(CH2)r, (CH2)rOC(O)NR3(CH2)r, (CH2)rNR3C(O)(CH2)r, (CH2)rNR3C(O)NR3(CH2)r, (CH2)rS(O)p(CH2)r, (CH2)rSO2NR3(CH2)r, (CH2)r NR3SO2(CH2)r и (CH2)rNR3SO2NR3(CH2)r, при условии, что Z не образует связь N-N, N-O, N-S, NCH2N, NCH2O или NCH2S с кольцом M или группой A;
R1a и R1b независимо представляют H или выбраны из -(CH2)r-R1', -CH=CH-R1', NCH2R1", OCH2R1", SCH2R1", NH(CH2)2(CH2)tR1', O(CH2)2(CH2)tR1' и S(CH2)2(CH2)tR1';
R1' выбран из H, C1-3алкила, F, Cl, Br, I, -CN, -CHO, (CF2)rCF3, (CH2)rOR2, NR2R2a, C(O)R2c, OC(O)R2, (CF2)rCO2R2c, S(O)pR2b, NR2(CH2)rOR2, C(=NR2c)NR2R2a, NR2C(O)R2b, NR2C(O)NHR2b, NR2C(O)2R2a, OC(O)NR2aR2b, C(O)NR2R2a, C(O)NR2(CH2)rOR2, SO2NR2R2a, NR2SO2R2b, C3-6 карбоциклической группы, замещенной 0-2 R4, и 5-10-членной гетероциклической системы, содержащей 1-4 гетероатома, выбранных из группы, состоящей из N, O и S, замещенной 0-2 R4;
R1" выбран из H, CH(CH2OR2)2, C(O)R2c, C(O)NR2R2a, S(O)R2b, S(O)2R2b и SO2NR2R2a;
R2 в каждом отдельном случае выбран из H, CF3, C1-6 алкила, бензила, C3-6 карбоциклической группы, замещенной 0-2 R4b, и 5-6-членной гетероциклической системы, содержащей 1-4 гетероатома, выбранных из группы, состоящей из N, O и S, замещенной 0-2 R4b;
R2a в каждом отдельном случае выбран из H, CF3, C1-6 алкила, бензила, фенетила, C3-6 карбоциклической группы, замещенной 0-2 R4b, и 5-6-членной гетероциклической системы, содержащей 1-4 гетероатома, выбранных из группы, состоящей из N, O и S, замещенной 0-2 R4b;
R2b в каждом отдельном случае выбран из CF3, C1-4 алкокси, C1-6 алкила, бензила, C3-6 карбоциклической группы, замещенной 0-2 R4b, и 5-6-членной гетероциклической системы, содержащей 1-4 гетероатома, выбранных из группы, состоящей из N, O и S, замещенной 0-2 R4b;
R2c в каждом отдельном случае выбран из CF3, OH, C1-4 алкокси, C1-6 алкила, бензила, C3-6 карбоциклической группы, замещенной 0-2 R4b, и 5-6-членной гетероциклической системы, содержащей 1-4 гетероатома, выбранных из группы, состоящей из N, O и S, замещенной 0-2 R4b;
R3 в каждом отдельном случае выбран из H, C1-4 алкила и фенила;
R3a в каждом отдельном случае выбран из H, C1-4 алкила и фенила;
R3c в каждом отдельном случае выбран из C1-4 алкила и фенила;
A представляет C3-10 карбоциклическую группу, замещенную 0-2 R4;
B представляет Y;
Y представляет 5-10-членную гетероциклическую систему, содержащую 1-4 гетероатома, выбранных из группы, состоящей из N, O и S, замещенную 0-2 R4a;
R4 в каждом отдельном случае выбран из H, =O, (CH2)rOR2, F, Cl, Br, I, C1-4алкила, -CN, NO2, (CH2)rNR2R2a, (CH2)rC(O)R2c, NR2C(O)R2b, C(O)NR2R2a, NR2C(O)NR2R2a, C(=NR2)R2R2a, C(=NS(O)2R5)NR2R2a, NHC(=NR2)NR2NR2a, C(O)NHC(=NR2)NR2NR2a, SO2NR2NR2a, NR2SO2NR2NR2a, NR2SO2-C1-4 алкила, NR2SO2R5, S(O)pR5, (CF2)rCF3, NCH2R1", OCH2R1", SCH2R1", N(CH2)2(CH2)tR1', O(CH2)2(CH2)tR1' и S(CH2)2(CH2)tR1';
R4a в каждом отдельном случае выбран из H, =O, (CH2)rOR2, (CH2)r-F, (CH2)r-Br, (CH2)r-Cl, I, C1-4 алкила, -CN, NO2, (CH2)rNR2R2a, (CH2)rNR2R2b, (CH2)rC(O)R2c, NR2C(O)R2b, C(O)NR2R2a, C(O)NH(CH2)2NR2R2a, NR2C(O)NR2R2a, C(=NR2)R2R2a, NHC(=NR2)NR2NR2a, SO2NR2NR2a, NR2SO2NR2R2a, NR2SO2-C1-4алкила, C(O)NHSO2-C1-4алкила, NR2SO2R5, S(O)3R5 и (CF2)rCF3;
R4b в каждом отдельном случае выбран из H, =O, (CH2)rOR3, F, Cl, Br, I, C1-4алкила, -CN, NO2, (CH2)rNR3R3a, (CH2)rC(O)R3, (CH2)rC(O)OR3c, NR3C(O)R3a, C(O)NR3R3a, NR3C(O)NR3R3a, CH(=NR3)NR3R3a, NH3C(=NR3)NR3NR3a, SO2NR3NR3a, NR3SO2NR3NR3a, NR3SO2-C1-4алкила, NR3SO2CF3, NR3SO2-фенила, S(O)3CF3, S(O)p-C1-4алкила, S(O)p-фенила и (CF2)rCF3;
R5 в каждом отдельном случае выбран из CF3, C1-6алкила, фенила, замещенного 0-2 R6, и бензила, замещенного 0-2 R6;
R6 в каждом отдельном случае выбран из H, =O, (CH2)rOR2, F, Cl, Br, I, C1-4алкила, CN, NO2, (CH2)rNR2R2a, (CH2)rC(O)R2b, NR2C(O)R2b, NR2C(O)NR2R2a, C(=NH)NH2, NHC(=NH)NH2, SO2NR2NR2a, NR2SO2NR2NR2a и NR2SO2-C1-4алкила;
p выбран из 0, 1 и 2;
r выбран из 0, 1, 2 и 3 и
t выбран из 0 и 1.
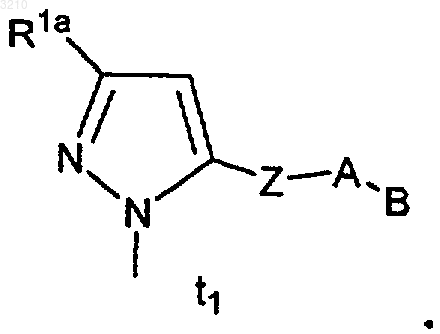
18. Соединение по п.17, где M представляет
19. Соединение по п.17, где D-E выбран из группы, включающей 3-аминоиндазол-5-ил; 3-гидроксииндазол-5-ил; 3-аминобензизоксазол-5-ил; 3-гидроксибензизоксазол-5-ил; 3-аминобензизотиазол-5-ил; 3-гидроксибензизотиазол-5-ил и 1-аминоизоиндол-6-ил.
20. Соединение по п.17, где D-E выбран из группы, включающей 3-аминобензизоксазол-5-ил; 3-аминобензизотиазол-5-ил и 1-аминоизоиндол-6-ил.
21. Соединение по п.17, где D-E выбран из группы, включающей 3-аминобензизоксазол-5-ил и 1-аминоизоиндол-6-ил.
22. Соединение по п.17, где D-E выбран из группы, включающей 3-аминобензизоксазол-5-ил.
23. Соединение по п.17, где Z выбран из (CH2)rC(O)(CH2)r, (CH2)rC(O)O(CH2)r, (CH2)rC(O)NR3(CH2)r, (CH2)rS(O)p(CH2)r и (CH2)rSO2NR3(CH2)r.
24. Соединение по п.17, где Z выбран из (CH2)rC(O)(CH2)r и (CH2)rC(O)NR3(CH2)r.
25. Соединение по п.17, где Z выбран из (CH2)rC(O)NR3(CH2)r.
26. Соединение по п.17, где Z представляет C(O)NH.
27. Соединение по п.17, где Y выбран из одной из следующих карбоциклических и гетероциклических систем, замещенных 0-2 R4a: фенила, пиперидинила, пиперазинила, пиридила, пиримидила, фуранила, морфолинила, тиофенила, пирролила, пирролидинила, оксазолила, изоксазолила, тиазолила, изотиазолила, пиразолила, имидазолила, оксадиазола, тиадиазола, триазола, 1,2,3-оксадиазола, 1,2,4-оксадиазола, 1,2,5-оксадиазола, 1,3,4-оксадиазола, 1,2,3-тиадиазола, 1,2,4-тиадиазола, 1,2,5-тиадиазола, 1,3,4-тиадиазола, 1,2,3-триазола, 1,2,4-триазола, 1,2,5-триазола, 1,3,4-триазола, бензофурана, бензотиофурана, индола, бензимидазола, бензоксазола, бензтиазола, индазола, бензизоксазола, бензизотиазола и изоиндазола.
28. Соединение по п.17, где Y выбран из одной из следующих карбоциклических и гетероциклических систем, замещенных 0-2 R4a: фенила, пиперидинила, пиперазинила, пиридила, пиримидила, фуранила, морфолинила, тиофенила, пирролила, пирролидинила, оксазолила, изоксазолила, тиазолила, изотиазолила, пиразолила, имидазолила, оксадиазола, тиадиазола, триазола, 1,2,3-оксадиазола, 1,2,4-оксадиазола, 1,2,5-оксадиазола, 1,3,4-оксадиазола, 1,2,3-тиадиазола, 1,2,4-тиадиазола, 1,2,5-тиадиазола, 1,3,4-тиадиазола, 1,2,3-триазола, 1,2,4-триазола, 1,2,5-триазола, 1,3,4-триазола, бензофурана, бензотиофурана, индола, бензимидазола, бензоксазола, бензтиазола, индазола, бензизоксазола, бензизотиазола и изоиндазола.
29. Соединение по п.17, где Y выбран из одной из следующих карбоциклических и гетероциклических систем, замещенных 0-2 R4a: фенила, пиперидинила, пиперазинила, пиридила, пиримидила, фуранила, морфолинила, тиофенила, пирролила, пирролидинила, оксазолила, изоксазолила, тиазолила, изотиазолила, пиразолила, имидазолила, бензимидазолила, оксадиазола, тиадиазола, триазола, 1,2,3-оксадиазола, 1,2,4-оксадиазола, 1,2,5-оксадиазола, 1,3,4-оксадиазола, 1,2,3-тиадиазола, 1,2,4-тиадиазола, 1,2,5-тиадиазола, 1,3,4-тиадиазола, 1,2,3-триазола, 1,2,4-триазола, 1,2,5-триазола, 1,3,4-триазола.
30. Соединение по п.17, где Y представляет имидазолил, замещенный 0-2 R4a.
31. Соединение по п.17, где A представляет C5-6 карбоциклическую группу, замещенную 0-2 R4, и R4 в каждом отдельном случае выбран из H, =O, OR2, CH2OR2, F, Cl, C1-4 алкила, NR2R2a, CH2NR2R2a, C(O)R2c, CH2C(O)R2c, C(O)NR2R2a, CH(=NR2)NR2R2a, CH(=NS(O)2P5)NR2R2a, SO2NR2R2a, NR2SO2-C1-4 алкила, S(O)R5 и CF3.
32. Соединение по п.17, где A представляет фенил, замещенный R4; и R4 представляет F.
33. Соединение по п.17, где R1a представляет -(CH2)r-R1', R1' выбран из H, C1-3 алкила, F, Cl, Br, I, CF3, (CH2)rOR2, NR2R2a, C(O)R2c, S(O)pR2b и NR2SO2R2b.
34. Соединение по п.17, где R1a выбран из H, C1-3 алкила, F, Cl, Br, CF3, CH2OR2, C(O)R2c, S(O)pR2b и NR2SO2R2b.
35. Соединение по п.17, где R1a представляет CF3.
36. Соединение по п.17, где R4a в каждом отдельном случае выбран из H, =O, OR2, (CH2)rOR2, F, Cl, C1-4 алкила, NR2R2a, CH2NR2R2a, NR2R2b, CH2NR2R2b, (CH2)rC(O)R2c, NR2C(O)R2b, C(O)NR2R2a, C(O)NH(CH2)2NR2R2a, NR2C(O)NR2R2a, SO2NR2R2a, S(O)2R5 и CF3.
37. Соединение по п.17, где R4a в каждом отдельном случае выбран из (CH2)rOR2 и CH2NR2R2a.
38. Соединение по п.17, где R2 в каждом отдельном случае выбран из H и C1-6алкила; R2a в каждом отдельном случае выбран из H и C1-6 алкила; R2b в каждом отдельном случае выбран из C1-4алкокси и C1-6 алкила; R2c в каждом отдельном случае выбран из OH, C1-4алкокси и C1-6 алкила.
39. Соединение по п.17, где R2 в каждом отдельном случае выбран из H и CH3; и R2a в каждом отдельном случае выбран из H и C3.
40. Фармацевтическая композиция, включающая фармацевтически приемлемый носитель и терапевтически эффективное количество соединения по любому из пп.9-39 или его фармацевтически приемлемой соли.
41. Применение соединения по любому из пп.1-39 или его фармацевтически приемлемой соли, для получения лекарственного средства для лечения или предотвращения тромбоэмболического осложнения.
Текст
1 Область изобретения Данное изобретение относится в общем к новым миметикам (имитаторам, подражателям) гуанидина, которые являются ингибиторами трипсин-подобных сериновых ферментов протеазы, в частности, фактора Ха, содержащим их фармацевтическим композициям и способам применения их в качестве антикоагулянтных агентов для лечения и предупреждения тромбоэмболических нарушений. Предпосылки изобретения В WO 96/28427 описаны бензамидиновые антикоагулянты формулы где Z1 и Z2 обозначают О, N(R), S или OCH2, и центральное кольцо может быть фенилом или различными гетероциклами. Заявляемые здесь соединения не содержат связующей группы(линкера) Z1 или структуры замещения вышеупомянутых соединений. В WO 95/13155 и международной заявке РСТ US 96/07692 описаны антагонисты рецептора фибриногена, являющиеся производными изоксазолина и изоксазола, формулы где R1 может быть основной группой, U-V может быть шестичленным ароматическим кольцом, W-X может быть различными линейными или циклическими группами и Y является оксигруппой. Таким образом, все эти соединения содержат кислотную функциональную группу(т.е. W-X-C(=O)-Y). В противоположность этому, заявляемые здесь соединения не содержат кислотной функциональной группы. В ЕР 0513387 описаны ингибиторы активного кислорода, которые являются оксазолами или тиазолами формулы где Х обозначает О или S, R2 обозначает предпочтительно водород и оба R1 и R3 являются замещенными циклическими группами, причем,по меньшей мере, одна из которых является фенилом. Заявляемые здесь соединения не относятся к этим типам оксазолов или тиазолов. В WO 95/18111 описаны антагонисты рецептора фибриногена, содержащие на концах основную и кислотную группы, формулы где R1 обозначает основную конечную группу,U обозначает алкилен или гетероатом в качестве 2 связующего звена (линкера), V может быть гетероциклом, а правая часть этой молекулы обозначает кислотную конечную группу. Заявляемые здесь соединения не содержат кислотных конечных групп WO 95/18111. Патент США 5463071, Himmelsbach etal., описывает ингибиторы агрегации клеток,которые представляют собой 5-членные гетероциклы формулы где этот гетероцикл может быть ароматическим и группы А-В-С- и F-E-D- присоединены к этой циклической системе. А-В-С- может быть широким кругом заместителей, в том числе основной группой, присоединенной к ароматическому кольцу. Однако группа F-E-D- является кислотной группой, что является отличием от данного изобретения. Кроме того, эти соединения не обсуждаются в качестве ингибиторов фактора Ха. Патент США 5317103, Baker et al., обсуждает агонисты 5-HT1, которые являются индол-замещенными пятичленными гетероароматическими соединениями формулы где R1 может быть пирролидином или пиперидином и А может быть основной группой, в том числе амино или амидино. Однако Baker et al.,не указывают, что А может быть замещенной кольцевой системой, подобной системе, содержащейся в заявляемых здесь гетероароматических соединениях. В WO 94/02477, Baker et al., обсуждаются агонисты 5-HT1, которые являются имидазолами, триазолами или тетразолами формулы где R1 обозначает азотсодержащую кольцевую систему или замещенный азотом циклобутан и А может быть основной группой, в том числе амино или амидино. Но Baker et al. не указывают, что А может быть замещенной кольцевой системой, подобной системе, содержащейся в заявляемых здесь гетероароматических соединениях.Tidwell et al., в J. Med. Chem. 1978, 21 (7),613-623, описывают ряд производных диариламидина, в том числе 3,5-бис(4-амидинофенил) изоксазол. Этот ряд соединений испытывали против тромбина, трипсина и панкреатического калликреина. Заявляемое здесь изобретение не включает эти типы соединений. Активированный фактор Ха, главная практическая роль которого состоит в генерирова 3 нии тромбина посредством ограниченного протеолиза протромбина, занимает центральное положение, связывающее внутренние и наружные механизмы активации в конечном общем пути коагуляции крови. Генерирование тромбина, конечной сериновой протеазы в этом пути генерирования фибринового сгустка, из его предшественника усиливается образованием протромбиназного комплекса (фактор Ха, фактор V, Са 2+ и фосфолипид). Поскольку рассчитано, что одна молекула фактора Ха может генерировать 138 молекул тромбина (Elodi, S.,Varadi, К.: Optimization of conditions for thecatalytic effect of the factor Ixa-factor VIII Complex: Probable role of the complex in the amplification of blood coagulation. Thromb. Res. 1979,15, 617-629), ингибирование фактора Ха может быть более эффективным, чем инактивация тромбина, в прерывании системы свертывания крови. Таким образом, необходимы эффективные и специфические ингибиторы фактора Ха в качестве потенциально ценных терапевтических агентов для лечения тромбоэмболических нарушений. Таким образом, желательным является открытие новых ингибиторов фактора Ха. Сущность изобретения Таким образом, одной целью данного изобретения является обеспечение новых миметиков гуанидина, которые применимы в качестве ингибиторов фактора Ха, или их фармацевтически приемлемых солей или пролекарств. Другой целью данного изобретения является обеспечение фармацевтических композиций, содержащих фармацевтически приемлемый носитель и терапевтически эффективное количество, по меньшей мере, одного соединения данного изобретения или его фармацевтически приемлемой соли или пролекарства. Другой целью данного изобретения является обеспечение способа лечения тромбоэмболических нарушений, предусматривающего введение хозяину, нуждающемуся в таком лечении, терапевтически эффективного количества,по меньшей мере, одного из соединений данного изобретения или его фармацевтически приемлемой соли или пролекарства. Эти и другие цели, которые станут очевидными во время следующего детального описания, были достигнуты открытием заявителей,что соединения формулы (I) или их фармацевтически приемлемые соли или пролекарства, где D, Е и М определены ниже,являются эффективными ингибиторами фактора Ха. 4 Подробное описание предпочтительных вариантов[1] Таким образом, в первом варианте,данное изобретение обеспечивает новые соединения формулы I или их стереоизомеры или их фармацевтически приемлемые соли,где кольцо D выбрано из -СН 2N=СН-,-CH2CH2N=CH-, 5-6-членной ароматической системы, содержащей 0-2 гетероатома, выбранных из группы N, О и S; кольцо D замещено 0-2 R при условии что,когда кольцо D является незамещенным, оно содержит, по меньшей мере, один гетероатом; кольцо Е содержит 0-2 атома N и замещено 0-1 R;(CH2)rNR SO2NR (CH2)r при условии, что Z не образует связи N-N, N-O, N-S, NCH2N, NCH2O или NCH2S с кольцом М или группой A;R1a и R1b независимо отсутствуют или выбраны из -(CH2)r-R1', -CH=CH-R1', NCH2R1",OCH2R1", SCH2R1", NH(CH2)2(CH2)t R1', O(CH2)2(CH2)tR1' и S(CH2)2(CH2)tR1'; альтернативно R1a и R1b, когда они присоединены к соседним атомам углерода, вместе с атомами, к которым они присоединены, образуют 5-8-членное насыщенное, частично насыщенное или ненасыщенное кольцо, замещенное 0-2 R4 и содержащее 0-2 гетероатома, выбранных из группы, состоящей из N, О и S; альтернативно, когда Z представляет собойC(O)NH и R1a присоединен к кольцевому углероду, смежному с Z, тогда R1a представляет собой группу С(О), которая замещает амидный водород Z с образованием циклического имида;R2c, в каждом случае, выбран из СF3, ОН,C1-4 алкокси, C1-6 алкила, бензила, С 3-6 карбоциклического остатка, замещенного 0-2 R4b, и 56-членной гетероциклической системы, содержащей 1-4 гетероатома, выбранных из группы,состоящей из N, О и S, замещенной 0-2 R4b; альтернативно R2 и R2a, вместе с атомом, к которому они присоединены, объединяются с образованием 5-6-членного насыщенного, частично насыщенного или ненасыщенного кольца,замещенного 0-2 R4b и содержащего 0-1 дополнительных гетероатомов, выбранных из группы,состоящей из N, О и S;X-Y не образуют связи N-N, O-N или S-N,С 3-10 карбоциклического остатка, замещенного 0-2 R4a, и 5-10-членной гетероциклической системы, содержащей 1-4 гетероатома, выбранных из группы, состоящей из N, О и S, замещенной 0-2 R4a;R4, в каждом случае, выбран из Н, =O,(CH2)rOR2, F, Cl, Br, I, C1-4 алкила, -CN, NO2,(СН 2)rNR2R2a, (CH2)rC(O)R2c, NR2C(O)R2b,C(O)NR2R2a, NR2C(O)NR2R2a,CH(=NR2)NR2R2a, CH(=NS(O)2R5)NR2R2a,NHC(=NR2)NR2R2a, C(O)NHC(=NR2)NR2R2a,SO2NR2R2a, NR2SO2NR2R2a, NR2SO2-C1-4 алкила,NR2SO2R5, S(O)pR5, (CF2)rCF3, NCH2R1",OCH2R1", SCH2R1", N(CH2)2(CH2)tR1',O(CH2)2(CH2)tR1' и S(CH2)2(CH2)tR1'; альтернативно один из R4 представляет собой 5-6-членный ароматический гетероцикл,содержащий 1-4 гетероатома, выбранных из группы, состоящей из N, О и S; при условии, что если В представляет собой Н, то R4 является иным, чем тетразол, С(O)алкокси и C(O)NR2R2a;(СF2)rСF3; альтернативно один из R4a представляет собой 5-6-членный ароматический гетероцикл,содержащий 1-4 гетероатома, выбранных из группы, состоящей из N, О и S, и замещенный 0-1 R5;R4b в каждом случае выбран из Н, =O,(CH2)rOR3, F, Cl, Br, I, C1-4 алкила, -CN, NO2,(CH2)rNR3R3a, (CH2)rC(O)R3, (CH2)rC(O)OR3c,NR3C(O)R3a,С(O)NR3R3a,NR3C(O)NR3R3a,3 3 3a 3 3[2] В предпочтительном варианте, данное изобретение обеспечивает новые соединения, в которых D-E выбран из группы: 1-аминоизохинолин-7-ил; 1,3-диаминоизохинолин-7-ил; 1,4-диаминоизохинолин-7-ил; 1,5-диаминоизохинолин-7-ил; 1,6-диаминоизохинолин-7-ил; 1-амино-3-гидроксиизохинолин-7-ил; 1-амино-4-гидроксиизохинолин-7-ил; 1-амино-5-гидроксиизохинолин-7-ил; 1-амино-6-гидроксиизохинолин-7-ил; 1-амино-3-метоксиизохинолин-7-ил; 1-амино-4-метоксиизохинолин-7-ил; 1-амино-5-метоксиизохинолин-7-ил; 1-амино-6-метоксиизохинолин-7-ил; 1-гидроксиизохинолин-7-ил; 4-аминохиназол-6-ил; 2,4-диаминохиназол-6-ил; 4,7-диаминохиназол-6-ил; 4,8-диаминохиназол-6-ил; 1-аминофталаз-7-ил; 1,4-диаминофталаз-7-ил; 1,5-диаминофталаз-7-ил; 1,6-диаминофталаз-7-ил; 4-аминоптерид-6-ил; 2,4-диаминоптерид-6-ил; 4,6-диаминоптерид-6-ил; 8-амино-1,7-нафтирид-2-ил; 6,8-диамино-1,7-нафтирид-2-ил; 5,8-диамино-1,7-нафтирид-2-ил; 4,8-диамино-1,7-нафтирид-2-ил; 3,8-диамино-1,7-нафтирид-2-ил; 5-амино-2,6-нафтирид-3-ил; 5,7-диамино-2,6-нафтирид-3-ил; 5,8-диамино-2,6-нафтирид-3-ил; 1,5-диамино-2,6-нафтирид-3-ил; 5-амино-1,6-нафтирид-3-ил; 5,7-диамино-1,6-нафтирид-3-ил; 5,8-диамино-1,6-нафтирид-3-ил; 2,5-диамино-1,6-нафтирид-3-ил; 3-аминоиндазол-5-ил; 3-гидроксииндазол-5-ил; 3-аминобензизоксазол-5-ил; 3-гидроксибензизоксазол-5-ил; 3-аминобензизотиазол-5-ил; 3-гидроксибензизотиазол-5-ил; 1-амино-3,4-дигидроизохинолин-7-ил и 1-аминоизоиндол-6-ил; М выбран из группыY выбран из одной из следующих карбоциклических и гетероциклических систем, которые замещены 0-2 R4a; фенил, пиперидинил, пиперазинил, пиридил, пиримидил, фуранил, морфолинил, тиофенил, пирролил, пирролидинил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил,имидазолил, оксадиазол, тиадиазол, триазол,1,2,3-оксадиазол, 1,2,4-оксадиазол, 1,2,5-оксадиазол, 1,3,4-оксадиазол, 1,2,3-тиадиазол, 1,2,4 тиадиазол, 1,2,5-тиадиазол, 1,3,4-тиадиазол,1,2,3-триазол, 1,2,4-триазол, 1,2,5-триазол, 1,3,4 триазол, бензофуран, бензотиофуран, индол,бензимидазол, бензоксазол, бензтиазол, индазол, бензизоксазол, бензизотиазол и изоиндазол;Y может быть также выбран из следующих бициклических гетероарильных кольцевых систем[3] В более предпочтительном варианте,данное изобретение обеспечивает новые соединения, в которых D-E выбран из группы: 1-аминоизохинолин-7-ил; 1,3-диаминоизохинолин-7-ил;Y выбран из одной из следующих карбоциклических и гетероциклических систем, которые замещены 0-2 R4a; фенил, пиперидинил, пиперазинил, пиридил, пиримидил, фуранил, морфолинил, тиофенил, пирролил, пирролидинил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил,имидазолил, оксадиазол, тиадиазол, триазол,1,2,3-оксадиазол, 1,2,4-оксадиазол, 1,2,5-оксадиазол, 1,3,4-оксадиазол, 1,2,3-тиадиазол, 1,2,4 тиадиазол, 1,2,5-тиадиазол, 1,3,4-тиадиазол,1,2,3-триазол, 1,2,4-триазол, 1,2,5-триазол, 1,3,4 триазол, бензофуран, бензотиофуран, индол,бензимидазол, бензоксазол, бензтиазол, индазол, бензизоксазол, бензизотиазол и изоиндазол.[4] В еще более предпочтительном варианте данное изобретение обеспечивает новые соединения, в которых D-E выбран из группы: 1-аминоизохинолин-7-ил; 1,3-диаминоизохинолин-7-ил; 1,4-диаминоизохинолин-7-ил; 1,5-диаминоизохинолин-7-ил; 1,6-диаминоизохинолин-7-ил; 1-аминофталаз-7-ил; 1,4-диаминофталаз-7-ил; 1,5-диаминофталаз-7-ил; 1,6-диаминофталаз-7-ил; 4-аминоптерид-6-ил; 8-амино-1,7-нафтирид-2-ил; 5-амино-1,6-нафтирид-3-ил; 5-амино-2,6-нафтирид-3-ил; 3-аминобензизоксазол-5-ил; 1-амино-3,4-дигидроизохинолин-7-ил и 1-аминоизоиндол-6-ил; М выбран из группыY выбран из одной из следующих карбоциклических и гетероциклических систем, которые замещены 0-2 R4a; фенил, пиперидинил, пиперазинил, пиридил, пиримидил, фуранил, морфолинил, тиофенил, пирролил, пирролидинил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил,имидазолил, бензимидазолил, оксадиазол, тиадиазол,триазол,1,2,3-оксадиазол,1,2,4 оксадиазол, 1,2,5-оксадиазол, 1,3,4-оксадиазол,1,2,3-тиадиазол, 1,2,4-тиадиазол, 1,2,5-тиадиазол, 1,3,4-тиадиазол, 1,2,3-триазол, 1,2,4 триазол, 1,2,5-триазол и 1,3,4-триазол;R2a в каждом случае выбран из Н, СF3,C1-6 алкила, бензила, фенетила, C5-6 карбоциклического остатка, замещенного 0-2 R4b, и 5-6 членной гетероциклической системы, содержащей 1-4 гетероатома, выбранных из группы,состоящей из N, О и S, замещенной 0-2 R4b;R2b в каждом случае выбран из CF3, C1-4 алкокси, C1-6 алкила, бензила, С 5-6 карбоциклического остатка, замещенного 0-2 R4b, и 5-6 003210R2c в каждом случае выбран из СF3, ОН,C1-4 алкокси, C1-6 алкила, бензила, C5-6 карбоциклического остатка, замещенного 0-2 R4b, и 5-6 членной гетероциклической системы, содержащей 1-4 гетероатома, выбранных из группы,состоящей из N, О и S, замещенной 0-2 R4b; альтернативно R2 и R2a вместе с атомом, к которому они присоединены, объединяются с образованием 5-6-членного кольца, выбранного из имидазолила, морфолино, пиперазинила, пиридила и пирролидинила, замещенного 0-2 R4b;R4 в каждом случае выбран из Н, =O, OR2,CH2OR2, F, Cl, C1-4 алкила, NR2R2a, CH2NR2R2a,С(O)R2c, CH2C(O)R2 с, C(O)NR2R2a, CH(=NR2)[5] В следующем предпочтительном варианте, данное изобретение обеспечивает новые соединения, в которых D-E выбран из группы: 1-аминоизохинолин-7-ил; 1,3-диаминоизохинолин-7-ил; 1,4-диаминоизохинолин-7-ил; 1,5-диаминоизохинолин-7-ил; 1,6-диаминоизохинолин-7-ил; 8-амино-1,7-нафтирид-2-ил; 5-амино-1,6-нафтирид-3-ил; 5-амино-2,6-нафтирид-3-ил; 3-аминобензизоксазол-5-ил; 1-амино-3,4-дигидроизохинолин-7-ил и 1-аминоизоиндол-6-ил.[6] Еще в одном предпочтительном варианте данное изобретение обеспечивает новое соединение, выбранное из соединений: 1-(1'-аминоизохинол-7'-ил)-3-метил-5-[(2'аминосульфонил-[1,1']-бифен-4-ил)карбониламино]пиразол; 1-(1'-аминоизохинол-7'-ил)-3-метил-5-[(2'метилсульфонил-[1,1']-бифен-4-ил)карбониламино]пиразол; 1-(4'-аминоизохинол-7'-ил)-3-метил-5-[(2'аминосульфонил-[1,1']-бифен-4-ил)карбониламино]пиразол; 19 пиперазин-1-илметил)-3-фтор-[1,1']-бифен-4 ил)аминокарбонил]пиразол; 1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[2'-(N,N-диметиламино)пиридинийметил)-3-фтор-[1,1']-бифен-4-ил)аминокарбонил]пиразол; 1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[(3-фтор-2'-пиперазин-1"-илметил[1,1']-бифен-4-ил)аминокарбонил]пиразол; 1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[(3-фтор-2'-N-метилморфолинийметил-[1,1']-бифен-4-ил)аминокарбонил] пиразол; 1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[(3-фтор-2'-морфолинометил-[1,1']бифен-4-ил)аминокарбонил]пиразол; 1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[(3-фтор-2'-(N-метил-N-метоксиамино)-[1,1']-бифен-4-ил)аминокарбонил] пиразол; 1-(3'-аминобензизоксазол-5'-ил)-5-[(2'метилсульфонил-3-фтор-[1,1']-бифен-4-ил)аминокарбонил]триазол; 1-(3'-аминобензизоксазол-5'-ил)-5-[(2'аминосульфонил-3-фтор-[1,1']-бифен-4-ил)аминокарбонил]триазол; 1-(3'-аминобензизоксазол-5'-ил)-3-трифторметил-5-[(2'-метиламиносульфонил-3-фтор[1,1']-бифен-4-ил)аминокарбонил]пиразол; 1-(3'-аминобензизоксазол-5'-ил)-5-[(2'-диметиламинометил-3-фтор-[1,1']-бифен-4-ил) аминокарбонил]тетразол; 1-(3'-аминобензизоксазол-5'-ил)-3-этил-5[(2'-диметиламинометил-3-фтор-[1,1']-бифен-4 ил)аминокарбонил]пиразол и 1-(3'-аминобензизоксазол-5'-ил)-3-этил-5[(4'-(2"-диметиламинометилимидазол-1-ил)-2'фторфенил)аминокарбонил]пиразол; или его фармацевтически приемлемую соль. Во втором варианте, данное изобретение обеспечивает новые фармацевтические композиции, содержащие фармацевтически приемлемый носитель и терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли. В третьем варианте, данное изобретение обеспечивает новые соединения формулы (I) или их фармацевтически приемлемую соль для применения в терапии. В четвертом варианте, данное изобретение обеспечивает применение новых соединений для приготовления лекарственного препарата для лечения тромбоэмболического нарушения. Определения Описанные здесь соединения могут иметь асимметричные центры. Соединения данного изобретения, содержащие асимметрично замещенный атом, могут быть выделены в оптически чистой или рацемической формах. В данной области хорошо известно, как получить оптически активные формы, например, разделением 20 рацемических форм или синтезом из оптически активных исходных веществ. Многие геометрические изомеры олефинов, двойные связи C=N и т.п. могут также присутствовать в описанных здесь соединениях, и все такие стабильные изомеры предполагаются в данном изобретении. Цис и транс геометрические изомеры соединений данного изобретения описаны и могут быть выделены в виде смеси изомеров или в виде разделенных изомерных форм. Все хиральные,диастереомерные, рацемические формы и все геометрически изомерные формы структуры предполагаются, если не указывается специфическая стереохимия или изомерная форма. Термин "замещенный", в применении здесь, означает, что любые один или несколько атомов водорода на указанном атоме замещены заместителем, выбранным из указанной группы,при условии, что не превышается нормальная валентность указанного атома и что замещение приводит к стабильному соединению. Если заместителем является кетогруппа (т.е. =O), то замещены 2 водорода на этом атоме. Кетозаместители не присутствуют на ароматических частях молекул. Данное изобретение включает все изотопы атомов, встречающихся в этих соединениях. Изотопы включают атомы, имеющие одно и то же атомное число (атомный номер), но различные массовые числа. В качестве общего примера и без ограничения, изотопы водорода включают тритий и дейтерий. Изотопы углерода включают С-13 и С-14. В случае, когда любая переменная (например, R6) встречается более одного раза в любой составляющей формулы или в формуле соединения, ее определение в каждом случае является независимым от ее определения в любом другом случае. Так, например, если не указано, что вышеупомянутая группа замещена 0-2 R6, то эта группа может быть необязательно замещенной до 2 групп R6, и R6 в каждом случае выбирают независимо из определения R6. Также, комбинации заместителей и/или переменных являются допустимыми только в том случае, если такие комбинации приводят к стабильным соединениям. Если показано, что связь с заместителем пересекает связь, соединяющую два атома в кольцо, то такой заместитель может быть связан с любым атомом на кольце. Когда заместитель указан без указания атома, через который этот заместитель связан с остальной частью соединения данной формулы, тогда такой заместитель может быть связан через любой атом в таком заместителе. Комбинации заместителей и/или переменных допустимы только в том случае,если такие комбинации приводят к стабильным соединениям. В применении здесь "C1-6 алкил" включает насыщенные алифатические углеводородные группы как с разветвленной, так и с прямой це 21 пью, имеющие указанное число атомов углерода, примеры которых включают, но не ограничиваются ими, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил,пентил и гексил. '"Алкенил"' включает углеводородные цепи как прямой, так и разветвленной конфигурации, и одну или несколько ненасыщенных связей углерод-углерод, которые могут встречаться в любой стабильной точке вдоль цепи, такие как этенил, пропенил и т.п."Гало" или "галоген" в применении здесь относится к фтору, хлору, брому и иоду; и "противоион" используют для обозначения небольших, отрицательно заряженных молекул, таких как хлорид, бромид, гидроксид, ацетат, сульфат и т.п. В применении здесь, термины "карбоцикл" или "карбоциклический остаток" означают любой стабильный 3-7-членный моноциклический или 7-13-членный бициклический или трициклический остаток, любой из которых может быть насыщенным, частично ненасыщенным или ароматическим. Примеры таких карбоциклов включают, но не ограничиваются ими, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, адамантил, циклооктил,[3.3.0]бициклооктан,[4.3.0]бициклононан,[4.4.0]бициклодекан (декалин), [2.2.2]бициклооктан, флуоренил, фенил, нафтил, инданил,адамантил или тетрагидронафтил (тетралин). В применении здесь, термин "гетероцикл" или "гетероциклическая система"' означает стабильное 5-7-членное моноциклическое или бициклическое или 7-10-членное бициклическое гетероциклическое кольцо, которое является насыщенным, частично ненасыщенным или ненасыщенным (ароматическим) и которое состоит из атомов углерода и от 1 до 4 гетероатомов,независимо выбранных из группы, состоящей изN, О и S, и включает любую бициклическую группу, в которой любое из определенных выше гетероциклических колец конденсировано с бензольным кольцом. Гетероатомы азот и сера могут быть необязательно окисленными. Гетероциклическое кольцо может присоединяться к его дополнительной группе через любой гетероатом или атом углерода, которые приводят к стабильной структуре. Гетероциклические кольца, описанные здесь, могут быть замещенными на атоме углерода или на атоме азота, если полученное соединение является стабильным. Если специально указано, азот в гетероцикле необязательно может быть кватернизированным. Предпочтительно, в случае, когда общее число атомов S или O в гетероцикле превышает 1, чтобы эти гетероатомы не были соседними относительно друг друга. Предпочтительно, чтобы общее число атомов S и O в гетероцикле было не более 1. В применении здесь,термин "ароматическая гетероциклическая система" обозначает стабильное 5-7-членное моноциклическое или бициклическое или 7-10 003210 22 членное бициклическое гетероциклическое ароматическое кольцо, которое состоит из атомов углерода и из 1-4 гетероатомов, независимо выбранных из группы, состоящей из N, О и S. Предпочтительно, чтобы общее число атомов S и О в ароматическом гетероцикле было не более 1. Примеры гетероциклов включают, но не ограничиваются ими, акридинил, азоцинил, бензимидазолил, бензофуранил, бензотиофуранил,бензотиофенил, бензоксазолил, бензтиазолил,бензтриазолил, бензтетразолил, бензизоксазолил, бензизотиазолил, бензимидазалинил, карбазолил, 4 аН-карбазолил, карболинил, хроманил, хроменил, циннолинил, декагидрохинолинил, 2 Н, 6 Н-1,5,2-дитиазинил, дигидрофуро[2,3b]тетрагидрофуран, фуранил, фуразанил, имидазолидинил, имидазолинил, имидазолил, 1 Ниндазолил, индоленил, индолинил, индолизинил, индолил, 3 Н-индолил, изобензофуранил,изохроманил, изоиндазолил, изоиндолинил,изоиндолил, изохинолинил, изотиазолил, изоксазолил, морфолинил, нафтиридинил, октагидроизохинолинил, оксадиазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксидиазолил, оксазолидинил, оксазолил, оксазолидинил, пиримидинил, фенантридинил, фенантролинил, феназинил, фенотиазинил, феноксатиинил, феноксазинил, фталазинил,пиперазинил, пиперидинил, птеридинил, пуринил, пиранил, пиразинил, пиразолидинил, пиразолинил, пиразолил, пиридазинил, пиридооксазол, пиридоимидазол, пиридотиазол, пиридинил, пиридил, пиримидинил, пирролидинил,пирролинил, 2 Н-пирролил, пирролил, хиназолинил, хинолинил, 4 Н-хинолизинил, хиноксалинил, хинуклидинил, тетрагидрофуранил, тетрагидроизохинолинил,тетрагидрохинолинил,6 Н-1,2,5-тиадиазинил, 1,2,3-тиадиазолил, 1,2,4 тиадиазолил,1,2,5-тиадиазолил,1,3,4 тиадиазолил, тиантренил, тиазолил, тиенил,тиенотиазолил, тиенооксазолил, тиеноимидазолил, тиофенил, триазинил, 1,2,3-триазолил,1,2,4-триазолил,1,2,5-триазолил,1,3,4 триазолил и ксантенил. Предпочтительные гетероциклы включают, но не ограничиваются ими,пиридинил, фуранил, тиенил, пирролил, пиразолил, пирролидинил, имидазолил, индолил, бензимидазолил, 1H-индазолил, оксазолидинил,бензотриазолил, бензизоксазолил, оксиндолил,бензоксазолинил или изатиноил. Также включены конденсированные кольцевые и спиросоединения, например, приведенные выше гетероциклы. Фразу "фармацевтически приемлемые" используют для соединений, материалов, композиций и/или дозированных лекарственных форм, которые являются подходящими, в рамках здравой медицинской оценки, для применения в контакте с тканями человека и животных без чрезмерной токсичности, раздражения, аллергической реакции или иных проблем или 23 осложнений, соразмерно с разумных соотношением польза/риск. В применении здесь, "фармацевтически приемлемыми солями" называют производные описанных здесь соединений, в которых исходное соединение модифицировано с образованием солей кислот или оснований. Примеры фармацевтически приемлемых солей включают, но не ограничиваются ими, соли минеральных или органических кислот основных остатков, таких как амин; основные или органические соли кислотных остатков, таких как карбоновые кислоты, и т.п. Фармацевтически приемлемые соли включают обычные нетоксичные соли или соли четвертичного аммония исходного соединения,образованные, например, из нетоксичных неорганических или органических кислот. Например, такие обычные нетоксичные соли включают соли, образованные из неорганических кислот, таких как хлористо-водородная, бромистоводородная, серная, сульфаминовая, фосфорная,азотная и т.п.; и соли, полученные из органических кислот, таких как уксусная, пропионовая,янтарная, гликолевая, стеариновая, молочная,яблочная, винная, лимонная, аскорбиновая, памовая, малеиновая, гидроксималеиновая, фенилуксусная, глутаминовая, бензойная, салициловая, сульфаниловая, 2-ацетоксибензойная, фумаровая, толуолсульфоновая, метансульфоновая, этандисульфоновая, щавелевая, изэтионовая и т.п. Фармацевтически приемлемые соли данного изобретения могут быть синтезированы из исходного соединения, которое содержит основную или кислотную часть молекулы, общепринятыми химическими способами. В общем,такие соли могут быть получены взаимодействием свободной кислоты или основания этих соединений со стехиометрическим количеством подходящего основания или кислоты в воде или органическом растворителе или в смеси этих двух компонентов; обычно предпочтительными являются неводные среды, такие как эфир, этилацетат, этанол, изопропанол или ацетонитрил. Списки подходящих солей можно найти вMack Publishing Company, Easton, PA, 1985, p. 1418, описание которого включено в качестве ссылки. Термин "пролекарство" относится к любым ковалентно связанным носителям, которые высвобождают активное исходное лекарственное средство формулы (I) in vivo при введении такого пролекарства субъекту-млекопитающему. Пролекарства соединения формулы (I) получают модификацией функциональных групп,присутствующих в соединении, таким образом,что эти модификации расщепляются либо при рутинном манипулировании, либо in vivo с образованием исходного соединения. Пролекарства включают соединения формулы (I), в которых гидрокси, амино или сульфгидрильная 24 группа связана с любой группой, которая при введении пролекарства или соединения формулы (I) субъекту-млекопитающему отщепляется с образованием свободного гидроксила, свободной аминогруппы или свободной сульфгидрильной группы, соответственно. Примеры пролекарств включают, но не ограничиваются ими,ацетатные, формиатные и бензоатные производные спиртовых групп и аминогрупп в соединениях формулы (I) и т.п. Термины "стабильное соединение" и "стабильная структура" предназначены для указания соединения, которое является достаточно крепким, чтобы выдерживать выделение с применимой степенью чистоты из реакционной смеси и приготовление его в виде эффективного терапевтического агента. Синтез Соединения данного изобретения могут быть получены различными путями, известными специалисту в области органического синтеза. Соединения данного изобретения могут быть синтезированы при помощи описанных ниже способов, вместе с синтетическими способами,известными в области синтетической органической химии, или их вариациями, как будет удобней специалистам с квалификацией в этой области. Предпочтительные способы включают,но не ограничиваются ими, способы, описанные ниже. Реакции проводят в растворителе, подходящем для реагентов и материалов, используемых и подходящих для выполняемых превращений. Специалистам в области органического синтеза будет понятно, что функциональная группа, присутствующая в молекуле, должна быть в соответствии с предполагаемыми превращениями. Иногда это требует оценки для модификации порядка синтетических стадий или для предпочтительного выбора одной конкретной схемы процесса, а не другой для получения целевого соединения данного изобретения. Должно быть также понятно, что другим основным предметом рассмотрения в планировании любого синтетического пути в этой области является разумный выбор защитной группы, используемой для защиты реакционноспособных функциональных групп, присутствующих в соединениях, описанных в данном изобретении. Авторитетной оценкой, описывающей многие альтернативы для квалифицированного практика, является Greene and Wuts (ProtectiveGroups In Organic Synthesis, Wiley and Sons,1991). Все цитированные ссылки включены здесь тем самым полностью в качестве ссылки. Один общий синтез соединений формулы(I) , где кольцо М является N-связанным, показан на схеме 1a. Q, В' и Rf представляют собой защищенные функциональные группы, которые могут быть превращены в R, В и R1a, соответственно. D-E может быть также назван Р 1, боковая цепь которого входит в карман S1 fXa. Эти соединения могут быть также получены изме 25 нением последовательности реакционных стадий, описанных на схеме 1 а. Для N-связанного М-кольца подходящий гетероциклический анилин обрабатывают в условиях, описанных в"The Chemistry of Heteriocyclic Compounds,Weissberger, A. and Taylor, E.C. Ed., John WileySons", или как описано далее в разделе синтеза для получения N-связанного кольца М. Дальнейшие модификации и снятие защитных групп дают N-связанное кольцо М с заместителями R,Z-A-В и R1a. Схема 1 а 26 Схема 1b Для углеродсвязанного гетероцикла М Для азотсвязанного гетероцикла М На схеме 1b показано, как можно получить соединения, в которых кольцо М является Ссвязанным и является пяти- или шестичленным. Анилин из схемы 1 а диазотируют азотистой кислотой и обрабатывают NaBr с получением гетероциклического бромида. Обработка н-BuLi и затем ДМФ дает альдегид, который может быть превращен в кольцо М, как описано в "TheChemistry of Heterocyclic Compounds, Weissberger, A. and Taylor, E.C. Ed., John WileySons,или как будет описано. Другие функциональные группы-предшественники, такие как кислота,цианид, метилкетон и т.д., также могут быть использованы для образования кольца М. Дальнейшие модификации и удаления защитных групп могут давать пятичленное кольцо М, замещенное R, Z-A-B и R1a. Соответствующее Ссвязанное шестичленное кольцо М может быть получено превращением вышеупомянутого бромида н-бутиллитием и триизопропилборатом с образованием гетероциклической бороновой кислоты. Сочетание Сузуки с подходящим гетероциклическим бромидом с последующими модификациями и удалениями защитных групп дает С-связанное шестичленное кольцо М с заместителями R, Z-A-B и R1a.Z-A-B присоединены к С-3 и С-5 пиразола, соответственно. Синтез начинается с 7-аминоизохинолина (J. Chem. Soc. 1951, 2851). Диазотирование и восстановление хлоридом олова превращает ариламин в гидразин (J. Chem. Soc. 1956 б 21, 394), который конденсируется с R1a и(J. Heterocycl. Chem. 1993, 30,307). Сочетание полученных Z-H-замещенных пиразолов с фрагментом А-В' выполняют при помощи стандартных процедур для Z в виде карбоксильной группы, аминогруппы или сульфоновой группы. Для Z в виде карбоксилата взаимодействие выполняют с использованием процедуры Вайнреба(Tetr. Lett. 1977, 48, 4171) с первичными аминами типа H2N-A-B'. 1-Аминирование изохинолина выполняют через образование N-оксида с последующей обработкой тозилхлоридом и затем этаноламином (U.S. Patent No. 4673676). Альтернативно, превращение аминированием может быть выполнено через обработку Nоксидов изохинолина фосфорилхлоридом. Последующее замещение образующегося 1-хлорзаместителя выполняют с подходящими реагентами. Удаление защитных групп на фрагменте Схема 2b иллюстрирует получение 5 аминозамещенных соединений 1,6 нафтиридина. Соединения этого типа могут быть получены из 3-нитро-1,6-нафтиридина(Tetr. 1989, 45, 2693). Восстановление до соответствующего амина сделает возможным превращение в целевой 5-членный азотсодержащий гетероцикл с заместителями Rf и Z-H. Введение 5-аминогруппы может быть выполнено через 5 хлорсоединение (Chem. Pharm. Bull. 1969, 17,1045), как описано ранее в схеме 2 а. Перед введением фрагмента А-В' применяют подходящую защиту аминозаместителя. Превращение в конечный продукт может быть выполнено аналогично процедуре, описанной в схеме 2 а. Схема 2b На схеме 2 с показано, как получить изохинолины, которые содержат 1,5-диаминозаместитель, из 7-аминоизохинолина путем подходящей защиты аминогруппы в виде амида, направленного нитрования и деблокирования аминогруппы с образованием 5-нитро-7 аминоизохинолина. Целевой 5-членный азотсодержащий гетероцикл с заместителями Rf и Z-H может быть синтезирован, как показано выше на схеме 2 а. Присоединение фрагмента А-В' и 1 аминоизохинолиновой части может быть выполнено, как описано ранее. Превращение А-В' ,Rf и 4-нитрозаместителя в А-В, R1a и 4 аминогруппу, соответственно, выполняют описанными ранее способами. На схеме 2d показано, как получить изохинолины, которые содержат 1,4-диаминозамещение. Из 7-аминоизохинолина целевой 5 членный азотсодержащий гетероцикл с заместителями Rf и Z-H может быть синтезирован, как показано выше на схеме 2 а. Нитрование в положении 4 изохинолина может быть выполнено при помощи стандартных условий с получением 4-нитрогруппы. Присоединение фрагмента А-В' и 1-аминоизохинолиновой части может быть выполнено, как описано ранее. Превращение АВ', Rf и 4-нитрозаместителя в А-В, R1a и 4 аминогруппу, соответственно, выполняют описанными ранее способами. Схема 2d Схема 3 иллюстрирует получение промежуточного соединения для 3-аминобензизоксазола и 3-аминоиндазола. Соединения этого типа могут быть получены из фторцианобензальдегида, полученного из коммерчески доступного 2-фтор-5-метилбензонитрила сначала бис-бромированием в непротонном растворителе в присутствии AIBN (азобисизобутиронитрила) или другого подходящего свободнорадикального инициатора при температуре в пределах от температуры окружающей среды до температуры дефлегмации выбранного растворителя или под УФ-светом. Бис-бромсоединение может быть затем превращено в альдегид при помощи протонного растворителя в сильных кислых или основных условиях при температуре окружающей среды или более высокой температуре. Этот альдегид или эквивалент кислоты могут быть затем превращены в различные С-связанные кольца М при помощи способов, которые будут описаны ниже. Схема 3 Схема 4 описывает в общих чертах образование С-связанных аминобензизоксазолов. Аминобензизоксазол Р 1 может быть получен сначала обработкой оксима ацетона трет-буто 29 ксидом калия в апротонном полярном растворителе, с последующим присоединением фторцианофенилгетероцикла Н и затем обработкой протонным растворителем в сильно кислых условиях (J. Heterocycl. Chem. 1989, 26, 1293). Сочетание и удаление защитных групп, как описано выше, дает 3-аминобензизоксазолы формулы I. Схема 4 Схема 5 описывает в общих чертах образование С-связанных 3-аминоиндазолов формулыI. Защита альдегида в виде пропиленкеталя посредством стандартных условий с последующим нагреванием при температуре дефлегмации с гидразином в этаноле дает кеталь 3-аминоиндазола. Защита аминогруппы CBZCl и удаление защитных групп кеталя при помощиHCl/MeOH дает альдегид. Этот альдегид или эквивалент кислоты может быть превращен в различные С-связанные гетероциклы, как описано ниже. Сочетание и удаление защитных групп, как описано выше, дает 3-аминоиндазолы формулы I. Схема 5 Схема 6 иллюстрирует получение альдегида аминобензимидазола, который может быть перенесен на С-связанные или N-связанные гетероциклы при помощи способов, описанных ниже, в разделе синтеза. Циклизация 3,4 диаминобензоата с получениемcbzзащищенного 2-аминобензимидазола с последующим восстановлением при помощи DIBAL и окислением дает целевой альдегид. Схема 6 Схема 7 иллюстрирует получение Nсвязанных аминобензизоксазолов, аминоиндазолов, диаминохиназолинов и аминохиназолинов формулы I. Соединения этого типа могут быть получены из производного анилина, полу 003210 30 ченного из коммерчески доступного 2-фтор-5 нитробензонитрила с использованием хлорида олова (II) или других совместимых восстанавливающих агентов в протонном или апротонном растворителе с совместимым сорастворителем или без него при температуре от температуры окружающей среды до температуры дефлегмации выбранного растворителя.N-связанные 3-аминобензизоксазолы и 3 аминоиндазолы могут быть получены, как описано ранее. Р 1 в виде N-связанных аминохиназолинов и диаминохиназолинов может быть получен конденсацией фторцианосоединения с ацетатом формамидина или гидрохлоридом гуанидина (J. Heterocycl. Chem. 1988, 25, 1173). Схема 7 Схема 8 иллюстрирует получение гетероциклических промежуточных продуктов Р 1 в виде 1-амино-2-бензопиранов, приводящих к соединениям формулы I. Соединения этого общего типа могут быть получены из аминостильбена, полученного из коммерчески доступного 2-циано-4-нитротолуола сначала конденсацией нитротолуола с бензальдегид ом или одним из его аналогов в спиртовом растворителе в присутствии алкоксидного основания при температуре в диапазоне от -10 С - температура дефлегмации выбранного растворителя. Затем нитростильбен может быть восстановлен до аминостильбена реакцией с хлоридом олова (II) или другим совместимым восстанавливающим агентом в протонном растворителе с совместимым сорастворителем или без него при температуре окружающей среды или более высокой температуре. Затем этот анилин может быть перенесен на N-связанные или С-связанные гетероциклы Н при помощи способов, описанных ранее. Схема 8 также описывает, далее, в общих чертах превращение N-связанных и С-связанных (не показаны) гетероциклических стильбенов в 1-аминофталазины формулы I. Окислительное расщепление двойной связи стильбена в соответствии со способом Narasimhan et al(J. Am. Chem. Soc. 1990, 112, 879) или эквивалентных им способов должно давать альдегид. Этот альдегид может быть обработан гидразином, неразбавленным или в полярном или аполярном растворителе, при температуре окружающей среды или до температуры дефлегмации растворителя, выбранного для индуцирования замыкания кольца. Затем группа Z-H может быть связана с группой H2N-A-B в соответствии со способами, описанными в общих чертах в схеме 2 а.N-связанные и С-связанные гетероциклические 2-цианобензальдегиды, полученные по схеме 8, могут быть также использованы в качестве подходящих исходных материалов для получения N-связанного 1,3-диаминоизохинолинового промежуточного продукта схемы 9 и Ссвязанного (не показан) 1,3-диаминоизохинолинового промежуточного продукта схемы 9 соответствующей адаптацией способа, описанного в общих чертах ниже. 2-Цианобензальдегид может быть восстановлен до бензилового спирта гидридным восстанавливающим агентом, предпочтительно боргидридом натрия, затем обработан сульфонилхлоридом,метансульфонилхлоридом, как предполагается схемой 9, или эквивалентом, с использованием основания триалкиламина и сухого хлоруглеродного растворителя при охлаждении. Мезилатные и бисциано-промежуточные соединения могут быть также превращены в соответствующие 1-аминоизоиндольный Р 1 и 1-амино-3,4 дигидроизохинолиновый Р 1, соответственно. Схема 9 32 Схема 10 иллюстрирует другой подход для получения N-связанных и С-связанных гетероциклических бензиловых спиртов в качестве промежуточных соединений. Эти соединения могут быть получены из 2-циано-4-нитротолуола фотохимическим бензильным бромированием с N-бромсукцинимидом в тетрахлориде углерода с лампой солнечного света и при дефлегмации в присутствии каталитического количества свободнорадикального инициатора,такого как AIBN или дибензоилпероксид. Затем бензилбромид легко замещают ацетатом натрия в условиях фазового переноса с использованием 18-кроун-6 в качестве агента фазового переноса вместе с водой и не смешивающимся органическим сорастворителем с нагреванием или без нагревания. Затем полученный ацетат гидролизуют водной кислотой или переэтерифицизуют с водной кислотой в спиртовом растворителе с получением бензилового спирта. В зависимости от дальнейших требований способа, участвующего в стадии (стадиях) образования гетероцикла, бензиловый спирт может быть защищен в соответствии с методологией, рекомендуемойGreene and Wuts. Затем нитрогруппа полученного продукта может быть восстановлена до анилина в соответствии с описанными выше способами схемы 8 и затем перенесена на Nсвязанные или С-связанные гетероциклические бензиловые спирты схемы 10. Должно быть понятно, что эти бензиловые спирты могут быть легко превращены в промежуточные продукты,являющиеся бензиловыми эфирами сульфокислоты, схемы 9 или окислены до бензальдегида схемы 8 способами, известными квалифицированному практику. Схема 10 Соединения данного изобретения, в которых остаток D-E представляет собой изохиназолин-1-он, могут быть получены, как описано в схеме 11. Для соединений, которые являются Nсвязанными с гетероциклом М, реакция 5 нитроизатового ангидрида с формамидом при 150 С дает 7-нитроизохиназолин-1-он, который может быть восстановлен до соответствующего 7-аминоизохиназолин-1-она различными восстанавливающими агентами. Диазотирование,восстановление до гидразина и образование Nгетероцикла может быть проведено с получением изохиназолин-1-она, N-связанного с подходящим гетероциклом. Для соединений, которые С-связаны с гетероциклом М, реакция 5 бромантраниловой кислоты с формамидом при 150 С дает 7-бромизохиназолин-1-он. Этот 33 бромид может быть превращен в альдегидную или ацетильную группу, которая может быть затем превращена в подходящий С-связанный гетероцикл. Схема 11 Соединения данного изобретения, в которых остаток D-E представляет собой изохинолин-1-он, могут быть получены, как описано в схеме 12. Для соединений, которые являются Nсвязанными с гетероциклом М, окисление 7 нитроизохинолина до его соответствующего Nоксида с последующей последовательной обработкой уксусным ангидридом и затем гидроксидом будет давать целевой 7-нитроизохинолин-1 он. Это превращение может быть проведено также с другими реагентами. Восстановление нитрогруппы и последующее образование Nгетероцикла будет давать изохинолин-1-он, Nсвязанный с подходящим гетероциклом. Для соединений, которые являются С-связанными с гетероциклом М, аналогичный способ может быть использован для получения целевого 7 бромизохинолин-1-она, который может быть затем превращен в подходящий альдегид или ацетильную группу для последующего превращения в С-связанный гетероцикл. В одном способе превращения этого бромида в ацетильную группу используют катализируемое палладием сочетание с (этоксивинил)трибутилоловом с последующим гидролизом промежуточного,являющегося простым виниловым эфиром, остатка. Схема 12 Соединения, в которых D-E представляет собой 3-аминобензизотиазол, иллюстрируются синтезом на кольце пиразола, как показано на схеме 13. Может быть использован 4-фтор-3 цианопиразол в качестве промежуточного соединения, как описано выше. Замещение замес 003210 34 тителя фтора посредством методологии нуклеофильного ароматического замещения тионуклеофилом с последующей стандартной методологией сочетания Вайнреба должно давать целевое связанное промежуточное тиобензил-соединение. Этот нитрил может быть превращен в амидин с использованием стандартных условий. Окисление сульфида до сульфоксида при помощи МСРВА с последующим стандартным замыканием, применяемым Wright et al. для изотиазолонов, с трихлоруксусным ангидридом должно давать целевые аминоизотиазолоны. Схема 13 Соединения, в которых М-гетероцикл является тиазолом, могут быть получены в соответствии с процедурами, описанными в схеме 14. Подходящий Q-D-E-бромид может быть превращен в сложный бета-кетоэфир несколькими путями. Один предпочтительный способ включает переметаллирование реагентом алкиллитием с последующим гашением при помощи ДМФ с получением соответствующего альдегида. Добавление этилдиазоацетата в присутствии хлорида олова (II) дает сразу же сложный бета-кетоэфир. Для этого превращения подходят другие способы, один из которых включает реакцию Реформатского этого альдегида с последующим окислением до сложного бета-кетоэфира. Схема 14 Второй способ превращения бромида в сложный бета-кетоэфир включает катализируемое палладием сочетание с (этоксивинил)трибутилоловом с последующим кислотным гидролизом с получением соответствующего ацетилпроизводного. Существует много способов для превращения ацетилпроизводного в сложный 35 бета-кетоэфир, причем один предпочтительный способ включает взаимодействие ацетилпроизводного с диалкилкарбонатом в присутствии основания, такого как гидрид натрия или диизопропиламид лития. Сложный бета-кетоэфир может быть превращен в соответствующие производные тиазола бромированием при помощиNBS с последующей циклизацией подходящими тиомочевиной или тиоамидом в растворителе,таком как этанол или тетрагидрофуран. Способ одного сосуда для этого превращения включает обработку сложного бета-кетоэфира гидрокситозилоксииодбензолом в ацетонитриле, что дает промежуточный сложный альфа-тозилоксибета-кетоэфир, с последующим добавлением тиомочевины или тиоамида для циклизации в соответствующий тиазол. Манипулирование сложноэфирной группой этих тиазолов может затем давать соединения, содержащие подходящую Z-A-B-группу. В случае Z=CONH, могут быть использованы стандартные способы пептидного взаимодействия с подходящим амином,такие как взаимодействие сложного эфира с алюминийсодержащим реагентом, произведенным из этого амина. В случае Z=СОСН 2, образование хлорангидрида стандартными способами может сопровождаться добавлением подходящего цинксодержащего реагента. Группой R1a на кольце тиазола можно также манипулировать с получением множества различных групп. Например, при использовании тиомочевины в качестве партнера циклизации получают 2 аминотиазол. Эта аминогруппа может быть легко диазотирована и замещена подходящим галогенидом меди с образованием 2-галогентиазолов. Атом галогена может быть затем легко замещен разнообразными содержащими углерод, азот, кислород и серу нуклеофилами с образованием большого разнообразия алкил-,арил-, гетероатом- и гетероциклических производных R1a. Соединения тетразола данного изобретения, в которых Z представляет собой -CONH-,могут быть получены, как показано на схеме 15. Подходящим образом замещенный амин (DENH2) ацилируют этилоксалилхлоридом. Полученный амид может быть превращен в тетразол любым из способов, описанных Duncia (J. Org.Chem. 1991, 2395-2400) или Thomas (Synthesis 1993, 767-768, 1993). Этот амид может быть сначала превращен в иминоилхлорид и затем подвергнут взаимодействию с NaN3 с образованием 5-карбоэтокситетразола (J. Org. Chem. 1993, 58, 32-35 и Bioorg.Med. Chem. Lett. 1996, 6, 1015-1020). Затем 5-карбоэтокситетразол подвергают реакции сочетания с подходящим амином (BaNH2) по способу, описанномуWeinreb (Tetr. Lett. 1977, 48, 4171-4174). Конечное удаление защитных групп, как описано прежде, дает целевой продукт. Соединения тетразола данного изобретения, в которых Z представляет собой -СО-, могут быть также получены через иминоилхлорид(Chem. Ber. 1961, 94, 1116 и J. Org. Chem. 1976,41, 1073) с использованием подходящим образом замещенного ацилхлорида в качестве исходного продукта. Кетон в качестве связующего агента (линкера) может быть восстановлен до соединений, где Z является алкилом. Соединения тетразола данного изобретения, где Z является -SO2NH-, -S-, -S(O)-, SO2-,могут быть получены, как проиллюстрировано на схеме 16. Подходящим образом замещенный тиоизоцианат взаимодействует с азидом натрия с образованием 5-тиотетразола (J. Org. Chem. 1967, 32, 3580-3592). Это тиосоединение может быть алкилировано (J. Org. Chem. 1978, 43,1197-1200) и затем окислено до сульфоксида и сульфона. Это тиосоединение может быть также превращено в сульфонилхлорид и подвергнуто взаимодействию с амином с образованием целевого сульфонамида. Соединения тетразола данного изобретения, в которых Z является -О-,могут быть получены с помощью способа, описанного в схеме 16, с использованием подходящим образом замещенного изоцианата в качестве исходного продукта. Схема 16 Соединения тетразола данного изобретения, где Z является -NH-, -NHCO-, -NHSO2-,могут быть получены из 5-аминотетразола, который может быть получен перегруппировкой Смайлса, как показано на схеме 17. Тиосоединение, полученное, как описано в схеме 3, алкилируют 2-хлорацетамилом. Затем полученное соединение нагревают при температуре дефлегмации в этанольном растворе гидроксида натрия с получением соответствующего 5-аминотетра 37 зола (Chem. Pharm. Bull. 1991, 39, 3331-3334). Затем полученный 5-аминотетразол может быть алкилирован или ацилирован с образованием целевого продукта. Схема 17N-связанное кольцо имидазола М может быть синтезировано по синтетическому пути,показанному на схеме 18. Алкилирование D-ENH2 2-бромэтилацетатом с последующим взаимодействием с реагентом Гоулда в присутствии основания, такого как NaOMe или LDA, образует кольцо имидазола М. Схема 18 Дополнительные производные имидазола могут быть получены при помощи общих процедур, как описано в схеме 18 а. Здесь, Р представляет собой защитную группу для аминогруппы. Е представляет собой замещенную группу или группы. G представляет собой ароматическое кольцо (кольцо шесть, шесть-шесть или пять-шесть). R1 и/или R2 обозначает Н, замещенную алкильную группу или либо V, либо предшественник (CH2)nV. V обозначает нитро,амино, тио, гидрокси, сульфон, сложный сульфоновый эфир, сульфоксид, сложный эфир, кислоту или галогенид. n=0 и 1. U обозначает альдегид, сложный эфир, кислоту, амид, амино,тиол, гидрокси, сульфоновую кислоту, сложный сульфоновый эфир, сульфонилхлорид или метиленгалогенид. Z, А и В являются такими же, как описано для формулы I. Схема 18 а Общая процедура получения 2,4,5-тризамещенных или 4,5-дизамещенных производных имидазола описана в схеме 18 а. Исходный сложный эфир b может быть получен ацилированием N, O-диметилгидроксиамина этилмалонилхлоридом. После металлирования реагентом лития соединение а может взаимодействовать сb с образованием соединения с. Соединение с может быть также получено непосредственно из реакции сочетания а с цинковым реагентом этилмалонилхлорида. Соединение с может быть 38 бромировано при помощи NBS с образованием соединения d, которое может реагировать с избытком NН 3 и R1CO2H с образованием соединения е. Сложноэфирная группа в е может быть перенесена к другим функциональным группам,которые могут быть подвергнуты дополнительному взаимодействию с образованием соединения f. Схема 18b Общая процедура получения С-связанного кольца имидазола М описана в схеме 19. Альдегид D-E-CHO из схемы 1 может быть превращен в цианосоединение обработкой гидроксиламином и затем дегидратацией РОСl3. Амидин может быть получен из цианосоединения реакцией Пиннера, который может быть циклизован сложным альфа-галогенэфиром, кетоном или альдегидом с образованием имидазольного кольца М. Схема 19 Кольцо пиразола М общей формулы I, такое как описано в схеме 1, может быть получено конденсацией подходящим образом замещенного гидразина с различными сложными дикетоэфирами. Конденсации этого типа обычно дают смесь региоизомеров пиразола, которые могут быть эффективно разделены колоночной хроматографией на силикагеле (схема 20). Гидролиз этих сложных эфиров с последующим взаимодействием с подходящим амином может давать целевой промежуточный амид. Затем различные заместители на пиразоле могут быть преобразованы с образованием разнообразных бензо-,гетероциклических и бициклических соединений. Схема 20 39 Вышеописанная методология при применении к дикетопроизводным дает также смесь региоизомеров пиразола. Ими можно манипулировать дополнительно с образованием соединений формулы I, как показано на схеме 21. Схема 21 При использовании кетоимидатов для конденсации с гидразинами получают соответствующие региоаддукты сложных аминоэфиров пиразола (схема 22). Затем может быть выполнено превращение этих промежуточных продуктов в конечные соединения формулы I посредством защиты аминогруппы подходящей защитной группой, обычно известной специалистам в данной области, или посредством образования производных (например, сульфонамид) и затем согласно общей синтетической стратегии получения соединений данного изобретения. Схема 22 Сложноэфирный промежуточный продукт пиразола может быть подвергнут дополнительной манипуляции с кетонами согласно купратному способу, описанному Knochel et al (схема 23). Альтернативно, этот сложный эфир может быть восстановлен до спирта или альдегида при помощи способов, известных в этой области, с последующим восстановительным аминированием подходящим амином до алкиламина или превращением этого спирта в уходящую группу,которая, в свою очередь, может быть замещена большим числом нуклеофилов с получением промежуточных продуктов, которые при дополнительных манипуляциях должны давать соединения данного изобретения. Схема 23 40 Тиосоединения, такие как описано в схеме 24, могут быть легко получены превращением 5-гидроксипиразола в его тиол обработкой реагентом Лавессона в нагревающемся при температуре дефлегмации толуоле. Схема 24 Соединения данного изобретения, в которых кольцо пиразола М заменено 1,2,3 триазолом, могут быть получены, как описано в общих чертах в схеме 25. Схема 25 Соединения данного изобретения, в которых кольцо М является 1,2,4-триазолом, могут быть легко получены по способу Huisgen et al.(Liebigs Ann. Chem. 1962, 653, 105) путем циклоприсоединения молекулярных частиц нитрилиминия (полученных в результате обработки триэтиламина хлоргидразоном) и подходящего нитрильного диполярофила, как показано на схеме 26. Схема 26 Этот способ обеспечивает большое разнообразие 1,2,4-триазолов с варьирующим характером замещения в положениях 1, 3 и 5. Альтернативно, 1,2,4-триазолы могут быть получены также по способу Zecchi et al (Synthesis 1986,9, 772) через азаконденсацию Виттига (схема 27). Схема 27 Альтернативно, 1,2,4-триазолы могут быть также получены по способу Sauer et al (Tetr.Lett. 1968, 325) посредством фотолиза циклического карбоната подходящим нитрилом (схема 28). Для соединений данного изобретения сложные эфиры могут быть превращены в промежуточные амиды по способу Weinreb (Tetr.Lett. 1977, 48, 4171), т.е. конденсацией подходящего комплекса амин-алюминий с этим сложным эфиром (схема 29). Схема 29 Кольцо изоксазолина М формулы I, в котором положения 4 и 5 являются замещенными,может быть получено по способу 1,3-диполярного циклоприсоединения, описанному в схеме 30. Подходящий бензгидроксиминоилхлорид или гетероциклический оксиминоилхлорид, или оксим при проведении с ним протокола 1,2-диполярного циклоприсоединения с подходящим 1,2-дизамещенным олефином в качестве диполярофила должен давать смесь региоизомеров. Разделение этих региоизомеров колоночной хроматографией с последующей последовательностью реакций, как описано выше,должно затем давать выбранные соединения. Оптически активные изоксазолины могут быть также получены ферментативным разделением региоизомерных сложных эфиров или путем использования подходящего хирального вспомогательного вещества на диполярофиле, как описано Olsson et al (J. Org. Chem. 1988, 53,2468). Схема 30 В случае соединений общей формулы I, в которой Z обозначает амид, способ циклоприсоединения, описанный в схеме 30, использует подходящим образом замещенный сложный эфир кротоновой кислоты. Сложные эфиры кротоновой кислоты могут быть получены из коммерческих источников или могут быть получены из этил-4-бромкротоната при помощи реакций нуклеофильного замещения, показанных на схеме 31. Тризамещенные олефины в качестве диполярофилов могут быть получены из этилпропиолята согласно купратному способу (схема 32) в соответствии со способом, описаннымDeslongchamps et al. (Synlett 1994, 660). Схема 32 Соединения данного изобретения с кольцом 1,3,4-триазола М могут быть легко получены с помощью способа Moderhack et al (J. Prakt. Эта реакция включает конденсацию карбазида с подходящим образом замещенным коммерчески доступным тиоизоцианатом с образованием циклического производного тиомочевины, как описано ранее. Реакции алкилирования или нуклеофильного замещения на промежуточном тионо-продукте дает затем тиоалкилили тиоарилсоединение в качестве промежуточного продукта, которое может быть гидролизовано, окислено и декарбоксилировано до 5-Н-2 тиотриазола в качестве промежуточного продукта, который может быть эффективно превращен в соединения данного изобретения. Альтернативно, промежуточный продукт, тиономочевина, может быть окислен непосредственно до 2-Н-триазола, который может быть затем превращен в сложный эфир и затем подвергнут разнообразным реакциям, показанным выше, с получением соединений данного изобретения. Эти сложные эфиры могут быть также превращены в амин посредством перегруппировки Гофманна, и эта методология обеспечивает разнообразные аналоги, сходные с аналогами,показанными выше. Промежуточный продукт,циклическая тиономочевина, может быть также окислен до сульфонилхлорида согласно показанным ранее способам. Это, в свою очередь,может обеспечить сульфонамиды, показанные на схеме 34. Схема 35 описывает общий синтез пиразолов, которые имеют тио- и окисленные производные серы. Подходящим образом замещенный амин алкилируют этилбромацетатом и гидролизуют до производного глицина. ПолучениеN-нитрозосоединения легко достигалось с нитритом натрия (J. Chem. Soc. 1935, 899) . Циклизацию с образованием сиднона с использованием уксусного ангидрида (J. Chem. Soc. 1935,899) проводили введением сульфидной единицы с применением сульфоксида в качестве растворителя и ацетилхлорида в качестве активирующего реагента (Tetr. 1974, 30, 409). Фотолитическое расщепление сиднона в присутствии ацетиленового соединения давало 1,3,5-тризамещенный пиразол в виде основного региоизомера(Сhem. Веr. 1979, 112, 1206). Эти реакции могут продолжаться, как описано выше, до конечных соединений, содержащих сульфидную, сульфоксидную или сульфоновую функциональность. Схема 35 Схема 36 показывает один возможный синтез изоксазолов. Замещенные бензальдегиды взаимодействуют с гидроксиламином, затем их хлорируют с получением гидроксиминоилхлорида в соответствии с процедурой (J. Оrg. Сhem. 1980, 45, 3916). Получение нитрилоксида in situ с триэтиламином и циклоприсоединение с замещенным алкином дают смесь региоизомерных изоксазолов, как показано Н. Kawakami(Chem. Lett. 1987, 1, 85). Получение дизамещенного алкина достигается нуклеофильной атакой алкиниланиона на электрофиле, как показаноJungheim (J. Оrg. Chem. 1987, 57, 4007). Альтернативно, можно было бы получить гидроксиминоилхлорид на участке R1a и подвергнуть его взаимодействию с подходящим образом замещенным алкином с получением 44 другого ряда региоизомерных изоксазолов, которые могут быть разделены хроматографически. Схема 36 Где V = NO2, SO2NR2 или СО 2 Ме, синтетический предшественник для -Z-A-B. Альтернативная процедура, дающая только один региоизомер, описана в схеме 37. Метилированная форма V может быть депротонирована и силилирована. Хлорирование тетрахлоридом углерода или фторирование дифтордибромметаном при катализе триэтилбораном дает геминальное дигалогенсоединение, как показано Sugimoto (Chem. Lett. 1991, 1319). Опосредованное купратом присоединение/элиминирование конъюгата дает целевой алкен, как описано в Harding (J. Org. Chem. 1978, 43, 3874). Альтернативно, можно ацилировать хлор ангидридом с образованием кетона, как описано в Andrews (Tetr. Lett. 1991, 7731) и затем диазометаном с образованием простого эфира енола. Каждое их этих соединений может быть подвергнуто взаимодействию с гидроксиминоилхлоридом в присутствии триэтиламина с получением одного региоизомерного изоксазола, как показано Stevens (Tetr. Lett. 1984, 4587). Схема 37V = NO2, SO2NR2 или СО 2 Ме, синтетический предшественник для -Z-A-B. Когда заместитель кольца R1a представляет собой СН 2R1', синтез показан на схеме 38. После обработки LDA кетон в качестве исходного продукта взаимодействует с PhSSO2Ph с образованием фенилтиолированного соединения, которое реагирует с гидразином в уксусной кислоте с образованием производного пиразола. Сложный эфир пиразола взаимодействует с амином или анилином (предварительно обработанным АlМе 3) с образованием амида. Окисление этого сульфида mСРВА дает соответствующий сульфон. Депротонирование сульфона основанием с последующим улавливанием электрофилом (Е-Х) и обработкой SmI2, давало целевое соединение после удаления защитной группы. Схема 39 показывает другие способы синтеза для R1a = CH2R1', или COR1'. Защита гидроксильной группы гидроксиацетона бензилгалогенидом и обработка основанием и CO(CO2Et)2 дает трикарбонильное соединение. Нагревание при температуре дефлегмации с NH2OMeHCl в пиридине и этаноле в присутствии молекулярного сита 3 А дает оксим. Циклизация оксима при помощи D-E-NHNH2 обеспечивает пиразол,который может быть превращен в соответствующий амин или анилин (предварительно активированный АlМе 3). Дебензилирование каталитическим гидрированием дает спирт. Этот спирт превращают в тозилат при помощи TsCl с последующим замещением нуклеофилом для обеспечения целевого соединения. Этот спирт может быть также окислен до соответствующих альдегида или кислоты или дополнительно превращен в сложный эфир или амид. Схема 39 Схема 40 показывает синтез кольца пиразола с хлоридной группой. Хлорирование пиразола в качестве исходного продукта, полученного ранее в схеме 2 а, с NCS, давало хлорпиразол. Хлорпиразол может взаимодействовать с анилином в присутствии АlМе 3 с последующим аминированием, как описано в схеме 2 а, с образованием целевого продукта. Схема 41 описывает синтез соединений, в которых М является бензольным кольцом и V представляет собой нитро, защищенную сульфонамидную или сложноэфирную группу и предшественник группы Z формулы I. Группу V помещают на подходящим образом замещенный фенол либо посредством нитрования, как показано Poirier et al. (Tetrahedron 1989, 45(5), 1415),сульфонилирования, как показано Kuznetsov(Akad. Nauk SSSR Ser. Khim 1990, 8, 1888), либо карбоксилирования по Sartori et al. (Synthesis 1988, 10, 763). Бромирование трифенилфосфином и бромом (J. Am. Chem. Soc. 1964, 86, 964) дает целевой бромид. Сочетание Сузуки с подходящей бороновой кислотой дает целевой замещенный пиридин. Схема 41 Схемы 42-45 описывают синтез соединений, в которых М представляет собой пиридин. Каждая схема представляет отличающуюся картину замещений для пиридинового кольца. На схеме 42 подходящим образом защищенный альдегид подвергают катализируемой основанием конденсации с активированным сложным эфиром с получением после удаления защитной группы целевого альдегида. Нагревание при температуре дефлегмации с хлоридом аммония,как показано Dornow and Ische (Chem. Ber. 1956,89, 876), обеспечивает пиридинол, который бромируют РОВr3 (Tjeenk et al. Rec. Trav. Chim. 1948, 67, 380) с получением целевого 2 бромпиридина. Сочетание Сузуки с подходящей бороновой кислотой дает целевой замещенный пиридин. Схема 42 Обработка подходящим образом замещенного 5-этоксиоксазола алкеном, как показано 47 катализируемым палладием сочетанием с бороновой кислотой обеспечивает целевой замещенный пиридин. Схема 43 Схема 44 описывает синтез третьей картины замещения на пиридиновом кольце. Подходящее трикарбонилсоединение, которое может быть получено способами, описанными в схеме 42, обрабатывают хлоридом аммония с получением пиридинола, который затем бромируют. Катализируемое палладием сочетание обеспечивает целевой замещенный пиридин. Схема 44 В схеме 45 используют подходящим образом замещенное дикарбонилсоединение и при помощи способа, проиллюстрированного на схемах 42 и 44, подвергают его взаимодействию с хлоридом аммония. Бромирование дает 3 бромпиридин, который при катализируемом палладием сочетании дает целевой замещенный пиридин. Схема 45 Схемы 46-48 описывают синтез соединений, в которых М представляет собой пиридазин. Каждая схема представляет отличающуюся картину замещений для пиридинового кольца. В схеме 46 активированный сложный эфир взаимодействует с подходящим образом замещенным -кетоальдегидом и гидразином, как показано Schmidt and Druey (Helv. Chim. Acta 1954,37, 134 and 1467). Превращение пиридазинона в бромид при помощи РОВr3 и катализируемого палладием сочетания обеспечивает целевой замещенный пиридазин. Схема 46 48 В схеме 47 глиоксаль может реагировать в щелочных условиях с активированным кетоном и затем быть подвергнут бромированию/дегидробромированию с получением целевого кетоальдегида. Альтернативно, защищенный кетон может быть подвергнут взаимодействию с активированным альдегидом, бромированию/дегидробромированию, удалению защитных групп и окислению с образованием региоизомерного кетоальдегида. Циклизация, как показано Sprioand Madonia (Ann. Chim. 1958, 48, 1316), гидразином с последующим катализируемым палладием сочетанием обеспечивает целевой замещенный пиридазин. Схема 47 Аналогично схеме 47, в схеме 48 альдегид может быть подвергнут взаимодействию с активированным кетоном, бромированию, дегидробромированию и удалению защитных групп с получением целевого дикетона. Альтернативно,региоизомерный кетон может быть подвергнут той же самой последовательности реакций для получения изомерного кетоальдегида. Взаимодействие с гидразином с последующим катализируемым палладием сочетанием обеспечивает целевой замещенный пиридазин. Схема 48 Схемы 49 и 50 описывают синтез соединений, в которых М представляет собой пиримидин. Каждая схема представляет отличающуюся картину замещений для пиримидинового кольца. В схеме 49 конденсация с подходящим образом замещенным хлорангидридом и активированным сложным эфиром с последующим восстановлением конъюгата гидридом олова (Moriya et al. J. Org. Chem. 1986, 51, 4708) дает целевое 1,4-дикарбонилсоединение. Циклизация формамидином или замещенным амидином с последующим бромированием дает целевой региоизомерный пиримидин. Катализируемая 49 палладием реакция сочетания обеспечивает целевой замещенный пиримидин. Схема 49 При помощи подобного способа, схема 50 показывает, как амидин может быть конденсирован с 1,3-дикарбонилсоединением и затем бромирован в положении 5 (J. Het. Chem. 1973,10, 153) с получением специфического региоизомерного бромпиримидина. Катализируемая палладием реакция сочетания обеспечивает целевой замещенный пиримидин. Схема 50 С использованием того же самого кетоальдегида из схемы 50 циклизация с подходящим образом замещенным 1,2-диамином (Chimia 1967, 21, 510) с последующей ароматизацией(Helv. Chim. Acta 1967, 50, 1734) обеспечивает региоизомерную смесь пиразинов, как показано на схеме 51. Бромирование гидробромидной соли (U.S. Patent No. 2403710) дает промежуточный продукт для стадии катализируемого палладием сочетания, которая происходит, как описано выше. Схема 51 Схемы 52 и 53 описывают синтез соединений, в которых М представляет собой 1,2,3 триазин. В схеме 52 винилбромид подвергается катализируемому палладием сочетанию с образованием молекулы, содержащей заместительR1b. Аллильное бромирование с последующим замещением азидом обеспечивает предшественник циклизации. Опосредованная трифенилфосфином циклизация (J. Оrg. Chem. 1990, 55,4724) дает 1-аминопиразол, который затем бромируют N-бромсукцимидом. Опосредованная тетраацетатом свинца перегруппировка, как показано Neunhoeffer et al. (Ann. 1985, 1732), обеспечивает целевой 1,2,3-триазин. Катализируемая палладием реакция сочетания обеспечивает целевой замещенный триазин. В схеме 53 алкен аллильно бромируют и бромид замещают с получением региоизомера азида в схеме 52. По той же самой последовательности реакций, описанной выше, циклизация дает 1-аминопиразол. Бромирование с последующей опосредованной тетраацетатом свинца перегруппировкой дает 1,2,3-триазин. Катализируемая палладием реакция сочетания обеспечивает другой целевой триазин. Схема 53Chem. 1971, 36, 3921). Бромирование, как описано Rykowski and van der Plas (J. Org. Chem. 1987, 52, 71), с последующим катализируемым палладием сочетанием обеспечивает целевой 1,2,4-триазин. Схема 54 В схеме 55, для получения противоположного региоизомера приведенная выше схема реакций модифицирована путем замещения защищенного -кетоэфира. Это позволяет наиболее нуклеофильному азоту атаковать сложноэфирную группу, устанавливая противоположную региохимию. Удаление защитной группы и термическая циклизация дают триазинон, который бромируют, как показано выше. Катализируемая палладием реакция сочетания обеспечивает другой целевой 1,2,4-триазин. Схема 55 51 Схема 56 описывает синтез соединений, в которых М представляет собой 1,2,3,4-тетразин. Литиирование винилбромида, переметаллирование оловом, катализируемое палладием карбонилирование и образование гидразона обеспечивают диен для последующей реакции Дильса-Альдера, как показано Carboni and Lindsey (J.Am. Chem. Soc. 1959, 81, 4342). Взаимодействие с дибензилазодикарбоксилатом с последующим каталитическим гидрированием до дебензилата и декарбоксилата должны давать после бромирования целевой 1,2,3,4-тетразин. Катализируемая палладием реакция сочетания обеспечивает целевое замещение. Схема 56 Соединения данного изобретения, в которых В представляет собой карбоциклический или гетероциклический остаток, как определено в формуле I, подвергают реакции сочетания с А,как показано в общем виде и посредством конкретного примера на схеме 57, причем любой из А и В или оба А и В могут быть замещены 0-2R4. W определен как подходящий защищенный азот, такой как NО 2 или NHBOC; защищенная сера, такая как S-tBu или SMOM; или метиловый эфир. Галоген-металл обмен брома в бромВ с н-бутиллитием, гашение триизопропилборатом и кислотный гидролиз должны давать требующуюся бороновую кислоту, В'-D(ОН)2. Субъединица W-A-Br может быть уже связана с кольцом М перед реакцией сочетания Сузуки. Удаление защитных групп может обеспечить полную субъединицу. Схема 57 Схема 58 описывает типичный пример получения субъединицы А-В для присоединения к кольцу М. 4-Броманилин может быть защищен в виде Вос-производного и подвергнут реакции сочетания с 2-(трет-бутиламино)сульфонилфенилбороновой кислотой в условиях реакции сочетания Сузуки. 2-(трет-Бутиламино)сульфонилфенилбороновая кислота может быть получена по способу, описанному Rivero [Bioorg.Med. Chem. Lett. 1994, 189). Удаление защитной группы при помощи ТФУ может дать аминобифенилсоединение. Затем аминобифенил может 52 быть соединен сочетанием с кольцевыми структурами кольца, как описано ниже. Схема 58 Для N-замещенных гетероциклов, схема 59 показывает образование бороновой кислоты при помощи стандартной, описанной в литературе процедуры (Ishiyama, Т.; Murata, М.; and Miyaura, N. J. Org. Chem. 1995, 60, 7508-7510). Активируемое медью C-N-сочетание бороновой кислоты и гетероцикла может быть выполнено,как описано (Lam, P.Y.S. et al., Tet. Lett. 1998,39, 2941-2944). Предпочтительным является использование бороксина или пространственно затрудненного бората в качестве источника бора. Полученная кислота может быть конденсирована с Н-А-В' и после удаления защитных групп дает целевой продукт. Схема 59 Синтетический путь для получения производных аминобензизоксазола с имидазольным кольцом показан на схеме 60. Катализируемая палладием (0) реакция перекрестного сочетания алкоксидибора (дибората пинакона) с галогенареном (см. Ishiyama et al., J. Org. Chem. 1995, 60,7508-7510) должна давать промежуточный продукт арилборат, который может быть гидролизован 4 М НСl (10 экв.) в минимальном количестве ТГФ при комнатной температуре с образованием арилбороновой кислоты. 4-Имидазолкарбоновая кислота может быть превращена в 4 трифторметилимидазол взаимодействием с SF4(3 экв.) и HF (7,5 экв.) во встряхиваемой пробирке при 40 С. Катализируемая медью (II) реакция сочетания арилбороновой кислоты с 4 трифторметилимидазолом в присутствии пиридина (5 экв.) и молекулярных сит 4 А в ТГФ должна обеспечить 1-арил-4-трифторметилимидазол. Литиирование этого имидазола с использованием н-BuLi с последующим гашением метилхлорформиатом может давать 1-арил-4 трифторметил-1 Н-имидазол-5-метилкарбоксилат. Нуклеофильное замещение фторбензола предварительно смешанными трет-бутоксидом калия и оксимом ацетона с последующей обработкой 20% НСl в этаноле может образовать 1 53 аминобензизоксазол-4-трифторметил-1 Н-имидазол-5-метилкарбоксилат. Затем этот сложный эфир может быть превращен в амид реакцией сочетания Вайнреба. Альтернативно, после омыления этого сложного эфира в водномNaOH в ТГФ полученная кислота может быть превращена в соответствующий ацилхлорид обработкой SOCl2 или оксалилхлоридом с последующим взаимодействием с анилином, содержащим о-заместитель, с образованием амида. Фторбензол может быть подобным образом превращен в производное аминобензизоксазола обработкой предварительно смешанными третбутоксидом калия и оксимом ацетона с последующим взаимодействием с 20% НСl в этаноле. Этот сложный эфир может быть также омылен в водном NaOH в ТГФ с получением кислоты,которая затем может быть превращена в амид реакцией сочетания с анилином с использованием реагента сочетания (например, РуВrор) в щелочных условиях. Схема 60 Производные о-фторбензонитрила с ядром имидазола могут быть превращены в производные 1-аминохиназолин-1 Н-имидазола обработкой солью формамидина в пиридине и этаноле Схема 62 иллюстрирует получение промежуточных продуктов с бициклическим ядром,приводящих к образованию соединений с ядра 003210 54 ми индазола и индола. Соединения этого общего типа могут быть получены по способу, описанному в Chem. Ber. (1926) 35-359. Пиразол-Nоксид может быть восстановлен любым числом способов, в том числе трифенилфосфином в нагреваемом при температуре дефлегмации толуоле с последующим гидролизом нитрильного заместителя до карбоновой кислоты щелочным пероксидом водорода с получением промежуточного продукта имидазола, который может быть подвергнут обычной реакции сочетания с образованием производного индазола. Индольный промежуточный продукт может быть получен путем синтеза индола по Фишеру (Org. Syn.Col. Vol. III 725) из подходящим образом замещенных фенилгидразина и ацетофенона. Дополнительное усовершенствование с использованием стандартных синтетических способов включает введение 3-формильной группы обработкой РОСl3 в ДМФ, необязательную защиту группы(TMSCH2CH2OCH2Cl, NaH, ДМФ) и окисление альдегида до карбоновой кислоты, которая теперь готова для превращения в индольный продукт. Когда В определен как X-Y, применимо следующее описание. Группы А и В либо доступны из коммерческих источников, известных из литературы, либо легко синтезируются адаптированием стандартных процедур, известных практикам с квалификацией в области органического синтеза. Требующиеся реакционноспособные функциональные группы, присоединяемые к аналогам А и В, являются также либо доступными из коммерческих источников, известных из литературы, либо легко синтезируются адаптированием стандартных процедур,известных практикам с квалификацией в области органического синтеза. В таблицах, которые следуют далее, описан в общих чертах способ,необходимый для выполнения сочетания А с В. Таблица А. Получение амидной, сложноэфирной, карбамидной, сульфонамидной и сульфамидной связей между А и В 56 низкой температуре (-20 С или более низкой) и с большим избытком хлорангидрида или с каталитическим или стехиометрическим комплексом бромид меди - диметилсульфид в диметилсульфиде в качестве растворителя или с его вариантом. Другие подходящие способы включают превращение реагента Гриньяра в кадмиевый реагент и сочетание в соответствии с процедурой Carson and Prout (Org. Syn. Col. Vol. 3(Cahiez and Laboue, Tetr. Lett. 1992, 33(31),4437). Таблица С. Получение простых эфирной и тиоэфирной связей между А и В Простые эфирные и тиоэфирные связи таблицы С могут быть получены взаимодействием этих двух компонентов в полярном апротонном растворителе, таком как ацетон, диметилформамид или диметилсульфоксид, в присутствии основания, такого как карбонат калия,гидрид натрия или трет-бутоксид калия, при температуре в пределах от температуры окружающей среды до температуры дефлегмации используемого растворителя. Таблица D. Получение связей -SO- и -SO2- из простых тиоэфиров таблицы 3 Реакцию табл. А можно проводить в апротонных растворителях, таких как хлоруглерод,пиридин, бензол или толуол, при температурах от -20 С до точки дефлегмации растворителя и с основанием триалкиламином или без него. Таблица В. Получение кетоновых связей между А и В Реакция сочетания табл. В может проводиться различными способами. Реагент Гриньяра, необходимый для Y, получают из галогенаналога Y в сухом эфире, диметоксиэтане или тетрагидрофуране при температуре от 0 С до точки дефлегмации растворителя. Этот реагент Гриньяра может реагировать непосредственно при очень строго контролируемых условиях, т.е. Простые тиоэфиры таблицы С служат в качестве подходящего исходного продукта для получения сульфоксидных и сульфоновых аналогов табл. D. Комбинация влажного оксида алюминия и оксона может обеспечить надежный реагент для окисления простого тиоэфира до сульфоксида, тогда как окисление мхлорпербензойной кислотой будет давать сульфон. Другие признаки данного изобретения станут очевидными в ходе следующих далее примеров, которые приводятся для иллюстрации изобретения и не предназначены для ограничения ими изобретения. Примеры Пример 1. 1-(1'-Аминоизохинол-7'-ил)-3 метил-5-[(2'-аминосульфонил-[1,1']-бифен-4-ил) карбониламино]пиразол, мезилатная соль.Chem. Soc. 1951, 2851) добавляли к 40 мл концентрированной хлористо-водородной кислоты при 0 С. Нитрит натрия (3,0 г, 43,4 ммоль) растворяли в 15 мл воды, охлажденной до 0 С, и добавляли по каплям к раствору изохинолина. Реакционную смесь перемешивали в течение 30 мин при 0 С. Дигидрат хлорида олова (29,3 г,130,2 ммоль, 3 экв.) растворяли в 25 мл концентрированной хлористо-водородной кислоты,раствор охлаждали до 0 С и добавляли по каплям к раствору изохинолина. Реакционную смесь помещали в холодильник на ночь. На следующий день осадок выделяли фильтрованием,промывали 100 мл охлажденного льдом насыщенного раствора соли и затем 100 мл раствора 2:1 петролейный эфир/этиловый эфир. Коричневое твердое вещество сушили в динамичном вакууме в течение ночи. Двойную соль олова изохинолина (9,0 г, 26 ммоль) суспендировали в 100 мл ледяной уксусной кислоты и добавляли по каплям оксим этил 2,4-диоксопентаноата (4,0 г, 21,3 ммоль). Реакционную смесь нагревали при температуре дефлегмации в течение ночи. На следующий день уксусную кислоту выпаривали и к остатку добавляли 100 мл воды, охлаждали до 0 С и нейтрализовали твердым бикарбонатом натрия. Раствор экстрагировали этилацетатом (6 х 50 мл), сушили над сульфатом натрия и упаривали с получением указанного в заголовке соединения в виде коричневатого твердого вещества (5,15 г, выход 86%), которое было более чем на 85% целевым региоизомером пиразола. Этот продукт может быть очищен флэш-хроматографией на силикагеле, элюируя 5% метанолом в хлороформе: 1H-ЯМР (CDCl3):1,24 (т, 3 Н, J=7,1 Гц,ОСН 2 СН 3), 2,40 (с, 3H, СН 3 пиразола), 4,24 (к,2 Н, J=7,1 Гц, ОСН 2 СН 3), 6,89 (с, 1 Н, Н пиразола), 7,70 (д, J=5,9 Гц, Н 4), 7,75 (дд, 1 Н, J=8,8 Гц,J=2,2 Гц, Н 6), 7,89 (д, 1 Н, J=8,8 Гц, Н 5), 8,05 (д,1 Н, J=2,0 Гц, Н 7), 8,58 (с, 1 Н, J=5, 9 Гц, Н 3),9,29 (с, 1 Н, Hl), MS (ES+): 282,1 (M+H)+ (100%),C30H29N5O3S 539,65. К раствору 2'-трет-бутиламиносульфонил[1,1']-бифенил-4-иламина (2,19 г, 7,19 ммоль) в 100 мл безводного дихлорметана в атмосфере азота добавляли по каплям триметилалюминий(10,9 мл, 21,6 ммоль, 2 М в гексане). Раствор перемешивали в течение 30 мин при температуре окружающей среды. Этил 1-(изохинолин-7'ил)-3-метил-5-пиразолкарбоксилат (2,02 г, 7,19 ммоль) в 70 мл безводного дихлорметана добавляли по каплям и реакционную смесь нагревали до 40 С и давали перемешиваться в течение 15 ч. Реакцию гасили 50 мл 1 н. хлористоводородной кислоты при 0 С, разбавляли 50 мл воды и подщелачивали твердым карбонатом натрия. Фазы разделяли и водную фазу экстрагировали дихлорметаном (3 х 30 мл), сушили над сульфатом натрия и упаривали с получени 003210 58 ем амида (3,50 г, выход 90%) в виде коричневого твердого вещества и с достаточной чистотой для следующей стадии. Этот продукт может быть очищен флэш-хроматографией на силикагеле, элюируя 5% метанолом в хлороформе. MS(ES+): 540,22 (М+Н)+ (100%). Этот амид растворяли в 60 мл ацетона, к которому добавляли мета-хлорпербензойную кислоту (79%) (1,86 г,7,55 ммоль), и реакционной смеси давали перемешиваться в течение ночи при температуре окружающей среды. На следующий день растворитель удаляли при пониженном давлении и остаток поглощали в 100 мл каждого из этилацетата и насыщенного бикарбоната натрия. Фазы разделяли и органическую фазу сушили над сульфатом натрия и упаривали с получением N-оксида в виде бледно-красного твердого вещества с количественным выходом и достаточной чистотой для следующей стадии. MSN-оксид растворяли в 110 мл безводного пиридина и добавляли тозилхлорид (1,64 г, 8,63 ммоль) в виде трех равных порций и реакционной смеси давали перемешиваться при температуре окружающей среды в течение ночи. Пиридин удаляли при пониженном давлении и к остатку добавляли 45 мл этаноламина и реакционную смесь перемешивали при температуре окружающей среды в течение 2 дней. Реакционную смесь выливали на раздробленный лед и твердые вещества выделяли фильтрованием и сушили в вакууме с получением 2,33 г (выход 65%) смеси 1-аминоизохинолина в качестве основного продукта и 4-аминоизохинолина в качестве не основного продукта в виде рыжеватокоричневого твердого вещества. MS (ES+): 555,22 (М+Н)+ (100%), HRMS (FAB+) дляC30H30N6O3S вычислено (M+H)+ 555,217836; найдено 555,21858. К 20 мл трифторуксусной кислоты добавляли соединение 1-аминоизохинолина и реакционную смесь нагревали до температуры дефлегмации в течение ночи. На следующий день растворитель удаляли при пониженном давлении и остаток подщелачивали водным карбонатом натрия, охлажденным до 0 С, экстрагировали этилацетатом (3 х 40 мл), сушили над сульфатом натрия и упаривали. Рыжеватокоричневое твердое вещество очищали колоночной флэш-хроматографией на силикагеле,элюируя смесью 15% МеОН/СНСl3 с получением 1,60 г (выход 76%) указанного в заголовке соединения в виде светлого рыжеватокоричневого твердого вещества. MS (ES+): 499,14 (М+Н)+ (100%), HRMS (FAB+) дляC26H22N6O3S вычислено (М+Н)+ 499,155236; найдено 499,153551. Затем продукт обрабатывали одним эквивалентом метансульфоновой кислоты в ТГФ. Выпаривание растворителя давало соединение, 59 указанное в заголовке примера 1, MS (ES+): 499,0 (М+Н)+ (100%), т.пл. 195 С. Пример 2. 1-(1'-Аминоизохинол-7'-ил)-3 метил-5-[(2'-метилсульфонил[1,1']бифен-4-ил) карбониламино]пиразол, мезилат. Указанное в заголовке соединение получали аналогично примеру 1. MS (ES+): 498,0(М+Н)+ (100%), т.пл. 175 С. Пример 3. 1-(4'-Аминоизохинол-7'-ил)-3 метил-5-[(2'-аминосульфонил[1,1']бифен-4-ил) карбониламино]пиразол. Указанное в заголовке соединение получали аналогично примеру 1. MS (ES+): 499,0(M+H)+ (100%), т.пл. 204 С. Пример 4. 1-(Изохинол-7'-ил)-3-метил-5[(2'-аминосульфонил[1,1']бифен-4-ил)карбониламино]пиразол. Указанное в заголовке соединение получали аналогично примеру 1. MS (ES+): 484,1(M+H)+ (100%). Пример 5. 3-(1'-Аминоизохинол-7'-ил)-5[(2'-аминосульфонил[1,1']бифен-4-ил)карбониламино]-5-метилизоксазолин. Указанное в заголовке соединение получали аналогично примеру 1. MS (ES+): 502,3(М+Н)+ (100%). Пример 6. 3-(Изохинол-5'-ил)-5-[(2'аминосульфонил[1,1']бифен-4-ил)карбониламино]-5-метилизоксазолин. Указанное в заголовке соединение получали аналогично примеру 1. MS (ES+): 487,3(М+Н)+ (100%). Пример 7. 3-(Изохинол-7'-ил)-5-[(2'-аминосульфонил-[1,1']-бифен-4-ил)карбониламино]-5 метилизоксазолин. Указанное в заголовке соединение получали аналогично примеру 1. MS (ES+): 487,3(7,50 г) в метаноле (225 мл) добавляли N,N'дикарбобензилоксиметилизотиомочевину (16,20 г). Реакционную смесь нагревали при температуре дефлегмации в течение 4 ч. Нагревание прекращали и смеси давали остыть. Перемешивание продолжали при комнатной температуре в течение ночи. Осадок фильтровали и промывали эфиром (40 мл) и сушили на воздухе с получением 2-бензилоксикарбониламино-5-метоксикарбонилбензимидазола (9,80 г) в виде фиолетового твердого вещества. ESI-масс-спектр z(отн. интенсивность) 326 (М+Н, 100). Суспензию бензимидазола (1,58 г) в метиленхлориде (40 мл) охлаждали до -78 С. Через шприц добавляли DIBAL (1,0 М в CH2Cl2, 21,87 мл). Реакционную смесь перемешивали при 78 С в течение 1,5 ч и медленно нагревали до комнатной температуры. Реакцию гасили метанолом (2 мл), НСl (5%. 2 мл). Растворитель удаляли и остаток распределяли между этилацета 003210 60 том (60 мл) и водой (60 мл), промывали водой (2 х 40 мл), насыщенным раствором соли (40 мл); сушили над сульфатом натрия с получением 2 бензилоксикарбониламино-5-гидроксиметилбензимидазола (1,2 г). ESI-масс-спектр z (отн. интенсивность) 298 (М+Н, 100). К раствору пиридина (3,83 г) в метиленхлориде (30 мл) добавляли СrО 3 (2,42 г). Смесь перемешивали при комнатной температуре в течение 45 мин с последующим добавлением раствора 2-бензилоксикарбониламино-5-гидроксиметилбензимидазола (1,2 г) в метиленхлориде (20 мл) и ДМФ (10 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2,5 ч. Две трети растворителя удаляли и остаток распределяли между этилацетатом и бикарбонатом натрия (нас.), промывали KHSO4(5% в H2O), водой и насыщенным раствором соли; сушили над сульфатом натрия с получением альдегида (0,95 г). ESI-масс-спектр z (отн. интенсивность) 296 (М+Н, 100). К раствору альдегида (0,50 г) в этаноле добавляли раствор гидрохлорида гидроксиамина(0,28 г) в воде (5 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи. На следующий день этанол удаляли и белый осадок отфильтровывали, промывали водой и сушили на воздухе с получением оксима (0,50 г). ESI-масс-спектр z (отн. интенсивность) 311(М+Н, 100). К раствору 2-бензилоксикарбониламино-5 оксимбензимидазола (0,31 г) в ТГФ (50 мл) добавляли метилакриловую кислоту (0,11 г), к этой смеси добавляли по каплям обесцвечивающий агент при перемешивании при 0 С. После добавления обесцвечивающего агента перемешивание продолжали при комнатной температуре в течение ночи. Большую часть растворителя удаляли и смесь распределяли между этилацетатом и водой. Органический слой отделяли и промывали водой, насыщенным раствором соли; сушили над сульфатом натрия. Полученное твердое вещество перекристаллизовывали с использованием смеси метиленхлорид/гексан (1:1) с получением изоксазолина (0,25 г) в виде чистого соединения. ESI-масс-спектр z(115 мг) и ВОР (168 мг). Реакционную смесь перемешивали при 55 С в течение ночи. На следующий день смесь распределяли между этилацетатом (25 мл) и водой (25 мл), промывали НСl (5%, 4 х 10 мл), бикарбонатом натрия (5%, 2 х 10 мл), водой (2 х 10 мл) и насыщенным раствором соли (10 мл); сушили над сульфатом натрия, фильтровали и концентрировали, оставляя 3-(2-бензилоксикарбониламино-5-ил)-5-[(2'трет-бутиламиносульфонил-[1,1']-бифен-4-ил) аминокарбонил]-5-метилизоксазолин (120 мг).
МПК / Метки
МПК: A61P 7/02, C07D 401/04, A61K 31/4725
Метки: гуанидина, новые, ингибиторов, фактора, миметики, качестве
Код ссылки
<a href="https://eas.patents.su/30-3210-novye-mimetiki-guanidina-v-kachestve-ingibitorov-faktora-ha.html" rel="bookmark" title="База патентов Евразийского Союза">Новые миметики гуанидина в качестве ингибиторов фактора ха</a>
Предыдущий патент: Новые бициклические аминопиразиноновые соединения, способ их получения и фармацевтические композиции, содержащие их
Следующий патент: Способ получения лимонной кислоты и ее солей путем периодической и непрерывной ферментации гриба aspergillus niger
Случайный патент: Новые способы идентификации биомолекул лигандов и мишеней












