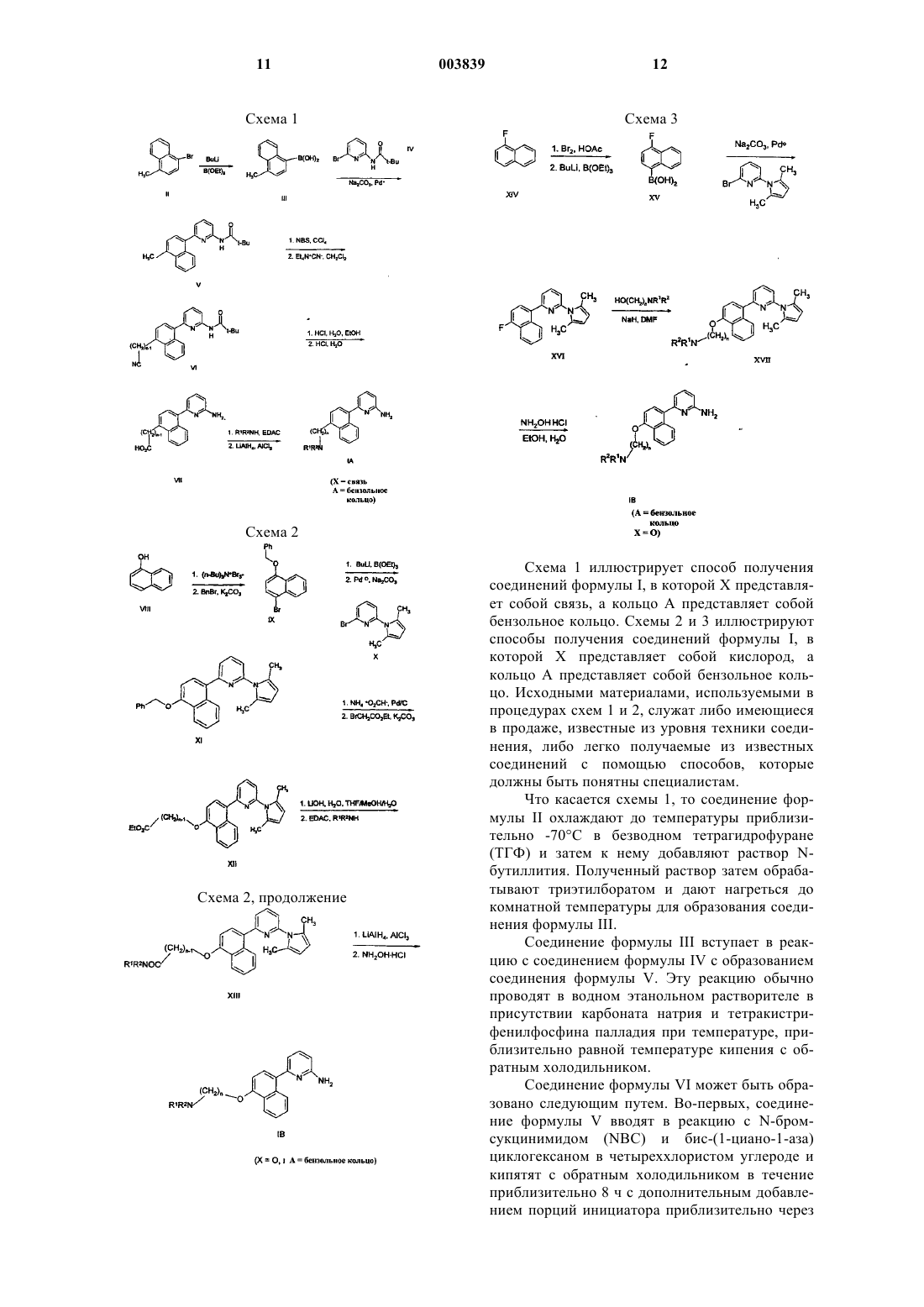
2-аминопиридины, содержащие в качестве заместителей конденсированные кольца, применяемые в качестве ингибиторов nos (no синтазы)
Формула / Реферат
1. Соединение формулы
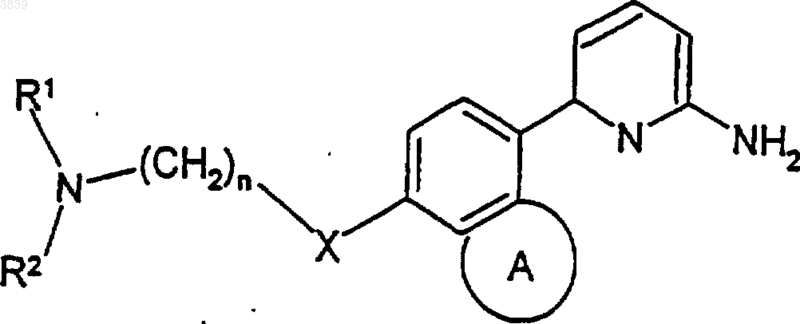
где кольцо A является 5-7-членным насыщенным или ненасыщенным конденсированным кольцом,
X является кислородом или связью;
n представляет собой целое число от 2 до 6 и
R1 и R2 независимо выбирают из водорода (C1-C6)алкила, арила, тетрагидронафталина и аралкила, где указанный арил и арильная часть указанного аралкила представляет собой фенил или нафтил, а алкильная часть является линейной или разветвленной и содержит от 1 до 6 углеродных атомов и где указанный (C1-C6)алкил, указанный арил, указанный тетрагидронафталин и арильная часть указанного аралкила могут необязательно быть замещенными заместителями в количестве от 1 до 3, которые независимо выбирают из галогена, выбранного из группы, состоящей из хлора, фтора, брома, иода, нитро, гидрокси, циано, амино, (C1-C4) алкокси и (C1-C4)алкиламино;
или R1 и R2 образуют вместе с азотом, к которому они присоединены, пиперазиновое, азетидиновое, пиперидиновое или пирролидиновое кольцо или азабициклическое кольцо, содержащее в кольце от 6 до 14 членов, из которых от 1 до 3 являются азотом, а остальные представляют собой углерод;
и где указанные пиперазиновое, азетидиновое, пиперидиновое и пирролидиновое кольца могут быть необязательно замещены одним или более заместителями, которые независимо выбирают из (C1-C6)алкила, амино, (C1-C6)алкиламино, [ди-(C1-C6)алкил]амино, 5-6-членных гетероциклических колец, замещенных фенилом, содержащих от 1 до 4 атомов азота бензоила, бензоилметила, бензилкарбонила, фениламинокарбонила, фенилэтила и феноксикарбонила, и где фенильные части любых из упомянутых выше заместителей могут быть необязательно замещены одним или более заместителями, которые независимо выбирают из галогена, (C1-C3)алкила, (C1-C3)алкокси, нитро, амино, циано, CF3 и OCF3;
R1 или R2 могут также быть присоединены к (CH2)n-группе, образуя 4-7-членное кольцо;
и фармацевтически приемлемая соль таких соединений.
2. Соединение по п.1, в котором NR1R2 представляет собой необязательно замещенное пиперидиновое, азетидиновое, пиперазиновое или пирролидиновое кольцо или 3-азабицикло [3.1.0]гекс-6-иламинное кольцо;
и где указанные пиперазиновое, азетидиновое, пиперидиновое и пирролидиновое кольца могут быть необязательно замещены одним или более заместителями, предпочтительно заместителями в количестве от 0 до 2, которые независимо выбирают из (C1-C6)алкила, амино, (C1-C6) алкиламино, [ди-(C1-C6)алкил]амино, фенилзамещенных 5-6-членных гетероциклических колец, содержащих от 1 до 4 атомов азота в кольцах, бензоила, бензоилметила, бензилкарбонила, фениламинокарбонила, фенилэтила и феноксикарбонила, и где фенильные части любых из упомянутых выше заместителей могут быть необязательно замещены одним или более заместителями, предпочтительно заместителями в количестве от 0 до 2, которые независимо выбирают из галогена, (C1-C3)алкила, (C1-C3)алкокси, нитро, амино, циано, CF3 и OCF3.
3. Соединение по п.1, в котором NR1R2 образует азабициклическое кольцо, имеющее формулу
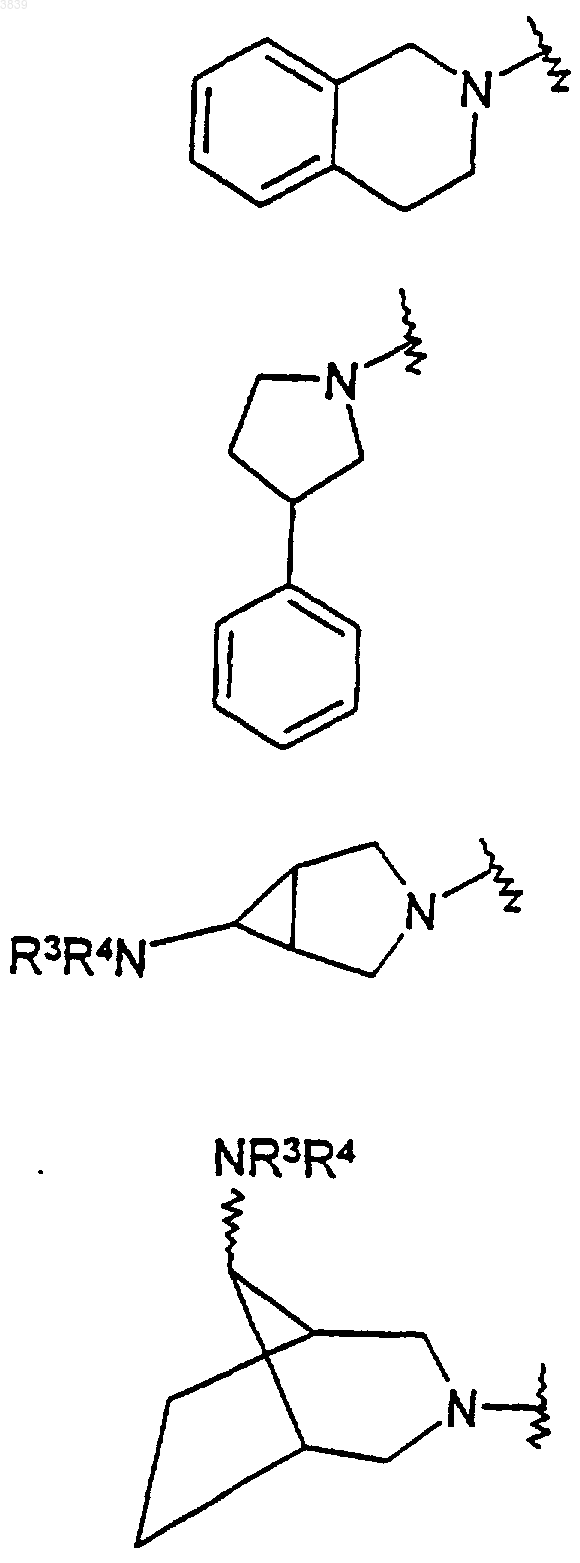
и

где R3 и R4 выбирают из водорода, (C1-C6) алкила, фенила, нафтила, (C1-C6)алкил-C(=O)-, HC(=O)-, (C1-C6)алкокси-(C=O)-, фенил-C(=O)-, нафтил-C(=O)- и R6R7NC (=O)-, где R6 и R7 независимо выбирают из водорода и (C1-C6)алкила; и
R5 выбирают из водорода, (C1-C6)алкила, фенила, нафтила, фенил- (C1-C6)алкил- и нафтил (C1-C6)алкил-.
4. Фармацевтическая композиция для лечения или предотвращения состояния, выбираемого из группы, состоящей из мигрени, воспалительных заболеваний, удара, острой и хронической боли, гиповолемического шока, травматического шока, реперфузионной травмы, болезни Крона, язвенного колита, септического шока, депрессии, болезни Паркинсона, множественного склероза, слабоумия, связанного со СПИДом, нейродегенеративных заболеваний, нейрональной токсичности, болезни Альцгеймера, состояния химической зависимости и привыкания, рвоты, эпилепсии, состояния тревожности, психоза, травмы головы, синдрома респираторного дистресса взрослых (ARDS), индуцированных морфином симптомов толерантности и отмены, воспалительного заболевания кишечника, остеоартрита, ревматоидного артрита, овуляции, дилятационной кардиомиопатии, острой травмы спинного мозга, болезни Хантингтона, глаукомы, дегенерации сетчатки, диабетической нейропатии, диабетической нефропатии и рака у млекопитающего, включающая эффективное количество в отношении лечения или предотвращения такого состояния соединения по п.1 и фармацевтически приемлемый носитель.
5. Способ лечения или предотвращения состояния, выбираемого из группы, состоящей из мигрени, воспалительных заболеваний, удара, острой и хронической боли, гиповолемического шока, травматического шока, реперфузионной травмы, болезни Крона, язвенного колита, септического шока, множественного склероза, слабоумия, связанного со СПИДом, нейродегенеративных заболеваний, нейрональной токсичности, депрессии, болезни Паркинсона, болезни Альцгеймера, состояния химической зависимости и привыкания, рвоты, эпилепсии, состояния тревожности, психоза, травмы головы, синдрома респираторного дистресса взрослых (ARDS), индуцированных морфином симптомов толерантности и отмены, воспалительного заболевания кишечника, остеоартрита, ревматоидного артрита, овуляции, дилятационной кардиомиопатии, острой травмы спинного мозга, болезни Хантингтона, глаукомы, дегенерации сетчатки, диабетической нейропатии, диабетической нефропатии и рака у млекопитающего, включающий введение указанному млекопитающему эффективного количества в отношении лечения или предотвращения такого состояния, соединения по п.1.
6. Фармацевтическая композиция для ингибирования синтазы окиси азота (NOS) у млекопитающего по п.1, включающая эффективное в отношении ингибирования NOS количество соединения по п.1 и фармацевтически приемлемый носитель.
7. Способ ингибирования NOS у млекопитающего, включающий введение указанному млекопитающему эффективного в отношении ингибирования NOS количества соединения по п.1.
8. Фармацевтическая композиция для лечения или предотвращения состояния, выбираемого из группы, состоящей из мигрени, воспалительных заболеваний, удара, острой и хронической боли, гиповолемического шока, травматического шока, реперфузионной травмы, болезни Крона, язвенного колита, септического шока, множественного склероза, слабоумия, связанного со СПИДом, нейродегенеративных заболеваний, нейрональной токсичности, депрессии, болезни Паркинсона, болезни Альцгеймера, состояния химической зависимости и привыкания, рвоты, эпилепсии, состояния тревожности, психоза, травмы головы, синдрома респираторного дистресса взрослых (ARDS), индуцированных морфином симптомов толерантности и отмены, воспалительного заболевания кишечника, остеоартрита, ревматоидного артрита, овуляции, дилятационной кардиомиопатии, острой травмы спинного мозга, болезни Хантингтона, глаукомы, дегенерации сетчатки, диабетической нейропатии, диабетической нефропатии и рака у млекопитающего, включающая эффективное в отношении ингибирования NOS количество соединения по п.1 и фармацевтически приемлемый носитель.
9. Способ лечения или предотвращения состояния, выбираемого из группы, состоящей из мигрени, воспалительных заболеваний, удара, остЁющ и хронической боли, гиповолемического шока, травматического шока, реперфузионной травмы, болезни Крона, язвенного колита, септического шока, множественного склероза, слабоумия, связанного со СПИДом, нейродегенеративных заболеваний, нейрональной токсичности, депрессии, болезни Паркинсона, болезни Альцгеймера, состояния химической зависимости и привыкания, рвоты, эпилепсии, состояния тревожности, психоза, травмы головы, синдрома респираторного дистресса взрослых (ARDS), индуцированных морфином симптомов толерантности и отмены, воспалительного заболевания кишечника, остеоартрита, ревматоидного артрита, овуляции, дилятационной кардиомиопатии, острой травмы спинного мозга, болезни Хантингтона, глаукомы, дегенерации сетчатки, диабетической нейропатии, диабетической нефропатии и рака у млекопитающего, включающий введение указанному млекопитающему эффективного в отношении ингибирования NOS количества соединения по п.1.
Текст
1 Настоящее изобретение относится к некоторым 2-аминопиридинам, содержащим в качестве заместителей конденсированные кольца,которые проявляют активность в качестве ингибиторов синтазы окиси азота (NOS), к содержащим их фармацевтическим композициям и к их применению при лечении и предотвращении нарушений центральной нервной системы, воспалительных заболеваний, септического шока и других нарушений. Известны три изоформы NOS - индуцибельная форма (I-NOS) и две конститутивные формы, описываемые как нейрональная NOS(N-NOS) и эндотелиальная NOS (E-NOS). Каждый из этих трех ферментов участвует в превращении аргинина в цитрулин в ответ на различные стимулы, что приводит к продукции молекулы окиси азота (NO). Считается, что избыток продукции окиси азота (NO) играет определенную роль в патологии ряда нарушений и состояний млекопитающих. Например, NO,продуцируемая с помощью I-NOS, как предполагают, имеет значение при заболеваниях, которые сопровождаются системной гипотензией,таких как токсический шок, и при терапии определенными цитокинами. Показано, что больные раком, которых лечат такими цитокинами,как интерлейкин-1 (ИЛ-1), интерлейкин-2 (ИЛ 2) или фактор некроза опухолей (ФНО), страдают от шока, индуцированного цитокинами, и от гипотонии, обусловленных продукцией NO макрофагами, т.е. действием индуцибельнойNOS (I-NOS), см. ChemicalEngineering News,Dec.20, p.33, (1993). Ингибиторы I-NOS могут предотвращать этот процесс. Считается также,что I-NOS имеет значение при патологических состояниях центральной нервной системы, таких как ишемия. Например, показано, что ингибирование I-NOS улучшает исход ишемического повреждения мозга у крыс, см. Am.J.Physiol.,268, p.R286 (1995). В Eur.J.Pharmacol., 273, p.1524 (1995) описано подавление вызванного адъювантом артрита с помощью избирательного торможения I-NOS.NО, продуцируемая N-NOS, как предполагается, играет роль при таких заболеваниях, как ишемия мозга, боль и толерантность к опиатам. Например, торможение N-NOS снижает объем некроза после окклюзии проксимальной средней церебральной артерии у крысы, см.J.Cerebr.Blood Flow Metab., 14, p.924-929 (1994). Показано также, что торможение N-NOS эффективно в плане анти-ноцицепции, что оценивается по активности в отношении лизания задней лапы, вызываемого формалином, в поздней фазе и по тестам абдоминальной конструкции, вызываемой уксусной кислотой, см. Br.J.Pharmacol.,110, р.219-224 (1993). Кроме того, подкожное введение крысе адъюванта Фрейнда вызывает рост NOS-позитивных нейронов в спинном мозге, что проявляется в виде увеличенной чувствительности к боли, которую можно лечить ин 003839 2 гибиторами NOS, см. Japanese Journal of Pharmacology, 75, p.327-335 (1997). Наконец, синдром отмены опиоидов у грызунов, как описано,снижается при торможении NOS, см. Neuropsychopharmacol., 13, р.269-293 (1995). Изобретение относится к соединениям формулы где кольцо А является 5-7-членным насыщенным или ненасыщенным конденсированным кольцом, в котором от нуля до двух членов кольца представляют собой гетероатомы, независимо выбираемые из азота, кислорода и серы,при условии, что два соседних члена кольца оба не могут быть гетероатомами;X является кислородом или связью;n представляет собой целое число от двух до шести; иR1 и R2 независимо выбирают из (C1-С 6) алкила, арила, тетра-гидронафталина и аралкила, где указанный арил и арильная часть указанного аралкила представляет собой фенил или нафтил, а алкильная часть является линейной или разветвленной и содержит от 1 до 6 углеродных атомов и где указанный (C1-С 6)алкил,указанный арил, указанный тетрагидронафталин и арильная часть указанного аралкила могут необязательно быть замещенными заместителями от одного до трех, предпочтительно заместителями в количестве от нуля до двух, которые независимо выбирают из галогена (например,хлора, фтора, брома, иода), нитро, гидрокси,циано, амино, (C1-С 4)алкокси и (C1-С 4)алкиламино; или R1 и R2 образуют вместе с азотом, к которому они присоединены, пиперазиновое,азетидиновое, пиперидиновое или пирролидиновое кольцо или азабициклическое кольцо,содержащее в кольце от 6 до 14 членов, из которых от 1 до 3 являются азотом, а остальные представляют собой углерод, примерами указанных азабициклических колец являются следующиеR1 или R2 также могут быть присоединены к (CH2)n группе, образуя кольцо из от 4 до 7 членов; где R3 и R4 выбирают из водорода, (C1-С 6) алкила, фенила, нафтила, (C1-С 6) алкил-С(=O)-,НС(=O)-, (C1-С 6) алкокси-(С=O)-, фенил-С(=О)-,нафтил-С(=O)- и R6R7NC(=O)-, где R6 и R7 независимо выбирают из водорода и (C1-С 6) алкила;(C1-С 6) алкил-; и где указанные пиперазиновое, азетидиновое, пиперидиновое и пирролидиновое кольца могут быть необязательно замещены одним или более заместителями, предпочтительно заместителями в количестве от нуля до двух, которые независимо выбирают из (C1-С 6)алкила, амино,(C1-С 6) алкиламино, [ди-(C1-С 6)алкил] амино,фенила, замещенного 5-6-членного гетероциклического кольца, содержащего от 1 до 4 атомов азота в кольце, бензоила, бензоилметила, бензилкарбонила, фениламинокарбонила, фенилэтила и феноксикарбонила, и где фенильные части любых из упомянутых выше заместителей могут быть необязательно замещены одним или более заместителями, предпочтительно заместителями в количестве от нуля до двух, которые независимо выбирают из галогена, (C1-С 3) алкила, (C1-С 3) алкокси, нитро, амино, циано, CF3 и ОСF3; и к фармацевтически приемлемым солям таких соединений. Следующие соединения являются предпочтительными соединениями изобретения: 6-[4-(2-диметиламиноэтокси)нафталин-1 ил]пиридин-2-иламин; 6-[4-(2-пирролидин-1-илэтокси)нафталин 1-ил]пиридин-2-иламин; 6-(4-2-[(бензо[1,3]диоксол-5-илметил) амино]этоксинафталин-1-ил)пиридин-2 иламин; 6-4-[2-(6,7-диметокси-3,4-дигидро-1 Низохинолин-2-ил)этокси]нафталин-1-илпиридин-2-иламин; 3-2-[4-(6-аминопиридин-2-ил)-нафталин 1-илокси]-этил-3-азабицикло[3.1.0]гекс-6 иламин; 6-4-[2-(4-фенэтилпиперазин-1-ил)этокси] нафталин-1-илпиридин-2-иламин; 6-4-[2-(3-аминопирролидин-1-ил)этокси]нафталин-1-ил-пиридин-2-иламин; 6-[4-(1-бензилпиперидин-4-илокси)нафталин-1-ил]пиридин-2-иламин; 6-[4-(1-бензилпирролидин-3-илокси)нафталин-1-ил]пиридин-2-иламин; 6-[4-(пиперидин-4-илокси)нафталин-1-ил] пиридин-2-иламин; 6-[4-(пирролидин-3-илокси)нафталин-1 ил]пиридин-2-иламин; 6 6-4-[2-(2-диэтиламиноэтокси)этокси] 5,6,7,8-тетрагидронафталин-1-илпиридин-2 иламин; 6-[4-(пиперидин-3-илметокси)-5,6,7,8 тетрагидронафталин-1-ил]пиридин-2-иламин; 6-[4-(2-аминоциклогексилокси)-5,6,7,8 тетрагидронафталин-1-ил]пиридин-2-иламин; 6-[4-(пирролидин-2-илметокси)-5,6,7,8 тетрагидронафталин-1-ил]пиридин-2-иламин; и 6-[4-(2-диметиламиноэтокси)-6,7,8,9 тетрагидро-5 Н-бензоциклогептен-1-ил]пиридин-2-иламин; и фармацевтически приемлемые соли представленных выше соединений. Ниже представлены дополнительные примеры соединений этого изобретения: 6-[4-(2-аминоциклопентилокси)-5,6,7,8 тетрагидронафталин-1-ил]пиридин-2-иламин; 6-[4-(2-аминоциклобутилокси)-5,6,7,8 тетрагидронафталин-1-ил]пиридин-2-иламин; 6-[4-(2-аминоциклопропилокси)-5,6,7,8 тетрагидронафталин-1-ил]пиридин-2-иламин; 6-[4-(3-аминоциклогексилокси)-5,6,7,8 тетрагидронафталин-1-ил]пиридин-2-иламин; 6-[4-(3-аминоциклопентилокси)-5,6,7,8 тетрагидронафталин-1-ил]пиридин-2-иламин; 6-[4-(3-аминоциклобутилокси)-5,6,7,8 тетрагидронафталин-1-ил]пиридин-2-иламин; 6-[4-(4-аминоциклогексилокси)-5,6,7,8 тетрагидронафталин-1-ил]пиридин-2-иламин; 6-[4-(2-аминоциклопентилокси)нафталин 1-ил]пиридин-2-иламин; 6-[4-(2-аминоциклобутилокси)нафталин-1 ил]пиридин-2-иламин; 6-[4-(2-аминоциклопропилокси)нафталин 1-ил]пиридин-2-иламин; 6-[4-(3-аминоциклогексилокси)нафталин 1-ил]пиридин-2-иламин; 6-[4-(3-аминоциклопентилокси)нафталин 1-ил]пиридин-2-иламин; 6-[4-(3-аминоциклобутилокси)нафталин-1 ил]пиридин-2-иламин; 6-[4-(4-аминоциклогексилокси)нафталин 1-ил]пиридин-2-иламин; 6-[4-(2-аминоциклопентилокси)индан-4 ил]пиридин-2-иламин; 6-[4-(2-аминоциклобутилокси)индан-4-ил] пиридин-2-иламин; 6-[4-(2-аминоциклопропилокси)индан-4 ил]пиридин-2-иламин; 6-[4-(3-аминоциклогексилокси)индан-4 ил]пиридин-2-иламин; 6-[4-(3-аминоциклопентилокси)индан-4 ил]пиридин-2-иламин; 6-[4-(3-аминоциклобутилокси)индан-4-ил] пиридин-2-иламин; 6-[4-(4-аминоциклогексилокси)индан-4 ил]пиридин-2-иламин; 6-[4-(пиперидин-3-илметокси)-6,7,8,9-тетрагидро-5 Н-бензоциклогептен-1-ил]пиридин-2 иламин; 7 6-[4-(2-пирролидинил-этокси)-6,7,8,9-тетрагидро-5 Н-бензоциклогептен-1-ил]пиридин-2 иламин; 6-[4-(2-аминоциклогексилокси)-6,7,8,9 тетрагидро-5 Н-бензоциклогептен-1-ил]пиридин-2-иламин; 6-[4-(2-(4-диметиламинопиперидин-1-ил) этокси)-6,7,8,9-тетрагидро-5 Н-бензоциклогептен-1-ил]пиридин-2-иламин и 6-[4-(2-(4-метилпиперазин-1-ил)этокси)6,7,8,9-тетрагидро-5 Н-бензоциклогептен-1-ил] пиридин-2-иламин. Настоящее изобретение также относится к фармацевтически приемлемым кислым аддитивным солям соединений формулы I. Кислоты,которые используют для получения фармацевтически приемлемых кислых аддитивных солей указанных выше основных соединений данного изобретения, представляют собой кислоты, образующие нетоксичные кислые аддитивные соли, т.е. соли, содержащие фармацевтически приемлемые анионы, такие как гидрохлорид,гидробромид, гидроиодид, нитрат, сульфат, бисульфат, фосфат, кислый фосфат, ацетат, лактат,цитрат, кислый цитрат, тартрат, битартрат, сукцинат, малеат, фумарат, глюконат, сахарат, бензоат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат [т.е. 1,1-метилен-бис-(2-гидрокси-3-нафтоат)]. Используемый здесь термин "алкил", если это специально не указано, включает насыщенные одновалентные углеводородные радикалы,которые являются линейными, разветвленными или циклическими, или их сочетаниями. Используемый здесь термин "один или более заместителей" относится к количеству заместителей, равному от одного до максимального количества возможных заместителей, в зависимости от количества доступных мест для присоединения. Используемый здесь термин, "галоген", если это специально не указано, включает хлор,фтор, бром и иод. Примеры наиболее специфических соединений настоящего изобретения включают:(a) соединения формулы I, в которой кольцо А представляет собой пиррольное кольцо;(b) соединения формулы I, в которой кольцо А представляет собой пиридиновое кольцо;(d) соединения формулы I, в которой кольцо А представляет собой пиримидиновое кольцо;R независимо выбирают из (C1-С 6)алкила;R не образуют кольцо с азотом, к которому они присоединены;(k) соединения формулы I, в которой кольцо А представляет собой тиенильное или тиазольное кольца. Настоящее изобретение также относится к фармацевтической композиции для лечения или предотвращения состояния, выбираемого из группы, состоящей из мигрени, воспалительных заболеваний (например, астмы), удара, острой и хронической боли, гиповолемического шока,травматического шока, реперфузионной травмы, болезни Крона, язвенного колита, септического шока, множественного склероза, слабоумия, связанного со СПИДом, нейродегенеративных заболеваний, нейрональной токсичности, депрессии (например, основного депрессивного расстройства и дистимии), болезни Паркинсона, болезни Альцгеймера, состояния химической зависимости и привыкания (например, зависимостей от наркотиков, алкоголя и никотина), рвоты, эпилепсии, состояния тревожности, психоза, травмы головы, синдрома респираторного дистресса взрослых (ARDS),индуцированных морфином симптомов толерантности и отмены, воспалительного заболевания кишечника, остеоартрита, ревматоидного артрита, овуляции, дилятационной кардиомиопатии, острой травмы спинного мозга, болезни Хантингтона, глаукомы, дегенерации сетчатки,диабетической нейропатии, диабетической нефропатии и рака у млекопитающего, включая человека, включающей количество соединения формулы I или его фармацевтически приемлемой соли, которое эффективно в отношении лечения или предотвращения такого состояния,и фармацевтически приемлемый носитель. Настоящее изобретение относится также к способу лечения или предотвращения состояния, выбираемого из группы, состоящей из мигрени, воспалительных заболеваний (например,астмы), удара, острой и хронической боли, гиповолемического шока, травматического шока,реперфузионной травмы, болезни Крона, язвенного колита, септического шока, множественного склероза, слабоумия, связанного со СПИДом,нейродегенеративных заболеваний, нейрональной токсичности, депрессии (например, основного депрессивного расстройства и дистимии),болезни Паркинсона, болезни Альцгеймера, состояния химической зависимости и привыкания 9 ма респираторного дистресса взрослых (ARDS),индуцированных морфином симптомов толерантности и отмены, воспалительного заболевания кишечника, остеоартрита, ревматоидного артрита, овуляции, дилятационной кардиомиопатии, острой травмы спинного мозга, болезни Хантингтона, глаукомы, дегенерации сетчатки,диабетической нейропатии, диабетической нефропатии и рака у млекопитающего, включая человека, включающему введение указанному млекопитающему количества соединения формулы I или его фармацевтически приемлемой соли, которое эффективно в отношении лечения или предотвращения такого состояния. Настоящее изобретение также относится к фармацевтической композиции для ингибирования синтазы окиси азота (NOS) у млекопитающего, включая человека, включающей эффективное в отношении ингибирования NOS количество соединения формулы I или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель. Настоящее изобретение также относится к способу ингибирования NOS у млекопитающего, включая человека, включающему введение указанному млекопитающему эффективного в отношении ингибирования NOS количества соединения формулы I или его фармацевтически приемлемой соли. Настоящее изобретение также относится к фармацевтической композиции для лечения или предотвращения состояния, выбираемого из группы, состоящей из мигрени, воспалительных заболеваний (например астмы), удара, острой и хронической боли, гиповолемического шока,травматического шока, реперфузионной травмы, болезни Крона, язвенного колита, септического шока, множественного склероза, слабоумия, связанного со СПИДом, нейродегенеративных заболеваний, нейрональной токсичности, депрессии (например, основного депрессивного расстройства и дистимии), болезни Паркинсона, болезни Альцгеймера, состояния химической зависимости и привыкания (например, зависимостей от наркотиков, алкоголя и никотина), рвоты, эпилепсии, состояния тревожности, психоза, травмы головы, синдрома респираторного дистресса взрослых (ARDS),индуцированных морфином симптомов толерантности и отмены, воспалительного заболевания кишечника, остеоартрита, ревматоидного артрита, овуляции, дилятационной кардиомиопатии, острой травмы спинного мозга, болезни Хантингтона, глаукомы, дегенерации сетчатки,диабетической нейропатии, диабетической нефропатии и рака у млекопитающего, включая человека, включающей эффективное в отношении ингибирования NOS количество соединения формулы I или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель. 10 Настоящее изобретение относится также к способу лечения или предотвращения состояния, выбираемого из группы, состоящей из мигрени, воспалительных заболеваний (например,астмы), удара, острой и хронической боли, гиповолемического шока, травматического шока,реперфузионной травмы, болезни Крона, язвенного колита, септического шока, множественного склероза, слабоумия, связанного со СПИДом,нейродегенеративных заболеваний, нейрональной токсичности, депрессии (например, основного депрессивного расстройства, и дистимии),болезни Паркинсона, болезни Альцгеймера, состояния химической зависимости и привыкания(например, зависимостей от наркотиков, алкоголя или никотина), рвоты, эпилепсии, состояния тревожности, психоза, травмы головы, синдрома респираторного дистресса взрослых(ARDS), индуцированных морфином симптомов толерантности и отмены, воспалительного заболевания кишечника, остеоартрита, ревматоидного артрита, овуляции, дилятационной кардиомиопатии, острой травмы спинного мозга,болезни Хантингтона, глаукомы, дегенерации сетчатки, диабетической нейропатии, диабетической нефропатии и рака у млекопитающего,включая человека, включающему введение указанному млекопитающему эффективного в отношении ингибирования NOS количества соединения формулы II или его фармацевтически приемлемой соли. Соединения формулы I могут содержать хиральные центры и таким образом могут существовать в различных энантиомерных и диастереомерных формах. Настоящее изобретение относится ко всем оптическим изомерам и всем стереоизомерам соединений формулы I и к их смесям и ко всем фармацевтическим композициям и способам лечения, указанным выше,которые соответственно их содержат или используют. Указанная выше формула I включает соединения, идентичные описанным выше, но в которых один или более атомов водорода, углерода или других атомов замещены их изотопами. Такие соединения могут применяться для научно-исследовательских и диагностических целей при изучении фармакокинетики метаболизма и тестировании связывания. Соединения формулы I могут быть получены, как описано в следующих схемах реакций и обсуждении. Если это не указано специально,кольцо А, X, n, R1, R2, R3, R4, R5, R6 и R7 и структурная формула I в нижеследующих схемах реакций определены как описано выше. Схема 1 иллюстрирует способ получения соединений формулы I, в которой X представляет собой связь, а кольцо А представляет собой бензольное кольцо. Схемы 2 и 3 иллюстрируют способы получения соединений формулы I, в которой X представляет собой кислород, а кольцо А представляет собой бензольное кольцо. Исходными материалами, используемыми в процедурах схем 1 и 2, служат либо имеющиеся в продаже, известные из уровня техники соединения, либо легко получаемые из известных соединений с помощью способов, которые должны быть понятны специалистам. Что касается схемы 1, то соединение формулы II охлаждают до температуры приблизительно -70 С в безводном тетрагидрофуране(ТГФ) и затем к нему добавляют раствор Nбутиллития. Полученный раствор затем обрабатывают триэтилборатом и дают нагреться до комнатной температуры для образования соединения формулы III. Соединение формулы III вступает в реакцию с соединением формулы IV с образованием соединения формулы V. Эту реакцию обычно проводят в водном этанольном растворителе в присутствии карбоната натрия и тетракистрифенилфосфина палладия при температуре, приблизительно равной температуре кипения с обратным холодильником. Соединение формулы VI может быть образовано следующим путем. Во-первых, соединение формулы V вводят в реакцию с N-бромсукцинимидом (NBC) и бис-(1-циано-1-аза) циклогексаном в четыреххлористом углероде и кипятят с обратным холодильником в течение приблизительно 8 ч с дополнительным добавлением порций инициатора приблизительно через 13 1, 2 и 4 ч. После упаривания растворителя продукт этой реакции вводят в реакцию с цианидом триэтиламмония в метиленхлориде при приблизительно комнатной температуре для образования соединения формулы VI. Насыщение раствора соединения формулыVI в этаноле хлористым водородом с последующим кипячением смеси с обратным холодильником и затем нагреванием в водной соляной кислоте дает соединение формулы VII. Соединение формулы VII, полученное на предшествующей стадии, может быть превращено в соединение формулы IA следующим путем. Во-первых, соединение формулы VII вводят в реакцию с подходящим соединением формулы R2R1NH и N-этил-N-диметиламинопропилкарбодиимидом (EDAC) в присутствии основания. Примерами подходящих оснований являются такие, которые выбирают из триалкиламинов, карбонатов щелочных металлов и карбонатов щелочно-земельных металлов. Эту реакцию обычно проводят в растворителе, таком как ацетонитрил, метиленхлорид или N,Nдиметилформамид (ДМФ), при температуре от приблизительно комнатной до приблизительно 100 С, предпочтительно при приблизительно комнатной температуре. Предпочтительно реакцию проводят в присутствии каталитической добавки, такой как N-гидроксисукцинамид или гидроксибензотриазол. Продукт предшествующей реакции восстанавливают затем с помощью способов, хорошо известных специалистам. Например, восстановление можно провести с помощью алюмогидрида лития в тетрагидрофуране в присутствии или в отсутствие хлористого алюминия,или с помощью метилсульфида борана в тетрагидрофуране при температуре от приблизительно -78 С до приблизительно 0 С, предпочтительно при приблизительно -70 С, для получения желаемого соединения формулы IA. Что касается схемы 2, соединение формулы VIII вводят в реакцию с трибромидом тетрабутиламмония в 1,2-дихлорэтане при приблизительно комнатной температуре. Продукт этой реакции затем обрабатывают бромистым бензилом и карбонатом калия в растворителе, таком как ацетонитрил при приблизительно температуре кипения реакционной смеси с обратным холодильником для образования соединения формулы IX. Соединение формулы IX превращают затем в 1-бензилокси-нафталин-4-борную кислоту с помощью процедуры, описанной выше для получения борнокислого производного формулы III в схеме 1. Реакция 1-бензилоксинафталин-4-борной кислоты с соединением формулы X в этанольном растворителе в присутствии карбоната натрия и тетракистрифенила палладия при приблизительно температуре кипения реакционной 14 смеси с обратным холодильником дает соединение формулы XI. Соединение формулы XI может быть превращено в соединение формулы XIII с помощью следующего двухстадийного процесса. Соединение формулы XI вводят в реакцию с муравьинокислым аммонием и десятью процентами палладия на угле в этанольном растворителе при приблизительно температуре кипения реакционной смеси с обратным холодильником для получения соединения, аналогичного соединению, имеющему формулу XI, в котором бензилоксигруппа формулы XI замещена гидроксильной группой. Соединение формулы XII получают затем с помощью взаимодействия указанного выше гидроксильного производного с 2-бромэтилацетатом и карбонатом калия в ацетонитриле при приблизительно температуре кипения реакционной смеси с обратным холодильником. Щелочной гидролиз соединения формулы(EDAC) и подходящим соединением, имеющим формулу R1R2NH, дает желаемое соединение формулы XIII. Щелочной гидролиз обычно проводят с помощью гидроокиси щелочного металла или щелочно-земельного металла в смеси ТГФ, метанола и воды при приблизительно комнатной температуре. Реакцию с R1R2NH иEDAC обычно проводят с помощью процедуры,описанной выше, для получения соединений формулы IA из соединений формулы VII на схеме 1. Соединение формулы XIII может быть превращено в желаемое соединение формулы IB следующим образом. Соединение формулы XIII восстанавливают с образованием соответствующего соединения, в котором карбонильная группа замещена метиленовой группой, после чего 2,5-диметилпирролильную защитную группу удаляют. Восстановление можно проводить с использованием способов, хорошо известных специалистам, например, с помощью алюмогидрида лития в тетрагидрофуране в присутствии или в отсутствие хлористого алюминия, или с помощью метилсульфида борана в тетрагидрофуране при температуре от приблизительно -78 С до приблизительно 0 С, предпочтительно при приблизительно -70 С. Удаление 2,5-диметилпирролильной защитной группы может быть выполнено с помощью реакции с гидрохлоридом гидроксиламина. Эту реакцию обычно проводят в спиртовом или водном спиртовом растворителе при температуре от приблизительно комнатной температуры до температуры, приблизительно равной температуре кипения с обратным холодильником,предпочтительно при температуре кипения с обратным холодильником, в течение приблизительно от 8 до приблизительно 72 ч. 15 Соединения формулы I идентичны таковым формулы IB, за исключением того, что кольцо А отлично от бензольного; могут быть получены аналогичным образом, начиная с соответствующего соединения, которое аналогично таковому формулы VIII, в котором незамещенное бензольное кольцо формулы VIII замещено кольцом, отличным от бензольного, в пределах определения кольца А. Что касается схемы 3, известный 1 фторнафталин (XIV) бромируют бромом в уксусной кислоте при температуре от приблизительно комнатной температуры до температуры,приблизительно равной температуре кипения с обратным холодильником, в течение от приблизительно 1 ч до приблизительно 48 ч и бромид охлаждают до приблизительно -70 С в безводном тетрагидрофуране (ТГФ) и затем к нему добавляют раствор н-бутиллития. Полученный раствор затем обрабатывают триэтилборатом и дают ему нагреться до комнатной температуры с образованием соединения формулы XV. Соединение формулы XV вводят в реакцию с соединением формулы IV с образованием соединения формулы XVI. Эту реакцию обычно проводят в водном этанольном растворителе в присутствии карбоната натрия и тетракистрифенилфосфина палладия при приблизительно температуре кипения с обратным холодильником. Соединение формулы XVI затем вводят в реакцию с алкоксидом щелочного металла, полученным из соединения формулы НО(СН 2)nNR1R2 и гидрида натрия в полярном растворителе, таком как диметилформамид, при температуре от комнатной до 140 С в течение приблизительно от 1 до приблизительно 48 ч. Эта реакция дает соответствующее соединение формулы XVII, которое затем подвергают деблокированию для удаления 2,5-диметилпирролильной защитной группы с помощью реакции с солянокислым гидроксиламином. Эту реакцию обычно проводят в спиртовом или водном спиртовом растворителе при температуре от приблизительно комнатной температуры до температуры, приблизительно равной температуре кипения с обратным холодильником,предпочтительно при температуре кипения с обратным холодильником, в течение от приблизительно 8 до приблизительно 72 ч. Соединения формулы I, идентичные таковым формулы IA и IB, за исключением того, что кольцо А отлично от бензольного, могут быть получены аналогичным способом, начиная с соответствующих исходных материалов, которые аналогичны таковым формул VIII и XIV схем 1, 2 и 3, соответственно, в которых незамещенное бензольное кольцо таких исходных материалов замещено кольцом, отличным от бензольного, в пределах определения кольца А. Получение других соединений формулы I,не описанных в предшествующем экспериментальном разделе, может быть произведено с по 003839 16 мощью комбинации описанных выше реакций,которые должны быть очевидны специалистам. В каждой из реакций, обсужденных или иллюстрированных выше, давление не является решающим, если это специально не оговорено. Обычно приемлемо давление от приблизительно 0,5 атм до приблизительно 5 атм и, по соображениям удобства, предпочтительно давление окружающей среды, то есть приблизительно 1 атм. Соединения формулы I ("активные соединения данного изобретения"), которые являются основными по своей природе, способны образовывать широкий спектр различных солей с различными неорганическими и органическими кислотами. Хотя такие соли должны быть фармацевтически приемлемыми для введения животным, часто на практике желательно сначала выделить соединение формулы I из реакционной смеси в виде фармацевтически не приемлемой соли и затем просто превратить последнюю назад в соединение в виде свободного основания путем обработки щелочным реагентом с последующим превращением последнего свободного основания в фармацевтически приемлемую кислую аддитивную соль. Кислые аддитивные соли активных основных соединений данного изобретения легко получить обработкой основного соединения, по существу, эквивалентным количеством избранной неорганической или органической кислоты в среде водного растворителя или подходящего органического растворителя, такого как метанол или этанол. После тщательного упаривания растворителя легко получают желаемую твердую соль. Активные соединения данного изобретения и их фармацевтически приемлемые соли пригодны в качество ингибиторов NOS, т.е. они обладают способностью тормозить ферментNOS у млекопитающих и, таким образом, они способны действовать в качестве терапевтических агентов при лечении упомянутых выше нарушений и заболеваний у страдающего ими млекопитающего. Активные соединения данного изобретения и их фармацевтически приемлемые соли могут вводиться либо пероральным, либо парентеральным, либо местным способами. В целом, эти соединения наиболее желательно вводить в дозах в диапазоне от приблизительно 0,01 до приблизительно 250 мг в день в виде одной дозы или дозы, разделенной на части (т.е. от 1 до 4 доз в день), хотя необходимы вариации в зависимости от вида, веса и состояния субъекта, подвергаемого лечению, и, в особенности, от выбранного способа введения. Однако величина дозы, находящаяся в диапазоне от приблизительно 0,07 мг до приблизительно 21 мг на кг веса тела в день, наиболее желательна для применения. Тем не менее, вариации могут иметь место в зависимости от вида животного, подвергаемого лечению, и индивидуальной реакции 17 на указанное лекарство, а также от типа выбранного фармацевтического состава и периода времени и интервала, с которыми проводят такое введение. В некоторых случаях могут быть более чем адекватны величины доз ниже нижнего предела, указанного выше диапазона, в то время как в других случаях могут быть использованы еще более высокие дозы без появления вредного побочного эффекта, если предлагается,что такие более высокие дозы сначала делят на несколько малых доз для введения на протяжении дня. Активные соединения изобретения могут вводиться самостоятельно или в сочетании с фармацевтически приемлемыми носителями или разбавителями с помощью любого из трех указанных ранее способов введения и такое введение можно проводить в виде одной или множественных доз. Более конкретно, новые терапевтические агенты данного изобретения можно вводить в широком диапазоне различных лекарственных форм, т.е. их можно объединять с различными фармацевтически приемлемыми инертными носителями в форме таблеток, капсул, подушечек, пастилок, плотных леденцов,порошков, спреев, кремов, бальзамов, суппозиториев, желе, гелей, паст, лосьонов, мазей, водных суспензий, растворов для инъекций, эликсиров, сиропов и тому подобное. Такие носители включают твердые разбавители или наполнители, стерильную водную среду и различные нетоксичные органические растворители и т.д. Более того, пероральные фармацевтические композиции могут быть подходящим образом подслащены и/или ароматизированы. В целом,терапевтически эффективные соединения данного изобретения присутствуют в таких лекарственных формах в концентрациях в диапазоне от приблизительно 5,0% до приблизительно 70% по весу. Для перорального введения могут применяться таблетки, содержащие различные наполнители, такие как микрокристаллическая целлюлоза, цитрат натрия, карбонат кальция, вторичный кислый фосфат кальция и глицин совместно с различными разрыхляющими агентами, такими как крахмал (и предпочтительно кукурузный, картофельный крахмал или крахмал тапиоки), альгиновая кислота и некоторые сложные силикаты совместно со связующими агентами грануляции, подобными поливинилпирролидону, сахарозе, желатину и камеди. Кроме того, для целей таблетирования часто очень полезны смазывающие агенты, такие как стеарат магния, лаурилсульфат натрия и тальк. Твердые композиции сходного типа могут также применяться в качестве наполнителей в желатиновых капсулах; предпочтительные материалы в этой связи также включают лактозу или молочный сахар, а также высокомолекулярные полиэтиленгликоли. Когда для перорального введения желательны водные суспензии и/или 18 эликсиры, активный ингредиент может быть объединен с различными подслащивающими или ароматизирующими агентами, окрашивающим материалом или красителями и, а также если это желательно, с эмульгирующими и/или суспендирующим агентами, совместно с такими разбавителями, как вода, этанол, пропипенгликоль, глицерин и различные подобные этому, их сочетания. Для парентерального введения могут быть использованы растворы активного соединения настоящего изобретения в кунжутном или арахисовом масле или в водном пропиленгликоле. Водные растворы следует подходящим образом забуферивать (предпочтительно, чтобы рН был выше 8), если это необходимо, и жидкий разбавитель следует сначала сделать изотоническим. Эти водные растворы пригодны для целей внутривенного введения. Масляные растворы пригодны для целей внутрисуставного, внутримышечного и подкожного введения. Получение этих растворов в стерильных условиях может быть легко произведено с помощью стандартных фармацевтических методов, хорошо известных специалистам. Кроме того, также возможно местное введение активных соединений настоящего изобретения при лечении воспалительных состояний кожи и это может быть выполнено с помощью кремов, желе, гелей, паст, пластырей, мазей и тому подобное в соответствии со стандартной фармацевтической практикой. Способность соединений формулы I ингибировать NOS может быть определена с помощью процедур, описанных в литературе. Способность соединений формулы I ингибировать эндотелиальную NOS может быть определена с помощью процедур, описанных Schmidt et al., inProc.Natl.Acad.Sci.U.S.A., 88, pp.365-369 (1991) и Pollak et al., in Proc.Natl.Acad.Sci.U.S.A., 88,pp.10480-10484 (1991). Способность соединений формулы I ингибировать индуцибельную NOS может быть определена с помощью процедур,описанных Schmidt et al., in Proc.Natl.Acad.SciJ.Biol.Chem., 269, pp.26669-26676 (1994). Способность соединений формулы I ингибировать нейрональную NOS может быть определена с помощью процедуры, описанной Bredt and Snyder in Proc.Natl.Acad.Sci U.S.A., 87, 682-685(1990). Из шестнадцати исследованных соединений формулы I все проявляли IC5010 мкМ в отношении ингибирования либо индуцибельной, либо нейрональной NOS. Настоящее изобретение иллюстрируется следующими примерами. Следует, однако, понимать, что изобретение не ограничивается конкретными деталями этих примеров. Точки плавления являются нескорректированными. Спектры протонного ядерного магнитного резонанса (1 Н-ЯМР) и 13 С спектры ядерного магнит 19 ного резонанса были измерены для растворов в дейтериохлороформе (СDСl3) или в СD3 ОD, или СD3SОСD3 и положения пиков выражены в частях на миллион (м.д.) по отношению к тетракцэтилсилану (ТМС). Форму пиков обозначали следующим образом: с - синглет; д - дуплет; т триплет; кв - квартет; м - мультиплет; уш - уширенный. Пример 1. 6-4-[2-(4-Фенетилпиперазин-1 ил)этил]нафален-1-илпиридин-2-иламин. А. N-трет-Бутилкарбонил-6-бромпиридил 2-амин. В 125 мл круглодонный сосуд с вводом N2,добавляли 0,865 г (5 ммоль) 6-бром-2 аминопиридина, 0,677 мл (5,5 ммоль) триметилацетилхлорида, 15 мл безводного ацтонитрила и 1,045 мл (7,5 ммоль) триэтиламина. Реакционную смесь перемешивали при комнатной температуре в течение 14 ч, вливали в воду и перемешивали до тех пор, пока не образовывался твердый осадок. Твердое вещество фильтровали, промывали водой и сушили, получая 1,04 г (81%), т.пл.87-90 С. 1B. 4-Метилнафталин-1-борная кислота. В 125 мл круглодонный сосуд с вводом N2 добавляли 1,78 г (11,4 ммоль) 1-бром-4 метилнафталин и 20 мл безводного тетрагидрофурана. Раствор охлаждали до -70 С и добавляли 5,49 мл (13,7 ммоль) 2,5 М раствора н-бутиллития в гексане в течение 5 мин и реакционную смесь перемешивали при -70 С в течение 10 мин. Раствор затем обрабатывали 2,34 мл(13,7 ммоль) триэтил-бората, перемешивали 5 мин при -70 С, затем нагревали до комнатной температуры и перемешивали 40 ч. Реакцию гасили жидким раствором хлористого аммония,вливали в 0,5 н. соляную кислоту и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и выпаривали до белого твердого вещества после растирания с гексаном,1,9 г (90%), т.пл. 224-228 С. 1 20 нола и 2 мл воды, и реакционную смесь нагревали при 80 С в течение 13 ч, при ТСХ выявлено основное пятно с отн.подвижностью=0,2 в 15% этилацетате в гексане и при ЖХ-МС (жидкостной хроматографии - масс-спектрометрии) выявлен основной пик при Р+1=319. Реакционную смесь охлаждали, вливали в воду и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, сушили над сульфатом натрия и выпаривали. Остаток хроматографировали на силикагеле, применяя в качестве элюента гексан/этилацетат для получения 1,25 г (100%) пены. 1N-трет-Бутилкарбонил-6-(4-цианометилнафталин-1-ил)пиридин-2-иламин. В 100 мл круглодонный сосуд, снабженный конденсатором и вводом N2, и добавляли 1,21 г (3,795 ммоль) N-трет-бутилкарбонил-6-(4 метилнафталин-1-ил)пиридин-2-иламина,810 мг (4,554 ммоль) N-бром-сукцинимида, 35 мл четыреххлористого углерода и 10 мг бис-(1 циано-1-азо)циклогексана. Реакционную смесь нагревали с обратным холодильником суммарно в течение 8 ч при добавлении дополнительных порций инициатора через 1, 2 и 4 ч. Реакционную смесь охлаждали, фильтровали с четыреххлористым углеродом и выпаривали. Красное масло 2,5 г использовали сразу. 1 Н-ЯМР (, CDCl3) : 1,33 (с, 9 Н), 5,00 (с,2H) , 7,26 (д, J= 7,5, 1 Н), 7,49(м, 2 Н), 7,63 (м,2 Н), 7,84 (т, J=8, 1H), 8,02 (д, J=8, 1 Н), 8,115(уш.с., 1 Н) , 8,22 (д, J=8, 1H), 8,36 (д, J=7,5, 1 Н). 13 С-ЯМР (, CDCl3): 27,6, 31,6, 39,9, 112,6,121,0, 124,1, 126,6, 126,7, 127,3, 131,5, 131,7,134,1, 138,8, 139,5, 151,4, 157,1, 177,35. МС (%): 397/399 (исходное+1, 100). Указанное выше масло вносили в 35 мл безводного метиленхлорида и обрабатывали 593 мг (3,795 ммоль) цианида тетраэтиламмония и реакционную смесь перемешивали при комнатной температуре в течение 13 ч, при ЖХ-МС основной пик выявлен при Р+1 = 344 и при ТСХ обнаружено основное пятно с отн. подвижностью=0,6 в 10% этилацетате в метиленхлориде. Реакционную смесь выпаривали и остаток хроматографировали на силикагеле, применяя в качестве элюента этилацетат в метиленхлориде,для получения 1,00 г (77%) пены. 1 С-ЯМР (, CDCl3): 22,0, 27,5, 39,9, 112,6,121,0, 122,75, 126,0, 126,7, 126,9, 127,2, 131,2,131,4, 138,9, 139,1, 151,4, 156,9, 177,35. МС (%): 344 (исходное+1, 100). Е. 6-(4-Карбоксиметилнафталин-1-ил)пиридин-2-иламин. В 100 мл круглодонный сосуд, имеющий конденсатор и ввод N2, добавляли 1,00 г (2,915 ммоль) N-трет-бутилкарбонил-6-(4-цианометилнафталин-1-ил)пиридин-2-иламин и 35 мл этанола. Раствор насыщали HCl и кипятили с обратным холодильником в течение 14 ч, добавляя две капли воды, как только он достигал температуры кипения. Реакционную смесь (ЖХ-МС показала Р+1=391) охлаждали и упаривали, остаток переносили в этилацетат, промывали водным раствором бикарбоната натрия, водой и насыщенным солевым раствором, сушили над сульфатом натрия и выпаривали до масла, 1,09 г(с, 9 Н), 4,09 (с, 2 Н), 4,13 (кв, J=7, 2 Н), 7,25 (д,J=7,5, 1 Н), 7,4-7,6 (м, 4 Н), 7,82 (т, J=7,5, 1H),7,99 (д, J=8, 1H) , 8,06 (д, J-8, 1H), 8,13 (уш.с.,1 Н), 8,31 (д, J=8, 1H). 13 С-ЯМР (, CDCl3): 14,2, 27,5, 39,5, 60,4,61,0, 112,3, 121,1, 124,2, 126,3, 126,4, 126,8,127,5, 131,4, 131,7, 132,5, 137,8, 138,7, 151,3,157,5, 171,4, 177,3. МС (%): 391 (исходное+1, 100). Указанное выше масло переносили в 25 мл 6 н. соляной кислоты и нагревали при 95-100 С в течение 12 ч. ЖХ-МС показала Р+1=279. Реакционную смесь охлаждали, промывали эфиром и упаривали, окончательно сушили под вакуумом до белого твердого продукта, 0,85 г (93% суммарно), в форме солянокислой соли. МС (%) : 279 (исходное+1, 100).F. 6-(4-(4-(2-Фенилэтил)пиперазинилкарбонил)метилнафталин-1-ил)пиридин-2-иламин. В 100 мл круглодонный сосуд, снабженный конденсатором и вводом N2, добавляли 157 мг (0,50 ммоль) 6-(4-карбоксиметилнафталин-1 ил)пиридин-2-иламина, 95 мг (0,50 ммоль) Nфенэтилпиперазина, 96 мг (0,50 ммоль) N-этилN-3-диметиламинопропилкарбодиимида, 0,230 мл (1,65 ммоль) триэтиламина, 10 мг Nгидроксибензотриазола и 7 мл безводного ацетонитрила. Реакционную смесь перемешивали при комнатной температуре 12 ч (ЖХ-МС показала Р+1 = 451 и при ТСХ выявлена отн.подвижность=0,3 в 10% метаноле/метиленхлориде),затем упаривали и остаток хроматографировали на силикагеле, применяя в качестве элюента метанол/метиленхлорид для получения продукта в виде пены, 230 мг (100%). 1G. 6-4-[2-(4-Фенэтилпиперазин-1-ил)этил] нафталин-1-илпиридин-2-иламин. В 100 мл круглодонный сосуд, снабженный конденсатором и вводом N2, добавляли 200 мг хлористого алюминия и 5 мл безводного тетрагидрофурана. Раствор охлаждали до 0 С, и добавляли 3,50 мл (3,50 ммоль) 1,0 М раствора алюмогидрида лития в тетрагидрофуране. Перемешивание продолжали при комнатной температуре в течение 20 мин, после чего раствор охлаждали до -70 С и добавляли раствор 225 мг(0,50 ммоль) 6-(4-(4-2-(фенилэтил)пиперазинилкарбонил)метилнафталин-1-ил)пиридин-2 иламина в 7 мл безводного тетрагидрофурана. Перемешивание продолжали 1 ч при -70 С и затем 2 ч при комнатной температуре (ЖХ-МС показала Р+1=437), после чего реакцию тщательно гасили 5 мл 1 н. соляной кислоты. После перемешивания в течение 20 мин реакционную смесь обрабатывали 6 мл 6 н. водного раствора гидроокиси натрия и экстрагировали несколькими порциями метиленхлорида. Органическую фазу сушили над сульфатом натрия и упаривали для получения масла, которое превращали в солянокислую соль с помощью HCl в эфире для получения 175 мг (64%) продукта в виде белого твердого вещества с т.пл. 80-105 С. 1 Н-ЯМР (, CDCl3): 2,65 (м, 6 Н), 2,76 (м,4 Н), 2,84 (м, 4 Н), 3,33 (м, 2 Н), 4,68 (уш.с., 2 Н,NН 2 ), 6,44 (д, J=8, 1H), 6,85 (д, J=7, 1 Н), 7,1-7,6(м, 10 Н), 8,11 (м, 2 Н). 13 С-ЯМР (, CDCl3): 30,9, 33,7, 53,3, 59,7,60,6, 106,9, 115,2, 123,9, 125,77, 125,83, 126,1,126,7, 126,9, 128,4, 128,7, 131,4, 132,3, 136,9,137,8, 138,0, 140,4, 157,9, 158,2. МС (%): 437 (исходное+1, 100). Анал. для C29H32N4Cl3/2H2O1/2 (С 4 Н 10 О). Вычислено: С 69,32; Н 7,69; N 10,43; Найдено: С 69,46; Н 7,35; N 10,36. Пример 2. 3-2-[4-(6-Аминопиридин-2-ил)нафталин-1-ил]этил-3-азабицикло[3,1,0]гекс-6 иламин. Получали, как в примере 1, с дополнительной стадией снятия защиты с использованием метиленхлорида для удаления трет-бутоксикарбонильной защитной группы с выходом 71%, т.пл.250-260 С, в форме солянокислой соли. 1 25 Пример 9. 6-4-[2-(3-Хлорбензиламино) этил]нафталин-1-илпиридин-2-иламин. Получали, как в примере 1, с использованием в качестве предшественника 3,4-дихлорбензиламина. В этом случае восстановление алюмогидридом лития/солянокислым алюминием приводило к удалению одного из атомов хлора, что давало 3-хлорбензильное соединение. Конечный продукт получали с 73% выходом,т.пл.60-75 С, в форме солянокислой соли. 1 Н-ЯМР (, CDCl3): 2,99 (т, J=7, 2H), 3,30(д, J=7, 2H), 3,79 (с, 2 Н), 4,68 (уш.с., 2 Н, NН 2),6,13 (уш.с., 1 Н), 6,26 (уш. с., 1 Н), 6,45 (д, J=8,1 Н), 6,83 (д, J=7,5, 1 Н), 7,3-7,6 (м, 6 Н), 8,08 (м,2 Н). 13 С-ЯМР (, CDCl3) : 33,4; 46,1; 49,5; 106,9; 107,0; 110,0; 115,05; 123,8; 125,7; 126,0; 126,4; 126,7, 131,6; 132,1; 136,2; 137,7; 138,0; 141,75; 153,5; 157,6; 158,1. МС (%): 344 (исходное+1, 100). Анал. для C22H21N3OHCl3/2H2O: Вычислено: С 64,23; Н 6,25; N 10,21; Найдено: С 64,42; Н 6,04; N 9,86. Пример 11. 6-4-[2-(3,4-Дихлорбензиламино)этил]нафталин-1-илпиридин-2-иламин. Получали, как в примере 1, с использованием на конечной стадии метилсульфидборана вместо восстановления алюмогидридом лития/солянокислым алюминием. Конечный продукт получен с выходом 68,5%, т.пл. 145-170 С,в форме солянокислой соли. 1 Н-ЯМР (, CDCl3): 2,98 (т, J=7, 2H), 3,295 26 Пример 12. 6-[4-(2-Диметиламиноэтокси) нафталин-1-ил]пиридин-2-иламин. Ссылка на схему 2. А. 4-Бром-1-бензилокси-нафталин. В 250 мл круглодонный сосуд, имеющий дополнительную горловину для ввода N2, добавляли 2,88 г (20 ммоль) 1-нафтола и 50 мл 1,2 дихлорэтана и при перемешивании по каплям в течение 10 мин раствор 9,64 г (20 ммоль) трехбромистого тетрабутиламмония в 30 мл 1,2 дихлорэтана. После дополнительного перемешивания в течение 10 мин при комнатной температуре раствор промывали водным раствором бисульфита натрия и водой, сушили над сульфатом натрия и упаривали. Смесь продукта и солей трибутиламмония использовали непосредственно. 1 Н-ЯМР (, CDCl3): 7,22 (д, J=8, 1 Н), 7,43(м, 2 Н), 7,50 (дт, J=1,8, 1 Н), 8,05 (д, J=8, 1H),8,18 (д, J=8, 1H). 13 С-ЯМР (, CDCl3): 109,8; 111,4; 122,7; 125,3; 126,25; 126,7; 137,4; 129,9; 132,5; 153,0. Указанное выше масло растворяли в 100 мл ацетонитрила и обрабатывали 3,57 мл (30 ммоль) бензилбромида и 5,53 г (40 ммоль) карбоната калия при кипячении с обратным холодильником 14 ч. При ТСХ выявлено основное пятно с отн.подвижностью = 0,2 в системе 5% метиленхлорид/гексан. Реакционную смесь охлаждали, выливали в смесь разбавленного водного раствора соляной кислоты/этилацетата и органический слой отделяли, промывали водой и солевым раствором, сушили над сульфатом натрия и упаривали. Остаток хроматографировали на силикагеле с использованием в качестве элюента смеси метиленхлорида/гексана для получения 5,8 г (93%) масла. 1 Н-ЯМР (, CDCl3): 5,22 (с, 2 Н), 6,74 (д,J=8, 1H), 7,4-7,7 (м, 8 Н), 8,21 (д, J=8, 1H), 8,39(д, J=8, 1H). 13 С-ЯМР (, CDCl3): 70,3; 105,9; 113,6; 122,7; 126,1; 126,9; 127,0; 127,4; 127,9; 128,1; 128,7; 129,5; 132,6; 136,7; 154,3. МС (%): 314 (исходное+1, 100). В. 1-Бензилокси-нафталин-4-борная кислота. С помощью процедуры примера 1 А 5,95 г(19 ммоль) 4-бром-1-бензилокси-нафталина было превращено в продукт с 55% выходом, в виде белого твердого вещества, т.пл. 149-152 С. 1 Н-ЯМР (, CDCl3): 5,18 (с, 2 Н), 6,82 (м,1 Н), 7,2-7,8 (м, 8 Н), 8,28(м, 2 Н). 13 С-ЯМР (, CDCl3): 69,9; 104,5; 104,7; 122,2; 122,4; 124,8; 125,0; 126,5; 126,6; 127,6; 127,7; 127,9; 128,0; 128,5; 130,9; 132,9; 136,9.D. 2-(2,5-Диметилпирролил)-6-(4-гидрокси-1-нафтил)пиридин. В 125 мл круглодонный сосуд, снабженный конденсатором и вводом N2, добавляли 1,53 г (3,795 ммоль) 2-(2,5-диметилпирролил)-6-(4 бензилокси-1-нафтил)пиридина, 1,20 г (18,975 ммоль) муравьинокислого аммония, 100 мг 10% палладия на угле и 30 мл этанола. Реакционную смесь кипятили с обратным холодильником 4 ч с дополнительным добавлением катализатора и соли муравьиной кислоты на 2 и 3 ч, после чего охлаждали и фильтровали через целит с использованием этанола и метиленхлорида. Фильтрат упаривали и остаток собирали смесью этилацетат/водный раствор бикарбоната натрия. Органический слой промывали солевым раствором,сушили над сульфатом натрия и упаривали до коричневатого твердого вещества, 1,21 гE. 2-(2,5-Диметилпирролил)-6-(4-(2-карбоэтоксиметилокси)-1-нафтил)пиридин. В 125 мл круглодонный сосуд, снабженный конденсатором и вводом N2, добавляли 1,19 г (3,795 ммоль) 2-(2,5-диметилпирролил)-6-(4 гидрокси-1-нафтил)пиридина, 0,505 мл (4,554 ммоль) этилбромацетата, 1,05 г (7,59 ммоль) карбоната калия и 25 мл ацетонитрила. Смесь кипятили с обратным холодильником 12 ч, охлаждали (отн.подвижность при ТСХ = 0,6 в смеси 1/1 этилацетат/гексан), выливали в воду и экстрагировали эилацетатом. Органический слой промывали солевым раствором, сушили над сульфатом натрия и упаривали. Остаток хроматографировали на силикагеле с использованием в качестве элюента гексана/этилацетата для получения 2,05 г (100%) масла. 1F. 2-(2,5-Диметилпирролил)-6-(4-(2-карбоксиметилокси)-1-нафтил)пиридин. В 125 мл круглодонный сосуд, снабженный конденсатором и вводом N2, добавляли 1,52 г (3,795 ммоль) 2-(2,5-диметилпирролил)-6-(4(2-карбоэтоксиметилокси)-1-нафтил)пиридина,15 мл тетрагидрофурана и 478 мг (11,385 ммоль) гидрата гидроокиси лития в 15 мл воды с добавлением метанола для поддержания раствора. Реакционную смесь перемешивали при комнатной температуре в течение 12 ч (ЖХ-МС Р+1 = 373), выливали в разбавленную водную соляную кислоту и экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над сульфатом натрия и упаривали до твердого вещества, 1,27 г (90%). 1I. 6-[4-(2-Диметиламиноэтокси)нафталин 1-ил]пиридин-2-иламин. В 100 мл круглодонный сосуд, снабженный конденсатором и вводом N2, добавляли 155 мг (0,403 ммоль) 2-(2,5-диметилпирролил)-6-(4(2-(2-диметиламиноэтил)метилокси)-1-нафтил) пиридина, 500 мг солянокислого гидроксилами 29 на, 9 мл этанола и 1 мл воды. Раствор нагревали с обратным холодильником 40 ч (ЖХ-МС Р+1 = 308), охлаждали, выливали в разбавленную водную соляную кислоту и промывали этилацетатом. рН водного слоя доводили до 12 6 н. водным раствором гидроокиси натрия и экстрагировали несколькими порциями метиленхлорида. Органический слой сушили над сульфатом натрия и упаривали до твердого вещества, 81 мг[3.1.0]гекс-6-иламин. Получали, как в примере 12, с выходом 63% (с последующей стадией деблокирования трифторуксусной кислотой в метиленхлориде для удаления трет-бутоксикарбонильной защитной группы), т.пл. 140-155 С, в форме солянокислой соли. 1 Н-ЯМР (, CDCl3): 1,35 (уш.с., 2 Н), 1,41(CH2Cl2). Вычислено: С 58,92; Н 7,87; N 9,37. Найдено: С 58,93; Н 7,84; N 7,77. Пример 19. 6-[4-(2-Диизопропиламиноэтокси)нафталин-1-ил]пиридин-2-иламин. Получали, как в примере 12, с выходом 97,5% в форме аморфного твердого вещества. 1 Н-ЯМР (, CDCl3): 1,09 (д, J=6,6, 12 Н),3,01 (т, J=7, 2H), 3,11 (м, 2 Н), 4,12 (т, J=7, 2 Н),4,62 (уш.с., 2 Н), 6,43(д, J= 8,1 Н), 6,86(м, 2 Н),7,47 (м, 4 Н), 8,14 (м, 1 Н), 8,35 (м, 1 Н). 13 С-ЯМР (, CDCl3): 20,94; 44,49; 49,61; 69,61; 104,27; 106,50; 115,22; 124,97; 125,70; 125,86; 126,59; 127,34; 131,20; 132,17; 137,98; 154,93; 157,90; 158,14. МС (%): 364 (исходное+1, 100). ПР-МС вычислено для С 23 Н 30 Н 3O: 364,2389. Найдено: 364,2383. Пример 20. 6-[4-(2-Морфолин-4-илэтокси) нафталин-1-ил]пиридин-2-иламин. Получали, как в примере 12, с выходом 60% в виде аморфного твердого вещества. 1(м, 4 Н), 8,11 (м, 1 Н), 8,30 (м, 1 Н). 13 С-ЯМР (, CDCl3): 54,10; 57,55; 66,54; 66,94; 104,32; 106,49; 115,19; 122,02; 125,07; 125,61; 125,78; 126,60; 127,13; 131,42; 132,10; 137,97; 154,56; 157,59; 157,93. МС (%): 350 (исходное+1, 100). Анал. для С 21 Н 23N3O21/4 Н 2O. Вычислено: С 72,18; Н 6,63; N 12,03; Найдено: С 71,62; Н 6,67; N 11,69. Пример 21. 6-[4-(2-Пиперидин-1-илэтокси)нафталин-1-ил]пиридин-2-иламин. Получали, как в примере 12, с выходом 68% в виде аморфного твердого вещества в форме солянокислой соли. 1 Н-ЯМР (, CDCl3): 1,45 (м, 2 Н), 1,60 (м,4 Н), 2,58 (м, 4 Н), 2,93 (т, J=6, 2 Н), 4,30 (т, J=6,2 Н), 4,66 (уш.с., 2 Н), 6,38 (д, J= 8, 1 Н), 6,82 (м,2 Н), 7,45 (м, 4 Н), 8, 11 (м, 1 Н), 8,32 (м, 1 Н). 13 С-ЯМР (, CDCl3): 24,19; 26,07; 55,08; 57,91; 66,66; 104,33; 106,54; 115,09; 122,22; 125,07; 125,75; 125,86; 126,62; 127,18; 131,46; 132,17; 137,94; 154,71; 157,75; 158,24. МС (%): 348 (исходное+1, 100) . Анал. для С 22 Н 25N3 О 2 НС 13 Н 2O1/4 32 Пример 22. 6-4-[2-(1,2,3,4-Тетрагидроизохинолин-2-ил)этокси]-нафталин-1-илпиридин 2-иламин. Получали, как в примере 12, с выходом 26%, в виде аморфного твердого вещества в форме солянокислой соли. 1 Н-ЯМР (, CDCl3): 2,96 (м, 4 Н), 3,16 (т,J=6, 2H), 3,87 (м, 2 Н), 4,42 (т, J=6, 2 Н), 4,58(м, 1 Н), 7,11 (м, 3H), 7,50 (м, 4 Н), 8,12 (м, 1 Н),8,36 (м, 1 Н). 13 С-ЯМР (, CDCl3): 28,96; 51,46; 56,43; 56,79; 66,94; 104,34; 106,45; 115,21; 122,10; 125,04; 125,57; 125,64; 125,84; 126,11; 126,52; 126,57; 127,16; 128,61; 131,46; 132,13; 133,98; 134,48; 137,92; 154,63; 157,73; 157,96. МС (%): 396 (исходное+1, 100). ПР-МС вычислено для С 26 Н 26N3 О: 396,2076. Найдено: 396,2080. Пример 23. 6-4-[2-(4-Диметиламинопиперидин-1-ил)этокси]нафталин-1-илпиридин-2 иламин. Получали, как в примере 12, с выходом 73%, в виде аморфного твердого вещества в форме солянокислой соли. 1 Н-ЯМР (, CDCl3): 1,56 (м, 2 Н), 1,80 (м,2 Н), 2,18 (м, 3H), 2,26 (с, 6 Н), 4,28 (т, J=6, 2 Н),3,10 (м, 2 Н), 4,28 (т, J=6,2H), 4,58 (уш.с., 2 Н),6,43 (д, J=8, 1 Н), 6,83 (м, 2 Н), 7,44 (м, 4 Н), 8,09(5,0 г, 34,25 ммоль) 1-фторнафталина и 10 мл четыреххлористого углерода с последующим добавлением по каплям 1,7 мл (5,5 г, 34,375 ммоль) брома в течение 3 мин. Реакционную смесь нагревали до 50-60 С при мониторинге НВr в течение 2 ч, после чего охлаждали и концентрировали. Остаток растворяли в метаноле и оставляли на ночь при 0 С. После фильтрации с холодным метанолом получен продукт в виде желтого масла с т.пл., близкой к комнатной температуре, весом 4,62 г (60%). 1 Н-ЯМР (, CDCl3): 7,02 (т, J=8, 1H), 7,67,7 (м, 3H), 8,10 (д, J=8,5, 1H), 8,20(д, J=8,5, 1H).B. 4-Фторнафталин-1-борная кислота. В 250 мл трехгорлый круглодонный сосуд,снабженный перегородкой и вводом N2, добавляли 4,62 г (20,53 ммоль) 4-бром-1-фторнафталина и 100 мл безводного тетрагидрофурана. Раствор охлаждали до -70 С и по каплям добавляли 15,4 мл (24,64 ммоль) 1,6 М раствора бутиллития в гексане в течение 5 мин. Реакционную смесь перемешивали при -70 С в течение 10 мин, после чего добавляли 4,2 мл (3,59 г,24,64 ммоль) триэтилбората и реакционную смесь перемешивали при -70 С в течение 20 мин и нагревали до комнатной температуры. После перемешивания в течение ночи при комнатной температуре реакцию гасили насыщенным водным раствором хлористого аммония,подкисляли 1 н. соляной кислотой и экстрагировали этилацетатом (дважды). Объединенный органический слой промывали солевым раствором, сушили над сульфатом натрия и упаривали. Остаток растирали с гексаном для получения беловатого порошка, 1,97 г (51%), представляющего собой смесь моноарильной и диарильной борной кислоты. 1 Н-ЯМР (, CDCl3): 7,2-7,4 (м, 1 Н), 7,5-7,7(2,13 ммоль) 4-фторнафталин-1-борной кислоты, 534 мг (2,13 ммоль) 2-(2,5-диметилпирролил)-6-бромпиридина, 902 мг (8,51 ммоль) карбоната натрия, 150 мг тетракистрифенилфосфина, 10 мл этанола и 2 мл воды. Реакционную смесь кипятили с обратным холодильником в течение ночи, охлаждали, выливали в воду и экстрагировали этилацетатом. Объединенный органический слой, полученный соединением с экстрактом другой, проведенной в большем масштабе реакции, промывали солевым раствором, сушили над сульфатом натрия и упаривали. Остаток хроматографировали на силикагеле с использованием в качестве элюента гексана/этилацетата для получения 4,72 г (85%) масла. 1 Н-ЯМР (, CDCl3): 2,25(с, 6 Н), 5,92 (с,2 Н), 7,1-7,2 (м, 2 Н), 7,4-7, 6 (м, 4 Н), 7,95 (т, J=8,1H), 8,12(д, J=8, 1 Н), 8,19 (д, J=8, 1H). 13 С-ЯМР (, CDCl3): 13,41; 106,97; 108,82; 109,02; 120,18; 120,78; 120,84; 123,42; 123,81; 123,96; 125,48; 126,20; 127,32; 127,68; 127,76; 128,56; 132,35; 133,90; 138,22; 151,87; 157,82; 158,30; 160,34. МС(%): 317(исходное+1, 100). ПР-МС вычислен для C21H18N2F (исходное+1) : 317,1454; Найдено: 317/1462.(0,633 ммоль) 4-гидрокси-N-бензил-пиперидина и 5 мл безводного диметилформамида и затем 32 мг (0,791 ммоль) гидрида натрия (60% в масле). Реакционную смесь нагревали до 70 С для обеспечения полного образования алкоксида и затем добавляли 100 мг (0,316 ммоль) 2-(2,5 диметилпирролил)-6-(4-фторнафт-1-ил)пиридина в 2 мл безводного диметилформамида и реакционную смесь нагревали до 80 С в течение 10 мин. Реакционную смесь охлаждали, выливали в воду и экстрагировали этилацетатом. Объединенный органический слой, полученный соединением с экстрактом другой, проведенной в большем масштабе, реакции, промывали солевым раствором, сушили над сульфатом натрия и упаривали. Остаток хроматографировали на силикагеле с использованием в качестве элюента метанола/метиленхлорида для получения 489 мг (54%) масла. 1 Н-ЯМР (, CDCl3): 2,04 (м, 2 Н), 2,10 (м,2 Н), 2,25 (с, 6 Н), 2,44 (м, 2 Н), 2,79 (м, 2 Н), 3,58(м, 1 Н), 3,69 (ABq, J=13, Dn=20, 2 Н), 4,74 (уш.с.,2 Н), 5,00 (м, 1 Н), 6,37 (д, J=8, 1H), 6,72 (д, J=8,1 Н), 6,83 (д, J=8, 1 Н), 7,2-7,6 (м, 9 Н), 8,14 (м,1 Н), 8,38 (м, 1 Н). 13 С-ЯМР (, CDCl3) : 32,37; 52,84; 60,17; 60,35; 77,0; 105,32; 106,52; 114,95; 122,40; 125,02; 125,70; 126,11; 126,62; 127,03; 127,12; 128,28; 128,82; 131,33; 132,28; 137,88; 138,70; 153,59; 157,59; 158,26. МС (%): 396 (исходное+1, 100). Анал. для С 26 Н 25N3O2 НСl5/3 Н 2O. Вычислено: С 62,65; Н 6,13; N 8,43. Найдено: С 62,73; Н 6,06; N 8,40. Пример 26. 6-[4-(4-Диметиламинобутокси)нафталин-1-ил]пиридин-2-иламин. Получали, как в примере 24, с выходом 71%, т.пл.78-90 С, в форме солянокислой соли. 1 Н-ЯМР (, CDCl3): 1,75(м, 2 Н), 1,94 (м,2 Н), 2,23 (с, 6 Н), 2,37(м, 2 Н), 4,16(т, J=6, 2 Н),4,63(уш.с., 2 Н), 6,43(д, J=8, 1 Н), 6,83(м, 2 Н), 7,47,6 (м, 4 Н), 8,08(м, 1 Н), 8,32(м, 1 Н). 13 С-ЯМР (, CDCl3): 24,33; 27,12; 45,31; 59,34; 67,90; 104,06; 106,44; 115,11; 122,09; 124,91; 125,57; 125,83; 126,49; 127,17; 131,12; 132,08; 137,88; 154,86; 157,73; 158,06. МС (%); 336 (исходное+1, 100). Анал. для C21H25N3O2HCl1/2 (Н 2 СO3)5/4 Н 2O. Вычислено: С 55,91; Н 6,66; N 9,10. Найдено: С 55,89; Н 6,89; N 8,80. Пример 27. 6-[4-(Пиперидин-4-илокси) нафталин-1-ил]пиридин-2-иламин. Получали, как в примере 24, с выходом 88%, т.пл. 65-75 С в форме свободного основания и т.пл. 205-220 С в форме солянокислой соли. 1(м, 4 Н), 8,10 (м, 1 Н), 8,34 (м, 1 Н). 13 С-ЯМР (, CDCl3): 32,01; 43,63; 73,20; 106,09; 106,44; 114,95; 122,30; 124,94; 125,66; 126,49; 126,67; 127,05; 131,32; 132,35; 137,84; 153,03; 157,64; 158,19. МС (%) : 320 (исходное+1, 100). Анал. для С 20 Н 21N3 О 3/4(С 4 Н 8O2)1/2 Н 2O. Вычислено: С 70,03; Н 7,15; N 10,65. Найдено: С 70,30; Н 6,77; N 10,99. Пример 28. 6-[4-(Пирролидин-3-илокси) нафталин-1-ил]пиридин-2-иламин. Получали, как в примере 24, с выходом 75%, т.пл. 60-70 С в форме свободного основания и т.пл. 180-200 С в форме солянокислой соли. 1 Н-ЯМР (, CDCl3): 2,05 (м, 2 Н), 2,87 (м,1 Н), 3,05 (м, 1 Н), 3,14 (м, 1 Н), 3,25 (м, 1 Н), 4,73(м, 3H), 2,96 (м, 2 Н), 3,30 (м, 1 Н), 4,56 (м, 1 Н),4,71 (уш.с., 2 Н), 6,39 (д, J=8, 1H), 6,70 (д, J= 8,1 Н), 6,81 (д, J=7, 1 Н), 7,43 (м, 4 Н), 8, 09 (м, 1 Н),8,32 (м, 1H). 13 С-ЯМР (, CDCl3): 19,61; 24,37; 25,15; 46,53; 47,33; 55,73; 73,44; 105,38; 106,47; 114,95; 122,07; 125,01; 125,73; 126,24; 126,54; 127,05; 131,29; 132,33; 137,84; 153,00; 157,56; 158,20. МС (%): 346 (исходное+1, 100). Анал. для C22H23N3O2HCl5/2H2O. Вычислено: С 57,02; Н 6,52; N 9,07. Найдено: С 57,07; Н 6,27; N 8,88. Пример 37. 6-[4-(2-Диметиламиноэтокси)5,6,7,8-тетрагидронафталин-1-ил]пиридин-2 иламин. А. 4-Бром-5,6,7,8-тетрагидро-1-бензилоксинафталин. В 250 мл круглодонный сосуд, снабженный дополнительной горловиной и вводом N2,добавляли 2,96 г (20 ммоль) 5,6,7,8-тетрагидронафталин-1-ола и 50 мл 1,2-дихлорэтана и по каплям в течение 10 мин при перемешивании раствор 9,64 г (20 ммоль) трехбромистого трибутиламмония в 30 мл 1,2-дихлорэтана. После перемешивания в течение еще 10 мин при комнатной температуре раствор промывали водой,разбавленным водным раствором бисульфита натрия и водой, сушили над сульфатом натрия и упаривали. Смесь продукта и бромида трибутиламмония использовали непосредственно. 1 Н-ЯМР (, CDCl3): 1,70(м, 4 Н), 2,56 (т,J=6, 2H), 2,61 (т, J=6, 2 Н), 7,02(АВ, 2 Н),8,0(уш.с., 1 Н, ОН). 13 С-ЯМР (, CDCl3): 22,2; 22,9; 23,8; 30,5; 114,0; 114,7, 126,6; 129,0; 136,7; 154,1. Указанное выше масло растворяли в 100 мл ацетонитрила и обрабатывали 3,57 мл (30 ммоль) бромистого бензила и 5,53 г (40 ммоль) карбоната калия при кипячении с обратным хо 39 лодильником 14 ч. При ТСХ выявляется основное пятно с отн.подвижностью = 0,3 в 10% метиленхлориде/гексане (с отн. подвижностью бромистого бензила=0,4). Реакционную смесь охлаждали, выливали в разбавленный водный раствор соляной кислоты/этилацетата и органический слой отделяли, промывали водой и солевым раствором, сушили над сульфатом натрия и упаривали. Остаток хроматографировали на силикагеле с использованием в качестве элюента метиленхлорида/гексана для получения 4,0 гB. 5,6,7,8-Тетрагидро-1-бензилоксинафталин-4-борная кислота. Получали, как в примере 12 В, в виде твердого белого вещества после растирания с гексаном, т.пл. 199-205 С, выход 72%. 1D. 2-(2,5-Диметилпирролил)-6-[4-гидрокси-5,6,7,8-тетрагидронафталин-1-ил]пиридин. Получали, как в примере 12D, с выходом 100% в виде легкоплавкого твердого вещества. 1 Н-ЯМР (, CDCl3): 1,67 (м, 2 Н), 1,77 (м,2 Н), 2,16 (с, 6 Н), 2,63(м, 2 Н), 2,73 (м, 2 Н), 5,89I. 6-[4-(N,N-Диметиламиноэтокси)-5,6,7,8 тетрагидронафталин-1-ил]пиридин-2-иламин. Получали, как в примере 12I, с выходом 57% в форме солянокислой соли, т.пл. 239242 С, из метанола/изопропилового эфира. 1 Н-ЯМР (, CDCl3): 1,64 (м, 2 Н), 1,71 (м,2 Н), 2,33 (с, 6 Н), 2,67 (м, 4 Н), 2,74 (т, J=6, 2H), 41 4,07 (т, J=6, 2H), 4,55 (уш.с., 2 Н), 6,36 (д, J=8,1H), 6,62 (д, J=8, 1 Н), 6,67 (д, J=8, 1H), 7,07 (д,J=8, 1H), 7,40 (т, J=8, 1H). 13 С-ЯМР (, CDCl3): 22,3; 22,8; 23,6; 28,1; 46,0; 58,2; 66,4; 106,0; 107,4; 114,3; 126,2; 126,8; 133,5; 136,2; 137,6; 156,3; 157,6; 158,8. МС (%): 312 (исходное+1, 100). Анал. для С 19 Н 25N3 О 2 НСl1/4 Н 2O. Вычислено: С 58,69; Н 7,13; N 10,8. Найдено: С 58,72; Н 7,14; N 10,79. 6-[4-(N,N-Диметиламиноэтокси)-5,6,7,8 тетрагидронафталин-1-ил]пиридин-2-иламин может быть получен также следующим способом:(44 ммоль) 4-бромо-5,6,7,8-тетрагидронафталин- 1-ола (пример 37 А), 19 г (130 ммоль) солянокислого хлористого 2-диметиламиноэтила,30,3 г (220 ммоль) порошкообразного карбоната калия и 600 мл ацетонитрила. Реакционную смесь кипятили с обратным холодильником в течение 60 ч, затем вносили дополнительную порцию хлорида и кипячение с обратным холодильником продолжали в течение 24 ч. Реакционную смесь охлаждали, фильтровали и концентрировали. Остаток хроматографировали на силикагеле с использованием в качестве элюента метанола/метиленхлорида для получения 8,55 г (65%) светло-коричневого масла. 1 Н-ЯМР (, CDCl3): 1,72 (м, 4 Н), 2,33 (с,6 Н), 2,63 (м, 2 Н), 2,68 (м, 2 Н), 2,73 (т, J=6, 2H),4,01 (т, J=6, 2H), 6,53 (д, J=8, 1 Н), 7,28 (д, J=8,1H). 13 С-ЯМР (, CDCl3): 22,1; 22,8; 23,7; 30,5; 46,0; 538,2; 66,6; 109,2; 116,4; 128,8; 129,2; 137,2; 155,6. МС: 298/300 (исходное+1). К. 1-(N,N-Диметиламиноэтокси)-5,6,7,8 тетрагидронафталин-4-борная кислота. В 1 л 3-горлый круглодонный сосуд, снабженный перегородкой и вводом N2, добавляли 8,55 г (28,7 ммоль) 4-бром-1-(2-метиламиноэтокси)-5,6,7,8-тетрагидронафталина и 300 мл безводного тетрагидрофурана. Раствор охлаждали до -70 С и добавляли 13,8 мл (34,4 ммоль) 2,5 М раствора бутиллития в гексанах. Реакционную смесь перемешивали при -70 С в течение 1 ч, после чего добавляли 5,9 мл (34,4 ммоль) триэтилбората и реакционную смесь перемешивали при -70 С в течение 2 ч и нагревали до комнатной температуры в течение ночи. Реакцию гасили водным насыщенным раствором хлористого аммония и трижды экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над сульфатом натрия и упаривали. Остаток растирали с гексаном до получения белого твердого вещества, 6,3 гL. 2-(2,5-Диметилпирролил)-6-[4-(N,Nдиметиламиноэтокси)-5,6,7,8-тетрагидронафталин-1-ил]пиридин. В 500 мл круглодонный сосуд, снабженный конденсатором и вводом N2, добавляли 6,3 г (23,4 ммоль) 1-(N,N-диметиламиноэтокси)5,6,7,8-тетрагидронафталин-4-борной кислоты,6,0 г (23,4 ммоль) 6-бром-2-(2,5-диметилпирролил)пиридина, 10,1 г (95,6 ммоль) карбоната натрия, 552 мг тетракистрифенилфосфинпалладия, 200 мл этанола и 20 мл воды. Реакционную смесь кипятили с обратным холодильником в течение 20 ч, охлаждали и фильтровали. Фильтрат концентрировали, собирали 1 н. раствором бикарбоната натрия и трижды экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором гидрокарбоната натрия и солевым раствором, сушили над сульфатом натрия и упаривали. Остаток хроматографировали на силикагеле с использованием в качестве элюента метанола/метиленхлорида для получения 7,67 г(д, J=8, 1H), 7,11 (д, J=8, 1H), 7,20 (д, J=8, 1 Н),7,36 (д, J=8, 1H), 7,81 (т, J=8, 1H). 13 С-ЯМР (, CDCl3): 13,3; 22,3; 22,9; 23,7; 28,7; 46,2; 58,4; 66,6; 106,6; 107,6; 119,5; 122,95; 126,5; 127,7; 128,6; 132,4; 136,6; 137,9; 151,2; 156,9; 160,35. МС (%): 390 (исходное+1, 100). Этот материал затем превращали в 6-[4(N,N-диметиламиноэтокси)-5,6,7,8-тетрагидронафталин-1-ил]пиридин-2-иламин с помощью способа, представленного в примере 37I, с выходом 83%. Пример 38. 6-[4-(2-Пирролидин-1-илэтокси)-5,6,7,8-тетрагидронафталин-1-ил]пиридин 2-иламин. Получали, как в примере 37, с выходом 58%, в виде гигроскопичного твердого вещества в форме солянокислой соли. 1(уш.с., 2 Н), 6,38 (д, J=8, 1H), 6,65 (д, J=8, 1 Н),6,70 (д, J=8, 1 Н), 7,09 (д, J=8, 1 Н), 7,42 (т, J=8,1H). 13 С-ЯМР (, CDCl3): 20,79; 22,37; 22,81; 23,63; 28,16; 44,51; 49,42; 69,26; 105,99; 107,53; 114,39; 126,14; 126,79; 133,18; 136,12; 137,67; 156,51; 157,60; 158,88. МС (%): 368 (исходное+1, 100). Анал. для С 23 Н 33N3 О 2 НСl5/2 Н 2 О(С 4 Н 10 О). Вычислено: С 57,95; Н 9,01; N 7,51. Найдено: С 57,74; Н 8,62; N 7,25. Пример 41. 6-[4-(2-Диэтиламиноэтокси)5,6,7,8-тетрагидронафталин-1-ил]-пиридин-2 иламин. Получали, как в примере 37, с выходом 42% в виде гигроскопического твердого вещества в форме солянокислой соли. 1 Н-ЯМР (, CDCl3): 1,07 (т, J=7, 6 Н), 1,66l07,43; 114,43; 126,20; 126,77; 133,39; 136,20; 137,64; 156,43; 157,54; 158,91. МС (%): 340 (исходное+1, 100). Пример 42. 6-4-[2-(1,2,3,4-Тетрагидроизохинолин-2-ил)этокси]-5,6,7,8-тетрагидронафталин-1-ил-пиридин-2-иламин. Получали, как в примере 37, с выходом 67% в виде аморфного твердого вещества в форме солянокислой соли. 1 Н-ЯМР (, CDCl3): 1,67 (м, 2 Н), 1,79 (м,2 Н), 2,73 (м, 4 Н), 2,94 (м, 4 Н), 3,03 (т, J=6, 2 Н), 003839-5,6,7,8-тетрагидронафаталин-1-ил]-пиридин-2 иламин. Получали, как в примере 37, с выходом 67% в виде белого аморфного твердого вещества. 1H-ЯМР (, CDCl3): 1,64(м, 2 Н), 1,74(м,2 Н), 2,58(м, 4 Н), 2,68(м, 4 Н), 2,81 (т, J=6, 2 Н),3,71(м, 4 Н), 4,11 (т, J=6, 2H), 4,45(уш.с., 2 Н),6,39(д, J=8, 1 Н), 6,66 (м, 2 Н), 7,09(д, J=8, 1 Н),7,43(т, J=8, 1H). 13 С-ЯМР (, CDCl3): 22,39; 22,85; 23,72; 28,21; 54,16; 57,73; 66,26; 67,03; 106,12; 107,61; 114,53; 126,36; 126,88; 136,39; 137,80; 156,30; 157,57; 158,83. МС (%): 354 (исходное+1, 100). Анал. для C21H27N3O21/2H2O. Вычислено: С 69,59; Н 7,79; N 11,59. Найдено: С 69,61; Н 7,51; N 11,56. Пример 45. 6-4-[2-(5,6,7,8-Тетрагидро[1,3]-диоксоло-[4,5-д]изохинолин-6-ил)этокси] 5,6,7,8-тетрагидронафталин-1-илпиридин-2 иламин. Получали, как в примере 37, с выходом 82% в виде белого аморфного твердого вещества в форме солянокислой соли. 1 Н ЯМР (, CDCl3): 1,65 (м, 2 Н), 1,76 (м,2 Н), 2,72 (м, 4 Н), 2,84 (м, 4 Н), 2,98 (т, J=6, 2 Н),3,69 (с, 2 Н), 4,20 (т, J=6, 2 Н), 4,52 (уш.с., 2 Н),5,86 (с, 2 Н), 6,37 (д, J=8, 1 Н), 6,47 (с, 1 Н), 6,55(д, J=8, 1H), 7,42 (т, J=8, 1H). 13 С-ЯМР (, CDCl3): 22,44; 22,89; 23,79; 28,25; 29,09; 51,47; 56,57; 56,87; 66,69; 100,59; 106,11; 106,47; 107,57; 108,43; 114,46; 126,31; 126,92; 127,04; 127,51; 133,65; 136,38; 137,76; 145,67; 146,03; 156,35; 157,68; 158,87. МС (%): 444 (исходное+1, 100). Анал. для C27H29N3O3. Вычислено: С 73,11; Н 6,59; N 9,47. Найдено: С 73,37; Н 7,19; N 8,96. ПР-МС вычислено для С 27 Н 30N3O3: 444,2287. Найдено: 444,2287. Пример 46. 6-4-[2-(4-Метилпиперазин-1 ил)этокси]-5,6,7,8-тетрагидронафталин-1-илпиридин-2-иламин. Получали, как в примере 37, с выходом 100% в виде аморфного твердого вещества в форме солянокислой соли. 1H-ЯМР (, CDCl3): 1,62 (м, 2 Н), 1,72 (м,2 Н), 2,26 (с, 3H), 2,4-2,8 (м, 12 Н), 2,81 (т, J=6,2 Н), 4,09 (т, J=6, 2 Н), 4,50 (уш.с. 2 Н), 6,35 (д,J=8, 1 Н), 6,63 (м, 2 Н), 7,07 (д, J=8, 1H), 7,39 (т,J=8, 1H). 13 С-ЯМР (, CDCl3) : 22,4; 22,9; 23,37; 28,2; 46,1; 53,37; 55,2; 57,3; 66,3; 106,1; 107,6; 114,4; 126,3; 126,9; 133,6; 136,3; 137,7; 156,3; 157,7; 158,9. МС (%): 367 (исходное+1, 100). Анал. для C22H30N4O3HClH2O1/2(C4H10O). Вычислено: С 54,29; Н 7,59; N 10,55. Найдено: С 54,20; Н 7,59; N 10,50. Пример 47. 6-4-[2-(4-Диметилопиперидин-1-ил)этокси]-5,6,7,8-тетрагидронафталин 1 илпиридин-2-иламин. Получали как в примере 37 с выходом 92% в виде аморфного твердого вещества в форме солянокислой соли. 1 Н ЯМР (d, CDCl3): 1,54 (м, 2 Н), 1,64 (м,2 Н), 1,77 (м, 4 Н), 2,12 (м, 3H), 2,26 (c, 6H), 2,66 46 пиридина, 4,0 г (9,4 ммоль) 3-(гидроксиметил)пиперидин-ди-п-толуолсульфоната, 3,5 г (25,2 моль) карбоната калия и 60 мл безводного диметилформамида. Реакционную смесь нагревали при 140 С в течение 14 ч, охлаждали и вливали в воду. Смесь экстрагировали этил-ацетатом и органический слой тщательно промывали водой и насыщенные солевым раствором, сушили над сульфатом натрия и упаривали. Остаток хроматографировали на силикагеле, применяя в качестве элюента гексан/этилацетат для получения 3,1 г (86%) белого твердого вещества. 1(109 ммоль) гидрохлорида гидроксиламина, 250 мл этанола и 25 мл воды. Реакционную смесь кипятили с обратным холодильником в течение 5 дней, охлаждали и упаривали. Остаток переносили в этилацетат и 1 н. соляную кислоту и органический слой промывали дополнительной порцией этилацетата и доводили рН до 12 с помощью 6 н. раствора гидроокиси натрия, затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и упаривали для получения 2,87 г (100%) ярко-коричневой пены. 1 Н-ЯМР (, CDCl3): 1,16 (м, 1 Н), 1,6-1,8 (м,7 Н), 2,2-2,4 (м, 3H), 2,41 (с, 3H), 2,7 (м, 4 Н), 3,73,9 (м, 4 Н), 4,51 (уш.с., 2 Н), 6,395 (д, J=8, 1H),6,61 (д, J=8, 1H), 6,64 (д, J=8, 1H), 7,08 (д, J=8,1 Н), 7,29 (м, 2 Н), 7,42 (т, J=8, 1 Н), 7,62 (м, 2 Н). 13 С-ЯМР (, CDCl3): 21,53; 22,39; 22,85; 23,62; 24,09; 26,52; 28,23; 35,84; 46,70; 49,43; 69,70; 106,19; 107,36; 114,43; 126,35; 126,87; 127,73; 129,61; 133,16; 133,71; 136,44; 137,80; 143,42; 156,18; 157,67; 158,73. МС (%): 492 (исходное+1, 100). С. 6-[4-(Пиперидин-3-илметокси)-5,6,7,8 тетрагидронафталин-1-ил]пиридин-2-иламин. В трехгорлый круглодонный сосуд, снабженный конденсатором, перегородкой и вводомN2, добавляли 4,5 г (33,6 ммоль) хлорида алю 47 миния и 150 мл безводного 1,2-диметоксиэтана. Реакционную смесь охлаждали до 0 С, и добавляли 79 мл (79 ммоль) 1,0 М раствора алюмогидрида лития в тетрагидрофуране. Реакционную смесь перемешивали при комнатной температуре в течение 30 мин, затем охлаждали-70 С, и добавляли раствор 2,77 г (5,6 ммоль) 6[4-N-(4-толуолсульфонил)-(пиперидин-3 илметокси)-5,6,7,8-тетрагидронафталин-1-ил]пиридин-2-иламина в 150 мл безводного 1,2 диметоксиэтана в течение 10 мин. Реакционную смесь перемешивали и нагревали до комнатной температуры, затем нагревали до кипения с обратным холодильником в течение 3 дней. Реакционную смесь охлаждали, осторожно гасили 1 н. соляной кислотой, затем доводили рН до 12 с помощью 6 н. раствора гидроокиси натрия. Смесь экстрагировали несколькими порциями метиленхлорида и органический слой промывали водным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над сульфатом натрия и упаривали. Остаток хроматографировали, применяя в качестве элюента метанол/метиленхлорид/триэтиламин для получения 784 мг (41,5%) беловатого твердого вещества, которое превращали в солянокислую соль. 1 Н-ЯМР (, CDCl3): 1,21 (м, 1 Н), 1,46 (м,1 Н), 1,6-2,0 (м, 8 Н), 2,4-2,6 (м, 2 Н), 2,66 (м, 3H),3,1 (м, 2 Н), 3,76 (м, 2 Н), 4,57 (уш.с., 2 Н), 6,35 (д,J=8, 1H), 6,60 (д, J=8, 1H), 6,63 (д, J=8, 1 Н), 7,39(т, J=8, 1H). 13 С-ЯМР (, CDCl3): 22,4; 22,9; 23,6; 25,3; 27,6; 28,2; 36,6; 46,2; 49,3; 70,7; 106,2; 107,3; 114,4; 126,4; 126,8; 133,5; 135,3; 137,8; 156,5; 157,8; 158,7. МС (%): 338 (исходное+1, 100). Анал. для C21H27N3O1/2 Н 2O. Вычислено: С 72,80; Н 8,15; N 12,13. Найдено: С 73,11; Н 8,29; N 11,89. Пример 49. 6-[4-(1-Метилпиперидин-3 илметокси)-5,6,7,8-тетрагидронафталин-1-ил]пиридин-2-иламин. Получали из примера 48 путем восстановительного аминирования с формальдегидом в муравьиной кислоте с выходом 84,5% в виде желтого аморфного твердого вещества в форме солянокислой соли. 1 Н-ЯМР (, CDCl3): 1,12 (м, 2 Н), 1,6-2,0 (м,8 Н), 2,18 (м, 1 Н), 2,29 (с, 3H), 2,69 (м, 4 Н), 2,79 48 Пример 50. 6-[4-(1-Изобутилпиперидин-3 илметокси)-5,6,7,8-тетрагидронафталин-1-ил] пиридин-2-иламин. Получали из примера 48 путем восстановительного аминирования с изобутиральдегидом с выходом 5,7% в виде яркого желтокоричневого аморфного твердого вещества в форме солянокислой соли. 1 Н-ЯМР (, CDCl3): 0,90 (д, J=6, 6 Н), 1,19(д, J=8, 1H), 7,435 (т, J=8, 1H). 13 С-ЯМР (, CDCl3): 20,99; 21,06; 22,42; 22,87; 23,61; 24,44; 25,36; 27,34; 28,22; 35,98; 54,48; 57,44; 67,05; 70,71; 106,19; 107,36; 114,54; 126,33; 126,86; 133,14; 136,24; 137,86; 156,58; 157,59; 158,82. МС (%): 394 (исходное+1, 100). ПР-МС вычисл. для С 25 Н 36N3 О: С 394,2858. Найдено: 394, 2893. Пример 51. 6-4-[2-(5,6,7,8-Тетрагидро[1,3]-диоксоло-[4,5-д]изохинолин-6-ил)этокси] нафталин-1-илпиридин-2-иламин. Получали, как в примере 12, с выходом 65% в виде аморфного твердого вещества. 1 Н-ЯМР (d, CDCl3): 2,85 (м, 2 Н), 2,93 (м,2 Н), 3,15 (т, J=6, 2 Н), 3,77 (с, 2 Н), 4,415 (т, J=6,2 Н), 4,56 (уш.с., 2 Н), 5,87 (с, 2 Н), 6,48 (с, 1 Н),6,51 (д, J=8, 1 Н), 6,56 (с, 1 Н), 6,88 (м, 2 Н), 7,47,6 (м, 4 Н), 8,10 (м, 1 Н), 8,31 (м, 1 Н). 13 С-ЯМР (d, CDCl3): 28,9; 51,4; 56,4; 56,6; 66,8; 100,5; 104,3; 106,4; 106,5; 108,3; 115,3; 122,1; 125,1; 125,6; 125,8; 126,6; 126,8; 127,2; 131,3; 132,1; 138,0; 145,7; 146,0; 154,6; 157,6; 157,8. МС (%): 440 (исходное+1, 100). ПР-МС вычислено для С 27 Н 26N3O3: 440,1974. Найдено: 440,1971. Пример 52. 6-[7-(2-Диметилаиминоэтокси)индан-4-ил]пиридин-2-иламин. Получали, как в примере 37, начиная с 1 инданола, с выходом 57%, т.пл. 215-218 С, в форме солянокислой соли. 1C21H30N3O: 340,2381. Найдено: 340,2389. Пример 58. 6-7-[2-(4-Диметиламинопиперидин-1-ил)этокси]индан-4-илпиридин-2 иламин. Получали, как в примере 37, с выходом 100% в виде аморфного твердого вещества в форме солянокислой соли. 1 Н-ЯМР (d, CDCl3): 1,60 (м, 2 Н), 1,82 (м,3H), 2,00 (пентет, J=7, 2 Н), 2,13 (м, 2 Н), 2,27 (с,6 Н), 2,80 (т, J=6, 2H), 2,85 (т, J=7, 2 Н), 3,06 (т,J=7, 2 Н), 4,15 (т, J=6, 2 Н), 4,75 (уш.с., 2 Н), 6,35(д, J=8, 1H), 6,84 (д, J=7, 1H), 7,3-7,5 (м, 5 Н),8,09 (м, 1 Н), 8,30 (м, 1 Н). 13 С-ЯМР (, CDCl3): 54,99; 61,12; 66,84; 104,54; 106,57; 107,86; 110,06; 115,18; 122,07; 125,15; 125,63; 126,72; 126,95; 131,79; 132,16; 138,01; 142,28; 151,47; 152,74; 157,49; 157,90. МС(%): 372 (исходное+1, 100). ПР-МС вычисл. для C23H22N4O2: 372,1712. Найдено: 372,1690. Пример 68. 6-[4-(Пирролидин-2-илметокси)-5,6,7,8-тетрагидронафталин-1-ил]-пиридин 2-иламин. Получали, как в примере 48, применяя RN-t-BOC-пирролидин-2-метанол, с последующим превращением в тозилат и алкилированием 2-(2,5-диметилпирролил)-6-(4-гидрокси-5,6,7,8 тетрагидронафталин-1-ил)пиридином и с последующим деблокированием для получения желто-коричневого аморфного твердого вещества с выходом 95% в форме солянокислой соли. 1S-(-)-1-метил-2-пирролидинметанол для получения после деблокирования желто-коричневого твердого вещества с выходом 88%, т.пл. 8095 С, D=-36,47 (с=1, СН 2 Сl2). 1 Н-ЯМР (, CDCl3): 1,8 (м, 2 Н), 1,9 (м, 1 Н),2,12 (м, 1 Н), 2,34 (м, 1 Н), 2,56 (с, 3H), 2,83 (м,1 Н), 3,13 (м, 1 Н), 4,13 (АВ, 2 Н), 4,63 (уш.с., 2 Н),6,41 (д, J=8, 1 Н), 6,83 (м, 2 Н), 7,46 (м, 4 Н), 8,10 С-ЯМР (, CDCl3): 23,00; 28,92; 41,87; 57,79; 64,27; 71,57; 104,06; 106,45; 115,09; 122,07; 124,97; 125,64; 125,73; 126,01; 126,53; 127,20; 131,29; 132,06; 137,89; 154,78; 157,69; 158,07. МС (%): 334 (исходное+1, 100). Анал. для С 21 Н 23N3 О 1/3 Н 2O. Вычислено: С 74,31; Н 7,03; N 12,38. Найдено: С 74,11; Н 7,19; N 12,22. Пример 70. 6-[4-(2-Аминоциклогексилокси)-5,6,7,8-тетрагидронафталин-1-ил]-пиридин-2-иламин. Получали, как в примере 48, путем следующих четырех последовательных стадий: 2(2,5-диметилпирролил)-6-[4-гидрокси-5,6,7,8 тетрагидронафталин-1-ил]пиридин сначала алкилировали 2-хлорциклогексаноном, применяя в качестве основания карбонат калия и каталитическое количество иодида натрия в диметилформамиде при 80 С в течение 24 ч, с выходом 92%. Полученный кетон превращали в оксимметиловый эфир, применяя гидрохлорид Ометилгидроксиламина и триэтиламин в метаноле при кипячении с обратным холодильником в течение 16 ч с выходом 81%. Эфир оксима затем восстанавливали до амина, применяя метилсульфид борана в тетрагидрофуране при кипячении с обратным холодильником в течение 2 дней, за которым следовало кипячение с обратным холодильником в этаноле с карбонатом натрия и фторидом цезия в течение 16 ч с выходом 12%. Амин затем деблокировали гидрохлоридом гидроксиламина при кипячении с обратным холодильником в водном этаноле для получения желаемого конечного продукта с выходом 89% в виде желто-коричневого твердого вещества после превращения в солянокислую соль. 1(м, 6 Н), 2,70 (м, 4 Н), 2,94 (м, 1 Н), 4,49 (м, 1 Н),4,55 (уш.с., 2 Н), 6,39 (д, J= 8, 1 Н), 6,65 (д, J=8,1 Н), 6,72 (д, J=8, 1H), 7,07 (д, J=8, 1H), 7,43 (т,J=8, 1H). 13 С-ЯМР (, CDCl3): 20,3; 22,4; 22,37; 23,7; 23,9; 27,4; 28,2; 30,9; 52,1; 75,8; 106,1; 108,6; 114,4; 126,8; 127,0; 133,1; 136,5; 137,7; 154,9; 157,6; 158,7. МС (%): 338 (исходное+1, 100). ПР-МС вычисл. для C21H28N3O: 338,2232. Найдено: 338,2256. Пример 71. 6-[4-(Азетидин-2-илметокси) нафталин-1-ил]пиридин-2-иламин. Получали, как в примере 24, применяя Lазетидин-2-карбоновую кислоту в качестве предшественника N-t-BOC-азетидин-2-метанола, применяемого в качестве реагента для добавления к 2-(2,5-диметилпирролил)-6-(4-фторнафталин-1-ил)пиридину с последующим удалением защитных групп для получения твердого вещества с выходом 45%, т.пл. 135-150 С.(м, 1 Н), 8,54 (с, 1 Н). 13 С-ЯМР (, CDCl3): 60,9; 51,4; 66,8; 104,5; 106,6; 115,1; 122,0; 123,4; 125,5; 125,7; 126,7; 126,9; 132,0; 132,2; 133,3; 136,0; 138,0; 148,7; 149,8; 152,7; 157,5; 158,0. МС (%): 383 (исходное+1, 100). Анал. C24H22N4O3HCl3H2O1/3(C4H8O). Вычислено: С 53,39; Н 5,95; N 9,83. Найдено: С 53,22; Н 6,18; N 9,43. Пример 73. 6-[4-(Азетидин-3-илметокси) нафталин-1-ил]пиридин-2-иламин. Получали, как в примере 24, в котором NBOC-азетидин-3-метанол добавляли к 2-(2,5 диметилпирролил)-6-(4-фторнафт-1-ил)пиридину, как в примере 24D, затем следовало последовательное удаление ВОС и пирролильных защитных групп с конечным этапом, дающим выход 75%, т.пл.88-110 С, в форме соляно-кислой соли. 1 Н-ЯМР (, CDCl3): 3,27 (м, 1 Н), 3,64 (м,2 Н), 3,78 (м, 2 Н), 4,25 (д, J=6, 2 Н), 4,63 (уш.с.,2 Н), 6,45 (д, J=8, 1H), 6,83 (м, 2 Н), 7,4-7,6 (м,4 Н), 8,09 (м, 1 Н), 8,29 (м, 1 Н). 13 С-ЯМР (, CDCl3): 34,2; 49,8; 69,8; 104,2; 106,5; 115,1; 122,0; 125,0; 125,4; 125,6; 125,7; 126,6; 127,1; 131,4; 132,0; 138,0; 154,7; 157,6; 158,1. МС (%): 306 (исходное+1, 100). Анал. для 56 Получали, как в примере 24, с выходом 24%, т.пл. 97-120 С, в форме солянокислой соли из тетрагидрофурана. 1 Н-ЯМР (, CDCl3): 3,42 (м, 2 Н), 3,89 (с,2 Н), 4,015 (м, 2 Н), 4,62 (уш.с., 2 Н), 5,045 (м,1 Н), 6,47 (д, J=8, 1H), 6,57 (д, J=8, 1 Н), 6,82 (д,J=7, 1 Н), 7,16 (м, 1 Н), 7,3-7,5 (м, 5 Н), 7,64 (т,J=8, 1 Н), 8,07 (м, 1 Н), 8,30 (м, 1 Н), 8,55 (м, 1 Н). 13 С-ЯМР (, CDCl3): 61,62; 64,89; 67,10; 104,52; 106,64; 115,14; 122,09; 122,13; 122,42; 125,18; 125,60; 126,73; 126,92; 131,75; 132,16; 136,58; 138,04; 149,30; 152,77; 157,41; 157,76; 157,96. МС (%): 383 (исходное+1, 100). Анал. для C24H22N4O3HCl7/4H2O. Вычислено: С 55,08; Н 5,49; N 10,70. Найдено: С 55,44; Н 5,61; N 10,31. Пример 75. 6-[4-(N-Метилазетидин-3-илокси)нафталин-1-ил]пиридин-2-иламин. Получали, как в примере 24, используя формальдегид в метаноле с цианоборгидридом при комнатной температуре, с выходом 30%,т.пл. 240-255 С, в форме солянокислой соли из тетрагидрофурана. 1(уш.с., 2 Н), 3,30 (м, 2 Н), 3,99 (м, 2 Н), 4,96 (м,1 Н), 6,47 (д, J=8, 1H), 6,55 (д, J=8, 1 Н), 6,80 (д,J=7, 1 Н), 7,3-7,5 (м, 4 Н), 8,03 (м, 1 Н), 8,28 (м,1 Н). 13 С-ЯМР (, CDCl3): 45,81; 63,07; 66,19; 104,44; 106,84; 115,08; 121,97; 125,23; 125,43; 125,57; 126,76; 126,87; 131,82; 132,15; 138,14; 152,56; 157,13; 158,05. МС (%): 306 (исходное+1, 100). Анал. для C19H19N3O2HCl2H2O. Вычислено: С 55,08; Н 6,08; N 10,14. Найдено: С 55,34; Н 6,01; N 9,82. Пример 76. 6-[4-(N-Изопропилазетидин-3 илокси)нафталин-1-ил]пиридин-2-иламин. Получали, как в примере 24, в качестве побочного продукта реакции, использованной для получения продукта примера 75, из ацетона в метаноле, с выходом 19%, т.пл. 120-135 С, в форме солянокислой соли из тетрагидрофурана. 1 Н-ЯМР (, CDCl3: 0,99 (д, J=6, 6H), 2,49 57 Получали, как в примере 37, с использованием в качестве исходного материала 4 гидрокси-6,7,8,9-тетрагидро-5 Н-бензоциклопентена, который получали следующим образом: в запаяной пробирке вводили в реакцию 8 г (71,4 ммоль) 2-гидроксипирона (Syn. Commun., 5,461, (1975 и 20 мл циклогептена при 150 С в течение 24 ч для получения 1-оксо-3,4,6,7,8,9 гексагидро-5 Н-бензоциклогептена с выходом 49,5%, с последующей реакцией с изопропенилацетатом для получения енолацетата и обработкой 2,3-дихлор-5,6-дицианобензохиноном при 90 С в течение 1,5 ч (см. J. Med.Chem.,37, 3803 (1994 для получения 4-ацетокси 6,7,8,9-тетрагидро-5 Н-бензоциклогептена с выходом 69% в виде масла. Гидролиз с использованием 3,7 эквивалентов порошкообразной гидроокиси калия в этаноле при комнатной температуре в течение 2 ч дал 44% выход желаемого 4-гидрокси-6,7,8,9 тетрагидро-5 Н-бензоциклогептена после очистки колоночной хроматографией в виде белого твердого вещества. Остальные стадии последовательности соответствовали примеру 48. Последняя стадия, проведенная с 89% выходом,дала продукт в виде аморфного твердого вещества в форме солянокислой соли из эфира. 1 Н-ЯМР (, CDCl3): 1,58 (м, 4 Н), 1,79 (м,2 Н), 2,34 (с, 6 Н), 2,75 (м, 4 Н), 2,93 (м, 2 Н), 4,06 где кольцо А является 5-7-членным насыщенным или ненасыщенным конденсированным кольцом,X является кислородом или связью;n представляет собой целое число от 2 до 6 иR1 и R2 независимо выбирают из водорода(C1-C6)алкила, арила, тетрагидронафталина и аралкила, где указанный арил и арильная часть указанного аралкила представляет собой фенил или нафтил, а алкильная часть является линейной или разветвленной и содержит от 1 до 6 углеродных атомов и где указанный (C1-C6)алкил, указанный арил, указанный тетрагидронафталин и арильная часть указанного аралкила могут необязательно быть замещенными заместителями в количестве от 1 до 3, которые независимо выбирают из галогена, выбранного из 58 группы, состоящей из хлора, фтора, брома, иода, нитро, гидрокси, циано, амино, (C1-C4) алкокси и (C1-C4 )алкиламино; или R1 и R2 образуют вместе с азотом, к которому они присоединены, пиперазиновое,азетидиновое, пиперидиновое или пирролидиновое кольцо или азабициклическое кольцо,содержащее в кольце от 6 до 14 членов, из которых от 1 до 3 являются азотом, а остальные представляют собой углерод; и где указанные пиперазиновое, азетидиновое, пиперидиновое и пирролидиновое кольца могут быть необязательно замещены одним или более заместителями, которые независимо выбирают из (C1-C6)алкила, амино, (C1-C6)алкиламино, [ди-(C1-C6)алкил]амино, 5-6-членных гетероциклических колец, замещенных фенилом, содержащих от 1 до 4 атомов азота бензоила, бензоилметила, бензилкарбонила, фениламинокарбонила, фенилэтила и феноксикарбонила, и где фенильные части любых из упомянутых выше заместителей могут быть необязательно замещены одним или более заместителями, которые независимо выбирают из галогена, (C1-C3)алкила, (C1-C3)алкокси, нитро, амино,циано, CF3 и OCF3;R1 или R2 могут также быть присоединены к (СН 2)n-группе, образуя 4-7-членное кольцо; и фармацевтически приемлемая соль таких соединений. 2. Соединение по п.1, в котором NR1R2 представляет собой необязательно замещенное пиперидиновое, азетидиновое, пиперазиновое или пирролидиновое кольцо или 3-азабицикло[3.1.0]гекс-6-иламинное кольцо; и где указанные пиперазиновое, азетидиновое, пиперидиновое и пирролидиновое кольца могут быть необязательно замещены одним или более заместителями, предпочтительно заместителями в количестве от 0 до 2, которые независимо выбирают из (C1-C6)алкила, амино, (C1-C6) алкиламино, [ди-(C1-C6)алкил]амино, фенилзамещенных 5-6-членных гетероциклических колец, содержащих от 1 до 4 атомов азота в кольцах, бензоила, бензоилметила, бензилкарбонила,фениламинокарбонила, фенилэтила и феноксикарбонила, и где фенильные части любых из упомянутых выше заместителей могут быть необязательно замещены одним или более заместителями, предпочтительно заместителями в количестве от 0 до 2, которые независимо выбирают из галогена, (C1-C3)алкила, (C1-C3)алкокси,нитро, амино, циано, CF3 и OCF3. 3. Соединение по п.1, в котором NR1R2 образует азабициклическое кольцо, имеющее формулу где R3 и R4 выбирают из водорода, (C1-C6) алкила, фенила, нафтила, (C1-C6)алкил-С(=О)-,НС(=О)-, (C1-C6)алкокси-(С=O)-, фенил-С(=О)-,нафтил-С(=О)- и R6R7NC (=O)-, где R6 и R7 независимо выбирают из водорода и (C1-C6)алкила; и(C1-C6)алкил-. 4. Фармацевтическая композиция для лечения или предотвращения состояния, выбираемого из группы, состоящей из мигрени, воспалительных заболеваний, удара, острой и хронической боли, гиповолемического шока, травматического шока, реперфузионной травмы,болезни Крона, язвенного колита, септического шока, депрессии, болезни Паркинсона, множественного склероза, слабоумия, связанного со СПИДом, нейродегенеративных заболеваний,нейрональной токсичности, болезни Альцгеймера, состояния химической зависимости и привыкания, рвоты, эпилепсии, состояния тревожности, психоза, травмы головы, синдрома респираторного дистресса взрослых (ARDS),индуцированных морфином симптомов толерантности и отмены, воспалительного заболевания кишечника, остеоартрита, ревматоидного артрита, овуляции, дилятационной кардиомиопатии, острой травмы спинного мозга, болезни Хантингтона, глаукомы, дегенерации сетчатки,диабетической нейропатии, диабетической нефропатии и рака у млекопитающего, включающая эффективное количество в отношении лечения или предотвращения такого состояния соединения по п.1 и фармацевтически приемлемый носитель. 5. Способ лечения или предотвращения состояния, выбираемого из группы, состоящей из мигрени, воспалительных заболеваний, удара,острой и хронической боли, гиповолемического шока, травматического шока, реперфузионной 60 травмы, болезни Крона, язвенного колита, септического шока, множественного склероза, слабоумия, связанного со СПИДом, нейродегенеративных заболеваний, нейрональной токсичности, депрессии, болезни Паркинсона, болезни Альцгеймера, состояния химической зависимости и привыкания, рвоты, эпилепсии, состояния тревожности, психоза, травмы головы, синдрома респираторного дистресса взрослых (ARDS),индуцированных морфином симптомов толерантности и отмены, воспалительного заболевания кишечника, остеоартрита, ревматоидного артрита, овуляции, дилятационной кардиомиопатии, острой травмы спинного мозга, болезни Хантингтона, глаукомы, дегенерации сетчатки,диабетической нейропатии, диабетической нефропатии и рака у млекопитающего, включающий введение указанному млекопитающему эффективного количества в отношении лечения или предотвращения такого состояния, соединения по п.1. 6. Фармацевтическая композиция для ингибирования синтазы окиси азота (NOS) у млекопитающего по п.1, включающая эффективное в отношении ингибирования NOS количество соединения по п.1 и фармацевтически приемлемый носитель. 7. Способ ингибирования NOS у млекопитающего, включающий введение указанному млекопитающему эффективного в отношении ингибирования NOS количества соединения по п.1. 8. Фармацевтическая композиция для лечения или предотвращения состояния, выбираемого из группы, состоящей из мигрени, воспалительных заболеваний, удара, острой и хронической боли, гиповолемического шока, травматического шока, реперфузионной травмы,болезни Крона, язвенного колита, септического шока, множественного склероза, слабоумия,связанного со СПИДом, нейродегенеративных заболеваний, нейрональной токсичности, депрессии, болезни Паркинсона, болезни Альцгеймера, состояния химической зависимости и привыкания, рвоты, эпилепсии, состояния тревожности, психоза, травмы головы, синдрома респираторного дистресса взрослых (ARDS),индуцированных морфином симптомов толерантности и отмены, воспалительного заболевания кишечника, остеоартрита, ревматоидного артрита, овуляции, дилятационной кардиомиопатии, острой травмы спинного мозга, болезни Хантингтона, глаукомы, дегенерации сетчатки,диабетической нейропатии, диабетической нефропатии и рака у млекопитающего, включающая эффективное в отношении ингибирования NOS количество соединения по п.1 и фармацевтически приемлемый носитель. 9. Способ лечения или предотвращения состояния, выбираемого из группы, состоящей из мигрени, воспалительных заболеваний, удара,острой и хронической боли, гиповолемического
МПК / Метки
МПК: A61K 31/495, C07D 401/10
Метки: качестве, синтазы, заместителей, содержащие, ингибиторов, 2-аминопиридины, конденсированные, кольца, применяемые
Код ссылки
<a href="https://eas.patents.su/30-3839-2-aminopiridiny-soderzhashhie-v-kachestve-zamestitelejj-kondensirovannye-kolca-primenyaemye-v-kachestve-ingibitorov-nos-no-sintazy.html" rel="bookmark" title="База патентов Евразийского Союза">2-аминопиридины, содержащие в качестве заместителей конденсированные кольца, применяемые в качестве ингибиторов nos (no синтазы)</a>
Предыдущий патент: Способ получения гидразингидрата
Следующий патент: Трубное резьбовое соединение с усиленным упором
Случайный патент: Способ получения (гетеро) ароматических гидроксиламинов