Способ получения (гетеро) ароматических гидроксиламинов
Номер патента: 3733
Опубликовано: 28.08.2003
Авторы: Фогельбахер Уве Йозеф, Хайлиг Манфред, Валь Йозеф, Даун Грегор, Клинтц Ральф, Вингерт Хорст, Гётц Норберт, Веттерих Франк, Кайл Михаэль
Формула / Реферат
1. Способ получения (гетеро)ароматических производных гидроксиламинов формулы I
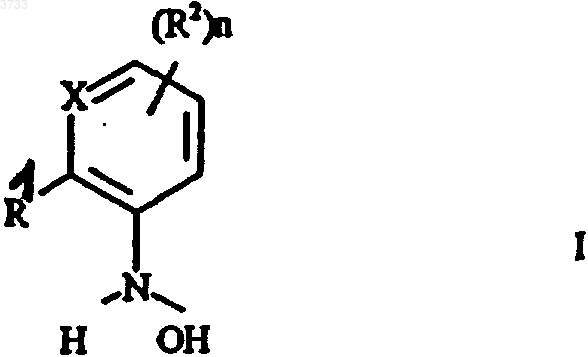
в которой заместители, атом кольца и индекс имеют следующее значение:
R1 обозначает водород, галоген, циано, C1-C4алкил, C1-C4галогеналкил, C1-C4алкокси, C1-C4галогеналкокси, C1-C4алкилтио, C1-C4-алкилкарбонил, C1-C4диалкиламинокарбонил, C1-C4алкилкарбониламино, C1-C4-алкилкарбонил-C1-C6алкиламино, C1-C4алкоксикарбонил, -CH2O-N=C(Ra)-C(Rb)=N-O-Rc, -CH2-O-N=C(Rd)-C1-C4алкил или группу A-B, причем
A обозначает -O-, -CH2-, -O-CH2-, CH2-O-, -CH2-O-CO-, -CH=CH-, -CH=N-O-, -CH2-O-N=C(Ra)- или простую связь и
B обозначает фенил, нафтил, пиридинил, пиразинил, пиримидинил, пиридазинил, пиразолил, имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, 1,2,4-триазолил, 1,2,3-триазолил, фуранил, тиенил, пирролил или C3-C7циклоалкил, причем B может быть замещен посредством 1-3 заместителей Ri;
Ri обозначает водород, галоген, циано, C1-C4алкил, C1-C4-галогеналкил, C1-C4алкокси, C1-C4галогеналкокси, C1-C4-алкилтио, C1-C4алкилкарбонил, C1-C4aлкил-C(Rd)=N-O-C1-C4-алкилен, C1-C4алкоксикарбонил, C1-C4-алкиламинокарбонил, C1-C4диалкиламинокарбокил, C1-C4алкилкарбониламино, C1-C4алкилкарбонил-C1-C4-алкиламино или фенил, который, в свою очередь, может быть замещен галогеном или C1-C4алкилом;
Ra, Rc обозначают водород, галоген, циано, C1-C4алкил, C1-C4-алкокси, C1-C4алкилтио, циклопропил или трифторметил;
Rb обозначает C1-C4алкил, C2-C4алкенил, C3-C6циклоалкил, фенил, гетарил или гетероциклил;
Rd - водород, C1-C4алкил, C2-C4алкенил или C2-C4-алкинил;
R2 обозначает галоген, C1-C4алкил, C1-C4галогеналкил, C1-C4-алкоксикарбонил;
X обозначает N или CH,
n равно 0, 1, 2 или 3, причем остатки R2 могут быть различными, если n имеет значение более 1,
путем гидрирования (гетеро)ароматического нитросоединения общей формулы II
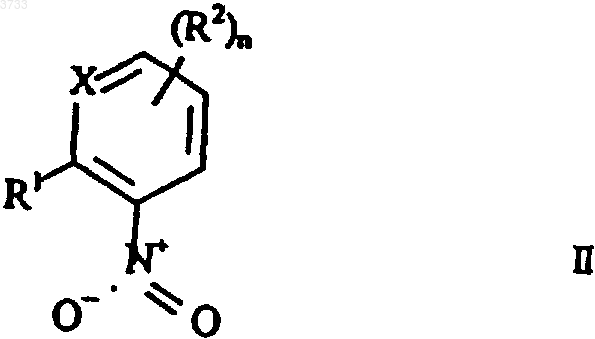
где R1, X и R2 имеют вышеприведенные значения,
в присутствии катализатора гидрирования,
отличающийся тем, что гидрирование проводят в смеси, состоящей из растворителя, выбранного из группы, включающей алифатический и ароматический эфир (например, тетрагидрофуран), алифатический и ароматический углеводород (например, бензол, толуол и хлорбензол), и первичного C1-C4алкиламина, причем катализатором не может служить комплексное соединение Pt-(фенилазо)2 на окиси алюминия.
2. Способ по п.1, получения (гетеро)ароматических соединений формулы I, в которой R1 обозначает -CH2-O-N=C(Ra)-C(Rb)=N-O-Rc, C1-C4-алкил-CRd=N-O-CH2 или группу A-B, причем A, B, Ra, Rb, Rc и Rd, а также R2, X и n имеют приведенное в п.1 значение.
3. Способ по одному из пп.1 или 2, отличающийся тем, что первичный C1-C4алкиламин имеет точку кипения ниже точки кипения растворителя.
4. Способ по одному из пп.1, 2 или 3, отличающийся тем, что гидрирование проводят в смеси из ароматического углеводорода и первичного C1-C4алкиламина.
5. Способ по одному из пп.1, 2 или 3, отличающийся тем, что в качестве катализатора гидрирования применяют палладий или платину в случае необходимости в присутствии носителя на активном угле.
6. Способ по одному из пп.1, 2 или 3, отличающийся тем, что в качестве катализатора гидрирования применяют скелетный никелевый или скелетный кобальтовый катализатор.
7. Способ по одному из пп.1, 2 или 3, отличающийся тем, что первичный C1-C4алкиламин применяют в молярном соотношении от 1 до 15 в пересчете на нитросоединение II.
8. Способ по одному из пп.1, 2 или 3, отличающийся тем, что концентрация первичного C1-C4алкиламина в растворителе составляет от 0,1 до 20 мас.%.
9. Способ получения (гетеро)ароматических производных гидроксиламинов формул III и IV, отличающийся тем, что гидроксиламины формулы I, полученные согласно способу по п.1, после законченного гидрирования и удаления амина дистилляцией или экстракцией без дальнейшей очистки подвергают N-ацилированию с получением соединений формулы III
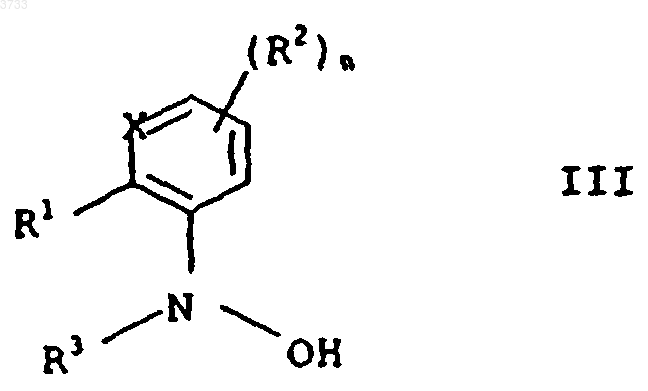
в которой заместители R1 и R2, атом кольца X и индекс n имеют приведенные в п.2 значения и R3 обозначает C1-C4алкоксикарбонил, C1-C4-алкилкарбонил, C1-C4алкиламинокарбонил или ди-(C1-C4-алкил)аминокарбонил, причем N-ацилирование проводят с помощью агента ацилирования R3-L1, в котором L1 обозначает нуклеофильную уходящую группу, такую как галогенид, гидроксид, ангидрид или изоцианат, и после этого, в случае необходимости, подвергают O-алкилированию с получением соединений формулы IV
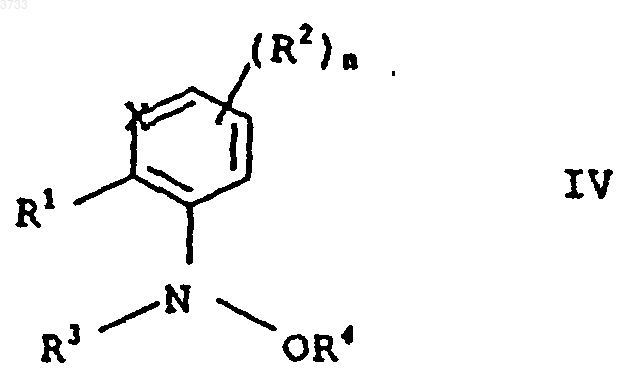
в которой заместители R1, R2 и R3, атом кольца X и индекс n имеют вышеприведенное значение и R4 обозначает C1-C6алкил, с помощью средства алкилирования R4-L2, где L2 обозначает нуклеофильную уходящую группу, такую как галогенид, сульфат или сульфонат.
Текст
1 Настоящее изобретение относится к способу получения (гетеро)ароматических производных гидроксиламинов формулы I в которой заместители, атом кольца и индекс имеют следующее значение:R1 обозначает водород, галоген, циано, С 1 С 4 алкил, С 1-С 4 галогеналкил, С 1-С 4 алкокси, С 1 С 4 галогеналкокси, С 1-С 4 алкилтио, С 1-С 4 алкилкарбонил, С 1-С 4 диалкиламинокарбонил, С 1 С 4 алкилкарбониламино, C1-C4-алкилкарбонилС 1-С 6 алкиламино,С 1-С 4 алкоксикарбонил,-СН 2O-N=C(Ra)-C(Rb)=N-O-Rc, -CH2-O-N=C(Rd)C1-C4 алкил или группу А-В, причем А обозначает -О-, -СН 2-, -O-CH2-, CH2-O-,-СН 2-O-СО-, -СН=СН-, -CH=N-O-, -CH2-ON=C(Ra)- или простую связь и В обозначает фенил, нафтил, пиридинил,пиразинил, пиримидинил, пиридазинил, пиразолил, имидазолил, оксазолил, изоксазолил, тиазолил изотиазолил, 1,2,4-триазолил, 1,2,3 триазолил, фуранил, тиенил, пирролил или С 3 С 7 циклоалкил, причем В может быть замещен посредством 1-3 заместителей Ri;Ri обозначает водород, галоген, циано, С 1 С 4 алкил, C1-C4-галогеналкил, С 1-С 4 алкокси, С 1 С 4 галогеналкокси,C1-C4-алкилтио,С 1 С 4 алкилкарбонил, C1-C4aлкил-C(Rd)=N-O-C1-С 4 алкил, С 1-С 4 алкоксикарбонил, C1-C4-алкиламинокарбонил, С 1-С 4 диалкиламинокарбонил, C1C4-алкилкарбониламино, С 1-С 4 алкилкарбонилС 1-С 4-алкиламино или фенил, который в свою очередь может быть замещен галогеном или С 1 С 4 алкилом;R2 обозначает галоген, С 1-C4 алкил, С 1 С 4 галогеналкил, C1-C4 алкоксикарбонил; Х обозначает N или СН,n равно 0, 1, 2 или 3, причем остатки R4 могут быть различными, если n имеет значение более 1,путем гидрирования (гетеро)ароматического нитросоединения общей формулы II 2 где R1, Х и R2 имеют вышеприведенные значения, в присутствии катализатора гидрирования. Из различных публикаций (DE-A 2455238 и DE-A 2455887) известно получение фенилгидроксиламинов путем каталитического восстановления нитроароматов в присутствии ароматических аминов, таких как пиридин. В патентной заявке DE-A 2357370 и DE-A 2327412 описывается подобный способ получения с помощью гетероциклических аминов, таких как пиперидин. Во всех этих публикациях амин служит одновременно в качестве растворителя. Достигаемый этими известными способами выход продукта после соответствующей переработки и очистки составляет прибл. 50-85%; если же способ проводят в присутствии пиридина,тогда выход в отдельных случаях лежит несколько выше. Однако проведение способа в присутствии пиридина является менее желательным в связи со сложными процессами подготовки (высокая точка кипения, похожие свойства растворения, что и для гидроксиламина), а также в связи с высокими затратами. Подходящий способ получения (гетеро)ароматических гидроксиламинов формулы I по изобретению описывается в DE-A 19502700. Этот способ проводят в присутствии специальных гетероциклических аминов, а именно, Nалкилморфолинов, которые также как и в вышеприведенных публикациях перенимают функцию растворителя. Этот известный способ приводит, правда, к высокому выходу продукта,однако, для полного растворения исходного продукта он требует больших количеств алкилморфолинов и для выделения продукта вследствие образования продуктов присоединения с применяемым алкилморфолином требует также и сложных операций по переработке. Так как алкилморфолины значительно мешают при проведении последующих стадий способа, они должны сильно истощаться путем дистилляции и полностью удаляться на дополнительной стадии экстракции. Высокая термическая нагрузка при часто нестабильных гидроксиламинах приводит к снижению чистоты и выхода продукта. Рециркулированный катализатор гидрирования после небольшого количества циклов теряет свою активность. Связанные с регенерацией катализатора затраты снижают экономичность способа. Из патентной заявки GB-A 1092027 известен способ гидрирования для получения циклогексилгидроксиламинов в присутствии аминов. Наряду с уже упомянутыми гетероциклическими аминами при этом известном способе применяют предпочтительно циклогексиламин,алициклический амин. Добавка протонного растворителя, такого как этанол, приводит в описанных примерах к значительно более низкому выходу продукта. Субстрат другого вида в отношении температуры реакции, применяемого амина и добавляемого в случае необходимости растворителя требует специальных условий(90 С, циклогексиламин, этанол), которые нельзя переносить на гидрирование (гетеро)ароматических нитросоединений. Задача настоящего изобретения заключается в разработке способа получения Nацилированных (гетеро)ароматических гидроксиламинов, который не имеет вышеприведенных недостатков. В соответствие с этим был разработан вышеприведенный способ, заключающийся в том,что гидрирование проводят в смеси, состоящей из растворителя, выбранного из группы, включающей алифатический и ароматический эфир(например, тетрагидрофуран), алифатический и ароматический углеводород (например, бензол,толуол и хлорбензол) и первичного С 1C4 алкиламина первичного С 1-С 4 алкиламина,причем катализатором не может служить комплексное соединение Рt-(фенилазо)2 на окиси алюминия. Неожиданным для способа по изобретению является то, что первичные С 1 С 4 алкиламины обеспечивают хорошие результаты гидрирования, однако, уровень техники ясно указывает на применение (гетеро)ароматических, а также гетероциклических аминов. Кроме того, при применении первичных C1 С 4 алкиламинов в небольшой степени имеет место образование продуктов присоединения с гидроксиламинами. Вследствие этого большая часть амина поддается щадящему удалению дистилляцией или экстракцией. Неожиданным является также и то, что гидрирование в присутствии первичных C1 С 4 алкиламинов можно оптимизировать путем добавки указанных выше неполярных, апотронных растворителей таким образом, что в общем исключается образование нежелательных побочных продуктов и вместе с этим полученная после удаления амина сырая смесь гидрирования может применяться непосредственно в последующих стадиях обработки. 4 И, наконец, неожиданным было то, что катализатор гидрирования при способе по изобретению имел четко более высокую продолжительность службы, чем в способе с Nалкилморфолинами. Способ по изобретению пригоден предпочтительно для получения(гетеро) ароматических соединений формулы I, в которойR , C1-C4-алкил-CRd=N-O-C1-C4-алкил или группу А-В, причем А, В, Ra, Rb, Rc и Rd, также R2, Х и n имеют приведенные в п.1 формулы изобретения значения. В частности, способом по изобретению можно получать названные в WO 96/01256 промежуточные продукты для соединений формулы IIIа и средства защиты растений формулыRf обозначает C1-С 6 алкил, С 2-С 6 алкенил,С 2-С 6 алкинил, необязательно замещенный насыщенный или один или два раза ненасыщенный гетероциклил, необязательно замещенный арил или;R3 и R4 имеют приведенные в п.1 формулы изобретения значения (см. табл. А и В).(азотным ацилированием) полученных способом по изобретению гидроксиламинов I с получением соединений III и последующего Oалкилирования (кислородного алкилирования) с получением соединений IV (см. схему 1). Схема 1 Ацилирование и алкилирование описываются ниже после гидрирования. В способе по изобретению применяются первичные C1-С 4 алкиламины, т.е. применяются алифатические амины, точка кипения которых лежит ниже точки кипения применяемого используемого инертного, апротонного растворителя. Амины вследствие их низкой точки кипения следует удалять дистилляцией. Кроме того,на основе низкой точки кипения амины имеют малую длину алкильной цепи и вследствие этого, как правило, имеют хорошую растворимость в воде, которая позволяет простую экстракцию аминов водой. Итак, для проведения предлагаемого способа применяют первичные C1-С 4 алкиламины. Предпочтительны н-пропиламин, изопропиламин, н-бутиламин и трет.-бутиламин и особенно предпочтителен н-пропиламин. С 1-С 4 алкиламины имеют низкую точку кипения и хорошую растворимость в воде. Кроме того, при дальнейшем превращении гидроксиламинов формулы I в N-ацилированные соединения III, соответственно O-алкилированные соединения IV остаточные количества этих аминов не мешают,в то время как даже очень небольшие количества, например, N-алкилморфолинов при этих последующих реакциях приводят к потерям выхода продукта. Применение С 1-С 4 алкиламинов позволяет дальнейшее упрощение переработки смесей гидрирования и вносит решающий вклад в осуществление способа получения соединенийIII, IV. В качестве инертных, апротонных растворителей применяются, например, алифатические или циклические эфиры, такие как тетрагидрофуран, или предпочтительно алифатические или ароматические углеводороды, такие как бензол,толуол или хлорбензол. Как правило, амин применяется в концентрации от 0,1 до 20 мас.%, предпочтительно от 0,1 до 15 мас.% в растворителе. Правда, возможны более высокие концентрации, однако,они едва приводят к улучшению выхода и селективности и поэтому являются неэкономичными. Выбранный температурный диапазон для гидрирования по изобретению лежит между-20 и +30 С, предпочтительно между -5 и +10 С. Минимальная температура определяется только точкой замерзания применяемого растворителя. Максимальная температура зависит от подлежащих гидрированию нитросоединений и от параметров реакции. Чтобы предотвратить пе 7 регидрирование при температуре, при которой гидрирование проходит достаточно быстро, устанавливается давление, которое лежит между нормальным давлением и избыточным давлением в 10 бар. Обычно водород вводится в реактор гидрирования при нормальном, соответственно слегка повышенном давлении. Для проведения способа по изобретению исходные вещества не должны быть растворены. Реакция в суспензии приводит также к оптимальным результатам. Амин, как правило, применяется в молярном соотношении от 1 до 15 в пересчете на нитросоединение II. В способе по изобретению применяются имеющиеся в продаже катализаторы (за исключением комплексного соединения Рt(фенилазо)2 на окиси алюминия), которые, например, содержат на носителе платину или палладий, или же скелетные никелевые или скелетные кобальтовые катализаторы. Если гидрированию при применении платинового или палладиевого катализатора подвергают исходные вещества, содержащие чувствительные группы,как, например, галогены или бензиловые эфиры,к катализатору в качестве примеси должны быть добавлены сера или селен, чтобы получить достаточную селективность. Катализатор после одного цикла реакции может отфильтровываться и без чувствительной потери активности снова применяться. Предпочтение отдается использованию платиновых или палладиевых катализаторов. Содержание платины, соответственно палладия в катализаторе не является критическим и может варьироваться в широких пределах. Целесообразным является содержание от 0,1 до 15 мас.%, предпочтительно от 0,5 до 10 мас.%, в пересчете на материал носителя. Количество применяемой платины или палладия составляет между 0,001 и 1 мас.%, предпочтительно между 0,01 и 0,1 мас.%, в пересчете на нитросоединение. При прерывном гидрогенизировании катализатор применяется предпочтительно в виде порошка. При одной предпочтительной форме выполнения изобретения способ проводят непрерывно и в качестве катализатора применяют платину или палладий на угле в качестве материала носителя. Возможны также и другие аморфные носители, такие как графит,ВаSO4 или SiC. После окончания реакции большую часть поданного амина дистиллируют или экстрагируют водой. Дистилляцию проводят предпочтительно под азотом, соответственно, под сниженным давлением. При работе с чувствительными гидроксиламинами необходимо следить за полным исключением кислорода. В связи с тем, что обращение с в большинстве чувствительными к кислороду гидроксиламинами в настоящее время связано с трудностями, преимущество может иметь дальнейшая 8 переработка гидроксиламинов формулы I непосредственно после отделения путем экстракции или дистилляции первичного С 1-С 4 алкиламина. При отделении амина дистилляцией преимуществом может являться то, что амин имеет более низкую точку кипения, чем растворитель. Получают раствор гидроксиамина в растворителе,который может подвергаться дальнейшей переработке. Для получения N-ацилированных соединений III и O-алкилированных соединений IV гидроксиламины I непосредственно после отделения алифатического амина дистилляцией или экстракцией без дальнейшей очистки подвергают O-ацилированию с получением соединений формулы III в которой заместители R1 и R2, атом кольца Х и индекс n имеют приведенное в п.2 формулы изобретения значение и R3 обозначает С 1 С 4 алкоксикарбонил, С 1-С 4 алкилкарбонил, С 1 С 4 алкиламинокарбонил или ди-(С 1-С 4-алкил) аминокарбонил, с помощью агента ацилирования R3-L1, в котором L1 обозначает нуклеофильную уходящую группу, такую как галогенид,гидроксид, ангидрид или изоцианат, и потом, в случае необходимости,подвергаютOалкилированию с получением соединений формулы IV в которой заместители R1, R2 и R3, атом кольца Х и индекс n имеют вышеприведенное значение и R4 обозначает C1-С 6 алкил, с помощью алкилирующего средства R4-L2, где L2 обозначает нуклеофильную уходящую группу, такую как галогенид, сульфат или сульфонат. Взаимодействие гидроксиламинов формулы I с агентами ацилирования R3-L1, при которых R3 имеет вышеприведенное значение и L1 означает нуклеофильную уходящую группу,такую как хлорид, происходит, как правило, в щелочных условиях. В качестве агентов ацилирования применяются,например,хлорангидриды,С 1 С 4 алкиловые эфиры хлоругольной кислоты, такие как метиловый эфир хлоругольной кислоты,хлорангидриды С 1-С 4 алканкарбоновой кислоты,хлорангидриды С 1-С 4 алкилкарбоновой кислоты,хлорангидриды ди-C1-С 4 алкилкарбаминовой кислоты, ангидриды или же изоцианаты. 9 Кроме того, в качестве агента ацилирования можно применять также свободные кислоты в соединении со средством конденсации, например, с карбонилдиимидазолом или дициклогексилкарбондиимидом или соответствующие ангидриды в качестве агента ацилирования. Ацилирование проводится в присутствии инертного органического растворителя, который уже применялся при гидрировании, т.е. в присутствии апротонного или ароматического углеводорода, такого как толуол, ксилол, гептан или циклогексан, в присутствии алифатического или циклического эфира, предпочтительно 1,2 диметоксиэтана, тетерагидрофурана или диоксана. Имеется также возможность добавлять к реакционной смеси полярный апротонный растворитель, такой как алифатический кетон,предпочтительно ацетон, амид, предпочтительно диметилформамид или сульфоксид, предпочительно диметилсульфоксид, мочевины, как например, тетраметилмочевину или 1,3 диметилтетерагидро-2(1 Н)-пиримидинон, сложный эфир карбоновой кислоты, как например,этиловый эфир уксусной кислоты, или галогенированный алифатический или ароматический углеводород, как, например, дихлорметан или хлорбензол. Как правило, реакцию проводят в присутствии неорганического основания, такого как гидроокись натрия или калия, карбонат натрия,гидрокарбонат натрия, карбонат калия, гидрокарбонат калия; амина, например, триетиламина, пиридина или N,N-диэтиланилина, или щелочного алкоголята, например, метанолята натрия или этанолята натрия или трет.-бутанолята калия. Основание не обязательно требуется и может быть, в случае необходимости, заменено другими улавливателями кислот, например основными ионообменниками или водой. Температура ацилирования составляет в общем от 0 С и до температуры кипения с обратным холодильником применяемого растворителя, предпочтительно от 0 и до 50 С. Реакция взаимодействия может проводиться в двухфазной системе, состоящей из раствора щелочных или щелочно-земельных гидроксидов или карбонатов в воде и из органической фазы. В качестве катализатора обмена фаз при этом применяют, например, галогениды и тетрафторобораты аммония, а также галогениды фосфония. Особенно предпочтительны хлорид тетрабутиламмония и хлорид бензилтриэтиламмония. Алкилирование проводится обычно в инертном растворителе или разбавителе, предпочтительно в присутствии основания. В качестве растворителя или разбавителя пригодны, например, приведенные для ацилирования растворители или разбавители. Для алкилирования применяют обычно галогенид, предпочтительно хлорид или бромид,сульфат,предпочтительно диметилсульфт,сульфонат, метансульфонат (мезилат), бензо 003733 10 сульфонат, о-толуолсульфонат (тозилат) или пбромбензолсульфонат (брозилат) или трифторметансульфонат (трифлат) или диазосоединение алкана. В качестве основания пригодны неорганические основания, например, карбонаты, такие как карбонат калия или карбонат натрия, или гидрокарбонаты, такие как гидрокарбонат калия или натрия, или гидроокиси, такие как гидроокиси калия или натрия, гидриды щелочных металлов, такие как гидрид калия или гидрид натрия, или органические основания, такие как амины, например, триэтиламин, пиридин илиN,N-диэтиламин, или щелочные алкоголяты,такие как например, диэтиланилин, или щелочные алкоголяты, такие как метанолят натрия или этанолят натрия или трет.-бутанолят калия. Предпочтительно смешивают средство алкилирования (например, диметилсульфат) и Nацилированный гидроксиламин III и добавляют основание (например, гидроокись калия). Количество основания, соответственно,средства алкилирования предпочтительно лежит между полумолярным и двойным молярным количеством в пересчете на количество соединения III. В частности, предпочтительны основания, соответственно, средства алкилирования в слегка избыточном количестве. В общем температура реакции алкилирования составляет от -78 С и до точки кипения реакционной смеси, предпочтительно от 0 и до 100 С и особенно предпочтительно от 60 до 90 С. Алкилирование можно проводить так же как и ацилирование в двухфазной системе. При этом могут применяться вышеупомянутые катализаторы разделения фаз. Ниже способ по изобретению поясняется с помощью примеров выполнения. Пример 1. N-гидрокси-N-2-[N'-(п-хлорфенил)пиразолил-3'-оксиметил]анилин. а). Гидрирование посредством нпропиламина в толуоле с катализатором Pt/C. В колбу вместимостью в 750 мл с трубкой для ввода газа при перемешивании подают 60 г(182 ммоль) 2-[N-(п-хлорфенил)пиразолил-3'оксиметил]нитробензола в 700 мл толуола. После охлаждения до прибл. 5 С добавляют 72,8 г(14 мас.% в пересчете на толуол) нпропиламина и 33 г платины на угле 2,5% и реакционный сосуд прополаскивают при 5 С водородом. Гидрирование производят при постоянном давлении водорода в 100 бар. Реакция заканчивается через 2 ч по данным хроматографичекого анализа ЖХВД. После прополаскивания реакционного сосуда азотом н-пропиламин отгоняют под вакумом при 100-150 мбар и 4050 С. Получают 430 мл толуольного раствора,который по анализу ЖХВД содержит 54,8 г Nгидрокси-N-2-[N'-(п-хпорфенил)пиразол-3 оксиметил]анилина (выход 93,4%). 11 б). Гидрирование посредством нпропиламина в толуоле с катализатором Pt/SiC. Гидрирование осуществляют при применении в качестве катализатора 1% Pt на SiC в условиях примера 1 а. После отделения катализатора получают описанный в примере 1 а гидроксиламид с выходом в 94,2%. в). Гидрирование посредством нбутиламина в хлорбензоле. Раствор из 19 г (57 ммоль) 2-[N-(пхлорфенил)пиразолил-3'-оксиметил]нитробензола в 500 мл хлорбензола смешивают с 42 гXRS/W фирмы Дегусса). После охлаждения до прибл. 5 С и промывания азотом и водородом гидрируют при температуре от 5 до 7 С и константном давлении в 100 мбар. Реакция заканчивается согласно анализу ЖХВД через 35 мин. После промывания реакционного сосуда азотом катализатор отфильтровывают и реакционный раствор концентрируют в вакууме при 40 С и 30-400 мбар. Получают 16,7 г остатка, который согласно анализу ЖХВД содержит 94,4 мас.% целевого соединения, что соответствует выходу в 87%. Пример 2. Получение сложного метилового эфира N-гидрокси-N-(2-[N'-(п-хлорфенил) пиразолил-3'-оксиметил]фенил)карбаминовой кислоты. а). N-гидрокси-N-2-[N'-(п-хлорфенил)пиразолил-3'-оксиметил]анилин соответствует примеру 1 а. б). Сложный метиловый эфир N-гидроксиN-(2-[N'-(п-хлорфенил)пиразолил-3'-оксиметил]фенил)карбаминовой кислоты. К полученному дистилляцией толуольному раствору подают при 30 С под азотом 51 г толуола и 33 г воды. К полученной эмульсии при интенсивном перемешивании в течение 2 ч подают 19 г (0,19 моль) метилового эфира хлоругольной кислоты. После перемешивания в течение еще 2,5 ч при 30 С остаток отфильтровывают при 15 С и сушат в вакууме при 40 С. Получают 59,7 г целевого соединения (по 1H-ЯМР 95 мас.%), что соответствует выходу продукта в 88% на обоих стадиях. Пример 3 (сравнительный пример). Проводят следующие сравнительные опыты получения N-гидрокси-N-2-[N'-(п-хлорфенил)пиразолил-3'-оксиметил]анилина. а) Взаимодействие с первичным амином в качестве растворителя. К раствору из 15 г (45 ммоль) 2-[N-(пхлорфенил)пиразолил-3-оксиметил]нитробензола в 261 г н-пропиламина после добавки 1,2 гPt/C 5% (F 105 XRS/W 55 фирмы Дегусса) и инертизирования азотом и промывки водородом при 0 С подают при температуре от 0 до 5 С и 100 мбар избыточного давления в течение 25 мин необходимое теоретически для полного превращения количество водорода. Анализ ЖХВД реакционного раствора показал наряду 12 со следами исходного материала и прибл. 55 мас.% желаемого продукта еще ок. 22 мас.% азоксисоединения с молярной массой 614. б) Взаимодействие с растворителем без амина. 15 г (45 ммоль) 2-[N-(п-хлорфенил) пиразолил-3-оксиметил]нитробензол растворяют в 350 мл толуола и смешивают с 1,2 г Pt/C 5% (F 105 XRS/W 55 фирмы Дегусса). После инертизирования и промывания водородом при 0 С проводят гидрирование при температуре от 0 до 5 С и 100 мбар избыточного давления в течение 3 ч. После этого было обнаружено еще ок. 90% исходного материала и ок. 10% желаемого продукта. Опыт прерывают. в) Взаимодействие с N-метилморфолином(аналогично DE-A 19502700). К раствору из 120 г 2-[N-(п-хлорфенил) пиразолил-3-оксиметил]нитробензола и 10 г активного угля в 2,2 л N-метилморфолина при прибл. 20 С подают 10 г катализатора Pt/C (F 105 XRS/W 55 фирмы Дегусса). После промывки азотом и водородом производят гидрирование при температуре от 20 до 30 С и константном давлении водорода в 100 мбар в течение прибл. 2,5 ч. После этого катализатор отфильтровывают и реакционную смесь концентрируют в вакууме при 50 С и 20 мбар. Для вытеснения оставшегося количества N-метилморфолина подают ок. 700 мл бензина 186-213 и в случае необходимости снова концентрируют при 5060 С и 0,5 мбар. Полученный продукт растворяют в 85 мл метанола и охлаждают до 0 С. Полученный осадок отсасывают и сушат при 30 С в вакууме. Получают 92,7 г желаемого продукта(согласно анализу ЖХВД 95 мас.%-ного), что соответствует выходу в 81%. Пример 4 (сравнительный пример аналогично DE-A 19502700). Получение сложного метилового эфираN-гидрокси-N-(2-[N'-(пхлорфенил)пиразолил-3'-оксиметил]фенил) карбаминовой кислоты. а) N-гидрокси-N-2-[N'-(п-хлорфенил)пиразолил-3'-оксиметил]анилин соответствует примеру 3 в. б) Сложный метиловый эфир N-гидроксиN-(2-[N'-(п-хлорфенил)пиразолил-3'-оксиметил] фенил)карбаминовой кислоты. Реакцию взаимодействия проводят в соответствии с примером 2 б) и получают выход продукта в 93%. На обеих стадиях получают,таким образом, выход в 75%. Пример 5. N-(2-толуол)гидроксиламин. Гидрирование в присутствии н-пропиламина. В колбе для гидрирования вместимостью 1,5 л с трубкой ввода газа смешивают 41,1 г (0,3 моль) о-нитротолуола в 600 мл толуола с 5,1 г активного угля. После охлаждения до прибл. от 5 до 8 С добавляют 67,4 г (1,1 моль) нпропиламина и 3 г платины на угле 5% (CF 105XRS фирмы Дегусса) и промывают колбу при 5 С азотом и потом водородом. Гидрирование 13 производят при констатном давлении водорода в 100 мбар. Реакция заканчивается согласно анализу ЖХВД через 100 мин. После промывки колбы азотом амин отгоняют при 60 С. Согласно анализу ЖХВД N-(2 толуол)гидроксиламин имеется в растворе с чистотой в 98-99%. Пример 6 (сравнительный опыт). N-(2 толуол)гидроксиламин. Гидрирование в присутствии N-метилморфолина. Суспензию из 411 г (3 моль) 2 нитротолуола и 15 г плаины на активном угле (F 105 XRS/W 5% фирмы Дегусса) в 2,8 л 4 метилморфолина промывают при 0 С сначала азотом и потом водородом. Реакцию проводят при 100 мбар избыточного давления. Через 13 ч реакция взаимодействия заканчивается. После промывки азотом и отфильтровывания катализатора раствор отгоняют под вакуумом при от 45 до 50 С. Остаток загружают в 2 л метиленхлорида/воды (1:1) и водную фазу после подкисления соляной кислотой экстрагируют метиленхлоридом. После сушки органической фазы и отгонки растворителя остаток дигидрируют в пентане. Отфильтровывают и промывают. Получают 305 г целевого соединения в качестве 89Gew.-%-го продукта (по анализу ЖХВД). Пример 7. Неожиданно лучшую пригодность реакционного раствора с остатками амина из способа по изобретению для непосредственного взаимодействия продукта реакции со сложным метиловым эфиром хлоругольной кислоты можно видеть на следующих опытах. Сложный метиловый эфир N-гидрокси-N(2-[N'-(п-хлорфенил)пиразолил-3'-оксиметил] фенил)карбоминовой кислоты.I) В присутствии н-пропиламина согласно изобретению. К суспензии из 10 г N-гидрокси-N-(2-[N'(п-хлорфенил)пиразолил-3'-оксиместил]анилина в 140 мл толуола подают 1,4 мл н-пропиламина. После этого добавляют 3,13 г гидрокарбоната натрия и в течение 10 мин 3,1 г сложного метилового эфира хлоругольной кислоты. После перемешивания в течение прибл. 14 ч при прибл. 20 С отсасывают твердое вещество и после промывки водой сушат в вакууме. Получают 10,8 г целевого соединения (по анализу 1H-ЯМР 95 мас.%-ого), что соответствует выходу в 94%.II) Аналогично DE-A 19502700 в присутствии N-метилморфолина. Опыт повторяют при добавке 1,4 мл Nметилморфолина при описанных в примере 7.I условиях. После осаждения, промывки и сушки остатка получают получают 8 г целевого соединения (согласно анализу 1H-ЯМР 95 маc.%ого), что соответствует выходу в 69%. Ацилирование проявляет себя неожиданно нечувствительным к присутствию прибл. 10 мас.% н-пропиламина, в то время как добавка 14 соответствующего количества N-метилморфолина приводит к четкому снижению выхода продукта. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения(гетеро)ароматических производных гидроксиламинов формулы I в которой заместители, атом кольца и индекс имеют следующее значение:R1 обозначает водород, галоген, циано, С 1 С 4 алкил, С 1-С 4 галогеналкил, C1-С 4 алкокси, С 1 С 4 галогеналкокси,С 1-С 4 алкилтио,С 1-С 4 алкилкарбонил, С 1-С 4 диалкиламинокарбонил,С 1-С 4 алкилкарбониламино, С 1-С 4-алкилкарбонил-С 1-С 6 алкиламино, С 1-С 4 алкоксикарбонил,-CH2O-N=C(Ra)-C(Rb)=N-O-Rc, -СН 2-O-N=C(Rd)C1-C4 алкил или группу А-В, причем А обозначает -О-, -СН 2-, -O-СН 2-, CH2-O-,-CH2-O-CO-, -СН=СН-, -СН=N-O-, -CH2-ON=C(Ra)- или простую связь и В обозначает фенил, нафтил, пиридинил,пиразинил, пиримидинил, пиридазинил, пиразолил, имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, 1,2,4-триазолил, 1,2,3 триазолил, фуранил, тиенил, пирролил или С 3 С 7 циклоалкил, причем В может быть замещен посредством 1-3 заместителей Ri;Ri обозначает водород, галоген, циано, С 1 С 4 алкил, С 1-С 4-галогеналкил, С 1-С 4 алкокси, С 1 С 4 галогеналкокси, С 1-С 4-алкилтио, С 1-С 4 алкилкарбонил,C1-C4aлкил-C(Rd)=N-O-C1-C4-aлкилeн, C1-С 4 алкоксикарбонил, C1-C4-алкиламинокарбонил, С 1-С 4 диалкиламинокарбокил, С 1-C4 алкилкарбониламино, С 1-С 4 алкилкарбонил-С 1 С 4 алкиламино или фенил, который, в свою очередь, может быть замещен галогеном или С 1 С 4 алкилом;R2 обозначает галоген, С 1-С 4 алкил, С 1 С 4 галогеналкил, С 1-С 4 алкоксикарбонил; Х обозначает N или СН,n равно 0, 1, 2 или 3, причем остатки R2 могут быть различными, если n имеет значение более 1,путем гидрирования (гетеро)ароматического нитросоединения общей формулы II где R1, X и R2 имеют вышеприведенные значения,в присутствии катализатора гидрирования,отличающийся тем, что гидрирование проводят в смеси, состоящей из растворителя, выбранного из группы, включающей алифатический и ароматический эфир (например, тетрагидрофуран), алифатический и ароматический углеводород (например, бензол, толуол и хлорбензол), и первичного С 1-C4 алкиламина, причем катализатором не может служить комплексное соединение Pt-(фенилазо)2 на окиси алюминия. 2. Способ по п.1, получения (гетеро)ароматических соединений формулы I, в которой R1 обозначает -CH2-O-N=C(Ra)-C(Rb)=NO-Rc, C1-C4-aлкил-CRd=N-O-CH2 или группу АВ, причем А, В, Ra, Rb, Rc и Rd, а также R2, Х и n имеют приведенное в п.1 значение. 3. Способ по одному из пп.1 или 2, отличающийся тем, что первичный С 1-C4 алкиламин имеет точку кипения ниже точки кипения растворителя. 4. Способ по одному из пп.1, 2 или 3, отличающийся тем, что гидрирование проводят в смеси из ароматического углеводорода и первичного С 1-С 4 алкиламина. 5. Способ по одному из пп.1, 2 или 3, отличающийся тем, что в качестве катализатора гидрирования применяют палладий или платину в случае необходимости в присутствии носителя на активном угле. 6. Способ по одному из пп.1, 2 или 3, отличающийся тем, что в качестве катализатора гидрирования применяют скелетный никелевый или скелетный кобальтовый катализатор. 7. Способ по одному из пп.1, 2 или 3, отличающийся тем,что первичный С 1 С 4 алкиламин применяют в молярном соотношении от 1 до 15 в пересчете на нитросоединение 16 8. Способ по одному из пп.1, 2 или 3, отличающийся тем, что концентрация первичного С 1-С 4 алкиламина в растворителе составляет от 0,1 до 20 мас.%. 9. Способ получения (гетеро)ароматических производных гидроксиламинов формул III и IV, отличающийся тем, что гидроксиламины формулы I, полученные согласно способу по п.1, после законченного гидрирования и удаления амина дистилляцией или экстракцией без дальнейшей очистки подвергают Nацилированию с получением соединений формулы IIIR3 обозначает С 1-С 4 алкоксикарбонил, С 1-С 4 алкилкарбонил, С 1-С 4 алкиламинокарбонил или ди-(С 1-С 4 алкил)аминокарбонил, причем Nацилирование проводят с помощью агента ацилирования R3-L1, в котором L1 обозначает нуклеофильную уходящую группу, такую как галогенид, гидроксид, ангидрид или изоцианат, и после этого, в случае необходимости, подвергают O-алкилированию с получением соединений формулы IV в которой заместители R1, R2 и R3, атом кольца Х и индекс n имеют вышеприведенное значение и R4 обозначает C1-С 6 алкил, с помощью средства алкилирования R4-L2, где L2 обозначает нукпеофильную уходящую группу, такую как галогенид, сульфат или сульфонат.
МПК / Метки
МПК: C07C 239/10, C07D 231/20
Метки: способ, получения, гидроксиламинов, гетеро, ароматических
Код ссылки
<a href="https://eas.patents.su/9-3733-sposob-polucheniya-getero-aromaticheskih-gidroksilaminov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения (гетеро) ароматических гидроксиламинов</a>
Предыдущий патент: Фармацевтические композиции, содержащие микронизированные бициклические лекарственные средства
Следующий патент: Нейротрофические факторы
Случайный патент: Разделительный элемент для отделения нижней части ванны от остальной ванны












