2-амино-6-(2-замещенные-4-фенокси)-замещенные-пиридины в качестве ингибиторов синтазы окиси азота
Номер патента: 3834
Опубликовано: 30.10.2003
Авторы: Волкманн Роберт Альфред, Лауэ Джон Адамс III, Новаковски Йоланта
Формула / Реферат
1. Соединение формулы
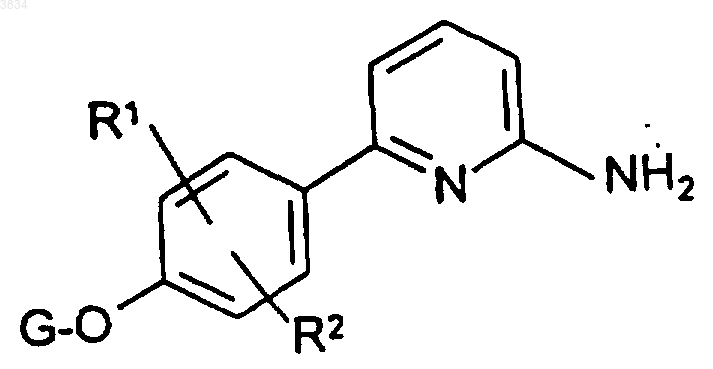
где R1 и R2 выбраны независимо из группы, включающей водород, галоид, гидрокси, (C1-C6)алкокси, (C1-C7)алкил, (C2-C6)алкенил, (C2-C10)алкоксиалкил;
G выбирают из группы, включающей водород, (C1-C6)алкил, (C1-C6)алкокси(C1-C3)алкил, аминокарбонил-(C1-C3)алкил-, (C1-C3)алкиламинокарбонил-(C1-C3)алкил-, ди-[(C1-C3)алкил]аминокарбонил-(C1-C3)алкил и N(R3)(R4)(C0-C4)алкил-, где R3 и R4 независимо выбирают из группы, включающей водород, (C1-C7)алкил, тетрагидронафталин и аралкил, где арильный остаток указанного аралкила представляет собой фенил или нафтил, а алкильный остаток является прямым или разветвленным и содержит 1-6 атомов углерода, и где указанный (C1-C7)алкил и указанный тетрагидронафталин, а также арильный остаток указанного аралкила могут быть необязательно замещены 1-3 заместителями, предпочтительно 0-2 заместителями, независимо выбранными из группы, включающей галоид, нитро, гидрокси, циано, амино, (C1-C4)алкокси и (C1-C4)алкиламино;
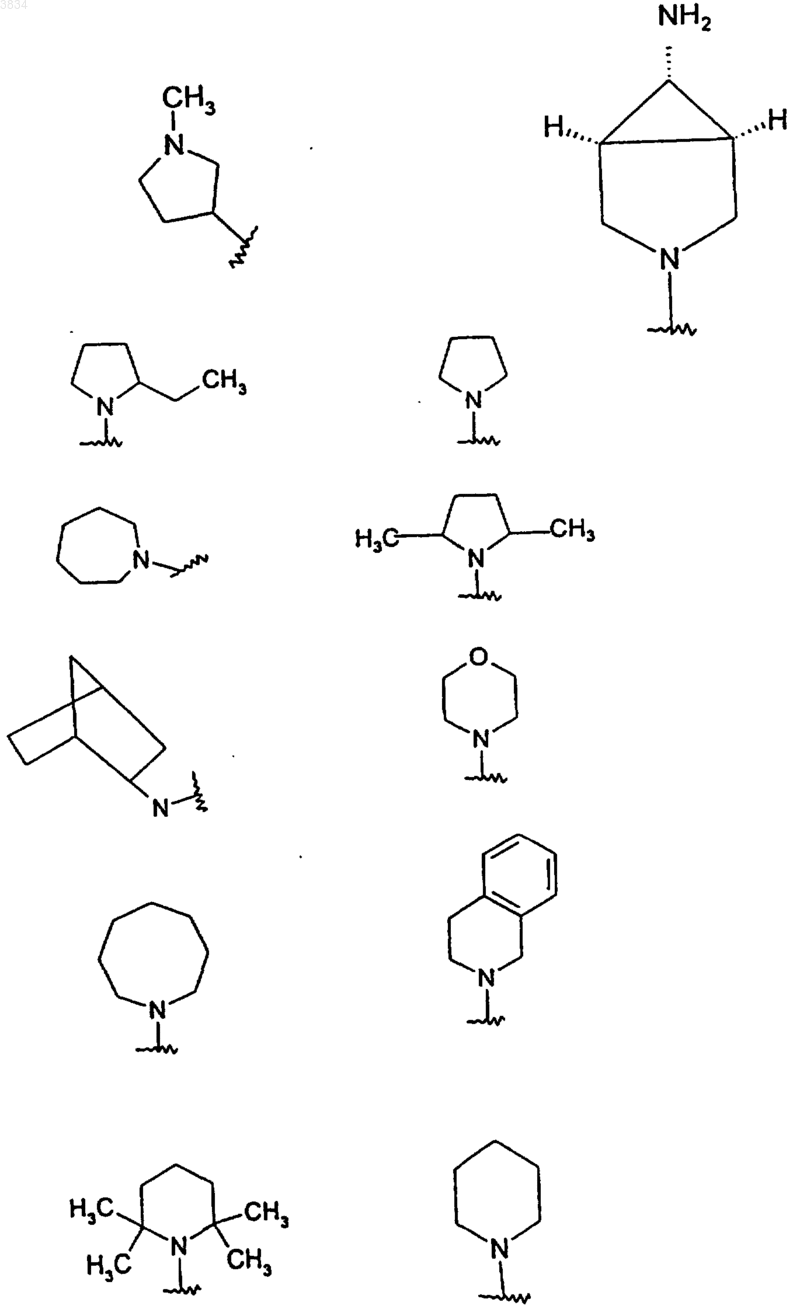
или R3 и R4 вместе с азотом, к которому они присоединены, образуют пиперазиновое, пиперидиновое, азетидиновое или пирролидиновое кольцо, либо насыщенную или ненасыщенную азабициклическую кольцевую систему, содержащую 6-14 членов в кольце, из которых 1-3 представляют собой азот, 0-2 - кислород, а остальное - углерод;
и где указанные пиперазиновые, пиперидиновые, азетидиновые и пирролидиновые кольца и указанные азабициклические кольцевые системы могут быть необязательно замещены одним или несколькими заместителями, предпочтительно 0-2 заместителями, независимо выбранными из группы, включающей (C1-C6)алкил-, амино, (C1-C6)алкиламино, [ди-(C1-C6)алкил]амино, замещенные фенилом 5-6-членные гетероциклические кольца, содержащие в кольце 1-4 атомов азота, бензоил, бензоилметил, бензилкарбонил, фениламинокарбонил, фенилэтил и феноксикарбонил, и где фенильные остатки любых из вышеуказанных заместителей могут быть необязательно замещены одним или несколькими заместителями, предпочтительно 0-2 заместителями, независимо выбранными из группы, включающей галоид, (C1-C3)алкил, (C1-C3)алкокси, нитро, амино, циано, CF3 и OCF3;
и где указанные пиперазиновые, пиперидиновые, азетидиновые и пирролидиновые кольца, а также указанные азабициклические кольцевые системы могут быть присоединены к -(C0-C4)алкил-O- (где кислород указанного -(C0-C4)алкил-O- представляет собой атом кислорода, указанный в структурной формуле I) через атом азота кольца NR3R4 или любой другой атом такого кольца, имеющий доступный связывающий сайт;
или G - группу формулы A
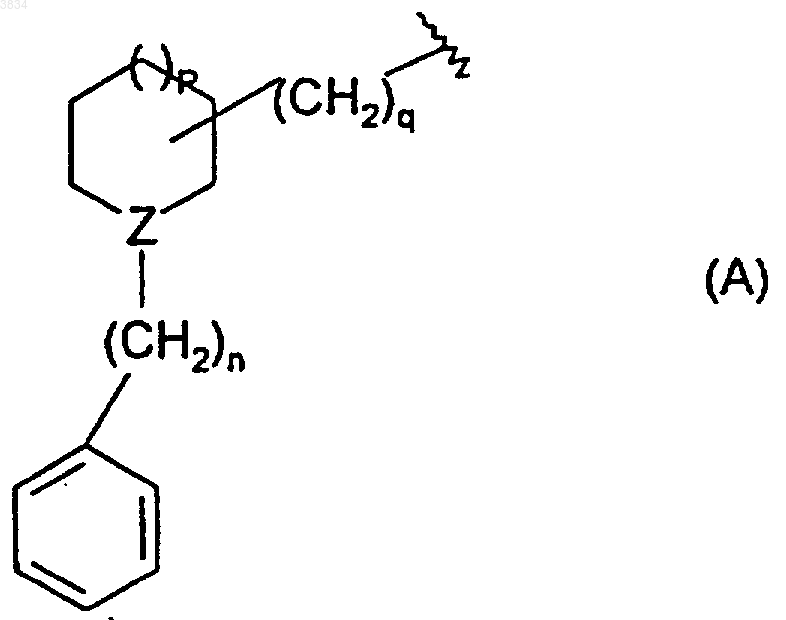
где Z - азот или CH, n = 0 или 1, q =0, 1, 2 или 3 и p =0, 1 или 2;
и где 2-аминопиперидиновое кольцо, указанное выше в структуре I, может быть необязательно замещено кольцом
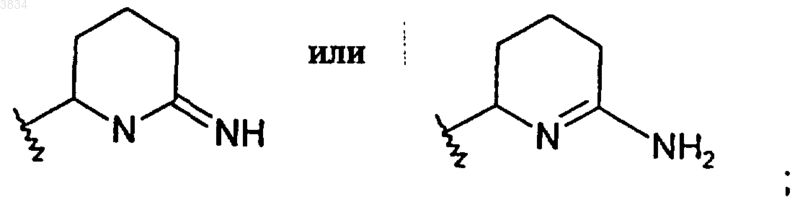
или фармацевтически приемлемая соль такого соединения.
2. Соединение по п.1, в котором G представляет NR3R4(C0-C4)алкил, а NR3R4 представляет пиперидиновое, пиперазиновое и пирролидиновое кольцо.
3. Соединение по п.1, в котором R1 и R2 выбирают из водорода и (C1-C2)алкила.
4. Соединение по п.1, в котором G представляет NR3R4(C0-C4)алкил, а NR3R4 представляет группу формулы
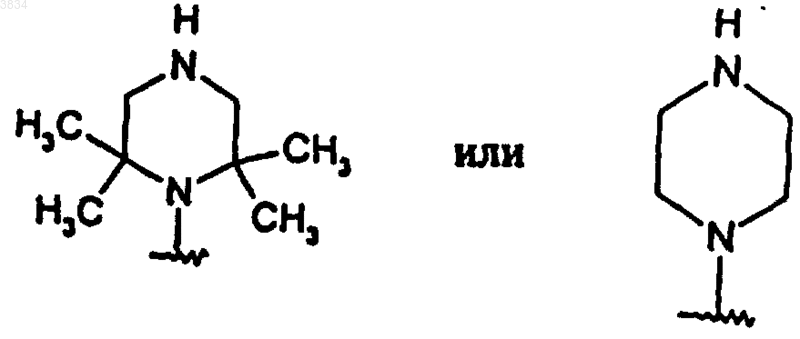
5. Соединение по п.1, в котором G представляет группу формулы A, а Z означает азот.
6. Соединение по п.1, в котором G представляет группу формулы A, а Z означает азот, каждый из n и p = 1, а q = 2.
7. Фармацевтическая композиция для лечения или профилактики состояния, включающего мигрень, воспалительные заболевания, удар, острую и хроническую боль, гиповолемический шок, травматический шок, реперфузионную травму, болезнь Крона, неспецифический язвенный колит, септический шок, рассеянный склероз, СПИД-ассоциированное слабоумие, нейродегенеративные заболевания, нейронную токсичность, болезнь Альцгеймера, химические зависимости и аддикции, рвоту, эпилепсию, тревогу, психоз, травму головы, респираторный дистресс-синдром у взрослых, морфино-индуцированную толерантность и абстинентные симптомы, воспалительные заболевания кишечника, остеоартрит, ревматоидный артрит, овуляцию, дилатированную кардиомиопатию, острые травмы позвоночника, болезнь Хантингтона, болезнь Паркинсона, глаукому, макулярную дегенерацию, диабетическую нейропатию, диабетическую нефропатию и рак у млекопитающих, включающая соединение по п.1 в количестве, эффективном для лечения или профилактики такого состояния, и фармацевтически приемлемый носитель.
8. Способ лечения или профилактики состояния, связанного с избытком окиси азота, продуцируемым синтазой окиси азота, входящего в группу, включающую мигрень, воспалительные заболевания, удар, острую и хроническую боль, гиповолемический шок, травматический шок, реперфузионную травму, болезнь Крона, неспецифический язвенный колит, септический шок, рассеянный склероз, СПИД-ассоциированное слабоумие, нейродегенеративные заболевания, нейронную токсичность, болезнь Альцгеймера, химические зависимости и аддикции, рвоту, эпилепсию, тревогу, психоз, травму головы, респираторный дистресс-синдром у взрослых, морфино-индуцированную толерантность и абстинентные симптомы, воспалительные заболевания кишечника, остеоартрит, ревматоидный артрит, овуляцию, дилатированную кардиомиопатию, острые травмы позвоночника, болезнь Хантингтона, болезнь Паркинсона, глаукому, макулярную дегенерацию, диабетическую нейропатию, диабетическую нефропатию и рак у млекопитающих, включающий соединение по п.1 в количестве, эффективном для лечения или профилактики такого состояния.
9. Фармацевтическая композиция для ингибирования синтазы окиси азота (NOS) у млекопитающих по п.1, включающая соединение по п.1 в количестве, эффективном для ингибирования синтазы окиси азота, и фармацевтически приемлемый носитель.
10. Способ ингибирования синтазы окиси азота у млекопитающих, включающий введение указанным млекопитающим эффективного количества соединения по п.1, ингибирующего синтазу окиси азота.
11. Фармацевтическая композиция для лечения и профилактики состояния, включающего мигрень, воспалительные заболевания, удар, острую и хроническую боль, гиповолемический шок, травматический шок, реперфузионную травму, болезнь Крона, неспецифический язвенный колит, септический шок, рассеянный склероз, СПИД-ассоциированное слабоумие, нейродегенеративные заболевания, нейронную токсичность, болезнь Альцгеймера, химические зависимости и аддикции, рвоту, эпилепсию, тревогу, психоз, травму головы, респираторный дистресс-синдром у взрослых, морфино-индуцированную толерантность и абстинентные симптомы, воспалительные заболевания кишечника, остеоартрит, ревматоидный артрит, овуляцию, дилатированную кардиомиопатию, острые травмы позвоночника, болезнь Хантингтона, болезнь Паркинсона, глаукому, макулярную дегенерацию, диабетическую нейропатию, диабетическую нефропатию и рак у млекопитающих, включающая соединение по п.1 в количестве, эффективном для ингибирования синтазы окиси азота, и фармацевтически приемлемый носитель.
12. Способ лечения шыш профилактики состояния, связанного с избытком окиси азота, продуцируемым синтазой окиси азота, включающего мигрень, воспалительные заболевания, удар, острую и хроническую боль, гиповолемический шок, травматический шок, реперфузионную травму, болезнь Крона, неспецифический язвенный колит, септический шок, рассеянный склероз, СПИД-ассоциированное слабоумие, нейродегенеративные заболевания, нейронную токсичность, болезнь Альцгеймера, химические зависимости и аддикции, рвоту, эпилепсию, тревогу, психоз, травму головы, респираторный дистресс-синдром у взрослых, морфино-индуцированную толерантность и абстинентные симптомы, воспалительные заболевания кишечника, остеоартрит, ревматоидный артрит, овуляцию, дилатированную кардиомиопатию, острые травмы позвоночника, болезнь Хантингтона, болезнь Паркинсона, глаукому, макулярную дегенерацию, диабетическую нейропатию, диабетическую нефропатию и рак у млекопитающих, включающий введение указанным млекопитающим эффективного количества соединения по п.1, ингибирующего синтазу окиси азота.
13. Соединение формулы
где R1 и R2 выбраны независимо из группы, включающей водород, галоид, гидрокси, (C1-C6)алкокси, (C1-C7)алкил, (C2-C6)алкенил, (C2-C10)алкоксиалкил; и
G выбирают из группы, включающей водород, (C1-C6)алкил, (C1-C6)алкокси-(C1-C3)алкил, аминокарбонил-(C1-C3)алкил-, (C1-C3)алкиламинокарбонил-(C1-C3)алкил-, ди-[(C1-C3)алкил]аминокарбонил-(C1-C3)алкил и N(R3)(R4)(C0-C4)алкил-, где R3 и R4 независимо выбирают из группы, включающей водород, (C1-C7)алкил, тетрагидронафталин и аралкил, где арильный остаток указанного аралкила представляет собой фенил или нафтил, а алкильный остаток является прямым или разветвленным и содержит 1-6 атомов углерода, и где указанный (C1-C7)алкил и указанный тетрагидронафталин, а также арильный остаток указанного аралкила могут быть необязательно замещены 1-3 заместителями, предпочтительно 0-2 заместителями, независимо выбранными из группы, включающей галоид, нитро, гидрокси, циано, амино, (C1-C4)алкокси и (C1-C4)алкиламино;
или R3 и R4 вместе с азотом, к которому они присоединены, образуют пиперазиновое, пиперидиновое, азетидиновое или пирролидиновое кольцо, либо насыщенную или ненасыщенную азабициклическую кольцевую систему, содержащую в кольце 6-14 членов, из которых 1-3 представляют собой азот, 0-2 - кислород, а остальное - углерод;
и где указанные пиперазиновые, пиперидиновые, азетидиновые и пирролидиновые кольца и указанные азабициклические кольцевые системы могут быть необязательно замещены одним или несколькими заместителями, предпочтительно 0-2 заместителями, независимо выбранными из группы, включающей (C1-C6)алкил-, амино, (C1-C6)алкиламино, [ди-(C1-C6)алкил] амино, замещенные фенилом 5-6-членные гетероциклические кольца, содержащие в кольце 1-4 атомов азота, бензоил, бензоилметил, бензилкарбонил, фениламинокарбонил, фенилэтил и феноксикарбонил, и где фенильные остатки любых из вышеуказанных заместителей могут быть необязательно замещены одним или несколькими заместителями, предпочтительно 0-2 заместителями, независимо выбранными из группы, включающей галоид, (C1-C3)алкил, (C1-C3)алкокси, нитро, амино, циано, CF3 и OCF3;
и где указанные пиперазиновые, пиперидиновые, азетидиновые и пирролидиновые кольца, а также указанные азабициклические кольцевые системы могут быть присоединены к -(C0-C4)алкил-O- (где кислород указанного -(C0-C4)алкил-O- представляет собой атом кислорода, указанный в структурной формуле I) через атом азота кольца NR3R4 или любой другой атом такого кольца, имеющий доступный связывающий сайт;
или G - группу формулы A
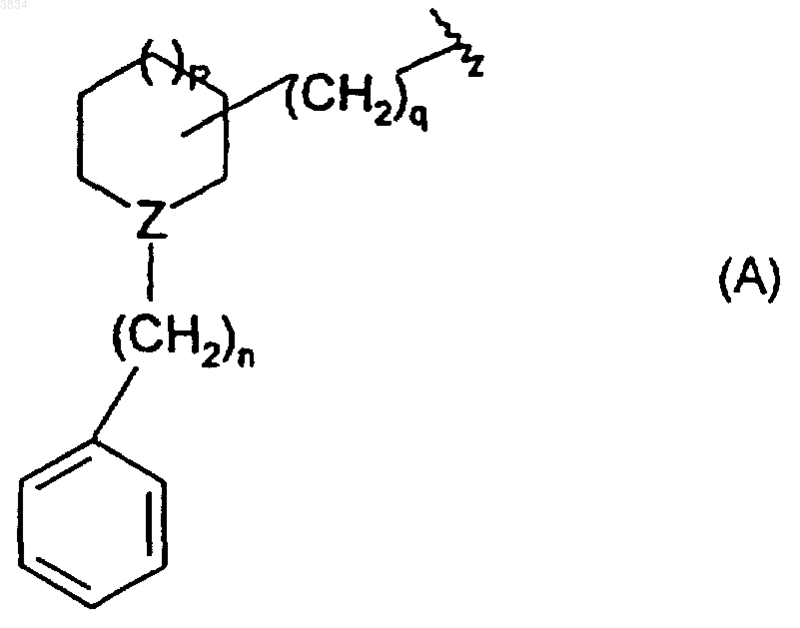
где Z - азот или CH, n = 0 или 1, q = 0, 1, 2 или 3 и р = 0, 1 или 2;
и где 2-аминопиперидиновое кольцо, указанное выше в структуре I, может быть необязательно замещено кольцом
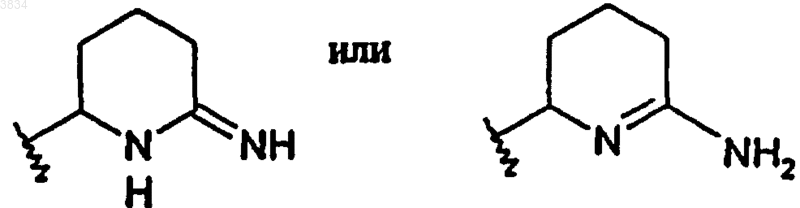
а P представляет группу, защищающую азот, такую как тритил, ацетил, бензоил, триметилацетил, трет-бутоксикарбонил, бензилоксикарбонил и трихлорэтилоксикарбонил, и где P, являясь 2,5-диметилпирролилом, может образовывать кольцо с защищенным азотом; в этом случае водород, который, как указано выше, прикреплен к такому азоту, отсутствует.
14. Соединение формулы
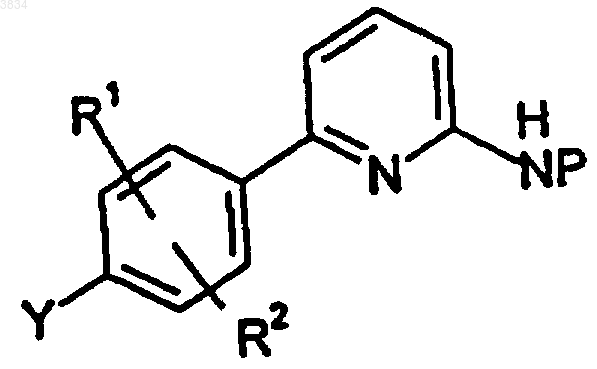
где Y представляет фтор или бензилокси;
R1 и R2 независимо выбирают из группы, включающей водород, галоид, гидрокси, (C1-C6)алкокси, (C1-C7)алкил, (C2-C6)алкенил, (C2-C10)алкоксиалкил; а
P представляет группу, защищающую азот, такую как тритил, ацетил, бензоил, триметилацетил, трет-бутоксикарбонил, бензилоксикарбонил и трихлорэтилоксикарбонил, и где P, являясь 2,5-диметилпирролилом, может образовывать кольцо с защищенным азотом; в этом случае водород, который, как указано выше, прикреплен к такому азоту, отсутствует.
Текст
1 Настоящее изобретение относится к определенным 2-амино-6-(2-замещенным-4-фенокси)замещенным-пиридинам, проявляющим активность в качестве ингибиторов синтазы окиси азота (NOS), к содержащим их фармацевтическим композициям и к их применению для лечения и профилактики нарушений центральной нервной системы, воспалительных нарушений,септического шока и других нарушений. Существует три известных изоформы NOS(синтазы окиси азота) - индуцируемая форма (INOS) и две конструктивных формы, называемые соответственно нейронная NOS (N-NOS) и эндотелиальная NOS (E-NOS). Каждый из этих ферментов осуществляет превращение аргинина в цитруллин, образуя молекулу окиси азота(NO) в ответ на различные раздражители. Полагают, что избыток окиси азота (NO), продуцируемый синтазой окиси азота, играет роль в патологии различных нарушений и состояний у млекопитающих, например, предполагают, чтоNO, продуцируемая (I-NOS), играет роль в заболеваниях, включающих системную гипотензию, таких как токсический шок, и лечение определенными цитокинами. Установлено, что больные раком, подвергаемые лечению цитокинами, такими как интерлейкин 1 (IL-1), интерлейкин 2 (IL-2) или фактор некроза опухоли(TNF), страдают от индуцированного цитокином шока и гипотензии, вызванными NO, продуцированной из макрофагов, т.е. индуцируемой синтазой окиси азота (I-NOS), см. ChemicalEngineering News, Dec. 20, р. 33 (1993). Ингибиторы I-NOS могут изменить такое положение. Также полагают, что I-NOS играет роль в патологии заболеваний центральной нервной системы, таких как ишемия. Например, установлено,что ингибирование I-NOS ухудшает церебральное ишемическое нарушение у крыс, см. Am. J.Physiol., 268, р. R286 (1995. Подавление артрита, индуцируемого адъювантами, путем селективного ингибирования I-NOS описано в Eur. J.Pharmacol., 273, р. 15-24 (1995). Предполагают, что NO, продуцируемая NNOS (нейронная синтаза оксиазота) играет роль в заболеваниях, таких как церебральная ишемия, боль и толерантность к опиатам. Например,ингибирование N-NOS снижает объем инфаркта после окклюзии проксимальной средней церебральной артерии у крыс, см. J. Cerebr. Blood.Flow Metab., 14, р. 924-929 (1994). Как показывает активность в поздней фазе тестов по лизанию индуцированных формалином задних лап и индуцированного уксусной кислотой абдоминального сокращения, ингибирование нейронной синтазы окиси азота также оказалось эффективным при антиноцицепции, см. Br. J.Pharmacol., 110, р. 219-224 (1993). Наконец, было описано снижение опиоидного астинентного синдрома у грызунов путем ингибирования NNOS, см. Neuropsychopharmacol., 13, р. 269-293 2 Другие ингибиторы NOS и их использование в качестве фармацевтических агентов для лечения центральной нервной системы и других нарушений описаны в предварительной заявке США 60/032 793, поданной 6 декабря 1996 г., и предварительной заявке США 60/014 343, поданной 29 марта 1996 г. Краткое описание изобретения Данное изобретение относится к соединениям формулы где R1 и R2 выбраны независимо из группы,включающей водород, галоид, гидрокси, (C1C6)алкокси, (C1-C7)алкил, (С 2-С 6)алкенил и (С 2 С 10)алкоксиалкил; и(С 0-С 4)алкил-, где R3 и R4 независимо выбирают из группы, включающей водород, (C1-C7)алкил,тетрагидронафталин и аралкил, где арильный остаток указанного аралкила представляет собой фенил или нафтил, а алкильный остаток является прямым или разветвленным и содержит 1-6 атомов углерода, и где указанный (С 1 С 7)алкил и указанный тетрагидронафталин, а также арильный остаток указанного аралкила могут быть необязательно замещены 1-3 заместителями, предпочтительно 0-2 заместителями,независимо выбранными из группы, включающей галоид, нитро, гидрокси, циано, амино, (C1C4)алкокси и (С 1-С 4)алкиламино; или R3 и R4 вместе с азотом, к которому они присоединены, образуют пиперазиновое,пиперидиновое, азетидиновое или пирролидиновое кольцо, либо насыщенную или ненасыщенную азабициклическую кольцевую систему,содержащую в кольце 6-14 членов, из которых 1-3 представляют собой азот, 0-2 - кислород, а остальное - углерод; и где указанные пиперазиновые, пиперидиновые, азетидиновые и пирролидиновые кольца и указанные азабициклические кольцевые системы могут быть необязательно замещены одним или несколькими заместителями,предпочтительно 0-2 заместителями, независимо выбранными из группы, включающей (C1 С 6)алкил-, амино, (C1-С 6)алкиламино, [ди-(C1C6)алкил]амино, замещенные фенилом 5-6 членные гетероциклические кольца, содержащие в кольце 1-4 атомов азота, бензоил, бензоилметил, бензилкарбонил, фениламинокарбонил, фенилэтил и феноксикарбонил, и где фенильные остатки любых из вышеуказанных заместителей могут быть необязательно замещены 3 одним или несколькими заместителями, предпочтительно 0-2 заместителями, независимо выбранными из группы, включающей галоид,(C1-С 3)алкил, (C1-С 3)алкокси, нитро, амино,циано, СF3 и ОСF3; и где указанные пиперазиновые, пиперидиновые, азетидиновые и пирролидиновые кольца, а также указанные азабициклические кольцевые системы могут быть присоединены к-(С 0-С 4)алкил-O- (где кислород указанного -(C0C4)алкил-O- представляет собой атом кислорода, указанный в структурной формуле I) через атом азота кольца NR3R4 или любой другой атом такого кольца, имеющий доступный связывающий сайт; или G представляет группу формулы А 4 мального числа возможных заместителей, исходя из числа имеющихся связывающих сайтов. Термин "галоид" в данном описании означает, если не указано иначе, хлор, фтор, бром и иод. Примерами соединений в соответствии с данным изобретением являются соединения формулы I и их фармацевтически приемлемые соли, где G представляет N(R3)(R4)(С 0-С 4)алкил иN(R3)(R4) представляет амино,диметиламино, метилбензиламино, (C1-С 4)алкиламино, ди-[(C1-C4)алкил]амино или одна из следующих групп: где Z представляет азот или СH,n = 0 или 1,q = 0, 1, 2 или 3 и р = 0, 1 или 2; и где 2-аминопиперидиновое кольцо, указанное выше в структуре I, может быть необязательно замещено и фармацевтически приемлемым солям таких соединений. Настоящее изобретение также относится к фармацевтически приемлемым кислым аддитивным солям соединений формулы I. Кислоты,используемые для получения фармацевтически приемлемых аддитивных кислых солей вышеуказанных основных соединений в соответствии с данным изобретением, представляют собой кислоты, образующие нетоксичные кислые аддитивные соли, т.е. соли, содержащие фармакологически приемлемые анионы, такие как гидрохлориды, гидробромиды, гидроиодиды, нитраты, сульфаты, бисульфаты, фосфаты, кислые фосфаты, ацетаты, лактаты, цитраты, кислые цитраты, сукцинаты, малеаты, фумараты, глюконаты, сахараты, бензоаты, метансульфонаты,этансульфонаты, бензолсульфонаты, р-толуолсульфонаты и памоаты (т.е. 1,1-метилен-бис-(2 гидрокси-3-нафтоаты. Термин "алкил" в данном описании, если не указано иначе, означает насыщенные одновалентные углеводородные радикалы, имеющие прямые, разветвленные или циклические цепи либо их сочетания. Термин "один или несколько заместителей" в данном описании относится к заместителям, число которых составляет от 1 до макси Предпочтительные соединения формулы I включают такие соединения, где R2 - водород, aR1 - (C1-С 3)алкокси и находятся в ортоположении относительно пиридинового кольца формулы I. Другие варианты данного изобретения относятся к соединениям формулы I, где G - группа формулы А, как указано выше, в которой Z азот. Другие варианты данного изобретения относятся к соединениям формулы I, где R1 и R2 независимо выбирают из (C1-С 2)алкокси. Другие варианты данного изобретения относятся к соединениям формулы I, где G - группа формулы А, как указано выше, в которой Z азот, каждый из p и n = 1, а q = 2. Другие варианты данного изобретения относятся к соединениям формулы I, где присут 5 ствует 2-аминопиридиновое кольцо, указанное в вышеприведенной формуле I. Настоящее изобретение также относится к фармацевтической композиции для лечения или профилактики состояния, входящего в группу,включающую мигрень, воспалительные заболевания (например, астма, псориаз, экзема, артрит), удар, острую и хроническую боль, гиповолемический шок, травматический шок, реперфузионную травму, болезнь Крона, неспецифический язвенный колит, септический шок,рассеянный склероз, СПИД-ассоциированное слабоумие, нейродегенеративные заболевания,нейронную токсичность, болезнь Альцгеймера,химические зависимости и аддикцию (например, зависимость от лекарственных препаратов,алкоголя и никотина), рвоту, эпилепсию, тревогу, психоз, травму головы, респираторный дистресс-синдром у взрослых,морфиноиндуцированную толерантность и абстинентные симптомы, воспалительное заболевание кишечника, остеоартрит, ревматоидный артрит, овуляцию, дилатированную кардиомиопатию, острые травмы позвоночника, болезнь Хантингтона, болезнь Паркинсона, глаукому, макулярную дегенерацию, дитиабетическую нейропатию,диабетическую нефропатию и рак у млекопитающих, в том числе и человека, включающей количество соединения формулы I или его фармацевтически приемлемой соли, эффективное для лечения или профилактики такого состояния, и фармацевтически приемлемому носителю. Настоящее изобретение также относится к способу лечения или профилактики состояния,входящего в группу, включающую мигрень,воспалительные заболевания (например, астма,псориаз, экзема, артрит), удар, острую и хроническую боль, гиповолемический шок, травматический шок, реперфузионную травму, болезнь Крона, неспецифический язвенный колит, септический шок, рассеянный склероз, СПИДассоциированное слабоумие, нейродегенеративные заболевания, нейронную токсичность,болезнь Альцгеймера, химические зависимости и аддикции (например, зависимость от лекарственных препаратов, алкоголя и никотина), рвоту, эпилепсию, тревогу, психоз, травму головы,респираторный дистресс-синдром у взрослых,морфино-индуцированную толерантность и абстинентные симптомы, воспалительное заболевание кишечника, остеоартрит, ревматоидный артрит, овуляцию, дилатированную кардиомиопатию, острые травмы позвоночника, болезнь Хантингтона, болезнь Паркинсона, глаукому,макулярную дегенерацию, диабетическую нейропатию, диабетическую нефропатию и рак у млекопитающих, в том числе и человека, включающему введение указанному млекопитающему количества соединения формулы I или его фармацевтически приемлемой соли, эффектив 003834 6 ного для лечения или профилактики такого состояния. Настоящее изобретение также относится к фармацевтической композиции для ингибирования синтазы окиси азота (NOS) у млекопитающих, в том числе и у человека, включающей ингибирующее синтазу окиси азота эффективное количество соединения формулы I или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель. Настоящее изобретение также относится к способу ингибирования NOS у млекопитающих,в том числе и у человека, включающему введение указанному млекопитающему ингибирующее синтазу окиси азота эффективное количество соединения формулы I или его фармацевтически приемлемой соли. Настоящее изобретение также относится к фармацевтической композиции для лечения или профилактики состояния, входящего в группу,включающую мигрень, воспалительные заболевания (например, астма, псориаз, артрит, экзема), удар, острую и хроническую боль, гиповолемический шок, травматический шок, реперфузионную травму, болезнь Крона, неспецифический язвенный колит, септический шок, рассеянный склероз, СПИД-ассоциированное слабоумие, нейродегенеративные заболевания,нейронную токсичность, болезнь Альцгеймера,химические зависимости и аддикции (например,зависимость от лекарственных препаратов, алкоголя и никотина), рвоту, эпилепсию, тревогу,психоз, травму головы, респираторный дистресс-синдром у взрослых, морфино-индуцированную толерантность и абстинентные симптомы, воспалительные заболевания кишечника,остеоартрит, ревматоидный артрит, овуляцию,дилатированную кардиомиопатию,острые травмы позвоночника, болезнь Гентингтона,глаукому, макулярную дегенерацию, диабетическую нейропатию, диабетическую нефропатию и рак у млекопитающих, в том числе и у человека, включающей ингибирующее синтазу окиси азота эффективное количество соединения формулы I или его фармацевтически приемлемой соли и фармацевтически приемлемого носителя. Настоящее изобретение также относится к способу лечения или профилактики состояния,входящего в группу, включающую мигрень,воспалительные заболевания (например, астма,псориаз, экзема, артрит), удар, острую и хроническую боль, гиповолемический шок, травматический шок, реперфузионную травму, болезнь Крона, неспецифический язвенный колит, септический шок, рассеянный склероз, СПИДассоциированное слабоумие, нейродегенеративные заболевания, нейронную токсичность, болезнь Альцгеймера, химические зависимости и аддикции (например, зависимость от лекарственных препаратов, алкоголя и никотина), рвоту, эпилепсию, тревогу, психоз, травму головы,респираторный дистресс-синдром у взрослых, 7 морфино-индуцированную толерантность и абстинентные симптомы, воспалительные заболевания кишечника, остеоартрит, ревматоидный артрит, овуляцию, дилатированную кардиомиопатию, острые травмы позвоночника, болезнь Гентингтона, болезнь Паркинсона, глаукому,дегенерацию желтого пятна, диабетическую нейропатию, диабетическую нефропатию и рак у млекопитающих, в том числе и у человека,включающему введение указанному млекопитающему ингибирующее синтазу окиси азота эффективное количество соединения формулы I или его фармацевтически приемлемой соли. Соединения формулы I имеют хиральные центры и поэтому могут существовать в различных энантиомерных и диастереомерных формах. Данное изобретение относится ко всем оптическим изомерам и всем стереоизомерам соединений формулы I и их смесям, а также ко всем фармацевтическим композициям и способам лечения, указанным выше, содержащим или применяющим их, соответственно. Формула I включает соединения, идентичные указанным соединениям, за исключением того, что один или несколько атомов водорода,углерода или других атомов замещены их изотопами. Такие соединения могут быть использованы как исследовательские и диагностические средства при фармакокинетическом изучении метаболизма и в анализах на связывание. Данное изобретение также относится к соединениям формулы где R1, R2 и G имеют значения, указанные выше для соединений формулы I, a P представляет собой защищающую азот группу, такую как тритил, ацетил, бензоил, триметилацетил, третбутоксикарбонил, бензилоксикарбонил или другую подходящую защищающую азот группу, и где Р может образовывать кольцо с защищенным азотом; в этом случае водород, который,как указано выше, присоединен к такому азоту,отсутствует. Такие соединения могут быть использованы как промежуточные соединения при синтезе фармацевтически активных соединений формулы I. Данное изобретение также относится к соединениям формулыY представляет фтор или бензилокси. Такие соединения могут быть использованы как про 003834 8 межуточные соединения при синтезе фармацевтически активных соединений формулы I. Подробное описание изобретения Соединения формулы I могут быть получены, как представлено в следующих реакционных схемах и их описании. Если не указано иначе, R1, R2, R3, R4, R5, R6, R7, R8 и R9 , а также структурная формула I в реакционных схемах и последующем описании имеют вышеуказанные значения. Схема 1 Схема 1 иллюстрирует способ получения соединений формулы I, где G - водород, R1 RO, в котором R - (C1-С 6)алкил, а R2 - водород. Эти соединения обозначены в схеме 1 как соединения формулы "IA". В соответствии со схемой 1 соединение формулы II подвергают реакции с избыточным карбонатом калия и одним эквивалентом хлорида тозила в ацетоне при температуре около 080 С, предпочтительно при температуре кипения реакционной смеси с обратным холодильником (температуре дефлегмации). Затем к реакционной смеси добавляют соединение формулы RX, где R - (C1-С 6)алкил, а Х - иод, хлор или бром, и смеси дают возможность реагировать при температуре около 0-80 С, предпочтительно при температуре дефлегмации смеси. В результате этой реакции получают соединение формулы III. Соединение формулы III затем превращают в соответствующее соединение формулыIV реакцией с гидроксидом калия в этаноле,используя воду в качестве растворителя. Эта реакция может быть проведена при температуре приблизительно от комнатной до температуры дефлегмации реакционной смеси. Предпочтительно реакционную смесь нагревают до дефлегмации и проводят реакцию при этой температуре. Затем соединение формулы IV подвергают реакции с карбонатом калия и бензилбромидом в ацетоне при температуре приблизительно от комнатной до 80 С для получения соответствующего соединения формулы V. Предпочтительно реакцию проводят приблизительно при температуре дефлегмации. В результате реакции полученного соединения формулы V с бутиллитием в тетрагидрофуране при температуре приблизительно -78 С с последующим добавлением триэтилбората и обеспечением возможности реакционной смеси нагреться до температуры окружающей среды получают соответствующее производное фенилборной кислоты формулы VI. 13 В результате реакции производного фенилборной кислоты формулы VI с 2-бром-6(2,5-диметилпиррол-1-ил)пиридином(VII), карбонатом натрия и тетракис(трифенилфосфин) палладием(0) в этаноле/воде или тетрагидрофуране/воде при температуре приблизительно от комнатной до температуры дефлегмации реакционной смеси получают соответствующее соединение формулы VIII. Альтернативно, реагент формулы VII может быть заменен другим соединением формулы где Р - азотозащитная группа, такая как тритил,ацетил, бензил, триметилацетил, трет-бутоксикарбонил, бензилоксикарбонил, трихлорэтилоксикарбонил или другая соответствующая азотозащитная группа, и где водород, связанный с защищенным азотом, отсутствует, когда Р представляет собой защитную группу, образующую кольцо с защищенным азотом, как и в случае,кода Р - 2,5-диметилпирролил. Такие защитные группы хорошо известны специалистам в данной области. Вышеуказанные соединения формулы VIIA либо являются коммерчески доступными, известными в научной литературе, либо могут быть легко получены с применением хорошо известных способов и реагентов. Заместитель бензила может быть удален из соединения формулы VIII реакцией такого соединения с формиатом аммония в воде или низшем спиртовом растворителе, либо в смеси одного или нескольких таких растворителей при температуре приблизительно от комнатной до температуры дефлегмации реакционной смеси. Эту реакцию предпочтительно проводят при температуре дефлегмации в присутствии около 20% гидроксида палладия на угле. Полученное соединение формулы IX затем превращают в желаемое соединение формулы IA, подвергая его реакции с гидроксиламином в растворителе,выбранном из воды, низших спиртов и смесей этих растворителей, при температуре приблизительно от комнатной до температуры дефлегмации растворителя, предпочтительно приблизительно при температуре дефлегмации. Процедура из схемы 1 также может быть использована для получения соединений формулы I, где R1 и R2 имеют значения, отличные от вышеуказанных и приведенных в схеме. Она может быть осуществлена путем использования соединения формулы в качестве исходного материала, а затем проведения серии реакций, как описано выше, представленных на схеме 1 как реакции 14 Схема 2 иллюстрирует способ превращения соединений формулы I, где G представляет водород, в соответствующие соединения формулы I, где G имеет значение, отличное от водорода. В соответствии со схемой 2 соединение формулы IA может быть превращено в соответствующее соединение формулы IC путем реакции с соединением формулы GX, где Х представляет иод, хлор или бром, а G представляетCH2CH2NR3R4, и карбонатом калия в диметилформамиде (DMF) или ацетоне при температуре приблизительно от комнатной до температуры дефлегмации смеси, предпочтительно приблизительно при температуре дефлегмации. Как показано на схеме 2, могут быть также получены соединения формул IC: вначале путем получения соответствующих соединений формулы IB, а затем, при желании, их превращением в соответствующие соединения формулы IC. Соединения формулы IB могут быть получены реакцией соответствующих соединений формулы IA с соединением формулы GX, где и Х имеет вышеуказанные значения, а G СН 2 С(=O)NR3R4, и карбонатом калия в диметилформамиде или ацетоне при температуре приблизительно от комнатной до температуры дефлегмации реакционной смеси. Реакцию предпочтительно проводят приблизительно при температуре дефлегмации. Полученные соединения формулы IB могут быть превращены в соответствующие соединения формулы IC путем их реакции с литийалюминийгидридом и хлоридом алюминия в тетрагидрофурановом растворителе или с гидридом бора в тетрагидрофуране. Могут быть также использованы другие восстанавливающие агенты, включающие гидрид алюминия, такие как диизобутилалюминий гидрид. Может быть также использован диборан. Эту реакцию обычно проводят при температуре приблизительно от комнатной до температуры дефлегмации реакционной смеси, предпочтительно, при температуре дефлегмации. Другие подходящие растворители включают другие органические эфиры, такие как этиловый эфир, диоксан и глим. Предпочтительным растворителем является тетрагидрофуран. Схема 3 показывает, как могут быть получены некоторые соединения формулы I, имеющие заместители R1 и R2, отличные от указанных в процессах схемы 1. Такие соединения получают в результате процесса, подобного процессу, изображенному на схеме 1, за исключением того, что процессы схемы 1, принимающие участие в синтезе соединения VI, заменяют процессами, изображенными на схеме 3. Конкретно, когда R2 - водород, а R1 - фтор в ортоположении, соединение формулы Х превращают в соответствующую фенилкарбоновую кислоту способом, аналогичным конверсии соединений формулы V в соединения формулы VI в 15 схеме 1. Получаемые производные фенилборной кислоты обозначены на схеме 3 как соединение VIA. Подобным образом, как показано на схеме 3, соединения формулы I, где R1 и R2 оба представляют собой метил и оба находятся в орто-положении относительно пиридинового кольца, могут быть получены путем превращения соединения формулы XI, как показано на схеме 3, в соответствующие производные фенилборной кислоты, обозначенные как соединение VIB, способом, аналогичным превращению соединений формулы V в соединения формулыVI в схеме 1. Соединения формул VIA и VIB могут быть затем превращены в нужные соответствующие соединения формулы I, применяя процедуры, аналогичные процедурам, показанным на схеме 1. Схема 4 иллюстрирует способы получения соединений формулы I, где G представляетNR3R4, a NR3R4 образует кольцо N-метилпирролин-2-ил. Соединения формулы I, где G представляет NR3R4, a NR3R4 образует другие азотосодержащие кольца, могут быть получены аналогичным способом. В соответствии со схемой 4 соединение формулы ID подвергают реакции с трет-бутиловым эфиром 3-метанбульфонилоксипирролидин-1-карбоновой кислоты для получения соединения формулы XII. Для защиты азота пирролидина могут быть использованы другие азотозащитные группы, такие как-С(=O)ОСН 2 С 6 Н 5 и COOR (где R - бензил, фенил, трет-бутил или подобная группа). Также отщепляемая мезилатная группа может быть замещена другой подходящей отщепляемой группой. К реакционной смеси предпочтительно добавляют каталитическое количество тетрабутиламмоний иодида (TBAI). Эту реакцию алкилирования обычно проводят в присутствии алкоголята щелочного металла, предпочтительно, трет-бутоксида (трет-бутилата) калия, в высококипящем полярном органическом растворителе, таком как диметилсульфоксид или диметилформамид, предпочтительно диметилсульфоксид. Реакционная температура может составлять приблизительно 50-100 С, предпочтительно около 100 С. Восстановление соединения формулы XII приводит к получению соединения формулы IF. Такое восстановление предпочтительно осуществляют, используя литийалюминийгидрид в качестве восстанавливающего агента и тетрагидрофуран или другой органический эфир (например, этиловый эфир или глим) в качестве растворителя. Могут быть также использованы другие алюминийгидридные восстанавливающие агенты, такие как диизобутилалюминийгидрид. Может быть также использован диборан. Данную реакцию обычно проводят при температуре приблизительно от комнатной до температуры дефлегмации реакционной смеси,предпочтительно приблизительно при температуре дефлегмации. 16 Как показано на схеме 5, алкилирование соединения формулы ID 1-(2-хлорэтил)пирролидином приводит к получению соединения формулы IE. Эту реакцию обычно проводят в присутствии основания, такого как карбонат цезия, калия или натрия, предпочтительно карбонат цезия, в растворителе, таком как ацетон,диметилсульфоксид или ацетонитрил, предпочтительно ацетон, при температуре приблизительно от комнатной до температуры дефлегмации, предпочтительно приблизительно при температуре дефлегмации. Соединения формулы I, где NR3R4 не образует кольцо, также могут быть получены способом, показанным на схеме 5 и описанным выше для получения соединения формулы IZ. Структурная формула IG, приведенная на схеме 5,включает такие соединения. Схема 6 иллюстрирует способ получения промежуточных соединений бензолборной кислоты, используемых для синтезов, описанных выше в схемах 1 и 3, где бензольное кольцо бензолборной кислоты содержит заместитель циклоалкила. Такие промежуточные соединения могут быть использованы в процессах схем 1 и 3 для получения соединений формулы I, где один или оба R1 и R2 - циклоалкильные группы. В соответствии со схемой 6, соединение формулы XIII подвергают дефлегмации в присутствии магния в тетрагидрофуране или этиловом эфире в течение приблизительно 8 ч, после чего к реакционной смеси добавляют циклобутанон. В результате реакции получают соединение формулы XIV. Восстановление соединения формулы XIV с применением, например, газообразного водорода и 10% палладия на угле в низшем спиртовом растворителе, таком как этанол, при приблизительно комнатной температуре приводит к получению соответствующего соединения формулы XV. Реакция соединения формулы XV с бензилбромидом в присутствии основания, такого как карбонат калия, цезия или натрия, в растворителе, таком как ацетон, дихлорэтан, хлороформ или хлористый метилен, при температуре приблизительно от комнатной до температуры дефлегмации реакционной смеси, предпочтительно приблизительно при температуре дефлегмации, приводит к получению соответствующего соединения формулы XVI. Соединение формулы XVI, полученное на вышеописанной стадии, затем подвергают броминированию реакцией с N-бромсукцинамидом (NBS) и силикагелем в хлорированном углеводородном растворителе, таком как четыреххлористый углерод, хлористый метилен или хлороформ. Эту реакцию обычно проводят при комнатной температуре. Соединение формулыXVII, получаемое в результате этой реакции,затем может быть превращено в производное фенилборной кислоты формулы XVIII следующим образом. Вначале соединение формулыXVII в растворителе, таком как тетрагидрофуран, охлаждают до температуры приблизительно (-78)-(-70)С, после чего добавляют нбутиллитий. После перемешивания реакционной смеси в течение приблизительно 1 ч, добавляют триэтилборат и смесь перемешивают еще в течение 1-3 ч. Промежуточное соединение фенилборной кислоты может быть затем выделено способами, хорошо известными специалистам в данной области (например, гашение хлоридом аммония, добавление воды и концентрированной соляной кислоты, а затем экстрагирование этилацетатом). Схема 7 иллюстрирует процесс получения соединений формулы I, где G - алкенил, а также соединений формулы I, где G - водород, a R2 алкильная или алкенильная группа. В соответствии со схемой 7, соединение формулы IA превращают в соответствующее соединение,имеющее формулу IH, применяя реакцию алкилирования, аналогичную реакции, используемой для превращения соединения формулы ID в соединение формулы IG в схеме 5. Нагревание полученного соединения IH приблизительно до 230 С приводит к получению соответствующих соединений IJ и IK. Гидрирование соединений формул IJ и IK с применением способов, хорошо известных специалистам в данной области(например, использование газообразного водорода в этаноле при давлении около 50 фунтов на кв.дюйм (3,5155 кг/см 2), в присутствии 10% палладия на угле приблизительно при комнатной температуре) приводит к получению соответствующих производных алкила, имеющих формулы IL и IM соответственно. Алкилирование соединений формул IL и IM (где G - водород) с применением любых способов алкилирования, описанных в схемах 2, 4 и 5, и соответствующих алкилирующих агентов приводит к получению соответствующих желаемых соединений, где 6 не является водородом. Схема 8 иллюстрирует альтернативный способ получения соединений формулы I, где G= NR3R4(C0-C4)алкил. В соответствии со схемой 8 соединение формулы XIX подвергают реакции с бромом в уксусной кислоте при температуре приблизительно 0-60 С, предпочтительно приблизительно при комнатной температуре. Эта реакция приводит к получению соответствующего соединения, имеющего бромный заместитель, который может быть замещен фторным заместителем, а затем может быть превращен в соответствующее производное борной кислоты формулы XX, как описано выше для синтеза соединений формулы VI (на схеме 1) и XVIII(на схеме 6). Добавление 2,5-диметилпирролилзащитной группы, как описано выше для синтеза соединений формулы VIII (на схеме 1), приводит к получению соответствующего соединения формулы XXI. Затем соединение формулы XXI подвергают реакции с соединением формулыR3R4NOH и гидридом щелочного металла, предпочтительно гидридом натрия, в полярном органическом растворителе, таком как диметилформамид или диметилсульфоксид, предпочтительно диметилформамид, при температуре около 50-100 С, предпочтительно около 100 С,для получения соединения, идентичного соответствующему желаемому соединению формулы IN, за исключением присутствия 2,5 диметилпирролиловой защитной группы. Удаление защитной группы, как описано выше для получения соединений формулы IA (на схеме 1),приводит к получению желаемого соединения формулы IN. Схема 9 иллюстрирует способ синтезирования соединений формулы I, где G - необязательно замещенная пирролидин-2-ил- или пирролидин-3-ил группа. В соответствии со схемой 9 соединение формулы IA подвергают реакции с соединением формулы трифенилфосфином и диэтилазодикарбоксилатом или другим водорастворимым азодикарбоксилатом в тетрагидрофуране при стандартных условиях реакции Mistsunobo. Обычно реагенты соединяют при температуре около 0 С, а затем дают им возможность нагреться до комнатной температуры. (Если в конечном продукте формулы IP желателен алкильный заместитель на пирролидиновом азоте, отличный от метила, это может быть осуществлено путем замещения бутоксикарбонильной группы формулы XXIII группой формулы -C(=O)R, где R - желательная алкильная группа). Соединение формулы XXII, получаемое в результате вышеописанной реакции (или соответствующее -С(=O)R-замещенное соединение),может быть превращено в желаемый продукт,имеющий формулу IP (или подобное соединение, где метильный заместитель, изображенный в структуре IP, замещается другой алкильной группой), путем его восстановления. Это восстановление может быть осуществлено путем реакции продукта из предыдущей реакции с литийалюминийгидридом и хлоридом алюминия в тетрагидрофуране или боране в тетрагидрофуране, как описано выше для получения соединений формулы IC. Соответствующее соединение формулы I,где алкильный заместитель на пирролидиновом азоте формулы IP замещен водородом, может быть получен путем реакции соединения формулы XXII (или алкильным аналогом соединения формулы XXII, как указано выше) с трифторуксусной или соляной кислотой в растворителе, таком как диоксан или эфир, предпочтительно диоксан, при температуре приблизительно от 0 С до температуры дефлегмации реакци 19 онной смеси, предпочтительно приблизительно при температуре дефлегмации. Исходные материалы, используемые в процедурах схем 1-9, синтез которых не был описан выше, либо выпускаются промышленностью, известны в данной области, либо могут быть легко получены из известных соединений с применением способа, очевидного специалистам. Получение других соединений формулы I,не описанных специально в экспериментальном разделе, может быть осуществлено с применением комбинаций вышеописанных реакций,очевидных для специалистов в данной области. В каждой из реакций, описанной или проиллюстрированной выше, давление не имеет значения, если не указано иначе. Обычно приемлемым является давление, приблизительно составляющее 0,5-5 атм., при этом для удобства предпочтительным является давление окружающей среды, т.е. около 1 атм. Соединения формулы I ("активные соединения данного изобретения"), основные по своей природе, способны образовывать большое количество различных солей с различными неорганическими и органическими кислотами. Несмотря на то, что такие соли должны быть фармацевтически приемлемы для введения животным, на практике часто желательно вначале выделить соединение формулы I из реакционной смеси как фармацевтически неприемлемую соль, а затем просто превратить последнюю обратно в свободное основание обработкой щелочным реагентом, а затем превратить это свободное основание в фармацевтически приемлемую аддитивную соль кислоты. Кислые аддитивные соли активных оснований в соответствии с данным изобретением могут быть легко получены обработкой основания, по существу,эквивалентным количеством выбранной минеральной или органической кислоты в среде водного растворителя или в подходящем органическом растворителе, таком как метанол или этанол. После осторожного выпаривания растворителя легко получают желаемую твердую соль. Активные соединения в соответствии с данным изобретением и их фармацевтически приемлемые соли могут быть использованы какNOS ингибиторы, т.е. они обладают способностью ингибировать фермент NOS у млекопитающих и поэтому они способны действовать как терапевтические агенты при лечении вышеуказанных нарушений и заболеваний у пораженных млекопитающих. Активные соединения в соответствии с данным изобретением и их фармацевтически приемлемые соли могут быть введены пероральным, парентеральным или локальным способом. В целом, эти соединения наиболее желательно вводят в дозах приблизительно 0,01-250 мг в сутки в виде разовых или разделенных доз (т.е. 1-4 дозы в сутки), хотя в зависимости от вида, и 20 состояния пациента, подвергаемого лечению, и конкретного выбранного способа введения неизбежны изменения. Однако наиболее желательно применяют дозировку в интервале 0,0721 мг на кг массы тела в сутки. Тем не менее в зависимости от вида животного, подвергаемого лечению и его индивидуальной реакции на указанное лекарственное средство, а также от вида выбранного фармацевтического состава, периода времени и интервала введения, могут происходить изменения. В некоторых случаях доза ниже нижнего предела указанного интервала может оказаться более чем адекватной, в то время как в других случаях могут применяться еще большие дозы, не оказывающие вредного побочного действия, при условии, что такие большие дозы вначале делят на несколько небольших доз, вводимых на протяжении суток. Активные соединения в соответствии с данным изобретением могут быть введены отдельно или в сочетании с фармацевтически приемлемыми носителями или разбавителями любым из вышеуказанных трех способов, и такое введение может быть разовым или многократным. Более конкретно, новые лечебные препараты в соответствии с данным изобретением могут быть введены посредством большого количества различных лекарственных форм, т.е. они могут быть соединены с различными фармацевтически приемлемыми инертными носителями в виде таблеток, капсул, пастилок, лепешек, твердых леденцов, порошков, распылителей, кремов, целебных мазей, суппозиториев,гелей, желе, паст, лосьонов, мазей, водных суспензий, растворов для инъекций, эликсиров,сиропов и т.д. Такие носители включают твердые разбавители или наполнители, стерильные водные среды и различные нетоксичные органические растворители и т.д. Более того, пероральным фармацевтическим композициям может быть придана соответствующая сладость и/или вкус. В целом, терапевтически эффективные соединения в соответствии с данным изобретением присутствуют в таких лекарственных формах в концентрации, составляющей приблизительно 5,0-70 маc.%. Для перорального введения могут применяться таблетки, содержащие различные наполнители, такие как микрокристаллическая целлюлоза, цитрат натрия, карбонат кальция, дифосфат кальция и глицин, наряду с различными дезинтегрантами (такими как крахмал (предпочтительно крахмал из кукурузы, картофеля или кассавы), альгиновая кислота и некоторые сложные силикаты вместе со связующими грануляции, такими как поливинилпирролидон,сахароза, желатин и акация. Кроме того, очень часто при изготовлении таблеток применяют смазывающие вещества, такие как стеарат магния, натрий лаурил сульфат и тальк. В качестве наполнителей в желатиновых капсулах могут быть использованы также твердые композиции 21 подобного типа; предпочтительные материалы в этом отношении также включают лактозу или молочный сахар, а также полиэтиленгликоли с большой молекулярной массой. Если при пероральном введении применяют водные суспензии и/или эликсиры, активные ингредиенты могут быть соединены с различными подслащивающими или корригирующими агентами, красящими веществами или красителями, и, при желании, также с эмульгирующими и/или суспендирующими агентами вместе с такими разбавителями, как вода, этанол, пропиленгликоль, глицерин и различные подобные сочетания этих веществ. Для парентерального введения могут применяться растворы активного соединения в соответствии с настоящим изобретением в кунжутном или арахисовом масле либо в водном пропиленгликоле. Водные растворы должны быть соответствующим образом забуферены(предпочтительно рН превышает 8) при необходимости, а жидкий растворитель вначале следует сделать изотоничным. Такие водные растворы подходят для внутривенных инъекций. Масляные растворы подходят для внутрисуставных,внутримышечных и подкожных инъекций. Получение всех этих растворов в стерильных условиях может быть легко осуществлено с помощью стандартных фармацевтических методов,хорошо известных специалистам в данной области. Кроме того, активные соединения в соответствии с настоящим изобретением могут быть также введены, обычно при лечении воспалительных состояний кожи, при помощи кремов,желе, гелей, паст, накладок, мазей и т.п. в соответствии со стандартной фармацевтической практикой. Способность соединений формулы I ингибировать синтазу окиси азота может быть определена с применением процедур, описанных в литературе. Способность соединений формулы I ингибировать эндотелиальную синтазу окиси азота может быть определена с помощью процедур, описанных Schmidt et al. в Proc. Natl.Acad. Sci., U.S.A., 88, pp. 365-369 (1991), и Pollocl. et al., в Proc. Natl. Acad. Sci., U.S.A., 88, pp. 10480-10484 (1991). Способность соединений формулы I ингибировать индуцируемую синтазу окиси азота может быть определена с применением процедур, описанных Schmidt et al. в(1991) и Garvey et al. в J. Biol. Chem., 269, pp. 26669-26676 (1994). Способность соединений формулы I ингибировать нейронную синтазу окиси азота может быть определена с помощью процедур, описанных Bredt and Snyder в Proc.Natl. Acad. Sci., U.S.A., 87, pp. 682-685 (1990). Целевые соединения примеров 1 и 2, приводимых ниже, были подвергнуты тестированию в соответствии с вышеуказанной процедурой и каждое из них показало IC50 10 M отно 003834 22 сительно ингибирования любой индуцируемой или нейронной синтазы окиси азота. Следующие примеры иллюстрируют данное изобретение. Однако следует отметить, что настоящее изобретение не ограничивается конкретными деталями этих примеров. Точки плавления не скорректированы. Спектры протонных ядерно-магнитных резонансов (1 Н NMR) и ядерно-магнитных резонансов в дейтерохлороформе (CDCl3), СD3 ОD или CD3SOCD3 и положения пиков выражены в частях на млн (ррm) вниз от тетраметилсилана (TMS). Формы пиков обозначены следующим образом: s - синглет, d дублет, t - триплет, q - квартет, m - мультиплет,b - широкий. Пример 1. 4-(6-Аминапиридин-2-ил)-3 метоксифенол. А. Толуол-4-сульфоновая кислота, 4-бром 3-метоксифениловый эфир. В атмосфере N2 в 300 мл ацетона соединяют 7,00 г (37,04 ммоль) 4-бромрезорцина и 32,76 г (237,0 ммоль) карбоната калия, к которым затем добавляют 6,246 г (37,04 ммоль) птолуолсульфонил хлорида. Реакции дают возможность дефлегмировать при перемешивании в течение 16 ч, после чего к ней добавляют 5,96 мл (96,29 ммоль) метилиодида. Раствор нагревают при температуре 45 С в течение 48 ч. Реакционную смесь охлаждают, разбавляют 300 мл диэтилового эфира, фильтруют через прокладку Celite и концентрируют в вакууме, получая 13,0 г сырого продукта в виде оранжевого масла, которое подвергают хроматографии на 400 г силикагеля 60 (ЕМ Science), используя гексан:этилацетат 4:1 для получения 10,10 гH NMR (CDCl3) : 1,93 (s-6H), 2,30 (s-3H),3,57 (s-3H), 6,88 (s-2H), 7,47 (d-1H), 7,62 (dd1H), 8,17 (d-1H). В. 4-Бром-3-метоксифенол. В атмосфере азота (N2) в растворе, содержащем 300 мл этанола и 300 мл воды, растворяют 10,0 г (27,99 ммоль) целевого соединения со стадии А. К этому раствору добавляют 21,0 г(318 ммоль) гидроокиси калия и полученный раствор нагревают до температуры дефлегмации течение 2 ч. Реакционную смесь охлаждают, концентрируют в вакууме приблизительно до 150 мл и нейтрализуют уксусной кислотой. Этот раствор экстрагируют этиловым эфиром(3200 мл). Соединенные экстракты промывают насыщенным NaCO3 (2400 мл), а затем - 3% гидроокисью калия (КОН) (4100 мл). Водный слой подкисляют концентрированной соляной кислотой (НСl) и водный слой экстрагируют этиловым эфиром (3200 мл). Органические экстракты промывают рассолом (1200 мл), высушивают над сульфатом магния и концентрируют в вакууме, получая 4,60 г (81%) желаемого фенола, кристаллизующегося при хранении. Рекристаллизацией из гексана/этилового эфира 23 получают 3,7 г целевого соединения в виде белого кристаллического продукта. 1H NMR (СDСl3) : 1,92 (s-6H), 2,31 (s-3H),6,89 (s-2H), 7,47 (d-1H), 7,63 dd-1H), 8,18 (d1H). С. 4-Бензилокси-1-бром-2-метоксибензол. В атмосфере N2 в 50 мл ацетона соединяют 3,689 г (18,17 ммоль) 4-бром-3-метоксифенола и 7,533 (54,51 ммоль) карбоната калия, к которым затем добавляют 2,38 мл (19,99 ммоль) бензилбромида. Реакцию продолжают до дефлегмации при перемешивании в течение 16 ч и концентрируют в вакууме. Твердый остаток разделяют между этилацетатом и водой. Водный слой экстрагируют этилацетатом (1200 мл), а соединенные органические экстракты промывают 1 М гидроокисью натрия (NaOH) (2100 мл) и рассолом (1100 мл), высушивают над сульфатом натрия, фильтруют и концентрируют в вакууме,получая 5,38 г (100%) сырого продукта в виде бесцветного масла. 1H NMR (СDСl3) : 1,37 (s-9H), 1,93 (s-6H),2,32 (s-3H), 6,08 (bs-1H), 6,96 (s-2H), 7,31 (m2H), 7,89 (m-1H). 4-Бензилокси-2-метоксифенилборная кислота. В атмосфере N2 в 75 мл безводного тетрагидрофурана добавляют 5,38 г (18,35 ммоль) 4 бензилокси-1-бром-2-метоксибензола. Раствор охлаждают до -78 С и по каплям добавляют 8,07 мл (20,19 ммоль) 2,5 М раствора бутиллития,поддерживая температуру на уровне ниже-70 С. Реакционную смесь перемешивают при-78 С в течение 1,5 ч, после чего к ней добавляют 3,43 мл (20,19 ммоль) триэтилбората. Реакцию продолжают перемешивать при температуре -78 С в течение еще 2,5 ч. Реакционную смесь гасят 50 мл насыщенного хлорида аммония (NH4Cl) и дают ей возможность нагреться до температуры окружающей среды. К этому раствору добавляют воду (100 мл), рН доводят до 5,0 с помощью 1 М HCl и полученный раствор экстрагируют этилацетатом (2200 мл). Объединенные экстракты промывают рассолом(1100 мл), высушивают над сульфатом натрия,фильтруют и концентрируют в вакууме, получая сырой продукт в виде твердого розового вещества, которое кристаллизуют этилацетатом/гексаном для получения 2,68 г (57%) 4 бензилокси-2-метоксифенилборной кислоты в виде твердого беловатого вещества. 1H NMR (CDCl3) : 1,38 (s-9H), 1,93 (s-6H),2,31 (s-3H), 4,10 (bs-2H), 5,57 (bs-1H), 6,50 (d1H), 6,77 (d-1H), 6,92 (s-2 Н), 7,10 (dd-1H). Е. 2-(4-Бензилокси-2-метоксифенил)-6(2,5-диметилпиррол-1-ил)пиридин. В атмосфере азота соединяют 2,53 г (10,07 ммоль) 2-бром-6-(2,5-диметилпиррол-1-ил) пиридина, 2,60 г (10,07 ммоль) бензилокси-2 метоксифенилборной кислоты, 4,27 г (40,30 ммоль) карбоната натрия и 292 мг тетра 003834 24 кис(трифенилфосфин)палладий(0) (0,25 ммоль) в 27 мл этанола и 3 мл воды. Раствор подвергают нагреванию с обратным холодильником (дефлегмации) в течение 18 ч, после чего реакционную смесь концентрируют в вакууме. Полученный желтый остаток разделяют между этилацетатом (200 мл) и водой (200 мл). Водный слой вновь экстрагируют этилацетатом (200 мл),соединенные органические экстракты промывают рассолом (1200 мл), высушивают над сульфатом натрия, фильтруют и концентрируют в вакууме, получая сырой продукт в виде желтого масла, кристаллизующийся при хранении. Рекристаллизацией этого твердого вещества из абсолютного этанола получают 3,10 г (80%) желаемого продукта в виде желтоватокоричневого твердого вещества. 1F. 4-[6-(2,5-Диметилпиррол-1-ил)пиридин 2-ил]-3-метоксифенол. В атмосфере азота соединяют 3,10 г (8,063 ммоль) 2-(4-бензилокси-2-метоксифенил)-6(2,5-диметилпиррол-1-ил)пиридина и 15,25 г(241,9 ммоль) формиата аммония в 100 мл этанола. Полученную суспензию нагревают с обратным холодильником в течение 2 ч, после чего реакционной смеси дают возможность охладиться до температуры окружающей среды,затем пропускают ее через 0,2 М нейлоновую мембрану, а остаток промывают дополнительной порцией метанола. Органический раствор концентрируют в вакууме, а полученный желтый остаток разделяют между этилацетатом(200 мл) и водой (200 мл). Водный слой вновь экстрагируют этилацетатом (200 мл), соединенные органические экстракты промывают рассолом (1200 мл), высушивают над сульфатом натрия, фильтруют и концентрируют в вакууме,получая 2,011 г (85%) желаемого фенола в виде желтовато-коричневого твердого вещества. 1G. 4-(6-Аминопиридин-2-ил)-3-метоксифенол. В атмосфере азота соединяют 5,92 г (20,11 ммоль) фенола и 16,77 г (241,3 ммоль) гидроксиламина гидрохлорида в 120 мл этанола и 20 мл воды. Полученную смесь нагревают с обратным холодильником в течение 16 ч, после чего реакционной смеси дают возможность охладиться до температуры окружающей среды и концентрируют ее в вакууме. Полученный жел 25 тый остаток разделяют между этилацетатом(200 мл). Водный слой вновь экстрагируют этилацетатом (2200 мл), соединенные органические экстракты промывают рассолом (1200 мл), высушивают над сульфатом натрия, фильтруют и концентрируют в вакууме, получая сырой продукт в виде коричневого масла, который подвергают хроматографии на 300 г силикагеля 60 (ЕМ Science) с применением гексана: этилацетата 4:1 для получения 4,20 г (97%) продукта в виде желтой пены, которую кристаллизуют из этилацетата/гексана, получая целевое соединение в виде твердого белого вещества. 1(dd-1H), 7,42 (d-1H). Пример 2. 6-[4-(3-диметиламиноэтокси)-2 метоксифенил]пиридин-2-иламин. В атмосфере азота (N2) в 30 мл ацетона соединяют 200 мг (0,92 ммоль) фенола и 383 мг(2,78 ммоль) карбоната калия, а затем к этом смеси добавляют 146 мг (1,017 ммоль) N-(2 хлорэтил)диметиламин гидрохлорида. Реакционную смесь нагревают с обратным холодильником с перемешиванием в течение 16 ч и концентрируют в вакууме. Твердый остаток разделяют между этилацетатом и 1 М гидроокисью натрия (NaOH). Водный слой экстрагируют этилацетатом (1200 мл) и соединенные органические экстракты промывают 1 М NaOH(2100 мл) и рассолом (1100 мл), высушивают над сульфатом натрия, фильтруют и концентрируют в вакууме, получая сырой продукт, который подвергают хроматографии на 75 г силикагеля 60 (ЕМ Science) с применением дихлорметана:метанола:гидроокиси аммония 9:1:0,1 для получения 165 мг (62%) целевого соединения в виде твердого беловатого вещества. 50 мг соответствующей соли гидрохлорида целевого соединения получают путем растворения порции целевого соединения в этилацетате и добавления раствора этилацетата, насыщенного HCl. Пример 3. 6-[4-(2-Диметиламиноэтокси)2,3-диметилфенил]пиридин-2-иламин. А. 3-Фтор-6-бром-о-ксилен. В 100-мл круглодонную колбу, имеющую отверстие для N2, помещают 2,50 мл (20 ммоль) 3-фтор-о-ксилена, 10 мл уксусной кислоты и 1,03 мл (20 ммоль) брома. Через 12 ч при комнатной температуре раствор становится бесцветным, его выливают в воду и экстрагируют в петролейном эфире. Органический слой промывают водой и раствором 1N гидроокиси натрия,высушивают над сульфатом натрия и выпаривают до жидкости, 4 г (100%) в виде смеси изомеров. 1C NMR (, СDСl3): 10,6, 10,7, 19,5, 19,6,112,2, 112,5, 113,7, 113,9, 125,0, 126,1, 130,2,138,2, 158,9, 160,0, 161,4, 162,4. В. 3-Фтор-о-ксилен-6-борная кислота. В 125-мл трехгорлую круглодонную колбу, оборудованную перегородкой и отверстием для N2, помещают 4,08 г (20 ммоль) 3-фтор-6 бром-о-ксилена и 20 мл сухого тетрагидрофурана. Раствор охлаждают до -70 С и к нему медленно, в течение 5 мин добавляют 9,6 мл (24 ммоль) 2,5 М раствора бутиллития в гексане. Реакционную смесь перемешивают в течение 5 мин при -70 С, затем добавляют 4,08 мл (24 ммоль) триэтилбората и перемешивание продолжают при -70 С в течение 5 мин. Затем реакционной смеси дают возможность нагреться до комнатной температуры и перемешивают ее в течение 16 ч, после этого выливают в разбавленную соляную кислоту и экстрагируют этилацетатом. Органический слой промывают рассолом, высушивают над сульфатом натрия и выпаривают. Остаток измельчают в порошок гексаном до твердого белого вещества, 2,06 гH NMR (, СDСl3): 2,22 (s, 3 Н), 2,20 (s,3H), 6,7-7,3(m, 2H). 13 С NMR (, CDCl3): 25,4, 26,3, 111,5,111,7, 112,1, 112,3, 124,9, 126,0, 126,1, 130,8,130,9, 159,9, 160,6, 162,3, 163,0. С. 2-(2,5-Диметилпирролил)-6-[4-фтор-2,3 диметилфенил]пиридин. В 100-мл круглодонную колбу, оборудованную конденсатором и отверстием для N2,помещают 3,08 г (12,27 ммоль) 6-бром-2-(2,5 диметилпирролил)пиридина, 2,06 г (12,27 ммоль) 3-фтор-о-ксилен-6-борной кислоты, 5,20 г (49,1 ммоль) карбоната натрия, 140 мг тетракистрифенилфосфинпалладия, 36 мл этанола и 4 мл воды. Реакционную смесь нагревают с обратным холодильником в течение 4 ч, охлаждают и выливают в воду, затем экстрагируют в этилацетате. Органический слой промывают рассолом, высушивают над сульфатом натрия и выпаривают. Остаток подвергают хроматографии на силикагеле, используя гексан/этилацетат в качестве элюанта для получения 3,2 г (89%) твердого вещества. 1D. 2-(2,5-Диметилпиррол)-6-[4-(2-диметиламиноэтокси)-2,3-диметилфенил]пиридин. В 100-мл круглодонную колбу, оборудованную перегородкой и отверстием для N2, помещают 0,121 мл (1,2 ммоль) 2-диметиламиноэтанола, 4 мл сухого диметилформамида и 27 115 мг (2,4 моль) гидрида натрия (60% в масле). Реакционную смесь нагревают в течение 30 мин, чтобы обеспечить полное получение алкоголята, охлаждают и добавляют 294 мг (1,0 ммоль) 2-(2,5-диметилпирролил)-6-[4-фторо 2,3-диметилфенил]пиридина. Реакционную смесь нагревают при 100 С в течение 18 ч, охлаждают и выливают в воду, затем экстрагируют в этилацетате. Органический слой промывают водой и рассолом, высушивают над сульфатом натрия и выпаривают. Остаток подвергают хроматографии на силикагеле, используя метанол/метиленхлорид в качестве элюанта для получения 260 мг (72%) масла. 1MS (%): 364 (осн.+1, 100). Е. 6-[4-(2-Диметиламиноэтокси)-2,3-диметилфенил]пиридин-2-иламин. В 100-мл круглодонную колбу, оборудованную конденсатором и отверстием для N2,помещают 260 мг (0,716 ммоль) 2-(2,5 диметилпирролил)-6-[4-(2-диметиламиноэтокси)-2,3-диметилфенил]пиридина, 500 мг гидроксиламина гидрохлорида, 9 мл этанола и 1 мл воды. Реакционную смесь нагревают с обратным холодильником в течение 40 ч, охлаждают,выливают в разбавленную соляную кислоту,промывают этилацетатом, рН доводят до 12 6N раствором гидроокиси натрия и дважды экстрагируют в метиленхлориде. Органический слой высушивают над сульфатом натрия и выпаривают, а затем превращают в соль соляной кислоты, используя HCl в эфире для получения твердого гигроскопического вещества, 182 мгC 53,62, Н 7,28, N 11,03. Найдено С 53,68, Н 7,12, N 10,86. Пример 4. 6-[4-(2-Пирролидинилэтокси)2,3-диметилфенил]пиридин-2-иламин. Получают так же, как и в примере 3, используя 2-пирролидинилэтанол, выход - 57%, в виде твердого гигроскопического вещества.MS (%): 312 (осн.+1, 100). Анал. Подсч. для C19H25N3O2HCl2H2O: С 54,29, Н 7,43, N 10,00. Найдено С 54,48, Н 7,60,N 9,64. Пример 5. 6-[4-(4-(N-метил)пиперидинилокси)-2,3-диметилфенил]пиридин-2-иламин. Получают так же, как и в примере 3, используя 4-гидрокси-N-метилпиперидин, выход 56%, температура плавления - 110-130 С, в виде соли соляной кислоты. 1C 55,48 Н 7,35 N 10,21. Найдено С 55,72, Н 7,32,N 10,66. Пример 6. 6-[4-(2-Диметиламиноэтокси)-3 метоксифенил]пиридин-2-иламин. Получают так же, как и в примере 2, используя 2-метокси-4-бромфенол, выход - 68%,температура плавления - 225-228 С, в виде соли соляной кислоты. 1- 65,5%, температура плавления 202-210 С, в виде соли соляной кислоты. 1 29 Анал. Подсч. для C18H23N3O22HCl1/2H2O: С 54,69, Н 6,63, N 10,63. Найдено: С 54,88, Н 6,88, N 10,01. Пример 8. 6-4-[2-(6,1-Диметокси-3,4 дигидро-1 Н-изохинолин-2-ил)этокси]-3-метоксифенилпиридин-2-иламин. Получают так же, как и примере 2, выход 79%, температура плавления 90-100 С, в виде соли соляной кислоты. 1MS (%): 436 (осн.+1, 100),Анал. Подсч. для C25H29N3O42HCl5/4H2O: С 56,55, Н 6,36, N 7,91. Найдено: С 56,59, Н 6,19, N 7,70. Пример 9. 6-3-Метокси-4-[2-(4-фенетилпиперазин-1-ил)этокси]фенилпиридин-2-иламин. Получают так же, как и в примере 2, выход 78%, температура плавления - 167-182 С, в виде соли соляной кислоты. 1(m, 2H), 2,825 (t, J=6, 2H), 3,86 (s, 3H), 4,13 (t,J=6, 2H), 4,70 (bs, 2H), 6,32 (d, J=8, 1H), 6,87 (d,J=8, 1H), 6,95 (d, J=8, 1H), 7,15 (m, 3H), 7,21 (m,2H), 7,37 (m, 2H), 7,51 (s, 1H). 13 С NMR (, СDСl3): 32,56, 33,46, 52,98,53,52, 55,82, 56,91, 60,37, 66,78, 106,47, 110,01,110,39, 113,04, 119,21, 125,90, 128,25, 128,51,128,58, 132,96, 138,18, 140,17, 148,73, 149,39,155,52, 158,29. MS (%): 433 (осн.+l, 100). Анал. Подсч. для С 26 Н 32N4O23HСlН 2O: С 55,77, Н 6,66, N 10,01. Найдено С 55,80, Н 6,56,N 9,59. Пример 10. 6-3-Метокси-4-[2-(4-метилпиперазин-1-ил)этокси]фенилпиридин-2-иламин. Получают так же, как и в примере 2, выход 71%, температура плавления - 75-95 С, в виде соли соляной кислоты. 1 30 Анал. Подсч. для С 19 Н 26N4O23HСl2 Н 2O 1/2(С 4 Н 10 О): С 48,05, Н 7,30, N 10,67. Найдено: С 47,85, Н 6,98, N 11,01. Пример 11. 6-4-[2-(4-Диметиламинопиперидин-1-ил)этокси]-3-метоксифенилпиридин-2-иламин. Получают так же, как и в примере 2, выход 61%, температура плавления - 215-221C, в виде соли соляной кислоты. 1MS (%): 371 (осн.+1, 100). Анал. Подсч. для C21H30N4O23HCl5/2H2O: С 48,05, Н 7,30, N 10,67. Найдено: 48,34, Н 7,28,N 10,66. Пример 12. 6-[4-(2-Диметиламиноэтокси)3-этоксифенил]пиридин-2-иламин. Получают так же, как и в примере 2 (используя 2-этокси-4-бромфенол), выход - 72%,температура плавления - 210-216 С, в виде соли соляной кислоты. 1MS (%): 302 (осн.+1, 100). Анал. Подсч. для C17H23N3O22HCl1/2H2O: С 53,27, Н 7,84, N 10,96. Найдено С 53,57, Н 7,16, N 10,71. Пример 13. 6-[4-(2-Пирролидин-1-илэтокси)-3-этоксифенил]пиридин-2-иламин. Получают так же, как и примере 2 (используя 2-этокси-4-бромфенол), выход - 69%, температура плавления - 190-198 С, в виде соли соляной кислоты. 1 31 В атмосфере N2 в 300 мл ацетона соединяют 20,0 мл (146,0 ммоль) 3-изопропилфенола и 40,35 г (291,9 ммоль) карбоната калия, а затем к ним добавляют 17,36 мл (146,0 ммоль) бензилбромида. Реакционную смесь нагревают с обратным холодильником при перемешивании в течение 16 ч. Добавляют еще порцию (5 мл) бензилбромида и нагревание продолжают еще в течение 24 ч. Реакционной смеси дают возможность охладиться до температуры окружающей среды, а твердые вещества удаляют фильтрацией и промывают ацетоном, фильтрат концентрируют в вакууме. Твердый остаток разделяют между этилацетатом и водой. Водный слой экстрагируют этилацетатом (1300 мл), а объединенные органические экстракты промывают 1 МNaOH (1200 мл) и рассолом (1150 мл), высушивают над сульфатом натрия, фильтруют и концентрируют в вакууме (100 С при 1 мм Нg),получая 33,80 г (100%) сырого продукта (целевое соединение) в виде желтого масла. 1(t-1H; J = 7,88 Hz), 7,30-7,45 (m-6H). В. 1-Бромо-2-изопропил-4-бензилоксибензол. В атмосфере N2 в 400 мл четыреххлористого углерода соединяют 33,50 г (148,0 ммоль) 1-изопропил-3-бензилоксибензола,27,66 г(155,4 ммоль) N-бромсукцинамида перекристаллизованного из воды), а затем к ним добавляют 60,0 г силикагеля (ЕМ Science). Реакцию перемешивают при отсутствии света в течение 48 ч. Затем силикагель удаляют фильтрацией и промывают дихлорметаном. Соединенный фильтрат промывают 1 М NaOH (2200 мл) и рассолом (1200 мл), высушивают над сульфатом натрия, фильтруют и концентрируют в вакууме, получая 44,46 г (98%) сырого продуктаH NMR (СDСl3) : 1,23 (d-6H; J = 6,84 Hz),3,28-3,35 (m-1H), 5,02 (s-2H), 6,64 (dd-1H; J = 3,12 Hz; J = 8,72 Hz), 6,89 (d-1H; J = 2,91 Hz) 7,30-7,42 (m-6H). С. 4-Бензилокси-2-изопропилфенилборная кислота. В атмосфере N2 к 300 мл безводного тетрагидрофурана добавляют 44,46 г (145,7 ммоль) 1 бром-2-изопропил-4-бензилоксибензола. Раствор охлаждают до -78 С и к нему по каплям добавляют 64,1 мл (160,2 ммоль) 2,5 М раствора бутиллития, поддерживая температуру ниже-70 С. Реакционную смесь перемешивают при температуре -78 С в течение 1 ч, после чего к ней добавляют 27,26 мл (160,2 ммоль) триэтилбората. Реакцию перемешивают при температуре ниже -60 С в течение еще 2 ч. Реакционной смеси дают возможность нагреться до температуры окружающей среды, а затем гасят ее 200 мл насыщенного NH4Cl. К этому раствору добавляют воду (100 мл), рН доводят до 3,0 кон 003834 32 центрированной HCl, а полученный раствор экстрагируют этилацетатом (1200 мл). Экстракт этилацетата промывают рассолом (1100 мл), высушивают над сульфатом натрия, фильтруют и концентрируют в вакууме, получая сырой продукт в виде твердого розового вещества,которое измельчают в порошок этилацетатом/гексаном для получения 16,80 г (43%) целевого соединения в виде желтовато-коричневого твердого вещества. 1D. 2-(4-Бензилокси-2-изопропилфенил)-6(2,5-диметилпиррол-1-ил)пиридин. В атмосфере азота соединяют 15,58 г(1,55 ммоль) в 243 мл этанола и 27 мл воды. Раствор подвергают дефлегмации в течение 72 ч, после чего реакционную смесь концентрируют в вакууме. Полученный остаток разделяют между этилацетатом (300 мл) и водой (300 мл). Водный слой вновь экстрагируют этилацетатом (200 мл) и соединенные органические экстракты промывают рассолом (1200 мл), высушивают над сульфатом натрия, фильтруют и концентрируют в вакууме, получая сырой продукт в виде твердого вещества янтарного цвета, кристаллизующегося при хранении. Перекристаллизацией этого твердого вещества из абсолютного этанола:гексана получают 21,35 г (87%) целевого соединения в виде твердого желтоватокоричневого вещества. 1E. 4-[6-(2,5-Диметилпиррол-1-ил)пиридин-2-ил]-3-изопропилфенол. В атмосфере азота соединяют 21,20 г(53,46 ммоль) 2-(4-бензилокси-2-изопропилфенил)-6-(2,5-диметилпиррол-1-ил)пиридина и 67,42 г (1,06,9 моль) формиата аммония, и 2,00 г гидроокиси палладия в 300 мл метанола. Полученную суспензию нагревают с обратным холодильником. Через 8 ч добавляют 10,0 г катализатора. Реакционной смеси дают возможность охладиться до температуры окружающей среды,затем пропускают ее через целитную подушку для удаления катализатора. Подушку из целита промывают метанолом. Фильтрат концентрируют в вакууме и полученный желтый остаток 33 разделяют между этилацетатом (200 мл) и водой(200 мл). Водный слой вновь экстрагируют этилацетатом (200 мл) и соединенные органические экстракты промывают рассолом (1200 мл), высушивают над сульфатом натрия, фильтруют и концентрируют в вакууме, получая 15,58 г (95%) желаемого фенола в виде твердого желтовато-коричневого вещества. 1F. 4-(6-Аминопиридин-2-ил)-3-изопропилфенол. В атмосфере азота соединяют 15,55 г(50,75 ммоль) фенола и 42,32 г (609,0 ммоль) гидроксиламина гидрохлорида в 180 мл этанола и 30 мл воды. Полученную смесь подвергают дефлегмации в течение 16 ч, после чего реакционной смеси дают возможность охладиться до температуры окружающей среды и концентрируют ее в вакууме. Полученный коричневый остаток разделяют между этилацетатом (300 мл) и разбавленным бикарбонатом натрия (300 мл). Водный слой вновь экстрагируют этилацетатом (4100 мл) и соединенные органические экстракты промывают рассолом(1400 мл), высушивают над сульфатом натрия,фильтруют и концентрируют в вакууме, получая сырой продукт в виде коричневой смолы. Хроматографией на 300 г силикагеля 60 (ЕМ Science) с применением гексана:этилацетата 3:2 и увеличением концентрации этилацетата получают 10,0 г (86%)аминопиридина в виде твердого розового вещества, которое рекристаллизуют из этилацетата/гексана для получения целевого соединения в виде твердого желтовато-коричневого вещества. 1G. 6-[4-(2-Диметиламиноэтокси)-2-изопропилфенил]пиридин-2-иламин. В атмосфере N2 в 175 мл ацетона соединяют 3,0 г (13,14 ммоль) фенола и 17,13 г (52,56 ммоль) карбоната цезия, а затем к ним добавляют 2,83 г (19,71 ммоль) N-(2-хлорэтил)диметиламина гидрохлорида. Реакционную смесь нагревают с обратным холодильником при перемешивании в течение 16 ч и концентрируют в вакууме. Твердый остаток разделяют между этилацетатом и водой (Н 2O). Водный слой экстрагируют этилацетатом (1200 мл) и соединенные органические экстракты промывают 1 М NaOH(2100 мл) и рассолом (1100 мл), высушивают над сульфатом натрия, фильтруют и концентрируют в вакууме, получая сырой продукт, который подвергают хроматографии на 80 г силика 003834 34 геля 60 (ЕМ Science) с применением дихлометана:метанола:гидроокиси аммония 95:5:0,05 для получения 3 г (76%) аминопиридина в виде бесцветного масла. Соответствующую соль гидрохлорида целевого соединения (2,95 г) получают путем растворения целевого соединения в дихлорметане (20 мл) и добавления диэтилового эфира (3 мл), насыщенного НСl. Смесь перемешивают в течение ночи, а белое осаждающее средство фильтруют и сушат. 1Hz), 6,81 (d-1H; J = 8,72 Hz), 6,97 (dd-1H; J = 8,51 Hz; J = 2,49 Hz), 7,09 (d-1H; J = 2,49 Hz),7,26 (d-1H; J = 8,51 Hz), 7,74-7,78 (m-1H). Пример 15. 4-(6-Аминопиридинил)-3 циклопропилфенол. А. 1-Циклопропил-3-бензилоксибензол. Циклопропилмагний бромид (J.O.C., 57,3499-3503, 1992) (полученный in situ, 50 ммоль в 25 мл тетрагидрофурана) добавляют шприцем в перемешиваемую смесь 1-бром-3-бензилоксибензола (7,9 г, 30 ммоль), [1,3-бис(дифенилфосфино)пропан]никель (II) дихлорида (70 мг) и тетрагидрофурана. Завершив добавление, смесь перемешивают при комнатной температуре в течение 2 ч, а затем нагревают до дефлегмации в течение 72 ч. Реакционную смесь охлаждают до комнатной температуры и разбавляют 100 мл этилового эфира (Et2O). Полученную смесь промывают 5% соляной кислотой (НСl), рассолом, а затем высушивают сульфатом магния(MgSO4) и концентрируют в вакууме. Сырой продукт подвергают хроматографии на силикагеле с применением гексанов:метиленхлорида(m, 6H). С. 2-Циклопропил-4-бензилоксикислота. Получают так же, как и в примере 1D, используя 1-бром-2-циклопропил-4-бензилоксибензол, выход - 98%, в виде розового масла. Сырой продукт не очищают, а непосредственно превращают в 2-(2-циклопропил-4-бензилоксифенил)-6-(2,5-диметилпиррол-1-ил)пиридин. 1MS (%): 396 (осн.+1, 100). Пример 19. 6-[2-Циклопропил-4-(1-метилпирролидин-3-илокси)фенил]пиридин-2-иламин. Получают путем восстановления литийалюминийгидридом (LiAlH4) трет-бутилового эфира 3-[3-(6-аминопиридин-2-ил)-4-циклопропилфенокси]пирролидин-1-карбоновой кислоты,как описано в примере 28, выход - 50%. 1H NMR (CDCl3) : 0,62-0,64 (m, 2H), 0,810,85 (m, 2H), 1,95-2,09 (m, 3H), 2,37 (s, 3H), 2,773,18 (m, 4H), 4,48 (bs, 2H), 4,81 (bs, 1H), 6,406,44 (m, 2H), 6,68 (d, J=8 Hz, 1H), 6,83 (d, J=8 Hz,1H), 7,28 (d, J=8 Hz, 1H), 7,45 (t, J=8 Hz, 1H). Пример 20. 4-(6-Аминопиридин-2-ил)-3 циклобутилфенол. А. 1-(3-Бензилоксифенил)циклобутанол. В высушенную над огнем колбу помещают магний и в атмосфере N2 добавляют раствор 1 бром-3-бензилоксибензола (10,53 г, 40 ммоль) в 30 мл безводного этилового эфира. Полученную смесь нагревают до дефлегмации в течение 8 ч. Затем реакционную смесь охлаждают до 0 С,после чего по каплям добавляют циклобутанон(J.A.C.S., 90, 3404-3415, 1968) (2,96 мл, 40 ммоль) в 10 мл безводного этилового эфира. Реакционную смесь перемешивают при комнатной температуре в течение 30 мин, а затем охлаждают до 0 С и гидролизуют водным хлоридом аммония (NH4Cl) (20 мл). Органические экстракты высушивают (МgSO4) и концентрируют в вакууме. Сырой продукт подвергают хроматографии на 300 г силикагеля, используя гексаны-этилацетат 3:1 для получения 8,5 г(Pd/C) (1,5 г). Полученную смесь подвергают гидрогенизации (J.A.C.S., 90, 3404-3415, 1968) при давлении 40 фунтов на кв.дюйм (2,8124 кг/см 2) в течение 24 ч. Реакционную смесь фильтруют через целитную подушку и концентрируют в вакууме. Сырой продукт подвергают хроматографии на 120 г силикагеля, используя гексаны-этилацетат для получения 2,9 г (83%) целевого соединения в виде бесцветного масла. 1C NMR (CDCl3) : 17,84, 28,60, 40,64,70,19, 113,09, 114,45, 114,85, 127,45, 127,99,128,55, 133,02, 136,68, 145,51, 158,17. Е. 2-Циклобутил-4-бензилоксифенилборная кислота. Получают так же, как и в примере 1, используя 1-бром-(-2-циклобутил-4-бензилоксибензол, в виде твердого вещества бежевого цвета, выход - 58%. 1H. 4-(6-Аминопиридин-2-ил)-3-циклобутилфенол. Получают нагреванием 2-(2-циклобутил-4 бензилоксифенил)-6-(2,5-диметилпиррол-1-ил) пиридина с NH2OHHCl в водном EtOH, как описано в примере 1F, в виде твердого беловатого вещества, выход - 61%,1B. 6-[2-Циклобутил-4-(1-метилпирролидин-3-илокси)фенил]пиридин-2-иламин. Получают восстановлением третбутилового эфира 3-[3-(6-аминопиридин-2-ил)4-циклобутилфенокси]пирролидин-1-карбоновой кислоты с помощью LiAlH4, как описано в примере 28, выход - 73%. 1MS (%): 324 (осн.+1, 100). Пример 24. 4-(6-Аминопиридин-3-ил)-3 циклопентилфенол. А. 1-(3-Бензилоксифенил)циклопентанол. В высушенную над огнем колбу, содержащую магний (Мg), добавляют раствор 1-бром-3 бензилоксибензола (10,53 г, 40 ммоль) в 40 мл безводного этилового эфира. В атмосфере N2 полученную смесь нагревают до дефлегмации в течение 8 ч. Реакционную смесь охлаждают до 0 С, а затем к ней по каплям добавляют циклопентанон (J.A.C.S., 90, 3404-3415, 1968) (3,54 мл, 40 ммоль) в 10 мл безводного этилового эфира. Реакцию перемешивают при комнатной температуре в течение 30 мин, затем охлаждают до 0 С и гидролизуют водным хлоридом аммония (NH4Cl) (20 мл). Органический экстракт высушивают (МgSO4) и концентрируют в вакууме. Сырой продукт подвергают хроматографии на 300 г силикагеля, используя гексаныэтилацетат (EtOAc) 3:1 для получения 4 г (37%) целевого соединения в виде бледно-желтого масла. 1Pd/C (1 г). Полученную смесь подвергают гидрогенизации (Tetrahedron Assymetry, 1360, 1993) при давлении 40 фунтов на кв.дюйм (2,8124 кг/см 2 ) в течение 2 ч. Реакционную смесь 40 фильтруют через целитную подушку и концентрируют в вакууме, получая 1,3 г (77%) целевого соединения в виде масла. 1H NMR (СDСl3) : 1,56-1,79 (m, 6H), 1,992,04 (m, 1H), 2,93 (q, J=8 Hz, 1H), 6,62 (d, J=8 Hz,1H), 6,71 (bs, 1H), 6,80 (d, J=8 Hz, 1H), 7,13 (d,J=8 Hz, 1H). С. 1-Циклопентил-3-бензилоксибензол. Получают путем нагревания 3-циклопентилфенола с бензилбромидом и карбонатом калия (К 2 СО 3) в ацетоне, как описано в примере 1 С, для получения целевого соединения; выходD. 1-Бром-2-циклопентил-4-бензилоксибензол. Получают путем бромирования 1 циклопентил-3-бензилоксибензола с помощью Н-бромсукцинамида, как описано в примере 14 В, выход составляет 76%. 1E. 2-Циклопентил-4-бензилоксифенилборная кислота. Получают путем литификации 1-бром-2 циклопентил-4-бензилоксибензола n-BuLi с последующим добавлением В(ОЕt)3, как описано в примере 1D, выход составляет 80%. 1F. 2-(2-Циклопентил-4-бензилоксифенил)6-(2,5-диметилпиррол-1-ил)пиридин. Получают путем поперечного соединения 2-циклопентил-4-бензилоксифенилборной кислоты с 2-бром-6-(2,5-диметилпиррол-1-ил) пиридина с помощью Pd, как описано в примере 1 Е, выход составляет 58%. 1G. 3-Циклопентил-4-[6-(2,5-диметилпиррол-1-ил)пиридин-2-ил]фенол. Получают восстановлением 2-(2-циклопентил-4-бензилоксифенил)-6-(2,5-диметилпиррол-1-ил)пиридина формиатом аммония и 20% гидроокисью палладия на угле (Pd(OH)2 на С),как описано в примере 1F, выход составляет 48%. 1MS (%): 352 (осн.+1, 100). Пример 27. Трет-бутиловый эфир 3-[4-(6 аминопиридин-2-ил)-3-метоксифенокси]пирролидин-1-карбоновой кислоты. В атмосфере N2 в 20 мл безводного тетрагидрофурана соединяют 173 мг (0,92 ммоль)(R)-N-бутоксикарбонил-3-оксипирролидина, 200 мг (0,92 ммоль) 4-(6-аминопиридин-2-ил)-3 метоксифенола и 267 мг (1,02 ммоль) трифенилфосфина. Реакционной смеси дают возможность охладиться до 0 С и при перемешивании добавляют 160 мкл диэтилазодикарбоксилата(1,02 ммоль). Реакционной смеси дают возмож 003834 42 ность нагреться до температуры окружающей среды и реакционную смесь перемешивают в течение 18 ч, после чего концентрируют в вакууме и вновь растворяют в этилацетате (150 мл). Органический слой промывают 1 М NaOH(2100 мл), рассолом (1100 мл), высушивают над сульфатом натрия, фильтруют и концентрируют в вакууме, получая сырой продукт, который подвергают хроматографии на 40 г силикагеля 60 (ЕМ Science) с применением этилацетата:гексана 2:1 для получения 397 мг сырого продукта (целевое соединение), которое используют непосредственно на следующей стадии. Пример 28. 6-[4-(1-Метилпирролидин-3 илокси)-2-метоксифенил]пиридин-2-иламин. В атмосфере N2 в 15 мл безводного тетрагидрофурана добавляют 357 мг (0,92 ммоль) сырого аминопиридина трет-бутилэфира 3-[4(6-аминапиридин-2-ил)-3-метоксифенокси]пирролидина-1-карбоновой кислоты и 2,31 мл (2,31 ммоль) 1,0 М раствора литийалюминийгидрида. Реакционную смесь нагревают до дефлегмации в течение 2 ч, а затем охлаждают до температуры окружающей среды. Реакционную смесь осторожно гасят 88 мкл воды, 88 мкл 1N NaOH и 264 мкл воды. Соли алюминия фильтруют и промывают этилацетатом, а фильтрат концентрируют в вакууме, получая 290 мг сырого продукта в виде зеленовато-желтого масла, которое подвергают хроматографии на 25 г силикагеля 60 (ЕМ Science) с применением дихлорметана:метанола:гидроокиси аммония 95:5:0,05 для получения 85 мг (31%) целевого соединения в виде бесцветного масла, которое превращают в 79 мг соли HCl путем растворения в дихлорметане и добавления 1 мл раствора эфира, насыщенного HCl, концентрирования и измельчения в порошок этилацетатом. 1(d-1 Н; J = 8,51 Hz). Пример 29. Трет-бутиловый эфир 4-[4-(6 аминопиридин-2-ил)-3-метоксифенокси]пиперидин-1-карбоновой кислоты. В атмосфере N2 в 15 мл диметилсульфоксида объединяют 57 мг (0,51 ммоль) третбутоксида калия, а затем добавляют 100 мг (0,46 ммоль) 4-(6-аминопиридин-2-ил)-3-метоксифенола. После этого добавляют N-бутоксикарбонил-4-оксипиперидинмезилат (142 мг, 0,51 ммоль) и полученную смесь нагревают до 105 С в течение 5 ч. Затем добавляют еще 142 мг (0,51 ммоль) мезилата и реакционную смесь нагревают еще в течение 75 мин. Реакционной смеси дают возможность охладиться до температуры окружающей среды, после этого к ней добавляют воду. Водный раствор экстрагируют этилацетатом (2150 мл). Органический слой про 43 мывают водой (2100 мл), 1 М NaOH (2100 мл),рассолом (1100 мл), сушат над сульфатом натрия, фильтруют и концентрируют в вакууме,получая сырой продукт, который подвергают хроматографии на 30 г силикагеля 60 (ЕМ Science) с применением этилацетата:гексана 2:1 для получения 210 мг сырого продукта (целевое соединение), которое используют непосредственно на следующей стадии. Пример 30. 6-[2-Метокси-4-(1-метилпиперидин-4-илокси)фенил]пиридин-2-иламин. Восстановлением трет-бутилового эфира 4-[4-(6-аминопиридин-2-ил)-3-метоксифенокси]пиперидин-1-карбоновой кислоты с помощью литийалюминийгидрида, как описано выше в связи с восстановлением трет-бутилового эфира 3-[4-(6-аминапиридин-2-ил)-3-метоксифенокси]пирролидин-1-карбоновой кислоты,получают после хроматографии на силикагеле= 8,10 Hz), 6,51-6,57 (m-2H), 7,11 (dd-1H; J = 0,62 Hz; J = 7,68 Hz), 7,41 (t-1H; J = 7,68 Hz),7,61 (d-1H; J = 8,52 Hz). Пример 31. 6-[4-(Аллилокси)-2-метоксифенил]пиридин-2-иламин. В атмосфере N2 в 75 мл ацетона соединяют 3,00 г (13,87 ммоль) 4-(6-аминопиридин-2-ил)-3 метоксифенола и 9,04 г (27,75 ммоль) карбоната цезия, к которым затем добавляют 3,39 мл(41,62 ммоль) аллилхлорида. Реакционной смеси дают возможность нагреться до 45 С при перемешивании в течение 16 ч и концентрируют смесь в вакууме. Твердый остаток разделяют между этилацетатом (200 мл) и водой (200 мл). Органический слой промывают рассолом (1x 100 мл), высушивают над сульфатом натрия,фильтруют и концентрируют в вакууме, получая продукт в виде твердого желтого вещества, которое измельчают в порошок гексаном и фильтруют для получения 3,24 г (91%) сырого продукта (целевое соединение) в виде бледножелтого твердого вещества. 1J = 8,30 Hz). Примеры 32-33. 4-(6-Аминопиридин-2-ил)3-метокси-6-аллилфенол и 4-(6-аминопиридин 2-ил)-3-метокси-2-аллилфенол. В атмосфере N2 в круглодонную колбу,оборудованную мешалкой, помещают 4-(6 аминопиридил-3-ил)-3-метоксифенол и аллиловый эфир. Из реакционного сосуда откачивают воздух при пониженном давлении, а затем продувают его газообразным азотом. Реакцион 003834 44 ный сосуд погружают в масляную ванну и нагревают до температуры 230 С с перемешиванием в течение 20 мин при этой температуре. Анализ после охлаждения с помощью тонкослойной хроматографии (2:1 этилацетат-гексан) показывает некоторое количество исходного эфира. Реакционный сосуд погружают в масляную ванну, нагретую до 230 С, еще на 20 мин. Полученное коричневое масло поглощают раствором метанола/этилацетата и соединяют с 15 г силикагеля 60 (ЕМ Science). Эту смесь концентрируют в вакууме, а полученный коричневый порошок помещают в верхнюю часть колонки из силикагеля (150 г) и подвергают хроматографии с применением этилацетата:гексана 3:2,получая 1,4 г сырого 6-аллилфенола, загрязненного некоторым количеством 2-аллилфенола. Сырой 6-аллилфенол подвергают повторной хроматографии с применением этилацетата:гексана для получения 1,05 г (33%) 6-аллилфенола в виде твердого бледно-желтого вещества. 1(m-1H), 7,42 (m-1H). Пример 34. 4-(6-Аминопиридин-2-ил)-3 метокси-6-пропилфенол. В атмосфере N2 в склянке Парра растворяют 1,20 г (4,682 ммоль) 4-(6-аминопиридин-2 ил)-3-метокси-6-аллилфенола в 25 мл абсолютного этанола. Раствор этанола подвергают гидрогенизации (при давлении 50 фунтов на кв. дюйм (3,5155 кг/см 2 в течение 45 мин при температуре окружающей среды. Затем реакционную смесь фильтруют через прокладку из целита, которую промывают дополнительным количеством метанола. Соединенные фильтраты концентрируют в вакууме, получая 1,20 г (99%) желаемого продукта. 1(dd-1H; J = 7,47 Hz; J = 8,09 Hz). Пример 35. 6-[4-(2-Диметиламиноэтокси)2-метокси-5-пропилфенил]пиридиниламин. В атмосфере N2 в 20 мл ацетона соединяют 150 мг (0,58 ммоль) 4-(6-аминопиридин-2-ил)-3 метокси-6-пропилфенола и 819 мг (2,32 ммоль) карбоната цезия, а затем к ним добавляют 125 мг (0,87 ммоль) N-(2-хлорэтил)диметиламина гидрохлорида. Реакцию подвергают дефлегмации при перемешивании в течение 16 ч и концентрируют в вакууме. Твердый остаток разделяют между этилацетатом (150 мл) и Н 2O. Органический экстракт промывают рассолом (1 х 45 100 мл), высушивают над сульфатом натрия,фильтруют и концентрируют в вакууме, получая сырой продукт, который подвергают хроматографии на 25 г силикагеля 60 (ЕМ Science) с применением дихлорметана:метанола 9:1 для получения 131 мг (69%) аминопиридина в виде твердого светло-желтого вещества. 145 мг соответствующей соли гидрохлорида целевого соединения получают путем растворения целевого соединения в дихлорметане и добавления диэтилового эфира, насыщенного НСl. Мутный раствор концентрируют в вакууме, добавляют изопропиловый спирт и раствор снова концентрируют в вакууме, получая твердое вещество,которое измельчают в порошок этилацетатом. 1J = 6,02 Hz), 3,82 (s-3H), 4,14 (t-2H; J = 6,02 Hz),4,48 (bs-2H), 6,39 (d-1H; J = 8,09 Hz), 6,50 (s-1H),7,14 (d-1H; J = 7,67 Hz), 7,43 (t-1H; J = 7,68 Hz),7,51 (s-1H). Целевые соединения примеров 36-42 получают с применением процедур, описанных в примерах 27-30. Пример 36. 6-[2-Изопропил-4-(пирролидин-3-илокси)фенил]пиридин-2-иламин. 1Hz). Целевые соединения примеров 43-75 получают с применением процедур, аналогичных процедурам, описанным в примере 2. Пример 43. 6-[4-(2-Диметиламиноэтокси)2-метоксифенил]пиридин-2-иламин. 1(t-1H; J = 7,47 Hz), 7,50 (d-1H; J = 8,72 Hz). Целевые соединения из примеров 76-94 получают с применением процедур, аналогичных процедурам, описанным в примерах 1 и 2730. Пример 76. 6-[2-Метокси-4-(пирролидин 3-илокси)фенил]пиридин-2-иламин. 1= 8,09 Hz), 7,48 (s-1 Н). Целевые соединения из примеров 95-108 получают с применением процедур, аналогичных процедурам, описанным в примере 14. где R1 и R2 выбраны независимо из группы,включающей водород, галоид, гидрокси, (С 1 С 6)алкокси, (C1-C7)алкил, (С 2-С 6)алкенил, (C2C10)алкоксиалкил;(С 0-С 4)алкил-, где R3 и R4 независимо выбирают из группы, включающей водород, (C1-C7)алкил,тетрагидронафталин и аралкил, где арильный остаток указанного аралкила представляет собой фенил или нафтил, а алкильный остаток 55 является прямым или разветвленным и содержит 1-6 атомов углерода, и где указанный (C1C7)алкил и указанный тетрагидронафталин, а также арильный остаток указанного аралкила могут быть необязательно замещены 1-3 заместителями, предпочтительно 0-2 заместителями,независимо выбранными из группы, включающей галоид, нитро, гидрокси, циано, амино, (C1 С 4)алкокси и (С 1-С 4)алкиламино; или R3 и R4 вместе с азотом, к которому они присоединены, образуют пиперазиновое,пиперидиновое, азетидиновое или пирролидиновое кольцо, либо насыщенную или ненасыщенную азабициклическую кольцевую систему,содержащую 6-14 членов в кольце, из которых 1-3 представляют собой азот, 0-2 - кислород, а остальное - углерод; и где указанные пиперазиновые, пиперидиновые, азетидиновые и пирролидиновые кольца и указанные азабициклические кольцевые системы могут быть необязательно замещены одним или несколькими заместителями,предпочтительно 0-2 заместителями, независимо выбранными из группы, включающей (C1C6)алкил-, амино, (C1-С 6)алкиламино, [ди-(C1C6)алкил]амино, замещенные фенилом 5-6 членные гетероциклические кольца, содержащие в кольце 1-4 атомов азота, бензоил, бензоилметил, бензилкарбонил, фениламинокарбонил, фенилэтил и феноксикарбонил, и где фенильные остатки любых из вышеуказанных заместителей могут быть необязательно замещены одним или несколькими заместителями, предпочтительно 0-2 заместителями, независимо выбранными из группы, включающей галоид,(C1-С 3)алкил, (C1-С 3)алкокси, нитро, амино,циано, СF3 и ОСF3; и где указанные пиперазиновые, пиперидиновые, азетидиновые и пирролидиновые кольца, а также указанные азабициклические кольцевые системы могут быть присоединены к-(С 0-С 4)алкил-O- (где кислород указанного -(С 0 С 4)алкил-O- представляет собой атом кислорода, указанный в структурной формуле I) через атом азота кольца NR3R4 или любой другой атом такого кольца, имеющий доступный связывающий сайт; или G - группу формулы А где Z - азот или СН, n = 0 или 1, q =0, 1, 2 или 3 и р =0, 1 или 2; и где 2-аминопиперидиновое кольцо, указанное выше в структуре I, может быть необязательно замещено кольцом или фармацевтически приемлемая соль такого соединения. 2. Соединение по п.1, в котором G представляет NR3R4(C0-С 4)алкил, a NR3R4 представляет пиперидиновое, пиперазиновое и пирролидиновое кольцо. 3. Соединение по п.1, в котором R1 и R2 выбирают из водорода и (C1-C2)алкила. 4. Соединение по п.1, в котором G представляет NR3R4(C0-С 4)алкил, a NR3R4 представляет группу формулы 5. Соединение по п.1, в котором G представляет группу формулы A, a Z означает азот. 6. Соединение по п.1, в котором G представляет группу формулы А, а Z означает азот,каждый из n и p = 1, a q = 2. 7. Фармацевтическая композиция для лечения или профилактики состояния, включающего мигрень, воспалительные заболевания,удар, острую и хроническую боль, гиповолемический шок, травматический шок, реперфузионную травму, болезнь Крона, неспецифический язвенный колит, септический шок, рассеянный склероз, СПИД-ассоциированное слабоумие,нейродегенеративные заболевания, нейронную токсичность, болезнь Альцгеймера, химические 57 зависимости и аддикции, рвоту, эпилепсию,тревогу, психоз, травму головы, респираторный дистресс-синдром у взрослых, морфиноиндуцированную толерантность и абстинентные симптомы, воспалительные заболевания кишечника, остеоартрит, ревматоидный артрит, овуляцию, дилатированную кардиомиопатию, острые травмы позвоночника, болезнь Хантингтона, болезнь Паркинсона, глаукому, макулярную дегенерацию, диабетическую нейропатию, диабетическую нефропатию и рак у млекопитающих, включающая соединение по п.1 в количестве, эффективном для лечения или профилактики такого состояния, и фармацевтически приемлемый носитель. 8. Способ лечения или профилактики состояния, связанного с избытком окиси азота,продуцируемым синтазой окиси азота, входящего в группу, включающую мигрень, воспалительные заболевания, удар, острую и хроническую боль, гиповолемический шок, травматический шок, реперфузионную травму, болезнь Крона, неспецифический язвенный колит, септический шок, рассеянный склероз, СПИДассоциированное слабоумие, нейродегенеративные заболевания, нейронную токсичность, болезнь Альцгеймера, химические зависимости и аддикции, рвоту, эпилепсию, тревогу, психоз,травму головы, респираторный дистресссиндром у взрослых, морфино-индуцированную толерантность и абстинентные симптомы, воспалительные заболевания кишечника, остеоартрит, ревматоидный артрит, овуляцию, дилатированную кардиомиопатию, острые травмы позвоночника, болезнь Хантингтона, болезнь Паркинсона, глаукому, макулярную дегенерацию,диабетическую нейропатию, диабетическую нефропатию и рак у млекопитающих, включающий соединение по п.1 в количестве, эффективном для лечения или профилактики такого состояния. 9. Фармацевтическая композиция для ингибирования синтазы окиси азота (NOS) у млекопитающих по п.1, включающая соединение по п.1 в количестве, эффективном для ингибирования синтазы окиси азота, и фармацевтически приемлемый носитель. 10. Способ ингибирования синтазы окиси азота у млекопитающих, включающий введение указанным млекопитающим эффективного количества соединения по п.1, ингибирующего синтазу окиси азота. 11. Фармацевтическая композиция для лечения и профилактики состояния, включающего мигрень, воспалительные заболевания, удар,острую и хроническую боль, гиповолемический шок, травматический шок, реперфузионную травму, болезнь Крона, неспецифический язвенный колит, септический шок, рассеянный склероз, СПИД-ассоциированное слабоумие,нейродегенеративные заболевания, нейронную токсичность, болезнь Альцгеймера, химические 58 зависимости и аддикции, рвоту, эпилепсию,тревогу, психоз, травму головы, респираторный дистресс-синдром у взрослых, морфиноиндуцированную толерантность и абстинентные симптомы, воспалительные заболевания кишечника, остеоартрит, ревматоидный артрит, овуляцию, дилатированную кардиомиопатию, острые травмы позвоночника, болезнь Хантингтона, болезнь Паркинсона, глаукому, макулярную дегенерацию, диабетическую нейропатию, диабетическую нефропатию и рак у млекопитающих, включающая соединение по п.1 в количестве, эффективном для ингибирования синтазы окиси азота, и фармацевтически приемлемый носитель. 12. Способ лечения или профилактики состояния, связанного с избытком окиси азота,продуцируемым синтазой окиси азота, включающего мигрень, воспалительные заболевания,удар, острую и хроническую боль, гиповолемический шок, травматический шок, реперфузионную травму, болезнь Крона, неспецифический язвенный колит, септический шок, рассеянный склероз, СПИД-ассоциированное слабоумие,нейродегенеративные заболевания, нейронную токсичность, болезнь Альцгеймера, химические зависимости и аддикции, рвоту, эпилепсию,тревогу, психоз, травму головы, респираторный дистресс-синдром у взрослых, морфиноиндуцированную толерантность и абстинентные симптомы, воспалительные заболевания кишечника, остеоартрит, ревматоидный артрит, овуляцию, дилатированную кардиомиопатию, острые травмы позвоночника, болезнь Хантингтона, болезнь Паркинсона, глаукому, макулярную дегенерацию, диабетическую нейропатию, диабетическую нефропатию и рак у млекопитающих, включающий введение указанным млекопитающим эффективного количества соединения по п.1, ингибирующего синтазу окиси азота. 13. Соединение формулы где R1 и R2 выбраны независимо из группы,включающей водород, галоид, гидрокси, (C1C6)алкокси, (C1-C7)алкил, (С 2-С 6)алкенил, (С 2 С 10)алкоксиалкил; и(С 0-С 4)алкил-, где R3 и R4 независимо выбирают из группы, включающей водород, (C1-C7)алкил,тетрагидронафталин и аралкил, где арильный остаток указанного аралкила представляет собой фенил или нафтил, а алкильный остаток является прямым или разветвленным и содер 59 жит 1-6 атомов углерода, и где указанный (C1C7)алкил и указанный тетрагидронафталин, а также арильный остаток указанного аралкила могут быть необязательно замещены 1-3 заместителями, предпочтительно 0-2 заместителями,независимо выбранными из группы, включающей галоид, нитро, гидрокси, циано, амино, (C1 С 4)алкокси и (C1-C4)алкиламино; или R3 и R4 вместе с азотом, к которому они присоединены, образуют пиперазиновое,пиперидиновое, азетидиновое или пирролидиновое кольцо, либо насыщенную или ненасыщенную азабициклическую кольцевую систему,содержащую в кольце 6-14 членов, из которых 1-3 представляют собой азот, 0-2 - кислород, а остальное - углерод; и где указанные пиперазиновые, пиперидиновые, азетидиновые и пирролидиновые кольца и указанные азабициклические кольцевые системы могут быть необязательно замещены одним или несколькими заместителями,предпочтительно 0-2 заместителями, независимо выбранными из группы, включающей (C1C6)алкил-, амино, (C1-С 6)алкиламино, [ди-(C1C6)алкил] амино, замещенные фенилом 5-6 членные гетероциклические кольца, содержащие в кольце 1-4 атомов азота, бензоил, бензоилметил, бензилкарбонил, фениламинокарбонил, фенилэтил и феноксикарбонил, и где фенильные остатки любых из вышеуказанных заместителей могут быть необязательно замещены одним или несколькими заместителями, предпочтительно 0-2 заместителями, независимо выбранными из группы, включающей галоид,(C1-С 3)алкил, (C1-С 3)алкокси, нитро, амино,циано, СF3 и ОСF3; и где указанные пиперазиновые, пиперидиновые, азетидиновые и пирролидиновые кольца, а также указанные азабициклические кольцевые системы могут быть присоединены к-(С 0-С 4)алкил-O- (где кислород указанного -(С 0 С 4)алкил-O- представляет собой атом кислорода, указанный в структурной формуле I) через атом азота кольца NR3R4 или любой другой атом такого кольца, имеющий доступный связывающий сайт; или G - группу формулы А где Z - азот или СН, n = 0 или 1, q = 0, 1, 2 или 3 и р = 0, 1 или 2; и где 2-аминопиперидиновое кольцо, указанное выше в структуре I, может быть необязательно замещено кольцом а Р представляет группу, защищающую азот,такую как тритил, ацетил, бензоил, триметилацетил, трет-бутоксикарбонил, бензилоксикарбонил и трихлорэтилоксикарбонил, и где Р, являясь 2,5-диметилпирролилом, может образовывать кольцо с защищенным азотом; в этом случае водород, который, как указано выше, прикреплен к такому азоту, отсутствует. 14. Соединение формулы где Y представляет фтор или бензилокси;R1 и R2 независимо выбирают из группы,включающей водород, галоид, гидрокси, (С 1 С 6)алкокси, (С 1-С 7)алкил, (С 2-С 6)алкенил, (С 2 С 10)алкоксиалкил; a Р представляет группу, защищающую азот,такую как тритил, ацетил, бензоил, триметилацетил, трет-бутоксикарбонил, бензилоксикарбонил и трихлорэтилоксикарбонил, и где Р, являясь 2,5-диметилпирролилом, может образовывать кольцо с защищенным азотом; в этом случае водород, который, как указано выше, прикреплен к такому азоту, отсутствует.
МПК / Метки
МПК: A61P 25/00, A61K 31/4418, C07D 213/73, C07D 401/12
Метки: окиси, синтазы, качестве, 2-амино-6-(2-замещенные-4-фенокси)-замещенные-пиридины, ингибиторов, азота
Код ссылки
<a href="https://eas.patents.su/30-3834-2-amino-6-2-zameshhennye-4-fenoksi-zameshhennye-piridiny-v-kachestve-ingibitorov-sintazy-okisi-azota.html" rel="bookmark" title="База патентов Евразийского Союза">2-амино-6-(2-замещенные-4-фенокси)-замещенные-пиридины в качестве ингибиторов синтазы окиси азота</a>