Производные [1,2,3]триазоло[4,5-d]пиримидина в качестве агонистов каннабиноидного рецептора 2
Номер патента: 24108
Опубликовано: 31.08.2016
Авторы: Гретер Уве, Рёфер Штефан, Роджерс-Эванс Марк, Кимбара Ацуси, Неттекофен Маттиас, Биссанц Катерина
Формула / Реферат
1. Соединение формулы (I)
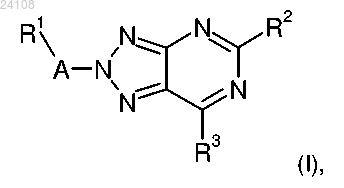
в которой А представляет собой C1-C8-алкилен, гидрокси-C1-C8-алкилен, -СН2С(О)-, -С(О)-, -SO2- или отсутствует;
R1 представляет собой водород, C1-C8-алкил, галоген-C1-C8-алкил, гидроксил, C1-C8-алкоксигруппу, галоген-C1-C8-алкоксигруппу, фенил, галогенфенил, C1-C8-алкоксифенил, галоген-C1-C8-алкилфенил, галоген-C1-C8-алкоксифенил, цианофенил, гидрокси-C1-C8-алкоксифенил, C1-C8-алкилсульфонилфенил, C1-C8-алкилсульфониламинофенил, (галоген)(галоген-C1-C8-алкил)фенил, (галоген)(C1-C8-алкокси)фенил, цианогруппу, С3-С8-циклоалкил, С3-С8-циклоалкил-С1-С8-алкоксигруппу, аминогруппу, гетероциклил, C1-C8-алкилгетероциклил, гидроксигетероциклил, C1-C8-алкилгетероциклил, гетероарил, галогенгетероарил, C1-C8-алкилгетероарил, (С1-С8-алкил)(С1-С8-алкилсульфонил)гетероарил, (галоген)(C1-C8-алкиламино)гетероарил, галоген-C1-C8-алкилгетероарил, С3-С8-циклоалкилгетероарил или нитробензо[1,2,5]оксадиазолиламиногетероарил, при этом гетероциклил представляет собой 3-8-членное карбоциклическое кольцо, включающее по меньшей мере один атом азота или кислорода, и при этом гетероарил представляет собой пиридинил, пиразолил, оксадиазолил, фуразанил, тетразолил, триазолил или оксипиридинил;
R2 представляет собой C1-C8-алкил, галоген-C1-C8-алкил, гидрокси-C1-C8-алкил, C1-C8-алкокси-С1-С8-алкил, С3-С8-циклоалкокси-С1-С8-алкил, С3-С8-циклоалкил-С1-С8-алкоксигруппу, галоген-C1-C8-алкоксигруппу, C1-C8-алкокси или C1-C8-алкиламиногруппу;
R3 представляет собой галоген или -NR4R5;
один из R4 и R5 представляет собой водород или C1-C8-алкил, а другой из них представляет собой C1-C8-алкил или С3-С8-циклоалкил;
или R4 и R5 совместно с атомом азота, которому они присоединены, образуют гетероциклил или замещенный гетероциклил, при этом гетероциклил представляет собой морфолинил, пиперидинил, пиперазинил, пирролидинил, 2-окса-6-азаспиро[3,3]гептил, азетидинил, тиазолидинил, тиоморфолинил, диоксотиоморфолинил, оксазепанил, 2-окса-6-азаспиро[3,4]октил, 6-окса-1-азаспиро[3,3]гептил, 2-окса-5-азаспиро[3,4]октил, изоксазолидинил, азиридинил или диоксоизотиазолидинил, при этом замещенный гетероциклил представляет собой гетероциклил, содержащий от одного до четырех заместителей, независимо выбранных из C1-C8-алкила, галогена, гидроксила, C1-C8-алкоксигруппы, гидрокси-C1-C8-алкила, карбоксила, C1-С8-алкокси-C1-C8-алкила, цианогруппы и C1-C8-алкилкарбониламиногруппы;
или его фармацевтически приемлемая соль или эфир.
2. Соединение по п.1, в котором A представляет собой C1-C8-алкилен, -CH2C(O)- или отсутствует.
3. Соединение по п.1 или 2, в котором A представляет собой С1-С8-алкилен.
4. Соединение по любому из пп.1-3, в котором A представляет собой метилен, этилен или -CH(CH3)-.
5. Соединение по любому из пп.1-4, в котором R1 представляет собой С1-С8-алкил, галоген-C1-C8-алкил, гидроксил, C1-C8-алкоксигруппу, фенил, галогенфенил, C1-C8-алкоксифенил, галоген-C1-C8-алкилфенил, галоген-C1-C8-алкоксифенил, цианофенил, С3-С8-циклоалкил, гетероциклил, галогенгетероарил или C1-C8-алкилгетероарил, при этом гетероциклил представляет собой оксетанил, при этом гетероарил представляет собой пиридинил или фуразанил.
6. Соединение по любому из пп.1-5, в котором R1 представляет собой C1-C8-алкил, галоген-C1-C8-алкил, гидроксил, C1-C8-алкоксигруппу, фенил, галогенфенил, C1-C8-алкоксифенил, галоген-C1-C8-алкилфенил, галоген-C1-C8-алкоксифенил, цианофенил, С3-С8-циклоалкил, оксетанил, пиридинил, галогенпиридинил или C1-C8-алкилфуразанил.
7. Соединение по любому из пп.1-6, в котором R1 представляет собой трифторметил, фенил, хлорфенил, бромфенил, цианофенил, циклогексил, пиридинил, хлорпиридинил, метилфуразанил или трифторметилфенил.
8. Соединение по любому из пп.1-7, в котором R2 представляет собой C1-C8-алкил.
9. Соединение по любому из пп.1-8, в котором R2 представляет собой трет-бутил.
10. Соединение по любому из пп.1-9, в котором R3 представляет собой -NR4R5.
11. Соединение по любому из пп.1-10, в котором R4 и R5 совместно с атомом азота, которому они присоединены, образуют морфолинил, галогенпирролидинил или гидроксипирролидинил.
12. Соединение по любому из пп.1-11, в котором R4 и R5 совместно с атомом азота, которому они присоединены, образуют морфолинил, дифторпирролидинил или гидроксипирролидинил.
13. Соединение по любому из пп.1-12, выбранное из следующих:
5-трет-бутил-2-(2-хлорбензил)-7-морфолин-4-ил-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(2-хлор-4-фторбензил)-7-морфолин-4-ил-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-этил-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-(2-метоксиэтил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
2-[5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-[1,2,3]триазоло[4,5-d]пиримидин-2-ил]этанол;
5-трет-бутил-2-циклогексилметил-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(3-хлорбензил)-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(4-хлорбензил)-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(2,3-дихлорбензил)-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(2,4-дихлорбензил)-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(2,5-дихлорбензил)-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(2,6-дихлорбензил)-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(2-хлор-4-фторбензил)-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(2-хлор-6-фторбензил)-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-пиридин-2-илметил-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-пиридин-3-илметил-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-пиридин-4-илметил-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-(2,2,2-трифторэтил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(2-хлор-4,5-дифторбензил)-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(2-хлор-3,6-дифторбензил)-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
2-(2-бромбензил)-5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-(2-трифторметилбензил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-(2-метоксибензил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-(2-трифторметоксибензил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
2-[5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-[1,2,3]триазоло[4,5-d]пиримидин-2-илметил]бензонитрил;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-фенэтил-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
2-[5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-[1,2,3]триазоло[4,5-d]пиримидин-2-ил]-1-фенилэтанон;
5-трет-бутил-2-[(R)-1-(2-хлорфенил)этил]-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-[(S)-1-(2-хлорфенил)этил]-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(2-хлор-3-фторбензил)-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(2-хлор-5-фторбензил)-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-оксетан-3-ил-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(2,6-дихлор-3-фторбензил)-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(2-хлорпиридин-3-илметил)-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(4-хлорпиридин-3-илметил)-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(3-хлорпиридин-2-илметил)-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(2,5-дихлорпиридин-3-илметил)-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(3,6-дихлорпиридин-2-илметил)-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-(4-метилфуразан-3-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-(3-метил-[1,2,4]оксадиазол-5-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-[2-(2-хлорфенил)этил]-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-[2-(3-хлорфенил)этил]-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-[2-(4-хлорфенил)этил]-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(2,4-дихлорпиридин-3-илметил)-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-(R)-тетрагидрофуран-3-ил-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-(S)-тетрагидрофуран-3-ил-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
2-[5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-[1,2,3]триазоло[4,5-d]пиримидин-2-ил]-1-(2-хлорфенил)этанон;
5-трет-бутил-2-(2,3-дихлор-6-фторбензил)-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-(2-метансульфонилбензил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-(2-пиридин-2-илэтил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-(3-метилоксетан-3-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
2-[5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-[1,2,3]триазоло[4,5-d]пиримидин-2-ил]-1-(3-хлорфенил)этанон;
2-[5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-[1,2,3]триазоло[4,5-d]пиримидин-2-ил]-1-(4-хлорфенил)этанон;
2-[5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-[1,2,3]триазоло[4,5-d]пиримидин-2-ил]-1-пиридин-3-илэтанон;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-(2,3,6-трихлорбензил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(2-хлор-3-трифторметилбензил)-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(2-хлор-6-фтор-3-метоксибензил)-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-(2-пиридин-3-илэтил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-(2-пиридин-4-илэтил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(2,3-дихлор-6-трифторметилбензил)-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(3,4-дихлорпиридин-2-илметил)-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-(1,1-диоксо-1l6-тиетан-3-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-(1,1-диоксотетрагидро-1l6-тиофен-3-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
2-[5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-[1,2,3]триазоло[4,5-d]пиримидин-2-ил]-1-пиридин-2-илэтанон;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-(5-метил-[1,3,4]оксадиазол-2-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(3-хлорпиридин-4-илметил)-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-(5-метил-[1,2,4]оксадиазол-3-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-(1-метил-1H-тетразол-5-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-(2-метил-2Н-[1,2,4]триазол-3-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-(5-метансульфонил-4-метил-4Н-[1,2,4]триазол-3-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
{3-[5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-[1,2,3]триазоло[4,5-d]пиримидин-2-илметил]-5-хлорпиридин-4-ил}диметиламин;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-(3-трифторметил-1H-пиразол-4-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
(S)-1-(5-трет-бутил-2-(4-метилфуразан-3-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]пирролидин-3-ол;
(S)-1-(5-трет-бутил-2-(3-метил-[1,2,4]оксадиазол-5-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]пирролидин-3-ол;
(S)-1-(5-трет-бутил-2-(3-хлорпиридин-2-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]пирролидин-3-ол;
(S)-1-(5-трет-бутил-2-(3,6-дихлорпиридин-2-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]пирролидин-3-ол;
(S)-1-(5-трет-бутил-2-(2-хлорпиридин-3-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]пирролидин-3-ол;
(S)-1-(5-трет-бутил-2-(2,3-дихлорбензил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]пирролидин-3-ол;
(S)-1-(5-трет-бутил-2-(2-трифторметилбензил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]пирролидин-3-ол;
(S)-1-(5-трет-бутил-2-(2-метансульфонилбензил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]пирролидин-3-ол;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-(2,5-диметил-2Н-пиразол-3-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-(3-метил-3H-[1,2,3]триазол-4-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-(4,5-диметил-4Н-[1,2,4]триазол-3-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-(2-метил-1-оксипиридин-3-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
(S)-1-(5-трет-бутил-2-(3,4-дихлорпиридин-2-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]пирролидин-3-ол;
(S)-1-(5-трет-бутил-2-(5-метил-[1,2,4]оксадиазол-3-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]пирролидин-3-ол;
(S)-1-(5-трет-бутил-2-(5-метил-[1,3,4]оксадиазол-2-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]пирролидин-3-ол;
(S)-1-[5-трет-бутил-2-(1-метил-1H-тетразол-5-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]пирролидин-3-ол;
(S)-1-(5-трет-бутил-2-(2-метил-2Н-[1,2,4]триазол-3-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]пирролидин-3-ол;
(S)-1-(5-трет-бутил-2-(3-метил-3H-[1,2,3]триазол-4-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]пирролидин-3-ол;
(S)-1-(5-трет-бутил-2-(2,5-диметил-2Н-пиразол-3-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]пирролидин-3-ол;
5-трет-бутил-2-(1-циклопропил-1H-тетразол-5-илметил)-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
(S)-1-{5-трет-бутил-2-[2-(7-нитробензо[1,2,5]оксадиазол-4-иламино)пиридин-3-илметил]-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил}пирролидин-3-ол;
(S)-1-[5-трет-бутил-2-(1-циклопропил-1H-тетразол-5-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]пирролидин-3-ол;
(S)-1-(5-трет-бутил-2-(2,5-диметил-2Н-[1,2,4]триазол-3-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]пирролидин-3-ол;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-(2,5-диметил-2Н-[1,2,4]триазол-3-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
(2S,3S)-1-[5-трет-бутил-2-(1-циклопропил-1H-тетразол-5-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]-2-гидроксиметилпирролидин-3-ол;
(2S,3S)-1-[5-трет-бутил-2-(4-метилфуразан-3-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]-2-гидроксиметилпирролидин-3-ол;
5-трет-бутил-2-(4-метилфуразан-3-илметил)-7-(3,3,4,4-тетрафторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(3-метил-[1,2,4]оксадиазол-5-илметил)-7-(3,3,4,4-тетрафторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(5-метил-[1,3,4]оксадиазол-2-илметил)-7-(3,3,4,4-тетрафторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(1-метил-1H-тетразол-5-илметил)-7-(3,3,4,4-тетрафторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(4,5-диметил-4Н-[1,2,4]триазол-3-илметил)-7-(3,3,4,4-тетрафторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(3-метил-3H-[1,2,3]триазол-4-илметил)-7-(3,3,4,4-тетрафторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(1-циклопропил-1H-тетразол-5-илметил)-7-(2-окса-6-азаспиро[3,3]гепт-6-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(4,5-диметил-4Н-[1,2,4]триазол-3-илметил)-7-(2-окса-6-азаспиро[3,3]гепт-6-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(2-метансульфонилбензил)-7-(2-окса-6-азаспиро[3,3]гепт-6-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(3-хлорпиридин-2-илметил)-7-(2-окса-6-азаспиро[3,3]гепт-6-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
(S)-1-[2-(2-хлорбензил)-5-(2,2,2-трифторэтокси)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]пирролидин-3-ол;
(S)-1-[5-(2,2,2-трифторэтокси)-2-(2-трифторметилбензил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]пирролидин-3-ол;
(S)-1-[2-(2-хлорбензил)-5-изопропокси-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]пирролидин-3-ол;
7-(3,3-дифторпирролидин-1-ил)-5-(2,2-диметилпропокси)-2-(1-метил-1H-тетразол-5-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
(R)-1-[5-трет-бутил-2-(1-метил-1H-тетразол-5-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]пирролидин-3-ол;
1-[5-трет-бутил-2-(1-метил-1Н-тетразол-5-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]пирролидин-3-ол;
7-(3,3-дифторпирролидин-1-ил)-2-(2-трифторметилбензил)-5-((S)-2,2,2-трифтор-1-метилэтокси)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
7-(3,3-дифторпирролидин-1-ил)-2-(2-метансульфонилбензил)-5-((S)-2,2,2-трифтор-1-метилэтокси)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
2-(3-хлорпиридин-2-илметил)-7-(3,3-дифторпирролидин-1-ил)-5-((S)-2,2,2-трифтор-1-метилэтокси)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
7-(3,3-дифторпирролидин-1-ил)-2-(5-метил-[1,3,4]оксадиазол-2-илметил)-5-((S)-2,2,2-трифтор-1-метилэтокси)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
7-(3,3-дифторпирролидин-1-ил)-2-(3-метил-[1,2,4]оксадиазол-5-илметил)-5-((S)-2,2,2-трифтор-1-метилэтокси)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
7-(3,3-дифторпирролидин-1-ил)-2-(1-метил-1H-тетразол-5-илметил)-5-((S)-2,2,2-трифтор-1-метилэтокси)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
7-(3,3-дифторпирролидин-1-ил)-2-(4-метилфуразан-3-илметил)-5-((S)-2,2,2-трифтор-1-метилэтокси)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
7-(3,3-дифторпирролидин-1-ил)-5-((S)-2,2,2-трифтор-1-метилэтокси)-2-(3,3,3-трифторпропил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
2-(1-циклопропил-1H-тетразол-5-илметил)-7-(3,3-дифторпирролидин-1-ил)-5-((S)-2,2,2-трифтор-1-метилэтокси)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
(S)-1-(5-трет-бутил-2-(2-хлорбензил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]-3-метилпирролидин-3-ол;
(R)-1-[5-трет-бутил-2-(2-хлорбензил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]-3-метилпирролидин-3-ол;
(S)-1-(5-трет-бутил-2-(2-трифторметилбензил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]-3-метилпирролидин-3-ол;
(R)-1-[5-трет-бутил-2-(2-трифторметилбензил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]-3-метилпирролидин-3-ол;
(S)-1-(5-трет-бутил-2-(2-метансульфонилбензил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]-3-метилпирролидин-3-ол;
(R)-1-[5-трет-бутил-2-(2-метансульфонилбензил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]-3-метилпирролидин-3-ол;
(S)-1-(5-трет-бутил-2-(3-хлорпиридин-2-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]-3-метилпирролидин-3-ол;
(R)-1-[5-трет-бутил-2-(3-хлорпиридин-2-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]-3-метилпирролидин-3-ол;
(S)-1-(5-трет-бутил-2-(5-метил-[1,3,4]оксадиазол-2-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]-3-метилпирролидин-3-ол;
(R)-1-[5-трет-бутил-2-(5-метил-[1,3,4]оксадиазол-2-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]-3-метилпирролидин-3-ол;
(S)-1-(5-трет-бутил-2-(3-метил-[1,2,4]оксадиазол-5-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]-3-метилпирролидин-3-ол;
(R)-1-[5-трет-бутил-2-(3-метил-[1,2,4]оксадиазол-5-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]-3-метилпирролидин-3-ол;
(S)-1-[5-трет-бутил-2-(1-метил-1H-тетразол-5-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]-3-метилпирролидин-3-ол;
(R)-1-[5-трет-бутил-2-(1-метил-1H-тетразол-5-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]-3-метилпирролидин-3-ол;
(S)-1-(5-трет-бутил-2-(4-метилфуразан-3-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]-3-метилпирролидин-3-ол;
(R)-1-[5-трет-бутил-2-(4-метилфуразан-3-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]-3-метилпирролидин-3-ол;
(S)-1-(5-трет-бутил-2-(3,3,3-трифторпропил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]-3-метилпирролидин-3-ол;
(R)-1-[5-трет-бутил-2-(3,3,3-трифторпропил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]-3-метилпирролидин-3-ол;
(S)-1-[5-трет-бутил-2-(1-циклопропил-1H-тетразол-5-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]-3-метилпирролидин-3-ол;
(R)-1-[5-трет-бутил-2-(1-циклопропил-1H-тетразол-5-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]-3-метилпирролидин-3-ол;
N-{(S)-1-[2-(2-хлорбензил)-5-(2,2-диметилпропокси)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]пирролидин-3-ил}ацетамид;
N-{(S)-1-[2-(3-хлорпиридин-2-илметил)-5-(2,2-диметилпропокси)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]пирролидин-3-ил}ацетамид;
трет-бутил-[7-(3,3-дифторпирролидин-1-ил)-2-(2-трифторметилбензил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-5-ил]амин;
трет-бутил-[7-(3,3-дифторпирролидин-1-ил)-2-(2-метансульфонилбензил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-5-ил]амин;
трет-бутил-[2-(3-хлорпиридин-2-илметил)-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-5-ил]амин;
трет-бутил-[7-(3,3-дифторпирролидин-1-ил)-2-(1-метил-1H-тетразол-5-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-5-ил]амин;
трет-бутил-[7-(3,3-дифторпирролидин-1-ил)-2-(4-метилфуразан-3-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-5-ил]амин;
N-{(S)-1-[2-(2-хлорбензил)-5-((S)-2,2,2-трифтор-1-метилэтокси)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]пирролидин-3-ил}ацетамид;
N-{(S)-1-[2-(2-трифторметилбензил)-5-((S)-2,2,2-трифтор-1-метилэтокси)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]пирролидин-3-ил}ацетамид;
N-{(S)-1-[2-(2-метансульфонилбензил)-5-((S)-2,2,2-трифтор-1-метилэтокси)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]пирролидин-3-ил}ацетамид;
N-{(S)-1-(5-трет-бутиламино-2-(2-хлорбензил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]пирролидин-3-ил}ацетамид и
(S)-1-[5-трет-бутиламино-2-(1-метил-1H-тетразол-5-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]пирролидин-3-ол.
14. Соединение по любому из пп.1-13, выбранное из следующих:
5-трет-бутил-2-(2-хлорбензил)-7-морфолин-4-ил-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-циклогексилметил-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-пиридин-4-илметил-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-(2,2,2-трифторэтил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
2-(2-бромбензил)-5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
2-[5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-[1,2,3]триазоло[4,5-d]пиримидин-2-илметил]бензонитрил;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-фенэтил-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-[(R)-1-(2-хлорфенил)этил]-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(4-хлорпиридин-3-илметил)-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(3-хлорпиридин-2-илметил)-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2-(4-метилфуразан-3-илметил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин;
5-трет-бутил-2-(3-хлорпиридин-4-илметил)-7-(3,3-дифторпирролидин-1-ил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин и
(S)-1-(5-трет-бутил-2-(2-трифторметилбензил)-2Н-[1,2,3]триазоло[4,5-d]пиримидин-7-ил]пирролидин-3-ол.
15. Применение соединения по любому из пп.1-14 в качестве терапевтически активного вещества, являющегося агонистом каннабиноидного рецептора 2.
16. Фармацевтическая композиция, обладающая агонистической активностью в отношении каннабиноидного рецептора 2, включающая соединение по любому из пп.1-14 и терапевтически инертный носитель.
17. Применение соединения по любому из пп.1-14 для лечения или профилактики боли, атеросклероза, возрастной макулярной дистрофии, диабетической ретинопатии, глаукомы, сахарного диабета, воспаления, воспалительного заболевания кишечника, ишемически-реперфузионного повреждения, острой печеночной недостаточности, фиброза печени, фиброза легких, фиброза почек, системного фиброза, острого отторжения аллотрансплантанта, хронической нефропатии аллотрансплантанта, диабетической нефропатии, гломерулонефропатии, кардиомиопатии, сердечной недостаточности, ишемии миокарда, инфаркта миокарда, системного склероза, термического повреждения, ожога, гипертрофических рубцов, келоидов, лихорадки при гингивите, цирроза или опухолей печени, регуляции костной массы, нейродегенерации, инсульта, преходящего нарушения мозгового кровообращения или увеита.
18. Применение соединения по любому из пп.1-14 для изготовления лекарственного средства для лечения или профилактики боли, атеросклероза, возрастной макулярной дистрофии, диабетической ретинопатии, глаукомы, сахарного диабета, воспаления, воспалительного заболевания кишечника, ишемически-реперфузионного повреждения, острой печеночной недостаточности, фиброза печени, фиброза легких, фиброза почек, системного фиброза, острого отторжения аллотрансплантанта, хронической нефропатии аллотрансплантанта, диабетической нефропатии, гломерулонефропатии, кардиомиопатии, сердечной недостаточности, ишемии миокарда, инфаркта миокарда, системного склероза, термического повреждения, ожога, гипертрофических рубцов, келоидов, лихорадки при гингивите, цирроза или опухолей печени, регуляции костной массы, нейродегенерации, инсульта, преходящего нарушения мозгового кровообращения или увеита.
19. Способ лечения или профилактики боли, атеросклероза, возрастной макулярной дистрофии, диабетической ретинопатии, глаукомы, сахарного диабета, воспаления, воспалительного заболевания кишечника, ишемически-реперфузионного повреждения, острой печеночной недостаточности, фиброза печени, фиброза легких, фиброза почек, системного фиброза, острого отторжения аллотрансплантанта, хронической нефропатии аллотрансплантанта, диабетической нефропатии, гломерулонефропатии, кардиомиопатии, сердечной недостаточности, ишемии миокарда, инфаркта миокарда, системного склероза, термического повреждения, ожога, гипертрофических рубцов, келоидов, лихорадки при гингивите, цирроза или опухолей печени, регуляции костной массы, нейродегенерации, инсульта, преходящего нарушения мозгового кровообращения или увеита, включающий введение эффективного количества соединения по пп.1-14 пациенту.
Текст
ПРОИЗВОДНЫЕ [1,2,3]ТРИАЗОЛО[4,5-d]ПИРИМИДИНА В КАЧЕСТВЕ АГОНИСТОВ КАННАБИНОИДНОГО РЕЦЕПТОРА 2 Настоящее изобретение касается органических соединений, полезных для лечения и/или профилактики у млекопитающих, и, в частности, к соединениям, которые представляют собой селективные агонисты каннабиноидного рецептора 2. Соединение формулы (I), в частности, полезны в лечении или профилактике, например, боли, атеросклероза, возрастной макулярной дистрофии, диабетической ретинопатии,глаукомы, сахарного диабета, воспаления, воспалительного заболевания кишечника, ишемическиреперфузионного повреждения, острой печеночной недостаточности, фиброза печени, фиброза легких,фиброза почек, системного фиброза, острого отторжения аллотрансплантанта, хронической нефропатии аллотрансплантанта, диабетической нефропатии, гломерулонефропатии, кардиомиопатии, сердечной недостаточности, ишемии миокарда, инфаркта миокарда, системного склероза, термического повреждения, ожога, гипертрофических рубцов, келоидов, лихорадки при гингивите, опухолей или цирроза печени, регуляции костной массы, нейродегенерации, инсульта, преходящего нарушения мозгового кровообращения или увеита. Настоящее изобретение относится, в частности, к соединению формулы (I)R1 представляет собой водород, алкил, галогеналкил, гидроксил, алкоксигруппу, галогеналкоксигруппу, фенил, галогенфенил, алкоксифенил, галогеналкилфенил, галогеналкоксифенил, цианофенил,гидроксиалкоксифенил,алкилсульфонилфенил,алкилсульфониламинофенил,(галоген)(галогеналкил)фенил, (галоген)(алкокси)фенил, цианогруппу, циклоалкил, циклоалкилалкоксигруппу, аминогруппу, гетероциклил, алкилгетероциклил, гидроксигетероциклил, алкилгетероциклил, гетероарил,галогенгетероарил,алкилгетероарил,(алкил)(алкилсульфонил)гетероарил,(галоген)(алкиламино)гетероарил, галогеналкил гетероарил, циклоалкил гетероарил или нитробензо[1,2,5]оксадиазолиламиногетероарил, при этом гетероциклил представляет собой карбоциклическое кольцо, включающее от трех до восьми членов, в том числе по меньшей мере один атом азота или кислорода, и при этом гетероарил представляет собой пиридинил, пиразолил, оксадиазолил, фуразанил, тетразолил, триазолил или оксипиридинил;R3 представляет собой галоген или -NR4R5; один из R4 и R5 представляет собой водород или алкил, а другой из них представляет собой алкил или циклоалкил; или R4 и R5 совместно с атомом азота, которому они присоединены, образуют гетероциклил или замещенный гетероциклил, при этом гетероциклил представляет собой морфолинил, пиперидинил, пиперазинил, пирролидинил, 2-окса-6-азаспиро[3.3]гептил, азетидинил, тиазолидинил, тиоморфолинил, диоксотиоморфолинил, оксазепанил, 2-окса-6-азаспиро[3.4]октил, 6-окса-1-азаспиро[3.3]гептил, 2-окса-5 азаспиро[3.4]октил, изоксазолидинил, азиридинил или диоксоизотиазолидинил, при этом замещенный гетероциклил представляет собой гетероциклил, содержащий от одного до четырех заместителей, независимо выбранных из алкила, галогена, гидроксила, алкоксигруппы, гидроксиалкила, карбоксила, алкоксиалкила, цианогруппы и алкилкарбониламиногруппы; или к его фармацевтически приемлемой соли или эфиру. Каннабиноидные рецепторы представляют собой класс рецепторов клеточной мембраны, принадлежащих к суперсемейству рецепторов, сопряженных с G-белком. В настоящее время известны два подтипа, обозначаемые как каннабиноидный рецептор 1 (СВ 1) и каннабиноидный рецептор 2 (СВ 2). Рецептор СВ 1 в основном экспрессируется в центральной нервной системе (например, в мозжечковой миндалине, гиппокампе) и в меньшей степени на периферии. Рецептор СВ 2, кодируемый геном CNR2, главным образом экспрессируется на периферии, на клетках иммунной системы, таких как макрофаги и Т-клетки(Wright, K.L. et al. Br J. Pharmacol. 2008, 153(2), 263-70). Рецептор СВ 2 также широко распространен в головном мозге, где он обнаруживается преимущественно на микроглии, а не на нейронах (Cabral, G.A.et al. Br J. Pharmacol. 2008, 153(2): 240-51). Интерес к агонистам рецептора СВ 2 непрерывно возрастал в последние десять лет (на текущий момент поступает 30-40 патентных заявок в год), поскольку было показано, что несколько ранее открытых соединений оказывают положительные эффекты в преклинических моделях некоторых заболеваний человека, включая хроническую боль (Beltramo, M. Mini Rev. Med. Chem. 2009, 9(1), 11-25), атеросклероз(Mach, F. et al. J. Neuroendocrinol 2008, 20 Suppl 1, 53-7), регуляцию костной массы (Bab, I. et al. Br J.Munoz-Luque, J. et al. J. Pharmacol. Exp Ther 2008, 324 (2), 475-83). Ишемически-реперфузионное (I/R) повреждение является основной причиной повреждения ткани,которое происходит при таких состояниях, как инсульт, инфаркт миокарда, сердечно-легочное шунтирование и другие операции на сосудах, и пересадка органов, а также представляет собой основной механизм повреждения концевых органов, осложняющих течение циркуляторного шока различной этиологии. Все эти состояния характеризуются нарушением нормального кровоснабжения, что приводит к недостаточной оксигенации тканей. Повторная оксигенация, например реперфузия, является окончательной мерой для восстановления нормальной тканевой оксигенации. Однако отсутствие кислорода и питательных веществ из кровотока вызывает состояние, при котором восстановление кровотока приводит к дальнейшему повреждению ткани. Поражение, вызываемое реперфузионным повреждением, частично обусловлено воспалительным ответом поврежденных тканей. Белые кровяные клетки, доставленные вновь возвращающейся кровью, выделяют в ответ на повреждение ткани большое количество факторов воспаления, таких как интерлейкины, а также свободные радикалы. Восстановленный кровоток снова вызывает поступление кислорода внутрь клеток, что повреждает клеточные белки, ДНК и цитоплазматическую оболочку. Дистанционное ишемическое прекондиционирование (RIPC) представляет собой стратегию использования внутренних защитных способностей организма против повреждения, вызванного ишемией и реперфузией. Эта стратегия затрагивает необычное явление, при котором преходящая нелетальная ишемия и реперфузия одного органа или ткани придает устойчивость для последующего случая "летального" ишемически-реперфукзионного повреждения в отдаленном органе или ткани. Действующий механизм,по которому преходящая ишемия и реперфузия органа или ткани обеспечивает защиту, в настоящее время неизвестен, хотя было выдвинуто несколько гипотез. В соответствии с гуморальной гипотезой полагают, что некое эндогенное вещество (например, аденозин, брадикинин, опиоиды, CGRP (кальцитонин-ген-связанный пептид), эндоканнабиноиды, Ангиотензин I или некоторые другие еще не известные гуморальные факторы), генерируемое в отдаленном органе или ткани, поступает в кровоток и активирует его соответствующий рецептор в ткани-мишени, и таким образом запускает различные внутриклеточные пути кардиопротекции, вовлеченные в ишемическое прекондиционирование. Недавно полученные данные указывают на то, что эндоканнабинноиды и их рецепторы, в частности СВ 2, могут быть вовлечены в прекондиционирование и вносят свой вклад в предотвращение реперфузионного повреждения за счет понижающей регуляции воспалительного ответа (Pacher, P. et al. Br J. Pharmacol. 2008, 153(2), 252-62). В частности, недавние исследования с применением в качестве инструмента агонистов СВ 2, продемонстрировали эффективность этой концепции для снижения ишемическиреперфузионного повреждения в сердце (Defer, N. et al. Faseb J. 2009, 23(7), 2120-30), головном мозге(Zhang, M. et al. J. Cereb Blood Flow Metab 2007, 27(7), 1387-96), печени (Batkai, S. et al. Faseb J. 2007,21(8), 1788-800) и почках (Feizi, A. et al. Exp Toxicol Pathol 2008, 60(4-5), 405-10). Более того, за последние несколько лет возрастающий объем литературы свидетельствует о том,что СВ 2 может также представлять интерес в субхронической и хронической ситуации. Было показано,что специфическая активация СВ 1 и СВ 2 в животных моделях хронических заболеваний, обусловленных фиброзом (Garcia-Gonzalez, E. et al. Rheumatology (Oxford) 2009, 48(9), 1050-6; Yang, Y.Y. et al. Liver Int 2009, 29(5), 678-85), связана с соответствующей экспрессией СВ 2 в миофибробластах - клетках, ответственных за прогрессирование фиброза. Фактически было показано, что активация рецептора СВ 2 селективным агонистом СВ 2 оказывает антифибротический эффект в диффузном системном склерозе (Garcia-Gonzalez, E. et al. Rheumatology(Oxford) 2009, 48(9), 1050-6), и оказалось, что рецептор СВ 2 является ключевой мишенью в экспериментальном дермальном фиброзе (Akhmetshina, A. et al. Arthritis Rheum 2009, 60(4), 1129-36), а также в патофизологии печени, включая фиброгенез, связанный с хроническими заболеваниями печени (Lotersztajn,S. et al. Gastroenterol Clin Biol 2007, 31(3), 255-8; Mallat, A. et al. Expert Opin Ther Targets 2007, 11(3), 4039; Lotersztajn, S. et al. Br J. Pharmacol. 2008, 153(2), 286-9). Соединения по настоящему изобретению связываются с рецептором СВ 2 и модулируют его активность, и обладают более низкой активностью в отношении рецептора СВ 1. В настоящем описании термин "алкил", отдельно или в сочетании, обозначает алкильную группу с линейной или разветвленной цепью, включающую от 1 до 8 атомов углерода, в частности алкильную группу с линейной или разветвленной цепью, включающую от 1 до 6 атомов углерода, и в частном случае алкильную группу с линейной или разветвленной цепью, включающую от 1 до 4 атомов углерода. Примерами C1-C8 алкильных групп с линейной или разветвленной цепью являются метил, этил, пропил,изопропил, бутил, изобутил, трет-бутил, изомерные пентилы, изомерные гексилы, изомерные гептилы и изомерные октилы, в частности метил, этил, пропил, бутил и пентил, в частном случае метил, этил, про-2 024108 пил, изопропил, изобутил, трет-бутил и изопентил. Частными примерами алкила являются метил, этил и пентил, в частности метил, этил и трет-бутил. В настоящем описании термин "алкилен", отдельно или в сочетании, обозначает алкиленовую группу с линейной или разветвленной цепью, включающую от 1 до 8 атомов углерода, в частности алкильную группу с линейной или разветвленной цепью, включающую от 1 до 6 атомов углерода, и в частном случае, алкильную группу с линейной или разветвленной цепью, включающую от 1 до 4 атомов углерода. Примерами C1-C8-алкиленовых групп с линейной или разветвленной цепью являются метилен или этилен, в частном случае, -CH2-, -CH2CH2- или -CH(CH3)-. Термин "циклоалкил", отдельно или в сочетании, обозначает циклоалкильное кольцо, включающее от 3 до 8 атомов углерода, и, в частности, циклоалкильное кольцо, включающее от 3 до 6 атомов углерода. Примерами циклоалкила являются циклопропил, циклобутил, циклопентил и циклогексил, циклогептил и циклооктил. В частности, примерами циклоалкила являются циклогексил или циклопропил. Термин "алкокси", отдельно или в сочетании, обозначает группу формулы алкил-О-, в которой термин "алкил" имеет указанное ранее значение, например метокси-, этокси-, н-пропокси-, изопропокси-, нбутокси-, изобутокси-, втор-бутокси- и трет-бутоксигруппу, в частности метоксигруппу. Термин "окси", отдельно или в сочетании, обозначает группу -О-. Термин "галоген", отдельно или в сочетании, обозначает фтор, хлор, бром или йод, в частности фтор, хлор или бром, в частном случае фтор и хлор. Термин "галоген", в сочетании с другой группой,обозначает замещение указанной группы по меньшей мере одним атомом галогена, в частности присутствие в качестве заместителей от одного до пяти атомов галогена, в частности от одного до четырех атомов галогена, т.е. одного, двух, трех или четырех атомов галогена. Галогены, в частности, представляют собой фтор, бром и хлор, в частном случае фтор и хлор. Термин "галогеналкил", отдельно или в сочетании, обозначает алкильную группу, содержащую в качестве заместителей по меньшей мере один атом галогена, в частности от одного до пяти атомов галогена, в частности от одного до трех атомов галогена. В частности, "галогеналкил" представляет собой трифторметил. Термин "галогеналкокси", отдельно или в сочетании, обозначает алкоксигруппу, содержащую в качестве заместителей по меньшей мере один атом галогена, в частности от одного до пяти атомов галогена, в частности от одного до трех атомов галогена. В частности, "галогеналкокси" группа представляет собой трифторметоксигруппу. Термин "галогенфенил", отдельно или в сочетании, обозначает фенильную группу, содержащую в качестве заместителей по меньшей мере один атом галогена, в частности от одного до трех атомов галогена. В частности, "галогенфенил" представляет собой хлорфенил, хлорфторфенил, дихлорфенил, бромфенил и хлордифторфенил. Термины "гидроксил" и "гидрокси", отдельно или в сочетании, обозначают группу -OH. Термин "карбонил", отдельно или в сочетании, обозначает группу -C(O)-. Термин "карбоксил" или "карбокси", отдельно или в сочетании, обозначает группу -СООН. Термин "амино", отдельно или в сочетании, обозначает первичную аминогруппу (-NH2), вторичную аминогруппу (-NH-), или третичную аминогруппу (-N-). Термин "сульфонил", отдельно или в сочетании, обозначает группу -SO2-. Частными примерами гетероциклильных групп в определении R1 являются оксетанил, тетрагидрофуранил, 1,1-диоксо-16-тиетанил и 1,1-диоксотетрагидро-16-тиофенил. Частными примерами галогенпирролидинила в определении R3 и R4 являются дифторпирролидинил и тетрафторпирролидинил. Термин "фармацевтически приемлемые соли" относится к таким солям, которые сохраняют биологическую эффективность и свойства свободных оснований или свободных кислот, которые не являются нежелательными с биологической или иной точки зрения. Такие соли образуются при участии неорганических кислот, таких как хлороводородная кислота, бромоводородная кислота, серная кислота, азотная кислота, фосфорная кислота, в частности хлороводородная кислота, и органических кислот, таких как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, малеиновая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, винная кислота,лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, салициловая кислота, N-ацетилцистеин. Кроме того, такие соли можно получить путем добавления неорганического основания или органического основания к свободной кислоте. Соли, полученные из неорганического основания, включают, без ограничения, соли натрия, калия, лития, аммония, кальция, магния. Соли, полученные из органических оснований, включают, без ограничения, соли первичных, вторичных и третичных аминов, замещенных аминов, включая природные замещенные амины, циклических аминов и основных ионообменных смол,таких как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, этаноламин, лизин,аргинин, N-этилпиперидин, пиперидин, полиаминовые смолы. Соединение формулы (I) может также присутствовать в форме цвиттер-ионов. Особо предпочтительными фармацевтически приемлемыми солями соединений формулы (I) являются соли хлороводородной кислоты, бромоводородной кислоты,-3 024108 серной кислоты, фосфорной кислоты и метансульфоновой кислоты. Термин "фармацевтически приемлемые эфиры" означает, что соединения общей формулы (I) можно дериватизировать по функциональным группам с получением производных, которые способны превращаться обратно в исходные соединения in vivo. Примеры таких соединений включают физиологически приемлемые и метаболически лабильные эфирные производные, например метоксиметиловые эфиры, метилтиометиловые эфиры и пивалоилоксиметиловые эфиры. Кроме того, любые физиологически приемлемые эквиваленты соединений общей формулы (I), аналогичные метаболически лабильным эфирам, которые способны давать исходные соединения общей формулы (I) in vivo, включены в объем настоящего изобретения. Если одно из исходных веществ или соединений формулы (I) содержат одну или более функциональных групп, которые нестабильны или реакционноспособны в условиях реакций на одной или более стадий синтеза, можно вводить подходящие защитные группы (например, описанные в следующем источнике: "Protective Groups in Organic Chemistry", Т.W. Greene и Р.G.M. Wuts, 3rd Ed., 1999, Wiley, NewYork) до проведения рискованной стадии способами, хорошо известными в данной области техники. Такие защитные группы можно удалять на более поздних стадиях синтеза стандартными способами, описанными в литературе. Примерами защитных групп являются трет-бутоксикарбонил (Boc), 9 флюоренилметил карбамат (Fmoc), 2-триметилсилилэтил карбамат (Теос), карбобензилокси- (Cbz) и пметоксибензилоксикарбонил (Moz). Соединение формулы (I) может содержать несколько асимметрических центров и может существовать в форме оптически чистых энантиомеров, смесей энантиомеров, таких как, например, рацематы,смеси диастереомеров, диастереомерные рацематы или смеси диастереомерных рацематов. Термин "асимметрический атом углерода" обозначает атом углерода с четырьмя различными заместителями. В соответствии с правилом Канна-Ингольда-Прелонга, асимметрический атом углерода может иметь конфигурацию "R" или "S". Настоящее изобретение относится, в частности, к соединению формулы (I) в котором A представляет собой алкилен, гидроксиалкилен, -CH2C(O)-, -C(O)-, -SO2- или отсутствует; R1 представляет собой водород, алкил, галогеналкил, гидроксил, алкоксигруппу, галогеналкоксигруппу, фенил, галогенфенил, алкоксифенил, галогеналкилфенил, галогеналкоксифенил, цианофенил, гидроксиалкоксифенил, алкилсульфонилфенил, алкилсульфониламинофенил, цианогруппу, циклоалкил, циклоалкилалкоксигруппу, аминогруппу, гетероциклил, алкилгетероциклил, гидроксигетероциклил, алкилгетероциклил, гетероарил или галогенгетероарил, при этом гетероциклил представляет собой карбоциклическое кольцо, включающее от трех до восьми членов, в том числе по меньшей мере один атом азота или кислорода, и при этом гетероарил представляет собой пиридинил, пиразолил, оксадиазолил или фуразанил;R3 представляет собой галоген или -NR4R5; один из R4 и R5 представляет собой водород или алкил, а другой из них представляет собой алкил или циклоалкил; или R4 и R5 совместно с атомом азота, которому они присоединены, образуют гетероциклил или замещенный гетероциклил, при этом гетероциклил представляет собой морфолинил, пиперидинил, пиперазинил, пирролидинил, 2-окса-6-азаспиро[3.3]гептил, азетидинил, тиазолидинил, тиоморфолинил, диоксотиоморфолинил, оксазепанил, 2-окса-6-азаспиро[3.4]октил, 6-окса-1-азаспиро[3.3]гептил, 2-окса-5-азаспиро[3.4]октил, изоксазолидинил, азиридинил или диоксоизотиазолидинил, и при этом замещенный гетероциклил представляет собой гетероциклил, содержащий от одного до четырех заместителей, независимо выбранных из алкила, галогена, гидроксила, алкоксигруппы, гид роксиал кила, карбоксила, алкоксиалкила и цианогруппы; или к его фармацевтически приемлемой соли или эфиру. Кроме того, настоящее изобретение относится, в частности, к следующему: соединение формулы (I), в которой A представляет собой алкилен, -CH2C(O)- или отсутствует; соединение формулы (I), в которой A представляет собой алкилен; соединение формулы (I), в которой А представляет собой метилен, этилен или -CH(CH3)-; соединение формулы (I), в которой R1 представляет собой водород, алкил, галогеналкил, гидроксил,алкоксигруппу, галогеналкоксигруппу, фенил, галогенфенил, алкоксифенил, галогеналкилфенил, галогеналкоксифенил, цианофенил, гидроксиалкоксифенил, алкилсульфонилфенил, алкилсульфониламинофенил, цианогруппу, циклоалкил, циклоалкилалкоксигруппу, аминогруппу, гетероциклил, алкилгетероцик-4 024108 лил, гидроксигетероциклил, алкилгетероциклил, гетероарил или галогенгетероарил, при этом гетероциклил представляет собой карбоциклическое кольцо, включающее от трех до восьми членов, в том числе по меньшей мере один атом азота или кислорода, и при этом гетероарил представляет собой пиридинил,пиразолил, оксадиазолил или фуразанил; соединение формулы (I), в которой R1 представляет собой водород, алкил, галогеналкил, гидроксил,алкоксигруппу, фенил, галогенфенил, алкоксифенил, галогеналкилфенил, галогеналкоксифенил, цианофенил, циклоалкил, оксетанил или пиридинил; соединение формулы (I), в которой R1 представляет собой трифторметил, фенил, хлорфенил, бромфенил, цианофенил, циклогексил или пиридинил; соединение формулы (I), в которой R1 представляет собой алкил, галогеналкил, гидроксил, алкоксигруппу, фенил, галогенфенил, алкоксифенил, галогеналкилфенил, галогеналкоксифенил, цианофенил,циклоалкил, гетероциклил, галогенгетероарил или алкилгетероарил, при этом гетероциклил представляет собой оксетанил, и при этом гетероарил представляет собой пиридинил или фуразанил; соединение формулы (I), в которой R1 представляет собой алкил, галогеналкил, гидроксил, алкоксигруппу, фенил, галогенфенил, алкоксифенил, галогеналкилфенил, галогеналкоксифенил, цианофенил,циклоалкил, оксетанил, пиридинил, галогенпиридинил или алкилфуразанил; соединение формулы (I), в которой R1 представляет собой трифторметил, фенил, хлорфенил, бромфенил, цианофенил, циклогексил, пиридинил, хлорпиридинил, метилфуразанил или трифторметилфенил; соединение формулы (I), в которой R2 представляет собой алкил; соединение формулы (I), в которой R2 представляет собой трет-бутил; соединение формулы (I), в которой R3 представляет собой -NR4R5; соединение формулы (I), в которой R4 и R5 совместно с атомом азота, которому они присоединены,образуют морфолинил или галогенпирролидинил; соединение формулы (I), в которой R4 и R5 совместно с атомом азота, которому они присоединены,образуют морфолинил или дифторпирролидинил; соединение формулы (I), в которой R4 и R5 совместно с атомом азота, которому они присоединены,образуют морфолинил, галогенпирролидинил или гидроксипирролидинил; и соединение формулы (I), в которой R4 и R5 совместно с атомом азота, которому они присоединены,образуют морфолинил, дифторпирролидинил или гидроксипирролидинил. Настоящее изобретение также относится, в частности, к соединению формулы (I), выбранному из следующих: Настоящее изобретение также относится, в частности, к соединению формулы (I), выбранному из следующих: Получение соединений формулы (I) по настоящему изобретению можно проводить параллельными или сходящимися путями синтеза. Синтез соединений по настоящему изобретению представлен на нижеследующих схемах. Навыки, которые требуются для проведения реакций и очистки получаемых продуктов, доступны специалистам в данной области техники. Заместители и индексы, используемые в ниже следующем описании способов, имеют значение, раскрытое ранее в данном тексте, если не указано противоположное. Более конкретно, соединения формулы (I) можно получать способами, раскрытыми ниже,способами, представленными в примерах, или аналогичными способами. Подходящие условия реакций для конкретных стадий синтеза известны специалисту в данной области техники. Кроме того, в литературе описаны условия проведения реакций, влияющие на приведенные реакции (см., например, Comprehensive Organic Transformations: A Guide to Functional Group Preparations, 2nd Edition, Richard C. Larock.John WileySons, New York, NY. 1999). Авторы изобретения считают удобным проводить данные реакции в присутствии или отсутствии растворителя. В отношении природы используемого растворителя не накладывается какого-либо особого ограничения, при условии, что растворитель не оказывает нежелательного воздействия на ход реакции или на используемые реагенты, и что он способен растворять реагенты, по меньшей мере, в некоторой степени. Описанные реакции могут протекать в широком диапазоне температур, и точная температура реакции не существенна в свете настоящего изобретения. Описанные реакции удобно проводить в интервале температур между -78C и температурой флегмы. Время,- 16024108 необходимое для протекания реакции, также может меняться в широком диапазоне, в зависимости от многих факторов, в частности от температуры реакции и природы реагентов. При этом обычно достаточно интервала от 0,5 ч до нескольких суток для получения желаемых промежуточных продуктов и конечных соединений. Последовательность реакций не ограничена представленной на схемах, а наоборот, в зависимости от исходных веществ и их относительной реакционной способности, последовательность реакционных стадий можно легко изменять. Исходные вещества либо имеются в продаже, либо их можно получить способами, аналогичными способам, представленным ниже, способами, описанными в цитируемых источниках в описании или примерах, или способами, известными в данной области техники. Схема 1a) Галиды II либо имеются в продаже, либо их можно синтезировать способами, известными в данной области техники. Галиды II удобно вводить в реакцию с азидом натрия в подходящем растворителе,таком как ацетонитрил, этанол или DMF, с получением производных азида III.b) Производные триазола IV можно получить путем [2+3] циклоприсоединения производных азидаIII с 2-цианоацетамидом в присутствии подходящего основания, такого как метоксид натрия или этоксид натрия, в подходящем растворителе, таком как метанол, этанол или DMF.c) Производные триазола V можно получить путем ацилированиея соединений IV ацилгалидом в присутствии основания, такого как DIEA, DMAP, пиридин и т.п.d) Производные триазолопиримидина VI можно получить путем внутримолеклярной циклизации производного триазола V в присутствии основания, такого как KHCO3, Na2CO3 и вода, в присутствии или отсутствии растворителя, такого как метанол, этанол, диоксан и толуол.e) Хлориды VII можно получить путем реакции соединения VI с хлорирующим реагентом, таким как POCl3, SOCl2 или (COCl)2, в присутствии подходящего основания, такого как N,N-диэтиланилин, лутидин, или пиридин.f) Соединение VII удобно вводить в реакцию с различными нуклеофилами, в частности с аминами,в присутствии подходящего основания, такого как триэтиламин, DIEA или DBU, в подходящем растворителе, таком как ацетонитрил, метанол, толуол или DMF, с получением производных триазолопиримидина VIII.g) Снятие защиты в соединениях VIII проводят в подходящих условиях, в случае PG=MPM - в кислых условиях (TFA и т.п.), путем гидрогенирования с помощью Pd катализатора или окислительного расщепления (DDQ или CAN и т.п.) с получением соединения IX.h) Производные триазола IX удобно вводить в реакцию либо с галидом (или сульфонатом) в присутствии подходящего основания, такого как DIEA, DBU, K2CO3, или Cs2CO3, в частности Ag2SO4, в растворителе, таком как DMF, диоксан или толуол, или, иначе, со спиртом в условиях реакции Мицунобу, с помощью подходящего диазодикарбоксилата (DEAD, DIAD и т.п.) и фосфина, такого как PBu3 или PPh3,в подходящем растворителе, таком как THF, DCM, толуол, с получением конечных производных триазолопиримидина I. Таким образом, настоящее изобретение также относится к способу получения соединения формулы(I), включающему реакцию соединения формулы (А) в присутствии R1-A-X и основания, или в присутствии R1-A-OH в условиях реакции Мицунобу, при этом A и R1-R3 таковы, как определено выше, и при этом X представляет собой галоген или SO2. Таким образом, в способе по настоящему изобретению можно использовать реакционные условия стадии h), описанной выше. Настоящее изобретение также относится к соединению формулы (I), если оно изготовлено способом по настоящему изобретению. Кроме того, настоящее изобретение относится к соединению формулы (I) для применения в качестве терапевтически активного вещества. Настоящее изобретение также относится к фармацевтической композиции, включающей соединение формулы (I) и терапевтически инертный носитель. Настоящее изобретение относится, в частности, к следующему: применение соединения формулы (I) для лечения или профилактики боли, атеросклероза, возрастной макулярной дистрофии, диабетической ретинопатии, глаукомы, сахарного диабета, воспаления,воспалительного заболевания кишечника, ишемически-реперфузионного повреждения, острой печеночной недостаточности, фиброза печени, фиброза легких, фиброза почек, системного фиброза, острого отторжения аллотрансплантанта, хронической нефропатии аллотрансплантанта, диабетической нефропатии, гломерулонефропатии, кардиомиопатии, сердечной недостаточности, ишемии миокарда, инфаркта миокарда, системного склероза, термического повреждения, ожога, гипертрофических рубцов, келоидов,лихорадки при гингивите, цирроза или опухолей печени, регуляции костной массы, нейродегенерации,инсульта, преходящего нарушения мозгового кровообращения или увеита; применение соединения формулы (I) для изготовления лекарственного средства для лечения или профилактики боли, атеросклероза, возрастной макулярной дистрофии, диабетической ретинопатии, глаукомы, сахарного диабета, воспаления, воспалительного заболевания кишечника, ишемическиреперфузионного повреждения, острой печеночной недостаточности, фиброза печени, фиброза легких,фиброза почек, системного фиброза, острого отторжения аллотрансплантанта, хронической нефропатии аллотрансплантанта, диабетической нефропатии, гломерулонефропатии, кардиомиопатии, сердечной недостаточности, ишемии миокарда, инфаркта миокарда, системного склероза, термического повреждения, ожога, гипертрофических рубцов, келоидов, лихорадки при гингивите, цирроза или опухолей печени, регуляции костной массы, нейродегенерации, инсульта, преходящего нарушения мозгового кровообращения или увеита; соединение формулы (I) для лечения или профилактики боли, атеросклероза, возрастной макулярной дистрофии, диабетической ретинопатии, глаукомы, сахарного диабета, воспаления, воспалительного заболевания кишечника, ишемически-реперфузионного повреждения, острой печеночной недостаточности, фиброза печени, фиброза легких, фиброза почек, системного фиброза, острого отторжения аллотрансплантанта, хронической нефропатии аллотрансплантанта, диабетической нефропатии, гломерулонефропатии, кардиомиопатии, сердечной недостаточности, ишемии миокарда, инфаркта миокарда,системного склероза, термического повреждения, ожога, гипертрофических рубцов, келоидов, лихорадки при гингивите, цирроза или опухолей печени, регуляции костной массы, нейродегенерации, инсульта,преходящего нарушения мозгового кровообращения или увеита; и способ лечения или профилактики боли, атеросклероза, возрастной макулярной дистрофии, диабетической ретинопатии, глаукомы, сахарного диабета, воспаления, воспалительного заболевания кишечника, ишемически-реперфузионного повреждения, острой печеночной недостаточности, фиброза печени,фиброза легких, фиброза почек, системного фиброза, острого отторжения аллотрансплантанта, хронической нефропатии аллотрансплантанта, диабетической нефропатии, гломерулонефропатии, кардиомиопатии, сердечной недостаточности, ишемии миокарда, инфаркта миокарда, системного склероза, термического повреждения, ожога, гипертрофических рубцов, келоидов, лихорадки при гингивите, цирроза или опухолей печени, регуляции костной массы, нейродегенерации, инсульта, преходящего нарушения мозгового кровообращения или увеита, включающий введение эффективного количества соединения формулы (I) пациенту, который в этом нуждается. Другим объектом настоящего изобретения является применение соединения формулы (I) для лечения или профилактики боли, в частности хронической боли, атеросклероза, регуляции костной массы,воспаления, ишемии, реперфузионного повреждения, системного фиброза, фиброза печени, фиброза легких, фиброза почек, хронической нефропатии аллотрансплантанта, застойной сердечной недостаточности, инфаркта миокарда, системного склероза, гломерулонефропатии, термического повреждения, ожога,гипертрофических рубцов, келоидов, лихорадки при гингивите, цирроза или опухолей печени. Еще одним объектом настоящего изобретения является применение соединения формулы (I) для изготовления лекарственного средства для лечения или профилактики боли, в частности хронической боли,атеросклероза, регуляции костной массы, воспаления, ишемии, реперфузионного повреждения, системного фиброза, фиброза печени, фиброза легких, фиброза почек, хронической нефропатии аллотрансплантанта, застойной сердечной недостаточности, инфаркта миокарда, системного склероза, гломерулонефропатии, термического повреждения, ожога, гипертрофических рубцов, келоидов, лихорадки при гингивите, цирроза или опухолей печени. Настоящее изобретение также относится к соединению формулы (I) для лечения или профилактики боли, в частности хронической боли, атеросклероза, регуляции костной массы, воспаления, ишемии, реперфузионного повреждения, системного фиброза, фиброза печени, фиброза легких, фиброза почек, хронической нефропатии аллотрансплантанта, застойной сердечной недостаточности, инфаркта миокарда,системного склероза, гломерулонефропатии, термического повреждения, ожога, гипертрофических рубцов, келоидов, лихорадки при гингивите, цирроза или опухолей печени. Настоящее изобретение в частности, относится к соединению формулы (I) для лечения или профилактики ишемии, реперфузионного повреждения, фиброза печени или фиброза почек, в частности ишемии или реперфузионного повреждения. Кроме того, настоящее изобретение относится к соединению формулы (I), если оно изготовлено способом по настоящему изобретению. Также объектом настоящего изобретения является способ лечения или профилактики боли, в частности хронической боли, атеросклероза, регуляции костной массы, воспаления, ишемии, реперфузионного повреждения, системного фиброза, фиброза печени, фиброза легких, фиброза почек, хронической нефропатии аллотрансплантанта, застойной сердечной недостаточности, инфаркта миокарда, системного склероза, гломерулонефропатии, термического повреждения, ожога, гипертрофических рубцов, келоидов, лихорадки при гингивите, цирроза или опухолей печени, включающий введение эффективного количества соединения формулы (I). В другом воплощении настоящего изобретению предложены фармацевтические композиции или лекарственные средства, содержащие соединения по настоящему изобретению и терапевтически инертный носитель, разбавитель или эксципиент, а также способы применения соединения по настоящему изобретению для изготовления таких композиций и лекарственных средств. В одном примере соединения формулы (I) можно включать в лекарственную форму путем смешения при комнатной температуре,при подходящем значении pH и при желаемой степени чистоты с физиологически приемлемыми носителями, т.е. носителями, которые не токсичны для реципиентов при дозировках и концентрациях, применяемых в галеновой лекарственной форме. Значение pH композиции зависит в основном от конкретного применения и концентрации соединения, но в любом случае находится предпочтительно в интервале примерно от 3 до 8. В одном примере соединение формулы (I) включают в лекарственную форму в ацетатном буфере при pH 5. В другом воплощении соединения формулы (I) являются стерильными. Соединение можно хранить, например, в виде твердого вещества или аморфной композиции, в виде лиофилизованной композиции или в виде водного раствора. Изготовление лекарственных форм с композициями, их дозирование и введение осуществляют в соответствии с надлежащей медицинской практикой. Факторы, которые следует учитывать в данном контексте, включают конкретное расстройство, на которое направлено лечение, конкретное млекопитающее, которому проводят лечение, клиническое состояние конкретного пациента, причину расстройства, сайт доставки действующего вещества, способ введения, схему введения и другие факторы, известные практикующим врачам. Соединения по настоящему изобретению можно вводить любым удобным способом, включая оральное, местное (в т.ч. трансбуккальное и сублингвальное), ректальное, вагинальное, трансдермальное,парентеральное, подкожное, внутрибрюшинное, внутрилегочное, внутрикожное, интратекальное, эпидуральное и интраназальное, а также, в целях местного лечения, внутриочаговое введение. Парентеральные инфузии включают внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение. Соединения по настоящему изобретению можно вводить в любой удобной форме для введения, например, в виде таблеток, порошков, капсул, растворов, дисперсий, суспензий, сиропов, спрэев, суппозиториев, гелей, эмульсий, пластырей и т.п. Такие композиции могут содержать компоненты, которые обычно применяются в фармацевтических препаратах, например разбавители, носители, модификаторы рН, подсластители, объемообразующие агенты и дополнительные действующие вещества. Типичную лекарственную форму изготавливают путем смешивания соединения по настоящему изобретению с носителем или эксципиентом. Подходящие носители и эксципиенты хорошо известны специалистам в данной области техники и подробно описаны, например, в следующих источниках:Excipients. Chicago, Pharmaceutical Press, 2005. Такие лекарственные формы могут также включать один или более буферных агентов, стабизизаторов, поверхностно-активных веществ, увлажняющих агентов,лубрикантов, эмульгаторов, суспендирующих агентов, консервантов, антиоксидантов, кроющих агентов,скользящих веществ, вспомогательных веществ для производственного процесса, красителей, подсластителей, отдушек, ароматизаторов, разбавителей и других известных добавок для обеспечения надлежащей формы выпуска лекарства (т.е. соединения по настоящему изобретению или его фармацевтической композиции) или вспомогательного средства при изготовлении фармацевтического продукта (т.е. лекарственного средства). Настоящее изобретение далее наглядно представлено в следующих примерах, которые не носят ограничивающий характер. Примеры Аббревиатура.TFA=трифторуксусная кислота; Ph=фенил; DCM=дихлорметан; МРМ=п-метоксифенилметил; DDQ=2,3 дихлор-5,6-дициано-1,4-бензохинон; РМВ=п-метоксибензил; DIPEA=диизопропилэтиламин. Хиральное разделение 1-(3-бензил-5-трет-бутил-3H-[1,2,3]триазоло[4,5-d]пиримидин-7-ил)-3 метилпирролидин-3-ола (пример 124, стадия a) давало соответствующие оптически чистые R- и S- производные. Тем не менее, окончательное стехиометрическое соотношение на данный момент выясняется. Поэтому стереохимическое распределение для оптически чистых примеров 124-133 не было определено. Пример 1. 5-трет-Бутил-2-(2-хлорбензил)-7-морфолин-4-ил-2 Н-[1,2,3]триазоло[4,5-d]пиримидин Смесь 1-(хлорметил)-4-метоксибензола (20,0 г; 128 ммоль) и азида натрия (12,5 г; 192 ммоль) в ацетонитриле (255 мл) нагревали с обратным холодильником 5 ч в атмосфере азота. Эту смесь фильтровали и концентрировали в вакууме. Остаток разводили в DCM, промывали водой и солевым раствором, высушивали над Na2SO4 и концентрировали в вакууме с получением неочищенного 1-(азидометил)-4 метоксибензола. Этот остаток использовали в следующей реакции без дополнительной очистки. Смесь полученного выше неочищенного остатка, 2-цианоацетамида (10,8 г; 128 ммоль) и этанолата натрия (8.71 г; 128 ммоль) в этаноле (256 мл) нагревали с обратным холодильником в течение 21 ч в атмосфере азота. Эту смесь концентрировали в вакууме, разбавляли 4 М водным раствором AcOH и фильтровали. Остаток промывали водой и высушивали в вакууме с получением 5-амино-1-(4-метоксибензил)1 Н-1,2,3-триазол-4-карбоксамида в виде бледно-оранжевого твердого вещества (26,5 г; 84% в 2 стадии). Смесь 5-амино-1-(4-метоксибензил)-1 Н-1,2,3-триазол-4-карбоксамида (10,0 г; 40.4 ммоль) и пивалоилхлорида (7,47 мл; 60,7 ммоль) в пиридине (20,2 мл) перемешивали при 80C в течение 2 ч в атмосфере азота. Затем к реакционной смеси добавляли 8 М водный раствор гидроксида натрия (15,2 мл; 121 ммоль) и метанол (20,2 мл). Перемешивали при 80C в течение 1 ч, после чего реакционную смесь вливали в 1 М водный раствор HCl, экстрагировали диэтиловым эфиром, промывали 2 М водным растворомHCl, водой и солевым раствором, высушивали над Na2SO4 и концентрировали в вакууме с получением смеси неочищенного 1-(4-метоксибензил)-5-пиваламидо-1 Н-1,2,3-триазол-4-карбоксамида и N-(4-циано 1-(4-метоксибензил)-1 Н-1,2,3-триазол-5-ил)пиваламида. Остаток использовали в следующей реакции без дополнительной очистки. Смесь полученного выше неочищенного осадка и KHCO3 (12,1 г; 121 ммоль) в Н 2 О (242 мл) нагревали с обратным холодильником в течение 18 ч. Реакционную смесь вливали в 1 М водный раствор HCl,экстрагировали с помощью EtOAc, промывали солевым раствором, высушивали над Na2SO4 и концентрировали в вакууме. Неочищенный осадок очищали флэш-хроматографией (силикагель, 10%-70% Смесь 5-трет-бутил-3-(4-метоксибензил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-7(4 Н)-она (50,0 мг; 160 мкмоль) и N,N-диэтиланилина (50,8 мкл, 319 мкмоль) в POCl3 (1000 мкл, 10,9 ммоль) нагревали с обратным холодильником в течение 4 ч в атмосфере азота. Реакционную смесь концентрировали в вакууме, разбавляли с помощью EtOAc, промывали холодной водой и солевым раствором, высушивали надNa2SO4 и концентрировали в вакууме с получением неочищенного 5-трет-бутил-7-хлор-3-(4 метоксибензил)-3 Н-[1,2,3]триазоло[4,5-d]пиримидина. Этот остаток использовали в следующей реакции без дополнительной очистки. Смесь полученного выше неочищенного остатка, морфолина (28,0 мкл, 320 мкмоль) и DIEA (55,9 мкл, 320 мкмоль) в ацетонитриле (250 мкл) перемешивали при комнатной температуре в течение ночи. Реакционную смесь непосредственно очищали с помощью препаративной ВЭЖХ (колонка: Gemini 5 мкм С 18 110 А 7530 мм; подвижная фаза: вода (0,05% Et3N): ацетонитрил 45:55%-5:95%; ДВ: 280 нм; поток: 30 мл/мин) с получением указанного в заголовке соединения в виде белого твердого вещества (47,7 мг; 78% в 2 стадии). MS (m/e): 383,4 (МН+).(49,0 мг; 128 мкмоль) и TFA (1000 мкл) нагревали с обратным холодильником в течение 8 ч в атмосфере азота. Реакционную смесь концентрировали в вакууме с получением неочищенного 5-трет-бутил-7 морфолин-4-ил-3H-[1,2,3]триазоло[4,5-d]пиримидина. Этот остаток использовали в следующей реакции без дополнительной очистки. Смесь части полученного выше остатка (85,3 мкмоль), 1-(бромметил)-2-хлорбензола (22,1 мкл, 171 мкмоль) и DBU (25,7 мкл, 171 мкмоль) в DMF (500 мкл) перемешивали при комнатной температуре в течение ночи. Реакционную смесь непосредственно очищали с помощью препаративной ВЭЖХ (колонка: Gemini 5 мкм С 18 110 А 7530 мм; подвижная фаза: вода (0,05% Et3N): ацетонитрил 65:35%-5:95%; ДВ: 300 нм; поток: 30 мл/мин) с получением указанного в заголовке соединения в виде белого твердого вещества (8,0 мг; 24%). MS (m/e): 387,4 (МН+). Пример 2. 5-трет-Бутил-2-(2-хлор-4-фторбензил)-7-морфолин-4-ил-2 Н-[1,2,3]триазоло[4,5d]пиримидин По аналогии со способом, описанным для синтеза 5-трет-бутил-2-(2-хлорбензил)-7-морфолин-4-ил 2 Н-[1,2,3]триазоло[4,5-d]пиримидина (пример 1, стадия d), указанное в заголовке соединение получали из 5-трет-бутил-7-морфолин-4-ил-3H-[1,2,3]триазоло[4,5-d]пиримидина и 1-(бромметил)-2-хлор-4 фторбензола и выделяли в виде белого твердого вещества (5,1 мг; 30%). MS (m/e): 405,4 (МН+). По аналогии со способом, описанным для синтеза 4-(5-трет-бутил-3-(4-метокси бензил)-3H[1,2,3]триазоло[4,5-d]пиримидин-7-ил)морфолина (пример 1, стадия с), указанное в заголовке соединение получали из 5-трет-бутил-7-хлор-3-(4-метоксибензил)-3H-[1,2,3]триазоло[4,5-d]пиримидина и 3,3 дифторпирролидина гидрохлорида и выделяли в виде белого твердого вещества (5,1 мг; 30%). MS (m/e): 405,4 (МН+).b) 5-трет-Бутил-7-(3,3-дифторпирролидин-1-ил)-2-этил-2 Н-[1,2,3]триазоло[4,5-d]пиримидин. Смесь 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-3-(4-метоксибензил)-3H-[1,2,3]триазоло[4,5d]пиримидина (264 мг; 656 мкмоль) и TFA (5,00 мл) нагревали с обратным холодильником в течение 8 ч в атмосфере азота. Реакционную смесь концентрировали в вакууме с получением неочищенного 5-третбутил-7-(3,3-дифторпирролидин-1-ил)-3H-[1,2,3]триазоло[4,5-d]пиримидина. Этот остаток использовали в следующей реакции без дополнительной очистки. Смесь части полученного выше остатка (41,0 мкмоль), иодэтана (6,63 мкл, 82,0 мкмоль) и DBU(12,4 мкл, 82,0 мкмоль) в DMF (250 мкл) перемешивали при комнатной температуре в течение ночи. Реакционную смесь непосредственно очищали с помощью препаративной ВЭЖХ (колонка: Gemini 5 мкм С 18 110 А 7530 мм; подвижная фаза: вода (0,05% Et3N): ацетонитрил 60:40-5:95%; ДВ: 300 нм; поток: 30 мл/мин) с получением указанного в заголовке соединения в виде белого твердого вещества (4,2 мг; 33%). По аналогии со способом, описанным для синтеза 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2 этил-2 Н-[1,2,3]триазоло[4,5-d]пиримидина (пример 3, стадия b), указанное в заголовке соединение получали из 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-3H-[1,2,3]триазоло[4,5-d]пиримидина и 1-бром-2 метоксиэтана и выделяли в виде светло-желтой смолы (4,5 мг; 32%). MS (m/e): 341,3 (МН+). Пример 5. 2-[5-трет-Бутил-7-(3,3-дифторпирролидин-1-ил)-[1,2,3]триазоло[4,5-d]пиримидин-2 ил]этанол По аналогии со способом, описанным для синтеза 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2 этил-2 Н-[1,2,3]триазоло[4,5-d]пиримидина (пример 3, стадия b), указанное в заголовке соединение получали из 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-3H-[1,2,3]триазоло[4,5-d]пиримидина и 2 бромэтанола и выделяли в виде белого твердого вещества (1,9 мг; 14%). MS (m/e): 327,3 (МН+). По аналогии со способом, описанным для синтеза 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2 этил-2 Н-[1,2,3]триазоло[4,5-d]пиримидина (пример 3, стадия b), указанное в заголовке соединение получали из 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-3H-[1,2,3]триазоло[4,5-d]пиримидина и (бромметил)циклогексана и выделяли в виде белого твердого вещества (6,1 мг; 39%). MS (m/e): 379,4 (МН+). Пример 7. 5-трет-Бутил-2-(3-хлорбензил)-7-(3,3-дифторпирролидин-1-ил)-2 Н-[1,2,3]триазоло[4,5d]пиримидин По аналогии со способом, описанным для синтеза 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2 этил-2 Н-[1,2,3]триазоло[4,5-d]пиримидина (пример 3, стадия b), указанное в заголовке соединение получали из 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-3H-[1,2,3]триазоло[4,5-d]пиримидина и 1(бромметил)-3-хлорбензола и выделяли в виде белого твердого вещества (4,8 мг; 29%). MS (m/e): 407,4 По аналогии со способом, описанным для синтеза 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2 этил-2 Н-[1,2,3]триазоло[4,5-d]пиримидина (пример 3, стадия b), указанное в заголовке соединение получали из 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-3H-[1,2,3]триазоло[4,5-d]пиримидина и 1(бромметил)-4-хлорбензола и выделяли в виде белого твердого вещества (5,1 мг; 31%). MS (m/e): 407,4 По аналогии со способом, описанным для синтеза 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2 этил-2 Н-[1,2,3]триазоло[4,5-d]пиримидина (пример 3, стадия b), указанное в заголовке соединение получали из 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-3H-[1,2,3]триазоло[4,5-d]пиримидина и 1(бромметил)-2,3-дихлорбензола и выделяли в виде белого твердого вещества (5,5 мг; 30%). MS (m/e): 441,4 (MH+). По аналогии со способом, описанным для синтеза 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2 этил-2 Н-[1,2,3]триазоло[4,5-d]пиримидина (пример 3, стадия b), указанное в заголовке соединение получали из 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-3H-[1,2,3]триазоло[4,5-d]пиримидина и 1(бромметил)-2,4-дихлорбензола и выделяли в виде белого твердого вещества (5,3 мг; 29%). MS (m/e): 441,4 (MH+). Пример 11. 5-трет-Бутил-2-(2,5-дихлорбензил)-7-(3,3-дифторпирролидин-1-ил)-2 Н-[1,2,3]триазоло[4,5-d]пиримидин По аналогии со способом, описанным для синтеза 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2 этил-2 Н-[1,2,3]триазоло[4,5-d]пиримидина (пример 3, стадия b), указанное в заголовке соединение получали из 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-3H-[1,2,3]триазоло[4,5-d]пиримидина и 2(бромметил)-1,4-дихлорбензола и выделяли в виде белого твердого вещества (4,6 мг; 25%). MS (m/e): 441,4 (MH+). Пример 12. 5-трет-Бутил-2-(2,6-дихлорбензил)-7-(3,3-дифторпирролидин-1-ил)-2 Н-[1,2,3]триазоло[4,5-d]пиримидин По аналогии со способом, описанным для синтеза 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2 этил-2 Н-[1,2,3]триазоло[4,5-d]пиримидина (пример 3, стадия b), указанное в заголовке соединение получали из 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-3H-[1,2,3]триазоло[4,5-d]пиримидина и 2(бромметил)-1,3-дихлорбензола и выделяли в виде белого твердого вещества (5,8 мг; 32%). MS (m/e): 441,4 (MH+). Пример 13. 5-трет-Бутил-2-(2-хлор-4-фторбензил)-7-(3,3-дифторпирролидин-1-ил)-2 Н-[1,2,3]триазоло[4,5-d]пиримидин По аналогии со способом, описанным для синтеза 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2 этил-2 Н-[1,2,3]триазоло[4,5-d]пиримидина (пример 3, стадия b), указанное в заголовке соединение получали из 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-3H-[1,2,3]триазоло[4,5-d]пиримидина и 1(бромметил)-2-хлор-4-фторбензола и выделяли в виде бесцветной смолы (5,5 мг; 32%). MS (m/e): 425,4 По аналогии со способом, описанным для синтеза 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2 этил-2 Н-[1,2,3]триазоло[4,5-d]пиримидина (пример 3, стадия b), указанное в заголовке соединение получали из 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-3H-[1,2,3]триазоло[4,5-d]пиримидина и 1-хлор-2(хлорметил)-3-фторбензола и выделяли в виде белого твердого вещества (5,4 мг; 31%). MS (m/e): 425,4 По аналогии со способом, описанным для синтеза 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2 этил-2 Н-[1,2,3]триазоло[4,5-d]пиримидина (пример 3, стадия b), указанное в заголовке соединение получали из 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-3H-[1,2,3]триазоло[4,5-d]пиримидина и 2(бромметил)пиридин гидробромида и выделяли в виде белой смолы (5,0 мг; 33%). MS (m/e): 374,4 (МН+). Пример 16. 5-трет-Бутил-7-(3,3-дифторпирролидин-1-ил)-2-пиридин-3-илметил-2 Н-[1,2,3]триа[4,5d]пиримидин По аналогии со способом, описанным для синтеза 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2 этил-2 Н-[1,2,3]триазоло[4,5-d]пиримидина (пример 3, стадия b), указанное в заголовке соединение получали из 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-3H-[1,2,3]триазоло[4,5-d]пиримидина и 3(хлорметил)пиридина гидрохлорида и выделяли в виде бесцветной смолы (2,2 мг; 14%). MS (m/e): 374,4 По аналогии со способом, описанным для синтеза 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2 этил-2 Н-[1,2,3]триазоло[4,5-d]пиримидина (пример 3, стадия b), указанное в заголовке соединение получали из 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-3H-[1,2,3]триазоло[4,5-d]пиримидина и 4(бромметил)пиридина гидробромида и выделяли в виде оранжевого твердого вещества (4,1 мг; 27%). MS По аналогии со способом, описанным для синтеза 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2 этил-2 Н-[1,2,3]триазоло[4,5-d]пиримидина (пример 3, стадия b), указанное в заголовке соединение получали из 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-3H-[1,2,3]триазоло[4,5-d]пиримидина и 2,2,2 трифторэтилтрифторметансульфоната и выделяли в виде светло-желтого твердого вещества (3,0 мг; 20%).MS (m/e): 365,3 (МН+). Пример 19. 5-трет-Бутил-2-(2-хлор-4,5-дифторбензил)-7-(3,3-дифторпирролидин-1-ил)-2 Н[1,2,3]триазоло[4,5-d]пиримидин По аналогии со способом, описанным для синтеза 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2 этил-2 Н-[1,2,3]триазоло[4,5-d]пиримидина (пример 3, стадия b), указанное в заголовке соединение получали из 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-3H-[1,2,3]триазоло[4,5-d]пиримидина и 1(бромметил)-2-хлор-4,5-дифторбензола и выделяли в виде бесцветной смолы (6,2 мг; 34%). MS (m/e): 443,4 (МН+). Пример 20. 5-трет-Бутил-2-(2-хлор-3,6-дифторбензил)-7-(3,3-дифторпирролидин-1-ил)-2 Н[1,2,3]триазоло[4,5-d]пиримидин По аналогии со способом, описанным для синтеза 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2 этил-2 Н-[1,2,3]триазоло[4,5-d]пиримидина (пример 3, стадия b), указанное в заголовке соединение получали из 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-3H-[1,2,3]триазоло[4,5-d]пиримидина и 2(бромметил)-3-хлор-1,4-дифторбензола и выделяли в виде белого твердого вещества (7,0 мг; 38%). MS По аналогии со способом, описанным для синтеза 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2 этил-2 Н-[1,2,3]триазоло[4,5-d]пиримидина (пример 3, стадия b), указанное в заголовке соединение получали из 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-3H-[1,2,3]триазоло[4,5-d]пиримидина и 1-бром-2(бромметил)бензола и выделяли в виде бесцветной смолы (6,9 мг; 37%). MS (m/e): 451,3 (MH+). По аналогии со способом, описанным для синтеза 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2 этил-2 Н-[1,2,3]триазоло[4,5-d]пиримидина (пример 3, стадия b), указанное в заголовке соединение получали из 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-3H-[1,2,3]триазоло[4,5-d]пиримидина и 1(бромметил)-2-(трифторметил)бензола и выделяли в виде бесцветной смолы (8,5 мг; 47%). MS (m/e): 441,4 (MH+). Пример 23. 5-трет-Бутил-7-(3,3-дифторпирролидин-1-ил)-2-(2-метоксибензил)-2 Н-[1,2,3]триазоло[4,5-d]пиримидин По аналогии со способом, описанным для синтеза 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2 этил-2 Н-[1,2,3]триазоло[4,5-d]пиримидина (пример 3, стадия b), указанное в заголовке соединение получали из 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-3H-[1,2,3]триазоло[4,5-d]пиримидина и 1(хлорметил)-2-метоксибензола и выделяли в виде бесцветной смолы (6,6 мг; 40%). MS (m/e): 403,4 По аналогии со способом, описанным для синтеза 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2 этил-2 Н-[1,2,3]триазоло[4,5-d]пиримидина (пример 3, стадия b), указанное в заголовке соединение получали из 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-3H-[1,2,3]триазоло[4,5-d]пиримидина и 1(бромметил)-2-(трифторметокси)бензола и выделяли в виде светло-желтой смолы (7,3 мг; 39%). MS По аналогии со способом, описанным для синтеза 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2 этил-2 Н-[1,2,3]триазоло[4,5-d]пиримидина (пример 3, стадия b), указанное в заголовке соединение получали из 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-3H-[1,2,3]триазоло[4,5-d]пиримидина и 2(бромметил)бензонитрила и выделяли в виде белого твердого вещества (6,1 мг; 37%). MS (m/e): 398,3 5-трет-Бутил-7-(3,3-дифторпирролидин-1-ил)-2-фенэтил-2 Н-[1,2,3]триазоло[4,5 По аналогии со способом, описанным для синтеза 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2 этил-2 Н-[1,2,3]триазоло[4,5-d]пиримидина (пример 3, стадия b), указанное в заголовке соединение получали из 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-3H-[1,2,3]триазоло[4,5-d]пиримидина и (2 бромэтил)бензола и выделяли в виде светло-желтой смолы (7,3 мг; 46%). MS (m/e): 387,4 (МН+). Пример 27. 2-[5-трет-Бутил-7-(3,3-дифторпирролидин-1-ил)-[1,2,3]триазоло[4,5-d]пиримидин-2-ил]1-фенилэтанон По аналогии со способом, описанным для синтеза 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2 этил-2 Н-[1,2,3]триазоло[4,5-d]пиримидина (пример 3, стадия b), указанное в заголовке соединение получали из 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-3H-[1,2,3]триазоло[4,5-d]пиримидина и 2-бром-1 фенилэтанона и выделяли коричневой смолы (0,8 мг; 5%). MS (m/e): 401,4 (МН+). Пример 28. 5-трет-Бутил-2-[(R)-1-(2-хлорфенил)этил]-7-(3,3-дифторпирролидин-1-ил)-2 Н[1,2,3]триазоло[4,5-d]пиримидин(250 мкл) добавляли DEAD (13,1 мкл, 82,6 мкмоль) при 0C. Перемешивали при комнатной температуре в течение 2 ч, после чего реакционную смесь непосредственно очищали с помощью препаративной ВЭЖХ (колонка: Gemini 5 мкм С 18 110 А 7530 мм; подвижная фаза: вода (0,05% Et3N): ацетонитрил 50:50-5:95%; ДВ: 300 нм; поток: 30 мл/мин) с получением указанного в заголовке соединения в виде белого твердого вещества (3,5 мг; 20%). MS (m/e): 421,4 (МН+). Пример 29. 5-трет-Бутил-2-[(S)-1-(2-хлорфенил)этил]-7-(3,3-дифторпирролидин-1-ил)-2 Н[1,2,3]триазоло[4,5-d]пиримидин По аналогии со способом, описанным для синтеза 5-трет-бутил-2-[(R)-1-(2-хлорфенил)этил]-7-(3,3 дифторпирролидин-1-ил)-2 Н-[1,2,3]триазоло[4,5-d]пиримидина (пример 28), указанное в заголовке соединение получали из 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-3H-[1,2,3]триазоло[4,5d]пиримидина и (R)-1-(2-хлорфенил)этанола и выделяли в виде белого твердого вещества (3,7 мг; 21%). По аналогии со способом, описанным для синтеза 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2 этил-2 Н-[1,2,3]триазоло[4,5-d]пиримидина (пример 3, стадия b), указанное в заголовке соединение получали из 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-3H-[1,2,3]триазоло[4,5-d]пиримидина и 1(бромметил)-2-хлор-3-фторбензола и выделяли в виде светло-желтой смолы (4,9 мг; 28%). MS (m/e): 425,3 (МН+). Пример 31. 5-трет-Бутил-2-(2-хлор 5-фторбензил)-7-(3,3-дифторпирролидин-1-ил)-2 Н-[1,2,3]триазоло[4,5-d]пиримидин По аналогии со способом, описанным для синтеза 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2 этил-2 Н-[1,2,3]триазоло[4,5-d]пиримидина (пример 3, стадия b), указанное в заголовке соединение получали из 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-3H-[1,2,3]триазоло[4,5-d]пиримидина и 2(бромметил)-1-хлор-4-фторбензола и выделяли в виде светло-желтой смолы (4,0 мг; 23%). MS (m/e): 425,3 (МН+). Пример 32. 5-трет-Бутил-7-(3,3-дифторпирролидин-1-ил)-2-оксетан-3-ил-2 Н-[1,2,3]триазоло[4,5d]пиримидин По аналогии со способом, описанным для синтеза 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2 этил-2 Н-[1,2,3]триазоло[4,5-d]пиримидина (пример 3, стадия b), указанное в заголовке соединение получали из 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-3H-[1,2,3]триазоло[4,5-d]пиримидина и 3 бромоксетана и выделяли в виде светло-коричневого твердого вещества (2,8 мг; 20%). MS (m/e): 339,3 По аналогии со способом, описанным для синтеза 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-2 этил-2 Н-[1,2,3]триазоло[4,5-d]пиримидина (пример 3, стадия b), указанное в заголовке соединение получали из 5-трет-бутил-7-(3,3-дифторпирролидин-1-ил)-3H-[1,2,3]триазоло[4,5-d]пиримидина и 2(бромметил)-1,3-дихлор-4-фторбензола и выделяли в виде белого твердого вещества. MS (m/e): 459,2
МПК / Метки
МПК: A61K 31/519, C07D 487/04
Метки: агонистов, 1,2,3]триазоло[4,5-d]пиримидина, производные, качестве, рецептора, каннабиноидного
Код ссылки
<a href="https://eas.patents.su/30-24108-proizvodnye-123triazolo45-dpirimidina-v-kachestve-agonistov-kannabinoidnogo-receptora-2.html" rel="bookmark" title="База патентов Евразийского Союза">Производные [1,2,3]триазоло[4,5-d]пиримидина в качестве агонистов каннабиноидного рецептора 2</a>
Предыдущий патент: Устройство мобильной станции, устройство базовой станции, способ связи и система связи
Следующий патент: Ингибиторы протеинкиназ
Случайный патент: Игровая принадлежность, в частности игральная кость












