Производные триазоло[4,5-d]пирамидина и их применение в качестве антагонистов пуринового рецептора
Номер патента: 18803
Опубликовано: 30.10.2013
Авторы: Тодд Ричард Саймон, Джиллеспай Роджер Джон, Бамфорд Саманта Джейн
Формула / Реферат
1. Соединение формулы (I)
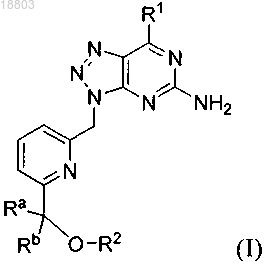
где R1 обозначает фенил или гетероарил, причем указанные фенил или гетероарил необязательно замещены алкилом, алкоксигруппой, галогеном или группой -CN,
Ra обозначает Н или алкил,
Rb обозначает Н или алкил,
или Ra и Rb вместе с атомом, к которому они присоединены, образуют 3-8-членный насыщенный или частично насыщенный углеводородный цикл или образуют 4-8-членный насыщенный или частично насыщенный гетероцикл, включающий атомы в цикле, выбранные из О, N(R3) и S,
R2 обозначает Н, алкил или гетероциклоалкил, причем указанный алкил необязательно может быть замещен галогеном, алкоксигруппой или гетероциклоалкилом,
при условии, что R2 выбирают из гетероциклоалкила и алкила, замещенного галогеном, алкоксигруппой или гетероциклоалкилом, если R1 обозначает фуран-2-ил или 5-метилфуран-2-ил, a Ra и Rb оба обозначают Н,
R3 обозначает Н или алкил,
где гетероарил обозначает 5- или 6-членный ароматический цикл, содержащий один или два атома в цикле, выбранных из N, N(R4), S и О,
алкил (или алкильная группа в составе алкоксигруппы) обозначает насыщенный углеводород с прямой или разветвленной цепью, содержащий до 10 атомов углерода,
гетероциклоалкил обозначает С- или N-присоединенный 3-10-членный неароматический моноциклический цикл, причем указанный гетероциклоалкил содержит 1, 2 или 3 атома в цикле, независимо выбранных из N, N(R4), S(O)q и О,
R4 обозначает Н или алкил,
q равен 0, 1 или 2,
и его таутомеры, стереоизомеры, фармацевтически приемлемые соли и сольваты.
2. Соединение по п.1, где R1 выбирают из фенила, 2-фуранила, 2-пирролила, 2-имидазолила, 2-оксазолила и 2-тиазолила, каждый из которых необязательно замещен алкилом или алкоксигруппой.
3. Соединение по п.1, где R1 обозначает 5-метилфуран-2-ил.
4. Соединение по любому из пп.1-3, где Ra и Rb вместе с атомом, к которому они присоединены, образуют тетрагидропирил, циклобутил, циклопентил или циклогексил.
5. Соединение по любому из пп.1-3, где Ra и Rb независимо выбирают из Н и С1-С6алкила.
6. Соединение по любому из пп.1-5, где R2 выбирают из Н, С1-С4алкила и тетрагидрофуранила, причем указанный С1-С4алкил необязательно может быть замещен фтором, С1-С3алкоксигруппой и тетрагидрофуранилом.
7. Соединение по любому из пп.1-5, где R2 выбирают из Н и тетрагидрофурила.
8. Соединение по п.1, выбранное из группы, включающей
7-(5-метилфуран-2-ил)-3-(6-[2-изопропилоксиэтокси]оксиметилпирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
7-(5-метилфуран-2-ил)-3-(6-[1-гидрокси-1-метилэтил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
7-(5-метилфуран-2-ил)-3-(6-[1-гидрокси-1-циклопентил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
7-(5-метилфуран-2-ил)-3-(6-[4-гидрокситетрагидропиран-4-ил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
S-7-фенил-3-(6-[тетрагидрофуран-3-ил]оксиметилпирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
7-фенил-3-(6-[1-гидрокси-1-метилэтил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
7-фенил-3-(6-[1-гидрокси-1-циклопентил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
7-фенил-3-(6-[1-гидроксициклобутил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
7-фенил-3-(6-[метоксиметил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
S-7-(3-метоксифенил)-3-(6-[тетрагидрофуран-3-ил]оксиметилпирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
S-7-(5-метилфуран-2-ил)-3-(6-[тетрагидрофуран-3-ил]оксиметилпирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
7-(3-метоксифенил)-3-(6-[1-гидрокси-1-циклопентил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
7-(3-метоксифенил)-3-(6-[4-гидрокситетрагидропиран-4-ил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
7-(3-метоксифенил)-3-(6-[1-гидроксициклобутил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
7-(3-метоксифенил)-3-(6-[метоксиметил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
7-(5-метилфуран-2-ил)-3-(6-[1-гидрокси-1-циклогексил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
S-7-(3-цианофенил)-3-(6-[тетрагидрофуран-3-ил]оксиметилпирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
7-(3-цианофенил)-3-(6-[1-гидрокси-1-метилэтил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
7-(3-цианофенил)-3-(6-[4-гидрокситетрагидропиран-4-ил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
7-(3-цианофенил)-3-(6-[1-гидроксициклобутил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
7-(3-метоксифенил)-3-(6-[1-гидрокси-1-метилэтил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
7-(3-цианофенил)-3-(6-[метоксиметил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
S-7-(4-метилтиазол-2-ил)-3-(6-[тетрагидрофуран-3-ил]оксиметилпирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
7-(4-метилтиазол-2-ил)-3-(6-[1-гидрокси-1-циклопентил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
7-(4-метилтиазол-2-ил)-3-(6-[4-гидрокситетрагидропиран-4-ил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
7-(5-метилфуран-2-ил)-3-(6-[1-гидроксициклобутил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
7-(4-метилтиазол-2-ил)-3-(6-[1-гидроксициклобутил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
7-(4-метилтиазол-2-ил)-3-(6-[метоксиметил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
7-(5-метилфуран-2-ил)-3-(6-[дифторметилоксиметил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
7-фенил-3-(6-[4-гидрокситетрагидропиран-4-ил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
7-(5-метилфуран-2-ил)-3-(6-[2-этоксиэтоксиметил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
7-(5-метилфуран-2-ил)-3-(6-[тетрагидрофуран-2-илметил]оксиметилпирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
7-(5-метилфуран-2-ил)-3-(6-[тетрагидрофуран-3-илметил]оксиметилпирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
7-(5-метилфуран-2-ил)-3-(6-[1-метокси-1-метилэтил]оксиметилпирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
7-(3-цианофенил)-3-(6-[1-гидрокси-1-циклопентил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
7-(5-метилфуран-2-ил)-3-(6-[2,2,2-трифторэтил]оксиметилпирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
S-7-(тиазол-2-ил)-3-(6-[тетрагидрофуран-3-ил]оксиметилпирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
7-(4-метилтиазол-2-ил)-3-(6-[1-гидрокси-1-метилэтил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,
и его фармацевтически приемлемые соли и сольваты.
9. Фармацевтическая композиция, включающая соединение формулы (I) по любому из пп.1-8 или его фармацевтически приемлемую соль или сольват и фармацевтически приемлемый носитель.
10. Способ лечения нарушения, включающий введение эффективной дозы соединения по любому из пп.1-8 или его фармацевтически приемлемой соли или сольвата субъекту, нуждающемуся в лечении нарушения, которое поддается лечению при блокировании пуриновых рецепторов.
11. Способ по п.10, где пуриновые рецепторы представляют собой рецепторы аденозина A2A.
12. Способ по п.10, где нарушение движения обозначает нарушение, выбранное из болезни Паркинсона, синдрома беспокойных ног или вздрагивания при засыпании, ночной миоклонии, индуцированного лекарственным средством паркинсонизма, постэнцефалитического паркинсонизма, паркинсонизма, индуцированного отравлением, или посттравматической болезни Паркинсона, прогрессирующего надъядерного паралича, болезни Гентингтона, множественной системной атрофии, кортикобазальной дегенерации, болезни Уилсона, болезни Галлервордена-Шпатца, прогрессирующего паллидарного синдрома, допа-чувствительной дистонии-паркинсонизма, мышечной спастичности.
13. Способ по п.10, где нарушением движения является болезнь Паркинсона.
14. Способ по п.10, где лечение дополнительно включает введение субъекту дополнительного лекарственного средства, используемого для лечения нарушений движения.
15. Способ по п.14, где дополнительным лекарственным средством, используемым для лечения нарушений движения, является лекарственное средство, используемое для лечения болезни Паркинсона.
16. Способ по п.15, где дополнительным лекарственным средством является L-допа или агонист допамина.
17. Способ по п.10, где нарушением является депрессия, нарушение когнитивных способностей или памяти, острая или хроническая боль, синдром дефицита внимания с гиперактивностью или нарколепсия.
18. Способ по п.17, где нарушением когнитивных способностей или памяти является болезнь Альцгеймера.
19. Применение соединения по любому из пп.1-8 или его фармацевтически приемлемой соли или сольвата для получения лекарственного средства, предназначенного для лечения нарушения, которое поддается лечению при блокировании пуриновых рецепторов.
20. Применение по п.19, где пуриновые рецепторы представляют собой рецепторы аденозина A2A.
21. Применение по п.19, где нарушение движения обозначает нарушение, выбранное из болезни Паркинсона, синдрома беспокойных ног или вздрагивания при засыпании, ночной миоклонии, индуцированного лекарственным средством паркинсонизма, постэнцефалитического паркинсонизма, паркинсонизма, индуцированного отравлением, или посттравматической болезни Паркинсона, прогрессирующего надъядерного паралича, болезни Гентингтона, множественной системной атрофии, кортикобазальной дегенерации, болезни Уилсона, болезни Галлервордена-Шпатца, прогрессирующего паллидарного синдрома, допа-чувствительной дистонии-паркинсонизма, мышечной спастичности.
22. Применение по п.19, где нарушением движения является болезнь Паркинсона.
23. Применение по п.19, где лечение дополнительно включает введение субъекту дополнительного лекарственного средства, используемого для лечения нарушений движения.
24. Применение по п.23, где дополнительным лекарственным средством, используемым для лечения нарушений движения, является лекарственное средство, используемое для лечения болезни Паркинсона.
25. Применение по п.24, где дополнительным лекарственным средством является L-допа или агонист допамина.
26. Применение по п.19, где нарушением является депрессия, нарушение когнитивных способностей или памяти, острая или хроническая боль, синдром дефицита внимания с гиперактивностью или нарколепсия.
27. Применение по п.26, где нарушением когнитивных способностей или памяти является болезнь Альцгеймера.
Текст
ПРОИЗВОДНЫЕ ТРИАЗОЛО[4,5-D]ПИРАМИДИНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ ПУРИНОВОГО РЕЦЕПТОРА В настоящем изобретении предлагаются соединения формулы (I) Бамфорд Саманта Джейн,Джиллеспай Роджер Джон, Тодд Ричард Саймон (GB) которые могут действовать как антагонисты пуриновых рецепторов, фармацевтические композиции, включающие указанные соединения, и способы их получения. Соединения и композиции можно использовать для лечения и профилактики нарушений, вызванных гиперфункцией пуриновых рецепторов. Область изобретения Настоящее изобретение относится к фармацевтическим композициям, способам их получения и применения. Предпосылки создания изобретения Нарушения движения представляют собой серьезную проблему здравоохранения, прежде всего у людей пожилого возраста. Такие нарушения движения в большинстве случаев развиваются при повреждении мозга. Нарушения, включающие базальный ганглий, которые вызывают нарушения движения,включают болезнь Паркинсона, болезнь Гентингтона и болезнь Вильсона. Более того, дискинезия часто развивается в виде осложнения церебральной ишемии и других неврологических нарушений. Известно четыре классических симптома болезни Паркинсона: тремор, ригидность, акинезия и перемена положения тела. Указанное заболевание обычно также связано с депрессией, деменцией и общим снижением когнитивных способностей. Распространенность болезни Паркинсона составляет 1 случай на 1000 человек общей популяции. Заболеваемость возрастает до 1 случая на 100 человек старше 60 лет. При развитии болезни Паркинсона важное значение имеют дегенерация допаминергических нейронов в черной субстанции и последующее снижение интерстициальной концентрации допамина в полосатом теле. Приблизительно 80% клеток в черной субстанции могут разрушаться перед проявлением клинических симптомов болезни Паркинсона. Некоторые стратегии лечения болезни Паркинсона основаны на заместительной терапии медиаторами (L-дигидроксифенилуксусная кислота (L-допа, ингибировании моноаминоксидазы (например,депренил), агонистах допаминовых рецеторов (например, бромкриптин и апоморфин) и антихолинергических агентах (например, бензтрофин, орфенадрин). Заместительная терапия медиаторами может не оказывать стабильного благоприятного клинического действия, прежде всего после продолжительного лечения, когда развиваются симптомы "включения-выключения". Более того, такое лечение может также сопровождаться непроизвольными движениями, то есть атетозом и хореей, тошнотой и рвотой. Кроме того, современные методы лечения не устраняют причину неврологического нарушения, вызывающую болезнь Паркинсона и приводящую к непрерывному снижению когнитивной способности у пациентов. При лечении нарушений движения, таких как болезнь Паркинсона, синдром беспокойных ног,вздрагивание при засыпании, и при лечении церебральной ишемии используют блокаду рецепторов аденозина A2 (см., например, заявку WO 02/055083, статьи Richardson P.J. и др., Trends Pharmacol. Sci., 18,338-344 (1997) и Gao Y. и Phillis J.W., Life Sci., 55, 61-65 (1994, каждая из которых включена в настоящее описание в полном объеме в качестве ссылок. Антагонисты рецептора аденозина A2A представляют собой перспективные агенты для лечения нарушений движения, таких как болезнь Паркинсона (см. статью Mally J. и Stone Т.W., CNS Drugs, 10, 311-320 (1998), которая включена в полном объеме в настоящее описание в качестве ссылки). Аденозин является природным пуриновым нуклеозидом, который проявляет множество зарегистрированных регуляторных функций и принимает участие в множестве физиологических явлений. Действие этого эндогенного нуклеозида на центральную нервную систему (ЦНС) привлекает особое внимание ученых при разработке лекарственных средств в связи с возможностью применения пуринергических агентов при лечении нарушений ЦНС (см. статьи Jacobson K.A. и др., J. Med. Chem. 35, 407-422 (1992) иBhagwhat S.S., Williams M.E., Opin. Ther. Patents, 5, 547-558 (1995), каждая из которых включена в настоящее описание в качестве ссылок). Рецепторы аденозина относятся к подклассу (Р 1) группы рецепторов пуриновых нуклеотидов и нуклеозидов, известных как пуринорецепторы. Известные основные фармакологически определенные подтипы аденозиновых рецепторов включают рецепторы А 1, A2A, A2B (с высокой и низкой аффинностью) и A3 (см. статью Fredholm В.В. и др., Pharmacol. Rev., 46, 143-156 (1994), которая в полном объеме включена в настоящее описание в качестве ссылки). Аденозиновые рецепторы присутствуют в ЦНС (см. статью Fredholm В.В., News Physiol. Sci., 10, 122-128 (1995), которая включена в настоящее описание в полном объеме в качестве ссылки). Опосредованные рецептором P1 агенты можно использовать при лечении церебральной ишемии или нейродегенеративных нарушений, таких как болезнь Паркинсона (см. статьи Jacobson K.A., Suzuki F., DrugBumnstock G., Purinergic Approaches Exp. Ther. 3-26, ред. Jacobson Kenneth A. (1997), Jarvis Michael F.,Wiley-liss, New York, N.Y., которые включены в настоящее описание в полном объеме в качестве ссылок). Предполагают, что производные ксантина, такие как кофеин, можно использовать при лечении нарушения внимания с гиперактивностью. В результате ряда исследований было установлено, что кофеин оказывает благоприятный эффект при контроле симптомов нарушения внимания с гиперактивностью(см. статью Garfinkel В.D. и др., Psychiatry, 26, 395-401 (1981), которая в полном объеме включена в настоящее описание в качестве ссылки). Полагают также, что антагонизм рецепторов аденозина вносит вклад во множество типов действия кофеина на поведение человека и таким образом с помощью блокады рецепторов аденозина A2A можно объяснить наблюдаемое действие кофеина на пациентов с нарушением внимания с гиперактивностью. Следовательно, селективный антагонист рецептора аденозина A2A может представлять собой эффективный агент для лечения нарушения внимания с гиперактивностью, но проявляющий сниженные побочные действия. Аденозиновые рецепторы могут играть важную роль в регуляции характера сна и действительно антагонисты аденозина, такие как кофеин, оказывают сильное стимулирующее действие и их можно использовать для увеличения периода бодрствования (см. статью Porkka-Heiskanen Т. и др., Science, 276,1265-1268 (1997), которая включена в настоящее описание в полном объеме в качестве ссылки). Регуляцию сна аденозином можно опосредовать аденозиновым рецептором A2A (см. статью Satoh S. и др., Proc.Natl. Acad. Sci., USA, 93: 5980-5984 (1996), которая включена в настоящее описание в полном объеме в качестве ссылки). Таким образом, селективный антагонист аденозинового рецептора A2A может оказывать благоприятное действие за счет снижения избыточной сонливости при нарушениях сна, таких как патологическая сонливость или нарколепсия. Пациенты с диагнозом большой депрессии характеризуются слабой ответной реакцией на индуцированную агонистом аденозина стимуляцию в тромбоцитах, что свидетельствует о возможности разрегуляции функции рецептора аденозина A2A при развитии депрессии (см. статью Berk М. и др., Eur. Neuropsycopharmacol. 11, 183-186 (2001), которая в полном объеме включена в настоящее описание в качестве ссылки). В экспериментах на моделях животных было установлено, что блокада функции рецептора аденозина A2A сопровождается антидепрессантной активностью (см. статью El Yacoubi M и др., Br. J. Pharmacol., 134, 68-77 (2001), которая включена в полном объеме в настоящее описание в качестве ссылки). Таким образом, антагонисты рецептора аденозина A2A можно использовать при лечении большой депрессии и других аффективных нарушений у пациентов. Обзор фармакологических свойств рецепторов аденозина A2A представлен в статье Ongini E., Fredholm В.В., Trends Pharmacol. Sci., 17(10), 364-372 (1996), которая в полном объеме включена в настоящее описание в качестве ссылки. Один из возможных механизмов лечения нарушений движения антагонистами аденозина A2A заключается в том, что рецепторы A2A предположительно функционально связаны с допаминовыми рецепторами D2 в ЦНС, см., например, статьи Ferre S. и др., Proc. Natl. Acad. Sci. USA, 88, 7238-7241 (1991),Puxe K. и др., Adenosine Adenine Nucleotides Mol. Biol. Integr. Physiol., (5-й Proc. Int. Symp.), 499-507, ред.Belardinelr, Luiz Pelleg, Amir. Изд. Kluwer, Boston (1995), Mass, и Ferre S. и др., Trends Neurosci., 20, 482487 (1997), каждая из которых в полном объеме включена в настоящее описание в качестве ссылок. Интерес к роли рецепторов аденозина A2A, частично связанный с результатами испытаний in vivo,которые указывали на взаимосвязь рецепторов аденозина A2A с каталепсией (см. статьи Ferre и др., Neurosci. Lett., 130, 1624 (1991) и Mandhane S.N. и др., Eur. J. Pharmacol., 328, 135-141 (1997), каждая из которых включена в полном объеме в настоящее описание в качестве ссылок), ускорил разработку агентов,которые селективно связываются с рецепторами аденозина A2A. Одно из преимуществ лечения антагонистами аденозина A2A заключается в том, что можно лечить основную причину нейродегенеративного нарушения (см., например, статью Ongini E., Adami M. Ferri С.,Bertorelli R., Ann. N.Y. Acad. Sci., 825 (Neuroprotective Agents), 3048 (1997), которая включена в полном объеме в настоящее описание в качестве ссылки). Прежде всего вклад в нейрозащиту от МРТРиндуцированной нейротоксичности у мышей вносит блокада функции рецептора аденозина A2A (см. статью Chen J- F., J. Neurosci., 21, RC143 (2001), которая включена в полном объеме в настоящее описание в качестве ссылки). Кроме того, потребление кофеина с пищей (известного антагониста рецептора аденозина A2A) связано со сниженным риском болезни Паркинсона (см. статьи Ascherio А. и др., Ann. Neurol.,50, 56-63 (2001) и Ross G.W. и др., JAMA, 283, 2674-2679 (2000), которые включены в полном объеме в настоящее описание в качестве ссылок). Таким образом, антагонисты рецептора аденозина A2A могут оказывать нейрозащитное действие при нейродегенеративных заболеваниях, таких как болезнь Паркинсона. Известно, что производные ксантина являются антагонистами рецептора аденозина A2A, которые можно использовать при лечении различных заболеваний, вызванных гиперфункцией рецепторов аденозина A2A, таких как болезнь Паркинсона (см., например, патент ЕР-А-565377, который включен в настоящее описание в полном объеме в качестве ссылки). Одним из перспективных селективных антагонистов аденозина A2A на основе производного ксантина является CSC, 8-(3-хлорстирил)кофеин (см. статьюJacobson и др., FEBS Lett., 323, 141-144 (1993), которая в полном объеме включена в настоящее описание в качестве ссылки). Проводили клинические испытания теофиллина, 1,3-диметилксантина, бронхолитического лекарственного средства, который является смешанным антагонистом рецепторов A1 и A2A. С целью оценки эффективности состава указанного рецептора для лечения болезни Паркинсона проводили открытые испытания с участием 15 пациентов с диагнозом болезни Паркинсона, которых лечили в течение периода до 12 недель пероральным препаратом теофиллина с замедленным высвобождением (150 мг/сут.), при этом уровень теофиллина в сыворотке достигал уровня 4,44 мг/л через одну неделю лечения. У пациентов наблюдались значительное улучшение основных объективных параметров оценки нетрудоспособности в баллах, а у 11 пациентов регистрировали умеренное или значительное улучшение (см. статью Mally J.,Stone Т.W. J., Pharm. Pharmacol., 46, 515-517 (1994), которая в полном объеме включена в настоящее описание в качестве ссылки).KF 17837 (Е-8-(3,4-диметиоксистирил)-1,3-дипропил-7-метилксантин) является селективным антагонистом рецептора аденозина A2A, который после перорального введения значительно снижает каталептическую, ответную реакцию, индуцированную при внутрицеребро-вентрикулярном введении агониста рецептора аденозина A2A, CGS 21680. KF снижает также каталепсию, индуцированную галоперидолом и резерпином. Кроме того, KF 17837 потенциирует антикаталептический эффект подпороговой дозы Lдопы плюс бензеразида, что свидетельствует о том, что KF 17837 является центральным активным антагонистом рецептора аденозина A2A и что допаминергическая функция сигнальных нигростриатных путей потенциируется антагонистами рецептора аденозина A2A (см. статью Kanda Т. и др., Eur. J. Pharmacol.,256, 263-268 (1994), которая в полном объеме включена в настоящее описание в качестве ссылки). Установлена взаимосвязь структуры и активности KF 17837 (см. статью Shimada J. и др., Bioorg. Med. Chem.Lett., 7, 2349-2352 (1997), которая в полном объеме включена в настоящее описание в качестве ссылки). Опубликованы также последние данные о свойствах антагониста рецептора аденозина A2A KW-6002 (см. статьи Kuwana Y. и др., Soc. Neurosci. Abstr., 23, 119.14 (1997) и Kanda Т. и др., Ann. Neurol., 43(4), 507513 (1998), которые в полном объеме включены в настоящее описание в качестве ссылок). Нексантиновые структуры, обладающие указанными фармакологическими свойствами, включаютSCH 58261 и его производные (см. статью Baraldi P.G. и др., J. Med Chem., 39, 1164-1171 (1996), которая в полном объеме включена в настоящее описание в качестве ссылки). Было установлено, что SCH 58261,(7-(2-фенилэтил)-5-амино-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин) проявляет эффективность при лечении нарушений движения (см. статью Ongini E., Drug Dev. Res., 42(2), 63-70 (1997),которая в полном объеме включена в настоящее описание в качестве ссылки). Позднее были получены серии соединений (см. статью Baraldi P. G. и др., J. Med. Chem., 41(12), 2126-2133 (1998), которая в полном объеме включена в настоящее описание в качестве ссылки). Соответственно, блокирование пуриновых рецепторов, прежде всего аденозиновых рецепторов и более предпочтительно рецепторов аденозина A2A может оказывать благоприятное действие при лечении или профилактике нарушений движения, таких как болезнь Паркинсона, синдром беспокойных ног и вздрагивания при засыпании, или нарушений, таких как депрессия, нарушение когнитивных способностей или памяти, острая и хроническая боль, синдром дефицита внимания с гиперактивностью или нарколепсия или нейрозащита у пациента. Ряд антагонистов рецептора аденозина A2A описан в международной заявке WO 02/055083 А 1, которая в полном объеме включена в настоящее описание в качестве ссылки. Описание изобретения Соединения по настоящему изобретению являются селективными антагонистами аденозина A2A. Таким образом, они характеризуются высокой аффинностью к рецептору аденозина A2A и селективностью к этому рецептору по сравнению с рецепторами аденозина другого типа (A1, A2A, A3). В значительной степени соединения по изобретению проявляют более высокую селективность к рецептору аденозина A2A по сравнению с рецептором аденозина A2B при сравнении с известными антагонистами рецепторов аденозина A2A. Преимущества такой селективности по сравнению с рецептором аденозина A2B обсуждаются ниже. Рецептор аденозина A2B широко распространен в макрофагах костного мозга и гладкой мускулатуре сосудов. В результате испытаний на модели мышей, нокаутных по рецептору A2B, было установлено, что удаление рецептора A2B у мышей приводит к более высокому уровню повреждения сосудов с последующим повреждением бедренной артерии, по сравнению с сосудами у мышей дикого типа, причем сигнал такого повреждения формируется в клетках костного мозга (Yang и др., 2008). Повреждение сосудов представляет собой важное индуцирующее явление в патогенезе различных сосудистых заболеваний,включая атеросклероз, рестеноз и сепсис. Следовательно, существует возможность того, что продолжительный антагонизм к рецепторам A2B повышает вероятность повреждения сосудов и провоцирует развитие различных сосудистых заболеваний. Следовательно, высокая степень селективности антагонизма к рецепторам аденозина A2A по сравнению с рецепторами A2B является ценным признаком, прежде всего при лечении болезни Паркинсона, заболевания популяции, которая включает людей пожилого возраста и людей с риском развития сердечно-сосудистых заболеваний (Yang D., Koupenova M.L, McCrann D.J., Kopeikina K.J., Kagan H.M., Schreiber B.M. и Ravid K, "The A2b adenosine receptor protects against vascularinjury", Proc. Natl. Acad Sci. 105(2): 792-796 (2008). Как указано выше, соединения по изобретению также характеризуются высокой селективностью к рецептору аденозина A2A по сравнению с рецептором аденозина A3. Преимущество такой селективности обсуждается ниже. Аденозин, который высвобождается в ходе развития ишемической болезни сердца, оказывает сильный защитный эффект на сердце. Существуют строго обоснованные данные о том, что активация рецепторов аденозина A3 играет важную роль в опосредовании такой защиты (Liang и Jacobson, 1998). Следовательно, возможно, что продолжительная блокада рецепторов аденозина A3 может повышать вероятность осложнений после любой предварительно перенесенной ишемической болезни сердца или после развития ишемической болезни сердца, такой как стенокардия или сердечная недостаточность. Следовательно, высокая степень селективности к рецептору аденозина A2A по сравнению с рецептором аденозинаA3 является крайне необходимым признаком, прежде всего при лечении болезни Паркинсона, заболевания популяции, которая включает людей пожилого возраста и людей с риском развития сердечнососудистых заболеваний (Liang В.Т. и Jacobson K.A., A physiological role of the adenosine A3 receptor: Sustained cardioprotection, Proc. Natl. Acad. Sci. 95 (12): 6995-6999 (1998). В одном объекте настоящего изобретения предлагаются соединения формулы (I) где R1 обозначает фенил или гетероарил, причем указанные фенил или гетероарил необязательно замещены алкилом, алкоксигруппой, галогеном или группой -CN,Ra обозначает Н или алкил,Rb обозначает Н или алкил,или Ra и Rb вместе с атомом, к которому они присоединены, образуют 3-8-членный насыщенный или частично насыщенный углеводородный цикл, или образуют 4-8-членный насыщенный или частично насыщенный гетероцикл, включающий атомы в цикле, выбранные из О, N(R3) и S,R2 обозначает Н, алкил или гетероциклоалкил, причем указанный алкил необязательно замещен галогеном, алкоксигруппой или гетероциклоалкилом,при условии, что R2 выбирают из гетероциклоалкила и алкила, замещенного галогеном, алкоксигруппой или гетероциклоалкилом, если R1 обозначает фуран-2-ил или 5-метилфуран-2-ил и Ra и Rb оба обозначают Н,R3 обозначает Н или алкил,где гетероарил обозначает 5- или 6-членный ароматический цикл, содержащий один или два атома в цикле, выбранных из N, N(R4), S и О,алкил (или алкильная группа в составе алкоксигруппы) обозначает насыщенный углеводород с прямой или разветвленной цепью, содержащий до 10 атомов углерода,гетероциклоалкил обозначает С- или N-присоединенный 3-10-членный неароматический моноциклический цикл, причем указанный гетероциклоалкил содержит 1, 2 или 3 атома в цикле, независимо выбранных из N, N(R4), S(O)q и O,R4 обозначает Н или алкил,q равен 0, 1 или 2,и их таутомеры, стереоизомеры, фармацевтически приемлемые соли и сольваты. В другом объекте настоящего изобретения предлагается пролекарство соединения формулы (I), как описано в данном контексте, или его фармацевтически приемлемая соль. В одном объекте настоящего изобретения предлагается N-оксид соединения формулы (I), как описано в данном контексте, или его пролекарство или фармацевтически приемлемая соль. Следует понимать, что некоторые соединения по настоящему изобретению могут существовать в виде сольватов, например гидратов, а также в несольватированных формах. Следует понимать, что настоящее изобретение включает все указанные сольватированные формы. В другом объекте настоящего изобретения предлагается фармацевтическая композиция, включающая фармацевтически приемлемый носитель и соединение формулы (I), как описано выше, или его фармацевтически приемлемую соль или сольват. В одном объекте настоящего изобретения предлагается способ лечения нарушения, заключающийся во введении эффективной дозы соединения формулы (I) или его фармацевтически приемлемой соли или сольвата субъекту, нуждающемуся в лечении нарушения, которое поддается лечению при блокировании пуринового рецептора. В другом объекте настоящего изобретения предлагается соединение формулы (I) или его фармацевтически приемлемая соль или сольват для применения при лечении нарушения, которое поддается лечению при блокировании пуринового рецептора. В одном объекте настоящего изобретения предлагается соединение формулы (I) или его фармацевтически приемлемая соль или сольват для получения лекарственного средства, предназначенного для лечения нарушения, которое поддается лечению при блокировании пуринового рецептора. Нарушение может быть связано с гиперфункцией пуриновых рецепторов. Субъект может нуждаться в блокировании рецептора аденозина. Пуриновые рецепторы могут обозначать рецепторы аденозинаA2A. Нарушение может обозначать нарушение движений. Нарушение движения может обозначать болезнь Паркинсона, синдром беспокойных ног или вздрагивание при засыпании, или нарушение движе-4 018803 ний может обозначать индуцированный лекарственным средством паркинсонизм, постэнцефалитический паркинсонизм, паркинсонизм, индуцированный отравлением, или посттравматическую болезнь Паркинсона. Нарушение движений может обозначать прогрессирующий надъядерный паралич, болезнь Гентингтона, множественную системную атрофию, кортикобазальную дегенерацию, болезнь Уилсона, болезнь Галлервордена-Шпатца, прогрессирующий паллидарный синдром, допа-чувствительную дистонию-паркинсонизм, мышечную спастичность или другие нарушения базального ганглия, которые приводят к дискинезии. Лечение может включать введение субъекту дополнительного лекарственного средства, пригодного для лечения нарушений движения. Дополнительное лекарственное средство, пригодное для лечения нарушений движения, может обозначать лекарственное средство, пригодное для лечения болезни Паркинсона, такое как, например, L-допа или агонист допамина. Нарушение может обозначать депрессию,ухудшение памяти или познавательных способностей, острую или хроническую боль, СДВП (синдром дефицита внимания с гиперактивностью) или нарколепсию. Ухудшение памяти или познавательных способностей может обозначать болезнь Альцгеймера. В одном объекте настоящего изобретения предлагается подгруппа соединений формулы (I), гдеR1 выбирают из группы, включающей 5-метилфуран-2-ил, фенил и 4-метилтиазол-2-ил,Ra обозначает Н или алкил,Rb обозначает Н или алкил,или Ra и Rb вместе с атомом, к которому они присоединены, образуют 4-6-членный насыщенный углеводородный цикл или образуют 5-6-членный насыщенный гетероцикл, включающий атомы в цикле,выбранные из О, N(R3) и S,R2 обозначает Н, алкил, алкоксиалкил- или гетероциклоалкил, при условии, что R2 обозначает Н,алкоксиалкил- или гетероциклоалкил,если R1 обозначает 5-метилфуран-2-ил и Ra и Rb, оба, обозначают Н,R3 обозначает Н или алкил,где гетероарил, алкил (или алкильная группа в составе алкоксигруппы или алкоксиалкильной группы) и гетероциклоалкил имеют значение, определенное выше,и их таутомеры, стереоизомеры, фармацевтически приемлемые соли и сольваты. Настоящее изобретение также включает следующие объекты и их комбинации. В одном объекте настоящего изобретения предлагается соединение формулы (I), где R1 выбирают из фенила или гетероарила, причем указанные фенил или гетероарил необязательно замещены алкилом или алкоксигруппой. В другом объекте настоящего изобретения предлагается соединение формулы (I), где R1 выбирают из фенила, тиенила, фуранила, пирролила, пиразолила, имидазолила, оксазолила, изоксазолила и тиазолила, каждый из которых необязательно замещен алкилом или алкоксигруппой. В одном объекте настоящего изобретения предлагается соединение формулы (I), где R1 выбирают из фенила, 2-фуранила, 2-пирролила, 2-имидазолила, 2-оксазолила и 2-тиазолила, каждый из которых необязательно замещен алкилом или алкоксигруппой. В другом объекте настоящего изобретения предлагается соединение формулы (I), где R1 выбирают из 5-метилфуран-2-ила, фенила и 4-метилтиазол-2-ила. В одном объекте настоящего изобретения предлагается соединение формулы (I), где R1 обозначает 5-метилфуран-2-ил. В другом объекте настоящего изобретения предлагается соединение формулы (I), где Ra и Rb вместе с атомом, к которому они присоединены, образуют 4-6-членный насыщенный углеводородный цикл, или образуют 5-6-членный насыщенный гетероцикл, включающий атомы в цикле, выбранные из О и N(R3),где R3 имеет значение, определенное выше. В одном объекте настоящего изобретения предлагается соединение формулы (I), где Ra и Rb вместе с атомом, к которому они присоединены, образуют тетрагидропирил, циклобутил, циклопентил или циклогексил. В другом объекте настоящего изобретения предлагается соединение формулы (I), где Ra и Rb независимо выбирают из Н и C1-С 6 алкила. В одном объекте настоящего изобретения предлагается соединение формулы (I), где Ra и Rb независимо выбирают из Н и метила. В другом объекте настоящего изобретения предлагается соединение формулы (I), где Ra и Rb оба обозначают Н. В одном объекте настоящего изобретения предлагается соединение формулы (I), где R2 выбирают из Н, C1-С 6 алкила и гетероциклоалкила, причем указанный C1-С 6 алкил необязательно замещен фтором,C1-С 6 алкоксигруппой, тетрагидрофуранилом, тетрагидропиранилом, пирролидинилом и пиперидинилом. В другом объекте настоящего изобретения предлагается соединение формулы (I), где R2 выбирают из Н, C1-С 4 алкила и тетрагидрофуранила, причем указанный C1-С 4 алкил необязательно замещен фтором,C1-С 3 алкоксигруппой и тетрагидрофуранилом. В одном объекте настоящего изобретения предлагается соединение формулы (I), где R2 выбирают из Н и тетрагидрофуранила. В другом объекте настоящего изобретения гетероарил обозначает 5-членный ароматический цикл,содержащий один или два атома N, или один атом N и одну группу NR4, или одну группу NR4 и один атом S или один атом О, где R4 имеет значение, определенное выше. В одном объекте настоящего изобретения гетероциклоалкил обозначает С-присоединенный 5- или 6-членный неароматический моноциклический цикл, причем указанный цикл содержит 1 или 2 атома,независимо выбранных из NR4 и О, где R4 имеет значение, определенное выше. В другом объекте настоящего изобретения предлагается соединение формулы (I), выбранное из следующих соединений: 7-(5-метилфуран-2-ил)-3-(6-[2-изопропилоксиэтокси]оксиметилпирид-2-илметил)-3H[1,2,3]триазоло[4,5-d]пиримидин-5-амин,7-(5-метилфуран-2-ил)-3-(6-[1-гидрокси-1-метилэтил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5d]пиримидин-5-амин,7-(5-метилфуран-2-ил)-3-(6-[1-гидрокси-1-циклопентил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5d]пиримидин-5-амин,7-(5-метилфуран-2-ил)-3-(6-[4-гидрокситетрагидропиран-4-ил]пирид-2-илметил)-3H[1,2,3]триазоло[4,5-d]пиримидин-5-амин,S-7-фенил-3-(6-[тетрагидрофуран-3-ил]оксиметилпирид-2-илметил)-3H-[1,2,3]триазоло[4,5d]пиримидин-5-амин,7-фенил-3-(6-[1-гидрокси-1-метилэтил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5 амин,7-фенил-3-(6-[1-гидрокси-1-циклопентил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5 амин,7-фенил-3-(6-[1-гидроксициклобутил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5 амин,7-фенил-3-(6-[метоксиметил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,S-7-(3-метоксифенил)-3-(6-[тетрагидрофуран-3-ил]оксиметилпирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,S-7-(5-метилфуран-2-ил)-3-(6-[тетрагидрофуран-3-ил]оксиметилпирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,7-(3-метоксифенил)-3-(6-[1-гидрокси-1-циклопентил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5d]пиримидин-5-амин,7-(3-метоксифенил)-3-(6-[4-гидрокситетрагидропиран-4-ил]пирид-2-илметил)-3H-[1,2,3]триазоло 7-(4-метилтиазол-2-ил)-3-(6-[метоксиметил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин 5-амин,7-(5-метилфуран-2-ил)-3-(6-[дифторметилоксиметил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5d]пиримидин-5-амин,7-фенил-3-(6-[4-гидрокситетрагидропиран-4-ил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,7-(5-метилфуран-2-ил)-3-(6-[2-этоксиэтоксиметил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5d]пиримидин-5-амин,7-(5-метилфуран-2-ил)-3-(6-[тетрагидрофуран-2-илметил]оксиметилпирид-2-илметил)-3H[1,2,3]триазоло[4,5-d]пиримидин-5-амин,7-(5-метилфуран-2-ил)-3-(6-[тетрагидрофуран-3-илметил]оксиметилпирид-2-илметил)-3H[1,2,3]триазоло[4,5-d]пиримидин-5-амин,7-(5-метилфуран-2-ил)-3-(6-[1-метокси-1-метилэтил]оксиметилпирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин,7-(3-цианофенил)-3-(6-[1-гидрокси-1-циклопентил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5d]пиримидин-5-амин,7-(5-метилфуран-2-ил)-3-(6-[2,2,2-трифторэтил]оксиметилпирид-2-илметил)-3H-[1,2,3]триазоло[4,5d]пиримидин-5-амин,S-7-(тиазол-2-ил)-3-(6-[тетрагидрофуран-3-ил]оксиметилпирид-2-илметил)-3H-[1,2,3]триазоло[4,5d]пиримидин-5-амин,7-(4-метилтиазол-2-ил)-3-(6-[1-гидрокси-1-метилэтил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5d]пиримидин-5-амин,и из их фармацевтически приемлемых солей и сольватов. Специалисту в данной области техники представляется очевидным, что каждое из соединений, указанных выше, или приведенных в разделе "Примеры" ниже, отдельно или в комбинации с другим указанным соединением, представляет собой независимый объект настоящего изобретения. Определения Термин "алкил", как использовано в данном контексте, обозначает насыщенные углеводородные остатки, включающие группы с прямой цепью, содержащие до 10 атомов (C1-C10), или до 6 атомов (C1-C6), или до 4 атомов (C1-C4). Примеры указанных алкильных групп включают, но не ограничиваясь только ими, C1-метил,С 2-этил, C3-пропил и С 4-н-бутил; группы с разветвленной цепью, содержащие от 3 до 10 атомов (C3-C10), или до 7 атомов (С 3-С 7), или до 4 атомов (С 3-С 4). Примеры указанных алкильных групп включают, но не ограничиваясь только ими,C3-изопропил, С 4-вторбутил, С 4-изобутил, С 4-трет-бутил и С 5-нео-пентил. Термин "алкоксигруппа" обозначает О-присоединенные углеводородные остатки, включающие группы с прямой цепью, содержащие от 1 до 6 атомов (C1-C6) или от 1 до 4 атомов (C1-C4). Примеры указанных алкоксигрупп включают, но не ограничиваясь только ими, C1-метокси, С 2-этокси, C3-нпропокси и С 4-н-бутокси; группы с разветвленной цепью, содержащие от 3 до 6 атомов (C3-C4) или от 3 до 4 атомов (С 3-С 4). Примеры указанных алкоксигрупп включают, но не ограничиваясь только ими, C3-изопропокси и С 4 вторбутокси и трет-бутокси. Термин "алкоксиалкил-" обозначает группу формулы алкил-О-алкил-, в которой алкил имеет значения, описанные ниже. Примеры указанных алкоксиалкильных групп включают, но не ограничиваясь только ими, метоксиметил (СН 3 ОСН 2-) и этоксиметил (С 2 Н 5 ОСН 2-). Термин "галоген" обозначает атомы Cl, F, Br и I. Термин "гетероциклоалкил" имеет значения, описанные выше. Примеры пригодных гетероциклоалкильных групп включают оксиранил, азиридинил, азетидинил, тетрагидрофуранил, пирролидинил,тетрагидропиранил, пиперидинил, N-метилпиперидинил, морфолинил, N-метилморфолинил, тиоморфолинил, тиоморфолинил-1-оксид, тиоморфолинил-1,1-диоксид, пиперазинил, N-метилпиперазинил, азепинил, оксазепинил, диазепинил и 1,2,3,4-тетрагидропиридинил. Термин "гетероарил" имеет значения, описанные выше. Примеры пригодных гетероарильных групп включают тиенил, фуранил, пирролил, пиразолил, имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиридинил, пиридазинил, пиримидинил и пиразинил. Термин "С-присоединенный", такой как "С-присоединенный гетероциклоалкил", обозначает, что гетероциклоалкильная группа присоединена к остатку молекулы через атом углерода. Термин "N-присоединенный", такой как "N-присоединенный гетероциклоалкил", обозначает, что гетероциклоалкильная группа присоединена к остатку молекулы через атом азота. Термин "О-присоединенный", такой как "О-присоединенный углеводородный остаток", обозначает,что углеводородный остаток присоединен к остатку молекулы через атом кислорода. В таких группах, как "алкоксиалкил-" и "-CN", символ "-" обозначает связь, через которую группа присоединена к остатку молекулы. Термин "фармацевтически приемлемая соль" обозначает физиологически или токсикологически приемлемую соль и включает, если используются, фармацевтически приемлемые основно-аддитивные соли и фармацевтически приемлемые кислотно-аддитивные соли. Можно также получать полусоли кислот и оснований, например полусульфат и полукальциевые соли. Пригодные соли описаны в справочнике "Handbook of Pharmaceutical Salts: Properties, Selection and Use" Stahl и Wermuth (Wiley-VCH, Weinheim, Германия, (2002). Термин "пролекарство" обозначает соединение, которое в ходе метаболизма in vivo (например, при гидролизе, восстановлении или окислении) превращается в соединение по настоящему изобретению. Пригодные для образования пролекарств группы описаны в статье "The Practice of Medicinal Chemistry",2-е изд., стр. 561-585 (2003) и в статье "F.J. Leinweber, Drug Metab. Res. ", 18, 379, (1987). Соединения по настоящему изобретению могут существовать как в несольватированной, так и в сольватированной форме. Термин "сольват", как использовано в данном контексте, обозначает молекулярный комплекс, содержащий соединение по настоящему изобретению и стехиометрическое количество одного или более фармацевтически приемлемых растворителей, например этанола. Термин "гидрат" используется, если растворителем является вода. Соединения по настоящему изобретению могут существовать в одной или более геометрических,оптических, энантиомерных, диастереомерных и таутомерных форм, включая, но не ограничиваясь только ими, цис- и трансформы, Е- и Z-формы, R,- S- и мезо-формы, кето- и енол-формы. Если не указано иное, то ссылка на конкретное соединение включает все приведенные изомерные формы, включая их рацемические и другие смеси. При необходимости такие изомеры выделяют из их смесей с использованием известных или модифицированных методов (например, хроматографией и перекристаллизацией). При необходимости, такие изомеры получают с использованием известных или модифицированных методов (например, асимметричным синтезом). Например, при использовании некоторых комбинаций заместителей Ra и Rb получают хиральные соединения по настоящему изобретению, такие как Аналогичным образом, при использовании некоторых заместителей R2 получают хиральные соединения по настоящему изобретению, такие как В контексте настоящего изобретения термин "лечение" включает медикаментозное, паллиативное и профилактическое лечение. Терапевтическое применение Соединения по настоящему изобретению можно использовать в качестве антагонистов пуриновых рецепторов, например в качестве антагонистов рецептора аденозина A2A. Фармацевтически приемлемые соли соединений по настоящему изобретению также можно использовать в качестве антагонистов пуриновых рецепторов, например в качестве антагонистов рецептора аденозина A2A. Соединения по настоящему изобретению можно применять для лечения или профилактики нарушений, при которых блокирование пуриновых рецепторов, прежде всего рецептора аденозина, предпочтительно рецептора аденозина A2A может оказывать лечебное действие. Соединения по настоящему изобретению вводят субъекту, нуждающемуся в указанном лечении. Например, субъекту можно ввести эффективную дозу соединения формулы (I) или его фармацевтически приемлемой соли или пролекарства. Нарушение может быть связано с гиперфункцией пуриновых рецепторов. Прежде всего интерес представляют нарушения, при которых блокирование пуриновых рецепторов,прежде всего рецепторов аденозина, предпочтительно рецепторов аденозина A2A, может оказывать ле-8 018803 чебное действие. Указанные нарушения включают нарушения движения, такие как болезнь Паркинсона,индуцированный лекарственным средством паркинсонизм, постэнцефалитический паркинсонизм, паркинсонизм, индуцированный отравлением (например, MIP (воспалительным белком макрофагов), марганцем, монооксидом углерода) или посттравматическую болезнь Паркинсона (синдром заторможенности от постоянных травм). Другие нарушения движений, при которых блокирование пуриновых рецепторов может оказывать лечебное действие, включают прогрессирующий надъядерный паралич, болезнь Гентингтона, множественную системную атрофию, кортикобазальную дегенерацию, болезнь Уилсона, болезнь ГаллерворденаШпатца, прогрессирующий паллидарный синдром, допа-чувствительную дистонию-паркинсонизм, мышечную спастичность или другие нарушения базального ганглия, которые приводят к аномальному движению или позе. Настоящее изобретение также является эффективным при лечении болезни Паркинсона с феноменом "включения-выключения", болезни Паркинсона с "феноменом застывания" (ухудшения состояния к концу действия дозы) и болезни Паркинсона с выраженной дискинезией. Соединения формулы (I) можно применять или вводить в комбинации с одним или более других лекарственных средств, пригодных для лечения нарушений движения, таких как L-допа или агонист допамина, причем компоненты могут находиться в одном составе или в различных составах для одновременного или последовательного введения. Другие нарушения движений, при которых блокирование пуриновых рецепторов, прежде всего рецепторов аденозина, предпочтительно рецепторов аденозина A2A, может оказывать лечебное действие,включают острую или хроническую боль, например невропатическую боль, боль при онкологических заболеваниях, невралгию тройничного нерва, мигрень и другие состояния, связанные с головной болью,первичную или вторичную гипералгезию, воспалительную боль, ноцицептивную боль, сухотку спинного мозга, фантомную боль в ампутированных конечностях, боль при повреждении спинного мозга, центральную боль, пост-герпетическую боль и боль при ВИЧ, аффективные расстройства, включая нарушения настроения, такие как биполярные расстройства, сезонные аффективные расстройства, депрессию,маниакальную депрессию, атипическую депрессию и монодепрессивное заболевание, дегенеративные нарушения центральной и периферической нервной системы, включая кортикобазальную дегенерацию,демиелинизирующее заболевание (рассеянный склероз, множественный склероз), атаксию Фридриха,мотонейронное заболевание (боковой амиотрофический склероз, прогрессирующую бульбарную атрофию), множественную системную атрофию, миелопатию, радикулопатию, периферическую невропатию(диабетическую невропатию, сухотку спинного мозга, индуцированную лекарственным средством невропатию, авитаминоз), системную красную волчанку, грануломатоз, оливопонтоцеребеллярную атрофию, прогрессирующий паллидарный синдром, прогрессирующий надъядерный паралич, спастичность,шизофрению и связанные с ней психозы, когнитивные нарушения, включая деменцию, болезнь Альцгеймера, лобно-височную деменцию, мультиинфарктную деменцию, деменцию, ассоциированную со СПИДом, деменцию, ассоциированную с болезнью Гентингтона, деменцию, ассоциированную с тельцами Леви, сенильную деменцию, возрастные нарушения памяти, когнитивных способностей, ассоциированные с деменцией, синдром Корсакова, деменция с позой гладиатора, нарушения внимания, такие как СДВП, дефицит внимания, минимальная мозговая дисфункция, синдром поврежденного мозга у детей,гиперкинетический синдром у детей, синдром гиперактивности у детей, повреждение центральной нервной системы, включая травматическое повреждение мозга, хирургическое повреждение мозга, нейрозащита травмы головы, повышенное внутричерепное давление, отек мозга, водянка головного мозга, повреждение спинного мозга, ишемия головного мозга, включая транзиторную ишемическую атаку, инсульт (тромботический инсульт, ишемический инсульт, эмболический инсульт, гемморагический инсульт, лакунарный инсульт), субарахноидальное кровоизлияние, спазм сосудов головного мозга, нейрозащита при инсульте, перинатальная асфиксия, утопление, остановка сердца, субдуральная гематома,ишемия миокарда, мышечная ишемия, нарушения сна, такие как повышенная сонливость и нарколепсия,глазные нарушения, такие как ишемия-повреждение сетчатки в результате реперфузии и диабетическая невропатия, сердечно-сосудистые нарушения, такие как перемежающаяся хромота и гипотензия, и диабет и его осложнения. Способы синтеза Соединения формулы (I) можно получать по стандартным методикам. Например, соединения формулы (I) можно синтезировать способом, который указан на схеме 1. На схеме 1R обозначает -(CRaRb)-OR2. Соединения формулы (4) получают из соединений формулы (3) стандартными методами, такими как взаимодействие с пригодным алкилгалогенидом, или замещенным алкилгалогенидом (например,арилалкилгалогенидом) в присутствии пригодного основания, такого как гидрид натрия. Соединения формулы (3) получают из известного хлорпроизводного формулы (2) стандартными методами, такими как фенильная или гетероарильная реакции конденсации. Пригодные фенильная или гетероарильная реакции конденсации включают реакции с соответствующим фенил- или гетероарилпроизводными бороновой кислоты, производными фенил- или гетероарилтриалкилолова или производными фенил- или гетероарилцинкгалогенидов в присутствии пригодного катализатора, такого как палладиевый комплекс. Соединения формулы (3) также можно получить из соединений формулы (7) стандартными методами, такими как обработка изоамилнитритом или нитритом натрия. Соединения формулы (7) описаны в литературе или их можно получить из соединений формулы (6) стандартными методами, такими как восстановление водородом в присутствии пригодного катализатора, такого как Pd. Соединения формулы (6) описаны в литературе или их можно получить из соединений формулы (5) стандартными методами, такими как фенильная или гетероарильная реакции конденсации, как описано выше. Соединения формулы (I) также можно получить стандартными методами, показанными на схеме 2. На указанной схеме R обозначает -(CRaRb)-O-R2. Схема 2 Соединения формулы (4) можно получить из соединений формулы (10) стандартными методами,такими как фенильная или гетероарильная реакции конденсации, как описано выше. Соединения формулы (10) можно получить методами, аналогичными описанным в литературе. Например, соединения формулы (10) можно получить из соединений формулы (9) стандартными методами, такими как обработка изоамилнитритом или нитритом натрия. Соединения формулы (9) можно получить методами, описанными в литературе, такими как обработка соединения формулы (8) соответствующим амином в пригодном растворителе при повышенной температуре. Соединения формулы (10) можно также получить по модифицированной методике, показанной на схеме 2, причем 5-аминогруппа в соединении (8) защищена, как показано на схеме 2 А. На указанной схеме R обозначает -(CRaRb)-O-R2, a PG обозначает защитную группу. Схема 2 А Соединения формулы (10) можно получить из соединений формулы (9 А) стандартными методами,такими как обработка изоамилнитритом или нитритом натрия. Соединения формулы (9 А) можно получить при обработке соединения формулы (8 А) соответствующим амином в пригодном растворителе при повышенной температуре. Соединения формулы (I) можно получить стандартными методами, как показано на схеме 3. На указанной схеме R обозначает -(CRaRb)-O-R2. Схема 3 Соединения формулы (4) можно получить из соединений формулы (15) стандартными методами,такими как обработка изоамилнитритом. Соединения формулы (15) можно получить из соединений формулы (14) стандартными методами, такими как восстановление водородом в присутствии пригодного катализатора, такого как Pd. Соединения формулы (14) можно получить из соединений формулы (13), гдеX обозначает пригодную уходящую группу, такую как тозилат или трифлат, стандартными методами,такими как обработка соответствующим амином в присутствии пригодного основания, такого как триэтиламин. Соединения формулы (13), где X обозначает пригодную уходящую группу, описаны в литературе или их можно получить из соединений формулы (12) стандартными методами, такими как обработка тозилхлоридом или трифторметансульфоновым ангидридом в присутствии пригодного основания,такого как триэтиламин или 2,6-диметилпиридин. Соединения формулы (12) описаны в литературе или их можно получить из соединений формулы (11) стандартными методами, такими как фенильная или гетероарильная реакции конденсации, как описано выше. Соединения формулы (I) можно использовать в форме фармацевтически приемлемых солей неорганических или органических кислот и оснований. Соли кислот включают ацетат, адипат, альгинат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, цитрат, камфорат, камфорсульфонат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, фумарат, глюкогептаноат, глицерофосфат, полусульфат, гептаноат, гексаноат, гидрохлорид, гидробромид, гидроиодид, 2-гидроксиэтансульфонат,лактат, малеат, метансульфонат, 2-нафталинсульфонат, никотинат, оксалат, памоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, сукцинат, тартрат, тиоцианат, тозилат и ундеканоат. Соли оснований включают соли аммония, соли щелочных металлов, такие как соли натрия и калия, соли щелочно-земельных металлов, такие как соли кальция и магния, соли органических оснований, такие как соли дициклогексиламина, N-метил-D-глюкамина, и соли аминокислот, такие как соли аргинина, лизина и т.д. Кроме того, основные азотсодержащие группы могут образовывать четвертичные производные при взаимодействии с такими агентами, как низшие алкилгалогениды, такие как метил-, этил-, пропил- и бутилхлориды, бромиды и иодиды, диалкилсульфаты, такие как диметил-, диэтил-, дибутил- и диамилсульфаты, галогениды с длинной цепью, такие как децил-, лаурил-, миристил- и стеарилхлориды, бромиды и иодиды, аралкилгалогениды, такие как бензил- и фенетилбромиды и т.п. В объем изобретения также включены растворимые или диспергируемые продукты в воде или масле. Соединение можно включать в фармацевтические композиции, которые можно вводить пероральным, парентеральным способом, ингаляцией спреем, местным способом, ректальным, назальным, трансбуккальным, вагинальным способом или с использованием имплантированного резервуара. Термин "парентеральный", как использовано в данном контексте, включает подкожную, внутривенную, внутримышечную, внутрисуставную, внутрисиновиальную, надчревную, интратекальную, внутрипеченочную,введение внутрь пораженных тканей и внутричерепную инъекцию или вливание. Фармацевтические композиции включают соединение формулы (I) или его фармацевтически приемлемые производные, в смеси с фармацевтически приемлемым носителем. Термин "носитель", как использовано в данном контексте, включает приемлемые адъюванты и наполнители. Фармацевтически приемлемые носители, которые можно использовать в фармацевтических композициях по настоящему изобретению, включают, но не ограничиваясь только ими, ионообменные смолы, оксид алюминия, стеарат алюминия, лецитин, сывороточные белки, такие как сывороточный альбумин, буферные вещества,такие как фосфаты, глицин, сорбиновую кислоту, сорбат калия, смеси частичных глицеридов насыщенных жирных кислот растительного происхождения, воду, соли или электролиты, такие как сульфат протамина, гидрофосфат динатрия, гидрофосфат калия, хлорид натрия, соли цинка, коллоидный диоксид кремния, трисиликат магния, поливинилпирролидон, производные целлюлозы, полиэтиленгликоль, натриевая соль карбоксиметилцеллюлозы, полиакрилаты воски, блок-сополимеры полиэтилена и полиоксипропилена, полиэтиленгликоль и ланолин. Фармацевтические композиции могут представлять собой стерильные инъекционные препараты,например стерильные инъекционные водные или масляные суспензии. Суспензию можно получать по стандартным методикам с использованием пригодных диспергирующих или смачивающих агентов и суспендирующих агентов. Стерильный инъекционный препарат может также представлять собой стерильный инъекционный раствор или суспензию в нетоксичном парентерально приемлемом разбавителе или растворителе, например раствор в 1,3-бутандиоле. Приемлемые наполнители и растворители включают воду, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды обычно используют стерильные нелетучие масла. Для этих целей можно использовать любое успокаивающее нелетучее масло, включая синтетические моно- или диглицериды. Для получения инъекционных препаратов можно использовать жирные кислоты, такие как олеиновая кислота и ее глицериды, а также природные фармацевтически приемлемые масла, такие как оливковое масло или касторовое масло, прежде всего в их полиоксиэтилированной форме. Указанные масляные растворы или суспензии могут также содержать спиртовой разбавитель или диспергирующий агент с длинной цепью. Фармацевтические композиции можно вводить перорально в любой перорально приемлемой лекарственной форме, включая, но не ограничиваясь только ими, капсулы, таблетки, водные суспензии или растворы. В случае таблеток для перорального применения используют стандартные носители, включая лактозу и кукурузный крахмал. Обычно также добавляют смазывающие вещества, такие как стеарат магния. Разбавители, пригодные для перорального введения в форме капсул, включают лактозу и сухой кукурузный крахмал. Если для перорального введения требуются водные суспензии, активный ингредиент смешивают с эмульгирующими и суспендирующими агентами. При необходимости также добавляют некоторые подсластители, ароматизаторы или красители. В другом варианте фармацевтические композиции можно вводить в форме суппозиториев для ректального введения. Их можно получить при смешивании агента с пригодным нераздражающим эксципиентом, который является твердым при КТ, но жидким при ректальной температуре, и будет расплавляться в прямой кишке, высвобождая лекарственное средство. Указанные материалы включают масло какао,пчелиный воск и полиэтиленгликоль. Фармацевтические композиции можно вводить местным способом, прежде всего если мишень лечения включает поверхность или орган, доступные для местного введения, включая заболевания глаз,кожи или нижний отдел кишечного тракта. Соответствующие составы для местного введения можно получать в виде состава, предназначенного для каждого из указанных органов или поверхностей. Для эффективного местного введения в нижний отдел кишечного тракта можно использовать ректальный суппозиторий (см. выше) или пригодный состав для клизмы. Можно также использовать чрескожные пластыри для местного введения. Фармацевтические композиции для местного введения можно получать в виде пригодных мазей,- 12018803 содержащих активный компонент, суспендированный или растворенный в одном или более носителях. Носители для местного введения соединений по настоящему изобретению включают, но не ограничиваясь только ими, минеральное масло, вазелиновое масло, медицинский вазелин, пропиленгликоль, полиоксиэтилен, соединение полиоксипропилена, эмульгированный воск и воду. В другом варианте фармацевтические композиции можно получать в виде пригодных лосьонов или кремов, содержащих активный компонент, суспендированный или растворенный в одном или более фармацевтически приемлемых носителях. Приемлемые носители включают, но не ограничиваясь только ими, минеральное масло, моностеарат сорбита, полисорбат 60, цетиловый эфир воска, цетилариловый спирт, 2-октилдодеканол, бензиловый спирт и воду. Фармацевтические композиции для офтальмологического применения можно получать в виде микронизированных суспензий в стерильном физиологическом растворе при изотоническом рН, или предпочтительно в виде растворов в стерильном физиологическом растворе при изотоническом рН, в присутствии или отсутствие консервантов, таких как хлорид бензилалкония. В другом варианте фармацевтические композиции для офтальмологического применения можно получать в виде мази, такой как вазелин. Фармацевтические композиции можно также вводить в виде назальных аэрозолей или ингаляций с применением распылителя, ингалятора для сухих порошков или ингалятора, отмеряющего определенную дозу. Указанные композиции получают по методикам, известным специалистам в данной области техники, в виде растворов в физиологическом растворе, с использованием бензилового спирта или других пригодных консервантов, активаторов всасывания для увеличения биодоступности, фторуглеродов и/или других соответствующих солюбилизирующих или диспергирующих агентов. Количество активного ингредиента, который смешивают с материалом носителя для получения единой стандартной лекарственной формы, в значительной степени зависит от пациента, нуждающегося в лечении, и от конкретного способа введения. Следует понимать, что конкретные дозы и курс лечения любого пациента зависит от различных факторов, включая активность используемого соединения, возраст, массу тела, общее состояние здоровья, пол, диету, время введения, скорость выведения, лекарственную комбинацию, а также мнение лечащего врача и тяжесть конкретного заболевания, подлежащего лечению. Количество активного ингредиента может также зависеть от совместно вводимого терапевтического или профилактического агента. Фармацевтическая композиция может включать эффективное количество соединения формулы (I). Эффективное количество определяется как количество, требуемое для достижения терапевтического эффекта у проходящего курс лечения пациента, и оно зависит от ряда факторов, таких как вид ингибитора,размер пациента, цель лечения, природа патологии, требующей лечения, применяемая фармацевтическая композиция и мнение лечащего врача. См. статьи Freireich и др., Cancer Chemother. Rep. 50, 219 (1966) иScientific Tables, Geigy Pharmaceuticals, Ardley, N.Y., 537 (1970). Пригодные дозы активного ингредиента составляют от приблизительно 0,001 до приблизительно 100 мг/кг массы тела в сутки, предпочтительно от приблизительно 0,1 до приблизительно 10 мг/кг массы тела в сутки. Следующие примеры приведены только для иллюстрации настоящего изобретения и не ограничивают его объем. Примеры Пример 1. S-7-(5-Метилфуран-2-ил)-3-(6-[тетрагидрофуран-3-ил]оксиметилпирид-2-илметил)-3H[1,2,3]триазоло[4,5-d]пиримидин-5-амин. 2-Амино-6-хлор-5-нитро-4-пиримидинол. Концентрированную серную кислоту (250 мл, 5 об.) перемешивали в круглодонной колбе объемом 1000 мл при 22 С и порциями добавляли 2-амино-6-хлор-4-пиримидинол (50 г). При добавлении первых порций температура быстро увеличивалась до 40 С. При добавлении следующих порций температура увеличивалась медленнее, достигая максимум приблизительно 45 С. Перед добавлением дымящей азотной кислоты (45 мл, 0,9 об.) смесь охлаждали на ледяной бане до 20 С, затем порциями примерно по 1,5 мл (вытесняющий объем пипетки) азотную кислоту добавляли по каплям с постоянной скоростью (приблизительно 1 капля в 1 мин). При добавлении первых порций происходила сильная экзотермическая реакция, при этом температура смеси достигала приблизительно 26 С, затем смесь охлаждали до 20 С на ледяной бане. Затем при добавлении следующих порций степень экзотермической реакции снижалась,при этом температуру поддерживали на уровне приблизительно до 21 С. После добавления 45 мл дымящей азотной кислоты смесь перемешивали в течение 2 ч (в этот период ледяную баню удаляли и температура достигала КТ приблизительно 22 С). Полученную смесь при перемешивании выливали в смесь лед/вода (1200 мл) и полученное твердое вещество желтого цвета отделяли фильтрованием в вакууме. Продукт последовательно промывали водой (600 мл), этанолом (600 мл) и диэтиловым эфиром (600 мл),при этом получали требуемый нитропиримидинол (63,5 г, выход 98%). 2-Амино-6-(5-метил-2-фурил)-5-нитро-4-пиримидинол (12). Двухфазную смесь тетрагидрофурана (1100 мл, 22 об.) и водного раствора карбоната натрия (550 мл, 11 об.) перемешивали в трехгорлой круглодонной колбе объемом 3000 мл при 22 С, затем порциями добавляли 2-амино-6-хлор-5-нитро-4-пиримидинол (11). Полученный раствор желтого цвета обрабатывали раствором 5-метилфуран-2-бороновой кислоты в приблизительно 30 мл ТГФ (0,43 моль, получали из 2 экв. 2-метилфурана), затем добавляли тетракис(трифенилфосфин)палладий(0) (5%, 0,0072 моль, 8,32 г) и реакционную смесь нагревали при 70 С в течение 3 ч. Реакционную смесь охлаждали до 22 С, при этом наблюдалось видимое небольшое помутнение смеси. Смесь фильтровали и фильтрат упаривали в вакууме для удаления тетрагидрофурана, при этом получали щелочную водную фазу. В смесь добавляли этилацетат (1000 л, 20 об.) и интенсивно перемешивали в течение 15 мин (на этой стадии продукт отмывали от нейтральных примесей, прежде всего от трифенилфосфиноксида). Водную и органическую фазы разделяли и органическую фазу снова экстрагировали водным раствором карбоната натрия (800 мл). Объединенные водные фазы охлаждали на ледяной бане и подкисляли (добавляли по каплям HCl) до рН 7. Полученный осадок ярко-желтого цвета отделяли фильтрованием в вакууме, промывали водой и сушили при 40 С, при этом получали требуемый продукт (37,8 г, 67%). 5-Метилфуран-2-бороновая кислота. В трехгорлой колбе объемом 2000 мл перемешивали безводный тетрагидрофуран (1000 мл, 25 об.) при 22 С в атмосфере азота, затем добавляли 2-метилфуран (41,16 мл, 0,43 моль) и N,N,N'N'тетраметилэтилендиамин (65 мл, 0,43 моль, 1 экв.). Раствор охлаждали до -78 С и по каплям обрабатывали н-бутиллитием (1 экв. 172 мл, 2,5 М раствор в гексане). Полученный раствор перемешивали при -78 С в течение 15 мин, затем медленно нагревали до 22 С. Раствор повторно охлаждали до -78 С, по каплям добавляли триметилборат (2 экв. 0,86 моль, 96,4 мл) и снова медленно нагревали до 22 С. Гидролиз вновь образовавшегося эфира бороновой кислоты проводили при добавлении смеси метанол/вода (9:1,280 мл). Через 15 мин раствор упаривали в вакууме, при этом получали твердое вещество желто-белого цвета. Для завершения гидролиза твердое вещество переносили в дополнительное количество метанола(100 мл) и упаривали в вакууме четыре раза, при этом получали неочищенный остаток темно-оранжевого цвета. Указанный остаток переносили в ТГФ (приблизительно 30 мл) и использовали непосредственно в реакции конденсации Сузуки, описанной выше - исходное количество использованного 2-метилфурана соответствовало 2 экв. исходного материала пиримидинола. 4-(5-Метил-2-фурил)-5-нитро-6-(паратолуолсульфонилокси)пиримидин-2-амин (13). Суспензию 2-амино-6-(5-метил-2-фурил)-5-нитро-4-пиримидинола (12) (20,96 г, 0,089 моль) в сухом ацетонитриле (800 мл, 40 об.) в высушенной на пламени трехгорлой колбе при 22 С при перемешивании обрабатывали триэтиламином (27,24 мл, 0,196 моль, 2,2 экв.). Полученная соль триэтиламина (нерастворимая в реакционном растворе) выпадала в виде вязкого осадка желтого цвета. Полученную смесь нагревали до температуры 50 С и порциями добавляли паратолуолсульфонилхлорид (18,57 г, 0,097 моль,1,1 экв.). Осадок желтого цвета быстро превращался в раствор темно-оранжево-коричневого цвета. Перемешивание продолжали при 50 С в течение еще 3,5 ч, завершение реакции контролировали по данным анализа МС-ЖХ и ТСХ (элюент: EtOAc/изогексан, 1:1). Реакционную смесь охлаждали до 22 С и упаривали в вакууме, при этом получали твердое вещество светло-коричневого цвета. Полученное твердое вещество растворяли в дихлорметане (800 мл, 40 об.) и дважды промывали 1,2 М водным раствором соляной кислоты. Органическую фракцию сушили над сульфатом магния и упаривали в вакууме, при этом получали твердое вещество кремового цвета. При растирании в толуоле эффективно удаляли избыток тозилхлорида, при этом получали требуемый продукт тозилат (соединение 13) в виде твердого вещества грязно-белого цвета, сушили при 40 С, получали 22,33 г (выход 65%).(S)-6-(Тетрагидрофуран-3-ил)оксиметил]пиридин-2-илметиламино-4-(5-метил-2-фурил)-5 нитропиримидин-2-амин. Раствор 4-(5-метил-2-фурил)-5-нитро-6-(паратолуолсульфонилокси)пиримидин-2-амина (13) (26,3 г,0,067 моль) в сухом диметоксиэтане (1100 мл, 40 об.) при перемешивании в закрытой высушенной на пламени трехгорлой колбе обрабатывали раствором (S)-6-(тетрагидрофуран-3-илоксиметил)-2 пиридинметанамина в сухом DME (16,72 г, 0,080 моль, 1,2 экв.). Полученный раствор затем обрабатывали триэтиламином (27,96 мл, 0,201 моль, 3 экв.) и нагревали до температуры 50 С. Через 18 ч по данным анализа МС-ЖХ реакция завершалась приблизительно на 90% (по данным ТСХ (элюент:EtOAc/изогексан, 1:1), в смеси присутствовал остаток исходного материала, после добавления дополнительного количества триэтиламина и проведения реакции в течение дополнительного времени выход продукта не повышался). Реакционную смесь охлаждали до 22 С и выливали в 1,25 М водный раствор соляной кислоты (1200 мл), добавляли этилацетат (1000 мл) и смесь интенсивно перемешивали в течение 15 мин. Водную фазу отделяли и нейтрализовали при добавлении 2 М водного раствора карбоната натрия. Полученный осадок ярко-желтого цвета отделяли фильтрованием, промывали водой и сушили при 40 С, при этом получали требуемый продукт (24,61 г, выход 86%).(S)-3-6-(Тетрагидрофуран-3-ил)оксиметил]пиридин-2-илметил-7-(5-метил-2-фурил)-3H[1,2,3]триазоло[4,5-d]пиримидин-5-иламин. В суспензию (S)-6-(тетрагидрофуран-3-ил)оксиметил]пиридин-2-илметиламино-4-(5-метил-2 фурил)-5-нитропиримидин-2-амина (4) (24 г, 0,056 моль) в этаноле (900 мл, 37 об.) при перемешивании добавляли оксид платины (IV) (кристаллич., 1,27 г, 0,0056 моль, 10%-экв.). Колбу тщательно вакуумировали и заполняли водородом. Колбу выдерживали при 22 С в течение 18 ч, при этом исходная суспензия материала превращалась в темный раствор триамина (по данным ТСХ и 1 Н ЯМР). Полученный раствор фильтровали через слой целита и фильтрат подкисляли при добавлении конц. HCl (30 мл). Подкислен- 14018803 ный раствор охлаждали до 0 С и по каплям обрабатывали водным раствором нитрита натрия (15,46 г,0,224 моль, 4 экв., 60 мл H2O), затем перемешивали при 0 С в течение 2 ч. Реакционную смесь подщелачивали при добавлении насыщенного водного раствора бикарбоната натрия (рН приблизительно 8). Этанол удаляли в вакууме, при этом продукт выпадал в осадок из полученной водной фракции. Твердое вещество светло-коричневого цвета отделяли фильтрованием, сушили при 40 С, при этом получали указанное в заголовке соединение (20,62 г, выход 90%) с чистотой приблизительно 95%. Пример 1 А. S-7-(5-Метилфуран-2-ил)-3-(6-тетрагидрофуран-3-ил]оксиметилпирид-2-илметил)-3H[1,2,3]триазоло[4,5-d]пиримидин-5-амин, альтернативный метод синтеза.(S)-2-Бромметил-6-(тетрагидрофуран-3-илоксиметил)пиридин. Указанное в заголовке соединение (выход 24%) получали из 2,6-бис(бромметил)пиридина и (S)тетрагидрофуран-3-ола при алкилировании аналогично тому, как описано на конечной стадии в примере 32. (М+Н)+ 272, 274. 1 Н ЯМР Н (400 МГц, CDCl3): 7,70 (1 Н, t, J=7,5 Гц), 7,39 (1 Н, d, J=7,5 Гц), 7,34 (1H, d, J=7,5 Гц),4,67-4,59 (2 Н, m), 4,52 (2 Н, s), 4,31-4,26 (1 Н, m), 3,98-3,81 (4 Н, m), 2,11-1,99 (2 Н, m).(S)-3-6-(Тетрагидрофуран-3-ил)оксиметил]пиридин-2-илметил-7-(5-метил-2-фурил)-3H[1,2,3]триазоло[4,5-d]пиримидин-5-иламин. Указанное в заголовке соединение получали из 7-(5-метил-2-фурил)-1 Н-[1,2,3]триазоло[4,5d]пиримидин-5-иламина и (S)-2-бромметил-6-(тетрагидрофуран-3-илоксиметил)пиридина при алкилировании, аналогично тому, как описано в примере 36. (М+Н)+ 408. tпл. 207,4-207,8 С. 1 Н ЯМР Н (400 МГц, ДМСО): 7,88 (1 Н, d, J=3,5 Гц), 7,78 (1H, t, J=8,0 Гц), 7,35 (1 Н, d, J=8,0 Гц),7,27 (2 Н, ушир.s), 7,05 (1H, d, J=8,0 Гц), 6,52-6,50 (1 Н, m), 5,74 (2 Н, s), 4,51-4,44 (2 Н, m), 4,23-4,20 (1 Н,m), 3,76-3,61 (4H, m), 2,46 (3H, s), 1,94-1,89 (2H, m). ИК max (DR)/см-1: 3514, 3294, 3170, 2938, 2868, 1631, 1609, 1576, 1540, 1498, 1459 и 1431. Элементный анализ: рассч. для C16H15N7O + 2 HCl +1,5 Н 2 О, С 45,62, Н 4,79, N 23,27. Найд. С 45,63,Н 4,71, N 23,14.(R)-3-6-(Тетрагидрофуран-3-ил)оксиметил]пиридин-2-илметил-7-(5-метил-2-фурил)-3H[1,2,3]триазоло[4,5-d]пиримидин-5-иламин. Указанное в заголовке соединение получали из 7-(5-метил-2-фурил)-1 Н-[1,2,3]триазоло[4,5d]пиримидин-5-иламина и (R)-2-бромметил-6-(тетрагидрофуран-3-илоксиметил)пиридина при алкилировании, аналогично тому, как описано в примере 36. (М+Н)+ 408. tпл. 169,7-170,6 С. 1H ЯМР Н (400 МГц, ДМСО): 7,88 (1 Н, d, J=3,5 Гц), 7,78 (1 Н, t, J=8,0 Гц), 7,35 (1 Н, d, J=8,0 Гц),7,27 (2 Н, ушир.s), 7,05 (1 Н, d, J=8,0 Гц), 6,52-6,50 (1 Н, m), 5,74 (2 Н, s), 4,51-4,44 (2 Н, m), 4,23-4,20 (1 Н,m), 3,76-3,61 (4 Н, m), 2,46 (3H, s), 1,94-1,89 (2 Н, m). ИК max (DR)/см-1: 3514, 3294, 3171, 2940, 2867, 1632, 1574, 1540, 1496, 1457 и 1431. Пример 1 В. S-7-(5-Метилфуран-2-ил)-3-(6-[тетрагидрофуран-3-ил]оксиметилпирид-2-илметил)-3H[1,2,3]триазоло[4,5-d]пиримидин-5-амин, альтернативный метод синтеза. 2-Хлорметилпиридин. Гидрохлорид 2-хлорметилпиридина (120 г, 0,732 моль, 1 экв.) растворяли в деминерализованной воде (500 мл). В полученный раствор небольшими порциями добавляли твердый NaHCO3 (67,60 г, 0,805 моль, 1,1 экв.) и смесь перемешивали до полного прекращения выделения газа. Свободное основание экстрагировали этилацетатом (2800 мл), объединенные экстракты промывали насыщенным солевым раствором (300 мл) и упаривали, при этом получали указанное в заголовке соединение (90,43 г, 97%) в виде масла красного цвета.(S)-2-(Тетрагидрофуран-3-илоксиметил)пиридин. В трехгорлую колбу в атмосфере азота через трубку добааляли безводный ТГФ (600 мл). NaH (60% дисперсия в минеральном масле, 21,16 г, 0,529 моль, 1,5 экв.), суспендировали в растворителе при интенсивном перемешивании, добавляли (S)-(+)-3-гидрокситетрагидрофуран (34,14 г, 0,388 моль, 1,1 экв.) и перемешивали при КТ в течение 30 мин. В полученную смесь добавляли неразбавленный 2 хлорметилпиридин (1 а, 45,00 г, 0,353 моль, 1 экв.) и смесь кипятили с обратным холодильником при перемешивании в течение 16 ч. Реакционную смесь охлаждали до КТ и реакцию останавливали при добавлении насыщенного водного раствора хлорида аммония (520 мл). ТГФ удаляли при пониженном давлении и водный остаток экстрагировали этилацетатом (2800 мл). Объединенные органические экстракты промывали насыщенным солевым раствором (250 мл), сушили над Na2SO4 и упаривали досуха. Маслообразный остаток коричневого цвета переносили в ацетонитрил (520 мл) и остальное минеральное масло экстрагировали гексаном (330 мл). Ацетонитрил упаривали в вакууме, при этом получали остаток коричневого цвета (выход 87%). МС-ЖХ: (М+Н)+ 180, в.у. 1,22 мин.(900 мл) и охлаждали на ледяной бане. В полученный раствор добавляли 3-хлорпероксибензойную кислоту (151,77 г, 0,677 моль, 1,1 экв.), раствор нагревали до КТ и перемешивали в течение ночи, затем добавляли твердый K2CO3 (85,09 г, 0,616 моль, 1 экв.) и перемешивали в течение 2 ч. Осадок белого цве- 15018803 та отделяли фильтрованием и осадок на фильтре промывали дихлорметаном. Другую порцию K2CO3(85,09 г, 0,616 моль, 1 экв.) добавляли в фильтрат и перемешивали в течение трех суток. Твердое вещество белого цвета отделяли фильтрованием и фильтрат упаривали, при этом получали указанное в заголовке соединение в виде масла желтого цвета (119,62 г, 99%). МС-ЖХ: (М+Н)+ 196, в.у. 1,27 мин.(S)-2-(Тетрагидрофуран-3-илоксиметил)пиридин-1-оксид (24,08 г, 0,123 моль, 1 экв.) растворяли в безводном ДХМ (400 мл), добавляли N,N-диметилкарбамилхлорид (19,89 г, 0,185 моль, 1,5 экв.) и триметилсилилцианид (18,35 г, 0,185 моль, 1,5 экв.). Раствор перемешивали при 40 С в течение 24 ч (при этом получали раствор красного цвета). Реакционную смесь охлаждали до КТ, затем добавляли 2 М водный раствор Na2CO3 (80 мл) и перемешивали в течение ночи. Эмульсию фильтровали, при этом получали осадок белого цвета. Слои разделяли и органический слой упаривали, при этом получали масло коричневого цвета. Полученное масло растворяли в этилацетате (160 мл), добавляли 2 М водный раствор Na2CO3(160 мл) и перемешивали в течение 2 ч. Слои разделяли и органический слой промывали насыщенным солевым раствором (30 мл), сушили над Na2CO4 и упаривали, при этом получали масло коричневого цвета. МС-ЖХ: (М+Н) 205, в.у. 1,82 мин.(S)-6-(Тетрагидрофуран-3-илоксиметил)пиридин-2-карбонитрил (0,206 моль, 1 экв.) добавляли в боран (1M в ТГФ, 290 мл, 0,290 моль, 3 экв.) при 0 С в атмосфере азота. Реакционную смесь нагревали с обратным холодильником в течение 5 ч, охлаждали до КТ и реакцию останавливали при добавлении метанола (100 мл) (экзотермическая реакция), смесь упаривали. В объединенные остатки добавляли 2 М водный раствор HCl (310 мл), (рН 1), затем рН доводили до 7 при добавлении 5 М NaOH (35 мл). Водную смесь экстрагировали дихлорметаном (2500 мл). Органические экстракты отбрасывали. Водную фазу доводили до рН 14 при добавлении 5 н. NaOH (100 мл) и экстрагировали ДХМ (21000 мл). Объединенные органические экстракты (из щелочного раствора) промывали насыщенным солевым раствором (100 мл), сушили над Na2SO4 и упаривали, при этом получали указанное в заголовке соединение (50,70 г, 39% в расчете на 2 стадии) в виде масла янтарного цвета. МС-ЖХ: (М+Н) 205, в.у. 0,62 мин. Пример 2. 7-(5-Метилфуран-2-ил)-3-(6-[1-гидрокси-1-метилэтил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин. Указанное в заголовке соединение получали из 7-(5-метил-2-фурил)-1 Н-[1,2,3]триазоло[4,5d]пиримидин-5-амина и 2-(6-бромметилпиридин-2-ил)пропан-2-ола при алкилировании, аналогично тому, как описано в примере 36. (М+Н)+ 366. 1 Н ЯМР Н (400 МГц, ДМСО): 7,88 (1 Н, d, J=3,5 Гц), 7,74 (1 Н, t, J=8,0 Гц), 7,54 (1H, d, J=8,0 Гц),7,30 (2 Н, ушир.s), 6,95 (1H, d, J=8,0 Гц), 6,52-6,51 (1 Н, m), 5,76 (2 Н, s), 5,15 (1 Н, s), 2,46 (3H, s), 1,27 (6 Н,s). ИК max (DR)/см-1: 3487, 3335, 3120, 2974, 2926, 1517, 1540, 1491 и 1418. Пример 3. 7-(5-Метилфуран-2-ил)-3-(6-[1-гидрокси-1-циклопентил]пирид-2-илметил)-3H-[1,2,3] триазоло[4,5-d]пиримидин-5-амин. 2-(1-Гидрокси-1-циклопентил)пиридин. Указанное в заголовке соединение получали из 2-бромпиридина и циклопентанона аналогично тому, как описано в примере 10. 2-(1-Гидрокси-1-циклопентил)пиридин-N-оксид. Указанное в заголовке соединение получали из 2-(1-гидрокси-1-циклопентил)пиридина аналогично тому, как описано выше в примере 10. (М+Н)+ 180. 1H ЯМР Н (400 МГц, CDCl3): 1,68-1,78 (2 Н, m), 1,96-2,06 (4 Н, m), 2,26-2,35 (2 Н, m), 7,14 (1 Н, s),7,24 (1 Н, dd, J=6,5 Гц, 2,0 Гц), 7,32-7,41 (2 Н, m), 8,26 (1 Н, dd, J=6,0 Гц, 1,0 Гц). 6-(1-Гидрокси-1-циклопентил)пиридин-2-карбонитрил. Указанное в заголовке соединение получали из 2-(1-гидрокси-1-циклопентил)пиридин-N-оксида аналогично тому, как описано выше в примере 10. 1 Н ЯМР Н (400 МГц, CDCl3): 1,74-1,94 (6 Н, m), 2,15-2,22 (2 Н, m), 7,49 (1 Н, dd, J=7,5 Гц, 1,5 Гц),7,72-7,80 (2 Н, m). 6-(1-Гидрокси-1-циклопентил)пиридин-2-метанамин. Указанное в заголовке соединение получали из 6-(1-гидрокси-1-циклопентил)пиридин-2 карбонитрила аналогично тому, как описано в примере 10. (М+Н)+ 194. 1 Н ЯМР Н (400 МГц, CDCl3): 1,48 (2 Н, s), 1,66-1,75 (2 Н, m), 1,78-1,92 (6 Н, m), 3,83 (2 Н, s), 5,12 (1 Н,s), 7,01 (1 Н, d, J=7,5 Гц), 7,08 (1 Н, d, J=8,0 Гц), 7,51 (1H, t, J=8,0 Гц).N-(2-Амино-6-хлор-4-[6-(1-гидрокси-1-циклопентил)пиридин-2-метиламино]пиримидин-5 ил)формамид. Указанное в заголовке соединение (0,256 г, 47%) получали в виде порошка кремового цвета из N-(2 амино-4,6-дихлорпиримидин-5-ил)формамида и 6-(1-гидрокси-1-циклопентил)пиридин-2-метанамина аналогично тому, как описано в примере 10. (М+Н)+ 363. 1 Н ЯМР Н (400 МГц, ДМСО): 1,68-1,80 (4 Н, m), 1,81-1,92 (2 Н, m), 2,04-2,12 (2 Н, m), 4,56 (2 Н, d,- 16018803(1 Н, t, J=7,5 Гц), 8,19 (1 Н, s), 9,21 (1 Н, s). 7-Хлор-3-(6-[1-гидрокси-1-циклопентил]пиридин-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин 2-амин. Указанное в заголовке соединение получали из N-(2-амино-6-хлор-4-[6-(1-гидрокси-1 циклопентил)пиридин-2-метиламино]пиримидин-5-ил)формамида аналогично тому, как описано в примере 10. (М+Н)+ 335. 1 Н ЯМР Н (400 МГц, ДМСО): 1,44-1,51 (2 Н, m), 1,55-1,62 (2 Н, m), 1,67-1,76 (4 Н, m), 4,96 (1 Н, s),5,78 (2 Н, s), 7,07 (1 Н, d, J=7,0 Гц), 7,54 (1 Н, d, J=8,5 Гц), 7,61 (2 Н, s), 7,73 (1 Н, t, J=7,5 Гц). 3-(6-[1-Гидрокси-1-циклопентил]пиридин-2-илметил)-7-(5-метил-2-фурил)-3H-[1,2,3]триазоло[4,5d]пиримидин-2-амин. Указанное в заголовке соединение получали из 7-хлор-3-(6-[1-гидрокси-1-циклопентил]пиридин-2 илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-2-амина аналогично тому, как описано в примере 10.(М+Н)+ 392. 1 Н ЯМР Н (400 МГц, ДМСО): 1,47-1,55 (2 Н, m), 1,57-1,63 (2 Н, m), 1,67-1,76 (2 Н, m), 1,80-1,87 (2 Н,m), 2,46 (3H, s), 4,97 (1 Н, s), 5,76 (2 Н, s), 6,50 (1 Н, dd, J=3,5, 1,0 Гц), 6,98 (1H, d, J=7,5 Гц), 7,23 (2 Н, s),7,55 (1 Н, d, J=7,5 Гц), 7,72 (1H, t, J=7,5 Гц), 7,87 (1H, d, J=3,0 Гц). ИК max (DR)/см-1: 3325, 3203, 2959, 2871, 1537, 1504, 1433, 1325, 1206, 1107, 1026 и 794. Пример 4. 7-(5-Метилфуран-2-ил)-3-(6-[1-гидрокси-1-циклогексил]пирид-2-илметил)-3H-[1,2,3] триазоло[4,5-d]пиримидин-5-амин. 1-(6-[трет-Бутилдиметилсилилоксиметил]пиридин-2-ил)-1-циклогексанол. Указанное в заголовке соединение (0,49 г, 15%) получали в виде масла желтого цвета из 6-бром-О(трет-бутилдиметилсилил)-2-пиридинметанола и циклогексанона аналогично тому, как описано в примере 10. 1 Н ЯМР Н (400 МГц, CDCl3): 0,13 (6 Н, s), 0,96 (9 Н, s), 1,61-1,91 (10H, m), 4,82 (2 Н, s), 5,17 (1 Н, s),7,21 (1H, dd, J=8,0 Гц, 1,0 Гц), 7,38 (1 Н, dd, J=7,5 Гц, 1,0 Гц), 7,71 (1H, t, J=7,5 Гц). ТСХ (элюент: гексан/EtOAc, 9:1). Rf =0,30 6-(1-Гидрокси-1-циклогексил)-2-пиридинметанол. Указанное в заголовке соединение (0,35 г, количественный выход) получали в виде масла желтого цвета из 1-(6-[трет-бутилдиметилсилилоксиметил]пиридин-2-ил)-1-циклогексанола аналогично тому, как описано на конечной стадии в примере 27. (М+Н)+ 208. 1H ЯМР Н (400 МГц, CDCl3): 1,67-1,89 (10H, m), 3,73-3,77 (1H, m), 4,78 (2 Н, s), 7,17 (1 Н, d, J=7,5 Гц), 7,34 (1 Н, d, J=8,0 Гц), 7,71 (1 Н, t, J=7,5 Гц). 1-(6-Бромметилпиридин-2-ил)-1-циклогексанол. Указанное в заголовке соединение (0,309 г, 44%) получали в виде масла желтого цвета из 6-(1 гидрокси-1-циклогексил)-2-пиридинметанола при бромировании аналогично тому, как описано в примере 31. (М+Н)+ 270. 1 Н ЯМР Н (400 МГц, CDCl3): 1,62-1,89 (10H, m), 4,55 (2 Н, s), 4,89 (1 Н, s), 7,30 (1H, dd, J=8,0 Гц, 1,0 Гц), 7,34 (1 Н, dd, J=7,5 Гц, 1,0 Гц), 7,71 (1H, t, J=7,5 Гц). 3-(6-[1-Гидрокси-1-циклогексил]пиридин-2-илметил)-7-(5-метил-2-фурил)-3H-[1,2,3]триазоло[4,5d]пиримидин-5-амин. Указанное в заголовке соединение получали из 7-(5-метил-2-фурил)-1 Н-[1,2,3]триазоло[4,5d]пиримидин-5-иламина и 1-(6-бромметилпиридин-2-ил)-1-циклогексанола при алкилировании аналогично тому, как описано в примере 36. 1 Н ЯМР Н (400 МГц, ДМСО): 0,81-0,87 (1 Н, m), 1,02-1,15 (1 Н, m), 1,33-1,43 (4 Н, m), 1,50-1,73 (4 Н,m), 2,46 (3H, s), 4,87 (1H, s), 5,76 (2 Н, s), 6,51 (1 Н, dd, J=3,5, 1,0 Гц), 6,95 (1 Н, d, J=7,5 Гц), 7,29 (2 Н, s),7,53 (1 Н, d, J=8,0 Гц), 7,73 (1 Н, t, J=7,5 Гц), 7,88 (1 Н, d, J=3,5 Гц). ИК max (DR)/см-1: 3321, 3205, 2931, 2857, 1604, 1573, 1537, 1503, 1433, 1326, 1206 и 794. Пример 5. 7-(5-Метилфуран-2-ил)-3-(6-[4-гидрокситетрагидропиран-4-ил]пирид-2-илметил)-3H[1,2,3]триазоло[4,5-d]пиримидин-5-амин. Указанное в заголовке соединение получали из 7-хлор-3-(6-[4-гидрокситетрагидропиран-4 ил]пиридин-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-2-амина и 5-метил-2-фуранбороновой кислоты аналогично тому, как описано в примере 10. (М+Н)+ 408. 1 Н ЯМР Н (400 МГц, ДМСО): 1,39 (2 Н, d, J=12,5), 2,09 (2 Н, dt, J=12,5), 2,45 (3H, s), 3,63-3,73 (4 Н,m), 5,28 (1 Н, s), 5,97 (2 Н, s), 6,49 (1H, d, J=3,5 Гц), 7,03 (2 Н, s), 7,11 (1 Н, d, J=7,5 Гц), 7,63 (1 Н, d, J=7,5 Гц), 7,70 (1 Н, d, J=3,5 Гц), 7,82 (1 Н, t, 7,5 Гц). ИК max (DR/см-1: 3305, 3206, 2956, 1731, 1680, 1622, 1494, 1372, 1226, 1142, 1029 и 792. Пример 6. 7-(5-Метилфуран-2-ил)-3-(6-[1-гидроксициклобутил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин. 4-(6-[1-Гидрокси-1-циклобутил]пиридин-2-метиламино)-6-(5-метил-2-фурил)-5-нитропиримидин-2 амин. Указанное в заголовке соединение (0,14 г, 38%) получали в виде твердого вещества желтого цвета из 6-(5-метил-2-фурил)-5-нитро-4-(паратолуолсульфонилокси)пиримидин-2-амина и 6-(1-гидрокси-1 циклобутил)пиридин-2-метанамина аналогично тому, как описано в примере 1. (М+Н)+ 397. 1 Н ЯМР Н (400 МГц, ДМСО): 8,90 (1 Н, ушир. t), 7,75 (1H, t, J=7,7 Гц), 7,47 (1H, d, J=7,7 Гц), 7,34(2 Н, d, J=3,9 Гц), 2,59 (2 Н, m), 2,30 (3H, s), 2,20 (2 Н, m), 1,89 (2 Н, m). 3-6-[1-Гидрокси-1-циклобутил]пиридин-2-илметил-7-(5-метил-2-фурил)-3H-[1,2,3]триазоло[4,5d]пиримидин-5-амин. Указанное в заголовке соединение (0,05 г, 38%) получали в виде твердого вещества бежевого цвета из 4-(6-[1-гидрокси-1-циклобутил]пиридин-2-метиламино)-6-(5-метил-2-фурил)-5-нитропиримидин-2 амина аналогично тому, как описано в примере 1. (М+Н)+ 378. 1 Н ЯМР Н (400 МГц, ДМСО): 1,36-1,44 (1 Н, m), 1,61-1,69 (1 Н, m), 2,03-2,10 (2 Н, m), 2,19-2,25 (2 Н,m), 2,46 (3H, s), 5,62 (1 Н, s), 5,81 (2 Н, s), 6,51 (1H, d, J=2,5 Гц), 7,08 (1 Н, d, J=7,5 Гц), 7,22 (2 Н, ушир.b),7,44 (1 Н, d, J=8,0 Гц), 7,73 (1 Н, t, J=8,0 Гц), 7,87 (1 Н, d, J=3,5 Гц). Пример 7. S-7-Фенил-3-(6-[тетрагидрофуран-3-ил]оксиметилпирид-2-илметил)-3H-[1,2,3]триазоло(12,64 мл, 90,70 ммоль) в пропан-2-оле (165 мл) нагревали с обратным холодильником в течение 2 ч, охлаждали и полученный осадок отделяли фильтрованием, промывали холодным пропан-2-олом и сушили,при этом получали указанное в заголовке соединение (22,66 г, 73%) в виде твердого вещества розового цвета. МС-ЖХ: (М+Н)+ 379, в.у. 1,46 мин. 6-Хлор-N4-6-[(S)-(тетрагидрофуран-3-ил)оксиметил]пиридин-2-илметилпиримидин-2,4,5-триамин. Смесь N-[2-амино-4-хлор-6-(6-[(S)-(тетрагидрофуран-3-ил)оксиметил]пиридин-2-илметиламино) пиримидин-5-ил]формамида (10,00 г, 26,40 ммоль) и хлористо-водородной кислоты (6 М, 22 мл) в EtOH(100 мл) нагревали с обратным холодильником в течение 15 ч, охлаждали, подщелачивали при добавлении водного раствора гидроксида натрия (5 М, 50 мл) и концентрировали в вакууме для удаления EtOH. Полученную смесь дважды экстрагировали дихлорметаном и объединенные органические экстракты промывали насыщенным солевым раствором, сушили (Na2SO4) и концентрировали в вакууме, при этом получали указанное в заголовке соединение (8,09 г, 87%) в виде твердого вещества розового цвета. МСЖХ: (М+Н)+ 351, в.у. 1,52 мин. 7-Хлор-3-6-[(S)-(тетрагидрофуран-3-ил)оксиметил]пиридин-2-илметил-3H-[1,2,3]триазоло[4,5d]пиримидин-5-иламин. Раствор 6-хлор-N4-6-[(S)-(тетрагидрофуран-3-ил)оксиметил]пиридин-2-илметилпиримидин-2,4,5 триамина (8,09 г, 23,06 ммоль) в EtOH (85 мл) и ледяной уксусной кислоте (21 мл) при 0 С обрабатывали раствором нитрита натрия (2,07 г, 29,979 ммоль) в воде (5,3 мл), перемешивали при 0 С в течение 1 ч и полученный осадок отделяли фильтрованием, промывали EtOH (85 мл) и сушили, при этом получали указанное в заголовке соединение (5,82 г, 70%) в виде твердого вещества грязно-белого цвета. МС-ЖХ:(М+Н)+ 362, в.у. 1,94 мин. 7-Фенил-3-[6-(тетрагидрофуран-3-илоксиметил)пиридин-2-илметил]-3H-[1,2,3]триазоло[4,5d]пиримидин-5-иламин. Указанное в заголовке соединение (0,060 г, 68%) получали из 7-хлор-3-6-[(S)-(тетрагидрофуран-3 ил)оксиметил]пиридин-2-илметил-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-иламина и фенилбороновой кислоты аналогично тому, как описано в примере 13. МС-ЖХ: (М+Н)+ 404, в.у. 2,28 мин. 1 Н ЯМР Н (400 МГц, d6-ДМСО): 8,77-8,74 (2 Н, m), 7,79 (1 Н, t, J=8 Гц), 7,67-7,63 (3H, m), 7,35 (1H,d, J=8 Гц), 7,33 (2 Н, ушир.s), 7,08 (1 Н, d, J=8 Гц), 5,79 (2 Н, s), 4,49-4,47 (2 Н, m), 4,23-4,20 (1 Н, m), 3,753,61 (4 Н, m), 1,93-1,89 (2 Н, m). Пример 8. 7-Фенил-3-(6-[1-гидрокси-1-метилэтил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5d]пиримидин-5-амин. Указанное в заголовке соединение (48 мг, 17%) получали в виде порошка белого цвета из 7-хлор-3(6-[1-гидрокси-1-метилэтил]пиридин-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-2-иламина (0,25 г,0,78 ммоль) и 3-фенилбороновой кислоты (0,11 г, 0,93 ммоль) аналогично тому, как описано в примере 20. МС-ЖХ: (М+Н)+ 362, в.у. 2,26 мин. 1 Н ЯМР Н (400 МГц, CDCl3): 8,76 (2 Н, m), 7,73 (1H, t, J=7,7 Гц), 7,62 (3H, m), 7,55 (1 Н, d, J=4,3 Гц),7,30 (2 Н, ушир.s), 6,98 (1 Н, d, J=7,7 Гц), 5,80 (2 Н, s), 5,12 (1 Н, s), 1,26 (6H, s). Пример 9. 7-Фенил-3-(6-[1-гидрокси-1-циклопентил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5d]пиримидин-5-амин. Указанное в заголовке соединение получали из 7-хлор-3-(6-[1-гидрокси-1-циклопентил]пиридин-2 илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-2-амина аналогично тому, как описано в примере 10.[4,5-d]пиримидин-5-амин. 2-(4-Гидрокситетрагидропиран-4-ил)пиридин. В охлажденный раствор 2-бромпиридина (5 г, 31,65 ммоль) в ТГФ (75 мл) при -78 С при перемешивании по каплям добавляли н-бутиллитий (2,5 М в гексане, 12,66 мл, 31,65 ммоль) и раствор перемешивали при -78 С в течение 10 мин, добавляли тетрагидро-4 Н-пиран-4-он (3,49 г, 34,81 ммоль), реакционную смесь нагревали до КТ и перемешивали в течение ночи. Реакцию останавливали при добавлении насыщенного водного раствора хлорида аммония и ТГФ удаляли в вакууме. Полученную водную фазу дважды экстрагировали этилацетатом и объединенные органические фазы сушили (сульфат магния) и фильтровали. После концентрирования в вакууме, очистки колоночной хроматографией (SiO2, элюент: гексан/этилацетат, 2:1) получали остаток, который растирали в гексане, при этом получали указанное в заголовке соединение (3,47 г, 61%) в виде твердого вещества белого цвета. МС-ЖХ: (М+Н)+ 180, в.у. 0,51 мин. 1H ЯМР Н (400 МГц, CDCl3): 8,49 (1 Н, m), 7,81 (1H, td, J=7,8 Гц, 1,8 Гц), 7,68 (1 Н, m), 7,25 (1 Н, ddd,J=7,5 Гц, 4,9 Гц, 1,1 Гц), 3,85 (4 Н, m), 3,30 (1H, m), 2,30 (2 Н, td, J=13,3 Гц, 5,3 Гц), 1,54 (1 Н, dd, J=13,8 Гц,1,9 Гц). 2-(4-Гидрокситетрагидропиран-4-ил)пиридин-N-оксид. В раствор 2-(4-гидрокситетрагидропиран-4-ил]пиридина (2,08 г, 11,6 ммоль) в дихлорметане (100 мл) при перемешивании добавляли m-СРВА (77%, 2,86 г, 12,76 ммоль) и смесь перемешивали при КТ в течение ночи, добавляли карбонат калия (1,62 г, 11,60 ммоль), реакционную смесь перемешивали в течение 2 ч и фильтровали. В фильтрат добавляли дополнительную порцию карбоната калия (1,62 г, 11,60 ммоль) и смесь снова перемешивали в течение 2 ч. После фильтрования и концентрирования в вакууме получали N-оксид в виде твердого вещества светло-коричневого цвета (2,28 г, выход количественный),который использовали без дополнительной очистки. МС-ЖХ: (М+Н)+ 196, в.у. 0,99 мин. 1 Н ЯМР Н (400 МГц, ДМСО): 8,33 (1 Н, dd, J=6,3 Гц, 1,1 Гц), 7,65 (1 Н, dd, J=8,0 Гц, 2,0 Гц), 7,52(1 Н, td, J=7,9 Гц, 1,3 Гц), 7,44 (1 Н, td, J=7,6 Гц, 2,0 Гц), 7,32 (1H, ушир.s), 3,78 (4 Н, m), 2,23 (2 Н, td, J=12,5 Гц, 5,1 Гц), 1,80 (1 Н, d, J=11,4 Гц). 6-(4-Гидрокситетрагидропиран-4-ил)пиридин-2-карбонитрил. В раствор 2-(4-гидрокситетрагидропиран-4-ил)пиридин-N-оксида (3,69 г, 18,91 ммоль) в безводном дихлорметане при перемешивании добавляли диметилкарбамоилхлорид (3,05 г, 28,4 ммоль) и триметилсилилцианид (2,82 г, 28,4 ммоль). Полученную смесь перемешивали в течение шестидесяти ч при 40 С,затем добавляли дополнительные порции диметилкарбамоилхлорида (3,05 г, 28,4 ммоль) и триметилсилилцианида (2,82 г, 28,4 ммоль). После перемешивания при 40 С в течение еще 24 ч добавляли раствор карбоната натрия (50 мл, 2 М водный раствор) и смесь перемешивали в течение ночи. Полученную смесь фильтровали и слои разделяли. В органическую фазу добавляли раствор карбоната натрия (50 мл, 2 М водный раствор) и смесь перемешивали в течение ночи. После разделения фаз органический слой упаривали при КТ, при этом получали указанное в заголовке соединение в виде масла коричневого цвета, которое использовали на следующей стадии без дополнительной очистки. МС-ЖХ: (М+Н)+ 205, в.у. 1,62 мин. 6-(4-Гидрокситетрагидропиран-4-ил)пиридин-2-метанамин. 6-(4-Гидрокситетрагидропиран-4-ил)пиридин-2-карбонитрил (приблизительно 18,9 ммоль) растворяли в безводном ТГФ (80 мл) и добавляли 1 М раствор ВН 3 в ТГФ (95 мл, 95 ммоль). Полученный раствор перемешивали в течение 2,5 ч при КТ, затем реакцию останавливали при добавлении метанола. Раствор подкисляли до рН 1 при добавлении 2 н. раствора хлористо-водородной кислоты, затем нейтрализовали до рН 5 при добавлении 5 н. раствора гидроксида натрия. Смесь экстрагировали дихлорметаном, в водную фазу добавляли дополнительную порцию 2 н. гидроксида натрия до рН 14. Эту фазу дважды экстрагировали дихлорметаном и объединенные экстракты упаривали, при этом получали смолу желтого цвета. Водные экстракты подкисляли при добавлении 2 н. раствора хлористо-водородной кислоты и концентрировали досуха, при этом получали остаток белого цвета. Полученный остаток растирали в метаноле три раза и полученные метанольные фракции концентрировали, получали вторую порцию смолы желтого цвета. После высушивания в вакууме получали указанное в заголовке соединение (2,51 г, 64%) в виде пены желтого цвета. МС-ЖХ: (М+Н)+ 209, в.у. 0,43 мин. 1 Н ЯМР Н (400 МГц, ДМСО): 8,53 (1 Н, ушир.s), 7,85 (1 Н, t, J=7,8 Гц), 7,62 (1 Н, d, J=7,8 Гц), 7,34(1 Н, d, J=7,5 Гц), 5,75 (1 Н, s), 3,72 (4 Н, m), 3,16 (2 Н, s), 2,29 (2 Н, m), 1,42 (1 Н, d, J=12,3 Гц). 7-Хлор-3-(6-[4-гидрокситетрагидропиран-4-ил]пиридин-2-илметил)-3H-[1,2,3]триазоло[4,5d]пиримидин-2-амин. Указанное в заголовке соединение (0,42 г, 14%) получали в виде порошка коричневого цвета из 2- 19018803(0,12 г, 0,55 ммоль) в 1,4-диоксане (5 мл) дегазировали при продувании азотом, затем добавляли тетракистрифенилфосфинпалладий (16 мг), раствор еще раз дегазировали и полученную смесь нагревали при 100 С в течение 7 ч, затем смесь концентрировали в вакууме на установке Isolute-HM, очищали колоночной хроматографией (силикагель, элюент: этилацетат/гексан, 3:1 и 100% этилацетат) и растирали в диэтиловом эфире, при этом получали указанное в заголовке соединение (41 мг, 37%) в виде твердого вещества бежевого цвета. МС-ЖХ: (М+Н)+ 404, в.у. 2,17 мин. 1 Н ЯМР Н (400 МГц, ДМСО): 8,76 (2 Н, m), 7,77 (1 Н, t, J=7,8 Гц), 7,64 (3H, m), 7,57 (1 Н, d, J=7,5 Гц),7,31 (2 Н, ушир.s), 7,02 (1 Н, d, J=7,5 Гц), 5,81 (2 Н, s), 5,20 (1H, s), 3,60 (4 Н, m), 1,97 (2 Н, m), 1,33 (2 Н, d,J=12,0 Гц). Пример 11. 7-Фенил-3-(6-[1-гидроксициклобутил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5d]пиримидин-5-амин. 2-(1-Гидрокси-1-циклобутил)пиридин. Указанное в заголовке соединение (7,62 г, выход количественный) получали в виде масла оранжевого цвета из 2-бромпиридина и циклобутанона аналогично тому, как описано в примере 10. (М+Н)+ 151. 1 Н ЯМР Н (400 МГц, ДМСО): 8,54 (1H, m), 7,75 (1 Н, td, J=7,6 Гц, 1,7 Гц), 7,59 (1H, m), 7,22 (1H, m),5,70 (1 Н, s), 2,58 (2 Н, m), 2,23 (2 Н, m), 1,91 (2 Н, m). 2-(1-Гидрокси-1-циклобутил)пиридин-N-оксид. Указанное в заголовке соединение получали в виде масла желтого цвета из 2-(1-гидрокси-1 циклобутил)пиридина аналогично тому, как описано выше в примере 10. (М+Н)+ 167. 1 Н ЯМР Н (400 МГц, ДМСО): 8,36 (1H, dd, J=6,3 Гц, 1,1 Гц), 8,31 (1 Н, s), 7,67 (1H, dd, J=8,1 Гц, 2,1 Гц), 7,50 (1 Н, td, J=8,7 Гц, 1,1 Гц), 7,44 (1H, m), 6,84 (1H, s), 2,51 (2 Н, m), 2,27 (2 Н, m), 1,94 (2 Н, m). 6-(1-Гидрокси-1-циклобутил)пиридин-2-карбонитрил. Указанное в заголовке соединение (1,66 г, 21%) получали из 2-(1-гидрокси-1-циклобутил)пиридинN-оксида аналогично тому, как описано выше в примере 10. (М+Н)+ 177. 1 Н ЯМР Н (400 МГц, ДМСО): 8,02 (1 Н, арр t, J=8,0 Гц), 7,89 (1H, d, J=2,7 Гц), 7,87 (1 Н, dd, J=3,0 Гц,0,9 Гц), 5,96 (1H, s), 2,54 (2 Н, m), 2,25 (2 Н, m), 1,94 (1H, m), 1,79 (1 Н, m). 6-(1-Гидрокси-1-циклобутил)пиридин-2-метанамин. Указанное в заголовке соединение (0,87 г, 53%) получали в виде масла желтого цвета из 6-(1 гидрокси-1-циклобутил)пиридин-2-карбонитрила аналогично тому, как описано в примере 10. (М+Н)+ 181. 1 Н ЯМР H (400 МГц, ДМСО): 7,68 (1 Н, t, J=7,8 Гц), 7,40 (1 Н, d, J=7,6 Гц), 7,25 (1 Н, d, J=7,6 Гц),5,73 (1 Н, s), 3,82 (2 Н, s), 2,55 (2 Н, m), 2,22 (2 Н, m), 1,83 (2 Н, m).N-(2-Амино-6-хлор-4-[6-(1-гидрокси-1-циклобутил)пиридин-2-метиламино]пиримидин-5 ил)формамид. Указанное в заголовке соединение (0,92 г, 85%) получали в виде твердого вещества оранжевого цвета из N-(2-амино-4,6-дихлорпиримидин-5-ил)формамида и 6-(1-гидрокси-1-циклобутил)пиридин-2 метанамина аналогично тому, как описано в примере 7. (М+Н)+ 350. 1(1 Н, d, J=9,7 Гц), 7,37 (1H, t, J=5,7 Гц), 7,14 (1 Н, d, J=7,7 Гц), 5,66 (1H, s), 5,40 (2 Н, d, J=5,7 Гц), 2,52 (2 Н,m), 2,19 (2 Н, m), 1,90 (1 Н, m), 1,81 (1 Н, m). 7-Хлор-3-6-[1-гидрокси-1-циклобутил]пиридин-2-илметил-3H-[1,2,3]триазоло[4,5-d]пиримидин 5-иламин. Указанное в заголовке соединение (0,12 г, 66%) получали в виде твердого вещества оранжевого цвета из(1 Н, d, J=7,6 Гц), 5,83 (2 Н, s), 5,62 (1H, s), 2,12 (2 Н, m), 2,04 (2 Н, m), 1,64 (1 Н, m), 1,29 (1H, m). 3-6-[1-Гидрокси-1-циклобутил]пиридин-2-илметил-7-фенил-3H-[1,2,3]триазоло[4,5-d]пиримидин 5-иламин. Указанное в заголовке соединение (0,03 г) получали из 7-хлор-3-6-[1-гидрокси-1 циклобутил]пиридин-2-илметил-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-иламина и фенилбороновой кислоты аналогично тому, как описано в примере 7. (М+Н)+ 374. Н ЯМР Н (400 МГц, ДМСО): 1,32-1,39 (1H, m), 1,59-1,66 (1 Н, m), 2,01-2,09 (2 Н, m), 2,18-2,24 (2 Н,m), 5,62 (1 Н, s), 5,87 (2 Н, s), 7,10 (1H, d, J=8,0 Гц), 7,25 (2 Н, ушир.b), 7,43 (1 Н, d, J=8,0 Гц), 7,62-7,66 (3H,m), 7,74 (1 Н, t, J=7,5 Гц), 8,74-8,77 (2 Н, m). Пример 12. 7-Фенил-3-(6-[метоксиметил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5 амин. Указанное в заголовке соединение получали из 7-хлор-3-(6-метоксиметилпиридин-2-илметил)-3H[1,2,3]триазоло[4,5-d]пиримидин-5-амина и соответствующей арилбороновой кислоты аналогично тому,как описано в примере 1 для сравнения. МС-ЖХ: (М+Н)+ 348, в.у. 2,25 мин. 1 Н ЯМР Н (400 МГц, ДМСО): 8,75 (2 Н, m), 8,35 (2 Н, ушир.s), 7,78 (1 Н, t, J=6,9 Гц), 7,64 (2 Н, m),7,34 (2 Н, ушир.s), 7,04 (1 Н, d, J=7,6 Гц), 5,78 (2 Н, s), 4,43 (2 Н, s), 3,37 (3H, s). Пример 13. S-7-(3-Метоксифенил)-3-(6-[тетрагидрофуран-3-ил]оксиметилпирид-2-илметил)-3H[1,2,3]триазоло[4,5-d]пиримидин-5-амин. Смесь раствора 7-хлор-3-6-[(S)-(тетрагидрофуран-3-ил)оксиметил]пиридин-2-илметил-3H[1,2,3]триазоло[4,5-d]пиримидин-5-иламина (0,100 г, 0,276 ммоль) и 3-метоксифенилбороновой кислоты(0,084 г, 0,55 ммоль) в 1,4-диоксане (4 мл) и насыщенного солевого раствора (1 мл) дегазировали при продувании азотом, обрабатывали тетракис(трифенилфосфин)палладием(0) (0,016 г, 0,014 ммоль), нагревали при 90 С в течение 6,5 ч, затем распределяли между водой и EtOAc. Органическую фазу отделяли,водную фазу повторно экстрагировали EtOAc, объединенные органические экстракты сушили (Na2SO4),концентрировали в вакууме и полученное твердое вещество коричневого цвета (0,150 г) очищали полупрепаративной МС-ЖХ, при этом получали указанное в заголовке соединение (0,052 г, 43%) в виде твердого вещества грязно-белого цвета. МС-ЖХ: (М+Н)+ 434, в.у. 2,32 мин. 1 Н ЯМР Н (400 МГц, d6-ДМСО): 8,39 (1H, dt, J=7,5 Гц, 1 Гц), 8,30 (1H, dd, J=2,5 Гц, 0,5 Гц), 7,79(1 Н, t, J=7,5 Гц), 7,65-7,53 (3H, m), 7,37 (2 Н, ушир.s), 7,24 (1 Н, ddd, J=8,5 Гц, 2,5 Гц, 1 Гц), 7,09 (1H, d,J=7,5 Гц), 5,78 (2H, s), 4,47 (2H, s), 4,23-4,19 (1H, m), 3,88 (3H, s), 3,76-3,60 (4H, m), 1,93-1,88 (2H, m). Пример 14. 7-(3-Метоксифенил)-3-(6-[1-гидрокси-1-метилэтил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин. 2-Бромметил-6-(1-гидрокси-1-метилэтил)пиридин. В раствор 2-гидроксиметил-6-(1-гидрокси-1-метилэтил)пиридина (5,1 г, 30,5 ммоль) в дихлорметане (300 мл) добавляли четырехбромистого углерода (8,81 г, 33,6 ммоль) и трифенилфосфин (11,14 г, 33,6 ммоль). Реакционную смесь перемешивали при КТ в течение ночи, затем выливали в насыщенный раствор бикарбоната натрия. Органический слой отделяли, концентрировали досуха и очищали колоночной хроматографией (элюент: градиент 100% гексан - гексан/этилацетат, 3:1), при этом получали указанное в заголовке соединение (5,21 г, 74%) в виде бесцветного масла. МС-ЖХ: (М+Н)+ 230, 232, в.у. 2,08 мин. 2-Азидометил-6-(1-гидрокси-1-метилэтил)пиридин. 2-Бромметил-6-(1-гидрокси-1-метилэтил)пиридин (7,61 г, 33 ммоль) растворяли в диметилформамиде (100 мл) и добавляли азид натрия (2,6 г, 39,7 ммоля). Реакционную смесь перемешивали при КТ в течение ночи, затем выливали в дихлорметан и промывали водой. Органический слой сушили (сульфат магния), фильтровали и концентрировали досуха. Полученное масло желтого цвета (5,88 г, 93%) использовали без дополнительной очистки. МС-ЖХ: (М+Н)+ 193, в.у. 2,06 мин. 1 Н ЯМР Н (400 МГц, CDCl3): 7,70 (1 Н, t, J=7,8 Гц), 7,30 (1 Н, d, J=8,0 Гц), 7,19 (1 Н, d, J=7,8 Гц), 4,82(1 Н, ушир.s), 4,42 (2 Н, s), 1,51 (6 Н, s). 6-(1-Гидрокси-1-метилэтил)пиридин-2-метанамин. 2-Азидометил-6-(1-гидрокси-1-метилэтил)пиридин (5,88 г, 30,6 ммоль) растворяли в метаноле (100 мл) и добавляли палладий (5% мас./мас. на угле). Суспензию медленно встряхивали в атмосфере водорода в течение ночи, фильтровали через целит и концентрировали досуха, при этом получали амин (4,61 г,90%) в виде бесцветного масла. МС-ЖХ: (М+Н)+ 167, в.у. 0,42 мин. 1 Н ЯМР Н (400 МГц, CDCl3): 7,63 (1 Н, t, J=7,8 Гц), 7,19 (1 Н, d, J=7,8 Гц), 7,12 (1 Н, d, J=7,6 Гц), 3,93(2 Н, s), 1,49 (6 Н, s). 7-Хлор-3-(6-[1-гидрокси-1-метилэтил]пиридин-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-2 амин. Раствор 6-(1-гидрокси-1-метилэтил)пиридин-2-метанамина (2,5 г, 15,0 ммоль), 2-амино-4,6-дихлор 5-формиламинопиримидина (3,12 г, 15,0 ммоль) и триэтиламина (4,2 мл, 30 ммоль) в изопропиловом спирте (35 мл) нагревали при 90 С в течение 4 ч, затем охлаждали до 0 С и выливали в ледяную воду. Полученную смесь фильтровали и жидкость концентрировали досуха. Полученное твердое вещество повторно растворяли в этаноле (35 мл) и добавляли концентрированную хлористо-водородную кислоту(12 М, 2,5 мл, 30 ммоль). Полученную смесь затем нагревали при 90 С в течение 2 ч, затем снова охлаждали до 0 С. В смесь по каплям добавляли раствор нитрита натрия (1,24 г, 18 ммоль) в воде (2,5 мл) и смесь перемешивали при 0 С в течение 30 мин. Полученную смесь выливали в охлажденный насыщенный раствор бикарбоната натрия, остаточный этанол удаляли в вакууме, остаток фильтровали и высушивали в вакууме, при этом получали указанное в заголовке соединение (2,25 г, 47%) в виде порошка красно-коричневого цвета. МС-ЖХ: (М+Н)+ 320, в.у. 1,89 мин.(2 Н, d), 5,45 (2 Н, ушир.s), 1,47 (6 Н, s). 3-(6-[1-Гидрокси-1-метилэтил]пиридин-2-илметил)-7-(3-метоксифенил)-3H-[1,2,3]триазоло[4,5d]пиримидин-2-амин. Указанное в заголовке соединение (68 мг, 37%) получали в виде твердого вещества желтого цвета из 7-хлор-3-(6-[1-гидрокси-1-метилэтил]пиридин-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-2 амина и 3-метоксифенилбороновой кислоты (0,08 г, 0,56 ммоль) аналогично тому, как описано в примере 20. МС-ЖХ: (М+Н)+ 392, в.у. 2,27 мин. 1 Н ЯМР Н (400 МГц, CDCl3): 8,49 (1 Н, d, J=7,7 Гц), 8,38 (1 Н, ушир.s), 7,64 (1H, t, J=8,0 Гц), 7,47(1 Н, t, J=8,0 Гц), 7,27 (1 Н, d, J=7,9 Гц), 7,13 (1 Н, dd, J=7,9 Гц, 3,4 Гц), 6,99 (1 Н, d, J=7,7 Гц), 5,84 (2 Н, s),5,45 (2 Н, ушир.s), 3,93 (2 Н, s), 1,49 (6 Н, s). Пример 15. 7-(3-Метоксифенил)-3-(6-[1-гидрокси-1-циклопентил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин. Указанное в заголовке соединение получали из 7-хлор-3-(6-[1-гидрокси-1-циклопентил]пиридин-2 илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-2-амина аналогично тому, как описано в примере 10.(2 Н, s), 7,02 (1 Н, d, J=7,5 Гц), 7,22-7,28 (3H, m), 7,54-7,58 (2 Н, m), 7,73 (1 Н, t, J=8,0 Гц), 8,29-8,30 (1 Н, m),8,38 (1H, dt, J=8,0 Гц, 1,5 Гц). ИК max (DR)/см-1: 3375, 3187, 2954, 1602, 1522, 1219, 1017 и 793. Пример 16. 7-(3-Метоксифенил)-3-(6-[4-гидрокситетрагидропиран-4-ил]пирид-2-илметил)-3H[1,2,3]триазоло[4,5-d]пиримидин-5-амин. Указанное в заголовке соединение (45 мг, 38%) получали в виде твердого вещества из 7-хлор-3-(6[4-гидрокситетрагидропиран-4-ил]пиридин-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-2-амина и 3 метоксифенилбороновой кислоты (0,08 г, 0,55 ммоль) аналогично тому, как описано в примере 10. МСЖХ: (М+Н)+ 434, в.у. 2,18 мин. 1 Н ЯМР Н (400 МГц, ДМСО): 8,40 (1 Н, dt, J=7,9 Гц, 1,1 Гц), 8,30 (1 Н, m), 7,77 (1H, t, J=7,8 Гц), 7,56[4,5-d]пиримидин-5-амин. Указанное в заголовке соединение (0,04 г, 16%) получали из 7-хлор-3-6-[1-гидрокси-1 циклобутил]пиридин-2-илметил-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-иламина и 3-метоксифенилбороновой кислоты аналогично тому, как описано в примере 7. (М+Н)+ 404. 1 Н ЯМР Н (400 МГц, ДМСО): 1,32-1,38 (1H, m), 1,57-1,66 (1H, m), 2,01-2,09 (2 Н, m), 2,17-2,24 (2 Н,m), 3,88 (3H, s), 5,63 (1H, s), 5,86 (2 Н, s), 7,10 (1H, d, J=7,5 Гц), 7,22-7,30 (3H, m), 7,43 (1H, d, J=7,5 Гц),7,56 (1H, t, J=8,0 Гц), 7,74 (1H, t, J=7,5 Гц), 8,30 (1H, s), 8,40 (1H, d, J=7,5 Гц). Пример 18. 7-(3-Метоксифенил)-3-(6-[метоксиметил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5d]пиримидин-5-амин. Указанное в заголовке соединение получали из 7-хлор-3-(6-метоксиметилпиридин-2-илметил)-3H[1,2,3]триазоло[4,5-d]пиримидин-5-амина и соответствующей арилбороновой кислоты аналогично тому,как описано в примере 1 для сравнения. Пример 19.(5 мл) и насыщенного раствора бикарбоната натрия (0,8 мл) дегазировали при продувании азотом и вакуумировали (указанные операции повторяли три раза). Затем добавляли тетракистрифенилфосфинпалладий (50 мг), раствор снова дегазировали и полученную смесь нагревали при 70 С в течение ночи. Смесь охлаждали до КТ и наносили непосредственно на предварительно заполненную (20 г силикагеля) колонку (элюент: градиент от 100% дихлорметана до дихлорметан/метанол, 95:5), при этом получали воскообразное масло желтого цвета, которое очищали препаративной ЖХВР, при этом получали указан- 22018803 ное в заголовке соединение (15 мг, 8%) в виде порошка желтого цвета. МС-ЖХ: (М+Н)+ 387, в.у. 2,25 мин. 1H ЯМР Н (400 МГц, CDCl3): 9,17 (1 Н, dt, J=8,1 Гц, 1,4 Гц), 9,11 (1 Н, ушир.s), 7,83 (1 Н, dt, J=7,8 Гц,1,3 Гц), 7,66 (2 Н, m), 7,28 (1 Н, d, J=7,8 Гц), 7,04 (1 Н, d, J=7,8 Гц), 5,86 (2 Н, s), 5,40 (2 Н, ушир.s), 1,48 (6 Н, s). Пример 21. 7-(3-Цианофенил)-3-(6-[1-гидрокси-1-циклопентил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин. Указанное в заголовке соединение получали из 7-хлор-3-(6-[1-гидрокси-1-циклопентил]пиридин-2 илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-2-амина аналогично тому, как описано в примере 10.(1 Н, d, J=7,5 Гц), 7,40 (2 Н, s), 7,55 (1 Н, d, J=7,0 Гц), 7,73 (1H, t, J=7,5 Гц), 7,90 (1 Н, t, J=8,0 Гц), 8,14 (1 Н,dt, J=8,0 Гц, 1,5 Гц), 9,02-9,07 (2 Н, m). ИК max (DR)/см-1: 3323, 2967, 2232, 1732, 1595, 1507, 1436, 1234, 1012 и 794. Пример 22. 7-(3-Цианофенил)-3-(6-[4-гидрокситетрагидропиран-4-ил]пирид-2-илметил)-3H[1,2,3]триазоло[4,5-d]пиримидин-5-амин. Указанное в заголовке соединение (28 мг, 20%) получали в виде твердого вещества желтого цвета из 7-хлор-3-(6-[4-гидрокситетрагидропиран-4-ил]пиридин-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-2-амина и 3-цианофенилбороновой кислоты (0,09 г, 0,66 ммоль) аналогично тому, как описано в примере 10. МС-ЖХ: (М+Н)+ 429, в.у. 2,16 мин. 1 Н ЯМР Н (400 МГц, CDCl3): 9,06 (2 Н, m), 8,13 (1 Н, dt, J=7,8 Гц, 1,3 Гц), 7,89 (1 Н, t, J=7,9 Гц), 7,78[4,5-d]пиримидин-5-амин. Указанное в заголовке соединение (0,06 г) получали в виде порошка белого цвета из 7-хлор-3-6-[1 гидрокси-1-циклобутил]пиридин-2-илметил-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-иламина и 3 цианофенилбороновой кислоты аналогично тому, как описано в примере 7. (М+Н)+ 399. 1 Н ЯМР Н (400 МГц, ДМСО): 1,31-1,39 (1H, m), 1,60-1,66 (1 Н, m), 2,04-2,08 (2 Н, m), 2,17-2,26 (2 Н,m), 5,62 (1 Н, s), 5,89 (2 Н, s), 7,15 (1 Н, d, J=7,5 Гц), 7,40-7,51 (3H, m), 7,75 (1 Н, t, J=8,0 Гц), 7,90 (1 Н, t,J=7,5 Гц), 8,15 (1H, d, J=7,5 Гц), 9,04-9,12 (2 Н, m). Пример 24. 7-(3-Цианофенил)-3-(6-[метоксиметил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5d]пиримидин-5-амин. Указанное в заголовке соединение получали из 7-хлор-3-(6-метоксиметилпиридин-2-илметил)-3H[1,2,3]триазоло[4,5-d]пиримидин-5-амина и соответствующей арилбороновой кислоты аналогично тому,как описано в примере 1 для сравнения. Пример 25. S-7-(4-Метилтиазол-2-ил)-3-(6-[тетрагидрофуран-3-ил]оксиметилпирид-2-илметил)-3H[1,2,3]триазоло[4,5-d]пиримидин-5-амин. Указанное в заголовке соединение получали из 7-хлор-3-6-[(S)-(тетрагидрофуран-3 ил)оксиметил]пиридин-2-илметил-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-иламина и 4-метилтиазола аналогично тому, как описано в примере 38. Пример 26. 7-(4-Метилтиазол-2-ил)-3-(6-[1-гидрокси-1-метилэтил]пирид-2-илметил)-3H-[1,2,3] триазоло[4,5-d]пиримидин-5-амин. Указанное в заголовке соединение получали из 7-хлор-3-(6-[1-гидрокси-1-метилэтил]пирид-2 илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амина и 4-метилтиазола аналогично тому, как описано в примере 38. Пример 27. 7-(4-Метилтиазол-2-ил)-3-(6-[1-гидрокси-1-циклопентил]пирид-2-илметил)-3H[1,2,3]триазоло[4,5-d]пиримидин-5-амин. 7-Хлор-3-6-[1-триметилсилилокси-1-циклопентил]пиридин-2-илметил-3H-[1,2,3]триазоло[4,5d]пиримидин-5-иламин. Раствор 7-хлор-3-6-[1-гидрокси-1-циклопентил]пиридин-2-илметил-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-иламина (0,5 г, 1,5 ммоль) в сухом ТГФ (15 мл) при КТ обрабатывали триметилсилилхлоридом (0,38 мл, 3,0 ммоль), затем триэтиламином (0,42 мл, 3,0 ммоль), перемешивали при 35 С в течение ночи, обрабатывали дополнительными порциями триметилсилилхлорида (0,19 мл, 1,5 ммоль) и триэтиламина (0,21 мл, 1,5 ммоль), перемешивали при 35 С в течение 24 ч. Полученную смесь выливали в воду(60 мл), дважды экстрагировали EtOAc, концентрировали в вакууме и очищали хроматографией (SiO2,элюент: изогексан/EtOAc, 3:1), при этом получали указанное в заголовке соединение (0,55 г, 88%).[4,5-d]пиримидин-5-иламин. Раствор 7-(4-метилтиазол-2-ил)-3-6-[1-триметилсилилокси-1-циклопентил]пиридин-2-илметил 3H-[1,2,3]триазоло[4,5-d]пиримидин-5-иламина (0,105 г, 0,22 ммоль) в ТГФ (6 мл) обрабатывали фторидом тетрабутиламмония (1,0 М в ТГФ, 0,33 мл, 0,33 ммоль), кипятили с обратным холодильником в течение 90 мин, охлаждали, концентрировали в вакууме и распределяли между водой и EtOAc. Водную фазу экстрагировали EtOAc и объединенные органические фазы сушили (MgSO4), концентрировали в вакууме, растирали в EtOAc и полученное твердое вещество отделяли фильтрованием, при этом получали указанное в заголовке соединение (0,021 г, 24%) в виде твердого вещества желтого цвета. (М+Н)+ 409. 1 Н ЯМР Н (400 МГц, ДМСО): 1,43-1,51 (2 Н, m), 1,58-1,62 (2 Н, m), 1,67-1,73 (2 Н, m), 1,77-1,83 (2 Н,m), 2,57 (3H, s), 4,97 (1 Н, s), 5,82 (2 Н, s), 7,02 (1 Н, d, J=7,5 Гц), 7,38 (2 Н, ушир.b), 7,55 (1H, d, J=8,0 Гц),7,72-7,75 (2 Н, m). Пример 28. 7-(4-Метилтиазол-2-ил)-3-(6-[4-гидрокситетрагидропиран-4-ил]пирид-2-илметил)-3H[1,2,3]триазоло[4,5-d]пиримидин-5-амин. Указанное в заголовке соединение получали из 7-хлор-3-(6-[4-гидрокситетрагидропиран-4 ил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амина и 4-метилтиазола аналогично тому,как описано в примере 38. Пример 29. 7-(4-Метилтиазол-2-ил)-3-(6-[1-гидроксициклобутил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин. Указанное в заголовке соединение получали из 7-хлор-3-(6-[1-гидроксициклобутил]пирид-2 илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амина и 4-метилтиазола аналогично тому, как описано в примере 38. Пример 30. 7-(4-Метилтиазол-2-ил)-3-(6-[метоксиметил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5d]пиримидин-5-амин.N-[2-Амино-4-хлор-6-(6-[метоксиметил]пиридин-2-илметиламино)пиримидин-5-ил]формамид. Указанное в заголовке соединение получали из N-(2-амино-4,6-дихлорпиримидин-5-ил)формамида(коммерческий препарат) и 6-метоксиметилпиридин-2-метанамина аналогично тому, как описано в примере 1 для сравнения. 7-Хлор-3-(6-метоксиметилпиридин-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-иламин. Указанное в заголовке соединение получали из N-[2-амино-4-хлор-6-(6-[метоксиметил]пиридин-2 илметиламино)пиримидин-5-ил]формамида аналогично тому, как описано в примере 1 для сравнения. МС-ЖХ: (М+Н)+ 306, в.у. 1,91 мин. 3-(6-Метоксиметилпиридин-2-илметил)-7-(4-метилтиазол-2-ил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-иламин. Раствор 4-метилтиазола (0,15 мл, 1,65 ммоль) в сухом ТГФ (7,5 мл) охлаждали до -78 С в атмосфере азота, обрабатывали n-BuLi (1,0 мл, 1,65 ммоль) и перемешивали в течение 30 мин, затем добавлялиZnCl2 (1M, 1,65 мл, 1,65 ммоль) и реакционную смесь нагревали до КТ. В полученную смесь добавляли 7-хлор-3-(6-метоксиметилпиридин-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин(250 мг,0,825 ммоль), а затем Pd(PPh3)4 (48 мг, 0,04 ммоль) и реакционную смесь нагревали с обратным холодильником в течение 1 ч. Реакционную смесь охлаждали до КТ, реакцию останавливали при добавлении хлорида аммония, смесь экстрагировали этилацетатом. Органическую фазу промывали водой, сушили и концентрировали в вакууме. Неочищенный продукт очищали хроматографией (элюент: EtOAc/гептан, от 1:1 до 2:1), при этом получали указанное в заголовке соединение (38 мг, 13%) в виде твердого вещества желтого цвета. МС-ЖХ: (М+Н) 369, в.у. 1,01 мин (50:80). 1 Н ЯМР H (400 МГц, ДМСО): 7,78 (1 Н, t, J=7,5 Гц), 7,73 (1 Н, s), 7,43 (2 Н, ушир.s), 7,34 (1 Н, d, J=7,5 Гц), 7,04 (1 Н, d, J=7,0 Гц), 5,78 (2 Н, s), 4,42 (2 Н, s), 3,33 (3H, s), 2,56 (3H, s). ИК max (DR)/см-1: 3324, 3302, 2921, 1651, 1596, 1519, 1418, 1366, 1257, 1198 и 1112. Пример 31. 7-(5-Метилфуран-2-ил)-3-(6-[дифторметилоксиметил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин. Этиловый эфир 6-дифторметоксиметилпиридин-2-карбоновой кислоты. В раствор этилового эфира 6-гидроксиметилпиридин-2-карбоновой кислоты (800 мг, 4,79 ммоль) иCuI (91 мг, 0,479 ммоль) в MeCN (10 мл) при КТ по каплям добавляли 2,2-дифтор-2(фторсульфонил)уксусную кислоту (495 мл, 4,79 ммоль), при добавлении реагента поддерживали температуру смеси приблизительно 30 С. Смесь перемешивали при КТ в течение 20 мин, выливали в солевой раствор/воду и трижды экстрагировали EtOAc. Объединенные экстракты сушили (MgSO4), фильтровали,- 24018803 упаривали и очищали колоночной хроматографией (элюент: изогексан/EtOAc, градиент от 4:1 до 2:1),при этом получали указанное в заголовке соединение (130 мг, 13%) в виде бесцветного масла. (М+Н)+ 232. 1 Н ЯМР Н (400 МГц, CDCl3): 8,01 (1 Н, d, J=7,5 Гц), 7,89 (1 Н, t, J=7,5 Гц), 7,66 (1 Н, d, J=7,5 Гц), 6,41(1 Н, t, J=74,0 Гц), 5,14 (2 Н, s), 4,49 (2 Н, q, J=7,0 Гц), 1,44 (3H, t, J=7,0 Гц). 6-Дифторметоксиметилпиридин-2-метанол. В раствор этилового эфира 6-дифторметоксиметилпиридин-2-карбоновой кислоты (2,30 г, 9,96 ммоль) в EtOH (50 мл) при 0 С добавляли NaBH4 (377 мг, 9,96 ммоль), смесь нагревали до 80 С и перемешивали в течение 5 ч, затем смесь охлаждали до 0 С, реакцию останавливали при добавлении насыщенного водного раствора NH4Cl, концентрировали в вакууме и распределяли между EtOAc и солевым раствором. Органический слой отделяли, сушили (MgSO4), фильтровали и упаривали, при этом получали указанное в заголовке соединение (1,50 г, 80%) в виде бесцветного масла. (М+Н)+ 190. 1 Н ЯМР Н (400 МГц, CDCl3): 7,73 (1 Н, t, J=8,0 Гц), 7,35 (1 Н, d, J=8,0 Гц), 7,19 (1H, d, J=8,0 Гц), 6,39(1 Н, t, J=74,0 Гц), 5,02 (2 Н, s), 4,76 (2 Н, s). 2-Бромметил-6-дифторметоксиметилпиридин. Указанное в заголовке соединение (52%) получали из 6-дифторметоксиметилпиридин-2-метанола при бромировании аналогично тому, как описано в примере 36. (М+Н)+ 252, 254. 1 Н ЯМР Н (400 МГц, CDCl3): 7,74 (1 Н, t, J=8,0 Гц), 7,39 (1 Н, d, J=8,0 Гц), 7,37 (1H, d, J=8,0 Гц), 6,40(1 Н, t, J=74,0 Гц), 5,01 (2 Н, s), 4,53 (2 Н, s). 3-(6-Дифторметоксиметилпиридин-2-илметил)-7-(5-метил-2-фурил)-3H-[1,2,3]триазоло[4,5d]пиримидин-5-иламин. Указанное в заголовке соединение получали из 7-(5-метил-2-фурил)-1 Н-[1,2,3]триазоло[4,5d]пиримидин-5-иламина и 2-бромметил-6-дифторметоксиметилпиридина при алкилировании аналогично тому, как описано в примере 36. (М+Н)+ 388. tпл. 194,8-195,1 С. 1 Н ЯМР Н (400 МГц, ДМСО): 7,88 (1H, d, J=3,5 Гц), 7,84 (1 Н, t, J=8,0 Гц), 7,40 (1H, d, J=8,0 Гц),7,31 (2 Н, ушир.s), 7,10 (1 Н, d, J=8,0 Гц), 6,81 (1 Н, t, J=75,8 Гц), 6,52 (1 Н, m), 5,76 (2 Н, s), 4,92 (2 Н, s), 2,46(3H, s). ИК max (DR)/см-1: 3512, 3295, 3172, 1632, 1574, 1499, 1464, 1436 и 1417. Элементный анализ: рассч. для C17H15N7O2F2, С 52,17, Н 3,90, N 25,30, найд. С 52,69, Н 3,97, N 25,19. Пример 32. 7-(5-Метилфуран-2-ил)-3-(6-[2-этоксиэтоксиметил]пирид-2-илметил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин. 3-(6-Бромметилпиридин-2-илметил)-7-(5-метил-2-фурил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5 иламин. Указанное в заголовке соединение получали из 7-(5-метил-2-фурил)-1 Н-[1,2,3]триазоло[4,5d]пиримидин-5-иламина и 2,6-бис(бромметил)пиридина при алкилировании аналогично тому, как описано в примере 36. ТСХ (элюент: гексан/EtOAc, 1:1), Rf= 0,28. 1 Н ЯМР Н (400 МГц, ДМСО): 2,46 (3H, s), 4,64 (2 Н, s), 5,75 (2 Н, s), 6,50 (1H, d, J=3,5 Гц), 7,04 (1 Н,d, J=8,0 Гц), 7,31 (2 Н, s), 7,49 (1 Н, d, J=7,5 Гц), 7,80 (1H, t, J=7,5 Гц), 7,88 (1 Н, d, J=3,5 Гц). 3-(6-Этоксиэтоксиметилпиридин-2-илметил)-7-(5-метил-2-фурил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-иламин. Раствор 2-этоксиэтанола (242 мкл, 2,5 ммоль) в безводном ТГФ (15 мл) охлаждали до 0 С и обрабатывали NaH (100 мг, 2,5 ммоль). Реакционную смесь перемешивали при 0 С в течение 10 мин, затем обрабатывали 3-(6-бромметилпиридин-2-илметил)-7-(5-метил-2-фурил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-иламином (100 мг, 0,25 ммоль), перемешивали при КТ в течение 30 мин. Реакцию останавливали при добавлении водного раствора NH4Cl и смесь экстрагировали EtOAc. Объединенные органические фазы сушили (MgSO4) и концентрировали в вакууме. Полученное твердое вещество суспендировали в МеОН (10 мл) и обрабатывали HCl в диоксане (4 М, 2 мл), затем реакционную смесь разбавляли диэтиловым эфиром (40 мл) и полученное твердое вещество отделяли фильтрованием, при этом получали продукт (34 мг, 31%) в виде твердого вещества желтого цвета. 1 Н ЯМР Н (400 МГц, ДМСО): 1,09 (3H, t, J=7,0 Гц), 2,46 (3H, s), 3,42 (2 Н, q, J=7,0 Гц), 3,50 (2 Н, dd,J=5,5 Гц, 3,0 Гц), 3,58 (2 Н, dd, J=5,5 Гц, 4,0 Гц), 4,51 (2 Н, s), 5,73 (2 Н, s), 6,51 (1 Н, dd, J=3,5 Гц, 1,0 Гц),7,03 (1H, d, J=7,5 Гц), 7,29 (2 Н, s), 7,36 (1 Н, t, J=7,5 Гц), 7,88 (1 Н, d, J=3,5 Гц). ИК max (DR)/см-1: 3519, 3296, 3177, 2877, 1625, 1574, 1499, 1433, 1322, 1228, 1112, 1023, 958 и 767. Пример 33. 7-(5-Метилфуран-2-ил)-3-(6-[тетрагидрофуран-2-илметил]оксиметилпирид-2-илметил)3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин. 2-Бромметил-6-(тетрагидрофуран-2-илметоксиметил)пиридин. Указанное в заголовке соединение (19%) получали из 2,6-бис(бромметил)пиридина и (RS)тетрагидрофуран-2-метанола при алкилировании аналогично тому, как описано на последней стадии в примере 32. (М+Н)+ 286, 288. 1 Н ЯМР Н (400 МГц, CDCl3): 7,70 (1 Н, t, J=7,5 Гц), 7,42 (1 Н, d, J=7,5 Гц), 7,33 (1H, d, J=7,5 Гц),- 25018803(RS)-3-6-(Тетрагидрофуран-2-илметоксиметил]пиридин-2-илметил-7-(5-метил-2-фурил)-3H[1,2,3]триазоло[4,5-d]пиримидин-5-иламин. Указанное в заголовке соединение получали из 7-(5-метил-2-фурил)-1 Н-[1,2,3]триазоло[4,5d]пиримидин-5-иламина и 2-бромметил-6-(тетрагидрофуран-2-илметоксиметил)пиридина при алкилировании аналогично тому, как описано в примере 36. (М+Н)+ 422, tпл. 154,2-154,5 С. 1 Н ЯМР H (400 МГц, ДМСО): 7,88 (1 Н, d, J=3,5 Гц), 7,78 (1 Н, t, J=8,0 Гц), 7,36 (1H, d, J=8,0 Гц),7,29 (2 Н, ушир.s), 7,04 (1H, d, J=8,0 Гц), 6,53-6,51 (1H, m), 5,73 (2 Н, s), 4,51 (2 Н, s), 3,98-3,93 (1 Н, m),3,74-3,68 (1H, m), 3,64-3,58 (1 Н, m), 3,45-3,43 (2 Н, m), 2,46 (3H, s), 1,91-1,71 (3H, m), 1,56-1,48 (1 Н, m). ИК max (DR)/см-1: 3334, 3188,2871, 1738, 1652, 1600 и 1419. Пример 34. 7-(5-Метилфуран-2-ил)-3-(6-[тетрагидрофуран-3-илметил]оксиметилпирид-2-илметил)3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин. 2-Бромметил-6-(тетрагидрофуран-3-илметоксиметил)пиридин. Указанное в заголовке соединение (37%) получали из 2,6-бис(бромметил)пиридина и (RS)тетрагидрофуран-3-метанола при алкилировании аналогично тому, как описано на последней стадии в примере 32. (М+Н)+ 286, 288. 1 Н ЯМР Н (400 МГц, CDCl3): 7,70 (1 Н, t, J=8,0 Гц), 7,37-7,33 (2 Н, m), 4,63 (2 Н, s), 4,53 (2 Н, s), 3,893,82 (2 Н, m), 3,77-3,72 (1 Н, m), 3,65-3,61 (1 Н, m), 3,56-3,46 (1 Н, m), 2,66-2,56 (1 Н, m), 2,09-1,99 (1 Н, m),1,69-1,60 (1H, m).(RS)-3-6-(Тетрагидрофуран-3-илметоксиметил]пиридин-2-илметил-7-(5-метил-2-фурил)-3H[1,2,3]триазоло[4,5-d]пиримидин-5-иламин. Указанное в заголовке соединение получали из 7-(5-метил-2-фурил)-1 Н-[1,2,3]триазоло[4,5d]пиримидин-5-иламина и 2-бромметил-6-(тетрагидрофуран-3-илметоксиметил)пиридина при алкилировании аналогично тому, как описано в примере 36. (М+Н)+ 422, tпл. 168,7-168,9C. 1 Н ЯМР H (400 МГц, ДМСО): 7,88 (1 Н, d, J=3,5 Гц), 7,79 (1 Н, t, J=7,5 Гц), 7,34 (1 Н, d, J=7,5 Гц),7,28 (2 Н, ушир.s), 7,06 (1H, d, J=7,5 Гц), 6,51 (1 Н, dd, J=3,5 Гц, 1,0 Гц), 5,73 (2 Н, s), 4,49 (2 Н, s), 3,71-3,55(3H, m), 3,44-3,33 (3H, m), 2,51-2,41 (1 Н, m), 2,46 (3H, s), 1,93-1,84 (1 Н, m), 1,54-1,45 (1H, m). ИК max (DR)/см-1: 3514, 3293, 3171, 2935, 2860, 1610, 1575, 1498 и 1434. Пример 35. 7-(5-Метилфуран-2-ил)-3-(6-[2-изопропилоксиэтилокси]оксиметилпирид-2-илметил)3H-[1,2,3]триазоло[4,5-d]пиримидин-5-амин. 2-Бромметил-6-(изопропилоксиэтоксиметил)пиридин. Указанное в заголовке соединение (28%) получали из 2,6-бис(бромметил)пиридина и 2(изопропилокси)этанола при алкилировании аналогично тому, как описано на последней стадии в примере 32. (М+Н)+ 288, 290. 1[4,5-d]пиримидин-5-иламин. Указанное в заголовке соединение получали из 7-(5-метил-2-фурил)-1H-[1,2,3]триазоло[4,5d]пиримидин-5-иламина и 2-бромметил-6-(изопропилоксиэтоксиметил)пиридина при алкилировании аналогично тому, как описано в примере 36. (М+Н)+ 424, tпл. 127,4-127,6 С. 1 Н ЯМР Н (400 МГц, ДМСО): 7,88 (1 Н, d, J=3,5 Гц), 7,78 (1 Н, t, J=7,5 Гц), 7,37 (1 Н, d, J=7,5 Гц),7,28 (2 Н, ушир.s), 7,03 (1 Н, d, J=7,5 Гц), 6,51 (1H, dd, J=3,5 Гц, 1,0 Гц), 5,73 (2 Н, s), 4,51 (2 Н, s), 3,58-3,47(5 Н, m), 2,46 (3H, s), 1,06 (6 Н, d, J=6,0 Гц). ИК max (DR)/см-1: 3484, 3326, 3210, 2968, 2869, 1640, 1569, 1541, 1512, 1438 и 1416. Пример 36. 7-(5-Метилфуран-2-ил)-3-(6-[1-метокси-1-метилэтил]оксиметилпирид-2-илметил)-3H[1,2,3]триазоло[4,5-d]пиримидин-5-амин. 2-Гидроксиметил-6-(1-гидрокси-1-метилэтил)пиридин. В раствор метилового эфира 2-(гидроксиметил)пиридин-2-карбоновой кислоты (1,0 г, 5,52 ммоль) в ТГФ (15 мл) при перемешивании при 0 С медленно добавляли метилмагнийбромид (1,0 М в толуоле/ТГФ, 3:1, 19,7 мл, 27,6 ммоль), смесь нагревали до КТ и перемешивали в течение 16 ч. Реакционную смесь нейтрализовали водным раствором NH4Cl, распределяли между EtOAc и насыщенным водным раствором NH4Cl, органическую фазу отделяли, сушили (MgSO4), фильтровали и упаривали. Остаток очищали колоночной хроматографией (элюент: EtOAc/изогексан, 1:1), при этом получали указанное в заголовке соединение (530 мг, 58%) в виде бесцветного масла. (М+Н)+ 168. 1 Н ЯМР Н (400 МГц, CDCl3): 7,72 (1 Н, t, J=7,5 Гц), 7,32 (1 Н, d, J=7,5 Гц), 7,19 (1H, d, J=7,5 Гц), 4,79(2 Н, s), 4,42 (1 Н, ушир.s), 3,18 (1H, ушир.s), 1,57 (6 Н, s). 2-трет-Бутилдиметилсилилоксиметил-6-(1-гидрокси-1-метилэтил)пиридин. В раствор 2-гидроксиметил-6-(1-гидрокси-1-метилэтил)пиридина (5,30 г, 31,7 ммоль) и третбутилдиметилсилилхлорида (5,02 г, 33,3 ммоль) в ДМФА (70 мл) при перемешивании добавляли имида- 26018803 зол (2,27 г, 33,3 ммоль) и полученную смесь перемешивали при КТ в течение 16 ч. Смесь выливали в воду, экстрагировали EtOAc, органический слой отделяли, сушили (MgSO4), фильтровали и упаривали,при этом получали указанное в заголовке соединение (8,19 г, 92%) в виде бесцветного масла. (М+Н)+ 282. 1 Н ЯМР Н (400 МГц, CDCl3): 7,74-7,70 (1 Н, m), 7,40-7,38 (1 Н, m), 7,20-7,18 (1 Н, m), 5,34 (1 Н, s),4,83 (2 Н, s), 1,52 (6 Н, s), 0,97 (9 Н, s), 0,13 (6 Н, s). 2-трет-Бутилдиметилсилилоксиметил-6-(1-метокси-1-метилэтил)пиридин. В раствор 2-трет-бутилдиметилсилилоксиметил-6-(1-гидрокси-1-метилэтил)пиридина (2,0 г, 7,12 ммоль) в ДМФА (30 мл) при КТ при перемешивании порциями добавляли NaH (285 мг, 7,12 ммоль). Через 20 мин добавляли метилиодид (1,33 мл, 21,4 ммоль), полученную смесь нагревали до 50 С и перемешивали при указанной температуре в течение 16 ч. Смесь выливали в воду, трижды экстрагировалиEtOAc, объединенные экстракты сушили (MgSO4), фильтровали, упаривали и остаток очищали колоночной хроматографией (элюент: изогексан/EtOAc, градиент от 20:1 до 10:1), при этом получали указанное в заголовке соединение (1,20 г, 57%) в виде бесцветного масла. 1 Н ЯМР Н (400 МГц, CDCl3): 7,69-7,65 (1 Н, m), 7,38-7,34 (2 Н, m), 4,81 (2 Н, s), 3,15 (3H, s), 1,53 (6 Н,s), 0,96 (9 Н, s), 0,12 (6 Н, s). 2-Гидроксиметил-6-(1-метокси-1-метилэтил)пиридин. Раствор 2-трет-бутилдиметилсилилоксиметил-6-(1-метокси-1-метилэтил)пиридина (1,20 г, 4,08 ммоль) в АсОН (45 мл), ТГФ (15 мл) и воде (15 мл) перемешивали при КТ в течение 48 ч. Растворитель удаляли в вакууме, остаток распределяли между ДХМ и насыщенным водным раствором NaHCO3, органический слой отделяли, сушили (MgSO4), фильтровали и упаривали, при этом получали указанное в заголовке соединение (740 мг, 100%) в виде бесцветного масла. 1 Н ЯМР Н (400 МГц, CDCl3): 7,70-7,66 (1 Н, m), 7,48-7,45 (1 Н, m), 7,07-7,04 (1 Н, m), 4,74 (2 Н, d,J=5,0 Гц), 4,14 (1 Н, t, J=5,0 Гц), 3,18 (3H, s), 1,57 (6 Н, s). 2-Бромметил-6-(1-метокси-1-метилэтил)пиридин. В раствор 2-гидроксиметил-6-(1-метокси-1-метилэтил)пиридина (724 мг, 4,00 ммоль) и трифенилфосфина (1,15 г, 4,40 ммоль) в ДХМ (50 мл) при 0 С при перемешивании порциями добавляли тетрабромид углерода (1,59 г, 4,80 ммоль). Полученную смесь перемешивали при 0 С в течение 1 ч, затем концентрировали в вакууме. Остаток очищали колоночной хроматографией (элюент: изогексан/EtOAc, градиент от 20:1 до 5:1), при этом получали указанное в заголовке соединение (732 мг, 75%) в виде бесцветного масла. 1 Н ЯМР Н (400 МГц, CDCl3): 7,69-7,65 (1 Н, m), 7,46-7,43 (1 Н, m), 7,32-7,30 (1H, m), 4,55 (2 Н, s),3,17 (3H, s), 1,55 (6 Н, s). 3-6-(2-Метокси-2-пропил)пиридин-2-илметил-7-(5-метилфуран-2-ил)-3H-[1,2,3]триазоло[4,5d]пиримидин-5-иламин. В суспензию триазола (538 мг, 2,50 ммоль) в ДМФА (10 мл) при 0 С при перемешивании порциями добавляли NaH (100 мг, 2,50 ммоль). Через 15 мин добавляли 2-бромметил-6-(1-метокси-1 метилэтил)пиридин (732 мг, 3,00 ммоль) в ДМФА (3 мл), смесь нагревали до КТ и перемешивали в течение 16 ч. Растворитель удаляли в вакууме, остаток переносили в МеОН и упаривали над диоксидом кремния, очищали колоночной хроматографией (элюент: EtOAc/изогексан, градиент от 1:1 до 2:1), при этом получали указанное в заголовке соединение (280 мг, 30%) в виде твердого вещества грязно-белого цвета. (М+Н)+ 380, tпл. 178,0-178,5 С. 1 Н ЯМР Н (400 МГц, ДМСО): 7,88 (1 Н, d, J=3,0 Гц), 7,76 (1 Н, t, J=7,5 Гц), 7,41 (1 Н, d, J=7,5 Гц),7,24 (2 Н, ушир.s), 7,02 (1H, d, J=7,5 Гц), 6,52-6,50 (1H, m), 5,77 (2 Н, s), 3,01 (3H, s), 2,46 (3H, s), 1,28 (6 Н,s). ИК max (DR)/см-1: 3469, 3317, 3175, 2982, 2932, 2825, 1648, 1568, 1512 и 1436. Пример 37. 7-(5-Метилфуран-2-ил)-3-(6-[2,2,2-трифторэтил]оксиметилпирид-2-илметил)-3H-[1,2,3] триазоло[4,5-d]пиримидин-5-амин. Указанное в заголовке соединение получали из 3-(6-бромметилпиридин-2-илметил)-7-(5-метил-2 фурил)-3H-[1,2,3]триазоло[4,5-d]пиримидин-5-иламина и трифторэтанола аналогично тому, как описано в примере 32. 1(0,5 М в ТГФ, 2,47 мл), затем нагревали до КТ и перемешивали в течение 1 ч. Полученную смесь обрабатывали 7-хлор-3-6-[(S)-(тетрагидрофуран-3-ил)оксиметил]пиридин-2-илметил-3H-[1,2,3]триазоло[4,5d]пиримидин-5-иламином (0,099 г, 0,274 ммоль) и тетракис(трифенилфосфин)палладием(0) (0,016 г,- 27018803 0,014 ммоль), нагревали с обратным холодильником в течение 5 ч, охлаждали, концентрировали в вакууме и очищали хроматографией (SiO2, EtOAc), при этом получали указанное в заголовке соединение(0,024 г, 21%) в виде твердого вещества. МС-ЖХ: (М+Н)+ 411, в.у. 1,89 мин. 1 Н ЯМР Н (400 МГц, d6-ДМСО): 8,28 (1H, d, J=3,0 Гц), 8,17 (1 Н, d, J=3,0 Гц), 7,79 (1 Н, t, J=8,0 Гц),7,50 (2 Н, ушир.s), 7,35 (1H, d, J=8,0 Гц), 7,08 (1 Н, d, J=8,0 Гц), 5,78 (2 Н, s), 4,47 (2 Н, s), 4,22-4,19 (1H, m),3,75-3,60 (4 Н, m), 1,99-1,88 (2 Н, m). Приведенный ниже пример не включен в объем настоящего изобретения. Пример 1(для сравнения). 7-Фенил-3-(6-[2-оксопирролидин-1-ил]пирид-2-илметил)-3H[1,2,3]триазоло[4,5-d]пиримидин-5-амин. 6-Бромпиридин-2-метанол. Раствор 6-бромпиридин-2-карбальдегида (10,00 г, 53,76 ммоль) в МеОН (120 мл) обрабатывали боргидридом натрия (2,04 г, 53,76 ммоль), смесь перемешивали в течение 1 ч и распределяли междуEtOAc и водой. Органическую фазу отделяли, водную фазу повторно экстрагировали этилацетатом. Объединенные органические экстракты сушили (MgSO4) и концентрировали в вакууме, при этом получали указанное в заголовке соединение (9,76 г, 97%) в виде жидкости светло-желтого цвета. МС-ЖХ (М+Н)+ 188 и 190, в.у. 1,52 мин. 1-(6-Гидроксиметилпиридин-2-ил)пирролидин-2-он. Смесь 6-бромпиридин-2-метанола (9,76 г, 51,9 ммоль), иодида меди(I) (0,99 г, 5,19 ммоль), N,N'диметилэтан-1,2-диамина (1,12 мл, 10,38 ммоль), 1,4-диоксана (400 мл) и карбоната калия (14,35 г, 103,84 ммоль) нагревали с обратным холодильником в течение 8 ч, охлаждали, концентрировали в вакууме и распределяли между EtOAc и водой. Органическую фазу отделяли, водную фазу повторно экстрагировали этилацетатом. Объединенные органические экстракты сушили (MgSO4) и концентрировали в вакууме,при этом получали указанное в заголовке соединение (10,19 г, выход количественный) в виде твердого вещества светло-желтого цвета. МС-ЖХ: (М+Н)+ 193, в.у. 1,46 мин. 1 Н ЯМР Н (400 МГц, CDCl3): 8,32 (1 Н, d, J=8,5 Гц), 7,69 (1H, dd, J=8,5, 7,5 Гц), 6,96 (1 Н, dd, J=7,5,1,5 Гц), 4,71 (2 Н, d, J=5,0 Гц), 4,17-4,13 (2 Н, m), 3,50 (1 Н, t, J=5,0 Гц), 2,70-2,66 (2 Н, m), 2,19-2,11 (2 Н, m). 1-(6-Бромметилпиридин-2-ил)пирролидин-2-он. Раствор 1-(6-гидроксиметилпиридин-2-ил)пирролидин-2-она (10,19 г, 53,01 ммоль) в дихлорметане(600 мл) при перемешивании обрабатывали трифенилфосфином (15,29 г, 58,31 ммоль), а затем четырехбромистым углеродом (15,66 г, 58,31 ммоль), перемешивали в течение 1 ч, концентрировали в вакууме и очищали колоночной хроматографией (SiO2, элюент: EtOAc/гексан, 1:1), при этом получали указанное в заголовке соединение (10,19 г) в виде твердого вещества белого цвета, содержащего оксид трифенилфосфина в качестве примеси. (М+Н)+ 255, 257. 1 Н ЯМР Н (400 МГц, d6-ДМСО): в том числе 8,22 (1 Н, d, J=8,5 Гц), 7,81 (1 Н, t, J=7,5 Гц), 7,28 (1 Н,d, J=7,5 Гц), 4,63 (2 Н, s), 3,98 (2 Н, t, J=7,0 Гц), 2,58 (2 Н, t, J=8,0 Гц), 2,08-2,00 (2 Н, m). 1-(6-Азидометилпиридин-2-ил)пирролидин-2-он. Раствор 1-(6-бромметилпиридин-2-ил)пирролидин-2-она (10,19 г, 39,94 моль), содержащего оксид трифенилфосфина в качестве примеси, в ДМФА (80 мл) обрабатывали азидом натрия (2,60 г, 39,94 ммоль),перемешивали в течение 18 ч и распределяли между EtOAc и водой. Органическую фазу отделяли, водную фазу повторно дважды экстрагировали этилацетатом. Объединенные органические экстракты сушили (MgSO4) и концентрировали в вакууме, при этом получали указанное в заголовке соединение в виде масла желтого цвета, содержащего оксид трифенилфосфина в качестве примеси. Продукт использовали на следующей стадии без дополнительной очистки. МС-ЖХ: (М+Н)+ 218, в.у. 2,19 мин. 1-(6-Аминометилпиридин-2-ил)пирролидин-2-он. Раствор неочищенного 1-(6-азидометилпиридин-2-ил)пирролидин-2-она (содержащего оксид трифенилфосфина) в этаноле (100 мл) обрабатывали платиной (5% на угле), перемешивали в атмосфере водорода при 45 С и при атмосферном давлении в течение 18 ч, фильтровали через слой целлита, концентрировали в вакууме, затем упаривали в смеси с толуолом и затем с хлороформом, при этом получали указанное в заголовке соединение (11,32 г) в виде твердого вещества белого цвета, содержащего оксид трифенилфосфина в качестве примеси. МС-ЖХ: (М+Н)+ 192, в.у. 0,66 мин.N-(2-Амино-4-хлор-6-[6-(2-оксопирролидин-1-ил)пиридин-2-илметил]амино]пиримидин-5 ил)формамид. Смесь N-(2-амино-4,6-дихлорпиримидин-5-ил)формамида (3,61 г, 17,43 ммоль), 1-(6 аминометилпиридин-2-ил)пирролидин-2-она (содержащего оксид трифенилфосфина) (10,00 г, приблизительно 50 ммоль) и триэтиламина (4,86 мл, 34,86 ммоль) в пропан-2-оле (100 мл) нагревали с обратным холодильником в течение 18 ч, охлаждали и полученный осадок отделяли фильтрованием, при этом получали указанное в заголовке соединение (3,41 г) в виде твердого вещества грязно-белого цвета. 1 Н ЯМР Н (400 МГц, d6-ДМСО): 9,21 (1 Н, s), 8,20 (1 Н, d, J=1 Гц), 8,12 (1 Н, d, J=8,5 Гц), 7,73 (1 Н, t,J=7,5 Гц), 7,38 (1 Н, t, J=6 Гц), 7,02 (1 Н, d, J=7,5 Гц), 6,45 (2 Н, ушир.s), 4,53 (2 Н, d, J=6,0 Гц), 4,00-3,95 Смесь N-(2-амино-4-хлор-6-[6-(2-оксопирролидин-1-ил)пиридин-2-илметил]аминопиримидин-5 ил)формамида (3,41 г, 9,43 ммоль) в этаноле (36 мл) обрабатывали хлористо-водородной кислотой (6 М, 8 мл), нагревали с обратным холодильником в течение 2 ч, охлаждали и доводили рН до 13 при добавлении водного гидроксида натрия (5 М). Полученную смесь трижды экстрагировали EtOAc, объединенные органические экстракты сушили (Na2SO4) и концентрировали в вакууме, при этом получали указанное в заголовке соединение (2,12 г, 68%) в виде твердого вещества кораллово-розового цвета. МС-ЖХ: (М+Н)+ 334, в.у. 1,64 мин. 1-[6-(5-Амино-7-хлор[1,2,3]триазоло[4,5-d]пиримидин-3-илметил)пиридин-2-ил 1 пирролидин-2-он. Суспензию 1-6-[(2,5-диамино-6-хлорпиримидин-4-иламино)метил]пиридин-2-илпирролидин-2 она (2,10 г, 6,29 ммоль) в ледяной уксусной кислоте (6 мл) и EtOH (24 мл) при 0 С обрабатывали раствором нитрита натрия (0,564 г, 8,17 ммоль) в воде (1,5 мл), перемешивали в течение 2 ч, нагревали до КТ,полученный осадок отделяли фильтрованием и сушили, при этом получали указанное в заголовке соединение (1,67 г, 77%) в виде твердого вещества грязно-белого цвета. МС-ЖХ: (М+Н)+ 345, в.у. 1,99 мин. 1-[6-(5-Амино-7-фенил[1,2,3]триазоло[4,5-d]пиримидин-3-илметил)пиридин-2-ил]пирролидин-2-он. Смесь 1-[6-(5-амино-7-хлор[1,2,3]триазоло[4,5-d]пиримидин-3-илметил)пиридин-2-ил]пирролидин 2-она (0,50 г, 1,45 ммоль) и фенилбороновой кислоты (0,354 г, 2,90 ммоль) в насыщенном водном растворе гидрокарбоната натрия (5 мл) и 1,4-диоксана (20 мл) дегазировали в потоке азота в течение 10 мин,затем обрабатывали тетракис(трифенилфосфин)палладием(0) (0,083 г, 0,0725 ммоль), кипятили с обратным холодильником в течение 2 ч, затем распределяли между EtOAc и водой. Органическую фазу отделяли, водную фазу повторно дважды экстрагировали EtOAc. Объединенные органические экстракты сушили (MgSO4) и концентрировали в вакууме, при этом получали твердое вещество (1,00 г) желтого цвета, которое очищали колоночной хроматографией (SiO2, элюент: EtOAc/гексан, 1:1, затем EtOAc). Полученное твердое вещество (0,68 г) желтого цвета растирали в диэтиловом эфире, при этом получали указанное в заголовке соединение (0,38 г, 68%) в виде твердого вещества грязно-белого цвета. МС-ЖХ:H ЯМР Н (400 МГц, d6-ДМСО): 8,77-8,74 (2 Н, m), 8,19 (1 Н, d, J=8,5 Гц), 7,79 (1 Н, t, J=7,5 Гц), 7,667,65 (2 Н, m), 7,32 (2 Н, ушир.s), 6,96 (1 Н, d, J=7,5 Гц), 5,77 (2 Н, s), 3,67 (2 Н, t, J=7 Гц), 1,99-1,89 (2 Н, m). Биологические методы анализа Связывание с аденозиновым рецептором: аффинность связывания с рецепторами hA1. Соединения анализировали методом анализа in vitro по связыванию с рецепторами аденозина A1 человека при замещении радиоактивного лиганда, селективного к рецептору аденозина А 1, 8 циклопентил-1,3-дипропилксантина ([3H]DPCPX) по стандартной методике (см., например, статью Lohseadenosine receptors, Naunyn Schmiedebergs Arch Pharmacol., 336(2):204-210 (1987), которая в полном объеме включена в настоящее описание в качестве ссылки. Замороженные клетки СНО-K1 (трансфектированные вектором экспрессии рецептора аденозинаA1) гомогенизировали в 130 мл 50 мМ буферного раствора трис-HCl, рН 7,5, содержащего 10 мМ MgCl2 и 0,1 ME аденозиндеаминазы в пеллете, на гомогенизаторе Ultra-Turrax. Полученный гомогенат немедленно использовали для анализа. Анализ связывания проводили в общем объеме реакционной смеси 250 мкл, содержащем 3,0 нМ[3H]DPCPX, мембранную фракцию и дополнительные лекарственные средства. Общее связывание определяли с использованием буферного раствора для разбавления лекарственного средства (50 мМ трисHCl, рН 7,5, 10 мМ MgCl2 и 5% ДМСО). Неспецифическое связывание (НСС) определяли с использованием 300 мкМ N6-циклогексиладенозина (ЦГА). После инкубации в течение 90 мин при 21 С реакцию останавливали при быстром фильтровании через фильтры GF/B (предварительно пропитанные 0,1 мас./об.% полиэтиленимином) в устройстве Canberra Packard filtermate 196, фильтры промывали 3 раза ледяным раствором трис-HCl, рН 7,4. Фильтры сушили в течение ночи, затем в фильтры добавляли сцинтилляционную жидкость микросцинт-0, фильтры выдерживали в течение по крайней мере 2 ч и измеряли радиоактивность на сцинтилляционном счетчике для микропланшет Canberra Packard TopCount. Для определения концентрации свободного лиганда в трех флаконах, содержащих 25 мкл[3H]DPCPX в 4 мл сцинтилляционной жидкости Ultima-Gold MV, определяли радиоактивность в сцинтилляционном счетчике многоцелевого назначения Beckman LS6500. Данные анализировали с использованием 4-параметрического логистического уравнения и нелинейной регрессии, по которому рассчитывали константы аффинности (pIC50) и параметры наклона где Е обозначает величину связывания,[А] обозначает концентрацию конкурирующего соединения,НСС - неспецифическое связывание,- 29
МПК / Метки
МПК: A61K 31/505, C07D 487/04, A61P 25/28
Метки: рецептора, качестве, антагонистов, производные, пуринового, применение, триазоло[4,5-d]пирамидина
Код ссылки
<a href="https://eas.patents.su/30-18803-proizvodnye-triazolo45-dpiramidina-i-ih-primenenie-v-kachestve-antagonistov-purinovogo-receptora.html" rel="bookmark" title="База патентов Евразийского Союза">Производные триазоло[4,5-d]пирамидина и их применение в качестве антагонистов пуринового рецептора</a>
Предыдущий патент: Использование тиазолопиридин-2-илоксифенил- и тиазолопиразин-2-илоксифениламинов в качестве модуляторов лейкотриен а4 гидролазы
Следующий патент: Интерферометрическая система с использованием несущей пространственной частоты, способная к формированию изображений в полихроматическом излучении
Случайный патент: Анкерное устройство












