Производное фенантроиндолизидина и ингибитор nfkb, содержащий его в качестве активного ингредиента
Номер патента: 23622
Опубликовано: 30.06.2016
Авторы: Яегаси Такаси, Хасимото Сусуке, Савада Сейго, Ямазаки Риута, Мацузаки Такеси, Икеда Такаси
Формула / Реферат
1. Соединение формулы (1) или его соль
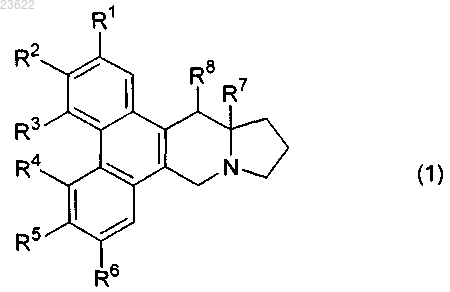
в котором R1 представляет собой атом водорода, (С1-С6)алкильную группу, гидроксильную группу, (C1-С6)алкилоксигруппу или атом галогена;
R2 представляет собой атом водорода, (C1-C6)алкильную группу, атом галогена, (C1-C6)алкилкарбонилоксигруппу, (C1-С6)алкилкарбонилоксигруппу, имеющую один заместитель, выбранный из метоксикарбонильной группы и 6-карбо[(12aS,13S)-13-гидрокси-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-илокси]группы, гетероциклическую карбонилоксигруппу, выбранную из никотиноилоксигруппы, изоникотиноилоксигруппы, пиперидинопиперидинилкарбонилоксигруппы, 2-тиофенкарбонилоксигруппы, 3-тиофенкарбонилоксигруппы, 2-фуроилоксигруппы и 3-фуроилоксигруппы, (C1-С6)алкилоксикарбонилоксигруппу, 2-пропинилоксикарбонилоксигруппу, (C1-C6)алкилзамещенную аминокарбонилоксигруппу, аминогруппу, метансульфонамидную группу, (C1-C6)алкилзамещенную аминогруппу, (C1-С6)алкилзамещенную аминогруппу, замещенную двумя фенильными группами, гетероциклическую группу, выбранную из пирролидинильной группы и пиперидиногруппы, (C1-C6)алкилоксикарбониламиногруппу, (C1-C6)алкилоксикарбониламиногруппу, замещенную одной фенильной группой, (C1-C6)алкилкарбониламиногруппу, трифторацетамидную группу, бензамидную группу, формамидную группу или гидрокси(С1-С6)алкильную группу;
R3 представляет собой атом водорода, (C1-C6)алкильную группу, гидроксильную группу или атом галогена;
R4 представляет собой атом водорода или (С1-С6)алкилоксигруппу;
R5 представляет собой (C1-C6)алкилоксигруппу, атом галогена, гидроксильную группу или метилендиоксигруппу, образованную вместе с R6, или изопропилидендиоксигруппу, образованную вместе с R6;
R6 представляет собой (C1-C6)алкилоксигруппу или метилендиоксигруппу, образованную вместе с R5, или изопропилидендиоксигруппу, образованную вместе с R5;
R7 представляет собой атом водорода или (C1-C6)алкильную группу;
R8 представляет собой атом водорода, гидроксильную группу, аминогруппу, (C1-C6)алкилкарбонилоксигруппу или атом галогена.
2. Соединение или его соль по п.1,
в котором R1 представляет собой атом водорода, метильную группу, гидроксильную группу, метоксигруппу, атом хлора или атом фтора;
R2 представляет собой атом водорода, этильную группу, атом фтора, ацетоксигруппу, пропионилоксигруппу, изобутирилоксигруппу, валероилоксигруппу, 3-метоксикарбонилпропионилоксигруппу, пивалоилоксигруппу, бутирилоксигруппу, 6-карбо[(12aS,13S)-13-гидрокси-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-илокси]гептаноилоксигруппу, никотиноилоксигруппу, изоникотиноилоксигруппу, пиперидинопиперидинилкарбонилоксигруппу, 2-тиофенкарбонилоксигруппу, 3-тиофенкарбонилоксигруппу, 2-фуроилоксигруппу, 3-фуроилоксигруппу, метоксикарбонилоксигруппу, 2-пропинилоксикарбонилоксигруппу, этоксикарбонилоксигруппу, диметиламинокарбонилоксигруппу, аминогруппу, метансульфонамидную группу, дифенилметиламиногруппу, этиламиногруппу, пирролидинильную группу, изобутилоксикарбониламиногруппу, бензилоксикарбониламиногруппу, метоксикарбониламиногруппу, ацетамидную группу, трифторацетамидную группу, бензамидную группу, формамидную группу или гидроксиметильную группу;
R3 представляет собой атом водорода, метильную группу, гидроксильную группу, атом фтора или атом хлора;
R4 представляет собой атом водорода или метоксигруппу;
R5 представляет собой метоксигруппу, этоксигруппу, атом фтора, гидроксильную группу или метилендиоксигруппу, образованную вместе с R6, или изопропилидендиоксигруппу, образованную вместе с R6;
R6 представляет собой метоксигруппу, этоксигруппу или метилендиоксигруппу, образованную вместе с R5, или изопропилидендиоксигруппу, образованную вместе с R5;
R7 представляет собой атом водорода или метильную группу;
R8 представляет собой атом водорода, гидроксильную группу, аминогруппу, ацетоксигруппу или атом фтора.
3. Соединение или его соль по п.1 или 2, в котором соединение формулы (1) имеет конформацию формулы (2)
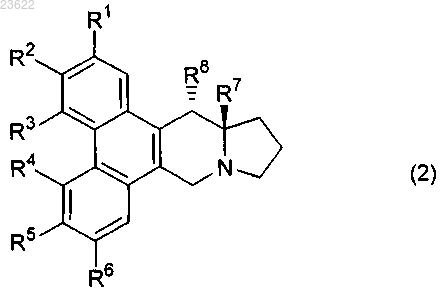
в которой группы R1-R8 являются такими, как указано в п.1 или 2.
4. Соединение или его соль по любому из пп.1-3, в котором соединение формулы (1) является соединением формулы (3)
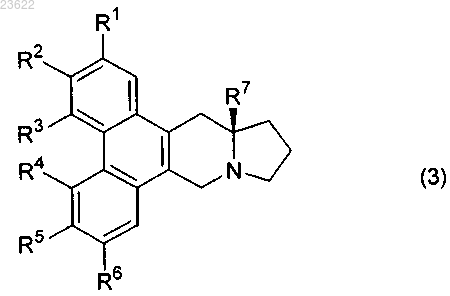
в которой группы R1-R7 являются такими, как указано в п.1 или 2.
5. Соединение или его соль, выбранное из группы, состоящей из
(12aS,13S)-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-13-ола;
(12aR,13R)-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-13-ола;
(12aS,13S)-3-этил-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-13-ола;
(12aR,13R)-3-этил-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-13-ола;
(12aS,13S)-3-фтор-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-13-ола;
(12aR,13R)-3-фтор-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-13-ола;
(12aS,13S)-13-гидрокси-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-илового эфира уксусной кислоты;
(12aS,13S)-3-ацетокси-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-13-илового эфира уксусной кислоты;
(12aS,13S)-13-гидрокси-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-илового эфира изомасляной кислоты;
(12aS,13S)-13-гидрокси-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-илового эфира 2,2-диметилпропионовой кислоты;
(12aS,13S)-13-гидрокси-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-илового эфира никотиновой кислоты;
(12aS,13S)-13-гидрокси-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-илового эфира изоникотиновой кислоты;
(12aS,13S)-13-гидрокси-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-илового эфира [1,4']бипиперидинил-1'-карбоновой кислоты;
(S)-13-фтор-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-илового эфира уксусной кислоты;
(12aS,13S)-13-гидрокси-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-илового эфира пропионовой кислоты;
метилового эфира (12aS,13S)-13-гидрокси-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-илового эфира янтарной кислоты;
метилового эфира (12aS,13S)-13-гидрокси-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-илового эфира карбоновой кислоты;
изобутилового эфира ((12aS,13S)-13-гидрокси-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-ил)карбаминовой кислоты;
(12aS,13S)-13-гидрокси-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-илового эфира тиофен-2-карбоновой кислоты;
(12aS,13S)-13-гидрокси-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-илового эфира фуран-2-карбоновой кислоты;
(12aS,13S)-13-гидрокси-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-илового эфира диметилкарбаминовой кислоты;
(12aS,13S)-13-гидрокси-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-илового эфира фуран-3-карбоновой кислоты;
(12aS,13S)-13-гидрокси-6,7-диметокси-9,10,11,12,12a,13-гексагидро-9а-азациклопента[b]трифенилен-3-илового эфира тиофен-3-карбоновой кислоты;
(12aS,13S)-13-гидрокси-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-илового эфира (9S,12S)-13-гидрокси-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-илового эфира октандионовой кислоты;
(12aS,13S)-3-амино-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-13-ола;
бензилового эфира ((12aS,13S)-13-гидрокси-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-ил)карбаминовой кислоты;
(12aS,13S)-13-гидрокси-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-илового эфира-пропин-2-илового эфира карбоновой кислоты;
(12aS,13S)-13-гидрокси-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-илового эфира этилового эфира карбоновой кислоты;
(12aS,13S)-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-2,13-диола;
(12aS,13S)-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-4,13-диола;
(S)-3-фтор-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилена;
(S)-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилена;
(S)-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-2-ола;
(S)-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-илового эфира уксусной кислоты;
(S)-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-илового эфира 2,2-диметилпропионовой кислоты;
(S)-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-илового эфира метилового эфира янтарной кислоты;
метилового эфира (S)-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-илового эфира карбоновой кислоты;
(S)-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-илового эфира фуран-2-карбоновой кислоты;
(S)-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-илового эфира никотиновой кислоты;
(S)-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента [b]трифенилен-4-ола;
(S)-3-этил-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилена;
изобутилового эфира ((S)-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-ил)карбаминовой кислоты;
(S)-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-илового эфира валериановой кислоты;
(S)-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-илового эфира масляной кислоты;
(S)-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-илового эфира пропионовой кислоты;
(S)-3-амино-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилена;
N-((S)-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-ил)ацетамида;
(S)-6,7-диметокси-3-пирролидин-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилена;
бензгидрил-((S)-6,7-диметокси-3-пирролидин-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-ил)амина;
((S)-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-ил)метанола;
N-((S)-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-ил)-2,2,2-трифторацетамида;
((S)-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-ил)этиламина;
метилового эфира ((S)-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-ил)карбаминовой кислоты;
N-((S)-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-ил)метансульфонамида;
N-((S)-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-ил)формамида и
N-((S)-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-ил)бензамида.
6. Лекарственное средство для предотвращения или лечения заболеваний, связанных с увеличенной активностью транскрипционного ядерного фактора (NFkB), содержащее соединение или его фармацевтически приемлемую соль по любому из пп.1-5 в качестве активного ингредиента.
7. Ингибитор NFkB, содержащий соединение или его фармацевтически приемлемую соль по любому из пп.1-5 в качестве активного ингредиента.
8. Профилактическое или терапевтическое средство для заболеваний, связанных с увеличенной активностью NFkB, содержащее соединение или его фармацевтически приемлемую соль по любому из пп.1-5 в качестве активного ингредиента.
9. Противораковое средство, содержащее соединение или его фармацевтически приемлемую соль по любому из пп.1-5 в качестве активного ингредиента.
10. Фармацевтическая композиция для предотвращения или лечения заболеваний, связанных с увеличенной активностью NFkB, содержащая соединение или его фармацевтически приемлемую соль по любому из пп.1-5 и фармацевтически приемлемый носитель.
11. Применение соединения или его фармацевтически приемлемой соли по любому из пп.1-5 для получения профилактического или терапевтического средства для заболеваний, связанных с увеличенной активностью NFkB.
12. Применение соединения или его фармацевтически приемлемой соли по любому из пп.1-5 для получения противоракового агента.
13. Способ предотвращения или лечения заболеваний, связанных с увеличенной активностью NFkB, включающий введение соединения или его фармацевтически приемлемой соли по любому из пп.1-5.
14. Способ предотвращения или лечения рака, включающий введение соединения или его фармацевтически приемлемой соли по любому из пп.1-5.
Текст
Предложено соединение, обладающее превосходным ингибирующим эффектом ядерного фактора(71)(73) Заявитель и патентовладелец: КАБУСИКИ КАЙСЯ ЯКУЛТ ХОНСА Область техники, к которой относится изобретение Настоящее изобретение относится к ингибитору ядерного фактора B (в дальнейшем, может называться как NFB). Более детально настоящее изобретение относится к новому соединению алкалоида фенантроиндолизидина или его соли, ингибирующему NFB, и лекарственному средству, содержащему их. Уровень техникиNFB существует в виде димера, образованного с помощью различных комбинаций р 50, p65/RelA,c-Rel, Rel-B и р 52, которые все являются членами семейства NFB. Среди них самый известный димер представляет собой гетеродимер, составленный из 50 кДа субъединиц (р 50) и 65 кДа субъединиц (р 65). Обычно этот гетеродимер присутствует в неактивном состоянии в цитоплазме через связывание с ингибитором NFB (IB). Однако, как только клетки стимулируются воспалительными цитокинами,факторами роста клетки и подобными, IB киназа активируется через путь сигнальной трансдукции АКТ и подобное, приводя к фосфорилированию IB. Фосфорилированный IB убиквитинируют и затем разрушают с помощью протеасомы. В результате NFB отделяют от IB и переносят в ядро, где он связывается с NFB восприимчивым элементом для активирования транскрипции различных целевых генов. Целевые гены включают много генов, связанных с воспалением и иммунным ответом (непатентный документ 1), и известно, что активация NFB связана с заболеваниями, такими как ревматоидный артрит,остеоартрит, воспалительное заболевание кишечника, атопический дерматит и астма (непатентный документ 2). Также известно, что различные вирусы, такие как ВИЧ, активируют NFB в клетках хозяина, из которых NFB, как полагают, вносит свой вклад в вирусную инфекцию (непатентные документы 3 и 4). Дополнительно за последнее время известно, что NFB часто конститутивно активируется в различных опухолях, и таким образом полагают, что NFB может быть вовлечен также в индукцию экспрессии различных генов, связанных с развитием рака, такого как канцерогенез, метастаз, антиапоптоз и клеточная пролиферация, и резистентностью к терапии противораковыми агентами (непатентные документы 5 и 6). Дополнительно также известно, что NFB связан с заболеваниями, такими как ишемическая болезнь сердца (непатентный документ 7), болезнь Альцгеймера (непатентный документ 8), пиемия (непатентный документ 9) и метаболический синдром (непатентный документ 10). Соответственно соединение, ингибирующее NFB, пригодно в качестве профилактического или терапевтического агента для хронического воспалительного заболевания, аутоиммунного заболевания, вирусного заболевания, иммунного заболевания, новой терапии рака и других заболеваний, относящихся к активации NFB, и такое соединение активно разрабатывают. Тем временем тилофорин, представленный с помощью следующей формулы (А), и его аналог называют алкалоидом фенантроиндолизидином, который является соединением, главным образом, полученным из растения, принадлежащего семейству Asclepiadaceae (рода Tylophora, Vincetoxicum, Pergularia иCynanchum) (непатентный документ 11). Также некоторые из вышеупомянутых растений, принадлежащих к роду Tylophora, известны в качестве сырьевых материалов для противовоспалительных лекарственных средств, противоастматических лекарственных средств и противоамебных лекарственных средств (непатентный документ 12). Кроме того, известно, что тилофорин проявляет сильную цитотоксическую активность, и также интенсивно проводят исследование его синтетического способа (непатентный документ 13). Дополнительно известно, что наряду с вышеуказанным алкалоидом фенантроиндолизидином тилосребрин, представленный с помощью следующей формулы (В), имеет нейротоксичность (непатентный документ 14). Кроме того, за последнее время известно, что аналоги тилофорина, представленные с помощью следующих формул (С) и (D), постоянно проявляли сильную цитотоксическую активность при исследовании группы клеток опухоли NCI-60, и что механизм действия таких аналогов тилофорина отличается от механизма существующих противоопухолевых агентов (непатентный документ 15). Дополнительно известно, что соединение,представленное следующей формулой (Е), которое представляет собой алкалоид фенантроиндолизидин,полученный из насекомого, проявляет сильную цитотоксическую активность (непатентный документ 16). Кроме того, известно, что алкалоид фенантроиндолизидин ингибирует транскрипцию, опосредованную NFB, который является транскрипционным фактором (непатентный документ 15). Документ известного уровня техники. Непатентные документы. Непатентный документ 1. Am. J. Respir. Cell Mol. Biol. 1997, 17, 3-9. Непатентный документ 2. N. Engl. J. Med. 1997, 336, 1066-1071. Непатентный документ 3. Nature 1987, 326, 711-713. Непатентный документ 4. Semin. Cancer Biol. 1997, 8, 121-129. Непатентный документ 5. Oncogene 1999, 18, 6938-6947. Непатентный документ 6. Cell Death Differ. 2006, 13, 738-747. Непатентный документ 7. Nat Med. 1997, 3, 894-899. Непатентный документ 8. J. Neural Transm. Suppl. 1997, 49, 125-134. Непатентный документ 9. J. Crit Care. 1995, 10, 198-212. Непатентный документ 10. Obes Res. 2004, 12, 180-186. Непатентный документ 11. The Alkaloids, Chemistry and Biological Perspectives 1987, p. 55-132. Непатентный документ 12. Phytochemisty 1990, 3327-3330. Непатентный документ 13. Synthesis 2001, 2365-2378. Непатентный документ 14. Anticancer Agents Based on Natural Product Models 1980, p. 465-487. Непатентный документ 15. Cancer Research 2004, 678-688. Непатентный документ 16. J. Med. Chem. 2001, 1833-1836. Непатентный документ 17. Bioorg. Med. Chem. Lett. 2007, 4338-4342. Сущность изобретения Проблема, которая будет решена в соответствии с изобретением Соответственно задача настоящего изобретения заключается в обеспечении нового соединения, обладающего превосходным NFB ингибирующим действием. Способы решения проблемы Несмотря на то что алкалоид фенантроиндолизидин проявляет сильную цитотоксическую активность и интересный механизм действия, как описано выше, существует очень немного сообщений относительно системной и всесторонней оценки биологической активности, особенно оценки in vivo противоопухолевой активности такого алкалоида (непатентные документы 15 и 17). При таких обстоятельствах авторы настоящего изобретения провели интенсивное исследование,чтобы выполнить вышеупомянутую задачу. В результате обнаружено, что соединение, представленное следующей формулой (1), или его соль обладают превосходной NFB ингибирующей активностью, противоопухолевым действием и противовоспалительным действием, имея немного побочных эффектов и превосходную растворимость, и таким образом являются пригодными в качестве лекарственного средства, такого как противораковый агент, посредством чего осуществляя настоящее изобретение. Таким образом, настоящее изобретение обеспечивает соединение, представленное следующей формулой (1), или его соль: в которой R1 представляет собой атом водорода, (C1-C6)алкильную группу, гидроксильную группу,(C1-C6)алкилоксигруппу или атом галогена;R2 представляет собой атом водорода, (C1-C6)алкильную группу, атом галогена, (C1C6)алкилкарбонилоксигруппу, (С 1,-С 6)алкилкарбонилоксигруппу имеющую один заместитель, выбранный из метоксикарбонильной группы и 6-карбо[(12aS,13S)-13-гидрокси-6,7-диметокси-9,10,11,12,12 а,13 гексагидро-9 а-азациклопента[b]трифенилен-3-илокси]группы, гетероциклическую карбонилоксигруппу,выбранную из никотиноилоксигруппы, изоникотиноилоксигруппы, пиперидинопиперидинилкарбонилоксигруппы, 2-тиофенкарбонилоксигруппы, 3-тиофенкарбонилоксигруппы, 2-фуроилоксигруппы и 3 фуроилоксигруппы, 2-пропинилоксикарбонилоксигруппу, (C1-С 6)алкилоксикарбонилоксигруппу,(C1-C6)алкилзамещенную аминокарбонилоксигруппу, аминогруппу, (C1-C6)алкилзамещенную аминогруппу, замещенную двумя фенильными группами, гетероциклическую группу, выбранную пирролидинильной группы и пиперидиногруппы, (C1-C6)алкилоксикарбониламиногруппу, (C1-С 6)алкилоксикарбониламиногруппу, замещенную одной фенильной группой, (C1-C6)алкилкарбониламиногруппу, трифторацетамидную группу, бензамидную группу, формамидную группу или гидрокси (C1-C6)алкильную группу;R3 представляет собой атом водорода, (C1-C6)алкильную группу, гидроксильную группу или атом галогена;R4 представляет собой атом водорода или (C1-С 6)алкилоксигруппу;R7 представляет собой атом водорода или (C1-C6)алкильную группу;R8 представляет собой атом водорода, гидроксильную группу, аминогруппу, (C1C6)алкилкарбонилоксигруппу или атом галогена. Настоящее изобретение также обеспечивает лекарственное средство, содержащее соединение,представленное вышеупомянутой формулой (1), или его фармацевтически приемлемую соль в качестве активного ингредиента. Настоящее изобретение также обеспечивает фармацевтическую композицию, содержащую соединение, представленное вышеупомянутой формулой (1), или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. Настоящее изобретение дополнительно обеспечивает применение соединения, представленного вышеупомянутой формулой (1), или его фармацевтически приемлемой соли для получения лекарственного средства. Настоящее изобретение дополнительно обеспечивает способ предотвращения или лечения заболеваний, связанных с увеличенной активностью NFB, или рака, характеризующийся введением соединения, представленного вышеупомянутой формулой (1), или его фармацевтически приемлемой соли. Эффекты изобретения. Соединение, представленное формулой (1), или его соль по настоящему изобретению имеет превосходное NFB ингибирующее действие, противоопухолевое действие и противовоспалительное действие, при этом имея немного побочных эффектов и превосходную растворимость, таким образом, оно является пригодным в качестве лекарственного средства, NFB ингибитора, профилактического или терапевтического агента для заболеваний, связанных с увеличенной активностью NFB, включая пролиферацию или метастаз рака, резистентность в отношении противораковых агентов, воспалительное заболевание (ревматоидный артрит, остеоартрит, атопический дерматит, бронхиальная астма, псориаз, воспалительная болезнь кишечника и подобные), сердечно сосудистое заболевание (ишемическая болезнь, сосудистый рестеноз после чрескожной транслюминальной коронарной ангиопластики (ЧТКА) и подобные),фиброз легких, диабет, аутоиммунное заболевание, вирусное заболевание, болезнь Альцгеймера, пиемию, метаболический синдром и подобные. Способ выполнения изобретения. В общей формуле (1) примеры R1 включают атом водорода, (С 1-С 6)алкильную группу, гидроксильную группу, (C1-C6)алкилоксигруппу и атом галогена. Среди них атом водорода, гидроксильная группа или следующие функциональные группы являются наиболее предпочтительными. Примеры (C1-C6)алкильной группы включают алкильную группу с числом углеродов от 1 до 6. Определенные ее примеры включают метильную группу, этильную группу, пропильную группу, бутильную группу, пентильную группу и гексильную группу. Среди них метильная группа является наиболее предпочтительной. Примеры (C1-C6)алкилоксигруппы включают алкилоксигруппу с числом углеродов от 1 до 6. Определенные ее примеры включают метоксигруппу, этоксигруппу, пропоксигруппу, бутоксигруппу, пентилоксигруппу и гексилоксигруппу. Среди них метоксигруппа является наиболее предпочтительной. Кроме того, примеры атома галогена включают атом хлора, атом брома, атом фтора и атом йода. Среди них атом хлора и атом фтора являются наиболее предпочтительными. Таким образом, в общей формуле (1) в качестве R1 атом водорода, метильная группа, гидроксильная группа, метоксигруппа, атом хлора или атом фтора являются наиболее предпочтительными. В общей формуле (1) примеры R2 включают атом водорода, (C1-С 6)алкильную группу, атом галогена, (C1-С 6)алкилкарбонилоксигруппу, (C1-C6)алкилкарбонилоксигруппу, имеющую один заместитель,выбранный из метоксикарбонильной группы и 6-карбо[(12aS,13S)-13-гидрокси-6,7-диметокси 9,10,11,12,12 а,13-гексагидро-9 а-азациклопента[b]трифенилек-3-илокси]группы, гетероциклическую карбонилоксигруппу, выбранную из никотиноилоксигруппы, изоникотиноилоксигруппы, пиперидинопиперидинилкарбонилоксигруппы,2-тиофенкарбонилоксигруппы,3-тиофенкарбонилоксигруппы,2 фуроилоксигруппы и 3-фуроилоксигруппы, 2-пропинилоксикарбонилоксигруппу, (C1-С 6)алкилоксикарбонилоксигруппу, (C1-C6)алкилзамещенную аминокарбонилоксигруппу, аминогруппу, (C1-C6)алкилзамещенную аминогруппу, замещенную двумя фенильными группами, гетероциклическую группу, выбранную пирролидинильной группы и пиперидиногруппы, (C1-C6)алкилоксикарбониламиногруппу,(C1-C6)алкилоксикарбониламинсгруппу, замещенную одной фенильной группой, (C1-C6)алкилкарбониламиногруппу, трифторацетамидную группу, бензамидную группу, формамидную группу или гидрокси (C1-C6)алкильную группу. Среди них атом водорода, формамидная группа или следующие функциональные группы являются наиболее предпочтительными. Примеры (C1-C6)алкильной группы включают алкильную группу с числом углеродов от 1 до 6. Определенные ее примеры включают метильную группу, этильную группу, пропильную группу, бутильную группу, пентильную группу и гексильную группу. Среди них этильная группа является наиболее предпочтительной. Кроме того, примеры атома галогена включают атом хлора, атом брома, атом фтора и атом йода. Среди них атом фтора является наиболее предпочтительным. Примеры (C1-C6)алкилкарбонилоксигруппы, необязательно имеющей заместитель, включают алкилкарбонилоксигруппу с числом углеродов от 1 до 6, необязательно имеющую заместитель. В частности, ацетоксигруппа, пропионилоксигруппа, изобутирилоксигруппа, валероилоксигруппа, 3 метоксикарбонилпропионилоксигруппа, пивалоилоксигруппа, бутирилоксигруппа и 6-карбо[(12aS,13S)13-гидрокси-6,7-диметокси-9,10,11,12,12 а,13-гексагидро-9 а-азациклопента[b]трифенилен-3-илокси]гептаноилоксигруппа являются предпочтительными. Примеры (C1-C6)алкилоксикарбонилоксигруппы включают алкилоксикарбонилоксигруппу с числом углеродов от 1 до 6. Определенные ее примеры включают метоксикарбонилоксигруппу, 2 пропинилоксикарбонилоксигруппу, этоксикарбонилоксигруппу, пропионилоксикарбонилоксигруппу,винилоксикарбонилоксигруппу, пропенилоксикарбонилоксигруппу и этинилоксикарбонилоксигруппу. Среди них метоксикарбонилоксигруппа, 2-пропинилоксикарбонилоксигруппа и этоксикарбонилоксигруппа являются наиболее предпочтительными. Примеры замещенной (C1-C6)алкилом аминокарбонилоксигруппы включают замещенную алкилом аминокарбонилоксигруппу с числом углеродов от 1 до 6. Определенные ее примеры включают диметиламинокарбонилоксигруппу и диэтиламинокарбонилоксигруппу. Среди них диметиламинокарбонилоксигруппа является наиболее предпочтительной. Кроме того, аминогруппа, замещенная двумя фенильными группами, аминогруппа и метансульфонамидная группа являются наиболее предпочтительными. Примеры (C1-C6)алкилоксикарбониламиногруппы, необязательно имеющей заместитель, включают алкилоксикарбониламиногруппу с числом углеродов от 1 до 6, необязательно имеющую заместитель, и алкилоксикарбониламиногруппу с числом углеродов от 1 до 6, необязательно имеющую ароматическую группу. Определенные ее примеры включают изобутилоксикарбониламиногруппу, бензилоксикарбониламиногруппу, метоксикарбониламиногруппу и этоксикарбониламиногруппу. Среди них изобутилоксикарбониламиногруппа, бензилоксикарбониламиногруппа и метоксикарбониламиногруппа являются наиболее предпочтительными. Примеры (C1-C6)алкилкарбониламиногруппы включают алкилкарбониламиногруппу с числом углеродов от 1 до 6. Определенные ее примеры включают ацетамидную группу, пропиониламидную груп-4 023622 пу, бутириламидную группу, трифторацетамидную группу и бензамидную группу. Среди них ацетамидная группа, трифторацетамидная группа и бензамидная группа являются предпочтительными. Примеры гидрокси (C1-C6)алкильной группы включают гидроксиалкильную группу с числом углеродов от 1 до 6. Определенные ее примеры включают гидроксиметильную группу и гидроксиэтильную группу. Среди них гидроксиметильная группа является наиболее предпочтительной. Таким образом, в общей формуле (1) в качестве R2 атом водорода, этильная группа, атом фтора,ацетоксигруппа,пропионилоксигруппа,изобутирилоксигруппа,валероилоксигруппа,3 метоксикарбонилпропионилоксигруппа, пивалоилоксигруппа, бутирилоксигрупла, 6-карбо[(12aS,13S)13-гидрокси-6,7-диметокси-9,10,11,12,12 а,13-гексагидро-9 а-азациклопента[b]трифенилен-3-илокси]гептаноилоксигруппа, никотиноилоксигруппа, изоникотиноилоксигруппа, пиперидинопиперидинилкарбонилоксигруппа, 2-тиофенкарбонилоксигруппа, 3-тиофенкарбонилоксигруппа, 2-фуроилоксигруппа, 3 фуроилоксигруппа, метоксикарбонилоксигруппа, 2-пропинилоксикарбонилоксигруппа, этоксикарбонилоксигруппа, диметиламинокарбонилоксигруппа, аминогруппа, метансульфонамидная группа, дифенилметиламиногруппа, этиламиногруппа, пирролидинильная группа, изобутилоксикарбониламиногруппа,бензилоксикарбониламиногруппа, метоксикарбониламиногруппа, ацетамидная группа, трифторацетамидная группа, бензамидная группа, формамидная группа или гидроксиметильная группа являются наиболее предпочтительными. В общей формуле (1) примеры R3 включают атом водорода, (C1-С 6)алкильную группу, гидроксильную группу и атом галогена. Среди них атом водорода, гидроксильная группа или следующие функциональные группы являются наиболее предпочтительными. Примеры (C1-С 6)алкильной группы включают алкильную группу с числом углеродов от 1 до 6. Определенные ее примеры включают метильную группу, этильную группу, пропильную группу, бутильную группу, пентильную группу и гексильную группу. Среди них метильная группа является наиболее предпочтительной. Примеры атома галогена включают атом фтора, атом хлора, атом брома и атом йода. Среди них атом фтора и атом хлора являются наиболее предпочтительными. Таким образом, в общей формуле (1) в качестве R3 атом водорода, метильная группа, гидроксильная группа, атом фтора или атом хлора является наиболее предпочтительным. В общей формуле (1) примеры R4 включают атом водорода и (C1-С 6)алкилоксигруппу. Среди них атом водорода или следующие функциональные группы являются наиболее предпочтительными. Примеры (C1-С 6)алкилоксигруппы включают алкилоксигруппу с числом углеродов от 1 до 6. Определенные ее примеры включают метоксигруппу, этоксигруппу, пропоксигруппу, бутоксигруппу, пентилоксигруппу и гексилоксигруппу. Среди них метоксигруппа является наиболее предпочтительной. Таким образом, в общей формуле (1) в качестве R4 атом водорода или метоксигруппа является наиболее предпочтительной. В общей формуле (1) примеры R5 включают (C1-С 6)алкилоксигруппу, атом галогена, гидроксильную группу, метилендиоксигруппу, образованную вместе с R6, и изопропилидендиоксигруппу, образованную вместе с R6, и среди них атом водорода, гидроксильная группа, метилендиоксигруппа, образованная вместе с R6, и изопропилидендиоксигруппа, образованная вместе с R6, или следующие функциональные группы являются наиболее предпочтительными. Примеры (C1-С 6)алкилоксигруппы включают алкилоксигруппу с числом углеродов от 1 до 6. Определенные ее примеры включают метоксигруппу, этоксигруппу, пропоксигруппу, бутоксигруппу, пентилоксигруппу и гексилоксигруппу, из которых метоксигруппа и этоксигруппа являются наиболее предпочтительными. Кроме того, примеры атома галогена включают атом хлора, атом брома, атом фтора и атом йода, и среди них атом фтора является наиболее предпочтительным. Таким образом, в общей формуле (1) в качестве R5 метоксигруппа, этоксигруппа, атом фтора, гидроксильная группа, метилендиоксигруппа, образованная вместе с R6, или изопропилидендиоксигруппа,образованная вместе с R6, является наиболее предпочтительной. В общей формуле (1) примеры R6 включают (C1-С 6)алкилоксигруппу, метилендиоксигруппу, образованную вместе с R5, или изопропилидендиоксигруппу, образованную вместе с R5, и среди них атом водорода, метилендиоксигруппа, образованная вместе с R5, изопропилидендиоксигруппа, образованная вместе с R5, или следующие функциональные группы являются наиболее предпочтительными. Примеры (C1-С 6)алкилоксигруппы включают алкилоксигруппу с числом углеродов от 1 до 6. Определенные ее примеры включают метоксигруппу, этоксигруппу, пропоксигруппу, бутоксигруппу, пентилоксигруппу и гексилоксигруппу, и среди них метоксигруппа и этоксигруппа являются наиболее предпочтительными. Таким образом, в общей формуле (1) в качестве R6 метоксигруппа, этоксигруппа, метилендиоксигруппа, образованная вместе с R5, или изопропилидендиоксигруппа, образованная вместе с R5, является наиболее предпочтительной. В общей формуле (1) примеры R7 включают атом водорода и (C1-С 6)алкильную группу, и среди них атом водорода или следующие функциональные группы являются наиболее предпочтительными. Примеры (C1-С 6)алкильной группы включают алкильную группу с числом углеродов от 1 до 6. Определенные ее примеры включают метильную группу, этильную группу, пропильную группу, бутильную группу, пентильную группу и гексильную группу, и среди них метильная группа является наиболее предпочтительной. Таким образом, в общей формуле (1) в качестве R7 атом водорода или метильнач группа является наиболее предпочтительной. В общей формуле (1) примеры R8 включают атом водорода, гидроксильную группу, аминогруппу,(C1-С 6)алкилкарбонилоксигруппу и атом галогена. В частности, атом водорода, гидроксильная группа,аминогруппа или следующие функциональные группы являются наиболее предпочтительными. Примеры (C1-С 6)алкилкарбонилоксигруппы включают алкилкарбонилоксигруппу с числом углеродов от 1 до 6. Определенные ее примеры включают ацетоксигруппу, пропионилоксигруппу и бутирилоксигруппу, и среди них ацетоксигруппа является наиболее предпочтительной. Кроме того, примеры атома галогена включают атом хлора, атом брома, атом фтора и атом йода, и среди них атом фтора является наиболее предпочтительным. Таким образом, в общей формуле (1) в качестве R8 атом водорода, гидроксильная группа, аминогруппа, ацетоксигруппа или атом фтора является наиболее предпочтительным. Соединение общей формулы (1), в которой R1 представляет собой атом водорода; R2 представляет собой ацетоксигруппу или 3-метоксикарбонилпропионилоксигруппу; R3 представляет собой атом водорода; R4 представляет собой атом водорода; R5 представляет собой метоксигруппу; R6 представляет собой метоксигруппу; R7 представляет собой атом водорода и R8 представляет собой атом водорода или гидроксильную группу, является наиболее предпочтительным. В настоящем изобретении соединение вышеупомянутой формулы (1) имеет два стереоцентра (атомы углерода, у которых R7 и R8 замещены). Поскольку эти стереоцентры могут иметь или Rконфигурацию, или S-конфигурацию, возможны четыре вида стереоизомеров. Однако все такие стереоизомеры и смеси различных комбинаций стереоизомеров охвачены объемом настоящего изобретения. Примеры изомеров включают (конфигурацию, в которой R7=S, R8=S), (конфигурацию, в которой 7R =R, R8=R), (конфигурацию, в которой R7=S, R8=R) и (конфигурацию, в которой R7=R, R8=S); и среди них (конфигурация, в которой R7=S, R8=S) является наиболее предпочтительной, поскольку соединение,имеющее такую конфигурацию, сильно ингибирует NFB, не вызывая нежелательных побочных эффектов. В настоящем изобретении соединение следующей формулы (2) или его фармацевтически приемлемая соль является более предпочтительным, поскольку такое соединение или соль сильно ингибируетNFB, не вызывая нежелательных побочных эффектов, в которой R1, R2, R3, R4, R5, R6, R7 и R8 являются такими же, как описано выше. В настоящем изобретении соединение следующей формулы (3) или его фармацевтически приемлемая соль дополнительно является предпочтительным, поскольку такое соединение или соль сильно ингибирует NFB, не вызывая нежелательных побочных эффектов, в которой R1, R2, R3, R4, R5, R6 и R7 являются такими же, как описано выше. В настоящем изобретении определенные примеры наиболее предпочтительного соединения или его соли включают соединение, выбранное из группы, состоящей из В настоящем изобретении соль соединения, представленного общими формулами (1)-(3), может быть фармацевтически приемлемой солью. Примеры ее включают соль неорганической кислоты, такую как гидрохлорид, сульфат, фосфат, гидробромат, гидройодид, нитрат, пиросульфат и метафосфат; соль органической кислоты, такую как цитрат, оксалат, бензоат, ацетат, трифторацетат, пропионат, сукцинат,фумарат, лактат, малеат, тартрат, глутарат, цитрат, сульфонат (например, метансульфонат, птолуолсульфонат и нафталинсульфонат); и соль металла, такую как соль лития, соль натрия, соль калия,соль магния и соль кальция. Соединение по настоящему изобретению можно получить, например, в соответствии со следующей формулой реакции (соединение, в котором R7=Н, R8=ОН (соединение j), и соединение, в котором в которой группы от R1 до R6 представляют собой группы, как упомянуто выше, или если существует функциональная группа, включенная в реакцию, такая группа может быть соответственно защищенной. Таким образом, бензальдегид взаимодействовал с бензилцианидом для получения соединения (а),которое циклизовали для получения соединения (b). В дальнейшем восстанавливали цианогруппу, в результате чего получали альдегид (с). Затем восстанавливали карбонильную группу для получения спирта(d), который бромировали для получения соединения (е). В дальнейшем соединение (е) взаимодействовало с эфиром глутаминовой кислоты с последующей циклизацией, в результате чего получали соединение (f). Соединение (f) гидролизовали для получения соединения (g), из которого получали соединение(h) путем внутримолекулярного ацилирования. И затем восстанавливали карбонильную группу для получения соединения (i) с последующим восстановлением лактама, в результате чего получали фенантроиндолизидин (j), содержащий гидроксильную группу при R8. Гидроксильную группу при R8 соединения(i) удаляли при помощи восстановления для получения (k) с последующим восстановлением лактама, в результате чего получали фенантроиндолизидин (l), содержащий атом водорода при R8. Взаимодействие бензальдегида с бензилцианидом предпочтительно проводят в спирте в присутствии основания. На этой стадии определенные примеры основания включают метоксид натрия и этоксид натрия. Циклизацию соединения (а) предпочтительно проводят с помощью фотооблучения в присутствии йода и пропиленоксида. Кроме того, могут применять реакцию циклизации, включающую обработку ванадием (V) или таллием (III). Восстановление соединения (b) предпочтительно проводят при взаимодействии с диизобутилалю- 11023622 миния гидридом. Кроме того, восстановление соединения (с) предпочтительно проводят при взаимодействии с боргидридом натрия. Бромирование соединения (d) предпочтительно проводят при взаимодействии с трибромидом фосфора в присутствии триэтиламина. Кроме того, бромирование могут проводить, позволяя действовать тетрабромиду углерода в присутствии трифенилфосфина. Аминирование-лактамизацию соединения (е) с диизопропиловым эфиром L-глутаминовой кислоты предпочтительно проводят в растворителе, таком как диметилформамид, в присутствии основания, такого как карбонат калия, и позволяя кислоте, такой как уксусная кислота, действовать на результирующий аминированный продукт в спирте, таком как метанол. На этой стадии, когда используют диизопропиловый эфир D-глутаминовой кислоты, получают соответствующий энантиомер. Гидролиз соединения (f) предпочтительно проводят, используя основание в растворителе, таком как метанол. На этой стадии определенные примеры основания включают гидроксид калия и гидроксид натрия. Внутримолекулярную реакцию по Фриделю-Крафтсу соединения (g) предпочтительно проводят в растворителе, таком как метиленхлорид, превращая соединение (g) в кислотный хлорид с помощью оксалилхлорида в пределах системы, с последующей обработкой с помощью кислоты Льюиса. На этой стадии определенные примеры кислоты Льюиса включают хлорид олова и хлорид алюминия. Восстановление соединения (h) предпочтительно проводят при использовании восстанавливающего агента, такого как боргидрид натрия и три-втор-бутил боргидрид лития. Для стереоселективного восстановления предпочтительно проводят восстановление при использовании восстанавливающего агента,такого как три-втор-бутил боргидрид лития. Восстановление лактама соединения (i) предпочтительно проводят при использовании восстанавливающего агента, такого как боран и алюмогидрид лития. Восстановление гидроксильной группы соединения (i) предпочтительно проводят при комбинации кислоты и восстанавливающего агента. В качестве кислоты предпочтительными являются трифторуксусная кислота, комплекс трифторид бора-диэтиловый эфир и подобные. В качестве восстанавливающего агента предпочтительным является триэтилсилан. Восстановление лактама соединения (k) предпочтительно проводят при использовании восстанавливающего агента, такого как боран и алюмогидрид лития. В следующих примерах будет показано, что соединение, представленное формулой (1), или его соль обладает превосходным NFB ингибирующим действием и противоопухолевым действием. Соответственно соединение или его фармацевтически приемлемая соль по настоящему изобретению является пригодным в качестве лекарственного средства, NFB ингибитора, противоракового агента(пролиферация или метастаз рака) и профилактического или терапевтического агента для заболеваний,связанных с увеличенной активностью NFB, включая резистентность в отношении противораковых агентов, воспалительное заболевание (ревматоидный артрит, остеоартрит, атопический дерматит, бронхиальная астма, псориаз, воспалительная болезнь кишечника и подобные), сердечнососудистое заболевание (ишемическая болезнь, сосудистый рестеноз после чрескожной аранслюминальной коронарной ангиопластики (ЧТКА) и подобные), фиброз легких, диабет, аутоиммунное заболевание, вирусное заболевание, болезнь Альцгеймера, сепсис, метаболический синдром и подобные. В настоящем изобретении не накладывают никакое определенное ограничение на "NFB ингибитор", пока он имеет ингибирующее действие на NFB. Более определенно, NFB ингибитор показывает величину IC50 ингибирующего действия на NFB предпочтительно 2000 нг/мл или менее, более предпочтительно 500 нг/мл или менее и наиболее предпочтительно 100 нг/мл или менее, как измерено с помощью способа примера 1, описанного ниже. Кроме того, NFB ингибитор показывает величину IC50 ингибирующего действия на пролиферацию раковых клеток предпочтительно 2000 нг/мл или менее, более предпочтительно 500 нг/мл или менее и наиболее предпочтительно 100 нг/мл или менее, как измерено с помощью способа примера 2, описанного ниже. При использовании соединения, представленного формулой (1), или его фармацевтически приемлемой соли в качестве лекарственного средства, один вид соединения или его фармацевтически приемлемой соли можно использовать отдельно или многие его виды могут использовать в комбинации. Дополнительно соединение, представленное формулой (1), или его фармацевтически приемлемую соль можно также использовать в комбинации с другими терапевтически предпочтительными соединениями,и механизм действия этих терапевтически предпочтительных соединений может быть одинаковым или отличным от механизма действия соединения по настоящему изобретению. При использовании соединения по настоящему изобретению в качестве лекарственного средства его можно вводить в любой лекарственной форме. Примеры ее включают перорально вводимое средство,такое как таблетка, капсула, гранула, покрытая сахаром таблетка, пилюля, мелкодисперсная гранула,порошок, пылевой состав, состав с замедленным высвобождением, суспензия, эмульсия, сироп, эмульгированный состав, лиофилизированный препарат, жидкость и эликсир; и парентерально вводимое средст- 12023622 во, включая инъекцию, такую как внутривенная инъекция, внутримышечная инъекция, подкожная инъекция или капельная инфузия, средство для наружного применения, такое как внутрикожная жидкая мазь или пластырь, суппозитория, инфузионный раствор, подкожное средство, трансмукозальное средство,назальное средство, ингалятор, болюс и подобные. Дополнительно, при использовании соединения в качестве лекарственного средства, лекарственное средство можно получить с помощью стандартного способа, в котором соединение, представленное формулой (1), или его фармацевтически приемлемую соль по настоящему изобретению можно использовать отдельно или в комбинации с фармацевтически приемлемым носителем. Примеры фармацевтически приемлемого носителя включают эксципиент, связующее вещество, дезинтегрирующее вещество, поверхностно-активное вещество, смазывающее вещество, способствующее текучести вещество, корригирующее вещество, краситель, ароматизатор, разбавитель, дезинфицирующее вещество, регулирующее осмотическое давление вещество, регулирующее рН вещество, эмульгирующее вещество, консервант,стабилизатор, улучшающее абсорбцию вещество, антиоксидант, поглотитель ультрафиолетовых лучей,увлажняющее вещество, усиливающее вязкость вещество, глазирователь, усиливающее активность вещество, противовоспалительный агент, регулирующее тоничность вещество, успокаивающее средство и ароматизатор. Примеры связующего вещества включают крахмал, декстрин, порошковую аравийскую камедь, желатин, гидроксипропил крахмал, метилцеллюлозу, карбоксиметилцеллюлозу натрия, гидроксипропилцеллюлозу, кристаллическую целлюлозу, этилцеллюлозу, поливинилпирролидон и макрогол. Примеры дезинтегрирующего вещества включают крахмал, гидроксипропил крахмал, карбоксиметилцеллюлозу натрия, карбоксиметилцеллюлозу кальция, карбоксиметилцеллюлозу, низко-замещенную гидроксипропилцеллюлозу. Примеры поверхностно-активного вещества включают лаурилсульфат натрия, соевый лецитин,эфир жирной кислоты сахарозы и полисорбат 80. Примеры смазывающего вещества включают тальк, воски, гидрогенизированное растительное масло, эфир жирной кислоты сахарозы, стеарат магния, стеарат кальция, стеарат алюминия и полиэтиленгликоль. Примеры вещества, способствующего текучести, включают легкую безводную кремниевую кислоту, высушенный гель гидроксида алюминия, синтезированный силикат алюминия и силикат магния. Примеры разбавителя включают дистиллированную воду для инъекции, физиологический солевой раствор, водный раствор глюкозы, оливковое масло, кунжутное масло, арахисовое масло, соевое масло,кукурузное масло, пропиленгликоль и полиэтиленгликоль. Дополнительно, при систематическом введении лекарственного средства, содержащего соединение,представленное формулой (1), или его фармацевтически приемлемую соль в качестве активного ингредиента, предпочтительная лекарственная форма представляет собой инъекцию или перорально вводимый агент, и в качестве инъекции внутривенная инъекция является наиболее предпочтительной. В этом случае лекарственное средство можно вводить через другие пути инъекции, такие как подкожная, внутримышечная или внутрибрюшинная инъекция, или лекарственное средство можно вводить трансмукозально или подкожно, используя проникающее вещество, такое как соль желчной кислоты, или фуксинсернистая кислота, или другие поверхностно-активные вещества. Вышеупомянутое введение фармацевтической композиции можно применять местно или в форме мази, пасты, геля и подобного. Кроме того, ингибитор NFB по настоящему изобретению можно использовать не только в качестве фармацевтических продуктов, как описано выше, но также в качестве пищевых продуктов, напитков и подобного. В этом случае соединение алкалоида фенантроиндолизидина или его фармацевтически приемлемая соль по настоящему изобретению могут содержаться в пищевых продуктах и напитках как есть или вместе с различными пищевыми компонентами. Пищевые продукты и напитки, полученные таким образом, можно применять в качестве пищевых продуктов для здорового использования или пищевых продуктов, которые являются пригодными для облегчения симптомов, предотвращения и т.д. пролиферации или метастаза рака, резистентности в отношении противораковых агентов, воспалительного заболевания (ревматоидный артрит, остеоартрит, атопический дерматит, бронхиальная астма, псориаз, воспалительная болезнь кишечника и подобные), сердечно-сосудистого заболевания (ишемическая болезнь,сосудистый рестеноз после чрескожной транслюминальной коронарной ангиопластики (ЧТКА) и подобные), фиброза легких, диабета, аутоиммунного заболевания, вирусного заболевания, болезни Альцгеймера, сепсиса, метаболического синдрома и подобного. Эти пищевые продукты и напитки или их содержание могут показать, что пищевые продукты и напитки проявляют вышеупомянутые эффекты. Определенно, при добавлении NFB ингибитора по настоящему изобретению к пищевым продуктам и напиткам при желании они могут быть сформированы в форму, подходящую для приема пищи, например гранула,зерно, таблетка, капсула и паста, с помощью стандартных способов, используя добавки, разрешенные для использования в пищевых продуктах и напитках. Кроме того, NFB ингибитор по настоящему изобретению можно добавить к различным пищевым продуктам, например обработанное мясо, такое как ветчина и колбаса, обработанные морепродукты, такие как приготовленный рыбный фарш или рыбная колбаса, хлеб, кондитерские изделия, масло, сухое молоко и ферментированные пищевые продукты и напитки, или NFB ингибитор по настоящему изобретению также можно добавить к напиткам, таким как вода, фруктовый сок, молоко, безалкогольный напиток и чай. Следует отметить, что пищевые продукты и напитки также включают корма для животных. Дополнительно, в качестве пищевых продуктов и напитков предпочтительно применяют ферментированные молочные продукты, такие ферментированное молоко, ферментированные бактериальные напитки, ферментированное соевое молоко, ферментированный фруктовый сок и ферментированный овощной сок, содержащие соединение алкалоида фенантроиндолизидина или его фармацевтически приемлемую соль в качестве активного ингредиента. Эти ферментированные молочные продукты и напитки можно получить с помощью стандартного способа. Например, ферментированное молоко получают при посеве кисломолочных бактерий и бифидобактерий в стерилизованную молочную среду и культивировании их, и подвергая результирующий продукт гомогенизационной обработке для получения ферментированного молочного основания. В дальнейшем в отдельно приготовленный раствор сиропа добавляют соединение алкалоида фенантроиндолизидина или его фармацевтически приемлемую соль и смешивают, и результирующий продукт гомогенизируют, используя гомогенизатор и подобное, и затем добавляют ароматизатор для получения конечного продукта. Ферментированные молочные продукты и напитки, полученные таким способом, можно также обеспечить в форме, например, любого не содержащего добавок типа, мягкого типа, ароматизированного фруктами типа, твердых и жидких продуктов. Никакое строгое ограничение не накладывают на размер дозировки соединения алкалоида фенантроиндолизидина или его фармацевтически приемлемой соли, которое является активным ингредиентомNFB ингибитора по настоящему изобретению. Поскольку достигнутые эффекты изменяются в зависимости от различных особенностей использования, включая объект введения, симптом и подобное, размер дозировки желательно определять для каждого случая, и размер дозировки соединения алкалоида фенантроиндолизидина или его фармацевтически приемлемой соли представляет собой предпочтительно от 1 мг до 10 г, более предпочтительно от 10 мг до 1 г в сутки. Кроме того, NFB ингибитор по настоящему изобретению можно применять ко всем видам млекопитающих, включая человека. Примеры Настоящее изобретение будет дополнительно изложено подробно с помощью примеров, как описано ниже, но настоящее изобретение этим не ограничивается. Алкалоид фенантроиндолизидин по настоящему изобретению синтезировали в соответствии со схемой реакции, включая следующие стадии 1-10. Когда любой из заместителей, представленных R, необходимо было защитить для протекания реакции, использовали соответствующую защитную группу для проведения реакции. Пример синтеза 1. Синтезировали соединение, содержащее следующие группы при R1-R6. Проведение стадий от 1 до 10 будет описано ниже. Таблица 1 Соединение 1 Стадия 1. Синтез стильбена. В круглодонной колбе 380 мг (5,64 ммоль, 0,1 экв.) этоксида натрия добавляли к суспензии 10,0 г(56,43 ммоль) 3,4-диметоксибензилцианида и 5,99 г (56,43 ммоль, 1,0 экв.) бензальдегида в 150 мл этанола под атмосферой аргона при комнатной температуре при перемешивании и результирующую смесь нагревали с обратным холодильником (масляная баня температура: 85 С). После 3 ч подтверждали исчезновение исходных продуктов и результирующую реакционную жидкость охлаждали на льду для осаждения твердого вещества. Затем собирали с помощью фильтрования с отсасыванием, используя воронку Бюхнера и фильтровальную колбу, твердое вещество, которое затем дважды промывали 100 мл метанола. Твердое вещество высушивали под пониженным давлением при 60 С с получением 13,70 г (92%) светло-желтого порошка. 1H-ЯМР (400 МГц, CDCl3) : 3,94 (с, 3 Н), 3,97 (с, 3 Н), 6,93 (д, J=8,8 Гц, 1 Н), 7,16 (д, J=2,4 Гц, 1 Н),7,27 (дд, J=8,8, 2,4 Гц, 1 Н), 7,39-7,49 (м, 3 Н), 7,44 (с, 1 Н), 7,83-7,92 (м, 2 Н). Стадия 2. Синтез фенантрена с помощью фотоинициированной электроциклической реакции. В контейнере для фотореакции аргон вводили в раствор 5,5 г (20,75 ммоль) стильбена в 7 л ацетонитрила при комнатной температуре при перемешивании. После 10 мин добавляли 5,2 7 г (20,75 ммоль,1,0 экв.) йода и 58 мл (830 ммоль, 40 экв.) пропиленоксида с последующим облучением светом при комнатной температуре при перемешивании. После 72 ч облучения подтверждали исчезновение исходных продуктов и результирующую реакционную жидкость концентрировали. Остаточный продукт растворяли в 500 мл хлороформа с последующим промыванием 1 л насыщенного тиосульфата натрия и 500 мл солевого раствора. Органический слой высушивали над сульфатом магния, и затем растворитель отгоняли под пониженным давлением с получением твердого вещества. Собирали с помощью фильтрования с отсасыванием, используя воронку Бюхнера и фильтровальную колбу, твердое вещество, которое затем дважды промывали 50 мл метанола. Твердое вещество высушивали под пониженным давлением при 60 С с получением 4,70 г (86,0%) светло-коричневого порошка. Н-ЯМР (400 МГц, CDCl3) : 4,11 (с, 3 Н), 4,14 (с, 3 Н), 7,56-7,66 (м, 2 Н), 7,72-7,82 (м, 1 Н), 7,92 (д,J=8,3 Гц, 1 Н), 8,01 (с, 1 Н), 8,17 (с, 1 Н), 8,54 (д, J=8,3 Гц, 1 Н). Стадия 3. Восстановление цианогруппы с помощью гидрида диизобутилалюминия. В круглодонной колбе 14,8 мл 1,0 М раствора гидрида диизобутилалюминия в метиленхлориде(14,8 ммоль, 1,3 экв.) добавляли по каплям к раствору 3,0 г (11,41 ммоль) цианида в 200 мл метиленхлорида под атмосферой аргона при перемешивании с охлаждением на льду. В течение добавления по каплям смесь превратилась в желтую суспензию. Суспензию перемешивали в течение 1 ч на льду и затем в течение 3 ч при комнатной температуре, после этого подтверждали исчезновение исходных продуктов. Результирующую реакционную жидкость охлаждали на льду, к которой медленно добавляли 100 мл 10% соляной кислоты. Реакционная жидкость превращалась в суспензию, которую растворяли в растворе хлороформ-метанол=4:1. Органический слой отделяли, и водный слой экстрагировали раствором хлороформ-метанол=4:1. Органический слой объединяли и результирующую смесь высушивали над сульфатом магния. Затем растворитель отгоняли под пониженным давлением с получением 2,38 г (78%) желтого твердого вещества. 1 Н-ЯМР (400 МГц, CDCl3) : 4,12 (с, 3 Н), 4,14 (с, 3 Н), 7,60-7,66 (м, 1 Н), 7,76-7,84 (м, 1 Н), 8,03 (с,1 Н), 8,02-8,07 (м, 1 Н), 8,19 (с, 1 Н), 8,54-8,57 (м, 1 Н), 8,98 (с, 1 Н), 10,33 (с, 1 Н). Стадия 4. Восстановление альдегида с помощью боргидрида натрия. В колбе для восстановления 344 мг (9,10 ммоль, 1,1 экв.) боргидрида натрия добавляли к суспензии 2,2 г (8,27 ммоль) альдегида в 40 мл метанола и 80 мл 1,4-диоксана под атмосферой аргона при перемешивании с охлаждением на льду. После 1 ч подтверждали исчезновение исходных продуктов и к результирующей реакционной жидкости добавляли 100 мл солевого раствора. Далее добавляли раствор хлороформ-метанол=4:1 для получения завершенного раствора. И затем органический слой отделяли, и водный слой экстрагировали раствором хлороформ-метанол=4:1. Органический слой объединяли и результирующую смесь высушивали над сульфатом магния. Затем растворитель отгоняли под пониженным давлением с получением 2,04 г (92%) светло-коричневого твердого вещества. 1 Н-ЯМР (400 МГц, CDCl3) : 4,07 (с, 3 Н), 4,13 (с, 3 Н), 5,14-5,16 (м, 2 Н), 7,52-7,65 (м, 2 Н), 7,57 (с,1 Н), 7,69 (с, 1 Н), 7,87 (д, J=7,8 Гц, 1 Н), 8,05 (с, 1 Н), 8,51 (д, J=8,3 Гц, 1 Н). Стадия 5. Бромирование гидроксильной группы. В круглодонной колбе 521 мкл (3,73 ммоль, 1 экв.) триэтиламина добавляли к суспензии 1 г (3,73 ммоль) спирта в 50 мл хлороформа под атмосферой аргона. В дальнейшем при перемешивании с охлаждением на льду медленно добавляли по каплям 356 мкл (3,73 ммоль, 1,0 экв.) трибромида фосфора. После 2 ч подтверждали исчезновение исходных продуктов и медленно добавляли по каплям 30 мл воды для осаждения твердого вещества. После 30 мин твердое вещество растворяли в растворе хлороформметанол=4:1. И затем органический слой отделяли, и водный слой экстрагировали раствором хлороформметанол=4:1. Органический слой собирали и высушивали над сульфатом магния. Затем растворитель отгоняли под пониженным давлением с получением 1,0 9 г (88%) продукта реакции. 1H-ЯМР (400 МГц, CDCl3) : 4,11 (с, 3 Н), 4,14 (с, 3 Н), 5,00 (с, 2 Н), 7,50-7,56 (м, 1 Н), 7,56 (с, 1 Н),7,60-7,66 (м, 1 Н), 7,77 (с, 1 Н), 7,82-7,86 (м, 1 Н), 8,06 (с, 1 Н), 8,49-8,52 (м, 1 Н). Стадия 6. Введение единицы глутаминовой кислоты. В круглодонной колбе 550 мг (2,38 ммоль, 1,25 экв.) диизопропилового эфира L-глутаминовой кислоты и 657 мг (4,75 ммоль, 2,5 экв.) карбоната калия добавляли к раствору 543 мг (1,9 ммоль) бромида в 20 мл ДМФ и 2 0 мл бензола с последующим перемешиванием при нагревании при 80 С. После 2 ч подтверждали исчезновение исходных продуктов. Результирующую реакционную жидкость охлаждали на льду и добавляли к ней 100 мл воды и 100 мл солевого раствора. Далее добавляли 200 мл этилацетата, и затем органический слой промывали каждым из насыщенного водного раствора бикарбоната натрия и солевого раствора. Результирующий раствор высушивали над сульфатом магния, и растворитель отгоняли под пониженным давлением с получением аминированного неочищенного продукта. Раствор неочищенного продукта, полученный таким способом, в 16 мл метанола, 16 мл 1,4 диоксана и 8 мл уксусной кислоты перемешивали при 45 С. После 16 ч подтверждали исчезновение исходных продуктов. Результирующую реакционную жидкость охлаждали и добавляли к ней 100 мл солевого раствора. Далее постепенно добавляли насыщенный водный раствор бикарбоната натрия для создания водного слоя слабого основания. Водный слой экстрагировали этилацетатом, и органический слой высушивали над сульфатом магния. Растворитель затем удаляли под пониженным давлением. Остаточный продукт очищали с помощью колоночной хроматографии на силикагеле (гексан:этилацетат=1:1) с получением 532 мг (77%) твердого вещества белого цвета. 1 Н-ЯМР (400 МГц, CDCl3) : 1,19 (д, J=6,4 Гц, 3 Н), 1,20 (д, J=6,4 Гц, 3 Н), 1,92-2,01 (м, 1 Н), 2,06-2,16 Кроме того, с помощью подобного вышеупомянутого проведения реакции можно достигнуть синтеза энантиомера при использовании диизопропилового эфира D-глутаминовой кислоты вместо диизопропилового эфира L-глутаминовой кислоты. Реакции проводили аналогично стадиям 7-10 в последующих стадиях с получением энантиомера соединения 1 (соединения 2). Следующие энантиомеры также получали подобным образом. Выход: 83%, 97,5% э.и., []D26-98,17 (с=0,11, CH3Cl). Стадия 7. Гидролиз сложного эфира пироглутаминовой кислоты. В круглодонной колбе водный раствор гидроксида калия (KOH: 303 мг (5,4 ммоль, 4,5 экв.), H2O: 5 мл) добавляли к раствору 500 мг (1,2 ммоль) эфира в 10 мл метанола и 20 мл 1,4-диоксана при комнатной температуре при перемешивании. После 1 ч подтверждали исчезновение исходных продуктов, и растворитель удаляли под пониженным давлением. К оставшемуся водному раствору постепенно при перемешивании с охлаждением на льду добавляли 1 моль/л соляную кислоту до достижения рН 2-3 для осаждения твердого вещества белого цвета. Собирали с помощью фильтрования с отсасыванием, используя воронку Бюхнера и фильтровальную колбу, белое твердое вещество, которое дважды промывали 50 мл очищенной воды. Принимающую колбу заменяли другой фильтровальной колбой, и твердое вещество растворяли в растворе хлороформ-метанол=4:1. Результирующий раствор переносили в делительную воронку, и органический слой отделяли и высушивали над сульфатом магния. После этого растворитель отгоняли под пониженным давлением с получением 416 мг (92%) твердого вещества от светло-розового до белого цвета. 1 Н-ЯМР (400 МГц, ДМСО-d6) : 1,82-1,94 (м, 1 Н), 2,08-2,20 (м, 1 Н), 2,26-2,48 (м, 2 Н), 3,64-3,72 (м,1 Н), 3,87 (с, 3 Н), 4,01 (с, 3 Н), 4,28 (д, J=14,9 Гц, 1 Н), 5,42 (д, J=14,9 Гц, 1 Н), 7,52-7,57 (м, 3 Н), 7,60-7,65(м, 1 Н), 7,88-7,91 (м, 1 Н), 8,19 (с, 1 Н), 8,73-8,76 (м, 1 Н). Стадия 8. Внутримолекулярное ацилирование по Фриделю-Крафтсу. В круглодонной колбе 210 мкл (2,4 ммоль, 2,0 экв.) оксалилхлорида и одну каплю ДМФ добавляли к суспензии 416 мг (1,2 ммоль) карбоновой кислоты в 200 мл метиленхлорида под атмосферой аргона при комнатной температуре комнаты при перемешивании. После 1 ч медленно добавляли 3,6 мл 1,0 М раствора хлорида олова(IV) в метиленхлориде (3,6 ммоль, 3,0 экв.). После завершения добавления по каплям результирующую смесь нагревали с обратным холодильником. После 4 ч подтверждали исчезновение исходных продуктов. Результирующую реакционную смесь (суспензию от коричневого до оранжевого цвета) охлаждали на льду и добавляли 50 мл 1 моль/л соляной кислоты с последующим перемешиванием в течение 30 мин. Добавляли раствор хлороформ-метанол=4:1 для превращения смеси в раствор и впоследствии органический слой промывали 1 моль/л каждым из соляной кислоты, насыщенного водного раствора бикарбоната натрия и солевого раствора. Органический слой высушивали над сульфатом магния, и растворитель удаляли под пониженным давлением. Остаточный продукт очищали с помощью колоночной хроматографии на силикагеле (хлороформ-метанол=50:1) с получением 274 мг (63%) твердого вещества желтого цвета. 99,9% э.и. (ВЭЖХ условие В). 1H-ЯМР (400 МГц, CDCl3) : 2,25-2,68 (м, 4 Н), 4,10 (с, 3 Н), 4,17 (с, 3 Н), 4,44-4,48 (м, 1 Н), 4,73 (д,J=18,2 Гц, 1 Н), 5,77 (д, J=18,2 Гц, 1 Н), 7,36 (с, 1 Н), 7,63-7,70 (м, 2 Н), 8,03 (с, 1 Н), 8,52-8,56 (м, 1 Н), 9,359,41 (м, 1 Н). Энантиомер. Выход: 60%, 99,9% э.и. Стадия 9. Диастереоселективное восстановление кетона с помощью три-втор-бутил боргидрида лития. В круглодонной колбе 1,35 мл 1,0 М раствора три-втор-бутил боргидрида лития в ТГФ (1,35 ммоль,2,0 экв.) добавляли к раствору 240 мг (0,67 ммоль) кетона в 20 мл ТГФ при -78 С под атмосферой аргона. После 1 ч подтверждали исчезновение исходных продуктов и затем к результирующей реакционной жидкости добавляли насыщенный водный хлорид аммония для подавления реакции. Водный слой экстрагировали этилацетатом, и органический слой высушивали над безводным сульфатом магния. Растворитель удаляли под пониженным давлением, и остаточный продукт очищали с помощью колоночной хроматографии на силикагеле (хлороформ-метанол=100:1) с получением 145 мг (63%) твердого вещества желтого цвета. 99,9% э.и. (ВЭЖХ условие A), []D22+163,20 (с=0,10, CH3Cl). 1H-ЯМР (400 МГц, CDCl3) : 2,30-2,41 (м, 1 Н), 2,52-2,66 (м, 1 Н), 2,72-2,82 (м, 1 Н), 3,97-4,02 (м, 1 Н),4,00 (с, 3 Н), 4,13 (с, 3 Н), 4,55 (д, J=17,8 Гц, 1 Н), 5,32 (д, J=2,2 Гц, 1 Н), 5,43 (д, J=17,8 Гц, 1 Н), 7,16 (с, 1 Н),7,62-7,70 (м, 1 Н), 8,02 (с, 2 Н), 8,27-8,32 (м, 1 Н), 8,54-8,60 (м, 1 Н). Энантиомер. Выход: 78%, 97,6% э.и., []D24-153, 09 (с=0,03, CH3Cl). Стадия 10. Восстановление лактама. В круглодонной колбе 1,6 мл 1,0 М раствора ВН 3 ТГФ в ТГФ (1,6 ммоль, 4,0 экв.) добавляли по каплям к раствору 135 мг (0,38 ммоль) лактама в 30 мл ТГФ под атмосферой аргона при перемешивании с охлаждением на льду. После 2 ч подтверждали исчезновение исходных продуктов. Результирующую реакционную жидкость охлаждали на льду и к ней при перемешивании добавляли 242 мкл (1,6 ммоль,4,0 экв.) N,N,N',N'-тетраметилэтилендиамина. После 16 ч подтверждали исчезновение комплекса аминборан, и растворитель удаляли под пониженным давлением. И затем остаточный продукт очищали с помощью колоночной хроматографии на силикагеле (хлороформ-метанол=50:1) с получением 88 мг (74%) твердого вещества белого цвета. Выход: 49%, 99,9% э.и. (ВЭЖХ условие В), []D28+115,11 (с=0,10, CH3Cl). 1(м, 1 Н), 7,26 (с, 1 Н), 7,55-7,60 (м, 2 Н), 8,16 (с, 1 Н), 8,26-8,32 (м, 1 Н), 8,72-8,76 (м, 1 Н). Выход и удельное оптическое вращение соединения 2 показаны ниже. Энантиомер (соединение 2). Выход: 60%, 99,7% э.и., []D28-114,13 (с=0,05, CH3Cl). При подобных условиях реакции производные, в которых кольца фенантрена имеют различные заместители, можно синтезировать, изменяя исходный материал. Каждая из производных будет описана далее, но в случае, при котором одинаковое проведение реакции повторялось, описание проведения реакции пропускали. Пример синтеза 2. Синтезировали соединение, содержащее следующие группы при R1-R6. Проведение и выход каждой стадии показаны ниже. Таблица 2 Соединение 29(1 Н, м), 7,14 (1 Н, д, J=2,4 Гц), 7,26 (1 Н, дд, J=2,4, 8,5 Гц), 7,31-7,48 (8 Н, м), 7,53-7,56 (1 Н, м). Стадия 2. Выход: 88,7%. Выделяли смесь региоизомеров относительно бензилоксигруппы в ароматическом кольце (соотношение изомеров 66:34). Стадия 3. Выход: 97,6%. Выделяли смесь региоизомеров относительно бензилоксигруппы в ароматическом кольце (соотношение изомеров 66:34). Стадия 4. Выход: количественный. Выделяли смесь региоизомеров относительно бензилоксигруппы в ароматическом кольце (соотношение изомеров 66:34). Стадия 5. Выход: 87,8% Выделяли смесь региоизомеров относительно бензилоксигруппы в ароматическом кольце (соотношение изомеров 66:34). Стадия 6. Выход: 38,9%, []D29+96,37 (с=0,18, CHCl3). 1 Н-ЯМР (400 МГц, CDCl3) : 1,18 (6 Н, д, J=6,2 Гц), 1,90-1,99 (1 Н, м), 2,07-2,17 (1 Н, м), 2,34-2,44(2 Н, м), 7,49-7,58 (2 Н, м), 7,84 (1 Н, д, J=2,4 Гц), 8,07 (1 Н, с), 8,67 (1 Н, д, J=9,0 Гц). Фенольную гидроксильную группу защищали как бензиловый эфир. Защиту снимали с помощью гидрогенолиза в заключительной стадии. Стадия 11. Гидрогенолиз бензилового эфира. В суспензию 53 мг (0,12 ммоль) соединения, полученного на стадии 10, в 10 мл метанола добавляли 5 мг 10% палладия на углероде с последующим перемешиванием под атмосферой водорода. После 3 ч подтверждали исчезновение исходных продуктов, и палладий на углероде удаляли при помощи фильтрации. Результирующий фильтрат отгоняли под пониженным давлением и остаточный продукт очищали с помощью колоночной хроматографии (хлорсформ:метанол=40:1) с получением 32 мг (75,3%) твердого вещества белого цвета.(1 Н, д, J=8,9 Гц), 9,62 (1 Н, уш.с). Пример синтеза 3. Синтезировали соединение, содержащее следующие группы при R1-R6. Проведение и выход каждой стадии показаны ниже. Таблица 3 Соединение 30(1 Н, м), 7,14 (1 Н, д, J=2,4 Гц), 7,26 (1 Н, дд, J=2,4, 6,5 Гц), 7,31-7,48 (8 Н, м), 7,53-7,56 (1 Н, м). Стадия 2. Выход: 88,7%. Выделяли смесь региоизомеров относительно бензилоксигруппы в ароматическом кольце (соотношение изомеров 66:34). Стадия 3. Выход: 97,6%. Выделяли смесь региоизомеров относительно бензилоксигруппы в ароматическом кольце (соотношение изомеров 66:34). Стадия 4. Выход: количественный. Выделяли смесь региоизомеров относительно бензилоксигруппы в ароматическом кольце (соотношение изомеров 66:34). Стадия 5. Выход: 87,8%. Выделяли смесь региоизомеров относительно бензилоксигруппы в ароматическом кольце (соотношение изомеров 66:34). Стадия 6. Выход: 53,0%, []D23+54,73 (с=0,11, CHCl3). 1 Н-ЯМР (400 МГц, CDCl3) : 1,20 (3 Н, д, J=6,2 Гц), 1,21 (3 Н, д, J=6,2 Гц), 1,90-1,99 (1 Н, м), 2,01-2,12H-ЯМР (400 МГц, CDCl3) : 2,52-2,68 (4 Н, м), 3,24 (3 Н, с), 4,04 (3 Н, с), 4,42-4,50 (1 Н, м), 4,70 (1 Н,д, J=17,9 Гц), 5,20-5,30 (2 Н, м), 5,75 (1 Н, д, J=17,9 Гц), 7,28-7,36 (2 Н, м), 7,40-7.49 (3 Н, м), 7,55-7,64 (3 Н,м), 8,90-8,98 (1 Н, м), 9,14 (1 Н, с). Стадия 9. Выход: 43,1%, []D28+205,68 (с=0,10, CHCl3). 1 Н-ЯМР (400 МГц, CDCl3) : 2,27-2,41 (1 Н, м), 2,52-2,64 (2 Н, м), 2,70-2,81 (1 Н, м), 3,24 (3 Н, с), 3,954,043,93 (2 Н, м), 4,01 (3 Н, с), 4,57 (1 Н, д, J=17,5 Гц), 5,27 (2 Н, с), 5,30 (1 Н, д, J=2,2 Гц), 5,47 (1 Н, д, J=17,5 Гц), 7,21 (1 Н, с), 7,30 (1 Н, д, Гц J=8,1), 7,41-7,48 (3 Н, м), 7,55-7,64 (3 Н, м), 8,00 (1 Н, д, J=8,1 Гц), 9,17 (1 Н,с). Стадия 10. Выход: 55,9%, []D29+84,08 (с=0,11, CHCl3). 1 Н-ЯМР (400 МГц, ДМСО-d6) : 1,75-1,93 (3 Н, м), 2,11-2,28 (1 Н, м), 2,30-2,46 (2 Н, м), 3,13 (3 Н, с),3,20-3,35 (1 Н, м), 3.50 (1 Н, д, J=15,7 Гц), 3,88 (3 Н, с), 4,58 (1 Н, д, J=17,5 Гц), 4,60-4,66 (1 Н, м), 4,94 (1 Н,дд, J=2,1, 9,6 Гц), 7,22 (1 Н, с), 7,37 (1 Н, д, J=7,9 Гц), 7,40-7,49 (4 Н, м), 7,51-7,58 (1 Н, м), 7,62-7,68 (1 Н, м),8,02 (1 Н, д, J=7,9 Гц), 9,07 (1 Н, с). Стадия 11. Выход: 61,2%, []D28+88,17 (с=0,11, CHCl3: СН 3 ОН=1:1). 1 Н-ЯМР (400 МГц, ДМСО-d6) : 1,75-1,91 (3 Н, м), 2,10-2,26 (1 Н, м), 2,28-2,45 (2 Н, м), 3,50 (1 Н, д,J=15,9 Гц), 3,91 (3 Н, с), 3,93 (3 Н, с), 4,10-4,15 (1 Н, м), 4,52-4,58 (1 Н, м), 4,59 (1 Н, д, J=15,9 Гц), 4,89 (1 Н,дд, J=2,0, 10,0 Гц), 7,06 (1 Н, д, J=7,8 Гц), 7,24 (1 Н, с), 7,36 (1 Н, т, J=7,8 Гц), 7,64-7,75 (1 Н, м), 7,84 (1 Н, д,J=7,8 Гц), 9,48 (1 Н, с), 10,45 (1 Н, уш.с). Пример синтеза 5. Синтезировали соединение, содержащее следующие группы при R1-R6. Проведение и выход каждой стадии показаны ниже. Таблица 4 Соединение 3(2 Н, кв, J=7,8 Гц), 3,29-3,38 (1 Н, м), 3,49 (1 Н, д, J=15,64 Гц), 3,93 (3 Н, с), 4,02 (3H, с), 4,58 (1 Н, д, J=15,64 Гц), 4,62 (1 Н, д, J=10,24 Гц), 4,91-4,99 (1 Н, м), 7,23 (1 Н, с), 7,40-7,48 (1 Н, м), 8,15 (1 Н, с), 8,32 (1 Н, д,J=8,8 Гц), 8,52 (1 Н, с). Выход и удельное оптическое вращение соединения 4 показаны ниже. Энантиомер (соединение 4). Выход: 33,6%, 98,62% э.и., []D29-89,30 (с=0,07, CHCl3). Пример синтеза 6. Синтезировали соединение, содержащее следующие группы при R1-R6. Проведение и выход каждой стадии показаны ниже. Таблица 5 Соединение 5(1 Н, с), 7,41-7,48 (1 Н, м), 8,11 (1 Н, с), 8,30-8,37 (1 Н, м), 8,55-8,61 (1 Н, м). Выход и удельное оптическое вращение соединения 6 показаны ниже. Энантиомер (соединение 6). Выход: 64,8%, 100% э.и., []D28-154, 04 (с=0,21, CHCl3). Справочный пример 1. Синтезировали соединение, содержащее следующие группы при R1-R6, в качестве ацильного прекурсора. Проведение и выход каждой стадии показаны ниже. Таблица 6 Известное соединение 1 в качестве ацильного прекурсора(2 Н, м), 3,92 (3 Н, м), 3,99 (3 Н, м), 4,53 (1 Н, д, J=16,1 Гц), 4,58-4,61 (1 Н, м), 4,90-4,92 (1 Н, м), 7,09 (1 Н, д,J=2,2, 9,0 Гц), 7,19 (1 Н, с), 7,91 (1 Н, с), 7,91 (1H, с), 8,12 (1 Н, д, J=9,0 Гц), 9,63 (1 Н, уш.с). Энантиомер. Выход: 52%, []D31-66,0 (с=0,1, CHCl3-МеОН (1:1. Пример синтеза 7. Синтезировали соединение, содержащее следующие группы при R1-R6. Проведение и выход каждой стадии показаны ниже. Таблица 7 Соединение 18(2 Н, м), 8,03 (1 Н, с), 8,15 (1 Н, d=2,6 Гц), 8,22 (1 Н, d=9,2 Гц). Пример синтеза 8 Синтезировали соединение, содержащее следующие группы при R1-R6. Проведение и выход каждой стадии показаны ниже. Таблица 8 Соединение 26(1 Н, м), 5,22 (2 Н, с), 7,20-7,26 (1 Н, м), 7,32-7,49 (5 Н, м), 7,66-7,74 (1 Н, м), 7,88 (1 Н, с), 8,21 (1 Н, д, J=9,0 Гц), 8,69-8,76 (1 Н, м), 9,91-10,02 (1 Н, м). Пример синтеза 9. Синтезировали соединение, содержащее следующие группы при R1-R6. Проведение и выход каждой стадии показаны ниже. Таблица 9 Соединение 25 Это соединение доступно через гидрогенолиз бензилкарбамата, полученного в вышеупомянутой стадии 10 (условия реакции являются такими же, как в стадии 11). Выход: 46,5%. 1(1 Н, с), 7,98 (1 Н, д, J=8,8 Гц). Алкалоид фенантроиндолизидин, содержащий алкилкарбонилоксигруппу при R2 или R8, синтезировали с помощью ацилирования алкалоида фенантроиндолизидина, содержащего соответствующую гидроксильную группу. Схема синтеза показана в следующих стадиях 12 или 13. Пример синтеза 10. Синтезировали соединение, содержащее СН 3 при R', которое получали через вышеупомянутую стадию 12. Проведение и выход каждой стадии показаны ниже (соединение 7). Стадия 12. Ацилирование фенольной гидроксильной группы. В круглодонной колбе триэтиламин (35 мкл, 3,0 экв.) и уксусный ангидрид (36 мкл, 2,2 экв.) добавляли к суспензии исходных продуктов (52 мг, 0,12 ммоль) в метиленхлориде (1 мл) под атмосферой аргона при перемешивании с охлаждением на льду. Затем добавляли диметиламинопиридин (1,5 мг, 0,1 экв.) с последующим перемешиванием в течение 6 ч. Подтверждали исчезновение исходных продуктов,и затем результирующую реакционную жидкость концентрировали, а затем очищали с помощью колоночной хроматографии (CHCl3:МеОН=300:1) с получением 12 мг (21,0%) твердого вещества желтого цвета.[]D27+102,72 (с=0,016, CHCl3). 1 Н-ЯМР (400 МГц, ДМСО-d6) : 1,78-1,92 (3 Н, м), 2,15-2,25 (1 Н, м), 2,30-3,05 (2 Н, м), 2,36 (3 Н, с),3,25-3,40 (1 Н, м), 3,48-3,63 (1 Н, м), 3,94 (3 Н, м), 4,01 (3 Н, м), 4,59-5,05 (3 Н, м), 7,26 (1 Н, с), 7,35 (1 Н, дд,J=2,20, 9,03 Гц), 8,08 (1 Н, с), 8,32 (1 Н, д, J=9,03 Гц), 8,48 (1 Н, д, J=2,20 Гц). Далее синтезировали соединения, используя соответствующий хлорид кислоты подобным способом, как в примере синтеза 18. Пример синтеза 11. Синтезировали соединение, содержащее СН 3 СН 2 при R', которое получали через вышеупомянутую стадию 12. Проведение и выход каждой стадии показаны ниже (соединение 15). Выход: 90,2%, 99,6% э.и. (ВЭЖХ условие В), []D27+113,479 (с=0,12, CHCl3). 1(1 Н, д, J=15,9 Гц), 4,75 (1 Н, д, J=9,8 Гц), 4,96 (1 Н, дд, J=2,0, 9,8 Гц), 7,34 (1 Н, дд, J=2,4, 9,2 Гц), 7,23 (1 Н,с), 8,01 (1 Н, с), 8,32 (1 Н, д, J=9,2 Гц), 8,45 (1 Н, д, J=2,4 Гц). Пример синтеза 12. Синтезировали соединение, содержащее (СН 3)2 СН при R', которое получали через вышеупомянутую стадию 12. Проведение и выход каждой стадии показаны ниже (соединение 9). Выход: 93,1%, 99,3% э.и. (ВЭЖХ условие В), []D29+92, 777 (с=0,1, CHCl3). 1(1 Н, д, J=15,6 Гц), 4,75 (1 Н, д, J=9,8 Гц), 4,97 (1 Н, дд, J=2,1, 9,8 Гц), 7,25 (1 Н, с), 7,32 (1H, дд, J=2,2, 9,0 Гц), 8,08 (1 Н, с), 8,33 (1 Н, д, J=9,0 Гц), 8,43 (1 Н, д, J=2,2 Гц). Пример синтеза 13. Синтезировали соединение, содержащее (СН 3)3C при R', которое получали через вышеупомянутую стадию 12. Проведение и выход каждой стадии показаны ниже (соединение 10). Выход: 80,6%, 99,3% э.и. (ВЭЖХ условие В), []D30+89, 723 (с=0,1, CHCl3). 1 при R', которое получали через вышеупомянутую стадию 12. Проведение и выход каждой стадии показаны ниже (соединение 11). Выход: 85,0%, 99,9% э.и. (ВЭЖХ условие В), []D29+64,279 (с=0,1, CHCl3). 1 при R', которое получали через вышеупомянутую стадию 12. Проведение и выход каждой стадии показаны ниже (соединение 12). Выход: 82,9%, 99,9% э.и. (ВЭЖХ условие В), []D27+68,677 (с=0,1, CHCl3). 1 при R', которое получали через вышеупомянутую стадию 12. Проведение и выход каждой стадии показаны ниже (соединение 16). Выход: 81,4%, 99,2% э.и. (ВЭЖХ условие В), []D30+77,88 (с=0,1, CHCl3). 1 Н-ЯМР (400 МГц, ДМСО-d6) : 1,80-1,92 (3 Н, м), 2,14-2,29 (1 Н, м), 2,32-2,49 (2 Н, м), 2,74 (2 Н, т,J=6,6 Гц), 2,95 (2 Н, т, J=6,6 Гц), 3,33-3,40 (1 Н, м), 3,49 (1 Н, д, J=16,1 Гц), 3,65 (3 Н, с), 3,94 (3 Н, с), 4,01(3 Н, с), 4,58 (1 Н, д, J=16,1 Гц), 4,76 (1 Н, д, J=9,5 Гц), 4,97 (1 Н, д, J=9,5 Гц), 7,24 (1 Н, с), 7,32 (1 Н, дд,J=2,0, 9,3 Гц), 8,33 (1 Н, д, J=9,3 Гц), 8,44 (1 Н, д, J=2,0 Гц). Пример синтеза 17. Синтезировали соединение, содержащее СН 3 О при R', которое получали через вышеупомянутую стадию 12. Проведение и выход каждой стадии показаны ниже (соединение 17). Выход: 79,2%, 99,4% э.и. (ВЭЖХ условие В), []D26+118,53 (с=0,1, CHCl3). 1 Н-ЯМР (400 МГц, ДМСО-d6) : 1,80-1,92 (3 Н, м), 2,14-2,29 (1 Н, м), 2,32-2,49 (2 Н, м), 3,33-3,40 (1 Н,м), 3,50 (1 Н, д, J=16,1 Гц), 3,88 (3 Н, с), 3,94 (3 Н, с), 4,01 (3 Н, с), 4,58 (1 Н, д, J=16,1 Гц), 4,80 (1 Н, д, J=9,5 Гц), 4,97 (1 Н, д, J=9,5 Гц), 7,24 (1 Н, с), 7,45 (1 Н, дд, J=2,0, 9,3 Гц), 8,11 (1 Н, с), 8,34 (1 Н, д, J=9,3 Гц), 8,63 при R', которое получали через вышеупомянутую стадию 12. Проведение и выход каждой стадии показаны ниже (соединение 19). Выход: 79,2%, 92,9% э.и. (ВЭЖХ условие В), []D28+52, 894 (с=0,1, CHCl3). 1 Н-ЯМР (400 МГц, ДМСО-d6) : 1,80-1,92 (3 Н, м), 2,14-2,29 (1 Н, м), 2,32-2,49 (2 Н, м), 3,33-3,40 (1 Н,м), 3,52 (1 Н, д, J=15,9 Гц), 3,94 (3 Н, с), 3,99 (3 Н, с), 4,61 (1 Н, д, J=15,9 Гц), 4,79 (1 Н, д, J=9,8 Гц), 5,00 (1 Н,д, J=9,8 Гц), 7,26 (1 Н, с), 7,35 (1 Н, дд, J=3,7, 4,9 Гц), 7,49 (1 Н, дд, J=2,2, 9,0 Гц), 8,11 (1 Н, дд, J=1,2, 3,7 Гц), 8,13 (1 Н, с), 8,13 (1 Н, дд, J=1,2, 3,7 Гц), 8,37 (1H, д, J=9,0 Гц), 8,67 (1H, д, J=2,2 Гц) Пример синтеза 19. Синтезировали соединение, содержащее при R', которое получали через вышеупомянутую стадию 12. Проведение и выход каждой стадии показаны ниже (соединение 20). Выход: 66,5%, 94,4% э.и. (ВЭЖХ условие В), []D26+46,929 (с=0,1, CHCl3). 1 Н-ЯМР (400 МГц, ДМСО-d6) : 1,76-1,91 (3 Н, м), 2,10-2,29 (1 Н, м), 2,32-2,49 (2 Н, м), 3,33-3,40 (1 Н,м), 3,49 (1 Н, д, J=16,0 Гц), 3,94 (3 Н, с), 3,99 (34, с), 4,57 (1 Н, д, J=15, 9 Гц), 4,81 (1 Н, д, J=9,8 Гц), 4,98(1 Н, дд, J=2,0, 9,8 Гц), 7,24 (1 Н, с), 7,48 (1 Н, дд, J=2,4, 9,0 Гц), 7,65 (1 Н, дд, J=0,7, 3,7 Гц), 8,11 (1 Н, с),8,15 (1 Н, дд, J=0,1, 2,0 Гц), 8,37 (1 Н, д, J=9,0 Гц), 8,66 (1 Н, д, J=2,4 Гц). Пример синтеза 20. Синтезировали соединение, содержащее (CH3)2N при R', которое получали через вышеупомянутую стадию 12. Проведение и выход каждой стадии показаны ниже (соединение 21). Выход: 86,8%, 86,0% э.и. (ВЭЖХ условие В), []D27+74,724 (с=0,1, CHCl3). 1 Н-ЯМР (400 МГц, ДМСО-d6) : 1,75-1,92 (3 Н, м), 2,14-2,29 (1 Н, м), 2,32-2,49 (2 Н, м), 2,96 (3 Н, с),3,14 (3 Н, с), 3,33-3,40 (1 Н, м), 3,51 (1 Н, д, J=15,6 Гц), 3,94 (3 Н, с), 4,01 (3 Н, с), 4,62 (1 Н, д, J=15,6 Гц), 4,72 при R', которое получали через вышеупомянутую стадию 12. Проведение и выход каждой стадии показаны ниже (соединение 22). Выход: 43,6%, 95,0% э.и. (ВЭЖХ условие В), []D26+58,45 (с=0,08, CHCl3). 1 при R', которое получали через вышеупомянутую стадию 12. Проведение и выход каждой стадии показаны ниже (соединение 23). Выход: 42,1%, 99,5% э.и. (ВЭЖХ условие В), []D29+53,654 (с=0,1, CHCl3). 1 при R', которое получали через вышеупомянутую стадию 12. Проведение и выход каждой стадии показаны ниже (соединение 24). Выход: 42,8%. 1 при R', которое получали через вышеупомянутую стадию 12. Проведение и выход каждой стадии показаны ниже (соединение 27). Выход: 75,1%, []D28+91,68. 1H-ЯМР (400 МГц, ДМСО-d6) : 1,78-1,90 (3 Н, м), 2,12-2,27 (1 Н, м), 2,34-2,50 (2 Н, м), 3,27-3,34 (1 Н,м), 3,41 (1 Н, д, J=15,5 Гц), 3,75 (1 Н, т, J=2,4 Гц), 3,95 (3 Н, с), 4,01 (3 Н, с), 4,62 (1 Н, д, J=15,5 Гц), 4,76 (1 Н,д, J=9,8 Гц), 4,95 (2 Н, д, J=2,4 Гц), 4,98 (1 Н, дд, J=2,2, 9,8 Гц), 7,27 (1 Н, с), 7,46 (1 Н, дд, J=2,4, 9,0 Гц),8,12 (1H, с), 8,35 (1H, д, J=9,0 Гц), 8,66 (1H, д, J=2,4 Гц). Пример синтеза 25. Синтезировали соединение, в котором R' представляет собой СН 3 СН 2 О, которое получали через вышеупомянутую стадию 12. Проведение и выход каждой стадии показаны ниже (соединение 28). Выход: 52,3%, []D28+90,54. 1 при R', которое получали через вышеупомянутую стадию 12. Проведение и выход каждой стадии показаны ниже (соединение 13). Выход: 93,0%, []D27+47,265 (с=0,1, CHCl3). 1(3 Н, с), 4,00-4,27 (4 Н, м), 4,02 (3 Н, с), 4,59 (1 Н, д, J=15,6 Гц), 4,75 (1 Н, д, J=9,8 Гц), 4,97 (1 Н, дд, J=2,1, 9,8 Гц), 7,25 (1 Н, с), 7,30 (1 Н, дд, J=2,2, 9,0 Гц), 8,08 (1 Н, с), 8,33 (1 Н, д, J=9,0 Гц), 8,39 (1 Н, д, J=2,2 Гц). Пример синтеза 26. Синтезировали соединение, в котором R представляет собой СН 3, которое получали через вышеупомянутую стадию 13. Проведение и выход каждой стадии показаны ниже (соединение 8). Стадия 13. Диацилирование гидроксильных групп R2 и R8. В 100-мл круглодонной колбе триэтиламин (1,4 мл, 40 экв.), уксусный ангидрид (0,95 мл, 40 экв.) и диметиламинопиридин (3 мг, 0,1 экв.) добавляли к суспензии исходных продуктов (90 мг, 0,25 ммоль) в метиленхлориде (15 мл) под атмосферой аргона при перемешивании с охлаждением на льду с последующим перемешиванием в течение 6 ч. Подтверждали исчезновение исходных продуктов, и затем результирующую реакционную жидкость концентрировали, а затем очищали с помощью колоночной хроматографии (только CHCl3) с получением 47 мг(1 Н, д, J=15,38 Гц), 6,73 (1 Н, уш.с), 7,23 (1 Н, с), 7,31 (1 Н, дд, J=2,20, 9,03 Гц), 7,89 (1 Н, с), 7,95 (1 Н, д,J=9,03 Гц), 8,21 (1 Н, д, J=2,20 Гц). 99% э.и. (ВЭЖХ анализ условие В), []D29+156,9 (с=0,12, CHCl3). Будет описан синтетический способ для соединения, происходящий в результате восстановительного удаления гидроксильной группы соединения, полученного через стадию 9 (гидроксильная группа в положении R8 в общей формуле (1) или (2. Синтез проводили в соответствии со следующими стадиями 14 и 15.
МПК / Метки
МПК: A61P 43/00, A61P 25/28, A61P 37/06, A61P 37/08, A61P 19/02, A61K 31/437, A61P 35/00, A61P 3/10, A61P 9/08, A61P 1/00, A61P 31/04, A61P 37/02, A61P 31/12, A61P 35/04, C07D 471/04, A61P 17/00, A61P 29/00, A61P 3/04, A61K 31/444, A61P 11/06, A61P 17/06, A61P 9/10
Метки: производное, содержащий, активного, nfkb, ингредиента, фенантроиндолизидина, качестве, ингибитор
Код ссылки
<a href="https://eas.patents.su/30-23622-proizvodnoe-fenantroindolizidina-i-ingibitor-nfkb-soderzhashhijj-ego-v-kachestve-aktivnogo-ingredienta.html" rel="bookmark" title="База патентов Евразийского Союза">Производное фенантроиндолизидина и ингибитор nfkb, содержащий его в качестве активного ингредиента</a>
Предыдущий патент: Способ и устройство для установки электродов в жидкости
Следующий патент: Получение защищенных производных (r)- и (s)-n-(3,4-дифтор-2-(2-фтор-4-йодфениламино)-6-метоксифенил)-1-(2,3-дигидроксипропил)циклопропан-1-сульфонамида
Случайный патент: Ослабленная популяция ротавирусов и содержащая ее вакцинная композиция


































