Фенантроиндолизидиновое соединение и ингибитор nfkb, содержащий его в качестве действующего ингредиента
Номер патента: 19927
Опубликовано: 30.07.2014
Авторы: Ямазаки Риута, Савада Сейго, Мацузаки Такеси, Яегаси Такаси, Хасимото Сусуке, Икеда Такаси
Формула / Реферат
1. Соединение, представленное следующей формулой (1), или его соль:
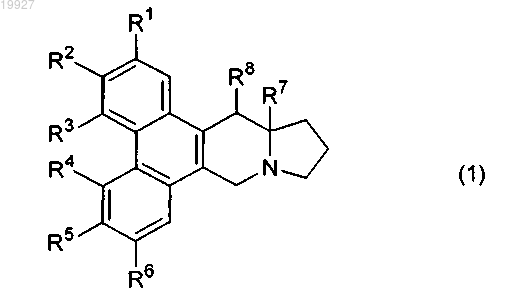
в котором
R1 представляет собой атом водорода, алкильную группу с числом атомов углерода от 1 до 6, алкилоксигруппу с числом атомов углерода от 1 до 6 или атом галогена;
R2 представляет собой гидроксильную группу или алкилоксигруппу с числом атомов углерода от 1 до 6;
R3 представляет собой атом водорода, алкильную группу с числом атомов углерода от 1 до 6 или атом галогена;
R4 представляет собой атом водорода или алкилоксигруппу с числом атомов углерода от 1 до 6;
R5 представляет собой атом водорода, алкилоксигруппу с числом атомов углерода от 1 до 6, атом галогена или гидроксильную группу;
R6 представляет собой атом водорода, алкилоксигруппу с числом атомов углерода от 1 до 6;
или R5 и R6 вместе с атомами углерода, с которыми они связаны, образуют метилендиоксигруппу или изопропилидендиоксигруппу;
R7 представляет собой атом водорода или алкильную группу с числом атомов углерода от 1 до 6; и
R8 представляет собой атом водорода, гидроксильную группу, аминогруппу или алкилкарбонилоксигруппу с числом атомов углерода от 1 до 6;
при условии исключения следующих случаев: случая, когда R1, R3, R4 и R7 представляют собой атомы водорода; R2 и R8 представляют собой гидроксильные группы и R5 и R6 представляют собой метоксигруппы; случая, когда R1, R3, R4 и R7 представляют собой атомы водорода, R2, R5 и R6 представляют собой метоксигруппы и R8 представляет собой гидроксильную группу; случая, когда R1, R3, R4, R7 и R8 представляют собой атомы водорода и R2, R5 и R6 представляют собой метоксигруппы; случая, когда R1, R3, R4 и R7 представляют собой атомы водорода, R2, R5 и R8 представляют собой гидроксильные группы и R6 представляет собой метоксигруппу; случая, когда R1, R3, R4 и R7 представляют собой атомы водорода, R2 и R6 представляют собой метоксигруппы и R5 и R8 представляют собой гидроксильные группы; случая, когда R1, R3, R4, R7 и R8 представляют собой атомы водорода, R2 и R6 представляют собой метоксигруппы и R5 представляет собой гидроксильную группу; случая, когда R1, R2, R5 и R6 представляют собой метоксигруппы и R3, R4, R7 и R8 представляют собой атомы водорода; случая, когда R1, R2, R4 и R5 представляют собой метоксигруппы и R3, R6, R7 и R8 представляют собой атомы водорода; случая, когда R1, R2, R5 и R6 представляют собой метоксигруппы, R3, R4 и R7 представляют собой атомы водорода и R8 представляет собой гидроксильную группу; случая, когда R1 и R2 представляют собой метоксигруппы, R3, R4, R6, R7 и R8 представляют собой атомы водорода и R5 представляет собой гидроксильную группу; случая, когда R1, R2 и R5 представляют собой метоксигруппы и R3, R4, R6, R7 и R8 представляют собой атомы водорода; случая, когда R1, R2 и R5 представляют собой метоксигруппы, R3, R4, R6 и R7 представляют собой атомы водорода и R8 представляет собой гидроксильную группу; случая, когда R1, R2 и R5 представляют собой метоксигруппы, R3, R4, R6 и R8 представляют собой атомы водорода и R7 представляет собой метильную группу; случая, когда R1, R2 и R5 представляют собой метоксигруппы, R3, R4 и R6 представляют собой атомы водорода, R7 представляет собой метильную группу и R8 представляет собой гидроксильную группу; случая, когда R1, R2 и R6 представляют собой метоксигруппы, R3, R4, R7 и R8 представляют собой атомы водорода и R5 представляет собой гидроксильную группу; случая, когда R1, R2 и R4 представляют собой метоксигруппы, R3, R6, R7 и R8 представляют собой атомы водорода и R5 представляет собой гидроксильную группу; случая, когда R1, R5 и R6 представляют собой метоксигруппы, R2 и R8 представляют собой гидроксильные группы и R3, R4 и R7 представляют собой атомы водорода; случая, когда R1 представляет собой изопропилоксигруппу, R2 и R5 представляют собой метоксигруппы и R3, R4, R6, R7 и R8 представляют собой атомы водорода; случая, когда R1 и R5 представляют собой метоксигруппы, R2 представляет собой изопропилоксигруппу и R3, R4, R6, R7 и R8 представляют собой атомы водорода; случая, когда R1 и R2 представляют собой метоксигруппы, R3, R4, R6, R7 и R8 представляют собой атомы водорода и R5 представляет собой изопропилоксигруппу; случая, когда R1 и R5 представляют собой метоксигруппы, R2 представляет собой гидроксильную группу и R3, R4, R6, R7 и R8 представляют собой атомы водорода; случая, когда R1 и R2 представляют собой метоксигруппы и R3, R4, R5, R6, R7 и R8 представляют собой атомы водорода; случая, когда R1, R3, R4 и R7 представляют собой атомы водорода, R2, R5 и R6 представляют собой метоксигруппы и R8 представляет собой ацетоксигруппу; случая, когда R1, R3, R4 и R8 представляют собой атомы водорода, R2, R5 и R6 представляют собой метоксигруппы и R7 представляет собой метильную группу; случая, когда R1, R2, R5 и R6 представляют собой метоксигруппы, R3, R4 и R7 представляют собой атомы водорода и R8 представляет собой ацетоксигруппу; и случая, когда R1, R2 и R5 представляют собой метоксигруппы, R3, R4, R5 и R7 представляют собой атомы водорода и R8 представляет собой ацетоксигруппу.
2. Соединение или его соль по п.1, в котором R1 представляет собой атом водорода, метильную группу, метоксигруппу, атом хлора или атом фтора;
R2 представляет собой гидроксильную группу или метоксигруппу;
R3 представляет собой атом водорода, метильную группу, атом хлора или атом фтора;
R4 представляет собой атом водорода или метоксигруппу;
R5 представляет собой атом водорода, метоксигруппу, этоксигруппу, атом фтора или гидроксильную группу;
R6 представляет собой атом водорода, метоксигруппу или этоксигруппу;
или R5 и R6 вместе с атомами углерода, с которыми они связаны, образуют метилендиоксигруппу или изопропилидендиоксигруппу;
R7 представляет собой атом водорода или метильную группу и
R8 представляет собой атом водорода, гидроксильную группу, аминогруппу или ацетоксигруппу;
при условии исключения следующих случаев: случая, когда R1, R3, R4 и R7 представляют собой атомы водорода; R2 и R8 представляют собой гидроксильные группы и R5 и R6 представляют собой метоксигруппы; случая, когда R1, R3, R4 и R7 представляют собой атомы водорода, R2, R5 и R6 представляют собой метоксигруппы и R8 представляет собой гидроксильную группу; случая, когда R1, R3, R4, R7 и R8 представляют собой атомы водорода и R2, R5 и R6 представляют собой метоксигруппы; случая, когда R1, R3, R4 и R7 представляют собой атомы водорода, R2, R5 и R8 представляют собой гидроксильные группы и R6 представляет собой метоксигруппу; случая, когда R1, R3, R4 и R7 представляют собой атомы водорода, R2 и R6 представляют собой метоксигруппы и R5 и R8 представляют собой гидроксильные группы; случая, когда R1, R3, R4, R7 и R8 представляют собой атомы водорода, R2 и R6 представляют собой метоксигруппы и R5 представляет собой гидроксильную группу; случая, когда R1, R2, R5 и R6 представляют собой метоксигруппы и R3, R4, R7 и R8 представляют собой атомы водорода; случая, когда R1, R2, R4 и R5 представляют собой метоксигруппы, и R3, R6, R7 и R8 представляют собой атомы водорода; случая, когда R1, R2, R5 и R6 представляют собой метоксигруппы, R3, R4 и R7 представляют собой атомы водорода и R8 представляет собой гидроксильную группу; случая, когда R1 и R2 представляют собой метоксигруппы, R3, R4, R6, R7 и R8 представляют собой атомы водорода и R5 представляет собой гидроксильную группу; случая, когда R1, R2 и R5 представляют собой метоксигруппы и R3, R4, R6, R7 и R8 представляют собой атомы водорода; случая, когда R1, R2 и R5 представляют собой метоксигруппы, R3, R4, R6 и R7 представляют собой атомы водорода и R8 представляет собой гидроксильную группу; случая, когда R1, R2 и R5 представляют собой метоксигруппы, R3, R4, R6 и R8 представляют собой атомы водорода и R7 представляет собой метильную группу; случая, когда R1, R2 и R5 представляют собой метоксигруппы, R3, R4 и R6 представляют собой атомы водорода, R7 представляет собой метильную группу и R8 представляет собой гидроксильную группу; случая, когда R1, R2 и R6 представляют собой метоксигруппы, R3, R4, R7 и R8 представляют собой атомы водорода и R5 представляет собой гидроксильную группу; случая, когда R1, R2 и R4 представляют собой метоксигруппы, R3, R6, R7 и R8 представляют собой атомы водорода и R5 представляет собой гидроксильную группу; случая, когда R1, R5 и R6 представляют собой метоксигруппы, R2 и R8 представляют собой гидроксильные группы и R3, R4 и R7 представляют собой атомы водорода; случая, когда R1 представляет собой изопропилоксигруппу, R2 и R5 представляют собой метоксигруппы и R3, R4, R6, R7 и R8 представляют собой атомы водорода; случая, когда R1 и R5 представляют собой метоксигруппы, R2 представляет собой изопропилоксигруппу и R3, R4, R6, R7 и R8 представляют собой атомы водорода; случая, когда R1 и R2 представляют собой метоксигруппы, R3, R4, R6, R7 и R8 представляют собой атомы водорода и R5 представляет собой изопропилоксигруппу; случая, когда R1 и R5 представляют собой метоксигруппы, R2 представляет собой гидроксильную группу и R3, R4, R6, R7 и R8 представляют собой атомы водорода; случая, когда R1 и R2 представляют собой метоксигруппы и R3, R4, R5, R6, R7 и R8 представляют собой атомы водорода; случая, когда R1, R3, R4 и R7 представляют собой атомы водорода, R2, R5 и R6 представляют собой метоксигруппы и R8 представляет собой ацетоксигруппу; случая, когда R1, R3, R4 и R8 представляют собой атомы водорода, R2, R5 и R6 представляют собой метоксигруппы и R7 представляет собой метильную группу; случая, когда R1, R2, R5 и R6 представляют собой метоксигруппы, R3, R4 и R7 представляют собой атомы водорода и R8 представляет собой ацетоксигруппу; и случая, когда R1, R2 и R5 представляют собой метоксигруппы, R3, R4, R6 и R7 представляют собой атомы водорода и R8 представляет собой ацетоксигруппу.
3. Соединение или его соль по п.1 или 2, где соединение, представленное формулой (1), имеет конформацию, представленную следующей формулой (2):
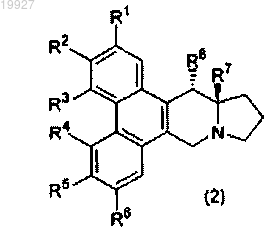
где значения групп R1-R8 являются аналогичными вышеописанным.
4. Соединение или его соль по п.3, в котором R8 в формуле (2) представляет собой атом водорода.
5. Соединение или его соль, выбранные из группы, состоящей из
(12aS,13S)-5,6,7-триметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3,13-диола;
(12aR,13R)-5,6,7-триметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3,13-диол;
(12aS,13S)-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3,13-диола;
(12aS,13S)-6-фтор-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3,13-диола;
(12aS,13S)-3-гидрокси-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-13-илового эфира уксусной кислоты;
6,7-диметокси-12а-метил-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3,13-диола;
(S)-13-амино-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-ола;
(12aS,13S)-6,7-метилендиокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3,13-диола;
(12aS,13S)-6,7-изопропилидендиокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3,13-диола;
(12aS,13S)-6,7-диэтокси-9,10,11,12,12a,13-гексагидро-9а-азациклопента[b]трифенилен-3,13-диола;
(S)-6,7-диметокси-9,10,11,12,12a,13-гексагидро-9а-азациклопента[b]трифенилен-3-ола;
(R)-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-ола;
(S)-6,7-метилендиокси-9,10,11,12,12а, 13-гексагидро-9а-азациклопента[b]трифенилен-3-ола;
(S)-6,7-диэтокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-ола;
(12aS,13S)-2,3-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-6,13-диола;
(S)-2-хлор-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-ола;
(S)-4-хлор-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-ола;
(S)-2,4-дихлор-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-ола;
(S)-4-фтор-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-ола;
(S)-2-фтор-6,7-диметокси-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-ола; и
(S)-6,7-диметокси-2,4-диметил-9,10,11,12,12а,13-гексагидро-9а-азациклопента[b]трифенилен-3-ола.
6. Лекарственное средство для лечения заболеваний, ассоциированных с повышенной активностью ядерного фактора-kВ (NFkB), содержащее в качестве активного ингредиента соединение или его соль по любому из пп.1-5.
7. Ингибитор NFkB, содержащий в качестве активного ингредиента соединение или его соль по любому из пп.1-5.
8. Профилактическое или терапевтическое средство для лечения заболеваний, ассоциированных с повышенной активностью NFkB, содержащее в качестве активного ингредиента соединение или его соль по любому из пп.1-5.
9. Противораковое средство, содержащее в качестве активного ингредиента соединение или его соль по любому из пп.1-5.
10. Профилактическое или терапевтическое средство для лечения воспалительных заболеваний, содержащее в качестве активного ингредиента соединение или его соль по любому из пп.1-5.
11. Фармацевтическая композиция для лечения заболеваний, ассоциированных с повышенной активностью NFkB, содержащая соединение или его соль по любому из пп.1-5 и фармацевтически приемлемый носитель.
12. Применение соединения или его соли по любому из пп.1-5 для получения профилактического или терапевтического средства для лечения заболеваний, ассоциированных с повышенной активностью NFkB.
13. Применение соединения или его соли по любому из пп.1-5 для получения противоракового средства.
14. Применение соединения или его соли по любому из пп.1-5 для получения профилактического или терапевтического средства для лечения воспалительного заболевания.
15. Способ предупреждения или лечения заболеваний, ассоциированных с повышенной активностью NFkB, включающий введение соединения или его соли по любому из пп.1-5.
16. Способ предупреждения или лечения рака, включающий введение соединения или его соли по любому из пп.1-5.
17. Способ предупреждения или лечения воспалительного заболевания, включающий введение соединения или его соли по любому из пп.1-5.
Текст
Представлено новое соединение, обладающее отличным ингибирующим эффектом в отношении NFB, и конкретно раскрыто соединение, представленное общей формулой (1), или его соль: в котором R1 представляет собой атом водорода, алкильную группу с числом атомов углерода от 1 до 6, алкилоксигруппу с числом атомов углерода от 1 до 6 или атом галогена; R2 представляет собой гидроксильную группу или алкилоксигруппу с числом атомов углерода от 1 до 6; R3 представляет собой атом водорода, алкильную группу с числом атомов углерода от 1 до 6 или атом галогена; R4 представляет собой атом водорода или алкилоксигруппу с числом атомов углерода от 1 до 6; R5 представляет собой атом водорода, алкилоксигруппу с числом атомов углерода от 1 до 6, атом галогена или гидроксильную группу; R6 представляет собой атом водорода, алкилоксигруппу с числом атомов углерода от 1 до 6; или R5 и R6 вместе с атомами углерода, с которыми они связаны, образуют метилендиоксигруппу или изопропилидендиоксигруппу; R7 представляет собой атом водорода или алкильную группу с числом атомов углерода от 1 до 6; и R8 представляет собой атом водорода, гидроксильную группу, аминогруппу или алкилкарбонилоксигруппу с числом атомов углерода от 1 до 6; при условии исключения ряда значений радикалов, которые описаны в формуле изобретения.(71)(73) Заявитель и патентовладелец: КАБУСИКИ КАЙСЯ ЯКУЛТ ХОНСА (JP) Область техники, к которой относится изобретение Изобретение относится к ингибитору ядерного фактора-B (здесь и далее в этом документе может называться NFB). Более детально, настоящее изобретение относится к новому фенантроиндолизидиновому алкалоидному соединению или его соли, ингибирующим NFB, и к содержащему их лекарственному средству. Предпосылки создания изобретенияNFB существует в виде димера, образованного различными сочетаниями р 50, p65/RelA, c-Rel, Rel3 и р 52, которые все входят в состав семейства NFB. Средни них наиболее хорошо известный димер представляет собой гетеродимер, состоящий из субъединицы (р 50) массой 50 кДа и субъединицы (р 65) массой 65 кДа. Обычно этот гетеродимер присутствует в неактивном состоянии в цитоплазме посредством связывания с ингибитором NFkB (IB). Однако как только клетки стимулируются провоспалительными цитокинами, факторами роста клетки, и тому подобное, IB киназа активируется посредством АКТ каскада передачи сигнала, и тому подобное, приводящему к фосфорилированию IB. Фосфорилированный IB убиквитинируется, а затем расщепляется протеосомой. В результате NFB отсоединяется от IB и мигрирует в ядро, где он связывается с чувствительным к NFB элементом с активацией транскрипции различных генов-мишеней. Гены-мишени включают множество генов, ассоциированных с воспалением и иммунным ответом(непатентный документ 1), и известно, что активация NFB связана с заболеваниями, такими как ревматоидный артрит, остеоартрит, воспалительное заболевание кишечника, атопический дерматит и бронхиальная астма (непатентный документ 2). Также известно, что различные вирусы, такие как HIV, активируют NFB В клетках хозяина, откудаNFkB предположительно способствует вирусной инфекции (непатентные документы 3 и 4). Кроме того, недавно стало известно, что NFB часто конститутивно активируется в различных опухолях, а потому считается, что NFB, вероятно, может быть также вовлечен в индукцию экспрессии различных генов, ассоциированных с развитием рака, например, с канцерогенезом, метастазированием, анти-апоптозом, пролиферацией клеток и устойчивостью к противораковой лекарственной терапии (непатентные документы 5 и 6). Кроме того, также известно, что NFB связан с такими заболеваниями, как ишемическая болезнь сердца (непатентный документ 7), болезнь Альцгеймера (непатентный документ 8), септицемия (непатентный документ 9) и метаболический синдром (непатентный документ 10). Соответственно, ингибирующее NFB соединение применимо в качестве профилактического или терапевтического средства для хронического воспалительного заболевания, аутоиммунного заболевания,вирусного заболевания, иммунного заболевания, новой противораковой терапии и других заболеваний,обусловленных активацией NFB, И такое соединение активно разрабатывается. Между тем, тилофорин, представленный следующей формулой (А), и его аналог называют фенантроиндолизидиновым алкалоидом, который представляет собой соединение, получаемое главным образом из растений, принадлежащих семейству Asclepiadaceae (род Tylophora, Vincetoxicum, Pergularia иCynanchum) (непатентный документ 11). Кроме того, некоторые из вышеупомянутых растений, принадлежащих роду Tylophora, известны в качестве исходных веществ для противовоспалительных средств, противоастматических средств и противоамебных средств (непатентный документ 12). Также известно, что тилофорин обладает сильным цитотоксическим действием, а также энергично проводится изучение способа его синтеза (непатентный документ 13). Кроме того, известно, что тилокребрин, представленный следующей формулой (В), из числа вышеуказанных фенантроиндолизидиновых алкалоидов обладает нейротоксичностью (непатентный документ 14). Кроме того, недавно стало известно, что аналоги тилофорина, представленные следующими формулами (С) и (D), стабильно демонстрируют сильное цитотоксическое действие в отношении опухолевых клеток NCI-60 в групповом исследовании, и что механизм действия этих аналогов тилофорина отличается от такового у существующих противоопухолевых средств (непатентный документ 15). Кроме того, известно, что представленное следующей формулой (Е) соединение, которое представляет собой полученный из насекомого фенантроиндолизидиновый алкалоид, обладает сильным цитотоксическим действием (непатентный документ 16). Кроме того, известно, что фенантроиндолизидиновый алкалоид ингибирует транскрипцию, опосредованную NFB, который представляет собой фактор транскрипции (непатентный документ 15). Документы известного уровня техники Непатентные документы[Непатентный документ 17] Bioorg. Med. Chem. Lett. 2007, 4338-4342 Краткое описание сущности изобретения Задача, подлежащая решению настоящим изобретением Соответственно, целью настоящего изобретения является обеспечение новым соединением, обладающим превосходным ингибирующим действием в отношении NFB. Средства решения задачи Несмотря на тот факт, что фенантроиндолизидиновый алкалоид обладает сильным цитотоксическим действием и описанным выше интересным механизмом действия, существует очень мало сообщений о системной и комплексной оценке биологической активности, в частности оценки противоопухолевой активности in vivo, такого алкалоида (непатентные документы 15 и 17). В этих обстоятельствах авторы настоящего изобретения провели интенсивное исследование для достижения вышеупомянутой цели. В результате они обнаружили, что соединение, представленное следующей формулой (1), или его соль обладают превосходным ингибирующим действием в отношенииNFB, противоопухолевым действием и противовоспалительным действием, обладая при этом немногочисленными побочными эффектами и отличной растворимостью, а потому применимы в качестве лекарственного средства, такого как противораковое средство, оформив тем самым настоящее изобретение. Таким образом, настоящее изобретение относится к соединению, представленному следующей формулой (1), или его соли:-2 019927 в котором R1 представляет собой атом водорода, алкильную группу с числом атомов углерода от 1 до 6, алкилоксигруппу с числом атомов углерода от 1 до 6 или атом галогена;R2 представляет собой гидроксильную группу или алкилоксигруппу с числом атомов углерода от 1 до 6;R3 представляет собой атом водорода, алкильную группу с числом атомов углерода от 1 до 6 или атом галогена;R4 представляет собой атом водорода или алкилоксигруппу с числом атомов углерода от 1 до 6;R5 представляет собой атом водорода, алкилоксигруппу с числом атомов углерода от 1 до 6, атом галогена или гидроксильную группу;R6 представляет собой атом водорода, алкилоксигруппу с числом атомов углерода от 1 до 6; или R5 и R6 вместе с атомами углерода, с которыми они связаны, образуют метилендиоксигруппу или изопропилидендиоксигруппу;R7 представляет собой атом водорода или алкильную группу с числом атомов углерода от 1 до 6; иR8 представляет собой атом водорода, гидроксильную группу, аминогруппу или алкилкарбонилоксигруппу с числом атомов углерода от 1 до 6; при условии исключения следующих случаев: случая, когда R1, R3, R4 и R7 представляют собой атомы водорода; R2 и R8 представляют собой гидроксильные группы и R5 и R6 представляют собой метоксигруппы; случая, когда R1, R3, R4 и R7 представляют собой атомы водорода, R2, R5 и R6 представляют собой метоксигруппы и R8 представляет собой гидроксильную группу; случая, когда R1, R3, R4, R7 и R8 представляют собой атомы водорода и R2, R5 и R6 представляют собой метоксигруппы; случая, когда R1,R3, R4 и R7 представляют собой атомы водорода, R2, R5 и R8 представляют собой гидроксильные группы и R6 представляет собой метоксигруппу; случая, когда R1, R3, R4 и R7 представляют собой атомы водорода, R2 и R6 представляют собой метоксигруппы и R5 и R8 представляют собой гидроксильные группы; случая, когда R1, R3, R4, R7 и R8 представляют собой атомы водорода, R2 и R6 представляют собой метоксигруппы и R5 представляет собой гидроксильную группу; случая, когда R1, R2, R5 и R6 представляют собой метоксигруппы и R3, R4, R7 и R8 представляют собой атомы водорода; случая, когда R1, R2, R4 и R5 представляют собой метоксигруппы и R3, R6, R7 и R8 представляют собой атомы водорода; случая, когдаR1, R2, R5 и R6 представляют собой метоксигруппы, R3, R4 и R7 представляют собой атомы водорода и R8 представляет собой гидроксильную группу; случая, когда R1 и R2 представляют собой метоксигруппы,R3, R4, R6, R7 и R8 представляют собой атомы водорода и R5 представляет собой гидроксильную группу; случая, когда R1, R2 и R5 представляют собой метоксигруппы и R3, R4, R6, R7 и R8 представляют собой атомы водорода; случая, когда R1, R2 и R5 представляют собой метоксигруппы, R3, R4, R6 и R7 представляют собой атомы водорода и R8 представляет собой гидроксильную группу; случая, когда R1, R2 и R5 представляют собой метоксигруппы, R3, R4, R6 и R8 представляют собой атомы водорода и R7 представляет собой метильную группу; случая, когда R1, R2 и R5 представляют собой метоксигруппы, R3, R4 и R6 представляют собой атомы водорода, R7 представляет собой метильную группу и R8 представляет собой гидроксильную группу; случая, когда R1, R2 и R6 представляют собой метоксигруппы, R3, R4, R7 и R8 представляют собой атомы водорода и R5 представляет собой гидроксильную группу; случая, когда R1,R2 и R4 представляют собой метоксигруппы, R3, R6, R7 и R8 представляют собой атомы водорода, и R5 представляет собой гидроксильную группу; случая, когда R1, R5 и R6 представляют собой метоксигруппы, R2 и R8 представляют собой гидроксильные группы и R3, R4 и R7 представляют собой атомы водорода; случая, когда R1 представляет собой изопропилоксигруппу, R2 и R5 представляют собой метоксигруппы и R3, R4, R6, R7 и R8 представляют собой атомы водорода; случая, когда R1 и R5 представляют собой метоксигруппы, R2 представляет собой изопропилоксигруппу и R3, R4, R6, R7 и R8 представляют собой атомы водорода; случая, когда R1 и R2 представляют собой метоксигруппы, R3, R4, R6, R7 и R8 представляют собой атомы водорода и R5 представляет собой изопропилоксигруппу; случая, когда R1 и R5 представляют собой метоксигруппы, R2 представляет собой гидроксильную группу и R3, R4, R6, R7 и R8 представляют собой атомы водорода; случая, когда R1 и R2 представляют собой метоксигруппы и R3, R4, R5,R6, R7 и R8 представляют собой атомы водорода; случая, когда R1, R3, R4 и R7 представляют собой атомы водорода, R2, R5 и R6 представляют собой метоксигруппы и R8 представляет собой ацетоксигруппу; случая, когда R1, R3, R4 и R8 представляют собой атомы водорода, R2, R5 и R6 представляют собой метоксигруппы и R7 представляет собой метильную группу; случая, когда R1, R2, R5 и R6 представляют собой метоксигруппы, R3, R4 и R7 представляют собой атомы водорода и R8 представляет собой ацетоксигруппу; и случая, когда R1, R2 и R5 представляют собой метоксигруппы, R3, R4, R6 и R7 представляют собой атомы водорода и R8 представляет собой ацетоксигруппу. В предпочтительном варианте осуществления настоящего изобретения R1 представляет собой атом водорода, метильную группу, метоксигруппу, атом хлора или атом фтора;R2 представляет собой гидроксильную группу или метоксигруппу;R3 представляет собой атом водорода, метильную группу, атом хлора или атом фтора;R4 представляет собой атом водорода или метоксигруппу;R5 представляет собой атом водорода, метоксигруппу, этоксигруппу, атом фтора или гидроксильную группу;R6 представляет собой атом водорода, метоксигруппу или этоксигруппу; или R5 и R6 вместе с атомами углерода, с которыми они связаны, образуют метилендиоксигруппу или изопропилидендиоксигруппу;R7 представляет собой атом водорода или метильную группу; иR8 представляет собой атом водорода, гидроксильную группу, аминогруппу или ацетоксигруппу; при условии исключения следующих случаев: случая, когда R1, R3, R4 и R7 представляют собой атомы водорода; R2 и R8 представляют собой гидроксильные группы и R5 и R6 представляют собой метоксигруппы; случая, когда R1, R3, R4 и R7 представляют собой атомы водорода, R2, R5 и R6 представляют собой метоксигруппы и R8 представляет собой гидроксильную группу; случая, когда R1, R3, R4, R7 и R8 представляют собой атомы водорода, и R2, R5 и R6 представляют собой метоксигруппы; случая, когда R1,R3, R4 и R7 представляют собой атомы водорода, R2, R5 и R8 представляют собой гидроксильные группы и R6 представляет собой метоксигруппу; случая, когда R1, R3, R4 и R7 представляют собой атомы водорода, R2 и R6 представляют собой метоксигруппы, и R5 и R8 представляют собой гидроксильные группы; случая, когда R1, R3, R4, R7 и R8 представляют собой атомы водорода, R2 и R6 представляют собой метоксигруппы и R5 представляет собой гидроксильную группу; случая, когда R1, R2, R5 и R6 представляют собой метоксигруппы, и R3, R4, R7 и R8 представляют собой атомы водорода; случая, когда R1, R2, R4 и R5 представляют собой метоксигруппы, и R3, R6, R7 и R8 представляют собой атомы водорода; случая, когдаR1, R2, R5 и R6 представляют собой метоксигруппы, R3, R4 и R7 представляют собой атомы водорода и R8 представляет собой гидроксильную группу; случая, когда R1 и R2 представляют собой метоксигруппы,R3, R4, R6, R7 и R8 представляют собой атомы водорода и R5 представляет собой гидроксильную группу; случая, когда R1, R2 и R5 представляют собой метоксигруппы и R3, R4, R6, R7 и R8 представляют собой атомы водорода; случая, когда R1, R2 и R5 представляют собой метоксигруппы, R3, R4, R6 и R7 представляют собой атомы водорода и R8 представляет собой гидроксильную группу; случая, когда R1, R2 и R5 представляют собой метоксигруппы, R3, R4, R6 и R8 представляют собой атомы водорода и R7 представляет собой метильную группу; случая, когда R1, R2 и R5 представляют собой метоксигруппы, R3, R4 и R6 представляют собой атомы водорода, R7 представляет собой метильную группу и R8 представляет собой гидроксильную группу; случая, когда R1, R2 и R6 представляют собой метоксигруппы, R3, R4, R7 и R8 представляют собой атомы водорода, и R5 представляет собой гидроксильную группу; случая, когда R1,R2 и R4 представляют собой метоксигруппы, R3, R6, R7 и R8 представляют собой атомы водорода и R5 представляет собой гидроксильную группу; случая, когда R1, R5 и R6 представляют собой метоксигруппы, R2 и R8 представляют собой гидроксильные группы и R3, R4 и R7 представляют собой атомы водорода; случая, когда R1 представляет собой изопропилоксигруппу, R2 и R5 представляют собой метоксигруппы и R3, R4, R6, R7 и R8 представляют собой атомы водорода; случая, когда R1 и R5 представляют собой метоксигруппы, R2 представляет собой изопропилоксигруппу и R3, R4, R6, R7 и R8 представляют собой атомы водорода; случая, когда R1 и R2 представляют собой метоксигруппы, R3, R4, R6, R7 и R8 представляют собой атомы водорода и R5 представляет собой изопропилоксигруппу; случая, когда R1 и R5 представляют собой метоксигруппы, R2 представляет собой гидроксильную группу и R3,' R4, R6, R7 и R8 представляют собой атомы водорода; случая, когда R1 и R2 представляют собой метоксигруппы и R3, R4, R5,R6, R7 и R8 представляют собой атомы водорода; случая, когда R1, R3, R4 и R7 представляют собой атомы водорода, R2, R5 и R6 представляют собой метоксигруппы и R8 представляет собой ацетоксигруппу; случая, когда R1, R3, R4 и R8 представляют собой атомы водорода, R2, R5 и R6 представляют собой метоксигруппы и R7 представляет собой метильную группу; случая, когда R1, R2, R5 и R6 представляют собой метоксигруппы, R3, R4 и R7 представляют собой атомы водорода и R8 представляет собой ацетоксигруппу; и случая, когда R1, R2 и R5 представляют собой метоксигруппы, R3, R4, R6 и R7 представляют собой атомы водорода и R8 представляет собой ацетоксигруппу. В предпочтительном варианте осуществления настоящего изобретения соединение, представленное формулой (1), имеет конформацию, представленную следующей формулой (2): где значения групп R1-R8 являются аналогичными вышеописанным. В предпочтительном варианте осуществления настоящего изобретеия R8 в формуле (2) представляет собой атом водорода. Настоящее изобретение также относится к соединению или его соли, выбранному из группы, состоящей из(S)-6,7-диметокси-2,4-диметил-9 ,10,11,12,12 а,13-гексагидро-9 а-азациклопента[b]трифенилен-3-ола. Ещ одним объектом настоящего изобретения является лекарственное средство для лечения заболеваний, ассоциированных с повышенной активностью ядерного фактора-B (NFB), содержащее в качестве активного ингредиента соединение, охарактеризованное выше, или его соль. Настоящее изобретение также относится к ингибитору NFB, содержащему в качестве активного ингредиента предложенное в настоящем изобретении соединение, охарактеризованное выше, или его соль. Другим объектом настоящего изобретения является профилактическое или терапевтическое средство для лечения заболеваний, ассоциированных с повышенной активностью NFB, содержащее в качестве активного ингредиента предложенное в настоящем изобретении соединение, охарактеризованное выше или его соль. Ещ одним объектом настоящего изобретения является противораковое средство, содержащее в качестве активного ингредиента предложенное в настоящем изобретении соединение, охарактеризованное выше, или его соль. Ещ одним другим объектом настоящего изобретения фвляется профилактическое или терапевтическое средство для лечения воспалительных заболеваний, содержащее в качестве активного ингредиента предложенное в настоящем изобретении соединение, охарактеризованное выше, или его соль. Настоящее изобетение также относится к фармацевтической композиции для лечения заболеваний,ассоциированных с повышенной активностью NFB, содержащей предложенное в настоящем изобретении соединение, охарактеризованное выше, или его соль. Ещ одним объектом настоящего изобретения является применение предложенного в настоящем изобретении соединения, охарактеризованного выше, или его соли для получения профилактического или терапевтического средства для лечения заболеваний, ассоциированных с повышенной активностьюNFB. Другим объектом настоящего изобретения является применение предложенного в настоящем изобретении соединения, охарактеризованного выше, или его соли для получения противоракового средства. Ещ одним другим объектом настоящего изобретения является применение предложенного в настоящем изобретении соединения, охарактеризованного выше, или его соли для получения профилактического или терапевтического средства для лечения воспалительного заболевания. Настоящее изобетение также относится к способу предупреждения или лечения заболеваний, ассоциированных с повышенной активностью NFB, включающему введение предложенного в настоящем изобретении соединения, охарактеризованного выше, или его соли. Настоящее изобретение также относится к способу предупреждения или лечения рака, включающему введение предложенного в настоящем изобретении соединения, охарактеризованного выше, или его соли. Настоящее изобретение также относится к способу предупреждения или лечения воспалительного заболевания, включающий введение предложенного в настоящем изобретении соединения, охарактеризованного выше, или его соли. Эффекты настоящего изобретения Соединение, представленное вышеуказанной формулой (1), или его соль по настоящему изобретению обладают отличным ингибирующим действием в отношении NFB, противоопухолевым действием и противовоспалительным действием, обладая при этом немногочисленными побочными эффектами и отличной растворимостью, а потому применимо в качестве лекарственного средства, ингибитора NFB,профилактического или терапевтического средства для заболеваний, ассоциированных с повышенной активностью NFB, включая противораковые средства (пролиферация или метастазирование рака), устойчивость к противораковым средствам, воспалительного заболевания (ревматоидный артрит, остеоартрит, атопический дерматит, бронхиальная астма, псориаз, воспалительное заболевание кишечника, и тому подобное), сердечно-сосудистого заболевания (ишемическая болезнь сердца, сосудистый рестеноз после чрескожной транслюминальной коронарной ангиопластики (РТСА), и тому подобное), легочного фиброза, сахарного диабета, аутоиммунного заболевания, вирусного заболевания, болезни Альцгеймера,септицемии, метаболического синдрома, и тому подобное. Более конкретно, соединение по настоящему изобретению, представленное формулой (1), или его соль применимо в качестве противоракового средства и профилактического или терапевтического средства для различных воспалительных заболеваний. Краткое описание чертежей Фиг. 1 представляет собой график, отражающий противоопухолевый эффект соединения по настоящему изобретению на мышах с пересаженными клетками промиелоцитарного лейкоза человека HL60. Фиг. 2 представляет собой график, отражающий противовоспалительный эффект соединения по настоящему изобретению на мышах с отеком уха, индуцированным ТРА. Способ осуществления настоящего изобретения В общей формуле (1) примеры низшей алкильной группы включают алкильные группы с углеродным числом от 1 до 6. Их конкретные примеры включают метильную группу, этильную группу, пропильную группу, бутильную группу, пентильную группу и гексильную группу. Среди них особенно предпочтительной является метильная группа. В общей формуле (1) примеры низшей алкилоксигруппы включают алкилоксигруппу с числом атомов углерода от 1 до 6. Их конкретные примеры включают метоксигруппу, этоксигруппу, пропоксигруппу, бутоксигруппу, пентилоксигруппу и гексилоксигруппу. Среди них особенно предпочтительной является метоксигруппа. В общей формуле (1) примеры атома галогена включают атом хлора, атом брома, атом фтора и атом йода. Среди них особенно предпочтительными являются атом хлора и атом фтора. В общей формуле (1) примеры низшей алкилкарбонилоксигруппы включают алкилкарбонилоксигруппу с числом атомов углерода от 1 до 6. Их конкретные примеры включают ацетоксигруппу, пропионилоксигруппу и бутирилоксигруппу, и среди них особенно предпочтительной является ацетоксигруппа. В настоящем изобретении соединение вышеуказанной формулы (1) содержит два стереоцентра(атомы углерода, в которых замещены R7 и R8). Поскольку указанные стереоцентры могут принимать либо R-конфигурацию, либо S-конфигурацию, возможны четыре вида стереоизомеров. Тем не менее, все такие стереоизомеры и смесь различных сочетаний стереоизомеров охватываются объемом настоящего изобретения. Примеры изомера включают конфигурацию, в которой R7=S, R8=S, конфигурацию, в которой R7=R,8R =R, конфигурацию, в которой R7=S, R8=R, и конфигурацию, в которой R7=R, R8=S. Среди них особенно предпочтительной является конфигурация, в которой R7=S, R8=S, поскольку соединение в такой конфигурации сильно ингибирует NFKB без индукции нежелательных побочных эффектов. В настоящем изобретении соединение следующей формулы (2) или его фармацевтически приемлемая соль являются более предпочтительными, поскольку такое соединение или соль сильно ингибируетNFKB без индукции нежелательных побочных эффектов. где значения групп R1, R2, R3, R4, R5, R6, R7 и R8 аналогичны вышеуказанным. Если соединение, представленное формулой (1), имеет конформацию, представленную формулой(2), то соединение предпочтительно содержит атом водорода в R8, поскольку такое соединение сильно ингибирует NFB без индукции нежелательных побочных эффектов. В настоящем изобретении конкретные примеры особенно предпочтительного соединения или его соли включают соединение, выбранное из группы, состоящей из(S)-6,7-диметокси-2,4-диметил-9,10,11,12,12 а,13-гексагидро-9 а-азациклопента[b]трифенилен-3-ола. В настоящем изобретении соль соединения, представленного общими формулами (1) или (2), может представлять собой фармацевтически приемлемую соль. Их примеры включают соль неорганической кислоты, такую как гидрохлорид, сульфат, фосфат, гидробромид, гидройодид, нитрат, пиросульфат и метафосфат; и соль органической кислоты, такую как цитрат, оксалат, бензоат, ацетат, трифторацетат,пропионат, сукцинат, фумарат, лактат, малеат, тартрат, глутарат, цитрат, сульфонат (например, метансульфонат, паратолуолсульфонат и нафталинсульфонат); и соль металла, такую как соль лития, соль натрия, соль калия, соль магния и соль кальция. Соединение по настоящему изобретению может быть получено, например, в соответствии со следующей схемой реакций (в качестве примеров будут представлены соединение, в котором R7=H, R8=OH где группы R1-R6 представляют собой группы, аналогичные вышеупомянутым, и если существует функциональная группа, участвующая в реакции, то такая группа может быть соответствующим образом замещена. То есть, осуществляют взаимодействие бензальдегида с бензилцианидом с получением соединения(а), которое циклизуют с получением соединения (b). Затем, цианогруппу восстанавливают, в результате чего получают альдегид (с). После этого карбонильную группу восстанавливают с получением (d), которое бромируют с получением (е), затем осуществляют взаимодействие (е) со сложным эфиром глутаминовой кислоты с последующей циклизацией, в результате чего получают (f). Соединение (f) гидролизуют с получением (g), из которого получают (h) посредством внутримолекулярного ацилирования. После этого карбонильную группу восстанавливают с получением (i), а затем восстанавливают лактам, в результате чего получают фенантроиндолизидин (j), содержащий гидроксильную группу в R8. Гидроксильную группу в R8 соединения (i) восстановительно удаляют с получением (k), а затем восстанавливают лактам, в результате чего получают фенантроиндолизидин (l), содержащий атом водорода в R8. Взаимодействие бензальдегида с бензилцианидом предпочтительно проводят в спирте в присутствии основания. На этой стадии конкретные примеры основания включают метоксид натрия и этоксид натрия. Циклизацию соединения (а) предпочтительно проводят путем облучения светом в присутствии йода и пропиленоксида. При этом может использоваться реакция циклизации, включающая обработку ванадием (V) или таллием (III). Восстановление соединения (b) предпочтительно проводят путем осуществления взаимодействия с гидридом диизобутилалюминия. При этом восстановление соединения (с) предпочтительно проводят путем осуществления взаимодействия с боргидридом натрия. Бромирование соединения (d) предпочтительно проводят путем осуществления взаимодействия с трибромидом фосфора в присутствии триэтиламина. При этом бромирование может проводиться путем предоставления возможности взаимодействовать с тетрабромидом углерода в присутствии трифенилфосфина. Аминирование/лактамизацию соединения (е) со сложным диизопропиловым эфиром Lглутаминовой кислоты предпочтительно проводят в растворителе, таком как диметилформамид, в присутствии основания, такого как карбонат калия, и путем предоставления кислоте, такой как уксусная кислота, возможности взаимодействовать с полученным аминированным продуктом в спирте, таком как метанол. На этой стадии, если используют сложный диизопропиловый эфир D-глутаминовой кислоты, то получают соответствующий энантиомер. Гидролиз соединения (f) предпочтительно проводят с использованием основания в растворителе,таком как метанол. На этой стадии, конкретные примеры основания включают гидроксид калия и гидроксид натрия. Внутримолекулярную реакцию Фриделя-Крафтса соединения (g) предпочтительно проводят в растворителе, таком как хлористый метилен, путем преобразования соединения (g) до хлорангидрида оксалилхлоридом внутри системы, с последующей обработкой кислотой Льюиса. На этой стадии, конкретные примеры кислоты Льюиса включают хлорид олова и хлорид алюминия. Восстановление соединения (h) предпочтительно проводят с использованием восстановителя, такого как боргидрид натрия и три-втор-бутилборгидрид лития. Для стереоселективного восстановления восстановление предпочтительно проводят с использованием восстановителя, такого как три-вторбутилборгидрид лития. Восстановление лактама соединения (i) предпочтительно проводят с использованием восстановителя, такого как боран и алюмогидрид лития. Восстановление гидроксильной группы соединения (i) предпочтительно проводят с использованием сочетания кислоты и восстановителя. В качестве кислоты предпочтительными являются трифторуксусная кислота, комплекс трехфтористого бора и диэтилового эфира, и тому подобное. В качестве восстановителя предпочтительным является триэтилсилан. Восстановление лактама соединения (k) предпочтительно проводят с использованием восстановителя, такого как боран и алюмогидрид лития. Как будет показано в последующих примерах, соединение, представленное формулой (l), или его соль обладают отличным ингибирующим действием в отношении NFB, противоопухолевым действием и противовоспалительным действием. Соответственно, соединение или его соль по настоящему изобретению применимы в качестве лекарственного средства, ингибитора NFB, противоракового средства (пролиферация или метастазирование рака), профилактического или терапевтического средства при заболеваниях, ассоциированных с повышенной активностью NFB, включая устойчивость к противораковым средствам, воспалительное заболевание (ревматоидный артрит, остеоартрит, атопический дерматит, бронхиальная астма, псориаз,воспалительное заболевание кишечника, и тому подобное), сердечно-сосудистое заболевание (ишемическая болезнь сердца, сосудистый рестеноз после чрескожной транслюминальной коронарной ангиопластики (РТСА), и тому подобное), легочный фиброз, сахарный диабет, аутоиммунное заболевание, вирусное заболевание, болезнь Альцгеймера, септицемию, метаболический синдром и тому подобное. В настоящем изобретении на "ингибитор NFB" не накладываются особые ограничения до тех пор,пока он обладает ингибирующим действием в отношении NFB. Более конкретно, значение IC50 применительно к ингибирующему действию в отношении NFB ДЛЯ ингибитора NFB предпочтительно составляет 2000 нг/мл или менее, более предпочтительно 500 нг/мл или менее и особенно предпочтительно 100 нг/мл или менее, как измерено способом по примеру 2, описанному ниже. Кроме того, значение IC50 применительно к ингибирующему действию на пролиферацию рака для ингибитора NFB предпочтительно составляет 2000 нг/мл или менее, более предпочтительно 500 нг/мл или менее и особенно предпочтительно 100 нг/мл или менее, как измерено способом по примеру 3, описанному ниже. Если соединение, представленное формулой (1) или его соль применяют в качестве лекарственного средства, то один вид соединения или его соли может использоваться отдельно, или множество его видов может использоваться в сочетании. Кроме того, соединение, представленное формулой (1), или его соль могут также использоваться в сочетании с другими терапевтически эффективными соединениями, и механизм действия указанных терапевтически эффективных соединений может быть аналогичным или отличным от такового у соединения по настоящему изобретению. Если соединение по настоящему изобретению используют в качестве лекарственного средства, то оно вводиться в любой лекарственной форме. Их примеры включают перорально вводимое средство,такое как таблетка, капсула, гранула, таблетка с сахарным покрытием, пилюля, мелкозернистая гранула,порошок, порошковидный состав, состав с замедленным высвобождением, суспензия, эмульсия, сироп,эмульгированный состав, лиофилизированный препарат, жидкость и эликсир; и парентерально вводимое средство, включая препарат для инъекции, такой как препарат для внутривенной инъекции, препарат для внутримышечной инъекции, подкожный инъекционный препарат или капельница для вливания, наружное средство, такое как кожная мазь или пластырь, суппозиторий, инфузионный раствор, чрескожное средство, чресслизистое средство, назальное средство, средство для ингаляции, болюс и тому подобное. Если соединение применяют в качестве лекарственного средства, то препарат может быть приготовлен обычным способом, в котором соединение, представленное формулой (1), или его соль по настоящему изобретению может использоваться отдельно или в сочетании с фармацевтически приемлемым носителем. Примеры фармацевтически приемлемого носителя включают наполнитель, связующее вещество, разрыхлитель, поверхностно-активное вещество, лубрикант, фактор, способствующий разжиже-9 019927 нию, корригирующее средство, краситель, отдушку, разбавитель, дезинфицирующее вещество, регулятор осмотического давления, регулятор рН, эмульгатор, консервант, стабилизатор, средство для абсорбции,антиоксидант, поглотитель ультрафиолетовых лучей, увлажнитель, усилитель вязкости, глазирователь,усилитель активности, противовоспалительное средство, вещество, регулирующее тоничность, успокаивающее средство и ароматизатор. Примеры связующего вещества включают крахмал, порошок аравийской камеди, желатин, гидроксипропилкрахмал, метилцеллюлозу, карбоксиметилцеллюлозу натрия, гидроксипропилцеллюлозу, кристаллическую целлюлозу, этилцеллюлозу, поливинилпирролидон и макрогол. Примеры разрыхлителя включают крахмал, гидроксипропилкрахмал, карбоксиметилцеллюлозу натрия, карбоксиметилцеллюлозу кальция, карбоксиметилцеллюлозу, гидроксипропилцеллюлозу с низкой степенью замещения. Примеры поверхностно-активного вещества включают лаурилсульфат натрия, соевый лецитин,сложный эфир жирной кислоты сахарозы и полисорбат 80. Примеры лубриканта включают тальк, воск, гидрогенизированное растительное масло, сложный эфир жирной кислоты и сахарозы, стеарат магния, стеарат кальция, стеарат алюминия и полиэтиленгликоль. Примеры фактора, способствующего разжижению, включают легкий ангидрид кремниевой кислоты, высушенный гель гидроокиси алюминия, синтезированный силикат алюминия и силикат магния. Примеры разбавителя включают дистиллированную воду для инъекции, физиологический раствор,водный раствор глюкозы, оливковое масло, кунжутное масло, арахисовое масло, соевое масло, кукурузное масло, пропиленгликоль и полиэтиленгликоль. Если лекарственное средство, содержащее в качестве активного компонента соединение, представленное формулой (1), или его соль вводят системно, то предпочтительной лекарственной формой является препарат для инъекции или перорально вводимое средство, и в качестве препарата для инъекции особенно предпочтителен внутривенный препарат для инъекции. В этом случае, лекарственное средство может вводиться другими путями инъекционного введения, такими как подкожная, внутримышечная или интраперитонеальная инъекция, или лекарственное средство может вводиться чресслизисто или чрескожно с использованием пенетранта, такого как соль желчных кислот, фуксиновая кислота или другие поверхностно-активные вещества. Вышеупомянутое введение фармацевтической композиции может выполняться местно или в форме мази, пасты, геля, и тому подобное. Ингибитор NFB по настоящему изобретению может использоваться не только в виде фармацевтических продуктов, как описано выше, но также в качестве продуктов питания, напитков, и тому подобное. В этом случае фенантроиндолизидиновое алкалоидное соединение или его соль по настоящему изобретению могут содержаться в пище и напитках "как есть" или в сочетании с различными питательными компонентами. Продукты питания и напитки, полученные таким образом, могут использоваться в качестве пищевых продуктов для здорового питания или в качестве питательного вещества, которое применимо для улучшения, профилактики, и т.п. пролиферации или метастазирования рака, устойчивости к противораковым средствам, воспалительного заболевания (ревматоидный артрит, остеоартрит, атопический дерматит, бронхиальная астма, псориаз, воспалительное заболевание кишечника, и тому подобное),сердечно-сосудистого заболевания (ишемическая болезнь сердца, сосудистый рестеноз после чрескожной транслюминальной коронарной ангиопластики (РТСА), и тому подобное), легочного фиброза, сахарного диабета, аутоиммунного заболевания, вирусного заболевания, болезни Альцгеймера, септицемии, метаболического синдрома, и тому подобное. На указанных продуктах питания и напитках или на содержащей их таре может быть отражено, что продукты питания и напитки обладают вышеупомянутыми эффектами. Конкретно, если ингибитор NFB по настоящему изобретению добавлен в продукты питания и напитки, то при желании обычным путем и с использованием добавок, разрешенных к использованию в продуктах питания и напитках, им может быть придана форма, подходящая для приема внутрь,например, гранула, зерно, таблетка, капсула и паста. Кроме того, ингибитор NFB по настоящему изобретению может быть добавлен к различным пищевым продуктам, например, к готовому мясному блюду, такому как ветчина и сосиска, готовому блюду из морепродуктов, такому как приготовленный рыбный фарш или рыбная сосиска, хлебу, кондитерскому изделию, маслу, сухому молоку и к ферментированным продуктам питания и напиткам, или ингибитор NFB по настоящему изобретению может быть также добавлен в напитки, такие как вода, фруктовый сок, молоко, безалкогольный напиток и чайный напиток. Следует отметить, что продукты питания и напитки также включают корм для животных. Кроме того, что касается продуктов питания и напитков, то предпочтительно используют ферментированные молочные продукты, такие как ферментированное молоко, ферментированные бактериальными культурами напитки, ферментированное соевое молоко, ферментированный фруктовый сок и ферментированный овощной сок, содержащие в качестве активного ингредиента фенантроиндолизидиновое алкалоидное соединение или его соль. Указанные ферментированные молочные продукты и напитки могут быть получены обычным способом. Например, ферментированное молоко получают путем внесения закваски молочнокислых бактерий и бифидобактерий в стерилизованную молочную среду и их культи- 10019927 вирования, и обработке конечного продукта путем гомогенизации с получением ферментированной молочной базы. Далее, по отдельности добавляют приготовленный раствор сиропа и фенантроиндолизидиновое алкалоидное соединение или его соль и перемешивают, и гомогенизируют конечный продукт с использованием гомогенизатора, и тому подобное, а затем добавляют отдушку с получением готового продукта. Полученные таким образом ферментированные молочные напитки и продукты также могут быть предоставлены в форме, например, не содержащих добавки продуктов, полумягких продуктов, продуктов с фруктовыми наполнителями, твердых и жидких продуктов. На размер дозировки фенантроиндолизидинового алкалоидного соединения или его соли, которые представляют собой активный компонент ингибитора NFB по настоящему изобретению, жесткие ограничения не налагаются. Поскольку достигаемые эффекты варьируют в зависимости от различных особенностей использования, включая субъект введения, показания, и тому подобное, размер дозировки желательно определять для каждого случая, и размер дозировки фенантроиндолизидинового алкалоидного соединения или его соли составляет предпочтительно от 1 мг до 10 г, более предпочтительно от 10 мг до 1 г в сутки. Ингибитор NFB по настоящему изобретению может использоваться для всех видов млекопитающих, включая человека. Примеры Как описано ниже в этом документе, хотя настоящее изобретение будет далее детально описано примерами, настоящее изобретение ими не ограничивается. Фенантроиндолизидиновый алкалоид по настоящему изобретению синтезировали в соответствии с последовательностью синтеза, включающей следующие стадии 1-10. Если любой из заместителей, представленных R, требовал защиты для протекания реакции, то при проведении реакции использовали подходящую защитную группу. Пример синтеза 1. Синтезировали соединение, содержащее следующие группы в положениях R1-R6. Процессы, проводимые на стадиях 1-10, будут описаны ниже. Таблица 1. Соединение 1 Стадия 1. Синтез стильбена. В круглодонной колбе к суспензии 5,0 г (24,1 ммоль) 3,4-5-триметоксибензилцианида и 5,1 г (24,1 ммоль, 1,0 экв.) 4-гидроксибензальдегида в 150 мл этанола в атмосфере аргона при комнатной температуре и перемешивании добавляли 160 мг (2,4 ммоль, 0,1 экв.) этоксида натрия, и нагревали полученную смесь до температуры возгонки (температура масляной бани: 85C). Спустя 3 ч подтверждали исчезновение исходных веществ, и охлаждали полученную реакционную жидкость на льду с выпадением в оса- 11019927 док твердого вещества. Затем, путем фильтрования с отсасыванием с использованием воронки Бюхнера и фильтровальной колбы собирали твердое вещество, которое затем дважды промывали 100 мл метанола. Твердое вещество сушили в условиях пониженного давления при 60C с получением 9,3 г (97%) светложелтого порошка. 1 Н-ЯМР (400 МГц, CDCl3)3,87 (с, 3H), 3,91 (с, 6 Н), 5,12 (с, 2 Н), 6,83 (с, 2 Н), 7,04 (д, J=8,8 Гц, 2 Н),7,30-7,45 (м, 6 Н), 7,85 (д, J=8,8 Гц, 2 Н). Стадия 2. Синтез фенантрена путем фотоиндуцированной электроциклической реакции. В фотореакторе при комнатной температуре и перемешивании аргон продували через раствор 4,0 г(10,0 ммоль) стильбена в 7 л ацетонитрила. Спустя 10 мин добавляли 2,5 г (10,0 ммоль, 1,0 экв.) йода и 28 мл (400,0 ммоль, 40 экв.) пропиленоксида, а затем облучали светом при комнатной температуре и перемешивании. После 72 ч облучения подтверждали исчезновение исходных веществ, и концентрировали полученную реакционную жидкость. Остаточный продукт растворяли в 500 мл хлороформа, а затем промывали 1 л насыщенного тиосульфата натрия и 500 мл солевого раствора. Органический слой сушили над сульфатом магния, а затем выпаривали растворитель в условиях пониженного давления с получением твердого вещества. Твердое вещество собирали путем фильтрования с отсасыванием с использованием воронки Бюхнера и фильтровальной колбы, которое затем дважды промывали 50 мл метанола. Твердое вещество сушили в условиях пониженного давления при 60C с получением 2,6 г (64%) светлокоричневого порошка. 1 Н-ЯМР (400 МГц, CDCl3)3,87 (с, 3H), 4,04 (с, 3H), 4,08 (с, 3H), 5,31 (с, 2 Н), 7,33 (дд, J=2,7, 8,8 Гц,1 Н), 7,34-7,53 (м, 5 Н), 7,49 (с, 1 Н), 7,82 (д, J=8,8 Гц, 1 Н), 8,12 (с, 1 Н), 9,13 (д, J=2,7 Гц, 1 Н). Стадия 3. Восстановление цианогруппы диизобутилалюминия гидридом. В круглодонной колбе к раствору 1,6 г (3,9 ммоль) цианида в 200 мл хлористого метилена в атмосфере аргона при перемешивании и охлаждении на льду по каплям добавляли раствор 5,1 мл 1,0 М диизобутилалюминия гидрида в хлористом метилене (5,1 ммоль, 1,3 экв.). В процессе покапельного добавления смесь превращалась в желтую суспензию. Суспензию перемешивали в течение 1 ч на льду, затем в течение 3 ч при комнатной температуре, а затем подтверждали исчезновение исходных веществ. Полученную реакционную жидкость охлаждали на льду, медленно добавляли к жидкости 100 мл 10% соляной кислоты. Реакционная жидкость превращалась в суспензию, которую растворяли в растворе хлороформа/метанола (4/1). Органический слой разделяли, и экстрагировали водный слой раствором хлороформа/метанола (4/1). Органический слой объединяли, и сушили полученную смесь над сульфатом магния. Растворитель удаляли в условиях пониженного давления с получением 1,4 г (90%) желтого твердого вещества. 1H-HMP (400 МГц, CDCl3)3,87 (с, 3H), 4,05 (с, 3H), 4,08 (с, 3H), 5,33 (с, 2 Н), 7,34 (дд, J=2,4, 8,8 Гц, 1 Н), 7,36-7,56 (м, 5 Н), 7,93 (д, J=8,8 Гц, 1 Н), 8,12 (с, 1 Н), 8,96 (с, 1 Н), 9,18 (д, J=2,4 Гц, 1 Н), 10,24 (с,1 Н). Стадия 4. Восстановления альдегида боргидридом натрия. В круглодонной колбе к суспензии 1,4 г (3,5 ммоль) альдегида в 40 мл метанола и 80 мл 1,4 диоксана в атмосфере аргона при перемешивании и охлаждении на льду добавляли 148 мг (3,9 ммоль, 1,1 экв.) боргидрида натрия. Спустя 1 ч подтверждали исчезновение исходных веществ, и добавляли к полученной реакционной жидкости 100 мл солевого раствора. Затем, добавляли раствор хлороформа/метанола (4/1) с получением готового раствора, затем разделяли органический слой, и экстрагировали водный слой раствором хлороформа/метанола (4/1). Органический слой объединяли, и сушили полученную смесь над сульфатом магния. Растворитель удаляли в условиях пониженного давления с получением 1,5 г (колич.) светло-коричневого твердого вещества. 1 Н-ЯМР (400 МГц, CDCl3)3,87 (с, 3H), 4,037 (с, 3H), 4,044 (с, 3H), 5,10 (с, 2 Н), 5,29 (с, 2 Н), 7,28(д, J=2,4 Гц, 1 Н). Стадия 5. Бромирование гидроксильной группы. В приемную колбу к суспензии 1,5 г (3,5 ммоль) спирта в 50 мл хлороформа в атмосфере аргона добавляли 492 мкл (3,5 ммоль, 1 экв.) триэтиламина. Затем, при перемешивании с охлаждением на льду медленно по каплям добавляли 336 мкл (3,5 ммоль, 1,0 экв.) трехбромистого фосфора. Спустя 2 ч подтверждали исчезновение исходных веществ, и медленно по каплям добавляли 30 мл воды с выпадением в осадок твердого вещества. Спустя 30 мин твердое вещество растворяли в растворе хлороформа/метанола(4/1). Органический слой разделяли, и экстрагировали водный слой раствором хлороформа/метанола(4/1). Органический слой собирали и сушили над сульфатом магния, а затем удаляли растворитель в условиях пониженного давления с получением 1,6 г (95%) продукта реакции. Стадия 6. Введение фрагмента глутаминовой кислоты. В круглодонной колбе к раствору 783 мг (1,7 ммоль) бромида в 20 мл DMF и 20 мл бензола добавляли 491 мг (2,1 ммоль, 1,25 экв.) сложный диизопропиловый эфир L-глутаминовой кислоты и 588 мг(4,3 ммоль, 2,5 экв.) карбонат калия, а затем перемешивали с нагреванием при 80C. Спустя 2 ч подтверждали исчезновение исходных веществ. Полученную реакционную жидкость охлаждали на льду, и до- 12019927 бавляли к жидкости 100 мл воды и 100 мл солевого раствора. Затем добавляли 200 мл этилацетата, а затем промывали органический слой насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Полученный раствор сушили над сульфатом магния, и удаляли растворитель в условиях пониженного давления с получением аминированного неочищенного продукта. Раствор неочищенного продукта, полученного сходным путем в 16 мл метанола, 16 мл 1,4-диоксана и 8 мл уксусной кислоты перемешивали при 45C. Спустя 16 ч подтверждали исчезновение исходных веществ. Полученную реакционную жидкость отстаивали для охлаждения, и добавляли к жидкости 100 мл солевого раствора. Затем, постепенно добавляли насыщенный водный раствор бикарбоната натрия для слабого подщелачивания водного слоя. Водный слой экстрагировали этилацетатом, и сушили органический слой над сульфатом магния. Растворитель удаляли в условиях пониженного давления. Остаточный продукт очищали по методу колоночной хроматографии на силикагеле (гексан/этилацетат = 1/1) с получением 153 мг (15%) белого твердого вещества. Стадия 7. Гидролиз сложного эфира пироглутаминовой кислоты. В круглодонной колбе к раствору 153 мг (0,3 ммоль) сложного эфира в 10 мл метанола и 20 мл 1,4 диоксана при комнатной температуре и перемешивании добавляли водный раствор гидроксида калия(KOH: 70 мг (1,2 ммоль, 4,5 экв.), H2O: 5 мл). Спустя 1 ч подтверждали исчезновение исходных веществ,и выпаривали растворитель в условиях пониженного давления. К оставшемуся водному раствору понемногу при перемешивании с охлаждением на льду добавляли 1 моль/л соляную кислоту до достижения рН 2-3 с выпадением в осадок белого твердого вещества. Белое твердое вещество собирали путем фильтрования с отсасыванием с использованием воронки Бюхнера и фильтровальной колбы и дважды промывали 50 мл очищенной воды. Сборник помещали на другую фильтровальную колбу, и растворяли твердое вещество в растворе хлороформа/метанола (4/1). Полученный раствор переносили на делительную воронку, органический слой разделяли и сушили над сульфатом магния. После этого, удаляли растворитель в условиях пониженного давления с получением 114 мг (81%) желтовато-белого твердого вещества. Результаты стадий 5-7 будут описаны ниже. 1H-ЯМР (400 МГц, ДМСО-d6)1,80-1,92 (м, 1 Н), 2,06-2,22 (м, 1 Н), 2,30-2,40 (м, 2 Н), 3,65-3,71 (м,1 Н), 3,80 (с, 3H), 3,88 (с, 3H), 3,90 (с, 3H), 4,23 (д, J=14,7 Гц, 1 Н), 5,29 (с, 2 Н), 5,34 (д, J=14,7 Гц, 1 Н),7,28-7,36 (м, 2 Н), 7,38-7,46 (м, 3H), 7,50-7,56 (м, 3H), 7,84 (д, J=8,8 Гц, 1 Н), 8,97 (д, J=2,4 Гц, 1 Н). Стадия 8. Внутримолекулярная реакция ацилирования по Фриделю-Крафтсу. В круглодонной колбе к суспензии 114 мг (0,2 ммоль) карбоновой кислоты в 20 мл хлористого метилена в атмосфере аргона при комнатной температуре и перемешивании добавляли 41 мкл (0,5 ммоль,2,0 экв.) оксалилхлорида и одну каплю DMF. Спустя 1 ч медленно добавляли 690 мкл (0,7 ммоль, 3,0 экв.) 1,0 М хлорида олова (IV) в хлористом метилене. После завершения покапельного добавления полученную смесь нагревали до температуры возгонки. Спустя 4 ч подтверждали исчезновение исходных веществ. Полученную реакционную смесь (коричнево-оранжевую суспензию) охлаждали на льду, добавляли 50 мл 1 моль/л соляной кислоты, а затем перемешивали в течение 30 мин. Раствор хлороформа/метанола (4/1) добавляли для превращения смеси в раствор, и последовательно промывали органический слой 1 моль/л соляной кислотой, насыщенным водным раствором бикарбоната натрия и солевым раствором. Органический слой сушили над сульфатом магния, и удаляли растворитель в условиях пониженного давления. Остаточный продукт очищали по методу колоночной хроматографии на силикагеле(хлороформ/метанол =50/1) с получением 70 мг (60%) желтого твердого вещества. Стадия 9. Диастереоселективное восстановление кетона три-втор-бутилборгидридом лития. В круглодонной колбе к 20 мл (70 мг (0,15 ммоль кетона в THF при -78C в атмосфере аргона добавляли 300 мкл (2,0 экв.) три-втор-бутилборгидрида лития (1,0 М раствор в THF). Спустя 1 ч подтверждали исчезновение исходных веществ, а затем к полученной реакционной жидкости добавляли насыщенный водный хлорид аммония для гашения реакции. Водный слой экстрагировали этилацетатом, и сушили органический слой над безводным сульфатом магния. Растворитель удаляли в условиях пониженного давления, и очищали остаточный продукт по методу колоночной хроматографии на силикагеле(дд, J=8,8, 2,4 Гц, 1 Н), 8,15 (д, J=8,8 Гц, 1 Н), 9,00 (д, J=2,4 Гц, 1 Н). Стадия 10. Восстановление лактама. В круглодонной колбе к раствору 40 мг (0,08 ммоль) лактама в 30 мл THF в атмосфере аргона при перемешивании и охлаждении на льду по каплям добавляли 320 мкл (0,32 ммоль, 4,0 экв.) 1,0 МBH3THF в THF. Спустя 2 ч подтверждали исчезновение исходных веществ. Полученную реакционную жидкость охлаждали на льду, и при перемешивании добавляли к жидкости 49 мкл (0,32 ммоль, 4,0 экв.)N,N,N',N'-тетраметилэтилендиамин. Спустя 16 ч подтверждали исчезновение амин/боранового комплекса, удаляли растворитель в условиях пониженного давления, а затем очищали остаточный продукт по методу колоночной хроматографии на силикагеле (хлороформ/метанол = 50/1) с получением 16 мг (38%)(с, 3H), 5,03 (с, 1 Н), 6,48-6,55 (м, 1 Н), 7,20 (дд, J=8,8, 2,4 Гц, 1 Н), 8,38 (д, J=8,8 Гц, 1 Н), 8,99 (д, J=2,4 Гц,1 Н). Реакции проводили с использованием на упомянутой выше стадии 6 сложного изопропилового эфира D-глутаминовой кислоты вместо сложного изопропилового эфира L-глутаминовой кислоты, а на последующих стадиях реакции проводили тем же путем, что и упомянуто выше, с получением энантиомера. Следующие энантиомеры также получали сходным путем. Энантиомер (Соединение 2) Выход: 13%, 95,8% ее. Пример синтеза 2. Синтезировали соединение, содержащее следующие группы в положениях R1-R6. Процессы и выход каждого процесса представлены ниже. Таблица 2. Соединение 3- 14019927 Синтезировали соединение, содержащее следующие группы в положениях R1-R6. Процессы и выход каждого процесса представлены ниже. Таблица 3. Соединение 4(4 Н, м), 7,02-7,20 (1 Н, м), 7,50-7,58 (2 Н, м), 7,94 (1 Н, д, J=2,44 Гц), 8,01-8,10 (1 Н, м), 8,37 (1 Н, д, J=9,03 Гц). Стадия 11. Гидрогенолиз бензилового эфира. К суспензии 25 мг (0,06 ммоль) полученного на стадии 10 соединения в 10 мл метанола добавляли 5 мг 10% палладий на угле, а затем перемешивали в атмосфере водорода. Спустя 24 ч подтверждали исчезновение исходных веществ, и удаляли палладий на уголе путем фильтрации. Полученный фильтрат упаривали в условиях пониженного давления, и очищали остаточный продукт по методу колоночной хроматографии (хлороформ/метанол = 40/1) с получением 7 мг (28,6%) белого твердого вещества.H-ЯМР (400 МГц, CDCl3) : 1,86-2,06 (3H, м), 2,24-2,38 (1 Н, м), 2,40-2,52 (1 Н, м), 2,54-2,65 (1 Н, м),3,32-3,41 (1 Н, м), 3,59 (1 Н, д, J=15,13 Гц), 4,44 (1 Н, д, J=15,13 Гц), 5,04-5,13 (1 Н, м), 7,20-7,25 (1 Н, м),7,27-7,33 (1 Н, м), 7,68-7,78 (1 Н, м), 7,87 (1H, д, J=2,44 Гц), 8,08-8,15 (1H, м), 8,30 (1H, д, J=9,03 Гц). Пример синтеза 4. Синтезировали соединение, содержащее следующие группы в положениях R1-R6. Процессы и выход каждого процесса представлены ниже. Таблица 4. Соединение 8 1(2 Н, д, J=4,0 Гц), 7,10 (1 Н, дд, J=2,4, 8,8 Гц), 7,33 (1 Н, с), 7,82 (1 Н, д, J=2,4 Гц), 8,01 (1 Н, с), 8,12 (1 Н, д,J=8,8 Гц), 9,73 (1 Н, шир.с). Пример синтеза 5. Синтезировали соединение, содержащее следующие группы в положениях R1-R6. Процессы и выход каждого процесса представлены ниже. Таблица 5. Соединение 15(1 Н, дд, J=2,l, 10,0 Гц), 7,08 (1 Н, дд, J=2,4, 8,9 Гц), 7,78 (1 Н, д, J=8,9 Гц), 7,89 (1 Н, с), 7,94 (1 Н, д, J=2,4 Гц), 9,74 (1 Н, с). Производные, в которых стильбен синтезировали способом, отличным от описанного выше, синтезировали в соответствии с последовательностью синтеза, представленной для последующих стадий 1217. Взаимодействия после стадии 17 проводили в реакционных условиях, сходных с использованными после описанной выше стадии 5. Пример синтеза 6. Синтезировали соединение, содержащее следующие группы в положениях R1-R6. Процессы и выход каждого процесса представлены ниже. Таблица 6. Соединение 9 Стадия 12. Синтез стильбена. В круглодонную колбу добавляли 8,6 г (41,4 ммоль) 3,4-изопропилидендиоксифенилацетата, 13,2 г(62,2 ммоль, 1,5 экв.) 4-бензилоксибензальдегида, 8,6 мл (62,2 ммоль, 1,5 экв.) триэтиламина и 20 мл (207 ммоль, 5 экв.) безводной уксусной кислоты, а затем перемешивали при нагревании. Спустя 6 ч подтверждали исчезновение исходных веществ. Полученную реакционную жидкость отстаивали для охлаждения, а затем добавляли воду для гашения реакции. Добавляли разбавленную соляную кислоту, а затем экстрагировали полученную жидкость этилацетатом. Органический слой сушили над безводным сульфатом магния, а затем удаляли растворитель в условиях пониженного давления. Остаточный продукт очи- 17019927 щали по методу колоночной хроматографии (гексан/этилацетат = 5/11/1) с получением 7,5 г (44,8%) маслянистого продукта. 1(4 Н, м), 7,79 (1 Н, с). Стадия 13. Метилэстерификация. В круглодонной колбе к раствору 7,3 г (18,4 ммоль) карбоновой кислоты в 70 мл хлористого метилена, который представлял собой исходное вещество, в атмосфере аргона добавляли 2,4 мл (27,5 ммоль,1,5 экв.) оксалилхлорида. Спустя 30 мин подтверждали получение хлорангидрида, затем охлаждали реакционную смесь до 0C, а затем добавляли 3 мл (73,6 ммоль, 4 экв.) метанола. Спустя 1 ч подтверждали исчезновение исходных веществ, и добавляли к полученной реакционной жидкости солевой раствор. Водный слой экстрагировали хлороформом, органический слой собирали и сушили над безводным сульфатом магния. Растворитель удаляли в условиях пониженного давления с получением 8,8 г (колич.) неочищенного продукта. 1 Н-ЯМР (400 МГц, CDCl3) : 1,71 (6 Н, с), 3,78 (3H, с), 5,02 (2 Н, с), 6,59-6,81 (6 Н, м), 7,04-7,07 (2 Н,м), 7,36-7,40 (4 Н, м), 7,74 (1 Н, с). Стадия 14. Синтез фенантрена путем фотоиндуцированной электроциклической реакции. В фотореакторе при комнатной температуре и перемешивании продували аргон через раствор 8,7 г(18,4 ммоль) стильбена в 7 л ацетонитрила в течение приблизительно 10 мин. Спустя 10 мин добавляли 4,7 г (18,4 ммоль, 1,0 экв.) йода и 52 мл (736,0 ммоль, 40 экв.) пропиленоксида, а затем облучали светом при комнатной температуре и перемешивании. После 72 ч облучения подтверждали исчезновение исходных веществ, и концентрировали полученную реакционную жидкость. Остаточный продукт растворяли в 500 мл хлороформа, а затем промывали 1 л насыщенного тиосульфата натрия и 500 мл насыщенного солевого раствора. Органический слой сушили над сульфатом магния, а затем удаляли растворитель в условиях пониженного давления с получением твердого вещества. Путем фильтрования с отсасыванием с использованием воронки Бюхнера и фильтровальной колбы собирали твердое вещество, которое затем дважды промывали 50 мл метанола. Затем твердое вещество сушили в условиях пониженного давления при 60C с получением 6,3 г (66,5%) светло-коричневого порошка. 1H-ЯМР (400 МГц, CDCl3) : 1,77 (6 Н, с), 4,00 (3H, с), 5,28 (2 Н, с), 7,27 (1 Н, дд, J=2,4, 8,8 Гц), 7,347,46 (4 Н, м), 7,50-7,54 (2 Н, м), 7,83 (1 Н, с), 7,84 (1 Н, д, J=8,8 Гц), 7,86 (1 Н, д, J=2,4 Гц), 8,34-8,36 (1 Н, м). Стадия 17. Восстановление сложного эфира. В атмосфере аргона к раствору 900 мг (2,2 ммоль) сложного метилового эфира в 20 мл хлористого метилена в круглодонной колбе при 0C по каплям добавляли 9,6 мл 1,0 М раствора диизобутилалюминия гидрида в толуоле (9,6 ммоль, 4,4 экв.). Спустя 1 ч подтверждали исчезновение исходных веществ, и медленно добавляли 1 М соляную кислоту для гашения реакции. Водный слой экстрагировали хлороформом, и сушили органический слой над безводным сульфатом магния. Растворитель удаляли в условиях пониженного давления с получением 988 мг (колич.) неочищенного продукта. 1(1 Н, д, J=9,0 Гц), 9,67 (1 Н, шир.с). Пример синтеза 7. Синтезировали соединение, содержащее следующие группы в положениях R1-R6. Процессы и выход каждого процесса представлены ниже. Таблица 7. Соединение 10 Стадия 15. Депротекция ацетонида. К 2 г (4,8 ммоль) исходных веществ в круглодонной колбе добавляли 20 мл 6 н соляной кислоты и 20 мл уксусной кислоты, а затем нагревали с обратным холодильником. Спустя 4 ч подтверждали исчезновение исходных веществ. Полученную реакционную жидкость охлаждали на льду, и добавляли к ней солевой раствор. Водный слой экстрагировали этилацетатом, и сушили органический слой над безводным сульфатом магния. Растворитель удаляли в условиях пониженного давления. К остаточному продукту добавляли хлороформ с выпадением в осадок твердого вещества, которое собирали путем фильтрации с использованием воронки Кириямы. Полученное таким образом твердое вещество сушили в условиях пониженного давления с получением 956 мг (52,9%) продукта реакции. 1H-ЯМР (400 МГц, ДМСО-d6) : 3,91 (3H, с), 5,37 (2 Н, с), 7,26 (1 Н, дд, J=2,4, 8,8 Гц), 7,32-7,38 (1 Н,м), 7,40-7,45 (2 Н, м), 7,51-7,58 (2 Н, м), 7,96 (1 Н, д, J=8,8 Гц), 7,96 (1 Н, д, J=2,4 Гц), 8,05 (1 Н, с), 8,25 (1 Н,с), 8,26 (1 Н, с), 9,51 (1 Н, с), 9,90 (1 Н, с). Стадия 16. Этилэтерификация гидроксильной группы фенола. В круглодонной колбе к раствору 956 мг (2,6 ммоль) диола в 30 мл ацетона добавляли 2,2 г (15,6 ммоль, 6 экв.) К 2 СО 3 и 1,2 мл (15,6 ммоль, 6 экв.) этилбромида, а затем нагревали с обратным холодильником. Спустя 12 ч подтверждали исчезновение исходных веществ, и удаляли ацетон в условиях пониженного давления. Затем, к остаточному продукту добавляли солевой раствор. Водный слой экстрагировали этилацетатом, и сушили органический слой над безводным сульфатом магния. Растворитель удаляли в условиях пониженного давления, и очищали остаточный продукт по методу колоночной хроматографии (гексан/этилацетат =3/1) с получением 654 мг (76,9%) белого твердого вещества. 1 Н-ЯМР (400 МГц, CDCl3) : 1,57 (3H, т, J=7,0 Гц), 1,59 (3H, т, J=7,0 Гц), 4,00 (3H, с), 4,31 (2 Н, кв,J=7,0 Гц), 4,32 (2 Н, кв, J=7,0 Гц), 5,29 (2 Н, с), 7,27 (1 Н, дд, J=2,4, 8,8 Гц), 7,35-7,39 (1 Н, м), 7,41-7,47 (2 Н,м), 7,50-7,56 (2 Н, м), 7,85 (1 Н, д, J=8,8 Гц), 7,85 (1 Н, с), 7,89 (1 Н, д, J=2,4 Гц), 8,43 (1 Н, с), 8,63 (1 Н, с). Стадия 17. Выход: 82,9%. 1(2 Н, кв, J=7,0 Гц), 4,43 (1 Н, д, J=15,5 Гц), 4,60 (1 Н, д, J=8,9 Гц), 4,88 (1 Н, д, J=8,9 Гц), 7,08 (1 Н, дд, J=2,2,8,8 Гц), 7,13 (1 Н, с), 7,88 (1 Н, д, J=2,2 Гц), 7,89 (1 Н, с), 8,11 (1 Н, д, J=8,8 Гц), 9,60 (1 Н, с). Фенантроиндолизидиновый алкалоид, содержащий алкилкарбонилоксигруппу в R2 или R8, синтезировали путем ацилирования фенантроиндолизидинового алкалоида, содержащего соответствующую гидроксильную группу. Последовательность синтеза представлена на последующих стадиях 18 и 19. Пример синтеза 8. Синтезировали соединение, в котором R представляет собой СН 3, которое получали в соответствии с упомянутыми выше стадиями 18 и 19. Процессы и выход каждого процесса представлены ниже (соединение 5). Стадия 18. Диацилирование гидроксильных групп в положениях R2 и R8. В круглодонной колбе емкостью 100 мл к суспензии исходных веществ (90 мг, 0,25 ммоль) в хлористом метилене (15 мл) в атмосфере аргона при перемешивании с охлаждением на льду добавляли триэтиламин (1,4 мл, 40 экв.), безводную уксусную кислоту (0,95 мл, 40 экв.) и диметиламинопиридин (3 мг,0,1 экв.), а затем перемешивали в течение 6 ч. Подтверждали исчезновение исходных веществ, полученную реакционную жидкость затем концентрировали и очищали по методу колоночной хроматографии(1 Н, д, J=15,38 Гц), 6,73 (1 Н, brc), 7,23 (1 Н, с), 7,31 (1 Н, дд, J=2,20, 9,03 Гц), 7,89 (1 Н, с), 7,95 (1 Н, д,J=9,03 Гц), 8,21 (1 Н, д, J=2,20 Гц). 99% ее (условия проведения ВЭЖХ В), []D29+156,9 (с = 0,12, CHCl3). Стадия 19. Гидролиз феноксиэфира. В круглодонной колбе емкостью 100 мл к раствору диацетила (114 мг, 0,26 ммоль) в метаноле/тетрагидрофуране/воде (1/1/1) (6 мл) при перемешивании с охлаждением на льду добавляли бикарбонат натрия (24 мг, 1,1 экв.). Подтверждали исчезновение исходных веществ, а затем экстрагировали полученную смесь этилацетатом/гексаном. Органический слой сушили над безводным сульфатом магния, а затем удаляли растворитель. Остаточный продукт очищали по методу колоночной хроматографии (только CHCl3CHCl3/МеОН = 200/1) с получением 83 мг (78,4%) желтого твердого вещества. 1 Н-ЯМР (400 МГц, ДМСО-d6) : 1,43-1,55 (1 Н, м), 1,74-1,94 (3H, м), 2,04 (3H, с), 2,30-2,40 (1 Н, м),2,60-2,69 (1 Н, м), 3,10-3,40 (1 Н, м), 3,53 (1 Н, д, J=15,74 Гц), 3,94 (3H, с), 4,00 (3H, с), 4,67 (1 Н, д, J=15,74 Гц), 6,50 (1 Н, шир.с), 7,08 (1 Н, дд, J=2,44, 8,79 Гц), 7,27 (1 Н, с), 7,62 (1 Н, д, J=8,79 Гц), 7,95 (1 Н, с), 7,99(1 Н, д, J=2,44 Гц). 99% ее (условия проведения ВЭЖХ В), [] D28+172, 68 (с = 0,11, СН 3 ОН/CHCl3 = 1/1). Далее будет описан способ синтеза соединения, полученного путем восстановительного удаления гидроксильной группы соединения, полученного на стадии 9 (гидроксильной группы в положении R8 в общей формуле (1) или (2. Синтез проводили в соответствии со стадиями 20 и 21, представленными ниже. Пример синтеза 9. Соединение, содержащее следующие группы в положениях R1-R6, синтезировали на стадиях 20 и 21. Процессы и выход каждого процесса представлены ниже. Таблица 8. Соединение 11H-ЯМР (400 МГц, CDCl3) : 2,30-2,76 (4 Н, м), 3,97-4,02 (1 Н, м), 4,02 (3H, с), 4,10 (3H, с), 4,52 (1 Н,д, J=17,6 Гц), 5,25-5,27 (1 Н, м), 5,31 (2 Н, с), 5,41 (1 Н, д, J=17,6 Гц), 7,35-7,45 (5 Н, м), 7,52-7,55 (2 Н, м),7,82 (1 Н, с), 7,98 (1 Н, д, J=2,4 Гц), 8,21 (1 Н, д, J=9,3 Гц). Энантиомер Выход: 48%, [] D32-94,0 (с = 0,1, CHCl3). Стадия 20: Восстановительное удаление гидроксильной группы. В круглодонной колбе к раствору 719 мг (1,54 ммоль) спирта в 10 мл хлористого метилена при 0C в атмосфере аргона добавляли 293 мкл (2,31 ммоль, 1,5 экв.) комплекса трехфтористого бора и диэтилового эфира. Спустя 5 мин добавляли 984 мкл (6,16 ммоль, 4,0 экв.) триэтилсилана. Спустя 4 ч подтверждали исчезновение исходных веществ, и добавляли раствор хлороформа/метанола (4/1) с получением 1 полного раствора. Затем разделяли органический слой, и экстрагировали водный слой раствором хлороформа/метанола (4/1). Органический слой объединяли, и сушили полученную смесь над сульфатом магния. Растворитель удаляли в условиях пониженного давления, и очищали остаточный продукт по методу колоночной хроматографии (хлороформ/метанол = 50/1) с получением 516 мг (74%) белого твердого вещества, [] D30+185,34 (с = 0,1, CHCl3). 1[]D27-196,52 (с = 0,1, CHCl3). Стадия 21. Восстановление лактама (процесс был аналогичен описанному на стадии 10). Выход: 74%, [] D30+90,40 (с = 0,1, CHCl3). 1(2 Н, м), 7,93 (1 Н, д, J=9,0 Гц), 8,17 (1 Н, д, J=2,4 Гц). Удельное оптическое вращение энантиомера (соединение 12) []D29-103,88 (с = 0,1, CHCl3). Пример синтеза 10. Соединение, содержащее следующие группы в положениях R1-R6, синтезировали на стадиях 20 и 21 и путем депротекции на стадии 11. Процессы и выход каждого процесса представлены ниже.(1 Н, дд, J=2,4, 8,8 Гц), 7,29 (1 Н, с), 7,83 (1 Н, д, J=8,8 Гц), 7,84 (1 Н, д, J=2,4 Гц), 8,00 (1 Н, с), 9,67 (1 Н, с). Пример синтеза 11. Соединение, содержащее следующие группы в положениях R1-R6, синтезировали на стадиях 20 и 21 и путем депротекции на стадии 11. Процессы и выход каждого процесса представлены ниже. Таблица 10. Соединение 14 1H-ЯМР (400 МГц, ДМСО-d6) : 1,41 (3H, т, J=7,0 Гц), 1,43 (3H, кв, J=7,0 Гц), 1,51-1,68 (1 Н, м), 1,751,94 (2 Н, м), 2,07-2,23 (1 Н, м), 2,32-2,40 (2 Н, м), 2,68-2,83 (1 Н, м), 3,26-3,42 (2 Н, м), 3,48 (1 Н, д, J=15,0 Гц), 4,19 (2 Н, дкв, J=7,0, 10,0 Гц), 4,26 (2 Н, кв, 7,0 Гц), 4,50 (1 Н, д, J=15,0 Гц), 7,08 (1 Н, дд, J=2,3, 8,9 Гц),7,17 (1 Н, с), 7,83 (1 Н, т, J=8,9 Гц), 7,90 (1 Н, д, J=2,3 Гц), 7,91 (1 Н, с), 9,64 (1 Н, с). Пример синтеза 12. Синтезировали соединение, содержащее следующие группы в положениях R1-R6. Процессы и выход каждого процесса представлены ниже. Таблица 11. Соединение 21 1H-ЯМР (400 МГц, CDCl3) : 3,93 (3H, с), 3,96 (3H, с), 5,24 (2 Н, с), 6,91 (1 Н, д, J=8,3 Гц), 7,50 (1 Н, д,J=9,3 Гц), 7,11 (1 Н, д, J=2,4 Гц), 7,23 (1 Н, дд, J=2,4, 8,3 Гц), 7,28 (1 Н, с), 7,32-7,50 (5 Н, м), 7,81-7,89 (2 Н,м). Стадия 2. Выход: 96,4%. Выделяли смесь региоизомеров по положению атома хлора на ароматическом кольце. Стадия 3. Выход: 86,3%. Выделяли смесь региоизомеров по положению атома хлора на ароматическом кольце. Стадия 4. Выход: 92,5%. Выделяли смесь региоизомеров по положению атома хлора на ароматическом кольце. Стадии 5 и 6. Выход: 64,4%. Выделяли смесь региоизомеров по положению атома хлора на ароматическом кольце. Стадия 7. Выход: 72,4%. 1 Выделяли смесь региоизомеров по положению атома хлора на ароматическом кольце. Стадия 8. R1 = Cl, R3 = Н (производное соединения 21). Выход: 31,6%. 1H-ЯМР (400 МГц, ДМСО-d6) : 1,55-1,70 (1 Н, м), 1,74-1,92 (2 Н, м), 2,07-2,21 (1 Н, м), 2,29-2,41 (2 Н,м), 2,70-2,86 (1 Н, м), 3,25-3,36 (2 Н, м), 3,55 (1 Н, д, J=15, 6 Гц), 3,93 (3H, с), 3,96 (3H, с), 4,54 (1 Н, д, J=15,6 Гц), 5,38 (2 Н, с), 7,24 (1 Н, с), 7,32-7,46 (3H, м), 7,52-7,64 (3H, м), 8,02 (1 Н, д, J=9,0 Гц), 9,26 (1 Н, с). Стадия 11. Депротекция бензильной группы R1 = Cl, R3 = Н (соединение 21). Выход: 48,2%. 1R1 = Н, R3 = Cl (соединение 22). Выход: 56,7%. 1 Н-ЯМР (400 МГц, ДМСО-d6) : 1,55-1,70 (1 Н, м), 1,76-1,92 (2 Н, м), 2,08-2,21 (1 Н, м), 2,30-2,40 (2 Н,м), 2,71-2,83 (1 Н, м), 3,22-3,41 (2 Н, м), 3,52 (1 Н, д, J=15,1 Гц), 3,92 (3H, с), 3,95 (3H, с), 4,52 (1 Н, д, J=15,1 Гц), 7,21 (1 Н, с), 7,30 (1 Н, д, J=9,0 Гц), 7,87 (1 Н, д, J=9,0 Гц), 9,26 (1 Н, с). Пример синтеза 13. Синтезировали соединение, содержащее следующие группы в положениях R1-R6. Процессы и выход каждого процесса представлены ниже. Таблица 13. Соединение 23H-ЯМР (400 МГц, ДМСО-d6) : 1,56-1,72 (1 Н, м), 1,75-1,93 (2 Н, м), 2,07-2,22 (1 Н, м), 2,29-2,40 (2 Н,м), 2,70-2,81 (1 Н, м), 3,22-3,40 (2 Н, м), 3,52 (1 Н, д, J=15,1 Гц), 3,92 (3H, с), 3,94 (3H, с), 4,51 (1 Н, д, J=15,1 Гц), 7,20 (1 Н, с), 7,95 (1 Н, с), 9,16 (1 Н, с). Пример синтеза 14. Синтезировали соединение, содержащее следующие группы в положениях R16R . Процессы и выход каждого процесса представлены ниже. Таблица 14. Соединение 25 1(1 Н, м), 7,11 (1 Н, д, J=2,2 Гц), 7,23 (1 Н, дд, J=2,2, 8,6 Гц), 7,29 (1 Н, с), 7,32-7,49 (5 Н, м), 7,56-7,64 (1 Н, м),7,66-7,73 (1 Н, м). Стадия 2. Выход: 55,6%. Выделяли смесь региоизомеров по положению атома фтора. Стадия 3. Выход: колич. Выделяли смесь региоизомеров по положению атома фтора. Стадия 4. Выход: 99,0%. Выделяли смесь региоизомеров по положению атома фтора. Стадии 5 и 6. R1 = F, R3 = Н. Выход: 58,2%. 1H-ЯМР (400 МГц, ДМСО-d6) : 1,54-1,70 (1 Н, м), 1,74-1,94 (2 Н, м), 2,09-2,21 (1 Н, м), 2,26-2,43 (2 Н,м), 2,69-2,81 (1 Н, м), 3,26-3,42 (2 Н, м), 3,53 (1 Н, д, J=15,1 Гц), 3,92 (3H, с), 3,95 (3H, с), 4,55 (1 Н, д, J=15,1 Гц), 7,24 (1 Н, с), 7,27 (1 Н, дд, J=8,8, 8,9 Гц), 7,70 (1 Н, д, J=8,9 Гц), 8,44 (1 Н, д, J=6,1 Гц), 9,97 (1 Н, шир.с). Пример синтеза 15. Синтезировали соединение, содержащее следующие группы в положениях R1-R6. Процессы и выход каждого процесса представлены ниже. Таблица 16. Соединение 26 Стадия 22. Преобразование кетона до оксима. В круглодонной колбе к раствору 200 мг (0,43 ммоль) исходных веществ в этаноле (20 мл) и 1,4 диоксане (50 мл) добавляли 1 мл пиридина и 70 мг (1,0 ммоль, 2,3 экв.) гидроксиламина гидрохлорида, и нагревали полученную смесь с обратным холодильником. Спустя 72 ч подтверждали исчезновение ис- 26019927 ходных веществ, и добавляли воду к полученной реакционной жидкости для гашения реакции. Водный слой экстрагировали этилацетатом, и сушили органический слой над безводным сульфатом магния. Растворитель удаляли в условиях пониженного давления, и очищали остаточный продукт по методу колоночной хроматографии (хлороформ/метанол =50/140/1) с получением 120 мг (57,8%) целевого соединения. 1H-ЯМР (400 МГц, CDCl3) : 1,92-2,06 (1 Н, м), 2,32-2,43 (1 Н, м), 2,50-2,66 (1 Н, м), 2,89-3,00 (1 Н, м),3,78 (1 Н, д, J=15,6 Гц), 4,06 (6 Н, с), 4,06-4,13 (1 Н, м), 4,79 (1 Н, ушир.с), 5,27 (2 Н, с), 5,50 (1 Н, д, J=15,6 Гц), 7,06 (1 Н, с), 7,50-7,58 (2 Н, м), 7,32-7,49 (5 Н, м), 7,68-7,73 (1 Н, м), 8,43-8,54 (1 Н, м). Стадия 23. Восстановление оксима и лактама. В круглодонной колбе к 440 мкл 1,0 М раствора алюмогидрида лития в THF (0,44 ммоль, 4 экв.) в атмосфере аргона при перемешивании и охлаждении на льду по каплям добавляли 50 мг (0,11 ммоль) исходных веществ в 20 мл THF, а затем нагревали полученную смесь с обратным холодильником. Спустя 2 ч подтверждали исчезновение исходных веществ, и добавляли 0,25 мл 15% гидроксида натрия для гашения реакции. Водный слой экстрагировали этилацетатом, и сушили органический слой над безводным сульфатом магния. Растворитель удаляли в условиях пониженного давления, и очищали остаточный продукт по методу колоночной хроматографии (хлороформ/метанол = 50/120/1) с получением 31 мг(1 Н, м), 7,03 (1 Н, дд, J=2,4, 8,8 Гц), 7,33 (1 Н, с), 7,82 (1 Н, с), 7,88 (1 Н, д, J=2,4 Гц), 8,11 (1 Н, д, J=8,8 Гц),9,65 (1 Н, ушир.с). Пример синтеза 17. Соединение, содержащее метильную группу в положении R7 в общей формуле (1) или (2) (соединение 6), может быть синтезировано путем замены сложного эфира аминокислоты, использованного на стадии 6, на сложный эфир -метилглутаминовой кислоты.(40/60). Скорость потока: 0,5 мл/мин. Детекция: 254 нм. Температура колонки: 40C. Время измерения: 30 мин. Условия проведения ВЭЖХ-анализа C Колонка: Daicel CHIRALPAK AS-RH (5 мкм, 4,6150 мм). Подвижная фаза: смешанный раствор H2O/CH3CN (1/4). Скорость потока: 0,5 мл/мин. Детекция: 24 нм. Температура колонки: 40C. Условия проведения ВЭЖХ-анализа D Колонка: Daicel CHIRALCEL OD-RH (5 мкм, 4,6150 мм). Подвижная фаза: смешанный раствор 20 мМ (натрий) фосфатный буфер (рН 5,6)/CH3CN (1/4). Скорость потока: 0,5 мл/мин. Детекция: 254 нм. Температура колонки: 40C. Пример 1. Измерение растворимости. Для исследований in vivo фенантроиндолизидиновые алкалоидные соединения использовали в форме соли. Результаты измерения растворимости (S)-6,7-диметокси-9,10,11,12,12 а,13-гексагидро-9 а-азациклопента[b]трифенилен-3-ола гидрохлорида (соединение 11), (S)-6,7-диметокси-9,10,11,12,12 а,13-гексагидро-9 а-азациклопента[b]трифенилен-3-ола сульфата (соединение 17), (S)-6,7-диметокси-9,10,11,12,12 а,13 гексагидро-9 а-азациклопента[b]трифенилен-3-ола метансульфоната (соединение 16) и метансульфоната сложного (12aS,13S)-3-гидрокси-6,7-диметокси-9,10,11,12,12 а,13-гексагидро-9 а-азациклопента[b] трифенилен-13-илового эфира уксусной кислоты (соединение 20) представлены ниже. Таблица 17 растворимость в водном 5% растворе глюкозы. Описанное выше фенантроиндолизидиновое алкалоидное соединение продемонстрировало хорошую растворимость в растворителе. В частности, когда его метансульфонат растворяли в водном 5% растворе глюкозы, он демонстрировал значительную для целей введения растворимость (10 мг/мл). Соединения, синтезированные как описано выше, использовали для проведения тестов на биологическую активность в форме некоторой соли. Конкретно, использованные соли были следующими. Следует отметить, что соединения 16, 17, 18, 19 и 20 и упомянутые выше соединения 11, 13, 12 и 5 являются одинаковыми по структуре, но различающимися по типу соли; поэтому, метод синтеза указанных соединений соответствует упомянутому выше методу синтеза.
МПК / Метки
МПК: A61P 1/00, A61P 11/06, A61P 35/00, A61P 17/06, A61P 3/10, A61P 37/02, A61P 25/28, A61P 3/04, A61P 31/04, C07D 471/04, A61P 29/00, A61K 31/437, A61P 35/04, A61P 19/02, A61P 43/00, A61P 31/12, A61P 9/10, A61P 17/00, A61P 37/06, A61P 37/08, A61P 9/08, C07D 491/147
Метки: соединение, действующего, качестве, содержащий, nfkb, ингредиента, ингибитор, фенантроиндолизидиновое
Код ссылки
<a href="https://eas.patents.su/30-19927-fenantroindolizidinovoe-soedinenie-i-ingibitor-nfkb-soderzhashhijj-ego-v-kachestve-dejjstvuyushhego-ingredienta.html" rel="bookmark" title="База патентов Евразийского Союза">Фенантроиндолизидиновое соединение и ингибитор nfkb, содержащий его в качестве действующего ингредиента</a>
Предыдущий патент: Полимерный гель как модификатор текучести для системы нагнетания воды в пласт
Следующий патент: Способ получения аденовирусных векторов
Случайный патент: Схема обезболивания












