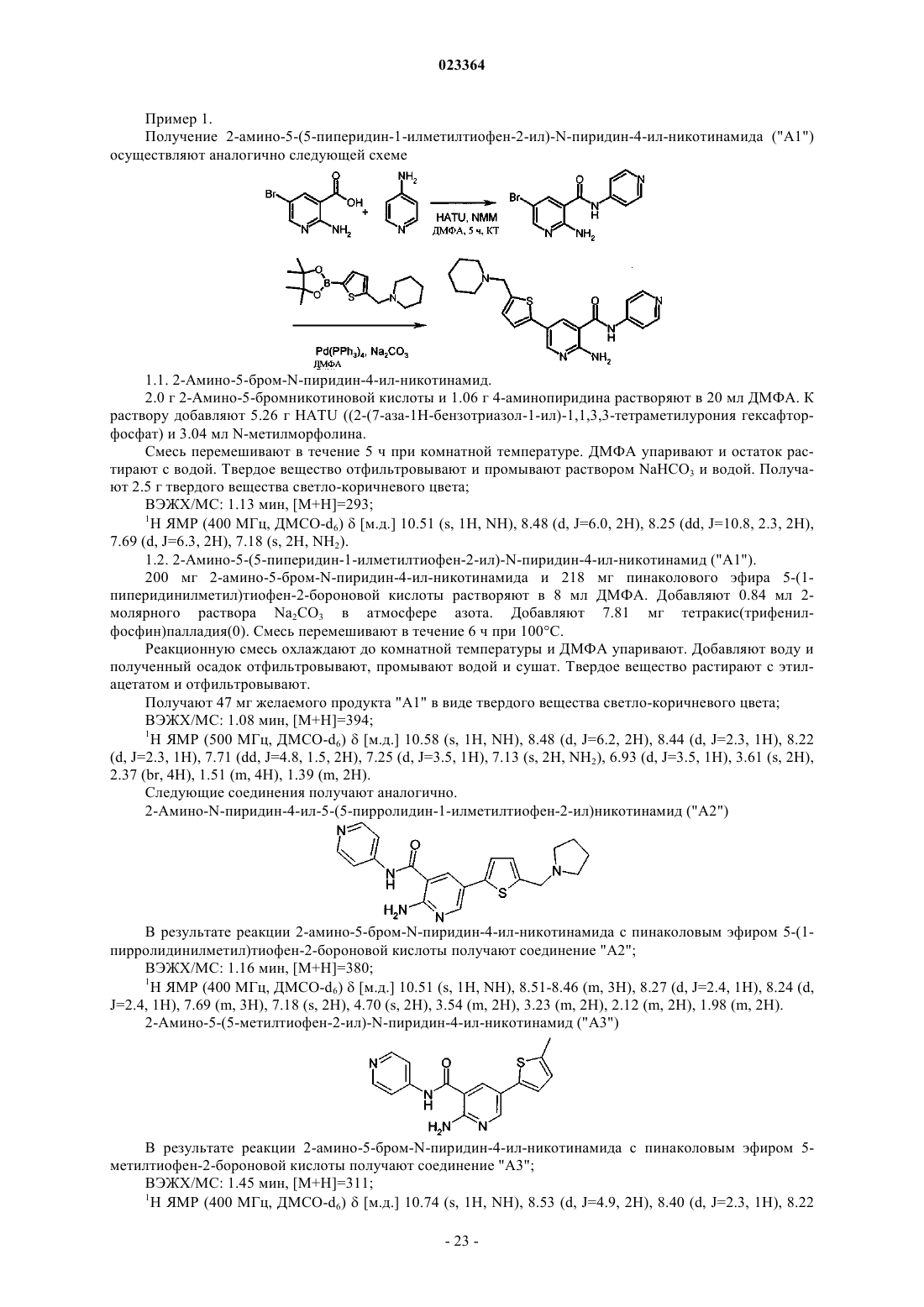
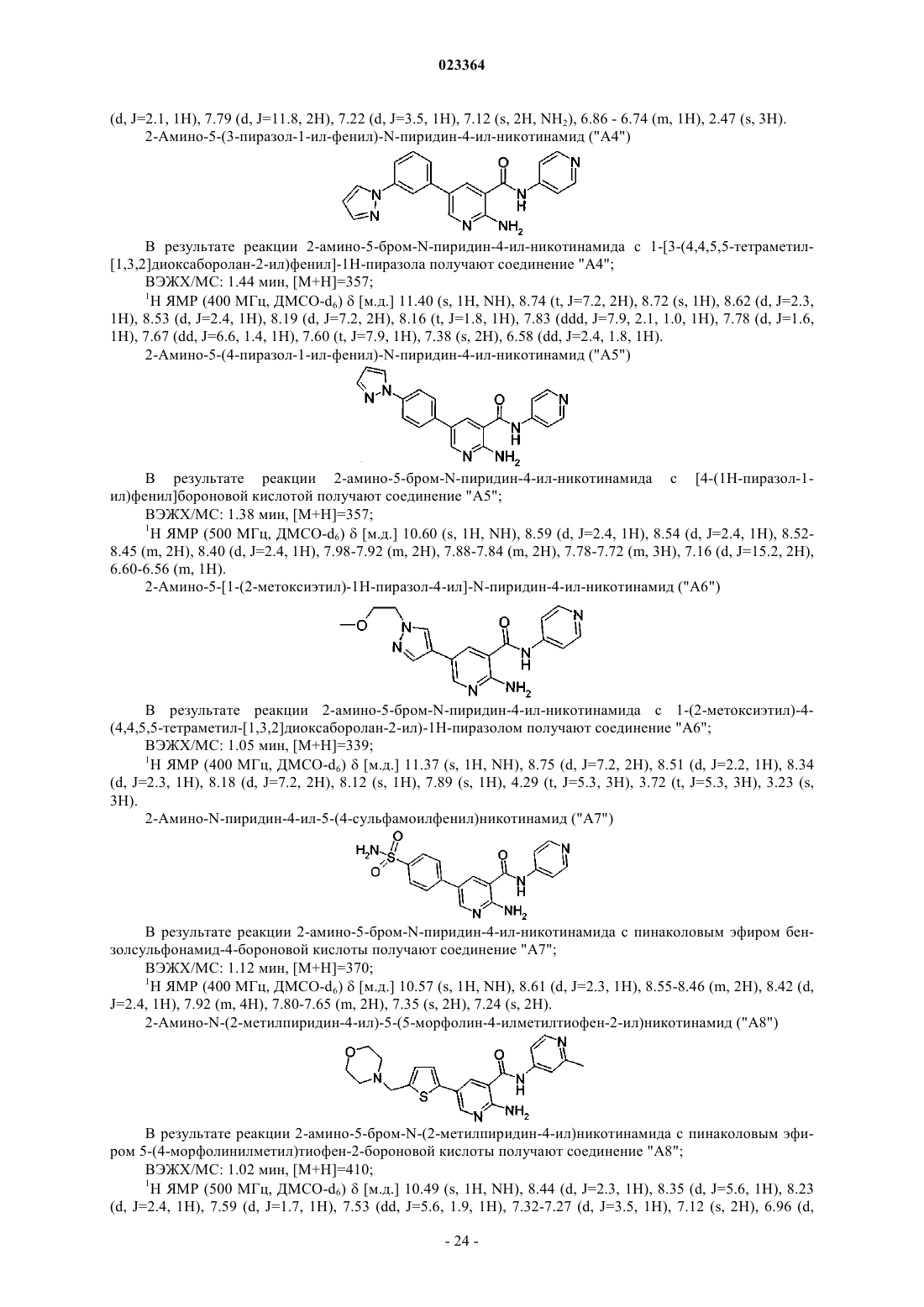
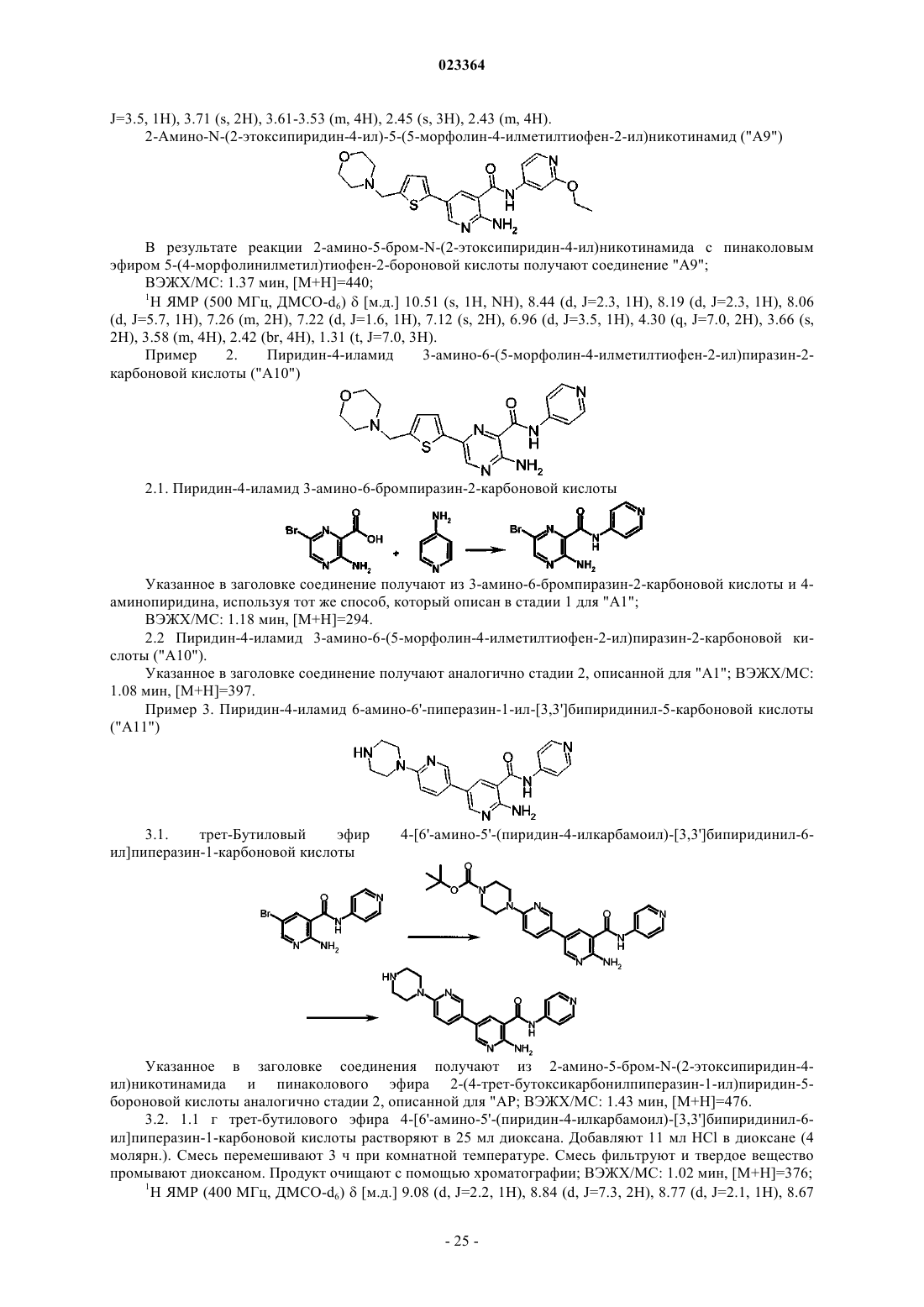
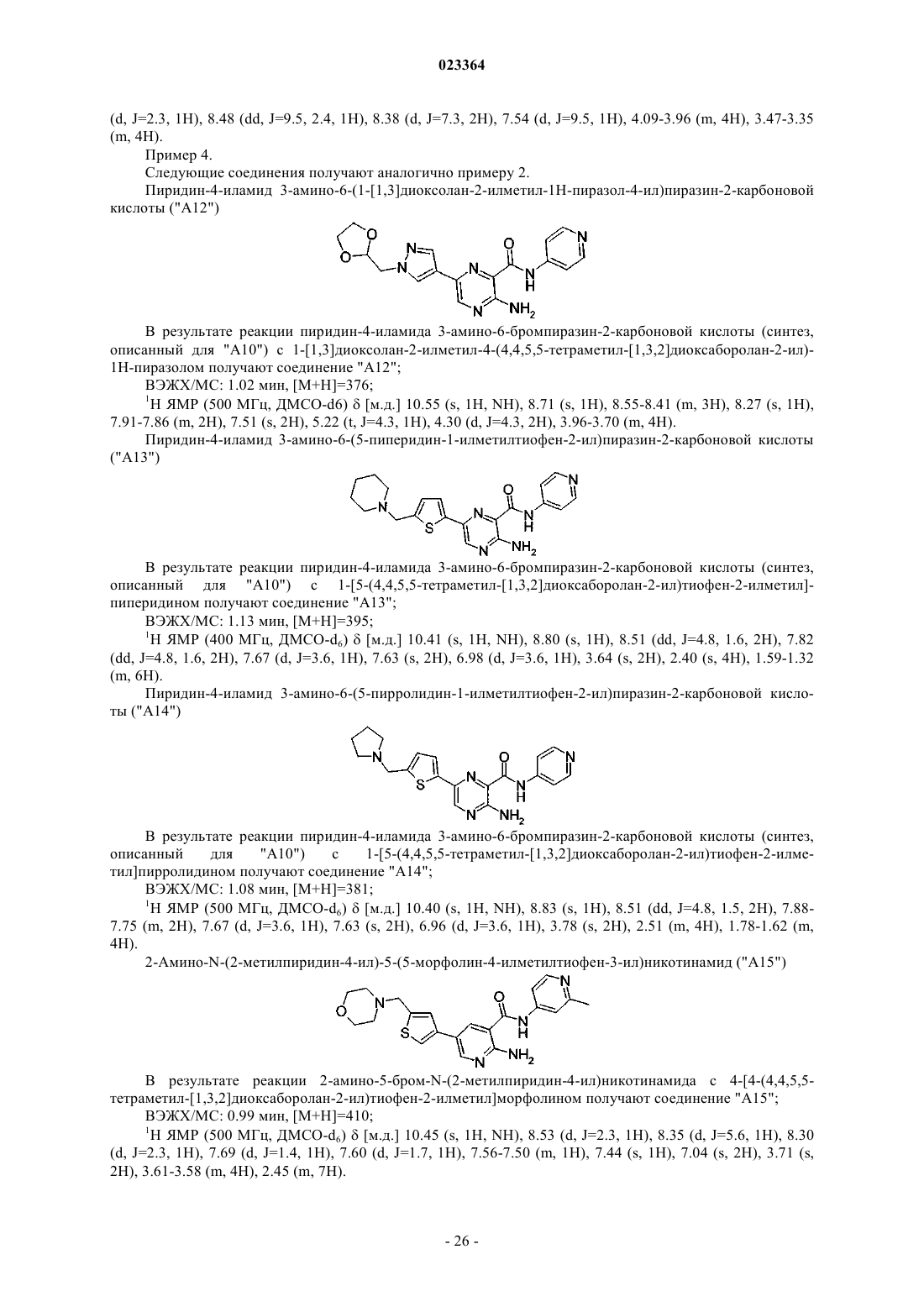
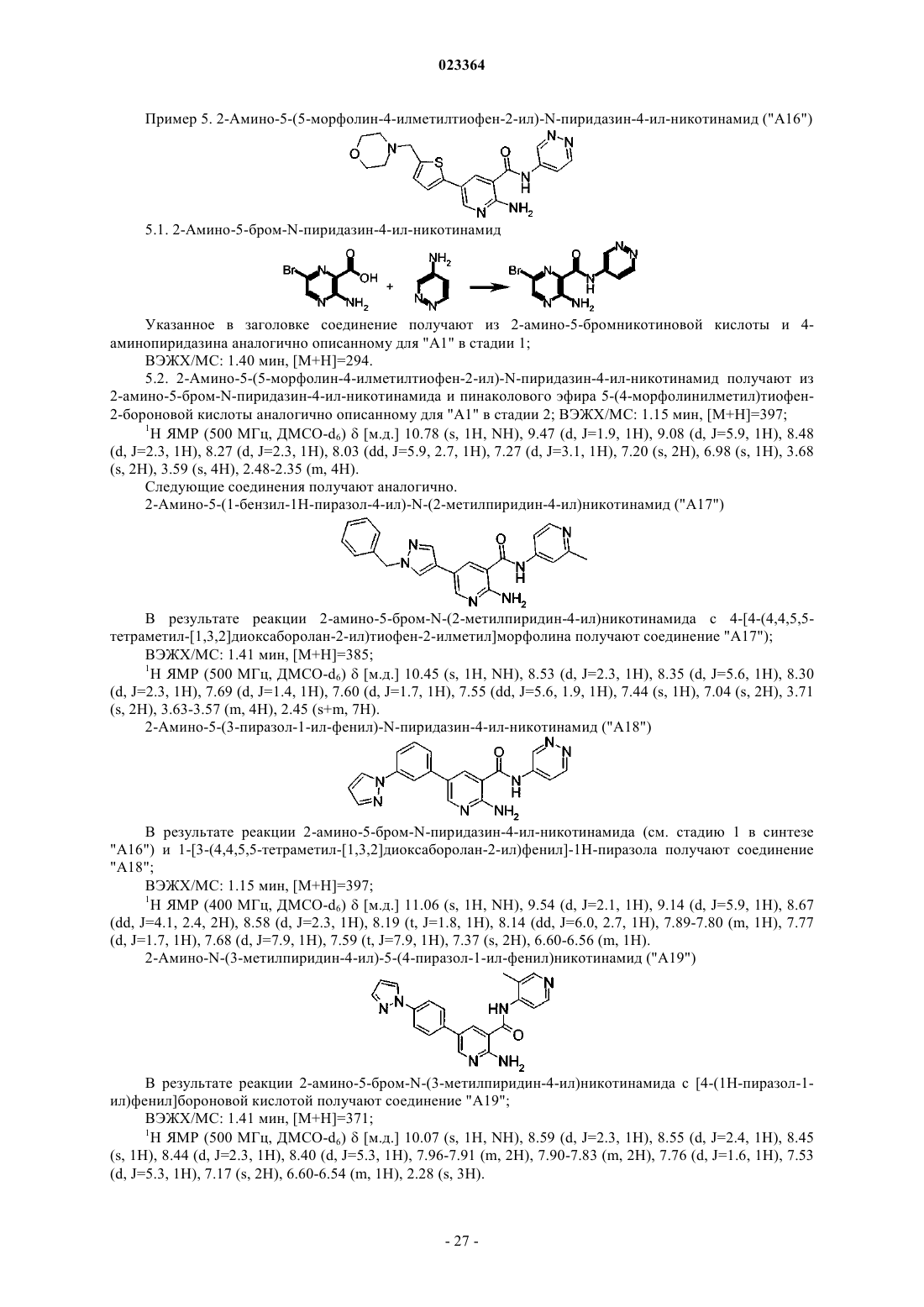
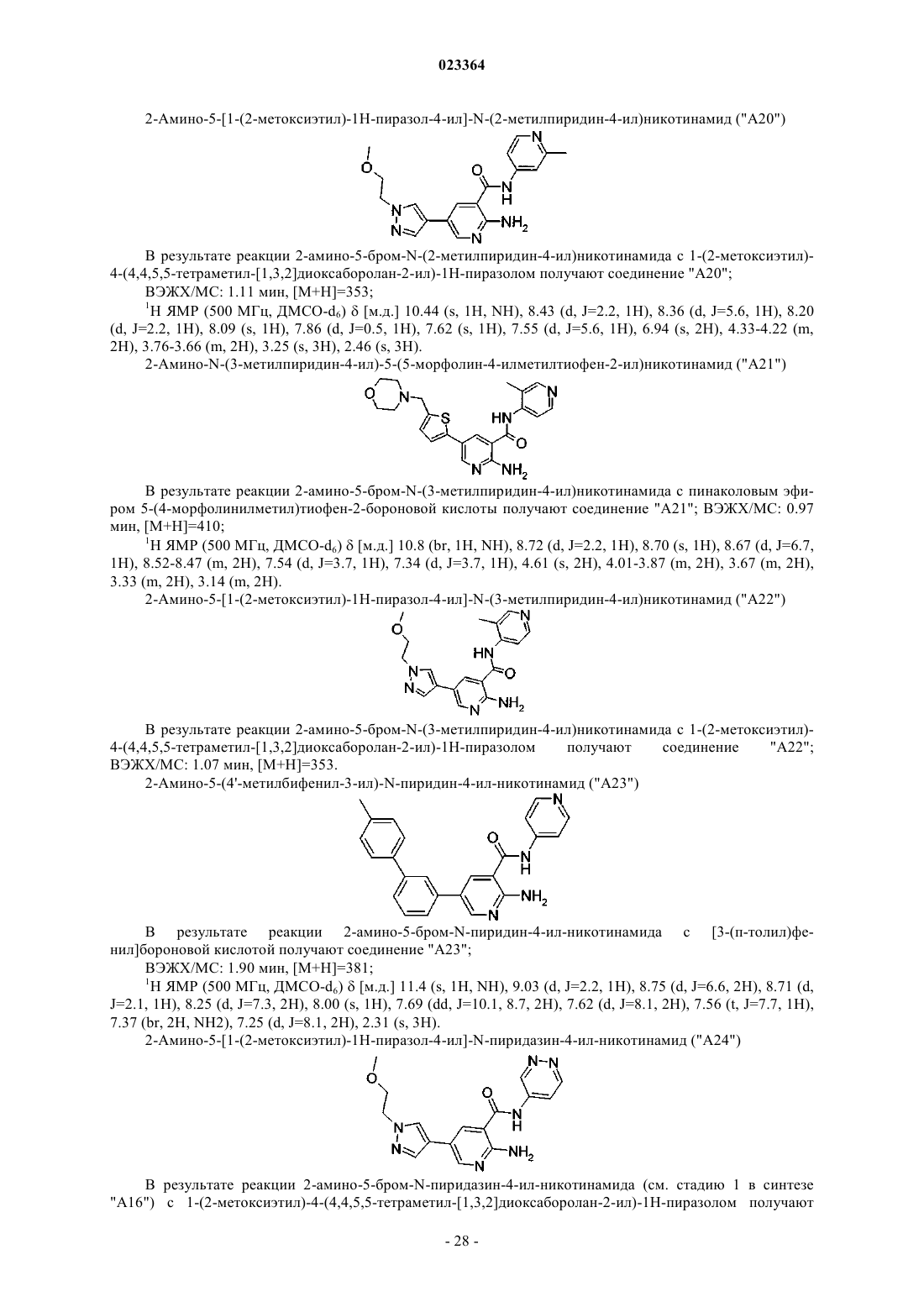
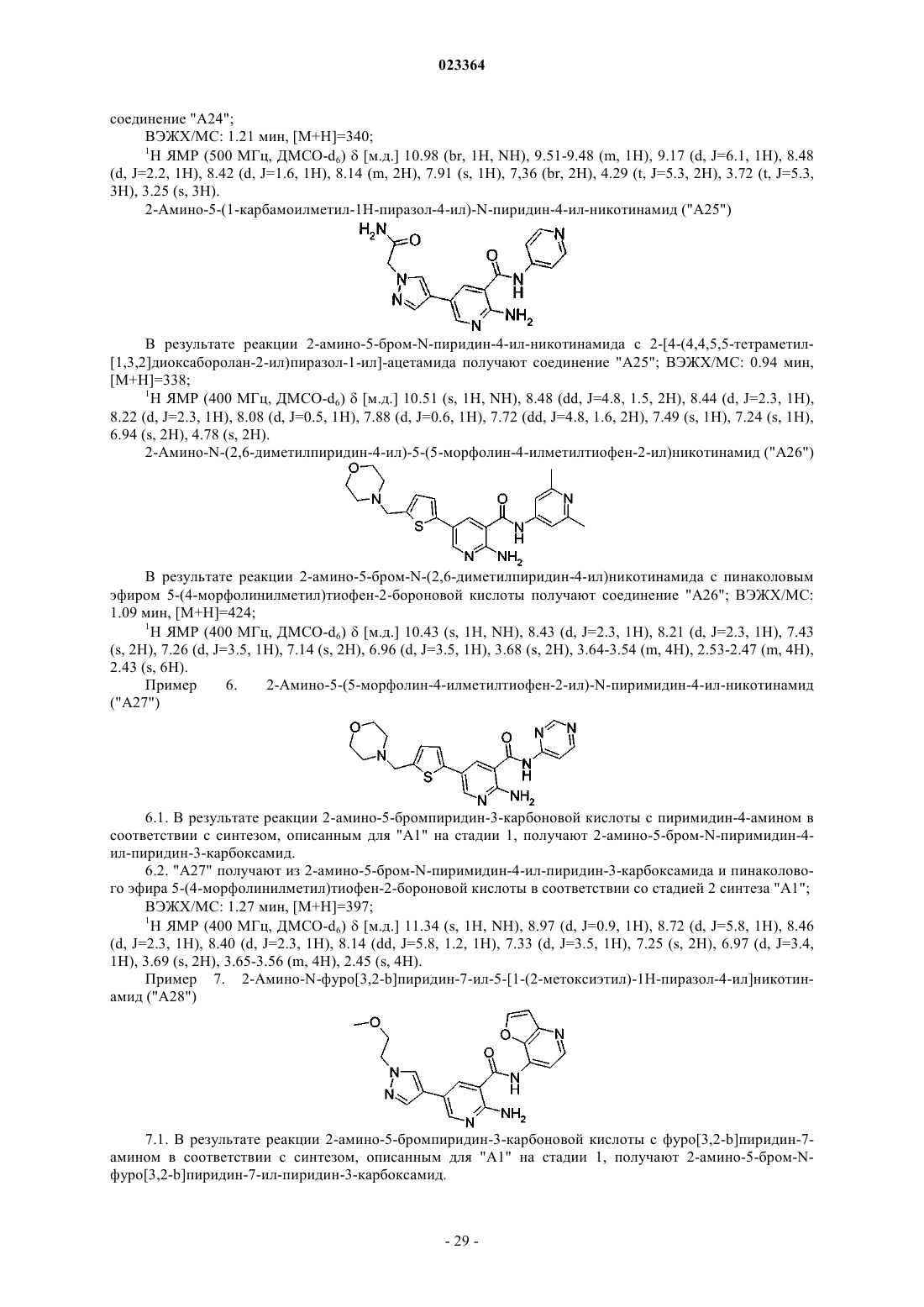
Производные пиридина и пиразина
Номер патента: 23364
Опубликовано: 31.05.2016
Авторы: Карра Сриниваса Р., Хёльцеманн Гюнтер, Эггенвайлер Ханс-Михаэль
Формула / Реферат
1. Соединения формулы I
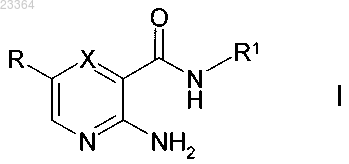
в которой X означает CH;
R означает Ar или Het;
R1 означает фурил, тиенил, пирролил, имидазолил, пиразолил, оксазолил, изоксазолил, тиазолил, пиридил, пиримидил, пиридазинил, индолил, изоиндолил, бензимидазолил, индазолил, хинолил, 1,3-бензодиоксолил, бензотиофенил, бензофуранил, имидазопиридил или фуро[3,2-b]пиридил, каждый из которых незамещен или моно- или дизамещен Hal, A, OR5, CN, COOA, COOH, CON(R5)2 и/или NR5COA';
Ar означает фенил, бифенил или нафтил, каждый из которых незамещен или моно-, ди- или тризамещен Hal, A, Het1, (CH2)nOR5, (CH2)nN(R5)2, NO2, CN, (CH2)nCOOR5, CON(R5)2, CONH(CH2)qNHCOOA', CON[R5(CH2)nHet1], NR5COA, NHCOOA, NR5SO2A, COR5, SO2Het2, SO2N(R5)2 и/или S(O)pA;
Het означает фурил, тиенил, пирролил, имидазолил, пиразолил, оксазолил, изоксазолил, тиазолил, пиридил, пиримидинил, триазолил, тетразолил, тиадиазол, пиридазинил, пиразинил, индолил, изоиндолил, бензимидазолил, индазолил, хинолил, 1,3-бензодиоксолил, бензотиофенил, бензофуранил или имидазопиридил, каждый из которых незамещен или моно-, ди- или тризамещен А, COA, (CH2)pHet2, OH, OA, Hal, (CH2)pN(R5)2, NO2, CN, (CH2)pCOOR5, (CH2)pCON(R5)2, NR5COA, (CH2)pCOHet2 и/или (CH2)рфенилом;
Het1 означает фурил, тиенил, пирролил, имидазолил, пиразолил, оксазолил, изоксазолил, тиазолил, пиридил, пиримидинил, триазолил, тетразолил, тиадиазол, пиридазинил, пиразинил, каждый из которых незамещен или моно-, ди- или тризамещен A, OH, OA, Hal, CN и/или (CH2)pCOOR5;
Het2 означает дигидропирролил, пирролидинил, тетрагидроимидазолил, дигидропиразолил, тетрагидропиразолил, дигидропиридил, тетрагидропиридил, пиперидинил, морфолинил, гексагидропиридазинил, гексагидропиримидинил, [1,3]диоксоланил, пиперазинил, каждый из которых незамещен или монозамещен OH и/или А;
A' означает неразветвленный или разветвленный алкил, который имеет 1-6 C атомов, где 1-7 H атомов могут быть заменены на F;
A означает неразветвленный или разветвленный алкил, который имеет 1-10 C атомов, где одна или две несмежных CH- и/или CH2-группы могут быть заменены на N, О, S атомов и/или на -CH=CH-группы и/или дополнительно 1-7 H атомов могут быть заменены на F;
R5 означает H или неразветвленный или разветвленный алкил, который имеет 1-6 C атомов, где 1-7 H атомов могут быть заменены на F;
Hal означает F, Cl, Br или I;
n означает 0, 1, 2, 3 или 4;
p означает 0, 1 или 2;
q означает 1, 2, 3 или 4,
и их фармацевтически пригодные соли и стереоизомеры, включая их смеси во всех соотношениях.
2. Соединения по п.1, в которых R1 означает пиридил, пиримидил, пиридазинил или фуро[3,2-b]пиридил, каждый из которых незамещен или монозамещен Hal, A, OR5, COOA, COOH, CON(R5)2 и/или NR5COA', и их фармацевтически пригодные соли и стереоизомеры, включая их смеси во всех соотношениях.
3. Соединения по п.1 или 2, в которых Ar означает фенил, бифенил или нафтил, каждый из которых незамещен или моно-, ди- или тризамещен A, Hal, Het1, COR5, CON(R5)2, CONH(CH2)qNHCOOA', CON[R5(CH2)nHet1], NHCOOA, (CH2)nN(R5)2, (CH2)nOR5, (CH2)nCOOR5, SO2Het2 и/или SO2N(R5)2, и их фармацевтически пригодные соли и стереоизомеры, включая их смеси во всех соотношениях.
4. Соединения по одному или нескольким из пп.1-3, в которых Het означает тиенил, пиразолил, пиридил, каждый из которых незамещен или моно- или дизамещен A, (CH2)pHet2, (CH2)pCON(R5)2 и/или (CH2)рфенилом, и их фармацевтически пригодные соли и стереоизомеры, включая их смеси во всех соотношениях.
5. Соединения по одному или нескольким из пп.1-4, в которых Het1 означает пиразолил или имидазолил, каждый из которых незамещен или монозамещен A, и их фармацевтически пригодные соли и стереоизомеры, включая их смеси во всех соотношениях.
6. Соединения по одному или нескольким из пп.1-5, в которых Het2 означает пирролидинил, пиперидинил, морфолинил, [1.3]диоксоланил, пиперазинил, каждый из которых незамещен или монозамещен OH и/или А, и их фармацевтически пригодные соли и стереоизомеры, включая их смеси во всех соотношениях.
7. Соединения по одному или нескольким из пп.1-6, в которых A означает неразветвленный или разветвленный алкил, который имеет 1-6 C атомов, где одна или две несмежные CH и/или CH2-группы могут быть заменены на N и/или О атомов и/или дополнительно 1-7 H атомов могут быть заменены на F, и их фармацевтически пригодные соли и стереоизомеры, включая их смеси во всех соотношениях.
8. Соединения по одному или нескольким из пп.1-7, в которых
X означает CH;
R означает Ar или Het;
R1 означает пиридил, пиримидил, пиридазинил или фуро[3,2-b]пиридил, каждый из которых незамещен или монозамещен Hal, A, OR5, COOA, COOH, CON(R5)2 и/или NR5COA';
Ar означает фенил, бифенил или нафтил, каждый из которых незамещен или моно-, ди- или тризамещен A, Hal, Het1, COR5, CON(R5)2, CONH(CH2)qNHCOOA', CON[R5(CH2)nHet1], NHCOOA, (CH2)nN(R5)2, (CH2)nOR5, (CH2)nCOOR5, SO2Het2 и/или SO2N(R5)2;
Het означает тиенил, пиразолил, пиридил, каждый из которых незамещен или моно- или дизамещен A, (CH2)pHet2, (CH2)pCON(R5)2 и/или (CH2)рфенилом;
Het1 означает пиразолил или имидазолил, каждый из которых незамещен или монозамещен А;
Het2 означает пирролидинил, пиперидинил, морфолинил, [1.3]диоксоланил, пиперазинил, каждый из которых незамещен или монозамещен OH и/или А;
A' означает неразветвленный или разветвленный алкил, который имеет 1-6 C атомов, где 1-7 H атомов могут быть заменены на F;
A означает неразветвленный или разветвленный алкил, который имеет 1-6 C атомов, где одна или две несмежные CH- и/или CH2-группы могут быть заменены на N и/или О атомов и/или дополнительно 1-7 H атомов могут быть заменены на F;
R5 означает H или неразветвленный или разветвленный алкил, который имеет 1-6 C атомов, где 1-7 H атомов могут быть заменены на F;
Hal означает F, Cl, Br или I;
n означает 0, 1, 2, 3 или 4;
p означает 0, 1 или 2;
q означает 1, 2, 3 или 4,
и их фармацевтически пригодные соли и стереоизомеры, включая их смеси во всех соотношениях.
9. Соединения по п.1, выбранные из группы
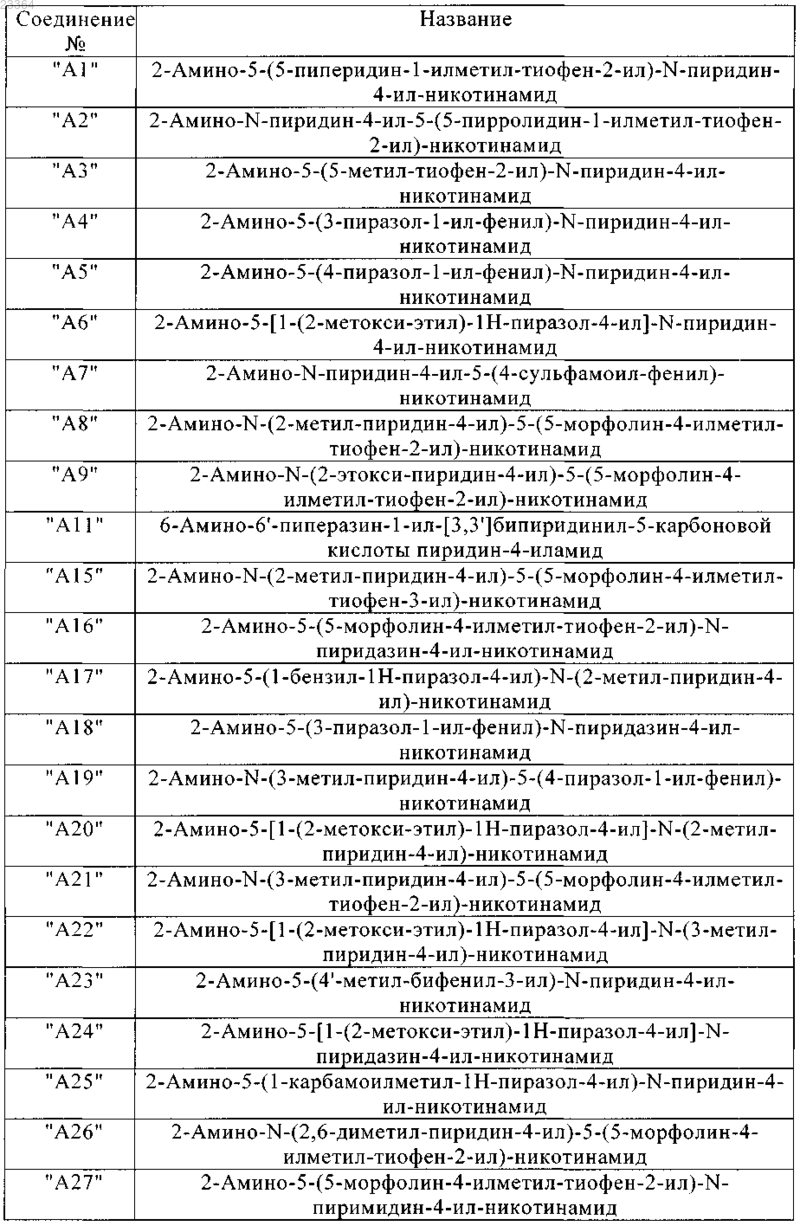
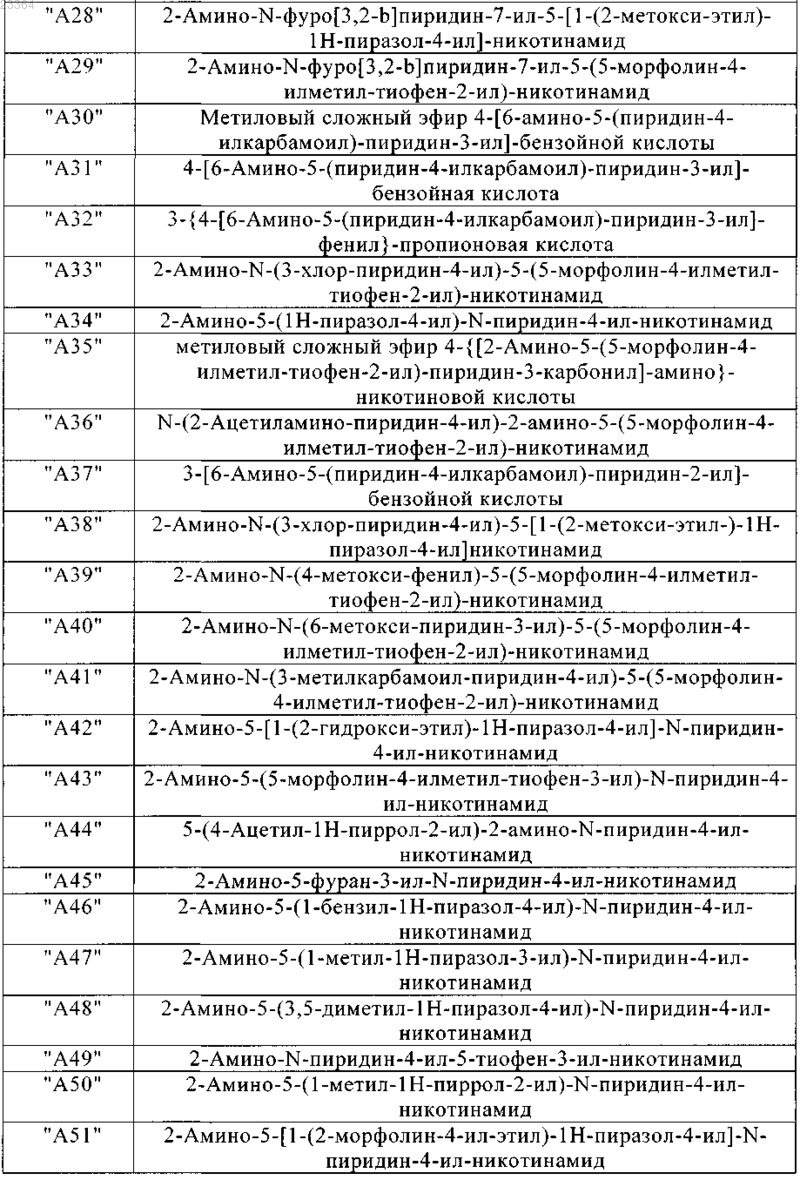

и их фармацевтически пригодные соли и стереоизомеры, включая их смеси во всех соотношениях.
10. Лекарственное средство, обладающее ингибирующим действием в отношении TBK1 и IKKe, которое содержит по меньшей мере одно соединение формулы I по пп.1-9 и/или его фармацевтически пригодные соли и стереоизомеры, включая их смеси во всех соотношениях, и необязательно вспомогательные вещества и/или адъюванты.
Текст
в которых R, R1 и X имеют значения, указанные в п.1, являются ингибиторами TBK1 и IKK и могут быть использованы, в частности, для лечения злокачественного новообразования и воспалительных заболеваний.(71)(73) Заявитель и патентовладелец: МЕРК ПАТЕНТ ГМБХ (DE) Предпосылки изобретения Задачей изобретения является выявление новых соединений, которые имеют ценные свойства, в особенности тех, которые могут быть использованы для приготовления лекарственных средств. Настоящее изобретение относится к соединениям пиридина, способным ингибировать одну или несколько киназ. Соединения находят свое применение в лечении различных нарушений, включая злокачественное новообразование, септический шок, первичную открытоугольную глаукому (POAG), гиперплазию, ревматоидный артрит, псориаз, артеросклероз, ретинопатию, остеоартрит, эндометриоз, хроническое воспаление и/или нейродегенеративные заболевания, такие как болезнь Альцгеймера. Настоящее изобретение относится к соединениям и применению соединений, где играет роль ингибирование, регуляция и/или модуляция передачи сигналов киназой, в частности рецепторными тирозинкиназами, кроме того, к фармацевтическим композициям, которые содержат эти соединения, и к применению соединений для лечения вызванных киназой заболеваний. Поскольку протеинкиназы регулируют почти каждый клеточный процесс, включая метаболизм,пролиферацию клеток, дифференцировку клеток и жизнестойкость клеток, они являются важной целью для терапевтического вмешательства для различных болезненных состояний. Например, контроль клеточного цикла и ангиогенез, где протеинкиназы играют основную роль, являются клеточными процессами, связанными с многочисленными болезненными состояниями, такими как, но не ограничиваясь ими,злокачественное новообразование, воспалительные заболевания, аномальный ангиогенез и относящиеся к нему заболевания, атеросклероз, дегенерация желтого пятна, диабет, ожирение и боль. В частности, настоящее изобретение относится к соединениям и к применению соединений, в котором играет роль ингибирование, регуляция и/или модуляция передачи сигналов TBK1 и IKK. Одним из основных механизмов, по которому осуществляется клеточная регуляция, это посредством трансдукции внеклеточных сигналов через мембрану, что, в свою очередь, модулирует биохимические пути внутри клетки. Фосфорилирование белков представляет собой одно направление, по которому внутриклеточные сигналы распространяются от молекулы к молекуле, приводя в итоге к клеточному ответу. Эти каскады передачи сигналов являются высокорегулируемыми и часто пересекаются, как это очевидно исходя из существования многих протеинкиназ, а также фосфатаз. Фосфорилирование белков происходит преимущественно по остаткам серина, треонина или тирозина, и поэтому протеинкиназы были классифицированы по их специфичности сайта фосфорилирования, т.е. серин-/треонинкиназы и тирозинкиназы. Поскольку фосфорилирование является таким распространенным процессом в клетках и поскольку на клеточные фенотипы сильно влияет активность этих путей, в настоящее время считается,что ряду болезненных состояний и/или заболеваний присущи либо аберрантная активация, либо функциональные мутации в молекулярных компонентах киназных каскадов. Следовательно, значительное внимание было уделено характеристике этих белков и соединений, которые способны модулировать их активность (см. Weinstein-Oppenheimer et al. Pharma. . Therap., 2000, 88, 229-279).IKK и TBK1 являются серин-/треонинкиназами, которые очень соответствуют друг другу и другимIkB киназам. Две киназы играют ключевую роль во врожденной иммунной системе. Вирусы, содержащие двуспиральную РНК, распознаются Toll-подобными рецепторами 3 и 4 и РНК-геликазами RIG-I иMDA-5 и приводят к активации TRIF-TBK1/IKK-IRF3 сигнального каскада, что приводит к ответу интерферонов типа I. В 2007 г. Boehm et al. было описано IKK как новый онкоген рака молочной железы [J.S. Boehm etal., Cell, 129, 1065-1079, 2007]. Было исследовано 354 киназы относительно их способности повторятьRas-трансформированный фенотип вместе с активированной формой MAPK киназы Mek. IKK была установлена в этом документе как кооперативный онкоген. Кроме того, авторы смогли показать, что IKK амплифицируются и сверхэкспрессируются в многочисленных клеточных линиях рака молочной железы и образцах опухолей. Снижение в экспрессии генов посредством РНК-интерференции в клетках рака молочной железы вызывает апоптоз и ослабляет их пролиферацию. Eddy et al. обнаружил подобное в 2005 г., что подчеркивает важность роли IKK в заболеваниях рака молочной железы [S.F. Eddy et al.,Cancer Res., 2005; 65 (24), 11375-11383]. Проопухолевый эффект TBK1 впервые было указан в 2006 г. При проверке генотеки, которая содержит 251000 кДНК, Korherr et al. точно определил три гена, TRIF, TBK1 и IRF3, которые являются типично задействованными во врожденной иммунной защите в качестве проангиогенных факторов [С.Korherr et al., PNAS, 103, 4240-4245, 2006]. В 2006 г. Chien et al. [Y. Chien et al., Cell, 127, 157-170, 2006] опубликовал, что TBK1-/- клетки могут быть лишь до определенной меры быть преобразованы с использованием онкогенного Ras, что предполагает вовлечение TBK1 в Ras-опосредованное превращение. Кроме того, они смогли показать, что РНК-i-опосредованное отключение TBK1 запускает апоптоз вMCF-7 и Panc-1 клетках. Barbie et al. недавно опубликовала, что TBK1 является чрезвычайно важной в бесчисленных раковых клеточных линиях с мутированным K-Ras, что предполагает, что TBK1 интерверсия могла бы сыграть важную роль в терапевтическом плане в соответствующей опухоли [D.A.Barbie et al., Nature Letters, 1-5, 2009]. Заболевания, вызванные протеинкиназами, характеризуются аномальной активностью или гиперак-1 023364 тивностью таких протеинкиназ. Аномальная активность относится либо к: (1) экспрессии в клетках, которые обычно не экспрессируют эти протеинкиназы; (2) повышенной киназной экспрессии, которая приводит к нежелательной пролиферации клеток, такой как злокачественное новообразование; (3) повышенной киназной активности, которая приводит к нежелаемой пролиферации клеток, такой как злокачественное новообразование, и/или к гиперактивности соответственных протеинкиназ. Гиперактивность относится либо к амплификации гена, который кодирует определенную протеинкиназу, либо к генерации уровня активности, который может быть коррелирован заболеванием, связанным с пролиферацией клеток (т.е. тяжесть одного или нескольких симптомов заболевания, связанного с пролиферацией клеток возрастает с возрастанием уровня киназы). На биодоступность протеинкиназы может также повлиять присутствие или отсутствие связывающих белков этой киназы.IKK и TBK1 являются очень гомологичными Ser/Thr киназам, которые критично вовлечены во врожденный иммунный ответ через индукцию интерфеонов типа 1 и других цитокинов. Эти киназы стимулируются в ответ на вирусную/бактериальную инфекцию. Иммунный ответ на вирусную и бактериальную инфекцию включает присоединение антигенов, таких как бактериальные липополисахариды(LPS), вирусной двуспиральной РНК (дсРНК) к Toll-подобным рецепторам, затем последующую активацию пути TBK1. Активированные TBK1 и IKK фосфорилируют IRF3 и IRF7, что запускает димеризацию и ядерную транслокацию тех интерферон-регулирующих факторов транскрипции, которые в конечном счете индуцируют сигнальные каскады, ведущие к выработке IFN. В последнее время, IKK и TBK1 также связывают со злокачественным новообразованием. Было продемонстрировано, что IKK взаимодействует с активированным MEK для преобразования клеток человека. Кроме того, IKK является часто амплифицированной/сверхэкспрессированной в клеточных линиях рака молочной железы и опухолях, полученных у пациента. TBK1 индуцируется в гипоксических условия и экспрессируется на значительных уровнях во многих солидных опухолях. Кроме того, TBK1 требуется для поддержки онкогенного превращения Ras, TBK1 киназная активность повышается в видоизмененных клетках и требуется для их выживания в культуре. Подобным образом было обнаружено, что TBK1 и NF-kB сигнализация имеет важное значение в KRAS мутантных опухолях. Они определили TBK1 в качестве синтетического летального партнера онкогенного KRAS. Литература. 1. Y.-H. Ou et al., Molecular Cell, 41, 458-470, 2011. 2. D.A. Barbie et al., nature, 1-5, 2009. Следовательно, соединения в соответствии с изобретением или их фармацевтически приемлемую соль вводят для лечения злокачественного новообразования, включая солидные карциномы, такие как,например, карциномы (например, легких, поджелудочной железы, щитовидной железы, мочевого пузыря или ободочной кишки), миелоидных заболеваний (например, миелоидного лейкоза) или аденом (например, ворсинчатой аденомы ободочной кишки). Кроме того, опухоли включают моноцитарный лейкоз, рак головного мозга, мочеполовой системы,лимфатической системы, желудка, гортани и легких, включая аденокарциному легких и мелкоклеточный рак легких, рак поджелудочной железы и/или молочной железы. Кроме того, соединения пригодны для лечения иммунодефицита, индуцированного ВИЧ-1 (вирусом иммунодефицита типа 1). Как ракоподобные гиперпролиферативные заболевания рассматриваются рак головного мозга, рак легких, плоскоклеточный рак, рак мочевого пузыря, рак желудка, рак поджелудочной железы, рак печени, рак почки, рак ободочной и прямой кишки, рак молочной железы, рак головы, рак шеи, рак пищевода, рак женских половых органов, рак щитовидной железы, лимфомы, хронический лейкоз и острый лейкоз. В частности, рост ракоподобных клеток представляет собой заболевание, которое является целью настоящего изобретения. Таким образом, настоящее изобретение относится к соединениям в соответствии с изобретением в качестве лекарственных средств и/или активных компонентов лекарственных средств для лечения и/или профилактики указанных заболеваний и к применению соединений в соответствии с изобретением для приготовления фармацевтического препарата для лечения и/или профилактики указанных заболеваний и к способу лечения указанных заболеваний, включающему введение одного или нескольких соединений в соответствии с изобретением пациенту, нуждающемуся в таком введении. Может быть продемонстрировано, что соединения в соответствии с изобретением обладают антипролиферативным действием. Соединения в соответствии с изобретением вводятся пациенту с гиперпролиферативным заболеванием, например, для ингибирования роста опухоли, для уменьшения воспаления, связанного с лимфопролиферативным заболеванием, для ингибирования отторжения трансплантата или неврологического повреждения в результате восстановления ткани, и т.д. Эти соединения пригодны для профилактических или терапевтических целей. Используемый в настоящем изобретении термин "лечение" применяется для обозначения как предотвращения заболеваний, так и лечения ранее существующих состояний. Предотвращение пролиферации/жизнеспособности достигают путем введения соединений в соответствии с изобретением до явного развития заболевания, например для предотвращения роста опухолей. Альтернативно, соединения применяются для лечения продолжающихся заболева-2 023364 ний путем стабилизации или улучшения клинических симптомов у пациента. Хозяин или пациент может принадлежать к любому виду млекопитающих, например, такому как приматы, предпочтительно человек; грызуны, включая мышей, крыс и хомячков; кролики; лошади, коровы, собаки, коты и т.д. Животные модели представляют интерес для экспериментальных исследований, поскольку они обеспечивают модель для лечения заболевания человека. Чувствительность определенной клетки к лечению с помощью соединений в соответствии с изобретением может быть определена при исследованиях в условиях in vitro. Обычно культуру клеток инкубируют с соединением в соответствии с изобретением при различных концентрациях в течение периода времени, достаточного для того, чтобы позволить активным веществам индуцировать гибель клетки или ингибировать пролиферацию, жизнеспособность клеток или миграцию, обычно в интервале времени приблизительно от одного часа до одной недели. Для исследования в условиях in vitro можно использовать культивируемые клетки из образца биопсии. Затем определяют количество клеток, оставшихся после обработки. Доза будет изменяться в зависимости от конкретного применяемого соединения, конкретного заболевания, состояния пациента и т.д. Обычно терапевтическая доза будет достаточной для существенного уменьшения нежелательной популяции клеток в ткани-мишени, при поддержании жизнеспособности пациента. Лечение в общем случае продолжают до тех пор, пока не будет достигнуто существенного уменьшения, например по меньшей мере приблизительно 50% уменьшения, популяции клеток, представляющих интерес, при этом лечение можно продолжать до тех пор, пока, по существу, в организме не будут определяться нежелательные клетки. Существует много заболеваний, связанных с нарушением регуляции пролиферацией клеток и клеточной гибели (апоптоза). Состояния, представляющие интерес, включают, но не ограничиваясь только ими, следующие. Соединения в соответствии с изобретением пригодны для лечения различных состояний, в которых присутствует пролиферация и/или миграция гладкомышечных клеток и/или воспалительных клеток в интимальный слой сосудов, что приводит к ограничению кровотока через этот сосуд, например, в случае неоинтимальных окклюзионных поражений. Окклюзионные заболевания трансплантированных сосудов, которые представляют интерес, включают атеросклероз, заболевание коронарных сосудов после трансплантации, стеноз венозного трансплантата, перианастомотический простетический рестеноз, рестеноз после ангиопластики или установления стента, и др. В дополнение, соединения в соответствии с изобретением можно применять для достижения аддитивного или синергетического эффектов в определенных существующих химиотерапиях и лучевых терапиях злокачественных опухолей и/или для восстановления эффективности определенных существующих химиотерапии и лучевых терапий злокачественных опухолей. Термин "способ" относится к методам, средствам, технологиям и методикам выполнения данной задачи, включая, но не ограничиваясь ими, те методы, средства, технологии и методики, которые либо известны, либо быстро разрабатываемы из известных методов, средств, технологий и методик специалистами в областях химии, фармакологии, биологии, биохимии и медицины. Термин "введение", используемый в данной заявке, относится к способу сведения соединения в соответствии с изобретением и целевой киназы вместе таким образом, что соединение может оказать воздействие на ферментную активность киназа либо непосредственно; т.е. путем взаимодействия с киназой как таковой, либо опосредованно, т.е. путем взаимодействия с другой молекулой, от которой зависит каталитическая активность киназы. Как употреблено в данной заявке, введение можно выполнять in vitro,т.е. в пробирках, или in vivo, т.е. в клетках или тканях живого организма. В данной заявке термин "лечение" включает прекращение, существенное ингибирование, замедление или изменение направления прогрессии заболевания или нарушения, существенное улучшение клинических симптомов заболевания или нарушения или существенное предотвращение появления клинических симптомов заболевания или нарушения. В данной заявке термин "предотвращение" относится к способу удержания организма от приобретения нарушения или заболевания изначально. Для любого соединения, используемого в данном изобретении, терапевтически эффективное количество, которое также в данной заявке употребляется как терапевтически эффективная доза, может быть установлено в начальной стадии из анализов культуры клеток. Например, в животной модели может быть составлена доза, с целью достижения диапазона циркулирующей концентрации, который включаетIC50 или IC100, как определено в культуре клеток. Такая информация может быть использована для того,чтобы более точно определить применимую дозу у людей. Начальные дозы могут также устанавливаться из данных in vivo. Используя эти исходные рекомендации, специалист в данной области мог бы определить эффективную дозу для человека. Кроме того, токсичность и терапевтическая эффективность соединений, описанных в данной заявке, могут быть определены с помощью стандартных фармацевтических методик в культурах клеток или экспериментальных животных, например, путем определения LD50 и ED50. Соотношение доз между токсическим и терапевтическим эффектом представляет собой терапевтический индекс и может быть выражено как соотношение между LD50 и ED50. Соединения, которые демонстрируют высокие терапевтиче-3 023364 ские индексы, являются предпочтительными. Данные, полученные из этих анализов культур клеток и исследований животных, можно использовать в составлении диапазона доз, который не является токсическим для человека. Доза таких соединений предпочтительно находится в пределах циркулирующих концентраций, которые включают ED50, с небольшой токсичностью или без нее. Доза может варьироваться в этих пределах, в зависимости от используемых лекарственной формы и пути введения. Точный состав, путь введения и доза может быть выбрана врачом индивидуально с учетом состояния пациента(см., например, Fingl et al., 1975, In: Pharmacological Basis of Therapeutics, глава 1, с. 1). Количество доз и промежуток можно устанавливать индивидуально для обеспечения в плазме таких уровней концентрации активного соединения, которые были бы достаточными для поддержания терапевтического эффекта. Обычная доза пациента для перорального введения находится в диапазоне от приблизительно 50-2000 мг/кг/день, обычно от приблизительно 100-1000 мг/кг/день, предпочтительно от приблизительно 150-700 мг/кг/день и наиболее предпочтительно от приблизительно 250-500 мг/кг/день. Предпочтительно терапевтически эффективных уровней в сыворотке достигают путем введения многократных доз каждый день. В случаях местного введения или селективного поглощения, эффективная местная концентрация лекарственного средства может не соответствовать концентрации в плазме. Специалист в данной области техники сможет оптимизировать терапевтически эффективные местные дозировки без чрезмерных экспериментирований. Предпочтительными заболеваниями или нарушениями, для предотвращения, лечения и/или изучения которых могут быть пригодны описанные в данной заявке соединения, являются нарушения клеточной пролиферации, особенно злокачественное новообразование, такое как, но не ограничиваясь, следующими: папиллома, бластоглиома, саркома Капоши, меланома, рак легкого, рак яичника, рак предстательной железы, плоскоклеточная карцинома, астроцитома, рак головы, рак шеи, рак кожи, рак печени,рак мочевого пузыря, рак молочной железы, рак легких, рак матки, рак предстательной железы, карцинома яичка, рак толстой и прямой кишок, рак щитовидной железы, рак поджелудочной железы, рак желудка, гепатоцеллюлярная карцинома, лейкемия, лимфома, болезнь Ходжкина и лимфома Беркитта. Уровень техники Другие гетероциклические производные и их применение в качестве противоопухолевых агентов были описаны в WO 2007/129044. Другие производные пиридина и пиразина были описаны в применении для лечения злокачественного новообразования в WO 2009/053737 и для лечения других заболеваний в WO 2004/055005. Другие гетероциклические производные были раскрыты в качестве ингибиторов IKK в WO 2009/122180. Пирролопиримидины были описаны в качестве ингибиторов IKK и TBK1 в WO 2010/100431. Производные пиримидина были описаны в качестве ингибиторов IKK и TBK1 в WO 2009/030890. Краткое описание изобретения Изобретение относится к соединениям формулы IR1 означает фурил, тиенил, пирролил, имидазолил, пиразолил, оксазолил, изоксазолил, тиазолил,пиридил, пиримидил, пиридазинил, индолил, изоиндолил, бензимидазолил, индазолил, хинолил, 1,3 бензодиоксолил, бензотиофенил, бензофуранил, имидазопиридил или фуро[3,2-b]пиридил, каждый из которых незамещен или моно- или дизамещен Hal, A, OR5, CN, COOA, COOH, CON(R5)2 и/или NR5COA';Ar означает фенил, бифенил или нафтил, каждый из которых незамещен или моно-, ди- или тризамещен Hal, A, Het1, (CH2)nOR5, (CH2)nN(R5)2, NO2, CN, (CH2)nCOOR5, CON(R5)2, CONH(CH2)qNHCOOA',CON[R5(CH2)nHet1], NRSCOA, NHCOOA, NR5SO2A, COR5, SO2Het2, SO2N(R5)2 и/или S(O)pA;Het означает фурил, тиенил, пирролил, имидазолил, пиразолил, оксазолил, изоксазолил, тиазолил,пиридил, пиримидинил, триазолил, тетразолил, тиадиазол, пиридазинил, пиразинил, индолил, изоиндолил, бензимидазолил, индазолил, хинолил, 1,3-бензодиоксолил, бензотиофенил, бензофуранил или имидазопиридил, каждый из которых незамещен или моно-, ди- или тризамещен A, COA, (CH2)pHet2, OH,OA, Hal, (CH2)pN(R5)2, NO2, CN, (CH2)pCOOR5, (CH2)pCON(R5)2, NR5COA, (CH2)pCOHet2 и/илиHet1 означает фурил, тиенил, пирролил, имидазолил, пиразолил, оксазолил, изоксазолил, тиазолил,пиридил, пиримидинил, триазолил, тетразолил, тиадиазол, пиридазинил, пиразинил, каждый из которых незамещен или моно-, ди- или тризамещен A, OH, OA, Hal, CN и/или (CH2)pCOOR5; нил, гексагидропиримидинил, [1,3]диоксоланил, пиперазинил, каждый из которых незамещен или монозамещен OH и/или A;A' означает неразветвленный или разветвленный алкил, который имеет 1-6 C атомов, где 1-7 H атомов могут быть заменены на F;A означает неразветвленный или разветвленный алкил, который имеет 1-10 C атомов, где одна или две несмежных CH- и/или CH2-группы могут быть заменены на N, O, S атомов и/или на -CH=CH-группы и/или дополнительно 1-7 H атомов могут быть заменены на F;R5 означает H или неразветвленный или разветвленный алкил, который имеет 1-6 C атомов, где 1-7H атомов могут быть заменены на F;q означает 1, 2, 3 или 4,и его фармацевтически пригодные соли, таутомеры и стереоизомеры, включая их смеси во всех соотношениях. Изобретение также относится к оптически активным формам (стереоизомеры), солям, энантиомерам, рацематам, диастереомерам и гидратам и сольватам этих соединений. Под сольватами соединений подразумевают аддукции молекул инертного растворителя на соединениях, которые образуются благодаря их силе взаимного притяжения. Сольваты представляют собой, например, моно- или дигидраты, или алкоголяты. Естественно, изобретение также относится к сольватам солей. Под фармацевтически приемлемыми производными подразумевают, например, соли соединений в соответствии с изобретением, а также так называемые соединения - пролекарства. Под производными - пролекарствами подразумевают соединения формулы I, которые являются модифицированными посредством, например, алкильной или ацильной групп, сахаров или олигопептидов,и которые быстро расщепляются в организме с образованием эффективных соединений в соответствии с изобретением. Это понятие также включает биоразлагаемые полимерные производные соединений в соответствии с изобретением, как описано, например, в Int. J. Pharm., 115, 61-67 (1995). Выражение "эффективное количество" означает количество лекарственного средства или фармацевтического активного компонента, которое вызывает в ткани, системе, животном или человеке биологическую или медицинскую ответную реакцию, которую стремиться получить или ожидает, например,исследователь или врач. Кроме того, выражение "терапевтически эффективное количество" означает то количество, которое имеют следующие последствия по сравнению с соответствующим субъектом, который не получал этого количества: улучшение лечения, излечение, предотвращение или элиминация заболевания, синдрома,состояния, жалобы, расстройства или побочных действий, или также уменьшение прогрессирования заболевания, состояния или расстройства. Выражение "терапевтически эффективное количество" также охватывает количества, которые являются эффективными для повышения нормальной физиологической функции. Изобретение также относится к применению смесей соединений формулы I, например смесей двух диастереомеров, например, в соотношении 1:1, 1:2, 1:3, 1:4, 1:5, 1:10, 1:100 или 1:1000. Особенно предпочтительными являются смеси стереоизомерных соединений. Изобретение относится к соединениям формулы I и их солям, а также к способу получения соединений формулы I по пп.1-10 и их фармацевтически пригодных солей, таутомеров и стереоизомеров, который отличается тем, что: а) соединение формулы IIL означает бороновую кислоту или группу сложных эфиров бороновой кислоты, илиL1 означает Cl, Br, I или свободную или реактивно функционально модифицированную OH группу,вводят в реакцию с соединением формулы V в которой R1 имеет значение, указанное в п.1, или с) его высвобождают из одного из его функциональных производных путем обработки сольволизирующим или гидрогенизирующим агентом, и/или основание или кислоту формулы I превращают в одну из их солей. Выше и нижеуказанные радикалы R1, R и X имеют значения, указанные для формулы I, если определенно не указано иначе. А означает алкил, который является неразветвленным (линейным) или разветвленным, и имеет 1, 2,3, 4, 5, 6, 7, 8, 9 или 10 C атомов. А предпочтительно означает метил, кроме того, этил, пропил, изопропил, бутил, изобутил, втор-бутил или трет-бутил, кроме того, также пентил, 1-, 2- или 3-метилбутил, 1,1-,1,2- или 2,2-диметилпропил, 1-этилпропил, гексил, 1-, 2-, 3- или 4-метилпентил, 1,1-, 1,2-, 1,3-, 2,2-, 2,3 или 3,3-диметилбутил, 1- или 2-этилбутил, 1-этил-1-метилпропил, 1-этил-2-метилпропил, 1,1,2-или 1,2,2 триметилпропил, также предпочтительно, например, трифторметил. А особенно предпочтительно означает алкил, который имеет 1, 2, 3, 4, 5 или 6 C атомов, предпочтительно метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, трифторметил, пентафторэтил или 1,1,1-трифторэтил. Одна или две CH- и/или CH2-группы в A могут также быть заменены на N, O или S атомов и/или на-CH=CH-группы. А поэтому также означает, например, 2-метоксиэтил. Более предпочтительно A означает неразветвленный или разветвленный алкил, который имеет 1-6C атомов, где одна или две несмежных CH и/или CH2-группы могут быть заменены на N и/или O атомы и/или дополнительно 1-7 H атомов могут быть заменены на F.A' означает алкил, который является неразветвленным (линейным) или разветвленным, и имеет 1, 2,3, 4, 5 или 6 C атомов. А предпочтительно означает метил, кроме того, этил, пропил, изопропил, бутил,изобутил, втор-бутил или трет-бутил, кроме того, также пентил, 1-, 2- или 3-метилбутил, 1,1-, 1,2- или 2,2-диметилпропил, 1-этилпропил, гексил, 1-, 2-, 3- или 4-метилпентил, 1,1-, 1,2-, 1,3-, 2,2-, 2,3- или 3,3 диметилбутил, 1- или 2-этилбутил, 1-этил-1-метилпропил, 1-этил-2-метилпропил, 1,1,2-или 1,2,2 триметилпропил, также предпочтительно, например, трифторметил.Ar особенно предпочтительно означает фенил, бифенил или нафтил, каждый из которых незамещен или моно-, ди- или тризамещен A, Hal, Het1, COR5, CON(R5)2, CONH(CH2)qNHCOOA',CON[R5(CH2)nHet1], NHCOOA, (CH2)nN(R5)2, (CH2)nOR5, (CH2)nCOOR5, SO2Het2 и/или SO2N(R5)2.Het предпочтительно означает тиенил, пиразолил, пиридил, каждый из которых незамещен или моно- или дизамещен A, (CH2)pHet2, (CH2)pCON(R5)2 и/или (CH2)рфенилом.Het1 предпочтительно означает пиразолил или имидазолил, каждый из которых незамещен или монозамещен A.Het2 предпочтительно означает пирролидинил, пиперидинил, морфолинил, [1,3]диоксоланил, пиперазинил, каждый из которых незамещен или монозамещен OH и/или A.R1 предпочтительно означает пиридил, пиримидил, пиридазинил или фуро[3,2-b]пиридил, каждый из которых незамещен или монозамещен Hal, A, OR5, COOA, COOH, CON(R5)2 и/или NR5COA'.Hal предпочтительно означает F, Cl или Br, но также I, особенно предпочтительно F или Cl. Для всего изобретения все радикалы, которые встречаются более одного раза, могут быть одинаковыми или различными, то есть они независимы друг от друга. Соединения формулы I могут иметь один или несколько хиральных центров и поэтому могут встречаться в разных стереоизомерных формах. Формула I охватывает все эти формы. Соответственно изобретение, в частности, относится к соединениям формулы I, где по меньшей мере один из указанных радикалов имеет одно из предпочтительных значений, указанных выше. Некоторые предпочтительные группы соединений могут быть изображены с помощью следующих подформулIa-Ig, которые соответствуют формуле I и в которых радикалы, не определенные более подробно, имеют значения, указанные для формулы I, но в которых в Ia R1 означает пиридил, пиримидил, пиридазинил или фуро[3,2-b]пиридил, каждый из которых незамещен или монозамещен Hal, A, OR5, COOA, COOH, CON(R5)2 и/или NR5COA'; в Ib Ar означает фенил, бифенил или нафтил, каждый из которых незамещен или моно-, ди- или тризамещен A, Hal, Het1, COR5, CON(R5)2, CONH(CH2)qNHCOOA', CON[R5(CH2)nHet1], NHCOOA,(CH2)nN(R5)2, (CH2)nOR5, (CH2)nCOOR5, SO2Het2 и/или SO2N(R5)2; в Ic Het означает тиенил, пиразолил, пиридил, каждый из которых незамещен или моно- или дизамещен A, (CH2)pHet2, (CH2)pCON(R5)2 и/или (CH2)рфенилом; в Id Het1 означает пиразолил или имидазолил, каждый из которых незамещен или монозамещен A; в Ie Het2 означает пирролидинил, пиперидинил, морфолинил, [1,3]диоксоланил, пиперазинил, каждый из которых незамещен или монозамещен OH и/или А; в If A означает неразветвленный или разветвленный алкил, который имеет 1-6 C атомов, где одна или две несмежных CH- и/или CH2-группы могут быть заменены на N и/или O атомов и/или дополнительно 1-7 H атомов могут быть заменены на F; в Ig X означает CH или N,R означает Ar или Het,R1 означает пиридил, пиримидил, пиридазинил или фуро[3,2-b]пиридил, каждый из которых незамещен или монозамещен Hal, A, OR5, COOA, COOH, CON(R5)2 и/или NR5COA';Ar означает фенил, бифенил или нафтил, каждый из которых незамещен или моно-, ди- или тризамещен A, Hal, Het1, COR5, CON(R5)2, CONH(CH2)qNHCOOA', CON[R5(CH2)nHet1], NHCOOA,(CH2)nN(R5)2, (CH2)nOR5, (CH2)nCOOR5, SO2Het2 и/или SO2N(R5)2;Het означает тиенил, пиразолил, пиридил, каждый из которых незамещен или моно- или дизамещенHet1 означает пиразолил или имидазолил, каждый из которых незамещен или монозамещен A;Het2 означает пирролидинил, пиперидинил, морфолинил, [1,3]диоксоланил, пиперазинил, каждый из которых незамещен или монозамещен OH и/или A;A' означает неразветвленный или разветвленный алкил, который имеет 1-6 C атомов, где 1-7 H атомов могут быть заменены на F; А означает неразветвленный или разветвленный алкил, который имеет 1-6 C атомов, где одна или две несмежных CH- и/или CH2-группы могут быть заменены на N и/или O атомов и/или дополнительно 1-7 H атомов могут быть заменены на F;R5 означает H или неразветвленный или разветвленный алкил, который имеет 1-6 C атомов, где 1-7H атомов могут быть заменены на F;q означает 1, 2, 3 или 4,и их фармацевтически пригодные соли, таутомеры и стереоизомеры, включая их смеси во всех соотношениях. Соединения формулы I, а также исходные вещества для их получения, кроме того, получают методами, известными per se, как описано в литературе (например, в стандартных работах, таких как HoubenWeyl, Methoden der organischen Chemie [Методы органической химии], Georg-Thieme-Verlag, Штутгарт),более точно, при реакционных условиях, которые являются известными и пригодными для указанных реакций. Также в данном случае можно использовать варианты, известные per se, которые не упомянуты здесь более подробно. Соединения формулы I можно предпочтительно получить путем введения в реакцию соединений формулы II с соединением формулы III. Соединения формулы II и формулы III являются, как правило, известными. Однако, если же они являются новыми, их можно получить способами, известными per se. Реакцию осуществляют в стандартных условиях, известных специалисту в данной области как реакция Сузуки. В зависимости от используемых условий время реакций находится в интервале между несколькими минутами и 14 днями, реакционная температура находится в интервале между приблизительно -30 и 140, обычно между 0 и 110, особенно предпочтительно между приблизительно 60 и приблизительно 110. Примерами подходящих инертных растворителей являются углеводороды, такие как гексан, петролейный эфир, бензол, толуол или ксилол; хлорированные углеводороды, такие как трихлорэтилен, 1,2 дихлорэтан, четыреххлористый углерод, хлороформ или дихлорметан; спирты, такие как метанол, этанол, изопропанол, н-пропанол, н-бутанол или трет-бутанол; простые эфиры, такие как диэтиловый эфир,диизопропиловый эфир, тетрагидрофуран (ТГФ) или диоксан; гликолевые эфиры, такие как этиленгликольмонометиловый или моноэтиловый эфир, этиленгликольдиметиловый эфир (диглим); кетоны, такие как ацетон или бутанон; амиды, такие как ацетамид, диметилацетамид или диметилформамид (ДМФА); нитрилы, такие как ацетонитрил; сульфоксиды, такие как диметилсульфоксид (ДМСО); сероуглерод,карбоновые кислоты, такие как муравьиная кислота или уксусная кислота, нитросоединения, такие как нитрометан или нитробензол; сложные эфиры, такие как этилацетат, или смеси указанных растворителей. Особенно предпочтительными являются этанол, толуол, иметоксиэтан, ацетонитрил, дихлорметан,ДМФА и/или вода. Кроме того, соединения формулы I можно предпочтительно получить путем введения в реакцию соединения формулы IV с соединением формулы V. Соединения формулы IV и формулы V являются, как правило, известными. Однако, если они являются новыми, их можно получить с помощью способов, известных per se. В соединениях формулы IV L1 предпочтительно означает Cl, Br, I или свободную или реактивно модифицированную OH группу, такую как, например, активированный сложный эфир, имидазолид или алкилсульфонилокси, который имеет 1-6 C атомов (предпочтительно метилсульфонилокси или трифторметилсульфонилокси) или арилсульфонилокси, который имеет 6-10 C атомов (предпочтительно фенилили п-толилсульфонилокси). Реакцию обычно осуществляют в присутствии вещества, связывающего кислоту, предпочтительно органического основания, такого как DIPEA, триэтиламин, диметиланилин, пиридин или хинолин. Добавление гидроксида, карбоната или бикарбоната щелочного или щелочно-земельного металла,или другой соли слабой кислоты щелочных или щелочно-земельных металлов, предпочтительно калия,натрия, кальция или цезия, также может являться благоприятным. В зависимости от применяемых условий время реакции составляет от нескольких минут до 14 дней,температура реакции находится в интервале от приблизительно от -30 до 140, обычно от -10 до 90, особенно предпочтительно от приблизительно 0 и приблизительно 70. Примерами подходящих инертных растворителей являются углеводороды, такие как гексан, петролейный эфир, бензол, толуол или ксилол; хлорированные углеводороды, такие как трихлорэтилен, 1,2 дихлорэтан, четыреххлористый углерод, хлороформ или дихлорметан; спирты, такие как метанол, этанол, изопропанол, н-пропанол, н-бутанол или трет-бутанол; простые эфиры, такие как диэтиловый эфир,диизопропиловый эфир, тетрагидрофуран (ТГФ) или диоксан; гликолевые эфиры, такие как этиленгликольмонометиловый или моноэтиловый эфир, этиленгликольдиметиловый эфир (диглим); кетоны, такие как ацетон или бутанон; амиды, такие как ацетамид, диметилацетамид или диметилформамид (ДМФА); нитрилы, такие как ацетонитрил; сульфоксиды, такие как диметилсульфоксид (ДМСО); сероуглерод,карбоновые кислоты, такие как муравьиная кислота или уксусная кислота, нитросоединения, такие как нитрометан или нитробензол; сложные эфиры, такие как этилацетат, или смеси указанных растворителей. Особенно предпочтительными являются ацетонитрил, дихлорметан и/или ДМФА. Расщепление простого эфира осуществляют с помощью методов, которые известны специалисту в данной области техники. Стандартным способом расщепления простого эфира, например простого метилового эфира, является применение трибромида бора. Гидрогенолитически удаляемые группы, например, при расщеплении простого бензилового эфира могут быть отщеплены, например, путем обработки водородом в присутствии катализатора (например,катализатора на основе благородного металла, такого как палладий, благоприятно на подложке, такой как уголь). Подходящими растворителями для этого являются растворители, указанные выше, в особенности, например, спирты, такие как метанол или этанол, или амиды, такие как ДМФА. Гидрогенолиз обычно осуществляют при температурах в интервале от приблизительно 0 до 100 и давлении от приблизительно 1 до 200 бар, предпочтительно при 20-30 и 1-10 бар. Сложные эфиры могут быть омылены, например, используя уксусную кислоту или используя NaOH или KOH в воде, воде/ТГФ или воде/диоксане, при температуре в интервале от 0 до 100. Алкилирования по азоту осуществляют в стандартных условиях, которые известны специалисту в данной области техники. Соединения формулы I также могут быть получены их выделением в свободном состоянии из их функциональных производных путем сольволиза, в частности гидролиза, или путем гидрогенолиза. Предпочтительными исходными веществами для сольволиза или гидрогенолиза являются те, которые содержат соответствующие защищенные амино и/или гидроксильные группы вместо одной или больше свободных амино и/или гидроксильных групп, предпочтительно те, которые несут аминозащитную группу вместо атома водорода, связанного с атомом азота, например, те, которые соответствуют формуле I, но несут NHR' группу (в которой R' представляет собой аминозащитную группу, напримерBOC или CBZ) вместо NH2 группы. Кроме того, предпочтительными являются исходные вещества, которые несут гидроксилзащитную группу вместо атома водорода гидроксильной группы, например, те, которые соответствуют формуле I,но содержат R"O-фенильную группу (в которой R" представляет собой гидроксилзащитную группу) вместо гидроксифенильной группы. Также существует возможность присутствия в молекуле исходного вещества множества - одинаковых или различных - защищенных амино и/или гидроксильных групп. Если присутствующие защитные группы отличаются друг от друга, то во многих случаях они могут быть отщеплены селективно. Выражение "аминозащитная группа", в общем, известно и относится к группам, которые являются подходящими для защиты (блокирования) аминогруппы от химических реакций, но которые легко удаляются после того, как желательная химическая реакция была проведена в другой части молекулы. Типичными такими группами являются, в частности, незамещенная или замещенная ацильная группа,арильная группа, аралкоксиметильная группа или аралкильная группа. Так как аминозащитные группы удаляют после желательной реакции (или последовательности реакций), то их тип и размер не являются,кроме того, критическими; однако предпочтение отдается тем, которые имеют 1-20, в особенности 1-8,атомов углерода. Выражение "ацильная группа" следует понимать в самом широком смысле в связи с настоящим способом. Оно включает ацильные группы, производные от алифатических, аралифатических, ароматических или гетероциклических карбоновых кислот или сульфоновых кислот, и, в частности, алкоксикарбонильные, арилоксикарбонильные и особенно аралкоксикарбонильные группы. Примерами таких ацильных групп являются алканоил, такой как ацетил, пропионил, бутирил; аралканоил, такой как фенилацетил; ароил, такой как бензоил, толил; арилоксиалканоил, такой как POA; алкоксикарбонил, такой как метоксикарбонил, этоксикарбонил, 2.2.2-трихлорэтоксикарбонил, BOC, 2 йодэтоксикарбонил; аралкоксикарбонил,такой как("карбобензокси"),4 метоксибензилоксикарбонил, FMOC; арилсульфонил, такой как Mtr, Pbf, Pmc. Предпочтительными аминозащитными группами являются BOC и Mtr, кроме того, CBZ, Fmoc, бензил и ацетил. Выражение "гидроксилзащитная группа" также, в общем, известно и относится к группам, которые являются подходящими для защиты гидроксильной группы от химических реакций, но которые легко удаляются после того, как желательная химическая реакция была проведена в другой части молекулы. Типичными такими группами являются указанные выше незамещенные или замещенные арильная, аралкильная или ацильная группы, кроме того, также алкильные группы. Природа и размер гидроксилзащитных групп не являются критическими, так как их удаляют после желательной химической реакции или последовательности реакций; предпочтение отдается группам, которые имеют 1-20, особенности 1-10,атомов углерода. Примерами гидроксилзащитных групп являются, в числе других, третбутоксикарбонил, бензил, п-нитробензоил, п-толуолсульфонил, трет-бутил и ацетил, где бензил и третбутил являются особенно предпочтительными. Группы COOH в аспарагиновой кислоте и глутаминовой кислоте предпочтительно защищены в виде их трет-бутиловых эфиров (например, Asp(OBut. Соединения формулы I выделяют в свободном состоянии из их функциональных производных в зависимости от используемых защитных групп, например, применяя сильные кислоты, преимущественно применяя ТФУ или перхлорную кислоту, но также используют другие сильные неорганические кислоты,такие как соляная кислота или серная кислота, сильные органические карбоновые кислоты, такие как трихлоруксусная кислота, или сульфоновые кислоты, такие как бензол- или п-толуолсульфоновая кислота. Присутствие дополнительного инертного растворителя допускается, но не всегда необходимо. Приемлемыми инертными растворителями предпочтительно являются органические, например карбоновые кислоты, такие как уксусная кислота, простые эфиры, такие как тетрагидрофуран или диоксан, амиды,такие как ДМФА, галогенированные углеводороды, такие как дихлорметан, кроме того, также спирты,такие как метанол, этанол или изопропанол, и вода. Также приемлемыми являются смеси указанных выше растворителей. ТФУ предпочтительно используют в избытке без добавления другого растворителя,перхлорную кислоту предпочтительно используют в виде смеси уксусной кислоты и 70% перхлорной кислоты в соотношении 9:1. Температура реакций для осуществления расщепления предпочтительно находится в интервале между приблизительно 0 и приблизительно 50, предпочтительно между 15 и 30BOC, OBut, Pbf, Pmc и Mtr группы могут, например, предпочтительно быть отщеплены при использовании ТФУ в дихлорметане или используя приблизительно 3-5 н. HCl в диоксане при 15-30, FMOC группа может быть отщеплена, используя приблизительно 5-50% раствор диметиламина, диэтиламина или пиперидина в ДМФА при 15-30. Защитные группы, которые могут быть удалены гидрогенолитически (например, CBZ или бензил),могут быть отщеплены, например, обработкой водородом в присутствии катализатора (например, катализатора на основе благородного металла, такого как палладий, предпочтительно на подложке, такой как уголь). При этом подходящими растворителями являются растворители, указанные выше, в частности,например, спирты, такие как метанол или этанол, или амиды, такие как ДМФА. Гидрогенолиз в основном проводят при температурах в интервале от приблизительно 0 до 100 и давлении между приблизительно 1 и 200 бар, предпочтительно при 20-30 и 1-10 бар. Гидрогенолиз CBZ группы происходит успешно, например, на 5-10% Pd/C в метаноле или при использовании формиата аммония (вместо водорода) на Pd/C в метаноле/ДМФА при 20-30. Фармацевтические соли и другие формы. Соединения в соответствии с изобретением могут использоваться в своей конечной, несолевой форме. С другой стороны, настоящее изобретение также охватывает применение таких соединений в форме их фармацевтически приемлемых солей, которые могут быть получены с помощью разнообразных органических и неорганических кислот и оснований в соответствии со способами, хорошо известными в данной области техники. Фармацевтически приемлемые солевые формы соединений формулы I получают, главным образом, с использованием традиционных способов. Если соединение формулы I содержит карбоксильную группу, то одна из его пригодных солей может быть образована с помощью реакции соединения с приемлемым основанием для получения соответствующей соли присоединения основания. Такими основаниями являются, например, гидроксиды щелочных металлов, включая гидроксид калия, гидроксид натрия и гидроксид лития; гидроксиды щелочноземельных металлов, такие, как гидроксид бария и гидроксид кальция; алкоксиды щелочных металлов, например этилат калия и пропилат натрия; а также различные органические основания, такие, как пиперидин, диэтаноламин и Nметилглутамин. Сюда также включены соли алюминия соединений формулы I. Для некоторых соединений формулы I соли присоединения кислоты могут быть образованы путем обработки указанных соединений фармацевтически приемлемыми органическими и неорганическими кислотами, например галогеноводородами, такими как хлороводород, бромоводород или йодоводород, другими минеральными кислотами, и их соответствующими солями, такими как, сульфат, нитрат или фосфат, и т.п.; и алкил- и моноарилсульфонатами, такими как этансульфонат, толуолсульфонат и бензолсульфонат; и другими органическими кислотами, их соответствующими солями, такими как ацетат, трифторацетат, тартрат, малеат,сукцинат, цитрат, бензоат, салицилат, аскорбат и т.п. Таким образом, фармацевтически приемлемые соли присоединения кислоты соединений формулы I включают следующие соли, но не ограничиваясь только ими: ацетат, адипат, альгинат, аргинат, аспартат, бензоат, бензолсульфонат (безилат), бисульфат, бисульфит, бромид, бутират, камфорат, камфорсульфонат, каприлат, хлорид, хлорбензоат, цитрат, циклопентанпропионат, диглюконат, дигидрофосфат, динитробензоат, додецилсульфат, этансульфонат, фумарат, галактерат (из слизевой кислоты), галактуронат, глюкогептаноат, глюконат, глутамат, глицерофосфат, гемисукцинат, гемисульфат, гептаноат, гексаноат, гиппурат, гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтансульфонат, йодид, изотионат, изобутират, лактат, лактобионат, малат, малеат, малонат, манделат, метафосфат, метансульфонат, метилбензоат, моногидрофосфат, 2-нафталинсульфонат,никотинат, нитрат, оксалат, олеат, пальмоат, пектинат, персульфат, фенилацетат, 3-фенилпропионат,фосфат, фосфонат, фталат. Кроме того, основные соли соединений в соответствии с изобретением включают, но не ограничиваясь только ими, соли алюминия, аммония, кальция, меди, железа(III), железа(II), лития, магния, марганца(III), марганца(II), калия, натрия и цинка. Предпочтительными среди перечисленных выше солей являются аммонийные; соли щелочных металлов натрия и калия и соли щелочно-земельных металлов кальция и магния. Соли соединений формулы I, которые происходят от фармацевтически приемлемых органических нетоксических оснований, включают, но не ограничиваясь только ими, соли первичных,вторичных и третичных аминов, замещенных аминов, также включая природные замещенные амины,циклические амины и основные ионообменные смолы, например аргинин, бетаин, кофеин, хлорпрокаин,холин, N,N'-дибензилэтилендиамин (бензатин), дициклогексиламин, диэтаноламин, диэтиламин, 2 диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, Nэтилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лидокаин, лизин, меглумин, N-метил-D-глюкамин, морфолин, пиперазин, пиперидин, полиаминные смолы, прокаин, пурины,теобромин,триэтаноламин,триэтиламин,триметиламин,трипропиламин и трис(гидроксиметил)метиламин (трометамин). Соединения в соответствии с настоящим изобретением, которые включают основные азотсодержащие группы, могут быть кватернизированы с помощью таких агентов, как (C1-C4)алкилгалогениды, например метил-, этил-, изопропил- и трет-бутилхлориды, бромиды и йодиды; ди(С 1-С 4)алкилсульфаты,например диметил-, диэтил- и диамилсульфаты; (C10-C18)алкилгалогениды, например децил-, додецил-,- 10023364 лаурил-, миристил- и стеарилхлориды, бромиды и йодиды; и арил(С 1-С 4)алкилгалогениды, например бензилхлорид и фенетилбромид. Указанные соли позволяют получать как растворимые в воде, так и растворимые в масле соединения в соответствии с изобретением. Предпочтительные фармацевтические соли, указанные выше, включают, но не ограничиваясь только ими, ацетат, трифторацетат, безилат, цитрат, фумарат, глюконат, гемисукцинат, гиппурат, гидрохлорид, гидробромид, изотионат, манделат, меглумин, нитрат, олеат, фосфонат, пивалат, фосфат натрия,стеарат, сульфат, сульфосалицилат, тартрат, тиомалат, тозилат и трометамин. Кислотно-аддитивные соли основных соединений формулы I получают путем приведения в контакт свободной основной формы с достаточным количеством желаемой кислоты для получения соли традиционным способом. Свободное основание можно регенерировать путем приведения в контакт солевой формы с основанием и выделения свободного основания традиционным способом. Свободные основные формы в некоторой степени отличаются от своих соответствующих солевых форм своими определенными физическими свойствами, такими, как растворимость в полярных растворителях; однако во всем остальном соли являются эквивалентными своим соответствующим свободным основным формам для целей настоящего изобретения. Как было указано, фармацевтически приемлемые соли присоединения основания соединений формулы I образуют с металлами или аминами, такими, как щелочные металлы и щелочноземельные металлы или органические амины. Предпочтительные металлы представляют собой натрий, калий, магний и кальций. Предпочтительные органические амины представляют собой N,N'-дибензилэтилендиамин,хлорпрокаин, холин, диэтаноламин, этилендиамин, N-метил-D-глюкамин и прокаин. Соли присоединения основания кислых соединений в соответствии с изобретением получают путем приведения в контакт свободной кислотной формы с достаточным количеством желаемого основания для получения соли традиционным способом. Свободную кислоту можно регенерировать путем приведения в контакт солевой формы с кислотой и выделения свободной кислоты известным способом. Свободные кислотные формы в некоторой степени отличаются от своих соответствующих солевых форм определенными физическими свойствами, такими как растворимость в полярных растворителях; однако во всем остальном соли являются эквивалентными своим соответствующим свободным кислотным формам для целей настоящего изобретения. Если соединение в соответствии с изобретением включает более чем одну группу, которая способна к образованию фармацевтически приемлемых солей этого типа, то изобретение также охватывает составные соли. Примеры типичных составных солевых форм включают, но не ограничиваясь только ими,битартрат, диацетат, дифумарат, димеглумин, дифосфат, динатрий и тригидрохлорид. В свете вышеописанного можно увидеть, что выражение "фармацевтически приемлемая соль" в контексте данной заявки подразумевает активный компонент, который включает соединение формулы I в форме одной из своей соли, особенно в том случае, если указанная солевая форма обеспечивает указанному активному компоненту улучшенные фармакокинетические свойства по сравнению со свободной формой указанного активного компонента или любой другой солью указанного активного компонента,которые использовались ранее. Фармацевтически приемлемая солевая форма активного компонента может также изначально обеспечивать желаемое фармакокинетическое свойство указанному активному компоненту, которым оно ранее не обладало, а также может даже положительно влиять на фармакодинамику указанного активного компонента в отношении его терапевтической активности в организме. Изотопы. Кроме того, подразумевается, что соединение формулы I включает его меченные изотопом формы. Меченная изотопом форма соединения формулы I является идентичной этому соединению, не смотря на тот факт, что один или несколько атомов соединения были заменены на атом или атомы, которые имеют атомную массу или массовое число, которое отличается от атомной массы или массового числа атома,обычно встречающегося в природе. Примеры изотопов, которые являются коммерчески легкодоступными и которые могут быть введены в соединение формулы I хорошо известными способами, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, например 2H, 3H, 13C, 14C, 15N,18O, 17O,31P, 32P, 35S, 18F и 36Cl соответственно. Соединение формулы I, его пролекарство или фармацевтически приемлемая соль того или другого, которое содержит один или несколько из вышеуказанных изотопов и/или другие изотопы других атомов, считается частью настоящего изобретения. Меченное изотопом соединение формулы I можно применять в ряде выгодных способов. Например, меченное изотопом соединение формулы I, в которое, например, введен радиоизотоп, такой как 3H или 14C, является пригодным для анализа распределения лекарственного средства и/или субстрата в тканях. Эти радиоизотопы,т.е. тритий (3H) и углерод-14 (14C), являются особенно предпочтительными благодаря простому получению и отличной обнаружительной способности. Введение более тяжелых изотопов, например, дейтерия(2H) в соединение формулы I имеет терапевтические преимущества благодаря более высокой метаболической стабильности этого меченного изотопом соединения. Более высокая метаболическая стабильность транслируется непосредственно в увеличенный период полураспада in vivo или более низкие дозы,что в большинстве случаев представляло бы собой предпочтительный вариант настоящего изобретения. Меченное изотопом соединение формулы I, как правило, можно получить с помощью осуществления методик, описанных в схемах синтеза и соответствующем описании, в разделе примеров и в разделе получения в настоящей заявке, заменяя не меченный изотопом реагент на легкодоступный меченный изотопом реагент. Дейтерий (2H) может также быть введен в соединение формулы I с целью управления окислительным метаболизмом соединения путем первичного кинетического изотопного эффекта. Основным кинетическим изотопным эффектом является изменение скорости химической реакции, которое происходит в результате обмена изотопических нуклидов, который в свою очередь вызван изменением в энергиях основного состояния, необходимых для образования ковалентной связи после этого изотопного обмена. Обмен более тяжелых изотопов обычно приводит к понижению энергий основного состояния для химической связи и таким образом вызывает снижение скорости в ограничивающем скорость разрыве связи. Если происходит разрыв связи в или возле области седловой точки по оси координат многопродуктовой реакции, соотношения распределения продуктов могут быть существенно изменены. Для пояснения: если дейтерий связан с атомом углерода в незаменяемом положении, разницы в скорости kM/kD=2-7 являются типичными. Если эта разница в скорости успешно применяется к соединению формулы I, которое является чувствительным к окислению, профиль этого соединение in vivo может радикально модифицироваться и привести к улучшенным фармакокинетическим свойствам. При обнаружении и совершенствовании терапевтических агентов, специалист в данной области пытается оптимизировать фармакокинетические параметры, при этом сохраняя желательные свойства invitro. Следует предположить, что многие соединения с плохими фармакокинетическими профилями являются чувствительными к окислительному метаболизму. Доступные в настоящее время микросомальные анализы печени in vitro предоставляют ценную информацию в отношении окислительного метаболизма этого типа, что в свою очередь позволяет обеспечить рациональную модель дейтерированных соединений формулы I с улучшенной стабильностью посредством стойкости к такому окислительному метаболизму. Таким образом, получают значительные улучшения в фармакокинетических профилях соединений формулы I, которые могут быть выражены количественно в рамках увеличений в периоде полураспада in vivo (t/2), концентрации при максимальном терапевтическом эффекте (Cmax), площади под кривой зависимости "доза-эффект" (AUC), и F; и в рамках сниженных клиренса, дозы и материальных затрат. Нижеследующее предназначено для иллюстрации указанного выше: соединение формулы I, которое имеет множество потенциальных точек атаки для окислительного метаболизма, например атомы водорода бензила и атомы водорода, связанные с атомом азота, получают как ряд аналогов, в которых различные комбинации атомов водорода заменены на атомы дейтерия, таким образом, что некоторые, многие или все эти атомы водорода были заменены на атомы дейтерия. Определения периода полураспада дают возможность удобно и точно определить степень, до которой улучшилась стойкость к окислительному метаболизму. В этом случае, определяется, что период полураспада исходного соединения может быть продлен до 100% как результат обмена дейтерий-водород этого типа. Обмен дейтерий-водород в соединении формулы I также может быть использован для достижения благоприятной модификации метаболического спектра исходного соединения с целью уменьшить или исключить нежелательные токсические метаболиты. Например, если токсический метаболит возникает посредством окислительного расщепления связи углерод-водород (C-H), уместно допустить, что дейтерированный аналог значительно уменьшит или исключит выработку нежелательного метаболита, даже если данное окисление не является определяющей скорость стадией. Дополнительную информацию касательно обмена дейтерий-водород можно найти, например, в Hanzlik et al., J. Org. Chem., 55, 3992-3997,1990, Reider et al., J. Org. Chem., 52, 3326-3334, 1987, Foster, Adv. Drug Res., 14, 1-40, 1985, Gillette et al.,Biochemistry, 33(10) 2927-2937, 1994 и Jarman et al. Carcinogenesis, 16(4), 683-688, 1993. Кроме того, изобретение относится к лекарственным средствам, содержащим по меньшей мере одно соединение формулы I и/или его фармацевтически применимые соли, таутомеры и стереоизомеры,включая их смеси во всех соотношениях, и необязательно вспомогательные вещества и/или адъюванты. Лекарственные препараты могут вводиться в виде дозированных единиц, которые содержат заранее установленное количество активного компонента на дозированную единицу. Такая единица может включать, например, от 0,5 мг до 1 г, предпочтительно от 1 до 700 мг, более предпочтительно от 5 до 100 мг соединения в соответствии с изобретением в зависимости от состояния, подвергаемого лечению, способа введения, а также возраста, веса тела и состояния пациента, или фармацевтические композиции могут вводиться в виде дозированных единиц, которые содержат заранее установленное количество активного компонента на дозированную единицу. Предпочтительными дозированными единицами лекарственных препаратов являются те, которые содержат суточную дозу или часть суточной дозы, как указано выше, или соответствующую порцию их активного компонента. Лекарственные средства этого типа также могут быть получены способом, который хорошо известен в области фармацевтики. Лекарственные препараты могут адаптироваться для введения при помощи любого подходящего способа, например путем перорального (включая буккальное или подъязычное), ректального, назального,местного (включая буккальное, подъязычное или трансдермальное), вагинального или парентерального могут быть приготовлены с помощью любого способа, известного в области фармацевтики, например,путем объединения активного компонента со вспомогательным(-ыми) веществом(-ами) и/или адъювантом(-ами). Лекарственные препараты, адаптированные для перорального введения, могут вводиться в виде отдельных единиц, таких как, например, капсулы или таблетки; порошки или гранулы; растворы или суспензии в водных или неводных жидкостях; пищевых пен или пенистых пищевых продуктов; или жидких эмульсий масло-в-воде или жидких эмульсий вода-в-масле. Так, например, в случае перорального введения в виде таблетки или капсулы активный компонент может быть объединен с пероральным, нетоксичным и фармацевтически приемлемым инертным наполнителем, таким как, например, этанол, глицерин, вода и т.п. Порошки получают путем измельчения соединения до подходящего небольшого размера и смешивания его с фармацевтическим наполнителем,измельченным аналогичным способом, таким как, например, пищевой углеводород, такой как, например,крахмал или маннит. Также можно добавлять ароматизатор, консервант, диспергирующее вещество и краситель. Капсулы получают путем приготовления порошковой смеси, как описано выше, и заполнения ею желатиновых капсул определенной формы. Перед заполнением капсул к порошковой смеси можно добавлять скользящие и смазывающие вещества, такие как, например, высокодисперсная кремниевая кислота, тальк, стеарат магния, стеарат кальция или полиэтиленгликоль в твердой форме. Для улучшения доступности лекарственного средства, заключенного в капсулу, также можно добавлять дезинтегрирующее вещество или солюбилизатор, такой как, например, агар-агар, карбонат кальция или карбонат натрия. Дополнительно, если это является желательным или необходимым, в смесь также можно добавлять подходящие связующие, смазывающие вещества, дезинтеграторы, а также красители. Подходящими связующими являются крахмал, желатин, природные сахара, такие как, например, глюкоза или бета-лактоза,подсластители, приготовленные из кукурузы, естественных и синтетических резин, такие как, например,аравийская камедь, трагакантовая камедь или альгинат натрия, карбоксиметилцеллюлоза, полиэтиленгликоль, воски и т.п. Смазывающие вещества, которые могут применяться в таких дозированных формах,включают олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и т.п. Дезинтеграторы включают, но не ограничиваясь только ими, крахмал, метилцеллюлозу, агар, бентонит, ксантановую камедь и т.п. Лекарственные средства в виде таблеток получают, например, путем приготовления порошковой смеси, гранулирования или сухого прессования смеси, добавления смазывающего вещества и дезинтегратора и прессования полученной смеси в таблетки. Порошковую смесь готовят путем смешивания соединения, измельченного подходящим образом, с разбавителем или основанием,как описано выше, и необязательно со связующим, таким как, например, карбоксиметилцеллюлоза, альгинат, желатин или поливинилпирролидон, замедлителем растворения, таким как, например, парафин,усилителем поглощения, таким как, например, четвертичная соль, и/или абсорбентом, таким как, например, бентонит, каолин или дикальцийфосфат. Порошковую смесь можно гранулировать путем смачивания со связующим, таким как, например, сироп, крахмальная паста, слизь акации или растворы целлюлозы или полимерных веществ и прессования ее через сито. В качестве альтернативы грануляции порошковую смесь можно пропускать через таблетировочную машину, получая куски неправильной формы, которые распадаются, образуя гранулы. Гранулы можно замасливать путем добавления стеариновой кислоты, стеарата, талька или минерального масла для предотвращения слипания в таблетировочной литейной форме. После этого смазанную смесь спрессовывают, получая таблетки. Соединения в соответствии с изобретением также можно объединять с сыпучим инертным наполнителем и затем подвергать прямому прессованию, получая таблетки без осуществления стадий грануляции или сухого прессования. Таблетки также можно покрывать прозрачным или светонепроницаемым защитным слоем, состоящим из шеллакового запечатывающего слоя, слоя сахара или полимерного вещества и глянцевого слоя воска. К этим покрытиям также можно добавлять красители для возможности различения между разными дозируемыми единицами. Жидкости для перорального введения, такие как, например, раствор, сиропы и эликсиры, могут быть приготовлены в виде дозируемых единиц таким образом, чтобы они содержали заранее установленное количество соединения. Сиропы могут быть получены путем растворения соединения в водном растворе с подходящим ароматизатором, тогда как эликсиры готовят с применением нетоксичного спиртового наполнителя. Суспензии могут быть приготовлены путем диспергирования соединения в нетоксичном наполнителе. Также можно добавлять солюбилизаторы и эмульсификаторы, такие как, например,этоксилированные изостеариловые спирты и полиоксиэтиленовые эфиры сорбита, консерванты, ароматические добавки, такие как, например, масло мяты перечной, или натуральные заменители сахара или сахарин, или другие искусственные заменители сахара и т.п. Лекарственные препараты для перорального введения в виде дозированных единиц могут быть инкапсулированы в микрокапсулы, если это является желательным. Также лекарственный препарат может быть приготовлен таким образом, чтобы пролонгировать или замедлить высвобождение, например, путем применения покрытий или заделывания требуемого вещества в полимеры, воск и т.п. Соединения формулы I и их фармацевтически пригодные соли, таутомеры и стереоизомеры также могут вводиться в виде липосомных систем доставки, таких как, например, небольшие однослойные пузырьки, большие однослойные пузырьки и многослойные пузырьки. Липосомы могут быть образованы с помощью различных фосфолипидов, таких как, например, холестерин, стеариламин или фосфатидилхолины. Соединения формулы I и их фармацевтически пригодные соли, таутомеры и стереоизомеры также могут доставляться с помощью моноклональных антител в качестве индивидуальных носителей, к которым присоединены молекулы соединения. Соединения также могут быть соединены с растворимыми полимерами в качестве нацеливающих носителей лекарственных средств. Такими полимерами могут являться поливинилпирролидон, сополимер пирана, полигидроксипропилметакриламидофенол, полигидроксиэтиласпартамидофенол или полиэтиленоксид полилизина, замещенный пальмитоиловыми радикалами. Кроме того, соединения можно связывать с биоразлагаемыми полимерами, которые пригодны для обеспечения контролируемого высвобождения лекарственного средства, например полимолочной кислотой, поли-эпсилон-капролактоном, полигидроксимасляной кислотой, полиортоэфирами, полиацеталями, полидигидроксипиранами, полицианоакрилатами и перекрестно-сшитыми или амфипатическими блок-сополимерами гидрогелей. Лекарственные препараты, адаптированные для трансдермального введения, могут вводиться в виде независимых пластырей для удлиненного, тесного контакта с эпидермисом реципиента. Таким образом, например, активный компонент может доставляться из пластыря путем ионофореза, как, в общем,описано в Pharmaceutical Research, 3(6), 318 (1986). Фармацевтические композиции, адаптированные для местного введения, могут быть приготовлены в виде мазей, кремов, суспензий, лосьонов, порошков, растворов, паст, гелей, спреев, аэрозолей или масел. Для лечения глаз или других наружных тканей, например рта и кожи, предпочтительно применяются лекарственные препараты в виде местной мази или крема. Для приготовления лекарственного препарата в виде мази активный компонент может применяться с парафиновым или смешивающимся с водой мазевым основанием. Альтернативно, для получения крема активный компонент может быть приготовлен с основой для крема типа масло-в-воде или основой вода-в-масле. Лекарственные препараты, адаптированные для местного введения в глаза, включают глазные капли, в которых активный компонент растворен или суспендирован в подходящем носителе, предпочтительно в водном растворителе. Лекарственные препараты, адаптированные для местного введения в полость рта, включают лепешки, пастилки и жидкости для полоскания рта. Лекарственные препараты, адаптированные для ректального введения, могут вводиться в виде суппозиториев или клизм. Лекарственные препараты, адаптированные для назального введения, в которых носитель представляет собой твердое вещество, включают крупный порошок, имеющий размер частичек, например, в интервале 20-500 мкм, который вводится путем вдыхания, то есть путем быстрого вдоха через нос из контейнера, содержащего порошок, который придерживают возле носа. Подходящие лекарственные препараты для введения в виде назального аэрозоля или носовых капель с жидкостью в качестве носителя включают растворы активного вещества в воде или в масле. Лекарственные препараты, адаптированные для введения путем ингаляции, включают тонкоизмельченные частички в виде пыли или тумана, которые могут быть получены с помощью различных диспергирующих устройств под давлением с аэрозолями, распылителями или инсуффляторами. Лекарственные препараты, адаптированные для вагинального введения, могут вводиться в виде пессариев, тампонов, кремов, гелей, паст, пен или аэрозолей. Лекарственные препараты, адаптированные для парентерального введения, включают водные или неводные стерильные растворы для инъекций, содержащие антиоксиданты, буферы, бактериостатические вещества и растворенные вещества, с помощью которых лекарственное средствоподдерживается изотоническим по отношению к крови реципиента, подвергаемого лечению; и водные или неводные стерильные суспензии, которые могут содержать суспензионную среду и загустители. Лекарственные препараты могут вводиться с помощью емкостей для однократного или многократного введения, например запечатанных ампул и флаконов, и храниться в лиофилизированном состоянии, при этом непосредственно перед введением необходимо только добавить стерильную жидкость-носитель, например воду для инъекций. Растворы и суспензии для инъекций, приготовленные согласно рецептуре, могут быть приготовлены из стерильных порошков, гранул и таблеток. Также является очевидным, что дополнительно к предпочтительным вышеописанным составляющим, лекарственные препараты также могут содержать другие вещества, которые используются в данной области для конкретных типов лекарственных средств; например, лекарственные препараты, пригодные для перорального введения, могут содержать ароматизаторы. Терапевтически эффективное количество соединения формулы I зависит от многих факторов,включая, например, возраст и вес животного, определенное состояние, которое необходимо лечить, и его тяжесть, природу лекарственного средства и способ введения, и в конченом счете оно может быть определено лечащим врачом или ветеринаром. Тем не менее, эффективное количество соединения в соответствии с изобретением для лечения роста опухолей, например рака толстой кишки или молочной железы,как правило, находится в интервале от 0,1 до 100 мг/кг веса тела реципиента (млекопитающего) в сутки и предпочтительно обычно находится в интервале от 1 до 10 мг/кг веса тела в сутки. Следовательно, действующее суточное количество для взрослого млекопитающего весом 70 кг обычно может составлять от 70 до 700 мг, причем это количество может вводиться в виде отдельной дозы один раз в день или обычно в виде циклов частичных доз (таких как, например, два, три, четыре, пять или шесть раз) в день, таким образом, что общая суточная доза является аналогичной. Эффективное количество его соли или сольвата или физиологически функционального производного может быть определено в виде доли эффективного количества соединения в соответствии с изобретением per se. Также можно предположить, что аналогичные дозы пригодны для лечения других состояний, описанных выше. Кроме того, изобретение относится к лекарственным средствам, содержащим по меньшей мере одно соединение формулы I и/или его фармацевтически пригодные соли, таутомеры и стереоизомеры,включая их смеси во всех соотношениях, и по меньшей мере один дополнительный активный компонент лекарственного средства. Изобретение также относится к комплекту (набору), состоящему из отдельных пакетов:(а) эффективного количества соединения формулы I и/или его фармацевтически пригодных солей,таутомеров и стереоизомеров, включая их смеси во всех соотношениях,(б) эффективного количества дополнительного активного компонента лекарственного средства. Комплект включает подходящие емкости, такие как коробки, индивидуальные бутылки, пакеты или ампулы. Комплект может включать, например, отдельные ампулы, каждая из которых содержит эффективное количество соединения формулы I и/или его фармацевтически пригодных пригодные солей, таутомеров и стереоизомеров, включая их смеси во всех соотношениях, и эффективное количество дополнительного активного компонента лекарственного средства в растворенной или лиофилизированной форме. Применение. Изобретение относится к соединениям формулы I для применения для лечения злокачественного новообразования, септического шока, первичной открытоугольной глаукомы (POAG), гиперплазии, ревматоидного артрита, псориаза, артеросклерозм, ретинопатии, остеоартрита, эндометриоза, хронического воспаления, и/или нейродегенеративных заболеваний, таких как болезнь Альцгеймера. Изобретение относится к применению соединений формулы I для получения лекарственного средства для лечения злокачественного новообразования, септического шока, первичной открытоугольной глаукомы (POAG), гиперплазии, ревматоидного артрита, псориаза, артеросклероза, ретинопатии, остеоартрита, эндометриоза, хронического воспаления, и/или нейродегенеративных заболеваний, таких как болезнь Альцгеймера. Изобретение относится к способу лечения млекопитающего, у которого заболевание, выбранное из группы, которая включает злокачественное новообразование, септический шок, первичную открытоугольную глаукому (POAG), гиперплазию, ревматоидный артрит, псориаз, артеросклероз, ретинопатию,остеоартрит, эндометриоз, хроническое воспаление, и/или нейродегенеративные заболевания, такие как болезнь Альцгеймера, где способ включает введение млекопитающему терапевтически эффективного количества соединения формулы I. Соединения согласно настоящему изобретению пригодны в качестве фармацевтически активных компонентов для млекопитающих, в особенности для людей, для лечения и борьбы со злокачественными заболеваниями и воспалительными заболеваниями. Хозяин или пациент может принадлежать к любому виду млекопитающих, например, такому как,приматы, предпочтительно человек; грызуны, включая мышей, крыс и хомячков, кролики; лошади, коровы, собаки, кошки и т.д. Животные модели представляют интерес для экспериментальных исследований,поскольку они обеспечивают модель для лечения заболевания человека. Чувствительность определенной клетки к лечению с помощью соединений в соответствии с изобретением может быть определена при исследованиях в условиях in vitro. В общем случае культуру клеток комбинируют с соединением в соответствии с изобретением при различных концентрациях в течение периода времени, достаточного для того, чтобы позволить активным веществам, таким как анти-IgM индуцировать ответ клеток, такой как экспрессия маркера клеточной поверхности, обычно продолжительностью от одного часа до одной недели. Для исследования в условиях in vitro можно использовать культивируемые клетки из крови или образца биопсии. Количество экспрессированых маркеров поверхности оценивают с помощью проточной цитометрии с использованием распознающего специфические антитела маркера. Доза изменяется в зависимости от конкретного применяемого соединения, конкретного заболевания, состояния пациента и т.д. Обычно терапевтическая доза будет достаточной для существенного уменьшения нежелательной популяции клеток в ткани-мишени при поддержании жизнеспособности пациента. Лечение, как правило, продолжают до тех, пока не будет достигнуто существенное уменьшение,- 15023364 например, по меньшей мере приблизительно 50% уменьшения популяции клеток, представляющих интерес, при этом лечение можно продолжать до тех пор, пока, по существу, в организме не будет обнаружено нежелательных клеток. С целью распознания пути передачи сигналов и выявления взаимодействий между различными путями передачи сигналов, различные ученые разработали пригодные модели или системы моделей, например модели клеточных культур (например, Khwaja et al., EMBO, 1997, 16, 2783-93) и модели трансгенных животных (например, White et al., Oncogene, 2001, 20, 7064-7072). Для определения отдельных стадий в каскаде передачи сигналов, взаимодействующее соединения можно использовать для модулирования сигнала (например, Stephens et al., Biochemical J., 2000, 351, 95-105). Соединения в соответствии с изобретением также можно применять в качестве реагентов для исследования киназо-зависимых путей передачи сигналов у животных и/или моделей клеточных культур или в клинических заболеваниях, указанных в данной заявке. Измерение киназной активности является хорошо известным методом для специалиста в данной области техники. Системы общих исследований для определения киназной активности с использованием субстратов, например гистона (например, Alessi et al., FEBS Lett., 1996, 399, 3, с. 333-338) или основного миелинового белка, описаны в литературе (например, Campos-Gonzalez, R. и Glenney, Jr., J.R. 1992, J.Biol. Chem., 267, с. 14535). Для распознавания ингибиторов киназы доступны различные системы анализа. В сцинтилляционном анализе сближения (Sorg et al., J. of Biomolecular Screening, 2002, 7, 11-19) и анализе с использованием флеш-планшета измеряют радиоактивное фосфорилирование белка или пептида как субстрата с уАТФ. В присутствии соединения-ингибитора может быть обнаружен уменьшенный радиоактивный сигнал, или вовсе его отсутствие. Кроме того, метод резонансного переноса энергии гомогенной флуоресценции с временным разрешением (HTR-FRET) и поляризационный флуоресцентный (FP) метод являются пригодными в качестве методов анализа (Sills et al., J. of Biomolecular Screening, 2002, 191-214). В других нерадиоактивных ELISA методах анализа используют специфические фосфо-антитела(фосфо-ABs). Фосфо-АВ связывает только фосфорилированный субстрат. Связывание может быть обнаружено с помощью хемилюминесценции с использованием вторичного сопряженного с пероксидазой анти-овечьего антитела (Ross et al., 2002, Biochem. J.). Настоящее изобретение охватывает применение соединений формулы I и/или их физиологически приемлемых солей, таутомеров и сольватов для приготовления лекарственного средства для лечения или предотвращения злокачественного новообразования. Предпочтительные карциномы для лечения выбирают из группы рака головного мозга, рака мочеполового тракта, рака лимфатической системы, рака желудка, рака гортани и рака легкого, рака кишечника. Дальнейшей группой предпочтительных форм злокачественного новообразования являются моноцитарный лейкоз, аденокарцинома легких, мелкоклеточный рак легких, рак поджелудочной железы, глиобластомы и рак молочной железы. Также охватывается применение соединений формулы I и/или их физиологически приемлемых солей, таутомеров и сольватов для приготовления лекарственного средства для лечения и/или контроля заболевания, индуцированного опухолью, у млекопитающего, где для этого способа терапевтически эффективное количество соединения в соответствии с изобретением вводят больному млекопитающему,нуждающемуся в таком лечении. Терапевтическое количество изменяется в зависимости от конкретного заболевания и может быть определено специалистом в данной области без чрезмерных усилий. Особенно предпочтительным является применение для лечения заболевания, где раковое заболевание представляет собой солидную опухоль. Солидную опухоль предпочтительно выбирают из группы опухолей плоского эпителия, мочевого пузыря, желудка, почек, головы и шеи, пищевода, шейки матки, щитовидной железы, кишечника, печени, головного мозга, предстательной железы, мочеполового тракта, лимфатической системы, желудка,гортани и/или легкого. Солидную опухоль более предпочтительно выбирают из группы аденокарциномы легких, мелкоклеточного рака легких, рака поджелудочной железы, глиобластом, рака толстой кишки и рака молочной железы. Солидную опухоль более предпочтительно выбирают из группы аденокарциномы легких, мелкоклеточного рака легких, рака поджелудочной железы, глиобластом, рака толстой кишки и рака молочной железы. Кроме того, предпочтительным является применение для лечения опухоли крови и иммунной системы, предпочтительно для лечения опухоли, выбранной из группы острого миелоидного лейкоза, хронического миелоидного лейкоза, острого лимфолейкоза и/или хронического лимфолейкоза. Кроме того, изобретение относится к применению соединений в соответствии с изобретением для лечения патологий костей, где патологию костей выбирают из группы остеосаркомы, остеоартрита и рахита. Соединения формулы I также могут вводиться одновременно с другими хорошо известными терапевтическими средствами, которые выбирают исходя из их индивидуальной пригодности для состояния,подвергаемого лечению. Соединения согласно настоящему изобретению также пригодны для комбинирования с известными противораковыми средствами. Эти известные противораковые средства включают следующие: модуляторы эстрогенового рецептора, модуляторы андрогенового рецептора, модуляторы ретиноидного рецептора, цитотоксические агенты, антипролиферативные агенты, ингибиторы пренил-протеин-трансферазы,ингибиторы HMG-CoA редуктазы, ингибиторы ВИЧ протеазы, ингибиторы обратной транскриптазы и другие ингибиторы ангиогенеза. Соединения согласно настоящему изобретению особенно пригодны для одновременного применения с лучевой терапией. Выражение "модуляторы эстрогенового рецептора" относится к соединениям, которые препятствуют или ингибируют связывание эстрогена с рецептором, независимо от механизма. Примеры модуляторов эстрогенового рецептора включают, но не ограничиваются только ими, тамоксифен, ралоксифен,идоксифен, LY353381, LY 117081, торемифен, фулвестрант, 4-[7-(2,2-диметил-1-оксопропокси-4-метил 2-[4-[2-(1-пиперидинил)этокси]фенил]-2 Н-1-бензопиран-3-ил]фенил-2,2-диметилпропаноат,4,4'-дигидроксибензофенон-2,4-динитрофенилгидразон и SH646. Выражение "модуляторы андрогенового рецептора" относится к соединениям, которые препятствуют или ингибируют связывание андрогенов с рецептором, независимо от механизма. Примеры модуляторов андрогенового рецептора включают финастерид и другие ингибиторы 5-редуктазы, нилутамид,флутамид, бикалутамид, лиарозол и абиратерон ацетат. Выражение "модуляторы ретиноидного рецептора" относится к соединениям, которые препятствуют или ингибируют связывание ретиноидов с рецептором, независимо от механизма. Примеры таких модуляторов ретиноидного рецептора включают бексаротен, третиноин, 13-цис-ретиноевую кислоту, 9 цис-ретиноевую кислоту, -дифторметилорнитин, ILX23-7553, транс-N-(4'-гидроксифенил)ретинамид иN-4-карбоксифенилретинамид. Выражение "цитотоксические агенты" относится к соединениям, которые приводят к смерти клетки главным образом путем прямого действия на функционирование клетки или ингибируют или препятствуют миозису клетки, включая алкилирующие агенты, факторы некроза опухоли, интеркалирующие агенты, ингибиторы микротрубулина и ингибиторы топоизомеразы. Примеры цитотоксических агентов включают, но не ограничиваясь только ими, тирапазимин, сертенеф, кахектин, ифосфамид, тазонермин, лонидамин, карбоплатин, алтретамин, преднимустин, дибромдулцитол, ранимустин, фотемустин, недаплатин, оксалиплатин, темозоломид, гептаплатин, эстрамустин,импросульфан тозилат, трофосфамид, нимустин, диброспидиум хлорид, пумитепа, лобаплатин, сатраплатин,профиромицин,цисплатин,ирофулвен,дексифосфамид,цис-аминдихлор(2 метилпиридин)платина, бензилгуанин, глуфосфамид, GPX100, (транс,транс,транс)-бис-мю-(гексан-1,6 диамин)мю-[диаминплатина(II)]-бис-[диамин(хлор)платина(II)] тетра-хлорид, диаризидинилспермин,триоксид мышьяка, 1-(11-додециламино-10-гидроксиундецил)-3,7-диметилксантин, зорубицин, идарубицин, даунорубицин, бисантрен, митоксантрон, пирарубицин, пинафид, валрубицин, амрубицин, антинеопластон, 3'-деамино-3'-морфолино-13-деоксо-10-гидроксикарминомицин, аннамицин, галарубицин,элинафид, MEN10755 и 4-деметокси-3-деамино-3-азиридинил-4-метилсульфонилдаунорубицин (см. WO 00/50032). Примеры ингибиторов микротрубулина включают паклитаксел, виндезин сульфат, 3',4'-дидегидро 4'-деокси-8'-норвинкалеукобластин, доцетаксол, ризоксин, доластатин, мивобулин изетионат, ауристатин, цемадотин, RPR109881, BMS184476, винфлунин, криптофицин, 2,3,4,5,6-пентафтор-N-(3-фтор-4 метоксифенил)бензолсульфонамид,ангидровинбластин,N,N-диметил-L-валил-L-валил-N-метил-Lвалил-L-пролил-L-пролин-трет-бутиламид, TDX258 HBMS188797. Ингибиторами топоизомеразы являются, например, топотекан, гикаптамин, иринотекан, рубитекан,6-этоксипропионил-3',4'-О-эксобензилиденчартреузин, 9-метокси-N,N-диметил-5-нитропиразоло[3,4,5k1]акридин-2-(6 Н)пропанамин,1-амино-9-этил-5-фтор-2,3-дигидро-9-гидрокси-4-метил-1 Н,12 Нбензо[de]пирано[3',4':b,7]индолизино[1,2b]хинолин-10,13(9 Н,15 Н)дион,луртотекан,7-[2-(Nизопропиламино)этил]-(20S)камптотецин, BNP1350, BNPI1100, BN80915, BN80942, этопозид фосфат,тенипозид, собузоксан, 2'-диметиламино-2'-деоксиэтопозид, GL331, N-[2-(диметиламино)этил]-9 гидрокси-5,6-диметил-6 Н-пиридо[4,3-b]карбазол-1-карбоксамид, азулакрин, (5 а,5 аВ,8 аа,9b)-9-[2-[N-[2(диметиламино)этил]-N-метиламино]этил]-5-[4-гидрокси-3,5-диметоксифенил]-5,5 а,6,8,8 а,9-гексогидрофуро(3',4':6,7)нафто(2,3-d)-1,3-диоксол-6-он,2,3-(метилендиокси)-5-метил-7-гидрокси-8-метоксибензо[с]фенантридиний, 6,9-бис-[(2-аминоэтил)амино]бензо[g]изохинолин-5,10-дион, 5-(3-аминопропиламино)-7,10-дигидрокси-2-(2-гидроксиэтиламинометил)-6 Н-пиразоло[4,5,1-de]акридин-6-он,N-[1[2(диэтиламино)этиламино]-7-метокси-9-оксо-9 Н-тиоксантен-4-илметил]формамид,N-(2-(диметиламино)этил)акридин-4-карбоксамид,6-2-(диметиламино)этил]амино]-3-гидрокси-7 Н-индено[2,1 с]хинолин-7-он и димесна."Антипролиферативные агенты" включают антисмысловые РНК и ДНК олигонуклеотиды, такие как G3139, ODN698, RVASKRAS, GEM231 и INX3001 и антиметаболиты, такие как, например, эноцитабин, кармофур, тегафур, пентостатин, доксифлуридин, триметрексат, флударабин, капецитабин, галоцитабин, цитарабин окфосфат, фостеабин натрия гидрат, ралтитрексед, палтитрексид, эмитефур, тиазофу- 17023364 рин, децитабин, нолатрексед, пеметрексед, нелзарабин, 2'-деокси-2'-метилиденцитидин, 2'-фторметилен 2'-деоксицитидин,N-[5-(2,3-дигидробензофурил)сульфонил]-N'-(3,4-дихлорфенил)мочевина,N6-[4 деокси-4-[N2-[2(Е),4(Е)-тетрадекадиеноил]глициламино]-L-глицеро-В-L-манногептопиранозил]аденин,аплидин, эктеинасцидин, троксацитабин, 4-[2-амино-4-оксо-4,6,7,8-тетрагидро-3H-пиримидино[5,4-b]1,4-тиазин-6-ил-(S)этил]-2,5-тиеноил-L-глутаминовая кислота, аминоптерин, 5-фторурацил, аланозин,сложный эфир 11-ацетил-8-(карбамоилоксиметил)-4-формил-6-метокси-14-окса-1,11-диазатетрацикло(7.4.1.0.0)тетрадека-2,4,6-триен-9-илуксусной кислоты, свайнсонин, лометрексол, дексразоксан,метиониназа, 2'-циано-2'-деокси-N4-палмитоил-1-В-D-арабинофуранозил цитозин и 3-аминопиридин-2 карбоксальдегид тиосемикарбазон. "Антипролиферативные агенты" также включают моноклональные антитела к факторам роста, отличающиеся от тех, которые перечислены для "ингибиторов ангиогенеза",такие как трастузумаб, и подавляющие опухоли гены, такие как p53, которые могут быть доставлены с помощью переноса генов, опосредованного рекомбинантным вирусом (см., например, патент US No. 6069134). Тестирование ингибирования IKK. Анализ IKK - киназы (IKKepsilon). Краткое описание. Киназный анализ осуществляют в виде анализа с использованием 384-луночного флеш-планшета(биотин-C6-C6GLKKERLLDDRHDSGLDSMKDEE) и 10 мкМ АТФ (с 0.3 мкКи 33 Р-АТФ/лунку) инкубируют в общем объеме 50 мкл (10 мМ MOPS, 10 мМ ацетат магния, 0.1 мМ EGTA, 1 мМ дитиотреитол, 0.02% Brij35,0.1% BSA, 0.1% BioStab, pH 7.5) с или без тестируемого соединения при 30C в течение 2 ч. Реакцию прекращают с использованием 25 мкл 200 мМ раствора EDTA. Спустя 30 мин при комнатной температуре жидкость удаляют и каждую лунку трижды промывают 100 мкл 0.9% раствора хлорида натрия. Неспецифическую реакцию определяют в присутствии 3 мкМ MSC2119074 (ВХ-795). Радиоактивность измеряют с помощью Topcount (PerkinElmer). Результаты (например, значения IC50) подсчитывают с помощью программных средств, обеспеченных отделом информационных технологий (например, AssayExplorer, Symyx). Тестирование ингибирования TBK1. Ферментный тест. Краткое описание. Киназный анализ осуществляли в виде анализа с использованием 384-луночного флеш-планшета(например, измерение с помощью Topcount). 0.6 нМ TANK-связывающую киназу (TBK1), 800 нМ биотинилированный MELK-производный пептид (биотин-Ah-Ah-AKPKGNKDYHLQTCCGSLAYRRR) и 10 мкМ АТФ (с 0.25 мкКи 33 Р-АТФ/лунку) инкубируют в общем объеме 50 мкл (10 мМ MOPS, 10 мМ ацетат магния, 0.1 мМ EGTA, 1 мМ DTT,0.02% Brij35, 0.1% BSA, pH 7.5) с тестируемым веществом или без него при 30C в течение 120 мин. Реакцию останавливают, используя 25 мкл 200 мМ раствора EDTA. Спустя 30 мин при комнатной температуре жидкость удаляют и каждую лунку трижды промывают с помощью 100 мкл 0.9% раствора хлорида натрия. Неспецифическую реакцию определяют в присутствии 100 нМ стауроспорина. Радиоактивность измеряют на Topcount (PerkinElmer). Результаты (например,значения IC50) подсчитывают с помощью программных средств, обеспеченных отделом информационных технологий (например, AssayExplorer, Symyx). Клеточный тест. Дозозависимое ингибирование фосфо-IRF3Ser 386 клетка/MDAMB468/INH/PHOS/IMAG/pIRF3. 1. Область действия. Несмотря на то что TBK1 и IKK наиболее известны как ключевые участники в естественном иммунном ответе, недавние полученные сведения указывают на роль TBK1 и IKK в Ras-индуцированной онкогенной трансформации. TBK1 была опознана как RalB эффектор в Ras-подобном пути фактора обмена (Ral)-гуаниновых нуклеотидов (GEF), необходимом для Ras-индуцированной трансформации.TBK1 непосредственно активирует IRF3, которое при фосфорилировании гомодимеризирует и перемещается к ядру, где активизирует процессы, связанные с воспалением, иммунорегуляцией, жизнестойкостью клеток и пролиферацией. Этот анализ был разработан с целью оценивания эффективности/действенности соединенийингибиторов TBK1/IKK на основе иммуноцитохимического обнаружения локализированной в ядре фосфо-IRF3 мишени, направленной ниже TBK1. Обработка полиинозин-полицитидиловой кислотой (поли(I:С), синтетическим аналогом двуспиральной РНК (дсРНК), молекулярная модель связана с вирусной инфекцией, которая опознается Tollподобным рецептором 3 (TLR3), используется для индуцирования активности TBK1/IKK и фосфорилирования IRF3 при Ser386. 2. Обзор анализа. День 1: MDA-MB-468 клетки отделяли с помощью HyQ-Tase, подсчитывали и высеивали на 384 луночный планшет с прозрачным дном с поверхностью TC при плотности 10000 клеток на лунку в общем объеме 35 мкл полной среды. Альтернативно, клетки непосредственно высеивают из замороженных пробирок. День 2: клетки предварительно обрабатывают ингибитором соединения в течение 1 ч до стимуляции поли(I:C). Спустя 2 ч инкубации с помощью поли(I:C), клетки фиксируют в (пара)формальдегиде(PFA) и пермеабилизируют метанолом (MeOH). Затем клетки блокируют и инкубируют антителом кpIRF3 при 4C в течение ночи. День 3: первичное антитело вымывают, добавляют вторичное AlexaFluor488-сопряженное, клетки докрашивают пропидиум йодидом с последующим получением изображения на ридере IMX Ultra highRPMI 1640, Invitrogen 31870,10% FCS, Invitrogen 10270-106,2 мМ глутамакс, Invitrogen 35050-038 1 мМ,пируват натрия, Invitrogen 11360,1% Pen/Strep 37C, 5% СО 2,планшеты: черные/с прозрачным дном 384-луночные планшеты для культур клеток, Falcon 35 3962 или Greiner 781090,субкультивирование: HyQ-Tase, Thermo Scientific (HyClone) SV30030.01,другие реагенты: поли(I:C) (LMW), Invivogentlrl-picw (готовят 20 мг/мл исходный раствор в стерильном PBS, денатурируют 30 мин 55C в водной бане, медленно охлаждают до КТ, хранят при -20C в аликвотах),образцовый ингибитор: MSC2119074 А-4=ВХ-795 (IC50: 200-800 нМ),ингибиторный контроль: 10 мкМ MSC2119074 А-4=ВХ-795,нейтральный контроль: 0.5% ДМСО,10-точечная кривая зависимости "доза-эффект" с MSC2119074A-4=ВХ-795 включена в каждый эксперимент,Hepes, Merck 1.10110,PBS 1DPBS, Invitrogen 14190,формальдегид (не содержащий метанол, 16%, сверхчистый EM Grade), Polysciences18814 (хранение при КТ), конечная концентрация: 4%,метанол, Merck1.06009.1011 (-20C предварительно охлажден),сыворотка козла, РААВ 15-035 (хранение при 4C, длительное время -20C), конечная концентрация: 10%,BSA (IgG и без протеазы, 30%), US-BiologicalA1317(хранение 4C, длительное время -20C), конечная концентрация: 2%,Tween 20 Detergent, Calbiochem655204 (хранение RT), (готовят 10% исходный раствор в воде; конечная концентрация: 0.1%),анти-pIRF-3 Rabbit mAb, Epitomics2526-B (хранение -20 С), конечная концентрация: 1:2000 вH ЯМР: постоянная взаимодействия J [Гц]. Предпочтительная общая схема получения соединения формулы I Порядок проведения эксперимента. К перемешиваемому раствору 5-бром-2-аминоникотиновой кислоты (500 мг, 2.3 моль, 1 экв.) и 4 аминопиридина (260 мг, 2.7 моль, 1.2 экв.) в сухом ДМФА (5 мл) добавляют HATU (1.31 г, 3.4 моль, 1.5 экв.) и N-метилморфолин (690 мг, 6.9 моль, 3 экв.) и позволяют перемешаться в течение 3 ч. После завершения реакции реакционную смесь концентрируют; добавляют воду, твердое вещество осаждают и фильтруют, промывают NaHCO3 и водой с получением продукта. 1 К перемешиваемому раствору 2-амино-5-бром-N-пиридин-4-ил-никотинамида (1 экв.) в смеси толуол:этанол (4:1) добавляют замещенную бороновую кислоту (1.2 экв.), 2 М Na2CO3 (1.5 экв.) и дегазируют в течение 15 мин в атмосфере N2. К этой реакционной смеси добавляют Pd(PPh3)4 (0.012 экв.) и нагревают до 100C в течение 18 ч. После завершения реакции смесь пропускают через слой целита для удаления неорганических примесей. Фильтрат концентрируют в вакууме. С помощью колоночной хроматографии получают чистое соединение. Пример 1. Получение 2-амино-5-(5-пиперидин-1-илметилтиофен-2-ил)-N-пиридин-4-ил-никотинамида ("A1") осуществляют аналогично следующей схеме 1.1. 2-Амино-5-бром-N-пиридин-4-ил-никотинамид. 2.0 г 2-Амино-5-бромникотиновой кислоты и 1.06 г 4-аминопиридина растворяют в 20 мл ДМФА. К раствору добавляют 5.26 г HATU 2-(7-аза-1H-бензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат) и 3.04 мл N-метилморфолина. Смесь перемешивают в течение 5 ч при комнатной температуре. ДМФА упаривают и остаток растирают с водой. Твердое вещество отфильтровывают и промывают раствором NaHCO3 и водой. Получают 2.5 г твердого вещества светло-коричневого цвета; ВЭЖХ/МС: 1.13 мин, [М+Н]=293; 1H ЯМР (400 МГц, ДМСО-d6)[м.д.] 10.51 (s, 1H, NH), 8.48 (d, J=6.0, 2H), 8.25 (dd, J=10.8, 2.3, 2H),7.69 (d, J=6.3, 2H), 7.18 (s, 2H, NH2). 1.2. 2-Амино-5-(5-пиперидин-1-илметилтиофен-2-ил)-N-пиридин-4-ил-никотинамид ("A1"). 200 мг 2-амино-5-бром-N-пиридин-4-ил-никотинамида и 218 мг пинаколового эфира 5-(1 пиперидинилметил)тиофен-2-бороновой кислоты растворяют в 8 мл ДМФА. Добавляют 0.84 мл 2 молярного раствора Na2CO3 в атмосфере азота. Добавляют 7.81 мг тетракис(трифенилфосфин)палладия(0). Смесь перемешивают в течение 6 ч при 100C. Реакционную смесь охлаждают до комнатной температуры и ДМФА упаривают. Добавляют воду и полученный осадок отфильтровывают, промывают водой и сушат. Твердое вещество растирают с этилацетатом и отфильтровывают. Получают 47 мг желаемого продукта "A1" в виде твердого вещества светло-коричневого цвета; ВЭЖХ/МС: 1.08 мин, [М+Н]=394; 1(d, J=2.3, 1H), 7.71 (dd, J=4.8, 1.5, 2H), 7.25 (d, J=3.5, 1H), 7.13 (s, 2H, NH2), 6.93 (d, J=3.5, 1H), 3.61 (s, 2H),2.37 (br, 4H), 1.51 (m, 4H), 1.39 (m, 2H). Следующие соединения получают аналогично. 2-Амино-N-пиридин-4-ил-5-(5-пирролидин-1-илметилтиофен-2-ил)никотинамид ("А 2") В результате реакции 2-амино-5-бром-N-пиридин-4-ил-никотинамида с пинаколовым эфиром 5-(1 пирролидинилметил)тиофен-2-бороновой кислоты получают соединение "А 2"; ВЭЖХ/МС: 1.16 мин, [М+Н]=380; 1 В результате реакции 2-амино-5-бром-N-пиридин-4-ил-никотинамида с пинаколовым эфиром 5 метилтиофен-2-бороновой кислоты получают соединение "A3"; ВЭЖХ/МС: 1.45 мин, [М+Н]=311; 1 В результате реакции 2-амино-5-бром-N-пиридин-4-ил-никотинамида с [4-(1H-пиразол-1 ил)фенил]бороновой кислотой получают соединение "А 5"; ВЭЖХ/МС: 1.38 мин, [М+Н]=357; 1 В результате реакции 2-амино-5-бром-N-пиридин-4-ил-никотинамида с пинаколовым эфиром бензолсульфонамид-4-бороновой кислоты получают соединение "А 7"; ВЭЖХ/МС: 1.12 мин, [М+Н]=370; 1 В результате реакции 2-амино-5-бром-N-(2-метилпиридин-4-ил)никотинамида с пинаколовым эфиром 5-(4-морфолинилметил)тиофен-2-бороновой кислоты получают соединение "А 8"; ВЭЖХ/МС: 1.02 мин, [М+Н]=410; 1 В результате реакции 2-амино-5-бром-N-(2-этоксипиридин-4-ил)никотинамида с пинаколовым эфиром 5-(4-морфолинилметил)тиофен-2-бороновой кислоты получают соединение "А 9"; ВЭЖХ/МС: 1.37 мин, [М+Н]=440; 1 Указанное в заголовке соединение получают из 3-амино-6-бромпиразин-2-карбоновой кислоты и 4 аминопиридина, используя тот же способ, который описан в стадии 1 для "A1"; ВЭЖХ/МС: 1.18 мин, [М+Н]=294. 2.2 Пиридин-4-иламид 3-амино-6-(5-морфолин-4-илметилтиофен-2-ил)пиразин-2-карбоновой кислоты ("А 10"). Указанное в заголовке соединение получают аналогично стадии 2, описанной для "A1"; ВЭЖХ/МС: 1.08 мин, [М+Н]=397. Пример 3. Пиридин-4-иламид 6-амино-6'-пиперазин-1-ил-[3,3']бипиридинил-5-карбоновой кислоты 4-[6'-амино-5'-(пиридин-4-илкарбамоил)-[3,3']бипиридинил-6 Указанное в заголовке соединения получают из 2-амино-5-бром-N-(2-этоксипиридин-4 ил)никотинамида и пинаколового эфира 2-(4-трет-бутоксикарбонилпиперазин-1-ил)пиридин-5 бороновой кислоты аналогично стадии 2, описанной для "АР; ВЭЖХ/МС: 1.43 мин, [М+Н]=476. 3.2. 1.1 г трет-бутилового эфира 4-[6'-амино-5'-(пиридин-4-илкарбамоил)-[3,3']бипиридинил-6 ил]пиперазин-1-карбоновой кислоты растворяют в 25 мл диоксана. Добавляют 11 мл HCl в диоксане (4 молярн.). Смесь перемешивают 3 ч при комнатной температуре. Смесь фильтруют и твердое вещество промывают диоксаном. Продукт очищают с помощью хроматографии; ВЭЖХ/МС: 1.02 мин, [М+Н]=376; 1(m, 4H). Пример 4. Следующие соединения получают аналогично примеру 2. Пиридин-4-иламид 3-амино-6-(1-[1,3]диоксолан-2-илметил-1H-пиразол-4-ил)пиразин-2-карбоновой кислоты ("А 12") Указанное в заголовке соединение получают из 2-амино-5-бромникотиновой кислоты и 4 аминопиридазина аналогично описанному для "A1" в стадии 1; ВЭЖХ/МС: 1.40 мин, [М+Н]=294. 5.2. 2-Амино-5-(5-морфолин-4-илметилтиофен-2-ил)-N-пиридазин-4-ил-никотинамид получают из 2-амино-5-бром-N-пиридазин-4-ил-никотинамида и пинаколового эфира 5-(4-морфолинилметил)тиофен 2-бороновой кислоты аналогично описанному для "A1" в стадии 2; ВЭЖХ/МС: 1.15 мин, [М+Н]=397; 1(s, 2H), 3.59 (s, 4H), 2.48-2.35 (m, 4H). Следующие соединения получают аналогично. 2-Амино-5-(1-бензил-1H-пиразол-4-ил)-N-(2-метилпиридин-4-ил)никотинамид ("А 17") В результате реакции 2-амино-5-бром-N-(3-метилпиридин-4-ил)никотинамида с [4-(1H-пиразол-1 ил)фенил]бороновой кислотой получают соединение "А 19"; ВЭЖХ/МС: 1.41 мин, [М+Н]=371; 1 В результате реакции 2-амино-5-бром-N-(3-метилпиридин-4-ил)никотинамида с пинаколовым эфиром 5-(4-морфолинилметил)тиофен-2-бороновой кислоты получают соединение "А 21"; ВЭЖХ/МС: 0.97 мин, [М+Н]=410; 1 В результате реакции 2-амино-5-бром-N-пиридин-4-ил-никотинамида с [3-(п-толил)фенил]бороновой кислотой получают соединение "А 23"; ВЭЖХ/МС: 1.90 мин, [М+Н]=381; 1 В результате реакции 2-амино-5-бром-N-(2,6-диметилпиридин-4-ил)никотинамида с пинаколовым эфиром 5-(4-морфолинилметил)тиофен-2-бороновой кислоты получают соединение "А 26"; ВЭЖХ/МС: 1.09 мин, [М+Н]=424; 1 6.1. В результате реакции 2-амино-5-бромпиридин-3-карбоновой кислоты с пиримидин-4-амином в соответствии с синтезом, описанным для "A1" на стадии 1, получают 2-амино-5-бром-N-пиримидин-4 ил-пиридин-3-карбоксамид. 6.2. "А 27" получают из 2-амино-5-бром-N-пиримидин-4-ил-пиридин-3-карбоксамида и пинаколового эфира 5-(4-морфолинилметил)тиофен-2-бороновой кислоты в соответствии со стадией 2 синтеза "A1"; ВЭЖХ/МС: 1.27 мин, [М+Н]=397; 1
МПК / Метки
МПК: A61K 31/497, C07D 407/14, A61P 17/06, A61K 31/4427, A61P 25/28, A61P 19/02, C07D 401/14, C07D 409/04, C07D 409/14, C07D 401/12, C07D 471/04, C07D 491/048
Метки: производные, пиридина, пиразина
Код ссылки
<a href="https://eas.patents.su/30-23364-proizvodnye-piridina-i-pirazina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиридина и пиразина</a>