Производные пиразина и их применение в качестве ингибиторов pi3k
Номер патента: 15937
Опубликовано: 30.12.2011
Авторы: Черч Деннис, Кваттропани Анна, Гайяр Паскаль, Помель Винсэн, Кличич Ясна, Рюкле Томас
Формула / Реферат
1. Применение производного пиразина формулы (I)
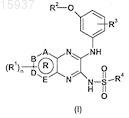
где А, В, D и Е независимо выбирают из С и N, так что кольцо R представляет собой ароматическое кольцо;
R1 выбирают из Н, галогена, нитро, C1-C6-алкила, C2-C6-алкенила и C2-C6-алкинила;
R2 выбирают из Н, C1-C6-алкила, C2-C6-алкенила и C2-C6-алкинила;
R3 выбирают из Н, галогена, C1-C6-алкила, C2-C6-алкенила, C2-C6-алкинила, алкокси, арила и гетероарила;
R4 выбирают из C1-C6-алкила, C2-C6-алкенила, C2-C6-алкинила, арила, гетероарила, C3-C8-циклоалкила, гетероциклоалкила, арил-C1-C6-алкила, гетероарил-C2-C6-алкила, C3-C8-циклоалкил-C1-C6-алкила, гетероциклоалкил-C1-C6-алкила, арил-C2-C6-алкенила и гетероарил-C2-C6-алкенила, ацилфенила, карбоксифенила, карбокси-C1-C6-алкила;
R1-R4могут быть необязательно замещены от 1 до 5 заместителями, выбранными из группы, состоящей из "C1-C6-алкила", "C2-C6-алкенила", "C2-C6-алкинила", "циклоалкила", "гетероциклоалкила", "C1-C6-алкиларила", "C1-C6-алкилгетероарила", "C1-C6-алкилциклоалкила", "C1-C6-алкилгетероциклоалкила", "амино", "аминосульфонила", "аммония", "ациламино", "аминокарбонила", "арила", "гетероарила", "сульфинила", "сульфонила", "алкокси", "алкоксикарбонила", "карбамата", "сульфанила", "галогена", тригалогенметила, циано, гидрокси, меркапто, нитро;
"арил" относится к содержащей от 6 до 14 атомов углерода ненасыщенной ароматической карбоциклической группе, включающей одно кольцо или несколько конденсированных колец;
"гетероарил" относится к моноциклической гетероароматической или бициклической или трициклической конденсированной гетероароматической группе;
"гетероциклоалкил" относится к C3-C8-циклоалкильной группе в соответствии с представленным выше определением, в которой до 3 атомов углерода заменены гетероатомами, выбранными из группы, состоящей из О, S, NR, где значение R определено как водород или метил; и
"алкокси" относится к группе -O-R, где R включает "C1-C6-алкил", или "арил", или "гетероарил", или "арил-C1-C6-алкил", или "гетероарил-C1-C6-алкил";
n равно целому числу, выбранному из 0, 1, 2, 3 и 4;
а также его геометрических изомеров, его оптически активных форм, таких как энантиомеры, диастереоизомеры, таутомеры, рацематные формы, а также его фармацевтически приемлемых солей в качестве лекарственного средства.
2. Производное пиразина формулы (I)
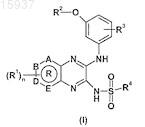
где А, В, D и Е независимо выбирают из С и N, так что кольцо R представляет собой ароматическое кольцо;
R1 выбирают из Н, галогена, нитро, C1-C6-алкила, C2-C6-алкенила и C2-C6-алкинила;
R2 выбирают из Н, C1-C6-алкила, C2-C6-алкенила и C2-C6-алкинила;
R3 выбирают из Н, галогена, C1-C6-алкила, C2-C6-алкенила, C2-C6-алкинила, алкокси, арила и гетероарила;
R4 выбирают из C1-C6-алкила, C2-C6-алкенила, C2-C6-алкинила, арила, гетероарила, C3-C8-циклоалкила, гетероциклоалкила, арил-C1-C6-алкила, гетероарил-C1-C6-алкила, C3-C8-циклоалкил-C1-C6-алкила, гетероциклоалкил-C1-C6-алкила, арил-C2-C-6алкенила и гетероарил-C2-C6-алкенила;
где "арил" относится к содержащей от 6 до 14 атомов углерода ненасыщенной ароматической карбоциклической группе, включающей одно кольцо или несколько конденсированных колец;
"гетероарил" относится к моноциклической гетероароматической, или бициклической, или трициклической конденсированной гетероароматической группе;
"гетероциклоалкил" относится к C3-C8-циклоалкильной группе в соответствии с представленным выше определением, в которой до 3 атомов углерода заменены гетероатомами, выбранными из группы, состоящей из О, S, NR, где значение R определено как водород или метил; и
"алкокси" относится к группе -O-R, где R включает "C1-C6-алкил", или "арил", или "гетероарил", или "арил-C1-C6-алкил", или "гетероарил-C1-C6-алкил";
n равно целому числу, выбранному из 0, 1, 2, 3 и 4;
при первом условии, что если R4 представляет собой тиофенил, то он не является группой, выбранной из незамещенного тиофенила, незамещенного хлор-5-тиофенила или незамещенного бром-5-тиофенила;
при втором условии, что если R4 представляет собой фенил, то он представляет собой монозамещенный фенил, который не выбирают из группы, состоящей из пара-бромфенила, пара-метоксифенила, пара-этоксифенила, орто-, мета- или пара-хлорфенила; мета- или пара-метилфенила; орто- или пара-фторфенила; орто-CF3-фенила; пара- или мета-нитрофенила; пара-NHAc-фенила и пара-аминофенила; или он представляет собой полизамещенный фенил, который не является дизамещенным фенилом, выбранным из группы, состоящей из мета,пара-диметилфенила; мета,мета-диметилфенила; орто,пара-диметилфенила; орто,мета-диметилфенила; орто-метил-пара-фторфенила; мета,мета-дихлорфенила; орто,мета-дихлорфенила; пара-хлор-мета-нитрофенила и орто-этокси-мета-бромфенила;
при последнем условии, что если R4 представляет собой 1,4-бензодиоксин, то он представляет собой замещенную бензодиоксигруппу;
а также его геометрические изомеры, его оптически активные формы, такие как энантиомеры, диастереоизомеры, таутомеры, рацематные формы, а также его фармацевтически приемлемые соли.
3. Применение производного пиразина по п.1, где R1 выбирают из Н и галогена.
4. Применение производного пиразина по пп.1, 3, где R2 представляет собой метил.
5. Применение производного пиразина по пп.1, 3, 4, где R3 выбирают из Н и алкокси.
6. Применение производного пиразина по любому из пп.1, 3, 4, где R3выбирают из галогена, арила и необязательно замещенного гетероарила.
7. Применение производного пиразина по любому из пп.1, 3-6, где R4выбирают C1-C6-алкила, C2-C6-алкенила, C2-C6-алкинила, арил-C1-C6-алкила и гетероарил-C1-C6-алкила.
8. Применение производного пиразина по любому из пп.1, 3-6, где R4выбирают из арила и гетероарила.
9. Применение производного пиразина по любому из пп.1, 3-8, где А, В, D и Е представляют собой С.
10. Применение производного пиразина по любому из пп.1, 3-8, где А представляет собой N; В, D и Е представляют собой С.
11. Применение производного пиразина по любому из пп.1, 3-8, где А, В и Е представляют собой С; D представляет собой N.
12. Применение производного пиразина по любому из пп.1, 3-11, где R1выбирают из Н и галогена; R2представляет собой метил; R3выбирают из Н и алкокси; значения R, n, R4, А, В, D и Е определены в предшествующих пунктах.
13. Применение производного пиразина по любому из пп.1, 3-12, где R1выбирают из Н и галогена; R2представляет собой метил; R3выбирают из Н и алкокси; А, В, D и Е представляют собой С; значения R, n и R4 определены в предшествующих пунктах.
14. Применение производного пиразина по любому из пп.1, 3-13, где R1представляет собой Н; n равно 3; R2 представляет собой метил; R3 выбирают из Н и алкокси; А, В, D и Е независимо выбирают из С и N, так что кольцо R представляет собой необязательно замещенный пиридинил; значение R4 определено в предшествующих пунктах.
15. Применение производного по п.1, где производное пиразина выбрано из следующей группы, включающей:
4-циано-N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}бензолсульфонамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}бензолсульфонамид;
3-[({3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}амино)сульфонил]бензойную кислоту;
N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}-1-метил-1Н-имидазол-4-сульфонамид;
N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}-4-метилбензолсульфонамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-3-метилбензолсульфонамид;
N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}-3-метилбензолсульфонамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-4-метилбензолсульфонамид;
5-бром-N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}тиофен-2-сульфонамид;
N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}-1-пиридин-3-илметан сульфонамид;
метил-3-{4-[({3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}амино)сульфонил]фенил}пропаноат;
метил-4-[({3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}амино)сульфонил]бензоат;
N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}-3-фторбензолсульфонамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-4-(метилсульфонил)бензолсульфонамид;
N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}-2,3-дигидро-1,4-бензодиоксин-6-сульфонамид;
N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}-4-(пирролидин-1-илсульфонил)бензолсульфонамид;
N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}-3-(метилсульфонил)бензолсульфонамид;
N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}-3-(метилсульфонил)бензолсульфонамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-3-(метилсульфонил)бензолсульфонамид;
2-циано-N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}бензолсульфонамид;
2-циано-N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}бензолсульфонамид;
2-хлор-N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}бензолсульфонамид;
N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}пиридин-3-сульфонамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-1-метил-1Н-имидазол-4-сульфонамид;
N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}-4-фторбензолсульфонамид;
N-{3-[(2,5-диметоксифенил)амино]пиридо[2,3-b]пиразин-2-ил}бензолсульфонамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-4-фторбензолсульфонамид;
4-циано-N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}бензолсульфонамид;
N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}бензолсульфонамид;
N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}метансульфонамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}тиофен-3-сульфонамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}метансульфонамид;
3-[({3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}амино)сульфонил]бензойную кислоту;
метил-4-[({3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}амино)сульфонил]бензоат;
метил-3-[({3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}амино)сульфонил]тиофен-2-карбоксилат;
5-хлор-N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}-1,3-диметил-1Н-пиразол-4-сульфонамид;
4-хлор-N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}бензолсульфонамид;
3-[({3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}амино)сульфонил]тиофен-2-карбоновую кислоту;
3-{4-[({3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}амино)сульфонил]фенил}пропановую кислоту;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-3-метил-2-оксо-2,3-дигидро-1,3-бензотиазол-6-сульфонамид;
N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}-2,1,3-бензотиадиазол-4-сульфонамид;
4-хлор-N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}бензолсульфонамид;
N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}-3-метил-2-оксо-2,3-дигидро-1,3-бензотиазол-6-сульфонамид;
4-бром-N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}бензолсульфонамид;
N-{3-[(3,5-диметоксифенил)амино]пиридо[2,3-b]пиразин-2-ил}бензолсульфонамид;
4-бром-N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}бензолсульфонамид;
4-ацетил-N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}бензолсульфонамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}пропан-1-сульфонамид;
N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}тиофен-3-сульфонамид;
4-ацетил-N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}бензолсульфонамид;
N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}-1,2-диметил-1Н-имидазол-5-сульфонамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-2,1,3-бензоксадиазол-4-сульфонамид;
3-хлор-N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}бензолсульфонамид;
3-циано-N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}бензолсульфонамид;
N-{3-[({3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}амино)сульфонил]фенил}ацетамид;
N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}пропан-1-сульфонамид;
N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}-4-(трифторметил)бензолсульфонамид;
4-[({3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}амино)сульфонил]бутановую кислоту;
3-хлор-N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}бензолсульфонамид;
N-{6-хлор-3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}бензолсульфонамид;
N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}-1-пиридин-2-илметансульфонамид;
N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}-4-метоксибензолсульфонамид;
N-{3-[(3,5-диметоксифенил)амино]пиридо[2,3-b]пиразин-2-ил}этансульфонамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-3-метоксибензолсульфонамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-1-пиридин-2-илметансульфонамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-1-пиридин-3-илметансульфонамид;
метил-3-[({3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}амино)сульфонил]тиофен-2-карбоксилат;
N-{2-[(2,5-диметоксифенил)амино]пиридо[3,4-b]пиразин-3ил}бензолсульфонамид;
N-{3-[(3-метоксифенил)амино]хиноксалин-2-ил}бензолсульфонамид;
N-{3-[(3-метоксифенил)амино]хиноксалин-2-ил}бензолсульфонамид;
4-хлор-N-{3-[(3-метоксифенил)амино]хиноксалин-2-ил}бензолсульфонамид;
N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}-3-метоксибензолсульфонамид;
4-[({3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}амино)сульфонил]бутановую кислоту;
N-{3-[(3-метоксифенил)амино]хиноксалин-2-ил}метансульфонамид;
N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}-4-йодбензолсульфонамид;
4-бром-N-{3-[(3-метоксифенил)амино]хиноксалин-2-ил}бензолсульфонамид;
4-[({3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}амино)сульфонил]бензойную кислоту;
метил-4-[({3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}амино)сульфонил]бутаноат;
4-[({3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}амино)сульфонил]бензойную кислоту;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-2-фторбензолсульфонамид;
N-(3-{[5-метокси-2-(1Н-пиррол-1-ил)фенил]амино}хиноксалин-2-ил)бензолсульфонамид;
метил-3-[({3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}амино)сульфонил]бензоат;
N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}-6-морфолин-4-илпиридин-3-сульфонамид;
4-метокси-N-{3-[(3-метоксифенил)амино]хиноксалин-2-ил}бензолсульфонамид;
метил-3-[({3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}амино)сульфонил]бензоат;
3-[({3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}амино)сульфонил]тиофен-2-карбоновую кислоту;
N-{3-[(2-хлор-5-метоксифенил)амино]хиноксалин-2-ил}бензолсульфонамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-2-(метилсульфонил)бензолсульфонамид;
N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}-2-фторбензолсульфонамид;
4,5-дихлор-N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}тиофен-2-сульфонамид;
N-{3-[(5-метокси-2-метилфенил)амино]хиноксалин-2-ил}бензолсульфонамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-3-фторбензолсульфонамид;
N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}-2-(метилсульфонил)бензолсульфонамид;
N-{3-[(2,3-дигидро-1,4-бензодиоксин-5-илметил)амино]хиноксалин-2-ил}бензолсульфонамид;
N-{3-[(3,5-диметоксифенил)амино]-6-нитрохиноксалин-2-ил}бензолсульфонамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-4-(пирролидин-1-илсульфонил)бензолсульфонамид;
метил-4-[({3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}амино)сульфонил]бутаноат;
метил-5-[({3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}амино)сульфонил]-4-метилтиофен-2-карбоксилат;
метил-5-[({3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}амино)сульфонил]-1-метил-1Н-пиррол-2-карбоксилат;
метил-5-[({3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}амино)сульфонил]-1-метил-1Н-пиррол-2-карбоксилат;
N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}тиофен-2-сульфонамид;
2-хлор-N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}-4-фторбензолсульфонамид;
2-хлор-N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-4-фторбензолсульфонамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}пиридин-3-сульфонамид;
3-циано-N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-4-фторбензолсульфонамид;
3-циано-N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}-4-фторбензолсульфонамид;
6-хлор-N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}пиридин-3-сульфонамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-6-(диметиламино)пиридин-3-сульфонамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-6-[(3-метоксипропил)амино]пиридин-3-сульфонамид;
N-{3-[(5-метокси-2-метилфенил)амино]хиноксалин-2-ил}пиридин-3-сульфонамид;
N-{3-[(2-хлор-5-метоксифенил)амино]хиноксалин-2-ил}-4-цианобензолсульфонамид;
N-{3-[(2-хлор-5-метоксифенил)амино]хиноксалин-2-ил}пиридин-3-сульфонамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-6-метоксипиридин-3-сульфонамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-6-оксо-1,6-дигидропиридин-3-сульфонамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-6-метилпиридин-3-сульфонамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-4-фтор-2-метилбензолсульфонамид;
N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}-6-метилпиридин-3-сульфонамид;
4-циано-N-{3-[(5-метокси-2-метилфенил)амино]хиноксалин-2 ил}бензолсульфонамид;
N-{3-[(5-метокси-2-метилфенил)амино]хиноксалин-2-ил}-6-метилпиридин-3-сульфонамид;
N-{3-[(2-хлор-5-метоксифенил)амино]хиноксалин-2-ил}-6-метилпиридин-3-сульфонамид;
метил-5-[({3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}амино)сульфонил]пиридин-2-карбоксилат;
N-{3-[(2-бром-5-метоксифенил)амино]хиноксалин-2-ил}-1-метил-1Н-имидазол-4-сульфонамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-3-(морфолин-4-илкарбонил)бензолсульфонамид;
5-[({3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}амино)сульфонил]-4-метилтиофен-2-карбоновую кислоту;
5-[({3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}амино)сульфонил]-4-метилтиофен-2-карбоновую кислоту;
5-[({3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}амино)сульфонил]-1-метил-1Н-пиррол-2-карбоновую кислоту;
5-[({3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}амино)сульфонил]-1-метил-1Н-пиррол-2-карбоновую кислоту;
5-[({3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}амино)сульфонил]пиридин-2-карбоновую кислоту;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-3-(морфолин-4-илметил)бензолсульфонамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-4-[(4-метилпиперазин-1-ил)метил]бензолсульфонамид;
4-(аминометил)-N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}бензолсульфонамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-3-(гидроксиметил)бензолсульфонамид;
3-(аминометил)-N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}бензолсульфонамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-4-(гидроксиметил)бензолсульфонамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-6-(гидроксиметил)пиридин-3-сульфонамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-4-(морфолин-4-илметил)бензолсульфонамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-3-[(4-метилпиперазин-1-ил)метил]бензолсульфонамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-4-[(диметиламино)метил]бензолсульфонамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-3-[(диметиламино)метил]бензолсульфонамид;
4-[({3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}амино)сульфонил]бензамид;
4-[({3-[(5-метокси-2-метилфенил)амино]хиноксалин-2-ил}амино)сульфонил]бензамид;
4-[({3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}амино)сульфонил]-N-(3-метоксипропил)бензамид;
4-[({3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}амино)сульфонил]-N-[3-(диметиламино)пропил]бензамид;
3-[({3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}амино)сульфонил]-N-[3-(диметиламино)пропил]бензамид;
5-[({3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}амино)сульфонил]-N,N-диметилпиридин-2-карбоксамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-3-[(4-метилпиперазин-1-ил)карбонил]бензолсульфонамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-6-(морфолин-4-илкарбонил)пиридин-3-сульфонамид;
N-{3-[(3,5-диметоксифенил)амино]пиридо[2,3-b]пиразин-2-ил}этансульфонамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-6-[(4-метилпиперазин-1-ил)метил]пиридин-3-сульфонамид;
5-(аминометил)-N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}тиофен-2-сульфонамид.
16. Производное пиразина по п.2, выбранное из следующей группы, включающей:
4-амино-N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}бензолсульфонамид;
5-хлор-N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-1,3-диметил-1Н-пиразол-4-сульфонамид;
N-{3-[({3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}амино)сульфонил]фенил}ацетамид;
3-циано-N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}бензолсульфонамид;
N-{3-[(2,5-диметоксифенил)амино]хиноксалин-2-ил}-4-(трифторметил)бензолсульфонамид;
N-{3-[(3,5-диметоксифенил)амино]хиноксалин-2-ил}-4-йодбензолсульфонамид.
17. Применение производного пиразина, определенного по любому из пп.1-16, а также его изомеров и их смесей для получения лекарственного средства для профилактики и/или лечения аутоиммунных нарушений и/или воспалительных заболеваний, сердечно-сосудистых заболеваний, нейродегенеративных нарушений, бактериальных и вирусных инфекций, аллергии, бронхиальной астмы, панкреатита, полиорганной недостаточности, заболеваний почек, агрегации тромбоцитов, рака, нарушений при трансплантации, подвижности сперматозоидов, дефицита эритроцитов, отторжения трансплантата или повреждений легких.
18. Применение по п.17, где указанные заболевания выбирают из группы, включающей рассеянный склероз, псориаз, ревматоидный артрит, системную красную волчанку, воспалительную болезнь кишечника, воспаление легких, тромбоз или инфекцию/воспаление головного мозга, такие как менингит или энцефалит.
19. Применение по п.17, где указанные заболевания выбирают из группы, включающей болезнь Альцгеймера, болезнь Гентингтона, травму ЦНС, инсульт и ишемические состояния.
20. Применение по п.17, где указанные заболевания выбирают из группы, включающей атеросклероз, гипертрофию сердца, дисфункцию миоцитов сердца, повышенное кровяное давление или сужение сосудов.
21. Применение по п.17, где указанные заболевания выбирают из группы, включающей хроническое обструктивное заболевание легких, анафилактический шок, фиброз, псориаз, аллергические заболевания, бронхиальную астму, инсульт и ишемические состояния, ишемию/реперфузию, агрегацию/активацию тромбоцитов, атрофию/гипертрофию скелетных мышц, рекрутинг лейкоцитов в раковую ткань, ангиогенез, инвазивное метастазирование, меланому, саркому Капоши, острую и хроническую бактериальную и вирусную инфекцию, сепсис, отторжение трансплантата, гломерулосклероз, гломерулонефрит, прогрессирующий фиброз почек, повреждения эндотелия и эпителия в легких или, в целом, воспаление дыхательных путей легких.
22. Применение пиразина, определенного по любому из пп.1-16, для модулирования, в частности для ингибирования, активности PI3-киназы.
23. Фармацевтическая композиция, содержащая по меньшей мере одно производное пиразина, определенное по любому из пп.1-16, и фармацевтически приемлемый носитель, разбавитель или эксципиент.
24. Способ получения производного пиразина, определенного по любому из пп.1-16, включающий стадию взаимодействия соединения формулы (II) с анилином формулы (III) в отсутствие основания
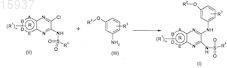
где значения n, А, В, D, E, R, R1, R2, R3, R4определены в любом из предшествующих пунктов.
25. Способ получения производного пиразина, определенного по любому из пп.1-16, включающий стадию взаимодействия аминопроизводного формулы (XI) и сульфонилхлорида формулы (IX) в присутствии основания
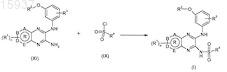
где значения n, А, В, D, E, R, R1, R2, R3, R4определены в любом из предшествующих пунктов.
26. Способ получения по п.25, где основанием является пиридин.
27. Соединение формулы (XI)

где значения n, А, В, D, E, R, R1, R2, R3 определены в любом из предшествующих пунктов, при условии, что соединение формулы (XI) не является ни N-(3-метоксифенил)-2,3-хиноксалиндиамином (RN 165058-49-1), ни 3-[(3-амино-2-хиноксалинил)амино]фенолом (RN 165058-51-5).
28. Соединение по п.27, выбранное из следующей группы, включающей:
N-(2,5-диметоксифенил)хиноксалин-2,3-диамин;
N-(5-метокси-2-метилфенил)хиноксалин-2,3-диамин;
N-(5-метокси-2-пиррол-1-илфенил)хиноксалин-2,3-диамин;
N-(5-метокси-2-хлорфенил)хиноксалин-2,3-диамин;
N-(3-метоксифенил)хиноксалин-2,3-диамин;
N-(5-метокси-2-бромфенил)хиноксалин-2,3-диамин;
N-(3,5-диметоксифенил)хиноксалин-2,3-диамин.
Текст
Дата публикации и выдачи патента Номер заявки Настоящее изобретение относится к производным пиразина формулы (I) в частности, для лечения и/или профилактики аутоиммунных нарушений и/или воспалительных заболеваний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, бактериальных и вирусных инфекций, заболеваний почек, агрегации тромбоцитов,рака, нарушений при трансплантации, отторжения трансплантата или повреждений легких. 015937 Настоящее изобретение относится к применению производных пиразина формулы (I) для лечения и/или профилактики аутоиммунных нарушений и/или воспалительных заболеваний, сердечнососудистых заболеваний, нейродегенеративных заболеваний, бактериальных и вирусных инфекций, аллергии, бронхиальной астмы, панкреатита, полиорганной недостаточности, заболеваний почек, агрегации тромбоцитов, рака, нарушений при нарушений при трансплантации, подвижности сперматозоидов,дефицита эритроцитов, отторжения трансплантата или повреждений легких. Конкретно, настоящее изобретение относится к производным пиразина для модулирования, в частности, ингибирования активности или функции фосфоинозитид-3-киназ (PI3K). Фосфоинозитид-3-киназы (PI3K) играют ключевую сигнальную роль в пролиферации клеток, выживании клеток, васкуляризации, трансмембранном переносе, транспорте глюкозы, росте нейритов, активных перемещениях возбуждения в мембране клеток, продукции супероксида, реорганизации актина и хемотаксисе (Cantley, 2000, Science, 296, 1655-1657). Термин "PI3K" присвоен семейству липидных киназ, которое у млекопитающих включает восемь идентифицированных PI3K, разделенных на три подсемейства в соответствии с их структурой и субстратной специфичностью. Группа PI3K класса I состоит из двух подгрупп: класса IA и класса IB. Класс IA представляет собой семейство гетеродимерных липидных киназ, содержащих регуляторную субъединицу массой 85 кДа (отвечающую за межбелковые взаимодействия посредством взаимодействия домена Src гомологии 2 (SH2-домен) с остатками фосфотирозина других белков) и каталитической субъединицы массой 110 кДа, которая генерирует в цепи передачу сигналов вторичных мессенджеров ниже тирозинкиназ, регулируя, тем самым, метаболизм, рост, пролиферацию, дифференцировку, подвижность и выживание клеток. Для этого класса существуют три каталитические формы (p110, р 110 и р 110) и пять регуляторных изоформ (р 85, р 85, р 55, р 55 и р 50). Класс IB стимулируетсясубъединицами G-белка гетеродимерных G-белков. Единственным охарактеризованным представителем класса IB является PI3K (комплекс каталитической субъединицы р 110 с регуляторным белком массой 101 кДа, р 101).PI3K класса II включают ,иизоформы, которые имеют массу приблизительно 170 кДа и характеризуются наличием С-концевого С 2 домена.PI3K класса III включают специфические фосфатидилинозит-3-киназы. Эволюционно консервативные изоформы р 110 и р 110 экспрессируются повсеместно, тогда как изоформыиболее специфически экспрессируются в клетках системы гемопоэза, гладкомышечных клетках, миоцитах и эндотелиальных клетках (Vanhaesebroeck et al., 2001, Annu. Rev. Biochem., 70, 535602). Их экспрессия может также регулироваться индуцибельным путем в зависимости от типа клеток,типа ткани и стимулов, а также фона заболевания.PI3K представляют собой ферменты, вовлеченные в передачу сигналов с участием фосфолипидов, и активируются в ответ на целый ряд внеклеточных сигналов, таких как факторы роста, митогены, интегрины (межклеточные взаимодействия), гормоны, цитокины, вирусы и нейротрансмиттеры, а также путем внутриклеточной перекрестной регуляции другими сигнальными молекулами (взаимное влияние, когда начальный сигнал может активировать несколько путей, при котором на второй стадии сигналы передаются PI3K путем внутриклеточных событий передачи сигнала), такими как, например, малые ГТФазы,киназы или фосфатазы. Фосфатидилинозит (PtdIns) представляет собой основной структурный элемент внутриклеточных инозитных липидов в эукариотических клетках, состоящий из D-миоинозит-1-фосфат (Ins1P), соединенный через фосфатную группу с диациглицерином. Инозитная головная группа PtdIns содержит пять свободных гидроксигрупп, три из которых, как было обнаружено, фосфорилированы в клетках в различных комбинациях. PtdIns и его фосфорилированные производные совместно называют инозитфосфолипидами или фосфоинозитидами (PI). В эукариотических клетках было документально подтверждено восемь видов PI (Vanhaesebroeck et al., 2001, выше). Все PIs расположены в мембранах и являются субстратами для киназ, фосфатаз и липаз.In vitro PI3K фосфорилируют 3-гидроксильную группу инозитольного кольца в трех различных субстратах: фосфатидилинозите (PtdIns), фосфатидилинозит-4-фосфате (PI(4)P) и фосфатидилинозит-4,5 дифосфате (PI(4,5)P2), соответственно генерируя три липидных продукта, а именно фосфатидилинозит-3 монофосфат (PI(3)P), фосфатидилинозит-3,4-дифосфат (PI(3,4)P2) и фосфатидилинозит-3,4,5-трифосфат(PI(3,4,5)P3, (см. представленную ниже схему А). Предпочтительным субстратом для PI3K класса I является PI(4,5)P2. В качестве субстрата PI3K класса II строгое предпочтение имеют PtdIns по сравнению с PI(4)P и PI(4,5)P2. PI3K класса III могут использовать в качестве субстрата только PtdIns и, по-видимому, отвечают за образование наибольшей части PI(3)P в клетках (Vanhaesebroeck et al., 2001, выше). Фосфоинозитидный внутриклеточный сигнальный путь начинается со связывания сигнальной молекулы (внутриклеточные лиганды, стимулы, димеризация рецептора, трансактивация гетерологичным рецептором (например, рецепторной тирозинкиназой со связанным с G-белком трансмембранным рецептором, встроенным в плазматическую мембрану, что приводит к активации PI3K. Будучи активированными PI3K преобразуют мембранный фосфолипид PI(4,5)P2 в PI(3,4,5)P3, который, в свою очередь, может быть в дальнейшем преобразован в другую 3'-фосфорилированную форму фосфоинозитидов 5'-специфичными фосфоинозитидфосфатазами, поэтому ферментативная активностьPI3K приводит, прямо или опосредованно, к образованию двух подтипов 3'-фосфоинозитидов, которые действуют в качестве вторичных мессенджеров во внутриклеточной передаче сигнала (Toker et al., 2002,Cell Mol. Life Sci., 59(5), 761-79). В качестве вторичных мессенджеров фосфорилированные продукты PtdIns вовлечены в целый ряд путей передачи сигналов, включая пути, важные для пролиферации клеток, дифференцировки клеток,роста клеток, размера клеток, выживания клеток, апоптоза, адгезии, подвижности клеток, миграции клеток, хемотаксиса, инвазии, цитоскелетной перегруппировки, изменений формы клеток, переноса везикул и метаболизма (Stein, 2000, Mol. Med. Today, 6(9), 347-57). Хемотаксис - направленное движение клеток по градиенту концентраций химических аттрактантов, также называемых хемокинами, - вовлечен во многие важные заболевания, такие как воспаление/аутоиммунитет, нейродегенерация, ангиогенез, инвазия/метастазирование и заживление ран (Wyman et al., 2000, Immunol. Today, 21(6), 260-4 и Gerard et al.,2001, Nat. Immunol., 2(2), 108-15). Поэтому считается, что активация PI3-киназы вовлечена в целый ряд клеточных реакций, включая рост, дифференцировку, миграцию и апоптоз клеток (Parker et al., 1995, Current Biology, 5, 577-99; Yao etal., 1995, Science, 267, 2003-05). В недавних биохимических исследованиях было выявлено, что PI3K класса I (например, PI3K изоформа класса IB) представляют собой киназы с двойной специфичностью, т.е. они обладают как липидкиназной (фосфорилирование фосфоинозитидов), так и протеинкиназной активностью, поскольку они способны индуцировать фосфорилирование другого белка в качестве субстрата, включая аутофосфорилирование в качестве внутримолекулярного регуляторного механизма. По-видимому, PI3K вовлечены в целый ряд аспектов активации лейкоцитов. Было показано, что активность ассоциированной с р 85 PI3-киназы физически связана с цитоплазматическим доменом CD28,который представляет собой важную костимулирующую молекулу для активации Т-клеток в ответ на антиген. Такие эффекты связаны с усилением транскрипции целого ряда генов, включая ген интерлейкина-2 (IL-2), важного Т-клеточного фактора роста (Fraser et al., 1991, Science, 251, 313-16). Мутация CD28,приводящая к невозможности взаимодействовать с PI3-киназой, приводит к утрате способности инициировать продукцию IL-2, что наводит на мысль о важной роли PI3-киназы в активации Т-клеток.-2 015937 Клеточные процессы, в которых важную роль играют PI3K, включают супрессию апоптоза, реорганизацию актинового скелета, рост кардиомиоцитов, стимуляцию инсулином гликогенсинтетазы, TNFопосредованный прайминг нейтрофилов, генерацию супероксида и миграцию лейкоцитов и их адгезию к эндотелиальным клеткам. Недавно было показано, что PI3K передает сигналы воспаления через G(i)-связанные рецепторы(Laffargue et al., 2002, Immunity, 16(3), 441-51) и их основную функцию иммунологии тучной клетки, стимула в окружении лейкоцитов, включает, например, цитокины, хемокины, аденозины, антитела, интегрины, факторы агрегации, факторы роста, вирусы или гормоны (Lawlor et al., 2001, J. Cell. Sci., 114(Pt. 16), 2903-1). Два соединения, LY294002 и вортманнин (цитируемые здесь или далее в данном описании), широко использовались в качестве ингибиторов PI3-киназы. Указанные соединения являются неспецифическими ингибиторами PI3K, поскольку они не делают различия между четырьмя представителями PI3-киназ класса I. Значения IC50 для вортманнина в отношении каждой из различных PI3-киназ класса I составляет 1-10 нМ, и значения IC50 для LY294002 в отношении каждой из указанных PI3-киназ составляют приблизительно 15-20 мкМ (Fruman et al., 1998, Ann. Rev. Biochem., 67, 481-507), а также 5-10 мМ в отношенииCK2-протеинкиназы и некоторую ингибирующую активность в отношении фосфолипаз. Вортманнин представляет собой продукт обмена вещества грибов, который необратимо ингибирует активность PI3K путем ковалентного связывания с каталитическим доменом данного фермента. Ингибирование активности PI3K вортманнином отменяет последующий клеточный ответ на внеклеточный фактор (Thelen et al., 1994, Proc. Natl. Acad. Sci. USA, 91, 4960-64). Эксперименты с вортманнином показывают, что активность PI3K в кроветворных клетках, в частности в нейтрофилах, моноцитах и других типах лейкоцитов, вовлечена во многие иммунные ответы, не относящиеся к иммунологической памяти и ассоциированные с острым и хроническим воспалением. На основании исследований с использованием вортманнина получено доказательно, что действиеPI3-киназы также необходимо для некоторых аспектов передачи сигнала в лейкоцитах через связанные сG-белком рецепторы (Thelen et al., 1994, выше). Более того, было показано, что вортманнин и LY294002 блокируют миграцию нейтрофилов и высвобождение супероксида. Некоторые результаты указывают на то, что ингибиторы PI3K, например LY294002, могут усиливать in vivo противоопухолевую активность определенных цитотоксических средств (например, паклитаксела) (Grant, 2003, Current Drugs, 6(10), 946-948). Однако, поскольку указанные соединения не делают различия между различными изоформамиPI3K, остается неясным, какая конкретно изоформа или изоформы PI3K вовлечены в это явление. Специфические ингибиторы отдельных представителей семейства ферментов дают ценный инструмент для расшифровки функций каждого фермента, поскольку в зависимости от заболевания варьируют степень селективности для представляющих интерес изоформ PI3K. Р 110 преимущественно экспрессируется на гемопоэтических клетках, таких как лейкоциты. Для оценки роли р 110 изоформы каталитической субъединицы PI3K недавно были полученыPI3K-null мыши (Jou et al., 2002, Mol. Cell. Biol., 22(4), 8580-8591) и их специфический иммунофенотип был хорошо охарактеризован (Vanhaesebroeck et al., 2005, Trends Biochem. Sci., 30(4), 194-204). В данных экспериментах показано, что PI3K-null животные являются жизнеспособными, и дефицит PI3K приводит к очень специфической утрате функции комплекса антигенспецифического рецептора В-клеток, тогда как передача сигнала через комплексы цитокиновых рецепторов осталась неизменной (Jou et al.,2002, выше). Также было показано, что инактивация изоформы р 110 PI3K в тучных клетках приводит in vitro к нарушению индуцированной фактором стволовых клеток пролиферации, адгезии и миграции клеток и к нарушенной аллерген-IgE-индуцированной дегрануляции и высвобождению цитокинов. Инактивация р 110 защищает мышей от анафилактических аллергических реакций, наводя на мысль о р 110 в качестве мишени для терапевтического вмешательства при аллергии и связанных с тучными клетками патологий (Ali et al., 2004, Nature, 431, 1007-1010).-3 015937 Тучные клетки оказались уникальными иммунными клетками, которые могут принимать участие в целом ряде воспалительных заболеваний в нервной системе (например, рассеянный склероз), коже, суставах, а также в сердечно-сосудистой системе, тонком кишечнике и мочеполовой системе (Theoharides etal., 2004, J. Of Neuroimmunology, 146, 1-12). Высокая значимость PI3K-пути при некоторых широко распространенных заболеваниях подчеркивает необходимость разработки ингибиторов, включая селективные ингибиторы, изоферментов PIK для того, чтобы действие каждого изофермента могло быть лучше охарактеризовано. Недавно были разработаны ингибиторы PI3K: производные тиазола (WO 2005/021519 иWO 04/078754), производные тиазолидина (WO 2004/007491 и WO 2004/056820) и производные хиназолинона (WO 03/035075). В соответствии с одним аспектом настоящее изобретение относится к веществам, которые полезны для лечения и/или профилактики нарушений, связанных с фосфоинозитид-3-киназами (PI3K), такими какPI3K, или PI3K, или PI3K. В соответствии с другим аспектом настоящее изобретение относится к веществам, которые полезны для лечения и/или профилактики аутоиммунных и/или воспалительных нарушений. В соответствии с другим аспектом настоящее изобретение относится к веществам, которые полезны для лечения и/или профилактики сердечно-сосудистых заболеваний. В соответствии с другим аспектом настоящее изобретение относится к веществам, которые полезны для лечения и/или профилактики нейродегенеративных нарушений. В соответствии с другим аспектом настоящее изобретение относится к веществам, которые полезны для лечения и/или профилактики рака. В соответствии с другим аспектом настоящее изобретение относится к веществам, которые полезны для лечения и/или профилактики нарушения, выбранного из бактериальных и вирусных инфекций, аллергии, бронхиальной астмы, панкреатита, полиорганной недостаточности, заболеваний почек, агрегации тромбоцитов, рака, нарушений при трансплантации, подвижности сперматозоидов, дефицита эритроцитов, отторжения трансплантата, повреждений легких, респираторных заболеваний и ишемических состояний. В соответствии с другим аспектом настоящее изобретение относится к химическим соединениям,которые способны модулировать, в частности ингибировать, активность или функционирование фосфоинозитид-3-киназ (PI3K) при болезненных состояниях у млекопитающих, в частности у людей. В соответствии с другим аспектом настоящее изобретение относится к новой категории фармацевтических препаратов для лечения заболеваний, опосредованных PI3K, выбранных из аутоиммунных,воспалительных нарушений, сердечно-сосудистых заболеваний, нейродегенеративных нарушений, бактериальных и вирусных инфекций, аллергии, бронхиальной астмы, панкреатита, полиорганной недостаточности, заболеваний почек, агрегации тромбоцитов, рака, нарушений при трансплантации, подвижности сперматозоидов, дефицита эритроцитов, отторжения трансплантата, повреждений легких, респираторных заболеваний и ишемических состояний. В соответствии с другим аспектом настоящее изобретение относится к способу лечения и/или профилактики нарушений, выбранных из аутоиммунных, воспалительных нарушений, сердечно-сосудистых заболеваний, нейродегенеративных нарушений, бактериальных и вирусных инфекций, аллергии, бронхиальной астмы, панкреатита, полиорганной недостаточности, заболеваний почек, агрегации тромбоцитов,рака, нарушений при трансплантации, подвижности сперматозоидов, дефицита эритроцитов, отторжения трансплантата, повреждений легких, респираторных заболеваний и ишемических состояний. В первом аспекте настоящее изобретение относится к производным пиразина формулы (I) где значения n, А, В, D, E, R, R1, R2, R3 и R4 определены ниже при подробном описании настоящего изобретения. Во втором аспекте настоящее изобретение относится к соединению формулы (I) для применения в качестве лекарственного средства. В третьем аспекте настоящее изобретение относится к применению соединения формулы (I) для приготовления лекарственного средства для лечения нарушения, выбранного из аутоиммунных, воспалительных нарушений, сердечно-сосудистых заболеваний, нейродегенеративных нарушений, бактериальных и вирусных инфекций, аллергии, бронхиальной астмы, панкреатита, полиорганной недостаточности, заболеваний почек, агрегации тромбоцитов, рака, нарушений при трансплантации, подвижности-4 015937 сперматозоидов, дефицита эритроцитов, отторжения трансплантата, повреждений легких, респираторных заболеваний и ишемических состояний и других заболеваний и нарушений, ассоциированных с фосфоинозитид-3-киназами (PI3K), включая PI3K,или . В четвертом аспекте настоящее изобретение относится к фармацевтической композиции, содержащей по меньшей мере одно соединение формулы (I) и фармацевтически приемлемый носитель, разбавитель или эксципиент. В пятом аспекте настоящее изобретение относится к способам синтеза соединения формулы (I). В шестом аспекте настоящее изобретение относится к соединениям формулы (II). В седьмом аспекте настоящее изобретение относится к соединениям формулы (XI). В последующих параграфах представлены определения различных химических фрагментов, которые составляют соединения в соответствии с настоящим изобретением и предназначены для единообразного применения по всему описанию изобретения и формуле изобретения, если иное специально не установлено определением, обеспечивающим более широкое толкование. Термин "C1-C6-алкил" относится к одновалентным алкильным группам, содержащим 1-6 атомов углерода. Данный термин представлен такими примерами групп, как метил, этил, н-пропил, изопропил,н-бутил, изобутил, трет-бутил, н-гексил и т.п. По аналогии, термин "C1-C12-алкил" относится к одновалентным алкильным группам, содержащим 1-12 атомов углерода, включая "C1-C6-алкильные" группы и гептильную, октильную, нонильную, деканоильную, ундеканоильную и додеканоильную группы, и термин "C1-C10-алкил" относится к одновалентным алкильным группам, содержащим 1-10 атомов углерода,термин "C1-C8-алкил" относится к одновалентным алкильным группам, содержащим 1-8 атомов углерода, и термин "C1-C5-алкил" относится к одновалентным алкильным группам, содержащим 1-5 атомов углерода. Термин "гетероалкил" относится к C1-C12-алкилу, предпочтительно к C1-C6-алкилу, где по меньшей мере один атом углерода заменен гетероатомом, выбранным из О, N или S, включая 2-метоксиэтил. Термин "арил" относится к содержащей от 6 до 14 атомов углерода ненасыщенной ароматической карбоциклической группе, содержащей одно кольцо (например, фенил) или несколько конденсированных колец (например, нафтил). Арил включает фенил, нафтил, фенантренил и т.п. Термин "C1-C6-алкиларил" относится к арильным группам, содержащим C1-C6-алкильный заместитель, включая метилфенил, этилфенил и т.п. Термин "арил-C1-C6-алкил" относится к C1-C6-алкильным группам, содержащим арильный заместитель, включая 3-фенилпропаноил, бензил и т.п. Термин "гетероарил" относится к моноциклической гетероароматической или бициклической или трициклической конденсированной гетероароматической группе. Частные примеры гетероароматических групп включают необязательно замещенный пиридил, пирролил, пиримидил, фурил, тиенил, имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил, 1,2,3-триазолил, 1,2,4-триазолил,1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, 1,3,4-триазинил, 1,2,3 триазинил, бензофурил, [2,3-дигидро]бензофурил, изобензофурил, бензотиенил, бензотриазолил, изобензотиенил, индолил, изоиндолил, 3 Н-индолил, бензимидазолил, имидазо[1,2-а]пиридил, бензотиазолил,бензоксазолил, хинолизинил, хиназолинил, фталазинил, хиноксалинил, циннолинил, нафтиридинил, пиридо[3,4-b]пиридил, пиридо[3,2-b]пиридил, пиридо[4,3-b]пиридил, хинолинил, изохинолинил, тетразолил, 5,6,7,8-тетрагидрохинолинил, 5,6,7,8-тетрагидроизохинолинил, пуринил, птеридинил, карбазолил,ксантенил или бензохинолинил. Термин "C1-C6-алкилгетероарил" относится к гетероарильным группам, содержащимC1-C6-алкильный заместитель, включая метилфурил и т.п. Термин "гетероарил-C1-C6-алкил" относится к C1-C6-алкильным группам, содержащим гетероарильный заместитель, включая фурилметил и т.п. Термин "C2-C6-алкенил" относится к алкенильным группам, предпочтительно содержащим от 2 до 6 атомов углерода и содержащим по меньшей мере 1 или 2 двойные связи. Предпочтительные алкенильные группы включают этенил (-СН=СН 2), н-2-пропенил (аллил, -СН 2 СН=СН 2) и т.п. Термин "C2-C6-алкениларил" относится к арильным группам, содержащим C2-C6-алкенильный заместитель, включая винилфенил и т.п. Термин "арил-C2-C6-алкенил" относится к C2-C6-алкенильным группам, содержащим арильный заместитель, включая фенилвинил и т.п. Термин "C2-C6-алкенилгетероарил" относится к гетероарильным группам, содержащимC2-C6-алкенильный заместитель, включая винилпиридинил и т.п. Термин "гетероарил-C2-C6-алкенил" относится к C2-C6-алкенильным группам, содержащим гетероарильный заместитель, включая пиридинилвинил и т.п. Термин "C2-C6-алкинил" относится к алкинильным группам, предпочтительно содержащим от 2 до 6 атомов углерода и содержащим по меньшей мере 1-2 тройные связи; предпочтительные алкинильные группы включают этинил (-ССН), пропаргил (-СН 2 ССН) и т.п.-5 015937 Термин "C3-C8-циклоалкил" относится к содержащей от 3 до 8 атомов углерода насыщенной карбоциклической группе, содержащей одно кольцо (например, циклогексил) или несколько конденсированных колец (например, норборнил). C3-C8-Циклоалкил включает циклопентил, циклогексил, норборнил и т.п. Термин "гетероциклоалкил" относится к C3-C8-циклоалкильной группе в соответствии с представленным выше определением, в которой до 3 атомов углерода заменены гетероатомами, выбранными из группы, состоящей из О, S, NR, где значение R определено как водород или метил. Гетероциклоалкил включает пирролидин, пиперидин, пиперазин, морфолин, тетрагидрофуран и т.п. Термин "C1-C6-алкилциклоалкил" относится к C3-C8-циклоалкильным группам, содержащим"гетероарил-C1-C6-алкил", "арил-C2-C6-алкенил", "гетероарил-C2-C6-алкенил", "арил-C2-C6-алкинил", "гетероарил-C2-C6-алкинил", "циклоалкил-C1-C6-алкил", "гетероциклоалкил-C1-C6-алкил". Термин "ацилокси-C1-C6-алкил" относится к C1-C6-алкильным группам, содержащим ацилоксизаместитель, включая этиловый эфир пропионовой кислоты и т.п. Термин "алкокси" относится к группе -O-R, где R включает "C1-C6-алкил", или "арил", или "гетероарил", или "арил-C1-C6-алкил", или "гетероарил-C1-C6-алкил". Предпочтительные алкоксигруппы включают, например, метокси, этокси, фенокси и т.п. Термин "алкокси-C1-C6-алкил" относится к алкоксигруппам, содержащим C1-C6-алкильный заместитель, включая метокси, метоксиэтил и т.п. Термин "алкоксикарбонил" относится к группе -С(О)OR, где R включает Н, "C1-C6-алкил", или"арил", или "гетероарил", или "арил-C1-C6-алкил", или "гетероарил-C1-C6-алкил", или "гетероалкил". Термин "алкоксикарбонил-C1-C6-алкил" относится к C1-C5-алкильным группам, содержащим алкоксикарбонильный заместитель, включая 2-(бензилоксикарбонил)этил и т.п. Термин "аминокарбонил" относится к группе -C(O)NRR', где каждый R, R' независимо включает водород, или C1-C6-алкил, или арил, или гетероарил, или "арил-C1-C6-алкил", или "гетероарил-C1-C6 алкил", включая N-фенилформамид. Термин "аминокарбонил-C1-C6-алкил" относится к C1-C6-алкильным группам, содержащим аминокарбонильный заместитель,включая 2-(диметиламинокарбонил)этил,N-этилацетамид,N,N-диэтилацетамид и т.п. Термин "ациламино" относится к группе -NRC(O)R', где каждый R, R' независимо представляет собой водород, "C1-C6-алкил", "C2-C6-алкенил", "C2-C6-алкинил", "C3-C8-циклоалкил", "гетероциклоалкил","арил", "гетероарил", "арил-C1-C6-алкил" или "гетероарил-C1-C6-алкил", "арил-C2-C6-алкенил","гетероарил-C2-C6-алкенил", "арил-C2-C6-алкинил", "гетероарил-C2-C6-алкинил", "циклоалкил-C1-C6 алкил", "гетероциклоалкил-C1-C6-алкил". Термин "ациламино-C1-C6-алкил" относится к C1-C6-алкильным группам, содержащим ациламинозаместитель, включая 2-(пропиониламино)этил и т.п. Термин "уреидо" относится к группе -NRC(О)NR'R, где каждый R, R', R независимо представляет собой водород, "C1-C6-алкил", "C2-C6-алкенил", "C2-C6-алкинил", "C3-C8-циклоалкил", "гетероциклоалкил", "арил", "гетероарил", "арил-C1-C6-алкил" или "гетероарил-C1-C6-алкил", "арил-C2-C6-алкенил", "гетероарил-C2-C6-алкенил", "арил-C2-C6-алкинил", "гетероарил-C2-C6-алкинил", "циклоалкил-C1-C6-алкил","гетероциклоалкил-C1-C6-алкил" и где R' и R могут необязательно образовывать вместе с атомом азота,к которому они присоединены, 3-8-членное гетероциклоалкильное кольцо. Термин "уреидо-C1-C6-алкил" относится к C1-C6-алкильным группам, содержащим уреидозаместитель, включая 2-(N'-метилуреидо)этил и т.п.-6 015937 Термин "карбамат" относится к группе -NRC(О)OR', где каждый R, R' независимо представляет собой водород, "C1-C6-алкил", "C2-C6-алкенил", "C2-C6-алкинил", "C3-C8-циклоалкил", "гетероциклоалкил","арил", "гетероарил", "C1-C6-алкиларил" или "гетероарил-C1-C6-алкил", "арил-C2-C6-алкенил","гетероарил-C2-C6-алкенил", "арил-C2-C6-алкинил", "гетероарил-C2-C6-алкинил", "циклоалкил-C1-C6 алкил", "гетероциклоалкил-C1-C6-алкил". Термин "амино" относится к группе -NRR', где каждый R, R' независимо представляет собой водород, или "C1-C6-алкил", или "арил", или "гетероарил", или "C1-C6-алкиларил", или "C1-C6 алкилгетероарил", или "циклоалкил", или "гетероциклоалкил" и где R и R' могут необязательно образовывать вместе с атомом азота, к которому они присоединены, 3-8-членное гетероциклоалкильное кольцо. Термин "амино-C1-C6-алкил" относится к C1-C5-алкильным группам, содержащим аминозаместитель, включая 2-(1-пирролидинил)этил и т.п. Термин "аммоний" относится к положительно заряженной группе -N+RR'R, где каждый R, R', R независимо представляет собой "C1-C6-алкил", или "C1-C6-алкиларил", или "C1-C6-алкилгетероарил", или"циклоалкил", или "гетероциклоалкил" и где R и R' могут необязательно образовывать вместе с атомом азота, к которому они присоединены, 3-8-членное гетероциклоалкильное кольцо. Термин "аммоний-C1-C6-алкил" относится к C1-C6-алкильным группам, содержащим аммониевый заместитель, включая 1-этилпирролидиний и т.п. Термин "галоген" относится к атомам фтора, хлора, брома и йода. Термин "сульфонилокси" относится к группе -OSO2-R, где R выбирают из Н, "C1-C6-алкила", замещенного галогенами "C1-C6-алкила", например группа -OSO2-CF3, "C2-C6-алкенила", "C2-C6-алкинила","C3-C8-циклоалкила", "гетероциклоалкила", "арила", "гетероарила", "арил-C1-C6-алкила" или"гетероарил-C1-C6-алкила", "арил-C2-C6-алкенила", "гетероарил-C2-C6-алкенила", "арил-C2-C6-алкинила","гетероарил-C2-C6-алкинила", "циклоалкил-C1-C6-алкила", "гетероциклоалкил-C1-C6-алкила". Термин "сульфинил-C1-C6-алкил" относится к C1-C6-алкильным группам, содержащим сульфинильный заместитель, включая 2-(метилсульфинил)этил и т.п. Термин "сульфанил" относится к группам -S-R, где R включает Н, "C1-C6-алкил", замещенный галогенами "C1-C6-алкил", например группа -SO-CF3, "C2-C6-алкенил", "C2-C6-алкинил", "C3-C8-циклоалкил","гетероциклоалкил", "арил", "гетероарил", "арил-C1-C6-алкил" или "гетероарил-C1-C6-алкил", "арил-C2C6-алкенил", "гетероарил-C2-C6-алкенил", "арил-C2-C6-алкинил", "гетероарил-C2-C6-алкинил", "циклоалкил-C1-C6-алкил", "гетероциклоалкил-C1-C6-алкил". Предпочтительные сульфанильные группы включают метилсульфанил, этилсульфанил и т.п. Термин "сульфанил-C1-C6-алкил" относится к C1-C6-алкильным группам, содержащим сульфанильный заместитель, включая 2-(этилсульфанил)этил и т.п. Термин "сульфониламино" относится к группе -NRSO2-R', где каждый R, R' независимо включает водород, "C1-C6-алкил", "C2-C6-алкенил", "C2-C6-алкинил", "C3-C8-циклоалкил", "гетероциклоалкил","арил", "гетероарил", "арил-C1-C6-алкил" или "гетероарил-C1-C6-алкил", "арил-C2-C6-алкенил","гетероарил-C2-C6-алкенил", "арил-C2-C6-алкинил", "гетероарил-C2-C6-алкинил", "циклоалкил-C1-C6 алкил", "гетероциклоалкил-C1-C6-алкил". Термин "сульфониламино-C1-C6-алкил" относится к C1-C6-алкильным группам, содержащим сульфониламинозаместитель, включая 2-(этилсульфониламино)этил и т.п. Термин "аминосульфонил" относится к группе -SO2-NRR', где каждый R, R' независимо включает водород, "C1-C6-алкил", "C2-C6-алкенил", "C2-C6-алкинил", "C3-C8-циклоалкил", "гетероциклоалкил","арил", "гетероарил", "арил-C1-C6-алкил" или "гетероарил-C1-C6-алкил", "арил-C2-C6-алкенил","гетероарил-C2-C6-алкенил", "арил-C2-C6-алкинил", "гетероарил-C2-C6-алкинил", "циклоалкил-C1-C6 алкил", "гетероциклоалкил-C1-C6-алкил". Термин "аминосульфонил-C1-C6-алкил" относится к C1-C6-алкильным группам, содержащим аминосульфонильный заместитель, включая 2-(циклогексиламиносульфонил)этил и т.п.-7 015937 Термин "замещенный или незамещенный", если иное не ограничено определением отдельного заместителя, то представленные выше группы, такие как "алкенил", "алкинил", "арил", "гетероарил","циклоалкил", "гетероциклоалкил" и т.д., могут быть необязательно замещены 1-5 заместителями,выбранными из группы, состоящей из "C1-C6-алкила", "C2-C6-алкенила", "C2-C6-алкинила", "циклоалкила", "гетероциклоалкила", "C1-C6-алкиларила", "C1-C6-алкилгетероарила", "C1-C6-алкилциклоалкила","C1-C6-алкилгетероциклоалкила", "амино", "аммония", "ацила", "ацилокси", "ациламино", "аминокарбонила", "алкоксикарбонила", "уреидо", "арила", "карбамата", "гетероарила", "сульфинила", "сульфонила","алкокси", "сульфанила", "галогена", "карбокси", тригалогенметила, циано, гидрокси, меркапто, нитро и т.п. Термин "замещенный" относится к группам, замещенным 1-5 заместителями, выбранными из группы, состоящей из "C1-C6-алкила", "C2-C6-алкенила", "C2-C6-алкинила", "циклоалкила","гетероциклоалкила", "C1-C6-алкиларила", "C1-C6-алкилгетероарила", "C1-C6-алкилциклоалкила","C1-C6-алкилгетероциклоалкила", "амино", "аминосульфонила", "аммония", "ациламино", "аминокарбонила", "арила", "гетероарила", "сульфинила", "сульфонила", "алкокси", "алкоксикарбонила", "карбамата","сульфанила", "галогена", тригалогенметила, циано, гидрокси, меркапто, нитро и т.п. Термин "фармацевтически приемлемые соли или комплексы" относится к солям или комплексам определенных ниже соединений формулы (I), которые сохраняют желаемую биологическую активность. Примеры таких солей включают, но без ограничения, аддитивные соли кислоты, образованные с неорганическими кислотами (например, с хлористо-водородной кислотой, бромисто-водородной кислотой, серной кислотой, фосфорной кислотой, азотной кислотой и т.п.), и соли, образованные с органическими кислотами, такими как уксусная кислота, щавелевая кислота, винная кислота, янтарная кислота, яблочная кислота, фумаровая кислота, малеиновая кислота, аскорбиновая кислота, бензойная кислота, дубильная кислота, памовая кислота, альгиновая кислота, полиглутаминовая кислота, нафталинсульфоновая кислота, нафталиндисульфоновая кислота и полигалактуроновая кислота. Указанные соединения также могут быть введены в виде известных специалисту в данной области фармацевтически приемлемых четвертичных солей, которые, в частности, включают четвертичную аммониевую соль формулы -NRR'R+Z-,где R, R', R независимо представляют собой водород, алкил или бензил, C1-C6-алкил, C2-C6-алкенил,C2-C6-алкинил, C1-C6-алкиларил, C1-C6-алкилгетероарил, циклоалкил, гетероциклоалкил и Z представляет собой противоион, включая хлорид, бромид, йодид, -О-алкил, толуолсульфонат, метилсульфонат,сульфонат, фосфат или карбоксилат (такой как бензоат, сукцинат, ацетат, гликолят, малеат, малат, фумарат, цитрат, тартрат, аскорбат, циннамат, манделат и дифенилацетат). В настоящее изобретение также включены соли, образованные путем взаимодействия соединений формулы (I) с органическими и неорганическими основаниями, такими как гидроксид, карбонат или бикарбонат катиона металла, такого как выбранный из группы, состоящей из щелочных металлов (натрия,калия или лития), щелочно-земельных металлов (например, кальция или магния), или с органическим первичным, вторичным или третичным алкиламином. Предполагается, что соли производные амина, полученные из метиламина, диметиламина, триметиламина, этиламина, диэтиламина, триэтиламина, морфолина, аммония, N-метил-D-глюкамина, N,N'-бис-(фенилметил)-1,2-этандиамина, трометамина,этаноламина, диэтаноламина, этилендиамина, N-метилморфолина, прокаина, пиперидина, пиперазина и т.п., входят в объем настоящего изобретения. Термин "фармацевтически активное производное" относится к любому соединению, которое при введении реципиенту способно обеспечивать, прямо или опосредованно, раскрытую в данном описании активность. Термин "опосредованно" также охватывает пролекарства, которые могут быть преобразованы в активную форму лекарства посредством модификации эндогенными ферментами или в процессе метаболизма. Было обнаружено, что соединения по настоящему изобретению являются модуляторами фосфоинозитид-3-киназ (PI3K), включая PI3K ,или . Если фермент фосфоинозитид-3-киназа (PI3K) ингибируется соединениями по настоящему изобретению, то PI3K не способен осуществлять свое ферментативное, биологическое и/или фармакологическое действие. Поэтому соединения по настоящему изобретению полезны для лечения и профилактики аутоиммунных нарушений и/или воспалительных заболеваний, сердечно-сосудистых заболеваний, нейродегенеративных нарушений, бактериальных и вирусных инфекций, аллергии, бронхиальной астмы, панкреатита, полиорганной недостаточности, заболеваний почек, агрегации тромбоцитов, рака, нарушений при трансплантации, подвижности сперматозоидов, дефицита эритроцитов, отторжения трансплантата или повреждений легких. Общая формула (I) соединения в соответствии с настоящим изобретением также включает его таутомеры, его геометрические изомеры, его оптически активные формы, такие как энантиомеры, диастереоизомеры, и его рацематные формы, а также его фармацевтически приемлемые соли. Предпочтительные фармацевтически приемлемые соли соединения формулы (I) представляют собой аддитивные соли основания, образованные путем взаимодействия соединений формулы (I) с фармацевтически приемлемыми основаниями, такими как гидроксиды натрия, калия или кальция, аммоний или N-метил-Dглюкамин.-8 015937 Соединения формулы (I) полезны для модулирования, в частности, ингибирования активности фосфоинозитид-3-киназ (PI3K). Поэтому считается, что соединения по настоящему изобретению также особенно полезны для лечения и/или профилактики нарушений, которые опосредуются PI3K, в частности PI3K, и/или PI3K, и/или PI3K. Указанное лечение включает модулирование, в частности, ингибирование или снижение активности фосфоинозитид-3-киназ. Соединения формулы (I) полезны для применения в качестве лекарственного средства. В одном варианте осуществления настоящее изобретение относится к применению производных пиразина формулы (I) где А, В, D и Е независимо выбирают из С и N, так что кольцо R представляет собой ароматическое кольцо, включая необязательно замещенный фенил и необязательно замещенный пиридинил;R4 выбирают из необязательно замещенного C1-C6-алкила, включая метил, этил, бутил, пропил, карбокси-C1-C6-алкил (например, бутановая кислота), алкоксикарбонил-C1-C6-алкил (например, метил-4 бутаноат); необязательно замещенного C2-C6-алкенила; необязательно замещенного C2-C6-алкинила; необязательно замещенного арила, включая необязательно замещенный фенил, такой как цианофенил (например, 4-цианофенил, 2-цианофенил, 3-цианофенил), фенил, галогенфенил, такой как фторфенил (например, 3-фторфенил, 4-фторфенил, 2-фторфенил), хлорфенил (например, 2-хлорфенил, 3-хлорфенил,4-хлорфенил), йодфенил (например, 4-йодфенил) и бромфенил (например, 4-бромфенил), сульфонилфенил (например, 4-метилсульфонилфенил, 3-метилсульфонилфенил), необязательно замещенныйC1-C6-алкилфенил (например, 4-метилфенил, 3-метилфенил, 4-трифторметилфенил), карбоксифенил (например, 3-бензойная кислота, 4-бензойная кислота, (3-пропановая кислота)фенил), необязательно замещенный ациламинофенил (3-метилацетамидфенил), необязательно замещенный алкоксифенил (например, 4-метоксифенил, 3-метоксифенил), необязательно замещенный ацилфенил (например,4-ацетилфенил), алкоксикарбонил-C1-C6-алкилфенил (например, (метил-3-пропаноат)фенил, метил-4 бензоат, метил-3-бензоат; необязательно замещенного гетероарила, включая необязательно замещенный имидазолил (например, 1-метилимидазолил, 1,2-диметилимидазол-5-ил), необязательно замещенный тиофенил, такой как галогентиофенил (например, 5-бромтиофенил, 4,5-дихлортиофенил), тиофен-3-ил,карбокситиофенил (например, тиофен-2-карбоновая кислота), алкоксикарбонил-C1-C6-алкилтиофенил(например, метил-3-тиофен-2-карбоксилат) и алкоксикарбонилтиофенил (например, метил-3-тиофен-2 ил), необязательно замещенный пиридинил (например, 6-морфолин-4-илпиридин-3-ил), необязательно замещенный пиразолил, такой как галогенпиразолил (например, 5-хлор-1,3-диметилпиразол-4-ил), необязательно конденсированное гетероарильное кольцо, такое как необязательно замещенный дигидробензодиоксинил (например, 2,3-дигидро-1,4-бензодиоксинил), необязательно замещенный оксодигидробензотиазолил (например, 3-метил-2-оксо-2,3-дигидро-1,3-бензотиазолил), необязательно замещенный дигидробензотиадиазолил (например, 2,1,3-бензотиадиазолил), необязательно замещенный бензоксадиазолил (например, 2,1,3-бензоксадиазол-4-ил); необязательно замещенного C3-C6-циклоалкила; необязательно замещенного гетероциклоалкила, включая необязательно замещенный пирролидинил; необязательно замещенного арил-C1-C6-алкила; необязательно замещенного гетероарил-C1-C6-алкила, включая необязательно замещенный C1-C6-алкилпиридинил, такой как пиридинилметил (например, пиридинил-3 метил, пиридинил-2-метил); необязательно замещенного C3-C8-циклоалкил-C1-C6-алкила; необязательно замещенного гетероциклоалкил-C1-C6-алкила; необязательно замещенного арил-C2-C6-алкенила, включая фенилэтиленил; необязательно замещенного гетероарил-C2-C6-алкенила;n равно целому числу, выбранному из 0, 1, 2, 3 и 4; а также к их геометрическим изомерам, их оптически активным формам, таким как энантиомеры,диастереоизомеры, таутомеры и их рацематные формы, а также к их фармацевтически приемлемым солям для применения в качестве лекарственного средства.-9 015937 В другом варианте осуществления настоящее изобретение относится к производным пиразина формулы (I) где А, В, D и Е независимо выбирают из С и N, так что кольцо R представляет собой стабильное ароматическое кольцо, включая необязательно замещенный фенил и необязательно замещенный пиридинил;R4 выбирают из необязательно замещенного C1-C6-алкила, включая метил, этил, бутил, пропил, карбокси-C1-C6-алкил (например, бутановая кислота), алкоксикарбонил-C1-C6-алкил (например, метил-4 бутаноат); необязательно замещенного C2-C6-алкенила; необязательно замещенного C2-C6-алкинила; необязательно замещенного арила, включая необязательно замещенный фенил, такой как цианофенил (например, 4-цианофенил, 2-цианофенил, 3-цианофенил), фенил, галогенфенил, такой как фторфенил (например, 3-фторфенил, 4-фторфенил, 2-фторфенил), хлорфенил (например, 2-хлорфенил, 3-хлорфенил,4-хлорфенил), йодфенил (например, 4-йодфенил) и бромфенил (например, 4-бромфенил), сульфонилфенил (например, 4-метилсульфонилфенил, 3-метилсульфонилфенил), необязательно замещенныйC1-C6-алкилфенил (например, 4-метилфенил, 3-метилфенил, 4-трифторметилфенил), карбоксифенил (например, 3-бензойная кислота, 4-бензойная кислота, (3-пропановая кислота)фенил), необязательно замещенный ациламинофенил (3-метилацетамидфенил), необязательно замещенный алкоксифенил (например, 4-метоксифенил, 3-метоксифенил), необязательно замещенный ацилфенил (например,4-ацетилфенил), алкоксикарбонил-C1-C6-алкилфенил (например, (метил-3-пропаноат)фенил, метил-4 бензоат, метил-3-бензоат); необязательно замещенного гетероарила, включая необязательно замещенный имидазолил (например, 1-метилимидазолил, 1,2-диметилимидазол-5-ил), необязательно замещенный тиофенил, такой как галогентиофенил (например, 5-бромтиофенил, 4,5-дихлортиофенил), тиофен-3-ил,карбокситиофенил (например, тиофен-2-карбоновая кислота), алкоксикарбонил-C1-C6-алкилтиофенил(например, метил-3-тиофен-2-карбоксилат) и алкоксикарбонилтиофенил (например, метил-3-тиофен-2 ил), необязательно замещенный пиридинил (например, 6-морфолин-4-илпиридин-3-ил), необязательно замещенный пиразолил, такой как галогенпиразолил (например, 5-хлор-1,3-диметилпиразол-4-ил), необязательно конденсированное гетероарильное кольцо, такое как необязательно замещенный дигидробензодиоксинил (например, 2,3-дигидро-1,4-бензодиоксинил), необязательно замещенный дигидробензотиазолил (например, 3-метил-2,3-дигидро-1,3-бензотиазолил), необязательно замещенный дигидробензотиадиазолил (например, 2,1,3-бензотиадиазолил), необязательно замещенный бензоксадиазолил (например, 2,1,3-бензоксадиазол-4-ил); необязательно замещенного C3-C8-циклоалкила; необязательно замещенного гетероциклоалкила, включая необязательно замещенный пирролидинил; необязательно замещенного арил-C1-C6-алкила; необязательно замещенного гетероарил-C1-C6-алкила, включая необязательно замещенный C1-C6-алкилпиридинил, такой как пиридинилметил (например, пиридинил-3-метил, пиридинил-2-метил); необязательно замещенного C3-C8-циклоалкил-C1-C6-алкила; необязательно замещенного гетероциклоалкил-C1-C6-алкила; необязательно замещенного арил-C2-C6-алкенила, включая фенилэтиленил; необязательно замещенного гетероарил-C2-C6-алкенила;n равно целому числу, выбранному из 0, 1, 2, 3 и 4; при первом условии, что если R4 представляет собой тиофенил, то он не является группой,выбранной из незамещенного тиофенила, незамещенного хлор-5-тиофенила или незамещенного бром-5 тиофенила; при втором условии, что если R4 представляет собой фенил, то он представляет собой монозамещенный фенил, который не выбирают из группы, состоящей из пара-бромфенила, пара-метоксифенила,пара-этоксифенила, орто-, мета- или пара-хлорфенила; мета- или пара-метилфенила; орто- или парафторфенила; орто-CF3-фенила; пара- или мета-нитрофенила; пара-NHAc-фенила и пара-аминофенила; или он представляет собой полизамещенный фенил, который не является дизамещенным фенилом, вы- 10015937 бранным из группы, состоящей из мета,пара-диметилфенила; мета,мета-диметилфенила; орто,парадиметилфенила; орто,мета-диметилфенила; орто-метил-пара-фторфенила; мета,мета-дихлорфенила; орто,мета-дихлорфенила; пара-хлор-мета-нитрофенила; орто-этокси-мета-бромфенила; при последнем условии, что если R4 представляет собой 1,4-бензодиоксин, то он представляет собой замещенный бензодиокси; а также к их геометрическим изомерам, их оптически активным формам, таким как энантиомеры,диастереоизомеры, таутомеры и их рацематные формы, а также к их фармацевтически приемлемым солям. В конкретном варианте осуществления настоящее изобретение относится к производным пиразина формулы (I), где R1 выбирают из Н и галогена, включая хлор. В другом конкретном варианте осуществления настоящее изобретение относится к производным пиразина формулы (I), где R2 представляет собой метил. В другом конкретном варианте осуществления настоящее изобретение относится к производным пиразина формулы (I), где R3 выбирают из Н и необязательно замещенной алкокси, включая метокси. В другом конкретном варианте осуществления настоящее изобретение относится к производным пиразина формулы (I), где R3 выбирают из галогена, включая хлор, необязательно замещенного арила и необязательно замещенного гетероарила, включая пирролил. В другом конкретном варианте осуществления настоящее изобретение относится к производным пиразина формулы (I), где R4 выбирают из необязательно замещенного C1-C6-алкила, необязательно замещенного C2-C6-алкенила, необязательно замещенного C2-C6-алкинила, необязательно замещенного арил-C1-C6-алкила и необязательно замещенного гетероарил-C1-C6-алкила. В другом конкретном варианте осуществления настоящее изобретение относится к производным пиразина формулы (I), где R4 выбирают из необязательно замещенного арила и необязательно замещенного гетероарила. В другом конкретном варианте осуществления настоящее изобретение относится к производным пиразина формулы (I), где А, В, D и Е представляют собой С. В другом дополнительном варианте осуществления настоящее изобретение относится к производным пиразина формулы (I), где А представляет собой N; В, D и Е представляют собой С. В другом дополнительном варианте осуществления настоящее изобретение относится к производным пиразина формулы (I), где А, В и Е представляют собой С; D представляет собой N. В другом конкретном варианте осуществления настоящее изобретение относится к производным пиразина формулы (I), где R1 выбирают из Н и галогена; R2 представляет собой метил; R3 выбирают из Н и необязательно замещенной алкокси; значения R, n, R4, А, В, D и Е определены выше. В другом конкретном варианте осуществления настоящее изобретение относится к производным пиразина формулы (I), где R1 выбирают из Н и галогена; R2 представляет собой метил; R3 выбирают из Н и необязательно замещенной алкокси; А, В, D и Е представляют собой С; значения R, n и R4 определены выше. В другом конкретном варианте осуществления настоящее изобретение относится к производным пиразина формулы (I), где R1 представляет собой Н; R2 представляет собой метил; R3 выбирают из Н и алкокси; n равно 3; А, В, D и Е независимо выбирают из С и N, так что кольцо R представляет собой необязательно замещенный пиридинил; значение R4 определено выше.- 11015937 Соединения по настоящему изобретению включают, в частности, соединения из группы, состоящей из: Соединения по настоящему изобретению полезны в качестве лекарственных средств. Они могут использоваться при приготовлении лекарственного средства для профилактики и/или лечения аутоиммунных нарушений и/или воспалительных заболеваний, сердечно-сосудистых заболеваний, нейродегенеративных нарушений, бактериальных и вирусных инфекций, заболеваний почек, агрегации тромбоцитов, рака, нарушений при трансплантации, дефицита эритроцитов, отторжения трансплантата или повреждений легких. В одном варианте осуществления настоящего изобретения соединения формулы (I) полезны для лечения и/или профилактики аутоиммунных заболеваний или воспалительных заболеваний, таких как рассеянный склероз, псориаз, ревматоидный артрит, системная красная волчанка, воспалительная болезнь кишечника, воспаление легких, тромбоз или инфекция/воспаление головного мозга, такие как менингит или энцефалит. В другом варианте осуществления настоящего изобретения соединения формулы (I) полезны для лечения и/или профилактики нейродегенеративных заболеваний, включая болезнь Альцгеймера, болезнь Гентингтона, травму ЦНС, инсульт и ишемические состояния. В еще одном варианте осуществления настоящего изобретения соединения формулы (I) полезны для лечения и/или профилактики сердечно-сосудистых заболеваний, таких как атеросклероз, гипертрофия сердца, дисфункция миоцитов сердца, повышенное кровяное давление или сужение сосудов. В еще одном варианте осуществления настоящего изобретения соединения формулы (I) полезны для лечения и/или профилактики дефицита эритроцитов, такого как анемия, включая гемолитическую анемию, апластическую анемию и истинную эритроцитарную аплазию. В еще одном варианте осуществления настоящего изобретения соединения формулы (I) полезны для лечения и/или профилактики рака, включая немелкоклеточный рак легких (NSCL), рак поджелудочной железы, рак эндометрия, рак яичников, рак мочевого пузыря, семиномы, рак щитовидной железы,рак молочной железы, мультиформную глиому, карциному молочной железы, рак желудка и лимфомы,рак легких, предстательной железы, печени, толстой кишки, молочной железы, почек, мозга, кожи,включая злокачественную меланому, яичек и яичников, или лейкозы, включая миелолейкозы и лимфолейкозы, острый миелолейкоз (AML), вызванные множественной миеломой поражения костей, метастатическую меланому и злокачественную меланому, и саркому Капоши. В еще одном варианте осуществления настоящего изобретения соединения формулы (I) полезны для лечения и/или профилактики хронического обструктивного заболевания легких, анафилактического шока, фиброза, псориаза, аллергических заболеваний, бронхиальной астмы, инсульта и ишемических состояний, ишемии/реперфузии, агрегации/активации тромбоцитов, атрофии/гипертрофии скелетных мышц, рекрутинга лейкоцитов в раковую ткань, ангиогенеза, инвазивного метастазирования, в особенности меланомы, саркомы Капоши, острой и хронической бактериальной и вирусной инфекций, сепсиса,нарушений при трансплантации, отторжения трансплантата, гломерулосклероза, гломерулонефрита, про- 18015937 грессирующего фиброза почек, повреждений эндотелия и эпителия в легких или, в целом, воспаления дыхательных путей легких. В другом варианте осуществления настоящее изобретение относится к способу получения производного пиразина формулы (I), включающему стадию взаимодействия хлорпроизводного формулы (II) с анилином формулы (III) в подходящем растворителе, таком как EtOH или МеОН, в отсутствие основания, либо с использованием обычного нагревания, либо с использованием микроволнового нагревания,как описано выше в данном описании и в примерах ниже: где значения n, А, В, D, E, R, R1, R2, R3, R4 определены выше. В другом варианте осуществления настоящее изобретение относится к способу получения производного пиразина формулы (I), включающему стадию осуществления взаимодействия аминопроизводного формулы (XI) с сульфонилхлоридом формулы (IX) в присутствии основания, такого как триэтиламин,изопропиламин, DIEA (диизопропилэтиламин), с необязательным присутствием сорастворителя, такого как 1,2-дихлорбензол. Предпочтительным основанием является пиридин где значения n, А, В, D, Е, R, R1, R2, R3, R4 определены выше. В другом варианте осуществления настоящее изобретение относится к соединению формулы (XI) где значения n, А, В, D, Е, R, R1, R4 определены выше, при условии, что соединение формулы (XI) не является ни N-(3-метоксифенил)-2,3-хиноксалиндиамином (RN 165058-49-1), ни 3-[(3-амино-2 хиноксалинил)амино]фенолом (165058-51-5). В дополнительном варианте осуществления настоящее изобретение относится к соединению формулы (XI), выбранному из группы, включающей:N-(3,5-диметоксифенил)хиноксалин-2,3-диамин. Производные пиразина формулы (I) могут быть получены из доступных исходных веществ с использованием следующих общих способов и методик. Следует учитывать, что в случае если представлены общие или предпочтительные условия проведения эксперимента (т.е. температура реакции, время,количество молей реагентов, растворители и т.д.), то также могут быть использованы другие условия проведения эксперимента, если особо не указано иное. Оптимальные условия реакции могут варьировать в зависимости от конкретно используемых реагентов или растворителей, но такие условия могут быть определены специалистом в данной области с использованием предусмотренных методик оптимизации. При использовании в качестве лекарственных средств соединения по настоящему изобретению обычно вводят в форме фармацевтической композиции. Следовательно, фармацевтические композиции,содержащие соединение формулы (I) и фармацевтически приемлемый носитель, разбавитель или эксципиент, также входят в объем настоящего изобретения. Специалисту в данной области известен целый ряд- 19015937 таких носителей, разбавителей или эксципиентов, подходящих для составления фармацевтической композиции. Соединения по настоящему изобретению, вместе с традиционно используемым адъювантом, носителем, разбавителем или эксципиентом, могут быть включены в состав фармацевтических композиций и содержащих их дозированных форм и могут применяться в такой форме в виде твердых веществ, таких как таблетки или наполненные капсулы, или жидкостей, таких как растворы, суспензии, эмульсии, эликсиры или наполненные ими капсулы, все для перорального применения, или в форме стерильных инъецируемых растворов для парентерального введения (включая подкожное введение). Такие фармацевтические композиции и содержащие их дозированные формы могут содержать ингредиенты в обычных пропорциях, с добавлением дополнительных активных соединений или компонентов или без добавления,и такие дозированные формы могут содержать любое подходящее эффективное количество активного ингредиента, соразмерное с назначенной суточной дозировкой, необходимой для применения. Фармацевтические композиции, содержащие производные пиразина по настоящему изобретению,могут быть получены путем, хорошо известным в области фармацевтики, и содержат по меньшей мере одно активное соединение. Соединения по настоящему изобретению, как правило, вводят в фармацевтически эффективном количестве. Действительно вводимое количество соединения обычно может быть определено врачом в свете соответствующих обстоятельств, включая подвергаемое лечению состояние,выбранный путь введения, конкретно вводимое соединение, возраст, массу и восприимчивость конкретного пациента, тяжесть симптомов у пациента и т.п. Фармацевтические композиции по настоящему изобретению могут вводиться целым рядом путей,включая пероральный, ректальный, трансдермальный, подкожный, внутривенный, внутримышечный и интраназальный. Композиции для перорального введения могут принимать форму нетарированных жидких растворов или суспензий или нерасфасованных порошков. Однако чаще композиции представлены в виде дозированных форм для облегчения точного дозирования. Термин "дозированные формы" относится к физически дискретным единицам, подходящим в качестве разовых дозировок для людей и других млекопитающих, причем каждый элемент содержит заранее установленное количество активного материала, рассчитанное как вызывающее желаемый терапевтический эффект, вместе с подходящим фармацевтическим эксципиентом. В случае твердых композиций обычные дозированные формы включают наполненные ампулы или шприцы с отмеренным количеством жидких композиций или пилюли, таблетки, капсулы и т.п. В таких композициях производное пиразина обычно является меньшим компонентом(приблизительно от 0,1 приблизительно до 50 мас.% или предпочтительно приблизительно от 1 приблизительно до 40 мас.%), при этом оставшаяся часть представляет собой различные растворители или носители и технологические добавки, полезные для получения желаемой дозированной формы. Жидкие формы, приемлемые для перорального введения, могут содержать подходящий водный или неводный растворитель с буферными смесями, суспендирующими или диспергирующими агентами, красителями, ароматизаторами и т.п. Твердые формы содержат, например, любое из следующих ингредиентов или соединения сходной природы: связующее вещество, такое как микрокристаллическая целлюлоза,трагакантовая камедь или желатин; эксципиент, такой как крахмал или лактоза; разрыхлитель, такой как альгиновая кислота, Primogel или кукурузный крахмал; лубрикант, такой как стеарат магния; скользящее вещество, такое как коллоидный кремнезем; подсластитель, такой как сахароза или сахарин; или ароматизатор, такой как перечная мята, метилсалицилат или апельсиновый ароматизатор. Инъецируемые композиции обычно основаны на инъецируемом стерильном солевом растворе, или на забуференном фосфатом солевом растворе, или на других известных в данной области инъецируемых носителях. Как указано выше, в таких композициях производные пиразина формулы (I) являются меньшим компонентом, содержание которых часто варьирует от 0,05 до 10 мас.%, при этом оставшаяся часть представляет собой инъецируемый носитель и т.п. Описанные выше компоненты для перорально вводимых или инъецируемых композиций представлены только в качестве примеров. Дополнительные материалы, а также методики получения и т.п. представлены в 5-й части Remington's Pharmaceutical Sciences, 20th Edition, 2000, Marck Publishing Company,Easton, Pennsylvania, включенной в данное описание посредством ссылки. Соединения по настоящему изобретению также могут быть введены в виде форм с замедленным высвобождением или в виде систем доставки лекарств с замедленным высвобождением. Описание конкретных веществ с замедленным высвобождением также могут быть найдены во включенных в данное описание материалах Remington's Pharmaceutical Sciences. Синтез соединений по настоящему изобретению. Производные пиразина формулы (I) могут быть получены из доступных исходных веществ с использованием следующих общих способов и методик. Следует учитывать, что в случае если представлены общие или предпочтительные условия проведения эксперимента (т.е. температура реакции, время,количество молей реагентов, растворители и т.д.), то могут быть использованы также другие условия проведения эксперимента, если особо не указано иное. Оптимальные условия реакции могут варьировать в зависимости от конкретно используемых реагентов или растворителей, но такие условия могут быть определены специалистом в данной области с использованием предусмотренных методик оптимизации.- 20015937 Следующие сокращения соответственно относятся к представленным ниже определениям: мин - минута; ч - час; г - грамм; ммоль - миллимоль; т.пл. - точка плавления; экв. - эквиваленты; мл - миллилитр; мкл - микролитры;Rt - время удерживания. В зависимости от природы А, В, D, Е, R, R1, R2, R3, R4, R5 и R6 для синтеза соединений формулы (I) могут быть выбраны различные стратегии синтеза. В способе синтеза, проиллюстрированном последующими схемами, значения А, В, D, Е, R, R1, R2, R3, R4 и R5 определены выше в описании изобретения. Как правило, производные хиноксалинсульфонамида и азахиноксалинсульфонамида общей формулы (I) могут быть получены несколькими способами с использованием методов жидкофазной химии. В соответствии с одним способом синтеза производные хиноксалинсульфонамида и азахиноксалинсульфонамида общей формулы (I), где значения заместителей А, В, D, Е и R, R1, R2, R3 и R4 определены выше, получают из хлорпроизводных формулы (II) и анилинов формулы (III) в соответствии с хорошо известными методами жидкофазной химии, как представлено ниже на схеме 1. В соответствии с общей методикой нуклеофильное замещение проводят в подходящем растворителе, таком как EtOH или МеОН,в отсутствие основания или в присутствии кислоты, такой как АсОН, либо с использованием обычного нагревания, либо с использованием микроволнового нагревания, как описано выше в данном описании и в примерах ниже. Анилиновые производные формулы (III) могут быть приобретены из коммерческих источников или могут быть получены из известных соединений с использованием методик, как описано выше в данном описании и ниже в примерах, или традиционно используемых методик, хорошо известных специалисту в данной области. Хлорпроизводные формулы (II), где значения заместителей А, В, D, Е и R, R1, R2, R3 и R4 определены выше, получают из дихлорпроизводных формулы (IV) и сульфонамидов формулы (V) в соответствии с хорошо известными методами жидкофазной химии, как представлено ниже на схеме 2 (Litvinenko et al.,1994, Chemistry of heterocyclic compounds, 30 (3), 340-344). В соответствии с общей методикой нуклеофильное замещение проводят в подходящем растворителе, таком как ДМФА или DMA, в присутствии основания, такого как K2CO3, Cs2CO3 или TDB pol. В зависимости от собственной реакционноспособности дихлорпроизводных формулы (IV) и сульфонамидов формулы (V) реакцию можно проводить при различных температурах в присутствии или в отсутствие NaI или CuI, либо с использованием обычного нагревания, либо с использованием микроволнового нагревания, как описано выше в данном описании и в примерах ниже. Схема 2 Дихлорпроизводные формулы (IV) могут быть приобретены из коммерческих источников или могут быть получены из соответствующих бис-(амино)производных формулы (VI) с использованием традиционных методик, известных специалисту в данной области, как представлено ниже на схеме 3. В соответствии с общей методикой первую стадию проводят в водной HCl при кипячении с обратным холодильником. На последующей стадии дион формулы (VIII) обрабатывают POCl3 в присутствии органического основания, такого как Et3N, с получением требуемых дихлорпроизводных формулы (IV), таких как описано выше и ниже в примерах. Схема 3 Сульфонамиды формулы (V) могут быть приобретены из коммерческих источников или могут быть получены из соответствующих сульфонилхлоридов формулы (IX) с использованием традиционных методик, известных специалисту в данной области, как представлено ниже на схеме 4. В соответствии с общей методикой реакцию проводят в присутствии аммиака формулы (X) в растворителе, таком какEtOH, MeOH, диоксан или вода, как описано выше в данном описании и в примерах ниже. Схема 4 В соответствии с другим способом синтеза производные хиноксалинсульфонамида и азахиноксалинсульфонамида общей формулы (I), где значения заместителей А, В, D, Е и R, R1, R2, R3 и R4 определены выше, получают из аминопроизводных формулы (XI) и сульфонилхлоридов формулы (IX) в соответствии с хорошо известными методами жидкофазной химии, как представлено ниже на схеме 5. В соответствии с общей методикой сульфонилирование проводят в присутствии пиридина и в присутствии или в отсутствие сорастворителя, такого как 1,2-дихлорбензол. В зависимости от собственной реакционноспособности сульфонилхлоридов формулы (IX) реакцию можно проводить при различных температурах, либо с использованием обычного нагревания, либо с использованием микроволнового нагревания,- 22015937 как описано выше в данном описании и в примерах ниже. Схема 5 Аминопроизводные формулы (XI) получают из 2-амино-3-хлорпроизводных формулы (XII) и анилинов формулы (III) в соответствии с хорошо известными методами жидкофазной химии, как представлено ниже на схеме 6. В соответствии с общей методикой нуклеофильное замещение проводят в отсутствие основания с использованием подходящего растворителя, такого как NMP, ДМФА или DMA, как описано выше в данном описании и в примерах ниже. Схема 6 2-Амино-3-хлорпроизводные формулы (XII) получают из дихлорпроизводных формулы (IV) в соответствии с хорошо известными методами жидкофазной химии, как представлено ниже на схеме 7. В соответствии с общей методикой реакцию проводят с использованием (NH4)2CO3 (XIII) или водного раствора аммиака в подходящем растворителе, таком как ДМФА, DMA или диоксан, как описано выше в данном описании и в примерах ниже. Схема 7 Если представленные выше общие способы синтеза не приемлемы для получения соединений формулы (I), то следует использовать подходящие способы получения, известные специалисту в данной области. Фармацевтически приемлемые катионные соли соединений по настоящему изобретению легко получают путем взаимодействия кислотных форм с подходящим основанием, обычно одним эквивалентом,в сорастворителе. Примеры основания представляют собой гидроксид натрия, метоксид натрия, этоксид натрия, гидрид натрия, гидроксид калия, метоксид калия, гидроксид магния, гидроксид кальция, бензатин, холин, диэтаноламин, этилендиамин, меглумин, бенетамин, диэтиламин, пиперазин и трометамин. Соль выделяют путем концентрирования досуха или путем добавления осадителя. В некоторых случаях соли могут быть получены путем смешивания раствора кислоты с раствором катиона (этилгексаноат натрия, олеат магния) с использованием растворителя, в котором желаемая катионная соль выпадает в осадок, или может быть выделена иначе путем концентрирования и добавления осадителя. В соответствии с дополнительным общим способом синтеза соединения формулы (I) могут быть преобразованы в альтернативные соединения формулы (I) с использованием подходящих методик взаимного преобразования, хорошо известных специалисту в данной области. Если представленные выше общие способы синтеза не приемлемы для получения соединений формулы (I) и/или необходимых для синтеза соединений формулы (I) промежуточных продуктов, то следует использовать подходящие способы получения, известные специалисту в данной области. Как правило,пути синтеза для каждого конкретного соединения формулы (I) зависят от конкретных заместителей на каждой молекуле и от степени доступности необходимых промежуточных продуктов, причем указанные факторы очевидны специалистам в данной области. Описание всех способов введения или снятия защитных групп описано у Philip J. Kocienski, "Protecting Groups", Georg Thieme Verlag Stuttgart, New York,1994 и Theodora W. Greene and Peter G.M. Wuts "Protective Groups in Organic Synthesis", Wiley Interscience,3rd Edition, 1999. Соединения по настоящему изобретению могут быть выделены в ассоциации молекул растворителя путем кристаллизации или выпаривания подходящего растворителя. Фармацевтически приемлемые аддитивные соли кислоты соединений формулы (I), которые содержат основный центр, могут быть получены общепринятыми способами. Например, раствор свободного основания может быть обработан под- 23015937 ходящей кислотой, неразбавленной или в подходящем растворе, и полученную соль выделяют либо фильтрованием, либо выпариванием в вакууме реакционного растворителя. Фармацевтически приемлемые аддитивные соли основания могут быть получены аналогично, путем обработки раствора соединения формулы (I) подходящим основанием. Оба типа солей могут быть получены или взаимно преобразованы друг в друга с использованием методик ионообменных смол. Далее настоящее изобретение будет проиллюстрировано посредством нескольких примеров, которые не должны истолковываться как ограничивающие объем настоящего изобретения. Примеры Коммерческие исходные вещества, используемые в последующем описании экспериментов, были приобретены у Aldrich или Fluka, если особо не оговорено иное. Данные ВЭЖХ, ЯМР и МС, представленные в описанных ниже примерах, получены следующим образом: ВЭЖХ: колонка Waters Symmetry C8 504,6 мм; условия: MeCN/H2O, 5-100% (8 мин), обнаружение в режиме "max plot" при 230-400 нм; спектры ЖХ/МС: Waters ZMD (ES); 1H-ЯМР: Bruker DPX-300 МГц. Очистку препаративной ВЭЖХ проводили на системе HPLC Waters Prep LC 4000 System, оснащенной колонками XTerraPrepMS C18 10 мкм, 50300 мм. Все процедуры очистки проводили с использованием градиента ACN/H2O+0,1% ТФУК. Микроволновую химию проводили на однорежимном микроволновом реакторе Emrys Optimiser производства Personal Chemistry. Промежуточный продукт 1. 3-Хлорхиноксалин-2-амин (формула XII) 2,3-Дихлорхиноксалин (4 г, 20 ммоль, коммерчески доступный от Aldrich) растворяли в безводном ДМФА (20 мл) и обрабатывали твердым (NH4)2CO3 (9,7 г, 101 ммоль). Полученную смесь перемешивали при 60 С в течение 3 суток (степень завершения реакции 60%). Реакционную смесь разбавляли водой и экстрагировали продукт EtOAc. Органический слой сушили и удаляли растворитель при пониженном давлении. Полученный неочищенный остаток очищали колоночной хроматографией, элюируя смесью петролейный эфир/EtOAc с получением 1,9 г (53%) указанного в заголовке соединения в виде бледножелтого твердого вещества. ЖХ/МС: (ES+): 180,1. Промежуточный продукт 2. N-(3,5-Диметоксифенил)хиноксалин-2,3-диамин (формула XI) 3-Хлорхиноксалин-2-амин (1,8 г, 10 ммоль) и 3,5-диметоксианилин (4,6 г, 30 ммоль, коммерчески доступный от Aldrich) помещали в NMP (4,5 мл) и нагревали до 145 С в герметичном сосуде в течение 3 ч в атмосфере N2. После подтверждения ТСХ полного расходования исходного вещества реакционную смесь охлаждали до к.т. и обрабатывали EtOAc (4 мл). Фильтровали первую партию твердого вещества и затем вторую партию. Первую партию перекристаллизовывали из CHCl3/EtOAc и промывали вторую партию EtOAc с получением 1,8 г (60%) чистого указанного в заголовке соединения. ЖХ/МС: (ES+): 297,1, (ES-): 295,1. Промежуточный продукт 3. N-(2,5-Диметоксифенил)хиноксалин-2,3-диамин (формула XI) Следуя методике, изложенной для синтеза промежуточного продукта 2, N-(2,5 диметоксифенил)хиноксалин-2,3-диамин получали из 3-хлорхиноксалин-2-амина (1,6 г, 8,9 ммоль) и 2,5 диметоксианилина (4,1 г, 2 6,8 ммоль, коммерчески доступный от Aldrich). Указанное в заголовке соединение экстрагировали EtOAc, органический слой последовательно промывали водой (420 мл) и насыщенным раствором соли (25 мл) и затем сушили. Растворитель удаляли при пониженном давлении и очищали полученный остаток колоночной хроматографией, элюируя DCM/MeOH, с получением 1,1 г(42%) указанного в заголовке соединения в виде желтого твердого вещества. Водный NH3 (200 мл) охлаждали до -10 С и обрабатывали бензолсульфонилхлоридом (13 г,73 ммоль). Полученную смесь перемешивали при этой температуре в течение 3 ч. После подтверждения ТСХ завершения реакции реакционную смесь нагревали до к.т., полученное твердое вещество фильтровали, промывали водой и сушили в вакууме с получением указанного в заголовке соединения (11,1 г,96%). ЖХ/МС: (ES+): 158,2, (ES-): 156,2. Промежуточный продукт 5. Пропан-1-сульфонамид (формула V) К раствору метил-3-(4-хлорсульфонил)фенилпропионата (1000 мг; 3,81 ммоль; 1 экв., коммерчески доступный от Lancaster) в ТГФ (5 мл) добавляли аммиак 0,5 М в диоксане (38,1 мл, 0,5 М, 19 ммоль,5 экв.). Полученную суспензию перемешивали при к.т. в течение 1 ч. Растворитель удаляли и помещали остаток в DCM. Органическую фазу промывали насыщенным водным раствором NH4Cl, затем насыщенным раствором соли и удаляли DCM при пониженном давлении с получением, после сушки в вакууме при 40 С, 831,4 мг (90%) указанного в заголовке соединения в виде не совсем белого порошка. 1 Следуя методике В, промежуточный продукт 7 получали из м-толуолсульфонилхлорида (761 мкл,5,25 ммоль, 1 экв.) и аммиака 2 М в EtOH (13,1 мл, 2 М, 26,2 ммоль, 5 экв.) в ТГФ (5 мл) при перемешивании при к.т. в течение 2 ч с получением 898 мг (100%) указанного в заголовке соединения. 1(1000 мг, 4,57 ммоль, 1 экв.) и аммиака 0,5 М в диоксане (45,7 мл, 0,5 М, 22,9 ммоль, 5 экв.) в ТГФ (5 мл) при перемешивании при к.т. в течение 1 ч с получением 715 мг (78%) указанного в заголовке соединения. 1(1000 мг, 3,98 ммоль, 1 экв., коммерчески доступный от Lancaster) и аммиака 0,5 М в диоксане (39,7 мл,0,5 М, 19,9 ммоль, 5 экв.) в ТГФ (5 мл) при перемешивании при к.т. в течение 1 ч с получением 802 мг Следуя методике В, промежуточный продукт 10 получали из пипсилхлорида (2000 мг, 6,61 ммоль,1 экв.) и аммиака 2 М в EtOH (66,1 мл, 0,5 М, 33,1 ммоль, 5 экв.) в ТГФ (8 мл) при перемешивании при к.т. в течение 3 ч с получением 1336,3 мг (71%) указанного в заголовке соединения. 1(1000 мг, 5,6 ммоль, 1 экв., коммерчески доступный от Davos) и аммиака 0,5 М в диоксане (23,9 мл, 2 М,47,9 ммоль, 8,5 экв.) в ТГФ (5 мл) при перемешивании при к.т. в течение 1 ч с получением 636,6 мг (71%) указанного в заголовке соединения в виде желтоватого порошка. 1 Следуя методике В, промежуточный продукт 12 получали из 5-хлор-1,3-диметилпиразол-4 сульфонилхлорида (1000 мг, 4,4 ммоль, 1 экв., коммерчески доступный от Maybridge) и аммиака 0,5 М в диоксане (43,6 мл, 0,5 М, 21,8 ммоль, 5 экв.) в ТГФ (5 мл) при перемешивании при к.т. в течение 1 ч с получением 345,3 мг (38%) указанного в заголовке соединения в виде не совсем белого порошка. 1 Н ЯМР (ДМСО-d6)7,39 (с, 2 Н), 3,74 (с, 3 Н), 2,28 (с, 3 Н). ВЭЖХ (max plot) 100%; Rt 0,98 мин. Промежуточный продукт 13. 5-Бромтиофен-2-сульфонамид (формула V)(1000 мг, 3,82 ммоль, 1 экв., коммерчески доступный от Maybridge) и аммиака 0,5 М в диоксане (38,2 мл,0,5 М, 19,1 ммоль, 5 экв.) в ТГФ (5 мл) при перемешивании при к.т. в течение 1 ч с получением 904 мг Следуя методике В, промежуточный продукт 14 получали из метил-5-(хлорсульфонил)-4-метил-2 тиофенкарбоксилата (600 мг; 2,36 ммоль; 1 экв., коммерчески доступный от Acros) и аммиака 2 М в МеОН (5,89 мл; 2 М; 11,78 ммоль; 5 экв.) в ТГФ (3 мл) при перемешивании при к.т. в течение 3 ч с получением 413,7 мг (75%) указанного в заголовке соединения. 1 Следуя методике В, промежуточный продукт 15 получали из 2-тиофенсульфонилхлорида (1000 мг; 5,47 ммоль; 1 экв., коммерчески доступный от Aldrich) и аммиака 2 М в EtOH (13,7 мл; 2 М; 27,4 ммоль; 5 экв.) в ТГФ (10 мл) при перемешивании при к.т. в течение 3 ч с получением 540 мг (60%) указанного в заголовке соединения в виде серого порошка. 1 Следуя методике В,промежуточный продукт 16 получали из 2-хлор-4 фторбензолсульфонилхлорида (1000 мг; 4,37 ммоль; 1 экв., коммерчески доступный от ABCR) и аммиака 2 М в МеОН (10,91 мл; 2 М; 21,83 ммоль; 5 экв.) в ТГФ (4 мл) при перемешивании при к.т. в течение 3 ч с получением 784 мг (86%) указанного в заголовке соединения. 1 Следуя методике В, промежуточный продукт 17 получали из 5-(1,3-диоксо-1,3-дигидроизоиндол-2 илметил)тиофен-2-сульфонилхлорида (2000 мг; 5,85 ммоль; 1 экв.) и аммиака 2 М в EtOH (14,63 мл; 2 М; 29,26 ммоль; 5 экв.) в ТГФ (10 мл) при перемешивании при к.т. в течение 2 ч с получением 1428 мг (76%) указанного в заголовке соединения. 1 Н ЯМР (ДМСО-d6)7,93-7,84 (м, 4 Н), 7,37 (д, J=3,8 Гц, 1 Н), 7,30 (с, 2 Н), 7,09 (д, J=3,8 Гц, 1 Н), 4,96 Следуя методике В,промежуточный продукт 18 получали из 4-фтор-3 цианобензолсульфонилхлорида (2000 мг; 9,11 ммоль; 1 экв., коммерчески доступный от Aldrich) и аммиака 2 М в EtOH (22,77 мл; 2 М; 45,53 ммоль; 5 экв.) в ТГФ (8 мл) при перемешивании при -10 С в течение 30 мин с получением 1625,5 мг (89%) указанного в заголовке соединения в виде белого твердого вещества. 1 Следуя методике В, промежуточный продукт 19 получали из 6-метоксипиридин-3 сульфонилхлорида (1000 мг; 4,82 ммоль; 1 экв., коммерчески доступный от Anichem) и аммиака 2 М в МеОН (12,04 мл; 2 М; 24,08 ммоль; 5 экв.) в ТГФ (8 мл) при перемешивании при к.т. в течение 3 ч с получением 474,5 мг (52%) указанного в заголовке соединения. 1 Н ЯМР (ДМСО-d6)8,56 (д, J=2,6 Гц, 1 Н), 8,05 (дд, J=2,6, 8,7 Гц, 1 Н), 7,34 (с, 3 Н), 6,98 (д,J=8,7 Гц, 1 Н). ВЭЖХ (max plot) 100%; Rt 0,88 мин. ЖХ/МС: (ES+): 189,1, (ES-): 187,2. Методика С. Промежуточный продукт 20. 3-(Аминосульфонил)бензойная кислота (формула V) К ледяному раствору гидроксида аммония (25%, 250 мл) порциями добавляли 3-(хлорсульфонил)бензойную кислоту (25 г, коммерчески доступную от Aldrich) и перемешивали смесь при комнатной температуре в течение 15 ч. Растворитель удаляли в вакууме приблизительно до 50 мл и подкисляли смесь конц. HCl. Осадок отделяли фильтрованием и сушили в вакууме с получением 22 г(96%) указанного в заголовке соединения в виде белого твердого вещества. 1 Н ЯМР (ДМСО-d6)13,44 (ушир.с, 1 Н), 8,38 (с, 1 Н), 8,14 (д, J=7,5 Гц, 1 Н), 8,04 (д, J=7,9 Гц, 1 Н),7,72 (т, J=7,9 Гц, 1 Н), 7,49 (с, 2 Н). ВЭЖХ (max plot) 97%; Rt 0,68 мин. ЖХ/МС: (ES-): 199,8. Промежуточный продукт 21. 6-Хлорпиридин-3-сульфонамид (формула V) Следуя методике С, промежуточный продукт 21 получали из гидроксида аммония (150 мл, 25% м/о) и 6-хлорпиридин-3-сульфонилхлорида (19,3 г, коммерчески доступный от Aldrich) при к.т. в течение 12 ч с получением 14,5 г (83%) указанного в заголовке соединения в виде не совсем белого твердого вещества, т.пл.: 151-154 С. ВЭЖХ (max plot) 99%; Rt 4,77 мин. ЖХ/МС: (ES-): 190,7. 1 Следуя методике С, промежуточный продукт 22 получали из гидроксида аммония (25 мл, 25% м/о) и 6-метилпиридин-3-сульфонилхлорида (2,5 г) при к.т. в течение 3 ч с получением 1 г (41%) указанного в заголовке соединения в виде не совсем белого твердого вещества, т.пл.: 151-155 С. ВЭЖХ (max plot) 95%; Rt 4,05 мин. ЖХ/МС: (ES+): 172,9. 1 Н ЯМР (ДМСО-d6, 400 МГц)9,10 (1 Н, м), 8,04-8,06 (1 Н, м), 7,53 (2 Н, ушир.с), 7,45-7,47 (1 Н, м),2,54 (3 Н, с). Методика D. Промежуточный продукт 23. 6-Цианопиридин-3-сульфонилхдорид (формула IX) Тионилхлорид (34,1 мл, 0,467 моль) добавляли к воде (182 мл) при 0 С в течение 1 ч, поддерживая температуру реакции ниже 5 С. Реакционную смесь оставляли нагреваться до 18 С в течение 20 ч. К полученной смеси добавляли хлорид меди(I) (0,143 г, 0,0014 моль) и охлаждали полученный желтозеленый раствор до -5 С. Параллельно, 5-амино-2-цианопиридин (10 г, 0,084 моль) растворяли в концентрированной HCl(98 мл) и охлаждали смесь до -5 С. К полученной смеси по каплям в течение 1 ч добавляли растворNaNO2 (8,2 г, 0,118 моль) в воде (50 мл), поддерживая температуру реакции от -5 до 0 С. Затем полученную взвесь по каплям в течение 1 ч добавляли к указанной выше реакционной смеси (смесь тионилхлорид/вода), поддерживая температуру реакции от -5 до 0 С. (Замечание: деазотированную смесь следует сохранять при температуре -5 С в процессе добавления). По мере того как происходит добавление, в осадок выпадает твердое вещество. После завершения добавления реакционную смесь дополнительно перемешивали в течение 1 ч. Осадок отделяли фильтрованием, промывали холодной водой и сушили в вакууме с получением указанного в заголовке соединения в виде светло-желтого твердого вещества Следуя методике D, промежуточный продукт 24 получали из тионилхлорида (42 мл, 0,575 моль) и хлорида меди(I) (0,151 г, 0,00152 моль) в воде (250 мл) при 0 С, к которому в течение 2 ч добавляли взвесь, полученную из 5-амино-2-хлорпиридина (17,3 г, 0,134 моль) в концентрированной HCl (135 мл) иNaNO2 (10 г, 0,1449 моль) в воде (40 мл) при -5 С с получением 19,7 г (70%) указанного в заголовке соединения в виде твердого вещества, т.пл.: 48,3-49,3 С. ЖХ/МС: (ES-): 192, что соответствует сульфоновой кислоте. 1 Следуя методике D, промежуточный продукт 25 получали из тионилхлорида (46,1 мл, 0,39 моль) и хлорида меди(I) (0,118 г, 0,0012 моль) в воде (160 мл) при 0 С, к которому в течение 2 ч добавляли взвесь, полученную из 3-амино-6-пиколина (10 г, 0,094 моль) в концентрированной HCl (80 мл) и NaNO2(6,8 г, 0,0988 моль) в воде (20 мл) при -5 С с получением 2,5 г (14%) указанного в заголовке соединения в виде жидкости, которую использовали на следующей стадии без хранения. ЖХ/МС: (ES-): 172, что соответствует сульфоновой кислоте.
МПК / Метки
МПК: C07D 417/12, C07D 405/12, A61K 31/498, C07D 401/12, C07D 403/12, C07D 409/12, A61P 35/00, C07D 241/44
Метки: качестве, пиразина, применение, производные, ингибиторов
Код ссылки
<a href="https://eas.patents.su/30-15937-proizvodnye-pirazina-i-ih-primenenie-v-kachestve-ingibitorov-pi3k.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиразина и их применение в качестве ингибиторов pi3k</a>
Предыдущий патент: Плeнка, сополимер этилена и бутена и его применение для изготовления пленки
Случайный патент: Регулятор роста растений












