Замещённые арильные производные 1,4-пиразина
Формула / Реферат
1. Соединение формулы I
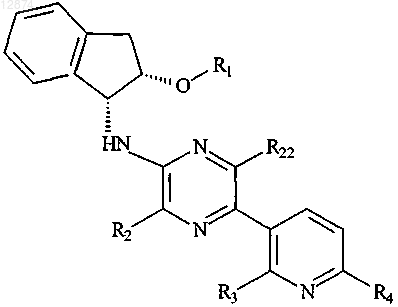
или его фармацевтически приемлемая соль,
где R1 представляет собой C1-С6алкил, С(О)С1-С6алкил;
R2 представляет собой C1-С6алкил;
R22 представляет собой C1-С6алкил;
R3 представляет собой C1-С6алкил, галоген, OC1-С6алкил;
R4 представляет собой C1-С6алкил, галоген, OC1-С6алкил, NR5R6;
R5 представляет собой C1-С6алкил и
R6 представляет собой C1-С6алкил.
2. Соединение по п.1, где R1 представляет собой этил или С(О)СН3.
3. Соединение по п.1, где R2 представляет собой этил и R22 представляет собой этил.
4. Соединение по п.1, где R3 представляет собой C1-С6алкил.
5. Соединение по п.1, где R4 представляет собой NR5R6.
6. Соединение по п.5, где R3 представляет собой C1-С6алкил.
7. Соединение по п.6, где R3 представляет собой метил и R4 представляет собой N(CH3)2.
8. Соединение, выбранное из группы, состоящей из
(1R,2S) 1-[5-(6-диметиламино-2-метилпиридин-3-ил)-3,6-диэтилпиразин-2-иламино]индан-2-илового эфира уксусной кислоты;
(1R,2S) 1-[5-(6-диметиламино-2-метилпиридин-3-ил)-3,6-диэтилпиразин-2-иламино]индан-2-иловый эфир уксусной кислоты _ толуол 4-сульфоновой кислоты и
(1R,2S) [5-(6-диметиламино-2-метилпиридин-3-ил)-3,6-диэтилпиразин-2-ил]-(2-этоксииндан-1-ил)-амина.
9. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и соединение по п.1.
10. Способ лечения расстройства, выбранного из группы, состоящей из генерализированного тревожного расстройства, социального тревожного расстройства, панического расстройства, обсессивно-компульсивного расстройства, тревоги с сопутствующим патологическим депрессивным заболеванием, аффективного расстройства, тревоги, расстройств приема пищи, биполярного расстройства и депрессии у млекопитающего, включающий введение млекопитающему соединения по п.1.
11. Способ лечения расстройства, при котором проявляется гиперсекреция кортикотропин-рилизинг фактора (CRF) у млекопитающего, включающий введение млекопитающему терапевтически эффективного количества соединения по п.1.
12. Способ отбора лигандов к рецепторам CRF1, включающий: а) проведение конкурентного анализа связывания с рецепторами CRF1 между соединением по п.1, меченым обнаруживаемой меткой, и лигандом-кандидатом; и б) определение способности указанного лиганда-кандидата замещать указанное меченое соединение.
13. Способ обнаружения рецепторов CRF в ткани, включающий: а) приведение в контакт соединения по п.1, меченого обнаруживаемой меткой, с тканью в условиях, которые позволяют соединению связываться с тканью; и б) обнаружение меченого соединения, связанного с тканью.
14. Способ ингибирования связывания CRF с рецептором CRF1, включающий приведение в контакт соединения по п.1 с раствором, содержащим клетки, экспрессирующие рецептор CRF1, где соединение присутствует в растворе в концентрации, достаточной для ингибирования связывания CRF с рецептором CRF1.
15. Способ уменьшения уровня связывания CRF in vitro с клетками, экспрессирующими рецептор CRF1, включающий приведение в контакт соединения по п.1 с раствором, содержащим указанные клетки, где соединение присутствует в растворе в концентрации, достаточной для уменьшения уровней связывания CRF с клетками in vitro.
Текст
012874 Предшествующий уровень техники Данное изобретение относится к замещенным арильным производным 1,4-пиразина и способам их получения, содержащим их фармацевтическим композициям и способам их применения для лечения расстройства или состояния, которое можно осуществлять или облегчать путем антагонистического действия в отношении рецептора кортикотропин-рилизинг фактора (CRF), включая расстройства, вызываемые или CRF, или которым способствует CRF, такие как тревожные расстройства, и депрессия и расстройства, связанные со стрессом. Дополнительно изобретение относится к применению таких соединений в качестве зондов для локализации рецепторов CRF1 в клетках или тканях. Кортикотропин-рилизинг фактор (CRF) представляет собой пептид из 41 аминокислоты, который является основным физиологическим регулятором секреции пептида-производного проопиомеланокортина (РОМС) передней долей гипофиза [J. Rivier et al., Proc. Natl. Acad. Sci (USA) 80:4851 (1983); W. Valeet al., Science 213:1394 (1981)]. Дополнительно к своей эндокринной роли в гипофизе иммуногистохимическая локализация CRF показала, что гормон обладает широким экстрагипоталамическим распределением в центральной нервной системе и вызывает широкий спектр автономных, электрофизиологических и поведенческих эффектов, согласующихся с нейротрансмиттерной или нейромодуляторной ролью в головном мозге [W. Vale et al., Rec. Prog. Horm. Res. 39:245 (1983); F. Koob, Persp. Behav. Med. 2:39(1985); E.B. De Souza et al., J. Neurosci. 5:3189 (1985)]. Также существует доказательство того, что CRF играет существенную роль в интеграции ответа в иммунной системе на физиологические, психологические и иммунологические стресс-факторы [J.E. Blalock, Physiological Reviews 69:1 (1989); J.E. Morley,Life Sci. 41:527 (1987)]. Также существует доказательство того, что CRF играет роль при психиатрических расстройствах и неврологических заболеваниях, включая депрессию, расстройства, связанные с тревогой, и расстройства приема пищи. Также предположили, что CRF играет роль в этиологии и патофизиологии болезни Альцгеймера, болезни Паркинсона, болезни Гентингтона, прогрессирующем супрануклеарном параличе и боковом амиотрофическом склерозе, поскольку они связаны с дисфункцией CRF нейронов в центральной нервной системе [обзор см. в: Е.В. De Souze, Hosp. Practice 23:59 (1988)]. Тревожные расстройства представляют собой группу заболеваний, которые включают фобические расстройства, тревожные состояния, посттравматическое стрессовое расстройство и атипичные тревожные расстройства [The Merck Manual of Diagnosis and Therapy, 16th edition (1992)]. Эмоциональный стресс часто представляет собой ускоряющий фактор при тревожных расстройствах, и такие расстройства обычно реагируют на лекарственные средства, которые снижают реакцию на стресс. При аффективном расстройстве или глубокой депрессии концентрация CRF значительно увеличивается в спинно-мозговой жидкости (СМЖ) индивидов, которым не вводили лекарство [С.В. Nemeroff etal., Science 226:1342 (1984); C.M. Banki et al., Am. J. Psychiatry 144:873 (1987); R.D. France et al., Biol. Psychiatry 28:86 (1988); M. Arato et al., Biol. Psychiatry 25:355 (1989)]. Более того, плотность рецепторов CRF значительно уменьшена в лобной доле коры головного мозга жертв суицида, согласуясь с гиперсекрецией CRF [С.В. Nemeroff et al., Arch. Gen. Psychiatry 45:577(1988)]. Кроме того, существует притуплнный адренокортикотропный (АСТН) ответ на CRF (внутривенное введение (в.в., обнаруженный у пациентов с депрессией [P.W. Gold et al., Am. J. Psychiatry 141:619 (1984); F. Holsboer et al., Psychoneuroendocrinology 9:147 (1984); P.W. Gold et al., New Engl. J.Med. 314:1129 (1986)]. Доклинические исследования на крысах и приматах кроме человека обеспечили дополнительную поддержку гипотезы о том, что гиперсекреция CRF может быть вовлечена в симптомы,обнаруженные при депрессии у людей [R.M. Sapolsky, Arch. Gen. Psychiatry 46:1047 (1989)]. Также существует предварительное доказательство того, что трициклические антидепрессанты могут изменять уровни CRF и таким образом модулировать количество рецепторов в головном мозге [Grigoriadis et al.,Neuropsychopharmacology 2:53 (1989)].CRF также вовлечен в этиологию расстройств, связанных с тревогой, и известен тем, что вызывает анксиогенные эффекты у животных. Взаимодействия между бензодиазепиновыми/небензодиазепиновыми анксиолитическими средствами и CRF были продемонстрированы на множестве моделей тревожного поведения [D.R. Britton et al., Life Sci. 31:363 (1982); C.W. Berridge and A.J. Dunn Regul. Peptides 16:83 (1986)]. Предварительные исследования с использованием предполагаемого антагониста CRF рецептора, -спирального овечьего CRF (9-41), на множестве моделей поведения демонстрируют то, что антагонист вызывает эффекты, "подобные действию анксиолитического средства", которые качественно похожи на действия бензодиазепинов [C.W. Berridge and A.J. Dunn Horm. Behav. 21:393 (1987), Brain Research Reviews 15:71 (1990)]. Нейрохимические, эндокринные исследования и исследования связывания рецептора продемонстрировали взаимодействия CRF и бензодиазепиновых анксиолитических средств, обеспечивая дополнительное доказательство того, что CRF вовлечен в эти расстройства. Клодиазепоксид усиливает "анксиогенные" эффекты CRF у крыс в конфликт-тесте [K.Т. Britton et al., Psychopharmacology 86:170 (1985);al., Psychopharmacology 88:147 (1986)]. Антагонист бензодиазепинового рецептора Ro 15-1788, который самостоятельно не оказывал действия на поведение в оперантном конфликт-тесте, обращал эффектыCRF в зависимости от дозы, в то время как бензодиазепиновый обратный агонист FG 7142 усиливал действия CRF [K.T. Britton et al., Psychopharmacology 94:396 (1988)]. Механизмы и сайты действия, через которые обычные анксиолитики и антидепрессанты оказывают свои терапевтические действия, находятся в состоянии, не требующем объяснения. Предварительные исследования, в которых испытывали эффекты пептида-антагониста рецептора CRF1 (-спирального CRF9-41) на множестве моделей поведения,продемонстрировали, что антагонист CRF1 вызывает эффекты, "подобные действию анксиолитического средства", которые качественно похожи на эффекты бензодиазепинов [обзор см. в: G.F. Koob and K.T.C.B. Nemeroff eds., CRC Press p.221 (1990)]. Применение антагонистов CRF1 для лечения Синдрома X также было описано в заявке на патент США 09/696822, поданной 26 октября 2000 года, в настоящее время изданной как патент США 6589947, и заявке на европейский патент 003094414, поданной 26 октября 2000 года, которые также включены здесь путем ссылки. Способы применения антагонистов CRF1 для лечения застойной сердечной недостаточности описаны в заявке на патент США 09/248073, поданной 10 февраля 1999 года, в настоящее время патенте США 6043260 (28 марта 2000 года), который также включен здесь путем ссылки. Известно, что CRF обладает широким экстрагипоталамическим распределением в центральной нервной системе (ЦНС), внося вклад в ней в широкий спектр автономных поведенческих и физиологических эффектов [см., например, Vale et al., 1983; Koob, 985; и Е.В. De Souze et al., 1985]. Например, концентрации CRF значительно увеличены в спинномозговой жидкости пациентов, пораженных аффективным расстройством или глубокой депрессией [см., например, Nemeroff et al., 1984; Banki et al., 1987;France et al., 1988; Arato et al., 1989]. Более того, известно, что избыточные уровни CRF вызывают анксиогенные эффекты на животных моделях [см., например, Britton et al., 1982; Berridge and Dunn, 1986and 1987], а антагонисты CRF1 вызывают анксиолитические эффекты; соответственно, терапевтически эффективные количества предложенных здесь соединений определяют, например, путем оценки анксиолитических эффектов различных количеств соединений на таких животных моделях. В следующих патентах или патентных заявках раскрыты соединения в качестве антагонистов рецепторов CRF1: WO01/60806, WO97/35901, WO98/29119, WO97/36886, WO97/36898 и патентах США 5872136, 5880140 и 5883105. Эти соединения полезны для лечения расстройств, связанных с центральной нервной системой (ЦНС), в частности аффективных расстройств и острых и хронических неврологических расстройств. Соединения в качестве антагонистов CRF также раскрыты в публикации патента США 20030144297, включенной здесь путем ссылки. Краткое изложение сущности изобретения Авторы изобретения обнаружили, что описанные ниже соединения формулы I, a также их фармацевтически приемлемые соли представляют собой антагонисты CRF1 и полезны в лечении расстройств и заболеваний, ассоциирующихся с рецепторами CRF1, включая расстройства и заболевания, связанные с ЦНС. Таким образом, в изобретении предложено соединение формулы I или его фармацевтически приемлемая соль, гдеR6 представляет собой водород, C1-С 6 алкил, C1-С 6 алкенил или C1-С 6 алкинил. В другом аспекте настоящего изобретения предложен способ лечения расстройства или заболевания, ассоциирующегося с рецепторами CRF1, или расстройства, лечение которого можно осуществлять или облегчать путем антагонистического действия в отношении CRF1 у млекопитающего, в частности-2 012874 человека, такого как генерализированное тревожное расстройство, социальное тревожное расстройство; паническое расстройство; обсессивно-компульсивное расстройство; тревога с сопутствующим патологическим депрессивным заболеванием; аффективное расстройство; тревога; расстройства приема пищи и депрессия, причем способ включает введение млекопитающему соединения формулы I. В еще одном аспекте настоящего изобретения предложена фармацевтическая композиция, содержащая фармацевтически приемлемый носитель или эксципиент и соединение по изобретению. Соединение по изобретению в композиции может быть представлено в количестве, которое является терапевтически эффективным для лечения расстройства или заболевания, ассоциирующегося с рецепторами CRF1,или расстройства, лечение которого можно осуществлять или облегчать путем антагонистического действия в отношении CRF1 у млекопитающего, в частности человека. В еще одном аспекте настоящего изобретения предложен способ лечения расстройства, при котором проявляется гиперсекреция CRF у млекопитающего, включающий введение млекопитающему терапевтически эффективного количества соединения по изобретению. Предпочтительно, млекопитающее представляет собой млекопитающее, нуждающееся в описанном здесь лечении. В еще одном аспекте настоящего изобретения предложен способ отбора лигандов к рецепторамCRF1, включающий: а) проведение конкурентного анализа связывания с рецепторами CRF1 между соединением по изобретению, меченым обнаруживаемой меткой, и лигандом-кандидатом; и б) обнаружение способности указанного лиганда-кандидата замещать указанное меченое соединение. В еще одном аспекте настоящего изобретения предложен способ обнаружения рецепторов CRF в ткани, включающий: а) приведение в контакт соединения по изобретению, меченного обнаруживаемой меткой, с тканью в условиях, которые позволяют соединению связываться с тканью; и б) обнаружение меченного соединения, связанного с тканью. В еще одном аспекте настоящего изобретения предложен способ ингибирования связывания CRF с рецептором CRF1, включающий приведение в контакт соединения по изобретению с раствором, содержащим клетки, экспрессирующие рецептор CRF1, где соединение присутствует в растворе в концентрации, достаточной для ингибирования связывания CRF с рецептором CRF1. В еще одном аспекте настоящего изобретения предложен способ уменьшения уровня связывания invitro CRF с клетками, экспрессирующими рецептор CRF1, включающий приведение в контакт соединения по п.1 с раствором, содержащим клетки, где соединение присутствует в растворе в концентрации,достаточной для уменьшения уровней связывания CRF с клетками in vitro. В еще одном аспекте настоящего изобретения предложено изделие производства, содержащее: а) упаковочный материал; б) соединение по изобретению; и в) этикетку или вкладыш в указанный упаковочный материал, указывающий на то, что указанное соединение эффективно для лечения расстройства или заболевания, ассоциирующегося с рецепторами CRF1, или расстройства, лечение которого может быть осуществлено или облегчено путем антагонистического действия в отношении CRF1 у млекопитающего. В еще одном аспекте настоящего изобретения предложено применение соединения по изобретению в анализе связывания, где одно или более чем одно из соединений может быть связано с меткой, где метка прямо или опосредовано может обеспечивать обнаруживаемый сигнал. Различные метки включают радиоактивные метки, люминофоры, хемилюминисцентные вещества, специфические связывающие молекулы, частицы, например магнитные частицы, и тому подобное. В еще одном аспекте настоящее изобретение относится к применению соединений по изобретению(в частности меченых соединений по изобретению) в качестве зондов локализации рецепторов в клетках и тканях и в качестве стандартов и реагентов для применения при определении характеристик связывания с рецептором тестируемых соединений. Примеры воплощений по изобретению включают соединения формулы I, где R1 представляет собой этил или С(О)СН 3. Примеры воплощений по изобретению также включают соединения формулы I, где R2 представляет собой этил, и R22 представляет собой этил. Примеры воплощений по изобретению также включают соединения формулы I, где R3 представляет собой C1-С 6 алкил, C1-С 6 алкенил или C1-С 6 алкинил. Примеры воплощений по изобретению также включают соединения формулы I, где R4 представляет собой NR5R6. Примеры воплощений по изобретению также включают соединения формулы I, где R3 представляет собой C1-С 6 алкил, C1-С 6 алкенил или C1-С 6 алкинил, и R4 представляет собой NR5R6. Примеры воплощений по изобретению также включают соединения формулы I, где R3 представляет собой метил, и R4 представляет собой N(СН 3)2. Соединение по изобретению может демонстрировать благоприятную растворимость в воде и желудочных жидкостях. Например, соединение по изобретению, где R4 представляет собой NR5R6, может демонстрировать благоприятную растворимость в воде и желудочных жидкостях. В качестве еще одного примера соединение по изобретению, где R3 представляет собой C1-С 6 алкил, и R4 представляет собойNR5R6, может демонстрировать благоприятную растворимость в воде и желудочных жидкостях. В еще одном примере воплощения соединение по изобретению, где R3 представляет собой метил, и R4 представляет собой N(СН 3)2, может демонстрировать благоприятную растворимость в воде и желудочных жидкостях. Используемый здесь "галоген" представляет собой группу, выбранную из -F, -Cl, -Br и -I. Используемый здесь термин "C1-С 6 алкил" обозначает как прямоцепочечные, так и разветвленные насыщенные группировки, имеющие 1-6 атомов углерода. Используемый здесь термин "C1-С 6 алкенил" обозначает как прямоцепочечные, так и разветвленные группировки, имеющие 1-6 атомов углерода, содержащие одну или более чем одну двойную связь. Используемый здесь термин "C1-С 6 алкинил" обозначает как прямоцепочечные, так и разветвленные группировки, имеющие 1-6 атомов углерода, содержащие одну или более чем одну тройную связь. Используемый здесь термин "фармацевтически приемлемая соль" относится к соли, полученной из фармацевтически приемлемых нетоксичных кислот, в том числе неорганических кислот и органических кислот. Подходящие нетоксичные кислоты включают неорганические и органические кислоты основных остатков, таких как амины, например уксусная, бензолсульфоновая, бензойная, камфорсульфоновая, лимонная, этенсульфоновая, фумаровая, глюконовая, глутаминовая, бромистоводородная, соляная, изэтионовая, молочная, малеиновая, яблочная, миндальная, метансульфоновая, слизевая, азотная, памоевая,пантотеновая, фосфорная, янтарная, серная, барбаровая (barbaric) кислота, паратолуолсульфоновая кислота и тому подобное; и щелочные или органические соли остатков таких кислот, как карбоновые кислоты, например соли щелочного и щелочно-земельного металла, полученные из следующих оснований: гидрида натрия, гидроксида натрия, гидроксида калия, гидроксида кальция, гидроксида алюминия, гидроксида лития, гидроксида магния, гидроксида цинка, аммиака, триметиламмиака, триэтиламмиака, этилендиамина, лизина, аргинина, орнитина, холина, N,N'-дибензилэтилендиамина, хлорпрокаина, диэтаноламина, прокаина, н-бензилфенетиламина, диэтиламина, пиперазина, трис(гидроксиметил)-аминометана,гидроксида тетраметиламмония и тому подобного. Фармацевтически приемлемые соли соединений формулы I могут быть получены путем взаимодействия этих соединений в форме свободной кислоты или свободного основания со стехиометрическим количеством соответствующего основания или кислоты в воде или в органическом растворителе, или в смеси двух растворителей; при этом предпочтительными обычно являются неводные среды, подобные эфиру, этилацетату, этанолу, изоприловому спирту или ацетонитрилу. Списки подходящих солей можно обнаружить в книге Remington's Pharmaceutical Sciences, 17th ea., Mack Publishing Company, Easton, PA, 1985, p. 1418, описание которой включено здесь путем ссылки. В примере воплощения соль соединения формулы I и паратолуолсульфоновой кислоты представляет собой фармацевтически приемлемую соль соединения формулы I. Термин "терапевтически эффективное количество" соединения по этому изобретению обозначает количество, эффективное для того, чтобы противодействовать аномальному уровню CRF или лечить симптомы аффективного расстройства, тревоги, депрессии или других описанных выше расстройств хозяина. Термин "соединение по изобретению" обозначает соединение формулы I или его фармацевтически приемлемую соль. Заявленное изобретение также охватывает пролекарства соединений формулы I. Используемый здесь термин "пролекарство" обозначает любой носитель с ковалентной связью, который при введении такого пролекарства млекопитающему высвобождает активное родительское лекарство формулы I invivo. Пролекарства соединений формулы I представляют собой, в рамках здравого медицинского суждения, подходящие для применения при контактировании с тканями людей и низших животных с ненадлежащей токсичностью, раздражением, аллергическим ответом и тому подобным, соизмеримыми с приемлемым соотношением польза/риск, и эффективные для их предполагаемого применения, а также, где это возможно, цвиттерионные формы соединений по изобретению. Термин "пролекарство" обозначает соединения, которые быстро превращаются in vivo с получением родительского соединения формулы I,например путем гидролиза в крови. Функциональные группы, которые могут быстро превращаться путем метаболического расщепления in vivo, образуют класс групп, которые являются реакционноспособными в отношении карбоксильной группы соединений по изобретению. Они включают такие группы, как алканоильная (такая как ацетильная, пропионильная, бутирильная и тому плдобное), незамещенная и замещенная ароильная (такая как бензоильная и замещенная бензоильная), алкоксикарбонильная (такая как этоксикарбонильная), триалкилсилильная (такая как триметил- и триэтилсилильная),группы сложных моноэфиров, образуемых с дикарбоновыми кислотами (такие как сукцинильная) и тому подобное, но не ограничиваются ими. Ввиду легкости, с которой метаболически расщепляемые группы полезных соединений по этому изобретению отщепляются in vivo, соединения, несущие такие группы,действуют в качестве пролекарств. Соединения, несущие метаболически отщепляемые группы, обладают преимуществом, заключающимся в том, что они могут проявлять улучшенную биодоступность в результате повышенной растворимости и/или скорости абсорбции, придаваемой родительскому соединению путем присутствия метаболически отщепляемой группы. Подробное обсуждение пролекарств описано вHiguchi and V. Stella, Vol. 14 of the A.C.S. Symposium Series, and Bioreversible Carriers in Drug Design, Edward B. Roche, ea., American Pharmaceutical Association and Pergamon Press, 1987, которые включены здесь путем ссылки. "Пролекарства" рассматривают как любые носители с ковалентной связью, которые при введении такого пролекарства млекопитающему высвобождают активное родительское лекарство формулы I in vivo. Пролекарства соединений формулы I получают путем модифицирования присутствующих в соединениях функциональных групп таким образом, что модификации расщепляются до родительских соединений или путем стандартного обращения, или in vivo. Пролекарства включают соединения, где гидрокси, амино или сульфгидрильные группы связаны с любой группой, которая при введении млекопитающему отщепляется с образованием свободной гидроксильной, амино или сульфгидрильной группы, соответственно. Примеры пролекарств включают ацетатные, формиатные и бензоатные производные спиртовой и аминофункциональных групп соединений формулы I и т.п., но не ограничиваются ими. Меченые соединения по изобретению могут быть использованы в исследованиях in vitro, таких как авторадиография срезов тканей, или в способах in vivo, например сканировании путем позитронэмиссионной томографии (ПЭТ) или однофотонной эмиссионной компьютерной томографии (ОФЭКТ). В частности, соединения по изобретению полезны в качестве стандартов и реагентов при определении способности потенциального фармацевтического препарата связываться с рецептором CRF1. Предложенные здесь соединения могут иметь один или более чем один асимметрический центр или плоскость, и все диастереоизомерные формы соединения включены в настоящее изобретение. Среди соединений также может быть множество геометрических изомеров олефинов, двойных связей C=N и тому подобного, и все такие стабильные изомеры предусмотрены в настоящем изобретении. Соединения по изобретению могут быть выделены в оптически чистой форме, например путем расщепления рацемической формы при помощи обычных способов, таких как кристаллизация, в присутствии расщепляющего агента, или путем хроматографии с использованием, например, хиральной колонки для высокоэффективной жидкостной хроматографии (ВЭЖХ), или синтезированы путем асимметрического синтеза, дающего возможность для получения энантиомерно обогащенного материала. Настоящее изобретение охватывает все возможные таутомеры соединений, представленных формулой I. Подробное описание изобретения Примерами соединений по изобретению являются следующие:(1R,2S) 1-[5-(6-диметиламино-2-метилпиридин-3-ил)-3,6-диэтилпиразин-2-иламино]индан-2 иловый эфир уксусной кислоты;(1R,2S) 1-[5-(6-диметиламино-2-метилпиридин-3-ил)-3,6-диэтилпиразин-2-иламино]индан-2 иловый эфир уксусной кислоты толуол 4-сульфоновая кислота и(1R,2S) [5-(6-диметиламино-2-метилпиридин-3-ил)-3,6-диэтилпиразин-2-ил]-(2-этоксииндан-1-ил) амин. Соединения по изобретению могут быть получены с использованием реакций, изображенных на следующих схемах, или их вариантов, известных специалистам в данной области техники. Как проиллюстрировано на схеме А для типичного соединения по изобретению, аминопиразин А-II может быть получен из подходящим образом функционализированного хлорпиразина A-I (смотри схему Б) путем взаимодействия с соответствующим гетероциклическим или карбоциклическим амином в присутствии катализатора на основе переходного металла (например, ацетата палладия (II) или трис(дибензилиденацетон) дипалладия(0, основания (например, трет-бутоксида натрия или калия) в растворителях, таких как толуол, диметилформамид (ДМФ) или диоксан, но не ограничивающихся ими (см., например, Buchwald,S.L. et al, J. Org. Chem., 2000, 65, 1158). Ацетат может быть образован путем сочетания с уксусным ангидридом или ацетилхлоридом в присутствии основания (см. А-III). Эфиры могут быть получены путем сочетания алкилйодида с натриевым алкоксидом А-II. Галогенирование А-III может быть осуществлено при помощи множества способов, хорошо известных специалистам в данной области техники, с использованием таких реагентов, как N-хлорсукцинимид, N-бромсукцинимид, N-йодсукцинимид, бром, йод,трибромид пиридиния, в растворителях, таких как дихлорметан, уксусная кислота, ДМФ и так далее, с получением галогенпиразина A-IV. Образования заявленных соединений достигают путем катализируемой переходным металлом реакции сочетания A-IV и подходящего металл-арильного реагента, такого как арилбороновые кислоты (см., например, Miyaura, N.; et al, Chem. Rev., 1995, 95, 2457), арилстаннаны(см., например, Mitchell, T.N. Synthesis, 1992, 803) или арильные реагенты Гриньяра (см., например,Miller, J.A. Tetrahedron Lett., 1998, 39, 7275). Схема Б иллюстрирует получение монохлорпиразинов, таких как A-I. В монохлорпиразинах на схеме Б R2 и R22, в результате сочетания соответствующих аминокислот, могут представлять собой одинаковые C1-С 6 алкильные группы, такие как этильная или разные C1-С 6 алкильные группы. Представленная ниже последовательность реакций соответствует описанной в Chemical and Pharmaceutical Bulletin of Схема В иллюстрирует получение типичного фрагмента, связывающего бороновую кислоту. Бороновые кислоты могут быть получены путем обмена металл-галоген или при помощи способов палладиевого сочетания, известных специалистам в данной области техники. Схема В Дополнительно к описанным выше состояниям соединения по изобретению полезны для лечения различных расстройств у млекопитающего, в частности у человека, таких как социальное тревожное расстройство; паническое расстройство; обсессивно-компульсивное расстройство; тревога с сопутствующим патологическим депрессивным заболеванием; аффективное расстройство; тревога; депрессия; синдром раздраженного кишечника; посттравматическое стрессовое расстройство; супрануклеарный паралич; иммуносупрессия; желудочно-кишечное заболевание; нервно-психическая анорексия или другое расстройство приема пищи; симптомы наркотической или алкогольной абстиненции; расстройство злоупотребления веществами (например, никотином, кокаином, этанолом, опиатами или другими лекарствами); воспалительное расстройство; проблемы с фертильностью; расстройства, лечение которых можно осуществлять или облегчать путем антагонистического действия в отношении CRF1, включающие расстройства, вызываемые CRF или которым способствует CRF, но не ограничивающиеся ими; расстройство, выбранное из воспалительных расстройств, таких как ревматоидный артрит и остеоартрит, боль, астма,псориаз и аллергии; генерализированное тревожное расстройство; паника, фобии, обсессивнокомпульсивное расстройство; посттравматическое стрессовое расстройство; расстройства сна, вызванные стрессом; перцепция боли, такая как фибромиалгия; расстройства настроения, такие как депрессия,включая глубокую депрессию, одноэпизодическую депрессию, рецидивирующую депрессию, депрес-6 012874 сию, вызванную жестоким отношением с ребенком, и послеродовую депрессию; дистимия; биполярные расстройства; циклотимия; синдром хронической усталости; головная боль, вызванная стрессом; рак,инфекции вирусом иммунодефицита человека (HIV); нейродегенеративные заболевания, такие как болезнь Альцгеймера, болезнь Паркинсона и болезнь Гентингтона; кожные расстройства, такие как акне и псориаз; желудочно-кишечные заболевания, такие как язвы, синдром раздраженного кишечника, болезнь Крона, синдром раздражнной толстой кишки,диарея и послеоперационная кишечная непроходимость и гиперчувствительность толстой кишки, ассоциирующаяся с психопатологическими нарушениями или стрессом; геморрагический стресс; вызванные стрессом психотические эпизоды; синдром эутиреоидной слабости; синдром неадекватной секреции антидиуретического гормона (ADH); ожирение; бесплодие; травма головы; травма спинного мозга; ишемическое нейрональное повреждение (например, церебральная ишемия, такая как церебральная ишемия гиппокампа); эксцитотоксическое нейрональное повреждение; эпилепсия; расстройства, связанные с сердечно-сосудистой системой и сердцем, включающие гипертензию, тахикардию и застойную сердечную недостаточность; удар; иммунные дисфункции, включающие вызванные стрессом иммунные дисфункции (например, вызванные стрессом лихорадки, синдром стресса у свиней, транспортная лихорадка у коров, пароксизмальная фибрилляция у лошадей, дисфункции, вызванные ограничением пространства для цыплят, стресс у овец при стрижке или стресс у собак, связанный с взаимодействием людей и животных); мышечные спазмы; недержание мочи; старческая деменция Альцгеймеровского типа; мультиинфарктная деменция; боковой амиотрофический склероз; химические зависимости и пристрастия (например, зависимости от алкоголя, кокаина, героина, бензодиазепинов или других лекарств); остеопороз; психосоциальная карликовость и гипогликемия. Соединение по данному изобретению может быть введено для лечения описанных здесь состояний у млекопитающего или человека при помощи средств, которые приводят к контакту активного агента с сайтом действия агента в организме млекопитающего или человека. Соединения могут быть введены посредством любых традиционных средств, доступных для применения в сочетании с фармацевтическими препаратами или в виде индивидуального терапевтического агента, или в комбинации терапевтических агентов. Их можно вводить самостоятельно, но как правило их вводят с фармацевтическим носителем, выбранным на основе пути введения и стандартной фармацевтической практики. Вводимую дозу будут варьировать в зависимости от применения и известных факторов, таких как фармакодинамический характер конкретного агента, и способ и путь его введения; возраста реципиента,массы и состояния здоровья; природы и степени симптомов; типа сопутствующего лечения; частоты лечения и желаемого эффекта. Для применения в лечении описанных здесь заболеваний или состояний соединение по данному изобретению может быть введено перорально в дозе активного ингредиента от 0,002 до 200 мг/кг массы организма. Для достижения желаемого фармакологического эффекта обычно будет эффективной доза от 0,01 до 10 мг/кг в разделенных дозах от одного до четырех раз в сутки, или в препарате с длительным высвобождением. Активный ингредиент может быть введен перорально в твердых лекарственных формах, таких как капсулы, таблетки и порошки; или в жидких формах, таких как эликсиры, сиропы и/или суспензии. Соединения по данному изобретению также могут быть введены парентерально в стерильных жидких препаратах доз. Лекарственные формы (композиции), подходящие для введения, содержат от приблизительно 1 мг до приблизительно 100 мг активного ингредиента на единицу. В этих фармацевтических композициях активный ингредиент обычно представлен в количестве от приблизительно 0,5 до 95 мас.%, основываясь на общей массе композиции. Соединения по данному изобретению также могут быть использованы в качестве реагентов или стандартов в биохимическом исследовании неврологической функции, дисфункции и заболевания. Получения и примеры Изобретение дополнительно проиллюстрировано следующими примерами и получениями, которые не следует рассматривать как ограничивающие изобретение в объеме или сущности конкретных процедур, описанных в нем. Пример А. Анализ связывания с рецептором CRF1 для оценки биологической активности. Нижеследующее представляет собой описание выделения мембран головного мозга крыс для применения в стандартном анализе связывания, а также описание самого анализа связывания. Он основан на модифицированном протоколе, описанном De Souza (De Souza, 1987). Для приготовления мембран головного мозга для анализов связывания лобную долю коры головного мозга крыс гомогенизируют в 10 мл ледяного тканевого буфера (50 мМ буфер HEPES рН 7,0, содержащий 10 мМ MgC2, 2 мМ этиленгликоль-бис(2-аминоэтиловый эфир)-N,N,N',N'-тетрауксусную кислоту(EGTA), 1 мкг/мл апротинина, 1 мкг/мл лейпептина и 1 мкг/мл пепстатина). Гомогенат центрифугируют при 48000g в течение 10 мин и получающийся в результате осадок повторно гомогенизируют в 10 мл тканевого буфера. После дополнительного центрифугирования при 48000g в течение 10 мин осадок ресуспендируют до концентрации белка 300 мкг/мл.-7 012874 Анализы связывания осуществляют в 96-луночных планшетах с конечным объемом 300 мкл. Анализы инициируют путем добавления 150 мкл мембранной суспензии к 150 мкл буфера для анализа, содержащего 125I-овечий-CRF (конечная концентрация 150 пМ) и различные концентрации ингибиторов. Буфер для анализа является таким же, как описано выше для мембранного препарата с добавлением 0,1% овальбумина и 0,15 мМ бацитрацина. Связывание радиолиганда останавливают через 2 ч при комнатной температуре путем фильтрования через Packard GF/C пластины с монофильтрами (предварительно промытыми 0,3% полиэтиленимином) с использованием аппарата для сбора клеток Packard. Фильтры трижды промывают ледяным физиологическим раствором, забуференным фосфатом, рН 7,0, содержащим 0,01% Triton Х-100. Радиоактивность на фильтрах оценивают в Packard TopCount. Неспецифическое связывание определяют в присутствии избытка (10 мкМ) -спирального CRF. Альтернативно, в анализах связывания, аналогичных описанным выше, могут быть использованы ткани и клетки, которые в природе экспрессируют рецепторы CRF, такие как человеческие клетки нейробластомы IMR-32 (ATCC; Hogg et al., 1996). Значения средней ингибирующей концентрации (IC50) рассчитывают с использованием стандартных способов, известных в области техники, таких как программа подбора нелинейной кривой RS/1(BBN Software Products Corp., Cambridge, MA). Соединение рассматривают как активное, если оно имеет значение IC50 меньше чем приблизительно 10 микромоль (мкМ) для ингибирования рецепторов CRF1. Аффинность связывания соединений формулы I, выраженная в виде значений IC50, обычно находится в диапазоне от приблизительно 0,5 наномоль (нМ) до приблизительно 10 мкМь. Предпочтительные соединения формулы I демонстрируют IC50 1 мкМ или меньше, более предпочтительные соединения формулыI демонстрируют IC50 меньше чем 100 нМ или меньше, еще более предпочтительные соединения формулы I демонстрируют IC50 меньше чем 10 нМ или меньше. Пример Б. Ингибирование CRF-стимулированной аденилатциклазной активности. Ингибирование CRF-стимулированной аденилатциклазной активности может быть осуществлено,как описано ранее [G. Battaglia et al., Synapse 1:572 (1987)]. Кратко, анализы осуществляют при 37 С в течение 10 мин в 200 мл буфера, содержащего 100 мМ Tris-HCl (pH 7,4 при 37 С), 10 мМ MgCl2, 0,4 мМEGTA, 0,1% бычьего сывороточного альбумина (БСА), 1 мМ изобутилметилксантина (IBMX), 250 Е/мл фосфокреатининкиназы, 5 мМ креатинфосфата, 100 мМ гуанозин 5'-трифосфата, 100 нМ o-CRF, антагонистические пептиды (различные концентрации) и 0,8 мг ткани с исходной влажной массой (приблизительно 40-60 мг белка). Реакции инициируют путем добавления 1 мМ аденозинтрифосфата (АТФ)/[32 Р]АТФ (приблизительно 2-4 мКи/пробирку) и останавливают путем добавления 100 мл 50 мМ TrisHCl, 45 мМ АТФ и 2% додецилсульфата натрия. Для контролирования высвобождения цАМФ в каждую пробирку перед разделением добавляют 1 мл [3 Н]цАМФ (приблизительно 40000 dpm). Отделение[32 Р]цАМФ от [32 Р]АТФ осуществляют путем последовательной элюции с колонки Dowex и колонки с окисью алюминия. Альтернативно, аденилатциклазная активность может быть оценена в 96-луночном формате с использованием анализа FlashPlate с аденилилциклазной активацией от NEN Life Sciences в соответствии с предоставленными протоколами. Кратко, фиксированное количество цАМФ, меченного радиоактивным изотопом, добавляют к 96-луночным планшетам, которые предварительно покрыты антителами против циклического АМФ. Добавляют клетки или ткани и стимулируют в присутствии или отсутствие ингибиторов. Немеченый цАМФ, продуцируемый клетками, вытесняет радиоактивно меченый цАМФ с антитела. Связанный, меченный радиоактивным изотопом цАМФ обеспечивает слабый сигнал, который может быть обнаружен с использованием сцинтилляционного счетчика микропланшетов, такого как PackardTopCount. Увеличенные количества немеченого цАМФ приводят в результате к уменьшению обнаруживаемого сигнала в течение времени инкубации (2-24 ч). Примеры Получение 1. (1R,2S)-1-(3,6-Диэтилпиразин-2-иламино)индан-2-ол. В продуваемый азотом 200-литровый эмалированный реактор добавляли (1R,2S)-(+)-цис-1-амино-2 инданол (2,5 кг, 16,1 моль, 1,5 экв.), ацетат палладия (II) (72 г, 0,3 моль, 3 мол.%), 2,2'бис(дифенилфосфино)-1,1'-бинафтил (200 г, 0,3 моль, 3 мол.%) и карбонат цезия (7,0 кг, 21,5 моль, 2,0 экв.), а затем толуол (65 л, затаренный в бочку исходный продукт). К перемешиваемой белой суспензии при комнатной температуре добавляли 3-хлор-2,5-диэтилпиразин (1,83 кг, 10,7 моль, 1,0 экв.), и содержимое нагревали до температуры дефлегмации (110 С) 2 ч, в течение которых окончание реакции оценивали с использованием ВЭЖХ (4 капли реакционной смеси гасили в воде и затем экстрагировали в 1 мл метил-трет-бутилового эфира (МТВЕ), удаляли растворитель и разбавляли 1,5 мл смеси CH3CN/вода). К реакционной смеси при условиях окружающей среды добавляли метил-трет-бутиловый эфир (45 л,затаренный в бочку исходный продукт) и воду (45 л) и слои разделяли. Органический слой второй раз промывали водой (45 л), затем экстрагировали метил-трет-бутиловым эфиром (45 л, затаренный в бочку исходный продукт). Затем объединенные органические слои концентрировали под вакуумом до минимального объема. Добавляли диметилформамид (15,14 л (4 галлона), ЕМ Science) и получающийся в результате темный раствор переносили в 20-литровую бутыль. С использованием количественной ВЭЖХ-8 012874 определяли выход (1R,2S)-1-(3,6-диэтилпиразин-2-иламино)индан-2-ола (2,27 кг, 73%). Этот материал использовали без дополнительной очистки. Время удерживания указанного в заголовке соединения при ВЭЖХ составляет 2,1 мин. Колонка 150 мм 4,6 мм, Luna 5 мкм фенилгексил; 50/50 CH3CN/вода + 0,1% трифторуксусная кислота (ТФУ) с градиентом до 75/25 + 0,1% CH3CN/вода + 0,1% ТФУ. Инфракрасная спектроскопия (ИК)(ИРЭ+) 384,0; МС (Cl) m/z 284 (МН+); масс-спектр высокого разрешения (МСВР) (бомбардировка быстрыми атомами (ББА: рассчит. для C17H21N3O +H1 284,1763, обнаружено 284,1754. [ ]25D=12 (с 0,55,метиленхлорид); химический состав, рассчит. Для C17H21N3O: С 72,06; Н 7,47; N 14,83. Обнаружено: С 72,15; Н, 7.53; N 14,42. Получение 2. (1R,2S) 1-(3,6-Диэтил-5-йодпиразин-2-иламино)индан-2-иловый эфир уксусной кислоты. В продуваемый азотом 1200-литровый эмалированный реактор добавляли (1R,2S)-1-(3,6-диэтилпиразин-2-иламино)индан-2-ол (25 кг, 86,1 моль, 1,0 экв.), 4-диметиламинопиридин (1,0 кг, 8,6 моль, 10 мол.%) и тетрагидрофуран (139 л, затаренный в бочку исходный продукт), а затем триэтиламин (18 кг,177,9 моль, 2,1 экв.). К этому раствору добавляли уксусный ангидрид (10,6 кг, 103,8 моль, 1,2 экв.), поддерживая внутреннюю температуру меньше 30 С. После перемешивания в течение 3 ч при 20-25 С ВЭЖХ анализ (3 капли гасили в 1,0 мл метанола, затем разбавляли 0,5 мл воды) показал, что реакция не завершилась. Добавляли дополнительное количество уксусного ангидрида (2,4 кг, 23,8 моль, 0,3 экв.) и содержимое перемешивали в течение 1 ч, затем повторно анализировали и оценивали окончание реакции. Добавляли метанол (6,3 кг, 197,2 моль) для поглощения избытка уксусного ангидрида и перемешивали в течение 1 ч, после чего смесь разбавляли метил-трет-бутиловым эфиром (200 л) и водой (200 л),содержащей лимонную кислоту (23,0 кг, 119,7 моль). Фазы разделяли и водный слой экстрагировали метил-трет-бутиловым эфиром (100 л). Объединенные органические фазы промывали 1 н. водным гидроксидом натрия (200 л) и водой (2100 л). Объединенные органические вещества перегоняли под вакуумом менее чем до 75 л, после чего добавляли диметилформамид (150 л, затаренный в бочку исходный продукт) и концентрирование продолжали до объема контейнера приблизительно 160 л. Этот раствор добавляли во второй 1200-литровый эмалированный реактор, содержащий N-йодсукцинимид (30,0,кг,133,3 моль, 1,5 экв.) и затем нагревали до 55 С три часа, в течение которых окончание реакции оценивали с использованием ВЭЖХ (3 капли реакционной смеси гасили в воде и затем экстрагировали 1 мл МТВЕ, удаляли растворитель и разбавляли 1,5 мл смеси CH3CN/вода). Смесь при условиях окружающей среды разбавляли метил-трет-бутиловым эфиром (200 л) и обрабатывали водой (200 л), содержащей пентагидрат тиосульфата натрия (22,6 кг, 91 моль). Слои разделяли и водный слой экстрагировали метилтрет-бутиловым эфиром (100 л). Объединенные органические слои промывали водой (3 100 л) и затем перегоняли под вакуумом до небольшого объема с получением неочищенного (1R,2S) 1-(3,6-диэтил-5 йод-пиразин-2-иламино)индан-2-илового эфира уксусной кислоты. Очистку осуществляли на диоксиде кремния (500 кг) с элюированием смесью 20/80 EtOAc/октан, собирая 200-литровые фракции. Концентрирование соответствующих фракций с колонки с добавлением октана дало суспензию, которую охлаждали до 0 С, фильтровали и промывали октаном, затем сушили азотом при 40 С с получением 31,1 кг(80%) указанного в заголовке соединения в виде белого твердого вещества. 1 Н Ядерный магнитный резонанс (ЯМР) (400 МГц, диметилсульфоксид (ДМСО)-d6)7.28 (m, 4 Н), 6.66 (d, J=9 Гц, 1 Н), 5.80 (m, 1 Н),5.68 (m, 1 Н), 3.29 (m, 1 Н), 3.01 (d, J=17 Гц, 1 Н), 2.69 (m, 4 Н), 1.88 (s, 3 Н), 1.15 (m, 6H); 13 С NMR (ДМСОd6)169.72, 153.75, 151.01, 143.73, 141.24, 139.89, 127.80, 126.75, 124.72, 124.39, 100.66, 74.33, 57.01,36.82, 31.04, 24.71, 20.86, 12.60, 11.17. Получение 3.(5-Бром-6-метилпиридин-2-ил)диметиламин. К раствору 5-бром-6-метилпиридин-2-иламина (4 г, 0,021 моль) в тетрагидрофуране (105 мл) добавляли гидрид натрия (60%, 1,2 экв., 1 г). Через 30 мин добавляли йодметан (1,56 мл, 1,2 экв.). Через еще 24 ч добавляли гидрид натрия (60%, 1,2 экв., 1 г) и йодметан (1,56 мл, 1,2 экв.). Реакционную смесь перемешивали в течение 72 ч и выливали в 1 н. NaOH, экстрагировали этиловым эфиром, сушили над сульфатом магния, фильтровали и концентрировали. Жидкостная хроматография среднего давления (ЖХСД,(MPLC Biotage с элюированием смесью 2-10% этилацетат/гексан позволила получить указанное в заголовке соединение в виде масла (4,31 г, 96%). 1 Н ЯМР (400 МГц, CDCl3)7.45 (d, J=8.7 Гц, 1 Н), 6.20 (d,J=8.7 Гц, 1 Н), 3.01 (s, 6H), 2.46 (s, 3H). Получение 4. (5-Бороновая кислота-6-метилпиридин-2-ил)диметиламин. К раствору (5-бром-6-метил-пиридин-2-ил)-диметил-амина (1,0 г, 0,0046 моль) в тетрагидрофуране(1,6 мл)/толуоле (6,6 мл) по каплям в атмосфере азота при -78 С добавляли n-BuLi (2,24 мл 2,5 М). Через 30 мин по каплям добавляли триизопропилборат (1,28 мл). Через 30 мин реакционную смесь нагревали до температуры окружающей среды и перемешивали в течение 30 мин с последующим добавлением 7 мл 1 н. HCl. Реакционную смесь перемешивали в течение 1 ч и гасили до рН 8 с использованием 1 н. NaOH. Экстрагирование этилацетатом, сушка сульфатом магния и концентрирование позволили получить белое-9 012874 твердое вещество. Растирание с гексаном и фильтрование позволили получить указанное в заголовке соединение в виде белого твердого вещества (550 мг, 65%) (400 МГц, ДМСО)7.90 (m, 1 Н), 6.45 (m, 1 Н), 3.01 (s, 6H), 2.63 (s, 3 Н). Пример 1. (1R,2S) 1-[5-(6-Диметиламино-2-метилпиридин-3-ил)-3,6-диэтилпиразин-2-иламино]индан-2-иловый эфир уксусной кислоты. В чистую сухую трехгорлую круглодонную колбу объемом 1 л, снабженную верхним перемешивающим устройством, трубкой подачи азота и обратным холодильником, загружали тетрагидрофуран(8,60 моль; 700 мл; 620 г), (5-бороновая кислота-6-метилпиридин-2-ил)диметиламин (1,00 экв. [лимитирующий реагент]; 194 ммоль; 35,0 г), (1R,2S) 1-(3,6-диэтил-5-йодпиразин-2-иламино)индан-2-иловый эфир уксусной кислоты (0,500 экв.; 97,2 ммоль; 43,9 г), Pd(OAc)2 (0,0200 экв.; 3,89 ммоль; 873 мг), 1,1'бис(дифенилфосфино)ферроцен (0,0200 экв.; 3,89 ммоль; 2,16 г), гидрофторид калия, 99-100-мас./мас.%(4,00 экв.; 778 ммоль; 61,0 г). Реакционную смесь нагревали до 60 С и оставляли на 18 ч. Затем реакционную смесь охлаждали до комнатной температуры, фильтровали и продукт выделяли путем хроматографии (20% МЕТВ/гексан). Выделяли 42 г желаемого продукта. Его использовали без дополнительной очистки. (Легкоплавкое твердое вещество) 1 Н ЯМР (400 МГц, CDCl3)7.37 (m, 1H), 7.28 (m, 4 Н), 6.40 (d,J=8.7 Гц, 1 Н), 6.05 (m, 1H), 5.72 (m, 1 Н), 4.82 (d, J=9.1 Гц, 1H), 3.33 (dd, J=17.0, 5.0 Гц, 1 Н), 3.08 (s, 6 Н),2.05 (m, 1 Н), 2.67 (q, J=7.5 Гц, 2 Н), 2.49 (q, J=7.5 Гц, 2 Н), 2.23 (s, 3 Н), 1.94 (s, 3 Н), 1.27 (m, 3 Н), 1.12 (t,J=7.5 Гц, 3 Н); МС: (исходн. М+Н m/z = 460,4). Пример 2. (1R,2S) 1-[5-(6-Диметиламино-2-метилпиридин-3-ил)-3,6-диэтилпиразин-2-иламино]индан-2-иловый эфир уксусной кислоты толуол 4-сульфоновая кислота. В чистую и сухую круглодонную колбу, которую ополоснули 2-метил ТГФ, загружали 650 мл 2 метил ТГФ, 65 г (1R,2S) 1-[5-(6-диметиламино-2-метилпиридин-3-ил)-3,6-диэтилпиразин-2-иламино]индан-2-илового эфира уксусной кислоты. Этот раствор фильтровали в специальную свободную (specfree) круглодонную колбу объемом 2 л, которую ополоснули 2-метил ТГФ. В нее путем фильтрования добавляли раствор 150 мл 2-метил ТГФ и 34,4 г моногидрата пара-толуолсульфоновой кислоты. Солевой раствор нагревали до 60 С и оставляли охладиться до комнатной температуры. Продукт оставляли гранулироваться при температуре окружающей среды и выделяли путем фильтрования, промывали профильтрованным 2-метил ТГФ и сушили в вакуумном сушильном шкафу в течение ночи при 45 С. Продукт (79,2 г, выход 89%) согласовывался по желаемой структуре, а дифракция рентгеновских лучей на порошке соответствовала желаемой полиморфной форме. 1 Н ЯМР (400 МГц, CDCl3)7.80 (d, J=8.3 Гц,2 Н), 7.67 (d, J=9.5 Гц, 1H), 7.34 (m, 1H), 7.29 (m, 3H), 7.15 (d, J=8.7 Гц, 2 Н), 6.72 (d, J=9.1 Гц, 1H), 6.03 (m,1H), 5.72 (m, 1H), 4.97 (d, J=9.1 Гц, 1H), 3.39 (s, 6H), 3.34 (dd, J = 17.4, 5.4 Гц, 1H), 3.09 (d, J=17.0 Гц, 1H),2.63 (m, 2H), 2.57 (s, 3H), 2.42 (q, J=7.5 Гц, 2H), 2.32 (s, 3H), 1.96 (s, 3H), 1.27 (t, J=7.5 Гц, 3 Н), 1.15 (t,J=7.5 Гц, 3 Н); МС: (исходный М+Н m/z = 460,1); химический состав, рассчит. для C34H41N5O5S: С, 64.64; Н, 6.54; N, 11.08; S, 5.07. Обнаружено: С, 64.27; Н, 6.57; N, 10.94; S, 5.41. Получение 5. (1R,2S) 1-[5-(6-Диметиламино-2-метилпиридин-3-ил)-3,6-диэтил-пиразин-2-иламино] индан-2-ол. К раствору (1R,2S) 1-(3,6-диэтил-5-йодпиразин-2-иламино)индан-2-ола (1 г) в бензоле (20 мл) добавляли (5-бороновая кислота-6-метилпиридин-2-ил)диметиламин (880 мг, 2 экв.), дитрифенилфосфин дихлорпалладия (171 мг, 0,1 экв.) и 2 н. раствор карбоната натрия (4 мл) и реакционную смесь нагревали при 75 С в течение 18 ч. Реакционную смесь охлаждали до температуры окружающей среды, выливали в насыщенный бикарбонат и экстрагировали этилацетатом (2). Органический слой сушили сульфатом магния, фильтровали и концентрировали. Очистка путем ЖХСД Biotage с элюированием смесью 20-40% этилацетат/гексан позволила получить указанное в заголовке соединение (355 мг, 36%). 1H ЯМР (400 МГц, CDCl3)7.23 (m, 5 Н), 6.40 (d, J=8.3 Гц, 1 Н), 6.57 (t, J=5.4 Гц, 1H), 4.80 (m, 2H), 3.21 (m, 2H), 3.08(s, 6H), 2.70 (q, J=7.5 Гц, 2 Н), 2.51 (q, J=7.5 Гц, 2 Н), 2.23 (s, 3 Н), 1.28 (t, J=7.5 Гц, 3 Н), 1.12 (t, J=7.5 Гц,3 Н); МС: (исходный М+Н m/z = 418,3). Пример 3. (1R,2S) [5-(6-Диметиламино-2-метилпиридин-3-ил)-3,6-диэтилпиразин-2-ил]-(2-этоксииндан-1-ил)амин. К раствору (1R,2S) 1-[5-(6-диметиламино-2-метилпиридин-3-ил)-3,6-диэтилпиразин-2-иламино]индан-2-ола (93 мг) в диметилформамиде (2,2 мл) при 0 С добавляли гидрид натрия (11 мг, 1,2 экв.) подN2. Через 5 минт добавляли йодэтан (1,2 экв.). Через 2 ч реакционную смесь выливали в насыщенный бикарбонат натрия, экстрагировали метиленхлоридом, сушили сульфатом магния, фильтровали и концентрировали. Очистка путем ЖХСД Biotage с элюированием смесью 5-20% этилацетат/гексан позволила получить указанное в заголовке соединение (61 мг). 1 Н ЯМР (400 МГц, CDCl3)7.43 (d, J=6.6 Гц,1 Н), 7.25 (m, 1H), 7.23 (m, 3H), 6.40 (d, J=8.3 Гц, 1H), 5.79 (m, 1H), 5.26 (d, J=7.9 Гц, 1H), 4.35 (m, 1H),3.66 (m, 1H), 3.46 (m, 1H), 3.10 (m, 2H), 3.09 (s, 6H), 2.70 (q, J=7.5 Гц, 2H), 2.50 (q, J=7.5 Гц, 2H), 2.24 (s,3H), 1.28 (t, J=7.5 Гц, 3 Н), 1.12 (m, 6H); МС: (исходный M+H m/z=446,3). Значение Ki, представляющую собой константу связывания с рецептором CRF1, измеряли для примеров соединений по изобретению. Обнаружено, что соединение примера 1, (1R,2S) 1-[5-(6 диметиламино-2-метилпиридин-3-ил)-3,6-диэтилпиразин-2-иламино]индан-2-иловый эфир уксусной ки- 10012874 слоты, имеет Ki 19 нМ. Обнаружено, что соединение примера 3, (1R,2S) [5-(6-диметиламино-2-метилпиридин-3-ил)-3,6-диэтилпиразин-2-ил]-(2-этоксииндан-1-ил)амин, имеет K1 13 нМ. Эти результаты обеспечивают строгое доказательство в пользу способности соединений по изобретению действовать в качестве антагонистов рецептора CRF1. Раскрытые здесь конкретные воплощения предполагаются в качестве иллюстрации аспектов по изобретению и не предназначены для какого-либо ограничения объема изобретения. Предполагают, что любые эквивалентные воплощения находятся в объеме изобретения. Различные модификации изобретения дополнительно к представленным и описанным здесь будут понятны специалистам в данной области техники из предшествующего описания. Также предполагают, что такие модификации находятся в объеме прилагаемой формулы изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы I или его фармацевтически приемлемая соль,где R1 представляет собой C1-С 6 алкил, С(О)С 1-С 6 алкил;R6 представляет собой C1-С 6 алкил. 2. Соединение по п.1, где R1 представляет собой этил или С(О)СН 3. 3. Соединение по п.1, где R2 представляет собой этил и R22 представляет собой этил. 4. Соединение по п.1, где R3 представляет собой C1-С 6 алкил. 5. Соединение по п.1, где R4 представляет собой NR5R6. 6. Соединение по п.5, где R3 представляет собой C1-С 6 алкил. 7. Соединение по п.6, где R3 представляет собой метил и R4 представляет собой N(CH3)2. 8. Соединение, выбранное из группы, состоящей из(1R,2S) 1-[5-(6-диметиламино-2-метилпиридин-3-ил)-3,6-диэтилпиразин-2-иламино]индан-2-иловый эфир уксусной кислоты толуол 4-сульфоновой кислоты и(1R,2S) [5-(6-диметиламино-2-метилпиридин-3-ил)-3,6-диэтилпиразин-2-ил]-(2-этоксииндан-1-ил)амина. 9. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и соединение по п.1. 10. Способ лечения расстройства, выбранного из группы, состоящей из генерализированного тревожного расстройства, социального тревожного расстройства, панического расстройства, обсессивнокомпульсивного расстройства, тревоги с сопутствующим патологическим депрессивным заболеванием,аффективного расстройства, тревоги, расстройств приема пищи, биполярного расстройства и депрессии у млекопитающего, включающий введение млекопитающему соединения по п.1. 11. Способ лечения расстройства, при котором проявляется гиперсекреция кортикотропин-рилизинг фактора (CRF) у млекопитающего, включающий введение млекопитающему терапевтически эффективного количества соединения по п.1. 12. Способ отбора лигандов к рецепторам CRF1, включающий: а) проведение конкурентного анализа связывания с рецепторами CRF1 между соединением по п.1, меченым обнаруживаемой меткой, и лигандом-кандидатом; и б) определение способности указанного лиганда-кандидата замещать указанное меченое соединение. 13. Способ обнаружения рецепторов CRF в ткани, включающий: а) приведение в контакт соединения по п.1, меченого обнаруживаемой меткой, с тканью в условиях, которые позволяют соединению связываться с тканью; и б) обнаружение меченого соединения, связанного с тканью.- 11012874 14. Способ ингибирования связывания CRF с рецептором CRF1, включающий приведение в контакт соединения по п.1 с раствором, содержащим клетки, экспрессирующие рецептор CRF1, где соединение присутствует в растворе в концентрации, достаточной для ингибирования связывания CRF с рецепторомCRF1. 15. Способ уменьшения уровня связывания CRF in vitro с клетками, экспрессирующими рецепторCRF1, включающий приведение в контакт соединения по п.1 с раствором, содержащим указанные клетки, где соединение присутствует в растворе в концентрации, достаточной для уменьшения уровней связывания CRF с клетками in vitro.
МПК / Метки
МПК: C07D 401/04, A61P 25/00, A61K 31/497
Метки: арильные, производные, 1,4-пиразина, замещённые
Код ссылки
<a href="https://eas.patents.su/13-12874-zameshhyonnye-arilnye-proizvodnye-14-pirazina.html" rel="bookmark" title="База патентов Евразийского Союза">Замещённые арильные производные 1,4-пиразина</a>
Предыдущий патент: 6,6-бициклические кольцевые замещенные гетеробициклические ингибиторы протеинкиназ
Следующий патент: Производные пиримидина и их применение в терапии в качестве ингибиторов киназы csbp/rk/p38
Случайный патент: Стабильная солнцезащитная композиция












