Замещенные триазольные производные как модуляторы гамма-секретазы
Номер патента: 22093
Опубликовано: 30.10.2015
Авторы: Гейсен Хенрикус Якобус Мария, Де Клейн Михел Анна Йозеф, Суркин Михел, Бертело Дидье Жан-Клод, Ван Брандт Свен Францискус Анна
Формула / Реферат
1. Соединение формулы (I)
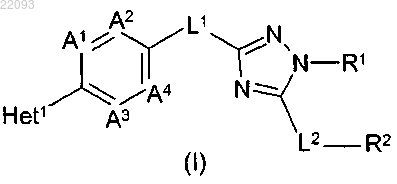
или его стереоизомерная форма, где
Het1 является гетероциклом, имеющим формулы (а-1) или (а-3)

R3 является C1-4-алкилом;
R4 представляет водород;
R7a представляет водород;
R7b и R7c, каждый независимо, представляют водород, C1-4-алкилокси или C1-4-алкил, необязательно замещенные 1-4 галогеновыми заместителями;
Ха представляет CH или N;
А1 представляет CR9; где R9 представляет водород, галоген или C1-4-алкилокси;
А2 представляет CH или N;
А3 и А4 представляют CH;
L1 представляет NR10, NH-(C=O) или (C=O)-NH; где R10 представляет водород или C1-4-алкил;
R1 представляет цикло-C3-7-алкил; C2-6-алкенил или C1-6-алкил, необязательно замещенный 1-4 заместителями, причем каждый независимо выбран из группы, состоящей из 1-пирролидинила, NR11aR12a и C1-6-алкилокси;
L2 представляет прямую связь; О; NR13a; C1-3-алкандиил, необязательно замещенный 1-4 галогеновыми заместителями;
R2 представляет пирролидинил; пиперидинил; морфолинил; пиперазинил; цикло-C3-7-алкил; гексагидро-1H-1,4-диазепин-1-ил; 3,4-дигидро-2(1H)-изохинолинил; 1,2-дигидропиридинил; или Ar;
где пирролидинил, пиперидинил, морфолинил, пиперазинил, цикло-C3-7-алкил, гексагидро-1H-1,4-диазепин-1-ил, 3,4-дигидро-2(1H)-изохинолинил, и 1,2-дигидропиридинил могут быть замещенными 1-4 заместителями, каждый из которых независимо выбран из группы, состоящей из цикло-C3-7-алкила, C1-4-алкилкарбонила, гидроксила, оксо, галогена, C1-4-алкилокси, C1-4-алкилокси-C1-4-алкила, C1-4-алкилоксикарбонила, Ar и C1-4-алкила, необязательно замещенного 1-4 галогеновыми заместителями;
где каждый Ar независимо является фенилом, необязательно замещенным 1-4 заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, C1-4-алкилокси, циано, NR11bR12b, морфолинила, C1-4-алкилокси, замещенного 1-4 галогеновыми заместителями, и C1-4-алкила, необязательно замещенного 1-4 галогеновыми заместителями;
каждый R11a, R11b и R11c независимо представляет водород, C1-4-алкил или C1-4-алкилкарбонил;
каждый R12a, R12b и R12c независимо представляет водород или С1-4-алкил;
R13a представляет водород;
или его фармацевтически приемлемая соль или его гидрат.
2. Соединение по п.1 или его стереоизомерная форма, где
Het1 является гетероциклом, имеющим формулу (а-1) или (а-3а)
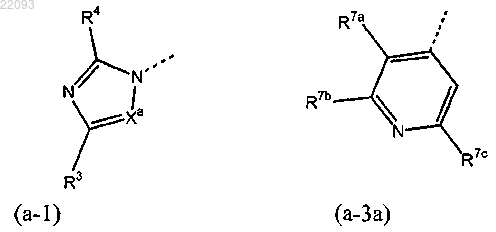
R1 представляет цикло-C3-7-алкил или С1-6-алкил, необязательно замещенный 1-4 заместителями, причем каждый независимо выбран из группы, состоящей из NR11aR12a и C1-6-алкилокси;
R2 представляет пирролидинил; пиперидинил; морфолинил; пиперазинил; цикло-C3-7-алкил; 3,4-дигидро-2(1H)-изохинолинил; 1,2-дигидропиридинил или Ar;
где пирролидинил, пиперидинил, морфолинил, пиперазинил, цикло-C3-7-алкил, 3,4-дигидро-2(1H)-изохинолинил и 1,2-дигидропиридинил могут быть замещенными 1-4 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-4-алкилкарбонила, оксо, галогена, C1-4-алкилокси, C1-4-алкилоксикарбонила, Ar и C1-4-алкила, необязательно замещенного 1-4 галогеновыми заместителями;
и его фармацевтически приемлемая соль и его гидрат.
3. Соединение по п.1 или его стереоизомерная форма, где
Het1 является гетероциклом, имеющим формулу (а-1) или (а-3);
R7b является водородом, C1-4-алкилокси или C1-4-алкилом, необязательно замещенным 1-4 галогеновыми заместителями,
R7c является водородом или C1-4-алкилом;
L1 представляет NR10, NH-(C=O) или (C=O)-NH; где R10 является водородом или C1-4-алкилом;
L2 представляет прямую связь; О; NR13a или C1-3-алкандиил,
R2 представляет пирролидинил; пиперидинил; морфолинил; пиперазинил; гексагидро-1H-1,4-диазепин-1-ил; 3,4-дигидро-2(1H)-изохинолинил; или Ar; где пирролидинил, пиперидинил, морфолинил, пиперазинил и гексагидро-1H-1,4-диазепин-1-ил могут быть замещенными 1-4 заместителями, каждый из которых независимо выбран из группы, состоящей из цикло-C3-7-алкила, C1-4-алкилкарбонила, гидроксила, галогена, C1-4-алкилокси, C1-4-алкилокси-С1-4-алкила, C1-4-алкилоксикарбонила, Ar и C1-4-алкила, необязательно замещенного 1-4 галогеновыми заместителями;
где каждый Ar независимо является фенилом, необязательно замещенным 1-4 заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, морфолинила, C1-4-алкилокси и C1-4-алкила, необязательно замещенного 1-4 галогеновыми заместителями,
каждый R11a независимо представляет водород или C1-4-алкил;
каждый R12a независимо представляет водород или С1-4-алкил;
R13a является водородом;
и его фармацевтически приемлемая соль и его гидрат.
4. Соединение по п.1, где
R2 представляет пирролидинил; пиперидинил; морфолинил; пиперазинил; цикло-C3-7-алкил; гексагидро-1H-1,4-диазепин-1-ил; 3,4-дигидро-2(1H)-изохинолинил или Ar;
где пирролидинил, пиперидинил, морфолинил, пиперазинил, цикло-C3-7-алкил, гексагидро-1H-1,4-диазепин-1-ил и 3,4-дигидро-2(1H)-изохинолинил могут быть замещенными 1-4 заместителями, каждый из которых независимо выбран из группы, состоящей из цикло-C3-7-алкила, С1-4-алкилкарбонила, гидроксила, галогена, C1-4-алкилокси, С1-4-алкилокси-C1-4-алкила, C1-4-алкилоксикарбонила, Ar и C1-4-алкила, необязательно замещенного 1-4 галогеновыми заместителями.
5. Соединение по п.1, где L1 является NH.
6. Соединение по п.1, где Het1 является гетероциклом, имеющим формулу (а-1) или (а-3а)
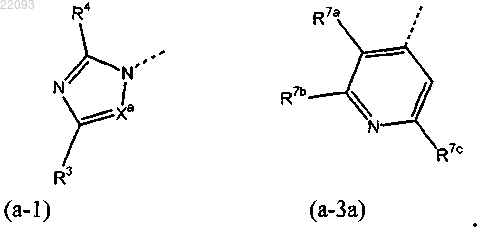
7. Соединение по п.1, где соединение представляет собой
5-(2-хлорфенокси)-N-[3-метокси-4-(4-метил-1Н-имидазол-1-ил)фенил]-1-(1-метилэтил)-1Н-1,2,4-триазол-3-амин,
N-[3-метокси-4-(2-метил-4-пиридинил)фенил]-1-(1-метилэтил)-5-[3-(трифторметил)-1-пиперидинил]-1Н-1,2,4-триазол-3-амин×2,2НСl×2,7Н2O,
5-(2-хлорфенокси)-N-[3-метокси-4-(2-метил-4-пиридинил)фенил]-1-(1-метилэтил)-1Н-1,2,4-триазол-3-амин×НСl×2,7Н2O,
N-[3-метокси-4-(3-метил-1Н-1,2,4-триазол-1-ил)фенил]-1-(1-метилэтил)-5-[3-(трифторметил)-1-пиперидинил]-1Н-1,2,4-триазол-3-амин,
N-[3-метокси-4-(2-метил-4-пиридинил)фенил]-1-(1-метилэтил)-5-[2-(трифторметил)фенокси]-1Н-1,2,4-триазол-3-амин×НСl×Н2О или
N-[3-метокси-4-(2-метил-4-пиридинил)фенил]-1-(1-метилэтил)-5-[3-(трифторметил)фенокси]-1Н-1,2,4-триазол-3-амин×НCl×1,5Н2О,
его стереомерная форма
или его фармацевтически приемлемая соль или гидрат.
8. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента эффективное количество соединения по любому из пп.1-7.
9. Применение соединения по любому из пп.1-7 в качестве лекарственного средства.
10. Применение соединения по любому из пп.1-7 для лечения или профилактики заболевания или патологического состояния, выбранного из болезни Альцгеймера, травматического повреждения головного мозга, легкого нарушения познавательных способностей, старческого угасания, деменции, деменции с тельцами Леви, церебральной амилоидной ангиопатии, полиинфарктной деменции, деменции боксеров, синдрома Дауна, деменции, связанной с болезнью Паркинсона, и деменции, связанной с бета-амилоидом.
11. Применение по п.10, где заболеванием является болезнь Альцгеймера.
12. Применение соединения по любому из пп.1-7 для получения лекарственного средства для модуляции активности гамма-секретазы.
Текст
ЗАМЕЩЕННЫЕ ТРИАЗОЛЬНЫЕ ПРОИЗВОДНЫЕ КАК МОДУЛЯТОРЫ ГАММАСЕКРЕТАЗЫ Данное изобретение относится к новым замещенным триазольным производным формулы (1),где Het1, R1, R2, А 1, А 2, A3, A4, L1 и L2 имеют значения, получившие определения в формуле изобретения. Соединения по данному изобретению применимы в качестве модуляторов гаммасекретазы. Данное изобретение, кроме того, относится к способам получения таких новых соединений, фармацевтическим композициям, содержащим указанные соединения в качестве активного ингредиента, а также к применению указанных соединений в качестве лекарственного средства. Ван Брандт Свен Францискус Анна,Де Клейн Михел Анна Йозеф, Гейсен Хенрикус Якобус Мария, Бертело Дидье Жан-Клод, Суркин Михел (BE) Медведев В.Н. (RU) Область изобретения Данное изобретение относится к новым, замещенным триазольным производным, применимым в качестве модуляторов гамма-секретазы. Данное изобретение, кроме того, относится к процессам получения таких новых соединений, фармацевтическим композициям, содержащим указанные соединения в качестве активного ингредиента, а также применению указанных соединений в качестве лекарственного средства. Предпосылки создания изобретения Болезнь Альцгеймера (БА) является прогрессирующим нейродегенеративным заболеванием, характеризующимся потерей памяти, познавательной способности и стабильности поведения. БА поражает 610% населения в возрасте свыше 65 лет и до 50% в возрасте свыше 85 лет. Она является ведущей причиной деменции и третьей главной причиной смерти после сердечно-сосудистых заболеваний и рака. В настоящее время не существует эффективного лечения БА. Общие результирующие затраты, связанные с БА в США, превышают 100 миллиардов долларов ежегодно. У БА не простая этиология, однако ее связали с определенными факторами риска, включающими(1) возраст, (2) семейный анамнез и (3) травму головы; другие факторы включают токсины в окружающей среде и низкие уровни образования. Специфические нейропатологические повреждения в лимбической и церебральной коре включают внутриклеточные нейрофибриллярные сплетения, состоящие из гиперфосфорилированного тау-белка, и экстраклеточное отложение фибриллярных агрегатов амилоидных бета-пептидов (амилоидные бляшки). Главным компонентом амилоидных бляшек являются амилоидные бета-(А-бета, Абета или А) пептиды различной длины. Их вариант, которым является А 1-42-пептид(Абета-42), как полагают, представляет главное являющееся причиной заболевания вещество для образования амилоида. Другим вариантом является A1-40-пептид (Абета-40). А представляет собой протеолитический продукт белка-предшественника, бета-амилоидного протеина-предшественника (бета-АПП или АПП; АРР). Семейные, аутосомные доминантные формы с ранним началом БА связали с бессмысленными мутациями -амилоидного протеина-предшественника (-АПП или АПП) и в пресинилинных белках 1 и 2. У некоторых пациентов формы БА с поздним началом имели корреляции со специфическим аллелем гена аполипопротеина Е (АпоЕ; АроЕ), а позднее с данными о мутации в альфа 2-макроглобулине, которая может быть связана по меньшей мере с 30% БА у населения. Несмотря на гетерогенность, при всех формах БА проявляются сходные патологические показатели. Генетический анализ предоставил наилучшие решения для логического терапевтического подхода при БА. Все мутации, обнаруженные к настоящему времени, влияют на количественную и качественную продукцию амилоидогенных пептидов,известных как Абета-пептиды (А), в частности А 42, и представляют сильное обоснование "гипотезе амилоидного каскада" при БА (Tanzi and Bertram, 2005, Cell 120, 545). Вероятная связь между выработкой пептида А и патологией БА подчеркивает необходимость лучшего понимания механизмов продукции А и веско обосновывает терапевтический подход по модуляции уровней А. Выделение пептидов А модулируется по меньшей мере двумя протеолитическими действиями, называемыми - и -секретазным расщеплением на N-конце (Met-Asp связи) и С-конце (остатки 37-42) пептида А соответственно. В отношении секреторного пути существуют данные, что -секретаза расщепляет первой, приводя к секреции s-APP (s) и сохранению 11 кДа связанного с мембраной карбоксиконцевого фрагмента (ККФ; CTF). Последний, как полагают, дает начало А пептидам после расщепления -секретазой. Количество более длинной изоформы, А 42 селективно повышается у пациентов с некоторыми мутациями в особом белке (пресенилине), и показана корреляция этих мутаций с семейной БА с ранним началом. Поэтому А 42, как полагают многие исследователи, является главным виновником патогенеза БА. В настоящее время стало понятно, что активность -секретазы может быть приписана единственному белку, но фактически связана с агрегатом из разных белков. Активность гамма -секретазы заключена в полипротеиновом комплексе, содержащем по меньшей мере четыре компонента: гетеродимер пресинилин (ПС; PS), никастрин, aph-1 и pen-2. Гетеродимер ПС состоит из амино- и карбоксиконцевых фрагментов ПС, образующихся при эндопротеолизе белкапредшественника. Два аспартата каталитического сайта находятся на границе этого гетеродимера. Недавно сделано предположение, что никастрин служит в качестве рецептора субстрата гамма-секретазы. Функции других компонентов гамма-секретазы неизвестны, но все они необходимы для активности(Steiner, 2004, Curr. Alzheimer Research 1(3): 175-181). Таким образом, хотя молекулярный механизм второго этапа расщепления до сих пор остается неуловимым, -секретазный комплекс стал одной из главных мишеней в поиске соединений для лечения БА. Были предложены различные стратегии для направленного действия на -секретазу при БА, с выбором от направленного действия непосредственно на каталитический сайт до разработки субстратоспецифических ингибиторов и модуляторов активности -секретазы (Marjaux et al., 2004, Drug DiscoveryToday: Therapeutic Strategies, Volume 1, 1-6). Соответственно, был описан ряд соединений, для которых секретазы служили мишенями (Larner, 2004. Secretases as therapeutics targets in AD: patents 2000-2004.Expert Opin. Ther. Patents 14, 1403-1420). Действительно, эти данные были подтверждены биохимическими исследованиями, при которых было показано действие некоторых нестероидных противовоспалительных лекарственных средств (НПВС) на -секретазу (US 2002/0128319; Eriksen (2003) J. Clin. Invest. 112, 440). Потенциальными ограничениями для применения НПВС для профилактики или лечения БА являются их подавляющее действие на активность ферментов циклооксигеназ (ЦОГ), которое может приводить к нежелательным побочным действиям, и их низкое проникновение в ЦНС (Peretto et al., 2005,J. Med. Chem. 48, 5705-5720). Позднее НПВС R-флурбипрофен, энантиомер, у которого отсутствует подавляющее действие на активность ЦОГ и связанное с этим токсичное действие на желудок, не прошел крупномасштабные испытания III этапа, так как этот лекарственный препарат не улучшал в значительно большей степени, чем плацебо мыслительные способности или способности пациентов осуществлять ежедневные действия.WO-2009/050227 относится к пиридазиновым производным для снижения подавляющего бетаамилоидного пептида;WO-2004/110350 относится к триазольным производным и их применению для модуляции А;WO-2010/010188 относится к [1,2,4]триазол-[1,5-а]пиридиновым соединениям, применимым для лечения дегенеративных заболеваний суставов и воспалительных заболеваний;WO-2010/098495 относится имидазолилпиразиновым производным в качестве терапевтических средств от БА иWO-2010/083141 относится к бициклическим соединениям для снижения продукции бетаамилоида. Существует высокая потребность в новых соединениях, которые модулируют активность секретазы, открывая тем самым новые пути для лечения БА. Целью данного изобретения является преодоление или облегчение по меньшей мере одного из недостатков прототипов или получение полезной альтернативы. Соединения данного изобретения или часть соединений данного изобретения могут обладать улучшенными свойствами метаболической стабильности, улучшенной доступности для проникновения в центральную нервную систему, улучшенной растворимостью или сниженным подавлением цитохрома (CYP) по сравнению с соединениями, описанными в прототипах. Соответственно, целью данного изобретения является получение таких новых соединений. Краткое изложение сущности изобретения Было обнаружено, что соединения данного изобретения применимы в качестве модуляторов секретазы. Соединения данного изобретения и фармацевтически приемлемые композиции с ними могут быть полезны при лечении или профилактике БА. Данное изобретение относится к новым соединениям формулы (I).R7b и R7c, каждый независимо, представляют водород, C1-4-алкилокси или C1-4-алкил, необязательно замещенные 1-4 галогеновыми заместителями; Ха представляет СН или N; А 1 представляет CR9; где R9 представляет водород, галоген или C1-4-алкилокси; А 2 представляет СН или N; А 3 и А 4 представляют СН;L1 представляет NR10, NH-(C=O) или (C=O)-NH; где R10 представляет водород или C1-4-алкил;R1 представляет цикло-C3-7-алкил; C2-6-алкенил или C1-6-алкил, необязательно замещенный 1-4 заместителями, причем каждый независимо выбран из группы, состоящей из 1-пирролидинила, NR11aR12a иR2 представляет пирролидинил; пиперидинил; морфолинил; пиперазинил; цикло-C3-7-алкил; гексагидро-1H-1,4-диазепин-1-ил; 3,4-дигидро-2(1H)-изохинолинил; 1,2-дигидропиридинил; или Ar; где пирролидинил, пиперидинил, морфолинил, пиперазинил, цикло-C3-7-алкил, гексагидро-1H-1,4 диазепин-1-ил, 3,4-дигидро-2(1H)-изохинолинил, и 1,2-дигидропиридинил могут быть замещенными 1-4 заместителями, каждый из которых независимо выбран из группы, состоящей из цикло-C3-7-алкила, C1-4-алкилкарбонила, гидроксила, оксо, галогена, C1-4-алкилокси, C1-4-алкилокси-C1-4 алкила, C1-4-алкилоксикарбонила, Ar и C1-4-алкила, необязательно замещенного 1-4 галогеновыми заместителями; где каждый Ar независимо является фенилом, необязательно замещенным 1-4 заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, C1-4-алкилокси, циано, NR11bR12b,морфолинила,C1-4-алкилокси, замещенного 1-4 галогеновыми заместителями,и C1-4-алкила, необязательно замещенного 1-4 галогеновыми заместителями; каждый R11a, R11b и R11c независимо представляет водород, C1-4-алкил или C1-4-алкилкарбонил; каждый R12a, R12b и R12c независимо представляет водород или C1-4-алкил;R13a представляет водород; или их фармацевтически приемлемым солям или их гидратам. Данное изобретение относится также к способам получения соединений формулы (I) и содержащим их фармацевтическим композициям. Данные соединения, как обнаружено, модулируют активность -секретазы in vitro и in vivo и поэтому могут быть полезны при лечении или профилактике БА, травматического повреждения головного мозга (ТГМ; TBI), легком нарушении познавательных способностей (ЛНПС; MCI), старческого угасания,деменции, деменции с тельцами Леви, церебральной амилоидной ангиопатии, полиинфарктной деменции, синдрома Дауна, деменции, связанной с болезнью Паркинсона и деменции, связанной с бетаамилоидом, предпочтительно, БА и других заболеваний с бета-амилоидной патологией (например, глаукомы). Из рассмотрения вышеназванных фармакологических свойств соединений формулы (I) следует, что они могут быть пригодны для применения в качестве лекарственного средства. Более конкретно, данные соединения могут быть пригодны для лечения или профилактики БА, церебральной амилоидной ангиопатии, полиинфарктной деменции, деменции боксеров или синдрома Дауна. Данное изобретение относится также к применению соединения по общей формуле (I), его стереоизомерных форм и фармацевтически приемлемых солей с кислотами или основаниями и их сольватов для получения лекарственного средства для модуляции активности -секретазы. Предпочтительно применение соединения формулы (I) для модуляции активности -секретазы,приводящей к снижению относительного количества продуцируемых пептидов А 42. Одно из преимуществ данных соединений или части соединений данного изобретения может заключаться в их повышенном проникновении в ЦНС. Далее данное изобретение теперь будет дополнительно описано. В следующих параграфах дано более подробное определение разным аспектам изобретения. Каждый аспект, получивший определение таким образом, может быть объединен с любым(и) другим(и) аспектом или аспектами, если четко не указано противоположное. В частности, любой характерный признак, указанный как являющийся предпочтительным или преимущественным, может сочетаться с любым(и) другим(и) характерным(и) признаком или признаками, которые указаны как предпочтительные или преимущественные. Подробное описание изобретения При описание соединений данного изобретения используемые термины должны истолковываться в соответствии со следующими ниже определениями, если контекст не предписывает иное. Где бы в данном изобретении ни применялся термин "замещенный", он предназначен, если не указано иначе, или иное ясно не следует из контекста, для представления того, что один или несколько атомов водорода, в частности от 1 до 4 водородов, предпочтительно от 1 до 3 водородов, более предпочтительно 1 водород, у атома или радикала, указанного в выражении с применением "замещенный", заменены с выбором из указанной группы, при условии, что нормальная валентность не превышена, и что замещение дает в результате химически стабильное соединение, т.е. соединение, которое достаточно прочное, чтобы перенести выделение до пригодной степени чистоты из реакционной смеси, и переработку в терапевтическое средство. Термин "галоген" в качестве группы или части группы является общим для фтора, хлора, брома,-3 022093 йода, если не указано иное, или это не ясно из контекста. Термин "C1-6-алкил" в качестве группы или части группы относится к углеводородному радикалу формулы CnH2n+1, где n является числом от 1 до 6. C1-6-алкильные группы содержат от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода, более предпочтительно, от 1 до 3 атомов углерода,еще предпочтительнее, 1-2 атом(а) углерода. Алкильные группы могут быть линейными или разветвленными и могут быть замещенными, как здесь указано. Когда здесь применен подстрочный индекс после атома углерода, этот индекс относится к числу атомов углерода, которое может содержать названная группа. Таким образом, например, C1-6-алкил включает все линейные, разветвленные алкильные группы с числом атомов углерода от 1 до 6 и, таким образом, включает, например, такие как метил, этил, нпропил, изопропил, 2-метилэтил, бутил и их изомеры (например, н-бутил, изобутил и трет-бутил), пентил и его изомеры, гексил и его изомеры и тому подобное. Термин "C1-4-алкил" в качестве группы или части группы относится к углеводородному радикалу формулы CnH2n+1, где n является числом от 1 до 4. C1-4-алкильные группы содержат от 1 до 4 атомов углерода, предпочтительно от 1 до 3 атомов углерода, более предпочтительно 1-2 атом(а) углерода. C1-4 алкил включает все линейные, разветвленные алкильные группы с числом атомов углерода от 1 до 4 и,таким образом, включает, например, такие как метил, этил, н-пропил, изопропил, 2-метилэтил, бутил и его изомеры (например, н-бутил, изобутил и трет-бутил) и тому подобное. Термин "С 2-6-алкил" в качестве группы или части группы относится к углеводородному радикалу формулы CnH2n+1, где n является числом в интервале от 2 до 6. С 2-6-алкильные группы содержат от 2 до 6 атомов углерода, в частности от 2 до 4 атомов углерода, более конкретно 2-3 атома углерода. Алкильные группы могут быть линейными или разветвленными и могут быть замещенными, как здесь указано. Когда здесь применен подстрочный индекс после атома углерода, этот индекс относится к числу атомов углерода, которое может содержать названная группа. Таким образом, например, С 2-6-алкил включает все линейные, разветвленные алкильные группы с числом атомов углерода от 2 до 6 и, таким образом, включает, например, такие как этил, н-пропил, изопропил, 2-метилэтил, бутил и их изомеры (например, нбутил, изобутил и трет-бутил), пентил и его изомеры, гексил и его изомеры и тому подобное. Термин "C1-6-алкилокси" в качестве группы или части группы относится к радикалу, имеющему формулу ORb, где ORb является C1-6-алкилом. Не ограничивающие примеры подходящих алкилокси включают метилокси, этилокси, пропилокси, изопропилокси, бутилокси, изобутилокси, втор-бутилокси,трет-бутилокси, пентилокси и гексилокси. Термин "C1-4-алкилокси" в качестве группы или части группы относится к радикалу, имеющему формулу ORc, где ORc является C1-4-алкилом. Не ограничивающие примеры подходящих C1-4-алкилокси включают метилокси (также метокси), этилокси (также этокси), пропилокси, изопропилокси, бутилокси,изобутилокси, втор-бутилокси, трет-бутилокси. В структуре этой заявки C2-6-алкенил представляет линейный или разветвленный углеводородный радикал, имеющий от 2 до 6 атомов углерода, содержащий двойную связь, такой как этенил, пропенил,бутенил, пентенил, 1-пропен-2-ил, гексенил и тому подобное. Термин "цикло-C3-7-алкил" отдельно или в сочетании, относится к циклическому насыщенному углеводородному радикалу, имеющему от 3 до 7 атомов углерода. Не ограничивающие примеры подходящих цикло-C3-7-алкилов включают циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Термин "C1-3-алкандиил" в качестве группы или части группы определяет дивалентные насыщенные углеводородные радикалы с прямой или разветвленной цепью, имеющие от 1 атома до 3 атомов углерода, такие как, например, метилен или метандиил, этан-1,2-диил, пропан-1,3-диил, пропан-1,2-диил и тому подобное. Термин "C2-6-алкандиил" в качестве группы или части группы определяет дивалентные насыщенные углеводородные радикалы с прямой или разветвленной цепью, имеющие от 2 атома до 6 атомов углерода, такие как, например, этан-1,2-диил, пропан-1,3-диил, пропан-1,2-диил, бутан-1,4-диил, пентан 1,5-диил, гексан-1,6-диил, 2-метанбутан-1,4-диил, 3-метилпентан-1,5-диил и тому подобное. В конкретном воплощении C1-3-алкандиил и C2-6-алкандиил определяют дивалентные насыщенные углеводородные радикалы с прямой цепью. Термин "С 2-6-алкендиил" в качестве группы или части группы определяет дивалентные углеводородные радикалы с прямой или разветвленной цепью, содержащие одну двойную связь и имеющие от 2 до 6 атомов углерода, такие как, например, 1,2-этендиил, 2-пропендиил, 3-бутендиил, 2-пентендиил, 3 пентендиил, 3-метил-2-бутендиил и тому подобное. В конкретном воплощении C2-6-алкендиил определяет дивалентные углеводородные радикалы с прямой цепью. Термин "тиофенил" эквивалентен термину "тиенил". Когда L1 определен, например, как NH-(C=O), это означает, что азот связан с 6-членной кольцевой структурой, содержащей А 1, А 2, А 3 и А 4, и что карбонильная группа связана с тиазольной группой. Когда L1 определяют как, например, (C=O)-NH, это означает, что карбонильная группа связана с 6 членной кольцевой структурой, содержащей А 1, А 2, А 3 и А 4, и что азот связан с тиазольной группой. Когда L2 определяют как, например, NR13b-С 1-3-алкандиил, это означает, что азот NR13b связан с-4 022093 триазольной группой, a C1-3-алкандиил связан с группой R2. Когда L2 определяют как, например, С 1-3-алкандиил-NR13c, это означает, что C1-3-алкандиил связан с триазольной группой, и что азот NR13c связан с группой R2. Символ означает место присоединения к остальной молекуле. Химические названия соединений данного изобретения были образованы по правилам номенклатуры, согласованным с Химической реферативной службой с применением программного обеспечения по номенклатуре Advanced Chemical Development Inc. (ACD/name product, версия 10.01; конструкция 15494,1 декабря 2006 г). В случае таутомерных форм должно быть ясно, что другая неописанные таутомерная форма также включена в объем данного изобретения. Когда любая переменная встречается более одного раза в любом компоненте, каждое определение является независимым. Будет понятно, что некоторые из соединений формулы (I) и их фармацевтически приемлемые соли и стереомерные формы могут содержать один или несколько центров хиральности и существуют в виде стереоизомерных форм. Термин "стереоизомерные формы" в соответствии с данным описанием определяет все возможные изомерные формы, которыми могут обладать соединения формулы (I). Если не упомянуто или не указано иное, химическое название соединений означает смесь всех стереохимически возможных изомерных форм. Более конкретно, стереогенные центры могут иметь R- и S-конфигурацию; заместители дивалентных циклических (частично) насыщенных радикалов могут иметь или цис-, или транс-конфигурацию. Соединения, включающие двойные связи, могут иметь Е- и Z-стереохимию при указанной двойной связи. Стереоизомерные формы соединений формулы (I) охватываются объемом данного изобретения. Когда указана конкретная стереоизомерная форма, это означает, что указанная форма является, по существу, свободной, т.е. сочетается с менее чем 50%, предпочтительно менее чем 20%, более предпочтительно менее чем 10%, еще более предпочтительно менее чем 5%, и еще предпочтительнее менее чем 2%, а наиболее предпочтительно менее чем 1% другого(их) изомера(ов). Когда указана конкретная пространственно изомерная форма, это означает, что указанная форма является, по существу, свободной, т.е. ассоциируется с менее чем 50%, предпочтительно менее чем 20%,более предпочтительно менее чем 10%, еще предпочтительнее менее чем 5% и еще предпочтительнее менее чем 2%, а наиболее предпочтительно менее чем 1% другого(их) изомера(ов). Для терапевтического применения соли соединений формулы (I) являются теми, в которых противоион является фармацевтически приемлемым. Однако соли кислот и оснований, которые являются фармацевтически неприемлемыми, также могут найти применение, например, при получении или очистке фармацевтически приемлемого соединения. Все соли, являются ли они фармацевтически приемлемыми или нет, включены в объем данного изобретения. Фармацевтически приемлемые соли кислот и оснований, которые упомянуты выше или далее, как подразумевается, включают терапевтически активные нетоксические формы солей с присоединением кислоты и основания, которые способны образовывать соединения формулы (I). Фармацевтически приемлемые соли с присоединением кислоты можно легко получить путем воздействия на форму основания такой подходящей кислотой. Соответствующие кислоты включают, например, неорганические кислоты, такие как галогенводородные кислоты, например, соляную или бромисто-водородную кислоту, серную, азотную, фосфорную и тому подобные кислоты; или органические кислоты, такие как, например, уксусная, пропановая, гликолевая, молочная, пировиноградная, щавелевая (т.е. этандикарбоновая), малоновая, янтарная (т.е. бутандикарбоновая кислота), малеиновая, фумаровая, яблочная, виннокаменная, лимонная, метансульфоновая,этансульфоновая,бензолсульфоновая,п-толуолсульфоновая,цикламовая,салициловая,паминосалициловая, памовая и тому подобные кислоты. И наоборот, указанные солевые формы можно превратить путем воздействия соответствующим основанием в форму свободного основания. Соединения формулы (I), содержащие протон кислоты, можно также превратить в их нетоксичные формы солей с металлами или аминами путем воздействия соответствующих органических и неорганических оснований. Соответствующие формы солей с основаниями включают, например, соли аммония,соли щелочных и щелочно-земельных металлов, например соли лития, натрия, калия, магния, кальция и тому подобное, соли с органическими основаниями, например с первичными, вторичными и третичными алифатическими и ароматическими аминами, такими как метиламин, этиламин, пропиламин, изопропиламин, четыре изомера бутиламина, диметиламин, диэтиламин, диэтаноламин, дипропиламин, диизопропиламин, ди-н-бутиламин, пирролидин, пиперидин, морфолин, триметиламин, триэтиламин, трипропиламин, хинуклидин, пиридин, хинолин и изохинолин; бензатин, N-метил-D-глюкамин, соли гидрабамина, и соли с аминокислотами, такими как, например, аргинин, лизин и тому подобное. И наоборот,форму соли можно превратить путем воздействия кислотой в форму свободной кислоты. Соединения формулы I, которые получены при процессах, описанных ниже, можно синтезировать в виде рацемических смесей энантиомеров, которые могут быть отделены один от другого по известным методам разделения. Способы разделения энантиомерных форм данных соединений формулы I включа-5 022093 ют жидкостную хроматографию с применением хиральной стационарной фазы. Указанные стереохимически чистые изомерные формы также могут быть также получены из соответствующих стереохимически чистых изомерных форм соответствующих исходных веществ, при условии, что реакция происходит стереоспецифически. Предпочтительно, когда желателен специфический стереоизомер, чтобы указанное соединение синтезировали бы стереоспецифическими методами получения. При этих методах преимущественно нужно применять чистые по определенному энантиомеру исходные вещества. В рамках этой заявки соединение по данному изобретению, по сути, как подразумевается, включает все изотопные сочетания его химических элементов. В рамках этой заявки химический элемент, в частности, когда упоминается в отношении соединения по формуле (I), включает все изотопы и смеси изотопов этого элемента. Например, когда упоминается водород, подразумевается, что это относится к 1H, 2 Н,3 Н и их смеси. Соединение по данному изобретению поэтому по сути включает соединение с одним или несколькими изотопами одного или нескольких элементов и их смесей, включая радиоактивное соединение,также называемое радиоактивно меченым соединением, в котором один или несколько нерадиоактивных атомов заменены одним или несколькими радиоактивными изотопами. Под термином "радиоактивно меченое соединение" подразумевается любое соединение по формуле (I), или его фармацевтически приемлемая соль, которая содержит по меньшей мере один радиоактивный атом. Например, соединение может быть меченым позитроном или гамма-излучающими радиоактивными изотопами. Для методик связывания радиолигандов предпочтительными для замены атомами являются атом 3 Н или атом 125I. Для получения изображения наиболее часто используемыми излучающими позитроны (ПИ; PET) радиоактивными изотопами являются 11 С, 18F, 15O и 13N, все из которых получают на ускорителе и имеют периоды полураспада в 20, 100, 2 и 10 мин (мин) соответственно. Так как периоды полураспада этих радиоактивных изотопов являются такими короткими, их можно применять только в институтах, которые имеют ускоритель на месте их производства, с ограничением, таким образом, их применения. Наиболее широко используемыми из этих изотопов являются 18F, 99mTc, 201Tl и 123I. Манипуляции с этими радиоактивными изотопами, их производство, выделение и включение в молекулу известны специалистам в данной области. В частности, радиоактивный атом выбирают из группы из водорода, углерода, азота, серы, кислорода и галогена. В частности, радиоактивный изотоп выбирают из группы из 3 Н, 11 С, 18F, 122I, 123I, 125I, 131I,75Br, 76Br, 77Br, и 82Br. В соответствии с данным описанием и прилагаемой формулой изобретения формы единственного числа включают также множественные объекты, если контекст четко не требует иного. Например, соединение означает 1 соединение или более 1 соединения. Термины, описанные здесь, и другие термины, используемые в описании, вполне понятны специалистам в данной области. Теперь будут представлены предпочтительные характерные признаки соединений данного изобретения. В одном из воплощений данное изобретение относится к новым соединениям формулы (I)L1 представляет NR10, NH-(C=O) или (C=O)-NH; где R10 представляет водород или C1-4-алкил;R1 представляет цикло-C3-7-алкил; C2-6-алкенил или C1-6-алкил, необязательно замещенный 1-4 заместителями, причем каждый независимо выбран из группы, состоящей из 1-пирролидинила, NR11aR12a, иR2 представляет пирролидинил; пиперидинил; морфолинил; пиперазинил; цикло-C3-7-алкил; гексагидро-1H-1,4-диазепин-1-ил; 3,4-дигидро-2(1H)-изохинолинил; 1,2-дигидропиридинил; или Ar; где пирролидинил, пиперидинил, морфолинил, пиперазинил, цикло-C3-7-алкил, гексагидро-1H-1,4 диазепин-1-ил, 3,4-дигидро-2(1H)-изохинолинил, и 1,2-дигидропиридинил могут быть замещенными 1-4 заместителями, каждый из которых независимо выбран из группы, состоящей из цикло-C3-7-алкила, C1-4 алкилкарбонила, гидроксила, оксо, галогена, C1-4-алкилокси, C1-4-алкилокси-C1-4-алкила, C1-4 алкилоксикарбонила, Ar и C1-4-алкила, необязательно замещенного 1-4 галогеновыми заместителями; где каждый Ar независимо является фенилом, необязательно замещенным 1-4 заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, C1-4-алкилокси, циано, NR11bR12b,морфолинила, C1-4-алкилокси, замещенного 1-4 галогеновыми заместителями, и C1-4-алкила, необязательно замещенного 1-4 галогеновыми заместителями; каждый R11a, R11b и R11c независимо представляет водород, С 1-4-алкил или C1-4-алкилкарбонил; каждый R12a, R12b и R12c независимо представляет водород или C1-4-алкил;R13a представляет водород; и их фармацевтически приемлемым солям и их гидратам. Еще одно воплощение данного изобретения относится к тем соединениям формулы (I) или любой их подгруппе, которые упомянуты в любом из других воплощений, при которых R9 является водородом или C1-4-алкилокси; в частности C1-4-алкилокси. Еще одно воплощение данного изобретения относится к тем соединениям формулы (I) или любой их подгруппе, которые упомянуты в любом из других воплощений, при которых по меньшей мере один из А 1, А 2, А 3 и А 4 является другой группой, а не CH. Еще одно воплощение данного изобретения относится к тем соединениям формулы (I) или любой их подгруппе, которые упомянуты в любом из других воплощений, при которых по меньшей мере один из А 1, А 2, А 3 и А 4 является N; предпочтительно, когда точно один из А 1, А 2, А 3 и А 4 является N. В еще одном воплощении данное изобретение относится к тем соединениям формулы (I) или любой их подгруппе, которая упоминается в любом из других воплощения, причем А 3 и А 4 являются CH. В еще одном воплощении данное изобретение относится к тем соединениям формулы (I) или любой их подгруппе, которая упоминается в любом из других воплощения, причем максимум один из А 1, А 2, А 3 и А 4 является N. В еще одном воплощении данное изобретение относится к тем соединениям формулы (I) или любой их подгруппе, которая упоминается в любом из других воплощений, причем пирролидинил является 1 пирролидинилом, пиперидинил является 1-пиперидинилом, а морфолинил является 4-морфолинилом. В одном из воплощений данное изобретение относится к тем соединениям формулы (I) и их стереоизомерным формам, или любой их подгруппе, которая упомянута в любом из других воплощений, при которых L2 является О или ковалентной связью; в частности О. В одном из воплощений данное изобретение относится к тем соединениям формулы (I) и их стереоизомерным формам, или любой их подгруппе, которая упомянута в любом из других воплощений, при которых L2 является О или ковалентной связью, в частности О, и R2 является пиперидинилом, замещенным одной трифторметильной группой; в частности R2 является 1-пиперидинил, замещенный одной трифторметильной группой В одном из воплощений данное изобретение относится к тем соединениям формулы (I) и их стереоизомерным формам, или любой их подгруппе, которая упомянута в любом из других воплощений, при которых пирролидинил является 1-пирролидинилом, пиперидинил является 1-пиперидинилом, морфолинил является 4-морфолинилом, пиперазинил является 1 пиперазинилом. В одном из воплощений данное изобретение относится к тем соединениям формулы (I) и их стереоизомерным формам, или любой их подгруппе, которая упомянута в любом из других воплощений, при которых L1 представляет NR10, NH-(C=O) или (C=O)-NH; где R10 является C1-4-алкилом. В одном из воплощений данное изобретение относится к тем соединениям формулы (I) и их стереоизомерным формам, или любой их подгруппе, которая упомянута в любом из других воплощений, при которых R2 является Ar; в частности, R2 является фенилом, необязательно замещенным одним или несколькими заместителями, каждый из которых независимо выбран из галогена или трифторметила; более конкретно, R2 является фенилом, замещенным одним заместителем, выбранным из галогена или трифторметила; предпочтительно, R2 является фенилом, замещенным одним атомом хлора, наиболее предпочтительно, R2 является фенилом, замещенным одним атомом хлора в орто-положении. В одном из воплощений данное изобретение относится к тем соединениям формулы (I) и их стереоизомерным формам, или любой их подгруппе, которая упомянута в любом из других воплощений, при которыхL2 является прямой связью или О; в частности, прямой связью; иR2 является фенилом или пиперидинилом, причем оба замещены одним заместителем в орто- или мета-положении, причем указанный заместитель выбран из группы, состоящей из галогена и трифторметила; в частности R2 является фенилом или пиперидинилом, причем фенил или пиперидинил замещены одной трифторметильной группой в орто- или мета-положении. В одном из воплощений данное изобретение относится к тем соединениям формулы (I) и их стереоизомерным формам, или любой их подгруппе, которая упомянута в любом из других воплощений, при которых каждый Ar независимо является фенилом, необязательно замещенным одним или несколькими заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, C1-4 алкилокси, циано, NR11bR12b, морфолинила, C1-4-алкилокси, замещенного одним или несколькими галогеновыми заместителями, и С 1-4-алкила, необязательно замещенного одним или несколькими галогеновыми заместителями. В одном из воплощений данное изобретение относится к тем соединениям формулы (I) и их стереоизомерным формам, или любой их подгруппе, которая упомянута в любом из других воплощений, при которых R1 является C1-4-алкилом, предпочтительно, C1-4-алкилом; более предпочтительно, изопропилом. В одном из воплощений данное изобретение относится к тем соединениям формулы (I) или любой их подгруппе, которая упомянута в любом из других воплощений, при которых применяются следующие ограничения: R2 представляет пирролидинил, тетрагидрофуранил; пиперидинил; тетрагидропиранил; морфолинил; пиперазинил; цикло-C3-7-алкил; 1,3-дигидро-2 Н-изоиндол-2-ил; 2,3-дигидро-1H-индол-1 ил; 3,4-дигидро-1(2 Н)-хинолинил; 3,4-дигидро-2(1H)-изохинолинил; 1,2-дигидропиридинил; инданил; 1,3-бензодиоксолил или Ar; где пирролидинил, тетрагидрофуранил, пиперидинил, тетрагидропиранил,морфолинил, пиперазинил, цикло-C3-7-алкил, 1,3-дигидро-2 Н-изоиндол-2-ил, 2,3-дигидро-1H-индол-1-ил,3,4-дигидро-1(2 Н)-хинолинил, 3,4-дигидро-2(1H)-изохинолинил, 1,2-дигидропиридинил, инданил и 1,3 бензодиоксолил могут быть замещенными одним или несколькими заместителями, каждый из которых независимо выбран из группы, состоящей из C2-6-алкенила, С 1-4-алкилкарбонила, галогена, C1-4 алкилокси, C1-4-алкилоксикарбонила, Ar и C1-4-алкила, необязательно замещенного одним или несколькими галогеновыми заместителями; причем каждый Ar независимо является фенилом, необязательно замещенным одним или несколькими заместителями, каждый из которых независимо выбран из группы,состоящей из галогена, C1-4-алкшюкси, циано, NR11bR12b, морфолинила и C1-4-алкила, необязательно замещенного одним или несколькими галогеновыми заместителями. В еще одном из воплощений данное изобретение относится к тем соединениям формулы (I) или любой их подгруппе, которая упомянута в любом из других воплощений, при которых применяются следующие ограничения:R2 представляет пирролидинил, тетрагидрофуранил; пиперидинил; тетрагидропиранил; морфолинил; пиперазинил; цикло-C3-7-алкил; 1,3-дигидро-2 Низоиндол-2-ил; 2,3-дигидро-1H-индол-1-ил; 3,4-дигидро-1(2 Н)-хинолинил; 3,4-дигидро-2(1H)изохинолинил; 1,2-дигидропиридинил; инданил; 1,3-бензодиоксолил; где пирролидинил, тетрагидрофуранил, пиперидинил, тетрагидропиранил, морфолинил, пиперазинил, цикло-C3-7-алкил, 1,3-дигидро-2 Н-изоиндол-2-ил, 2,3-дигидро-1H-индол-1-ил, 3,4-дигидро-1(2 Н)хинолинил, 3,4-дигидро-2(1H)-изохинолинил, 1,2-дигидропиридинил, инданил и 1,3-бензодиоксолил могут быть замещенными одним или несколькими заместителями, каждый из которых независимо выбран из группы, состоящей из C2-6-алкенила, C1-4-алкилкарбонила, оксо, галогена, C1-4-алкилокси, C1-4 алкилоксикарбонила, Ar и C1-4-алкила, необязательно замещенного одним или несколькими галогеновыми заместителями; в частности C2-6-алкенила, C1-4-алкилкарбонила, галогена, С 1-4-алкилокси, C1-4 алкилоксикарбонила или C1-4-алкила, необязательно замещенного одним или несколькими галогеновыми заместителями. В одном из воплощений данное изобретение относится к тем соединениям формулы (I) и их стереоизомерным формам, или любой их подгруппе, которая упомянута в любом из других воплощений,при которых R1 представляет цикло-C3-7-алкил; C2-6-алкенил; или C1-6-алкил, необязательно замещенный одним или несколькими заместителями, причем каждый независимо выбран из группы, состоящей из галогена, циано, 1-пирролидинила, 1-пиперидинила, 4-морфолинила, NR11aR12a, цикло-C3-7-алкила и C1-6-алкилокси; где каждый цикло-C3-7-алкил может быть замещенным одним или несколькими заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, C1-6-алкилокси, циано и C1-4 алкила, необязательно замещенного одним или несколькими галогеновыми заместителями;C1-3-алкандиил-NR13c; C1-3-алкандиил, необязательно замещенный одним или несколькими галогеновыми заместителями; или C1-3-алкандиил, где два атома водорода у одного углерода могут быть заменены C2-6 алкандиилом;R2 представляет пирролидинил, тетрагидрофуранил; пиперидинил; тетрагидропиранил; морфоли-8 022093 нил; пиперазинил; цикло-C3-7-алкил; гексагидро-1H-1,4-диазепин-1-ил; 1,3-дигидро-2 Н-изоиндол-2-ил; 2,3-дигидро-1H-индол-1-ил; 3,4-дигидро-1(2 Н)-хинолинил; 3,4-дигидро-2(1H)-изохинолинил; 2-оксо-5(трифторметил)-1(2 Н)-пиридинил; инданил; 1,3-бензодиоксолил или Ar; где пирролидинил, тетрагидрофуранил, пиперидинил, тетрагидропиранил, морфолинил, пиперазинил, цикло-C3-7-алкил, гексагидро-1H-1,4-диазепин-1-ил, 1,3-дигидро-2 Н-изоиндол-2-ил, 2,3-дигидро-1Hиндол-1-ил, 3,4-дигидро-1(2 Н)-хинолинил, 3,4-дигидро-2(1H)-изохинолинил, инданил и 1,3 бензодиоксолил могут быть замещенными одним или несколькими заместителями, каждый из которых независимо выбран из группы, состоящей из C2-6-алкенила, цикло-C3-7-алкила, С 1-4-алкилкарбонила, гидроксила, галогена, C1-4-алкилокси, С 1-4-алкилокси-С 1-4-алкила, C1-4-алкилоксикарбонила, Ar и C1-4-алкила,необязательно замещенного одним или несколькими галогеновыми заместителями; где каждый Ar независимо является фенилом, необязательно замещенным одним или несколькими заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, С 1-4 алкилокси, циано, NR11bR12b, морфолинила, C1-4-алкилокси, замещенного одним или несколькими галогеновыми заместителями, и C1-4-алкила, необязательно замещенного одним или несколькими галогеновыми заместителями; или 5- или 6-членным гетероарилом, выбранным из группы, состоящей из фуранила,тиофенила, пиразолила, оксазолила, изооксазолила, тиазолила, изотиазолила, тиадиазолила, оксадиазолила, пиридинила, пиримидинила, пиридазинила и пиразинила,где указанный 5- или 6-членный гетероарил может быть замещенным одним или несколькими заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, C1-4-алкилокси,циано, NR11cR12c, морфолинила и C1-4-алкила, необязательно замещенного одним или несколькими галогеновыми заместителями. В еще одном из воплощений данное изобретение относится к тем соединениям формулы (I) или любой их подгруппе, которая упомянута в любом из других воплощений, при которых L2 представляет прямую связь. В еще одном из воплощений данное изобретение относится к тем соединениям формулы (I) или любой их подгруппе, которая упомянута в любом из других воплощений, при которых Het1 является гетероциклом, имеющим формулу (а-1). В еще одном из воплощений данное изобретение относится к тем соединениям формулы (I) или любой их подгруппе, которая упомянута в любом из других воплощений, при которых R4, R5, R6 и R8,каждый независимо, представляют водород или C1-4-алкил. В одном из воплощений данное изобретение относится к тем соединениям формулы (I) и их стереоизомерным формам, или любой их подгруппе, которая упомянута в любом из других воплощений, при которых L1 представляет NH. В одном из воплощений данное изобретение относится к тем соединениям формулы (I) и их стереоизомерным формам, или любой их подгруппе, которая упомянута в любом из других воплощений, при которых L2 представляет прямую связь; C2-6-алкендиил, карбонил; О; S; S(=O)p; NR13a; NR13b-С 1-3 алкандиил; C1-3-алкандиил-NR13c или С 1-3-алкандиил, необязательно замещенный одним или несколькими галогеновыми заместителями; где p имеет значение 1 или 2. В одном из воплощений данное изобретение относится к тем соединениям формулы (I) или любой их подгруппе, которая упомянута в любом из других воплощений, при которых структура гетероцикла В еще одном из воплощений данное изобретение относится к тем соединениям формулы (I) или любой их подгруппе, которая упомянута в любом из других воплощений, при которых выражение "на одной или нескольких CH2 групппах" ограничено до "на одной или двух группах CH2". В одном из воплощений соединение формулы (I) выбрано из группы, включающей: их стереомерные формы и их фармацевтически приемлемые соли, свободные основания и сольваты. Все возможные комбинации вышеуказанных интересующих воплощений, как подразумевается, охватываются объемом данного изобретения. Получение соединений Данное изобретение охватывает также способы получения соединений формулы (I) и их подгрупп. При описанных реакциях может быть необходимо защитить реактивные функциональные группы, например, гидрокси, амино или карбоксигруппы, где они желательны в конечном продукте, чтобы исключить их нежелательное участие в реакциях. Можно применять общепринятые защитные группы в соответствии со стандартной практикой, например, см. T.W. Greene и P.G.M. Wuts в "Protective Groups in Organic Chemistry", John Wiley and Sons, 1999. Соединения формулы (I) и их подгруппы можно получить по последовательности стадий, которые описаны ниже. Их обычно получают из исходных веществ, которые доступны для приобретения или получают стандартными средствами, очевидными для специалистов в данной области. Соединения данного изобретения можно также получить, используя стандартные процессы синтеза, обычно используемые в области органической химии. Общее получение некоторых типичных примеров представлено ниже. Все переменные имеют определения, представленные выше, если не указано иначе. Экспериментальная методика 1. В основном, соединения формулы (I), где L1 представляет NH, таким образом, называемые соединениями формулы (I-а), могут быть получены, как представлено ниже, на схеме 1, причем галоген определяют как Cl, Br или I, и где все переменные имеют определения, которые приведены выше: Схема 1 Соединения формулы (I-а) могут быть получены путем реакции присоединения между промежуточным соединением формулы (II) и промежуточным соединением формулы (III) или, альтернативно,путем реакции присоединения между промежуточным соединением формулы (IV) и промежуточным соединением формулы (V) (схема 1). Эта реакция может быть выполнена в присутствии подходящего основания, такого как, например, Cs2CO3 или трет-бутоксид натрия. Реакция может быть выполнена в реакционно инертном растворителе, таком как, например, толуол, ДМФ, трет-бутанол (t-BuOH) или диоксан. Реакцию обычно выполняют в присутствии катализаторной системы, состоящей из подходящего катализатора, такого как ацетат палладия(II) (Pd(OAc)2) или трис(дибензилиденацетон)дипалладий(Pd2(dba)3) и лиганда, такого как (9,9-диметил-9 Н-ксантен-4,5-диил)бис(дифенилфосфин) (Xantphos),[1,1'-бинафтален]-2,2'-диил-бис[дифенилфосфин] (БИНАФ; BINAP) или дициклогексил-[2',4',6'-трис(1 метилэтил)-[1,1'-бифенил]-2-ил]-фосфин (Х-фос; X-phos). Предпочтительно проводить эту реакцию в- 18022093 инертной атмосфере, такой как азот или аргон. Скорость реакции и выход могут быть повышены микроволновым нагреванием. Экспериментальная методика 2. Соединения формулы (I), где L1 представляет (C=O)-NH, таким образом, называемые соединениями формулы (I-b), могут быть получены по стандартной реакции образования амидной связи с применением промежуточного соединения формулы (V) в качестве источника амина и промежуточного соединения формулы (VI) в качестве источника карбоновой кислоты. Альтернативно соединения формулы (I-b) могут быть получены по катализируемой Pd реакции введения СО между промежуточным соединением формулы (IV) и промежуточным соединением формулы (V). Обе методики синтеза иллюстрируются на схеме 2, где Halo определен как Cl, Br или I и где все другие переменные имеют определения, которые приведены ранее. Перемешивание при повышенной температуре (например, 150C) и/или давление может повысить скорость реакции. В реакционную среду можно нагнетать газ СО, и данная реакция может обычно выполняться в органическом растворителе, таком как ТГФ. Реакция может катализироваться с помощью источника Pd, такого как, например, тетракис(трифенилфосфин)палладий (Pd(PPh3)4),Pd(OAc)2 или Pd2(dba)3, связанного с соответствующим лигандом. Схема 2 Экспериментальная методика 3. Соединения формулы (I), где L1 представляет NH-(С=О), таким образом, называемые соединениями формулы (I-b), могут быть получены по катализируемой Pd реакции введения СО между промежуточным соединением формулы (III) и промежуточным соединением формулы (II) в соответствии со схемой 3, где Halo определен как Cl, Br или I и где все переменные имеют определения, которые приведены выше. Перемешивание при повышенной температуре (например, 150C) и/или давлении может повышать скорость реакции. В реакционную среду нагнетается газ СО, и данная реакция обычно выполняется в органическом растворителе, таком как ТГФ. Реакция может катализироваться с помощью источника Pd,такого как, например, Pd(OAc)2 или Pd2(dba)3 или Pd(PPh3)4. К реакционной смеси может быть добавлен соответствующий лиганд. Схема 3 Альтернативно, соединение формулы (I-c) может быть получено по стандартной реакции образования амидной связи с применением источника амина формулы (II) и соответствующего производного карбоновой кислоты промежуточного соединения формулы (III). Эта реакция может быть выполнена при типичных условиях реакции, подобным условиям, описанным в экспериментальной методике 2. Экспериментальная методика 4. Промежуточное соединение формулы (IV), где все переменные имеют определения, которые приведены ранее, могут быть получены путем превращения аминогруппы в промежуточном соединении формулы (II) в галогенную группу, известного как реакция Сандмейера (Sandmeyer) (схема 4). На схеме 4Halo определен как Cl, Br или I, и где все переменные имеют определения, которые приведены выше. Промежуточное соединение (II) сначала превращают в соответствующую соль диазония путем взаимодействия с источником нитрита, таким как NaNO2 в кислых условиях, затем воздействием источником галогенида, таким как, например, KI, CuBr или CuCl. Можно применять типичные условия реакции, известные специалистам в данной области. Схема 4 Экспериментальная методика 5. Промежуточное соединение формулы (II), где все переменные имеют определения, которые приве- 19022093 дены ранее, могут быть получены путем восстановления промежуточного соединения формулы (VII) в соответствии со схемой 5. Восстановление промежуточного соединения формулы (VII) до промежуточного соединения формулы (II) может быть проведено общепринятым методом, таким как восстановительное гидрирование, восстановление металлом или солью металла и кислотой [например, таким металлом, как Fe или такой солью металла, как SnCl2, и такой кислотой, как неорганическая кислота (HCl,H2SO4 или тому подобное) или органическая кислота (уксусная кислота и тому подобное)]. Альтернативно можно применять другие хорошо известные методы для превращения нитрогруппы в соответствующий ей амин. Схема 5 Экспериментальная методика 6. Промежуточные соединения формулы (VII) или (II), где значение Het1 ограничено гетероциклами,имеющими формулу (а-1), где Ra определен NO2 или NH2 и где другие переменные имеют определения,которые приведены ранее, и таким образом, называемые промежуточным соединением формулы (X),могут быть получены путем нуклеофильного ароматического замещения промежуточного соединения формулы (IX) промежуточным соединением формулы (VIII) в соответствии со схемой 6, где LG определена как удаляемая группа, такая как, например, F, Cl, Br, I, тозилат, мезилат или трифлат, в частности, F,Cl, Br или I, более конкретно, Cl, Br или I; и где все другие переменные имеют значения, приведенные выше. Данную реакцию можно осуществить в инертной атмосфере, такой как, например, N2. Перемешивание при повышенной температуре (например, между 70-170C) и/или давлении может повышать скорость реакции. Данную реакцию обычно выполняют в органическом растворителе, таком как ДМСО,ДМФ или NMП (N-метилпирролидинон) в присутствии основания, такого как K2CO3, Cs2CO3 или Et3N. Данную реакцию можно осуществить в присутствии медного катализатора. Соли меди, такие как,например, Cu2O, CuI или CuBr могут применяться в каталитических или стохиометрических количествах. Схема 6 Экспериментальная методика 7. Промежуточное соединение формулы (VII), где значение Het1 ограничено оксазолом, замещенным 6R , таким образом, поименованное промежуточным соединением формулы (XIII), может быть получено путем реакции конденсации промежуточного соединения формулы (XI) с промежуточным соединением формулы (XII), как проиллюстрировано на схеме 7. Промежуточное соединение (XI) может быть доступно для приобретения или может быть получено по обычным реакционным методикам, в основном известным специалистам в данной области. Эту реакцию конденсации выполняют в присутствии подходящего основания, такого как, например, K2CO3 или этоксид натрия (NaOEt). Реакция может быть выполнена в протонном растворителе, таком как, например, метанол (MeOH) или этанол (EtOH). Перемешивание и/или повышенная температура (например, между 70 и 110C) могут повышать скорость реакции. На схеме 7 все переменные имеют определения, которые приведены здесь, выше. Схема 7 Экспериментальная методика 8. Промежуточное соединение формулы (VII), где значение Het1 ограничено оксазолом, замещенным 5R в положении 2 и CH3 в положении 4, таким образом, поименованной промежуточным соединением формулы (XIV), может быть получено путем реакции конденсации промежуточного соединения формулы (XI) с промежуточным соединением формулы (XV) в соответствии со схемой 8, где все переменные имеют определения, которые приведены здесь ранее. Оба промежуточные соединения могут быть доступны для приобретения или могут быть получены по общепринятым реакционным методикам, в основном известным специалистам в данной области. Эту реакцию конденсации обычно можно выполнять в таком растворителе, как пиридин. Перемешивание и/или повышенная температура (например, между 70- 20022093 и 110C) могут повышать скорость реакции. Схема 8 Экспериментальная методика 9. Промежуточные соединения формулы (VII) или (II), где значение Het1 ограничено гетероциклами(а-2), (а-3) или (а-4), и таким образом, называемые промежуточным соединением формулы (XVII), могут быть получены по реакции перекрестного связывания Сузуки-Мияура (Suzuki-Miyaura) между промежуточным соединением формулы (XVI), где значение Het1 ограничено гетероциклом по формуле (а-2), (а-3) или (а-4) и промежуточным соединением (IX), где Ra может быть NO2 или NH2 в соответствии со схемой 9. В формуле (IX) LGa определена как удаляемая группа, такая как, например, Cl, Br, I, тозилат, мезилат или трифлат, в частности, Cl, Br или I, и в формуле (XVI) B(OR)2 относится к бороновой кислоте В(ОН)2 или ее соответствующему боронатному эфиру, такому как пинаколовый эфир. Эта реакция катализируется Pd катализатором, таким как, например, Pd(PPh3)4 или [1,1'-бис(дифенилфосфино-P) ферроцен]дихлорпалладий (PdCl2(dppf. Реакция осуществляется в присутствии подходящего основания, такого как, например, K2CO3 илиK3PO4, и в реакционно инертном растворителе, таком как толуол, ДМФ, MeCN, и он может также включать H2O. Перемешивание при повышенной температуре (например, между 50 и 120C) и/или давлении может повышать скорость реакции, что можно осуществить, используя микроволновое излучение или путем обычного нагревания. Схема 9 Экспериментальная методика 10. Промежуточное соединение формулы (IV), где по меньшей мере один из А 1 или А 3 представляет N,и где значение Het1 ограничено формулой (а-1), и где все другие переменные имеют определения, которые приведены ранее, таким образом, называемые промежуточным соединением формулы (XIX), может быть получено путем нуклеофильного ароматического замещения промежуточного соединения формулы(XVIII), где по меньшей мере один из А 1 или А 3 представляет N, необязательно замещенный имидазолом или триазолом формулы (VIII) в соответствии со схемой 10, где LG имеет определение, приведенное ранее, где Halo определена как Br, Cl или I и где все другие заместители имеют определения, приведенные ранее. Реакция может быть выполнена при условиях, подобных условиям, которые описаны для экспериментальной методики 4. Схема 10 Экспериментальная методика 11. Промежуточное соединение формулы (IV), где Het1 представляет группу формулы (а-1), где значение Xa ограничено CH и где все другие переменные имеют определения, которые приведены ранее, и таким образом называемые промежуточным соединением формулы (XXIV), может быть получено путем ацилирования промежуточного соединения (XX) с получением промежуточного соединения (XXI) в присутствии реакционно инертного растворителя, такого как, например, ТГФ, и, необязательно, подходящего основания, такого как Et3N, в соответствии со схемой 11. Промежуточное соединение формулы (XXIII) может быть получено путем алкилирования промежуточного соединения формулы (XXI) с промежуточным соединением формулы (XXII) в присутствии реакционно инертного растворителя, такого как, например, ДМФ, и подходящего основания, такого как,например, Cs2CO3 или K2CO3 и, необязательно, в присутствии каталитического количества йодидной соли, такой как, например, KI или NaI. И наконец, реакция конденсации промежуточного соединения(XXIII) с источником аммония, таким как, например, ацетат аммония (NH4OAc) дает соединение форму- 21022093 лы (XXIV). На схеме 11 значение Halo определено как Cl, Br или I, значение Halo определено как Cl, Br или I; Haloa определена как Cl или Br; и все другие переменные имеют определения, которые приведены ранее. Схема 11 Экспериментальная методика 12. Промежуточное соединение формулы (III), где все переменные имеют определения, которые приведены ранее, может быть получено путем превращения аминогруппы в промежуточном соединении формулы (V) в галогеновую группу по реакции Сандмейера (схема 12). На схеме 12, значение Halo определена как I, Br или Cl, a все другие переменные имеют определения, которые приведены ранее. Промежуточное соединение формулы (V) является первым превращенным в соответствующую соль диазония путем воздействия источником нитрита, такого как NaNO2 в кислых условиях, или изоамилнитрит или tбутилнитрит в органическом растворителе, таком как CH3CN, затем с воздействием источником галогенида, таким как KI, CuBr или CuCl. Можно применять типичные условия реакции, известные специалистам в данной области. Схема 12 Экспериментальная методика 13 Промежуточное соединение формулы (III), где значение L2 ограничено L2a, причем L2a представляет 13aNR , О или прямую связь; где значение R2 ограничено R2a, причем R2a представляет пиперидинил, морфолинил или пирролидинил; где Halo представляет Br, I или Cl; и где все другие переменные имеют определения, которые приведены ранее, и таким образом называемые промежуточными соединениями формулы (III-a1), могут быть получены, начиная с замещения промежуточного соединения формулы(XXV) R1, например, путем алкилирования алкилгалогенидом с последующей пространственно селективной реакцией замещения между полученным промежуточным соединением формулы (XXVI) и аминной или спиртовой формой (XXVII) в соответствии со схемой 13, значение Halo определено как I, Br илиCl, и H-L2a-R2a относится к аминному или спиртовому производному. Реакцию замещения выполняют в присутствии подходящего основания, такого как, например, K2CO3, и в реакционно инертном растворителе, таком как ДМФ, CH3CN, и он может также включать H2O. Эту реакцию обычно выполняют при комнатной температуре (к.т.), но повышенная температура (например, 40-160C) при микроволновом облучении и/или под давлением может повышать скорость реакции. Схема 13 Экспериментальная методика 14. Промежуточное соединение формулы (III), где значение L2 ограничено L2b, причем L2b представляет прямую связь, где значение Halo определено как I, Br или Cl и где все другие переменные имеют определения, которые приведены ранее, и таким образом называемые промежуточным соединением формулы(III-а 2), могут быть получены по реакции перекрестного соединения Сузуки-Мияура между промежуточным соединением формулы (XXVI) и (XXVII-а) в соответствии со схемой 14. В формуле (XXVII)B(OR)2 относится к бороновой кислоте (В(ОН)2 или ее соответствующему боронатному эфиру, такому как пинаколовый эфир. Эта реакция катализируется Pd катализатором, таким как, например, Pd(PPh3)4 или PdCl2(dppf). Реакцию выполняют в присутствии подходящего основания, такого как, например,K2CO3 или K3PO4, и в реакционно инертном растворителе, таком как толуол, ДМФ или MeCN, и он может также включать H2O. Перемешивание при повышенных температуре (например, между 50 и 120C)- 22022093 и/или давлении может повышать скорость реакции, что может осуществляться с применением микроволнового облучения или путем обычного нагревания. Схема 14 Экспериментальная методика 15. Промежуточное соединение формулы (V), где значение L2 ограничено L2c, причем L2c представляет 13aNR , и таким образом, называемые промежуточными соединениями формулы (V-a1), могут быть получены, начиная с замещения цианокарбонимидата, такого как, например, дифенилцианокарбондиимидата(представленного на схеме 15) амином формулы (XXIX) в присутствии подходящего основания, такого как LiHMDS в реакционно инертном растворителе, таком как ТГФ при комнатной температуре промежуточное соединение формулы (XXX) затем может быть конденсировано большей частью пространственно селективным образом с соответствующим гидразином R1-NHNH2 формулы (XXVIII) в спиртовом растворителе, таком как пропан-2-ол. Перемешивание при повышенных температуре (например, между 40 и 160C) и/или давлении может повысить скорость реакции, что можно осуществить, используя микроволновое облучение, или путем обычного нагревания. Схема 15 Исходные вещества в описанных выше схемах доступны для приобретения или могут быть получены специалистами в данной области. Где необходимо или желательно, любая одна или несколько из следующих дополнительных стадий могут быть выполнены в любом порядке. Соединения формулы (I), любая их подгруппа, соли присоединения, сольваты и их стереохимические изомерные формы могут быть превращены в дополнительные соединения по данному изобретению с применением методик, известных специалистам в данной области. Специалистам будет понятно, что при процессах, описанных выше, функциональные группы промежуточных соединений могут быть заблокированы защитными группами. В случае, когда функциональные группы промежуточных соединений блокированы защитными группами, у них защита может удаляться после стадии реакции. Фармакология Обнаружено, что соединения данного изобретения модулируют активность -секретазы. Соединения по данному изобретению и фармацевтически приемлемые композиции с ними могут быть полезны при лечении и для профилактики БА, ТГМ, ЛНПС, старческого угасания, деменции, деменции с тельцами Леви, церебральной амилоидной ангиопатии, полиинфарктной деменции, синдрома Дауна, деменции,связанной с болезнью Паркинсона и деменции, связанной с бета-амилоидом, предпочтительно БА. Соединения по данному изобретению и фармацевтически приемлемые композиции с ними могут быть полезны при лечении и для профилактики заболевания или патологического состояния, выбранного из группы, состоящей из БА, ТГМ, ЛНПС, старческого угасания, деменции, деменции с тельцами Леви,церебральной амилоидной ангиопатии, полиинфарктной деменции, деменции боксеров, синдрома Дауна,деменции, связанной с болезнью Паркинсона и деменции, связанной с бета-амилоидом. В соответствии с описанием термин "модуляция активности -секретазы" относится к эффекту на процессинг АПП с помощью -секретазного комплекса. Предпочтительно он относится к действию, при котором общая скорость процессинга АПП остается, по существу, такой, как без применения указанных соединений, но при котором относительные количества превращаемых продуктов изменяются, более предпочтительно, таким образом, что количество образуемого A42-пептида снижается. Например, могут образовываться другие виды Абета (например, Абета-38 или другие виды пептида Абета из более короткой аминокислотной последовательности вместо Абета-42), или относительные количества данных продуктов различны (например, отношение Абета-40 к Абета-42 изменяется, предпочтительно, повышается). Ранее показано, что -секретазный комплекс участвует также в процессинге Notch-белка. Notch является сигнальным белком, который играет решающую роль в процессах развития (например, рассмотренных у Schweisguth F. (2004) Curr. Biol. 14, R129). В отношении применения модуляторов -секретазы в терапии, по-видимому, особенно благоприятно не вмешиваться в активность Notch-процессинга путем- 23022093 действия -секретазы, чтобы исключить предполагаемые нежелательные побочные эффекты. Хотя ингибиторы -секретазы проявляют побочные эффекты из-за сопутствующего подавления Notch-процессинга,модуляторы -секретазы могут обладать преимуществом селективного снижения продукции высоко агрегируемых и нейротоксических форм А, т.е. A42, без снижения продукции менее агрегируемых форм А меньшего размера, т.е. А 38, и без сопутствующего подавления процессинга Notch. Таким образом,предпочтительны соединения, которые не проявляют воздействия -секретазного комплекса на активность процессинга Notch. В соответствии с описанием термин "лечение", как подразумевается, относится ко всем процессам,где может быть замедление, прерывание, задержка или остановка прогрессирования заболевания, но не обязательно указывает на полное устранение симптомов. Данное изобретение относится к соединению по общей формуле (I), его стереоизомерным формам и его фармацевтически приемлемым кислотно- или основно-аддитивным солям и их сольватам для применения в качестве лекарственного средства. Данное изобретение относится к соединению по общей формуле (I), его стереоизомерным формам и его фармацевтически приемлемым кислотно- или основно-аддитивным солям и их сольватам для применения для модуляции активности -секретазы. Данное изобретение относится к соединению по общей формуле (I), его стереоизомерным формам и его фармацевтически приемлемым кислотно- или основно-аддитивным солям и их сольватам для применения для лечения или профилактики заболеваний или патологических состояний, выбранных из группы,состоящей из БА, ТГМ, ЛНПС, старческого угасания, деменции, деменции с тельцами Леви, церебральной амилоидной ангиопатии, полиинфарктной деменции, синдрома Дауна, деменции, связанной с болезнью Паркинсона, и деменции, связанной с бета-амилоидом. В одном из воплощений указанное заболевание или патологическое состояние предпочтительно является БА. Данное изобретение относится к соединению по общей формуле (I), его стереоизомерным формам и его фармацевтически приемлемым кислотно- или основно-аддитивным солям и их сольватам для применения при лечении указанных заболеваний. Данное изобретение относится к соединению по общей формуле (I), его стереоизомерным формам и его фармацевтически приемлемым кислотно- или основно-аддитивным солям и их сольватам для лечения или профилактики указанных заболеваний. Данное изобретение относится также к соединению по общей формуле (I), его стереоизомерным формам и его фармацевтически приемлемым кислотно- или основно-аддитивным солям и их сольватам для лечения или профилактики, в частности лечения, опосредуемых -секретазой заболеваний или патологических состояний. Данное изобретение относится к соединению по общей формуле (I), его стереоизомерным формам и его фармацевтически приемлемым кислотно- или основно-аддитивным солям и их сольватам для производства лекарственного средства. Данное изобретение относится к соединению по общей формуле (I), его стереоизомерным формам и его фармацевтически приемлемым кислотно- или основно-аддитивным солям и их сольватам для производства лекарственного средства для модуляции -секретазной активности. Данное изобретение относится к соединению по общей формуле (I), его стереоизомерным формам и его фармацевтически приемлемым кислотно- или основно-аддитивным солям и их сольватам для производства лекарственного средства для лечения или профилактики любого одного из состояний заболевания, указанных здесь ранее. Данное изобретение относится к соединению по общей формуле (I), его стереоизомерным формам и его фармацевтически приемлемым кислотно- или основно-аддитивным солям и их сольватам для применения для производства лекарственного средства для лечения любого одного из состояний заболевания,указанных ранее. В данном изобретении особое предпочтение отдается соединениям формулы (I) или любой их подгруппе со значением IC50 для подавления продукции A42-пептида меньше 1000 нМ, предпочтительно менее 100 нМ, более предпочтительно менее 50 нМ, еще предпочтительнее менее 20 нМ, которые определены соответствующим исследованием, таким как исследование в примерах, приведенных ниже. Соединения данного изобретения можно применять у млекопитающих, предпочтительно, людей,для лечения или профилактики любого одного из заболеваний, указанных ранее. Принимая во внимание эффективность соединений формулы (I), представлен способ лечения теплокровных животных, включая людей, или способ профилактики у теплокровных животных, включая людей, которые страдают от любого одного из заболеваний, указанных ранее. Указанные способы включают применение, т.е. системное введение или местное применение, предпочтительно пероральный прием, эффективного количества соединения формулы (I), его стереоизомерной формы и его фармацевтически приемлемых аддитивной соли или сольвата у теплокровных животных, включая людей.- 24022093 Специалисты в области лечения таких заболеваний могли бы определить эффективное терапевтическое суточное количество по результатам испытания, представленным далее. Эффективное терапевтическое суточное количество, вероятно, составит от примерно 0,005 до 50 мг/кг, в частности от 0,01 до 50 мг/кг веса тела, более конкретно от 0,01 до 25 мг/кг веса тела, предпочтительно от примерно 0,01 до примерно 15 мг/кг, более предпочтительно от примерно 0,01 до примерно 10 мг/кг, еще предпочтительнее от примерно 0,01 до примерно 1 мг/кг, наиболее предпочтительно от примерно 0,05 до примерно 1 мг/кг веса тела. Количество соединения по данному изобретению, называемого здесь также активным ингредиентом, которое необходимо для достижения терапевтического эффекта, будет, разумеется, меняться в зависимости от случая, например, в связи с конкретным соединением, в зависимости от пути введения, возраста и состояния получающего, и конкретного нарушения или заболевания, которое нужно лечить. Способ лечения может также включать применение активного ингредиента в режиме между одним и четырьмя приемами в день. При этих способах лечения соединения по данному изобретению перед применением предпочтительно перерабатывают в лекарственные формы. Как описано здесь ниже, подходящие фармацевтические лекарственные формы получают по известным методам, используя хорошо известные и легко доступные для приобретения ингредиенты. Соединения данного изобретения, которые пригодны для лечения или профилактики болезни Альцгеймера или ее симптомов, можно применять отдельно или в комбинации с одним или несколькими из дополнительных терапевтических средств. Комбинированная терапия включает применение единственного фармацевтического дозированного препарата, который содержит соединение формулы (I) и одного или нескольких из дополнительных терапевтических средств, а также применение соединения формулы(I) и каждого из дополнительных терапевтических средств в его собственной отдельной фармацевтической дозированной лекарственной форме. Например, соединение формулы (I) и терапевтическое средство можно назначать пациенту вместе, в единственной пероральной дозированной композиции, такой как таблетка или капсула, или каждое средство можно применять в отдельной пероральной дозированной форме. Хотя возможно, чтобы активный ингредиент применялся отдельно, предпочтительно, когда он представлен в виде фармацевтической композиции. Соответственно, данное изобретение дополнительно представляет фармацевтическую композицию,содержащую фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество соединения по формуле (I). Носитель или растворитель должен быть "приемлемым" в смысле совместимости с другими ингредиентами композиции и не вредным для принимающих ее. Для легкости применения рассматриваемые соединения могут быть переработаны в различные фармацевтические формы по целям применения (введения). Соединения по данному изобретению, в частности соединения по формуле (I), их фармацевтически приемлемые аддитивной соли с кислотой или основанием, их стереохимические изомерные формы или любая их подгруппа или комбинация могут быть переработаны в разные лекарственные формы по целям применения. В качестве соответствующих композиций здесь могут быть приведены все композиции, обычно применяемые для системного введения лекарственных средств. Чтобы изготовить фармацевтические композиции данного изобретения, эффективное количество конкретного соединения, необязательно при добавлении аддитивной солевой формы, в качестве активного ингредиента соединяют в однородной смеси с фармацевтически приемлемым носителем, который может принимать ряд форм, в зависимости от формы препарата, желаемого для введения. Эти фармацевтические композиции желательны в удобных дозированных формах на одно введение, в частности, для перорального введения, ректального введения, подкожного введения, путем парентеральной инъекции или путем ингаляции. Например, при изготовлении композиций в пероральной дозированной форме можно применять любую из обычных фармацевтических сред, такую как, например, вода, гликоли, масла, спирты и тому подобное в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры,эмульсии и растворы; или твердые носители, такие как разные виды крахмала, сахара, каолин, разбавители, улучшающие скольжение вещества, связывающие вещества, дезинтегрирующие средства и тому подобное, в случае порошков, пилюль, капсул и таблеток. Из-за легкости применения таблетки и капсулы представляют наиболее благоприятные пероральные дозированные формы на один прием, в случае которых обычно используют твердые фармацевтические носители. Для парентеральных композиций носитель будет обычно включать стерильную воду, по меньшей мере, большей частью, хотя могут быть включены и другие ингредиенты, например, чтобы способствовать растворимости. Например, могут быть изготовлены инъекционные растворы, в которых носитель состоит из физиологического раствора,раствора глюкозы или смеси физиологического раствора и раствора глюкозы. Инъекционные растворы,содержащие соединения формулы (I), могут быть созданы в виде лекарственной формы в масле для продолжительного действия. Соответствующими маслами для этой цели являются, например, арахисовое масло, кунжутное масло, хлопковое масло, кукурузное масло, соевое масло, синтетические сложные эфиры гликоля и жирных кислот с длинной цепью и их смеси и другие масла. Можно также изготовить- 25022093 инъекционные суспензии, в случае которых можно применять соответствующие жидкие носители, суспендирующие средства и тому подобное. Также включены твердые формы препаратов, которые предназначены для превращения непосредственно перед применением в препараты в жидкой форме. В композициях, пригодных для чрезкожного введения, носитель, необязательно, включает усиливающее проникновение средство и/или подходящее увлажняющее средство, необязательно в сочетании с подходящими добавками любой природы в минимальных пропорциях, которые не придают значительного повреждающего эффекта для кожи. Указанные добавки могут облегчать применение на коже и/или может быть полезным для изготовления желаемых композиций. Эти композиции можно вводить разными путями,например, в виде пластыря для чрезкожного введения, для точечного (spot-on) нанесения, в виде мази. Аддитивные соли с кислотой или основанием соединения формулы (I) благодаря их повышенной растворимости в воде, выше, чем у формы основания или кислоты, больше подходят для изготовления водных композиций. Особенно благоприятно изготавливать лекарственную форму вышеназванных фармацевтических композиций в дозированной на один прием форме для легкости применения и постоянства дозировки. Дозированная на один прием форма, в соответствии с описанием, относится к физически разделенным элементам, пригодным в качестве однократных доз, причем каждый элемент содержит предопределенное количество активного ингредиента, рассчитанное на создание желаемого терапевтического эффекта в связи с необходимым фармацевтическим носителем. Примерами каждой из дозированных на один прием форм являются таблетки (включая рифленые или имеющие покрытие таблетки), капсулы, пилюли, пакетики с порошком, пластинки, суппозитории, инъекционные растворы или суспензии и тому подобное, и их разделенные множества. Так как соединения по данному изобретению являются сильными перорально применяемыми соединениями, фармацевтические композиции, содержащие указанные соединения, для перорального введения имеют особые преимущества. Чтобы повысить растворимость и/или стабильность соединений формулы (I) в фармацевтических композициях, может быть полезно применять -, - или -циклодекстрины или их производные, в частности замещенные гидроксиалкилами циклодекстрины, например 2-гидроксипропилциклодекстрин или сульфобутилциклодекстрин, а также улучшать растворимость и/или стабильность соединений по данному изобретению в фармацевтических композициях могут сорастворители, такие как спирты. В зависимости от способа введения фармацевтическая композиция будет предпочтительно содержать от 0,05 до 99 вес.%, более предпочтительно от 0,1 до 70 вес.%, еще предпочтительнее от 0,1 до 50 вес.% соединения формулы (1) и от 1 до 99,95 вес.%, более предпочтительно от 30 до 99,9 вес.%, еще предпочтительнее от 50 до 99,9 вес.% фармацевтически приемлемого носителя, все проценты даны от веса композиции в целом. Следующие примеры иллюстрируют данное изобретение. Примеры Здесь далее термин "ТГФ" означает тетрагидрофуран, "ДХМ" означает дихлорметан; "MeOH" означает метанол; "EtOH" означает этанол; "ВЭЖХ" означает высокоэффективную жидкостную хроматографию; "нас." означает насыщенный, "водн." означает водный; "EtOAc" означает этилацетат; "НОАс" означает уксусную кислоту; "Et3N" означает триэтиламин; "ОФ" означает обращенную фазу; "мин" означает минуту(ы); "конц." Означает концентрированный; "ч" означает час(ы); "q.s." означает достаточное количество; "NaBH(OAc)3" означает триацетоксиборогидрид натрия; "В.Д." означает внутренний диаметр;"Et2O" означает диэтиловый эфир; "СЖХ" означает сверхкритическую жидкостную хроматографию;"iPrOH" означает 2-пропанол. А. Получение промежуточных соединений а) Получение промежуточного соединения 1 Этоксикарбонилизотиоцианат (2,91 г, 22,2 ммоль) по каплям добавляли при комнатной температуре к смеси 3-хлорпиразин-2-иламина (2,5 г, 16,3 ммоль) в диоксане (80 мл). Реакционную смесь перемешивали при комнатной температуре в течение 24 ч. Затем растворители выпаривали при пониженном давлении. Полученные твердые вещества растирали в ДИПЭ, фильтровали и сушили под вакуумом, получаяb) Получение промежуточного соединения 2 ДИПЭА (3,57 г, 27,6 ммоль) по каплям при комнатной температуре добавляли к перемешиваемой смеси гидрохлорида гидроксиламина (3,2 г, 46 ммоль) в MeOH (100 мл) и EtOH (100 мл). Порциями при комнатной температуре добавляли промежуточное соединение 1 (2,4 г, 9,2 ммоль) и реакционную смесь перемешивали при 70C в течение 4 ч. Реакционную смесь охлаждали до комнатной температуры и выпаривали при пониженном давлении. Остаток распределяли между ДХМ и водой. Объединенные органические слои сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной флэш-хроматографией на силикагеле (элюент: ДХМ/MeOH от 100/0 до 98/2). Фракции продукта собирали и концентрировали в вакууме с получением 1 г промежуточного соединения 2 (64%). с) Получение промежуточного соединения 3 К смеси 3-фторметилфенилбороновой кислоты (1,34 г, 7 ммоль), промежуточного соединения 2 (0,8 г, 4,7 ммоль) и Cs2CO3 (4,77 г, 14,6 ммоль) в ДМЭ (8 мл) и воды (4 мл) добавляли Pd(PPh3)4 (0,436 г, 0,377 ммоль), и смесь дегазировали. Полученную смесь перемешивали и нагревали при 95C в течение 18 ч. Р.м. охлаждали до комнатной температуры и распределяли между водой и ДХМ. Органическую фазу отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали в вакууме. Остаток очищали колоночной флэш-хроматографией на силикагеле (элюент: ДХМ/MeOH от 100/0 до 99/1). Фракции продукта собирали и концентрировали в вакууме с получением 1,30 г промежуточного соединения 3.d) Получение промежуточного соединения 4 Промежуточное соединение 42 (1,41 г, 4,66 ммоль), Pd2(dba)3 (426 г, 0,466 ммоль), X-Phos (444 мг,0,93 ммоль) и Cs2CO3 (6,07 г, 18,6 ммоль) добавляли к раствору промежуточного соединения 3 (1,3 г, 4,66 ммоль) в 2-метил-2-пропаноле (50 мл) в атмосфере N2. Реакционную смесь нагревали до 100C и выдерживали при этой температуре в течение 20 ч, добавляли воду и смесь экстрагировали ДХМ. Объединенные органические слои сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной флэш-хроматографией на силикагеле (элюент: ДХМ/MeOH от 100/0 до 99/1). Фракции продукта собирали и концентрировали в вакууме. Остаток растирали в ДИПЭ с получением 0,95 г промежуточного соединения 4 (44%). Пример А 2. а) Получение промежуточного соединения 5 Смесь 2-хлоранилина (5 г, 39,2 ммоль) и дифенилцианокарбонимидата (8,89 г, 37,3 ммоль) нагревали до температуры кипения с обратным холодильником в 2-пропаноле (35 мл) в течение 20 ч. Реакционную смесь затем концентрировали при пониженном давлении. Остаток растирали с диэтиловым эфиром и полученное твердое вещество отфильтровывали и сушили в вакууме, получая 1,6 г промежуточного соединения 5 при чистоте 93% по анализу ЖХ-МС (выход 15%).b) Получение промежуточного соединения 6 Метилгидразин (0,31 мл, 5,9 ммоль) добавляли к смеси промежуточного соединения 5 (1,6 г, 5,9 ммоль) в 2-пропаноле. Реакционную смесь нагревали до температуры кипения с обратным холодильником в течение 2 ч. Затем реакционную смесь концентрировали под пониженным давлением. Полученное- 27022093 твердое вещество растирали с диэтиловым эфиром, отфильтровывали и сушили под вакуумом, получая 493 мг промежуточного соединения 6 (37%). Пример A3. а) Получение промежуточного соединения 7 Промежуточное соединение 7 получали, исходя из промежуточного соединения 24 и RS-2(трифторметил)пиперазина в соответствии с получением, описанным в примере А 8.с.b) Получение промежуточного соединения 8 К раствору промежуточного соединения 7 (500 мг, 1,46 ммоль) в ДХМ (10 мл) добавляли водн. раствор формальдегида (37%, 2,2 мл, 29 ммоль) и NaBH(OAc)3 (1,86 г, 8,77 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 30 мин, добавляли Na2SO4 (6,2 г) и реакционную смесь дополнительно перемешивали при комнатной температуре в течение ночи. Реакционную смесь распределяли между водой и ДХМ. Объединенные органические экстракты сушили (MgSO4) и концентрировали под пониженным давлением с получением неочищенного промежуточного соединения 8 (570 мг) при 83% чистоте по анализу ЖХ-МС (91% выход), которое применяли как таковое на следующей стадии. Пример А 4. а) Получение промежуточного соединения 9 Смесь 4-фтор-2-метилфенол (2,35 г, 18,6 ммоль), промежуточное соединение 24 (5,0 г, 18,6 ммоль) и K2CO3 (5,14 г, 37,2 ммоль) в ДМФ (20 мл) нагревали до 100C и выдерживали при этой температуре в течение 18 ч. Реакционную смесь охлаждали, а затем выливали в H2O и экстрагировали ДХМ. Объединенные органические экстракты сушили (MgSO4) и концентрировали под пониженным давлением. Остаток очищали колоночной флэш-хроматографией на силикагеле (элюент: н-гептан/EtOAc от 100/0 до 70/30). Фракции продукта собирали и концентрировали в вакууме, получая 3,52 г промежуточного соединения 9 (60%).b) Получение промежуточного соединения 10 Смесь промежуточного соединения 9 (3,52 г, 11,2 ммоль), Pd(OAc)2 (51 мг, 0,224 ммоль) и 1,3 бис(дифенилфосфино)пропана (185 мг, 0,45 ммоль) в ТГФ/MeOH (30 мл/10 мл) готовили в автоклаве из нержавеющей стали в атмосфере N2. Сосуд закрывали и создавали давление СО до 20 бар (g) и полученную реакционную смесь нагревали и выдерживали при 125C в течение 16 ч. Охлажденную реакционную смесь выпаривали под пониженным давлением. Остаток суспендировали в ДИПЭ и полученный осадок отфильтровывали и сушили в вакууме, получая 2,25 г промежуточного соединения 10 (68%). с) Получение промежуточного соединения 11 К раствору промежуточного соединения 10 (587 мг, 2,0 ммоль) в ТГФ добавляли водн. 1 н. растворNaOH (10 мл, 10 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Затем добавляли водн. 1 н. раствор HCl и полученную смесь экстрагировали ДХМ. Объединенные органические экстракты сушили (MgSO4) и концентрировали под пониженным давлением, охлажденную реакционную смесь выпаривали под пониженным давлением, получая 543 мг промежуточного соединения 11 (97%).- 28022093 Пример А 5. а) Получение промежуточного соединения 12 К раствору 4-фторбензоилхлорида (1,5 г, 9,5 ммоль) в ацетоне (70 мл) добавляли тиоцианат аммония (864 мг, 11,4 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1,5 ч. Затем по каплям добавляли раствор промежуточного соединения 41 (2,12 г, 10,4 ммоль) в ацетоне (20 мл, и полученную реакционную смесь перемешивали при комнатной температуре в течение ночи. Смесь концентрировали в вакууме и остаток распределяли между водой и ДХМ. Объединенные органические экстракты сушили (MgSO4) и концентрировали под пониженным давлением. Остаток растирали с CH3CN и полученный осадок сушили в вакууме, получая 2,8 г промежуточного соединения 12 (77%).b) Получение промежуточного соединения 13 К раствору промежуточного соединения 12 (2,88 г, 7,5 ммоль) в ацетоне (200 мл) добавляли K2CO3(1,04 г, 7,5 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 30 мин. Затем добавляли метилйодид (1,06 г, 7,5 ммоль) и полученную реакционную смесь перемешивали при комнатной температуре в течение 30 мин. Смесь выливали в воду со льдом и экстрагировали ДХМ. Объединенные органические экстракты сушили (MgSO4) и концентрировали под пониженным давлением,получая 2,8 г неочищенного промежуточного соединения 13 (94%), которое применяли как таковое на следующей стадии. Пример А 8. а) Получение промежуточного соединения 24NaH (60% дисперсию в минеральном масле; 5,29 г, 132 ммоль) добавляли к перемешиваемому раствору 3,5-дибромтриазола (20,0 г, 88,2 ммоль) в ДМФ в атмосфере N2 при комнатной температуре. Через 30 мин медленно добавляли 2-йодпропан (10,6 мл, 106 ммоль), реакционную смесь нагревали до 40C и выдерживали при этой температуре в течение 2-3 ч. Содержимое осторожно выливали на лед с H2O (11),и смесь экстрагировали ДИПЭ. Объединенные органические экстракты промывали H2O (4200 мл), затем насыщенным раствором соли и сушили (Na2SO4). Фильтрование и концентрирование под пониженным давлением давали желтое масло. Выход: 16,50 г промежуточного соединения 24 (70%).b) Получение промежуточного соединения 25(1,54 г, 11 ммоль) в ДМФ (20 мл) нагревали до 160 С и выдерживали при этой температуре в течение 45 мин, используя микроволновое облучение. Реакционную смесь охлаждали, а затем выливали в Н 2 О и экстрагировали ДХМ. Объединенные органические экстракты сушили (MgSO4) и концентрировали под пониженным давлением. Остаток растирали с раствором ДИПЭ/н-гептане. Полученное твердое вещество отфильтровывали и сушили в вакууме при 50C, получая 1 г промежуточного соединения 25 (56%). с) Получение промежуточного соединения 26 Смесь промежуточного соединения 24 (2,2 г, 7,4 ммоль), 2-м-толилморфолина (2,0 г, 7,4 ммоль) иK2CO3 (4,1 г, 30 ммоль) в ДМФ (20 мл) нагревали и выдерживали при 160C в течение 45 мин в микроволновке. Реакционную смесь охлаждали, а затем выливали в Н 2 О и экстрагировали ДХМ. Объединенные органические экстракты сушили (MgSO4) и концентрировали под пониженным давлением. Остаток очищали колоночной флэш-хроматографией на силикагеле (элюент: н-гептан/EtOAc от 100/0 до 50/50). Фракции продукта собирали и концентрировали в вакууме, получая 0,25 г промежуточного соединения 26 (9%).
МПК / Метки
МПК: C07D 403/10, C07D 401/12, C07D 413/04, C07D 403/14, C07D 487/04, C07D 403/12, A61K 31/4196, C07D 401/14, A61P 25/28, C07D 471/04
Метки: модуляторы, замещенные, gamma;-секретазы, триазольные, производные
Код ссылки
<a href="https://eas.patents.su/30-22093-zameshhennye-triazolnye-proizvodnye-kak-modulyatory-gamma-sekretazy.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные триазольные производные как модуляторы гамма-секретазы</a>












