Конденсированные гетероароматические пирролидиноны как ингибиторы syk
Номер патента: 21568
Опубликовано: 30.07.2015
Авторы: Не Чжэ, Такахаси Масаси, Феер Виктория, Арикава Ясуёси, Смит Кристофер, Дун Цин, Джоунз Бенджамин, Лэм Бетти
Формула / Реферат
1. Соединение формулы 1
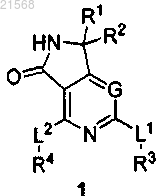
или его фармацевтически приемлемая соль, где
G представляет собой C(R5);
каждый из L1 и L2 независимо выбран из -NH- и связи;
каждый из R1 и R2 независимо выбран из водорода, галогена и C1-3 алкила или R1 и R2 вместе с атомом, к которому они присоединены, образуют С3-6 циклоалкил;
R3 выбран из 2-амино-С2-6-алк-1-ила, 2-амино-С3-8-циклоалк-1-ила и 3-аминотетрагидро-2Н-пиран-4-ила, каждый необязательно замещен заместителями в количестве от одного до четырех, независимо выбранными из галогена, оксо, -CN, R6 и R7;
R4 выбран из фенила, который необязательно замещен заместителями в количестве от одного до пяти, независимо выбранными из галогена, -CN, R6 и R7 и из пирролила, фуранила, тиенила, пиразолила, имидазолила, изоксазолила, оксазолила, изотиазолила и тиазолила, каждый необязательно замещен одним-тремя заместителями, независимо выбранными из галогена, -CN, R6 и R7;
R5 выбран из водорода, галогена, -CN, C1-4 алкила, С2-4 алкенила и R10, где каждая алкиловая и алкениловая группа необязательно замещена оксогруппой;
каждый R6 независимо выбран из -OR8, -N(R8)R9, -C(O)R8, -C(O)N(R8)R9 и -S(O)nR8;
каждый R7 независимо выбран из C1-6 алкила, С3-6 циклоалкил-(CH2)m- и C6-14 арил-(CH2)m-, каждый необязательно замещен заместителями в количестве от одного до пяти, независимо выбранными из галогена и R10;
каждый R8 и R9 независимо выбран из водорода и C1-6 алкила, необязательно замещенного заместителями в количестве от одного до пяти, независимо выбранными из R10;
каждый R10 независимо выбран из -OR11 и -N(R11)R12;
каждый R11 и R12 независимо выбран из водорода и C1-6 алкила;
каждый n независимо выбран из 0, 1 и 2; и
каждый m независимо выбран из 0, 1, 2, 3 и 4.
2. Соединение или фармацевтически приемлемая соль по п.1, отличающееся тем, что L1 является -NH-.
3. Соединение или фармацевтически приемлемая соль по любому из пп.1, 2, отличающееся тем, что L2 является связью.
4. Соединение или фармацевтически приемлемая соль по любому из предыдущих пунктов, отличающееся тем, что R1 и R2 оба являются водородом.
5. Соединение или фармацевтически приемлемая соль по любому из предыдущих пп.1-4, отличающееся тем, что R3 является 2-амино-C3-8 циклоалк-1-илом, необязательно замещенным заместителями в количестве от одного до четырех, независимо выбранными из галогена, оксо, -CN, R6 и R7.
6. Соединение или фармацевтически приемлемая соль по п.5, отличающееся тем, что R3 является 2-амино-циклогекс-1-илом, необязательно замещенным заместителями в количестве от одного до четырех, независимо выбранными из галогена, оксо, -CN, R6 и R7.
7. Соединение или фармацевтически приемлемая соль по любому одному из пп.1-4, отличающееся тем, что R3 аминотетрагидро-2H-пиран-4-илом, необязательно замещенным заместителями в количестве от одного до четырех, независимо выбранными из галогена, оксо, -CN, R6 и R7.
8. Соединение или фармацевтически приемлемая соль по любому из предыдущих пунктов, отличающееся тем, что R4 выбран из фенила, который необязательно замещен заместителями в количестве от одного до пяти, независимо выбранными из галогена, -CN, R6 и R7, и из пирролила, фуранила, тиенила, пиразолила, имидазолила, изоксазолила, оксазолила, изотиазолила и тиазолила, каждый необязательно замещен заместителями в количестве от одного до трех, независимо выбранными из галогена, -CN, R6 и R7.
9. Соединение или фармацевтически приемлемая соль по п.8, отличающееся тем, что R4 является пиразол-4-илом, необязательно замещенным заместителями в количестве от одного до трех, независимо выбранными из галогена, -CN, R6 и R7.
10. Соединение или фармацевтически приемлемая соль по любому из пп.8, 9, отличающееся тем, что R4 замещен метилом, этилом, циклопропилом или C1-2 галоалкилом.
11. Соединение или фармацевтически приемлемая соль по любому из предшествующих пунктов, отличающееся тем, что R5 выбран из водорода и галогена.
12. Соединение по п.1, выбранное из следующих соединений:






стереоизомера любого из вышеупомянутых соединений; и фармацевтически приемлемой соли любого из вышеупомянутых соединений или стереоизомеров.
13. Фармацевтическая композиция, обладающая SYK ингибирующей активностью, включающая соединение или фармацевтически приемлемую соль по любому из пп.1-12 и фармацевтически приемлемое связующее средство.
14. Применение соединения или фармацевтически приемлемой соли, которые определены в любом из пп.1-12, в качестве лекарственного средства.
15. Применение по п.14 в качестве лекарственного средства для лечения заболевания или состояния, выбранного из аллергического ринита, аллергической астмы, атопического дерматита, ревматоидного артрита, рассеянного склероза, системной красной волчанки, псориаза, иммунной тромбоцитопенической пурпуры, воспалительной болезни кишечника, хронической обструктивной болезни легких, тромбоза, гематологической злокачественной опухоли и эпителиального рака.
16. Применение по п.15, где заболевание или состояние выбранно из гематологической злокачественной опухоли и эпителиального рака.
17. Применение по п.16, где гематологическая злокачественная опухоль выбрана из острой миеломной лейкемии, В-клеточной хронической лимфоцитарной лейкемии, В-клеточной лимфомы и Т-клеточной лимфомы.
18. Применение по п.16, где эпителиальный рак выбран из рака легких, рака поджелудочной железы и рака толстой кишки.
19. Применение соединения или фармацевтически приемлемой соли по любому из пп.1-12 для производства лекарственных средств для лечения заболеваний или состояний, выбранных из аллергического ринита, аллергической астмы, атопического дерматита, ревматоидного артрита, рассеянного склероза, системной красной волчанки, псориаза, иммунной тромбоцитопенической пурпуры, воспалительной болезни кишечника, хронической обструктивной болезни легких, тромбоза, гематологической злокачественной опухоли и эпителиального рака.
Текст
КОНДЕНСИРОВАННЫЕ ГЕТЕРОАРОМАТИЧЕСКИЕ ПИРРОЛИДИНОНЫ КАК ИНГИБИТОРЫ SYK В изобретении раскрыты соединения формулы 1 и их фармацевтически приемлемые соли, где определены G, L1, L2, R1, R2, R3 и R4. Настоящее описание касается также материалов и способов получения соединений формулы 1, фармацевтических композиций, содержащих их, а также их применения для лечения расстройств, заболеваний и состояний, затрагивающих иммунную систему и воспаления, включая ревматоидный артрит, гематологические злокачественные опухоли,эпителиальные виды рака (то есть карциномы) и другие расстройства, заболевания и состояния,для которых показано ингибирование SYK.(71)(73) Заявитель и патентовладелец: ТАКЕДА ФАРМАСЬЮТИКАЛ КОМПАНИ ЛИМИТЕД (JP) Область техники Изобретение относится к конденсированным пирролидиноновым соединениям, к фармацевтическим композициям, содержащим их, и к использованию этих соединений для лечения расстройств и состояний, затрагивающих иммунную систему и воспаления, в том числе ревматоидный артрит. Гетероароматические пирролидиноны являются ингибиторами селезеночной тирозинкиназы. Уровень техники Селезеночная тирозинкиназа (SYK) является нерецепторной цитоплазматической тирозинкиназой размером 72 кДа. SYK имеет такую же первичную аминокислотную последовательность, что и zetaассоциированный белок-70 (ZAP-70) и участвует в опосредованной рецепторами сигнальной трансдукции. N-концевой домен SYK содержит два домена Src-гомологии 2 (SH2), которые связаны с дифосфорилированными иммунорецепторными тирозиновыми активирующими мотивами (ITAM), расположенными в цитоплазматических сигнальных доменах многих иммунорецепторных комплексов. С-конец содержит каталитический домен и включает несколько каталитических петлевых центров аутофосфорилирования, которые отвечают за рецептор-индуцированную активацию SYK и последующее нисходящее распространение сигнала. SYK экспрессируется во многих типах клеток, участвующих в приобретенном и врожденном иммунитете, включая лимфоциты (В-клетки, Т-клетки и NK-клетки), гранулоциты (базофилы, нейтрофилы и эозинофилы), моноциты, макрофаги, дендритные клетки и мастоциты. SYK экспрессируется в других типах клеток, включая эпителий дыхательных путей и фибробласты в верхних дыхательных путях. См., например, публикации Martin Turner et al., Immunology Today (2000) 21(3): 14854; и Michael P. Sanderson et al., InflammationAllergy - Drug Targets (2009) 8:87-95. Роль SYK в ITAM-зависимой передаче сигналов и ее экспрессия во многих типах клеток позволяет предположить, что соединения, которые ингибируют активность SYK, могут быть полезными для лечения расстройств, затрагивающих иммунную систему и воспаления. Такие расстройства включают реакции гиперчувствительности I типа (аллергический ринит, аллергическую астму и атопический дерматит); аутоиммунные заболевания (ревматоидный артрит, рассеянный склероз, системную красную волчанку,псориаз и иммунную тромбоцитопеническую пурпуру); и воспаление легких (хроническое обструктивное заболевание легких). См., например, публикации Brian R. Wong et al., Expert Opin. Investig. Drugs(2004) 13(7):743-62; Sanderson et al. (2009); Jane DenyerVipul Patel, Drug News Perspective (2009) 22(3):146-50; Esteban S. MasudaJochen Schmitz, Pulmonary PharmacologyTherapeutics (2008) 21:46167; Malini Bajpai et al., Expert Opin. Investig. Drugs (2008) 17(5):641-59; и Anna Podolanczuk et al.,Blood(2009) 113:3154-60. Другие расстройства включают гематологические злокачественные опухоли,такие как острый миелоидный лейкоз, хронический лимфолейкоз В-клеток, лимфома В-клеток (например, лимфома клеток мантийной ткани) и лимфома Т-клеток (например, периферийная лимфома Тклеток); а также эпителиальные виды рака, такие как рак легких, рак поджелудочной железы и рак толстой кишки. См., например, публикации Cynthia K. Hahn et al., Cancer Cell (2009) 16:281-294; D. H. Chu etResearch (2009) 69(13):5424-32; A. D. Baudot et al., Oncogene (2009) 28:3261-73; и Anurag Singh et al., Cancer Cell (2009) 15:489-500. Различные ингибиторы SYK были описаны в опубликованных патентных заявках. См., например,ЕР 1184376 A1, WO 01/83485 A1, WO 03/057695 А 1, WO 2006/129100 A1, WO 01/09134 A1, WO 03/063794 A1, WO 2005/012294 А 1, WO 2004/087699 А 2, WO 2009/026107 A1, WO 2009/136995 А 2 и WO 2009/145856 А 1. Сущность изобретения В настоящем изобретении представлены конденсированные гетероароматические пирролидиноновые производные, включая 6,7-дигидро-5H-пирроло[3,4-d]пиримидин-5-оны, 1H-пирроло[3,4-с]пиридин 3(2H)-оны, а также их фармацевтически приемлемые соли. В настоящем изобретении представлены также фармацевтические композиции, содержащие гетероароматические пирролидиноновые производные, и применение гетероароматических пирролидиноновых производных для лечения расстройств и состояний, затрагивающих иммунную систему и воспаления, включая ревматоидный артрит. В одном аспекте настоящего изобретения представлены соединения формулы 1 или их фармацевтически приемлемые соли, гдеG представляет собой C(R5); каждый из L1 и L2 независимо выбран из -NH- и связи; каждый из R1 и R2 независимо выбран из водорода, галогена и C1-3 алкила или R1 и R2 вместе с атомом, к которому они присоединены, образуют C3-6 циклоалкил;R3 выбран из 2-амино-С 2-6-алк-1-ила, 2-амино-С 3-8-циклоалк-1-ила и 3-аминотетрагидро-2 Н-пиран-1 021568 4-ила, каждый необязательно замещен заместителями в количестве от одного до четырех, независимо выбранными из галогена, оксо, -CN, R6 и R7;R4 выбран из фенила, который необязательно замещен заместителями в количестве от одного до пяти, независимо выбранными из галогена, -CN, R6 и R7 и из пирролила, фуранила, тиенила, пиразолила,имидазолила, изоксазолила, оксазолила, изотиазолила, каждый необязательно замещен одним-тремя заместителями, независимо выбранными из галогена, -CN, R6 и R7;R5 выбран из водорода, галогена, -CN, C1-4 алкила, C2-4 алкенила и R10, где каждая алкиловая и алкениловая группа необязательно замещена оксогруппой; каждый R6 независимо выбран из -OR8, -N(R8)R9, -C(O)R8, -C(O)N(R8)R9, и -S(O)nR8; каждый R7 независимо выбран из C1-6 алкила, C3-6 циклоалкил-(СН 2)m- и C6-14 арил-(СН 2)m-, каждый необязательно замещен заместителями в количестве от одного до пяти, независимо выбранными из галогена, и R10; каждый R8 и R9 независимо выбран из водорода и C1-6 алкила, необязательно замещенного заместителями в количестве от одного до пяти, независимо выбранными из R10; каждый R10 независимо выбран из -OR11 и -N(R11)R12; каждый R11 и R12 независимо выбран из водорода и C1-6 алкила; каждый n независимо выбран из 0, 1 и 2; и каждый m независимо выбран из 0, 1, 2, 3 и 4. В другом аспекте настоящего изобретения представлено соединение, которое выбрано из следующей группы соединений и их фармацевтически приемлемых солей: и стереоизомеров любого из вышеупомянутых соединений и их фармацевтических приемлемых солей. В следующем аспекте настоящего изобретения представлена фармацевтическая композиция, обладающая SYK ингибирующей активностью, которая включает: соединение формулы 1, как определено выше, или его фармацевтически приемлемую соль, или соединение, выбранное из группы соединений,определенных в предыдущем параграфе, или их фармацевтически приемлемых солей; и фармацевтически приемлемое связующее средство. В дополнительном аспекте настоящего изобретения представлено применение в качестве лекарственного средства соединения формулы 1, как определено выше, или его фармацевтически приемлемой соли, или соединения, выбранного из группы соединений, определенных выше, или их фармацевтически приемлемых солей. Соединения настоящего изобретения могут быть пригодны для лечения заболевания или состояния у пациентов, для которых показан ингибитор SYK, путем введения пациенту эффективного количества соединения формулы 1, как определено выше, или соединения, выбранного из группы соединений, определенных выше, или их фармацевтически приемлемых солей. В дополнительном аспекте настоящего изобретения представлено применение соединения формулы 1, как определено выше, или его фармацевтически приемлемой соли, или соединения, выбранного из группы соединений, определенных выше, или их фармацевтически приемлемых солей для лечения заболевания или состояния, выбранного из аллергического ринита, аллергической астмы, атопического дерматита, ревматоидного артрита, рассеянного склероза, системной красной волчанки, псориаза, иммунной тромбоцитопенической пурпуры, воспалительной болезни кишечника, хронического воспалительного заболевания легких и тромбоза. В другом аспекте настоящего изобретения представлено применение соединения формулы 1, как определено выше, или его фармацевтически приемлемой соли, или соединения, выбранного из группы соединений, определенных выше, или их фармацевтически приемлемых солей, для лечения заболевания или состояния, выбранного из гематологической злокачественной опухоли и эпителиального рака. В частности, гематологическая злокачественная опухоль выбрана из острой миеломной лейкемии,В-клеточной хронической лимфоцитарной лейкемии, В-клеточной лимфомы и Т-клеточной лимфомы.-6 021568 Эпителиальный рак выбран из рака легких, рака поджелудочной железы и рака толстой кишки. В следующем аспекте настоящего изобретения представлено применение соединения или его фармацевтически приемлемой соли для производства лекарственных средств для лечения заболеваний или состояний, выбранных из аллергического ринита, аллергической астмы, атопического дерматита, ревматоидного артрита, рассеянного склероза, системной красной волчанки, псориаза, иммунной тромбоцитопенической пурпуры, воспалительной болезни кишечника, хронической обструктивной болезни легких,тромбоза, гематологической злокачественной опухоли и эпителиального рака. Подробное описание изобретения"Стереоизомер" и "стереоизомеры" соединения с данной стереохимической конфигурацией относятся к противоположному энантиомеру этого соединения и к любым диастереоизомерам, включая геометрические изомеры (Z/E) этого соединения. Например, если соединение имеет стереохимическую конфигурацию S,R,Z, то его стереоизомеры будут включать его противоположный энантиомер, имеющий конфигурацию R,S,Z, и его диастереомеры, имеющие конфигурацию S,S,Z, конфигурацию R,R,Z,конфигурацию S,R,E, конфигурацию R,S,E, конфигурацию S,S,E и конфигурацию R,R,E. Если стереохимическая конфигурация соединения не указана, то "стереоизомер" относится к любой из возможных стереохимических конфигураций этого соединения."В основном чистый стереоизомер" и варианты этой фразы относятся к образцу, содержащему соединение, имеющее определенную стереохимическую конфигурацию и составляющее по меньшей мере около 95% образца."Чистый стереоизомер" и варианты этой фразы относятся к образцу, содержащему соединение,имеющее определенную стереохимическую конфигурацию и составляющее по меньшей мере около 99,5% образца."Фармацевтически приемлемые" вещества относятся к веществам, которые пригодны для применения в контакте с тканями пациентов без чрезмерной токсичности, раздражения, аллергической реакции и тому подобного, которые соразмерны с разумным соотношением пользы и риска и эффективны для заданного применения в рамках обоснованной медицинской оценки."Связующее средство" относится к любому веществу, которое может влиять на биодоступность лекарства, но в остальном является фармакологически неактивным."Фармацевтическая композиция" относится к комбинации одного или более лекарственных веществ и одного или более связующих средств."В настоящем описании используются следующие аббревиатуры: Ас (ацетил), ACN (ацетонитрил),AIBN (азо-бис-изобутиронитрил), API (активный фармацевтический компонент), aq (водный), Boc (третбутоксикарбонил), BSA (бычий сывороточный альбумин), Cbz (карбобензилокси), dba (дибензилиденацетон), DCC (1,3-дициклогексилкарбодиимид), ДХМ (дихлорметан), ДИПЭА (N,N-диизопропилэтиламин, основание Хюнига), ДМА (N,N-диметилацетамид), ДМАП (4-диметиламинопиридин),DMARD (противоревматическое лекарство, модифицирующее болезнь), ДМЭ (1,2-диметоксиэтан), ДМФ(М) единицах), Pr (пропил), i-Pr (изопропил), ПТФЭ (политетрафторэтилен), RT (комнатная температура примерно от 20 до 25 С), SYK (селезеночная тирозинкиназа), ТСЕР (трис(2-карбоксиэтил)фосфин),ТФУК (трифторуксусная кислота), ТФУКА (2,2,2-трифторуксусный ангидрид), ТГФ (тетрагидрофуран) и буфер Tris (2-амино-2-гидроксиметилпропан-1,3-диоловый буфер). Настоящее изобретение касается соединений формулы 1, которая включает соединения, отдельно перечисленные выше, и их фармацевтически приемлемые соли. Соединения формулы 1 включают соединения, в которых L1 является связью, a L2 является -NH-; L1 является -NH-, a L2 является связью; какL1, так и L2 являются связями или как L1, так и L2 являются -NH-. Соединения формулы 1 включают соединения, в которых L1 является -NH-, a L2 является связью; G является C(R5); и R1, и R2 являются водородом; a R3 является 2-амино-C3-8 циклоалк-1-илом или, в частности, 2-аминоциклогекс-1-илом, необязательно замещенным заместителями в количестве от одного до четырех, независимо выбранными из галогена, оксо, -CN, R6 и R7. Соединения формулы 1 также включают соединения, в которых L1 является -NH-, a L2 является свя-7 021568 зью; G является C(R5); и R1, и R2 являются водородом; а R3 является 2-амино-С 2-6 алк-1-илом или, в частности, 2-аминоэтан-1-илом, или 2-амино-2-оксоэтан-1-илом, необязательно замещенным заместителями в количестве от одного до пяти, от одного до четырех или от одного до двух, соответственно, независимо выбранными из галогена, оксо, -CN, R6 и R7. Соединения формулы 1 дополнительно включают соединения, в которых L1 является -NH-, a L2 является связью; G является C(R5); и R1, и R2 являются водородом; а R3 является 3-аминотетрагидро-2Hпиран-4-ил, необязательно замещенным заместителями в количестве от одного до пяти или от одного до четырех, соответственно, независимо выбранными из галогена, оксо, -CN, R6 и R7. Соединения формулы 1 включают соединения, в которых L1 является -NH-, a L2 является связью; G является C(R5); и R1, и R2 являются водородом; a R4 является фенилом, необязательно замещенным заместителями в количестве от одного до пяти, независимо выбранными из галогена, -CN, R6 и R7. Соединения формулы 1 также включают соединения, в которых L1 является -NH-, a L является связью; G является C(R5); и R1, и R2 являются водородом; а R4 выбран из пирролила, фуранила, тиенила,пиразолила, имидазолила, изоксазолила, оксазолила, изотиазолила и тиазолила или, в частности, из тиофенеила, пиразолила, изотиазолила и тиазолила, каждый необязательно замещен заместителями в количестве от одного до трех, независимо выбранными из галогена, -CN, R6 и R7. Соединения формулы 1 дополнительно включают соединения, в которыхявляется -NH-, a L2 является -NH- или связью; G является C(R5); и R1, и R2 являются R4 является пиразол-4-илом, необязательно замещенной заместителями в количестве от одного до трех, независимо выбранными из галогена, -CN,R6 и R7. Соединения формулы 1 включают соединения, в которых R4 замещен метилом, этилом, циклопропилом или С 1-2 галоалкилом. Все ссылки на соединения, включая соединения формулы 1 и соединения, перечисленные в настоящем описании, как правило, включают все соли этих соединений. Соединения формулы 1, которые включают соединения, отдельно перечисленные выше, могут образовывать фармацевтически приемлемые соли. Эти соли включают соли присоединения кислот (включая дикислоты) и соли оснований фармацевтически приемлемые соли присоединения кислот включают нетоксичные соли, полученные из неорганических кислот, таких как хлороводородная кислота, азотная кислота, фосфорная кислота, серная кислота, бромоводородная кислота, йодоводородная кислота, фтороводородная кислота и фосфорные кислоты, а также нетоксичные соли, полученные из органических кислот, таких как алифатические моно- и дикарбоновые кислоты, фенилзамещенные алкановые кислоты,гидроксиалкановые кислоты, алкандионовые кислоты, ароматические кислоты, алифатические и ароматические сульфоновые кислоты, и так далее. Такие соли включают ацетатные, адипатные, аспартатные,бензоатные, безилатные, бикарбонатные, карбонатные, бисульфатные, сульфатные, боратные, камзилатные, цитратные, цикламатные, эдизилатные, эзилатные, формиатные, фумаратные, глюцептатные, глюконатные, глюкуронатные, гексафторфосфатные, гибензатные, гидрохлоридные/хлоридные, гидробромидные/бромидные, гидройодидные/йодидные, изетионатные, лактатные, малатные, малеатные, малонатные, мезилатные, метилсульфатные, нафтилатные, 2-напзилатные, никотинатные, нитратные, оротатные, оксалатные, пальмитатные, памоатные, фосфатные, гидрофосфатные, дигидрофосфатные, пироглютаматные, сахаратные, стеаратные, сукцинатные, таннатные, тартратные, тозилатные, трифторацетатные и ксинофоатные соли. Фармацевтически приемлемые соли оснований включают нетоксичные соли, полученные из оснований, включая катионы металлов, такие как катионы щелочных или щелочноземельных металлов, а также аминов. Примеры пригодных катионов металлов включают натрий (Na+), калий (K+), магний(Mg2+), кальций (Са 2+), цинк (Zn2+) и алюминий (Al3+). Примеры пригодных аминов включают аргинин,N,N'-дибензилэтилендиамин, хлорпрокаин, холин, диэтиламин, диэтаноламин, дициклогексиламин, этилендиамин, глицин, лизин, N-метилглюкамин, оламин, 2-амино-2-гидроксиметил-пропан-1,3-диол и прокаин. Обсуждение пригодных солей присоединения кислот и оснований представлено в публикации S.M. Berge et al, J. Pharm. Sci. (1977) 66:1-19; см. также публикацию Stahl and Wermuth, Handbook of Pharmaceutical Salts. Properties, Selection, and Use (2002). Фармацевтически приемлемые соли могут быть получены различными способами. Например, путем взаимодействия соединения формулы 1 с соответствующей кислотой или основанием для получения заданной соли. Можно также выполнить реакцию предшественника соединения формулы 1 с кислотой или основанием для удаления кислотной или основной подвижной защитной группы или для раскрытия лактоновой или лактамовой группы предшественника. Кроме того, можно осуществить превращение соли соединения формулы 1 в другую соль путем обработки соответствующей кислотой или основанием или взаимодействием с ионообменной смолой. После реакции можно выделить соль фильтрацией, если она выпала в осадок из раствора, или выпариванием для выделения соли. Степень ионизации соли может варьироваться от полностью ионизированной до почти неионизированной. Соединения формулы 1 могут существовать в непрерывном диапазоне твердых состояний от полностью аморфного до полностью кристаллического. Термин "аморфный" относится к состоянию, в котором у материала отсутствует пространственная упорядоченность на молекулярном уровне и, в зависимости от температуры, может проявлять физические свойства твердого вещества или жидкости. Обычно такие материалы не дают харак-8 021568 терных диаграмм рентгеновской дифракции и, несмотря на проявления свойств твердого вещества, более формально описываются как жидкость. При нагревании возникает изменение свойств от твердого вещества к жидкости, которое характеризуется изменением состояния, обычно второго порядка ("стеклование"). Термин "кристаллический" относится к твердой фазе, в которой материал имеет упорядоченную внутреннюю структуру на молекулярном уровне и дает характерную диаграмму рентгеновской дифракции с определенными пиками. Такие материалы при достаточном нагревании также демонстрируют свойства жидкости, но изменение от твердого вещества к жидкости характеризуется фазовым изменением, обычно первого порядка ("температура плавления"). Соединения формулы 1 могут также существовать в несольватированных и сольватированных формах. Термин "сольват" описывает молекулярный комплекс, включающий данное соединение и одну или более молекул фармацевтически приемлемого растворителя (например, EtOH). Термин "гидрат" является сольватом, в котором растворителем является вода. Фармацевтически приемлемые сольваты включают сольваты, в которых растворитель может быть замещен изотопами (например, D2O, ацетон-d6, ДМСО-d6). Принятая в настоящее время классификация сольватов и гидратов органических соединений является классификацией, выделяющей сольваты и гидраты с изолированными центрами, канальные и металл-ионные координированные сольваты и гидраты. См., например, публикацию K. R. Morris (H. G.Brittain ed.) Polymorphism in Pharmaceutical Solids (1995). Сольваты и гидраты с изолированными центрами являются такими сольватами и гидратами, в которых молекулы растворителя (например, воды) изолированы от прямого контакта друг с другом за счет промежуточных молекул органического соединения. В канальных сольватах молекулы растворителя лежат в каналах решетки, где они расположены вслед за другими молекулами растворителя. В металл-ионных координированных сольватах молекулы растворителя связаны с ионом металла. Если растворитель или вода прочно связаны, то комплекс имеет точную стехиометрию, не зависящую от влажности. Однако если растворитель или вода связаны слабо, как в канальных сольватах и в гигроскопичных соединениях, то содержание воды или растворителя зависит от влажности и условий высушивания. В таких случаях обычно наблюдается отсутствие стехиометрии. Соединения формулы 1 могут также существовать в виде многокомпонентных комплексов (отличных от солей и сольватов), в которых соединение (лекарство) и по меньшей мере один другой компонент присутствуют в стехиометрических или нестехиометрических количествах. Комплексы такого типа включают клатраты (комплексы-включения лекарства и носителя) и сокристаллы. Последние обычно определяются как кристаллические комплексы нейтральных молекулярных компонентов, которые связаны посредством нековалентных взаимодействий, но могут также быть комплексом нейтральной молекулы с солью. Сокристаллы могут быть получены кристаллизацией расплава, перекристаллизацией из растворителей или совместным физическим измельчением компонентов. См., например, публикацию О.Almarsson and М. J. Zaworotko, Chem. Commun. (2004) 17:1889-1896. Общий обзор многокомпонентных комплексов представлен в публикации J. К. Haleblian, J. Pharm. Sci (1975) 64(8):1269-88. При воздействии соответствующих условий соединения формулы 1 могут существовать в мезоморфном состоянии (мезофаза или жидкий кристалл). Мезоморфное состояние находится между настоящим кристаллическим состоянием и настоящим жидким состоянием (расплав или раствор). Мезоморфизм, возникающий в результате изменения температуры, описывается как "термотропный", а мезоморфизм, возникающий в результате добавления второго компонента, такого как вода или другой растворитель, описывается как "лиотропный". Соединения, обладающие способностью образовывать лиотропные мезофазы, описываются как "амфифильные" и включают молекулы, которые имеют полярную ионную группу (например, -COO-Na+, -COO-K+, -SO3-Na+) или полярную неионную группу (такую как -NN+(СН 3)3). См., например, публикацию N. Н. Hartshorne and A. Stuart, Crystals and the Polarizing Microscope (4-е изд., 1970). Все ссылки на соединения, включая соединения формулы 1 и соединения, перечисленные в настоящем описании, обычно включают все их полиморфы и кристаллические формы, стереоизомеры и таутомеры, а также их меченные изотопами соединения. Некоторые соединения, описанные здесь, могут иметь стереоизомеры. Такие соединения могут существовать в виде единых энантиомеров (энантиочистые соединения) или смесей энантиомеров (обогащенные и рацемические образцы), что зависит от относительного избытка одного энантиомера по сравнению с другим энантиомером в образце, могут обладать оптической активностью. Такие стереоизомеры, которые являются неналагающимися зеркальными изображениями, обладают стереогенной осью или одним или более стереогенных центров (то есть хиральностью). Другие соединения могут быть стереоизомерами, которые не являются зеркальными изображениями. Такие стереоизомеры, известные как диастереоизомеры, могут быть хиральными или ахиральными (не содержащими стереогенных центров). Они включают молекулы, содержащие алкениловую или циклиловую группу, так, что возможны цис/транс (или Z/E) изомеры или молекулы, содержащие два или более стереогенных центров, в которых инверсия одного стереогенного центра образует соответствующий диастереоизомер. Если не указано или не очевидно иное (например, при использовании стереосвязей, дескрипторов стереоцентров и так далее),то в рамки настоящего изобретения и раскрытия, как правило, включены ссылки на соединения и их сте-9 021568 реоизомеры, как чистые (например, энантиочистые), так и смеси (например, энантиомерно обогащенные или рацемические). Геометрические (цис/транс) изомеры могут быть разделены обычными способами, такими как хроматография и фракционная кристаллизация. Отдельные энантиомеры соединений могут быть получены хиральным синтезом из соответствующих оптически чистых предшественников или могут быть выделены разделением рацемата (или рацемата соли, или производного) с использованием, например, хиральной ВЭЖХ. Альтернативно рацемат (или рацемический предшественник) может взаимодействовать с соответствующим энантиомерно чистым соединением (например, кислотой или основанием) для получения пары диастереоизомеров, каждый - состоящий из одного энантиомера, которые разделяются, например, фракционной перекристаллизацией или хроматографией. Заданный энантиомер затем выделяется из соответствующего диастереоизомера. Часто заданный энантиомер может быть дополнительно обогащен перекристаллизацией из соответствующего растворителя (например, ACN), если он имеется в достаточном количестве (например, обычно немного меньше чем около 85% э.и., а в некоторых случаях немного меньше чем около 90% э.и.). Дополнительное рассмотрение способов разделения стереоизомеров представлено в публикации Е. L. Eliel and S. H. Wilen, Stereochemistry of Organic Compounds (1994). Термин "таутомеры" относится к структурным изомерам, которые являются взаимопревращающимися за счет низкого энергетического барьера. Таутомерный изомеризм (таутомеризм) может иметь форму протонного таутомеризма, в котором соединение содержит, например, имино, кето или оксимовую группу,или форму валентного таутомеризма, в котором соединение содержит ароматическую группу. Соединения,описанные здесь, включают также все фармацевтически приемлемые изотопные варианты, в которых по меньшей мере один атом замещен атомом, имеющим такой же атомный номер, но атомную массу, отличную от атомной массы, обычно встречающейся в природе. Изотопы, пригодные для включения в соединения формулы 1, включают, например, изотопы водорода, такие как 2 Н и 3 Н; изотопы углерода, такие как 11 С, 13 С и 14 С; изотопы азота, такие как 13N и 15N; изотопы кислорода, такие как 15 О, 17 О и 18 О; изотопы серы, такие как 35S; изотопы фтора, такие как 18F; изотопы хлора, такие как 36Cl; и изотопы йода,такие как 123I и 125I. Использование изотопных вариантов (например, дейтерия, 2 Н) может давать определенные терапевтические преимущества за счет большей метаболической стабильности, например, увеличивать период полувыведения in vivo или снижать необходимые дозы. Кроме того, некоторые изотопные варианты описанных соединений могут содержать радиоактивные изотопы (например, тритий, 3 Н или 14 С), что может быть полезным при изучении распределения лекарства и/или субстрата в тканях. Замещение позитрон-излучающими изотопами, такими как 11 С, 18F, 15O и 13N, может быть полезным в исследованиях позитрон-эмиссионной томографии (ПЭТ) для изучения степени занятости рецептора субстратом. Изотопно-меченные соединения могут быть получены по способу, аналогичному способам, описаным где-либо в настоящем раскрытии, с использованием соответствующего меченного изотопом реактива вместо реактива без метки. Соединения формулы 1 могут быть получены по способам, описанным ниже. В некоторых схемах и примерах могут быть опущены подробности обычных реакций, включая окисление, восстановление и так далее, способов разделения (экстракции, выпаривания, осаждения, хроматографии, фильтрации, растирания в порошок, кристаллизации и тому подобных), которые известны специалистам в области органической химии. Подробности таких реакций и способов представлены в ряде научных трудов, включая Richard Larock, Comprehensive Organic Transformations (1999), и многотомное издание под редакцией Michael В. Smith и др., Compendium of Organic Synthetic Methods (1974 etseq.). Исходные материалы и реактивы могут быть получены из коммерческих источников или могут быть приготовлены с использование способов, описанных в литературе. В некоторых схемах реакций могут быть опущены побочные продукты, получающиеся в результате химических превращений (например, спирт в результате гидролиза сложного эфира, СО 2 в результате декарбоксилирования дикислоты и так далее). Кроме того, в некоторых случаях промежуточные продукты реакции могут использоваться на следующих этапах без выделения или очистки (то есть in situ).В некоторых схемах реакций и примерах,представленных ниже, некоторые продукты могут быть получены с использованием защитных групп,предотвращающих нежелательные химические реакции у центров, которые иначе были бы активными. Защитные группы могут также использоваться для улучшения растворимости или другого изменения физических свойств соединения. Рассмотрение методик использования защитных групп, описание материалов и способов установки и снятия защитных групп, а также компиляция подходящих защитных групп для общих функциональных групп, включая амины, карбоновые кислоты, спирты, кетоны, альдегиды и так далее, представлено в публикациях Т. W. Greene and P. G. Wuts, Protecting Groups in OrganicChemistry (1999) и Р. Kocienski, Protective Groups (2000). Как правило, химические превращения, описанные в настоящем описании, могут быть выполнены с использованием, по сути, стехиометрических количеств реактивов, хотя для некоторых реакций может быть полезно использовать избыток одного или более реактивов. Кроме того, многие реакции, описанные в настоящем описании, могут быть выполнены примерно при комнатной температуре (RT) и обычном давлении, но, в зависимости от кинетики реакции, выхода продуктов и так далее, некоторые реакции могут протекать при повышенных давлениях или с использованием более высоких температур (например, условия дефлегмации) или более низких температур (например, от -78 до 0 С). Любое упоминание в- 10021568 настоящем раскрытии стехиометрического диапазона, температурного диапазона, диапазона рН и так далее, независимо от того, четко ли использовано слово "диапазон" или нет, также включает указанные конечные точки. Во многих химических преобразованиях может использоваться также один или более совместимых растворителей, которые могут влиять на скорость и выход реакции. В зависимости от природы реактивов, один или более растворителей могут быть полярным протонным растворителем (включая воду), полярным апротонным растворителем, неполярным растворителем или какой-либо комбинацией. Типичные растворители включают насыщенные алифатические углеводороды (например, нпентан, н-гексан, н-гептан, н-октан); ароматические углеводороды (например, бензол, толуол, ксилолы); галогенированные углеводороды (например, метиленхлорид, хлороформ, четыреххлористый углерод); алифатические спирты (например, метанол, этанол, пропан-1-ол, пропан-2-ол, бутан-1-ол, 2-метилпропан-1-ол, бутан-2-ол, 2-метилпропан-2-ол, пентан-1-ол, 3-метилбутан-1-ол, гексан-1-ол, 2-метоксиэтанол,2-этоксиэтанол, 2-бутоксиэтанол, 2-(2-метоксиэтокси)этанол, 2-(2-этоксиэтокси)этанол, 2-(2-бутоксиэтокси)этанол; простые эфиры (например, диэтиловый эфир, ди-изопропиловый эфир, дибутиловый эфир,1,2-диметоксиэтан, 1,2-диэтоксиэтан, 1-метокси-2-(2-метоксиэтокси)этан, 1-этокси-2-(2-этоксиэтокси) этан, тетрагидрофуран, 1,4-диоксан); кетоны (например, ацетон, метилэтилкетон); сложные эфиры (метилацетат, этилацетат); азотсодержащие растворители (например, формамид, N,N-диметилформамид,ацетонитрил, N-метилпирролидон, пиридин, хинолин, нитробензол); серосодержащие растворители (например, дисульфид углерода, диметилсульфоксид, тетрагидротиофен-1,1-диоксид); и фосфорсодержащие растворители (например, гексаметилфосфорной кислоты триамид). На представленных ниже схемах определители заместителей (например, R1, R3, R4, R5, R7, R8, R9, L1 и L2) являются такими, как определено выше для формулы 1. Однако, как упоминалось ранее, некоторые исходные материалы и промежуточные соединения могут включать защитные группы, которые удаляются перед получением конечного продукта. В таких случаях определитель заместителя относится к группам, определенным в формуле 1, и к этим группам с соответствующими защитными группами. Например, исходный материал или промежуточное соединение на схемах могут включать R3, который является группой, имеющей потенциально активный амин. В таких случаях R3 включает группу, имеющую, например, группу Boc или Cbz, присоединенную к этому амину, или не имеющую такой группы. На схеме 1 представлен способ получения соединения 1-5. Исходный материал 1-0 (например, метил 6-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-5-карбоксилат) хлорируется при повышенной температуре (например, 95-105 С) с использованием фосфорилтрихлорида в качестве растворителя реактива в присутствии каталитического количества N,N-диметиланилина для получения метил пиримидин карбоксилата 1-1. Группы 2-хлор и 4-хлор промежуточного соединения 1-1 затем удаляются обработкой амином, замещенным соответствующим образом. Как показано на схеме 1, 2-хлор-группа взаимодействует с R4-NH2(например, замещенным анилином) в полярном апротонном органическом растворителе (например, ACN или ТГФ) и в присутствии затрудненного основания, такого как Et3N или ДИПЭА (2 экв.) для получения промежуточного соединения 1-2. Реакция может быть выполнена при повышенных температурах (например, от 90 С до состояния дефлегмации). Точно так же 4-хлор-группа замещается R3-NH2 для получения промежуточного соединения 1-3. Второе замещение выполняется при повышенных температурах (например, от 90 С до состояния дефлегмации) в полярном апротонном органическом растворителе (например,ДМА или ДМФ) в присутствии затрудненного основания (например, Et3N или ДИПЭА). Схема 1- 11021568 На схеме 1 показаны два способа циклизации промежуточного соединения 1-3. В одном способе соединение 1-3 окисляется SeO2 (2-4 экв.) в органическом растворителе, таком как 1,4-диоксан, при дефлегмации (например, около 100 С) для получения промежуточного кетона (или альдегида) (не показано). Следующая реакция с 2,4-диметоксибензиламином в присутствии мягкого восстанавливающего агента, такого как цианоборгидрид натрия (1,5 экв.) или триацетокси-боргидрида натрия в МеОН, дает при восстановительном аминировании промежуточное амино-соединение, которое циклизуется в 1-4 или сразу, или при нагревании примерно до 50 С. Диметоксибензиловую группу можно удалить обработкой промежуточного соединения 1-4 кислотой (например, ТФУК) примерно при 60 С, что дает заданное соединение 1-5. Во втором способе промежуточное соединение 1-3 обрабатывается бромирующим реагентом, таким как NBS, в присутствии инициатора (например, дибензоилпероксида или AIBN) в CCl4. Дефлегмация реакционной смеси дает промежуточное соединение 1-6, которое обрабатывается источником аммиака (например, гидроксидом аммония) в ТГФ для получения 1-5. Схема 2 На схеме 2 представлен способ получения соединения 2-8. Исходный материал 2-0 (2-(1,3 диоксоизоиндолин-2-ил)уксусная кислота) взаимодействует с 2,2-диметил-1,3-диоксан-4,6-дионом (1-1,5 экв.) и 4-диметиламинопиридином (1-1,5 экв.) в присутствии DCC (1-1,5 экв.) и органического растворителя, такого как дихлорметан, для получения промежуточного соединения 2-1. Последующая обработка соединения 2-1 2,4-диметоксибензиламином (1 экв.) в EtOH примерно при 50 С дает имин 2-2, который выделяют, повторно растворяют в органическом растворителе (например, ТГФ) и обрабатывают активированным карбонилизоцианатом (например, хлоридом карбонизоцианатидина, 1 экв.) примерно при 80 С для получения промежуточного соединения 2-3. В результате обработки 2-3 кислотой (например,ТФУК при температуре от комнатной до 60 С) удаляется диметоксибензиловая группа для получения промежуточного соединения 2-4, которое затем взаимодействует с хлорирующим агентом (например,POCl3) при дефлегмации (например, при около 100 С) для получения промежуточного соединения 2-5. Поэтапное замещение двух хлор-групп на соответствующие замещенные амины (R4-NH2 и R3-NH2) дает промежуточные соединения 2-6 и 2-7. Обработка промежуточного соединения 2-7 гидразингидратом (4-5 экв.) в EtOH при нагревании (например, при около 65 С) дает соединение 2-8. На схеме 3 представлен другой способ получения соединения 2-8. Исходный материал 3-0 (2,4,6 трихлорпиримидин) обрабатывается сильным основанием, таким как LDA (свежим, полученным из диизопропиламина и n-BuLi, или купленным) при -78 С в сухом ТГФ, а затем гасится сухим льдом. Нагревание смеси до комнатной температуры и перемешивание дает промежуточное соединение 3-1. Замена хлор-группы обработкой соответствующим замещенным амином (R4-NH2, 1 экв.) в присутствии затрудненного основания (например, Et3N или ДИПЭА, 2 экв.) и полярного апротонного органического растворителя (например, ДМФ) дает промежуточное соединение 3-2. Последующая обработка соединением 3-2MeI (1-1,5 экв.) и основанием (например, бикарбонатом натрия, 1,5-3 экв.) дает сложный эфир 3-3, который может быть превращен в соединение 2-8 двумя различными способами. В одном способе промежуточное соединение 3-3 обрабатывается соответствующим замещенным амином (R3-NH2, 1-1,1 экв.) в присутствии затрудненного основания (например, ДИПЭА) и полярного апротонного органического растворителя (например, ТГФ) для получения промежуточного соединения 3-4 и изомера. После выделения промежуточное соединение 3-4 реагирует с цианидом цинка (0,5-1 экв.) и каталитическим количеством(10%) тетракис(трифенилфосфин)палладия(0) в ДМФ примерно при 90 С для получения нитрила 3-5. Восстановление нитрильной группы до амина путем гидрогенирования с Pd на углероде (5-10%) в EtOH и каталитическим количеством HCl дает, при обработке бикарбонатом натрия, 2-8. В альтернативном способе промежуточное соединение 3-3 сначала превращается в нитрил 3-6 путем цианирования на палладиевом катализаторе путем нагревания смеси 3-3, цианида цинка (0,5-1 экв.),тетракис(трифенилфосфин)палладия(0) (0,1 экв.) и полярного апротонного растворителя (например,ДМФ) в микроволновой печи примерно при 120 С в течение около 1 ч. После выделения промежуточное соединение 3-6 превращается при комнатной температуре в 3-5 по реакции с соответствующим замещенным амином (R3-NH2, 1-1,5 экв.) в полярном апротонном растворителе (например, ДМФ) в присутствии затрудненного основания (например, ДИПЭА). Как описано выше, восстановление нитрильной группы 3-5 и последующая циклизация дает соединение 2-8. На схеме 4 представлен способ получения соединения 4-6. Литирование исходного материала 4-0 (2,6-ди-гало-3-йодпиридина) направленным ортолитированием LDA в ТГФ при -78 С, с последующим погашением сухим льдом, дает 4-1, которое затем эстерифицируется при комнатной температуре с использованием MeI и основания (например, карбоната калия). Как и на схеме 3, йод-группа промежуточного соединения 4-2 превращается в нитрильную группу путем цианирования на палладиевом катализаторе для получения 4-3. Поэтапное замещение двух хлор-групп соответствующими замещенными аминами (R4-NH2 и R3-NH2) дает промежуточные соединения 4-4 и 4-5. Как и на этапе замыкания кольца, отображенном на схеме 3, гидрогенирование с последующей циклизацией дает соединение 4-6. На схеме 5 представлен способ получения соединения 5-4. Исходный материал 1-1 (метил 2,4 дихлор-6-метилпиримидин-5-карбоксилат) взаимодействует с ароматической бороновой кислотой или боратом (например, R4-B(OR13)2, где R4 является C6-14 арилом или C1-9 гетероарилом, и, например, каждый R13 является Н или C1-4 алкилом) в присутствии палладиевого катализатора (например, Pd(PPh3)4,(PPh3)2PdCl2 и так далее), основания (например, KF или Na2CO3) и органического растворителя (например, диоксана, ДМФ и так далее). Связывание типа Сузуки выполняется при повышенной температуре(например, при около 90 С) и дает промежуточное соединение 5-1. Замещение хлор-группы на соответствующий замещенный амин (R3-NH2) дает промежуточное соединение 5-2. Как и на схеме 1, метиловая группа пиримидина окисляется SeO2 (2-4 экв.) в органическом растворителе (например, 1,4-диоксане) при дефлегмации для получения промежуточного альдегида, который затем реагирует с 2,4 диметоксибензиламином в присутствии мягкого восстанавливающего агента (например, около 1,5 экв.NaCNBH3 или NaBH(OAc)3) в МеОН для получения, при восстановительном аминировании, промежуточного амино-соединения, которое циклизуется в 5-3 или сразу, или при нагревании примерно до 50 С. Обработка промежуточного соединения 5-3 кислотой (например, TFA) примерно при 60 С дает соединение 5-4. Схема 5 На схеме 6 представлен способ получения соединения 6-3. Исходный материал 6-0, который может быть получен из метил 2,4-дихлор-6-метилпиримидин-5-карбоксилата по способу, описанному выше,взаимодействует с ароматической бороновой кислотой или боратом (например, R3-B(OR13)2, где R3 является C6-14 арилом или C1-9 гетероарилом, и, например, R13 является Н или C1-4 алкилом) в присутствии палладиевого катализатора (например, Pd(PPh3)4, (PPh3)2PdCl2 и так далее), основания (например, KF илиNa2CO3) и органического растворителя (например, диоксана, ДМФ, ДМЭ и так далее). Связывание типа Сузуки выполняется при повышенной температуре (например, при около 90 С) и дает промежуточное- 14021568 соединение 6-1. Метиловая группа пиримидина окисляется SeO2 (2-4 экв.) в органическом растворителе(например, 1,4-диоксане) при дефлегмации для получения промежуточного альдегида, который затем реагирует с 2,4-диметоксибензиламином в присутствии мягкого восстанавливающего агента (например,около 1,5 экв. NaCNBH3 или NaBH(OAc)3) в МеОН, для получения промежуточного соединения 6-2. Обработка 6-2 кислотой (например, ТФУК) примерно при 60 С дает соединение 6-3. Схема 6 На схеме 7 представлены способы получения соединений 7-2, 7-3, 7-4, 7-5 и 7-6. Исходный материал 7-0, который может быть получен по способам, описанным выше, может взаимодействовать с NBS или NIS для получения гало-пиридинового промежуточного соединения (Y1 является Br или I). Как и на схеме 3, гало-группа 7-1 может быть превращена в нитрильную группу цианированием на палладиевом катализаторе для получения 7-2. Соединение 7-2 затем реагирует с реактивом Гриньяра (R7-MgBr) для получения промежуточного имина (не показан), который при кислотом гидролизе дает соединение 7-3. Альтернативно гало-пиридиновое промежуточное соединение 7-1 может реагировать с NHR8R9 в присутствии катализатора палладия (II) (например, PdCl2(dppf, стехиометрического количества основания(например, NaOt-Bu) и органического растворителя (напрмер, диоксана, толуола и так далее) при повышенной температуре (например, при около 100 С). Сочетание Бухвальда-Хартвига дает гетероариловый амин 7-4. Кроме того, 7-1 может взаимодействовать с концевым алкином (HCR13, например, R13 является Н или C1-4 алкилом) в присутствии катализатора палладия (II) (например, (PPh3)2PdCl2), сокатализатора меди (I) (например, CuI) и аминного основания (например, Et3N) при комнатной температуре. Последующее связывание Соногашира, восстановление алкиновой группы дает соединение 7-5, гдеR5 является, например, C1-5 алкилом. Соединение 7-1 может взаимодействовать с ароматической бороновой кислотой или боратом (например, R5-B(OR13)2, где R5 является C1-9 гетероарилом, и, например, R13 является Н или C1-4 алкилом) в присутствии палладиевого катализатора (например, Pd(PPh3)4,(PPh3)2PdCl2 и так далее), основания (например, KF или Na2CO3) и органического растворителя (например, диоксана, ДМФ и так далее). Связывание типа Сузуки выполняется при повышенной температуре Как показано на схеме 7, соединение 7-0 может альтернативно быть обработано фторирующим агентом, таким как SELECTFLUOR (1-(хлорметил)-4-фтор-1,4-диазониабицикло[2.2.2]октан дитетрафторборат), в органическом растворителе (например, ДХМ) или в смеси органических растворителей (например, ДХМ и МеОН) для получения фтор-пиридинового производного 7-6 (Y2 является F). Точно так же 7-0 может быть обработан хлорирующим агентом, таким как NCS, в апротонном растворителе (например, ДХМ) для получения хлор-пиридинового производного 7-6 (Y2 является Cl). На схеме 8 представлен альтернативный способ получения соединения 4-6. Исходный материал 8-0(2-хлор-3-йодпиридин) подвергается орто-направленному литированию обработкой LDA в ТГФ при 78 С. Погашение сухим льдом дает 8-1, которое затем эстерифицируется при комнатной температуре с использованием йодметана и основания (например, карбоната калия). Как и на схеме 4, йод-группа промежуточного соединения 8-2 превращается в нитрильную группу цианированием на палладиевом катализаторе или обработкой цианомедью или цианидом цинка в соответствующем растворителе (например,ДМФ, ДМА и так далее) при повышенной температуре. Заместитель R4 устанавливается на 8-3 по реакции Сузуки, что дает промежуточное соединение 8-4. N-оксидирование пиридиновой группы обработкой комплексом перекиси водорода и мочевины дает активированное промежуточное соединение 8-5, которое хлорируется по реакции с оксихлоридом фосфора при повышенной температуре (например, 90100 С). Замещение хлор-группы в соединении 8-6 по реакции с соответствующим замещенным амином(R3-NH2) дает промежуточное соединение 8-7. Последующее восстановление гидрогенированием на палладиевом катализаторе и циклизация дает соединение 4-6. Схема 8 На схеме 9 представлен синтез соединения 9-5. Исходный материал 9-0 (2,6-дихлор-5 фторникотиновая кислота) литируется обработкой LDA в ТГФ при -78 С. Погашение ДМФ дает промежуточный альдегид 9-1, который подвергается восстановительному аминированию по реакции с амином (например, 2,4-диметоксифенил)метанамином) и восстановительным агентом (например, NaBH(OAc)3). Полученная аминокислота (не показана) циклизуется амидным связыванием, в котором используется соответствующий связывающий агент (например, EDCI, DCC и так далее), катализатор (HOBt, ДМАП и так далее) и растворитель (например, ДМФ, ДМСО, ACN, ТГФ, ДХМ и так далее). Как и на предыдущих схемах, замещение хлор-группы соединения 9-2 соответствующим амином (R3-NH2) дает промежуточное соединение 93, которое затем реагирует с ароматической бороновой кислотой или боратом (например, R4-B(OR13)2 в присутствии палладиевого катализатора (например, Pd(PPh3)4, (PPh3)2PdCl2 и так далее), основания (например, KF или Na2CO3) и органического растворителя (например, диоксана, ДМФ и так далее) при повышенной температуре (например, около 90 С) для получения 9-4. Последующее связывание Сузуки, обработка 9-4 при помощи ТФУК при повышенной температуре (например, 40-60 С) дает 9-5. На схеме 10 представлен другой способ получения соединения 1-5. Хлоргруппа соединения 1-2 сначала замещается метантиолатом натрия для получения 10-1. Как и на схеме 1, промежуточное соединение 10-1 окисляется SeO2 для получения промежуточного кетона (или альдегида) (не показано), который реагирует с 2,4-диметоксибензиламином в присутствии восстанавливающего агента для получения,посредством восстановительного аминирования, промежуточной аминокислоты, которая циклизуется в 10-2. Метилтио-группа превращается в метилсульфонил при помощи mCPBA (м-хлорпероксибензойной кислоты), которая замещается соответствующим амином (R3-NH2) для получения промежуточного соединения 10-4. Обработка 10-4 кислотой (например, TFA) при повышенной температуре (например, 4060 С) дает соединение 1-5. Схема 11 На схеме 11 представлен альтернативный синтез соединения 9-5. Исходный материал 11-0 (2,6 дихлор-5-фторникотинонитрил) гидролизуется обработкой концентрированной серной кислотой при повышенной температуре (например, около 65 С) для получения амида 11-1, который литируется обработкой LiHMDS примерно при 0 С или взаимодействием с LDA в THF при -78 С. Погашение при помощи ДМФ дает промежуточный альдегид 11-2, который восстанавливается до лактама 11-3 обработкой восстанавливающим агентом (например, триэтилсиланом) и кислотой (например, ТФУК) в органическом растворителе (например, ДХМ). Последующая установка защитной группы Boc на лактам 11-3, замещение хлор-группы соединения 11-4 по реакции с соответствующим амином (R3-NH2) дает промежуточное соединение 11-5. Это промежуточное соединение затем реагирует с ароматической бороновой кислотой или боратом (например, R4-B(OR13)2 в присутствии палладиевого катализатора (например, Pd(PPh3)4,(PPh3)2PdCl2, Pd2(dba)3 и так далее), необязательного лиганда (например, 2-(дициклогексилфосфино) бифенила), основания (например, KF или Na2CO3) и органического растворителя (например, диоксана,ДМФ и так далее) для получения соединения 11-6. Реакция Сузуки выполняется при повышенной температуре (например, 90-160 С) обычным нагреванием или микроволновым излучением. Альтернативно- 17021568 соединение 11-5 может взаимодействовать с ароматическим реагентом олова (например, R4-Sn(n-Bu)3) в присутствии палладиевого катализатора (например, Pd(PPh3)4) и органического растворителя (например,толула) при повышенной температуре (например, около 100 С). Последующее связывание Сузуки или Стилле, обработка 11-6 кислотой (например, ТФУК или HCl) при комнатной температуре или выше (например, около 20-60 С) дает 9-5. Соединения формулы 1, которые включают соединения, перечисленные выше, и их фармацевтически приемлемые соли должны быть оценены по своим биофармацевтическим свойствам, таким как растворимость и устойчивость раствора в зависимости от рН, проницаемость и тому подобное, для выбора соответствующей лекарственной формы и способа введения. Соединения, предназначенные для фармацевтического использования, могут вводиться в виде кристаллических или аморфных продуктов и могут быть получены, например, в виде твердых пробок, порошков или пленок такими способами как осаждение, кристаллизация, сублимационная сушка, распылительная сушка, сушка выпариванием, микроволновая сушка или радиочастотная сушка. Соединения формулы 1 могут вводиться самостоятельно или в комбинации с одним другим или с одним или более фармакологически активных соединений, которые являются отличными от соединений формулы 1. Как правило, одно или более этих соединений вводятся в виде фармацевтических композиций (рецептур) в сочетании с одним или более фармацевтически приемлемых формообразующих средств. Выбор формообразующих средств зависит от конкретного режима введения, влияния формообразующего средства на растворимость и устойчивость, а также, помимо прочего, от природы лекарственной формы. Пригодные фармацевтические композиции и способы их получения представлены, например, в публикации A. R. Gennaro (ed.), Remington The Science and Practice of Pharmacy (20-е изд., 2000). Соединения формулы 1 могут вводиться перорально. Пероральное введение может включать проглатывание, и в этом случае соединение поступает в кровоток через желудочно-кишечный тракт. Альтернативно или дополнительно пероральное введение может включать введение через слизистую оболочку (например, буккальное, сублингвальное, супралингвальное введение), так, что соединение поступает в кровоток через слизистую оболочку рта. Композиции, пригодные для перорального введения, включают твердые, полутвердые и жидкие системы, такие как таблетки; мягкие или твердые капсулы, содержащие мульти- или наночастицы, жидкости или порошки; лепешки, которые могут быть наполнены жидкостью; жвачки; гели, быстро диспергирующиеся лекарственные формы; пленки; суппозитории; спреи; и буккальные или мукоадгезивные пластыри. Жидкие композиции включают суспензии, растворы, сиропы и эликсиры. Такие композиции могут использоваться как наполнители в мягких и твердых капсулах (сделанных, например, из желатина или гидроксипропилметилцеллюлозы) и обычно включают носитель (например, воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или подходящее масло) и один или более эмульгирующих агентов, суспендирующих агентов или их обоих. Жидкие композиции могут быть также получены восстановлением твердых форм (например, из саше). Соединения формулы 1 могут также использоваться в виде быстрорастворимых, быстрорасщепляющихся лекарственных форм, таких как описно в публикации Liang and Chen, Expert Opinion in Therapeutic Patents (2001) 11(6):981-986. Для таблеточных лекарственных форм, в зависимости от дозировки, активный фармацевтический компонент (API) может включать от около 1 вес.% до около 80 вес.% лекарственной формы или более типично от около 5 вес.% до около 60 вес.% лекарственной формы. Помимо API, таблетки могут включать один или более дезинтегрирующих средств, связующих веществ, разбавителей, поверхностноактивных веществ, глидантов, смазывающих веществ, антиоксидантов, красителей, ароматизаторов, консервативов и средств маскировки вкуса. Примеры дезинтегрирующих средств включают натрия гликолят крахмала, натрия карбоксиметилцеллюлозу, кальция карбоксиметилцеллюлозу, кроскармеллозу натрия,кроспровидон, поливинилпирролидон, метилцеллюлозу, микрокристаллическую целлюлозу, C1-6 алкилзамещенную гидроксипропилцеллюлозу, крахмал, пептизированный крахмал и альгинат натрия. Как правило, дезинтегрирующее средство составляет от около 1 вес.% до около 25 вес.% или от около 5 вес.% до около 20 вес.% лекарственной формы. Связующие вещества обычно используются для сообщения когезивных свойств таблеточной композиции. Пригодные связующие вещества включают микрокристаллическую целлюлозу, желатин, сахара, полиэтиленгликоль, природные и синтетические смолы, поливинилпирролидон, пептизированный крахмал, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. Таблетки могут также содержать разбавители, такие как лактоза (моногидрат, высушенный распылением моногидрат, безводная),маннит, ксилит, декстроза, сахароза, сорбит, микрокристаллическая целлюлоза, крахмал и дигидрат двухосновного фосфата кальция. Таблетки могут также включать поверхностно-активные агенты, такие как натрия лаурилсульфат и полисорбат 80, и глиданты, такие как диоксид кремния и тальк. Если они есть, то поверхносто-активные агенты могут составлять от около 0,2 вес.% до около 5 вес.% таблетки, а глиданты могут составлять от около 0,2 вес.% до около 1 вес.% таблетки. Таблетки могут также содержать смазывающие вещества, такие как стеарат магния, стеарат кальция, стеарат цинка, натрия стеарилфумарат и смеси стеарата магния и натрия лаурилсульфата. Смазы- 18021568 вающие вещества могут составлять от около 0,25 вес.% до около 10 вес.% или от около 0,5 вес.% до около 3 вес.% таблетки. Таблеточные смеси могут прессоваться напрямую или вальцеванием для формирования таблеток. Таблеточные смеси или порции смесей могут быть альтернативно гранулированы во влажном виде, в сухом виде или из расплава, заморожены из расплава или экструдированы перед таблетированием. При необходимости перед смешиванием один или более компонентов могут быть калиброваны просеиванием или измельчением, или и тем, и другим. Готовая лекарственная форма может содержать один или более слоев и может быть с покрытием, без покрытия или инкапсулирована. Примеры таблеток могут содержать примерно до 80 вес.% API, от около 10 вес.% до около 90 вес.% связующего вещества, от около 0 вес.% до около 85 вес.% разбавителя, от около 2 вес.% до около 10 вес.% дезинтегрирующего средства и от около 0,25 вес.% до около 10 вес.% смазывающего вещества. Рассмотрение смешивания, гранулирования, измельчения, просеивания, таблетирования, нанесения покрытия, а также описание альтернативных способов получения лекарственных продуктов представлено в публикациях A.(ed.), Pharmaceutical Dosage Forms: Tablets, Vol. 1-3 (2nd ed., 1990); и D. K. ParikhС. K. Parikh, Handbook of Pharmaceutical Granulation Technology, Vol. 81 (1997). В пригодных к потреблению пероральных пленках для лечения людей или для ветеринарии используются гибкие водорастворимые или разбухающие в воде тонкие пленочные лекарственные формы, которые могут быстро растворяться или являются мукоадгезивными. Кроме API, типичная пленка включает один или более пленкообразующих полимеров, связующих веществ, растворителей, увлажнителей,пластификаторов, стабилизаторов или эмульгаторов, модификаторов вязкости и растворителей. Другие компоненты пленки могут включать антиоксиданты, красители, ароматизаторы и усилители вкуса, консерванты, средства стимуляции слюновыделения, охлаждающие средства, совместные растворители(включая масла), мягчители, наполнители, антивспенивающие агенты, поверхностно-активные вещества и средства маскировки вкуса. Некоторые компоненты композиции могут выполнять более одной функции. Помимо требований дозировки, количество API в пленке может зависеть от его растворимости. Если он является водорастворимым, то API обычно составляет от около 1 вес.% до около 80 вес.% компонентов, не являющихся растворителем (растворенных веществ), в пленке или от около 20 вес.% до около 50 вес.% растворенных веществ в пленке. Менее растворимый API может составлять более значительную часть композиции, обычно примерно до 88 вес.% компонентов, не являющихся растворителем, в пленке. Пленкообразующий полимер может быть выбран из природных полисахаридов, белков или синтетических гидроколлоидов и обычно составляет от около 0,01 вес.% до около 99 вес.% или от около 30 вес.% до около 80 вес.% пленки. Пленочные лекарственные формы обычно получают испарительным высушиванием тонких водных пленок, нанесенных на легкоотслаивающуюся несущую подложку или бумагу,что может быть выполнено в сушильной печи или сушильной камере (например, в комбинированных аппаратах нанесения покрытия и высушивания), в лиофилизирующем оборудовании или в вакуумной печи. Полезные твердые композиции для перорального введения могут включать композиции незамедлительного высвобождения и композиции с модифицированным высвобождением. Композиции с модифицированным высвобождением включают композиции замедленного, устойчивого, импульсного, контролируемого, целевого и программируемого высвобождения. Общее описание пригодных композиций с модифицированным высвобождением представлено в патенте США 6106864. Подробности других пригодных технологий высвобождения, таких как высокоэнергетические дисперсии, осмотические частицы и частицы с покрытием, представлены в публикации Verma et al, Pharmaceutical Technology On-line(2001) 25(2):1-14. Соединения формулы 1 также могут вводиться прямо в кровоток, мышцы или внутренние органы пациента. Пригодные способы парентерального введения включают внутривенное, внутриартериальное,внутрибрюшинное, интратекальное, внутрижелудочковое, интрауретральное, интрастернальное, внутричерепное, внутримышечное, внутрисуставное и подкожное введение. Приемлемые устройства для парентерального введения включают игловые шприцы, включая микроигловые шприцы, безигловые шприцы и устройства для инфузии. Парентеральные композиции обычно являются водными растворами, которые могут содержать формообразующие средства, такие как соли, углеводы и буферные агенты (например, рН от около 3 до около 9). Однако для некоторых применений соединения формулы 1 могут быть более удобно составлены в композиции в виде стерильных неводных растворов или в виде высушенных форм для использования в комбинации с соответствующим носителем, таким как стерильная апирогенная вода. Приготовление парентеральных композиций в стерильных условиях (например, путем лиофилизации) может быть легко выполнено по стандартным фармацевтическим способам. Растворимость соединений, используемых для получения парентеральных растворов, может быть увеличена за счет соответствующих методик составления композиций, таких как введение средств улучшения растворимости. Композиции для парентерального введения могут быть составлены для незамедлительного или модифицированного высвобождения. Композиции с модифицированным высвобождени- 19021568 ем включают композиции замедленного, устойчивого, импульсного, контролируемого, целевого и программируемого высвобождения. Так, соединения формулы 1 могут быть составлены в композиции в виде суспензий, твердых веществ, полутвердых веществ или тиксотропной жидкости для введения в виде имплантированного депо, обеспечивающего модифицированное высвобождение активного соединения. Примеры таких композиций включают стенты, покрытые лекарством, и полутвердые вещества и суспензии, включающие наполненные лекарством микросферы из поли(DL-молочно-когликолевой)кислоты(PGLA). Соединения формулы 1 могут также вводиться местно, внутрикожно или трансдермально в кожу или слизистую оболочку. Типичные композиции для этой цели включают гели, гидрогели, лосьоны, растворы, кремы, мази, пылящие порошки, перевязочные материалы, пены, пленки, кожные пластыри, пластины, имплантаты, губки, волокна, бандажи и микроэмульсии. Также могут использоваться липосомы. Типичные носители могут включать спирт, воду, минеральное масло, жидкий петролатум, белый петролатум, глицерин, полиэтиленгликоль и пропиленгликоль. Композиции для местного применения могут включать также усилители проницаемости. См., например, Finnin and Morgan, J. Pharm. Sci. 88(10):955958 (1999). Другие средства местного введения включают доставку электропорацией, ионтофорезом, фонофорезом, сонофорезом и микроигловыми или безигловыми (например, Powderject и Bioject) инъекциями. Композиции для местного введения могут быть составлены для незамедлительного или модифицированного высвобождения, как описано выше. Соединения формулы 1 могут также вводиться интраназально или путем ингаляций, обычно в форме сухого порошка, аэрозольного спрея или назальных капель. Ингалятор может использоваться для введения сухого порошка, который состоит только из API, порошковой смеси API и разбавителя, такого как лактоза, или смешанных частиц компонентов, включающих API и фосфолипид, такой как фосфатидилхолин. Для интраназального применения порошок может включать биоадгезивное средство, например хитозан или циклодекстрин. Аэрозольная тара, насос, распылитель, атомизатор или ингалятор могут использоваться для создания аэрозольного спрея из раствора или суспензии, включающей API, один или более агентов для диспергирования, солюбилизации или усиления высвобождения API (например, EtOH с водой или без воды), один или более растворителей (например, 1,1,1,2-тетрафторэтан или 1,1,1,2,3,3,3 гептафторпропан), которые служат как пропеллент, и, необязательно, поверхностно-активное вещество,такое как сорбиттриолеат, олеиновая кислота или олигомолочная кислота. Для получения мелкодисперсного тумана может использоваться электрогидродинамический атомизатор. Перед применением в сухом порошке или в суспензионной композиции лекарственный продукт обычно измельчается до размера частиц, пригодного для доставки путем ингаляции (обычно 90% частиц в объемном выражении, которые имеют максимальный размер менее 5 мкм). Это может быть достигнуто любым соответствующим способом измельчения, таким как струйное измельчение, струйное измельчение с псевдоожиженным слоем, обработка сверхкритической жидкости, гомогенизация под высоким давлением или распылительная сушка. Капсулы, блистеры и картриджи (сделанные, например, из желатина или гидроксипропилметилцеллюлозы) для применения в ингаляторе и инсуфляторе, могут быть составлены в композиции, содержащие порошковую смесь активного соединения, соответствующей основы порошка, такой как лактоза или крахмал, и модификатора свойств, такого как L-лейцин, маннит или стеарат магния. Лактоза может быть безводной или моногидратом. Другие пригодные формообразующие средства включают декстран, глюкозу, мальтозу, сорбит, ксилит, фруктозу, сахарозу и трегалозу. Соответствующая композиция в растворе для применения в электрогидродинамическом атомизаторе для получения мелкодисперсного тумана может содержать от около 1 мкг до около 20 мг API за одно нажатие, а объем, выделяемый при одном нажатии, варьируется от около 1 мкл до около 100 мкл. Типичная композиция может включать одно или более соединений формулы 1, пропиленгликоль, стерильную воду, EtOH и NaCl. Альтернативные растворители, которые могут использоваться вместо пропиленгликоля, включают глицерин и полиэтиленгликоль. Композиции для введения ингаляцией, интраназального введения или их обоих, могут быть составлены для непосредственного или модифицированного высвобождения с использованием, например, PGLA. Приемлемые ароматизаторы, такие как ментол и левоментол, или подсластители, такие как сахарин или сахарин натрия, могут добавляться в композиции, предназначенные для ингаляции/интраназального введения. В случае ингаляторов сухого порошка и аэрозолей единица дозирования определяется за счет клапана, через который происходит доставка отмеренного количества. Единицы дозирования обычно настроены на введение отмеренной дозы или "струи", содержащей от около 10 мкг до около 1000 мкг API. Общая дневная доза обычно находится в диапазоне от около 100 мкг до около 10 мг, которая может вводиться единой дозой или, более часто, в виде отдельных доз в течение дня. Активные соединения могут вводиться ректально или вагинально, например, в форме суппозиториев, пессариев или клизм. Масло какао является традиционной основой суппозиториев, но могут использоваться различные соответствующие альтернативы. Композиции для ректального или вагинального введения могут быть составлены для незамедлительного или модифицированного высвобождения, как описано выше. Соединения формулы 1 также могут вводиться напрямую в глаза или уши, обычно - в форме- 20021568 капель или микронизированной суспензии или раствора в изотоническом стерильном солевом растворе с отрегулированным рН. Другие композиции, пригодные для введения в глаза и уши, включают мази, гели,биоразлагаемые имплантаты (например, абсорбирующиеся гелевые губки, коллаген), небиоразлагаемые имплантаты (например, силикон), пластины, линзы и дисперсные или пористые структуры, такие как ниосомы и липосомы. Композиция может включать один или более полимеров и консервантов, таких как бензалкония хлорид. Типичные полимеры включают поперечно сшитую полиакриловую кислоту, поливиниловый спирт, гиалуроновую кислоту, полимеры целлюлозы (например, гидроксипропилметилцеллюлозу, гидроксиэтилцеллюлозу, метилцеллюлозу) и гетерополисахаридные полимеры (например, геллановую камедь). Такие композиции также могут доставляться ионтофорезом. Композиции для введения в глаза или уши могут быть составлены для незамедлительного или модифицированного высвобождения,как описано выше. Для улучшения их растворимости, скорости растворения, маскировки вкуса, биодоступности или устойчивости соединения формулы 1 могут комбинироваться с растворимыми макромолекулярными элементами, включая циклодекстрин и его производные и полиэтиленгликольсодержащие полимеры. Например, комплексы API-циклодекстрина в основном являются полезными для большинства лекарственных форм и способов введения. Могут использоваться комплексы-включения и соединения, не являющиеся таковыми. В качестве альтернативы прямому комплексообразованию с API циклодекстрин может использоваться как вспомогательная добавка, то есть в качестве носителя, разбавителя или солюбилизатора. В большинстве случаев для этих целей используются альфа-, бета- и гамма-циклодекстрины. См., например, WO 91/11172, WO 94/02518 и WO 98/55148. Как указано выше, одно или более соединений формулы 1, включая соединения, отдельно перечисленные выше, и их фармацевтически активные соли, могут комбинироваться друг с другом или с одним или более других активных фармацевтически активных соединений для лечения различных заболеваний,состояний и расстройств. В таких случаях активные соединения могут комбинироваться в единой лекарственной форме, как описано выше, или могут быть представлены в форме набора, который является пригодным для совместного введения композиций. Набор включает (1) две или более различных фармацевтических композиций, по меньшей мере одна из которых содержит соединение формулы 1; и (2) устройство для раздельного хранения двух фармацевтических композиций, таких как секционная бутылка или секционный пленочный пакет. Примером такого набора является обычная блистерная упаковка, которая используется для упаковки таблеток или капсул. Такой набор пригоден для введения различных типов лекарственных форм (например, пероральных и парентеральных) или для введения различных фармацевтических композиций с разным интервалом дозирования, или для титрования различных фармацевтических композиций относительно друг друга. Для облегчения соблюдения больными режима и схемы лечения набор включает указания по введению и может быть снабжен памяткой. Для введения пациентам, являющимся людьми, общая дневная доза заявленных и описанных соединений обычно находится в диапазоне от около 0,1 мг до около 3000 мг, в зависимости от способа введения. Например,при пероральном введении может потребоваться общая дневная доза от около 1 мг до около 3000 мг,тогда как для внутривенного введения может потребоваться дневная доза лишь от около 0,1 мг до около 300 мг. Общая дневная доза может вводиться одноразово или в виде раздельных доз и, на усмотрение врача, может находиться за пределами представленных выше диапазонов. Хотя эти дозировки основаны на обычном пациенте, являющемся человеком с массой от около 60 кг до около 70 кг, врач может определить соответствующую дозу для пациента (например, ребенка), масса которого находится за пределами этого весового диапазона. Как указано выше, соединения формулы 1 могут использоваться для лечения расстройств, заболеваний и состояний, для которых показано ингибирование SYK. Такие расстройства, заболевания и состояния обычно связаны с любым нездоровым или аномальным состоянием пациента, для которого ингибирование SYK дает терапевтическую пользу. В частности, такие расстройства,заболевания и состояния могут затрагивать иммунную систему и воспаления, включая реакции гиперчувствительности (аллергические реакции) I типа (аллергический ринит, аллергическую астму и атопическийдерматит); аутоиммунные заболевания (ревматоидный артрит, рассеянный склероз, системную красную волчанку, псориаз и иммунную тромбоцитопеническую пурпуру); воспаление легких (хроническое обструктивное заболевание легких) и тромбоз. Соединения формулы 1 могут также применяться для лечения расстройств, заболеваний и состояний, связанных с аномальным клеточным ростом, включая гематологические злокачественные опухоли, такие как острый миелоидный лейкоз, хронический лимфоцитарный лейкоз В-клеток, лимфому В-клеток (например, лимфому мантийных клеток) и лимфому Т-клеток (например, периферийную лимфому Т-клеток), а также эпителиальные виды рака (то есть карциномы), такие как рак легких (мелкоклеточный рак легких и немелкоклеточный рак легких), рак поджелудочной железы и рак толстой кишки. Помимо гематологических злокачественных опухолей и эпителиальных видов рака, указанных выше, соединения формулы 1 могут также использоваться для лечения других типов рака, включая, среди прочего, лейкоз (хронический миелогенный лейкоз и хронический лимфоцитарный лейкоз); рак молочной железы, рак мочеполовой системы, рак кожи, рак костей,рак предстательной железы и рак печени; рак мозга; рак гортани, желчного пузыря, прямой кишки, паращитовидных желез, щитовидной железы, надпочечников, нервной ткани, мочевого пузыря, головы,- 21021568 шеи, желудка, бронхов и почек; базально-клеточный рак, плоскоклеточный рак, метастатический рак кожи, остеосаркому, саркому Юинга, ретикулосаркому и саркому Капоши; миелому, гигантому, опухоль островковых клеток, острый и хронический лимфолейкоз и гранулоцитарные опухоли, опухоль ворсистых клеток, аденому, медуллярный рак, феохромоцитому, невриному слизистых оболочек, кишечную генглионейрому, гиперпластическую опухоль роговичного нерва, опухоль марфаноидного вида, опухоль Вильмса, семиному, опухоль яичников, лейомиому, дисплазию шейки матки, нейробластому, ретинобластому, миелодиспластический синдром, рабдомиосаркому, астроцитому, неходжкинскую лимфому, злокачественную гиперкальциемию, истинную полицитемию, аденокарциному, мультиформную глиобластому, глиому, лимфому и злокачественную меланому. Помимо рака, соединения формулы 1 могут использоваться также для лечения других заболеваний, связанных с аномальным клеточным ростом, включая, среди прочего, доброкачественные пролиферативные заболевания, такие как доброкачественная гипертрофия предстательной железы, рестиноз, гиперплазия, расстройства сингвиальной пролиферации,ретинопатия или другие неоваскулярные расстройства глаз. Соединения формулы 1 могут также использоваться для лечения аутоиммунных расстройств, помимо тех, которые перечислены выше. Такие расстройства, заболевания и состояния включают, среди прочего, болезнь Крона, дерматомиозит, сахарный диабет 1 типа, синдром Гудпасчера, болезнь Грейвса, синдром Гийена-Барре, болезнь Хашимото, смешанное повреждение соединительной ткани, миастению гравис, нарколепсию, пузырчатку обыкновенную, злокачественную анемию, полимиозит, первичный билиарный цирроз печени, синдром Шегрена,височный артериит, язвенный колит, васкулит и гранулематоз Вегенера. Кроме того, соединения формулы 1 могут использоваться для лечения воспалительных расстройств,включая астму, хроническое воспаление, хронический простатит, гломерулонефрит, гиперчувствительность, воспалительную болезнь кишечника (неспецифический язвенный колит, помимо болезни Крона),воспаление тазовых органов, реперфузинное повреждение, отторжение трансплантата, васкулит и синдром систематической воспалительной реакции. Соединения формулы 1 могут также использоваться для лечения отдельных заболеваний, которые входят в рамки одного или более общих расстройств, описанных выше, включая артрит. Помимо ревматоидного артрита, синдрома Шегрена, системной красной волчанки, СКВ у детей и подростков, соединения формулы 1 могут также использоваться для лечения других артритных заболеваний, включая, среди прочего, анкилозирующий спондилит, асептический некроз, болезнь Беше, бурсит, болезнь отложения кристаллического дигидрата пирофосфата кальция (псевдоподагра), синдром запястного канала, синдром Элерса-Данлоса, фибромиалгию, Пятую болезнь, гигантоклеточный артериит, подагру, ювенильный дерматомиозит, ювенильный ревматоидный артрит, ювенильную спондилоартопатию, болезнь Лайма,синдром Марфана, миозит, остеоартроз, несовершенный остеогенез, остеопороз, болезнь Педжета, псориатический артрит, синдром Рейно, реактивный артрит, синдром рефлекторной симпатической дистрофии, склеродермию, стеноз позвоночного канала, болезнь Стилла и тендинит. Заявленные и описанные соединения могут комбинироваться с одним или более других фармакологически активных соединений или терапий для лечения одного или более расстройств, заболеваний или состояний, для которых показана SYK, включая расстройства, заболевания и состояния, затрагивающие иммунную систему, воспаления и аномальный клеточный рост. Например, соединения формулы 1, которые включают соединения, отдельно перечисленные выше, и их фармацевтически приемлемые комплексы, соли, сольваты и гидраты, могут вводиться одновременно, последовательно или раздельно в комбинации с одним или более соединений или терапий для лечения артрита, включая ревматоидный артрит и остеоартрит, или для лечения рака, включая гематологические злокачественные опухоли, такие как острый миелоидный лейкоз, хронический лимфоцитарный лейкоз В-клеток, лимфома В-клеток и лимфома Т-клеток, а также карцином, таких как рак легких, рак поджелудочной железы и рак толстой кишки. Такие комбинации могут давать существенную терапевтическую пользу, включая меньшее количество побочных эффектов, улучшенную доступность для неимущих пациентов или синергетическую активность. Например, при использовании для лечения артрита соединения формулы 1 могут комбинироваться с одним или более нестероидных противовоспалительных лекарств (NSAID), анальгетиков, кортикостероидов, модификаторов биологической реакции и иммуносорбционной терапии белка-А. Альтернативно или дополнительно при лечении ревматоидного артрита соединения формулы 1 могут комбинироваться с одним или более антиревматических лекарств, модифицирующих болезнь (DMARD), а при лечении остеоартрита соединения формулы 1 могут комбинироваться с одним или более остеопорозных средств. Типичные NSAID включают апазон, аспирин, целекоксиб, диклофенак (с мизопростолом или без него), дифлунизал, этодолак, фенопрофен, флурбипрофен, ибупрофен, индометацин, кетопрофен, меклофенамат натрия, мефенамовую кислоту, мелоксикам, набуметон, напроксен, оксапрозин, фенилбутазон, пироксикам, холин и магния салицилаты, салсалат и сулиндак. Типичные анальгетики включают ацетаминофен и сульфат морфина, а также кодеин, гидрокодон, оксикодон, пропоксифен и трамадол, все с ацетаминофеном или без него. Типичные кортикостероиды включают бетаметазон, ацетат кортизона,дексаметазон, гидрокортизон, метилпреднизолон, приднизолон и преднизон. Типичные модификаторы биологической реакции включают ингибиторы TNF-, такие как адалимумаб, этанерцепт и инфликсимаб; селективные ингибиторы В-клеток, такие как ритуксимаб; ингибиторы IL-1, такие как анакинра, и- 22021568 селективные модуляторы костимуляции, такие как абатацепт. Типичные DMARD включают ауранофин (пероральное золото), азатиоприн, хлорамбуцил, циклофозамид, циклоспорин, тиомалат золота-натрия (золото для инъекций), гидроксихлорохин, лефлуномид,метотрексат, миноциклин, миофенолят мофетил, пеницилламин и сульфазалазин. Типичные остеопорозные средства включают бисфосфонаты, такие как алендронат, ибандронат, ризедронат и золедроновая кислота; селективные модуляторы рецепторов эстрогенов, такие как дролоксифен, лазофоксифен и ралоксифен; гормоны, такие как кальцитонин, эстрогены и паратироидный гормон; и иммуноподавляющие средства, такие как азатиоприн, циклоспорин и рапамицин. Особенно полезные комбинации для лечения ревматоидного артрита включают соединение формулы 1 и метотрексат; соединение формулы 1 и один или более модификаторов биологической реакции, таких как лефлуономид, этанерцепт, адалимумаб и инфликсимаб; или соединение формулы 1, метотрексат и один или более модификаторов биологической реакции, таких как лефлуономид, этанерцепт, адалимумаб и инфликсимаб. Для лечения тромбоза и рестеноза соединения формулы 1 могут комбинироваться с одним или более сердечно-сосудистых средств, таких как блокаторы кальциевого канала, статины, фибраты, бетаблокаторы, ингибиторы АСЕ и ингибиторы агрегации тромбоцитов. Соединения формулы 1 также могут комбинироваться с одним или более соединений или терапий для лечения рака. Они включают химиотерапевтические средства (то есть цитотоксические или антинеопластические средства), такие как алкилирующие агенты, антибиотики, антиметаболические средства,производные растений и ингибиторы топоизомеразы, а также молекулярно направленные лекарства, которые блокируют рост и распространение рака за счет взаимодействия с определенными молекулами,участвующими в росте и развитии опухоли. Молекулярно направленные лекарства включают низкомолекулярные соединения и биопрепараты. Типичные алкилирующие агенты включают бисхлорэтиламины (азотные иприты, например, хлорамбуцил, циклофосфамид, ифосфамид, мехлоретамин, мелфалан и урациловый иприт); азиридины (например, тиотепа); алкилалконовые сульфонаты (например, бусульфан); нитрозомочевины (например,кармустин, ломустин и стрептозоцин); неклассические алкилирующие агенты (например, альтретамин,дакарбазин и прокарбазин); и соединения платины (например, карбоплатин, цисплатин, недаплатин, оксалиплатин, сатраплатин и триплатин тетранитрат). Типичные антибиотики включают антрациклины(например, акларубицин, амрубицин, даунорубицин, доксорубицин, эпирубицин, идарубицин, пирарубицин, валрубицин и зорубицин); антрацендионы (например, митоксантрон и пиксантрон); и стрептомицеты (например, актиномицин, блеомицин, дактиномицин, митомицин С и пликамицин). Типичные антиметаболитические средства включают ингибиторы дигидрофолат-редуктазы (например, аминоптерин, метотрексат и пеметрексед); ингибиторы гимидилат-синтазы (например, ралтитрексед и пеметрексед); фолиновую кислоту (например, лейковорин); ингибиторы аденозин-дезаминазы(например, пентостатин); ингибиторы галогенированной/рибонуклеотид-редуктазы (например, кладрибин, клофарабин и флударабин); тиопурины (например, тиогуанин и меркаптопурин); ингибиторы тимидилат-синтазы (например, фторурацил, капецитабин, тегафур, кармофур и флоксуридин); ингибиторы ДНК-полимеразы (например, цитарабин); ингибиторы рибонкулеотид-редуктазы (например, гемцитабин); гипометилирующие агенты (например, азацитидин и децитабин); и ингибиторы рибонуклеотидредуктазы (например, гидроксимочевина); и средства истощения аспарагина (например, аспарагиназа). Типичные производные растений включают алкалоиды барвинка (например, винкристин, винбластин, виндезин, винзолидин и винорелбин), подофиллотоксины (например, этопозид и тенипозид) и таксаны (например, доцетаксел, ларотаксел, ортатаксел, паклитаксел и тезетаксел). Типичные ингибиторы топоизомеразы I типа включают камптотецины, такие как белотекан, иринотекан, рубитекан и топотекан. Типичные ингибиторы топоизомеразы II типа включают амсакрин, этопозид, этопозид фосфат и тенипозид, которые являются производными эпиподофиллотоксинов. Молекулярно направленные терапии включают биологические средства, такие как цитокины и другие иммунорегулирующие средства. Полезные цитокины включают интерлейкин-2 (IL-2, альдеслейкин),интерлейкин 4 (IL-4), интерлейкин 12 (IL-12) и интерферон, который включает более 23 родственных подтипов. Другие цитокины включают гранулоцитарный колониестимулирующий фактор (CSF) (филграстим) и гранулоцитарно-макрофагальный колониестимулирующий фактор (сарграмостим). Другие иммуномодулирующие средства включают бациллу Кальметта-Герена, левамизол и октреотид; моноклональные антитела против опухолевых антигенов, такие как траструзумаб и ритуксимаб; и противоопухолевые вакцины, которые вызывают иммунную реакцию на опухоль. Кроме того, молекулярно направленные лекарства, которые взаимодействуют с определенными молекулами, участвующими в росте и развитии опухоли, включают ингибиторы эпидермального фактора роста (EGF), трансформирующего альфа-фактора роста (TGF), TGF, герегулина, инсулин-подобного фактора роста (IGF), фактора роста фибробластов (FGF), фактора роста кератиноцитов (KGF), колониестимулирующего фактора (CSF), эритропоэтина (ЕРО), интерлейкина-2 (IL-2), фактора роста нервов(NGF), фактора роста, полученного из тромбоцитов (PDGF), фактора роста гетаптоцитов (HGF), васкулярного эндотелиального фактора роста (VEGF), ангиопоэтина, рецептора эпидермального фактора роста(EGFR), рецептора эпидермального фактора роста человека 2 (HER2), HER4, рецептора инсулин- 23021568 подобного фактора роста 1 (IGF1R), IGF2R, рецептора фактора роста фибробластов 1 (FGF1R), FGF2R,FGF3R, FGF4R, рецептора васкулярного эндотелиального фактора роста (VEGFR), тирозинкиназы с иммуноглобулин-подобными и подобными эпидермальному фактору роста доменами 2 (Tie-2), рецептора фактора роста, полученного из тромбоцитов (PDGFR), Abl, Bcr-Abl, Raf, FMS-подобной тирозинкиназы 3(FLT3), c-Kit, Src, протеинкиназы с (PKC), тропомиозиновой рецепторной киназы (Trk), Ret, мишени рапамицина в клетках млекопитающих (mTOR), киназы Aurora, polo-подобной киназы (PLK), митогенактивированной протеинкиназы (МАРК), мезенхимно-эпителиального фактора перехода (с-МЕТ), циклин-зависимой киназы (CDK), Akt, внеклеточных сигнал-регулируемых киназ (ERK), полимеразы поли(АДФ) рибозы (PARP) и так далее. Конкретные молекулярно направленные лекарства включают селективные модуляторы рецептора эстрогена, такие как тамоксифен, торемифен, фулвестрант и ралоксифен; антиандрогены, такие как бикалутамид, нилутамид, мегестрол и флутамид; и ингибиторы ароматазы, такие как экземестан, анастрозол и летрозол. Другие конкретные молекулярно направленные лекарства включают средства, которые ингибируют сигнальную трансдукцию, такие как иматиниб, дазатиниб, нилотиниб, трастузумаб, гефитиниб, эрлотиниб, цетоксимаб, лапатиниб, панитумумаб и темсиролимус; средства, которые вызывают апоптоз, такие как бортезомиб; средства, блокирующие ангиогенез, такие как бевацизумаб, сорафениб и сунитиниб; средства, облегчающие разрушение раковых клеток иммунной системой, такие как ритуксимаб и алемтузумаб; и моноклональные антитела, которые доставляют токсичные молекулы к раковым клеткам, такие как гемтузумаб озогамицин, тозитумомаб, 131I-тозитумоаб и ибритумомаб тиуксетан. Биологическая активность: ингибирование SYK Способность соединений ингибировать активность SYK может быть оценена при помощи различных способов, включая анализы in vitro и in vivo. В следующем анализе in vitro измеряется способность исследуемого соединения ингибировать SYK-опосредованное фосфорилирование FAM-меченного SYKспецифичного субстрата (5FAM-KKKKEEIYFFFG-NH2). Белок SYK получили из кДНК, кодирующей селезеночную тирозинкиназу человека, и экспрессировали в клетках насекомых, используя экпрессирующий бакуловирусный вектор. кДНК (IMAGE: 3542895) закупили у компании Open Biosystems. Домен SYK киназы (остатки 356-635) амплифицировали при помощи PCR и клонировали в pFastBac1 плазмид (Invitrogen) на сайтах BamHI/XbaI. Рекомбинантную плазмиду, кодирующую Met-Ala-Lys-SYK(356-635)-HHHHHH секвенировали и трансформировали в штамм Е. coli DH10Bac. Рекомбинантную бакмиду ДНК выделили и трансфицировали в клетки насекомых Sf9. Рекомбинантный вирус собрали через 72 часа после трансфекции. Исходный вирусный раствор с высоким титром получили путем инфицирования клеток Sf9 при множественности заражения (MOI) около 0,01. Суспензию клеток Sf9 (10 л) инфицировали рекомбинантным вирусом (MOI=5) и инкубировали в системе Wave Bioreactor (GE-Healthcare) в течение 48 ч. Клетки собрали и хранили при -80 С. Для очистки экспрессированного белка замороженные клетки Sf9 (10 л) разбили на небольшие (1 см) части и суспендировали в лизисном буфере (300 мл), содержащем 20 мМ Tris (рН 7,6), 0,25 мМ ТСЕР, 100 мМNaCl, 5% глицерина и ингибитор протеазы. Суспензию перемешивали при комнатной температуре до полного растаивания, лизировали в течение дополнительных 2-4 мин на гомогенизаторе с ротационным ножом, затем центрифугировали при 4200 г в течение 1 ч. После центрифугирования надосадочную жидкость пролили через ситовую ткань и смешали с никелевой хелатирующей смолой (Probond Resin, Invitrogen), которая была предварительно уравновешена в промывочном буфере, содержащем 10 мМ Tris (pH 7,6), 0,25 мМ ТСЕР, 300 мМ NaCl, 5% глицерина и 20 мМ имидазола. Смесь встряхивали в течение 3 ч в холодном помещении, затем центрифугировали при 900 г в течение 10 мин. Смолу диспергировали в промывочном буфере (50 мл), центрифугировали в течение 10 мин при 900 г, повторно диспергировали в небольшом количестве промывочного буфера (5 мл), а затем перелили в одноразовую хроматографическую колонку Poly-Prep, через которую самотеком пропускали промывочный буфер до исчезновения белка в буфере кумасси (около 120 мл промывочного буфера). Буфер для элюирования (30 мл), содержащий 10 мМ HEPES (рН 7,4), 150 мМ NaCl, 10% глицерина, 5 мМ ДТТ и 400 мМ имидазола, использовали для элюирования белка SYK из смолы. Элюат концентрировали (5 мл) и дополнительно очистили на колонке Superdex 200 (1,2 мл/мин, в течение 160 мин, 10 мМ HEPES (рН 7,4), 10 мМ NaCl, 10 мМMgCl, 0,1 мМ ЭДТК и 0,25 мМ ТСЕР). Хроматографированные фракции обработали SDS-PAGE, а нужные фракции объединили и концентрировали. Буфер окончательного выпуска содержал 10 мМ HEPES(рН 7,4), 10 мМ метиона, 150 мМ NaCl, 10% глицерина, 5 мМ ДТТ. Ингибирование SYK определили при помощи черного формата 384-луночного планшета в буфере,содержащем 50 мМ HEPES, 10 мМ NaCl, 10 мМ MgCl2, 0,2 мМ ЭДТК, 0,01% ЭДС (Brij35), 1 мМ ДТТ и 0,1 мг/мл BSA при рН 7,3. Каждое исследуемое соединение приготовили в ДМСО, используя 2-кратное серийное разбавление для 11 точек данных, которые добавили в буфер, так, что каждое разбавление содержало 3% ДМСО. В каждую лунку добавили 2 мкл 3 мкМ раствора 5FAM-KKKKEEIYFFFG-NH2 (в буфере), 2 мкл разбавленного исследуемого соединения (3% ДМСО в буфере) и 2 мкл 2,4 нМ раствораSYK и 45 мкМ АТФ (в буфере). Реакционную смесь инкубировали при комнатной температуре в течение 60 мин, затем погасили добавлением 50 мМ Hepes, 30 мМ ЭДТК, 0,1% Triton Х-100 (рН 7,3). Для количе- 24021568 ственного определения субстрата с флуоресцентной меткой и продукта после реакции исследуемый планшет установили на Caliper LC-3000, при помощи которого измерили процент превращения за счет микрожидкостного разделения. Соответствующие значения IC50 рассчитали построением нелинейной кривой по концентрациям соединения и процентам ингибирования для стандартного уравнения IC50 и записали как pIC50, то есть -log(IC50), где IC50 является молярной концентрацией. Примеры Представленные далее примеры являются иллюстративными, а не ограничивающими, и отображают отдельные варианты воплощения настоящего изобретения. Спектры 1 Н ядерного магнитного резонанса (ЯМР) получили для многих соединений в следующих примерах. Характеристические химические сдвигиданы в миллионных долях, отнесенных к тетраметилсилану с использованием обычных аббревиатур для обозначения главных пиков, включая с (синглет),д (дублет), т (триплет), к (квартет), м (мультиплет), спт (септет) и ш (широкий). Масс-спектры (m/z) записали при помощи электрораспылительной ионизации (ESI) или химической ионизации при атмосферном давлении (APCI). Для обычных растворителей используются следующие аббревиатуры: CDCl3 (дейтерохлороформ), ДМСО-d6 (дейтеродиметилсульфоксид), CD3OD (дейтерометанол) и ТГФ-d8 (дейтеротетрагидрофуран). "Аммиак" относится к концентрированному раствору аммиака в воде, обладающего удельным весом 0,88. Если указано, продукты определенных препаратов и примеров очищены при помощи массактивированной ВЭЖХ (например, насос: Waters 2525; МС: ZQ; программное обеспечение: MassLynx), флэш-хроматографией или препаративной тонкослойной хроматографией (ТСХ). Препаративная ВЭЖХ выполняется в кислотных или щелочных условиях. Кислотные условия обычно являются градиентами в растворителе А (вода с 0,05% ТФУК) и растворителе В (ацетонитрил с 0,035% ТФУК); щелочные условия обычно являются градиентами в растворителе А (10 мМ NH4HCO3 в воде) и растворителе В (10 мМ NH4HCO3 в 20/80 (об./об.) вода/ацетонитрил). В упомянутых условиях препаративной ВЭЖХ используются кислотные условия, если не указаны щелочные условия. Препаративная ТСХ обычно выполняется на силикагелевых пластинах 60 F254. После выделения хроматографией, растворитель удаляется, а продукт получается высушиванием в центрифужном испарителе (например,GeneVac), ротационном испарителе, вакуумной колбе, лиофилизаторе и так далее. Реакции в инертной(например, азотной) или активной (например, H2) атмосфере обычно выполняются при давлении от около 1 атмосферы (14,7 psi) или выше. Препарат 1. Метил 2,4-дихлор-6-метилпиримидин-5-карбоксилат К суспензии метил 6-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-5-карбоксилата (1 г, 5,43 ммоль) в POCl3 (10 мл) добавили 10 капель N,N-диметиланилина. Реакционную смесь нагревали при 105 С в течение 6 ч, пока она не стала прозрачным раствором. Затем смесь охладили, концентрировали под пониженным давлением, вылили на лед и экстрагировали EtOAc. Органический экстракт промыли водой и насыщенным солевым раствором, высушили и концентрировали под пониженным давлением для получения указанного в заголовке соединения в виде зеленовато-желтого твердого вещества (940 мг,78%). [М+Н], рассчитанное для C7H6Cl2N2O2, 222; обнаруженное 221, 223. Препарат 2. Метил 2-хлор-4-метил-6-(м-толиламино)пиримидин-5-карбоксилат(0,461 мл, 4,25 ммоль) и N-этилдиизопропиламина (1,481 мл, 8,51 ммоль) в CH3CN (30 мл) нагревали с обратным холодильником в течение 3 ч. Смесь разбавили EtOAc и промыли насыщенным солевым раствором и водой. Органический экстракт высушили и концентрировали под пониженным давлением для получения указанного в заголовке соединения в виде светло-желтого твердого вещества (1,2 г, 97%). Раствор метил 2-хлор-4-метил-6-(м-толиламино)пиримидин-5-карбоксилата (1,2 г, 4,11 ммоль),трет-бутил (1S,2R)-2-аминоциклогексилкарбамата (0,882 г, 4,11 ммоль) и триэтиламина (1,720 мл, 12,34 ммоль) в ДМА (10 мл) нагревали при 90 С в течение 4 ч. Затем раствор разбавили EtOAc, промыли насыщенным солевым раствором и водой. Органический экстракт высушили и концентрировали под пониженным давлением для получения светло-желтого остатка; при растирании с ACN (5 мл) образовались белые кристаллы. Полученное твердое вещество отфильтровали, промыли ACN и высушили для получения указанного в заголовке соединения в виде твердого белого вещества (1,2 г, 62%). [М+Н], рассчитанное для C25H35N5O4, 470; обнаруженное 470. В. трет-Бутил Смесь метил 2-1R,2S)-2-(трет-бутоксикарбониламино)циклогексиламино)-4-метил-6-(м-толиламино)пиримидин-5-карбоксилата (500 мг, 1,065 ммоль) и диоксида селена (236 мг, 2,130 ммоль) в диоксане (10 мл) нагревали при 100 С в течение 24 ч. Затем раствор охладили и отфильтровали. Фильтрат концентрировали под пониженным давлением и высушили для получения коричневой пены (534 мг; по масс-спектроскопии наблюдали дигидроксильную форму), которую использовали на следующем этапе напрямую, без дополнительной очистки. Смесь неочищенного промежуточного соединения (534 мг,1,065 ммоль) и (2,4-диметоксифенил)метанамина (0,160 мл, 1,065 ммоль) в МеОН (10 мл) перемешивали при комнатной температуре в течение 10 мин, после чего добавили цианоборгидрид натрия (100 мг,1,597 ммоль) и перемешивали реакционную смесь при комнатной температуре в течение 20 ч. Реакционную смесь нагрели до 50 С и перемешивали еще 2 ч до завершения реакции. Смесь охладили до комнатной температуры, твердое вещество отфильтровали и промыли МеОН для получения указанного в заголовке соединения в виде розоватого твердого вещества (237 мг, 37%). [М+Н], рассчитанное для(5 мл) перемешивали при 60 С в течение 2 ч, а затем очистили обращенно-фазовой препаративной ВЭЖХ. Фракции собрали, концентрировали под пониженным давлением, разбавили EtOAc и подщелочили насыщенным водным раствором NaHCO3. Органический экстракт высушили и концентрировали под пониженным давлением для получения указанного в заголовке соединения в виде твердого белого вещества (60 мг, 44%). 1 Н ЯМР (400 MHz, ДМСО-d6)ppm 1.33-1.60 (m, 10 Н), 2.32 (s, 3 Н), 3.16 (m, 2 Н),3.92 (br s, 1 H), 4.14 (s, 2 H), 6.88 (d, J=7.07 Hz, 1 H), 7.13 (br s, 1 H), 7.22 (t, J=7.45 Hz, 1 H), 7.34 - 7.55 (m,1 H), 7.70 (br s, 1 H), 8.01 (br s, 1 H), 8.58 (br s, 1 H). [M+H], рассчитанное для C19H24N6O, 353; обнаруженное 353. Приммер 2. 2-1R,2S)-2-Аминоциклогексиламино)-4-(3-фторфениламино)-6,7-дигидро-5 Н-пирроло Указанное в заголовке соединение получили так же, как и пример 1, по реакции метил 2,4-дихлор 6-метилпиримидин-5-карбоксилата с 3-фторанилином вместо м-толуидина. Конечный продукт очистили обращенно-фазовой препаративной ВЭЖХ. В результате лиофилизации получили соль ТФУК указанного в заголовке соединения в виде твердого белого вещества. 1 Н ЯМР (400 MHz, ДМСО-d6)ppm 1.291.56 (m, 2 Н), 1.56-1.73 (m, 4 Н), 1.77-1.85 (br s, 2 Н), 4.22 (br s, 4 H), 6.90 (br s, 1 H), 7.25-7.44 (m, 2 H),7.48 (br s, 1 H), 7.77 (br s, 3 H), 8.20 (d, J=13.64 Hz, 1 H), 8.83 (d, J=14.40 Hz, 1 H). [M+H], рассчитанное для C18H21FN6O, 357; обнаруженное 357. Пример 3. 2-1R,2S)-2-Аминоциклогексиламино)-4-(3-хлорфениламино)-6,7-дигидро-5 Н-пирроло Указанное в заголовке соединение получили так же, как и пример 1, по реакции метил 2,4-дихлор 6-метилпиримидин-5-карбоксилата с 3-хлоранилином вместо м-толуидина. Конечный продукт очистили обращенно-фазовой препаративной ВЭЖХ. В результате лиофилизации получили соль ТФУК указанного в заголовке соединения в виде твердого белого вещества. 1 Н ЯМР (400 MHz, ДМСО-d6)ppm 1.43 (br Указанное в заголовке соединение получили так же, как и пример 1, по реакции метил 2,4-дихлор 6-метилпиримидин-5-карбоксилата с 1 Н-индазол-6-амином вместо м-толуидина. Конечный продукт очистили обращенно-фазовой препаративной ВЭЖХ. В результате лиофилизации получили соль ТФУК указанного в заголовке соединения в виде твердого белого вещества. 1 Н ЯМР (400 MHz, ДМСО-d6)ppm 1.43-1.92 (br s, 8 Н), 2.33 (s, 1 Н), 3.57 (m, 1 Н), 4.21 (br s, 2 H), 6.94 (s, 1 H), 7.07 (s, 1 H), 7.14-7.31 (m, 1 Метил 2-1R,2S)-2-(трет-бутоксикарбониламино)циклогексиламино)-4-метил-6-(3-(трифторметил) фениламино)пиримидин-5-карбоксилат (104 мг, 0,199 ммоль), который получили так же, как и метил 21R,2S)-2-(трет-бутоксикарбониламино)циклогексиламино)-4-метил-6-(м-толиламино)пиримидин-5 карбоксилат на этапе В примера 1, используя 3-(трифторметил)анилин вместо м-толуидина на этапе А этого примера, смешали с 1-бромпирролидин-2,5-дионом (53,0 мг, 0,298 ммоль) и бензоил пероксиангидридом (48,1 мг, 0,199 ммоль) в CCl4 (10 мл), и полученную смесь перемешивали при 70 С в течение 18 ч. Реакцию остановили. Смесь концентрировали под пониженным давлением, разделили между водой и EtOAc. Органический экстракт высушили и концентрировали под пониженным давлением для получения указанного в заголовке соединения, которое использовали на следующем этапе без дополнительной очистки. [М+Н], рассчитанное для C25H31BrN5O4, 603; обнаруженное 604. В. 2-1R,2S)-2-Аминоциклогексиламино)-4-(3-(трифторметил)фениламино)-6,7-дигидро-5 Н-пирроло[3,4-d]пиримидин-5-он Смесь метил 4-(бромметил)-2-1R,2S)-2-(трет-бутоксикарбониламино)циклогексиламино)-6-(3(трифторметил)фениламино)пиримидин-5-карбоксилата (120 мг, 0,199 ммоль) в ТГФ обработали гидроксидом аммония. Реакционную смесь перемешивали при комнатной температуре в течение ночи, а затем выделили продукт реакции и очистили обращенно-фазовой препаративной ВЭЖХ. Фракции собрали и концентрировали под пониженным давлением для получения остатка, который обработали ТФУК/ДХМ.- 27021568 Конечный продукт снова очистили обращенно-фазовой препаративной ВЭЖХ. В результате лиофилизации получили соль ТФУК указанного в заголовке соединения в виде твердого белого вещества (2,6 мг,3%). [М+Н], рассчитанное для C19H21F3N6O, 407; обнаруженное 407. Пример 6. цис-2-(2-Аминоциклогексиламино)-4-(3-(трифторметил)фениламино)-6,7-дигидро-5 Нпирроло[3,4-d]пиримидин-5-он Указанное в заголовке соединение получили так же, как и пример 5, используя метил цис-2-(2(трет-бутоксикарбониламино)циклогексиламино)-4-метил-6-(3-(трифторметил)фениламино)пиримидин 5-карбоксилат вместо метил 2-1R,2S)-2-(трет-бутоксикарбониламино)циклогексиламино)-4-метил-6-(3(трифторметил)фениламино)пиримидин-5-карбоксилата. Конечный продукт очистили обращеннофазовой препаративной ВЭЖХ. В результате лиофилизации получили соль ТФУК указанного в заголовке соединения в виде твердого белого вещества. [М+Н], рассчитанное для C19H21F3N6O, 407; обнаруженное 407. Пример 7. 2-(1-Метил-1H-пиразол-4-ил)-4-(м-толиламино)-6,7-дигидро-5 Н-пирроло[3,4-d]пиримидин-5-он Соль ТФУК указанного в заголовке соединения получили так же, как и пример 1, используя 1 метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол вместо трет-бутил(150 мл) добавили раствор DCC (3,36 г, 16,28 ммоль) в ДХМ (50 мл) при 0 С. Смесь перемешивали при комнатной температуре в течение 16 ч. Нерастворимые материалы отфильтровали, а фильтрат промыли 5% водным раствором NaHSO4. Органическую фазу высушили над безводным Na2SO4, отфильтровали, а фильтрат концентрировали под пониженным давлением. Остаток обработали EtOH (200 мл) и полученную смесь перемешивали при 70 С в течение 4 ч, а затем концентрировали под пониженным давлением. К остатку добавили воду и экстрагировали смесь EtOAc. Объединенные органические слои промыли водой и насыщенным солевым раствором, высушили над MgSO4 и отфильтровали. Фильтрат концентрировали под пониженным давлением, а остаток промыли IPE для получения указанного в заголовке соединения в виде бесцветного твердого вещества (3,43 г, 85%). 1H ЯМР (400 MHz, CDCl3)ppm 1.31 (t,J=6.8Hz, 3H,), 3.58 (s, 2H), 4.24 (q, J=6.8 Hz, 2H), 4.67 (s, 2H), 7.73-7.78 (m, 2H), 7.86-7.91 (m, 2H). В. Этил 1-(2,4-диметоксибензил)-6-1,3-диоксоизоиндолин-2-ил)метил)-2,4-диоксо-1,2,3,4-тетрагидропиримидин-5-карбоксилат(2,4-диметоксифенил)метанамина (152 мг, 0,908 ммоль) в EtOH (4 мл) перемешивали при 50 С в течение 16 ч. Полученное твердое вещество отделили фильтрацией и получили бесцветное твердое вещество(51,7 мг). К суспензии этого твердого вещества в ТГФ (4 мл) добавили хлорид карбонизоцианатидина (96 мг, 0,908 ммоль) и перемешивали смесь при 80 С в течение 1 ч. После охлаждения до комнатной темпе- 28021568 ратуры добавили воду (10 мл) и экстрагировали смесь EtOAc. Органические слои промыли насыщенным солевым раствором, высушили над безводным Na2SO4 и отфильтровали. Фильтрат концентрировали под пониженным давлением, а остаток очистили колоночной хроматографией (SiO2, гексан/EtOAc=1/1) для получения указанного в заголовке соединения (56,2 мг, 13%). 1H ЯМР (400 MHz, CDCl3)ppm 1.28 (t,J=7.2Hz, 3H), 3.63 (s, 3 Н), 3.81 (s, 3 Н), 4.22 (q, J=7.2Hz, 2H), 4.95 (s, 2H), 5.12 (s, 2H), 6.18 (dd, J=8.4,6.4Hz, 1H), 6.23 (d, J=6.4Hz, 1H), 6.75 (d, J=8.4Hz, 1H), 7.63-7.72 (m, 4H), 8.23 (br s, 1H). С. Этил 6-1,3-диоксоизоиндолин-2-ил)метил)-2,4-диоксо-1,2,3,4-тетрагидропиримидин-5-карбоксилат К трифторуксусной кислоте (2 мл, 26,0 ммоль) добавили этил 1-(2,4-диметоксибензил)-6-1,3 диоксоизоиндолин-2-ил)метил)-2,4-диоксо-1,2,3,4-тетрагидропиримидин-5-карбоксилат (198,9 мг, 0,403 ммоль) при 0 С. Смесь перемешивали при 0 С в течение 1 ч, затем при комнатной температуре в течение 6 ч. Смесь концентрировали под пониженным давлением, а остаток промыли IPE (5 мл) для получения указанного в заголовке соединения (183,3 мг). 1 Н ЯМР (400 MHz, CDCl3)ppm 1.42 (t, J=7.2Hz, 3H), 4.45D. Этил 2,4-дихлор-6-1,3-диоксоизоиндолин-2-ил)метил)пиримидин-5-карбоксилат. Смесь этил 6-1,3-диоксоизоиндолин-2-ил)метил)2,4-диоксо-1,2,3,4-тетрагидропиримидин-5 карбоксилата (96,1 мг, 0,280 ммоль) и оксихлорида фосфора (1 мл, 10,92 ммоль) перемешивали при 100 С в течение 12 ч и оставили остывать. Смесь концентрировали под пониженным давлением для удаления избытка POCl3. Остаток обработали концентрированным водным раствором NaHCO3 и экстрагировали EtOAc. Органическую фазу промыли насыщенным водным раствором NaHCO3, водой и насыщенным солевым раствором, высушили над безводным Na2SO4, а затем отфильтровали через SiO2. Фильтрат концентрировали под пониженным давлением, а остаток очистили колоночной хроматографией(SiO2, гексан/EtOAc=4/1) для получения указанного в заголовке соединения (46,0 мг, 43%). 1 Н ЯМР (400 К раствору этил 2,4-дихлор-6-1,3-диоксоизоиндолин-2-ил)метил)пиримидин-5-карбоксилата (45,3 мг, 0,119 ммоль) в MeCN (1 мл) добавили м-толуидин (0,020 мл, 0,187 ммоль) и N,Nдиизопропилэтиламин (0,037 мл, 0,212 ммоль). Смесь перемешивали при комнатной температуре в течение 12 ч. К смеси добавили насыщенный водный раствор NaHCO3 и смесь затем экстрагировали EtOAc. Органические слои снова промыли насыщенным водным раствором NaHCO3, водой и насыщенным солевым раствором, высушили над безводным Na2SO4, а затем отфильтровали через SiO2. Фильтрат концентрировали под пониженным давлением, а остаток промыли IPE для получения указанного в заголовке соединения в виде бледно-коричневого твердого вещества (37,1 мг, 69%). 1H ЯМР (400 MHz, CDCl3)
МПК / Метки
МПК: A61P 37/00, A61P 11/00, A61K 31/437, A61P 7/00, A61K 31/519, A61P 35/00, A61P 17/00, A61P 19/00, C07D 487/04, C07D 471/04, A61P 29/00
Метки: конденсированные, ингибиторы, гетероароматические, пирролидиноны
Код ссылки
<a href="https://eas.patents.su/30-21568-kondensirovannye-geteroaromaticheskie-pirrolidinony-kak-ingibitory-syk.html" rel="bookmark" title="База патентов Евразийского Союза">Конденсированные гетероароматические пирролидиноны как ингибиторы syk</a>
Предыдущий патент: Соединения, обладающие антибактериальной активностью в отношении clostridium
Следующий патент: Минеральная пена
Случайный патент: Производные 2-фенил-1- [4-(2-аминоэтокси)бензил] индола в качестве эстрогенных агентов


































