Бициклические гетероароматические соединения в качестве ингибиторов протеин-тирозинкиназ
Номер патента: 2455
Опубликовано: 25.04.2002
Авторы: Смит Кэтрин Джейн, Кокерилл Джордж Стюарт, Лаки Карен Элизабет, Гантрип Стивен Барри, Картер Малком Клайв
Формула / Реферат
1. Соединение формулы (I)
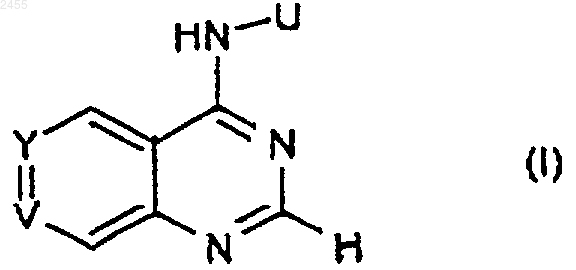
или его соль или сольват;
где Y представляет собой CR1, а V представляет собой N;
или Y представляет собой CR1, a V представляет собой CR2;
R1 представляет собой группу
СН3SO2СН2СН2NНСН2-Аr-,
где -Аr- выбран из фурана и тиазола, каждый из которых может быть возможно замещен одной или двумя гало, С1-4алкильной или С1-4 алкоксигруппами;
R2 выбран из группы, включающей в себя водород, гало, гидрокси, С1-4алкил, С1-4алкокси, С1-4алкиламино и ди[С1-4алкил]амино;
U представляет собой фенильную, пиридильную, 3Н-имидазолильную, индолильную, изоиндолильную, индолинильную, изоиндолинильную, 1H-индазолильную, 2,3-дигидро-1Н-индазолильную, 1Н-бензимидазолильную, 2,3-дигидро-1H-бензимидазолильную или 1Н-бензотриазолильную группу, замещенную группой R3 и возможно замещенную, по меньшей мере, одной независимо выбранной группой R4;
R3 выбран из группы, включающей в себя бензил, гало-, дигало- и тригалобензил, бензоил, пиридилметил, пиридилметокси, фенокси, бензилокси, гало-, дигало- и тригалобензилокси и бензолсульфонил;
или R3 представляет собой группу формулы
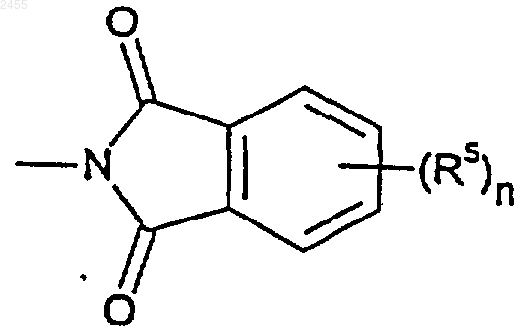
где каждый R5 независимо выбран из галогена, С1-4алкила и С1-4алкокси, а n представляет собой число от 0 до 3;
каждый R4 независимо представляет собой гидрокси, галоген, С1-4алкил, С2-4алкенил, С2-4алкинил, С1-4алкокси, амино, С1-4алкиламино, ди[С1-4алкил]амино, С1-4алкилтио, С1-4алкилсульфинил, С1-4алкилсульфонил, C1-4алкилкарбонил, карбокси, карбамоил, С1-4алкоксикарбонил, C1-4алканоиламино, N-(С1-4алкил) карбамоил, N,N-ди(С1-4алкил)карбамоил, циано, нитро и трифторметил;
с условием, что следующие соединения исключены:
(1-бензил-1H-индазол-5-ил)-(6-(5-((2-метансульфонилэтиламино)метил)фуран-2-ил)пиридо[3,4-d]пиримидин-4-ил)амин,
(4-бензилоксифенил)-(6-(5-((2-метансульфонилэтиламино)метил)фуран-2-ил)пиридо[3,4-d]пиримидин-4-ил)амин,
(1-бензил-1H-индазол-5-ил)-(6-(5-((2-метансульфонилэтиламино)метил)фуран-2-ил)хиназолин-4-ил)амин
и их соли гидрохлориды.
2. Соединение по п.1, где R2 представляет собой водород или метокси.
3. Соединение по п.1 или 2, где группа Аr представляет собой незамещенный фуран или тиазол.
4. Соединение по любому из пп.1-3, где U представляет собой фенильную или 1Н-индазолильную группу, замещенную группой R3 и возможно замещенную, по меньшей мере, одной независимо выбранной группой R4.
5. Соединение по любому из пп.1-4, где R3 представляет собой 3-фторбензилокси.
6. Соединение по любому из пп.1-5, где U замещена группой R4, выбранной из гало.
7. Соединение по любому из пп.1-4, где группа U вместе с заместителем(ями) R3 и R4 представляет собой 3-фторбензилокси-3-хлорфенил, бензилокси-3-хлорфенил, бензилокси-3-трифторметилфенил, бензилокси-3-фторфенил, 3-фторбензилокси-3-фторфенил или 3-фторбензилиндазолил.
8. Соединение по п.1, выбранное из
(4-(4-фторбензилокси)фенил)-(6-(5-((2-метансульфонилэтиламино)метил)фуран-2-ил)пиридо[3,4-d]пиримидин-4-ил)амина;
(4-(3-фторбензилокси)фенил)-(6-(5-((2-метансульфонилэтиламино)метил)фуран-2-ил)пиридо[3,4-d]пиримидин-4-ил)амина;
(4-бензолсульфонилфенил)-(6-(5-((2-метансульфонилэтиламино)метил)фуран-2-ил)пиридо[3,4-d]пиримидин-4-ил)амина;
(4-бензилоксифенил)-(6-(3-((2-метансульфонилэтиламино)метил)фенил)пиридо[3,4-d]пиримидин-4-ил)амина;
(4-бензилоксифенил)-(6-(5-((2-метансульфонилэтиламино)метил)фуран-2-ил)хиназолин-4-ил)амина;
(4-(3-фторбензилоксифенил)-(6-(4-((2-метансульфонилэтиламино)метил)фуран-2-ил)пиридо[3,4-d]пиримидин-4-ил)амина;
(4-бензилоксифенил)-(6-(2-((2-метансульфонилэтиламино)метил)тиазол-4-ил)хиназолин-4-ил)амина;
N-{4-[(3-фторбензил)окси]фенил}-6-[5-({[2-(метансульфонил)этил]амино}метил)-2-фурил]-4-хиназолинамина;
N-{4-[(3-фторбензил)окси]-3-метоксифенил}-(6-[5-({[2-(метансульфонил)этил]амино}метил)-2-фурил]-4-хиназолинамина;
N-[4-(бензилокси)фенил]-7-метокси-6-[5-({[2-(метансульфонил)этил]амино}метил)-2-фурил]-4-хиназолинамина;
N-[4-(бензилокси)фенил]-6-[4-({[2-(метансульфонил)этил]амино}метил)-2-фурил]-4-хиназолинамина;
N-{4-[(3-фторбензил)окси]-3-метоксифенил}-6-[2-({[2-(метансульфонил)этил]амино}метил)-1,3-тиазол-4-ил]-4-хиназолинамина;
N-{4-[(3-бромбензил)окси]фенил}-6-[2-({[2-(метансульфонил)этил]амино}метил)-1,3-тиазол-4-ил]-4-хиназолинамина;
N-{4-[(3-фторбензил)окси]фенил}-6-[2-({[2-(метансульфонил)этил]амино}метил)-1,3-тиазол-4-ил]-4-хиназолинамина;
N-[4-(бензилокси)-3-фторфенил]-6-[2-({[2-(метансульфонил)этил]амино}метил)-1,3-тиазол-4-ил]-4-хиназолинамина;
N-(1-бензил-1Н-индазол-5-ил)-7-метокси-6-[5-({[2-(метансульфонил)этил]амино}метил)-2-фурил]-4-хиназолинамина;
N-{3-фтор-4-[(3-фторбензил)окси]фенил}-6-[5-({[2-(метансульфонил)этил]амино}метил)-2-фурил]-4-хиназолинамина;
N-{4-[(3-бромбензил)окси]фенил}-6-[5-({[2-(метансульфонил)этил]амино}метил)-2-фурил]-4-хиназолинамина;
N-[4-(бензилокси)фенил]-6-[3-({[2-(метансульфонил)этил]амино}метил)-2-фурил]-4-хиназолинамина;
N-[1-(3-фторбензил)-1Н-индазол-5-ил]-6-[2-({[2-(метансульфонил)этил]амино}метил)-1,3-тиазол-4-ил]-4-хиназолинамина;
6-[5-({[2-(метансульфонил)этил]амино}метил)-2-фурил]-N-[4-(бензолсульфонил)фенил]-4-хиназолинамина;
6-[2-({[2-(метансульфонил)этил]амино}метил)-1,3-тиазол-4-ил]-N-[4-(бензолсульфонил)фенил]-4-хиназолинамина;
N-{3-фтор-4-[(3-фторбензил)окси]фенил}-6-[2-({[2-(метансульфонил)этил]амино}метил)-1,3-тиазол-4-ил]-4-хиназолинамина;
N-(1-бензил-1Н-индазол-5-ил)-6-[2-({[2-(метансульфонил)этил]амино}метил)-1,3-тиазол-4-ил]-4-хиназолинамина;
N-(3-фтор-4-бензилоксифенил)-6-[2-({[2-(метансульфонил)этил]амино}метил)-1,3-тиазол-4-ил]-4-хиназолинамина;
N-(3-xлop-4-бeнзилoкcифeнил)-6-[2-({[2-(метансульфонил)этил]амино}метил)-1,3-тиазол-4-ил]-4-хиназолинамина;
N-{3-хлор-4-[(3-фторбензил)окси]фенил}-6-[5-({[2-(метансульфонил)этил]амино}метил)-2-фурил]-4-хиназолинамина;
6-[5-({[2-(метансульфонил)этил]амино}метил)-2-фурил]-7-метокси-N-(4-(бензолсульфонил)фенил-4-хиназолинамина;
N-[4-(бензилокси)фенил]-7-фтор-6-[5-({[2-(метансульфонил)этил]амино}метил)-2-фурил]-4-хиназолинамина;
N-(1-бензил-1Н-индазол-5-ил)-7-фтор-6-[5-({[2-(метансульфонил)этил]амино}метил)-2-фурил]-4-хиназолинамина;
N-[4-(бензолсульфонил)фенил]-7-фтор-6-[5-({[2-(метансульфонил)этил]амино}метил)-2-фурил]-4-хиназолинамина;
N-(3-трифторметил-4-бензилоксифенил)-6-[5-({[2-(метансульфонил)этил]амино}метил)-4-фурил]-4-хиназолинамина;
и их солей или сольватов, в частности их фармацевтически приемлемых солей.
9. Фармацевтический препарат, содержащий, по меньшей мере, одно соединение формулы (I) по любому из пп.1-8 или его фармацевтически приемлемую соль или сольват вместе с одним или более чем одним фармацевтически приемлемым носителем, разбавителем или эксципиентом.
10. Применение соединения формулы (I) по любому из пп.1-8 или его фармацевтически приемлемой соли или сольвата в терапии.
11. Применение соединения формулы (I) по любому из пп.1-8 или его фармацевтически приемлемой соли или сольвата в приготовлении лекарства для лечения расстройства, опосредованного аберрантной активностью протеин-тирозинкиназы.
12. Применение по п.11 в приготовлении лекарства для лечения рака и злокачественных опухолей.
13. Способ лечения субъекта - человека или животного, страдающего расстройствюь, опосредованным аберрантной активностью протеин-тирозинкиназы, при котором вышеуказанному субъекту вводят эффективное количество соединения формулы (I) по любому из пп.1-8 или его фармацевтически приемлемой соли или сольвата.
14. Способ по п.13 для лечения рака или злокачественных опухолей.
Текст
1 Настоящее исследование относится к ряду замещенных гетероароматических соединений,к способам их получения, к фармацевтическим композициям, содержащим их, и к их применению в медицине. В частности, изобретение относится к производным хинолина, хиназолина,пиридопиридина и пиридопиримидина, которые демонстрируют ингибирование протеинтирозинкиназы. Протеин-тирозинкиназы катализируют фосфорилирование специфических тирозиновых остатков различных белков, вовлеченных в регуляцию клеточного роста и дифференциации(A.F. Wilks, Progress in Growth Factor Research,1990, 2, 97-111; S.A. Courtneidge, Dev.Supp.I.,1993, 57-64; J.A. Cooper, Semin. Cell Biol., 1994,5(6), 377-387; R.F. Paulson, Semin. Immunol.,1995, 7(4), 267-277; A.C. Chan, Curr. Opin. Immunol., 1996, 8(3), 394-401). Протеин-тирозинкиназы в широком смысле могут быть классифицированы как рецепторные (например EGFr(рецептор эпидермального фактора роста), сеrВ-2, c-met, tie-2, PDGFr (рецептор тромбоцитарного фактора роста), FGFr (рецептор трансформирующего -фактора роста или не рецепторные (например c-src, Ick, zap70) киназы. Несоответствующая или неконтролируемая активация многих из этих киназ, то есть аберрантная активность протеин-тирозинкиназ, например изза сверхэкспррессии или мутации, приводит, как было показано, к неконтролируемому клеточному росту. Аберрантная активность протеинтирозинкиназ, таких как с-еrВ-2, c-src, с-met,EGFr и PDGFr, вовлечена в злокачественности человека. Повышенная активность EGFr, например, вовлечена в немелкоклеточный рак легкого, рак мочевого пузыря, рак в области головы и шеи, а увеличение активности с-еrbВ-2 наблюдается при раке молочной железы, яичников, желудка и поджелудочной железы. Следовательно, ингибирование активности протеинтирозинкиназ должно обеспечивать лечение опухолей, таких как опухоли, о которых в общих чертах сказано выше. Аберрантная активность протеинтирозинкиназ также вовлечена во многие другие расстройства: псориаз (Dvir et al, J.Cell.Biol; 1991, 113, 857-865), фиброз, атеросклероз, рестеноз (Buchdunger et al, Proct. Natl. Acad. Sci.USA; 1991, 92, 2258-2262), аутоиммунное заболевание, аллергия, астма, отторжение трансплантата (Klausner and Samelson, cell; 1991, 64,875-878), воспаление (Bercois, Blood; 1992,79(9), 2446-2454), тромбоз (Salari et al, FEBS; 1990, 263(1), 104-108) и заболевания нервной системы (Ohmichi et al, Biochemistry, 1992, 31,4034-4039). Ингибиторы специфических протеин-тирозинкиназ, вовлеченные в эти заболевания, например PDFG-R при рестенозе и EGF-R при псориазе, приводят к новым терапиям для таких расстройств. P56Ick и zap70 выявлены при 2 болезненных состояниях, при которых Т-клетки гиперактивны, например при ревматоидном артрите, аутоиммунном заболевании, аллергии,астме и отторжении трансплантата. Процесс ангиогенеза ассоциирован с множеством болезненных состояний (например с состояниями онкогенеза, с псориазом, с ревматоидным артритом), и было показано, что он контролируется через действие ряда рецепторных тирозинкиназ(L.K. Shawver, DDT, 1997, 2 (2), 50-63). Поэтому общая задача настоящего изобретения состоит в том, чтобы предоставить соединения, пригодные для лечения расстройств,опосредованных активностью протеинтирозинкиназ, и в частности для лечения вышеупомянутых расстройств. В дополнение к лечению опухолей, согласно настоящему изобретению предусматривается, что другие расстройства, опосредованные активностью протеин-тирозинкиназ, можно эффективно лечить путем ингибирования, в том числе селективного ингибирования, активности соответствующей протеин-тирозинкиназы. Широкого спектра ингибирование протеин-тирозинкиназы не всегда может обеспечить оптимальное лечение, например, опухолей, и в некоторых случаях может быть даже пагубным для субъектов, так как протеин-тирозинкиназы играют существенную роль в нормальной регуляции клеточного роста. Другая задача настоящего изобретения состоит в том, чтобы предоставить соединения,которые селективно ингибируют протеинтирозинкиназы, такие как EGFr, c-erbB-2, cerbB-4, c-met, tie-2, PDGFr, c-src, Ick, Zap70 иfyn. Понятно, что есть также польза в селективном ингибировании, затрагивающем небольшие группы протеин-тирозинкиназ, например группы, включающие в себя два или более из c-erbB2, c-erbB-4, EGFr, Ick и zap70. Еще одна задача настоящего изобретения состоит в том, чтобы предоставить соединения,полезные в лечении заболеваний, связанных с протеин-тирозинкиназой, которые сводят к минимуму нежелательные побочные эффекты у реципиента. Настоящее изобретение относится к гетероциклическим соединениям, которые можно использовать для лечения расстройств, опосредованных протеин-тирозинкиназами, и, в частности, которые обладают противораковыми свойствами. Более конкретно, соединения по настоящему изобретению являются сильными ингибиторами протеин-тирозинкиназ, таких какEGFr, c-erbB-2, c-erbB-4, c-met, tie-2, PDGFr, csrc, Ick, Zap70 и fyn, что дает возможность клинического менеджмента конкретных пораженных тканей. Согласно настоящему изобретению предусматривается, в частности, лечение злокачественных новообразований у человека, например опухоли молочной железы, немелкоклеточного 3 рака легкого, опухолей мочевого пузыря, желудка и поджелудочной железы, особенно опухолей, связанных с EGF-R или c-erbB-2, с использованием соединений по настоящему изобретению. Например, изобретение включает в себя соединения, которые высоко активны против протеин-тирозинкиназы c-erbB-2, часто в предпочтение рецептору EGF, что, следовательно, дает возможность лечить опухоли, связанные с c-erbB-2. Однако изобретение также включает в себя соединения, которые высоко активны против как c-erbB-2, так и EGF-R рецепторных киназ, что, следовательно, дает возможность лечить опухоли широкого спектра. Настоящее изобретение также включает в себя соединения, которые активны против Ick и/или Zap70 рецепторных киназ. Эти соединения могут быть также активны и против c-erbB2 и/или EGF-R рецепторных киназ. Соединения могут быть селективными в отношении Ick и/или Zap70 по сравнению с c-erbB-2 и/илиEGF-R. Более конкретно, согласно настоящему изобретению предусматривается, что расстройства, опосредованные активностью протеинтирозинкиназ, можно эффективно лечить путем ингибирования активности соответствующей протеин-тирозинкиназы относительно селективным образом, тем самым сводя к минимуму потенциальные побочные эффекты. Соответственно, согласно настоящему изобретению предложено соединение формулы или его соль или сольват; где Х представляет собой N или СН;R1 СН 3SO2 СН 2 СН 2NНСН 2-Аr-, где -Аr- выбран из фенила, фурана, тиофена, пиррола и тиазола,каждый из которых может быть возможно замещен одной или двумя гало, С 1-4 алкильными или С 1-4 алкоксигруппами; 4 бензотриазолильную группу, замещенную группой R3 и возможно замещенную, по меньшей мере, одной независимо выбранной группой R4;R3 выбран из группы, включающей в себя бензил, гало-, дигало- и тригалобензил, бензоил,пиридилметил, пиридилметокси, фенокси, бензилокси, гало-, дигало- и тригалобензилокси и бензолсульфонил; или R3 представляет собой тригалометилбензил или тригалометилбензилокси; или R3 представляет собой группу формулы где каждый R5 независимо выбран из галогена,С 1-4 алкила и С 1-4 алкокси; и n представляет собой число от 0 до 3; каждый R4 независимо представляет собой гидрокси, галоген, С 1-4 алкил, С 2-4 алкенил, С 2-4 алкинил, С 1-4 алкокси, амино, С 1-4 алкиламино, ди[С 1-4 алкил]амино, С 1-4 алкилтио, С 1-4 алкилсульфинил, С 1-4 алкилсульфонил, С 1-4 алкилкарбонил,карбокси, карбамоил, С 1-4 алкоксикарбонил, C1-4 алканоиламино, N-(С 1-4 алкил)карбамоил, N,Nди(С 1-4 алкил)карбамоил, циано, нитро и трифторметил; с условием, что следующие соединения исключены:(1-бензил-1 Н-индазол-5-ил)-(6-(5-2 метансульфонилэтиламино)метил)-1-метилпиррол-2-ил)хиназолин-4-ил-амин; и их соли гидрохлориды. Сольваты соединений формулы (I) также включены в объем настоящего изобретения. Определения для X, Y и V, таким образом,дают начало ряду возможных основных кольцевых систем для соединений формулы (I). В частности, соединения могут содержать следующие основные кольцевые системы: 5 Можно видеть, что для соединений, содержащих основную кольцевую систему (1),группа R1 может находиться в положении 6 или 7; соединения, в которых группа R1 находится в положении 7, особенно интересны в контексте активности Ick и/или активности zap70. Можно видеть, что для соединений, содержащих основную кольцевую систему (2),группа R1 может находиться в положении 6 или 7; соединения, в которых группа R1 находится в положении 6, особенно интересны в контексте активности с-еrbВ-2, тогда как соединения, в которых группа R1 находится в положении 7,особенно интересны в контексте активности Ick или активности zap70. Предпочтительны кольцевые системы (1),(2), (5) и (6). Более предпочтительны кольцевые системы (2) и (6). Кольцевая система (1) также более предпочтительна. Алкильные группы, содержащие три или более чем три углеродных атома, могут быть нормальными, разветвленными или циклическими; предпочтительно они нормальные или разветвленные. Ссылки на конкретную алкильную группу, такую как "бутил", подразумевают ссылку только на изомер с нормальной цепью(н-). Ссылки на другие общие термины, такие как алкокси, алкиламино и другие следует рассматривать аналогично. Подходящими являются следующие значения для различных вышеперечисленных групп в определениях R1, R2, R3, R4: гало представляет собой, например, фторо,хлоро, бромо или йодо, предпочтительно фторо,хлоро или бромо, более предпочтительно фторо или хлоро; С 1-4 алкил представляет собой, например,метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил или трет-бутил, предпочтительно метил, этил, пропил, изопропил или бутил,более предпочтительно метил; С 2-4 алкенил представляет собой, например,этенил, проп-1-енил или проп-2-енил, предпочтительно этенил; С 2-4 алкинил представляет собой, например,этинил, проп-1-инил или проп-2-инил, предпочтительно этинил; С 1-4 алкокси представляет собой, например,метокси, этокси, н-пропокси, изопропокси, нбутокси, изобутокси, втор-бутокси или третбутокси, предпочтительно метокси, этокси,пропокси, изопропокси или бутокси, более предпочтительно метокси; С 1-4 алкиламино представляет собой, например, метиламино, этиламино или пропиламино, предпочтительно метиламино; ди[С 1-4 алкил]амино представляет собой,например, диметиламино, диэтиламино, Nметил-N-этиламино или дипропиламино, предпочтительно диметиламино; 6 С 1-4 алкилтио представляет собой, например, метилтио, этилтио, пропилтио или изопропилтио, предпочтительно метилтио; С 1-4 алкилсульфинил представляет собой,например, метилсульфинил, этилсульфинил,пропилсульфинил или изопропилсульфинил,предпочтительно метилсульфинил; С 1-4 алкилсульфонил представляет собой,например, метансульфонил, этилсульфонил,пропилсульфонил или изопропилсульфонил,предпочтительно метансульфонил; С 1-4 алкилкарбонил представляет собой,например, метилкарбонил, этилкарбонил, пропилкарбонил; С 1-4 алкоксикарбонил представляет, собой например, метоксикарбонил, этоксикарбонил,пропоксикарбонил, бутоксикарбонил или третбутоксикарбонил; С 1-4 алканоиламино (где в число углеродных атомов включена функциональная группа СО) представляет собой, например, формамидо,ацетамидо, пропионамидо или бутирамидо;N,N-ди(С 1-4 алкил)карбамоил представляет собой, например, N,N-диметилкарбамоил, Nметил-N-этилкарбамоил или N,N-диэтилкарбамоил. В особенно предпочтительном воплощении Х представляет собой N, Y представляет собой CR1, а V представляет собой CR2 (кольцевая система (2), указанная выше). В еще одном особенно предпочтительном воплощении Х представляет собой N, Y представляет собой CR2, a V представляет собой CR1(кольцевая система (2), указанная выше). В еще одном особенно предпочтительном воплощении Х представляет собой N, Y представляет собой CR1, а V представляет собой N(кольцевая система (6), указанная выше). В предпочтительном воплощении R2 представляет собой водород или С 1-4 алкокси. В более предпочтительном воплощении R2 представляет собой водород или метокси. В еще одном предпочтительном воплощении R2 представляет собой гало; более предпочтительно R2 представляет собой фторо. В предпочтительном воплощении группа Аr замещена одной гало, С 1-4 алкильной или С 1-4 алкоксигруппой. В более предпочтительном воплощении группа Аr замещена С 1-4 алкильной группой. В еще одном более предпочтительном воплощении группа Аr не несет никаких функциональных заместителей. В еще одном более предпочтительном воплощении группа Аr представляет собой фуран,фенил или тиазол, каждый из которых может быть возможно замещен как указано выше. В еще одном более предпочтительном воплощении группа Аr представляет собой фуран 7 или тиазол, каждый из которых может быть возможно замещен как указано выше. В наиболее предпочтительном воплощении группа Аr представляет собой незамещенный фуран или тиазол. Боковая цепь CH3SO2CH2CH2NHCH2 может быть связана с любым подходящим положением группы Аr. Аналогично, группа R1 может быть связана через углеродный атомом с любым подходящим положением группы Аr. В предпочтительном воплощении, когда Аr представляет собой фуран, боковая цепьCH3SO2CH2CH2NHCH2 находится в положении 4 фуранового кольца, а связь с углеродным атомом, несущим группу R1, находится в положении 2 фуранового кольца. В другом предпочтительном воплощении,когда Аr представляет собой фуран, боковая цепь СН 3SO2 СН 2 СН 2NНСН 2 находится в положении 3 фуранового кольца, а связь с углеродным атомом, несущим группу R1, находится в положении 2 фуранового кольца. В наиболее предпочтительном воплощении, когда группа Аr представляет собой фуран,боковая цепь СН 3SO2 СН 2 СН 2NНСН 2 находится в положении 5 фуранового кольца, а связь с углеродным атомом, несущим группу R1, находится в положении 2 фуранового кольца. В еще одном наиболее предпочтительном воплощении, когда группа Аr представляет собой тиазол, боковая цепь СН 3SO2 СН 2 СН 2NНСН 2 находится в положении 2 тиазольного кольца, а связь с углеродным атомом, несущим группу R1,находится в положении 4 тиазольного кольца. Группы R3 и R4 могут быть связаны с кольцевой системой U либо по углеродному атому, либо по гетероатому кольцевой системы. Кольцевая система сама по себе может быть связана с мостиковой NН-группой по углеродному атому или гетероатому, но предпочтительно связана по углеродному атому. ГруппыR3 и R4 могут быть связаны с любым кольцом из двух, когда U представляет собой бициклическую кольцевую систему, но эти группы предпочтительно связаны с кольцом, которое в этом случае не связано с мостиковой NH-группой. В предпочтительном воплощении U представляет собой фенильную, индолильную или 1 Н-индазолильную группу, замещенную группой R3 и возможно замещенную, по меньшей мере, одной независимо выбранной группой R4. В более предпочтительном воплощении U представляет собой фенильную или 1Hиндазолильную группу, замещенную группой R3 и возможно замещенную, по меньшей мере, одной независимо выбранной группой R4. В более предпочтительном воплощении,когда U представляет собой фенильную группу,группа R3 находится в пара-положении по отношению к связи, связывающей U с NHгруппой. 8 В еще одном более предпочтительном воплощении, когда U представляет собой 1 Ниндазолильную группу, группа R3 находится в положении 1 индазолильной группы. В предпочтительном воплощении R3 представляет собой бензил, пиридилметил, фенокси,бензилокси, гало-, дигало- и тригалобензилокси и бензолсульфонил. В еще одном предпочтительном воплощении R3 представляет собой тригалометилбензилокси. В еще одном предпочтительном воплощении R3 представляет собой группу формулыCl, более конкретно, где заместитель Hal находится в положении, помеченном звездочкой на кольце, как показано. В более предпочтительном воплощении R3 представляет собой бензилокси, фторбензилокси (особенно 3-фторбензилокси), бензил, фенокси и бензолсульфонил. В еще одном более предпочтительном воплощении R3 представляет собой бромбензилокси (особенно 3-бромбензилокси) и трифторметилбензилокси. В еще одном предпочтительном воплощении кольцо U не замещено группой R4; в особенно предпочтительном воплощении U представляет собой фенил или индазолил, не замещенный какой-либо группой R4. В еще одном предпочтительном воплощении кольцо U замещено группой R4, выбранной из гало или С 1-4 алкокси; особенно хлоро, фторо или метокси. В более предпочтительном воплощении кольцо U замещено группой R4, где R4 представляет собой гало, в особенности 3-фторо. В особенно предпочтительном воплощении U вместе с R4 представляет собой метоксифенил, фторфенил, трифторметилфенил или хлорфенил. В особо предпочтительном воплощении U вместе с R4 представляет собой метоксифенил или фторфенил. В особенно предпочтительном воплощении группа U вместе с заместителем(ями) R3 иR4 представляет собой бензилоксифенил, (фторбензилокси)фенил,(бензолсульфонил)фенил,бензилиндазолил или феноксифенил. В особо предпочтительном воплощении группа U вместе с заместителем(ями) R3 и R4 представляет собой бензилоксифенил, (3-фторбензилокси)фенил,(бензолсульфонил)фенил,бензилиндазолил. В другом особо предпочтительном воплощении группа U вместе с заместителем(ями) R3 и R4 представляет собой (3-бромбензилокси)(3-фторбензилокси)-3-метоксифенил. В другом особо предпочтительном воплощении группа U вместе с заместителем(ями) R3 и R4 представляет собой 3-фторбензилокси-3 хлорфенил, бензилокси-3-хлорфенил, бензилокси-3-трифторметилфенил, (бензилокси)-3-фторфенил, (3-фторбензилокси)-3-фторфенил или (3 фторбензил)индазолил. В самом особо предпочтительном воплощении группа U вместе с заместителем(ями) R3 и R4 представляет собой бензилоксифенил или(3-фторбензилокси)фенил. В предпочтительном воплощении предложено соединение формулы (I) или его соль или сольват, где Х представляет собой N; V представляет собой CR2, где R2 представляет собой водород, гало (в частности фторо) или С 1-4 алкокси (в частности метокси); Y представляет собой CR1, где R1 является таким, как определено выше, в котором Аr представляет собой незамещенный фенил, фуран или тиазол; U представляет собой фенил или индазол; R3 представляет собой бензил, фторбензил, бензилокси,фторбензилокси, бромбензилокси, трифторметилбензилокси, фенокси или бензолсульфонил; а R4 не присутствует или представляет собой гало (в частности хлоро или фторо) или метокси. В наиболее предпочтительном воплощении предложено соединение формулы (I) или его соль или сольват, где Х представляет собойN; V представляет собой CR2, где R2 представляет собой водород, гало (в частности фторо) или С 1-4 алкокси (в частности метокси); Y представляет собой CR1, где R1 является таким, как определено выше, в котором Аr представляет собой незамещенный фуран или тиазол; U представляет собой фенил; R3 представляет собой бензилокси, фторбензилокси или бензолсульфонил; а R4 не присутствует или представляет собой гало (в частности хлоро или фторо), или метокси. В наиболее предпочтительном воплощении предложено соединение формулы (I) или его соль или сольват, где Х представляет собойN; V представляет собой CR2, где R2 представляет собой водород, гало (в частности фторо) или С 1-4 алкокси (в частности метокси); Y представляет собой CR1, где R1 является таким, как определено выше, в котором Аr представляет собой незамещенный фуран или тиазол; U представляет собой индазол; R3 представляет собой бензил или фторбензил; а R4 не присутствует. В еще одном более предпочтительном воплощении предложено соединение формулы (I) или его соль или сольват, где Х представляет собой N; 10 как определено выше, в котором Аr представляет собой незамещенный фенил, фуран или тиазол; U представляет собой фенил или индазол;R3 представляет собой бензил, фторбензил, бензилокси, фторбензилокси, бромбензилокси,трифторметилбензилокси, фенокси или бензолсульфонил; a R4 не присутствует или представляет собой гало (в частности хлоро или фторо) или метокси. В еще одном наиболее предпочтительном воплощении предложено соединение формулы(I) или его соль или сольват, где Х представляет собой N; Y представляет собой CR2, где R2 представляет собой водород, гало (в частности фторо) или С 1-4 алкокси (в частности метокси); V представляет собой CR1, где R1 является таким,как определено выше, в котором Аr представляет собой незамещенный фуран или тиазол; U представляет собой фенил; R3 представляет собой бензилокси, фторбензилокси или бензолсульфонил; а R4 не присутствует или представляет собой гало (в частности хлоро или фторо) или метокси. В еще одном наиболее предпочтительном воплощении предложено соединение формулы(I) или его соль или сольват, где Х представляет собой N; Y представляет собой CR2, где R2 представляет собой водород, гало (в частности фторо) или С 1-4 алкокси (в частности метокси); V представляет собой CR1, где R1 является таким,как определено выше, в котором Аr представляет собой незамещенный фуран или тиазол; U представляет собой индазол; R3 представляет собой бензил или фторбензил; а R4 не присутствует. В особенно наиболее предпочтительном воплощении предложено соединение формулы(I) или его соль или сольват, где Х представляет собой N; Y представляет собой CR2, где R2 представляет собой водород, гало (в частности фторо) или С 1-4 алкокси (в частности метокси); V представляет собой CR1, где R1 является таким,как определено выше, в котором Аr представляет собой незамещенный фуран или тиазол; U представляет собой фенил; R3 представляет собой фенокси; а R4 не присутствует. В другом более предпочтительном воплощении предложено соединение формулы (I) или его соль или сольват, где Х представляет собойN; V представляет собой N; Y представляет собой CR1, где R1 является таким, как определено выше, в котором Аr представляет собой незамещенный фенил, фуран или тиазол; U представляет собой фенил или индазол; R3 представляет собой бензил, фторбензил, бензилокси,фторбензилокси, бромбензилокси, трифторметилбензилокси, фенокси или бензолсульфонил;a R4 не присутствует или представляет собой гало (в частности хлоро или фторо) или метокси. В другом наиболее предпочтительном воплощении предложено соединение формулы (I) 11 или его соль или сольват, где Х представляет собой N; V представляет собой N; Y представляет собой CR1, где R1 является таким, как определено выше, в котором Аr представляет собой незамещенный фуран или тиазол; U представляет собой фенил; R3 представляет собой бензилокси, фторбензилокси или бензолсульфонил; а R4 не присутствует или представляет собой гало (в частности хлоро или фторо) или метокси. В другом наиболее предпочтительном воплощении предложено соединение формулы (I) или его соль или сольват, где Х представляет собой N; V представляет собой N; Y представляет собой CR1, где R1 является таким, как определено выше, в котором Аr представляет собой незамещенный фуран или тиазол; U представляет собой индазол; R3 представляет собой бензил или фторбензил; a R4 нe присутствует. В еще одном другом предпочтительном воплощении предложено соединение формулы(I) или его соль или сольват, где Х представляет собой СН; Y представляет собой CR2, где R2 представляет собой водород, гало (в частности фторо) или С 1-4 алкокси (в частности метокси); V представляет собой CR1, где R1 является таким,как определено выше, в котором Аr представляет собой незамещенный фенил, фуран или тиазол; U представляет собой фенил или индазол;R3 представляет собой бензил, фторбензил, бензилокси, фторбензилокси, бромбензилокси,трифторметилбензилокси, фенокси или бензолсульфонил; а R4 не присутствует или представляет собой гало (в частности хлоро или фторо) или метокси. В еще одном другом наиболее предпочтительном воплощении предложено соединение формулы (I) или его соль или сольват, где Х представляет собой СН; Y представляет собойCR2, где R2 представляет собой водород, гало (в частности фторо) или С 1-4 алкокси (в частности метокси); V представляет собой CR1, где R1 является таким, как определено выше, в котором Аr представляет собой незамещенный фуран или тиазол; U представляет собой фенил; R3 представляет собой бензилокси, фторбензилокси, фенокси или бензолсульфонил; a R4 не присутствует или представляет собой гало (в частности хлоро или фторо) или метокси. В еще одном другом наиболее предпочтительном воплощении предложено соединение формулы (I) или его соль или сольват, где Х представляет собой CH; Y представляет собойCR2, где R2 представляет собой водород, гало (в частности фторо) или С 1-4 алкокси (в частности метокси); V представляет собой CR1, где R1 является таким, как определено выше, в котором Аr представляет собой незамещенный фуран или тиазол; U представляет собой индазол; R3 представляет собой бензил или фторбензил; а R4 не присутствует. 12 В особенно наиболее предпочтительном воплощении предложено соединение формулы(I) или его соль или сольват, где Х представляет собой СH; Y представляет собой CR2, где R2 представляет собой водород, гало (в частности фторо) или С 1-4 алкокси (в особенности метокси); V представляет собой CR1, где R1 является таким, как определено выше, в котором Аr представляет собой незамещенный фуран или тиазол; U представляет собой фенил; R3 представляет собой фенокси; a R4 нe присутствует. Предпочтительные соединения по настоящему изобретению включают в себяN-(3-трифторметил-4-бензилоксифенил)-6[5-([2-(метансульфонил)этил]аминометил)-4 фурил]-4-хиназолинамин; и их соли или сольваты, в частности их фармацевтически приемлемые соли. Другие предпочтительные соединения по настоящему изобретению включают в себя(4-феноксифенил)-(7-(5-(2-метансульфонил)этиламинометил)фуран-2-ил]хинолин-4 ил)амин; и их соли или сольваты, в частности их фармацевтически приемлемые соли. Другие предпочтительные соединения по настоящему изобретению включают в себя следующие (в группах, обозначенных ниже как списки с 1 до 48): Список 1N-[1-(3-фторбензил-1 Н-индазол-5-ил]-7 фтор-6-[2-([2-(метансульфонил)этил]амино метил)-1,3-тиазол-4-ил]-4-хиназолинамин; и их соли или сольваты, в частности их фармацевтически приемлемые соли или сольваты. Особенно предпочтительные соединения по настоящему изобретению включают в себяN-3-трифторметил-4-бензилоксифенил)6-(5-([2-(метансульфонил)этил]аминометил)4-фурил]-4-хиназолинамин; и их соли или сольваты, в частности их фармацевтически приемлемые соли или сольваты. Далее, особенно предпочтительные соединения по настоящему изобретению включают в себя(4-феноксифенил)-(7-(5-(2-метансульфонил)этиламинометил)фуран-2-ил)-хинолин-4 ил)амин; и их соли или сольваты, в частности их фармацевтически приемлемые соли или сольваты. Другие, особенно предпочтительные соединения по настоящему изобретению включают в себя(4-феноксифенил)-(7-(4-2-метансульфонилэтиламино)метил)фенил)хинолин-4-ил) амин; и их соли или сольваты, в частности их фармацевтически приемлемые соли или сольваты. Другие самые предпочтительные соединения по настоящему изобретению включают в себя(4-феноксифенил)-(7-(5-2-метансульфонилэтиламино)метил)тиазол-2-ил)хинолин-4 ил)амин; и их соли или сольваты, в частности их фармацевтически приемлемые соли или сольваты. Некоторые соединения формулы (I) могут существовать в форме стереоизомеров (т.е. они могут содержать один или более чем один асимметрический атом углерода или могут проявлять цис-транс-изомерию). Индивидуальные стереоизомеры (энантиомеры и диастереоизомеры) и их смеси включены в объем настоящего изобретения. Понятно также, что соединения формулы (I) могут существовать в таутомерных формах, иных чем показано в формуле, и они тоже включены в объем настоящего исследования. Соли соединений по настоящему изобретению могут включать соли присоединения кислот, образованные по азоту в соединении формулы (I). Терапевтическая активность присуща части, производной от соединения по изобретению, как оно здесь определено, а индивидуальность другой составной части имеет меньшее 33 значение, хотя для терапевтических и профилактических целей эта часть предпочтительно является фармацевтически приемлемой для пациента. Примеры фармацевтически приемлемых солей присоединения кислот, образованных из минеральных кислот, таких как соляная, бромоводородная, фосфорная, метафосфорная, азотная или серная, или органических кислот, таких как винно-каменная, уксусная, трифторуксусная, лимонная, малоновая, молочная, фумаровая, бензойная, гликолевая, глюконовая, янтарная, метансульфоновая и арилсульфоновая, например п-толуолсульфоновая кислота. Согласно следующему аспекту настоящего изобретения предложен способ получения соединения формулы (I), как оно определено выше, включающий в себя стадии, на которыхY' представляет собой CL', а V' представляет собой N; или Y' представляет собой N, а V' представляет собой CL'; или Y' представляет собой CL', a V' представляет собой CR2; или Y' представляет собой CR2, a V' представляет собой CL'; где R2 такой, как определено выше, a L и L' представляют собой подходящие уходящие группы,подвергают взаимодействию с соединением формулы (III)(III) где U такой, как определено выше, с получением соединения формулы (IV) а затем (б) подвергают взаимодействию с соответствующим(и) реагентом(ами) для замещения уходящей группы L' группой R1; и, если требуется, (в) затем превращают соединение формулы (I), полученное таким образом, в другое соединение формулы (I) с использованием соответствующих реагентов. Альтернативно соединение формулы (II),как оно определено выше, подвергают взаимодействию с соответствующими реагентами для замещения уходящей группы L' группой R1, а затем полученный таким образом продукт(I), полученного таким образом, в другое соединение формулы (I). 34 Как вариант этой альтернативы, соединение формулы (V) где X, Y, V, U и L такие, как определено выше,может быть получено взаимодействием соединения формулы (VI) где V' и Y' такие, как определено выше, с соответствующими реагентами для замещения уходящей группы L' группой R1 с получением соединения формулы (VII) и последующим взаимодействием для введения уходящей группы L. Например, уходящая группа хлоро может быть введена путем взаимодействия соответствующего 3,4-дигидропирими дона со смесью четыреххлористый углерод/ трифенилфосфин в подходящем растворителе. Группа R1, таким образом, может быть введена в основную кольцевую систему путем замещения подходящей уходящей группы. Это может быть выполнено, например, путем взаимодействия соответствующего производного арил- или гетероарилстаннана с соответствующим соединением формулы (IV), несущим уходящую группу L' в соответствующем положении на кольце. Согласно следующему аспекту настоящего изобретения предложен способ получения соединения формулы (I), как оно определено выше, включающий в себя стадии, на которых(а) соединение формулы (IV), как оно определено выше, подвергают взаимодействию с соответствующим(и) реагентом(ами) с получением соединения формулы (VIII)Y" представляет собой СТ, а V" представляет собой N; или Y" представляет собой N, а V" представляет собой СТ; или Y" представляет собой СТ, а V" представляет собой CR2; или Y" представляет собой CR2, a V" представляет собой СТ; где R2 такой, как определено выше, а Т представляет собой соответственно функционализированную группу; и (б) затем превращают группу Т в группуR1 с использованием соответствующего(их) реагента(ов); и, если требуется, (в) затем превращают соединение формулы (I), полученное та 35 ким образом, в другое соединение формулы (I) с использованием соответствующих реагентов. В одной альтернативе группа Т может представлять собой группу Аr, как она определена выше, несущую формильную группу(СНО). В том случае, когда Т представляет собой группу Аr, несущую формильную группу, соединение (формулы (VIIIa может быть получено, например, кислотным гидролизом. Диоксоланил-замещенное соединение может быть получено взаимодействием соединения формулы (IV) с соответствующим реагентом для замещения подходящей уходящей группы заместителем, несущим диоксоланильное кольцо. Этим реагентом может быть, например, соответствующее производное гетероарилстаннана. Таким образом, подходящий способ может включать в себя взаимодействие соединения формулы (VIIIa), в котором Т представляет собой группу Аr, несущую формильный заместитель (т.е. группу -СНО), с соединением формулы CH3SO2CH2CH2NH2. Это взаимодействие предпочтительно заключается в восстановительном аминировании с использованием подходящего восстановителя, например натрия триацетоксиборгидрида. Альтернативно, другой подходящий способ может включать в себя окисление соединения формулы (VIIIc), в котором Т представляет собой группу Аr, несущую заместитель формулы CH3SCH2CH2NHCH2 или CH3SOCH2CH2NHCH2. Подходящие методы окисления до желательного соединения формул (I) хорошо известны опытному специалисту. Они включают в себя, например, взаимодействие с органическим пероксидом, таким как надуксусная кислота или метахлорбензойная кислота, или взаимодействие с неорганическим окислителем, таким какOXONE. Соединение формулы (VIIIc), в котором Т представляет собой группу Аr, несущую заместитель формулы СН 3SСН 2 СН 2NНСН 2 илиCH3SOCH2CH2NHCH2, может быть получено путем взаимодействия, аналогичного взаимодействию, описанному выше, а именно: взаимодействием соединения формулы (VIIIa), в котором Т представляет собой группу Аr, несущую формильный заместитель (т.е. группу -СОН), с соединением формулы CH3SCH2CH2NH2 илиCH3SOCH2CH2NH2, соответственно. Альтернативно можно использовать схему,аналогичную схеме, описанной выше, где введение группы R1 на основную кольцевую систему происходит до реакции сочетания с соединением формулы (III). Согласно еще одному альтернативному способу группу Т превращают в группу R1 путем синтеза de novo замещенной гетероциклической системы с использованием соответствующих исходных реагентов. Такой способ включает в себя известную специалисту стандартную 36 методологию построения гетероциклической кольцевой системы. Например, Т может представлять собой галокетонную группу, как показано в соединении формулы (IX) на схеме 1, приведенной ниже,которая, когда она связана с соответствующимN-защищенным тиоамидом [соединение формулы (XI) на схеме 2], может приводить к образованию N-защищенной амино-замещенной тиазольной системы формулы (X). В качестве примера, на схеме 1 изображен синтез производных, несущих замещенное тиазольное кольцо в качестве заместителя R1: Схема 1 На схеме 1 гало такой, как определено ранее (предпочтительно йодо), а Р' в соединении формулы (XI) представляет собой подходящую защитную группу, такую как трифторкарбонил. Аналогичный способ можно использовать для получения соединения формулы (I), которое несет R1 в положении 7 основной кольцевой системы из исходного соединения формулы через промежуточные соединения формул (Хb) и (XIb), которые представляют собой соединения, аналогичные соединениям формул (Ха) и(XIa), соответственно. Соответственно замещенный тиоамидный реагент сочетания, пригодный для получения тиазольной кольцевой системы, может быть получен согласно схеме 2 Схема 2 На схеме 2 трифторкарбонильная защитная группа в соединениях формул (XIV), (XV) и 37 Альтернативно может быть использована схема, аналогичная схеме, описанной выше, где введение группы R1 на основную кольцевую систему происходит до реакции сочетания с соединением формулы (III). Другие замещенные тиоамиды получают,используя способы, аналогичные способам,описанным выше. В общем случае, группа R2 будет присутствовать в качестве заместителя в основной кольцевой системе до введения группы R1 или группы NHU. В том случае, когда R2 является иным, чем водород, в некоторых обстоятельствах может возникнуть необходимость защитить эту группу до проведения реакционной стадии введения заместителей R1 и NHU. Особо следует упомянуть о ситуации, когда R2 представляет собой гидрокси. Подходящие защитные группы для гарантии невмешательства в последующие реакционные стадии включают в себя 2 метоксиэтоксиметилэфирную группу (МЭМ) или большую силильную защитную группу,такую как трет-бутилдифенилсилил (ТБДФС). Подходящие защитные группы, способы их введения и способы их удаления хорошо известны специалисту. Описание защитных групп и их использование можно найти в T.W. GreeneSynthesis", 2nd edn, John WileySons, New York,1991. Подходящие уходящие группы для L и L' хорошо известны специалисту, и они включают в себя, например, гало, такой как фторо, хлоро,бромо и йодо; сульфонилоксигруппы, такие как метансульфонилокси и толуол-п-сульфонилокси; алкоксигруппы; и трифлат. Указанную выше реакцию сочетания с соединением формулы (III) удобно проводить в присутствии подходящего инертного растворителя, например С 1-4 алканола, такого как изопропанол, галогенированный углеводород, эфир,ароматический углеводород или диполярный апротонный растворитель, такой как ацетон,ацетонитрил или ДМСО, при неэкстремальной температуре, например от 0 С до 150 С, приемлемо от 10 до 120 С, предпочтительно от 50 до 100 С. Возможно эту реакцию проводят в присутствии основания. Примеры подходящих оснований включают в себя органический амин, такой как триэтиламин, или карбонат, гидрид или гидроксид щелочного металла, такой как карбонат,гидрид или гидроксид натрия или калия. Соединение формулы (I) может быть получено этим способом в форме соли с кислотойHL, где L такой, как было определено здесь ранее, или в форме свободного основания путем обработки соли основанием, как было определено здесь ранее. Соединения формул (II) и (III), как они определены выше, реагенты для введения группыR1 и реагент(ы) для превращения группы Т в 38 группу R1 либо легко доступны, либо могут быть легко синтезированы специалистом с использованием общепринятых методов органического синтеза. Как было указано выше, полученное соединение формулы (I) может быть превращено в другое соединение формулы (I) путем химического превращения соответствующего заместителя или заместителей с использованием подходящих химических методов (например, известных из J. March "Advanced Organic Chemistry",Edition III, Wiley Interscience, 1985). Например, соединение, содержащее алкилтиогруппу, может быть окислено до соответствующего сульфинильного или сульфонильного соединения с использованием органического пероксида (например бензоилпероксида) или подходящего неорганического окислителя (например OXONE). Соединение,содержащее нитрозаместитель, может быть восстановлено до соответствующего аминосоединения, например с использованием водорода и подходящего катализатора (если нет другой чувствительной группы), с использованием никеля Ренея и гидразингидрата или с использованием железа/уксусной кислоты. Амино-заместители могут быть ацилированы с использованием хлорангидрида или ангидрида кислоты в подходящих условиях. Точно так же амидная группа может быть расщеплена с образованием аминосодержащего соединения путем обработки например разбавленным водным основанием. Амино-заместитель также может быть превращен в диметиламино-заместитель путем взаимодействия с муравьиной кислотой и цианоборгидридом натрия. Аналогично, взаимодействие первичной или вторичной аминогруппы с другим подходящим альдегидом в восстановительных условиях приведет к образованию соответствующего замещенного амина. Все вышеупомянутые химические трансформации могут быть использованы также для превращения любого релевантного промежуточного соединения в другое промежуточное соединение до конечной реакции получения соединения формулы (I), что должно включать также их использование для превращения одного соединения формулы (III) в дополнительное соединение формулы (III) до любой последующей реакции. Различные промежуточные соединения,используемые в вышеуказанных способах,включая, но не ограничиваясь ими, некоторые соединения формул (II), (III), (IV), (V), (VI),(VII) и (VIII), как они определeны выше, представляют собой новые соединения и, таким образом, составляют дополнительный аспект настоящего изобретения. В частности, дополнительным аспектом настоящего изобретения являются промежуточ 39 ные соединения формул (IIIa) и (VIIIb), определенные выше, за исключением следующих соединений(1-бензил-1 Н-индазол-5-ил)-(7-(5-[1,3 диоксолан-2-ил]фуран-2-ил)хиназолин-4-ил) амин; 5-(4-(1-бензил-1 Н-индазол-5-иламино)хиназолин-7-ил)фуран-2-карбальдегид. В частности, еще одним дополнительным аспектом настоящего изобретения являются промежуточные соединения формулы (VIIIc),как они определены выше, с условием, что исключено следующее соединение: (4-бензилоксифенил)-(6-(5-2-метансульфонилэтиламино)метил)фуран-2-ил)пиридо[3,4-d]пиримидин 4-ил)амин. В частности, другим дополнительным аспектом настоящего изобретения являются промежуточные соединения формул (X), (XI), (XII),(XIII), (XIV), (XV) и (XVI), как они определены выше. Соединения формулы (I) и их соли имеют противораковую активность, как это показано ниже по их способности ингибировать протеинтирозинкиназы c-erbB-2, c-erbB-4 и/или EGF-R и по их влиянию на выбранные клеточные линии, чей рост зависит от активности тирозинкиназ c-erbB-2 или EGF-r. Ниже также показано,что некоторые соединения формулы (I) ингибируют протеин-тирозинкиназу Ick и/или zap70, и,как ожидалось, обладают активностью при болезненных состояниях, при которых Т-клетки гиперактивны. Согласно настоящему изобретению, таким образом, предложены соединения формулы (I) и их фармацевтически приемлемые соли или сольваты для использования в медицинской терапии, и в частности при лечении расстройств, опосредованных аберрантной активностью протеин-тирозинкиназ, таких как злокачественности и другие расстройства у людей,упомянутые выше. Соединения по настоящему изобретению особенно полезны для лечения 40 расстройств, вызванных аберрантной активностью c-erbB-2, и/или EGF-r, и/или Ick, таких как рак молочной железы, яичника, желудка, поджелудочной железы, немелкоклеточный рак легкого, рак мочевого пузыря, рак в области головы и шеи, псориаз и ревматоидный артрит. Согласно следующему аспекту настоящего изобретения предложен способ лечения субъекта человека или животного, страдающего расстройством, опосредованным аберрантной активностью протеин-тирозинкиназ, включая чувствительные злокачественности, при котором указанному субъекту вводят эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли или сольвата. Согласно следующему аспекту настоящего изобретения предложено применение соединения формулы (I) или его фармацевтически приемлемой соли или сольвата в терапии. Согласно следующему аспекту настоящего изобретения предложено применение соединения формулы (I) или его фармацевтически приемлемой соли или сольвата в приготовлении лекарства для лечения рака и злокачественных опухолей. Согласно следующему аспекту настоящего изобретения предложено применение соединения формулы (I) или его фармацевтически приемлемой соли или сольвата в приготовлении лекарства для лечения псориаза. Согласно следующему аспекту настоящего изобретения предложено применение соединения формулы (I) или его фармацевтически приемлемой соли или сольвата в приготовлении лекарства для лечения ревматоидного артрита. Несмотря на то, что возможно введение соединений или солей или сольватов по настоящему изобретению в виде новых химических веществ, предпочтительно представлять их в форме фармацевтического препарата. Согласно следующему аспекту настоящего изобретения предложен фармацевтический препарат, содержащий, по меньшей мере, одно соединение формулы (I) или его фармацевтически приемлемую соль или сольват вместе с одним или более чем одним фармацевтически приемлемым носителем, разбавителем или эксципиентом. Фармацевтические препараты могут быть представлены в стандартных лекарственных формах, содержащих заданное количество активного ингредиента на единицу дозы. Такая единица может содержать например от 0,5 мг до 1 г, предпочтительно от 70 мг до 700 мг, более предпочтительно от 5 мг до 100 мг соединения формулы (I) в зависимости от состояния, которое лечат, пути введения и возраста, веса и состояния пациента. Фармацевтические препараты могут быть адаптированы для введения любым подходящим путем, например пероральным (включая буккальный или подъязычный), ректальным, на 41 зальным, местным (включая буккальный, подъязычный или трансдермальный), вагинальным или парентеральным (включая подкожный,внутримышечный, внутривенный, внутрикожный) путем. Такие препараты могут быть приготовлены любым способом, известным в фармацевтической области, например путем объединения активного ингредиента с носителем(ями) или эксципиентом(ами). Фармацевтические препараты, адаптированные для перорального введения, могут быть представлены в виде дискретных стандартных единиц, таких как капсулы или таблетки; порошки или гранулы; растворы или суспензии в водных или неводных средах; съедобные пены или взбитые массы; или жидкие эмульсии масло-в-воде или жидкие эмульсии вода-в-масле. Фармацевтические препараты, адаптированные для трансдермального введения, могут быть представлены в виде отдельных пластырей, рассчитанных на то, чтобы оставаться в тесном контакте с эпидермисом реципиента в течение длительного времени. Например, активный ингредиент может доставляться с пластыря посредством ионтофореза, как в общих чертах описано в Pharmaceutical Research, 3(6),318 (1986). Фармацевтические препараты, адаптированные для местного введения, могут быть приготовлены в виде мазей, кремов, суспензий,лосьонов, порошков, растворов, паст, гелей,спреев, аэрозолей или масел. Для лечения глаза или других наружных тканей, например рта и кожи, предпочтительно применяют препараты в виде мази или крема для местного применения. В том случае, когда препарат представляет собой мазь, активный ингредиент можно использовать с либо парафиновой, либо смешивающейся с водой основой. Альтернативно, активный ингредиент может быть введен в состав крема на основе эмульсии масло-в-воде или вода-в-масле. Фармацевтические препараты, адаптированные для местного введения в глаз, включают в себя глазные капли, где активный ингредиент растворен или суспендирован в подходящем носителе, в частности в водном растворителе. Фармацевтические препараты, адаптированные для местного введения в рот, включают в себя лепешки, пастилки и полоскания для рта. Фармацевтические препараты, адаптированные для ректального введения, могут быть представлены в форме суппозиториев или клизм. Фармацевтические препараты, адаптированные для назального введения, где носитель является твердым веществом, включают в себя крупнозернистый порошок с размером частиц например в пределах от 20 до 500 микрон, который вводят способом, при котором его вдыхают через нос, т.е. быстрой ингаляцией через носовой проход, из контейнера с порошком, который 42 подносят близко к носу. Подходящие препараты, где носителем является жидкость, для введения в виде спрея для носа или капель для носа, включают в себя водные или масляные растворы активного ингредиента. Фармацевтические препараты, адаптированные для введения ингаляцией, включают в себя тонкодисперсные пыли или туманы, которые могут быть созданы с помощью дозирующих под давлением аэрозолей, распылителей или инсуффляторов различных типов. Фармацевтические препараты, адаптированные для вагинального введения, могут быть представлены в виде препаратов пессариев,тампонов, кремов, гелей, паст, пен или спреев. Фармацевтические препараты, адаптированные для парентерального введения, включают в себя водные и неводные стерильные растворы для инъекций, которые могу содержать антиоксиданты, буферы, бактериостаты и растворенные вещества, которые делают препарат изотоническим с кровью намеченного реципиента; и водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты и загустители. Препараты могут быть представлены в однодозовых и многодозовых контейнерах, например запаянных ампулах и виалах, и могут храниться в высушенном замораживанием (лиофилизированном) состоянии,что требует только добавления стерильного жидкого носителя, например воды для инъекций, непосредственно перед использованием. Импровизированные растворы и суспензии для инъекций могут быть приготовлены из стерильных порошков, гранул и таблеток. Предпочтительны стандартные лекарственные препараты, которые содержат суточную дозу или под-дозу, как здесь было изложено ранее, или соответствующую ее фракцию активного ингредиента. Должно быть понятно, что в добавление к ингредиентам, в частности упомянутым выше,препараты могут включать в себя другие традиционные агенты, соответствующие типу рассматриваемого препарата, например препараты,подходящие для перорального введения, могут включать в себя корригенты. Животным, требующим лечения соединением, солью или сольватом по настоящему изобретению, обычно является млекопитающее,такое как человеческое существо. Терапевтически эффективное количество соединения, соли или сольвата по настоящему исследованию будет зависеть от многих факторов, включая, например, возраст и вес животного, точно установленное состояние, требующее лечения, и его тяжесть, природу препарата и путь введения, и окончательно будет на усмотрении лечащего врача или ветеринара. Однако эффективное количество соединения по настоящему изобретению для лечения новообразований, например рака кишечника или молоч 43 ной железы, обычно будет в пределах от 0,1 до 100 мг/кг массы тела реципиента (млекопитающего) в сутки и, чаще, в пределах от 1 до 10 мг/кг массы тела в сутки. Так, для взрослого млекопитающего весом 70 кг фактическое количество в сутки обычно будет составлять от 70 до 700 мг, и это количество можно давать один раз в сутки или, чаще, несколько (два, три, четыре, пять или шесть) раз в сутки так, чтобы общая суточная доза была одной и той же. Эффективное количество соли или сольвата по настоящему изобретению может быть определено как пропорция эффективного количества соединения per se. Предусматривается, что подобные дозировки будут подходить для лечения других состояний, упомянутых выше. Соединения по настоящему изобретению и их соли и сольваты можно использовать одни или в комбинации с другими терапевтическими средствами для лечения указанных выше состояний. В частности, при противораковой терапии предусмотрена комбинация с другими хемотерапевтическими, гормональными средствами или антителами. Комбинированная терапия согласно настоящему изобретению, таким образом, включает в себя введение, по меньшей мере, одного соединения формулы (I) или его фармацевтически приемлемой соли или сольвата и, по меньшей мере, одного другого фармацевтически активного агента. Соединение(я) формулы (I) и другой(ие) фармацевтически активный(ые) агент(ы) можно вводить вместе или по отдельности, и введение по отдельности можно производить одновременно или последовательно в любом порядке. Для достижения желаемого комбинированного терапевтического эффекта следует выбрать определенное количество соединения(ий) формулы (I) и другого(их) фармацевтически активного(ых) агента(ов) и режим введения. Некоторые воплощения настоящего изобретения будут теперь проиллюстрированы только в качестве примера. Физические данные,приведенные для соединений из примеров, согласуются с заданной структурой этих соединений. 1 Н ЯМР-спектры были получены при 500 МГц на спектрофотометре Bruker AMX500, на спектрофотометре Bruker при 300 МГц, на спектрофотометре Bruker AC250 или Bruker AM250 при 250 МГц и на спектрофотометре VarianJ даны в Гц. Масс-спектры (МС) были получены на одном из следующих приборов: массспектрометр VG Micromass Platform (электрораспылительная ионизация позитивная или негативная), масс-спектрометр НР 5989 А Engine(термораспылительная ионизация позитивная) или масс-спектрометр Finnigan-МАТ LCQ (ионная ловушка). Аналитическая тонкослойная хроматография (ТСХ) была использована для проверки чистоты некоторых промежуточных 44 соединений, которые не могли быть выделены или которые были слишком нестабильны для полной характеристики, и для того, чтобы следить за протеканием реакции. Если особо не оговорено, то ее проводили с использованием силикагеля (Merck Silica Gel 60 F254). Если особо не оговорено, то в колоночной хроматографии для очистки некоторых соединений использовали Merck Silica Gel 60 (Арт. 1.09385, 230400 меш) и указанную систему растворителей под давлением. Бензин означает петролейный эфир, либо фракция, кипящая при 40-60 С, либо фракция,кипящая при 60-80 С. Эфир означает диэтиловый эфир. ДМСО означает диметилсульфоксид. ТГФ обозначает тетрагидрофуран. ЖХВД обозначает жидкостная хроматография высокого давления.NMM обозначает N-метилморфолин. Используемые препаративные методики описаны в WO 96/09294, WO 97/03069, WO 97/13771, WO 95/19774, WO 96/40142 и WO 97/30034. Однако описанные в этих публикациях промежуточные соединения иные, чем промежуточные соединения, конкретизированные ниже. Способы получения, описанные в уровне техники, или подробности экспериментов, приведенные ниже для соединений с конкретной основной кольцевой системой с (1) по (6), приведенной выше, могут быть адаптированы для других соединений с этими основными кольцевыми системами. Общие процедуры(А) Взаимодействие амина с бициклическим соединением,содержащим 4 хлорпиримидиновое или 4-хлорпиридиновое кольцо Возможно замещенное бициклическое соединение и конкретный амин смешивают в подходящем растворителе (обычно в ацетонитриле,если не указано иначе, хотя этанол, 2-пропанол или ДМСО также могут быть использованы) и нагревают до образования флегмы. По окончании реакции (судя по ТСХ) реакционной смеси дают возможность остыть. Полученную суспензию разбавляют, например ацетоном, и твердое вещество собирают фильтрацией, промывая,например избытком ацетона, и высушивают при 60 С в вакууме с получением продукта в виде гидрохлоридной соли. Если требуется свободное основание (например для последующей реакции), его получают путем обработки основанием, например триэтиламином, а затем, если требуется, проводят очистку хроматографией.(Б) Взаимодействие продукта из процедуры (А) с гетероарилоловом. Перемешиваемую смесь продукта из процедуры (А) (содержащего подходящую уходящую группу, такую как хлоро, бромо, йодо или трифлат), гетероарилстаннана и подходящегоal., Inorg. Chem., (1991), 30(1), 125-130), вместе с другими соответствующими добавками (такими как диизопропилэтиламин или хлорид лития),нагревают до образования флегмы в сухом диоксане или другом подходящем растворителе(например ДМФ (диметилформамид под азотом до окончания реакции. Полученную смесь обычно очищают хроматографией на силикагеле.(В) Удаление 1,3-диоксолан-2-ильной защитной группы с высвобождением альдегида. Соединение, содержащее 1,3-диоксолан-2 ильную группу, суспендируют в подходящем растворителе, например в ТГФ, и обрабатывают соляной кислотой, либо водным раствором (например 2 н.), либо раствором в диоксане (например 4 М) и перемешивают при температуре окружающей среды до тех пор, пока не убедятся в том, что реакция закончилась (например анализом ТСХ или ЖХ/МС (жидкослойная хроматография/масс-спектрометрия. Обычно смесь разбавляют водой, и полученный осадок собирают фильтрацией, промывают водой и высушивают с получением альдегида.(Г) Взаимодействие альдегида с амином по реакции восстановительного аминирования. Альдегид (такой как продукт общей Процедуры В) и требуемый первичный или вторичный амин перемешивают вместе в подходящем растворителе (таком как дихлорметан), содержащем ледяную уксусную кислоту (молекулярные сита 4 А также могут присутствовать) в течение приблизительно 1 ч. Затем добавляют подходящий восстановитель, такой как (триацетокси)боргидрид натрия и перемешивание продолжают под азотом до тех пор, пока реакция не закончится (что подтверждают ЖХВД или ТСХ). Полученную смесь промывают водным основным раствором (например карбонатом натрия или калия) и экстрагируют подходящим растворителем, например дихлорметаном. Высушенную органическую фазу упаривают, и остаток очищают либо колоночной хроматографией, либо с помощью картриджа Bond Elut. Если требуется, выделенное вещество превращают в гидрохлоридную соль, например путем обработки раствором HCl в эфире.(Д) Последовательность реакций для получения соответствующих замешенных тиоамидов. Д-1. Взаимодействие аминосульфида с хлорацетонитрилом. К перемешиваемой смеси аминосульфида и подходящего основания, такого как бикарбонат натрия или карбонат натрия, в подходящем растворителе (обычно в ацетонитриле, хотя ДМФ или диоксан тоже могут быть использованы) по каплям добавляют хлорацетонитрил. По 002455 46 лученную смесь с обратным холодильником до окончания реакции. Твердое вещество отфильтровывают, и фильтрат концентрируют с получением соответствующего аминонитрила. Д-2. Трифторацетамидная защита аминонитрила. Раствор аминонитрила (такого как продукт общей Процедуры А) и аминного основания,такого как триэтиламин или NMM, в подходящем растворителе (например в дихлорметане),охлаждают до 0 С и по каплям добавляют трифторуксусный ангидрид. Полученную смесь перемешивают при комнатной температуре до окончания реакции. Добавляют воду, смесь экстрагируют подходящим растворителем (например дихлорметаном), органический слой высушивают над безводным сульфатом магния и концентрируют. Неочищенный продукт очищают колоночной хроматографией с получением соответствующего трифторацетамида. Д-3. Окисление цианосульфида. К перемешиваемому раствору сульфида(такого как продукт общей процедуры Д-1) в подходящем растворителе (обычно в смеси метанол-вода в соотношении 2:1, хотя можно использовать дихлорметан), охлажденному до 0 С, добавляют окислитель (обычно оксон, хотя можно использовать МСРВА). Полученную смесь перемешивают при комнатной температуре до окончания реакции. Реакционную смесь концентрируют для удаления органических растворителей, разбавляют водой и экстрагируют подходящим растворителем (например дихлорметаном). Органический слой высушивают с получением соответствующего цианосульфона. Д-4. Получение тиоамидов. К раствору цианосульфона (такого как продукт общей процедуры Д-3) и органического основания (например триэтиламина) в ТГФ добавляют газ сероводород. Полученную смесь перемешивают при комнатной температуре до окончания реакции. Смесь концентрируют и растирают с гексаном с получением тиоамида.(Е) Последовательность реакций для получения возможно замешенного тиазола. Е-1. Взаимодействие винилстаннана с продуктом из процедуры (А). Перемешиваемую смесь возможно замещенного бициклического 4-анилинпиримидина,трибутил(1-этоксивинил)станнана (от 1 до 5 молярных эквивалентов) и подходящего палладиевого катализатора, такого как бис (трифенилфосфин)палладия(II) хлорид или тетракис(трифенилфосфин)палладий(0), нагревают с обратным холодильником в подходящем растворителе (обычно в ацетонитриле, хотя можно использовать ДМФ или диоксан) до окончания реакции. Полученную смесь концентрируют и обычно очищают растиранием с диэтиловый эфиром с получением соответствующего бициклического пиримидинвинилового эфира. 47 Е-2. Взаимодействие продукта из процедуры Е-1 с бромирующим реагентом. Бициклический пиримидинвиниловый эфир (такой как продукт общей процедуры Е-1) и 1 эквивалент бромирующего реагента, такого как N-бромсукцинимид или бром, перемешивают при 0 С в подходящем растворителе (обычно в 10% водном ТГФ или дихлорметане) до окончания реакции. Полученную смесь сушат над безводным сульфатом магния и концентрируют или, в случае когда используют бром, твердое вещество отфильтровывают с получением соответствующего -бромкетона. Е-3. Взаимодействие продукта из процедуры Е-2 с продуктом из процедуры Д-4. Перемешиваемую смесь -бромкетона (такого как продукт общей процедуры Е-2) и тиоамида из процедуры Д-4 в молярном соотношении 1:1 нагревают до 70-100 С в подходящем растворителе (обычно в ДМФ, хотя ацетонитрил или ТГФ могут быть использованы) до окончания реакции. Полученную смесь промывают водным основным раствором (например карбоната натрия) и экстрагируют подходящим растворителем, например этилацетатом. Высушенный органический слой концентрируют, и остаток очищают колоночной хроматографией с получением соответствующего аминотиазола. Е-4. Удаление трифторацетамидной защитной группы с высвобождением аминотиазола. Смесь защищенного трифторацетамидной группой аминотиазола (такого как продукт из общей процедуры Е-3) в смеси 2 МNaOH/метанол (1:1) перемешивают при комнатной температуре до окончания реакции. Смесь концентрируют, вливают в воду и экстрагируют подходящим растворителем, например смесью 10% дихлорметана и МеОН. Высушенный органический слой концентрируют, затем растворяют в смеси этилацетат/МеОН (1:1) и обрабатывают смесью 4 М HCl/диоксан. Полученное твердое вещество отфильтровывают с получением гидрохлоридной соли соответствующего амина. Синтез промежуточных соединенийN-5-[N-трет-Бутоксикарбонил)амино]-2 хлорпиридин Перемешиваемый раствор 6-хлорникотиновой кислоты (47,3 г), дифенилфосфорилазида (89,6 г) и триэтиламина (46 мл) нагревали с обратным холодильником в трет-бутаноле (240 мл) под азотом в течение 2,5 ч. Раствор охлаждали и концентрировали в вакууме. Сиропообразный остаток вливали в 3 л быстро перемешиваемого 0,33 н. водного раствора карбоната натрия. Осадок перемешивали в течение одного часа и фильтровали. Твердое вещество промывали водой и сушили в вакууме при температуре 70 С с получением указанного в заголовке соединения (62 г) в виде бледно-коричневого 48 твердого вещества; т.пл. 144-146 С; Н [2H6]ДМСО 8.25 (1 Н, d), 7.95 (1 Н, bd), 7.25 (1 Н, d),6.65 (1 Н, bs), 1.51 (9 Н, s); m/z (M+1)+ 229. Это вещество потом можно перенести в соответствующее замещенное пиридопиримидиновое промежуточное соединение по методикам, описанным в WО 95/19774, J. Med. Chem.,1996, 39, стр. 1823-1835, и J. Chem. Soc., PekinTrans. 1996, стр. 2221-2226. Конкретные соединения, полученные по таким методикам включают в себя 6-хлорпиридо[3,4-d]пиримидин-4 он и 4,6-дихлорпиридо[3,4-d]пиpимидин. 2-Амино-4-фтор-5-йод-бензойная кислота К энергично перемешиваемому раствору дихлорметана (700 мл), метанола (320 мл) и 2 амино-4-фтор-бензойной кислоты добавляли твердый гидрокарбонат натрия (110 граммов,1,31 моль) с последующим добавлением порциями бензилтриметиламмония дихлориодата(82,5 г, 237 ммоль). Смесь оставляли перемешиваться в течение 48 ч. Смесь фильтровали для удаления нерастворимых веществ. Твердый остаток промывали 200 мл дихлорметана. Фильтрат концентрировали и вновь растворяли в смеси 1:1 этилацетата (1 л) и 0,2 н. раствора гидроксида натрия (1 л), добавленных в 2-х литровую делительную воронку, и экстрагируют. Органический слой промывали дополнительными 200 мл воды. Водные слои объединяли и подкисляли 2 н. соляной кислотой. Образовавшийся осадок собирали фильтрацией на всасывающем фильтре, промывали водой и сушили в вакууме при 60 С с получением 46,5 г (77%) указанного в заголовке соединения. 4-Фтор-5-йод-изатоновый ангидрид Безводный диоксан (0,5 л), 2-амино-4 фтор-5-йод-бензойную кислоту (97,4 г; 492 ммоль) добавляли в однолитровую одногорлую колбу, снабженную магнитной мешалкой и обратным холодильником. Раствор помещали в атмосферу безводного азота, перемешивали и нагревали с обратным холодильником в течение 16 ч. Реакционную смесь оставляли охлаждаться и вливали в 1 л гексанов. Твердое вещество собирали фильтрацией на всасывающем фильтре, промывали дополнительными 0,5 л гексанов и сушили под вакуумом при комнатной температуре с получением 45,5 г (90%) указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) :11.86 (s,1 Н), 8.24 (d, 1H), 6.84 (d, 1H). ЭРИ-МС m/z 308(М+1). (ЭРИ-МС - масс-спектрометрия,электрораспылительный метод ионизации). 4-Хлор-6-бромхиназолин и 4-хлор-6 йодхиназолин были получены как описано в 49 магнитной мешалкой. Смесь помещали в атмосферу безводного азота и нагревали при 110 С в течение 6 ч. Смеси давали остыть, после чего ее концентрировали до 1/3 от ее первоначального объема на роторном испарителе. Полученную смесь вливали в 3 л ледяной воды. Выпавшее в осадок твердое вещество собирали фильтрацией на всасывающем фильтре. Это твердое вещество промывали дополнительным одним литром дистиллированной воды. Полученное твердое вещество сушили под вакуумом при 70 С с получением 38,9 г (92%) указанного в заголовке соединения. 1 Н ЯМР (400 МГц, ДМСО-d6) : 12.43 (s,1 Н), 8.46 (d, 1 Н), 8.12 (s, 1H), 7.49 (d, 1H). ЭРИМС m/z 291 (М+1). 4-Хлор-6-йод-7-фторхиназолин гидрохлорид Тионилхлорид (0,6 л), 4-гидрокси-6-йод-7 фторхиназолин (36 г, 124 ммоль) и диметилформамид (6 мл) объединяли в однолитровой одногорлой колбе, снабженной магнитной мешалкой. Смесь помещали в атмосферу безводного азота и мягко нагревали с обратным холодильником в течение 24 ч. Смеси давали остыть,после чего концентрировали ее до густого желтоватого остатка. К этому остатку добавляли дихлорметан (0,1 л) и толуол (0,1 л). Эту смесь концентрировали до сухого состояния. Эту процедуру повторяли еще два раза. К полученному твердому веществу добавляли 0,5 л сухого дихлорметана, и эту смесь перемешивали в течение одного часа. Смесь фильтровали, и оставшееся твердое вещество промывали минимальным количеством дихлорметана. Дихлорметановые фильтраты объединяли, концентрировали до твердого вещества и сушили в вакууме при комнатной температуре с получением 28,6 г(67%) указанного в заголовке соединения. 1H ЯМР (400 МГц, CDCl3-d1) : 9.03 (s, 1H), 8.76 (d,1H), 7.69 (d, 1H). ЭРИ-МС m/z 291(M+1). 2-Бром-4-(1,3-диоксолан-2-ил)тиазол 2-Бромтиазол-4-карбальдегид (6,56 г, 34,17 ммоль) [А.Т. Ung, S.G. Pyne/Tetrahedron: Asymmetry 9 1988 1395-1407] и этиленгликоль (5,72 мл, 102,5 ммоль) нагревали с обратным холодильником в толуоле (50 мл) с установленной ловушкой Дина-Старка в течение 18 ч. Продукт концентрировали и очищали колоночной хроматографией (смесь 15% этилацетата/гексан) с получением продукта в виде желтого твердого вещества (6,03 г); m/z 236, 238. 4-(1,3-Диоксолан-2-ил)-5-(трибутилстаннил) тиазол 2-Бром-4-(1,3-диоксолан-2-ил)тиазол (6,4 г, 27,14 ммоль) перемешивали при -78 С в сухом ТГФ (38 мл). По каплям добавляли 1,6 М нбутиллитий в гексане (18,6 мл, 29,78 ммоль) под азотом. После 30 мин при этой температуре хлорид трибутилолова (7,35 мл, 27,14 ммоль) добавляли по каплям. Реакционной смеси давали нагреться до 0 С и добавляли воду (20 мл). 50 Продукт экстрагировали в эфир (3 х 100 мл). Объединенные органические экстракты высушивали (MgSO4) и выпаривали. Остаток растирали с изогексаном (3 х 100 мл), и маточные жидкости сливали, объединяли и концентрировали с получением коричневого масла (11,88 г);(50 г), карбоната калия (46,6 г, 1,1 экв.) и бензилбромида (57,6 г, 1,1 экв.) в N,Nдиметилформамиде (500 мл) нагревали до 75 С в течение 4 ч. Затем реакционную смесь охлаждали и постепенно добавляли воду (500 мл) для осаждения продукта, который затем отфильтровывали, промывали водой (50 мл) и высушивали на воздухе при температуре окружающей среды. Масса бледно-желтого твердого вещества, полученного таким образом, составила 72,3 г(93%), т.пл. 95-97 С; ЖХВД (Partisil 5, дихлорметан, 4 мл/мин, 250 нм) дала соотношение изомеров (1-N-бензил:2-N-бензил) 63:37 (RT-1N 3,4 мин, RT-2N 6,6 мин (RT - время удерживания. К фильтрованному раствору региоизомеров (100 г) в ацетоне (470 мл) при комнатной температуре постепенно при перемешивании добавляли воду (156 мл), и смесь перемешивали в течение одного часа. Полученное желтое твердое кристаллическое вещество отфильтровывали и высушивали на воздухе при температуре окружающей среды с получением 36,4 г материала; т.пл. 124-126 С; ЖХВД показала соотношение изомеров (1-N-бензил-2-N-бензил) 96:4; Н (CDCl3) 5.58 (2 Н, s, CH2), 7.12-7.15 (2 Н)7.22-7.29 (3 Н)-(фенил), 7.33 (1 Н, dt, J=1 Гц 9 Гц, Н-7), 8.15 (1 Н, dd, J=2 Гц 9 Гц, Н-6),8.19 (1 Н, d,J=1 Гц, Н-3), 8.67 (1 Н, dd, J=1 Гц 2 Гц, Н-4). Также примите к сведению способ, описанный в FR 5600, 8 января 1968. 5-Амино-1-N-бензил-1 Н-индазол 1-Бензил-5-нитроиндазол (400 г) суспендировали в этаноле (5 л) и гидрировали в присутствии катализатора 5% платина на углероде(20 г) при давлении 1 бар (1 кПа) и температуре 50-60 С. Когда поглощение водорода заканчивaлось, содержимое реактора нагревали до 70 С, выгружали и фильтровали, пока оно оставалось горячим, и фильтрат концентрировали до 4 л, что вызывало кристаллизацию. Затем постепенно при перемешивании добавляли воду (4 л), и смесь перемешивали при 5 С в течение ночи. Полученные кристаллы отфильтровывали и высушивали на воздухе при температуре окружающей среды с получением 305 г (86%) вещества, т.пл. 150-152 С; ЖХВД (Supelcosil 51 мин, RT-2N 5,29 мин); Н (CDCl3) 3.3-3.8 (2 Н,широкий s, NH2), 5.47 (2 Н, s, СН 2), 6.74 (1 Н, dd,J=2 Гц 9 Гц, Н-6), 6.87 (1 Н, dd, J=1 Гц 2 Гц,Н-4), 7.06-7.11 (3 Н)7.17-7.25 (3 Н)-(фенилН-7), 7.77 (1 Н, d, J=1 Гц, H-3). Также примите к сведению способ, описанный в FR 5600, 8 января 1968. 1-Бензил-3-метил-5-нитро-1 Н-индазол 2-Фтор-5-нитроацетофенон (H.Sato et al,Bioorganic and Medician Chemisry Letters, 5(3),233-236, 1995) (0,24 г) обрабатывали триэтиламином (0,73 мл) и дигидрохлоридом бензилгидразина (0,255 г) в этаноле (20 мл) при дефлегмации под N2 в течение 8 дней. Смесь охлаждали,и твердый 1-бензил-3-метил-5-нитроиндазол(0,16 г) собирали фильтрацией; m/z (М+1)+ 268. 1-Бензил-3-метил-1 Н-индазол-5-иламин 1-Бензил-3-метил-5-нитроиндазол (0,15 г) в ТГФ (15 мл) обрабатывали платиной на углероде (0,05 г, 5%) в атмосфере водорода при комнатной температуре. Когда поглощение водорода заканчивалось, смесь фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения;m/z (M+1)+ 268. Другие амино-индазольные промежуточные соединения Соответствующий нитро-замещенный 1 Ниндазол обрабатывали основанием, таким как карбонат калия или гидроксид натрия в подходящем растворителе, таком как ацетон или ацетонитрил. Добавляли соответствующий арилгалогенид или гетероарилгалогенид, и реакционную смесь нагревали или перемешивали при комнатной температуре в течение ночи. Последующие концентрирование в вакууме и хроматография на силикагеле давали желаемые 1 замещенные нитро-1 Н-индазолы. Гидрирование проводили по аналогии с получением 5-амино 1-бензил-1 Н-индола, как описано ранее. Амины, полученные таким способом,включают в себя 5-амино-1-бензил-1 Н-индазол; m/z (М+1)+ 224; 5-амино-1-(2-фторбензил)-1 Н-индазол; m/z 52 1-Бензолсульфонилиндол-5-ил-амин получали согласно известному способу (J. Org.Chem., 55, 1379-90, (1990. 4-Бензилоксианилин имеется в продаже в виде гидрохлоридной соли; его обрабатывают водным раствором карбоната натрия, и эту смесь экстрагируют этилацетатом; органический раствор высушивают (MgSO4) и концентрируют с получением свободного основания в виде коричневого твердого вещества, не используя других способов очистки. Другие замещенные анилины в общем случае получали, используя способы, аналогичные способам, изложенным в WO 96/09294,и/или следующим образом: Стадия 1. Получение предшественников нитросоединений. 4-Нитрофенол (или подходящий замещенный аналог, такой как 3-хлор-4-нитрофенол) обрабатывали основанием, таким как карбонат калия или гидроксид натрия, в подходящем растворителе, таком как ацетон или ацетонитрил. Добавляли соответствующий арилгалогенид или гетероарилгалогенид, и реакционную смесь нагревали или перемешивали при комнатной температуре в течение ночи. Очистка А. Большую часть ацетонитрила удаляли в вакууме, и остаток распределяли между водой и дихлорметаном. Водный слой экстрагировали избытком дихлорметана (х 2), и объединеные дихлорметановые слои концентрировали в вакууме. Очистка Б. Удаление нерастворимого вещества фильтрацией с последующим концентрированием реакционной смеси в вакууме и хроматографией на силикагеле. Стадия 2. Восстановление до соответствующего анилина. Предшественник нитросоединения восстанавливали каталитическим гидрированием при атмосферном давлении, используя 5% Pt/ углерод, в подходящем растворителе (например в этаноле, ТГФ или их смеси, чтобы добиться растворимости). После завершения восстановления смесь фильтровали через Harborlite,промывали избытком растворителя, и полученный раствор концентрировали в вакууме с получением желаемого анилина. В некоторых случаях анилины подкисляли НСl (например диоксановым раствором) с получением соответствующей гидрохлоридной соли. Анилины, полученные такими способами,включают в себя: 4-(2-фторбензилокси)анилин; m/z (M+1)+ 218; 4-(3-фторбензилокси)анилин; m/z (M+1)+ 218; 4-(4-фторбензилокси)анилин; m/z (М+1)+ 218; 3-хлор-4-(2-фторбензилокси)анилин; m/z(M+1)+ 252; 4-бензилокси-3-хлоранилин; m/z (M+1)+ 234 и, в соответствующих случаях, их соли гидрохлориды. 4-Бензолсульфониланилин получали опубликованным способом (Helv.Chim.Acta., 1983,66(4), р.1046). 4-Бензилокси-3-трифторметил-нитробензол 60% дисперсию NaH (1,4 г, 33,5 ммоль) в вазелиновом масле промывали гексанами, а затем суспендировали в ДМФ (диметилформамид) (10 мл). К этой суспензии NaH в ДМФ добавляли бензиловый спирт (2,8 мл, 26,3 ммоль),используя водяную баню для поддержания температуры ниже 30 С. Реакционную смесь перемешивали до завершения выделения водорода. К раствору 2-фтор-5-нитробензотрифторида (5,0 г, 23,9 ммоль) в ДМФ (20 мл) медленно добавляли при 0 С раствор бензилалкоксида. По окончании добавления ледяную баню убирали,и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь вливали в 200 мл ледяной воды, перемешивали до образования желтого твердого вещества, фильтровали, и твердое вещество промывали водой, а затем растирали с пентаном. Собрали 5,9 г желтого твердого вещества (выход: 83%). ЭРИ-МС m/z 298 (М+1)+. 4-Бензилокси-3-трифторметиланилин Суспензию никеля Ренея (около 200 мг Ni) перемешивали с метанолом. Супернатант сливали. Это повторяли дважды, а затем добавляли свежий метанол. В эту суспензию Ni в метаноле добавляли 2-O-бензил-6-нитротрифторид (375 мг, 1,26 ммоль). Медленно добавляли гидразингидрат (189 мг, 3,79 ммоль), используя водяную баню для поддержания температуры ниже 30 С. По окончании добавления реакционную смесь перемешивали при комнатной температуре в течение 10 мин, а затем при 45 С до прекращения выделения азота. Фильтровали через Celite, и фильтрат концентрировали при пониженном давлении. Было получено 336 г густого желтого сиропа (выход 100%). ЭРИ-МС 268Kelly и F.Lang, Tetrahedron Lett., 36, 9293,(1995 (15,0 г) растворяли в ТГФ (150 мл) в атмосфере азота, охлаждали до -85 С и обрабатывали трет-бутиллитием (1,7 М, в пентане, 43 мл). Смесь перемешивали при -85 С в течение 30 мин, а затем шприцем добавляли Nформилморфолин (8,4 г). После дополнительного перемешивания еще в течение 10 мин при-85 С смеси давали нагреться до комнатной температуры. Добавляли воду (200 мл), и эту смесь экстрагировали диэтиловым эфиром (4 х 54 100 мл). Объединенные эфирные экстракты промывали водой, высушивали (NaSO4) и концентрировали в вакууме. Хроматография на силикагеле с использованием в качестве элюента смеси 10% эфира/изогексан дала соединение,указанное в заголовке, в виде желтого масла; Н [2 Н 6] ДМСО 10.03 (1H, s), 8.29 (1H, s),1.55 (6H, q), 1.21-1.37 (6H, m), 1.09-1.20 (6H, m),0.85 (9H, t). Гидрохлорид (1-бензил-1 Н-индазол-5-ил)-(6 хлорпиридо[3,4-d)]пиримидин-4-ил)амина Получали согласно процедуре А из 1 бензил-1 Н-индазол-5-иламина и 4,6-дихлорпиридо[3,4-d]пиримидина; Н [2H6]-ДМСО 9.08 (1 Н, s), 8.92 (1 Н, s),8.82 (1 Н, s), 8.23 (1 Н, d), 8.19 (1 Н, s), 7.80 (1 Н,d), 7.70 (1 Н, dd), 7.38-7.22 (5 Н, m), 5.69 (2 Н, s),m/z (M+H)+ 387.Chem. Soc., Chem. Commun., (1988), р.560) (10 г) и 1,4-бис(дифенилфосфино)бутанпалладия(II) хлорид (1 г) нагревали с обратным холодильником в диоксане (150 мл) в течение 24 ч (Процедура Б). Растворитель удаляли в вакууме, и остаток хроматографировали на силикагеле. Последующее растирание дало соединение, указанное в заголовке, в виде желтого твердого вещества. Н [2 Н 6]-ДМСО 10.46 (1 Н, s), 9.17 (1 Н, s),8.74 (1 Н, s), 8.52 (1 Н, s), 8.23 (1 Н, s), 8.18 (1 Н, s),7.80-7.68 (5 Н, m), 7.41-7.22 (5 Н, m), 7.17 (1 Н, d),6.80 (1 Н, d), 6.06 (1 Н, s), 5.71 (2 Н, s), 4.20-3.96(1-Бензил-1 Н-индазол-5-ил)-(6-(5-[1,3-диоксоланил]фуран-2-ил)пиридо[3,4-d]пиримидин 4-ил)амин (3,03 г) и 2 н. HCl (50 мл) перемешивали в ТГФ (50 мл) в течение 16 ч. Полученный осадок отфильтровывали и промывали водой с получением гидрохлоридной соли продукта. Н [2 Н 6]-ДМСО 11.70 (1 Н, s), 9.74 (1 Н, s),9.30 (1 Н, s), 9.27 (1 Н, s), 8.85 (1 Н, s), 8.23 (1 Н, s),8.18 (1 Н, s), 7.68-7.87 (3 Н, m), 7.55 (1 Н, d), 7.227.38 (5 Н, m), 5.71 (2 Н, s). Последующая нейтрализация триэтиламином в смеси этанол/вода дала соединение, указанное в заголовке. Н [2 Н 6]-ДМСО 9.64 (1 Н, s), 9.19 (1 Н, s),9.09 (1 Н, s), 8.72 (1 Н, s), 8.12 (2 Н, m), 7.71 (2 Н,m), 7.63 (1 Н, dd), 7.43 (1 Н, d), 7.20 (5 Н, m), 5.62(4-Бензилоксифенил)-(6-хлорпиридо[3,4-d] пиримидин-4-ил)амин Получали согласно процедуре А из 4 бензилоксианилина и 4,6-дихлорпиридо[3,4-d] пиримидина; Н (CDCl3) 9.11 (1 Н, s), 8.78 (1 Н, s), 7.75(6,0 г, 14,0 ммоль) подвергали взаимодействию по процедуре, аналогичной процедуре Б, описанной выше, в течение 20 ч. Реакционной смеси давали остыть, добавляли 1 н. HCl (50 мл) и перемешивали при комнатной температуре 15 мин. Реакционную смесь фильтровали, и остаток промывали диоксаном (20 мл) и 2 н. HCl (20 мл). Объединенный фильтрат и промывки перемешивали при комнатной температуре еще час. Диоксан удаляли под вакуумом, реакционную смесь разбавляли водой и выпавшее в осадок твердое вещество собирали фильтрацией и промывали в воде, изогексане и ацетоне. Этот осадок превращали в свободное основание распределением в смеси триэтиламина, этилацетата и воды. Органическую фазу промывали водой,сушили (сульфат магния), и растворитель удаляли под вакуумом. Остаток растирали со смесью изогексан/этилацетат с получением продукта (2,41 г, 52%) в виде желтого твердого вещества; Н [2 Н 6]-ДМСО 10.60 (1 Н, b, NH), 9.83(150 мл) согласно процедуре Б с последующей очисткой хроматографией на силикагеле (элюировали смесью 50-100% ЕtOАс/изогексан), что позволило выделить диоксолановый продукт(1 Н, d), 7.09 (2 Н, d), 6.77 (1 Н, d), 6.03 (1 Н, s),5.15 (2 Н, s), 3.95-4.19 (4 Н, m). Используя процедуру В, это вещество можно затем превратить в 5-(4-(4-бензилоксифениламино)пиридо[3,4-d]пиримидин-6-ил)(120 С) в течение ночи (18 ч). После охлаждения полученный осадок собирали фильтрацией и промывали ацетонитрилом (2 х 50 мл). Полученное твердое вещество суспендировали в хлороформе (500 мл) и 2 н. растворе карбоната натрия (300 мл) и грели при 75 С в течение 45 мин. После охлаждения полученный осадок собирали фильтрацией, промывали водой (2 х 50 мл) и сушили с получением бледно-коричневого твердого вещества (9,95 г, 66%). Н [2 Н 6]-ДМСО 8.35 (3 Н, m), 8.20 (1 Н, s),8.01 (1 Н, d), 7.85 (1 Н, s), 7.35 (4 Н, m), 7.15 (4 Н,d), 6.75 (1 Н, d). Гидрохлорид (4-бензилоксифенил)-(6 бромхиназолин-4-ил)амина 4-Хлор-6-бромхиназолин (0,25 г, 1,0 ммоль) и 4-бензилоксианилин (0,25 г, 1,3 ммоль) смешивали в 2-пропаноле (6 мл) и нагревали с обратным холодильником в течение 10 мин (процедура А). Раствору давали остыть до комнатной температуры, и 2-пропанол удаляли под вакуумом. Полученное твердое вещество растирали с ацетоном с получением продукта в виде желтого твердого вещества (0,39 г,88%); Н [2H6]-ДМСО 11.60 (1 Н, b, NH), 9.21(500 мл) при нагревании с обратным холодильником под N2 в течение 18 ч. Последующее охлаждение и фильтрация дали указанное в заголовке соединение (13,13 г); Н [2H6]-ДМСО 11.45 (1 Н, b, NH), 9.22(2 Н, s, CH2), m/z (М+1)+ 454. Гидрохлорид (4-бензилоксифенил)-(6-йод-7 фторхиназолин-4-ил)амина Получали согласно процедуре А из гидрохлорида 4-хлор-6-йод-7-фторхиназолина (4,02 г,11,65 ммоль), безводного диоксана (70 мл), дихлорметана (20 мл) и гидрохлорида 4 бензилоксианилина (2,83 г, 12 ммоль). Смесь перемешивали и нагревали до 100 С (температура масляной бани) в течение 16 ч. Смесь ох 57 лаждали до комнатной температуры и фильтровали для удаления осажденных твердых веществ. Твердые вещества промывали холодным безводным диоксаном (100 мл), а затем холодным безводным диэтиловым эфиром. Желтоватое твердое вещество собирали и сушили под вакуумом при комнатной температуре с получением 4,68 г (79%) указанного в заголовке соединения. Н (400 МГц, ДМСО-d6): 11.2 (s, 1H), 9.3(d, 1 Н), 8.79 (s, 1H), 7.64 (d, 1H), 7.58 (d, 2H),7.44 (d, 2H), 7.38 (m, 2H), 7.31 (m, 1H), 7.09 (d,2H), 5.14 (s, 1H), ЭРИ-МС m/z 472 (M+1). Гидрохлорид (1-бензил-1 Н-индазол-5-ил)-(6 йод-7-фторхиназолин-4-ил)амина Получали согласно процедуре А из 1 бензил-1 Н-индазол-5-иламина и 4-хлор-6-йод-7 фторхиназолина. Н (400 МГц, ДМСО-d6): 11.55 (s, 1H), 9.41(d, 1H), 7.69 (d, 1H), 7.61 (m, 1H), 7.29 (m, 2H),7.23 (m, 3 Н), 5.67 (s, 2H), ЭРИ-МС m/z 496(M+1). Гидрохлорид (4-бензенсульфонил)фенил-(6 йод-7-фторхиназолин-4-ил)амина Получали согласно процедуре А из (4 бензолсульфонил)фениламина и 4-хлор-6-йод-7 фторхиназолина. 1 Н ЯМР (400 МГц, ДМСО-d6) : 10.89 (s,1H), 9.3 (d, 1H), 8.79 (s, 1H), 8.07 (d, 2H), 8.0 (d,2H), 7.94 (d, 2H), 7.67 (m, 2H), 7.61 (m, 2H),ЭРИ-МС m/z 504(М-1). 6-Йод-(4-(3-фторбензилокси)-3-хлорфенил)хиназолин-4-ил)-амин Получали согласно процедуре А из (4-(3 фторбензилокси)-3-хлорфенил)амина и 4-хлор 6-йод-хиназолина. 1H ЯМР (ДMCO-d6) 9.83 (s,1H), 8.92 (s,1H),8.58 (s,1H), 8.09 (d, 1H), 8.00 (d, 1H), 7.61 (d,1H), 7.52 (d, 1H), 7.44 (m, 1H), 7.20-7.33 (m, 3 Н),7.15 (m, 1H), 5.21 (s, 2H), MC m/z 506(M+1). 6-Йод-(4-(3-фторбензилокси)-3-фторфенил)хиназолин-4-ил)-амин Получали согласно процедуре А из (4-(3 фторбензилокси)-3-фторфенил)амина и 4-хлор 6-йод-хиназолина. 1H ЯМР (ДМСО-d6) 9.83 (s,1H), 8.92 (s,1H),8.57 (s,1 Н), 8.08 (d, 1H), 7.85 (d, 1H), 7.53 (d,1H), 7.50 (d, 1H), 7.43 (m, 1H), 7.30-7.20 (m, 3 Н),7.15 (m, 1H), 5.20 (s, 2H), MC m/z 490 (M+1). 6-Йод-(4-(3-фторбензилокси)-3 метоксифенил)хиназолин-4-ил)амин Получали согласно процедуре А из (4-(3 фторбензилокси)-3-метоксифенил)амина и 4 хлор-6-йод-хиназолина. 1 Н ЯМР 400 МГц (ДMCO-d6) 11.29 (bs,1H), 9.14 (s,1H), 8.87(s,1 Н), 8.32 (d, 1H), 7.62 (d,1H), 7.42 (m, 1H), 7.34 (d, 1H), 7.29-7.22 (m, 3 Н),7.18-7.08 (m, 2H), 5.15 (s, 2H), 3.80 (s, 3H), MC 58 6-Йод-(4-бензилокси)-3-фторфенил)хиназолин 4-ил)амин Получали согласно процедуре А из (4 бензилокси)-3-фторфениламина и 4-хлор-6-йодхиназолина. 1(m, 1H), 5.18 (s, 2H), MC m/z 472 (M+1). 6-Йод-(4-(3-бромбензилокси)фенил)хиназолин 4-ил)амин Получали согласно процедуре А из (4-(3 бромбензилокси)фенил)амина и 4-хлор-6-йодхиназолина. 1 Н ЯМР (ДМСО-d6) 9.84 (s,1H), 8.98 (s,1H),8.57 (s, 1H), 8.13 (m, 2H), 7.71 (d, 2H), 7.56 (d,2H), 7.50 (m, 1H), 7.41 (m, 1H), 7.08 (d, 2H), 5.17(s, 2H). 6-Йод-(4-(3-фторбензилокси)фенил)хиназолин 4-ил)амин Получали согласно процедуре А из (4-(3 фторбензилокси)фенил)амина и 4-хлор-6-йодхиназолина. 1H ЯМР (ДМСО-d6) 9.77 (s,1H), 8.92(d, 1H), 7.42 (m, 1H), 7.30-7.25 (m, 2H), 7.14 (m,1H), 7.03 (d, 2H), 5.13 (s, 2H), MC m/z 472 (M+1). 6-Йод-(4-(3-трифторметилбензилокси) фенил) хиназолин-4-ил)амин Получали согласно процедуре А из (4-(3 трифторметилбензилокси)фенил)амина и 4 хлор-6-йодхиназолина. 1 Н ЯМР (ДMCO-d6) 9.2 (bs, 1H), 8.91 (s,1H), 8.37 (d, 1H), 7.89-7.72 (m, 8H), 7.19 (d, 2H),5.30 (s, 2H). 6-Йод-(4-бензилокси-3-трифторметилфенил)хиназолин-4-ил)амин Смесь 4-хлор-6-йод-хиназолина (366 мг,1,26 ммоль) и 4-O-бензил-3-трифторанилина(405 мг, 1,26 ммоль) в изопропаноле (12 мл) нагревали с обратным холодильником в течение 3,5 ч. Фильтровали, промывали изопропанолом и сушили. Это дало 535 мг желтого твердого вещества (выход 76%). ЭРИ-МС m/z 522(4-Бензилоксифенил)-(6-(5-(1,3-диоксолан-2-) фуран-2-ил)-7-фторхиназолин-4-ил)амин Синтезировали согласно поцедуре Б из раствора гидрохлорида (4-бензилоксифенил)-(6 йод-7-фтор-хиназолин-4-ил)амина (508 мг, 1 ммоль),5-(1,3-диоксолан-2-ил)-2-(трибутилстаннил)фурана (645 мг, 1,5 ммоль), диизопропилэтиламина (650 мг, 5 ммоль), и дихлорбис(трифенилфосфин)палладия (140 мг, 0,2 ммоль) в 6 мл ДМФ под азотом перемешивали при 100 С (температура масляной бани) в течение 4 ч. Охлажденную реакционную смесь экстрагировали водой (100 мл) и этилацетатом (100 мл). Органическую фазу промывали рассолом(100 мл). Водные слои объединяли и промывали дополнительным этилэцетатом (100 мл). Органические слои объединяли, сушили MgSO4,фильтровали и концентрировали до остатка. 59 Этот остаток хроматографировали на силикагеле с использованием смеси метанол-хлороформ. Фракции собирали, объединяли и концентрировали. Полученное твердое вещество суспендировали в дихлорметане (10 мл) и добавляли диэтиловый эфир для облегчения осаждения. Твердое вещество отфильтровывали и сушили под вакуумом при комнатной температуре с получением 287 мг (59%) желтоватого твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6) : 10.1(1-Бензил-1 Н-индазол-5-ил)-(6-(5-(1,3-диоксолан-2-ил)-фуран-2-ил)-7-фторхиназолин-4-ил) амин Получали согласно процедуре Б из гидрохлорида (1-бензил-1 Н-индазол-5-ил)-(6-иод-7 фторхиназолин-4-ил)амина и 5-(1,3-диоксолан 2-ил)-2-(трибутилстаннил)фурана.1H ЯМР (400 МГц, ДMCO-d6)10.27(4-Бензолсульфонил)фенил-(6-(5-(1,3 диоксолан-2-ил)фуран-2-ил)-7-фторхиназолин 4-ил)амин Получали согласно процедуре Б из гидрохлорида(4-Бензилоксифенил)-(6-(5-(1,3-диоксолан-2 ил)-фуран-2-ил)хиназолин-4-ил)амин Получали согласно процедуре Б из раствора(4-бензилоксифенил)-(6-бромхиназолин-4 ил)-амина (1,5 г, 3,7 ммоль) и 5-(1,3-диоксолан 2-ил)-2-(трибутилстаннил)фурана (1,9 г, 4,42 ммоль), растворенных в диоксане (30 мл), и нагревали с обратным холодильником под азотом в течение 6 ч. Растворитель удаляли из охлажденной реакционной смеси под вакуумом, и оставшееся масло растирали со смесью изогексан/этилацетат с получением бледно-желтого твердого вещества (1,07 г, 62%); Н[2 Н 6]-ДМСО 9.96 (1 Н, b, NH), 8.80 (1 Н,s, 5-Н), 8.51 (1 Н, s, 2-Н), 8.18 (1 Н, d, 7-Н), 7.80(4-Бензилокси-3-трифторметилфенил)-(6-(5(1,3-диоксолан-2-ил)фуран-2-ил)хиназолин-4 ил)амин Получали согласно процедуре Б, используя 6-йод-(4-бензилокси-3-трифторметилфенил) хиназолин-4-ил)амин (480 мг, 0,92 ммоль) и 5 трибутилолово-(1,3-диоксолан-2-ил)фуран (731 мг, 1,38 ммоль) в диоксане (10 мл). Полученный продукт был твердым веществом (0,47 г, выход 95,8%). ЭРИ-МС m/z 534 (М+Н)+. 5-(4-(4-Бензилокси-3 трифторметилфениламино)хиназолин-6-ил)фуран-2-карбальдегид Получали согласно процедуре Б, используя раствор (4-бензилокси-3-трифторметилфенил)(6-(5-(1,3-диоксолан-2-ил)фуран-2-ил)хиназолин-4-ил)амина (470 мг, 0,88 ммоль) в ТГФ (5 мл) с последующим добавлением 2 н. HCl (20 мл) при комнатной температуре. Полученную смесь перемешивали в течение 30 мин. Добавляли воду (15 мл), а затем фильтровали. Желтое твердое вещество промывали водой и небольшим количеством эфира и сушили в вакууме(4-Бензилоксифенил)-(6-(5-[1,3-диоксолан-2 ил]-фуран-2-ил)-7-метоксихиназолин-4-ил)амин Получали согласно процедуре Б из раствора (4-бензилоксифенил)-7-метокси-6-трифторметансульфонилхиназолин-4-ил)амина (0,30 г,0,59 ммоль) и 5-(1,3-диоксолан-2-ил)-2-(трибутилстаннил)фурана (0,37 г, 0,86 ммоль), хлорида лития (78 мг, 1,8 ммоль) и дихлор-бис(трифенилфосфин)палладия (90 мг, 0,13 ммоль) в 2 мл ДМФ под азотом, который перемешивали при 85-90 С в течение 50 мин. Охлажденную реакционную смесь распределяли между 30 мл воды и 40 мл этилацетата. Органический раствор промывали 30 мл рассола, сушили Na2SO4 и концентрировали в вакууме. Остаток хроматографировали на силикагеле с использованием смеси гексаны/этилацетат (от 1:1 до 0:1). Полученный раствор концентрировали до почти сухого состояния и, полученное твердое вещество суспендировали в эфире и фильтровали с получением 0232 г продукта в виде бледно-желтого твердого вещества. 1(4-Бeнзилoксифенил)-(6-(5-(1,3-диоксолан-2-ил) фуран-2-ил)-7-фтopхиназолин-4-ил)амин Получали согласно процедуре Б из раствора гидрохлорида (4-бензилоксифенил)-(6-иод-7 фторхиназолин-4-ил)амина (508 мг, 1 ммоль), 5(1,3-диоксолан-2-ил)-2-(трибутилстаннил)фурана (645 мг, 1,5 ммоль), диизопропилэтиламина (650 мг, 5 ммоль) и дихлорбис(трифенилфосфин)палладия (140 мг, 0,2 ммоль) в 6 мл
МПК / Метки
МПК: A61K 31/519, C07D 471/04, A61P 35/00
Метки: качестве, соединения, бициклические, ингибиторов, протеин-тирозинкиназ, гетероароматические
Код ссылки
<a href="https://eas.patents.su/30-2455-biciklicheskie-geteroaromaticheskie-soedineniya-v-kachestve-ingibitorov-protein-tirozinkinaz.html" rel="bookmark" title="База патентов Евразийского Союза">Бициклические гетероароматические соединения в качестве ингибиторов протеин-тирозинкиназ</a>
Предыдущий патент: Экскаватор
Следующий патент: Игровая система, соответствующие способы и устройства для ее осуществления
Случайный патент: Улучшенная композиция реконструированных сурфактантов, содержащая аналоги сурфактантного белка в (sp-b) и сурфактантного белка с (sp-c)












