Ингибиторы бета-секретазы
Номер патента: 20875
Опубликовано: 27.02.2015
Авторы: Сингх Суреш, Ву Чжунжэнь, Моралес-Рамос Энджел, Фукс Клаус, Диллард Лоуренс В., Лефтерис Катерина, Венкатраман Шанкар, Маккивер Брайан, Сюй Чжэньжун, Чжэн Яцзюнь, Юань Цзин, Ву Гуошэн, Хайне Никлас, Цзя Ланьци, Кэкэйшн Салвасьон, Клэрмон Дэвид А.
Формула / Реферат
1. Соединение, представленное следующей структурной формулой:
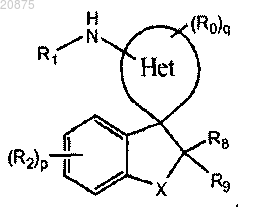
или его фармацевтически приемлемая соль,
где кольцо Het представляет собой 5-6-членный гетероцикл, содержащий фрагмент -N=C(NHR1) и дополнительно 1-2 гетероатома, выбранных из N, О, S, причем, если присутствует второй атом N, он может быть замещен радикалом R0 и причем любой атом в Het может быть замещен оксорадикалом;
R0 представляет собой (C1-C6)алкил; пиперидинил, необязательно замещенный (C1-C4)алкилом; (C3-C6)циклоалкил или (C1-C3)алкил, замещенный 1 или 2 группами, выбранными из галогена, галогено(C1-C4)алкила, (C1-C4)алкокси, гидрокси, -С(О)ОН, -С(О)О(C1-C4-алкила), -C(O)NH2, мезил(метил)амино, ди(C1-C4)алкиламино, тиазолила, 1,3,4-триазолила, необязательно замещенного (C1-C3)алкилом, пиридазинила, пиримидинила, пиридинила, необязательно замещенного галогеном или галоген(C1-C4)алкилом, оксазолила, необязательно замещенного (C1-C3)алкилом, оксадиазолила, необязательно замещенного (C1-C3)алкилом, пирролидинила, необязательно замещенного (C1-C3)алкилом, пиперидинила, необязательно замещенного либо карбоновой кислотой, либо сульфоновой кислотой, оксетанила, тетрагидрофуранила, тетрагидропиранила, бензопиразинила, (C3-C6)циклоалкила или фенила, который может быть замещен галогеном, (C1-C4)алкокси, мезилом, циано, триазолилом, тетрагидропиранилом, оксетанилом, диметиламино, 1-метилпиперазин-4-илом, метилацетатом или мезиламино;
q имеет значение 0 или 1;
R1 представляет собой Н или ацетил;
R2 представляет собой Н или фенил, необязательно замещенный 1 или 2 заместителями, выбранными из галогена, циано, (C1-C4)алкила, (C1-C4)алкокси, галоген(C1-C4)алкокси, галоген(C1-C4)алкила или мезила; пиридинил, необязательно замещенный заместителем, выбранным из галогена, циано, галоген(C1-C4)алкила, (C2-C4)алкинила, (C1-C4)алкила или (C1-C4)алкокси; фенокси или бензилокси, необязательно замещенный (C1-C4)алкокси, циано или 1 или 2 атомами галогена; тиенил или тиазолил, необязательно замещенный галогеном, циано, (C1-C4)алкилом, (C2-C4)алкинилом или (C3-C6)циклоалкилом; этинил или пропинил, необязательно замещенный радикалом, выбранным из 1-4 атомов галогена, тиенила, (C3-C6)циклоалкила, фенила, бензила, (C1-C4)алкила, галоген(C1-C4)алкила, (C1-C4)алкокси, (C1-C3)алкокси(C1-C2)алкила или (C3-C6)циклоалкенила, необязательно замещенного гидрокси; винил, необязательно замещенный 1-3 атомами галогена или галоген(C1-C4)алкилом; пиразинил, необязательно замещенный (C1-C4)алкокси; 2-оксо-1Н-пиридинил, необязательно замещенный (C1-C4)алкилом или (C3-C6)циклоалкилом; (C1-C6)алкил, необязательно замещенный 1-5 заместителями, выбранными из галогена, гидрокси, (C1-C4)алкокси, галоген(С1-С4)алкила, фенила, 1,3-диоксол-2-ила или (C3-C6)циклоалкила; (C1-C4)алкокси, необязательно замещенный 1-4 атомами галогена, (C3-C6)циклоалкилом, необязательно замещенный 1-2 атомами галогена, диметиламино, галоген(C1-C4)алкилом, (C1-C4)алкокси или тетрагидрофуранилом; (C3-C5)циклоалкокси; (C3-C6)циклоалкил; галоген; циано; индолил; пиридазинил; пиримидин, необязательно замещенный (C1-C4)алкилом; пирролидинил, необязательно замещенный 1-3 атомами галогена; пирролидинон; пирролидинилкарбонил; пирролидинилкарбониламино; метоксикарбонил; метилкарбамоил; диметилкарбамоил; карбокси; гидрокси; пропилсульфанил; фенилсульфанил или циклопентен, необязательно замещенный гидрокси;
р имеет значение 1 или 2 или р имеет значение 3, если один R2 представляет собой галоген;
Х=О, СН2, СН2СН2, СМе2 и
R8 и R9 вместе с углеродом, к которому они присоединены, образуют кольцо А, выбранное из циклогексила, циклопентанила, циклопропила, циклогексенила, циклопентенила, необязательно замещенного 1 или 2 группами, выбранными из галогена, (C1-C4)алкила, гидрокси, (C1-C4)алкокси, галоген(C1-C4)алкиламино, галоген(C1-C4)алкокси, 3-(4-гидроксифенил)-2-аминопропаноилокси, диметиламино, диаминокарбонила, диметилкарбамоила, (C1-C3)алкокси(C1-C3)алкокси, фенила и бензила; 1,2,3,4-тетрагидронафталин-2,2-диила, необязательно замещенного 1 или 2 атомами галогена; пиперидинила, необязательно замещенного ацетилом; азетидина, необязательно замещенного пиримидином; циклогексенила, конденсированного с 3-метилизоксазолом, 5-метилизоксазолом или 1,3-диметилпиразолом; циклопентанила, конденсированного с бензолом или пиридазином; оксепандиила, конденсированного с бензольным кольцом; бензоциклогептила; циклогептанила, конденсированного с пиридазином; 1Н-фенален-2,2-диила, необязательно замещенного 1 или 2 гидрокси; 1,1-диоксотиотетрагидропиранила; тетрагидропирана и тетрагидротиопирандиоксида; или
X представляет собой циклопент-3-ен-1,1-диил, 1-ацетилпиперидин-4,4-диил или тетрагидро-2Н-пиран и
R8=R9=H.
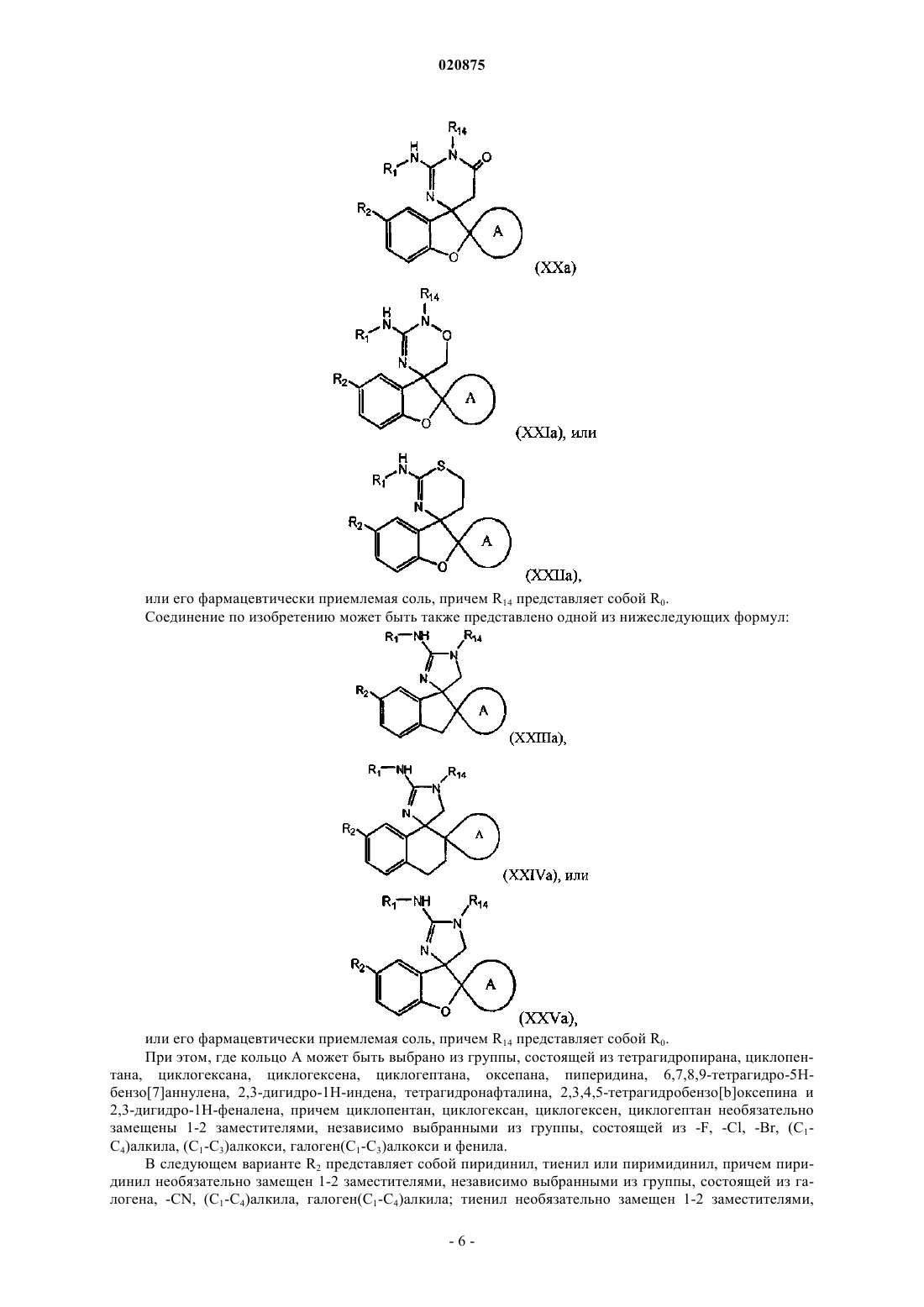
2. Соединение по п.1, где соединение представлено следующей структурной формулой:
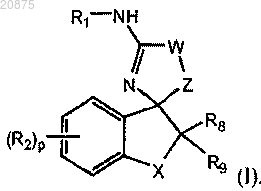
или его фармацевтически приемлемая соль,
где W представляет собой -N(R0)-, -S-, -О-;
Z представляет собой -С(=О), -C(=S), -C(=NR15)-, -О-, -C(=O)C(R16R17)-, -C(=S)C(R16R17)-,
-C(=NR15)C(R16R17)-, -N(R18)-, -(CR16R17)m- или -O-(CR16R17)-, при условии, когда W представляет собой -S- или -О-, Z не представляет собой -О-;
R15 представляет собой -Н или (C1-C6)алкил;
R16 и R17, каждый независимо, представляют собой -Н или (C1-C3)алкил;
R18 представляет собой -Н или (C1-C3)алкил.
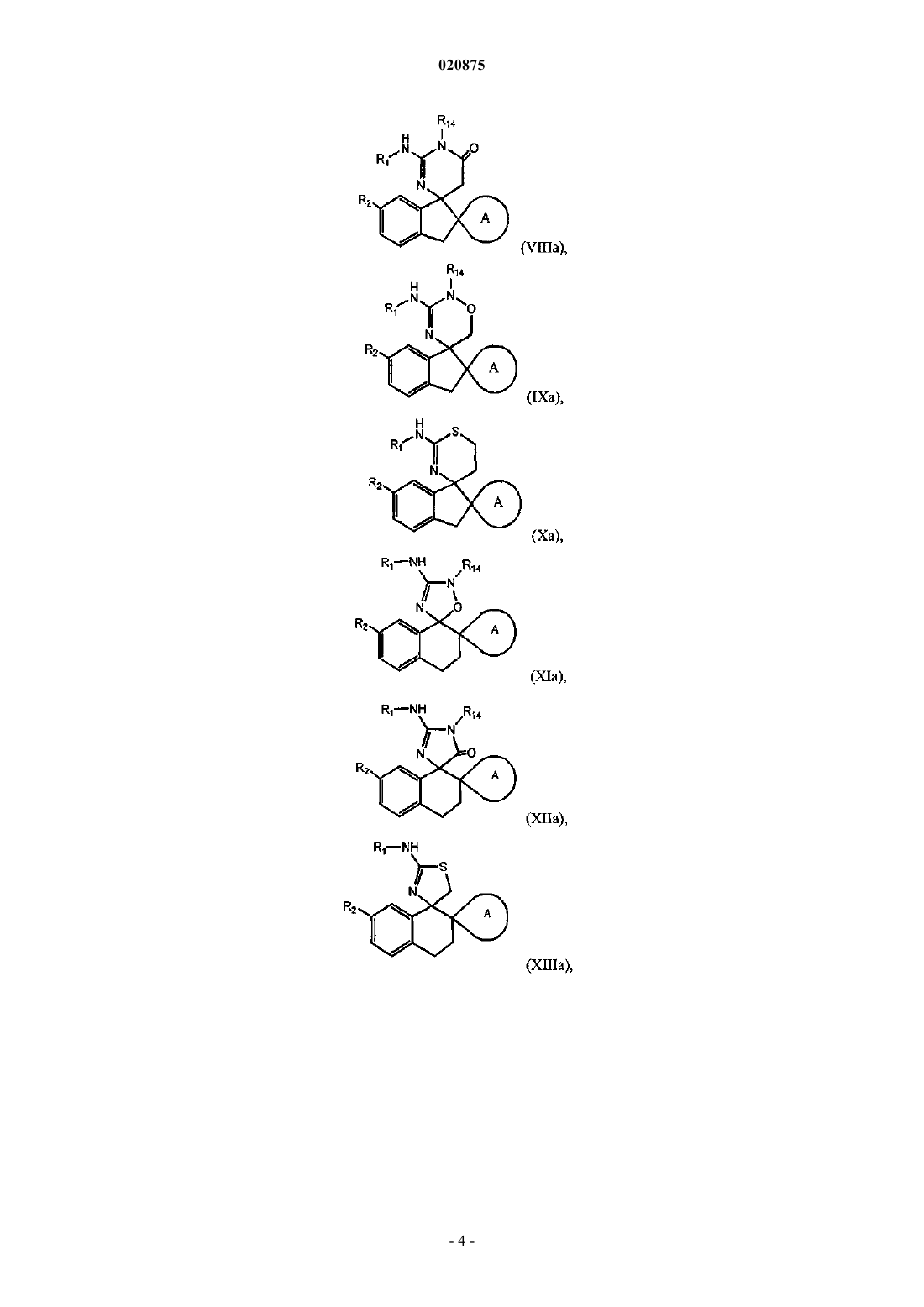
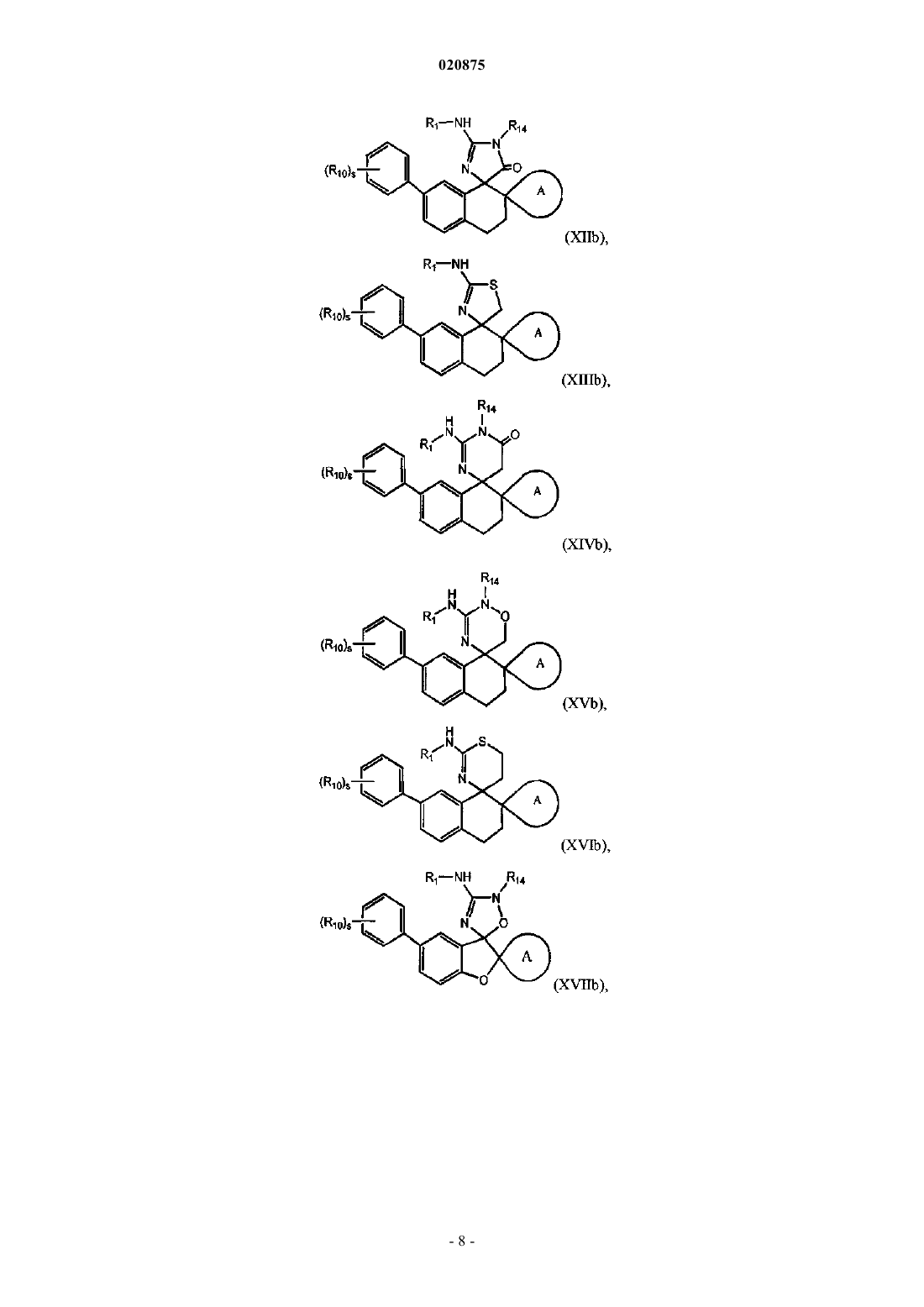
3. Соединение по п.1 или 2, где соединение представлено одной из следующих структурных формул:
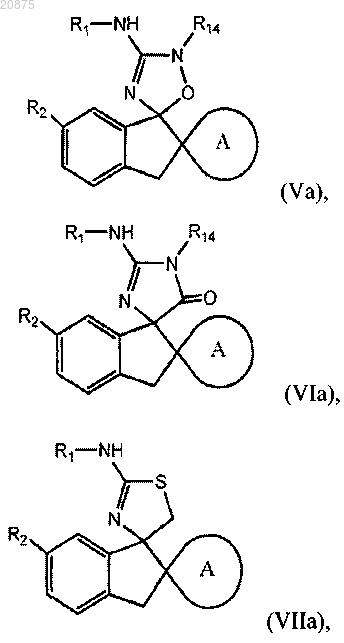
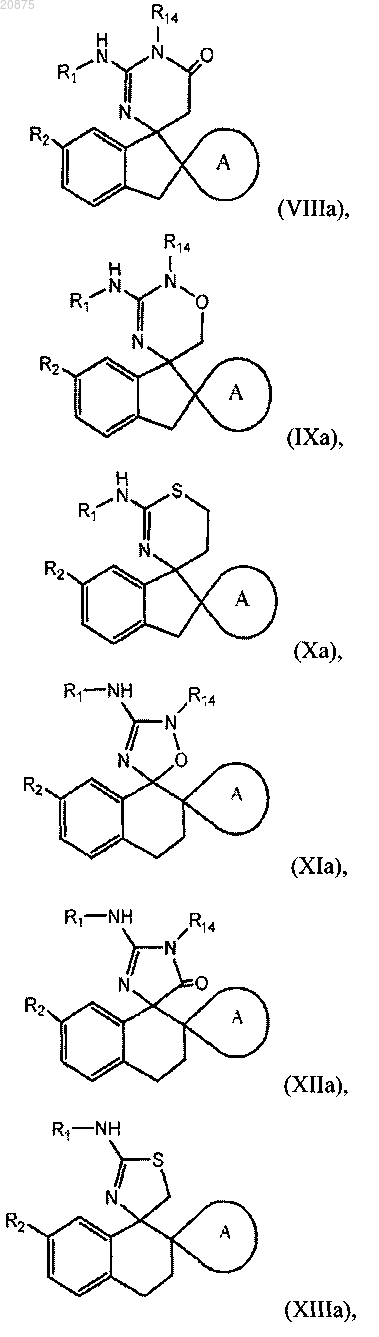
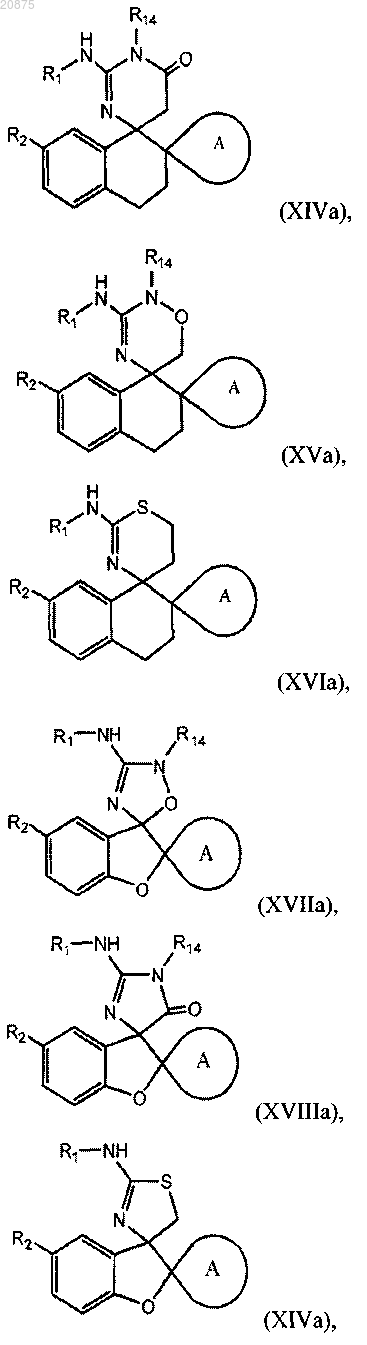
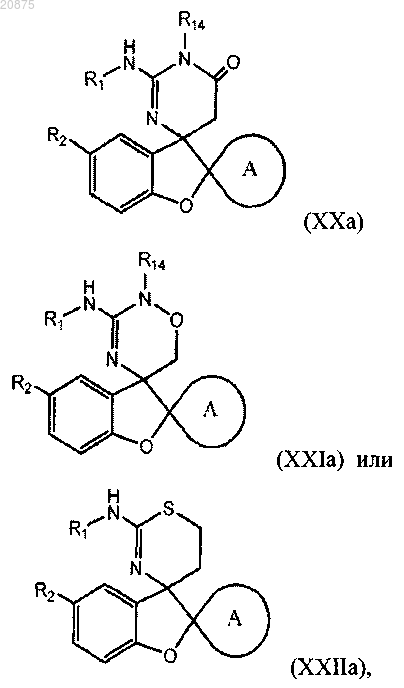
или его фармацевтически приемлемая соль,
причем R14 представляет собой R0.
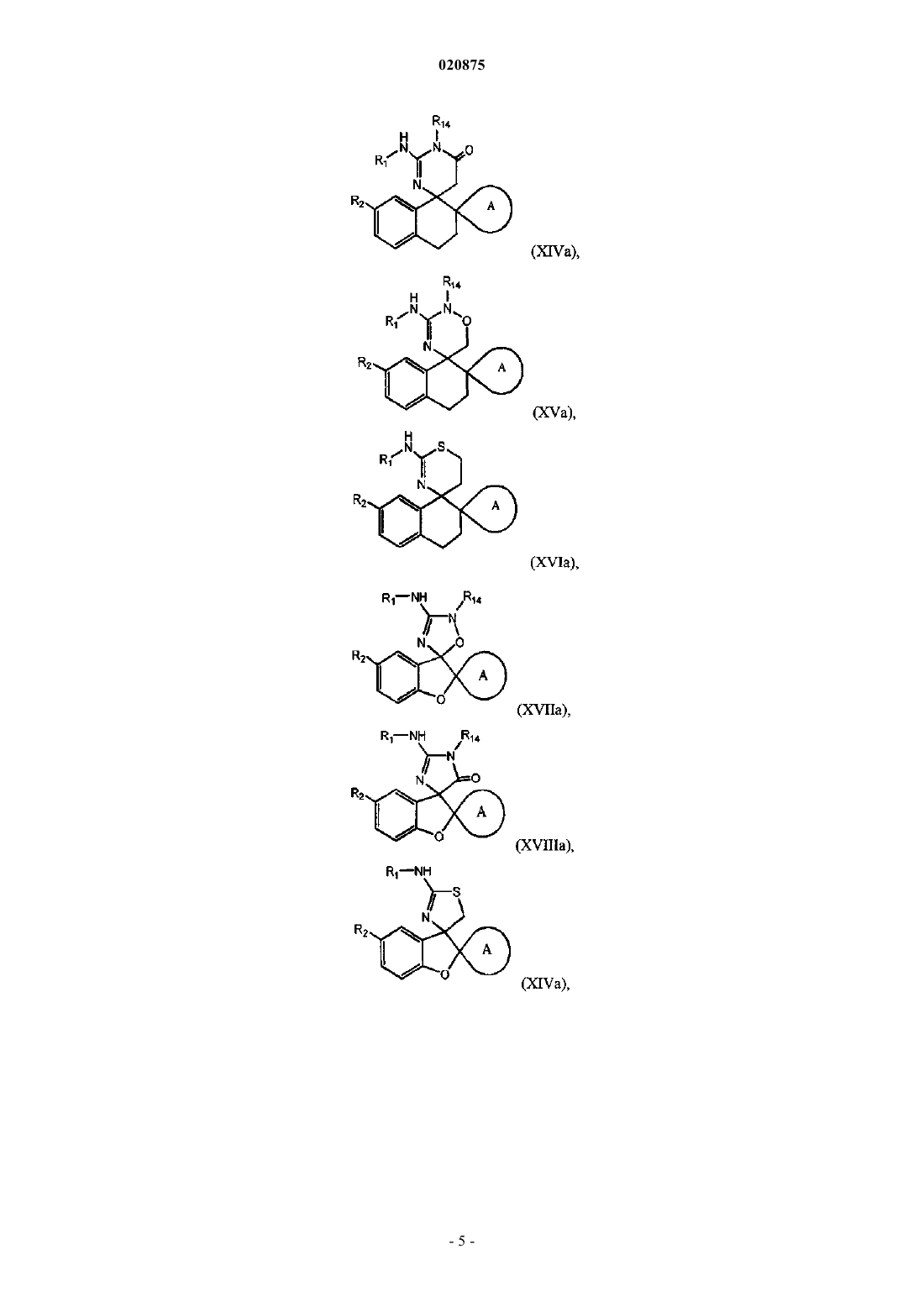
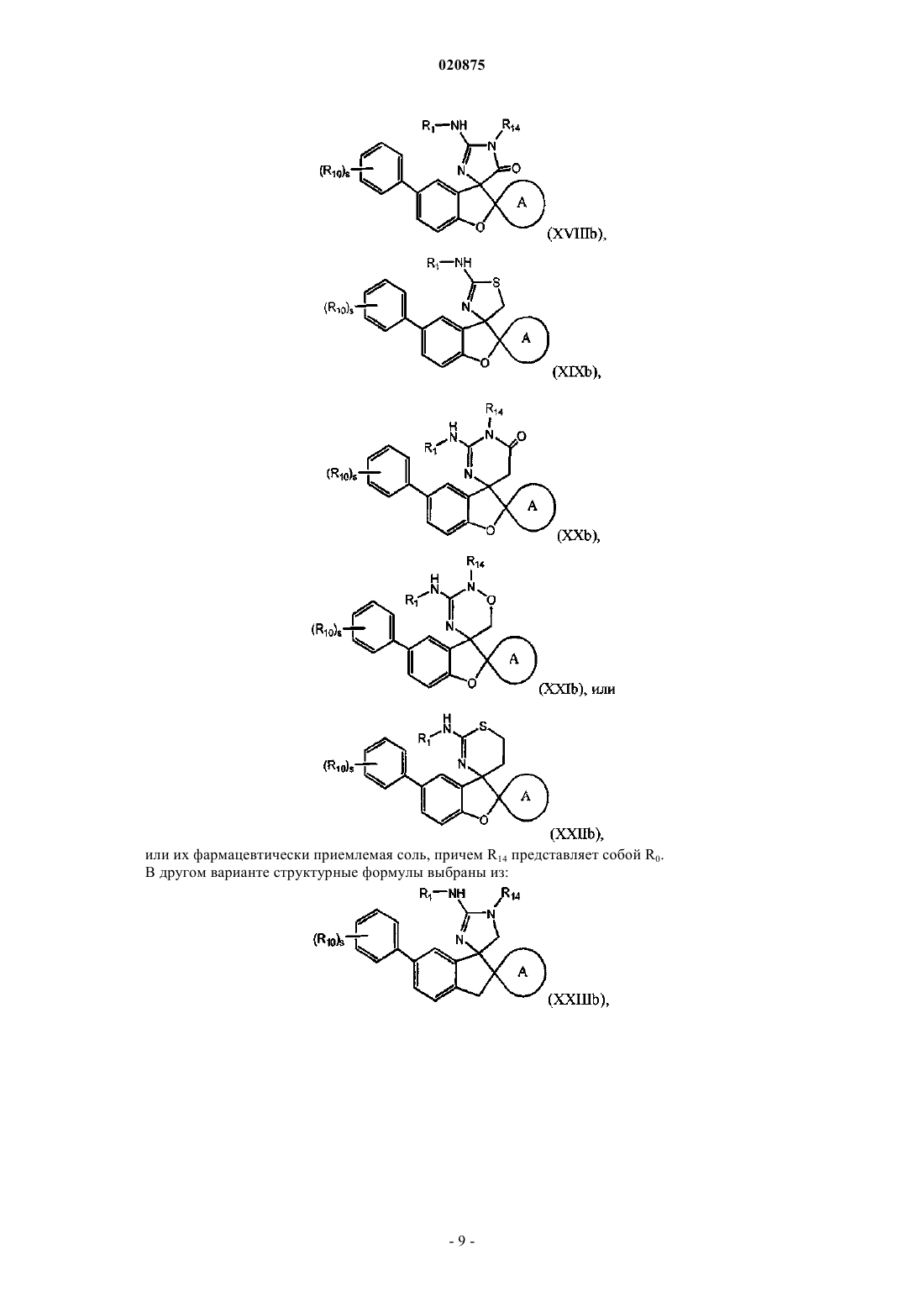
4. Соединение по п.1 или 2, где соединение представлено одной из следующих структурных формул:
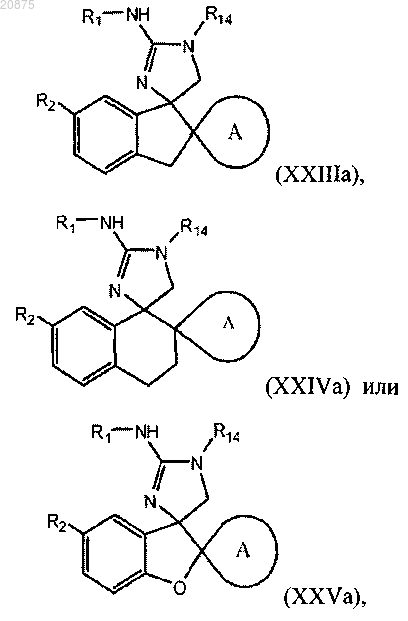
или его фармацевтически приемлемая соль,
причем R14 представляет собой R0.
5. Соединение по любому из пп.1-4, где кольцо А выбрано из группы, состоящей из тетрагидропирана, циклопентана, циклогексана, циклогексена, циклогептана, оксепана, пиперидина, 6,7,8,9-тетрагидро-5Н-бензо[7]аннулена, 2,3-дигидро-1Н-индена, тетрагидронафталина, 2,3,4,5-тетрагидробензо[b]оксепина и 2,3-дигидро-1Н-феналена, причем циклопентан, циклогексан, циклогексен, циклогептан необязательно замещены 1-2 заместителями, независимо выбранными из группы, состоящей из -F, -Cl, -Br, (C1-C4)алкила, (C1-C3)алкокси, галоген(С1-С3)алкокси и фенила.
6. Соединение по любому из пп.1-5, где R2 представляет собой пиридинил, тиенил или пиримидинил, причем пиридинил необязательно замещен 1-2 заместителями, независимо выбранными из группы, состоящей из галогена, -CN, (C1-C4)алкила, галоген(C1-C4)алкила; тиенил необязательно замещен 1-2 заместителями, независимо выбранными из группы, состоящей из галогена, -CN, (C1-C4)алкила, (C2-C4)алкенила и (C3-C6)циклоалкила; и пиримидинил необязательно замещен 1-2 (C1-C4)алкилами.
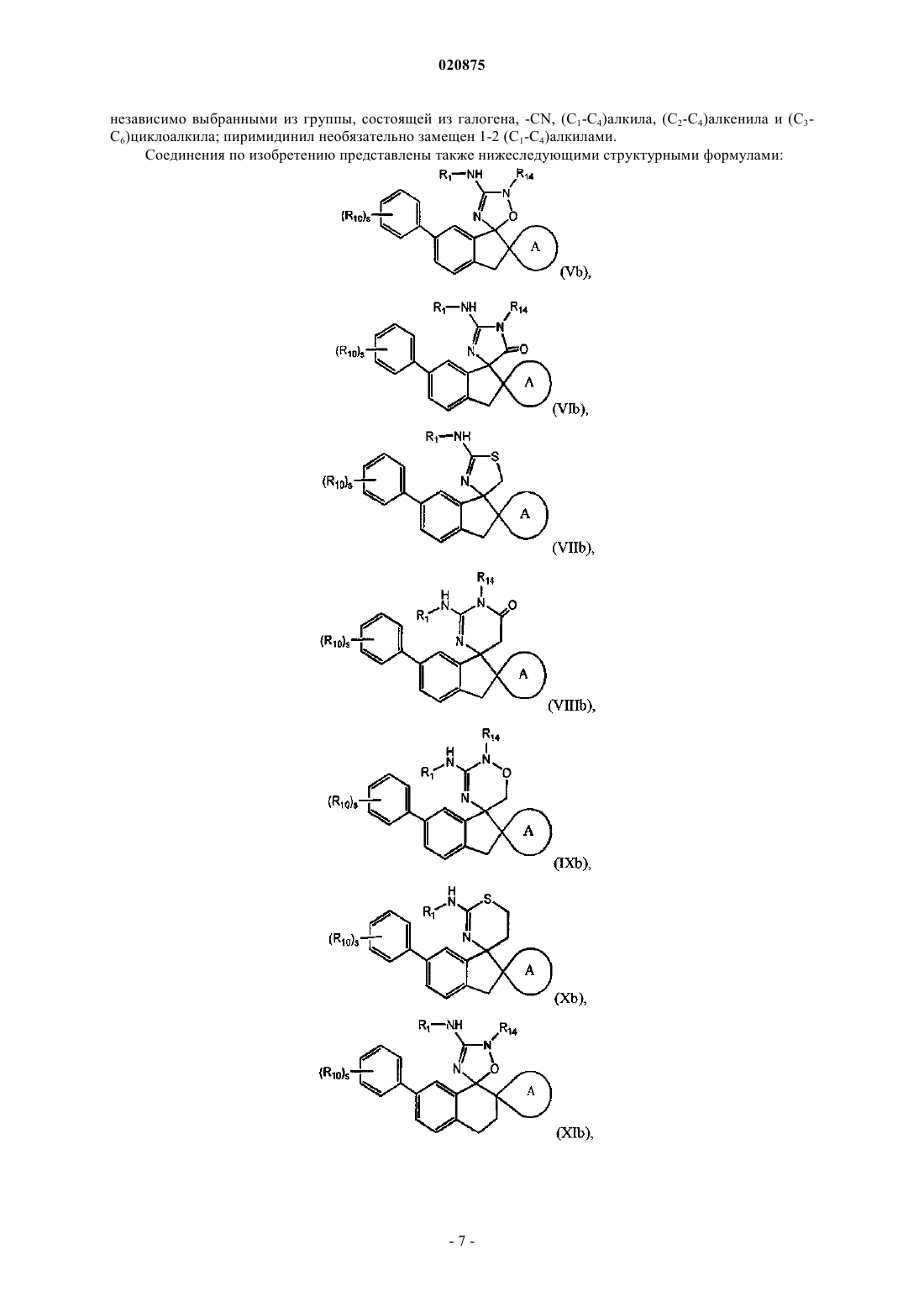
7. Соединение по любому из пп.1-5, где соединение представлено следующей структурной формулой:
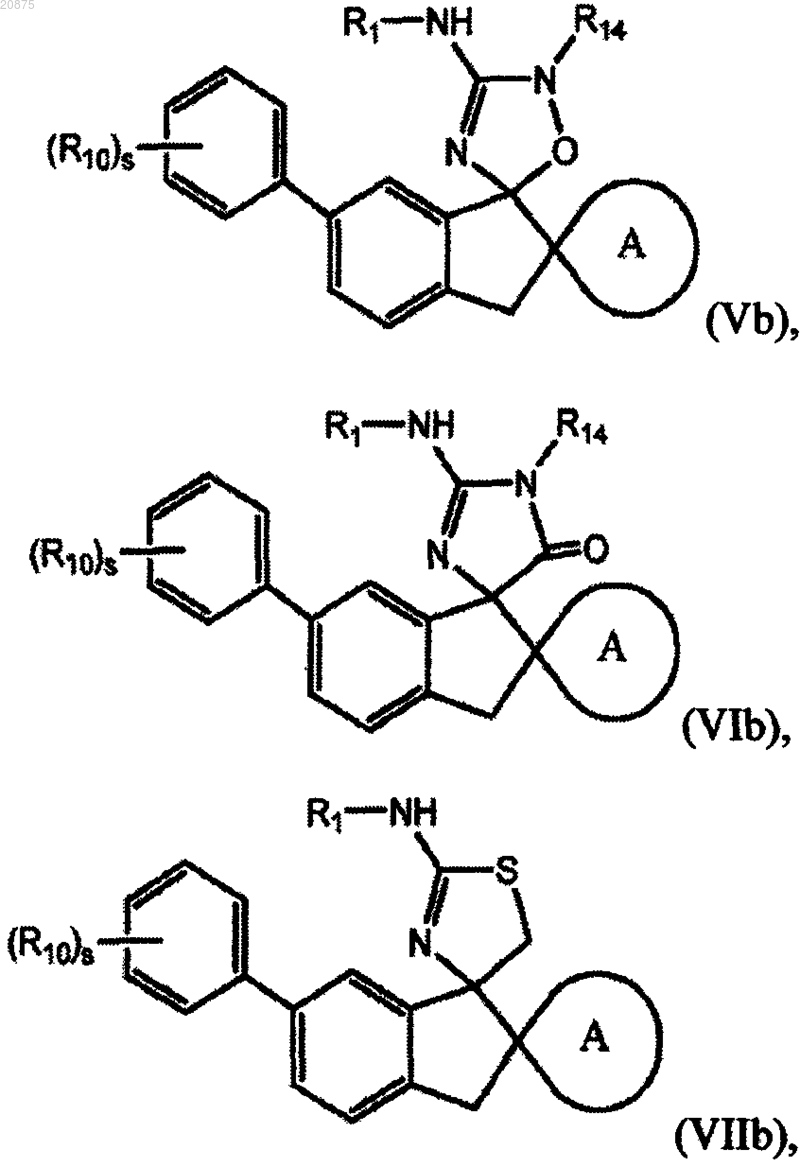
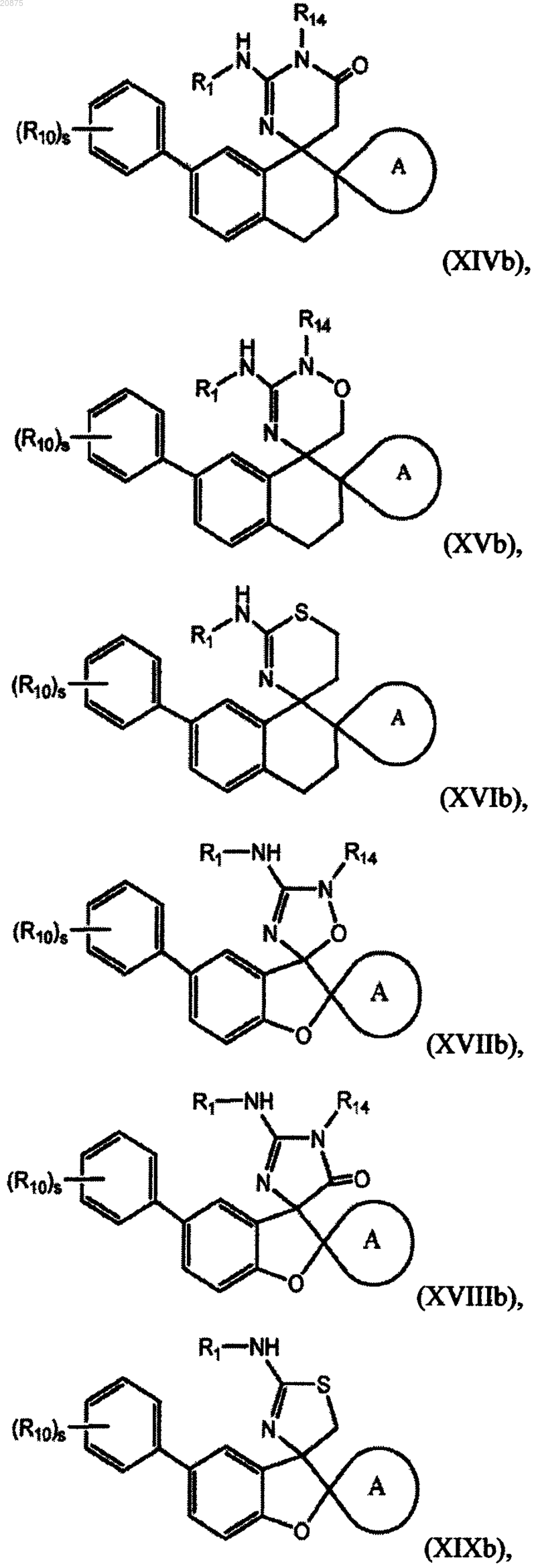
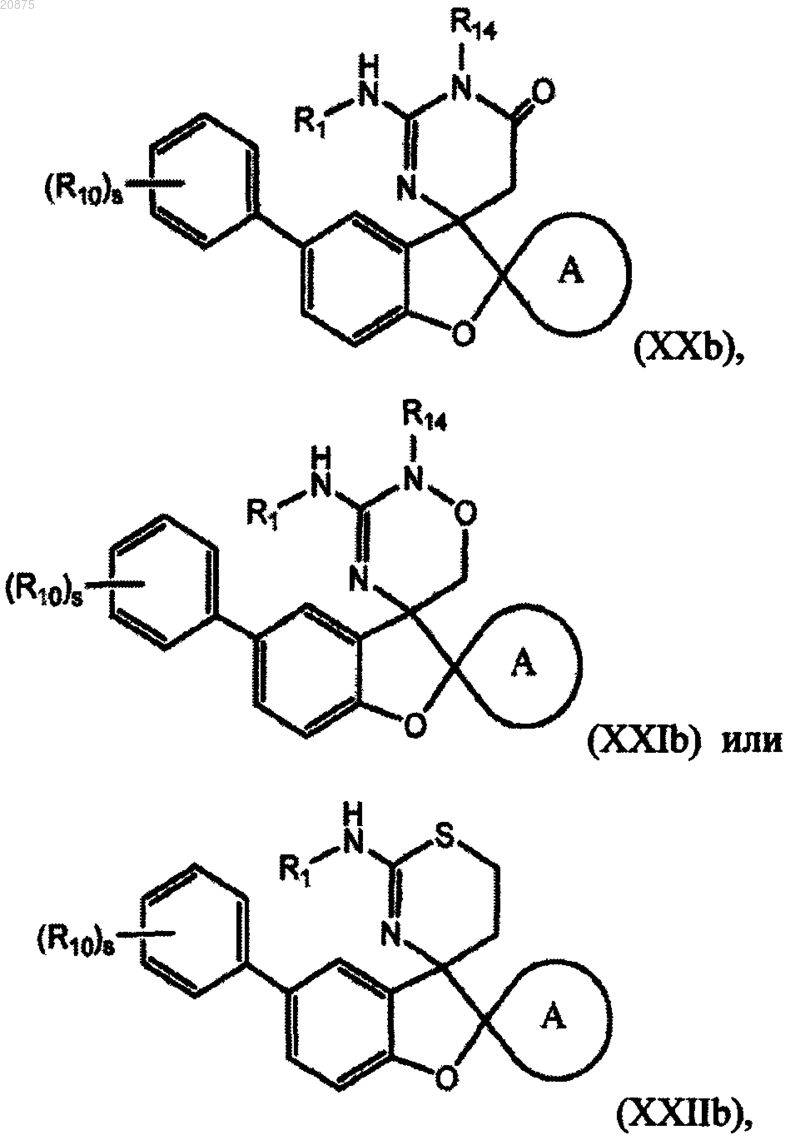
или его фармацевтически приемлемая соль,
причем R14 представляет собой R0.
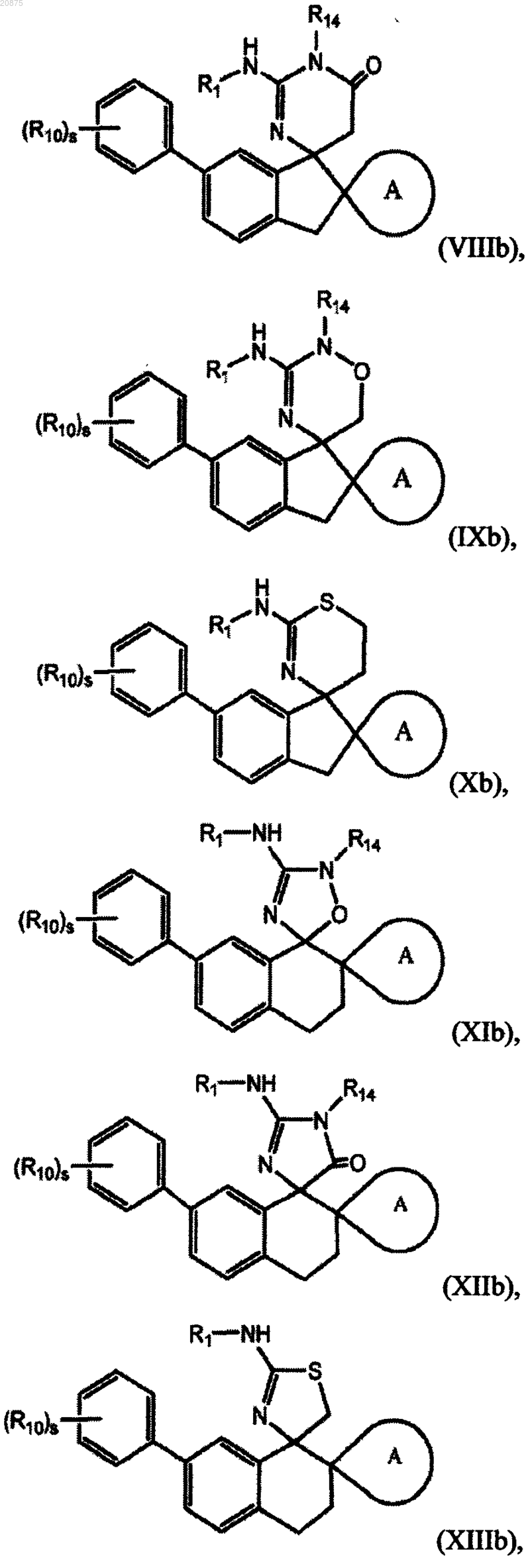
8. Соединение по любому из пп.1-5, где соединение представлено следующей структурной формулой:
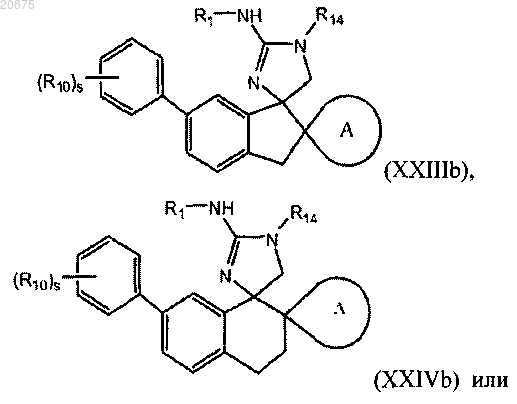
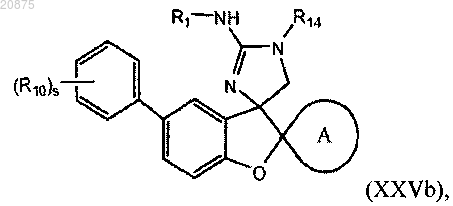
или его фармацевтически приемлемая соль,
причем R14 представляет собой R0;
где R10 является независимо выбранным из группы, состоящей из -галогена, -CN, (C1-C4)алкила, (C1-C4)алкокси, галоген(C1-C4)алкокси, галоген(C1-C4)алкила и -S(O)2(C1-C4)алкила;
s представляет собой 0, 1, 2 или 3.
9. Соединение по любому из пп.7 и 8, где R10 является независимо выбранным из группы, состоящей из -F,
-Cl, -Br, (C1-C4)алкила, (C1-C4)алкокси, галоген(C1-C4)алкила и галоген(C1-C4)алкокси.
10. Соединение по п.9, где R10 является независимо выбранным из группы, состоящей из -F, -Cl, -Br, -CN,
-Me, -Et, -OMe, -CF3, -OCF3.
11. Соединение по любому из предыдущих пунктов, где R1 представляет собой -Н и R14, при наличии, представляет собой -Me.
12. Соединение по любому из пп.1, 3, 4 и 6-11, где кольцо А представлено следующей структурной формулой:
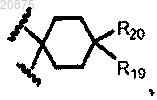
где каждый R19 и R20 является независимо выбранным из -Н, галогена, (C1-C4)алкила, гидрокси, (C1-C4)алкокси, галоген(C1-C4)алкиламино, галоген(C1-C4)алкокси, 3-(4-гидроксифенил)-2-аминопропаноилокси, диметиламино, диаминокарбонила, диметилкарбамоила, (C1-C3)алкокси(C1-C3)алкокси, фенила и бензила.
13. Соединение по п.12, где R20 представляет собой -Н и R19 представляет собой -ОН, (C1-C3)алкокси, гало(C1-C3)алкокси или (С1-С3)алкокси(C1-C3)алкокси.
14. Соединение по любому из пп.1, 3, 4 и 6-11, где кольцо А представлено следующей структурной формулой:
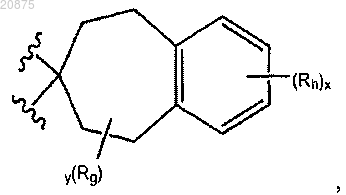
где х и у имеют значения 1;
Rg представляет собой -Н;
Rh представляет собой -Н.
15. Фармацевтическая композиция, включающая фармацевтически приемлемый носитель или разбавитель и соединение по любому из пп.1-14 или его фармацевтически приемлемую соль.
16. Способ ингибирования активности ВАСЕ у субъекта, нуждающегося в таком лечении, включающий введение субъекту эффективного количества соединения по любому из пп.1-14 или его фармацевтически приемлемой соли.
17. Способ лечения ВАСЕ-опосредованного расстройства у субъекта, включающий введение этому субъекту эффективного количества соединения по любому из пп.1-14 или его фармацевтически приемлемой соли.
18. Способ по п.17, где расстройство является выбранным из группы, состоящей из болезни Альцгеймера, когнитивного расстройства, синдрома Дауна, HCHWA-D, снижения когнитивных функций, старческого слабоумия, церебральной амилоидной ангиопатии, дегенеративной деменции, других нейродегенеративных расстройств и глаукомы.
19. Способ по п.18, где расстройство представляет собой болезнь Альцгеймера.
20. Способ по п.18, где расстройство представляет собой глаукому.
Текст
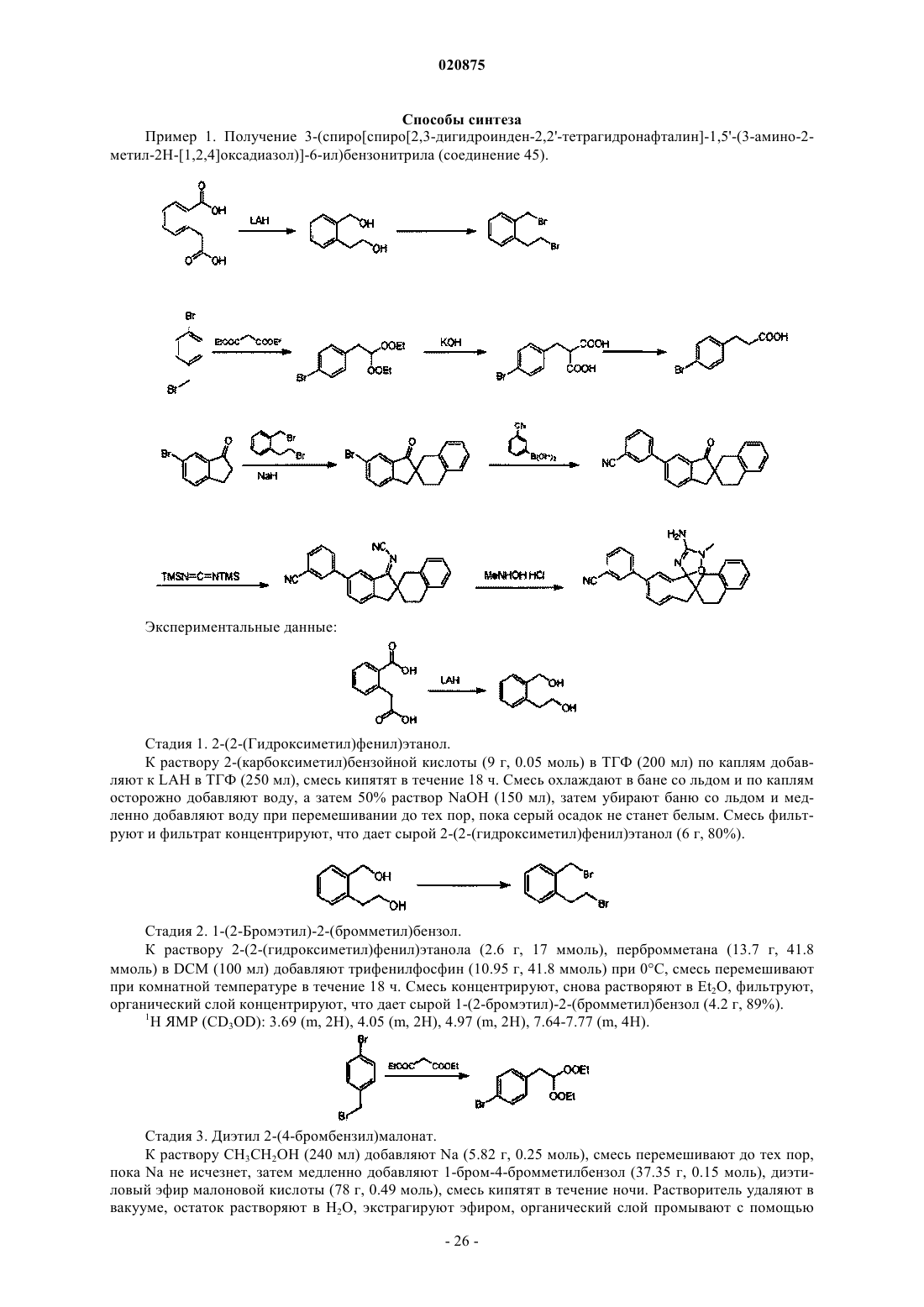
Настоящее изобретение относится к соединению, представленому следующей структурной формулой: или его фармацевтически приемлемой соли. Фармацевтические композиции и способ применения соединения также описаны.(US); БЕРИНГЕР ИНГЕЛЬХАЙМ ИНТЕРНЭШНЛ ГМБХ (DE) Заявка на данный патент испрашивает приоритет согласно предварительной заявке на патент US 61/210146, поданной 13 марта 2009 г., и предварительной заявке на патент US 61/307542, поданной 24 февраля 2010 г. Уровень техники Депозиты -амилоида и нейрофибриллярные клубки являются двумя основными патологоанатомическими характеристиками, связанными с болезнью Альцгеймера (AD). Клинически AD характеризуется потерей памяти, когнитивных функций, логики, понимания и ориентации. Также поражаются при прогрессировании заболевания двигательные, чувствительные и лингвистические функции вплоть до развития распространенного нарушения разнообразных когнитивных функций. Эти когнитивные расстройства развиваются постепенно, но обычно приводят к тяжелым нарушениям и возможно к смерти через 4-12 лет. Депозиты -амилоида преимущественно являются скоплениями АВ пептида, который, в свою очередь, является продуктом протеолиза белка-предшественника амилоида (АРР). Более конкретно, А пептид получается в результате отщепления АРР на С-концах посредством одной или более -секретаз и наN-концах посредством фермент А-секретазы (ВАСЕ), также известного как аспартилпротеаза, как часть-амилоидогенного патогенеза. ВАСЕ активность непосредственно направлена на получение А пептида из АРР, и исследования все больше указывают, что ингибирование ВАСЕ ингибирует продукцию А пептида. Амилоидные бляшки и сосудистая амилоидная ангиопатия также характерна для мозга пациентов с трисомией по 21 паре хромосом (синдром Дауна), наследственной церебральной геморрагией с амилоидозом голландского типа (HCHWA-D) и другими нейродегенеративными расстройствами. Нейрофибриллярные клубочки также встречаются при других нейродегенеративных расстройствах, включая вызванные деменцией расстройства. В последнее время амилоид- (АВ), как обнаружено, задействован в развитии апоптоза RGC при глаукоме, при этом наблюдается каспаза-3-опосредованный патологический процессинг белкапредшественника амилоида, повышенная экспрессия АВ в клетках RGC при экспериментальной глаукоме и сниженные уровни А в водянистой влаге (сопоставимый с отложением А в сетчатке) у пациентов с глаукомой. Настоящее изобретение предусматривает соединения, которые являются ингибиторами ВАСЕ и применимы в качестве терапевтических агентов в лечении, профилактике и облегчении заболевания или расстройства, характеризующегося повышенным отложением -амилоида или уровней -амилоида у пациента. Сущность изобретения В одном воплощении настоящее изобретение указывает на соединение, представленное следующей структурной формулой: или его фармацевтически приемлемую соль,где кольцо Het представляет собой 5-6-членный гетероцикл, содержащий фрагмент -N=C(NHR1) и дополнительно 1-2 гетероатома, выбранных из N, О, S, причем, если присутствует второй атом N, он может быть замещен радикалом R0 и причем любой атом в Het может быть замещен оксорадикалом;R0 представляет собой (C1-C6)алкил; пиперидинил, необязательно замещенный (C1-C4)алкилом; (C3C6)циклоалкил или (C1-C3)алкил, замещенный 1 или 2 группами, выбранными из галогена, галогено(C1C4)алкила, (C1-C4)алкокси, гидрокси, -С(О)ОН, -С(О)О(C1-C4-алкила), -C(O)NH2, мезил(метил)амино,ди(C1-C4)алкиламино, тиазолила, 1,3,4-триазолила, необязательно замещенного (C1-C3)алкилом, пиридазинила, пиримидинила, пиридинила, необязательно замещенного галогеном или галоген(C1-C4)алкилом,оксазолила, необязательно замещенного (C1-C3)алкилом, оксадиазолила, необязательно замещенного (C1C3)алкилом, пирролидинила, необязательно замещенного (C1-C3)алкилом, пиперидинила, необязательно замещенного либо карбоновой кислотой, либо сульфоновой кислотой, оксетанила, тетрагидрофуранила,тетрагидропиранила, бензопиразинила, (C3-C6)циклоалкила или фенила, который может быть замещен галогеном, (C1-C4)алкокси, мезилом, циано, триазолилом, тетрагидропиранилом, оксетанилом, диметиламино, 1-метилпиперазин-4-илом, метилацетатом или мезиламино; ми из галогена, циано, (C1-C4)алкила, (C1-C4)алкокси, галоген(C1-C4)алкокси, галоген(C1-C4)алкила или мезила; пиридинил, необязательно замещенный заместителем, выбранным из галогена, циано, галоген(C1-C4)алкила, (C2-C4)алкинила, (C1-C4)алкила или (C1-C4)алкокси; фенокси или бензилокси, необязательно замещенный (C1-C4)алкокси, циано или 1 или 2 атомами галогена; тиенил или тиазолил, необязательно замещенный галогеном, циано, (C1-C4)алкилом, (C2-C4)алкинилом или (C3-C6)циклоалкилом; этинил или пропинил, необязательно замещенный радикалом, выбранным из 1-4 атомов галогена, тиенила,(C3-C6)циклоалкила, фенила, бензила, (C1-C4)алкила, галоген(C1-C4)алкила, (C1-C4)алкокси, (C1C3)алкокси(C1-C2)алкила или (C3-C6)циклоалкенила, необязательно замещенного гидрокси; винил, необязательно замещенный 1-3 атомами галогена или галоген(C1-C4)алкилом; пиразинил, необязательно замещенный (C1-C4)алкокси; 2-оксо-1 Н-пиридинил, необязательно замещенный (C1-C4)алкилом или (C3C6)циклоалкилом; (C1-C6)алкил, необязательно замещенный 1-5 заместителями, выбранными из галогена,гидрокси, (C1-C4)алкокси, галоген(C1-C4)алкила, фенила, 1,3-диоксол-2-ила или (C3-C6)циклоалкила; (C1C4)алкокси, необязательно замещенный 1-4 атомами галогена, (C3-C6)циклоалкилом, необязательно замещенный 1-2 атомами галогена, диметиламино, галоген(C1-C4)алкилом, (C1-C4)алкокси или тетрагидрофуранилом; (C3-C5)циклоалкокси; (C3-C6)циклоалкил; галоген; циано; индолил; пиридазинил; пиримидин, необязательно замещенный (C1-C4)алкилом; пирролидинил, необязательно замещенный 1-3 атомами галогена; пирролидинон; пирролидинилкарбонил; пирролидинилкарбониламино; метоксикарбонил; метилкарбамоил; диметилкарбамоил; карбокси; гидрокси; пропилсульфанил; фенилсульфанил или циклопентен, необязательно замещенный гидрокси; р имеет значение 1 или 2 или р имеет значение 3, если один R2 представляет собой галоген; Х=О, СН 2, СН 2 СН 2, CMe2 иR8=R9=H. В другом воплощении соединение настоящего изобретения является представленым следующей структурной формулой: или его фармацевтически приемлемая соль,где W представляет собой -N(R0)-, -S-, -О-;Z представляет собой -С(=О), -C(=S), -C(=NR15)-, -О-, -C(=O)C(R16R17)-, -C(=S)C(R16R17)-,-C(=NR15)C(R16R17)-, -N(R18)-, -(CR16R17)m- или -O-(CR16R17)-,при условии, что, когда W представляет собой -S- или -О-, Z не представляет собой -О-;R18 представляет собой -Н или (C1-C3)алкил. Остальная часть переменных предсталяет собой, как описано выше для структурной формулы (А). Следующее воплощение изобретения представляет собой фармацевтическую композицию, включающую в себя фармацевтически приемлемый носитель или разбавитель и соединение, раскрытое в настоящем изобретение, или его фармацевтически приемлемую соль. Другое воплощение изобретения представляет собой способ ингибирования ВАСЕ активности у субъекта, нуждающегося в таком лечении. Способ включает введение субъекту эффективного количест-2 020875 ва ВАСЕ ингибитора, раскрытого в настоящем изобретении, или его фармацевтически приемлемой соли. Другое воплощение изобретения представляет собой способ лечения ВАСЕ опосредованного расстройства у субъекта. Способ включает введение субъекту эффективного количества ВАСЕ ингибитора,раскрытого в настоящем изобретении. Ингибитор ВАСЕ, раскрытый в настоящем изобретении, может быть использован в производстве лекарственных средств для лечения ВАСЕ опосредованного расстройства у субъекта. Другое воплощение изобретения представляет собой использование ингибитора ВАСЕ, раскрытого в настоящем изобретении, для ингибирования ВАСЕ активности у субъекта, нуждающегося в таком лечении. Другое воплощение изобретения представляет собой использование ВАСЕ ингибитора, раскрытого в настоящем изобретении, для лечения ВАСЕ опосредованного расстройства у субъекта. При этом расстройство является выбранным из группы, состоящей из болезни Альцгеймера, когнитивного расстройства, синдрома Дауна, HCHWA-D, снижения когнитивных функций, старческого слабоумия, церебральной амилоидной ангиопатии, дегенеративной деменции, других нейродегенеративных расстройств и глаукомы. Подробное описание изобретения Настоящее изобретение относится к соединениям, представленным структурными формулами (А),(I), или их фармацевтически приемлемым солям. В других вариантах соединение представлено одной из следующих структурных формул: или его фармацевтически приемлемая соль, причем R14 представляет собой R0. Соединение по изобретению может быть также представлено одной из нижеследующих формул: или его фармацевтически приемлемая соль, причем R14 представляет собой R0. При этом, где кольцо А может быть выбрано из группы, состоящей из тетрагидропирана, циклопентана, циклогексана, циклогексена, циклогептана, оксепана, пиперидина, 6,7,8,9-тетрагидро-5 Нбензо[7]аннулена, 2,3-дигидро-1 Н-индена, тетрагидронафталина, 2,3,4,5-тетрагидробензо[b]оксепина и 2,3-дигидро-1 Н-феналена, причем циклопентан, циклогексан, циклогексен, циклогептан необязательно замещены 1-2 заместителями, независимо выбранными из группы, состоящей из -F, -Cl, -Br, (C1C4)алкила, (C1-C3)алкокси, галоген(C1-C3)алкокси и фенила. В следующем варианте R2 представляет собой пиридинил, тиенил или пиримидинил, причем пиридинил необязательно замещен 1-2 заместителями, независимо выбранными из группы, состоящей из галогена, -CN, (C1-C4)алкила, галоген(C1-C4)алкила; тиенил необязательно замещен 1-2 заместителями,-6 020875 независимо выбранными из группы, состоящей из галогена, -CN, (C1-C4)алкила, (C2-C4)алкенила и (C3C6)циклоалкила; пиримидинил необязательно замещен 1-2 (C1-C4)алкилами. Соединения по изобретению представлены также нижеследующими структурными формулами: или их фармацевтически приемлемая соль, причем R14 представляет собой R0. В другом варианте структурные формулы выбраны из: или их фармацевтически приемлемая соль, причем R14 представляет собой R0; где R10 является независимо выбранным из группы, состоящей из -галогена, -CN, (C1-C4)алкила,(C1-C4)алкокси, галоген(C1-C4)алкокси, галоген(C1-C4)алкила и -S(O)2(C1-C4)алкила;s представляет собой 0, 1, 2 или 3. В некоторых вариантах R10 являются независимо выбранными из группы, состоящей из -F, -Cl, -Br,(C1-C4)алкила, (C1-C4)алкокси, галоген(C1-C4)алкила и галоген(C1-C4)алкокси. В других вариантах R10 является независимо выбранным из группы, состоящей из -F, -Cl, -Br, -CN,-Me, -Et, -OMe, -CF3, -OCF3. В следующих вариантах R1 представляет собой -Н и R14, при наличии, представляет собой -Me. Рассматриваются также варианты соединений, когда кольцо А представлено следующей структурной формулой: где каждый R19 и R20 является независимо выбранным из -Н, галогена, (C1-C4)алкила, гидрокси, (C1C4)алкокси,галоген(C1-C4)алкиламино,галоген(C1-C4)алкокси,3-(4-гидроксифенил)-2 аминопропаноилокси, диметиламино, диаминокарбонила, диметилкарбамоила, (C1-C3)алкокси(C1C3)алкокси, фенила и бензила. При этом возможно, что R20 представляет собой -Н и R19 представляет собой -ОН, (C1-C3)алкокси,гало(C1-C3)алкокси или (C1-C3)алкокси(C1-C3)алкокси. В некоторых вариантах в соединении согласно изобретению кольцо А представлено следующей структурной формулой: где х и у имеют значения 1; Rg представляет собой -Н и Rh представляет собой -Н. Определения. Для терминов, которые не определены как специальные, будут даны значения средним специалистом с учетом уровня техники в свете настоящего описания и контекста. Как используют в описании,если не оговорено противоположное, следующие термины имеют определения, как они раскрыты, и необходимо придерживаться указанным условностям. В группах у радикалов или остатков, которые определены ниже, число атомов углерода часто определяет предшествующую группу. Например, (C1-C6)алкил означает алкильную группу или радикал, имеющий от 1 до 6 атомов углерода. В общем, для групп, содержащих две или более подгруппы, последняя названная подгруппа представляет собой радикал в точке присоединения. Например, заместитель"арил(C1-C3)алкил" означает арильную группу, которая связана с (C1-C3)алкильной группой, последняя из которых связана с ядром или с группой, к которой присоединен заместитель. Когда соединение настоящего изобретения описано в форме химического названия и в виде формулы, в случае любого противоречия, формула должна преобладать. Когда любая переменная (например, арил, гетероциклил, R1, R6 и т.д.) появляется более чем один раз в соединении, ее определение при каждом появлении не зависит от любого другого появления."Алкил" означает насыщенный алифатический разветвленный или с прямой цепью моновалентный углеводородный радикал, имеющий определенное число атомов углерода. Например, "(C1-C6)алкил" означает радикал, имеющий 1-6 атомов углерода в цепи или в разветвлении. "(C1-C6)алкил" включает метил, этил, пропил, бутил, пентил и гексил."Алкенил" означает разветвленный или с прямой цепью моновалентный углеводородный радикал,содержащий по крайней мере одну двойную связь и имеющий определенное число атомов углерода. Алкенил может быть моно- или полиненасыщенным и может существовать в Е или Z конфигурации. Например, "(C2-C6)алкенил" означает радикал, имеющий 2-6 атомов углерода в линейной цепи или в разветвлении."Алкинил" означает разветвленный или с прямой цепью моновалентный углеводородный радикал,содержащий по крайней мере одну тройную связь и имеющий определенное число атомов углерода. Например, "(C2-C6)алкинил" означает радикал, имеющий 2-6 атомов углерода в линейной цепи или в разветвлении."Циклоалкил" означает насыщенный алифатический циклический углеводородный радикал, имеющий определенное число атомов углерода. Он может быть моноциклическим, бициклическим, полициклическим (например, трициклическим), конденсированным, мостиковым или спиро. Например, моноциклический (C3-C8)циклоалкил означает радикал, имеющий 3-8 атомов углерода, замкнутый в моноциклическое кольцо. Моноциклический (C3-C8)циклоалкил включает, но без ограничения, циклопропил,циклобутил, циклопентил, циклогексил, циклогептил и циклооктан. Моноциклические кольцовые системы имеют одно кольцо в структуре. Они включают насыщенное или ненасыщенное, алифатическое циклические углеводородные кольца или ароматическое углеводородное кольцо, имеющее определенное число атомов углерода. Моноциклическая кольцевая система может необязательно содержать от 1 до 3 гетероатомов в кольцевой структуре и каждый гетероатом независимо выбран из группы, содержащей О, N и S. Когда гетероатом в кольце, которым является атом азота, связан с другими атомами кольца только простыми связями, он может быть замещен. Примеры заместителей, если иное не определено, включают -Н, алкил, циклоалкил, циклоалкилалкил, арил, арилалкил, гетероарил, гетероарилалкил (предпочтительно -Н, гало(C1-C6)алкил или (C1-C3)алкилкарбонил),каждый из которых может быть необязательно замещенным галогеном, гидроксилом, алкокси, галогеналкилом, алкилом и т.д. Когда гетероатом представляет собой S, он может быть необязательно моноили диоксидом (т.е. -S(O)- или -S(O)2-). Примеры моноциклической кольцевой системы включают, но без ограничения, моноциклические циклоалкилы (например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктан), частично ненасыщенные циклоалкилы; моноциклические гетероциклоалкилы (например, азетидин, пирролидин, пиперидин, пиперазин, гексагидропиримидин, тетрагидрофуран, тетрагидропиран, оксепан, тетрагидротиофен, тетрагидротиопиран, изоксазолидин, 1,3 диоксалан, 1,3-дитиолан, 1,3-диоксан, 1,4-диоксан, 1,3-дитиан, 1,4-дитиан, морфолин, тиоморфолин,тиоморфолин 1,1-диоксид, тетрагидро-2 Н-1,2-тиазин, тетрагидро-2 Н-1,2-тиазин 1,1-диоксид, изотиазолидин 1,1-диоксид, тетрагидротиофен 1-оксид, тетрагидротиофен 1,1-диоксид, тиоморфолин 1-оксид,тиоморфолин 1,1-диоксид, тетрагидро-2 Н-1,2-тиазин 1,1-диоксид, изотиазолидин 1,1-диоксид, пирролидин-2-он, пиперидин-2-он, пиперазин-2-он и морфолин-2-он); моноциклические арилы (например, фенил) и моноциклические гетероарилы (см. описание ниже). Бициклическая кольцевая система имеет два кольца, которые имеют по крайней мере один общий кольцевой атом. Бициклическая кольцевая система включает конденсированную, мостиковую и спиро кольцевую систему. Два кольца могут быть оба алифатическими (например, циклоалкил или циклогетероалкил), оба могут быть ароматическими (например, арил или гетероарил) или их комбинацией. Бициклические кольцевые системы могут необязательно содержать от 1 до 3 гетероатомов в кольцевой структуре и каждый гетероатом является независимо выбранным из группы, содержащей О, N и S. Когда гетероатом является атомом азота в кольце, связанным с другими атомами в кольце только простыми связями, он может быть замещен. Примеры заместителей, если иное не определено, включают Н, алкил, циклоалкил, циклоалкилалкил, арил, арилалкил, гетероарил, гетероарилалкил (предпочтительно -Н, (C1C6)алкил, галоген(C1-C6)алкил или (C1-C3)алкилкарбонил), каждый из которых может быть необязательно замещен галогеном, гидроксилом, алкокси, галогеналкилом, алкилом и т.д. Когда гетероатом представляет собой S, он может быть необязательно моно- или диоксидом (т.е. -S(O)- или -S(O)2-). Конденсированная бициклическая кольцевая система имеет два кольца, которые имеют два общих смежных атомов в кольце. Два кольца могут быть алифатическими (например, циклоалкил или циклогетероалкил), оба могут быть ароматическими (например, арил или гетероарил) или их комбинацией. Например, первое кольцо может быть моноциклическим циклоалкилом или моноциклическим циклогетероалкилом, и второе кольцо может быть циклоалкилом, частично ненасыщенным карбоциклом, арилом,гетероарилом или моноциклическим циклогетероалкилом. Например, второе кольцо может быть (C3C6)циклоалкилом, таким как циклопропил, циклобутил, циклопентил и циклогексил. Альтернативно,второе кольцо может быть арильным кольцом, например фенилом. Примеры конденсированной бициклической кольцевой системы включают, но без ограничения, 6,7,8,9-тетрагидро-5 Н-бензо[7]аннулен, 2,3 дигидро-1 Н-инден, октагидро-1 Н-инден, тетрагидронафталин, декагидронафталин, индолин, изоиндо- 11020875 лин, 2,3-дигидро-1 Н-бензо[d]имидазол, 2,3-дигидробензо[d]оксазол, 2,3-дигидробензо[d]тиазол, октагидробензо[d]оксазол, октагидро-1 Н-бензо[d]имидазол, октагидробензо[d]тиазол, октагидроциклопента[с]пиррол, 3-азабицикло[3.1.0]гексан, 3-азабицикло[3.2.0]гептан, 5,6,7,8-тетрагидрохинолин и 5,6,7,8 тетрагидроизохинолин и 2,3,4,5-тетрагидробензо[b]оксепин. Спиробициклическая кольцевая система имеет два кольца, которые имеют только один общий кольцевой атом. Два кольца могут быть оба алифатическими (например, циклоалкил или циклогетероалкил). Например, первое кольцо может быть моноциклическим циклоалкилом или моноциклическим циклогетероалкилом и второе кольцо может быть циклоалкилом, частично ненасыщенным карбоциклом,или моноциклическим циклогетероалкилом. Примеры спиробициклической кольцевой системы включают, но без ограничения, спиро[2.2]пентан, спиро[2.3]гексан, спиро[3.3]гептан, спиро[2.4]гептан, спиро[3.4]октан, спиро[2.5]октан, азаспиро[4.4]нонан, 7-азаспиро[4.4]нонан, азаспиро[4.5]декан, 8 азаро[4.5]декан, азаро[5.5]ундекан, 3-азаспиро[5.5]ундекан и 3,9-диазаспиро[5.5]ундекан. Мостиковая бициклическая кольцевая система имеет два кольца, которые имеют три или более общих смежных кольцевых атомов. Например, первое кольцо может быть моноциклическим циклоалкилом или моноциклическим циклогетероалкилом и другое кольцо является циклоалкилом, частично ненасыщенным карбоциклом или моноциклическим циклогетероалкилом. Примеры мостиковой бициклической кольцевой системы включают, но без ограничения, бицикло[1.1.0]бутан, бицикло[1.2.0]пентан, бицикло[2.2.0]гексан, бицикло[3.2.0]гептан, бицикло[3.3.0]октан, бицикло[4.2.0]октан, бицикло[2.2.1]гептан,бицикло[2.2.2]октан,бицикло[3.2.1]октан,бицикло[3.2.2]нонан,бицикло[3.3.1]нонан,бицикло[3.3.2]декан, бицикло[3.3.3]ундекан, азабицикло[3.3.1]нонан, 3-азабицикло[3.3.1]нонан, азабицикло[3.2.1]октан, 3-азабицикло[3.2.1]октан, 6-азабицикло[3.2.1]октан и азабицикло[2.2.2]октан, 2 азабицикло[2.2.2]октан и 2-оксабицикло[2.2.2]октан. Полициклическая кольцевая система имеет более чем два кольца (например, три кольца, образующие трициклическую кольцевую систему) и смежные кольца, имеющие, по крайней мере, один общий кольцевой атом. Полициклическая кольцевая система включает конденсированную, мостиковую и спирокольцевую систему. Конденсированная полициклическая кольцевая система имеет по крайней мере два кольца, которые имеют два общих смежных кольцевых атомов. Спирополициклическая кольцевая система имеет по крайней мере два кольца, которые имеют только один общий кольцевой атом. Мостиковая полициклическая кольцевая система имеет по крайней мере два кольца, которые имеют три или более общих смежных атомов в кольце. Примеры полициклической кольцевой системы включают, но без ограничения, трицикло[3.3.1.0J'7]нонан (норадамантан) и трицикло[3.3.1.1']декан (адамантан) и 2,3 дигидро-1 Н-фенален."Гетероцикл" означает насыщенную, ненасыщенную, или ароматическую моно- или полициклическую кольцевую систему, содержащую один или более гетероатомов, независимо выбранных из N, О илиS. Когда гетероатом представляет собой N, если другое не определено, он может быть замещен. Примеры заместителей включают Н, алкил, циклоалкил, циклоалкилалкил, арил, арилалкил, гетероарил, гетероарилалкил (предпочтительно -Н, (C1-C6)алкил, галоген(C1-C6)алкил или (С 1-С 3)алкилкарбонил), каждый из которых может быть необязательно замещен галогеном, гидроксилом, алкокси, галогеналкилом, алкилом и т.д. Когда гетероатом представляет собой S, если другое не определено, может быть необязательно моно- или диокисленным (т.е. -S(O)- или -S(O)2-). Гетероцикл может быть гетероарильным кольцом или гетероциклоалкильным кольцом."Циклогетероалкил" или "гетероциклоалкил" означает насыщенный или частично насыщенный 412-членный кольцевой радикал, имеющий определенное число кольцевых атомов углерода. Циклогетероалкил или гетероциклоалкил содержит от 1 до 4 кольцевых гетероатомов, которые могут быть одинаковыми или различными, выбранными из N, О или S. Циклогетероалкильное или гетероциклоалкильное кольцо необязательно содержит одну или более двойных связей. Оно может быть моноциклическим, бициклическим, трициклическим, конденсированным, мостиковым или спиро. Например, (C3C9)гетероциклоалкил означает кольцевой радикал, содержащий 3-9 кольцевых атомов углерода. Термин"циклогетероалкил" или "гетероциклоалкил", как предполагают, включает все возможные изомерные формы. Когда гетероатом представляет собой атом азота в кольце, связанный с другими атомами в кольце только простыми связями, он может быть замещен. Примеры заместителей, если другое не определено, включают Н, алкил, циклоалкил, циклоалкилалкил, арил, арилалкил, гетероарил, гетероарилалкил(предпочтительно -Н, (C1-C6)алкил, галоген(C1-C6)алкил или (C1-C3)алкилкарбонил), каждый из которых может быть необязательно замещен галогеном, гидроксилом, алкокси, галогеналкилом, алкилом и т.д. Когда гетероатом представляет собой S, он может быть необязательно моно- или диокисленным (т.е.-S(O)- или -S(O)2-). Галогеналкил и галогенциклоалкил включают моно-, поли- и пергалогеналкильные группы, где галогены независимо выбраны из фтора, хлора и брома. Термины, такие как "гетероарил", "гетероарильная группа", "гетероарильное кольцо", "гетероароматический", "гетероароматическая группа" и "гетероароматическое кольцо", используют как взаимозаменяемые. Термин "гетероарил" означает моновалентный гетероароматический моноциклический или полициклический кольцевой радикал. Моноциклические гетероарильные кольца являются 5- и 6- 12020875 членными ароматическими гетероциклическими кольцами, содержащими от 1 до 4 гетероатомов, независимо выбранных из N, О и S, и включают, но без ограничения, фуран, тиофен, пиррол, имидазол, пиразол, оксазол, изоксазол, тиазол, изотиазол, 1,2,3-триазол, 1,2,4-триазол, 1,3,4-оксадиазол, 1,2,5-тиадиазол,1,2,5-тиадиазол 1-оксид, 1,2,5-тиадиазол 1,1-диоксид, 1,3,4-тиадиазол, пиридин, пиридин-И-оксид, пиразин, пиримидин, пиридазин, 1,2,4-триазин, 1,3,5-триазин и тетразол. Бициклические гетероарильные кольца представляют собой бицикло[4.4.0] и бицикло[4,3.0]конденсированную кольцевую систему, содержащую от 1 до 4 гетероатомов, независимо выбранных из N, О и S, и включают индолизин, индол,изоиндол, бензо[b]фуран, бензо[b]тиофен, индазол, бензимидазол, бензтиазол, пурин, 4 Н-хинолизин,хинолин, изохинолин, циннолин, фталазин, хинозолин, хиноксвлин, 1,8-нафтиридин и птеридин. "Алкокси" означает алкильный радикал, присоединенный через кислородный мостик. "(C1-C4)алкокси" включает метокси, этокси, пропокси и бутокси. Термины "ароматический", "ароматический группа", "ароматический кольцо", "арил", "арильная группа" и "арильное кольцо" используют как взаимозаменяемые. Термин "арил" означает ароматическую моноциклическую или полициклическую углеводородную кольцевую систему. Арильная система включает, без ограничения, фенил, нафталенил, флуоренил, инденил, азуленил и антраценил. Термин "гетеро" относится к замещению по крайней мере одного атома углерода как члена кольцевой системы по крайней мере одним гетероатомом, выбранным из N, S и О. Гетерогенное кольцо может иметь 1, 2, 3 или 4 членов в виде атомов углерода, замещенных гетероатомом. Термин "галоген", как используют здесь, относится ко фтору, хлору, брому или йоду. Термин "карбоцикл" означает 3-14-членное насыщенное или ненасыщенное алифатическое циклическое углеводородное кольцо. Термин "циклоалкен" обозначает ненасыщенный и неароматический алифатический циклический углеводородный радикал, имеющий определенное число атомов углерода. Он может быть моноциклическим, бициклическим, трициклическим, конденсированным, мостиковым или спиро. Таким образом, (C3C8)циклоалкен означает радикал, имеющий 3-8 атомов углерода, встроенных в кольцо. (C3C8)циклоалкен включает циклобутен, циклопентен, циклогексен, циклогептен и циклооктен. Соединения по настоящему изобретению могут находиться в виде фармацевтически приемлемых солей. Для использования в медицине соли соединений по изобретению относятся к нетоксичным "фармацевтически приемлемым солям". Определение "фармацевтически приемлемые" употреблено в описании по отношению к тем соединениям, материалам, композициям и/или дозированным формам, которые в рамках медицинского использования пригодны для использования с целью нанесения их на кожу человека и животного без излишней токсичности, раздражения, аллергической реакции или других проблем или осложнений, и обеспечивают оправданное соотношение преимущество/риск. Как использовано в описании, термин "фармацевтически приемлемые соли " относится к производным раскрытых соединений, в которых исходное соединение модифицируют через получение их кислотных или щелочных солей. Фармацевтически приемлемые солевые формы включают фармацевтически приемлемые кислотно/анионные или основно/катионные соли. Примеры фармацевтически приемлемых солей включают, но без ограничения, минеральные или органические кислотные соли основных остатков, таких как амины; щелочные или органические соли кислотных остатков, таких как карбоксильные кислоты; и т.п. Например, такие соли включают ацетат, аскорбат, бензолсульфонат, бензоат, бензилат, бикарбонат,битартрат, бромид, эдитат кальция, камсилат, карбонат, хлорид, цитрат, дигидрохлорид, эдитат, эдизилат, этандисульфонат, эстолат, эсилат, фумарат, глицептат, глюканат, глутамат, гликолат, гликолиларсанилат, гексилрезорцинат, гидрабамин, гидробромид, гидрохлорид, гидроксималеат, гидроксинафтоат,иодид, изетионат, лактат, лактобионат, малат, малеат, манделат, метансульфонат, мезилат, метилбромид,метилнитрат, метилсульфат, мукат, нитрат, напсилат, оксалат, памоат, пантотенат, фенилацетат, фосфат/дифосфат, полигалактуронат, пропионат, салицилат, стеарат, основная уксуснокислая, сукцинат,сульфамид, сульфат, таннат, тартрат, теоклат, тозилат, тритиоиодид, аммоний, бензатин, хлорпрокаин,коллин, диэтаноламин, этилендиамин, меглумин и прокаиновые соли. Дополнительные фармацевтически приемлемые соли могут быть сформированы с катионами из металлов, подобных алюминию, кальцию,литию, магнию, калию, натрию, цинку и т.п. (см. также Pharmaceutical salts, Birge, S.M. et al., J. Pharm.Sci. (1977), 66, 1-19). Фармацевтически приемлемые соли по настоящему изобретению могут быть синтезированы из исходного соединения, которое содержит основной или кислотный остаток c помощью приемлемых химических методик. Как правило, такие соли могут быть приготовлены реакцией свободных кислотных или основных форм этих соединений с достаточным количеством подходящего основания или кислоты в воде или органическом разбавителе, таком как эфир, этилэтилацетат, этанол, изопропанол, или ацетонитрил, или их смесь. Соли других кислот, отличных от тех, которые были упомянуты выше, которые, например, применимы для очистки или выделения соединений по настоящему изобретению (например, трифторацетатные соли), также составляют часть изобретения. Соединения по изобретению могут быть приготовлены в виде индивидуальных изомеров либо c помощью изомерно-специфического синтеза, либо разделения изомерной смеси. Приемлемая техника разделения включает образование соли свободного основания каждого изомера изомерной пары, используя оптически активную кислоту (с последующей фракционной кристаллизацией и регенерацией свободного основания), образуя соль кислотной формы каждого изомера изомерной пары, используя оптически активный амин (с последующей фракционной кристаллизацией и регенерации свободной кислоты), образуя эфир или амид каждого из изомеров изомерной пары, используя чистую кислоту, амин или спирт(с последующей хроматографическим разделением и удалением хиральной примеси), или разделением изомерной смеси либо в виде исходного продукта, либо конечного продукта, используя различные известные хроматографические методы. Когда стереохимия раскрытого соединения названа или описана c помощью структуры, названный или описанный стереоизомер имеет оптическую чистоту по крайней мере 60, 70, 80, 90, 99 или 99.9% по массе по отношению к другим стереоизомерам. Когда единственный энантиомер назван или описан c помощью структуры, описанный или названный стереоизомер имеет оптическую чистоту по крайней мере 60, 70, 80, 90, 99 или 99.9% по массе. Процент оптической чистоты по массе представляет собой отношение веса энантиомера над весом энантиомера плюс масса его оптического изомера. Когда раскрытое соединение названо или описано c помощью структуры без обозначения стереохимии и соединение имеет по крайней мере один хиральный центр, должно быть понятно, что название или структура включает один энантиомер соединения, свободный от соответствующего оптического изомера, рацематную смесь соединения и смеси, обогащенные одним энантиомером, родственным его соответствующему оптическому изомеру. Когда раскрытое соединение названо или описано c помощью структуры без указания стереохимии и имеет по крайней мере два хиральных центра, должно быть понятно, что название или структура включает диастереоизомер, свободный от других диастереоизомеров, пару диастереомеров, свободных от других диастереоизомерных пар, смеси диастереомеров, смеси диастереомерных пар, смеси диастереомеров, в которых один диастереомер обогащен по отношению к другому(им) диастереомеру(ам) и смеси диастереомерных пар, в которых одна диастереомерная пара обогащена по отношению к другой диастереомерной(ым) паре(ам). Когда соединения, имеющие один или более стереоцентров, описаны c помощью конкретной стереохимии по отношению по крайней мере к одному стереоцентру, настоящее изобретение также включает соединения, которые имеют противоположную стереохимию при соответствующих стереоцентре(ах) и соединения, которые не имеют специфической стереохимии у соответствующих(его) стереоцентрах(е). Раскрытые соединения по изобретению являются ингибиторами ВАСЕ, подходящими для лечения,профилактики или облегчения расстройства или заболевания, которое характеризуется повышенным отложением депозитов -амилоида или уровнем -амилоида у субъекта. Настоящее изобретение также предусматривает способ лечения расстройства, относящегося к или связанного с избыточной ВАСЕ активностью у пациента, который в этом нуждается, который включает введение указанному пациенту эффективного количества раскрытого соединения или его фармацевтически приемлемой соли. Настоящее изобретение также предусматривает способы ингибирования активности ВАСЕ у субъекта, который в этом нуждается, включающий введение субъекту и/или контактирование с его рецепторами эффективного количества по меньшей мере одного раскрытого соединения или его фармацевтически приемлемой соли. Настоящее изобретение также предусматривает способы улучшения состояния, характеризующегося отложением -амилоида у субъекта, который в этом нуждается, включающий введение указанному субъекту эффективного количества, по меньшей мере, одного раскрытого соединения или его фармацевтически приемлемой соли. По существу, раскрытые ВАСЕ ингибиторы могут быть использованы для лечения нейродегенеративных расстройств, расстройств, характеризующихся снижением когнитивных функций, нарушением когнитивных функций, деменцией и заболеваний, характеризующихся образованием депозитов амилоида или нейрофибриллярных клубков. Показательные заболевания или расстройства, которые могут быть пролечены c помощью раскрытых ВАСЕ ингибиторов, включают болезнь Альцгеймера, трисомию по 21 паре хромосом (синдром Дауна), наследственную церебральную геморрагию с амилоидозом голландского типа (HCHWA-D), старческое слабоумие, церебральную амилоидную ангиопатию, дегенеративную деменцию, деменции смешанного сосудистого и дегенеративного происхождения, деменцию, связанную с болезнью Паркинсона, деменцию, связанную с прогрессирующим надъядерным параличом и деменцию, связанную с дегенерацией базальной коры, тип болезни Альцгеймера с диффузными тельцами Леви и глаукому. Соответственно, настоящее изобретение относится к соединению, раскрытому в описании, или его фармацевтически приемлемой соли в качестве лекарственного препарата. В дальнейшем воплощении настоящее изобретение относится к способам для лечения или профилактики вышеупомянутых заболеваний и состояний, данный способ включает введение эффективного количества соединения, раскрытого в описании, или его фармацевтически приемлемой соли. Изобретение включает терапевтический способ лечения или облегчения ВАСЕ-опосредованного расстройства у субъекта, который в этом нуждается, включающий введение субъекту, который в этом нуждается, эффективного количества соединения по формуле I или любым другим формулам изобретения, раскрытым в описании, или его фармацевтически приемлемых солей или его композиции. Способы введения включают введение эффективного количества (т.е. эффективного количества) соединения или композиции по изобретению через различные временные промежутки во время курса терапии или одновременно в комбинированной форме. Способы изобретения включают все известные терапевтические лечебные режимы. Используемые в описании термины "субъект" и "пациент" могут быть использованы взаимозаменяемо и обозначают млекопитающего, нуждающегося в лечении, например, домашние животные (например, собаки, кошки, и т.п.), сельскохозяйственные животные (например, коровы, свиньи, лошади,овцы, козы и т.п.) и лабораторные животные (например, крысы, мыши, морские свинки и т.п.). Обычно,субъект является человеком, нуждающимся в лечении. Используемые в описании термины "лечебное воздействие" или "лечение" относятся к получению желаемого фармакологического и/или физиологического эффекта. Эффект может быть профилактический или терапевтический, который включает достижение, частичное или существенное, одного или более из следующих результатов: частичное или полное снижение выраженности заболевания, расстройства или синдрома; облегчение или улучшение клинического симптома или показателя, связанного с этим расстройством; замедление, подавление или уменьшение вероятности прогрессирования заболевания, расстройства или синдрома; или частичное или полное замедление, подавление или уменьшение вероятности начала или развития заболевания, расстройства или синдрома."Эффективное количество" означает такое количество активного соединения, которое вызывает желаемый биологический ответ у субъекта. Такой ответ включает ослабление симптомов заболевания или расстройства, подверженного лечению. Эффективное количество соединения по изобретению в таком терапевтическом способе составляет от около 0.01 до около 1000 мг/кг/день, от около 0.1 до около 100 мг/кг/день."Фармацевтически приемлемый носитель" означает соединения и композиции, которые имеют достаточную чистоту и качество для применения в приготовлении композиции по изобретению, и которые при правильном введении животному или человеку не вызывают побочных эффектов. В одном воплощении настоящее изобретение включает комбинированную терапию для лечения или облегчения заболевания или расстройства, раскрытого в описании. Комбинированная терапия включает введение комбинации по меньшей мере одного соединения, имеющего структурную формулу (А), (I) или(Y), с другим соединением, выбранным из следующей группы: например, ингибиторы гамма-секретазы; ингибиторы агрегации амилоида (например, ELND-005); непосредственно или опосредовано действующие нейропротективные и/или модифицирующие заболевание вещества; антиоксиданты (например, витамин Е или гинколид); противовоспалительные вещества (например, ингибиторы ЦОГ, НПВС, дополнительно или исключительно имеющие амилоид-бета-снижающие свойства); ингибиторы HMG-CoA редуктазы (статины); ингибиторы ацетилхолинэстеразы (например, донепезил, ривастигмин, такрин, галантамин, мемантин; такрин); антагонисты NMDA рецептора (например, мемантин); агонисты АМРА рецепторов; позитивные модуляторы АМРА рецептора, ампакины, ингибиторы рецепторов обратного захвата моноаминов, вещества, модулирующие концентрацию или высвобождение нейротрансмиттеров; вещества, вызывающие секрецию гормона роста (например, ибутаморена месилат и капроморелин); антагонисты или обратные агонисты CB-I рецептора; антибиотики (например, миноциклин или рифампицин); ингибиторы PDE2, PDE4, PDE5, PDE9, PDE10; обратные агонисты GABAA рецептора, антагонисты GABAA рецептора, агонисты или частичные агонисты или позитивные модуляторы никотиновых рецепторов, агонисты или частичные агонисты или позитивные модуляторы альфа-4-бета-2 никотиновых рецепторов, агонисты или частичные агонисты или позитивные модуляторы альфа 7 никотиновых рецепторов; Н 3 антагонисты гистамина, 5 НТ-4 агонисты или частичные агонисты, 5 НТ-6 антагонисты, антагонисты альфа 2-адренорецепторов, антагонисты кальция, агонисты или частичные агонисты или позитивные модуляторы мускаринового рецептора M1, антагонисты мускаринового рецептора М 2, антагонисты мускаринового рецептора М 4, позитивные модуляторы метаботропного глутаматного рецептора 5 типа,антидепрессанты, такие как циталопрам, флуоксетин, пароксетин, сертралин и тразодон; анксиолитики,такие как лоразепам и оксазепам; антипсихотические средства, такие как арипипразол, клозапин, галоперидол, оланзапин, кветиапин, респиридон и зипрасидон, и другие вещества, которые модулируют рецепторы или ферменты таким образом, что эффективность и/или безопасность соединений согласно изобретению возрастает и/или нежелательные побочные эффекты снижаются. Соединения согласно изобретению могут также применяться в комбинации с иммунотерапевтическими препаратами (например, активная иммунизация амилоидом-бета или его частями или пассивная иммунизация гуманизированными антиамилоид-бета антителами или нанотелами) для лечения вышеупомянутых заболеваний и состояний. Комбинированная терапия включает совместное введение соединения по изобретению и указанный другой агент, последовательное введение соединения и другого агента, введение композиции, содержащей соединение и другой агент, или одновременное введение отдельных композиций, содержащих со- 15020875 единение и другой агент. Подходящие лекарственные формы для введения соединения по формуле будут очевидны среднему специалисту в данной области и включают, например, таблетки, пилюли, капсулы, суппозитории, облатки, пастилки, растворы, сиропы, эликсиры, саше, препараты для инъекций, ингаляционные препараты,порошки и т.п. Содержание фармацевтически активного соединения(й) должно быть в пределах от 0.005 до 10% по весу от всей композиции. Лекарственная форма, содержащая композицию по изобретению, содержит эффективное количество активного ингредиента, необходимое для обеспечения терапевтического эффекта. Композиция может содержать от около 5.000 до около 0.5 мг (предпочтительно от около 1.000 до около 0.5 мг) соединения по изобретению или его солевой формы и может быть произведена в любой форме, подходящей для выбранного пути введения. Подходящие таблетки могут быть получены, например, путем смешивания одного или более соединений в соответствии с формулой I c известными наполнителями, например инертными разбавителями,носителями, дезинтегрантами, адъювантами, сурфактантами, связующими веществами и/или смазывающими веществами. Такие таблетки могут также состоять из нескольких слоев. Способы получения Соединения настоящего изобретения могут быть легко получены согласно следующим реакционным схемам и примерам или их модификациям, используя готовые доступные исходные материалы, реагенты и пригодные синтетические процессы. Многие из реакций могут быть проведены в условиях нагревания в микроволновой печи, или используя другое требуемое нагревание, или используя другие технологии, такие как твердофазный синтез с реагентами/поглотителями или химией в потоке. К этим реакциям также возможно применить варианты, которые известны среднему специалисту, но не раскрытые в деталях. Более того, другие методики для приготовления соединений по изобретению также будут легко доступны среднему специалисту в свете следующих реакционных схем и примеров. Если иное не указано, все переменные имеют значения, как определено ниже. Аббревиатуры, применяемые в эксперименте,раскрыты в перечне и дополнительные сокращения известны среднему специалисту в данной области. В дополнение имеется возможность обратиться к следующим ссылкам, раскрывающим пригодные методы синтеза, как описано у March, Advanced Organic Chemistry, 3rd edition, John WileySons, 1985 or Greeneand Wuts Protective groups in organic Синтез 2nd edition, John Wileysons 1991 and as in Richard Larock,comprehensive organic transformations, 4th edition, VCH publishers Inc, 1989. Схема 1. Синтез ключевого промежуточного соединения А. Приведенное выше промежуточное соединение может быть синтезировано следующими способами или любыми другими способами, которые не раскрываются здесь в деталях, но известны любому специалисту в этой области. Способ 1. 1. R8-Y: Основание, растворитель 2. R9-Y: Основание, растворитель Способ 1. Исходя из подходящего кетона, возможно последовательно алкилировать c помощью алкилгалоидов, трифлатов и мезилатов, используя основания, такие как LDA, NaH в различных растворителях, таких как ТГФ, DME и т.д., при температурах, изменяющихся от -78 до 50 С. Каждое алкилирование может быть проведено последовательно, при этом выделенное каждое промежуточное соединение очищают или в одной емкости постадийно. В случае, если конечный продукт, полученный в приведенных выше реакциях, имеет заместитель на алкильной группе, такой как олефин, сульфон, циано и т.д., он может быть дополнительно подвергнут манипуляциям, таким как циклизация по Дикману, циклизация с метатезисом (RCM) или другим известным реакциям, таким как циклоприсоединение, нуклеофильное замещение и т.д., чтобы получить высокофункционализированные спироциклические промежуточные соединения. Способ 2 представляет специфический способ синтеза спироциклических соединений через реакцию Дильса-Альдера или через другие реакции циклоприсоединения, такие как 1,3-диполярное циклоприсоединение. Первая стадия включает конденсацию кетона с формальдегидом, альдегидами и кетонами в присутствии любой протонной кислоты или бороновой кислоты, в растворителях, таких как бензол или толуол, при температурах, изменяющихся от комнатной температуры до 80 С. Диенофиловое (или енон) промежуточное соединение затем может реагировать с различными диенами, используя реакцию Дильса-Альдера. Эта реакция может быть проведена в чистом виде или в присутствии непротонных растворителей, таких как бензол, ТГФ, в герметичной трубке при температуре 30-220 С. Кроме того, возможно использование кислот Льюиса или любых других агентов, которые могут способствовать получению в реакции чистых энантиомеров или диастереомеров. Полученный спироциклический циклогексильный продукт может необязательно содержать один или более алкил/арильных заместителей или функциональных групп, таких как кетон, альдегид, циано и т.д. Эти функциональные группы могут быть подвергнуты дополнительной обработке c помощью известных процессов трансформации функциональной группы. Например, реакция диенофила с диеном Данишефски в кипящих растворителях, таких как бензол или толуол, в атмосфере азота, приводит к спироциклогексанону. Спироциклогексанон может быть дополнительно обработан c помощью реакций, таких как восстановление гидридами, подобнымиNaBH4, LAH, DiBAL и т.д., чтобы получить спирт. Этот спирт может быть дополнительно алкилирован c помощью различных алкильных групп в присутствии основания, такого как NaH или LiHMDS в растворителях, таких как ДМФ, ТГФ и т.д., при комнатной температуре, чтобы получить спироциклические алкилэфиры. Спирт также может быть подвергнут реакции с арил/гетероарилгалоидами в присутствии палладиевого или медного катализатора одновременно с подходящими основаниями, такими как Cs2CO3 чтобы получить арильные простые эфиры. Альтернативно, кетонная функциональная группа может быть дополнительно модифицирована c помощью известных из уровня техники процессов для получения гетероциклических или других бициклических кольцевых систем. Дополнительно к диенофилу промежуточное соединение может также взаимодействовать с 1,3 илидами для получения 5-членных спироциклических гетероциклов или карбоциклов. Применение указанных реакций циклоприсоединения подробно описано в уровне техники и примеры их приведены в ссылках. Синтез гетероциклов через циклоприсоединения, том 1 By Alfred Hassner,Topic в томе 12 гетероциклической химии 12, 1st edition, springer, 2008 и реакции циклоприсоединения в Органическом Синтезе; Kobayashi and Jrgensen, 1st edition, Wiley-VCH, 2002. Способ 3. В способе 3, исходя из алкил или циклоалкил или гетероциклоалкильных производных, содержащих электронодонорные группы,такие как циано или эфирные группы,алкил/циклоалкил/гетероциклоалкильные группы могут быть алкилированы c помощью необязательно замещенных ортогалогенбензилбромидов или хлоридов, используя основание, такое как LDA, NaH, илиLiHMDS в растворителях, таких как бензол, ТГФ и т.д., при температурах в интервале от -78 до 80 С. Алкилированное промежуточное соединение может быть выделено и дополнительно обработано основанием, таким как н-BuLi или LDA, в апротонных растворителях, таких как ТГФ, гексан и т.д., для инициирования циклизации с получением конечного промежуточного соединения А. Альтернативно, можно использовать химию переходного металла, такую как Pd/Cu или Rh, содержащий хелатные агенты, такие как фосфиновые производные или амины в растворителях, таких как ДМФА, DMA, ТГФ и толуол, в присутствии основания (TEA или K2CO3) при температурах, изменяющихся от комнатной температуры до 80 С. В случае, если конечный продукт, полученный указанными выше реакциями, получает заместитель на алкильной группе, такой как олефины или сульфоны, циано и т.д., они могут быть дополнительно вовлечены в реакции, такие как циклизация по Дикману, RCM или другие реакции, такие как циклоприсоединение, нуклеофильное присоединение и т.д., для того, чтобы получить высокофункционализированные спироциклические промежуточные соединения. Способ 4 представляет собой реакцию в одном сосуде ("in one pot"), направленную на синтез спироциклического кетонного промежуточного соединения А. Исходя из подходящего кетона, возможно применить химию алкилирования на внутренней границе бисалкилгалоидов/трифлатов или мезилатов в присутствии оснований, таких как LDA, LiHMDS, и в апротонных растворителях, таких как ТГФ, диоксан, эфир и т.д., при температурах, изменяющихся от 0 до 80 С, с образованием спироциклического промежуточного соединения А. Альтернативно, кетоны могут реагировать с акрилатами в присутствии основания, такого какKotBu, и растворителей, таких как трет-бутанол, с последующим декарбоксилированием -кето эфира с образованием спироциклического кетонного промежуточного соединения А. Схема 2. Синтез моноциклических гетероциклических аминов. Кетонное промежуточное соединение А может быть дополнительно функционализировано и циклизовано с образованием различных моноциклических гетероциклов, как описано в "Comprehensive Heterocyclic Chemistry: The Structure, Reactions, Synthesis and Uses of Heterocyclic Compounds: Structure, Reactions, Synthesis and Uses of Heterocyclic Compound" by Katritzky and Rees, Wiley and sons, 3rd edition 1991,or as described in Heterocyclic Chemistry by Joule Keith Mills. 5th edition by Wiley. Альтернативно, способы,раскрытые в WO 2008/103351, также могут быть применены в синтезе различных моноциклических гетероциклов. Представленные примеры некоторых моноциклических аминогетероциклов приведены ниже. Схема 2 а. Синтез 2,5-дигидро-1,2,4-оксадиазол-3-аминовый гетероцикл. Основание, растворитель Кетонное промежуточное соединение конденсируют с триметилсилилкарбодиимидом в присутствии кислот Льюиса, таких как изопропоксид титана в растворителях, таких как DCM или ТГФ при комнатной температуре с образованием N-цианоиминного продукта. Имин последовательно конденсируют с производным гидроксиламина в присутствии оснований, таких как метилат натрия, в протонном растворителе, таком как метанол, трет-бутанол и т.д., при комнатной температуре с образованием желаемого 1,2,4-оксадиазол-3-аминового гетероцикла. Схема 2b. Синтез 2-амино-1 Н-имидазол-5(4 Н)-она.N-цианосодержащее промежуточное соединение, описанное на схеме 2 а, взаимодействует с карбонатом аммония и KCN в смеси протонных растворителей, таких как этанол/вода, при нагревании в интервале 50-150 С в течение ночи в герметичной трубке. Полученный гидантоин может быть алкилирован различными алкилирующими агентами в присутствии неорганических снований, таких как Cs2CO3 илиK2CO3, или органических оснований, таких как TEA или DBU, в различных растворителях, таких как этанол, ДМФА или диоксан, при температурах в интервале от комнатной температуры до 120 С. Полученный алкилированный продукт взаимодействует с серосодержащими реагентами, такими реагент Лоуссона или P2S5, в растворителе, таком как ТГФ, диоксан, толуол и т.д., при температурах в интервале 50150 С. Тиоимид затем превращают в 2-аминоимидазалинон взаимодействием с трет-бутил гидропероксидом в присутствии аммиака и/или алкиламинов. Альтернативно, синтез 2-аминоимидазолинона может быть реализован, исходя из гидантоина путем превращения его в тиоимид, с последующим бис-алкилированием тиоамидных и имидных функций в процессе "в одном сосуде". Такой бис-алкилирующий реагент может реагировать с гидроксидом аммония и иодидом аммония в различных растворителях, таких как ДМФА, этанол, диоксан и т.д., при температурах в интервале от комнатной температуры до 150 С в герметичной трубке с образованием 2-амино- 18020875 1 Н-имидазол-5(4 Н)-она. Аналогичный процесс может быть выполнен, исходя из кетонного промежуточного соединения А. Схема 2 с. Синтез 2-амино-5,6-дигидропиримидин-4(3 Н)-она. Промежуточное соединение кетона А может быть конденсировано с t-бутилсульфониламином или любым другим амином, таким как -метилбензиламин, в дегидратирующих условиях, как можно видеть на примере алкоксидтитановых реагентов или в аппарате Дина Старка. Имин взаимодействует с различными нуклеофилами, как проиллюстрировано на литерованном этилацетате. Снятие защиты с tбутилсульфонамида достигают реакцией с кислотами, такими как HCl, в протонных растворителях, таких как метанол и т.д. Аминоэфирное промежуточное соединение затем конденсируют с тиофосгеном или эквивалентным ему реагентом, чтобы превратить аминоэфир в тиоизоцианатный эфир. Конденсация тиоизоцианатного промежуточного соединения с различными первичными/вторичными аминами дает тиодигидропиримидинон. Тиодигидропиримидинон может быть превращен в 2-амино дигидропиримидинон, используя способы, аналогичные описанным в схеме 2b. Схема 2d. Синтез 5,6-дигидро-4 Н-1,3-оксазин-2-амина. Иминовое промежуточное соединение, полученное в приведенном выше примере, может взаимодействовать с углеродными нуклеофилами, такими как аллилмагнийбромид, с образованием сульфонамида. Олефин последовательно окисляют до альдегида c помощью озонолиза или по любой другой аналогичной методике. Получают спирт из реакции альдегида с восстанавливающими агентами, такими как боргидрид натрия, используя реагенты Гриньяра, чтобы получить первичные и вторичные спирты. Полученный аминоспирт может реагировать с цианбромидом в протонных растворителях при комнатной температуре с образованием 5,6-дигидро-4 Н-1,3-оксазин-2-аминовых производных. Схема 2 е. Синтез 5,6-дигидро-2 Н-1,2,4-оксадиазин-3-амина или 1,2,5,6-тетрагидро-1,2,4-триазин-3 амина. Кетонное промежуточное соединение А может быть превращено в олефин, используя реакцию Виттига или любую ее модификацию, известную из уровня техники. Олефин гидроборируют c помощью борана или его эквивалента в апротонных растворителях, таких как ТГФ, DCM, диэтиловый эфир и т.д.,при комнатной температуре. Спирт конденсируют с сульфамоилхлоридом в присутствии основания, такого как NMM, TEA, в растворителях, таких как DCM, при комнатной температуре. Циклизация метилсульфамата может быть инициирована c помощью родиевого катализатора в присутствии окисляющего агента, такого как фенилиодацетата, в растворителях, таких как толуол, ацетонитрил, дихлорметан, при температуре от комнатной до температуры кипения растворителя. Циклический сульфамат затем активируют для нуклеофильной атаки взаимодействием с хлорформиатами, с последующим добавлением нуклеофила, такого как алкоксид, как проиллюстрировано на boc защищенном-N-замещенном гидроксиламине. Защитная группа, такая как t-бутилкарбамат, может быть регенерирована и полученный аминоспирт конденсируют с цианбромидом в растворителях, таких как этанол, с образованием 2,4-оксадиазин 3-аминового или 1,2,5,6-тетрагидро-1,2,4-триазин-3-аминового гетероциклов. Схема 2f. Синтез 5,6-дигидро-4 Н-1,3-тиазин-2-амина. Кетонное промежуточное соединение А взаимодействует с производным винилмагния или замещенным виниллития при комнатной температуре в растворителях, таких как ТГФ, эфир, толуол или в гексане с образованием винилового спирта. Виниловый спирт подвергается электрофильному замещению в кислотных условиях (таких как АсОН/1 М HCl или MeSO3H) в присутствии тиомочевины с образованием производного виниловой тиомочевины. Указанное промежуточное соединение может быть циклизовано в 1,3 тиазин-2-амин в случае выдерживания в сильных кислотных условиях, какTFA/MeSO3H, при комнатной температуре в течение ночи. Схема 3. Получение моногетероциклического промежуточного соединения. Моногетероциклическое промежуточное соединение. Моногетероциклическое промежуточное соединение А, содержащее галогены на бензольном кольце, может быть дополнительно подвергнуто известным органическим трансформациям, таким как конденсация по Сузуки боронатов или трифторборатов с пинаколборонатами, используя различные палладиевые катализаторы, такие как Pd[P(Ph3)3] или Pd(dppf)2Cl2 или любой похожий катализатор, в присутствии нерганических оснований, таких как K2CO3, CSCO3, в различных растворителях, либо в одном растворителе, либо в комбинации, содержащей толуол, DMF, этанол, воду и т.д., при температуре в интервале 50-100 С. Возможно использовать медь при синтетическом пути через конденсацию Соногашира для введения алкиновых заместителей на основу. Альтернативно, возможно использовать дополнительно методики химии переходного металла для введения алкиновых, алкеновых, ариловых, гетероциклов и дополнительных функциональных групп. Множество таких химических трансформаций раскрыты в следующими ссылках: Transition Metals for Organic Synthesis: Building Blocks and Fine Chemicals, by Bellerand Bolm, 2nd Edition by Wiley-VCH, 2002 and in Modern Arilation Methods by Lutz Ackermann, 1st edition,2009. Например, аминогетероцикл бромсодержащего промежуточного соединения защищают как Boc производное, используя Boc ангидрид в растворителях, таких как ТГФ, DCM, при комнатной температуре. Это дает превращение бромпроизводного в соответствующее пинаколборонатное производное, как описано в уровне техники. Пероксидное окисление пинаколбороната приводит к спирту, затем доступный выбор. Спирт может быть дополнительно алкилирован различными алкил/циклоалкил/гетероалкильными галоидами в присутствии оснований, таких как Cs2CO3, KOtBu илиTEA в растворителях, таких как ДМФА или диоксан. Кроме того, спирт может быть арилирован в различных условиях конденсации с образованием арил/гетероарильных эфиров. Boc группа дополнительно удаляется с образованием конечного соединения. Схема 4. Синтез ключевого промежуточного соединения с кольцом, являющимся циклогексильной группой, замещенной c помощью -OR5. Примеры реагентов и условия реакции описаны в примере 410G. Схема 5. Синтез ключевого промежуточного соединения с кольцом А, являющимся циклогексильной группой, замещенной c помощью -ОН. Пригодные реагенты и условия реакции для реакции Гриньяра могут быть использованы для реакции, описанной на схеме. Примеры реагентов и условия реакции раскрыты в примере 410I. В случаях, когда синтетические промежуточные соединения и конечные продукты формулы (А), (I') или (I), описанные ниже, содержат потенциально реакционноспособные функциональные группы, например амино, гидроксильную, тиольную и карбоксильную группы, которые могут пересекаться с желаемой реакцией, возможно полезно применить защитные формы промежуточного соединения. Способы выбора, введения и последующего удаления защитных групп хорошо известны из уровня техники (T.W.Greene and P.G.M. Wuts "Protective groups in Organic Synthesis", John WileySons, Inc., New York 1999). Такие манипуляции с защитной группой содержатся в дискуссии ниже и обычно не обсуждаются специально. Как правило, реагенты в реакционных схемах используют в эквимолярных количествах; однако в некоторых случаях может быть желательным использовать избыток одного из реагентов для доведения реакции до завершения. В особенном случае, когда используют избыток реагента, он может быть легко удален отгонкой или экстракцией. Основания, применяемые для нейтрализации HCl в реакционных смесях, как правило, используются при небольшом избытке (1.05-5 экв.). Соединения по изобретению могут быть получены, применяя обычные способы, которые используют готовые доступные реагенты и исходные материалы. Реагенты, используемые в приготовлении соединений по настоящему изобретению, могут быть либо коммерчески доступными, либо могут быть получены по стандартным методикам, описанным в уровне технике. Представленные соединения по настоящему изобретению могут быть получены, используя следующие синтетические схемы. Способы синтеза Пример 1. Получение 3-(спиро[спиро[2,3-дигидроинден-2,2'-тетрагидронафталин]-1,5'-(3-амино-2 метил-2H-[1,2,4]оксадиазол)]-6-ил)бензонитрила (соединение 45). Стадия 1. 2-(2-(Гидроксиметил)фенил)этанол. К раствору 2-(карбоксиметил)бензойной кислоты (9 г, 0.05 моль) в ТГФ (200 мл) по каплям добавляют к LAH в ТГФ (250 мл), смесь кипятят в течение 18 ч. Смесь охлаждают в бане со льдом и по каплям осторожно добавляют воду, а затем 50% раствор NaOH (150 мл), затем убирают баню со льдом и медленно добавляют воду при перемешивании до тех пор, пока серый осадок не станет белым. Смесь фильтруют и фильтрат концентрируют, что дает сырой 2-(2-(гидроксиметил)фенил)этанол (6 г, 80%). Стадия 2. 1-(2-Бромэтил)-2-(бромметил)бензол. К раствору 2-(2-(гидроксиметил)фенил)этанола (2.6 г, 17 ммоль), пербромметана (13.7 г, 41.8 ммоль) в DCM (100 мл) добавляют трифенилфосфин (10.95 г, 41.8 ммоль) при 0 С, смесь перемешивают при комнатной температуре в течение 18 ч. Смесь концентрируют, снова растворяют в Et2O, фильтруют,органический слой концентрируют, что дает сырой 1-(2-бромэтил)-2-(бромметил)бензол (4.2 г, 89%). 1 Н ЯМР (CD3OD): 3.69 (m, 2 Н), 4.05 (m, 2 Н), 4.97 (m, 2 Н), 7.64-7.77 (m, 4 Н). Стадия 3. Диэтил 2-(4-бромбензил)малонат. К раствору СН 3 СН 2 ОН (240 мл) добавляют Na (5.82 г, 0.25 моль), смесь перемешивают до тех пор,пока Na не исчезнет, затем медленно добавляют 1-бром-4-бромметилбензол (37.35 г, 0.15 моль), диэтиловый эфир малоновой кислоты (78 г, 0.49 моль), смесь кипятят в течение ночи. Растворитель удаляют в вакууме, остаток растворяют в Н 2 О, экстрагируют эфиром, органический слой промывают c помощью 0.5N водного раствора HCl, затем промывают рассолом, сушат над Na2SO4, концентрируют, что дает диэтил 2-(4-бромбензил)малонат (40 г, 85%). Стадия 4. 2-(4-Бромбензил)малоновая кислота. Диэтил 2-(4-бромбензил)малонат (40 г, 13 ммоль) и KOH (42.8 г, 76 ммоль) растворяют в смеси НОАС-Н 2 О-ТГФ (1:2:3, 200 мл), смесь кипятят в течение 12 ч. Растворитель удаляют в вакууме, к остатку добавляют водный раствор HCl, затем экстрагируют c помощью EtOAc, промывают рассолом, сушат над Na2SO4, концентрируют, что дает 2-(4-бромбензил)малоновую кислоту (31 г, 95%). Стадия 5. 3-(4-Бромфенил)пропановая кислота. 2-(4-Бромфенил)малоновую кислоту (36 г, 11 ммоль) нагревают при 165 С до выделения СО 2. Продукт кристаллизуют из петролейного эфира, что дает 2-(4-бромфенил)уксусную кислоту (26 г, 87%). Стадия 6. 6-Броминдан-1-он. Смесь 3-(4-бромфенил)пропановой кислоты (26 г, 12 ммоль) в SOCl2 (50 мл) кипятят в течение ночи, смесь концентрируют, затем добавляют к AlCl3 (80 г, 61 ммоль) в DCM (100 мл), смесь перемешивают при комнатной температуре в течение ночи. Смесь гасят водным раствором HCl, экстрагируют c помощью DCM, промывают рассолом, сушат над Na2SO4, концентрируют, что дает 6-броминдан-1-он (12 г,48%). 1 Н ЯМР (CD3OD): 2.65 (m, 2H), 3.06 (m, 2H), 7.31 (m, 1H), 7.62 (m, 1H), 7.80 (m, 1H). Стадия 8. 3-(1-Оксо-1,3,3',4'-тетрагидро-1'H-спиро[индан-2,2'-нафталин]-6-ил)бензонитрил. К 6-бром-3',4'-дигидро-1'H-спиро[индан-2,2'-нафталин]-1(3H)-ону (163 мг, 0.5 ммоль), 3 цианофенилбороновой кислоте (147 г, 1 ммоль) в [1,4]-диоксане (12 мл), Cs2CO3 (2N, 3.2 мл), затем добавляют Pd(PPh3)2Cl2 (5 мг, 0.01 ммоль) в атмосфере Ar2, смесь кипятят в течение 30 мин. Реакционную смесь концентрируют в вакууме, что дает остаток, который очищают c помощью ТСХ, что дает 3-(1 оксо-1,3,3',4'-тетрагидро-1'H-спиро[инден-2,2'-нафталин]-6-ил)бензонитрил (35 мг, 6%). 0.1 ммоль) в DCM (5 мл) по каплям добавляют TiCl4 (76 мг, 0.4 ммоль), смесь перемешивают при 50 С в атмосфере Ar2 под микроволновым излучением в течение 5 мин, по каплям добавляют N,N'метандиилиден-бис-(1,1,1-триметилсиланамин) (74 мг, 0.4 ммоль). Смесь перемешивают при 60 С в атмосфере Ar2 под действием микроволнового излучения в течение 10мин и выливают в воду со льдом (10 мл). Водный слой экстрагируют c помощью CH2Cl2, который объединяют c органическим слоем. Органический слой сушат и концентрируют, что дает сырой (Z)-N-(5-(3-цианофенил)-3',4'-дигидро-1'Hспиро[индан-2,2'-нафталин]-3(1H)-илиден)цианамид (50 мг, 93%).MeONa (0.026 мл, 25 мас.% в МеОН), а затем (Z)-N-(5-(3-цианофенил)-3',4'-дигидро-1'H-спиро[индан 2,2'-нафталин]-3(1H)-илиден)цианамид (50 мг, 0.13 ммоль). После перемешивания в течение 10 мин растворитель удаляют в вакууме. Сырой продукт очищают c помощью препаративной ВЭЖХ, что дает соединение, указанное в названии в виде трифторацетата. 1 Н ЯМР (CD3OD, 400 МГц):8.05 (m, 1H), 7.99 (m, 2H), 7.84 (m, 1H), 7.79-7.62 (m, 4H), 7.66 (m,1H), 7.43 (m, 1H), 7.18-7.07 (m, 2H), 3.34 (s, 3H). Стадия 1. Получение 6-бром-2',3',5',6'-тетрагидроспиро[инден-2,4'-пиран]-1(3 Н)-она. К раствору 6-бром-1-инданона (1.033 г, 4.89 ммоль) в безводном ТГФ (100 мл) в атмосфере N2 при комнатной температуре добавляют раствор t-BuOK в t-BuOH (1 M, 10.3 мл, 10.3 ммоль) в течение 30 мин(цвет становится глубоко-черным при добавлении капли раствора t-BuOK), а затем добавляют 1-бром-2(2-бромэтокси)этан (1.134 г, 0.62 мл, 4.89 ммоль). Реакцию гасят насыщенным водным раствором NH4Cl и дважды экстрагируют эфиром. Объединенные органические фазы промывают Н 2 О, рассолом, сушат над безводным Na2SO4, фильтруют и концентрируют, что дает смолу черного цвета. Смолу очищают c помощью флэш-хроматографии на силикагеле, что дает 300 мг целевого продукта.MC ESI +ve m/z 281 (М+Н)+. Стадия 2. Получение 3-(1-оксо-1,2',3,3',5',6'-гексагидроспиро[инден-2,4'-пиран]-6-ил)бензонитрила. В СЕМ микроволновую тестовую трубку объемом 10 мл загружают Cs2CO3 (232 мг, 0.712 ммоль),PdCl2(PPh3)2 (20 мг, 0.028 ммоль), 6-бром-2',3',5',6'-тетрагидроспиро[инден-2,4'-пиран]-1(3 Н)-он (100 мг,0.356 ммоль), 3-цианофенилбороновую кислоту (78 мг, 0.534 ммоль), диоксан (4 мл) и Н 2 О (0.4 мл), систему заполняют N2 и закрывают, нагревают в СЕМ микроволновом реакторе при 100 С в течение 10 мин. Реакционную смесь разбавляют c помощью DCM, промывают рассолом, сушат над безводным Na2SO4,фильтруют и концентрируют. Остаток очищают c помощью флэш-хроматографии на силикагеле, элюируя ЭА в гексане (0-30%), что дает 42 мг 3-(1-оксо-1,2',3,3',5',6'- гексагидроспиро[инден-2,4'-пиран]-6 ил)бензонитрила. МС ESI +ve m/z 304 (М+Н)+. Стадия 3. Получение N-(5-(3-цианофенил)-2',3',5',6'-тетрагидроспиро[инден-2,4'-пиран]-3(1 Н)илиден)цианамида. К раствору 3-(1-оксо-1,2',3,3',5',6'-гексагидроспиро[инден-2,4'-пиран]-6-ил)бензонитрила (42 мг,0.139 ммоль) в безводном DCM (10 мл) в атмосфере N2 по каплям добавляют 1 М раствор TiCl4 (в DCM,0.28 мл, 0.28 ммоль) в течение 15 мин при комнатной температуре. После добавления раствор перемешивают еще 1 ч. К этой смеси по каплям добавляют бис-триметилсилилкарбодиимид (0.1 мл, 0.427 ммоль). Результирующую смесь перемешивают в течение ночи. Реакционную смесь гасят водой со льдом (20 г),перемешивают в течение 20 мин, затем ее переносят в делительную воронку, отделенную водную фазу экстрагируют 2 раза c помощью DCM. Объединенные органические фазы сушат над безводным Na2SO4,- 28020875 фильтруют и концентрируют, что дает 44 мг N-(5-(3-цианофенил)-2',3',5',6'-тетрагидроспиро[инден-2,4'пиран]-3(1 Н)-илиден)цианамида в виде твердого вещества светло-коричневого цвета, которое используют на следующей стадии без дополнительной очистки. МС ESI +ve m/z 328 (М+Н)+. Стадия 4. 3-(Спиро[спиро[2,3-дигидроинден-2,1'-(4-оксациклогексан)]-1,5'-(3-амино-2-метил-2 Н[1,2,4]оксадиазол)]-6-ил)бензонитрил. К суспензии сырого продукта, полученного на предыдущей стадии, в МеОН (5 мл) добавляют раствор N-метилгидроксиламина в МеОН (0.373 М, 0.40 мл, полученного из гидрохлорида Nметилгидроксиламина и 0.9 экв. 25 мас.% NaOMe/MeOH в МеОН). Смесь перемешивают при комнатной температуре в течение 20 мин c последующим добавлением еще одной порции N-метилгидроксиламина в МеОН (0.373 М, 1 мл). Растворитель удаляют при пониженном давлении после того, как перемешивают еще в течение 20 мин. Остаток очищают c помощью препаративной ВЭЖХ, что дает 16.5 мг указанного в название соединения в виде трифторацетата. 1 Н ЯМР (CD3OD, 400 МГц):8.02-7.90 (m, 3 Н), 7.79-7.62 (m, 3 Н), 7.48 (d, J=7.6 Гц, 1H), 4.05-3.92-78 С добавляют раствор NHMDS (1 M в ТГФ, 2.5 мл, 2.5 ммоль) в течение 30 мин c последующим добавлением TMSCl (0.281 г, 0.327 мл 2.59 ммоль), спустя 30 мин перемешивания. К данной реакционной смеси добавляют NHMDS (1 M в ТГФ, 6.0 мл, 6.0 ммоль) в течение 30 мин при данной температуре. Температуре позволяют нагреться от -30 до -20 С, после того как перемешивают еще в течение 30 мин,добавляют 2,2-дихлордиэтиловый эфир (336 мг, 0.275 мл, 2.35 ммоль). Затем температуре реакции позволяют нагреться до комнатной температуры без удаления охлаждающей бани и перемешивают в течение ночи. Реакцию гасят насыщенным водным раствором NH4Cl и дважды экстрагируют c помощью ЭА. Объединенные органические фазы промывают последовательно 1 М раствором HCl, Н 2 О, рассолом, сушат над безводным Na2SO4, фильтруют и концентрируют, что дает масло черного цвета. Масло очищаютc помощью флэш-хроматографии на силикагеле, что дает 103 мг целевого продукта. МС ESI +ve m/z 281 (М+Н)+. Стадия 2. 3-(3-Оксо-2,2',3,3',5',6'-гексагидроспиро[инден-1,4'-пиран]-5-ил)бензонитрил. В СЕМ микроволновую тестовую трубку объемом 10 мл загружают Cs2CO3 (147 мг, 0.45 ммоль),PdCl2(PPh3)2 (20 мг, 0.028 ммоль), 5-бром-2',3',5',6'-тетрагидроспиро[инден-1,4'-пиран]-3(2 Н)-он (51 мг,0.18 ммоль), 3-цианофенилбороновую кислоту (35 мг, 0.24 ммоль), диоксан (3 мл) и Н 2 О (0.1 мл), систему заполняют N2, закрывают и нагревают в СЕМ микроволновом реакторе при 100 С в течение 10 мин. Реакционную смесь разбавляют c помощью DCM, промывают рассолом, сушат над безводным Na2SO4,фильтруют и концентрируют. Остаток очищают c помощью флэш-хроматографии на силикагеле, элюируя ЭА в гексане (0-30%), что дает 42 мг 3-(3-оксо-2,2',3,3,5',6'-гексагидроспиро[инден-1,4'-пиран]-5 ил)бензонитрила в виде твердого вещества белого цвета. МС ESI +ve m/z 304 (М+Н)+. Стадия 3. Получение N-(5-(3-цианофенил)-2',3',5',6'-тетрагидроспиро[инден-1,4'-пиран]-3(2 Н)илиден)цианамида. К раствору 3-(3-оксо-2,2',3,3',5',6'-гексагидроспиро[инден-1,4'-пиран]-5-ил)бензонитрила (42 мг,0.139 ммоль) в безводном DCM (10 мл) в атмосфере N2 по каплям добавляют 1 М раствор TiCl4 (в DCM,0.28 мл, 0.28 ммоль) в течение 15 мин при комнатной температуре. Раствор перемешивают еще в течение
МПК / Метки
МПК: C07D 277/60, A61K 31/428, A61K 31/4245, C07D 491/10, C07D 235/02, C07D 239/70, C07D 498/10, A61K 31/519, C07D 403/06, C07D 271/12, C07D 487/10, A61K 31/517, C07D 405/12, A61K 31/4184, A61K 31/4188
Метки: ингибиторы, бета-секретазы
Код ссылки
<a href="https://eas.patents.su/30-20875-ingibitory-beta-sekretazy.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы бета-секретазы</a>
Предыдущий патент: Антагонисты с5ar
Следующий патент: Твердотопливный котел
Случайный патент: Электромагнитный двигатель