Ингибиторы 11-бета-гидроксистероид дегидрогеназы 1
Номер патента: 15106
Опубликовано: 30.06.2011
Авторы: Снайдер Нэнси Джун, Сюй Яньпин, Уоллэйс Оуэн Брендан, Мэбри Томас Эдвард, Ли Жэньхуа, Буш Джули Кей, Хансен Марвин Мартин
Формула / Реферат
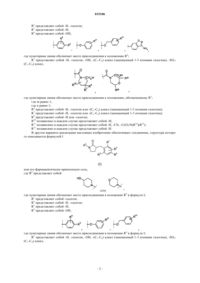
1. Соединение структурной формулы
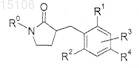
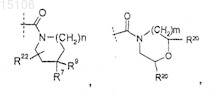
где R0 представляет собой
где пунктирная линия указывает место присоединения к положению R0;
R1 представляет собой -галоген;
R2 представляет собой -Н, -галоген;
R3 представляет собой -Н;
R4 представляет собой -ОН,
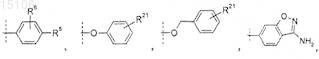
где пунктирная линия обозначает место присоединения к положению R4;
R5 представляет собой -Н, -галоген, -ОН, -(C1-C4) алкил, замещенный 1-3 атомами галогена, -SO2-(С1-С4) алкил,
где пунктирная линия обозначает место присоединения к положению, обозначенному R5;
где m равно 1;
где n равно 1;
R6 представляет собой -Н, -галоген или -(C1-C4) алкил, замещенный 1-3 атомами галогена;
R7 представляет собой -Н, -галоген или -(C1-C4) алкил, замещенный 1-3 атомами галогена;
R9 представляет собой -Н или -галоген;
R20 независимо в каждом случае представляет собой -Н;
R21 независимо в каждом случае представляет собой -Н, -CN, -C(O)-N(R22)(R22);
R22 независимо в каждом случае представляет собой -Н;
или его фармацевтически приемлемая соль.
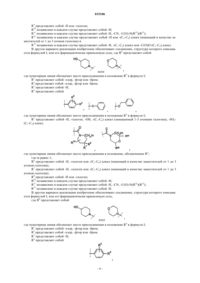
2. Соединение по п.1, отличающееся тем, что
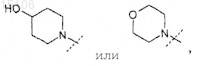
R0 представляет собой
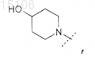
или его фармацевтически приемлемая соль.
3. Соединение по п.1, отличающееся тем, что
R0 представляет собой
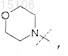
или его фармацевтически приемлемая соль.
4. Соединение по любому из пп.1-3, отличающееся тем, что R1 и R2представляют собой хлор, или его фармацевтически приемлемая соль.
5. Соединение по любому из пп.1-4, отличающееся тем, что R3 представляет собой водород, или его фармацевтически приемлемая соль.
6. Соединение по любому из пп.1-5, отличающееся тем, что
R4 представляет собой

или его фармацевтически приемлемая соль.
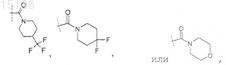
7. Соединение по любому из пп.1-5, отличающееся тем, что
R4 представляет собой
и R6представляет собой -Н,
или его фармацевтически приемлемая соль.
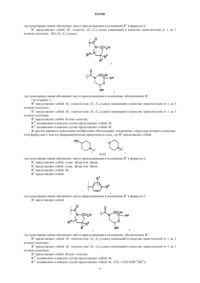
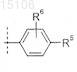
8. Соединение по любому из пп.1-7, отличающееся тем, что
R5 представляет собой
или его фармацевтически приемлемая соль.
9. Соединение по любому из пп.1-7, отличающееся тем, что
R5 представляет собой
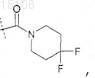
или его фармацевтически приемлемая соль.
10. Соединение по любому из пп.1-7, отличающееся тем, что
R5 представляет собой
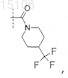
или его фармацевтически приемлемая соль.
11. Соединение по любому из пп.1-7, отличающееся тем, что R5 представляет собой хлор или фтор, или его фармацевтически приемлемая соль.
12. Фармацевтическая композиция, включающая соединение или соль по любому из пп.1-11, и фармацевтически приемлемый носитель.
13. Применение соединения или его соли по любому из пп.1-11 для получения лекарственного средства для лечения диабета 2 типа.
14. Соединение, представляющее собой (R)-3-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-1-(4-гидроксипиперидин-1-ил)пирролидин-2-он, или его фармацевтически приемлемая соль.
15. Соединение, представляющее собой (R)-3-[3,5-дихлор-4'-(4,4-дифторпиперидин-1-карбонил)бифенил-4-илметил]-1-(4-гидроксипиперидин-1-ил)пирролидин-2-он, или его фармацевтически приемлемая соль.
16. Промежуточное соединение для получения соединения по п.14, где промежуточное соединение представляет собой (R)-3-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-5-гидроксидигидрофуран-2-он.
17. Кристаллический (R)-3-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-1-(4-гидроксипиперидин-1-ил)пирролидин-2-он.
18. Кристаллический (R)-3-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-1-(4-гидроксипиперидин-1-ил)пирролидин-2-он по п.17, характеризующийся пиками рентгенограммы при углах дифракции 2q, равных 8,6±0,1° и 15,3±0,1°.
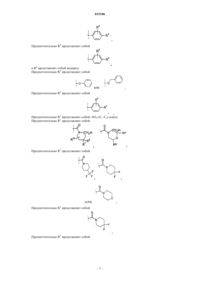
Текст
В настоящем изобретении описаны новые соединения формулы I обладающие антагонистической активностью по отношению к 11HSD 1 типа, а также способы получения таких соединений. В другом варианте реализации изобретение раскрывает фармацевтические композиции, включающие соединения формулы I, a также способы применения таких соединений и композиций для лечения диабета, гипергликемии, ожирения, гипертензии, гиперлипидемии, метаболического синдрома и других патологических состояний, ассоциированных с активностью 11HSD 1 типа.(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) 015106 Данная заявка испрашивает приоритет в соответствии с предварительной заявкой на патент США 60/745475, поданной 24 апреля 2006 г. Настоящее изобретение относится к соединениям, представляющим собой ингибиторы 11-гидроксистероид дегидрогеназы 1 типа (11HSD1), к фармацевтическим композициям, содержащим эти соединения, применению таких соединений и композиций для лечения организма человека или животного и к новым промежуточным соединениям, которые можно применять для получения ингибиторов. Настоящие соединения демонстрируют эффективное и селективное ингибирование 11HSD1 и в этом качестве могут быть полезны при лечении нарушений, чувствительных к модуляции 11HSD1,например диабета, метаболического синдрома, расстройства познавательной способности и т.п. Глюкокортикоиды, функционирующие в печени, жировой ткани и в мышцах, являются важными регуляторами метаболизма глюкозы, липидов и белков. Хронический избыток глюкокортикоидов связан с резистентностью к инсулину, висцеральным ожирением, гипертензией и дислипидемией, которые также представляют собой классические признаки метаболического синдрома. Фермент 11HSD1 катализирует преобразование неактивного кортизона в активный кортизол, и, как полагают, этот фермент вовлечен в развитие метаболического синдрома. Данные, полученные для грызунов и человека, свидетельствуют о связи 11HSD1 с метаболическим синдромом. Данные позволяют предположить, что лекарственный препарат, специфично ингибирующий 11HSD1 у пациентов с диабетом 2 типа, снижает уровень глюкозы в крови, замедляя глюконеогенез в печени, снижает центральное ожирение, улучшает атерогенный липопротеиновый фенотип, уменьшает кровяное давление и снижает резистентность к инсулину. Действие инсулина в мышцах должно усиливаться, и секреция инсулина -клетками островков также может возрастать. Данные, полученные при исследовании животных и человека, также свидетельствуют о том, что избыток глюкокортикоидов нарушает познавательную функцию. Недавние результаты указывают, что инактивация 11HSD1 усиливает функционирование памяти как у человека, так и у мышей. Было показано, что ингибитор 11HSD карбеноксолон улучшает познавательную функцию у здоровых пожилых людей и у людей, страдающих диабетом 2 типа, и инактивация гена 11HSD1 предотвращает обусловленные старением повреждения у мышей. Недавно было показано, что селективное ингибирование 11HSD1 фармацевтическим агентом улучшает сохранение информации в памяти у мышей. В последние годы появился ряд публикаций, сообщающих об агентах, ингибирующих 11HSD1. См. международную публикацию заявки WO 2004/056744, описывающую адамантилацетамиды в качестве ингибиторов 11HSD1, международную публикацию WO 2005/108360, в которой в качестве ингибиторов 11HSD описаны производные пирролидин-2-она и пиперидин-2-она, и международную публикацию WO 2005/108361, в которой в качестве ингибиторов 11HSD1 описаны производные адамантилпирролидин-2-она. Несмотря на существование ряда способов лечения заболеваний, в которые вовлечена 11HSD1, современные способы лечения имеют ряд недостатков, в том числе низкую или недостаточную эффективность, неприемлемые побочные эффекты и противопоказания для некоторых групп пациентов. Таким образом, сохраняется потребность в улучшении способов лечения с применением альтернативных или усовершенствованных фармацевтических агентов, которые ингибируют 11HSD1, и,таким образом, могут оказаться полезными при лечении заболеваний, при которых ингибирование 11-HSD1 может оказывать благоприятный эффект. Настоящее изобретение обеспечивает такой вклад в данную область техники благодаря тому, что был обнаружен новый класс соединений, оказывающих сильное и селективное ингибирующее действие на 11HSD1. Отличительной особенностью настоящего изобретения являются представленные конкретные структуры и их активность. Сохраняется потребность в новых способах лечения диабета, метаболического синдрома и расстройств познавательной способности, и задачей настоящего изобретения является удовлетворение данной и других потребностей. Настоящее изобретение обеспечивает соединение, структура которого описывается формулой или его фармацевтически приемлемую соль,где R0 представляет собой где пунктирная линия указывает место присоединения к положению R0;R4 представляет собой -ОН, где пунктирная линия обозначает место присоединения к положению R4;R5 представляет собой -Н, -галоген, -ОН, -(C1-C4) алкил (замещенный 1-3 атомами галогена), -SO2(C1-C4) алкил, где пунктирная линия обозначает место присоединения к положению, обозначенному R5; где m равно 1; где n равно 1;R20 независимо в каждом случае представляет собой -Н;R21 независимо в каждом случае представляет собой -Н, -CN, -C(O)-N(R22)(R22);R22 независимо в каждом случае представляет собой -Н. В другом варианте реализации настоящее изобретение обеспечивает соединение, структура которого описывается формулой I или его фармацевтически приемлемую соль,где R0 представляет собой где пунктирная линия обозначает место присоединения в положение R0 в формуле I;R4 представляет собой -ОН, где пунктирная линия обозначает место присоединения в положение R4 в формуле I; где пунктирная линия обозначает место присоединения в положение, обозначенное R5; где m равно 1; где n равно 1;R20 в каждом случае независимо представляет собой -Н;R20 независимо в каждом случае представляет собой -Н;R21 независимо в каждом случае представляет собой -Н, -CN, -C(O)-N(R22)(R22);R22 независимо в каждом случае представляет собой -Н. Согласно настоящему изобретению предложены соединения формулы I, полезные в качестве эффективных и селективных ингибиторов 11HSD1. Настоящее изобретение, кроме того, обеспечивает фармацевтическую композицию, содержащую соединение формулы I, или его фармацевтическую соль и фармацевтически приемлемый носитель, растворитель или эксципиент. Кроме того, настоящее изобретение обеспечивает способ лечения метаболического синдрома и связанных с ним нарушений, включающий введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы I или его фармацевтически приемлемой соли. В одном варианте реализации настоящее изобретение обеспечивает соединение формулы I или его фармацевтически приемлемую соль, как описано подробно выше. Несмотря на то что все соединения согласно настоящему изобретению подходят для применения, некоторые соединения представляют особенный интерес и являются предпочтительными. Ниже перечислено несколько групп предпочтительных соединений. В другом варианте реализации изобретение обеспечивает соединение, структура которого описывается формулой I, или его фармацевтически приемлемую соль, где R0 представляет собой где пунктирная линия обозначает место присоединения в положение R0 в формуле I; где пунктирная линия обозначает место присоединения в положение R4 в формуле I;R5 представляет собой -Н, -галоген, -ОН, -(C1-C4) алкил (замещенный 1-3 атомами галогена), -SO2(C1-C4) алкил, где пунктирная линия обозначает место присоединения в положение, обозначенное R5; где m равно 1; где n равно 1;R6 представляет собой -Н, -галоген, -CN или -(C1-C4) алкил (имеющий в качестве заместителей от 1 до 3 атомов галогена);R7 представляет собой -Н, -галоген, или -(C1-C4) алкил (имеющий в качестве заместителей от 1 до 3 атомов галогена);R20 независимо в каждом случае представляет собой -Н;R21 независимо в каждом случае представляет собой -Н, -CN, -C(O)-N(R22)(R22);R22 независимо в каждом случае представляет собой -Н или -(C1-С 6) алкил (имеющий в качестве заместителей от 1 до 3 атомов галогена) иR23 независимо в каждом случае представляет собой -Н, -(C1-С 4) алкил или -С(О)О-(C1-C4) алкил. В другом варианте реализации изобретение обеспечивает соединение, структура которого описывается формулой I, или его фармацевтически приемлемую соль, где R0 представляет собой где пунктирная линия обозначает место присоединения в положение R0 в формуле I; где пунктирная линия обозначает место присоединения в положение R4 в формуле I;R5 представляет собой -Н, -галоген, -ОН, -(C1-C4) алкил (замещенный 1-3 атомами галогена), -SO2(C1-C4) алкил, где пунктирная линия обозначает место присоединения в положение, обозначенное R5; где m равно 1;R6 представляет собой -Н, -галоген или -(C1-C4) алкил (имеющий в качестве заместителей от 1 до 3 атомов галогена);R7 представляет собой -Н, -галоген или -(C1-C4) алкил (имеющий в качестве заместителей от 1 до 3 атомов галогена);R20 независимо в каждом случае представляет собой -Н;R21 независимо в каждом случае представляет собой -Н, -CN, -C(O)-N(R22)(R22);R22 независимо в каждом случае представляет собой -Н. В другом варианте реализации изобретение обеспечивает соединение, структура которого описывается формулой I, или его фармацевтически приемлемую соль,где R0 представляет собой где пунктирная линия обозначает место присоединения в положение R0 в формуле I;-4 015106 где пунктирная линия обозначает место присоединения в положение R4 в формуле I;R5 представляет собой -Н, -галоген, -(C1-C4) алкил (имеющий в качестве заместителей от 1 до 3 атомов галогена), -SO2-(C1-C4) алкил, где пунктирная линия обозначает место присоединения в положение, обозначенное R5; где m равно 1;R6 представляет собой -Н, -галоген или -(C1-C4) алкил (имеющий в качестве заместителей от 1 до 3 атомов галогена);R7 представляет собой -Н, -галоген или -(C1-C4) алкил (имеющий в качестве заместителей от 1 до 3 атомов галогена);R20 независимо в каждом случае представляет собой -Н;R22 независимо в каждом случае представляет собой -Н. В другом варианте реализации изобретение обеспечивает соединение, структура которого описывается формулой I, или его фармацевтически приемлемую соль, где R0 представляет собой где пунктирная линия обозначает место присоединения в положение R0 в формуле I; где пунктирная линия обозначает место присоединения в положение R4 в формуле I; где пунктирная линия обозначает место присоединения в положение, обозначенное R5;R6 представляет собой -Н, -галоген или -(C1-C4) алкил (имеющий в качестве заместителей от 1 до 3 атомов галогена);R7 представляет собой -Н, -галоген или -(C1-C4) алкил (имеющий в качестве заместителей от 1 до 3 атомов галогена);R20 независимо в каждом случае представляет собой -Н;R21 независимо в каждом случае представляет собой -Н, -CN, -C(O)-N(R22)(R22);R22 независимо в каждом случае представляет собой -Н иR23 независимо в каждом случае представляет собой -Н, -(С 1-С 4) алкил или -С(О)О-(C1-C4) алкил. В другом варианте реализации изобретение обеспечивает соединение, структура которого описывается формулой I, или его фармацевтически приемлемую соль, где R0 представляет собой где пунктирная линия обозначает место присоединения в положение R0 в формуле I; где пунктирная линия обозначает место присоединения в положение R4 в формуле I;R5 представляет собой -SO2-(C1-C4) алкил,где пунктирная линия обозначает место присоединения в положение, обозначенное R5; где m равно 1;R6 представляет собой -Н, -галоген или -(С 1-С 4) алкил (имеющий в качестве заместителей от 1 до 3 атомов галогена);R7 представляет собой -Н, -галоген или -(C1-C4) алкил (имеющий в качестве заместителей от 1 до 3 атомов галогена). Предусмотрены другие варианты реализации изобретения, при этом каждый из вариантов реализации, описанных выше, дополнительно сужается, как описано в следующих предпочтительных вариантах. В частности, каждый из предпочтительных вариантов, представленный ниже, независимо объединяется с каждым из вариантов реализации, описанным выше, и конкретная комбинация обеспечивает другой вариант реализации, при этом переменная, указанная в предпочтительном варианте, сужена согласно предпочтительному варианту. Предпочтительно R0 представляет собой Предпочтительно R6 представляет собой -Н. Предпочтительно R6 представляет собой -галоген. Предпочтительно R6 представляет собой -(C1-C4) алкил (имеющий в качестве заместителей от 1 до 3 атомов галогена). Предпочтительно R7 представляет собой -Н. Предпочтительно R7 представляет собой-галоген или -(C1-C4) алкил (имеющий в качестве заместителей от 1 до 3 атомов галогена). Предпочтительно R7 представляет собой -галоген. Предпочтительно R7 представляет собой -(C1-C4) алкил (имеющий в качестве заместителей от 1 до 3 атомов галогена). Предпочтительно R9 представляет собой -Н. Предпочтительно R9 представляет собой -галоген. Предпочтительно R7 представляет собой -фтор, и 9R представляет собой -фтор. Предпочтительными вариантами реализации изобретения являются соединения формулы (R)-3-[3,5 дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-1-(4-гидроксипиперидин-1 ил)пирролидин-2-он или их фармацевтически приемлемые соли. Предпочтительными вариантами реализации изобретения являются соединения формулы (R)-3-[3,5-дихлор-4'-(4,4-дифторпиперидин-1 карбонил)бифенил-4-илметил]-1-(4-гидроксипиперидин-1-ил)пирролидин-2-он или их фармацевтически приемлемые соли. Другим вариантом реализации изобретения являются новые препараты промежуточных соединений, описанных в данной заявке, которые применимы для получения ингибиторов 11-HSD1 согласно формуле I и вариантам реализации, описанным выше. Другим вариантом реализации изобретения являются новые препараты промежуточных соединений, описанных в данной заявке, которые применимы для получения (R)-3-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4 илметил]-1-(4-гидроксипиперидин-1-ил)пирролидин-2-она или его фармацевтически приемлемой соли. У пациентов с диабетом 2 типа часто наблюдается развитие "резистентности к инсулину", вызывающей нарушение гомеостаза глюкозы и гипергликемии, что приводит к повышению процента смертности и преждевременным летальным исходам. Нарушение гомеостаза глюкозы связано с ожирением,гипертензией и с изменениями метаболизма липидов, липопротеинов и аполипопротеинов. У людей,страдающих диабетом 2 типа, имеется повышенный риск развития сердечно-сосудистых осложнений,например атеросклероза, коронарной болезни сердца, удара, заболевания периферических сосудов, гипертензии, нефропатии, невропатии и ретинопатии. Таким образом, терапевтический контроль гомеостаза глюкозы, метаболизма липидов, ожирения и гипертензии важен для терапии и лечении сахарного диабета. Многие пациенты, у которых имеется резистентность к инсулину, но у которых не развился диабет 2 типа, также имеют риск развития "синдрома X" или "метаболического синдрома". Метаболический синдром характеризуется резистентностью к инсулину наряду с брюшным ожирением, гиперинсулинемией, повышенным кровяным давлением, низким уровнем ЛВП, высоким содержанием ЛОНП, гипертензией, атеросклерозом, коронарной болезнью сердца и хронической почечной недостаточностью. У таких пациентов имеется повышенный риск развития сердечно-сосудистых осложнений, указанных выше, независимо от того, страдают ли они выраженным сахарным диабетом или нет. Благодаря способности соединений согласно настоящему изобретению ингибировать 11HSD1,они применимы для лечения широкого спектра патологических состояний и нарушений, при которых ингибирование 11HSD1 оказывает благоприятное действие. Такие нарушения и состояния в данной заявке обозначены как "диабетические расстройства" и "нарушения, связанные с метаболическим синдромом". Специалист в данной области способен выявить "диабетические расстройства" и "нарушения,связанные с метаболическим синдромом" по вовлечению в патологический процесс активности 11-HSD1, либо в патофизиологию конкретного нарушения, либо в гомеостатический ответ на конкретное нарушение. Таким образом, соединения могут найти применение, например, для предотвращения, лечения или облегчения симптомов заболевания или патологического состояния, или связанных с ним симптомов или осложнений "диабетических расстройств" и "нарушений, связанных с метаболическим синдромом"."Диабетические расстройства" и "нарушения, связанные с метаболическим синдромом", включают,но не ограничены перечисленными, диабет 1 типа, диабет 2 типа, гипергликемию, гиперактивную инсулинемию, гамартию -клеток, усиление функции -клеток за счет возобновления первой фазы ответа,прандиальную гипергликемию, предотвращение апоптоза, нарушенную гликемию натощак, метаболический синдром, гипогликемию, гипер-/гипокалиемию, стабилизацию уровня глюкагона, увеличение соотношения ЛНП/ЛВП, уменьшение аппетита, расстройства пищевого поведения, потерю веса, синдром поликистозных яичников (СКПЯ), ожирение вследствие диабета, латентный аутоиммунный диабет взрослых (LADA, latent autoimmune diabetes in adult), инсулит, трансплантацию островков, диабет детского возраста, гестационный диабет, поздние осложнения диабета, микро-/макроальбуминурию, нефропатию, ретинопатию, невропатию, диабетические язвы стопы, снижение перистальтики кишечника-8 015106 вследствие введения глюкагона, синдром укороченной тонкой кишки, антидиарейное действие, усиление желудочной секреции, ослабление кровотока, эректильную дисфункцию, глаукому, постхирургический стресс, улучшение повреждений тканей органов, вызванных реперфузией кровотока после ишемической болезни, ишемическое повреждение сердца, сердечную недостаточность, застойную сердечную недостаточность, удар, инфаркт миокарда, аритмию, преждевременную смерть, антиапоптотическое действие,заживляемость ран, нарушение толерантности к глюкозе (IGT), синдромы инсулиновой резистентности,метаболический синдром, синдром X, гиперлипидемию, дислипидемию, гипертриглицеридемию, гиперлипопротеинемию, гиперхолестеролемию, артериосклероз, в том числе атеросклероз, глюкагоному, острый панкреатит, сердечно-сосудистые заболевания, гипертензию, сердечную гипертрофию, желудочнокишечные заболевания, ожирение, диабет, обусловленный ожирением, диабетическую дислипидемию и т.п. Таким образом, настоящее изобретение также обеспечивает способ лечения "диабетических нарушений" и "нарушений, связанных с метаболическим синдромом", который при этом уменьшает и/или устраняет один или более из нежелательных побочных эффектов, ассоциированных с существующими в настоящее время способами лечения. Кроме того, настоящее изобретение обеспечивает соединение формулы I или его фармацевтическую соль, фармацевтическую композицию, включающую соединение формулы I или его фармацевтическую соль, и фармацевтически приемлемый носитель, растворитель или эксципиент для применения для ингибирования активности 11HSD1; для применения для ингибирования обусловленных активностью 11HSD1 ответов клеток у млекопитающих; для применения для снижения уровня глюкозы у млекопитающего; для применения при лечении заболевания, вызванного избыточной активностью 11HSD1; для применения при лечении диабетических и других нарушений, связанных с метаболическим синдромом у млекопитающего; и для применения при лечении диабета, метаболического синдрома, ожирения,гипергликемии, атеросклероза, ишемической болезни сердца, удара, невропатии и заживления ран. Таким образом, способы согласно настоящему изобретению охватывают профилактическое и терапевтическое введение соединения формулы I. Настоящее изобретение, кроме того, обеспечивает применение соединения формулы I или его фармацевтической соли для производства лекарственного средства для ингибирования активности 11-HSD1; для производства лекарственного средства для ингибирования опосредованных активностью 11-HSD1 ответов клеток у млекопитающих; для производства лекарственного средства для снижения уровня глюкозы у млекопитающего; для производства лекарственного средства для лечения заболевания,вызванного избыточной активностью 11HSD1; для производства лекарственного средства для лечения диабетических расстройств и других нарушений, связанных с метаболическим синдромом у млекопитающего, и для производства лекарственного средства для предотвращения или лечения диабета, метаболического синдрома, ожирения, гипергликемии, атеросклероза, ишемической болезни сердца, удара,невропатии и плохой заживляемости ран. Кроме того, настоящее изобретение обеспечивает фармацевтическую композицию, которая включает соединение формулы I, или его фармацевтическую соль и фармацевтически приемлемый носитель,растворитель или эксципиент, предназначенную для применения для ингибирования активности 11-HSD1; предназначенную для применения для ингибирования клеточных ответов, опосредованных активностью 11HSD1; предназначенную для применения для снижения уровня глюкозы у млекопитающего; предназначенную для применения для лечения диабетических и других нарушений, связанных с метаболическим синдромом у млекопитающего; и предназначенную для применения для предотвращения или лечения диабета, метаболического синдрома, ожирения, гипергликемии, атеросклероза, ишемической болезни сердца, удара, невропатии и плохой заживляемости ран. Соединения, предложенные согласно настоящему изобретению, вводят в комбинации с одним или более дополнительным активным веществом в любых подходящих соотношениях. Такие дополнительные активные вещества могут быть выбраны, например, из антидиабетического средства, средства против ожирения, гипотензивного средства, средства для лечения осложнений, вызванных или связанных с диабетом, и средства для лечения осложнений и нарушений, вызванных или связанных с ожирением. Ниже перечислены несколько групп комбинаций. Очевидно, что каждый из упомянутых агентов может быть объединен с другим упомянутым агентом с получением дополнительных комбинаций. Таким образом, настоящие соединения можно вводить в комбинации с одним или более антидиабетическими средствами. Подходящие антидиабетические средства включают инсулин, аналоги и производные инсулина, например, описанные в ЕР 792290 (Novo Nordisk A/S), например NВ 29-тетрадеканоил дес (В 30) инсулин человека, ЕР 214826 и ЕР 705275 (Novo Nordisk A/S), например инсулин человека AspB28, US 5504188 (EliLilly), например инсулин человека LysB28 ProB29, ЕР 368187 (Aventis), например Lantus, GLP-1 и производные GLP-1, например описанные в WO 98/08871 (Novo Nordisk A/S), а также активные при пероральном введении соединения, понижающие уровень сахара в крови. Активные при пероральном введении соединения, понижающие уровень сахара в крови, предпочтительно включают имидазолины, сульфонилмочевины, бигуаниды, меглитиниды, оксадиазолидиндио-9 015106 ны, тиазолидиндионы, сенсибилизаторы инсулина, средства, усиливающее секрецию инсулина, такие как глимепирид, ингибиторы -глюкозидазы, агенты, воздействующие на АТФ-зависимый калиевый канал-клеток, например блокаторы калиевого канала, например, описанные в WO 97/26265, WO 99/03861 иWO 00/37474 (Novo Nordisk A/S), или митиглинид, или такие блокаторы калиевого канала, как BTS67582, натеглинид, антагонисты глюкагона, например такие, как описаны в WO 99/01423 и WO 00/39088(Novo Nordisk A/S и Agouron Pharmaceuticals, Inc.), антагонисты GLP-1, ингибиторы DPP-IV (дипептидилпептидазы), ингибиторы белковой тирозинфосфатазы, ингибиторы ферментов печени, вовлеченные в стимулирование глюконеогенеза и/или гликогенолиза, модуляторы поглощения глюкозы, активаторы глюкокиназы (ГК), например, описанные в WO 00/58293, WO 01/44216, WO 01/83465, WO 01/83478, WO 01/85706, WO 01/85707 и WO 02/08209 (Hoffman-La Roche) или описанные в WO 03/00262, WO 03/00267 и WO 03/15774 (AstraZeneca), ингибиторы GSK-3 (киназы гликогенсинтазы-3), соединения, модифицирующие метаболизм липидов, например противолипидемические агенты, например ингибиторы HMG СоА (статины), соединения, снижающие потребление пищи, лиганды PPAR (рецептора, активируемого пролифератором пероксисом), в том числе подтипов -PPAR, -PPAR и -PPAR, и агонисты RXR (ретиноидного рецептора X), например ALRT-268, LG-1268 или LG-1069. Также соединения настоящего изобретения могут вводиться в комбинации с инсулином или аналогом или производным инсулина, например NB29-тетрадеканоил дем (В 30) инсулина человека, инсулина человека AspB28, инсулина человека LysB28 ProB29, Lantus или смеси, включающей одно или более из перечисленных средств. Соединения настоящего изобретения вводят в комбинации с сульфонилмочевиной, например глибенкламидом, глипизидом, толбаутамидом, хлоропамидемом, толазамидом, глимепридом, гликазидом и глибуридом. А также соединения настоящего изобретения вводят в комбинации с бигуанидом, например метформином. Соединения настоящего изобретения вводят в комбинации с меглитинидом, например репаглинидом или натеглинидом. Соединения настоящего изобретения вводят в комбинации с тиазолидиндионовым сенсибилизатором инсулина, например троглитазоном, циглитазоном, пиоглитазоном, розиглитазоном, изаглитазоном,дарглитазоном, энглитазоном, CS-011/CI-1037 или Т 174, или соединениями, описанными в WO 97/41097, WO 97/41119, WO 97/41120, WO 00/41121 и WO 98/45292 (Dr. Reddy's Research Foundation). Соединение настоящего изобретения можно вводить в комбинации с сенсибилизатором инсулина,таким как, например, GI 262570, YM-440, МСС-555, JTT-501, AR-H039242, KRP-297, GW-409544, CRE16336, AR-H049020, LY510929, МВХ-102, CLX-0940, GW-501516, или соединением, описанным в WO 99/19313, WO 00/50414, WO 00/63191, WO 00/63192, WO 00/63193, например рагаглитазаром (NN 622 или (-)DRF 2725) (Dr. Reddy's Research Foundation) и WO 00/23425, WO 00/23415, WO 00/23451, WO 00/23445, WO 00/23417, WO 00/23416, WO 00/63153, WO 63196, WO 00/63209, WO 00/63190 и WO 00/63189 (Novo Nordisk A/S). Соединения согласно настоящему изобретению вводят в комбинации с ингибитором глюкозидазы, например воглибозой, эмиглитатом, миглитолом или акарбозой. Соединения согласно настоящему изобретению вводят в комбинации с агентом, действующим на АТФ-зависимые калиевые каналы -клеток, например толбутамидом, глибенкламидом, глипизидом, гликазидом, BTS-67 582 или репаглинидом. Соединения согласно настоящему изобретению вводят в комбинации с натеглинидом. Соединения согласно настоящему изобретению вводят в комбинации с противолипидемическим агентом или антигиперлипидемическим агентом, например холестирамином, колестиполом, клофибратом, гемфиброзилом, ловастатином, правастатином, симвастатином, питавастатином, розувастатином,пробуколом, декстротироксином, фенофибратом или аторвастатином. Соединения согласно настоящему изобретению вводят в комбинации с соединениями, уменьшающими потребление пищи. Соединения согласно настоящему изобретению вводят в комбинации более чем с одним из вышеуказанных соединений, например в комбинации с метформином и сульфонилмочевиной, например глибуридом; сульфонилмочевиной и акарбозой; натеглинидом и метформином; репаглинидом и метформином, акарбозой и метформином; сульфонилмочевиной, метформином и троглитазоном; инсулином и сульфонилмочевиной; инсулином и метформином; инсулином, метформином и сульфонилмочевиной; инсулином и троглитазоном; инсулином и ловастатином и т.п. Общие термины, используемые для описания соединений в данной заявке, имеют общепринятые значения. При использовании в данной заявке термины "(C1-С 3) алкил", " (C1-C4) алкил" или " (C1-С 6) алкил" обозначают насыщенные алифатические группы с неразветвленной или разветвленной цепью с указанным количеством атомов углерода, например метил, этил, н-пропил, изопропил, н-бутил, изобутил, вторбутил, трет-бутил и т.п. Термин "(C1-C6) алкокси" обозначает группу С 1-С 6 алкила, присоединенную че- 10015106 рез кислород, и включает такие группы, как, например, метокси, этокси, н-пропокси, изопропокси и т.п. Термин "галоген" относится к фтору, хлору, брому и йоду. Термин "(С 3-С 8) циклоалкил" относится к насыщенному или частично насыщенному карбоциклическому кольцу, включающему от 3 до 8 атомов углерода, как правило, от 3 до 7 атомов углерода. Примеры (С 3-С 8) циклоалкилов включают, но не ограничены перечисленными, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и т.п. Следует понимать, что морские свинки, собаки, кошки, крысы, мыши, хомяки и приматы, включая человека, представляют собой примеры пациентов в пределах значения термина "пациент". Термин "пациент" включает домашний скот. К домашнему скоту относятся животные, выращиваемые для продовольственных целей. Примерами домашнего скота являются жвачные животные или "жвачные", например коровы, быки, телки, волы, овцы, буйволы, бизоны, козы и антилопы. Другие примеры домашнего скота включают свиней и птиц (домашняя птица), таких как цыплята, утки, индейки и гуси. Пациент,подлежащий лечению, предпочтительно представляет собой млекопитающее, в частности человека. Термины "лечение" и "лечить" при использовании в данной заявке включают их общепринятые значения, то есть терапию и наблюдение пациента с целью предотвращения, уменьшение риска появления или развития данного патологического состояния или заболевания, запрещения, сдерживания, облегчения, улучшения, снижения, остановки, задержки или уменьшения прогрессирования или тяжести заболевания, и сдерживания и/или лечения существующих признаков болезни, нарушения или патологического состояния, описанного в данной заявке, включая ослабление или облегчение симптомов или осложнений, или лечение или устранение заболевания, нарушения или патологического состояния. Настоящий способ включает как медицинское терапевтическое, так и/или профилактическое лечение при необходимости. При использовании в данной заявке термин "терапевтически эффективное количество" обозначает количество соединения согласно настоящему изобретению, которое способно облегчать симптомы описанных выше различных патологических состояний. Конкретная доза вводимого соединения согласно настоящему изобретению, несомненно, определяется конкретными обстоятельствами, в том числе, например, вводимым соединением, способом введения, общим состоянием пациента и патологическим состоянием, подлежащим лечению."Композиция" обозначает фармацевтическую композицию и охватывает фармацевтический продукт, включающий активный компонент (компоненты), включающий соединение (соединения) формулыI, и инертный компонент (компоненты), формирующие носитель. Таким образом, фармацевтические композиции настоящего изобретения охватывают любую композицию, полученную путем смешивания соединения настоящего изобретения и фармацевтически приемлемого носителя. Термин "подходящий растворитель" относится к любому растворителю или смеси растворителей,инертных по отношению к протекающей реакции, который солюбилизирует реагирующее вещество в достаточной степени для обеспечения среды, в пределах которой осуществляется желаемая реакция. Термин "стандартная лекарственная/дозированная форма" обозначает физически дискретные единицы, применимые в виде единичных дозировок для человека и других животных, помимо человека, содержащие заданное количество активного вещества, рассчитанное так, что оно вызывает желаемый терапевтический эффект, вместе с подходящим фармацевтическим носителем. Соединения согласно настоящему изобретению могут иметь один или более хиральный центр и могут существовать в различных стереоизомерных конфигурациях. Вследствие наличия хиральных центров соединение согласно настоящему изобретению может быть представлено в виде рацемической смеси, в виде энантиомеров или смеси энантиомеров, а также в виде диастереомеров и смеси диастереомеров. Все рацемические смеси, энантиомеры, диастереомеры и смеси находятся в пределах объема настоящего изобретения, находятся ли они в чистом виде, в значительной степени чистом или в виде неочищенной смеси. В примерах, представленных в данной заявке, в случае, если представлена молекула, содержащая хиральный центр или центры с известной конфигурацией, ее стереохимическая структура обозначена в названии и в структурном изображении молекулы. Если стереохимическая структура молекулы не известна или не определена в названии и в структурном обозначении молекулы, стереохимическая структура не указывается. Варианты реализации изобретения включают примеры, представленные в данной заявке, и хотя представленные в примерах соединения могут иметь одну хиральную или конформационную форму или их соли, дополнительные варианты реализации изобретения включают все другие стереоизомеры и конформационные формы описанных в примерах соединений, а также их фармацевтически приемлемые соли. Такие варианты реализации включают любые изолированные энантиомеры, диастереомеры и/или конформационные варианты таких структур, а также любые смеси, содержащие более одной формы. Кроме того, если в молекуле присутствует двойная связь или полностью или частично насыщенная кольцевая система, или присутствует более одного центра асимметрии или связь с ограниченным вращением, могут образовываться диастереомеры. Предполагается, что любые диастереомеры, выделенные,очищенные или частично очищенные диастереомеры или их смесь, входят в объем охвата настоящего изобретения. Кроме того, некоторые соединения настоящего изобретения могут существовать в различных таутомерных формах, и предполагается, что любые таутомерные формы, которые могут образовы- 11015106 вать соединения согласно изобретению, входят в объем настоящего изобретения. Термин "энантиомерное обогащение" при использовании в данной заявке относится к увеличению количества одного энантиомера, по сравнению с другим. Удобным методом выражения достигнутого энантиомерного обогащения является понятие энантиомерного избытка, или "ее" (enantiomeric excess),который определяют с использованием следующего уравнения: где Е 1 представляет собой количество первого энантиомера, а Е 2 представляет собой количество второго энантиомера. Таким образом, если исходное соотношение двух энантиомеров составляет 50:50, например, в рацемической смеси, достигается энантиомерное обогащение, достаточное до получения конечного соотношения 70:30, "ее" в отношении первого энантиомера составляет 40%. При этом, если конечное соотношение составляет 90:10, "ее" в отношении первого энантиомера составляет 80%. Значение "ее" более 90% является предпочтительным, более предпочтительным является "ее" более 95% и особенно предпочтительным является "ее" более 99%. Энантиомерное обогащение может быть легко определено специалистом в данной области с использованием стандартных способов и процедур, например газовой хроматографии или высокоэффективной жидкостной хроматографии с хиральной колонкой. Выбор подходящей хиральной колонки, элюента и условий, необходимых для осуществления разделения энантиомерных пар, находится в пределах компетенции специалиста в данной области. Кроме того, некоторые стереоизомеры и энантиомеры соединений формулы I могут быть получены специалистом в данной области с использованием хорошо известных методик и способов, например, таких как описаны в J.S.H. Wilen, "Stereochemistry of Organic Compounds", (Wiley-Interscience 1994), и европейской заявке на патентЕР-А-838448, опубликованной 29 апреля 1998 г. Примеры способов разделения включают методы рекристаллизации или хиральную хроматографию. Соединения формулы I могут быть получены специалистом в данной области на основании ряда процедур, некоторые из которых проиллюстрированы в изложенных ниже способах и схемах. Конкретный порядок стадий, необходимых для получения соединения формулы I, зависит от конкретного синтезируемого соединения, исходного вещества и относительной лабильности замещенных групп. Реагенты или исходные вещества доступны для специалиста в данной области и в тех случаях, когда они не являются коммерчески доступными, они могут быть легко синтезированы специалистом в данной области на основании стандартных процедур, обычно применяемых в данной области, наряду с различными способами и схемами, изложенными ниже. Следующие схемы, препараты, примеры и способы представлены для лучшего объяснения практического применения настоящего изобретения, и они не ограничивают области изобретения. Как ясно специалисту в данной области, возможны различные модификации, не выходящие за пределы сущности и объема изобретения. Все публикации, упомянутые в описании, свидетельствуют об уровне специалистов в области, к которой относится изобретение. Оптимальное время проведения реакций, представленных в схемах, примерах, описаниях получения препаратов и способах, можно определить путем наблюдения протекания реакции с помощью стандартных хроматографических методов. Кроме того, предпочтительно проведение реакций согласно изобретению в инертной атмосфере, такой как, например, аргоновой, азотной. Выбор растворителя, как правило, не является критичным, при условии, что используемый растворитель является инертным по отношению к протекающей реакции и в достаточной степени солюбилизирует реагенты, чтобы могла проходить желаемая реакция. Соединения предпочтительно изолированы и очищены перед их применением в последующих реакциях. Некоторые соединения могут быть кристаллизованы из реакционного раствора и затем собраны путем фильтрации, или может быть удален растворитель реакции путем экстракции,выпаривания или декантацией. Промежуточные и конечные продукты формулы I могут быть дополнительно очищены, если необходимо, с применением стандартных способов, например рекристаллизации или хроматографии на твердых подложках, таких как силикагель или оксид алюминия. Специалисту в данной области понятно, что не все заместители совместимы со всеми условиями реакции. Такие соединения могут быть защищены или модифицированы на подходящем этапе синтеза способами, хорошо известными в данной области. Термины и сокращения, используемые в настоящих схемах, описаниях получения соединений,примерах и способах, имеют общепринятые значения, если не определено иначе. Например, при использовании в данной заявке следующие термины имеют указанное значение: "фунтов/кв.дюйм" означает фунты на квадратный дюйм; "ТСХ" обозначает тонкослойную хроматографию; "ВЭЖХ" относится к высокоэффективной жидкостной хроматографии; "Rf" относится к фактору удержания; "Rt" относится ко времени удержания; относится к химическом сдвигу в миллионных долях (ppm) по стандартной шкале относительно тетраметилсилана; "МС" обозначает масс-спектрометрию, наблюдаемая масса обозначается как [М+Н], если не указано иначе. "MC(APCi) " относится к масс-спектрометрии с химической ионизацией при атмосферном давлении, "UV" относится к ультрафиолетовой спектрометрии, "1 Н ЯМР"- 12015106 относится к протонному спектру ядерно-магнитного резонанса, "LCMS" относится к жидкостной хроматографии-масс-спектрометрии, "GC/MS" относится к газовой хроматографии/масс-спектрометрии. "IR" относится к инфракрасной спектрометрии, максимумы поглощения, указанные для IR-спектров, соответствуют только представляющим интерес, но не всем наблюдаемым максимумам. "RT" относится к комнатной температуре, "THF" относится к тетрагидрофурану, "LAH" относится к алюмогидриду лития,"LDA" обозначает диизопропиламид лития, "DMSO" обозначает диметилсульфоксид, "DMF" обозначает диметилформамид, "EtOAc" относится к этилацетату, "Pd-C" относится к палладию-на-углероде, "DCM" имеет отношение к дихлорметану, "DMAP" относится к диметиламинопиридину, "LiHMDS" относится к гексаметилдисилизану лития, "TFA" относится к трифторуксусной кислоте, "EDAC" относится к гидрохлориду N-этил-N'-(3-диметиламинопропил)карбодиимида, "НОВТ" относится к 1-гидроксибензотриазолу, "Bn-9-BBN" относится к бензил-9-борабицикло[3.3.1]нонану, "Pd(dppf)Cl2" обозначает [1,1'бис(дифенилфосфино)ферроцен)дихлорпалладия(II), "EDCI" обозначает гидрохлорид N-этил-N'-(3 диметиламинопропил)карбодиимида, "DBU" обозначает 1,8-диазабицикло[5.4.0]ундецен-7, "TBSCl" относится к трет-бутилдиметилсиланилоксиметилхлориду, "NBS" относится к N-бромсукцинимиду,"TsOH" относится к п-толуолсульфокислоте, "DCE" относится к дихлорэтану, "DAST" обозначает трифторид(диэтиламино)серы, "ЕА/Н" обозначает смесь этилацетата/гексана, "Pd2(dba)3" обозначает бис(дибензилиденацетон)палладий, "BINAP" относится к 2,2'-бис(дифенилфосфино-1,1'-бинафталину,"NMP" относится к N-метилпирролидину, "TMSCN" обозначает триметилсилилцианид, "TBAF" обозначает тетрабутиламмонийфторид, "Tf2O" обозначает трифторметансульфоновый ангидрид, "TBSO" обозначает трет-бутилдиметилсиланилокси, "OTf" относится к трифторметансульфонату, "MeTi(Oi-Pr)3" обозначает триизопропоксид метилтитана, "BBr3" обозначает трибромид бора, "PBr3" - трибромид фосфора, "Pd(PPh3)4" относится к тетракис(трифенилфосфин)палладию(0), "ОАс" относится к ацетату,"DME" относится к диметилэтану, "Et2O" обозначает диэтиловый эфир, "(Ph3P)4Pd" обозначает тетракис(трифенилфосфин)палладия(0), "DMFDMA" обозначает N,N-диметилформамиддиметилацеталь,"Et3N" обозначает триэтиламин, "tBu" обозначает трет-бутил, "DIPEA" относится к диизопропилэтиламину, "EDC" обозначает гидрохлорид (3-диметиламинопропил)-3-этилкарбодиимида, "НОАс" относится к уксусной кислоте, "boc" относится к трет-бутоксикарбонилу. В структурных формулах "Ph" относится к фенилу, "Me" относится к метилу, "Et" обозначает этил, "Bn" обозначает бензил, "MeOH" обозначает метанол, "OTf" относится к трифторметансульфонату, "TIPSO" относится к триизопропилсиланилокси,"TBSO" обозначает трет-бутилдиметилсиланилокси, "NaBH(OAc)3" относится к триацетоксиборгидриду натрия, "[Ir(cod)Cl]2" обозначает дихлорбис 1,2,5,6-ета)-1,5-циклооктадиен)дииридий. Примеры, представленные в данной заявке, иллюстрируют настоящее изобретение, но никоим образом не ограничивают область заявленного изобретения. Препараты и примеры соединений приведены с использованием программ AutoNom 2.2 в ChemDraw Ultra или AutoNom 2000 в MDL ISIS/Draw версии 2.5 SP1 от MDL Information Systems, Inc. или получены с помощью Chemical Abstracts Services. Для получения спектров 1 Н ЯМР с использованием указанных растворителей применяли спектрометр Varian INOVA 400 МГц. Прибор Agilent HP1100, оснащенный масс-спектрометром (Agilent MSDSL), использовали для LCMS. В качестве стационарной фазы применяли Waters Xterra C18 (2,150 мм,3,5 мкм), стандартная методика включала следующие условия: градиент 5-100% ацетонитрил/метанол(50:50) с 0,2% формиатом аммония в течение 3,5 мин, затем - 100% В в течение 0,5 мин при температуре колонки 50 С и скорости потока 1,0 мл/мин. В соответствии с другой стандартной методикой использовали градиент от 5 до 100% ацетонитрил/метанол (50:50) с 0,2% с формиатом аммония в течение 7,0 мин,затем - 100% В в течение 1,0 мин при температуре колонки 50 С и скорости потока 1,0 мл/мин. Дополнительный анализ проводили методом МС с помощью Agilent MSD (замкнутая система) со стандартным проточно-инжекционным анализатором (ПИА) в отсутствие колонки, при использовании потока со скоростью 0,5 мл/мин 80% МеОН с 6,5 мМ ацетатом аммония при времени анализа 30 с. Схема А В схеме А необязательно замещенный фенол (1) "защищают" (например, с помощью TBSCl) с образованием соединения 2, затем соединение 2 преобразуют в альдегид (3). Соединение 3 реагирует с со- 13015106 единением, содержащим защитную группу (Pg) и уходящую группу (Lg) с образованием эфирного соединения 4. Pg может представлять собой -СН 3 или -СН 2-фенил, a Lg может представлять собой мезилат или галоген. Предпочтительно соединение Lg-Pg представляет собой I-СН 3 или Br-СН 2-фенил. Альдегид восстанавливается с образованием спирта (5) и затем преобразуется в соединение 6. Предпочтительно соединение 5 галогенировано с помощью PBr3 с образованием 2-бром-метил-соединений. Введение и удаление защитных групп из соединений с образованием соединения формулы I и других хорошо известны специалистам в данной области, описаны в литературе. (Например, см. Greene and На схеме В представлен стереоспецифичный синтез с образованием промежуточного соединения 9. Соединение 7 получают путем ацилирования коммерчески доступного (R)-4-бензилоксазолидин-2-он с помощью 4-пентеноилхлорида. Это соединение алкилируют с помощью необязательно замещенного соединения 6 (см. схему А) с образованием соединения 8. Соединение 8 окисляют с образованием альдегидного промежуточного соединения 9 и с помощью озона трифенилфосфина или тетраоксида осмия и окислителя, такого как метапериодат натрия. Схема С- 14015106 В схеме С обработка альдегида 9 амином приводит к образованию гидразида 10. Из соединения 10 удаляют защитную группу с образованием фенольного соединения 11 и затем получают соединение трифлат 12 при реакции с трифторметансульфоновым ангидридом и основанием, таким как пиридин. Проводят реакцию сочетания (12) с помощью реагента на основе фенилбороновой кислоты и катализатора, такого как тетракистрифенилфосфин палладия, с образованием эфира (13), который гидролизуют с получением кислоты (14). Проводят реакцию сочетания кислоты (14) с амином с применением стандартных условий амидного сочетания, например с использованием 1,1'-карбонилдиимидазола, с получением амида (15). Схема D В схеме D осуществляют реакцию сочетания (16) с использованием реагента на основе фенилбороновой кислоты и катализатора, такого как тетракистрифенилфосфин палладия, с получением соединения 17. Схема Е В схеме Е проводят реакцию сочетания (16) с использованием реагента на основе фенилбороновой кислоты и катализатора, такого как тетракистрифенилфосфин палладия, с образованием соединения 19. Из соединения 19 получают амид (20), бензоизоксазол (21) и индазол (22) с использованием реагентов,как описано. В схеме G обработка альдегида 9 амином приводит к образованию гидразида 26, и затем обрабатывают триизопропилсилилтрифторметансульфонатом с образованием соединения 27. Удаляют защитную группу соединения 27 с использованием палладия-на-углероде с получением фенола (28), который затем обрабатывают трифлатным ангидридом с получением соединения 29. Проводят реакцию сочетания (29) с использованием реагента на основе фенилбороновой кислоты и катализатора, такого как тетракистрифенилфосфин палладия с получением сложного эфира (30), который гидролизуют с образованием кислоты(31). Проводят реакцию сочетания кислоты (31) с амином с использованием стандартных условий амидного сочетания, например 1,1'-карбонилдиимидазола, с получением амида (32). Затем амид (32) обрабатывают кислотой, например трифторуксусной кислотой, с получением амида (33). В схеме Н проводят реакцию сочетания (34) с использованием реагента на основе фенилбороновой кислоты (R-B(OH)2) и катализатора, например тетракистрифенилфосфин палладия, с получением соединения 35, которое обрабатывают трифторуксусной кислотой с образованием соединения 36. Схема I В схеме I проводят реакцию сочетания (37) с использованием реагента на основе фенилбороновой кислоты (R-B(OH)2) и катализатора, например тетракистрифенилфосфин палладия, с получением соединения 38. Схема J Препарат 1. 2,6-Дихлор-4-гидроксибензальдегид. Растворяют 3,5 дихлорфенол (1 кг, 6,13 моль) в 3 л диметилформамида (DMF) и охлаждают до 0 С. Добавляют имидазол (918,74 г, 6,75 моль), затем трет-бутилдиметилсилилхлорид (1017,13 г, 6,75 моль). Нагревают смесь до комнатной температуры, перемешивают в течение 15 мин. Выливают в воду (6 л) и экстрагируют эфиром (4 л). Промывают органический слой водой 2 раза, 10%-ным водным раствором хлорида лития, затем выдерживают в соляном растворе перед высушиванием над сульфатом натрия. Фильтруют и концентрируют под вакуумом с получением трет-бутил-(3,5 дихлорфенокси)диметилсилана (1700 г) в виде масла. Растворяют трет-бутил-(3,5-дихлорфенокси)диметилсилан (425 г, 1,5 моль) в 4 л сухого тетрагидрофурана и охлаждают до -68 С. Медленно добавляют 1,1 экв. втор-бутиллития (103,1 г, 1,61 моль) при-68 С (-1,75 ч). После добавления перемешивают реакционную смесь при -70 С в течение 30 мин. Добавляют диметилформамид (168,5 г, 2,3 моль) и перемешивают реакционную смесь при -70 С в течение 1 ч. Добавляют 1 М соляной кислоты в воде (3,5 л) и оставляют реакционную смесь нагреваться до комнатной температуры. Выливают реакционную смесь в эфир (5 л), промывают водой, а затем соляным раствором. Сушат над сульфатом натрия и концентрируют под вакуумом до твердого вещества оранжевого цвета. Растирают с холодным дихлорметаном и фильтруют с получением 250 г (80%) твердого вещества бледножелтого цвета. Препарат 2. 2,6-Дихлор-4-метоксибензальдегид. Объединяют 2,6-дихлор-4-гидроксибензальдегид (120 г, 628,4 ммоль) и карбонат калия (173,65 г,1256,5 ммоль) в 900 мл диметилформамида и обрабатывают йодметаном (107 г, 753,9 ммоль). Перемешивают реакционную смесь при комнатной температуре в течение 3 ч. Фильтруют твердую фазу и добавляют в 6 л воды. Фильтруют твердую фазу, промывают несколько раз водой, сушат на воздухе и растворяют в этилацетате. Промывают водой, затем выдерживают в соляном растворе, сушат над сульфатом натрия. Фильтруют и концентрируют под вакуумом до объема 100 мл до момента, когда начнет выпадать твердая фаза. Фильтруют, затем концентрируют фильтрат, получают второй выход. Промывают гексаном, объединяют все твердые фазы и сушат над вакуумом с получением 112,3 г беловатого твердого вещества. 1 Н ЯМР (400 МГц, CDCl3) 10,41 (с, 1 Н), 6,90 (с, 2 Н), 3,87 (с, 3 Н). Препарат 3. 2,6-Дихлор-4-бензилоксибензальдегид. Обрабатывают смесь 2,6-дихлор-4-гидроксибензальдегид (250 г, 1,3 моль) и карбоната калия (361,8 г, 2,62 моль) в 2 л диметилформамида с бензилбромидом (268,64 г, 1,57 моль). Перемешивают реакционную смесь при комнатной температуре в течение 1 ч. Фильтруют твердую- 18015106 фазу и добавляют 12 л воды. Твердую фазу фильтруют, промывают несколько раз водой, сушат на воздухе и растворяют в этилацетате. Сушат над сульфатом магния, фильтруют и концентрируют под вакуумом до 1,5 л. Оставляют на ночь, затем фильтруют. Промывают твердую фазу минимальным количеством гексана и сушат в вакууме. Концентрируют фильтрат под вакуумом и растирают с гексаном с получением второго выхода продукта, который при объединении с первым выходом составляет 245 г кристаллов белого цвета. Повторяют процедуру для получения продукта третьего выхода, 80 г, в виде светлого желтовато-коричневого порошка (88% общий выход). 1 Н ЯМР (400 МГц, ДМСО-d6)10,26 (с, 1 Н), 7,43 (м, 5 Н), 7,28 (с, 2 Н), 5,25 (с, 2 Н). Препарат 4. (2,6-Дихлор-4-метоксифенил)метанол. Получают суспензию 2,6-дихлор-4-метоксибензальдегида (112 г, 546 ммоль) в 1500 мл этанола и охлаждают в ледяной бане до 7 С. Добавляют боргидрид натрия (20,67, 546 ммоль) порциями, чтобы получить раствор. Убирают ледяную баню и перемешивают реакционную смесь в течение 2 ч. Осторожно добавляют реакционную смесь к насыщенному раствору хлорида аммония (4 л) и перемешивают до полного гашения реакции. Экстрагируют дихлорметаном (31 л) и сушат объединенные органические экстракты над сульфатом натрия. Фильтруют и концентрируют под вакуумом с получением 113 г твердого вещества светлого желтовато-коричневого оттенка. 1 Н ЯМР (400 МГц, CDCl3)6,86 (с, 2 Н), 4,86 (с, 2 Н), 3,78 (с, 3 Н), 2,07 (с, 1 Н). Препарат 5. (2,6-Дихлор-4-бензилоксифенил)метанол. Получают указанное в названии соединение, по существу, с использованием метода получения препарата 4. ЯМР (ДМСО-d6)7,38 (м, 4 Н), 7,33 (м, 1 Н), 7,12 (с, 2 Н), 5,14 (с, 2 Н), 5,05 (т, 1 Н), 4,59 (д, 2 Н). Препарат 6. 2-Бромметил-1,3-дихлор-5-метоксибензол. Растворяют (2,6-дихлор-4-метоксифенил)метанол (113 г, 545,76 ммоль) в 1200 мл сухого THF и охлаждают до 0 С под азотом. Добавляют PBr3 (59,1 г, 218,3 ммоль) под азотом, перемешивают при 0 С в течение 30 мин. Переливают в насыщенный водный раствор NaHCO3 и экстрагируют EtOAc. Сушат и концентрируют под вакуумом с получением 129,4 г продукта в виде беловатого твердого вещества. ЯМР (CDCl3)6,88 (с, 2 Н), 4,73 (с, 2 Н), 3,79 (с, 3 Н). Препарат 7. 2-Бромметил-1,3-дихлор-5-бензилоксибензол. Получают указанное в названии соединение, по существу, с использованием метода получения препарата 6 с выходом 89%.ES МС (m/z): 347 (М+1). Препарат 8. (R)-4-Бензил-3-пент-4-еноилоксазолидин-2-он. Промывают азотом 12-л 3-горлую круглодонную колбу, оснащенную механической мешалкой, датчиком внутренней температуры/входным отверстием для N2 и дополнительной 1-л воронкой, в течение 20 мин, затем добавляют (R)-4-бензил-2-оксазолидинон (250 г, 1,41 моль). Разбавляют тетрагидрофураном (THF) (1,8 л) и охлаждают на бане из сухого льда/ацетона до тех пор, пока внутренняя температура не достигнет -74 С. Помещают 1,6 М раствор н-бутиллития (970 мл, 1,552 моль) в гексанах в дополнительную воронку через канюлю и добавляют его к раствору оксазолидинона с такой скоростью, чтобы внутренняя температура не превышала -65 С. После добавления раствора оставляют реакционную смесь перемешиваться в холодной бане в течение 30 мин. Помещают 4-пентеноилхлорид (175 мл, 1,585 моль) в дополнительную воронку и добавляют его по капле к анионному раствору в течение 25 мин. Перемешивают реакционную смесь в течение 45 мин на охлаждающей бане. Убирают охлаждающую баню и перемешивают реакционную смесь в течение 18 ч, пока она постепенно не достигнет комнатной температуры. Разбавляют смесь 1 н. водным раствором соляной кислоты (1,5 л) и диэтиловым эфиром (1 л). Разделяют слои и промывают органическую фазу водой (21 л), затем соляным раствором (1 л). Экстрагируют объединенные водные смывы простым эфиром (1 л). Сушат объединенные органические фазы над безводным сульфатом магния, фильтруют и концентрируют с получением 390 г масла светлого желтоватокоричневого оттенка. Очищают полученное вещество путем хроматографии на силикагеле с использованием гексана:этилацетата с получением 345 г (94,5%) прозрачного желтого масла. Препарат 9. (R)-4-Бензил-3-[(S)-2-(4-бензилокси-2,6-дихлорбензил)пент-4-еноил]оксазолидин-2-он. Перемешивают смесь (R)-4-бензил-3-пент-4-еноилоксазолидин-2-она (345 г, 1,33 моль) и THF (1,8 л) в 3-горлой круглодонной колбе с датчиком внутренней температуры/входным отверстием для N2 и дополнительной воронкой в атмосфере азота и охлаждают до -75 С. Помещают 1 М LiHMDS (1,6 л) в дополнительную воронку и добавляют с такой скоростью, чтобы внутренняя температура не превышала-60 С. После добавления раствора оставляют реакционную смесь перемешиваться, при -25 С в течение 30 мин, затем охлаждают до примерно -60 С. На этом этапе добавляют твердое вещество 2-бромметил 1,3-дихлор-5-бензилоксибензол порциями в течение 5 мин. После этого помещают реакционный сосуд в ацетоновую баню при -10 С, и в течение 1 ч поддерживают внутреннюю температуру в реакционном сосуде ниже 10 С. Охлаждают смесь до 0 С, затем погасить реакцию 2 л водного раствора 1 Н соляной кислоты. Переносят смесь в 22-л разделительную воронку и разбавляют 2,5 л воды и 2 л эфира. Разделяют слои и экстрагируют водный слой эфиром. Сушат объединенную органическую фазу над безводным- 19015106 сульфатом магния, фильтруют и концентрируют с получением 800 г вязкого масла. Очищают с помощью хроматографии на силикагеле с использованием смеси гексан:этилацетат с получением 597 г (86%) бесцветного масла. Препарат 10. (R)-4-R)-4-Бензил-2-оксооксазолидин-3-ил)-3-(4-бензилокси-2,6-дихлорбензил)-4 оксобутиральдегид. Охлаждают смесь (R)-4-бензил-3-[(S)-2-(4-бензилокси-2,6-дихлорбензил)пент-4-еноил]оксазолидин-2-она (100 г, 190,68 ммоль) и дихлорметана (800 мл) до -74 С. Барботируют озон, продуцируемый генератором озона А-113 при 75%, через реакционную смесь посредством воздуха-носителя со скоростью 5 куб.фт/мин до тех пор, пока раствор не окрасится в синий цвет (приблизительно 3 ч). Добавляют трифенилфосфин (60 г, 228,8 ммоль) в виде раствора в 200 мл дихлорметана и оставляют реакционную смесь перемешиваться до достижения комнатной температуры в течение ночи. Концентрируют раствор под вакуумом и очищают путем хроматографии на силикагеле с использованием градиента 20-50% этилацетата в гексанах с получением 82,1 г (82%) продукта в виде белой пены. МС (m/z): 526 (М+). Альтернативный способ получения (R)-4-R)-4-бензил-2-оксооксазолидин-3-ил)-3-(4-бензилокси 2,6-дихлорбензил)-4-оксобутиральдегида. Обрабатывают смесь (R)-4-бензил-3-[(S)-2-(4-бензилокси-2,6-дихлорбензил)пент-4-еноил]оксазолидин-2-он (0,96 г, 1,8 ммоль), THF (21 мл) и воды (7 мл) 2,5% тетраоксидом осмия в трет-бутаноле (46 мг, 0,18 ммоль). Добавляют периодат натрия (1,17 г, 5,5 ммоль) и перемешивают реакционную смесь в течение 4 ч при комнатной температуре. Гасят реакцию водой и экстрагируют этилацетатом. Промывают органическую фазу водным раствором 1 н. тиосульфата натрия, затем соляным раствором. Сушат органический слой над сульфатом магния, фильтруют и концентрируют под вакуумом. Очищают неочищенное вещество хроматографией на силикагеле с использованием гексана:этилацетата и элюируют чистый продукт. Концентрируют фракции, содержащие продукт, под вакуумом с получением 0,46 г (48%) желаемого продукта. МС (m/z): 526 (М+). Препарат 11. (R)-4-Бензил-3-[(S)-2-(4-метокси-2,6-дихлорбензил)пент-4-еноил]оксазолидин-2-он. Перемешивают смесь (R)-4-бензил-3-пент-4-еноилоксазолидин-2-она (5,0 г, 19,3 ммоль) и тетрагидрофурана (75 мл) в 250 мл круглодонной колбе при -75 С. Вводят 2 М LDA (14,5 мл) в сосуд при помощи шприца и добавляют при такой скорости, чтобы внутренняя температура не превысила -60 С. После этого оставляют реакционную смесь перемешиваться при -25 С в течение 30 мин, затем охлаждают до примерно -60 С. На этом этапе добавляют раствор 2-бромметил-1,3-дихлор-5-метоксибензола (7,76 г, 28,96 ммоль) в THF (25 мл). Затем реакционный сосуд медленно нагревают до 0 С и поддерживают внутреннюю температуру реакционной смеси 0 С в течение 4 ч. Гасят реакцию 30 мл водного раствора 1 н. соляной кислоты. Помещают смесь в 500 мл разделительную воронку и разбавляют 100 мл воды и 100 мл эфира. Разделяют слои и экстрагируют водный слой простым эфиром. Сушат объединенную органическую фазу над безводным сульфатом натрия, фильтруют и концентрируют с получением вязкого масла. Очищают хроматографией на силикагеле с использованием гексанов:этилацетата с получением 6,65 г(R)-4-R)-Бензил-2-оксооксазолидин-3-ил)-3-(4-метокси-2,6-дихлорбензил)-4 оксобутиральдегид. Обрабатывают смесь (R)-4-бензил-3-[(S)-2-(4-метокси-2,6-дихлорбензил)пент-4-еноил]оксазолидин-2-она (6,65 г, 14,87 ммоль), тетрагидрофурана (140 мл) и воды (45 мл) 2,5% тетраоксидом осмия в трет-бутаноле (378 мл, 1,487 ммоль). Добавляют периодат натрия (9,55 г, 44,63 ммоль) и перемешивают реакционную смесь в течение 4 ч при комнатной температуре. Гасят реакцию водой и экстрагируют этилацетатом. Промывают органическую фазу водным раствором 1 н. тиосульфата натрия, затем соляным раствором. Сушат органический слой над сульфатом магния, фильтруют и концентрируют под вакуумом. Очищают неочищенное вещество хроматографией на силикагеле с использованием гексанов:этилацетата, элюируют чистый продукт. Концентрируют фракции, содержащие продукт под вакуумом с получением 3,35 г (49%) желаемого продукта. МС (m/z): 451 (М+). Препарат 13. 1-Нитрозопиперидин-4-ол. Добавляют раствор нитрита натрия (13,8 г, 200 ммоль) в воде (40 мл) к 4-гидроксипиперидину (10,1 г, 100 ммоль) в воде (20 мл). Охлаждают смесь до 0 С на ледяной бане. Добавляют уксусную кислоту(8,6 мл, 150 ммоль) по каплям в течение 20 мин. Затем оставляют реакционную смесь перемешиваться при 0 С в течение 30 мин, медленно подогревают до комнатной температуры и перемешивают при комнатной температуре в течение 5 ч. Добавляют карбонат натрия (15,9 г, 150 ммоль) порциями, чтобы погасить кислоту. Экстрагируют реакционную смесь этилацетатом (360 мл), объединяют органический слой, сушат над сульфатом натрия, фильтруют и концентрируют с получением желаемого продукта в виде желтого масла. Выход: 12,9 г, (98%). Препарат 14. 1-Аминопиперидин-4-ол. Добавляют раствор LAH (1,0 М, 175 мл) небольшими порциями в течение 40 мин к 1- 20015106 нитрозопиперидин-4-олу (12,9 г) в THF (250 мл). Затем нагревают реакционную смесь с обратным холодильником в течение 3 ч, охлаждают до комнатной температуры и затем до 0 С на ледяной бане. Добавляют воду (40 мл), медленно нагревают реакционную смесь до комнатной температуры в течение 10 мин,затем нагревают с обратным холодильником в течение 30 мин. Фильтруют преципитат, суспендируют в горячем THF (100 мл) и фильтруют еще раз. Объединяют фильтраты, сушат над сульфатом натрия,фильтруют и концентрируют с образованием желаемого продукта в виде бледно-желтого масла. Выход: 10,7 г, 94%. Препарат 15. 3,5-Дихлор-4-[1-(4-гидроксипиперидин-1-ил)-2-оксопирролидин-3-илметил]фениловый эфир (R)-трифторметансульфокислоты. Обрабатывают смесь (R)-3-(2,6-дихлор-4-гидроксибензил)-1-(4-гидроксипиперидин-1-ил)пирролидин-2-она (0,2 г, 0,558 ммоль), 4-диметиламинопиперидина (0,204 г, 1,676 ммоль) в метиленхлориде при 0 С трифторметансульфоангидридом (0,473 г, 1,67 6 ммоль). Перемешивают реакционную смесь в течение 1 ч при 0 С и 2 ч при комнатной температуре. Разбавляют реакционную смесь метиленхлоридом и промывают водой. Сушат органический слой (над Na2SO4), удаляют растворитель in vacuo и очищают неочищенный продукт на колонке из силикагеля с 50% этилацетатом в гексанах и 100% этилацетатом с получением 0,17 г (62%) указанного в названии соединения. МС (m/z): 490 (М+). Препарат 16. (R)-3',5'-Дихлор-3-фтор-4'-[2-оксо-1-(4-триизопропилсиланилоксипиперидин-1-ил) пирролидин-3-илметил]бифенил-4-карбонитрил. Продувают азотом в течение 10 мин смесь (R)-трифторметансульфокислоты 3,5-дихлор-4-[2-оксо-1(4-триизопропилсиланилоксипиперидин-1-ил)пирролидин-3-илметил]фенилового эфира (0,18 г, 0,28 ммоль), 3-фтор-4-цианофенилбороновой кислоты (0,055 г, 0,33 ммоль), карбоната натрия (0,089 г, 0,84 ммоль) в THF (10 мл) и воды (3 мл). Добавляют в смесь Pd(PPh3)4 (0,016 г, 0,01 ммоль). Перемешивают реакционную смесь при 80 С в течение 1 ч. Охлаждают реакционную смесь, разбавляют этилацетатом и промывают водой и соляным раствором. Сушат органический слой (над Na2SO4), удаляют растворительin vacuo с получением неочищенного продукта и очищают на колонке из силикагеля 0%-50% этилацетатом в градиенте гексана с получением 0,151 г указанного в названии продукта. МС (m/z): 617 (М+). Препарат 17. (R)-4-3,5-Дихлор-4-[2-оксо-1-(4-триизопропилсиланилоксипиперидин-1-ил)пирролидин-3-илметил]феноксибензонитрил. Перемешивают смесь (R)-4-3,5-дихлор-4-[1-(4-гидроксипиперидин-1-ил)-2-оксопирролидин-3 илметил]феноксибензонитрила (0,238 г, 0,5 ммоль) и 15 мл дихлорметана в ледяной бане. Добавляют пиридин (0,205 г, 2,59 ммоль), а затем триизопропилсилилтрифторметансульфонат (0,19 г, 0,62 ммоль). Убирают ледяную баню и перемешивают реакционную смесь в течение 1 ч при комнатной температуре. Разбавляют реакционную смесь дихлорметаном и промывают водой. Сушат органическую фазу над сульфатом натрия, фильтруют и концентрируют. Очищают осадок путем хроматографии на силикагеле,элюируя 0-50% этилацетатом в градиенте гексанов с получением 0,295 г указанного в названии соединения. МС (m/z): 615 (М+). Препарат 18. (R)-4-3,5-Дихлор-4-[2-оксо-1-(4-триизопропилсиланилоксипиперидин-1-ил)пирролидин-3-илметил]феноксибензамид. Охлаждают раствор(R)-4-3,5-дихлор-4-[2-оксо-1-(4-триизопропилсиланилоксипиперидин-1 ил)пирролидин-3-илметил]феноксибензонитрила (0,295 г, 0,48 ммоль) в DMSO (5 мл) в ледяной бане. Добавляют в раствор карбонат калия (0,331 г, 2,4 ммоль) и перекись водорода (30% в воде, 1 мл) и перемешивают реакционную смесь при 0 С в течение 1,5 ч и затем при комнатной температуре в течение 12 ч. Разбавляют реакционную смесь этилацетатом и промывают три раза водой, а затем один раз соляным раствором. Сушат органическую фазу над сульфатом натрия, фильтруют и концентрируют. Очищают осадок путем хроматографии на силикагеле, элюируя 40-100% этилацетатным градиентом в гексанах с получением 0,210 г (69%) указанного в названии соединения. МС (m/z): 633 (М+). Препарат 19. 3,5-Дихлор-4-(1-морфолин-4-ил-2-оксопирролидин-3-илметил)фениловый эфир (R)трифторметансульфокислоты. Обрабатывают смесь (R)-3-(2,6-дихлор-4-гидроксибензил)-1-морфолин-4-илпирролидин-2-она (0,4 г, 1,16 ммоль) и пиридина (10 мл) при 0 С трифторметансульфоновым ангидридом (1,05 г, 3,72 ммоль). Перемешивают реакционную смесь в течение 1 ч при 0 С, а затем в течение 1 ч при комнатной температуре. Удаляют избыточный пиридин in vacuo и к остатку добавляют дихлорметан, промывают водой и насыщенным хлоридом аммония. Сушат органический слой (Na2SO4), удаляют растворитель in vacuo и очищают неочищенный продукт на колонке из силикагеля 50-100% этилацетатным градиентом в гексанах с получением 0,4 г (72%) указанного в названии соединения. МС (m/z): 477 (М+). Препарат 19 А. (R)-3-(3,5-Дихлор-4'-фторбифенил-4-илметил)-1-морфолин-4-илпирролидин-2-он трифторацетат.- 21015106 Доводят смесь (R)-3,5-дихлор-4-(1-морфолин-4-ил-2-оксопирролидин-3-илметил)фенилового эфира трифторметансульфокислоты (0,126 г, 0,26 ммоль), 4-фторфенилбороновой кислоты (0,044 г, 0,31 ммоль), карбоната натрия (0,084 г, 0,79 ммоль) в THF (10 мл) и воды (3 мл) до 60 С. В смесь при 60 С добавляют Pd(PPh3)4 (0,015 г, 0,011 ммоль), затем повышают температуру реакции до 80 С, перемешивают в течение 2 ч. Охлаждают реакционную смесь, разбавляют этилацетатом и промывают водой и соляным раствором. Сушат органический слой (Na2SO4), удаляют растворитель in vacuo с получением неочищенного продукта и очищают продукт на колонке из силикагеля 50-100% градиентом этилацетата в гексанах с получением 0,102 г (92%) указанного в названии продукта, затем преобразуют его в соль TFA,обработав с трифторуксусной кислотой. МС (m/z): 423 (М+). Препарат 19 В. трет-Бутиловый эфир (R)-3',5'-дихлор-4'-(1-морфолин-4-ил-2-оксопирролидин-3 илметил)бифенил-4-карбоновой кислоты. Доводят смесь 3,5-дихлор-4-(1-морфолин-4-ил-2-оксопирролидин-3-илметил)фенилового эфира(R)-трифторметансульфокислоты (0,19 г, 0,4 ммоль), 4-трет-бутилоксикарбонилфенилбороновой кислоты (0,106 г, 0,48 ммоль), карбоната натрия (0,127 г, 1,2 ммоль) в THF (10 мл) и воды (3 мл) до 60 С. В смесь при 60 С, добавляют Pd(PPh3)4 (0,023 г, 0,02 ммоль), затем увеличивают температуру реакционной смеси до 80 С и оставляют перемешиваться в течение 3 ч. Охлаждают реакционную смесь, разбавляют этилацетатом и промывают водой и соляным раствором. Сушат органический слой (Na2SO4), удаляют растворитель in vacuo с получением неочищенного продукта, затем очищают на колонке из силикагеля с 40% этилацетатом в гексанах с получением 0,15 г (74%) указанного в названии продукта. МС (m/z): 461 (М+). Препарат 19 С. Трифторацетат (R)-3',5'-дихлор-4'-(1-морфолин-4-ил-2-оксопирролидин-3-илметил) бифенил-4-карбоновой кислоты. Обрабатывают раствор трет-бутилового эфира(R)-3',5'-дихлор-4'-(1-морфолин-4-ил-2 оксопирролидин-3-илметил)бифенил-4-карбоновой кислоты (0,15 г) в дихлорметане (5 мл) TFA (1 мл),перемешивают реакционную смесь при комнатной температуре в течение 12 ч. Удаляют растворитель и избыток TFA in vacuo с получением 0,165 г (98%) указанного в названии соединения. МС (m/z): 449 (М+). Препарат 20. (R)-3-(4-Бензилокси-2,6-дихлорбензил)-1-(4-триизопропилсиланилоксипиперидин-1 ил)пирролидин-2-он. Подготавливают смесь (R)-3-(4-бензилокси-2,6-дихлорбензил)-1-(4-гидроксипиперидин-1-ил)пирролидин-2-она (1,23 г, 2,75 ммоль) и 15 мл дихлорметана в ледяной бане. Добавляют пиридин (0,52 г, 6,6 ммоль), затем триизопропилсилилтрифторметан сульфонат (0,924 г, 3,02 ммоль). Убирают ледяную баню, перемешивают реакционную смесь в течение 12 ч при комнатной температуре. Разбавляют реакционную смесь дихлорметаном и промывают водой. Сушат органическую фазу над сульфатом натрия,фильтруют и концентрируют. Очищают остаток с помощью хроматографии на силикагеле, элюируют смесью 4:1 гексаны:этилацетат с получением 1,2 г (72%) указанного в названии соединения. МС (m/z): 605 (М+). Препарат 21. (R)-3-(2,6-Дихлор-4-гидроксибензил)-1-(4-триизопропилсиланилоксипиперидин-1 ил)пирролидин-2-он. Продувают смесь (R)-3-(4-бензилокси-2,6-дихлорбензил)-1-(4-триизопропилсиланилоксипиперидин-1-ил)пирролидин-2-она (1,2 г) и 20% гидроксида палладия(II) на углероде (0,24 г) в этаноле (40 мл)N2 и Н 2, затем перемешивают реакционную смесь при давлении Н 2 20 фунтов/кв.дюйм в течение 2 ч при комнатной температуре. Фильтруют смесь через целит, концентрируют фильтрат в вакууме с получением 0,95 г (99%) указанного в названии продукта. МС (m/z): 515 (М+). Препарат 22. 3,5-Дихлор-4-[2-оксо-1-(4-триизопропилсиланилоксипиперидин-1-ил)пирролидин-3 илметил]фениловый эфир (R)-трифторметансульфоновой кислоты. Обрабатывают смесь (R)-3-(2,6-дихлор-4-гидроксибензил)-1-(4-триизопропилсиланилоксипиперидин-1-ил)пирролидин-2-она (20,2 г, 39,3 ммоль), пиридина (31,05 г, 393 ммоль) в метиленхлориде (200 мл) при 0 С с трифторметансульфоновым ангидридом (13,30 г, 47,16 ммоль). Перемешивают реакционную смесь в течение 1 ч при 0 С и затем в течение 1 ч при комнатной температуре. Разбавляют реакционную смесь метиленхлоридом и промывают водой. Сушат органический слой (Na2SO4), удаляют растворитель в вакууме и очищают неочищенный продукт на колонке из силикагеля с использованием 25% этилацетата в гексанах с получением 22 г (87%) указанного в названии соединения. МС (m/z): 647 (М+). Препарат 23. Метиловый эфир (R)-3',5'-дихлор-4'-[2-оксо-1-(4-триизопропилсиланилоксипиперидин-1-ил)пирролидин-3-илметил]бифенил-4-карбоновой кислоты. Доводят смесь 3,5-дихлор-4-[2-оксо-1-(4-триизопропилсиланилоксипиперидин-1-ил)пирролидин-3 илметил]фенилового эфира(0,52 г,0,8 ммоль),4 метоксикарбонилфенилбороновой кислоты (0,174 г, 0,966 ммоль), карбоната натрия (0,256 г, 2,41 ммоль) в THF (20 мл) и воде (6 мл) до 60 С. К смеси при 60 С добавляют Pd(PPh3)4 (0,046 г, 0,04 ммоль) и нагре- 22015106 вают реакционную смесь до 80 С и перемешивают в течение 1 ч. Охлаждают реакционную смесь, разбавляют этилацетатом и промывают водой и соляным раствором. Сушат органический слой (Na2SO4),удаляют растворитель в вакууме с получением на выходе неочищенного продукта, затем очищают продукт на колонке из силикагеля с использованием 25-50% градиента этилацетата в гексанах с получением 0,4 9 г (96%) указанного в названии продукта. МС (m/z): 633 (М+). Препарат 24. (R)-3',5'-Дихлор-4'-[2-оксо-1-(4-триизопропилсиланилоксипиперидин-1-ил)пирролидин-3-илметил]бифенил-4-карбоновая кислота. Обрабатывают раствор метилового эфира (R)-3',5'-дихлор-4'-[2-оксо-1-(4-триизопропилсиланилоксипиперидин-1-ил)пирролидин-3-илметил]бифенил-4-карбоновой кислоты (0,36 г) в THF (5 мл) и метанола (2 мл) 2 Н LiOH (5 мл) и перемешивают при комнатной температуре в течение 3 ч. Разделяют смесь между этилацетатом (25 мл) и 1 н. HCl (10 мл). Сушат органический слой (Na2SO4) и удаляют растворитель в вакууме с получением 0,34 г (97%) указанного в названии соединения. МС (m/z): 619 (М+). Препарат 25. (R)-3-[3,5-Дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-1(4-триизопропилсиланилоксипиперидин-1-ил)пирролидин-2-он. Обрабатывают раствор (R)-3',5'-дихлор-4'-[2-оксо-1-(4-триизопропилсиланилоксипиперидин-1 ил)пирролидин-3-илметил]бифенил-4-карбоновой кислоты (0,337 г, 0,545 ммоль) в CH2Cl2 (20 мл) 1,1'карбонилдиимидазолом (0,177 г, 1,09 ммоль) и перемешивают реакционную смесь в течение 45 мин при комнатной температуре. Обрабатывают реакционную смесь 4-трифторметилпиперидингидрохлоридом(0,155 г, 0,818 ммоль) и диизопропилэтиламином (0,106 г, 0,818 ммоль) и перемешивают в течение 12 ч при комнатной температуре. Помещают смесь на колонку из силикагеля, прокачивают 25-50% этилацетатом в гексанах с получением 0,34 г (84%) указанного в названии соединения. МС (m/z): 754 (М+). Препарат 26. (R)-3-[3,5-Дихлор-4'-(4,4-дифторпиперидин-1-карбонил)бифенил-4-илметил]-1-(4 триизопропилсиланилоксипиперидин-1-ил)пирролидин-2-он. Обрабатывают раствор (R)-3',5'-дихлор-4'-[2-оксо-1-(4-триизопропилсиланилоксипиперидин-1 ил)пирролидин-3-илметил]бифенил-4-карбоновой кислоты (4,0 г, 6,45 ммоль) в CH2Cl2 (40 мл) 1,1'карбонилдиимидазолом (2,09 г, 12,91 ммоль) и перемешивают реакционную смесь в течение 1 ч при комнатной температуре. Обрабатывают реакционную смесь 4,4-дифторпиперидингидрохлоридом (1,53 г,9,68 ммоль) и диизопропилэтиламином (1,69 г, 9,68 ммоль) и перемешивают реакционную смесь в течение 12 ч при комнатной температуре. Помещают смесь на колонку из силикагеля и прокачивают 25-35% этилацетатом в гексанах с получением 3,8 г (81%) указанного в названии соединения. МС (m/z): 722 (М+). Препарат 27. (R)-3-[3,5-Дихлор-4'-(морфолин-4-карбонил)бифенил-4-илметил]-1-(4-триизопропилсиланилоксипиперидин-1-ил)пирролидин-2-он. Обрабатывают раствор (R)-3',5'-дихлор-4'-[2-оксо-1-(4-триизопропилсиланилоксипиперидин-1 ил)пирролидин-3-илметил]бифенил-4-карбоновой кислоты (0,2 г, 0,32 ммоль) в CH2Cl2 (15 мл) 1,1'карбонилдиимидазолом (0,10 г, 0,65 ммоль) и перемешивают в течение 1 ч при комнатной температуре. Обрабатывают реакционную смесь морфолином (0,06 г, 0,65 ммоль) и перемешивают в течение 12 ч при комнатной температуре. Помещают смесь на колонку из силикагеля и прокачивают 25-35% этилацетатом в гексанах с получением 0,20 г (90%) указанного в названии соединения. МС (m/z): 688 (М+). Препарат 28.(R)-3-[4-(3-аминобензо[d]изоксазол-6-ил)-2,6-дихлорбензил]-1-(4-триизопропилсиланилоксипиперидин-1-ил)пирролидин-2-он. Смесь ацетогидроксамовой кислоты (0,046 г, 0,61 ммоль), карбоната калия (0,169 г, 1,22 ммоль) в ДМФ (5 мл) и воды (2 мл) перемешивают при комнатной температуре в течение 10 мин. В смесь добавляют раствор (R)-3',5'-дихлор-3-фтор-4'-[2-оксо-1-(4-триизопропилсиланилоксипиперидин-1-ил)пирролидин-3-илметил]бифенил-4-карбонитрил (0,151 г, 0,244 ммоль) и перемешивают реакционную смесь при комнатной температуре в течение 5 ч и затем при 60 С в течение 1 ч. Охлаждают реакционную смесь, разбавляют этилацетатом (40 мл) и промывают три раза водой (по 15 мл), затем соляным раствором (15 мл). Затем сушат органический слой над сульфатом натрия, фильтруют и концентрируют под вакуумом. Очищают остаток с помощью хроматографии на силикагеле с использованием 0-50% градиента этилацетат/гексан с получением 0,095 г (62%) указанного в названии соединения. МС (m/z): 631 (М+). Препарат 29. (R)-3-(2-Хлор-4-гидроксибензил)-1-(4-триизопропилсиланилоксипиперидин-1-ил)пирролидин-2-он. Продувают с помощью N2 и Н 2 смесь (R)-3-(4-бензилокси-2,6-дихлорбензил)-1-(4-триизопропилсиланилоксипиперидин-1-ил)пирролидин-2-она (36,61 г) и 20% гидроксида палладия(II) на углероде (7,2 г) в этаноле (250 мл) и метаноле (250 мл) и перемешивают под давлением Н 2 в течение 12 ч при комнатной температуре. Фильтруют смесь через целит. Концентрируют фильтрат в вакууме и очищают неочи- 23015106 щенную смесь на колонке из силикагеля с использованием 25-35% этилацетата в гексане с получением 0,75 г указанного в названии продукта. МС (m/z): 481 (М+). Препарат 30. 3-Хлор-4-[(R)-2-оксо-1-(4-триизопропилсиланилоксипиперидин-1-ил)пирролидин-3 илметил]фениловый эфир трифторметансульфокислоты. Обрабатывают смесь (R)-3-(2-хлор-4-гидроксибензил)-1-(4-триизопропилсиланилоксипиперидин-1 ил)пирролидин-2-она (0,75 г, 1,56 ммоль), пиридина (1,26 г, 15,6 ммоль) в метиленхлориде (200 мл) при 0 С трифторметансульфоновым ангидридом (0,66 г, 2,34 ммоль) и перемешивают реакционную смесь в течение 1 ч при 0 С и затем 1 ч при комнатной температуре. Разбавляют реакционную смесь метиленхлоридом и промывают водой. Сушат органический слой над Na2SO4, удаляют растворитель в вакууме и очищают неочищенный продукт на колонке из силикагеля с использованием 25% этилацетата в гексанах с получением 0,94 г (98%) указанного в названии соединения. МС (m/z): 613 (М+). Препарат 31. Метиловый эфир 3'-хлор-4'-[(R)-2-оксо-1-(4-триизопропилсиланилоксипиперидин-1 ил)пирролидин-3-илметил]бифенил-4-карбоновой кислоты. Смесь 3-хлор-4-[(R)-2-оксо-1-(4-триизопропилсиланилоксипиперидин-1-ил)пирролидин-3-илметил] фенилового эфира трифторметансульфокислоты (0,83 г, 1,35 ммоль), 4-метоксикарбонилфенилбороновой кислоты (0,29 г, 1,62 ммоль), карбоната натрия (0,43 г, 4,06 ммоль) в THF (20 мл) и воды (6 мл) доводят до 60 С. В смесь при 60 С добавляют Pd(PPh3)4 (0,08 г, 0,07 ммоль). Нагревают реакционную смесь до 80 С и перемешивают в течение 1 ч. Охлаждают реакционную смесь, разбавляют этилацетатом и промывают водой и соляным раствором. Сушат органический слой над Na2SO4, удаляют растворитель в вакууме и очищают на колонке из силикагеля с использованием 0-50% градиента этилацетата в гексанах с получением 0,76 г (93%) указанного в названии продукта. МС (m/z): 599 (М+). Препарат 32. 3'-Хлор-4'-[(R)-2-ОКСО-1-(4-триизопропилсиланилоксипиперидин-1-ил)пирролидин-3 илметил]бифенил-4-карбоновая кислота. Обрабатывают раствор метилового эфира 3'-хлор-4'-[(R)-2-оксо-1-(4-триизопропилсиланилоксипиперидин-1-ил)пирролидин-3-илметил]бифенил-4-карбоновой кислоты (0,76 г) в THF (15 мл) 2 НLiOH (15 мл) при комнатной температуре в течение 5 ч. Разделяют смесь между этилацетатом (25 мл) и 1 н. HCl (10 мл). Сушат органический слой над Na2SO4 и удаляют растворитель в вакууме с получением 0,73 г (98%) указанного в названии соединения. МС (m/z): 585 (М+). Препарат 33. (R)-3-[3'-Хлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-1-(4 триизопропилсиланилоксипиперидин-1-ил)пирролидин-2-он. Обрабатывают раствор 3'-хлор-4'-[(R)-2-оксо-1-(4-триизопропилсиланилоксипиперидин-1-ил)пирролидин-3-илметил]бифенил-4-карбоновой кислоты (0,2 г, 0,34 ммоль) в CH2Cl2 (15 мл) 1,1'карбонилдиимидазолом (0,11 г, 0,68 ммоль) и перемешивают в течение 60 мин при комнатной температуре. Обрабатывают реакционную смесь 4-трифторметилпиперидингидрохлоридом (0,10 г, 0,51 ммоль) и диизопропилэтиламином (0,07 г, 0,51 ммоль) и перемешивают в течение 12 ч при комнатной температуре. Помещают смесь на колонку из силикагеля, прокачивают 0-50% этилацетатом в гексанах с получением 0,12 г (49%) указанного в названии соединения. МС (m/z): 720 (М+). Препарат 34. (R)-3-[3-Хлор-4'-(4,4-дифторпиперидин-1-карбонил)бифенил-4-илметил]-1-(4-триизопропилсиланилоксипиперидин-1-ил)пирролидин-2-он. Обрабатывают раствор 3'-хлор-4'-[2-оксо-1-(4-триизопропилсиланилоксипиперидин-1-ил)пирролидин-3-илметил]бифенил-4-карбоновой кислоты (0,2 г, 0,34 ммоль) в CH2Cl2 (15 мл) 1,1'карбонилдиимидазолом (0,11 г, 0,68 ммоль) и перемешивают в течение 1 ч при комнатной температуре. Обрабатывают реакционную смесь 4,4-дифторпиперидингидрохлоридом (0,08 г, 0,51 ммоль) и диизопропилэтиламином (0,07 г, 0,51 ммоль) и перемешивают реакционную смесь в течение 12 ч при комнатной температуре. Помещают смесь на колонку из силикагеля, прокачивают 0-50% этилацетатом в гексанах с получением 0,15 г (64%) указанного в названии соединения. МС (m/z): 688 (М+). Препарат 35. (S)-4-Бензил-3-[(R)-2-(4-бензилокси-2,6-дихлорбензил)пент-4-еноил]оксазолидин-2 он. Растворяют 4-бензил-3-пент-4-еноилоксазолидин-2-он (2,21 г, 8,52 ммоль) в 25 мл сухого THF. Охлаждают до -78 С. Добавляют LiN(TMS)2 (10,23 мл, 10,23 ммоль). Перемешивают в течение 30 мин при этой же температуре. Добавляют 5-бензилокси-2-бромметил-1,3-дихлорбензол (3,10 г, 8,95 ммоль) в 5 млTHF. Оставляют реакционную смесь медленно нагреваться до комнатной температуры. Гасят реакцию насыщенным раствором хлорида аммония. Экстрагируют в этилацетате. После разделения на колонке выход составляет 3,09 г (69%) продукта.(S)-4-S)-4-Бензил-2-оксооксазолидин-3-ил)-3-(4-бензилокси-2,6-дихлорбензил)-4-оксобутиральдегид. Растворяют 4-бензил-3-[2-(4-бензилокси-2,6-дихлорбензил)пент-4-еноил]оксазолидин-2-он (3,09 г,5,89 ммоль) в смеси 3/1 THF/вода (100 мл). Добавляют OsO4 (5,99 г, 0,59 ммоль) и NaIO4 (3,82 г, 17,86 ммоль). Перемешивают полученную суспензию в течение 3 ч при комнатной температуре. Гасят реакцию 1 М раствором тиосульфата натрия (300 мл). Экстрагируют в этилацетате. После разделения на колонке выход составляет 0,885 г (28,5%) 4-(4-бензил-2-оксооксазолидин-3-ил)-3-(4-бензилокси-2,6 дихлорбензил)-4-оксобутиральдегида. Пример 1. (R)-3-(4-Бензилокси-2,6-дихлорбензил)-1-морфолин-4-илпирролидин-2-он. Смесь дихлорэтана (25 мл), N-аминоморфолина (0,204 г, 2 ммоль), (R)-4-R)-4-бензил-2 оксооксазолидин-3-ил)-3-(4-бензилокси-2,6-дихлорбензил)-4-оксобутиральдегида (1,064 г, 2 ммоль) и натрия триацетоксиборгидрида (1,266 г, 6 ммоль) перемешивают при комнатной температуре в течение 12 ч. Доводят реакционную смесь до 60 С, перемешивают в течение 3 ч. Охлаждают реакционную смесь,разбавляют дихлорметаном и промывают водой. Сушат органический слой (Na2SO4), удаляют растворитель в вакууме с образованием неочищенного продукта, очищают продукт с помощью силикагеля с использованием 50-75% градиента этилацетат в гексанах с получением 0,07 г (80%) указанного в названии продукта. МС (m/z): 435 (М+). Пример 2. (R)-3-(2,6-Дихлор-4-гидроксибензил)-1-морфолин-4-илпирролидин-2-он. Продувают смесь (R)-3-(4-бензилокси-2,6-дихлорбензил)-1-морфолин-4-илпирролидин-2-она (0,66 г) и 20% гидроксида палладия(II) на углероде (0,15 г) в этилацетате (30 мл) с помощью N2 и Н 2, перемешивают под давлением Н 2 в течение 2 ч при комнатной температуре. Фильтруют смесь через целит и концентрируют фильтрат в вакууме с получением 0,43 г (82%) указанного в названии продукта. МС (m/z): 345 (М+). Пример 3. (R)-3-[3,5-Дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-1 морфолин-4-илпирролидин-2-он. Обрабатывают смесь трифторацетата (R)-3',5'-дихлор-4'-(1-морфолин-4-ил-2-оксопирролидин-3 илметил)бифенил-4-карбоновой кислоты (0,16 г, 0,28 ммоль) в CH2Cl2 (10 мл) 1,1'карбонилдиимидазолом (0,092 г, 0,57 ммоль), 4-трифторметилпиперидингидрохлоридом (0,081 г, 0,43 ммоль) и диизопропилэтиламином (0,110 г, 0,86 ммоль), перемешивают в течение 12 ч при комнатной температуре. Помещают смесь на колонку из силикагеля и пропускают с 50-100% этилацетатом в гексанах с получением 0,081 г смеси указанного в названии соединения и примесей. Проводят повторную очистку с использованием обратно-фазной ВЭЖХ с получением 0,055 г (34%) указанного в названии соединения. МС (m/z): 584 (М+). Пример 4. (R)-3-(4-Бензилокси-2,6-дихлорбензил)-1-(4-гидроксипиперидин-1-ил)пирролидин-2-он. Смесь дихлорэтана (500 мл), N-амино-4-гидроксипиперидина (10,66 г, 91,88 ммоль), (R)-4-R)-4 бензил-2-оксооксазолидин-3-ил)-3-(4-бензилокси-2,6-дихлорбензил)-4-оксобутиральдегида (40,2 г, 76,57 ммоль) и триацетоксиборгидрида натрия (48,47 г, 229,71 ммоль) перемешивают при комнатной температуре в течение 21 ч. Реакционную смесь нагревают до 55 С и перемешивают в течение 1 ч. Охлаждают реакционную смесь, разбавляют дихлорметаном и промывают водой. Сушат органический слой(R)-3-(4-бензилокси-2,6-дихлорбензил)-1-(4-гидроксипиперидин-1-ил)пирролидин-2-она (0,26 г) и 20% гидроксида палладия(II) на углероде (0,08 г) в этилацетате (25 мл) с помощью N2 и Н 2, затем перемешивают реакционную смесь под давлением Н 2 в течение 4 ч при комнатной температуре. Фильтруют смесь через целит и концентрируют фильтрат в вакууме с получением 0,205 г Смесь (R)-3,5-дихлор-4-[1-(4-гидроксипиперидин-1-ил)-2-оксопирролидин-3-илметил]фенилового эфира трифторметансульфокислоты (0,102 г, 0,21 ммоль), 4-фторфенилбороновой кислоты (0,035 г, 0,25 ммоль), карбоната натрия (0,0 66 г, 0,62 ммоль) в THF (10 мл) и воды (3 мл) доводят до 60 С. В смесь при 60 С добавляют Pd(PPh3)4 (0,015 г, 0,011 ммоль), нагревают реакционную смесь до 80 С и перемешивают реакцию в течение 2,5 ч. Охлаждают реакционную смесь, разбавляют этилацетатом и промывают водой и соляным раствором. Сушат органический слой (Na2SO4), удаляют растворитель в вакууме с получением неочищенного продукта. Очищают продукт на колонке из силикагеля и методом ВЭЖХ (обратнофазной) с получением 0,02 г указанного в названии продукта. МС (m/z): 437 (М+). Пример 7. (R)-3-[3,5-Дихлор-4'-(4-трифторметилпилеридин-1-карбонил)бифенил-4-илметил]-1-(4 гидроксипиперидин-1-ил)пирролидин-2-он.(R)-3-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-1-(4 триизопропилсиланилоксипиперидин-1-ил)пирролидин-2-она (0,34 г), THF (6 мл) и воды (6 мл) обрабатывают TFA (2 мл) при комнатной температуре в течение 1 ч и при 50 С в течение 2 ч. Охлаждают реакционную смесь, разбавляют этилацетатом и промывают гидрокарбонатом натрия (насыщенным). Сушат органический слой (Na2SO4), удаляют растворитель в вакууме с получением неочищенного продукта. Очищают продукт на колонке из силикагеля с использованием 100% этилацетата и 10% метанола в метиленхлориде с получением 0,205 г (76%) указанного в названии продукта. МС (m/z): 598 (М+). Пример 8.TFA (20 мл). Перемешивают реакционную смесь при комнатной температуре в течение 12 ч. Разделяют реакционную смесь с использованием этилацетата (200 мл) и гидрокарбоната натрия (насыщенный раствор, 150 мл), отделяют органический слой, экстрагируют водную фазу с дополнительно 200 мл этилаце- 26015106 тата и объединяют органические растворы. Сушат над сульфатом натрия, фильтруют и концентрируют. Растворяют остаток в 40 мл дихлорметана и помещают на колонку Biotage Si 65M 1385-1, пропускают с этилацетатом в течение 30 минут, затем с 8% метанолом в дихлорметане с получением 8,02 г (97%) желаемого продукта в виде белого твердого вещества. МС (m/z): 566 (М+). Пример 9. К раствору (R)-3-[3,5-дихлор-4'-(морфолин-4-карбонил)бифенил-4-илметил]-1-(4-триизопропилсиланилоксипиперидин-1-ил)пирролидин-2-она в THF (3 мл) добавляют воду (3 мл) и TFA (1 мл). Перемешивают реакционную смесь при комнатной температуре в течение 12 ч. Проводят реакцию с использованием этилацетата (20 мл) и гидрокарбоната натрия (насыщенный раствор, 15 мл), отделяют органический слой, экстрагируют водную фазу дополнительно 20 мл этилацетата и объединяют органические растворы. Сушат над сульфатом натрия, фильтруют и концентрируют. Растворяют остаток в 4 мл дихлорметана, помещают на колонку из силикагеля и пропускают с этилацетатом в течение 15 мин, затем с 8% метанолом в дихлорметане с получением 0,13 г (84%) желаемого продукта в виде белого твердого вещества. МС (m/z): 532 (М+). Пример 10. (R)-3-[4-(3-Аминобензо[d]изоксазол-6-ил)-2,6-дихлорбензил]-1-(4-гидроксипиперидин 1-ил)пирролидин-2-он. Добавляют воду (3 мл) и TFA (1 мл) к (R)-3-[4-(3-аминобензо [d]изоксазол-6-ил)-2,6-дихлорбензил]1-(4-триизопропилсиланилоксипиперидин-1-ил)пирролидин-2-ону (0,095 г) в THF (3 мл). Перемешивают реакционную смесь при комнатной температуре в течение 5 ч. Разбавляют реакционную смесь этилацетатом, промывают гидрокарбонатом натрия (насыщенный раствор), разделяют органический слой, сушат над сульфатом натрия, фильтруют и концентрируют. Очищают остаток на колонке из силикагеля с использованием этилацетата, затем 5% метанола в дихлорметане с получением 0,062 г (87%) желаемого продукта в виде белого твердого вещества. МС (m/z): 475 (М+). Пример 11. (R)-4-3,5-Дихлор-4-[1-(4-гидроксипиперидин-1-ил)-2-оксопирролидин-3-илметил]феноксибензонитрил.(0,5 г, 1,4 ммоль) в DMSO добавляют карбонат калия (0,385 г, 2,8 ммоль) и 4-фторбензонитрил (0,253 г,2,1 ммоль). Перемешивают реакционную смесь при 80 С в течение 3 ч. Охлаждают реакционную смесь,разбавляют этилацетатом и промывают три раза водой и один раз соляным раствором. Затем сушат органический слой над сульфатом натрия, фильтруют и концентрируют в вакууме. Очищают остаток путем хроматографии с силикагелем с использованием 50-100% градиента этилацетата в гексане с получением 0,32 г (50%) указанного в названии соединения. МС (m/z): 460 (М+). Пример 12. (R)-4-3,5-Дихлор-4-[1-(4-гидроксипиперидин-1-ил)-2-оксопирролидин-3-илметил]феноксибензамид.(R)-4-3,5-дихлор-4-[2-оксо-1-(4-триизопропилсиланилоксипиперидин-1-ил)пирролидин-3- 27015106 илметил]феноксибензамиду (0,21 г) в THF (6 мл) добавляют воду (6 мл) и TFA (2 мл). Перемешивают реакционную смесь при комнатной температуре в течение 12 ч. Разбавляют реакционную смесь этилацетатом и промывают гидрокарбонатом натрия (насыщенный раствор), отделяют органический слой, сушат над сульфатом натрия, фильтруют и концентрируют. Очищают остаток на колонке из силикагеля используя этилацетат, затем 5% метанол в дихлорметане с получением 0,158 г (100%) желаемого продукта в виде белого твердого вещества. МС (m/z): 478 (М+). Пример 13. (R)-3-(3,5-Дихлор-4'-трифторметилбифенил-4-илметил)-1-(4-гидроксипиперидин-1 ил)пирролидин-2-он. Смесь 3,5-дихлор-4-[(R)-2-оксо-1-(4-триизопропилсиланилоксипиперидин-1-ил)пирролидин-3 илметил]фенилового эфира трифторметансульфокислоты (0,18 г, 0,29 ммоль), 4-трифторметилфенилбороновой кислоты (0,07 г, 0,36 ммоль), карбоната натрия (0,09 г, 0,86 ммоль) в THF (26 мл) и воды (13 мл) нагревают до 60 С. В смесь при 60 С добавляют Pd(PPh3)4 (0,02 г, 0,01 ммоль). Нагревают реакционную смесь до 80 С, перемешивают в течение 1 ч. Охлаждают реакционную смесь, разбавляют этилацетатом, промывают водой и соляным раствором. Сушат органический слой (Na2SO4), удаляют растворитель в вакууме с получением неочищенного продукта. Очищают продукт на колонке из силикагеля с использованием 25-50% градиента зтилацетата в гексанах с получением 0,12 г (R)-3-(3,5-дихлор-4'трифторметилбифенил-4-илметил)-1-(4-триизопропилсиланилоксипиперидин-1-ил)пирролидин-2-она. К смеси (R)-3-(3,5-дихлор-4'-трифторметилбифенил-4-илметил)-1-(4-триизопропилсиланилоксипиперидин-1-ил)пирролидин-2-она (0,12 г) в THF (6 мл) добавляют воду (6 мл) и TFA (2 мл). Перемешивают смесь при комнатной температуре в течение 12 ч. Разбавляют реакционную смесь этилацетатом и промывают гидрокарбонатом натрия (насыщенный) и водой. Отделяют органический слой и сушат над сульфатом натрия, фильтруют и концентрируют. Очищают неочищенную смесь на колонке из силикагеля с 50% этилацетатом в гексане - 100% этилацетатом с получением 0,088 г указанного в названии продукта. МС (m/z): 487 (М+). Пример 14. (R)-3-(3,5-Дихлор-4'-метансульфонилбифенил-4-илметил)-1-(4-гидроксипиперидин-1 ил)пирролидин-2-он. Смесь трифторметансульфокислоты 3,5-дихлор-4-[(R)-2-оксо-1-(4-триизопропилсиланилоксипиперидин-1-ил)пирролидин-3-илметил]фенилового эфира (0,14 г, 0,22 ммоль), 4-метилсульфонилфенилбороновой кислоты (0,06 г, 0,28 ммоль), карбоната натрия (0,07 г, 0,67 ммоль) в THF (26 мл) и воды (13 мл) доводят до 60 С. В смесь при 60 С добавляют Pd(PPh3)4 (0,02 г, 0,01 ммоль). Нагревают реакционную смесь до 80 С, перемешивают в течение 1 ч. Охлаждают реакционную смесь, разбавляют этилацетатом, промывают водой и соляным раствором. Сушат органический слой (Na2SO4), удаляют растворитель в вакууме с получением неочищенного продукта. Очищают продукт на колонке из силикагеля с использованием 25-50% градиента этилацетата в гексанах с получением 0,12 г (R)-3-(3,5-дихлор-4'метансульфонилбифенил-4-илметил)-1-(4-триизопропилсиланилоксипиперидин-1-ил)пирролидин-2-она. К смеси (R)-3-(3,5-дихлор-4'-метансульфонилбифенил-4-илметил)-1-(4-триизопропилсиланилоксипиперидин-1-ил)пирролидин-2-она (0,12 г) в THF (6 мл) добавляют воду (6 мл) и TFA (2 мл). Перемешивают реакционную смесь при комнатной температуре в течение 12 ч. Разбавляют реакционную смесь этилацетатом и промывают гидрокарбонатом натрия (насыщенным) и водой. Отделяют органический слой и сушат над сульфатом натрия, фильтруют и концентрируют. Очищают неочищенную смесь на колонке из силикагеля с 50% этилацетатом в гексане - 100% этилацетатом с получением 0,088 г указанного в названии продукта. МС (m/z): 497 (М+). Пример 15. (R)-3-[3'-Хлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-1-(4 гидроксипиперидин-1-ил)пирролидин-2-он.TFA (1 мл) при комнатной температуре в течение 5 ч. Разбавляют реакционную смесь этилацетатом и промывают гидрокарбонатом натрия (насыщенным). Сушат органический слой (Na2SO4), удаляют растворитель в вакууме с получением неочищенного продукта. Очищают продукт на колонке из силикагеля с 100% этилацетатом и 10% метанолом в метиленхлориде с получением 0,05 г (53%) указанного в названии продукта. МС (m/z): 564 (М+). Пример 16. (R)-3-[3-Хлор-4'-(4,4-дифторпиперидин-1-карбонил)бифенил-4-илметил]-1-(4-гидроксипиперидин-1-ил)пирролидин-2-он.TFA (1 мл). Перемешивают реакционную смесь при комнатной температуре в течение 5 ч. Разделяют реакционную смесь с использованием этилацетата и гидрокарбоната натрия (насыщенный раствор), отделяют органический слой, экстрагируют водную фазу дополнительно этилацетатом, объединяют органические растворы, сушат над сульфатом натрия, фильтруют и концентрируют. Очищают остаток на колонке из силикагеля с использованием этилацетата в течение 30 мин, затем 8% метанола в дихлорметане с получением 0,06 г (52%) желаемого продукта в виде белого твердого вещества. МС (m/z): 532 (M+). Пример 17. (S)-3-[3,5-Дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-1-(4 гидроксипиперидин-1-ил)пирролидин-2-он. Синтезируют указанное в названии соединение с использованием способа, описанного в примере 7,за исключением использования (S)-4-S)-4-бензил-2-оксооксазолидин-3-ил)-3-(4-бензилокси-2,6 дихлорбензил)-4-оксобутиральдегида. МС (m/z): 598 (М+). Пример 18. Кристаллический (R)-3-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-1-(4-гидроксипиперидин-1-ил)пирролидин-2-он ангидрат. Растворяют аморфный (R)-3-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4 илметил]-1-(4-гидроксипиперидин-1-ил)пирролидин-2-он (100 мг) в гептане (1 мл) и EtOAc (1 мл) с нагреванием (50 С) и перемешиванием. В течение 30 мин в теплом растворе образуется кристаллическая взвесь. Оставляют взвесь при 40-45 С на ночь, затем извлекают твердый продукт путем вакуумной фильтрации и высушивания на воздухе с получением указанного в названии соединения (91 мг). Альтернативный способ получения кристаллического (R)-3-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-1-(4-гидроксипиперидин-1-ил)пирролидин-2-она ангидрата. Растворяют аморфный (R)-3-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4 илметил]-1-(4-гидроксипиперидин-1-ил)пирролидин-2-он (25 мг) примерно в 40 объемах приблизительно 3:1 об./об. EtOAc:гептана со слабым нагреванием и перемешиванием. Оставляют раствор уравновешиваться при комнатной температуре с перемешиванием и затравливанием (R)-3-[3,5-дихлор-4'-(4 трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-1-(4-гидроксипиперидин-1-ил)пирролидин-2 оном гидратом. Кристаллическая взвесь образуется в пределах 45 мин. Удаляют остаточную жидкость пипеткой и подсушивают на воздухе твердую фазу. Альтернативный способ получения кристаллического (R)-3-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-1-(4-гидроксипиперидин-1-ил)пирролидин-2-она.
МПК / Метки
МПК: A61P 3/10, A61K 31/4025, A61K 31/4015, C07D 207/50, C07D 207/26, C07D 401/12
Метки: 11-бета-гидроксистероид, дегидрогеназы, ингибиторы
Код ссылки
<a href="https://eas.patents.su/30-15106-ingibitory-11-beta-gidroksisteroid-degidrogenazy-1.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы 11-бета-гидроксистероид дегидрогеназы 1</a>
Предыдущий патент: Антагонисты активина – actriia и их применение для стимулирования роста кости
Следующий патент: Серосодержащие производные пиразола в качестве избирательных антагонистов рецептора каннабиноидов св1
Случайный патент: Предохранительный колпачок для бутылки