Ингибиторы гамма-секретазы
Номер патента: 17286
Опубликовано: 30.11.2012
Авторы: Миллер Мелинда Джой Хоуп, Портер Уоррен Джей, Рубио-Эстебан Алмудена, Рил Джон Кэвин
Формула / Реферат
1. Соединение формулы I
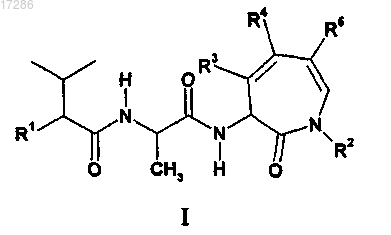
в которой R1 представляет собой гидрокси или фтор;
R2 представляет собой C1-C4-алкил;
R3 представляет собой водород или фенил;
R4 представляет собой водород, фенил или C1-C4-алкил;
R5 представляет собой водород или фенил; при этом один из R3, R4 и R5 отличен от водорода, а два другие представляют собой атомы водорода.
2. Соединение по п.1, в котором R4 представляет собой водород или фенил.
3. Соединение по любому из пп.1 или 2, в котором R4 представляет собой фенил.
4. Соединение по любому из пп.1-3, в котором R1 представляет собой гидрокси и R2 представляет собой метил.
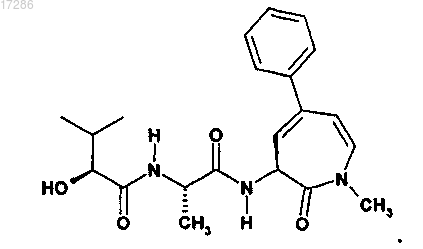
5. Соединение
6. Фармацевтическая композиция, ингибирующая γ-секретазу, включающая соединение по любому из пп.1-5 и фармацевтически приемлемый разбавитель.
7. Применение соединения по любому из пп.1-5 в качестве фармацевтического средства, ингибирующего γ-секретазу.
8. Применение соединения по любому из пп.1-5 для получения лекарственного средства, полезного для лечения болезни Альцгеймера.
9. Применение соединения по любому из пп.1-5 для получения лекарственного средства, полезного для подавления прогрессирования болезни Альцгеймера.
Текст
(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) В изобретении описаны соединения формулы I Миллер Мелинда Джой Хоуп, Портер Уоррен Джей, Рил Джон Кэвин, РубиоЭстебан Алмудена (US) Медведев В.Н. (RU) 017286 Болезнь Альцгеймера, поздние стадии которой характеризуются нарушением когнитивных способностей и поведения, является значительной социальной и финансовой проблемой. Нейрофибриллярные клубки и нейритические бляшки обычно обнаруживают в участках мозга, связанных с памятью и когнитивными способностями субъектов, пораженных болезнью Альцгеймера. Такие бляшки также обнаруживают в мозге лиц с синдромом Дауна, наследственной церебральной геморрагией голландского типа и другими нейродегенеративными расстройствами. Нейритические бляшки главным образом состоят из амилоидного (A) пептида, нейротоксичного и обладающего высокой способностью к агрегации пептидного фрагмента белка-предшественника амилоида (АРР). Пептид А образуется в результате протеолитического расщепления АРР -секретазой (ВАСЕ), за которым следует по меньшей мере еще одно расщепление на С-конце -секретазой. По этой причине ингибирование -секретазы является привлекательной мишенью для лечения или предотвращения болезни Альцгеймера, а также других заболеваний, характеризующихся наличием амилоидных бляшек. Ингибиторы -секретазы, полезные в лечении болезни Альцгеймера и других расстройств, известны в данной области (WO 98/282 68 и WO 04/080983). Настоящее изобретение обеспечивает дополнительные ингибиторы -секретазы. Некоторые соединения согласно настоящему изобретению обладают подходящим терапевтическим индексом. Настоящее изобретение обеспечивает соединения формулы I: в которой R1 представляет собой гидрокси или фтор;R3 представляет собой водород или фенил;R5 представляет собой водород или фенил; при условии, что один из R3, R4 и R5 отличен от водорода, а два другие представляют собой атомы водорода. В другом варианте реализации настоящее изобретение обеспечивает фармацевтическую композицию, включающую соединение формулы I и фармацевтически приемлемый разбавитель. Настоящее изобретение также предусматривает применение соединения формулы в качестве фармацевтического средства. В одном из аспектов, относящихся к способам, настоящее изобретение относится к способу уменьшения количества пептида -амилоида у пациента, включающий введение указанному пациенту эффективного количества соединения формулы I. Настоящее изобретение также обеспечивает применение соединения формулы I для получения лекарственного средства для уменьшения количества белка амилоида. В одном из вариантов реализации способа настоящее изобретение обеспечивает способ лечения болезни Альцгеймера, включающий введение пациенту, нуждающемуся в этом, эффективного количества соединения формулы I. Настоящее изобретение также обеспечивает применение соединения формулы I для получения лекарственного средства для лечения болезни Альцгеймера. Настоящее изобретение также обеспечивает способ предотвращения или подавления прогрессирования болезни Альцгеймера, включающий введение пациенту, нуждающемуся в этом, эффективного количества соединения формулы I. Настоящее изобретение также обеспечивает применение соединения формулы I для получения лекарственного средства для предотвращения или подавления прогрессирования болезни Альцгеймера. Основные химические термины, используемые в приведенных выше формулах, имеют обычные значения. Например, термин "С 1-С 4-алкил" включает метил, этил, пропил, изопропил, бутил, изобутил,втор-бутил и трет-бутил. Термин "защитная группа азота" означает молекулу, которая стабильна в предполагаемых условиях реакции и, тем не менее, ее можно избирательно удалить реагентами и в условиях реакции, подходящих для регенерированного амина. Такие группы хорошо известны специалисту в данной области и описаны в литературе (см., например, Greene и Wuts, Protective Groups in Organic Synthesis, третье издание, глава 7, John Wiley and Sons Inc., (1999. Предусмотренные защитные группы азота включают подходящие карбаматы, такие как трет-бутоксикарбонил. Для специалиста в данной области, очевидно, что все соединения формулы I включают по меньшей мере 3 хиральных центра, отмеченных на следующей структуре: Хотя настоящее изобретение включает все отдельные диастереомеры, а также смеси диастереомеров указанных соединений, включая рацематы, диастереомер, предпочтительный для соединения формулы I, показан на формуле (i) Соединения формулы I представляют собой полезные ингибиторы -секретазы, но некоторые классы соединений являются предпочтительными. В следующих абзацах описаны такие предпочтительные классы:c) R4 представляет собой водород или фенил;e) соединение формулы I, в которой R2 представляет собой метил и R4 представляет собой фенил;f) соединение формулы I, в которой R1 представляет собой гидроксил, R2 представляет собой метил 4 и R представляет собой фенил; и Соединения формулы I представляют собой ингибиторы -секретазы. Таким образом, настоящее изобретение также обеспечивает способ ингибирования -секретазы у млекопитающего, который включает введение млекопитающему, нуждающемуся в указанном лечении, ингибирующего -секретазу количества соединения формулы I. Предпочтительно указанное млекопитающее, которое лечат введением соединений формулы I, представляет собой человека. В качестве ингибиторов -секретазы соединения согласно настоящему изобретению полезны для подавления продукции пептида А и, следовательно, для лечения расстройств, причиной которых являются избыточные уровни пептида А. Соответственно полагают, что соединения формулы I полезны для лечения или предотвращения болезни Альцгеймера, умеренного когнитивного нарушения, синдрома Дауна, наследственной церебральной геморрагии с амилоидозом голландского типа, церебральной амилоидной ангиопатии, других дегенеративных деменций, таких как деменция смешанного васкулярного и дегенеративного происхождения, деменция, связанная с болезнью Паркинсона, деменция, связанная с прогрессирующим супрануклеарным параличом, деменция, связанная с кортикальной базальной дегенерацией, и тип болезни Альцгеймера с диффузными тельцами Леви. Соединения согласно настоящему изобретению можно получать с помощью различных процедур,некоторые из которых показаны на схемах ниже. Для специалиста в данной области, очевидно, что отдельные этапы в приведенных ниже схемах можно изменять и получать в результате соединения формулы I. Конкретный порядок этапов, необходимый для получения соединений формулы I, зависит от конкретного синтезируемого соединения, исходного соединения и относительной неустойчивости, содержащих заместители молекул. Более того, отдельные изомеры, энантиомеры или диастереомеры можно разделить на любом удобном этапе синтеза соединений формулы I.-2 017286 Соединения формулы I можно получить, как описано на следующей схеме, в которой переменныеR2, R3, R4 и R5 такие, как определено ранее, и переменная Pg представляет собой защитную группу азота. Схема I Осуществляют реакцию амина (а) в стандартных условиях образования амида, хорошо известных специалисту в данной области, с получением амида (b). Осуществляют реакцию аланина с защищенным подходящим образом азотом, например N-(трет-бутоксикарбонил)аланина или его эквивалента, такого как карбоксилатная соль натрия или калия, с агентом, связывающим пептид, таким как дициклогексилкарбодиимид (DCC), 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (EDC) или нпропилфосфиновый ангидрид, и подходящим амином, таким как N-метилморфолин, диизопропилэтиламин или триэтиламин, в подходящем растворителе, таком как дихлорметан, диметилформамид (DMF) или тетрагидрофуран (ТГФ), с получением амида (b). При желании или необходимости можно добавить в реакционную смесь вспомогательное вещество, такое как 4-(диметиламино)пиридин и/или 1 гидроксибензотриазол или его эквиваленты, чтобы облегчить течение реакции. В качестве альтернативы можно непосредственно осуществить реакцию других эквивалентов карбоновой кислоты, включая ацилирующие агенты, таких как подходящий ацилимидазол или подходящий галогенангидрид, с амином (а) с получением целевого амида (b). Затем с амида (b) удаляют защитные группы в условиях, хорошо известных специалисту в данной области (например, см. Greene и Wuts, Protective Groups in Organic Synthesis, третье издание, главы 2 и 7, John Wiley and Sons Inc., (1999. Полученный амин затем приводят во взаимодействие либо с 2-гидроксиизовалериановой кислотой, либо с 2-фторизовалериановой кислотой в стандартных условиях сочетания амидов, которые, как описано ранее, позволяют получить соединения формулы I. Необходимые амины (а) можно получить, как описано в следующей схеме, в которой переменныеR2, R3, R4 и R5 такие, как определено ранее, X представляет собой -NRaRb или -ORa и переменные Ra и Rb представляют собой независимо С 1-С 4-алкил. Схема II Осуществляют реакцию содержащего подходящие заместители нитробензола (с) либо с подходящим амином и триамидом фосфора при повышенной температуре в запечатанной пробирке с получением промежуточного продукта (d), при этом X представляет собой -NRaRb, либо с подходящим С 1-С 4 спиртом и триалкилфосфином при повышенной температуре в запечатанной пробирке с получением промежуточного продукта (d), при этом X представляет собой -ORa. Промежуточный продукт (d) затем приводят во взаимодействие с водой с получением лактама (е). Этот лактам затем N-алкилируют при стандартных условиях, например, путем реакции с алкилгалогенидом в присутствии подходящего основания, такого как трет-бутоксид калия или карбонат цезия, с получением N-алкилированного лактама (f). Необходимую молекулу амина можно ввести путем реакции лактама (f) с подходящим основанием, таким как трет-бутоксид калия, а затем реакции с изоамиловым нитритом с получением оксима (g). Указанный оксим затем восстанавливают в стандартных условиях, например, путем реакции с цинковой пылью в уксусной кислоте, с получением целевого амина (а). Пример синтеза 1. Диэтил-(5-фенил-3H-азепин-2-ил)амин. Смесь 4-нитробифенила (26,35 г, 132,3 ммоль), диэтиламина (137,0 мл, 1,32 моль) и гексаэтилтриамида фосфора (72,6 мл, 265,0 ммоль) разделяли между двумя пробирками для работы под давлением. Пробирки запечатывали и содержимое нагревали до 120-125C в течение 16 ч. После охлаждения до комнатной температуры содержимое пробирок для работы под давлением объединяли и концентрировали в вакууме. Осадок промывали водой (2100 мл). Водный нерастворимый материал разбавляли ди-3 017286 хлорметаном, промывали водой (100 мл) и экстрагировали 1 н. HCl (2150 мл). Водную кислотную фазу промывали дихлорметаном (3200 мл). Указанную водную кислотную фазу подщелачивали с помощьюNaOH (pH 12) и экстрагировали дихлорметаном. Полученную органическую фазу промывали насыщенным водным хлоридом натрия, сушили над MgSO4 и концентрировал в вакууме с получением 6,89 г(22%) указанного в заголовке промежуточного продукта в виде маслянистого твердого остатка темнокоричневого цвета, с примесью небольшого количества гексаэтилфосфорамида. Смыв кислотной фазы дихлорметаном сушили над MgSO4 и концентрировали в вакууме с получением 80 г жидкости темнокоричневого цвета, состоящей из приблизительно 66% гексаэтилфосфорамида и 34% указанного в заголовке промежуточного продукта в виде HCl-соли. Этот материал разбавляли дихлорметаном (100 мл) и экстрагировали 1 н. HCl (2100 мл). Объединенные водные фазы подщелачивали (рН 13) с помощьюNaOH и экстрагировали дихлорметаном (2300 мл). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над MgSO4 и концентрировали в вакууме с получением 18,81 г указанного в заголовке промежуточного продукта в виде кристаллов темно-коричневого цвета,которые были загрязнены приблизительно на 30% гексаэтилфосфорамидом. Указанное в заголовке соединение использовали в следующей реакции без дополнительной очистки. МС: (m/z)=241,2 (М+1). Следующие соединения получены, по существу, способом, описанным в примере синтеза 1. Пример синтеза 4. 5-Фенил-1,3-дигидроазепин-2-он. Неочищенный диэтил-(5-фенил-3H-азепин-2-ил)-амин (12,47 г) добавляли в воду (10,0 мл) и 2 метоксиэтанол (40,0 мл), полученную смесь нагревали до кипения с обратным холодильником и перемешивали в течение 4 дней. Летучие компоненты удаляли в вакууме и остаток разбавляли дихлорметаном и промывали 0,1 н. HCl (2200 мл) и насыщенным водным NaHCO3 (2200 мл). Органическую фазу сушили над Na2SO4 и концентрировали в вакууме с получением неочищенного указанного в заголовке соединения в виде твердого остатка темно-коричневого цвета (9,63 г). Этот материал использовали в следующей реакции без дополнительной очистки. Пример синтеза 7. 2-Бутокси-5-фенил-3H-азепин. 22-литровый реакционный сосуд оборудовали колбонагревателем, верхней мешалкой, конденсором, воронкой для добавления, датчиком температуры и устройством подвода/вывода азота. Сосуд тщательно продували азотом и сохраняли в атмосфере азота на протяжении всей реакции. В сосуд загружали 4-нитробифенил (1700 г, 8,53 моль) и 1-бутанол (3793 г, 51,2 моль). Полученную смесь нагревали до кипения с обратным холодильником с получением прозрачного раствора. Трибутилфосфин (3500 г, 17,3 моль) наливали в воронку для добавления и добавляли по каплям в горячий раствор 4-нитробифенила. Температуру постепенно повышали при необходимости для поддержания кипения с обратным холодильником. За завершением реакции следили с помощью газовой хроматографии. Реакционную смесь охлаждали и добавляли воду (500 мл). Реакционную смесь концентрировали с получением масла, после чего добавляли петролейный эфир (8,0 л). Полученную смесь охлаждали до -40C и фильтровали, чтобы удалить нежелательный оксид трибутилфосфина. Фильтрат снова концентрировали и добавляли петролейный эфир (8,0 л). Смесь охлаждали и фильтровали. Полученный фильтрат концентрировали с получением масла и очищали с помощью хроматографии на силикагеле с получением указанного в заголовке соединения (908 г, 44%).MC: (m/z)=242,1 (М+1). Пример синтеза 8. 5-Фенил-1,3-дигидроазепин-2-он. 2-Бутокси-5-фенил-3H-азепин (9,08 г, 3,42 моль) растворяли в 2 В-3 этаноле (8172 мл) и деионизированной воде (2724 мл). Раствор помещали в автоклав и нагревали до 150C в течение 20 ч. Раствор охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаточную воду удаляли путем азеотропной дистилляции из толуола (22 л). Остаточные твердые осадки растворяли в толуоле (1,7 л) и нагревали до 95-100C. Раствор охлаждали до 90C и добавляли гептан (приблизительно 4,8 мл/г). Раствору позволяли остыть до комнатной температуры и затем охлаждали до 0-5C с-4 017286 помощью ледяной бани. Твердые осадки фильтровали, промывали гептаном и сушили с получением указанного в заголовке соединения (559 г, 88%) в виде твердого остатка светло-коричневого цвета. МС (ЭИ): (m/z)=185,1. Пример синтеза 9. 1-Метил-5-фенил-1,3-дигидроазепин-2-он. 5-Фенил-1,3-дигидроазепин-2-он (168,5 г, 911,3 ммоль) объединяли с тетрагидрофураном (1300 мл) и раствор охлаждали до приблизительно -30C. Третичный бутоксид калия (107,4 г, 956,9 ммоль) добавляли в виде одной порции. Наблюдали разогрев, в результате которого реакционная смесь нагрелась до-12C. После этого содержимое оставляли остыть до -25C и добавляли йодметан (113,5 мл, 1,823 моль),который вызывал легкий разогрев. Реакционной смеси позволяли нагреться до комнатной температуры и перемешивали. Через 10 ч реакционную смесь разбавляли метил-трет-бутиловым эфиром (1300 мл) и экстрагировали насыщенным раствором хлорида аммония (2250 мл), водой и насыщенным водным раствором хлорида натрия. Объединенные водные фазы реэкстрагировали метил-трет-бутиловым эфиром(200 мл). Экстракты метил-трет-бутилового эфира объединяли, сушили над MgSO4 и фильтровали. Раствор концентрировали путем ротационного испарения с получением указанного в заголовке соединения(185 г, 100%) в виде порошкообразного остатка коричневого цвета. Этот материал использовали непосредственно, без очистки, в следующем этапе. Следующие соединения получены, по существу, способом, описанным в примере синтеза 9.(1500 мл) и раствор охлаждали до -25C - -30C. Добавляли изоамиловый нитрит (148,1 мл, 1,102 моль), а затем третичный бутоксид калия (108,2 г, 964,4 ммоль), что вызывало разогрев до приблизительно -5C. Раствор снова охлаждали до -10C, затем позволяли ему медленно нагреться до комнатной температуры. Реакционную смесь перемешивали в течение ночи. Реакционную смесь разбавляли 3 н. водным HCl (300 мл) до рН, равного приблизительно 2. Затем его разбавляли метил-трет-бутиловым эфиром (4 л) и промывали содержимое 0,5-1,0 н. HCl (2600 мл) и насыщенным водным хлоридом натрия. Темную органическую фазу сушили над MgSO4, фильтровали и концентрировали с получением остатка, увлажненного тетрагидрофураном. Остаток разбавляли циклогексаном (300 мл) и концентрировали с получением приблизительно 275 г неочищенного остатка, который затем суспендировали в метил-трет-бутиловом эфире(450 мл) и циклогексане (1000 мл). Нагревали суспензию до приблизительно 40C, охлаждали до комнатной температуры, фильтровали и ополаскивали циклогексаном. Сушили в вакууме при 40C с получением указанного в заголовке соединения (169 г, 81%) в виде порошка коричневого цвета. Следующие соединения получены, по существу, способом, описанным в примере синтеза 13.(80 мл), метанолом (80 мл) и водой (40 мл) и полученную суспензию охлаждали до приблизительно 5C. Цинковую пыль (29,81 г, 436 ммоль) добавляли по частям. Реакционной смеси позволяли снова остыть до комнатной температуры. Через 2 ч реакционную смесь фильтровали через слой Целита и ополаскивали метанолом. Фильтрат концентрировали путем ротационного испарения до тех пор, пока не удалили большую часть метанола. Маслянистый пурпурный раствор затем разбавляли дихлорметаном (200 мл),-5 017286 что вызвало небольшую немедленную преципитацию. Вязкую суспензию фильтровали, что обеспечивало удаление ацетата цинка в виде белого порошка. Полученный пурпурный фильтрат дополнительно разбавляли дихлорметаном (200 мл) и экстрагировали раствором гидроксида аммония (2100 мл). Органические экстракты сушили над MgSO4, фильтровали и концентрировали с получением 21,5 г (92%) пурпурного масла. После разбавления теплым этилацетатом (200 мл) наблюдали мелкодисперсный преципитат и удаляли его с помощью фильтрации. Оставшийся раствор этилацетата обрабатывали газообразным хлороводородом (приблизительно 5 г, 137 ммоль) с получением вначале вязкой суспензии, которая становилась более жидкой после добавления остального количества хлороводорода. После перемешивания суспензии при комнатной температуре в течение 2 ч содержимое фильтровали и сушили в вакууме при 45C с получением HCl соли указанного в заголовке промежуточного продукта (22,9 г, 94%) в виде порошка коричневого цвета. 22,9 г соли HCl обрабатывали 150 мл 1 н. гидроксидом натрия и дихлорметаном. Фазам позволяли разделиться и дихлорметановую фазу дополнительно промывали насыщенным раствором бикарбоната натрия. Раствор дихлорметана затем сушили над сульфатом магния, фильтровали и концентрировали с получением 19,6 г указанного в заголовке соединения в виде масла краснокоричневого цвета. Следующие соединения получены, по существу, способом, описанным в примере синтеза 17.(3 л), N-(трет-бутоксикарбонил)-L-аланином (291,4 г, 1,54 моль) и гидроксибензотриазолгидратом (259,5 г, 1,617 моль). Полученный раствор охлаждали до приблизительно 10C. К этому раствору добавляли диизопропилэтиламин (335,4 мл, 1,925 моль), а затем гидрохлорид 1-(3-диметиламинопропил)-3 этилкарбодиимида (310,1 г, 1,617 моль) и содержимому позволяли постепенно нагреваться до комнатной температуры. Через 3,5 ч реакционную смесь вливали в воду (1000 мл) и фазам позволяли разделиться. Органическую фазу дополнительно промывали водой (1000 мл), 0,1 н. HCl (1000 мл), насыщенным раствором NaHCO3 (1000 мл) и насыщенным водным раствором хлорида натрия. Фазу дихлорметана сушили над Na2SO4, фильтровали и концентрировали путем ротационного испарения с получением указанного в заголовке соединения (приблизительно 574 г, 97%) в виде пены желтовато-коричневого цвета. Материал был достаточно чистым для непосредственного использования в следующем этапе. Следующие соединения получены, по существу, способом, описанным в примере синтеза 21.(S)-2-Амино-N-(1-метил-2-оксо-5-фенил-2,3-дигидро-1 Н-азепин-3-6 017286 ил)пропионамид. К охлажденному раствору трифторуксусной кислоты (800 мл) при -5C добавляли раствор третбутилового эфира (S)-[1-(1-метил-2-оксо-5-фенил-2,3-дигидро-1 Н-азепин-3-илкарбамоил)этил]карбаминовой кислоты (564 г, 1,46 моль) в дихлорметане (2 л) через воронку для добавления. Реакционную смесь перемешивали при 0C в течение 2 ч, после чего в аликвоте реакционной смеси выявили лишь следовое количество остатков начального материала. Реакционную смесь концентрировали путем ротационного испарения, заново разбавляли дихлорметаном и заново концентрировали с получением сиропа. Масло,имеющее консистенцию сиропа, разбавляли дихлорметаном (2-3 л) и добавляли в 10% раствор карбоната натрия (2 л). Для того чтобы довести рН водного слоя до основного значения потребовалось еще 10% раствора карбоната натрия (2 л). Фазы разделяли и водную фазу реэкстрагировали дихлорметаном (600 мл). Объединенные органические фазы затем экстрагировали насыщенным бикарбонатом натрия (1000 мл), сушили над сульфатом натрия, фильтровали и концентрировали путем ротационного испарения с получением указанного в заголовке промежуточного продукта (приблизительно 435 г) в виде маслянистой пены, приблизительно 406 г (97%) которой составляло указанное в заголовке соединение. Следующие соединения получены, по существу, способом, описанным в примере синтеза 25. Пример синтеза 29. (S)-2-Фтор-3-метилмасляная кислота. Загружали в контейнер Nalgene объемом 3 галлона триэтиламин-тригидрофторид (4,06 л, 25,1 моль), (S)-2-амино-3-метилбутановую кислоту (147,9 г, 1,26 моль) и нитрит натрия (113 г, 1,64 моль). Помешивали при комнатной температуре в течение 12-15 ч. Вливали в холодную воду (5 л) и диэтиловый эфир (7 л) в контейнере Nalgene. Помешивали и затем позволяли фазам разделиться. Промывали органическую фазу водой (3 л). Экстрагировали объединенные водные фазы диэтиловым эфиром (3 л). Промывали объединенные органические фазы водой (3 л) и затем насыщенным водным бикарбонатом натрия. Доводили рН фазы насыщенного водного бикарбоната натрия до рН 4 с помощью 1 н. серной кислоты. Экстрагировали диэтиловым эфиром (22 л), сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении путем ротационного испарения, принимая необходимые меры для того, чтобы температура бани не превышала 30C, с получением 60 г указанного в заголовке соединения в виде масла приблизительно 85-90% чистоты и с энантиомерным избытком, составляющим приблизительно 60%. Пример синтеза 30. Обогащение энантиомерного избытка (S)-2-фтор-3-метилмасляной кислоты. 2-Фтор-3-метилмасляную кислоту (235,5 г, 1,96 моль) добавляли в этилацетат (2,9 л) и добавлялиR-(+)метилбензиламин (237,5 г, 1,96 моль) по каплям через воронку для добавления. Наблюдали повышение температуры до 40C. При естественном охлаждении раствора получали суспензию и перемешивали ее при комнатной температуре в течение 45 мин. Суспензию затем фильтровали и осадок после фильтрации ополаскивали этилацетатом (300 мл). Влажный осадок суспендировали в этилацетате (4,5 л) и нагревали с обратным холодильником. Добавляли дополнительный этилацетат (450 мл) с получением раствора и затем раствор оставляли стоять при комнатной температуре в течение ночи. Полученную суспензию фильтровали и осадок фильтрации ополаскивали этилацетатом (200 мл). Осадок фильтрации сушили в вакууме при 40C с получением 262,3 г (R)-+метилбензиламиновой соли (S)-2-фтор-3 метилмасляной кислоты в виде порошка. Энантиомерный избыток этой соли составлял 94% согласно измерению методом капиллярного электрофореза для целевого (S)-изомера.(R)-+Метилбензиламиновую соль (S)-2-фтор-3-метилмасляной кислоты (252 г, 1,044 моль) добавляли в 1 н. соляную кислоту (1472 мл) и экстрагировали добавлением в диэтиловый эфир (22,5 л). Органические фазы объединяли и промывали 1 н. соляной кислотой (600 мл), сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении путем ротационного испарения, принимая необходимые меры для того, чтобы температура бани не превышала 30C, с получением 122 г (S)-2 фтор-3-метилмасляной кислоты с выходом 97,2% в виде прозрачного масла. Энантиомерный избыток указанной кислоты составлял 96% согласно измерению методом капиллярного электрофореза.(S)-2-Амино-N-(1-метил-2-оксо-5-фенил-2,3-дигидро-1 Н-азепин-3-ил)пропионамид (406 г, 1,423 моль) объединяли с дихлорметаном (3 л) и раствор охлаждали до 0-2C. К этому раствору добавляли (S)2-гидрокси-3-метилмасляную кислоту (168,1 г, 1,423 моль), гидроксибензотриазолгидрат (239,7 г, 1,565 моль) и диизопропилэтиламин (310 мл, 1,779 моль), что вызывало небольшой разогрев. Содержимое снова охлаждали до приблизительно 4C и добавляли гидрохлорид 1-(3-диметиламинопропил)-3 этилкарбодиимида (286,5 г, 1,494 моль). Реакционной смеси позволяли постепенно нагреться до комнатной температуры. Анализ методом высокоэффективной жидкостной хроматографии через 4,5 ч (температура 14C) выявил присутствие приблизительно 5% непрореагировавшего исходного амина. После перемешивания в течение дополнительных 1-1,5 ч реакционную смесь охлаждали путем вливания в воду(1000 мл) и фазы разделялись. Фазу дихлорметана дополнительно экстрагировали водой (1000 мл), 0,1 н.HCl (1000 мл), насыщенным бикарбонатом натрия (1000 мл) и, наконец, насыщенным водным хлоридом натрия. Фазу дихлорметана затем сушили над сульфатом магния, фильтровали и концентрировали путем ротационного испарения с получением неочищенной смеси диастереомеров (505 г) продукта в виде пены желтовато-коричневого цвета. Изомеры разделяли с помощью хиральной хроматографии с использованием колонки Chiralpak AD и 100% метанола в качестве элюата. После удаления растворителя для элюирования из фракций изомеров приблизительно 210 г элюированного первым изомера получали в виде пены желтовато-коричневого цвета и для требуемого изомера 2 получали приблизительно 220 г(44%) также в виде порошка желтовато-коричневого цвета. Элюированный вторым изомер представляет собой требуемый (S,S,S)-диастереомер. Приблизительно 140 г указанного в заголовке соединения переносили в ацетон (1000 мл) и воду (95 мл). Раствор нагревали на роторном испарителе до тех пор, пока не перестали наблюдать суспендированные частицы. Раствор переносили в сосуд, оборудованный верхней мешалкой, и постепенно добавляли воду (2750 мл) в течение 15 мин. Полученной суспензии позволяли остыть до комнатной температуры, затем фильтровали и осадок ополаскивали 20% раствором ацетон/вода (650 мл). После сушки в вакууме при 40C в течение ночи получали приблизительно 102 г соединения, указанного в заголовке примера. МС (m/z): 386,2 (М+1). Следующие соединения получены, по существу, способом, описанным в примере 1. Пример 7. Определение абсолютной конфигурации (S)-2-гидрокси-3-метил-N-[(S)-1-S)-1-метил-2 оксо-5-фенил-2,3-дигидро-1 Н-азепин-3-илкарбамоил)этил]бутирамида. Кристаллы выращивали путем диффузии примесей из газовой фазы н-пентана в раствор (S)-2 гидрокси-3-метил-N-[(S)-1-S)-1-метил-2-оксо-5-фенил-2,3-дигидро-1 Н-азепин-3-илкарбамоил)этил]бутирамида (пример 1, элюированная второй фракция), растворенного в дихлорметане. Отдельный кристалл (S)-2-гидрокси-3-метил-N-[(S)-1-S)-1-метил-2-оксо-5-фенил-2,3-дигидро-1 Н-азепин-3-илкарбамоил)этил]бутирамида сажали на тонкое стекловолокно и погружали в поток азота при -173C. Результаты получали, применяя источники излучения MoK (=0,71073 ) и дифрактометр Р 4, оборудованный площадным детектором SMART 1000CCD (Bruker-AXS. Мэдисон, Висконсин, США). Уточнение ячеек и предварительную обработку данных выполняли, применяя программу SAINT (Sheldrick, G.M.SHELXS86, Acta Cryst. A46, 467-473 (1990. Регистрировали элементарную ячейку, обладающую орторомбическими параметрами а=8,010 (5) , b=20,345 (15) , с=25,513 (19) . Объем элементарной ячейки кристаллической структуры составлял 4157 (5). 3 и плотность составляла 1,232 г/см 3, что соответствовало двум молекулам в элементарной ячейке. Структуру определяли прямыми методами (Sheldrick, G.M.,SHELXS93, Institute fur anorg chemie, Геттинген, Германия). Все параметры решетки атомного кристалла уточняли независимо. Выбор пространственной группы, которая представляла собой P212121, подтверждали успешной сходимостью уточнения полноматричным методом наименьших квадратов по F2 с конечной точностью приближения, составляющей 1,297. Конечный индекс уточнения, R1, составлял = 0,1905, и наибольшее отклонение пика и ямы после последнего цикла уточнения составляли 0,988 и-0,754 (е.А-3) соответственно. Два стереогенных центра определили с помощью коммерческого материала с известной стереохимией (N-(трет-бутоксикарбонил)-L-аланин в примере синтеза 21 и (S)-2-гидрокси-3-метилмасляная кислота в примере 1). Не наблюдалось признаков значительного нарушения стереохимии в любом из этих двух стереогенных центров во время синтеза, соответственно по относительной стереохимии кристаллической структуры стереогенного центра во втором элюируемом диастереомере из примера 1 определили как (S). Пример А. Подавление in vitro продукции -амилоида. Способность соединения подавлять продукцию -амилоида оценивали в линии клеток, несущих мутацию Swedish. В этом скрининговом исследовании использовали клетки (НЕК 293 = линия клеток почки человека), которые были стабильно трансфецированы геном белка-предшественника амилоида 751(АРР 751), содержащим двойную мутацию с заменой Lys651Met652 на Asn651Leu652 (нумерация АРР 751),способом, описанным в международной заявке на патент, номер публикации 94/10569. Эту мутацию обычно называют мутацией Swedish, клетки, обозначенные как "293 751 SWE", высевали в 96-луночные планшеты Corning при плотности 2-4104 клеток на лунку в минимальную поддерживающую среду Дульбекко (Sigma, Сент-Луис, МО) с добавлением 10% эмбриональной бычьей сыворотки. Количество клеток важно для получения результатов твердофазного иммуноферментного анализа (ELISA) амилоидов в линейной области этого анализа (от приблизительно 0,03 до 1,0 нг в мл). После инкубирования в течение ночи при 37C в инкубаторе с 5% диоксида углерода среду удаляли и заменяли на концентрированный раствор тестируемого соединения (200 мкл на лунку) и инкубировали в течение 2 ч. Готовили маточные растворы лекарственных средств в 100% диметилсульфоксиде таким образом, что при конечной концентрации лекарственного средства, используемой для лечения, концентрация диметилсульфоксида не превышала 0,5% и обычно соответствовала 0,1%. По окончании периода инкубации по 100 мкл кондиционированной среды или подходящих разбавлений из каждой лунки переносили на планшеты для ELISA, предварительно покрытые антителом 266[P. Seubert, Nature (1992) 359:325-327] к аминокислотам 13-28 пептида -амилоида, как описано в международной заявке на патент, номер публикации 94/10569, и хранили при 4C в течение ночи. На следующий день проводили анализ ELISA, в котором использовали меченое антитело 3D6 [Р. Seubert, Nature(1992) 359:325-327] к аминокислотам 1-5 пептида -амилоида, чтобы измерить количество продуцированного -амилоидного пептида. Результаты ELISA для пептида -амилоида аппроксимировали стандартной кривой и выражали в нг/мл пептида -амилоида, и концентрацию тестируемого соединения,обеспечивающую подавление 50% ингибирование (IC50) продукции пептида -амилоида, оценивали с использованием четырехпараметрической логистической модели в программе Graph Pad Prism (СанДиего, Калифорния). Влияние соединений на синтез белка клетками измеряли путем оценки включения [35S]метионина в суммарный клеточный белок в клетках 293 751 SWE, которые обрабатывали соединениями. 2-4104 293 751 SWE клеток/лунку в покрытых поли-D-лизином микротитрационных планшетах Cytostar-T (Amersham, Пискатавей, Нью-Джерси) обрабатывали в течение 2 ч тестируемыми соединениями в различных концентрациях в свободной от метионина среде DMEM, содержащей 1% ФБР, 20 мМ HEPES и 1 мкКи[35S]метионина (43,5 ТБк/ммоль; New England Nuclear, Бостон, Массачусетс, США). После инкубирования с тестируемыми соединениями определяли включение [35S]-метионина в суммарный клеточный белок в фиксированных метанолом, промытых ФБР клетках, с помощью сцинцилляционного счетчика Wallac Micobeta (PerkinElmer, Бостон, Массачусетс). По меньшей мере один диастереомер приведенных в качестве примера соединений проявлял IC501 мкМ при тестировании, по существу, как описано выше. Следующие соединения тестировали, по существу, как описано выше, и было обнаружено, что они имеют следующую активность: В данной заявке термин "диастереомер 1" относится к элюируемому первым диастереомеру и "диастереомер 2" относится к элюируемому вторым диастереомеру соединения, которое рассматривается в примере с указанным номером. Пример В. Супрессия in vivo высвобождения и/или синтеза -амилоида. В этом примере показано, как соединения согласно настоящему изобретению можно тестировать на супрессию in vivo высвобождения и/или синтеза -амилоида. Для этих экспериментов использовали мышей PDAPP в возрасте от 3 до 4 месяцев [Games et al., (1995) Nature 373:523-527]. В зависимости от того,какое соединение тестировали, это соединение, как правило, использовали в составе лекарственной формы в концентрации от 1 до 10 мг/мл. Вследствие низких значений растворимости указанных соединений их можно изготавливать с различными средами, такими как кукурузное масло; 10% этанол в кукурузном масле; 2-гидроксипропилциклодекстрин (Research Biochemicals International, Натик, Массачусетс); и карбоксиметилцеллюлоза (Sigma Chemical Co., Сент-Луис, Миссури). Для исследования непосредственной эффективности (в краткосрочном периоде) мышам PDAPP вводили препарат путем перорального гаважа и через 3 ч животных умерщвляли путем наркоза CO2. Для исследования при суб-хроническом применении препарата мышам PDAPP вводили соединение раз в день или дважды в день в течение 7 дней и умерщвляли через 3 ч после последнего введения. Кровь брали путем пункции сердца, применяя туберкулиновый шприц/иглу 1 см 3 25G 5/8", покрытый раствором 0,5 М ЭДТА, рН 8,0. Кровь помещали в вакуумную пробирку Becton-Dickinson, содержащую ЭДТА, и центрифугировали в течение 15 мин при 1500g при 5C. Мозг мышей затем удаляли и вырезали кору и гиппокамп, помещали в подписанные пробирки eppendorf и быстро замораживали на сухом льду. Анализ мозга. Чтобы подготовить ткань гиппокампа и коры к исследованиям методом твердофазного иммуноферментного анализа (ELISA), каждый участок мозга гомогенизировали в 10 об. ледяного гуанидинового буфера (5,0 М гуанидин-HCl, 50 мМ Tris-HCl, рН 8,0), применяя Polytron. Гомогенаты аккуратно качали на поворотной платформе в течение от трех до четырех часов при комнатной температуре и хранили при-20C перед количественным анализом -амилоида. Гомогенаты мозга разбавляли 1:10 ледяным казеиновым буфером [0,25% казеин, фосфатно-солевой буферный раствор (ФБР), 0,05% азида натрия, 20 мкг/мл апротинин, 5 мМ ЭДТА, рН 8,0, 10 мкг/мл леупептин], что приводило к снижению концентрации гуанидина в клетках до 0,5 М, а затем центрифугировали на 16000g в течение 20 мин при 4C. B случае необходимости образцы дополнительно разбавляли, чтобы достигнуть оптимального диапазона измерений ELISA, путем добавления казеинового буфера с добавленным 0,5 М гидрохлоридом гуанидина. Стандарты -амилоида (аминокислоты 1-40 или 1-42) получали таким образом, чтобы конечный состав также содержал 0,5 М гуанидина в присутствии 0,1% бычьего сывороточного альбумина (BSA).- 10017286 В 1-м анализе ELISA модификации "сэндвич" на общий -амилоид, определить количество, по существу, всех видов -амилоида (включая -амилоид 1-40 и -амилоид 1-42), использовали моноклональные антитела (мАт) к -амилоиду. Фиксирующее антитело, 266 [P. Seubert, Nature (1992) 359:325-327],специфично к аминокислотам 13-28 -амилоида. Антитело 3D6 [Johnson-Wood et al., PNAS USA (1997) 94:1550-1555], которое специфично к аминокислотам 1-5 -амилоида, биотинилировали и использовали в качестве репортерного антитела в этом тесте. Процедуру биотинилирования 3D6 осуществляли согласно протоколу производителя (Pierce, Рокфорд, Иллинойс) для мечения иммуноглобулинов NHS-биотином,за исключением того, что использовали буфер, содержащий 100 мМ бикарбоната натрия, рН 8,5. Антитело 3D6 не распознает секретированный белок-предшественник амилоида (АРР) или полноразмерный АРР и позволяет обнаружить только те виды -амилоида, которые содержат аспарагиновую кислоту на конце. Нижний предел чувствительности данного анализа составляет приблизительно 50 пг/мл (11 пМ), и антитело не вступает в перекрестные реакции с эндогенным пептидом -амилоидным мыши при концентрации вплоть до 1 нг/мл. В модификации "сэндвич" метода ELISA, обеспечивающей количественный анализ уровня амилоида (АК 1-42), используют мАт 21F12 [Johnson-Wood et al., PNAS SA (1997) 94:1550-1555] (которое распознает аминокислоты 33-42 -амилоида) в качестве фиксирующего антитела. В данном анализе,который имеет нижний предел чувствительности, равный 125 пг/мл (28 пМ), в качестве репортерного антитела также используют биотинилированное 3D6. Фиксирующие мАт 266 и 21F12 наносили на 96-луночные планшеты для иммунологического анализа в концентрации 10 мкг (Costar, Кембридж, Массачусетс) в течение ночи при комнатной температуре. Из планшетов затем удаляли жидкость и блокировали их 0,25% альбумином сыворотки человека в буфере ФБР в течение по меньшей мере 1 ч при комнатной температуре, затем хранили в безводной среде при 4C до использования. Перед использованием в планшеты наливали промывочный буфер (Trisсолевой буфер, 0,05% Tween 20). В планшеты добавляли образцы и стандарты и инкубировали в течение ночи при 4C. Планшеты промывали 3 раза промывочным буфером между каждым этапом теста. Биотинилированное 3D6, разбавленное до 0,5 мкг/мл в казеиновом буфере для инкубирования (0,25% казеин,ФБР, 0,05% Tween 20, рН 7,4), инкубировали в лунке в течение 1 ч при комнатной температуре. АвидинHRP (пероксидаза хрена) (Vector, Берлингем, Калифорния), разбавленный 1:4000 в казеиновом буфере для инкубирования, добавляли в лунки и выдерживали 1 ч при комнатной температуре. Добавляли цветной субстрат, Slow TMB-ELISA (Pierce, Кембридж, Массачусетс) и оставляли для протекания реакции на 15 мин, после чего ферментативную реакцию останавливали добавлением 2 н. H2SO4. Определяли количество продукта реакции с помощью Molecular Devices Vmax (Molecular Devices, Менло Парк, Калифорния) путем измерения разницы между поглощением на 450 и 650 нм. Соединение из примера 1 (элюируемый вторым диастереомер) тестировали, по существу, как описано выше, и обнаружили, что оно имеет следующую активность. Суммарное снижение содержания гиппокампального А-бета Анализ крови. Плазму с ЭДТА разбавляли 1:1 в разбавителе для образцов (0,2 г/л фосфата натрияH2O (одноосновного), 2,16 г/л фосфата натрия 7 Н 2 О (двухосновного), 0,5 г/л тимеросала, 8,5 г/л хлорида натрия, 0,5 мл Triton X-405, 6,0 г/л свободного от глобулинов бычьего сывороточного альбумина; и вода). Образцы и стандарты в разбавителе образца исследовали с использованием анализа на суммарный -амилоид (266 захватывающее/3D6-репортерное), описанный выше для анализа мозга, за исключением того, что использовали разбавитель для образцов вместо описанных казеиновых разбавителей. Соединение из примера 1 (элюируемый вторым диастереомер) тестировали, по существу, как описано выше, и обнаружили, что оно снижает количество А-бета в плазме на 54% (р 0,001 по сравнению с носителем, который использовали в качестве контроля) при дозе, равной 3 мг/кг (дважды в день в течение 7 дней). Также понятно, что специалист в данной области может воздействовать на болезнь Альцгеймера путем лечения пациента, страдающего этим заболеванием, в текущий момент или путем профилактического лечения пациента, находящегося в группе риска развития этого заболевания. Таким образом, тер- 11017286 мины "терапия" и "лечение" относятся ко всем процессам, среди которых могут быть замедление, прерывание, подавление, контроль или остановка прогрессирования болезни Альцгеймера, но не обязательно указывают на полное устранение всех симптомов. Таким образом, способы согласно настоящему изобретению включают предотвращение начала болезни Альцгеймера у пациента, находящегося в группе риска развития болезни Альцгеймера, подавление прогрессирования болезни Альцгеймера и лечение болезни Альцгеймера в прогрессирующей стадии. В данной заявке термин "эффективное количество" соединения формулы I относится к количеству,которое является эффективным для снижения уровней пептида А у пациента и, в частности, при лечении болезни Альцгеймера. Пероральное введение соединений согласно настоящему изобретению является предпочтительным. Тем не менее, пероральное введение не является единственным путем или единственным предпочтительным путем. Например, трансдермальное введение может быть очень желательным для пациентов,которые забывают принять лекарство для перорального введения или недовольны указанным путем введения, а внутривенный путь может быть предпочтительным с точки зрения удобства или поскольку он позволяет избежать потенциальных осложнений, связанных с пероральным введением. В определенных обстоятельствах соединения формулы I также можно вводить чрескожным, внутримышечным, интраназальным или интраректальным путем. Путь введения может меняться любым образом и ограничен физическими свойствами лекарственных препаратов, удобством для пациента и лица, осуществляющего процедуру, и другими подобными факторами (Remington's Pharmaceutical Sciences, 18-e изд., Mack PublishingCo. (1990. Фармацевтические композиции получают способами, хорошо известными в области фармацевтики. Носитель или вспомогательное вещество может представлять собой твердое вещество, полутвердое вещество или жидкий материал, который может служить в качестве среды или носителя для действующего ингредиента. Подходящие носители или вспомогательные вещества хорошо известны. Фармацевтическую композицию можно адаптировать для введения пероральным, ингаляционным, парентеральным путем или местным введением, и можно вводить пациенту в виде таблеток, капсул, аэрозолей, суппозиториев, растворов, суспензий, при помощи ингаляторов и т.п. Соединения согласно настоящему изобретению можно вводить перорально, например, с инертным разбавителем, или в капсуле, или спрессованными в таблетки. Для перорального введения в терапевтических целях указанные соединения можно объединить со вспомогательными веществами и применять в форме таблеток, пастилок, капсул, эликсиров, суспензий, сиропов, облаток, жевательных резинок и т.п. Такие составы должны содержать по меньшей мере 4% соединения согласно настоящему изобретению действующего ингредиента, но могут различаться в зависимости от конкретной формы и могут содержать от 4 до приблизительно 70 вес.% дозированной лекарственной формы. Количество соединения,присутствующее в композиции, должно быть таким, чтобы обеспечить подходящую дозировку. Предпочтительные композиции и составы согласно настоящему изобретению можно определить способами,хорошо известными специалисту в данной области. Таблетки, пилюли, капсулы, пастилки и т.п. также могут содержать один или более из следующих адъювантов: связующие вещества, такие как повидон, гидроксипропилцеллюлоза, микрокристаллическая целлюлоза или желатин; вспомогательные вещества или разбавители, такие как крахмал, лактоза, микрокристаллическая целлюлоза или двухкальциевый фосфат, дезинтегрирующие агенты, такие как кроскармелоза, кросповидон, натрия крахмал гликолят, кукурузный крахмал и тому подобные; лубриканты, такие как стеарат магния, стеариновая кислота, тальк или гидрогенизированное растительное масло; вещества, облегчающие скольжение, такие как коллоидный диоксид кремния; смачивающие агенты, такие как лаурилсульфат натрия и полисорбат 80; также можно добавлять подслащивающие агенты, такие как сахароза, аспартам или сахарин, или вкусовую добавку, такую как мята перечная, метилсалицилат или апельсиновый ароматизатор. Когда лекарственная форма, содержащая одну дозу, представляет собой капсулу, она может содержать, вдобавок к материалам перечисленных выше типов, жидкий носитель,такой как полиэтиленгликоль или нелетучее жидкое масло. Другие дозированные лекарственные формы могут содержать другие различные материалы, которые изменяют физическую форму единиц дозировки,например, такие как покрытие. Таким образом, таблетки или пилюли могут быть покрыты сахаром, гидроксипропилметилцеллюлозой, полиметакрилатами или другими покрывающими агентами. Сиропы могут содержать в дополнение к соединениям согласно настоящему изобретению сахарозу в качестве подслащивающего агента и некоторые консерванты, красители и красящие вещества и вкусоароматические добавки. Материалы, используемые при получении этих различных композиций, должны быть фармацевтически чистыми и нетоксичными в используемых количествах. Соединения формулы I в целом являются эффективными в широком диапазоне дозировок. Например, ежедневные дозировки обычно лежат в диапазоне от приблизительно 0,001 до приблизительно 30 мг/кг веса тела. В некоторых случаях уровни дозирования ниже нижнего предела указанного диапазона могут быть более чем подходящими, тогда как в других случаях можно использовать даже еще большие дозы, и это не приведет к возникновению побочных эффектов, требующих прекращения терапии, и, следовательно, указанный диапазон дозировок не предполагает какого-либо ограничения объема настояще- 12017286 го изобретения. Очевидно, что количество соединения, которое фактически будут вводить, определяет лечащий врач с учетом сопутствующих обстоятельств, включая заболевание, от которого лечат, выбранный способ введения, конкретное соединение или соединения, которые вводят, возраст, вес и реакцию конкретного пациента, и тяжесть симптомов у пациента. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы I в которой R1 представляет собой гидрокси или фтор;R3 представляет собой водород или фенил;R5 представляет собой водород или фенил; при этом один из R3, R4 и R5 отличен от водорода, а два другие представляют собой атомы водорода. 2. Соединение по п.1, в котором R4 представляет собой водород или фенил. 3. Соединение по любому из пп.1 или 2, в котором R4 представляет собой фенил. 4. Соединение по любому из пп.1-3, в котором R1 представляет собой гидрокси и R2 представляет собой метил. 5. Соединение 6. Фармацевтическая композиция, ингибирующая -секретазу, включающая соединение по любому из пп.1-5 и фармацевтически приемлемый разбавитель. 7. Применение соединения по любому из пп.1-5 в качестве фармацевтического средства, ингибирующего -секретазу. 8. Применение соединения по любому из пп.1-5 для получения лекарственного средства, полезного для лечения болезни Альцгеймера. 9. Применение соединения по любому из пп.1-5 для получения лекарственного средства, полезного для подавления прогрессирования болезни Альцгеймера.
МПК / Метки
МПК: A61K 31/55, A61P 25/00, C07D 223/12
Метки: gamma;-секретазы, ингибиторы
Код ссылки
<a href="https://eas.patents.su/14-17286-ingibitory-gamma-sekretazy.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы гамма-секретазы</a>
Предыдущий патент: Способ каротажа скважины с использованием материала, поглощающего тепловые нейтроны
Следующий патент: Способ получения морфийных соединений
Случайный патент: Сокристаллы пириметанила и дитианона












