Производные арилсульфонамида в качестве ингибиторов матриксной металлопротеазы
Номер патента: 20114
Опубликовано: 29.08.2014
Авторы: Томмаси Рубен Алберто, Рижолье Паскаль, Рожель Оливье, Шультц Майкл, Маккуайр Лесли Уайтон, Эрхардт Клаус
Формула / Реферат
1. Соединение формулы (II)
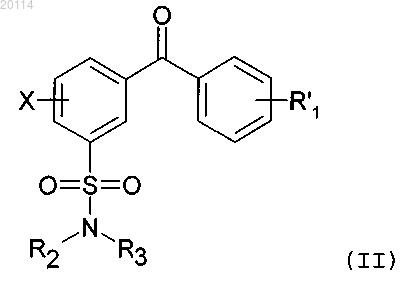
в которой R'1 выбран из группы, включающей (C3-C7)циклоалкил, 5-9-членный гетероарил, 4-9-членный гетероциклил и (C6-C12)арил, где указанный (C6-C12)арил, 5-9-членный гетероарил и 4-9-членный гетероциклил необязательно содержат 1 или 2 заместителя, выбранных из группы, включающей гидроксигруппу, галоген, (C1-C7)алкил, карбоксигруппу, (C1-C7)алкоксикарбонил и НС(О)-;
R2 и R3 обозначают водород;
X обозначает галоген или (C1-C7)алкоксигруппу;
где гетероарил означает 5-9-членную моноциклическую или бициклическую ароматическую кольцевую систему, содержащую от 1 до 2 гетероатомов, выбранных из группы, включающей N, О или S;
гетероциклил означает полностью или частично насыщенную гетероциклическую группу, где каждое кольцо гетероциклической группы, содержащей гетероатом, может содержать 1, 2 или 3 гетероатома, выбранных из группы, включающей атомы азота, кислорода или серы, где группа -СН2- кольца может быть заменена на группу -С(О)- и являющийся гетероатомом атом серы также необязательно может быть окислен в группы S(O) или S(O)2.
или его фармацевтически приемлемая соль, или его оптический изомер, или смесь оптических изомеров.
2. Соединение формулы (III)

в которой R'1 выбран из группы, включающей водород, (C1-C4)алкил, (C6-C12)арил, 5-9-членный гетероарил, (C3-C7)циклоалкил, каждый из которых необязательно содержит 1 или 2 заместителя, выбранных из группы, включающей (C1-C4)алкил-SO2-, (C1-C4)алкил-С(О)-, 5-9-членный гетероциклил(C1-C4)алкил-, (C1-C4)алкил(C1-C4)алкокси-, (C1-C4)алкокси-, (C1-C4)алкил, (C3-C7)циклоалкил, галоген, (C1-C4)алкокси(C1-C4)алкил-, (C1-C4)алкил-О-С(О)-, (C1-C4)диалкиламино(C1-C4)алкокси- и (C1-C4)диалкиламино(C1-C4)алкил-;
R2 и R3 обозначают водород;
X обозначает водород, галоген или (C1-C7)алкил;
Y обозначает С или N;
где гетероарил означает 5-9-членную моноциклическую или бициклическую ароматическую кольцевую систему, содержащую от 1 до 2 гетероатомов, выбранных из группы, включающей N, О или S;
гетероциклил означает полностью или частично насыщенную гетероциклическую группу, где каждое кольцо гетероциклической группы, содержащей гетероатом, может содержать 1, 2 или 3 гетероатома, выбранных из группы, включающей атомы азота, кислорода или серы, где группа -СН2- кольца может быть заменена на группу -C(О)- и являющийся гетероатомом атом серы также необязательно может быть окислен в группы S(O) или S(O)2,
или его фармацевтически приемлемая соль, или его оптический изомер, или смесь оптических изомеров.
3. Соединение по п.2, в котором R'1 обозначает водород, (C1-C4)алкил, фенил, пиридин, где указанный пиридин необязательно содержит 1 или 2 заместителя, выбранных из группы, включающей (C3-C7)циклоалкил, (C1-C4)алкил, галоген, (C1-C4)алкокси(C1-C4)алкил-, 5-9-членный гетероциклил(C1-C4)алкил- и (C1-C4)диалкиламино(C1-C4)алкил-; R2 и R3 обозначают водород; X обозначает галоген; Y обозначает С или N, или его фармацевтически приемлемая соль, или его оптический изомер, или смесь оптических изомеров.
4. Фармацевтическая композиция, обладающая ингибирующей активностью в отношении матриксных металлопротеиназ (ММР), выбранных из ММР-2, ММР-8, ММР-9, ММР-12 и ММР-13, содержащая соединение по п.1 или 2 в терапевтически эффективном количестве и один или более фармацевтически приемлемых носителей.
5. Способ ингибирования активности ММР-2, и/или ММР-8, и/или ММР-9, и/или ММР-12, и/или ММР-13 у субъекта, включающий введение субъекту соединения по п.1 или 2 в терапевтически эффективном количестве.
6. Способ лечения у субъекта нарушения или заболевания, опосредуемого ММР-2, и/или ММР-8, и/или ММР-9, и/или ММР-12, и/или ММР-13, включающий введение субъекту соединения по п.1 или 2 в терапевтически эффективном количестве.
7. Способ по п.6, в котором нарушение или заболевание выбрано из группы, включающей синдром Альпорта, астму, ринит, хронические обструктивные заболевания легких (ХОЗЛ), артрит, атеросклероз и рестеноз, прорастание и метастазирование рака, заболевания, включающие разрушение тканей, нестабильность протезов тазобедренного сустава, заболевание периодонта, фиброзное заболевание, инфаркт и заболевание сердца, эндометриоз, заболевания, связанные с ослаблением внеклеточного матрикса, сердечную недостаточность, аневризмы аорты, заболевания, связанные с ЦНС (центральная нервная система), гематологические нарушения.
8. Способ по п.7, в котором заболевание, связанное с ЦНС, выбрано из болезни Альцгеймера и рассеянного склероза.
9. Способ по п.7, в котором фиброзное заболевание выбрано из фиброза печени и почек.
10. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по п.1 или 2 в комбинации с ингибитором ангиотензинпревращающего фермента (ингибитор АСЕ).
11. Фармацевтическая композиция по п.10, содержащая соединение по п.1 или 2 в терапевтически эффективном количестве и ингибитор АСЕ, выбранный из группы, включающей беназеприл, каптоприл, цилазаприл, эналаприл, фозиноприл, имидаприл, лизиноприл, моэксиприл, хинаприл, периндоприл, рамиприл, спираприл или трандолаприл.
12. Применение соединения по п.1 или 2 для приготовления фармацевтической композиции, предназначенной для лечения у субъекта нарушения или заболевания, опосредуемого ММР-2, и/или ММР-8, и/или ММР-9, и/или ММР-12, и/или ММР-13.
13. Применение фармацевтической композиции по пп.4, 10 или 11 для приготовления лекарственного средства, предназначенного для лечения у субъекта нарушения или заболевания, опосредуемого ММР-2, и/или ММР-8, и/или ММР-9, и/или ММР-12, и/или ММР-13.
Текст
ПРОИЗВОДНЫЕ АРИЛСУЛЬФОНАМИДА В КАЧЕСТВЕ ИНГИБИТОРОВ МАТРИКСНОЙ МЕТАЛЛОПРОТЕАЗЫ Изобретение относится к соединениям формулы (II) и (III), где R'1, R2, R3, X, Y имеют значения,определенные в формуле изобретения, которые являются ингибиторами ММР-2, и/или ММР-8,и/или ММР-9, и/или ММР-12, и/или ММР-13 и могут использоваться для лечения нарушения или заболевания, характеризующегося аномальной активностью ММР-2, и/или ММР-8, и/или ММР-9,и/или ММР-12, и/или ММР-13. Также изобретение относится к фармацевтическим композициям,содержащим указанные соединения. Эрхардт Клаус (CH), Маккуайр Лесли Уайтон (US), Рижолье Паскаль,Рожель Оливье (CH), Шультц Майкл,Томмаси Рубен Алберто (US) Медведев В.Н., Павловский А.Н. (RU) Настоящее изобретение относится к новым соединениям, которые применимы в качестве ингибиторов матриксных металлопротеиназ, таких как матриксная металлопротеиназа 2 (ММР-2), матриксная металлопротеиназа 8 (ММР-8), матриксная металлопротеиназа 9 (ММР-9), матриксная металлопротеиназа 12 (ММР-12) и матриксная металлопротеиназа 13 (ММР-13). Матриксные металлопротеиназы (ММР) являются протеиназами, которые участвуют в разрушении и ремоделировании внеклеточных матриксов (ВКМ) при различных физиологических и патологических состояниях. В ММР, которые представляют собой семейство, содержащее более 20 представителей, в активных центрах используется Zn2+, чтобы катализировать гидролиз ВКМ. По специфичности по отношению к субстратам их приблизительно можно разделить на три подсемейства: коллагеназы, стромелизины и желатиназы. При нормальных физиологических условиях эти ферменты выполняют много важных функций,включая залечивание ран и ремоделирование тканей. Однако, когда эти ферменты сверхактивированы,они могут привести к чрезмерному разрушению ВКМ, что приводит к патологическим состояниям. Например, ММР-2 и ММР-9 (обе являются желатиназами) предположительно участвуют в патогенезе воспалительных, инфекционных и опухолевых заболеваний многих органов. Чрезмерная активность ММР 8, также известной под названием коллагеназа-2 или коллагеназа нейтрофилов, связана с такими заболеваниями, как эмфизема легких и остеоартрит. См. публикацию Balbin et al. "Collagenase 2 (MMP-8) expression in murine tissue-remodeling processes, analysis of its potential role in postpartum involution of theuterus", J. Biol. Chem., 273(37): 23959-23968 (1998). Чрезмерная активность ММР-12, также известной под названием эластаза макрофагов или металлоэластаза, играет ключевую роль при прорастании опухоли,артрите, атеросклерозе, синдроме Альпорта и хроническом обструктивном заболевании легких (ХОЗЛ). ММР-1 и ММР-13 участвуют в протеолизисе коллагена. Чрезмерное разложение коллагена связано с развитием различных заболеваний, включая остеоартрит. См., например, публикацию P.G. Mitchell et al.,"Cloning, expression, and type II collagenolytic activity of matrix metalloproteinase-13 from human osteoarthritic cartilage", J. Clin Invest. 1996 February 1; 97(3): 761-768. В данной области техники известно много ингибиторов ММР. Однако имеющиеся ингибиторы ММР обычно основаны на производных гидроксамовой кислоты. Например, в патенте US6500983,выданном Kottirsch et al., раскрыто применение производных гидроксамовой кислоты в качестве ингибиторов ММР. В патентах US6277987 и 6410580, выданных Kukkola et al., раскрыты производные сульфониламинокислоты и сульфониламиногидроксамовой кислоты в качестве ингибиторов ММР. Содержащийся в этих ингибиторах фрагмент гидроксамовой кислоты связывается с Zn2+ активного центра и ингибирует активность ферментов. Хотя ингибиторы ММР предшествующего уровня техники на основе гидроксамовой кислоты эффективно ингибируют разные ММР, сохраняется необходимость в других типах ингибиторов ММР. Настоящее изобретение относится к новым ингибиторам ММР, которые основаны на арилсульфонамидах. Ниже описаны различные варианты осуществления настоящего изобретения. Следует понимать, что признаки, указанные для каждого варианта осуществления, можно объединить с другими указанными признаками и получить другие варианты осуществления. Одним объектом настоящего изобретения является соединение формулы (II) в которой R'1 выбран из группы, включающей (C3-C7)циклоалкил, 5-9-членный гетероарил, 4-9 членный гетероциклил и (C6-C12)арил, где указанный (C6-C12)арил, 5-9-членный гетероарил и 4-9 членный гетероциклил необязательно содержат 1 или 2 заместителя, выбранных из группы, включающей гидроксигруппу, галоген, (C1-C7)алкил, карбоксигруппу, (C1-C7)алкоксикарбонил и НС(О)-;X обозначает галоген или (C1-C7)алкоксигруппу; где гетероарил означает 5-9-членную моноциклическую или бициклическую ароматическую кольцевую систему, содержащую от 1 до 2 гетероатомов, выбранных из группы, включающей N, О или S; гетероциклил означает полностью или частично насыщенную гетероциклическую группу, где каждое кольцо гетероциклической группы, содержащей гетероатом, может содержать 1, 2 или 3 гетероатома,выбранных из группы, включающей атомы азота, кислорода или серы, где группа -СН 2- кольца может быть заменена на группу -С(О)- и являющийся гетероатомом атом серы также необязательно может быть окислен в группы S(O) или S(O)2,или его фармацевтически приемлемая соль, или его оптический изомер, или смесь оптических изомеров. Одним объектом настоящего изобретения является соединение формулы (III) в которой R'1 выбран из группы, включающей водород, (C1-C4)алкил, (C6-C12)арил, 5-9-членный гетероарил, (C3-C7)циклоалкил, каждый из которых необязательно содержит 1 или 2 заместителя, выбранных из группы, включающей (C1-C4)алкил-SO2-, (C1-C4)алкил-С(О)-, 5-9-членный гетероциклил(C1C4)алкил-, (C1-C4)алкил(C1-C4)алкокси-, (C1-C4)алкокси-, (C1-C4)алкил, (C3-C7)циклоалкил, галоген, (C1C4)алкокси(C1-C4)алкил-,(C1-C4)алкил-О-С(О)-,(C1-C4)диалкиламино(C1-C4)алкоксииY обозначает С или N; где гетероарил означает 5-9-членную моноциклическую или бициклическую ароматическую кольцевую систему, содержащую от 1 до 2 гетероатомов, выбранных из группы, включающей N, О или S; гетероциклил означает полностью или частично насыщенную гетероциклическую группу, где каждое кольцо гетероциклической группы, содержащей гетероатом, может содержать 1, 2 или 3 гетероатома,выбранных из группы, включающей атомы азота, кислорода или серы, где группа -СН 2- кольца может быть заменена на группу -С(О)- и являющийся гетероатомом атом серы также необязательно может быть окислен в группы S(O) или S(O)2,или его фармацевтически приемлемая соль, или его оптический изомер, или смесь оптических изомеров. Настоящее изобретение предпочтительно также относится к соединению формулы (III), в которойR'1 обозначает водород, (C1-C4)алкил, фенил, пиридин, указанный пиридин необязательно содержит 1 или 2 заместителя, выбранных из группы, включающей (C3-C7)циклоалкил, (C1-C4)алкил, галоген, (C1C4)алкокси(C1-C4)алкил-, 5-9-членный гетероциклоалкил(C1-C4)алкил-, 5-9-членный гетероциклоалкил(C1-C4)алкокси- и (C1-C4)диалкиламино(C1-C4)алкил-; R2 и R3 обозначают водород; X обозначает галоген; Y обозначает С или N, или его фармацевтически приемлемой соли, или его оптическому изомеру,или смеси оптических изомеров. Настоящее изобретение относится к соединениям формулы (II) и (III) и к фармацевтическим композициям, в которых применяются такие соединения, и к способам применения таких соединений. Для разъяснения настоящего описания используются указанные ниже определения и, когда это является подходящим, термины, использующиеся в единственном числе, включают множественное число,и наоборот. При использовании в настоящем изобретении термин "алкил" означает полностью насыщенный разветвленный или неразветвленный углеродный фрагмент. Предпочтительно, если алкил включает от 1 до 20 атомов углерода, более предпочтительно от 1 до 16 атомов углерода, от 1 до 10 атомов углерода, от 1 до 7 атомов углерода или от 1 до 4 атомов углерода. Типичные примеры алкила включают, но не ограничиваются только ими, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, нпентил, изопентил, неопентил, н-гексил, 3-метилгексил, 2,2-диметилпентил, 2,3-диметилпентил, нгептил, н-октил, н-нонил, н-децил и т.п. Термин "арил" означает моноциклические или бициклические ароматические углеводородные группы, содержащие в кольцевом фрагменте 6-20 атомов углерода. Предпочтительно, если арил означает(C6-C12)арил. Неограничивающие примеры включают фенил, бифенил, нафтил или тетрагидронафтил,каждый из которых необязательно может содержать 1-4 заместителя, таких как необязательно замещенный алкил, трифторметил, циклоалкил, галоген, гидроксигруппу, алкоксигруппу, ацил, алкил-С(О)-О-,арил-О-, гетероарил-О-, необязательно замещенную аминогруппу, тиогруппу, алкилтиогруппу, арилтиогруппу, нитрогруппу, цианогруппу, карбоксигруппу, алкил-О-С(О)-, карбамоил, алкилтионовую группу,сульфонил, сульфонамидную группу, гетероциклоалкил и т.п. Кроме того, термин "арил" при использовании в настоящем изобретении означает ароматический заместитель, который может являться одиночным ароматическим кольцом или несколькими ароматическими кольцами, которые сконденсированы друг с другом, связаны ковалентной связью или связаны с общей группой, такой как метиленовый или этиленовый фрагмент. Общей связывающей группой также может быть карбонил, как в бензофеноне, или кислород, как в дифениловом эфире, или азот, как в дифениламине. При использовании в настоящем изобретении термин "карбамоил" означает H2NC(O)-, алкилNHC(О)-, (алкил)2 НС(О)-, арил-NHC(О)-, алкил(арил)-NC(О)-, гетероарил-NHC(О)-, алкил(гетероарил)NC(О)-, арилалкил-NHC(О)-, алкил(арилалкил)-NC(О)- и т.п. При использовании в настоящем изобретении термин "сульфонамидная группа" означает алкилS(О)2-NH-, арил-S(О)2-NH-, арилалкил-S(О)2-NH-, гетероарил-S(О)2-NH-, гетероарилалкил-S(О)2-NH-,алкил-S(О)2-N(алкил)-, арил-S(О)2-N(алкил)-, арилалкил-S(О)2-N(алкил)-, гетероарил-S(О)2-N(алкил)-,гетероарилалкил-S(О)2-N(алкил)- и т.п. При использовании в настоящем изобретении термин "гетероциклоалкил" или "гетероциклил" означает необязательно замещенную, полностью насыщенную, частично насыщенную или ненасыщенную ароматическую или неароматическую гетероциклическую группу, которая, например, представляет собой 4-7-членную моноциклическую, 7-12-членную бициклическую или 10-15-членную трициклическую кольцевую систему, которая может быть сконденсированной, боковой или спиросочлененной и содержит по меньшей мере один гетероатом по меньшей мере в одном кольце, содержащем атомы углерода. Каждое кольцо гетероциклической группы, содержащей гетероатом, может содержать 1, 2 или 3 гетероатома,выбранных из группы, включающей атомы азота, кислорода и серы, где группа -СН 2- кольца может быть заменена на группу -С(О)- и являющийся гетероатомом атом серы также необязательно может быть окислен в группы S(O) или S(O)2. В конденсированной кольцевой системе одно кольцо может представлять собой неароматическое гетероциклическое кольцо, а другое кольцо (кольца) может представлять собой циклоалкил, арил или гетероарил. Гетероциклическая группа может быть присоединена по гетероатому или атому углерода. Типичные моноциклические гетероциклические группы включают пирролидинил, пирролил, пиразолил, оксетанил, пиразолинил, имидазолил, имидазолинил, имидазолидинил, триазолил, оксазолил, оксазолидинил, изоксазолинил, изоксазолил, тиазолил, тиадиазолил, тиазолидинил, изотиазолил, изотиазолидинил, фурил, тетрагидрофурил, тиенил, оксадиазолил, пиперидинил, пиперазинил, 2 оксопиперазинил, 2-оксопиперидинил, 2-оксопирролодинил, 2-оксоазепинил, азепинил, 4-пиперидонил,пиридил, пиразинил, пиримидинил, пиридазинил, тетрагидропиранил, морфолинил, тиаморфолинил,тиаморфолинилсульфоксид, тиаморфолинилсульфон, 1,3-диоксолан и тетрагидро-1,1-диоксотиенил,1,1,4-триоксо-1,2,5-тиадиазолидин-2-ил и т.п. Типичные бициклические гетероциклические группы включают индолил, дигидроиндолил, бензотиазолил, бензоксазинил, бензоксазолил, бензотиенил, бензотиазинил, хинуклидинил, хинолинил, тетрагидрохинолинил, декагидрохинолинил, изохинолинил, тетрагидроизохинолинил, декагидроизохинолинил, бензимидазолил, бензопиранил, индолизинил, бензофурил, хромонил, кумаринил, бензопиранил,циннолинил, хиноксалинил, индазолил, пирролопиридил, фуропиридинил (такой как фуро[2,3 с]пиридинил, фуро[3,2-b]пиридинил] или фуро[2,3-b]пиридинил), дигидроизоиндолил, 1,3-диоксо-1,3 дигидроизоиндол-2-ил, дигидрохиназолинил (такой как 3,4-дигидро-4-оксохиназолинил), фталазинил и т.п. Типичные трициклические гетероциклические группы включают карбазолил, дибензоазепинил, дитиеноазепинил, бензиндолил, фенантролинил, акридинил, фенантридинил, феноксазинил, фенотиазинил,ксантенил, карболинил и т.п. При использовании в настоящем изобретении термин "сульфонил" означает R-SO2-, где R обозначает водород, алкил, арил, гетероарил, арилалкил, гетероарилалкил, арил-О-, гетероарил-О-, алкоксигруппу, арилоксигруппу, циклоалкил или гетероциклоалкил. При использовании в настоящем изобретении термин "алкоксигруппа" означает алкил-О-, где алкил определен выше в настоящем изобретении. Типичные примеры алкоксигрупп включают, но не ограничиваются только ими, метоксигруппу, этоксигруппу, пропоксигруппу, 2-пропоксигруппу, бутоксигруппу, трет-бутоксигруппу, пентилоксигруппу, гексилоксигруппу, циклопропилокси-, циклогексилокси- и т.п. При использовании в настоящем изобретении термин "низш. алкоксигруппа" означает алкоксигруппы, содержащие примерно 1-7, предпочтительно примерно 1-4 атомов углерода. При использовании в настоящем изобретении термин "ацил" означает группу R-C(O)-, содержащую от 1 до 10 атомов углерода, обладающую линейной, разветвленной или циклической конфигурацией, или их комбинацию, присоединенную к основной структуре через карбонильную группу. Такая группа может быть насыщенной или ненасыщенной и алифатической или ароматической. Предпочтительно, еслиR в ацильном остатке обозначает алкил, или алкоксигруппу, или арил, или гетероарил. Если R обозначает алкил, то этот фрагмент называется алканоилом. Также предпочтительно, если один или более атомов углерода в ацильном остатке могут быть заменены на азот, кислород или серу при условии, что сохраняется присоединение к основной структуре через карбонильную группу. Примеры включают, но не ограничиваются только ими, ацетил, бензоил, пропионил, изобутирил, трет-бутоксикарбонил, бензилоксикарбонил и т.п. Низш. ацил означает ацил, содержащий от 1 до 4 атомов углерода. При использовании в настоящем изобретении термин "циклоалкил" означает необязательно замещенные насыщенные или ненасыщенные, моноциклические, бициклические или трициклические углеводородные группы, содержащие 3-12 атомов углерода, каждая из которых может содержать один или более заместителей, таких как алкил, галоген, оксогруппу, гидроксигруппу, алкоксигруппу, алкил-С(О)-,ациламиногруппу, карбамоил, алкил-NH-, (алкил)2N-, тиогруппу, алкилтиогруппу, нитрогруппу, цианогруппу, карбоксигруппу, алкил-О-С(О)-, сульфонил, сульфонамидную группу, сульфамоил, гетероциклоалкил и т.п. Типичные моноциклические углеводородные группы включают, но не ограничиваются толь-3 020114 ко ими, циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил и циклогексенил и т.п. Типичные бициклические углеводородные группы включают борнил, индил, гексагидроиндил, тетрагидронафтил, декагидронафтил, бицикло[2,1,1]гексил, бицикло[2.2.1]гептил, бицикло[2.2.1]гептенил, 6,6 диметилбицикло[3.1.1 ]гептил, 2,6,6-триметилбицикло[3.1.1]гептил, бицикло[2.2.2]октил и т.п. Типичные трициклические углеводородные группы включают адамантил и т.п. При использовании в настоящем изобретении термин "сульфамоил" означает H2NS(O)2-, алкилNHS(О)2-, (алкил)2NS(О)2-, арил-NHS(O)2-, алкил(арил)-NS(О)2-, (арил)2NS(О)2-, гетероарил-NHS(О)2-,арилалкил-NHS(О)2-, гетероарилалкил-NHS(O)2- и т.п. При использовании в настоящем изобретении термин "арилоксигруппа" означает и -О-арильную, и-О- гетероарильную группу. При использовании в настоящем изобретении термин "ациламиногруппа" означает группу-NRC(O)R', в которой каждый из R и R' независимо обозначает водород, алкил, арил, гетероарил или гетероциклоалкил, где обе группы R и R' необязательно связаны с образованием гетероциклической группы (например, морфолиновой группы), где алкил, арил, гетероарил и гетероциклоалкил являются такими, как определено в настоящем изобретении. При использовании в настоящем изобретении термин "гетероарил" означает 5-14-членную моноциклическую или бициклическую или конденсированную полициклическую кольцевую систему, содержащую от 1 до 8 гетероатомов, выбранных из группы, включающей N, О и S. Предпочтительно, если гетероарил представляет собой 5-10-членную кольцевую систему. Типичные гетероарильные группы включают 2- или 3-тиенил, 2- или 3-фурил, 2- или 3-пирролил, 2-, 4- или 5-имидазолил, 3-, 4- или 5 пиразолил, 2-, 4- или 5-тиазолил, 3-, 4- или 5-изотиазолил, 2-, 4- или 5-оксазолил, 3-, 4- или 5 изоксазолил, 3- или 5-1,2,4-триазолил, 4- или 5-1,2,3-триазолил, тетразолил, 2-, 3- или 4-пиридил, 3- или 4-пиридазинил, 3-, 4- или 5-пиразинил, 2-пиразинил, 2-, 4- или 5-пиримидинил. Термин "гетероарил" также означает группу, в которой гетероароматическое кольцо сконденсировано с одним или большим количеством арильных, циклоалкильных или гетероциклоалкильных колец, в которой радикал или положение присоединения находится в гетероароматическом кольце. Неограничивающие примеры включают, но не ограничиваются только ими, 1-, 2-, 3-, 5-, 6-, 7- или 8-индолизинил, 1-,3-, 4-, 5-, 6- или 7-изоиндолил, 2-, 3-, 4-, 5-, 6- или 7-индолил, 2-, 3-, 4-, 5-, 6- или 7-индазолил, 2-, 4-, 5-,6-, 7- или 8- пуринил, 1-, 2-, 3-, 4-, 6-, 7-, 8- или 9-хинолизинил, 2-, 3-, 4-, 5-, 6-, 7- или 8-хинолил, 1-, 3-,4-, 5-, 6-, 7- или 8-изохинолил, 1-, 4-, 5-, 6-, 7- или 8-фталазинил, 2-, 3-, 4-, 5- или 6-нафтиридинил, 2-, 3-,5-, 6-, 7-или 8-хиназолинил, 3-, 4-, 5-, 6-, 7- или 8-циннолинил, 2-, 4-, 6- или 7-птеридинил, 1-, 2-, 3-, 4-,5-, 6-, 7- или 8-4 аН карбазолил, 1-, 2-, 3-, 4-, 5-, 6-, 7- или 8-карбазолил, 1-, 3-, 4-, 5-, 6-, 7-, 8- или 9 карболинил, 1-, 2-, 3-, 4-, 6-, 7-, 8-, 9- или 10-фенантридинил, 1-, 2-, 3-, 4-, 5-, 6-, 7-, 8- или 9-акридинил,1-, 2-, 4-, 5-, 6-, 7-, 8- или 9-пиримидинил, 2-, 3-, 4-, 5-, 6-, 8-, 9- или 10-фенантролинил, 1-, 2-, 3-, 4-, 6-, 7-,8- или 9-феназинил, 1-, 2-, 3-, 4-, 6-, 7-, 8-, 9- или 10-фенотиазинил, 1-, 2-, 3-, 4-, 6-, 7-, 8-, 9- или 10 феноксазинил, 2-, 3-, 4-, 5-, 6- или 1-, 3-, 4-, 5-, 6-, 7-, 8-, 9- или 10-бензизохинолинил, 2-, 3-, 4- или тиено[2,3-b]фуранил, 2-, 3-, 5-, 6-, 7-, 8-, 9-, 10- или 11-7 Н-пиразино[2,3-с]карбазолил, 2-, 3-, 5-, 6- или 7-2 Нфуро[3,2-b]пиранил, 2-, 3-, 4-, 5-, 7- или 8-5 Н-пиридо[2,3-d]-о-оксазинил, 1-, 3- или 5-1 Н-пиразоло[4,3d]оксазолил, 2-, 4- или 5-4 Н-имидазо[4,5-d]тиазолил, 3-, 5- или 8-пиразино[2,3-d]пиридазинил, 2-, 3-, 5 или 6-имидазо[2,1-b]тиазолил, 1-, 3-, 6-, 7-, 8- или 9-фуро[3,4-с]циннолинил, 1-, 2-, 3-, 4-, 5-, 6-, 8-, 9-, 10-,или 11-4 Н-пиридо[2,3-с]карбазолил, 2-, 3-, 6- или 7-имидазо[1,2-b][1,2,4]триазинил, 7-бензо[b]тиенил, 2-,4-, 5-, 6- или 7-бензоксазолил, 2-, 4-, 5-, 6-или 7-бензимидазолил, 2-, 4-, 4-, 5-, 6- или 7-бензотиазолил, 1-,2-, 4-, 5-, 6-, 7-, 8- или 9-бензоксапинил, 2-, 4-, 5-, 6-, 7- или 8-бензоксазинил, 1-, 2-, 3-, 5-, 6-, 7-, 8-, 9-, 10 или 11-1 Н-пирроло[1,2-b][2]бензазапинил. Типичные конденсированные гетероарильные группы включают, но не ограничиваются только ими, 2-, 3-, 4-, 5-, 6-, 7- или 8-хинолинил, 1-, 3-, 4-, 5-, 6-, 7- или 8 изохинолинил, 2-, 3-, 4-, 5-, 6- или 7-индолил, 2-, 3-, 4-, 5-, 6- или 7-бензо[b]тиенил, 2-, 4-, 5-, 6- или 7 бензоксазолил, 2-, 4-, 5-, 6- или 7-бензимидазолил, 2-, 4-, 5-, 6- или 7-бензотиазолил. Гетероарильная группа может быть моно-, би-, три- или полициклической, предпочтительно моно-,би- или трициклической, более предпочтительно моно- или бициклической. При использовании в настоящем изобретении термин "галоген" означает фтор, хлор, бром или йод. При использовании в настоящем изобретении термин "изомеры" означает разные соединения, которые обладают одной и той же молекулярной формулой. Кроме того, при использовании в настоящем изобретении термин "оптический изомер" означает любую из разных стереоизомерных конфигураций,которые могут существовать для данного соединения, предлагаемого в настоящем изобретении, и включает геометрические изомеры. Следует понимать, что заместитель может быть присоединен к атому углерода, являющемуся хиральным центром. Поэтому настоящее изобретение включает энантиомеры, диастереоизомеры и рацематы соединения. "Энантиомеры" представляют собой пару стереоизомеров, которые являются зеркальными изображениями, не налагающимися друг на друга. Смесь двух энантиомеров состава 1:1 называется "рацемической" смесью. Этот термин используется для обозначения рацемической смеси, если это является подходящим. "Диастереоизомеры" являются стереоизомерами, которые содержат не менее двух асимметрических атомов, но которые не являются зеркальными изображениями друг друга. Абсолютную стереохимическую конфигурацию описывают с помощью R-S системы Кана-4 020114 Ингольда-Прелога. Если соединение является чистым энантиомером, то стереохимическую конфигурацию каждого хирального атома углерода можно описать, как R или S. Разделенные соединения, абсолютная конфигурация которых не установлена, можно описать с помощью символов (+) или (-) в зависимости от направления, в котором они вращают плоскость поляризации света при длине волны линии D натрия (право- или левовращающие). Некоторые соединения, описанные в настоящем изобретении, содержат один или более асимметрических центров и поэтому могут образовывать энантиомеры, диастереоизомеры и другие стереоизомерные формы, абсолютную стереохимическую конфигурацию которых можно обозначить, как (R)- или (S)-. В объем настоящего изобретения входят все такие возможные изомеры, включая рацемические смеси, оптически чистые формы и смеси промежуточного состава. Оптически активные (R)- и (S)-изомеры можно получить с помощью хиральных синтонов или хиральных реагентов или выделить по обычным методикам. Если соединение содержит двойную связь, то заместители могут находиться в Е или Z конфигурации. Если соединение представляет собой дизамещенный циклоалкил, то заместители циклоалкила могут находиться в цис- или транс-конфигурации. Предполагается,что в объем настоящего изобретения входят все таутомерные формы. При использовании в настоящем изобретении термин "фармацевтически приемлемые соли" означает соли, которые сохраняют биологическую эффективность и свойства соединений, предлагаемых в настоящем изобретении, и которые не являются нежелательными в биологическом или ином отношении. Неограничивающие примеры солей включают нетоксичные, образованные с неорганическим или органическим основанием или кислотой соли присоединения соединений, предлагаемых в настоящем изобретении. Во многих случаях соединения, предлагаемые в настоящем изобретении, могут образовывать соли с кислотой и/или основанием вследствие наличия аминогрупп и/или карбоксигрупп или аналогичных им групп. Фармацевтически приемлемые соли присоединения с кислотами можно образовать с неорганическими кислотами и с органическими кислотами. Неорганические кислоты, из которых можно образовать соли, включают, например, хлористо-водородную кислоту, бромисто-водородную кислоту,серную кислоту, азотную кислоту, фосфорную кислоту и т. п. Органические кислоты, из которых можно образовать соли, включают, например, уксусную кислоту, пропионовую кислоту, гликолевую кислоту,пировиноградную кислоту, щавелевую кислоту, малеиновую кислоту, малоновую кислоту, янтарную кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, коричную кислоту, миндальную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, птолуолсульфоновую кислоту, салициловую кислоту и т.п. Фармацевтически приемлемые соли присоединения с основанием можно образовать с неорганическими и органическими основаниями. Неорганические основания, из которых можно образовать соли, включают, например, основания натрия, калия, лития, аммония, кальция, магния, железа, цинка, меди, марганца, алюминия и т.п.; особенно предпочтительными являются соли аммония, калия, кальция и магния. Органические основания, из которых можно образовать соли, включают, например, первичные, вторичные и третичные амины, замещенные амины,включая природные замещенные амины, циклические амины, основные ионообменные смолы и т.п.,предпочтительно такие как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин и этаноламин. Фармацевтически приемлемые соли, предлагаемые в настоящем изобретении, можно синтезировать из исходного соединения, основного или кислотного фрагмента по обычным химическим методикам. Обычно такие соли можно получить по реакции свободных кислотных форм этих соединений со стехиометрическим количеством соответствующего основания (такого как гидроксид, карбонат, бикарбонат и т.п. Na, Ca, Mg или K) или по реакции свободных основных форм этих соединений со стехиометрическим количеством соответствующей кислоты. Такие реакции обычно проводят в воде или в органическом растворителе или в их смеси. Обычно, если это возможно, предпочтительными являются неводные среды, такие как эфир, этилацетат, этанол, изопропанол или ацетонитрил. Перечни дополнительных подходящих солей приведены, например, в публикации Remington's Pharmaceutical Sciences, 20th ed.,Mack Publishing Company, Easton, Pa. (1985), которая включена в настоящее изобретение в качестве ссылки. При использовании в настоящем изобретении термин "фармацевтически приемлемый носитель" включает любой и все растворители, диспергирующие среды, покрытия, поверхностно-активные вещества, антиоксиданты, консерванты (например, бактерицидные агенты, фунгицидные агенты), изотонические агенты, агенты, задерживающие всасывание, соли, консерванты, лекарственные средства, стабилизаторы лекарственных средств, связующие, инертные наполнители, разрыхлители, смазывающие агенты,подсластители, ароматизаторы, красители, аналогичные материалы и их комбинации, как это должно быть известно специалисту с общей подготовкой в данной области техники (см., например, публикациюRemington's Pharmaceutical Sciences, 18th Ed. Mack Printing Company, 1990, p. 1289-1329, которая включена в настоящее изобретение в качестве ссылки). За исключением случаев, когда обычный носитель несовместим с активным ингредиентом, подразумевается его использование в терапевтических или фармацевтических композициях. Термин "терапевтически эффективное количество" соединения, предлагаемого в настоящем изобретении, означает количество соединения, предлагаемого в настоящем изобретении, которое приводит к биологической или медицинской реакции субъекта, или облегчает симптомы, замедляет или задерживает прогрессирование заболевания, или предупреждает заболевание и т.п. В предпочтительном варианте осуществления "эффективное количество" означает количество, которое ингибирует или уменьшает экспрессирование или активность ММР-2, и/или ММР-8, и/или ММР-9, и/или ММР-12, и/или ММР-13. При использовании в настоящем изобретении термин "субъект" означает животное. Предпочтительно, если животным является млекопитающее. Субъект также означает, например, приматов (например, людей), коров, овец, коз, лошадей, собак, кошек, кроликов, крыс, мышей, рыб, птиц и т.п. В предпочтительном варианте осуществления субъектом является человек. При использовании в настоящем изобретении термин "нарушение" или "заболевание" означает любое расстройство или аномалию функции; болезненное физическое или умственное состояние. См. публикацию Dorland's Illustrated Medical Dictionary (W.B. Saunders Co. 27th ed. 1988). При использовании в настоящем изобретении термин "ингибирование" или "подавление" означает ослабление или подавление данного патологического состояния, симптома, или нарушения, или заболевания или значительное ослабление исходной биологической активности или процесса. Предпочтительно, если патологическое состояние связано с ММР-2, и/или ММР-8, и/или ММР-9, и/или ММР-12, и/или ММР-13, или опосредуется ими. При использовании в настоящем изобретении термин "лечение" любого заболевания или нарушения в одном варианте осуществления означает улучшение протекания заболевания или нарушения (т.е. остановку или ослабление развития заболевания или по меньшей мере одного из его клинических симптомов). В другом варианте осуществления "лечение" означает улучшение по меньшей мере одного физического параметра, который может не ощущаться пациентом. В еще одном варианте осуществления"лечение" означает изменение протекания заболевания или нарушения, физическое (например, стабилизацию проявляющегося симптома) или физиологическое (например, стабилизацию физикального параметра), или и то, и другое. В еще одном варианте осуществления "лечение" означает предупреждение или задержку начала, или развития, или прогрессирования заболевания или нарушения. При использовании в настоящем изобретении (в особенности в формуле изобретения) термины, использующиеся в единственном числе, включают множественное число, и наоборот, если в настоящем изобретении не указано иное и если это явно не противоречит контексту. Указание диапазонов значений в настоящем изобретении используется просто для краткого указания на все отдельные значения, находящиеся в этом диапазоне. Если в настоящем изобретении не указано иное, то каждое отдельное значение включено в описание, как если бы оно было специально указано в настоящем изобретении. Все методики, описанные в настоящем изобретении, можно проводить в любом подходящем порядке, если в настоящем изобретении не указано иное и если это явно не противоречит контексту. Использование любого и всех примеров или указаний на типичные значения (например, "такой как") в настоящем изобретении предназначено просто для лучшего описания настоящего изобретения и не налагает ограничения на объем настоящего изобретения, определяющийся формулой изобретения. Никакое выражение в описании не следует рассматривать, как указывающее на какой-либо незаявленный элемент, важный для практического осуществления настоящего изобретения. Любой асимметрический атом углерода в соединениях, предлагаемых в настоящем изобретении,может обладать (R)-, (S)- или (R,S)-конфигурацией, предпочтительно (R)- или (S)-конфигурацией. Заместители атомов, образующих кратную связь, если это возможно, могут находиться в цис- (Z)- или транс(Е)-конфигурации. Поэтому соединения, предлагаемые в настоящем изобретении, могут находиться в форме одного из возможных изомеров или в виде их смесей, например, в виде в основном чистых геометрических (цис- или транс-) изомеров, диастереоизомеров, оптических изомеров (антиподов), рацематов или их смесей. С использованием различий физико-химических характеристик компонентов все полученные смеси изомеров можно разделить на чистые геометрические или оптические изомеры, диастереоизомеры, рацематы, например, с помощью хроматографии на силикагеле и/или фракционной кристаллизации. Все полученные рацематы конечных или промежуточных продуктов можно разделить на оптические антиподы по известным методикам, например, путем разделения солей их диастереоизомеров, полученных с оптически активной кислотой или основанием, с последующим выделением оптически активной кислоты или основания. В заключение отметим, что соединения, предлагаемые в настоящем изобретении, получают в свободной форме, в виде соли или в виде их пролекарственных производных. Если в соединениях, предлагаемых в настоящем изобретении, содержится основная группа, то соединения можно превратить в соли присоединения с кислотами, в частности в соли присоединения с кислотами по имидазолильному фрагменту структуры, предпочтительно в их фармацевтически приемлемые соли. Они образуются с неорганическими кислотами или с органическими кислотами. Подходящие неорганические кислоты включают, но не ограничиваются только ими, хлористо-водородную кислоту,серную кислоту, фосфорную кислоту и галогенводородную кислоту. Подходящие органические кислоты включают, но не ограничиваются только ими, карбоновые кислоты, такие как (C1-C4)алканкарбоновые кислоты, которые, например, являются незамещенными или замещены галогеном, например уксусную кислоту, такие как насыщенные или ненасыщенные дикарбоновые кислоты, например щавелевую, ян-6 020114 тарную, малеиновую или фумаровую кислоту, такие как гидроксикарбоновые кислоты, например гликолевую, молочную, яблочную, винную или лимонную кислоту, такие как аминокислоты, например аспарагиновую или глутаминовую кислоту, органические сульфоновые кислоты, такие как (C1C4)алкилсульфоновые кислоты, например метансульфоновую кислоту; или арилсульфоновые кислоты,которые являются незамещенными или замещены, например, галогеном. Предпочтительными являются соли, образованные с хлористо-водородной кислотой, метансульфоновой кислотой и малеиновой кислотой. Если в соединениях, предлагаемых в настоящем изобретении, содержится кислотная группа, то соединения можно превратить в соли с фармацевтически приемлемыми основаниями. Такие соли включают соли щелочных металлов, такие как соли натрия, лития и калия; соли щелочно-земельных металлов,такие как соли кальция и магния; соли аммония и соли с органическими основаниями, например соли с триметиламином, соли с диэтиламином, соли с трис-(гидроксиметил)метиламином, соли с дихлоргексиламином и соли с N-метил-D-глюкамином; соли с аминокислотами, такими как аргинин, лизин и т. п. Соли можно получить по обычным методикам, предпочтительно в присутствии эфирного или спиртового растворителя, такого как низший алканол. Из раствора в последнем соли можно осадить простыми эфирами, например диэтиловым эфиром. Полученные соли можно превратить в свободные соединения путем обработки кислотами. Эти и другие соли также можно использовать для очистки полученных соединений. Если в одной молекуле содержатся одновременно основная группа и кислотная группа, то соединения, предлагаемые в настоящем изобретении, также могут образовывать внутренние соли. Кроме того, соединения, предлагаемые в настоящем изобретении, включая их соли, также можно получить в форме их гидратов или с включением других растворителей, использовавшихся для их кристаллизации. Соединения, предлагаемые в настоящем изобретении, обладают ценными фармакологическими характеристиками, они применимы в качестве ингибиторов матриксных металлопротеиназ, таких как матриксная металлопротеиназа 2 (ММР-2), матриксная металлопротеиназа 8 (ММР-8), матриксная металлопротеиназа 9 (ММР-9), матриксная металлопротеиназа 12 (ММР-12) и матриксная металлопротеиназа 13(ММР-13). ММР-2 и ММР-9 являются желатиназами, участвующими в процессах ремоделирования тканей, и они обе способствуют метастазированию опухолей. Само по себе селективное ингибирование этих протеаз желатиназ может быть полезно для борьбы с метастазированием опухолей. ММР-8, также известная под названием коллагеназа-2 или коллагеназа нейтрофилов, также участвует в ремоделировании тканей. Ингибирование ММР-8 применимо для предупреждения, задержки прогрессирования или лечения заболеваний, таких как фиброзные заболевания легких, разрушающих заболеваний, таких как эмфизема легких и остеоартрит и т.п. ММР-12, также известная под названием эластаза макрофагов или металлоэластаза, способна разрушать компоненты внеклеточного матрикса, такие как эластин, и участвует в процессах ремоделирования тканей. Указано, что ММР-12 является ключевым белком в патогенезе прорастания опухолей, артрита, атеросклероза, синдрома Альпорта и хронического обструктивного заболевания легких (ХОЗЛ). Указано, что ММР-13, также известная под названием коллагеназа-3, участвует (1) в разрушении внеклеточного матрикса и нарушении взаимодействий клетка-матрица, связанных с метсатазированием, в частности это обнаружено при прорастающем раке молочной железы и злокачественном росте эпителия при онкогенезе кожи; и (2) при первичном окостенении и ремоделировании скелета (М. Stahle-Backdahl et al. (1997), Lab. Invest. 76 (5):717-728; N. Johansson et al. (1997), Dev. Dyn. 208(3):387-397), при деструктивных заболеваниях костей, таких как ревматоидный артрит и остеоартрит(D. Wernicke et al. (1996), J. Rheumatol. 23:590-595; P. G. Mitchell et al. (1996), J. Clin. Invest. 97(3):761768; O. Lindy et al. (1997), Arthritis Rheum. 40 (8:1391-1399); и асептической нестабильности протезов тазобедренного сустава (S. Imai et al. (1998), J. Bone Joint Surg. Br. 80(4):701-710). MMP13 также участвует в хроническом периодонтите взрослых, поскольку она локализована в эпителии хронически воспаленной слизистой оболочки десневой ткани человека (V.J. Uitto et al. (1998), Am. J. Pathol. 152(6): 14891499) и в ремоделировании коллагенового матрикса при долго незаживающих ранах (М. Vaalamo et al.(1997), J. Invest. Dermatol. 109(1): 96-101). В соответствии с этим соединения, предлагаемые в настоящем изобретении, также применимы для лечения нарушения или заболевания, опосредуемого ММР-2, и/или ММР-8, и/или ММР-9, и/или ММР 12, и/или ММР-13. В частности, соединения, предлагаемые в настоящем изобретении, применимы для лечения по меньшей мере одного нарушения или заболевания, выбранного из группы, включающей синдром Альпорта, астму, ринит, хронические обструктивные заболевания легких (ХОЗЛ), артрит (такой как ревматоидный артрит и остеоартрит), атеросклероз и рестеноз, прорастание и метастазирование рака,заболевания, включающие разрушение тканей, нестабильность протезов тазобедренного сустава, заболевание периодонта, фиброзное заболевание, инфаркт и заболевание сердца, фиброз печени и почек, эндометриоз, заболевания, связанные с ослаблением внеклеточного матрикса, сердечную недостаточность,аневризмы аорты, заболевания, связанные с ЦНС (центральная нервная система), такие как болезнь Альцгеймера и рассеянный склероз (MS), гематологические нарушения. Кроме того, настоящее изобретение относится к: соединению, предлагаемому в настоящем изобретении, предназначенному для применения в качестве лекарственного средства; применению соединения, предлагаемого в настоящем изобретении, для приготовления фармацевтической композиции, предназначенной для задержки прогрессирования и/или лечения нарушения или заболевания, опосредуемого ММР-2, и/или ММР-8, и/или ММР-9, и/или ММР-12, и/или ММР-13; применению соединения, предлагаемого в настоящем изобретении, для приготовления фармацевтической композиции, предназначенной для задержки прогрессирования и/или лечения нарушения или заболевания, выбранного из группы, включающей синдром Альпорта, астму, ринит, хронические обструктивные заболевания легких (ХОЗЛ), артрит (такой как ревматоидный артрит и остеоартрит), атеросклероз и рестеноз, прорастание и метастазирование рака, заболевания, включающие разрушение тканей,нестабильность протезов тазобедренного сустава, заболевание периодонта, фиброзное заболевание, инфаркт и заболевание сердца, фиброз печени и почек, эндометриоз, заболевания, связанные с ослаблением внеклеточного матрикса, сердечную недостаточность, аневризмы аорты, заболевания, связанные с ЦНС(центральная нервная система), такие как болезнь Альцгеймера и рассеянный склероз (MS), гематологические нарушения. Соединения формулы (I) и (II) можно получить по любой из четырех общих методик синтеза кетонов, описанных в приведенном ниже разделе. Первая методика (методика А) представляет собой формирование кетона путем ацилирования по Фриделю-Крафтсу, как это показано в приведенном ниже примере. Стандартная методика синтеза бензоилхлоридов. 4-Хлор-3-сульфамоилбензоилхлорид. Смесь 4-хлор-3-сульфамоилбензойной кислоты (50 г, 212 ммоль) и тионилхлорида (31 мл, 424 ммоль) кипятят с обратным холодильником в течение 5 ч, затем ей дают охладиться до комнатной температуры. К этой смеси добавляют гексан и полученное твердое вещество фильтруют, промывают гексаном, сушат в вакууме и получают 52,3 г (97%) искомого соединения в виде почти белого твердого вещества. Стандартная методика получения кетонов путем ацилирования по Фриделю-Крафтсу. Искомый кетон можно путем смешивания реагентов сочетания в метиленхлориде (дихлорметане(ДХМ или 1,2-дихлорэтане (ДХЭ) и добавления кислоты Льюиса (хлорид алюминия, MeAlCl2 илиMe2AlCl) для стимулирования образования ацилиевого иона, который вводят в реакцию ацилирования по Фриделю-Крафтсу. Вторая методика (методика В) включает добавление металлоорганического реагента к альдегиду с последующим окислением полученного спирта с образованием кетона. Обычно необходимый альдегид(2-хлор-5-формилбензолсульфонамид) синтезируют, как это описано ниже. Общая методика синтеза 2-хлор-5-формилбензолсульфонамида. Этиловый эфир 4-хлор-3-сульфамоилбензойной кислоты. Через суспензию 4-хлор-3-сульфамоилбензойной кислоты (50 г, 212 ммоль) в 500 мл этанола пропускают газообразный HCl в течение 10 мин. Затем полученную суспензию кипятят с обратным холодильником в течение 16 ч, охлаждают и концентрируют в вакууме. Полученный остаток перекристаллизовывают из изопропанола и получают 55,9 г (99%) искомого соединения в виде почти белого твердого вещества. 2-Хлор-5-гидроксиметилбензолсульфонамид. К раствору этилового эфира 4-хлор-3-сульфамоилбензойной кислоты (46,95 г, 166 ммоль) в 500 мл сухого тетрагидрофурана (ТГФ) при перемешивании по каплям добавляют 199 мл 2 М раствора борогидрида лития в тетрагидрофуране. Смесь перемешивают и кипятят с обратным холодильником в течение 5 ч, затем выдерживают при комнатной температуре в течение 18 ч и затем осторожно разбавляют с помощью 400 мл воды. Смесь в течение 24 ч охлаждают до 4 С, фильтруют и получают 32,7 г (82%) искомого соединения в виде почти белого твердого вещества. 2-Хлор-5-формилбензолсульфонамид. При энергичном перемешивании к раствору 2-хлор-5-гидроксиметилбензолсульфонамида (31,6 г,143 ммоль) в 300 мл тетрагидрофурана добавляют 62,0 г (713 ммоль) MnO2. Полученный раствор кипятят с обратным холодильником в течение 16 ч, фильтруют через целит, затем через тефлоновый фильтр с размером пор, равным 0,4 мкм, и фильтрат концентрируют в вакууме для удаления тетрагидрофурана. Растирание с гексанами дает 25 г (80%) искомого соединения в виде серого твердого вещества. 2-Хлор-5-(4-фторбензоил)бензолсульфонамид. 2-Хлор-5-[(4-фторфенил)гидроксиметил]бензолсульфонамид. Раствор 590 мг 1-бромфторбензола (1,11 ммоль, 3 экв.) в 10 мл безводного тетрагидрофурана перемешивают при -78 С, в то время как по каплям добавляют 3,9 мл трет-бутиллития (1,7 М раствор в циклогексане, 6,66 ммоль, 6 экв.). Реакционную смесь перемешивают при -78 С в течение 2 ч, затем переносят в предварительно приготовленный раствор 243 мг 2-хлор-5-формилбензолсульфонамида (1,11 ммоль,1 экв.) и 0,65 мл трет-бутиллития (1,7 М раствор в циклогексане, 1 экв.) в 10 мл безводного тетрагидрофурана. Реакционной смеси дают нагреться до комнатной температуры и ее перемешивают при комнатной температуре в течение 18 ч. Реакцию останавливают 0,1 н. раствором HCl и затем смесь несколько раз экстрагируют этилацетатом. Объединенные органические экстракты сушат над сульфатом натрия и концентрируют в вакууме и получают 65 мг искомого соединения, которое используют на следующей стадии без дополнительной очистки. 2-Хлор-5-(4-фторбензоил)бензолсульфонамид. Раствор 65 мг 2-хлор-5-4-фторфенил)гидроксиметил)бензолсульфонамида в 1 мл ацетона перемешивают при комнатной температуре, в то время как добавляют 0,2 мл 3 М раствора реагента Джонса. Реакционную смесь перемешивают при комнатной температуре в течение 30 мин, затем разбавляют этилацетатом, фильтруют через целит и фильтрат концентрируют в вакууме. Неочищенный продукт очищают с помощью хроматографии на силикагеле и получают 48 мг искомого соединения в виде белого вспененного вещества. 1 Н ЯМР (спектроскопия ядерного магнитного резонанса (CDCl3:5,15 (br, 2 Н), 7,12-7,30 (m, 3 Н),7,70 (d, J=8 Гц, 1 Н), 7,80-7,90 (m, 2H), 7,90-8,0 (dd, 1H), 8,5 (d, J=2 Гц, 1 Н).MC (масс-спектроскопия) (m/z): 312 (M-1). В третьей методике (методика С) синтез кетона осуществляют с использованием в качестве реагента сочетания электрофильного амида Вайнреба вместо альдегида. Стандартная методика получения реагента сочетания Вайнреба. Получение 4-хлор-N-метокси-N-метил-3-сульфамоилбензамида. 4-Хлор-3-сульфамоилбензойную кислоту (5 г) обрабатывают с помощью 20,5 мл тионилхлорида и кипятят с обратным холодильником в течение 5,5 ч. Тионилхлорид удаляют, остаток сушат в вакууме при 50 С и получают 5,6 г 4-хлор-3-сульфамоилбензоилхлорида в виде желтовато-коричневого порошкообразного вещества. Это вещество переносят в 28 мл метиленхлорида и при 0 С обрабатывают с помощью 2,64 г N,О-диметилгидроксиламингидрохлорида, затем с помощью 10,9 мл пиридина и перемешивают при комнатной температуре в течение ночи. Реакцию останавливают при 0 С с помощью 19 мл 3 н. водного раствора HCl и смесь экстрагируют этилацетатом. Органические вещества объединяют, промывают насыщенным водным раствором бикарбоната натрия, 0,1 н. водным раствором HCl и насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют в вакууме. Полученные кристаллы отфильтровывают через тонкий слой силикагеля (1:2 гексаны/этилацетат) и получают искомое соединение в виде белого порошкообразного вещества.MC (m/z): (M-1) 277; Rf (коэффициент удерживания)=0,36 (1:2 гексаны/этилацетат). Стандартная процедура получения кетонов по методике С. 2-Хлор-5-(4-диметиламинобензоил)бензолсульфонамид. Раствор 1,07 г N,N-диметил-4-бромамина (5,39 ммоль, 3 экв.) в 30 мл безводного тетрагидрофурана перемешивают при -78 С, в то время как добавляют 6,34 мл трет-бутиллития (1,7 М раствор в пентане,10,78 ммоль, 6 экв.). Реакционную смесь перемешивают при -78 С в течение 10 мин, затем добавляют 430 мг 4-хлор-N-метокси-N-метил-3-сульфамоилбензамида (1,54 ммоль, 1 экв.) в 10 мл безводного тетрагидрофурана. Реакционную смесь перемешивают при -78 С в течение 20 мин, затем нагревают до комнатной температуры и перемешивают при комнатной температуре в течение 18 ч. Реакцию останавливают водой и смесь экстрагируют этилацетатом. Объединенные органические экстракты промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют в вакууме. После очистки с помощью флэш-хроматографии получают 300 мг продукта в виде твердого вещества (выход 57%). 1 Н ЯМР (400 МГц, CDCl3):3,10 (s, 6H), 5,17 (s, 2 Н), 6,68 (d, 2H, J=12 Гц), 7,64 (d, 1H, J=8 Гц), 7,74(d, 2H, J=8 Гц), 7,86 (d, 1H, J=2 Гц), 8,41 (s, 1H). МС (m/z): 339 (М+1). В четвертой методике (методика D) синтез кетона осуществляют с использованием катализируемой палладием реакции перекрестного сочетания оловоорганического соединения с хлорангидридом кислоты. Стандартная методика катализируемой палладием реакции перекрестного сочетания, синтез производных индазола. Броминдазол (1,0 экв.) и гексаметилдиолово (1,25 экв.) в атмосфере азота растворяют в деоксигенированном толуоле. Добавляют тетракис-(трифенилфосфин)палладий (0,07 экв.) и смесь кипятят с обратным холодильником до тех пор, пока анализ с помощью ЖХ-МС (жидкостная хроматография-массспектроскопия) не свидетельствует о полном израсходовании бромида. Реакционную смесь подвергают распределению между буфером, обладающим значением рН, равным 7, и этилацетатом и объединенные органические вещества сушат над сульфатом натрия и концентрируют и получают неочищенный арилстаннан, который используют без дополнительной очистки. Арилстаннан (1,0 экв.) и 1,8-бис(диметиламино)нафталин (0,5 экв.), растворенные в тетрагидрофуране, обрабатывают бензоилхлоридом(1,0 экв.). Через несколько минут добавляют димер аллилпалладийхлорида (0,05 экв.), реакционную смесь перемешивают при температуре окружающей среды в течение 5 мин и затем кипятят с обратным холодильником в течение 2-18 ч. После охлаждения до температуры окружающей среды реакционную смесь разбавляют дихлорметаном, промывают насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия. Сушка над сульфатом натрия, фильтрование и концентрирование дают неочищенный продукт, который очищают с помощью флэш-хроматографии и получают бежевое твердое вещество. Специалист с общей подготовкой в данной области техники должен понимать, что без отклонения от объема настоящего изобретения возможны модификации этих общих схем синтеза кетонов. Специалистам в данной области техники также должно быть очевидно, что существуют другие методики синтеза кетонов, и эти четыре методики являются только примерами подходов к получению кетонов. В исходных соединениях и промежуточных продуктах, которые превращают в соединения, предлагаемые в настоящем изобретении, по методикам, описанным в настоящем изобретении, содержатся функциональные группы, такие как аминогруппы, тиогруппы, карбоксигруппы и гидроксигруппы, которые необязательно защищены с помощью обычных защитных групп, которые типичны для препаративной органической химии. Защищенными аминогруппами, тиогруппами, карбоксигруппами и гидроксигруппами являются такие, которые в мягких условиях можно превратить в свободные аминогруппы, тиогруппы, карбоксигруппы и гидроксигруппы без разрушения структуры молекулы и протекания других нежелательных побочных реакций. Задачей введения защитных групп является защита функциональных групп от нежелательных реакций с реакционноспособными компонентами при условиях, использующихся для проведения необходимого химического превращения. Необходимость и выбор защитных групп для конкретной реакции известны специалистам в данной области техники и зависят от характера защищаемой функциональной группы (гидроксигруппы, аминогруппы, карбоксигруппы и т.п.), структуры и стабильности молекулы,частью которой является заместитель, и условий проведения реакции. Хорошо известные защитные группы, которые соответствуют этим условиям, и их введение и удаление описаны, например, в публикациях McOmie, "Protective Groups in Organic Chemistry", Plenum Press,London, NY (1973); Greene and Wuts, "Protective Groups in Organic Synthesis", John Wiley and Sons, Inc.,NY (1999). Указанные выше реакции проводят по стандартным методикам в присутствии или при отсутствии разбавителя, предпочтительно такого как инертный по отношению к реагентами и их растворителям,- 10020114 катализаторов, конденсирующих или других указанных реагентов, в инертной атмосфере, при низкой температуре, комнатной температуре или повышенной температуре, предпочтительно при температуре кипения использующихся растворителей или близкой к ней температуре, при атмосферном или более высоком, чем атмосферное, давлении. Предпочтительные растворители, катализаторы и условия проведения реакций указаны в прилагающихся иллюстративных примерах. Настоящее изобретение также относится к любому варианту описанных способов, в котором промежуточных продукт, получаемый на любой стадии, используют в качестве исходного вещества, и проводят последующие стадии, или в котором исходные вещества образуются in situ при проведении реакции, или в котором компоненты реакции используются в виде солей или оптически чистых антиподов. Соединения, предлагаемые в настоящем изобретении, и промежуточные продукты также можно превратить друг в друга по методикам, которые являются общеизвестными. Другим объектом настоящего изобретения является фармацевтическая композиция, включающая соединение, предлагаемое в настоящем изобретении, и фармацевтически приемлемый носитель. Фармацевтическую композицию можно приготовить для конкретных путей введения, таких как пероральное введение, парентеральное введение и ректальное введение и т.п. Кроме того, фармацевтические композиции, предлагаемые в настоящем изобретении, можно приготовить в твердой форме, включая капсулы,таблетки, пилюли, гранулы, порошки или суппозитории, или в жидкой форме, включая растворы, суспензии или эмульсии. Фармацевтические композиции можно подвергнуть обычной фармацевтической обработке, такой как стерилизация, и/или они могут содержать обычные инертные разбавители, смазывающие агенты или буферные агенты, а также вспомогательные вещества, такие как консерванты, стабилизаторы, смачивающие агенты, эмульгаторы и буферные агенты и т.п. Предпочтительно, если фармацевтические композиции являются таблетками или капсулами из желатина, включающими активный ингредиент, а также:b) смазывающие агенты, например диоксид кремния, тальк, стеариновую кислоту, ее магниевую или кальциевую соль и/или полиэтиленгликоль; для таблеток такжеc) связующие, например алюмосиликат магния, крахмальная паста, желатин, трагакантовую камедь,метилцеллюлозу, натриевую соль карбоксиметилцеллюлозы и/или поливинилпирролидон; при необходимостиd) разрыхлители, например крахмалы, агар, альгиновую кислоту или ее натриевую соль либо шипучие смеси; и/илиe) абсорбенты, красители, ароматизаторы и подсластители. На таблетки по методикам, известным в данной области техники, можно нанести пленочное покрытие или энтеросолюбильное покрытие. Композиции, подходящие для перорального введения, включают соединение, предлагаемое в настоящем изобретении, в эффективном количестве в виде таблеток, лепешек, водных или масляных суспензий, диспергирующихся порошков или гранул, эмульсий, твердых или мягких капсул или сиропов,или эликсиров. Композиции, предназначенные для перорального применения, получают по любой методике, известной в данной области техники для приготовления фармацевтических композиций, и такие композиции могут содержать один или более агентов, выбранных из группы, включающей подсластители, ароматизаторы, красители и консерванты, чтобы получить фармацевтически привлекательные и обладающие приятным вкусом препараты. Таблетки содержат активный ингредиент в смеси с нетоксичными фармацевтически приемлемыми инертными наполнителями, которые являются подходящими для изготовления таблеток. Этими инертными наполнителями являются, например, инертные разбавители,такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие и обеспечивающие распадаемость агенты, например кукурузный крахмал или альгиновая кислота; связывающие агенты, например крахмал, желатин или камедь акации; и смазывающие агенты, например стеарат магния, стеариновая кислота или тальк. Таблетки не содержат покрытия или на них по известным методикам наносят покрытие для задержки распада и всасывания в желудочно-кишечном тракте,что обеспечивает непрерывное воздействие в течение более длительного периода времени. Например,можно использовать такое замедляющее вещество, как глицерилмоностеарат или глицерилдистеарат. Препараты для перорального применения также могут представлять собой капсулы из твердого желатина, в которых активный ингредиент смешан с инертным твердым разбавителем, например карбонатом кальция, фосфатом кальция или каолином, или капсулы из мягкого желатина, в которых активный ингредиент смешан с водой или масляной средой, например арахисовым маслом, жидким парафином или оливковым маслом. Композиции для инъекций предпочтительно представляют собой изотонические водные растворы или суспензии, а суппозитории предпочтительно готовят из эмульсий или суспензий жиров. Указанные композиции можно стерилизовать и/или прибавлять к ним вспомогательные вещества, такие как консервирующие, смачивающие или эмульгирующие агенты, стимуляторы растворения, соли для регулирования осмотического давления и/или буферные агенты. Кроме того, они также могут содержать другие те- 11020114 рапевтически ценные вещества. Указанные композиции получают по обычным технологиям смешивания, гранулирования или нанесения покрытий и они содержат примерно 0,1-75%, предпочтительно примерно 1-50% активного ингредиента. Композиции, подходящие для чрескожного введения, включают эффективное количество соединения, предлагаемого в настоящем изобретении, с носителем. Предпочтительные носители включают впитывающиеся фармакологически приемлемые растворители, способствующие проникновению через кожу реципиента. Например, устройства для чрескожного введения представляют собой повязку, включающую защитный слой, резервуар, содержащий соединение необязательно с носителями, необязательно барьер, регулирующий доставку соединения через кожу реципиента с заданной скоростью в течение пролонгированного периода времени, и средства закрепления устройства на коже. Композиции, подходящие для местного введения, например на кожу или в глаза, включают водные растворы, суспензии, мази, кремы, гели или распыляемые композиции, например для подачи в виде аэрозоля и т.п. Такие устройства местного действия являются особенно подходящими для воздействия на кожу, например для лечения рака кожи, например, для использования профилактических средств в солнцезащитных кремах, лосьонах, аэрозольных препаратах и т.п. Поэтому они являются особенно подходящими для использования в средствах местного действия, включая косметические, хорошо известных в данной области техники. Они могут содержать солюбилизаторы, стабилизаторы, агенты, регулирующие тоничность, буферные агенты и консерванты. Настоящее изобретение также относится к безводным фармацевтическим композициям и дозированным формам, включающим соединения, предлагаемые в настоящем изобретении, в качестве активных ингредиентов, поскольку вода может облегчать разложение некоторых соединений. Например, прибавление воды (например, 5%) широко используется в фармацевтике в качестве средства улучшения долговременной сохранности и определения таких характеристик, как срок годности при хранении и стабильность композиции во времени. См., например, Jens Т. Carstensen, Drug Stability: PrinciplesPractice,2d. Ed., Marcel Dekker, NY, N.Y., 1995, p. 379-80. На самом деле вода и тепло ускоряют разложение некоторых соединений. При этом влияние воды на композицию может быть более значительным, поскольку вода и/или влажность обычно воздействуют при изготовлении, обращении, упаковке, транспортировке и применении препаратов. Безводные фармацевтические композиции и дозированные формы, предлагаемые в настоящем изобретении, можно получить с использованием безводных или обладающих низкой влажностью ингредиентов в условиях низкой влажности. Предпочтительно, чтобы фармацевтические композиции и дозированные формы, которые включают лактозу и по меньшей мере один активный ингредиент, который включает первичный или вторичный амин, являлись безводными, если при изготовлении, упаковке и/или хранении предполагается воздействие влаги. Безводную фармацевтическую композицию следует готовить и хранить так, чтобы она оставалась безводной. В соответствии с этим безводные композиции предпочтительно упаковывать в материалы,для которых известно, что они защищают от воздействия воды, так чтобы их было можно включить в подходящие наборы препаратов. Примеры подходящих упаковочных средств включают, но не ограничиваются только ими, герметично запаиваемую фольгу, пластмассы, контейнеры для разовых доз (например, флаконы), блистерные упаковки и ленточные упаковки. Настоящее изобретение также относится к фармацевтическим композициям и дозированным формам, которые включают один или более агентов, которые регулируют скорость, с которой будет разлагаться соединение, предлагаемое в настоящем изобретении в качестве активного ингредиента. Такие агенты, которые в настоящем изобретении называют "стабилизаторами", включают, но не ограничиваются только ими, антиоксиданты, такие как аскорбиновая кислота, буферные агенты, регулирующие рН, и солевые буферные агенты и т. п. Фармацевтические композиции содержат соединение, предлагаемое в настоящем изобретении, определенное выше, в терапевтически эффективном количестве по отдельности или в комбинации с другим терапевтическим средством, например, каждое в терапевтически эффективной дозе, указанной в данной области техники. В одном варианте осуществления такие терапевтические средства включают, например,1) антагонисты рецептора AT1, выбранные из группы, включающей абитесартан, бензиллосартан, кандесартан, элисартан, эмбусартан, енолтазосартан, эпросартан, фонсартан, форасартан, глициллосартан, ирбесартан, изотеолин, лосартан, милфасартан, олмесартан, опомисартан, пратосартан, риписартан, саприсартан, саралазин, сармезин, тазосартан, телмисартан, валсартан, золасартан; которые сами по себе известны, или их любые физиологически совместимые соли, сольваты, пролекарства или сложные эфиры; 2) неселективные антагонисты альфа-адренорецептора, например толазолин или феноксибензамин; 3) селективные антагонисты альфа-адренорецептора, например доксазозин, празозин, теразозин или урапидил; антагонисты бета-адренорецептора, например ацебутолол, алпренолол,атенолол, бетаксолол, бисопролол, бупранолол, каразолол, картеолол, целипролол, мепиндолол, метипранолол, метопролол, надолол, окспренолол, пенбутолол, пиндолол, пропранолол, соталол и тимолол; 4) смешанные антагонисты альфа- и бета-адренорецепторов, например карведилол или лабетолол; ганглиоблокаторы, например резерпин или гванетидин; 5) агонисты альфа-2-адренорецептора (включая агонисты альфа-2-адренорецептора центрального действия), например клонидин, гуанфацин, гуанабенз, метилдопа и моксонидин; 6) ингибиторы ренина, например алискирен; 7) ингибиторы АСЕ, например беназеприл, каптоприл, цилазаприл, эналаприл, фозиноприл, имидаприл, лизиноприл, моэксиприл, хинаприл,периндоприл, рамиприл, спираприл или трандолаприл; 8) антагонисты эндотелинового рецептора смешанного или селективного действия, например атрасентан, босентан, клазосентан, дарусентан, ситакссентан, тезосентан, BMS-193884 или J-104132; сосудорасширяющие средства прямого действия, например диазоксид, дигидралазин, гидралазин или миноксидил; 9) смешанные двойные ингибиторыACE/NEP, например омапатрилат; ингибиторы ЕСЕ, например FR-901533; PD-069185; CGS-26303; CGS34043; CGS-35066; CGS-30084; CGS-35066; SM-19712; Ro0677447; 10) селективные ингибиторы NEP; 11) антагонисты вазопрессина; 12) антагонисты альдостеронового рецептора, например эплеренон; 13) ингибиторы альдостерона; 14) ангиотензиновую вакцину; 15) антагонисты уротензинового рецептора II; 16) противовоспалительные средства или противоревматические средства. В другом варианте осуществления такие терапевтические средства включают антипролиферативные соединения. Такие антипролиферативные соединения включают, но не ограничиваются только ими,ингибиторы ароматазы; антиэстрогены; ингибиторы топоизомеразы I; ингибиторы топоизомеразы II; соединения, активные по отношению к микротрубочкам; алкилирующие соединения; ингибиторы гистондезацетилазы; соединения, которые индуцируют процессы дифференциации клеток; ингибиторы циклооксигеназы; ингибиторы ММР; ингибиторы mTOR; противоопухолевые антиметаболиты; соединения платины; соединения, предназначенные для избирательного воздействия/уменьшения активности протеин или липидкиназы и другие антиангиогенные соединения; соединения, которые предназначены для избирательного воздействия/уменьшения или ингибирования активности протеин или липидфосфатазы; агонисты гонадорелина; антиандрогены; ингибиторы метионинаминопептидазы; бисфосфонаты; модификаторы биологического ответа; антипролиферативные антитела; ингибиторы гепараназы; ингибиторы онкогенных изоформ Ras; ингибиторы теломеразы; ингибиторы протеосомы; соединения, применяющиеся при лечении злокачественных заболеваний крови; соединения, которые предназначены для избирательного воздействия, уменьшения или ингибирования активности Flt-3; ингибиторы Hsp90, такие как 17-AAG (17-аллиламиногелданамицин, NSC330507), 17-DMAG (17-диметиламиноэтиламино-17 деметоксигелданамицин, NSC707545), IPI-504, CNF1010, CNF2024, CNF1010 от фирмы Conforma Therapeutics; темозоломид (ТЕМОДАЛ); ингибиторы кинезинового белка веретена, такие как SB715992 илиSB743921 от фирмы GlaxoSmithKline, или пентамидин/хлорпромазин от фирмы CombinatoRx; ингибиторы MEK, такие как ARRY142886 от фирмы Array PioPharma, AZD6244 от фирмы AstraZeneca, PD181461 от фирмы Pfizer, и лейковорин. Термин "ингибитор ароматазы" при использовании в настоящем изобретении означает соединение,которое ингибирует продуцирование эстрогена, т.е. превращение субстратов андростендиона и тестостерона в эстрон и эстрадиол соответственно. Термин предпочтительно включает, но не ограничивается только ими, атаместан, экземестан и форместан и, предпочтительно, нестероидные соединения, предпочтительно аминоглютетимид, роглетимид, пироглютетимид, трилостан, тестолактон, кетоконазол, воро- 13020114 зол, фадрозол, анастрозол и летрозол. Экземестан можно вводить, например, в той форме, в которой он продается, например, под торговым названием АРОМАЗИН. Форместан можно вводить, например, в той форме, в которой он продается, например, под торговым названием ЛЕНТАРОН. Фадрозол можно вводить, например, в той форме, в которой он продается, например, под торговым названием АФЕМА. Анастрозол можно вводить, например, в той форме, в которой он продается, например, под торговым названием АРИМИДЕКС. Летрозол можно вводить, например, в той форме, в которой он продается, например, под торговым названием ФЕМАРА или ФЕМАР. Аминоглютетимид можно вводить, например, в той форме, в которой он продается, например, под торговым названием ОРИМЕТЕН. Комбинация, предлагаемая в настоящем изобретении, включающая химиотерапевтическое средство, которое представляет собой ингибитор ароматазы, является особенно подходящей для лечения гормональнорецептороположительных опухолей, например, опухолей молочной железы. Термин "антиэстроген" при использовании в настоящем изобретении относится к соединению, которое противодействует воздействию эстрогена на уровне эстрогенного рецептора. Термин включает, но не ограничивается только ими, тамоксифен, фулвестрант, ралоксифен и ралоксифенгидрохлорид. Тамоксифен можно вводить, например, в той форме, в которой он продается, например, под торговым названием НОЛВАДЕКС. Ралкосифенгидрохлорид можно вводить, например, в той форме, в которой он продается, например, под торговым названием ЭВИСТА. Фулвестрант можно приготовить так, как это раскрыто в US 4659516, или его можно вводить, например, в той форме, в которой он продается, например,под торговым названием ФАЗЛОДЕКС. Комбинация, предлагаемая в настоящем изобретении, включающая хемотерапевтическое средство, которое является антиэстрогеном, является особенно полезной для лечения эстрогенных рецептороположительных опухолей, например опухолей молочной железы. Термин "антиандроген" при использовании в настоящем изобретении относится к любому соединению, которое может ингибировать биологические воздействие андрогенных гормонов, и включает, но не ограничивается только ими, бикалутамид (КАСОДЕКС), который можно приготовить, например, так, как это раскрыто в US 4636505. Термин "агонист гонадорелина" при использовании в настоящем изобретении включает, но не ограничивается только ими, абареликс, госерелин и госерелинацетат. Госерелин раскрыт в US 4100274 и его можно вводить, например, в той форме, в которой он продается, например, под торговым названием ЗОЛАДЕКС. Абареликс можно приготовить, например, так, как это раскрыто в US 5843901. Термин "ингибитор топоизомеразы I" при использовании в настоящем изобретении включает, но не ограничивается только ими, топотекан, гиматекан, иринотекан, камптотецин и его аналоги, 9 нитрокамптотецин и макромолекулярный конъюгат камптотецина PNU-166148 (соединение А 1 в WO 99/17804). Иринотекан можно вводить, например, в той форме, в которой он продается, например, под торговым названием КАПМТОСАР. Топотекан можно вводить, например, в той форме, в которой он продается, например, под торговым названием ГИКАМТИН. Термин "ингибитор топоизомеразы II" при использовании в настоящем изобретении включает, но не ограничивается только ими, антрациклины, такие как доксорубицин (включая липосомную композицию, например, КАЕЛИКС), даунорубицин, эпирубицин, идарубицин, неморубицин, антрахиноны митоксантрон и лозоксантрон и подофиллотоксины этопозид и тенипозид. Этопозид можно вводить, например, в той форме, в которой он продается, например, под торговым названием ЭТОПОФОС. Тенипозид можно вводить, например, в той форме, в которой он продается, например, под торговым названиемVM 26-БРИСТОЛ. Доксорубицин можно вводить, например, в той форме, в которой он продается, например, под торговым названием АДРИБЛАСТИН или АДРИАМИЦИН. Эпирубицин можно вводить,например, в той форме, в которой он продается, например, под торговым названием ФАРМОРУБИЦИН. Идарубицин можно вводить, например, в той форме, в которой он продается, например, под торговым названием ЗАВЕДОС. Митоксантрон можно вводить, например, в той форме, в которой он продается,например, под торговым названием НОВАНТРОН. Термин "средство, активное по отношению к микротрубочкам" относится к стабилизирующим микротрубочки, дестабилизирующим микротрубочки соединениям и ингибиторам полимеризации микротубулина и включая, но не ограничиваясь только ими, таксаны, например паклитаксел и доцетаксел; алкалоиды барвинка, например винбластин, предпочтительно винбластинсульфат, винкристин, предпочтительно винкристинсульфат и винорелбин, дискодермолиды, колхицин и эпотилоны и их производные,например, эпотилон В или D или его производные. Паклитаксел можно вводить, например, в той форме,в которой он продается, например, ТАКСОЛ. Доцетаксел можно вводить, например, в той форме, в которой он продается, например, под торговым названием ТАКСОТЕР. Винбластинсульфат можно вводить,например, в той форме, в которой он продается, например, под торговым названием ВИНБЛАСТИН R.P. Винкристинсульфат можно вводить, например, в той форме, в которой он продается, например, под торговым названием ФАРМИСТИН. Дискодермолид можно получить, например, так, как это раскрыто вUS 5010099. Также включены производные эпотилона, которые раскрыты в WO 98/10121, US 6194181,WO 98/25929, WO 98/08849, WO 99/43653, WO 98/22461 и WO 00/31247. Особенно предпочтительными являются эпотилон А и/или В. Термин "алкилирующиее средство" при использовании в настоящем изобретении включает, но не ограничивается только ими, циклофосфамид, ифосфамид, мелфалан и нитрозомочевину (BCNU или глиадель). Циклофосфамид можно вводить, например, в той форме, в которой он продается, например,под торговым названием ЦИКЛОСТИН. Ифосфамид можно вводить, например, в той форме, в которой он продается, например, под торговым названием ГОЛОКСАН. Термин "ингибиторы гистондезацетилазы" или "ингибиторы HDAC" относится к соединениям, которые ингибируют гистондезацетилазу и которые обладают антипролиферативной активностью. Они включают соединения, раскрытые в WO 02/22577, предпочтительно N-гидрокси-3-[4-(2 гидроксиэтил)[2-(1H-индол-3-ил)этил]амино]метил]фенил]-2E-2-пропенамид,N-гидрокси-3-[4-2-(2 метил-1H-индол-3-ил)этил]амино]метил]фенил]-2E-2-пропенамид и их фармацевтически приемлемые соли. Они также предпочтительно включают субероиланилид гидроксамовой кислоты (САГА). Термин "противоопухолевый антиметаболит" включает, но не ограничивается только ими, 5 фторурацил или 5-FU, капецитабин, гемцитабин, деметилирующие ДНК агенты, такие как 5-азацитидин и децитабин, метотрексат и эдатрексат и антагонисты фолиевой кислоты, такие как пеметрексед. Капецитабин можно вводить, например, в той форме, в которой он продается, например, под торговым названием КСЕЛОДА. Гемцитабин можно вводить, например, в той форме, в которой он продается, например,под торговым названием ГЕМЗАР. Термин "соединение платины" при использовании в настоящем изобретении включает, но не ограничивается только ими, карбоплатин, цисплатин, цисплатинум и оксалиплатин. Карбоплатин можно вводить, например, в той форме, в которой он продается, например, под торговым названием КАРБОПЛАТ. Оксалиплатин можно вводить, например, в той форме, в которой он продается, например, под торговым названием ЭЛОКСАТИН. Термин "соединения, избирательно действующие/уменьшающие активность протеин или липидкиназы; или активности протеин или липидфосфатазы; или другие антиангиогенные соединения" при использовании в настоящем изобретении включает, но не ограничивается только ими, ингибиторы протеинтирозинкиназы и/или серин и/или треонинкиназы или липидкиназы, например,a) соединения, избирательно действующие, уменьшающие или ингибирующие активность рецепторов тромбоцитарного фактор роста (PDGFR), такие как соединения, которые избирательно действуют,уменьшают или ингибируют активность PDGFR, предпочтительно соединения, которые ингибируют рецептор PDGF, например, производное N-фенил-2-пиримидинамина, например иматиниб, SU101,SU6668 и GFB-111;b) соединения, избирательно действующие, уменьшающие или ингибирующие активность рецепторов фактора роста фибробластов (FGFR);c) соединения, избирательно действующие, уменьшающие или ингибирующие активность рецептора инсулиноподобного фактора роста I (IGF-IR), такие как соединения, которые избирательно действуют,уменьшают или ингибируют активность IGF-IR, предпочтительно соединения, которые ингибируют активность киназы рецептора IGF-I, такие как соединения, раскрытые в WO 02/092599, или антитела, которые избирательно действуют на внеклеточный домен рецептора IGF-I или его факторы роста;d) соединения, избирательно действующие, уменьшающие или ингибирующие активность семейства тирозинкиназ рецептора Trk, или ингибиторы эфрина В 4;e) соединения, избирательно действующие, уменьшающие или ингибирующие активность семейства тирозинкиназ рецептора Axl;f) соединения, избирательно действующие, уменьшающие или ингибирующие активность тирозинкиназы рецептора Ret;g) соединения, избирательно действующие, уменьшающие или ингибирующие активность тирозинкиназы рецептора Kit/SCFR, например, иматиниб;h) соединения, избирательно действующие, уменьшающие или ингибирующие активность тирозинкиназ рецептора C-kit - (часть семейства PDGFR), такие как соединения, которые избирательно действуют, уменьшают или ингибируют активность семейства тирозинкиназ рецептора c-Kit, предпочтительно соединения, которые ингибируют рецептор c-Kit, например иматиниб;i) соединения, избирательно действующие, уменьшающие или ингибирующие активность представителей семейства с-Abl, продуктов их слияния с генами (например, BCR-Abl киназы) и мутантов, такие как соединения, которые избирательно действуют, уменьшают или ингибируют активность представителей семейства с-Abl и продуктов их слияния с генами, например, производное N-фенил-2 пиримидинамина, например иматиниб или нилотиниб (AMN107); PD180970; AG957; NSC 680410;j) соединения, избирательно действующие, уменьшающие или ингибирующие активность представителей семейства протеинкиназ С (РКС) и семейства Raf серин/треонинкиназ MEK, SRC, JAK, FAK,PDK1, PKB/Akt, и представителей семейства Ras/MAPK, и/или представителей семейства циклинзависимых киназ (CDK) и в особенности производные стауроспорина, раскрытые в US 5093330, например мидостаурин; примеры других соединений включают, например, UCN-01, сафингол, BAY 43-9006, бриостатин 1; перифосин; илмофосин; RO 318220 и RO 320432; GO 6976; Isis 3521; LY333531/LY379196; изохинолиновые соединения, такие как раскрыты в WO 00/09495; FTIs; PD184352 или QAN697 (ингибиторk) соединения, избирательно действующие, уменьшающие или ингибирующие активность ингибиторов протеинтирозинкиназы, включая иматинибмезилат (ГЛЕЕВЕК) и тирфостин. Тирофостин предпочтительно представляет собой соединение с низкой молекулярной массой (Mr1500) или его фармацевтически приемлемую соль, предпочтительно соединение, выбранное из группы, включающей класс бензилиденмалонитрилов или класс S-арилбензолмалонитрилов или класс бисубстратных хинолинов,более предпочтительно любое соединение, выбранное из группы, включающей тирфостин A23/RG50810; AG 99; тирфостин AG 213; тирфостин AG 1748; тирфостин AG 490; тирфостин В 44; тирфостин В 44 (+)-энантиомер; тирфостин AG 555; AG 494; тирфостин AG 556, AG957 и адафостин (адамантиловый эфир 4-[(2,5-дигидроксифенил)метил]аминобензойной кислоты); NSC 680410, адафостин);l) соединения, избирательно действующие, уменьшающие или ингибирующие активность семейства тирозинкиназ рецептора эпидермального фактора роста (EGFR, ErbB2, ErbB3, ErbB4 в виде гомо- или гетеродимеров) и их мутантов, такие как соединения, которые избирательно действуют, уменьшают или ингибируют активность семейства рецепторов эпидермального фактора роста, предпочтительно соединения, белки или антитела, которые ингибируют представителей семейства тирозинкиназ рецептораEGF, например, рецептора EGF, ErbB2, ErbB3 и ErbB4, или связываются с относящимися к EGF или EGF лигандами и предпочтительно являются такими соединениями, белками или моноклональными антителами, которые в общем и конкретно раскрыты в WO 97/02266, например, соединение примера 39, или в ЕР 0564409, WO 99/03854, ЕР 0520722, ЕР 0566226, ЕР 0787722, ЕР 0837063, US 5747498, WO 98/10767,WO 97/30034, WO 97/49688, WO 97/38983 и, в особенности, в WO 96/30347 (например, соединение, известное, как СР 358774), WO 96/33980 (например, соединение ZD 1839) и WO 95/03283 (например, соединение ZM105180); например, трастузумаб (герцептин), цетуксимаб (эрбутукс), пресса, тарцева,OSI-774, CI-1033, ЕКВ-569, GW-2016, Е 1.1, Е 2.4, Е 2.5, Е 6.2, Е 6.4, E2.11, Е 6.3 или Е 7.6.3, и производные 7H-пирроло-[2,3-d]пиримидина, которые раскрыты в WO 03/013541; иm) соединения, избирательно действующие, уменьшающие или ингибирующие активность рецептора c-Met, такие как соединения, которые избирательно действуют, уменьшают или ингибируют активность рецептора c-Met, предпочтительно соединения, которые ингибируют киназную активность рецептора c-Met, или антитела, которые избирательно действуют на внеклеточный домен c-Met или связываются с HGF. Другие антиангиогенные соединения включают соединения, характеризующиеся другим механизмом своей активности, например, не относящейся к ингибированию протеин или липидкиназы, например талидомид (ТАЛОМИД) и TNP-470. Соединения, которые избирательно действуют, уменьшают или ингибируют активность протеин или липидфосфатазы, являются, например ингибиторами фосфатазы 1, фосфатазы 2 А или CDC25, например, окадаевая кислота или ее производные. Соединения, которые индуцируют процессы дифференциации клеток, представляют собой например, ретиноевую кислоту, -, - или -токоферол или -, -или -токотриенол. Термин "ингибитор циклооксигеназы" при использовании в настоящем изобретении включает, но не ограничивается только ими, например, ингибиторы Сох-2, 5-алкилзамещенную 2 ариламинофенилуксусную кислоту и производные, такие как целекоксиб (ЦЕЛЕБРЕКС), рофекоксиб(ВИОКС), эторикоксиб, валдекоксиб и 5-алкил-2-ариламинофенилуксусная кислота, например, 5-метил 2-(2'-хлор-6'-фторамино)фенилуксусная кислота и лумиракоксиб. Термин "бисфосфонаты" при использовании в настоящем изобретении включает, но не ограничивается только ими, этридоновую, клодроновую, тилудроновую, памидроновую, алендроновую, ибандроновую, риседроновую и золендроновую кислоту. "Этридроновую кислоту" можно вводить, например, в той форме, в которой она продается, например, под торговым названием ДИДРОНЕЛ. "Клодроновую кислоту" можно вводить, например, в той форме, в которой она продается, например, под торговым названием БОНЭФОС. "Тилудроновую кислоту" можно вводить, например, в той форме, в которой она продается,например, под торговым названием СКЕЛИД. "Памидроновую кислоту" можно вводить, например, в той форме, в которой она продается, например, под торговым названием АРЕДИА. "Алендроновую кислоту" можно вводить, например, в той форме, в которой она продается, например, под торговым названием ФОСАМАКС. "Ибандроновую кислоту" можно вводить, например, в той форме, в которой она продается, например, под торговым названием БОНДРАНАТ. "Риседроновую кислоту" можно вводить, например, в той форме, в которой она продается, например, под торговым названием АКТОНЕЛ. "Золендроновую кислоту" можно вводить, например, в той форме, в которой она продается, например, под торговым названием ЗОМЕТА. Термин "ингибиторы mTOR" относится к соединениям, которые ингибируют мишень воздействия рапамицина у млекопитающих (mTOR) и которые обладают антипролиферативной активностью, такие как сиролимус (рапамун), эверолимус (цертикан), CCI-779 и АВТ 578. Термин "ингибитор гепариназы" при использовании в настоящем изобретении означает соединения, которые избирательно действуют, уменьшают или ингибируют разложение гепаринсульфата. Тер- 16020114 мин включает, но не ограничивается только им, PI-88. Термин "модификатор биологического ответа" при использовании в настоящем изобретении означает лимфокин или интерфероны, например, интерферон . Термин "ингибитор онкогенных изоформ Ras", например, H-Ras, K-Ras, или N-Ras, при использовании в настоящем изобретении означает соединения, которые избирательно действуют, уменьшают или ингибируют онкогенную активность Ras, например, "ингибитор фарнезилтрансферазы", например, L744832, DK8G557 или R115777 (зарнестра). Термин "ингибитор теломеразы" при использовании в настоящем изобретении означает соединения, которые избирательно действуют, уменьшают или ингибируют активность теломеразы. Соединения,которые избирательно действуют, уменьшают или ингибируют активность теломеразы, предпочтительно представляют собой соединения, которые ингибируют рецептор теломеразы, например, теломестатин. Термин "ингибитор метионинаминопептидазы" при использовании в настоящем изобретении означает соединения, которые избирательно действуют, уменьшают или ингибируют активность метионинаминопептидазы. Соединения, которые избирательно действуют, уменьшают или ингибируют активность метионинаминопептидазы, представляют собой, например, бенгамид или его производные. Термин "ингибитор протеосомы" при использовании в настоящем изобретении означает соединения, которые избирательно действуют, уменьшают или ингибируют активность протеосомы. Соединения, которые избирательно действуют, уменьшают или ингибируют активность протеосомы, включают,например, бортезомид (велкаде) и MLN 341. Термин "ингибитор матриксной металлопротеиназы" или "ингибитор ММР" при использовании в настоящем изобретении включает, но не ограничивается только ими, пептидомиметические и непептидомиметические ингибиторы коллагена, производные тетрациклина, например, пептидомиметический ингибитор гидроксамата - батимастат и его обладающий пероральной биологической доступностью аналог маримастат (ВВ-2516), приномастат (AG3340), метастат (NSC 683551) BMS-279251, BAY 12-9566,ТАА 211, MMI270B или AAJ996. Термин "соединения, применяющиеся при лечении злокачественных заболеваний крови" при использовании в настоящем изобретении включает, но не ограничивается только ими, FMS-подобные ингибиторы тирозинкиназы, например, соединения, избирательно действующие, уменьшающие или ингибирующие активность рецепторов FMS-подобной тирозинкиназы (Flt-3R); интерферон, 1-b-Dарабинофурансилцитозин (ara-с) и бисульфан; и ингибиторы ALK, например, соединения, которые избирательно действуют, уменьшают или ингибируют киназы анапластической лимфомы. Соединения, которые избирательно действуют, уменьшают или ингибируют активность рецепторовFMS-подобной тирозинкиназы (Flt-3R), предпочтительно представляют собой соединения, белки или антитела, которые ингибируют представителей семейства тирозинкиназ рецептора Flt-3R, например,PKC412, мидостаурин, производное стауроспорина, SU11248 и MLN518. Термин "ингибиторы HSP90" при использовании в настоящем изобретении включает, но не ограничивается только ими, соединения, которые избирательно действуют, уменьшают или ингибируют специфическую АТФазную активность HSP90; разрушают избирательно действуют, уменьшают или ингибируют клиентные белки HSP90 по убиквитиновому пути протеосомы. Соединения, избирательно действующие, уменьшающие или ингибирующие специфическую АТФазную активность HSP90, предпочтительно представляют собой соединения, белки или антитела, которые ингибируют специфическую АТФазную активность HSP90, например, 17-аллиламино,17-деметоксигелданамицин (17AAG), производное гелданамицина, другие родственные гелданамицину соединения, радицикол и ингибиторы HDAC. Термин "антипролиферативные антитела" при использовании в настоящем изобретении включает,но не ограничивается только ими, трастузумаб (герцептин), трастузумаб-DM1, эрбутукс, бевацизумаб(авастин), ритуксимаб (ритуксан), PRO64553 (анти-CD40) и 2 С 4 антитела. Под антителами понимаются, например, интактные моноклональные антитела, поликлональные антитела, поливалентные антитела, сформированные по меньшей мере из двух интактных антител, и фрагменты антител, если они обладают необходимой биологической активностью. Кроме того, описанные выше комбинации можно вводить субъекту путем одновременного, раздельного или последовательного введения (применения). Одновременное введение (применение) можно проводить в виде одной фиксированной комбинации двух или большего количества активных ингредиентов или путем одновременного введения двух, трех или большего количества соединений, которые приготовлены в виде отдельных препаратов. Последовательное введение (применение) предпочтительно означает введение одного (или большего количества) соединений или активных ингредиентов комбинации в один момент времени, других соединений или активных ингредиентов в другой момент времени, т. е. хронологически поочередным образом, предпочтительно так, чтобы комбинация проявляла более значительную эффективность, чем отдельные соединения, вводимые независимо (предпочтительно, чтобы проявляла синергизм). Раздельное введение (применение) предпочтительно означает введение соединений или активных ингредиентов комбинации независимо друг от друга в разные моменты времени,предпочтительно означает, что два соединения вводят так, чтобы одновременно оба соединения не нахо- 17020114 дились в крови в измеримых содержаниях (не происходило перекрывания). Также возможны комбинации одного, двух или большего количества последовательных, раздельных и одновременных введений, предпочтительно, чтобы такая комбинация соединение-лекарственные средства проявляла объединенное терапевтическое воздействие, которое превышает воздействие, проявляющееся, когда комбинации соединение-лекарственные средства применяются по отдельности через промежутки времени, столь большие, что не обнаруживается взаимное влияние на терапевтическую эффективность, особенно предпочтительным является синергетическое воздействие. Кроме того, настоящее изобретение относится к: фармацевтической композиции или комбинации, предлагаемой в настоящем изобретении для применения в качестве лекарственного средства; применению фармацевтической композиции или комбинации, предлагаемой в настоящем изобретении, для задержки прогрессирования и/или лечения нарушения или заболевания, опосредуемого ММР-2,и/или ММР-8, и/или ММР-9, и/или ММР-12, и/или ММР-13. применению фармацевтической композиции или комбинации, предлагаемой в настоящем изобретении, для задержки прогрессирования и/или лечения нарушения или заболевания, выбранного из группы,включающей гипокалиемию, гипертензию, застойную сердечную недостаточность, почечную недостаточность, в частности, хроническую почечную недостаточность, рестеноз, атеросклероз, синдром X,ожирение, нефропатию, состояние после инфаркта миокарда, ишемическую болезнь сердца, усиленное образование коллагена, фиброз и ремоделирование после гипертензии и дисфункцию эндотелия; применению фармацевтической композиции или комбинации, предлагаемой в настоящем изобретении, для задержки прогрессирования и/или лечения нарушения или заболевания, выбранного из группы,включающей гинекомастию, остеопороз, рак предстательной железы cancer, эндометриоз, фиброз матки,маточное дисфункциональное кровотечение, гиперплазию эндометрия, поликистозную болезнь яичников, бесплодие, кистозно-фиброзное заболевание молочной железы, рак молочной железы и кистознофиброзную мастопатию. Фармацевтическая композиция или комбинация, предлагаемая в настоящем изобретении, может содержать в разовой дозе примерно 1-1000 мг активных ингредиентов для субъекта массой примерно 50-70 кг, предпочтительно примерно 5-500 мг активных ингредиентов. Терапевтически эффективная доза соединения, фармацевтической композиции или их комбинаций зависит от вида субъекта, массы тела, возраста и индивидуального состояния, нарушения или заболевания, подвергающегося лечению, и его тяжести. Врач, клиницист или ветеринар с общей подготовкой должен легко определить эффективное количество каждого из активных ингредиентов, необходимое для предупреждения, лечения или подавления прогрессирования нарушения или заболевания. Указанные выше характеристики доз можно определить с помощью провидимых in vitro и in vivo исследований, предпочтительно с использованием млекопитающих, например, мышей,крыс, собак, обезьян или изолированных органов, тканей и их препаратов. Соединения, предлагаемые в настоящем изобретении, можно использовать in vitro в виде растворов, например, предпочтительно водных растворов, иin vivo энтерально, парентерально, предпочтительно внутривенно, например, в виде суспензии или водного раствора. Доза in vitro может находиться в диапазоне примерно от 10-3 до 10-9 М. Терапевтически эффективное количество in vivo в зависимости от пути введения может находиться в диапазоне примерно 0,1-500 мг/кг, предпочтительно примерно 1-100 мг/кг. Эти соединения являются особенно подходящими для лечения, например, воспалительных патологических состояний, остеоартрита, ревматоидного артрита и борьбы с опухолями. С помощью фармакологических исследований, в целом известных в данной области техники и описанных в настоящем изобретении, оценены благоприятные эффекты. Противовоспалительную активность можно исследовать с помощью стандартных экспериментальных моделей воспаления и артрита на животных, хорошо известных в данной области техники, например, адъювантной модели артрита на крысах и модели вызванного коллагеном II артрита на мышах (Mediators of Inflam. 1, 273-279 (1992. Ингибирующую активность по отношению к желатиназе (ММР-2) можно определить следующим образом: Исходные растворы субстрата (MCA-Lys-Pro-Leu-Gly-Leu-Dpa-Ala-Arg-NH2) готовят в ДМСО при концентрации, равной 1,4 мМ. Исходные растворы ингибиторов (0,03 мкМ-3 мМ) также готовят в ДМСО. Ингибиторы разводят в растворах для анализа и для приготовления контрольных растворов используют такой же объем ДМСО, так чтобы конечная концентрация ДМСО в разведенных растворах ингибитора и субстрата равнялась 1,0%. Анализы проводят в буфере для анализа (100 мМ хлорид натрия,10 мкМ ZnCl2, 10 мМ CaCl2, 100 мМ Tris-Cl [Tris - трис-(гидроксиметиламинометан)] рН 7,5, 0,05% Brij35), содержащем 1,0% ДМСО, поступившего после добавления субстрата и ингибитора. Концентрация субстрата при анализах равна 5 мкМ. Анализы проводят при 20-25 С. Изменения интенсивности флуоресценции, вызванные разложением субстрата, определяют с использованием возбуждения при длине волны, равной 325 нм, и испускания при длине волны, равной 405 нм. Исследования проводят по 2 раза с добавлением реакционных смесей в лунки 384-луночного планшета для анализа. Реакционные смеси предварительно инкубируют с ингибиторами в течение 60 мин. Реакции инициируют путем добавления субстрата ММР и через 60 мин определяют изменения интенсивности флуоресценции. Затем кажущуюся активность фермента в присутствии ингибитора сопоставляют с активностью при отсутствии ингибитора и определяют ингибирующее воздействие ингибитора. Эти методики известны специалисту в данной области техники. Полученные характеристики ингибирования представляют в виде концентраций ингибитора, необходимых для ингибирования активности фермента на 50% (IC50) по сравнению с контрольными реакциями (без ингибирования). Соединение 80, приведенное в представленной ниже таблице, иллюстрирующее настоящее изобретение, обладает значением IC50, равным 55 нМ. Ингибирующую активность по отношению к коллагеназе-3 (ММР-13) определяют, как описано выше. Рекомбинантную pro-коллагеназу-3 активируют с помощью 1 мМ АРМА (4-аминофенилацетат ртути(II и после интенсивного диализа в буфере для анализа хранят в буфере для анализа. Соединение 80, приведенное в представленной ниже таблице, иллюстрирующее настоящее изобретение, обладает значением IC50, равным примерно 113 нМ. Ингибирующую активность по отношению к ММР-12 определяют, как описано выше. Воздействие in vivo соединений, предлагаемых в настоящем изобретении, можно определить на крысах. Обычно крысам (N=12) перорально вводят соединение и через 4 ч внутрисуставно в оба колена вводят от 0,1 до 2 мкг/колено рекомбинантного ММР-13 человека, растворенного в 0,05 мл физиологического раствора. Через 2 ч крыс умерщвляют, собирают синовиальный лаваж и количественно определяют содержание хондроитинсульфата (CS), выделившегося в сустав. Содержание хондроитинсульфата определяют по ингибированию с помощью иммуноферментного анализа (ELISA) с использованием специфичных по отношению к хондроитинсульфату антител (CS-56 - выпускаются фирмой Sigma) по методике, аналогичной описанной в публикации Thonar (Thonar, E.J.-М.A., Lenz, M.Е., Klinsworth, G.K., Caterson, В., Pachman, L.M., Glickman, P., Katz, R., Huff, J., Keuttner, K.Е. Quantitation of keratan sulfate inblood as a marker of cartilage catabolism, Arth. Rheum. 28, 1367-1376 (1985. Влияние на защиту хряща от разрушения при артритных нарушениях можно определить, например,с помощью хирургической модели остеоартрита, описанной в публикации Arthritis and Rheumatism, Vol. 26, 875-886 (1983). Воздействие соединений, предлагаемых в настоящем изобретении, при лечении эмфиземы можно определить с помощью экспериментальных моделей на животных, описанных в публикации AmericanReview of Respiratory Disease 117, 1109 (1978). Противоопухолевое воздействие соединений, предлагаемых в настоящем изобретении, можно определить, например, путем измерения роста опухолей человека, имплантированных подкожно голым мышам линии Balb/c, по методике, хорошо известной в данной области техники, при сопоставлении с введение плацебо мышам. Иллюстративными опухолями являются, например, эстрогензависимая карцинома молочной железы человека ВТ 20 и MCF7, карцинома мочевого пузыря человека Т 24, карцинома толстой кишки человека Colo 205, аденокарцинома легких человека А 549 и карцинома яичника человекаNIH-OVCAR3. Подавление метастазирования опухоли можно исследовать с помощью 2 моделей метастазирования в легкие. В модели меланомы B16-F10 метастазирование изучают путем подсчета количества местастазированных в легкие узелков меланомы, образовавшихся после внутривенного введения клеток меланомы B16-F10 мышам, которым ввели BDF1, по методике, хорошо известной в данной области техники. В модели НТ 1080 метастазирование количественно изучают путем измерения интенсивности флуоресценции усиленного зеленого флюоресцентного белка (EGFP) в легких голых мышей линии Balb/c, вызванной метсатазирующей опухолью после внутривенного введения клеток фибросаркомы человека НТ 1080,экспрессирующих GFP. В обеих методиках степень ингибирования определяют путем сопоставления данных для мышей, которым вводили соединение, и мышей, которым вводили плацебо. В модели НТ 1080 клетки, экспрессирующие EGFP, готовили по методике ограниченных разведений в присутствии генетицина после трансфицирования вектора экспрессии EGFP (pEGFP-Cl) (CLONTECH LaboratoriesInc., Palo Alto, Calif.). Суспензию клеток (10 клеток/0,1 мл ЗФФ (забуференный фосфатом физиологический раствор внутривенно вводили голым мышам линии Balb/c. После перорального введения исследуемых соединений разбавителя в течение 3 недель мышей умерщвляли, легкие с метастазирующей опухолью отделяли и гомогенизировали. После центрифугирования клетки 3 раза промывали лизирующим реагентом (150 мМ хлорида аммония, 0,1 мМ EDTA-4 Na (EDTA этилендиаминтетрауксусная кислота),10 мМ KHCO3, рН 7,4) для проведения лизиса эритроцитов и 2 раза с помощью ЗФФ. После центрифугирования EGFP экстрагировали из клеток с помощью 10% Triton в ЗФФ и помещали в лунки 96-луночного планшета. Интенсивность флуоресценции определяли с помощью устройства считывания флуоресценции планшетов при длинах волн возбуждения и испускания, равных 485 и 530 нм соответственно. Воздействие соединений, предлагаемых в настоящем изобретении, при атеросклеротических патологических состояниях можно исследовать с использованием атеросклеротических бляшек, взятых у кроликов, которым в корме давали холестерин, которые содержат активированные матриксные металлопротеиназы, как это описано в публикации Sukhova et al., Circulation 90, I 404 (1994). Ингибирующее воздействие на активность фермента матриксной металлопротеиназы в атеросклеротических бляшках кро- 19020114 ликов можно определить с помощью зимографии in situ, как это описано в публикации Galis et al., J. Clin.Invest. 94, 2493 (1994), и она свидетельствует о разрыве бляшек. Соединения, предлагаемые в настоящем изобретении, являются особенно подходящими для введения млекопитающим в качестве противовоспалительных средств, предназначенных для лечения, например, остеоартрита и ревматоидного артрита, в качестве противоопухолевых средств, предназначенных для лечения и предупреждения роста опухолей, метастазирования опухолей, прорастания или прогрессирования опухолей, и в качестве противоатеросклеротических средств, предназначенных для лечения и предупреждения разрыва атеросклеротических бляшек. Настоящее изобретение также относится к способам применения соединений, предлагаемых в настоящем изобретении, и их фармацевтически приемлемых солей или содержащих их фармацевтических композиций, у млекопитающих для ингибирования разрушающих матрикс металлопротеиназ, например стромелизина, желатиназы, коллагеназы и металоэластазы макрофагов, для подавления разрушения матрикса тканей и для лечения патологических состояний, зависящих от разрушающей матрикс металлопротеиназы, описанных в настоящем изобретении, например воспаления, ревматоидного артрита, остеоартрита, а также опухолей (роста, метастазирования, прогрессирования или прорастания), легочных нарушений и т.п., описанных в настоящем изобретении. Опухоли (карциномы) млекопитающих включают рак молочной железы, легких, мочевого пузыря, толстой кишки, предстательной железы и яичников и рак кожи, включая меланому и саркому Капоши. Приведенные ниже примеры предназначены для иллюстрации настоящего изобретения и их не следует считать ограничивающими. Температуры указаны в градусах Цельсия. Если не указано иное, все выпаривания проводят при пониженном давлении, предпочтительно при давлении, примерно равном от 15 мм рт.ст. до 100 мм рт.ст. (=20-133 мбар). Структуры конечных продуктов, промежуточных продуктов и исходных веществ подтверждают с помощью стандартных аналитических методов, например, с помощью микроанализа и/или спектроскопических методов (например, МС, ИК (инфракрасная спектроскопия), ЯМР). Использованные аббревиатуры являются такими, как принято в данной области техники. Примеры Настоящее изобретение подробно проиллюстрировано с помощью приведенных ниже примеров, в которых описаны особенно предпочтительные варианты осуществления. Однако следует отметить, что эти варианты осуществления не следует рассматривать в качестве каким-либо образом ограничивающих объем настоящего изобретения. Пример 23. 2-Хлор-5-(4-пирролидин-1-илбензоил)бензолсульфонамид 1-(4-Бромфенил)пирролидин. В высушенную в сушильном шкафу круглодонную колбу объемом 50 мл помещают Pd2(dba)3 (116 мг, 0,13 ммоль), БИНАФ (2,2'-бис-(дифенилфосфино)-1,1'-бинафтил) (158 мг, 0,25 ммоль) и третбутоксид натрия (916 мг, 9,54 ммоль). Колбу откачивают и заполняют аргоном. Затем добавляют дегазированный толуол (5 мл), 1-йод-4-бромбензол (1,8 г, 6,36 ммоль) и пирролидин (542 мг, 7,63 ммоль). Смесь нагревают при 80 С до тех пор, пока анализ с помощью ЖХ-МС не свидетельствует о полном израсходовании арилйодида. Смесь разбавляют этилацетатом, фильтруют через целит и концентрируют в вакууме. Неочищенный продукт очищают с помощью флэш-хроматографии и получают 1,1 г продукта в виде светло-коричневого твердого вещества. 1 Н ЯМР (400 МГц, CDCl3):2,00 (t, 4 Н, J=4 Гц), 3,24 (t, 4H, J=4 Гц), 6,42 (d, 2H, J=8 Гц), 7,29 (d, 2 Н,J=8 Гц). 2-Хлор-5-(4-пирролидин-1-илбензоил)бензолсульфонамид. 1-(4-Бромфенил)пирролидин превращают в искомое соединение по методике С. 1 Н ЯМР (400 МГц, CDCl3):2,06 (t, 4H, J=8 Гц), 3,40 (t, 4H, J=8 Гц), 5,19 (s, 2H), 6,55 (d, 2 Н, J=6 Гц), 7,63 (d, 1 Н, J=8 Гц), 7,72 (d, 2H, J=8 Гц), 7,86 (d, 1H, J=8 Гц), 8,41 (s, 1H). 2-Хлор-5-4-диаллиламинофенил)гидроксиметил)бензолсульфонамид синтезируют из соответствующего арилйодида по методике В. 2-Хлор-5-[4-(2,5-дигидропиррол-1-ил)фенил]гидроксиметилбензолсульфонамид. Раствор 100 мг 2-хлор-5-4-диаллиламино-фенил)гидроксиметил)бензолсульфонамида (0,25 ммоль,1 экв.) в 5 мл хлороформа дегазируют аргоном в течение 5 мин, затем добавляют 5 мг катализатора Грабба (0,005 ммоль, 2 ммол.%). Реакционную смесь перемешивают при комнатной температуре в течение 1 ч, затем разбавляют дихлорметаном, фильтруют через целит и слой силикагеля, затем концентрируют в вакууме и получают 70 мг искомого соединения, которое используют на следующей стадии без дополнительной очистки. 2-Хлор-5-[4-(2,5-дигидропиррол-1-ил)бензоил]бензолсульфонамид. Искомое соединение получают из 2-хлор-5-[4-(2,5-дигидропиррол-1 ил)фенил]гидроксиметилбензолсульфонамида по методике В. 1 Н ЯМР (400 МГц, CDCl3):0,92 (s, 4H), 5,28 (m, 2H), 6,42 (s, 2H), 7,180 (t, 1H, J=2 Гц), 7,55-7,7 (m,3 Н), 7,85-8,05 (m, 2H). Раствор 300 мг 4-хлор-3-сульфамоилбензоилхлорида (1,186 ммоль, 1 экв.) в 20 мл дихлорметана перемешивают при комнатной температуре, в то время как по каплям добавляют 2,37 мл диэтилалюминийхлорида (1,0 М раствор в гексане). Реакционную смесь перемешивают при комнатной температуре в течение 10 мин, затем добавляют 229 мг 1-фенилпиперидина. Реакционную смесь перемешивают при комнатной температуре в течение 30 мин. Реакционную смесь выливают в 2 н. раствор HCl со льдом и экстрагируют дихлорметаном. Затем водный слой подщелачивают 2 н. раствором гидроксида натрия и экстрагируют дихлорметаном. Объединенные органические экстракты промывают водой, сушат над сульфатом натрия и концентрируют в вакууме. После очистки с помощью флэш-хроматографии получают 180 мг продукта. 1 Н ЯМР (400 МГц, CDCl3):1,69 (s, 6H), 3,18 (m, 1H), 3,42 (s, 3 Н), 5,18 (s, 2H), 6,86 (d, 2H, J=8 Гц),7,62 (d, 1H, J=8 Гц), 7,70 (d, 2H, J=8 Гц), 7,87 (d, 1H, J=8 Гц), 8,42 (s, 1H).MC (m/z): 255 (М+1). Раствор 0,821 г 1-(4-бромфенил)-3-метилпиперидин в тетрагидрофуране охлаждают до -78 С и об- 21020114 рабатывают с помощью 0,3 г 4-хлор-N-метокси-N-метил-3-сульфамоилбензамида. Смесь перемешивают в течение 10 мин и медленно обрабатывают с помощью 4,31 мл раствора трет-бутиллития (1,5 М) в тетрагидрофуране (3 мл). Оранжевый раствор перемешивают при -78 С в течение 15 мин, затем при 0 С в течение 1 ч. Реакцию останавливают насыщенным водным раствором хлорида аммония (100 мл) и экстрагируют этилацетатом (250 мл). Органические вещества промывают водой, насыщенным раствором хлорида натрия, сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Остаток загружают в целит и очищают с помощью хроматографии на силикагеле (1:1 гексаны/этилацетат) и получают 2 хлор-5-[4-(3-метилпиперидин-1-ил)бензоил]бензолсульфонамид в виде светло-желтого сиропа.-78 С и обрабатывают трет-бутиллитием (1,5 М раствор в пентане), 2 порциями по 0,29 мл. Через 20 мин при -78 С реакционную смесь обрабатывают с помощью 0,1 г 4-хлор-N-метокси-N-метил-3 сульфамоилбензамида в тетрагидрофуране (5 мл) и перемешивают в течение еще 1,5 ч. Затем температуру медленно повышают до 0 С и после завершения реакции ее останавливают путем добавления 2 мл насыщенного водного раствора хлорида аммония и смесь экстрагируют диэтиловым эфиром. Органические вещества промывают водой, сушат над сульфатом магния, концентрируют и получают 0,27 г неочищенного продукта, который очищают с помощью хроматографии на силикагеле (1:1 гексаны/этилацетат) и получают 2-хлор-5-[4-(4-фенилпиперидин-1-ил)бензоил]бензолсульфонамид в виде порошкообразного вещества. МС (m/z): (M-1) 453; Rf=0,65 (1:1 гексаны/этилацетат). Пример 28. 2-Хлор-5-[4-(4-метилпиперазин-1-ил)бензоил]бензолсульфонамид-78 С реакционную смесь обрабатывают с помощью 0,1 г 4-хлор-N-метокси-N-метил-3 сульфамоилбензамида в тетрагидрофуране (3 мл). Затем температуру медленно повышают до 0 С и после завершения реакции ее останавливают путем добавления 2 мл насыщенного водного раствора хлорида аммония и смесь экстрагируют диэтиловым эфиром. Органические вещества промывают водой, сушат(сульфат магния) и концентрируют и получают 0,32 г неочищенного продукта, который очищают с помощью хроматографии на силикагеле (95:5 метиленхлорид/метанол) и получают 2-хлор-5-[4-(4 метилпиперазин-1-ил)бензоил]бензолсульфонамид в виде желтовато-коричневого порошкообразного вещества. МС (m/z): 394 (М+1); Rf=0,06 (95:5 метиленхлорид/метанол). Пример 40. 2-Хлор-5-[4-(2,5-диметилпиррол-1-ил)-3-фторбензоил]бензолсульфонамид 2-Хлор-5-4-(2,5-диметилпиррол-1-ил)-3-фторфенил)гидроксиметил)бензолсульфонамид синтезируют из соответствующего арилбромида по методике В. На следующей стадии раствор 100 мг 2-хлор-54-(2,5-диметилпиррол-1-ил)-3-фторфенил)гидроксиметил)бензолсульфонамида (0,24 ммоль, 1 экв.), 43 мг 4-метилморфолин-N-оксида и 122 мг молекулярных сит 4 в 5 мл дихлорметана перемешивают при комнатной температуре и при этом добавляют 5 мг перрутената тетрапропиламмония. Реакционную смесь перемешивают при комнатной температуре в течение 1 ч, затем фильтруют через слой силикагеля,элюируют этилацетатом и концентрируют в вакууме. После очистки с помощью флэш-хроматографии Дисперсию гидрида калия в масле (33,15 ммоль) в атмосфере аргона промывают гексанами, затем при 0 С добавляют тетрагидрофуран (310 мл) и полученную суспензию обрабатывают путем проводимого по каплям добавления 6,77 г 6-броминдола в тетрагидрофуране (61 мл). Реакционную смесь перемешивают при 0 С в течение 15 мин и получают желтый раствор. При -78 С медленно добавляют раствор 44,2 мл трет-бутиллития (1,5 M раствор в пентане), поддерживая температуру ниже -75 С, и получают желтую суспензию. Через 15 мин добавляют раствор 3,08 г 4-хлор-N-метокси-N-метил-3 сульфамоилбензамида в тетрагидрофуране (61 мл) и температуре дают медленно повыситься до 0 С. Реакцию останавливают путем добавления 62 мл насыщенного водного раствора хлорида аммония и смесь экстрагируют этиловым эфиром. Органические вещества промывают водой, сушат над сульфатом магния и концентрируют и получают 9,65 г коричневого масла, которое хроматографируют на силикагеле (1:1 гексаны/этилацетат) и получают 2-хлор-5-(1H-индол-6-карбонил)бензолсульфонамид в виде желтого вспененного вещества. Раствор 0,997 г 6-броминдола в тетрагидрофуране (20 мл) охлаждают до -50 С и обрабатывают путем медленного добавления 8,79 мл трет-бутиллития (1,5 М раствор в пентане). Через 2 ч при -50 С реакционную смесь обрабатывают с помощью 0,4 г 4-фтор-N-метокси-N-метил-3-сульфамоилбензамида в тетрагидрофуране (10 мл), перемешивают при -50 С в течение еще 3 ч и реакцию останавливают путем добавления 2 мл насыщенного водного раствора хлорида аммония. Реакционную смесь переносят в этилацетат, промывают насыщенным раствором хлорида натрия и сушат (сульфат магния). После концентрирования в вакууме остаток очищают с помощью хроматографии на силикагеле (1:1 гексаны/этилацетат) и получают 2-фтор-5-(1 Н-индол-6-карбонил)бензолсульфонамид в виде аморфного твердого вещества. МС (m/z): 317 (М-1); Rf=0,32 (1:1 гексаны/этилацетат). Пример 43: 5-(1 Н-Индол-6-карбонил)-2-метилбензолсульфонамидN,Oдиметилгидроксиламингидрохлорида и 5,02 мл триэтиламина в метиленхлориде (120 мл) обрабатывают с помощью 8,32 г бензотриазол-1-илокси-трис-(диметиламино)фосфонийгексафторфосфата. Реакционную смесь перемешивают при комнатной температуре в течение ночи, последовательно промывают насыщенным водным раствором бикарбонат натрия, водой и насыщенным раствором хлорида натрия, сушат(сульфат магния) и концентрируют в вакууме. Неочищенное вещество очищают с помощью хроматографии на силикагеле (1:2 гексаны/этилацетат) и получают N-метокси-4,N-диметил-3-сульфамоилбензамид в виде белого порошкообразного вещества. МС (m/z): 257 (М-1); Rf=0,25 (1:2 гексаны/этилацетат).MC (m/z): 243 (М-1); Rf=0,21 (1:2 гексаны/этилацетат). Получение 4-фтор-N-метокси-N-метил-3-сульфамоилбензамида. 4-Фтор-N-метокси-N-метил-3-сульфамоилбензамид получают из 0,5 г 4-фтор-3 сульфамоилбензойной кислоты по процедуре, описанной в методике С. МС (m/z): 261 (М-1); Rf=0,45 (9:1 метиленхлорид/метанол). Пример 45. 2-Хлор-5-(3-фенил-1 Н-индол-6-карбонил)бензолсульфонамид Методика получения 5-[3-бром-1-(трет-бутилдиметилсилил)-1 Н-индол-6-карбонил]-2-хлор-N-(третбутилдиметилсилил)бензолсульфонамида. Стадия 1. Раствор 3,89 г 2-хлор-5-(1 Н-индол-6-карбонил)бензолсульфонамида в тетрагидрофуране (370 мл) охлаждают до -78 С и обрабатывают путем проводимого по каплям добавления н-бутиллития в гексане(1,6 М раствор, 24,4 мл). Через 15 мин при -78 С оранжевый раствор обрабатывают путем добавления 3,47 г трет-бутилдиметилхлорсилана в тетрагидрофуране (50 мл) и температуре дают медленно повыситься до 0 С. Через 1,5 ч при 0 С реакционную смесь при 0 С обрабатывают водой и экстрагируют диэтиловым эфиром. Органическую фазу промывают насыщенным раствором хлорида натрия, сушат(сульфат магния) и концентрируют и получают масло, которое при обработке ультразвуком растирают с диизопропиловым эфиром и получают 5-[1-(трет-бутилдиметилсилил)-1 Н-индол-6-карбонил]-2-хлор-N(трет-бутилдиметилсилил)бензолсульфонамид в виде белого порошкообразного вещества. МС (m/z): 563 (М+1), Rf=0,60 (2:1 гексаны/этилацетат). Стадия 2. Раствор 1,7 г 5-[1-(трет-бутилдиметилсилил)-1 Н-индол-6-карбонил]-2-хлор-N-(третбутилдиметилсилил)бензолсульфонамид в тетрагидрофуране (110 мл) при -78 С обрабатывают с помощью 0,564 г N-бромсукцинимида. Через 6 ч при -78 С температуре дают медленно повыситься до комнатной температуры. Реакционную смесь переносят в диэтиловый эфир, промывают водой и сушат(сульфат магния). Растворитель выпаривают и остаток при обработке ультразвуком растирают с диизопропиловым эфиром и получают 5-[3-бром-1-(трет-бутилдиметилсилил)-1 Н-индол-6-карбонил]-2-хлорN-(трет-бутилдиметилсилил)бензолсульфонамид в виде желтовато-коричневого порошкообразного вещества.MC (m/z): 643 (М+1); Rf=0,90 (95:5 метиленхлорид/метанол). 2-Хлор-5-(3-фенил-1 Н-индол-6-карбонил)бензолсульфонамид. К смеси 0,1 г 5-[3-бром-1-(трет-бутилдиметилсилил)-1 Н-индол-6-карбонил]-2-хлор-N-(третбутилдиметилсилил)бензолсульфонамида, 0,039 г фенилбороновой кислоты и 0,025 г комплекса [1,1'бис-(дифенилфосфино)ферроцен]дихлорпалладий(II)-дихлорметан в диметоксиэтане (3,6 мл) добавляют 0,099 г трикалийфосфата в воде (1,2 мл). Раствор нагревают при 130 С в течение 5 мин (с помощью микроволнового излучения). Реакционную смесь экстрагируют этилацетатом. Органическую фазу промывают водой, сушат (сульфат магния) и концентрируют и получают 0,094 г неочищенного продукта. Очистка с помощью флэш-хроматографии на силикагеле (98:2 метиленхлорид/метанол) дает 2-хлор-5-(3 фенил-1 Н-индол-6-карбонил)бензолсульфонамид в виде желтовато-коричневого порошкообразного вещества. МС (m/z): 409 (М-1); Rf=0,22 (95:5:0,5 метиленхлорид/метанол/гидроксид аммония). Аналогичным образом, указанные ниже соединения получают из 5-[3-бром-1-(третбутилдиметилсилил)-1H-индол-6-карбонил]-2-хлор-N-(трет-бутилдиметилсилил)бензолсульфонамида. К смеси 0,1 г 5-[3-бром-1-(трет-бутилдиметилсилил)-1 Н-индол-6-карбонил]-2-хлор-N-(третбутилдиметилсилил)бензолсульфонамида, 0,095 г неочищенной (2-метил-4-пиридинил)бороновой кислоты и 0,025 г комплекса [1,1'-бис-(дифенилфосфино)ферроцен]дихлорпалладий(II)-дихлорметан в диметоксиэтане (3,6 мл) добавляют 0,099 г трикалийфосфата в воде (1,2 мл). Раствор нагревают при 130 С в течение 5 мин (с помощью микроволнового излучения). Реакционную смесь экстрагируют этилацетатом. Органическую фазу промывают водой, сушат над сульфатом магния и концентрируют и получают 0,071 г неочищенного продукта. Очистка с помощью флэш-хроматографии на силикагеле (95:5:0,5 метиленхлорид/метанол/гидроксид аммония) дает 2-хлор-5-[3-(2-метилпиридин-4-ил)-1H-индол-6 карбонил]бензолсульфонамид в виде желтовато-коричневого порошкообразного вещества.-78 С реакционную смесь обрабатывают путем медленного добавления раствора 7,69 мл фенилхлорформиата в тетрагидрофуране (20 мл), что приводит к повышению температуры реакционной смеси до комнатной температуры. Реакционную смесь перемешивают при комнатной температуре в течение 10 мин и затем обрабатывают путем проводимого при 0 С добавления насыщенного водного раствора хлорида аммония (84 мл), затем диэтилового эфира. Органическую фазу промывают водой, 2 н. водным растворомHCl, водой и насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют в вакууме и получают 17,1 г карбамата в виде оранжевого масла. Это вещество переносят в толуол (200 мл) и обрабатывают раствором 15,64 г о-хлоранила в уксусной кислоте (117 мл). Через 26 ч при комнатной температуре полученный раствор обрабатывают 30% водным раствором гидроксида натрия. Полученную эмульсию фильтруют через целит. Фазы разделяют и экстрагируют толуолом. Органические вещества промывают водой и экстрагируют 2 н. раствором HCl. Кислые экстракты промывают диэтиловым эфиром, при 0 С обрабатывают 30% водным раствором гидроксида натрия и экстрагируют метиленхлоридом. Органические экстракты сушат (сульфат магния), концентрируют, очищают с помощью хроматографии на силикагеле (1:1 метиленхлорид/диэтиловый эфир) и получают 4-бром-2-метилпиридин в виде масла. МС (m/z): 174 (М+1); Rf=0,31 (1:1 метиленхлорид/диэтиловый эфир). Стадия 2. Раствор 4,7 мл н-бутиллития (1,6 М раствор в гексане) в диэтиловом эфире (20 мл) охлаждают до-78 С и обрабатывают раствором 1,07 г 4-бром-2-метилпиридина в диэтиловом эфире (10 мл), предварительно высушенным над молекулярными ситами при 40 С в течение ночи. Через 20 мин при -78 С полученную оранжевую суспензию обрабатывают с помощью 1,87 мл триизопропилбората и температуре в течение 2 ч дают повыситься до комнатной температуры. Еще через 2 ч реакционную смесь обрабатывают водой. Органическую фазу экстрагируют 0,5 н. раствором гидроксида натрия. Экстракты промывают диэтиловым эфиром и подкисляют 2 н. раствором HCl до рН 6. Полученную суспензию концентрируют в вакууме и получают пастообразное вещество, содержащее (2-метил-4-пиридинил)бороновую кислоту,которое используют без дополнительной очистки в реакции сочетания по Судзуки. МС (m/z): 136 (М-1). Аналогичным образом, указанные ниже соединения получают из 5-[3-бром-1-(третбутилдиметилсилил)-1 Н-индол-6-карбонил]-2-хлор-N-(трет-бутилдиметилсилил)бензолсульфонамида и соответствующих бороновых кислот 2-Хлор-5-[3-(2-этилпиридин-4-ил)-1H-индол-6-карбонил]бензолсульфонамид МС (m/z): 438 (М-1); Rf=0,10 (95:5:0,5 метиленхлорид/метанол/гидроксид аммония). Получение (2-этил-4-пиридинил)бороновой кислоты.(2-Этил-4-пиридинил)бороновую кислоту получают из 5 г гидрохлорида 4-бромпиридина по методике, описанной в примере 46, стадия 1 и стадия 2. МС (m/z): 150 (М-1). 2-Хлор-5-[3-(2-циклопропилпиридин-4-ил)-1 Н-индол-6-карбонил]бензолсульфонамид(2-Циклопропил-4-пиридинил)бороновую кислоту получают из 5 г гидрохлорида 4-бромпиридина по методике, описанной в примере 46, стадия 1 и стадия 2. МС (m/z): 162 (М-1). 2-Хлор-5-3-[2-(3-метоксипропил)пиридин-4-ил]-1H-индол-6-карбонилбензолсульфонамид МС (m/z): 482 (М-1); Rf=0,07 (95:5:0,5 метиленхлорид/метанол/гидроксид аммония).[2-(3-Метоксипропил)-4-пиридинил]бороновую кислоту получают из 1,35 г гидрохлорида 4 бромпиридина по методике, описанной в примере 46, стадия 1 и стадия 2. МС (m/z): 196 (М+1). 2-Хлор-5-3-[2-(3-морфолин-4-илпропил)пиридин-4-ил]-1H-индол-6-карбонилбензолсульфонамид. МС (m/z): 539 (М+1); Rf=0,15 (90:10:1 этилацетат/метанол/гидроксид аммония).[2-(3-Морфолин-4-илпропил)-4-пиридинил]бороновую кислоту получают из 5,36 г гидрохлорида 4 бромпиридина по методике, описанной в примере 46, стадия 1 и стадия 2. МС (m/z): 251 (М+1). 2-Хлор-5-3-[2-(2-диметиламиноэтокси)пиридин-4-ил]-1H-индол-6-карбонилбензолсульфонамид МС (m/z): 497 (М-1); Rf=0,2 (90:10:1 этилацетат/метанол/гидроксид аммония). Пример 47. Получение [2-(2-диметиламиноэтокси)-4-пиридинил]бороновой кислоты. Стадия 1. Смесь 5,55 г натрия и 26,9 мл 2-диметиламиноэтанол в тетрагидрофуране (180 мл) кипятят с обратным холодильником в течение 20 ч. Реакционную смесь охлаждают до комнатной температуры, обрабатывают с помощью 4 г 4-амино-2-хлорпиридина и нагревают при 140 С в течение 20 мин (с помощью микроволнового излучения). Реакционную смесь при 0 С обрабатывают концентрированной HCl до установления рН 8, насыщают хлоридом натрия и экстрагируют диэтиловым эфиром. Органические вещества сушат (сульфат магния), концентрируют и получают 11,9 г неочищенного продукта, который очищают с помощью хроматографии на силикагеле (90:10:1 этилацетат/метанол/гидроксид аммония) и получают 2-(2-диметиламиноэтокси)пиридин-4-иламин в виде желтовато-коричневых кристаллов. МС (m/z): 182 (М+1); Rf=0,1 (90:10:1 этилацетат/метанол/гидроксид аммония). Стадия 2. Смесь 1,2 г 2-(2-диметиламиноэтокси)пиридин-4-иламина, 0,749 г бромида натрия и 1,16 г сульфата меди охлаждают до 0 С и при перемешивании обрабатывают с помощью 12 мл 9 М раствора серной кислоты. Полученную темную суспензию при 0 С обрабатывают раствором 0,503 г нитрита натрия в воде(0,8 мл) и перемешивают при 0 С в течение 1,5 ч и при комнатной температуре в течение 1,5 ч. Реакционную смесь выливают в воду со льдом, подщелачивают 30% раствором гидроксида натрия и экстрагируют метиленхлоридом. Органические вещества сушат (сульфат магния), концентрируют и очищают с помощью хроматографии на силикагеле (7:3 этилацетат/метанол) и получают [2-(4-бромпиридин-2 илокси)этил]диметиламин в виде масла. МС (m/z): 245 (М+1); Rf=0,25 (7:3 этилацетат/метанол). Стадия 3.[2-(2-Диметиламиноэтокси)-4-пиридинил]бороновую кислоту получают из 0,713 г [2-(4 бромпиридин-2-илокси)этил]диметиламина по методике, описанной в примере 6, стадия 2. МС (m/z): 211 (М+1). Следующее соединение можно получить по аналогичной последовательности стадий реакций. 2-Хлор-5-3-[2-(2-морфолин-4-илэтокси)пиридин-4-ил]-1 Н-индол-6-карбонилбензолсульфонамид. МС (m/z): 539 (М-1); Rf=0,38 (90:10:1 этилацетат/метанол/гидроксид аммония). Получение [2-(2-морфолин-4-илэтокси)-4-пиридинил]бороновой кислоты.N-(2 гидроксиэтил)морфолина по методике, описанной для получения [2-(2-диметиламиноэтокси)-4 пиридинил]бороновой кислоты. 2-Метил-5-[3-(2-метилпиридин-4-ил)-1 Н-индол-6-карбонил]бензолсульфонамид получают из 0,25 г 5-[3-бром-1-(трет-бутилдиметилсилил)-1 Н-индол-6-карбонил]-N-(трет-бутилдиметилсилил)-2 метилбензолсульфонамида по методике, описанной в примере 6 (нагрев с помощью микроволнового излучения при 150 С в течение 5 мин). МС (m/z): 404 (М-1); Rf=0,19 (90:10:1 метиленхлорид/метанол/гидроксид аммония). Получение 5-[3-бром-1-(трет-бутилдиметилсилил)-1H-индол-6-карбонил]-N-(третбутилдиметилсилил)-2-метилбензолсульфонамида. Стадия 1. 5-[1-(трет-Бутилдиметилсилил)-1 Н-индол-6-карбонил]-N-(трет-бутилдиметилсилил)-2 метилбензолсульфонамид получают из 3,09 г 5-(1 Н-индол-6-карбонил)-2-метилбензолсульфонамида по методике, описанной в примере 5, стадия 1. МС (m/z): 543 (М+1); Rf=0,75 (2:1 гексаны/этилацетат). Стадия 2. 5-[3-Бром-1-(трет-бутилдиметилсилил)-1H-индол-6-карбонил]-N-(трет-бутилдиметилсилил)-2 метилбензолсульфонамид получают из 3,21 г 5-[1-(трет-бутилдиметилсилил)-1 Н-индол-6-карбонил]-N(трет-бутилдиметилсилил)-2-метилбензолсульфонамида по методике, описанной в примере 5, стадия 2. МС (m/z): 622 (М+1); Rf=0,77 (95:5 метиленхлорид/метанол). Пример 49. 3-[3-(2-Метилпиридин-4-ил)-1 Н-индол-6-карбонил]бензолсульфонамид 3-[3-(2-Метилпиридин-4-ил)-1 Н-индол-6-карбонил]бензолсульфонамид получают из 0,25 г 5-[3 бром-1-(трет-бутилдиметилсилил)-1 Н-индол-6-карбонил]-N-(третбутилдиметилсилил)бензолсульфонамида по методике, описанной в примере 6 (нагрев с помощью микроволнового излучения при 150 С в течение 5 мин). МС (m/z): 390 (М-1); Rf=0,19 (90:10:1 метиленхлорид/метанол/гидроксид аммония). Получение 5-[3-бром-1-(трет-бутилдиметилсилил)-1H-индол-6-карбонил]-N-(третбутилдиметилсилил)бензолсульфонамид. Стадия 1. 5-[1-(трет-Бутилдиметилсилил)-1 Н-индол-6-карбонил]-N-(трет-бутилдиметилсилил)бензолсульфонамид получают из 1,857 г 3-(1 Н-индол-6-карбонил)бензолсульфонамида по методике, описанной в примере 45, стадия 1. МС (m/z): 529 (М+1); Rf=0,66 (2:1 гексаны/этилацетат). Стадия 2. 5-[3-Бром-1-(трет-бутилдиметилсилил)-1 Н-индол-6-карбонил]-N-(трет-бутилдиметилсилил)бензолсульфонамид получают из 1,14 г 5-[1-(трет-бутилдиметилсилил)-1 Н-индол-6-карбонил]-N-(третбутилдиметилсилил)бензолсульфонамида по методике, описанной в примере 45, стадия 2. МС (m/z): 607 (М+1); Rf=0,78 (95:5 метиленхлорид/метанол). Аналогичным образом, указанные ниже соединения получают из 5-[3-бром-1-(третбутилдиметилсилил)-1 Н-индол-6-карбонил]-N-(трет-бутилдиметилсилил)бензолсульфонамида и соответствующих бороновых кислот. 3-3-[2-(3-Метоксипропил)пиридин-4-ил]-1 Н-индол-6-карбонилбензолсульфонамид МС (m/z): 450 (М+1); Rf=0,22 (90:10:1 метиленхлорид/метанол/гидроксид аммония). 3-3-[2-(3-Метоксипропил)пиридин-4-ил]-1H-индол-6-карбонилбензолсульфонамидMC (m/z): 505 (M+1); Rf=0,10 (90:10:1 метиленхлорид/метанол/гидроксид аммония). Пример 50. Указанные ниже соединения получают по методике А с использованием трихлорида алюминия или других подходящих реагентов, содержащих алюминий, и соответствующим образом замещенного фенильного фрагмента, как это описано в приведенной ниже методике. 5-Бензоил-2-хлорбензолсульфонамид. При энергичном перемешивании к раствору 4-хлор-3-сульфамоилбензоилхлорида (0,5 г, 1,97 ммоль) в 5 мл метиленхлорида добавляют хлорид алюминия (0,485 г, 1,85 ммоль). Через 30 мин добавляют бензол (1 мл, 5,72 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Затем реакционную смесь выливают на лед, подкисляют 6 н. раствором HCl и трижды экстрагируют диэтиловым эфиром. Органические слои объединяют, сушат над сульфатом магния, фильтруют и концентрируют в вакууме. Полученный остаток очищают с помощью хроматографии на силикагеле и получают 40 мг (69%) искомого соединения в виде желтовато-коричневого твердого вещества.
МПК / Метки
МПК: C07C 311/16, C07D 213/40, C07D 295/116, A61K 31/18, C07D 235/06, C07D 207/20, C07C 323/24, C07D 211/24, A61P 29/00, C07D 209/08, C07C 317/24, C07D 333/18
Метки: матриксной, качестве, металлопротеазы, ингибиторов, производные, арилсульфонамида
Код ссылки
<a href="https://eas.patents.su/30-20114-proizvodnye-arilsulfonamida-v-kachestve-ingibitorov-matriksnojj-metalloproteazy.html" rel="bookmark" title="База патентов Евразийского Союза">Производные арилсульфонамида в качестве ингибиторов матриксной металлопротеазы</a>
Предыдущий патент: Нейтрализующие антитела, которые связываются с il-17 человека, и их применение
Следующий патент: Предмет одежды и способ его складывания
Случайный патент: Профиль опалубки и щит опалубки, изготовленный с использованием указанного профиля












