Противовирусные соединения
Номер патента: 19749
Опубликовано: 30.06.2014
Авторы: Пянь Хюн-Цзюн, Линк Джон О., Чоу Эзоп, Ву Кяойин, Ким Чанг Ю., Шенг Сяонин С., Кларк Майкл О'нэйл Ханрахан
Формула / Реферат
1. Соединение формулы (I)
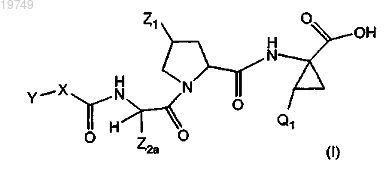
или его фармацевтически приемлемая соль,
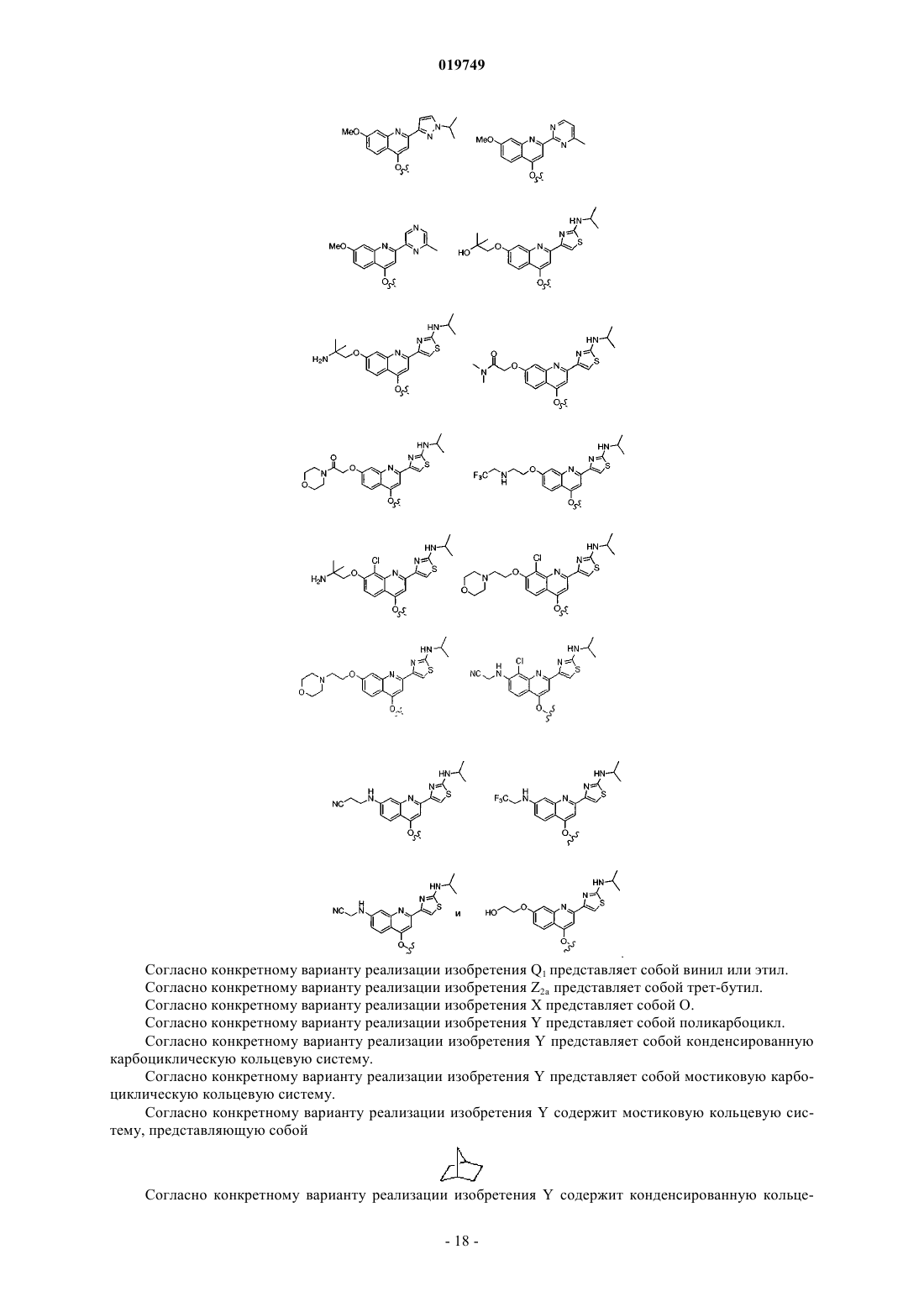
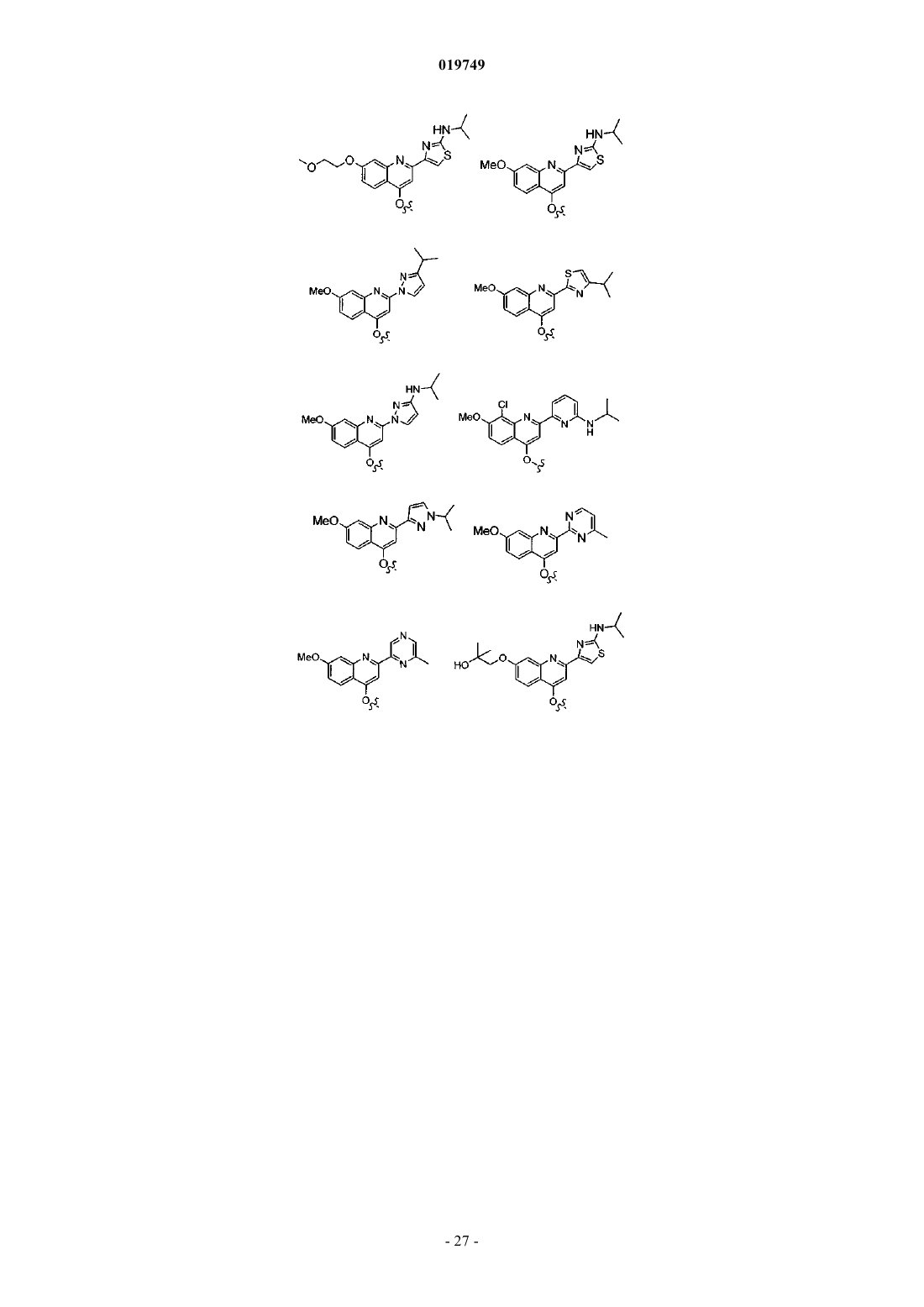
где Z1 представляет собой
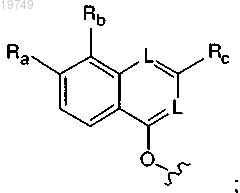
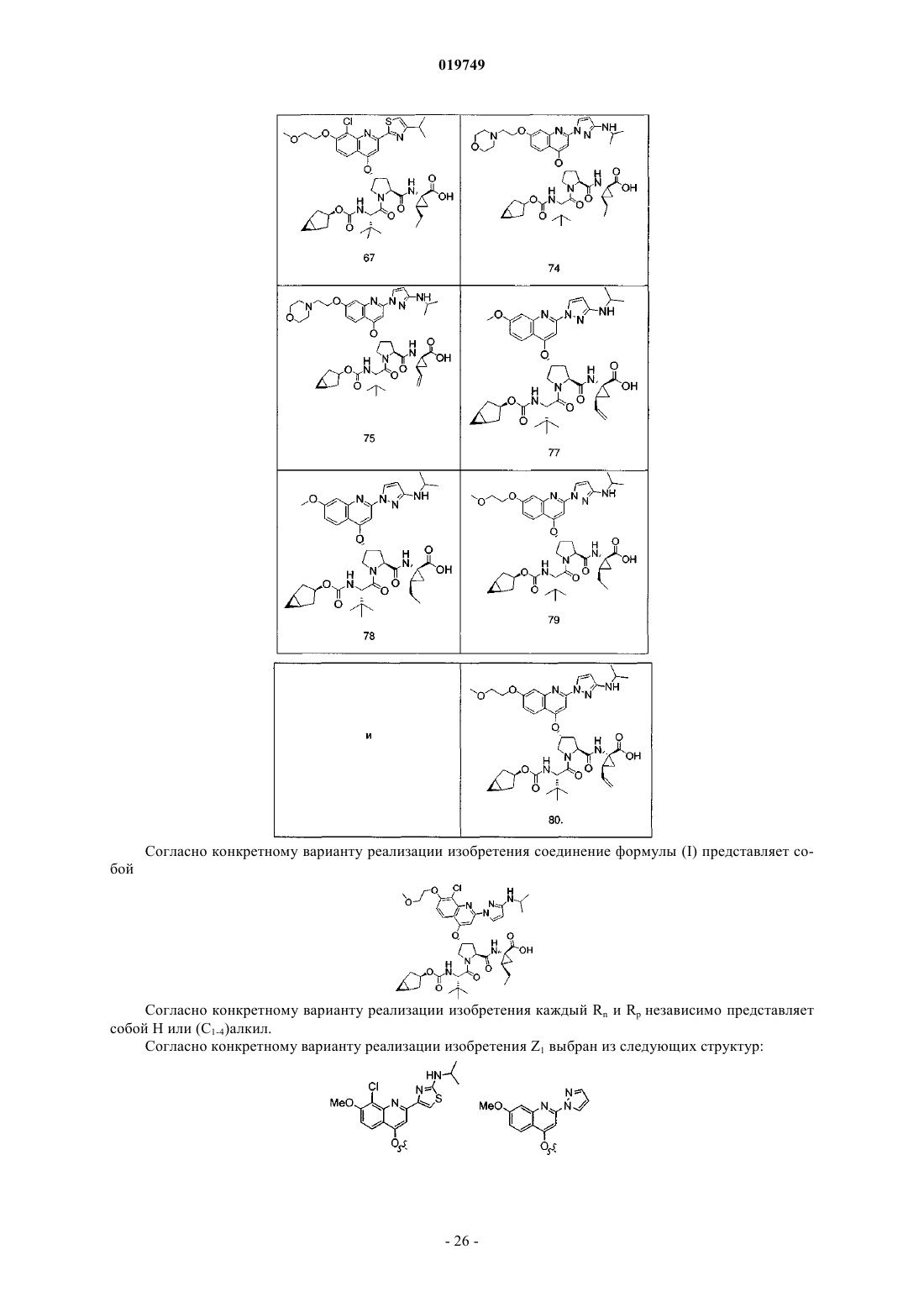
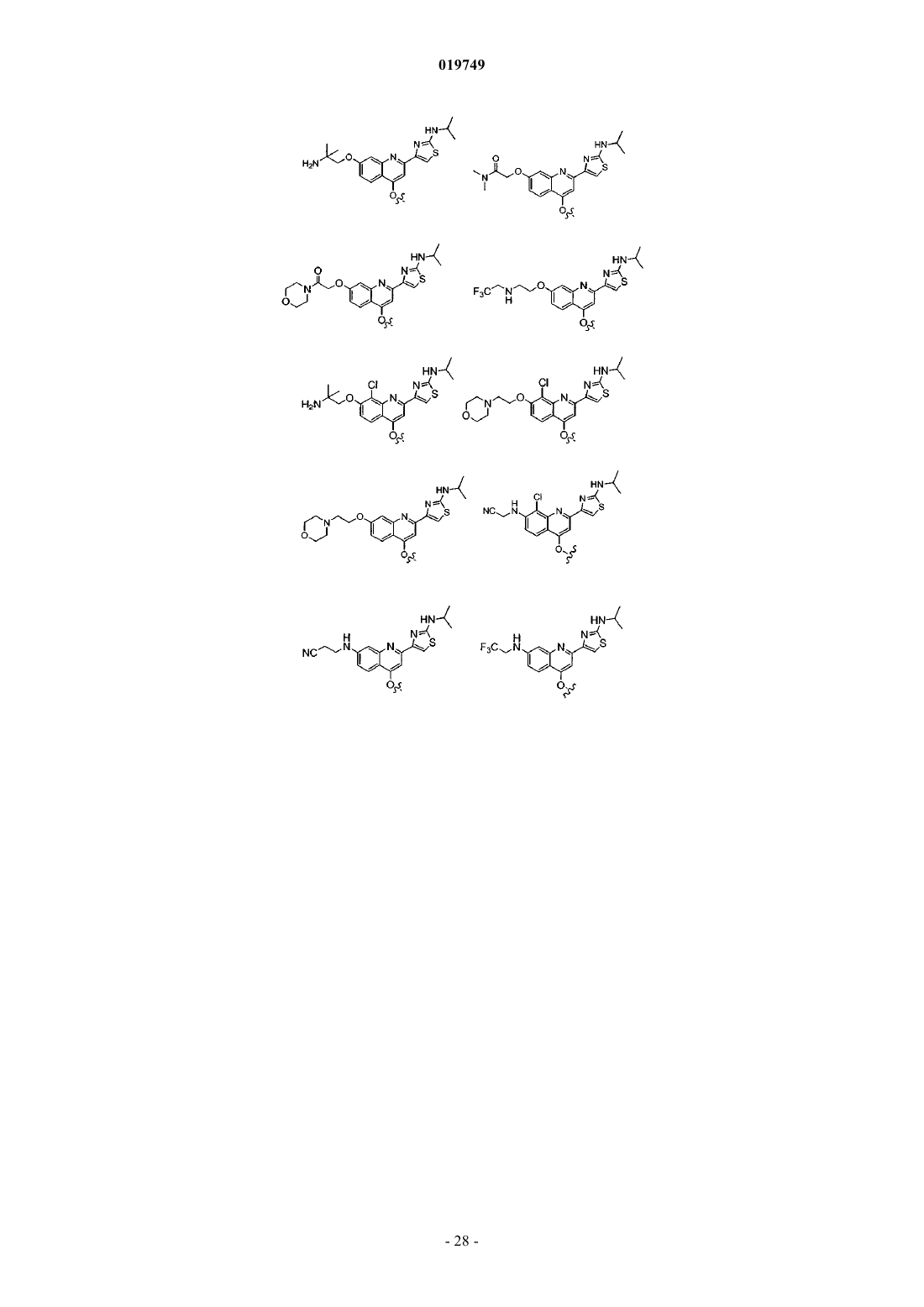
Ra представляет собой Н, метокси, N-(2-цианоэтил)амино, N-(3,3,3-трифторэтил)амино, 2-метоксиэтокси, 2-гидроксиэтокси, 2-гидрокси-2-метилпропокси, 2-амино-2-метилпропокси, N,N-диметиламинокарбонилметокси, морфолинокарбонилметокси, 2-[N-(2,2,2-трифторэтил)амино]этокси, 2-морфолиноэтокси, цианометокси, 2-пиперазин-1-илэтокси, 2-(N,N-диметиламино)этокси, 2-(3,3-диметилморфолино)этокси, 2-(4-метилпиперазин-1-ил)этокси или карбоксиметокси;
Rb представляет собой Н или Cl;
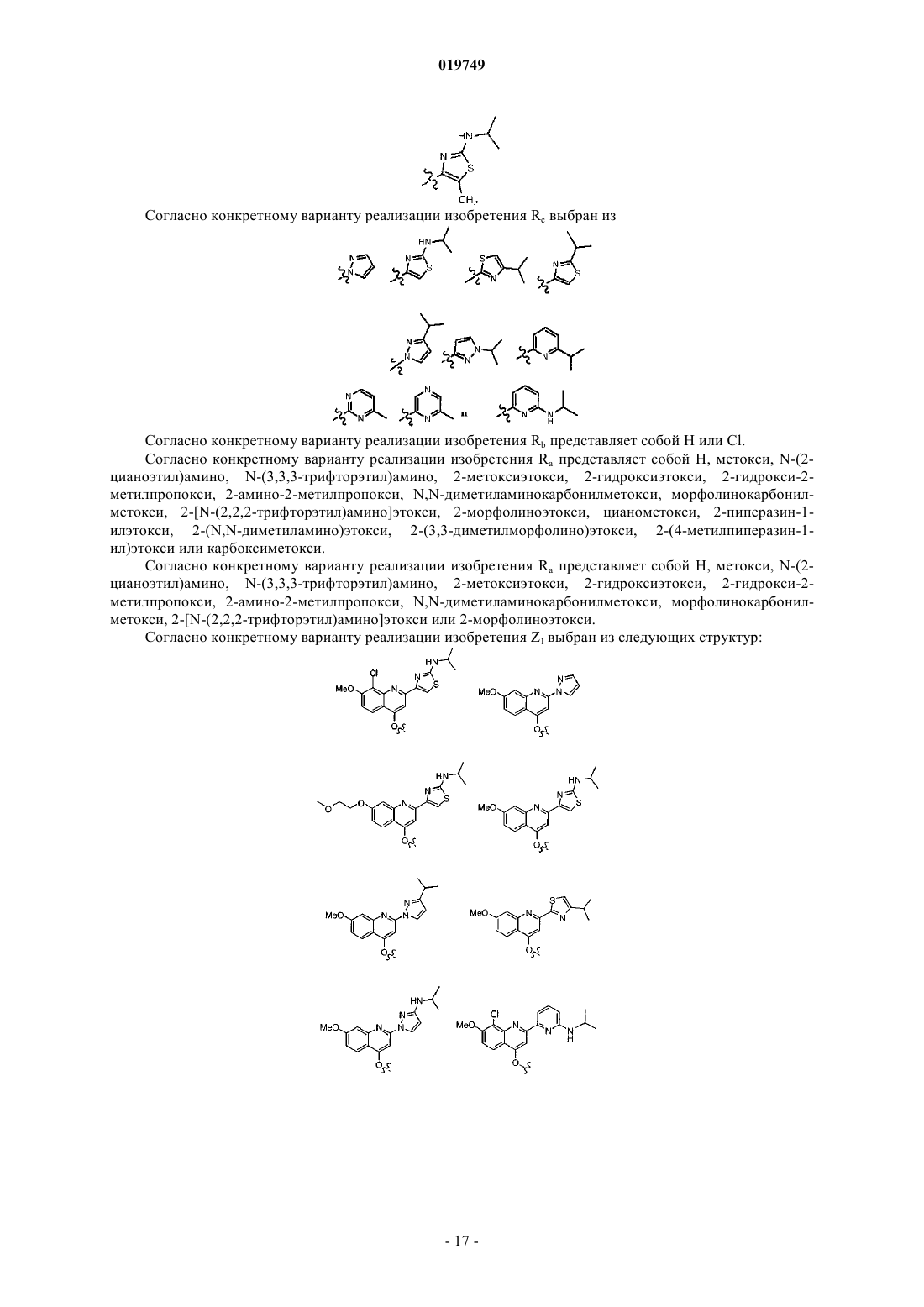
Rc представляет собой гетероарильное кольцо, выбранное из

при этом указанное гетероарильное кольцо необязательно содержит в качестве заместителей одну или более (С1-3)алкильных групп или NRnRp, причем каждый Rn и Rp независимо представляет собой Н или (С1-4)алкил;
каждый L независимо представляет собой СН или N;
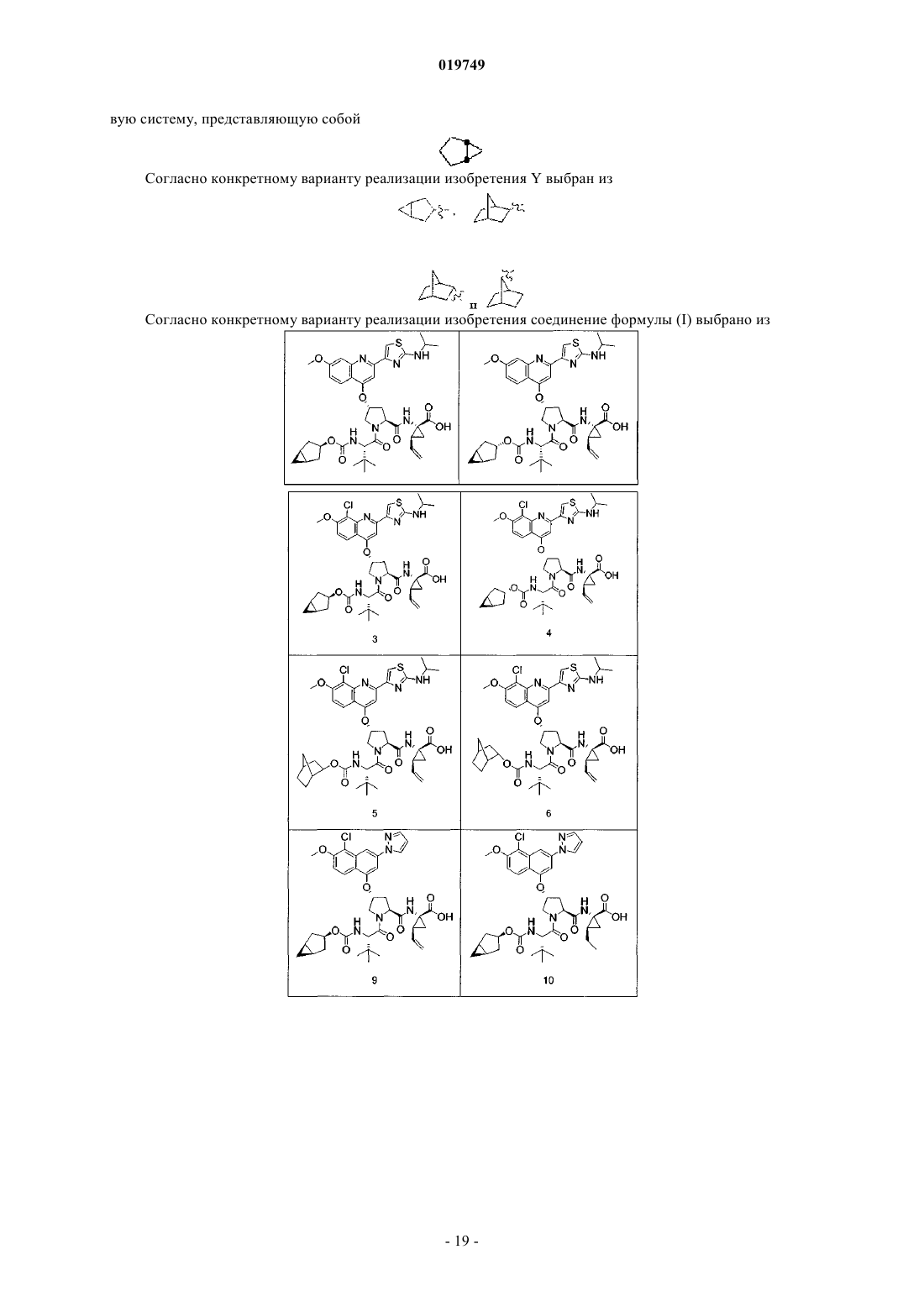
Z2a представляет собой (С1-4)алкил;
Q1 представляет собой винил или этил;
X представляет собой О;
Y выбран из
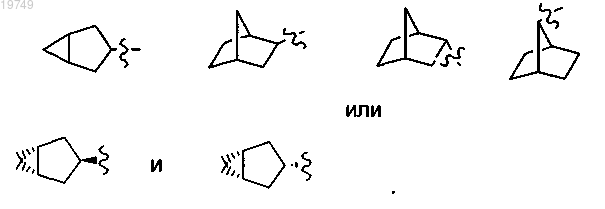
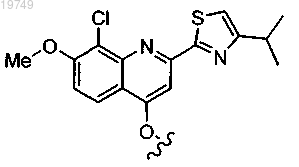
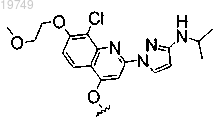
2. Соединение по п.1, в котором Z1 выбран из следующих структур:
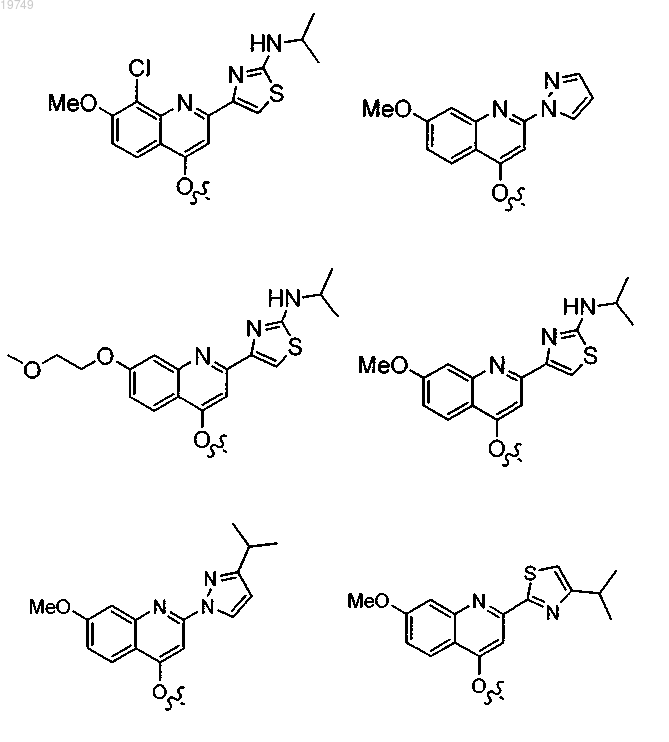

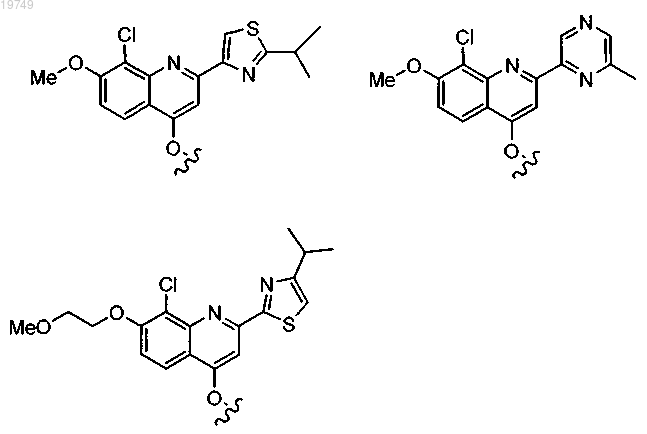
и
или
3. Соединение по п.1, в котором Z2a представляет собой трет-бутил.
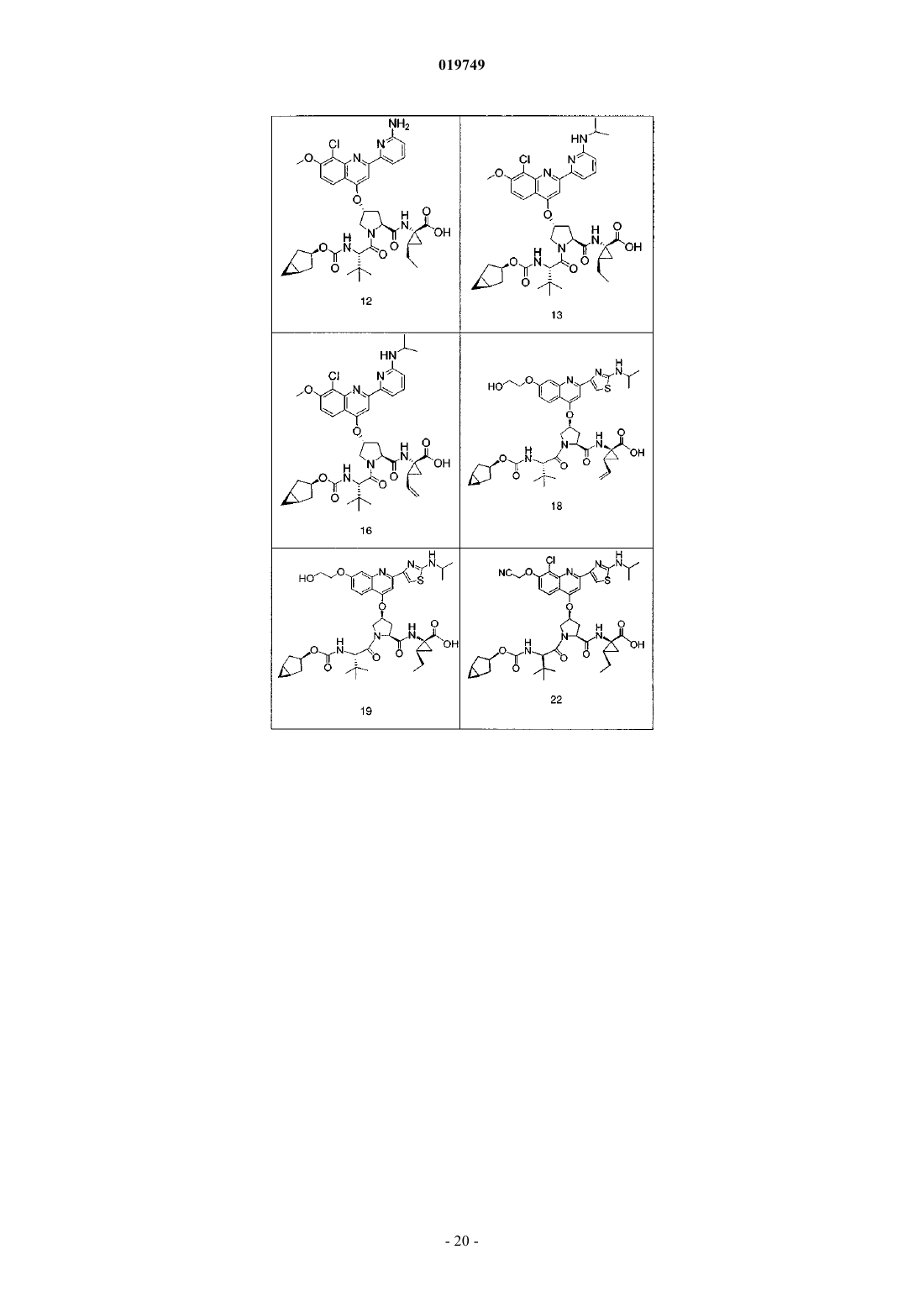
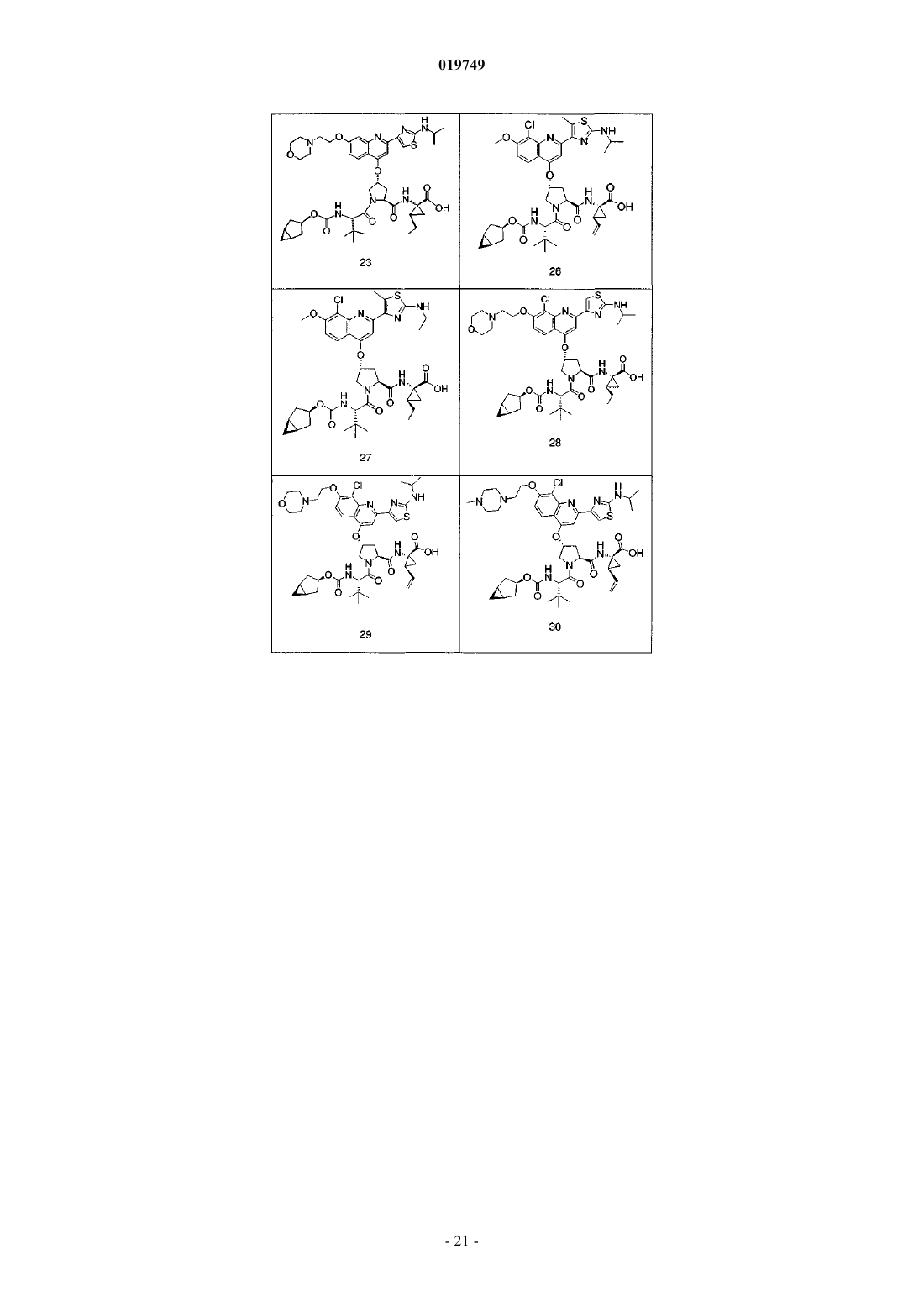
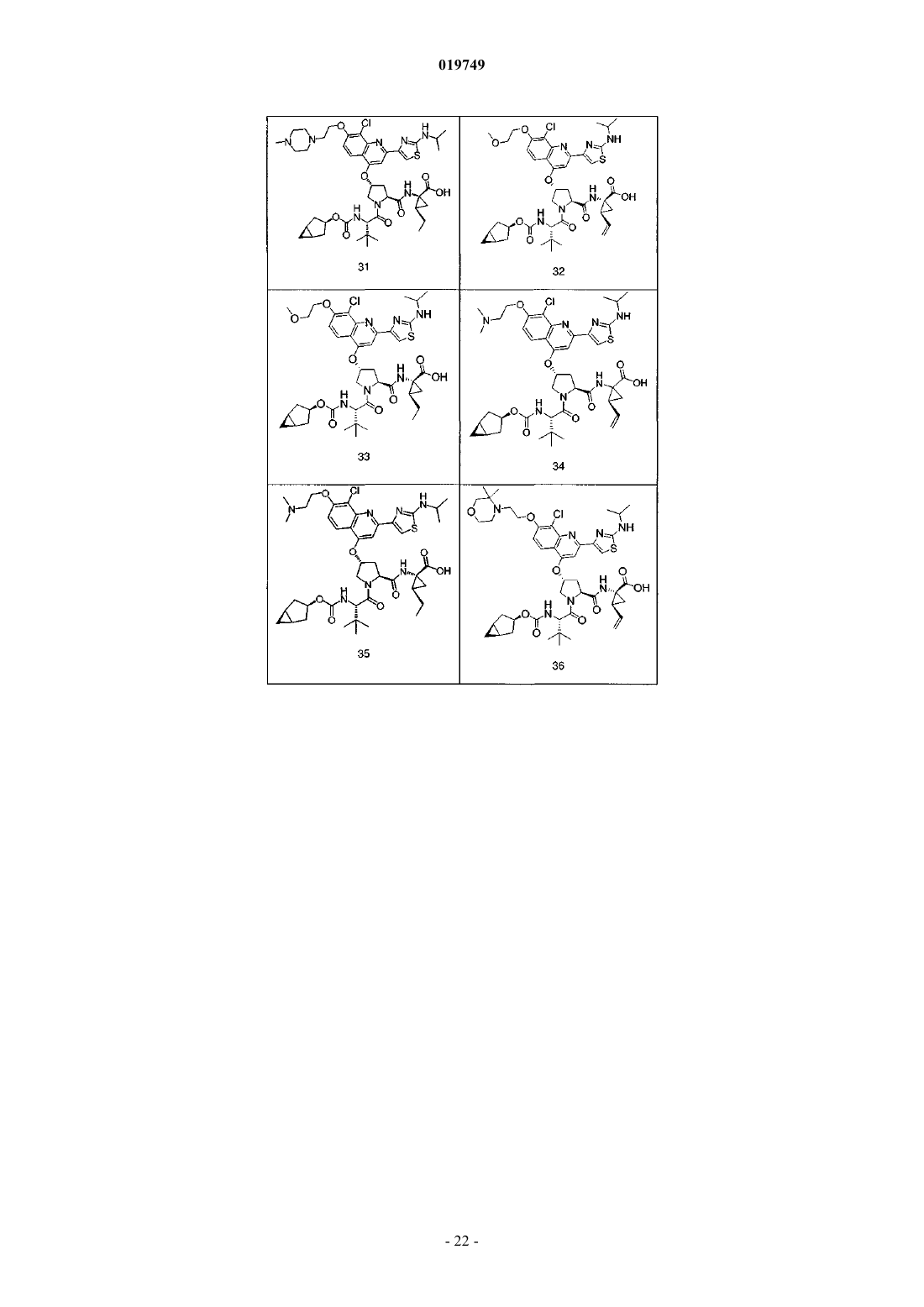
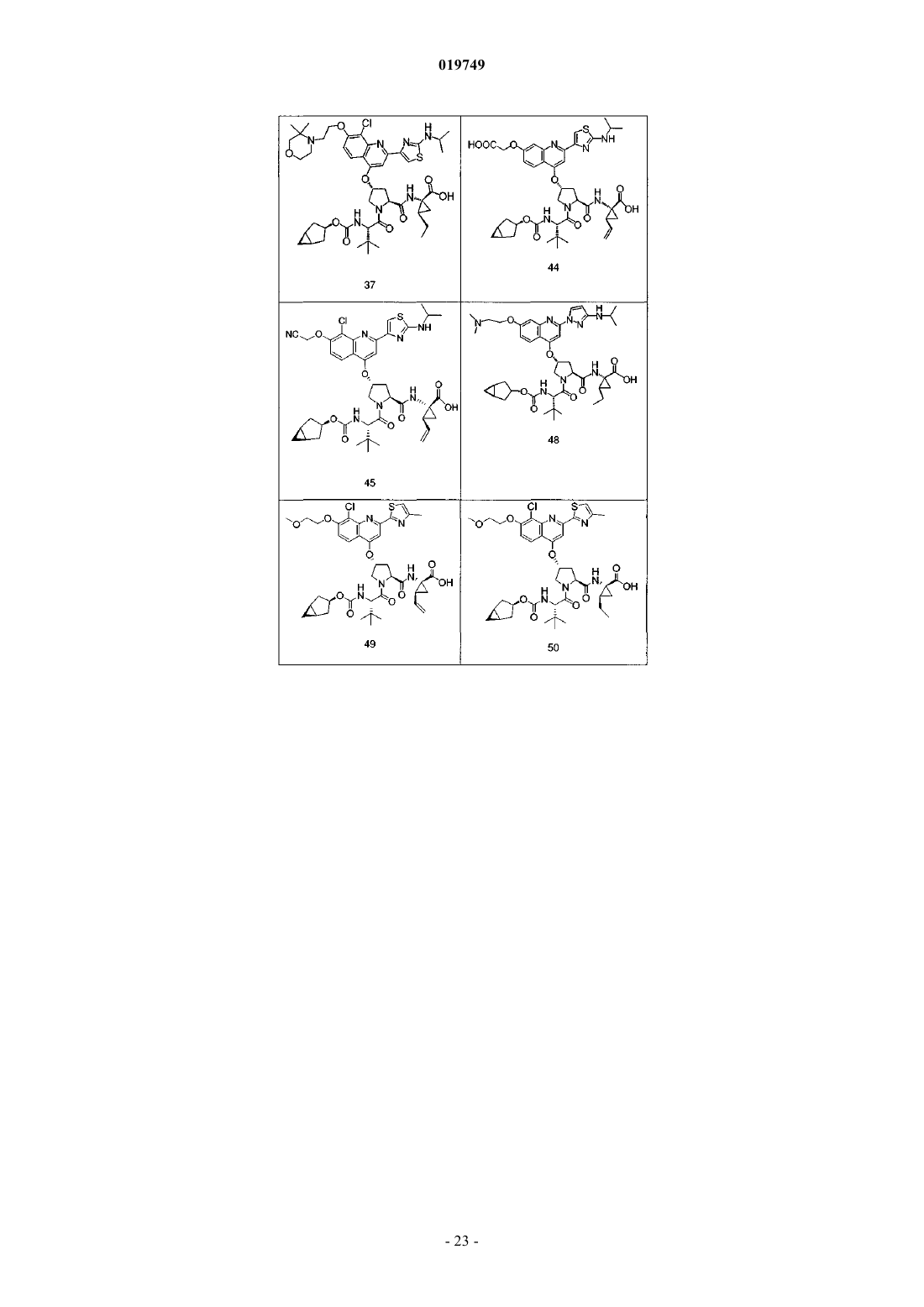
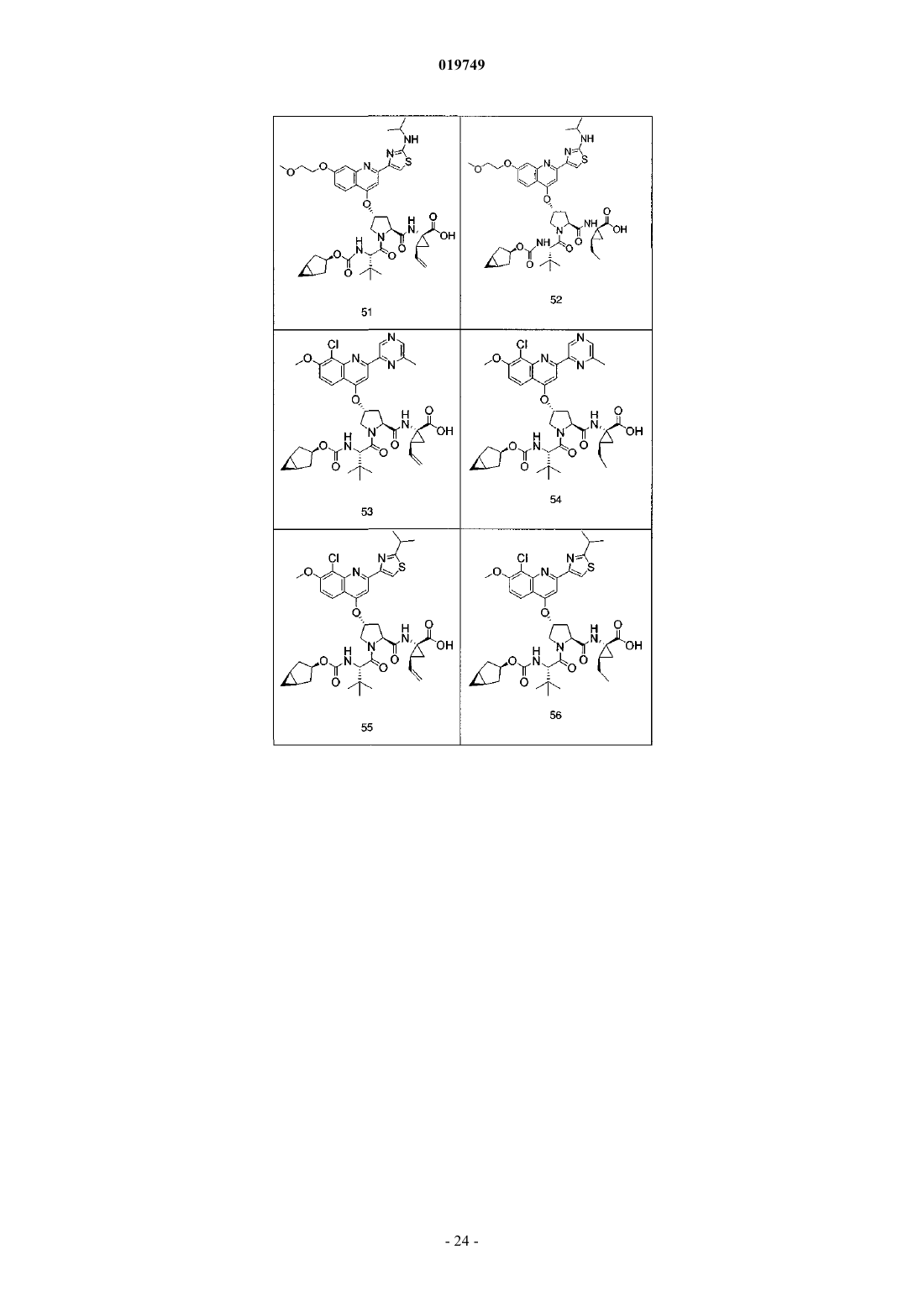
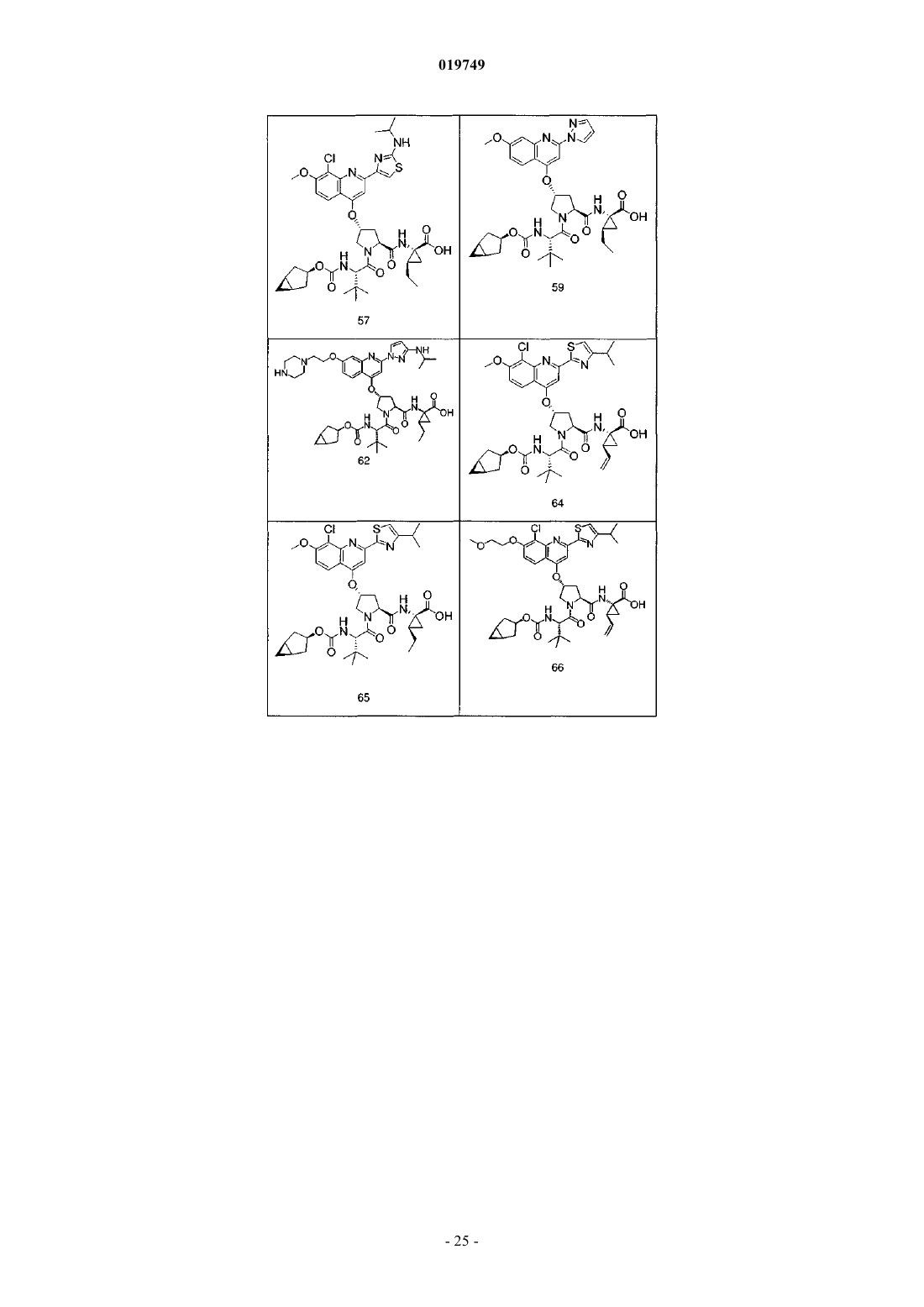
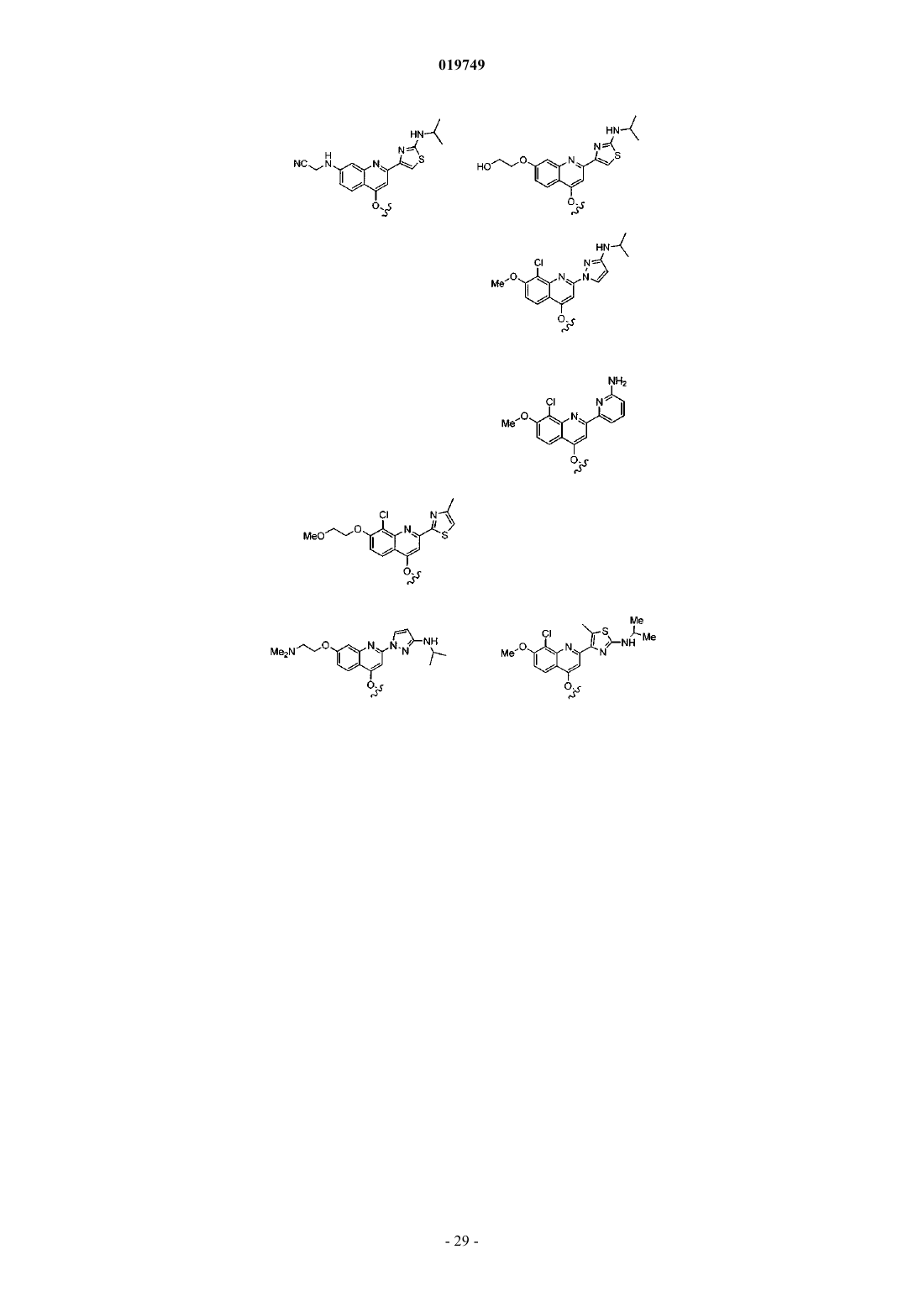
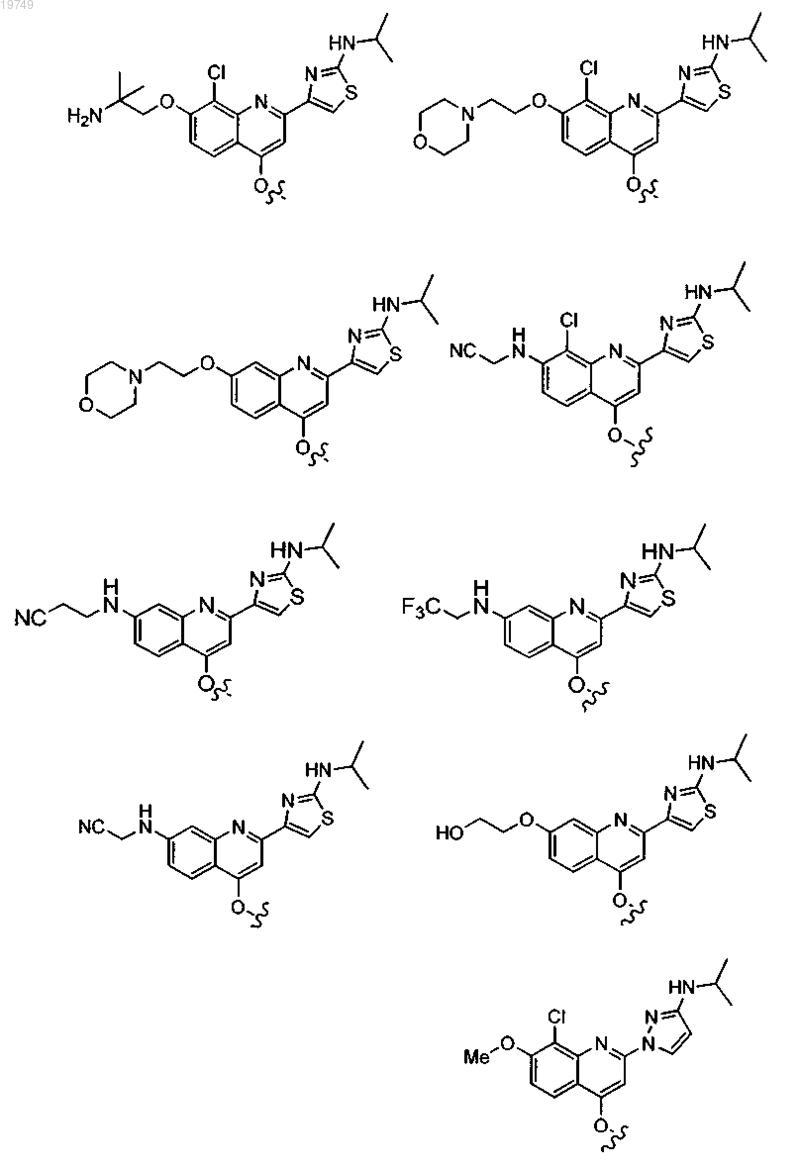
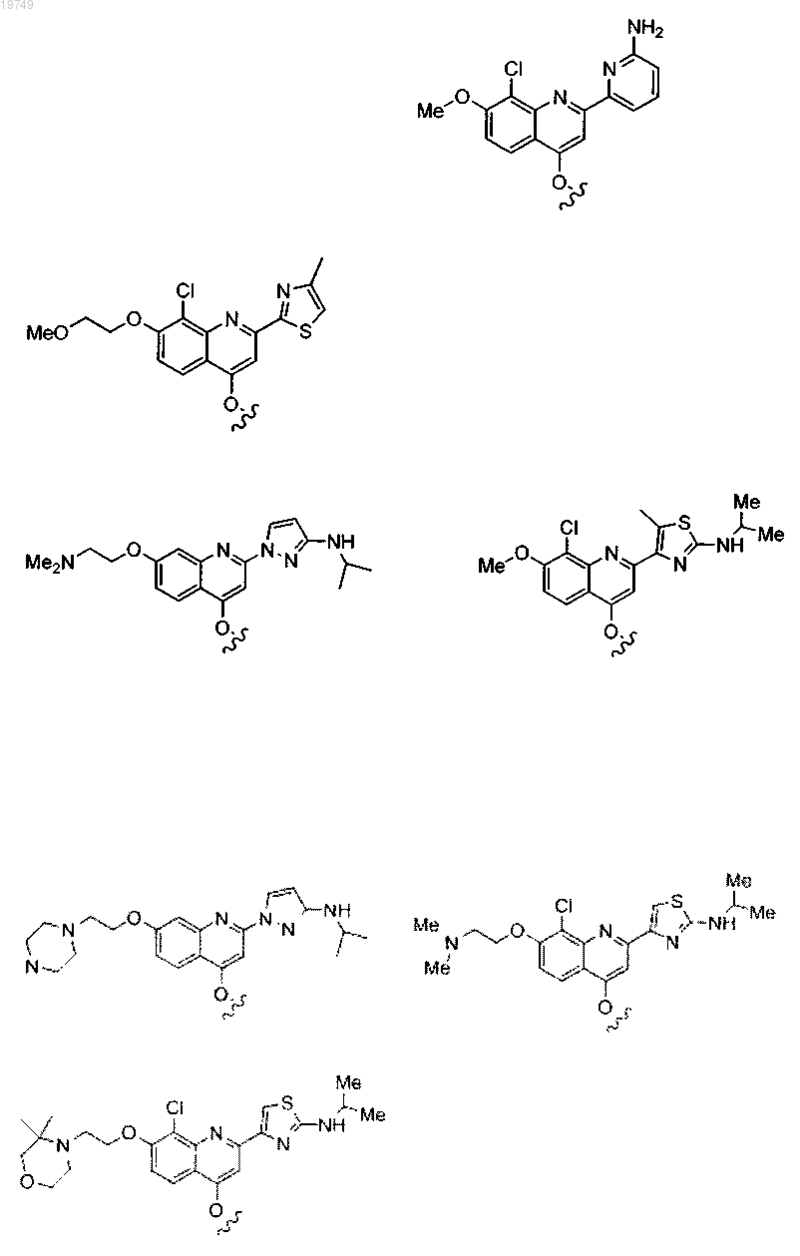
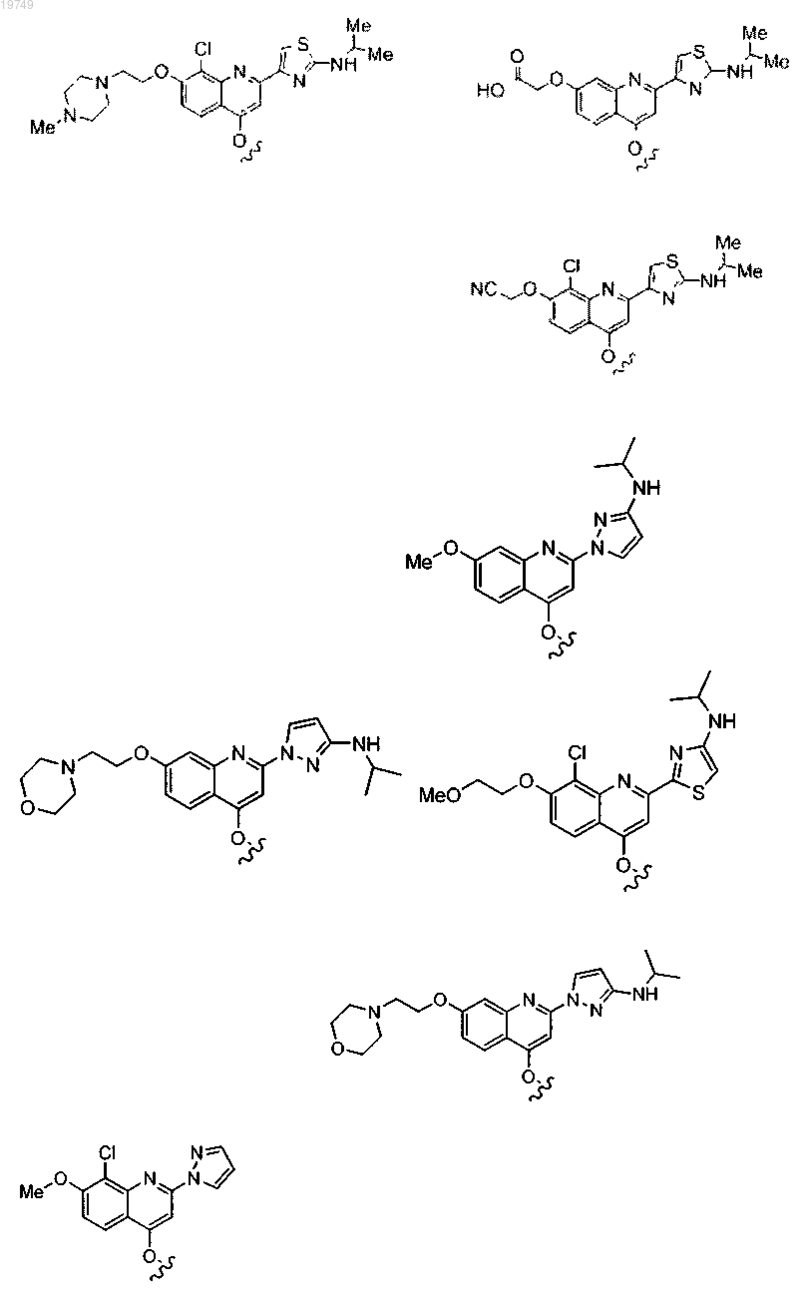
4. Соединение по п.1, выбранное из
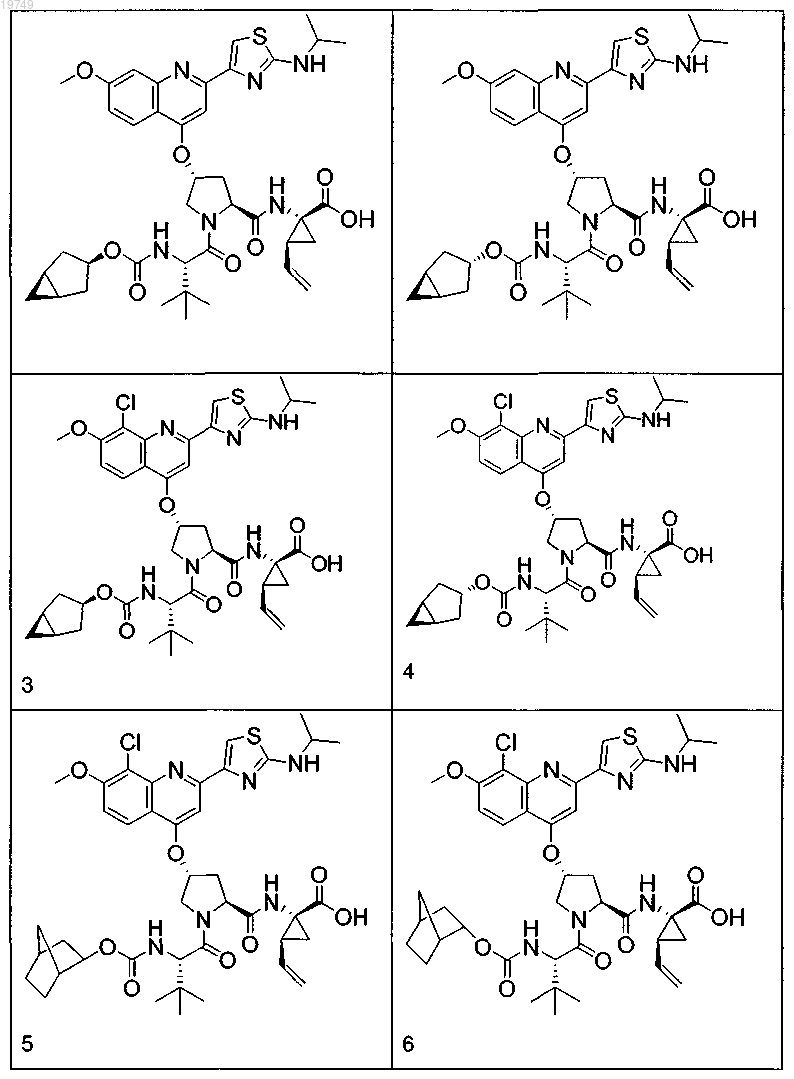
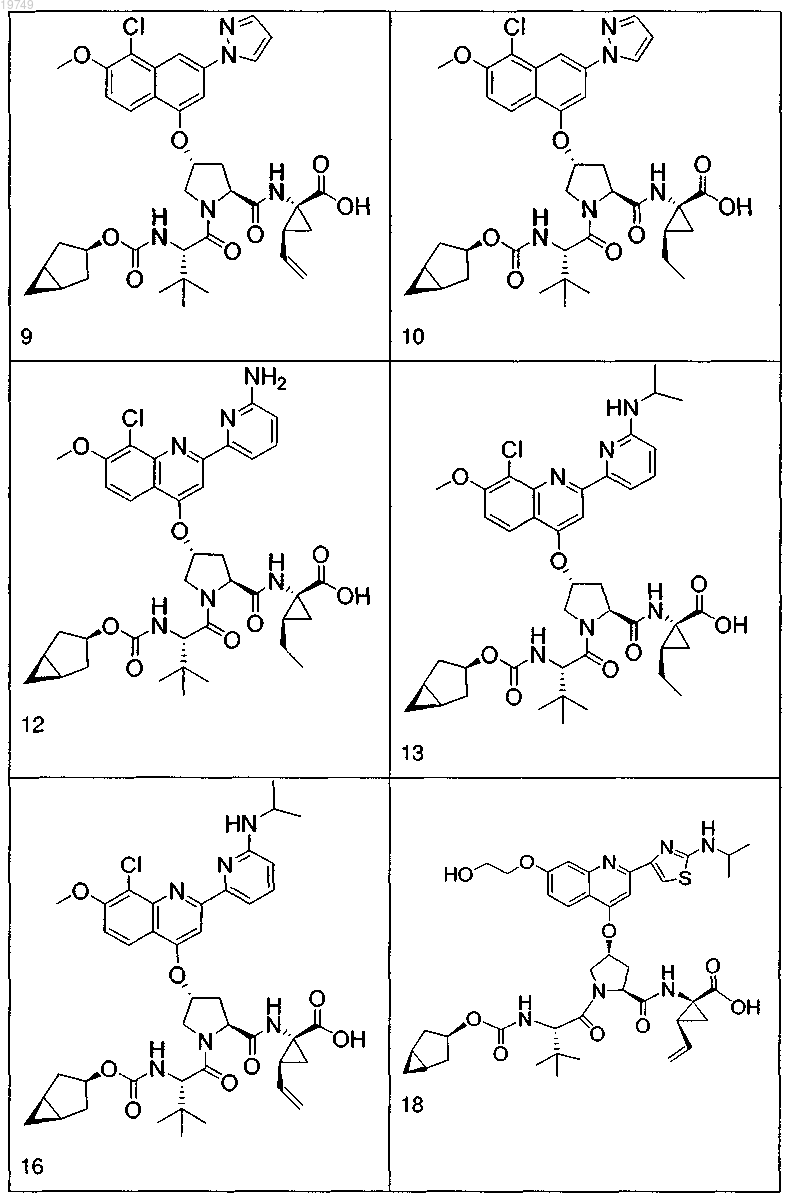

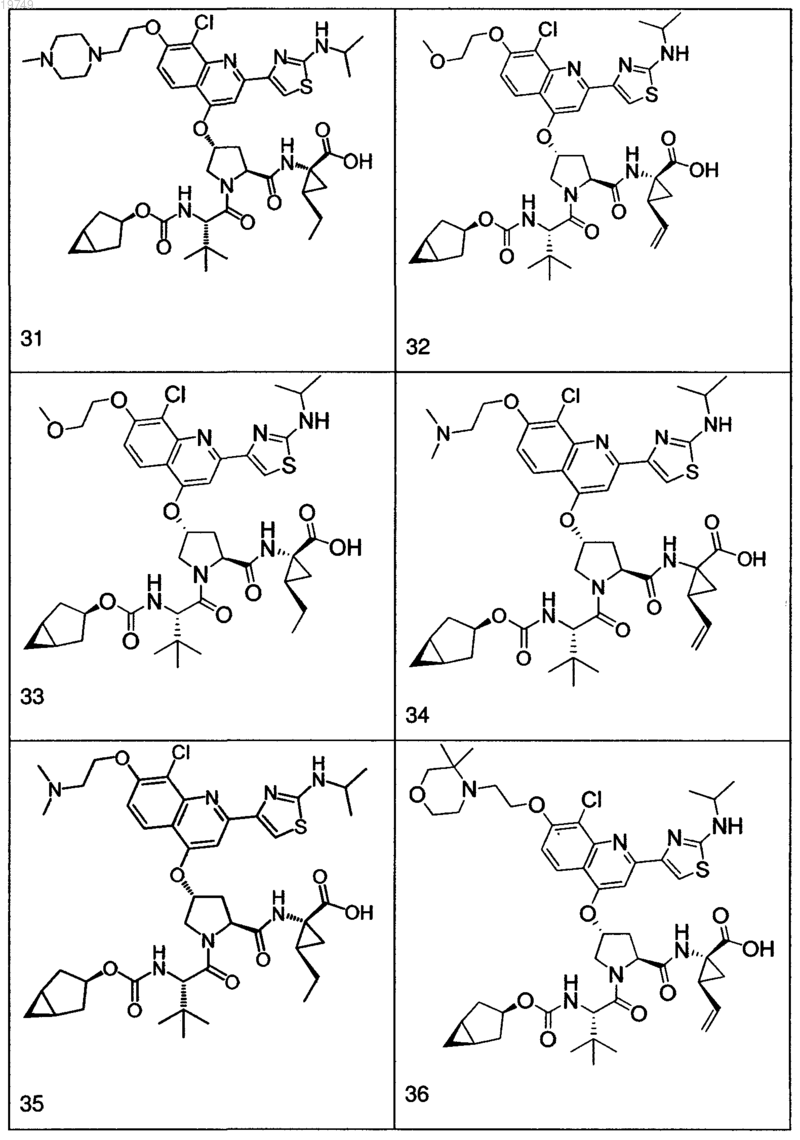
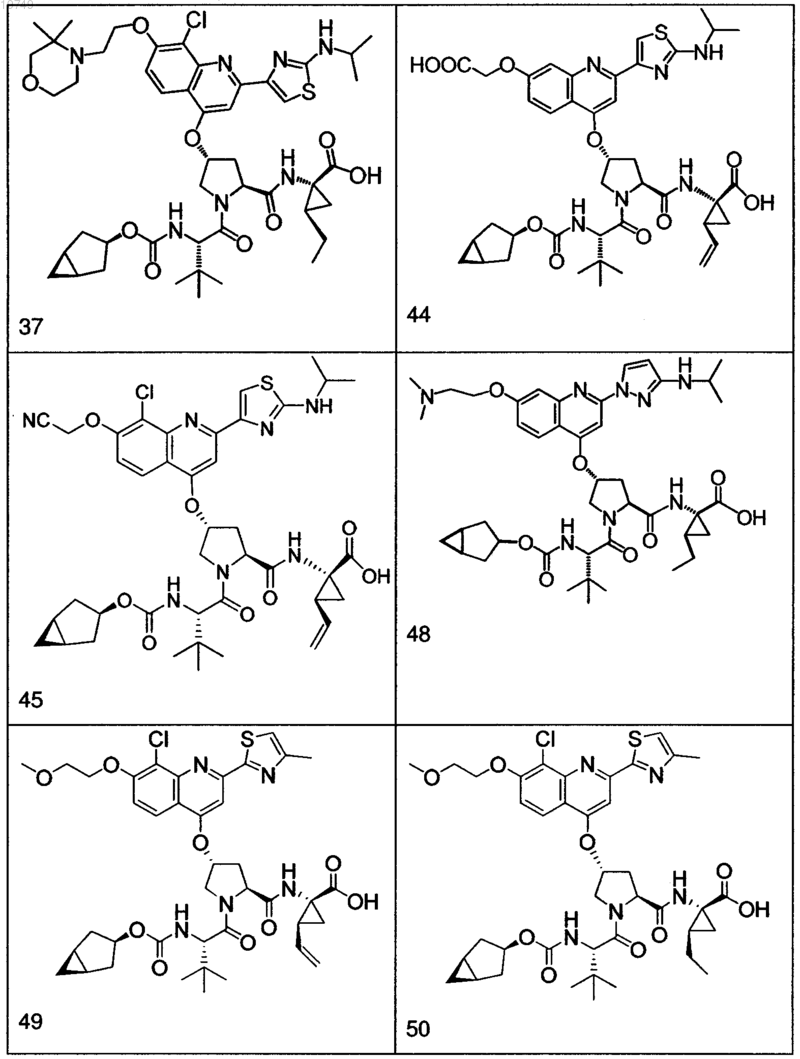
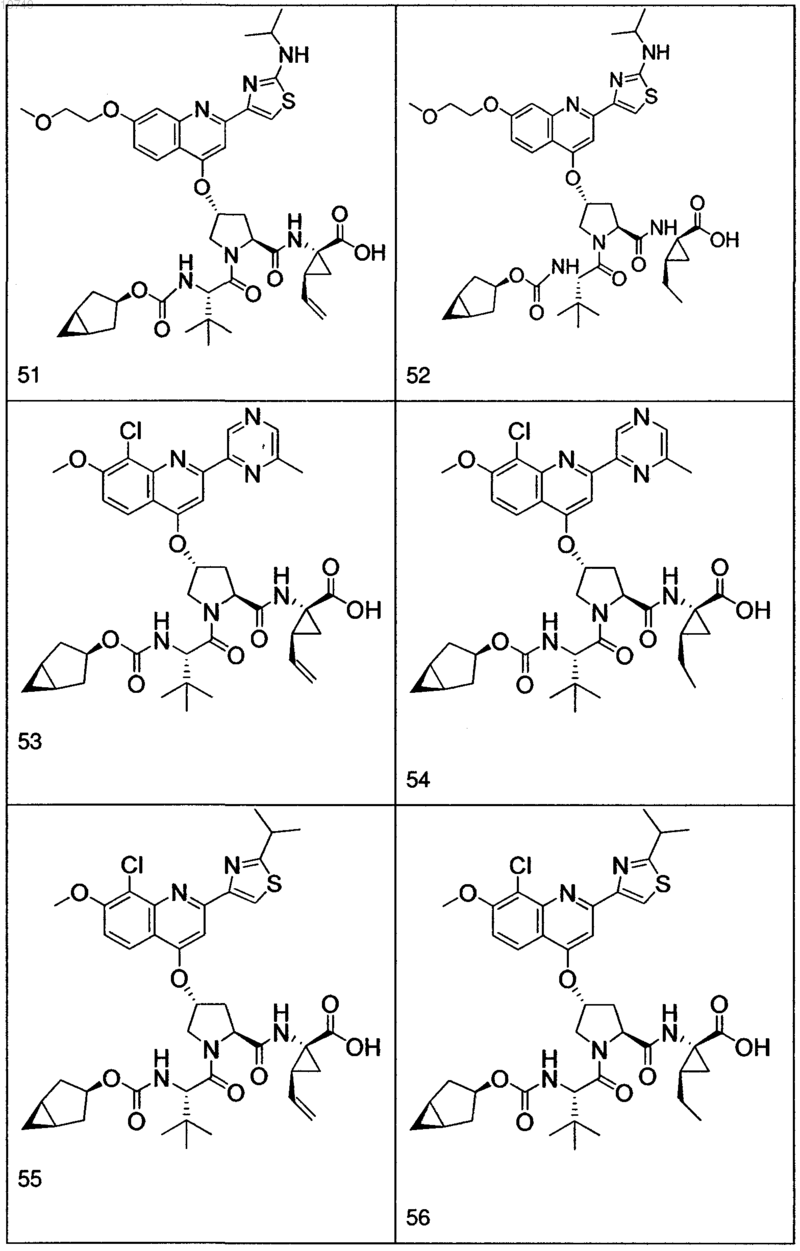
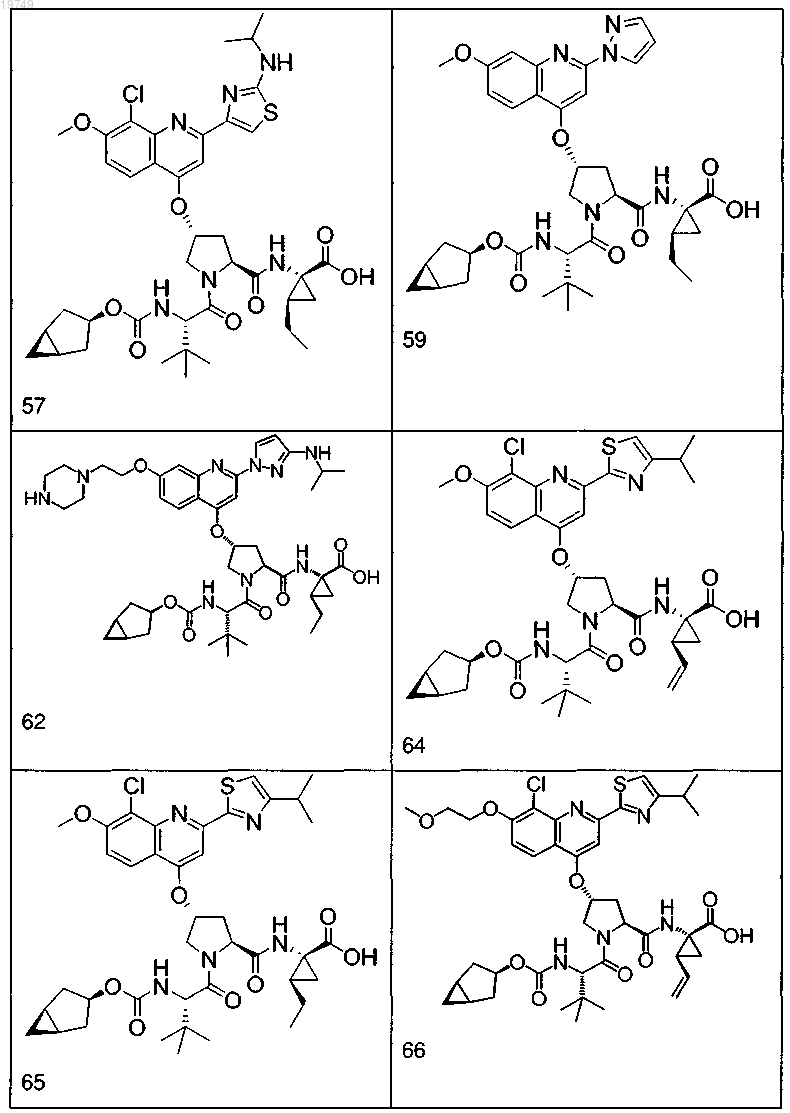
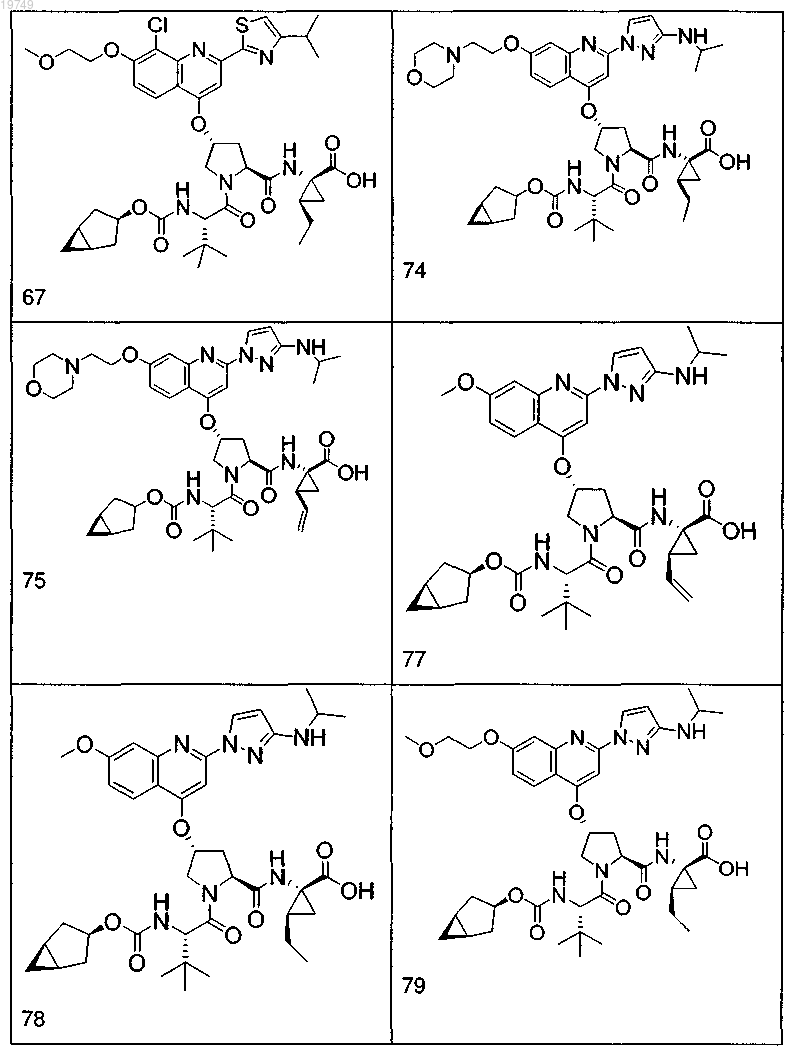

или
и фармацевтически приемлемых солей указанных соединений.
5. Соединение по любому из пп.1-4 в форме фармацевтически приемлемой соли.
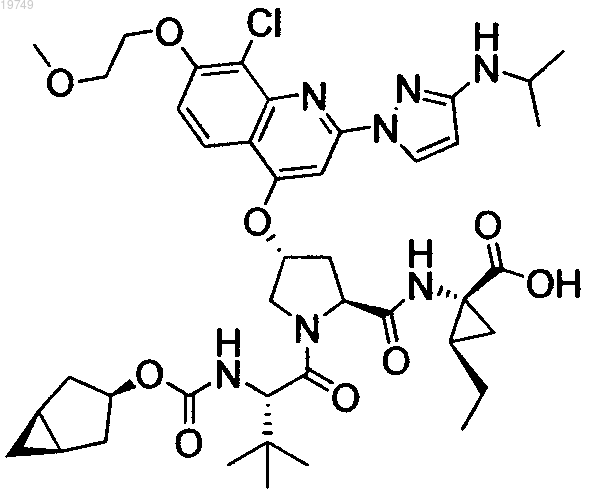
6. Соединение формулы
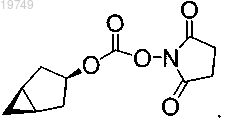
7. Соединение формулы
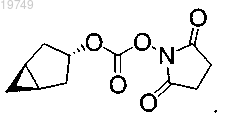
8. Фармацевтическая композиция для лечения расстройств, ассоциированных с гепатитом С, содержащая соединение по любому из пп.1-5 и по меньшей мере один фармацевтически приемлемый носитель.
9. Фармацевтическая композиция по п.8, которая дополнительно содержит по меньшей мере один дополнительный терапевтический агент.
10. Фармацевтическая композиция по п.9, отличающаяся тем, что указанный дополнительный терапевтический агент выбран из группы, состоящей из интерферонов, аналогов рибавирина, ингибиторов NS3-протеазы, ингибиторов полимеразы NS5b, ингибиторов α-глюкозидазы 1, гепатозащитных агентов, ингибиторов ВГС, отличных от нуклеозидов, и других препаратов для лечения вируса гепатита С.
11. Фармацевтическая композиция по п.8, дополнительно содержащая аналог нуклеозида.
12. Фармацевтическая композиция по п.11, дополнительно содержащая интерферон или пегилированный интерферон.
13. Фармацевтическая композиция по п.11, отличающаяся тем, что указанный аналог нуклеозида выбран из рибавирина, вирамидина, левовирина, L-нуклеозида и изаторибина и указанный интерферон представляет собой α-интерферон или пегилированный интерферон.
14. Способ лечения расстройств, ассоциированных с гепатитом С, включающий введение индивидууму фармацевтической композиции, содержащей терапевтически эффективное количество соединения по любому из пп.1-4.
15. Применение соединения по любому из пп.1-4 для приготовления лекарственного средства для лечения гепатита С или расстройства, ассоциированного с гепатитом С, у животного.
16. Соединение формулы
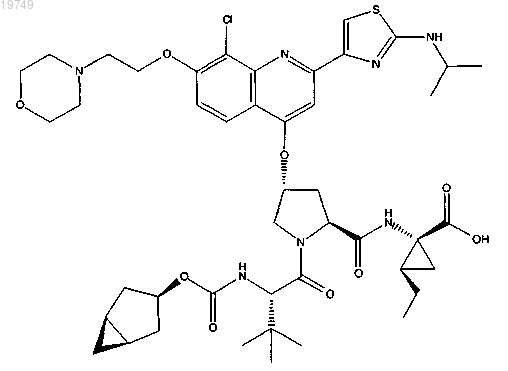
или фармацевтически приемлемая соль указанного соединения.
17. Фармацевтическая композиция для лечения расстройств, ассоциированных с гепатитом С, содержащая соединение формулы
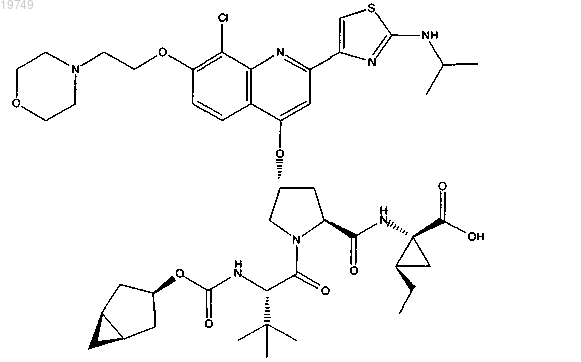
или фармацевтически приемлемую соль указанного соединения и по меньшей мере один фармацевтически приемлемый носитель.
Текст
Изобретение относится к противовирусным соединениям формулы (I) или фармацевтически приемлемым солям указанного соединения, к композициям, содержащим такие соединения, и к способам лечения, которые включают введение указанных соединений, а также к промежуточным соединениям, полезным для их получения. Область изобретения Настоящее изобретение в целом относится к соединениям, обладающим ингибирующей активностью в отношении вируса гепатита С. Уровень техники Установлено, что гепатит С представляет собой хроническое вирусное заболевание печени, которое характеризуется поражением печени. И хотя лекарства для направленной доставки к печени широко используются и уже показали свою эффективность, полезность этих лекарств ограничена их токсичностью и другими побочными эффектами. Ингибиторы ВГС являются полезными для ограничения заражения вирусом гепатита С (ВГС) и развития ВГС-инфекции, а также в диагностических исследованиях на заражение ВГС (вирусом гепатита С). Существует необходимость в новых терапевтических агентах для лечения ВГС. Краткое изложение сущности изобретения Согласно одному варианту реализации настоящего изобретения предложено соединение, которое представляет собой соединение формулы (I) или фармацевтически приемлемую соль указанного соединения, гдеRc представляет собой гетероарильное кольцо, выбранное из причем указанное гетероарильное кольцо необязательно содержит в качестве заместителей одну или более (С 1-3)алкильных групп или NRnRp; каждый L независимо представляет собой СН или N;Q1 представляет собой винил или этил; каждый из Rn и Rp независимо представляет собой Н или (С 1-4)алкил. Настоящее изобретение также относится к фармацевтической композиции, которая содержит соединение формулы I или фармацевтически приемлемую соль указанного соединения и по меньшей мере один фармацевтически приемлемый носитель. Настоящее изобретение также относится к способу лечения расстройств, ассоциированных с гепатитом С, который включает введение индивидууму фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I или его фармацевтически приемлемой соли. Настоящее изобретение также обеспечивает применение соединения формулы I или его фармацевтически приемлемой соли для изготовления лекарственного средства, полезного для лечения состояния,-1 019749 ассоциированного с активностью ВГС, у млекопитающего. В настоящем изобретении также предложены новые промежуточные соединения, раскрытые в настоящем описании, которые являются полезными для получения соединений согласно настоящему изобретению. Некоторые из соединений согласно настоящему изобретению являются полезными для получения других соединений согласно настоящему изобретению. Согласно одному варианту реализации настоящее изобретение обеспечивает соединение, обладающее улучшенными ингибирующими или фармакокинетическими свойствами, включая повышенную активность, направленную против развития вирусной устойчивости, улучшенную пероральную бйодоступность, более высокую эффективность или пролонгированное эффективное время полужизни in vivo. Некоторые соединения согласно настоящему изобретению вызывают меньше побочных эффектов, требуют менее сложных режимов дозирования или являются перорально активными. Подробное описание изобретения Далее приведено подробное описание изобретения со ссылкой на конкретные варианты реализации настоящего изобретения, примеры которых проиллюстрированы прилагаемыми структурами и формулами. Несмотря на то что в данном описании перечислены конкретные варианты реализации изобретения,подразумевается, что настоящее изобретение не ограничено приведенными вариантами реализации. Напротив, подразумевается, что настоящее изобретение включает все альтернативы, модификации и эквиваленты, которые могут быть включены в объем настоящего изобретения, определенный указанными вариантами реализации. Соединения согласно настоящему изобретению Соединения согласно настоящему изобретению не включают ранее известные соединения. Однако применение соединений, о противовирусных свойствах которых не было известно прежде, для противовирусных целей (например, для достижения противовирусного эффекта при введении животному), входит в объем настоящего изобретения. Применительно к США, соединения или композиции, предложенные в данном изобретении, не включают соединения, которые могут попасть под действие 35 USC 102 или попадают под действие 35 USC 103. Во всех случаях, когда соединение, приведенное в данном описании, имеет в качестве заместителей более одной из одинаково обозначенных групп, например "L", подразумевается, что данные группы могут быть одинаковыми или разными, то есть каждую группу выбирают независимо."Алкил" представляет собой углеводород, содержащий нормальные, вторичные, третичные или кольцевые атомы углерода. Примеры включают метил (Me, -CH3), этил (Et, -СН 2 СН 3), 1-пропил (н-Pr, нпропил, -СН 2 СН 2 СН 3), 2-пропил (изо-Pr, изопропил, -СН(СН 3)2), циклопропил, 1-бутил (н-Bu, н-бутил,-СН 2 СН 2 СН 2 СН 3), 2-метил-1-пропил (изо-Bu, изобутил, -СН 2 СН(СН 3)2), 2-бутил (втор-Bu, втор-бутил,-СН(СН 3)СН 2 СН 3), 2-метил-2-пропил (трет-Bu, трет-бутил, -С(СН 3)3), 1-пентил (н-пентил,-СН 2 СН 2 СН 2 СН 2 СН 3), 2-пентил (-СН(СН 3)СН 2 СН 2 СН 3), 3-пентил (-СН(СН 2 СН 3)2), 2-метил-2-бутил"Алкенил" представляет собой углеводород, содержащий нормальные, вторичные, третичные или кольцевые атомы углерода, и по меньшей мере одну ненасыщенную связь, а именно углерод-углероднуюsp2 двойную связь. Примеры включают этилен или винил (-СН=СН 2), аллил (-СН 2 СН=СН 2), циклопентенил (-С 5 Н 7) и 5-гексенил (-СН 2 СН 2 СН 2 СН 2 СН=СН 2), но не ограничены ими."Алкинил" представляет собой углеводород, содержащий нормальные, вторичные, третичные или кольцевые атомы углерода, и по меньшей мере одну ненасыщенную связь, а именно углерод-углероднуюsp тройную связь. Примеры включают этинил (-CCH) и пропаргил (-СН 2 С=СН), но не ограничены ими. Термин "алкилен" относится к насыщенному углеводородному радикалу с разветвленной или нормальной цепью или к насыщенному циклическому углеводородному радикалу, имеющему два одновалентных радикальных центра, образованные в результате удаления двух атомов водорода у одного и того же или у двух разных атомов углерода соответствующего алкана. Типичные алкиленовые радикалы включают метилен (-СН 2-) 1,2-этил (-СН 2 СН 2-), 1,3-пропил (-СН 2 СН 2 СН 2-), 1,4-бутил (-СН 2 СН 2 СН 2 СН 2-) и т.п., но не ограничены ими. Термин "арил" означает одновалентный ароматический углеводородный радикал, который содержит 6-20 атомов углерода, образованный в результате удаления одного атома водорода у одного из углеродных атомов исходной ароматической кольцевой системы. Типичные арильные группы включают радикалы, образованные из бензола, замещенного бензола, нафталина, антрацена, бифенила и т.п., но не ограничены ими. Термин "галоген" включает F, Cl, Br и I. Термин "гетероарил" в контексте данного описания включает 5-20-атомные моно- или полициклические кольцевые системы, в которых по меньшей мере одно кольцо представляет собой ароматическое кольцо, содержащее один или более гетероатомов (например, О, S, N и т.д.). Согласно одному варианту реализации настоящего изобретения термин гетероарил включает радикал моноциклического ароматического кольца, содержащего пять или шесть кольцевых атомов углерода и от одного до четырех гетероатомов, каждый из которых выбран из группы, состоящей из непероксидного кислорода, атома серы иN(X), где X отсутствует или представляет собой Н, О, (С 1-С 4)алкил, фенил или бензил, а также радикал орто-конденсированного бициклического гетероцикла, содержащего приблизительно от восьми до десяти кольцевых атомов, образованный, в частности, из бензопроизводного или путем конденсации бензопроизводного с пропиленовым, триметиленовым или тетраметиленовым бирадикалом. Термин "гетероцикл" в контексте данного описания включает в качестве примера, но не ограничения, гетероциклы, описанные в Paquette, Leo A.; Principles of Modern Heterocyclic Chemistry (W.A. Benjamin, New York, 1968), в особенности в главах 1, 3, 4, 6, 7 и 9; The Chemistry of Heterocyclic Compounds AJ. Am. Chem. Soc. (1960) 82:5566. Согласно одному конкретному варианту реализации настоящего изобретения "гетероцикл" включает "карбоцикл", такой как определено в данном описании, у которого один или более (например, 1, 2, 3 или 4) атомов углерода заменен гетероатомом (например, О, N или S). КогдаQ1 и Z2a совместно с атомами, к которым они присоединены, образуют гетероцикл, данный гетероцикл,образованный Q1 и Z2a, совместно с атомами, к которым они присоединены, обычно может содержать до приблизительно 25 атомов. Примеры гетероциклов включают в качестве примера, но не ограничения, пиридил, дигидропиридил, тетрагидропиридил (пиперидил), тиазолил, тетрагидротиофенил, S-окисленный тетрагидротиофенил, пиримидинил, фуранил, тиенил, пирролил, пиразолил, имидазолил, тетразолил, бензофуранил, тианафталинил, индолил, индоленил, хинолинил, изохинолинил, бензимидазолил, пиперидинил, 4 пиперидонил, пирролидинил, 2-пирролидонил, пирролинил, тетрагидрофуранил, тетрагидрохинолинил,тетрагидроизохинолинил, декагидрохинолинил, окгагидроизохинолинил, азоцинил, триазинил, 6 Н-1,2,5 тиадиазинил, 2 Н,6 Н-1,5,2-дитиазинил, тиантренил, пиранил, изобензофуранил, хроменил, ксантенил,феноксатинил, 2 Н-пирролил, изотиазолил, изоксазолил, пиразинил, пиридазинил, индолизинил, изоиндолил, 3 Н-индолил, 1 Н-индазолил, пуринил, 4 Н-хинолизинил, фталазинил, нафтиридинил, хиноксалинил, хиназолинил, циннолинил, птеридинил, 4 Н-карбазолил, карбазолил, -карболинил, фенантридинил,акридинил, пиримидинил, фенантролинил, феназинил, фенотиазинил, фуразанил, феноксазинил, изохроманил, хроманил, имидазолидинил, имидазолинил, пиразолидинил, пиразолинил, пиперазинил, индолинил, изоиндолинил, хинуклидинил, морфолинил, оксазолидинил, бензотриазолил, бензизоксазолил, оксиндолил, бензоксазолинил, изатиноил и бис-тетрагидрофуранил В качестве примера, но не ограничения, гетероциклы, присоединенные по атому углерода, присоединены в положении 2, 3, 4, 5 или 6 пиридина, в положении 3, 4, 5 или 6 пиридазина, в положении 2, 4, 5 или 6 пиримидина, в положении 2, 3, 5 или 6 пиразина, в положении 2, 3, 4 или 5 фурана, тетрагидрофурана, тиофурана, тиофена, пиррола или тетрагидропиррола, в положении 2, 4 или 5 оксазола, имидазола или тиазола, в положении 3, 4 или 5 изоксазола, пиразола или изотиазола, в положении 2 или 3 азиридина, в положении 2, 3 или 4 азетидина, в положении 2, 3, 4, 5, 6, 7 или 8 хинолина или в положении 1, 3, 4,5, 6, 7 или 8 изохинолина. Наиболее типичные гетероциклы, присоединенные по атому углерода, включают 2-пиридил, 3-пиридил, 4-пиридил, 5-пиридил, 6-пиридил, 3-пиридазинил, 4-пиридазинил, 5 пиридазинил, 6-пиридазинил, 2-пиримидинил, 4-пиримидинил, 5-пиримидинил, 6-пиримидинил, 2 пиразинил, 3-пиразинил, 5-пиразинил, 6-пиразинил, 2-тиазолил, 4-тиазолил или 5-тиазолил. В качестве примера, но не ограничения, гетероциклы, присоединенные по атому азота, присоединены в положении 1 азиридина, азетидина, пиррола, пирролидина, 2-пирролина, 3-пирролина, имидазола,имидазолидина, 2-имидазолина, 3-имидазолина, пиразола, пиразолина, 2-пиразолина, 3-пиразолина, пиперидина, пиперазина, индола, индолина, 1 Н-индазола, в положении 2 изоиндола или изоиндолина, в положении 4 морфолина и в положении 9 карбазола или -карболина. Наиболее типичные гетероциклы,присоединенные по атому азота, включают 1-азиридил, 1-азетедил, 1-пирролил, 1-имидазолил, 1 пиразолил и 1-пиперидинил. Термин "карбоцикл" относится к насыщенному, ненасыщенному или ароматическому кольцу, содержащему до приблизительно 25 атомов углерода. Обычно карбоцикл содержит приблизительно от 3 до 7 атомов углерода в случае моноцикла, приблизительно от 7 до 12 атомов углерода в случае бицикла и до приблизительно 25 атомов углерода в случае полицикла. Моноциклические карбоциклы обычно содержат от 3 до 6 кольцевых атомов, но чаще 5 или 6 кольцевых атомов. Бициклические карбоциклы обычно содержат от 7 до 12 кольцевых атомов, образующих, например, бицикло [4,5], [5,5], [5,6] или [6,6] систему, или 9 или 10 кольцевых атомов, образующих бицикло [5,6] или [6,6] систему. Термин карбоцикл включает "циклоалкил", который представляет собой насыщенный или ненасыщенный карбоцикл. Примеры моноциклических карбоциклов включают циклопропил, циклобутил, циклопентил, 1-циклопент-1 енил, 1-циклопент-2-енил, 1-циклопент-3-енил, циклогексил, 1-циклогекс-1-енил, 1-циклогекс-2-енил, 1 циклогекс-3-енил, фенил, спирил (спиро-конденсированные кольца) и нафтил. Термин "поликарбоцикл" относится к насыщенной или ненасыщенной полициклической кольцевой системе, содержащей от приблизительно 6 до приблизительно 25 атомов углерода и имеющей два или более кольца (например, 2, 3, 4 или 5 колец). Данная полициклическая кольцевая система содержит кольца, которые конденсированы или соединены мостиковой связью. Например, данный термин включает бицикло [4,5], [5,5], [5,6] или [6,6] кольцевые системы, а также следующие мостиковые кольцевые системы:(то есть [2.1.1], [2.2.1], [3.3.3], [4.3.1], [2.2.2], [4.2.2], [4.2.1], [4.3.2], [3.1.1], [3.2.1], [4.3.3], [3.3.2],[3.2.2] и [3.3.1] полициклические кольца соответственно), которые могут быть присоединены к оставшейся части соединения формулы (I) в любом положении, подходящем для образования связи. Термин "хиральный" относится к молекулам, которые характеризуются тем, что не совпадают при наложении с их зеркальным изображением, тогда как термин "ахиральный" относится к молекулам, которые совпадают при наложении с их зеркальным изображением. Термин "стереоизомеры" относится к соединениям, которые имеют одинаковое химическое строение, но различаются расположением атомов или групп в пространстве. Термин "замещенный/имеющий замещение", используемый по отношению к алкилу, алкилену,арилу, арилалкилу, алкокси, гетероциклилу, гетероарилу, карбоциклилу и т.д., например "замещенный алкил", "замещенный алкилен", "замещенный арил", "замещенный арилалкил", "замещенный гетероциклил" и "замещенный карбоциклил", означает алкил, алкилен, арил, арилалкил, гетероциклил, карбоциклил соответственно, у которых один или более атомов водорода независимо заменены на заместитель,который не является атомом водорода. Типичные заместители включают, без ограничения, -X, -R, -О,=O, -OR, -SR, -S-, -NR2, -N+R3,=NR, -СХ 3, -CN, -OCN, -SCN, -N=C=O, -NCS, -NO, -NO2,=N2, -N3,-NHC(=O)R, -C(=O)R, -C(=O)NRR-S(=O)2-, -S(=O)2OH, -S(=O)2R, -OS(=O)2OR, -S(=O)2NR, -S(=O)R,-OP(=O)(OR)2, -P(=O)(OR)2, -P(=O)(O-)2, -P(=O)(OH)2, -P(O)(OR)(O-), -C(=O)R, -C(=O)X, -C(S)R, C(O)OR, -C(O)O, -C(S)OR, -C(O)SR, -C(S)SR, -C(O)NRR, -C(S)NRR, -C (=NR)NRR, где каждый X независимо представляет собой атом галогена, F, Cl, Br или I и каждый R независимо представляет собой Н,алкил, арил, арилалкил, гетероцикл или защитную группу. Аналогично, алкиленовая, алкениленовая и алкиниленовая группы также могут быть замещенными. Если не указано иное, термин "замещенный",использованный по отношению к таким группам, как арилалкил, которые содержит две или более группировки, каждая из которых может иметь заместители, означает, что данные заместители могут быть присоединены к арильной группировке, к алкильной группировке или к обеим. Термин "возможно замещенный" по отношению к конкретной группировке соединения формулы (I)(например, арильная группа, которая может иметь заместители) относится к группировке, имеющей 0, 1,2 или более заместителей. Термин "диастереомеры" относится к стереоизомерам, которые содержат два или более центра хиральности и молекулы которых не являются зеркальными изображениями друг друга. Диастереомеры имеют разные физические свойства, например точки плавления, точки кипения, спектральные свойства,и разную реакционную способность. Смеси диастереоизомеров можно разделить с использованием аналитических методик высокого разрешения, таких как электрофорез и хроматография. Термин "энантиомеры" относятся к двум стереоизомерам соединения, зеркальные изображения которого невозможно наложить друг на друга. Термин "лечение" или "лечить", когда он относится к заболеванию или состоянию, включает предупреждение возникновения заболевания или состояния, замедление развития заболевания или состоя-4 019749 ния, устранение заболевания или состояния и/или ослабление одного или более симптома заболевания или состояния. Стереохимические определения и условные обозначения, использованные в данном описании,обычно соответствуют S.P. Parker, Ed., McGraw-Hill Dictionary of Chemical Terms (1984) McGraw-HillWileySons, Inc., New York. Многие органические соединения существуют в оптически активных формах, то есть обладают способностью вращать плоскость плоскополяризованного света. При описании оптически активного соединения для обозначения абсолютной конфигурации молекулы относительно ее хирального(ых) центра(ов) используют префиксы D и L или R и S. Префиксы d и l или (+) и (-) используют для обозначения знака вращения соединением плоскополяризованного света, (-) или l означает, что соединение является левовращающим. Соединение с префиксом (+) или d является правовращающим. Данные стереоизомеры с одинаковой химической структурой идентичны, за исключением того, что они являются зеркальными отражениями друг друга. Конкретный стереоизомер также может называться энантиомером, и смесь таких изомеров часто называют энантиомерной смесью. Смесь, содержащая энантиомеры в соотношении 50:50, называется рацемической смесью или рацематом, такая смесь может получаться в результате химической реакции или использования методики, где отсутствует стереоселекция или стереоспецифичность. Термины "рацемическая смесь" и "рацемат" относятся к эквимолярной смеси двух энантиомерных препаратов, которая является оптически неактивной. Изобретение включает все стереоизомеры соединений, приведенных в данном описании. Защитные группы. В контексте настоящего изобретения защитные группы включают пролекарственные группировки и химические защитные группы. Термин "защитная группа" относится к группировке в составе соединения, которая маскирует или изменяет свойства функциональной группы или свойства соединения как целого. Химические защитные группы и стратегии введения/снятия защитных групп хорошо известны в данной области техники; см.,например, Protective Groups in Organic Chemistry, Theodora W. Greene, John WileySons, Inc., New York,1991. Защитные группы часто используют для маскировки реакционной способности некоторых функциональных групп, что помогает эффективно выполнять желаемые химические реакции, например упорядоченно и планомерно создавать и разрывать химические связи. Помимо реакционной способности защищенной функциональной группы защита функциональных групп соединения также изменяет его физические свойства, такие как полярность, липофильность (гидрофобность) и другие свойства, которые можно оценить с применением стандартных аналитических инструментов. Сами химически защищенные промежуточные соединения могут быть как биологически активными, так и неактивными. Защищенные соединения также могут проявлять измененные и, в некоторых случаях, оптимизированные свойства in vitro и in vivo, такие как проникновение через клеточные мембраны и устойчивость к ферментативной деградации или разрушению. В такой роли защищенные соединения с заданным терапевтическим действием можно рассматривать как пролекарства. Другая функция защитной группы состоит в том, чтобы превращать исходное лекарство в пролекарство, в результате чего исходное лекарство высвобождается после превращения пролекарства in vivo. Так как активные пролекарства могут абсорбироваться более эффективно, чем исходное лекарство, пролекарства могут быть более эффективными invivo, чем исходное лекарство. Защитные группы удаляют либо in vitro, в случае химических промежуточных соединений, либо in vivo, в случае пролекарств. В случае химических промежуточных соединений не очень важно, чтобы продукты, полученные в результате снятия защитных групп, например спирты, являлись физиологически приемлемыми, хотя в целом желательно, чтобы эти продукты были фармакологически безвредными. Защитные группы доступны, общеизвестны и широко используются, защитные группы можно использовать для предотвращения побочных реакций с участием защищаемых групп во время синтетических процедур, то есть путей или методик синтеза, при получении соединений согласно изобретению. Решение о том, какие группы защищать, когда это делать и какой природы химические защитные группы(PG) использовать, в основном зависит от того, какие химические вещества присутствуют в реакционной смеси, от воздействия которых необходимо защищать (например, от кислых, основных, окислительных,восстановительных или других условий) и от заданного направления синтеза. Если соединение имеет несколько PG, нет необходимости в том, чтобы все PG-группы были одинаковыми, и обычно они не являются одинаковыми. В основном PG используют для защиты таких функциональных групп, как карбоксильная группа, гидроксильная группа, тиогруппа или аминогруппа, и таким образом предотвращают побочные реакции или способствуют эффективному синтезу иным образом. Порядок снятия защитных групп с получением свободных незащищенных групп зависит от заданного направления синтеза и условий реакции, которые должны быть использованы, снятие защитных групп может быть выполнено в любом порядке, определяемом специалистом в данной области. У соединений согласно настоящему изобретению могут быть защищены различные функциональные группы. Например, защитные группы для группы -ОН (независимо от того, является эта группа гидроксилом, входит в состав функциональной группы карбоновой кислоты, фосфоновой кислоты или в состав других функциональных групп) включают "группы, образующие простые или сложные эфиры". Группы, образующие простые или сложные эфиры, могут функционировать в качестве химических защитных групп в схемах синтеза, приведенных в данном описании. Однако некоторые гидрокси- и тиозащитные группы не способны образовывать ни простые, ни сложные эфиры, что обычно понимают специалисты в данной области техники, такие защитные группы рассматриваются вместе с амидами ниже. Многие гидроксизащитные группы, амид-образующие группы и соответствующие химические реакции снятия защитных групп описаны в Protective Groups in Organic Synthesis, Theodora W. Greene (JohnWileySons, Inc., New York, 1991, ISBN 0-471-62301-6) ("Greene"); см., также Kocienski, Philip J.; Protecting Groups (Georg Thieme Verlag Stuttgart, New York, 1994), данная публикация включена в настоящее описание посредством ссылки во всей полноте, в частности Chapter 1, Protecting Groups: An Overview,pages 1-20, Chapter 2, Hydroxyl Protecting Groups, pages 21-94, Chapter 3, Diol Protecting Groups, pages 95117, Chapter 4, Carboxyl Protecting Groups, pages 118-154, Chapter 5, Carbonyl Protecting Groups, pages 155184. Защитные группы для карбоновой кислоты, фосфоновой кислоты, фосфоната, сульфоновой кислоты и другие защитные группы для кислот описаны в Greene (см. выше). Согласно одному варианту реализации настоящего изобретения соединение находится в выделенной и очищенной форме. Обычно термин "выделенный и очищенный" означает, что соединение, по существу, не содержит биологических веществ (например, крови, ткани, клеток и т.д.). Согласно одному конкретному варианту реализации изобретения данный термин означает, что соединение или конъюгат согласно настоящему изобретению по меньшей мере приблизительно на 90 мас.% очищены от биологических веществ; согласно другому конкретному варианту реализации данный термин означает, что соединение или конъюгат согласно изобретению по меньшей мере приблизительно на 98 мас.% очищены от биологических веществ; и согласно другому варианту реализации данный термин означает, что соединение или конъюгат согласно настоящему изобретению по меньшей мере приблизительно на 99 мас.% очищены от биологических веществ. Согласно другому конкретному варианту реализации в изобретении предложено соединение или конъюгат согласно изобретению, которые получены синтетическим путем (например, ex vivo). Аккумуляция в клетках. Согласно одному варианту реализации настоящее изобретение обеспечивает соединения, способные аккумулироваться в гепатоцитах человека. С физиологической точки зрения гепатоциты являются ключевым компонентом механизма защиты от инфекции. Гепатоциты можно выделить из обычных здоровых доноров, выделенные клетки промывают (например, фосфатно-солевым буфером) и хранят в среде для замораживания. Гепатоциты можно культивировать в многолуночных планшетах. В различное время из культуры отбирают пробы, которые можно использовать для анализа либо супернатанта, либо клеток (Smith R. et al. (2003) Blood 102 (7):2532-2540. Стереоизомеры. Соединения согласно изобретению могут содержать хиральные центры, например хиральные атомы углерода или фосфора. Соответственно соединения согласно изобретению включают рацемические смеси всех стереоизомеров, включая энантиомеры, диастереоизомеры и атропоизомеры. Кроме того, соединения согласно изобретению включают обогащенные или разделенные оптические изомеры, соответствующие любым или всем асимметричным хиральным атомам. Другими словами, если на изображении присутствуют хиральные центры, данное соединение включает как хиральные изомеры, так и их рацемические смеси. Рацемические и диастереоизомерные смеси, а также выделенные или синтезированные отдельные оптические изомеры, по существу, не содержащие своих энантиомерных или диастереоизомерных антиподов, включены в объем настоящего изобретения. Рацемические смеси разделяют на отдельные, по существу, оптически чистые изомеры с использованием хорошо известных методик, таких как, например, разделение диастереоизомерных солей, образованных с оптически активными адъюнктами, например кислотами или основаниями, с последующим превращением в оптически активные вещества. В большинстве случаев желаемый оптический изомер синтезируют с использованием стереоспецифических реакций, в которых в качестве желаемого исходного вещества используют его подходящий стереоизомер. В некоторых случаях соединения согласно настоящему изобретению могут существовать также в виде таутомерных изомеров. Хотя может быть изображена только одна делокализованная резонансная структура, все такие формы включены в объем изобретения. Например, могут существовать ен-аминовые таутомеры пуриновой, пиримидиновой, имидазольной, гуанидиновой, амидиновой и тетразольной систем, и все их возможные таутомерные формы включены в объем изобретения. Соли и гидраты. Примеры физиологически приемлемых солей соединений согласно настоящему изобретению включают соли, образованные с подходящим основанием, таким как щелочной металл (например, натрий),щелочноземельный металл (например, магний), аммоний и NX4+ (где X представляет собой С 1-С 4 алкил). Физиологически приемлемые соли, образованные с участием атома водорода или аминогруппы, включают соли органических карбоновых кислот, таких как уксусная, бензойная, молочная, фумаровая, винная, малеиновая, малоновая, яблочная, изэтионовая, лактобионовая и янтарная кислоты; органических сульфоновых кислот, таких как метансульфоновая, этансульфоновая, бензолсульфоновая и паратолуолсульфоновая кислоты; и неорганических кислот, таких как соляная, серная, фосфорная и сульфаминовая кислоты. Физиологически приемлемые соли соединения с гидроксильной группой включают анион указанного соединения в комбинации с подходящим катионом, таким как Na+ и NX4+ (где X независимо выбран из Н или С 1-С 4 алкильной группы). Если речь идет о терапевтическом применении, соли соединений согласно настоящему изобретению, используемые в качестве активных ингредиентов, обычно являются физиологически приемлемыми,то есть представляют собой соли, образованные с физиологически приемлемой кислотой или основанием. Однако соли кислот или оснований, которые не являются физиологически приемлемыми, также могут найти применение, например, при получении или очистке физиологически приемлемого соединения. Все соли, независимо от того, происходят они или нет от физиологически приемлемой кислоты или основания, включены в объем настоящего изобретения. Соли металлов обычно получают в результате взаимодействия гидроксида металла с соединением согласно настоящему изобретению. Примерами солей металлов, которые получают таким образом, являются соли, содержащие Li+, Na+ и K+. Менее растворимые соли металлов можно осаждать из раствора более растворимой соли путем добавления подходящего металл-содержащего соединения. Кроме того, соли могут быть образованы путем присоединения кислоты (для этого могут быть использованы некоторые органические и неорганические кислоты, например HCl, HBr, H2SO4, H3PO4 или органические сульфоновые кислоты) к основным центрам, обычно аминам, или к кислотным группам. В заключение следует отметить, что композиции, приведенные в данном описании, включают соединения согласно настоящему изобретению в их неионизированной, а также в цвиттер-ионной форме, и их комбинации со стехиометрическим количеством воды, как в гидратах. В объем настоящего изобретения также включены соли исходных соединений с одной или более аминокислотой. Для этих целей подходят любые природные или неприродные аминокислоты, особенно встречающиеся в природе аминокислоты, найденные в белках. Данные аминокислоты обычно содержит боковую цепь с основной или кислотной группой, например лизин, аргинин или глутаминовая кислота,или с нейтральной группой, например глицин, серин, треонин, апанин, изолейцин или лейцин. Способы ингибирования ВГС. Соединения согласно настоящему изобретению можно использовать в качестве ингибиторов ВГС, в качестве промежуточных соединений при получении таких ингибиторов или иметь другое применение,как описано ниже. Данные ингибиторы обычно связываются с сайтами на поверхности или в полости печени. Соединения, связывающиеся в печени, могут отличаться степенью обратимости этого связывания. Многие организмы заражены ВГС. Соединения согласно настоящему изобретению являются полезными для лечения состояний, ассоциированных с активацией ВГС в организме животного или человека. Однако при скрининге соединений, способных ингибировать ВГС, необходимо иметь в виду, что данные ферментного анализа не всегда коррелируют с результатами анализа, выполненного на клеточной культуре. Соответственно в качестве инструмента первичного скрининга обычно следует применять клеточный анализ. Отбор ингибиторов ВГС. Скрининг соединений согласно настоящему изобретению на ингибирующую активность в отношении ВГС может быть выполнен с помощью любых стандартных методик оценки ферментной активности. В контексте данного изобретения обычно сначала проводят скрининг соединений на ингибирование ВГСin vitro и затем соединения, показывающие ингибирующую активность in vitro, используют в скрининге на ингибирующую активность in vivo. Для исследования in vivo используют соединения, имеющие invitro Ki (константы ингибирования) 510-6 М, обычно Ki 110-7 М и предпочтительно Ki 510-8 М. Полезные методики in vitro скрининга были подробно описаны ранее. Фармацевтические препараты. Соединения согласно настоящему изобретению готовят в виде препарата со стандартными носителями и эксципиентами, которые обычно выбирают в соответствии со сложившейся практикой. Таблетки обычно содержат эксципиенты, вещества, усиливающие скольжение, наполнители, связующие вещества и т.п. Водные препараты готовят в стерильной форме, обычно данные препараты являются изотоническими, если не предназначены для доставки путем перорального введения. Все препараты возможно содержат эксципиенты, такие как эксципиенты, описанные в Handbook of Pharmaceutical Excipients (1986). Эксципиенты включают аскорбиновую кислоту и другие антиоксиданты, хелатирующие агенты, такие как ЭДТА, углеводы, такие как декстрин, гидроксиалкилцеллюлоза, гидроксиалкилметилцеллюлоза, стеариновую кислоту и т.п. рН препаратов находится в диапазоне от приблизительно 3 до приблизительно 11, но обычно в диапазоне от приблизительно 7 до 10. Хотя активные ингредиенты можно вводить в чистом виде, предпочтительно, чтобы они были приготовлены в виде фармацевтических препаратов. Препараты для использования как в ветеринарии, так и в лечении человека согласно изобретению содержат по меньшей мере один активный ингредиент, такой как определено выше, совместно с одним или более приемлемым носителем и возможно другими тера-7 019749 певтическими ингредиентами. Носитель(и) должен(ны) быть "приемлемым(и)" в том смысле, что должен(ны) быть совместимым(и) с другими ингредиентами препарата и физиологически безвредным(и) для реципиента. Препараты согласно настоящему изобретению включают препараты, подходящие для путей введения, описанных ниже. Обычно препараты могут находиться в стандартной лекарственной форме и могут быть приготовлены с использованием методик, хорошо известных в области фармацевтики. Описание данных методик и препаратов можно найти в Remington's Pharmaceutical Sciences (Mack Publishing Co.,Easton, PA). Такие методики включают стадию смешивания активного ингредиента с носителем, который состоит из одного или более вспомогательного ингредиента. В общем случае препараты приготавливают путем перемешивания активного ингредиента с жидкими носителями, или тонкоизмельченными твердыми носителями, или с теми и другими, до однородного состояния и, при необходимости, последующего формования данного продукта. Препараты согласно настоящему изобретению, подходящие для перорального введения, могут находиться в форме дискретных единиц дозирования, таких как капсулы, крахмальные облатки или таблетки, каждая из которых содержит заданное количество активного ингредиента; в форме порошка или гранул; в форме раствора или суспензии в водной или неводной жидкости: или в форме жидкой эмульсии типа масло-в-воде, или жидкой эмульсии типа вода-в-масле. Активный ингредиент также может быть введен в форме болюса, электуария или пасты. Таблетка может быть приготовлена путем прессования или формования, возможно, с одним или более вспомогательным ингредиентом. Прессованные таблетки можно приготовить путем прессования в подходящем устройстве активного ингредиента в сыпучей форме, такой как порошок или гранулы, возможно смешанного со связующим веществом, смазывающим веществом, инертным разбавителем, консервантом, поверхностно активным или диспергирующим агентом. Формованные таблетки можно приготовить путем формования в подходящем устройстве смеси, содержащей порошкообразный активный ингредиент, увлажненной инертным жидким разбавителем. Таблетки могут быть покрыты оболочкой или иметь риску и могут быть приготовлены в виде препарата, с тем чтобы обеспечить замедленное или контролируемое высвобождение активного ингредиента. Для введения в глаза или другие внешние ткани, например в полость рта и кожу, предпочтительно использовать препараты в форме мази или крема для местного применения, содержащие активный(е) ингредиент(ы) в количестве, например, от 0,075 до 20% (мас./мас.) (включая количество активного(ых) ингредиента(ов) в диапазоне от 0,1 до 20% с инкрементом 0,1% (мас./мас.), например 0,6% (мас./мас.),0,7% (мас./мас.) и т.д.), предпочтительно от 0,2 до 15% (мас./мас.) и наиболее предпочтительно от 0,5 до 10% (мас./мас.). Когда активные ингредиенты приготовлены в форме мази, может быть использована парафиновая или смешивающаяся с водой мазевая основа. Альтернативно, активные ингредиенты можно приготовить в форме крема с кремовой основой типа масло-в-воде. При желании водная фаза кремовой основы может включать, например, по меньшей мере 30%(мас./мас.) многоатомного спирта, то есть спирта, содержащего две или более гидроксильных группы,такого как пропиленгликоль, бутан 1,3-диол, маннит, сорбит, глицерин и полиэтиленгликоль (включая ПЭГ 400) и их смеси. Может оказаться желательным, чтобы препараты для местного введения включали соединение, которые улучшает абсорбцию или проникновение активного ингредиента через кожу или другие пораженные зоны. Примеры агентов, способствующих проникновению через кожу, включают диметилсульфоксид и соответствующие аналоги. Масляная фаза эмульсий согласно настоящему изобретению может состоять, в известной степени,из известных ингредиентов. Несмотря на то что данная фаза может содержать только эмульгатор (также известный как эмульгирующий агент), желательно, чтобы она содержала смесь по меньшей мере одного эмульгатора с жиром, или маслом, или с жиром и маслом. Предпочтительно масляная фаза содержит гидрофильный эмульгатор совместно с липофильным эмульгатором, который действует в качестве стабилизатора. Также предпочтительно, когда масляная фаза содержит как масло, так и жир. Эмульгатор(ы),совместно со стабилизатором(ами) или без него, дают так называемый эмульгирующий воск, смесь данного воска с маслом и жиром образует так называемую эмульгирующую мазевую основу, которая формирует масляную дисперсную фазу кремовых препаратов. Эмульгаторы и стабилизаторы эмульсии, подходящие для использования в препарате согласно изобретению, включают Твин 60, Span 80, цетостеариловый спирт, бензиловый спирт, миристиловый спирт, глицерилмоностеарат и лаурилсульфат натрия. Выбор подходящих масел или жиров, используемых в препарате, основан на том, какие желаемые косметические свойства нужно получить. Предпочтительно крем должен представлять собой нежирный,не оставляющий пятен и смывающийся продукт подходящей консистенции, которая не допускает его вытекания из тубы или других контейнеров. Можно использовать одно- или двухосновные сложные алкиловые эфиры с нормальной или разветвленной цепью, такие как диизоадипат, изоцетилстеарат, пропиленгликолевый диэфир жирных кислот кокосового масла, изопропилмиристат, децилолеат, изопропилпальмитат, бутилстеарат, 2-этилгексилпальмитат или смесь сложных эфиров с разветвленной цепью, известная как Crodamol CAP, последние три эфира являются предпочтительными. Данные эфиры можно применять по одному или в комбинации, в зависимости от требуемых свойств. В качестве альтернативы используют липиды с высокой температурой плавления, такие как белый мягкий парафин и/или вазелиновое масло или другие минеральные масла. Фармацевтические препараты согласно настоящему изобретению включают одно или более соединение согласно настоящему изобретению совместно с одним или более фармацевтически приемлемым носителем или эксципиентом и возможно другими терапевтическими агентами. Фармацевтические препараты, содержащие указанный активный ингредиент, могут находиться в любой форме, подходящей для предполагаемого пути введения. Для перорального использования можно приготовить, например,таблетки, пастилки, лепешки, водные или масляные суспензии, диспергируемые порошки или гранулы,эмульсии, твердые или мягкие капсулы, сиропы или эликсиры. Композиции, предназначенные для перорального использования, могут быть приготовлены в соответствии с любой методикой приготовления фармацевтических композиций, известной в данной области техники; для получения препарата с приятным вкусом такие композиции могут содержать один или более агентов, включающих подслащивающие агенты, корригенты, окрашивающие агенты и консерванты. Таблетки могут содержать активный ингредиент в смеси с нетоксичным фармацевтически приемлемым эксципиентом, подходящим для изготовления таблеток. Такими эксципиентами могут быть, например, инертные разбавители, такие как карбонат кальция или натрия, лактоза, моногидрат лактозы, натрий-кроскармелоза, повидон, фосфат кальция или натрия; гранулирующие агенты и разрыхлители, так как кукурузный крахмал или альгиновая кислота; связующие агенты, такие как целлюлоза, микрокристаллическая целлюлоза, крахмал, желатин или гуммиарабик; и смазывающие агенты, такие как стеарат магния, стеариновая кислота или тальк. Таблетки могут не иметь оболочки или могут быть покрыты оболочкой с использованием известных методик,включая микрокапсулирование, с целью замедления дезинтеграции и адсорбции в желудочно-кишечном тракте, что позволяет обеспечить пролонгированное действие на протяжении длительного перйода. Например, может быть использовано такое замедляющее вещество, как глицерилмоностеарат или глицерилдистеарат, сам по себе или с воском. Препараты для перорального использования могут находиться также в форме твердых желатиновых капсул, в которых активный ингредиент смешан с инертным твердым разбавителем, например фосфатом кальция или каолином, или в форме мягких желатиновых капсул, где активный ингредиент смешан с водной или масляной средой, такой как арахисовое масло, вазелиновое масло или оливковое масло. Водные суспензии согласно настоящему изобретению содержат активные вещества в смеси с эксципиентами, подходящими для изготовления водных суспензий. Такие эксципиенты включают суспендирующий агент, такой как натрий-карбоксиметилцеллюлоза, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, трагакантовая камедь и гуммиарабик, и диспергирующие или увлажняющие агенты, такие как природный фосфатид (например, лецитин), продукт конденсации алкиленоксида с жирной кислотой (например, полиоксиэтиленстеарат), продукт конденсации этиленоксида с длинноцепочечным алифатическим спиртом (например, гептадекаэтиленоксицетанол),продукт конденсации этиленоксида с неполным эфиром, образованным жирной кислотой и ангидридом гексита (например, полиоксиэтиленсорбитанмоноолеат). Водная суспензия также может содержать один или более консервант, такой как этил или н-пропил парагидроксибензоат, один или более окрашивающий агент, один или более корригент и один или более подслащивающий агент, такой как сахароза или сахарин. Масляные суспензии можно приготовить в виде препарата путем суспендирования активного ингредиента в растительном масле, таком как арахисовое масло, оливковое масло, кунжутное масло или кокосовое масло, или в минеральном масле, таком как вазелиновое масло. Пероральные суспензии могут содержать загуститель, такой как пчелиный воск, твердый парафин или цетиловый спирт. Для получения перорального препарата с приятным вкусом можно добавлять подслащивающие агенты, такие как указано выше, и корригенты. В данные композиции в качестве консерванта может быть добавлен антиоксидант, такой как аскорбиновая кислота. Диспергируемые порошки и гранулы согласно настоящему изобретению, подходящие для приготовления водной суспензии путем добавления воды, позволяют получить активный ингредиент в смеси с диспергирующим или увлажняющим агентом, суспендирующим агентом и одним или более консервантом. Примеры подходящих диспергирующих или увлажняющих агентов и суспендирующих агентов приведены выше. В водной суспензии также могут присутствовать дополнительные эксципиенты, например подслащивающие агенты, корригенты и окрашивающие агенты. Фармацевтические композиции согласно настоящему изобретению также могут находиться в форме эмульсий типа масло-в-воде. Масляная фаза может представлять собой растительное масло, такое как оливковое масло или арахисовое масло, минеральное масло, такое как вазелиновое масло, или смесь этих масел. Подходящие эмульгирующие агенты включают природные камеди, такие как гуммиарабик и трагакант, природные фосфатиды, такие как соевый лецитин, эфиры или неполные эфиры, образованные жирными кислотами и ангидридами гексита, такие как сорбитанмоноолеат, и продукты конденсации указанных неполных эфиров с этиленоксидом, такие как полиоксиэтиленсорбитанмоноолеат. Эмульсия также может содержать подслащивающие агенты и корригенты. Сиропы и эликсиры можно приготовить в виде препарата с подслащивающими агентами, такими как глицерин, сорбит или сахароза. Такие препараты также могут содержать агент, уменьшающий раздражение, консервант, корригент или окрашивающий агент. Фармацевтические композиции согласно изобретению могут находиться в форме стерильного инъекционного препарата, такого как стерильная инъекционная водная или масляная суспензия. Данная суспензия может быть приготовлена в виде препарата в соответствии с известными в данной области техники методиками с использованием подходящих диспергирующих или увлажняющих агентов и суспендирующих агентов, указанных выше. Стерильный инъекционный препарат также может представлять собой стерильный инъекционный раствор или суспензию в нетоксичном и приемлемом для парентерального введения разбавителе или растворителе, например раствор в 1,3-бутандиоле, или может быть приготовлен в форме лиофилизированного порошка. Примерами приемлемых носителей и растворителей, которые можно использовать, являются вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды обычно можно использовать стерильные нелетучие масла. Для этой цели может быть использовано любое безвкусное нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, для приготовления инъекционных препаратов могут быть использованы жирные кислоты, такие как олеиновая кислота. Количество активного ингредиента, который может быть смешан с веществом носителя при приготовлении лекарственной формы для однократного введения, обычно варьирует в зависимости от объекта,который лечат, и от конкретного способа введения. Например, препарат с пролонгированным действием,предназначенный для перорального введения человеку, может содержать приблизительно от 1 до 1000 мг активного вещества в смеси с подходящим и приемлемым количеством носителя, которое может составлять от приблизительно 5 до приблизительно 95% (мас./мас.) от общей массы композиции. Фармацевтическая композиция может быть приготовлена таким образом, чтобы вводимое количество препарата легко поддавалось измерению. Например, водный раствор, предназначенный для внутривенной инфузии, может содержать от приблизительно 3 до 500 мкг активного ингредиента на 1 мл раствора, чтобы инфузию подходящего объема препарата можно было проводить со скоростью приблизительно 30 мл/ч. Препараты, подходящие для введения в глаза, включают глазные капли, где активный ингредиент растворен или суспендирован в подходящем носителе, главным образом в водном растворителе для активного ингредиента. В таких препаратах концентрация активного ингредиента составляет предпочтительно 0,5-20%, преимущественно 0,5-10%, в основном приблизительно 1,5% (мас./мас.). Препараты, подходящие для местного введения в полость рта, включают таблетки, содержащие активный ингредиент в ароматизированной основе, обычно в сахарозе и гуммиарабике или в трагаканте; пастилки, содержащие активный ингредиент в инертной основе, такой как желатин и глицерин, или в сахарозе и гуммиарабике; и жидкости для полоскания рта, содержащие активный ингредиент в подходящем жидком носителе. Препараты для ректального введения могут находиться в форме суппозитория с подходящей основой, содержащей, например, масло какао или салицилат. Препараты, подходящие для внутрилегочного или назального введения, содержат частицы, имеющие размер в диапазоне, например, от 0,1 до 500 мкм (включая частицы, имеющие размер в диапазоне от 0,1 до 500 мкм с инкрементом 0,5 мкм, например частицы размером 0,5, 1, 30, 35 мкм и т.д.), которые вводят путем быстрой ингаляции через носовой ход или путем ингаляции через полость рта, так чтобы они достигли альвеолярных мешочков. Подходящие препараты включают водные или масляные растворы активного ингредиента. Препараты, подходящие для аэрозольного введения или введения в форме сухого порошка, можно приготовить в соответствии со стандартными методиками и можно вводить совместно с другими терапевтическими агентами, например с соединениями, уже используемыми в лечении или профилактике состояний, ассоциированных с ВГС-активностью. Препараты, подходящие для вагинального введения, могут находиться в форме пессариев, тампонов, кремов, гелей, паст, пен или спрея, содержащих наряду с активным ингредиентом подходящие для таких препаратов носители, известные в данной области техники. Препараты, подходящие для парентерального введения, включают водные и неводные стерильные инъекционные растворы, которые могут содержать антиоксиданты, буферные агенты, бактериостатические вещества и растворенные вещества, которые делают препарат изотоническим с кровью предполагаемого реципиента; и водные и неводные стерильные суспензии, которые могут содержать суспендирующие агенты и загустители. Данные препараты находятся в упаковках для одноразового или многократного приема, например в герметично закрытых ампулах и пробирках, и могут храниться в лиофилизированном состоянии (после сублимационной сушки), требующем непосредственно перед использованием добавления стерильного жидкого носителя, например воды для инъекции. Экстемпоральные инъекционные растворы и суспензии получают из стерильных порошков, гранул и таблеток, описанных выше. Предпочтительные препараты в стандартной лекарственной форме представляют собой препараты, содержащие суточную дозу или суточную субдозу активного ингредиента, такую как указано выше, или подходящую часть таких доз. Следует понимать, что кроме ингредиентов, упомянутых выше, препараты согласно настоящему изобретению могут содержать другие агенты, обычно используемые в данной области техники, которые пригодны для данного препарата, например агенты, подходящие для перорального введения, могут включать корригенты. Настоящее изобретение дополнительно обеспечивает ветеринарные композиции, содержащие по меньшей мере один активный ингредиент, такой как определено выше, совместно с носителем для ветеринарных препаратов. Носители для ветеринарных препаратов представляют собой вещества, полезные для введения ветеринарной композиции, совместимые с активным ингредиентом и в других отношениях являющиеся нейтральными или приемлемыми для использования в ветеринарии; данные носители могут быть твердыми, жидкими или газообразными веществами. Ветеринарные композиции можно вводить пероральным, парентеральным или любым другим желательным путем. Соединения согласно настоящему изобретению также можно приготовить в виде препарата с контролируемым высвобождением активного ингредиента, что позволяет реже вводить лекарство или улучшает фармакокинетический или токсический профиль активного ингредиента. Соответственно в изобретении также предложены композиции, содержащие одно или более соединений согласно настоящему изобретению, приготовленные в виде препарата с замедленным или контролируемым высвобождением. Эффективная доза активного ингредиента зависит, по меньшей мере, от природы состояния, которое лечат, токсичности, от того, будет ли соединение использовано для профилактики (более низкие дозы), от способа доставки и фармацевтического препарата и обычно определяется лечащим врачом на основе стандартных исследований с увеличением дозы. Можно предположить, что эффективная доза будет находиться в диапазоне от приблизительно 0,0001 до приблизительно 100 мг/кг массы тела в сутки. Обычно от приблизительно 0,01 до приблизительно 10 мг/кг массы тела в сутки. В основном от приблизительно 0,01 до приблизительно 5 мг/кг массы тела в сутки. Чаще всего от приблизительно 0,05 до приблизительно 0,5 мг/кг массы тела в сутки. Например, возможная суточная доза для взрослого человека с массой тела приблизительно 70 кг будет находиться в диапазоне от 1 до 1000 мг, предпочтительно в диапазоне от 5 до 500 мг, и может быть введена в форме однократных или многократных доз. Пути введения. Одно или более соединение согласно изобретению (в данном описании называемое активным ингредиентом) вводят любым путем, подходящим для состояния, которое лечат. Подходящие пути введения включают пероральный, ректальный, назальный, местный (включая трансбуккальный и сублингвальный), вагинальный и парентеральный (включая подкожный, внутримышечный, внутривенный, интрадермальный, интратекальный и эпидуральный) и т.п. Следует понимать, что предпочтительный путь введения зависит, например, от состояния реципиента. Преимущество соединений согласно настоящему изобретению заключается в том, что они являются перорально бйодоступными и могут быть введены пероральным путем. Комбинированная терапия. Активные ингредиенты согласно изобретению также можно применять в комбинации с другими активными ингредиентами. При подборе таких комбинаций учитывают состояния, для лечения которых они предназначены, перекрестную реактивность ингредиентов и фармакологические свойства комбинации. Кроме того, любое соединение согласно настоящему изобретению можно комбинировать с одним или более другим активным ингредиентом в стандартной лекарственной форме для одновременного или последовательного введения пациенту. Схемы комбинированной терапии включают как одновременный,так и последовательный режим введения. При последовательном введении комбинация может быть введена путем двух или более введений. Комбинированная терапия может обеспечить "синергизм" и "синергетический эффект", данные термины означают, что эффект, получаемый при совместном использовании активных ингредиентов больше суммы эффектов при использовании каждого из соединений по отдельности. Синергетический эффект может быть достигнут, когда активные ингредиенты (1) приготовлены совместно в виде одного препарата и их вводят или доставляют одновременно в виде комбинированного препарата, (2) доставляются поочередно или одновременно в виде отдельных препаратов или (3) доставляют с использованием некоторых других режимов. При терапии с доставкой лекарственного средства по схеме чередования синергетический эффект может быть достигнут в том случае, когда соединения вводят или доставляют последовательно, например в отдельных таблетках, пилюлях или капсулах либо путем инъекций с использованием разных шприцов. В общем случае, при терапии с доставкой лекарственного средства по схеме чередования эффективные дозы активных ингредиентов вводят последовательно, то друг за другом, тогда как при комбинированной терапии эффективные дозы двух или более активных ингредиентов вводят совместно. Подходящие активные терапевтические агенты или ингредиенты, которые можно комбинировать с соединениями формулы (I), могут включать интерфероны, например пегилированный rlFN-alpha 2b, пегилированный rlFN-alpha 2 а, rlFN-alpha 2b, IFN alpha-2b XL, rlFN-alpha 2a, консенсусный IFN alpha, инферген (infergen), ребиф, локтерон (locteron), AVI-005, ПЭГ-инферген, пегилированный IFN-beta, перо- 11019749NS5a, например А-831 и А-689; ингибиторы полимеразы NS5b, например NM-283, валопицитабин,R1626, PSI-6130 (R1656), HCV-796, BILB 1941, MK-0608, NM-107, R7128, VCH-759, PF-868554,GSK625433 и XTL-2125; ингибиторы NS3-протеазы, например SCH-503034 (SCH-7), VX-950 (Телапревир), ITMN-191 и BILN-2065; ингибиторы альфа-глюкозидазы 1, например МХ-3253 (селгозивир (celgosivir и UT-231 В; гепатозащитные агенты, например IDN-6556, ME 3738, MitoQ и LB-84451; отличные от нуклеозидов ингибиторы ВГС, например бензимидазольные производные, бензо-1,2,4-тиадиазиновые производные и фенилаланиновые производные; и другие лекарства для лечения ВГС, например задаксин,нитазоксанид (alinea), BIVN-401 (виростат (virostat, DEBIO-025, VGX-410C, EMZ-702, AVI 4065, бавитуксимаб, оглуфанид, PYN-17, KPE02003002, актилон (actilon) (CPG-10101), KRN-7000, civacir, Gl-5005,ANA-975 (изаторибин), XTL-6865, ANA 971, NOV-205, тарвацин (тарвацин), ЕНС-18 и NIM811. Согласно еще одному варианту реализации настоящего изобретения в данном изобретении раскрыты фармацевтические композиции, содержащие соединение согласно настоящему изобретению или его фармацевтически приемлемую соль, в комбинации по меньшей мере с одним дополнительным терапевтическим агентом и фармацевтически приемлемый носитель или эксципиент. Согласно настоящему изобретению в комбинации с соединением согласно настоящему изобретению может быть использован любой терапевтический агент, оказывающий терапевтическое действие при использовании в комбинации с соединением согласно настоящему изобретению. Например, терапевтические агенты, используемые в комбинации с соединением согласно настоящему изобретению, могут представлять собой интерфероны, аналоги рибавирина, ингибиторы NS3-протеазы, ингибиторы полимеразы NS5b, ингибиторы альфа-глюкозидазы 1, гепатозащитные агенты, ненуклеозидные ингибиторы ВГС и другие лекарства для лечения ВГС. Согласно другому варианту реализации настоящего изобретения в данном изобретении предложены фармацевтические композиции, которые содержат соединение согласно настоящему изобретению или его фармацевтически приемлемую соль, в комбинации по меньшей мере с одним дополнительным терапевтическим агентом, выбранным из группы, состоящей из пегилированного интерферона rlFN-alpha 2b, пегилированного интерферона rlFN-alpha 2 а, rlFN-alpha 2b, IFN alpha-2b XL, rlFN-alpha 2a, консенсусного интерферона IFN alpha, инфергена, ребифа, локтерона, AVI-005, ПЭГ-инфергена, пегилированного IFN-beta, перорального интерферона альфа, ферона, реаферона, интермакса альфа, r-IFN-beta, инфергена+актиммуна, IFN-omega с DUROS, альбуферона, ребетола, копегуса, левовирина, VX-497, вирамидина (тарибавирина), А-831, А-689, NM-283, валопицитабина, R1626, PSI-6130 (R1656), ВГС-796,BILB 1941, MK-0608, NM-107, R7128, VCH-759, PF-868554, GSK625433, XTL-2125, SCH-503034 (SCH7), VX-950 (Телапревира), ITMN-191 и BILN-2065, МХ-3253 (селгозивира), UT-231B, IDN-6556, ME 3738, MitoQ и LB-84451, бензимидазольных производных, бензо-1,2,4-тиадиазиновых производных и фенилаланиновых производных, задаксина, нитазоксанида (alinea), BIVN-401 (виростата), DEBIO-025,VGX-410C, EMZ-702, AVI 4065, бавитуксимаба, оглуфанида, PYN-17, KPE02003002, актилона (CPG10101), KRN-7000, civacir, Gl-5005, ANA-975 (изаторибина), XTL-6865, ANA 971, NOV-205, тарвацина,ЕНС-18 и NIM811, и фармацевтически приемлемый носитель или эксципиент. Согласно еще одному варианту реализации настоящего изобретения в данном изобретении предложен комбинированный фармацевтический агент, содержащий: а) первую фармацевтическую композицию, содержащую соединение согласно настоящему изобретению или фармацевтически приемлемую соль указанного соединения; б) вторую фармацевтическую композицию, содержащую по меньшей мере один дополнительный терапевтический агент, выбранный из группы, состоящей из соединений, ингибирующих протеазу ВИЧ(вируса иммунодефицита человека), ненуклеозидных ингибиторов обратной транскриптазы ВИЧ, нуклеозидных ингибиторов обратной транскриптазы ВИЧ, нуклеотидных ингибиторов обратной транскриптазы ВИЧ, ингибиторов интегразы ВИЧ, ингибиторов gp41, ингибиторов CXCR4 (рецептора 4 хемокинов СХС), ингибиторов gp120, ингибиторов CCR5 (рецептора 5 хемокинов С-С типа), интерферонов, аналогов рибавирина, ингибиторов NS3-протезы, ингибиторов альфа-глюкозидазы 1, гепатозащитных агентов,ненуклеозидных ингибиторов ВГС и других лекарств для лечения ВГС и их комбинаций. Могут быть подобраны комбинации соединений формулы I и дополнительных активных терапевтических агентов для лечения пациентов, инфицированных ВГС и другими инфекциями, такими как ВИЧ-инфекция. Соответственно соединения формулы (I) можно комбинировать с одним или более соединением, полезным в лечении ВИЧ, например с соединениями, ингибирующими протеазу ВИЧ, отличными от нуклеозидов ингибиторами обратной транскриптазы ВИЧ, нуклеозидными ингибиторами обратной транскриптазы ВИЧ, нуклеотидными ингибиторами обратной транскриптазы ВИЧ, ингибиторами интегразы ВИЧ, ингибиторами gp41, ингибиторами CXCR4, ингибиторами gp120, ингибиторами CCR5,интерферонами, аналогами рибавирина, ингибиторами NS3-протеазы, ингибиторами полимеразы NS5b,ингибиторами альфа-глюкозидазы 1, гепатозащитными агентами, ненуклеозидными ингибиторами ВГС и другими лекарствами для лечения ВГС. Более конкретно, одно или более соединение согласно настоящему изобретению можно комбинировать с одним или более соединением, выбранным из группы, состоящей из 1) ингибиторов протеазы ВИЧ, например ампренавира, атазанавира, фосампренавира, индинавира, лопинавира, ритонавира, лопинавира+ритонавира, нелфинавира, саквинавира, типранавира, бреканавира, дарунавира, ТМС-126, ТМС 114, мозенавира (DMP-450), JE-2147 (AG1776), AG1859, DG35, L-756423, RO0334649, KNI-272, DPC681, DPC-684 и GW640385X, DG17, PPL-100, 2) ненуклеозидного ингибитора обратной транскриптазы ВИЧ, например каправирина, эмивирина, делавиридина (delaviridine), эфавиренза, невирапина, (+) каланолида А, этравирина, GW5634, DPC-083, DPC-961, DPC-963, MIV-150 и ТМС-120, ТМС-278 (рилпивирина), эфавиренза, BILR 355 BS, VRX 840773, UK-453,061, RDEA806, 3) нуклеозидного ингибитора обратной транскриптазы ВИЧ, например зидовудина, эмтрицитабина, диданозина, ставудина, зальцитабина, ламивудина, абакавира, амдоксовира, элвуцитабина, аловудина, MIV-210, рацивира (-FTC), D-d4FC,эмтрицитабина, фосфазида, фозивудина тидоксила (fozivudine tidoxil), фосалвудина тидоксила, априцитибина(AVX754),амдоксовира,KP-1461,абакавира+ламивудина,абакавира+ламивудина+зидовудина, зидовудина+ламивудина, 4) нуклеотидного ингибитора обратной транскриптазы ВИЧ, например тенофовира, тенофовира дизопроксил фумарата+эмтрицитабина, тенофовира дизопроксил фумарата+эмтрицитабина+эфавиренза и адефовира (adefovir), 5) ингибитора интегразы ВИЧ, например куркумина, производных куркумина, цикориевой кислоты, производных цикориевой кислоты, 3,5-дикофеил-хинной кислоты, производных 3,5-дикофеил-хинной кислоты, ауринтрикарбоновой кислоты, производных ауринтрикарбоновой кислоты, кофеиновой кислоты фенетилового эфира,производных кофеиновой кислоты фенетилового эфира, тирфостина, производных тирфостина, кверцетина, производных кверцетина, S-1360, зинтевира (zintevir) (AR-177), L-870812 и L-870810, MK-0518IDN-6556, ME 3738, MitoQ и LB-84451, 18) ненуклеозидных ингибиторов ВГС, например бензимидазольных производных, бензо-1,2,4-тиадиазиновых производных и фенилаланиновых производных, 19) других лекарств для лечения ВГС, например задаксина, нитазоксанида (alinea), BIVN-401 (виростата),DEBIO-025, VGX-410C, EMZ-702, AVI 4065, бавитуксимаба, оглуфанида, PYN-17, KPE02003002, актилона (CPG-10101), KRN-7000, civacir, Gl-5005, ANA-975 (изаторибина), XTL-6865, ANA 971, NOV-205,тарвацина, ЕНС-18 и NIM811, 19) фармакокинетических усилителей, например BAS-100 и SPI452, 20) ингибиторов РНКазы Н, например ODN-93 и ODN-112, 21) других агентов, обладающих активностью в отношении ВИЧ, например VGV-1, РА-457 (бевиримата), амплигена (ampligen), HRG214, цитолина (cytolin), полимуна (polymun), VGX-410, KD247, AMZ 0026, CYT 99007, А-221 HIV, BAY 50-4798, MDX010(иплимумаба (iplimumab, PBS119, ALG889 и РА-1050040. Метаболиты соединений согласно настоящему изобретению. В объем настоящего изобретения также входят продукты метаболического распада in vivo соединений, приведенных в данном описании. Такие продукты могут образовываться в результате, например,окисления, восстановления, гидролиза, амидирования, этерификации и т.д. введенного соединения, главным образом, вследствие ферментативных реакций. Соответственно изобретение включает соединения,полученные способом, который включает осуществление контакта соединения согласно настоящему изобретению с млекопитающим в течение перйода времени, достаточного для образования продукта метаболического превращения. Для идентификации таких продуктов обычно используют соединение согласно настоящему изобретению, меченное радиоактивным изотопом (например, С 14 или Н 3); обнаруживаемую дозу (например, приблизительно более 0,5 мг/кг) меченого соединения вводят парентеральным путем животному, такому как крыса, мышь, морская свинка, обезьяна, или человеку, и после осуществления контакта соединения с реципиентом в течение времени, достаточного для метаболического распада (обычно от приблизительно 30 с до 30 ч), выделяют продукты его превращения из мочи, крови или других биологических образцов. Данные продукты могут быть легко выделены, так как они содержат метку (немеченые продукты выделяют с использованием антител, способных связываться с эпитопами,сохранившимися после метаболического превращения). Структуры выделенных метаболитов определя- 13019749 ют с использованием стандартного анализа, например путем МС или ЯМР. Обычно анализ метаболитов выполняют таким же путем, как в стандартных исследованиях метаболизма лекарств, соответствующие методики хорошо известны специалистам в данной области техники. Продукты превращения, поскольку они не обнаруживаются in vivo, если реципиент не получал соединение, являются полезными в диагностических исследованиях для определения терапевтических доз соединений согласно настоящему изобретению, даже если эти продукты сами по себе не обладают никакой ингибирующей активностью в отношении ВГС. Методики определения стабильности соединений в секретах суррогатного желудочно-кишечного тракта известны. В контексте данного описания соединения считаются стабильными в желудочнокишечном тракте, если у них удалено приблизительно менее 50 мол.% защитных групп после инкубации в течение 1 ч при 37 С в суррогатном кишечном или желудочном соке. Тот факт, что соединения остаются стабильными в желудочно-кишечном тракте, еще не означает, что они не могут быть гидролизированы in vivo. Типичные способы получения соединений согласно настоящему изобретению Изобретение также относится к способам получения композиций согласно изобретению. Данные композиции получают с использованием любой пригодной методики органического синтеза. Многие из таких методик хорошо известны в данной области техники. Однако многие из известных методик дополнительно усовершенствованы, см. Compendium of Organic Synthetic Methods (John WileySons, NewOrganic Chemistry. In 9 Volumes, Barry M. Trost, Editor-in-Chief (Pergamon Press, New York, 1993 printing). Другие методики, подходящие для получения соединений согласно настоящему изобретению, описаны в публикации международной заявкиWO 2006/020276. Ниже предложен ряд типичных способов получения композиций согласно настоящему изобретению. Подразумевается, что предложенные способы иллюстрируют сущность получения указанных композиций и не ограничивают объем способов получения, которые можно использовать. Обычно условия реакции, такие как температура, время проведения реакции, растворители, методики выделения и т.п., представляют собой стандартные условия реакции, которые используют в данной области техники для выполнения конкретных реакций. Подробное описание таких условий содержится в цитированном ссылочном материале и материале, приведенном в данном изобретении. Обычно температура находится в диапазоне от -100 до 200 С, растворители являются апротонными или протонными и время выполнения реакции находится в диапазоне от 10 с до 10 суток. Выделение продукта обычно подразумевает гашение любого непрореагировавшего реагента и последующее распределение реакционной смеси между водным и органическим слоями (экстракцию) и отделение слоя, содержащего желаемый продукт. Реакции окисления и восстановления обычно проводят при температуре, близкой к комнатной температуре (приблизительно 20 С), хотя при восстановлении гидридами металлов температуру часто понижают до 0 - -100 С, для восстановления обычно используют апротонные растворители, для окисления можно использовать либо протонные, либо апротонные растворители. Время выполнения реакции подбирают таким образом, чтобы осуществить желаемое превращение. Реакции конденсации обычно проводят при температуре, близкой к комнатной температуре, хотя в случае неравновесных, кинетически контролируемых реакций конденсации температуру также часто понижают (0 - -100 С). Растворители могут быть либо протонными (обычно в случае равновесных реакций) или апротонными (обычно в случае кинетически контролируемых реакций). Когда это необходимо, можно применять такие стандартные методики синтеза, как азеотропное удаление побочных продуктов реакции и использование безводных условий реакции (например, атмосферы инертного газа). Термины "обработанный", "обрабатывать", "обработка" и т.п. применительно к химическому синтезу употребляются в значении "контактировать/осуществлять контакт", "смешивать", "взаимодействовать", "подвергать взаимодействию", "приводить в соприкосновение" и т.п., и обычно используются в данной области техники, когда необходимо указать, что одно или более химическое вещество обрабатывают таким образом, чтобы его превратить в одно или более другое химическое вещество. Это означает,что выражение "соединение один обрабатывают соединением два" синонимично выражениям "соединение один подвергают взаимодействию с соединением два", "соединение один контактирует с соединением два", "соединение один взаимодействует с соединением два" и другим выражениям, обычно используемым в области органического синтеза, когда необходимо указать, что соединение один "обрабатывают" соединением два, соединение один "взаимодействует" с соединением два или соединение один "подвергают взаимодействию" с соединением два и т.д. Например, термин "обработка" указывает приемлемый стандартный способ, каким органические химические соединения подвергают взаимодействию. Подразумевается, что реакцию выполняют с использованием стандартных концентраций (от 0,01 до 10 М, обычно от 0,1 до 1 М), температур (от -100 до 250 С, обычно от -78 до 150 С, чаще от -78 до 100 С преимущественно от 0 до 100 С), реакционных сосудов (обычно стеклянных, пластмассовых, металлических), растворителей, давления, газообразной среды (обычно воздуха для реакций, нечувствительных к присутствию кислорода и воды, или азота или аргона для реакций, чувствительных к присутствию кислорода и воды) и т.д., если не указано иное. Выбор условий и устройств, которые необходимо использовать для "обработки" в соответствии с конкретной методикой, основан на знании аналогичных реакций в области органического синтеза. В частности, средний специалист в области органического синтеза на основе знаний в данной области техники может выбрать условия и устройства, предположительно необходимые для успешного осуществления химических реакций описанных здесь методик. Модификации каждой из типичных схем и схем, описанных в примерах (в дальнейшем "типичных схем"), позволяют получить различные аналоги конкретныхтипичных соединений. Подходящие методики органического синтеза, описанные выше посредством ссылки на соответствующие публикации, пригодны для такой модификации. В каждой из типичных схем бывает полезно разделить полученные продукты реакции и/или разделить продукты реакции и исходные вещества. Желаемые продукты на каждой стадии или после нескольких стадий разделяют и/или очищают (в дальнейшем разделяют) до желаемой степени гомогенности с помощью методик, которые обычно используют для этих целей в данной области техники. Обычно такое разделение включает мультифазную экстракцию, кристаллизацию из растворителя или смеси растворителей, дистилляцию, сублимацию или хроматографию. Хроматография может включать любой набор методик, в том числе, например, методики и соответствующее оборудование для обратнофазовой и нормальнофазовой хроматографии; гель-фильтрации; ионообменной хроматографии; жидкостной хроматографии высокого, среднего и низкого давления; методики аналитической хроматографии для маломасштабного разделения, хроматографии в псевдоподвижном слое (SMB) и препаративной тонкослойной или толстослойной хроматографии, а также методики тонкослойной хроматографии для маломасштабного разделения и флэш-хроматографии. Другая группа методик разделения включает обработку смеси реагентом, который может избирательно связываться с желаемым продуктом, непрореагировавшим исходным веществом, побочным продуктом реакции и т.п. или обеспечивать выделение желаемого продукта другим образом. Такие реагенты включают адсорбенты или абсорбенты, такие как активированный уголь, молекулярные сита, ионообменные среды и т.п. Альтернативно, данные реагенты могут представлять собой кислоты, в случае основного соединения, основания в случае кислотного соединения, связующие реагенты, такие как антитела, связывающие белки, селективные хелатирующие агенты, такие как краун-эфиры, реагенты для жидкостной экстракции ионов (LIX) и т.п. Выбор подходящих методик разделения зависит от природы присутствующих в реакционной смеси веществ. Например, от температуры кипения и молекулярной массы при разделении путем дистилляции и сублимации, наличия или отсутствия полярных функциональных групп при разделении путем хроматографии, стабильности веществ в кислой и щелочной среде при мультифазовой экстракции и т.п. Специалист в данной области техники обычно использует методики, наиболее подходящие для достижения желаемого разделения. Отдельный стереоизомер, например энантиомер, по существу, не содержащий своего стереоизомерного антипода, может быть получен путем разделения рацемической смеси с помощью такой методики, как получение диастереоизомеров с использованием агентов для оптического расщепления (Stereochemistry of Carbon Compounds (1962) E.L. Eliel, McGraw Hill; Lochmuller, C.H., (1975) J. Chromatogr.,113, 3) 283-302). Рацемические смеси хиральных соединений согласно изобретению можно разделить с выделением отдельных стереоизомеров с помощью любой подходящей методики, включая (1) образование ионных диастереоизомерных солей с хиральными соединениями и их разделение путем фракционной кристаллизации или с использованием других методик, (2) получение диастереоизомерных соединений с использованием хиральных разделяющих реагентов, разделение данных диастереоизомеров и их превращение в чистые стереоизомеры и (3) разделение, по существу, чистых или обогащенных стереоизомеров непосредственно в хиральных условиях. В соответствии с методикой (1) диастереоизомерные соли могут быть получены путем взаимодействия энантиомерно чистых хиральных оснований, таких как бруцин, хинин, эфедрин, стрихнин, метилфенилэтиламин (амфетамин) и т.п., с асимметрическими соединениями, содержащими кислотную функциональную группу, такими как карбоновая кислота и сульфоновая кислота. Полученные диастереоизомерные соли можно разделять путем фракционной кристаллизации или ионной хроматографии. Если необходимо разделить оптические изомеры аминосоединений, диастереоизомерные соли могут быть получены путем добавления хиральных карбоновых или сульфоновых кислот, таких как камфорсульфоновая кислота, винная кислота, миндальная кислота или молочная кислота. Альтернативно, в соответствии с методикой (2) субстрат, который требуется разделить, подвергают взаимодействию с одним энантиомером хирального соединения с получением диастереоизомерной пары(Eliel, E. and Wilen, S. (1994) Stereochemistry of Organic Compounds, John WileySons, Inc., p. 322). Диастереоизомерные соединения могут быть получены в результате взаимодействия асимметрических соединений с энантиомерно чистыми хиральными разделяющими реагентами, такими как метилпроизводные, последующего разделения данных диастереоизомеров и их гидролиза с выходом свободного энантиомерно обогащенного ксантена. Методика определения оптической чистоты включает получение из рацемической смеси хиральных сложных эфиров, таких как метиловый эфир, например (-)метил хлорформиат (в присутствии основания), или эфир Мошера, -метокси(трифторметил)фенилацетат(Jacob III. (1982) J. Org. Chem. 47:4165), и анализ ЯМР-спектра на присутствие двух атропизомерных диастереоизомеров. Стабильные диастереоизомеры атропизомерных соединений можно разделять и выделены путем нормальнофазовой и обратнофазовой хроматографии в соответствии с методиками разделения атропизомерных нафтил-изохинолинов (Ноуе, Т., WO 96/15111). В соответствии с методикой (3) рацемическая смесь двух энантиомеров может быть разделена путем хроматографии с использованием хиральной стационарной фазы (Chiral Liquid Chromatoqraphy (1989) W.J. Lough, Ed. Chapman and Hall,New York; Okamoto, (1990) J. of Chromatogr. 513:375-378). Обогащенные или очищенные энантиомеры можно различить с помощью методик, используемых для различения других хиральных молекул с асимметрическими атомами углерода, таких как оптическое вращение и круговой дихроизм. Примеры вариантов реализации настоящего изобретения. Конкретные значения и варианты реализации, указанные в данном описании для радикалов, заместителей и диапазонов, приведены только для иллюстрации и не исключают другие определенные в данном описании значения радикалов и заместителей или другие значения радикалов и заместителей в пределах определенных диапазонов. Согласно конкретному варианту реализации изобретения Z1 выбран из следующих структур: Согласно конкретному варианту реализации изобретения Rc представляет собой гетероарильное кольцо, выбранное из которое может иметь в качестве заместителей одну или более (С 1-3)алкильных групп или NRnRp, где каждый Rn и Rp независимо представляет собой Н или (С 1-4)алкил. Согласно конкретному варианту реализации изобретения Rc выбран из Согласно конкретному варианту реализации изобретения Rc выбран из Согласно конкретному варианту реализации изобретения Rb представляет собой Н или Cl. Согласно конкретному варианту реализации изобретения Ra представляет собой Н, метокси, N-(2 цианоэтил)амино, N-(3,3,3-трифторэтил)амино, 2-метоксиэтокси, 2-гидроксиэтокси, 2-гидрокси-2 метилпропокси, 2-амино-2-метилпропокси, N,N-диметиламинокарбонилметокси, морфолинокарбонилметокси, 2-[N-(2,2,2-трифторэтил)амино]этокси, 2-морфолиноэтокси, цианометокси, 2-пиперазин-1 илэтокси, 2-(N,N-диметиламино)этокси, 2-(3,3-диметилморфолино)этокси, 2-(4-метилпиперазин-1 ил)этокси или карбоксиметокси. Согласно конкретному варианту реализации изобретения Ra представляет собой Н, метокси, N-(2 цианоэтил)амино, N-(3,3,3-трифторэтил)амино, 2-метоксиэтокси, 2-гидроксиэтокси, 2-гидрокси-2 метилпропокси, 2-амино-2-метилпропокси, N,N-диметиламинокарбонилметокси, морфолинокарбонилметокси, 2-[N-(2,2,2-трифторэтил)амино]этокси или 2-морфолиноэтокси. Согласно конкретному варианту реализации изобретения Z1 выбран из следующих структур: Согласно конкретному варианту реализации изобретения Q1 представляет собой винил или этил. Согласно конкретному варианту реализации изобретения Z2a представляет собой трет-бутил. Согласно конкретному варианту реализации изобретения X представляет собой О. Согласно конкретному варианту реализации изобретения Y представляет собой поликарбоцикл. Согласно конкретному варианту реализации изобретения Y представляет собой конденсированную карбоциклическую кольцевую систему. Согласно конкретному варианту реализации изобретения Y представляет собой мостиковую карбоциклическую кольцевую систему. Согласно конкретному варианту реализации изобретения Y содержит мостиковую кольцевую систему, представляющую собой Согласно конкретному варианту реализации изобретения Y содержит конденсированную кольце- 18019749 Согласно конкретному варианту реализации изобретения Y выбран из Согласно конкретному варианту реализации изобретения соединение формулы (I) выбрано из Согласно конкретному варианту реализации изобретения соединение формулы (I) представляет собой Согласно конкретному варианту реализации изобретения каждый Rn и Rp независимо представляет собой Н или (С 1-4)алкил. Согласно конкретному варианту реализации изобретения Z1 выбран из следующих структур:
МПК / Метки
МПК: C07D 401/14, A61K 31/401, A61K 31/407, C07D 403/12, C07D 417/14, C07D 403/14, A61K 31/4025, C07D 487/04, C07D 401/12
Метки: соединения, противовирусные
Код ссылки
<a href="https://eas.patents.su/30-19749-protivovirusnye-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Противовирусные соединения</a>
Предыдущий патент: Антибактериальные композиции
Следующий патент: Ограждение и пластиковая ячеистая структура для его возведения
Случайный патент: Экранирующее устройство с приводным двигателем и его применение