Противовирусные производные пиримидиновых нуклеозидов
Номер патента: 15178
Опубликовано: 30.06.2011
Авторы: Макгиган Кристофер, Бальзарини Ян, Мильоре Марко
Формула / Реферат
1. Соединение общей формулы (II)
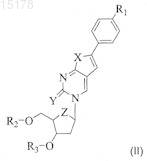
где X представляет собой О, S, NH или СН2,
Y представляет собой О, S или NH,
Z представляет собой О, S или СН2,
R1 представляет собой C1-6 алкил и
один из R2и R3 представляет собой Н, а другой является остатком нейтральной неполярной аминокислоты формулы
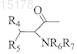
где R4, R5, R6и R7 независимо друг от друга являются Н или C1-2 алкилом,
либо его фармацевтически приемлемая соль или гидрат.
2. Соединение по п.1, где R1 представляет собой н-алкил.
3. Соединение по п.2, где R1 представляет собой н-пентил или н-гексил.
4. Соединение по пп.1-3, где R6 и R7оба представляют собой Н.
5. Соединение по п.1, где один из R2 или R3является валином, лейцином, изолейцином или аланином.
6. Соединение по п.1 или 5, где R2 или R3представляет собой валин.
7. Соединение по п.6, где указанный валин является L-валином, D-валином или D,L-валином.
8. Соединение по любому из предшествующих пунктов, где X, Y и Z все предпочтительно являются О.
9. Соединение по п.1, которое представляет собой
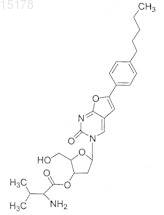
Соединение 3,

Соединение 5
или гидрохлорид соединения 3 или соединения 5.
10. Соединение по п.1, которое представляет собой
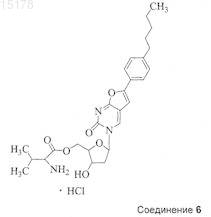
11. Способ получения соединения по любому из пп.1-10, включающий этерификацию соединения формулы (III)
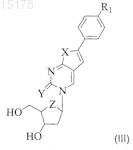
защищенной нейтральной неполярной аминокислотой формулы (IV)
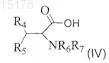
где R1, R4, R5, R6и R7, X, Y и Z определены в п.1, и возможно затем взаимодействие полученного эфира с кислотой для формирования фармацевтически приемлемой соли.
12. Способ по п.11, где R6 и R7оба являются Н, а указанная a-аминогруппа защищена во время этерификации 3,9-флуоренилметоксикарбонильной (Fmoc) защитной группой.
13. Способ по п.11 или 12, где этерификация проводится в условиях Мицунобу.
14. Способ по любому из пп.11-13, включающий дальнейшую обработку эфира раствором HCl для формирования хлористо-водородной соли.
15. Способ по любому из пп.11-14, где R1 является н-пентилом или н-гексилом, X, Y и Z все являются О, а и R4, и R5 оба представляют собой метил.
16. Применение соединения по любому из пп.1-10 в способе лечения организма человека или животного.
17. Применение соединения по любому из пп.1-10 в изготовлении лекарства для профилактики или лечения вирусной инфекции.
18. Способ профилактики или лечения вирусной инфекции, включающий введение пациенту, представляющему собой человека или животное, не являющееся человеком, нуждающемуся в таком лечении, эффективной дозы соединения по любому из пп.1-10.
19. Фармацевтическая композиция, включающая соединение по любому из пп.1-10 в комбинации с фармацевтически приемлемым эксципиентом.
Текст
ПРОТИВОВИРУСНЫЕ ПРОИЗВОДНЫЕ ПИРИМИДИНОВЫХ НУКЛЕОЗИДОВ Соединение для применения в лечении или профилактике вирусных инфекций, таких, например, как ветряная оспа или опоясывающий герпес, вызванных вирусом Varicella Zoster, имеющее общую формулу где X представляет собой О, S, NH или СН 2, Y представляет собой О, S или NH, Z представляет собой О, S или СН 2, R1 представляет собой С 1-6 алкил, предпочтительно н-алкил, например н-пентил или н-гексил, и один из R2 или R3 представляет собой Н, а другой является остатком нейтральной неполярной аминокислоты формулы где R4, R5, R6 и R7 независимо друг от друга являются Н или C1-2 алкилом, либо его фармацевтически приемлемая соль или гидрат. В предпочтительных воплощениях один из R2 или R3 является валином, лейцином, изолейцином или аланином, особенно предпочтителен валин.(71)(73) Заявитель и патентовладелец: ЮНИВЕРСИТИ КОЛЛЕДЖ КАРДИФФ КОНСАЛТЕНТС ЛИМИТЕД (GB); КАТОЛИКЕ УНИВЕРСИТЕТ ЛВЕН (BE) 015178 Данное изобретение относится к эфирным производным некоторых нуклеозидных аналогов, имеющим терапевтическое применение в профилактике и лечении вирусных инфекций, например, вызванных вирусом Varicella Zoster (VZV). Вирус Varicella Zoster является этиологическим фактором развития ветряной оспы и опоясывающего герпеса, который может причинять человеку сильную боль и страдание. Изобретение также предлагает фармацевтическую композицию, включающую это эфирное производное,и способ лечения или профилактики вирусной инфекции путем введения этого производного. В публикации WO 01/83501 А 1, содержание которой включено сюда путем ссылки, описаны некоторые нуклеозидные аналоги, обладающие высокой активностью против вируса Varicella Zoster (VZV) и имеющие общую формулу (I) где Ar представляет собой возможно замещенную ароматическую кольцевую систему, которая включает одно шестичленное ароматическое кольцо или два конденсированных шестичленных ароматических кольца;R8 и R9 независимо друг от друга выбраны из группы, включающей водород, алкил, циклоалкил, галогены, амино, алкиламино, диалкиламино, нитро, циано, алкилокси, арилокси, тиол, алкилтиол, арилтиол, арил;Q выбран из группы, включающей О, S и CY2, где Y могут быть одинаковыми или различными и выбраны из водорода, алкила или галогенов;X выбран из группы, включающей О, NH, S, N-алкил, (СН 2), где m имеет значение от 1 до 10, иCY2, Y могут быть одинаковыми или различными и выбраны среди водорода, алкила и галогенов;U" представляет собой Н, a U' выбран из Н и СН 2 Т, либо U' и U" соединяются таким образом, чтобы сформировать кольцевую группировку, включающую Q, где U'-U" вместе соответственно выбраны из группы, включающей СТН-СТ'Т" и СТ'=СТ' так, чтобы образовались кольцевые группировки, выбранные из группы, включающей где Т выбран из группы, включающей ОН, Н, галогены, О-алкил, О-ацил, О-арил, CN, NH2 и N3; Т' выбран из группы, включающей Н и галогены, причем если имеется более одного Т', они могут быть одинаковыми или различными; Т" выбран из группы, включающей Н и галогены иW выбран из группы, включающей Н, фосфатную группу и фармакологически приемлемую соль,его производное или пролекарство; с условием, что когда Т является ОАс, а Т' и Т" имеются и являются Н, то в этом случае Ar не является 4-(2-бензоксазолил)фенилом. В соответствии с WO 01/83501 А 1 особенно предпочтительны соединения 1 и 2, приведенные ниже Целью данного изобретения является предложение новых соединений для лечения или профилактики вирусных инфекций, особенно вызванных или обострившихся вирусом Varicella Zoster (VZV). Другой целью данного изобретения является предложение соединений с улучшенной биодоступностью для лечения этих вирусных инфекций.-1 015178 Еще одной целью данного изобретения является предложение соединений с выгодными фармакокинетическими свойствами. Другой целью данного изобретения является предложение способа производства этих соединений. Согласно одному из аспектов данного изобретения здесь предлагается соединение со следующей общей формулой (II): где X представляет собой О, S, NH или СН 2,Y представляет собой О, S или NH,Z представляет собой О, S или СН 2,R1 представляет собой C1-6 алкил, предпочтительно н-алкил, например н-пентил или н-гексил, и один из R2 или R3 представляет собой Н, а другой является остатком нейтральной неполярной аминокислоты формулы где R4, R5, R6 и R7 независимо друг от друга являются Н или С 1-2 алкилом,либо его фармацевтически приемлемая соль или гидрат. Предпочтительно, чтобы R6 и R7 оба являлись Н. В некоторых случаях один из R2 или R3 может быть валином, лейцином, изолейцином или аланином. Предпочтительно, когда R2 или R3 являются валином. Необходимо понимать, что эфир валина в данном изобретении может быть L-валином, D-валином или D,L-валином. Далее предпочтительно, когда X, Y и Z все являются О. Согласно данному изобретению наиболее предпочтительными соединениями являются Понятно, что соединения 3 и 5 являются валиновыми эфирами соединения 1 по 3'- и 5'гидроксигруппам соответственно. Согласно другому аспекту данного изобретения здесь предлагается способ синтеза соединения данного изобретения, и этот способ включает этерифицирование соединения формулы (III) защищенной нейтральной неполярной аминокислотой, где R1, X, Y и Z являются такими, как определено-2 015178 выше. Предпочтительно, когда указанная аминокислота имеет следующую формулу (IV): где R4, R5, R6 и R7 являются такими, как определено выше. Во время реакции этерификации -аминогруппа соответственно защищается. В некоторых воплощениях, таких, где и R6, и R7 являются Н, указанная аминокислота может быть защищена с помощью 3,9 флуоренилметоксикарбонильной (Fmoc) защитной группы. Специалистам в этой области известны и доступны другие подходящие защитные группы. Группа Fmoc может быть введена в условиях Шоттена-Баумана. Она исключительно устойчива к кислоте. Отщепление этой группы может быть катализировано основанием (аммиак, пиперидин, морфолин, DBU) и следует по механизму Е 1 -элиминации. Этерификация предпочтительно выполняется в условиях Мицунобу (Mitsunobu, Synthesis, January 1981: 1-28) Хлороводородная соль может быть получена при обработке эфира (V) раствором HCl в ТГФ (тетрагидрофуран).R1 предпочтительно является н-пентилом, X, Y и Z являются О, a R4 и R5 оба представляют собой метил. Было установлено, что соединения данного изобретения и их хлористо-водородные соли, например соединение 6 (см. ниже), обладают выгодными фармакокинетическими (ФК) свойствами и лучшей по сравнению с соединением 1 из WO 01/83501 А 1 биодоступностью. Биодоступность зачастую является ключевым фактором при практическом применении лекарства в качестве терапевтического агента, и соединения, которые демонстрируют повышенную ФК и/или растворимость, обычно имеют лучшую эффективность в условиях in vivo по сравнению с соединениями с менее благоприятными ФК свойствами, даже если in vitro их эффективность одинакова. Такие соединения, т.е. производные известных и активных in vitro соединений, часто упоминаются как пролекарства. Примерами таких пролекарств являются новое соединение 5 и его хлористо-водородная соль соединение 6. Соединения 5 и 6 были протестированы на антивирусную активность, как описано ниже, при этом-3 015178 было выявлено, что они обладают этой активностью. Кроме того, на мышиной модели было проведено сравнительное исследование фармакокинетических свойств соединений 1 и 5, при этом была показана лучшая биодоступность соединения 5 по сравнению с соединением 1. Согласно другому аспекту данного изобретения представленное в данном изобретении соединение предлагается для применения в способе лечения, особенно в профилактике или лечении вирусной инфекции. В некоторых воплощениях указанное соединение может быть предложено для применения при лечении или профилактики инфекции вирусом Varicella Zoster. Согласно еще одному аспекту данного изобретения предлагается применение представленного в данном изобретении соединения в производстве лекарства для профилактики или лечения вирусной инфекции,особенно вызванной вирусом Varicella Zoster, например ветряной оспы или опоясывающего герпеса. Согласно еще одному аспекту данного изобретения предлагается способ профилактики или лечения вирусной инфекции, включающий введение человеку или животному, не являющемуся человеком, нуждающемуся в подобном лечении, эффективной дозы соединения согласно данному изобретению. Согласно следующему аспекту данного изобретения предлагается фармацевтическая композиция,включающая соединение, представленное в данном изобретении, в комбинации с фармацевтически приемлемым эксципиентом. Лекарства, воплощающие данное изобретение, могут быть введены пероральным, энтеральным или парентеральным путем, включая внутривенный, внутримышечный, внутрибрюшинный, подкожный, внутрикожный (трансдермальный), воздухоносный (аэрозоль), ректальный, вагинальный и местный (в т.ч. под язык или щеку). Для перорального введения соединения, воплощающие данное изобретение, будут, как правило,предоставляться в форме таблеток или капсул, порошка или гранул, а также в форме водного раствора или суспензии. В таблетках для перорального приема активный компонент может быть смешан с фармацевтически приемлемыми эксципиентами, такими как инертные разбавители, разрыхляющие агенты, связывающие агенты, смазывающие агенты, подслащивающие агенты, ароматические агенты, окрашивающие агенты и консерванты. К подходящим инертным разбавителям относятся карбонат натрия и кальция, фосфат натрия и кальция, лактоза, а к подходящим разрыхляющим агентам - кукурузный крахмал и альгиновая кислота. Связывающими агентами могут быть крахмал и желатин, а в качестве смазочного агента в настоящее время обычно используют стеарат магния, стеариновую кислоту или тальк. При желании таблетки могут быть покрыты материалом, таким как моно- или дистеарат глицерина, что приводит к уменьшению всасывания в желудочно-кишечном тракте. Капсулы для перорального приема могут быть твердыми желатиновыми, в которых активный компонент смешан с твердым разбавителем, и мягкими желатиновыми, в которых активный компонент смешан с водой или маслом, таким как жидкий парафин, арахисовое или оливковое масло. Формы для ректального введения могут быть представлены в виде свечей с подходящей основой,включающей, например, масло какао или салицилат. Формы, подходящие для вагинального введения, могут быть представлены в виде пессариев, тампонов, кремов, гелей, паст, пены или спрея, содержащих в дополнение к активному компоненту соответствующие используемые в этой области носители. Для внутримышечного, внутрибрюшинного, подкожного и внутривенного использования соединения, воплощающие данное изобретение, обычно предлагаются в виде стерильных водных растворов или суспензий, изотоничных и доведенных до соответствующих значений рН с помощью буфера. Подходящим водным носителем может быть раствор Рингера или изотонический раствор хлорида натрия. Водные суспензии, воплощающие изобретение, могут включать суспендирующие агенты, такие как производные целлюлозы, альгинат натрия, поливинилпирролидон и трагакантовую камедь, и увлажняющие агенты, например лецитин. Подходящие консерванты для водных суспензий включают этил- или нпропилпарагидроксибензоат. Соединения, воплощающие данное изобретение, могут быть представлены в препаратах липосом. Как правило, подходящая доза находится в диапазоне от 0,001 до 300 мг на 1 кг массы тела пациента в день, предпочтительный диапазон составляет от 0,01 до 25 мг на 1 кг массы тела в день, а наиболее предпочтительный от 0,05 до 10 мг на 1 кг массы тела в день. Предпочтительно, чтобы нужная доза была представлена в виде двух, трех, четырех, пяти или шести или больше субдоз, которые вводятся через соответствующие интервалы времени в течение дня. Эти субдозы можно вводить в виде стандартной лекарственной формы, содержащей, например, 0,1-1500 мг, предпочтительно 0,2-1000 мг и наиболее предпочтительно 0,5-700 мг активного компонента на форму. Далее следуют различные примеры изобретения со ссылками на сопровождающие чертежи, из которых будут очевидны дальнейшие преимущества и эффекты соединений изобретения. В разделе графических материалов единственная иллюстрация представляет собой графикMeanSD (среднее значениестандартное отклонение) плазменной концентрации соединения 1 (обозначена как относительная площадь пика) у мышей женского пола после однократного перорального введения через зонд соединения 1 (25 мг/кг) или соединения 5 (31,25 мг/кг, эквивалентные 25 мг/кг соединения 1).-4 015178 Экспериментальные методики и биологические результаты Получение соединений. Пример 1. Получение соединения 5; образование валинового эфира. Соединение 1 (200 мг, 0,5 ммоль, полученное, как описано в WO 01/83501 А 1, пример 3, стр. 15) было растворено в сухом диметилформамиде (ДМФ) (5 мл), затем к смеси добавили связанный с полимером трифенилфосфин [370 мг, 1,1 ммоль, (3 ммоль р/g смола)] и ди-трет-бутила азодикарбоксилат(DBAD) (231 мг, 1,0 ммоль) и перемешивали в течение 20 мин. Раствор Fmoc-Val-OH (340 мг, 1,0 ммоль) в ДМФ (5 мл) добавлялся по капле в течение 30 мин. Реакционная смесь перемешивалась при комнатной температуре в аргоновой атмосфере до полного исчезновения начального материала (в течение ночи). Смола была отфильтрована и промыта этилацетатом. К раствору был добавлен пиперидин (1 мл, 10 ммоль), после чего он перемешивался в течение 10 мин. Растворитель был удален под низким давлением при температуре не выше 35 С, а осадок растворен в этилацетате (20 мл), отмыт 10%-м растворомNaHCO3 (320 мл) и солевым раствором (220 мл). Конечный осадок был очищен колоночной хроматографией (градиент CH2Cl2: МеОН 100% 98% 95% 90%), в результате получено 137 мг соединения 5(55% выход), которое представляло собой твердое вещество желтого цвета. 1 Н-ЯМР (CDCl3) : 8.3 (1 Н, s), 7.55 (2 Н, d), 7.15 (2 Н, d), 6.6 (1 Н, s), 6.25 (1 Н, t), 4.45-4.30 (4 Н, m),3.23 (1 Н, d), 2.80 (1 Н, m), 2.53 (2 Н, t), 2.12 (1 Н, m), 1.97 (1 Н, m), 1.60 (2 Н, m), 1.24 (4 Н, m), 0.90-0.78 (9 Н,m). 13 С-ЯМР (CDCl3) : 175,16, 171,62, 156,26, 154,89, 145,19, 135,29, 129,02, 125,69, 124,95, 108,60,96,82, 88,73, 85,08, 70,90, 64,19, 60,19, 41,91, 35,82, 32,32, 31,44, 30,89, 22,50, 19,30, 17,24, 13,99. Пример 2. Получение соединения 6; образование соли HCl. Соединение 6 300 мг соединения 5 были растворены в 3 мл ТГФ. При температуре 0 С и энергичном перемешивании было добавлено 2 мл 1 М HCI и затем смесь перемешивалась в течение 10 мин. Растворители были высушены при пониженном давлении, в результате чего получено 322 мг (100%) маслянистой жидкости желтого цвета, которая затвердела при добавлении эфира. 1 Н-ЯМР (d6-DMSO) : 8.6 (4 Н, bs), 7.70 (2 Н, d), 7.30 (2 Н, d), 7.20 (1 Н, s), 6.22 (1 Н, t), 5.60 (1 Н, bs),4.48 (2 Н, m), 4.30 (1 Н, m), 4.16 (1 Н, m), 3.98 (1 Н, m), 2.61 (2 Н, t), 2.44 (1 Н, m), 2.25 (1 Н, m), 2.18 (1 Н, m),1.57 (2 Н, m), 1.32 (4 Н, m), 1.00-0.83 (9 Н, m). 13 С-ЯМР (d6-DMSO) : 171,13, 168,88, 153,97, 153,70, 144,18, 137,94, 129,04, 125,77, 124,58, 107,22,98,75, 87,71, 84,13, 69,73, 65,26, 57,35, 40,18, 34,88, 30,88, 30,39, 29,38, 21,91, 18,26, 17,55, 13,90. Биологические и фармакокинетические исследования Для демонстрации улучшения качества воздействия соединения 5 было проведено несколько экспериментов с использованием мышиных моделей. Результаты представлены ниже.-5 015178 Экспериментальное сравнительное вирусологическое исследование соединений 1 и 5. Цель этого экспериментального исследования состояла в том, чтобы сравнить антивирусную активность соединений 1 и 5 в клетках HEL (клетки эритролейкоза человека), инокулированных дефицитным по тимидинкиназе штаммом Oka VZV. Антивирусная деятельность оценивалась как способность соединения 1 или 5 уменьшить формирование вирусных бляшек по сравнению с необработанными контрольными культурами после инкубационного периода в пределах от 3 до 7 дней. Предварительные результаты исследования антивирусной эффективности, приведенные в табл. 4.2, показывают сопоставимую эффективность этих двух соединений. Таблица 1 Предварительные результаты сравнения антивирусной активности соединения 1 и соединения 5 в отношении вируса Varicella Zoster в клетках HEL Примечание: молекулярная масса соединения 5 приблизительно в 1,25 раза больше массы соединения 1 из-за валинового эфира. В итоге, результаты данного сравнительного эксперимента in vitro показали, что соединение 5 in vitro имеет антивирусную активность, сопоставимую с активностью соединения 1. Неклинические фармакокинетические исследования соединения 5. Экспериментальное исследование проводилось на мышах с использованием соединений 1 и 5 для сравнения относительной биодоступности соединений 1 и 5 при пероральном способе введения. Две группы самок мышей получили эквимолярные дозы соединения 1 (25 мг/кг) или 5 (31,25 мг/кг; эквивалентный 25 мг/кг соединения 1) в 0,5% карбоксиметилцеллюлозе в виде однократного перорального введения через зонд. В интервале времени от 0,25 до 3 ч после введения дозы через определенные промежутки времени мыши были последовательно умерщвлены (по 3 особи через каждый промежуток). В полученных от них образцах плазмы был проанализирован уровень концентрации соединения 1 с помощью некалиброванного метода HPLC (высокоэффективная жидкостная хроматография) с определением флюоресценции. Результаты были представлены как относительные площади пиков соединения 1, при этом предполагается, что каждая площадь пика прямо пропорциональна концентрации в пределах данного диапазона концентраций. Результаты этого исследования представлены на сопровождающем графике. Концентрации в плазме соединения 1 были значительно выше у мышей, получивших соединение 5, по сравнению с мышами,получившим соединение 1. Следует обратить внимание, что эти данные не означают абсолютные концентрации в плазме соединения формулы 1, но по площади пика можно оценить, что соединение 5 повышает пероральную биодоступность соединения 1 примерно в 8,4-10 раз (например, AUC (площадь под кривой) возросла примерно на 840%, и Cmax возросла примерно на 1000%). В заключение можно сказать, что эти данные подтверждают гипотезу о том, что соединение 5 является пролекарством соединения 1 и значительно повышает биодоступность соединения 1 при пероральном приеме. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение общей формулы (II) где X представляет собой О, S, NH или СН 2,Y представляет собой О, S или NH,Z представляет собой О, S или СН 2,R1 представляет собой C1-6 алкил и один из R2 и R3 представляет собой Н, а другой является остатком нейтральной неполярной аминокислоты формулы где R4, R5, R6 и R7 независимо друг от друга являются Н или C1-2 алкилом,либо его фармацевтически приемлемая соль или гидрат. 2. Соединение по п.1, где R1 представляет собой н-алкил. 3. Соединение по п.2, где R1 представляет собой н-пентил или н-гексил. 4. Соединение по пп.1-3, где R6 и R7 оба представляют собой Н. 5. Соединение по п.1, где один из R2 или R3 является валином, лейцином, изолейцином или аланином. 6. Соединение по п.1 или 5, где R2 или R3 представляет собой валин. 7. Соединение по п.6, где указанный валин является L-валином, D-валином или D,L-валином. 8. Соединение по любому из предшествующих пунктов, где X, Y и Z все предпочтительно являются О. 9. Соединение по п.1, которое представляет собой Соединение 3, Соединение 5 или гидрохлорид соединения 3 или соединения 5. 10. Соединение по п.1, которое представляет собой 11. Способ получения соединения по любому из пп.1-10, включающий этерификацию соединения защищенной нейтральной неполярной аминокислотой формулы (IV) где R1, R4, R5, R6 и R7, X, Y и Z определены в п.1, и возможно затем взаимодействие полученного эфира с кислотой для формирования фармацевтически приемлемой соли. 12. Способ по п.11, где R6 и R7 оба являются Н, а указанная -аминогруппа защищена во время этерификации 3,9-флуоренилметоксикарбонильной (Fmoc) защитной группой. 13. Способ по п.11 или 12, где этерификация проводится в условиях Мицунобу. 14. Способ по любому из пп.11-13, включающий дальнейшую обработку эфира раствором HCl для формирования хлористо-водородной соли. 15. Способ по любому из пп.11-14, где R1 является н-пентилом или н-гексилом, X, Y и Z все являются О, а и R4, и R5 оба представляют собой метил. 16. Применение соединения по любому из пп.1-10 в способе лечения организма человека или животного. 17. Применение соединения по любому из пп.1-10 в изготовлении лекарства для профилактики или лечения вирусной инфекции. 18. Способ профилактики или лечения вирусной инфекции, включающий введение пациенту, представляющему собой человека или животное, не являющееся человеком, нуждающемуся в таком лечении,эффективной дозы соединения по любому из пп.1-10. 19. Фармацевтическая композиция, включающая соединение по любому из пп.1-10 в комбинации с фармацевтически приемлемым эксципиентом.
МПК / Метки
МПК: A61K 31/70, C07D 491/04, C07H 19/04, A61P 31/12
Метки: производные, нуклеозидов, противовирусные, пиримидиновых
Код ссылки
<a href="https://eas.patents.su/9-15178-protivovirusnye-proizvodnye-pirimidinovyh-nukleozidov.html" rel="bookmark" title="База патентов Евразийского Союза">Противовирусные производные пиримидиновых нуклеозидов</a>
Предыдущий патент: Способ осуществления перехода от одного сорта полиолефина к другому
Следующий патент: Тиазолпиразолопиримидин в качестве антагониста рецептора крф1
Случайный патент: Системы и способы анализа шихты для производства стекла












