Конъюгаты соединения, содержащего сульфгидрильную группу, и производного жирной кислоты, способ получения конюгатов, промежуточные соединения для их получения, способы повышения абсорбции и пролонгированного сохранения в крови и тканях млекопитающего соединения, содержащего сульфгидрильную группу
Формула / Реферат
1. Соединение общей формулы VI

где Р является фрагментом соединения, содержащего сульфгидрильную группу, выбранного из группы, включающей пептиды, белки или олигонуклеотиды;
R1 представляет собой водород, низший алкил или арил;
R2 представляет собой фрагмент, содержащий липидную группу; а
R3 представляет собой гидроксил, фрагмент, содержащий липидную группу или аминокислотную последовательность, включающую 1 или 2 аминокислоты и заканчивающуюся -СО2Н или -COR2.
2. Соединение по п.1, отличающееся тем, что R1 представляет собой водород, R2 - липидную группу и R3 - гидроксил.
3. Соединение по п.1, отличающееся тем, что R1 представляет собой водород, R2 - -CH2CH2CH(NH2)CO2H или -СН2СН2СН(NНСО-липид)СО-липид и R3 - -NHCH2CO2H или -NНСН2СО-липид, причем, по крайней мере, один заместитель из R2 и R3 содержит липидную группу.
4. Соединение по п.1, отличающееся тем, что указанная липидная группа является гидрофобным заместителем, включающим примерно от 4 до 26 атомов углерода.
5. Соединение по п.1, отличающееся тем, что указанная липидная группа является гидрофобным заместителем, включающим примерно от 5 до 19 атомов углерода.
6. Способ повышения абсорбции соединения, содержащего сульфгидрильную группу, выбранного из группы, включающей пептиды, белки и олигонуклеотиды, в клетках млекопитающих, отличающийся тем, что получают на основе указанного сульфгидрилсодержащего соединения соединение общей формулы VI
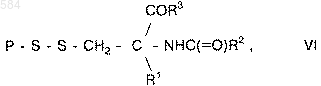
где Р является фрагментом соединения, содержащего сульфгидрильную группу, выбранного из группы, включающей пептиды, белки и олигонуклеотиды;
R1 представляет собой водород, низший алкил или арил;
R2 - фрагмент, содержащий липидную группу; а
R3 - гидроксил, фрагмент, содержащий липидную группу или аминокислотную последовательность, включающую 1 или 2 аминокислоты и заканчивающуюся на -CO2H или -COR2, а затем обрабатывают клетки полученным соединением.
7. Способ по п.6, отличающийся тем, что R1 представляет собой водород, R2 - липидную группу, а R3 - гидроксил.
8. Способ по п.6, отличающийся тем, что R1 представляет собой водород, R2 - -CH2CH2CH(NH2)CO2H или -СН2СН2СН(NНСО-липид)СО-липид и R3 - -NHCH2CO2H или -NНСН2СО-липид, причем, по крайней мере, один заместитель из R2 и R3 содержит липидную группу.
9. Способ пролонгированного сохранения в крови и тканях млекопитающих соединения, содержащего сульфгидрильную группу, выбранного из группы, включающей пептиды, белки и олигонуклеотиды, отличающийся тем, что получают на основе указанного сульфгидрилсодержащего соединения соединение общей формулы VI
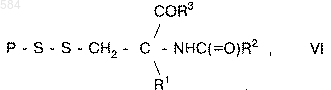
где P является фрагментом соединения, содержащего сульфгидрильную группу, выбранного из группы, состоящей из пептидов, белков и олигонуклеотидов;
R1 - водород, низший алкил или арил;
R2 - фрагмент, содержащий липидную группу; а
R3 - гидроксил, фрагмент, содержащий липидную группу или аминокислотную последовательность, включающую 1 или 2 аминокислоты и заканчивающуюся -CO2H или -COR2, а затем обрабатывают клетки полученным соединением.
10. Способ по п.9, отличающийся тем, что R1 представляет собой водород, R2 - липидную группу, а R3 - гидроксил.
11. Способ по п.9, отличающийся тем, что R1 представляет собой водород, R2 - -CH2CH2CH(NH2)CO2H или -СН2СН2СH(NНСО-липид)CО-липид и R3 - -NHCH2CO2H или -NНСН2СО-липид, причем, по крайней мере, один заместитель из R2 и R3 содержит липидную группу.
12. Соединение общей формулы V
А - S - S - СН2 - CR1(NHCOR2)C(=O)R3, V
где А - активирующий ароматический остаток;
R1 - водород, низший алкил или арил;
R2 - фрагмент, содержащий липидную группу; а
R3 - гидроксил, фрагмент, содержащий липидную группу или аминокислотную последовательность, включающую 1 или 2 аминокислоты и заканчивающуюся -СО2Н или -COR2.
13. Соединение по п.12, отличающееся тем, что А представляет собой 2-пиридил или 4-нитрофенил.
14. Соединение по п.12, отличающееся тем, что R1 представляет собой водород, R2 - липидную группу, а R3 - гидроксил.
15. Соединение по п.12, отличающееся тем, что R1 представляет собой водород, R2 - -СН2СН2СН(NН2)СO2Н или -СН2СН2СН(NНСО-липид)CО-липид и R3 - -NHCH2CO2H или -NНСН2СО-липид, причем, по крайней мере, один заместитель из R2 и R3 содержит липидную группу.
16. Способ получения соединения общей формулы VI, заключающийся в том, что обеспечивают взаимодействие соединения общей формулы PSH, где Р представляет собой пептид, белок или олигонуклеотид, с соединением общей формулы V
A- S - S - СН2- CR1(NHCOR2)C(=O)R3, V
где А - активирующий ароматический остаток;
R1 представляет собой водород, низший алкил или арил;
R2 - фрагмент, содержащий липидную группу; а
R3 - гидроксил, фрагмент, содержащий липидную группу или аминокислотную последовательность, включающую 1 или 2 аминокислоты и заканчивающуюся -CO2H или -COR2.
17. Способ по п.16, отличающийся тем, что А представляет собой 2-пиридил или 4-нитрофенил.
18. Способ по п.16, отличающийся тем, что R1 представляет собой водород, R2 - липидную группу, а R3 - гидроксил.
19. Способ по п.16, отличающийся тем, что R1 представляет собой водород, R2 - -CH2CH2CH(NH2)CO2H или -СН2СН2СН(NНСО-липид)СО-липид и R3 - -NHCH2CO2H или -NНСН2СО-липид, причем, по крайней мере, один заместитель из R2 и R3 содержит липидную группу.
20. Соединение общей формулы III
А - S - S - СН2 - CR1(NH2)C(=O)R3, III
где R3 представляет собой гидроксил или аминокислотную последовательность, включающую 1 или 2 аминокислоты и заканчивающуюся -СО2Н;
А - активирующий ароматический остаток;
R1 - водород, низший алкил или арил.
21. Соединение по п.20, отличающееся тем, что R1 представляет собой водород и R3 - гидроксил.
22. Соединение по п.20, отличающееся тем, что R1 представляет собой водород и R3 - -NHCH2CO2H.
Текст
1 Область техники, к которой относится изобретение Настоящее изобретение в основном относится к области биологии и медицины. Точнее,изобретение касается способов и композиций,полезных для повышения абсорбции и задержания гидрофильных молекул, в особенности пептидов и белков, у млекопитающих. Предшествующий уровень техники Эта заявка является частичным продолжением заявки 08/349,717, поданной 25 января 1995 года. Успехи биотехнологии сделали возможным производство большого числа терапевтически активных и очищенных белков и пептидов. В настоящее время терапевтический эффект большинства этих агентов может быть достигнут только путем инвазии, например инъекцией. Так как большинство белков имеют очень короткий период полужизни, эффективные концентрации указанных агентов могут поддерживаться только путем частых инъекций. Хотя введение белков путем инъекций является наиболее эффективным сособом их применения in vivo, переносимость пациентами множественных инъекций невелика. Кроме того, введение лекарственных средств путем инъекций требует определенной квалификации и обучения; далеко не все пациенты обладают подобными навыками. В случаях, когда лекарственные средства белковой природы имеют жизненно важное значение, введение их путем инъекций может быть приемлемым для пациентов. Однако когда применение лекарственных средств белковой природы являются только одним из нескольких возможных вариантов терапии, маловероятно, что больные будут осуществлять подобные инъекции белков и пептидов. Таким образом, существует необходимость в разработке альтернативных способов введения белков и пептидов. Альтернативные способы введения белков и пептидов могут включать защечный, назальный, оральный, легочный, ректальный и глазной. Без исключения, эти способы менее эффективны, чем парентеральные. Однако указанные способы введения белков и пептидов гораздо более привлекательны, чем парентеральные,поскольку они предлагают пациентам удобство и контроль. При этом оральный способ введения препаратов наиболее подходящий и удобный для пациентов. Барьеры слизистых оболочек, разделяющие внутреннюю и наружную части тела (например, желудочно-кишечные, глазные, легочные, ректальные и назальные слизистые) состоят из слоя плотно соединенных монослоев клеток, который непосредственным образом регулирует транспорт молекул. Отдельные клетки в барьерах связаны плотными контактами, которые регулируют выход молекул в межклеточное пространство. Таким образом, слизистая обо 000584 2 лочка является первым физическим барьером,транспорт через который зависит как от межклеточных, так и околоклеточных путей. [Lee,V.H.L. (1988) CRC. Critical Rev. Ther. Drug Delivery Sys. 5, 69-97]. Околоклеточный транспорт с помощью воды, заполняющей плотные контакты, ограничивается небольшими молекулами (мол. масса 1 кДа) и в действительности является диффузионным процессом, вызываемым градиентом концентрации через слизистую оболочку. [Lee(1988), см. выше; Artursson, P., and Magnusson,С., (1990) J.Pharm. Sci. 79, 595-600]. Плотные контакты составляют менее чем 0,5% от общей поверхности слизистых оболочек [GonzalezMariscal, L.M. et al. (1985) J. Membrane Вiоl., 86,113-125; Vetvicka, V., and Lubor, F. (1988), CRC.Critical Rev. Ther. Drug Delivery Sys. 5, 141-170]; таким образом, они играют очень небольшую роль в переносе лекарственных средств белковой природы через слизистую оболочку. Межклеточный транспорт лекарственных средств небольшой мол. массы может быть эффективным благодаря физико-химическим свойствам препарата, обеспечивающим транспорт через гидрофобные клеточные барьеры. Однако межклеточный транспорт белков и пептидов ограничивается процессом трансцитоза[Shen W.C. et al. (1992 Adv. Drug Delivery Rev. 8,93-113]. Трансцитоз - это сложный процесс, в котором пептиды и белки заключаются в везикулы по одну сторону от клетки и далее переносятся через клетку на другую сторону, где высвобождаются из эндоцитозных везикул. [Mostov K.E., and Semister, N.E. (1985) Cell 43, 389390]. Клеточная мембрана барьеров слизистых оболочек является двойным гидрофобным слоем липидов, который не имеет никакого сродства к таким гидрофильным заряженным макромолекулам, как белки и пептиды. Кроме того,клетки слизистых оболочек могут секретировать муцин, который может действовать как барьер при транспорте многих макромолекул [Edwards,P. (1978) British Med. Bull. 34, 55-56]. Таким образом, если только не существует специфических механизмов транспорта белков и пептидов,их естественный перенос через барьеры слизистых оболочек почти невозможен. Кроме того, для обеспечения плотного физического барьера для транспорта белков и пептидов, клетки слизистых оболочек вырабатывают ферменты, которые могут разрушать белки и пептиды перед, после и во время их прохождения через слизистую. Такой барьер называется энзиматическим барьером. Энзиматический барьер обусловлен функционированием эндо- и экзопептидаз, которые расщепляют белки и пептиды на концах или внутри их молекул. Изучена ферментативная активность некоторых слизистых оболочек и результаты исследований показали, что существует значительная протеазная активность в гомогенатах щечных, носовых, 3 ректальных и вагинальных слизистых оболочек кроликов-альбиносов, и эта активность сравнима с таковой в подвздошной кости [Lee et al.(1988) см. выше]. Таким образом, какая бы слизистая оболочка не расматривалась, имеющийся энзиматический барьер будет играть значительную роль в деградации молекул белка и пептида.N- и С-концевые участки пептидов заряжены, и наличие заряженных боковых цепей придает высокогидрофильные свойства этим макромолекулам. Кроме того, наличие боковых заряженных цепей означает, что белки и пептиды имеют сильную водород-связывающую активность; показано, что эта Н-связывающая активность играет основную роль в ингибировании транспорта даже небольших пептидов через клеточные мембраны [Conradi, N.A. et al. (1991)Pharm. Res. 8, 1453-1460]. Таким образом, сочетание размера и гидрофильной природы белков и пептидов строго ограничивает их транспорт через барьеры слизистых оболочек. Одним из подходов, используемых для преодоления физической природы барьеров слизистых оболочек является применение усилителей проницаемости. Использование усилителей проницаемости основано на разрушении клеточных барьеров с помощью агентов низкой молекулярной массы, которые могут размегчать клеточные мембраны [Kaji, M. et al. (1985) LifePress 8, 91-192]. Использование этих агентов приводит к неспецифической потере целостности барьера и может способствовать абсорбции многочисленных крупных молекул, которые иногда токсичный для клеток in vivo. Ингибиторы протеаз применяются совместно с белками и пептидами и обнаруживают некоторую ограниченную активность в усилении абсорбции этих макромолекул in vivo [Kidron, M. et al. (1982) Life Sci. 31, 2837-2841; Takaroi, К. et al. (1986) Biochem. Biophys. Res.Comm. 137, 682-687]. Безопасность и долгосрочные эффекты указанного подхода все еще тщательно исследуются. Подход, связанный с синтезом предшественников лекарственных средств, основан на модификации пептидов так, чтобы защитить их от распознавания и разрушения ферментами. Это достигается замещением D-форм аминокислот в пептидах, блокировкой уязвимых групп пептидов путем амидирования и ацилирования,инверсией хиральности пептидов и введением конформационных напряжений в структуру пептида. Синтез предшественников применим только для небольших пептидов, имеющих легко определяемые области активности. 4 Уменьшение размера является еще одним возможным подходом к повышению транспортного потенциала белков. Однако, перед попыткой уменьшения размера активные участки белка необходимо картировать. В целом по отношению к большинству белков указанный подход встречает определенные трудности. Лиганды-носители, в силу их свойств, могут изменять способность клетки к поглощению веществ и "транспортные" характеристики белков и пептидов. Суть данного подхода состоит в том, что белок или пептид, для которого клетка непроницаема, ковалентно связывают с носителем, который легко проникает в клетку. Механизмы, благодаря которым лиганды-носители подвергаются эндоцитозу и трансцитозу, важны в принятии решения о том, подходит ли носитель для усиления транспорта белков и пептидов. Макромолекулярные носители гидрофильны и не разрушают мембрану. Таким образом,перенос крупных полимерных носителей в клетки опосредован сродством носителя к клеточной мембране. В основном, поглощение макромолекулярных коньюгатов начинается со связывания с клеточной мембраной. Связывание носителя с клетками может быть специфическим (например, связывание антител с антигенами поверхности клеток), неспецифическим(связывание катионных лигандов или лектинов с сахарами поверхности клеток) или опосредовано рецептором (связывание трансферрина или инсулина с их рецепторами). После того, как носитель связался с поверхностью клетки, он заключается в везикулы, которые затем подвергаются постадийному прессингу, осуществляемому различным образом. В одном случае везикула возвращается назад, к мембране, из которой она образовалась путем инвагинации. Другой путь, разрушающий коньюгат, - это слияние с лизосомами. Альтернативным путем, который приводит к трансцитозу коньюгата, является слияние везикулы с мембраной на стороне, противоположной той, из которой она образовалась. Точный баланс между процессами эндоцитоза и трансцитоза определяет доставку белкового коньюгата к его мишени. Например, эндоцитоз может определять степень, поглощение конъюганта клеткой-мишенью, но трансцитоз определяет, достигнет ли коньюгат этой мишени [Shen et al.(1992), supra]. Для успешной абсорбции через желудочно-кишечный тракт,коньюгат должен связаться с апикальной мембраной слизистой желудочно-кишечного тракта,проникнуть в клетки слизистой, пересечь внутри клеточное пространство и, наконец, высвободиться из базолатеральной мембраны. Известны многочисленные источники информации, в которых показано, что неспецифические носители, такие как полилизины [Shen,W.С., and Ryser, H.J.P. (1981) Proc. Natl. Acad.R.D. et al. (1988) Proc. Natl. Acad. Sci. USA 85,632-646] и специфические носители, такие как трансферрин [Wan, J et al. (1992) J. Вiоl. Chem. 267, 13446-13450], асиалогликопротеин [Seth, R.etal. (1993) J. Infect. Diseases 168, 994-999] и антитела [Vitetta, E.S. (1990) J. Clin. Immunol. 10,15S-18S] могут усиливать эндоцитоз белков в клетки. Сообщений, касающихся носителей трансцитоза, меньше, и очень небольшое число исследований посвящено количественной оценке транспорта коньюгатов белка через клеточные барьеры. Описан трансцитоз через гематоэнцефалический барьер in vivo для агглютинина из проростков пшеницы [Broadwell, R.D. et al.Wallus, L.R. (1993) Adv. Exp. Med. Biol. 331,129-136]. Кроме того, описан трансцитоз через монослои клеток in vitro для коньюгатов полилизина с пероксидазой хрена (HRP) и коньюгата трансферрина с HRP [Wan, J. and Shen, W.C.et al. (1992) J. Biol. Chem. 267, 13446-13450, см. выше]. Жирные кислоты, как составная часть фосфолипидов, образуют значительную часть клеточных мембран. Они коммерчески доступны и относительно дешевы. Благодаря липидной природе, жирные кислоты могут легко включаться в клеточную мембрану и взаимодействовать с ней не вызывая токсических эффектов. Таким образом, жирные кислоты представляют собой наиболее полезные лиганды-носители для введения белков и пептидов. Подходы, которые подразумевают использование жирных кислот с этой целью основаны на ковалентной модификации белков и пептидов и применении эмульсий жирных кислот. В некоторых исследованиях показано успешное использование эмульсий жирных кислот для доставки пептидов и белков in vivo [Yoshikawa, H. et al., (1985) Pharm. Res. 2, 249-251; Fix,J.A. et al. Am. J. Physiol. 251, G332-G340]. Механизм, с помощью которого эмульсии жирных кислот могут способствовать абсорбции белков и пептидов, еще не известен. Эмульсии жирных кислот могут "открывать" плотные контакты,растворять мембраны, защищать белки и пептиды от действия желудочно-кишечной среды и переносить белки и протеины через слизистую оболочку желудочно-кишечного тракта в процессе их собственной абсорбции [Smith, P. et al.(1992) Adv. Drug Delicery Rev. 8, 253-290]. Последний предполагаемый не согласуется с современными знаниями о механизмах абсорбции жиров. Более целесообразным подходом осуществления транспорта белков и пептидов через эпителий желудочно-кишечного тракта является использование жирных кислот в качестве неспецифических мембранных адсорбирующих 6 агентов. В некоторых исследованиях было показано, что неспецифический мембранный связывающий агент, соединенный с белком, может способствовать трансцитозу белковых коньюгатов через клетки in vitro [Wan, J. et al. (1990) J.Cell. Physiol. 145, 9-15; Taub and Shen (1992), см. выше]. Было также показано, что конъюгация с жирной кислотой улучшает проникновение макромолекул в и через клеточные мембраныProtein Eng. 3, 39-42]. Тем не менее, существуют трудности осуществления конъюгации жирных кислот с пептидами и белками, включая: (1) отсутствие растворимости жирных кислот в водном растворе для реакции конъюгации;(2) потерю биологической активности пептидами и белками после ацилирования жирной кислоты и (3) отсутствие растворимости конъюгированных с жирной кислотой пептидов в водных растворах [см. например, Hashimoto, M. etetal., Biochem. Biophys. Res. Commun. 196, 447454 (1993)]. Объектами настоящего изобретения являются способы и композиции для использования в процессе конъюгации жирных кислот с гидрофильными молекулами и улучшении биологической доступности белков и пептидов. Сущность изобретения В соответствии с настоящим изобретением, производные жирных кислот и соединений,содержащих сульфгидрил (например, пептидов,белков или олигонуклеотидов, которые содержат или модифицированы так, чтобы содержать,сульфгидрильные группы), включая продукты конъюгирования жирных кислот с дисульфидной связью, применяются для введения сульфгидрилсодержащих соединений в клетки млекопитающих. Такая модификация значительно повышает абсорбцию клетками млекопитающих указанных соединений по сравнению со скоростью абсорбции неконьюгированных веществ,так же как и пролонгирует задержку веществ в крови и тканях. Более того, дисульфидная связь в коньюгате довольно лабильна, что облегчает внутриклеточное высвобождение интактных веществ из соединений, включающих жирную кислоту. Изобретение также относится к реагентам и способам получения производных жирных кислот. Перечень фигур чертежей. Изобретение может быть лучше понято с помощью рисунков. На фиг. 1 показано проникновение BBI,BBIssPal и BBIssOleic в клетки Сасо-2; на фиг. 2 - биораспределение BBI иBBIssPal(4) через Сасо-2 и накопление этих веществ в клетках; на фиг. 6 - результаты анализа гельфильтрацией на колонке с Сефадексом G50 основной среды клеток Сасо-2, содержащих BBI,BBIPal(2) и BBIPal(4) после трансцитоза. Сведения, подтверждающие возможность осуществления изобретения Согласно настоящему изобретению сульфгидрилсодержащее соединение (например, биополимер, как определено ниже) прикрепляется к производному жирной кислоты через обратимую, биоразрушаемую дисульфидную связь. Можно ожидать, что такой конъюгат будучи связанным с апикальной стороной клеточной мембраны, достигнет базолатеральной мембраны желудочно-кишечного эпителия в результате мембранного транспорта и кругооборота, и высвободится в интерстициальную жидкость за счет восстановления дисульфидной связи. Согласно одному аспекту настоящего изобретения предложены конъюгаты основной формулы VI: где Р является фрагментом соединения, содержащего сульфгидрильную группу, R1 представляет собой водород, низший алкил или арил: R2 представляет собой фрагмент, содержащий липидную группу (как определено ниже); а R3 представляет собой гидроксил, фрагмент, содержащий липидную группу, или аминокислотную последовательность, включающую одну или 2 аминокислоты и заканчивающуюся -CO2H или -COR2. Эти конъюгаты особенно полезны для повышения абсорбции и пролонгирования задержки в крови и тканях сульфгидрилсодержащего соединения PSH. Согласно другому аспекту настоящего изобретения предложены способы повышения абсорбции в клетках или пролонгирования задержки в крови и тканях сульфгидрилсодержащего соединения основной формулы PSH у млекопитающих, в которых конъюгат основной формулы VI образован из сульфгидрилсодержащего соединения и вводится млекопитающему (например, в виде водного раствора или оральным путем). Согласно третьему аспекту изобретения предложены соединения основной формулы V: А-S-S-СН 2-CR1(NHCOR2)C(=O)R3,V где А - активирующий ароматический остаток 8 ранее. Соединения основной формулы V особенно полезны для получения конъюгатов основной формулы VI из сульфгидрилсодержащих соединений основной формулы PSH. Согласно четвертому аспекту настоящего изобретения предложен способ получения конъюгатов основной формулы VI из сульфгидрилсодержащих соединений основной формулыPSH, который включает реакцию соединения основной формулы PSH с соединением основной формулы V. Реакцию обычно проводят при избытке (например, двукратном или десятикратном) соединения основной формулы V в период времени, составляющий примерно от одного часа до примерно 24 ч при температуре от около 4 С до около 37 С в подходящем водном буферном растворе (например, фосфатном,бикарбонатном или боратном). Предпочтительно реакцию проводят в бикарбонатном буфере,рН 8. Согласно пятому аспекту настоящего изобретения предложены соединения основной формулы III:A-S-S-СН 2-CR1(NH2)C(=O)R3,III где R3- гидроксил или аминокислотная последовательность, включающая одну или две аминокислоты и заканчивающаяся -CO2H, а А и R1 обозначены ранее. Соединения основной формулы III полезны для получения соединений основной формулы V. Соединения основной формулы III удобно получать реакцией соединения с основной формулой II: Н-S-СН 2-CR1(NH2)C(=O)R3,II с соединением основной формулы А-S-S-А или А-S-S-А', где А' отличается от А и является активирующим ароматическим остатком. Эти реагенты также доступны на рынке [например, 2,2'дитиопиридин и 5,5'-дитиобис(2-нитробензойная кислота)] или могут быть получены с применением обычных методик синтеза, хорошо известных специалистам. Согласно шестому аспекту настоящего изобретения предложены способы для получения соединений основной формулы V, в которой R2 является липидной группой, причем соединение основной формулы III реагирует с активированной липидной группой основной формулы Х-O2C-В или Х-ОС-В, где Х - липидактивирующая группа (как определено ниже) и В - липидная группа (как определено ниже). Соединения основной формулы Х-О 2 С-В или Х-ОС-В могут быть легко получены известным способом. Для получения соединения основной формулы III могут быть смешаны равные молярные количества соединения основной формулы II и соединения формулы А-S-S-А или А-S-S-А' в полярном органическом растворителе (например, этаноле). Продукт основной формулы III может быть затем изолирован кристаллизацией из неполярного органического растворителя(например, бензола). Конечно, могут быть ис 9 пользованы другие подходящие методики, известные специалистам. Для получения Х-О 2 С-В или Х-ОС-В жирная кислота может, например, прореагировать с:(а) - N-гидроксисукцинимидным и карбодиимидным реагентом с образованием Нгидроксисукцинимидного активного эфира; (b) трифторуксусным ангидридом с образованием ангидрида жирной кислоты; (с) тионилхлоридом с образованием хлорида жирной кислоты. Для получения указанных или других липидактивирующих групп могут также применяться альтернативные методики. В описании настоящего изобретения термин "фрагмент, содержащий липидную группу" относится как к липидной группе как таковой,так и к липидной группе, соединенной с углеводородом (в особенности с одной или более аминокислотами). Под термином "липидная группа" подразумевается гидрофобный заместитель,включающий примерно от 3 до примерно 26 атомов углерода, предпочтительно примерно от 5 до примерно 19 атомов углерода. Подходящие липидные группы включают, но не ограничиваются, указанными: пальмитил (С 15 Н 31); олеил(C15H29); стеарил (С 17 Н 35); холат и дезоксихолат. Под ароматическим активирующим остатком подразумевается структура, которая служит для образования дисульфидной группы соединений основной формулы V, более лабильная по отношению к реакции замещения с сульфгидрилсодержащими соединениями основной формулы PSH (и таким образом служащая хорошей отщепляемой группой). Предпочтительной ароматической активирующей группой, является 2 пиридил; другие подходящие ароматические активирующие группы включают 4-нитрофенил. Термин "липид-активирующая группа" относится к структуре, которая активирует карбоксилипидную группу, с которой она связана,так что указанная группа способна вступать в реакцию с соединением основной формулы III. Предпочтительной липид-активирующей группой, является N-гидроксисукцинимидный эфир; другие подходящие липид-активирующие группы включают хлорид кислоты и ангидрид кислоты. Хотя настоящее изобретение предполагает получение и использование конъюгатов основной формулы VI, описывающих широкий круг соединений, содержащих сульфгидрильные группы, особенно целесообразно применять способы и композиции, заявленные согласно настоящему изобретению для получения конъюгатов, содержащих биополимеры. Эти биополимеры включают пептиды, белки и олигонуклеотиды (как определено ниже). Как очевидно для специалиста, биополимеры или тиолированные биополимеры, включающие сульфгидрильные группы, могут содержать многочисленные группы, соответствующие структуре конъюгатов основной формулы VI (т.е. группы, 000584 10 имеющие структуру соединений основной формулы VI минус Р). При описании настоящего изобретения термин "пептид" относится к последовательностям аминокислот, включающим от двух до 50 аминокислот и термин "белок" - к цепочкам аминокислот, включающим более чем 50 аминокислот. Белки и пептиды могут быть выделены из естественных источников или получены способами, хорошо известными специалистам,такими как технология рекомбинантных ДНК или твердофазный синтез. Предполагается, что пептиды и белки, использованные в соответствии с настоящим изобретением могут включать только L-аминокислоты естественного происхождения, комбинации L-аминокислот и другие аминокислоты (включая R-аминокислоты и модифицированные аминокислоты), или только аминокислоты, иные, чем L-аминокислоты. Для образования конъюгата основной формулы I,пептид или белок должен содержать, по крайней мере, одну реакционноспособную тиоловую группу. Во многих случаях пептид или белок содержит остаток цистеина (аминокислоты,включающей тиоловую группу). Пептид или белок, который не содержит тиоловую группу,может быть модифицирован способами, хорошо известными специалистам; для этой цели могут обычно применяться хорошо известные тиолирующие агенты [напр. N-сукцинимидил-3-(2 пиридилдитио)пропионат(SPDP) и 2 иминотиолан (реагент Траута)]. Термин "олигонуклеотид" относится к последовательностям, включающим два или более природных или модифицированных нуклеотидов, образующих нуклеиновые кислоты, например, природную или рекомбинантную дезоксирибонуклеиновую кислоту (ДНК) или рибонуклеиновую кислоту (РНК). Для образования конъюгата, в соответствии с настоящим изобретением, олигонуклеотид должен быть модифицирован реакцией тиолирования так, чтобы он содержал сульфгидрильную группу для связывания с липидсодержащей структурой. Такие модификации могут быть легко выполнены методами, известными специалистам. Например,олигонуклеотид может быть связан с цистамином с использованием карбодиимида и впоследствии восстановлен дитиотреитолом для получения свободной сульфгидрильной группы. В одном предпочтительном классе соединений основной формулы VI, R1 - водород, R2 липидная группа и R3 - -ОН. Этот тип конъюгата соответственно происходит от цистеина. В другом предпочтительном классе конъюгатов в соответствии с настоящим изобретением, R1 водород, R2 - -СН 2 СH2 СН(NH2)CO2H или-СН 2 СН 2 СН(NНСО-липид)СО-липид и R3 -NHCH2CO2H или -NНСН 2 СО-липид, в котором,по крайней мере, один из R2 и R3 включает липидную группу. Этот тип конъюгатов соответственно происходит из глутатиона. 11 Синтез соединения основной формулы VI(в котором Р - белок) показан на схеме I. Конечно, можно разработать множество альтернативных схем синтеза, что с готовностью подтвердил бы любой специалист. Коньюгаты жирных кислот, полученных согласно настоящему изобретению, растворимы в большинстве буферных растворов, в которых растворимы белки и пептиды. В частности, любые свободные карбоксильные группы заряжены при нейтральном рН и таким образом улучшают растворимость конъюгатов. Это значительно облегчает соединение конъюгата с подходящими фармацевтически приемлемыми носителями или адьювантами для введения белков и пептидов пациенту оральным или другими путями. Особым преимуществом в соответствии с настоящим изобретением является то, что дисульфидная связь между структурой, содержащей жирную кислоту, и пептидом или белком может быть легко восстановлена. Таким образом, активные молекулы белка или пептида высвобождаются в интактной форме внутри тканей или клеток, являющихся мишенью. Более того, структура, содержащая жирную кислоту в составе конъюгатов, включает только аминокислоты и молекулы липидов, не токсичные для млекопитающих, особенно человека. Изобретение может быть лучше понято с помощью примеров, которые предназначены только для иллюстрации изобретения и их не следует считать ограничивающими объем изобретения, которое охарактеризовано в приведенных ниже пунктах формулы. Пример 1. СинтезN-пальмитил-2 пиридилдитиоцистеина (Pal-PDC). Охлажденный на льду раствор L-цистеина(I) (3,0 г) в этаноле (50 мл) по каплям добавляют к перемешанному раствору 2,2-дитиопиридина(II) (7,5 г) в этаноле (30 мл), и реакцию проводят при 25 С в течение 18 ч. Раствор центрифугируют для удаления всего преципитата и объем супернатанта уменьшают до 40 мл в роторном 12 испарителе. Далее реакционную смесь добавляют по каплям к 400 мл охлажденного на льду бензола. PDC (III), который кристаллизуется в бензоле, выделяют фильтрацией, снова растворяют в 40 мл этанола и затем рекристаллизуют в 400 мл охлажденного на льду бензола, как описано выше. Рекристаллизованный продукт выделяют фильтрацией, высушивают под вакуумом в течение ночи и, наконец, хранят приPDC (100 мг) (III) растворяют в 5 мл DMF и смешивают с 100 мкл триэтиламина и получившуюся суспензию вводят в реакцию с Nгидроксисукцинимидным эфиром пальмитиновой кислоты (IV) (250 мг) в DMF (5 мл) при 25 С в течение 24 ч, за это время суспензия стала прозрачной. Затем суспензию растворяют в 40 мл охлажденной на льду воды, рН 3,0, и преципитат, содержащий Pal-PDC (V) и пальмитиновую кислоту, выделяют центрифугированием при 10000 об/мин в течение 30 мин. Pal-PDC (V) отделяют от пальмитиновой кислоты суспендированием преципитата в воде, рН 7,0, которая растворяет Pal-PDC (V), но не пальмитиновую кислоту. Pal-PDC (V) далее очищают с использованием более двух стадий кислотной преципитации, как описано выше. Пример 2. Синтез конъюгатов. Кроме оговоренных случаев, конечные реагенты, использованные на стадиях конъюгации (PalPDC и PDC) анализируют с помощью тонкослойной хроматографии (TLC) на пластинках с нанесенным силикагелем, содержащих флуоресцентные индикаторы. Эти пластинки не были активированы нагреванием ни перед одним из анализов. Для обычного анализа синтезированных реагентов, на пластинки наносят 5 мкл раствора этанола, содержащего реагент (5 мкг/мл). Далее, пластинки помещают в камеры с растворителем, уравновешенные с мобильной фазой. Как только фронт растворителя проходит достаточное расстояние, пластинки вынимают,высушивают и изучают под УФ-лампой. Положение пятен отмечают на пластинках немедленно и делают рисунок пластинок и пятен. Значение Rf для каждого замеченного пятна вычисляют и записывают. Композиции мобильных фаз, используемых в анализе корректируют для достижения оптимального разделения пятен реагентов. Для иллюстрации синтезируют конъюгатыBBI. BBI является гидрофильным белком, который слабо поглащается клетками и биологически недоступен при оральном применении. Кроме того, ВВI стабилен в желудочнокишечном тракте и выдерживает разрушительное действие протеаз млекопитающих в кишечнике [Yavelow, J. et al. (1983) Cancer. Res. 43,2454s-2459s]. Использование BBI для химиопрофилактики может быть осуществлено, только при разработке формы BBI, способной к абсорбции при оральном применении.BBI (20 мг) растворяют в 1 мл раствора бикарбоната натрия (0,3 М, рН 8,0) и вводят в реакцию с SPDP (5 мг/100 мкл DMF в течение 2 ч при 25 С. После очищения BBI-PDP с использованием гель-фильтрационной хроматографии на СефадексеG50, связывание PDP с BBI оценивают путем измерения высвобождения тиопиридиновой группы после восстановленияBBI-PDP дитиотреитолом (DTT). При использовании этой методики, приблизительно 4 аминогруппы на молекулу BBI были модифицированы с SPDP. Уровень связывания BBI можно проконтролировать доведением рН реакционного буфера; модификация ВВI может быть отрегулирована от одной аминогруппы на молекулу ВВI, когда реакцию проводят при рН 7, до 4,5 модифицированных аминогрупп, когда реакцию проводят при рН 8,5.DTT (25 мМ) в течение 30 мин и далее элюируют с колонки, наполненной СефадексомG50. Фракции BBI, содержащие сульфгидрил, элюированные с незаполненного объема колонки,идентифицируют с использованием реагента Элмена и затем вводят в реакцию с 3-кратным избытком (на каждую сульфгидрильную группуBBI) Pal-PDC (V) в PBS, рН 7,0 в течение 16 ч при 4 С. Затем реакционную смесь подкисляют до рН 3,0 с использованием HCl (1 М) и оставляют на льду на 30 мин. Супернатант анализируют отдельно с использованием гельфильтрационной колонки, наполненной Сефадексом G25. Преципитат, содержащий пальмитилдисульфидный конъюгат BBI, BBIssPal (VI) и избыточный реагент, отделяют центрифугированием, растворяют в DMF (2 мл) и элюируют с колонки, наполненной СефадексомLH20 с использованием DMF. Фракции BBIssPal (VI) элюируют с незаполненного объема колонки,изолируют, диализируют 3 раза против 500 объемов воды и затем лиофилизируют. При использовании этого способа выход конъюгата составляет приблизительно 80% (по весу). Наличие конъюгации Pal-PDC и BBI подтверждают и количественно оценивают после конъюгацииBBI(BBIssOleic). Пример 3. Транспорт конъюгатов. Клетки карциномы толстой кишки человека (Сасо-2) собирают из флаконов с исходной культурой, объемом 25 см 2 путем инкубации в течение 10 мин при 37 С с 0,5 мл раствора трипсин/ЭДТА (0,5% трипсина, 5,3 мМ ЭДТА). Затем клетки суспендируют в 3 мл минимальной необходимой среды Дульбекко, содержащей 15% сыворотки плода коровы (FBS), Lглутамин (1%) и основные аминокислоты (1%) и подсчитывают с помощью счетчика. 14 Клетки Сасо-2, суспендированные в 1,5 мл среды, высеивают в апикальную часть лунок с проницаемым дном при плотности 0,5 миллионов клеток на лунку. Затем в базальную часть каждой лунки добавляют 2,5 мл среды. Клетки оставляют в спокойном состоянии на 2 суток для прикрепления и затем их "кормят" через день до окончания экспериментов. Клетки поддерживают в течение примерно 14-20 суток перед экспериментами и их "кормят" за 24 ч перед каждым экспериментом. Монослой клеток вырабатывает трансэпителиальную электрическую устойчивость (TEER) величиной приблизительно 500-600 Омсм 2 в пределах одной недели после посева и поддерживает эту устойчивость до 21 дня после посева. Мечение радиоактивным иодом BBI иBBIssPal проводят при использовании хлорамина-Т [McConahey, P.С., and Dixon, F.J. (1980)Meth. Enzymol 707 221-247]. Плотный монослой клеток, образовавшийся через 14 дней, один раз промывают, и далее инкубируют в среде Дульбекко без сыворотки при 37 С в течение 30 мин,и затем культивированую среду заменяют средой без сыворотки, содержащей 125I-BBI (10 мкг/мл), или нативный BBI, или BBIssPal,BBIssOleic, и монослой инкубируют еще 60 мин при 37 С. Затем монослой промывают трижды охлажденным на льду PBS и подвергают действию трипсина (0,5%, ЭДТА 5,3 мМ) в течение 10 мин при 37 С. Открепившиеся клетки помещают в пробирки, собирают центрифугированием, трижды промывают охлажденным на льдуPBS, исследуют на кумулятивную радиоактивность с помощью гамма-счетчика, и наконец тестируют на клеточный белок известным методом [Lowry, O.H. et al.(1951) J. Biol. Biochem. 193, 265-275]. В некоторых экспериментах определяют поглощение восстановленного 125I-BBIssPal в клетки. 125I-BBIssPal восстанавливают DTT (50 мМ) при 60 С в течение 5 мин и затем еще 25 мин при 37 С. В контрольных экспериментах 125I-BBIssPal выдерживают в среде при тех же температурных условиях без добавления DTT. Поглощение 125I-BBIssPal в присутствииBSA (не содержащем жирных кислот) определяют следующим образом. 125I-BBIssPal инкубируют со средой, содержащей 0,1% BSA в течение 30 мин при 37 С перед добавлением к монослою клеток. В некоторых экспериментах по поглощению BSA сначала смешивают с трехкратным молярным избытком пальмитиновой кислоты и затем инкубируют с конъюгатами перед экспериментами. В экспериментах, где поглощение 125I-BBIssPal определяется в среде,содержащей FBS, конъюгаты просто добавляют к среде, содержащей требуемое количество FBS. Плотный монослой клеток, образовавшийся через 2 или 3 недели, и имеющий значениеTEER приблизительно 500 Омсм 2, сначала инкубируют со средой MEM Дульбекко, содержа 15 щей 1% FBS в течение 30 мин при 37 С. Далее инкубационную среду удаляют и конъюгаты 125I-BBI (10 мкг/мл) в 1,5 мл среды добавляют в апикальную часть лунок с проницаемым дном. В базальную часть лунок добавляют 2,5 мл среды и лунки инкубируют при 37 С. В предопределенное время всю среду из базальной лунки(2,5 мл) с проницаемым дном удаляют и проверяют на радиоактивность с помощью гаммасчетчика. В каждом эксперименте обычно отбирают семь образцов через 1, 2, 3, 4, 5, 6 и 24 ч после инкубации. После того, как отбирают образцы через 24 ч, монослой клеток трижды промывают охлажденным на льду PBS, вырезают включения и тестируют их на кумулятивную радиоактивность с помощью гамма-счетчика. Интеграцию конъюгатов 125I-BBI, транспортированных через монослои клеток, изучают с применением гель-фильтрационной хроматографии на колонке с Сефадексом G50. После того, как из базальной среды отбирают образец через 24 ч, 1,0 мл среды центрифугируют при 2000 об/мин и затем элюируют с колонки G50(10 мл) с использованием PBS; собирают по 1 мл фракции и ассоциированную с фракциями радиоактивность определяют на гаммасчетчике. Интактные конъюгаты элюируют с незаполненного объема колонки и фрагменты меньше, чем 1 кДа элюируют объемом колонки или более. Результаты поглощения 125I-BBI, как свободного белка, так и в конъюгированной форме с пальмитиновой кислотой, в присутствии различных количеств добавленной FBS, показаны в табл. 1. Когда конъюгаты инкубируют с клетками на среде без сыворотки, поглощениеBBIssPal было приблизительно в 140 раз выше,чем таковое BBI. В среде, содержащей 1% FBS,поглощение BBIssPal возрастает в 35 раз по сравнению с BBI. Повышение концентрации сыворотки далее до 10% вызывает дальнейшее уменьшение поглощения BBIssPal клетками только до 10-кратного уровня по отношению к нативной BBI. Поглощение BBIssPal клетками Сасо-2 значительно снижается в присутствии сыворотки для сред, содержащих 1% и 10% FBS- соответственно до 14% и 2,3% от значений для среды без сыворотки. Таблица 1 Поглощение (нг BBI/мг клеточного белка)/ч без сыворотки 1% FBS 10% FBS Монослой клеток инкубируют с 125Iмеченными конъюгатами в концентрации 10 мкг/мл в течение 60 мин при 37 С. Представленные результаты являются средними для трех монослоев SEM. Эксперименты по поглощению осуществляют при использовании среды Дульбекко в присутствии или отсутствии FBS. 16 Поскольку поглощение BBIssPal клетками,как полагают, уменьшается лигандами пальмитиновой кислоты конъюгата, изучают поглощение 125I-BBIssPal в клетки Сасо-2 перед и после восстановления DTT. Так как присутствие сыворотки в инкубационной среде обладало ингибирующим эффектом на поглощение конъюгатов клетками, этот процесс изучают в среде без сыворотки. Результаты показаны в табл. 2. Поглощение немеченного 125I-BBIssPal в клетки было в 80 раз выше, чем таковое 125I-BBI. Обработка 125I-BBI в DTT не вызывает уменьшения поглощения. Наоборот, восстановление 125IBBIssPal DTT уменьшает поглощение конъюгатов клетками приблизительно на 80%. Восстановление BBIssPal DTT вызывает отщепление пальмитиновой кислоты от конъюгата. Таким образом, поглощение 125I-BBIssPal опосредовано гидрофобным лигандом пальмитиновой кислоты. Таблица 2 Поглощение (нг ВВI/мг клеточного белка)/ч Необработанный Обработанный DTT ВВI 4,80,00 5,2+0,00 Поглощение клетками BBI, как нативного белка так и BBIssPal определяют перед и после восстановления DTT (50 мМ) в течение 5 мин при 60 С и 25 мин при 37 С. Известно, что бычий сывороточный альбумин (BSA) является in vivo переносчиком жирных кислот и содержит гидрофобные области, которые могут крепко связывать жирные кислоты. Так как поглощение 125I-BBIssPal уменьшается в присутствии сыворотки, была исследована вероятность, что I-BBIssPal связывается с BSA, содержащимся в FBS. Было изучено поглощение клетками 125I-BBIssPal и 125IBBI в среде, содержащей как свободный от жира BSA, так и BSA, связанный жирными кислотами. Результаты исследований показаны в таблице 3. В содержащей "свободный" BSA среде,поглощение клетками 125I-BBIssPal в 80 раз выше, чем таковое BBI, как и ожидается по результатам предыдущих экспериментов. Когда"обезжиренный" BSA (свободный от жирных кислот BSA) (0,1%) содержится в среде, поглощение 125I-BBIssPal снижается на 82%, тогда как на поглощение 125I-BBI это не влияет. КогдаBSA связывают с жирной кислотой (1%), в 3 кратном молярном избытке пальмитиновой кислоты, на поглощение 125I-BBI это опять не сказывается. Таким образом, 125I-BBIssPal эффективно связывается с BSA и этот процесс зависит от количества жирных кислот, уже связанных с 17 Эксперименты по поглощению выполняют на среде Дульбекко, в присутствии и отсутствии добавленного свободного от жирных кислотBSA (BSA) или BSA, связанного с жирной кислотой (BSA/FA). Результаты исследований по поглощению клетками Сасо-2 125I-BBI, как нативного, так и в конъюгированной форме с пальмитиновой или олеиновой кислотами, в бессывороточной среде представлены на фиг. 1. Результаты выражают как среднее количество(нг) включенного в клетки BBI SEM, n=3. Поглощение 125I-BBIssPal клетками приблизительно в 100 раз выше, чем 125I-BBI. Аналогично,поглощение 125I-BBIssOleic клетками приблизительно в 108 раз выше, чем 125I-BBI. Различие между поглощением 125I-BBIssPal и 125IBBIssOleic незначительно. Пример 4. Исследования биораспределения. Для экспериментов на животных используют самок мышей CF-1, в возрасте 2 и 3 недель, весом 20-25 г каждая, со свободным доступом к пище и воде перед экспериментами. 125I-BBI (3 мг/кг), как нативную форму, так и конъюгаты BBIssPal или BBIssOleic, вводят животным через хвостовую вену. Через 0,5, 3 и 24 ч после инъекции, по три животных из каждой экспериментальной группы забивают, удаляют почки, легкие и печень и отбирают кровь (200 мкл). Органы отмывают в охлажденном на льдуPBS, и вместе с кровью исследуют на кумулятивную радиоактивность. Вес органов записывают и используют для расчета концентрации конъюгатов в органах. В исследованиях биораспределения при внутрибрюшинном введении 125I-BBI (3 мг/кг),как нативную форму BBI, так и конъюгатыBBissPal, вводят в нижний левый квадрант брюшной полости каждого животного. Животные затем обрабатывают так, как описано выше для исследований биораспределения при внутривенном введении. Результаты исследований биораспределения ВВI и BBIssPal после внутривенного введения показаны на фиг. 2, как % кумулятивной дозы на г органа SEM. Результаты показывают,что, если ВВI быстро выводится из организма без достижения высокого уровня в крови, тоBBIssPal накапливается в крови на относительно высоких уровнях и медленнее удалялся из циркуляции. Результаты биораспределения в почках показывают, что если ВВI быстро аккумулируется в почках, то BBIssPal - нет. Накопление в печени BBIssPal примерно в 5 раз выше,чем ВВI, и уровни BBIssPal в печени остаются высокими даже через 24 ч после инъекции. Накопление BBIssPal в легких также приблизительно в 2 раза выше, чем ВВI, но этот результат может быть обусловлен наличием в органе после его иссечения остаточной крови. Ясно,что BBIssPal задерживается дольше и имеет более высокие уровни в крови и печени. С другой 18 стороны, выведение почками BBIssPal в 4 раза менее эффективно, чем нативного ВВI. Также было изучено биораспределение ВВI и BBIssOleic при внутривенном введении мышам CF-1. Результаты исследований представлены на фиг. 3, как % кумулятивной дозы на г органаSEM, n=3, через 0,5, 3 и 24 ч. Биораспределение BBIssOleic аналогично таковомуBBIssPal. Как и в случае BBIssPal, BBIssOleic имеет более высокую концентрацию в крови,чем BBI и гораздо медленнее выводится из циркуляции. Концентрация в крови BBIssOleic примерно в 4 раза выше, чем BBI в те же моменты времени. Выведение почками BBIssOleic примерно в четыре раза менее эффективно и накопление в печени BBIssOleic приблизительно в 4 раза выше, чем у нативной формы BBI. Задержка BBIssOleic в печени была пролонгированной, со значительным уровнем конъюгатов в печени даже через 24 часа после введения. Уровень BBIssOleic в легких примерно в 2 раза выше, чем уровень нативного BBI, но при этом нужно учитывать высокий уровень остаточной крови в легких. Результаты исследований биораспределения при внутрибрюшинном введении 125IBBIssPal мышам CF-1 показаны на фиг. 4, как % кумулятивной дозы на г органаотклонение(столбики), через 0,5 ч (фиг. 4 А), 3 ч (фиг. 4 В) и 24 ч после инъекции (фиг. 4 С). Накопление в почках 125I-BBIssPal была в 3 раза ниже, чем 125IBBI для моментов времени 0,5 и 3 ч. Через 24 ч уровни 125I-BBIssPal выше в почках, чем 125IBBI. Уровень в крови 125I-BBIssPal был аналогичен таковому 125I-BBI через 0,5 ч, в 1,5 раза выше чем BBI через 3 ч и приблизительно в 3 раза выше, чем BBI через 24 ч. Накопление в печени 125I-BBIssPal в 1,5 раза выше, чем 125IBBI через 0,5 ч, в 2,5 раза выше через 3 ч и приблизительно в 4 раза выше через 24 ч. Относительно высокое содержание 125I-BBIssPal обнаруживается в печени и почках через 24 ч. Пример 5. Исследования трансформации invitro. Опыты по трансформации выполняют с использованием клеток С 3 Н 10 Т 1/2 (клон 8) согласно опубликованным рекомендациям[Reznikoff, С.A. et al. (1973) Cancer Res. 33,3231-3238]. Исходные культуры клеток без микоплазмы поддерживают пассированием 50000 клеток на флакон площадью 75 см 2 каждые семь дней. Согласно данной схеме клетки всегда пассируют примерно за 2 дня до образования монослоя. Исходную культуру выращивают на основной среде Игла, с добавлением 10% FBS,пенициллина (100 единиц) и стрептомицина(100 мкг) и используют для опытов по трансформации на пассажах от 9 до 14. Клетки пассируют обработкой исходной культуры трипсином (0,1%) в PBS в течение 5 мин и инактивацией трипсина 5 мл среды. Эта процедура обеспечивает минимальную спонтанную трансформа 19 цию исходных культур и максимальную эффективность посева на чашки Петри. Запас FBS,используемой для культивирования клеток,предварительно проверяют на способность поддерживать экспрессию и рост трансформированных клеток. Для опытов по трансформации клетки С 3 Н 10 Т 1/2 (1000/ на чашку) засевают в чашки Петри диаметром 60 мм и выращивают в увлажненной атмосфере в присутствии 5% СО 2 в основной среде Игла, с добавлением 10% FBS, пенициллина (100 единиц) и стрептомицина (100 мкг), в течение 24 ч. Далее клетки обрабатывают 25 мкг 3-метилхолантрена (МСА) в исходном растворе в ацетоне (0,25 мкг/мл) до конечной концентрации 1 мкг/мл МСА (5 мкг/5 мл). Клетки выращивают в присутствии канцерогена или растворителя в течение 24 ч, и культуральную среду в каждой чашке затем заменяют свежей, не содержащей канцерогена или растворителя. Среду в чашках заменяют дважды в неделю в течение первых двух недель опыта, далее один раз в неделю в течение оставшихся четырех недель опыта. В экспериментах, проводимых для определения ингибиторной активности конъюгатов на трансформацию, клетки выращивают в среде, содержащей конъюгаты (1 мкг/мл) в течение первых трех недель опыта,далее клетки выращивают в среде, не содержащей конъюгатов. Через шесть недель после обработки канцерогеном клетки изучают под микроскопом на способность к прикреплению к чашкам для культивирования, промывают FBS и затем фиксируют в 100% метаноле. Фиксированные клеточные монослои затем окрашивают красителем Гимза. В каждом эксперименте исследуют 20 чашек на группу. В дополнение к опытным группам во все эксперименты по трансформации включают, по крайней мере, три другие группы: отрицательный контроль (без обработки канцерогеном или растворителем); ацетоновый контроль (обработка 20 мкл ацетона) и положительный контроль [обработка МСА (1 мкг/мл) в 25 мкл ацетона]. Очаги трансформации (3 мм в диаметре) на чашках изучают под микроскопом и классифицируют согласно опубликованным руководствам как типы I, II и III(ed. Kakunaga, T. and Yamasaki, H.) IARC Scientific Publications, Lyon, France pp. 185-201]. Коротко говоря, очаги типа III плотные, многослойные, базофильные, с областями клеточного роста, которые окрашиваются в синий цвет красителем Гимза и имеют грубые, пересеченные края. Очаги типа II также плотные, многослойные, но области клеточного роста окрашены красителем Гимза в фиолетовый (пурпурный) цвет и имеют более гладкие, нежные края по сравнению с очагами типа III. Очаги типа I не учитываются в опытах. 20 Эффективность посева (РЕ) клеток также изучают в каждом эксперименте по трансформации. Для определения РЕ в различных группах клетки из каждой экспериментальной группы (200 клеток на чашку) засевают в три чашки Петри (60 мм) и обрабатывают как описано выше в опытах по трансформации. Клетки отбирают через 10 дней, фиксируют в 100% метаноле и окрашивают красителем Гимза; колонии состоящие из 50 или более клеток, видимые под микроскопом, учитывают количественно. Эффективность посева определялась как (число колоний/число посеянных клеток)100. Антитрансформационная активность BBI,BBIssPal и BBIssOleic in vitro показана в таблице 4. BBI, как в виде свободного белка, так и в конъюгированной форме с пальмитиновой или олеиновой кислотой, добавляют к культурам (1 мкг/мл) в первые три недели опыта по трансформации, сразу же после обработки МСА. Обработанные МСА клетки подвергают воздействию 3-метилхолантрена, растворенного в 25 мкл ацетона, при концентрации 1 мкг/мл в течение 24 ч. Обработанные ацетоном клетки подвергают воздействию только 25 мкг ацетона в течение 24 ч. Экспериментальные группы клеток подвергают воздействию МСА в течение 24 ч и затем - конъюгатов в течение первых трех недель опыта. Необработанные клетки не подвергают воздействию ни МСА, ни ацетона. Результаты статистического анализа (метод ксиквадрата): Группа 4 против группы 3, р 0,05; Группа 5 против группы 3, 0,05 р 0,1; Группа 6 против группы 3, р 0,05. Контрольные необработанные клетки примерно через 14 дней после посева образуют плотный монослой и обладают контактным ингибированием. Соответствующие чашки не содержат трансформации. Обработанные ацетоном клетки также образуют плотный монослой через 14 дней после посева, не содержащие трансформации. В обработанных МСА чашках, однако, обнаруживаются очаги морфологической трансформации: в 6 из 19 включенных в опыт чашек выявляются очаги типа III. Группа чашек, обработанная BBI, не обнаруживает трансформации; это свидетельствует о том,что BBI может предотвращать индуцированную МСА трансформацию указанных клеток. Чашки с клетками, обработанными BBIssPal, содержат один очаг типа II на 20 включенных в опыт чашек. Клетки, обработанные BBIssOleic, не обнаруживают очагов трансформации. РЕ всех групп в этом опыте находится в интервале между 20% и 25%. Как показано в таблице 4 и BBIssPal, и Таблица 4 Эффектив- Количество Часть чашек, соность посе- чашек с держащих ва (%) очагами трансформа- очаги ции/Общее трансфорколичество мации чашек 231,5 Пример 6. Транспорт одиночных и множественных конъюгатов. Исследования транспорта 125I-BBIssPal,связанного с апикальной мембраной, выполняют при использовании панелей, с лунками,имеющими проницаемое дно и 6-луночных планшетов. В экспериментах с шестилуночными планшетами 125I-BBI или 125I-BBIssPal (10 мкг/мл) инкубируют с клетками Сасо-2 в среде без сыворотки в течение часа при 37 С. Далее клетки трижды промывают охлажденным на льду PBS и затем разделяют на две группы. В первой группе поглощение конъюгатов определяют после трипсинизации и сбора клеток. Во второй группе клетки еще раз инкубируют в среде без сыворотки, и высвобождение конъюгатов из клеток контролируют в течение 24 ч; среду собирают с часовыми интервалами и тестируют на радиоактивность. По окончании эксперимента клетки трипсинизируют, собирают и исследуют на кумулятивную радиоактивность. Определяют общую радиоактивность (срm) в каждом эксперименте (среда + клетки cpms) и вычисляют % высвобождаемых конъюгатов в разное время. В экспериментах с лунками, имеющими проницаемое дно, конъюгаты инкубируют с апикальной стороны лунок в течение 1 ч при 37 С. Лунки панелей промывают трижды охлажденным на льду PBS и затем снова инкубируют со средой без сыворотки. Высвобождение конъюгатов в апикальную и базальную среду контролируют в течение 24 ч путем определения радиоактивности "апикальной" или "базальной" среды в разное время. По окончании эксперимента определяют общую радиоактивность(% от общего) в различные моменты времени. Для подтверждения того, что результаты, полученные при использовании лунок с проницаемым дном через 24 ч, обусловлены присутствием конъюгатов в клетках, а не неспецифическим связыванием с пластиком, указанные лунки помещают в трипсин на 10 мин, промывают трижды охлажденным на льду PBS, и определяют их кумулятивную радиоактивность.BBI модифицируют реакцией с 2 или 4 молекулами пальмитиновой кислоты и определяют транспорт в лунках с проницаемым дном. Кумулятивный транспорт BBI, BBI, модифицированного 4 молекулами пальмитиновой кислоты [BBIssPal(4)] и BBI, модифицированного 2 молекулами пальмитиновой кислоты[BBIssPal(2)] в монослое клеток Сасо-2 оценивается на фиг. 5 А. Результаты выражены как количество BBI (нг/монослой)SEM, n=3. Полученные величины имеют следующий порядок:BBIssPal(4)BBIBBIssPal(2). Результаты экспериментов по поглощению конъюгатов теми же самыми клетками показаны на фиг. 5 В (нгBBI на монослой). Как и ожидалось, BBIssPal(4) имеет самую высокую величину поглощения клетками, затем следует BBIssPal(2) и BBI. Базальную среду, полученную через 24 ч из лунок с проницаемым дном проанализируют с использованием колонки, наполненной СефадексомG50; результаты показаны на фиг. 6. Как было замечено раньше ни BBI, ни BBIssPal(4) не подвергаются трансцитозу через монослои. Однако небольшое, но существенное количество базальной среды BBIssPal(2) содержит интактный конъюгат (примерно от 10 до 20% общей радиоактивности базальной среды). Пример 7. Абсорбция BBIssPal кожей. Свежеприготовленные образцы кожи от лишенных шерсти мышей закрепляют на небольших кольцах. На каждый образец кожиBBIssPal в концентрации 0,5 мг/мл. В каждом эксперименте используют два кусочка кожи. Кожу выдерживают при комнатной температуре(23 С) во влажной среде. Через 30 мин поверхность кожи сначала тщательно промывают PBS,потом кусочки кожи открепляют и дважды промывают в 100 мл PBS. Затем кожу подсушивают фильтровальной бумагой и определяют радиоактивность на гамма-счетчике. Количество BBI,оставшегося на коже, вычисляют по специфической радиоактивности меченных BBI илиBBIssPal. Абсорбция BBI или BBIssPal кожей мышей составляет 0,14 и 1,6 мкг/см 2, соответственно. Эти данные показывают, что более чем 10-кратное увеличение абсорбции BBI кожей достигается при модификациии полипептидаPal-PDC. Пример 8. Синтез пальмитилированной пероксидазы хрена (HRPssPal). 23 Десять миллиграммов пероксидазы хрена(молекулярный вес 40000; Сигма Р 8375) в 0,5 мл PBS смешивают с 2 мл SPDP в 0,1 мМ DMF при 25 С в течение двух часов. Реакцию останавливают разбавлением 0,5 мл PBS, и смесь диализуют в 500 мл PBS при 4 С. Через 24 ч раствор удаляют из диализной пробирки, восстанавливают добавлением 50 мкл DTT и разделяют с использованием колонки, наполненной Сефадексом G50. Фракции, снятые с незаполненного объема колонки, объединяют и смешивают с 10-кратным молярным избытком Pal-PDS в боратном буфере, рН 9,6 при 25 С в течение 4 ч. Реакционную смесь затем полностью диализуют при 4 С в течение 3 суток, и конечный продукт, по оценкам, содержит 10 остатков пальмитиновой кислоты на молекулу HRP. Молекулы HRP сохраняют примерно 20% первоначальной активности фермента. Пример 9. Поглощение HRPssPal клетками. Плотные клеточные монослои фибробластов мыши L929 в 6-луночных планшетах инкубируют в среде без сыворотки с 30 мкг/мл HRP(нативная HRP и конъюгат с пальмитиновой кислотой (HRPssPal. Через 1 ч при 37 С монослои трижды промывают PBS и затем лизируют в 1 мл 0,05% Тритона Х 100. Ассоциированную с клетками HRP определяют измерением активности фермента в каждом клеточном экстракте,и результаты выражают как количество HRP(нг) на монослой клеток. Они показывают, что поглощение HRP и HRPssPal клетками составляет 7 и 229 нг на монослой клеток, соответственно. Таким образом, 30-кратное повышение поглощения клетками достигается ее модификацией Pal-PDC. Пример 10. Липидизация олигонуклеотидов. Антисмысловой олигонуклеотид, состоящий из 21 олигонуклеотида, комплементарный мРНК моноаминоксидазы В, тиолируют следующим образом. Олигонуклеотид смешивают с двукратным молярным избытком цистамина в присутствии водорастворимого карбодиимидного реагента EDC. Смесь выдерживают при 25 С в течение 2 ч и затем добавляют двукратный молярный избыток по цистамину ДДТ для восстановления дисульфидных связей. После отделения олигонуклеотида от свободного цистамина и DTT с использованием колонки, наполненной Сефадексом G25, небольшое количество тиолированного олигонуклеотида вводят в реакцию с реагентом Элмена и содержание сульфгидрильных групп определяют по величине поглощения при 412 нм (считая эпсилон за 1,36 х 104 М-1). Далее определяют число сульфгидрильных групп на молекулу олигонуклеотида. Тиолированный олигонуклеотид смешивают в бикарбонатном буфере, рН 8, с Pal-PDC, взятым в двукратном молярном избытке по отношению к 24 числу сульфгидрильных групп в олигонуклеотиде. Пальмитилированый олигонуклеотид очищают на колонке, наполненной СефадексомG25. Из настоящего описания специалист может легко понять сущность изобретения и, не выходя за его рамки, осуществлять различные варианты изобретения. Все использованные здесь специфические термины имеют описательный смысл и не ограничивают объема изобретения,так же, как и эквивалентные понятия и изменения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение общей формулы VIR1 представляет собой водород, низший алкил или арил;R3 представляет собой гидроксил, фрагмент, содержащий липидную группу или аминокислотную последовательность, включающую 1 или 2 аминокислоты и заканчивающуюся-NНСН 2 СО-липид, причем, по крайней мере,один заместитель из R2 и R3 содержит липидную группу. 4. Соединение по п.1, отличающееся тем,что указанная липидная группа является гидрофобным заместителем, включающим примерно от 4 до 26 атомов углерода. 5. Соединение по п.1, отличающееся тем,что указанная липидная группа является гидрофобным заместителем, включающим примерно от 5 до 19 атомов углерода. 6. Способ повышения абсорбции соединения, содержащего сульфгидрильную группу,выбранного из группы, включающей пептиды,белки и олигонуклеотиды, в клетках млекопитающих, отличающийся тем, что получают на основе указанного сульфгидрилсодержащего соединения соединение общей формулы VIR1 представляет собой водород, низший алкил или арил;R3 - гидроксил, фрагмент, содержащий липидную группу или аминокислотную последовательность, включающую 1 или 2 аминокислоты и заканчивающуюся на -CO2H или -COR2, а затем обрабатывают клетки полученным соединением. 7. Способ по п.6, отличающийся тем, что-NНСН 2 СО-липид, причем, по крайней мере,один заместитель из R2 и R3 содержит липидную группу. 9. Способ пролонгированного сохранения в крови и тканях млекопитающих соединения,содержащего сульфгидрильную группу, выбранного из группы, включающей пептиды,белки и олигонуклеотиды, отличающийся тем,что получают на основе указанного сульфгидрилсодержащего соединения соединение общей формулы VIR1 - водород, низший алкил или арил;R3 - гидроксил, фрагмент, содержащий липидную группу или аминокислотную последовательность, включающую 1 или 2 аминокислоты и заканчивающуюся -CO2H или -COR2, а затем обрабатывают клетки полученным соединением. 10. Способ по п.9, отличающийся тем, что 26 один заместитель из R2 и R3 содержит липидную группу. 12. Соединение общей формулы V А-S-S-СН 2-CR1(NHCOR2)C(=O)R3,V где А - активирующий ароматический остаток;R1 - водород, низший алкил или арил;R3 - гидроксил, фрагмент, содержащий липидную группу или аминокислотную последовательность, включающую 1 или 2 аминокислоты и заканчивающуюся -СО 2 Н или -COR2. 13. Соединение по п.12, отличающееся тем, что А представляет собой 2-пиридил или 4 нитрофенил. 14. Соединение по п.12, отличающееся тем, что R1 представляет собой водород, R2 липидную группу, а R3 - гидроксил. 15. Соединение по п.12, отличающееся тем, что R1 представляет собой водород, R2 -СН 2 СН 2 СН(NН 2)СO2 Н или -СН 2 СН 2 СН(NНСОлипид)CО-липид и R3 - -NHCH2CO2H или-NНСН 2 СО-липид, причем, по крайней мере,один заместитель из R2 и R3 содержит липидную группу. 16. Способ получения соединения общей формулы VI, заключающийся в том, что обеспечивают взаимодействие соединения общей формулы PSH, где Р представляет собой пептид,белок или олигонуклеотид, с соединением общей формулы VR1 представляет собой водород, низший алкил или арил;R3 - гидроксил, фрагмент, содержащий липидную группу или аминокислотную последовательность, включающую 1 или 2 аминокислоты и заканчивающуюся -CO2H или -COR2. 17. Способ по п.16, отличающийся тем, что А представляет собой 2-пиридил или 4 нитрофенил. 18. Способ по п.16, отличающийся тем, что-NНСН 2 СО-липид, причем, по крайней мере,один заместитель из R2 и R3 содержит липидную группу. 20. Соединение общей формулы III А-S-S-СН 2-CR1(NH2)C(=O)R3,III гдеR3 представляет собой гидроксил или аминокислотную последовательность, включаю 27 щую 1 или 2 аминокислоты и заканчивающуюсяR1 - водород, низший алкил или арил.
МПК / Метки
МПК: A61K 31/44, C12P 21/06, G01N 33/92, C07K 16/38, C07H 19/048, C07D 213/70, C08G 69/04
Метки: сохранения, жирной, конъюгаты, тканях, промежуточные, производного, абсорбции, пролонгированного, соединения, кислоты, повышения, группу, конюгатов, способы, получения, крови, содержащего, сульфгидрильную, способ, млекопитающего
Код ссылки
<a href="https://eas.patents.su/17-584-konyugaty-soedineniya-soderzhashhego-sulfgidrilnuyu-gruppu-i-proizvodnogo-zhirnojj-kisloty-sposob-polucheniya-konyugatov-promezhutochnye-soedineniya-dlya-ih-polucheniya-sposoby-pov.html" rel="bookmark" title="База патентов Евразийского Союза">Конъюгаты соединения, содержащего сульфгидрильную группу, и производного жирной кислоты, способ получения конюгатов, промежуточные соединения для их получения, способы повышения абсорбции и пролонгированного сохранения в крови и тканях млекопитающего соединения, содержащего сульфгидрильную группу</a>
Предыдущий патент: Смесь ферментов, выделенных из бактерий clostridium histolyticum
Следующий патент: Способ прогнозирования перспективных площадей для поиска месторождений углеводородов
Случайный патент: Способ управления воздушным компрессором компрессорной установки












