Диамидные производные адамантана, содержащая их фармацевтическая композиция и их применение
Номер патента: 19546
Опубликовано: 30.04.2014
Авторы: Хименес Эрмогенес Н., Го Маоцзюнь, Ли Гуйин, Уайт Эндрю Д., Гренон Мишель, Ма Гил, Доллер Дарио
Формула / Реферат
1. Соединение формулы (I)
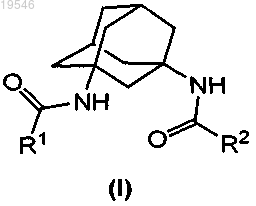
где R1 и R2, каждый независимо, представляют собой С3-С8-циклоалкил, арил или гетероарил, где каждый необязательно моно-, ди- или тризамещен независимо С1-С8-алкилом, С1-С8-алкокси, галогеном, циано, трифтор-C1-C8-алкилом, ди-С1-С8-алкиламино, ацилом, арилом, гетероарилом, гетероциклилом, гетероциклил-R3, -NHR3, -C(O)NHR3 или -С(О)N(C1-C8-алкил)R3,
где R3 представляет собой C1-С6-алкил, который необязательно замещен галогеном, C1-C3-алкокси, ОН,
-N(C1-C3-алкил)2 или -NHC(O)-C1-C3-алкилом;
где арил представляет собой фенил и
где гетероциклил выбран из морфолинила, пирролидинила и пиперазинила;
где гетероарил представляет собой пиридинил, пиримидинил, пиридазинил, тиазолил, пиразолил, индазолил, тиофенил, фуранил, бензофуранил, бензо[с]изоксазолил, бензоксазолил, бензотиазолил, имидазо[1,2-а]пиридинил, индазолил, индолил, изохинолинил, изоксазолил, нафтиридинил, оксазолил, пиразинил, пиримидинил, пирроло[3,2-b]пиридинил, хинолинил, хиноксалинил или дигидротиено[3,4-b][1,4]диоксинил;
при условии, что соединение формулы (I) не представляет собой
N,N'-(1,3-адамантилен)-бис-(3-метоксибензамид);
N,N'-(1,3-адамантилен)-бис-(4-этоксибензамид);
N,N'-(1,3-адамантилен)-бис-(4-метоксибензамид);
N,N'-(1,3-адамантилен)-бис-(3,4,5-триметоксибензамид);
N,N'-(1,3-адамантилен)-бис-(2-йод-бензамид);
N,N'-(1,3-адамантилен)-бис-бензамид;
N,N'-(1,3-адамантилен)-бис-(3-нитробензамид) и
N,N'-(1,3-адамантилен)-бис-(3-пиридинкарбоксамид),
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где R1 и R2, оба, представляют собой арил.
3. Соединение по п.1, где R1 и R2, оба, представляют собой гетероарил.
4. Соединение по п.1, где R1 представляет собой арил и R2 представляет собой гетероарил.
5. Соединение по п.1, где R1 представляет собой арил или гетероарил и R2 представляет собой циклоалкил или гетероциклил.
6. Соединение по п.1, где либо R1, либо R2 представляет собой гетероарил.
7. Соединение по п.1, где либо R1, либо R2 представляет собой арил.
8. Соединение по п.1, где либо R1, либо R2 представляет собой циклоалкил.
9. Соединение по п.1, где по меньшей мере один арил представляет собой фенил.
10. Соединение по п.1, где по меньшей мере один гетероарил представляет собой пиридинил, пиримидинил, пиридазинил, тиазолил, пиразолил, индазолил, тиофенил, фуранил, бензофуранил, бензо[с]изоксазолил, бензоксазолил, бензотиазолил, дигидротиено[3,4-b][1,4]диоксинил, имидазо[1,2-а]пиридинил, индазолил, индолинил, индолил, изохинолинил, изоксазолил, нафтиридинил, оксазолил, пиразинил, пирроло[3,2-с]пиридинил, хинолинил или хиноксалинил.
11. Соединение по п.1, где циклоалкил представляет собой циклобутил, циклогексил, циклопентил или циклопропил.
12. Соединение по п.1, где по меньшей мере один циклоалкил, арил или гетероарил замещен, как указано выше.
13. Соединение по п.12, где моно-, ди- или тризаместители независимо выбраны из группы, состоящей из метила, метокси, диметиламиноэтокси, амино, метиламино, диметиламино, циано, хлора, циано, диметиламино, диметиламиноэтокси, метила, метиламино, метокси, фтора, -C(O)NHCH3, фуранила, пирролидинила, тиофенила и трифторметила.
14. Соединение по п.12, где гетероарил представляет собой пиридинил и пиридинил моно-, ди- или тризамещен, как указано выше.
15. Соединение по п.14, где моно-, ди- или тризаместители независимо представляют собой гетероарил, гетероциклил, гетероциклил-R3, -NHR3, -N(алкил)N3, где R3 имеет значения, как указано выше.
16. Соединение по п.8, где циклоалкил тетразамещен фтором.
17. Соединение по п.1, где соединение представляет собой
N,N'-(1,3-адамантилен)-бис-(6-метилпиридин-2-карбоксамид);
N,N'-(1,3-адамантилен)-бис-(2-пиридинкарбоксамид);
N,N'-(1,3-адамантилен)-бис-(3-хлорбензамид);
N,N'-(1,3-адамантилен)-бис-(4-пиридинкарбоксамид);
N,N'-(1,3-адамантилен)-бис-(3-цианобензамид);
[3-(3-хлорбензоиламино)адамантан-1-ил]амид пиридин-2-карбоновой кислоты;
[3-(3-цианобензоиламино)адамантан-1-ил]амид пиридин-2-карбоновой кислоты;
{3-[(1-метил-5-тиофен-2-ил-1Н-пиразол-3-карбонил)амино]адамантан-1-ил}амид пиридин-2-карбоновой кислоты;
{3-[(5-фуран-2-ил-1-метил-1Н-пиразол-3-карбонил)амино]адамантан-1-ил}амид пиридин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 2-метил-2Н-индазол-3-карбоновой кислоты;
(3-бензоиламиноадамантан-1-ил)амид 6-метилпиридин-2-карбоновой кислоты;
[3-(4-диметиламинобензоиламино)адамантан-1-ил]амид пиридин-2-карбоновой кислоты;
[3-(4-метоксибензоиламино)адамантан-1-ил]амид пиридин-2-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид 6-метилпиридин-2-карбоновой кислоты;
[3-(3-цианобензоиламино)адамантан-1-ил]амид пиридин-2-карбоновой кислоты;
{3-[(бензофуран-5-карбонил)амино]адамантан-1-ил}амид пиридин-2-карбоновой кислоты;
{3-[4-(2-диметиламиноэтокси)бензоиламино]адамантан-1-ил}амид пиридин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 6-метилпиридин-2-карбоновой кислоты;
N,N'-(1,3-адамантилен)-бис-(4-метилпиридин-2-карбоксамид);
N,N'-(1,3-адамантилен)-бис-(хинолин-2-карбоксамид);
N,N'-(1,3-адамантилен)-бис-(хиноксалин-2-карбоксамид);
N,N'-(1,3-адамантилен)-бис-(тиофен-2-карбоксамид);
N,N'-(1,3-адамантилен)-бис-(3-фторбензамид);
N,N'-(1,3-адамантилен)-бис-(3-метилбензамид);
N,N'-(1,3-адамантилен)-бис-(1-метил-1Н-пиразол-3-карбоксамид);
{3-[(1-метил-1Н-пиразол-3-карбонил)амино]адамантан-1-ил}амид 5-метилпиразин-2-карбоновой кислоты;
{3-[(1-метил-1Н-пиразол-3-карбонил)амино]адамантан-1-ил}амид тиазол-2-карбоновой кислоты;
{3-[(1-метил-1Н-пиразол-3-карбонил)амино]адамантан-1-ил}амид 6-метилпиридин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-метилпиразин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-морфолин-4-илпиридин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-трифторметилпиридин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид пиридазин-3-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-цианометилпиридин-2-карбоновой кислоты;
{3-[(5-циклопропилизоксазол-3-карбонил)амино]адамантан-1-ил}амид 6-метилпиридин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид[1,8]нафтиридин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 4-метилпиридин-2-карбоновой кислоты;
{3-[(2-метилоксазол-4-карбонил)амино]адамантан-1-ил}амид 6-метилпиридин-2-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид 6-метилпиридин-2-карбоновой кислоты;
{3-[(изоксазол-5-карбонил)амино]адамантан-1-ил}амид 6-метилпиридин-2-карбоновой кислоты;
[3-(3-цианобензоиламино)адамантан-1-ил]амид 6-метилпиридин-2-карбоновой кислоты;
{3-[(бензофуран-5-карбонил)амино]адамантан-1-ил}амид 6-метилпиридин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид хиноксалин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид пиримидин-4-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид бензотиазол-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 1-метил-1Н-индазол-3-карбоновой кислоты;
{3-[(2,3-дигидротиено[3,4-b][1,4]диоксин-5-карбонил)амино]адамантан-1-ил}амид 6-метилпиридин-2-карбоновой кислоты;
{3-[(5-метилизоксазол-3-карбонил)амино]адамантан-1-ил}амид 6-метилпиридин-2-карбоновой кислоты;
{3-[(тиазол-2-карбонил)амино]адамантан-1-ил}амид 6-метилпиридин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид пиразин-2-карбоновой кислоты;
{3-[(1-этил-1Н-пиразол-3-карбонил)амино]адамантан-1-ил}амид 6-метилпиридин-2-карбоновой кислоты;
[3-(3-метоксибензоиламино)адамантан-1-ил]амид 6-метилпиридин-2-карбоновой кислоты;
[3-(3-пиримидин-2-илбензоиламино)адамантан-1-ил]амид 6-метилпиридин-2-карбоновой кислоты;
[3-(3-хлорметилбензоиламино)адамантан-1-ил]амид 6-метилпиридин-2-карбоновой кислоты;
[3-(циклобутанкарбониламино)адамантан-1-ил]амид 6-метилпиридин-2-карбоновой кислоты;
{3-[(3,3-дифторциклобутанкарбонил)амино]адамантан-1-ил}амид 6-метилпиридин-2-карбоновой кислоты;
{3-[(2-метилциклопропанкарбонил)амино]адамантан-1-ил}амид 6-метилпиридин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 2-метил-2Н-индазол-3-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-хлор-имидазо[1,2-а]пиридин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид имидазо[1,2-а]пиридин-7-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид имидазо[1,2-а]пиридин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид имидазо[1,2-а]пиридин-6-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-метилимидазо[1,2-а]пиридин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 5-метилимидазо[1,2-а]пиридин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 7-метилимидазо[1,2-а]пиридин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-хлорпиридин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 6-метилпиразин-2-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид пиридин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид пиримидин-4-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 6-пирролидин-1-илпиридин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид бензо[с]изоксазол-3-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 5-метилпиразин-2-карбоновой кислоты;
2-метиламид 6-({3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид)пиридин-2,6-дикарбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 2-метилбензоксазол-6-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 1Н-пирроло[3,2-b]пиридин-5-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 2,3-дигидро-1Н-индол-5-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 6-метоксипиридин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 1-метил-1Н-индол-5-карбоновой кислоты;
трет-бутиловый эфир 6-{3-[(пиридин-2-карбонил)амино]адамантан-1-илкарбамоил}-3,4-дигидро-1Н-изохинолин-2-карбоновой кислоты;
(3-бензоиламиноадамантан-1-ил)амид пиридин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 6-метилпиридин-2-карбоновой кислоты;
{3-[(5-метилизоксазол-3-карбонил)амино]адамантан-1-ил}амид пиридин-2-карбоновой кислоты;
{3-[(тиазол-2-карбонил)амино]адамантан-1-ил}амид пиридин-2-карбоновой кислоты;
{3-[(тиофен-2-карбонил)амино]адамантан-1-ил}амид пиридин-2-карбоновой кислоты;
{3-[(1-метил-1Н-пиразол-3-карбонил)амино]адамантан-1-ил}амид пиридин-2-карбоновой кислоты;
{3-[(изоксазол-5-карбонил)амино]адамантан-1-ил}амид пиридин-2-карбоновой кислоты;
{3-[(3-метилизоксазол-5-карбонил)амино]адамантан-1-ил}амид пиридин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 2-метил-2Н-индазол-3-карбоновой кислоты;
[3-(3-метоксибензоиламино)адамантан-1-ил]амид пиридин-2-карбоновой кислоты;
[3-(4-метоксибензоиламино)адамантан-1-ил]амид пиридин-2-карбоновой кислоты;
[3-(циклобутанкарбониламино)адамантан-1-ил]амид пиридин-2-карбоновой кислоты;
{3-[(2,2-дифторциклопропанкарбонил)амино]адамантан-1-ил}амид пиридин-2-карбоновой кислоты;
[3-(циклогексанкарбониламино)адамантан-1-ил]амид пиридин-2-карбоновой кислоты;
[3-(циклопентанкарбониламино)адамантан-1-ил]амид пиридин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 6-хлоримидазо[1,2-а]пиридин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид имидазо[1,2-а]пиридин-7-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид имидазо[1,2-а]пиридин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид имидазо[1,2-а]пиридин-6-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 6-метилимидазо[1,2-а]пиридин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 7-метилимидазо[1,2-а]пиридин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 5-метилимидазо[1,2-а]пиридин-2-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид пиримидин-4-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид 5-метилпиразин-2-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид пиразин-2-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид 6-метилпиразин-2-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид 1-метил-1Н-пиразол-3-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид 6-хлоримидазо[1,2-а]пиридин-2-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид имидазо[1,2-а]пиридин-7-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид имидазо[1,2-а]пиридин-2-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид имидазо[1,2-а]пиридин-6-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид 6-метилимидазо[1,2-а]пиридин-2-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид 5-метилимидазо[1,2-а]пиридин-2-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид 7-метилимидазо[1,2-а]пиридин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 6-морфолин-4-илпиридин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 6-(4-метилпиперазин-1-ил)пиридин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 6-(3-диметиламинопирролидин-1-ил)пиридин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 4-гидрокси-3,4,5,6-тетрагидро-2Н-[1,2']бипиридинил-6'-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 6-(3-гидроксипирролидин-1-ил)пиридин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 6-[(2-гидроксиэтил)метиламино]пиридин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 6-(3-гидроксипропиламино)пиридин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-[(2-диметиламиноэтил)метиламино]пиридин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-(3-гидроксипирролидин-1-ил)пиридин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 4-гидрокси-3,4,5,6-тетрагидро-2Н-[1,2]бипиридинил-6-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-[(2-метоксиэтил)метиламино]пиридин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-(2-гидроксиэтиламино)пиридин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-[(2-гидроксиэтил)метиламино]пиридин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-(3-гидроксипропиламино)пиридин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-морфолин-4-илпиридин-2-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид 6-(2-гидроксиэтиламино)пиридин-2-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид 6-[(2-гидроксиэтил)метиламино]пиридин-2-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид 6-(3-гидроксипропиламино)пиридин-2-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид 6-морфолин-4-илпиридин-2-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид 6-(4-метилпиперазин-1-ил)пиридин-2-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид 6-(3-диметиламинопирролидин-1-ил)пиридин-2-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид 4-гидрокси-3,4,5,6-тетрагидро-2Н-[1,2']бипиридинил-6'-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид 6-(3-гидроксипирролидин-1-ил)пиридин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 6-(3-метоксипропиламино)пиридин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 6-[(3-диметиламинопропил)метиламино]пиридин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 6-(2-диметиламиноэтиламино)пиридин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 6-(2-ацетиламиноэтиламино)пиридин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 6-(2-метоксиэтиламино)пиридин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 6-[(2-метоксиэтил)метиламино]пиридин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 6-(3-диметиламинопропиламино)пиридин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 6-[(2-диметиламиноэтил)метиламино]пиридин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 6-((S)-2-гидроксиметилпирролидин-1-ил)пиридин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 6-((R)-2-гидроксиметилпирролидин-1-ил)пиридин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 6-((S)-2-карбамоилпирролидин-1-ил)пиридин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-(3-метоксипропиламино)пиридин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-(2-диметиламиноэтиламино)пиридин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-[(3-диметиламинопропил)метиламино]пиридин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-(2-ацетиламиноэтиламино)пиридин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-(2-метоксиэтиламино)пиридин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-(3-диметиламинопропиламино)пиридин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-((S)-2-гидроксиметилпирролидин-1-ил)пиридин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-((R)-2-гидроксиметилпирролидин-1-ил)пиридин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-((S)-2-карбамоилпирролидин-1-ил)пиридин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-(2-карбамоилэтиламино)пиридин-2-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид 6-(3-метоксипропиламино)пиридин-2-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид 6-(2-диметиламиноэтиламино)пиридин-2-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид 6-[(3-диметиламинопропил)метиламино]пиридин-2-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид 6-(2-ацетиламиноэтиламино)пиридин-2-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид 6-(2-метоксиэтиламино)пиридин-2-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид 6-[(2-метоксиэтил)метиламино]пиридин-2-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид 6-(3-диметиламинопропиламино)пиридин-2-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид 6-[(2-диметиламиноэтил)метиламино]пиридин-2-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид 6-((S)-2-гидроксиметилпирролидин-1-ил)пиридин-2-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид 6-((R)-2-гидроксиметилпирролидин-1-ил)пиридин-2-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид 6-((S)-2-карбамоилпирролидин-1-ил)пиридин-2-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид 6-(2-карбамоилэтиламино)пиридин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 6-имидазол-1-илпиридин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-имидазол-1-илпиридин-2-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид 6-имидазол-1-илпиридин-2-карбоновой кислоты;
{3-[(6-метилпиразин-2-карбонил)амино]адамантан-1-ил}амид 6-(4-фторфенил)пиримидин-4-карбоновой кислоты;
{3-[(6-метилпиразин-2-карбонил)амино]адамантан-1-ил}амид 6-фенилпиримидин-4-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид пиримидин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 4-метилпиримидин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 4-трифторметилпиримидин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 2-метилпиримидин-4-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 2-трифторметилпиримидин-4-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 6-трифторметилпиразин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 5-трифторметилпиразин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид пиримидин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 4-метилпиримидин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 4-трифторметилпиримидин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 2-метилпиримидин-4-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 2-трифторметилпиримидин-4-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-трифторметилпиразин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 5-трифторметилпиразин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 5-фторпиридин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 5-фторпиридин-2-карбоновой кислоты;
{3-[(5-фторпиридин-2-карбонил)амино]адамантан-1-ил}амид пиразин-2-карбоновой кислоты;
{3-[(5-фторпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-метилпиразин-2-карбоновой кислоты;
{3-[(5-фторпиридин-2-карбонил)амино]адамантан-1-ил}амид 5-метилпиразин-2-карбоновой кислоты;
{3-[(5-фторпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-трифторметилпиразин-2-карбоновой кислоты;
{3-[(5-фторпиридин-2-карбонил)амино]адамантан-1-ил}амид 5-трифторметилпиразин-2-карбоновой кислоты;
{3-[(5-фторпиридин-2-карбонил)амино]адамантан-1-ил}амид пиримидин-2-карбоновой кислоты;
{3-[(5-фторпиридин-2-карбонил)амино]адамантан-1-ил}амид 4-метилпиримидин-2-карбоновой кислоты;
{3-[(5-фторпиридин-2-карбонил)амино]адамантан-1-ил}амид 4-трифторметилпиримидин-2-карбоновой кислоты;
{3-[(5-фторпиридин-2-карбонил)амино]адамантан-1-ил}амид 2-трифторметилпиримидин-4-карбоновой кислоты;
{3-[(5-фторпиридин-2-карбонил)амино]адамантан-1-ил}амид 2-метилпиримидин-4-карбоновой кислоты;
{3-[(5-фторпиридин-2-карбонил)амино]адамантан-1-ил}амид пиримидин-4-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид пиримидин-2-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид 4-метилпиримидин-2-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид 4-трифторметилпиримидин-2-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид 2-метилпиримидин-4-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид 2-трифторметилпиримидин-4-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид 6-трифторметилпиразин-2-карбоновой кислоты;
[3-(3-фторбензоиламино)адамантан-1-ил]амид 5-трифторметилпиразин-2-карбоновой кислоты;
{3-[3-(2-гидроксиэтокси)бензоиламино]адамантан-1-ил}амид 6-метилпиразин-2-карбоновой кислоты;
(3-{[4-(2-гидроксиэтокси)пиридин-2-карбонил]амино}адамантан-1-ил)амид 6-метилпиразин-2-карбоновой кислоты;
{3-[3-(2-гидрокси-2-метилпропокси)бензоиламино]адамантан-1-ил}амид 6-метилпиразин-2-карбоновой кислоты;
(3-{[4-(2-гидрокси-2-метилпропокси)пиридин-2-карбонил]амино}адамантан-1-ил)амид 6-метилпиразин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид пиразин-2-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 2,6-диметилпиримидин-4-карбоновой кислоты;
{3-[(пиридин-2-карбонил)амино]адамантан-1-ил}амид 4-фторпиридин-2-карбоновой кислоты;
{3-[(1,5-диметил-1Н-пиразол-3-карбонил)амино]адамантан-1-ил}амид пиридин-2-карбоновой кислоты;
{3-[(2-метилтиазол-4-карбонил)амино]адамантан-1-ил}амид пиридин-2-карбоновой кислоты;
[3-(3-диметиламинобензоиламино)адамантан-1-ил]амид 6-метилпиридин-2-карбоновой кислоты;
{3-[(пиридин-3-карбонил)амино]адамантан-1-ил}амид 6-метилпиридин-2-карбоновой кислоты;
{3-[(пиридин-4-карбонил)амино]адамантан-1-ил}амид 6-метилпиридин-2-карбоновой кислоты;
{3-[(6-аминопиридин-2-карбонил)амино]адамантан-1-ил}амид 6-метилпиридин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 2,6-диметилпиримидин-4-карбоновой кислоты;
{3-[(тиазол-4-карбонил)амино]адамантан-1-ил}амид 6-метилпиридин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид бензоксазол-5-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид[1,6]нафтиридин-2-карбоновой кислоты;
{3-[(2,3-дигидробензо[1,4]диоксин-6-карбонил)амино]адамантан-1-ил}амид 6-метилпиридин-2-карбоновой кислоты;
{3-[(4-фторпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-метилпиридин-2-карбоновой кислоты;
{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 4,6-диметилпиридин-2-карбоновой кислоты;
{3-[(1,5-диметил-1Н-пиразол-3-карбонил)амино]адамантан-1-ил}амид 6-метилпиридин-2-карбоновой кислоты;
{3-[(4-метоксипиридин-2-карбонил)амино]адамантан-1-ил}амид 6-метилпиридин-2-карбоновой кислоты;
{3-[(3-фторпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-метилпиридин-2-карбоновой кислоты;
{3-[(5-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-метилпиридин-2-карбоновой кислоты;
{3-[(4-гидроксипиридин-2-карбонил)амино]адамантан-1-ил}амид 6-метилпиридин-2-карбоновой кислоты;
2-амид 6-({3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид)пиридин-2,6-дикарбоновой кислоты;
{3-[(6-гидроксиметилпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-метилпиридин-2-карбоновой кислоты;
{3-[(6-фторпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-метилпиридин-2-карбоновой кислоты;
{3-[(2-метилтиазол-4-карбонил)амино]адамантан-1-ил}амид 6-метилпиридин-2-карбоновой кислоты;
{3-[(4-бромпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-метилпиридин-2-карбоновой кислоты;
метиловый эфир 6-{3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-илкарбамоил}пиридин-2-карбоновой кислоты;
{3-[(6-ацетилпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-метилпиридин-2-карбоновой кислоты;
{3-[(6-(1-гидроксиэтил)пиридин-2-карбонил)амино]адамантан-1-ил}амид 6-метилпиридин-2-карбоновой кислоты;
{3-[(6-(1-гидрокси-1-метилэтил)пиридин-2-карбонил)амино]адамантан-1-ил}амид 6-метилпиридин-2-карбоновой кислоты;
N,N'-(1,3-адамантилен)-бис-(6-метилпиразин-2-карбоксамид);
[3-(3-метоксибензоиламино)адамантан-1-ил]амид 6-метилпиразин-2-карбоновой кислоты;
[3-(3-этоксибензоиламино)адамантан-1-ил]амид 6-метилпиразин-2-карбоновой кислоты;
[3-(2,5-дифторбензоиламино)адамантан-1-ил]амид 6-метилпиразин-2-карбоновой кислоты;
[3-(3-хлор-4-фторбензоиламино)адамантан-1-ил]амид 6-метилпиразин-2-карбоновой кислоты;
[3-(2-фтор-3-трифторметилбензоиламино)адамантан-1-ил]амид 6-метилпиразин-2-карбоновой кислоты;
{3-[(6-метоксипиридин-2-карбонил)амино]адамантан-1-ил}амид 6-метилпиразин-2-карбоновой кислоты;
[3-(3-хлор-2-фторбензоиламино)адамантан-1-ил]амид 6-метилпиразин-2-карбоновой кислоты;
{3-[(4-метоксипиридин-2-карбонил)амино]адамантан-1-ил}амид 6-метилпиразин-2-карбоновой кислоты;
{3-[(2-метоксипиридин-4-карбонил)амино]адамантан-1-ил}амид 6-метилпиразин-2-карбоновой кислоты;
{3-[(2-этоксипиридин-4-карбонил)амино]адамантан-1-ил}амид 6-метилпиразин-2-карбоновой кислоты;
{3-[(2-метилпиридин-4-карбонил)амино]адамантан-1-ил}амид 6-метилпиразин-2-карбоновой кислоты;
{3-[(2-метилтиазол-4-карбонил)амино]адамантан-1-ил}амид 6-метилпиразин-2-карбоновой кислоты;
[3-(3-фтор-5-метилбензоиламино)адамантан-1-ил]амид 6-метилпиразин-2-карбоновой кислоты;
[3-(4-фтор-3-метоксибензоиламино)адамантан-1-ил]амид 6-метилпиразин-2-карбоновой кислоты;
{3-[(2-фторпиридин-4-карбонил)амино]адамантан-1-ил}амид 6-метилпиразин-2-карбоновой кислоты;
[3-(5-хлор-2-фторбензоиламино)адамантан-1-ил]амид 6-метилпиразин-2-карбоновой кислоты;
[3-(3-дифторметоксибензоиламино)адамантан-1-ил]амид 6-метилпиразин-2-карбоновой кислоты;
[3-(3-хлор-5-фторбензоиламино)адамантан-1-ил]амид 6-метилпиразин-2-карбоновой кислоты;
{3-[(6-фторпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-метилпиразин-2-карбоновой кислоты;
{3-[(5-метилпиридин-3-карбонил)амино]адамантан-1-ил}амид 6-метилпиразин-2-карбоновой кислоты;
[3-(4-фтор-3-метилбензоиламино)адамантан-1-ил]амид 6-метилпиразин-2-карбоновой кислоты;
[3-(2-фтор-3-метоксибензоиламино)адамантан-1-ил]амид 6-метилпиразин-2-карбоновой кислоты;
{3-[(3-метилпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-метилпиразин-2-карбоновой кислоты;
[3-(2-фтор-5-трифторметилбензоиламино)адамантан-1-ил]амид 6-метилпиразин-2-карбоновой кислоты;
{3-[(5-хлорпиридин-3-карбонил)амино]адамантан-1-ил}амид 6-метилпиразин-2-карбоновой кислоты;
{3-[(4-фторпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-метилпиразин-2-карбоновой кислоты;
{3-[(6-метилпиразин-2-карбонил)амино]адамантан-1-ил}амид пиримидин-2-карбоновой кислоты;
{3-[(6-метилпиразин-2-карбонил)амино]адамантан-1-ил}амид 2-метилпиримидин-4-карбоновой кислоты;
{3-[(6-метилпиразин-2-карбонил)амино]адамантан-1-ил}амид[1,6]нафтиридин-2-карбоновой кислоты;
{3-[(6-метилпиразин-2-карбонил)амино]адамантан-1-ил}амид бензоксазол-5-карбоновой кислоты;
{3-[(4-бромпиридин-2-карбонил)амино]адамантан-1-ил}амид 6-метилпиразин-2-карбоновой кислоты;
[3-(4-фторбензоиламино)адамантан-1-ил]амид 6-метилпиразин-2-карбоновой кислоты;
{3-[(2-бромпиридин-4-карбонил)амино]адамантан-1-ил}амид 6-метилпиразин-2-карбоновой кислоты;
{3-[(6-метилпиразин-2-карбонил)амино]адамантан-1-ил}амид 2-трифторметилпиримидин-4-карбоновой кислоты;
{3-[(6-метилпиразин-2-карбонил)амино]адамантан-1-ил}амид 4-трифторметилпиримидин-2-карбоновой кислоты;
{3-[(2-бромпиридин-4-карбонил)амино]адамантан-1-ил}амид пиразин-2-карбоновой кислоты;
{3-[(2-метилтиазол-4-карбонил)амино]адамантан-1-ил}амид пиразин-2-карбоновой кислоты;
{3-[(5-циклопропил-2Н-пиразол-3-карбонил)амино]адамантан-1-ил}амид пиразин-2-карбоновой кислоты;
{3-[(пиразин-2-карбонил)амино]адамантан-1-ил}амид 4-метилпиримидин-2-карбоновой кислоты;
{3-[(пиразин-2-карбонил)амино]адамантан-1-ил}амид 2-трифторметилпиримидин-4-карбоновой кислоты;
{3-[(2-метилпиримидин-4-карбонил)амино]адамантан-1-ил}амид 4-трифторметилпиримидин-2-карбоновой кислоты;
{3-[(4-метилпиримидин-2-карбонил)амино]адамантан-1-ил}амид 2-метилпиримидин-4-карбоновой кислоты;
{3-[(пиримидин-4-карбонил)амино]адамантан-1-ил}амид 4-метилпиримидин-2-карбоновой кислоты;
{3-[(пиримидин-4-карбонил)амино]адамантан-1-ил}амид 4-трифторметилпиримидин-2-карбоновой кислоты,
или его фармацевтически приемлемая соль.
18. Фармацевтическая композиция, содержащая по меньшей мере одно соединение по п.1 или его фармацевтически приемлемую соль и по меньшей мере один фармацевтически приемлемый носитель.
19. Способ лечения депрессии и беспокойства, который включает введение терапевтически эффективного количества по меньшей мере одного соединения по п.1 или его фармацевтически приемлемой соли.
Текст
ДИАМИДНЫЕ ПРОИЗВОДНЫЕ АДАМАНТАНА, СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ИХ ПРИМЕНЕНИЕ Изобретение относится к диамидным производным адамантана формулы (I) где R1 и R2 имеют указанные здесь значения, или их фармацевтически приемлемым солям, а также к фармацевтической композиции и способу лечения депрессии и беспокойства. Область техники, к которой относится изобретение Настоящее изобретение относится к диамидным производным адамантана, а также к фармацевтическим композициям и к способам лечения с их использованием. Предпосылки изобретения Настоящее изобретение относится к диамидным производным адамантана, которые действуют как аллостерические модуляторы метаботропного глютаматного рецептора 5 (рецепторы mGlu5, илиmGluR5), а также к фармацевтическим композициям и к способам лечения с использованием данных соединений. Глютамат является основным возбуждающим нейротрансмиттером центральной нервной системы млекопитающих. Одно подразумевает, что модулирование нейротрансмиссии глютамата осуществляется через метаботропные глютаматные рецепторы (mGluR); другое подразумевает ионотропные рецепторы. В настоящее время восемь mGluR были клонированы и классифицированы на три группы на основе степени родства между последовательностями предпочтительного пути сигнальной трансдукции и фармакологии. Группа I mGluR включает mGluR1 и mGluR5, тогда как группа II включает mGluR2 и mGluR3 и группа III включает рецепторы mGlu4, 6, 7 и 8. Рецепторы mGlu играют существенную роль в нормальном функционировании мозга, а также в неврологических, психиатрических и нервно-мышечных нарушениях. Рецепторы mGlu5 располагаются,главным образом, постсинаптически и высокоэкспрессированы в лимбические участки мозга. РецепторыmGlu5 также экспрессированы в таламус, спинной мозг и вагальные нервные системы, а также периферически в кожу на нервные окончания и С-волокна. Было показано, что лиганды рецепторов mGlu5 участвуют в нарушениях периферической и центральной нервной системы; см., например, G. Jaeschke et al., "mGlu5 receptor antagonists and their therapeutic potential", Expert Opin. Ther. Patents, 2008, 18, 2: 123-142. Существует еще предположение, что аналоги глютамата, нацеленные на участки ортостерического связывания, могут быть ограничены в использовании ввиду низкой проницаемости в мозг и недостаточной селективности в отношении подтипов mGluR. Синтетические агонисты могут приводить к продолжительной стимуляции рецептора, поскольку они часто могут быть метаболически стабильными. Эта продолжительная стимуляция не является обязательно желательной из-за возможных случаев гипосенсибилизации рецепторов. Также, что касается захвата рецепторов, синтетические антагонисты могут приводить к пролоугированной блокаде функции рецепторов, которая не может быть совместимой с кинетикой патологии нарушения центральной нервной системы. Однако более селективное и контролируемое "точно регулируемое" действие на рецептор mGlu5 допустимо через аллостерическую модуляцию; см., например, P. Bach et al., "Metabotropic glutamate receptor 5 modulators and their potential therapeutic applications", Expert Opin. Ther. Patents, 2007, 17, 4: 371381. Аллостерическая модуляция относится к связыванию модуляторного лиганда с сайтом на рецепторе,который отличается от ортостерического первичного субстратного или лигандного связывающего сайта. Этот процесс лигандного связывания приводит к конформационным изменениям, которые могут глубоко влиять на функцию белка (например, G-белоксвязанные рецепторы, такие как mGluR, включая mGluR5). Новые лиганды mGluR5, которые аллостерически модулируют рецептор mGlu5, могут улучшить терапевтическое окно обычных агентов центральной нервной системы и/или лечения нарушений центральной нервной системы. Настоящее изобретение касается указанных и других важных целей. Сущность изобретения Настоящее изобретение относится к соединению формулы (I) где R1 и R2, каждый независимо, представляют собой С 3-С 8-циклоалкил, арил или гетероарил, где каждый необязательно моно-, ди- или тризамещен независимо C1-C8-алкилом, C1-C8-алкокси, галогеном,циано, трифтор-C1-C8-алкилом, ди-C1-C8-алкиламино, ацилом, арилом, гетероарилом, гетероциклилом,гетероциклил-R3, -NHR3, -C(O)NHR3 или -С(О)N(C1-C8-алкил)R3, гдеR3 представляет собой С 1-С 6-алкил, который необязательно замещен галогеном, С 1-С 3-алкокси, ОН,-N(C1-С 3-алкил)2 или -NHC(O)-C1-C3-алкилом; где арил представляет собой фенил и где гетероциклил выбран из морфолинила, пирролидинила и пиперазинила; где гетероарил представляет собой пиридинил, пиримидинил, пиридазинил, тиазолил, пиразолил,индазолил, тиофенил, фуранил, бензофуранил, бензо[с]изоксазолил, бензоксазолил, бензотиазолил, имидазо[1,2-а]пиридинил, индазолил, индолил, изохинолинил, изоксазолил, нафтиридинил, оксазолил, пиразинил, пиримидинил, пирроло[3,2-b]пиридинил, хинолинил, хиноксалинил или дигидротиено[3,4b][1,4]диоксинил; при условии, что соединение формулы (I) не представляет собойN,N'-(1,3-адамантилен)-бис-(3-пиридинкарбоксамид),или его фармацевтически приемлемой соли. Настоящее изобретение касается также фармацевтической композиции, содержащей по меньшей мере одно соединение по изобретению или его фармацевтически приемлемую соль и по меньшей мере один фармацевтически приемлемый носитель. Настоящее изобретение касается также способа лечения депрессии и беспокойства, которое включает введение терапевтически эффективного количества по меньшей мере одного соединения по настоящему изобретению или его фармацевтически приемлемой соли млекопитающему при необходимости этого. Подробное описание изобретения В одном аспекте настоящее изобретение относится к диамидным производным адамантана. Настоящее изобретение включает соединение формулы (I) где R1 и R2, каждый независимо, представляют собой С 3-С 8-циклоалкил, арил или гетероарил, где каждый необязательно моно-, ди- или тризамещен независимо C1-C8-алкилом, C1-C8-алкокси, галогеном,циано, трифтор-C1-C8-алкилом, ди-C1-C8-алкиламино, ацилом, арилом, гетероарилом, гетероциклилом,гетероциклил-R3, -NHR3, -C(O)NHR3 или -С(О)N(С 1-С 8-алкил)R3, гдеR3 представляет собой С 1-С 6-алкил, который необязательно замещен галогеном, C1-C3-алкокси, ОН,-N(С 1-С 3-алкил)2 или -NHC(O)-C1-C3-алкилом; где арил представляет собой фенил и где гетероциклил выбран из морфолинила, пирролидинила и пиперазинила; где гетероарил представляет собой пиридинил, пиримидинил, пиридазинил, тиазолил, пиразолил,индазолил, тиофенил, фуранил, бензофуранил, бензо[с]изоксазолил, бензоксазолил, бензотиазолил, имидазо[1,2-а]пиридинил, индазолил, индолил, изохинолинил, изоксазолил, нафтиридинил, оксазолил, пиразинил, пиримидинил, пирроло[3,2-b]пиридинил, хинолинил, хиноксалинил или дигидротиено[3,4b][1,4]диоксинил; при условии, что соединение формулы (I) не представляет собойN,N'-(1,3-адамантилен)-бис-(3-пиридинкарбоксамид),или его фармацевтически приемлемую соль. Термин "алкил", используемый самостоятельно или в качестве части группы, обозначает в данном документе, если не указано иного, либо прямой, либо разветвленный насыщенный углеводород, содержащий от 1 до 8 атомов углерода. В некоторых вариантах осуществления изобретения алкильная группа содержит 8, 7, 6, 5, 4, 3, 2 или 1 атомов углерода. Если термин "алкил" приводится здесь без указания количества атомов углерода, это означает, что их число находится в интервале C1-C8. Примеры насыщенных углеводородных алкильных радикалов включают, но этим не ограничиваются, химические группы, такие как метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, изобутил, втор-бутил, нпентил, н-гексил и т.п. Термин "алкокси", используемый самостоятельно или в сочетании с другими терминами, обозначает в данном документе, если не указано иного, -О-алкил, где "алкил" имеет значения, указанные здесь выше. Примеры алкоксигрупп включают, но этим не ограничиваются, химические группы, такие как метокси, этокси, изопропокси, втор-бутокси, трет-бутокси и гомологи, изомеры и т.п. "Алкокси" относится также к -О-алкильной группе, где алкильная группа замещена гидрокси, циано, алкокси, алкиламино,-2 019546 диалкиламино, алкиламидом, диалкиламидом и т.п., включая, без ограничения, -OC1-C4-алкил-OH,-OC1-C4-алкил-ОСН 3,-OC1-C4-алкил-NHCH3,-OC1-C4-алкил-N(СН 3)2,-OC1-C4-алкил-CONHCH3,-OC1-C4-алкил-CON(CH3)2, -ОС 1-С 4-алкил-NHCOCH3 и -OC1-С 4 алкил-N(СН 3)СОСН 3. Как используется в настоящем описании, термин "циклоалкил", используемый самостоятельно или в сочетании с другими терминами, обозначает в данном документе, если не указано иного, циклическую алкильную группу, имеющую от 3 до 8 кольцевых атомов углерода, где "алкил" имеет указанные здесь значения. Примеры циклоалкильных групп включают, но этим не ограничиваются, химические группы,такие как циклопропил, циклобутил, циклопентил и циклогексил. Как используется в настоящем описании, термин "кетоциклоалкил", используемый самостоятельно или в сочетании с другими терминами, обозначает в данном документе, если не указано иного, циклоалкил, содержащий присоединенный к нему кеторадикал, где "циклоалкил" имеет указанные здесь значения. Примеры включают циклопентанон или циклогексанон. Термины "гало" или "галоген", используемые самостоятельно или в сочетании с другими терминами, обозначают в данном документе, если не указано иного, фтор, хлор, бром или йод. Термин "арил", используемый самостоятельно или в сочетании с другими терминами, обозначает в данном документе, если не указано иного, ароматический углеводород, содержащий до 14 атомов углерода, который может представлять собой одинарное кольцо (моноциклический) или много колец (например, бициклический, трициклический, полициклический), конденсированных или соединенных ковалентно. Любое подходящее положение кольца арильной группы может быть ковалентно связано с определенными химическими структурами. Примеры арильных групп включают, но этим не ограничиваются,химические группы, такие как фенил, бензил, 1-нафтил, 2-нафтил и т.п. Арильная группа может быть незамещенной или замещенной, как описано в данном документе. Термин "гетероарил", используемый самостоятельно или в сочетании с другими терминами, обозначает в данном документе, если не указано иного, моноциклическое или полициклическое (конденсированное или связанное ковалентно) ароматическое углеводородное кольцо, содержащее один или несколько гетероатомов, независимо выбранных из азота, кислорода и серы. Гетероарильная группа содержит до 14 атомов углерода и от 1 до 6 гетероатомов. Примеры гетероарильной группы включают, но этим не ограничиваются, пиридинил, пиридазинил, триазинил, пирролил, пиразолил, имидазолил, (1,2,3)и (1,2,4)-триазолил, пиразинил, пиримидинил, тетразолил, фурил, тиенил, изоксазолил, тиазолил, оксазолил, 2-хинолинил, 2-хиназолинил, 3-фенил-2-хинолинил и т.п. Гетероарильная группа может быть незамещенной или замещенной, как описано в данном документе. Термин "гетероциклил", используемый самостоятельно или в сочетании с другими терминами, обозначает в данном документе, если не указано иного, одновалентную группу, образованную путем удаления атома водорода от любого кольцевого атома гетероцикла. Термин "ацил", используемый самостоятельно или в сочетании с другими терминами, обозначает в данном документе, если не указано иного, группу формулы -С(О)-алкил, где алкил имеет значения, описанные здесь ранее; то есть алкилкарбонил, такой как формил, ацетил и т.п. Термин "аминоалкил", используемый самостоятельно или в сочетании с другими терминами, обозначает в данном документе, если не указано иного, алкиламино, где термин "алкил" имеет значения,указанные здесь выше, и термин "амино" представляет собой -NH2, -NH- или -N. Неограничивающие примеры включают -CH3NH-, CH3CH2NH-, (C1-C3-алкил)NH-, (C1-C3-алкил)2N- и т.п. Термин "алкиламино", используемый самостоятельно или в сочетании с другими терминами, обозначает в данном документе, если не указано иного, аминоалкил, где термин "алкил" имеет значения,указанные здесь выше, и термин "амино" представляет собой -NH2, -NH- или -N. Неограничивающие примеры включают -NHCH3, -NHCH2CH3, -NH(C1-C3-алкил), -N(C1-C3-алкил)2 и т.п. В некоторых вариантах осуществления изобретения R1 и R2, оба, представляют собой арил, представляющий собой фенил. В некоторых вариантах осуществления изобретения R1 и R2, оба, представляют собой гетероарил, представляющий собой пиридинил, пиримидинил, пиридазинил, тиазолил, пиразолил, индазолил, тиофенил, фуранил, бензофуранил, бензо[с]изоксазолил, бензоксазолил, бензотиазолил,имидазо[1,2-а]пиридинил, индазолил, индолил, изохинолинил, изоксазолил, нафтиридинил, оксазолил,пиразинил, пиримидинил, пирроло[3,2-b]пиридинил, хинолинил, хиноксалинил или дигидротиено[3,4b][1,4]диоксинил. В некоторых вариантах осуществления изобретения R1 представляет собой арил и R2 представляет собой гетероарил. В некоторых вариантах осуществления изобретения по меньшей мере один арил или гетероарил является замещенным, как описано выше. В некоторых таких вариантах осуществления изобретения 1, 2 или 3 заместителя независимо выбраны из группы, состоящей из метила, метокси, диметиламиноэтокси,диметиламино, циано, хлора, фтора, фуранила и тиофенила. В некоторых вариантах осуществления изобретения R1 и R2, каждый независимо, выбраны из группы, включающей фенил, 3- или 4-метилфенил, 3- или 4-хлорфенил, 3- или 4-фторфенил, 3- или 4 диметиламиноэтоксифенил, 3- или 4-диметиламинофенил, 3- или 4-цианофенил, 3-(5-метил[1,2,4]оксадиазол-3-ил)фенил, 1 Н-индол-5-ил, 1H-индол-6-ил, 1 Н-бензимидазол-5-ил, пиридил, 2 пиридил, 4-пиридил, 4- или 5-метилпиридин-2-ил, 6-метилпиридин-2-ил, 6-хлорпиридин-2-ил, пиразин-3 019546 2-ил, тиазол-2-ил, 5-(тиофен-2-ил)-1 Н-пиразол-3-ил, 1-метил-5-(тиофен-2-ил)-1 Н-пиразол-3-ил, 5-(фуран 2-ил)-1-метил-1 Н-пиразол-3-ил, индазол-3-ил, 2-метил-2 Н-индазол-3-ил, бензофуранил, бензофуран-5 ил. В некоторых вариантах осуществления изобретения соединение по настоящему изобретению представляет собой соединение, описанное в экспериментальной части ниже. В некоторых вариантах осуществления изобретения соединение является одним из указанных в табл. 1-3 или 4 ниже. В некоторых вариантах осуществления изобретения R1 и R2, оба, представляют собой арил, представляющий собой фенил. В некоторых вариантах осуществления изобретения R1 и R2, оба, представляют собой гетероарил, представляющий собой пиридинил, пиримидинил, пиридазинил, тиазолил, пиразолил, индазолил, тиофенил, фуранил, бензофуранил, бензо[с]изоксазолил, бензоксазолил, бензотиазолил,имидазо[1,2-а]пиридинил, индазолил, индолил, изохинолинил, изоксазолил, нафтиридинил, оксазолил,пиразинил, пиримидинил, пирроло[3,2-b]пиридинил, хинолинил, хиноксалинил или дигидротиено[3,4b][1,4]диоксинил. В некоторых вариантах осуществления изобретения R1 представляет собой арил и R2 представляет собой гетероарил. В некоторых вариантах осуществления изобретения либо R1, либо R2 представляет собой гетероарил. В некоторых вариантах осуществления изобретения либо R1, либо R2 представляет собой арил. В некоторых вариантах осуществления изобретения оба гетероарила выбраны из группы, содержащей по меньшей мере один гетероарил, и представляют собой пиридинил, пиримидинил, пиридазинил,тиазолил, пиразолил, индазолил, тиофенил, фуранил, бензофуранил, бензо[с]изоксазолил, бензоксазолил,бензотиазолил, имидазо[1,2-а]пиридинил, индазолил, индолил, изохинолинил, изоксазолил, нафтиридинил, оксазолил, пиразинил, пиримидинил, пирроло[3,2-b]пиридинил, хинолинил, хиноксалинил или дигидротиено[3,4-b][1,4]диоксинил. В некоторых вариантах осуществления изобретения гетероарил представляет собой пиридинил и пиридинил является моно-, ди- или тризамещенным, как указано выше. В некоторых таких вариантах осуществления изобретения моно-, ди- или тризаместители независимо представляют собой гетероарил,гетероциклил, гетероциклил-R3, -NHR3, где R3 такой, как указано выше. В некоторых вариантах осуществления изобретения R1 представляет собой арил или гетероарил и 2R представляет собой C3-С 8-циклоалкил. В некоторых вариантах осуществления изобретения либо R1,либо R2 представляет собой С 3-С 8-циклоалкил. В некоторых вариантах осуществления изобретения по меньшей мере один циклоалкил представляет собой циклобутил, циклогексил, циклопентил или циклопропил. В некоторых вариантах осуществления изобретения циклоалкил замещен далее сверх трех замещений, указанных ранее, то есть циклоалкил замещен более трех раз, как описано выше; например,циклоалкил тетразамещен фтором. В некоторых вариантах осуществления изобретения по меньшей мере один циклоалкил, гетероциклил, арил или гетероарил замещен, как описано выше. В некоторых таких вариантах осуществления изобретения 1, 2 или 3 заместителя независимо выбраны из группы, состоящей из метила, метокси, диметиламиноэтокси, метиламино, диметиламино, циано, хлора, фтора, фуранила и тиофенила. В некоторых вариантах осуществления изобретения моно-, ди- или тризаместители независимо выбраны из группы, состоящей из хлора, циано, диметиламино, диметиламиноэтокси, метила, метиламино,метокси, фтора, -C(O)NHCH3, фуранила, пирролидинила, тиофенила и трифторметила. В некоторых вариантах осуществления изобретения соединение по настоящему изобретению представляет собой соединение, описанное в экспериментальной части ниже. В некоторых вариантах осуществления изобретения соединение является одним из указанных в табл. 1-3 или 4 ниже. Другим аспектом настоящего изобретения является композиция, которая содержит фармацевтически эффективное количество соединения в соответствии с настоящим изобретением и фармацевтически приемлемый носитель или вспомогательное вещество. Композиция по настоящему изобретению может быть пригодна для любого способа введения, такого как пероральное (включая сублингвальное), через импланты, парентеральное (включая внутривенные,интраперитонеальные, внутрисуставные и подкожные инъекции), ректально, интраназально, местно, в глаза (посредством глазных капель), вагинально и трансдермально. Соединение по настоящему изобретению может использоваться либо в виде свободного основания,либо в виде солей, полученных из фармацевтически приемлемых кислот или оснований. Соли включают,без ограничения, следующие: соли с неорганическими кислотами, например с хлористо-водородной кислотой, бромисто-водородной кислотой, серной кислотой, азотной кислотой и фосфорной кислотой, и с органическими кислотами, например с уксусной кислотой, щавелевой кислотой, лимонной кислотой,винной кислотой, янтарной кислотой, малеиновой кислотой, бензойной кислотой, бензолсульфоновой кислотой, фумаровой кислотой, яблочной кислотой, метансульфоновой кислотой, памоевой кислотой и пара-толуолсульфоновой кислотой. Другие соли включают соли со щелочными металлами или щелочноземельными металлами, например с натрием, калием, кальцием и магнием, или с органическими основаниями, включая четвертичные соли аммония. Следующие нелимитирующие примеры солей с фармацевтически приемлемыми неорганическими и органическими кислотами включают те, которые указаны в работах [S.M. Berge et al., J. Pharm. Sci. 1977, 66, 1: 2 и G.S. Paulekuhn, et al., J. Med. Chem. 2007, 50, 26: 6665-6672]. Соединение по настоящему изобретению также может быть использовано в виде его сложного эфира, карбамата и другой общеизвестной формы пролекарства, которая обычно является функциональным производным соединения, легко преобразующимся в активную форму in vivo. Также включены метаболиты соединения по настоящему изобретению, определяемые как активные образцы, образуемые при введении соединения в биологическую систему. Когда соединение по настоящему изобретению используется так, как описано выше, оно может быть объединено с одним или несколькими фармацевтически приемлемыми вспомогательными веществами или носителями, например растворителями, разбавителями и т.п. Такие фармацевтические препараты могут быть введены перорально в таком виде, как таблетки, капсулы (включая, например, препараты с отсроченным и с замедленным высвобождением), пилюли, пастилки, аэрозоли, диспергируемые порошки, гранулы, растворы, суспензии (содержащие, например, суспендирующий агент, например, в количестве от приблизительно 0,05 до приблизительно 5% суспендирующего агента), сиропы (содержащие,например, сахар или заменитель сахара, такой как аспартам, например, в количестве от приблизительно 10 до приблизительно 50% сахара или заменителя сахара), эликсиры и т.п., или парентерально в виде стерильных растворов для инъекций, суспензий или эмульсий, содержащих, например, от приблизительно 0,05 до приблизительно 5% суспендирующего агента в изотонической среде. Такие препараты могут содержать, например, от приблизительно 25 до приблизительно 90 мас.% активного ингредиента в сочетании с носителем, более обычно от приблизительно 5 и до приблизительно 60 мас.%. Эффективная доза используемого активного ингредиента (например, соединение или соль по настоящему изобретению и его пролекарство или метаболит) может меняться в зависимости от конкретного используемого соединения, соли, пролекарства или метаболита, способа введения, возраста, массы, пола и медицинских показаний пациента и серьезности заболевания, нарушения, состояния и/или системы, подвергаемых лечению. Выбор подходящего пути введения и лекарственной формы для каждого отдельного млекопитающего понятен специалисту в данной области. Такие определения являются обычными для врача, ветеринара или клинициста среднего уровня в данной области (см., например, Harrison's Principles of Internal Medicine, Anthony Fauci et al. (eds.) 14th ed. New York: McGraw Hill (1998. Кроме того, может быть установлен режим доз для обеспечения оптимального терапевтического ответа. Например, несколько разделенных доз могут быть введены в течение суток или доза может быть пропорционально уменьшена, как это следует по показаниям терапевтической ситуации. Могут быть использованы твердые носители, например крахмал, лактоза, дикальций фосфат, микрокристаллическая целлюлоза, сахароза и каолин, жидкие носители, например стерильная вода, полиэтиленгликоли, глицерин, неионные поверхностно-активные вещества и пищевые масла, такие как кукурузное, арахисовое и кунжутное масла, смотря что является подходящим в соответствии с природой активного ингредиента и конкретного вида желаемого пути введения. С успехом могут быть включены вспомогательные вещества, обычно используемые при получении фармацевтических композиций. Неограничивающие примеры вспомогательных веществ включают ароматизирующие агенты, окрашивающие агенты, консервирующие агенты и антиоксиданты, такие как витамин Е, аскорбиновая кислота, ВНТ и ВНА. Активное соединение также может быть введено парентерально или внутрибрюшинно. Растворы или суспензии активного соединения в виде свободного основания, нейтрального соединения или фармакологически приемлемой соли могут быть получены в воде, подходящим образом смешанной с поверхностно-активным соединением, таким как гидроксипропилцеллюлоза. Дисперсии также могут быть получены в глицерине, жидких полиэтиленгликолях и их смесях в маслах. Данные препараты могут содержать консервант для предупреждения роста микроорганизмов в обычных условиях хранения и использования. Фармацевтические формы, подходящие для инъекционного или инфузионного применения, включают стерильные водные растворы, суспензии или дисперсии, а также стерильные порошки, предназначенные для приготовления с целью немедленного приема стерильных подходящих для инъекционного или инфузионного растворов, суспензий или дисперсий. Во всех случаях форма должна быть стерильной и должна быть текучей настолько, чтобы быть легко инъекцируемой или инфузируемой. Она должна быть стабильной в условиях производства и хранения и должна быть защищена от вредного воздействия микроорганизмов. Носителем может быть среда растворителя или дисперсии, содержащая, например,воду, этанол и полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль), их подходящие смеси и растительное масло. Далее, активные соединения по настоящему изобретению могут быть введены интраназально или трансдермально, используя наполнители, подходящие для интраназальной или трансдермальной доставки, известные обычному специалисту в данной области. Трансдермальное введение включает все виды введения через поверхность тела и иные телесные проникающие покрытия, включая эпителиальные и слизистые ткани, используя системы носителей, такие как лосьоны, кремы, пены, пасты, пластыри, суспензии, растворы и суппозитории (ректальные и вагинальные). Кремы и мази могут быть вязкими жидкими или полутвердыми эмульсиями типа либо масло-в-воде, либо вода-в-масле. Пасты, содержащие абсорбирующие порошки в бензине или гидрофильном бензине, содержащие активный ингредиент, также могут быть подходящими. Для доставки активного ингредиента в кровяной поток могут быть использованы различные закрытые устройства, такие как полупроницаемая мембрана, покрывающая резервуар,содержащий активный ингредиент с носителем или без носителя, или матрикс,содержащий активный ингредиент. Другие закрытые устройства известны из литературы. Когда используют трансдермальную систему доставки, введение дозы будет более продолжительным, чем разовая или разделенная дневная доза. Соединение по настоящему изобретению также может быть введено в виде липосомной системы доставки, где липосомный липидный би-слой образован из различных фосфолипидов. Соединение по настоящему изобретению также может быть доставлено с помощью носителя, такого как моноклональные антитела, с которыми связано соединение. Другие носители, с которыми соединение по настоящему изобретению также может быть связано, представляют собой растворимый полимер или биоразлагаемый полимер, используемый при достижении контролируемого высвобождения активного ингредиента. Специалистам в данной области понятно, что некоторые соединения по настоящему изобретению могут содержать один или несколько асимметрических центров и поэтому могут быть в виде энантиомеров и диастереомеров. Настоящее изобретение включает все стереоизомеры, включая индивидуальные диастереомеры и разделенные, энантиомерно чистые стереоизомеры, а также рацематы и все другие варианты стереоизомеров и их смеси и фармацевтически приемлемые соли, которые обладают указанной активностью. Оптические изомеры могут быть получены в чистом виде общеизвестными способами,известными специалистам в данной области, и включают, но этим не ограничиваются, хиральные хроматографические разделения, образование диастереомерной соли, кинетическое перерастворение и асимметрический синтез. Следует также учесть, что данное изобретение охватывает все возможные изомеры положения, эндо-экзо-изомеры и их смеси, которые обладают указанной активностью. Такие изомеры могут быть получены в чистом виде общеизвестными способами, известными специалистам в данной области, и включают, но этим не ограничиваются, колоночную хроматографию, тонкослойную хроматографию и жидкостную хроматографию высокого разрешения. Специалистам в данной области понятно,что некоторые соединения по настоящему изобретению могут быть хиральными ввиду затрудненного вращения, и давать атропизомеры, которые могут быть разделены и получены в чистом виде с помощью общеизвестных методов, известных специалистам в данной области. Специалистам в данной области понятно также, что некоторые соединения по настоящему изобретению имеют структурные изомеры,включая таутомеры. В данное изобретение включены также все полиморфы и гидраты соединений по настоящему изобретению. Другим аспектом настоящего изобретения является способ применения соединений по изобретению. Следует учесть, что изобретение охватывает одновременное, последовательное или отдельное применение любого сочетания соединений по изобретению с любой фармацевтической композицией, используемой в способах, описанных здесь. В некоторых вариантах осуществления изобретения способ включает введение эффективного количества сочетания двух или нескольких соединений, описанных здесь, или их солей. Следует особенно отметить, что фраза "сочетание двух или нескольких соединений, описанных здесь, или их солей" или"по меньшей мере одно соединение, описанное здесь, или его фармацевтически приемлемая соль" или подобное выражение, описывающее конкретные соединения, включает введение такого соединения в любом соотношении и сочетании солей, нейтральных или форм свободных оснований; то есть включает введение такого соединения любого в форме основания, любого в нейтральном виде или любого в виде соли, или одного или нескольких в виде основания и одного или нескольких в нейтральном виде, или одного или нескольких в виде основания и одного или нескольких в виде соли, или одного или нескольких в нейтральном виде и одного или нескольких в виде соли, в любом соотношении нейтрального и/или основного соединения и/или соли. Как используется в настоящем описании, фраза "эффективное количество", когда применяется к соединению по изобретению, предназначена для указания количества, достаточного для проявления предполагаемого биологического эффекта. Фраза "терапевтически эффективное количество", когда применяется к соединению по изобретению, предназначена для указания количества, достаточного для улучшения, временного облегчения, стабилизации, обратного протекания, замедления или остановки развития нарушения или состояния заболевания или симптома нарушения или заболевания. В некоторых вариантах осуществления изобретения способ по настоящему изобретению относится к введению сочетаний соединений. В таком случае "эффективное количество" является количеством сочетания, достаточного для проявления предполагаемого биологического эффекта. Термин "лечение" или "обработка", как используется в настоящем описании, подразумевает исцеление, улучшение или реверсию развития заболевания или нарушения или улучшение или реверсию одного или нескольких симптомов или побочных эффектов такого заболевания или нарушения. "Лечение" или "обработка", как используется в настоящем описании, также подразумевает ингибирование или блокирование, в виде задержки, подавления, сдерживания, препятствия или затруднения, развития системы,-6 019546 условия или состояния заболевания или нарушения. В целях данного изобретения "лечение" или "обработка", кроме того, подразумевает возможность достижения успешных или желаемых клинических результатов, где "успешные или желаемые клинические результаты" включают, без ограничения, облегчение симптома, уменьшение длительности нарушения или заболевания, стабилизацию состояния (то есть не усугубление) заболевания или нарушения, задержку или замедление состояния заболевания или нарушения, улучшение или временное облегчение состояния заболевания или нарушения и ремиссию заболевания или нарушения, либо частично, либо полностью, поддающиеся обнаружению или не поддающиеся обнаружению. Термин "предотвращать" или "предохранять", как используется в настоящем описании, подразумевает предохранение от возникновения или усиления заболевания. Термин "введение", как используется в настоящем описании, относится либо к прямому введению соединения по настоящему изобретению, либо к введению пролекарства, производного или их аналога, что будет обеспечивать эффективное количество соединения у млекопитающего. Настоящее изобретение также касается способа лечения депрессии и беспокойства, который включает введение терапевтически эффективного количества по меньшей мере одного соединения по настоящему изобретению или его фармацевтически приемлемой соли млекопитающему при необходимости этого. Соединение по настоящему изобретению может аллостерически модулировать рецептор mGlu5. Аллостерический модулятор, который повышает или усиливает действие сродства ортостерического лиганда по отношению к рецептору mGluR5 и/или повышает или усиливает эффективность ортостерических агонистов, представляет собой аллостерический усиливатель (или потенциатор) или положительный аллостерический модулятор (РАМ); см., например, May, L.T. Annu. Rev. Pharmacol. Toxicol. 2007,47, 1-51. Аллостерический модулятор, который уменьшает или ослабляет сродство ортостерического лиганда по отношению к рецептору mGluR5 и/или уменьшает или ослабляет эффективность ортостерических агонистов, представляет собой аллостерический антагонист (или ингибитор) или отрицательный аллостерический модулятор (NAM). В некоторых вариантах осуществления изобретения млекопитающим по способу по изобретению является человек. В некоторых вариантах осуществления изобретения депрессия выбрана из группы, включающей атипичную депрессию, биполярную депрессию, униполярную депрессию, большую депрессию, эндогенную депрессию (то есть острую депрессию без очевидной причины), инволюционную депрессию (то есть депрессию, которая встречается в середине жизни или в пожилом возрасте), реактивную депрессию (то есть депрессию, вызванную обычным травматическим жизненным событием), постнатальную депрессию, первичную депрессию (то есть депрессию, которая не имеет явной физической или психологической причины, такая как медицинское заболевание или расстройство), психотическую депрессию и вторичную депрессию (то есть депрессию, которая кажется вызванной другим основным состоянием, таким как другое медицинское заболевание или расстройство). В некоторых вариантах осуществления изобретения по меньшей мере один симптом депрессии представляет собой подавленное настроение, депрессивное состояние, потерю интереса или удовольствия в некоторых или во всех видах активности, изменение аппетита, изменение массы тела, изменение в характере сна, упадок сил, усталость, заниженную самооценку, ослабление умственных способностей,внимания или решительности, чувство безысходности или бесполезности, психомоторное возбуждение или заторможенность, самообвинение, чувство несуществующей вины, частые мысли о смерти или самоубийстве, планы или попытки совершения самоубийства или их сочетание. В некоторых вариантах осуществления изобретения по меньшей мере один симптом беспокойства представляет собой ощущение тревоги, страх, нервную дрожь, мышечную боль, инсомнию, абдоминальные расстройства, головокружение, чувствительность, постоянно повторяющиеся навязчивые мысли,компульсивые побуждения, учащенное сердцебиение, боль в груди, дискомфорт в груди, потоотделение,ощущение покалывания, чувство удушья, страх потери контроля, повторяющиеся яркие ментальные образы, ониродинии, навязчивые мысли, навязчивые воспоминания, поведение избегания, эмоциональное оцепенение, невозможность уснуть, чувство беспокойства, сверхактивный старт-рефлекс, сверхнастороженность, взрывы гнева, обмороки, покраснение, профузное потоотделение или их сочетание. Получение соединений по настоящему изобретению Соединения по настоящему изобретению могут быть получены, без ограничения, в соответствии с одним из общих способов, описанных ниже. Например, схемы 1-11, представленные далее, предназначены для иллюстрации некоторых вариантов осуществления настоящего изобретения, но не предназначены для ограничения настоящего изобретения. Далее раскрыты используемые здесь аббревиатуры, если не указано иного для конкретных случаев. ВОР = бензотриазол-1-илокси-трис-(диметиламино)фосфоний гексафторфосфат, CAS56602-336,ДХМ = дихлорметан или метиленхлорид,DIEA = N,N-диизопропилэтиламин, CAS7087-68-5,-7 019546DMA = N,N-диметилацетамид, CAS127-19-5,DMC = диметилимидазолиний хлорид,ДМФА = N,N-диметилформамид, CAS68-12-2,DPPA = дифенилфосфорил азид, CAS26386-88-9,EDCI = N-этил-N'-(3-диметиламинопропил)карбодиимид гидрохлорид, CAS93128-40-6,HBTU = 2-(1 Н-бензотриазол-1-ил)-1,1,3,3-тетраметилуроний гексафторфосфат, CAS94790-37-1,NMP = N-метилпирролидон, CAS872-50-4,РуВОР = бензотриазол-1-илокситрипирролидинофосфоний гексафторфосфат, CAS128625-52-5,RT или к.т. = комнатная температура,TBTU = О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилуроний тетрафторборат, CAS125700-67-6,TEA = триэтаноламин, CAS102-71-6,ТГФ = тетрагидрофуран, CAS109-99-9. Симметричные амиды формулы (I) (R1=R2) могут быть получены способом, представленным на схеме 1, используя общеизвестные способы амидирования, исходя из коммерчески доступного соединения 1, адамантан-1,3-диамина, где R1 равен R2 и R1 и R2 такие, как указано в настоящем документе выше. Схема 1b) R1COCl, DIEA или Et3N, CH2Cl2. Несимметричные амиды формулы (I) (R1R2) могут быть также получены способами, представленными на схемах 2 и 3, где R1 и R2 являются такими, как указано в настоящем документе выше. Схема 2b) 1,1 экв. R1COCl, 1,1 экв. R2COCl, DIEA, CH2Cl2. Амидирование соединения 1 смесью R1COCl и R2COCl или смесью R1CO2H и R2CO2H, используя общеизвестные способы амидирования, приводит к получению несимметричных амидов формулы (I). Схема 3b) R2COCl, DIEA или TEA, CH2Cl2; R2COCl, водн. NaOH, ТГФ/CH2Cl2. Амидирование промежуточного соединения А с помощью R2CO2H или R2COCl, используя общеизвестные способы амидирования, приводит к получению несимметричных амидов формулы (I). Промежуточное соединение А может быть получено способами, представленными на схемах 4-6. Схема 4b) R1COCl, DIEA, CH2Cl2 или R1OCl, водн. NaOH, ТГФ/CH2Cl2. Амидирование соединения 1 с помощью R1CO2H или R1COCl, используя общеизвестные способы амидирования, дает промежуточное соединение А. Выход по этому пути ниже ввиду образования бисамидов. Схема 5f) DPPA, NEt3, толуол, затем HCl, H2O. Коммерчески доступная 1-адамантанкарбоновая кислота (соединение 2) может быть преобразована в ацетамид 3 посредством реакции Риттера. Гидролиз соединения 3 в кислотных условиях приводит к соответствующей соли амина, которую затем преобразуют в метиловый эфир 4. Обычное амидирование соединения 4 дает соединение 5. Гидролиз сложного эфира 5, затем стандартная перегруппировка Курциуса дают промежуточное соединение А. Схема 6c) тиомочевина EtOH, HOAc, 80C. Обычное амидирование коммерчески доступного 3-аминоадамантан-1-ола (соединение 6) дает моноамид 7, который затем преобразуют в соединение 8 посредством реакции Риттера. Гидролиз соединения 8 дает промежуточное соединение А. Амиды с солюбилизирующими группами (формулы I-A, I-B и I-С) могут быть получены способами,представленными на схемах 7-9. Схема 7a) (R20)NH(R21), K2CO3 или Cs2CO3, DMA или NMP, микроволновое облучение, 180 С. Замещение хлорида в промежуточном соединении В с помощью аминов (R20)NH(R21) в основных условиях при микроволновом облучении дает соединения формулы (I-A), где R20 и R21 представляют собой алкил, или, связанные вместе, образуют гетероцикл, который необязательно замещен гидроксилом,алкокси, амином, алкиламином, диалкиламином, -С(О)NH-алкилом, -С(О)N(диалкил), -NHC(О)-алкилом,-N(алкил)-С(О)-алкилом; или один из R20 и R21 представляет собой Н, а другой представляет собой алкил,циклоалкил или гетероцикл, который необязательно замещен гидроксилом, циано, алкокси, амином, алкиламином, диалкиламином, -C(O)-NH2, -С(О)NH-алкилом, -С(О)N(диалкил), -NHC(О)-алкилом,-N(алкил)-С(О)-алкилом; Q, Y и W представляют собой CR23, где R23 представляет собой Н, алкил или циклоалкил; или один из Q, Y и W представляет собой азот. Схема 8c) Et3N, PyBOP, ДХМ. Алкилирование коммерчески доступного соединения 9 с помощью R24Br, R24OMs или R24OTs в основных условиях, таких как K2CO3 или Cs2CO3 в ДМФА, дает соединение 10. R24OMs или R24OTs могут быть легко получены из соответствующих R24OH и MeSO2Cl или 4-метилбензолсульфонил хлорида. Омыление сложного эфира 10 дает карбоновую кислоту 11. Амидирование соединения 11 с помощью промежуточного соединения А, используя общеизвестные способы, может дать соединения формулы (IB), где R24 представляет собой алкил, циклоалкил или гетероцикл, которые необязательно замещены гидроксилом, алкокси, амином, алкиламином, диалкиламином, -С(О)NH-алкилом, -С(О)N(диалкил),-NHC(O)-алкилом, -N(алкил)-С(О)-алкилом.c) R24OH, реакция Мицуноби или R24Br (R24OMs или R24OTs), основание, ДМФА (или ТГФ), 60100 С. Обычное амидирование коммерчески доступной карбоновой кислоты 12 с помощью промежуточного соединения А дает соединение 13, которое при деметилировании приводит к получению соединения 14. Реакция Мицуноби соединения 14 с R24OH или алкилирование соединения 14 с R24Br, R24OMs или R24OTs в основных условиях, таких как K2CO3 или Cs2CO3 в ДМФА, ТГФ или CH3CN, приводит к получению соединения формулы (I-C), где U представляет собой СН или N, и R24 имеет значения, указанные здесь выше. Промежуточное соединение В может быть получено способом, представленным на схеме 10. Схема 10a) R1CO2H, PyBOP (или ВОР, или HBTU, или EDCI, или DMC), DIEA или Et3N, ДХМ (или ДМФА,или CH2CN). Обычное амидирование промежуточного соединения А с помощью карбоновой кислоты 15 приводит к получению промежуточного соединения В. Недоступные коммерчески карбоновые кислоты могут быть получены способом, представленным на схеме 11. Схема 11b) HCl, вода, кипение с обратным холодильником или 1) NaOH, вода, 90 С; 2) HCl и вода. Замена галогена X (X=F, Cl, Br или I) в соединении 16 на циано, используя общеизвестные способы,такие как Zn(CN)2 и катализатор Ph2-пентедиенон Pd с лигандом (Ph2P)2-ферроцен в ДМФА при 100 С,дает соединение 17, которое при гидролизе в кислотных или основных условиях приводит к получению промежуточного соединения С. Экспериментальная часть 1. Общие способы. Если не оговорены специально иные условия, экспериментальные методы осуществляли в следующих условиях. Все процедуры проводили при комнатной температуре (от приблизительно 18 до приблизительно 25 С) в атмосфере азота. Упаривание растворителя осуществляли, используя роторный испаритель при пониженном давлении или используя испарительную для растворителей систему высокого разрешения НТ-4 Х (Genevac Inc., Gardiner, NY, USA). Реакционную смесь затем подвергали тонкослойной хроматографии (ТСХ) или процедуре жидкая хроматография-масс-спектрометрия (ЖХ/МС), и время реакции приведено только в целях иллюстрации. Хроматографию на силикагеле проводили на системеCombiFlash (Teledyne Isco, Inc., Lincoln, NE, USA) с предварительно упакованным силикагелевым картриджем или осуществляли на силикагеле 60 фирмы Merck (230-400 меш). Структуру и чистоту всех конечных продуктов подтверждали по меньшей мере одним из следующих способов анализа: ядерный магнитный резонанс (ЯМР) и ЖХ/МС. Спектры ЯМР получали на спектрометре Bruker Avance 300 (BrukerBioSpin Corp., Billerica, MA, USA) или Varian UNITY INOVA 400 (Varian, Inc., Palo Alto, CA, USA), используя индикаторный растворитель. Химический сдвигуказан в миллионных долях (м.д.) относительно тетраметилсилана (TMS) в качестве внутреннего стандарта. Постоянная взаимодействия (J) указана в герцах (Гц) и условные сокращения, используемые для сигнала сдвига: с - синглет; д - дублет; т триплет; м - мультиплет; ушир. - уширенный и т.д. За исключением других условий, масс-спектр получали, используя ионизацию электрораспылением (ESMS) либо с помощью системы Micromass Platform II,либо системы Quattro micro (обе от фирмы Waters Corp., Milford, MA, USA), и указывали (М+Н)+. 2. Получение промежуточных соединений по изобретению. Если не указано иного, реагенты, используемые при получении соединений, включая промежуточные соединения, по настоящему изобретению, были от фирмы Sigma-Aldrich Corporation (St. Louis, MO,- 10019546 Получение промежуточного соединения 1 осуществляли способом по схеме 4 выше, как указано далее. В колбу, содержащую 6-метилпиридин-2-карбоновую кислоту и (3-аминоадамантан-1-ил)амид (1,0 г, 7 ммоль) в ДХМ (75 мл), добавляли DIEA (2 мл, 10 ммоль) и бензотриазол-1-илокси-трис(диметиламино)фосфоний гексафторфосфат (3,2 г, 7,3 ммоль), затем по каплям раствор адамантан-1,3 диамина (1,3 г, 8 ммоль, Zerenex Molecular Ltd., Greater Manchester, UK) в ДХМ (25 мл). После перемешивания при комнатной температуре в течение 16 ч реакционную смесь промывали насыщенным раствором бикарбоната натрия. Органический слой сушили над сульфатом натрия и упаривали при пониженном давлении. Остаток очищали на очистительной системе хроматография с обращенной фазой/масс-спектроскопия (RP-HPLC/MS) (градиент: ацетонитрил в воде, 18-95%, в течение 3,9 мин со временем цикла 5 мин. Градиент широкого диапазона в диапазоне 19-30% ацетонитрила использовали в интервале 0,7-2,5 мин для отделения близко элюируемых примесей. Скорость потока: 100 мл/мин. Добавка к подвижной фазе: 25 мМ формиата аммония. Колонка: Inertsil C18, 3050 мм, размер частиц 5 мкм (GL Sciences, Tokyo, Japan с получением 0,5 г (20%) указанного в заголовке соединения, (3 аминоадамантан-1-ил)амида 6-метилпиридин-2-карбоновой кислоты, в виде твердого вещества белого цвета. 1 Н-ЯМР (400 МГц, CD3OD)7,89-7,81 (м, 2 Н), 7,46-7,42 (м, 1 Н), 2,59 (с, 3H), 2,44-2,06 (м, 6 Н),2,09-1,67 (м, 8 Н). ESI-MS m/z: 286,1 (М+Н)+. Промежуточное соединение 1 получали также посредством тех же методов синтеза, что и при получении промежуточного соединения 2 (см. ниже) исходя из гидрохлорида метилового эфира 3 аминоадамантан-1-карбоновой кислоты (14,9 г, 60,8 ммоль), путем конденсации с 6-метилпиридин-2 карбоновой кислотой получали метиловый эфир 3-[(6-метилпиридин-2-карбонил)амино]адамантан-1 карбоновой кислоты (14,9 г, 75%). Метиловый эфир затем подвергали гидролизу с получением 3-[(6 метилпиридин-2-карбонил)амино]адамантан-1-карбоновой кислоты (12,2 г, 86%). В заключение, перегруппировка Курциуса 3-[(6-метилпиридин-2-карбонил)амино]адамантан-1-карбоновой кислоты (10,0 г,31,8 ммоль) давала промежуточное соединение 1 (8,48 г, 93%). Промежуточное соединение 2. (3-Аминоадамантан-1-ил)амид пиридин-2-карбоновой кислоты Промежуточное соединение 2 синтезировали способом по схеме 5 выше, как указано далее. Стадия 1. 3-Ацетиламиноадамантан-1-карбоновая кислота В 10-литровый реактор добавляли 1-адамантанкарбоновую кислоту (503 г, 2,79 моль; TCI America,Wellesley Hills, MA, USA) и 70% азотную кислоту (400 мл, 6,72 моль) и полученную суспензию охлаждали до температуры 0 С с помощью рециркуляционного холодильника. К смеси медленно добавляли 98%-ную серную кислоту (3,00 л, 55,5 моль), температуру поддерживали ниже 10 С. После завершения добавления добавляли ацетонитрил (2,00 л, 38,5 моль) с такой скоростью, чтобы температура поддерживалась 10 С. После добавления всего ацетонитрила реакционную смесь перемешивали при 0 С в течение 1 ч. Сырую реакционную смесь затем помещали в 20-литровый реактор, наполненный 10 л смеси льда и небольшого количества воды, полученную смесь перемешивали и давали ей нагреться до комнатной температуры. Твердые продукты затем фильтровали и промывали водой. Большая часть твердых продуктов выпадала из кислого водного слоя, их отфильтровывали, а также промывали водой. Объединенные твердые продукты затем сушили в высоком вакууме при 50 С в течение 2 дней с получением 432 г (73%) указанного в заголовке соединения, 3-ацетиламиноадамантан-1-карбоновой кислоты, в виде твердого вещества белого цвета. Стадия 2. Гидрохлорид 3-аминоадамантан-1-карбоновой кислоты В 3-горлую 5-литровую колбу, снабженную обратным холодильником, механической мешалкой и термометром, добавляли 3-ацетиламиноадамантан-1-карбоновую кислоту (432 г, 1,82 моль), воду (1,00 л) и концентрированную хлористо-водородную кислоту (2,44 л) и полученную смесь нагревали при 95 С в течение 6 дней. В процессе добавления из раствора выпадали в осадок твердые продукты. После охлаждения при 0 С твердые продукты фильтровали и промывали ацетоном. Твердые продукты затем сушили в высоком вакууме при 50 С в течение приблизительно 2 ч с получением 328 г (78%) указанного в заго- 11019546 ловке соединения, гидрохлорида 3-аминоадамантан-1-карбоновой кислоты, в виде твердого вещества белого цвета. 1 Н-ЯМР (300 МГц, ДМСО-d6)12,35 (ушир.с, 1 Н), 8,27 (ушир.с, 3H), 2,22-2,12 (м, 2 Н),1,92-1,85 (м, 2 Н), 1,83-1,71 (м, 6 Н), 1,69-1,48 (м, 4 Н). Стадия 3. Гидрохлорид метилового эфира 3-аминоадамантан-1-карбоновой кислоты В 3-горлую 2-литровую колбу, снабженную обратным холодильником и термометром, добавляли гидрохлорид 3-аминоадамантан-1-карбоновой кислоты (100 г, 432 ммоль) и метанол (1,0 л). К этому раствор медленно добавляли тионилхлорид (15,7 мл, 216 ммоль) и реакционную смесь нагревали при 60 С в течение 4 ч. После охлаждения до комнатной температуры сырую реакционную смесь упаривали при пониженном давлении для удаления большей части метанола. Затем добавляли гептан (приблизительно 1 л) и смесь повторно упаривали при пониженном давлении, при этом начинал выпадать твердый осадок. Этот способ повторяли еще три раза, затем твердые продукты отфильтровали, промывали гептаном и оставляли сушиться на воздухе с получением 97,2 г (92%) указанного в заголовке соединения, гидрохлорида метилового эфира 3-аминоадамантан-1-карбоновой кислоты, в виде твердого вещества белого цвета. 1 Н-ЯМР (300 МГц, CDCl3)8,46 (ушир.с, 3H), 3,65 (с, 3H), 2,33-2,24 (м, 2 Н), 2,23-2,16 (м, 2 Н), 2,111,95 (м, 4 Н), 1,94-1,78 (м, 4 Н), 1,75-1,62 (м, 2 Н). Стадия 4. Метиловый эфир 3-[(пиридин-2-карбонил)амино]адамантан-1-карбоновой кислоты В круглодонную колбу помещали гидрохлорид метилового эфира 3-аминоадамантан-1-карбоновой кислоты (20,0 г, 81,4 ммоль) и метиленхлорид (500 мл) и раствор охлаждали при 0 С. К этому раствору затем добавляли триэтиламин (57 мл, 0,41 моль), затем гидрохлорид пиколиноилхлорида (15,2 г, 85,4 ммоль; TCI America, Wellesley Hills, MA, USA) и реакционную смесь перемешивали при 0 С в течение 30 мин, затем при комнатной температуре в течение 6 ч. В реакционную смесь добавляли насыщенный водный раствор бикарбоната натрия (500 мл) и двухфазную смесь энергично перемешивали в течение нескольких минут, затем переносили в 2-литровую делительную воронку. Смесь экстрагировали, слои разделяли и водный слой вновь экстрагировали метиленхлоридом (2200 мл). Объединенные органические слои промывали насыщенным солевым раствором (300 мл), сушили над сульфатом натрия, фильтровали и упаривали при пониженном давлении с получением 24,8 г (97%) указанного в заголовке соединения, метилового эфира 3-[(пиридин-2-карбонил)амино]адамантан-1-карбоновой кислоты, в виде твердого вещества бледно-коричневого цвета. 1 Н-ЯМР (400 МГц, CDCl3)8,54-8,49 (м, 1 Н), 8,16 (дт, J=7,8,1,0 Гц, 1 Н), 7,96 (ушир.с, 1 Н), 7,83 (тд, J=7,8, 1,8 Гц, 1 Н), 7,40 (ддд, J=7,6, 4,8, 1,3 Гц, 1 Н), 3,66 (с, 3H),2,34-2,30 (м, 2 Н), 2,29-2,23 (м, 2 Н), 2,17-2,13 (м, 4 Н), 1,97-1,80 (м, 4 Н), 1,78-1,62 (м, 2 Н). ESI-MS m/z: 315,0 (М+Н)+. Стадия 5. 3-[(Пиридин-2-карбонил)амино]адамантан-1-карбоновая кислота В круглодонную колбу помещали метиловый эфир 3-[(пиридин-2-карбонил)амино]адамантан-1 карбоновой кислоты (24,8 г, 78,9 ммоль), тетрагидрофуран (250 мл), воду (250 мл) и моногидрат гидроксида лития (14,9 г, 355 ммоль) и смесь энергично перемешивали при комнатной температуре в течение 25 ч. Сырую смесь упаривали при пониженном давлении для удаления большей части тетрагидрофурана,затем водный раствор разбавляли водой (200 мл) и устанавливали рН равным приблизительно 3-4 путем добавления твердого моногидрата лимонной кислоты. Появлялся объемный осадок белого цвета, который фильтровали, промывали водой и сушили в высоком вакууме при 50 С с получением 22,1 г (93%) указанного в заголовке соединения, 3-[(пиридин-2-карбонил)амино]адамантан-1-карбоновой кислоты, в виде твердого вещества белого цвета. 1 Н-ЯМР (400 МГц, CDCl3)8,55-8,50 (м, 1 Н), 8,18 (д, J=7,7 Гц,1 Н), 7,97 (ушир.с, 1 Н), 7,85 (тд, J=7,8, 1,8 Гц, 1 Н), 7,42 (ддд, J=7,6, 4,8, 1,3 Гц, 1 Н), 2,35-2,31 (м, 2 Н), 2,312,25 (м, 2 Н), 2,25-2,09 (м, 4 Н), 2,00-1,86 (м, 4 Н), 1,80-1,64 (м, 2 Н). ESI-MS m/z: 301,0 (М+Н)+. Стадия 6. (3-Аминоадамантан-1-ил)амид пиридин-2-карбоновой кислоты В круглодонную колбу помещали 3-[(пиридин-2-карбонил)амино]адамантан-1-карбоновую кислоту(10,0 г, 33,3 ммоль) и толуол (100 мл). К суспензии добавляли триэтиламин (5,6 мл, 40 ммоль) и смесь перемешивали в течение нескольких минут до растворения большей части твердых продуктов. К смеси затем добавляли дифенилфосфин азид (7,9 мл, 37 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь переносили в капельную воронку и добавляли по каплям в 3-горлую круглодонную колбу, снабженную обратным холодильником, содержащую толуол (70 мл), нагревали при 90 С. После добавления реакционную смесь перемешивали при 90 С в течение еще 2 ч, затем давали остыть до комнатной температуры. Реакционную смесь затем медленно добавляли в колбу, содержащую 6,0 н. водную хлористо-водородную кислоту (55 мл, 330 ммоль), и энергично перемешивали в течение 1 ч. Двухфазную смесь переносили в делительную колонку и толуольный слой отбрасывали. Водный кислотный слой затем медленно обрабатывали твердым карбонатом натрия до рН 10. Водный слой переносили в 500-мл делительную колонку и экстрагировали метиленхлоридом (3100 мл). Объединенные органические слои затем промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и упаривали при пониженном давлении с получением 8,38 г (93%) указанного в заголовке соединения, (3-аминоадамантан-1-ил)амида пиридин-2-карбоновой кислоты, в виде смолистой пены. 1 Н-ЯМР (300 МГц, CDCl3)8,55-8,50 (м, 1 Н), 8,16 (д, J=7,9 Гц, 1 Н), 7,94 (ушир.с, 1 Н), 7,84(тд, J=7,7, 1,7 Гц, 1 Н), 7,40 (ддд, J=7,6, 4,7, 1,3 Гц, 1 Н), 2,31-2,21 (м, 2 Н), 2,13-1,97 (м, 6 Н), 1,71-1,51 (м,6 Н). ESI-MS m/z: 272 (М+Н)+. Промежуточное соединение 2 также получали способом по схеме 6 выше, как указано далее. Стадия 1. (3-Гидроксиадамантан-1-ил)амид пиридин-2-карбоновой кислоты В 40-мл пробирку помещали пиколиновую кислоту (0,68 г, 5,5 ммоль), ДМФА (15 мл), триэтиламин(0,90 мл, 6,4 ммоль) и O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилуроний гексафторфосфат (HBTU, 2,3 г, 6,0 ммоль). Смесь перемешивали при комнатной температуре в течение 5 мин с получением прозрачного раствора. К вышеуказанному раствору добавляли 3-аминоадамантанол (0,84 г, 5,0 ммоль; AK Scientific, 897-4G Indepedence Ave., Mountain View, CA 94043) и перемешивали при комнатной температуре в течение 2 ч. ДМФА удаляли с помощью Genevac и остаток растворяли в ДХМ (20 мл), промывали 1 н. водным раствором NaOH, водой и насыщенным солевым раствором, сушили над Na2SO4 и упаривали при пониженном давлении с получением 1,32 г (97%) сырого указанного в заголовке соединения, (3 гидроксиадамантан-1-ил)амида пиридин-2-карбоновой кислоты, в виде масла, которое становилось бесцветным по мере стояния при комнатной температуре. ЖХ/МС (градиент: ацетонитрил в воде, 20-85%, в течение 1,7 мин со временем цикла 2 мин. Скорость потока: 5,0 мл/мин. Добавка к подвижной фазе: 30 мМ формиата аммония. Колонка: Inertsil ODS-3, 504,6 мм, размер частиц 3 мкм (GL Sciences, Tokyo,Japan. Время удерживания: 0,79 мин; чистота (UV254): 100%; ESI-MS m/z: 273 (М+Н)+. Продукт использовали на следующей стадии без дополнительной очистки. Стадия 2. [3-(2-Хлорацетиламино)адамантан-1-ил]амид пиридин-2-карбоновой кислоты Хлорацетонитрил (2,0 мл, 32 ммоль) охлаждали до 0 С. Медленно при 0 С добавляли серную кислоту (1,0 мл, 19 ммоль). После завершения добавления смесь перемешивали при 0 С в течение 5 мин. Добавляли одной порцией (3-гидроксиадамантан-1-ил)амид пиридин-2-карбоновой кислоты (0,42 г, 1,56 ммоль со стадии 1) и смесь перемешивали при комнатной температуре в течение ночи. Густой раствор выливали в смесь лед-вода (10 мл). Добавляли ДХМ (10 мл). При охлаждении смеси на ледяной бане рН водной фазы (вверху) устанавливали равным 10-13 с помощью 10 н. водн. NaOH. Водный слой экстрагировали с помощью ДХМ. Объединенный органический слой промывали водой и насыщенным солевым раствором, сушили над Na2SO4 и упаривали при пониженном давлении с получением 0,53 г (96,9%) сырого указанного в заголовке соединения, [3-(2-хлорацетиламино)адамантан-1-ил]амида пиридин-2 карбоновой кислоты, в виде масла, которое становилось бесцветным по мере стояния при комнатной температуре. ЖХ/МС (градиент: ацетонитрил в воде, 20-85%, в течение 1,7 мин со временем цикла 2 мин. Скорость потока: 5,0 мл/мин. Добавка к подвижной фазе: 30 мМ формиата аммония. Колонка: Inertsil ODS, 504,6 мм, размер частиц 3 мкм (GL Sciences, Tokyo, Japan. Время удерживания: 1,08 мин; чистота (UV254): 100%; ESI-MS m/z: 348 (М+Н)+. Продукт использовали на следующей стадии без дополнительной очистки. Стадия 3. (3-Аминоадамантан-1-ил)амид пиридин-2-карбоновой кислоты(20,0 мл) и уксусную кислоту (4,0 мл). Смесь перемешивали при 78 С в течение ночи. Реакционный раствор охлаждали до комнатной температуры, выливали в воду (100 мл) и рН раствора устанавливали равным 10-13, используя 10 н. водн. NaOH. Смесь переносили в делительную воронку, экстрагировали ДХМ(3150 мл). Объединенные органические слои промывали водой и насыщенным солевым раствором, сушили над Na2SO4 и упаривали при пониженном давлении с получением 1,35 г (95,4%) сырого указанного в заголовке соединения, (3-аминоадамантан-1-ил)амида пиридин-2-карбоновой кислоты, в виде масла,которое становилось бесцветным по мере стояния при комнатной температуре. ЖХ/МС (градиент: ацетонитрил в воде, 10-85%, в течение 1,7 мин со временем цикла 2 мин. Скорость потока: 5,0 мл/мин. Добавка к подвижной фазе: 30 мМ формиата аммония. Колонка: Inertsil C8, 504,6 мм, размер частиц 3 мкм (GL Sciences, Tokyo, Japan. Время удерживания: 0,63 мин; чистота (UV254): 93%; ESI-MS m/z: 272(М+Н)+. Продукт использовали на следующей стадии амидирования без дополнительной очистки. Промежуточное соединение 3. N-(3-Аминоадамантан-1-ил)-3-фторбензамид Используя те же методы, что и в синтезе промежуточного соединения 2, получали промежуточное соединение 3 в масштабах реакции 4,33 ммоль и получали 1,26 г (95,6%) сырого продукта. ЖХ/МС (градиент: ацетонитрил в воде, 10-85%, в течение 1,7 мин со временем цикла 2 мин. Скорость потока: 5,0 мл/мин. Добавка к подвижной фазе: 30 мМ формиата аммония. Колонка: Inertsil C8, 504,6 мм, размер частиц 3 мкм (GL Sciences, Tokyo, Japan. Время удерживания: 0,70 мин; чистота (UV254): 95%. ESI-MSm/z: 289 (М+Н)+. Продукт использовали на следующей стадии без дополнительной очистки. Промежуточное соединение 4. 3-[(Пиридин-2-карбонил)амино]адамантан-1-иламид 6 хлорпиридин-2-карбоновой кислоты Промежуточное соединение 4 получали, исходя из промежуточного соединения 2, способом по схеме 10 выше, как указано далее. В 40-мл пробирку помещали 6-хлорпиридин-2-карбоновую кислоту (0,79 г, 5,0 ммоль), ДМФА (15 мл), триэтиламин (0,90 мл, 6,4 ммоль) и О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилуроний гексафторфосфат (2,3 г, 6,0 ммоль). Смесь перемешивали при комнатной температуре в течение 5 мин с получением прозрачного раствора. К раствору добавляли (3-аминоадамантан-1-ил)амид пиридин-2-карбоновой кислоты (промежуточное соединение 2, 1,38 г, 4,73 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. ДМФА удаляли с помощью Genevac. Остаток растворяли в ДХМ(20 мл), промывали водн. 1 н. NaOH (15 мл), водой (15 мл) и насыщенным солевым раствором (15 мл) и сушили над Na2SO4. Растворитель удаляли при пониженном давлении с получением 1,85 г (95,2%) сырого указанного в заголовке соединения, 3-[(пиридин-2-карбонил)амино]адамантан-1-иламида 6 хлорпиридин-2-карбоновой кислоты. ЖХ/МС (градиент: ацетонитрил в воде, 30-90%, в течение 1,7 мин со временем цикла 2 мин. Скорость потока: 5,0 мл/мин. Добавка к подвижной фазе: 30 мМ формиата аммония. Колонка: Inertsil C8, 504,6 мм, размер частиц 3 мкм (GL Sciences, Tokyo, Japan. Время удерживания: 1,17 мин; чистота (UV254): 100%. ESI-MS m/z: 411 (М+Н)+. Продукт использовали на следующей стадии без дополнительной очистки. Промежуточное соединение 5. 3-[(6-Метилпиридин-2-карбонил)амино]адамантан-1-иламид 6 хлорпиридин-2-карбоновой кислоты Тем же способом, что использовали при получении промежуточного соединения 4, промежуточное соединение 5 получали исходя из промежуточного соединения 1 (2,00 г, 7,01 ммоль). После очистки с помощью хроматографии на силикагеле промежуточное соединение 5 (1,94 г, 65%) получали в виде твердого вещества белого цвета. 1 Н-ЯМР (300 МГц, CDCl3)8,13 (ушир.с, 1 Н), 8,09 (д, J=7,5 Гц, 1 Н),7,98 (д, J=7,7 Гц, 1 Н), 7,84-7,69 (м, 3H), 7,44 (д, J=7,7 Гц, 1 Н), 7,26 (д, 1 Н), 2,60-2,55 (м, 5 Н), 2,40-2,32 (м,2 Н), 2,31-2,12 (м, 8 Н), 1,76-1,70 (м, 2 Н). ESI-MS m/z: 425,0 (М+Н)+. Промежуточное соединение 6. [3-(3-Фторбензоиламино)адамантан-1-ил]амид 6-хлорпиридин-2 карбоновой кислоты Тем же способом, что использовали при получении промежуточного соединения 4, получали промежуточное соединение 6 исходя из промежуточного соединения 3 в масштабах реакции 4,6 ммоль. Получали сырой продукт (1,99 г, 97%). ЖХ/МС (градиент: ацетонитрил в воде, 30-90%, в течение 1,7 мин со временем цикла 2 мин. Скорость потока: 5,0 мл/мин. Добавка к подвижной фазе: 30 мМ формиата аммония. Колонка: Inertsil C8, 504,6 мм, размер частиц 3 мкм (GL Sciences, Tokyo, Japan. Время удерживания: 1,21 мин; чистота (UV254): 100%. ESI-MS m/z: 428 (М+Н)+. Продукт использовали на следующей стадии без дополнительной очистки. Промежуточное соединение 7 синтезировали способом по схеме 5 исходя из соединения 4 выше,как указано далее. Стадия 1. 3-[(Пиразин-2-карбонил)амино]адамантан-1-карбоновая кислота В круглодонную колбу добавляли гидрохлорид метилового эфира 3-аминоадамантан-1-карбоновой кислоты (7,00 г, 28,5 ммоль), 2-пиразинкарбоновую кислоту (3,71 г, 29,9 ммоль) и метиленхлорид (200 мл). Смесь энергично перемешивали и обрабатывали РуВОР (15,6 г, 29,9 ммоль), затем триэтиламином(9,9 мл, 71 ммоль) и затем перемешивали при комнатной температуре в течение 16 ч. В реакционную смесь добавляли насыщенный водный раствор бикарбоната натрия (200 мл) и двухфазную смесь энергично перемешивали в течение нескольких минут, затем переносили в 1-литровую делительную воронку. Смесь экстрагировали, слои разделяли и водный слой повторно экстрагировали метиленхлоридом (200 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и упаривали при пониженном давлении. Остаток затем растворяли в тетрагидрофуране (200 мл) и добавляли воду (200 мл). В двухфазную смесь добавляли моногидрат гидроксида лития (5,38 г, 128 ммоль) и полученную смесь энергично перемешивали при комнатной температуре в течение 22 ч. Большую часть легколетучих продуктов удаляли при пониженном давлении, полученный водный раствор переносили в 500-мл делительную колонку и промывали метиленхлоридом (3150 мл). Водный слой разбавляли водой (200 мл) и рН устанавливали равным приблизительно 3-4 путем добавления твердого моногидрата лимонной кислоты. Образовавшийся объемный осадок белого цвета фильтровали, промывали водой и сушили в высоком вакууме при 50 С с получением 8,11 г (95%) указанного в заголовке соединения, 3-[(пиразин-2-карбонил)амино]адамантан-1-карбоновой кислоты, в виде твердого вещества белого цвета. 1 Н-ЯМР (300 МГц, CDCl3)11,14-10,07 (ушир.с, 1 Н), 9,38 (д, J=1,5 Гц, 1 Н), 8,74 Используя тот же способ, что и для получения промежуточного соединения 2 на стадии 6, исходя из 3-[(пиразин-2-карбонил)амино]адамантан-1-карбоновой кислоты (4,00 г, 13,3 ммоль) путем перегруппировки Курциуса получали 3,56 г (99%) указанного в заголовке соединения, (3-аминоадамантан-1 ил)амида пиразин-2-карбоновой кислоты, в виде твердого вещества не совсем белого цвета. 1H-ЯМР (300 МГц, CDCl3)9,37 (д, J=1,4 Гц, 1 Н), 8,73 (д, J=2,5 Гц, 1 Н), 8,49 (дд, J=2,4, 1,5 Гц, 1 Н), 7,64 (ушир.с, 1 Н),2,31-2,21 (м, 2 Н), 2,14-1,95 (м, 6 Н), 1,71-1,51 (м, 6 Н) (внимание: сигналы -NH2 маскировались между 2,52-1,78 м.д.). ESI-MS m/z: 273,0 (М+Н)+. Промежуточное соединение 8. (3-Аминоадамантан-1-ил)амид 6-метилпиразин-2-карбоновой кислоты Промежуточное соединение 8 синтезировали способом по схеме 5 исходя из соединения 4 выше,как указано далее. Стадия 1. 3-[(6-Метилпиразин-2-карбонил)амино]адамантан-1-карбоновая кислота Используя тот же способ, что использовался для получения промежуточного соединения 7 на стадии 1, исходя из гидрохлорида метилового эфира 3-аминоадамантан-1-карбоновой кислоты (7,00 г, 28,5 ммоль) и 6-метилпиразин-2-карбоновой кислоты (4,13 г, 29,9 ммоль, RihaChem, Kostalov Czech Republic),путем реакции конденсации с РуВОР с последующим щелочным гидролизом метильной эфирной группы получали 8,01 г (89%) указанного в заголовке соединения, 3-[(6-метилпиразин-2 карбонил)амино]адамантан-1-карбоновой кислоты, в виде твердого вещества белого цвета. 1H-ЯМР (400 МГц, CDCl3)12,03-10,32 (ушир.с, 1 Н), 9,17 (с, 1 Н), 8,60 (с, 1 Н), 7,72 (ушир.с, 1 Н), 2,60 (с, 3H), 2,35-2,26 Используя тот же способ, что и для получения промежуточного соединения 2 на стадии 6, исходя из 3-[(6-метилпиразин-2-карбонил)амино]адамантан-1-карбоновой кислоты (3,00 г, 9,51 ммоль) путем перегруппировки Курциуса получали 2,65 г (97%) указанного в заголовке соединения, (3-аминоадамантан-1 ил)амида 6-метилпиразин-2-карбоновой кислоты, в виде твердого вещества не совсем белого цвета. 1 НЯМР (400 МГц, CDCl3)9,17 (с, 1 Н), 8,59 (с, 1 Н), 7,69 (ушир.с, 1 Н), 2,60 (с, 3H), 2,32-2,21 (м, 2 Н), 2,131,97 (м, 6 Н), 1,70-1,52 (м, 6 Н) (внимание: сигналы -NH2 маскировались между 2,41-1,29 м.д.). ESI-MS Используя те же методы, что и в синтезе промежуточного соединения 7, промежуточное соединение 9 получали при температуре в масштабах реакции 16,8 ммоль исходя из гидрохлорида метилового эфира 3-аминоадамантан-1-карбоновой кислоты и пиримидин-4-карбоновой кислоты (Ark Pharm Inc.,Libertyville, IL, USA) и получали 4,00 г (88%) сырого продукта. ЖХ/МС (градиент: ацетонитрил в воде,20-85%, в течение 1,7 мин со временем цикла 2 мин. Скорость потока: 5,0 мл/мин. Добавка к подвижной фазе: 30 мМ формиата аммония. Колонка: Inertsil ODS, 504,6 мм, размер частиц 3 мкм (GL Sciences. Время удерживания: 0,24 мин; чистота (UV254): 95%. ESI-MS m/z: 273 (М+Н)+. Продукт использовали на следующей стадии без дополнительной очистки. Промежуточное соединение 10. (3-Аминоадамантан-1-ил)амид 2-метилпиримидин-4-карбоновой кислоты Используя те же методы, что и в синтезе промежуточного соединения 7, промежуточное соединение 10 получали при температуре в масштабах реакции 15,8 ммоль исходя из гидрохлорида метилового эфира 3-аминоадамантан-1-карбоновой кислоты и 2-метилпиримидин-4-карбоновой кислоты (Ark PharmInc.) и получали 4,6 г (100%) сырого продукта. ЖХ/МС (градиент: ацетонитрил в воде, 20-85%, в течение 1,7 мин со временем цикла 2 мин. Скорость потока: 5,0 мл/мин. Добавка к подвижной фазе: 30 мМ формиата аммония. Колонка: Inertsil ODS, 504,6 мм, размер частиц 3 мкм (GL Sciences. Время удерживания: 0,30 мин; чистота (UV254): 82%. ESI-MS m/z: 287 (М+Н)+. Продукт использовали на следующей стадии без дополнительной очистки. Промежуточное соединение 11. 4-Трифторметилпиримидин-2-карбоновая кислота Промежуточное соединение 11 получали способом по схеме 11 выше, как указано далее. Стадия 1. 4-Трифторметилпиримидин-2-карбонитрил К раствору 2-хлор-4-(трифторметил)пиримидина (5,00 г, 27,4 ммоль) в диметилсульфоксиде (25 мл) добавляли цианид натрия (1,68 г, 34,2 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 30 мин и выливали в холодный насыщенный водный раствор NaHCO3. Смесь переносили в 100-мл делительную колонку и экстрагировали этиловым эфиром (350 мл). Объединенные органические слои промывали насыщенным солевым раствором (50 мл), сушили над сульфатом натрия, фильтровали и упаривали при пониженном давлении с получением указанного в заголовке соединения, 4 трифторметилпиримидин-2-карбонитрила, в виде масла коричневого цвета, которое использовали на следующей стадии без дополнительной очистки. 1 Н-ЯМР (400 МГц, CDCl3)9,16 (д, J=5,1 Гц, 1 Н), 7,88 Сырой 4-трифторметилпиримидин-2-карбонитрил со стадии 1 растворяли в растворе хлористоводородной кислоты в воде (6 М, 20,0 мл) и нагревали при температуре кипения с обратным холодильником в течение ночи. Реакционную смесь охлаждали до комнатной температуры и упаривали при пониженном давлении. Затем добавляли толуол (20 мл) и смесь упаривали при пониженном давлении. Этот процесс повторяли с 1,4-диоксаном и этиловым эфиром, затем твердые продукты отфильтровали. Фильтрат упаривали при пониженном давлении с получением 4,80 г (82,1%) указанного в заголовке соедине- 16019546 ния, 4-трифторметилпиридин-2-карбоновой кислоты, в виде твердого вещества коричневого цвета, которое использовали на следующей стадии без дополнительной очистки. 1 Н-ЯМР (400 МГц, ДМСО-d6)9,35 (д, J=5,0 Гц, 1 Н), 8,25 (д, J=5,1 Гц, 1 Н). Промежуточное соединение 12. 4-Метилпиримидин-2-карбоновая кислота К раствору 2-хлор-4-метилпиримидина (3,00 г, 23,3 ммоль; 3 В Pharmachem International, China) в этиловом эфире (24 мл) добавляли раствор цианида натрия (2,86 г, 58,3 ммоль) в растворе триметиламина (1:3, триметиламин:вода, 24,0 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Водный слой экстрагировали этиловым эфиром (320 мл). Объединенные органические слои сушили над MgSO4, фильтровали и упаривали при пониженном давлении с получением указанного в заголовке соединения, 4-метилпиримидин-2-карбонитрила (1,80 г; 64,8%), которое использовали на следующей стадии без дополнительной очистки. 1 Н-ЯМР (400 МГц, D2O)8,64 (д, J=5,4 Гц, 1 Н), 7,59 (д,J=5,5 Гц, 1 Н). Стадия 2. 4-Метилпиримидин-2-карбоновая кислота Раствор 4-метилпиримидин-2-карбонитрила (500 мг, 4,20 ммоль) и гидроксида натрия (504 мг, 12,6 ммоль) в воде (12,5 мл) перемешивали при 60 С в течение 1 ч. Реакционную смесь охлаждали до комнатной температуры, подкисляли до рН приблизительно 2 лимонной кислотой и экстрагировали смесьюCHCl3:изо-PrOH (3:1, 220 мл). Объединенные органические слои сушили над MgSO4 и упаривали при пониженном давлении с получением 0,294 г указанного в заголовке соединения, 4-метил-2 пиримидинкарбоновой кислоты (51%), которую использовали на следующей стадии без дополнительной очистки. 1 Н-ЯМР (300 МГц, D2O)8,50 (д, J=5,2 Гц, 1 Н), 7,31 (д, J=5,3 Гц, 1 Н). 3. Получение соединений по изобретению. Если не указано иного, реагенты, используемые при получении соединений, включая промежуточные соединения, по настоящему изобретению, были получены от фирмы Sigma-Aldrich Corporation (St. Пример 1 осуществляли способом по схеме 1 выше, как указано далее. В сосуд, содержащий 6-метилпиколиновую кислоту (40 мг, 0,3 ммоль), метиленхлорид (10 мл) иN,N-диизопропилэтиламин (60 мг, 0,5 ммоль), добавляли гидрохлорид N-(3-диметиламинопропил)-N'этилкарбодиимида (60 мг, 0,3 ммоль). Смесь перемешивали в течение 5 мин. Добавляли соль гидрохлорид адамантан-1,3-диамина (20 мг, 0,1 ммоль; Zerenex Molecular Ltd., Greater Manchester, UK) и реакционную смесь оставляли взаимодействовать в течение 16 ч. Реакционную смесь промывали насыщенным раствором бикарбоната натрия, сушили над сульфатом натрия и упаривали при пониженном давлении. Остаток очищали на очистительной хроматографической системе с обращенной фазой/массспектроскопия (RP-HPLC/MS) (градиент: ацетонитрил в воде, 25-95%, в течение 3,9 мин со временем цикла 5 мин. Градиент широкого диапазона между 28-58% ацетонитрила использовали в интервале 0,753,5 мин для отделения близко элюируемых примесей. Скорость потока: 100 мл/мин. Добавка к подвижной фазе: 25 мМ ацетата аммония. Колонка: Inertsil C8, 3050 мм, размер частиц 5 мкм) с получением указанного в заголовке соединения (33 мг, 80%) в виде масла не совсем белого цвета. 1 Н-ЯМР (400 МГц,CDCl3)8,09 (с, ушир., 2 Н), 7,96 (д, J=7,76 Гц, 2 Н), 7,70 (т, J=7,70 Гц, 2 Н), 7,27-7,22 (м, 2 Н), 2,58-2,55 (м,2 Н), 2,38-2,13 (м, 10 Н), 1,75-1,71 (м, 2 Н). ESI-MS m/z: 405,0 (М+Н)+. Пример 2. N,N'-(1,3-Адамантилен)-бис-(2-пиридинкарбоксамид) Пример 2 осуществляли способом по схеме 1 выше, как указано далее. В сосуд, содержащий адамантан-1,3-диамин (50 мг, 0,3 ммоль; Zerenex Molecular Ltd., GreaterManchester, UK) и метиленхлорид (10 мл), при 0 С добавляли N,N-диизопропилэтиламин (200 мг, 2 ммоль; Alfa Aesar, Ward Hill, MA, USA). В реакционную смесь добавляли пиридин-2-карбонилхлорид(60 мг, 0,4 ммоль; TCI America, Wellesley Hills, MA, USA). После перемешивания при комнатной температуре в течение 16 ч реакционную смесь промывали насыщенным раствором бикарбоната натрия, сушили над сульфатом натрия и упаривали при пониженном давлении. Остаток очищали на очистительной хроматографической системе с обращенной фазой/масс-спектроскопия (RP-HPLC/MS) (градиент: ацетонитрил в воде, 30-95%, в течение 3,9 мин со временем цикла 5 мин. Скорость потока: 100 мл/мин. Добавка к подвижной фазе: 25 мМ формиата аммония. Колонка: Inertsil C8, 3050 мм, размер частиц 5 мкм) с получением указанного в заголовке соединения в виде масла коричневатого цвета (58 мг, 50%). 1 Н-ЯМРm/z: 377,0 (М+Н)+. Способом, аналогичным описанному в примере 2, осуществляли примеры 3-5 табл. 1 ниже исходя из коммерчески доступного арил или гетероарил карбонилхлорида в масштабах реакции от 0,1 до 0,3 ммоль. Пример 6. [3-(3-Хлорбензоиламино)адамантан-1-ил]амид пиридин-2-карбоновой кислоты Пример 6 получали способом по схемам 4 и 3 выше, как указано далее. В сосуд, содержащий адамантан-1,3-диамин (50 мг, 0,3 ммоль) и тетрагидрофуран (5 мл), добавляли по каплям 5 М водн. NaOH (0,6 мл, 3 ммоль). При энергичном перемешивании порциями добавляли гидрохлорид пиколиноил хлорида (50 мг, 0,3 ммоль). После перемешивания при комнатной температуре в течение 16 ч реакционную смесь распределяли в дихлорметане и насыщенном растворе бикарбоната. Органический слой сушили над сульфатом натрия и упаривали при пониженном давлении. Остаток повторно обрабатывали 5 мл ДХМ (дихлорметан). К суспензии добавляли DIEA (N,N-диизопропилэтиламин) (160 мг, 1,2 ммоль) и 3-хлорбензоил хлорид (79 мг, 0,45 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч, промывали насыщенным раствором бикарбоната натрия, сушили над сульфатом натрия и упаривали при пониженном давлении. Остаток очищали на очистительной системе хроматография с обращенной фазой/масс-спектроскопия (RP-HPLC/MS) (градиент: ацетонитрил в воде, 25-95%, в течение 3,9 мин со временем цикла 5 мин. Градиент широкого диапазона между 35-65% ацетонитрила использовали в интервале 0,75-3,5 мин для отделения близко элюируемых примесей. Скорость потока: 100 мл/мин. Добавка к подвижной фазе: 25 мМ ацетата аммония. Колонка:Inertsil C8, 3050 мм, размер частиц 5 мкм) с получением указанного в заголовке соединения (28 мг,22%) в виде масла не совсем белого цвета. 1H-ЯМР (400 МГц, CDCl3)8,51 (д, J=4,75 Гц, 1 Н), 8,15 (д,J=7,84 Гц, 1 Н), 8,03 (с, ушир., 1 Н), 7,83 (т, J=7,72 Гц, 1 Н), 7,69 (т, J=1,82 Гц, 1 Н), 7,57 (д, J=7,60 Гц, 1 Н),7,46-7,31 (м, 3H), 5,87 (с, ушир., 1 Н), 2,56 (с, ушир., 2 Н), 2,38-2,31 (м, 2 Н), 2,24-2,12 (м, 8 Н), 1,76-1,69 (м,2 Н). ESI-MS m/z: 410,0 (М+Н)+. Способом, аналогичным описанному в примере 6, осуществляли примеры 7-10 табл. 1 ниже исходя из коммерчески доступного арил или гетероарил карбонилхлорида в масштабах реакции 0,3 ммоль. Пример 11. N,N'-(1,3-Адамантилен)-бис-(4-метилпиридин-2-карбоксамид) Пример 11 синтезировали способом по схеме 1 выше, как указано далее. В сосуд, содержащий 4-метилпиридин-2-карбоновую кислоту (30 мг, 0,22 ммоль) в ДМФА (1 мл),добавляли бензотриазол-1-илокси-трис-(диметиламино)фосфоний гексафторфосфат (97 мг, 0,22 ммоль),DIEA (40 мг, 0,3 ммоль; Alfa Aesar, Ward Hill, MA, USA), затем адамантан-1,3-диамин (20 мг, 0,1 ммоль в 1 мл ТГФ; Zerenex Molecular Ltd., Greater Manchester, UK). После перемешивания в течение 16 ч при комнатной температуре реакционную смесь распределяли в дихлорметане и насыщенном растворе бикарбоната натрия. Органический слой сушили над сульфатом натрия, фильтровали и упаривали при пониженном давлении. Остаток очищали на очистительной системе хроматография с обращенной фазой/масс-спектроскопия (RP-HPLC/MS) (градиент: ацетонитрил в воде, 30-95%, в течение 3,7 мин со временем цикла 5 мин. Скорость потока: 100 мл/мин. Добавка к подвижной фазе: 25 мМ формиата аммония. Колонка: Inertsil C8, 3050 мм, размер частиц 5 мкм (GL Sciences, Tokyo, Japan с получением 18 мг (40%) указанного в заголовке соединения, N,N'-(1,3-адамантилен)-бис-(4-метилпиридин-2 карбоксамида), в виде масла не совсем белого цвета. 1 Н-ЯМР (400 МГц, CDCl3)8,35 (д, J=4,9 Гц, 2 Н),8,02 (с, ушир., 2 Н), 7,98-7,96 (м, 2 Н), 7,21-7,19 (м, 2 Н), 2,57-2,55 (м, 2 Н), 2,41 (с, 6 Н), 2,36-2,31 (м, 2 Н),2,25-2,13 (м, 8 Н), 1,74-1,70 (м, 2 Н). ESI-MS m/z: 405,0 (M+H)+. Способом, аналогичным описанному в примере 11, примеры 12-16 табл. 1 ниже осуществляли ис- 18019546 ходя из коммерчески доступных арил или гетероарил карбоновых кислот в масштабах реакции от 0,1 до 0,3 ммоль. Пример 17. N,N'-(1,3-Адамантилен)-бис-(1-метил-1 Н-пиразол-3-карбоксамид) Пример 17 синтезировали исходя из гетероарил карбонилхлорида способом по схеме 1 выше, как указано далее. К раствору адамантан-1,3-диамин (20 мг, 0,1 ммоль; Zerenex Molecular Ltd., Greater Manchester, UK) в ТГФ (4 мл) добавляли 1-метил-1 Н-пиразол-3-карбонилхлорид (40 мг, 0,3 ммоль) и DIEA (40 мг, 0,3 ммоль). После перемешивания в течение 16 ч при комнатной температуре реакционную смесь распределяли в дихлорметане и насыщенном растворе бикарбоната натрия. Органический слой сушили над сульфатом натрия, фильтровали и упаривали при пониженном давлении. Остаток очищали на очистительной системе RP-HPLC/MS (градиент: ацетонитрил в воде, 18-95%, в течение 3,9 мин со временем цикла 5 мин. Скорость потока: 100 мл/мин. Добавка к подвижной фазе: 25 мМ ацетата аммония. Колонка: Inertsil C8, 3050 мм, размер частиц 5 мкм (GL Sciences, Tokyo, Japan с получением 19 мг (50%) указанного в заголовке соединения, N,N'-(1,3-адамантилен)-бис-(1-метил-1 Н-пиразол-3-карбоксамида), в виде бесцветного масла. 1 Н-ЯМР (400 МГц, CDCl3)7,32 (д, J=2,3 Гц, 2 Н), 6,74-6,71 (м, 4 Н), 3,89 (с, 6 Н), 2,49 Пример 18 синтезировали способом по схеме 2, используя коммерчески доступные карбоновые кислоты выше, как указано далее. К раствору адамантан-1,3-диамина (20 мг, 0,1 ммоль; Zerenex Molecular Ltd., Greater Manchester,UK) в ДХМ (2 мл) добавляли DIEA (26 мг, 0,15 ммоль), 1-метил-1 Н-пиразол-3-карбоновую кислоту (14 мг, 0,11 ммоль), 5-метилпиразин-2-карбоновую кислоту (15 мг, 0,11 ммоль) и бензотриазол-1 илокситрипирролидинофосфоний гексафторфосфат (110 мг, 0,20 ммоль). После перемешивания в течение 3 ч при комнатной температуре реакционную смесь распределяли в дихлорметане и насыщенном растворе бикарбоната натрия. Органический слой сушили над сульфатом натрия, фильтровали и упаривали при пониженном давлении. Остаток очищали на очистительной системе RP-HPLC/MS (градиент: ацетонитрил в воде, 25-95%, в течение 3,4 мин со временем цикла 5 мин. Градиент широкого диапазона в интервале 25-50% ацетонитрила использовали в интервале 0,75-3,3 мин для отделения близко элюируемых примесей. Скорость потока: 100 мл/мин. Добавка к подвижной фазе: 25 мМ формиата аммония. Колонка: Inertsil C8, 3050 мм, размер частиц 5 мкм (GL Sciences, Tokyo, Japan с получением 15 мг Пример 19 осуществляли способом по схеме 2, используя коммерчески доступные хлорангидриды карбоновых кислот выше, как указано далее. К раствору адамантан-1,3-диамина (17 мг, 0,1 ммоль, Zerenex Molecular Ltd., Greater Manchester,UK) в ДХМ (2 мл) добавляли DIEA (20 мг, 0,15 ммоль), 1-метил-1 Н-пиразол-3-карбонилхлорид (16 мг,0,11 ммоль; Maybridge Chemical Co., Cornwall, UK) и тиазол-2-карбонилхлорид (16 мг, 0,11 ммоль; Maybridge Chemical Co., Cornwall, UK). После перемешивания при комнатной температуре в течение 3 ч реакционную смесь распределяли в дихлорметане и насыщенном растворе бикарбоната натрия. Органический слой сушили над сульфатом натрия и упаривали при пониженном давлении. Остаток очищали на очистительной системе RP-HPLC/MS (градиент: ацетонитрил в воде, 25-95%, в течение 3,9 мин со временем цикла 5 мин. Градиент широкого диапазона в интервале 27-53% ацетонитрила использовали в интервале 0,75-3,3 мин для отделения близко элюируемых примесей. Скорость потока: 100 мл/мин. Добавка к подвижной фазе: 25 мМ формиата аммония. Колонка: Inertsil C8, 3050 мм, размер частиц 5 мкм Пример 20 осуществляли исходя из промежуточного соединения 1 способом по схеме 3 выше, как указано далее. К раствору (3-аминоадамантан-1-ил)амида 6-метилпиридин-2-карбоновой кислоты (промежуточное соединение 1, 20 мг, 0,07 ммоль) в ДХМ (5 мл) добавляли DIEA (30 мг, 0,2 ммоль) и 1-метил-1 Нпиразол-3-карбонилхлорид (20 мг, 0,1 ммоль, Maybridge Chemical Co., Cornwall, UK). После перемешивания при комнатной температуре в течение 16 ч реакционную смесь распределяли в дихлорметане и насыщенном растворе бикарбоната натрия. Органический слой сушили над сульфатом натрия и упаривали при пониженном давлении. Остаток очищали на очистительной системе RP-HPLC/MS (градиент: ацетонитрил в воде, 25-95%, в течение 3,9 мин со временем цикла 5 мин. Скорость потока: 100 мл/мин. Добавка к подвижной фазе: 25 мМ формиата аммония. Колонка: Inertsil C8, 3050 мм, размер частиц 5 мкм (GL Sciences, Tokyo, Japan с получением 10 мг (30%) указанного в заголовке соединения, 3-[(1 метил-1 Н-пиразол-3-карбонил)амино]адамантан-1-иламида 6-метилпиридин-2-карбоновой кислоты, в виде твердого вещества белого цвета. 1 Н-ЯМР (400 МГц, CDCl3)8,07 (с, ушир., 1 Н), 7,95 (д, J=7,7 Гц,1 Н), 7,69 (т, J=7,8 Гц, 1 Н), 7,33 (д, J=2,3 Гц, 1 Н), 7,26-7,21 (м, 1 Н), 6,76-6,72 (м, 2 Н), 3,89 (с, 3H), 2,55 (с,3H), 2,54-2,52 (м, 2 Н), 2,35-2,08 (м, 10H), 1,72-1,69 (м, 2 Н). ESI-MS m/z: 394,1 (М+Н)+. Способом, аналогичным описанному в примере 20, осуществляли примеры 21-57 табл. 1 ниже исходя из коммерчески доступных арил, гетероарил или алифатических карбоновых кислот или арил, гетероарил или алифатических карбонилхлоридов в масштабах реакции 0,05-7,0 ммоль. Способом, аналогичным описанному в примере 20, примеры 114-130, 132-139 и 142 табл. 1 ниже осуществляли исходя из коммерчески доступных арил, гетероарил или алифатических карбоновых кислот или арил, гетероарил или алифатических карбонилхлоридов. Способом, аналогичным описанному в примере 20, примеры 131 и 141 табл. 1 ниже осуществляли исходя из 4-трифторметилпиримидин-2-карбоновой кислоты (промежуточное соединение 11) и 4 метилпиримидин-2-карбоновой кислоты (промежуточное соединение 12). Пример 58. 3-[(Пиридин-2-карбонил)амино]адамантан-1-иламид 6-метилпиразин-2-карбоновой кислоты Пример 58 осуществляли исходя из промежуточного соединения 2 способом по схеме 3 выше, как указано далее. В круглодонную колбу добавляли (3-аминоадамантан-1-ил)амид пиридин-2-карбоновой кислоты(3,10 г, 11,0 ммоль, промежуточное соединение 2), 6-метилпиразин-2-карбоновую кислоту (1,83 г, 13,3 ммоль; RihaChem, Kostalov, Czech Republic) и метиленхлорид (120 мл). Далее в раствор добавляли РуВОР (6,90 г, 13,3 ммоль), затем триэтиламин (3,85 мл, 27,6 ммоль) и реакционную смесь перемешивали в течение 2 ч при комнатной температуре. Реакционную смесь переносили в 500-мл делительную колонку с метиленхлоридом (50 мл) и насыщенным водным раствором бикарбоната натрия (150 мл) и экстрагировали метиленхлоридом. Органический слой отделяли и водный слой повторно экстрагировали метиленхлоридом (275 мл). Объединенные органические слои промывали насыщенным солевым раствором(150 мл), сушили над сульфатом натрия, фильтровали и упаривали при пониженном давлении. Остаток очищали на очистительной системе RP-HPLC/MS (градиент: ацетонитрил в воде, 27-95%, в течение 3,5 мин с градиентом широкого диапазона от 30-60% в интервале 0,75-3,4 мин и времени цикла 5 мин. Скорость потока: 100 мл/мин. Добавка к подвижной фазе: 38 мМ ацетата аммония. Колонка: Inertsil C8,3050 мм, размер частиц 5 мкм (GL Sciences, Tokyo, Japan). Температура подвижной фазы и колонки: 50 С). Фракции затем упаривали при пониженном давлении для удаления большей части ацетонитрила,полученный водный слой подщелачивали с помощью твердого карбоната натрия (рН 10) и водный слой экстрагировали этилацетатом (3200 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и упаривали при пониженном давлении с получением 3,21 г(74%) указанного в заголовке соединения,3-[(пиридин-2 карбонил)амино]адамантан-1-иламида 6-метилпиразин-2-карбоновой кислоты, в виде твердого вещества белого цвета. 1 Н-ЯМР (400 МГц, CDCl3)9,17 (с, 1 Н), 8,58 (с, 1 Н), 8,54-8,50 (м, 1 Н), 8,17 (дт, J=7,8,1,0 Гц, 1 Н), 8,06 (ушир.с, 1 Н), 7,85 (тд, J=7,7, 1,7 Гц, 1 Н), 7,77 (ушир.с, 1 Н), 7,42 (ддд, J=7,6, 4,8, 1,3 Гц,1 Н), 2,61-2,57 (м, 5 Н), 2,40-2,28 (м, 4 Н), 2,27-2,19 (м, 2 Н), 2,18-2,08 (м, 4 Н), 1,78-1,68 (м, 2 Н). ESI-MSm/z: 392,0 (М+Н)+. Способом, аналогичным описанному в примере 58, примеры 59-92 табл. 1 ниже осуществляли исходя из коммерчески доступных арил, гетероарил или алифатических карбоновых кислот или арил, гетероарил или алифатических карбонилхлоридов в масштабах реакции 0,05-0,5 ммоль. Способом, аналогичным описанному в примере 58, осуществляли примеры 105-111 табл. 1 ниже исходя из коммерчески доступных арил, гетероарил или алифатических карбоновых кислот или арил,гетероарил или алифатических карбонилхлоридов. Способом, аналогичным описанному в примере 58, осуществляли пример 113 табл. 1 ниже исходя из 4-трифторметилпиримидин-2-карбоновой кислоты (промежуточное соединение 11). Способом, аналогичным описанному в примере 58, осуществляли примеры 93-104 табл. 1 ниже исходя из промежуточного соединения 3, N-(3-аминоадамантан-1-ил)-3-фторбензамида и коммерчески доступных гетероарил карбоновых кислот в масштабах реакции 0,05-0,5 ммоль. Способом, аналогичным описанному в примере 58, осуществляли примеры 182 и 184 исходя из промежуточного соединения 3, N-(3-аминоадамантан-1-ил)-3-фторбензамида и 4-метилпиримидин-2 карбоновой кислоты (промежуточное соединение 12) и 4-трифторметилпиримидин-2-карбоновой кислоты (промежуточное соединение 11) соответственно. Способом, аналогичным описанному в примере 58, осуществляли пример 183 табл. 1 ниже исходя из промежуточного соединения 3, N-(3-аминоадамантан-1-ил)-3-фторбензамида и коммерчески доступной гетероарил карбоновой кислоты. Способом, аналогичным описанному в примере 58, осуществляли примеры 145-179 табл. 1 ниже исходя из промежуточного соединения 8, (3-аминоадамантан-1-ил)амида 6-метилпиразин-2-карбоновой кислоты и коммерчески доступных арил или гетероарил карбоновых кислот, тогда как пример 181 табл. 1 ниже осуществляли исходя из промежуточного соединения 8 и 4-трифторметилпиримидин-2 карбоновой кислоты (промежуточное соединение 11). Способом, аналогичным описанному в примере 58, осуществляли примеры 185-188 табл. 1 ниже исходя из промежуточного соединения 7, (3-аминоадамантан-1-ил)амида пиразин-2-карбоновой кислоты и коммерчески доступных гетероарил карбоновых кислот; пример 189 осуществляли исходя из промежуточного соединения 7 и 4-метилпиримидин-2-карбоновой кислоты (промежуточное соединение 12). Способом, аналогичным описанному в примере 58, осуществляли примеры 191-193 табл. 1 ниже исходя из промежуточного соединения 10, (3-аминоадамантан-1-ил)амида 2-метилпиримидин-4 карбоновой кислоты и коммерчески доступной 5-фторпиридин-2-карбоновой кислоты (Beta Pharm, Inc.,New Haven, CT, USA), 4-трифторметилпиримидин-2-карбоновой кислоты (промежуточное соединение 11) или 4-метилпиримидин-2-карбоновой кислоты (промежуточное соединение 12). Способом, аналогичным описанному в примере 58, осуществляли примеры 194-196 табл. 1 ниже исходя из промежуточного соединения 9, (3-аминоадамантан-1-ил)амида пиримидин-4-карбоновой кислоты и 4-метилпиримидин-2-карбоновой кислоты (промежуточное соединение 12), коммерчески доступной 5-фторпиридин-2-карбоновой кислоты или 4-трифторметилпиримидин-2-карбоновой кислоты Пример 143 табл. 1 ниже осуществляли из соединения по примеру 142 путем восстановления с помощью NaBH4 выше, как указано далее. В сосуд,содержащий 3-[(6-ацетилпиридин-2-карбонил)амино]адамантан-1-иламид 6 метилпиридин-2-карбоновой кислоты (50 мг, 0,1 ммоль, пример 142) в МеОН (2 мл), добавляли боргидрид натрия (6 мг, 0,17 ммоль) при 0 С. После перемешивания в течение 2 ч реакционную смесь упаривали и распределяли в дихлорметане и насыщенном растворе бикарбоната натрия. Органический слой сушили над сульфатом натрия и упаривали при пониженном давлении. Остаток очищали на очистительной системе RP-HPLC/MS (градиент: ацетонитрил в воде, 25-95%, в течение 3,6 мин при градиенте широкого диапазона в области 33-63% ацетонитрила в интервале 0,75-3,3 мин и времени цикла 5 мин. Скорость потока: 100 мл/мин. Добавка к подвижной фазе: 48 мМ формиата аммония. Колонка: Inertsil C18, 3050 мм, размер частиц 5 мкм) с получением 45 мг (90%) указанного в заголовке соединения, 3-[(6-(1 гидроксиэтил)пиридин-2-карбонил)амино]адамантан-1-иламида 6-метилпиридин-2-карбоновой кислоты. 1 Н-ЯМР (400 МГц, CDCl3)8,07-8,00 (м, 2 Н), 7,90 (д, J=7,9 Гц, 1 Н), 7,78 (т, J=7,9 Гц, 1 Н), 7,74 (с,ушир., 1 Н), 7,64 (т, J=7,8 Гц, 1 Н), 7,41 (д, J=7,8, Гц 1 Н), 7,20-7,06 (м, 1 Н), 4,91-4,85 (м, 1 Н), 2,50 (с, ушир.,5 Н), 2,31-2,26 (м, 2 Н), 2,21-2,06 (м, 8 Н), 1,69-1,64 (м, 2 Н), 1,48 (с, 3H). ESI-MS m/z: 435,0 (М+Н)+. Пример 144 табл. 1 ниже осуществляли из соединения по примеру 142 путем реакции Гриньяра выше, как указано далее. В сосуд,содержащий 3-[(6-ацетилпиридин-2-карбонил)амино]адамантан-1-иламид 6 метилпиридин-2-карбоновой кислоты (35 мг, 0,08 ммоль, пример 142) в ТГФ (2 мл), добавляли 1 М метиллития (0,4 мл) при -40 С. После перемешивания в течение 2 ч реакционную смесь гасили холодной водой, упаривали и распределяли в дихлорметане и насыщенном растворе бикарбоната натрия. Органический слой сушили над сульфатом натрия и упаривали при пониженном давлении. Остаток очищали на очистительной системе RP-HPLC/MS (градиент: ацетонитрил в воде, 28-95%, в течение 3,6 мин при градиенте широкого диапазона в области 33-60% ацетонитрила в интервале 0,75-3,4 мин и времени цикла 5 мин. Скорость потока: 100 мл/мин. Добавка к подвижной фазе: 48 мМ формиата аммония. Колонка: Inertsil C8, 3050 мм, размер частиц 5 мкм) с получением 25 мг (69%) указанного в заголовке соединения,(3-[6-(1-гидрокси-1-метилэтил)пиридин-2-карбонил]аминоадамантан-1-ил)амида 6-метилпиридин-2 карбоновой кислоты. 1 Н-ЯМР (400 МГц, CDCl3)8,10-8,06 (м, 2 Н), 7,95 (д, J=7,6 Гц, 1 Н), 7,86 (т, J=7,8 Гц, 1 Н), 7,75 (с, 1 Н), 7,70 (т, J=7,8 Гц, 1 Н), 7,59 (д, J=7,9 Гц, 1 Н), 7,26-7,22 (м, 1 Н), 2,58-2,55 (м, 5 Н), 2,392,13 (м, 10H), 1,76-1,71 (м, 2 Н), 1,59 (с, 6 Н). ESI-MS m/z: 449,0 (М+Н)+. Пример 180. 3-[(6-Метилпиразин-2-карбонил)амино]адамантан-1-иламид 2 трифторметилпиримидин-4-карбоновой кислоты Пример 180 табл. 1 ниже осуществляли способом по схеме 3 исходя из промежуточного соединения 8 и 2-трифторметилпиримидин-4-карбоновой кислоты, которую получали исходя из соответствующего сложного эфира выше, как указано далее. В сосуд для микроволнового облучения добавляли метиловый эфир 2-трифторметилпиримидин-4 карбоновой кислоты (110 мг, 0,52 ммоль, CNH Tech, MA), ТГФ (2 мл) и гидроксид лития (18 мг, 0,75 ммоль) в 200 мкл воды. Смесь нагревали в микроволновой печи в течение 5 мин при 100 С и затем упаривали досуха при пониженном давлении. К остатку добавляли промежуточное соединение 8, (3 аминоадамантан-1-ил)амид 6-метилпиразин-2-карбоновой кислоты (100 мг, 0,4 ммоль), ТГФ (5 мл),DIEA (90 мг, 0,7 ммоль) и TBTU (140 мг, 0,42 ммоль, AKSCI, СА). После перемешивания при комнатной температуре в течение 16 ч реакционную смесь упаривали и распределяли в ДХМ и насыщенном растворе бикарбоната натрия. Органический слой отделяли, сушили над сульфатом натрия, фильтровали и упаривали досуха при пониженном давлении. Сырой продукт очищали на системе RP-HPLC/MS (градиент: ацетонитрил в воде, 30-95%, в течение 3,6 мин со временем цикла 5 мин при градиенте широкого диапазона в области 40-68% ацетонитрила в интервале 0,75-3,4 мин. Скорость потока: 100 мл/мин. Добавка к подвижной фазе: 48 мМ формиата аммония. Колонка: Inertsil C8, 3050 мм, размер частиц 5 мкм) с получением 60 мг(40%) указанного в заголовке соединения,3-[(6-метилпиразин-2 карбонил)амино]адамантан-1-иламида 2-трифторметилпиримидин-4-карбоновой кислоты. 1 Н-ЯМР (400 МГц, CDCl3)9,16 (с, 1 Н), 9,12 (д, J=5,0, 1H), 8,6 (с, 1 Н), 8,28 (д, J=5,0, 1 Н), 7,80-7,75 (м, 2 Н), 2,6 (с,ушир., 5 Н), 2,42-2,36 (м, 2 Н), 2,23-2,17 (м, 8 Н), 1,77-1,73 (м, 2 Н). ESI-MS m/z: 460,9 (М+Н)+. Способом, аналогичным описанному в примере 180, осуществляли примеры 112, 140 и 190 табл. 1 ниже исходя из промежуточного соединения 2, (3-аминоадамантан-1-ил)амида пиридин-2-карбоновой кислоты, промежуточного соединения 1, (3-аминоадамантан-1-ил)амида 6-метилпиридин-2-карбоновой кислоты, и промежуточного соединения 7, (3-аминоадамантан-1-ил)амида пиразин-2-карбоновой кислоты, соответственно.
МПК / Метки
МПК: A61P 25/00, C07D 241/44, C07D 213/81, A61K 31/444, C07D 401/12, C07D 231/14, C07D 333/38, C07C 233/79, C07D 215/48, A61K 31/4412, C07D 405/14, C07D 401/14, C07C 233/00, C07D 403/12, C07D 405/12
Метки: фармацевтическая, содержащая, применение, диамидные, адамантана, композиция, производные
Код ссылки
<a href="https://eas.patents.su/30-19546-diamidnye-proizvodnye-adamantana-soderzhashhaya-ih-farmacevticheskaya-kompoziciya-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Диамидные производные адамантана, содержащая их фармацевтическая композиция и их применение</a>
Предыдущий патент: Многонаправленное уголковое световозвращающее изделие
Следующий патент: Индивидуальный летательный аппарат, включающий систему управления
Случайный патент: Композиции и способы ингибирования экспрессии генов eg5 и vegf












