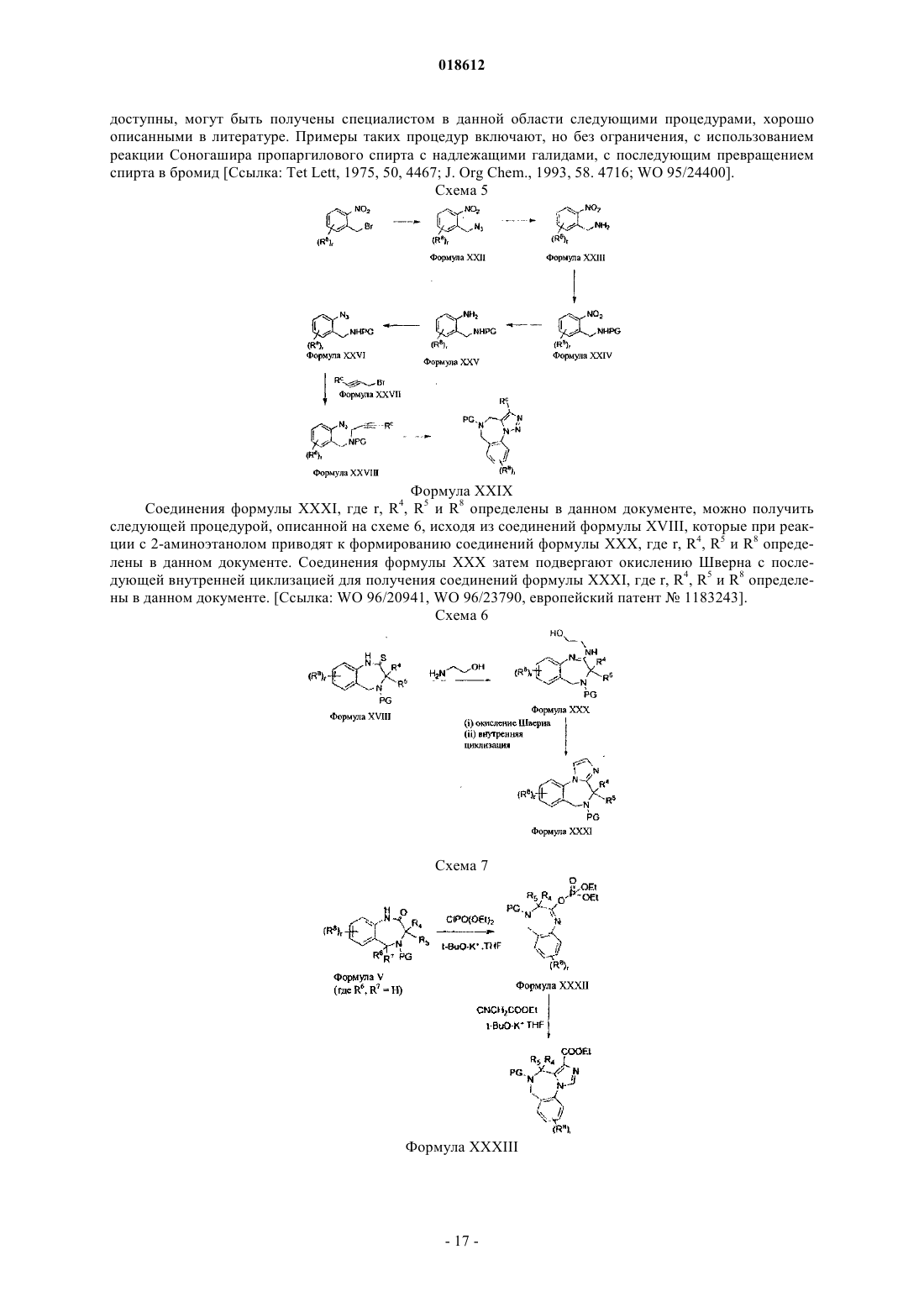
Новые гетероциклические соединения
Номер патента: 18612
Опубликовано: 30.09.2013
Авторы: Сингх Нишан, Трехан Санджай, Магади Ситарам Кумар, Шарма Садхир Кумар, Нанда Гурмит Каур, Дас Джагаттаран, Джаин Раджеш
Формула / Реферат
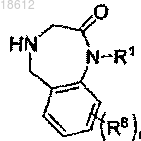
1. Соединение формулы I
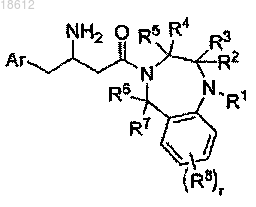
или его фармацевтически приемлемые производные, таутомерные формы, стереоизомеры, включая R и S изомеры, соли или их сольваты, где
Ar представляет собой фенил, который может быть замещенным в любом доступном положении одним или более заместителями, выбранными из галогена;
R1 выбран из группы, включающей (CH2)nCONRaRb, (CH2)nCOORa, водород, С1-12 алкил, С2-12 алкенил, С1-12 галоалкил, (СН2)n-С3-8 циклоалкил, (СН2)n-фенил; где фенильная группа может быть факультативно замещена в любом доступном положении одним или более заместителями, выбранными из водорода, галогена, CN, С1-12 алкокси, С1-12 галоалкила;
R2 и R3 вместе представляют отдельный атом кислорода, который связан с диазепиновым кольцом двойной связью; или R1 и R3 вместе с атомом азота, к которому R1 присоединен, формируют моноциклическое 5-членное гетероарильное кольцо, которое дополнительно содержит один или два гетероатома N; причем сформированное кольцо может быть факультативно замещено одним или более заместителями, выбранными из Rc или Rc', и R2 представляет двойную связь;
R4 и R5 независимо выбраны из водорода или С1-12 алкила;
R6 и R7 представляют собой водород;
R8 независимо выбран из водорода, галогена или С1-12 алкокси;
Ra и Rb независимо выбраны из водорода, C1-12 алкила, С1-12 галоалкила, С3-8 циклоалкила, изоксазолила, (СН2)n-фенила; где фенильная группа может быть факультативно замещена С1-12 алкокси; или Ra и Rb могут быть соединены вместе с атомом азота, к которому они присоединены, для формирования моноциклического пяти- или шестичленного гетероциклического кольца, которое может дополнительно содержать еще один гетероатом, выбранный из О или S, причем сформированное кольцо может быть факультативно замещено одним или более заместителями, выбранными из водорода, галогенаа, оксо,
-ОН; причем сформованное кольцо может дополнительно быть слито с 6-членным ненасыщенным кольцом, слитое кольцо может факультативно быть замещено одним или более заместителями C1-12 алкокси;
Rc или Rc' независимо выбран из группы, включающей водород, C1-12 алкил, С1-12 галоалкил, С3-8 циклоалкил, фенил, -(СО)NR9R10, -СООН, -СООС1-12 алкил; где фенильная группа может быть факультативно замещена галогеном или С1-12 алкокси;
R9 и R10 независимо выбраны из водорода, C1-12 алкила, С1-12 галоалкила, С3-8 циклоалкила, (СН2)n-фенила, где фенильная группа может быть факультативно замещена С1-12 галоалкилом; или R9 и R10 могут быть соединены вместе для формирования моноциклического пяти- или шестичленного гетероциклического кольца, которое может включать гетероатом О, образованное таким образом кольцо может факультативно быть замещено одним или более заместителями выбранными из галогена;
n представляет собой 1, 2, 3 или 4;
r представляет собой 1, 2, 3 или 4.
2. Соединение по п.1, имеющее формулу Ia
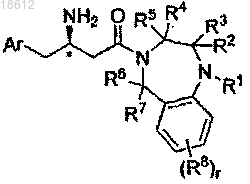
где r, Ar, R1, R2, R3, R4, R5, R6, R7 и R8 определены в п.1;
его фармацевтически приемлемые производные, таутомерные формы, стереоизомеры, соли или их сольваты.
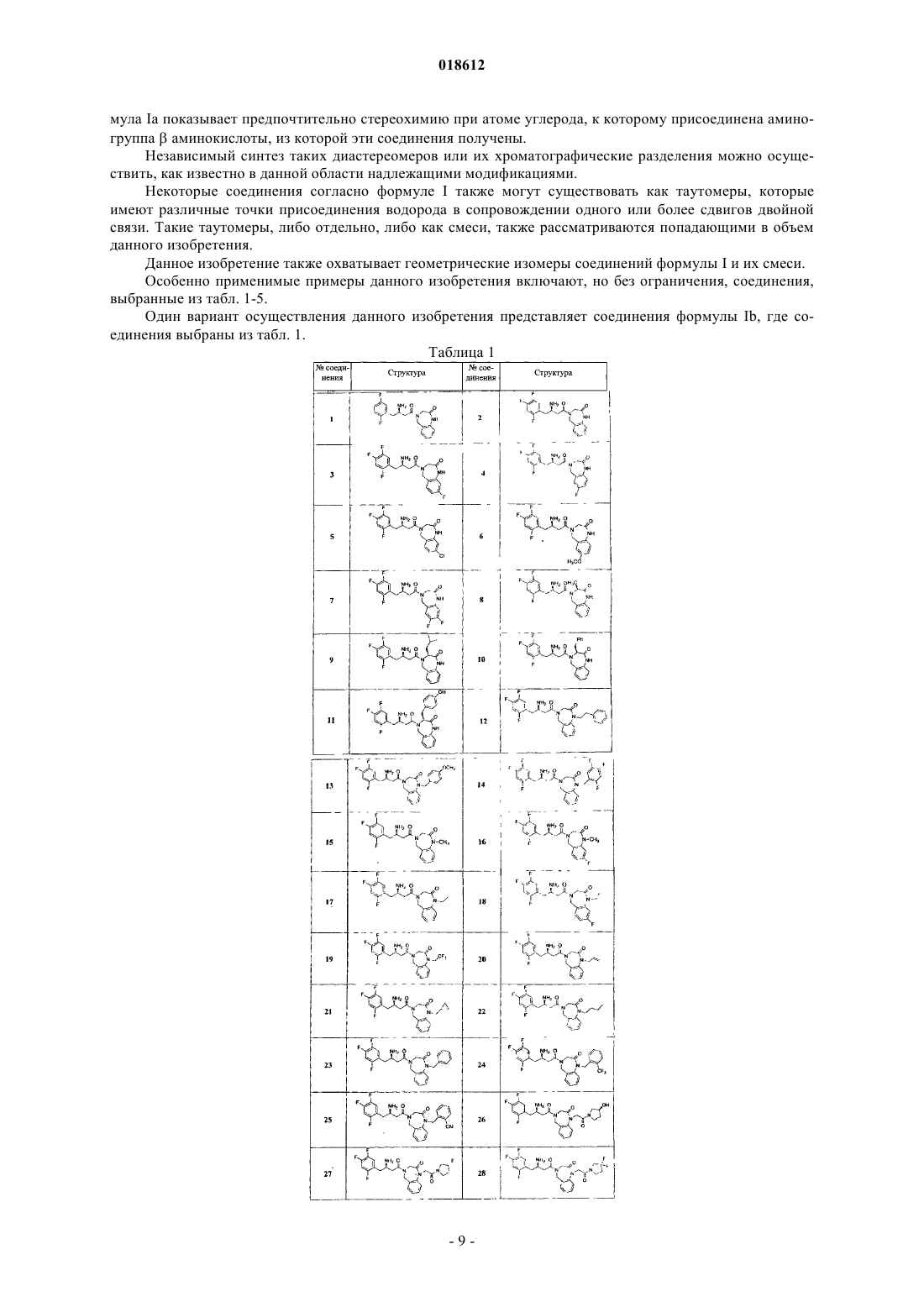
3. Соединение по п.1, имеющее формулу Ib
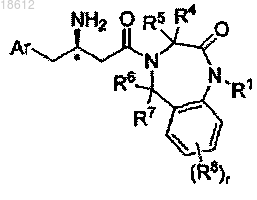
где r, Ar, R1, R4, R5, R6, R7 и R8 определены в п.1;
его фармацевтически приемлемые производные, таутомерные формы, стереоизомеры, соли или их сольваты.
4. Соединение по п.1, имеющее формулу Ic
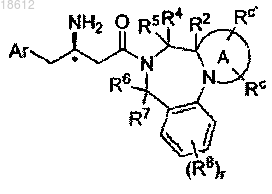
где кольцо А факультативно замещено в любом доступном положении одним или более заместителями, независимо выбранными из Rc или Rc'; R2 представляет собой двойную связь; r, Ar, R4, R5, R6, R7, R8, Rc и Rc' определены в п.1;
его фармацевтически приемлемые производные, таутомерные формы, стереоизомеры, соли или их сольваты.
5. Соединение по п.1, имеющее формулу Id
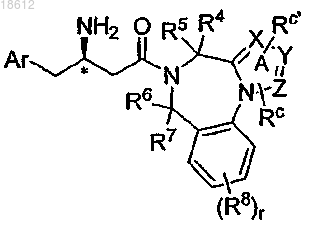
где X, Y и Z независимо выбраны из группы, включающей N и -СН; причем кольцо А факультативно замещено в любом доступном положении одним или более заместителями, независимо выбранными из Rc или Rc; r, Ar, R4, R5, R6, R7, R8, Rc и Rc' определены в п.1;
его фармацевтически приемлемые производные, таутомерные формы, стереоизомеры, соли или их сольваты.
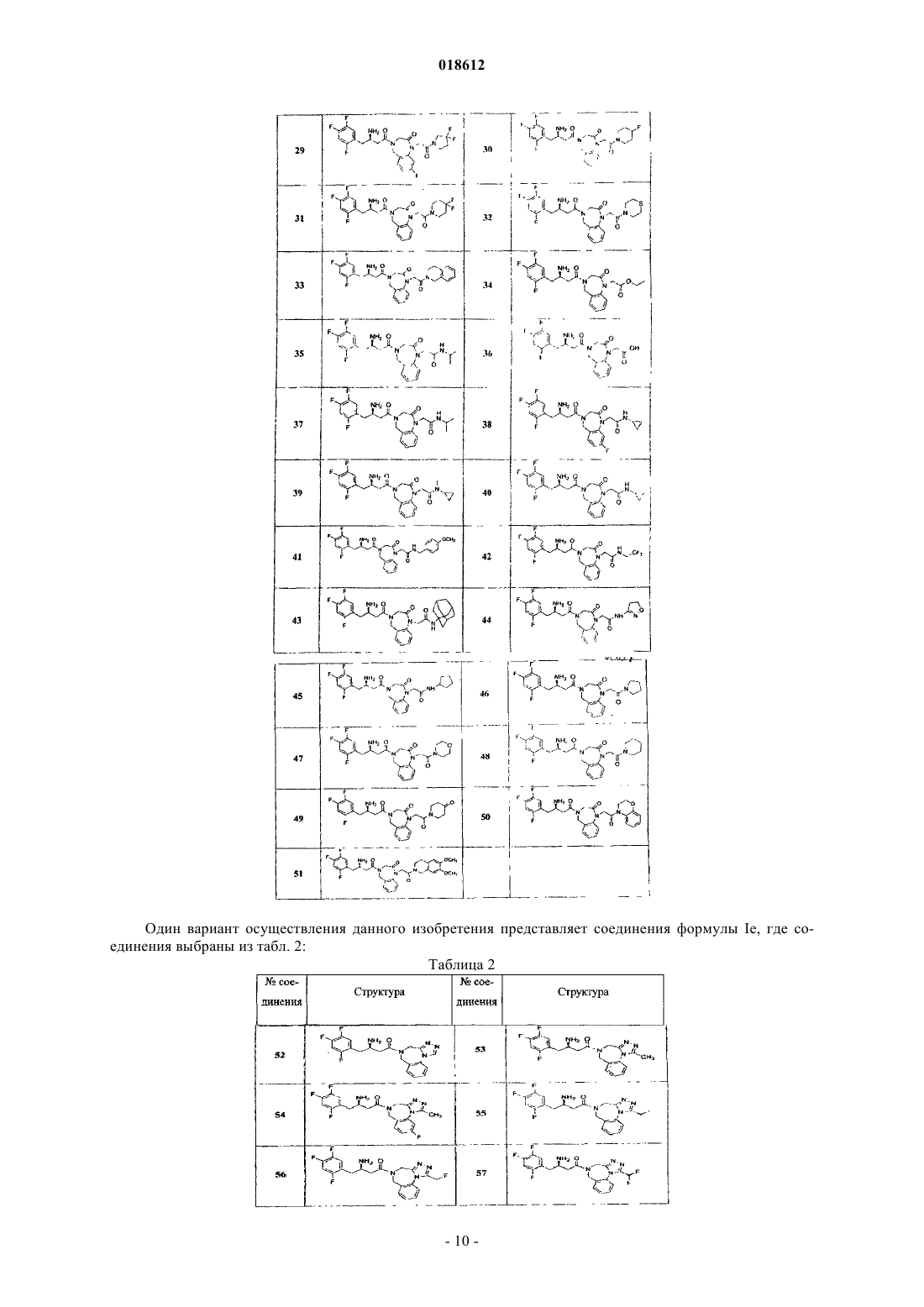
6. Соединение по п.1, имеющее формулу Ie
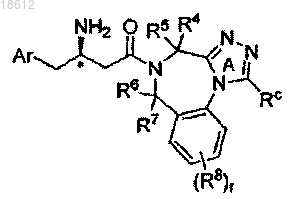
где кольцо А замещено Rc; r, Ar, R4, R5, R6, R7, R8 и Rc определены в п.1;
его фармацевтически приемлемые производные, таутомерные формы, стереоизомеры, соли или их сольваты.
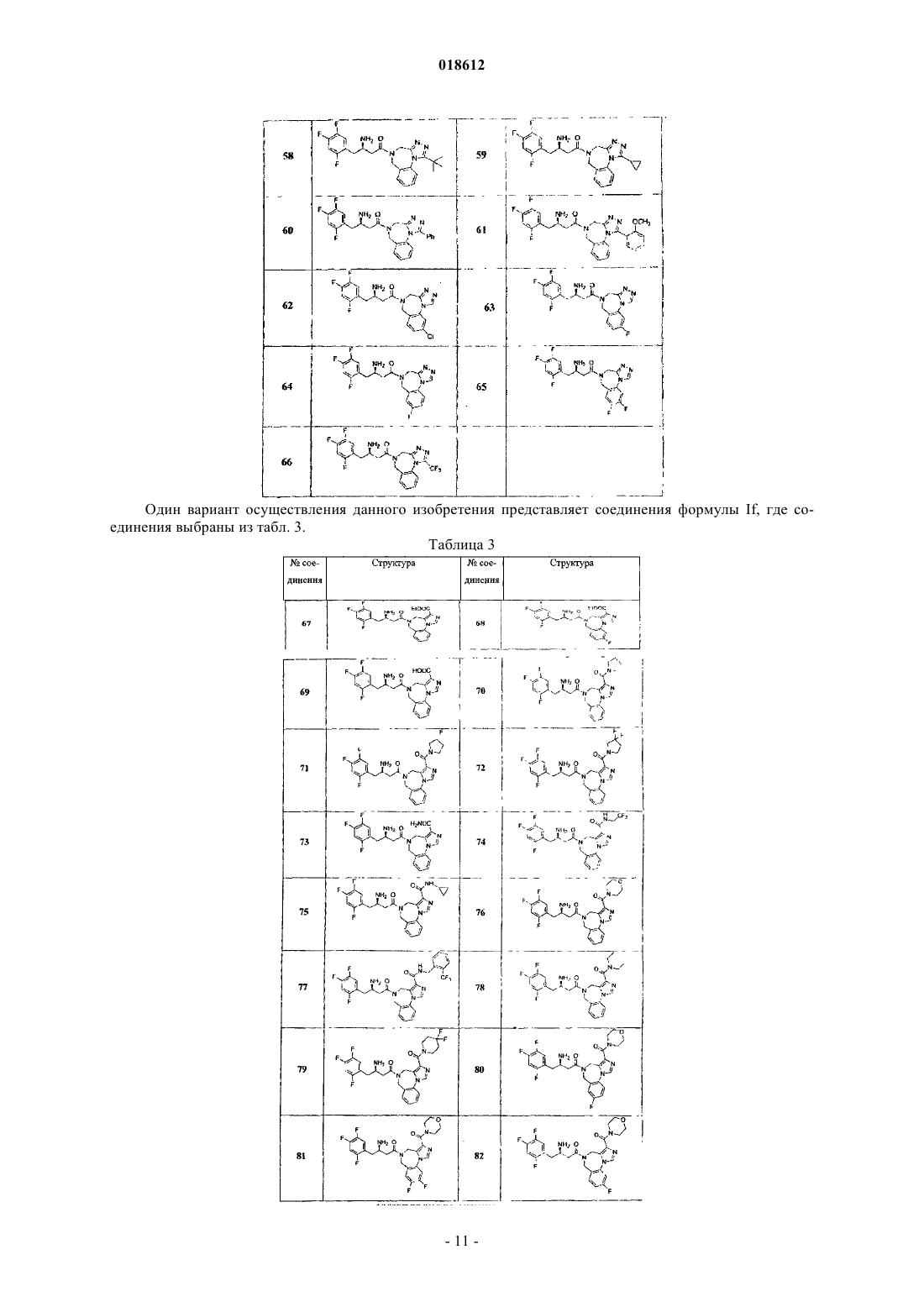
7. Соединение по п.1, имеющее формулу If
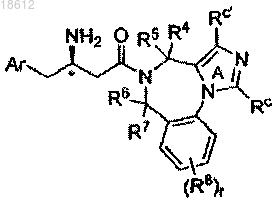
где кольцо А замещено Rc или R c'; r, Ar, R4, R5, R6, R7, R8, Rc и Rc' определены в п.1;
его фармацевтически приемлемые производные, таутомерные формы, стереоизомеры, соли или их сольваты.
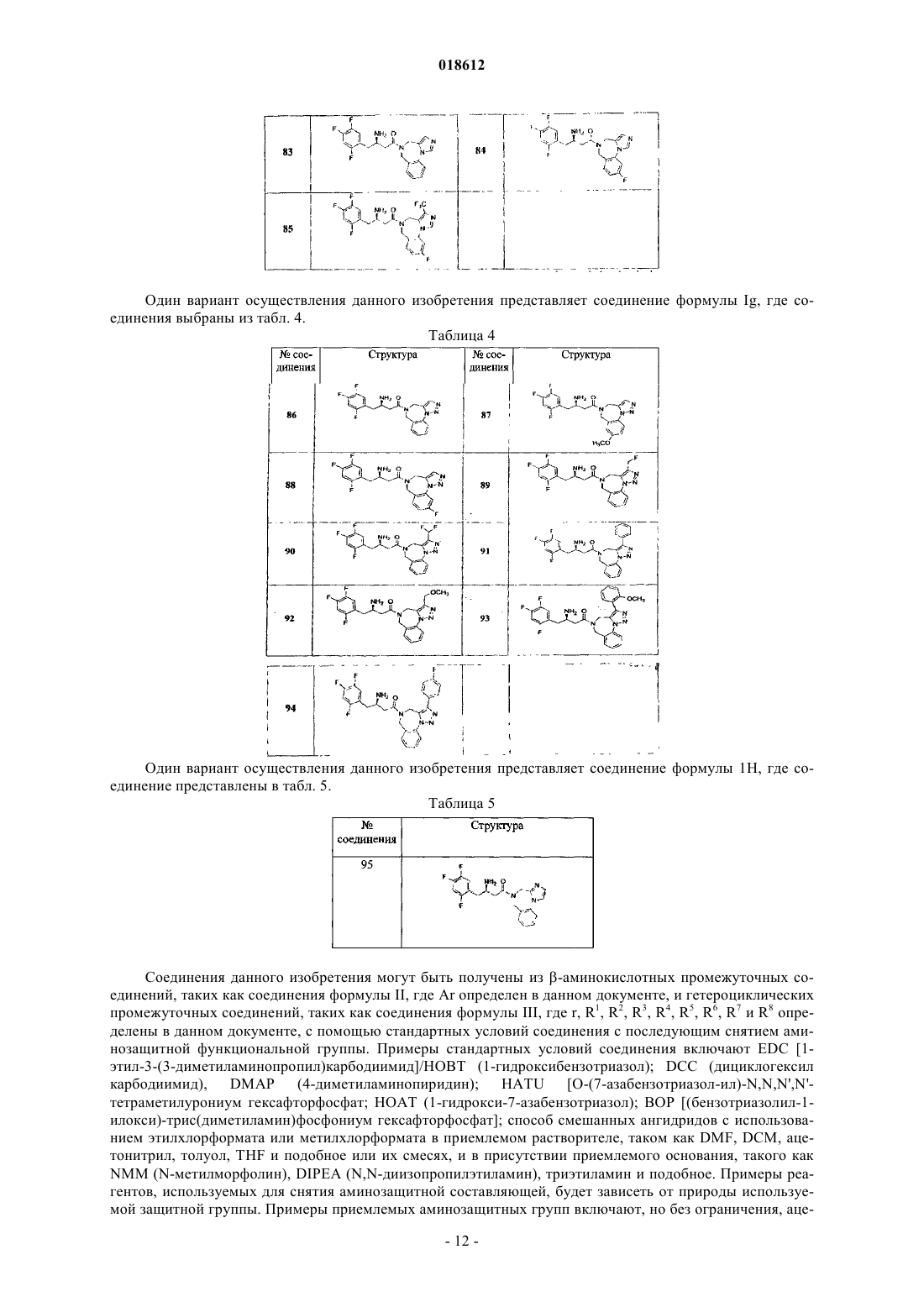
8. Соединение по п.1, имеющее формулу Ig
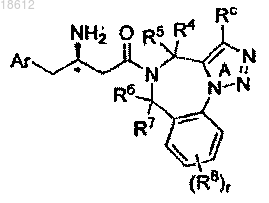
где кольцо А замещено Rc; r, Ar, R4, R5, R6, R7, R8 и Rc определены в п.1; его фармацевтически приемлемые производные, таутомерные формы, стереоизомеры, соли или их сольваты.
9. Соединение по п.1, имеющее формулу Ih
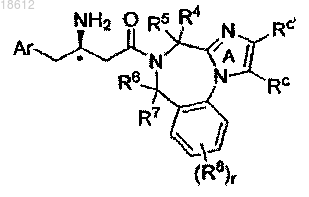
где кольцо А замещено Rc или Rc'; r, Ar, R4, R5, R6, R7, R8, Rc и Rc' определены в п.1;
его фармацевтически приемлемые производные, таутомерные формы, стереоизомеры, соли или их сольваты.
10. Соединение по п.1, где Ar выбран из группы, включающей 2,4,5-трифторфенил и 2,5-дифторфенил.
11. Соединение по п.1, где R8 выбран из группы, включающей водород, фтор, хлор и метокси.
12. Соединение по пп.1-3, где R1 выбран из группы, включающей водород, С1-12 алкил, С2-12 алкенил, (СН2)n-фенил,
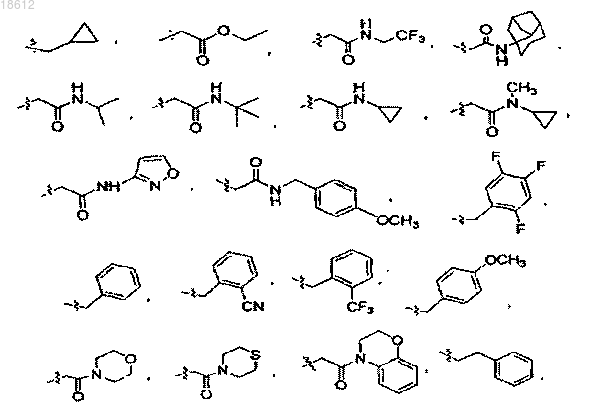
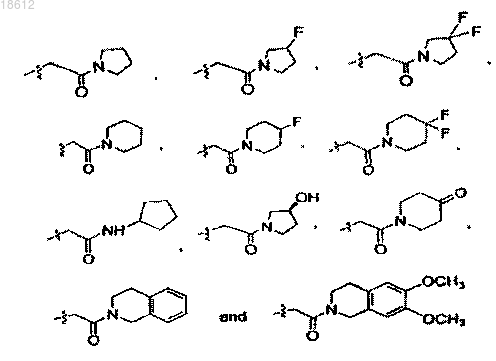
13. Соединение по пп.4-9, где кольцо А замещено одним или более Rc и Rc', независимо выбранными из группы, включающей водород, С1-12 алкил, С3-8 циклоалкил, фенил, -CH2F, -CHF2, -CF3, -COOH, -CONH2, CH2-OCH3, COOC1-6 алкил,
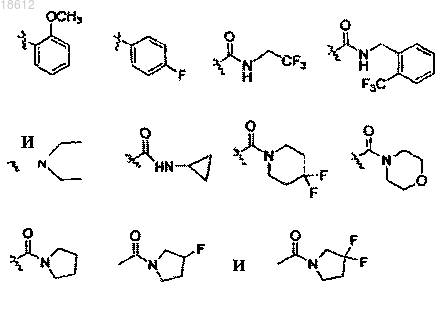
14. Соединение по п.1, где R4 и R5 оба являются водородом.
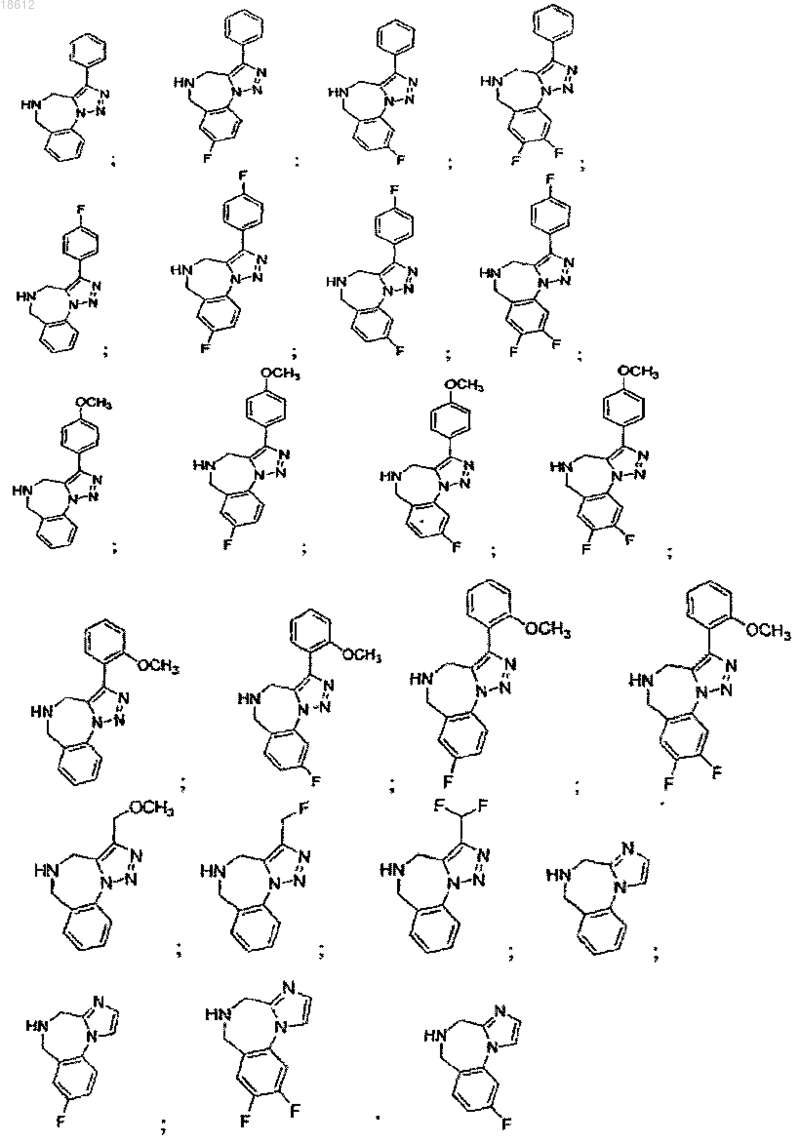
15. Соединение, выбранное из группы, включающей
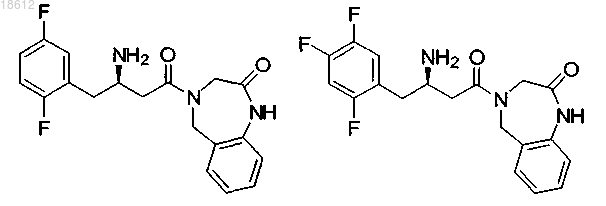
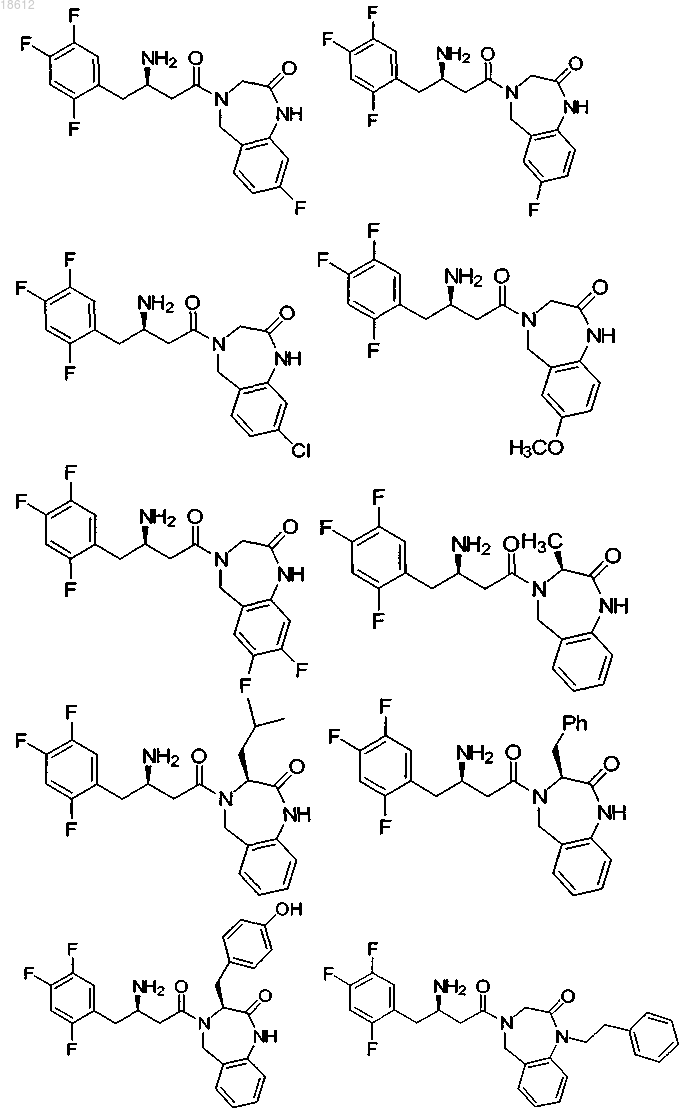
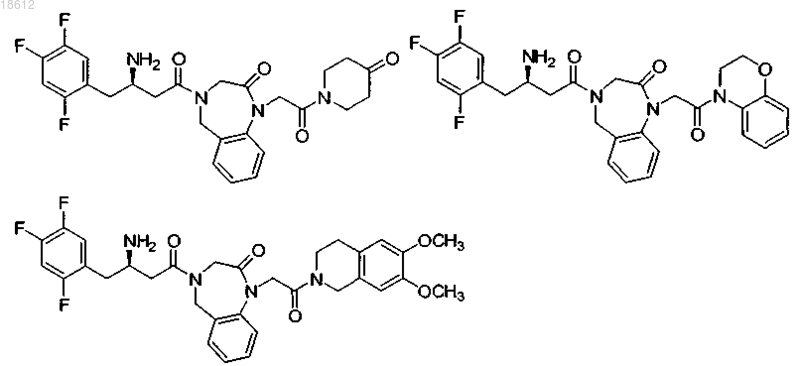
и его фармацевтически приемлемые соли или его сольваты.
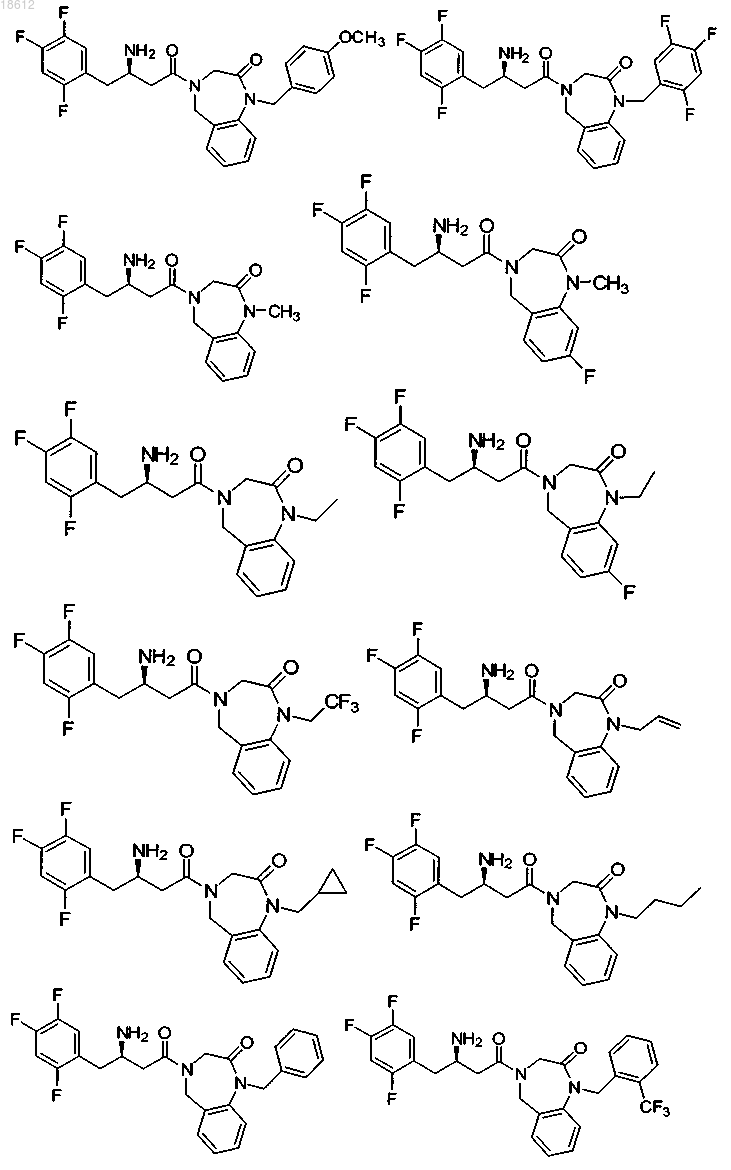
16. Соединение, выбранное из группы, включающей
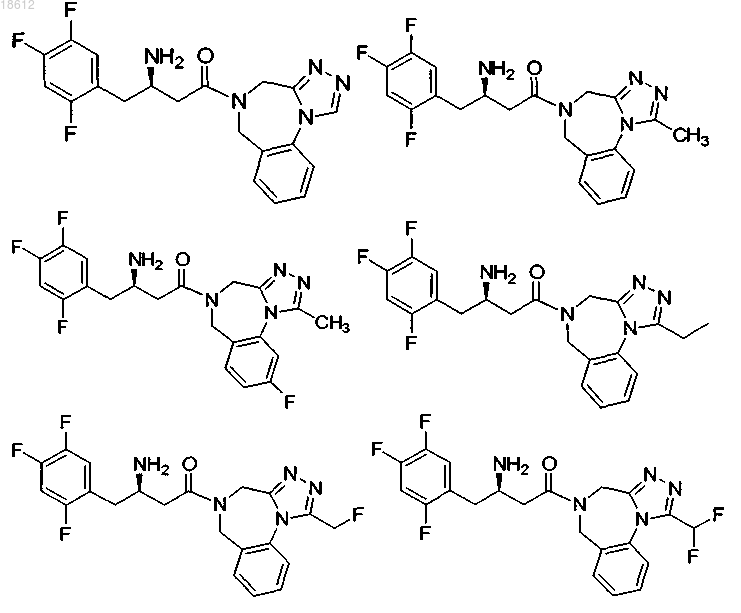
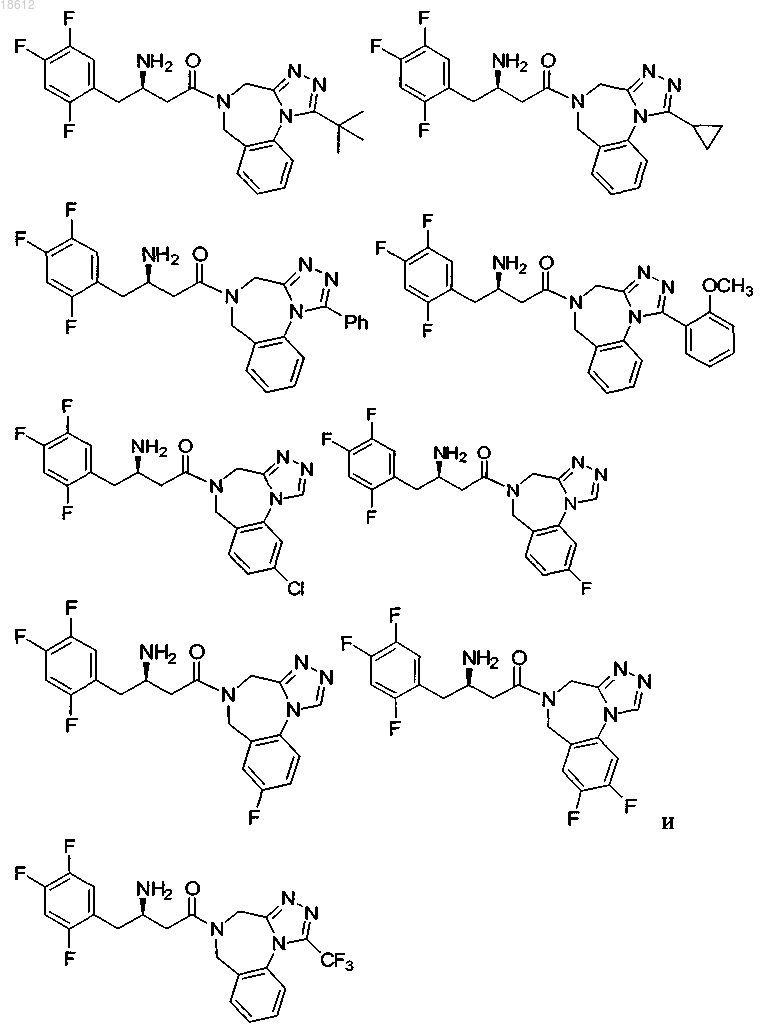
и его фармацевтически приемлемые соли или его сольваты.
17. Соединение, выбранное из группы, включающей
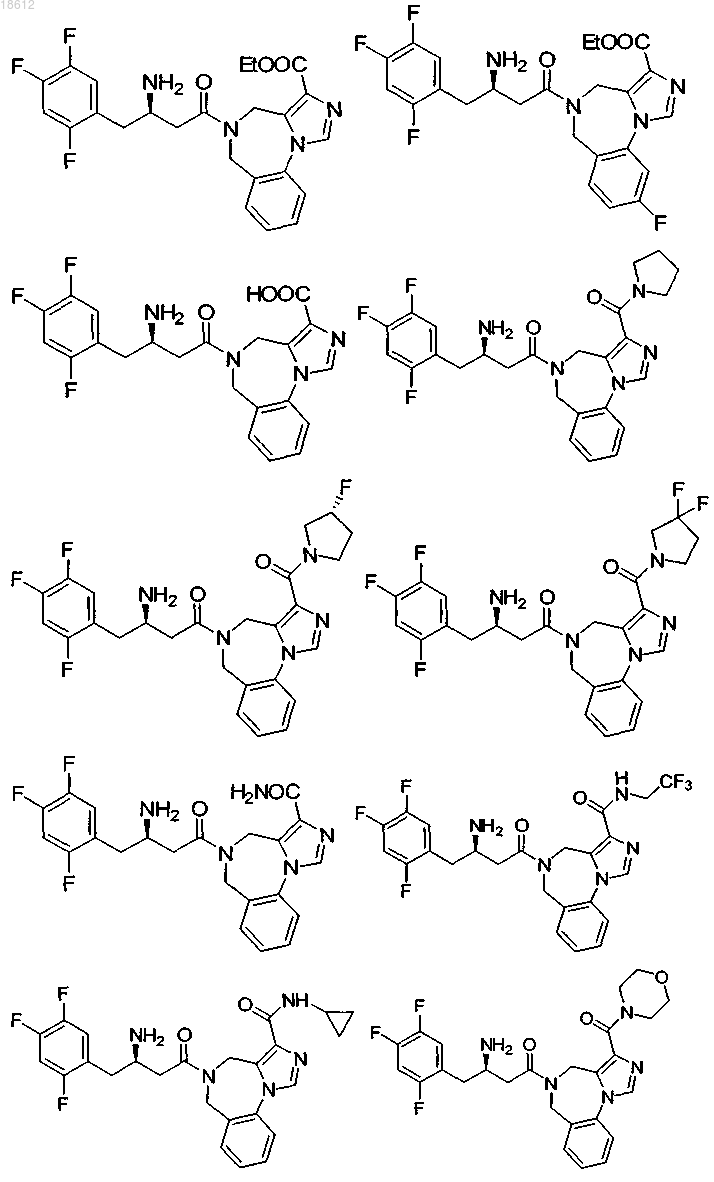
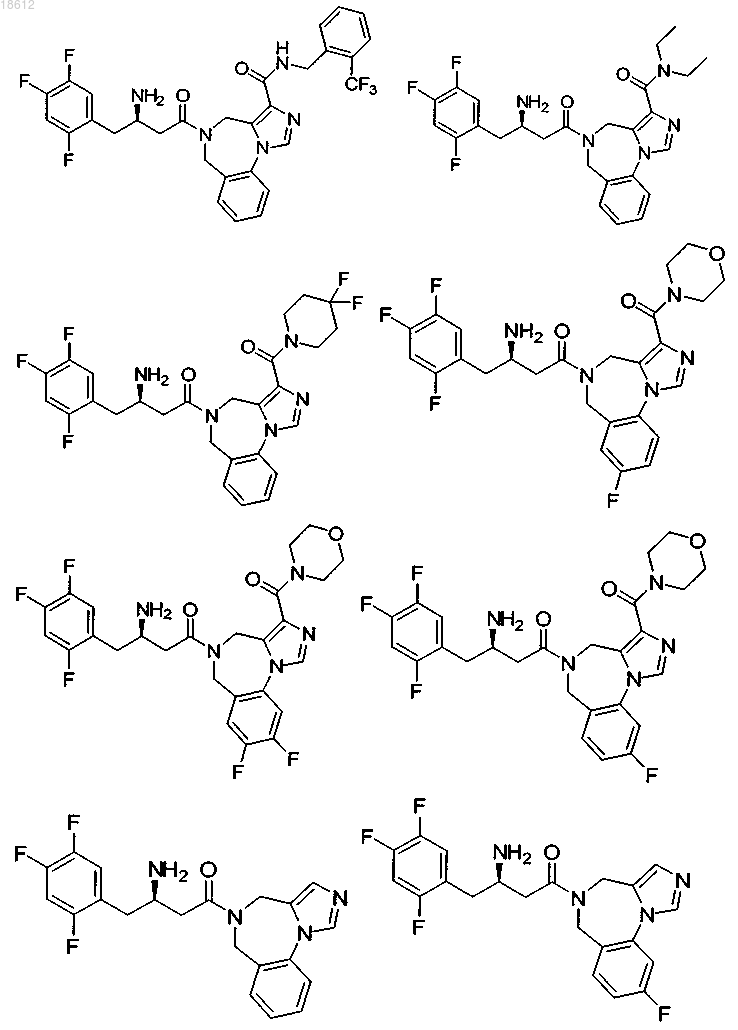
и его фармацевтически приемлемые соли или его сольваты.
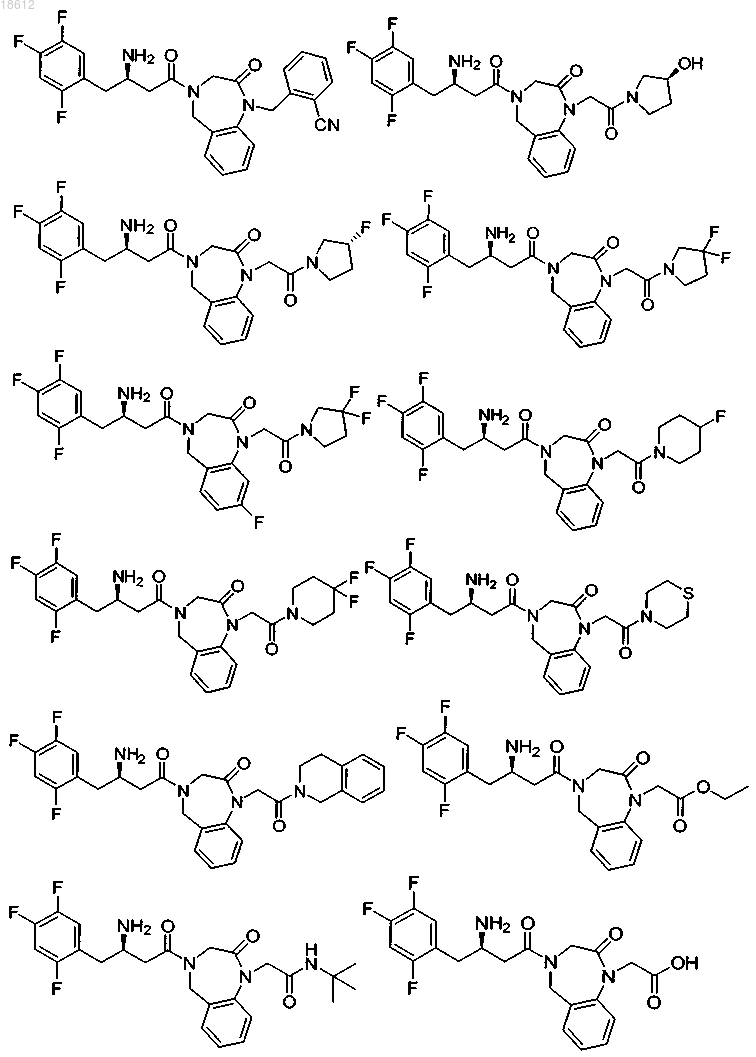
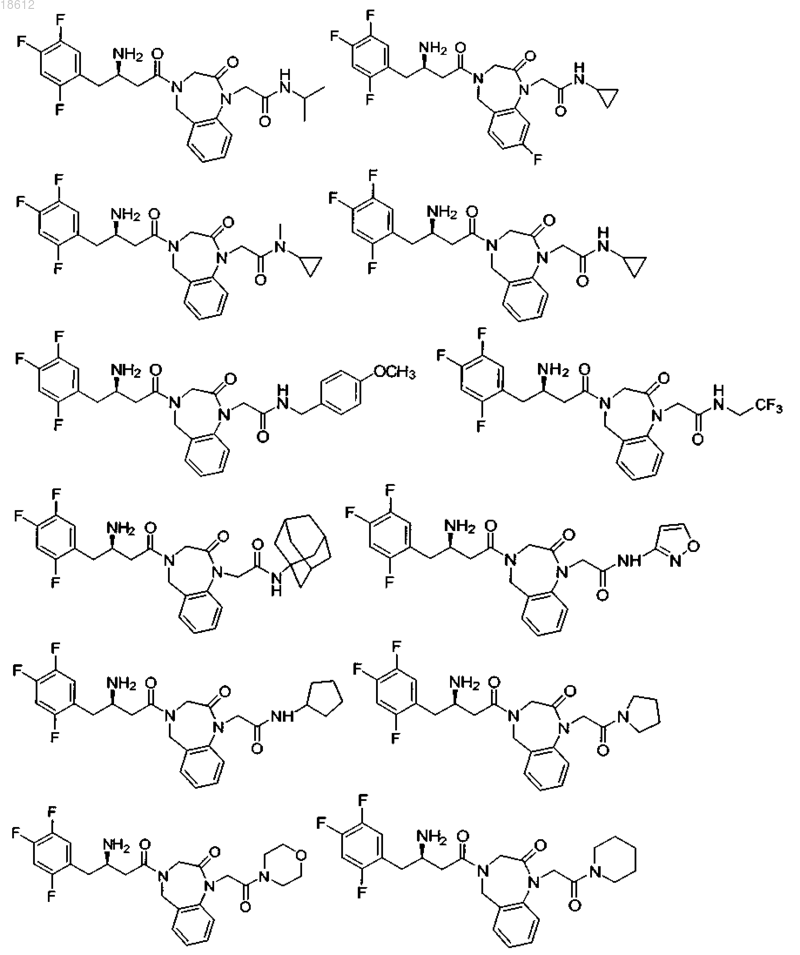
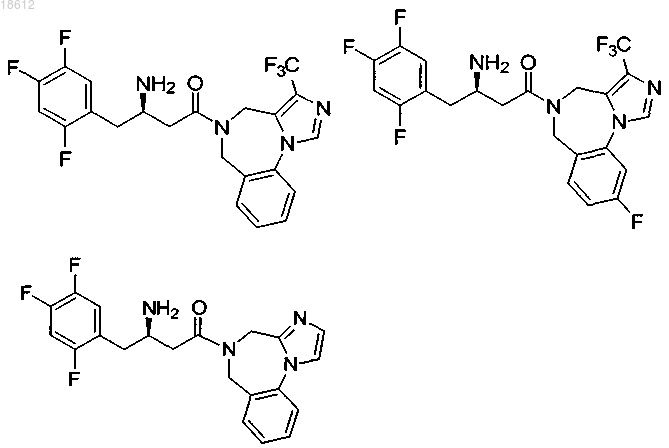
18. Соединение, выбранное из группы, включающей

и его фармацевтически приемлемые соли или его сольваты.
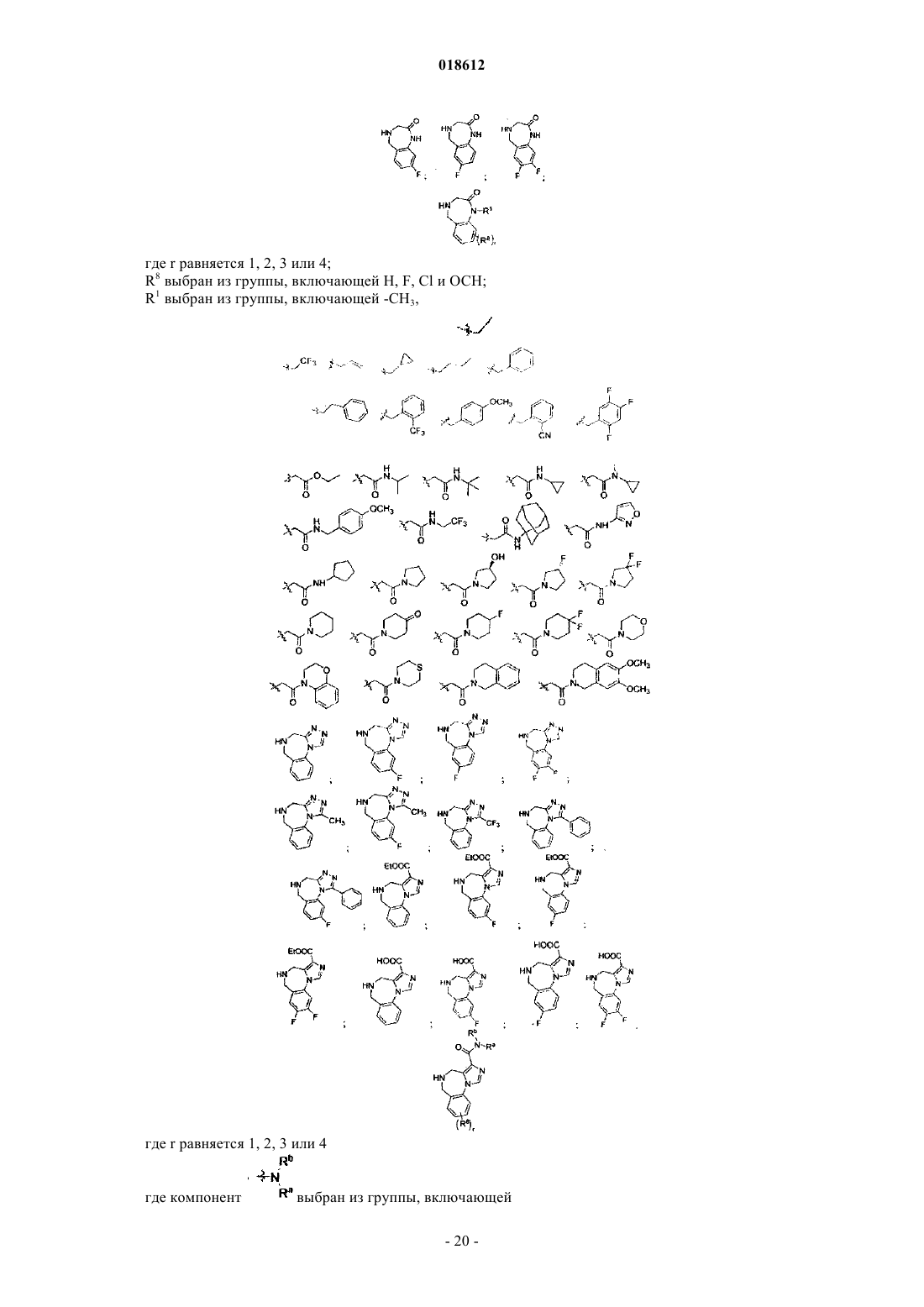
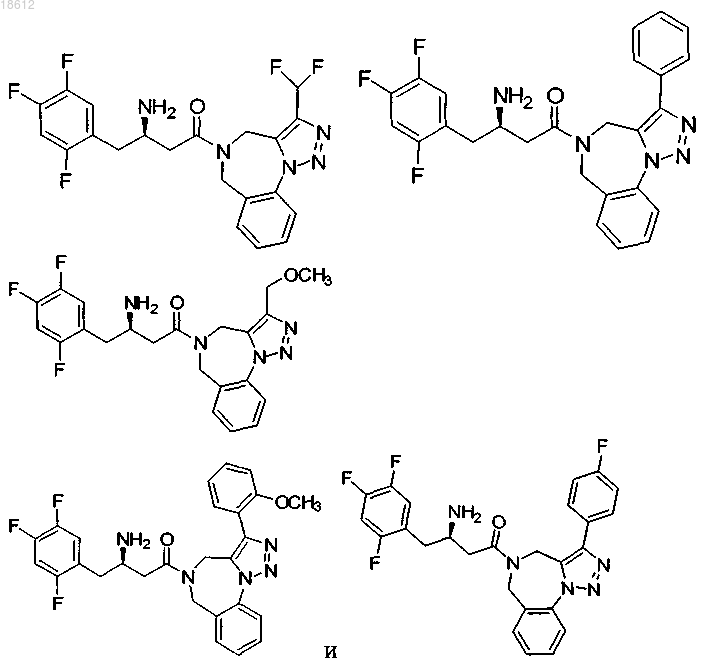
19. Соединение, выбранное из группы, включающей
где r равняется 1, 2, 3 или 4,
R8 выбран из группы, включающей Н, F, Cl и ОСН3,
R1 выбран из группы, включающей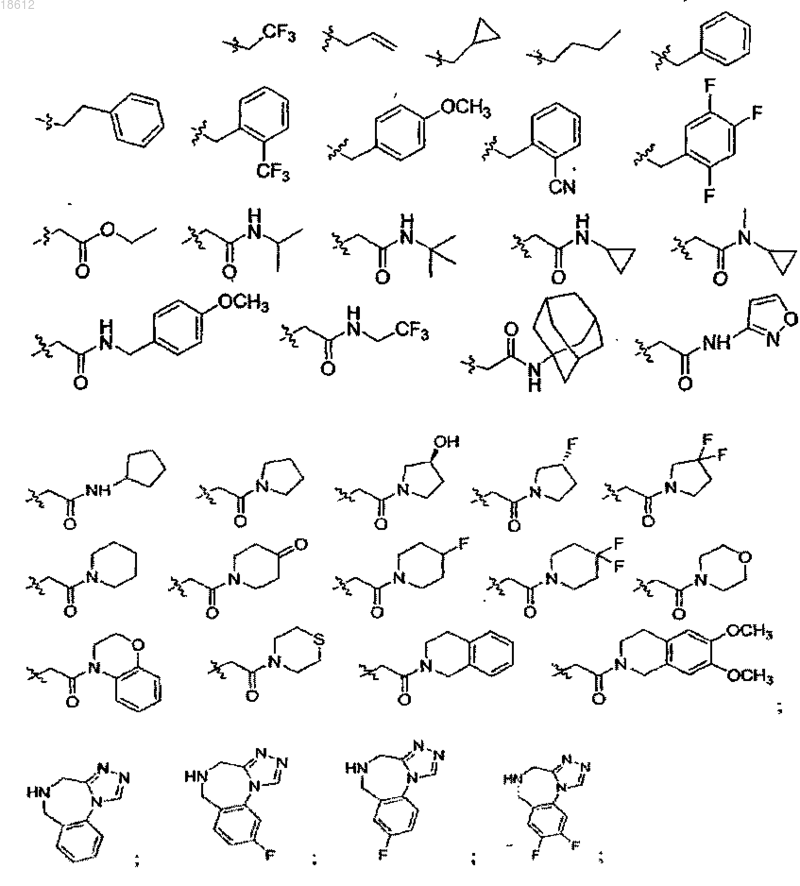
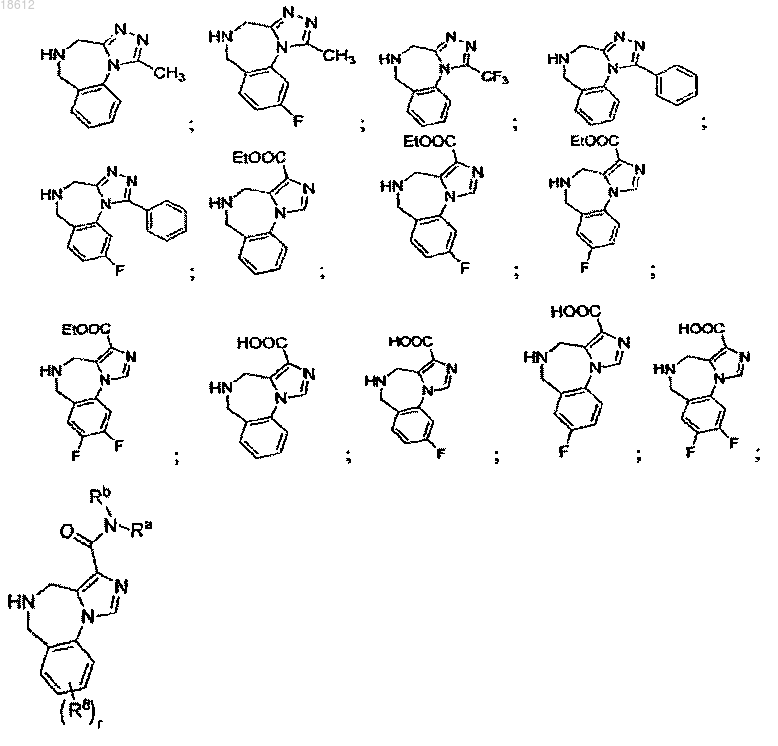
где r равняется 1, 2, 3 или 4,
компонент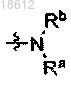 выбран из группы, включающей
выбран из группы, включающей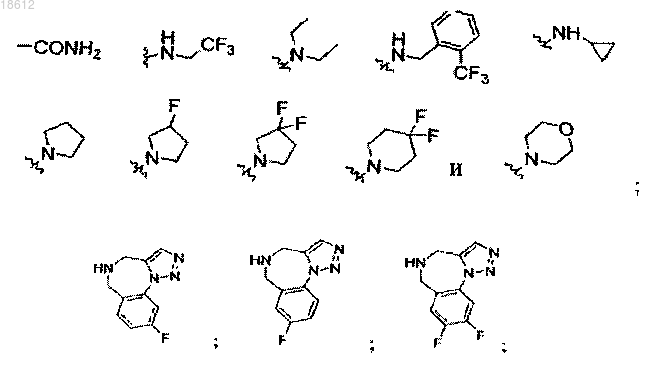
и его фармацевтически приемлемые соли или его сольваты.
20. Способ получения соединения формулы I по п.1 или его фармацевтически приемлемых производных, таутомерных форм, стереоизомеров, солей или их сольватов, включающий следующие этапы, на которых:
а) осуществляют взаимодействие соединения формулы II
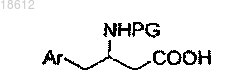
где PG является защитной группой, с соединением формулы III
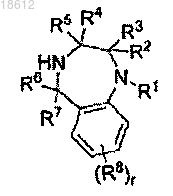
с использованием условий реакции, реагентов и защитных групп;
b) удаляют защитную группу (PG) с использованием реагента, снимающего защитную группу;
где r, Ar, R1, R2, R3, R4, R5, R6, R7 и R8 определены в п.1.
21. Фармацевтическая композиция для профилактики, облегчения и/или лечения одного или более состояния, опосредованного DPP-IV, у субъекта, нуждающегося в этом, включающая соединение по пп.1, 15-18, его фармацевтически приемлемые производные, таутомерные формы, стереоизомеры, соли или сольваты, факультативно в комбинации с одним или более фармацевтически приемлемым носителем(носителями).
22. Способ профилактики, облегчения и/или лечения одного или более состояний, опосредованных DPP-IV, у субъекта, нуждающегося в этом, при котором вводят терапевтически эффективное количество соединения по пп.1, 15-18 или его фармацевтически приемлемых производных, таутомерных форм, стереоизомеров, солей или сольватов.
23. Способ профилактики, облегчения и/или лечения диабета у субъекта, нуждающегося в этом, при котором вводят терапевтически эффективное количество соединения по пп.1, 15-18 или его фармацевтически приемлемых производных, таутомерных форм, стереоизомеров, солей или их сольватов.
24. Применение соединения по пп.1, 15-18 или его фармацевтически приемлемых производных, таутомерных форм, стереоизомеров, солей, сложных эфиров или их сольватов для изготовления медикамента для профилактики, облегчения и/или лечения одного или более состояний, опосредованных DPP-IV, у субъекта, нуждающегося в этом.
25. Применение соединения по пп.1, 15-18 или его фармацевтически приемлемых производных, таутомерных форм, стереоизомеров, солей или их сольватов в комбинации с другими терапевтическими средствами для профилактики, облегчения и/или лечения одного или более состояний, опосредованных DPP-IV, у субъекта, нуждающегося в этом.
26. Применение по п.24, где медикамент вводится орально, парентерально или местно.
Текст
Данное изобретение касается соединений формулы I, их фармацевтически приемлемых производных, таутомерных форм, стереоизомеров, включая R и S изомеры, соли или их сольваты. Данное изобретение также касается способов получения соединений формулы I, их фармацевтически приемлемых производных, таутомерных форм, стереоизомеров, солей или их сольватов. Данное изобретение также касается фармацевтических композиций для профилактики,облегчения и/или лечения одного или более состояния, опосредованного дипептидилпептидазойIV (DPP-IV), у субъекта, нуждающегося в этом, включающих соединения формулы I, способов лечения, профилактики и/или облегчения одного или более состояний, опосредованных DPP-IV,способов профилактики, облегчения и/или лечения диабета и применения соединений формулы I(71)(73) Заявитель и патентовладелец: ПАНАЦЕА БИОТЕК ЛИМИТЕД (IN) Область изобретения Данное изобретение касается соединений формулы I, их фармацевтически приемлемых производных, таутомерных форм, стереоизомеров, включая их R и S изомеры, соли или сольваты. Данное изобретение также касается способов синтеза соединений формулы I, их фармацевтически приемлемых производных, их таутомерных форм, стереоизомеров, солей или сольватов. Данное изобретение также представляет фармацевтические композиции, включающие соединения формулы I и способы лечения или предупреждения одного или более состояний, которые можно регулировать или нормализовать путем ингибирования дипептидилпептидазы IV (DPP-IV): Формула I Предпосылки изобретения Сахарный диабет 2 типа является многогранным и гетерогенным метаболическим синдромом, который составляет 90-95% случаев всех диабетов. Это нарушение быстро развивается как глобальная проблема здравоохранения, которая угрожает достичь пандемических уровней к 2030 году; ожидается, что число людей с диабетом во всем мире возрастет от 171 млн в 2000 году до 366 млн к 2030 году. Это возрастание, как ожидают, будет наиболее заметным в развивающихся странах, где число людей с диабетом,как ожидают, вырастет от 84 млн до 228 млн. Ключевой компонент патофизиологии сахарного диабета 2 типа включает ухудшенную рклеточную функцию поджелудочной железы, что, в конечном счете, способствует снижению инсулиновой секреции в ответ на повышение глюкозы в плазме. Ранним дефектом сахарного диабета 2 типа является устойчивость к инсулину, которая представляет собой состояние снижения чувствительности к циркулирующим концентрациям инсулина и часто присутствует за годы до проявления гипергликемии и клинического диагноза диабета. -клетка компенсирует повышение инсулиновой устойчивости усилением секреции инсулина, что, в конечном счете, приводит к снижению массы -клеток. Следовательно,уровни глюкозы в крови становятся аномально высокими, что со временем приводит к серьезным проблемам со здоровьем у таких пациентов, включая ожирение, гипертензию и дислипидемию. Неконтролируемая гипергликемия далее может привести к осложнениям, таким как нефропатия, невропатия, ретинопатия и ранний атеросклероз. Зависимая от глюкозы секреция инсулина в основном обеспечивается инкретинами, преимущественно зависимым от глюкозы инсулинотропичным пептидом (GIP) и глюкагон-подобным пептидом I(GLP-1) (7-36). Эти кишечные пептиды высвобождаются из желудочно-кишечного тракта в ответ на проглатывание пищи и стимулируют ассимиляцию питательных веществ через потенцирование зависимой от глюкозы секреции инсулина. Благодаря этому физиологическому профилю действия GLP-1 (7-36) применимы для снижения глюкозы в крови у субъектов с сахарным диабетом 2 типа и, таким образом,обладают сильным потенциалом как хронические лекарственные средства для диабета. Исследования, в которых пациентам с диабета 2 типа вливали GLP-1, продемонстрировали эффективность в нормализации и гликемии натощак, и "послеобеденной" гликемии. Однако, GLP-1 (7-36), как показали, имеет короткий период полураспада in vivo (около 1,5 мин), поскольку он подвергается быстрому разрушению на амино-конце (His-Ala) дипептидилпептидазой (DPP-IV). DPP-IV является членом семейства s9b серинпептидаз. Дипептидилпептидаза IV (DPP-IV), которую также называют аденозин деаминазу связывающий белок (ADAbp) или CD26, является 220 кДа гомодимерным трансмембранным гликопротеином 2 типа, широко распространенным на поверхности ряда эпителиальных, эндотелиальных и лимфоидных типов клеток. DPP-IV регулирует различные физиологические процессы расщеплением Хаа-Pro дипептидов от N-конца регуляторных пептидов, включая многие хемокины, нейропептиды и пептидные гормоны.GLP-1 (7-36) эффективно разрушается DPP-IV до GLP-1 (9-36), который, как предполагают, действует как физиологический антагонист к GLP-1 (7-36) и полностью снижает активность GLP-1 (7-36). Короткий период полураспада GLP-1 в кровообращении является главным препятствием к применению в качестве терапевтического средства. Чтобы обойти этот недостаток GLP-1, DPP-IV ингибирование представляет применимую стратегию для пролонгирования действия GLP-1, что приводит к замедлению снижения глюкозы в крови. Клиническое проявление показывает, что специфические DPP-IV ингибиторы снижают уровни глюкозы у диабетиков типа 2. Преимущественно, поскольку инкретины продуцируются организмом, только при потреблении пищи и их действие зависит от глюкозы, не ожидается, чтоDPP-IV ингибирование повысит уровень инсулина в неподходящее время, например, между приемами-1 018612 пищи, что может привести к гипогликемическим явлениям. Поэтому ожидается, что ингибирование DPPIV повысит инсулин без увеличения риска гипогликемии, которая является опасным побочным эффектом, связанным с применением других стимуляторов секреции инсулина. Соединения, показанные ниже,являются ингибиторами DPP-IV, которые либо достигли продвинутых стадий исследования клинических испытаний на человеке, либо ожидают одобрения контролирующего органа: "Ситаглиптин" фирмыMerck с Формулой А является первым ингибитором DPP-IV, который выпущен под названием "Янувия",(Expert Opinion, 2007, 7, 557; Current Topics in Medicinal Chemistry, 2007, 533), Формула В представляетWO199819998, WO2000034241, WO2006127530, патенты США 6110949, 6011155, 7169806 и японская публикация JP-2005139107 раскрывают цианопирролидины как DPP-IV ингибиторы. РСТ публикация WO2004101514 раскрывает цианофторпирролидины, обладающие DPP-IV ингибиторной активностью. Публикации США 20006110949, US 20006107317 и РСТ публикация WO199961431 раскрывают цианотиазолидины как DPP-IV ингибиторы. Аминопиперидиновые производные раскрыты, например, в РСТ публикации WO2006058064, WO2006039325, WO2006058064. Остальные представляют собой пирролидиновые, тиазолидиновые, пиперадиновые или пиридиновые производные (см., например,WO2006116157, WO2005120494, WO03084940, WO2006062063, WO2005042488). Другие представляют собой ксантиновые и пуриновые производные (см., например, РСТ публикации WO2004018467,WO2004018469).DPP-IV ингибиторы на основе р-аминокислот раскрыты в РСТ публикациях, напримерWO2004043940, WO2005044195, WO2006009886, WO2006023750, WO2006039325, WO2003004498,WO2005116029, WO2005113510, WO2006097175, WO2005120494, WO2005121131, WO2005123685,WO2005040095 WO2007063928, WO2007054577, WO2007053819, WO2006081151, WO2004085378 и патентах США, таких как 7259160, 7101871 и 7208498. Данное изобретение направлено на класс DPP-IV ингибиторов на основе -аминокислот с использованием новых гетероциклов, структурально не относящихся к каким-либо DPP-IV ингибиторам, известным до настоящего времени. Хотя ряд DPP-IV ингибиторов был раскрыт в данной области, тем не менее, по-прежнему существует необходимость новых DPP-IV ингибиторов, которые обладают лучшим периодом полураспада,предпочтительной активностью, стабильностью, селективностью, меньшей токсичностью и/или лучшими фармакодинамическими свойствами. Существует потребность в DPP-IV ингибиторах, которые могут-2 018612 увеличивать количество циркулирующего GLP-1 за пролонгированный период времени, что, таким образом, ведет к лучшему контролю осложнений, связанных с диабетом. В этом отношении, в данном документе представлен новый класс DPP-IV ингибиторов. Краткое описание изобретения Данное изобретение касается соединений формулы I, их фармацевтически приемлемых производных, таутомерных форм, стереоизомеров, включая их R и S изомеры, полиморфы, пролекарства, метаболиты, соли или сольваты, Формула I где Ar представляет собой фенил, который может быть замещенным в любом доступном положении одним или более заместителями, выбранными из галогена;R1 выбран из группы, включающей (CH2)nCONRaRb, (CH2)nCOORa, водород, С 1-12 алкил,С 2-12 алкенил, С 1-12 галоалкил, (CH2)n-С 3-8 циклоалкил, (СН 2)n-фенил, где фенильная группа может быть факультативно замещенна в любом доступном положении одним или более заместителями, выбранными из водорода, галогена, CN, C1-12 алкокси, С 1-12 галоалкила;R2 и R3 вместе представляют отдельный атом кислорода, который связан с диазепиновым кольцом двойной связью; или R1 и R3 вместе с атомом азота, к которому R1 присоединен, формируют моноциклическое 5-членное или гетероарильное кольцо, которое дополнительно содержит один или два гетероатома N; причем сформированное кольцо может быть факультативно замещено одним или более заместителями, выбранными из Rc или Rc', и R2 представляет водород или двойную связь;R4 и R5 независимо выбраны из водорода или С 1-12 алкила;R8 независимо выбран из водорода, галогена или С 1-12 алкокси;Ra и Rb независимо выбраны из водорода, С 1-12 алкилаС 1-12 галоалкила, С 3-8 циклоалкила, изоксазолила, (СН 2)n-фенила, где фенильная группа может быть факультативно замещена С 1-12 алкокси; или Ra иRb могут быть соединены вместе с атомом азота, к которому они присоединены, для формирования моноциклического пяти- или шестичленного гетероциклического кольца, которое может дополнительно содержать еще один гетероатом, выбранный из О или S, причем сформированное кольцо может факультативно быть замещено одним или более заместителями, выбранными из водорода, галогена, оксо, -ОН; причем сформованное кольцо может дополнительно быть слито с 6-членным ненасыщенным кольцом,слитое кольцо может факультативно быть замещено одним или более заместителями С 1-12 алкокси;Rc или Rc' независимо выбран из группы, включающей водород, С 1-12 алкил, С 1-12 галоалкил, С 3-8 циклоалкил, фенил, -(CO)NR9R10, -COOH, -СООС 1-12 алкил; где фенильная группа может быть факультативно замещена галогеном или C1-12 алкокси;R9 и R10 независимо выбраны из водорода, С 1-12 алкила, С 1-12 галоалкила, С 3-8 циклоалкила, (СН 2)nфенила, где фенильная группа может быть факультативно замещена С 1-12 галоалкилом; или R9 и R10 могут быть соединены вместе для формирования моноциклического пяти- или шестичленного гетероциклического кольца, которое может включать гетероатом О, образованное таким образом кольцо может факультативно быть замещено одним или более заместителями выбранными из галогена;n представляет собой 1, 2, 3 или 4; r представляет собой 1, 2, 3 или 4. Другой аспект данного изобретения представляет способы получения новых соединений формулыI, их фармацевтически приемлемых производных, таутомерных форм, стереоизомеров, включая R и S изомеры, соли или их сольваты. Следующий аспект данного изобретения представляет фармацевтические композиции, включающие соединения формулы I, их фармацевтически приемлемые производные, таутомерные формы, стереоизомеры, включая R и S изомеры, соли или их сольваты, в комбинации с одним или более фармацевтически приемлемым носителем(носителями). Другой аспект данного изобретения представляет собой применение соединений формулы I для профилактики, облегчения и/или лечения одного или более состояния(состояний)/болезни(болезней)/ нарушения(нарушений), которые могут быть регулированы или нормализованы путем ингибированияDPP-IV. Еще один аспект данного изобретения представляет собой обеспечение способов применения соединений формулы I данного изобретения или композиций, включающих соединения формулы I для профилактики, облегчения и/или лечения болезни(болезней)/нарушения(нарушений), опосредованныхDPP-IV, которые включают введение субъекту, нуждающемуся в этом, соединений формулы I или композиций, включающих фармацевтически эффективное количество соединений формулы I.-3 018612 Следующий аспект данного изобретения представляет собой применение соединения формулы I для изготовления медикамента для профилактики, облегчения и/или лечения одного или более состояния(состояний)/болезни(болезней)/нарушения(нарушений), опосредованных DPP-IV у субъекта, нуждающегося в этом. Другие аспекты данного изобретения будут приведены в описании, которое следует, и в части, которая будет очевидна из описания, или могут быть понятны из осуществления данного изобретения. Детальное описание изобретения Данное изобретение касается соединений формулы I, их фармацевтически приемлемых производных, таутомерных форм, стереоизомеров, включая R и S изомеры, солей или их сольватов, Формула I где Ar представляет собой фенил, который может быть замещенным в любом доступном положении одним или более заместителями, выбранными из галогена;R1 выбран из группы, включающей (CH2)nCONRaRb, (CH2)nCOORa, водород, Сыгалкил, C2-12 алкенил, С 1-12 галоалкил, (СН 2)n-С 3-8 циклоалкил, (СН 2)n-фенил; где фенильная группа может быть факультативно замещена в любом доступном положении одним или более заместителями, выбранными из водорода, галогена, CN, С 1-12 алкокси, С 1-12 галоалкила;R2 и R3 вместе представляют отдельный атом кислорода, который связан с диазепиновым кольцом двойной связью; или R1 и R3 вместе с атомом азота, к которому R1 присоединен, формируют моноциклическое 5-членное гетероарильное кольцо, которое дополнительно содержит один или два гетероатома N; причем сформированное кольцо может быть факультативно замещено одним или более заместителями,выбранными из Rc или Rc', и R2 представляет двойную связь;R4 и R5 независимо выбраны из водорода или С 1-12 алкила;R8 независимо выбран из водорода, галогена или С 1-12 алкокси;Ra и Rb независимо выбраны из водорода, C1-12 алкила, С 1-12 галоалкила, С 3-8 циклоалкила, изоксазолила, (СН 2)n-фенила; где фенильная группа может быть факультативно замещена С 1-12 алкокси; или Ra иRb могут быть соединены вместе с атомом азота, к которому они присоединены, для формирования моноциклического пяти- или шестичленного гетероциклического кольца, которое может дополнительно содержать еще один гетероатом, выбранный из О или S, причем сформированное кольцо может быть факультативно замещено одним или более заместителями, выбранными из водорода, галогена, оксо,-ОН; причем сформованное кольцо может дополнительно быть слито с 6-членным ненасыщенным кольцом, слитое кольцо может факультативно быть замещено одним или более заместителями С 1-12 алкокси;Rc или Rc независимо выбран из группы, включающей водород, С 1-12 алкил, С 1-12 галоалкил, С 3-8 циклоалкил, фенил, -(CO)NR9R10, -COOH, -СООС 1-12 алкил; где фенильная группа может быть факультативно замещена галогеном или С 1-12 алкокси;R9 и R10 независимо выбраны из водорода, С 1-12 алкила, С 1-12 галоалкила, С 3-8 циклоалкила, (СН 2)nфенила, где фенильная группа может быть факультативно замещена С 1-12 галоалкилом; или R9 и R10 могут быть соединены вместе для формирования моноциклического пяти- или шестичленного гетероциклического кольца, которое может включать гетероатом О, образованное таким образом кольцо может факультативно быть замещено одним или более заместителями выбранными из галогена;r представляет собой 1, 2, 3 или 4. Один вариант осуществления данного изобретения представляет соединения формулы Ia где r, Ar, R1, R2, R3, R4, R5, R6, R7 и R8 определены в данном документе; их фармацевтически приемлемые производные, таутомерные формы, стереоизомеры, соли или их сольваты. Другой вариант осуществления данного изобретения представляет соединения формулы Ib где R2 и R3 вместе представляет отдельный кислород, который связан с диазепиновым кольцом двойной связью; r, Ar, R1, R4, R5, R6, R7 и R8 определены в данном документе; их фармацевтически приемлемые производные, таутомерные формы, стереоизомеры, соли или их сольваты. Другой вариант осуществления данного изобретения представляет соединения формулы Ic где R1 и R3 вместе с атомом азота, к которому R1 присоединен, формирует гетероциклическое или гетероарильное кольцо А, которое факультативно замещено в любом доступном положении одним или более заместителями, независимо выбранными из Rc или Rc'; R2 представляет собой двойную связь; r, Ar,R4, R5, R6, R7, R8, Rc и Rc' определены в данном документе; их фармацевтически приемлемые производные, таутомерные формы, стереоизомеры, соли или их сольваты. Другой вариант осуществления данного изобретения представляет соединения формулы Id где R1 и R3 вместе с атомом азота, к которому R1 присоединен, формирует 5-членный гетероциклил или гетероарильное кольцо А, где X, Y и Z независимо выбраны из группы, включающей N и -СН, кольцо А факультативно замещено в любом доступном положении одним или более заместителями, независимо выбранными из Rc или Rc'; R2 представляет двойную связь; r, Ar, R4, R5, R6, R7, R8, Rc и Rc' определены в данном документе; их фармацевтически приемлемые производные, таутомерные формы, стереоизомеры, соли или их сольваты. Другой вариант осуществления данного изобретения представляет соединения формулы IeR определены в данном документе; их фармацевтически приемлемые производные, таутомерные формы, стереоизомеры, соли или их сольваты. Еще один вариант осуществления данного изобретения представляет соединения формулы If где кольцо А факультативно замещено одним или более заместителями, независимо выбранными изRc или Rc'; R2 представляет двойную связь; r, Ar, R4, R5. R6, R7, R8, Rc и Rc' определены в данном документе, их фармацевтически приемлемые производные, таутомерные формы, стереоизомеры, соли или их сольваты. Другой вариант осуществления данного изобретения представляет соединения формулы IgR определены в данном документе; их фармацевтически приемлемые производные, таутомерные форc-5 018612 мы, стереоизомеры, соли или их сольваты. Другой вариант осуществления данного изобретения представляет соединения формулы 1H где кольцо А факультативно замещено одним или более заместителями, независимо выбранными изRc или Rc'; R2 представляет двойную связь; r, Ar, R4, R5, R6, R7, R8, Rc и Rc' определены в данном документе; их фармацевтически приемлемые производные, таутомерные формы, стереоизомеры, соли или их сольваты. В следующем варианте осуществления соединений данного изобретения, предпочтительно, что Аr выбран из группы, включающей 2,4,5-трифторфенил, и 2,5-дифторфенил. В следующем варианте осуществления соединений данного изобретения более предпочтительно,что R8 выбран из группы, включающей водород, фтор, хлор и метокси. В следующем варианте осуществления соединений данного изобретения еще более предпочтительно, что R8 независимо выбран из водорода и фтора. В другом варианте осуществления соединений данного изобретения R1 выбран из группы, включающей водород, (CH2)nCONRaRb, -(CO)NRaRb, -(CO)R3, (CH2)nCOORa, (CH2)nNRaRb, (CH2)nNCORa,(CH2)nC(=L)Ra (где L представляет собой О или S), С 1-12 алкил, С 2-12 алкенил, С 1-12 галоалкил, С 1-12 галоалкокси, C2-12 галоалкенил, C2-12 алкенил, С 3-8 циклоалкил, гетероциклил, арил, гетероарил, (СН 2)nциклоалкил, (СН 2)n-гетероциклил, (СН 2)n-арил, (СН 2)n-гетероарил, каждый из которых является незамещенным или замещенным, в любом доступном положении, одним или более заместителями независимо выбранными из группы, включающей галоген, CN, С 1-12 алкил, С 2-12 алкенил, C2-12 алкинил, С 1-12 алкокси,С 1-12 галоалкил, С 1-12 галоалкокси, C2-12 галоалкенил, C2-12 галоалкинил, C1-12 алкилкарбонил, С 1-12 алкоксикарбонил, оксо, -ORa, -SRa, -NO2, -NRaRb, -N(Ra)(CO)Rb, -N(Ra)(CO)ORb, -N(Ra)(CO)NRaRb, -(CO)Ra,-(CO)NRaRb, -O(CO)Ra, -O(CO)NRaRb, -COORa, C3-8 циклоалкил, гетероарил, гетероциклил. В следующем варианте осуществления соединений данного изобретения предпочтительно, что R1 выбран из группы, включающей водород, С 1-12 алкил, C2-12 алкенил, (СН 2)n-фенил, Другой вариант осуществления данного изобретения представляет соединения формулы Ic, Id, Ie, If,Ig и 1H, где кольцо А замещено одним или более Rc и Rc', независимо выбранными из группы, включаю-6 018612 щей галоген, С 1-12 алкил, C2-12 алкенил, C2-12 алкинил, С 1-12 галоалкил, C2-12 галоалкенил, С 2-12 галоалкинил, C1-12 алкокси, C1-12 галоалкокси, С 3-8 циклоалкил, гетероциклил, арил, гетероарил, (СН 2)nциклоалкил, (СН 2)n-гетероциклил, (СН 2)n-арил, (СН 2)n-гетероарил, С 1-12 алкилкарбонил, С 1-12 алкоксикарбонил, -CN, -OR9, -OCF3, -NO2, =NOR10, -NR9V10, -N(R9)(CO)R10, -N(R9XCO)OR10, -N(R9XCO)NR9R10,-C(=L)R9 (где L представляет собой О или S), -(CO)NR9R10, -O(CO)R9, -O(CO)NR9R10, -COOR9, -SR9,-S(O)mR9, -SO2NR9R10; -SO3H, -NHSO2R9 и P(O)R9R10, где R9 и R10 определены в данном документе. В следующем варианте осуществления соединений формулы Ic, Id, Ie, If, Ig и 1h, предпочтительно,что кольцо А замещено одним или более Rc и Rc', независимо выбранными из группы, включающей водород, С 1-12 алкил, С 3-8 циклоалкил, фенил, -CH2F, -CHF2, -CF3, -СООН, -CONH2, -CH2-OCH3, СООС 1-6 алкил, В варианте осуществления соединений данного изобретения R4 и R5 независимо выбраны из группы, включающей водород, галоген, С 1-12 алкил, C2-12 алкенил, C2-12 алкинил, C1-12 алкокси, С 1-12 галоалкил, С 1-12 галоалкокси, C2-12 галоалкенил, С 2-12 галоалкинил, -NO2, циклоалкил, арил, гетероарил или гетероциклил, каждый из которых может быть незамещенным или замещенным, в любом доступном положении, одним или более заместителями независимо выбранными из Rc или Rc'. В варианте осуществления соединений данного изобретения R6 и R7 независимо выбраны из группы, включающей водород, С 1-12 алкил и С 1-12 алкокси, которые являются незамещенными или замещенными, в любом доступном положении, одним или более заместителями, выбранными из группы, включающей галоген, гидроксил, C1-12 алкокси и арил. В следующем варианте осуществления соединений данного изобретения предпочтительно, что R6 и 7R оба являются водородом. Относительно вышеописанных соединений данного изобретения применяются следующие определения. Если не определено иное, выражения "алкил", "алкенил" и "алкинил" могут быть прямыми или разветвленными с 1-12 атомами углерода. Эти группы могут быть дополнительно замещены одним или более заместителями, выбранными из, но без ограничения, например, галогена, гидроксила, оксо, карбоксила, карбоксиалкила, азидо, алкенила, алкинила, алкокси, циклоалкила, циклоалкинила, ацил ацилокси,арила, гетероциклила и гетероарила. Выражение "циклоалкил" означает циклические алкильные группы, включающие 3-20 атомов углерода, имеющие отдельное циклические кольцо или несколько конденсированных колец, например, слитые или спиро системы, которые могут факультативно включать одну или более олефиновых связей, если не определено иное. Такие циклоалкильные группы включают, в качестве примера, отдельные кольцевые структуры, например, циклопропил, циклобутил, циклопентенил, циклогексил, циклооктил и подобное, или несколько кольцевых структур, например, адамантил и бицикло[2.2.1] гептан, или циклические алкильные группы, с которыми сливается арильная группа, например индан и подобное. Циклоалкильные группы могут быть дополнительно замещены одним или более заместителями, выбранными, но без ограничения, например, из галогена, гидроксила, оксо, карбокси, карбоксиалкила, азидо, алкенила,алкинила, алкокси, циклоалкила, циклоалкинила, ацил ацилокси, арила, гетероциклила, гетероарила. Выражение "алкокси" означает группу О-алкила, где алкил такой же, как определено выше. Выражение "аралкил" означает алкил-арил, связанный через алкильную (где алкил такой же, как определено выше) часть, и указанная алкильная часть включает атомы углерода от 1 до 6, и арил является таким, как определено в данном документе далее. Примеры аралкильных группы включают бензил и подобное. Выражение "арил" в данном документе означает карбоциклическую ароматическую группу, например фенильное или нафтильное кольцо и подобное, факультативно замещенную одним или более заместителями, выбранными из, но без ограничения, например, галогена, гидроксила, алкила, алкенила, алкинила, циклоалкила, алкокси, ацила, арилокси, CF3, COORd (где Rd может быть водородом, алкилом, алкенилом, циклоалкилом, аралкилом, гетероциклилалкилом или гетероарилалкилом), циано, нитро, карбокси, гетероциклила, гетероарила, гетероциклилалкила или гетероарилалкила. Арильная группа может быть факультативно слитая с циклоалкильной группой, где указанная циклоалкильная группа может фа-7 018612 культативно включать гетероатомы, выбранные из О, N и S. Выражение "арилокси" означает группу Оарила, где арил определен выше. Выражение "гетероарил", если не определено иное, означает ароматическую кольцевую структуру или бициклическую ароматическую группу с одним или более гетероатомом(гетероатомами), независимо выбранными из N, О и S, и факультативно замещенную в любом доступном положении заместителем(заместителями), выбранными из, но без ограничения, галогена, гидроксила, алкила, алкенила, алкинила, циклоалкила, ацила, карбокси, арила, алкокси, аралкила, циано, нитро, гетероциклила или гетероарила. Примеры гетероарильных групп включают оксазолил, имидазолил, пирролил, 1,2,3-триазолил,1,2,4-триазолил, тетразолил, тиазолил, оксадиазолил, бензоимидазолил, тиадиазолил, пиридинил, пиридазинил, пиримидинил, тиенил, изоксазолил, триазинил, фуранил, бензофуранил, индолил, бензотиазолил, бензоксазолил и подобное. Выражение "гетероциклил", если не определено иное, означает циклическую, бициклическую или трициклическую циклоалкильную группу, полностью или частично ненасыщенную, имеющую 5-10 атомов углерода; с одним или более гетероатомом(гетероатомами), независимо выбранными из N, О и S, и являющуюся факультативно слитой с бензо кольцом или слитой с гетероарилом с 5-6-кольцевыми членами; кольца могут быть факультативно замещенными, где заместители выбраны, но без ограничения, из галогена, гидроксила, алкила, алкенила, алкинила, циклоалкила, ацила, карбокси, арила, алкокси, аралкила, циано, нитро, гетероциклила, или гетероарила. Примеры гетероциклильных групп включают, но без ограничения, оксазолидинил, тетрагидрофуранил, дигидрофуранил, дигидропиридинил, дигидроизооксазолил, дигидробензофурил, азабициклогексил, дигидроиндонил, пиперидинил или пиперазинил."Гетероарилалкил" означает алкилгетероарильную группу, связанную через алкильную часть, где алкил и гетероалкил такие же, как определено ранее."Гетероциклилалкил" означает алкилгетероциклильную группу, связанную через алкильную часть,где алкил и гетероциклил такие же, как определено ранее. Галоген означает фтор, хлор, бром или йод. Выражение "защитная группа" или "PG" означает группу, которая находится в модифицированной форме для предотвращения нежелательных побочных реакций на защищенном участке. Выражение защитная группа, если не определено иное, может использоваться с группами, например, гидроксилом,амино, карбоксилом, и примеры таких групп можно найти в T.W. Greene, et al. "Protecting Groups in Organic Synthesis," 3rd Ed, Wiley, New York, которая включена в данный документ путем ссылки. Виды используемых карбоксил защитных групп, аминозащитных групп или гидроксил защитных групп не являются критическими, поскольку дериватизированные составляющие/составляющая являются/является стабильными в условиях последующих реакций и могут быть удалены без разрушения остатка молекулы. Примеры приемлемых гидроксил и аминозащитных групп включают, но без ограничения, триметилсилил, триэтилсилил, о-нитробензилоксикарбонил, р-нитробензилоксикарбонил, t-бутилдифенилсилил, tбутилдиметилсилил, ацетил, трифторацетил, бензилоксикарбонил (CBz), t-бутоксикарбонил (Boc), 9 фторэнилметилэноксикарбонил (Fmoc), 2,2,2-трихлорэтилоксикарбонил, аллилоксикарбонил и подобное. Примерами приемлемых карбоксил защитных групп являются бензгидрил, о-нитробензил, р-нитробензил, 2-нафтилметил, аллил, 2-хлораллил, бензил, 2,2,2-трихлорэтил, триметилсилил, t-бутилдиметилсилил, t-бутилдифенилсилил, 2-(триметилсилил)этил, фенацил, р-метоксибензил, ацентонил, р-метоксифенил, 4-пиридилметил, t-бутил и подобное. Выражение "терапевтически эффективное количество" означает количество соединения, которое,при введении субъекту для лечения болезни, является достаточным для эффективности такого лечения болезни. "Терапевтически эффективное количество" будет варьировать в зависимости от соединения,болезни и ее тяжести, веса, физического состояния и ответной реакции субъекта, подлежащего лечению,среди других факторов."Фармацевтически приемлемая соль" означает соли, полученные из фармацевтически приемлемых нетоксичных оснований или кислот, включая неорганические или органические основания и неорганические или органические кислоты. Асимметричные центры могут присутствовать в соединениях данного изобретения. Соединения формулы I могут иметь один или более стереогенных центров и, поэтому, может существовать оптическая изомерия. Все эти изомеры, включая энантиомеры, диастереомеры и эпимеры включены в объем данного изобретения. Кроме того, данное изобретение включает такие соединения, как отдельные изомеры (R и/или S) и как смеси, включая рацематы. При желании, рацемические смеси соединений могут быть разделены так, что отдельные энантиомеры являются изолированными. Разделение можно выполнить способами, хорошо известными в данной области, таким как соединение рацемической смеси соединений с энантиомерно чистым соединением для формирования диастереомерной смеси с последующим разделением отдельных диастереомеров стандартными способами, таким как фракционная кристаллизация или хроматография. Исходные материалы специфической стереохимии либо могут быть коммерчески доступными, либо могут быть сделаны способами, раскрытыми в данном документе, и разделены методиками, хорошо известными в данной области. Формула I показывает структуру соединений без какой-либо предпочтительной стереохимии. Фор-8 018612 мула Ia показывает предпочтительно стереохимию при атоме углерода, к которому присоединена аминогруппааминокислоты, из которой эти соединения получены. Независимый синтез таких диастереомеров или их хроматографические разделения можно осуществить, как известно в данной области надлежащими модификациями. Некоторые соединения согласно формуле I также могут существовать как таутомеры, которые имеют различные точки присоединения водорода в сопровождении одного или более сдвигов двойной связи. Такие таутомеры, либо отдельно, либо как смеси, также рассматриваются попадающими в объем данного изобретения. Данное изобретение также охватывает геометрические изомеры соединений формулы I и их смеси. Особенно применимые примеры данного изобретения включают, но без ограничения, соединения,выбранные из табл. 1-5. Один вариант осуществления данного изобретения представляет соединения формулы Ib, где соединения выбраны из табл. 1. Таблица 1 Один вариант осуществления данного изобретения представляет соединения формулы Ie, где соединения выбраны из табл. 2: Таблица 2 Один вариант осуществления данного изобретения представляет соединения формулы If, где соединения выбраны из табл. 3. Таблица 3 Один вариант осуществления данного изобретения представляет соединение формулы Ig, где соединения выбраны из табл. 4. Таблица 4 Один вариант осуществления данного изобретения представляет соединение формулы 1 Н, где соединение представлены в табл. 5. Таблица 5 Соединения данного изобретения могут быть получены из -аминокислотных промежуточных соединений, таких как соединения формулы II, где Ar определен в данном документе, и гетероциклических промежуточных соединений, таких как соединения формулы III, где r, R1, R2, R3, R4, R5, R6, R7 и R8 определены в данном документе, с помощью стандартных условий соединения с последующим снятием аминозащитной функциональной группы. Примеры стандартных условий соединения включают EDC [1 этил-3-(3-диметиламинопропил)карбодиимид]/НОВТ (1-гидроксибензотриазол); DCC (дициклогексил карбодиимид), DMAP (4-диметиламинопиридин); HATU [О-(7-азабензотриазол-ил)-N,N,N',N'тетраметилурониум гексафторфосфат; HOAT (1-гидрокси-7-азабензотриазол); ВОР [(бензотриазолил-1 илокси)-трис(диметиламин)фосфониум гексафторфосфат]; способ смешанных ангидридов с использованием этилхлорформата или метилхлорформата в приемлемом растворителе, таком как DMF, DCM, ацетонитрил, толуол, THF и подобное или их смесях, и в присутствии приемлемого основания, такого какNMM (N-метилморфолин), DIPEA (N,N-диизопропилэтиламин), триэтиламин и подобное. Примеры реагентов, используемых для снятия аминозащитной составляющей, будет зависеть от природы используемой защитной группы. Примеры приемлемых аминозащитных групп включают, но без ограничения, аце- 12018612 тил, трифторацетил, бензилоксикарбонил (CBz), t-бутоксикарбонил (Вос), 9-фторенилметиленоксикарбонил (Fmoc), 2,2,2-трихлорэтилоксикарбонил, аллилоксикарбонил и подобное. Надлежащие условия для удаления аминозащитной группы легко могут быть выбраны специалистом в данной области. Примеры реагентов, используемых для снятия аминозащитной составляющей, включают, но без ограничения, применение кислых условий (трифторуксусная кислота, хлористоводородная кислота, фосфорная кислота, р-толуолсульфоновая кислота и подобное), основных условий (пиперидин и подобное) или условий гидрогенизации (палладий на древесном угле или платина и подобное). Образовавшиеся соединения могут быть в форме свободного амина или соли в зависимости от природы защитной группы и соответствующего используемого реагента, снимающего защитную группу. В случае, когда снятие защитной группы приводит к формированию соли, соответствующий амин можно легко получить обработкой соли соответствующим основанием, таким как триэтиламин, диэтилизопропиламин, натрия бикарбонат, натрия гидроксид или подобное. Формула III Энантиомерно чистые -аминокислоты, имеющие формулу II, могут быть удобно синтезированы с использованием способов, описанных в Tetrahedron, 1994, 32, 9517.; Enantioselective Synthesis of -AminoAcids, Ed., Wiley- VCH, New York: 1997; Aldrichimica Acta, 1994, 27:3 и Angew Chem Int Ed Engl. 1981,20, 798. В частности, 3-амино-4-(2,4,5-трифторфенил)масляная кислота может быть синтезирована, как сообщено в патентной заявке WO 2004069162 и в J. Med Chem., 2005,48, 141. Соединения формулы III легко можно получить из соединений формулы IV, где r, R1, R2, R3, R4, R5,6R , R7 и R8, как определено в данном документе, снятием аминозащитной группы с использованием стандартного реагента, снимающего защитную группу. Образовавшиеся соединения могут быть в форме свободного амина или соли в зависимости от природы защитной группы и соответствующего используемого реагента, снимающего защитную группу. Примеры реагентов, используемых для снятия аминозащитной составляющей, включают, но без ограничения, применение кислых условий (трифторуксусная кислота, хлористоводородная кислота, фосфорная кислота, р-толуолсульфоновая кислота и подобное),основных условий (пиперидин и подобное) или условий гидрогенизации (палладий на древесном угле или платина и подобное). Образовавшиеся соединения могут находиться в форме свободного амина или соли в зависимости от природы защитной группы и соответствующего используемого реагента, снимающего защитную группу. В случае, когда снятие защитной группы дает формирование соли, соответствующий амин можно легко получить обработкой соли соответствующим основанием, таким как триэтиламин, диэтилизопропиламин, натрия бикарбонат, натрия гидроксид или подобное. Формула IV Соединения формулы IV можно легко получить рядом способов, известных специалисту в данной области. Некоторые общепринятые пути получения таких соединений показаны на схемах 1-11. Соединения формулы IV обычно можно синтезировать из соединений формулы V, где r, R4, R5, R6,7R и R8 определены в данном документе [Ссылка: Синтез, 2005, 1881]. Один приемлемый путь синтеза соединений формулы V приведен на схеме 1.- 13018612 Соединения формулы V можно получить, исходя из надлежащего 2-нитробензилбромида, который соединяется с нужным сложным эфиром аминокислоты в присутствии основания, такого как DIPEA,NMM, калия карбонат и подобное, и растворителя, такого как DMF, THF, ацетонитрила и подобного, что приводит к формированию соединений формулы VI, где r, R4, R5 и R8 определены в данном документе. Затем соединения формулы VI защищаются при аминной функциональности с использованием надлежащей защитной группы, что приводит к соединениям формулы VII. Затем соединения формулы VII, гдеr, R4, R5 и R8 определены в данном документе, превращают в соединения формулы VIII, где r, R4, R5 и R8 определены в данном документе, путем гидролиза сложноэфирной составляющей в основных условиях. Примеры основных гидролизирующих реагентов включают натрия гидроксид, лития гидроксид, калия гидроксид и подобное, которые можно использовать в надлежащих растворителях, подобных THF/вода,диоксан/вода или THF/MeOH/вода. Нитрогруппу формулы VIII затем можно восстановить до соответствующих аминосоединений формулы IX, где r, R4, R5 и R8 определены в данном документе, рядом восстанавливающих средств, таких как гидрогенизация над надлежащим катализатором, таким как палладий,платина или рутений на активированном древесном угле, или химическими способами, такими как реакция с FeCl3, или SnCl2/HCl, или Fe/NH4Cl, или NiCl2/NaBH4, или Fe/HCl, известными специалисту в данной области. Соединения формулы IX, включающие амино и карбоновокислотную функциональность,затем циклизируют при стандартных условиях соединения, например, с использованием EDC [1-этил-3(3-диметиламинопропил)карбодиимид]/НОВТ (1-гидроксибензотриазол) или DCC (дициклогексил карбодиимид), DMAP (4-диметиламинопиридин) или HATU [О-(7-азабензотриазол-ил)-N,N,N',N'-тетраметилурониум гексафторфосфат или HOAT (1-гидрокси-7-азабензотриазол), или ВОР [(бензотриазолил-1 илокси)-трис(диметиламин)фосфониум гексафторфосфат], или способом смешанных ангидридов с использованием этилхлорформата или метилхлорформата в приемлемом растворителе, таком как DMF,DCM, ацетонитрил, толуол или THF и подобное, или в их смесях, и в присутствии приемлемого основания, такого как NMM (N-метилморфолин), DIPEA (N,N-диизопропилэтиламин) или триэтиламин, для получения соединений формулы V Схема 1 Приемлемый путь получения соединений формулы XVII, где R4 и R3 определены в данном документе, описан на схеме 2. Соединения формулы XVII можно получить, исходя из 2-амино-4,5-дифторбензойной кислоты, которую восстанавливают с использованием надлежащих восстанавливающих средств, таких как алюмогидрид лития или боран диметилсульфид или смешанный ангидрид/натрия боргидрид в приемлемом растворителе, таком как диэтиловый эфир или THF, или DCM, или их смеси, для получения соединений формулы X. Соединения формулы X затем защищают с использованием аминозащитных реагентов, таких как бензилхлорформат или ди-трет-бутил дикарбонат или фторенилметилоксикарбонил хлорид(Fmoc-Cl), в приемлемом растворителе, таком как DCM, или диоксан, или THF, с образованием соединений формулы XI. Соединения формулы XI затем хлорируют при стандартных условиях хлорирования с использованием тионилхлорида или POCl3, или PCl5, с образованием соединений формулы XII, которые затем соединяются с приемлемо защищенной аминокислотой с использованием надлежащего основания,такого как DIPEA, или триэтиламин, или калия карбонат, или цезия карбонат, или натрия карбонат и подобного, в надлежащем растворителе для получения соединений формулы XIII, где R4 и R5 определены в данном документе. Соединения формулы XIII затем снова защищают при аминной составляющей с использованием защитной группы, отличной от ранее использованной для защиты соединений формулы X,- 14018612 для формирований соединений формулы XIV, где R4 и R5 определены в данном документе, которые затем гидролизируют в основных условиях с образованием соединений формулы XV, где R4 и R5 определены в данном документе. Примеры основных гидролизирующих реагентов включают натрия гидроксид,лития гидроксид, калия гидроксид и подобное, которые можно использовать в надлежащих растворителях, таких как THF/вода, диоксан/вода или THF/MeOH/вода. В соединениях формулы XV селективно снимают защиту при одной из аминных составляющих для получения соединений формулы XVI, где R4 и R5 определены в данном документе, которые затем подвергают внутренней циклизация для формирования соединений формулы XVII. Специалист в данной области легко сможет подобрать надлежащие условия для селективного удаления одной из аминозащитных групп. Примеры стандартных условий циклизации включают EDC [1-этил-3-(3-диметиламинопропил)карбодиимид]/НОВТ (1-гидроксибензотриазол); DCC (дициклогексил карбодиимид), DMAP (4-диметиламинопиридин); HATU [О-(7 азабензотриазол-ил)-N,N,N',N-тетраметилурониум гексафторфосфат; HOAT (1-гидрокси-7-азабензотриазол); ВОР [(бензотриазолил-1-илокси)-трис(диметиламин)фосфониум гексафторфосфат]; способ смешанных ангидридов с использованием этилхлорформата или метилхлорформата в приемлемом растворителе, таком как DMF, DCM, ацетонитрил, толуол, THF и подобное, или их смесях и в присутствии приемлемого основания, такого как NMM (N-метилморфолин), DIPEA (N,N-диизопропилэтиламин), триэтиламин и подобное. Схема 2 Соединения формулы XX, где r, R4, R5, R8 и Rc определены в данном документе, можно получить из соединений формулы V, как описано на схеме 3. Соединения формулы V превращают в соединения формулы XVIII, где r, R4, R5 и R8 определены в данном документе, реагированием с реагентом Лавессона или фосфора пентасульфидом в присутствии приемлемого растворителя, такого как толуол, бензол, ксилол, диоксан и подобное, или их смесей в приемлемых условиях нагревания [ссылка: J Org Chem, 1964,29, 231]. Соединения формулы XVIII затем реагируют с соединениями формулы ХIХ, где Rc определен в данном документе, при условиях нагревания в надлежащем растворителе, таком как бензол, или толуол,или DMSO, или их смеси, для получения соединений формулы XX [Ссылка: сообщалось в патентной заявке WO 9620941]. Соединения формулы XIX или коммерчески доступные, или могут быть получены специалистом в данной области. Один приемлемый путь получения таких соединений описан на Схеме 4. Исходя из коммерчески доступного трет-бутил карбазата и подвергая его реакции с надлежащей замещенной кислотой или кислым хлоридом, при стандартных условиях соединения, можно получить соединения формулы XXI, где Rc определен в данном документе, с которого затем можно снять защиту в кислых условиях, таких как использование трифторуксусной кислоты, или пропускание хлористоводородного газа, илиp-толуолсульфоновая кислота и подобное, с образованием соединений формулы XIX или соответствующих их солей. Примеры стандартных условий соединения включают EDC [1-этил-3-(3-диметиламинопропил)карбодиимид]/НОВТ (1 -гидроксибензотриазол); DCC (дициклогексил карбодиимид), DMAP (4 диметиламинопиридин); HATU [О-(7-азабензотриазол-ил)-N,N,N',N'-тетраметилурониум гексафторфосфат; HOAT (1-гидрокси-7-азабензотриазол); ВОР [(бензотриазолил-1-илокси)-трис(диметиламин) фосфониум гексафторфосфат]; способ смешанных ангидридов с использованием этилхлорформата или метилхлорформата в приемлемом растворителе, таком как DMF, DCM, ацетонитрил, толуол, THF и подобное или их смеси, и в присутствии приемлемого основания, такого как NMM (N-метилморфолин), DIPEA Соединения формулы XXIX, где r, Rc и R8 определены в данном документе, можно получить процедурой, описанной на схеме 5, исходя из надлежащего замещенного 2-нитробензилбромида, который можно превратить в соответствующие азиды с использованием натрия азида в приемлемом растворителе,подобно DMF, или THF, или толуолу, при условиях нагревания для формирований соединений формулыXXII, где r и R8 определены в данном документе, которые затем восстанавливают при нейтральных восстанавливающих условиях с использованием трифенил фосфина в THF/воде, что приводит к формированию соответствующих аминов формулы XXIII, где r и R8 определены в данном документе. Аминная функциональность соединений формулы XXIII защищена приемлемой защитной группой, такой как бензилхлорформат или ди-трет-бутил дикарбонат, или фторенилметилоксикарбонил хлорид (Fmoc-Cl) в приемлемом растворителе, таком как DCM, или диоксан, или THF, для получения соединений формулыXXIV, где r и R8 определены в данном документе. Нитрогруппа соединений формулы XXIV затем может быть восстановлена до соответствующих аминогрупп формулы XXV, где r и R8 определены в данном документе, рядом восстанавливающих средств, таких как гидрогенизация на надлежащем катализаторе,таком как палладий, платина или рутений на активированном древесном угле, или химическими способами, таким как реакция с FeCl3, или SnCl2/HCl, или Fe/NH4Cl, или NiC)2/NaBH4, известными специалисту в данной области. Аминосоединения формулы XXV затем подвергают реакции диазотизации с использованием натрия нитрита в присутствии уксусной кислоты/воды, с последующей реакцией с натрия азидом для получения соединений формулы XXVI, где r и R8 определены в данном документе. Соединения формулы XXVI затем реагируют с пропаргил бромидами формулы XXVII, где Rc определено в данном документе, что приводит к формированию соединений формулы XXVIII, где r, R8 и Rc определены в данном документе, которые при нагревании в приемлемом растворителе, подобном бензолу, толуолу,ксилолу и подобному, или их смесях, приводят к формированию соединений формулы XXIX [Ссылка:Org. Lett., 2008, 10, 1617]. Замещенные пропаргил бромиды формулы XXVII, которые коммерчески не- 16018612 доступны, могут быть получены специалистом в данной области следующими процедурами, хорошо описанными в литературе. Примеры таких процедур включают, но без ограничения, с использованием реакции Соногашира пропаргилового спирта с надлежащими галидами, с последующим превращением спирта в бромид [Ссылка: Tet Lett, 1975, 50, 4467; J. Org Chem., 1993, 58. 4716; WO 95/24400]. Схема 5 Формула XXIX Соединения формулы XXXI, где r, R4, R5 и R8 определены в данном документе, можно получить следующей процедурой, описанной на схеме 6, исходя из соединений формулы XVIII, которые при реакции с 2-аминоэтанолом приводят к формированию соединений формулы XXX, где r, R4, R5 и R8 определены в данном документе. Соединения формулы XXX затем подвергают окислению Шверна с последующей внутренней циклизацией для получения соединений формулы XXXI, где r, R4, R5 и R8 определены в данном документе. [Ссылка: WO 96/20941, WO 96/23790, европейский патент 1183243]. Схема 6- 17018612 Соединения формулы XXXIII, где r, R4, R5 и R8 определены в данном документе, можно получить после процедуры, как описано на схеме 7. Соединения формулы V (где R6, R7 = Н), реагируют с диэтилхлорфосфатом с использованием разных оснований, таких как натрия гидрид, лития диизопропиламид,DBU, калия карбонат и калия трет-бутоксид, в приемлемом растворителе, подобном THF или DMF, для получения соединений формулы XXXII, где r, R4, R5 и R8 определены в данном документе. Соединения формулы XXXII затем реагируют с этилизоцианоацетатом с использованием калия трет-бутоксида как основания с использованием THF как растворителя для получения соединений формулы XXXIII [Ссылка: J. Med. Chem., 2008, 51, 4370 и ссылки, упомянутые в данном документе]. Соединения формулы XXXVI, где r, Ar, R4, R5. R8, Ra и Rb определены в данном документе, можно получить следующей процедурой, как описано на схеме 8. С соединений формулы XXXIII, где r, R4, R3 иR8 определены в данном документе, сняли защиту при аминной функциональности и затем соединили с соединениями формулы II, при стандартных условиях соединения, с образованием соединений формулыXXXIV, где r, Ar, R4, R5 и R8 определены в данном документе. Примеры стандартных условий соединения включают EDC [1-этил-3-(3-диметиламинопропил)карбодиимид]/НОВТ (1-гидроксибензотриазол);DCC (дициклогексил карбодиимид), DMAP (4-диметиламинопиридин); HATU [О-(7-азабензотриазолил)-N,N,N',N'-тетраметилурониум гексафторфосфат; НОАТ (1-гидрокси-7-азабензотриазол); ВОР [(бензотриазолил-1-илокси)-трис(диметиламин) фосфониум гексафторфосфат]; способ смешанных ангидридов с использованием этилхлорформата или метилхлорформата в приемлемом растворителе, таком какDMF, DCM, ацетонитрил, толуол, THF и подобное или их смеси, и в присутствии приемлемого основания, такого как NMM (TV-метилморфолин), DIPEA (N,N-диизопропилэтиламин), триэтиламин и подобное. Соединения формулы XXXIV затем гидролизовали в основных условиях с использованием надлежащего основания для получения соединений формулы XXXV, где r, Ar, R4, R3 и R8 определены в данном документе, которые затем соединили с надлежащими аминами при стандартных условиях соединения, что привело к формированию соединений формулы XXXVI. Примеры основных гидролизирующих реагентов включают натрия гидроксид, лития гидроксид, натрия метоксид и подобное, которые можно использовать в надлежащих растворителях, подобно THF/вода, диоксан/вода или THF/MeOH/вода. Схема 8 Соединения формулы XXXVII, где r, R1, R4, R5, R6, R7 и R8 определены в данном документе, можно получить из соединений формулы V следующей процедурой, как описано на схеме 9. Соединения формулы V были N-алкилированы при амидном положении с использованием надлежащего галида в присутствии приемлемых оснований, таких как натрия гидрид, калия карбонат или цезия карбонат, в приемлемом полярном растворителе, таком как DMF, THF и подобное или смеси [Ссылка: заявка на патент США 20060148790 и J. Med. Chem, 2007, 50, 5564]. Схема 9 Соединения формулы XXXIX, где r, R4, R5, R6, R7, R8, Ra и Rb определены в данном документе,можно получить следующей процедурой, как описано на схеме 10. Соединения формулы XXXVII, где R1 представляет собой CH2COOEt и r, R4, R5, R6, R7 и R8 определены в данном документе, можно гидролизовать в основных условиях для получения соединений формулы XXXVIII, где r, R4, R5, R6, R7 и R8 определены в данном документе, которые затем соединяют с различными аминами при стандартных условиях соединения для обеспечения соединений формулы XXXIX. Примеры основных гидролизирующих- 18018612 реагентов включают натрия гидроксид, лития гидроксид, натрия метоксид и подобное, которые можно использовать в надлежащих растворителях, таких как THF/вода, диоксан/вода или THF/MeOH/вода. Примеры стандартных условий соединения включают EDC [1-этил-3-(3-диметиламинопропил) карбодиимид]/НОВТ (1-гидроксибензотриазол); DCC (дициклогексил карбодиимид), DMAP (4-диметиламинопиридин); HATU [О-(7-азабензотриазол-ил)-N,N,N',N'-тетраметилурониум гексафторфосфат; HOAT (1 гидрокси-7-азабензотриазол); ВОР [(бензотриазолил-1-илокси)-трис(диметиламин)фосфониум гексафторфосфат]; способ смешанных ангидридов с использованием этилхлорформата или метилхлорформата в приемлемом растворителе, таком как DMF, DCM, ацетонитрил, толуол, THF и подобное или их смеси, и в присутствии приемлемого основания, такого как NMM (N-метилморфолин), DIPEA (N,N-диизопропилэтиламин), триэтиламин и подобное. Схема 10 Как показано на cxeмe 11, соединения формулы XXXIII могут быть альтернативно превращены в соединения формулы ХХХХ, где r, R4, R5 и R8 определены в данном документе, путем основного гидролиза с последующим соединением с надлежащим амином, что приводит к формированию соединений формулы XXXXI, где r, R4, R5, R8, Ra и Rb определены в данном документе. Примеры основных гидролизирующих реагентов включают натрия гидроксид, лития гидроксид, натрия метоксид и подобное, которые можно использовать в надлежащих растворителях, таких как THF/вода, диоксан/вода илиTHF/MeOH/вода. Примеры стандартных условий соединения включают EDC [1-этил-3-(3-диметиламинопропил)карбодиимид]/НОВТ (1-гидроксибензотриазол); DCC (дициклогексил карбодиимид), DMAP (4 диметиламинопиридин); HATU [O-(7-азабензотриазол-ил)-N,N,N',N'-тетраметилурониум гексафторфосфат; НОАТ (1-гидрокси-7-азабензотриазол); ВОР [(бензотриазолил-1-илокси)-трис(диметиламин) фосфониум гексафторфосфат]; способ смешанных ангидридов с использованием этилхлорформата или метилхлорформата в приемлемом растворителе, таком как DMF, DCM, ацетонитрил, толуол, THF и подобное или их смеси, и в присутствии приемлемого основания, такого как NMM (N-метилморфолин), DIPEA Некоторые образцовые примеры новых гетероциклических промежуточных соединений, синтезированных с использованием процедур, описанных на схемах 1-11, включают, но без ограничения: Понятно, что, как используется в данном документе, ссылки на соединения структурной формулы I подразумевают также включение фармацевтически приемлемых солей, а также солей, которые не являются фармацевтически приемлемыми, когда используются как предшественники свободных соединений или их фармацевтически приемлемых солей или в других манипуляциях синтеза. Соединения данного изобретения можно вводить в форме фармацевтически приемлемой соли. Выражение "фармацевтически приемлемая соль" означает соли, приготовленные из фармацевтически приемлемых нетоксичных оснований или кислот, включая неорганические или органические основания и неорганические или органические кислоты. Соли могут быть получены во время окончательного выделения и очистки соединений или отдельно созданием основных или кислотных аддитивных солей. Образцовые соли основных соединений данного изобретения можно получить осуществлением реакции формы свободного основания соединения с приемлемой кислотой, включая, но без ограничения, ацетат, трифторацетат, адипат, цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, безилат, бутират, камфорсульфонат, дифлюконат, гемисульфат, гептаноат, формат, фумарат, лактат, малеат, метансульфонат, нафтилсульфонат, никотинат, оксалат,пикрат, пивалат, сукцинат, тартрат, трихлорацетат, глутамат, p-толуолсульфонат, хлористоводород, бромистоводород, сульфат, фосфат и подобное. Характерные соли кислотных соединений данного изобретения можно получить осуществлением реакции свободной кислотной формы соединения с приемлемым основанием, включая, но без ограничения, соли аммония, кальция, магния, калия, натрия, соли первичных, вторичных и третичных аминов, замещенных аминов, включая амины природного происхождения,- 21018612 например, аргинин, бетаин, кофеин, холин, глюкамин, глюкозамин, гистидин, лизин, морфолин, пиперазин, пиперидин, пурин, триэтиламин и подобное. Могут использоваться соединения данного изобретения, которые включают карбоновую кислоту (-СООН) или спиртовую группу, их фармацевтически приемлемые эстеры карбоновой кислоты, такие как метиловый, этиловый и подобное, или ацильные производные спиртов, такие как ацетат и подобное. Соединения данного изобретения, которые включают основный атом азота, могут быть кватеринизированы алкил галидами, алкил сульфатами и подобным. Такие соли позволяют получить растворимые в воде и растворимые в масле соединения данного изобретения. Очевидно, что свободные основные или свободные кислотные формы будут типично отличаться от их соответствующих солевых форм до некоторой степени физическими свойствами, такими как растворимость в полярных растворителях, но с другой стороны соли эквивалентны их соответствующим свободным формам для цели данного изобретения."Фармацевтически приемлемые сольваты" означают сольваты с водой (т.е. гидраты) или фармацевтически приемлемыми растворителями, например, этанолом и подобным. Данное изобретение также охватывает "пролекарства" соединений данного изобретения, которые при in vivo введении подвергаются химическому превращению метаболическими способами перед тем,как стать активными фармакологическими веществами. Обычно такие пролекарства будут функциональными производными соединения данного изобретения, которые легко превращаются in vivo в соединение данного изобретения. Традиционные процедуры для выбора и получения производных приемлемого пролекарства описаны, например, в "Targeted prodrug design to optimize drug delivery", AAPS PharmaSci(2000), 2(1), E6. Данное изобретение также охватывает активные "метаболиты" соединения данного изобретения. Активный метаболит является активным производным DPP-IV ингибитора, продуцированного, когда метаболизирован DPP-IV ингибитор. Различные "полиморфы" соединения общей формулы I, образующей часть данного изобретения,могут быть получены кристаллизацией соединения формулы I при других условиях. Например, использованием других обыкновенно используемых растворителей или их смесей для рекристаллизации; кристаллизациями при других температурах; различными способами охлаждения, варьирующими от очень быстрого до очень медленного охлаждения во время кристаллизации, нагреванием или плавлением соединения с последующим постепенным или быстрым охлаждением также можно получить полиморфы. Присутствие полиморф может быть определено твердопробной ЯМР (ядерный магнитный резонанс) спектроскопией, ИК (инфракрасной) спектроскопией, дифференциальной сканирующей калориметрией,порошковой рентгеновской дифракцией или другими такими методиками. Данное изобретение также представляет фармацевтические композиции для профилактики, облегчения и/или лечения одного или более состояния, опосредованного DPP-IV, у субъекта, нуждающегося в этом, включающие соединения данного изобретения или их фармацевтически приемлемые производные,таутомерные формы, стереоизомеры, соли или их сольваты факультативно в комбинации с одним или более фармацевтически приемлемыми носителями, включая наполнители и вспомогательные средства. Фармацевтические композиции могут быть в любой форме, известной в данной области, такой как таблетки, капсулы, порошки, сиропы, растворы, суспензии и подобное, могут включать вкусовые добавки,подсластители и т.д. в приемлемых твердых или жидких носителях или разбавителях, или в приемлемой стерильной среде для формирования инъекционных растворов или суспензий. Такие композиции типично включают активное соединение, факультативно в комбинации с фармацевтически приемлемыми носителями, разбавителями или растворителями. Фармацевтические композиции данного изобретения могут быть изготовлены способами, хорошо известными в данной области, например, посредством способов традиционного смешивания, растворения, сухой грануляции, влажной грануляции, изготовления драже, растирания в порошок, эмульгации,инкапсулирования, улавливания, лиофилизации или сушки распылением. Соединения или фармацевтические композиции, включающие такие соединения данного изобретения, можно вводить в форме любого фармацевтического состава. Фармацевтический состав будет зависеть от природы активного соединения и их пути введения. Можно использовать любой путь введения, например оральное, буккальное,пульмонарное, местное, парентеральное (включая подкожное, внутримышечное и внутривенное), трансдермальное, глазное (офтальмическое), ингаляцией, внутриназальное, трансмукозальное, имплантное или ректальное введение. Предпочтительно соединения данного изобретения вводятся орально, парентерально или местно. В варианте осуществления количество новых соединений, имеющих формулу I по данному изобретению, подлежащие включению в фармацевтические композиции данного изобретения, могут варьировать в широком диапазоне в зависимости от известных факторов, таких как, например, нарушение, подлежащее лечению, тяжесть нарушения, вес тела пациента, дозированная форма, выбранный путь введения и число введения в день. Типично, количество соединений формулы I в фармацевтических композициях данного изобретения будет варьировать от приблизительно от 0,01 мг до около 5000 мг. В варианте осуществления дневная доза композиции, включающей новые соединения, имеющие формулу I, находится в диапазоне от около 0,01 мг/кг до около 100 мг/кг на основании веса тела субъекта, нуждающего- 22018612 ся в этом, которую можно вводить как отдельную или как несколько доз. В варианте осуществления новые соединения, имеющие формулу I по данному изобретению, особенно применимы для лечения болезни(болезней) или нарушения(нарушений), особенно тех которые острые по природе, и которые требуют краткосрочного, но от слабого до умеренного лечения, или даже некоторых хронических состояний, которые благоприятно отвечают на или облегчаются новыми соединениями, имеющими формулу I, или композициями, включающими их. Композиции, включающие новые соединения, имеющие формулу I, применяют профилактически или терапевтически в зависимости от патологического состояния, намеченного для предотвращения или лечения, соответственно.DPP-IV ингибиторы данного изобретения применимы для профилактики, облегчения и/или лечения диабета 2 типа и в профилактике, облегчении и/или лечении многочисленных состояний, которые часто сопровождают диабет 2 типа. Болезни, нарушения и состояния, которые связаны с диабетом 2 типа и,поэтому, могут лечиться, контролироваться, а в некоторых случаях предотвращаться, лечением DPP-IV ингибиторами, включают, но без ограничения, например, гипергликемию и метаболический синдром или'синдром X', включая ухудшенную толерантность к глюкозе, инсулиновую устойчивость, метаболический ацидоз или кетоз, нарушения потребления пищи, нарушения сытости, ожирение, дислипидемию(включая гиперлипидемию, гипертриглицеридемию, гиперхолестеринемию, низкие уровни HDL (липопротеинов высокой плотности), высокие уровни LDL (липопротеинов низкой плотности, атеросклероз и его 30 последствий, гипертензию, связанную с метаболическими нарушениями. Другие воспалительные условия включают, но без ограничения, например, болезнь раздраженного кишечника (IBS), болезнь воспаленного кишечника, включая болезнь Крона и язвенный колит, панкреатит, нейродегенеративную болезнь, ретинопатию, нефропатию, невропатию, яичниковый гиперандрогенизм (синдром поликистозных яичников) и другие нарушения, где компонентом является инсулиновая устойчивость. Кроме того, соединения данного изобретения можно также применять для профилактики, облегчения и/или лечения заживления ран, ишемии тканей, катаракты, глаукомы, повышенного сердечнососудистого риска, дефицита гормона роста, нейтропении, невронального нарушения, прорастания опухоли и метастазирования, доброкачественной гипертрофии предстательной железы (ВРН), гингивита,остеопороза, подвижности сперматозоидов/мужской контрацепции, боли, невропатической боли, ревматоидной боли, остеоартритной боли, акне, кожных нарушений (например, пигментационные нарушения или псориаз), тревоги, анорексии, эпилепсии, мужской и женской половой дисфункции, глубокого депрессивного нарушения, болезни Паркинсона, мигрени, остеоартрита, иммуносупрессии, ВИЧ инфекции,гемопоэза, анемии и других состояний, проявляемых рядом метаболических, неврологических, противовоспалительных и аутоиммунных нарушений, включая, например, ревматоидный артрит, вирусные, раковые и желудочно-кишечные нарушения, которые можно предотвратить или вылечить ингибированиемDPP-IV. Следующий вариант осуществления данного изобретения представляет собой применение соединения формулы I для изготовления медикамента для профилактики, облегчения и/или лечения одного или более состояния(состояний)/болезни(болезней)/нарушения(нарушений), опосредованных DPP-IV, у субъекта, нуждающегося в этом. Другой вариант осуществления данного изобретения представляет способы профилактики, облегчения и/или лечения одного или более состояния(состояний)/ болезни(болезней)/нарушения(нарушений),опосредованного DPP-IV, у субъекта, нуждающегося в этом, которые включают введение терапевтически эффективного количества соединений формулы I. В следующем варианте осуществления данного изобретения представлено применение дозированной формы композиций, включающих новые соединения формулы I, для лечения одного или более состояния(состояний)/болезни(болезней)/ нарушения(нарушений), опосредованных DPP-IV, которое включает введение субъекту, нуждающегося в этом, фармацевтически эффективного количества композиции. В еще одном варианте осуществления соединения данного изобретения применимы в лечении вышеупомянутых болезней, нарушений и состояний в комбинации с другим модифицирующим болезнь лекарственным средством. Соединения данного изобретения можно использовать в комбинации с одним или более другими лекарственными средствами при лечении, предотвращении, подавлении или облегчении болезней или состояний, для которых соединения формулы I или другие лекарственное средства можно применять, где комбинация лекарственных средств вместе более безопасна или более эффективна, чем любое лекарственное средство отдельно. Другие терапевтические средства, приемлемые для комбинации с соединениями данного изобретения, включают, но без ограничения, известные терапевтические средства, применимые при лечении вышеупомянутых нарушений, включая противодиабетические средства; противогипергликемические средства; гиполипидемические/понижающие липиды средства; средства против ожирения; противогипертензийные средства, средство против TNF средство или средства повышающие с-АМР и супрессанты аппетита. Примеры приемлемых противодиабетических средств для применения в комбинации с соединениями данного изобретения включают, но без ограничения, (а) другие DPP-IV ингибиторы, такие как Ситаг- 23018612 липтин (Merck), Вилдаглиптин (Novartis); (b) средства, повышающие чувствительность к инсулину,включая (i) PPAR у агонисты, такие как глитазоны (например, пиоглитазон, розиглитазон и подобное), и другие PPAR лиганды, включая PPAR /дуальные агонисты и PPARагонисты, такие как производные фенофибровой кислоты (гемфиброзил, клофибрат, фенофибрат и безафибрат, (ii) бигуаниды, такие как метформин и фенформин, и (iii) ингибиторы протеинтирозинфосфатазые-1 В (РТР-1 В); (с) инсулин или инсулиновые миметики; (d) сульфонилмочевины и другие стимуляторы секреции инсулина, такие как толбутамид, глибурид, глипизид, глимепирид и меглитиниды, такие как репаглинид; (е) ингибиторы альфа-глюкозидазы (такие как акарбоза и миглитол); (f) антагонисты глюкагоновых рецепторов; (g) GLP1, миметики GLP-1, такие как эксендин-4 или амилин и агонисты GLP-1 рецепторов; (h) GIP и миметикиGIP; (i) РАСАР, миметики РАСАР, и агонисты РАСАР рецепторов; (j) активаторы АМРК; (k) ингибиторы 11-HSD; (1) ингибиторы SGLT-2; (m) ингибиторы глюкоза-6-фосфат, фруктоза-1,6-бифосфат, гликогенфосфорилазы, аминопептидазы-N или пируватдегидрокиназы; (n) активаторы глюкокиназы (GKA). Полагают, что применение соединений формулы I в комбинации по меньшей мере с одним или более другим противодиабетичеким средством(средствами) обеспечивает противогипергликемические результаты, большие, чем возможные от каждого из этих медикаментов отдельно, или большие, чем комбинированные аддитивные противогипергликемические эффекты, производимые этими медикаментами. Примеры приемлемых гиполипидемических/понижающих липиды средств для применения в комбинации с соединениями данного изобретения включают, но без ограничения, (а) средства, понижающие холестерин, такие как (i) ингибиторы HMG-CoA редуктазы (ловастатин, симвастатин, правастатин, церивастатин, флувастатин, аторвастатин, итавастатин, росувастатин и другие статины), (ii) секвестранты(холестирамин, холестипол и диалкиламиноалкильные производные перекрестно-связанного декстрана),(iii) никотиниловый спирт, никотиновая кислота или ее соль, (iv) PPAR агонисты, как описано в данном документе, (vi) ингибиторы абсорбции холестерола, такие как бета-ситостерол и эзетимиб, (vii) ингибиторы ацил СоА холестерол ацилтрансферазы, такие как авазимиб, и (viii) антиоксиданты, такие как пробукол; (b) ингибиторы переносчика подвздошных желчных кислот; (с) соединения, повышающие HDL,такие как ингибиторы СЕТР; (d) ингибиторы липоксигеназы; (е) ингибиторы АСАТ, такие как авазимиб;(f) производные фибровой кислоты; (g) ингибиторы МТР. Примеры приемлемых соединений против ожирения для применения в комбинации с соединениями данного изобретения включают, но без ограничения,(a) фенфлурамин, дексфенфлурамин, фентеимин, сибутрамин, орлистат и подобное;(g) антагонисты рецепторов меланин-концентрирующего гормона (МСН). Примеры приемлемых противогипертензивных средств для применения в комбинации с соединениями данного изобретения включают, но без ограничения, (а) ингибиторы вазопептидазы, такие как ингибиторы нейтральной эндопептидазы (неприлизин) и/или ингибиторы АСЕ или дуальные ингибиторы NEP/ACE (эналаприл, лизиноприл, каптоприл, квинаприл, тандолаприл); (b) Бета блокаторы и блокаторы кальциевых каналов; (с) блокаторы А-II рецепторов (лозаитан, кандесартан, ирбесартан, валсартан,телмисартан, эпросартан); (d) Ренин ингибиторы, например, алискирен. Примеры приемлемых противовоспалительных средств для применения в комбинации с соединениями данного изобретения включают, но без ограничения, аспирин, нестероидные противовоспалительные лекарственные средства, глюкокортикоиды, азулфидин и селективные ингибиторы циклооксигеназы-2. Примеры Данное изобретение поясняется в деталях в следующих примерах, которые приведены исключительно с целью иллюстрации только, и не должны рассматриваться как ограничивающие объем данного изобретения. Все исходные материалы являются или коммерчески доступными, или их можно получить процедурами, которые хорошо известные специалисту в органической химии. Растворители были высушены до применения где-либо необходимыми стандартными способами (Perrin, D. D.; Armarego, W.L.F.Purification of Laboratory Chemicals, Pergamon Press: Oxford, 1988). Масс-спектр (MS) был получен электронной ионизацией распылением (ESI) эВ с использованием биосистемы Applied 4000 Q TRAP. 1 Н ЯМР был зарегестрирован на ЯМР спектрометре Bruker 400 МГц Avance П. Химические смещения выражались как 5 значения в частях на миллион (ppm), относительно TMS как внутреннего стандарта. Все значения констант (J) соединения приведены в Гц. Аббревиатуры Следующие аббревиатуры применяются в примерах и где-либо еще в данном документе:- 25018612 Пример 1. Получение соли трифторуксусной кислоты 4-[(R)-3-амино-4-(2,4,5-трифторфенил)бутирил]-1,3,4,5-тетрагидробензо[е][1,4]диазепин-2-она Этап 1. Получение (2-нитробензиламино)уксусной кислоты метилового эфира. К раствору 2-нитробензил бромида (1,0 г, 4,63 ммоль) и глицинового метилового эфира гидрохлорида (868 мг, 6,94 ммоль) в сухом DMF (10 мл) добавили DIPEA (2,42 мл, 13,89 ммоль) в атмосфере азота. Реакционную смесь взбалтывали при к. т. на протяжении ночи. После завершения реакции, как подтвердили с помощью TLC, к реакционной смеси добавили воду (50 мл). Неочищенный продукт экстрагировали этилацетатом (20 мл). Водный слой промыли этилацетатом (2 10 мл). Комбинированный органический экстракт высушили над Na2SO4, а растворители удалили в вакууме для получения неочищенного соединения, которое очистили колоночной хроматографией (силикагель, 1:9 EtOAc: пет. эфир) для получения чистого (2-нитробензиламино)уксусной кислоты метилового эфира (765 мг 73%) как вязкого масла. ESIMS (масса/заряд): 224,7 (М+1). Этап 2. Получение [трет-бутоксикарбонил-(2-нитробензил)амино]уксусной кислоты метилового эфира. К раствору (2-нитробензиламино)уксусной кислоты метилового эфира (760 мг, 3,39 ммоль) в сухомDCM (20 мл), добавили ди-трет-бутилдикарбонат (1,11 г, 5,08 ммоль) и реакционную смесь взбалтывали при к. т. на протяжении ночи. После завершения реакции, как подтвердили с помощью TLC, растворитель удалили в вакууме для получения неочищенного соединения, которое очистили колоночной хроматографией (силикагель, 2:8 EtOAc:пет. эфир) для получения чистого [трет-бутоксикарбонил-(2-нитробензил)амино]уксусной кислоты метилового эфира (850 мг, 77%) как вязкого масла. ESIMS (масса/заряд): 346,8 (M+Na), 325,1 (М+1). Этап 3. Получение [(2-амино-бензил)-трет-бутоксикарбониламино]уксусной кислоты метилового эфира. К раствору трет-бутоксикарбонил-(2-нитробензил)амино]уксусной кислоты метилового эфира (845 мг, 2,61 ммоль) в МеОН (15 мл) добавили 10% Pd/C (84,5 мг, 10 вес.%) в атмосфере азота. Из реакционной смеси откачали воздух, и затем наполнили водородным газом и гидрогенировали с использованием водородного баллона в течение 3 ч. После завершения реакции, как подтвердили с помощью TLC, из реакционной смеси откачали воздух и поместили в атмосферу азота, а затем отфильтровали через слой целита, промыли с МеОН (10 мл). Фильтрат концентрировали в вакууме для получения [(2-аминобензил)трет-бутоксикарбониламино]уксусной кислоты метилового эфира (660 мг, 86%) как желтого масла, которое использовали без какой-либо последующей очистки для следующего этапа. ESIMS (масса/заряд): 295,4 (М+1). Этап 4. Получение 2-оксо-1,2,3,5-тетрагидробензо[е][1,4]диазепин-4-карбоновой кислоты третбутилового эфира. К раствору [(2-аминобензил)-трет-бутоксикарбониламино]уксусной кислоты метилового эфира (640 мг, 2,18 ммоль) в толуоле (30 мл) добавили НОВТ (177 мг, 1,31 ммоль). Реакционную смесь нагревали при 100 С в течение 24 ч. После завершения реакции, как подтвердили с помощью TLC, растворитель удалили в вакууме для получения неочищенного соединения, которое очистили колоночной хроматографией (силикагель, 7:13 EtOAc: пет. эфир) для получения чистого 2-оксо-1,2,3,5-тетрагидробензоESIMS (масса/заряд): 263,3 (М+1). Этап 5. Получение соли трифторуксусной кислоты 1,3,4,5-тетрагидробензо[е][1,4]диазепин-2-она. К раствору 2-оксо-1,2,3,5-тетрагидро-бензо[е][1,4]диазепин-4-карбоновой кислоты трет-бутилового эфира (300 мг, 1,14 ммоль) в сухом DCM (10 мл) добавили трифторуксусную кислоту (3,42 мл, 3 мл/ммоль). Реакционную смесь взбалтывали при к. т. в течение 2 часов. После завершения реакции, как подтвердили с помощью TLC, избыток трифторуксусной кислоты и DCM удалили под вакуумом для получения соли трифторуксусной кислоты 1,3,4,5-тетрагидробензо[е][1,4]диазепин-2-она (295 мг, 93%) как вязкого твердого вещества. Неочищенное соединение использовали без последующей очистки для следующего этапа. ESIMS (масса/заряд): 185,3 (M+Na), 163,3 (М+1). Этап 6. Получение [(R)-3-оксо-3-(2-оксо-1,2,3,5-тетрагидробензо[е][1,4]диазепин-4-ил)-1-(2,4,5 трифторбензил)пропил]карбаминовой кислоты трет-бутилового эфира. К раствору (R)-3-[(трет-бутоксикарбонил)амино]-4-(2,4,5-трифторфенил)бутановой кислоты (90 мг,0,26 ммоль) в сухом DCM (10 мл) добавили НОВТ (47 мг, 0,34 ммоль), EDC (67 мг, 0,34 ммоль) и DIPEA(0,24 мл, 1,35 ммоль). Реакционную смесь взбалтывали при к. т. в течение 10 мин. Раствор 1,3,4,5 тетрагидробензо[е][1,4]диазепин-2-она трифторацетат (74 мг, 0,26 ммоль) в сухом DCM (5 мл) добавили и реакционную смесь взбалтывали при к. т. на протяжении ночи в атмосфере азота. После завершения- 26018612 реакции, как подтвердили с помощью TLC, неочищенный продукт экстрагировали с DCM (10 мл) и промыли последовательно с 10% раствором HCl (10 мл) и насыщенным раствором натрия бикарбоната (10 мл). Органические слой отделили, промыли с водой, высушили над Na2SO4 и концентрировали в вакууме для получения неочищенного соединения, которое очистили колоночной хроматографией (силикагель,2:3 EtOAc:пет. эфир) для получения [(R)-3-оксо-3-(2-оксо-1,2,3,5-тетрагидробензо[е][1,4]диазепин-4-ил)1-(2,4,5-трифторбензил)пропил]карбаминовой кислоты трет-бутилового эфира (80 мг, 62%) как белого твердого вещества. ESIMS (масса/заряд): 500,2 (M+Na), 478,2 (М+1). Этап 7. Получение соли трифторуксусной кислоты (R)-4-[3-амино-4-(2,4,5-трифторфенил)бутирил]1,3,4,5-тетрагидробензо[е][1,4]диазепин-2-она. К раствору [(R)-3-оксо-3-(2-оксо-1,2,3,5-тетрагидробензо[е][1,4]диазепин-4-ил)-1-(2,4,5-трифторбензил)пропил]карбаминовой кислоты трет-бутилового эфира (40 мг, 0,08 ммоль) в DCM (5 мл) добавили трифторуксусную кислоту (0,24 мл, 3 мл/ммоль). Реакционную смесь взбалтывали при к. т. в течение 1 ч. После завершения реакции, как подтвердили с помощью TLC, избыток трифторуксусной кислоты иDCM выпарили в вакууме для получения вязкого твердого вещества, которое затвердело из гексана для получения соли трифторуксусной кислоты 4-[-3-амино-4-(2,4,5-трифторфенил)бутирил]-1,3,4,5 тетрагидробензо[е][1,4] диазепин-2-она (30 мг, 73%) как тревдого вещества. 1 Н ЯМР (400 MГц, MeOD):2,62-2,70 (m, 1 Н), 2,75-2,87 (m, 1H), 2,97-3,03 (m, 2H), 3,76-3,86 (два m,1H), 4,17 (s, 1H), 4,50 (s, 1H), 4,62 (s, 1H), 4,66 (s, 1H), 7,05-7,15 (m, 2H), 7,14-7,25 (m, 2H), 7,27-7,30 (m,2H). ESIMS (масса/заряд): 400,3 (M+Na), 378,2 (M+l). Пример 2. Получение соли трифторуксусной кислоты (R)-4-(3-амино-4-(2,4,5-трифторфенил)бутаноил)-7,8-дифтор-4,5-дигидро-1 Н-бензо[е][1,4]диазепин-2(3 Н)-она Этап 1. Получение 2-амино-4,5-дифторфенилметанола. К раствору алюмогидрида лития (2,13 г, 57,76 ммоль) в сухом THF (35 мл) при 0 С, медленно добавили раствор 2-амино-4,5-дифтор бензойную кислоту (5 г, 28,88 ммоль), растворенную в сухом THF (35 мл). Реакционную смесь взбалтывали при к. т. в течение 2 часов. После завершения реакции, как подтвердили с помощью TLC, воду (2,1 мл), 10% NaOH (2,1 мл) и воду (32,1 мл) добавили последовательно в реакционную смесь при 0 С. Полученную взвесь взбалтывали при к. т. в течение 20 мин. Взвесь отфильтровали со слоя целита и промыли с EtOAc (220 мл). Фильтрат высушили над Na2SO4 и растворители удалили в вакууме для получения неочищенного соединения как твердого вещества. Неочищенное соединение (2-амино-4,5-дифторфенил)метанол (4,50 г, 98%) использовали без какойлибо последующей очистки для следующего этапа. ESMS (масса/заряд): 158,1 (М-1). Этап 2. Получение трет-бутил 4,5-дифтор-2-(гидроксиметил)фенилкарбамата. К раствору (2-амино-4,5-дифторфенил)метанола (4,50 г, 28,30 ммоль) в 1,4-диоксане и воде (1:1, 50 мл) добавили NaHCO3 (4,7 г, 56,60 ммоль) при 0 С. К образовавшемуся раствору добавили ди-трет-бутил дикарбонат (9,7 мл, 42,45 ммоль). Реакционную смесь взбалтывали при к. т. В течение 10 ч. После завершения реакции, как подтвердили с помощью TLC, 1,4-диоксан удалили в вакууме и неочищенное соединение экстрагировали с EtOAc (350 мл). Комбинированные органические слои высушили надNa2SO4 и растворители удалили в вакууме для получения неочищенного соединения, которое очистили колоночной хроматографией (силикагель, 1:9 EtOAc: пет. эфир) для получения чистого (4,5-дифтор-2 гидроксиметил-фенил)-карбаминовой кислоты трет-бутилового эфира (5,86 г, 80%) как густого геля.ESMS (масса/заряд): 258,3 (М-1). Этап 3. Получение 2-(хлорметил)-4,5-дифторфенилкарбамата. К раствору (4,5-дифтор-2-гидроксиметилфенил)карбаминовой кислоты трет-бутилового эфира (5,86 г, 22,62 ммоль) в сухом DCM (50 мл) добавили тионил хлорид (3,28 мл, 45,64 ммоль) при 0 С. Реакционную смесь взбалтывали при к. т. в течение 2 ч под аргоном. После завершения реакции, как подтвердили с помощью TLC, воду (30 мл) добавили к реакционной смеси и неочищенное соединение экстрагировали с DCM (330 мл). Комбинированные органические слои высушили над Na2SO4 и растворители удалили в вакууме для получения неочищенного (2-хлорметил-4,5-дифторфенил)карбаминовой кислоты третбутилового эфира (5,65 г, 90%), который использовали без какой-либо последующей очистки для следующего этапа. ESIMS (масса/заряд): 279,3 (М+1). Этап 4. Получение (2-трет-бутоксикарбониламино-4,5-дифторбензиламино)уксусной кислоты метилового эфира. К раствору (2-хлорметил-4,5-дифторфенил)карбаминовой кислоты трет-бутилового эфира (5,65 г,20,3 ммоль) в DMF (50 мл) добавили DIPEA (10,6 мл, 60,9 ммоль). Образовавшийся раствор взбалтывали в течение 5 мин, с последующим добавлением по каплям раствора глицинового метилового эфира гидрохлорида в DMF при 0 С. Реакционную смесь взбалтывали на протяжении ночи при 50 С. После завер- 27018612 шения реакции, как подтвердили с помощью TLC, воду (60 мл) добавили к реакционной смеси и неочищенное соединение экстрагировали с EtOAc (350 мл). Комбинированные органические слои высушили над Na2SO4. Растворители удалили в вакууме для получения неочищенного соединения, которое очистили колоночной хроматографией (силикагель: 1,5:8,5 EtOAc:пет. эфир) для получения чистого (2-третбутоксикарбониламино-4,5-дифторбензиламино)уксусной кислоты метилового эфира (5,37 г, 80%) как густого геля. ESIMS (масса/заряд): 331,4 (М+1). Этап 5. Получение бензилокси карбонил-(2-трет-бутоксикарбониламино-4,5-дифторбензил)амино] уксусной кислоты метилового эфира. К раствору (2-трет-бутоксикарбониламино-4,5-дифторбензиламино)уксусной кислоты метилового эфира (5,37 г, 16,28 ммоль) в 1,4-диоксан:вода (1:1, 50 мл) добавили NaHCO3 (2,73 г, 32,56 ммоль) при 0 С, с последующим добавлением бензилхлорформата (4,09 мл, 24,42 ммоль). Реакционную смесь взбалтывали при к. т. в течение 10 ч. После завершения реакции, как подтвердили с помощью TLC, 1,4 диоксан удалили в вакууме и неочищенное соединение экстрагировали с EtOAc (350 мл). Комбинированные органические слои высушили над Na2SO4 и растворители удалили в вакууме для получения неочищенного соединения, которое очистили колоночной хроматографией (силикагель, 1,5: 8,5 EtOAc:пет. эфир), для получения чистого [бензилокси карбонил-(2-трет-бутоксикарбониламино-4,5-дифторбензил) амино]уксусной кислоты метилового эфира (5,28 г, 70%) как густого геля. ESIMS (масса/заряд): 463,4(М-1). Этап 6. Получение бензилокси карбонил-(2-трет-бутоксикарбониламино-4,5-дифторбензил)амино] уксусной кислоты. К раствору бензилокси карбонил-(2-трет-бутоксикарбониламино-4,5-дифторбензил)амино]уксусной кислоты метилового эфира (5,28 г, 11,39 ммоль) в THF (30 мл) добавили раствор лития гидроксида (2,87 г, 68,34 ммоль) в воде (10 мл). Реакционную смесь взбалтывали при к. т. в течение 10 ч. После завершения реакции, как подтвердили с помощью TLC, реакционную смесь подкислили до рН 4 добавлением 10% HCl и неочищенное соединение экстрагировали с EtOAc (350 мл). Комбинированные органические слои высушили над Na2SO4 и растворители удалили в вакууме для получения неочищенного соединения[бензилокси карбонил-(2-трет-бутоксикарбониламино-4,5-дифторбензил)амино]уксусной кислоты (4,76 г, 93%) как твердого вещества, которое использовали без какой-либо последующей очистки для следующего этапа. ESIMS (масса/заряд): 448,8 (М-1). Этап 7. Получение 2-[(бензилоксикарбонилкарбоксиметиламино)метил]-4,5-дифторфениламмония трифторацетат. К раствору бензилокси карбонил-(2-трет-бутоксикарбониламино-4,5-дифторбензил)амино]уксусной кислоты(4,76 г, 10,56 ммоль) в сухом DCM (40 мл) добавили трифторуксусную кислоту (14,35 мл, 3 мл/ммоль) при 0 С. Реакционную смесь взбалтывали при к. т. в течение 2 ч под аргоном. После завершения реакции, как подтвердили с помощью TLC, реакционную смесь выпарили в вакууме для удаления избытка растворителя и трифторуксусной кислоты. Оставшиеся растворители удалили под вакуумом и получили 2-[(бензилоксикарбонилкарбоксиметиламино)метил]-4,5-дифторфениламмоний трифторацетат(4,75 г, 97%) как густое коричневое желе, которое использовали без какой-либо последующей очистки для следующего этапа. ESIMS (масса/заряд): 351,2 (М+1). Этап 8. Получение бензил 7,8-дифтор-2-оксо-2,3-дигидро-1H-бензо[е][1,4]диазепин-4(5 Н)карбоксилата. К раствору 2-[(бензилоксикарбонилкарбоксиметиламино)метил]-4,5-дифторфениламмония трифторацетата (4,75 г, 10,25 ммоль) в DCM (40 мл) добавили EDC (2,55 г, 13,32 ммоль) и НОВТ (1,79 г, 13,32 ммоль) при 0 С. Образовавшийся раствор взбалтывали в течение 5 мин и добавили к нему DIPEA (5,35 мл, 30,75 ммоль). Реакционную смесь взбалтывали на протяжении ночи при к. т. под аргоном. После завершения реакции, как подтвердили с помощью TLC, воду (60 мл) добавили к реакционной смеси и неочищенное соединение экстрагировали с DCM (350 мл). Комбинированные органические слои высушили над Na2SO4 и растворители удалили в вакууме для получения неочищенного соединения, которое очистили колоночной хроматографией (силикагель: 2:8 EtOAc: пет. эфир) для получения чистого бензил 7,8-дифтор-2-оксо-2,3-дигидро-1 Н-бензо[е][1,4]диазепин-4(5 Н)-карбоксилата (2,04 г, 60%) как густого геля. ESMS (масса/заряд): 331,2(М-1). Этап 9. Получение 7,8-дифтор-1,3,4,5-тетрагидробензо[е][1,4]диазепин-2-она. К раствору (7,8-дифтор-2-оксо-1,2,3,5-тетрагидробензо[е][1,4]диазепин-4-карбоновой кислоты фениловый эфир) (2,04 г, 6,15 ммоль) в МеОН (30 мл) добавили 10% Pd/C (200 мг, 20% вес./вес.) под аргоном. Реакционную смесь взбалтывали при к. т. В течение 5 ч в атмосфере водорода. После завершения реакции, как подтвердили с помощью TLC, реакционную смесь отфильтровали через слой целита и промыли с EtOAc и МеОН. Растворители удалили в вакууме для получения неочищенного соединения, которое очистили колоночной хроматографией (силикагель: 1:9 МеОН: CHCl3) для получения чистого 7,8 дифтор-1,3,4,5-тетрагидро-бензо[е][1,4]диазепин-2-она как грязно-белого твердого вещества (0,98 г,80%). ESIMS (масса/заряд): 199,7 (М+1). Этап 10. Получение (R)-трет-бутил-4-(7,8-дифтор-2-оксо-2,3-дигидро-1H-бензо[е][1,4]диазепин- 28018612 4(5 Н)-ил)-4-оксо-1-(2,4,5-трифторфенил)бутан-2-илкарбамата. К раствору (R)-3-[(трет-бутоксикарбонил)амино]-4-(2,4,5-трифторфенил)бутановой кислоты (1,64 г,4,92 ммоль) в сухом DCM (15 мл) добавили EDC (1,037 г, 5,412 ммоль) и НОВТ (0,731 г, 5,412 ммоль) при 0 С. Образовавшийся раствор взбалтывали в течение 5 мин и добавили к нему DIPEA (0,94 мл, 5,412 ммоль), с последующим добавлением 7,8-дифтор-1,3,4,5-тетрагидробензо[е][1,4]диазепин-2-она (0,97 г,4,92 ммоль). Реакционную смесь взбалтывали в течение 5 ч при к. т. под аргоном. После завершения реакции, как подтвердили с помощью TLC, воду (30 мл) добавили к реакционной смеси и неочищенное соединение экстрагировали с DCM (330 мл). Комбинированные органические слои высушили надNa2SO4 и растворители удалили в вакууме для получения неочищенного соединения, которое очистили колоночной хроматографией (силикагель: 0,7:99,3 МеОН:CHCl3) для получения чистого [3-(7,8-дифтор 2-оксо-1,2,3,5-тетрагидробензо[е][1,4]диазепин-4-ил)-3-оксо-1-(2,4,5-трифторзил)пропил]карбаминовой кислоты трет-бутиловый эфир (0,682 г, 27%). 1 Н ЯМР (400 MHz, CDCl3):1,35 и 1,38 (два ротамерных синглета, 9 Н), 2,54-2,65 (m, 2 Н), 2,89-2,92(m, 2 Н), 8,11 и 8,31 (два bs, 1H). ESIMS (масса/заряд): 514,4 (М+1). Этап 11. Получение соли трифторуксусной кислоты (R)-4-(3-амино-4-(2,4,5-трифторфенил)бутаноил)-7,8-дифтор-4,5-дигидро-1 Н-бензо[е][1,4]диазепин-2(3 Н)-она. К раствору [3-(7,8-дифтор-2-оксо-1,2,3,5-тетрагидро-бензо[е][1,4]диазепин-4-ил)-3-оксо-1-(2,4,5 трифторзил)пропил]карбаминовой кислоты трет-бутилового эфира, (0,682 г, 1,32 ммоль) в сухом DCM (5 мл) добавили трифторуксусную кислоту (3,96 мл, 3 мл/ммоль) при 0 С. Реакционную смесь взбалтывали при к. т. в течение 2 ч под аргоном. После завершения реакции, как подтвердили с помощью TLC, реакционную смесь выпарили под вакуумом для удаления избытка растворителя и трифторуксусной кислоты. Оставшиеся растворители удалили под вакуумом и неочищенное соединение растерли с диэтиловым эфиром (5 мл) с образованием соли трифторуксусной кислоты (R)-4-(3-амино-4-(2,4,5-трифторфенил) бутаноил)-7,8-дифтор-4,5-дигидро-1H-бензо[е][1,4]диазепин-2(3 Н)-она (0,63 г, 90%) как белого твердого вещества. 1 Н ЯМР (400 MHz, CDCl3):2,65-2,88 (m, 2H), 2,97-3,08 (m, 2H), 3,81-3,92 (m, 1H), 4,22 (s, 1H),4,45-4,64 (m, 3H), 7,01-7,33 (m, 4H). ESIMS (масса/заряд): 415,6 (M+l). Пример 3. Получение соли трифторуксусной кислоты 4-[(R)-3-амино-4-(2,4,5-трифторфенил)бутирил]-1-метил-1,3,4,5-тетрагидро-бензо[е][1,4]диазепин-2-она Этап 1. Получение 1-метил-2-оксо-1,2,3,5-тетрагидробензо[е][1,4]диазепин-4-карбоновой кислоты трет-бутилового эфира. Натрия гидрид (18 мг, 0,45 ммоль, 60% суспензия в минеральном масле) промыли с гексаном (22 мл) в высушенной пламенем круглодонной колбе в атмосфере азота. К образовавшемуся свободно плавающему порошку добавили раствор 2-оксо-1,2,3,5-тетрагидро-бензо[е][1,4]диазепин-4-карбоновой кислоты трет-бутилового эфира (80 мг, 0,30 ммоль) в сухом DMF (3 мл) при 0 С. Реакционную смесь взбалтывали при этой температуре в течение 1 ч. Йодметан (0,019 мл, 0,30 ммоль) добавили при 0 С и реакционной смеси позволили достичь к. т. и взбалтывали на протяжении ночи. После завершения реакции, как подтвердили с помощью TLC, реакционную смесь охладили до 0 С и насыщенный раствор аммония хлорида (2 мл) добавили по каплям к реакционной смеси. Неочищенный продукт экстрагировали этилацетатом (210 мл). Комбинированные органические слои высушили над Na2SO4 и растворители удалили в вакууме для получения 1-метил-2-оксо-1,2,3,5-тетрагидробензо[е][1,4]диазепин-4-карбоновой кислоты трет-бутилового эфира (75 мг, 89%) как вязкого масла, которое использовали без какой-либо последующей очистки для следующего этапа. ESMS (масса/заряд): 278,3 (М+2), 277,3 (М+1). Этап 2. Получение соли трифторуксусной кислоты 1-метил-1,3,4,5-тетрагидробензо [е][1,4]диазепин-2-она. К раствору 1-метил-2-оксо-1,2,3,5-тетрагидробензо[е][1,4]диазепин-4-карбоновой кислоты третбутилового эфира (70 мг, 0,25 ммоль) в сухом DCM (10 мл) добавили трифторуксусную кислоту (0,75 мл,3 мл/ммоль). Смесь взбалтывали при к. т. в течение 1 ч. После завершения реакции, как подтвердили с помощью TLC, избыток TFA и DCM выпарили в вакууме для получения соли трифторуксусной кислоты 1-метил-1,3,4,5-тетрагидробензо[е][1,4]диазепин-2-она (70 мг, 95%) как вязкого твердого вещества, которое использовали, как таковое, для следующего соединения. Этап 3. Получение 2-[3-(1-метил-2-оксо-1,2,3,5-тетрагидробензо[е][1,4]диазепин-4-ил)-3-оксо-(R)-1(2,4,5-трифторбензил)пропил]карбаминовой кислоты трет-бутилового эфира. К раствору (R)-3-[(трет-бутоксикарбонил)амино]-4-(2,4,5-трифторфенил)бутановой кислоты (80 мг,0,24 ммоль) в сухом DCM (10 мл) добавили НОВТ (42 мг, 0,31 ммоль), EDC (59 мг, 0,31 ммоль) и DIPEA(0,20 мл, 1,2 ммоль). Реакционную смесь взбалтывали при к. т. в течение 10 мин. Добавили раствор 1- 29
МПК / Метки
МПК: C07D 243/14, A61K 31/551, C07D 487/04, C07D 403/06, A61P 3/10, C07D 413/12
Метки: новые, соединения, гетероциклические
Код ссылки
<a href="https://eas.patents.su/30-18612-novye-geterociklicheskie-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Новые гетероциклические соединения</a>