Производные замещенных индазолов, активные в качестве ингибиторов киназ
Номер патента: 17852
Опубликовано: 29.03.2013
Авторы: Получчи Паоло, Ломбарди Борджиа Андреа, Перроне Этторе, Босси Роберто, Нези Марчелла, Бандьера Тициано
Формула / Реферат
1. Соединение формулы (I)
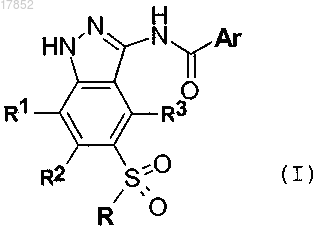
где Ar представляет собой фенил или 5-6-членный гетероарил, содержащий 1-2 атома азота, необязательно замещенный одним или несколькими заместителями, независимо выбранными из галогена, нитро, NHCOR4, COR4, NR5R6, NR5COR4, OR7, R8R9N-C1-C6-алкила, R8O-C1-C6-алкила, и 5-7-членный гетероциклил, включающий 1-2 атома азота, необязательно замещенного одним или более заместителями, независимо выбранными из неразветвленного или разветвленного C1-C6-алкила, 5-членного гетероциклила, включающего 1 атом азота, и NR5R6,
R4 представляет собой NR5R6, неразветвленный или разветвленный C1-C6-алкил, замещенный галогеном, 5-членный гетероарил, включающий 1 атом азота, или 5-6-членный гетероциклил, включающий 1 гетероатом, выбранный из азота и кислорода, необязательно замещенный одним или более заместителями, независимо выбранными из 5-членного гетероциклила, включающего 1 атом азота, и неразветвленного или разветвленного C1-C6-алкила, в свою очередь необязательно замещенного 5-членным гетероциклилом, включающим 1 атом азота;
R5 и R6 независимо представляют собой водород, R8R9N-C2-C6-алкил, R8O-C2-C6-алкил, неразветвленный или разветвленный C1-C6-алкил, необязательно замещенный одним или более заместителями, независимо выбранными из C1-C6-алкокси, 6-членного гетероциклила, включающего 1-2 гетероатома, выбранного из азота и кислорода, и NR5R6; или 5-6-членный гетероциклил, включающий 1 гетероатом, выбранный из азота и кислорода, необязательно замещенный одним или более неразветвленными или разветвленными C1-C6-алкилами;
R5 и R6, взятые вместе с атомом азота, с которым они связаны, могут образовывать 5-7-членную гетероциклическую группу, включающую 1-2 атома азота, необязательно замещенного одним или более заместителями независимо выбранными из NR5R6, 5-членного гетероциклила, включающего 1 атом азота, и неразветвленного или разветвленного C1-C6-алкила, в свою очередь необязательно замещенного 5-членным гетероциклилом, включающим 1 атом азота;
R7 представляет собой R8R9N-C2-C6-алкил или 6-членный гетероциклил, включающий 1 атом азота, необязательно замещенный одним или более неразветвленным или разветвленным C1-C6-алкилом;
R8 и R9 независимо представляют собой необязательно неразветвленный или разветвленный C1-C6-алкил или
R8 и R9, взятые вместе с атомом азота, с которым они связаны, могут образовывать 5-6-членную гетероциклическую группу, включающую 1 гетероатом, выбранный из азота и кислорода, необязательно замещенную одним или более неразветвленным или разветвленным C1-C6-алкилом;
R представляет собой фенил, необязательно замещенный одним или более заместителями, независимо выбранными из галогена и C1-C6-алкокси;
R1, R2 и R3 представляют собой водород,
и его фармацевтически приемлемая соль.
2. Соединение формулы (I) по п.1, где Ar представляет собой группу формулы
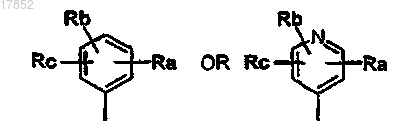
в которой Ra, Rb и Rc независимо представляют собой водород, галоген, нитро, NHCOR4, COR4, NR5R6, NR5COR4, OR7, R8R9N-C1-C6-алкил или 5-7-членный гетероциклил, включающий 1-2 атома азота, необязательно замещенный одним или более заместителями, независимо выбранными из неразветвленного или разветвленного C1-C6-алкила, 5-членного гетероциклила, включающего один атом азота, или NR5R6, где R4, R5, R6, R7, R8, R9 имеют значения, указанные выше.
3. Соединение формулы (I), указываемой в п.1 или 2, где Ar представляет собой группу формулы

в которой Ra представляет собой водород, галоген, нитро, NHCOR4 или NR5R6 и Rb представляет собой водород, нитро, NR5R6, OR7 или R8R9N-C1-C6-алкил, где R4, R5, R6, R7, R8 и R9 имеют значения, указанные выше.
4. Соединение или его фармацевтически приемлемая соль, которое выбрано из группы, включающей
N-(5-бензолсульфонил-1H-индазол-3-ил)-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)бензамид;
2-амино-N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)бензамид;
N-(5-бензолсульфонил-1H-индазол-3-ил)-4-(4-метилпиперазин-1-ил)-2-(тетрагидропиран-4-иламино)бензамид;
N-[5-(3-фторбензолсульфонил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)-2-(тетрагидропиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)-2-(тетрагидропиран-4-иламино)бензамид;
[2-(5-бензолсульфонил-1H-индазол-3-илкарбамоил)-5-(4-метилпиперазин-1-ил)фенил]амид 1H-пиррол-2-карбоновой кислоты;
[2-[5-(3-фторбензолсульфонил)-1H-индазол-3-илкарбамоил]-5-(4-метилпиперазин-1-ил)фенил]амид 1H-пиррол-2-карбоновой кислоты;
[2-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-илкарбамоил]-5-(4-метилпиперазин-1-ил)фенил]амид 1H-пиррол-2-карбоновой кислоты;
[2-(5-бензолсульфонил-1H-индазол-3-илкарбамоил)-5-(4-метилпиперазин-1-ил)фенил]амид (S)-тетрагидрофуран-2-карбоновой кислоты;
[2-(5-бензолсульфонил-1H-индазол-3-илкарбамоил)-5-(4-метилпиперазин-1-ил)фенил]амид 1H-пиррол-3-карбоновой кислоты;
[2-[5-(3-фторбензолсульфонил)-1H-индазол-3-илкарбамоил]-5-(4-метилпиперазин-1-ил)фенил]амид 1H-пиррол-3-карбоновой кислоты;
[2-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-илкарбамоил]-5-(4-метилпиперазин-1-ил)фенил]амид 1H-пиррол-3-карбоновой кислоты;
[2-(5-бензолсульфонил-1H-индазол-3-илкарбамоил)-5-(4-метилпиперазин-1-ил)фенил]амид 1-метил-1H-пиррол-2-карбоновой кислоты;
[2-[5-(3-фторбензолсульфонил)-1H-индазол-3-илкарбамоил]-5-(4-метилпиперазин-1-ил)фенил]амид 1-метил-1H-пиррол-2-карбоновой кислоты;
[2-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-илкарбамоил]-5-(4-метилпиперазин-1-ил)фенил]амид 1-метил-1H-пиррол-2-карбоновой кислоты;
N-[5-(3-фтор-5-метоксибензолсульфонил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)-2-(тетрагидропиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-4-(4-этил[1,4]диазепан-1-ил)-2-(тетрагидропиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-4-(2-диметиламиноэтокси)-2-(тетрагидропиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-4-(2-пирролидин-1-илэтокси)-2-(тетрагидропиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-4-(1-метилпиперидин-4-илокси)-2-(тетрагидропиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-4-диметиламинометил-2-(тетрагидропиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-4-пирролидин-1-илметил-2-(тетрагидропиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-4-пиперидин-1-илметил-2-(тетрагидропиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-4-(1-метилпиперидин-4-иламино)-2-(тетрагидропиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-4-(2-диметиламино-1-метилэтиламино)-2-(тетрагидропиран-4-иламино)бензамид;
4-(2-диэтиламино-1-метилэтиламино)-N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-2-(тетрагидропиран-4-иламино)бензамид;
4-[(2-диметиламиноэтил)метиламино]-N-[5-(3-фторбензолсульфонил)-1H-индазол-3-ил]-2-(тетрагидропиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-4-[(2-диметиламиноэтил)метиламино]-2-(тетрагидропиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-4-{[2-(изопропилметиламино)этил]метиламино}-2-(тетрагидропиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-4-[метил-(2-пиперидин-1-илэтил)амино]-2-(тетрагидропиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-4-[метил-(2-морфолин-4-илэтил)амино]-2-(тетрагидропиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-4-[(2-диметиламиноэтил)этиламино]-2-(тетрагидропиран-4-иламино)бензамид;
4-[(3-диметиламинопропил)метиламино]-N-[5-(3-фторбензолсульфонил)-1H-индазол-3-ил]-2-(тетрагидропиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-4-[(3-диметиламинопропил)метиламино]-2-(тетрагидропиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-4-(4-диметиламинопиперидин-1-ил)-2-(тетрагидропиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-4-(4-пирролидин-1-илпиперидин-1-ил)-2-(тетрагидропиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-4-[метил-(1-метилпирролидин-3-ил)амино]-2-(тетрагидропиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-2-(2-метоксиэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3-фторбензолсульфонил)-1H-индазол-3-ил]-2-(2-метоксиэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-4-[(2-диметиламиноэтил)метиламино]-2-(2-метоксиэтиламино)бензамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-4-[(3-диметиламинопропил)метиламино]-2-(2-метоксиэтиламино)бензамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-2-(2-метокси-1-метилэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3-фторбензолсульфонил)-1H-индазол-3-ил]-2-(2-метокси-1-метилэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-4-[(2-диметиламиноэтил)метиламино]-2-(2-метокси-1-метилэтиламино)бензамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-4-[(3-диметиламинопропил)метиламино]-2-(2-метокси-1-метилэтиламино)бензамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-4-диметиламинометил-2-(2-метокси-1-метилэтиламино)бензамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-2-((S)-2-метокси-1-метилэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3-фторбензолсульфонил)-1H-индазол-3-ил]-2-((S)-2-метокси-1-метилэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-2-((R)-2-метокси-1-метилэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3-фторбензолсульфонил)-1H-индазол-3-ил]-2-((R)-2-метокси-1-метилэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-2-(2-метокси-1-метоксиметилэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3-фторбензолсульфонил)-1H-индазол-3-ил]-2-(2-метокси-1-метоксиметилэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-4-[(2-диметиламиноэтил)метиламино]-2-(2-метокси-1-метоксиметилэтиламино)бензамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-4-[(3-диметиламинопропил)метиламино]-2-(2-метокси-1-метоксиметилэтиламино)бензамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-2-(2-метокси-1,1-диметилэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-2-((R)-1-метоксиметилпропиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-3-(тетрагидропиран-4-иламино)изоникотинамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-3-(2-метокси-1-метилэтиламино)изоникотинамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-6-(4-метилпиперазин-1-ил)-2-(тетрагидропиран-4-иламино)никотинамид;
N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-4-[(3-диметиламинопропил)метиламино]-2-изобутиламинобензамид.
5. Способ получения соединения формулы (I) по п.1, отличающийся тем, что способ включает:
g) гидролиз соединения формулы (X)
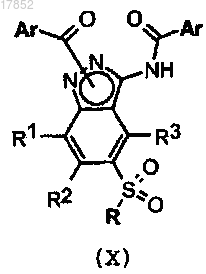
где Ar, R1, R2, R3 и R имеют значения, указанные в п.1, или
m) снятие защиты у соединения формулы (XVII)
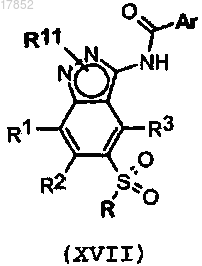
где R1, R2, R3, R и Ar имеют значения, указанные выше; и
R11 представляет собой бензил, 4-метоксибензил, 2,4-диметоксибензил или трифенилметил,
необязательное разделение образовавшегося соединения на индивидуальные изомеры;
превращение образовавшегося соединения формулы (I) в другое соединение формулы (I) и/или, при необходимости, в фармацевтически приемлемую соль.
6. Способ получения соединения формулы (I) по п.5, отличающийся тем, что превращение соединения формулы (XVII) в другое соединение формулы (XVII) проводят одной или несколькими из следующих реакций:
1) восстановление соединения формулы (XVII), где Ar представляет собой замещенный фенил или 5-6-членный гетероарил, содержащий 1-2 атома азота в качестве гетероатома, и один из заместителей представляет собой NO2, для получения соединения формулы (XVII), в которой такой заместитель представляет собой NH2;
2) ацилирование соединения формулы (XVII), где Ar представляет собой замещенный фенил или 5-6-членный гетероарил, содержащий 1-2 атома азота в качестве гетероатома, и один из заместителей представляет собой NH2, реакцией с ацилирующим агентом формулы (XXIII)
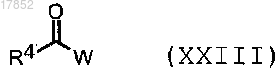
где R4 имеет значения, указанные в п.1; и
W представляет собой гидрокси, галоген или подходящую уходящую группу,
для получения соединения формулы (XVII), где такой заместитель представляет собой остаток NHCOR4, где R4 имеет значения, указанные выше;
3) реакция соединения формулы (XVII), где Ar представляет собой замещенный фенил или 5-6-членный гетероарил, содержащий 1-2 атома азота в качестве гетероатома, и один из заместителей представляет собой NH2, с подходящим альдегидом или кетоном в присутствии восстанавливающего агента для получения соединения формулы (XVII), где такой заместитель представляет собой группу NR5R6, где один из R5 или R6 представляет собой водород и другой представляет собой неразветвленный или разветвленный C1-C6-алкил, необязательно замещенный одним или более заместителями, независимо выбранными из C1-C6-алкокси, 6-членного гетероциклила, содержащего 1-2 гетероатома, выбранных из азота и кислорода, и NR5R6; или 5-6-членный гетероциклил, содержащий 1 гетероатом, выбранный из азота и кислорода, необязательно замещенный одним или более неразветвленным или разветвленным C1-C6-алкилом; R8R9N-C2-C6-алкил; R8O-C2-C6-алкил, где R8 и R9 определены в п.1;
4) гидролиз соединения формулы (XVII), где Ar представляет собой замещенный фенил или 5-6-членный гетероарил, содержащий 1-2 атома азота в качестве гетероатома, и один из заместителей представляет собой COR4, где R4 представляет собой, OR7, R7 представляет собой метил или этил, для получения соединения формулы (XVII), где такой заместитель COR4 представляет собой COOH;
5) амидирование соединения формулы (XVII), где Ar представляет собой замещенный фенил или 5-6-членный гетероарил, содержащий 1-2 атома азота в качестве гетероатома, и один из заместителей представляет собой COR4, где R4 представляет собой OR7, R7 представляет собой водород, с амином формулы NHR5R6, где R5 и R6 имеют значения, указанные выше, для получения соединения формулы (XVII), где такой заместитель представляет собой CONR5R6, где R5 и R6 имеют значения, указанные выше.
7. Способ получения соединения формулы (I) по п.5, отличающийся тем, что необязательное превращение соединения формулы (I) в другое соединение формулы (I) проводят одной или несколькими из следующих реакций:
6) восстановление соединения формулы (I), где Ar представляет собой замещенный фенил или 5-6-членный гетероарил, содержащий 1-2 атома азота в качестве гетероатома, и один из заместителей представляет собой NO2, для получения соединения формулы (I), где такой заместитель представляет собой NH2;
7) ацилирование соединения формулы (I), где Ar представляет собой замещенный фенил или 5-6-членный гетероарил, содержащий 1-2 атома азота в качестве гетероатома, и один из заместителей представляет собой NH2, реакцией с избытком соединения формулы (XXIII)
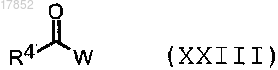
где R4 имеет значения, указанные в п.1; и
W представляет собой гидрокси, галоген или подходящую уходящую группу,
с последующим селективным удалением защитной ацильной группы на кольце пиразола для получения соединения формулы (I), где такой заместитель представляет собой остаток NHCOR4, где R4 имеет значения, указанные выше;
8) реакция соединения формулы (I), где Ar представляет собой замещенный фенил или 5-6-членный гетероарил, содержащий 1-2 атома азота в качестве гетероатома, и один из заместителей представляет собой NH2, с подходящим альдегидом или кетоном в присутствии восстанавливающего агента для получения соединения формулы (I), где такой заместитель представляет собой группу NR5R6, где один из R5 или R6 имеет значения, как указано в превращении 3).
8. Способ лечения заболевания, вызванного нарушенной активностью протеинкиназы и/или связанного с такой нарушенной активностью, который включает введение млекопитающему, нуждающемуся в этом, эффективного количества соединения формулы (I) по п.1.
9. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли по п.1 и по меньшей мере один фармацевтически приемлемый эксципиент, носитель и/или разбавитель.
10. Набор, содержащий соединение формулы (I) или его фармацевтически приемлемую соль по п.1 и один или несколько химиотерапевтических агентов, в качестве комбинированного препарата для одновременного, раздельного или последовательного применения при противораковой терапии.
11. Применение соединения формулы (I) или его фармацевтически приемлемой соли по п.1 в качестве лекарственного средства.
12. Применение соединения формулы (I) или его фармацевтически приемлемой соли по п.1 при изготовлении лекарственного средства с противораковой активностью.
Текст
Приведены описания производных замещенных индазолов формулы (I) и их фармацевтически приемлемых солей, указанных в описании, способ их получения и содержащие их фармацевтические композиции; соединения изобретения могут быть применимыми в терапии при лечении заболеваний, связанных с нарушенной активностью протеинкиназ, подобных раку.(71)(73) Заявитель и патентовладелец: НЕРВИАНО МЕДИКАЛ САЙЕНСИЗ С.Р.Л. (IT) Настоящее изобретение относится к некоторым производным замещенных индазолов, которые модулируют активность протеинкиназ. Поэтому соединения данного изобретения являются применимыми при лечении заболеваний, вызванных нарушенной активностью протеинкиназы. Настоящее изобретение относится также к способам получения этих соединений, фармацевтическим композициям, содержащим эти соединения, и способам лечения заболеваний с применением фармацевтических композиций, содержащих эти соединения. Нарушение функции протеинкиназ (PK) является отличительным признаком многочисленных заболеваний. Большая часть онкогенов и фотоонкогенов, принимающих участие в раковых заболеваниях человека, кодирует PK. Повышенные активности PK также участвуют во многих незлокачественных заболеваниях, таких как доброкачественная гиперплазия простаты, наследственный аденоматоз, полипоз,нейрофиброматоз, псориаз, пролиферация васкулярных гладкомышечных клеток, связанная с атеросклерозом, легочный фиброз, артрит, гломерулонефрит и послехирургический стеноз и рестеноз.PK принимают также участие в воспалительных состояниях и в размножении вирусов и паразитов.PK могут также играть основную роль в патогенезе и развитии нейродегенеративных нарушений. Для общей ссылки на нарушение функции или нарушенную активностью PK см., например, CurrentOpinion in Chemical Biology. 1999, 3, 459-465. Рецептор фактора роста, подобного инсулину (IGF-1R, IGF1R), является членом подсемейства рецепторов инсулина рецепторных тирозинкиназ (RTK). Существует несколько линий доказательства, подтверждающего, что передача сигнала IGF-1R может содействовать онкогенезу и что препятствие функции IGF-1R представляет собой обоснованный терапевтический способ при раковом заболевании. В отношении обзора передачи сигнала, физиологической функции IGF и IGF-1R и подробного описания доказательства, подтверждающего участие этой системы в раковых болезнях человека, которые суммированы выше, а также в других патологиях, читатель отсылается ко многим обзорам по данной теме и содержащимся в них ссылкам, например, Baserga R.Endocrinol. Metab., vol. 89, p. 1031-1044, 2004; Hofmann F. et al., Drug Discov Today, vol. 10, p. 1041-7,2005. Киназа анапластической лимфомы (ALK) является рецептором тирозинкиназы, относящимся к подсемейству рецепторов инсулина RTK: ген ALK расположен на хромосоме 2 и экспрессируется в основном в нейронных клетках, особенно во время развития. Ген ALK принимает участие в сбалансированной хромосомальной транслокации с геном нуклеофосмина (NPM) на хромосоме 5 в большой субпопуляции анапластических крупноклеточных лимфом (ALCL). В ALK+ ALCL в результате транслокации убиквитарный промотор NPM регулирует эктопическую экспрессию слитого белка, в которой часть NPM димеризуется и домен киназы ALK подвергается аутофосфорилированию и становится конституитивно активным. Многие данные из литературы демонстрировали, что слитый белок NPM-ALK обладает сильным онкогенным потенциалом и его эктопическая экспрессия является причиной клеточной трансформации. Кроме того, конституитивная экспрессия NPM-ALK человека в мышиных T-клеточных лимфоцитах является достаточной для развития лимфоидной неоплазии в трансгенных животных с коротким периодом латентности.ALCL является установленным заболеванием, характеризующимся поверхностной экспрессией антигена CD30 (Ki-1), и является причиной неходжкинских лимфом у 2% взрослых пациентов и 13% детей,поражая преимущественно молодых пациентов мужского пола. ALK+ ALCL составляют 70% всех ALCL и является агрессивным заболеванием с системными симптомами и частым экстралимфатическим поражением (костного мозга, кожи, кости, мягких тканей). Обнаружено, что приблизительно 15-20% ALK-экспрессирующих ALCL имеют различные хромосомальные транслокации, включающие цитоплазматическую часть ALK с разными N-концевыми частями, приводящими к конституитивной активации домена ALK-киназы. Кроме того, установлено, что клеточные линии, происходящие из солидных опухолей эктодермального происхождения, подобных меланомам, раку молочной железы, а также нейробластом, глиобластом,сарком Юинга, ретинобластом, экспрессируют рецептор ALK. В заключение, препятствие передачи сигнала ALK, вероятно, представляет собой специфический и эффективный путь блокирования пролиферации опухолевых клеток при ALCL и возможных других показаниях. Сущность изобретения Некоторые производные индазола, применимые для терапии различных заболеваний, таких как рак,нейродегенеративные, сердечно-сосудистые, метаболические заболевания и заболевания центральной нервной системы, описаны в WO 2007075847 на имя Takeda Pharmaceutical, в WO 2006003276,WO 2004062662, WO 2004022544 и WO 2003078403, все на имя Aventis, в WO 2006080450 на имя KyowaHakko Kogyo и в WO 2006003276 на имя University of Connecticut. Несмотря на эти разработки, все же существует потребность в эффективных агентах для указанных заболеваний. Авторы настоящего изобретения теперь обнаружили, что соединения формулы (I), описанные ниже, являются ингибиторами киназы и поэтому являются применимыми в терапии в качестве противораковых агентов. Согласно этому первой задачей настоящего изобретения является предоставление производного замещенного индазола, представленного формулой (I) где Ar представляет собой фенил или 5-6-членный гетероарил, содержащий 1-2 атома азота, необязательно замещенный одним или несколькими заместителями, независимо выбранными из галогена,нитро, NHCOR4, COR4, NR5R6, NR5COR4, OR7, R8R9N-C1-C6-алкила, R8O-C1-C6-алкила, и 5-7-членный гетероциклил, включающий 1-2 атома азота, необязательно замещенного одним или более заместителями, независимо выбранными из неразветвленного или разветвленного C1-C6-алкила, 5-членного гетероциклила, включающего 1 атом азота, и NR5R6;R4 представляет собой NR5R6, неразветвленный или разветвленный C1-C6-алкил, замещенный галогеном, 5-членный гетероарил, включающий 1 атом азота, или 5-6-членный гетероциклил, включающий 1 гетероатом, выбранный из азота и кислорода, необязательно замещенный одним или более заместителями, независимо выбранными из 5-членного гетероциклила, включающего 1 атом азота, и неразветвленного или разветвленного C1-C6-алкила, в свою очередь необязательно замещенного 5-членным гетероциклилом, включающим 1 атом азота;R5 и R6 независимо представляют собой водород, R8R9N-C2-C6-алкил, R8O-C2-C6-алкил, неразветвленный или разветвленный C1-C6-алкил, необязательно замещенный одним или более заместителями,независимо выбранными из C1-C6-алкокси, 6-членного гетероциклила, включающего 1-2 гетероатома,выбранного из азота и кислорода, и NR5R6; или 5-6-членный гетероциклил, включающий 1 гетероатом,выбранный из азота и кислорода, необязательно замещенный одним или более неразветвленными или разветвленными C1-C6-алкилами;R5 и R6, взятые вместе с атомом азота, с которым они связаны, могут образовывать 5-7-членную гетероциклическую группу, включающую 1-2 атома азота, необязательно замещенного одним или более заместителями, независимо выбранными из NR5R6, 5-членного гетероциклила, включающего 1 атом азота, и неразветвленного или разветвленного C1-C6-алкила, в свою очередь необязательно замещенного 5 членным гетероциклилом, включающим 1 атом азота;R7 представляет собой R8R9N-C2-C6-алкил или 6-членный гетероциклил, включающий 1 атом азота,необязательно замещенный одним или более неразветвленным или разветвленным C1-C6-алкилом;R8 и R9 независимо представляют собой необязательно неразветвленный или разветвленныйR8 и R9, взятые вместе с атомом азота, с которым они связаны, могут образовывать 5-6-членную гетероциклическую группу, включающую 1 гетероатом, выбранный из азота и кислорода, необязательно замещенную одним или более неразветвленным или разветвленным C1-C6-алкилом;R представляет собой фенил, необязательно замещенный одним или более заместителями, независимо выбранными из галогена и C1-C6-алкокси;R1, R2 и R3 представляют собой водород; и его фармацевтически приемлемой соли. Настоящее изобретение относится также к способам синтеза производных замещенных индазолов формулы (I), полученных посредством способа, состоящего из стандартных синтетических превращений. Настоящее изобретение относится также к способу лечения заболеваний, вызванных нарушением активности и/или связанных с таким нарушением активности протеинкиназы, особенно активности, относящейся к семейству PLK протеинкиназы C в разных изоформах, Met, PAK-4, PAK-5, ZC-1, STLK-2,DDR-2, Aurora 1, Aurora 2, Bub-1, Chk1, Chk2, HER2, raf1, MEK1, MAPK, EGF-R, PDGF-R, FGF-R, IGF-R,ALK, PI3K, weel киназа, Src, Abl, Akt, MAPK, ILK, MK-2, IKK-2, Cdc7, Nek, семействоCdk/циклинкиназа, более конкретно Aurora 2, IGF-1R и ALK, и далее более конкретно активности IGF1R, который включает введение млекопитающему, нуждающемуся в этом, эффективного количества замещенного производного соединения, представленного формулой (I), определяемой выше. Предпочтительным способом настоящего изобретения является лечение заболевания, вызванного нарушением активности и/или связанного с таким нарушением активности протеинкиназы, в частности рака. Кроме того, способ настоящего изобретения предусматривает также ингибирование ангиогенеза и метастаза опухоли. Настоящее изобретение относится также к фармацевтической композиции, содержащей одно или несколько соединений формулы (I) или их фармацевтически приемлемых солей и фармацевтически приемлемый эксципиент, носитель или разбавитель. Настоящее изобретение относится также к набору, содержащему соединение формулы (I) в комбинации с одним или несколькими химиотерапевтическими агентами или радиотерапией. Такие агенты могут включать, но не ограничиваются перечисленным, антигормональные агенты, такие как антиэстрогены, антиандрогены и ингибиторы ароматазы, ингибиторы топоизомеразы I, ингибиторы топоизомеразы II, агенты, которые поражают микротрубочки, агенты на основе платины, алкилирующие агенты,ДНК-повреждающие или интеркалирующие агенты, противоопухолевые антиметаболиты, другие ингибиторы киназ, другие антиангиогенные агенты, ингибиторы кинезинов и др. Подробное описание изобретения Соединения формулы (I) могут иметь один или несколько асимметричных центров и поэтому могут существовать в виде индивидуальных оптических изомеров или рацемических смесей. Соответственно этому, все возможные изомеры и их смеси соединений формулы (I) находятся в объеме настоящего изобретения. Помимо вышеуказанного, как известно специалисту в данной области, кольцо пиразола соединений формулы (I) в растворе быстро переходит в состояние равновесия с образованием смеси таутомеров, как показано ниже: где Ar, R, R1, R2 и R3 имеют значения, указанные выше. Соответственно этому, в настоящем изобретении, когда для соединений формулы (I) указывается только один таутомер, другой таутомер (Ia) также находится в объеме настоящего изобретения, если, в частности, не указывается иначе. Общие термины, применяемые в описании, если не оговорено особо, имеют значения, указанные ниже. Термин "неразветвленный или разветвленный C1-C6-алкил" относится к насыщенному алифатическому углеводородному радикалу, включающему группы с неразветвленной или разветвленной цепью с 1-6 атомами углерода, например метил, этил, пропил, 2-пропил, н-бутил, изобутил, трет-бутил, пентил и т.п. Алкильная группа может быть замещенной или незамещенной. Когда она замещена, предпочтительно имеется одна-три группы-заместителя, независимо выбранных из группы, состоящей из галогена, алкенила, алкинила, циано, нитро, NHCOR4, COR4, NR5R6, NR5COR4, OR7, SR7, SOR10, SO2R10, NHSOR10,NHSO2R10, R8R9N-C1-C6-алкила, R8O-C1-C6-алкила, необязательно дополнительно замещенногоC3-C6-циклоалкила, гетероциклила и арила, где R4, R5, R6, R7, R8, R9 и R10 имеют значения, указанные выше. Термин "гетероциклил" относится к 5-7-членному, насыщенному или частично ненасыщенному карбоциклическому кольцу, в котором один или несколько атомов углерода заменены гетероатомами,такими как атомы азота и кислорода. Неограничивающими примерами гетероциклическых групп являются, например, оксиранил, азиридинил, оксетанил, азетидинил, тетрагидрофуранил, дигидрофуранил,пирролидинил, дигидропирролил, пиранил, дигидропиранил, тетрагидропиранил, тетрагидротиопиранил,пиперидинил, пиразолинил, изоксазолидинил, изоксазолинил, диоксанил, пиперазинил, морфолинил,гексаметилениминил, гомопиперазинил и т.п. Гетероциклическая группа может быть замещенной или незамещенной. Когда она замещена, группами-заместителями предпочтительно являются один или два заместителя, независимо выбранные из группы, состоящей из галогена, алкенила, алкинила, циано, нитро, NHCOR4, COR4, NR5R6, NR5COR4, OR7, SR7, SOR10, SO2R10, NHSOR10, NHSO2R10, R8R9N-C1-C6 алкила, R8O-C1-C6-алкила, необязательно дополнительно замещенного неразветвленного или разветвленного C1-C6-алкила, C3-C6-циклоалкила, гетероциклила и арила, где R4, R5, R6, R7, R8, R9 и R10 имеют значения, указанные выше. Термин "арил" относится к фенилу или 5-6-членному гетероарилу. Неограничивающими примерами таких арильных групп являются, например, 2,3-дигидроиндолил, 2,3-дигидробензофуранил,2,3-дигидробензотиофенил, бензопиранил, 2,3-дигидробензоксазинил, 2,3-дигидрохиноксалинил и т.п. Арильная группа может быть необязательно замещена одним или несколькими, предпочтительно одним, двумя или тремя заместителями, независимо выбранными из галогена, алкенила, алкинила, циа-3 017852 но, нитро, NHCOR4, COR4, NR5R6, NR5COR4, OR7, SR7, SOR10, SO2R10, NHSOR10, NHSO2R10,R8R9N-C1-C6-алкила, R8O-C1-C6-алкила, необязательно дополнительно замещенного неразветвленного или разветвленного C1-C6-алкила, C3-C6-циклоалкила, гетероциклила и арила, где R4, R5, R6, R7, R8, R9 иR10 имеют значения, указанные выше. Термин "галоген" означает атом фтора, хлора, брома или йода. Термин "нитро" означает группу -NO2. Термин "фармацевтически приемлемая соль" соединений формулы (I) относится к тем солям, которые сохраняют биологическую эффективность и свойства "родительского" соединения. Такие соли включают кислотно-аддитивные соли с неорганическими кислотами, такими как хлористо-водородная, бромисто-водородная, азотная, фосфорная, серная, перхлорная кислоты и т.п., или с органическими кислотами,такими как уксусная, трифторуксусная, пропионовая, гликолевая, молочная, (D)- или (L)-яблочная, малеиновая, метансульфоновая, этансульфоновая, бензойная, п-толуолсульфоновая, салициловая, коричная,миндальная, винная, лимонная, янтарная, малоновая кислоты и т.п.; соли, образованные, когда кислотный протон, присутствующий в соединении формулы (I), либо заменен ионом металла, например, ионом щелочного металла, такого как натрий или калий, или ионом щелочно-земельного металла, такого как кальций или магний, либо координирован с органическим основанием, таким как этаноламин, диэтаноламин, триэтаноламин, трометамин, N-метилглюкамин и т.п. Предпочтительным классом соединений формулы (I) являются соединения, у которых R представляет собой необязательно замещенный фенил и R1, R2 и R3 представляют собой водород. Другим предпочтительным классом соединений формулы (I) являются соединения, у которых Ar представляет собой необязательно дополнительно замещенный фенил, пиридинил, пиримидинил или пиразинил. Особенно предпочтительным классом соединений формулы (I) являются соединения, у которых Ar представляет собой необязательно дополнительно замещенный фенил или пиридинил и R представляет собой необязательно дополнительно замещенный фенил. Более предпочтительным классом соединений формулы (I) являются соединения, у которых Ar представляет собой группу формулы где Ra, Rb и Rc независимо представляют собой водород, галоген, нитро, NHCOR4, COR4, NR5R6,NR COR4, OR7, R8R9N-C1-C6-алкил или 5-7-членный гетероциклил, включающий 1-2 атома азота, необязательно замещенный одним или более заместителями, независимо выбранными из неразветвленного или разветвленного C1-C6-алкила, 5-членного гетероциклила, включающего один атом азота; илиR представляет собой необязательно дополнительно замещенный фенил. Наиболее предпочтительным классом соединений формулы (I) являются соединения, у которых Ar представляет собой группу формулы 5R представляет собой необязательно дополнительно замещенный фенил. Конкретные соединения изобретения перечислены ниже:N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-4-[(3-диметиламинопропил)метиламино]-2 изобутиламинобензамид. Настоящее соединение относится также к способу получения соединения формулы (I), указываемой выше, отличающемуся тем, что включает:g) гидролиз соединения формулы (X)R11 представляет собой бензил, 4-метоксибензил, 2,4-диметоксибензил или трифенилметил,необязательное разделение образовавшегося соединения на индивидуальные изомеры; превращение образовавшегося соединения формулы (I) в другое соединение формулы (I) и/или, если нужно, в фармацевтически приемлемую соль. Настоящее соединение относится также к способу получения соединения формулы (I), где соединение формулы (XVII) можно превратить в другое соединение формулы (XVII), указанное превращение проводят одной или несколькими из следующих реакций: 1) восстановление соединения формулы (XVII), где Ar представляет собой замещенный арил и один из заместителей представляет собой NO2, для получения соединения формулы (XVII), в которой такой заместитель представляет собой NH2; 2) ацилирование соединения формулы (XVII), где Ar представляет собой замещенный арил и один из заместителей представляет собой NH2, реакцией с ацилирующим агентом формулы (XXIII) где R4 и W представляют собой гидрокси, галоген или подходящую уходящую группу, для получения соединения формулы (XVII), где такой заместитель представляет собой остаток NHCOR4, где R4 имеет значения, указанные выше; 3) реакция соединения формулы (XVII), где Ar представляет собой замещенный арил и один из заместителей представляет собой NH2, с подходящим альдегидом или кетоном в присутствии восстанавливающего агента для получения соединения формулы (XVII), где такой заместитель представляет собой группу NR5R6, где один из R5 или R6 представляет собой водород и другой представляет собой необязательно дополнительно замещенный неразветвленный или разветвленный C1-C6-алкил, C3-C6-циклоалкил,гетероциклил, R8R9N-C2-C6-алкил, R8O-C2-C6-алкил, где R8 и R9 имеют значения, указанные выше; 4) гидролиз соединения формулы (XVII), где Ar представляет собой замещенный арил и один из заместителей представляет собой COR4, где R4 представляет собой OR7, R7 представляет собой метил или этил, для получения соединения формулы (XVII), где такой заместитель COR4 представляет собойCOOH; 5) амидирование соединения формулы (XVII), где Ar представляет собой замещенный арил и один из заместителей представляет собой COR4, где R4 представляет собой OR7, R7 представляет собой водород, с амином формулы NHR5R6, где R5 и R6 имеют значения, указанные выше, для получения соединения формулы (XVII), где такой заместитель представляет собой CONR5R6, где R5 и R6 имеют значения,указанные выше. Как указано выше, соединение формулы (I) можно превратить в другое соединение формулы (I),такое превращение проводят одной или несколькими из следующих реакций: 6) восстановление соединения формулы (I), где Ar представляет собой замещенный фенил или 5-6-членный гетероарил, содержащий 1-2 атома азота в качестве гетероатома, и один из заместителей представляет собой NO2, для получения соединения формулы (I), где такой заместитель представляет собой NH2; 7) ацилирование соединения формулы (I), где Ar представляет собой замещенный фенил или 5-6-членный гетероарил, содержащий 1-2 атома азота в качестве гетероатома, и один из заместителей представляет собой NH2, реакцией с избытком соединения формулы (XXIII) где R4 имеет значения, указанные в п.1, и W представляет собой гидрокси, галоген или подходящую уходящую группу, с последующим селективным удалением защитной ацильной группы на кольце пиразола для получения соединения формулы (I), где такой заместитель представляет собой остаток NHCOR4,где R4 имеет значения, указанные выше; 8) реакция соединения формулы (I), где Ar представляет собой замещенный фенил или 5-6-членный гетероарил, содержащий 1-2 атома азота в качестве гетероатома, и один из заместителей представляет собой NH2, с подходящим альдегидом или кетоном в присутствии восстанавливающего агента для получения соединения формулы (I), где такой заместитель представляет собой группу NR5R6, где один из R5 или R6 имеет значения, как указано в превращении 3). Синтез соединения формулы (I) согласно описанным выше синтетическим способам можно проводить ступенчатым образом, в результате чего каждый промежуточный продукт выделяют и очищают стандартными способами очистки, подобными, например, колоночной хроматографии, перед проведением последующей реакции. В альтернативном случае, две или более стадий синтетической последовательности можно проводить так называемой методикой "одного реактора", как известно в данной области, в результате чего только соединение, являющееся результатом двух или более стадий, выделяют и очищают. Согласно стадии g) способа соединение формулы (X) превращают в соединение формулы (I) селективным отщеплением ацильного остатка у атома азота пиразола. В качестве примера данную реакцию можно проводить в основных условиях, например в присутствии гидроксида натрия, гидроксида калия,гидроксида лития или гидроксида бария или третичного амина, такого как триэтиламин, или гидразина, и в подходящем растворителе, таком как метанол, этанол, тетрагидрофуран, N,N-диметилформамид, вода и их смесь. Реакцию обычно проводят при температуре, варьирующейся от комнатной температуры до приблизительно 60C в течение времени, варьирующегося от приблизительно 30 мин до приблизительно 96 ч. Согласно превращению, описанному в 1), восстановление соединения формулы (XVII), где Ar представляет собой замещенный фенил или 5-6-членный гетероарил, содержащий 1-2 атома азота в качестве гетероатома, и один из заместителей представляет собой нитро, в соединение формулы (XVII), у которого такой заместитель представляет собой амино, можно проводить путем, аналогичным пути, указанным выше в c). Согласно превращению, описанному в 2), ацилирование соединения формулы (XVII), где Ar представляет собой замещенный фенил или 5-6-членный гетероарил, содержащий 1-2 атома азота в качестве гетероатома, и один из заместителей представляет собой амино, можно выполнить путем, аналогичным пути, указанному выше в f). Согласно превращению, описанному в 3), реакцию соединения формулы (XVII), где Ar представляет собой замещенный фенил или 5-6-членный гетероарил, содержащий 1-2 атома азота в качестве гетероатома и один из заместителей представляет собой амино, с альдегидом или кетоном можно проводить различными путями согласно общепринятым способам для проведения восстановительных алкилирований. Реакцию предпочтительно проводят в подходящем растворителе, таком как, например, метанол,N,N-диметилформамид, дихлорметан, тетрагидрофуран или их смесь, в присутствии подходящего восстанавливающего агента, такого как, например, боргидрид натрия, боргидрид тетраалкиламмония, цианоборгидрид натрия, триацетоксиборгидрид натрия, триацетоксиборгидрид тетраметиламмония, и в присутствии кислотного катализатора, такого как, например, уксусная кислота или трифторуксусная кислота, при температуре, варьирующейся от приблизительно 0C до температуры кипения с обратным холодильником, и в течение времени, варьирующегося от приблизительно 1 до приблизительно 96 ч. Согласно превращению, описанному в 4), гидролиз соединения формулы (XVII), где Ar представляет собой замещенный фенил или 5-6-членный гетероарил, содержащий 1-2 атома азота в качестве гетероатома, и один из заместителей представляет собой COR4, где R4 представляет собой OR7, R7 представляет собой метил или этил, можно проводить различными путями согласно общепринятым способам для гидролиза эфира карбоновой кислоты. Реакцию предпочтительно проводят в подходящем растворителе,таком как, например, вода, метанол, этанол или их смесь, в присутствии неорганического основания, такого как гидроксид натрия, лития или калия, при температуре, варьирующейся от приблизительно 0C до температуры кипения с обратным холодильником, в течение времени, варьирующегося от приблизительно 1 до приблизительно 96 ч. Согласно превращению, описанному в 5), амидирование соединения формулы (XVII), где Ar представляет собой замещенный фенил или 5-6-членный гетероарил, содержащий 1-2 атома азота в качестве гетероатома, и один из заместителей представляет собой COR4, где R4 представляет собой OR7, R7 представляет собой водород, с амином формулы NHR5R6, где R5 и R6 имеют значения, указанные выше, можно проводить различными путями согласно общепринятым способам для превращения карбоновых кислот в карбоксамиды. Данную реакцию предпочтительно проводят в подходящем растворителе, таком как, например, тетрагидрофуран, дихлорметан, толуол, 1,4-диоксан, N,N-диметилформамид, в присутствии агента сочетания, такого как, например, O-бензотриазол-1-ил-N,N,N',N'-тетраметилуронийтетрафторборат (TBTU) или карбодиимид, такого как, например, N,N'-дициклогексилкарбодиимид или гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC), необязательно в присутствии добавки, такой как 1-гидроксибензотриазол, при температуре, варьирующейся от приблизительно 0C до температуры кипения с обратным холодильником, и в течение времени, варьирующегося от приблизительно 1 до приблизительно 96 ч. Можно также добавить акцептор протона, такой как, например, триэтиламин, N,N-диизопропилэтиламин или пиридин. Согласно превращению, описанному в 6), восстановление соединения формулы (I), где Ar представляет собой замещенный фенил или 5-6-членный гетероарил, содержащий 1-2 атома азота в качестве гетероатома, и один из заместителей представляет собой нитро, в соединение формулы (I), где такой заместитель представляет собой амино, можно проводить путем, аналогичным пути, указанному выше в c). Согласно превращению, описанному в 7), соединение формулы (I) можно превратить в другое соединение формулы (I) путем, аналогичным пути, описанному выше в 2), с применением избытка производного карбоновой кислоты формулы (XXIII), где W имеет значения, указанные выше, с последующим селективным отщеплением ацильной группы на кольце пиразола согласно методике, описанной в g). Согласно превращению, описанному в 8), соединение формулы (I) можно превратить в другое соединение формулы (I) путем, аналогичным пути, описанному в 3). Снятие защиты у соединения формулы (XVII) или (I), где Ar представляет собой замещенный фенил или 5-6-членный гетероарил, содержащий 1-2 атома азота в качестве гетероатома, и один из замести-8 017852 телей представляет собой защищенную аминогруппу, можно проводить различными путями согласно общепринятым способам для удаления защиты у аминогрупп. В зависимости от аминозащитной группы данную реакцию можно проводить разными путями. В одном аспекте такую реакцию можно проводить обработкой неорганической кислотой, такой как хлористо-водородная, серная или перхлорная кислоты,или органической кислотой, такой как трифторуксусная или метансульфоновая кислота, в подходящем растворителе, таком как вода, метанол, этанол, 1,4-диоксан, тетрагидрофуран, диэтиловый эфир, диизопропиловый эфир, ацетонитрил, N,N-диметилформамид, дихлорметан или их смесь, при температуре,варьирующейся от -10 до 80C, и в течение периода времени, варьирующегося от 30 мин до 48 ч. В другом аспекте такую реакцию можно проводить обработкой неорганическим основанием, таким как гидроксид лития, или натрия, или калия или карбонат натрия, или калия, или цезия, или органическим основанием, таким как триэтиламин или N,N-диизопропилэтиламин, или безводным гидразином, или гидратом гидразина в подходящем растворителе, таком как вода, метанол, этанол, 1,4-диоксан, тетрагидрофуран,диэтиловый эфир, диизопропиловый эфир, ацетонитрил, N,N-диметилформамид, дихлорметан или их смесь, при температуре, варьирующейся от -10 до 80C, и в течение периода времени, варьирующегося от 30 мин до 72 ч. Еще в одном другом варианте такую реакцию можно проводить обработкой водородом или циклогексеном или циклогексадиеном и катализатором гидрирования, таким как палладий-наугле, или металлом, таким как цинк, и неорганической или органической кислотой, такой как хлористоводородная или уксусная кислота, в подходящем растворителе, таком как вода, метанол, этанол,1,4-диоксан, тетрагидрофуран или их смесь, при температуре, варьирующейся от -10 до 80C, и в течение периода времени, варьирующегося от 30 мин до 72 ч. Производные замещенных индолов можно получить с применением стандартных методик в органическом синтезе, как описано, например, в Smith, Michael - March's Advanced Organic Chemistry: reactions mechanisms and structure - 5th Edition, Michael B. Smith and Jerry March, John WileySons Inc., NewYork (NY), 2001. Специалисту в данной области известно, что для превращения химической функциональной группы в другую может потребоваться, чтобы один или несколько реакционноспособных центров в соединении, содержащем эту функциональную группу, были защищены, чтобы избежать нежелательных побочных реакций. Защиту таких реакционноспособных центров и последующее снятие защиты в конце синтетического превращения можно выполнить по стандартным методикам, описанным, например, в Green, Theodora W. and Wuts, Peter G.M. - Protective Groups in Organic Synthesis, Third Edition, JohnWileySons Inc., New York (NY), 1999. В случаях, когда соединение формулы (I) содержит один или несколько асимметричных центров,это соединение можно разделить на индивидуальные изомеры способами, известными специалисту в данной области. Такие способы содержат стандартные хроматографические способы, включающие хроматографию с применением хиральной неподвижной фазы, или кристаллизацию. Общие способы разделения соединений, содержащих один или несколько асимметричных центров, описаны, например, вInc., New York (NY), 1981. Соединение формулы (I) можно также превратить в фармацевтически приемлемую соль стандартными способами, которые известны специалисту в данной области. В альтернативном случае, соединение формулы (I), которое получают в виде соли, можно превратить в свободное основание или свободную кислоту согласно стандартным методикам, которые известны специалисту. Исходные соединения способа настоящего изобретения являются либо известными, либо их можно получить согласно известным способам. Например, соединения формулы (XXIII), например соединения, у которых W представляет собой атом галогена, например атом хлора, либо являются известными, либо их можно легко получить из соответствующих карбоновых кислот, которые либо являются известными, либо их можно получить обработкой согласно общепринятым синтетическим способам. Фармакология. Применяемые в описании короткие формы и аббревиатуры имеют следующие значения: Ки - Кюри; ДМСО - диметилсульфоксид; нМ - наномолярный. Анализы. Соединения настоящего изобретения испытывали в биохимическом анализе, а также анализе на клеточной основе, как описано ниже. Получение IGF-1R для применения в биохимическом анализе. Клонирование и экспрессия. кДНК человека применяли в качестве матрицы для полимеразной цепной реакции (ПЦР) предполагаемой цитоплазматической части IGF-1R (аминокислотные остатки 960-1367 белка-предшественника; см. NCBI Entrez Protein Accession Р 08069), который включает полный домен киназы. PCR проводили с применением последовательности прямого праймера 5'-CTCGGATCCAGAAAGAGAAATAACAGCAGGCTG-3'[SEQ ID NO: 1] и последовательности обратного праймера 5'CTCGGATCCTCAGCAGGTCGAAGACTGGGGCAGCGG-3' [SEQ ID NO: 2]. Для облегчения последующих стадий клонирования оба праймера содержат последовательность сайта эндонуклеазы рестрикции BamHI. Продукт этой ПЦР клонировали с сохранением рамки считывания с применением "липких" концов BamHI в вектор переноса для системы экспрессии бакуловируса,pVL1392 (Pharmingen), предварительно модифицированный инсерцией в сайт множественного клонирования pVL1392 последовательностей, кодирующих слитый белок глутатион-S-трансфераза (GST), сайт расщепления протеазы PreScission и кассеты частичной MCS, полученной из плазмиды pGex-6P (Amersham BioSciences). Вставку описанного выше продукта ПЦР IGF-1R в полученный из pGex-6P сайтBamHI модифицированного вектора pVL1392 приводят к открытой раме считывания, соответствующей белку pGEX-6P GST и пептиду PreScission, слитому с цитоплазматическим доменом IGF-1R человека. Для получения слитого белка клетки насекомого Sf21 (Invitrogen) котрансфицировали 2 мкг очищенной плазмиды и 1 мкг ДНК вируса (BaculoGoldTM Transfection Kit, Pharmingen), как описано в руководствеинструкции по бакуловирусам (Pharmingen). Первую амплификацию вируса проводят с применением 600 мкл котрансфицированного вируса на 6106 Sf21 в культуре монослоя в 12 мл среды (среда TNM-GHGrace's - Pharmingen). Спустя 3 дня среду собирают, центрифугируют и переносят в стерильную пробирку. Вторую амплификацию получают таким же способом с применением 2 мл на 3107 клетках, разводят в 40 мл среды. Для третьей амплификации вируса 1 мл супернатанта из второго цикла применяют для 3107 клеток, разведенных в 40 мл среды. Экспрессию белка проводят в клетках насекомого H5, инфицированных 14 мл вирус/1109 клеток насекомого (MOI=1,5), в течение 65 ч с встряхиванием при 27C. Клетки собирают центрифугированием при 1200g в течение 10 мин. Очистка белка. Клетки ресуспендировали в смеси физиологического раствора с фосфатным буфером (PBS), 20 мМ дитиотреита (DTT), 0,2% CHAPS, 20% глицерина, 1 мМ OVA, "полного" коктейля ингибитора протеазы(1 таблетка/50 мл буфера; Roche Diagnostics, Milan, Italy) и лизировали жидкостной экструзией гомогенизатором Gaulin (Niro Soavi, Italy). Лизат центрифугировали при 14000g в течение 45 мин и супернатант загружали в колонку, содержащую 10 мл глутатион-сефарозы (Amersham Biosciences). Колонку промывали сначала буфером PBS в количестве 5 объемов колонки, затем 100 мМ Трис с pH 8,0, 20% глицерином в количестве 5 объемов колонки и, наконец, элюировали 10 мМ глутатионом в 100 мМ Трис с pH 8,0, 20% глицерином. Собирали фракции по 10 мл и фракции, обогащенные белком, объединяли. Обычно выделяли 20 мг слитого белка из 1109 клеток с чистотой обычно 85%, оцененной SDS-PAGE с последующей окраской Coomassie. Очищенный белок хранили при -80C до его применения в биохимических анализах. Биохимический анализ ингибиторов активности киназы IGF-1R. Ингибирующую активность ингибиторов путативной киназы и эффективность выбранных соединений определяли с применением анализа транс-фосфорилирования. Специфический субстрат инкубировали с киназой в условиях подходящих буферов в присутствии АТФ, меченного 33 РАТФ (мечен гамма-фосфатом, Redivue Code Number AH9968,1000-3000 Ки/ммоль, Amersham Biosciences Piscataway, NJ, USA), оптимальных кофакторов и испытуемого соединения. В конце реакции фосфорилирования более чем 98% нерадиоактивного и радиоактивного АТФ были захвачены избытком ионообменной смолы Dowex. Смоле давали возможность осесть на дно реакционных лунок под действием силы тяжести. Супернатант, содержащий субстратный пептид, затем извлекали и переносили в счетную пластинку и радиоактивность (соответствующую фосфату, включенному в пептид) оценивали -подсчетом.i. Приготовление смолы Dowex. Взвешивали 500 г влажной смолы (SIGMA, обычно полученная смола DOWEX 18, 200-400 меш,2,5 кг) и разводили ее до 2 л в 150 мМ формиате натрия, pH 3,00. Смоле давали возможность осесть в течение нескольких часов и затем выгружали супернатант. Эту процедуру промывания повторяли три раза на протяжении двух дней. Наконец, смоле давали возможность осесть, супернатант выгружали и добавляли два объема (относительно объема смолы) буфера 150 мМ формиата натрия. Конечное значение pH было приблизительно 3,0. Промытую смолу выдерживали при 4C перед применением, смола была стабильной в течение более одной недели.ii. Буфер для киназы (KB). Буфер для киназы состоял из 50 мМ HEPES с pH 7,9, содержащей 3 мМ MgCl2, 1 мМ DTT, 3 мкМNa3VO4 и 0,2 мг/мл BSA. 3X KB является буфером такого же состава и с pH, как у KB, но с трехкратной концентрацией каждого компонента.iii. Предварительная активация фермента и получение смеси фермента 3X. Перед началом анализа ингибирования киназы IGF-1R предварительно фосфорилировали для линеаризации кинетик реакции. Для достижения этого требуемое общее количество фермента получали при концентрации фермента 360 нМ в KB, содержащем 100 мкМ АТФ, и этот препарат инкубировали в течение 30 мин при 28C. Смесь фермента 3X получали 20-кратным разведением данного предварительно активированного фермента в 3X KB.iv. Условия анализа. Анализ киназы проводили с конечной концентрацией фермента 6 нМ в присутствии 6 мкМ АТФ,1 нМ 33 РАТФ и 10 мкМ субстрата, биотинилированный у карбоксиконца пептид следующей последовательности: KKKSPGEYVNIEFGGGGGK-биотин. Пептид получали партиями с пептидной чистотой 95% от American Peptide Company, Inc. (Sunnyvale, CA, USA). Автоматизированный анализ Dowex. Реакции для испытания проводили в общем конечном объеме 21 мкл, состоящем из:a) 7 мкл/лунка смеси фермента 3X (18 нМ предварительно активированный фермент в буфере для киназы 3X),b) 7 мкл/лунка смеси 3X субстрат/АТФ (30 мкМ субстрат, 18 мкМ АТФ, 3 нМ 33 РАТФ в воде двойной перегонки (ddH2O),c) 7 мкл/лунка 3X испытуемых соединений, разведенных в смеси ddH2O-3% ДМСО. Разведение соединений и схема анализа описаны ниже.i. Разведение соединений. 10 мМ исходные растворы испытуемых соединений в 100% ДМСО распределяли в 96-луночные титрационные микропланшеты формата 128. Для изучения % ингибирования в планшетах для разведения получали 1 мМ, 100 и 10 мкМ растворы в 100% ДМСО, затем проводили разведение до требуемой конечной концентрации 3X (30, 3 и 0,3 мкМ) в ddH2O, 3% ДМСО. Для пипетирования соединений в планшеты для испытания применялиUSA). Для определения IC50 исходные растворы 30 мкМ соединения в 3% ДМСО получали из исходных растворов 1 мМ/100% ДМСО. Эти 30 мкМ исходные растворы применяли для проведения 9 дополнительных серийных разведений 1/3 в ddH2O, 3% ДМСО, так чтобы получить 10-точечную кривую разведения при конечной концентрации для анализа 3X. Серийное разведение проводили в 96-луночных планшетах с применением системы Biomek 2000 (Beckman Coulter). Получали кривые разведения 7 соединений/планшет, и каждый планшет включал также 10-точечную кривую разведения стауроспорина, а также несколько лунок отрицательного и положительного контроля.ii. Схема анализа. 7 мкл продукта разведения каждого испытуемого соединения (или контроля) в ddH2O, 3% ДМСО пипетировали в каждую лунку 384-луночного аналитического планшета с V-образным дном, который затем переносили в автоматизированное устройство PlateTrak 12 (Perkin Elmer, 45 William Street Wellesley, MA 02481-4078, USA), снабженное одной пипетирующей головкой с 384 наконечниками, для начала анализа плюс одной головкой с 96 наконечниками для диспенсирования смолы) и изготовленное с резервуарами, содержащими достаточное количество смеси фермента 3X и смеси АТФ (3X) для завершения проводимого анализа. В начале анализа система для манипулирования с жидкостью аспирирует 7 мкл смеси АТФ, вводит воздушный зазор внутрь наконечников (5 мкл) и затем аспирирует 7 мкл смеси фермента 3X. Для начала реакции содержимое наконечников диспенсировали в лунки для испытания, уже содержащие 7 мкл испытуемого соединения (при требуемой конечной концентрации 3X), с последующим проведением 3 циклов смешивания, так чтобы восстанавливать требуемую конечную концентрацию для всех компонентов реакции. Планшеты инкубировали в течение 60 мин при комнатной температуре и затем реакцию останавливали пипетированием 70 мкл суспензии смолы Dowex в реакционную смесь с последующим проведением 3 циклов смешивания. После остановки реакции планшетам давали возможность для нахождения в состоянии покоя в течение 1 ч для максимизации захвата АТФ. В этой точке 20 мкл супернатанта переносили из каждой лунки в лунки 384-Optiplate (Perkin Elmer), содержащие 70 мкл/лунку Microscint 40(Perkin Elmer); после 5 мин орбитального встряхивания проводили прочтение планшетов на счетчике радиоактивности Perkin-Elmer Top Count.iii. Анализ данных. Данные анализировали с применением специально разработанной версии пакета программного обеспечения "Assay Explorer" (Elsevier MDL, San Leandro, CA 94577). Для концентраций одного соединения ингибирующую активность обычно выражали как % ингибирования, полученного в присутствии соединения по сравнению с общей активностью фермента, полученной, когда ингибитор отсутствовал. Соединения, обнаруживающие требуемое ингибирование, дополнительно анализировали для изучения активности ингибитора посредством вычисления IC50. В этом случае данные ингибирования, полученные с применением серийных разведений ингибитора, подгоняли нелинейной регрессией с применением следующего уравнения: где vb представляет собой скорость реакции базовой линии;v представляет собой наблюдаемую скорость реакции;vo представляет собой скорость реакции в отсутствие ингибиторов и[I] представляет собой концентрацию ингибитора. Анализы на основе клеток для ингибиторов активности киназы IGF-1R. Вестерн-блоттинг-анализ фосфорилирования рецептора после стимуляции IGF-1 в клетках рака молочной железы человека MCF-7. Клетки MCF-7 (ATCC HTB-22) высевали в 12-луночных планшетах для культур тканей при 2105 клеток/лунка в среде E-МЕМ (MEM + BSS Игла + 2 мМ глутамин + 0,1 мМ заменимые аминокислоты) + 10% FCS и инкубировали на протяжении ночи при 37C, 5% CO2, 100% относительной влажности. Клетки затем выращивали на минимальной среде заменой Е-МЕМ + 10% FCS на Е-МЕМ + 0,1%BSA и инкубировали на протяжении ночи. После этой инкубации лунки обрабатывали требуемыми концентрациями соединения в течение 1 ч при 37C и затем стимулировали 10 нМ рекомбинантным IGF-1 человека (Invitrogen, Carlsbad, CA, USA) в течение 10 мин при 37C. Клетки затем промывали PBS и лизировали в 100 мкл на лунку буфера для лизиса клеток (реагент экстракции белка млекопитающего[Sigma-Aldrich product P8340] + коктейль ингибитора фосфатазы [Sigma-Aldrich products P2850 +P5726]). Лизаты клеток очищали центрифугированием при 10000g в течение 5 мин и 10 мкг/полосу очищенного белка лизата подвергали электрофорезу на гелях NuPAGE (NuPAGE 4-12% 10-lane Bis-Trisgels, Invitrogen) с буфером для электрофореза MOPS, затем переносили на нитроцеллюлозные фильтрыPROTEAN II (Bio-Rad Laboratories, Hercules, CA, USA). Фильтры, имеющие перенесенный белок, инкубировали в течение 1 ч в буфере для блокирования (TBS + 5% BSA + 0,15% твин 20) и подвергали зондированию в течение 2 ч в том же буфере, содержащем 1/1000 кроличье антифосфо-IGF-1R TyR1131/InsRTyr 1146-антитело (product 3021, Cell Signaling Technology, Beverly, MA, USA) для детектирования фосфорилированного IGF-1 или при разведении 1/1000 кроличье IGF-Ir (H-60)-антитело (product sc-9038,Santa Cruz Biotechnology, Inc., Santa Cruz, CA, USA) для детектирования -цепи общего IGF-1R. В каждом случае фильтры затем промывали в течение 30 мин с несколькими сменами TBS + 0,15% твина 20 и инкубировали в течение 1 ч в буфере для промывания, содержащем при разведении 1/5000 конъюгированный с пероксидазой хрена антикроличий IgG (Amersham, product NA934), затем снова промывали и проявляли с применением системы хемилюминесценции ECL (Amersham) согласно рекомендациям изготовителя. Если не указано иначе, применяемые реагенты были от Sigma-Aldrich, St. Louis, MO, USA. Фактор роста индуцировал фосфорилирование рибосомального белка в первичных фибробластах человека. Фосфорилирование рибосомального белка S6 в ответ на стимуляцию фактора роста нормальных дермальных фибробластов человека (NHDF) применяли для определения активности соединения при ингибировании IGF-1-индуцированной трансдукции сигнала в клетках и селективности по отношению к стимулам EGF и PDGF. Клетки NHDF, полученные от PromoCell (Heidelberg, Germany), выдерживали при 37C в увлажненной атмосфере с 5% CO2 в полной среде для выращивания фибробластов (PromoCell). Для анализа NHDF высевали в 384-луночных планшетах для культуры тканей (черные планшеты с прозрачным и плоским дном; Matrix Technologies Inc., Hudson, NH, USA) при плотности 5000 клеток на лунку в среде без сыворотки, содержащей 0,1% бычьего сывороточного альбумина (BSA), и инкубировали в течение 5 дней. Клетки, выращенные в минимальной среде, обрабатывали в течение 1 ч требуемыми дозами соединений и затем стимулировали в течение еще 2 ч либо 10 нМ IGF-1 (Invitrogen Corp., CA,USA), 10 нМ EGF (Glbco BRL, USA), либо 1 нМ PDGF-B/B (Roche Diagnostics GmbH, Germany). Клетки затем фиксировали в смеси PBS/3,7% параформальдегид в течение 20 мин при комнатной температуре,промывали X2 PBS и делали проницаемыми смесью PBS/0,3% тритона X-100 в течение 15 мин. Лунки затем насыщали смесью PBS/1% обезжиренного сухого молока (Bio-Rad Laboratories, Hercules, CA, USA) в течение 1 ч и затем зондировали в течение 1 ч при 37C с антифосфо-S6 (Ser 235/236)-антителом (CellSignaling Technology, Beverly, MA, USA, cat. 2211) при разведении 1/200 в смеси PBS/1% молока/0,3% твина 20. Лунки затем промывали дважды PBS и инкубировали в течение 1 ч при 37C со смесьюPBS/1% молока/0,3% твина 20 + 1 мкг/мл DAPI (4,6-диамидино-2-фенилиндола) + 1/500 козлиное антикроличье, Cy5-конъюгированное "второе" антитело (Amersham Biosciences, Little Chalfont, Buckinghamshire, UK). Лунки затем промывали Х 2 PBS и 40 мкл PBS дозировали в каждую лунку для иммунофлуоресцентного анализа. Автоматически получали изображения флуоресценции в каналах DAPI и Cy5,клетки накапливали и анализировали с применением инструмента Cellomics ArrayScan IV (Cellomics,Pittsburgh, USA); для количественного измерения цитоплазматической флуоресценции, связанной с фосфо-S6 (параметр сигнала Cy5: "Mean Lyso Mass-pH"), для каждой клетки в 10 полях зрения (микроскопа) на лунку применяли алгоритм цитотоксичности Cellomics и в результате флуоресценцию выражали как среднюю величину для популяции. Если не указано иначе, применяемые реагенты были получены отSigma-Aldrich, St. Louis, MO, USA. Получение цитоплазматического домена ALK для применения в биохимическом анализе. Клонирование и экспрессия. Цитоплазматический домен ALK, соответствующий остаткам 1060-1620 (номера аминокислотных остатков относятся к номерам доступа Genbank под номером NP 004295.2), был амплифицирован ПЦР из кДНК-библиотеки семенников человека. Амплификацию проводили с применением прямого олигонуклеотида: Для целей клонирования олигонуклеотиды включали сайты attB для полученияattB-фланкированного продукта ПЦР, подходящего для клонирования с применением способа Gateway(Invitrogen). Кроме того, для целей очистки прямой праймер включал сайт расщепления PreScission(Amersham Biosciences). Образовавшийся продукт ПЦР клонировали в вектор экспрессии pVL1393 бакуловируса (Invitrogen), Gateway-модифицированный. Для целей экспрессии и очистки GST-метку добавляли у N-конца к цитоплазматическому домену ALK. Клонирование проводили согласно протоколам,описанным в инструкции Gateway (Invitrogen). Бакуловирус генерировали котрансфицированием клеток насекомого Sf9 вектором экспрессии и вирусной ДНК с применением набора трансфицирования BaculoGold (Pharmingen). Вирусный супернатант выделяли спустя 5 дней и подвергали 3 циклам амплификации для повышения вирусного титра. Рекомбинантный белок получали инфицированием клеток насекомого Sf21 при плотности 1106 клеток/мл 30 мл вирусного супернатанта на биллион клеток с встряхиванием при 27C. После 48 ч инфицирования клетки выделяли, осаждали и замораживали при -80C. Очистка белка. Клетки ресуспендировали в буфере для лизиса (50 мМ трис-HCl, pH 8, 150 мМ NaCl, 0,2% CHAPS,20 мМ DTT, 20% глицерина, "полный" коктейль ингибитора протеазы (Roche Diagnostics), 1 мМ Na3VO4) и лизировали жидкостной экструзией гомогенизатором Gaulin (Niro Soavi Italy). Лизат очищали центрифугированием при 20000 g в течение 30 мин и загружали в колонку глутатион-сефароза 4 В (AmershamBiosciences). После экстенсивного промывания рекомбинантный белок элюировали 10 мМ глутатионом в 100 мМ трис-HCl, 10% глицерина. Аффинно очищенный GST-ALK загружали в колонку гепарин-сефароза FF (AmershamBiosciences) и элюировали смесью 50 мМ NaCl, 25 мМ TRIS, pH 7,5, 2 мМ DTT, 20% глицерина. Элюированные фракции объединяли и диализовали против смеси 150 мМ NaCl, 50 мМ трис-HCl,pH 7,4, 2 мМ DTT, 20% глицерина. Очищенный белок хранили при -80C перед его применением в биохимическом анализе. Биохимический анализ ингибиторов активности кииазы ALK. Анализ ингибирования киназы in vitro проводили таким же способом, как описан для IGF-1R. Как и для IGF-1R, фермент ALK необходимо преактивировать для линеаризации кинетик реакций.i. Буфер для киназы (KB) ALK. Буфер для киназы состоял из 50 мМ HEPES, pH 7,5, содержащей 1 мМ MnCl2, 5 мМ MgCl2, 1 мМDTT, 3 мкМ Na3VO4 и 0,2 мг/мл BSA. 3X KB является буфером такого же состава и значения pH, что иKB, но с трехкратной концентрацией каждого компонента.ii. Условия анализа. Анализ киназы проводили с конечной концентрацией фермента 20 нМ в присутствии 8 мкМ АТФ,1 нМ 33 РАТФ и 2 мкМ MBP; MBP был куплен у Sigma-Aldrich, St. Louis, MO, USA. Анализ на основе клеток на ингибиторов активности киназы ALK. Вестерн-блоттинг-анализ фосфорилирования ALK и STAT3 в клеточных линиях анапластической крупноклеточной лимфомы Karpas-299, SR-786 и SUP-M2. Клетки Karpas-299, SR-786 и SUP-M2 (DSMZ, Braunschwiegh, Germany) высевали в 6-луночных планшетах для культуры тканей при плотности 5105 клеток/мл в среде RPMI-1640 + 2 мМ глутамин + 10-15% FCS (EuroClone, Italy) и инкубировали на протяжении ночи при 37C, 5% CO2, 100% относительной влажности. После этой инкубации клетки обрабатывали требуемыми концентрациями соединения в течение 2 ч при 37C. Клетки собирали центрифугированием при 248g в течение 5 мин, промывали холодным PBS, снова центрифугировали при 248g в течение 5 мин и затем лизировали в смеси 100 мМ трис-HCl, pH 7,4, 2% SDS, 1 мМ Na3VO4, коктейля ингибитора протеазы [продукт Р 8340Sigma-Aldrich], коктейля ингибитора фосфатазы [продукты Р 2850 + 5726 Sigma-Aldrich]. После короткой обработки ультразвуком лизаты клеток очищали центрифугированием при 10000g в течение 20 мин при комнатной температуре и 20 мкг/полоса очищенного белка лизата подвергали электрофорезу на гелях NuPAGE (NuPAGE 4-12% 10-lane Бис-Tris gels, Invitrogen) с буфером для электрофореза MOPS, затем переносили на нитроцеллюлозные фильтры Hybond-ECL (Amersham Biosciences, Little Chalfont,Buckinghamshire, UK) с применением камер Mini PROTEAN II (Bio-Rad Laboratories, Hercules, CA, USA). Фильтры, содержащие перенесенный белок, инкубировали в течение 1 ч в буфере для блокирования(TBS + 5% обезжиренного сухого молока [1706404 Bio-Rad, Hercules, CA, USA] + 0,1% твина 20) и подвергали зондированию на протяжении ночи в смеси TBS+5% BSA + 0,1% твина 20, при 4C, содержащей 1/500 антифосфо-ALK Tyr 1604-антитело (продукт 3341 Cell Signaling Technology, Beverly, MA, USA),для детектирования фосфорилированного ALK или 1/500 мышиное анти-ALK-антитело (продукт 354300, Zymed Laboratories, South San Francisco, CA, USA) для детектирования общего ALK, или 1/500 мышиное STAT3 Tyr 705-антитело (продукт 612357, BD Transduction Laboratories, Canada) для детектирования фосфорилированного STAT3, или 1/1000 мышиное анти-STAT3-антитело (продукт 610190 BD Transduction Laboratories, Canada) для детектирования общего STAT3. Во всех случаях фильтры затем промывали в течение 20 мин с несколькими заменами TBS + 0,1% твина 20 и инкубировали в течение 1 ч в смеси TBS + 5% обезжиренного сухого молока + 0,1% твина 20,содержащей при разведении 1/10000 конъюгированный с пероксидазой хрена антикроличий или антимышиный IgG (Amersham, продукт NA934), затем снова промывали и проявляли с применением системы хемилюминесценции ECL (Amersham) согласно рекомендациям изготовителя. Если не указано иначе,применяемые реагенты были от Sigma-Aldrich, St. Louis, MO, USA. Анализ пролиферации клеток in vitro на ингибиторы активности кинаэы ALK. Клеточные линии ALCL человека Karpas-299, SR-786 и SUP-M2 высевали в 96-луночных планшетах (PerkinElmer, Wellesley, MA, USA) при плотности 1105 клеток/мл в среде RPMI-1640 + 2 мМ глутамин + 10-15% FCS (EuroClone, Italy) (100 мкл/лунка) и выдерживали при 37C, 5% CO2, 100% относительной влажности. Через день планшеты обрабатывали в двух повторностях соединениями при подходящем разведении, начиная с 10 мМ исходного раствора в ДМСО (конечная концентрация в ДМСО 0,1%). В каждый планшет включали восемь необработанных контрольных лунок. После 72 ч обработки к каждой лунке добавляли 50 мкл CellTiter-Glo Assay (Promega, Madison, WI, USA) и после перемешивания сигнал люминесценции измеряли с применением детектора Envision (PerkinElmer Wellesley, MA, USA). Величины IC50 вычисляли анализом LSW/Data с применением подбора сигмоидальной кривойMicrosoft Excel. Биохимический анализ ингибиторов активности киназы Aurora-2. Анализ ингибирования киназы in vitro проводили аналогично тому, как описано для IGF-1R. Однако в отличие от IGF-1R фермент Aurora-2 не требует предварительной активации.i. Буфер для киназы (KB) Aurora-2. Буфер для киназы состоял из 50 мМ HEPES, pH 7,0, 10 мМ MgCl2, 1 мМ DTT, 3 мкМ Na3VO4 и 0,2 мг/мл BSA.ii. Условия анализа для Aurora-2 (конечные концентрации). Анализ киназы проводили с концентрацией фермента 2,5 нМ, 10 мкМ АТФ, 1 нМ 33 РАТФ и 8 мкМ субстрата, состоящего из 4 повторов LRRWSLG. Анализы на основе клеток на ингибиторы активности киназы Aurora-2. Анализ пролиферации клеток in vitro для ингибиторов активности киназы Aurora-2. Клеточную линию HCT-116 рака толстой кишки человека высевали при плотности 5000 клеток/см 2 в 24-луночных планшетах (Costar) с применением среды F12 (Gibco), дополненной 10% FCS (EuroClone,Italy), 2 мМ L-глутамином и 1% пенициллина/стрептомицина, и выдерживали при 37C, 5% CO2 и 96% относительной влажности. На следующий день планшеты обрабатывали в двух повторностях 5 мл соединений с подходящим разведением, начиная от 10 мМ исходного раствора в ДМСО. В каждый планшет включали две лунки необработанного контроля. После 72 ч обработки среду удаляли и клетки отделяли от каждой лунки с применением 0,5 мл 0,05% (мас./об.) трипсина 0,02% (мас./об.) EDTA (Gibco). Образцы разводили 9,5 мл изотона (Coulter) и проводили подсчет с применением цитометра Multisizer 3(Beckman Coulter). Данные получали в виде процента контрольных лунок:% CTR=(обработанный образец-слепой опыт)/(контроль-слепой опыт)/100. Величины IC50 вычисляли анализом LSW/Data с применением подбора сигмоидальной кривойMicrosoft Excel. Данные биохимического анализа и анализа на основе клеток репрезентативных соединений указываются в табл. 1. Таблица 1 Те же соединения испытывали на ингибирование IGF1-индуцированного фосфорилирования IGF1R в клетках MCF-7, результаты показаны на фигуре. Соединения настоящего изобретения можно вводить либо в виде отдельных агентов, либо альтернативно в комбинации с известными противораковыми лечениями, такими как схема лечения лучевой терапии или химиотерапии, в комбинации, например, с антигормональными агентами, такими как антиэстрогены, антиандрогены и ингибиторы ароматазы, ингибиторы топоизомеразы I, ингибиторы топоизомеразы II, агенты, которые поражают микротрубочки, агенты на основе платины, алкилирующие агенты,ДНК-повреждающие или -интеркалирующие агенты, противоопухолевые антиметаболиты, другие ингибиторы киназ, другие антиангиогенные агенты, ингибиторы кинезинов, терапевтические моноклональные антитела, ингибиторы mTOR, ингибиторы гистондеацетилазы, ингибиторы фарнезилтрансферазы и ингибиторы гипоксической реакции. При изготовлении в виде фиксированной дозы в таких продуктах комбинаций применяют соединения данного изобретения в диапазоне доз, описанных ниже, и другой фармацевтически активный агент применяют в разрешенном диапазоне доз. Соединения формулы (I) можно применять последовательно с известными противораковыми агентами, когда комбинированный препарат является неподходящим. Соединения формулы (I) настоящего изобретения, подходящие для введения млекопитающему, например людям, можно вводить обычными путями, и уровень дозы зависит от возраста, массы и состояний пациента и пути введения. Например, подходящая доза, адаптированная для перорального введения соединения формулы (I), может быть в диапазоне от приблизительно 10 до приблизительно 500 мг на дозу, от 1 до 5 раз в день. Соединения изобретения можно вводить в виде различных лекарственных форм, например перорально в форме таблеток, капсул, покрытых сахаром или пленкой таблеток, жидких растворов или суспензий; ректально в форме суппозиториев; парентерально, например внутримышечно или посредством внутривенной, и/или внутриоболочечной, и/или интраспинальной инъекции или инфузии. Настоящее изобретение включает также фармацевтические композиции, содержащие соединение формулы (I) или его фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым эксципиентом, который может быть носителем или разбавителем. Фармацевтические композиции, содержащие соединения изобретения, обычно получают по общепринятым способам и вводят в подходящей фармацевтической форме. Например, твердые пероральные формы могут содержать вместе с активным соединением разбавители, например лактозу, декстрозу, сахарозу, целлюлозу, кукурузный крахмал или картофельный крахмал; смазывающие вещества, например диоксид кремния, тальк, стеариновую кислоту, стеарат магния или кальция и/или полиэтиленгликоли; связывающие агенты, например крахмалы, аравийскую камедь,желатин, метилцеллюлозу, карбоксиметилцеллюлозу или поливинилпирролидон; дезинтегрирующие агенты, например крахмал, альгиновую кислоту, альгинаты или натриевую соль гликолята крахмала; смеси, вызывающие выделение газа из жидкости в виде пузырьков; красители; подслащивающие вещества; увлажняющие агенты, такие как лецитин, полисорбаты, лаурилсульфаты; и в общем нетоксичные и фармакологически неактивные вещества, применяемые в фармацевтических препаратах. Эти фармацев- 15017852 тические препараты можно изготовить известным способом, например посредством способов смешивания, гранулирования, таблетирования, покрытия сахаром или покрытия пленкой. Жидкими дисперсиями для перорального введения могут быть, например, сиропы, эмульсии и суспензии. В качестве примера сиропы могут содержать в качестве носителя сахарозу или сахарозу с глицерином и/или маннит и сорбит. Суспензии и эмульсии могут содержать в качестве примеров носителей природную камедь, агар,альгинат натрия, пектин, метилцеллюлозу, карбоксиметилцеллюлозу или поливиниловый спирт. Суспензии или растворы для внутримышечных инъекций могут содержать вместе с активным соединением фармацевтически приемлемый носитель, например стерильную воду, оливковое масло,этилолеат, гликоли, например пропиленгликоль и, если требуется, подходящее количество гидрохлорида лидокаина. Растворы для внутривенных инъекций или инфузий могут содержать в качестве носителя стерильную воду, или предпочтительно они могут быть в форме стерильных водных изотонических солевых растворов, или они могут содержать пропиленгликоль в качестве носителя. Суппозитории могут содержать вместе с активным соединением фармацевтически приемлемый носитель, например какао-масло, полиэтиленгликоль, сурфактант в виде эфира полиоксиэтиленсорбитана и жирной кислоты или лецитин. С целью лучшей иллюстрации настоящего изобретения, без установления любого его ограничения,теперь предлагаются следующие примеры. Краткое описание графических материалов На фигуре показано ингибирование аутофосфорилирования IGF1R в выращенных в минимальной среде клетках MCF7, стимулированных 10 нМ IGF1, соединениями формулы (I), примерами которых являются соединения 1, 36 и 33. Обработка выращенных в минимальной среде клеток MCF7 10 нМ IGF1 индуцировала аутофосфорилирование рецептора, что показано появлением более интенсивной полосы фосфорилированногоIGF1R (pIGF1R). Инкубация клеток с повышающимися концентрациями соединений 1, 36 и 33 перед обработкой IGF1 приводила к ингибированию индуцированного IGF1 аутофосфорилирования IGF1R,что показано исчезновением полосы фосфорилированного IGF1R (pIGF1R). Экспериментальная часть Общие способы очистки и аналитические способы. Флэш-хроматографию проводили на силикагеле (Merck grade 9395, 60 А). ВЭЖХ проводили на колонке Waters X Terra RP 18 (4,650 мм, 3,5 мкм) с применением системы ВЭЖХ Waters 2790, снабженной детектором 996 Waters PDA и одним квадрупольным масс-спектрометром Micromass mod. ZQ, снабженным источником ионизации электрораспылением (ESI). Подвижной фазой А был буфер с 5 мМ ацетатом аммония (pH 5,5, смесь уксусная кислота-ацетонитрил, 95:5) и подвижной фазой В была смесь вода-ацетонитрил (5:95). Градиент был от 10 до 90% В в течение 8 мин, сохранение 90% В в течение 2 мин. УФ-детектирование при 220 и 254 нм. Скорость потока 1 мл/мин. Объем ввода 10 мкл. Полное сканирование, диапазон масс от 100 до 800 атомных единиц. Вольтаж капилляра был 2,5 кВ; температура источника была 120C; конус был 10 В. Времена удерживания (ВЭЖХ, к.т.) указываются в минутах при 220 или при 254 нм. Массы даны как отношение m/z. Когда необходимо, соединения очищали препаративной ВЭЖХ на колонке Waters Symmetry C18(1950 мм, 5 мкм) или на колонке Waters X Terra RP 18 (30150 мм, 5 мкм) с применением препаративного хроматографа ВЭЖХ Waters 600, снабженного детектором 996 Waters PDA и одним квадрупольным масс-спектрометром Micromass mod. ZMD с ионизацией электрораспылением и выполнением детектирования на положительных ионах. Кислотный способ: подвижной фазой А была смесь вода-0,01% трифторуксусной кислоты, и подвижной фазой В был ацетонитрил; градиент был от 10 до 90% В в течение 8 мин, сохранение 90% В в течение 2 мин; скорость потока 20 мл/мин. Основный способ: подвижной фазой А была смесь вода-0,1% NH3, и подвижной фазой В был ацетонитрил; градиент был от 10 до 100% В в течение 8 мин, сохранение 100% В в течение 2 мин; скорость потока 20 мл/мин. Спектрометрию 1H ЯМР проводили на приборе Mercury VX 400, функционирующем при 400,45 МГц и снабженным датчиком 5 мм двойного резонанса [1H (15N-31P) ID PFG Varian]. Пример 1. Получение 5-бензолсульфонил-1H-индазол-3-иламина (VIII), R1=R2=R3=H, R = фенил]. Стадия 1. 5-Фтор-2-нитробензамид [(III), R1=R2=R3=H]. 5-Фтор-2-нитробензойную кислоту (17,9 г, 96,8 ммоль) нагревали в тионилхлориде (35 мл,5 мол.экв.) в течение 2 ч при 85C (температура масляной бани). Реакционную смесь упаривали, растворяли и дважды упаривали с сухим толуолом. Образовавшийся хлорангидрид кислоты растворяли в сухом диоксане (180 мл) и добавляли к охлажденному на бане лед-вода раствору 33% NH4OH (23,5 мл,2 мол.экв.) в диоксане (180 мл). Реакционной смеси давали возможность медленно нагреться до комнатной температуры и затем упаривали досуха. Кристаллический остаток растирали в воде (50 мл), собира- 16017852 ли фильтрованием, промывали небольшим количеством воды и сушили в вакууме при 80C до постоянной массы (17,56 г, 98,5%). 1(2,48 г, 14,95 ммоль) и нагревали при 50C (температура масляной бани) в течение 60 ч. Реакционную смесь добавляли по каплям в 40 мл ледяной воды. Отделение фильтрованием твердого вещества давало 3,55 г (выход 85%) указанного в заголовке соединения. 1(200 мл), обрабатывали 10% Pd/C (1,5 г) и затем формиатом аммония (9,7 г, 153 ммоль). Смесь перемешивали при кипячении с обратным холодильником. Спустя 2 ч реакция была завершена. После охлаждения до комнатной температуры реакционную смесь фильтровали через целит и осадок промывали EtOH. Выпаривание фильтрата давало сырой продукт, который растворяли в небольшом количестве метанола и добавляли по каплям к 400 мл ледяной воды при перемешивании. Таким образом, образованное твердое вещество отделяли фильтрованием и промывали водой, получая при этом 1,87 г указанного в заголовке соединения (выход 66%). 1H ЯМР (400 МГц),(м.д., ДМСО-d6): 8,14, 7,31 (м, 2H), 7,92 (м, 2H), 7,59 (м, 4H), 7,45 (ушир. с,2H), 6,81 (м, 1H). Стадия 4. 2-Амино-5-бензолсульфонилбензонитрил [(VII), R1=R2=R3=H, R = фенил]. 2-Амино-5-бензолсульфонилбензамид (2,01 г, 7,29 ммоль) обрабатывали POCl3 (8 мл) и реакционную смесь нагревали до 90C. Твердое вещество постепенно растворялось. Спустя три часа реакционную смесь охлаждали до комнатной температуры и добавляли по каплям к 600 мл ледяной воды при перемешивании. Получали желтый осадок, который отделяли фильтрованием. Очистка сырого продукта хроматографией на силикагеле (96:4 DCM/MeOH или 93:7 DCM/EtOAc) давала 813 мг указанного в заголовке соединения (выход 43%). 1H ЯМР (400 МГц),(м.д., ДМСО-d6): 8,02 (д, J=2,31 Гц, 1H), 7,94 (м, 2H), 7,75 (дд, J1=9,02 Гц,J2=2,31 Гц, 1H), 7,67 (м, 1H), 7,61 (м, 2H), 7,08 (ушир. с, 2H), 6,87 (д, J=9,02 Гц, 1H). Стадия 5. 5-Бензолсульфонил-1H-индазол-3-иламин [(VIII), R1=R2=R3=H, R = фенил]. 2-Амино-5-бензолсульфонилбензонитрил (0,81 г, 3,15 ммоль) в 37% HCl (5 мл) обрабатывали по каплям при 4C NaNO2 (261 мг, 3,78 ммоль) в 5 мл воды. Спустя 1,75 ч суспензию добавляли по каплям к раствору SnCl2 (4,88 г, 25,21 ммоль) в 5 мл 37% HCl. После перемешивания при 4C в течение 3 ч твердое вещество отделяли фильтрованием, растворяли в воде (30 мл) и кипятили в течение 1,5 ч. Горячую смесь фильтровали и тщательно промывали кипящей водой. Фильтрат охлаждали до 4C и обрабатывали по каплям при перемешивании 17% NaOH (приблизительно 5 мл). После охлаждения на протяжении ночи в холодильнике твердое вещество отделяли фильтрованием и промывали водой до нейтрального pH,получая при этом 0,348 г указанного в заголовке соединения (выход 40%). 1[(XIII),R1=R2=R3=H,R = 3,5-дифторфенил]. Раствор 5-фтор-2-нитробензонитрила (2,4 г, 14,45 ммоль) в тетрагидрофуране (100 мл) обрабатывали карбонатом цезия (4,7 г) и охлаждали до -15C (баня лед/соль). К этой смеси по каплям добавляли 3,5-дифтортиофенол (2,11 г, 1 мол.экв.) в тетрагидрофуране (50 мл) в течение 30 мин. После дополнительного перемешивания в течение 1 ч реакционную смесь проверяли на присутствие любого непрореагировавшего исходного вещества. Большую часть растворителя удаляли роторным испарением и остаток распределяли между дихлорметаном и водой. Органический слой сушили над сульфатом натрия и упаривали, получая при этом продукт в виде твердого вещества. Растирание в малом количестве метанола и фильтрование давали указанное в заголовке соединение в чистой форме в виде беловатого порошка С применением аналогичного способа получали нижеследующие соединения. 2-Нитро-5-фенилсульфанилбензонитрил [(XIII), R1=R2=R3=H, R = фенил]. 1[(XIV),R1=R2=R3=H,R = 3,5-дифторфенил]. Периодную кислоту (10,14 г, 4 мол.экв.) перемешивали в сухом ацетонитриле (220 мл) до полного растворения. Добавляли триоксид хрома (22 мг, 0,02 мол.экв.) и смесь перемешивали до полного растворения. После охлаждения при помощи бани лед-вода при перемешивании добавляли раствор 5-(3,5 дифторфенилсульфанил)-2-нитробензонитрила (3,25 г, 11,12 ммоль) в сухом ацетонитриле. Охлаждающую баню удаляли и реакционную смесь перемешивали в течение 2 ч. Осадок отделяли фильтрованием,промывали свежим ацетонитрилом и объединенные растворы упаривали роторным испарителем. Остаток растворяли в дихлорметане, промывали последовательно насыщенным водным сульфитом натрия и насыщенным раствором соли, сушили над сульфатом натрия и упаривали, получая при этом указанное в заголовке соединение в виде белого твердого вещества (3,53 г, 98%). 1H ЯМР (400 МГц),(м.д., ДМСО-d6): 8,91 (м, 1H), 8,58 (м, 2H), 7,97 (м, 2H), 7,78 (м, 1H). С применением аналогичного способа получали нижеследующие соединения. 5-Бензолсульфонил-2-нитробензонитрил [(XIV), R1=R2=R3=H, R = фенил]. 1H ЯМР (400 МГц),(м.д., ДМСО-d6): 8,88 (м, 1H), 8,55 (м, 2H), 8,07 (м, 1H), 7,99 (м, 1H), 7,76 (м,1H), 7,67 (м, 1H). Стадия 3. 5-(3,5-Дифторбензолсульфонил)-1H-индазол-3-иламин [(VIII), R1=R2=R3=H, R = 3,5 дифторфенил]. 5-(3,5-Дифторбензолсульфонил)-2-нитробензонитрил (3,5 г, 10,8 ммоль) нагревали в безводном этаноле (175 мл) до полного растворения. Раствор затем обрабатывали гидратом гидразина (0,58 мл,1,1 мол.экв.) и кипятили с обратным холодильником в течение 3 ч. Реакционную смесь упаривали досуха; остаток растворяли в ацетоне, адсорбировали на силикагеле сорта для флэш-хроматографии с роторным выпариванием растворителя. Диоксид кремния загружали в колонку для флэш-хроматографии, кондиционировали смесью 10:1 дихлорметан/ацетон. Колонку затем элюировали смесью дихлорметан/ацетон (градиент от 10:1 до 2:1) с последующим конечным промыванием смесью дихлорметан/ацетон/метанол. Чистые фракции собирали и упаривали, получая при этом указанное в заголовке соединение в виде беловатого кристаллического порошка (2,44 г, 73%). 1H ЯМР (400 МГц),(м.д., ДМСО-d6): 12,05 (ушир. с, 1H), 8,58 (д, J=1,46 Гц, 1H), 7,76 (дд,J1=8,78 Гц, J2=1,83 Гц, 1H), 7,60-7,68 (м, 3H), 7,40 (дд, J1=8,90 Гц, J2=0,61 Гц, 1H), 5,81 (ушир. с, 1H). С применением аналогичного способа получали нижеследующее соединение: 5-(3-фторбензолсульфонил)-1H-индазол-3-иламин [(VIII), R1=R2=R3=H, R = 3-фторфенил].ESI (+) МС: m/z 292 (MH+). Пример 3. Получение метилового эфира 2-нитро-4-пиперидин-1-илметилбензойной кислоты. К раствору метилового эфира 4-гидроксиметил-2-нитробензойной кислоты (2,0 г, 9,47 ммоль) в сухом дихлорметане (80 мл) в атмосфере аргона при комнатной температуре добавляли триэтиламин(1,6 мл, 10,9 ммоль, 1,15 экв.) и затем добавляли п-толуолсульфонилхлорид (2,08 г, 10,9 ммоль,1,15 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем добавляли пиперидин (1,6 мл, 18,94 ммоль, 2 экв.) и смесь перемешивали в течение дополнительных 24 ч. Растворитель выпаривали и остаток очищали флэш-хроматографией на силикагеле с применением смеси 95:5 дихлорметан/этанол в качестве элюента, получая при этом 1,2 г указанного в заголовке соединения. 1(ушир. с, 2H), 2,36 (м, 4H), 1,53 (м, 4H), 1,41 (м, 2H). С применением аналогичного способа получали нижеследующее соединение: метиловый эфир 4-диметиламинометил-2-нитробензойной кислоты.ESI (+) МС: m/z 239 (MH+). Пример 4. Получение метилового эфира 3-аминоизоникотиновой кислоты. Смесь 3-аминоизоникотиновой кислоты (613 мг, 4,44 ммоль), метанола (15 мл) и тионилхлорида(0,7 мл, 8,88 ммоль) перемешивали при кипячении с обратным холодильником в течение 3 дней. Летучие компоненты удаляли при пониженном давлении и остаток перемешивали с диэтиловым эфиром (20 мл) и насыщенным раствором гидрокарбоната натрия (40 мл). Фазы разделяли и водную фазу экстрагировали диэтиловым эфиром (220 мл). Объединенные органические фазы сушили над сульфатом натрия и упаривали досуха, получая при этом 400 мг указанного в заголовке соединения. 1(100 мл) перемешивали при комнатной температуре в течение 20 ч. Реакционную смесь затем разбавляли этилацетатом (500 мл), промывали 1 н. HCl (500 мл), водой (500 мл), насыщенным раствором соли(500 мл), сушили над сульфатом натрия и упаривали досуха. Указанное в заголовке соединение получали в виде бледно-желтого масла (выход количественный) и его применяли на следующей стадии без какойлибо дополнительной очистки. 1N-метилпиперазина (17 мл) перемешивали при комнатной температуре в течение 6 ч. Реакционную смесь затем разбавляли водой (800 мл) и перемешивали магнитной мешалкой в течение 20 ч. Образовавшееся твердое вещество отделяли фильтрованием, тщательно промывали водой и сушили в вакууме при 40C. Указанное в заголовке соединение получали в виде желтого твердого вещества (16,4 г, выход 94%) и применяли на следующей стадии без какой-либо дополнительной очистки. 1 Н ЯМР (400 МГц),(м.д., ДМСО-d6): 7,69 (д, J=8,90 Гц, 1H), 7,29 (д, J=2,56 Гц, 1H), 7,15 (дд,J1=8,90 Гц, J2=2,56 Гц, 1H), 3,37 (м, 4H), 2,44 (м, 4H), 1,46 (с, 9H). С применением аналогичного способа получали нижеследующие соединения. трет-Бутиловый эфир 4-[(2-диметиламиноэтил)метиламино]-2-нитробензойной кислоты. 1H ЯМР (400 МГц),(м.д., ДМСО-d6): 7,64 (д, J=9,0 Гц, 1H), 7,03 (д, J=2,7 Гц, 1H), 6,91 (дд,J1=9,0 Гц, J2=2,7 Гц, 1H), 3,59 (м, 2H), 3,51 (м, 2H), 2,59 (м, 2H), 2,44 (м, 2H), 2,25 (с, 3H), 1,86 (м, 2H),1,44 (с, 9H). Пример 7. Получение трет-бутилового эфира 4-(2-диметиламиноэтокси)-2-нитробензойной кислоты. К раствору 2-диметиламиноэтанола (6,67 мл, 64,8 ммоль) в безводном тетрагидрофуране (100 мл) при 0C добавляли трет-бутоксид калия (6,66 г, 59,4 ммоль). Смесь перемешивали при 0C в течение 1 ч,затем добавляли трет-бутиловый эфир 4-фтор-2-нитробензойной кислоты (10 г, 41,5 ммоль) в безводном тетрагидрофуране (50 мл). После выдерживания 2 ч при 0C смесь выливали в воду (1 л) и экстрагировали этилацетатом (4200 мл). Органическую фазу промывали водой, насыщенным раствором соли, сушили над безводным сульфатом натрия, фильтровали и упаривали досуха. Сырой продукт очищали флэшхроматографией с применением смеси 9:1:0,01 дихлорметан-метанол-33% NH4OH в качестве элюента,получая при этом указанное в заголовке соединение (4,53 г) в виде желтого масла. 1H ЯМР (400 МГц),(м.д., ДМСО-d6): 7,81 (д, 1H), 7,52 (д, 1H), 7,31 (дд, 1H), 4,21 (т, 2H), 2,65 (т,2H), 2,22 (с, 6H), 1,49 (с, 9H). С применением аналогичного способа получали нижеследующие соединения. трет-Бутиловый эфир 2-нитро-4-(2-пирролидин-1-илэтокси)бензойной кислоты. 1H ЯМР (400 МГц),(м.д., ДМСО-d6): 7,79 (д, J=8,8 Гц, 1H), 7,53 (д, J=2,6 Гц, 1H), 7,31 (дд,J1=8,8 Гц, J2=2,6 Гц, 1H), 4,60 (м, 1H), 2,61 (м, 2H), 2,26-2,15 (м, 5H), 1,96 (м, 2H), 1,67 (м, 2H), 1,48 (с,9H). Пример 8. Получение гидрохлорида 4-(4-метилпиперазин-1-ил)-2-нитробензойной кислоты. Смесь трет-бутилового эфира 4-(4-метилпиперазин-1-ил)-2-нитробензойной кислоты (16,4 г,51 ммоль) и 37% HCl (100 мл) в 1,4-диоксане (200 мл) перемешивали при комнатной температуре в течение 4 ч. Образовавшееся твердое вещество фильтровали, тщательно промывали 1,4-диоксаном и сушили в вакууме при 45C. Указанное в заголовке соединение получали в виде бледно-желтого твердого вещества (13,45 г, выход 87,5%) и применяли на следующей стадии без какой-либо очистки. 1H ЯМР (400 МГц),(м.д., ДМСО-d6): 10,27 (ушир. с, 1H), 7,81 (д, J=8,90 Гц, 1H), 7,40 (д, J=2,69 Гц,1H), 7,24 (дд, J1=8,90 Гц, J2=2,69 Гц, 1H), 4,13 (ушир. с, 2H), 3,55-3,06 (ушир. с, 6H), 2,83 (с, 3H). С применением аналогичного способа получали нижеследующие соединения. Гидрохлорид 4-[(2-диметиламиноэтил)метиламино]-2-нитробензойной кислоты. 1H ЯМР (400 МГц),(м.д., ДМСО-d6): 13,05 (ушир. с, 1H), 10,06 (ушир. с, 1H), 7,79 (д, J=8,9 Гц,1H), 7,16 (д, J=2,6 Гц, 1H), 6,99 (дд, J1=8,9 Гц, J2=2,6 Гц, 1H), 4,0-3,7 (м, 2H), 3,6-3,4 (м, 4H), 3,25-3,0 (м,2H), 2,83 (с, 3H), 2,19 (м, 2H). Пример 9. Получение трет-бутилового эфира 2-амино-4-(4-метилпиперазин-1-ил)бензойной кислоты. Смесь трет-бутилового эфира 4-(4-метилпиперазин-1-ил)-2-нитробензойной кислоты (13,3 г,41,5 ммоль), циклогексена (45 мл), этанола (300 мл) и 10% Pd/C (0,4 г) перемешивали при 80C в течение 7 ч. Добавляли дополнительный 10% Pd/C (0,9 г) и смесь перемешивали при 80C в течение дополнительных 4 ч. Реакционную смесь фильтровали через слой целита, тщательно промывая этанолом, и фильтрат упаривали досуха, получая при этом указанное в заголовке соединение в виде бледно-желтого твердого вещества (11,5 г, выход 95%). 1H ЯМР (400 МГц),(м.д., ДМСО-d6): 7,47 (д, J=9,0 Гц, 1H), 6,40 (ушир. с, 2H), 6,18 (дд, J1=9,0 Гц,J2=2,4 Гц, 1H), 6,11 (д, J=2,4 Гц, 1H), 3,16 (м, 4H), 2,41 (м, 4H), 2,21 (с, 3H), 1,49 (с, 9H). С применением аналогичного способа получали нижеследующие соединения. трет-Бутиловый эфир 2-амино-4-[(2-диметиламиноэтил)метиламино]бензойной кислоты.(с, 9H). Пример 10. Получение трет-бутилового эфира 4-(4-метилпиперазин-1-ил)-2-(тетрагидропиран-4 иламино)бензойной кислоты. К раствору трет-бутилового эфира 2-амино-4-(4-метилпиперазин-1-ил)бензойной кислоты (11,5 г,39,5 ммоль) в дихлорметане (340 мл) добавляли тетрагидропиран-4-он (4,5 мл, 49,3 ммоль), трифторуксусную кислоту (8,2 мл) и триацетоксиборгидрид тетраметиламмония (15,57 г, 59,2 ммоль). Смесь перемешивали при комнатной температуре в течение 2 ч, затем промывали 0,5 н. хлористо-водородной кислотой, 0,5 н. NaOH и насыщенным раствором NaHCO3. Органический слой сушили над сульфатом натрия и упаривали досуха, получая при этом указанное в заголовке соединение в виде бледно-желтого твердого вещества (13,3 г, выход 90%). 1 С применением аналогичного способа получали нижеследующие соединения. Этиловый эфир 4-нитро-2-(тетрагидропиран-4-иламино)бензойной кислоты. 1(ушир. д, J=8,4 Гц, 1H), 4,02 (м, 1H), 3,84 (с, 3H), 3,43 (м, 2H), 3,31 (с, 3H), 1,19 (д, J=6,5 Гц, 3H). Пример 11. Получение 4-нитро-2-(тетрагидропиран-4-иламино)бензойной кислоты. Этиловый эфир 4-нитро-2-(тетрагидропиран-4-иламино)бензойной кислоты (11,2 г, 38 ммоль) растворяли в 200 мл этанола при 60C, затем добавляли 2 н. NaOH (40 мл, 80 ммоль). Смесь перемешивали при 60C в течение 4 ч, затем растворитель удаляли при пониженном давлении. Остаток растворяли в 200 мл воды и pH смеси доводили до кислотного значения 2 н. HCl (35 мл). Осажденное желтое твердое вещество отделяли фильтрованием, промывали большим количеством воды и сушили в сушильном шкафу при 40C, получая при этом указанное в заголовке соединение (9,3 г). 1 Н ЯМР (400 МГц),(м.д., ДМСО-d6): 13,49 (ушир. с, 1H), 8,17 (ушир. д, 1H), 8,04 (д, J=8,7 Гц, 1H),7,54 (д, J=2,2 Гц, 1H), 7,32 (дд, J1=8,7 Гц, J2=2,2 Гц, 1H), 3,90-3,78 (м, 3H), 3,54 (м, 2H), 1,98 (м, 2H), 1,46(м, 2H). С применением аналогичного способа получали нижеследующие соединения. Гидрохлорид 4-пиперидин-1-илметил-2-(тетрагидропиран-4-иламино)бензойной кислоты. 1(ушир. с, 1H), 3,99 (м, 1H), 3,41 (м, 2H), 3,30 (с, 3H), 1,18 (д, J=6,5 Гц, 3H). Пример 12. Получение трет-бутилового эфира 4-(4-метилпиперазин-1-ил)-2-[(тетрагидропиран-4-ил)-(2,2,2 трифторацетил)амино]бензойной кислоты. К раствору трет-бутилового эфира 4-(4-метилпиперазин-1-ил)-2-(тетрагидропиран-4 иламино)бензойной кислоты (13,3 г, 35,4 ммоль) в сухом дихлорметане (350 мл) в атмосфере аргона при 0C добавляли триэтиламин (7,5 мл, 53,1 ммоль) и трифторуксусный ангидрид (6,5 мл, 46,1 ммоль). Смесь перемешивали при 0C в течение 20 мин, затем по каплям добавляли воду (350 мл). Фазы разделяли и органическую фазу промывали насыщенным раствором соли, сушили над сульфатом натрия и упа- 22017852 ривали досуха. Сырой остаток очищали хроматографией на силикагеле с применением смеси 95:5 дихлорметан/этанол в качестве элюента, получая при этом 12,1 г указанного в заголовке соединения в виде бледно-желтого твердого вещества (выход 73%). 1(м, 1H), 1,51 (м, 1H), 1,46 (с, 9H), 1,03 (м, 1H). С применением аналогичного способа получали нижеследующие соединения. трет-Бутиловый эфир 4-[(2-диметиламиноэтил)метиламино]-2-[(тетрагидропиран-4-ил)-(2,2,2 трифторацетил)амино]бензойной кислоты. 1(с, 6H), 1,99 (м, 1H), 1,70-1,46 (м, 4H), 1,44 (с, 9H), 1,03 (м, 1H). Пример 13. Получение 4-нитро-2-[(тетрагидропиран-4-ил)-(2,2,2-трифторацетил)амино]бензойной кислоты. К 30 мл трифторуксусного ангидрида добавляли небольшими порциями 4-нитро-2(тетрагидропиран-4-иламино)бензойную кислоту (9,1 г, 34,2 ммоль) при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 1 ч, затем упаривали досуха. Остаток (коричневое масло) обрабатывали 200 мл воды и смесь энергично перемешивали в течение 3 ч при комнатной температуре. Таким образом, образованное белое твердое вещество отделяли фильтрованием, промывали большим количеством воды и сушили в сушильном шкафу при 40C, получая при этом указанное в заголовке соединение (11,8 г). 1(д, J=2,3 Гц, 1H), 8,26 (д, J=8,5 Гц, 1H), 4,58 (м, 1H), 3,84 (м, 2H), 3,45-3,2 (м, 2H), 1,98 (м, 1H), 1,59 (м,1H), 1,49 (м, 1H), 1,14 (м, 1H). С применением аналогичного способа получали нижеследующие соединения. Трифторацетат 4-пиперидин-1-илметил-2-[(тетрагидропиран-4-ил)-(2,2,2-трифторацетил)амино]бензойной кислоты.H ЯМР (400 МГц),(м.д., ДМСО-d6): 8,84, 8,80 (2 д, J=5,0 Гц, 1H), 8,69, 8,62 (2 с, 1H), 7,90, 7,84 (2 д,J=5,0 Гц, 1H), 4,82, 4,54 (2 м, 1H), 3,47-3,11 (м, 5H), 1,17, 0,87 (2 д, J=7,0 Гц, 3H), смесь ротамеров. Пример 14. Получение трифторацетата 4-(4-метилпиперазин-1-ил)-2-[(тетрагидропиран-4-ил)-(2,2,2 трифторацетил)амино]бензойной кислоты. Смесь трет-бутилового эфира 4-(4-метилпиперазин-1-ил)-2-[(тетрагидропиран-4-ил)-(2,2,2 трифторацетил)амино]бензойной кислоты (12,1 г, 25,7 ммоль), трифторуксусной кислоты (48,5 мл) и дихлорметана (195 мл) перемешивали при комнатной температуре в течение 2 ч. Летучие компоненты затем выпаривали, остаток растворяли в диэтиловом эфире и снова упаривали. Процедуру повторяли 5 раз,затем твердое вещество растирали с диэтиловым эфиром, фильтровали и сушили в сушильном шкафу при 40C, получая при этом указанное в заголовке соединение в виде бледно-коричневого твердого вещества (13,4 г). 1H ЯМР (400 МГц),(м.д., ДМСО-d6): 12,78 (ушир. с, 1H), 9,74 (ушир. с, 1H), 7,93 (д, J=8,8 Гц, 1H),7,13 (дд, J1=8,8 Гц, J2=2,5 Гц, 1H), 6,98 (д, J=2,5 Гц, 1H), 4,49 (м, 1H), 4,11 (м, 2H), 3,84 (м, 2H), 3,6-3,0 (м,8H), 2,89 (с, 3H), 1,98 (м, 1H), 1,59 (м, 1H), 1,53 (м, 1H), 1,08 (м, 1H). С применением аналогичного способа получали нижеследующие соединения. Трифторацетат 4-[(2-диметиламиноэтил)метиламино]-2-[(тетрагидропиран-4-ил)-(2,2,2 трифторацетил)амино]бензойной кислоты. 1t-BuOH (50 мл) добавляли (BOC)2O (13,8 г, 63,24 ммоль) и N,N-диметиламинопиридин (1,16 г,9,49 ммоль). Раствор перемешивали при комнатной температуре в течение 24 ч, затем разбавляли дихлорметаном и дважды промывали 1 н. HCl, насыщенным раствором NaHCO3, водой (3 раза) и насыщенным раствором соли. Органическую фазу сушили над сульфатом натрия, фильтровали и упаривали, получая при этом указанное в заголовке соединение (5,70 г, 84%) в виде желтоватого масла. 1NaHCO3 и смесь экстрагировали дихлорметаном (3 раза). Органическую фазу промывали дважды водой,затем насыщенным раствором соли, сушили над сульфатом натрия, фильтровали и упаривали досуха,получая при этом сырой продукт, который очищали колоночной хроматографией на силикагеле, элюируя смесью 9:1 гексан/этилацетат. Указанное в заголовке соединение (33,38 г, 84%) получали в виде масла. 1H ЯМР (400 МГц),(м.д., ДМСО-d6): 7,87 (д, J=7,80 Гц, 1H), 7,80 (т, J=7,19 Гц, 1H), 6,60 (дд,J1=13,05 Гц, J2=2,44 Гц, 1H), 6,36 (м, 1H), 3,80 (м, 1H), 3,40 (д, J=4,76 Гц, 2H), 3,30 (с, 3H), 1,53 (с, 9H),1,17 (д, J=6,58 Гц, 3H). С применением аналогичного способа получали нижеследующие соединения. трет-Бутиловый эфир 4-фтор-2-R)-2-метокси-1-метилэтиламино)бензойной кислоты. 1(1,54 г, 5,44 ммоль) в дихлорметане (30 мл) охлаждали до 0-5C. Добавляли триэтиламин (1,11 мл,8,16 ммоль) и трифторуксусный ангидрид (1,15 мл, 8,16 ммоль). После выдерживания 3 ч при 0-5C смесь промывали насыщенным раствором NaHCO3, водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия, фильтровали и упаривали, получая при этом указанное в заголовке соединение в виде желтоватого масла (2 г, 99%). 1H ЯМР (400 МГц),(м.д., ДМСО-d6): (смесь таутомеров) 8,07 (м, 1H), 7,53 (м, 1H), 7,29 (дд,J1=9,39 Гц, J2=2,68 Гц, 1H), 4,83 (м, 1H), 3,44 (м, 1H), 3,30 (с, 3H), 1,49 (с, 9H), 0,86 (д, 3H). С применением аналогичного способа получали нижеследующие соединения. трет-Бутиловый эфир 4-фтор-2-[R)-2-метокси-1-метилэтил)-(2,2,2-трифторацетил)амино]бензойной кислоты. 1 Н ЯМР (400 МГц),(м.д., ДМСО-d6): (смесь таутомеров) 8,07 (м, 1H), 7,53 (м, 1H), 7,29 (дд,J1=9,39 Гц, J2=2,68 Гц, 1H), 4,83 (м, 1H), 3,44 (м, 1H), 3,30 (с, 3H), 1,49 (с, 9H), 0,86 (д, 3H). трет-Бутиловый эфир 4-фтор-2-[(2-метоксиэтил)-(2,2,2-трифторацетил)амино]бензойной кислоты. 1H ЯМР (400 МГц),(м.д., ДМСО-d6): 8,07 (м, 1H), 7,50 (м, 1H), 7,41 (дд, J1=9,39 Гц, J2=2,56 Гц,1H), 4,28 (м, 1H), 3,55 (м, 1H), 3,46 (м, 1H), 3,38 (м, 1H), 3,18 (с, 3H), 1,49 (с, 9H). Пример 18. Получение трет-бутилового эфира 2-[S)-2-метокси-1-метилэтил)-(2,2,2-трифторацетил)амино]-4(4-метилпиперазин-1-ил)бензойной кислоты. Раствор трет-бутилового эфира 4-фтор-2-[S)-2-метокси-1-метилэтил)-(2,2,2 трифторацетил)амино]бензойной кислоты (2 г, 5,28 ммоль) и N-метилпиперазина (5,86 мл, 52,8 ммоль) в тетрагидрофуране (20 мл) перемешивали при 60C в течение 7 дней. Раствор затем упаривали, добавляли насыщенный раствор NaHCO3 и смесь экстрагировали дихлорметаном (3 раза). Органический слой промывали водой, насыщенным раствором соли, сушили над сульфатом натрия, фильтровали и упаривали,- 24017852 получая при этом сырой продукт, который очищали колоночной хроматографией на силикагеле (смесь 93:7 дихлорметан-метанол). Указанное в заголовке соединение (2,04 г, 84%) получали в виде желтоватого твердого вещества. 1H ЯМР (400 МГц),(м.д., ДМСО-d6): (смесь таутомеров) 7,81 (д, J=9,15 Гц, 1H), 7,06 (дд,J1=9,15 Гц, J2=2,56 Гц, 1H), 6,79 (д, J=2,56 Гц, 1H), 4,80 (м, 1H), 3,39 (м, 2H), 3,34-3,28 (м, 7H), 2,55 (м,4H), 2,29 (ушир. с, 3H), 1,46 (с, 9H), 0,83 (д, 3H). С применением аналогичного способа получали нижеследующие соединения. трет-Бутиловый эфир 2-[R)-2-метокси-1-метилэтил)-(2,2,2-трифторацетил)амино]-4-(4 метилпиперазин-1-ил)бензойной кислоты. 1(д, J=2,8 Гц, 1H), 4,40-4,31 (м, 1H), 3,59-3,39 (м, 4H), 3,23 (с, 3H), 3,22-3,15 (м, 1H), 3,00 (с, 3H), 2,40 (м,2H), 2,19 (ушир. с, 6H), 1,46 (с, 9H). Пример 19. Получение трифторацетата 2-[S)-2-метокси-1-метилэтил)-(2,2,2-трифторацетил)амино]-4-(4 метилпиперазин-1-ил)бензойной кислоты. К раствору трет-бутилового эфира 2-[S)-2-метокси-1-метилэтил)-(2,2,2-трифторацетил)амино]-4(4-метилпиперазин-1-ил)бензойной кислоты (2,03 г, 4,42 ммоль) в дихлорметане (15 мл) добавляли трифторуксусную кислоту (3,4 мл, 44,2 ммоль). Смесь перемешивали при комнатной температуре в течение 15 ч, затем раствор упаривали досуха, получая при этом указанное в заголовке соединение в виде масла, которое применяли для следующей стадии без какой-либо дополнительной очистки. 1H ЯМР (400 МГц),(м.д., ДМСО-d6): (смесь таутомеров) 12,10 (ушир. с, 1H), 9,74 (ушир. с, 1H),7,90 (д, J=8,90 Гц, 1H), 7,15 (дд, J1=8,90 Гц, J2=2,56 Гц, 1H), 6,89 (д, J=2,56 Гц, 1H), 4,76 (м, 1H), 4,03 (т,2H), 3,55 (м, 2H), 3,37 (м, 2H), 3,30 (с, 3H), 3,18 (м, 2H), 2,88 (ушир. с, 3H), 0,85 (д, 3H). С применением аналогичного способа получали нижеследующие соединения. Трифторацетат 2-[R)-2-метокси-1-метилэтил)-(2,2,2-трифторацетил)амино]-4-(4-метилпиперазин 1-ил)бензойной кислоты. 1 4-(4-Метилпиперазин-1-ил)-2-нитробензойную кислоту (5,54 г, 18,37 ммоль) в сухом тетрагидрофуране (100 мл) обрабатывали 0,070 мл N,N-диметилформамида с последующей обработкой неразбавленным тионилхлоридом (5,5 мл, 76,43 ммоль) и смесь кипятили с обратным холодильником в течение 3 ч. Летучие компоненты затем удаляли выпариванием при пониженном давлении и твердое вещество многократно растворяли в безводном толуоле (3100 мл) и упаривали. Таким образом, полученный желтый хлорангидрид кислоты тщательно сущили в вакууме при комнатной температуре, затем суспендировали в сухом тетрагидрофуране (100 мл) и обрабатывали суспензией 5-бензолсульфонилиндазол-3-иламина(2,11 г, 7,71 ммоль) и N,N-диизопропилэтиламина (6,3 мл, 36,74 ммоль). Реакционную смесь перемешивали при 60C (температура масляной бани) в течение 22 ч. Образовавшийся почти прозрачный раствор охлаждали до комнатной температуры и летучие компоненты удаляли выпариванием. Остаток обрабатывали тетрагидрофураном (100 мл), метанолом (100 мл) и 2 н. NaOH (30 мл). После перемешивания при комнатной температуре в течение 2 ч органические растворители удаляли выпариванием. pH водной фазы регулировали до 7,5 и экстрагировали несколько раз дихлорметаном. Беловатое твердое вещество,присутствующее между водным и органическим слоями, которое не могли растворить дихлорметаном,отделяли фильтрованием, получая при этом 0,4 г сырого продукта. Объединенные органические экстракты сушили над сульфатом натрия и упаривали, получая при этом 4,2 г сырого продукта. Очистка как отфильтрованного твердого вещества, так и органического экстракта флэш-хроматографией на силикагеле(элюент смесь дихлорметан/метанол/33% NH4OH в отношении 9:1:0,1) давала 0,9 г выделенного 5-бензолсульфонилиндазол-3-амина и 1,71 г указанного в заголовке соединения в виде желтого твердого вещества (выход 43%). 1H ЯМР (400 МГц),(м.д., ДМСО-d6): 13,27 (ушир. с, 1H), 11,19 (ушир. с, 1H), 8,61 (м, 1H), 7,91 (м,2H), 7,79 (дд, J1=8,90 Гц, J2=1,83 Гц, 1H), 7,57-7,72 (м, 5H), 7,47 (д, J=2,5 Гц, 1H), 7,27 (дд, J1=9,15 Гц,J2=2,5 Гц, 1H), 2,36 (м, 4H), 2,45 (м, 4H), 2,23 (с, 3H). С применением аналогичного способа получали нижеследующие соединения.(1,71 г,3,29 ммоль) суспендировали в смеси тетрагидрофурана (17 мл), этанола (33 мл), воды (25 мл) и циклогексена (17 мл), обрабатывали 10% палладием-на-угле и перемешивали при кипячении с обратным холодильником. Спустя 2 ч реакционную смесь охлаждали до комнатной температуры и фильтровали через целит, тщательно промывая тетрагидрофураном. Упаривание фильтрата и очистка сырого продукта флэш-хроматографией на силикагеле (элюент дихлорметан/метанол/33% NH4OH в отношении 95:5:1) давала 1,39 г указанного в заголовке соединения в виде желтого порошка (выход 86%). 1H ЯМР (400 МГц),(м.д., ДМСО-d6): 13,17 (ушир. с, 1H), 10,36 (ушир. с, 2H), 8,45 (ушир. с, 1H),7,92 (м, 2H), 7,77 (дд, J1=8,78 Гц, J2=1,70 Гц, 1H), 7,73 (д, J=9,03 Гц, 1H), 7,55-7,67 (м, 4H), 6,57 (ушир. с,2H), 6,26 (дд, J1=9,03 Гц, J2=2,32 Гц, 1H), 6,19 (д, J=2,32 Гц, 1H), 3,21 (м, 4H), 2,42 (м, 4H), 2,21 (с, 3H). С применением аналогичного способа получали нижеследующие соединения. 2-Амино-N-[5-(3,5-дифторбензолсульфонил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)бензамид(258 мг, 2 ммоль). Реакционную смесь перемешивали при комнатной температуре на протяжении ночи,затем обрабатывали дополнительным хлорангидридом кислоты (258 мг) и N,N-диизопропилэтиламином(0,35 мл). После 2 ч растворитель удаляли при пониженном давлении и сырой продукт растворяли в тетрагидрофуране (30 мл) и обрабатывали 2 н. NaOH (10 мл). После перемешивания на протяжении ночи растворитель удаляли и твердое вещество отделяли фильтрованием и тщательно промывали водой. Сырой продукт очищали флэш-хроматографией на силикагеле (элюент этилацетат/метанол/водный 33%NH4OH в отношении 9:1:0,1), получая при этом 60 мг указанного в заголовке соединения. 1(с, 1H), 8,61 (д, J=1,10 Гц, 1H), 8,39 (д, J=2,56 Гц, 1H), 8,07 (д, J=9,15 Гц, 1H), 7,93-7,97 (м, 2H), 7,85 (дд,J1=8,90 Гц, J2=1,70 Гц, 1H), 7,69 (д, J=8,90 Гц, 1H), 7,65 (м, 1H), 7,58 (м, 2H), 7,01 (м, 1H), 6,76 (м, 1H),6,73 (м, 1H), 6,17 (м, 1H), 3,35 (м, 4H), 2,48 (м, 4H), 2,25 (с, 3H). С применением аналогичного способа получали нижеследующие соединения. 2-Амино-N-(5-бензолсульфонил-1H-индазол-3-ил)-4-(4-метилпиперазин-1-ил)бензамид (245 мг,0,5 ммоль) растворяли в дихлорметане (5 мл) и трифторуксусной кислоте (0,77 мл, 10 ммоль), обрабатывали сначала тетрагидропиран-4-оном (0,055 мл, 0,6 ммоль) и затем триацетоксиборгидридом тетраметиламмония (197 мг, 0,75 ммоль). Реакционную смесь перемешивали при комнатной температуре на протяжении ночи, затем добавляли дополнительный кетон (0,055 мл, 0,6 ммоль) и гидрид (2 порции: сначала 197 мг и после 2 ч 50 мг). После дополнительного перемешивания на протяжении ночи летучие компоненты удаляли при пониженном давлении. Добавляли дихлорметан и органическую фазу промывали водным гидрокарбонатом натрия, сушили над сульфатом натрия и упаривали. Сырой продукт очищали флэш-хроматографией на силикагеле (элюент дихлорметан/метанол/33% NH4OH в отношении 95:5:1),получая при этом 186 мг продукта, все же содержащего некоторое количество примесей. Дополнительная очистка препаративной ВЭЖХ (основный способ) дала 80 мг указанного в заголовке соединения. 1H ЯМР (400 МГц),(м.д., ДМСО-d6): 13,22 (ушир. с, 1H), 10,44 (ущир. с, 1H), 8,41 (ушир. с, 1H),8,29 (д, J=7,81 Гц, 1H), 7,95 (м, 2H), 7,83 (м, 2H), 7,58-7,70 (м, 4H), 6,29 (дд, J1=9,03 Гц, J2=2,07 Гц, 1H),6,18 (д, J=2,07 Гц, 1H), 3,82-3,88 (м, 2H), 3,74 (м, 1H), 3,54 (м, 2H), 3,28-3,32 (м, 4H), 2,46 (м, 4H), 2,68 (с,3H), 1,99 (м, 2H), 1,40 (м, 2H). С применением аналогичного способа получали нижеследующее соединение.[(XXI),R1=R2=R3=H, R = 3-фторфенил]. Суспензию 5-(3-фторбензолсульфонил)-1H-индазол-3-иламина (15,35 г, 52,69 ммоль) в сухом дихлорметане (200 мл) обрабатывали трифторуксусным ангидридом (23 мл, 163,4 ммоль) и перемешивали на протяжении ночи при комнатной температуре. Раствор упаривали, обрабатывали этилацетатом и водным гидрокарбонатом натрия. Органическую фазу отделяли и водную фазу дополнительно экстрагировали этилацетатом. Объединенные органические экстракты сушили и упаривали. Твердое вещество растирали с небольшим количеством дихлорметана и фильтровали, получая при этом 18 г (88,3%) указанного в заголовке соединения в виде белого порошка. 1
МПК / Метки
МПК: A61K 31/4162, A61P 35/00
Метки: производные, киназ, индазолов, активные, качестве, замещенных, ингибиторов
Код ссылки
<a href="https://eas.patents.su/30-17852-proizvodnye-zameshhennyh-indazolov-aktivnye-v-kachestve-ingibitorov-kinaz.html" rel="bookmark" title="База патентов Евразийского Союза">Производные замещенных индазолов, активные в качестве ингибиторов киназ</a>
Предыдущий патент: Prlr-специфическое антитело и его применения
Следующий патент: Комбинации биологически активных веществ
Случайный патент: Способ модулирования рецептора gpr119, сопряженного с g-белком, и используемые при этом соединения












