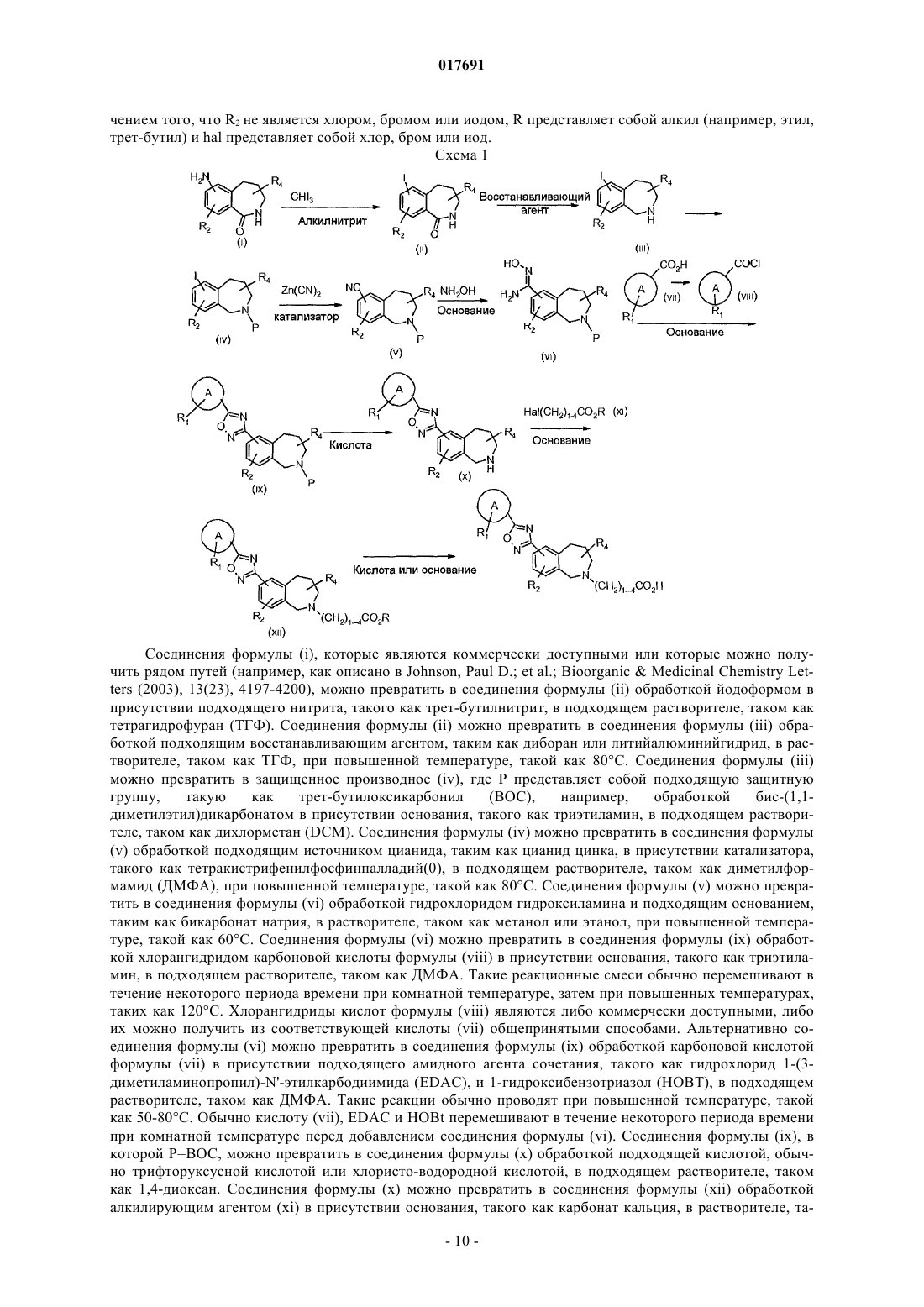
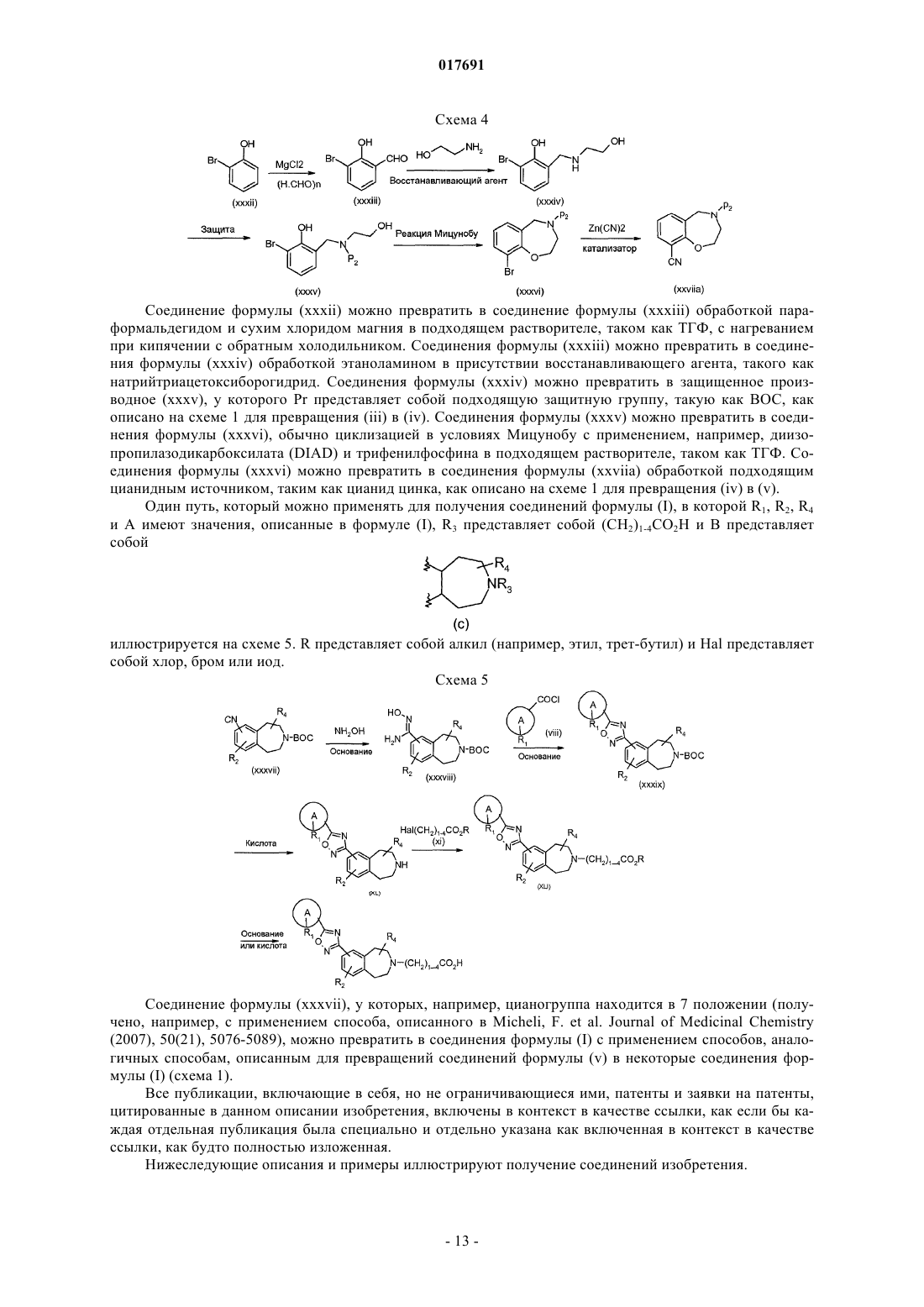
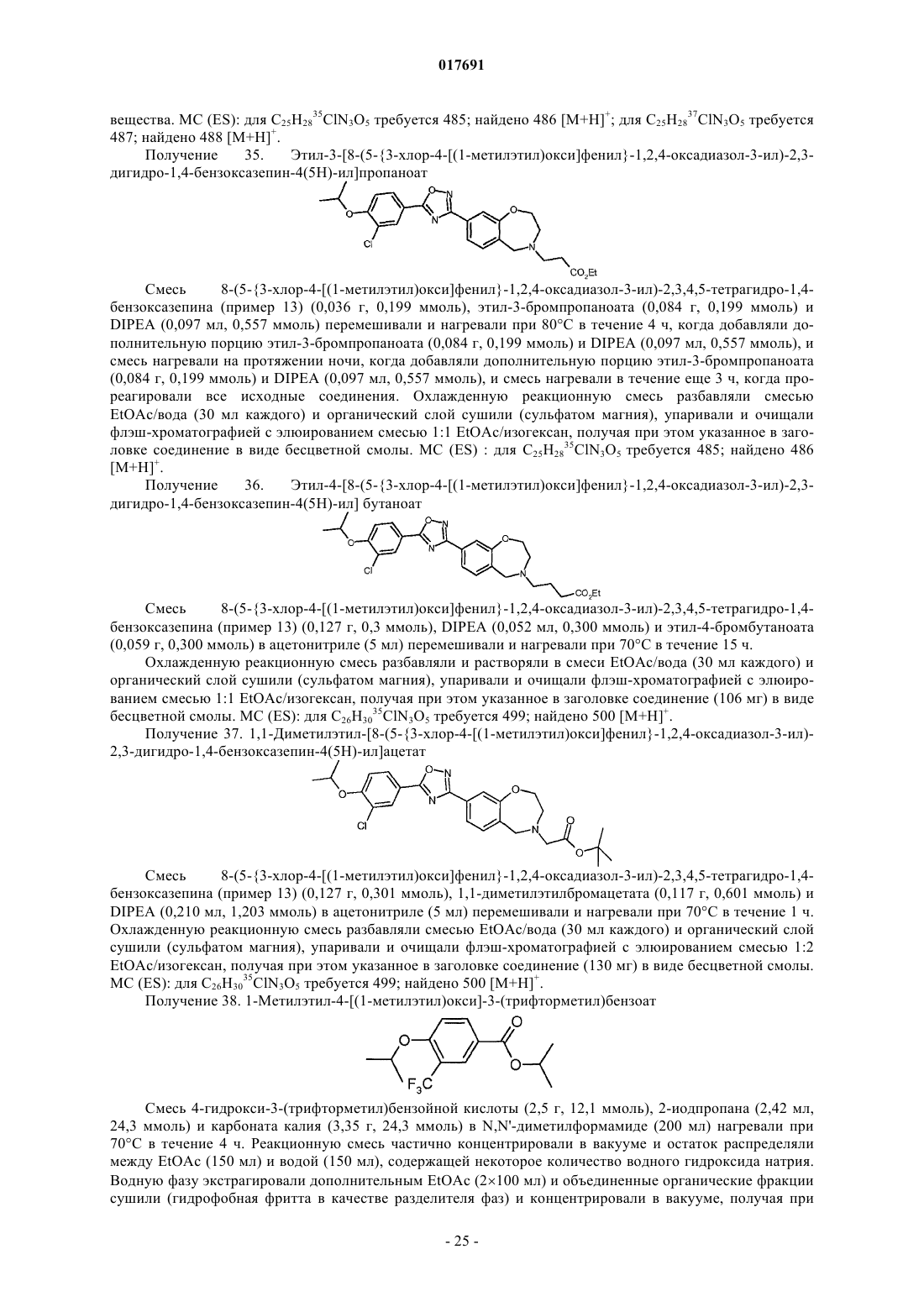
Производные оксадиазола, активные в отношении сфингозин-1-фосфата (s1p)
Номер патента: 17691
Опубликовано: 28.02.2013
Авторы: Джонсон Кристофер Норберт, Демон Эмманюэль Юбер, Хейтман Томас Дэниел, Визерингтон Джейсон, Скидмор Джон, Уолл Айан Дэвид, Херст Дэвид Найджел, Хир Джаг Пол
Формула / Реферат
1. Соединение формулы (I) или его фармацевтически приемлемая соль
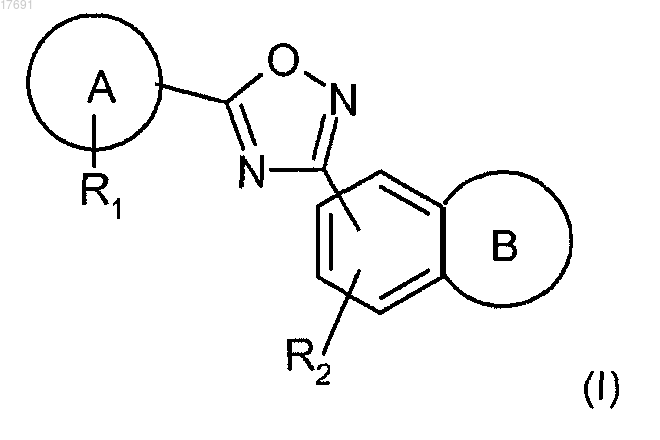
в которой А представляет собой фенил или пиридинил;
R1 представляет собой от одного до двух заместителей, независимо выбранных из галогена, С(1-3)алкокси, С(1-3)фторалкила, циано, незамещенного фенила;
R2 представляет собой водород;
В представляет собой 7-членное насыщенное кольцо, выбранное из колец (а), (b), (с)
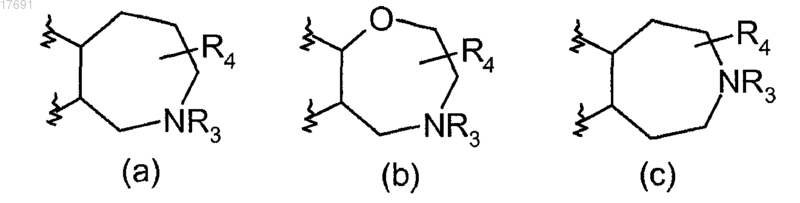
R3 представляет собой водород или (СН2)1-4CO2H;
R4 представляет собой водород.
2. Соединение формулы (I) или его фармацевтически приемлемая соль по п.1,
в которой А представляет собой фенил;
R1 представляет собой от одного до двух заместителей, независимо выбранных из хлора, изопропокси и циано;
R2 представляет собой водород;
В представляет собой кольцо (а);
R3 представляет собой водород или (СН2)1-3CO2H;
R4 представляет собой водород.
3. Соединение формулы (I) или его фармацевтически приемлемая соль по п.1,
в которой А представляет собой фенил или пиридинил;
R1 представляет собой от одного до двух заместителей, независимо выбранных из хлора, изопропокси и циано;
R2 представляет собой водород;
В представляет собой кольцо (b);
R3 представляет собой водород или (СН2)1-4CO2H;
R4 представляет собой водород.
4. Соединение формулы (I) или его фармацевтически приемлемая соль по п.1,
в которой А представляет собой фенил или пиридинил;
R1 представляет собой от одного до двух заместителей, независимо выбранных из хлора, метокси, изопропокси, трифторметила, фенила и циано;
R2 представляет собой водород;
В представляет собой кольцо (с);
R3 представляет собой водород или (СН2)1-3СО2Н;
R4 представляет собой водород.
5. Соединение по п.1, выбранное из
7-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2,3,4,5-тетрагидро-1Н-2-бензазепина;
[7-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-1,3,4,5-тетрагидро-2Н-2-бензазепин-2-ил]уксусной кислоты;
2-[(1-метилэтил)окси]-5-[3-(2,3,4,5-тетрагидро-1Н-2-бензазепин-7-ил)-1,2,4-оксадиазол-5-ил]бензонитрила;
[7-(5-{3-циано-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-1,3,4,5-тетрагидро-2Н-2-бензазепин-2-ил]уксусной кислоты;
4-[7-(5-{3-циано-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-1,3,4,5-тетрагидро-2Н-2-бензазепин-2-ил]бутановой кислоты;
3-[7-(5-{3-циано-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-1,3,4,5-тетрагидро-2Н-2-бензазепин-2-ил]пропановой кислоты;
2-[(1-метилэтил)окси]-5-[3-(2,3,4,5-тетрагидро-1Н-3-бензазепин-6-ил)-1,2,4-оксадиазол-5-ил]бензонитрила;
6-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2,3,4,5-тетрагидро-1Н-3-бензазепина;
3-[6-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-1,2,4,5-тетрагидро-3Н-3-бензазепин-3-ил]пропановой кислоты;
[6-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-1,2,4,5-тетрагидро-3Н-3-бензазепин-3-ил]уксусной кислоты;
6-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2,3,4,5-тетрагидро-1Н-2-бензазепина;
[6-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-1,3,4,5-тетрагидро-2Н-2-бензазепин-2-ил]уксусной кислоты;
8-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2,3,4,5-тетрагидро-1,4-бензоксазепина;
3-[8-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2,3-дигидро-1,4-бензоксазепин-4(5Н)-ил]пропановой кислоты;
4-[8-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2,3-дигидро-1,4-бензоксазепин-4(5Н)-ил]бутановой кислоты;
[8-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2,3-дигидро-1,4-бензоксазепин-4(5Н)-ил]уксусной кислоты;
7-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2,3,4,5-тетрагидро-1Н-3-бензазепина;
2-[(1-метилэтил)окси]-5-[3-(2,3,4,5-тетрагидро-1Н-3-бензазепин-7-ил)-1,2,4-оксадиазол-5-ил]бензонитрила;
7-{5-[4-[(1-метилэтил)окси]-3-(трифторметил)фенил]-1,2,4-оксадиазол-3-ил}-2,3,4,5-тетрагидро-1Н-3-бензазепина;
7-{5-[2-(трифторметил)-4-бифенилил]-1,2,4-оксадиазол-3-ил}-2,3,4,5-тетрагидро-1Н-3-бензазепина;
3-[7-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-1,2,4,5-тетрагидро-3Н-3-бензазепин-3-ил]пропановой кислоты;
[7-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-1,2,4,5-тетрагидро-3Н-3-бензазепин-3-ил]уксусной кислоты;
[7-(5-{3-циано-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-1,2,4,5-тетрагидро-3Н-3-бензазепин-3-ил]уксусной кислоты;
(7-{5-[4-[(1-метилэтил)окси]-3-(трифторметил)фенил]-1,2,4-оксадиазол-3-ил}-1,2,4,5-тетрагидро-3Н-3-бензазепин-3-ил)уксусной кислоты;
(7-{5-[2-(трифторметил)-4-бифенилил]-1,2,4-оксадиазол-3-ил}-1,2,4,5-тетрагидро-3Н-3-бензазепин-3-ил)уксусной кислоты;
4-[7-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-1,2,4,5-тетрагидро-3Н-3-бензазепин-3-ил]бутановой кислоты;
4-[7-(5-{3-циано-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-1,2,4,5-тетрагидро-3Н-3-бензазепин-3-ил]бутановой кислоты;
4-(7-{5-[4-[(1-метилэтил)окси]-3-(трифторметил)фенил]-1,2,4-оксадиазол-3-ил}-1,2,4,5-тетрагидро-3Н-3-бензазепин-3-ил)бутановой кислоты;
4-(7-{5-[2-(трифторметил)-4-бифенилил]-1,2,4-оксадиазол-3-ил}-1,2,4,5-тетрагидро-3Н-3-бензазепин-3-ил)бутановой кислоты;
2-(метилокси)-5-[3-(2,3,4,5-тетрагидро-1Н-3-бензазепин-7-ил)-1,2,4-оксадиазол-5-ил]бензонитрила;
9-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2,3,4,5-тетрагидро-1,4-бензоксазепина;
2-[(1-метилэтил)окси]-5-[3-(2,3,4,5-тетрагидро-1,4-бензоксазепин-9-ил)-1,2,4-оксадиазол-5-ил]бензонитрила;
4-[9-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2,3-дигидро-1,4-бензоксазепин-4(5Н)-ил]бутановой кислоты;
4-[9-(5-{3-циано-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2,3-дигидро-1,4-бензоксазепин-4(5Н)-ил]бутановой кислоты;
2-[(1-метилэтил)окси]-5-[3-(2,3,4,5-тетрагидро-1,4-бензоксазепин-7-ил)-1,2,4-оксадиазол-5-ил]бензонитрила;
гидрохлорида 7-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2,3,4,5-тетрагидро-1,4-бензоксазепина;
3-[7-(5-{3-циано-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2,3-дигидро-1,4-бензоксазепин-4(5Н)-ил]пропановой кислоты;
3-[7-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2,3-дигидро-1,4-бензоксазепин-4(5Н)-ил]пропановой кислоты;
4-[7-(5-{3-циано-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2,3-дигидро-1,4-бензоксазепин-4(5Н)-ил]бутановой кислоты;
4-[7-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2,3-дигидро-1,4-бензоксазепин-4(5Н)-ил]бутановой кислоты;
2-[(1-метилэтил)окси]-5-[3-(2,3,4,5-тетрагидро-1,4-бензоксазепин-8-ил)-1,2,4-оксадиазол-5-ил]бензонитрила;
4-[8-(5-{3-циано-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2,3-дигидро-1,4-бензоксазепин-4(5Н)-ил]бутановой кислоты;
5-[9-(5-{3-циано-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2,3-дигидро-1,4-бензоксазепин-4(5Н)-ил]пентановой кислоты;
[9-(5-{3-циано-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2,3-дигидро-1,4-бензоксазепин-4(5Н)-ил]уксусной кислоты;
3-[9-(5-{5-хлор-6-[(1-метилэтил)окси]-3-пиридинил}-1,2,4-оксадиазол-3-ил)-2,3-дигидро-1,4-бензоксазепин-4(5Н)-ил]пропановой кислоты;
3-[9-(5-{3-циано-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2,3-дигидро-1,4-бензоксазепин-4(5Н)-ил]пропановой кислоты;
3-[9-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2,3-дигидро-1,4-бензоксазепин-4(5Н)-ил]пропановой кислоты;
формиата 2-[(1-метилэтил)окси]-5-[3-(2,3,4,5-тетрагидро-1Н-3-бензазепин-7-ил)-1,2,4-оксадиазол-5-ил]-3-пиридинкарбонитрила;
гидрохлорида 7-(5-{5-хлор-6-[(1-метилэтил)окси]-3-пиридинил}-1,2,4-оксадиазол-3-ил)-2,3,4,5-тетрагидро-1Н-3-бензазепина;
4-[7-(5-{5-хлор-6-[(1-метилэтил)окси]-3-пиридинил}-1,2,4-оксадиазол-3-ил)-1,2,4,5-тетрагидро-3Н-3-бензазепин-3-ил]бутановой кислоты
и их фармацевтически приемлемых солей.
6. Соединение по п.1, которое представляет собой 4-[7-(5-{3-циано-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-1,2,4,5-тетрагидро-3Н-3-бензазепин-3-ил]бутановую кислоту или ее фармацевтически приемлемую соль.
7. Соединение по п.1, которое представляет собой 4-[9-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2,3-дигидро-1,4-бензоксазепин-4(5Н)-ил]бутановую кислоту или ее фармацевтически приемлемую соль.
8. Применение соединения по любому из пп.1-7 для лечения состояния или нарушения, опосредуемого рецепторами S1P1, где состоянием или нарушением является рассеянный склероз.
9. Применение соединения по любому из пп.1-7 для изготовления лекарственного средства для лечения состояний или нарушений, опосредуемых рецепторами S1P1.
10. Применение по п.9, где состоянием или нарушением является рассеянный склероз, аутоиммунные заболевания, хронические воспалительные нарушения, астма, воспалительные невропатии, артрит, трансплантация, болезнь Крона, неспецифический язвенный колит, красная волчанка, псориаз, реперфузионное повреждение при ишемии, солидные опухоли и метастаз опухолей, заболевания, связанные с развитием кровеносных сосудов, васкулярные заболевания, болезненные (болевые) состояния, острые вирусные заболевания, воспалительные заболевания кишечника, инсулинзависимый и инсулиннезависимый диабет.
11. Применение по п.10, где состоянием является красная волчанка.
12. Способ лечения состояния или нарушения у млекопитающих, в том числе у людей, которое может быть опосредовано рецепторами S1P1, включающий введение страдающему заболеванием пациенту терапевтически безопасного и эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, где состоянием или нарушением является рассеянный склероз.
Текст
Настоящая заявка относится к производным оксадиазола формулы (I), активным в отношении сфингозин-1-фосфата (S1P) и особенно применимым для лечения красной волчанки. В формуле А представляет собой фенил или 6-членное кольцо гетероарила; R1 представляет собой до двух заместителей, независимо выбранных из галогена, С(1-3)алкокси, С(1-3)фторалкила, циано,необязательно замещенного фенила; R2 представляет собой водород; В представляет собой 7 членное насыщенное кольцо, выбранное из следующих формул (а), (b) и (с), R3 представляет собой водород или (СН 2)1-4MCO2H; R4 представляет собой водород.(71)(73) Заявитель и патентовладелец: ГЛЭКСО ГРУП ЛИМИТЕД (GB) 017691 Настоящее изобретение относится к новым производным оксадиазола, обладающим фармакологической активностью, способам их получения, содержащим их фармацевтическим композициям и их применению при лечении различных нарушений. Сфингозин-1-фосфат (S1P) является биологически активным липидным медиатором, образуемым фосфорилированием сфингозина сфингозинкиназами, и обнаружен в крови при высоких уровнях. Он продуцируется и секретируется рядом типов клеток, включающих в себя клетки гемопоэтического происхождения, такие как тромбоциты и тучные клетки (Okamoto et al., 1998, J. Biol. Chem. 273(42): 27104;Sanchez and Hla 2004, J. Cell. Biochem. 92:913). Он обладает широким спектром биологических действий,включающих в себя регуляцию пролиферации, дифференциации, подвижности клеток, васкуляризации и активации воспалительных клеток и тромбоцитов (Pyne and Pyne 2000, Biochem J. 349: 385). Описано пять подтипов S1P-восприимчивых рецепторов, S1P1 (Edg-1), S1P2 (Edg-5), S1P3 (Edg-3), S1P4 (Edg-6) иS1P5 (Edg-8), образующих часть связанных с G-белком семейства рецепторов гена эндотелиальной дифференциации (Chun et al., 2002, Pharmacological Reviews 54:265, Sanchez and Hla 2004, J. Cellular Biochemistry, 92:913). Эти 5 рецепторов обнаруживают дифференциальную экспрессию мРНК, причем S1P1-3 экспрессируется широко, S1P4 экспрессируется на лимфоидных и гемопоэтических тканях и S1P5 в основном экспрессируется в головном мозге и в меньшей степени в селезенке. Они передают сигнал через различные субпопуляции G-белка для стимуляции множества биологических реакций (Kluk and Hla,2002, Biochem et Biophysica Acta, 1582:72, Sanchez and Hla, 2004, J. Cellular Biochem, 92:913). Предположительные роли рецептора S1P1 включают в себя направленную миграцию лимфоцитов,индукцию/подавление цитокинов и воздействия на эндотелиальные клетки (Rosen and Goetzl, 2005, Nat.Rev. Immunol. 5:560). Агонисты рецептора S1P1 применяли в ряде животных моделей аутоиммунных реакций и трансплантаций, включающих в себя модели экспериментального аутоиммунного энцефаломиелита (ЕАЕ), для уменьшения тяжести индуцированного заболевания (Brinkman et al., 2003, JBC,277:21453; Fujino et al., 2003, J. Pharmacol. Exp. Ther. 305:70; Webb et al., 2004, J. Neuroimmunol, 153:108;Rausch et al., 2004, J. Magn. Reson. Imaging, 20:16). Описано, что эта активность опосредуется действием агонистов S1P1 на циркуляцию лимфоцитов через лимфатическую систему. Обработка агонистами S1P1 приводит к секвестрации лимфоцитов во вторичных лимфатических органах, таких как лимфатические узлы, индуцирующие обратимую периферическую лимфопению у животных моделей (Chiba et al., 1998,J. Immunology, 160:5037, Forrest et al., 2004, J. Pharmacol. Exp. Ther., 309:758; Sanna et al., 2004, JBC,279:13839). Опубликованные данные по агонистам позволяют предположить, что обработка соединением индуцирует потерю рецептора S1P1 с поверхности клеток посредством интернализации (Graler andGoetzl, 2004, FASEB, J., 18:551; Matloubian et al., 2004, Nature, 427:355; Jo et al., 2005, Chem. Biol. 12:703) и именно это уменьшение рецептора S1P1 на иммунных клетках способствует уменьшению движения Тклеток от лимфатических узлов обратно в кровоток. Делеция гена S1P1 вызывает эмбриональную летальность. Эксперименты по изучению роли рецептора S1P1 в миграции и направленной миграции лимфоцитов включали в себя адоптивный перенос Тклеток с дефицитом меченого S1P1 в организм облученных мышей дикого типа. Эти клетки показывали уменьшенный выход из вторичных лимфатических органов (Matloubian et al., 2004, Nature, 427:355).S1P1 приписывалась также роль в модуляции соединения эндотелиальных клеток (Allende et al.,2003, 102:3665, Blood Singelton et al., 2005, FASEB J. 19:1646). Что касается этого эндотелиального действия, было описано, что агонисты S1P1 обладают действием на выделенные лимфатические узлы, что может содействовать роли в модуляции иммунных нарушений. Агонисты S1P1 вызывали закрытие эндотелиальных, относящихся к строме "ворот" лимфатических синусов, которые дренируют лимфатические узлы и предотвращают выход лимфоцитов (Wei et al., 2005, Nat. Immunology 6:1228). Было показано, что иммуносупрессивное соединение FTY720 (JP11080026-A) снижает циркуляцию лимфоцитов у животных и человека, обладает модулирующей заболевание активностью на животных моделях иммунных нарушений и снижает скорости ремиссии при уменьшении рецидивов рассеянного склероза (Brinkman et al., 2002, JBC, 277:21453, Mandala et al., 2002, Science, 296:346, Fujino et al., 2003, J.Pharmacology and Experimental Therapeutics, 305:45658, Brinkman et al., 2004, American J. Transplantation 4:1019, Webb et al., 2004, J. Neuroimmunology, 153:108, Morris et al., 2005, Eur. J. Immunol. 35:3570, Chiba,2005, Pharmacology and Therapeutics, 108:308, Kahan et al., 2003, Transplantation, 76:1079, Kappos et al.,2006, New Eng J. Medicine, 335:1124). Это соединение является пролекарством, которое фосфорилируетсяin vivo сфингозинкиназами с образованием молекулы, которая обладает активностью агониста в отношении рецепторов S1P1, S1P3, S1P4 и S1P5. Клинические исследования показали, что лечение FTY720 приводит к брадикардии в первые 24 ч лечения (Kappos et al., 2006, New Eng. J. Medicine, 335:1124). На основании ряда экспериментов, проведенных на клетках и животных, считается, что брадикардия является результатом агонизма в отношении рецептора S1P3. Они включают применение животных с дефицитомS1P3, которые в отличие от мышей дикого типа не обнаруживают брадикардию после введения FTY720 и применения S1P1-селективных соединений (Hale et al., 2004, BioorganicMedicinal Chemistry Letters 14:3501, Sanna et al., 2004, JBC, 279:13839, Koyrakh et al., 2005, American J. Transplantation, 5:529). Поэтому существует потребность в соединениях-агонистах в отношении S1P1 с селективностью по сравнению с S1P3, которые, как можно предполагать, проявляют уменьшенную тенденцию индуциро-1 017691 вать брадикардию. В следующих заявках на патенты описаны производные оксадиазола в качестве агонистов S1P1:WO 03/105771, WO 05/058848, WO 06/047195, WO 06/100633, WO 06/115188, WO 06/131336, WO 07/024922 и WO 07/116866. В следующих заявках на патенты описаны производные тетрагидроизохинолинилоксадиазола в качестве агонистов S1P1: WO 06/064757, WO 06/001463, WO 04/113330. В WO 08/064377 описаны бензоциклогептилсоединения, обладающие активностью в отношении рецептора S1P1. Теперь обнаружен структурно новый класс соединений, которые являются агонистами рецептораS1P1. Настоящее изобретение относится к соединениям формулы (I) или их фармацевтически приемлемым солям А представляет собой фенил или 5- или 6-членное кольцо гетероарила;R1 представляет собой до двух заместителей, независимо выбранных из галогена, С(1-3)алкокси, С(1-3) фторалкила, циано, необязательно замещенного фенила, С(1-3)фторалкокси, С(1-6)алкила и С(3-6)циклоалкила;R2 представляет собой водород, галоген или С(1-4)алкил; В представляет собой 7-членное насыщенное кольцо, выбранное из следующих колец:R3 представляет собой водород или (СН 2)1-4 СО 2 Н;R4 представляет собой водород или С(1-3)алкил, цепь которого необязательно прерывается кислоро В одном варианте осуществления изобретения А представляет собой фенил;R1 представляет собой до двух заместителей, независимо выбранных из хлора, изопропокси и циано;R2 представляет собой водород; В представляет собой кольцо (а);R3 представляет собой водород или (СН 2)1-3CO2H;R4 представляет собой водород. В одном варианте осуществления изобретения А представляет собой фенил или пиридинил;R1 представляет собой до двух заместителей, независимо выбранных из хлора, изопропокси и циано;R2 представляет собой водород; В представляет собой кольцо (b);R3 представляет собой водород или (СН 2)1-4 СО 2 Н;R4 представляет собой водород. В одном варианте осуществления изобретения А представляет собой фенил или пиридинил;R1 представляет собой до двух заместителей, независимо выбранных из хлора, метокси, изопропокси, трифторметила, фенила и циано;R2 представляет собой водород; В представляет собой кольцо (с);R3 представляет собой водород или (CH2)1-3CO2H;R4 представляет собой водород. В одном варианте осуществления А представляет собой фенил. В другом варианте осуществления А представляет собой 3,4-дизамещенный фенил. В одном варианте осуществления R1 представляет собой два заместителя, один из которых представляет собой С(1-3)алкокси, другой выбран из галогена или циано. В другом варианте осуществления R1 представляет собой два заместителя, один из которых представляет собой изопропокси и другой выбран из хлора или циано. В другом варианте осуществления R1 представляет собой два заместителя, выбранные из хлора, изопропокси и циано. В другом варианте осуществления R1 представляет собой хлор и изопропокси. В следующем варианте осуществления R1 представляет собой хлор в 3 положении и изопропокси в 4 положении, когда А представляет собой фенил,-2 017691 или R1 представляет собой хлор в 5 положении и изопропокси в 6 положении, когда А представляет собой пиридинил. В другом варианте осуществления R1 представляет собой изопропокси и циано. В следующем варианте осуществления R1 представляет собой циано в 3 положении и изопропокси в 4 положении, когда А представляет собой фенил, или R1 представляет собой хлор в 5 положении и изопропокси в 6 положении, когда А представляет собой пиридинил. В одном варианте осуществления R2 представляет собой водород. В одном варианте осуществления В представляет собой кольцо (b). В другом варианте осуществления В представляет собой кольцо (с). В одном варианте осуществления R3 представляет собой (СН 2)1-3CO2H, в другом одном варианте осуществления R3 представляет собой (CH2)3CO2H. В одном варианте осуществления R4 представляет собой водород. Настоящее изобретение относится также к соединениям формулы (IA) или их фармацевтически приемлемым солям А представляет собой фенил или 5- или 6-членное кольцо гетероарила;R1 представляет собой до двух заместителей, независимо выбранных из галогена, С(1-3)алкокси, С(1-3) фторалкила, циано, необязательно замещенного фенила, С(1-3)фторалкокси, С(1-6)алкила и С(3-6)циклоалкила;R2 представляет собой водород, галоген или С(1-4)алкил; В представляет собой 7-членное насыщенное кольцо, выбранное из следующих колец:R3 представляет собой водород или (CH2)1-3CO2H;R4 представляет собой водород или С(1-3)алкил, цепь которого необязательно прерывается кислоро В одном варианте осуществления изобретения А представляет собой фенил и/илиR1 представляет собой до двух заместителей, независимо выбранных из хлора, изопропокси и циано; и/илиR2 представляет собой водород; и/или В представляет собой кольцо (а); и/илиR3 представляет собой водород или (СН 2)1-3 СО 2 Н; и/илиR4 представляет собой водород. В одном варианте осуществления изобретения А представляет собой фенил; и/илиR1 представляет собой до двух заместителей, независимо выбранных из хлора, изопропокси и циано; и/илиR2 представляет собой водород; и/или В представляет собой кольцо (b); и/илиR3 представляет собой водород или (СН 2)1-3 СО 2 Н; и/илиR4 представляет собой водород. В одном варианте осуществления изобретения А представляет собой фенил; и/илиR1 представляет собой до двух заместителей, независимо выбранных из хлора, метокси, изопропокси, трифторметила, фенила и циано; и/илиR2 представляет собой водород; и/или В представляет собой кольцо (с); и/илиR3 представляет собой водород или (СН 2)1-3 СО 2 Н; и/илиR4 представляет собой водород. Термин "алкил" в качестве группы или части группы, например алкокси или гидроксиалкила, относится к неразветвленной или разветвленной алкильной группе во всех ее изомерных формах. Термин-3 017691 меньшей мере 1 и самое большее 6 атомов углерода. Примеры таких алкильных групп включают в себя метил, этил, пропил, изопропил, н-бутил, изобутил, втор-бутил или трет-бутил. Примеры таких алкоксигрупп включают в себя метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси и трет-бутокси. Подходящие С(3-6)циклоалкильные группы включают в себя циклопропил, циклобутил, циклопентил и циклогексил. Применяемый в контексте термин "галоген" относится к фтору (F), хлору (Cl), брому (Br) или иоду(I) и термин "гало" относится к атому галогена: фтора (-F), хлора (-Cl), брома (-Br) и иода (-I). Термин "гетероарил" представляет собой ненасыщенное кольцо, которое содержит один или несколько гетероатомов, выбранных из О, N или S. Примеры 5- или 6-членных гетероарильных колец включают в себя пирролил, триазолил, тиадиазолил, тетразолил, имидазолил, пиразолил, изотиазолил,тиазолил, изоксазолил, оксазолил, оксадиазолил, фуразанил, фуранил, тиенил, пиридил, пиримидинил,пиразинил, пиридазинил и триазинил. В некоторых соединениях формулы (I) в зависимости от природы заместителя имеются хиральные атомы углерода и поэтому соединения формулы (I) могут существовать в виде стереоизомеров. Изобретение распространяется на все оптические изомеры, такие как стереоизомерные формы соединений формулы (I), включающие в себя энантиомеры, диастереоизомеры и их смеси, такие как рацематы. Различные стереоизомерные формы можно разделить или отщепить один от другого общепринятыми способами или любой данный изомер можно получить общепринятым стереоселективным или асимметричным синтезом. Некоторые соединения контекста могут существовать в различных таутомерных формах, и должно быть понятно, что изобретение включает в себя все такие таутомерные формы. Предполагается, что некоторые соединения изобретения содержат как кислотные, так и основные группы и поэтому могут существовать в виде цвиттерионов при некоторых величинах рН. Подходящими соединениями являются 7-(5-3-хлор-4-[(1-метилэтилокси]фенил-1,2,4-оксадиазол-3-ил)-2,3,4,5-тетрагидро-1 Н-2-бензазепин;[9-(5-3-циано-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-2,3-дигидро-1,4-бензоксазепин 4(5 Н)-ил]уксусная кислота; 3-[9-(5-5-хлор-6-[(1-метилэтил)окси]-3-пиридинил-1,2,4-оксадиазол-3-ил)-2,3-дигидро-1,4 бензоксазепин-4(5 Н)-ил]пропановая кислота; 3-[9-(5-3-циано-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-2,3-дигидро-1,4-бензоксазепин-4(5 Н)-ил]пропановая кислота; 3-[9-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-2,3-дигидро-1,4-бензоксазепин-4(5 Н)-ил]пропановая кислота; формиат 2-[(1-метилэтил)окси]-5-[3-(2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)-1,2,4-оксадиазол-5 ил]-3-пиридинкарбонитрила; гидрохлорид 7-(5-5-хлор-6-[(1-метилэтил)окси]-3-пиридинил-1,2,4-оксадиазол-3-ил)-2,3,4,5 тетрагидро-1 Н-3-бензазепина; 4-[7-(5-5-хлор-6-[(1-метилэтил)окси]-3-пиридинил-1,2,4-оксадиазол-3-ил)-1,2,4,5-тетрагидро-3 Н 3-бензазепин-3-ил]бутановая кислота или их фармацевтически приемлемые соли. В одном варианте осуществления изобретения соединением формулы (I) является 4-[7-(5-3-циано-5 017691 4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-1,2,4,5-тетрагидро-3 Н-3-бензазепин-3-ил]бутановая кислота или ее фармацевтически приемлемая соль. В другом варианте осуществления изобретения соединением формулы (I) является 4-[9-(5-3-хлор 4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-2,3-дигидро-1,4-бензоксазепин-4(5 Н)-ил]бутановая кислота или ее фармацевтически приемлемая соль. Фармацевтически приемлемые производные соединений формулы (I) включают в себя любую фармацевтически приемлемую соль, сложный эфир или соль такого сложного эфира соединения формулы(I), которые при введении реципиенту способны образовывать (непосредственно или опосредованно) соединение формулы (I) или его активный метаболит или остаток. Соединения формулы (I) могут образовывать соли. Должно быть понятно, что для применения в терапии соли соединений формулы (I) должны быть фармацевтически приемлемыми. Подходящие фармацевтически приемлемые соли должны быть известны специалисту в данной области и включают в себя соли, описанные в J. Pharm. Sci, 1977, 66, 1-19, такие как кислотно-аддитивные соли, образованные с неорганическими кислотами, например хлористо-водородной, бромисто-водородной, серной, азотной или фосфорной кислотой; и органическими кислотами, такими как янтарная, малеиновая, уксусная, фумаровая, лимонная, винная, бензойная, п-толуолсульфоновая, метансульфоновая или нафталинсульфоновая кислота. Некоторые из соединений формулы (I) могут образовывать кислотно-аддитивные соли с одним или несколькими эквивалентами кислоты. Настоящее изобретение включает в свой объем все возможные стехиометрические и нестехиометрические формы. Соли можно также получить из фармацевтически приемлемых оснований, включающих в себя неорганические основания и органические основания. Соли,полученные из неорганических оснований, включают в себя соли алюминия, аммония, кальция, меди,железа(III), железа(II), лития, магния, марганца(III), марганца(II), калия, натрия, цинка и тому подобное. Соли, образованные из фармацевтически приемлемых органических оснований, включают в себя соли первичных, вторичных и третичных аминов; замещенных аминов, включающих в себя встречающиеся в природе замещенные амины; и циклические амины. Конкретные фармацевтически приемлемые органические основания включают в себя аргинин, бетаин, кофеин, холин, N,N'-дибензилэтилендиамин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, Nэтилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лизин, метилглюкамин,морфолин, пиперазин, пиперидин, прокаин, пурины, теобромин, триэтиламин, триметиламин, трипропиламин, трис(гидроксиметил)аминометан (TRIS, трометамол) и тому подобное. Соли можно также получить из основных ионообменных смол, например полиаминных, смол. Когда соединение настоящего изобретения является основным, соли можно получить из фармацевтически приемлемых кислот, включающих в себя неорганические и органические кислоты. Такие кислоты включают в себя уксусную, бензолсульфоновую, бензойную, камфорасульфоновую, лимонную, этансульфоновую, этандисульфоновую,фумаровую, глюконовую, глутаминовую, бромисто-водородную, хлористо-водородную, изетионовую,молочную, малеиновую, яблочную, миндальную, метансульфоновую, слизевую, памоевую, пантотеновую, фосфорную, пропионовую, янтарную, серную, винную, п-толуолсульфоновую кислоту и тому подобное. Фармацевтически приемлемые кислотно-аддитивные соли можно получить общепринятым способом реакцией с подходящей кислотой или производным кислоты. Фармацевтически приемлемые соли с основаниями можно получить общепринятым способом реакцией с подходящим неорганическим или органическим основанием. Соединения формулы (I) можно получить в кристаллической или некристаллической форме и, если в кристаллической форме, может быть необязательно в гидратированной или сольватированной форме. Данное изобретение включает в свой объем стехиометрические гидраты или сольваты, а также соединения, содержащие вариабельные количества воды и/или растворителя. В объем изобретения включены все соли, сольваты, гидраты, комплексы, полиморфы, пролекарства, радиомеченые производные, стереоизомеры и оптические изомеры соединений формулы (I). Активности и эффективности соединений данного изобретения в отношении рецептора S1P1 можно определить анализом GTPyS, проводимом на клонированном рецепторе человека, как описано в контексте. Соединения формулы (I) демонстрировали активность агониста в отношении рецептора S1P1 с применением описанных в контексте функциональных анализов. Соединения формулы (I) и их фармацевтически приемлемые соли поэтому являются применимыми при лечении состояний или нарушений, которые опосредуются посредством рецептора S1P1. В частности, соединения формулы (I) и их фармацевтически приемлемые соли являются применимыми при лечении рассеянного склероза, аутоиммунных заболеваний, хронических воспалительных нарушений, астмы,воспалительных невропатий, артрита, при трансплантации, при лечении болезни Крона, неспецифического язвенного колита, красной волчанки, псориаза, реперфузионного повреждения при ишемии, солидных опухолей и метастаз опухолей, заболеваний, связанных с развитием кровеносных сосудов, васкулярных заболеваний, болезненных состояний, острых вирусных заболеваний, воспалительных заболеваний кишечника, инсулинзависимого и инсулиннезависимого диабета (ниже в контексте называемые-6 017691 Соединения формулы (I) и их фармацевтически приемлемые соли, следовательно, являются применимыми при лечении красной волчанки. Соединения формулы (I) и их фармацевтически приемлемые соли, следовательно, являются применимыми при лечении псориаза. Соединения формулы (I) и их фармацевтически приемлемые соли, следовательно, являются применимыми при лечении рассеянного склероза. Должно быть понятно, что термин "лечение", применяемый в контексте, включает в себя профилактику, а также ослабление установленных симптомов. Таким образом, изобретение предлагает также соединения формулы (I) или их фармацевтически приемлемые соли для применения в качестве терапевтических веществ, в частности,при лечении состояний или нарушений, опосредуемых посредством рецептора S1P1. В частности, изобретение предлагает соединение формулы (I) или его фармацевтически приемлемую соль для применения в качестве терапевтического вещества при лечении рассеянного склероза, аутоиммунных заболеваний, хронических воспалительных нарушений, астмы, воспалительных невропатий, артрита, при трансплантации, при лечении болезни Крона, неспецифического язвенного колита, красной волчанки, псориаза, реперфузионного повреждения при ишемии, солидных опухолей и метастаз опухолей, заболеваний, связанных с развитием кровеносных сосудов, васкулярных заболеваний, болезненных состояний, острых вирусных заболеваний,воспалительных заболеваний кишечника, инсулинзависимого и инсулиннезависимого диабета. Соединения формулы (I) и их фармацевтически приемлемые соли являются применимыми в качестве терапевтических веществ при лечении красной волчанки. Соединения формулы (I) и их фармацевтически приемлемые соли являются применимыми в качестве терапевтических веществ при лечении псориаза. Соединения формулы (I) и их фармацевтически приемлемые соли являются применимыми в качестве терапевтических веществ при лечении рассеянного склероза. Изобретение далее относится к способу лечения состояний или нарушений у млекопитающих, в том числе у людей, которые могут быть опосредованы посредством рецептора S1P1, который содержит введение страдающему заболеванием пациенту терапевтически безопасного и эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В частности, изобретение предлагает способ лечения рассеянного склероза, аутоиммунных заболеваний, хронических воспалительных нарушений, астмы, воспалительных невропатий, артрита, способ применения при трансплантации, при лечении болезни Крона, неспецифического язвенного колита, красной волчанки, псориаза, реперфузионного повреждения при ишемии, солидных опухолей и метастаз опухолей, заболеваний, связанных с развитием кровеносных сосудов, васкулярных заболеваний, болезненных состояний, острых вирусных заболеваний, воспалительных заболеваний кишечника, инсулинзависимого и инсулиннезависимого диабета,который содержит введение страдающему заболеванием пациенту терапевтически безопасного и эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Изобретение относится к способу лечения красной волчанки, который содержит введение страдающему таким заболеванием пациенту терапевтически безопасного и эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Изобретение относится к способу лечения псориаза, который содержит введение страдающему таким заболеванием пациенту терапевтически безопасного и эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Изобретение относится к способу лечения рассеянного склероза, который содержит введение страдающему таким заболеванием пациенту терапевтически безопасного и эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В другом аспекте изобретение относится к применению соединения формулы (I) или его фармацевтически приемлемой соли при изготовлении лекарственного средства для применения при лечении состояний или нарушений, опосредуемых посредством рецептора S1P1. В частности, изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли для применения при изготовлении лекарственного средства для применения при лечении рассеянного склероза, аутоиммунных заболеваний, хронических воспалительных нарушений, астмы, воспалительных невропатий, артрита, при трансплантации, при лечении болезни Крона, неспецифического язвенного колита, красной волчанки, псориаза, реперфузионного повреждения при ишемии, солидных опухолей и метастаз опухолей, заболеваний, связанных с развитием кровеносных сосудов, васкулярных заболеваний, болезненных состояний, острых вирусных заболеваний, воспалительных заболеваний кишечника, инсулинзависимого и инсулиннезависимого диабета. Соединения формулы (I) и их фармацевтически приемлемые соли являются применимыми при изготовлении лекарственного средства для применения при лечении красной волчанки. Соединения формулы (I) и их фармацевтически приемлемые соли являются применимыми при изготовлении лекарственного средства для применения при лечении псориаза. Соединения формулы (I) и их фармацевтически приемлемые соли являются применимыми при изготовлении лекарственного средства для применения при лечении рассеянного склероза.-7 017691 Для применения соединений формулы (I) и их фармацевтически приемлемых солей в терапии их обычно изготовляют в составе фармацевтической композиции согласно стандартной фармацевтической практике. Настоящее изобретение предлагает также фармацевтическую композицию, которая содержит соединение формулы (I) или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель или эксципиент. В следующем аспекте настоящее изобретение относится к способу получения фармацевтической композиции, причем способ содержит смешивание соединение формулы (I) или его фармацевтически приемлемой соли и фармацевтически приемлемого носителя или эксципиента. Фармацевтическую композицию изобретения, которую можно получить смешиванием подходящим образом при температуре окружающей среды и атмосферном давлении, обычно адаптируют для перорального, парентерального или ректального введения, и, как таковая, она может быть в форме таблеток,капсул, пероральных жидких препаратов, порошков, гранул, лепешек, пересоздаваемых порошков, вводимых инъекцией или инфузией растворов или суспензий или суппозиториев. Перорально вводимые композиции обычно являются предпочтительными. Таблетки и капсулы для перорального введения могут быть в дозированной лекарственной форме и могут содержать общепринятые эксципиенты, такие как связывающие агенты (например, кукурузный крахмал, набухающий в холодной воде, поливинилпирролидон или гидроксипропилметилцеллюлозу); наполнители (например, лактозу, микрокристаллическую целлюлозу или гидрофосфат кальция); таблетирующие смазывающие вещества (например, стеарат магния, тальк или диоксид кремния); дезинтегрирующие агенты (например, картофельный крахмал или натриевую соль гликолята крахмала) и приемлемые смачивающие агенты (например, лаурилсульфат натрия). Таблетки можно покрыть оболочкой согласно способам, хорошо известным в обычной фармацевтической практике. Пероральные жидкие препараты могут быть в форме, например, водной или масляной суспензии,растворов, эмульсий, сиропов или эликсиров или могут быть в форме сухого продукта для пересоздания с водой или другим подходящим наполнителем перед применением. Такие жидкие препараты могут содержать общепринятые добавки, такие как суспендирующие агенты (например, сироп сорбита, производные целлюлозы или гидрогенизированные пищевые жиры), эмульгирующие агенты (например, лецитин или аравийскую камедь), неводные наполнители (которые могут включать в себя пищевые масла,например миндальное масло, маслянистые сложные эфиры, этиловый спирт или фракционированные растительные масла), консерванты (например, метил- или пропил-п-гидроксибензоаты или сорбиновую кислоту) и, если необходимо, общепринятые корригенты или окрашивающие вещества, буферные соли и подслащивающие агенты, если требуются. Препараты для перорального введения можно подходящим образом изготовить так, чтобы происходило регулируемое высвобождение активного соединения. Для парентерального введения жидкие дозированные лекарственные формы получают с применением соединения изобретения или его фармацевтически приемлемых солей и стерильного наполнителя. Препараты для инъекции можно представить в виде дозированной лекарственной формы, например в ампулах, или в виде многих доз с применением соединения изобретения или его фармацевтически приемлемых производных и стерильного наполнителя, необязательно с добавленным консервантом. Композиции могут иметь такие формы, как суспензии, растворы или эмульсии в масляных или водных наполнителях, и могут содержать образующие форму препарата агенты, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, активный ингредиент может быть в форме порошка для пересоздания с подходящим наполнителем, например, стерильной, не содержащей пирогенов водой, перед применением. Соединение, в зависимости от наполнителя и применяемой концентрации, можно либо суспендировать, либо растворить в наполнителе. При получении растворов соединение можно растворить для инъекции и стерилизовать пропусканием через фильтр перед заполнением раствором подходящего пузырька или ампулы и герметизировать. Преимущественно адъюванты, такие как местные анестетики, консерванты и буферные агенты, растворяют в наполнителе. Для повышения стабильности композицию можно заморозить после заполнения в ампулу и воду удалить в вакууме. Парентеральные суспензии получают,по существу,таким же способом, за исключением того, что соединение вместо растворения суспендируют в наполнителе, и стерилизацию нельзя выполнять фильтрованием. Соединение можно стерилизовать воздействием этиленоксида перед суспендированием в стерильном наполнителе. В композицию преимущественно включают поверхностно-активное вещество или смачивающий агент для облегчения равномерного распределения соединения. Лосьоны можно изготовить с водной или масляной основой, они обычно содержат также один или несколько эмульгирующих агентов, стабилизирующих агентов, диспергирующих агентов, суспендирующих агентов, загущающих агентов или красящих агентов. Капли можно изготовить с водной или неводной основой, содержащей также один или несколько диспергирующих агентов, стабилизирующих агентов, солюбилизирующих агентов или суспендирующих агентов. Они могут содержать также консервант. Соединения формулы (I) или их фармацевтически приемлемые соли можно также изготовить в составе ректальных композиций, таких как суппозитории или удерживающие клизмы, например содержащие общепринятые основы суппозитории, такие как какао-масло или другие глицериды.-8 017691 Соединения формулы (I) или их фармацевтически приемлемые соли можно изготовить также в составе препаратов-депо. Такие препараты длительного действия можно вводить имплантацией (например,подкожно или внутримышечно) или внутримышечной инъекцией. Так, например, соединения изобретения можно изготовить с подходящими полимерными или гидрофобными веществами (например, в виде эмульсии в подходящем масле) или ионообменными смолами, или в виде слаборастворимых производных, например в виде слаборастворимой соли. Для интраназального введения соединения формулы (I) или их фармацевтически приемлемые соли можно изготовить в виде растворов для введения посредством устройства для подачи подходящим образом измеренного количества или унифицированной дозы или в альтернативном случае в виде порошкообразной смеси с подходящим носителем для введения с применением подходящего устройства для доставки. Таким образом, соединения формулы (I) или их фармацевтически приемлемые соли можно изготовить для перорального, буккального, парентерального, местного (в том числе офтальмического и назального) введения, введения типа депо или ректального введения, или в форме, подходящей для введения ингаляцией или инсуффляцией (либо через рот, либо через нос). Соединения формулы (I) или их фармацевтически приемлемые соли можно изготовить для местного введения в форме мазей, кремов, гелей, лосьонов, пессарий, аэрозолей или капель (например, капель для глаз, ушей или носа). Мази и кремы можно изготовлять, например, с водной или масляной основой с добавлением подходящих загущающих и/или гелеобразующих агентов. Мази для введения в глаза можно изготовить стерильным способом с применением стерилизованных компонентов. Композиция может содержать от 0,1 до 99 мас.%, предпочтительно от 10 до 60 мас.% активного вещества в зависимости от способа введения. Доза соединения, применяемого при лечении вышеуказанных нарушений, обычно варьирует обычным образом в зависимости от тяжести нарушений, массы тела страдающего заболеванием пациента и других аналогичных факторов. Однако в качестве общих ориентировочных подходящих унифицированных доз могут быть количества 0,05-1000 мг, 1,0-500 мг или 1,0200 мг, и такие унифицированные дозы можно вводить более чем один раз в день, например два или три раза в день. Соединения формулы (I) или их фармацевтически приемлемые соли можно применять в комбинированных препаратах, в комбинации с другими активными ингредиентами. Например, соединения изобретения можно применять в комбинации с циклоспорином А, метотрексатом, стероидами, рапамицином, ингибиторами провоспалительных цитокинов, иммуномодуляторами, включающими в себя биологические или другие терапевтически активные соединения. Предмет изобретения включает в себя также меченые изотопом соединения, которые являются идентичными соединениям, описанным в формулах (I) и последующих, за исключением того факта, что один или несколько атомов заменены атомом, имеющим атомную массу или массовое число, отличное от атомной массы или массового числа атома, обычно находящегося в природе. Примеры изотопов, которые можно включить в соединения изобретения, включают в себя изотопы водорода, углерода, азота,кислорода, фосфора, фтора, иода и хлора, такие как 3 Н, 11C, 14C, 18F, 123I и 125I. Соединения настоящего изобретения и фармацевтически приемлемые соли указанных соединений,которые содержат вышеуказанные изотопы и/или другие изотопы других атомов, находятся в объеме настоящего изобретения. Меченые изотопом соединения настоящего изобретения, например соединения,в которые включены радиоактивные изотопы, такие как 3 Н, 14 С, являются применимыми в анализах распределения в лекарственном средстве и/или ткани-субстрате. Особенно предпочтительными являются изотопы тритий, т.е. 3 Н, и углерод-14, т.е. 14 С, вследствие их легкости получения и детектируемости. Изотопы 11 С и 8F являются особенно применимыми в PET (позитронной эмиссионной томографии) и изотопы 125I являются особенно применимыми в SPECT (однофотонной эмиссионной компьютерной томографии, ОЭКТ), причем все они применимы при получении изображения головного мозга. Кроме того,замена более тяжелыми изотопами, такими как дейтерий, т.е. 2 Н, может обеспечивать некоторые терапевтические преимущества, являющиеся результатом более высокой метаболической стабильности, например увеличенного полупериода существования in vivo или пониженных дозовых потребностей, и поэтому они могут быть в некоторых случаях предпочтительными. Меченые изотопами соединения формулы (I) и последующих формул данного изобретения обычно получают проведением методик, описанных ниже в схемах и/или в примерах, заменой не меченого изотопом реагента на легкодоступный меченый изотопом реагент. В следующем аспекте данное изобретение относится к способам получения соединения формулы (I). Один путь, который можно применять для получения соединений формулы (I), когда В представляет собой иллюстрируется на схеме 1, в которой R1, R2, R4 и А имеют значения, указанные в формуле (I), за исклю-9 017691 чением того, что R2 не является хлором, бромом или иодом, R представляет собой алкил (например, этил,трет-бутил) и hal представляет собой хлор, бром или иод. Схема 1 Соединения формулы (i), которые являются коммерчески доступными или которые можно получить рядом путей (например, как описано в Johnson, Paul D.; et al.; BioorganicMedicinal Chemistry Letters (2003), 13(23), 4197-4200), можно превратить в соединения формулы (ii) обработкой йодоформом в присутствии подходящего нитрита, такого как трет-бутилнитрит, в подходящем растворителе, таком как тетрагидрофуран (ТГФ). Соединения формулы (ii) можно превратить в соединения формулы (iii) обработкой подходящим восстанавливающим агентом, таким как диборан или литийалюминийгидрид, в растворителе, таком как ТГФ, при повышенной температуре, такой как 80 С. Соединения формулы (iii) можно превратить в защищенное производное (iv), где Р представляет собой подходящую защитную группу,такую как трет-бутилоксикарбонил(ВОС),например,обработкой бис-(1,1 диметилэтил)дикарбонатом в присутствии основания, такого как триэтиламин, в подходящем растворителе, таком как дихлорметан (DCM). Соединения формулы (iv) можно превратить в соединения формулы(v) обработкой подходящим источником цианида, таким как цианид цинка, в присутствии катализатора,такого как тетракистрифенилфосфинпалладий(0), в подходящем растворителе, таком как диметилформамид (ДМФА), при повышенной температуре, такой как 80 С. Соединения формулы (v) можно превратить в соединения формулы (vi) обработкой гидрохлоридом гидроксиламина и подходящим основанием,таким как бикарбонат натрия, в растворителе, таком как метанол или этанол, при повышенной температуре, такой как 60 С. Соединения формулы (vi) можно превратить в соединения формулы (ix) обработкой хлорангидридом карбоновой кислоты формулы (viii) в присутствии основания, такого как триэтиламин, в подходящем растворителе, таком как ДМФА. Такие реакционные смеси обычно перемешивают в течение некоторого периода времени при комнатной температуре, затем при повышенных температурах,таких как 120 С. Хлорангидриды кислот формулы (viii) являются либо коммерчески доступными, либо их можно получить из соответствующей кислоты (vii) общепринятыми способами. Альтернативно соединения формулы (vi) можно превратить в соединения формулы (ix) обработкой карбоновой кислотой формулы (vii) в присутствии подходящего амидного агента сочетания, такого как гидрохлорид 1-(3 диметиламинопропил)-N'-этилкарбодиимида (EDAC), и 1-гидроксибензотриазол (НОВТ), в подходящем растворителе, таком как ДМФА. Такие реакции обычно проводят при повышенной температуре, такой как 50-80 С. Обычно кислоту (vii), EDAC и HOBt перемешивают в течение некоторого периода времени при комнатной температуре перед добавлением соединения формулы (vi). Соединения формулы (ix), в которой Р=ВОС, можно превратить в соединения формулы (х) обработкой подходящей кислотой, обычно трифторуксусной кислотой или хлористо-водородной кислотой, в подходящем растворителе, таком как 1,4-диоксан. Соединения формулы (х) можно превратить в соединения формулы (xii) обработкой алкилирующим агентом (xi) в присутствии основания, такого как карбонат кальция, в растворителе, та- 10017691 ком как ДМФА или ацетонитрил. Такие реакции можно проводить при повышенной температуре, такой как 70 С. Алкилирующие агенты (xi) обычно являются коммерчески доступными или их можно получить с применением стандартных способов. Соединения формулы (xii) можно превратить в некоторые соединения формулы (I), у которых В представляет собой и R3 представляет собой (СН 2)1-4 СО 2 Н, обработкой основанием, таким как водный гидроксид натрия, в спиртовом растворителе, таком как этанол или метанол. Для помощи растворению можно добавить сорастворитель, такой как ТГФ. Реакцию гидролиза можно проводить при комнатной температуре или при повышенной температуре, такой как 50-80 С. Альтернативно, это превращение можно проводить с применением твердого гидроксида натрия в этаноле в микроволновом реакторе при такой температуре, как 100 С, или когда R = трет-бутил, с применением трифторуксусной кислоты (TFA) или HCl. Соединения формулы (I), у которых R2 и R4, оба, представляют собой водород, В представляет собойR3 представляет собой (СН 2)1-4 СО 2 Н, R1 и А имеют значения, указанные в формуле (I), и остаток оксадиазола присоединен к остатку бензазепина в положении 6, можно альтернативно получить путем, иллюстрированным на схеме 2. Схема 2 Коммерчески доступное соединение формулы (xiii) можно превратить в соединение формулы (xiv) обработкой гидрохлоридом гидроксиламина, как описано на схеме 1 для превращения (v) в (vi). Соединения формулы (xiv) можно превратить в соединения формулы (xv) обработкой хлорангидридом карбоновой кислоты формулы (viii) в присутствии основания, такого как триэтиламин, как описано на схеме 1 для превращения (vi) в (ix). Соединения формулы (xv) можно превратить в соединения формулы (xvi) обработкой подходящим основанием, таким как н-бутиллитий, с последующей обработкой аллилбромидом в растворителе, таком как ТГФ, при пониженных температурах, таких как -78 С. Соединения формулы (xvi) можно превратить в соединения формулы (xvii) обработкой озоном в подходящем растворителе, таком как DCM, при пониженной температуре, такой как -78 С, с последующим восстановлением с применением подходящего восстанавливающего агента, такого как комплекс боран-диметилсульфид, в подходящем растворителе, таком как ТГФ. Соединения формулы (xvii) можно превратить в соединения формулы (ix) обычно циклизацией в условиях Мицунобу, например, с применением диизопропилазодикарбоксилата (DIAD) и трифенилфосфина в подходящем растворителе, таком как DCM, с последующим введением подходящей защитной группы для атома азота бензазепина, такой как ВОС, как описано на схеме 1, для превращения (iii) в (iv). Соединения формулы (ixa) можно превратить в соединения формулы (I), как описано на схеме 1 для превращения (ix) в некоторые соединения формулы (I). Один путь, который можно применять для получения соединений формулы (I), в которой В представляет собой иллюстрируется на схеме 3, в которой R3 представляет собой (СН 2)1-4 СО 2 Н, R1, R2, R4 и А имеют значения, указанные в формуле (I), за исключением того, что R2 не является хлором, бромом или иодом, R представляет собой алкил (например, метил, трет-бутил) и Hal представляет собой хлор, бром или иод. Схема 3 Соединения формулы (xviii), которые являются либо коммерчески доступными (например, от Aldrich), либо их получают с применением стандартных способов, можно превратить в соединения формулы (хх) обычно реакцией с защищенным этаноламином (xix), где P1 представляет собой подходящую защитную группу, такую как ВОС, в условиях Мицунобу с применением, например, DIAD и трифенилфосфина в подходящем растворителе, таком как ТГФ. Соединения формулы (хх) можно превратить в соединения формулы (xxi) и/или (xii) обработкой кислотой, обычно трифторуксусной кислотой или хлористо-водородной кислотой. Соединения формулы (xxi) можно также превратить в соединения формулы(xxii) нагреванием в подходящем растворителе, таком как толуол, при повышенных температурах, таких как 80 С. Соединения формулы (xii) можно превратить в соединения формулы (xxiii) обработкой подходящим восстанавливающим агентом, таким как литийалюминийгидрид, при низкой температуре, такой как ниже 15 С, в растворителе, таком как ТГФ, затем повышением температуры, например до 80 С. Соединения формулы (xxiii) можно превратить в соединения формулы (xxiv) обработкой кислотой Льюиса,такой как трибромид бора, или сильной кислотой, такой как HBr. Соединения формулы (xxiv) можно превратить в защищенное производное (xxv), у которого Р 2 представляет собой подходящую защитную группу, такую как трет-бутилоксикарбонил (ВОС), как описано на схеме 1 для превращения (iii) в (iv). Соединения формулы (xxv) можно превратить в соединения формулы (xxvi) обработкой трифторметансульфоновым ангидридом в подходящем растворителе, таком как пиридин. Соединения формулы (xxvi) можно превратить в соединение формулы (xxvii) обработкой подходящим цианидом, таким как цианид цинка, в присутствии катализатора, такого как тетракистрифенилфосфинпалладий(0), в подходящем растворителе, таком как ДМФА. Соединения формулы (xxvii) можно превратить в соединения формулы (I) с применением способов, аналогичных способам, описанным для превращения соединений формулы (v) в некоторые соединения формулы (I) (схема 1). Альтернативный путь для получения промежуточного продукта (xxvii), у которого цианогруппы находятся в 9 положении и Р 2 представляет собой подходящую защитную группу, такую как ВОС, и R2 иR4 представляют собой водород (представлен формулой (xxviia, иллюстрируется на схеме 4. Соединение формулы (xxxii) можно превратить в соединение формулы (xxxiii) обработкой параформальдегидом и сухим хлоридом магния в подходящем растворителе, таком как ТГФ, с нагреванием при кипячении с обратным холодильником. Соединения формулы (xxxiii) можно превратить в соединения формулы (xxxiv) обработкой этаноламином в присутствии восстанавливающего агента, такого как натрийтриацетоксиборогидрид. Соединения формулы (xxxiv) можно превратить в защищенное производное (xxxv), у которого Pr представляет собой подходящую защитную группу, такую как ВОС, как описано на схеме 1 для превращения (iii) в (iv). Соединения формулы (xxxv) можно превратить в соединения формулы (xxxvi), обычно циклизацией в условиях Мицунобу с применением, например, диизопропилазодикарбоксилата (DIAD) и трифенилфосфина в подходящем растворителе, таком как ТГФ. Соединения формулы (xxxvi) можно превратить в соединения формулы (xxviia) обработкой подходящим цианидным источником, таким как цианид цинка, как описано на схеме 1 для превращения (iv) в (v). Один путь, который можно применять для получения соединений формулы (I), в которой R1, R2, R4 и А имеют значения, описанные в формуле (I), R3 представляет собой (СН 2)1-4 СО 2 Н и В представляет собой иллюстрируется на схеме 5. R представляет собой алкил (например, этил, трет-бутил) и Hal представляет собой хлор, бром или иод. Схема 5(2007), 50(21), 5076-5089), можно превратить в соединения формулы (I) с применением способов, аналогичных способам, описанным для превращений соединений формулы (v) в некоторые соединения формулы (I) (схема 1). Все публикации, включающие в себя, но не ограничивающиеся ими, патенты и заявки на патенты,цитированные в данном описании изобретения, включены в контекст в качестве ссылки, как если бы каждая отдельная публикация была специально и отдельно указана как включенная в контекст в качестве ссылки, как будто полностью изложенная. Нижеследующие описания и примеры иллюстрируют получение соединений изобретения. Раздел общей химии Способы, описанные ниже, приводятся для иллюстративных целей, промежуточные продукты в по- 14017691 лучениях или примерах не обязательно были получены из конкретно описанных количеств. Получение 1. 7-Иод-2,3,4,5-тетрагидро-1 Н-2-бензазепин-1-онPreparation of benzazepinylpyrrolidonylsulfonamides as Factor Xa inhibitors; WO 2007059952) (500 мг, 2,84 ммоль) и трииодметан (2234 мг, 5,67 ммоль) растворяли в ТГФ (100 мл). Затем по каплям на протяжении 20 мин добавляли 1,1-диметилэтилнитрит (0,675 мл, 5,67 ммоль), растворенный в ТГФ (20 мл), и образовавшийся раствор перемешивали в течение 1 ч. Смесь нагревали при 50 С в течение 30 мин. Большую часть растворителя удаляли выпариванием и сырой продукт подвергали хроматографии Biotage(EtOAc/гексан, 3:1), получая при этом указанное в заголовке соединение (550 мг) в виде бледно-желтого твердого вещества. МС (ES): для C10H10INO требуется 287; найдено 287,8 (М+Н)+. Получение 2. 7-Иод-2,3,4,5-тетрагидро-1 Н-2-бензазепин 7-Иод-2,3,4,5-тетрагидро-1 Н-2-бензазепин-1-он (получение 1) (550 мг, 1,916 ммоль) растворяли в сухом ТГФ (70 мл) и обрабатывали комплексом боран-ТГФ (1 М) (11,49 мл, 11,49 ммоль) и нагревали при кипячении с обратным холодильником в течение 4 ч. Затем реакционную смесь выдерживали на протяжении ночи. Добавляли дополнительный комплекс боран-ТГФ (1 М, 2 мл) и реакционную смесь нагревали при температуре флегмы в течение дополнительных 2 ч и 30 мин. Для охлаждения реакционной смеси осторожно добавляли метанол. Реакционную смесь перемешивали до прекращения выделения пузырьков газа. Затем осторожно порциями добавляли 2 н. HCl (водный) (20 мл) и после уменьшения выделения пузырьков газа раствор нагревали при 75 С в течение 30 мин. Анализ ЖХ/МС показал один основной продукт. Реакционную смесь охлаждали и добавляли воду (20 мл). Смесь промывали EtOAc (40 мл),подщелачивали 2 н. NaOH (водным) и экстрагировали EtOAc (50 мл). Слой EtOAc сушили над безводнымMgSO4 и упаривали, получая при этом указанное в заголовке соединение (400 мг) в виде белого твердого вещества. МС (ES): для C10H12IN требуется 273; найдено 274 (М+Н)+. Получение 3. 1,1-Диметилэтил 7-иод-1,3,4,5-тетрагидро-2 Н-2-бензазепин-2-карбоксилат(0,459 мл, 3,30 ммоль). Реакционную смесь перемешивали при к.т. в течение 30 мин. Анализ ЖХ/МС показал один основной продукт. Реакционную смесь промывали 0,5 М HCl (20 мл), насыщ. NaHCO3 (20 мл), сушили над безводным MgSO4 и упаривали, получая при этом указанное в заголовке соединение 1,1-Диметилэтил-7-иод-1,3,4,5-тетрагидро-2 Н-2-бензазепин-2-карбоксилат (получение 3) (650 мг,1,742 ммоль), цианид цинка(II) (123 мг, 1,045 ммоль) и тетракис(трифенилфосфин)палладий(0) (201 мг,0,174 ммоль) перемешивали в сухом ДМФА при 80 С в течение 45 мин. К охлажденному раствору добавляли EtOAc (100 мл) перед промыванием водой (270 мл) и насыщенным раствором соли (100 мл). Слой EtOAc сушили над безводным MgSO4 и упаривали. ТСХ (EtOAc/гексан, 1:3) показала 2 пятна, одно с очень высоким RF. Сырой продукт подвергали хроматографии Biotage (EtOAc/гексан, 1:3) и нижнее пятно RF выделяли. При упаривании получали указанное в заголовке соединение (350 мг) в виде бесцветного масла. МС (ES): для C16H20N2O2 требуется 272; найдено 217 (М+Н-56)+. Получение 5. 1,1-Диметилэтил-7-[(гидроксиамино)(имино)метил]-1,3,4,5-тетрагидро-2H-2-бензазепин-2-карбоксилат 1,1-Диметилэтил-7-циано-1,3,4,5-тетрагидро-2 Н-2-бензазепин-2-карбоксилат (получение 4) (350 мг,1,285 ммоль), гидрохлорид гидроксиламина (223 мг, 3,21 ммоль) и бикарбонат натрия (540 мг, 6,43 ммоль) суспендировали в этаноле (15 мл) и суспензию перемешивали при 55 С в течение 5 ч. Реакционную смесь выдерживали на протяжении ночи. Анализ ЖХ/МС показал один основной продукт. Неорганические вещества удаляли фильтрованием, промывая 10% раствором MeOH/DCM для растворения любого осажденного продукта. Выпаривание растворителя давало белое твердое вещество. Растирание с простым эфиром давало указанное в заголовке соединение (320 мг). МС (ES): для C16H23N3O3 требуется 305; найдено 306,2 (М+Н)+. Получение 6. 3-Хлор-4-[(1-метилэтил)окси]бензойная кислота Пропан-2-ол (2,45 мл) и PPh3 (1,18 г) растворяли в ТГФ (30 мл), охлаждали до 0 С, обрабатывали метил-3-хлор-4-гидроксибензоатом (6,00 г) с последующим добавлением по каплям DIAD (9,44 мл) и смесь перемешивали при к.т. на протяжении ночи. Реакционную смесь упаривали и очищали на картриджах диоксида кремния (4100 г), элюируя 0-40% раствором EtOAc в пентане, получая при этом сырой продукт (7,00 г) в виде бесцветного масла. Его растворяли в МеОН (30 мл) и 2 М водном NaOH (30 мл) и раствор перемешивали при к.т. в течение времени с субботы до понедельника. Реакционную смесь затем упаривали и снова растворяли в Н 2 О. Этот раствор промывали Et2O, подкисляли до рН 1 и экстрагировали Et2O. Эти последние экстракты сушили над безводным MgSO4, фильтровали и упаривали, получая при этом указанное в заголовке соединение (4,16 г) в виде белого твердого вещества. Н (MeOD, 400 МГц): 1,37 (6 Н, д), 4,77 (1 Н, септет), 7,12 (1 Н, д), 7,90 (1 Н, д), 7,98 (1 Н, с). МС (ES): для C10H1135ClO3 требуется 214; найдено 215 (М+Н)+. Получение 7. 1,1-Диметилэтил-7-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)1,3,4,5-тетрагидро-2 Н-2-бензазепин-2-карбоксилат 3-Хлор-4-[(1-метилэтил)окси]бензойная кислота (получение 6) (105 мг, 0,491 ммоль), EDC (113 мг,0,589 ммоль) и НОВТ (90 мг, 0,589 ммоль) растворяли в сухом ДМФА (5 мл) и раствор перемешивали в течение 5 мин. Добавляли 1,1-диметилэтил-7-[гидроксиамино(амино)метил]-1,3,4,5-тетрагидро-2 Н-2 бензазепин-2-карбоксилат (получение 5) (150 мг, 0,491 ммоль) и смесь перемешивали в течение 1 ч, нагревали при 90 С в течение 2 ч и затем выдерживали на протяжении ночи. Реакционную смесь нагревали при 90 С в течение дополнительных 3 ч. Добавляли EtOAc (50 мл) и реакционную смесь промывали насыщ. NaHCO3 (водный) (50 мл) и водой (250 мл) перед сушкой над безводным MgSO4 и выпариванием растворителя. Полученное сырое масло подвергали хроматографии Biotage (EtOAc/гексан, 1:4), получая при этом 100 мг бесцветного масла. Масло медленно начинало отверждаться на протяжении ночи с образованием белого восковидного твердого вещества. Растирание со смесью простой эфир/гексан давало указанное в заголовке соединение (38 мг) в виде белого твердого вещества после фильтрования. Из раствора медленно осаждалась дополнительная порция вещества (30 мг). Н (400 МГц, d6-ДМСО): 1,31 (9 Н, с), 1,36 (6 Н, д), 1,69 (2 Н, м), 3,06 (2 Н, м), 3,65 (2 Н, м), 4,44 (2 Н,с), 4,84-4,94 (1 Н, м), 7,38-7,46 (2 Н, м), 7,84-7,91 (2 Н, м), 8,11 (1 Н, дд), 8,18 (1 Н, д). Получение 8. 1,1-Диметилэтил-[7-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)1,3,4,5-тетрагидро-2 Н-2-бензазепин-2-ил]ацетат- 16017691 при к.т. в течение 1,5 ч. Добавляли EtOAc (50 мл) и простой эфир (20 мл) и смесь промывали водой (360 мл) и насыщенным раствором соли (40 мл). Сушка над безводным MgSCU и выпаривание растворителя давало прозрачное, бесцветное масло (80 мг). Масло подвергали хроматографии Biotage (EtOAc/гексан,3:1), получая при этом указанное в заголовке соединение (65 мг) в виде прозрачного, бесцветного масла. МС (ES): для C27H3235ClN3O4 требуется 497; найдено 498 (М+Н)+. Получение 9. 1,1-Диметилэтил-7-(5-3-циано-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)1,3,4,5-тетрагидро-2 Н-2-бензазепин-2-карбоксилат(3 мл) в течение 5 мин. Добавляли 1,1-диметилэтил-7-[(гидроксиамино)(имино)метил]-1,3,4,5 тетрагидро-2 Н-2-бензазепин-2-карбоксилат (получение 5) (450 мг, 1,474 ммоль) и реакционную смесь перемешивали при к.т. в течение 1 ч. После этого все еще присутствовало некоторое количество 3-циано 4-[(1-метилэтил)окси]бензойной кислоты. Добавляли дополнительные количества EDC (100 мг) и 1,1 диметилэтил-7-[(гидроксиамино)(имино)метил]-1,3,4,5-тетрагидро-2 Н-2-бензазепин-2-карбоксилата (100 мг) и реакционную смесь перемешивали в течение 1 ч. Затем реакционную смесь нагревали при 80 С в течение 3 ч и выдерживали на протяжении ночи. Реакционную смесь затем нагревали при 90 С в течение 1 ч. Добавляли EtOAc (70 мл) и реакционную смесь промывали насыщ. NaHCO3 (50 мл) и водой (270 мл), сушили над безводным MgSO4 и упаривали. Полученное сырое вещество подвергали хроматографииBiotage (EtOAc/гексан 1:2), получая при этом после выпаривания белое твердое вещество. Растирание с простым эфиром давало указанное в заголовке соединение (320 мг) в виде белого твердого вещества. ЯМР (400 МГц, d6-ДМСО): 1,31 (9 Н, с), 1,38 (6 Н, д), 1,69 (2 Н, ушир. с), 3,06 (2 Н, ушир. с), 3,65 (2 Н,ушир. с), 4,44 (2 Н, с), 4,94-5,03 (1 Н, м), 7,38-7,43 (1 Н, м), 7,56 (1 Н, д), 7,84-7,91 (2 Н, м), 8,40 (1 Н, дд), 8,50 Гидрохлорид 2-[(1-метилэтил)окси]-5-[3-(2,3,4,5-тетрагидро-1 Н-2-бензазепин-7-ил)-1,2,4-оксадиазол-5-ил]бензонитрила (пример 3) (70 мг, 0,170 ммоль) и карбонат цезия (167 мг, 0,511 ммоль) в сухом ДМФА (5 мл) обрабатывали трет-бутилацетатом (0,038 мл, 0,256 ммоль) и перемешивали при к.т. в течение 3 ч, получая при этом один продукт. Добавляли EtOAc (40 мл) и смесь промывали водой (250 мл),сушили над безводным MgSO4 и упаривали, получая при этом указанное в заголовке соединение (85 мг) в виде прозрачного, бесцветного масла. МС (ES): для C28H32N4O4 требуется 488; найдено 489 (М+Н)+. Получение 11. Этил-4-[7-(5-3-циано-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-1,3,4,5 тетрагидро-2 Н-2-бензазепин-2-ил]бутаноат Гидрохлорид 2-[(1-метилэтил)окси]-5-[3-(2,3,4,5-тетрагидро-1 Н-2-бензазепин-7-ил)-1,2,4-оксадиазол-5-ил]бензонитрила (пример 3) (70 мг, 0,170 ммоль) и карбонат цезия (167 мг, 0,511 ммоль) в сухом ДМФА (5 мл) обрабатывали этил-4-бромбутиратом (0,037 мл, 0,256 ммоль) и перемешивали при 60 С в течение 2 ч. Добавляли дополнительное количество этил-4-бромбутирата (37 мкл) и реакционную смесь нагревали при 60 С в течение 3 ч. Реакционную смесь выдерживали на протяжении ночи. ДобавлялиEtOAc (50 мл) и смесь промывали водой (260 мл), сушили над безводным MgSO4 и упаривали, получая при этом указанное в заголовке соединение (90 мг) в виде прозрачного, бесцветного масла. МС (ES): для Гидрохлорид 2-[(1-метилэтил)окси]-5-[3-(2,3,4,5-тетрагидро-1 Н-2-бензазепин-7-ил)-1,2,4-оксадиазол-5-ил]бензонитрила (пример 3) (70 мг, 0,170 ммоль) и карбонат цезия (167 мг, 0,511 ммоль) перемешивали в сухом ДМФА (5 мл) и обрабатывали 1,1-диметилэтил-3-бромпропаноатом (0,043 мл, 0,256 ммоль), затем перемешивали при 60 С в течение 2 ч. Добавляли дополнительные количества 1,1 диметилэтил-3-бромпропаноата (44 мкл) и реакционную смесь перемешивали при 60 С в течение 3 ч. Реакционную смесь выдерживали на протяжении ночи. Добавляли 1,1-диметилэтил-3-бромпропаноат (43 мкл) и реакционную смесь перемешивали при 60 С в течение 7 ч, затем выдерживали на протяжении ночи. Добавляли EtOAc (50 мл) и реакционную смесь промывали водой (250 мл), сушили над безводным MgSO4 и упаривали, получая при этом прозрачное, бесцветное масло (100 мг). Масло медленно отверждалось. Растирание со смесью простой эфир/гексан давало указанное в заголовке соединение (70 мг) в виде белого твердого вещества. МС (ES): для C29H34N4O4 требуется 502; найдено 503,0 (М+Н). Получение 13. 1,1-Диметилэтил-6-[(трифторметил)сульфонил]окси-1,2,4,5-тетрагидро-3 Н-3 бензазепин-3-карбоксилат К перемешиваемому раствору 1,1-диметилэтил-6-гидрокси-1,2,4,5-тетрагидро-3 Н-3-бензазепин-3 карбоксилата (можно получить, как описано в WO 2006/002928) (6,545 г) в сухом DCM (100 мл) в атмосфере аргона при -10 С добавляли триэтиламин (4 мл). Спустя 10 мин по каплям на протяжении 10 мин добавляли трифторметансульфоновый ангидрид (4,7 мл). Бесцветный раствор превращался в янтарный,затем в красный. Реакционной смеси давали возможность достичь к.т. на протяжении 30 мин, затем перемешивали при к.т. на протяжении 18 ч. Затем реакционную смесь выливали на насыщенный раствор карбоната натрия (100 мл) и слой DCM собирали, сушили и упаривали. Указанное в заголовке соединение (5 г) получали хроматографией (элюирование DCM). Н (400 МГц, CDCl3): 7,22-7,12 (3 Н, м), 3,59-3,57 (4 Н, м), 3,01-2,99 (4 Н, м), 1,48 (9 Н, с); МС (ES): для C16H20F3NO5S требуется 395; найдено 340 [М+Н-56]+. Получение 14. 1,1-Диметилэтил-6-циано-1,2,4,5-тетрагидро-3 Н-3-бензазепин-3-карбоксилат 1,1-Диметилэтил-6-[(трифторметил)сульфонил]окси-1,2,4,5-тетрагидро-3 Н-3-бензазепин-3 карбоксилат (получение 13) (5 г), цианид цинка(II) (1,5 г) и тетракис(трифенилфосфин)палладий(0) (1,5 г) нагревали в сухом ДМФА при 150 С в течение 18 ч. Охлажденную реакционную смесь разбавлялиEtOAc (200 мл) и фильтровали. Фильтрат промывали насыщенным бикарбонатом натрия (200 мл), водой(200 мл) и насыщенным раствором соли (200 мл). Сырую реакционную смесь сушили обычным способом и упаривали. Очистка хроматографией (элюирование DCM) давала указанное в заголовке соединение (3,4 г). Н (400 МГц, CDCl3): 7,50 (1 Н, д), 7,35 (1 Н, д), 7,27-7,21 (1 Н, м), 3,62-3,56 (4 Н, м), 3,22-3,20 (2 Н, м),2,97-2,94 (2 Н, м), 1,47 (9 Н, с); МС (ES): для C16H20N2O2 требуется 272; найдено 217 [М+Н-56]+, 273 1,1-Диметилэтил-6-циано-1,2,4,5-тетрагидро-3 Н-3-бензазепин-3-карбоксилат (получение 14) (1,15 г), гидрохлорид гидроксиламина (1,18 г) и бикарбонат натрия (1,76 г) нагревали при 60 С в этаноле (100 мл) в течение 18 ч в атмосфере аргона. Охлажденную реакционную смесь упаривали досуха, распределяли между DCM (100 мл) и водой (100 мл). Слой DCM собирали и водный слой промывали DCM (50 мл). Объединенные слои DCM сушили и упаривали. Указанное в заголовке соединение (506 мг) выделяли 1,1-Диметилэтил-6-[(гидроксиамино)(имино)метил]-1,2,4,5-тетрагидро-3 Н-3-бензазепин-3 карбоксилат (получение 15) (360 мг, 1,179 ммоль) растворяли в ТГФ (50 мл) и раствор перемешивали с гидридом натрия (60% дисперсия в минеральном масле, 51,9 мг, 1,2 97 ммоль) в атмосфере аргона при комнатной температуре в течение 30 мин. Затем добавляли метил-3-циано-4-[(1-метилэтил)окси]бензоат(можно получить, как описано в WO 2005058848) (388 мг, 1768 ммоль) в виде раствора в ТГФ (5 мл) и реакционную смесь нагревали при температуре флегмы в течение 1,5 ч. Охлажденный раствор упаривали и распределяли между DCM (100 мл) и водой (100 мл). Слой воды промывали DCM (50 мл) и объединенные слои DCM сушили (гидрофобной фриттой) и упаривали. Продукт выделяли хроматографией на диоксиде кремния (элюирование DCM), получая при этом 1,1-диметилэтил-6-(5-3-циано-4-[(1 метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-1,2,4,5-тетрагидро-3 Н-3-бензазепин-3-карбоксилат (505 мг, 1,011 ммоль, выход 86%) в виде белой пены. Н (400 МГц, CDCl3): 8,41 (1 Н, с), 8,33 (1 Н, дд), 7,7 (1 Н, дд), 7,31-7,25 (2 Н, м), 7,13 (1 Н, д), 4,80 (1 Н,септ.), 3,63-3,62 (4 Н, м), 3,3-3,2 (2 Н, м), 2,95-3,05 (2 Н, м), 1,47 (6 Н, д), 1,43 (9 Н, ушир. с); МС (ES) для 1,1-Диметилэтил-6-[(гидроксиамино)(имино)метил]-1,2,4,5-тетрагидро-3 Н-3-бензазепин-3-карбоксилат (получение 15) (170 мг, 0,557 ммоль) растворяли в ТГФ (30 мл) и раствор перемешивали с гидридом натрия (24,49 мг, 0,612 ммоль) в атмосфере аргона при комнатной температуре в течение 30 мин. Затем добавляли метил-3-хлор-4-[(1-метилэтил)окси]бензоат (можно получить, как описано в WO 2005058848) (191 мг, 0,835 ммоль) и реакционную смесь нагревали при температуре флегмы в течение 1,5 ч. Охлажденную реакционную смесь упаривали и распределяли между DCM (100 мл) и водой (100 мл). Слой воды промывали DCM (50 мл) и объединенные слои DCM сушили (гидрофобной фриттой) и упаривали. Указанное в заголовке соединение выделяли хроматографией на диоксиде кремния (элюирование DCM). 1,1-Диметилэтил-6-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-1,2,4,5 тетрагидро-3 Н-3-бензазепин-3-карбоксилат (260 мг, 0,537 ммоль, выход 96%) выделяли в виде не совсем белой пены. Н (400 МГц, CDCl3): 8,22 (1 Н, с), 8,05 (1 Н, д), 7,68 (1 Н, д), 7,30-7,24 (2 Н, м), 7,06 (1 Н, д), 4,72 (1 Н,септ.), 3,65-3,55 (4 Н, м), 3,35-3,25 (2 Н, м), 2,95-3,05 (2 Н, м), 1,45 (6 Н, д), 1,43 (9 Н, с); МС (ES): для В 5 мл микроволновый реакционный сосуд добавляли 6-(5-3-хлор-4-[(1-метилэтил)окси]фенил 1,2,4-оксадиазол-3-ил)-2,3,4,5-тетрагидро-1 Н-3-бензазепин (свободное основание примера 8, полученное стандартными способами, например распределением между органическим и основным водным растворителями, и сбором органического растворителя) (70 мг) в ДМФА (3 мл) с получением коричневого раствора. Затем добавляли карбонат калия (101 мг) с последующим добавлением 1,1-диметилэтил-3- 19017691 бромпропаноата (38,1 мг, 0,182 ммоль). Реакционную смесь нагревали при 100 С в течение 10 мин. Охлажденную реакционную смесь разбавляли DCM (5 мл) и очищали SCX (промывание метанолом и элюирование сырого сложного аминоэфира раствором аммиака в метаноле). Очистка посредством В 5 мл микроволновый реакционный сосуд добавляли гидрохлорид 6-(5-3-хлор-4-[(1 метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-2,3,4,5-тетрагидро-1 Н-3-бензазепина (пример 8) (110 мг,0,262 ммоль). Затем добавляли карбонат калия (101 мг) с последующим добавлением 1,1 диметилэтилбромацетата (51,0 мг, 0,262 ммоль). Реакционную смесь нагревали при 100 С в течение 10 мин. Охлажденную реакционную смесь разбавляли DCM (5 мл) и очищали SCX (промывание метанолом и элюирование сырого сложного аминоэфира раствором аммиака в метаноле). 1,1-Диметилэтил-[6-(5-3 хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-1,2,4,5-тетрагидро-3 Н-3-бензазепин-3-ил]ацетат (120 мг, 0,241 ммоль, выход 92%) выделяли в виде бледно-желтого масла. МС (ES): для Суспензию 2,6-дицианотолуола (25,0 г, 176 ммоль), гидрохлорида гидроксиламина (73,0 г, 1,06 моль) и триэтиламина (142 г, 1,41 моль) в хлороформе (500 мл) перемешивали при 50 С в течение 7 ч,затем выдерживали при комнатной температуре на протяжении ночи. Реакционную смесь охлаждали на льду, обрабатывали 5 М HCl до рН 1 и экстрагировали три раза хлороформом. Водный слой экстрагировали ТГФ (7), охлаждали на льду, рН повышали до 4 40% NaOH и экстрагировали ТГФ (3). Последние экстракты ТГФ объединяли и упаривали досуха, получая при этом тускло-желтое твердое вещество, состоящее из продукта и приблизительно трети эквивалента триэтиламина (11,0 г). 1 Н ЯМР (400 МГц, d4-MeOH)(среди прочего) 7,70-7,76 (1 Н, м), 7,57-7,63 (1 Н, м), 7,35-7,62 (1 Н, м),2,58 (3 Н, с); МС (ЕС): для C9H9N3O требуется 175; найдено 176 [М+Н]+. Первые семь экстрактов ТГФ объединяли, упаривали досуха и растворяли в воде. Водный раствор экстрагировали дважды хлороформом, рН регулировали до рН 4 и экстрагировали ТГФ (3). Упаривание комбинированных экстрактов ТГФ давало дополнительные 4,5 г продукта. Получение 21. 3-(5-3-Хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-2-метилбензонитрил К раствору 3-циано-N-гидрокси-2-метилбензолкарбоксимидамида (получение 20) (1,70 г, 9,70 ммоль) в ТГФ (100 мл) добавляли гидрид натрия (0,427 г, 10,67 ммоль) в атмосфере аргона при к.т. и суспензию перемешивали в течение 30 мин. Затем добавляли метил-3-хлор-4-[(1-метилэтил)окси]бензоат(можно получить, как описано в WO 2005058848) (3,33 г, 14,56 ммоль) и реакционную смесь нагревали при кипячении с обратным холодильником в течение 45 мин, затем охлаждали до к.т. и перемешивали в течение 3 дней. Отдельно к суспензии 3-циано-N-гидрокси-2-метилбензолкарбоксимидамида (получение 20) (10,48 г, 59,8 ммоль) в ТГФ (250 мл) в атмосфере аргона при к.т. порциями добавляли гидрид натрия (2,87 г,71,8 ммоль) и образовавшуюся суспензию перемешивали при к.т. в течение 30 мин. Добавляли метил-3 хлор-4-[(1-метилэтил)окси]бензоат (19,9 г, 87 ммоль) и реакционную смесь нагревали при кипячении с обратным холодильником в течение 4 ч, затем перемешивали при к.т. в течение 16 ч. Две реакционные смеси объединяли. Добавляли воду (200 мл), затем смесь экстрагировали DCM(2250 мл). Органические слои объединяли, промывали насыщенным раствором соли (100 мл) и концен- 20017691 трировали в вакууме, получая при этом сырое белое твердое вещество (28,1 г). Твердое вещество снова растворяли в DCM (200 мл), ТГФ (150 мл) и EtOH (50 мл) и пропускали через невысокий слой диоксида кремния (высота 1 см). Элюирование DCM с последующим концентрированием в вакууме давало бледно-желтое твердое вещество, 3-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-2 метилбензонитрил (18,10 г, 51,2 ммоль, выход 80%). Элюирование диоксида кремния смесью DCM-EtOH(2:1) с последующим концентрированием давало бледно-желтое твердое вещество 3-(5-3-хлор-4-[(1 метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-2-метилбензонитрил (2,81 г, 6,35 ммоль, выход 10%). Обе порции были аналитически идентичными. 1 Н ЯМР (4 00 МГц, CDCl3)8,27 (1 Н, д), 8,22 (1 Н, д), 8,05 (1 Н, дд), 7,77 (1 Н, д), 7,45 (1 Н, т), 7,07Ar по стенке колбы добавляли nBuLi (44,3 мл, 70,9 ммоль) и образовавшийся раствор перемешивали в течение 1 ч. В атмосфере Ar при скорости 10 мл/мин-1 по каплям добавляли раствор 3-(5-3-хлор-4-[(1 метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-2-метилбензонитрила (получение 21) (12,54 г, 35,4 ммоль) в сухом ТГФ (100 мл) в атмосфере Ar и образовавшийся темно-синий раствор перемешивали при-78 С в течение 45 мин. При скорости 3 мл/мин-1 по каплям добавляли аллилбромид (6,13 мл, 70,9 ммоль) и образовавшуюся темно-красный раствор перемешивали в течение 30 мин при -78 С. Добавляли 1 М HCl (водный) (375 мл), смеси давали возможность нагреться до к.т., затем слои разделяли. Водный слой экстрагировали EtOAc (2125 мл), затем объединенные органические слои промывали насыщенным раствором соли (250 мл), сушили (MgSO4), фильтровали и концентрировали в вакууме, получая при этом сырое красное масло (12,8 г). Масло снова растворяли в DCM (20 мл) и добавляли в предварительно смоченную (изогексаном) колонку диоксида кремния (55 см). Элюирование смесью EtOAc-изогексан (1:3) и концентрирование требуемых фракций давало бледно-оранжевое твердое вещество, 2-(3-бутен-1-ил)-3(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)бензонитрил (9,50 г, 20,98 ммоль, выход 59,2%). 1 Н ЯМР (400 МГц, CDCl3)8,26 (1 Н, д), 8,24 (1 Н, д), 8,05 (1 Н, дд), 7,79 (1 Н, д), 7,46 (1 Н, т), 7,07 Через раствор 2-(3-бутен-1-ил)-3-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3 ил)бензонитрил (получение 22) (8,26 г, 20,97 ммоль) в DCM (125 мл) в атмосфере Ar при -78 С барботировали Ar, затем O2 (4 мин каждого). Озонизатор (модель 502; 75 л/ч-1; 0,3 А) включали и оранжевый раствор озонировали до тех пор, пока он не окрашивался в темный зелено-серый цвет (3 ч). Озонизатор выключали и через раствор барботировали O2, затем Ar (10 мин каждый). Раствору давали возможность нагреться до к.т. в атмосфере Ar, затем его концентрировали в вакууме, получая при этом непрозрачное желтое масло. Его снова растворяли в сухом ТГФ (200 мл), добавляли ВН 3DMS (9,96 мл, 105 ммоль)(внимание: происходит выделение газа) и раствор перемешивали при к.т. в течение 18 ч и затем при 40 С в течение 3 ч. Реакционную смесь охлаждали до 0 С, затем осторожно добавляли 0,1 М водный HCl (150 мл) (внимание: происходит выделение газа), затем оставляли для перемешивания при к.т. в течение 18 ч. Раствор пропускали непосредственно через колонку SCX-2 (50 г), промывая МеОН. Продукт элюировали 0,5 М NH3 в МеОН; концентрирование в вакууме давало оранжевую пену, 3[2-(аминометил)-6-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)фенил]-1-пропанол К раствору 3-[2-(аминометил)-6-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3 ил)фенил]-1-пропанола (получение 23) (424 мг, 1,055 ммоль) и трифенилфосфина (1384 мг, 5,28 ммоль) в сухом DCM (150 мл) при к.т. в атмосфере Ar на протяжении 2 мин по каплями добавляли DIAD (0,974 мл, 5,01 ммоль) и образовавшийся бледно-желтый раствор перемешивали при к.т. в течение 2 ч. Раствор концентрировали до 10 мл, затем пропускали через картридж SCX-2 (10 г), промывали МеОН. Продукт элюировали 0,5 М раствором NH3 в МеОН; концентрирование в вакууме давало бледно-оранжевое масло(900 мг). Очистку SCX-2 повторяли для удаления оставшегося оксида трифенилфосфина, получая при этом бледно-желтое масло (314 мг). Масло снова растворяли в DCM (40 мл), последовательно добавляли ВОС 2 О (0,367 мл, 1,583 ммоль) и DMAP (6,44 мг, 0,053 ммоль) и смесь перемешивали в атмосфере Ar в течение 2 ч. Добавляли насыщенный водный NH4Cl (20 мл), затем водный слой экстрагировали DCM (25 мл). Органические слои объединяли, пропускали через гидрофобную фритту и концентрировали в вакууме, получая при этом сырое бледно-коричневое масло (496 мг). Флэш-хроматография (диоксид кремния; Flash 25M; линейный градиент (0,1-1%) МеОН в DCM) давала желтое масло, 1,1-диметилэтил-6-(53-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-1,3,4,5-тетрагидро-2 Н-2-бензазепин-2 карбоксилат (130 мг). Это вещество снова растворяли в 4 М HCl в диоксане (5 мл, 20,00 ммоль) и перемешивали при к.т. в течение 3 ч. Раствор добавляли в колонку SCX-3 (10 г) и колонку промывали МеОН. Продукт элюировали 0,5 М NH3 в МеОН; концентрирование в вакууме давало тускло-белое твердое вещество (102 мг). Продукт снова растворяли в сухом ДМФА (3 мл); добавляли карбонат калия (74,1 мг,0,536 ммоль) и трет-бутилбромацетат (0,042 мл, 0,281 ммоль), затем суспензию облучали до 100 С в течение 10 мин в микроволновой печи. Смесь разбавляли DCM (7 мл), затем добавляли в картридж SCX-3(10 г) и промывали МеОН. Продукт элюировали 0,5 М NH3 в МеОН; концентрирование в вакууме давало оранжевое масло (57 мг). Масса-направленная автоочистка с обращенной фазой (MDAP) давала продукт в растворе вода-MeCN. Требуемые фракции добавляли в картридж SCX-3 (1 г) и промывали МеОН. Продукт элюировали 0,5 М NH3 в МеОН; концентрирование в вакууме давало прозрачную пленку (21,4 мг) смеси с отношением 5:2 1,1-диметилэтил-[6-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3 ил)-1,3,4,5-тетрагидро-2 Н-2-бензазепин-2-ил]ацетата и [6-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4 оксадиазол-3-ил)-1,3,4,5-тетрагидро-2 Н-2-бензазепин-2-ил]уксусной кислоты. Основной компонент: 1 Н ЯМР (400 МГц, CDCl3)8,22 (1 Н, д), 8,05 (1 Н, дд), 7,68 (1 Н, д), 7,26 (1 Н,д), 7,25 (1 Н, т), 7,06 (1 Н, д), 4,72 (1 Н, септ.), 4,14 (2 Н, с), 3,28 (2 Н, ушир. с), 3,23 (2 Н, т), 3,16 (2 Н, с), 1,77DIAD (32,1 мл, 165 ммоль) добавляли по каплям на протяжении 15 мин к перемешиваемому охлаждаемому льдом раствору метил-2-гидрокси-4-(метилокси)бензоата (24,18 г, 150 ммоль), 1,1-диметилэтил(2-гидроксиэтил)карбамата (27,3 г, 150 ммоль) и трифенилфосфина (43,3 г, 165 ммоль) в ТГФ (450 мл),затем смесь перемешивали и давали ей возможность нагреться до комнатной температуры на протяжении 2 ч. Реакционную смесь упаривали, получая при этом 129,9 г вязкого желтого масла. Добавляли трифторуксусную кислоту (60 мл, 77 9 ммоль) в дихлорметане (DCM) (350 мл) и реакционную смесь выдерживали при комнатной температуре в течение 65 ч, затем упаривали досуха. Образовавшийся остаток растворяли в 500 мл простого эфира и раствор экстрагировали 2 М HCl (200 мл и 275 мл). Объединенные кислотные экстракты промывали 200 мл простого эфира, затем добавляли 500 мг льда вместе с 250 мл EtOAc и смесь подщелачивали 50% гидроксидом натрия при энергичном перемешивании. Органический слой отделяли и водный слой дополнительно экстрагировали 475 мл EtOAc и объединенные органические слои сушили (сульфатом магния) и упаривали, получая при этом 21,1 г желтого масла. Масло растворяли в толуоле (350 мл) и раствор перемешивали и кипятили с обратным холодильником в течение 24 ч, затем упаривали и очищали флэш-хроматографией с элюированием EtOAc, получая при этом указанное в заголовке соединение (8,61 г) в виде белого твердого вещества. МС (ES): для C10H11NO3 требуется 193; найдено 194 [М+Н]+. Получение 26. 8-Гидрокси-3,4-дигидро-1,4-бензоксазепин-5(2 Н)-он Смесь 8-(метилокси)-3,4-дигидро-1,4-бензоксазепин-5(2 Н)-она (получение 25) (7,98 г, 41,3 ммоль) и бромисто-водородной кислоты (100 мл, 1842 ммоль) перемешивали и нагревали при 110 С в течение 7 ч. Затем реакционную смесь упаривали и дважды подвергали азеотропной перегонке с 150 мл этанола, получая при этом указанное в заголовке соединение (8,66 г) в виде светло-коричневого твердого вещества,которое применяли без очистки. МС (ES): для C9H9NO3 требуется 179; найдено 180 [М+Н]+. Получение 27. 8-[(Фенилметил)окси]-3,4-дигидро-1,4-бензоксазепин-5(2 Н)-он Смесь 8-гидрокси-3,4-дигидро-1,4-бензоксазепин-5(2 Н)-она (получение 26) (8,66 г, 48,3 ммоль),бензилбромида (6,32 мл, 53,2 ммоль) и карбоната калия (20,04 г, 145 ммоль) в ДМФА (80 мл) перемешивали и нагревали при 60 С в течение 2 ч. Охлажденную реакционную смесь разбавляли смесьюEtOAc/вода (300 мл каждого) и водный слой экстрагировали EtOAc (275 мл). Объединенные органические слои промывали 3100 мл воды, сушили (сульфатом магния), упаривали, растирали с простым эфиром и фильтровали, получая при этом указанное в заголовке соединение (8,39 г) в виде белого твердого вещества. МС (ES): для C16H15NO3 требуется 269; найдено 270 [М+Н]+. Получение 28. 8-[(Фенилметил)окси]-2,3,4,5-тетрагидро-1,4-бензоксазепин 1 М Литийалюминийгидрид (62,4 мл, 62,4 ммоль) в ТГФ добавляли в атмосфере аргона к перемешиваемому раствору 8-(фенилметил)окси]-3,4-дигидро-1,4-бензоксазепин-5(2 Н)-она (получение 27) (8,39 г,31,2 ммоль) в ТГФ (150 мл) при охлаждении ледяной баней на протяжении 5 мин. Образовавшийся раствор нагревали с перемешиванием при 60 С в течение 3 ч. Реакционную смесь охлаждали и осторожно гасили медленным добавлением при охлаждении льдом 150 мл 2 М гидроксида натрия с последующим добавлением 150 мл EtOAc. Органический слой отделяли и водный слой экстрагировали 100 мл EtOAc. Объединенные органические экстракты сушили (сульфат магния) и упаривали, получая при этом указанное в заголовке соединение (7,53 г) в виде легкого бесцветного масла. МС (ES): для C16H17NO2 требуется 255; найдено 256 [М+Н]+. Получение 29. 1,1-Диметилэтил-8-[(фенилметил)окси]-2,3-дигидро-1,4-бензоксазепин-4(5 Н)карбоксилат ВОС 2 О (7,52 мл, 32,4 ммоль) добавляли к раствору 8-[(фенилметил)окси]-2,3,4,5-тетрагидро-1,4 бензоксазепина (получение 28) (7,52 г, 29,5 ммоль) в DCM (100 мл) и смесь выдерживали при комнатной температуре в течение 30 мин. Затем реакционную смесь упаривали досуха и очищали флэшхроматографией с элюированием 5% EtOAc в изогексане и заменой на 15% EtOAc в изогексане для элюирования продукта. Растирание с изогексаном и фильтрование давало 7,37 г белого твердого вещества. МС (ES): для C21H25NO4 требуется 355; найдено 300 [М+Н-56]+. Получение 30. 1,1-Диметилэтил-8-гидрокси-2,3-дигидро-1,4-бензоксазепин-4 (5 Н)-карбоксилат(0,735 г, 6,91 ммоль) в течение 18 ч, затем фильтровали и упаривали, получая при этом указанное в заголовке соединение (5,49 г) в виде белого твердого вещества. МС (ES): для C14H19NO4 требуется 265; найдено 166 [М+Н-100]+. Трифторметансульфоновый ангидрид (0,253 мл, 1,498 ммоль) добавляли к охлажденному льдом раствору 1,1-диметилэтил-8-гидрокси-2,3-дигидро-1,4-бензоксазепин-4(5 Н)-карбоксилата (получение 30)(0,265 г, 0,999 ммоль) в пиридине (4 мл) и смесь перемешивали в течение 1 ч. Реакционную смесь упаривали, растворяли в 40 мл EtOAc и промывали 20 мл 2 М HCl и 20 мл насыщенного бикарбоната натрия,затем сушили (сульфатом магния) и упаривали, получая при этом указанное в заголовке соединение (399 мг) в виде желтой смолы. МС (ES): для C15H18F3NO6S требуется 397; найдено 298 [M+H-100]+. Получение 32. 1,1-Диметилэтил-8-циано-2,3-дигидро-1,4-бензоксазепин-4(5 Н)-карбоксилат Смесь 1,1-диметилэтил-8-[(трифторметил)сульфонил]окси-2,3-дигидро-1,4-бензоксазепин-4(5 Н)карбоксилата (получение 31) (0,397 г, 0,999 ммоль), цианида цинка (0,176 г, 1,499 ммоль) и тетракис(трифенилфосфин)палладия(0) (0,115 г, 0,100 ммоль) в ДМФА (4 мл) перемешивали и нагревали при 80 С в течение 2 ч, затем охлаждали и разбавляли смесью EtOAc/вода (40 мл каждого) и органический слой промывали 320 мл воды, сушили (сульфатом магния), упаривали и очищали флэшхроматографией с элюированием смесью 1:4 EtOAc/изогексан, получая при этом указанное в заголовке соединение (198 мг) в виде смолы, которая медленно кристаллизовалась. МС (ES): для C15H18F3N2O3 требуется 274; найдено 175 [М+Н-100]+. Получение 33. 1,1-Диметилэтил-8-[(гидроксиамино)(имино)метил]-2,3-дигидро-1,4-бензоксазепин 4(5 Н)-карбоксилат(0,195 г, 0,711 ммоль), гидрохлорида гидроксиламина (0,099 г, 1,422 ммоль) и бикарбоната натрия (0,299 г, 3,55 ммоль) в этаноле (5 мл) перемешивали и нагревали при 60 С в течение 3 ч. Реакционную смесь охлаждали, упаривали и растворяли в смеси EtOAc/вода (40 мл каждого, необходимо некоторое нагревание) и органический слой сушили (сульфатом магния) и упаривали, получая при этом указанное в заголовке соединение (210 мг) в виде белого твердого вещества. МС (ES): для(4 мл) перемешивали при комнатной температуре в течение 20 мин, затем нагревали при 100 С в течение 17 ч. Охлажденную реакционную смесь разбавляли смесью EtOAc/вода (4 мл каждого) и органический слой собирали, сушили (сульфатом магния), упаривали и очищали хроматографией Biotage в смеси 1:4EtOAc/изогексан, получая при этом указанное в заголовке соединение (172 мг) в виде белого твердогоDIPEA (0,097 мл, 0,557 ммоль) перемешивали и нагревали при 80 С в течение 4 ч, когда добавляли дополнительную порцию этил-3-бромпропаноата (0,084 г, 0,199 ммоль) и DIPEA (0,097 мл, 0,557 ммоль), и смесь нагревали на протяжении ночи, когда добавляли дополнительную порцию этил-3-бромпропаноата(0,084 г, 0,199 ммоль) и DIPEA (0,097 мл, 0,557 ммоль), и смесь нагревали в течение еще 3 ч, когда прореагировали все исходные соединения. Охлажденную реакционную смесь разбавляли смесьюEtOAc/вода (30 мл каждого) и органический слой сушили (сульфатом магния), упаривали и очищали флэш-хроматографией с элюированием смесью 1:1 EtOAc/изогексан, получая при этом указанное в заголовке соединение в виде бесцветной смолы. МС (ES) : для C25H2835ClN3O5 требуется 485; найдено 486(0,059 г, 0,300 ммоль) в ацетонитриле (5 мл) перемешивали и нагревали при 70 С в течение 15 ч. Охлажденную реакционную смесь разбавляли и растворяли в смеси EtOAc/вода (30 мл каждого) и органический слой сушили (сульфатом магния), упаривали и очищали флэш-хроматографией с элюированием смесью 1:1 EtOAc/изогексан, получая при этом указанное в заголовке соединение (106 мг) в виде бесцветной смолы. МС (ES): для C26H3035ClN3O5 требуется 499; найдено 500 [М+Н]+. Получение 37. 1,1-Диметилэтил-[8-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)2,3-дигидро-1,4-бензоксазепин-4(5 Н)-ил]ацетатDIPEA (0,210 мл, 1,203 ммоль) в ацетонитриле (5 мл) перемешивали и нагревали при 70 С в течение 1 ч. Охлажденную реакционную смесь разбавляли смесью EtOAc/вода (30 мл каждого) и органический слой сушили (сульфатом магния), упаривали и очищали флэш-хроматографией с элюированием смесью 1:2EtOAc/изогексан, получая при этом указанное в заголовке соединение (130 мг) в виде бесцветной смолы. МС (ES): для C26H3035ClN3O5 требуется 499; найдено 500 [М+Н]+. Получение 38. 1-Метилэтил-4-[(1-метилэтил)окси]-3-(трифторметил)бензоат Смесь 4-гидрокси-3-(трифторметил)бензойной кислоты (2,5 г, 12,1 ммоль), 2-иодпропана (2,42 мл,24,3 ммоль) и карбоната калия (3,35 г, 24,3 ммоль) в N,N'-диметилформамиде (200 мл) нагревали при 70 С в течение 4 ч. Реакционную смесь частично концентрировали в вакууме и остаток распределяли между EtOAc (150 мл) и водой (150 мл), содержащей некоторое количество водного гидроксида натрия. Водную фазу экстрагировали дополнительным EtOAc (2100 мл) и объединенные органические фракции сушили (гидрофобная фритта в качестве разделителя фаз) и концентрировали в вакууме, получая при- 25017691 этом сырое указанное в заголовке соединение в виде желтого масла (3,6 г, 12,1 ммоль). Н (d6-ДМСО, 400 МГц): 8,16 (1 Н, дд), 8,08 (1 Н, д), 7,43 (1 Н, д), 5,13 (1 Н, септет), 4,91 (1 Н, септет),1,32 (12 Н, д). Получение 39. 4-[(1-Метилэтил)окси]-3-(трифторметил)бензойная кислота К смеси 1-метилэтил-4-[(1-метилэтил)окси]-3-(трифторметил)бензоата (получение 38) (3,63 г, 12,5 ммоль) в этаноле (100 мл) добавляли водный гидроксид натрия (12,5 М, 10,0 мл, 125 ммоль) и реакционную смесь нагревали для кипячения с обратным холодильником в течение 3 ч. Смесь концентрировали в вакууме и остаток распределяли между EtOAc (100 мл) и водой (100 мл) и подкисляли водной хлористоводородной кислотой. Водный слой экстрагировали дополнительно EtOAc (100 мл) и объединенные органические слои сушили и концентрировали в вакууме, получая при этом указанное в заголовке соединение в виде желтого твердого вещества (2,68 г, 10,8 ммоль). МС (ES-): для C11H11F3O3 требуется 248; найдено 247 [М-Н]+. Получение 40. 2-(Трифторметил)-4-бифенилкарбоновая кислота Реакционную смесь делили на 4 части с применением четверти указанного количества каждого из указанных реагентов: 4-бром-3-(трифторметил)бензонитрила (4 г, 16,00 ммоль), фенилбороновой кислоты (3,90 г, 32,0 ммоль) и карбоната калия (6,63 г, 48,0 ммоль) в ДМФА (64 мл) и к каждой смеси добавляли тетракистрифенилфосфинпалладий(0) (1,849 г, 1,600 ммоль). Каждую реакционную смесь нагревали в микроволновой печи при 150 С в течение 30 мин. Объединенные реакционные смеси фильтровали через целит, промывали EtOAc и растворитель удаляли в вакууме. Остаток распределяли между EtOAc(100 мл) и водой (100 мл) и органическую фазу промывали раствором бикарбоната натрия (100 мл). Органическую фазу сушили (MgSO4), фильтровали и растворитель удаляли в вакууме. Коричневое масло растирали с DCM и фильтровали, получая при этом бледно-желтое твердое вещество, 2-(трифторметил)4-бифенилкарбоксамид (2,47 г), который применяли без дополнительной очистки. К 2-(трифторметил)-4 бифенилкарбоксамиду (2 г, 7,54 ммоль) в этаноле (80 мл) добавляли гидроксид калия (4,23 г, 75 ммоль) и воду и смесь нагревали до 90 С в течение 18 ч. Реакционную смесь концентрировали в вакууме и остаток распределяли между DCM (100 мл) и 2 М HCl (100 мл). Органическую фазу отделяли и сушили (гидрофобная фритта в качестве разделителя фаз) и растворитель удаляли в вакууме, получая при этом сырой продукт. Хроматографическая очистка с применением Biotage Horizon, картриджа с обращенной фазой, и элюированием 5-100% MeCN в воде давала указанное в заголовке соединение в виде не совсем белого твердого вещества (960 мг). ЖХМС (ES-): для C14H9F3O2 требуется 266; найдено 265 [М-Н+]. Получение 41. 1,1-Диметилэтил-7-[(гидроксиамино)(имино)метил]-1,2,4,5-тетрагидро-3 Н-3-бензазепин-3-карбоксилат Суспензию 1,1-диметилэтил-7-циано-1,2,4,5-тетрагидро-3 Н-3-бензазепин-3-карбоксилата (можно получить, как описано в WO 2002040471) (5 г, 18,36 ммоль), гидрохлорида гидроксиламина (2,55 г, 36,7 ммоль) и бикарбоната натрия (7,71 г, 92 ммоль) в этаноле (250 мл) нагревали при 50 С на протяжении ночи. К реакционной смеси добавляли дополнительный гидрохлорид гидроксиламина (0,638 г, 9,18 ммоль) и нагревание при 50 С продолжали в течение 5 ч. Реакционной смеси позволяли охладиться и твердое вещество отделяли фильтрованием, раствор концентрировали в вакууме, получая при этом указанное в заголовке соединение в виде белого твердого вещества (5,77 г, 17,01 ммоль, выход 93%). Н (d6-ДМСО, 400 МГц): 9,56 (1 Н, с), 7,52-7,37 (2 Н, м), 7,14 (1 Н, д), 5,77 (2 Н, ушир. с), 3,50-3,32 К раствору 3-хлор-4-[(1-метилэтил)окси]бензойной кислоты (получение 6) (1,406 г, 6,55 ммоль) в ДМФА добавляли НОВТ (1,103 г, 7,20 ммоль) и EDC (1,381 г, 7,20 ммоль), образовавшийся раствор перемешивали в атмосфере аргона в течение 10 мин при комнатной температуре. Затем к реакционной смеси добавляли 1,1-диметилэтил-7-[(гидроксиамино)(имино)метил]-1,2,4,5-тетрагидро-3 Н-3-бензазепин-3 карбоксилат (получение 41) (2 г, 6,55 ммоль) и раствор нагревали при 80 С на протяжении ночи. Растворитель удаляли в вакууме, и остаток растворяли в метаноле и очищали Biotage Horizon, картриджем с обращенной фазой при элюировании 5-100% ацетонитрила в воде. Содержащие продукт фракции (последние 5) концентрировали в вакууме, получая при этом указанное в заголовке соединение в виде желтого масла (950 мг, 1,87 ммоль, выход 29%). Н (d6-ДМСО, 400 МГц): 8,19 (1 Н, д), 8,11 (1 Н, дд), 7,83-7,89 (2 Н, м), 7,45 (1 Н, д), 7,37 (1 Н, д), 4,89(687 мг, 3,63 ммоль), НОВТ (539 мг, 3,99 ммоль) и EDC (762 мг, 3,99 ммоль) перемешивали в ДМФА (30 мл) в атмосфере аргона в течение 20 мин. Добавляли 1,1-диметилэтил-7-[(гидроксиамино)(имино)метил]1,2,4,5-тетрагидро-3 Н-3-бензазепин-3-карбоксилат (получение 41) (1,11 г, 3,63 ммоль) и смесь перемешивали при комнатной температуре в течение 4 ч перед нагреванием ее до 80 С в течение 20 ч. Реакционную смесь распределяли между EtOAc (80 мл) и водой (80 мл) и органический слой промывали водным бикарбонатом натрия и водой перед тем, как его сушили обычным способом и упаривали. Остаток растирали с метанолом, получая при этом указанное в заголовке соединение в виде белого твердого вещества (981 мг, 2,07 ммоль). Н (d6-ДМСО, 400 МГц): 8,50 (1 Н, д), 8,40 (1 Н, дд), 7,88 (1 Н, ушир. с), 7,85 (1 Н, дд), 7,56 (1 Н, д),7,38 (1 Н, д), 4,98 (1 Н, септет), 3,53-3,47 (4 Н, м), 3,00-2,92 (4 Н, м), 1,41 (9 Н, с), 1,39 (6 Н, д). Получение 44. 1,1-Диметилэтил 7-5-[4-[(1-метилэтил)окси]-3-(трифторметил)фенил]-1,2,4 оксадиазол-3-ил-1,2,4,5-тетрагидро-3 Н-3-бензазепин-3-карбоксилат 4-[(1-Метилэтил)окси]-3-(трифторметил)бензойную кислоту (получение 39) (744 мг, 3,00 ммоль),НОВТ (446 мг, 3,30 ммоль) и EDC (630 мг, 3,30 ммоль) перемешивали в ДМФА (28 мл) в атмосфере аргона в течение 20 мин. Добавляли 1,1-диметилэтил-7-[(гидроксиамино)(имино)метил]-1,2,4,5-тетрагидро 3 Н-3-бензазепин-3-карбоксилат (получение 41) (915 мг, 3,00 ммоль) и смесь перемешивали при комнатной температуре в течение 2 ч перед тем, как ее нагревали до 80 С в течение 20 ч. Реакционную смесь распределяли между EtOAc и водой и органический слой промывали водным бикарбонатом натрия перед тем, как его сушили обычным способом и упаривали. Остаток очищали Biotage Horizon картриджем с обращенной фазой с применением для элюирования 5-100% ацетонитрила в воде, получая при этом указанное в заголовке соединение (749 мг, 1,45 ммоль). Н (d6-ДМСО, 400 МГц): 8,40 (1 Н, дд), 8,31 (1 Н, д), 7,89 (1 Н, ушир. с), 7,86 (1 Н, дд), 7,58 (1 Н, д),7,37 (1 Н, д), 4,98 (1 Н, септет), 3,54-3,46 (4 Н, м), 3,00-2,92 (4 Н, м), 1,41 (9 Н, с), 1,36 (6 Н, д). Получение 45. 1,1-Диметилэтил-7-5-[2-(трифторметил)-4-бифенилил]-1,2,4-оксадиазол-3-ил 1,2,4,5-тетрагидро-3 Н-3-бензазепин-3-карбоксилат 2-(Трифторметил)-4-бифенилкарбоновую кислоту (получение 40) (284 мг, 1,07 ммоль), НОВТ (159 мг, 1,18 ммоль) и EDC (225 мг, 1,18 ммоль) перемешивали в ДМФА (10 мл) в атмосфере аргона в течение 20 мин. Добавляли 1,1-диметилэтил-7-[(гидроксиамино)(имино)метил]-1,2,4,5-тетрагидро-3 Н-3 бензазепин-3-карбоксилат (получение 41) (326 мг, 1,07 ммоль) и смесь перемешивали при комнатной температуре в течение 2,5 ч перед тем, как ее нагревали до 80 С в течение 16 ч. Реакционную смесь распределяли между EtOAc (30 мл) и водой (30 мл) и органический слой промывали водным бикарбонатом натрия и водой перед тем, как его сушили (разделитель фаз) и упаривали. Остаток растирали с метанолом, получая при этом указанное в заголовке соединение в виде белого твердого вещества (370 мг, 0,69 ммоль). Фильтрат очищали Biotage Horizon картриджем с обращенной фазой с элюированием 5-100% ацетонитрила в воде, получая при этом указанное в заголовке соединение (70 мг, 0,13 ммоль). Н (d6-ДМСО, 400 МГц): 8,52 (1 Н, с), 8,50 (1 Н, д), 7,93 (1 Н, с), 7,90 (1 Н, дд), 7,74 (1 Н, д), 7,56-7,48 Гидрохлорид 7-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-2,3,4,5-тетрагидро 1 Н-3-бензазепина (пример 17) (100 мг, 0,238 ммоль), этилбромацетат (0,043 мл, 0,391 ммоль) и карбонат цезия (170 мг, 0,521 ммоль) перемешивали при комнатной температуре в ДМФА в течение 5 ч. Реакционную смесь разбавляли диэтиловым эфиром (20 мл) и промывали водой (2 20 мл), органический слой пропускали для сушки через картридж, разделяющий фазы, и концентрировали в вакууме, получая при этом указанное в заголовке соединение (77 мг, 0,16 ммоль, выход 60%) в виде желтого масла. Н (d6-ДМСО, 400 МГц): 8,19 (1 Н, с), 8,11 (1 Н, дд), 7,81-7,85 (2 Н, м), 7,45 (1 Н, д), 7,34 (1 Н, д), 4,89(ES): для C25H2835ClN3O4 требуется 469; найдено 470 [М+Н]+. Нижеследующие соединения получали аналогичными способами. Продукт получения 49 дополнительно очищали MDAP. Гидрохлорид 7-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-2,3,4,5-тетрагидро 1 Н-3-бензазепина (пример 17) (65 мг, 0,155 ммоль), DIPEA (0,104 мл, 0,593 ммоль) и этил-4 бромбутаноата (0,048 мл, 0,339 ммоль) перемешивали при 60 С в ДМФА (10 мл) в течение 24 ч. Реакционную смесь распределяли между EtOAc (30 мл) и водой (30 мл) и водный слой экстрагировали еще раз EtOAc (40 мл). Объединенные органические слои концентрировали в вакууме, получая при этом сырое указанное в заголовке соединение (100 мг, 0,171 ммоль) в виде оранжевого твердого вещества. МС Гидрохлорид 2-[(1-метилэтил)окси]-5-[3-(2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)-1,2,4-оксадиазол-5-ил]бензонитрила (пример 18) (200 мг, 0,534 ммоль), DIPEA (0,327 мл, 1,869 ммоль) и этил-4 бромбутаноат (0,153 мл, 1,068 ммоль) перемешивали при комнатной температуре в ДМФА (10 мл) в течение 5 ч, реакционную смесь затем нагревали до 60 С в течение 5 ч, реакционную смесь выдерживали на протяжении ночи при комнатной температуре, добавляли этил-4-бромбутаноат (0,076 мл, 0,534 ммоль) и реакционную смесь нагревали при 60 С в течение 6 ч. Реакционную смесь распределяли между этилацетатом (30 мл) и водой (30 мл) и водный слой экстрагировали еще раз этилацетатом (40 мл). Объединенные органические слои концентрировали в вакууме, получая при этом указанное в заголовке соединение (218 мг, 0,402 ммоль) в виде оранжевого масла. МС (ES): для C28H32N4O4 требуется 488; найдено 489 [М+Н]+. Получение 52. Этил-4-(7-5-[4-[(1-метилэтил)окси]-3-(трифторметил)фенил]-1,2,4-оксадиазол-3 ил-1,2,4,5-тетрагидро-3 Н-3-бензазепин-3-ил)бутаноат Гидрохлорид 7-5-[4-[(1-метилэтил)окси]-3-(трифторметил)фенил]-1,2,4-оксадиазол-3-ил-2,3,4,5 тетрагидро-1 Н-3-бензазепина (пример 19) (160 мг, 0,353 ммоль), DIPEA (0,234 мл, 1,342 ммоль) и этил-4 бромбутаноат (0,110 мл, 0,767 ммоль) перемешивали при комнатной температуре в ДМФА (10 мл) в течение 5 ч. Реакционную смесь затем нагревали при 60 С в течение 5 ч и выдерживали на протяжении ночи при комнатной температуре. Добавляли еще этил-4-бромбутаноат (0,055 мл, 0,383 ммоль) и реакционную смесь нагревали при 60 С в течение 6 ч. Реакционную смесь распределяли между EtOAc (30 мл) и водой (30 мл) и водный слой экстрагировали еще раз EtOAc (40 мл). Объединенные органические слои концентрировали в вакууме, получая при этом указанное в заголовке соединение (183 мг, 0,310 ммоль) в виде оранжевого твердого вещества. МС (ES): для C28H32F3N3O4 требуется 531; найдено 532(0,131 мл, 0,919 ммоль) перемешивали при к.т. в ДМФА (10 мл) в течение 5 ч. Реакционную смесь затем нагревали при 60 С в течение 5 ч и затем выдерживали ее на протяжении ночи при комнатной температуре. Добавляли дополнительный этил-4-бромбутаноат (0,066 мл, 0,459 ммоль) и реакционную смесь нагревали при 60 С в течение 6 ч. Реакционную смесь распределяли между EtOAc (30 мл) и водой (30
МПК / Метки
МПК: C07D 413/14, A61P 37/00, C07D 267/14, C07D 413/04, C07D 271/06, A61K 31/55, A61P 17/00, C07D 223/16
Метки: s1p, сфингозин-1-фосфата, оксадиазола, активные, отношении, производные
Код ссылки
<a href="https://eas.patents.su/30-17691-proizvodnye-oksadiazola-aktivnye-v-otnoshenii-sfingozin-1-fosfata-s1p.html" rel="bookmark" title="База патентов Евразийского Союза">Производные оксадиазола, активные в отношении сфингозин-1-фосфата (s1p)</a>
Предыдущий патент: Мутанты fgf21 и их применение
Следующий патент: Способ осуществления взлета без разбега или посадки без пробега конвертоплана
Случайный патент: Способ обработки приготавливаемого в микроволновой печи пищевого продукта и пищевой продукт