Фармацевтически активные производные пирролидина
Номер патента: 6424
Опубликовано: 29.12.2005
Авторы: Томас Рассел, Бакстер Энтони, Шер Александр, Шварц Маттиас, Куаттропани Анна, Алази Серж
Формула / Реферат
1. Производные пирролидина формулы I
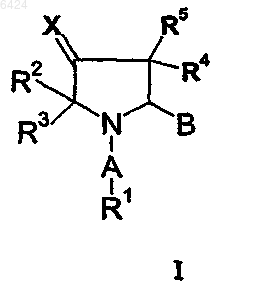
их геометрические изомеры, оптически активные формы, такие как энантиомеры, диастереомеры, рацемические формы и фармацевтически приемлемые соли, где
X выбирают из группы, включающей CR6R7, NOR6, NNR6R7;
A выбирают из группы, включающей -(C=O)-, -(C=O)-O-, -C(=NH)-, -(C=O)-NH-, -(C=S)-NH, -SO2-, -SO2NH-, -CH2-;
B представляет группу -(C=O)-NR8R9 или гетероциклический остаток формулы
R1 выбирают из группы, включающей незамещенный или замещенный C1-C6-алкил, незамещенный или замещенный C2-C6-алкенил, незамещенный или замещенный арил, незамещенный или замещенный, насыщенный или ненасыщенный 3-8-членный циклоалкил, ацил, незамещенный или замещенный C1-C6-алкиларил, незамещенный или замещенный C1-C6-алкилгетероарил, причем указанные циклоалкильные, арильные или гетероарильные группы могут быть конденсированы с 1-2 дополнительными циклоалкильными, арильными или гетероарильными группами;
R2, R3, R4 и R5 представляют водород;
R6 и R7 независимо выбирают из группы, включающей водород, незамещенный или замещенный C1-C6-алкил, незамещенный или замещенный C2-C6-алкенил, незамещенный или замещенный алкокси, незамещенный или замещенный тиоалкокси, галоген, циано, нитро, ацил, алкоксикарбонил, аминокарбонил, незамещенный или замещенный арил, незамещенный или замещенный C1-C6-алкиларил;
R8 и R9 независимо выбирают из группы, включающей водород, незамещенный или замещенный C1-C6-алкил, незамещенный или замещенный C2-C6-алкенил, незамещенный или замещенный, насыщенный или ненасыщенный 3-8-членный циклоалкил, который может содержать 1-3 гетероатома, выбранных из N, O, S, незамещенный или замещенный арил, незамещенный или замещенный гетероарил; либо
R8 и R9 вместе с атомом N, к которому они присоединены, могут образовывать 3-8-членное замещенное или незамещенное, насыщенное или ненасыщенное гетероциклическое кольцо, которое может содержать 1-2 дополнительных гетероатома, выбранных из N, S и O;
где термин "замещенный" означает, что указанная группа может быть замещена 1-5 заместителями, выбираемыми из группы, включающей C1-C6-алкил, C1-C6-алкиларил, C1-C6-алкилгетероарил, C2-C6-алкенил, C1-C6-алкинил, первичные, вторичные или третичные аминогруппы либо группы четвертичного аммония, ацил, ацилокси, ациламино, аминокарбонил, алкоксикарбонил, арил, гетероарил, карбоксил, циано, галоген, гидрокси, меркапто, нитро, сульфокси, сульфонил, алкокси, тиоалкокси, тригалогенметил, и где указанное замещение может также альтернативно включать случаи, когда смежные заместители замыкаются в кольцо, образуя таким образом лактамы, лактоны, циклические ангидриды, а также ацетали, тиоацетали, аминали;
термин "ацил" означает группу -C(O)R, где R представляет "C1-C6-алкил", "арил", "C1-C6-алкиларил" или "C1-C6-алкилгетеро арил";
термин "арил" означает ненасыщенную ароматическую карбоциклическую группу с 6-14 атомами углерода, имеющую одно кольцо или несколько конденсированных колец, предпочтительно выбранную из фенила, нафтила и фенантренила;
термин "гетероарил" означает гетероароматическую группу, имеющую моноциклическое гетероароматическое, бициклическое или трициклическое конденсированное кольцо, выбранное из следующих необязательно замещенных групп: пиридил, пирролил, фурил, тиенил, бензимидазолил, хиназолинил, хинолил, изохинолил, карбазолил, пиримидинил, бензотиадиазолил, бензодиоксолил, тиадиазолил;
при условии что, когда X означает (=CH2), A означает -(C=O)-O-, R1 означает трет-бутильную группу, B не может быть -(C=O)-NMe2, -(C=O)-NHMe, -(C=O)-NH-CH(Me)-(C=O)-NH-CH(Me)-COOH, -(C=O)-NH-CH-(COOCH2-Ph)-CH2-COOPh;
также при условии что, когда X означает (=CHR6), где R6 представляет циклогексилметил, A означает -(C=O)-O, R1 означает трет-бутильную группу, B не может быть -(C=O)-NH-трет-бутилом;
также при условии что, когда X означает C1-C20-алкилиден, A означает -(C=O)-O-, R1 означает трет-бутил, B не может быть

где R означает C1-C12-алкил и Hal представляет собой Cl, Br, J;
и также при условии, что когда X означает C1-C20-алкилиден, A-R1 представляет защитную группу, B не может быть
где R означает H или C1-C12-алкил.
2. Производное пирролидина по п.1, в котором B означает группу -(C=O)-NHR9, где R9 выбирают из группы, включающей незамещенный или замещенный C1-C6-алкил, незамещенный или замещенный C2-C6-алкенил, незамещенный или замещенный насыщенный или ненасыщенный 3-6-членный циклоалкил, который необязательно содержит атом N, незамещенный или замещенный арил, незамещенный или замещенный гетероарил.
3. Производное пирролидина по п.2, в котором R9 означает гетероарил, выбранный из группы, включающей пиридил, пирролил, фурил, тиенил, 2,1,3-бензотиадиазолил, бензодиоксолил, бензимидазолил, хиназолинил, хинолил, изохинолил, карбазолил, пиримидинил, тиадиазолил.
4. Производное пирролидина по любому из пп.1-4, в котором X означает NOR6, где R6 выбирают из группы, включающей H, незамещенный или замещенный C1-C6-алкил, незамещенный или замещенный C2-C6-алкенил, незамещенный или замещенный ацил, незамещенный или замещенный арил, незамещенный или замещенный C1-C6-алкиларил.
5. Производное пирролидина по п.4, в котором R6 означает H, CH3, незамещенный или замещенный CH2-фенил или аллил, предпочтительно H или метил.
6. Производное пирролидина по любому из пп.1-4, в котором X означает CHR6, где R6 выбирают из группы, включающей галоген, циано, незамещенный или замещенный C3-C6-алкил, незамещенный или замещенный C2-C6-алкенил, незамещенный или замещенный алкокси, незамещенный или замещенный тиоалкокси, нитро, ацил, алкоксикарбонил, аминокарбонил, незамещенный или замещенный арил, незамещенный или замещенный C1-C6-алкиларил.
7. Производное пирролидина по п.6, в котором R6 выбирают из группы, включающей галоген, циано, C1-C6-алкил, незамещенную или замещенную фенильную группу.
8. Производное пирролидина по любому из пп.1-7, в котором A означает -(C=O)-, -(C=O)-NH- или -SO2-.
9. Производное пирролидина по п.8, в котором A означает -(C=O)-.
10. Производное пирролидина по любому из пп.1-9, в котором R1 означает C1-C6-алкил, C2-C6-алкенил, незамещенный или замещенный арил, насыщенный или ненасыщенный 3-8-членный циклоалкил, C1-C6-алкиларил, C1-C6-алкилгетероарил.
11. Производное пирролидина по п.10, в котором R1 означает C1-C6-алкильную или арильную группу.
12. Производное пирролидина по п.11, в котором R1 означает бифенил.
13. Производное пирролидина по любому из пп.1-4, в котором X означрхт =NOR6 или =CHCl, R6 означает C1-C6-алкил, арил или C1-C6-алкиларильную группу, A означает -(C=O)- и R1 означает C1-C6-алкил, арил или C1-C6-алкиларильную группу.
14. Производное пирролидина по п.13, в котором X означает =NOR6 или =CHCl, R6 означает метил, B означает амидогруппу формулы -(C=O)NHR9, где R9 представляет незамещенную или замещенную C1-C6-алкиларильную группу, A означает -(C=O)- и R1 означает бифенил или ацетилметильную группу.
15. Производное пирролидина по п.14, в котором X означает =NOCH3, B означает амидогруппу формулы -(C=O)-NHR9, где R9 представляет замещенную фенилэтильную группу, A означает -(C=O)- и R1 означает замещенный бифенил.
16. Производное пирролидина по любому из предшествующих пунктов, выбранное из группы, включающей
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-(2-метоксиэтил)-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(хлорметилен)-N-(2-гидрокси-2-фенилэтил)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-(2-гидроксиэтил)-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-[(2RS)-2-гидрокси-2-фенетил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
O-метилоксим (3EZ,5S)-5-(1H-бензимидазол-2-ил)-1-([1,1'-бифенил]-4-илкарбонил)-3-пирролидинона;
(2S,4EZ)-N-(2,1,3-бензотиадиазол-4-ил)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)-N-(6-хинолинил)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-ацетоацетил-N-бензил-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(хлорметилен)-N-(2-фурилметил)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-[(4-хлорфенокси)ацетил]-4-{[(3,4-дихлорбензил)окси]имино}-N-[(2RS)-2-гидрокси-2-фенетил]-2-пирролидинкарбоксамид;
(2S,4EZ)-N-аллил-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)-N-(2-тиенилметил)-2-пирролидинкарбоксамид;
(2S,4EZ)-4-(цианометилен)-N-(2-фурилметил)-1-[(2-оксо-6-пентил-2H-пиран-3-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-(2-фурилметил)-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-ацетил-N-циклопропил-4-{[(3,4-дихлорбензил) окси]имино}-2-пирролидинкарбоксамид;
(2S,4EZ)-N-(2-фурилметил)-4-(метоксиимино)-1-[(2-оксо-6-пентил-2H-пиран-3-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4EZ)-N-бензил-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)-N-метил-2-пирролидинкарбоксамид;
(2S,4EZ)-1-(дифенилацетил)-4-(этоксиимино)-N-(2-тиенилметил)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-(2,1,3-бензотиадиазол-4-ил)-4-(цианометилен)-1-(дифенилацетил)-2-пирролидинкарбоксамид;
O-метилоксим (3EZ,5S)-5-(1H-бензимидазол-2-ил)-1-(дифенилацетил)-3-пирролидинона;
(2S)-2-[1-([1,1'-бифенил]-4-илкарбонил)-4-метилен-2-пирролидинил]-1H-бензимидазол;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(хлорметилен)-N-(2-метоксиэтил)-2-пирролидинкарбоксамид;
O-аллилоксим (3EZ,5S)-5-(1H-бензимидазол-2-ил)-1-(дифенилацетил)-3-пирролидинона;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-[2-(диэтиламино)этил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-(дифенилацетил)-4-{[(4-метоксибензил)окси]имино}-N-(2-тиенилметил)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-(3,4-диметоксибензил)-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-ацетоацетил-4-(метоксиимино)-N-(1-нафтилметил)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-аллил-4-{[(3,4-дихлорбензил)окси]имино}-1-(дифенилацетил)-2-пирролидинкарбоксамид;
(2S,4EZ)-4-{[(3,4-дихлорбензил)окси]имино}-N1-пентил-N2-(6-хинолинил)-1,2-пирролидиндикарбоксамид;
(2S,4EZ)-4-(хлорметилен)-1-(дифенилацетил)-N-[(2RS)-2-гидрокси-2-фенетил]-2-пирролидинкарбоксамид;
(2S)-1-([1,1'-бифенил]-4-илкарбонил)-N-[(2RS)-2-гидрокси-2-фенетил]-4-метилен-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(хлорметилен)-N-(6-хинолинил)-2-пирролидинкарбоксамид;
(2S,4EZ)-4-бензилиден-N-[2-(диэтиламино)этил]-1-(дифенилацетил)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-ацетоацетил-4-(метоксиимино)-N-(2-тиенилметил)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-ацетил-4-{[(3,4-дихлорбензил)окси]имино}-N-[(2RS)-2-гидрокси-2-фенетил]-2-пирролидинкарбоксамид;
(2S,4EZ)-4-{[(3,4-дихлорбензил)окси]имино}-N1-(3,5-дихлорфенил)-N2-(хинолинил)-1,2-пирролидиндикарбоксамид;
(2S,4EZ)-4-(метоксиимино)-N-(1-нафтилметил)-1-(феноксиацетил)-2-пирролидинкарбоксамид;
(2S,4EZ)-4-(хлорметилен)-N-(3,4-диметоксибензил)-1-[(2-оксо-6-пентил-2H-пиран-3-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4EZ)-1-(дифенилацетил)-4-(метоксиимино)-N-(2-тиенилметил)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-бензил-1-(дифенилацетил)-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-{[(3,4-дихлорбензил)окси]имино}-N-[2-(диэтиламино)этил]-2-пирролидинкарбоксамид;
(2S,4EZ)-4-{[(3,4-дихлорбензил)окси]имино}-1-[4-(диметиламино)бутаноил]-N-(6-хинолинил)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-(5-этил-1,3,4-тиадиазол-2-ил)-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-бензил-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-бензил-1-(дифенилацетил)-4-(этоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N2-циклопропил-4-{[(3,4-дихлорбензил)окси]имино}-N1-(3-метоксифенил)-1,2-пирролидиндикарбоксамид;
(2S,4EZ)-1-(дифенилацетил)-N-[(2RS)-2-гидрокси-2-фенетил]-4-{[(4-метоксибензил)окси]имино}-2-пирролидинкарбоксамид;
(2S)-N-(2-фурилметил)-4-метилен-1-[(2-оксо-6-пентил-2H-пиран-3-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4EZ)-N-(2,1,3-бензотиадиазол-4-ил)-1-(дифенилацетил)-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-бензил-1-(дифенилацетил)-4-{[(4-метоксибензил)окси]имино}-2-пирролидинкарбоксамид;
(2S,4EZ)-1-бензоил-4-{[(3,4-дихлорбензил)окси]имино}-N-(6-хинолинил)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-ацетоацетил-N-циклопропил-4-{[(3,4-дихлорбензил)окси]имино}-2-пирролидинкарбоксамид;
(2S,4EZ)-4-{[(3,4-дихлорбензил)окси]имино}-N2-[(2RS)-2-гидрокси-2-фенетил]-N1-пентил-1,2-пирролидиндикарбоксамид;
(2S,4EZ)-4-[(бензилокси)имино]-N-(1-нафтилметил)-1-(феноксиацетил)-2-пирролидинкарбоксамид;
(2S)-1-([1,1'-бифенил]-4-илкарбонил)-4-метилен-N-(6-хинолинил)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-циклопропил-4-{[(3,4-дихлорбензил)окси]имино}-1-(дифенилацетил)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-(4-цианобензоил)-4-{[(3,4-дихлорбензил)окси]имино}-N-(6-хинолинил)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-циклопропил-4-{[(3,4-дихлорбензил)окси]имино}-1-(метоксиацетил)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-(1,3-бензодиоксол-5-илметил)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)-2-пирролидинкарбоксамид;
O-(3,4-дихлорбензил)оксим (3EZ,5S)-5-[(4-ацетил-1-пиперазинил)карбонил]-1-акрилоил-3-пирролидинона;
(2S)-1-([1,1'-бифенил]-4-илкарбонил)-N-(2-фурилметил)-4-метилен-2-пирролидинкарбоксамид;
(2S,4EZ)-4-(цианометилен)-N-(3,4-диметоксибензил)-1-[(2-оксо-6-пентил-2H-пиран-3-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(2RS)-2-гидрокси-2-фенилэтил]-4-(метоксиимино)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-3-илкарбонил)-N-[(2RS)-2-гидрокси-2-фенилэтил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-(4-бензоилбензоил)-N-[(2RS)-2-гидрокси-2-фенилэтил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(2RS)-2-гидрокси-2-фенилэтил]-4-(метоксиимино)-1-(3-феноксибензоил)-2-пирролидинкарбоксаьшф;
(2S,4EZ)-N-[(2RS)-2-гидрокси-2-фенилэтил]-4-(метоксиимино)-1-(2-феноксибензоил)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(2S)-2-гидрокси-2-фенилэтил]-4-(метоксиимино)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(2R)-2-гидрокси-2-фенилэтил]-4-(метоксиимино)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4EZ)-N-(2-гидроксиэтил)-4-(метоксиимино)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4EZ)-N-(2-гидроксиэтил)-4-(метоксиимино)-N-метил-1-[(2'-метил-[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илсульфонил)-N-[(1S,2S,3R,4R)-3-(гидроксиметил)бицикло[2.2.1]гепт-2-ил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-(транс-4-гидроксициклогексил)-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-[(1R,2R)-2-(гидроксиметил)циклогексил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-[(2RS)-2-гидрокси-3-феноксипропил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(2RS)-2-гидрокси-3-феноксипропил]-4-(метоксиимино)-1-[4-(3-пиридинил)бензоил]-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,11-бифенил]-4-илсульфонил)-N-[(2RS)-2-гидрокси-3-феноксипропил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-[(2RS)-2-гидрокси-2-(4-гидроксифенил)этил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илсульфонил)-N-[(2RS)-2-гидрокси-2-(4-гидроксифенил)этил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-[(1-гидроксициклогексил)метил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(1-гидроксициклогексил)метил]-4-(метоксиимино)-1-[4-(3-пиридинил)бензоил]-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илсульфонил)-N-[(1-гидроксициклогексил)метил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-[(2RS)-2-(3,4-дигидроксифенил)-2-гидроксиэтил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(2S)-2-гидрокси-2-фенилэтил]-4-(метоксиимино)-1-[4-(4-пиридинил)бензоил]-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(2S)-2-гидрокси-2-фенилэтил]-4-(метоксиимино)-1-[4-(3-пиридинил)бензоил]-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(2S)-2-гидрокси-2-фенилэтил]-4-(метоксиимино)-1-[4-(2-пиридинил)бензоил]-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-[(2RS)-2,3-дигидроксипропил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илсульфонил)-N-[(2RS)-2,3-дигидроксипропил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-[(2RS)-2-гидрокси-3-(4-метоксифенокси)пропил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(2RS)-2-гидрокси-3-(4-метоксифенокси)пропил]-4-(метоксиимино)-1-[4-(3-пиридинил)бензоил]-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илсульфонил)-N-[(2RS)-2-гидрокси-3-(4-метоксифенокси)пропил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-[(2RS)-2-гидроксипропил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илсульфонил)-N-[(2RS)-2-гидроксипропил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илсульфонил)-N-[(2RS)-2-гидрокси-2-(2-нафтил)этил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-[(2RS)-2-гидрокси-2-(4-нитрофенил)этил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(2RS)-2-гидрокси-2-(4-нитрофенил)этил]-4-(метоксиимино)-1-[4-(4-пиридинил)бензоил]-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(2RS)-2-гидрокси-2-(4-нитрофенил)этил]-4-(метоксиимино)-1-[4-(3-пиридинил)бензоил]-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(2RS)-2-гидрокси-2-(4-нитрофенил)этил]-4-(метоксиимино)-1-[4-(2-пиридинил)бензоил]-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илсульфонил)-N-[(2RS)-2-гидрокси-2-(4-нитрофенил)этил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-{(2RS)-3-[4-(ацетиламино)фенокси]-2-гидроксипропил}-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-{(2RS)-3-[4-(ацетиламино)фенокси]-2-гидроксипропил}-4-(метоксиимино)-1-[4-(4-пиридинил)бензоил]-2-пирролидинкарбоксамид;
(2S,4EZ)-N-{(2RS)-3-[4-(ацетиламино)фенокси]-2-гидроксипропил}-4-(метоксиимино)-1-[4-(3-пиридинил)бензоил]-2-пирролидинкарбоксамид;
(2S,4EZ)-N-{(2RS)-3-[4-(ацетиламино)фенокси]-2-гидроксипропил}-1-([1,1'-бифенил]-4-илсульфонил)-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-[(2R)-2-гидрокси-2-фенилэтил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(2R)-2-гидрокси-2-фенилэтил]-4-(метоксиимино)-1-[4-(4-пиридинил)бензоил]-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(2R)-2-гидрокси-2-фенилэтил]-4-(метоксиимино)-1-[4-(3-пиридинил)бензоил]-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(2R)-2-гидрокси-2-фенилэтил]-4-(метоксиимино)-1-[4-(2-пиридинил)бензоил]-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илсульфонил)-N-[(2R)-2-гидрокси-2-фенилэтил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-(3-гидроксипропил)-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илсульфонил)-N-(3-гидроксипропил)-4-(метоксиимино)-2-пирролидинкарбоксамид;
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-[(4-гидрокси-4-фенил-1-пиперидинил)карбонил]-3-пирролидинона;
O-метилоксим (3EZ,5S)-5-[(4-гидрокси-4-фенил-1-пиперидинил)карбонил]-1-[4-(4-пиридинил)бензоил]-3-пирролидинона;
O-метилоксим (3EZ,5S)-5-[(4-гидрокси-4-фенил-1-пиперидинил)карбонил]-1-[4-(3-пиридинил)бензоил]-3-пирролидинона;
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илсульфонил)-5-[(4-гидрокси-4-фенил-1-пиперидинил)карбонил]-3-пирролидинона;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-[(1S,2S)-2-гидроксициклогексил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илсульфонил)-N-[(1S,2S)-2-гидроксициклогексил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-бензил-1-([1,1'-бифенил]-4-илкарбонил)-N-(2-гидроксиэтил)-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-бензил-N-(2-гидроксиэтил)-4-(метоксиимино)-1-[4-(3-пиридинил)бензоил]-2-пирролидинкарбоксамид;
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-{[(3RS)-3-гидроксипиперидинил]карбонил}-3-пирролидинона;
O-метилоксим (3EZ,5S)-5-{[(3RS)-3-гидроксипиперидинил]карбонил}-1-[4-(4-пиридинил)бензоил]-3-пирролидинона;
O-метилоксим (3EZ,5S)-5-{[(3RS)-3-гидроксипиперидинил]карбонил}-1-[4-(3-пиридинил)бензоил]-3-пирролидинона;
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илсульфонил)-5-{[(3RS)-3-гидроксипиперидинил]карбонил}-3-пирролидинона;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-[(1S,2S)-2-гидрокси-1-(гидроксиметил)-2-фенилэтил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(1S,2S)-2-гидрокси-1-(гидроксиметил)-2-фенилэтил]-4-(метоксиимино)-1-[4-(4-пиридинил)бензоил]-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(1S,2S)-2-гидрокси-1-(гидроксиметил)-2-фенилэтил]-4-(метоксиимино)-1-[4-(3-пиридинил)бензоил]-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илсульфонил)-N-[(1S,2S)-2-гидрокси-1-(гидроксиметил)-2-фенилэтил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-(2-анилиноэтил)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-(2-анилиноэтил)-4-(метоксиимино)-1-[4-(4-пиридинил)бензоил]-2-пирролидинкарбоксамид;
(2S,4EZ)-N-(2-анилиноэтил)-4-(метоксиимино)-1-[4-(3-пиридинил)бензоил]-2-пирролидинкарбоксамид;
(2S,4EZ)-N-(2-анилиноэтил)-4-(метоксиимино)-1-[4-(2-пиридинил)бензоил]-2-пирролидинкарбоксамид;
(2S,4EZ)-N-(2-анилиноэтил)-1-([1,1'-бифенил]-4-илсульфонил)-4-(метоксиимино)-2-пирролидинкарбоксамид;
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-[(4-гидрокси-1-пиперидинил)карбонил]-3-пирролидинона;
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илсульфонил)-5-[(4-гидрокси-1-пиперидинил)карбонил]-3-пирролидинона;
(2S,4EZ)-N-[(1S,2R,3S,4R)-3-(аминокарбонил)бицикло[2.2.1]гепт-5-ен-2-ил]-1-([1,1'-бифенил]-4-илсульфонил)-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-(3-амино-3-оксопропил)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(1S,2S,3R,4R)-3-(аминокарбонил)бицикло[2.2.1]гепт-5-ен-2-ил]-1-([1,1'-бифенил]-4-илсульфонил)-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-(4-гидроксибутил)-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илсульфонил)-N-(4-гидроксибутил)-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илсульфонил)-N-[(1R,2R)-2-(гидроксиметил)циклогексил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илсульфонил)-N-[(1R,2S,3R,4S)-3-(гидроксиметил)бицикло[2.2.1]гепт-2-ил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илсульфонил)-N-[(1R,2S)-2-(гидроксиметил)циклогексил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4E и 4Z)-N-[(2RS)-2-гидрокси-2-фенилэтил]-4-(метоксиимино)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4E и 4Z)-N-[(2S)-2-гидрокси-2-фенилэтил]-4-(метоксиимино)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4E и 4Z)-N-[(2R)-2-гидрокси-2-фенилэтил]-4-(метоксиимино)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-[(1R,2S)-2-(гидроксиметил)циклогексил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-[2-гидрокси-1-(гидроксиметил)этил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(1S,2R,3S,4R)-3-(аминокарбонил)бицикло[2.2.1]гепт-5-ен-2-ил]-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(1S,2S,3R,4R)-3-(аминокарбонил)бицикло[2.2.1]гепт-5-ен-2-ил]-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-[(2S)-2-гидрокси-2-фенилэтил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2RS)-3-({[(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)пирролидинил]карбонил}амино)-2-гидроксипропановая кислота;
(2S,4EZ)-N-[(1R,2S)-2-(аминокарбонил)циклогексил]-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-[(1RS)-2-гидрокси-1-метилэтил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-[(1S,2S)-2-гидрокси-1-(гидроксиметил)-2-(4-нитрофенил)этил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
4-({[(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)пирролидинил]карбонил}амино)бутановая кислота;
(2S,4EZ)-N-[(2S)-2-гидрокси-2-фенилэтил]-1-[(2'-метокси[1,1'-бифенил]-4-ил)карбонил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(2RS)-2-гидрокси-2-(2-нафтил)этил]-1-[(2'-метокси[1,1'-бифенил]-4-ил)карбонил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(1RS)-2-гидрокси-1-метилэтил]-4-(метоксиимино)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(1S,2S)-2-гидрокси-1-(гидроксиметил)-2-(4-нитрофенил)этил]-4-(метоксиимино)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(1S,2S)-2-гидрокси-1-(гидроксиметил)-2-(4-нитрофенил)этил-4-(метоксиимино)-1-[(2'-метокси[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид;
O-метилоксим (3EZ,5S)-5-[(4-гидрокси-1-пиперидинил)карбонил]-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-3-пирролидинона;
(2S,4EZ)-N-[(1S,2S,3R,4R)-3-(аминокарбонил)бицикло[2.2.1]гепт-5-ен-2-ил]-4-(метоксиимино)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(2RS)-2-гидрокси-2-фенилэтил]-1-[(2'-метокси[1,1'-бифенил]-4-ил)карбонил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(2RS)-2-гидроксипропил]-4-(метоксиимино)-1-[(2'-метил-[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(2RS)-2,3-дигидроксипропил]-4-(метоксиимино)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4EZ)-N-(3-гидроксипропил)-4-(метоксиимино)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4EZ)-N-(2-амино-2-оксоэтил)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-(2-амино-2-оксоэтил)-4-(метоксиимино)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-[(2RS)-2-гидрокси-2-(3-гидроксифенил)этил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-[(1S,2R,3S,4R)-3-(гидроксиметил)бицикло[2.2.1]гепт-2-ил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(1R,2S,3R,4S)-3-(гидроксиметил)бицикло[2.2.1]гепт-2-ил]-1-[(2'-метокси[1,1'-бифенил]-4-ил)карбонил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-(транс-4-гидроксициклогексил)-1-[(2'-метокси[1,1'-бифенил]-4-ил)карбонил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(1R,2R)-2-(гидроксиметил)циклогексил]-1-[(2'-метокси-[1,1'-бифенил]-4-ил)карбонил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(2RS)-2-гидрокси-3-феноксипропил]-4-(метоксиимино)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(2RS)-2-гидрокси-2-(4-гидроксифенил)этил]-4-(метоксиимино)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(2RS)-2-гидрокси-2-(4-гидроксифенил)этил]-4-(метоксиимино)-1-[(2'-метокси[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(2RS)-2-гидрокси-2-(4-гидрокси-3-метоксифенил)этил]-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(2RS)-2-гидрокси-2-(4-гидрокси-3-метоксифенил)этил]-1-[(2'-метокси[1,1'-бифенил]-4-ил)карбонил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(2RS)-2-(3,4-дигидроксифенил)-2-гидроксиэтил]-1-[(2'-метокси[1,1'-бифенил]-4-ил)карбонил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2R,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-[(2RS)-2-гидрокси-2-фенилэтил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2R,4EZ)-N-[(2RS)-2-гидрокси-2-фенилэтил]-4-(метоксиимино)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4EZ)-1-[(2'-циано[1,1'-бифенил]-4-ил)карбонил]-N-[(2RS)-2-гидрокси-2-фенилэтил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-[(3',4'-дихлор[1,1'-бифенил]-4-ил)карбонил]-N-[(2RS)-2-гидрокси-2-фенилэтил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-[(2',6'-диметил[1,1'-бифенил]-4-ил)карбонил]-N-[(2RS)-2-гидрокси-2-фенилэтил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-[(2',3-диметил[1,1'-бифенил]-4-ил)карбонил]-N-[(2RS)-2-гидрокси-2-фенилэтил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(2RS)-2-гидрокси-2-(3-гидроксифенил)этил]-4-(метоксиимино)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(2RS)-2-гидрокси-2-(3-гидроксифенил)этил]-4-(метоксиимино)-1-[(2'-циано[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(2RS)-2-гидрокси-2-(3-гидроксифенил)этил]-4-(метоксиимино)-1-[(3',4'-дихлор[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(2RS)-2-гидрокси-2-(3-гидроксифенил)этил]-4-(метоксиимино)-1-[(2',6'-диметил[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(2RS)-2-гидрокси-2-(3-гидроксифенил)этил]-4-(метоксиимино)-1-[(2',3-диметил[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4EZ)-1-[(3',4'-дихлор[1,1'-бифенил]-4-ил)карбонил]-N-[(2RS)-2-гидрокси-2-(4-гидроксифенил)этил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S, 4EZ)-1-[(2', 6'-диметиы[1,1'-бифенил]-4-ил)карбонил]-N-[(2RS)-2-гидрокси-2-(4-гидроксифенил)этил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-[(2',3-диметил[1,1'-бифенил]-4-ил)карбонил]-N-[(2RS)-2-гидрокси-2-(4-гидроксифенил)этил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-[(2',6'-диметил[1,1'-бифенил]-4-ил)карбонил]-N-[(2RS)-2-гидрокси-3-(4-метоксифенокси)пропил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-[(2',3-диметил[1,1'-бифенил]-4-ил)карбонил]-N-[(2RS)-2-гидрокси-3-(4-метоксифенокси)пропил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-(2-амино-2-оксоэтил)-1-[(2',6'-диметил[1,1'-бифенил]-4-ил)карбонил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-(2-амино-2-оксоэтил)-1-[(2',3-диметил[1,1'-бифенил]-4-ил)карбонил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-(3-амино-3-оксопропил)-1-[(2',6'-диметил[1,1'-бифенил]-4-ил)карбонил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-(3-амино-3-оксопропил)-1-[(2',3-диметил[1,1'-бифенил]-4-ил)карбонил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-[(2',6'-диметил[1,1'-бифенил]-4-ил)карбонил]-N-[2-гидрокси-1-(гидроксиметил)этил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-[(2',3-диметил[1,1'-бифенил]-4-ил)карбонил]-N-[2-гидрокси-1-(гидроксиметил)этил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-[(2'-циано[1,1'-бифенил]-4-ил)карбонил]-N-[(1R,2R)-2-(гидроксиметил)циклогексил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
O-метилоксим (3EZ,5S)-5-(3,4-дигидро-2(1H)-изохинолинилкарбонил)-1-[(2',3-диметил[1,1'-бифенил]-4-ил)карбонил]-3-пирролидинона;
(2S,4EZ)-N-[(1R)-2-гидрокси-1-фенилэтил]-4-(метоксиимино)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4EZ)-1-[(2',6'-диметил[1,1'-бифенил]-4-ил)карбонил]-N-[2-(4-гидроксифенил)этил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-[(2',3-диметил[1,1'-бифенил]-4-ил)карбонил]-N-[2-(4-гидроксифенил)этил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-[(2',6'-диметил[1,1'-бифенил]-4-ил)карбонил]-N-[2-(3-гидроксифенил)этил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-[(2',3-диметил[1,1'-бифенил]-4-ил)карбонил]-N-[2-(3-гидроксифенил)этил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-[(2',3-диметил[1,1'-бифенил]-4-ил)карбонил]-N-[(1R,2S)-2-гидрокси-1,2-дифенилэтил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2RS)-2-[({(2S,4EZ)-4-(метоксиимино)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]пирролидинил}карбонил)амино]-3-фенилпропановая кислота;
(2S,4EZ)-N-[(1R,2S)-2-(аминокарбонил)циклогексил]-1-[(2',6'-диметил-[1,1'-бифенил]-4-ил)карбонил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(1R,2S)-2-(аминокарбонил)циклогексил]-1-[(2',3-диметил-[1,1'-бифенил]-4-ил)карбонил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
4'-{[(2S,4EZ)-2-{[4-(2-гидроксиэтил)-1-пиперазинил]карбонил}-4-(метоксиимино)пирролидинил]карбонил}[1,1'-бифенил]-2-карбонитрил;
O-метилоксим (3EZ,5S)-1-[(3',4'-дихлор[1,1'-бифенил]-4-ил)карбонил]-5-{[4-(2-гидроксиэтил)-1-пиперазинил]карбонил}-3-пирролидинона;
O-метилоксим (3EZ,5S)-1-[(2',6'-диметил[1,1'-бифенил]-4-ил)карбонил]-5-{[4-(2-гидроксиэтил)-1-пиперазинил]карбонил}-3-пирролидинона;
O-метилоксим (3EZ,5S)-1-[(2',3-диметил[1,1'-бифенил]-4-ил)карбонил]-5-{[4-(2-гидроксиэтил)-1-пиперазинил]карбонил}-3-пирролидинона;
O-метилоксим (3EZ,5S)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-5-({4-[4-(трифторметил)фенил]-1-пиперазинил}карбонил)-3-пирролидинона;
O-метилоксим (3EZ,5S)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-5-({4-[3-(трифторметил)фенил]-1-пиперазинил}карбонил)-3-пирролидинона;
(2S,4EZ)-4-(метоксиимино)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4EZ)-4-(метоксиимино)-N-метил-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4EZ)-4-(метоксиимино)-N,N-диметил-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(3R)-3-гидрокси-3-фенилпропил]-4-(метоксиимино)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(3S)-3-гидрокси-3-фенилпропил]-4-(метоксиимино)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-[(3R)-3-гидрокси-3-фенилпропил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-[(3S)-3-гидрокси-3-фенилпропил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(2S)-2-гидрокси-2-фенилэтил]-4-(метоксиимино)-1-{[2'-(трифторметил)[1,1'-бифенил]-4-ил]карбонил}-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(2S)-2-гидрокси-2-фенилэтил]-4-(метоксиимино)-1-{[2'-хлор[1,1'-бифенил]-4-ил]карбонил}-2-пирролидинкарбоксамид;
(2S,4EZ)-N-(2-гидроксифенил)-4-(метоксиимино)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[2-(гидроксиметил)фенил]-4-(метоксиимино)-1-[(2'-метил-[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4EZ)-N-[(2S)-2-гидрокси-2-фенилэтил]-4-(метоксиимино)-1-[(2-метил[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4E и 4Z)-1-([1,1'-бифенил]-4-илкарбонил)-N-[(2S)-2-гидрокси-2-фенилэтил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-4-(метоксиимино)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-N-(2-фенилэтил)-2-пирролидинкарбоксамид.
17. Производное пирролидина по любому из пп.1-16, выбранное из группы, включающей
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(хлорметилен)-N-(2-гидрокси-2-фенилэтил)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-(2-гидроксиэтил)-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-[(2RS)-2-гидрокси-2-фенетил]-4-(метоксиимино)-2-пирролидинкарбоксамид;
O-метилоксим (3EZ,5S)-5-(1H-бензимидазол-2-ил)-1-([1,1'-бифенил]-4-илкарбонил)-3-пирролидинона;
(2S,4EZ)-N-(2,1,3-бензотиадиазол-4-ил)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)-2-пирролидинкарбоксамид;
(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)-N-(6-хинолинил)-2-пирролидинкарбоксамид;
(2S,4Z)-N-[(2S)-2-гидрокси-2-фенилэтил]-4-(метоксиимино)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид;
(2S,4E)-N-[(2S)-2-гидрокси-2-фенилэтил]-4-(метоксиимино)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид.
18. Производное пирролидина по любому из пп.1-17, для применения в качестве лекарственного средства для лечения и/или профилактики преждевременных родов, рождения недоношенного ребенка и дисменореи.
19. Применение производных пирролидина по любому из пп.1-18 для получения фармацевтической композиции, предназначенной для лечения и/или профилактики преждевременных родов, рождения недоношенного ребенка и дисменореи.
20. Применение производных пирролидина по любому из пп.1-19 для получения фармацевтической композиции, предназначенной для модуляции рецептора окситоцина.
21. Применение по п.20, где указанная модуляция включает блокирование рецептора окситоцина или антагонистическое воздействие на связывание окситоцина с его рецептором.
22. Применение по п.21 для лечения или профилактики нарушений, опосредованных рецептором окситоцина.
23. Применение производного пирролидина по любому из пп.1-17 для получения фармацевтической композиции, предназначенной для перорального введения.
24. Фармацевтическая композиция для лечения и/или профилактики преждевременных родов, рождения недоношенного ребенка и дисменореи, содержащая по меньшей мере одно производное пирролидина по любому из пп.1-17 и фармацевтически приемлемый носитель, разбавитель или наполнитель.
25. Способ получения производного пирролидина по любому из пп.1-17, который включает осуществление следующей реакции:

где LG означает удаляемую группу и заместители R1-R9, A и X имеют указанные выше значения.
26. Способ получения производного пирролидина по любому из пп.1-17, котоЁыщ включает осуществление следующей реакции:
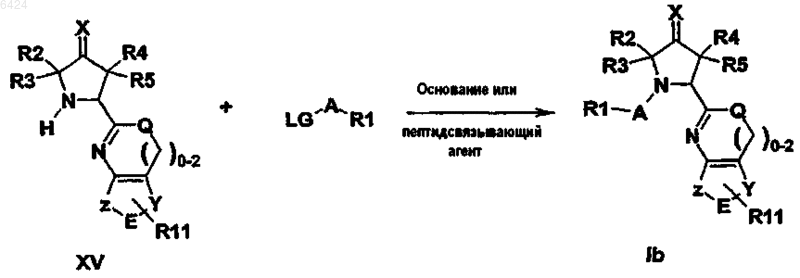
где LG означает удаляемую группу и заместители R1 -R5, R11, A, E, Q, X, Y и Z имеют указанные выше значения.
27. Способ по п.26, в котором соединение XV получают в соответствии со следующей схемой реакций:

Текст
006424 Область техники Настоящее изобретение относится к производным пирролидина. Указанные соединения являются фармацевтически активными веществами. Производные пирролидина формулы I предназначены для лечения и/или профилактики преждевременных родов, рождения недоношенного ребенка и дисменореи. Более конкретно, настоящее изобретение относится к производным пирролидина, обладающим значительной модуляторной, в частности антагонистической активностью в отношении рецептора окситоцина. Указанные соединения можно эффективно использовать для лечения и/или профилактики заболеваний,опосредованных окситоцином, включая преждевременные роды, рождение недоношенного ребенка и дисменорею. Настоящее изобретение далее относится к новым производным пирролидина, а также к способам их получения. Предпосылки изобретения Окситоцин (ОТ) является пептидным гормоном и вызывает сокращение матки у млекопитающих во время родов. Соответствующий рецептор окситоцина относится к семейству рецепторов, связанных с Gбелком, и подобен рецепторам вазопрессина V1a и V2. Количество рецепторов ОТ сильно увеличивается во время беременности. Установлено, что концентрация рецепторов ОТ определяет спонтанную активность матки (М. Maggi et al., J. Clin. Endocrinol Metabol; 70; 1142, 1990). Преждевременные роды и рождение недоношенного ребенка весьма нежелательны, так как они являются главной причиной перинатальной заболеваемости и смертности. Поэтому преждевременные роды представляют важную проблему в области акушерства. За последние годы были получены неопровержимые данные, свидетельствующие о том, что гормон окситоцин играет важную роль в стимуляции родов у млекопитающих, в частности у человека. Поэтому принято считать, что окситоцин прямо или косвенно вызывает сокращение миометрия матки, а также усиливает синтез и высвобождение сократительных простагландинов из эндометрия/децидуальной оболочки матки. Указанные простагландины могут далее участвовать в процессе цервикального созревания. Подобное увеличение количества рецепторов окситоцина и повышенная чувствительность матки, повидимому, являются следствием трофических эффектов, связанных с повышением в плазме уровней эстрогена к определенному сроку. Предполагается, что, уменьшая количество окситоцина, можно блокировать прямое (сократительное) и косвенное (увеличение синтеза простагландинов) воздействие окситоцина на матку. Вполне вероятно, что модулятор окситоцина, например, блокатор или антагонист позволит более эффективно решить проблему преждевременных родов, чем применяемые в настоящее время схемы лечения. Кроме того, поскольку окситоцин воздействует только на матку, такой модулятор окситоцина должен оказывать незначительное побочное действие или вообще не вызывать побочных эффектов. Другим нарушением, обусловленным окситоцином, является дисменорея, которая характеризуется циклическими болями, сопровождающими менструацию во время овулеторных циклов. Считается, что указанные боли возникают вследствие сокращения и ишемии матки, вероятно, под действием простагландинов, продуцируемых в секреторном эндометрии. Блокируя косвенные и прямые воздействия окситоцина на матку, антагонист окситоцина должен более эффективно лечить дисменорею по сравнению с применяемыми в настоящее время схемами лечения. Некоторые средства, подавляющие действие окситоцина (ОТ), в настоящее время проходят клинические исследования. К таким токолитическим средствам (то есть средствам, вызывающим расслабление матки) относятся бета-2-адренергические агонисты, сульфат магния и этанол. Наиболее эффективным бета-2-адренергическим агонистом является ритодрин, который оказывает побочное действие на сердечно-сосудистую систему и обмен веществ, в частности, вызывает у новорожденного тахикардию, повышенную секрецию ренина, гипергликемию и активную гипогликемию. Другие бета-2-адренергические агонисты, в том числе тербуталин и альбутерон, вызывают такие же побочные эффекты, что и ритодрин. Сульфат магния, используемый в концентрации, превышающей в плазме терапевтические пределы, равные 4-8 мг/дл, нарушает проводимость сердца и нейромышечную передачу, угнетает дыхание и сердечную деятельность, что делает данное средство непригодным при нарушении функции почек. Этанол подобно ритодрину эффективно предотвращает преждевременные роды, но в случае респираторного дистресс-синдрома плода он не оказывает требуемого действия, достигаемого при введении ритодрина. Основным недостатком, связанным с использованием пептидных антагонистов, включая атозибан,является низкая биологическая доступность указанных веществ при пероральном введении вследствие их расщепления в кишечнике. Поэтому указанные средства необходимо вводить парентерально. Считается, что создание непептидных лигандов для рецепторов пептидных гормонов позволит устранить указанную проблему. Компания Merck первой объявила о создании низкомолекулярных селективных антагонистов окситоцина. В отличие от циклических гексапептидов компания Merck предложила использовать инданилпиперидины и толилпиперазины в качестве антагонистов ОТ, предназначенных для перорального введения (Evans et al., J. Med. Chem., 35, 3919 (1992). В заявке WO 96/22775 и патенте США 5756497 компания Merck представила бензоксазинилпиперидины или бензоксазиноны в качестве антагонистов рецептора ОТ. Целью данного изобретения является получение веществ, которые более эффективно ослабляют функцию окситоцина вплоть до антагонистического воздействия на ОТ при болезненных состояниях-1 006424 животных, предпочтительно млекопитающих, в частности человека. Другой целью данного изобретения является создание способа антагонистического воздействия на функции окситоцина при заболевании млекопитающих. Кроме того, объектом настоящего изобретения являются низкомолекулярные химические соединения, предназначенные для модуляции, предпочтительно для снижения активности и даже антагонистического воздействия на рецептор окситоцина. Другим объектом настоящего изобретения являются способы получения указанных низкомолекулярных химических соединений. Еще одним объектом настоящего изобретения является новый класс фармацевтических препаратов, предназначенных для предотвращения преждевременных родов и лечения дисменореи и/или заболеваний, опосредованных рецептором окситоцина. И, наконец, еще одним объектом настоящего изобретения является способ лечения или профилактики нарушений, опосредованных рецептором окситоцина, таких как преждевременные роды и дисменорея, путем антагонистического воздействия на связывание окситоцина с его рецептором. Описание изобретения Вышеуказанные объекты изобретения соответствуют независимым пунктам формулы изобретения. Предпочтительные варианты осуществления изобретения описаны в зависимых пунктах изобретения,входящих в объем данного изобретения. Ниже приведены определения разных химических фрагментов, образующих соединения по данному изобретению, которые имеют одинаковые значения в описании и формуле изобретения за исключением особо оговоренных случаев, когда какой-либо термин имеет более широкое значение."C1-С 6-алкил" означает одновалентные алкильные группы с 1-6 атомами углерода. Указанный термин можно проиллюстрировать такими группами, как метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, н-гексил и тому подобные."Арил" означает ненасыщенную ароматическую карбоциклическую группу с 6-14 атомами углерода, имеющую одно кольцо (например, фенил) или несколько конденсированных колец (например, нафтил). Предпочтительным арилом является фенил, нафтил, фенантренил и тому подобные."Гетероарил" означает гетероароматическую группу, имеющую моноциклическое гетероароматическое, бициклическое или трициклическое конденсированное кольцо. Типичные примеры гетероароматических групп включают необязательно замещенный пиридил, пирролил, фурил, тиенил, имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил, 1,2,3-триазолил, 1,2,4-триазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, 1,3,4-триазинил, 1,2,3-триазинил,бензофурил, [2,3-дигидро]бензофурил, изобензофурил, бензотиенил, бензотриазолил, изобензотиенил,индолил, изоиндолил, 3 Н-индолил, бензимидазолил, имидазо[1,2-а]пиридил, бензотиазолил, бензоксазолил, хинолизинил, хиназолинил, фталазинил, хиноксалинил, циннолинил, нафтиридинил, пиридо[3,4-b] пиридил, пиридо[3,2-b]пиридил, пиридо[4,3-b]пиридил, хинолил, изохинолил, тетразолил, 5,6,7,8 тетрагидрохинолил, 5,6,7,8-тетрагидроизохинолил, пуринил, птеридинил, карбазолил, ксантенил или бензохинолил."Алкенил" означает алкенильные группы, предпочтительно имеющие 2-6 атомов углерода и по крайней мере 1 или 2 участка алкенильной ненасыщенности. Предпочтительными алкенильными группами являются этенил (-СН=СН 2) , н-2-пропенил (аллил, -СН 2 СН=СН 2) и тому подобные."Алкинил" означает алкинильные группы, предпочтительно имеющие 2-6 атомов углерода и по крайней мере 1-2 участка алкинильной ненасыщенности; предпочтительными алкинильными группами являются этинил (-ССН) , пропаргил (-СН 2 ССН) и тому подобные."Алкокси" означает группу -O-R, где R представляет "C1-С 6-алкил", "арил", "гетероарил", "C1-С 6 алкиларил" или "C1-C6-алкилгетероарил". В качестве примеров предпочтительных алкоксильных групп можно привести метокси, этокси, фенокси и тому подобные."Тиоалкокси" означает группы -S-R, где R представляет "C1-С 6-алкил", "арил", "гетероарил", "C1-С 6 алкиларил" или "C1-С 6-алкилгетероарил". Предпочтительными тиоалкоксильными группами являются тиометокси, тиоэтокси и тому подобные."Замещенный или незамещенный": за исключением случаев, ограниченных определением конкретного заместителя, вышеуказанные группы, такие как "алкил", "алкенил", "алкинил", "арил", "гетероарил" и т.д., могут быть необязательно замещены 1-5 заместителями, выбираемыми из группы, включающей"C1-С 6-алкил", "C1-С 6-алкиларил", "C1-С 6-алкилгетероарил", "С 2-С 6-алкенил", "C1-С 6-алкинил", первичные, вторичные или третичные аминогруппы либо части четвертичного аммония, "ацил", "ацилокси","ациламино", "аминокарбонил", "алкоксикарбонил", "арил", "гетероарил", карбоксил, циано, галоген,гидрокси, меркапто, нитро, сульфокси, сульфонил, алкокси, тиоалкокси, тригалогенметил и тому подобные. Указанное замещение может также альтернативно включать случаи, когда смежные заместители замыкаются в кольцо, в частности при использовании смежных функциональных заместителей, образуя таким образом лактамы, лактоны, циклические ангидриды, а также ацетали, тиоацетали, аминали, которые образуются при замыкании кольца, например, при необходимости получения защитной группы."Фармацевтически приемлемые соли или комплексы" означают соли или комплексы приведенных ниже соединений формулы I, которые сохраняют требуемую биологическую активность. Примеры таких солей включают, но не ограничиваются ими, кислотно-аддитивные соли, образующиеся при взаимодействии с неорганическими кислотами (такими как хлористоводородная, бромистоводородная, серная,фосфорная, азотная кислота и тому подобные) и органическими кислотами, такими как уксусная, щавелевая, винная, янтарная, яблочная, фумаровая, малеиновая, аскорбиновая, бензойная, танновая, памовая,альгиновая, полиглутаминовая, нафталинсульфоновая, нафталиндисульфоновая и полигалактуроновая кислоты. Указанные соединения можно также вводить в виде фармацевтически приемлемых четвертичных солей, известных специалистам в данной области, к которым, в частности, относится соль четвертичного аммония формулы -NR,R',R+Z-, где R, R', R независимо означают водород, алкил или бензил иZ представляет противоион, в том числе хлорид, бромид, иодид, -О-алкил, толуолсульфонат, метилсульфонат, сульфонат, фосфат или карбоксилат (такой как бензоат, сукцинат, ацетат, гликолат, малеат, малат,фумарат, цитрат, тартрат, аскорбат, циннамат, манделат и дифенилацетат)."Фармацевтически активное производное" означает любое соединение, которое при введении реципиенту прямо или косвенно оказывает описываемое здесь действие."Энантиомерный избыток" (ее) относится к продуктам, получаемым асимметрическим синтезом, то есть синтезом с использованием нерацемических исходных веществ и/или реагентов или синтезом,включающим по крайней мере одну энантиоселективную стадию, в результате чего образуется избыток одного энантиомера, равный по крайней мере 52%. При отсутствии асимметрического синтеза обычно получают рацемические продукты, которые также обладают активностью по данному изобретению в качестве антагонистов рецептора ОТ. В настоящее время установлено, что производные пирролидина формулы I являются фармацевтически приемлемыми активными веществами, которые способны эффективно модулировать, в частности,эффективно ингибировать функцию рецептора ОТ и, более конкретно, оказывать антагонистическое действие на рецептор окситоцина. При связывании рецептора окситоцина соединениями формулы I, блокируется доступ окситоцина к данному рецептору, вследствие чего он не может оказывать присущее ему биологическое или фармакологическое действие. Поэтому соединения по настоящему изобретению особенно полезны для лечения и/или профилактики обусловленных окситоцином нарушений у млекопитающих, в частности, у человека. Указанные нарушения, опосредованные рецептором окситоцина, включают преждевременные роды и дисменорею. К соединениям по настоящему изобретению относятся соединения формулы I. Соединения вышеуказанной формулы включают также геометрические изомеры, оптически активные формы, такие как энантиомеры и диастереомеры, рацемические формы и фармацевтически приемлемые соли. Предпочтительными фармацевтически приемлемыми солями соединения I являются кислотно-аддитивные соли, образующиеся при взаимодействии с фармацевтически приемлемыми кислотами, такие как гидрохлорид, гидробромид, сульфат или бисульфат, фосфат или гидрофосфат, ацетат, бен-3 006424 зоат, сукцинат, фумарат, малеат, лактат, цитрат, тартрат, глюконат, метансульфонат, бензолсульфонат и паратолуолсульфонат. В частности, изобретение описывает производные пирролидина формулы IX выбирают из группы, включающей CR6R7, NOR6, NNR6R7; А выбирают из группы, включающей -(С=O)-, -(С=O)-O-, -C(=NH)-, -(C=O)-NH-, -(C=S)-NH, -SO2-,-SO2NH-, -CH2-; В представляет группу -(C=O)-NR8R9 или гетероциклический остаток формулыR1 выбирают из группы, включающей незамещенный или замещенный C1-С 6-алкил, незамещенный или замещенный С 2-С 6-алкенил, незамещенный или замещенный арил, незамещенный или замещенный,насыщенный или ненасыщенный 3-8-членный циклоалкил, ацил, незамещенный или замещенный C1-С 6 алкиларил, незамещенный или замещенный C1-С 6-алкилгетероарил, причем указанные циклоалкильные,арильные или гетероарильные группы могут быть конденсированы с 1-2 дополнительными циклоалкильными, арильными или гетероарильными группами;R6 и R7 независимо выбирают из группы, включающей водород, незамещенный или замещенныйC1-С 6-алкил, незамещенный или замещенный С 2-С 6-алкенил, незамещенный или замещенный алкокси,незамещенный или замещенный тиоалкокси, галоген, циано, нитро, ацил, алкоксикарбонил, аминокарбонил, незамещенный или замещенный арил, незамещенный или замещенный C1-С 6-алкиларил;R8 и R9 независимо выбирают из группы, включающей водород, незамещенный или замещенныйC1-С 6-алкил, незамещенный или замещенный С 2-С 6-алкенил, незамещенный или замещенный, насыщенный или ненасыщенный 3-8-членный циклоалкил, который может содержать 1-3 гетероатома, выбранных из N, О, S, незамещенный или замещенный арил, незамещенный или замещенный гетероарил; либоR8 и R9 вместе с атомом N, к которому они присоединены, могут образовывать 3-8-членное замещенное или незамещенное, насыщенное или ненасыщенное гетероциклическое кольцо, которое может содержать 1-2 дополнительных гетероатома, выбранных из N, S и О; где термин "замещенный" означает, что указанная группа может быть замещена 1-5 заместителями,выбираемыми из группы, включающей C1-С 6-алкил, C1-С 6-алкиларил, C1-С 6-алкилгетероарил, С 2-С 6 алкенил, C1-С 6-алкинил, первичные, вторичные или третичные аминогруппы либо группы четвертичного аммония, ацил, ацилокси, ациламино, аминокарбонил, алкоксикарбонил, арил, гетероарил, карбоксил,циано, галоген, гидрокси, меркапто, нитро, сульфокси, сульфонил, алкокси, тиоалкокси, тригалогенметил и где указанное замещение может также альтернативно включать случаи, когда смежные заместители замыкаются в кольцо, образуя таким образом лактамы, лактоны, циклические ангидриды, а также ацетали, тиоацетали, аминали; термин "ацил" означает группу -C(O)R, где R представляет "C1-С 6-алкил", "арил", "C1-С 6 алкиларил" или "C1-С 6-алкилгетеро арил",термин "арил" означает ненасыщенную ароматическую карбоциклическую группу с 6-14 атомами углерода имеющую одно кольцо или несколько конденсированных колец, предпочтительно выбранную из фенила, нафтила и фенантренила; термин "гетероарил" означает гетероароматическую группу, имеющую моноциклическое гетероароматическое, бициклическое или трициклическое конденсированное кольцо, выбранное из следующих необязательно замещенных групп: пиридил(288), пирролил(25), фурил(26), тиенил(27), бензимидазолил(11-14), хиназолинил(15), хинолил(118), изохинолил(413), карбазолил(7,8), пиримидинил (48,213),бензотиадиазолил(50,65), бензодиоксолил(56,63,121), тиадиазолил(103); при условии, что, когда X означает (=СН 2), А означает -(С=O)-O-, R1 означает трет-бутильную группу, В не может быть: -(С=О)-NMe2, -(С=О)-NHMe, -(С=О)-NH-CH(Me)-(С=О)-NH-CH(Me)-COOH,-(С=О)-NH-CH-(COOCH2-Ph)-CH2-COOPh; также при условии, что, когда X означает (=CHR6), где R6 представляет циклогексилметил, А означает -(С=О)-О, R1 означает трет-бутильную группу, В не может быть -(С=О)-NH-трет-бутилом; где R означает Н или С 1-С 12-алкил. Предпочтительны: производные пирролидина, где В означает группу -(С=O)-NHR9, где R9 выбирают из группы, включающей: незамещенный или замещенный C1-С 6-алкил, незамещенный или замещенный С 2-С 6-алкенил,незамещенный или замещенный насыщенный или ненасыщенный 3-6-членный циклоалкил, который необязательно содержит атом N, незамещенный или замещенный арил, незамещенный или замещенный гетероарил, особенно где R9 означает гетероарил, выбранный из группы, включающей пиридил, пирролил, фурил, тиенил, 2,1,3-бензотиадиазолил, бензодиоксолил, бензимидазолил, хиназолинил, хинолил,изохинолил, карбазолил, пиримидинил, тиадиазолил; где X означает NOR6, где R6 выбирают из группы, включающей Н, незамещенный или замещенныйC1-С 6-алкил, незамещенный или замещенный С 2-С 6-алкенил, незамещенный или замещенный ацил, незамещенный или замещенный арил, незамещенный или замещенный С 1-С 6-алкиларил, особенно где R6 означает Н, СН 3, незамещенный или замещенный СН 2-фенил или аллил, предпочтительно Н или метил. Предпочтительны производные пирролидина, где X означает CHR6, где R6 выбирают из группы,включающей галоген, циано, незамещенный или замещенный С 3-С 6-алкил, незамещенный или замещенный С 2-С 6-алкенил, незамещенный или замещенный алкокси, незамещенный или замещенный тиоалкокси, нитро, ацил, алкоксикарбонил, аминокарбонил, незамещенный или замещенный арил, незамещенный или замещенный C1-С 6-алкиларил, особенно где R6 выбирают из группы, включающей галоген, циано,C1-С 6-алкил, незамещенную или замещенную фенильную группу. Предпочтительны производные пирролидина, где А означает -(С=O)-, - (С=O) -NH- или -SO2-, особенно где А означает -(С=O)-. Предпочтительны производное пирролидина, где R1 означает C1-С 6-алкил, С 2-С 6-алкенил, незамещенный или замещенный арил, насыщенный или ненасыщенный 3-8-членный циклоалкил, C1-С 6 алкиларил, C1-С 6-алкилгетероарил, особенно где R1 означает C1-С 6-алкильную или арильную группу, еще более предпочтительны производные пирролидина по п.11, где R1 означает бифенил. Предпочтительны производные пирролидина, где X означает =NOR6 или =СНСl, R6 означает C1-С 6 алкил, арил или С 1-С 6-алкиларильную группу, А означает -(С=О)- и R1 означает C1-С 6-алкил, арил илиC1-С 6-алкиларильную группу, особенно где X означает =NOR6 или =СНСl, R6 означает метил, В означает амидогруппу формулы -(C=O)NHR9, где R9 представляет незамещенную или замещенную C1-С 6 алкиларильную группу, А означает -(С=O)- и R1 означает бифенил или ацетилметильную группу, наиболее предпочтительны соединения, где X означает =NOCH3, В означает амидогруппу формулы -(С=O)NHR9, где R9 представляет замещенную фенилэтильную группу, А означает -(С=O)- и R1 означает замещенный бифенил. Типичными примерами соединений формулы I являются нижеследующие соединения:(2S,4EZ)-4-(метоксиимино)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-N-(2-фенилэтил)-2-пирроли- 12006424 динкарбоксамид. Наиболее предпочтительными соединениями являются соединения, выбираемые из нижеследующей группы:(2S,4 Е)-N-[(2S)-2-гидрокси-2-фенилэтил]-4-(метоксиимино)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид. Еще одним объектом настоящего изобретения является применение производных пирролидина формулы I для изготовления фармацевтических композиций, предназначенных для лечения и/или профилактики преждевременных родов, рождения недоношенного ребенка, дисменореи и прекращения сократительной деятельности матки перед кесаревым сечением. Соединения формулы I позволяют модулировать функцию ОТ, что делает возможным лечение и/или профилактику нарушений, опосредованных рецептором окситоцина. Указанное лечение включает модуляцию, в частности снижение активности или антагонистическое воздействие на рецептор окситоцина. Таким образом, соединения по настоящему изобретению можно использовать для предотвращения преждевременных родов, рождения недоношенного ребенка, лечения дисменореи и прекращения сократительной деятельности матки перед кесаревым сечением. Еще одним объектом настоящего изобретения являются новые соединения пирролидина формулы I. Незначительное число подобных соединений было описано до подачи настоящей заявки без указания на возможность их применения в медицине. Известными соединениями формулы I являются соединения, в которых где R означает С 1-С 12 алкил и Hal означает Cl, Br, J. Указанные соединения описаны в DE-1932823 в качестве промежуточных соединений.X означает C1-С 20 алкилиден, A-R1 означает защитную группу и В представляет где R означает Н или С 1-С 12 алкил (GB-1118306). Таким образом, новыми соединиями являются соединения формулы I за исключением вышеуказанных соединений.- 13006424 Еще одним объектом настоящего изобретения является способ получения производных пирролидина формулы I. Производные пирролидина, представленные в данном изобретении, можно получить из легко доступных исходных веществ при помощи описанных ниже общих способов и методик их выполнения. Следует отметить, что в тех случаях, когда указаны типичные или предпочтительные экспериментальные условия (то есть температуры реакций, время, молярные количества реагентов, растворители и т.д.),можно использовать и другие экспериментальные условия за исключением особо оговоренных случаев. Оптимальные условия реакций могут изменяться в зависимости от используемых реагентов или растворителей, но специалист в данной области может определить такие условия обычными методами оптимизации. Производные пирролидина общей формулы I можно получить несколькими способами, осуществляя синтез в фазе раствора или твердой фазе. В зависимости от характера А, В и X в некоторых случаях одни способы могут быть предпочтительнее других, поэтому предполагается, что специалист в данной области должен выбрать наиболее оптимальный способ. В соответствии с одним способом получения производного пирролидина он включает осуществление следующей реакции: где LG означает удаляемую группу и заместители R1-R9, А и X имеют указанные выше значения; другой способ получения производного пирролидина включает осуществление следующей реакции: где LG означает удаляемую группу и заместители R1-R5, R11, А, Е, Q, X, Y и Z имеют указанные выше значения. Следующий способ, касается получения соединения XV в соответствии со следующей схемой реакций: Последовательности реакций, представленные на приведенных выше схемах, позволяют получить энантиомерно чистые соединения формулы I при использовании энантиомерно чистых исходных веществ. Можно получить (R) и (S)-энантиомеры в зависимости от (R) или (S)-форм коммерчески производимых соединений формул II, III, VI и/или X, используемых в качестве исходных веществ.- 14006424 Однако в результате выполнения последовательностей реакций, представленных на приведенных выше схемах, обычно образуются смеси (Е) и (Z)-изомеров в зависимости от заместителей в положении экзоциклической двойной связи пирролидинового кольца. Во всех исследованных случаях указанные(Е)/(Z)-изомеры можно разделить стандартными хроматографическими методами, хорошо известными специалисту в данной области, такими как жидкостная хроматография высокого давления с обращенной фазой (ВЭЖХ) или флэш-хроматография на силикагеле (ФХ). Абсолютную конфигурацию экзоциклической двойной связи определяют методами ЯМР, подробно описанными в научной литературе, которые должны быть хорошо известны специалисту в данной области (для определения конфигурации функциональных оксимных групп см., например, Е. Breitmaier, W. Voelter Carbon-13 NMR Spectroscopy, 3rd Ed,VCH, 1987, p. 240). В соответствии с другим общим способом получения соединения формулы I можно превратить в альтернативные соединения формулы I при помощи подходящих методов взаимопревращения, описанных в приведенных ниже примерах. Если вышеописанные общие методы синтеза не подходят для получения соединений формулы I и/или промежуточных соединений, необходимых для синтеза соединений формулы I, следует использовать приемлемые способы получения, известные специалисту в данной области. Способы синтеза любого конкретного соединения формулы I зависят от специфических заместителей в каждой молекуле и от доступности необходимых промежуточных соединений, что также должно быть известно специалистам в данной области. Для ознакомления с методами защиты и снятия защиты см. Philip J. Kocienski, in "Protecting Groups", Georg Thieme Verlag Stuttgart, New York, 1994, и Theodora W. Greene and Peter G.M. Wutsin "Protective Groups in Organic Synthesis", Wiley-Interscience, 1991. Соединения по данному изобретению можно отделить от молекул растворителя кристаллизацией,выпаривая соответствующий растворитель. Фармацевтически приемлемые кислотно-аддитивные соли соединений формулы I, содержащие основный центр, можно получить обычным способом. Например,раствор свободного основания обрабатывают приемлемой кислотой, используемой в чистом виде или в подходящем растворе, и образовавшуюся соль выделяют фильтрованием или выпариванием в вакууме реакционного растворителя. Фармацевтически приемлемые основно-аддитивные соли можно получить аналогичным способом, обрабатывая раствор соединения формулы I приемлемым основанием. Можно получить оба типа соли или подвергнуть их взаимопревращению методами с использованием ионообменной смолы. Если вышеописанные общие методы синтеза не подходят для получения соединений формулы I,следует использовать приемлемые способы получения, известные специалисту в данной области. Последним объектом настоящего изобретения является применение соединений формулы I для модуляции рецептора окситоцина, для изготовления фармацевтических композиций, предназначенных для модуляции рецептора окситоцина, а также лекарственных препаратов, содержащих активные соединения формулы I. Считается, что указанная модуляция рецептора окситоцина может быть весьма полезна для предотвращения преждевременных родов, рождения недоношенного ребенка и лечения дисменореи. Таким образом, соединения по настоящему изобретению пригодны для предотвращения преждевременных родов, рождения недоношенного ребенка и лечения дисменореи. При использовании в качестве фармацевтических препаратов производные пирролидина по настоящему изобретению обычно вводят в виде фармацевтической композиции. Поэтому в объем настоящего изобретения входят также фармацевтические композиции, содержащие соединение формулы I и фармацевтически приемлемый носитель, разбавитель или наполнитель. Специалисту в данной области должны быть известны различные носители, разбавители или наполнители, подходящие для изготовления фармацевтической композиции. Кроме того, настоящее изобретение относится к соединениям, предназначенным для использования в качестве лекарственного средства. В частности, данное изобретение относится к соединениям формулы I, предназначенным для использования в качестве антагонистов рецептора окситоцина, для лечения или профилактики нарушений, обусловленных рецептором окситоцина у млекопитающих, в частности у человека, отдельно или в сочетании с другими лекарственными средствами, например, с другим антагонистом ОТ. Соединения по данному изобретению вместе с обычно применяемыми адъювантами, носителями,разбавителями или наполнителями, могут быть использованы для изготовления фармацевтических композиций и дозированных лекарственных форм в твердом виде, таких как таблетки или наполненные капсулы, или в виде жидкостей, таких как растворы, суспензии, эмульсии, эликсиры или заполненные ими капсулы, которые предназначены для перорального введения, или в форме стерильных инъекционных растворов, предназначенных для парентерального введения (включая подкожное введение). Такие фармацевтические композиции и дозированные лекарственные формы могут содержать ингредиенты в обычных соотношениях вместе с дополнительными активными соединениями или компонентами или без них, причем эффективное количество активного ингредиента в дозированных лекарственных формах должно соответствовать требуемой суточной дозе лекарственного средства. При использовании в качестве фармацевтических препаратов производные пирролидина по данному изобретению обычно вводят в виде фармацевтической композиции. Такие композиции, получаемые- 15006424 известными в фармакологии способами, содержат по крайней мере одно активное соединение. Соединения по данному изобретению обычно вводят в фармацевтически эффективном количестве. Количество вводимого соединения обычно определяет лечащий врач с учетом таких факторов, как характер заболевания, выбранный способ введения, вводимое соединение, возраст, масса тела и реакция конкретного субъекта, тяжесть симптомов заболевания и тому подобные. Фармацевтические композиции по данному изобретению можно вводить разными способами,включая пероральное, ректальное, чрескожное, подкожное, внутривенное, внутримышечное и назальное введение. В зависимости от выбранного способа доставки лекарственного средства, данные соединения используют для получения композиций, предназначенных для инъекций или перорального введения. Композиции для перорального введения могут быть в форме нерасфасованных жидких растворов, суспензий или порошков. Однако обычно указанные композиции представляют дозированные лекарственные формы, облегчающие точное дозирование. Термин "дозированные лекарственные формы" означает физически раздельные препараты, используемые в виде однократных доз для введения человеку и другим млекопитающим, которые содержат заранее определенное количество активного вещества, обеспечивающее достижение требуемого терапевтического эффекта, в сочетании с фармацевтически приемлемым наполнителем. Типичные дозированные лекарственные формы включают предварительно наполненные точно отмеренным количеством препарата ампулы или шприцы с жидкими композициями либо пилюли, таблетки, капсулы или подобные формы в случае твердых композиций. Соединение пирролидина содержится в таких композициях в небольшом количестве (от около 0,1 до около 50 мас.%, предпочтительно от около 1 до около 40 мас.%), при этом остальную часть композиции составляют разные наполнители или носители и вспомогательные средства, помогающие получить требуемую дозированную лекарственную форму. Жидкие формы, подходящие для перорального введения, могут содержать приемлемые водные или неводные наполнители вместе с буферами, суспендирующими и диспергирующими веществами, красителями, ароматизаторами и тому подобными. Твердые формы могут включать, например, любые нижеследующие ингредиенты или соединения подобного типа: связывающее вещество, такое как микрокристаллическая целлюлоза, трагакант или желатин; наполнитель, такой как крахмал или лактоза; дезинтегратор, такой как альгиновая кислота, примогель или кукурузный крахмал; смазывающее вещество, такое как стеарат магния; вещество, улучшающее скольжение, такое как коллоидный диоксид кремния; подслащивающее вещество, такое как сахароза или сахарин; или ароматизатор, такой как перечная мята,метилсалицилат или апельсиновый ароматизатор. Инъецируемые композиции обычно получают на основе инъекционного стерильного физиологического раствора, физиологического раствора с фосфатным буфером или других инъекционных носителей,известных в данной области. Как указывалось выше, производные пирролидина формулы I находятся в таких композициях в небольшом количестве часто от 0,05 до 10 мас.%, при этом остальную часть составляет инъекционный носитель и подобные вещества. Вышеописанные компоненты, используемые в композициях для перорального введения или инъекций, приведены в качестве примеров. Другие вещества, входящие в состав таких композиций, и способы их получения описаны в части 8 справочника Remington's Pharmaceutical Sciences, 17th Edition, 1985,Marck Publishing Company, Easton, Pennsylvania, который включен в данное описание изобретения в качестве ссылки. Соединения по данному изобретению можно также вводить в формах пролонгированного действия или в системах доставки лекарственного средства с пролонгированным действием. Типичные вещества,обеспечивающие пролонгированное действие, также описаны в справочнике Remington's PharmaceuticalSciences. Далее настоящее изобретение будет проиллюстрировано примерами, которые не ограничивают объем настоящего изобретения. Данные ВЭЖХ, ЯМР и МС, приведенные в нижеследующих примерах,получены описанными способами. В примерах использованы следующие аббревиатуры: мин (минуты), ч(часы), г (граммы), ммоль (миллимоль), т.п. (температура плавления), экв. (эквиваленты), мл (миллилитры), мкл (микролитры), ACN (ацетонитрил), CDCl3 (дейтерированный хлороформ), сНех (циклогексан),DCM (дихлорметан), DECP (диэтилцианофосфонат), DIC (диизопропилкарбодиимид), DMAP (4 диметиламинопиридин), ДМФ (диметилформамид), ДМСО (диметилсульфоксид), ДМСО-d6 (дейтерированный диметилсульфоксид), EDC (1-(3-диметиламинопропил)-3-этилкарбодиимид), EtOAc (этилацетат),Et2O (диэтиловый эфир), HOBt (1-гидроксибензотриазол), K2 СО 3 (карбонат калия), NaH (гидрид натрия),NаНСО 3 (бикарбонат натрия), nBuLi (н-бутиллитий), TBTU (тетрафторборат O-бензотриазолилN,N,N',N'-тетраметилурония), TEA (триэтиламин), ТФУ (трифторуксусная кислота), ТГФ (тетрагидрофуран), MgSO4 (сульфат магния), PetEther (петролейный эфир), к.т. (комнатная температура). Примеры Промежуточное соединение 1. (2S)-1-(трет-Бутоксикарбонил)-4-оксо-2-пирролидинкарбоновая кислота. Коммерческую (имеющуюся в продаже) (2S,4R)-1-(трет-бутоксикарбонил)-4-гидрокси-2-пирролидинкарбоновую кислоту (30 г, 0,13 моль) растворяют в ацетоне (1500 мл). В колбу вводят механическую- 16006424 мешалку и раствор интенсивно перемешивают. Получают свежий 8 н. раствор хромовой кислоты, для чего триоксид хрома (66,7 г, 0,667 моль) растворяют в воде (40 мл), добавляют концентрированную серную кислоту (53,3 мл) и воду в количестве, достаточном для доведения объема раствора до 115 мл. Затем 8 н. раствор хромовой кислоты (115 мл) при интенсивном перемешивании до каплям добавляют к реакционной смеси в течение 30 мин, используя баню со льдом для проведения экзотермической реакции при оптимальной температуре, равной 25 С. После добавления всего количества хромовой кислоты реакционную смесь продолжают перемешивать еще 15 мин, поддерживая оптимальную температуру, равную 25 С. Затем реакционную смесь гасят, добавляя метанол (20 мл) . Экзотермическую реакцию контролируют при помощи бани со льдом, при необходимости добавляя небольшое количество дробленого льда непосредственно в реакционную смесь. Реакционную смесь фильтруют через слой целита и концентрируют в вакууме. Полученный кислотный раствор экстрагируют этилацетатом (3 х 300 мл) и объединенные органические слои промывают насыщенным раствором соли (2 х 100 мл). Органическую часть сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт перекристаллизовывают из этилацетата, получая при этом белое кристаллическое вещество, (2S)-1-(трет-бутоксикарбонил)-4-оксо-2 пирролидинкарбоновую кислоту (22,55 г, 76%). Антипод промежуточного соединения, (2R)-1-(третбутоксикарбонил)-4-оксо-2-пирролидинкарбоновую кислоту получают аналогичным способом, используя в качестве исходного вещества коммерческую (2R,4S)-1-(трет-бутоксикарбонил)-4-гидрокси-2 пирролидинкарбоновую кислоту. 1 Н ЯМР (360 МГц, CDCl3): 1,4 (м, 9 Н), 2,5-3,0 (м, 2 Н), 3,7-3,9 (м, 2 Н), 4,75 (дд, 1 Н). Промежуточное соединение 2. 1-трет-Бутил-2-метил-(2S)-4-оксо-1,2-пирролидиндикарбоксилат. Получают раствор (2S)-1-(трет-бутоксикарбонил)-4-оксо-2-пирролидинкарбоновой кислоты (1 г, 4,3 ммоль) в смеси метанола и толуола (1:1) (60 мл). Триметилсилилдиазометан (6,5 мл 2 М раствора в гексане, 13 ммоль) по каплям добавляют к перемешиваемому раствору при комнатной температуре в атмосфере азота. После прекращения выделения газообразного азота полученный желтый раствор упаривают в вакууме и остаток фильтруют через слой силикагеля, производя элюирование этилацетатом. Удаляя растворитель из фильтрата, получают желтое масло (1,05 г, почти количественный выход). 1 Н ЯМР (400 МГц, CDCl3): 1,4 (м, 9 Н), 2,5 (м, 1 Н) , 2,8-2,9 (м, 1 Н), 3,7 (с, 3 Н), 3,9 (м, 2 Н), 4,6-4,8 (м,1 Н). Промежуточное соединение 3. 1-трет-Бутил-2-метил-(2S,4EZ)-4-(хлорметилен)-1,2-пирролидиндикарбоксилат. Иодид хлорметилтрифенилфосфония (270 мг, 0,62 ммоль) добавляют к раствору трет-бутоксида калия (67 мг, 0,59 ммоль) в безводном диэтиловом эфире (5 мл) в атмосфере азота и полученную яркожелтую смесь перемешивают в течение 30 мин при комнатной температуре. Затем реакционную смесь охлаждают до 0 С и по каплям добавляют раствор 1-трет-бутил-2-метил-(2S)-4-оксо-1,2-пирролидиндикарбоксилата (100 мг, 0,41 ммоль в 2 мл безводного диэтилового эфира). Реакционную смесь нагревают до комнатной температуры, перемешивают в течение 30 мин и добавляют насыщенный водный раствор хлорида аммония (0,5 мл). Органический слой удаляют в вакууме, и водный слой промывают диэтиловым эфиром (3 х 5 мл). Объединенные органические слои сушат насыщенным раствором соли и сульфатом магния, фильтруют и удаляют растворитель. Требуемый продукт выделяют хроматографией на силикагеле, производя элюирование 15% этилацетата в гексане, и получают 105 мг (выход 93%) не совсем белого воска. 1 Н ЯМР (400 МГц, CDCl3): 1,4 (9 Н, м), 2,6-2,75 (м, 1 Н), 2,8-3,0 (м, 3 Н),3,65 (с, 3 Н), 4,1 (м, 2 Н), 4,44,5 (м, 1 Н), 5,9-6,0 (м, 1 Н). Промежуточное соединение 4. 1-трет-Бутил-2-метил-(2S)-4-метилен-1,2-пирролидиндикарбоксилат. Бромид метилтрифенилфосфония (22 г, 61,6 ммоль) добавляют к раствору трет-бутоксида калия(6,5 г, 57,6 ммоль) в безводном диэтиловом эфире (450 мл) при 0 С в атмосфере азота и полученную ярко-желтую смесь перемешивают в течение 30 мин. К реакционной смеси медленно добавляют раствор 1 трет-бутил-2-метил-(2S)-4-оксо-1,2-пирролидиндикарбоксилата (10 г, 41,1 ммоль в 150 мл безводного диэтилового эфира) и нагревают при 35 С в течение 3 ч. Затем добавляют насыщенный водный раствор хлорида аммония (0,5 мл). Органический слой удаляют, и водный слой промывают диэтиловым эфиром(3 х 5 мл). Объединенные органические слои сушат насыщенным раствором соли и сульфатом магния,фильтруют и удаляют растворитель. Выполняют хроматографию на силикагеле, производя элюирование 15% этилацетата в гексане, и получают требуемый продукт (6,9 г, выход 70%) в виде не совсем белого воска. 1 Н ЯМР (400 МГц, CDCl3): 1,4 (9 Н, м), 2,5 (м, 1 Н), 2,8 (м, 1 Н), 3,65 (с, 3 Н), 4,0 (м, 2 Н), 4,3-4,5 (м,1 Н) , 4,9 (м, 2 Н). Промежуточное соединение 5. 1-трет-Бутил-2-метил-(2S,4EZ)-4-(цианометилен)-1,2-пирролидиндикарбоксилат. Диэтилцианометилфосфонат (0,86 мл, 4,4 ммоль) растворяют в сухом ТГФ (50 мл) и раствор охлаждают до 0 С. Затем осторожно добавляют гидрид натрия (205 мг 60% суспензии в парафиновом масле,5,1 ммоль) и перемешивают реакционную смесь в течение 30 мин. Затем реакционную смесь охлаждают до -78 С и по каплям добавляют раствор 1-трет-бутил-2-метил-(2S)-4-оксо-1,2-пирролидиндикарбо- 17006424 ксилата (1,0 г, 4,1 ммоль) в сухом ТГФ (5 мл). Реакционную смесь оставляют нагреваться до комнатной температуры. Затем добавляют насыщенный водный раствор хлорида аммония (15 мл) и этилацетат (100 мл). Органический слой удаляют, и водный слой промывают этилацетатом (3 х 5 мл). Объединенные органические слои сушат насыщенным раствором соли и сульфатом магния, фильтруют и удаляют растворитель. Образовавшееся вещество очищают хроматографией на силикагеле, производя элюирование 35% этилацетата в гексане, и получают требуемое соединение (860 мг, 80%) в виде не совсем белого воска. 1 Н ЯМР (360 МГц, CDCl3): 1,4 (м, 9 Н), 2,7-3,0 (м, 1 Н), 3,1-3,3 (м, 1 Н), 3,7 (м, 3 Н), 4,2-4,4 (м, 2 Н),4,5-4,7 (м, 1 Н), 5,4 (м, 1 Н). Промежуточное соединение 6. 1-трет-Бутил-2-метил-(2S,4EZ)-4-бензилиден-1,2-пирролидиндикарбоксилат. трет-Бутоксид калия (6,1 г, 54 ммоль) порциями добавляют к раствору хлорида бензилтрифенилфосфония (22,45 г, 58 ммоль) в безводном дихлорметане (400 мл) и реакционную смесь перемешивают при комнатной температуре в течение 1 ч. Затем раствор охлаждают до 0 С и по каплям добавляют раствор 1-трет-бутил-2-метил-(2S)-4-оксо-1,2-пирролидиндикарбоксилата (9,36 г, 38,5 ммоль) в сухом дихлорметане (30 мл). Смесь перемешивают в течение 1 ч при 0 С и затем еще 3 ч при комнатной температуре. Добавляют насыщенный водный раствор хлорида аммония (30 мл). Органический слой удаляют и водный слой промывают дихлорметаном (3 х 20 мл). Объединенные органические слои сушат насыщенным раствором соли и сульфатом магния, фильтруют и удаляют растворитель. Проводят хроматографию на силикагеле, производя элюирование 30% простого эфира в гексане, и получают требуемый продукт(м, 1 Н), 6,3-6,4 (м, 1 Н), 7,1-7,5 (м, 5 Н). Промежуточное соединение 7. (2S,4EZ)-1-(трет-Бутоксикарбонил)-4-(метоксиимино)-2-пирролидинкарбоновая кислота. Получают раствор (2S)-1-(трет-бутоксикарбонил)-4-оксо-2-пирролидинкарбоновой кислоты (5,0 г,21 ммоль) и гидрохлорида О-метилгидроксиламина (2,7 г, 32,8 ммоль) в хлороформе (100 мл), содержащем триэтиламин (5,5 г, 55 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи и удаляют растворитель. Полученную сырую реакционную смесь растворяют в этилацетате(150 мл) и быстро промывают 1 н. раствором НСl (40 мл). Кислотный слой экстрагируют этилацетатом (3 х 20 мл) и объединенные органические слои промывают насыщенным раствором соли, сушат над сульфатом магния, фильтруют и удаляют растворитель в вакууме. Требуемый продукт (5,3 г, 94%) выделяют в виде бледно-желтого масла. 1 Н ЯМР (400 МГц, CDCl3): 1,45 (м, 9 Н), 2,8-3,2 (м, 2 Н), 3,9 (с, 3 Н), 4,2 (м, 2 Н), 4,5-4,7 (м, 1 Н). Промежуточное соединение 8. (2S,4EZ)-1-(трет-Бутоксикарбонил)-4-(этоксиимино)-2-пирролидинкарбоновая кислота. Получают раствор (2S)-1-(трет-бутоксикарбонил)-4-оксо-2-пирролидинкарбоновой кислоты (5,0 г,22 ммоль) и гидрохлорида О-этилгидроксиламина (6,4 г, 65,5 ммоль) в смеси пиридина и этанола (1:1)(100 мл). Реакционную смесь нагревают до температуры кипения с обратным холодильником в течение 2,5 ч, охлаждают и удаляют растворитель. Остаток растворяют в этилацетате и быстро промывают 1,3 н. раствором НСl (40 мл). Кислотный слой экстрагируют этилацетатом (3 х 20 мл) и объединенные органические слои промывают насыщенным раствором соли, сушат над сульфатом магния, фильтруют и удаляют растворитель в вакууме. Требуемый продукт (5,5 г, 93%) выделяют в виде бледно-желтого масла. 1 Н ЯМР (400 МГц, ДМСО): 1,3 (т, 3 Н), 1,55 (м, 9 Н), 2,9-2,7 (м, 1 Н), 3,4-3,1 (м, 1 Н), 4,1-4,3 (м, 4 Н),4,6 (м, 1 Н), 12-13,5 (шир., 1 Н). Промежуточное соединение 9. (2S,4EZ)-4-[(Аллилокси)имино]-1-(трет-бутоксикарбонил)-2-пирролидинкарбоновая кислота. Получают раствор (2S)-1-(трет-бутоксикарбонил)-4-оксо-2-пирролидинкарбоновой кислоты (5,0 г,22 ммоль) и моногидрата гидрохлорида О-аллилгидроксиламина (7,2 г, 65,5 ммоль) в смеси пиридина и этанола (1:1) (100 мл). Реакционную смесь нагревают до температуры кипения с обратным холодильником в течение 2,5 ч, охлаждают и удаляют растворитель. Остаток растворяют в этилацетате и быстро промывают 1,3 н. раствором НСl (40 мл). Кислотный слой экстрагируют этилацетатом (3 х 20 мл) и объединенные органические слои промывают насыщенным раствором соли, сушат над сульфатом магния,фильтруют и удаляют растворитель в вакууме. Требуемый продукт (5,9 г, 94%) выделяют в виде бледножелтого масла. 1 Н ЯМР (400 МГц, CDCl3): 1,5 (м, 9 Н), 2,8-3,2 (м, 2 Н), 4,2 (м, 2 Н), 4,5-4,7 (м, 3 Н), 5,25 (м, 2 Н), 5,9(м, 1 Н), 11,1 (широкий с, 1 Н). Промежуточное соединение 10. 1-[(Aаминоокси)метил]-4-метоксибензол. Получают раствор Вос-гидроксиламина (2,0 г, 17,1 ммоль) в сухом ТГФ (60 мл). Добавляют гидрид натрия (1,1 г 60% суспензии в парафиновом масле, 25,7 ммоль) и суспензию перемешивают. К реакционной смеси добавляют каталитическое количество KI, после чего осторожно добавляют 4 метоксибензилхлорид (3,2 г, 20,4 ммоль). Реакционную смесь перемешивают в течение ночи и затем удаляют растворитель в вакууме. Остаток поглощают диэтиловым эфиром (100 мл) и барботируют газо- 18006424 образный НСl в течение 20 мин, в результате чего происходит осаждение продукта. Колбу закупоривают и оставляют выстаиваться в течение ночи. Продукт отфильтровывают в виде не совсем белого воска (выход 39-52% с учетом использования разных порций). 1 Н ЯМР (400 МГц, D2O): 3,8 (с, 3 Н), 5 (с, 2 Н), 7,0 (д, 2 Н), 7,4 (д, 2 Н). Промежуточное соединение 11. (2S,4EZ)-1-(трет-Бутоксикарбонил)-4-[(4-метоксибензил)окси] имино-2-пирролидинкарбоновая кислота. Аналогично способу получения промежуточного соединения 7, используя в качестве исходных веществ (2S)-1-(трет-бутоксикарбонил)-4-оксо-2-пирролидинкарбоновую кислоту (промежуточное соединение 1) и 1-[(аминоокси)метил]-4-метоксибензол (промежуточное соединение 10), получают указанное в заголовке соединение в виде камеди с выходом 85%. 1 Н ЯМР (400 МГц, ДМСО): 1,5 (м, 9 Н), 2,7-2,9 (м, 1 Н), 3,9 (с, 3 Н), 4,2 (м, 3 Н), 4,6 (м, 1 Н), 5,15 (с,2 Н), 7,1 (д, 2 Н), 7,45 (д, 2 Н). Промежуточное соединение 12. 2-Аминоэтилацетат (соль ТФУ). Получают раствор этаноламина (36,5 мл, 0,6 моль) в хлороформе (1000 мл). К полученному раствору по каплям медленно добавляют Вос 2 О (13,1 г, 60 ммоль), растворенный в хлороформе (600 мл), при 0 С в течение 6 ч (указанную температуру поддерживают в течение всего периода добавления). Реакционную смесь оставляют нагреваться до комнатной температуры и перемешивают в течение ночи. Органический слой промывают водой (2 х 500 мл), насыщенным раствором соли, сушат над сульфатом магния и концентрируют в вакууме. Требуемый продукт (9,5 г, 95%) выделяют в виде бесцветного масла и используют без дальнейшей очистки. Получают раствор Вос-этаноламина (1,92 г, 12 ммоль) и карбоната калия (5 г, 36 ммоль) в DCM (40 мл). Добавляют ацетилхлорид (30 мл, 0,42 моль) и реакционную смесь перемешивают в течение 6 ч при комнатной температуре. Избыток ацетилхлорида удаляют в вакууме и сырой продукт растворяют в DCM(100 мл). Органический слой промывают водой (50 мл), насыщенным раствором соли, сушат над сульфатом магния и концентрируют в вакууме. Требуемый продукт (1,86 г, 77%) выделяют в виде бесцветного масла и используют без дальнейшей очистки. Получают раствор О-ацил-Вос-этаноламина (1,65 г, 8,1 ммоль) в DCM (20 мл) и добавляют ТФУ (20 мл). Смесь выдерживают в течение одного часа при комнатной температуре и удаляют растворитель в вакууме. Сырой продукт концентрируют из метанола (2-3 раза) и из DCM (2-3 раза) , получая при этом целевое соединение (1,75 г, количественный выход) в виде масла, используемого без дальнейшей очистки. 1 Н ЯМР (400 МГц, D2O): 2,0 (м, 9 Н), 3,1-3,2 (м, 2 Н), 4,15-4,25 (м, 2 Н). Промежуточное соединение 13. 2'-Метил[1,1'-бифенил]-4-карбоновая кислота. К смеси 4-бромбензойной кислоты (30 г, 0,15 моль), 2-метилфенилбороновой кислоты (24 г, 0,15 моль), карбоната натрия (250 г) в толуоле (500 мл) и воде (500 мл) в атмосфере азота добавляют тетракистрифенилфосфинпалладий(0) (9 г, 0,0074 моль). Реакционную смесь нагревают с обратным холодильником в течение 10 ч. Затем к реакционной смеси добавляют 100 мл 10% NaOH, водный слой отделяют и промывают толуолом (2 х 200 мл). Водный слой подкисляют 3 н. раствором НСl и получают твердый продукт, который фильтруют, промывают водой и сушат. Сырой продукт кристаллизуют из толуола, получая при этом 2'-метил[1,1'-бифенил]-4-карбоновую кислоту (20 г, 62,5%). Указанный продукт можно также получить в аналогичных условиях из 1-бром-2-метилбензола и 4-карбоксибензолбороновой кислоты. 1 Н ЯМР (300 МГц, ДМСО): 2,2 (с, 3 Н), 7,2-7,4 (м, 4 Н), 7,43 (д, J=9 Гц, 2 Н), 7,99 (д, J=9 Гц, 2 Н) , 13(ш, 1 Н). Аналогичным образом, используя соответствующие коммерческие бороновые кислоты и арилбромиды, можно получить нижеследующие родственные 1,1'-бифенильные промежуточные соединения 13: 4'-метил[1,1'-бифенил]-4-карбоновая кислота; 2',3-диметил[1,1'-бифенил]-4-карбоновая кислота; 2',6'-диметил[1,1'-бифенил]-4-карбоновая кислота; 2-метил[1,1'-бифенил]-4-карбоновая кислота; 3-метил[1,1'-бифенил]-4-карбоновая кислота; 2,2'-диметил [1,1'-бифенил]-4-карбоновая кислота; 2'-метокси[1,1'-бифенил]-4-карбоновая кислота; 3'-метокси[1,1'-бифенил]-4-карбоновая кислота; 4'-метокси[1,1'-бифенил]-4-карбоновая кислота; 2'-хлор[1,1'-бифенил]-4-карбоновая кислота; 3'-хлор[1,1'-бифенил]-4-карбоновая кислота; 4'-хлор[1,1'-бифенил]-4-карбоновая кислота; 3',4'-дихлор[1,1'-бифенил]-4-карбоновая кислота; 2'-(трифторметил)[1,1'-бифенил]-4-карбоновая кислота; 3'-(трифторметил)[1,1'-бифенил]-4-карбоновая кислота; 2'-циано[1,1'-бифенил]-4-карбоновая кислота; 2',4'-дифтор[1,1'-бифенил]-4-карбоновая кислота;(25 г, 0,164 моль), Pd(PPh3)4 (9,5 г, 0,0082 моль) и карбоната натрия (200 г в 500 мл воды) в толуоле (750 мл) нагревают с обратным холодильником в атмосфере азота в течение 15 ч. Слой толуола отделяют и перегоняют при пониженном давлении, получая остаток. Остаток очищают хроматографией на колонке и получают [4-(3-метил-2-пиридинил)фенил]метанол (12 г, 47%). К раствору [4-(3-метил-2-пиридинил)фенил]метанола (12 г, 0,06 моль) в сухом ДМФ (150 мл) добавляют дихромат пиридиния (91 г, 0,24 моль) и перемешивают при комнатной температуре в течение 3 дней. Реакционную смесь выливают в воду и экстрагируют этилацетатом (250 мл). Органический слой промывают водой, насыщенным раствором соли, сушат и концентрируют. Сырой продукт очищают хроматографией на колонке с силикагелем, получая при этом 4-(3-метил-2-пиридинил)бензойную кислоту (3 г, 25%) в виде белого твердого вещества. 1 Н ЯМР (300 МГц, ДМСО): 2,3 (с, 3 Н) , 7,33 (дд, J=7,5 Гц, 5 Гц, 1 Н), 7,67 (д, J=8 Гц, 2 Н), 7,75 (д,J=7,5 Гц, 1 Н), 8,01 (д, J=8 Гц, 2 Н), 8,50 (д, J=5 Гц, 1 Н), 13 (ш, 1 Н). Промежуточное соединение 15. 4-(1-Оксидо-3-пиридинил)бензойная кислота. К смеси 4-толилбороновой кислоты (38 г, 0,28 моль), 3-бромпиридина (44 г, 0,28 моль), Nа 2 СО 3 (200 г) в толуоле (500 мл) и воде (500 мл) добавляют Pd(PPh3)4 (16 г, 0,014 моль) и нагревают с обратным холодильником в течение 16 ч. Реакционную смесь охлаждают, органический слой отделяют, промывают водой и насыщенным раствором соли и сушат. Растворитель удаляют, получая при этом 4-(3 пиридил)толуол (42 г, 90%). К смеси 4-(3-пиридил)толуола (35 г, 0,207 моль) в пиридине (400 мл) и воде (400 мл) порциями добавляют KМnО 4 (163 г, 1,03 моль) и нагревают с обратным холодильником в течение 12 ч. Реакционную смесь фильтруют через целит и подкисляют концентрированной НСl. Продукт промывают водой и сушат, получая 4-(3-пиридил)бензойную кислоту (32 г, 7 6%) в виде белого твердого вещества. К смеси 4(3-пиридил)бензойной кислоты (22 г, 0,11 моль) в ТГФ (2,51) добавляют mСРВА (152 г, 0,44 моль, 50%) и перемешивают при комнатной температуре в течение 12 ч. Твердое вещество фильтруют и промывают ТГФ, получая при этом 4-(1-оксидо-3-пиридинил)бензойную кислоту (20 г, 86%). 1 Н ЯМР (300 МГц, ДМСО): 7,5-7,8 (м, 5 Н), 7,9 (д, J=8 Гц, 2 Н), 8,33 (д, J=5 Гц, 2 Н). Аналогичным образом, используя в качестве исходных веществ 4-толилбороновую кислоту (45 г,0,33 моль) и 2-бромпиридин (52 г, 0,33 моль), получают родственное промежуточное соединение 4-(1 оксидо-2-пиридинил)бензойную кислоту. Пример 1. Общий способ омыления метиловых эфиров пролина олефинового типа, таких как промежуточные соединения 3-6. Раствор гидроксида натрия (4,5 г, 112 ммоль) в воде (70 мл) добавляют к соответствующему метиловому эфиру пролина олефинового типа (66 ммоль) в смеси диоксан:вода (3:1) (500 мл) и реакционную смесь перемешивают в течение 3 ч. Затем реакционную смесь промывают диэтиловым эфиром (2 х 50 мл), водную фазу подкисляют до рН 2 (0,1 н. раствор НСl) и экстрагируют в этилацетат. Этилацетатный слой сушат над сульфатом магния, фильтруют и растворитель удаляют в вакууме, получая при этом требуемый продукт почти с количественным выходом в виде масла, которое используют без дальнейшей очистки. Пример 2. Общий способ синтеза в фазе раствора оксимэфирных производных пирролидина общей формулы Iа (схема 1). Способ А. (2S,4EZ)-1-([1,1'-Бифенил]-4-илкарбонил)-N-(2-метоксиэтил)-4-(метоксиимино)-2-пирролидинкарбоксамид. а) Методика образования амидной связи. Получают раствор центрального элемента структуры (билдинг-блока), например, (2S,4EZ)-1-(третбутоксикарбонил)-4-(метоксиимино)-2-пирролидинкарбоновой кислоты (промежуточное соединение 7)(1,5 г, 5,8 ммоль), амина или соли амина, например, 2-метоксиэтиламина (0,51 мл, 5,81 ммоль) и DMAP(780 мг, 5,8 ммоль) в DCM (30 мл). При 0 С порциями медленно добавляют EDC (1,1 г, 5,8 ммоль). Реакционную смесь оставляют медленно нагреваться до комнатной температуры и перемешивают в течение ночи. DCM выпаривают, сырой продукт очищают хроматографией на колонке, используя EtOAc (100%),и получают требуемое соединение, например, трет-бутил(2S,4EZ)-2-[(2-метоксиэтил)амино]карбонил 4-(метоксиимино)-1-пирролидинкарбоксилат (1,5 г, 80%) в виде бесцветного масла. 1 Н ЯМР (400 МГц, CDCl3): 1,25 (м, 9 Н), 2,5-2,9 (м, 2 Н), 3,1 (с, 3 Н), 3,2-3,3 (м, 4 Н), 3,65 (с, 3 Н), 3,84,4 (м, 3 Н), 6,7 (широкий с, 1 Н).b) Методика выполнения стадии удаления N-защитной группы. Получают раствор амидных соединений с предыдущей стадии, например, трет-бутил-(2S,4EZ)-2[(2-метоксиэтил)амино]карбонил-4-(метоксиимино)-1-пирролидинкарбоксилата (1,5 г, 0,4 ммоль) в- 20006424 безводном простом эфире (35 мл). Через реакционную смесь медленно барботируют газообразный НСl,удаляют защитную группу и проводят тонкослойную хроматографию (ТСХ). Примерно через 20 мин выпаривают простой эфир. Полученный продукт концентрируют в вакууме из DCM (2-3 раза), чтобы удалить НСl. Требуемый продукт, например, (2S,4EZ)-N-(2-метоксиэтил)-4-(метоксиимино)-2 пирролидинкарбоксамид (1,2 г, количественный выход), выделяют в виде желтого масла и используют без дальнейшей очистки.c) Методика выполнения стадии N-кэппирования. Получают раствор свободного NH-соединения с предыдущей стадии, например, (2S,4EZ)-N-(2 метоксиэтил)-4-(метоксиимино)-2-пирролидинкарбоксамида (940 мг, 3,7 ммоль), карбоновой кислоты,например, [1,1'-бифенил]-4-карбоновой кислоты (740 мг, 3,7 ммоль) и DMAP (960 мг, 7,8 ммоль) в DCM(30 мл). При 0 С порциями медленно добавляют EDC (715 мг, 3,7 ммоль). Реакционную смесь оставляют медленно нагреваться до комнатной температуры и перемешивают в течение ночи. DCM выпаривают,сырой продукт очищают хроматографией на колонке, используя EtOAc (100%), и получают требуемый продукт, например, (2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-(2-метоксиэтил)-4-(метоксиимино)-2 пирролидинкарбоксамид в виде смеси двух изомеров, представляющей не совсем белое твердое вещество. 1 Н ЯМР (400 МГц, CDCl3): 2,75-2,85 (м, 1 Н), 3,1-3,3 (м, 4 Н), 3,4-3,5 (м, 4 Н), 3,8 (м, 3 Н), 4,1-4,3 (м,2 Н), 5,1 (м, 1 Н), 6,9 (м, 1 Н), 7,2-7,7 (м, 10 Н). М+(АРСI+); 396. Способ В. (2S,4E и 4Z)-N-[(2S)-2-Гидрокси-2-фенилэтил]-4-(метоксиимино)-1-[2'-метил[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид.a) Методика образования амидной связи. К раствору центрального элемента структуры, например, (2S,4EZ)-1-(трет-бутоксикарбонил)-4(метоксиимино)-2-пирролидинкарбоновой кислоты (промежуточное соединение 7) (24,2 ммоль, 6,24 г) в сухом ТГФ (125 мл) при -25 С добавляют NMM (2,5 экв., 60,4 ммоль, 6,64 мл) и изобутилхлорформиат(1,05 экв., 25,4 ммоль, 3,3 мл). Полученную смесь перемешивают при -25 С в течение 30 мин и добавляют амин или соль амина, например, (S)-2-амино-1-фенилэтанол (1,51 экв., 36,5 ммоль, 5 г). Смесь оставляют постепенно нагреваться до комнатной температуры. Через 16 ч удаляют растворители. Остаток растворяют в AcOEt, дважды промывают насыщенным раствором NH4Cl и дважды 10% раствором NаНСО 3. Органический слой сушат над Na2SO4, фильтруют и концентрируют, получая при этом требуемый продукт, например, трет-бутил-(2S,4EZ)-2-([(2S)-2-гидрокси-2-фенилэтил]аминокарбонил)-4-(метоксиимино)-1-пирролидинкарбоксилат (8,76 г, 96%) в виде бледно-желтого масла с чистотой 88,5% по результатам ВЭЖХ. 1 Н ЯМР (300 МГц, CDCl3):1,44 (с, 9 Н, N-Boc) , 3,23-2,85 (м, 4 Н), 3,72 (м, 1 Н), 3,85 (с, 3 Н, О-СН 3),4,10 (м, 2 Н), 4,49 (м, 1 Н), 4,83 (м, 1 Н), 7,34 (м, 5 Н, Ar-H); [M+Na+] (ESI+) : 400.b) Методика выполнения стадии удаления N-защитной группы. Получают раствор амидных соединений с предыдущей стадии, например, трет-бутил-(2S,4EZ)-2([(2S)-2-гидрокси-2-фенилэтил] аминокарбонил)-А-(метоксиимино)-1-пирролидинкарбоксилата (2,64 г,7 ммоль), в безводном DCM (35 мл). При 0 С через реакционную смесь медленно барботируют газообразный НСl, удаляют защитную группу и выполняют ТСХ. Примерно через 20 мин выпаривают DCM. Полученный продукт концентрируют в вакууме из DCM (2-3 раза), чтобы удалить НСl. Требуемый продукт, например, (2S,4EZ)-N-[(2S)-2-гидрокси-2-фенилэтил]-4-(метоксиимино)-2-пирролидинкарбоксамид(1/94 г, количественный выход) выделяют в виде желтого твердого вещества и используют без дальнейшей очистки. с) Методика выполнения стадии N-кэппирования. К суспензии 4-(2-метилфенил)бензойной кислоты (1,49 г, 7 ммоль) в 35 мл DCM добавляют оксалилхлорид и ДМФ (3 мл) при охлаждении льдом. Смесь перемешивают в течение 2 ч при комнатной температуре. Растворитель удаляют и получают соответствующий ацилхлорид в виде желтого твердого вещества. Полученное твердое вещество растворяют в DCM (30 мл) и медленно добавляют к находящемуся при 0 С раствору свободного NH-соединения с предыдущей стадии, например, (2S,4EZ)-N-[(2S)-2 гидрокси-2-фенилэтил]-4-(метоксиимино)-2-пирролидинкарбоксамида (1,94 г, 7 ммоль) и триэтиламина(5 экв., 35 ммоль, 4,9 мл) в сухом DCM (35 мл). Реакционную смесь перемешивают в течение ночи при комнатной температуре. Добавляют политрисамин (2,12 г, 3,4 5 ммоль/г), чтобы удалить избыток ацилхлорида. Смесь встряхивают в течение 3 ч, фильтруют и образовавшийся раствор промывают насыщенным раствором NH4Cl, насыщенным раствором соли и сушат над Na2SO4. Смесь фильтруют, растворители выпаривают и образовавшееся темное масло (3,26 г) очищают флэш-хроматографией (системаBiotage, колонка 40 М, 90 г SiO2, с использованием в качестве элюента градиентов DCM и МеОН), получая (2S, 4EZ)-N-[(2S)-2-гидрокси-2-фенилэтил]-4-(метоксиимино)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамид. E/Z-изомеры разделяют несколькими хроматографиями, что даетd) E/Z-изомеризация. Чистый Е-изомер изомеризуют до смеси E/Z-изомеров нижеследующим способом: Е-изомер растворяют в смеси диоксан/вода (3:1). Добавляют NaOH (1,7 экв., 0,52 мл 1,6 н. раствора NaOH) и полученный раствор перемешивают в течение 2 ч при комнатной температуре. Смесь нейтрализуют 0,1 н. раствором НСl и лиофилизуют. Компоненты полученной E/Z-смеси разделяют и очищают флэшхроматографией в описанных выше условиях. Пример 3. (2S,4EZ)-1-([1,1'-Бифенил]-4-илкарбонил)-N-[2-(диэтиламино)этил]-4-[(4-метоксибензил)окси]имино-2-пирролидинкарбоксамид. Общим способом по примеру 2, используя в качестве исходных веществ (2S,4EZ)-1-(третбутоксикарбонил)-4-[(4-метоксибензил)окси]имино-2-пирролидинкарбоновую кислоту, [1,1'-бифенил]4-карбоновую кислоту и N1,N1-диэтил-1,2-этандиамин, после проведения хроматографии на колонке получают указанное в заголовке соединение в виде смеси E/Z-изомеров, представляющей не совсем белое твердое вещество. 1 Н ЯМР (400 МГц, CDCl3): 1,05-1,15 (м, 6 Н), 2,7-2,8 (м, 1 Н), 2,9-3,2 (м, 6 Н), 3,4 (м, 1 Н), 3,6 (с, 3 Н),4,0-4,1 (м, 1 Н), 4,3-4,4 (м, 1 Н), 3,75 (м, 1 Н), 3,8 (м, 2 Н), 6,65 (м, 2 Н), 7,0-7,1 (м, 2 Н), 7,2-7,3 (м, 3 Н), 7,357,45 (м, 6 Н), 8,8 (шир.с, 0,5 Н). М+(АРСI+): 543. Пример 4. (2S,4EZ)-1-([1,1'-Бифенил]-4-илкарбонил)-4-(хлорметилен)-N-[(2RS)-2-гидрокси-2-фенетил]-2-пирролидинкарбоксамид. Общим способом по примеру 2, используя в качестве исходных веществ (2S,4EZ)-1-(третбутоксикарбонил)-4-(хлорметилен)2-пирролидинкарбоновую кислоту, [1,1'-бифенил]-4-карбоновую кислоту и (1RS)-2-амино-1-фенилэтанол, после выполнения хроматографии на колонке получают указанное в заголовке соединение в виде не совсем белого твердого вещества, представляющего смесь E/Zизомеров. Два изомера можно разделить, выполняя еще одну стадию очистки флэш-хроматографией.(2S,4Z)-l-([1,1'-бифенил]-4-илкарбонил)-4-(хлорметилен)-N-[(2RS)-2-гидрокси-2-фенетил]-2-пирролидинкарбоксамид. 1 Н ЯМР (400 МГц, CDCl3): 2,5-2,6 (м, 1 Н), 2,7-2,9 (м, 1 Н), 3,0 (м, 1 Н), 3,1-3,4 (м, 1 Н), 3,4-3,6 (м, 1 Н),3,9-4,0 (м, 1 Н), 4,2-4,4 (м, 2 Н), 4,6 (м, 1 Н), 4,8-4,9 (м, 1 Н), 5,75 (с, 1 Н), 7,0-7,5 (м, 14 Н). М+(АРСI+): 461. Пример 5. (2S,4EZ)-N-[2-(Диэтиламино)этил]-1-(дифенилацетил)-4-(метоксиимино)-2-пирролидинкарбоксамид. Общим способом по примеру 2, используя в качестве исходных веществ (2S,4EZ)-1-(третбутоксикарбонил)-4-(метоксиимино)-2-пирролидинкарбоновую кислоту, дифенилуксусную кислоту иN1,N1-диэтил-1,2-этандиамин, после проведения хроматографии на колонке получают указанное в заголовке соединение в виде не совсем белого твердого вещества, представляющего смесь E/Z-изомеров. 1 Н ЯМР (400 МГц, CDCl3): 0,9 (т, 3 Н), 1,0 (м, 3 Н), 2,6-3,1 (м, 7 Н), 3,15 (м, 1 Н), 3,4 (м, 1 Н), 3,75 (с,3 Н), 3,95 (т, 1 Н), 4,4-4,7 (м, 4 Н), 5,1 (м, 1 Н), 7,0-7,3 (м, 10 Н), 9,1 (м, 1 Н). М+(АРСI+): 451. Пример 6. (2S,4EZ)-4-(Этоксиимино)-N-(9-этил-9 Н-карбазол-3-ил)-1-(феноксиацетил)-2-пирролидинкарбоксамид. Общим способом по примеру 2, используя в качестве исходных веществ (2S, 4EZ)-1-(третбутоксикарбонил)-4-(этоксиимино)-2-пирролидинкарбоновую кислоту, феноксиуксусную кислоту и 9 этил-9 Н-карбазол-3-амин, после проведения хроматографии на колонке получают указанное в заголовке соединение в виде не совсем белого твердого вещества, представляющего смесь E/Z-изомеров. Указан- 22006424 ные изомеры затем разделяют хроматографией на колонке.(2S,4Z)-4-(Этоксиимино)-N-(9-этил-9 Н-карбазол-3-ил)-1-(феноксиацетил)-2-пирролидинкарбоксамид. 1 Н ЯМР (360 МГц, CDCl3): 1,2 (м, 6 Н), 2,7 (м, 1 Н), 3,2 (м, 1 Н), 4,1 (м, 4 Н), 4,35 (м, 2 Н), 4,7 (м, 2 Н),5,1 (м, 1 Н), 6,9-7,3 (м, 10 Н), 7,9 (д, 1 Н), 8,15 (м, 1 Н), 9,0 (шир.с, 1 Н). М+(АРСI+): 499. Пример 7. (2S,4EZ)-N-(9-этил-9 Н-карбазол-3-ил)-4-(метоксиимино)-1-[(2-оксо-6-пентил-2 Н-пиран 3-ил)карбонил]-2-пирролидинкарбоксамид. Общим способом по примеру 2, используя в качестве исходных веществ (2S,4EZ)-1-(третбутоксикарбонил)-А-(метоксиимино)-2-пирролидинкарбоновую кислоту, 2-оксо-6-пентил-2 Н-пиран-3 карбоновую кислоту и 9-этил-9 Н-карбазол-3-амин, после выполнения хроматографии на колонке получают указанное в заголовке соединение в виде не совсем белого твердого вещества, представляющего смесь E/Z-изомеров. Указанные изомеры разделяют хроматографией на колонке.(2S,4Z)-N-(9-Этил-9 Н-карбазол-3-ил)-4-(метоксиимино)-1-[(2-оксо-6-пентил-2 Н-пиран-3-ил)карбонил]-2-пирролидинкарбоксамид. 1 Н ЯМР (360 МГц, CDCl3): 0,8 (м, 6 Н), 1,2 (м, 6 Н), 2,5 (м, 2 Н), 3,05 (м, 1 Н), 3,25 (м, 1 Н), 3,75 (с, 3 Н),4,1 (м, 3 Н), 4,45 (д, 1 Н), 5,3 (д, 1 Н), 6,1 (д, 1 Н), 7,1 (т, 1 Н), 7,2 (м, 1 Н), 7,3 (м, 1 Н), 7,4 (м, 1 Н), 7,6 (м, 1 Н),7,7 (м, 1 Н), 8,0 (д, 1 Н), 8,45 (м, 1 Н), 9,1 (м, 1 Н). M+(ES+): 543. Пример 8. (2S,4EZ)-4-[(Аллилокси)имино]-1-бензоил-N-(9-этил-9 Н-карбазол-3-ил)-2-пирролидинкарбоксамид. Общим способом по примеру 2, используя в качестве исходных веществ (2S,4EZ)-4-[(аллилокси) имино]-1-(трет-бутоксикарбонил)-2-пирролидинкарбоновую кислоту, бензойную кислоту и 9-этил-9 Нкарбазол-3-амин, после выполнения хроматографии на колонке получают указанное в заголовке соединение в виде не совсем белого твердого вещества, представляющего смесь E/Z-изомеров. 1 Н ЯМР (360 МГц, CDCl3): 1,2 (м, 3 Н), 2,8 (м, 1 Н), 3,35 (м, 1 Н), 4,2 (м, 4 Н), 4,4 (м, 3 Н), 5,2 (м, 2 Н),5,35 (м, 1 Н), 5,85 (м, 1 Н), 7,0-7,5 (м, 5 Н), 7,9 (м, 3 Н), 8,1 (м, 2 Н), 8,3 (м, 1 Н), 9,2 (шир.с, 1 Н). М+(АРСI+): 481. Пример 9. Общий способ синтеза в фазе раствора оксимэфирных производных пирролидина общей формулы I, содержащих дополнительные реакционноспособные группы: (2S,4EZ)-1-([1,1'-бифенил]-4 илкарбонил)-N-(2-гидроксиэтил)-4-(метоксиимино)-2-пирролидинкарбоксамид. а) Методика образования амидной связи. Получают раствор центрального элемента структуры, например, (2S, 4EZ)-1-(трет-бутоксикарбонил)-4-(метоксиимино)-2-пирролидинкарбоновой кислоты (промежуточное соединение 7) (575 мг, 2,2 ммоль), амина или соли амина, содержащей должным образом защищенную реакционноспособную группу, например, 2-аминоэтилацетата (промежуточное соединение 12) (480 мг, 2,2 ммоль) и DMAP (870 мг, 7,1 ммоль) в DCM (20 мл). При 0 С порциями медленно добавляют EDC (427 мг, 2,2 ммоль). Реакционную смесь оставляют медленно нагреваться до комнатной температуры и перемешивают в течение ночи. DCM выпаривают, сырой продукт очищают хроматографией на колонке, используя EtOAc/гексан(55/45), и получают требуемое амидное соединение, например, трет-бутил-(2S,4EZ)-2-([2-(ацетилокси) этил]амино карбонил)-4-(метоксиимино)-1-пирролидинкарбоксилат (373 мг, 4 9%) в виде масла. 1 Н ЯМР (400 МГц, CDCl3): 1,7 (м, 9 Н), 2,1-2,2 (м, 3 Н), 2,8-3,3 (м, 2 Н), 3,7-3,8 (м, 2 Н), 4,0-4,1 (м, 3 Н),4,2-4,8 (м, 5 Н), 7,3 (широкий с, 1 Н).b) Методика выполнения стадии удаления N-защитной группы. Получают раствор Вос-защищенного соединения с предыдущей стадии, например, трет-бутил(2S,4EZ)-2-([2-(ацетилокси)этил]аминокарбонил)-4-(метоксиимино)-1-пирролидинкарбоксилата.(373 мг, 1,2 ммоль) в безводном простом эфире (40 мл). Через реакционную смесь медленно барботируют газообразный НСl, удаляют защитную группу и выполняют ТСХ. Примерно через 20 мин выпаривают простой эфир. Полученный продукт концентрируют в вакууме из DCM (2-3 раза), чтобы удалить НСl. Требуемый свободный NH-продукт, например, 2-([(2S,4EZ)-4-(метоксиимино)пирролидинил]карбониламино)этилацетат (300 мг, количественный выход) выделяют в виде желтого масла и используют без дальнейшей очистки. 1 Н ЯМР (400 МГц, D2O): 1,75 (с, 3 Н), 2,55-2,65 (м, 1 Н), 2,8-3,3 (м, 3 Н), 3,45-3,55 (м, 3 Н), 3,8-4,0 (м,4 Н), 4,25-4,35 (м, 1 Н).c) Методика выполнения стадии N-кэппирования.- 23006424 Получают раствор гидрохлорида амина с предыдущей стадии, например, 2-([(2S,4EZ)-4-(метоксиимино)пирролидинил]карбониламино)этилацетата (560 мг, 2 ммоль) и хлорангидрида кислоты, например, [1,1'-бифенил]-4-карбонилхлорида (433 мг, 2 ммоль) в DCM (20 мл). Добавляют триэтиламин(0,7 мл, 5 ммоль) и реакционную смесь перемешивают в течение ночи при комнатной температуре. DCM выпаривают, сырой продукт очищают хроматографией на колонке, используя EtOAc (100%), и получают требуемое амидное соединение, например, 2-([2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)пирролидинил]карбониламино)этилацетат (457 мг, 54%) в виде масла. 1 Н ЯМР (400 МГц, CDCl3): 1,9 (с, 3 Н), 2,7-2,8 (м, 1 Н), 3,2-3,6 (м, 3 Н), 3,75-3,85 (м, 3 Н), 4,0-4,4 (м,4 Н), 5,15-5,25 (м, 1 Н), 7,2-7,6 (м, 9 Н).d) Методика снятия защиты с реакционноспособной группы Получают раствор защищенного в боковой цепи соединения с предыдущей стадии, например, 2-([(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)4-(метоксиимино)пирролидинил]карбониламино)этилацетата (450 мг, 10,6 ммоль) в ТГФ (10 мл). Добавляют водный раствор (10 мл) гидроксида натрия (75 мг, 19 ммоль) с метанолом (5 мл) и реакционную смесь перемешивают при комнатной температуре в течение 3 ч. Растворитель удаляют в вакууме, сырой продукт очищают хроматографией на колонке, используя ТГФ (100%), и получают требуемый конечный продукт, например, (2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-(2-гидроксиэтил)-4-(метоксиимино)-2 пирролидинкарбоксамид (300 мг, 75%) в виде белого твердого вещества. 1 Н ЯМР (400 МГц, CDCl3): 2,86-3,0 (м, 1 Н), 3,3-3,6 (м, 3 Н), 3,7-3,8 (2 Н), 3,85-3,95 (м, 3 Н), 4,2-4,5 (м,2 Н), 5,15-5,25 (м, 1 Н), 7,2-7,9 (м, 9 Н). М+(АРСI+): 382. Пример 10. (2S,4EZ)-1-([1,1'-Бифенил]-4-илкарбонил)-N-[(2RS)-2-гидрокси-2-фенетил]-4-(метоксиимино)-2-пирролидинкарбоксамид. Общим способом по примеру 9, используя в качестве исходных веществ (2S,4EZ)-1-(трет-бутоксикарбонил)-4-(метоксиимино)-2-пирролидинкарбоновую кислоту, [1,1'-бифенил]-4-карбонилхлорид и 2-амино-1-фенилэтилацетат, после проведения хроматографии на колонке получают указанное в заголовке соединение в виде не совсем белого твердого вещества, представляющего смесь E/Z-изомеров. Два изомера можно разделить, выполняя еще одну стадию очистки флэш-хроматографией.(2S,4Z)-1-([1,1'-Бифенил]-4-илкарбонил)-N-[(2RS)-2-гидрокси-2-фенетил]-4-(метоксиимино)-2-пирролидинкарбоксамид. 1 Н ЯМР (400 МГц, CDCl3): 2,7-2,85 (м, 1 Н), 3,05-3,25 (м, 2 Н), 3,35 (м, 1 Н), 3,65-3,8 (м, 1 Н), 3,8 (с,3 Н), 4,15-4,25 (д, 1 Н), 4,25-4,4 (м, 1 Н), 4,75 (м, 1 Н), 5,1 (дд, 1 Н), 5,15-7,6 (м, 15 Н) . М+(АРСI+): 458. Пример 11. Общий способ синтеза в фазе раствора оксимэфирных производных пирролидина общей формулы Ib (схема 5). О-метилоксим (3EZ,5S)-5-(1 Н-бензимидазол-2-ил)-1-([1,1'-бифенил]-4-илкарбонил)-3-пирролидинона.a) Методика образования амидной связи. Получают раствор центрального элемента структуры, например, (2S, 4EZ)-1-(трет-бутоксикарбонил)-4-(метоксиимино)-2-пирролидинкарбоновой кислоты (промежуточное соединение 7) (2,1 г, 8,1 ммоль), замещенного в орто-положении ароматического амина или соли амина, например, 1,2 бензолдиамина (0,88 г, 8,1 ммоль) и DМАР (1,59 г, 13,0 ммоль) в сухом дихлорметане (30 мл). Полученный раствор охлаждают до 0 С, обрабатывают EDC (1,56 г, 8,2 ммоль), нагревают до комнатной температуры и перемешивают в течение 2 дней. Растворитель удаляют в вакууме, продукт очищают хроматографией на силикагеле, производя элюирование градиентом 30-80% этилацетата в гексане, и получают требуемый анилидный продукт, например, трет-бутил-(2S,4EZ)-2-[(2-аминоанилино)карбонил]-4-(метоксиимино)-1-пирролидинкарбоксилат (2,8 г, 97%) в виде бесцветной пены. 1 Н ЯМР (360 МГц, CDCl3): 1,7 (м, 9 Н), 2,5-3,5 (шир., 4 Н), 3,4 (м, 1 Н), 4,0 (м, 3 Н), 4,2-4,4 (м, 2 Н), 4,9b) Методика образования конденсированного гетероциклического кольца. Раствор анилидного соединения с предыдущей стадии, например, трет-бутил-(2S,4EZ)-2-[(2-аминоанилино)карбонил]-4-(метоксиимино)-1-пирролидинкарбоксилата (0,8 г, 2,3 ммоль) в дихлорметане (30 мл) и уксусной кислоты (3 мл) перемешивают при комнатной температуре в течение 3 дней. К реакционной смеси добавляют насыщенный водный раствор бикарбоната натрия (7 мл), органическую фазу собирают и сушат над сульфатом магния, фильтруют и удаляют растворитель в вакууме, получая при этом требуемый продукт, например, трет-бутил-(2S,4EZ)-2-(1 Н-бензимидазол-2-ил)-4-(метоксиимино)-1 пирролидинкарбоксилат (740 мг, 97%) в виде не совсем белой пены. 1 Н ЯМР (360 МГц, CDCl3): 1,5 (м, 9 Н), 3,1 (м, 1 Н), 3,8 (м, 3 Н), 3,9-4,3 (м, 3 Н), 5,3 (м, 1 Н), 7,1-7,6 (м,4 Н), 10-10,5 (шир., 1 Н).c) Методика выполнения стадии удаления N-защитной группы. Газообразный хлороводород барботируют в раствор конденсированного гетероциклического про- 24006424 дукта с предыдущей стадии,например,трет-бутил-(2S,4EZ)-2-(1 Н-бензимидазол-2-ил)-4(метоксиимино)-1-пирролидинкарбоксилата (740 мг, 2,2 ммоль) в сухом DCM (20 мл) в течение 30 мин. Растворитель удаляют в вакууме, получая требуемый продукт, например, О-метилоксим (3EZ,5S)-5-(1 Нбензимидазол-2-ил)-3-пирролидинона (0,58 г, 99%) в виде коричневого аморфного порошка, который используют без дальнейшей очистки.d) Методика выполнения стадии N-кэппирования. Раствор свободного NH-продукта с предыдущей стадии, например, О-метилоксима (3EZ,5S)-5-(1 Нбензимидазол-2-ил)-3-пирролидинона (0,58 г, 2,2 ммоль) в сухом дихлорметане (25 мл) обрабатывают хлорангидридом кислоты, например, [1,1'-бифенил]-4-карбонилхлоридом (0,48 г, 2,2 ммоль) и триэтиламином (0,9 мл, 6,6 ммоль). Полученный раствор перемешивают в течение 3 ч при комнатной температуре, растворитель удаляют в вакууме, требуемые изомеры выделяют флеш-хроматографией на силикагеле, производя элюирование градиентом этилацетата (10-80%) в гексане, и получают два изомера (120 мг менее полярного изомера и 400 мг более полярного изомера) требуемого продукта, например, Ометилоксим (3E,5S)- и (3Z,5S)-5-(1 Н-бензимидазол-2-ил)-1-([1,1'-бифенил]-4-илкарбонил)-3-пирролидинона в виде не совсем белых порошков. О-метилоксим(3Z,5S)-5-(1 Н-бензимидазол-2-ил)-1-([1,1'-бифенил]-4-илкарбонил)-3-пирролидинона. 1 Н ЯМР (360 МГц, CDCl3): 3,1 (м, 1 Н), 3,8 (с, 3 Н), 3,9 (м, 1 Н), 4,3 (м, 2 Н), 6,0 (м, 1 Н), 6,0 (м, 1 Н),7,2-7,7 (м, 13 Н), 10-11 (шир., 1 Н). М+(АРСI+): 411. Пример 12. Q-Метилоксим (3EZ, 5S)-5-(1 Н-бензимидазол-2-ил)-1-[(2'-метил[1,1'-бифенил]-4-ил) карбонил]-3-пирролидинона. Общим способом по примеру 11, используя в качестве исходных веществ(2S,4EZ)-1-(трет-бутоксикарбонил)-4-(метоксиимино)-2-пирролидинкарбоновую кислоту, 2'-метил[1,1'бифенил]-4-карбоновую кислоту и 1,2-бензолдиамин, получают указанное в заголовке соединение с чистотой 91% по результатам ВЭЖХ. МС (ESI+): (m/z)=425. Пример 13. О-Метилоксим (3EZ,5S)-5-(1-метил-1 Н-бензимидазол-2-ил)-1-[(2'-метил[1,1'-бифенил]4-ил)карбонил]-3-пирролидинона. Общим способом по примеру 11, используя в качестве исходных веществ (2S,4EZ)-1-(третбутоксикарбонил)-4-(метоксиимино)-2-пирролидинкарбоновую кислоту, 2'-метил[1,1'-бифенил]-4-карбоновую кислоту и N1-метил-1,2-бензолдиамин, получают указанное в заголовке соединение с чистотой 83% по результатам ВЭЖХ. МС (ESI+): (m/z)=439. Пример 14. О-метилоксим (3EZ,5S)-5-(7-гидрокси-1 Н-бензимидазол-2-ил)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-3-пирролидинона. Общим способом по примеру 11, используя в качестве исходных веществ (2S,4EZ)-1-(третбутоксикарбонил)-4-(метоксиимино)-2-пирролидинкарбоновую кислоту, 2'-метил[1,1'-бифенил]-4-карбоновую кислоту и 2,3-диаминофенол, получают указанное в заголовке соединение с чистотой 91% по результатам ВЭЖХ. МС (ESI+): (m/z)=441. Пример 15. О-Метилоксим (3EZ,5S)-5-(3,4-дигидро-2-хиназолинил)-1-[(2'-метил[1,1'-бифенил]-4 ил)карбонил]-3-пирролидинона. Общим способом по примеру 11, используя в качестве исходных веществ (2S,4EZ)-1-(третбутоксикарбонил)-4-(метоксиимино)-2-пирролидинкарбоновую кислоту, 2'-метил [1,1'-бифенил]-4 карбоновую кислоту и 2-(аминометил)анилин, получают указанное в заголовке соединение с чистотой 77% по результатам ВЭЖХ. МС (ESI+): (m/z)=439. Пример 16. О-Метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-(1-метил-1 Н-бензимидазол 2-ил)-3-пирролидинона. Общим способом по примеру 11, используя в качестве исходных веществ (2S,4EZ)-1-(третбутоксикарбонил)-4-(метоксиимино)-2-пирролидинкарбоновую кислоту,[1,1'-бифенил]-4 карбонилхлорид и N1-метил-1,2-бензолдиамин, получают указанное в заголовке соединение с чистотой 88% по результатам ВЭЖХ. МС (ESI+): (m/z)=425. Пример 17. Общий способ синтеза в фазе раствора оксимных и гидразоновых производных пирролидина общей формулы I (схема 6). (2S,4EZ)-1-([1,1'-Бифенил]-4-илкарбонил)-4-(гидроксиимино)-N[(2RS)-2-гидрокси-2-фенетил]-2-пирролидинкарбоксамид. а) Методика гидролиза оксимэфирной группы. Исходные оксимэфирные соединения, например, (2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N[(2RS)-2-гидрокси-2-фенетил]-4-(метоксиимино)-2-пирролидинкарбоксамид получают общими способами, описанными, например, в примерах 2, 11 или 22. Получают раствор оксимэфирного соединения, например, (2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N-[(2RS)-2-гидрокси-2-фенетил]-4-(метоксиимино)-2 пирролидинкарбоксамида (64 мг, 0,14 ммоль), порошкообразного параформальдегида (95%, 42 мг, 1,41 ммоль) и продукта Amberlyst 15 (30 мг) в ацетоне, содержащем 10% воды (2 мл). Реакционную смесь перемешивают в течение 4 ч при 60 С. Нерастворимые вещества отфильтровывают и промывают не- 25006424 большим количеством ацетона. Фильтрат концентрируют и остаток разводят DCM (15 мл). Органический раствор промывают насыщенным раствором соли (10 мл), сушат над Na2SO4 и концентрируют. Требуемый кетокарбонильный продукт, например, (2S)-1-([1,1'-бифенил]-4-илкарбонил)-N-[(2RS)2-гидрокси-2-фенилэтил]-4-оксо-2-пирролидинкарбоксамид (56 мг, 92%) выделяют в виде желтого масла и используют без дальнейшей очистки.b) Методика получения оксимных и/или гидразоновых соединений. Получают раствор производного кетопирролидина с предыдущей стадии, например, (2S)-1-([1,1'бифенил]-4-илкарбонил)-N-[(2RS)-2-гидрокси-2-фенетил]-4-оксо-2-пирролидинкарбоксамида (46 мг, 0,11 ммоль) и гидрохлорида гидроксиламина (12 мг, 0,17 ммоль) в хлороформе (1 мл), содержащем триэтиламин (29 мг, 0,2 9 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение одного дня и удаляют растворитель. Полученную сырую реакционную смесь очищают хроматографией на колонке, используя DCM/MeOH (25:1), и получают требуемый продукт, например, (2S,4EZ)-1-([1,1'бифенил]-4-илкарбонил)-4-(гидроксиимино)-N-[(2RS)-2-гидрокси-2-фенетил]-2-пирролидинкарбоксамид в виде смеси двух изомеров, представляющей не совсем белое твердое вещество (46 мг, выход 96%). 1 Н ЯМР (300 МГц, CDCl3): 2,6-3,3 (м, 4 Н), 4,0-4,7 (м, 4 Н), 4,9 (м, 1 Н), 5,5 (м, 1 Н), 7,1-7,5 (м, 8 Н),7,6-7,8 (м, 5 Н), 8,1 (м, 1 Н), 10,9 (м, 1 Н). М+(АРСI+): 444. Пример 18. (2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(диметилгидразоно)-N-[(2RS)-2-гидрокси-2 фенилэтил]-2-пирролидинкарбоксамид. Общим способом по примеру 17, используя в качестве исходных веществ (2S)-1-([1,1'-бифенил]-4 илкарбонил)-N-[(2RS)-2-гидрокси-2-фенилэтил]-4-оксо-2-пирролидинкарбоксамид и N,N-диметилгидразин, получают сырую реакционную смесь, которую очищают хроматографией на колонке, используяDCM/MeOH (30:1), и выделяют требуемый продукт, например (2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)4-(диметилгидразоно)-N-[(2RS)-2-гидрокси-2-фенилэтил]-2-пирролидинкарбоксамид в виде смеси двух изомеров, представляющей светло-желтое масло, с выходом 56% (чистота 90,2% по результатам ВЭЖХ). 1 Н ЯМР (300 МГц, CDCl3): 2,35-2,55 (шир.с, 3 Н), 2,40-2,60 (м, 1 Н), 2,75-3,55 (м, 5 Н), 3,55-3,82 (м,1 Н), 3,90-4,4 (м, 2 Н), 4,83 (м, 1 Н), 4,93-5,35 (м, 1 Н), 7,18-7,49 (м, 9 Н), 7,49-7,68 (м, 5 Н). М+(АРСI+): 469. Пример 19. (2S,4EZ)-1-([1,1'-Бифенил]-4-илкарбонил)-N-[(2RS)-2-гидрокси-2-фенилэтил]-4-(метилгидразоно)-2-пирролидинкарбоксамид. Общим способом по примеру 17, используя в качестве исходных веществ (2S)-1-([1,1'-бифенил]-4 илкарбонил)-N-[(2RS)-2-гидрокси-2-фенилэтил]-4-оксо-2-пирролидинкарбоксамид и N-метилгидразин,получают сырую реакционную смесь, которую очищают хроматографией на колонке, используяDCM/MeOH (30:1), и выделяют требуемый продукт, например (2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)N-[(2RS)-2-гидрокси-2-фенилэтил]-4-(метилгидразоно)-2-пирролидинкарбоксамид в виде смеси двух изомеров, представляющей бесцветное твердое вещество, с выходом 57% (чистота 95,2% по результатам ВЭЖХ). 1 Н ЯМР (300 МГц, CDCl3): 2,45-2,70 (м, 1 Н), 2,85 (шир.с, 3 Н, NNHCH3), 2,85-3,5 (м, 2 Н), 3,51-4,4 (м,4 Н), 4,84 (шир.с, 1 Н, NNHMe), 4,95-5,35 (м, 1 Н), 7,18-7,67 (м, 14 Н). М+(АРСI+): 457; М-(АРСI-): 455. Пример 20. (2S,4EZ)-1-([1,1'-Бифенил]-4-илкарбонил)-4-гидразоно-N-[(2RS)-2-гидрокси-2-фенилэтил]-2-пирролидинкарбоксамид. Общим способом по примеру 17, используя в качестве исходных веществ (2S)-1-([1,1'-бифенил]-4 илкарбонил)-N-[(2RS)-2-гидрокси-2-фенилэтил]-4-оксо-2-пирролидинкарбоксамид и гидразингидрат (4% в EtOH), получают сырую реакционную смесь, которую очищают хроматографией на колонке, используяDCM/MeOH (30:1), и выделяют требуемый продукт, например (2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)4-гидразоно-N-[(2RS)-2-гидрокси-2-фенилэтил]-2-пирролидинкарбоксамид в виде смеси двух изомеров,представляющей бесцветное твердое вещество, с выходом 63% (чистота 95,3% по результатам ВЭЖХ). 1 Н ЯМР (300 МГц, ДМСО-d6, 80 С): 2,55 (дд, J=9,8; 17,6 Гц, 1 Н), 2,73 (дд, J=9,8; 18,2 Гц, 1H), 3,28(м, 2H), 4,12 (м, 2 Н), 4,61 (м, 1 Н), 4,85 (м, 1 Н), 5,15 (м, 1 Н), 5,70 (шир.с, 2 Н, NH2N=C), 7,17-7,43 (м, 6 Н),7,44-7,60 (м, 4 Н), 7,66-7,77 (м, 5 Н). М+(АРСI+): 443; М-(АРСI-): 441. Пример 21. (2S, 4EZ)-4-(Ацетилгидразоно)-1-([1,1'-бифенил]-4-илкарбонил)-N-[(2RS)-2-гидрокси-2 фенилэтил]-2-пирролидинкарбоксамид. Производное гидразонопирролидина, полученное общим способом по примеру 17, например,(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-гидразоно-N-[(2RS)-2-гидрокси-2-фенилэтил]-2-пирролидинкарбоксамид (51 мг, 0,11 ммоль), растворяют в пиридине (1 мл). Добавляют уксусный ангидрид (3 экв.,32 мкл, 0,35 ммоль) и смесь перемешивают в течение ночи. Растворитель выпаривают, полученную сырую реакционную смесь очищают хроматографией на колонке, используя DCM/MeOH (20:1), и выделяют требуемый продукт, например, (2S,4EZ)-4-(ацетилгидразоно)-1-([1,1'-бифенил]-4-илкарбонил)-N[(2RS)-2-гидрокси-2-фенилэтил]-2-пирролидинкарбоксамид в виде смеси двух изомеров, представляющей бесцветное твердое вещество, с выходом 73% (чистота 98,4% по результатам ВЭЖХ). 1 Н ЯМР (300 МГц, ДМСО-d6, 80 С): 1,99 (шир.с, 3 Н, CH3CON), 2,7-3,4 (м, 5 Н), 4,26 (м, 2 Н), 4,63 (м,1 Н), 4,89 (м, 1 Н), 5,15 (м, 1 Н), 7,18-7,44 (м, 6 Н), 7,45-7,62 (м, 4 Н), 7,66-7,85 (м, 5 Н), 9,97 (шир.с, 1 Н, MeCONHN, первичный изомер), 10,04 (шир.с, 1 Н, MeCONHN, вторичный изомер). M+(ESI+): 485; M-(ESI-): 483.- 26006424 Пример 22. Общий способ синтеза в твердой фазе производных пирролидина общей формулы I. а) Стадия наполнения. Смолу оксима Кайзера (16,5 г, степень наполнения 1,57 ммоль/г) добавляют к раствору соответствующей пирролидинкарбоновой кислоты, являющейся элементом структуры (51,8 ммоль), и диизопропилкарбодиимида (8,1 мл, 51,8 ммоль) в сухом дихлорметане (150 мл). Полученную суспензию встряхивают в течение ночи, фильтруют перекачкой, последовательно промывают ДМФ, DCM и диэтиловым эфиром и сушат в вакууме при комнатной температуре.b) Стадия удаления N-защитной группы. Смолу, полученную на стадии наполнения, встряхивают с 20% раствором трифторуксусной кислоты в дихлорметане (200 мл) в течение 30 мин, фильтруют перекачкой, последовательно промывают аликвотами ДМФ, DCM и диэтиловым эфиром и сушат в вакууме при комнатной температуре.c) Стадия N-кэппирования. Смолу с предыдущей стадии переносят на 96-луночный фильтровальный планшет (примерно 50 мг сухой смолы/лунку) и каждую лунку обрабатывают N-реакционноспособным агентом, способствующим образованию производного, например, любым из нижеследующих растворов.b) кислота (0,165 ммоль) и DIC (0,165 ммоль) в сухом дихлорметане или NMP (1 мл) в зависимости от растворимости карбоновой кислоты, в течение ночи;d) дикетен (0,165 ммоль) в ТГФ, в течение ночи. Затем планшет заклеивают и встряхивают в течение ночи при комнатной температуре. Смолы фильтруют, последовательно промывают аликвотами ДМФ, DCM и диэтиловым эфиром и сушат в вакууме при комнатной температуре.d) Стадия расщепления. Во все лунки, содержащие смолу с предыдущей стадии, добавляют раствор амина (0,05 ммоль) в 2% растворе АсОН в дихлорметане (1 мл). Планшет заклеивают и встряхивают в течение двух дней при комнатной температуре. Содержимое лунок фильтруют в сборный планшет и растворитель удаляют в вакуумной центрифуге, получая 2-3 мг соответствующих продуктов обычно в виде масла. Полученные продукты исследуют ЖХ (205 нм) и масс-спектрометрией (ES+). Все нижеследующие соединения идентифицированы благодаря наличию правильного молекулярного иона в масс-спектре и, как показывают результаты ЖХ, характеризуются по крайней мере 40% чистотой (обычно чистота достигает 60-95%). Пример 23. (2S,4EZ)-N2-(2-Гидроксиэтил)-4-(метоксиимино)-N1-пентил-1,2-пирролидиндикарбоксамид. Общим способом по примеру 22, используя в качестве исходных веществ (2S,4EZ)-1-(трет-бутоксикарбонил)-4-(метоксиимино)-2-пирролидинкарбоновую кислоту, 1-изоцианатопентан и 2-аминоэтанол,получают указанное в заголовке соединение с чистотой 100% по результатам ЖХ/МС. МС (ESI+):(m/z)=315,2. Пример 24. (2S, 4EZ)-4-Бензилиден-1-([1,1'-бифенил]-4-илкарбонил)-N-[2-(диэтиламино)этил]-2 пирролидинкарбоксамид. Общим способом по примеру 22, используя в качестве исходных веществ (2S,4EZ)-4-бензилиден-1(трет-бутоксикарбонил)-2-пирролидинкарбоновую кислоту, [1,1'-бифенил]-4-карбонилхлорид и N1,N1 диэтил-1,2-этандиамин, получают указанное в заголовке соединение с чистотой 90% по результатам ЖХ/МС. МС (ESI+): (m/z)=482,4. Пример 25. (2S,4EZ)-4-[(Аллилокси)имино]-1-(4-цианобензоил)-N-[2-(1 Н-пиррол-1-ил)фенил]-2 пирролидинкарбоксамид. Общим способом по примеру 22, используя в качестве исходных веществ (2S,4EZ)-4-[(аллилокси) имино]-1-(трет-бутоксикарбонил)-2-пирролидинкарбоновую кислоту, 4-цианобензоилхлорид и 2-(1 Нпиррол-1-ил)фениламид, получают указанное в заголовке соединение с чистотой 51% по результатам ЖХ/МС. МС (ESI+): (m/z)=454,4. Пример 26. (2S,4EZ)-4-[(3,4-Дихлорбензил)окси]имино-N-(2-фурилметил)-1-[(2-оксо-6-пентил 2 Н-пиран-3-ил)карбонил]-2-пирролидинкарбоксамид. Общим способом по примеру 22, используя в качестве исходных веществ (2S,4EZ)-1-(третбутоксикарбонил)-4-[(3,4-дихлорбензил)окси]имино-2-пирролидинкарбоновую кислоту, 2-оксо-6 пентил-2 Н-пиран-3-карбонилхлорид и 2-фурилметиламин, получают указанное в заголовке соединение с чистотой 92% по результатам ЖХ/МС. МС (ESI+): (m/z)=574,4. Пример 27. (2S,4EZ)-4-(Метоксиимино)-N1-(3-метоксифенил)-N2-(2-тиенилметил)-1,2-пирролидин- 27006424 дикарбоксамид. Общим способом по примеру 22, используя в качестве исходных веществ (2S,4EZ)-1-(третбутоксикарбонил)-4-(метоксиимино)-2-пирролидинкарбоновую кислоту, 1-изоцианато-3-метоксибензол и 2-тиенилметиламин, получают указанное в заголовке соединение с чистотой 79% по результатам ЖХ/МС. МС (ESI+): (m/z)=403,2. Пример 28. (2S,4EZ)-2-[4-(1,3-Бензодиоксол-5-илметил)-1-пиперазинил]карбонил-4-(метоксиимино)-N-пентил-1-пирролидинкарбоксамид. Общим способом по примеру 22, используя в качестве исходных веществ (2S,4EZ)-1-(третбутоксикарбонил)-4-(метоксиимино)-2-пирролидинкарбоновую кислоту, 1-изоцианатопентан и 1-(1,3 бензодиоксол-5-илметил)пиперазин, получают указанное в заголовке соединение с чистотой 72% по результатам ЖХ/МС. МС (ESI+): (m/z)=474,4. Пример 29. (2S,4EZ)-4-[(Бензилокси)имино]-1-(4-цианобензоил)-N-(2-фурилметил)-2-пирролидинкарбоксамид. Общим способом по примеру 22, используя в качестве исходных веществ (2S, 4EZ)-4-[(бензилокси) имино]-1-(трет-бутоксикарбонил)-2-пирролидинкарбоновую кислоту, 4-цианобензоилхлорид и 2-фурилметиламин, получают указанное в заголовке соединение с чистотой 49% по результатам ЖХ/МС. МС(ESI+) : (m/z)=443,4. Пример 30. (2S,4EZ)-4-[(Бензилокси)имино]-N-[2-(диэтиламино)этил]-1-(4-феноксибензоил)-2 пирролидинкарбоксамид. Общим способом по примеру 22, используя в качестве исходных веществ (2S,4EZ)-4-[(бензилокси) имино]-1-(трет-бутоксикарбонил)-2-пирролидинкарбоновую кислоту, 4-феноксибензоилхлорид и N1,N1 диэтил-1,2-этандиамин, получают указанное в заголовке соединение с чистотой 86% по результатам ЖХ/МС. МС (ESI+): (m/z)=529,6. Пример 31. 4-[2S,4EZ)-4-[(Бензилокси)имино]-2-[4-(3,4-дихлорфенил)-1-пиперазинил]карбонил пирролидинил)карбонил]бензонитрил. Общим способом по примеру 22, используя в качестве исходных веществ (2S,4EZ)-4-[(бензилокси) имино]-1-(трет-бутоксикарбонил)-2-пирролидинкарбоновую кислоту, 4-цианобензоилхлорид и 1-(3,4 дихлорфенил)пиперазин, получают указанное в заголовке соединение с чистотой 43% по результатам ЖХ/МС. МС (ESI+): (m/z)=576,6. Пример 32. (2S, 4EZ)-4(метоксиимино)-N1-пентил-N2-[2-(1 Н-пиррол-1-ил)фенил]-1,2-пирролидиндикарбоксамид. Общим способом по примеру 22, используя в качестве исходных веществ (2S,4EZ)-1-третбутоксикарбонил)-4-(метоксиимино)-2-пирролидинкарбоновую кислоту, 1-изоцианатопентан и 2-(1 Нпиррол-1-ил)фениламин, получают указанное в заголовке соединение с чистотой 74% по результатам ЖХ/МС. МС (ESI+): (m/z)=412,2. Пример 33. (2S,4EZ)-1-Акрилоил-4-[(3,4-дихлорбензил)окси]имино-N-(2-фурилметил)-2-пирролидинкарбоксамид. Общим способом по примеру 22, используя в качестве исходных веществ (2S, 4EZ)-1-(третбутоксикарбонил)-4-[(3,4-дихлорбензил)окси]имино-2-пирролидинкарбоновую кислоту, акрилоилхлорид и 2-фурилметиламин, получают указанное в заголовке соединение с чистотой 74% по результатам ЖХ/МС. МС (ESI+): (m/z)=436,8. Пример 34. (2S,4EZ)-4-(трет-Бутоксиимино)-N2-циклопропил-N1-(3,5-дихлорфенил)-1,2-пирролидиндикарбоксамид. Общим способом по примеру 22, используя в качестве исходных веществ (2S,4EZ)-1-(третбутоксикарбонил)-4-(трет-бутоксиимино)-2-пирролидинкарбоновую кислоты, 1,3-дихлор-5-изоцианатобензол и циклопропиламин, получают указанное в заголовке соединение с чистотой 48% по результатам ЖХ/МС. МС (ESI+): (m/z)=427,6. Пример 35.(2S,4EZ)-4-[(Аллилокси)имино]-N-[2-(диэтиламино)этил]-1-[(2-оксо-6-пентил-2 Нпиран-3-ил)карбонил]-2-пирролидинкарбоксамид. Общим способом по примеру 22, используя в качестве исходных веществ (2S,4EZ)-4[(аллилокси) имино]-1-(трет-бутоксикарбонил)-2-пирролидинкарбоновую кислоту,2-оксо-6-пентил-2 Н-пиран-3 карбонилхлорид и N1,N1-диэтил-1,2-этандиамин, получают указанное в заголовке соединение с чистотой 93% по результатам ЖХ/МС. МС (ESI+): (m/z)=475,4. Пример 36. (2S,4EZ)-N2-[(2RS)-2-Гидрокси-2-фенетил]-4-(метоксиимино)-N1-(3-метилфенил)-1,2 пирролидиндикарбоксамид. Общим способом по примеру 22, используя в качестве исходных веществ (2S,4EZ)-1-(третбутоксикарбонил)-4-(метоксиимино)-2-пирролидинкарбоновую кислоту, 1-изоцианато-3-метилбензол и(1RS)-2-амино-1-фенилэтанол, получают указанное в заголовке соединение с чистотой 100% по результатам ЖХ/МС. МС (ESI+): (m/z)=411,2. Пример 37. (2S,4EZ)-1-[(бензоиламино)карбонил]-N-бензил-4-[(бензилокси)имино]-N-метил-2-пирролидинкарбоксамид. Общим способом по примеру 22, используя в качестве исходных веществ (2S,4EZ)-4- 28006424N-бензил-N-метиламин, получают указанное в заголовке соединение с чистотой 40% по результатам ЖХ/МС. МС (ESI+): (m/z)=485,4. Пример 38. (2S,4EZ)-1-(4-цианобензоил)-N-(9-этил-9 Н-карбазол-3-ил)-4-(метоксиимино)-2-пирролидинкарбоксамид. Общим способом по примеру 22, используя в качестве исходных веществ (2S, 4EZ)-1-(третбутоксикарбонил)-4-(метоксиимино)-2-пирролидинкарбоновую кислоту, 4-цианобензоилхлорид и 9 этил-9 Н-карбазол-3-амин, получают указанное в заголовке соединение с чистотой 72% по результатам ЖХ/МС. МС (ESI+): (m/z)=480,4. Пример 39. (2S,4EZ)-4-(метоксиимино)-N1-(3-метилфенил)-N2-(2-тиенилметил)-1,2-пирролидиндикарбоксамид. Общим способом по примеру 22, используя в качестве исходных веществ (2S,4EZ)-1-(третбутоксикарбонил)-4-(метоксиимино)-2-пирролидинкарбоновую кислоту, 1-изоцианато-3-метилбензол и 2-тиенилметиламин, получают указанное в заголовке соединение с чистотой 98% по результатам ЖХ/МС. МС (ESI+): (m/z)=387,2. Пример 40. (2S,4EZ)-4-(трет-Бутоксиимино)-N-(2-метоксиэтил)-1-[(2-оксо-6-пентил-2 Н-пиран-3-ил) карбонил]-2-пирролидинкарбоксамид. Общим способом по примеру 22, используя в качестве исходных веществ (2S,4EZ)-1-(третбутоксикарбонил)-4-(трет-бутоксиимино)-2-пирролидинкарбоновую кислоту, 2-оксо-6-пентил-2 Н-пиран 3-карбонилхлорид и 2-метоксиэтиламин, получают указанное в заголовке соединение с чистотой 75% по результатам ЖХ/МС. МС (ESI+): (m/z)=450,2. Пример 41. О-(3,4-дихлорбензил)оксим (3EZ,5S)-5-[4-(1,3-бензодиоксол-5-илметил)-1-пиперазинил]карбонил-1-бензоил-3-пирролидинона. Общим способом по примеру 22, используя в качестве исходных веществ (2S,4EZ)-1-(третбутоксикарбонил)-4-[(3,4-дихлорбензил)окси]имино-2-пирролидинкарбоновую кислоту, бензоилхлорид и 1-(1,3-бензодиоксол-5-илметил)пиперазин, получают указанное в заголовке соединение с чистотой 71% по результатам ЖХ/МС. МС (ESI+): (m/z)=609,8. Пример 42. трет-Бутил-3-[2S,4EZ)-4-(этоксиимино)-1-[(2-оксо-6-пентил-2 Н-пиран-3-ил)карбонил]пирролидинилкарбонил)амино]-1-азетидинкарбоксилат. Общим способом по примеру 22, используя в качестве исходных веществ (2S,4EZ)-1-(третбутоксикарбонил)-4-(этоксиимино)-2-пирролидинкарбоновую кислоту, 2-оксо-6-пентил-2 Н-пиран-3 карбонилхлорид и трет-бутил-3-амино-1-азетидинкарбоксилат, получают указанное в заголовке соединение с чистотой 100% по результатам ЖХ/МС. МС (ESI + ): (m/z)=519,6. Пример 43. (2S,4EZ)-4-[(4-Метоксибензил)окси]имино-N-(3-метилфенил)-2-(4-морфолинилкарбонил)-1-пирролидинкарбоксамид. Общим способом по примеру 22, используя в качестве исходных веществ (2S,4EZ)-1-(третбутоксикарбонил)-4-[(4-метоксибензил)окси]имино-2-пирролидинкарбоновую кислоту, 1-изоцианато 3-метилбензол и морфолин, получают указанное в заголовке соединение с чистотой 41% по результатам ЖХ/МС. МС (ESI+): (m/z)=467,4. Пример 44. (2S,4EZ)-N2-циклопропил-4-[(4-метоксибензил)окси]имино-N1-пентил-1,2-пирролидиндикарбоксамид. Общим способом по примеру 22, используя в качестве исходных веществ (2S,4EZ)-1-(третбутоксикарбонил)-4-[(4-метоксибензил)окси]имино-2-пирролидинкарбоновую кислоту, 1-изоцианатопентан и циклопропиламин, получают указанное в заголовке соединение с чистотой 75% по результатам ЖХ/МС. МС (ESI+): (m/z)=417,2. Пример 45. О-Бензилоксим (3EZ,5S)-5-[4-(3,4-дихлорфенил)-1-пиперазинил]карбонил-1-[(2-оксо 6-пентил-2 Н-пиран-3-ил)карбонил]-3-пирролидинона. Общим способом по примеру 22, используя в качестве исходных веществ (2S, 4EZ)-4-[(бензилокси) имино]-1-(трет-бутоксикарбонил)-2-пирролидинкарбоновую кислоту,2-оксо-6-пентил-2 Н-пиран-3 карбонилхлорид и 1-(3,4-дихлорфенил) пиперазин, получают указанное в заголовке соединение с чистотой 47% по результатам ЖХ/МС. МС (ESI+): (m/z)=639,8. Пример 46. (2S,4EZ)-4-(трет-Бутоксиимино)-N-[2-(1 Н-пиррол-1-ил)фенил]-2-пирролидинкарбоксамид. Общим способом по примеру 22, используя в качестве исходных веществ (2S,4EZ)-1-(трет-бутоксикарбонил)-4-(трет-бутоксиимино)-2-пирролидинкарбоновую кислоту и 2-(1 Н-пиррол-1-ил)фениламин,получают указанное в заголовке соединение с чистотой 83% по результатам ЖХ/МС. МС (ESI+):(m/z)=341,2. Пример 47. 1-2S,4EZ)-4-(Хлорметилен)-1-[(4-хлорфенокси)ацетил]пирролидинилкарбонил)-4(3,4-дихлорфенил)пиперазин. Общим способом по примеру 22, используя в качестве исходных веществ (2S,4EZ)-1-(третбутоксикарбонил)-4-(хлорметилен)-2-пирролидинкарбоновую кислоту, (4-хлорфенокси) ацетилхлорид и 1-(3,4-дихлорфенил)пиперазин, получают указанное в заголовке соединение с чистотой 64% по результа- 29006424 там ЖХ/МС. МС (ESI+): (m/z)=543,6. Пример 48.(2S,4EZ)-4-[(Бензилокси)имино]-N-(4,6-диметокси-2-пиримидинил)-1-[(2-оксо-6 пентил-2 Н-пиран-3-ил)карбонил]-2-пирролидинкарбоксамид. Общим способом по примеру 22, используя в качестве исходных веществ (2S,4EZ)-4[(бензилокси)имино]-1-(трет-бутоксикарбонил)-2-пирролидинкарбоновую кислоту, 2-оксо-6-пентил-2 Нпиран-3-карбонилхлорид и 4,6-диметокси-2-пиримидинамин, получают указанное в заголовке соединение с чистотой 62% по результатам ЖХ/МС. МС (ESI+): (m/z)=564,6. Пример 49. (2S,4EZ)-4-[(3,4-дихлорбензил)окси]имино-1-[4-(диметиламино)бутаноил]-N-(1-нафтилметил)-2-пирролидинкарбоксамид. Общим способом по примеру 22, используя в качестве исходных веществ (2S,4EZ)-1-(третбутоксикарбонил)-4-[(3,4-дихлорбензил)окси]имино-2-пирролидинкарбоновую кислоту, 4-(диметиламино)бутаноилхлорид и 1-нафтилметиламин, получают указанное в заголовке соединение с чистотой 62% по результатам ЖХ/МС. МС (ESI+): (m/z)=555,6. Пример 50. (2S)-N2-(2,1,3-Бензотиадиазол-4-ил)-N1-(3,5-дихлорфенил)-4-оксо-1,2-пирролидиндикарбоксамид. Общим способом по примеру 22, используя в качестве исходных веществ 1-(трет-бутоксикарбонил)-4-оксопролин, 1,3-дихлор-5-изоцианатобензол и 2,1,3-бензотиадиазол-4-амин, получают указанное в заголовке соединение с чистотой 47% по результатам ЖХ/МС. МС (ESI+): (m/z)=450,6. Пример 51. (2S,4EZ)-N-Бензил-4-(хлорметилен)-N-метил-1-(4-феноксибензоил)-2-пирролидинкарбоксамид. Общим способом по примеру 22, используя в качестве исходных веществ (2S,4EZ)-1-(трет-бутоксикарбонил)-4-(хлорметилен)-2-пирролидинкарбоновую кислоту, 4-феноксибензоилхлорид и N-бензил-Nметиламин, получают указанное в заголовке соединение с чистотой 61% по результатам ЖХ/МС. МС(ESI+): (m/z)=461,4. Пример 52. (2S,4EZ)-N2-(9-этил-9 Н-карбазол-3-ил)-4-[(4-метоксибензил)окси]имино-N1-(3-метилфенил)-1,2-пирролидиндикарбоксамид. Общим способом по примеру 22, используя в качестве исходных веществ (2S,4EZ)-1-(третбутоксикарбонил)-4-[(4-метоксибензил)окси]имино-2-пирролидинкарбоновую кислоту, 1-изоцианато 3-метилбензол и 9-этил-9 Н-карбазол-3-амин, получают указанное в заголовке соединение с чистотой 72% по результатам ЖХ/МС. МС (ESI+): (m/z)=590,8. Пример 53. (2S)-N-(трет-Бутил)-4-метилен-1-[(2-оксо-6-пентил-2 Н-пиран-3-ил)карбонил]-2-пирролидинкарбоксамид. Общим способом по примеру 22, используя в качестве исходных веществ 1-(третбутоксикарбонил)-4-метиленпролин, 2-оксо-6-пентил-2 Н-пиран-3-карбонилхлорид и трет-бутиламин,получают указанное в заголовке соединение с чистотой 100% по результатам ЖХ/МС. МС (ESI+):(m/z)=375,4. Пример 54. (2S,4EZ)-4-Бензилиден-1-[4-(диметиламино)бутаноил]-N-(6-хинолинил)-2-пирролидинкарбоксамид. Общим способом по примеру 22, используя в качестве исходных веществ (2S,4EZ)-4-бензилиден-1(трет-бутоксикарбонил)-2-пирролидинкарбоновую кислоту, 4-(диметиламино)бутаноилхлорид и 6 хинолинамин, получают указанное в заголовке соединение с чистотой 71% по результатам ЖХ/МС. МС(ESI+): (m/z)=443,6. Пример 55. (2S)-1-[4-(Диметиламино)бутаноил]-N-(9-этил-9 Н-карбазол-3-ил)-4-метилен-2-пирролидинкарбоксамид. Общим способом по примеру 22, используя в качестве исходных веществ 1-(трет-бутоксикарбонил)-4-метиленпролин, 4-(диметиламино)бутаноилхлорид и 9-этил-9 Н-карбазол-3-амин, получают указанное в заголовке соединение с чистотой 51% по результатам ЖХ/МС. МС (ESI+): (m/z)=433,6. Пример 56. (2S,4EZ)-N-(1,3-Бензодиоксол-5-илметил)-4-[(бензилокси)имино]-1-(4-цианобензоил)-2 пирролидинкарбоксамид. Общим способом по примеру 22, используя в качестве исходных веществ (2S,4EZ)-4-[(бензилокси) имино]-1-(трет-бутоксикарбонил)-2-пирролидинкарбоновую кислоту, 4-цианобензоилхлорид и 1,3 бензодиоксол-5-илметиламин, получают указанное в заголовке соединение с чистотой 51% по результатам ЖХ/МС. МС (ESI+): (m/z)=497,6. Пример 57. (2S)-1-(1-[4-Диметиламино)бутаноил]-4-метилен-2-пирролидинилкарбонил)-3-азетидинол. Общим способом по примеру 22, используя в качестве исходных веществ 1-(третбутоксикарбонил)-4-метиленпролин, 4-(диметиламино)бутаноилхлорид и 3-азетидинол, получают указанное в заголовке соединение с чистотой 100% по результатам ЖХ/МС. МС (ESI+): (m/z) = 296,4. Пример 58. (2S,4EZ)-1-([1,1'-Бифенил]-4-илкарбонил)-4-[3,4-дихлорбензил)окси]имино-N-[2-(1 Нпиррол-1-ил)фенил]-2-пирролидинкарбоксамид. Общим способом по примеру 22, используя в качестве исходных веществ (2S,4EZ)-1-(третбутоксикарбонил)-4-[(3,4-дихлорбензил)окси]имино-2-пирролидинкарбоновую кислоту, [1,1'-бифе- 30
МПК / Метки
МПК: A61K 31/4025, C07D 207/22, A61P 25/00
Метки: активные, пирролидина, производные, фармацевтически
Код ссылки
<a href="https://eas.patents.su/30-6424-farmacevticheski-aktivnye-proizvodnye-pirrolidina.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтически активные производные пирролидина</a>












