Мутанты fgf21 и их применение
Номер патента: 17690
Опубликовано: 28.02.2013
Авторы: Гамбургер Агнес Ева, Белуски Эдвард Джон, Хехт Рэнди Айра, Эллисон Мюриэль Мэри, Сан Джеонгун, Ксу Джинг, Михаелс Марк Лео, Ли Ю-Шенг
Формула / Реферат
1. Изолированный полипептид, содержащий аминокислотную последовательность SEQ ID NO: 4, где полипептид включает а) остаток аргинина в положении 98 последовательности SEQ ID NO: 4 и b) остаток глицина в положении 171 последовательности SEQ ID NO: 4.
2. Изолированный полипептид по п.1, дополнительно включающий мутацию в положении 180.
3. Составной полипептид, включающий полипептид по п.1, присоединенный к гетерологичному полипептиду.
4. Составной полипептид по п.3, в котором гетерологичный полипептид представляет собой Fc полипептид.
5. Составной полипептид по п.4, в котором Fc полипептид содержит аминокислотную последовательность SEQ ID NO: 13.
6. Составной полипептид по п.5, в котором полипептид присоединен к Fc полипептиду через линкер.
7. Составной полипептид по п.6, в котором линкер представляет собой GGGGGSGGGSGGGGS (SEQ ID NO: 23).
8. Составной полипептид по п.7, включающий аминокислотную последовательность SEQ ID NO: 38.
9. Составной полипептид по п.6, в котором линкер представляет собой GGGGSGGGGSGGGGS (SEQ ID NO: 31).
10. Составной полипептид по п.9, включающий аминокислотную последовательность SEQ ID NO: 36.
11. Составной полипептид, кодируемый нуклеотидами 1-1272 последовательности SEQ ID NO: 37.
12. Мультимер, включающий две или более копий составного полипептида по п.8.
13. Фармацевтическая композиция, содержащая составной полипептид по п.8 и фармацевтически приемлемый агент для приготовления лекарственной формы.
14. Мультимер, включающий две или более копий составного полипептида по п.10.
15. Фармацевтическая композиция, содержащая составной полипептид по п.10 и фармацевтически приемлемый агент для приготовления лекарственной формы.

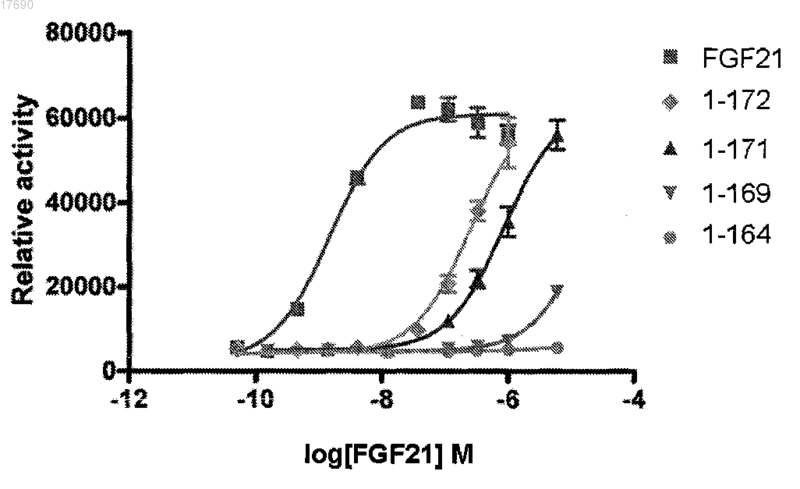
Текст
Изобретение предлагает молекулы нуклеиновых кислот, кодирующие мутантные полипептидыFGF21, мутантные полипептиды FGF21 как таковые, фармацевтические композиции, включающие мутантные полипептиды FGF21, и способы лечения метаболических заболеваний с применением таких нуклеиновых кислот, полипептидов или фармацевтических композиций. 017690 Область техники, к которой относится изобретение Настоящее изобретение относится к молекулам нуклеиновых кислот, кодирующим мутантные полипептиды FGF21, к мутантным полипептидам FGF21, к фармацевтическим композициям, содержащим мутантные полипептиды FGF21, и к способам лечения метаболических заболеваний с применением таких нуклеиновых кислот, полипептидов или фармацевтических композиций. Предпосылки создания изобретенияFGF21 представляет собой секретируемый полипептид, принадлежащий к подсемейству факторов роста фибробластов (FGF), которые включают FGF19, FGF21 и FGF23 (Itoh et al., 2004, Trend Genet. 20: 563-69). Полипептид FGF21 является атипичным FGF в том отношении, что он независим от гепарина и функционирует как гормон в регуляции глюкозы, липидов и энергетического метаболизма.FGF21 был выделен из библиотеки кДНК печени как секретируемый печеночный фактор. Он высоко экспрессируется в печени и поджелудочной железе, являясь единственным членом семейства FGF,экспрессируемым, главным образом, в печени. Трансгенные мыши с избыточной экспрессией FGF21 демонстрируют метаболические фенотипы замедленных темпов роста, низкого уровня глюкозы и триглицеридов в плазме, а также отсутствие связанного с возрастом сахарного диабета II типа, гиперплазии островковых клеток поджелудочной железы и ожирения. Фармакологическое введение рекомбинантного белка FGF21 в моделях грызунов и приматов приводит к нормализации уровня глюкозы в плазме, к снижению уровня триглицеридов и холестерина, а также к улучшению толерантности к глюкозе и чувствительности к инсулину. В дополнение к этому, FGF21 снижает вес тела и отложения телесного жира за счет увеличения потребления энергии, физической активности и скорости метаболизма. Экспериментальные исследования дают подтверждение фармакологическому введению FGF21 для лечения сахарного диабета II типа, ожирения, дислипидемии и других метаболических состояний или заболеваний у человека.FGF21 человека имеет короткий период полувыведения in vivo. У мышей период полувыведенияFGF21 человека составляет от 1 до 2 ч, а у обезьян cynomolgus период полувыведения составляет от 2,5 до 3 ч. При разработке белкового препарата FGF21 для применения в качестве лекарства при лечении сахарного диабета II типа было бы желательно увеличить период полувыведения. Белки FGF21, имеющие удлиненный период полувыведения, позволили бы реже вводить дозы лекарства больным, получающим такие препараты. Описание таких белков приводится в настоящем документе. Сущность изобретения Настоящее раскрытие сущности изобретения относится к выделенному полипептиду, содержащему аминокислотную последовательность SEQ ID NO: 4, кроме того включающему замещение любой аминокислоты на остаток аланина в положении 45, остаток лейцина в положении 86, остаток лейцина в положении 98, остаток аланина в положении 111, остаток аланина в положении 129, остаток глицина в положении 170, остаток пролина в положении 171, остаток серина в положении 172 или их комбинации. В одном из вариантов осуществления настоящего изобретения выделенный полипептид включает замещение любой аминокислоты на остаток лейцина в положении 98, остаток пролина в положении 171 или одновременно остаток лейцина в положении 98 и остаток пролина в положении 171. В другом варианте осуществления изобретения выделенный полипептид включает замещение любой аминокислоты как на остаток лейцина в положении 98, так и на остаток пролина в положении 171. Настоящее раскрытие изобретения также представляет выделенный полипептид, включающий аминокислотную последовательность SEQ ID NO: 4, имеющую: (а) как минимум одно аминокислотное замещение, которое представляет собой: (i) остаток глутамина, изолейцина или лизина в положении 19, (ii) остаток гистидина, лейцина или фениланина в положении 20, (iii) остаток изолейцина, фениланина, тирозина или валина в положении 21, (iv) остаток изолейцина, фенилаланина или валина в положении 22,(v) остаток аланина или аргинина в положении 150, (vi) остаток аланина или валина в положении 151,(vii) остаток гистидина, лейцина, фениланина или валина в положении 152, (viii) остаток аланина, аспарагина, аспарагиновой кислоты, цистеина, глутаминовой кислоты, глутамина, пролина или серина в положении 170, (ix) остаток аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутаминовой кислоты, глутамина, глицина, гистидина, лизина, серина, треонина, триптофана или тирозина в положении 171, (х) остаток лейцина или треонина в положении 172, (xi) остаток аргинина или глутаминовой кислоты в положении 173, или (b) как минимум одно аминокислотное замещение, которое представляет собой: (i) остаток аргинина, глутаминовой кислоты или лизина в положении 26, (ii) остаток аргинина, глутаминовой кислоты, глутамина, лизина или треонина в положении 45, (iii) остаток треонина в положении 52, (iv) остаток цистеина, глутаминовой кислоты, глицина или серина в положении 58, (v) остаток аланина, аргинина, глутаминовой кислоты или лизина в положении 60, (vi) остаток аланина, аргинина, цистеина или гистидина в положении 78, (vii) остаток цистеина или треонина в положении 86, (viii) остаток аланина, аргинина, глутаминовой кислоты, лизина или серина в положении 88, (ix) остаток аргинина, цистеина, глутаминовой кислоты, глутамина, лизина или треонина в положении 98, (х) остаток аргинина, аспарагиновой кислоты, цистеина или глутаминовой кислоты в положении 99, (xi) остаток лизина или треонина в положении 111, (xii) остаток аргинина, аспарагина, аспарагиновой кислоты, глутаминовой кислоты, глутамина, гистидина или лизина в положении 129 или (xiii) остаток аргинина, глута-1 017690 миновой кислоты, гистидина, лизина или тирозина в положении 134, а также их комбинации. В одном из вариантов осуществления изобретения аминокислотный остаток в положении 98 представлен аргинином,а аминокислотный остаток в положении 171 представлен пролином, а в другом варианте осуществления изобретения полипептид может включать аминокислотную последовательность, которая как минимум на 85% идентична аминокислотной последовательности SEQ ID NO: 4, но в которой как минимум одно аминокислотное замещение из (a)(i)-(xi) и (b)(i)-(xiii) далее не модифицируется. Настоящее раскрытие изобретения далее представляет выделенный полипептид, содержащий аминокислотную последовательность SEQ ID NO: 4, имеющую как минимум одно аминокислотное замещение, которое представляет собой: (а) остаток глутамина, лизина или изолейцина в положении 19, (b) остаток гистидина, лейцина или фенилаланина в положении 20, (с) остаток изолейцина, фенилаланина, тирозина или валина в положении 21, (d) остаток изолейцина, фенилаланина или валина в положении 22,(е) остатокаланина или аргинина в положении 150, (f) остаток аланина или валина в положении 151 (g) остаток гистидина, лейцина, фенилаланина или валина в положении 152, (h) остаток аланина, аспарагиновой кислоты или пролина в положении 170, (i) остаток аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутаминовой кислоты, глутамина, глицина, гистидина, лизина, серина, треонина,триптофана или тирозина в положении 171, (j) остаток лейцина в положении 172 или (k) остаток аргинина или глутаминовой кислоты в положении 173 либо их комбинации. В одном из вариантов осуществления изобретения аминокислотный остаток в положении 171 представлен пролином, а в другом варианте осуществления изобретения полипептид может включать аминокислотную последовательность, которая как минимум на 85% идентична аминокислотной последовательности SEQ ID NO: 4, но в которой как минимум одно аминокислотное замещение из (а)-(k) далее не модифицируется. Настоящее раскрытие изобретения дополнительно представляет выделенный полипептид, включающий аминокислотную последовательность SEQ ID NO: 4, имеющую как минимум одно аминокислотное замещение, которое представляет собой: (а) остаток аргинина, глутаминовой кислоты или лизина в положении 26, (b) остаток аргинина, глутаминовой кислоты, глутамина, лизина или треонина в положении 45, (с) остаток треонина в положении 52, (d) остаток глутаминовой кислоты, глицина или серина в положении 58, (е) остаток аланина, аргинина, глутаминовой кислоты или лизина в положении 60, (f) остаток аланина, аргинина или гистидина в положении 78, (g) остаток аланина в положении 88, (h) остаток аргинина, глутаминовой кислоты, глутамина, лизина или треонина в положении 98, (i) остаток аргинина,аспарагиновой кислоты, цистеина или глутаминовой кислоты в положении 99, (j) остаток лизина или треонина в положении 111, (k) остаток аргинина, аспарагина, аспарагиновой кислоты, глутаминовой кислоты, глутамина, гистидина или лизина в положении 129 или (l) остаток аргинина, глутаминовой кислоты, гистидина, лизина или тирозина в положении 134, а также их комбинации. В одном из вариантов осуществления изобретения аминокислотный остаток в положении 98 представлен аргинином, а в другом варианте осуществления изобретения полипептид может включать аминокислотную последовательность, которая как минимум на 85% идентична аминокислотной последовательности SEQ ID NO: 4, но в которой как минимум одно аминокислотное замещение из (а)-(l) далее не модифицируется. В различных вариантах осуществления изобретения полипептиды, раскрытые в данном документе,могут дополнительно включать как минимум одно аминокислотное замещение, которое представляет собой: (а) фенилаланин, пролин, аланин, серин или глицин в положении 179, (b) глутаминовую кислоту,глицин, пролин или серин в положении 180 или (с) лизин, глицин, треонин, аланин, лейцин или пролин в положении 181, а также могут дополнительно включать от 1 до 10 аминокислотных остатков слитых с Сконцом полипептида, которые могут быть представлены любой аминокислотой, например одним или более остатков, выбранных из группы, состоящей из глицина, пролина и их комбинаций. В различных вариантах осуществления изобретения полипептиды, раскрытые в данном документе,могут включать: (а) аминоконцевое усечение не более 8 аминокислотных остатков, при этом полипептид способен понижать уровень глюкозы в крови млекопитающего, (b) карбоксиконцевое усечение не более 12 аминокислотных остатков, при этом полипептид способен понижать уровень глюкозы в крови млекопитающего, или (с) аминоконцевое усечение не более 8 аминокислотных остатков и карбоксиконцевое усечение не более 12 аминокислотных остатков, при этом полипептид способен понижать уровень глюкозы в крови млекопитающего. В некоторых вариантах осуществления изобретения полипептиды, раскрытые в данном документе,могут быть ковалентно связаны с одним или более полимеров, таких как PEG. В других вариантах осуществления изобретения полипептиды по настоящему изобретению могут быть слиты с гетерологичной аминокислотной последовательностью, в необязательном порядке, через линкер, такой какGGGGGSGGGSGGGGS (SEQ ID NO: 23). Гетерологичная аминокислотная последовательность может представлять собой константный домен IgG или его фрагмент, такой как аминокислотная последовательность SEQ ID NO: 13. Такие гибридные полипептиды, раскрытые в данном документе, также могут образовывать мультимеры. Настоящее раскрытие изобретения также представляет фармацевтическую композицию, включающую полипептиды, раскрытые в данном документе, и фармацевтически приемлемый формообразующий агент. Такие фармацевтические композиции можно применять в способе лечения метаболического забо-2 017690 левания, а указанный способ включает введение больному человеку, нуждающемуся в лечении, фармацевтической композиции, соответствующей настоящему изобретению. Метаболические заболевания,которые можно лечить в соответствии с настоящим изобретением, включают сахарный диабет и ожирение. Также предлагаются выделенные молекулы нуклеиновых кислот, кодирующие полипептиды, раскрытые в данном документе, а также предлагаются векторы, включающие такие молекулы нуклеиновых кислот, и клетки-хозяева, включающие такие молекулы нуклеиновых кислот. Также раскрыты усеченные формы полипептида SEQ ID NO: 4. В различных вариантах осуществления изобретения полипептид может включать: (а) аминоконцевое усечение не более 8 аминокислотных остатков, при этом полипептид способен понижать уровень глюкозы в крови млекопитающего, (b) карбоксиконцевое усечение не более 12 аминокислотных остатков, при этом полипептид способен понижать уровень глюкозы в крови млекопитающего, или (с) аминоконцевое усечение не более 8 аминокислотных остатков и карбоксиконцевое усечение не более 12 аминокислотных остатков, при этом полипептид способен понижать уровень глюкозы в крови млекопитающего. Настоящее раскрытие изобретения дополнительно предлагает выделенный гибридный белок, который может включать: (а) константный домен IgG, (b) линкерную последовательность, слитую с константным доменом IgG, и (с) мутант FGF21, слитый с линкерной последовательностью и включающий аминокислотную последовательность SEQ ID NO: 4, в которой остаток аргинина был замещен остатком лейцина в положении 98, а остаток глицина был замещен остатком пролина в положении 171. В одном из вариантов осуществления изобретения линкерная последовательность может включатьGGGGGSGGGSGGGGS (SEQ ID NO: 23), а в другом варианте осуществления изобретения константный домен IgG может включать SEQ ID NO: 13. Еще в одном варианте осуществления изобретения линкерная последовательность включает GGGGGSGGGSGGGGS (SEQ ID NO: 23), а константный домен IgG включает аминокислотную последовательность SEQ ID NO: 13. Еще в одном варианте осуществления изобретения N-конец линкера слит с С-концом константного домена IgG, a N-конец мутанта FGF21 слит с Сконцом линкера. Раскрытый гибридный белок может образовывать мультимеры. В различных вариантах осуществления гибридного белка мутантный компонент FGF21 может включать как минимум одно аминокислотное замещение, которое представляет собой: (а) фенилаланин,пролин, аланин, серин или глицин в положении 179, (b) глутаминовую кислоту, глицин, пролин или серин в положении 180 или (с) лизин, глицин, треонин, аланин, лейцин или пролин в положении 181, а также может дополнительно включать от 1 до 10 аминокислотных остатков, слитых с С-концом мутантаFGF21, и от 1 до 10 аминокислотных остатков, которые могут быть представлены любой аминокислотой,например одним или более остатков, выбранных из группы, состоящей из глицина, пролина и их комбинаций. В других вариантах осуществления изобретения гибридного белка мутантный компонент FGF21 может включать: (а) аминоконцевое усечение не более 8 аминокислотных остатков, при этом полипептид способен понижать уровень глюкозы в крови млекопитающего, (b) карбоксиконцевое усечение не более 12 аминокислотных остатков, при этом полипептид способен понижать уровень глюкозы в крови млекопитающего, или (с) аминоконцевое усечение не более 8 аминокислотных остатков и карбоксиконцевое усечение не более 12 аминокислотных остатков, при этом полипептид способен понижать уровень глюкозы в крови млекопитающего. Еще в одном варианте осуществления мутантный компонент FGF21 гибридного белка может включать аминокислотную последовательность, которая как минимум на 85% идентична аминокислотной последовательности SEQ ID NO: 4, но в которой остатки аргинина и лизина далее не модифицируются. Настоящее раскрытие изобретения также представляет фармацевтическую композицию, включающую гибридный белок, раскрытый в данном документе, и фармацевтически приемлемый формообразующий агент. Такие фармацевтические композиции можно применять в способе лечения метаболического заболевания, а указанный способ включает введение больному человеку, нуждающемуся в лечении, фармацевтической композиции, соответствующей настоящему изобретению. Метаболические заболевания, которые можно лечить в соответствии с настоящим изобретением, включают сахарный диабет и ожирение. Также предлагаются выделенные молекулы нуклеиновых кислот, кодирующие гибридный белок,раскрытый в данном документе, а также предлагаются векторы, включающие такие молекулы нуклеиновых кислот, и клетки-хозяева, включающие такие молекулы нуклеиновых кислот. Специфические варианты осуществления настоящего изобретения будут очевидны из последующего более подробного описания некоторых вариантов осуществления изобретения и из формулы изобретения. Краткое описание чертежей На фиг. 1A, 1 В показаны результаты анализа активности ELK-люциферазы, проведенного на усеченных мутантах FGF21 7-181 и 8-181 (фиг. 1 А) и усеченных мутантах FGF21 1-172, 1-171, 1-169 и 1-164(фиг. 1 В); каждая панель показывает результаты, полученные на контрольных образцах FGF21 человека. На фиг. 2 показаны результаты анализа активности ELK-люциферазы, проведенного на контроль-3 017690 ных образцах FGF21 человека и на усеченных мутантах FGF21 3-181, 4-181, 5-181, 7-181, 8-181, 1-180, 1178, 1-177, 1-176, 1-175, 1-174, 1-173, 1-172, 9-181 и 1-149. На фиг. 3 показаны значения уровня глюкозы в крови, измеряемого у мышей, которым путем инъекции вводили PBS (закрашенный столбец), контрольный FGF21 человека (пустой столбец) или усеченные мутанты FGF21 8-181 (серый столбец) и 9-181 (столбец с шахматными клетками). На фиг. 4 показано процентное изменение уровня глюкозы в крови, измеряемого у мышей, которым путем инъекции вводили PBS (закрашенные кружки), контрольный Fc-FGF21 дикого типа (WT) (пустые кружки) или усеченные гибридные белки Fc-FGF21, включающие аминокислотные остатки 5-181 (закрашенные треугольники) или 7-181 (пустые треугольники). На фиг. 5 показано процентное изменение уровня глюкозы в крови, измеряемого у мышей, которым путем инъекции вводили PBS (закрашенные кружки), контрольный FGF21-Fc (WT) (пустые кружки),усеченный гибридный белок FGF21-Fc, включающий аминокислотные остатки 1-175 (закрашенные треугольники), или усеченный белок Fc-FGF21, включающий остатки 1-171 (пустые треугольники). На фиг. 6 А-6D показаны результаты анализа контрольного образца Fc(5)FGF21 человека (фиг. 6 А) и образцов Fc(5)FGF21, полученных от мышей через 6 ч (образец D6, фиг. 6 В), 24 ч (образец D24, фиг. 6C) и 48 ч (образец D48, фиг. 6D) после инъекции с применением комбинированного способа жидкостной хроматографии и масс-спектрометрии (LC-MS). На фиг. 7 А-7D показаны результаты анализа контрольного образца FGF21(3)Face человека (фиг. 7 А) и образцов FGF21(3)Face, полученных от мышей через 6 ч (образец D6, фиг. 7 В), 24 ч (образец D24,фиг. 7 С) и 48 ч (образец D48, фиг. 7D) после инъекции, способом LC-MS. На фиг. 8 А-8D показаны результаты анализа контрольного образца Face(15)FGF21 (фиг. 8 А) и образцов Face(15)FGF21, полученных от мышей через 6 ч (фиг. 8 В), 24 ч (фиг. 8 С) и 48 ч (фиг. 8D) после инъекции, способом LC-MS. На фиг. 9 А-D показаны результаты анализа контрольного образца FGF21(15)Face (фиг. 9 А) и образцов FGF21(15)Face, полученных от мышей через 6 ч (фиг. 9 В), 24 ч (фиг. 9 С) и 48 ч (фиг. 9D) после инъекции, способом LC-MS. На фиг. 10 А, 10 В показаны сайты расщепления, идентифицированные анализом LC-MS гибридных белков Face(15)FGF21 (фиг. 10 А, SEQ ID NO:24) и FGF21(15)Face (фиг. 10 В, SEQ ID NO:25), введенных мышам путем инъекции. На фиг. 11 показаны результаты измерений уровня глюкозы в крови у мышей, которым путем инъекции вводили PBS (закрашенный столбец), Face(15)FGF21 (пустой столбец) или такие мутанты(пустой столбец с диагональными полосками). На фиг. 12 показано процентное изменение уровня глюкозы в крови по результатам измерений у мышей, которым путем инъекции вводили PBS (закрашенные кружки), Face(15)FGF21 (пустые кружки) или такие мутанты Face(15)FGF21, как Face(15)FGF21 G170E (закрашенные треугольники),Face(15)FGF21 P171A (пустые треугольники), Face(15)FGF21 S172L (закрашенные ромбы),Face(15)FGF21 G170E/P171A/S172L (пустые ромбы) или Face(15)FGF21 G151A (закрашенные квадраты). На фиг. 13 показаны результаты измерений уровня глюкозы в крови у мышей, которым путем инъекции вводили PBS (закрашенный столбец), Fc(15)FGF21 (пустой столбец) или такие мутантыFc(15)FGF21, как Fc(15)FGF21 P150A/G151A/I152V (серый столбец), Fc(15)FGF21 G170E (пустой столбец с диагональными полосками), Fc(15)FGF21 G170E/P171A (серый столбец с диагональными полосками) или Fc(15)FGF21 G170E/S172L (пустой столбец с диагональными полосками). На фиг. 14 показано процентное изменение уровня глюкозы в крови по результатам измерений у мышей, которым путем инъекции вводили PBS (закрашенные квадраты), Fc(15)FGF21 (пустые квадраты) или такие мутанты Fc(15)FGF21, как Fc(15)FGF21 P150A/G151A/I152V (закрашенные перевернутые треугольники), Fc(15)FGF21 G170E (пустые перевернутые треугольники), Fc(15)FGF21 G170E/P171A (закрашенные кружки) или Fc(15)FGF21 G170E/S172L (пустые кружки). На фиг. 15 показаны результаты измерений уровня глюкозы в крови у мышей, которым путем инъекции вводили PBS (закрашенный столбец) или такие мутанты Fc(15)FGF21, как Fc(15)FGF21 G170E(пустой столбец), Fc(15)FGF21 G170A (серый столбец), Fc(15)FGF21 G170C (пустой столбец с диагональными полосками), Fc(15)FGF21 G170D (серо-белый столбец), Fc(15)FGF21 G170N (закрашенный столбец с диагональными полосками) или Fc(15)FGF21 G170S (пустой столбец с диагональными полосками). На фиг. 16 показано процентное изменение уровня глюкозы в крови по результатам измерений у мышей, которым путем инъекции вводили PBS (закрашенные кружки) или такие мутанты Fc(15)FGF21,как Fc(15)FGF21 G170E (пустые кружки), Fc(15)FGF21 G170A (закрашенные треугольники),Fc(15)FGF21 G170C (пустые треугольники), Fc(15)FGF21 G170D (закрашенные ромбы), Fc(15)FGF21G170N (пустые ромбы) или Fc(15)FGF21 G170S (перевернутые пустые треугольники). На фиг. 17 показаны результаты измерений уровня глюкозы в крови у мышей, которым путем инъ-4 017690 екции вводили PBS (закрашенный столбец) или такие мутанты Fc(15)FGF21, как Fc(15)FGF21 G170E(пустой столбец), Fc(15)FGF21 P171E (серый столбец), Fc(15)FGF21 Р 171 Н (закрашенный столбец с диагональными полосками), Fc(15)FGF21 P171Q (пустой столбец с диагональными полосками),Fc(15)FGF21 P171T (столбец с шахматными клетками) или Fc(15)FGF21 P171Y (серый столбец с диагональными полосками). На фиг. 18 показано процентное изменение уровня глюкозы в крови по результатам измерений у мышей, которым путем инъекции вводили PBS (закрашенные кружки) или такие мутанты Fc(15)FGF21,как Fc(15)FGF21 G170E (пустые кружки), Fc(15)FGF21 P171E (закрашенные треугольники), Fc(15)FGF21 Р 171 Н (пустые треугольники), Fc(15)FGF21 P171Q (закрашенные ромбы), Fc(15)FGF21 P171T (пустые ромбы) или Fc(15)FGF21 P171Y (закрашенные квадраты). На фиг. 19 А-19D показаны результаты анализа контрольного образца FGF21(15)Fc (фиг. 19 А) и образцов, полученных от мышей через 6 ч (фиг. 19 В), 24 ч (фиг. 19 С) и 48 ч (фиг. 19D) после инъекции,способом LC-MS. На фиг. 20 А-20D показаны результаты анализа контрольного образца Fc(15)FGF21 G170E (фиг. 20 А) и образцов Fc(15)FGF21 G170E, полученных от мышей через 6 ч (фиг. 20 В), 24 ч (фиг. 20 С) и 48 ч(фиг. 20D) после инъекции, способом LC-MS. На фиг. 21 А-21D показаны результаты анализа контрольного образца Fc(15)FGF21 P171 А (фиг. 21 А) и образцов Fc(15)FGF21 P171A, полученных от мышей через 6 ч (фиг. 21 В), 24 ч (фиг. 21 С) и 48 ч(фиг. 21D) после инъекции, способом LC-MS. На фиг. 22 А-22D показаны результаты анализа контрольного образца Fc(15)FGF21 S172L (фиг. 22 А) и образцов Fc(15)FGF21 S172L, полученных от мышей через 6 ч (фиг. 22 В), 24 ч (фиг. 22C) и 48 ч(фиг. 22D) после инъекции, способом LC-MS. На фиг. 23 А-23D показаны сайты расщепления, идентифицированные анализом LC-MS гибридных белков Fc(15)FGF21 (фиг. 23A, SEQ ID NO: 24), Fc(15)FGF21 G170E (фиг. 23B, SEQ ID NO: 26),Fc(15)FGF21 P171A (фиг. 23 С, SEQ ID NO: 27) и Fc(15)FGF21 S172L (фиг. 23D, SEQ ID NO: 28), введенных мышам путем инъекции. На фиг. 24 А-24 С показаны результаты анализа активности ELK-люциферазы, проведенного на таких мутантах FGF21, как FGF21 L99R, FGF21 L99D и FGF21 A111T (фиг. 24 А), на таких мутантахFGF21, как FGF21 A129D, FGF21 A129Q и FGF21 A134K (фиг. 24 В), и на таких мутантах FGF21, какFGF21 A134Y, FGF21 А 134 Е и FGF21 A129K (фиг. 24 С), при этом каждая панель показывает результаты,полученные на контрольных образцах FGF21 человека. На фиг. 25 А-25D показаны результаты анализа активности ELK-люциферазы, проведенного на таких мутантах Fc-FGF21, как Fc-FGF21 P171G, Fc-FGF21 P171S и Fc-FGF21 Р 171 Т (фиг. 25 А), на таких мутантах Fc-FGF21, как Fc-FGF21 P171Y, Fc-FGF21 P171W и Fc-FGF21 Р 171 С (фиг. 25 В), на таких мутантах Fc(15)FGF21, как Fc(15)FGF21 A45K/G170E и FGF21 A45K (фиг. 25 С), и на таких мутантахFc(15)FGF21, как Fc(15)FGF21 Р 171 Е и Fc(15)FGF21 A45K/G170E (фиг. 25D), при этом каждая панель показывает результаты, полученные на контрольных образцах FGF21 человека. На фиг. 26 А, 26 В показана агрегация как функция времени для зрелого FGF21 дикого типа и для разных мутантов FGF21, фиг. 26 А показывает процентное изменение агрегации для контрольного FGF21(WT, закрашенные ромбы) и FGF21 A45K (закрашенные кружки) после инкубации 65 мг/мл белка при 4 С в течение 1, 2 и 4 дней, тогда как фиг. 26 В показывает процентное изменение агрегации для контрольного FGF21 (WT) и вариантов FGF21 Р 78 С, P78R, L86T, L86R, L98C, L98R, A111T, A129D, A129Q,A129K, A134K, A134Y и А 134 Е (все маркированы на графике) после инкубации 65 мг/мл белка при 4 С в течение 1, 6 и 10 дней. На фиг. 27 показаны результаты анализа активности ELK-люциферазы, проведенного на контрольном FGF21 человека и на таких мутантах FGF21, как FGF21 A45K, FGF21 L52T и FGF21 L58E. На фиг. 28 А представлен график, показывающий изменение уровня агрегации для таких мутантовFc(15)FGF21, как Fc(15)FGF21 6-181/G170E (закрашенные ромбы), Fc(15)FGF21 A45K/G170E (пустые квадраты), Fc(15)FGF21 P171E (закрашенные треугольники), Fc(15)FGF21 P171 А (крестики),Fc(15)FGF21 G 170E (пустые треугольники) и для контрольного FGF21 (закрашенные кружки), после инкубации при 4 С в течение 1, 4 и 8 дней, а фиг. 28 В представляет собой гистограмму, также показывающую результаты инкубации. На фиг. 29 показаны результаты измерения уровня глюкозы в крови у мышей, которым путем инъекции вводили PBS (носитель) (закрашенные кружки) или такие мутанты Fc(15)FGF21, как Fc(15)FGF21L98R/P171G (пустые треугольники). На фиг. 30 представлен график, показывающий результаты анализа активности ELK-люциферазы,проведенного на FGF21 человека (закрашенные кружки, сплошная линия), на Fc-FGF21 (пустые кружки,сплошная линия) и на Fc-FGF21 L98R/P171G (закрашенные треугольники, пунктирная линия). На фиг. 31 представлен график, показывающий процентную величину агрегатов с высоким молекулярным весом, наблюдаемых после девяти дней выдерживания при комнатной температуре (фиг. 31 А) и 4 С (фиг. 31 В) для FGF21 (закрашенные кружки, сплошная линия), Fc-FGF21 (пустые кружки, сплошная-5 017690 линия) и Fc-FGF21 L98R/P171G (закрашенные треугольники, пунктирная линия). На фиг. 32 представлена серия трасс MALDI при масс-спектрометрии, показывающая наблюдаемые изменения Fc-F GF21 L98R/P171G в различных точках на протяжении 168-часового промежутка времени. На фиг. 33 представлен график, показывающий процентное изменение уровня глюкозы в крови у мышей ob/ob для контрольного носителя PBS (пустые кружки), зрелого FGF21 дикого типа (закрашенные квадраты) и таких мутантов FGF21, как L98R, P171G (перевернутые закрашенные треугольники),L98R, P171G, 182 Р (пустые ромбы) и L98R, P171G, 182G (закрашенные кружки). На фиг. 34 представлен график, показывающий процентное изменение уровня глюкозы в крови у мышей ob/ob для контрольного носителя PBS (закрашенные кружки) и таких мутантов FGF21, как L98R,P171G (закрашенные треугольники), L98R, P171G, 182G, 183G (пустые треугольники), L98R, P171G,182G (закрашенные ромбы) и L98R, P171G, 182 Р (пустые ромбы). На фиг. 35 представлен график, показывающий процентное изменение уровня глюкозы в крови у мышей ob/ob для контрольного носителя PBS (пустые кружки) и таких мутантов FGF21, как L98R,P171G (закрашенные квадраты), L98R, P171G, Y179S (пустые треугольники), L98R, P171G, Y179A (перевернутые закрашенные треугольники), L98R, P171G, 180S (пустые ромбы) и L98R, P171G, A180G (закрашенные кружки). На фиг. 36 представлен график, показывающий процентное изменение уровня глюкозы в крови у мышей ob/ob для контрольного носителя PBS (закрашенные кружки) и таких мутантов FGF21, как L98R,P171G (пустые квадраты), L98R, P171G, Y179F (закрашенные треугольники) и L98R, P171G, А 180 Е(пустые ромбы). На фиг. 37 представлена диаграмма, отображающую схему шестинедельного исследования с повышением дозы, проведенного на обезьянах резус. На указанной диаграмме полутоновые символы обозначают взятия крови натощак, а фактурные символы обозначают взятия крови после кормления. На фиг. 38 А-38D представлена серия графиков, отображающих рандомизацию обезьян резус по профилям OGTT, AUC (площади под кривой) OGTT и весу тела. Фиг. 38 А отображает базовый уровень глюкозы в OGTT1, при этом закрашенные квадраты соответствуют группе А, закрашенные кружки на сплошной линии соответствуют группе В, а пустые кружки на пунктирной линии соответствуют группе С перед распределением испытуемых соединений и носителя по группам. На фиг. 38 В отображен базовый уровень глюкозы в OGTT2, при этом закрашенные квадраты соответствуют группе А, закрашенные кружки на сплошной линии соответствуют группе В, а пустые кружки на пунктирной линии соответствуют группе С распределением испытуемых соединений и носителя по группам. На фиг. 38 С показан базовый уровень глюкозы в OGTT 1 и OGTT 2 в терминах AUC, при этом фактурный столбец соответствует группе А, полутоновой столбец соответствует группе В, а пустой столбец соответствует группе С. Фиг. 38D показывает базовый вес тела, при этом фактурный столбец соответствует группе А, полутоновой столбец соответствует группе В, а пустой столбец соответствует группе С. На фиг. 39 представлен график, показывающий влияние носителя, FGF21 и Fc-FGF21(RG) на вес тела у обезьян резус, при этом полутоновые столбцы 1 и 2 соответствуют 1-й и 2-й неделям на низкой дозе, пустые столбцы 3 и 4 соответствуют 3-й и 4-й неделям на средней дозе, закрашенные столбцы 5 и 6 соответствуют 5-й и 6-й неделям на высокой дозе, а фактурные столбцы 7, 8 и 9 соответствуют периоду отмывания (с 7-й по 9-ю неделю). На фиг. 40 представлен график, показывающий процентное изменение уровня инсулина натощак по отношению к базовому уровню у обезьян резус для носителя, FGF21 и Fc-FGF21(RG), при этом полутоновые столбцы 1 и 2 соответствуют 1-й и 2-й неделям на низкой дозе, пустые столбцы 3 и 4 соответствуют 3-й и 4-й неделям на средней дозе, закрашенные столбцы 5 и 6 соответствуют 5-й и 6-й неделям на высокой дозе, а фактурные столбцы 7 и 8 соответствуют 7-й и 8-й неделе в период отмывания. На фиг. 41 представлен график, показывающий влияние носителя, FGF21 и Fc-FGF21(RG) при введении высокой дозы на уровень инсулина у обезьян резус после кормления на 5-й и 6-й неделе исследования, при этом закрашенные столбцы соответствуют 5-й неделе, а полутоновые столбцы соответствуют 6-й неделе. На фиг. 42 представлен график, показывающий профили глюкозы в ходе теста OGTT5 (пероральный тест на толерантность к глюкозе), проведенного в конце двухнедельного лечения высокими дозамиFc-FGF21(RG), при этом закрашенные кружки на сплошной линии соответствуют носителю, пустые квадраты на пунктирной линии соответствуют FGF21, а закрашенные треугольники на сплошной линии соответствуют Fc-FGF21(RG). На фиг. 43 представлен график, показывающий профили инсулина в ходе теста OGTT5, проведенного в конце двухнедельного лечения высокими дозами Fc-FGF21(RG), при этом закрашенные кружки на сплошной линии соответствуют носителю, пустые квадраты на пунктирной линии соответствуют FGF21,а закрашенные треугольники на сплошной линии соответствуют Fc-FGF21(RG). На фиг. 44 представлен график, показывающий AUC 1-3 глюкозы в ходе теста OGTT, проведенном в конце каждого периода введения доз (низкой, средней и высокой дозы) обезьянам резус, при этом пустые столбцы соответствуют AUC3, рассчитанной по результатам измерений глюкозы в OGTT3, закра-6 017690 шенные столбцы соответствуют AUC4, рассчитанной по результатам измерений глюкозы в OGTT4, а полутоновые столбцы соответствуют AUC5, рассчитанной по результатам измерений глюкозы в OGTT5. На фиг. 45 представлен график, показывающий влияние носителя, FGF21 и Fc-FGF21(RG) на процентное изменение уровня триглицеридов в плазме по сравнению с базовым уровнем в каждой группе обезьян резус, при этом полутоновые столбцы 1 и 2 соответствуют 1-й и 2-й неделям на низкой дозе,пустые столбцы 3 и 4 соответствуют 3-й и 4-й неделям на средней дозе, закрашенные столбцы 5 и 6 соответствуют 5-й и 6-й неделям на высокой дозе, а фактурные столбцы 7, 8 и 9 соответствуют периоду отмывания (с 7-й по 9-ю неделю). На фиг. 46 представлен график, показывающий уровень триглицеридов в плазме после кормления в каждой группе обезьян резус по результатам измерений на пятой и шестой неделях лечения носителем,FGF21 или Fc-FGF21(RG) в высокой дозе, при этом полутоновые столбцы соответствуют 5-й неделе, а закрашенные столбцы соответствуют 6-й неделе. Фиг. 47 представляет собой график, показывающий индивидуальный уровень FGF21 у обезьяны по результатам измерений перед началом введения доз, а также в 5, 12, 19 и 26 дни при взятии образцов приблизительно через 21 ч после каждой инъекции. На фиг. 48 представлен график, показывающий индивидуальный уровень Fc-FGF21(RG) у обезьяны по результатам измерений перед началом введения доз, а также в 5, 12, 19 и 26 дни при взятии образцов приблизительно через 5 дней после каждой инъекции. На фиг. 49 представлен график, показывающий средние концентрации FGF21 и Fc-FGF21(RG) по результатам измерений в ходе трех тестов OGTT, проведенных после введения каждой дозы (низкой,средней и высокой), при этом полутоновые столбцы соответствуют OGTT3 с низкой дозой, закрашенные столбцы соответствуют OGTT4 со средней дозой, а пустые столбцы соответствуют OGTT5 с высокой дозой. Подробное описание изобретения Белок человека FGF21, обладающий улучшенными свойствами, в частности удлиненным периодом полувыведения и/или уменьшенной агрегацией, может быть изготовлен способами, раскрытыми в настоящем описании и стандартными способами молекулярной биологии. Факультативно можно дополнительно увеличить период полувыведения, гибридизируя антитело или его часть с N-концевым или Сконцевым участком последовательности FGF21 дикого типа. Также можно дополнительно увеличить период полувыведения или уменьшить агрегацию белка FGF21 дикого типа, вводя в этот белок аминокислотные замещения. Такие модифицированные белки упоминаются в данном документе как мутанты или мутанты FGF21 и формируют варианты осуществления настоящего изобретения. Способы рекомбинантных нуклеиновых кислот, упоминаемые в данном описании, включая примеры, в целом представляют собой способы, сформулированные в опубликованных источниках Sambrook etal., Molecular Cloning: A Laboratory Manual (Cold Spring Harbor Laboratory Press, 1989) или Current Protocols in Molecular Biology (Ausubel et al., eds., Green Publishers Inc. and Wiley and Sons 1994), причем оба указанных источника включены в настоящее описание в качестве ссылки с любой целью. 1. Общие термины и определения. Термин "выделенная молекула нуклеиновой кислоты" относится к молекуле нуклеиновой кислоты настоящего изобретения, которая: (1) была отделена как минимум приблизительно от 50% белков, липидов, углеводов или других материалов, вместе с которыми она встречается в природе, когда тотальную нуклеиновую кислоту выделяют из клеток-источников, (2) не сцеплена со всем полинуклеотидом или частью полинуклеотида, с которыми "выделенная молекула нуклеиновой кислоты" сцеплена в природе,(3) функционально связана с полинуклеотидом, с которым она не связана в природе, или (4) не встречается в природе как часть большей полинуклеотидной последовательности. Предпочтительно, чтобы выделенная молекула нуклеиновой кислоты по настоящему изобретению была, по существу, свободна от любых других загрязняющих молекул нуклеиновой кислоты или от других загрязнений, которые обнаруживаются в природном окружении и которые могли бы помешать ее применению в выработке полипептида или ее терапевтическому, диагностическому, профилактическому применению или применению в научно-исследовательских целях. Термин "вектор" употребляется для обозначения любой молекулы (например, нуклеиновой кислоты, плазмиды или вируса), используемой для переноса кодирующей информации в клетку-хозяина. Термин "вектор экспрессии" относится к вектору, который пригоден для трансформации клеткихозяина и содержит последовательности нуклеиновой кислоты, которые направляют и/или контролируют экспрессию вставленных гетерологичных последовательностей нуклеиновой кислоты. Экспрессия включает, но не ограничиваясь ими, такие процессы как транскрипция, трансляция и сплайсинг РНК,если присутствуют интроны. Термин "функционально связанный (-ая, -ое)" употребляется в данном документе для обозначения компоновки фланкирующих последовательностей, при этом фланкирующие последовательности, описанные таким образом, сконфигурированы или собраны так, что выполняют свою обычную функцию. Итак, фланкирующая последовательность, функционально связанная с кодирующей последовательностью, может быть способной вызывать репликацию, транскрипцию и/или трансляцию кодирующей по-7 017690 следовательности. Например, кодирующая последовательность функционально связана с промотором,если промотор способен управлять транскрипцией этой кодирующей последовательности. Фланкирующая последовательность не обязательно должна примыкать к кодирующей последовательности до тех пор, пока она правильно функционирует. Так, например, между промоторной последовательностью и кодирующей последовательностью могут быть вставлены промежуточные не транслируемые, но еще транскрибируемые последовательности, при этом промоторная последовательность, по-прежнему, может считаться "функционально связанной" с кодирующей последовательностью. Термин "клетка-хозяин" употребляется для обозначения клетки, которая была трансформирована или способна к трансформации последовательностью нуклеиновой кислоты, после чего она экспрессирует представляющий интерес ген. Этот термин включает потомство родительской клетки независимо от того, идентично ли оно или не идентично первоначальному родителю по морфологии или генетической структуре до тех пор, пока клетка экспрессирует избранный ген. Термин "выделенный полипептид" относится к полипептиду по настоящему изобретению, который:(1) был отделен как минимум приблизительно от 50% полинуклеотидов, липидов, углеводов или других материалов, вместе с которыми он встречается в природе, когда его выделяют из клеток-источников, (2) не связан (посредством ковалентного или нековалентного взаимодействия) со всем полипептидом или частью полипептида, с которыми "выделенный полипептид" связан в природе, (3) функционально связан(посредством ковалентного или нековалентного взаимодействия) с полипептидом, с которым он не связан в природе, или (4) не встречается в природе. Предпочтительно, чтобы выделенный полипептид был,по существу, свободен от любых других загрязняющих полипептидов или от других загрязнений, которые обнаруживаются в природном окружении и которые могли бы помешать его применению в терапевтических, диагностических, профилактических или научно-исследовательских целях. Термин "встречающийся в природе" применительно к таким биологическим материалам, как молекулы нуклеиновых кислот, полипептиды, клетки-хозяева и т.п., относится к материалам, которые встречаются в природе и не подвергаются манипуляциям со стороны человека. Сходным образом, термин "не встречающийся в природе" при использовании в данном документе относится к материалу, который не встречается в природе либо был структурно модифицирован или синтезирован человеком. При использовании по отношению к нуклеотидам термин "встречающийся в природе" относится к таким основаниям, как аденин (А), цитозин (С), гуанин (G), тимин (Т) и урацил (U). При использовании по отношению к аминокислотам термин "встречающаяся в природе" относится к следующим 20 аминокислотам: аланин(Q), аргинин (R), серин (S), треонин (Т), валин (V), триптофан (W) и тирозин (Y). Термин "полипептид FGF21" относится к встречающемуся в природе полипептиду дикого типа,экспрессируемому у человека. В целях этого раскрытия изобретения термин "полипептид FGF21" может использоваться взаимозаменяемо любого полноразмерного полипептида FGF21, например SEQ ID NO: 2,который состоит из 209 аминокислотных остатков и который кодируется нуклеотидной последовательностью SEQ ID NO: 1; любая зрелая форма полипептида, SEQ ID NO: 4, которая состоит из 181 аминокислотного остатка и которая кодируется нуклеотидной последовательностью SEQ ID NO: 3, в которой 28 аминокислотных остатков на аминоконце полноразмерного полипептида FGF21 (например, составляющих сигнальный пептид) были удалены, а также их варианты. Термины "мутант полипептида FGF21" и "мутант FGF21" относятся к варианту полипептида FGF21, в котором природная аминокислотная последовательность FGF21 была модифицирована. Такие модификации включают, но не ограничиваясь ими, одно или более аминокислотных замещений, включая замещения на аналоги аминокислот, не встречающиеся в природе, и усечения. Таким образом, мутанты полипептида FGF21 включают, но не ограничиваясь ими, сайт-специфические мутанты FGF21, усеченные полипептиды FGF21, мутантыFGF21 и гибридные белки FGF21, как описано в данном документе. В целях идентификации специфических усечений и аминокислотных замещений в мутантах FGF21 по настоящему изобретению нумерация усеченных или мутированных аминокислотных остатков соответствует нумерации в зрелом полипептидеFGF21, состоящем из 181 аминокислотного остатка. В других вариантах осуществления настоящего изобретения мутант полипептида FGF21 включает аминокислотную последовательность, которая как минимум на 85% идентична аминокислотной последовательности SEQ ID NO: 4, но в которой специфические остатки, придающие мутантному полипептиду FGF21 желательные свойства, например устойчивость к протеолизу, увеличенный период полувыведения, сниженную агрегацию или их комбинации, не были дополнительно модифицированы. Иными словами, за исключением тех остатков в мутантной последовательности FGF21, которые были модифицированы для придания полипептиду устойчивости к протеолизу, сниженной способности к агрегации или других свойств, модифицированными могут быть приблизительно 15% всех других аминокислотных остатков в мутантной последовательности FGF21. Например, в мутанте FGF21 Q173E могут быть модифицированы до 15% всех других аминокислотных остатков в дополнение к остатку глутаминовой кислоты, который был замещен на глутамин в положении 173. В других вариантах осуществления изобретения-8 017690 мутантный полипептид FGF21 включает аминокислотную последовательность, которая как минимум приблизительно на 90% или приблизительно на 95, 96, 97, 98 или 99% идентична аминокислотной последовательности SEQ ID NO: 4, но в которой специфические остатки, придающие мутантному полипептиду FGF21 свойства устойчивости к протеолизу или пониженной способности к агрегации, не были дополнительно модифицированы. Такие мутанты полипептида FGF21 обладают как минимум одним видом активности полипептида FGF21 дикого типа. Настоящее изобретение также охватывает молекулу нуклеиновой кислоты, кодирующую мутант полипептида FGF21, включающий аминокислотную последовательность, которая как минимум приблизительно на 85% идентична аминокислотной последовательности SEQ ID NO: 4, но в которой специфические остатки, придающие мутантному полипептиду FGF21 желательные свойства, например устойчивость к протеолизу, увеличенный период полувыведения, сниженную агрегацию или их комбинации, не были дополнительно модифицированы. Иными словами, за исключением нуклеотидов, кодирующих те остатки в мутантной последовательности FGF21, которые были модифицированы для придания полипептиду устойчивости к протеолизу, сниженной способности к агрегации или других свойств, модифицированными могут быть приблизительно 15% всех других нуклеотидов в мутантной последовательности, кодирующей FGF21. Например, в молекуле, кодирующей мутант FGF21 Q173E, могут быть модифицированы до 15% всех других нуклеотидов в дополнение к нуклеотидам, кодирующим остаток глутаминовой кислоты, который был замещен на глутамин в положении 173. Настоящее изобретение также охватывает молекулу нуклеиновой кислоты, кодирующую мутантный полипептид FGF21, включающий аминокислотную последовательность, которая как минимум приблизительно на 90% или приблизительно на 95, 96, 97, 98 или 99% идентична аминокислотной последовательности SEQ ID NO: 4, но в которой специфические остатки, придающие мутантному полипептиду FGF21 свойства устойчивости к протеолизу или пониженной способности к агрегации, не были дополнительно модифицированы. Такие мутантыFGF21 обладают как минимум одним видом активности полипептида FGF21 дикого типа. Настоящее изобретение также охватывает молекулу нуклеиновой кислоты, включающую нуклеотидную последовательность, которая как минимум приблизительно на 85% идентична нуклеотидной последовательности SEQ ID NO: 3, но в которой нуклеотиды, кодирующие аминокислотные остатки, которые придают кодируемому мутантному полипептиду FGF21 устойчивость к протеолизу, пониженную способность к агрегации или другие желательные свойства, не были дополнительно модифицированы. Говоря другими словами, за исключением тех остатков в мутантной последовательности FGF21, которые были модифицированы для придания полипептиду устойчивости к протеолизу, сниженной способности к агрегации или других свойств, модифицированными могут быть приблизительно 15% всех других аминокислотных остатков в мутантной последовательности FGF21. Например, в мутанте FGF21 Q173E могут быть модифицированы до 15% всех других аминокислотных остатков в дополнение к остатку глутаминовой кислоты, который был замещен на глутамин в положении 173. Далее, настоящее изобретение охватывает молекулу нуклеиновой кислоты, включающую нуклеотидную последовательность, которая как минимум приблизительно на 90% или приблизительно на 95, 96, 97, 98 или 99% идентична аминокислотной последовательности SEQ ID NO: 3, но в которой нуклеотиды, кодирующие аминокислотные остатки, которые придают кодируемому мутантному полипептиду FGF21 свойства устойчивости к протеолизу или пониженной способности к агрегации, не были дополнительно модифицированы. Такие молекулы нуклеиновых кислот кодируют мутанты FGF21, обладающие как минимум одним видом активности полипептида FGF21 дикого типа. Термин "биологически активный мутант полипептида FGF21" относится к любому мутантному полипептиду FGF21, описанному в данном документе, который обладает активностью полипептида FGF21 дикого типа, в частности способностью понижать уровень глюкозы, инсулина, триглицеридов или холестерина в крови, уменьшать вес тела и улучшать толерантность к глюкозе, потребление энергии или чувствительность к инсулину независимо от числа модификаций, введенных в мутант полипептида FGF21. Мутантные полипептиды FGF21, обладающие в некоторой степени пониженным уровнем активностиFGF21 по сравнению с полипептидом FGF21 дикого типа, могут, тем не менее, считаться биологически активными мутантами полипептида FGF21. Каждый из терминов "эффективное количество" и "терапевтически эффективное количество" относится к мутантному полипептиду FGF21, применяемому для поддержания наблюдаемого уровня одного или более видов биологической активности полипептида FGF21 дикого типа, в частности способности понижать уровень глюкозы, инсулина, триглицеридов или холестерина в крови, снижать вес тела или улучшать толерантность к глюкозе, потребление энергии или чувствительность к инсулину. Термин "фармацевтически приемлемый носитель" или "физиологически приемлемый носитель" при использовании в данном документе относится к одному или более рецептурных материалов, пригодных для осуществления или улучшения доставки мутантного полипептида FGF21. Термин "антиген" относится к молекуле или части молекулы, которые способны связываться с антителом и, кроме того, их можно использовать на животных для выработки антител, которые способны связывать эпитоп антигена. Антиген может иметь один или более эпитопов. Термин "нативный Fc" относится к молекуле или последовательности, включающей последова-9 017690 тельность неантигенсвязывающего фрагмента и полученной в результате расщепления целого антитела или выработанной другими средствами как в мономерной, так и в мультимерной форме, которая может содержать шарнирный участок. Предпочтительный первоначальный иммуноглобулиновый источник нативного Fc имеет человеческое происхождение и представляет собой любой из иммуноглобулинов,хотя более предпочтительны IgG1 и IgG2. Нативные молекулы Fc состоят из мономерных полипептидов,которые могут быть соединены в димерные или мультимерные формы посредством ковалентной (т.е. по типу дисульфидных связи) и нековалентной ассоциации. Число межмолекулярных дисульфидных связей между мономерными субъединицами нативных молекул Fc варьируется от 1 до 4 в зависимости от класса (например, IgG, IgA и IgE) или подкласса (например, IgG1, IgG2, IgG3, IgA1 и IgGA2). Один из примеров нативного Fc представляет собой дисульфидно связанный димер, полученный в результате папаинового расщепления IgG (см. Ellison et al., 1982, Nucleic Acids Res. 10: 4071-9). Термин "нативный Fc" при использовании в данном документе обобщает мономерные, димерные и мультимерные формы. Пример полипептидной последовательности Fc представлен в SEQ ID NO: 13. Термин "вариант Fc" относится к молекуле или последовательности, которые модифицированы из нативного Fc, но еще включают сайт связывания для рецептора утилизации, FcRn (рецептор Fc новорожденных). Международные патентные публикацииWO 97/34631 и WO 96/32478 описывают типичные варианты Fc, а также их взаимодействие с рецептором утилизации, в связи с чем указанные публикации включены в этот документ в качестве ссылки. Таким образом, термин "вариант Fc" может включать молекулу или последовательность, которые гуманизированы из нативного Fc нечеловеческого происхождения. Кроме того, нативный Fc включает участки, которые можно удалить, поскольку они обеспечивают структурные признаки биологической активности, не являющиеся необходимыми для гибридных молекул мутантов FGF21, соответствующих настоящему изобретению. Таким образом, термин "вариант Fc" включает молекулу или последовательность, в которых один или более сайтов или остатков нативного Fc утрачены или модифицированы, что влияет на: (1) образование дисульфидных связей, (2) несовместимость с выбранной клеткой-хозяином, (3) N-концевую гетерогенность при экспрессии в выбранной клетке-хозяине, (4) гликозилирование, (5) взаимодействие с комплементом, (6) связывание с другим рецептором Fc, нежели рецептор утилизации, или (7) антителозависимую клеточную цитотоксичность (ADCC). Варианты Fc более подробно описаны в данном документе ниже. Термин "домен Fc" охватывает нативный Fc, варианты Fc и их последовательности в соответствии с данными выше определениями. Как в отношении вариантов Fc, так и в отношении нативных молекул Fc термин "домен Fc" включает молекулы в мономерной или мультимерной форме, полученные в результате расщепления целого антитела или выработанные другими средствами. В некоторых вариантах осуществления настоящего изобретения домен Fc может быть соединен с FGF21 или мутантом FGF21 (включая усеченную форму FGF21 или мутанта FGF21) посредством, например, ковалентной связи между доменом Fc и последовательностью FGF21. Такие составные белки могут образовывать мультимеры через ассоциацию доменов Fc, при этом как составные белки, так и их мультимеры являются аспектомнастоящего изобретения. 2. Сайт-специфические мутанты FGF21. Термин "сайт-специфический мутант FGF21" или "замещенный мутант FGF21" относится к мутантному полипептиду FGF21, имеющему аминокислотную последовательность, которая отличается от аминокислотной последовательности природного полипептида FGF21, например SEQ ID NO:2, SEQ IDNO: 4 и их вариантов. Сайт-специфические мутанты FGF21 можно создавать, вводя аминокислотные замещения, консервативные или неконсервативные, и используя как встречающиеся, так и не встречающиеся в природе аминокислоты в специфических положениях полипептида FGF21."Консервативное аминокислотное замещение" может включать замещение нативного аминокислотного остатка (т.о. остатка, обнаруживаемого в данном положении полипептидной последовательностиFGF21 дикого типа) на ненативный остаток (т.н. остаток, который не обнаруживается в данном положении полипептидной последовательности FGF21 дикого типа), при этом не происходит никаких влияний или происходят очень незначительные влияния на полярность или заряд аминокислотного остатка в данном положении. Консервативные аминокислотные замещения также охватывают не встречающиеся в природе аминокислотные остатки, которые обычно встраиваются посредством химического пептидного синтеза, а не синтеза в биологических системах. Они включают пептидомиметики и другие реверсированные или инвертированные формы аминокислотных компонентов. Встречающиеся в природе аминокислотные остатки можно подразделить на классы, основываясь на общих свойствах боковой цепи:(5) остатки, которые влияют на ориентацию цепи: Gly, Pro; и(6) ароматические: Trp, Tyr, Phe. Консервативные замещения могут включать замену члена одного из этих классов другим членом- 10017690 того же класса. Неконсервативные замещения могут включать замену члена одного из этих классов другим членом другого класса. Желательные аминокислотные замещения (как консервативные, так и неконсервативные) могут определить компетентные специалисты в данной области в то время, когда такие замены понадобятся. Типичный (но не ограничивающий) список аминокислотных замещений представлен в табл. 1. Таблица 1 Аминокислотные замещения 3. Усеченные полипептиды FGF21. Один из вариантов осуществления настоящего изобретения относится к усеченным формам зрелого полипептида FGF21. Этот вариант осуществления настоящего изобретения возник в связи с попыткой выявить усеченные полипептиды FGF21, которые способны обеспечивать активность, равную активности не усеченных форм зрелого полипептида FGF21, а в некоторых случаях превосходящую ее. При использовании в настоящем описании термин "усеченный полипептид FGF21" относится к полипептиду FGF21, в котором были удалены аминокислотные остатки из аминоконцевого (или Nконцевого участка) полипептида FGF21, были удалены аминокислотные остатки из карбоксиконцевого(или С-концевого) участка полипептида FGF21 или были удалены аминокислотные остатки как из аминоконцевого, так и из карбоксиконцевого участков полипептида FGF21. Различные усечения, раскрытые в настоящем документе, были подготовлены так, как это изложено в примерах 3 и 6. Активность полипептидов FGF21, усеченных на N-конце, и полипептидов FGF21, усеченных на Сконце, можно оценивать, применяя анализ на ELK-люциферазу in vitro, как это описано в примере 4. Специфические подробности анализов in vitro, которые можно применять для исследования активности усеченных полипептидов FGF21, можно найти в примере 4. Активность усеченных полипептидов FGF21 по настоящему изобретению также можно оценивать в анализе in vivo, таком как анализ на мышах ob/ob, описанный в примерах 5 и 7. В целом, для оценки активности усеченного полипептида FGF21 in vivo этот усеченный полипептид можно ввести животному,используемому для тестирования, внутрибрюшинно. После нужного периода инкубации (например, 1 ч или более) можно взять образец крови и измерить уровень глюкозы. Специфические подробности анализов in vivo, которые можно применять для исследования активности усеченных полипептидов FGF21,можно найти в примерах 5 и 7.- 11017690 а. N-концевые усечения. В некоторых вариантах осуществления настоящего изобретения N-концевые усечения включают 17 или 8 аминокислотных остатков из N-концевого участка зрелого полипептида FGF21. Как продемонстрировано в примере 5 и на фиг. 3, усеченные полипептиды FGF21, имеющие концевые усечения длиной менее 9 аминокислотных остатков, сохраняют способность зрелого полипептида FGF21 понижать уровень глюкозы в крови субъекта. В соответствии с этим, в специфических вариантах осуществления настоящее изобретение охватывает усеченные формы зрелого полипептида FGF21 или мутантных полипептидов FGF21, имеющих Nконцевые усечения 1-7 или 8 аминокислотных остатков.b. С-концевые усечения. В некоторых вариантах осуществления настоящего изобретения С-концевые усечения включают 111 или 12 аминокислотных остатков из С-концевого участка зрелого полипептида FGF21. Как продемонстрировано в примере 4 и на фиг. 1 В, усеченные полипептиды FGF21, имеющие С-концевые усечения длиной менее 13 аминокислотных остатков, демонстрируют эффективность на уровне как минимум 50% эффективности FGF21 дикого типа в анализе на ELK-люциферазу in vitro, указывающую на то, что эти мутанты FGF21 сохраняют способность зрелого полипептида FGF21 понижать уровень глюкозы в крови субъекта. В соответствии с этим, в специфических вариантах осуществления настоящее изобретение охватывает усеченные формы зрелого полипептида FGF21 или мутантных полипептидов FGF21, имеющих С-концевые усечения 1-11 или 12 аминокислотных остатков.c. N-концевые и С-концевые усечения. С некоторых вариантах осуществления настоящего изобретения усеченные полипептиды FGF21 могут иметь сочетанные N-концевые и С-концевые усечения. Усеченные полипептиды FGF21, имеющие сочетание N-концевых и С-концевых усечений, сохраняют активность соответствующих усеченных полипептидов FGF21, имеющих только N-концевые или С-концевые усечения. Говоря иначе, усеченные полипептиды FGF21, имеющие как N-концевые усечения длиной менее 9 аминокислотных остатков, так и С-концевые усечения длиной менее 13 аминокислотных остатков, обладают такой же или даже большей активностью по снижению уровня глюкозы в крови, чем усеченные полипептиды FGF21, имеющие только N-концевые усечения длиной менее 9 аминокислотных остатков или С-концевые усечения длиной менее 13 аминокислотных остатков. В соответствии с этим, в специфических вариантах осуществления настоящее изобретение охватывает усеченные формы зрелого полипептида FGF21 или мутантных полипептидов FGF21, имеющих N-концевые усечения 1-7 или 8 аминокислотных остатков и С-концевые усечения 1-11 или 12 аминокислотных остатков. Как и в отношении всех мутантов FGF21 по настоящему изобретению, усеченные полипептидыFGF21 могут в необязательном порядке включать аминоконцевой остаток метионина, который можно ввести посредством направленной мутации или в результате процесса бактериальной экспрессии. Усеченные полипептиды FGF21 по настоящему изобретению можно изготовить так, как это описано в примерах 3 и 6. Средний специалист в данной области, знакомый со стандартными методиками молекулярной биологии, сможет употребить свои знания вместе со сведениями, представленными в настоящем раскрытии изобретения, чтобы изготовлять и применять усеченные полипептиды FGF21 по настоящему изобретению. Для рекомбинантной ДНК, олигонуклеотидного синтеза, тканевой культуры и трансформации можно использовать стандартные методики (например, электропорацию, липофекцию); см., например, публикацию Sambrook et al., Molecular Cloning: A Laboratory Manual., выше, которая включена в этот документ в качестве ссылки с любой целью. Ферментативные реакции и методики очистки можно проводить в соответствии со спецификациями производителей, как это общепринято в данной области техники или описано в настоящем документе. Если не представлены специальные определения, номенклатура, используемая в данном документе применительно к лабораторным процедурам и методикам аналитической химии, синтетической органической химии, медицинской и фармацевтической химии, представлена хорошо известной и общепринятой номенклатурой в данной области. Для химического синтеза, химических анализов, изготовления фармацевтических препаратов, рецептурных составов, их доставки и для лечения больных можно использовать стандартные методики. Усеченные полипептиды FGF21 по настоящему изобретению также можно соединять с другим компонентом, который способен придать усеченному полипептиду FGF21 дополнительные свойства. В одном из вариантов осуществления настоящего изобретения усеченный полипептид FGF21 может быть соединен с последовательностью Fc. Такое слияние можно осуществить, применяя известные способы молекулярной биологии и/или руководящие указания, представленные в данном документе. Преимущества таких составных полипептидов, а также способы изготовления таких составных полипептидов будут обсуждаться в данном документе более подробно. 4. Мутанты FGF21, устойчивые к протеолизу. Как указано в примере 8, было обнаружено, что зрелый FGF21 подвергается разрушению in vivo,которое, в конечном итоге, является результатом протеолитической атаки. Было обнаружено, что разрушение зрелого FGF21 in vivo укорачивает эффективный период его полувыведения, а это, в свою очередь, отрицательно влияет на терапевтический потенциал молекулы. В соответствии с этим, было прове- 12017690 дено целенаправленное исследование по идентификации мутантов FGF21, которые проявляют устойчивость к протеолизу. В результате этого исследования было определено, что сайты в молекуле зрелого полипептида FGF21, которые особенно чувствительны к протеолизу, включают аминокислотные остатки в положениях 4-5, 20-21, 151-152 и 171-172. Было проведено широкое, но сфокусированное и целенаправленное исследование по идентификации специфических замещений, которые устраняют наблюдаемый протеолитический эффект, хотя при этом не влияют на активность белка в недопустимой степени. Табл. 8 и 11 представляют некоторые из полученных и протестированных мутантов. Как описано в примерах 13 и 14, не все мутанты FGF21 демонстрируют идеальный профиль: одни мутанты, приобретая устойчивость к протеолизу, утрачивали или снижали полезную активность FGF21, а другие мутанты сохраняли активность FGF21, но не приобретали устойчивости к протеолизу. Некоторые мутанты, включая, например, FGF21 P171G, сохраняли уровень активности, сходный с FGF21 дикого типа, и в то же время демонстрировали устойчивость к протеолитическому разрушению. Один из критериев отбора при идентификации желательных мутантов FGF21, устойчивых к протеолизу, заключался в том, чтобы активность мутанта FGF21 была, по существу, такой же или даже большей по сравнению с активностью FGF21 дикого типа. Следовательно, еще один вариант осуществления настоящего изобретения направлен на мутанты FGF21, которые устойчивы к протеолизу, но при этом сохраняют активность, которая, по существу, не отличается от активности FGF21 дикого типа или превышает ее. Хотя в некоторых случаях это менее желательно, еще один вариант осуществления настоящего изобретения связан с мутантами FGF21, которые устойчивы к протеолизу, но проявляют в некоторой степени сниженную активность. В некоторых случаях может оказаться желательным поддерживать протеолиз, вследствие чего мутанты FGF21, которые допускают некоторую степень протеолиза, формируют еще один вариант осуществления настоящего изобретения. Как и все мутанты FGF21 по настоящему изобретению, мутанты FGF21, устойчивые к протеолизу,можно изготовить так, как описано в данном документе. Специалисты в данной области, например,знающие стандартные методики молекулярной биологии, смогут употребить свои знания вместе со сведениями, представленными в настоящем раскрытии изобретения, чтобы изготовлять и применять мутанты FGF21, устойчивые к протеолизу, в соответствии с настоящим изобретением. Для рекомбинантной ДНК, олигонуклеотидного синтеза, тканевой культуры и трансформации можно использовать стандартные методики (например, электропорацию, липофекцию); см., например, публикацию Sambrook et al.,Molecular Cloning: A Laboratory Manual., выше, которая включена в настоящий документ в качестве ссылки с любой целью. Ферментативные реакции и методики очистки можно проводить в соответствии со спецификациями производителей, как это общепринято в данной области техники или описано в настоящем документе. Если не представлены специальные определения, номенклатура, используемая в данном документе применительно к лабораторным процедурам и методикам аналитической химии, синтетической органической химии, медицинской и фармацевтической химии, представлена хорошо известной и общепринятой номенклатурой в данной области. Для химического синтеза, химических анализов,изготовления фармацевтических препаратов, рецептурных составов, их доставки и для лечения больных можно использовать стандартные методики. Мутанты FGF21, устойчивые к протеолизу, можно соединять с другим компонентом, который способен придать мутанту FGF21, устойчивому к протеолизу, дополнительные свойства. В одном из вариантов осуществления настоящего изобретения устойчивый к протеолизу мутант FGF21 можно соединить с последовательностью Fc IgG, например SEQ ID NO: 13. Такое слияние можно осуществить, применяя известные способы молекулярной биологии и/или руководящие указания, представленные в данном документе. Преимущества таких составных полипептидов, а также способы изготовления таких составных полипептидов известны и будут обсуждаться в данном документе более подробно. 5. Мутанты FGF21 с пониженной агрегацией. Как описано в примере 15, одним из свойств полипептида FGF21 дикого типа является его склонность к агрегации. При концентрации свыше приблизительно 5 мг/мл степень агрегации высока при комнатной температуре. Как показано и описано в данном документе, степень агрегации для полипептида FGF21 дикого типа зависит как от концентрации, так и от температуры. Агрегация может создать проблемы при работе с FGF21 дикого типа в этих концентрациях, например, в контексте составления терапевтической композиции. В соответствии с этим, было проведено целенаправленное исследование по идентификации мутантов FGF21, которые проявляют пониженную склонность к агрегации. Затем выявленные мутанты FGF21 были протестированы на склонность к агрегации в различных концентрациях. Было проведено широкое, но сфокусированное и целенаправленное исследование по идентификации специфических замещений, которые устраняют наблюдаемый эффект агрегации для FGF21 дикого типа, но при этом не влияют на активность белка в недопустимой степени. Подход к идентификации подходящих мутантов с пониженной агрегацией описан в примере 15. В табл. 16 представлены некоторые полученные и протестированные мутанты. Как показано в примере 17, не все мутанты FGF21 проявляют идеальный профиль. Одни мутанты, такие как FGF21 L58E, имели сниженную активность FGF21 и- 13017690 не исследовались далее, а другие мутанты, такие как FGF21 А 134 Е, сохраняли активность FGF21, но не приобретали свойства пониженной склонности к агрегации. В то же время некоторые мутанты, такие какFGF21 L98R, не только сохраняли активность FGF21, но и демонстрировали пониженную агрегацию. Один мутант, FGF21 А 45K, неожиданно проявил повышенную активность FGF21 наряду с пониженной склонностью к агрегации. Один из критериев отбора при идентификации желательных мутантов FGF21, не склонных к агрегации, заключался в том, чтобы активность мутанта FGF21 была, по существу, сходной или даже большей по сравнению с активностью FGF21 дикого типа. Следовательно, еще один вариант осуществления настоящего изобретения направлен на мутанты FGF21, имеющие пониженную склонность к агрегации,но в то же время сохраняющие активность FGF21, которая сходна с активностью FGF21 дикого типа или превышает ее. Несмотря на то что в некоторых случаях это менее желательно, еще один вариант осуществления настоящего изобретения связан с мутантами FGF21, которые имеют пониженную склонность к агрегации, но проявляют в некоторой степени сниженную активность FGF21. В некоторых случаях может оказаться желательным поддерживать определенный уровень агрегации, вследствие чего мутантыFGF21, которые допускают некоторую степень агрегации, формируют еще один вариант осуществления настоящего изобретения. Как и все мутанты FGF21 по настоящему изобретению, мутанты FGF21, обладающие пониженной склонностью к агрегации, можно изготовить так, как описано в данном документе. Средние специалисты в данной области, знакомые со стандартными методиками молекулярной биологии, смогут употребить свои знания вместе со сведениями, представленными в настоящем раскрытии изобретения, чтобы изготовлять и применять мутанты FGF21 с пониженной склонностью к агрегации, соответствующие настоящему изобретению. Для рекомбинантной ДНК олигонуклеотидного синтеза тканевой культуры и трансформации можно использовать стандартные методики (например, электропорацию, липофекцию); см.,например, Sambrook et al., Molecular Cloning: A Laboratory Manual., выше, которая включена в этот документ в качестве ссылки с любой целью. Ферментативные реакции и методики очистки можно проводить в соответствии со спецификациями производителей, как это общепринято в данной области техники или описано в настоящем документе. Если не представлены специальные определения, номенклатура, используемая в данном документе применительно к лабораторным процедурам и методикам аналитической химии, синтетической органической химии, медицинской и фармацевтической химии, представлена хорошо известной и общепринятой номенклатурой в данной области. Для химического синтеза, химических анализов, изготовления фармацевтических препаратов, рецептурных составов, их доставки и для лечения больных можно использовать стандартные методики. Мутанты FGF21, не склонные к агрегации,можно соединять с другим компонентом, который способен придать мутанту FGF21, не склонному к агрегации, дополнительные свойства. В одном из вариантов осуществления настоящего изобретения не склонный к агрегации мутант FGF21 можно соединить с последовательностью Fc IgG, например SEQ IDNO: 13. Такое слияние можно осуществить, применяя известные способы молекулярной биологии и/или руководящие указания, представленные в данном документе. Преимущества таких составных полипептидов, а также способы изготовления таких составных полипептидов обсуждаются в данном документе более подробно. 6. Комбинированные мутанты FGF21. Как описано в данном документе, последовательность FGF21 дикого типа обладает некоторыми свойствами, которые создают значительные проблемы при использовании FGF21 в качестве терапевтической молекулы. Среди этих проблем необходимо упомянуть чувствительность белка к разрушению и его склонность к агрегации в высоких концентрациях. После всесторонних попыток идентифицировать такие полипептиды FGF21, которые преодолевают каждую из этих проблем, было проведено целенаправленное исследование для определения того, можно ли скомбинировать аминокислотные замещения,придающие белку устойчивость к протеолизу, и замещения, понижающие склонность к агрегации, чтобы добиться аддитивного или синергического эффекта таких замещений в одной полипептидной последовательности, поддерживая при этом такой уровень активности, который соответствует активности FGF21 дикого типа или превосходит ее. Эта задача сложна для решения, поскольку в данной области знаний известно, что введение множественных мутаций в определенный полипептид иногда может отрицательно сказаться на экспрессии, активности и последующей выработке белка в производственных масштабах. Неожиданно, как это продемонстрировано в примерах 19 и 20, было обнаружено, что желательные свойства нескольких мутантов FGF21, действительно, можно комбинировать аддитивным или синергическим образом, чтобы получить такой мутант FGF21, который обладает улучшенными фармацевтическими свойствами. В данном документе раскрыты мутанты FGF21, которые устойчивы к протеолизу,имеют пониженную степень агрегации, но при этом сохраняют такую активность, которая соответствует активности FGF21 дикого типа или превосходит ее. Один из критериев отбора при идентификации желательных комбинированных мутантов FGF21 заключался в том, чтобы активность мутанта FGF21 была, по существу, сходной или даже большей по сравнению с активностью FGF21 дикого типа. Следовательно, еще один вариант осуществления настоящего изобретения направлен на мутанты FGF21, устойчивые к протеолизу и имеющие пониженную- 14017690 склонность к агрегации, но в то же время сохраняющие активность FGF21, которая сходна с активностьюFGF21 дикого типа или превышает ее. Хотя в некоторых случаях это менее желательно, еще один вариант осуществления настоящего изобретения связан с мутантами FGF21, которые устойчивы к протеолизу и имеют пониженную склонность к агрегации, но проявляют в некоторой степени сниженную активность FGF21. В некоторых случаях может оказаться желательным поддерживать определенный уровень протеолиза и/или агрегации, вследствие чего мутанты FGF21, которые допускают некоторую степень протеолиза и/или агрегации, формируют еще один вариант осуществления настоящего изобретения. Как и все мутанты FGF21 по настоящему изобретению, комбинированные мутанты FGF21, соответствующие этому изобретению, можно изготовить так, как описано в данном документе. Средние специалисты в данной области, знакомые со стандартными методиками молекулярной биологии, смогут употребить свои знания вместе со сведениями, представленными в настоящем раскрытии изобретения, чтобы изготовлять и применять комбинированные мутанты FGF21, соответствующие настоящему изобретению. Для рекомбинантной ДНК, олигонуклеотидного синтеза, тканевой культуры и трансформации можно использовать стандартные методики (например, электропорацию, липофекцию); см., например, Sambrooket al., Molecular Cloning: A Laboratory Manual., выше, которая включена в этот документ в качестве ссылки с любой целью. Ферментативные реакции и методики очистки можно проводить в соответствии со спецификациями производителей, как это общепринято в данной области техники или описано в настоящем документе. Если не представлены специальные определения, номенклатура, используемая в данном документе применительно к лабораторным процедурам и методикам аналитической химии, синтетической органической химии, медицинской и фармацевтической химии, представлена хорошо известной и общепринятой номенклатурой в данной области. Для химического синтеза, химических анализов,изготовления фармацевтических препаратов, рецептурных составов, их доставки и для лечения больных можно использовать стандартные методики. Комбинированные мутанты FGF21, соответствующие настоящему изобретению, можно соединять с другим компонентом, который способен придать комбинированному мутанту FGF21 дополнительные свойства. В одном из вариантов осуществления настоящего изобретения комбинированный мутантFGF21 можно соединить с последовательностью Fc IgG, например SEQ ID NO: 13. Такое слияние можно осуществить, применяя известные способы молекулярной биологии и/или руководящие указания, представленные в данном документе. Преимущества таких составных полипептидов, а также способы изготовления таких составных полипептидов обсуждаются в данном документе более подробно. 7. Составные белки FGF21. При использовании в данном документе термин "составной полипептид FGF21" или "составной белок FGF21" относится к соединению одного или более аминокислотных остатков (например, с образованием гетерологичного белка или пептида) на N-конце или С-конце любого мутантного полипептидаFGF21, описанного в данном документе. Гетерологичные пептиды и полипептиды включают, но не ограничиваясь ими, эпитоп, позволяющий выявить и/или выделить мутантный полипептид FGF21, трансмембранный рецепторный белок или его часть, такую как внеклеточный домен или трансмембранный и внутриклеточный домен, лиганд или часть лиганда, которые связываются с трансмембранным рецепторным белком, фермент или часть фермента, которые каталитически активны, пептид или полипептид, которые стимулируют олигомеризацию,например домен лейциновой застежки, пептид или полипептид, которые повышают стабильность, например, константный участок иммуноглобулина, функциональное или нефункциональное антитело либо его тяжелая или легкая цепь, а также полипептид, который обладает активностью, в частности терапевтической активностью, отличной от мутантных полипептидов FGF21 по настоящему изобретению. Настоящее изобретение также охватывает мутантов FGF21, соединенных с сывороточным альбумином человека (HSA). Составные белки FGF21 можно изготовить посредством соединения гетерологичных последовательностей или на N-конце, или на С-конце мутантного полипептида FGF21. Как описано в данном документе, гетерологичная последовательность может представлять собой аминокислотную последовательность или полимер, не содержащий аминокислот. Гетерологичные последовательности можно соединять с мутантным полипептидом FGF21 или напрямую, или через линкер/адаптерную молекулу. Линкер или адаптерная молекула могут представлять собой один или более аминокислотных остатков(или -меров), например 1-8 или 9 остатков (или -меров), предпочтительно от 10 до 50 аминокислотных остатков (или -меров), например 10-20, 25, 30, 35, 40, 45 или 50 остатков (или -меров) и более предпочтительно от 15 до 35 аминокислотных остатков (или -меров). Линкер или адаптерную молекулу также можно сконструировать с сайтом расщепления для рестрикционной ДНК-эндонуклеазы или для протеазы, что позволяет разделять соединенные компоненты. а. Соединения с Fc. В одном из вариантов осуществления настоящего изобретения мутантный полипептид FGF21 соединен с одним или более доменов участка Fc иммуноглобулина IgG человека. Антитела включают две функционально независимые части, вариабельный домен, известный как "Fab", который связывает антиген, и константный домен, известный как "Fc", который вовлечен в такие эффекторные функции как ак- 15017690 тивация комплемента и атака фагоцитарными клетками. Домен Fc имеет длинный период полувыведения из сыворотки, тогда как домен Fab является короткоживущим (Capon et al., 1989, Nature 337: 525-31). При соединении с терапевтическим белком домен Fc может обеспечить более длительный период полувыведения или встроить такие функции, как связывание рецептора Fc, связывание белка А, фиксация комплемента и, возможно, даже перенос через плаценту (Capon et al., 1989). Фармакокинетический анализ in vivo указывает на то, что FGF21 человека имеет короткий период полувыведения, который составляет у мышей приблизительно 1 ч, что связано с быстрым клиренсом и разрушением in vivo. Следовательно, для удлинения периода полувыведения FGF21 последовательностьFc присоединяли к N- или С-концевому участку полипептида FGF21. Слияние участка Fc с FGF21 дикого типа, в особенности присоединение Fc к N-концу FGF21 дикого типа, вопреки ожиданиям, не удлиняло период полувыведения, однако это привело к исследованию протеолитического распада FGF21 in vivo и к идентификации мутантов FGF21, которые были устойчивы к такому распаду. Такие мутанты, описанные в примерах 8 и 11, проявляют больший период полувыведения по сравнению с FGF21 дикого типа. Эти и другие составные белки FGF21 формируют варианты осуществления настоящего изобретения. По всему тексту настоящего раскрытия изобретения обозначение Fc-FGF21 относится к составному белку, в котором последовательность Fc присоединена к N-концу FGF21. Сходным образом, обозначениеFGF21. Полученный в результате такого слияния составной белок FGF21 можно очистить, например, применяя колонку для аффинной хроматографии с белком А. Было обнаружено, что пептиды и белки, к которым присоединен участок Fc, проявляют in vivo значительно более длительный период полувыведения по сравнению с негибридизированными аналогами. К тому же слияние с участком Fc создает возможность для димеризации/мультимеризации составного полииептида. Участок Fc может представлять собой участок Fc, встречающийся в природе, но также может подвергаться изменениям для улучшения определенных качеств, таких как терапевтические качества, время циркуляции или сниженная агрегация. Полезные модификации белковых терапевтических средств за счет слияния с доменом "Fc" антитела подробно обсуждаются в Международной патентной публикации WO 00/024782, содержание которой включено в этот документ в качестве ссылки во всей полноте. Этот документ обсуждает сцепление с"транспортировщиком", таким как полиэтиленгликоль (ПЭГ), декстран или участок Fc.b. Линкеры составных белков. При формировании составных белков по настоящему изобретению можно, но не обязательно, использовать линкер. Если линкер представлен, его химическая структура не принципиальна, поскольку он, в первую очередь, служит спейсером. Линкер может состоять из аминокислот, сцепленных друг с другом посредством пептидных связей. В некоторых вариантах осуществления настоящего изобретения линкер составлен из 1-20 аминокислот, сцепленных посредством пептидных связей, при этом аминокислоты выбраны из 20 аминокислот, встречающихся в природе. В различных вариантах осуществления изобретения от 1 до 20 аминокислот выбраны из глицина, серина, аланина, пролина, аспарагина, глутамина и лизина. В некоторых вариантах осуществления изобретения линкер составлен из большинства аминокислот, которые не испытывают стерических затруднений, таких как глицин и аланин. В некоторых вариантах осуществления изобретения линкеры представляют собой полиглицины (такие как (Gly)4(SEQ ID NO: 29) и (Gly)5 (SEQ ID NO: 30, полиаланины, комбинации глицина и аланина (такие как поли(Gly-Ala или комбинации глицина и серина (такие как поли(Gly-Ser. Другие подходящие линкеры включают: (Gly)5-Ser-(Gly)3-Ser-(Gly)4-Ser (SEQ ID NO: 23), (Gly)4-Ser-(Gly)4-Ser-(Gly)4-Ser (SEQ ID NO: 31), (Gly)3-Lys-(Gly)4 (SEQ ID NO: 32), (Gly)3-Asn-Gly-Ser-(Gly)2 (SEQ ID NO: 33), (Gly)3-Cys-(Gly)4 (SEQID NO: 34) и Gly-Pro-Asn-Gly-Gly (SEQ ID NO: 35). Несмотря на то что было обнаружено, что для составных белков FGF21 особенно хорош линкер из 15 аминокислот, настоящее изобретение рассматривает линкеры любой длины или любого состава. Линкеры, описанные в данном документе, типичны, но настоящее изобретение также рассматривает линкеры, которые намного длиннее и могут включать другие аминокислотные остатки. Непептидные линкеры также рассматриваются в настоящем изобретении. Например, можно использовать алкильные линкеры, такие как -NH-(CH2)s-С(О)-, в котором s = от 2 до 20. Далее, такие алкильные линкеры могут быть замещены любой стерически незатрудненной группой, включая, но не ограничиваясь ими, низший алкил (например, С 1-С 6), низший ацил, галоген (например, Cl, Br), CN, NH2 или фенил. Типичным непептидным линкером является полиэтиленгликолевый линкер, который имеет молекулярный вес от 100 до 5000 кДа, например от 100 до 500 кДа. 8. Химически модифицированные мутанты FGF21. Химически модифицированные формы мутантных полипептидов FGF21, описанные в данном документе, включая усеченные формы FGF21, описанные в данном документе, могут быть изготовлены квалифицированным специалистом с учетом информации, представленной в этом раскрытии изобретения. Такие химически модифицированные мутанты FGF21 изменены таким образом, что они отличаются от не модифицированных мутантов FGF21 или по типу, или по локализации молекул, естественным образом прикрепленных к мутанту FGF21. Химически модифицированные мутанты FGF21 могут включать- 16017690 молекулы, образующиеся посредством удаления одной или более химических групп, прикрепленных естественным образом. В одном из вариантов осуществления изобретения мутантные полипептиды FGF21 по настоящему изобретению могут быть модифицированы посредством ковалентного присоединения одного или более полимеров. Например, в типичном случае отобранный полимер растворим в воде, поэтому белок, к которому он присоединяется, не выпадает в осадок в водной среде, такой как физиологическая среда. В сферу пригодных полимеров включены смеси полимеров. В целях терапевтического использования препарата,являющегося конечным продуктом, предпочтительно, чтобы полимер был фармацевтически приемлемым. Нерастворимые в воде полимеры, конъюгированные с мутантными полипептидами FGF21 по настоящему изобретению, также формируют один из аспектов изобретения. Типичные полимеры могут иметь любой молекулярный вес и быть разветвленными или неразветвленными. Каждый типичные полимер имеет средний молекулярный вес приблизительно от 2 до 100 кДа(термин "приблизительно" указывает на то, что в препаратах водорастворимых полимеров вес некоторых молекул будет отличаться в большую или меньшую сторону от заявленного молекулярного веса). Предпочтительно, чтобы средний молекулярный вес каждого полимера составлял приблизительно от 5 до 50 кДа, более предпочтительно приблизительно от 12 до 40 кДа и наиболее предпочтительно приблизительно от 20 до 35 кДа. Подходящие водорастворимые полимеры или их смеси включают, но не ограничиваясь ими, Nсцепленные или О-сцепленные углеводы, сахара, фосфаты, полиэтиленгликоль (ПЭГ) (включая такие формы ПЭГ, которые были использованы для получения производных белков, включая моно(C1-C10),алкокси- или арилоксиполиэтиленгликоль), монометоксиполиэтиленгликоль, декстран (такой как декстран низкого молекулярного веса, например приблизительно 6 кДа), целлюлозу или другие полимеры на углеводной основе, поли-(N-винилпирролидон)полиэтиленгликоль, гомополимеры пропиленгликоля,сополимеры пропиленоксида/этиленоксида, полиоксиэтилированные полиоли (например, глицерин) и поливиниловый спирт. Настоящее изобретение также охватывает бифункциональные поперечно сшитые молекулы, которые могут быть использованы для получения ковалентно связанных мультимеров мутантных полипептидов FGF21. Настоящее изобретение также охватывает мутанты FGF21, ковалентно присоединенные к полисиаловой кислоте. В некоторых вариантах осуществления настоящего изобретения мутант FGF21 ковалентно или химически модифицирован с присоединением одного или более водорастворимых полимеров, включая, но не ограничиваясь ими, полиэтиленгликоль (ПЭГ), полиоксиэтиленгликоль или пропиленгликоль; см.,например, патенты США 4640835, 4496689, 4301144, 4670417, 4791192 и 4179337. В некоторых вариантах осуществления настоящего изобретения мутант FGF21 содержит один или более полимеров,включая, но не ограничиваясь ими, монометоксиполиэтиленгликоль, декстран, целлюлозу, другой полимер на углеводной основе, поли(N-винилпирролидон)полиэтиленгликоль, гомополимеры пропиленгликоля, сополимера полипропиленоксида/этиленоксида, полиоксиэтилированные полиоли (например, глицерин), поливиниловый спирт или смеси таких полимеров. В некоторых вариантах осуществления настоящего изобретения мутант FGF21 ковалентно модифицирован субъединицами ПЭГ. В некоторых вариантах осуществления изобретения один или более водорастворимых полимеров связаны в одном или более специфических положений (например, на Nконце) мутанта FGF21. В некоторых вариантах осуществления изобретения один или более водорастворимых полимеров в случайном порядке прикреплены к одной или более боковых цепей мутанта FGF21. В некоторых вариантах осуществления изобретения ПЭГ используется для улучшения терапевтической производительности мутанта FGF21. Некоторые из таких способов обсуждаются, например, в патенте США 6133426, который включен в этот документ в качестве ссылки с любой целью. В тех вариантах осуществления настоящего изобретения, где полимером является ПЭГ, группа ПЭГ может иметь любой подходящий молекулярный вес и может быть линейной или разветвленной. Предпочтительно, чтобы средний молекулярный вес группы ПЭГ варьировался в приблизительном диапазоне от 2 до 100 кДа и более предпочтительно приблизительно от 5 до 50 кДа, например 10, 20, 30, 40 или 50 кДа. Группы ПЭГ обычно прикрепляются к мутанту FGF21 посредством ацилирования или восстановительного алкилирования через реактивную группу на компоненте ПЭГ (например, альдегидную, амино,тиоловую или эфирную группу), взаимодействующую с реактивной группой на мутанте FGF21 (например, альдегидной, амино или эфирной группой). ПЭГилирование (или пегилирование) полипептидов, включая мутанты FGF21 по настоящему изобретению, может специфически осуществляться с применением любых реакций пегилирования, известных в данной области знаний. Такие реакции описаны, например, в следующих ссылках: Francis et al.,1992, Focus on Growth Factors 3: 4-10, европейские патенты 0154316 и 0401384, патент США 4179337. Например, пегилирование можно осуществить посредством реакции ацилирования или реакции алкилирования с реактивной молекулой полиэтиленгликоля (или аналогичного реактивного водорастворимого полимера), как описано в данном документе. Для реакций ацилирования выбранный полимер должен иметь одну реактивную эфирную группу. Для восстановительного алкилирования выбранный полимер должен иметь одну реактивную альдегидную группу. Реактивным альдегидом является, напри- 17017690 мер, пропиональдегид полиэтиленгликоля, который стабилен в воде, либо его моно C1-C10-алкокси или арилокси производные (см., например, патент США 5252714). В некоторых вариантах осуществления настоящего изобретения полезная стратегия присоединения группы ПЭГ к полипептиду включает комбинирование через образование конъюгатной связи в растворе между пептидом и компонентом ПЭГ, при этом каждый из них несет особую функциональность с взаимной реактивностью по отношению друг к другу. Пептиды можно легко приготовить с помощью традиционного твердофазного синтеза. Пептиды "предварительно активированы", то есть имеют соответствующую функциональную группу в специфическом сайте. Перед реакцией с компонентом ПЭГ предшественники очищают и получают их полные характеристики. Сшивание пептида с ПЭГ обычно происходит в водной фазе, и его можно легко мониторировать посредством обращенно-фазовой аналитической ВЭЖХ (высокоэффективная жидкостная хроматография). Пегилированные пептиды можно легко очистить посредством препаративной ВЭЖХ и охарактеризовать посредством аналитической ВЭЖХ, аминокислотного анализа и лазерной десорбционной масс-спектрометрии. Полисахаридные полимеры представляют собой еще один тип водорастворимого полимера, который можно применять для модификации белка. Следовательно, мутанты FGF21 по настоящему изобретению, соединенные с полисахаридным полимером, формируют варианты осуществления настоящего изобретения. Декстраны представляют собой полисахаридные полимеры, состоящие из отдельных субъединиц глюкозы, преимущественно соединенных альфа 1-6 связями. Декстран, как таковой, доступен в широком диапазоне молекулярного веса и легко доступен в диапазоне молекулярного веса приблизительно от 1 до 70 кДа. Декстран является подходящим водорастворимым полимером для применения в качестве носителя самостоятельно или в комбинации с другим носителем (например, Fc); см., например,Международную патентную публикациюWO 96/11953. В ней было описано применение декстрана,конъюгированного с терапевтическими или диагностическими иммуноглобулинами; см., например, Европейскую патентную публикацию 0315456, которая включена в этот документ в качестве ссылки. Настоящее изобретение также охватывает применение декстрана с молекулярным весом приблизительно от 1 до 20 кДа. В целом, химическую модификацию можно проводить в любых подходящих условиях, которые способствуют реакции белка с активированной молекулой полимера. Способы приготовления химически модифицированных полипептидов обычно включают следующие этапы: (а) реакция полипептида с активированной молекулой полимера (такой как реактивное эфирное или альдегидное производное молекулы полимера) в таких условиях, при которых мутантный полипептид FGF21 прикрепляется к одной или более молекул полимера, и (b) получение продуктов реакции. Оптимальные условия реакции можно определить, основываясь на известных параметрах и желательном результате. Например, чем больше соотношение между молекулами полимера и белка, тем больше процентный показатель присоединения молекул полимера. В одном из вариантов осуществления настоящего изобретения химически модифицированные мутанты FGF21 могут иметь единичный компонент, представленный молекулой полимера на аминоконце (см., например, патент США 5234784). В другом варианте осуществления настоящего изобретения мутантные полипептиды FGF21 могут быть химически соединены с биотином. Затем комплексам биотина с мутантными полипептидами FGF21 дают возможность связываться с авидином, что приводит к образованию тетравалента авидин/биотин/мутантный полипептид FGF21. Мутантные полипептиды FGF21 также можно ковалентно соединять с динитрофенолом (DNP) или тринитрофенолом (TNP), а полученные в результате конъюгаты, осаждаемые антителами IgM типа антиDNP или анти-TNP образуют декамерные конъюгаты с валентностью 10. В целом, состояния, которые можно облегчить или модулировать введением химически модифицированных мутантов FGF21 по настоящему изобретению, включают те же состояния, которые описаны в данном документе для мутантных полипептидов FGF21. Однако химически модифицированные мутантыFGF21, раскрытые в данном документе, могут обладать дополнительными видами активности, усиленной или ослабленной биологической активностью или другими свойствами, такими как удлиненный или укороченный период полувыведения по сравнению с немодифицированными мутантами FGF21. 9. Терапевтические композиции мутантов FGF21 и их введение. Терапевтические композиции, включающие мутанты FGF21, относятся к сфере настоящего изобретения и специфически рассматриваются в свете идентификации различных мутантных последовательностей FGF21, проявляющих улучшенные свойства. Такие фармацевтические композиции с мутантамиFGF21 могут включать терапевтически эффективное количество мутантного полипептида FGF21 в смеси с фармацевтически или физиологически приемлемым формообразующим агентом, подобранным в соответствии с предполагаемым способом введения. Предпочтительно, чтобы приемлемые формообразующие материалы были нетоксичными для реципиентов в применяемых дозах и концентрациях. Фармацевтическая композиция может содержать формообразующие материалы для модификации,поддержания или сохранения, например, рН, осмолярности, вязкости, прозрачности, цвета, изотоничности, запаха, стерильности, стабильности, скорости разложения или высвобождения, адсорбции или пе- 18017690 нетрации композиции. Соответствующие формообразующие материалы включают, но не ограничиваясь ими, аминокислоты (такие как глицин, глутамин, аспарагин, аргинин или лизин), противомикробные средства, антиоксиданты (такие как аскорбиновая кислота, сульфит натрия или гидросульфит натрия),буферы (такие как бораты, бикарбонаты, трис-HCl, цитраты, фосфаты или другие органические кислоты), наполнители (такие как маннит или глицин), хелатообразующие агенты (такие как этилендиаминтетрауксусная кислота (EDTA, комплексообразующие агенты (такие как кофеин, поливинилпирролидон, бета-циклодекстрин или гидроксипропил-бета-циклодекстрин), заполнители, моносахариды, дисахариды и другие углеводы (такие как глюкоза, манноза или декстрины), белки (такие как сывороточный альбумин, желатин или иммуноглобулины), красящие, вкусоароматические или разбавляющие агенты,эмульгирующие агенты, гидрофильные полимеры (такие как поливинилпирролидон), полипептиды низкого молекулярного веса, солеобразующие противоионы (такие как натрий), консерванты (такие как бензалконий хлорид, бензойная кислота, салициловая кислота, тимеросал, фенилэтиловый спирт, метилпарабен, пропилпарабен, хлоргексидин, сорбиновая кислота или перекись водорода), растворители (такие как глицерин, пропиленгликоль или полиэтиленгликоль), сахарные спирты (такие как маннит или сорбит), суспендирующие агенты, сурфактанты или смачивающие агенты (такие как плюроники, ПЭГ, эфиры сорбита, полисорбаты, такие как полисорбат 20 или полисорбат 80, тритон, трометамин, лецитин, холестерин или тилоксапол), агенты, усиливающие стабильность (такие как сахароза или сорбит), агенты,усиливающие тоничность (такие как галиды щелочных металлов, предпочтительно хлорид натрия или калия, маннит, сорбит), транспортировщики для доставки, разбавители, наполнители и/или фармацевтические адъюванты (см., например, Remington's Pharmaceutical Sciences (18th Ed., A.R. Gennaro, ed., MackPublishing Company 1990) и последующие издания той же книги, которые включены в этот документ в качестве ссылки с любой целью). Оптимальную фармацевтическую композицию вполне может определить квалифицированный специалист в зависимости, например, от намеченного способа введения, формата доставки и желательной дозы (см., например, Remington's Pharmaceutical Sciences, выше). Такие композиции могут влиять на физическое состояние, стабильность, скорость высвобождения in vivo и скорость клиренса in vivo мутантного полипептида FGF21. Основной транспортировщик или носитель в фармацевтической композиции может быть водным или не водным по своей природе. Например, подходящим транспортировщиком или носителем для инъекций может быть вода, физиологический солевой раствор или искусственная спинно-мозговая жидкость, возможно с добавлением других материалов, общепринятых в композициях для парентерального введения. Другими типичными транспортировщиками являются забуференный физиологический раствор или физиологический раствор, смешанный с сывороточным альбумином. Другими типичными фармацевтическими композициями являются буфер трис с приблизительным значением рН 7,0-8,5 или ацетатный буфер с приблизительным значением рН 4,0-5,5, которые дополнительно могут включать сорбит или его подходящий заменитель. В одном из вариантов осуществления настоящего изобретения композиции с мутантным полипептидом FGF21 можно приготовить для хранения, смешивая выбранную композицию, имеющую желательную степень чистоты, с факультативными формообразующими агентами (Remington's Pharmaceutical Sciences, выше) в виде лиофилизированной таблетки или водного раствора. Кроме того, фармацевтический продукт с мутантным полипептидом FGF21 может выпускаться в виде лиофилизата с применением соответствующих наполнителей, таких как сахароза. Фармацевтические композиции с мутантным полипептидом FGF21 могут быть подобраны для парентеральной доставки. В альтернативном варианте можно подобрать композиции для ингаляции или для доставки через пищеварительный тракт, например пероральной. Изготовление таких фармацевтически приемлемых композиций относится к квалификации специалистов, работающих в данной области. Формообразующие компоненты представлены в таких концентрациях, которые приемлемы в месте введения композиции. Например, буферы применяют для поддержания рН композиции на физиологическом уровне или несколько ниже, обычно в приблизительном диапазоне рН от 5 до 8. Когда речь идет о парентеральном введении, терапевтическая композиция для применения по настоящему изобретению может представлять собой апирогенный, парентерально приемлемый водный раствор, содержащий желательный мутантный полипептид FGF21 и фармацевтически приемлемый транспортировщик. Особенно подходящим транспортировщиком для парентеральных инъекций является стерильная дистиллированная вода, в которой растворяют мутантный полипептид FGF21, получая в результате стерильный изотонический раствор, законсервированный соответствующим образом. Еще один препарат может включать лекарственный состав из желательной молекулы с таким агентом как инъекционный микросферы, биологически распадающиеся частицы, полимерные соединения (такие как полимолочная кислота или полигликолевая кислота), капельки или липосомы, обеспечивающие управляемое и длительное высвобождение продукта, который модно доставлять посредством депонированных инъекций. Также можно использовать гиалуроновую кислоту, что может стимулировать длительное пребывание композиции в кровотоке. Другие подходящие средства для введения желательной молекулы включают имплантируемые приспособления для доставки лекарств. В одном из вариантов осуществления изобретения может быть составлена фармацевтическая ком- 19017690 позиция для ингаляции. Например, мутантный полипептид FGF21 может быть оформлен в виде сухого порошка для ингаляции. Также можно приготовить ингаляционные растворы мутантного полипептидаFGF21 с пропеллентом для аэрозольной доставки. Еще в одном варианте осуществления изобретения растворы можно распылять при помощи небулайзера. Пульмональное (легочное) введение более подробно описано в Международной патентной публикацииWO 94/20069, которая описывает пульмональное введение химически модифицированных белков. Также рассматривается возможность перорального введения некоторых лекарственных составов. В одном из вариантов осуществления настоящего изобретения мутантные полипептиды FGF21, которые вводят таким способом, можно вводить в лекарственные составы вместе с носителями или без носителей,которые обычно используют при изготовлении твердых лекарственных форм, таких как таблетки и капсулы. Например, можно сконструировать капсулу для высвобождения активной части лекарственного состава в том отделе желудочно-кишечного тракта, где биологическая доступность лекарства будет максимальной, а распад до попадания в системный кровоток будет минимальным. Для того чтобы облегчить всасывание мутантного полипептида FGF21, в лекарственный состав можно включить дополнительные агенты. Можно также использовать разбавители, вкусоароматические вещества, воски с низкой температурой плавления, растительные масла, смазки, суспендирующие агенты, агенты для распада таблеток и связующие вещества. Фармацевтическая композиция другого типа может включать эффективное количество мутантного полипептида FGF21 в смеси с нетоксичными наполнителями, которые удобны для производства таблеток. Растворяя таблетки в стерильной воде или другом подходящем носителе, можно приготовить растворы в стандартной дозовой форме. Подходящие наполнители включают, но не ограничиваясь ими,инертные разбавители, такие как карбонат кальция, карбонат или бикарбонат натрия, лактозу или фосфат кальция, связующие агенты, такие как крахмал, желатин или гуммиарабик, а также смазывающие вещества, такие как стеарат магния, стеариновую кислоту или тальк. Квалифицированным специалистам будут очевидны дополнительные варианты фармацевтических композиций с мутантными полипептидамиFGF21, включая лекарственные составы с замедленным или контролируемым высвобождением мутантных полипептидов FGF21. Компетентным специалистам также должны быть известны методики составления многих других средств с замедленным или контролируемым высвобождением, таких как липосомные носители, биологически разрушаемые микрочастицы, пористый бисер и депонированные инъекции(см., например, такие ссылки, как Международная патентная публикацияWO 93/15722, которая описывает контролируемое высвобождение пористых полимерных микрочастиц для доставки фармацевтических композиций, WischkeSchwendeman, 2008, Int. J. Pharm. 364: 298-327, а также FreibergZhu,2004, Int. J. Pharm, 282: 1-18, в которых обсуждается изготовление и применение микросфер/микрочастиц). Дополнительные примеры препаратов с замедленным высвобождением включают полупроницаемые полимерные матрицы в виде изделий с определенной формой, например пленок или микрокапсул. Матрицы с замедленным высвобождением могут включать сложные полиэфиры, гидрогели, полилактиды (патент США 3773919 и европейский патент 0058481), сополимеры L-глутаминовой кислоты и гамма-этил-L-глутамата (Sidman et al., 1983, Biopolymers 22: 547-56), поли(2-гидроксиэтилметакрилат)(Langer et al., 1981, J. Biomed. Mater. Res. 15: 167-277 и Langer, 1982, Chem. Tech. 12: 98-105), этиленвинилацетат (Langer et al., выше) или поли-D(-)-3-гидроксибутировую кислоту (европейский патент 0133988). Композиции с замедленным высвобождением также могут включать липосомы, которые можно изготовить любым из множества способов, известных в данной области техники; см., например, Epstein et al., 1985, Proc. Natl. Acad. Sci. U.S.A. 82: 3688-92 и европейские патенты 0036676, 0088046 и 0143949. Типичная фармацевтическая композиция с мутантным полипептидом FGF21, применяемая для введения in vivo, должна быть стерильной. Этого можно достичь пропусканием через мембраны для стерильной фильтрации. При изготовлении лиофилизированной композиции стерилизацию с применением этого способа можно проводить или до лиофилизации, или после лиофилизации и восстановления. Композицию для парентерального введения можно хранить в лиофилизированном виде или в растворе. В дополнение к этому, парентеральную композицию обычно помещают в контейнер, имеющий стерильный порт доступа, например, в мешок для внутривенного раствора или во флакон с пробкой, которую можно проколоть иглой для подкожной инъекции. После составления фармацевтической композиции ее можно хранить в стерильных флаконах в виде раствора, суспензии, геля, эмульсии, твердого вещества, обезвоженного или лиофилизированного порошка. Такие лекарственные составы можно хранить или в готовой для применения форме, или в такой форме, которая требует восстановления перед введением (например, в лиофилизированной). В специфическом варианте осуществления настоящее изобретение направлено на наборы для изготовления модулей разовых доз, предназначенных для введения. Такие наборы могут включать как первый контейнер с сухим белком, так и второй контейнер с водным составом. В сферу этого изобретения также входят наборы, включающие однокамерные и многокамерные предварительно заполненные шприцы (например, шприцы с жидкостью и шприцы с лиофилизатом).- 20017690 Эффективное количество фармацевтической композиции с мутантным полипептидом FGF21 для терапевтического применения будет зависеть, например, от терапевтической ситуации и целевых объектов терапии. Квалифицированный специалист поймет, что подходящие уровни доз для лечения будут варьироваться, что частично зависит от вводимой молекулы, от показания для применения мутантного полипептида FGF21, от способа введения, а также от габаритов больного (веса тела, площади поверхности тела или размера органа) и от его/ее медицинского статуса (возраста и общего состояния здоровья). В соответствии с этим клиницист, стремясь добиться оптимального терапевтического эффекта, может титровать дозу и изменять способ введения лекарства. Типичная доза может варьироваться в приблизительном диапазоне от 0,1 мкг/кг до 100 мг/кг или более в зависимости от вышеупомянутых факторов. В других вариантах осуществления изобретения доза может варьироваться в приблизительном диапазоне от 0,1 мкг/кг до 100 мг/кг, от 1 мкг/кг до 100 мг/кг или от 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75 мкг/кг до 100 мг/кг. В других вариантах осуществления изобретения доза может составлять 50, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650,700, 750, 800, 850, 900, 950, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 2000, 3000, 4000, 5000, 6000,7000, 8000, 9000 мкг/кг или 10 мг/кг. Частота введения доз будет зависеть от фармакокинетических параметров мутантного полипептидаFGF21 в применяемом лекарственном составе. В типичном случае клиницист будет вводить композицию так, чтобы была достигнута доза, позволяющая добиться желательного лечебного эффекта. Следовательно, композицию можно вводить в виде разовой дозы, а также двух или более доз, разделенных по времени (которые могут содержать одно и то же или разное количество нужной молекулы), либо посредством непрерывного вливания через имплантируемое приспособление или катетер. Дальнейшую доводку правильной дозы обычно проводит средний специалист, что находится в пределах его компетенции и входит в сферу его повседневных задач. Правильную дозу устанавливают, исходя из соответствующих данных по дозовой зависимости реакции на лечение. Способ введения фармацевтической композиции соответствует известным способам, например перорально, через инъекцию: внутривенную, внутрибрюшинную, внутримозговую (интрапаренхиматозную или интравентрикулярную), внутримышечную, внутриглазную, внутриартериальную, интрапортальную(в воротную вену), внутрь повреждения, а также через системы с длительным высвобождением (которые могут быть инъекционными или представлять собой имплантируемые приспособления). При желании композиции можно вводить болюсной инъекцией, непрерывным вливанием или через имплантируемое приспособление. Альтернативно или в дополнение к этому, композицию можно вводить местно через имплантацию мембраны, губки или другого подходящего материала, который впитывает или инкапсулирует нужную молекулу. При использовании имплантируемого приспособления это приспособление можно имплантировать в любую подходящую ткань или орган, при этом доставка нужной молекулы может происходить через диффузию, рассчитанный по времени болюс или в виде непрерывного введения. 10. Возможности терапевтического применения мутантных полипептидов FGF21. Мутантные полипептиды FGF21 можно применять для лечения, диагностики, облегчения или профилактики многих заболеваний или патологических состояний, включая нарушения обмена веществ, но не ограничиваясь ими. В одном из вариантов осуществления изобретения нарушение обмена веществ,подлежащее лечению, представляет собой сахарный диабет, например диабет II типа. В другом варианте осуществления изобретения нарушением обмена веществ является ожирение. Другие варианты осуществления изобретения направлены на такие метаболические состояния или нарушения как дислипидемия,гипертония, гепатостеатоз, в частности неалкогольный гепатостеатоз (NASH), сердечно-сосудистое заболевание, в частности атеросклероз, и возрастные изменения обмена веществ. В прикладном варианте осуществления изобретения такое заболевание/патологическое состояние,как сахарный диабет или ожирение, можно лечить посредством введения больному, нуждающемуся с таком лечении, мутантного полипептида FGF21 в терапевтически эффективной дозе, как описано в данном документе. Введение можно осуществить в соответствии со способами, описанными в данном документе, в частности посредством внутривенной инъекции, внутрибрюшинной инъекции, внутримышечной инъекции или перорально в виде таблеток или жидкого лекарственного состава. В большинстве ситуаций нужную дозу может определить клиницист, как описано в данном документе, при этом нужная доза представляет собой терапевтически эффективную дозу мутантного полипептида FGF21. Квалифицированному специалисту будет очевидно, что терапевтически эффективная доза мутантного полипептида FGF21 будет зависеть, кроме всего прочего, от графика введения, от стандартной дозы вводимого антигена, от того, вводят ли молекулу нуклеиновой кислоты или полипептида в комбинации с другими терапевтическими средствами, от иммунного статуса и общего состояния здоровья реципиента. Термин"терапевтически эффективная доза" при использовании в данном документе означает, что количество мутантного полипептида FGF21, вызывающее биологическую или медицинскую реакцию в тканевой системе, в организме животного или человека, которое пытается определить исследователь, лечащий врач или другой клиницист, вызывает облегчение симптомов заболевания или расстройства, подлежащего лечению.- 21017690 11. Антитела. В объеме настоящего изобретения рассматриваются антитела и фрагменты антител, которые специфично связываются с мутантными полипептидами FGF21 по настоящему изобретению, но не дают специфического связывания с полипептидами FGF21 дикого типа. Антитела могут быть поликлональными, включая специфические поликлональные, моноклональными (MAb), рекомбинантными, химерными, гуманизированными, такими как антитела с пересаженным гипервариабельным участком (CDR),антителами человека, одноцепочечными и/или биспецифическими, а также могут представлять собой их фрагменты, варианты или химически модифицированные молекулы. Фрагменты антител включают те части антитела, которые специфически связываются с эпитопом на мутантном полипептиде FGF21. Примеры таких фрагментов включают фрагменты Fab и F(ab'), полученные в результате ферментативного расщепления полноразмерных антител. Другие связывающие фрагменты включают фрагменты, полученные методиками рекомбинантных ДНК, такими как экспрессия рекомбинантных плазмид, содержащих последовательности нуклеиновой кислоты, кодирующие вариабельные участки антитела. Поликлональные антитела, направленные против мутантного полипептида FGF21, обычно вырабатывают у животных (например, кроликов или мышей) посредством множественных подкожных или внутрибрюшинных инъекций мутантного полипептида FGF21 и адъюванта. Может оказаться полезным конъюгировать мутантный полипептид FGF21 с белковым носителем, который является иммуногеном для иммунизированного биологического вида, таким как гемоцианин лимфы улитки, сывороточный альбумин, тиреоглобулин крупного рогатого скота или соевый ингибитор трипсина. Для усиления иммунного ответа также используют агрегирующие агенты, такие как квасцы. После иммунизации у животных берут образцы крови и проводят анализ сыворотки на титр антитела против мутантного FGF21. Моноклональные антитела, направленные на мутантные полипептиды FGF21, можно производить любым способом, который предусматривает выработку молекул антитела непрерывной клеточной линией в культуре. Примеры подходящих способов для выработки моноклональных антител включают способы гибридомы, описанные Kohler et al., 1975, Nature 256: 495-97, и способ гибридомы из В-клеток человека (Kozbor, 1984, J. Immunol. 133: 3001; Brodeur et al., Monoclonal Antibody Production Techniques andApplications 51-63 (Marcel Dekker, Inc., 1987). Настоящее изобретение также предлагает клеточные линии, которые вырабатывают моноклональные антитела, реагирующие с мутантными полипептидамиFGF21. Моноклональные антитела по изобретению можно модифицировать для применения в качестве лекарственных средств. В одном из вариантов осуществления изобретения моноклональное антитело представляет собой "химерное" антитело, в котором часть тяжелой (Н) и/или легкой (L) цепи идентична или гомологична соответствующей последовательности в антителах, полученных от определенного биологического вида или принадлежащих к особому классу/подклассу антител, тогда как остальная часть цепи(цепей) идентична или гомологична соответствующей последовательности в антителах, полученных от другого биологического вида или принадлежащих к другому классу/подклассу антител. Сюда же можно включить фрагменты таких антител, которые способны проявлять нужную биологическую активность; см., например, патент США 4816567, Morrison et al., 1985, Proc. Natl Acad. Sci. U.S.A. 81: 6851-55. В другом варианте осуществления моноклональное антитело по изобретению представляет собой"гуманизированное" антитело. Способы гуманизации антител, происходящих не от человека, хорошо известны в данной области техники; см., например, патенты США 5585089 и 5693762. Обычно гуманизированное антитело имеет один или более аминокислотных остатков, встроенных в него из источника нечеловеческого происхождения. Гуманизацию можно провести, например, применяя способы,описанные в данной области техники (см., например, Jones et al., 1986, Nature 321: 522-25; Riechmann etal., 1998, Nature 332: 323-27; Verhoeyen et al., 1988, Science 239: 1534-36), посредством замещения как минимум части гипервариабельного участка антитела грызуна соответствующими участками из антитела человека. Изобретение также охватывает антитела человека, которые связывают мутантные полипептидыFGF21 по настоящему изобретению. Используя трансгенных животных (например, мышей), которые способны вырабатывать набор антител человека при отсутствии эндогенной выработки иммуноглобулина, такие антитела получают, иммунизируя животных антигеном мутанта FGF21 (т.е. антигеном, имеющим как минимум 6 смежных аминокислот), факультативно соединенных с носителем; см., например,Jakobovits et al., 1993, Proc. Natl. Acad. Sci. U.S.A. 90: 2551-55; Jakobovits et al., 1993, Nature 362: 255-58;Bruggermann et al., 1993, Year in Immuno. 7: 33. В одном из способов таких трансгенных животных получают, выводя из строя эндогенные локусы, кодирующие у них тяжелые и легкие цепи иммуноглобулина,и вставляя в их геном локусы, кодирующие белки тяжелых и легких цепей человека. Затем частично модифицированных животных, т.е. животных, имеющих неполный комплект модификаций, скрещивают,чтобы получить животное, имеющее все нужные модификации иммунной системы. При введении иммуногена эти трансгенные животные вырабатывают антитела с аминокислотными последовательностями человека (скорее чем, например, с мышиными), включая вариабельные участки, которые иммуноспецифичны для этих антигенов; см., например, международные патентные публикацииWO 96/33735 иWO 94/02602. Дополнительные способы описаны в патенте США 5545807, международных патентных- 22017690 публикацияхWO 91/10741 и WO 90/04036, а также в европейском патенте 0546073. Антитела человека также можно вырабатывать посредством экспрессии рекомбинантной ДНК в клетках-хозяевах или экспрессии в клетках гибридомы, как описано в данном документе. В альтернативном варианте осуществления изобретения антитела человека также можно получать из библиотек фагового дисплея (см., например, Hoogenboom et al., 1991, J. Mol. Biol. 227: 381; Marks etal., 1991, J. Mol. Biol. 222: 581). Эти процессы имитируют иммунный отбор через демонстрацию репертуара антител на поверхности нитевидного бактериофага и последующий отбор фага посредством его связывания с антигеном выбора. Одна из таких методик описана в международной патентной публикацииWO 99/10494, которая описывает выделение высокоаффинных и функциональных агонистических антител для MPL- и msk-рецепторов с применением такого подхода. Химерные антитела, антитела с пересаженным CDR и гуманизированные антитела обычно получают рекомбинантными способами. Нуклеиновые кислоты, кодирующие антитела, вводят в клетки-хозяева и экспрессируют, применяя материалы и процедуры, описанные в данном документе. В одном из вариантов осуществления изобретения антитела вырабатывают в клетках-хозяевах млекопитающего, таких как клетки СНО. Моноклональные (например, человеческие) антитела можно получать посредством экспрессии рекомбинантной ДНК в клетках-хозяевах или в клетках гибридомы, как описано в данном документе. Антитела против мутанта FGF21 по изобретению можно использовать в любом известном способе анализа для выявления и количественной оценки мутантных полипептидов FGF21, таком как анализы конкурентного связывания, прямые и непрямые сэндвич-анализы и анализы иммунопреципитации (см.,например, публикацию Sola, Monoclonal Antibodies: A Manual of Techniques 147-158 (CRC Press, Inc.,1987), включенную в этот документ в качестве ссылки во всей полноте ее содержания). Антитела будут связывать мутантные полипептиды FGF21 с аффинностью, которая соответствует используемому методу анализа. При диагностическом использовании в некоторых вариантах осуществления изобретения антитела против мутантов FGF21 можно пометить выявляемым компонентом. Выявляемый компонент может представлять собой любой компонент, который способен создавать прямым или непрямым образом поддающийся выявлению сигнал. Например, выявляемым компонентом может быть радиоизотоп, такой как 3 Н, 14 С, 32 Р, 35S, 125I, 99 Тс, 111In или 67Ga, флуоресцентное или хемилюминесцентное соединение, такое как флуоресцинизотиоцианат, родамин или люциферин, а также фермент, такой как щелочная фосфатаза, галактозидаза или пероксидаза хрена (Bayer et al., 1990, Meth. Enz. 184: 138-63). Анализы с конкурентным связыванием основаны на способности меченого стандарта (например,мутантного полипептида FGF21 или его иммунологически реактивной части) конкурировать с испытуемым анализируемым продуктом (например, мутантным полипептидом FGF21) за связывание с ограниченным количеством антитела против мутанта FGF21. Количество мутантного полипептида FGF21 в испытуемом образце обратно пропорционально количеству стандарта, который вступает в связь с антителами. Для того чтобы облегчить определение количества связанного стандарта, антитела обычно инсобилизируют (переводят в нерастворимую форму) до или после конкуренции, чтобы стандарт и анализируемый продукт, связанные с антителами, было удобно отделить от стандарта и анализируемого продукта, оставшихся несвязанными. Сэндвич-анализы обычно включают использование двух антител, каждое из которых способно связываться с самостоятельной иммуногенной частью или эпитопом белка, подлежащего выявлению или количественной оценке. В сэндвич-анализе тестируемый образец анализируемого продукта обычно связывается с первым антителом, которое иммобилизовано на твердой опоре, а затем второе антитело связывается с анализируемым продуктом, формируя таким образом комплекс из трех частей, см., например,патент США 4376110. Второе антитело, само по себе, может быть мечено выявляемым компонентом(прямые сэндвич-анализы) или измеряться с применением антитела против иммуноглобулина, которое мечено выявляемым компонентом (непрямые сэндвич-анализы). Например, одним из типов сэндвичанализа является твердофазный иммуноферментный анализ (ELISA), в котором выявляемый компонент представляет собой фермент. Антитела против мутанта FGF21 по настоящему изобретению также полезны для получения визуальных изображений in vivo. Антитело, меченное выявляемым компонентом, можно ввести животному предпочтительно в кровоток с последующей оценкой наличия и локализации меченого антитела в организме хозяина. Антитело можно пометить любым компонентом, который поддается выявлению у животного способами ядерного магнитного резонанса, радиологии или другими средствами выявления, известными в данной области техники. Антитела к мутантам FGF21 по изобретению можно использовать как лекарственные средства. Терапевтические агенты обычно являются агонистами или антагонистами в том смысле, что они либо усиливают, либо ослабляют соответственно как минимум одну из биологических активностей мутантного полипептида FGF21. В одном из вариантов осуществления антагонистические антитела по изобретению представляют собой антитела или их связывающие фрагменты, которые способны к специфическому связыванию с мутантным полипептидом FGF21 и которые способны подавлять или устранять функцио- 23017690 нальную активность мутантного полипептида FGF21 in vivo или in vitro. В некоторых вариантах осуществления изобретения антагонистическое антитело будет подавлять функциональную активность мутантного полипептида FGF21 как минимум приблизительно на 50% и предпочтительно как минимум приблизительно на 80%. Еще в одном варианте осуществления изобретения антитело против мутанта способно вмешиваться во взаимодействие между мутантным полипептидом FGF21 и рецептором FGF,таким образом подавляя или устраняя активность мутантного полипептида FGF21 in vitro или in vivo. Агонистические и антагонистические антитела против мутанта FGF21 идентифицируют скринирующими анализами, которые хорошо известны в данной области техники. Изобретение также относится к набору, включающему антитела против мутанта FGF21 и другие реактивы, полезные для выявления уровня мутантного полипептида FGF21 в биологических образцах. Такие реактивы могут включать выявляемую метку, блокирующую сыворотку, положительные и отрицательные контрольные образцы, а также реактивы для выявления. Примеры Приведенные ниже примеры иллюстрируют специфические варианты осуществления изобретения и различные варианты его применения. Они сформулированы только в целях пояснения, и их не следует воспринимать как ограничивающие сферу действия изобретения каким-либо образом. Пример 1. Изготовление конструкций для экспрессии FGF21. Последовательность нуклеиновой кислоты, кодирующую зрелый полипептид FGF21, получали посредством амплификации в полимеразной цепной реакции (ПЦР) с использованием праймеров, имеющих нуклеотидные последовательности, которые соответствуют 5'- и 3'-концам последовательности зрелого FGF21. Табл. 2 перечисляет праймеры, использованные амплификации последовательности зрелогоFGF21. Таблица 2 Праймеры ПЦР для конструкции FGF21 Праймеры, использованные для изготовления конструкции, экспрессирующей FGF21, включали сайты рестрикционной эндонуклеазы для направленного клонирования последовательности в подходящий вектор экспрессии (например, рЕТ 30 (Novagen/EMD Biosciences; Сан-Диего, штат Калифорния) илиpAMG33 (Amgen; Саузенд Оукс, штат Калифорния. Вектор экспрессии pAMG33 содержит низкокопийную точку начала репликации R-100, модифицированный промотор lac и ген устойчивости к канамицину. Вектор экспрессии рЕТ 30 содержит точку начала репликации, полученную из pBR322, индуцируемый промотор Т 7 ген устойчивости к канамицину. Было обнаружено, что экспрессия из pAMG33 выше,но рЕТ 30 является более надежным вектором для клонирования. Таким образом, большинство конструкций, описанных в настоящей патентной заявке, сначала были созданы в рЕТ 30, а затем скринированы на эффективность. После этого отобранные последовательности были перенесены в pAMG33 для дальнейшей амплификации. Последовательность FGF21 была амплифицирована в реакционной смеси, содержащей 40,65 мклdH2O, 5 мкл реакционного буфера PfuUltra II Reaction Buffer (10), 1,25 мкл смеси dNTP (40 мМ-410 мМ), 0,1 мкл матрицы (100 нг/мл), 1 мкл праймера 1 (10 мкм), 1 мкл праймера 2 (10 мкм) и 1 мкл соединяющей ДНК-полимеразы HS PfuUltra II (Stratagene, Ла-Хойя, штат Калифорния). Реакции амплификации проводили с нагреванием в течение 2 мин при 95 С, сопровождающимся десятью циклами при 95 С в течение 20 с, 60 С в течение 20 с (с дополнительным вычитанием 1 С на цикл) и 72 С в течение 15 с на килобазу нужного продукта, после чего проводили 20 циклов при 94 С в течение 20 с, 55 С в течение 20 с и 72 С в течение 15 с на килобазу нужного продукта, а затем 72 С в течение 3 мин. Продукты амплификации расщепляли рестрикционными эндонуклеазами Ndel, Dpnl и EcoRI, вшивали в подходящий вектор, а затем встраивали в компетентную клетку для ее трансформации. Пример 2. Очистка белков FGF21, полученных из бактерий. В последующих примерах различные белки FGF21, включая полипептид FGF21 дикого типа, усеченные полипептиды FGF21, мутанты FGF21 и гибридные белки FGF21, были экспрессированы в бактериальной системе экспрессии. После экспрессии, которая описана ниже, белки FGF21 были очищены,как описано в этом примере, если специально не указано иное. Для очистки полипептида FGF21 дикого типа, усеченных полипептидов FGF21 и мутантов FGF21 от бактериальных телец включений дважды отмытые тельца включений (DWIB) солюбилизировали в солюбилизационном буфере, содержащем гуанидина гидрохлорид и DTT в буфере Tris при рН 8,5, затем перемешивали в течение 1 ч при комнатной температуре и солюбилизированную смесь добавляли к буферу для рефолдинга, содержащему мочевину, аргинин, цистеин и цистамина гидрохлорид при рН 9,5, а затем перемешивали 24 ч при 5 С (см., например, Clarke, 1998, Curr. Opin. Biotechnol. 9: 157-63; Mannall- 24017690 После солюбилизации и рефолдинга смесь пропускали через фильтр с размером ячеек 0,45 мкм. Затем концентрацию пула рефолдинга увеличивали приблизительно в 10 раз, используя для этого отделяющую кассету Pall Omega с молекулярным весом 10 кДа при трансмембранном давлении (ТМР) 20 psi,а также проводили диафильтрацию с 3 об. колонки 20 мМ Tris, рН 8,0 при ТМР 20 psi. После этого очищенный образец подвергали анионообменной хроматографии (АЕХ) с применением смолы Q Sepharose HP. Линейный солевой градиент от 0 до 250 мМ NaCl в 20 мМ Tris прогоняли при рН 8,0 и температуре 5 С. Пиковые фракции анализировали методом SDS-PAGE и объединяли. Затем пул элюата АЕХ подвергали хроматографии гидрофобного взаимодействия (HIC) с применением смолы Phenyl Sepharose HP. Белок элюировали, применяя понижающийся линейный градиент от 0,7 до 0 М сульфата аммония при рН 8,0 и температуре окружающей среды. Пиковые фракции анализировали методом by SDS-PAGE (Laemmli, 1970, Nature 227: 680-85) и объединяли. Концентрацию пула HIC увеличивали до 7 мг/мл, применяя для этого отделяющую кассету PallOmega 0,2 м 2 с молекулярным весом 10 кДа при ТМР 20 psi. Проводили диафильтрацию концентрата с 5 об. колонки 10 мМ KPO4, 5% сорбита, рН 8,0 при ТМР 20 psi, а восстановленный концентрат разбавляли до 5 мг/мл. Наконец, раствор фильтровали через позидиновую мембрану Pall mini-Kleenpac 0,2 мкМ. Для очистки составных белков FGF21 и составных мутантных белков FGF21 от бактериальных телец включений дважды отмытые тельца включений (DWIB) солюбилизировали в солюбилизационном буфере, содержащем гуанидина гидрохлорид и DTT в буфере Tris при рН 8,5, затем перемешивали в течение 1 ч при комнатной температуре и солюбилизированную смесь добавляли к буферу для рефолдинга,содержащему мочевину, аргинин, цистеин и цистамина гидрохлорид при рН 9,5, а затем перемешивали 24 ч при 5 С (см., например, Clarke, 1998, Curr. Opin. Biotechnol. 9: 157-63; Mannall et al., 2007, Biotechnol. Bioeng. 97: 1523-34; Rudolph et al. 1997, "Folding proteins", Protein Function: A Practical Approach(Creighton, ed., New York, IRL Press) 57-99 и Ishibashi et al., 2005, Protein Expr. Purif. 42: 1-6). После солюбилизации и рефолдинга смесь подвергали диализу в 5 об. 20 мМ Tris, рН 8,0 применяя диализную трубку 10 кДа. Уровень рН диализированного перевернутого материала доводили до 5,0 при помощи 50% уксусной кислоты, а затем осветляли материал центрифугированием в течение 30 мин при 4K. После этого осветленный образец подвергали анионообменной хроматографии (АЕХ) с применением смолы Q Sepharose HP. Линейный солевой градиент от 0 до 250 мМ NaCl в 20 мМ Tris прогоняли при 8,0 и температуре 5 С. Пиковые фракции анализировали методом SDS-PAGE (Laemmli, 1970, Nature 227: 680-85) и объединяли. Затем пул элюата АЕХ подвергали хроматографии гидрофобного взаимодействия (HIC) с применением смолы Phenyl Sepharose HP. Белок элюировали, применяя понижающийся линейный градиент от 0,6 до 0 М сульфата аммония при рН 8,0 и температуре окружающей среды. Пиковые фракции анализировали методом SDS-PAGE и объединяли. После этапа HIC пул подвергали диализу в 60 об. 10 мМ Tris, 2,2% сахарозы, 3,3% сорбита при рН 8,5. Концентрацию диализированного пула увеличивали до 5 мг/мл, применяя устройство Jumbosep. Наконец, раствор фильтровали через позидиновую мембрану Pall mini-Kleenpac 0,2 мкМ. Пример 3. Изготовление и экспрессия усеченных белков FGF21. Конструкции, кодирующие усеченные белки FGF21 и перечисленные в табл. 3, были получены посредством амплификации в ПЦР вектора экспрессии FGF21 дикого типа, как описано ниже (конструкция вектора экспрессии FGF21 дикого типа описана в примере 1). Таблица 3 Усечения FGF21 Усеченные белковые конструкции FGF21 были изготовлены с применением праймеров, имеющих последовательности, которые гомологичны участкам, расположенным выше и ниже кодона (или кодонов), подлежащего делеции (что приводит к усечению). Праймеры, использованные в таких реакциях амплификации, также обеспечивали приблизительно 15 нуклеотидов перекрывающейся последовательности, что позволяло рециркуляризировать амплифицированный продукт, а именно весь вектор, теперь содержащий нужный мутант. Типичная усеченная конструкция FGF21, кодирующая белок FGF21, в котором утрачен остаток гистидина в положении 1 зрелой последовательности FGF21 (т.е. усеченный мутант 2-181), была изготовлена с применением праймеров, показанных в табл. 4.- 26017690 Таблица 4 Праймеры ПЦР для изготовления типичного усеченного мутанта FGF21 Праймеры, показанные в табл. 4, рассчитаны на делецию остатка гистидина, как показано ниже, при этом верхняя последовательность (SEQ ID NO: 10) является частью зрелого полипептида FGF21, включающей N-концевой метионин, вторая последовательность является смысловым праймером (SEQ ID NO: 7), третья и четвертая последовательности (SEQ ID NO: 11 и SEQ ID NO: 12) являются частями конструкции, экспрессирующей FGF21, а пятая последовательность является антисмысловым праймером (SEQ Усеченные конструкции белка FGF21 были изготовлены с применением, по существу, тех же условий ПЦР, что описаны в примере 1. Продукты амплификации были подвергнуты расщеплению рестрикционной эндонуклеазой Dpnl, а затем введены в компетентные клетки для их трансформации. Полученные в результате клоны были секвенированы, чтобы подтвердить отсутствие ошибок, вызванных полимеразой. Усеченные белки FGF21 были экспрессированы посредством трансформации компетентных клетокBL21 (DE3) или BL21 Star (Invitrogen, Карлсбад, штат Калифорния) конструкцией, кодирующей частично усеченный белок FGF21. Трансформанты выращивали в течение ночи с ограниченной аэрацией в среде ТВ с добавлением 40 мкг/мл канамицина, аэрировали на следующее утро и после короткого периода восстановления индуцировали в 0,4 мМ IPTG. Мутанты FGF21 собирали центрифугированием через 1820 ч после индукции. Пример 4. Активность усеченных белков FGF21 in vitro. Были проведены эксперименты по идентификации усеченных белков FGF21, которые сохраняют активность FGF21 дикого типа в анализе на ELK-люциферазу in vitro. Табл. 5 показывает в сводном виде результаты, полученные для белков FGF21, имеющих усечения на N-конце, С-конце или как на N-конце,так и на С-конце. Анализы на ELK-люциферазу проводили с использованием рекомбинантной системы почечных клеток человека 293 Т, в которой клетки 293 Т избыточно экспрессируют генные конструкции бета-клото и репортера люциферазы. Эти конструкции также содержат последовательности, кодирующие GAL4-ELK1 и 5UAS-Luc, репортер люциферазы, управляемый промотором, который содержит тандемные копии сайта связывания Gal4. Бета-клото представляет собой корецептор, который востребован FGF21 для активации его FGF-рецепторов и индуцирования трансдукции внутриклеточного сигнала,который, в свою очередь, приводит к фосфорилированию Erk и ELK. Активность люциферазы регулируется уровнем фосфорилированного Erk/ELK1 и используется для непрямого мониторирования и количественной оценки активности FGF21. Анализы на ELK-люциферазу проводили, культивируя клетки 293 Т в присутствии разных концентраций полипептида FGF21 дикого типа или мутантного полипептида FGF21 в течение 6 ч, после чего проводили оценку клеточных лизатов на активность люциферазы. На фиг. 1A, 1B показывают результаты анализа активности ELK-люциферазы, проведенного на усеченных мутантах FGF21 7-181 и 8-181(фиг. 1 А) и усеченных мутантах FGF21 1-172, 1-171, 1-169 и 1-164 (фиг. 1 В). Люминесценция, полученная в анализах на активность ELK-люциферазы в каждом из усеченных мутантов FGF21: 3-181, 4-181, 5181, 7-181, 8-181, 1-180, 1-178, 1-177, 1-176, 1-175, 1-174, 1-173, 1-172, 9-181 и 1-149, показана на фиг. 2. Мутантные полипептиды FGF21 сравнивали со стандартом FGF21 дикого типа, а мутанты, показывающие эффективность, составляющую как минимум 50% эффективности FGF21 дикого типа, считали не утратившими активность FGF21 (в табл. 5 они помечены символом "+"). Собирательный взгляд на результаты, представленные в табл. 5 указывает на то, что С-концевые делеции 14 или более аминокислотных остатков (т.е. белка FGF21 с С-концевым усечением, состоящим из аминокислотных остатков 1-167 и более коротких белков) приводят к элиминации активности FGF21. В дополнение к этому, таблица 5 указывает на то, что N-концевые делеции 7 или более аминокислотных остатков (т.е. белка FGF21 с N-концевым усечением, состоящим из аминокислотных остатков 8-181 и более коротких белков) приводят к элиминации активности FGF21. Не удивительно, что усеченные белки FGF21, имеющие как N-концевые усечения от 8 до 14 остатков, так и С-концевые усечения от 12 до 32 остатков по результатам анализов на ELK-люциферазу утрачивали активность. В соответствии с данными, представленными в табл. 5, усеченные полипептиды FGF21, имеющиеN-концевые усечения менее 7 аминокислотных остатков, составляют варианты осуществления настоящего изобретения. Сходным образом, усеченные полипептиды FGF21, имеющие С-концевые усечения менее 13 аминокислотных остатков, составляют варианты осуществления настоящего изобретения. Пример 5. Активность усеченных белков FGF21 in vivo. Белок FGF21 обладает множеством видов биологической активности, включая способность понижать в крови уровень глюкозы, инсулина, триглицеридов или холестерина, уменьшать вес тела, а также улучшать толерантность к глюкозе, потребление энергии и чувствительность к инсулину. Далее усеченные полипептиды FGF21 были проанализированы на активность FGF21 in vivo посредством введения усеченных полипептидов FGF21 инсулинорезистентным мышам ob/ob и измерения способности частично усеченных полипептидов FGF21 понижать уровень глюкозы в крови. Тестируемый усеченный полипептид FGF21 впрыскивали внутрибрюшинно 8-недельным мышам ob/ob (Jackson Laboratory) и после разовой инъекции брали у животных образцы крови в разных точках времени, например через 0, 6, 24,72, 120 и 168 ч после инъекции. Уровень глюкозы в крови измеряли глюкометром OneTouch (LifeScan,Inc. Милпитас, штат Калифорния) и результаты измерений выражали в виде процентного изменения уровня глюкозы по сравнению с начальным уровнем глюкозы в крови (т.е. в точке времени 0). Результаты одного из экспериментов представлены на фиг. 3, которая отображает количество глюкозы в крови, выявленное у мышей, которым впрыскивали усеченные мутанты FGF21 8-181 и 9-181. Этот эксперимент продемонстрировал, что усеченные составные белки FGF21, включающие аминокислотные остатки 8-181, проявляют активность по снижению уровня глюкозы в крови in vivo, однако эта активность несколько меньше по сравнению с активностью FGF21 дикого типа через 3 и 6 ч после инъекции, но усеченные составные белки FGF21, включающие аминокислотные остатки 9-181, не проявляют- 28017690 такой активности. Таким образом, анализ эффектов, производимых усеченными полипептидами FGF21in vivo, показал, что делеция до 7 аминокислот с N-конца зрелого FGF21 не аннулирует биологическую активность молекулы (в отличие от анализа in vitro, результаты которого позволяли предположить, что делеция 7 аминокислот с N-конца зрелого FGF21 аннулирует такую активность). Различные результаты, полученные для отдельных полипептидов FGF21 с N-концевыми усечениями (например, FGF218-181) в анализах in vitro и in vivo, можно объяснить взаимодействием FGF21 с бета-клото и рецептором FGF при осуществлении сигнальной трансдукции. Более конкретно, FGF21 активирует двойной комплекс рецептора, включающий корецептор бета-клото и рецептор FGF (FGFR), который инициирует сигнальный каскад, включающий тирозинкиназу. Было показано, что N-конец FGF21 вовлечен в связывание и активацию FGFR, тогда как С-конец FGF21 необходим для взаимодействия с бета-клото (Yie et al., 2009 FEBS Lett. 583:19-24). Анализ на ELK-люциферазу in vitro был проведен с почечными клетками 293, в которых избыточно экспрессируется корецептор бета-клото, a FGFR экспрессируется на нормальном уровне. Количество FGFR по сравнению с количеством бета-клото относительно мало, следовательно, соотношение между бета-клото и FGFR в клетках 293 не является физиологическим, что может повлиять на формирование рецепторного комплекса, и, в конечном итоге, на связывание лиганда и активацию FGFR. Клеточная система 293 in vitro, по-видимому, более уязвима к полипептидам FGF21 с N-концевыми усечениями, следовательно, она могла давать потерю результатов при анализе активности нескольких протестированных мутантов с N-концевыми усечениями, в частностиFGF21 8-181. Таким образом, при определении того, сохраняет ли определенный мутант FGF21 с Nконцевым усечением активность FGF21 дикого типа, активность этого мутанта FGF21 в анализе in vivo рассматривалась как диспозитивная (допускающая выбор из нескольких вариантов). В соответствии с этим, усеченные полипептиды FGF21, имеющие N-концевые усечения менее 8 аминокислотных остатков, охватываются изобретением. Пример 6. Изготовление и экспрессия усеченных составных белков FGF21. Поскольку период полувыведения белка можно увеличить, соединяя белок с последовательностьюFGF21. Усеченные составные белки FGF21, перечисленные в табл. 6, были изготовлены из амплифицированных последовательностей FGF21 посредством ПЦР типа SOE (сплайсинг генов с удлинением перекрывания). Составные белки FGF21 были изготовлены таким образом, что участок Fc гена иммуноглобулина человека IgG1 (SEQ ID NO: 13) был присоединен или к N-концу, или к С-концу белка FGF21. Таблица 6 Усеченные составные белки FGF21
МПК / Метки
МПК: A61K 38/18, C07K 14/50
Метки: fgf21, применение, мутанты
Код ссылки
<a href="https://eas.patents.su/30-17690-mutanty-fgf21-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Мутанты fgf21 и их применение</a>
Предыдущий патент: Комбинированный телескопический гидроцилиндр двустороннего действия для больших ходов
Следующий патент: Производные оксадиазола, активные в отношении сфингозин-1-фосфата (s1p)
Случайный патент: Способ выделения высокочистого диоксида углерода












