Производные n,n-дибензил-2-аминопиримидина и лекарственные средства, их содержащие
Номер патента: 17321
Опубликовано: 30.11.2012
Авторы: Ямазаки Коити, Сибуя Кимиюки, Араи Тосихару, Миура Тору, Охгия Тадааки, Мийосава Катсутоси, Окуда Аюму, Аоки Таро, Сибата Харуки
Формула / Реферат
1. Соединение формулы (I) или его соль или сольват
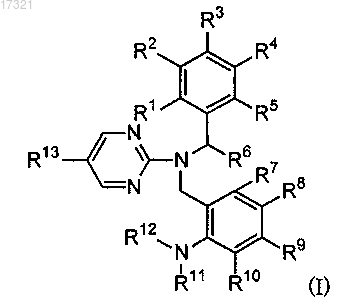
где R1, R2, R3, R4 и R5 являются одинаковыми или отличными друг от друга и представляют атом водорода, галоид (C1-С6алкильную) группу или цианогруппу,
R6 представляет C1-С6алкильную группу,
R7, R8, R9 и R10 являются одинаковыми или отличными друг от друга и представляют атом водорода, атом галогена, C1-С6алкильную группу, галоид (C1-С6алкильную) группу или C1-С6алкоксигруппу,
R11 и R12 являются одинаковыми или различными и представляют C1-C6алкильную группу или (С3-С8циклоалкил)(C1-С6алкильную) группу (данная (С3-С8циклоалкил)(С1-С6алкильная) группа может иметь одну гидроксикарбонил (C1-С6алкильную) группу или (C1-С6алкокси)карбонил(C1-С6алкильную) группу в качестве заместителя в циклоалкильной группе), или R11 и R12 объединены с образованием морфолиногруппы или пиперидиногруппы вместе с соседним атомом азота (морфолино- или пиперидиногруппа может иметь 1 или 2 С1-С6алкильные группы в качестве заместителя),
R13 представляет (С1-С6алкил)тио(С1-С6алкокси)группу, (C1-С6алкил)сульфинил(C1-С6алкокси) группу, или (C1-С6алкил)сульфонил(C1-С6алкокси)группу,
и формула (I) представляет как индивидуальные энантиомеры, так и их смеси.
2. Соединение или его соль или сольват по п.1, выбранное из
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-({2-[(циклопентилметил)(этил)амино]-5-(трифторметил)фенил}метил)-5-[2-(метилтио)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-({2-[(циклопентилметил)(этил)амино]-5-(трифторметил)фенил}метил)-5-[2-(метилсульфинил)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-({2-[(циклопентилметил)(этил)амино]-5-(трифторметил)фенил}метил)-5-[2-(метилсульфонил)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-({2-[(циклопентилметил)(этил)амино]-5-метоксифенил}метил)-5-[2-(метилтио)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-({2-[(циклопентилметил)(этил)амино]-5-метоксифенил}метил)-5-[2-(метилсульфонил)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-({2-[(циклопентилметил)(этил)амино]-3,5-дифторфенил}метил)-5-[2-(метилтио)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-({2-[(циклопентилметил)(этил)амино]-3,5-дифторфенил}метил)-5-[2-(метилсульфонил)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-({2-[(циклопентилметил)(этил)амино]-5-метилфенил}метил)-5-[2-(метилтио)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-({2-[(циклопентилметил)(этил)амино]-5-метилфенил}метил)-5-[2-(метилсульфонил)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-({2-[(циклопентилметил)(этил)амино]-4-фторфенил}метил)-5-[2-(метилтио)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-({2-[(циклопентилметил)(этил)амино]-4-фторфенил}метил)-5-[2-(метилсульфонил)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-({2-[(циклопентилметил)(этил)амино]-4-метоксифенил}метил)-5-[2-(метилтио)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-({2-[(циклопентилметил)(этил)амино]-4-метоксифенил}метил)-5-[2-(метилсульфонил)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-({2-[(циклопентилметил)(этил)амино]-4-(трифторметил)фенил}метил)-5-[2-(метилтио)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-({2-[(циклопентилметил)(этил)амино]-4-(трифторметил)фенил}метил)-5-[2-(метилсульфинил)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-({2-[(циклопентилметил)(этил)амино]-4-(трифторметил)фенил}метил)-5-[2-(метилсульфонил)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-({2-хлор-6-[(циклопентилметил)(этил)амино]-3-метилфенил}метил)-5-[2-(метилтио)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-({2-хлор-6-[(циклопентилметил)(этил)амино]-3-метилфенил}метил)-5-[2-(метилсульфонил)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-({2-[(циклопентилметил)(этил)амино]фенил}метил)-5-[2-(метилтио)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-({2-[(циклопентилметил)(этил)амино]фенил}метил)-5-[2-(метилсульфонил)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-({2-[(циклопентилметил)(этил)амино]-4,5-дифторфенил}метил)-5-[2-(метилтио)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-({2-[(циклопентилметил)(этил)амино]-4,5-дифторфенил}метил)-5-[2-(метилсульфонил)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-({4-хлор-2-[(циклопентилметил)(этил)амино]фенил}метил)-5-[2-(метилтио)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-({4-хлор-2-[(циклопентилметил)(этил)амино]фенил}метил)-5-[2-(метилсульфонил)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-({2-[(циклопентилметил)(этил)амино]-5-фторфенил}метил)-5-[2-(метилтио)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-({2-[(циклопентилметил)(этил)амино]-5-фторфенил}метил)-5-[2-(метилсульфонил)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-({4-бром-2-[(циклопентилметил)(этил)амино]фенил}метил)-5-[2-(метилтио)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-({4-бром-2-[(циклопентилметил)(этил)амино]фенил}метил)-5-[2-(метилсульфонил)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-({5-бром-2-[(циклопентилметил)(этил)амино]фенил}метил)-5-[2-(метилтио)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-({5-бром-2-[(циклопентилметил)(этил)амино]фенил}метил)-5-[2-(метилсульфонил)этокси]пиримидин-2 -амин,
3-{1-[({2-[(циклопентилметил)(этил)амино]-5-трифторметилфенил}метил){5-[2-(метилтио)этокси]пиримидин-2-ил}амино]этил}-5-(трифторметил)бензонитрил,
3-{1-[({2-[(циклопентилметил)(этил)амино]-5-трифторметилфенил}метил){5-[2-(метилсульфонил)этокси]пиримидин-2-ил}амино]этил}-5-(трифторметил)бензонитрил,
N-{1-[3,5-бис(трифторметил)фенил]пропил}-N-({2-[(циклопентилметил)(этил)амино]-5-(трифторметил)фенил}метил)-5-[2-(метилтио)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]пропил}-N-({2-[(циклопентилметил)(этил)амино]-5-(трифторметил)фенил}метил)-5-[2-(метилсульфонил)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-{[2-(пиперидино)-5-(трифторметил)фенил]метил}-5-[2-(метилтио)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-{[2-(пиперидино)-5-(трифторметил)фенил]метил}-5-[2-(метилсульфонил)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-{[2-(морфолино)-5-(трифторметил)фенил]метил}-5-[2-(метилтио)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-{[2-(морфолино)-5-(трифторметил)фенил]метил}-5-[2-(метилсульфонил)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-{[2-(4-метилпиперидино)-5-(трифторметил)фенил]метил}-5-[2-(метилтио)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-{[2-(4-метилпиперидино)-5-(трифторметил)фенил]метил}-5-[2-(метилсульфонил)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-{[2-(цис-2,6-диметилморфолино)-5-(трифторметил)фенил]метил}-5-[2-(метилтио)этокси]пиримидин-2-амин,
N-{1-[3,5-бис(трифторметил)фенил]этил}-N-{[2-(цис-2,6-диметилморфолино)-5-(трифторметил)фенил]метил}-5-[2-(метилсульфонил)этокси]пиримидин-2-амин,
этил транс-{4-[({2-[({1-[3,5-бис(трифторметил)фенил]этил}{5-[2-(метилтио)этокси]пиримидин-2-ил}амино)метил]-4-(трифторметил)фенил}(этил)амино)метил]циклогексил}ацетат,
транс-{4-[({2-[({1-[3,5-бис(трифторметил)фенил]этил}{5-[2-(метилтио)этокси]пиримидин-2-ил}амино)метил]-4-(трифторметил)фенил}(этил)амино)метил]циклогексил}уксусная кислота,
транс-{4-[({2-[({l-[3,5-бис(трифторметил)фенил]этил}{5-[2-(метилсульфонил)этокси]пиримидин-2-ил}амино)метил]-4-(трифторметил)фенил}(этил)амино)метил]циклогексил}уксусная кислота,
N-({2-[бис(циклопропилметил)амино]-3,5-дифторфенил}метил)-N-{1-[3,5-бис(трифторметил)фенил]этил}-5-[2-(метилтио)этокси]пиримидин-2-амин или
N-({2-[бис(циклопропилметил)амино]-3,5-дифторфенил}метил)-N-{1-[3,5-бис(трифторметил)фенил]этил}-5-[2-(метилсульфонил)этокси]пиримидин-2-амин.
3. Лекарственное средство, содержащее соединение или его соль или сольват по любому из пп.1-2 в качестве активного ингредиента.
4. Лекарственное средство по п.3, которое является профилактическим или терапевтическим агентом лечения заболеваний, включающих дислипидемию, артериосклероз, атеросклероз, периферические сосудистые заболевания, гипер-LDL-емию, гипо-HDL-емию, гиперхолестеринемию, гипертриглицеридемию, семейную гиперхолестеринемию, сердечно-сосудистые расстройства, стенокардию, ишемию, сердечную ишемию, тромбоз, инфаркт миокарда, реперфузионные повреждения, рестеноз при ангиопластике или гипертензию.
5. СЕТР ингибитор, содержащий соединение или его соль или сольват по любому из пп.1, 2 в качестве активного ингредиента.
6. HDL-повышающий агент, содержащий соединение или его соль или сольват по любому из пп.1, 2 в качестве активного ингредиента.
7. Фармацевтическая композиция, содержащая соединение или его соль или сольват по любому из пп.1, 2 и фармацевтически приемлемый носитель.
8. Способ профилактического или терапевтического лечения заболеваний, включающих дислипидемию, артериосклероз, атеросклероз, периферические сосудистые заболевания, гипер-LDL-емию, гипо-HDL-емию, гиперхолестеринемию, гипертриглицеридемию, семейную гиперхолестеринемию, сердечно-сосудистые расстройства, стенокардию, ишемию, сердечную ишемию, тромбоз, инфаркт миокарда, реперфузионные повреждения, рестеноз при ангиопластике или гипертензию, который включает введение соединения или его соли или сольвата по любому из пп.1, 2.
9. Применение соединения или его соли или сольвата по любому из пп.1, 2 для получения лекарственного средства для профилактического или терапевтического лечения дислипидемии, артериосклероза, атеросклероза, периферических сосудистых заболеваний, гипер-LDL-емии, гипо-HDL-емии, гиперхолестеринемии, гипертриглицеридемии, семейной гиперхолестеринемии, сердечно-сосудистых расстройств, стенокардии, ишемии, сердечной ишемии, тромбоза, инфаркта миокарда, реперфузионных повреждений, рестеноза при ангиопластике или гипертензии.
Текст
ПРОИЗВОДНЫЕ N,N-ДИБЕНЗИЛ-2-АМИНОПИРИМИДИНА И ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ИХ СОДЕРЖАЩИЕ Аоки Таро, Мийосава Катсутоси,Сибата Харуки, Сибуя Кимиюки (JP) Настоящее изобретение представляет соединение, представленное общей формулой (I),обладающее высоким уровнем ингибирующей активности в отношении белка переноса сложного эфира холестерина (СЕТР) Охгия Тадааки, Миура Тору, Окуда Аюму, Араи Тосихару, Ямазаки Коити, где R1, R2, R3, R4 и R5 представляют собой атом водорода, галоид (C1-С 6 алкильную) группу или цианогруппу, R6 представляет C1-С 6 алкильную группу, R7, R8, R9 и R10 являются одинаковыми или отличными друг от друга и представляют атом водорода, атом галогена, C1 С 6 алкильную группу, галоид (С 1-С 6 алкильную) группу или C1-С 6 алкоксигруппу, R11 и R12 являются одинаковыми или различными и представляют С 1-С 6 алкильную группу или (С 3-С 8 циклоалкил)(C1-С 6 алкильную) группу, данная (С 3-С 8 циклоалкил)(C1-С 6 алкильная) группа может иметь одну гидроксикарбонил (C1-С 6 алкильную) группу или (C1-С 6 алкокси)карбонил(С 1-С 6 алкильную) группу в качестве заместителя в циклоалкильной группе, или R11 и R12 объединены с образованием морфолиногруппы или пиперидиногруппы вместе с соседним атомом азота (морфолино- или пиперидиногруппа может иметь 1 или 2 С 1-С 6 алкильные группы в качестве заместителя), и R13 представляет (С 1-С 6 алкил)тио(C1-С 6 алкокси)группу, (C1-С 6 алкил)сульфинил(C1-С 6 алкокси)группу,или (C1-С 6 алкил)сульфонил(С 1-С 6 алкокси)группу. 017321 Область техники, к которой относится изобретение Настоящее изобретение относится к новому пиримидиновому соединению, имеющему структуру дибензиламина, обладающему ингибирующей активностью в отношении белка переноса эфира холестерина (СЕТР), и к лекарственному средству, включающему его. Уровень техники В последние годы дислипидемия (гиперлипидемия) и являющиеся результатом ее артериосклеротические заболевания быстро увеличиваются вследствие изменении питания в сторону высококалорийной пищи и пищи с высоким содержанием холестерина в связи с повышением уровня жизни, тучности, недостатка физических упражнений, старения и т.п. Вследствие того, что уровень холестерина липопротеинов низкой плотности (LDL) и уровень триглицеридов положительно коррелируются с частотой случаев сердечных заболеваний, общепринятые методы фармакотерапии дислипидемии и артериосклероза были сконцентрированы на снижении липидов в крови. Хотя многими исследователями до настоящего времени было обнаружено, что уровень холестерина липопротеина высокой плотности (HDL) в плазме отрицательно коррелируется с наступлением ишемических сердечных заболеваний, гипо-HDL-емия считается одним из факторов риска артериосклероза. Однако в настоящее время нет ни одного лекарственного средства, которое селективно и заметно повышает уровень HDL, и желательна разработка такого лекарственного средства. Белок переноса эфира холестерина (СЕТР) является крайне гидрофобным белком, который переводит эфир холестерина из HDL холестерина в LDL холестерин, холестерин липопротеина очень низкой плотности (VLDL) или аналогичный, и HDL холестерин может увеличиваться ингибированием перевода с помощью СЕТР. Ниацин значительно увеличивает HDL холестерин, но имеет серьезную проблему стойкости, которая уменьшает податливость, т.е. вызывает ощущение жара, головокружение, сердцебиение и тому подобное. Хотя фибраты и ингибиторы HMG-CoA редуктазы слегка увеличивают уровень HDL холестерина (10-12%), они недостаточно удовлетворяют медицинским потребностям в достижении значительного увеличения уровня HDL холестерина в плазме, чтобы задерживать прогрессирование атеросклероза. Хотя СЕТР ингибитор достигает сильного увеличения уровня HDL холестерина, так что можно ожидать,что он обеспечит дегенерацию артериосклеротических повреждений до степени, которая не может быть превышена ни фибратами, ни ингибиторами HMG-CoA редуктазы, и, таким образом, считается, что он может обеспечить профилактические или терапевтические средства против артериосклероза или дислипидемии, которые являются обычно недоступными. СЕТР ингибиторы достигают увеличения HDL холестерина и снижения LDL холестерина или VLDL холестерина с помощью механизма, отличного от механизма ингибиторов HMG-CoA редуктазы, и, соответственно, можно также ожидать комбинированный эффект СЕТР ингибитора и ингибитора HMG-CoA редуктазы. СЕТР продуцируется главным образом в печени и тонком кишечнике у человека, и возможно, что СЕТР, экспрессируемый в тонком кишечнике, участвует в абсорбции липидов. Имеется также сообщение о намерении достичь ингибирующего эффекта липидной абсорбции путем ингибирования СЕТР в тонкой кишке (патентный документ 1). Было сделано несколько сообщений, касающихся соединений для ингибирования СЕТР активности. Например, сообщалось о тиольном производном, которое образует дисульфидную связь с помощью реакции с цистеиновым остатком СЕТР для ингибирования СЕТР активности (патентный документ 2, непатентный документ 1). Однако для экспрессирования действия требуется введение большого количества тиольного производного, и вызывают озабоченность побочные реакции за счет образования дисульфидной связи с другими белками. В дополнение к сказанному, нет ни одного описания, предлагающего соединения настоящего изобретения. В качестве СЕТР ингибиторов, способ действия которых отличается от способа действия тиольных производных, были описаны производные тетрагидрохинолина (патентные документы 3-5). Однако данные производные являются высоколипорастворимыми соединениями, и вследствие низкой оральной абсорбции, являющейся результатом низкой растворимости в воде, они требуют фармацевтические средства для получения уровня в крови, достаточного для экспрессирования эффективности (патентный документ 6). В дополнение к сказанному, нет ни одного описания, предлагающего соединения настоящего изобретения. Кроме того, в качестве соединений, проявляющих СЕТР ингибирующую активность, описываются производные тетрагидронафталидина, производные бензил(гетероциклилметил)амина и аналогичные(патентные документы 7-9). Однако они являются высоколипорастворимыми соединениями так же, как упомянутые выше тетрагидрохинолиновые производные. При этом нет никаких описаний, предлагающих соединения настоящего изобретения. Кроме того, описываются соединения, имеющие структуру дибензиламина (патентный документ 10). Однако они не имеют заместителя, такого как низшая алкильная группа у атома углерода в бензильном положении, в отличие от пиримидиновых соединений настоящего изобретения, имеющих структуру дибензиламина, и нет ни одного описания, предлагающего соединения настоящего изобретения. Более того, найдено, что они обладают недостаточной СЕТР ингибирующей активностью.-1 017321 Патентный документ 1: Международная патентная публикация WO 2006/098394. Патентный документ 2: Не прошедшая экспертизу японская патентная публиация (Кокаи)1149743. Патентный документ 3: Международная патентная публикация WO 2000/17164. Патентный документ 4: Международная патентная публикация WO 2000/17165. Патентный документ 5: Международная патентная публикация WO 2000/17166. Патентный документ 6: Международная патентная публикация WO 2003/63868. Патентный документ 7: Международная патентная публикация WO 2005/095395. Патентный документ 8: Международная патентная публикация WO 2006/056854. Патентный документ 9: Международная патентная публикация WO 2006/073973. Патентный документ 10: Международная патентная публикация WO 2004/020393.Heпатентный документ 1: Circulation, 105(18), 2159-2165 (2002) Описание изобретения Цель, достигаемая изобретением Таким образом, целью настоящего изобретения является создание нового соединения, обладающего сильной ингибирующей активностью в отношении СЕТР. Средства достижения цели Авторы настоящего изобретения провели различные исследования для достижения вышеупомянутой цели. В результате они обнаружили, что соединения формулы (I) и их соли, а также их сольваты проявляют превосходную СЕТР ингибирующую активность и достигли настоящего изобретения:R1, R2, R3, R4 и R5 являются одинаковыми или отличными друг от друга и представляют атом водорода, галоид (С 1-С 6 алкильную) группу или цианогруппу, R6 представляет С 1-С 6 алкильную группу,R7, R8, R9 и R10 являются одинаковыми или отличными друг от друга и представляют атом водорода, атом галогена, С 1-С 6 алкильную группу, галоид (С 1-С 6 алкильную) группу или С 1-С 6 алкоксигруппу,R11 и R12 являются одинаковыми или различными и представляют С 1-С 6 алкильную группу или (С 3 С 8 циклоалкил) (C1-С 6 алкильную) группу, данная (С 3-С 8 циклоалкил) (С 1-С 6 алкильная) группа может иметь одну гидроксикарбонил (С 1-С 6 алкильную) группу или (С 1-С 6 алкокси)карбонил(С 1-С 6 алкильную) группу в качестве заместителя в циклоалкильной группе), или R11 и R12 объединены с образованием морфолиногруппы или пиперидиногруппы вместе с соседним атомом азота (морфолино- или пиперидиногруппа может иметь 1 или 2 С 1-С 6 алкильные группы в качестве заместителя),R13 представляет (С 1-С 6 алкил)тио(С 1-С 6 алкокси) группу, (C1-С 6 алкил)сульфинил(С 1-С 6 алкокси) группу, или (C1-С 6 алкил)сульфонил(С 1-С 6 алкокси) группу, и формула (I) представляет как индивидуальные энантиомеры, так и их смеси. Пиримидиновые соединения, имеющие структуру дибензиламина настоящего соединения, являются новыми соединениями, и они в структурном отношении полностью отличаются от известных соединений, имеющих СЕТР ингибирующую активность, особенно в том, что они имеют заместитель у атома углерода в бензильном положении (R6 в вышеупомянутой общей формуле). А именно, настоящее изобретение предоставляет соединение, представленное приведенной выше общей формулой (I), или его соль или сольват. Настоящее изобретение предоставляет также лекарственное средство, включающее соединение,представленное вышеупомянутой общей формулой (I), или его соль или сольват в качестве активного ингредиента, предпочтительно такое лекарственное средство предназначено для профилактики или терапевтического лечения заболеваний, включающих дислипидемию (гиперлипидемию), артериосклероз,атеросклероз, периферические сосудистые заболевания, гипер-LDL-емию, гипо-HDL-емию, гиперхолестеринемию, гипертриглицеридемию, семейную гиперхолестеринемию, сердечно-сосудистые расстройства, стенокардию, ишемию, сердечную ишемию, тромбоз, инфаркт миокарда, реперфузионные расстройства, рестеноз при ангиопластике, гипертензию и аналогичные. Настоящее изобретение предоставляет также СЕТР ингибитор и увеличивающий HDL агент, включающий соединение, представленное вышеупомянутой общей формулой (I), или его соль или сольват в качестве активного ингредиента. Настоящее изобретение, кроме того, предоставляет фармацевтическую композицию, включающую-2 017321 соединение, представленное вышеупомянутой общей формулой (I), или его соль или сольват и фармацевтически приемлемый носитель. Настоящее изобретение, кроме того, предоставляет способ профилактики или терапевтического лечения заболеваний, включающих дислипидемию (гиперлипидемию), артериосклероз, атеросклероз, периферические сосудистые заболевания, гипер-LDL-емию, гипо-HDL-емию, гиперхолестеринемию, гипертриглицеридемию, семейную гиперхолестеринемию, сердечно-сосудистые расстройства, стенокардию, ишемию, сердечную ишемию, тромбоз, инфаркт миокарда, реперфузионные повреждения, рестеноз при ангиопластике, гипертензию и аналогичные, который включает введение эффективного количества соединения, представленного вышеупомянутой общей формулой (I), или его соли или сольвата млекопитающему, включая человека. Настоящее изобретение также предоставляет способ ингибирования СЕТР в живом организме млекопитающего, включая человека, который включает введение эффективного количества соединения,представленного вышеупомянутой общей формулой (I), или его соли или сольвата млекопитающему,включая человека. Настоящее изобретение предоставляет также способ увеличения уровня HDL холестерина в крови в живом организме млекопитающего, включая человека, который включает введение эффективного количества соединения, представленного вышеупомянутой общей формулой (I), или его соли или сольвата млекопитающему, включая человека. Настоящее изобретение, кроме того, предоставляет применение соединения, представленного вышеупомянутой общей формулой (I), или его соли или сольвата для получения фармацевтических препаратов для профилактического или терапевтического лечения заболеваний, включающих дислипидемию(гиперлипидемию), артериосклероз, атеросклероз, периферические сосудистые заболевания, гипер-LDLемию, гипо-HDL-емию, гиперхолестеринемию, гипертриглицеридемию, семейную гиперхолестеринемию, сердечно-сосудистые расстройства, стенокардию, ишемию, сердечную ишемию, тромбоз, инфаркт миокарда, реперфузионные повреждения, рестеноз при ангиопластике, гипертензию, и аналогичные. Настоящее изобретение далее предоставляет применение соединения, представленного вышеупомянутой общей формулой (I), или его соли или сольвата для получения фармацевтических препаратов для ингибирования СЕТР в живом организме млекопитающего, включая человека. Настоящее изобретение также предоставляет применение соединения, представленного вышеупомянутой общей формулой (I), или его соли или сольвата для получения фармацевтических препаратов для увеличения уровня HDL холестерина в крови в живом организме млекопитающего, включая человека. Настоящее изобретение далее предоставляет лекарственное средство, включающее сочетание (а) соединения, представленного вышеупомянутой общей формулой (I), или его соли или сольвата и (b) ингибитора HMG-CoA редуктазы, предпочтительного, такое средство для профилактики или терапевтического лечения заболеваний, включающих дислипидемию (гиперлипидемию), артериосклероз, атеросклероз, периферические сосудистые заболевания, гипер-LDL-емию, гипо-HDL-емию, гиперхолестеринемию, гипертриглицеридемию, семейную гиперхолестеринемию, сердечно-сосудистые расстройства, стенокардию, ишемию, сердечную ишемию, тромбоз, инфаркт миокарда, реперфузионные повреждения,рестеноз при ангиопластике, гипертензию и аналогичные. Настоящее изобретение, кроме того, предоставляет комбинированную фармацевтическую композицию, включающую (а) соединение, представленное вышеупомянутой общей формулой (I), или его соль или сольват и (b) ингибитор HMG-CoA редуктазы. Эффект изобретения Соединение настоящего изобретения, представленное вышеупомянутой общей формулой (I), или его соль или сольват проявляет сильную ингибирующую активность в отношении СЕТР и сильное действие по увеличению HDL холестерина в крови, как продемонстрировано, в частности, в примерах испытаний, приведенных далее, и, следовательно, оно может подходящим образом использоваться в качестве активного ингредиента ингибитора СЕТР и дополнительно в качестве активного ингредиента агента, повышающего HDL. Далее, ввиду СЕТР ингибирующей активности и действия, повышающего HDL холестерин в крови,соединение настоящего изобретения, представленное вышеупомянутой общей формулой (I), или его соль или сольват могут использоваться подходящим образом в качестве активного ингредиента лекарственного средства, предпочтительно для профилактики или терапевтического лечения заболеваний, включающих дислипидемию (гиперлипидемию), артериосклероз, атеросклероз, периферические сосудистые заболевания, гипер-LDL-емию, гипо-HDL-емию, гиперхолестеринемию, гипертриглицеридемию, семейную гиперхолестеринемию, сердечно-сосудистые расстройства, стенокардию, ишемию, сердечную ишемию,тромбоз, инфаркт миокарда, реперфузионные повреждения, рестеноз при ангиопластике, гипертензию и аналогичные. Более того, соединение настоящего изобретения или его соль или сольват могут также предпочтительно использоваться в качестве активного ингредиента вышеупомянутого лекарственного средства, демонстрирующего низкое CYP ингибирующее действие.-3 017321 Краткое описание чертежа Фигура представляет собой график, показывающий уровни HDL холестерина крови в плазме хомячков,которым повторно вводилиN-1-[3,5-бис(трифторметил)фенил]этил-N-(2[(циклопентилметил)(этил)амино]-5-(трифторметил)фенилметил)-5-[2-(метилсульфонил)этокси]пиримидин-2-амин (пример 3) на протяжении семи дней в дозах 10, 30 и 100 мг/кг. Наилучший способ осуществления изобретения Примеры низшей алкильной группы в качестве низшей алкильной группы или низшей алкильной группы галоид(низшей алкильной) группы, (низший циклоалкил)(низшей алкильной) группы,арил(низшей алкильной) группы, гидроксикарбонил(низшей алкильной) группы и (низший алкокси)карбонил(низшей алкильной) группы, на которые ссылаются в настоящем изобретении, включают линейную или разветвленную алкильную группу, имеющую 1-6 атомов углерода (упоминается как C1-C6 алкил), например, метильную, этильную, н-пропильную, изопропильную, н-бутильную, изобутильную,трет-бутильную, н-пентильную, 2-метилбутильную, 2,2-диметилпропильную группу и аналогичные. Примеры низшей алкоксигруппы в качестве низшей алкоксигруппы или низшей алкоксигруппы галоид(низшей алкокси)группы,(низший алкил)тио(низшей алкокси)группы,(низший алкил)сульфинил(низшей алкокси)группы,(низший алкил)сульфонил(низшей алкокси)группы,арил(низшей алкокси)группы, (низший алкокси)(низшей алкокси)группы, (низший алкокси)(низший алкил)аминогруппы, гидрокси(низшей алкокси)группы, гидроксикарбонил(низшей алкокси)группы, амино(низшей алкокси)группы, (низший алкил)амино(низшей алкокси)группы и ди(низший алкил)амино(низшей алкокси)группы, упоминаемые в настоящем изобретении, включают линейную или разветвленную алкоксигруппу, имеющую 1-6 атомов углерода (упоминается как C1-C6 алкокси), например, метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, трет-бутокси, н-пентокси, 2 метилбутокси, 2,2-диметилпропоксигруппу и аналогичные. Примеры (низшей алкил)тиогруппы в качестве (низшей алкил)тиогруппы или (низшей алкил)тиогруппы (низший алкил)тио-(низшей алкокси)группы и (низший алкил)тио(низшей алкил)аминогруппы, упоминаемых в настоящем изобретении, включают линейную или разветвленную алкилтиогруппу, имеющую 1-6 атомов углерода (упоминается как (C1-C6 алкил)тио), например, метилтио,этилтио, н-пропилтио, изопропилтио, н-бутилтио, изобутилтио, трет-бутилтио, н-пентилтио, 2 метилбутилтио, 2,2-диметилпропилтиогруппу и аналогичные. Примеры (низшей алкил)сульфинильной группы в качестве (низшей алкил)сульфинильной группы или (низшей алкил)сульфинильной группы (низший алкил)сульфинил(низшей алкокси)группы и (низший алкил)сульфинил(низшей алкил)аминогруппы, упоминаемых в настоящем изобретении, включают линейную или разветвленную алкилсульфинильную группу, имеющую 1-6 атомов углерода (упоминается как (C1-C6 алкил)сульфинил), например, метилсульфинильную, этилсульфинильную, нпропилсульфинильную, изопропилсульфинильную, н-бутилсульфинильную, изобутилсульфинильную,трет-бутилсульфинильную, н-пентилсульфинильную, 2-метилбутилсульфинильную, 2,2-диметилпропилсульфинильную группу и аналогичные. Примеры (низшей алкил)сульфонильной группы в качестве (низшей алкил)сульфонильной группы или (низшей алкил)сульфонильной группы (низший алкил)сульфонил(низшей алкокси)группы и (низший алкил)сульфонил(низшей алкил)аминогруппы, упоминаемых в настоящем изобретении, включают линейную или разветвленную алкилсульфонильную группу, имеющую 1-6 атомов углерода (упоминается как (C1-C6 алкил)сульфонил), например, метилсульфонильную, этилсульфонильную, нпропилсульфонильную, изопропилсульфонильную, н-бутилсульфонильную, изобутилсульфонильную,трет-бутилсульфонильную, н-пентилсульфонильную, 2-метилбутилсульфонильную, 2,2-диметилпропилсульфонильную группу и аналогичные. Примеры (низшей алкил)карбонильной группы, упоминаемой в настоящем изобретении, включают линейную или разветвленную алкилкарбонильную группу, имеющую 2-6 атомов углерода (упоминается как (C2-C6 алкил)карбонил), например, метилкарбонильную, этилкарбонильную, н-пропилкарбонильную,изопропилкарбонильную, н-бутилкарбонильную, изобутилкарбонильную, трет-бутилкарбонильную, нпентилкарбонильную, 2-метилбутилкарбонильную, 2,2-диметилпропилкарбонильную группу и аналогичные. Примеры (низшей алкокси)карбонильной группы в качестве (низшей алкокси)карбонильной группы или (низшей алкокси)карбонильной группы (низший алкокси)карбонил(низшей алкильной) группы, упоминаемых в настоящем изобретении, включают линейную или разветвленную алкоксикарбонильную группу, имеющую 2-6 атомов углерода (упоминается как (C2-C6 алкокси)карбонил), например, метоксикарбонильную, этоксикарбонильную, н-пропоксикарбонильную, изопропоксикарбонильную, нбутоксикарбонильную,изобутоксикарбонильную,трет-бутоксикарбонильную,н-пентилоксикарбонильную, 2-метилбутоксикарбонильную, 2,2-диметилпропоксикарбонильную группу и аналогичные. Примеры ациламиногруппы, упоминаемой в настоящем изобретении, включают линейную или разветвленную ациламиногруппу, имеющую 2-6 атомов углерода (упоминается как (С 2-С 6 ацил)амино), например, ацетиламино, н-пропиониламино, изопропиониламино, бутириламино, изобутириламино, трет-4 017321 бутириламино, н-пентаноиламино, 2-метилбутириламино, 2,2-диметилпропиониламиногруппу и аналогичные. Примеры (низшей алкил)аминогруппы в качестве (низшей алкил)аминогруппы, или (низшей алкил)аминогруппы (низший алкил)тио(низшей алкил)аминогруппы, (низший алкил)сульфинил(низшей алкил)аминогруппы, (низший алкил)сульфонил(низшей алкил)аминогруппы, (низший алкокси)(низшей алкил)аминогруппы, гидрокси(низший алкил)аминогруппы и (низший алкил)амино(низшей алкокси)группы, упоминаемых в настоящем изобретении, включают линейную или разветвленную алкиламиногруппу, имеющую 1-6 атомов углерода (упоминается как (C1-C6 алкил)амино), например, метиламино,этиламино, н-пропиламино, изопропиламино, н-бутиламино, изобутиламино, трет-бутиламино, нпентиламино, 2-метилбутиламино, 2,2-диметилпропиламиногруппу и аналогичные. Примеры ди(низшей алкил)аминогруппы в качестве ди(низшей алкил)аминогруппы или ди(низшей алкил)аминогруппы ди(низший алкил)амино(низшей алкокси)группы, упоминаемой в настоящем описании, включают аминогруппу, замещенную двумя линейными или разветвленными алкильными группами, имеющими 1-6 атомов углерода, которые могут быть одинаковыми или различными (упоминается как(низшей алкил)сульфониламиногруппы или (низшей алкил)сульфониламиногруппы галоид(низший алкил)сульфониламиногруппы, упоминаемой в настоящем изобретении, включают линейную или разветвленную алкилсульфониламиногруппу, имеющую 1-6 атомов углерода (упоминается как (C1C6 алкил)сульфониламино),например,метилсульфониламино,этилсульфониламино,нпропилсульфониламино, изопропилсульфониламино, н-бутилсульфониламино, изобутилсульфониламино, трет-бутилсульфониламино, н-пентилсульфониламино, 2-метилбутилсульфониламино, 2,2 диметилпропилсульфониламиногруппу и аналогичные. Примеры низшей циклоалкильной группы в качестве низшей циклоалкильной группы или (низшей циклоалкильной)группы (низший циклоалкил)(низшей алкильной) группы, упоминаемой в настоящем изобретении, включают циклоалкильную группу, имеющую 3-8 атомов углерода (упоминается как C3-C8 циклоалкил), например, циклопропильную, циклобутильную, циклопентильную, циклогексильную группу и аналогичные. Примеры арильной группы в качестве арильной группы или арильной группы арил(низшей алкильной) группы, арил(низшей алкокси)группы, ариламиногруппы и арилсульфониламиногруппы, упоминаемой в настоящем изобретении, включают арильную группу, имеющую 6-10 атомов углерода (упоминается как C6-C10 арил), например, фенильную группу, нафтильную группу и аналогичные. Примеры атома галогена в качестве атома галогена или атома галогена галоид(низшей алкильной) группы и галоид(низшей алкокси)группы, упоминаемой в настоящем изобретении, включают атом фтора, хлора, брома, атом йода и аналогичные. В общей формуле (I) примеры галоид(низшей алкильной) группы в качестве R1, R2, R3, R4 и R5 включают, например, низшую алкильную группу, замещенную 1-5 атомами галогена, такую как трифторметильная, 2,2,2-трифторэтильная и пентафторэтильная группа, и предпочтительна трифторметильная группа. Далее примеры галоид(низшей алкокси)группы включают, например, низшую алкоксигруппу, замещенную 1-5 атомами галогена, такую как трифторметокси, 2,2,2-трифторэтоксигруппа и пентафторэтоксигруппа. В общей формуле (I) примеры заместителя аминогруппы, которая может иметь заместитель в качестве R1, R2, R3, R4 и R5, включают, например, низшую алкильную группу, галоид(низшую алкильную) группу, арильную группу и аналогичные. Аминогруппа может иметь 1 или 2 из данных заместителей. Что касается R1, R2, R3, R4 и R5 в общей формуле (I), предпочтительно, чтобы каждая группа, одинаковая или отличная, представляла атом водорода, атом галогена, C1-C6 алкильную группу, галоид(C1-C6 алкильную) группу, C1-C6 алкоксигруппу, галоид(C1-C6 алкокси)группу или цианогруппу, более предпочтительно, чтобы каждая группа, одинаковая или отличная, представляла атом водорода, галоид(C1-C6 алкильную) группу или цианогруппу, и особенно предпочтительно, чтобы R1, R3, и R5 представляли атомы водорода, и каждый из R2 и R4, одинаковых или различных, представлял галоид(C1-C6 алкильную) группу или цианогруппу. В общей формуле (I) примеры низшей алкильной группы в качестве R6 включают, например, метильную группу, этильную группу и аналогичные. В качестве низшей алкильной группы для R6 более предпочтительной является линейная или разветвленная алкильная группа, имеющая 1-4 атома углерода,еще более предпочтительной является метильная или этильная группа, и особенно предпочтительной является метильная группа. В общей формуле (I) примеры галоид(низшей алкильной) группы в качестве R6 включают, например, низшую алкильную группу, замещенную 1-5 атомами галогена, такую как монофторметильная, дифторметильная, трифторметильная, 2,2,2-трифторэтильная и пентафторэтильная группа, и аналогичные. В общей формуле (I) примеры низшей циклоалкильной группы в качестве R6 включают, например,-5 017321 циклопропильную, циклобутильную, циклопентильную группу и аналогичные. В общей формуле (I) примеры (низший циклоалкил)(низшей алкильной) группы в качестве R6 включают, например, (C3-C8 циклоалкил)(С 1-С 6 алкильную) группу, такую как циклопропилметильная и циклопентилметильная группа. В общей формуле (I) предпочтительно, чтобы R6 представлял C1-С 6 алкильную группу, галоид(C1 С 6 алкильную) группу, C3-С 8 циклоалкильную группу или (C3-С 8 циклоалкил) (C1-С 6 алкильную) группу,более предпочтительно, чтобы R6 представлял C1-C6 алкильную группу, еще более предпочтительно, чтобы R6 представлял метильную или этильную группу, и особенно предпочтительно, чтобы R6 представлял метильную группу. В общей формуле (I) примеры атома галогена в качестве R7, R8, R9 и R10 включают, например, атом фтора, хлора, брома и аналогичные. В общей формуле (I) примеры низшей алкильнойгруппы в качестве R7, R8, R9 и R10 включают, например, метильную группу и аналогичные. В качестве низшей алкильной группы для R7, R8, R9 и R10 более предпочтительна линейная или разветвленная алкильная группа, имеющая 1-4 атома углерода, еще более предпочтительна метильная или этильная группа, и особенно предпочтительна метильная группа. В общей формуле (I) примеры галоид(низшей алкильной) группы в качестве R7, R8, R9 и R10 включают, например, низшую алкильную группу, замещенную 1-5 атомами галогена, такую как трифторметильная, 2,2,2-трифторэтильная и пентафторэтильная группа, и предпочтительна трифторметильная группа. В общей формуле (I) примеры низшей алкоксигруппы в качестве R7, R8, R9 и R10 включают, например, метоксигруппу и аналогичные. В качестве низшей алкоксигруппы для R7, R8, R9 и R10 более предпочтительна линейная или разветвленная алкоксигруппа, имеющая 1-4 атома углерода, еще более предпочтительна метокси- или этоксигруппа и особенно предпочтительна метоксигруппа. В общей формуле (I) примеры заместителя аминогруппы, которая может иметь заместитель в качестве R7, R8, R9 и R10, включают, например, низшую алкильную группу, галоид(низшую алкильную) группу, арильную группу и аналогичные. Что касается R7, R8, R9 и R10 в общей формуле (I), предпочтительно, чтобы каждая из групп, одинаковых или отличных друг от друга, представляла атом водорода, атом галогена, C1-С 6 алкильную группу,галоид(C1-С 6 алкильную) группу или C1-С 6 алкоксигруппу, и более предпочтительно, чтобы R7, R9 и R10 представляли атомы водорода, a R8 представлял атом галогена, C1-С 6 алкильную группу, галоид(C1 С 6 алкильную) группу или C1-С 6 алкоксигруппу. В качестве предпочтительного воплощения сочетания R7, R8, R9 и R10 предпочтительно, чтобы по меньшей мере один из R8, R9 и R10 представлял атом галогена, а остальные из R7, R8, R9 и R10 представляли атомы водорода и более предпочтительно, чтобы R7, R9 и R10 представляли атомы водорода, a R8 представлял атом галогена, более предпочтительно атом брома. В качестве еще одного предпочтительного воплощения сочетания R7, R8, R9 и R10 предпочительно,чтобы R8 представлял C1-С 6 алкильную группу, и каждый из R7, R9 и R10, одинаковых или различных,представлял атом водорода или атом галогена, и более предпочтительно, чтобы R8 представлял C1 С 6 алкильную группу, а R7, R9 и R10 представляли атомы водорода. В качестве еще одного предпочтительного воплощения сочетания R7, R8, R9 и R10 предпочительно,чтобы по меньшей мере один из R8 и R9 представлял галоид (C1-С 6 алкильную) группу, а остальные из R7,R8, R9 и R10 представляли атомы водорода и более предпочтительно, чтобы R8 представлял галоид(C1 С 6 алкильную)группу, a R7, R9 и R10 представляли атомы водорода. В качестве еще одного предпочтительного воплощения сочетания R7, R8, R9 и R10 предпочтительно,чтобы по меньшей мере один из R8 и R9 представлял C1-С 6 алкоксигруппу, и остальные из R7, R8, R9 и R10 представляли атомы водорода, и более предпочтительно, чтобы R8 представлял C1-С 6 алкоксигруппу, aR7, R9 и R10 представляли атомы водорода. В общей формуле (I) примеры низшей алкильной группы в качестве R11 и R12 включают, например,метильную, этильную, н-пропильную группу и аналогичные. В качестве низшей алкильной группы дляR11 и R12 более предпочтительна линейная или разветвленная алкильная группа, имеющая 1-4 атома углерода, еще более предпочтительна метильная или этильная группа, и особенно предпочтительна этильная группа. В общей формуле (I) примеры (низший циклоалкил)(низшей алкильной) группы в качестве R11 и R12 включают, например, (C3-С 8 циклоалкил)(С 1-С 6 алкильную) группу, такую как циклопропилметильная,циклобутилметильная, циклопентилметильная, циклогексилметильная, циклопропилэтильная, циклобутилэтильная, циклопентилэтильная и циклогексилэтильная группа. В качестве (низший циклоалкил)(низшей алкильной) группы для R11 и R12 предпочтительна (C3-С 8 диклоалкил)(С 1-С 6 алкильная) группа,еще более предпочтительна циклопропилметильная, циклопентилметильная или циклогексилметильная группа, и особенно предпочтительна циклопропилметильная или циклопентилметильная группа. В общей формуле (I) примеры заместителя (низший циклоалкил)(низшей алкильной) группы, которая может иметь заместитель, в качестве R11 и R12 включают, например, низшую алкильную группу, галоид(низшую алкильную) группу, гидроксикарбонильную, (низший алкокси)карбонильную, гидрокси-6 017321 карбонил(низшую алкильную) группу, (низший алкокси)карбонил(низшую алкильную) группу и аналогичные, и предпочтительна гидроксикарбонилC1-С 6 алкильная) или (C1-С 6 алкокси)карбонил(C1 С 6 алкильная) группа. Хотя положение замещения для заместителя особо не ограничивается, в настоящем изобретении предпочтительно, чтобы он замещал в низшей циклоалкильной группе. Число заместителей составляет предпочтительно 1-3. Примеры (низший циклоалкил)(низшей алкильной) группы, имеющей такой заместитель, включают, например, (C3-С 8 циклоалкил) (С 1-С 6 алкильную) группу, имеющую в качестве заместителя в циклоалкильной группе одну гидроксикарбонил (С 1-С 6 алкильную) группу или (C1 С 6 алкокси)карбонил(С 1-С 6 алкильную) группу,такую как 4-[(гидроксикарбонил)метил]циклогексилметильная группа и 4-[(этоксикарбонил)метил]циклогексилметильная группа. В общей формуле (I) примеры азотсодержащего насыщенного гетероциклического кольца, образуемого R11 и R12, объединенными вместе с соседним атомом азота, включают, например, 5-8-членное азотсодержащее насыщенное гетероциклическое кольцо, которое может иметь 1 или 2 гетероатома одного или двух или более видов, выбранных из группы, состоящей из атомов азота, кислорода или серы, в дополнение к атому азота, соседнему с R11 и R12, такие как пирролидиногруппа, пиперидино-, гомопиперидино- и морфолиногруппа. Азотсодержащее насыщенное гетроциклическое кольцо, образуемое R11 иR12, объединенными вместе с соседним атомом азота, может иметь заместитель, и примеры заместителя включают, например, низшую алкильную группу, галоид(низшую алкильную) группу, низшую циклоалкильную группу и аналогичные. Число заместителей составляет предпочтительно 1 или 2. Примеры азотсодержащего насыщенного гетероциклического кольца, образуемого R11 и R12, объединенными вместе с соседним атомом азота, имеющего такой заместитель, включают пиперидиногруппу или морфолиногруппу, имеющую 1 или 2 C1-С 6 алкильные группы в качестве заместителя, такие как 4 метилпиперидиногруппа и цис-2,6-диметилфорфолиногруппа. В общей формуле (I) примеры заместителя арил(низшей алкильной) группы, которая может иметь заместитель в качестве R11 и R12, включают, например, атом галогена, низшую алкильную группу, галоид(низшую алкильную) группу, низшую алкоксигруппу, галоид(низшую алкокси)группу и цианогруппу. Число заместителей составляет предпочтительно 1-3. Хотя положение замещения для заместителя особо не ограничивается, в настоящем изобретении предпочтительно, чтобы он замещал в арильном кольце арил(низшей алкильной) группы. Примеры такой группы включают фенилC1-С 6 алкильную) группу,которая может иметь С 1-С 6 алкоксигруппу в фенильной группе в качестве заместителя, например 4 метоксибензильную группу и аналогичные. В общей формуле (I) предпочтительно, чтобы каждый из R11 и R12, одинаковых или различных,представлял С 1-С 6 алкильную группу, (С 3-С 8 циклоалкил)(С 1-С 6 алкильную) группу (данная (C3 С 8 циклоалкил)(С 1-С 6 алкильная) группа может иметь гидроксикарбонил (С 1-С 6 алкильную) группу или(C6-С 10 арил) (С 1-С 6 алкильную) группу, которая может иметь C1-С 6 алкоксигруппу в качестве заместителя в арильном кольце, или R11 и R12 объединялись с образованием 5-8-членного азотсодержащего насыщенного гетероциклического кольца, которое может иметь C1-С 6 алкильную группу в качестве заместителя,вместе с соседним атомом азота (данное гетероциклическое кольцо может иметь 1 или 2 гетероатома одного или более видов, выбранных из группы, состоящей из атомов азота, кислорода и серы, в дополнение к атому азота, соседнему с R11 и R12), более предпочтительно, чтобы каждый из R11 и R12, одинаковых или различных, представлял C1-С 6 алкильную группу или (C3-С 8 циклоалкил) (C1-С 6 алкильную) группу (данная (С 3-С 8 циклоалкил) (C1-С 6 алкильная) группа может иметь одну гидроксикарбонил (C1 С 6 алкильную) группу или (C1-С 6 алкокси)карбонил(C1-С 6 алкильную) группу в качестве заместителя в циклоалкильной группе), или R11 и R12 объединялись с образованием морфолиногруппы или пиперидиногруппы (морфолино- или пиперидиногруппа может иметь 1 или 2 C1-С 6 алкильных группы в качестве заместителей) вместе с соседним атомом азота, и особенно предпочтительно, чтобы каждый из R11 и R12,одинаковых или различных, представлял этильную группу, циклопентилметильную группу, этоксикарбонилметилциклогексилметильную или гидроксикарбонилметилциклогексилметильную группу, или R11 и R12 объединялись с образованием морфолиногруппы, пиперидиногруппы, метилпиперидино- или диметилморфолиногруппы вместе с соседним атомом азота. В общей формуле (I) примеры (низший алкил)тио(низшей алкокси) группы в качестве R13 включают (С 1-С 6 алкил)тио(C1-С 6 алкокси)группу, такую как метилтиометокси, 2-метилтиоэтокси- и 3 метилтиопропоксигруппа, и предпочтительна 2-метилтиоэтоксигруппа. В общей формуле (I) примеры (низший алкил)сульфинил(низшей алкокси)группы в качестве R13 включают (C1-С 6 алкил)сульфинил(C1-С 6 алкокси)группу, такую как метилсульфинилметокси, 2 метилсульфинилэтокси и 3-метилсульфинилпропоксигруппа,и предпочтительна 2 метилсульфинилэтоксигруппа. В общей формуле (I) примеры (низший алкил)сульфонил(низшей алкокси)группы в качестве R13 включают (C1-С 6 алкил)сульфонил(C1-С 6 алкокси)группу, такую как метилсульфонилметокси, 2 метилсульфонилэтокси и 3-метилсульфонилпропоксигруппа,и предпочтительна 2 метилсульфонилэтоксигруппа. В общей формуле (I) примеры циклической аминогруппы, которая может иметь гетероатом в каче-7 017321 стве составляющего кольцо атома, в качестве R13 включают, например, пирролидинильную, морфолинильную, пиперидинильную группу и аналогичные, и предпочтительна морфолиногруппа или пиперидиногруппа. В общей формуле (I) примеры заместителя арил(низшей алкокси)группы, которая может иметь заместитель, в качестве R13 включают, например, атом галогена, низшую алкильную группу, галоид(низшую алкильную) группу, цианогруппу и аналогичные. Кроме того, хотя положение замещения для заместителя особо не ограничивается, в настоящем изобретении предпочтительно, чтобы он замещал в арильном кольце арил(низшей алкокси)группы. Число заместителей предпочтительно составляет 1-3. Примеры данной группы включают фенил(C1-С 6 алкокси)группу, которая может иметь атом галогена,галоид(C1-С 6 алкильную) группу или цианогруппу в качестве заместителя в фенильной группе, например,3,5-бис(трифторметил)бензильную группу,3-циано-5-трифторметилбензилоксигруппу,2,3 дифторбензилоксигруппу и аналогичные. В общей формуле (I) предпочтительно, чтобы R13 представлял атом галогена, (C1-С 6 алкил) тио (С 1 С 6 алкокси) группу, (C1-С 6 алкил)сульфинил(C1-С 6 алкокси)группу, (C1-С 6 алкил)сульфонил (C1-С 6 алкокси) группу, (C6-С 10 арил) (C1-С 6 алкокси)группу (данная (C6-С 10 арил)(C1-С 6 алкокси)группа может иметь атом галогена, галоид (C1-С 6 алкильную) группу или цианогруппу в качестве заместителя в арильном кольце),морфолинильную группу или пиперидинильную группу, и особенно предпочтительно, чтобы R13 представлял (C1-С 6 алкил)тио(C1-С 6 алкокси)группу, (C1-С 6 алкил)сульфинил(C1-С 6 алкокси)группу или (C1 С 6 алкил)сульфонил(C1-С 6 алкокси)группу. Что касается предпочтительных сочетаний заместителей в вышеупомянутой общей формуле (I),предпочтительно, чтобы каждый из R1, R2, R3, R4 и R5, одинаковых или отличных друг от друга, представлял атом водорода, атом галогена, C1-С 6 алкильную группу, галоид(C1-С 6 алкильную) группу, C1 С 6 алкоксигруппу, галоид (C1-С 6 алкокси)группу или цианогруппу, R6 представляет C1-С 6 алкильную группу, галоид(C1-С 6 алкильную) группу, C3-С 8 циклоалкильную группу или (C3-С 8 циклоалкил)(C1 С 6 алкильную) группу,каждый из R7, R8, R9 и R10, одинаковых или отличных друг от друга, представляет атом водорода,атом галогена, C1-С 6 алкильную группу, галоид (C1-С 6 алкильную) группу или C1-С 6 алкоксигруппу,каждый из R11 и R12, одинаковых или различных, представляет C1-С 6 алкильную группу, (C3 С 8 циклоалкил) (C1-С 6 алкильную) группу (данная(C3-С 8 циклоалкил)(C1-С 6 алкильная) группа может иметь гидроксикарбонил (C1-C6 алкильную) группу или (C1-С 6 алкокси)карбонил(C1-С 6 алкильную) группу в качестве заместителя в циклоалкильной группе), или (C6-С 10 арил)(C1-С 6 алкильную) группу, которая может иметь C1-С 6 алкоксигруппу в качестве заместителя в арильном кольце, или R11 и R12 объединяются с образованием 5-8-членного азотсодержащего насыщенного гетероциклического кольца, которое может иметь C1-С 6 алкильную группу в качестве заместителя, вместе с соседним атомом азота (гетероциклическое кольцо может иметь 1 или 2 гетероатома одного или более видов, выбранных из группы, состоящей из атомов азота, кислорода и серы, в дополнение к атому азота, соседнему с R11 и R12), и R13 представляет атом галогена, (C1-С 6 алкил)тио(C1-С 6 алкокси)группу, (С 1-С 6 алкил)сульфинил(С 1-С 6 алкокси)группу, (C1 С 6 алкил)сульфонил(C1-С 6 алкокси)группу, (С 6-С 10 арил)(C1-С 6 алкокси)группу (данная (C6-С 10 арил)(C1 С 6 алкокси) группа может иметь атом галогена, галоид (C1-С 6 алкильную) группу или цианогруппу в качестве заместителя в арильном кольце), морфолинильную группу или пиперидинильную группу, более предпочтительно, чтобы каждый из R1, R2, R3, R4 и R5, одинаковых или отличных друг от друга, представлял атом водорода,галоид (C1-С 6 алкильную) группу или цианогруппу, R6 представлял С 1-С 6 алкильную группу,каждый из R7, R8, R9 и R10, одинаковых или отличных друг от друга, представлял атом водорода,атом галогена, C1-С 6 алкильную группу, галоид (С 1-С 6 алкильную) группу или C1-С 6 алкоксигруппу,каждый из R11 и R12, одинаковых или различных, представлял C1-С 6 алкильную группу или (C3 С 8 циклоалкил)(С 1-С 6 алкильную) группу (данная(C3-С 8 циклоалкил) (C1-С 6 алкильная) группа может иметь одну гидроксикарбонил (C1-С 6 алкильную) группу или (C1-С 6 алкокси)карбонил(C1-С 6 алкильную) группу в качестве заместителя в циклоалкильной группе), или R11 и R12 объединялись с образованием морфолино- или пиперидиногруппы вместе с соседним атомом азота (морфолино- или пипероидиногруппа может иметь 1 или 2 C1-С 6 алкильные группы в качестве заместителя), иR1, R3 и R5 представляли атомы водорода,каждый из R2 и R4, одинаковых или различных, представлял галоид(C1-С 6 алкильную) группу или цианогруппу,R6 представлял С 1-С 6 алкильную группу,R7, R8, R9 и R10 имели значения, определенные в любом из следующих пунктов i)-iv):i) по меньшей мере один из R8, R9 и R10 представляет атом галогена, предпочтительно атом брома, а остальные из R7, R8, R9 и R10 представляют атомы водорода,ii) R8 представляет C1-С 6 алкильную группу, и каждый из R7, R9 и R10, одинаковых или различных,представляет атом водорода или атом галогена,-8 017321iii) по меньшей мере один из R8 и R9 представляет галоид(C1-С 6 алкильную) группу и остальные изR , R , R9 и R10 представляют атомы водорода,iv) по меньшей мере один из R8 и R9 представляет C1-С 6 алкоксигруппу и остальные из R7, R8, R9 и 10R представляют атомы водорода,каждый из R11 и R12, одинаковых или различных, представляет C1-С 6 алкильную группу или (C3 С 8 циклоалкил)(C1-С 6 алкильную) группу (данная(C3-С 8 циклоалкил)(C1-С 6 алкильная) группа может иметь гидроксикарбонил (C1-С 6 алкильную) группу или (C1-С 6 алкокси)карбонил(C1-С 6 алкильную) группу в качестве заместителя в циклоалкильной группе), или R11 и R12 объединены с образованием морфолино- или пиперидиногруппы (морфолино- или пипероидиногруппа может иметь 1 или 2 C1-С 6 алкильных группы в качестве заместителя) вместе с соседним атомом азота, иR13 представляет (C1-С 6 алкил)тио(C1-C6 алкокси)группу, (C1-С 6 алкил)сульфинил(C1-С 6 алкокси)группу или (C1-С 6 алкил)сульфонил(C1-С 6 алкокси)группу. Предпочтительные примеры соединения настоящего изобретения, представленного общей формулой (I), или его соли или его сольвата включают:N-(2-[бис(циклопропилметил)амино]-3,5-дифторфенилметил)-N-1-[3,5-бис(трифторметил)фенил]этил-5-[2-(метилсульфонил)этокси]пиримидин-2-амин (пример 47), его соли и сольваты. Общая формула (I) представляет как индивидуальные энантиомеры, так и их смеси. А именно, в соединении настоящего изобретения, представленном общей формулой (I), атом углерода, к которому присоединен R6, представляет асимметрический углерод, и объемом настоящего изобретения охватываются изомеры любой стерической конфигурации, основанной на асимметрическом углероде. Например, объемом настоящего изобретения охватываются рацематы и один из энантиомеров. Кроме того, объемом настоящего изобретния охватываются все другие получаемые стереоизомеры. Примеры соли соединения, представленного общей формулой (I), включают, например, аддитивные соли соляной кислоты и аналогичные, и соли особо не ограничиваются до тех пор, пока они являются фармацевтически приемлемыми солями. Примеры их включают, например, аддитивные соли минеральных кислот, такие как гидрохлориды, гидробромиды, гидройодиды, сульфаты, нитраты и фосфаты; аддитивные соли органических кислот, такие как бензоаты, метансульфонаты, этансульфонаты, бензолсульфонаты, п-толуолсульфонаты, малеаты, фумараты, тартраты, цитраты и ацетаты. Однако соли не ограничиваются ими. Примеры сольвата соединения, представленного общей формулой (I), или его соли включают, на- 10017321 пример, гидраты и аналогичные, но сольват не ограничивается ими. В дополнение, соединения, которые метаболизируются в живом организме и превращаются в соединения настоящего изобретения, представленные вышеупомянутой общей формулой (I), так называемые пролекарства, также все охватываются объемом соединения настоящего изобретения, представленного вышеупомянутой общей формулой (I). Примеры групп, которые образуют пролекарства соединений настоящего изобретения, включают группы, описываемые в работе "Progress in Medicine", vol. 5, стр. 2157-2161, 1985, Life Science Medica, и группы, описываемые в "Development of Drugs", vol. 7, MolecularDesigns, стр. 163-198, 1990, Hirokawa Shoten. Соединение настоящего изобретения, представленное общей формулой (I), или его соль или сольват может быть получено с помощью различных известных способов, которые особо не ограничиваются. Например, соединение может быть получено в соответствии со следующими стадиями реакции, но способ получения не ограничивается ими. Кроме того, когда проводятся следующие реакции, функциональные группы, иные, чем реакционные участки, при необходимости могут быть заранее защищены, и на соответствующей стадии защита снимается. Кроме того, каждая реакция может проводиться на каждой стадии обычно используемым способом, а выделение и очистка могут проводиться с помощью средств,выбранных подходящим образом из общепринятых способов, таких как кристаллизация, перекристаллизация, хроматография и аналогичные, или их сочетаний. Способы получения соединения, представленного общей формулой (I), или его соли или сольватаI. Способы получения соединения, представленного общей формулой (I), или его соли или сольвата. Соединение настоящего изобретения, представленное общей формулой (I), может быть получено с помощью следующего способа. А именно так, как показано на следующей ниже реакционной схеме 1,реакцией альдегидного производного, представленного общей формулой (II), с производным пиримидин 2-амина, представленного общей формулой (IV), в соответствии со способом восстановительного аминирования, или реакцией соединения, представленного общей формулой (III), имеющего уходящую группуW1, с производным примидин-2-амина, представленным общей формулой (IV); с использованием основания может быть получено аминовое соединение, представленное общей формулой (V). Реакцией аминового соединения, представленного общей формулой (V), с соединением, имеющим уходящую группуW2, представленным общей формулой (VI), с использованием основания можно получить соединение настоящего изобретения, представленное общей формулой (I). Данный способ реакции представлен следующими реакционными формулами. где R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12 и R13 имеют те же значения, что и значения, объясняемые для общей формулы (I), упломянутой выше, и W1 и W2 представляют атом галогена, алкилсульфонилоксигруппу, галоидалкилсульфонилоксигруппу или арилсульфонилоксигруппу. Реакция альдегидного производного (II) и производного пиримидин-2-амина (IV) может проводиться с использованием восстанавливающего реагента в растворителе в присутствии или в отсутствие кислоты. В течение реакции дегидратация может проводиться с использованием аппарата Дина-Старка или аналогичных. В качестве растворителя, хотя он особо не ограничивается, может использоваться, например, 1,2-дихлорэтан, хлороформ, дихлорметан, этилацетат, изопропилацетат, толуол, бензол, тетрагидрофуран, диоксан, ацетонитрил, пропионитрил, метанол, этанол, изопропанол и аналогичные, отдельно или в сочетании. В качестве кислоты, хотя она особо не ограничивается, могут использоваться, например, протонные кислоты, такие как уксусная, трифторуксусная, пропионовая и бензойная кислота, и кислоты Льюиса, такие как тетрахлорид титана, трехфтористый бор и хлорид олова. Восстанавливающий реагент особо не ограничивается, и может использоваться каталитическое восстановление с использованием боргидридного реагента, такого как триацетоксиборгидрид натрия, триацетоксиборгидрид тетраметиламмония, цианоборгидрид натрия, боргидрид натрия, боргидрид лития, триметоксиборгидрид натрия- 11017321 и триэтилборгидрид лития, или алюминийгидридного реагента, такого как алюминийгидрид лития, гидрид диизопропилалюминия и натрий бис(2-метоксиэтокси)алюминийгидрид, металлический катализатор и источник водорода. Для каталитического восстановления в качестве водородного источника может использоваться, например, водород, циклогексадиен, муравьиная кислота, формиат аммония и аналогичные, а в качестве металлического катализатора может использоваться, например, палладий/уголь, палладиевая чернь, палладийгидроксид/угольный порошок, никель Ренея, диоксид платины, платиновая чернь и аналогичные. Реакция соединения (III), имеющего уходящую группу W1, и производного пиримидин-2-амина (IV) может проводиться в растворителе в присутствии основания. В качестве растворителя, хотя он особо не ограничивается, может использоваться, например, N,N-диметилформамид, N-метилпирролидон, диметилсульфоксид, диоксан, тетрагидрофуран, ацетонитрил, пропионитрил и аналогичные, отдельно или в сочетании, а в качестве основания, хотя оно особо не ограничивается, могут использоваться, например,гидриды щелочных металлов, такие как гидрид лития, гидрид натрия и гидрид калия, щелочные металлы, такие как литий, натрий и калий, гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия, карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия, карбонат калия и карбонат цезия, диизопропиламид лития, диизопропиламид натрия, диизопропиламид калия, гексаметилдисилазид лития, гексаметилдисилазид натрия, гексаметилдисилазид калия,трет-бутоксид натрия, трет-бутоксид калия, н-бутиллитий, втор-бутиллитий, трет-бутиллитий и аналогичные. Реакция аминового соединения (V), получаемого по упомянутому выше способу, и соединения (VI),имеющего уходящую группу W2, может проводиться в растворителе в присутствии основания. В качестве растворителя, хотя он особо не ограничивается, может использоваться, например, N,Nдиметилформамид, N-метилпирролидон, диметилсульфоксид, диоксан, тетрагидрофуран, ацетонитрил,пропионитрил и аналогичные, отдельно или в сочетании, а в качестве основания, хотя оно особо не ограничивается, могут использоваться, например, гидриды щелочных металлов, такие как гидрид лития, гидрид натрия и гидрид калия, щелочные металлы, такие как литий, натрий и калий, гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия, карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия, карбонат калия и карбонат цезия, диизопропиламид лития, диизопропиламид натрия, диизопропиламид калия, гексаметилдисилазид лития, гексаметилдисилазид натрия, гексаметилдисилазид калия, трет-бутоксид натрия, трет-бутоксид калия, н-бутиллитий, вторбутиллитий, трет-бутиллитий и аналогичные. Кроме того, помимо упомянутого выше способа, соединение настоящего изобретения, представленное общей формулой (I), может быть также получено с помощью следующего способа. А именно, как показано на следующей реакционной схеме 2, реакцией производного пиримидин-2-амина, представленного общей формулой (IV), с соединением, имеющим уходящую группу W2, представленным общей формулой (VI), с использованием основания, или реакцией производного пиримидин-2-амина, представленного общей формулой (IV), с кетоновым производным, представленным общей формулой (VII), в соответствии со способом восстановительного аминирования может быть получено аминовое соединение, представленное общей формулой (VIII). С помощью реакции аминового соединения, представленного общей формулой (VIII), с соединением, имеющим уходящую группу W1, представленным общей формулой (III), с использованием основания может быть получено соединение настоящего изобретения,представленное общей формулой (I). Данный способ реакции представлен следующими реакционными формулами. где R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12 И R13 имеют те же значения, что и значения, объясняемые для общей формулы (I), упомянутой выше, и W1 и W2 представляют атом галогена, алкилсульфонилоксигруппу, галоидалкилсульфонилоксигруппу или арилсульфонилоксигруппу. Реакция производного пиримидин-2-амина (IV) и соединения (VI), имеющего уходящую группуW2, может проводиться в растворителе в присутствии основания. В качестве растворителя, хотя он особо не ограничивается, может использоваться, например, N,N-диметилформамид, N-метилпирролидон, диметилсульфоксид, диоксан, тетрагидрофуран, ацетонитрил, пропионитрил и аналогичные, а в качестве основания, хотя оно особо не ограничивается, могут использоваться, например, гидриды щелочных металлов, такие как гидрид лития, гидрид натрия и гидрид калия, щелочные металлы, такие как литий, натрий и калий, гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия, карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия, карбонат калия и карбонат цезия, диизопропиламид лития, диизопропиламид натрия, диизопропиламид калия, гексаметилдисилазид лития, гексаметилдисилазид натрия, гексаметилдисилазид калия, трет-бутоксид натрия,трет-бутоксид калия, н-бутиллитий, втор-бутиллитий, трет-бутиллитий и аналогичные. Реакция производного пиримидин-2-амина (IV) и кетонового производного (VII) может проводиться с использованием восстанавливающего реагента в растворителе в присутствии или в отсутствие кислоты. В течение реакции дегидратация может проводиться с использованием аппарата Дина-Старка или аналогичных. В качестве растворителя, хотя он особо не ограничивается, может использоваться, например, 1,2-дихлорэтан, хлороформ, дихлорметан, этилацетат, изопропилацетат, толуол, бензол, тетрагидрофуран, диоксан, ацетонитрил, пропионитрил, метанол, этанол, изопропанол и аналогичные, отдельно или в сочетании. В качестве кислоты, хотя она особо не ограничивается, могут использоваться, например, протонные кислоты, такие как уксусная, трифторуксусная, пропионовая и бензойная кислота, и кислоты Льюиса, такие как тетрахлорид титана, трехфтористый бор и хлорид олова. Восстанавливающий реагент особо не ограничивается, и может использоваться каталитическое восстановление с использованием реагента боргидридного типа, такого как триацетоксиборгидрид натрия, триацетоксиборгидрид тетраметиламмония, цианоборгидрид натрия, боргидрид натрия, боргидрид лития, триметоксиборгидрид натрия и триэтилборгидрид лития, или алюминийгидридного реагента, такого как алюминийгидрид лития, гидрид диизопропилалюминия и натрий бис(2-метоксиэтокси)алюминийгидрид, металлического катализатора и источника водорода. Для каталитического восстановления в качестве водородного источника может использоваться, например, водород, циклогексадиен, муравьиная кислота, формиат аммония и аналогичные, а в качестве металлического катализатора может использоваться, например палладий/уголь, палладиевая чернь, палладийгидроксид/угольный порошок, никель Ренея, диоксид платины,платиновая чернь и аналогичные. Реакция соединения (III), имеющего уходящую группу W1, и аминового соединения (VIII) может проводиться в растворителе в присутствии основания. В качестве растворителя, хотя он особо не ограничивается, может использоваться, например, N,N-диметилформамид, N-метилпирролидон, диметилсульфоксид, диоксан, тетрагидрофуран, ацетонитрил, пропионитрил и аналогичные, а в качестве основания,хотя оно особо не ограничивается, могут использоваться, например, гидриды щелочных металлов, такие как гидрид лития, гидрид натрия и гидрид калия, щелочные металлы, такие как литий, натрий и калий,- 13017321 гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия, карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия, карбонат калия и карбонат цезия, диизопропиламид лития, диизопропиламид натрия, диизопропиламид калия, гексаметилдисилазид лития, гексаметилдисилазид натрия, гексаметилдисилазид калия, трет-бутоксид натрия, трет-бутоксид калия, н-бутиллитий, втор-бутиллитий, трет-бутиллитий и аналогичные. Примеры способов получения производного альдегида (II), соединения (III), имеющего уходящую группу W1, производного пиримидин-2-амина (IV) и соединения (VI), имеющего уходящую группу W2,используемые в указанных выше реакциях, упомянуты ниже. 1. Способы получения производного альдегида, представленного общей формулой (II), и соединения, представленного общей формулой (III), имеющего уходящую группу W1. В качестве упомянутого выше производного альдегида (II) и соединения (III), имеющего уходящую группу W1, могут использоваться соединения, доступные сами по себе, или они могут быть получены подходящим образом с использованием известного способа. Например, они могут быть получены с помощью нижеследующих способов. Однако способы получения не ограничиваются приведенными далее примерами. Как показано на следующей реакционной схеме 3, путем реакции производного о-фторальдегида,представленного общей формулой (IX), с амином, представленным общей формулой (X), может быть получено производное альдегида, представленное общей формулой (II). Данный способ реакции представлен следующими реакционными формулами. где R7, R8, R9, R10, R11 и R 12 имеют те же значения, что и значения, объясняемые для общей формулы (I), упомянутой выше. Реакция производного о-фторальдегида (IX) и амина (X) может проводиться в растворителе в присутствии или в отсутствие основания. В качестве растворителя, хотя он особо не ограничивается, может использоваться, например, тетрагидрофуран, толуол, диоксан, N,N-диметилформамид, Nметилпирролидон, вода и аналогичные, отдельно или в сочетании. Хотя основание особо не ограничивается, могут использоваться, например, гидриды щелочных металлов, такие как гидрид лития, гидрид натрия и гидрид калия, щелочные металлы, такие как литий, натрий и калий, гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия, карбонаты щелочных металлов,такие как карбонат лития, карбонат натрия, карбонат калия и карбонат цезия, 1,4 диазабицикло[2.2.2]октан (DABCO), диизопропиламид лития, диизопропиламид натрия, диизопропиламид калия, гексаметилдисилазид лития, гексаметилдисилазид натрия, гексаметилдисилазид калия, третбутоксид натрия, трет-бутоксид калия, н-бутиллитий, втор-бутиллитий, трет-бутиллитий и аналогичные. Хотя условия реакции следует менять в зависимости от используемого исходного материала, целевое соединение может быть получено путем проведения реакции обычно при 0-180 C, предпочтительно 50160C, в течение от 5 мин до 2 недель, предпочтительно от 3 ч до 1 недели. Производное альдегида (II) и соединение (III), имеющее уходящую группу W1, могут быть получены также следующим способом. А именно, как показано на следующей реакционной схеме 4, с помощью защиты гидроксигруппы спиртового производного, представленного общей формулой (XI), защитной группой R14, можно получить соединение простого эфира, представленное общей формулой (XII). Защитной группой R14 в общей формуле (XII) является защитная группа, обычно используемая в качестве защитной группы гидроксигруппы, и хотя она особо не ограничивается, предпочитаются метоксиметильная, бензилоксиметильная, 4-метоксибензилоксиметильная, метоксиэтоксиметильная, этоксиэтильная, трет-бутилдиметилсилильная, триэтилсилильная, трет-бутилдифенилсилильная, триизопропилсилильная, трифенилсилильная, 4-метоксибензильная, бензильная, 3,4-диметоксибензильная, 2,4,6 триметилбензильная, тритильная группы и аналогичные. С помощью реакции простого эфирного соединения, представленного общей формулой (XII), и амина, представленного общей формулой (XIII), может быть получено производное амина, представленное общей формулой (XIV). С помощью реакции получаемого производного амина, представленного общей формулой (XIV), с соединением, имеющим уходящую группу W4, представленным общей формулой (XV), или с использованием способа восстановительного аминирования, в котором иминовое соединение, получаемое по реакции производного амина и производного альдегида, представленного общей формулой (XVI), подвергается реакции восстановле- 14017321 ния, может быть получено производное амина, представленное общей формулой (XVII). Путем удаления защитной группы R14 из получаемого производного амина, представленного общей формулой (XVII), с получением спиртового соединения, представленного общей формулой (XVIII), и затем окисления получаемой гидроксигруппы, может быть получено производное альдегида, представленное общей формулой(II). Далее путем превращения спиртового фрагмента спиртового соединения, представленного общей формулой (XVIII), в уходящую группу W1, может быть получено соединение, представленное общей формулой (III), имеющее уходящую группу W1. Данный способ реакции представлен следующими реакционными формулами. где R7, R8, R9, R10, R11 и R12 имеют те же значения, что и значения, объясняемые для общей формулы (I), упомянутой выше, и W3 и W4 представляют атом галогена, алкилсульфонилоксигруппу, галоидалкилсульфонилоксигруппу или арилсульфонилоксигруппу, R14 представляет защитную группу, и R'12 представляет низшую алкильную группу, (низший циклоалкил)(низшую алкильную) группу или низшую циклоалкильную группу, в которой число атомов углерода, связываемых с атомом азота, составляет на 1 меньше, чем число в R12. Способ введения защитной группы R14 в спиртовое производное (XI), хотя он особо не ограничивается, может проводиться со ссылкой на способ, используемый обычно для введения защитных групп(Protective Groups in Organic Synthesis Third Edition, John WileySons, Inc.). Для реакции получаемого простого эфирного соединения (XII) и амина (XIII) может применяться способ реакции арилгалогенида и амина, проводимый в присутствии или в отсутствие основания и в присутствии или в отсутствие металлического катализатора. Во время реакции может проводиться микроволновое облучение. В качестве растворителя, хотя он особо не ограничивается, может использоваться, например, тетрагидрофуран, толуол, диоксан, N,N-диметилформамид, N-метилпирролидон, вода и аналогичные, отдельно или в сочетании. Хотя основание особо не ограничивается, могут использоваться,например, гидриды щелочных металлов, такие как гидрид лития, гидрид натрия и гидрид калия, щелочные металлы, такие как литий, натрий и калий, гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия, карбонаты щелочных металлов, такие как карбонат лития,карбонат натрия, карбонат калия и карбонат цезия, диизопропиламид лития, диизопропиламид натрия,диизопропиламид калия, гексаметилдисилазид лития, гексаметилдисилазид натрия, гексаметилдисилазид калия, трет-бутоксид натрия, трет-бутоксид калия, н-бутиллитий, втор-бутиллитий, трет-бутиллитий и аналогичные. В качестве металлического катализатора могут использоваться, например,трис(дибензилиденацетон)дипалладий(0), трис(дибензилиденацетон)(хлороформ)дипалладий(0), [1,1'бис(дифенилфосфино)ферроцен]дихлорпалладий(II), тетракис(трифенилфосфин)палладий и аналогичные отдельно, и лиганд, такой как (2-бифенил)ди-трет-бутилфосфин и (2-бифенил)дициклогексилфосфин могут также использоваться в сочетании. Хотя условия реакции следует менять в зависимости от исполь- 15017321 зуемого исходного материала, целевое соединение может быть получено путем проведения реакции обычно при 0-180C, предпочтительно 80-160C, в течение от 5 мин до 72 ч, предпочтительно от 10 мин до 24 ч. Когда проводят микроволновое облучение, целевое соединение может быть получено при начале реакции при 0-180C, предпочтительно при комнатной температуре, при микроволновом облучении с повышением температуры до 80-150C и проводением реакции в течение 1 мин - 20 ч, предпочтительно 1 мин - 3 ч, включая время повышения температуры. Реакция производного амина (XIV), получаемого в описанной выше реакции, и соединения (XV),имеющего уходящую группу W4, может проводиться в растворителе в присутствии основания. В качестве растворителя, хотя он особо не ограничивается, может использоваться, например, N,Nдиметилформамид, N-метилпирролидон, диметилсульфоксид, диоксан, тетрагидрофуран, ацетонитрил,пропионитрил и аналогичные, отдельно или в сочетании. В качестве основания, хотя оно особо не ограничивается, могут использоваться, например, гидриды щелочных металлов, такие как гидрид лития, гидрид натрия и гидрид калия, щелочные металлы, такие как литий, натрий и калий, гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия, карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия, карбонат калия и карбонат цезия, диизопропиламид лития, диизопропиламид натрия, диизопропиламид калия, гексаметилдисилазид лития, гексаметилдисилазид натрия, гексаметилдисилазид калия, трет-бутоксид натрия, трет-бутоксид калия, н-бутиллитий, вторбутиллитий, трет-бутиллитий и аналогичные. Реакция производного амина (XIV) и производного альдегида (XVI) может проводиться с использованием восстанавливающего агента в растворителе в присутствии или в отсутствие кислоты. Во время реакции дегидратация может проводиться с использованием аппарата Дина-Старка или аналогичных. В качестве растворителя, хотя он особо не ограничивается, может использоваться, например, 1,2 дихлорэтан, хлороформ, дихлорметан, этилацетат, изопропилацетат, толуол, бензол, тетрагидрофуран,диоксан, ацетонитрил, пропионитрил, метанол, этанол, изопропанол и аналогичные, отдельно или в сочетании. В качестве кислоты, хотя она особо не ограничивается, могут использоваться, например, протонные кислоты, такие как уксусная, трифторуксусная, пропионовая и бензойная кислота, и кислоты Льюиса, такие как тетрахлорид титана, трехфтористый бор и хлорид олова. Восстанавливающий реагент особо не ограничивается и может использоваться каталитическое восстановление с использованием боргидридного реагента, такого как триацетоксиборгидрид натрия, триацетоксиборгидрид тетраметиламмония, цианоборгидрид натрия, боргидрид натрия, боргидрид лития, триметоксиборгидрид натрия и триэтилборгидрид лития, или алюминийгидридногореагента, такого как алюминийгидрид лития, гидрид диизопропилалюминия и натрий бис(2-метоксиэтокси)алюминийгидрид, и могут использоваться металлический катализатор и источник водорода. Для каталитического восстановления в качестве водородного источника может использоваться, например, водород, циклогексадиен, муравьиная кислота, формиат аммония и аналогичные, а в качестве металлического катализатора может использоваться, например палладий/уголь, палладиевая чернь, палладийгидроксид/угольный порошок, никель Ренея, диоксид платины, платиновая чернь и аналогичные. Способ удаления защитной группы R14 производного амина (XVII), получаемого с помощью упомянутого выше способа, хотя он особо не ограничивается, можно проводить со ссылкой на способ, используемый обычно для удаления защитных групп (Protective Groups in Organic Synthesis Third Edition,John WileySons, Inc.). Для реакции окисления спиртового соединения (XVIII) для превращения в производное альдегида(II) может применяться обычный способ окисления гидроксигруппы в альдегид. Например, могут использоваться условия окисления в способе окисления Swern, окисления Moffatt, окисления Dess-Martin и аналогичные, и хлорхромат пиридиния (РСС), дихромат пиридиния (PDC), диоксид марганца, перрутенат тетрапропиламмония (ТРАР) и аналогичные. Хотя растворитель особо не ограничивается, может использоваться, например, тетрагидрофуран, дихлорметан, хлороформ, 1,2-дихлорэтан, N,Nдиметилформамид и аналогичные, отдельно или в сочетании. Реакция синтеза соединения (III), имеющего уходящую группу W1, из спиртового соединения(XVIII) может выбираться в зависимости от типа уходящей группы следующим образом. Когда W1 соединения (III), имеющего уходящую группу W1, является алкилсульфонилокси-, галоидалкилсульфонилокси- или арилсульфонилоксигруппой, соединение (III) может быть получено по реакции спиртового соединения (XVIII) и алкилсульфоновокислотного этерифицирующего агента, галоидалкилсульфонового кислотного или арилсульфоновокислотного этерифицирующего агента в растворителе в присутствии или в отсутствие основания. В качестве алкилсульфоновокислотного этерифицирующего агента, хотя он особо не ограничивается, может использоваться, например, метансульфонилхлорид, ангидрид метансульфоновой кислоты, этансульфонилхлорид, бензилсульфонилхлорид, аллилсульфонилхлорид и аналогичные. В качестве галоидалкилсульфоновокислотного этерифицирующего агента, хотя он особо не ограничивается, может использоваться, например, трифторметансульфонилхлорид, ангидрид трифторметансульфоновой кислоты, хлорметансульфонилхлорид и аналогичные. В качестве арилсульфоновокислотного этерифицирующего агента, хотя он особо не ограничивается, может использоваться,- 16017321 например, бензолсульфонилхлорид, п-толуолсульфонилхлорид, о-нитробензолсульфонилхлорид, пнитробензолсульфонилхлорид и аналогичные. В качестве растворителя, хотя он особо не ограничивается, может использоваться, например, 1,2-дихлорэтан, хлороформ, дихлорметан, этилацетат, изопропилацетат, толуол, бензол, тетрагидрофуран, диоксан, ацетонитрил, пропионитрил, N,N-диметилформамид и аналогичные, отдельно или в сочетании. В качестве основания, хотя оно особо не ограничивается, могут использоваться, например, органические основания, такие как пиридин, 4-диметиламинопиридин(DBN), DABCO, триэтиламин, 2,6-ди-трет-бутилпиридин, N,N-диизопропилэтиламин, N,Nдиизопропилпентиламин и триметиламин, гидриды щелочных металлов, такие как гидрид лития, гидрид натрия и гидрид калия, гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия, карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия, карбонат калия и карбонат цезия, кислые карбонаты, такие как кислый карбонат натрия и кислый карбонат калия. Когда W1 соединения (II), имеющего уходящую группу W1, является атомом галогена, соединение(II) может быть получено реакцией спиртового соединения (XVIII) и галоидирующего агента в растворителе или без него, в присутствии или в отсутствие основания. Примеры галоидирующего агента включают, хотя и не ограничиваются ими, хлорирующие, бромирующие или иодирующие агенты, такие как оксихлорид фосфора, пентахлорид фосфора, трифенилфосфиндихлорид, трифенилфосфиндибромид,трифенилфосфитдихлорид, трифенилфосфитдибромид, трибромид фосфора, тионилхлорид, трифенилфосфинтетрахлорид и тетрахлорид углерода, трифенилфосфинтетрабромид и тетрабромид углерода,трифенилфосфин, йод и имидазол, трифенилфосфин и N-иодсукцинимид (NIS), и метансульфонилхлорид и DMAP. В качестве растворителя, хотя он особо не ограничивается, может использоваться, например, 1,2-дихлорэтан, хлороформ, дихлорметан, диэтиловый эфир, этилацетат, изопропилацетат, толуол,бензол, тетрагидрофуран, диоксан, ацетонитрил, пропионитрил и аналогичные, отдельно или в сочетании. В качестве основания, хотя оно особо не ограничивается, могут использоваться, например, органические основания, такие как пиридин, DMAP, коллидин, лютидин, DBU, DBN, DABCO, триэтиламин,2,6-ди-трет-бутилпиридин, N,N-диизопропилэтиламин, N,N-диизопропилпентиламин и триметиламин,карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия, карбонат калия и карбонат цезия, кислые карбонаты, такие как кислый карбонат натрия и кислый карбонат калия и аналогичные. 2. Способы получения производного пиримидин-2-амина (IV). В качестве упомянутого выше производного пиримидин-2-амина (IV) может использоваться доступное само себе соединение, или оно может быть получено с помощью известного способа. Например,производное пиримидин-2-амина (IV) может быть получено с помощью следующих способов, в зависимости от типа R13 замещения в 5-положении производного пиримидин-2-амина (IV). Однако способ получения не ограничивается следующими примерами. 2-1. Способ получения производного пиримидин-2-амина (IV), в котором R13 представляет ди(низшую алкил)аминогруппу или циклическую аминогруппу, которая может иметь гетероатом в качестве атома, составляющего кольцо. Как показано на следующей реакционной схеме 5, с помощью реакции 5-бромпиримидин-2-амина(XIX) и ди(низший алкил)амина или циклического амина, который может иметь гетероатом в качестве составляющего кольцо атома, представленного общей формулой (XX), может быть получено производное пиримидин-2-амина, представленное общей формулой (IV), в котором R13 представляет ди(низшую алкил)аминогруппу или циклическую аминогруппу, которая может иметь гетероатом в качестве атома,составляющего кольцо. Данный способ реакции представлен следующими реакционными формулами. где каждый из R15 и R16, одинаковых или различных, представляет низшую алкильную группу, илиR и R16 объединены с образованием циклического амина, который может иметь гетероатом в качестве составляющего кольцо атома, вместе с соседним атомом азота. Для реакции 5-бромпиримидин-2-амина (XIX) и ди(низшего алкил)амина или циклического амина,который может иметь гетероатом в качестве составляющего кольцо атома, представленного общей формулой (XX), может применяться способ реакции арилгалогенида и амина, проводимый в растворителе или без него, в присутствии или в отсутствие основания и в присутствии металлического катализатора. Данная реакция может проводиться, например, с помощью реакции обоих соединений в растворителе в присут 15- 17017321 ствии металлического катализатора. Во время реакции может проводиться микроволновое облучение. В качестве металлического катализатора может использоваться, например, палладиевый комплекс, такой как трис(дибензилиденацетон)дипалладий(0),трис(дибензилиденацетон)(хлороформ)дипалладий(0),[1,1'бис(дифенилфосфино)ферроцен]дихлорпалладий(II) и тетракис(трифенилфосфин)палладий, или может использоваться одновалентный медный реагент, такой как йодид меди, бромид меди и цианид меди, отдельно, и лиганд, такой как (2-бифенил)ди-трет-бутилфосфин, (2-бифенил)дициклогексилфосфин, тетраметилэтилендиамин,N,N'-диметилэтилендиамин, глицин, N,N-диметилглицин и N-метилглицин в сочетании. В качестве растворителя, хотя он особо не ограничивается, может использоваться, например, тетрагидрофуран, толуол, диоксан, N,N-диметилформамид, N-метилпирролидон, диметилсульфоксид, вода и аналогичные, отдельно или в сочетании. Хотя основание особо не ограничивается, могут использоваться, например, гидриды щелочных металлов, такие как гидрид лития, гидрид натрия и гидрид калия, щелочные металлы, такие как литий, натрий и калий, гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия, карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия, карбонат калия и карбонат цезия, диизопропиламид лития, диизопропиламид натрия, диизопропиламид калия, гексаметилдисилазид лития, гексаметилдисилазид натрия, гексаметилдисилазид калия, третбутоксид натрия, трет-бутоксид калия, н-бутиллитий, втор-бутиллитий, трет-бутиллитий и аналогичные. Что касается условий реакции, целевое соединение может быть получено путем проведения реакции обычно при 0-180C, предпочтительно 80-150C, в течение от 1 мин до 5 дней, предпочтительно от 1 ч до 3 дней. 2-2. Способ получения-1 производного 2-аминопиримидина (IV"), в котором R13 представляет низшую алкоксигруппу, (низший алкил)тио-(низшую алкокси)группу, (низший алкокси)(низшую алкокси)группу или ди(низший алкил)амино(низшую алкокси)группу. Как показано на следующей реакционной схеме 6, с помощью реакции 5-бром-2-хлорпиримидина (XXI) и амина, замещенного удаляемой функциональной группой R17, представленного общей формулой (XXII), может быть получено производное пиримидин-2-амина, представленное общей формулой (XXIII). С помощью реакции данного получаемого производного пиримидин-2-амина, представленного общей формулой (XXIII), и низшего алкилового спирта, (низший алкил)тио(низшего алкилового) спирта, (низший алкокси)(низшего алкилового) спирта или ди(низший алкил)амино(низшего алкилового) спирта, представленного общей формулой(XXIV), с получением эфирного соединения, представленного общей формулой (XXV), и удаления R17 эфирного соединения, представленного общей формулой (XXV), может быть получено производное пиримидин-2-амина, представленного общей формулой (IV"), в котором R13 представляет низшую алкоксигруппу, (низший алкил)тио(низшую алкокси)группу, (низший алкокси)(низшую алкокси)группу или ди(низший алкил)амино(низшую алкокси)группу. Данный способ реакции представлен следующими реакционными формулами. где R17 представляет защитную группу, и R18 представляет низшую алкильную группу, (низший алкил)тио(низшую алкильную), (низший алкокси)(низшую алкильную) группу или ди(низший алкил)амино(низшую алкильную) группу. При реакции 5-бром-2-хлорпиримидина (XXI) и амина (XXII) целевое соединение может быть получено путем проведения реакции в растворителе или без растворителя. Во время реакции может проводиться микроволновое облучение. В качестве растворителя, хотя он особо не ограничивается, может использоваться,например,тетрагидрофуран,толуол,диоксан,N,N-диметилформамид,Nметилпирролидон, диметилсульфоксид, вода и аналогичные, отдельно или в сочетании. Что касается условий реакции, хотя их следует менять в зависимости от типа используемого амина, представленного общей формулой (XXII), целевое соединение можно получать путем проведения реакции обычно при 20-180C, предпочтительно 0-150C, в течение от 1 мин до 24 ч, предпочтительно от 5 мин до 10 ч. Для реакции получаемого производного пиримидин-2-амина (XXIII) и спирта (XXIV) может применяться способ реакции арилгалогенида и спирта, проводимый в растворителе или без него, в присутствии или в отсутствие основания и в присутствии металлического катализатора. В данной реакции, на- 18017321 пример, с помощью реакции обоих соединений в растворителе в присутствии металлического катализатора может быть получено целевое соединение, эфирное соединение (XXV). Во время реакции может проводиться микроволновое облучение. В качестве металлического катализатора может исользоваться,например,палладиевый комплекс,такой как трис(дибензилиденацетон)дипалладий(0),трис(дибензилиденацетон)(хлороформ)дипалладий(0), [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) и тетракис(трифенилфосфин)палладий, или может использоваться одновалетный медный реагент, такой как йодид меди, бромид меди и цианид меди, отдельно, и может использоваться лиганд, такой как (2-бифенил)ди-трет-бутилфосфин, (2-бифенил)дициклогексилфосфин, тетраметилендиамин,N,N'-диметилэтилендиамин, глицин, N,N-диметилглицин и N-метилглицин, в сочетании. В качестве растворителя, хотя он особо не ограничивается, может использоваться, например, тетрагидрофуран, толуол,диоксан, N,N-диметилформамид, N-метилпирролидон, диметилсульфоксид, вода и аналогичные, отдельно или в сочетании. Хотя основание особо не ограничивается, могут использоваться, например, гидриды щелочных металлов, такие как гидрид лития, гидрид натрия и гидрид калия, щелочные металлы, такие как литий, натрий и калий, гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия, карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия, карбонат калия и карбонат цезия, диизопропиламид лития, диизопропиламид натрия, диизопропиламид калия, гексаметилдисилазид лития, гексаметилдисилазид натрия, гексаметилдисилазид калия, третбутоксид натрия, трет-бутоксид калия, н-бутиллитий, втор-бутиллитий, трет-бутиллитий и аналогичные. Что касается условий реакции, целевое соединение может быть получено путем проведения реакции обычно при 0-180C, предпочтительно 80-150C, в течение от 1 мин до 5 дней, предпочтительно от 1 ч до 3 дней. Способ для удаления защитной группы R17 эфирного соединения (XXV), полученного вышеупомянутым способом, хотя особо не ограничивается, может быть осущствлен со ссылкой на способ, в основном используемый для удаления защитной группы (Protective Groups in Organic Syntesis Third Eddition,John WileySons, Inc.). 2-3. Способ получения 2-аминопиримидинового соединения (IV"), в котором R13 представляет низшую алкоксигруппу, (низший алкил)тио(низшую алкокси)группу, (низший алкокси)(низшую алкокси)группу или ди(низший алкил)амино(низшую алкокси)группу. Как показано на следующей реакционной схеме 7, подвергая ацетальное производное, представленное общей формулой (XXVI), реакции Вилсмейера, можно получить производное аминоакролеина, представленного общей формулой (XXVII). Каждый из R19 и R20 в общей формуле (XXVI) представляет низшую алкильную группу, или защитную группу, обычно используемую в качестве защитной группы гидроксигруппы,и хотя они особо не ограничиваются, каждая из них, одинаковых или различных, представляет предпочтительно метильную,этильную, пропильную, бензильную, п-метоксибензильную, 2,4,6-триметилбензильную группу или аналогичные. R21 и R22 в общей формуле (XXVII) являются одинаковыми или различными и представляют низшую алкильную группу или арилалкильную группу, которая может иметь заместитель, или могут быть объединены с образованием азотсодержащего насыщенного гетероциклического кольца, вместе с соседним атомом азота, каждый из них, хотя они особо не ограничиваются, одинаковых или различных,предпочтительно представляет метильную, этильную, пропильную, бензильную, п-метоксибензильную,2,4,6-триметилбензильную группу или аналогичные, а в качестве азотсодержащего насыщенного гетероциклического кольца, образуемого объединенными вместе с соседним атомом азота R21 и R22, предпочитаются пиперидин, пирролидин, морфолин и аналогичные. С помощью реакции данного получаемого аминоакролеинового производного, представленного общей формулой (XXVII), и гуанидиновой соли(XXVIII) может быть получено аминопиримидиновое производное, представленное общей формулой(XXIX). НА в общей формуле (XXVIII) представляет кислоту, которая образует соль с гуанидином. Кислотой, которая образует используемую здесь соль с гуанидином, хотя она особо и не ограничивается,предпочтительно является соляная, серная, азотная, угольная, уксусная, бромисто-водородная, йодистоводородная и аналогичные. С помощью защиты аминогруппы аминопиримидинового производного(XXIX) защитной группой R23 может быть получено соединение, представленное общей формулой(XXX). Защитной группой R23 в общей формуле (XXX) является защитная группа, обычно используемая в качестве защитной группы аминогруппы, и ею предпочтительно являются, хотя особо и не ограничиваются ими, формильная, ацетильная, пропионильная, бутирильная, гексаноильная, трифторацетильная,бензоильная, циклогексилкарбонильная, бензилоксикарбонильная, 2,2,2-трихлорэтилкарбонильная, третбутоксикарбонильная,4-метоксибензильная,бензильная,3,4-диметоксибензильная,2,4,6 триметилбензильная, трифторметансульфонильная группа или аналогичные. Путем удаления R19 из получаемого соединения, представленного общей формулой (XXX), может быть получено гидроксипиримидиновое производное, представленное общей формулой (XXXI). С помощью получения простого эфирного соединения, представленного общей формулой (XXXIII), по реакции Мицунобу гидроксипиримидинового производного (XXXI) и низшего алкилового спирта, (низший алкил)тио(низшего алкилового) спирта, (низший алкокси)(низшего алкилового) спирта, или ди(низший алкил)амино(низшего алкилового) спирта, представленного общей формулой (XXIV), или по реакции с соединением (XXXII),имеющим уходящую группу W5, и удалением R23 из эфирного соединения, представленного общей фор- 19017321 мулой (XXXIII), может быть получено 2-аминопиримидиновое производное, представленное общей формулой (IV"), в которой R13 представляет низшую алкоксигруппу, (низший алкил)тио(низшую алкокси)группу, (низший алкокси)(низшую алкокси)группу или ди(низший алкил)амино(низшую алкокси)группу. Данный способ реакции представлен следующими реакционными формулами. где R18 представляет низшую алкильную группу, (низший алкил)тио(низшую алкильную) группу,(низший алкокси)(низшую алкильную) группу или ди(низший алкил)амино(низшую алкильную) группу,R19 и R20 представляют низшую алкильную или защитную группу, R21 и R22 являются одинаковыми или различными и представляют низшую алкильную или арил(низшую алкильную) группу, которая может иметь заместитель, или могут быть объединены с образованием азотсодержащего насыщенного гетероциклического кольца вместе с соседним атомом азота, R23 представляет защитную группу, W5 представляет атом галогена, алкилсульфонилоксигруппу, галоидалкилсульфонилоксигруппу или арилсульфонилоксигруппу и НА представляет кислоту, которая образует соль с гуанидином. Что касается реакции Вилсмейера ацетального производного (XXVI), целевое соединение может быть получено при проведении реакции с реагентом Вилсмейера в растворителе или без него. Хотя реагент Вилсмейера особо не ограничивается, в качестве используемого формамида может использоваться,например, N,N-диметилформамид, N,N-диэтилформамид, N-формилпиперидин, N-формилпирролидин,N-формилморфолин и аналогичные, а в качестве фосфорного реагента могут использоваться, например,оксигалогениды фосфора, такие как оксихлорид фосфора и оксибромид фосфора, и галогениды фосфора,такие как пентахлорид фосфора и пентабромид фосфора. В качестве растворителя, хотя он особо не ограничивается, может использоваться, например, тетрагидрофуран, толуол, бензол, диоксан, хлороформ,дихлорметан, 1,2-дихлорэтан и аналогичные, отдельно или в сочетании. Что касается условий реакции,хотя их следует менять в зависимости от используемого производного ацеталя, представленного общей формулой (XXVI), целевое соединение может быть получено путем проведения реакции обычно при -20150C, предпочтительно 0-100C, в течение от 5 мин до 1 недели, предпочтительно от 30 мин до 100 ч. С помощью реакции получаемого производного аминоакролеина (XXVII) и соли гуанидина(XXVIII) в растворителе в присутствии основания можно получать целевое соединение, производное аминопиримидина (XXIX). В качестве основания, хотя оно особо не ограничивается, могут использоваться, например, гидриды щелочных металлов, такие как гидрид лития, гидрид натрия и гидрид калия,щелочные металлы, такие как литий, натрий и калий, гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия, карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия, карбонат калия и карбонат цезия, диизопропиламид лития, диизопропиламид натрия, диизопропиламид калия, гексаметилдисилазид лития, гексаметилдисилазид натрия, гексаметилдисилазид калия, метоксид натрия, метоксид калия, этоксид натрия, этоксид калия, трет-бутоксид на- 20017321 трия, трет-бутоксид калия, н-бутиллитий, втор-бутиллитий, трет-бутиллитий и аналогичные. В качестве растворителя, хотя он особо не ограничивается, могут использоваться метанол, этанол, изопропанол,N,N-диметилформамид, N-метилпирролидон, диметилсульфоксид, тетрагидрофуран, толуол, бензол, диоксан, хлороформ, дихлорметан, 1,2-дихлорэтан, ацетонитрил, нитрометан, вода и аналогичные, отдельно или в сочетании. Что касается условий реакции, хотя их следует менять в зависимости от используемого производного аминоакролеина (XXVII), целевое соединение может быть получено путем проведения реакции обычно при -20-150C, предпочтительно 0-100C, в течение от 30 мин до 1 недели, предпочтительно от 30 мин до 5 дней. Способ введения защитной группы R23 в аминогруппу производного аминопиримидина (XXIX) можно проводить со ссылкой на способ, используемый обычно для введения защитных групп (ProtectiveGroups in Organic Synthesis Third Edition, John WileySons, Inc.). Удаление R19 из соединения, представленного общей формулой (XXX), хотя оно особо не ограничивается, может проводиться в растворителе с использованием кислоты Льюиса или протонной кислоты. В качестве кислоты Льюиса, хотя она особо не ограничивается, может использоваться трибромид бора,трихлорид бора, алюминийхлорид, триметилсилилйодид, триметилсилилтрифторметансульфонат, этилалюминийдихлорид, хлорид диэтилалюминия и аналогичные. В качестве протонной кислоты, хотя она особо не ограничивается, может использоваться бромисто-водородная кислота, йодисто-водородная кислота и аналогичные. В качестве растворителя, хотя он особо не ограничивается, может использоваться толуол, бензол, хлороформ, дихлорметан, 1,2-дихлорэтан, хлорбензол, нитробензол, ацетонитрил, нитрометан, уксусная кислота и аналогичные, отдельно или в сочетании. Что касается условий реакции, хотя их следует менять в зависимости от используемого соединения, представленного общей формулой(XXX), целевое соединение можно получать путем проведения реакции обычно при -20-150 C, предпочтительно 0-120C, в течение от 10 мин до 3 дней, предпочтительно от 10 мин до 30 ч. Когда R19 является арилметильной группой, такой как бензильная, п-метоксибензильная и 2,4,6-триметилбензильная группа,помимо упомянутых выше способов, снятие защиты может достигаться с помощью гидрирования. В качестве источника водорода для гидрирования, хотя он особо не ограничивается, может использоваться водород, муравьиная кислота, формиат аммония, циклогексадиен и аналогичные. В качестве катализатора гидрирования, хотя он особо не ограничивается, может использоваться палладий/уголь, палладиевая чернь, платиновая чернь, диоксид платины, никель Ренея, гидроксид палладия/угольный порошок и аналогичные. В качестве растворителя, хотя он особо не ограничивается, может использоваться метанол,этанол, изопропанол, этилацетат, изопропилацетат, N,N-диметилформамид, тетрагидрофуран, диоксан,ацетонитрил, уксусная кислота, вода и аналогичные, отдельно или в сочетании. Что касается условий реакции, хотя их следует менять в зависимости от соединения, представленного общей формулой (XXX),целевое соединение может быть получено путем проведения реакции обычно при 0-150C, предпочтительно 0-100C, в течение от 30 мин до 3 дней, предпочтительно от 30 мин до 50 ч. С помощью реакции Мицунобу производного гидроксипиримидина (XXXI) со спиртом (XXIV), или реакции производного гидроксипиримидина (XXXI) с соединением (XXXII), имеющим уходящую группу W5, может быть получено соединение простого эфира (XXXIII). Реакция Мицунобу производного гидроксипиримидина (XXXI) и спиртового соединения (XXIV) может проводиться в растворителе с использованием фосфинового реагента и азо-реагента или этилендикарбоновокислотного реагента, или фосфонилидного реагента. В качестве фосфинового реагента, хотя он особо не ограничивается, может использоваться триалкилфосфин или триарилфосфин, в частности триметилфосфин, триэтилфосфин,трипропилфосфин, триизопропилфосфин, трибутилфосфин, триизобутилфосфин, трициклогексилфосфин, трифенилфосфин, дифенилфосфинополистирол и аналогичные. В качестве азореагента, хотя он особо не ограничивается, может использоваться диэтилазодикарбоксилат (DEAD), диизолропилазодикарбоксилат, 1,1'-(азодикарбонил)пиперидин (ADDP), 1,1'-азобис(N,N'-диизопропилформамид) (TIPA),1,6-диметил-1,5,7-гексагидро-1,4,6,7-тетразоцин-2,5-дион (DHTD) и аналогичные. В качестве этилендикарбоновокислотного реагента, хотя он особо не ограничивается, может использоваться диметилмалеат,диэтилмалеат, диметилфумарат, диэтилфумарат и аналогичные. В качестве растворителя, хотя он особо не ограничивается, может использоваться N,N'-диметилформамид, тетрагидрофуран, диоксан, ацетонитрил, пропионитрил, нитрометан, ацетон, этилацетат, изопропилацетат, бензол, толуол, хлорбензол, хлороформ, дихлорметан, 1,2-дихлорэтан и аналогичные, отдельно или в сочетании. Что касается условий реакции, хотя их следует менять в зависимости от используемого производного гидроксипиримидина,представленного общей формулой (XXXI), целевое соединение можно получать путем проведения реакции обычно при 0-120C, предпочтительно 0-100C в течение от 30 мин до 3 дней, предпочтительно от 30 мин до 50 ч. Реакция производного гидроксипиримидина (XXXI) и соединения (XXXII), имеющего уходящую группу W5, может проводиться в растворителе, в присутствии основания. В качестве растворителя, хотя он особо не ограничивается, может использоваться, например, N,N-диметилформамид, Nметилпирролидон, диметилсульфоксид, диоксан, тетрагидрофуран, ацетонитрил, пропионитрил и аналогичные, отдельно или в сочетании, и в качестве основания, хотя оно особо не ограничивается, могут использоваться, например, гидриды щелочных металлов, такие как гидрид лития, гидрид натрия и гидрид- 21017321 калия, щелочные металлы, такие как литий, натрий и калий, гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия, карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия, карбонат калия и карбонат цезия, диизопропиламид лития, диизопропиламид натрия, диизопропиламид калия, гексаметилдисилазид лития, гексаметилдисилазид натрия, гексаметилдисилазид калия, трет-бутоксид натрия, трет-бутоксид калия, н-бутиллитий, втор-бутиллитий, третбутиллитий и аналогичные. Способ удаления защитной группы R23 из простого эфирного соединения (XXXIII), получаемого согласно способу, упомянутому выше, хотя он особо не ограничивается, можно проводить со ссылкой на способ, используемый обычно для удаления защитных групп (Protective Groups in Organic Synthesis ThirdEdition, John WileySons, Inc.). В дополнение, производное гидроксипиримидина (XXXI), используемого в вышеупомянутом способе получения, может быть также получено, помимо вышеупомянутых способов, следующим способом. А именно, как показано на следующей реакционной схеме 8, оно может быть получено с помощью защиты аминогруппы и гидроксигруппы 5-гидроксипиримидин-2-амина (XXXIV) защитной группой R23 с получением соединения, представленного общей формулой (XXXV), и селективного удаления защитной группы R23 из кислородной функциональной группы. Защитной группой R23 в общей формуле (XXXV) является обычно защитная группа, которая может вводиться и в гидроксигруппу, и в аминогруппу, и хотя она особо не ограничивается, предпочтительными являются формильная, ацетильная, пропионильная,бутирильная, гексаноильная, триметилацетильная, трифторацетильная, бензоильная, циклогексилкарбонильная, бензилоксикарбонильная, 2,2,2-трихлорэтилкарбонильная, трет-бутоксикарбонильная, 4 метоксибензильная, бензильная, 3,4-диметоксибензильная, 2,4,6-триметилбензильная, трифторметансульфонильная группы и аналогичные. Данный способ реакции представлен следующими реакционными формулами. где R23 представляет защитную группу. Способ введения защитной группы R23 в аминогруппу и гидроксигруппу 5-гидроксипиримидин-2 амина (XXXIV), хотя он особо не ограничивается, можно проводить со ссылкой на способ, используемый обычно для введения защитных групп (Protective Groups in Organic Synthesis Third Edition, JohnWileySons, Inc.). Способ удаления защитной группы R23, вводимой в кислородную функциональную группу соединения (XXXV), получаемого с помощью упомянутого выше способа, хотя он особо не ограничивается,можно проводить со ссылкой на способ, используемый обычно для удаления защитных групп (ProtectiveGroups in Organic Synthesis Third Edition, John WileySons, Inc.). 3. Способ получения соединения (VI), имеющего уходящую группу W2. В качестве упомянутого выше соединения (VI), имеющего уходящую группу W2, может использоваться соединение, доступное само по себе, или оно может быть подходящим образом получено известным способом. Например, данное соединение может быть получено следующим способом. Однако данный способ получения не ограничивается следующим примером. Как показано на следующей реакционной схеме 9, с помощью восстановления производного кетона, представленного общей формулой (VII), может быть получено спиртовое производное, представленное общей формулой (XXXVIII). Кроме того, с помощью реакции альдегидного производного, представленного общей формулой (XXXVI), с алкилметаллическим реагентом, представленным общей формулой(XXXVII), может быть получено спиртовое производное, представленное общей формулой (XXXVIII). В качестве металла М в общей формуле (XXXVII) предпочтителен щелочной металл, такой как литий, натрий и калий, или галогенид магния, образующий реагент Гриньяра, такой как хлорид магния, бромид магния и йодид магния. Путем превращения спиртового фрагмента спиртового производного, представленного общей формулой (XXXVIII), в уходящую группу W2 может быть получено соединение, имеющее уходящую группу W2, представленное общей формулой (VI). Данный способ реакции представлен следующими реакционными формулами. где R1, R2, R3, R4, R5 и R6 имеют те же значения, что и значения, поясняемые для общей формулы(I), упомянутой выше, и W2 представляет атом галогена, алкилсульфонилоксигруппу, галоидалкилсульфонилоксигруппу или арилсульфонилоксигруппу. Реакция восстановления производного кетона (VII) может проводиться в растворителе с использованием восстанавливающего реагента. В качестве растворителя, хотя он особо не ограничивается, может использоваться, например, 1,2-дихлорэтан, хлороформ, дихлорметан, этилацетат, изопропилацетат, толуол, бензол, тетрагидрофуран, диоксан, ацетонитрил, пропионитрил, метанол, этанол, изопропанол, уксусная кислота, трифторуксусная кислота и аналогичные, отдельно или в сочетании. В качестве восстанавливающего реагента, хотя он особо не ограничивается, могут использоваться реагенты боргидридного типа, такие как триацетоксиборгидрид натрия, триацетоксиборгидрид тетраметиламмония, цианоборгидрид натрия, боргидрид натрия, боргидрид лития, триметоксиборгидрид натрия и триэтилборгидрид лития, и алюминийгидридные реагенты, такие как литийалюминийгидрид, диизопропилалюминийгидрид и бис(2-метоксиэтокси)алюминийгидрид натрия. Реакция производного альдегида (XXXVI) и алкилметаллического реагента, представленного общей формулой (XXXVII), может проводиться путем взаимодействия обоих соединений в безводном растворителе. В качестве растворителя, хотя он особо не ограничивается, может использоваться, например, тетрагидрофуран, толуол, диоксан, гексан и аналогичные, отдельно или в сочетании. Что касается условий реакции, хотя их следует менять в зависимости от используемых исходных материалов, целевое соединение, спиртовое соединение (XXXVIII) может быть получено путем проведения реакции обычно при -100-100C, предпочтительно 78-50C, в течение от 5 мин до 72 ч, предпочтительно от 10 мин до 24 ч. Реакция синтеза соединения (VI), имеющего уходящую группу W2, из спиртового соединения(XXXVIII), может выбираться в зависимости от типа уходящей группы W2 следующим образом. Когда W2 соединения (VI), имеющего уходящую группу W2, представляет сульфонилоксигруппу,соединение (VI) можно получать по реакции спиртового соединения (XXXVIII) и сульфоновокислотного этерифицирующего агента в растворителе в присутствии или в отсутствие основания. В качестве сульфоновокислотного этерифицирующего агента, хотя он особо не ограничивается, может использоваться,например, метансульфонилхлорид, метансульфоновый ангидрид, этансульфонилхлорид, бензилсульфонилхлорид, аллилсульфонилхлорид, трифторметансульфонилхлорид, трифторметансульфоновый ангидрид,хлорметансульфонилхлорид,бензолсульфонилхлорид,п-толуолсульфонилхлорид,онитробензолсульфонилхлорид, или п-нитробензолсульфонилхлорид. В качестве растворителя, хотя он особо не ограничивается, может использоваться, например, 1,2-дихлорэтан, хлороформ, дихлорметан,этилацетат, изопропилацетат, толуол, бензол, тетрагидрофуран, диоксан, ацетонитрил, пропионитрил,N,N-диметилформамид и аналогичные, отдельно или в сочетании. В качестве основания, хотя оно особо не ограничивается, могут использоваться, например, органические основания, такие как пиридин,DMAP, коллидин, лютидин, DBU, DBN, DABCO, триэтиламин, N,N-диизопропилэтиламин, N,Nдиизопропилпентиламин и триметиламин, гидриды щелочных металлов, такие как гидрид лития, гидрид натрия и гидрид калия, гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия, карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия, карбонат калия и карбонат цезия, кислые карбонаты, такие как кислый карбонат натрия и кислый карбонат калия и аналогичные. Когда W2 соединения (VI), имеющего уходящую группу W2, представляет атом галогена, соединение (VI) можно получать по реакции спиртового соединения (XXXVIII) и галоидирующего агента в растворителе или без него, в присутствии или в отсутствие основания. Примеры галоидирующего агента включают, хотя он особо не ограничивается, хлорирующие агенты, бромирующие агенты или йодирущие агенты, такие как оксихлорид фосфора, пентахлорид фосфора, трифенилфосфиндихлорид, трифенилфосфиндибромид, трифенилфосфитдихлорид, трифенилфосфитдибромид, трибромид фосфора, тионил- 23017321 хлорид, трифенилфосфин и четыреххлористый углерод, трифенилфосфин и четырехбромистый углерод,трифенилфосфин, йод и имидазол, трифенилфосфин и NIS, и метансульфонилхлорид и DMAP. В качестве растворителя может использоваться, например, 1,2-дихлорэтан, хлороформ, дихлорметан, диэтиловый эфир, этилацетат, изопропилацетат, толуол, бензол, тетрагидрофуран, диоксан, ацетонитрил, пропионитрил и аналогичные, отдельно или в сочетании. В качестве основания, хотя оно особо не ограничивается,могут использоваться, например, органические основания, такие как пиридин, DMAP, коллидин, лютидин, DBU, DBN, DABCO, триэтиламин, N,N-диизопропилэтиламин, N,N-диизопропилпентиламин и триметиламин, карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия, карбонат калия и карбонат цезия, кислые карбонаты, такие как кислый карбонат натрия и кислый карбонат калия и аналогичные. Способы получения соединения, представленного общей формулой (I), в которой R13 представляет(низший алкил)сульфинил(низшую алкокси)группу или (низший алкил)сульфонил(низшую алкокси)группу, или его соли или сольвата. Соединение, представленное общей формулой (I), в которой R13 представляет (низший алкил)сульфинил(низшую алкокси)группу или (низший алкил)сульфонил(низшую алкокси)группу, может быть также получено, помимо упомянутых выше способов, с помощью следующих стадий реакции. А именно, его можно получать окислением атома серы соединения, представленного общей формулой (I), в которой R13 представляет (низший алкил)тио(низшую алкокси)группу, которое получают с использованием производного пиримидин-2-амина (IV"), в которой R13 представляет (низший алкил)тио(низшую алкокси)группу. В качестве способа окисления может применяться обычный способ превращения атома серы в сульфинильную или сульфонильную группу, и, например, реакция окисления водной перекисью водорода с использованием каталитического количества вольфрамата натрия, дихлорида диоксида молибдена или пентахлорида тантала, или перйодата натрия, перйодата калия, метахлорнадбензойной кислоты(mCPBA), РСС, PDC, N-хлорсукцинимида (NCS), N-бромсукцинимида (NBS), NIS, йода, брома и аналогичных. В качестве растворителя, хотя он особо не ограничивается, может использоваться, например,вода, метанол, этанол, изопропанол, ацетонитрил, ацетон, тетрагидрофуран, дихлорметан, хлороформ,1,2-дихлорэтан, четыреххлористый углерод, N,N-диметилформамид, уксусная кислота и аналогичные,отдельно или в сочетании. Кроме того, соединение, представленное общей формулой (I), в которой R13 представляет (низший алкил)сульфонил(низшую алкокси)группу, может быть также получено из соединения, представленного общей формулой (I), в которой R13 представляет (низший алкил)сульфинил(низшую алкокси)группу, с использованием сходных условий реакции окисления. Способ получения соединения, представленного общей формулой (I), в которой R13 представляет гидроксигруппу, или его соли или сольвата. Соединение, представленное общей формулой (I), в которой R13 представляет гидроксигруппу, может быть также получено с помощью следующих стадий реакции, а также с помощью соответствующего использования упомянутых выше способов. А именно, соединение, представленное общей формулой (I),в которой R13 представляет гидроксигруппу, может быть получено путем получения соединения, представленного общей формулой (I), с использованием производного аминопиримидина (XXIX) в качестве производного пиримидин-2-амина (IV) в соответствии с реакционной схемой 1 или 2 и удаления защитной группы в положении R13. Промежуточные соединения и целевые соединения, получаемые в упомянутых выше реакциях, могут быть выделены и очищены, как требуется, методами очистки, обычно используемыми в области химии органического синтеза, например, фильтрованием, экстракцией, промывкой, сушкой, концентрированием, перекристаллизацией, различными типами хроматографии и аналогичными. Промежуточные соединения могут также использоваться для последующих реакций без особой очистки. Кроме того, различные виды изомеров могут быть выделены общепринятыми способами, использующими разницу в физико-химических свойствах изомеров. Например, рацемическую смесь можно превращать в оптически чистые изомеры с помощью обычного способа рацемического расщепления,такого как способ образования диастереомерных солей с обычной оптически активной кислотой, такой как винная кислота, и проведения оптического расщепления, или способ использования оптически активной колоночной хроматографии. Более того, расщепление диастереомерной смеси может также достигаться с помощью, например, фракционной кристаллизации, различных приемов хроматографии и тому подобного. Кроме того, оптически активное соединение может быть также получено с помощью использования подходящего оптически активного исходного материала. Получающееся в результате соединение (I) может быть превращено в кислотно-аддитивную соль с помощью общепринятого способа. Соединение может быть также получено в виде сольвата с растворителем, таким как реакционный растворитель и растворитель перекристаллизации или гидрата. Примеры дозированной формы лекарственного средства, включающего соединение настоящего изобретения, его соль или сольват в качестве активного ингредиента, включают, например, формы для орального введения, такие как таблетки, капсулы, гранулы, порошки и сиропы, и формы для паренте- 24017321 рального введения, такие как формы для внутривенной инъекции, внутримышечной инъекции, медицинские свечи, ингалянты, трансдермальные препараты, глазные капли и капли в нос. Для того чтобы получить лекарственные средства в различных дозированных формах, активный ингредиент может использоваться или один, или в соответствующем сочетании с другими фармацевтически приемлемыми добавками, такими как эксципиенты, связующие, наполнители, дезинтегрирующие агенты, поверхностноактивные агенты, смазки, диспергирующие агенты, буферные агенты, консервирующие агенты, лекарственные модификаторы, отдушки, покрывающие агенты и разбавители, для получения в виде фармацевтической композиции. Ингибитором HMG-CoA редуктазы, используемым для комбинированной композиции для лекарственного средства настоящего изобретения, является соединение, которое ингибирует биологическое превращение гидроксиметилглутарил-кофермента А в мевалоновую кислоту, катализируемое HMG-CoA редуктазой, и примеры его включают ловастатин, симвастатин, флувастатин, правастатин, питавастатин,аторвастатин, росвастатин и аналогичные. Хотя доза лекарственного средства, СЕТР ингибитора или HDL-повышающего агента настоящего изобретения может варьировать в зависимости от веса, возраста, пола и симптомов пациента и аналогичных факторов, обычно предпочтительно, чтобы она составляла 0,1-500 мг, особенно 1-300 мг, из расчета соединения, представленного общей формулой (I), которая могла бы вводиться орально или парентерально один раз или несколько раз в день в виде раздельных порций для взрослого. Примеры Настоящее изобретение будет пояснено со ссылкой на примеры. Однако настоящее изобретение не ограничивается данными примерами. Сокращения, используемые в нижеприведенных примерах, имеют следующие значения.H-NMR (или ЯМР): Протонный ядерный магнитный резонансN-1-[3,5-бис(трифторметил)фенил]этил-N-(2-[(циклопентилметил)(этил)амино]-5-(трифторметил)фенилметил)-5-[2-(метилтио)этокси]пиримидин-2-амина. Стадия 1. Получение 5-[2-(метилтио)этокси]пиримидин-2-амина. 5-[2-(Метилтио)этокси]пиримидин-2-амин получали с помощью способа, описанного в п. а), упомянутом ниже. Кроме того, его также получали с помощью способа, описанного в п. b), упомянутом ниже. В получении N-(5-гидроксипиримидин-2-ил)гексанамид, промежуточное соединение способа пунктаb), описанного ниже, также получали, помимо способа, описанного в п. b), способами, описанными в пп. с) и d), упомянутых ниже. а) Получение 5-[2-(метилтио)этокси]пиримидин-2-амина (1). 5-Бром-2-хлорпиримидин (300 мг, 1,55 ммоль) растворяли путем нагревания при 120C в 4 метоксибензиламине (2,10 г, 15,4 ммоль) и раствор перемешивали при той же температуре в течение 2 ч. Реакционную смесь непосредственно подвергали обработке с помощью колоночной хроматографии на силикагеле (гексан:этилацетат = 30:15:1) для очистки, с получением 5-бром-N-(4 метоксибензил)пиримидин-2-амина (445 мг, 98%) в виде бесцветного аморфного твердого вещества. 1 Н-ЯМР (CDCl3) : 3,80 (3H, s), 4,52 (2 Н, d, J=5,4 Hz), 5,45 (1 Н, br), 6,87 (2H, d, J=8,4 Hz), 7,24 (2H,d, J=8,4 Hz), 8,28 (2H, s). 5-Бром-N-(4-метоксибензил)пиримидин-2-амин (300 мг, 1,02 ммоль) суспендировали в толуоле (20 мл), в суспензию добавляли йодид меди (I) (200 мг, 1,05 ммоль), 2-метилтиоэтанол (1,06 г, 11,5 ммоль),N,N'-диметилэтилендиамин (0,83 г, 9,42 ммоль) и карбонат цезия (400 мг, 1,22 ммоль) и смесь перемешивали при 110C в течение 66 ч в атмосфере аргона. Реакционную смесь разделяли с помощью колоночной хроматографии на силикагеле (этилацетат), а затем очищали с помощью препаративной тонкослойной хроматографии на силикагеле (гексан:этилацетат = 1:1) с получением N-(4-метоксибензил)-5-[2(метилтио)этокси]пиримидин-2-амина (172 мг) в виде бесцветного аморфного твердого вещества. 1 Н-ЯМР (CDCl3) : 2,20 (3H, s), 2,85 (2 Н, t, J=6,8 Hz), 3,80 (3H, s), 4,10 (2 Н, t, J=6,8 Hz), 4,51 (2H, d,J=5,9 Hz), 5,31 (1H br), 6,86 (2H, d, J=8,6 Hz), 7,28 (2H, d, J=8,6 Hz), 8,05 (2H, s).N-(4-Метоксибензил-5-[2-(метилтио)этокси]пиримидин-2-амин (172 мг) растворяли в трифторуксусной кислоте (3 мл) при комнатной температуре и раствор перемешивали при 60C в течение 2,5 ч.- 25017321 Реакционную смесь концентрировали при пониженном давлении и полученный остаток очищали с помощью препаративной тонкослойной хроматографии на силикагеле (хлороформ:метанол = 15:1) с получением 5-[2-(метилтио)этокси]пиримидин-2-амина (34 мг, 18% в 2 стадии) в виде бесцветного аморфного твердого вещества. 1b) Получение 5-[2-(метилтио)этокси]пиримидин-2-амина (2). 5-Метоксипиримидин-2-амин (12,3 г, 98,3 ммоль) растворяли в пиридине (123 мл), к раствору добавляли гексаноилхлорид (14,5 г, 108 ммоль) на ледяной бане и смесь перемешивали при комнатной температуре в течение 30 мин. К реакционной смеси при 0C добавляли 1 М водный раствор глицина(98,3 мл) и смесь перемешивали в течение 1 ч, а затем экстрагировали хлороформом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, а затем концентрировали при пониженном давлении, и полученный остаток азеотропировали толуолом. Полученный остаток перекристаллизовывали из смеси хлороформ-гексан с получением N-(5-метоксипиримидин-2 ил)гексанамида (18,4 г, 84%) в виде бесцветного твердого вещества. 1(170 мл), к супензии добавляли трехбромистый бор (20,5 мл, 216 ммоль) и смесь нагревали с обратным холодильником в течение 30 мин. Реакционную смесь инактивировали метанолом (170 мл) при охлаждении льдом. Реакционную смесь концентрировали при пониженном давлении, к полученному остатку добавляли насыщенный раствор аммиака в метаноле (85 мл) при охлаждении льдом и смесь гомогенизировали. Реакционную смесь концентрировали при пониженном давлении, к полученному остатку добавляли воду и экстрагировали хлороформом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении, и полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (гексан:ацетон = 2:1), с получением N-(5-гидроксипиримидин-2-ил)гексанамида (9,36 г, 59%) в виде бледножелтого твердого вещества. 1N-(5-Гидроксипиримидин-2-ил)гексанамид (8,18 г, 39 ммоль) и трифенилфосфин (20,5 г, 78 ммоль) перемешивали и сушили при пониженном давлении, а затем атмосферу замещали аргоном. Эти вещества растворялись при нагревании в безводном N,N-диметилформамиде (80 мл) и раствор охлаждали до комнатной температуры, а затем добавляли 2-метилтиоэтанол (5,40 г, 58,6 ммоль). К реакционной смеси добавляли DEAD (2,2M раствор в толуоле, 26,6 мл, 58,6 ммоль) на ледяной бане и смесь перемешивали при комнатной температуре в течение 2 ч. К реакционной смеси добавляли воду (300 мл) и смесь перемешивали в течение 15 мин, а затем экстрагировали хлороформом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении, полученный остаток растворяли в насыщенном растворе аммиака в метаноле (60 мл) и раствор оставляли при комнатной температуре в течение 1 ч. Реакционную смесь концентрировали при пониженном давлении и полученный остаток очищали с помощью колоночной хроматографии на силикагеле (гексан:этилацетат = 3:1 гексан:ацетон = 2:1), элюат концентрировали при пониженном давлении и полученный остаток растворяли в хлороформе с помощью нагревания. Полученные при охлаждении раствора льдом кристаллы удаляли и фильтрат концентрировали при пониженном давлении. Остаток перекристаллизовывали из смеси хлороформ-гексан с получением N-5-[2-(метилтио)этокси]пиримидин 2-илгексанамида (6,80 г, 61%) в виде бледного темно-коричневого твердого вещества. 1 Н-ЯМР (CDCl3) : 0,91 (3H, t, J=7,l Hz), 1,26-1,41 (4 Н, m), 1,70-1,78 (2 Н, m), 2,22 (3H, s), 2,52-2,68N-5-[2-(метилтио)этокси]пиримидин-2-илгексанамид (6,80 г, 24 ммоль) суспендировали в метаноле (68 мл), к суспензии добавляли метоксид натрия (1 М раствор в метаноле, 120 мл, 120 ммоль), вещества в суспензии растворялись на масляной бане при 60C и раствор перемешивали при той же температуре в течение 2 ч. Реакционную смесь концентрировали при пониженном давлении, полученный остаток экстрагировали хлороформом и водой, органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, а затем концентрировали при пониженном давлении. Полученный остаток промывали смесью простой эфир/гексан и фильтровали, получая 5-[2(метилтио)этокси]пиримидин-2-амин (2,93 г, 59%) в виде бледно-желтого твердого вещества.c) Получение N-(5-гидроксипиримидин-2-ил)гексанамида (2). 5-Гидроксипиримидин-2-амин (40,0 г, 360 ммоль) растворяли в пиридине (200 мл), к раствору добавляли гексаноилхлорид (121 г, 899 ммоль) и смесь перемешивали при комнатной температуре в течение 0,5 ч. К реакционной смеси добавляли метанол (100 мл), смесь концентрировали при пониженном давлении и полученный остаток разбавляли водой и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, а затем концен- 26017321 трировали при пониженном давлении и полученный остаток растворяли в метаноле (200 мл). К раствору добавляли насыщенный раствор аммиака в метаноле (250 мл) при охлаждении льдом и перемешивании и смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении и полученный остаток очищали с помощью колоночной хроматографии на силикагеле (гексан:ацетон =2:1), с получением N-(5-гидроксипиримидин-2-ил)гексанамида (39,5 г, 52%) в виде бесцветного твердого вещества.d) Получение N-(5-гидроксипиримидин-2-ил)гексанамида (3). К [(2,2-диэтоксиэтокси)метил]бензолу (8,30 г, 37,0 ммоль) при перемешивании и охлаждении льдом добавляли пентахлорид фосфора (8,09 г, 38,8 ммоль) на протяжении 15 мин. Смесь перемешивали при той же температуре в течение 15 мин, а затем нагревали и перемешивали на масляной бане при 75C в течение 75 мин. Реакционную смесь охлаждали путем перемешивания при комнатной температуре в течение 20 мин, а затем добавляли безводный N,N-диметилформамид (8,6 мл, 111 ммоль) при той же температуре и смесь перемешивали при комнатной температуре в течение 3 дней. К реакционной смеси добавляли 8 М водный раствор гидроксида натрия на ледяной бане до тех пор, пока значение рН не становилось 8 или выше, а затем смесь разбавляли водой и экстрагировали простым эфиром. Органический слой последовательно промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия, а затем концентрировали при пониженном давлении и полученный остаток очищали с помощью колоночной хроматографии на силикагеле (гексан:ацетон = 4:12:1), с получением 2(бензилокси)-3-(диметиламино)акрилальдегида (4,05 г, 53%) в виде коричневого масла. 1H-ЯMP (CDCl3) : 3,04 (6 Н, s), 4,96 (2 Н, s), 6,17 (1 Н, s), 7,28-7,43 (5 Н, m), 8,64 (1 Н, s). 2-(Бензилокси)-3-(диметиламино)акрилальдегид (10,9 г, 53 ммоль) растворяли в Nметилпирролидоне (85 мл), к раствору добавляли гидрохлорид гуанидина (15,3 г, 160 ммоль) и затем к смеси добавляли гидрид натрия (50% в масле, 15,3 г, 320 ммоль) при перемешивании на ледяной бане и все перемешивали на масляной бане при 80C в течение 1 ч. К реакционной смеси на ледяной бане добавляли воду для разложения избыточного гидрида натрия, а затем экстрагировали простым эфиром и водой, и органический слой последовательно промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (гексан:ацетон = 10:14:12:11:1) и элюат концентрировали при пониженном давлении. Затем полученный остаток промывали смесью простой эфир-гексан и фильтровали с получением 5-(бензилокси)пиримидин-2-амина (6,99 г, 65%) в виде бледножелтого твердого вещества. 1H-ЯМР (CDCl3) : 4,76 (2 Н, br s), 5,03 (2 Н, s), 7,28-7,43 (5 Н, m), 8,08 (2 Н, s). К раствору 5-(бензилокси)пиримидин-2-амина (60,0 г, 0,30 ммоль) в дихлорметане (400 мл) добавляли пиридин (30 мл, 0,37 ммоль), к смеси по каплям добавляли раствор гексаноилхлорида (46,0 г, 0,34 ммоль) в дихлорметане (100 мл) при перемешивании на ледяной бане и смесь перемешивали при той же температуре в течение 1 ч. К реакционной смеси добавляли 1 М раствор соляной кислоты (500 мл) и экстрагировали хлороформом и органический слой последовательно промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия, а затем концентрировали при пониженном давлении. Полученный остаток перекристаллизовывали из смеси хлороформ-гексан с получением N-(5(бензилокси)пиримидин-2-ил)гексанамида (87,1 г, 98%) в виде бесцветных игл. 1 Н-ЯМР (CDCl3) : 0,90 (3H, t, J=6,9 Hz), 1,34-1,39 (4 Н, m), 1,69-1,75 (2 Н, m), 2,55-2,61 (2 Н, m), 5,12N-(5-(Бензилокси)пиримидин-2-ил)гексанамид (87,1 г, 0,29 ммоль) растворяли в метаноле (2,4 л), к раствору добавляли 10% палладий на угле (20 г) и смесь перемешивали при комнатной температуре в течение 3 ч в атмосфере водорода. Реакционную смесь фильтровали, фильтрат концентрировали при пониженном давлении и полученный остаток очищали с помощью колоночной хроматографии на силикагеле (хлороформ:метанол = 30:1) с получением N-(5-гидроксипиримидин-2-ил)гексанамида (28,0 г, 46%) в виде бледно-желтого твердого вещества. Стадия 2. Получение 1-бром-1-[3,5-бис(трифторметил)фенил]этана. К раствору 3,5-бис(трифторметил)ацетофенона (2,00 г, 7,81 ммоль) в метаноле (20 мл) добавляли боргидрид натрия (591 мг, 15,6 ммоль) при перемешивании на ледяной бане и смесь перемешивали при той же температуре в течение 30 мин. К реакционной смеси добавляли 1 М раствор соляной кислоты на ледяной бане до тех пор, пока значение pH не становилось 7 или менее, а затем концентрировали при пониженном давлении, к полученному остатку добавляли воду (20 мл) и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении с получением 1-[3,5 бис(трифторметил)фенил]этанола (2,00 г, 99%) в виде бесцветного твердого вещества. 1 Н-ЯМР (CDCl3) : 1,55 (3H, d, J=6,6 Hz), 2,00 (1 Н, br s), 5,05 (1H, q, J=6,6 Hz), 7,79 (1H, s), 7,85 (2H,s). К раствору 1-[3,5-бис(трифторметил)фенил]этанола (500 мг, 1,94 ммоль) в толуоле (5 мл) добавляли трехбромистый фосфор (550 мг, 2,03 ммоль) и смесь перемешивали при комнатной температуре в тече- 27017321 ние ночи. Реакционную смесь разбавляли водой и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, а затем концентрировали при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагелеN-(циклопентилметил)-N-этиламин (2,70 г, 21,2 ммоль), синтезированный способом, описанным в международной патентной публикации WO 2006/073973, и карбонат калия (6,50 г, 47,0 ммоль), и смесь нагревали с обратным холодильником в течение 68 ч. Реакционную смесь охлаждали до комнатной температуры, затем добавляли воду и экстрагировали хлороформом. Органический слой промывали насыщенным солевым раствором, затем сушили над безводным сульфатом натрия и концентрировали при пониженном давлении, а полученный остаток очищали с помощью колоночной хроматографии на силикагелеN-1-[3,5-бис(трифторметил)фенил]этил-N-(2-[(циклопентилметил)(этил)амино]-5-(трифторметил)фенилметил)-5-[2-(метилтио)этокси]пиримидин-2-амина. К раствору 2-[(циклопентилметил)(этил)амино]-5-(трифторметил)бензальдегида (3,34 г, 11,2 ммоль), полученного на стадии 3, и 5-[2-(метилтио)этокси]пиримидин-2-амина (2,27 г, 12,3 ммоль), полученного на стадии 1 в толуоле (80 мл), добавляли уксусную кислоту (317 мг, 5,19 ммоль) и смесь нагревали с обратным холодильником в течение 4 ч с помощью устройства Дина-Старка. Реакционную смесь оставляли охлаждаться до комнатной температуры и затем добавляли триацетоксиборгидрид натрия (4,73 г, 22,3 ммоль) при перемешивании на ледяной бане, и смесь перемешивали при комнатной температуре в течение 60 ч. В реакционную смесь добавляли воду и экстрагировали хлороформом, а затем органический слой промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (гексан: этилацетат = 20:110:14:1) с получением(40 мл) при охлаждении льдом добавляли гидрид натрия (50% в масле, 1,80 г, 37,5 ммоль) и смесь перемешивали при 50C в течение 1 ч. После охлаждения до -78C к реакционной смеси добавляли раствор 1 бром-1-[3,5-бис(трифторметил)фенил]этана (6,02 г, 18,7 ммоль), полученного на стадии 2 в N,Nдиметилформамиде (40 мл), и смесь перемешивали в течение 2.5 ч с нагреванием до комнатной температуры. В реакционную смесь добавляли воду и экстрагировали этилацетатом, органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении, а полученный остаток очищали с помощью колоночной хроматографии на силикагеле(трифторметил)фенил]этил-N-(2[(циклопентилметил)(этил)амино]-5-(трифторметил)фенилметил)-5-[2-(метилсульфинил)этокси]пиримидин-2-амина и N-1-[3,5-бис(трифторметил)фенил]этил-N-(2-[(циклопентилметил)(этил)амино]-5(трифторметил)фенилметил)-5-[2-(метилсульфонил)этокси]пиримидин-2-амина. К раствору N-1-[3,5-бис(трифторметил)фенил]этил-N-(2-[(циклопентилметил)(этил)амино]-5(трифторметил)фенилметил)-5-[2-(метилтио)этокси]пиримидин-2-амина (348 мг, 0,49 ммоль), полученного в примере 1, в ацетонитриле (7 мл) добавляли перекись двухлористого молибдена (14,6 мг, 0,073 ммоль) и 30% водный раствор перекиси водорода (220 мг, 1,94 ммоль) и смесь перемешивали при комнатной температуре в течение 23 ч. В реакционную смесь добавляли насыщенный водный раствор сульфита натрия и экстрагировали хлороформом. Затем органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали с помощью препаративной тонкослойной хроматографии на силикагеле(гексан:ацетон=2:1) с получением N-1-[3,5-бис(трифторметил)фенил]этил-N-(2-[(циклопентилме- 28017321 тил)(этил)амино]-5-(трифторметил)фенилметил)-5-[2-(метилсульфинил)этокси]пиримидин-2-амина (соединение примера 2, 32,8 мг, 9%) в виде желтого масла и N-1-[3,5-бис(трифторметил)фенил]этил-N(2-[(циклопентилметил)(этил)амино]-5-(трифторметил)фенилметил)-5-[2-(метилсульфонил)этокси]пиримидин-2-амина (соединение примера 3, 295 мг, 81%) в виде бледно-желтого масла. Пример 4. ПолучениеN-1-[3,5-бис(трифторметил)фенил]этил-N-(2-[(циклопентилметил)(этил)амино]-5-метоксифенилметил)-5-[2-(метилтио)этокси]пиримидин-2-амина. Реакции и обработки осуществляли таким же образом, как на стадии 3 примера 1, с использованием 2-фтор-5-метоксибензальдегида вместо 2-фтор-5-(трифторметил)бензальдегида,получая 2[(циклопентилметил)(этил)амино]-5-метоксибензальдегид в виде желтого масла. 1H-ЯMP (CDCl3) : 0,98 (3H, t, J=7,1 Hz), 1,09-1,24 (2 Н, m), 1,38-1,70 (6 Н, m), 1,94 (1 Н, m), 2,94 (2H,d, J=7,6 Hz), 3,06 (2H, q, J=7,1 Hz), 3,83 (3H, s), 7,12 (1H, dd, J=3,2, 8,8 Hz), 7,23 (1H, d, J=8,8 Hz), 7,31 (1H,d, J=3,2 Hz), 10,49 (1H, s). Реакции и обработки осуществляли таким же образом, как на стадии 4 примера 1, с использованием 2-[(циклопентилметил)(этил)амино]-5-метоксибензальдегида вместо 2-[(циклопентилметил)(этил)амино]-5-(трифторметил)бензальдегида, получая целевое соединение, N-1-[3,5-бис(трифторметил)фенил]этил-N-(2-[(циклопентилметил)(этил)амино]-5-метоксифенилметил)-5-[2-(метилтио)этокси]пиримидин-2-амин в виде бледно-желтого масла. Пример 5. ПолучениеN-1-[3,5-бис(трифторметил)фенил]этил-N-(2-[(циклопентилметил)(этил)амино]-5-метоксифенилметил)-5-[2-(метилсульфонил)этокси]пиримидин-2-амина. Реакции и обработки осуществляли таким же образом, как описано в примере 3, с использованиемN-1-[3,5-бис(трифторметил)фенил]этил-N-(2-[(циклопентилметил)(этил)амино]-3,5-дифторфенилметил)-5-[2-(метилтио)этокси]пиримидин-2-амина. Реакции и обработки осуществляли таким же образом, как на стадии 3 примера 1, с использованием 2,3,5-трифторбензальдегида вместо 2-фтор-5-(трифторметил)бензальдегида,получая 2[(циклопентилметил)(этил)амино]-3,5-дифторбензальдегид в виде желтого масла. 1H-ЯМР (CDCl3) : 0,99 (3H, t, J=6,6 Hz), 1,07-1,20 (2 Н, m), 1,41-1,70 (6 Н, m), 1,89 (1 Н, m), 3,03 (2H,d, J=7,6 Hz), 3,13 (2H, q, J=6,6 Hz), 7,04 (1H, m), 7,34 (1H, m), 10,50 (1H, d, J=3,4 Hz). Реакции и обработки осуществляли таким же образом, как на стадии 4 примера 1, с использованием 2[(циклопентилметил)(этил)амино]-3,5-дифторбензальдегида вместо 2-[(циклопентилметил)(этил)амино]-5-(трифторметил)бензальдегида,получая целевое соединениеN-1-[3,5-бис(трифторметил)фенил]этил-N-(2-[(циклопентилметил)(этил)амино]-3,5-дифторфенилметил)-5-[2-(метилсульфонил)этокси]пиримидин-2-амина. Реакции и обработки осуществляли таким же образом, как описано в примере 3, с использованиемN-1-[3,5-бис(трифторметил)фенил]этил-N-(2-[(циклопентилметил)(этил)амино]-5-метилфенилметил)-5-[2-(метилтио)этокси]пиримидин-2-амина. Реакции и обработки осуществляли таким же образом, как на стадии 3 примера 1, с использованием 2-фтор-5-метилбензальдегида вместо 2-фтор-5-(трифторметил)бензальдегида,получая 2[(циклопентилметил)(этил)амино]-5-метилбензальдегид в виде желтого масла. 1 Н-ЯМР (CDCl3) : 1,00 (3H, t, J=7,1 Hz), 1,14-1,19 (2 Н, m), 1,43-1,67 (6 Н, m), 2,01 (1 Н, m), 2,33 (3H,s), 2,99 (2H, d, J=7,6 Hz), 3,12 (2H, q, J=7,1 Hz), 7,13 (1H, d, J=8,3 Hz), 7,32 (1H, dd, J=2,2, 8,3 Hz), 7,62 (1H,d, J=2,2 Hz), 10,39 (1H, s). Реакции и обработки осуществляли таким же образом, как на стадии 4 примера 1, с использованием 2-[(циклопентилметил)(этил)амино]-5-метилбензальдегида вместо 2-[(циклопентилметил)(этил)амино]5-(трифторметил)бензальдегида, получая целевое соединение N-1-[3,5-бис(трифторметил)фенил]этилN-(2-[(циклопентилметил)(этил)амино]-5-метилфенилметил)-5-[2-(метилтио)этокси]пиримидин-2 амин в виде бледно-желтого масла. Пример 9. Получение
МПК / Метки
МПК: C07D 239/42, A61P 7/02, A61P 43/00, A61P 3/06, A61P 9/00, A61K 31/505, C07D 403/12
Метки: лекарственные, содержащие, производные, n,n-дибензил-2-аминопиримидина, средства
Код ссылки
<a href="https://eas.patents.su/30-17321-proizvodnye-nn-dibenzil-2-aminopirimidina-i-lekarstvennye-sredstva-ih-soderzhashhie.html" rel="bookmark" title="База патентов Евразийского Союза">Производные n,n-дибензил-2-аминопиримидина и лекарственные средства, их содержащие</a>
Предыдущий патент: Неформованный огнеупорный материал, способ получения землисто-влажного неформованного огнеупорного материала, а также применение неформованного огнеупорного материала
Следующий патент: Способы обработки сред для культур клеток, применяемых в биореакторах
Случайный патент: Способ и устройство расчета и оценки газового коллектора и устройство хранения программ












