Тризамещенные 1,2,4-триазолы
Номер патента: 16289
Опубликовано: 30.03.2012
Авторы: Даффи Джеймс Эдвард Стюард, Ван Росбрук Ив Эмиль Мария, Чжуан Вэй, Лезаж Анн Симон Жозефин, Макдональд Грегор Джеймс, Ван Ден Кейбюс Франс Альфонс Мария, Тюринг Йоханнес Вильхельмус Йохн Ф., Динкло Теодорус, Де Брюин Марсель Франс Леопольд
Формула / Реферат
1. Соединение формулы (I)
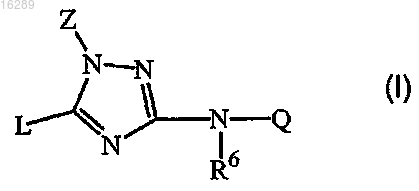
включая все его стереохимически изомерные формы, где
Z означает C1-6-алкил или C1-6-алкил, замещенный одним или более заместителями, независимо выбираемыми из группы, состоящей из гидрокси, циано, C1-6-алкил-O-, R1R2N-C(=O)-, R7-O-C(=O)-NR8-, R10-O-C(=O)-, R3-C(=O)-NR4-, HO-N-C-(=NH)-, галогена, оксо, полигалоген-C1-6-алкила и Het;
Q означает фенил, пиридинил, индолинил, бензодиоксолил, 1,4-бензодиоксанил, бензофуранил, 2,3-дигидробензофуранил, изоксазолил, оксазолил, тиазолил, изотиазолил, пиримидинил или пиридазинил, где каждый радикал необязательно замещен одним, двумя или тремя заместителями, причем каждый независимо выбирают из группы, состоящей из галогена, гидроксила, циано, C1-6-алкила, C1-6-алкил-O-, C1-6-алкилтио, C1-6-алкил-O-C(=O)-, HO-C(=O)-C1-6-алкила, Het, полигалоген-C1-6-алкила, HO-C1-6-алкила, полигалоген-C1-6-алкил-O-, амино, амино-C1-6-алкила, C1-6-алкил-S(=O)2-, моно- или ди(C1-6-алкил)амино, формиламино, C1-6-алкил-C(=O)-NR11- и R12R13N-C(=O)-;
L означает C1-6-алкил, необязательно замещенный одним или, где возможно, двумя или более заместителями, причем каждый независимо выбирают из группы, состоящей из галогена, C1-6-алкил-O-, C1-6-алкилтио, C1-6-алкил-O-C(=O)-, полигалоген-C1-6-алкила и полигалоген-C1-6-алкил-O-; или означает C3-6-циклоалкил, фенил, пиримидинил, пиридинил, пиримидазолил, пиридазинил, тетрагидропиранил, имидазотиазолил, бензодиоксолил, индолинил, изоиндолинил, бензофуранил, хинолинил, изохинолинил, бензоксазолил, 5,6,7,8-тетрагидрохинолинил, 5,6,7,8-тетрагидроизохинолинил, 2,3-дигидропирролопиридинил, фуропиридинил, 2,3-дигидробензофуранил, бензодиоксанил, дигидрофуропиридинил, 7-азаиндолинил и 3,4-дигидро-2H-1,4-бензоксазинил; где каждый из вышеуказанных радикалов необязательно замещен одним или двумя или более заместителями, причем каждый заместитель независимо выбирают из группы, состоящей из галогена, гидроксила, циано, C1-6-алкила, C1-6-алкил-O-, C1-6-алкилтио, C1-6-алкил-O-C(=O)-, HO-C(=O)-C1-6-алкила, Het1, полигалоген-C1-6-алкила, HO-C1-6-алкила, полигалоген-C1-6-алкил-O-, амино, амино-C1-6-алкила, C1-6-алкил-S(=O)2-, моно- или ди(C1-6-алкил)амино, формиламино, C1-6-алкил-C(=O)-NR14-, R15R16N-C(=O)-, морфолинила, CH3O-C1-6-алкил-NH-, HO-C1-6-алкил-NH-, бензилокси, C3-6-циклоалкила, C3-6-циклоалкил-NH-, C3-6-циклоалкил-C1-6-алкил-NH-, полигалоген-C1-6-алкил-C(=O)-NR14-, C1-6-алкил-C(=O)- и C1-6-алкил-O-C1-6-алкила;
R1 и R2, каждый независимо, означают водород, C1-6-алкил, C3-6-циклоалкил, C1-4-алкил-O-C1-6-алкил, Het2, HO-C1-6-алкил, полигалоген-C1-6-алкил, C3-6-циклоалкил, замещенный C1-4-алкилом, C3-6-циклоалкил-C1-6-алкил, диметиламино-C1-4-алкил или 2-гидроксициклопентан-1-ил;
или R1 и R2 вместе с атомом азота, к которому они присоединены, образуют гетероциклический радикал, выбираемый из группы, состоящей из пирролидинила, пиперидинила, пиперазинила, морфолинила, тиоморфолинила и пиразолидинила; где вышеуказанный гетероциклический радикал необязательно замещен 1, 2 или 3 заместителями, причем каждый независимо выбирают из группы, состоящей из галогена, гидрокси, амино, циано и C1-6-алкила;
R3 означает водород, C1-6-алкил, C3-6-циклоалкил, Het3 или C1-6-алкил, замещенный одним или более заместителями, выбираемыми из группы, состоящей из гидрокси, циано, C1-4-алкил-O- и Het4;
R4 и R8, каждый независимо, означают водород, C1-6-алкил или C3-6-циклоалкил; где каждый из этих алкильных радикалов может быть замещен одним или более заместителями, выбираемыми из группы, состоящей из гидрокси, циано и C1-4-алкил-O-;
R6 означает водород, C1-6-алкил или, когда Q означает фенил, R6 также может означать C2-6-алкандиил, присоединенный к вышеуказанному фенильному циклу, образуя вместе с атомом азота, к которому он присоединен, и вышеуказанным фенильным циклом конденсированную бициклическую систему, содержащую 9-10 атомов цикла, такую как индолинил или тетрагидрохинолинил, причем каждый необязательно замещен трифторметилом;
R7 и R10, каждый независимо, означают водород, C1-6-алкил или C3-6-циклоалкил; где каждый из этих алкильных радикалов может быть замещен одним или более заместителями, выбираемыми из группы, состоящей из гидрокси, циано, C1-4-алкил-O-, Het4 и NH2-C(CH3)=N-;
R11 и R14, каждый независимо, означает водород, C1-6-алкил или C3-6-циклоалкил; где каждый из этих алкильных радикалов может быть замещен одним или более заместителями, выбираемыми из группы, состоящей из гидрокси, циано и C1-4-алкил-O- ;
R12 и R13, каждый независимо, означают водород, C1-6-алкил или C3-6-циклоалкил; где каждый из этих алкильных радикалов может быть замещен одним или более заместителями, выбираемыми из группы, состоящей из гидрокси, циано или C1-4-алкил-O-; или R12 и R13 вместе с атомом азота, к которому они присоединены, могут образовывать гетероциклический радикал, выбираемый из группы, состоящей из пирролидинила, пиперидинила, пиперазинила, морфолинила, тиоморфолинила и пиразолидинила; где вышеуказанный гетероциклический радикал необязательно замещен 1, 2 или 3 заместителями, причем каждый независимо выбирают из группы, состоящей из галогена, гидрокси, амино, циано, C1-6-алкила или полигалоген-C1-6-алкила,
R15 и R16, каждый независимо, означают водород, C1-6-алкил или C3-6-циклоалкил; где каждый из этих алкильных радикалов может быть замещен одним или более заместителями, выбираемыми из группы, состоящей из гидрокси, циано и C1-4-алкил-O-; или R15 и R16 вместе с атомом азота, к которому они присоединены, могут образовывать гетероциклический радикал, выбираемый из группы, состоящей из пирролидинила, пиперидинила, пиперазинила, морфолинила, тиоморфолинила и пиразолидинила; где вышеуказанный гетероциклический радикал необязательно замещен 1, 2 или 3 заместителями, причем каждый независимо выбирают из группы, состоящей из галогена, гидрокси, амино, циано, C1-6-алкила и полигалоген-C1-6-алкила;
Het и Het1, каждый независимо, означают пиперидинил, пиперазинил, пирролидинил, морфолинил, имидазолил, оксазолил, оксадиазолил, тиазолил, изоксазолил, изотиазолил, тиоморфолинил или пиразолил; где каждый радикал необязательно замещен 1, 2 или 3 заместителями, причем каждый заместитель независимо выбирают из группы, состоящей из галогена, гидрокси, амино, циано, C1-6-алкила и полигалоген-C1-6-алкила;
Het2 означает пиперидинил, пиперазинил, пирролидинил, морфолинил, имидазолил, оксазолил, оксадиазолил, тиазолил, изоксазолил, изотиазолил, тиоморфолинил, пиразолил или тетрагидрофуранил; где каждый радикал необязательно замещен 1, 2 или 3 заместителями, причем каждый заместитель независимо выбирают из группы, состоящей из галогена, гидрокси, амино, циано, C1-6-алкила и полигалоген-C1-6-алкила;
Het3 означает пиперидинил, пиперазинил, пирролидинил, морфолинил, имидазолил, оксазолил, оксадиазолил, тиазолил, изоксазолил, изотиазолил, тиоморфолинил или пиразолил; где каждый радикал необязательно замещен 1, 2 или 3 заместителями, причем каждый заместитель независимо выбирают из группы, состоящей из галогена, гидрокси, амино, циано, C1-6-алкила и полигалоген-C1-6-алкила;
Het4 означает пиперидинил, пиперазинил, пирролидинил, морфолинил, имидазолил, оксазолил, оксадиазолил, тиазолил, изоксазолил, изотиазолил, тиоморфолинил или пиразолил; где каждый радикал необязательно замещен 1, 2 или 3 заместителями, причем каждый заместитель независимо выбирают из группы, состоящей из галогена, гидрокси, амино, циано или C1-6-алкила;
его N-оксид, фармацевтически приемлемая аддитивная соль, сольват или четвертичный амин;
при условии, что вышеуказанное соединение не представляет собой N-пропил-N-(2-метоксифенил)-1-метил-5-(2,4-дихлорфенил)-1H-1,2,4-триазол-3-амин и 1,5-диметил-N-фенил-1H-1,2,4-триазол-3-амин.
2. Соединение формулы (I) по п.1, включая все его стереохимически изомерные формы, где
Z означает C1-6-алкил или C1-6-алкил, замещенный одним или более заместителями, независимо выбираемыми из группы, состоящей из гидрокси, циано, C1-6-алкил-O-, R1R2N-C(=O)-, R7-O-C(=O)-NR8-, R10-O-C(=O)-, R3-C(=O)-NR4-, HO-N-C-(=NH)-, галогена, оксо, полигалоген-C1-6-алкила и Het;
Q означает фенил, пиридинил, бензодиоксолил, где каждый радикал необязательно замещен одним, двумя или тремя заместителями, причем каждый независимо выбирают из группы, состоящей из галогена, циано, C1-6-алкила, C1-6-алкил-O-, полигалоген-C1-6-алкила, полигалоген-C1-6-алкил-O- и моно- или ди(C1-6-алкил)амино;
L означает фенил, пиридинил, бензодиоксолил, индолинил, хинолинил, 2,3-дигидропирролопиридинил, фуропиридинил, бензодиоксанил, дигидрофуропиридинил, 7-азаиндолинил, 3,4-дигидро-2H-1,4-бензоксазинил; где каждый радикал необязательно замещен одним или двумя или более заместителями, причем каждый заместитель независимо выбирают из группы, состоящей из галогена, циано, C1-6-алкила, C1-6-алкил-O-, полигалоген-C1-6-алкила, HO-C1-6-алкила, полигалоген-C1-6-алкил-O-, амино-C1-6-алкила, моно- или ди(C1-6-алкил)амино, R15R16N-C(=O)-, морфолинила, CH3O-C1-6-алкил-NH-, HO-C1-6-алкил-NH-, бензилокси, C3-6-циклоалкила, C3-6-циклоалкил-NH-, C3-6-циклоалкил-C1-6-алкил-NH-, полигалоген-C1-6-алкил-C(=O)-NR14-, C1-6-алкил-C(=O)- и C1-6-алкил-O-C1-6-алкила;
R1 и R2, каждый независимо, означают водород, C1-6-алкил, C3-6-циклоалкил, C1-4-алкил-O-C1-6-алкил, Het2, HO-C1-6-алкил, полигалоген-C1-6-алкил, C3-6-циклоалкил, замещенный C1-4-алкилом, C3-6-циклоалкил-C1-6-алкил, диметиламино-C1-4-алкил или 2-гидроксициклопентан-1-ил;
или R1 и R2 вместе с атомом азота, к которому они присоединены, образуют гетероциклический радикал, выбираемый из группы, состоящей из пирролидинила и морфолинила;
R3 означает водород, C1-6-алкил, C3-6-циклоалкил или Het3;
R4 и R8, каждый независимо, означает водород или C1-6-алкил;
R6 означает водород или, когда Q означает фенил, R6 также может означать C2-6-алкандиил, присоединенный к вышеуказанному фенильному циклу, образуя вместе с атомом азота, к которому он присоединен, и вышеуказанным фенильным циклом индолинил, замещенный трифторметилом;
R7 и R10, каждый независимо, означают C1-6-алкил или C3-6-циклоалкил;
R11 и R14, каждый независимо, означает водород или C1-6-алкил;
R15 и R16, каждый независимо, означают водород или C1-6-алкил; или R15 и R16 вместе с атомом азота, к которому они присоединены, могут образовывать пирролидинил;
Het и Het1, каждый независимо, означают оксазолил, необязательно замещенный C1-6-алкилом;
Het2 означает тетрагидрофуранил;
Het3 означает оксазолил;
его N-оксид, фармацевтически приемлемая аддитивная соль, сольват или четвертичный амин.
3. Соединение формулы (I) по п.1, включая все его стереохимически изомерные формы, где
Z означает C1-6-алкил, замещенный гидрокси, R1R2N-C(=O)-, R3-C(=O)-NR4-;
Q означает фенил, пиридинил или бензодиоксолил, где каждый радикал необязательно замещен одним, двумя или тремя заместителями, причем каждый независимо выбирают из группы, состоящей из галогена, C1-6-алкила, C1-6-алкил-O-, полигалоген-C1-6-алкила, полигалоген-C1-6-алкил-O- и моно- или ди(C1-6-алкил)амино;
L означает фенил, пиридинил, бензодиоксолил, индолинил, 2,3-дигидропирролопиридинил, фуропиридинил, бензодиоксанил, дигидрофуропиридинил, 7-азаиндолинил или 3,4-дигидро-2H-1,4-бензоксазинил; где каждый радикал необязательно замещен одним или двумя или более заместителями, причем каждый заместитель независимо выбирают из группы, состоящей из галогена, C1-6-алкила, C1-6-алкил-O-, HO-C1-6-алкила, моно- или ди(C1-6-алкил)амино, C3-6-циклоалкила, C3-6-циклоалкил-NH-, C3-6-циклоалкил-C1-6-алкил-NH- и C1-6-алкил-O-C1-6-алкила;
R1 и R2, каждый независимо, означают водород, C1-6-алкил или C3-6-циклоалкил;
R3 означает C1-6-алкил;
R4 означает водород или C1-6-алкил;
R6 означает водород;
его N-оксид, фармацевтически приемлемая аддитивная соль, сольват или четвертичный амин.
4. Соединение формулы (I) по п.1, включая все его стереохимически изомерные формы, где
Z означает гидрокси-C2-3-алкил или R1R2N-C(=O)-C1-3-алкил;
Q означает фенил или пиридинил, где каждый радикал необязательно замещен одним, двумя или тремя заместителями, причем каждый независимо выбирают из группы, состоящей из галогена, C1-6-алкила, C1-6-алкил-O-, полигалоген-C1-6-алкила, полигалоген-C1-6-алкил-O- и моно- или ди(C1-6-алкил)амино или 2,2-дифтор-1,3-бензодиоксол-5-ила;
L означает фенил, пиридинил, индолинил, 2,3-дигидропирролопиридинил, бензодиоксанил, дигидрофуропиридинил, 7-азаиндолинил или 3,4-дигидро-2H-1,4-бензоксазинил; где каждый радикал необязательно замещен одним или двумя или более заместителями, причем каждый заместитель независимо выбирают из группы, состоящей из фтора, хлора, C1-2-алкила, C1-2-алкил-O-, моно- или ди(C1-2-алкил)амино, циклопропила, циклопропил-NH-, циклопропилметил-NH- и метил-O-метила;
R1 и R2, каждый независимо, означают водород, C1-2-алкил или C3-5-циклоалкил;
R6 означает водород;
его N-оксид, фармацевтически приемлемая аддитивная соль, сольват или четвертичный амин.
5. Соединение по п.1, где Z выбирают из группы, состоящей из гидроксиэтила, 2-гидроксипропила, метил-NH-C(=O)-метила, этил-NH-C(=O)-метила, диметиламино-C(=O)-этила, пирролидинил-C(=O)-этила, изопропиламино-C(=O)-метила и изоксазолкарбоксамидпропила, где вышеуказанный изоксазольный цикл необязательно замещен метилом.
6. Соединение по п.1, где Q представляет собой 2,2-дифтор-1,3-бензодиоксол-5-ил.
7. Соединение по п.1, где L выбирают из группы, состоящей из фенила, пиридинила или 1,4-бензодиоксанила, где вышеуказанный L необязательно замещен одним или более метильными или этиламино заместителями.
8. Соединение формулы (I), включая все его стереохимически изомерные формы, выбираемое из группы, состоящей из
(S)-5-[2-(этиламино)-4-пиридинил]-α-метил-3-[(3,4,5-трифторфенил)амино]-1H-1,2,4-триазол-1-этанола;
3-[(2,2-дифтор-1,3-бензодиоксол-5-ил)амино]-N,N-диметил-5-(4-пиридинил)-1H-1,2,4-триазол-1-ил}пропанамида;
N-этил-2-{3-[(2,2-дифтор-1,3-бензодиоксол-5-ил)амино]-5-(2-метил-4-пиридинил)-1H-1,2,4-триазол-1-ацетамида;
3-[(2,2-дифтор-1,3-бензодиоксол-5-ил)амино]-N,N-диметил-5-(2-метил-4-пиридинил)-1H-1,2,4-триазол-1-пропанамида;
N-(циклопропилметил)-2-{3-[(2,2-дифтор-1,3-бензодиоксол-5-ил)амино]-5-(2-метил-4-пиридинил)-1H-1,2,4-триазолил-1}ацетамида;
N-метил-2-{5-(2,3-дигидро-1,4-бензодиоксин-6-ил)-3-[[3-(трифторметил)фенил]амино]-1H-1,2,4-триазолил-1}ацетамида;
N-(1-метилэтил)-2-{5-(2,3-дигидро-1,4-бензодиоксин-6-ил)-N-(1-метилэтил)-3-[[3-(трифторметил)фенил]амино]-1H-1,2,4-триазолил-1}ацетамида;
5-(4-пиридинил)-3-[[3-(трифторметил)фенил]амино]-1H-1,2,4-триазол-1-этанола;
5-(2,3-дигидро-1,4-бензодиоксин-6-ил)-3-[[3-(трифторметил)фенил]амино]-1H-1,2,4-триазол-1-этанола;
5-(2-хлор-4-пиридинил)-3-[[3-(трифторметил)фенил]амино]-1H-1,2,4-триазол-1-этанола;
N,N-диметил-5-(4-пиридинил)-3-[[3-(трифторметил)фенил]амино]-1H-1,2,4-триазол-1-пропанамида;
5-(2,3-дигидро-1,4-бензодиоксин-6-ил)-N,N-диметил-3-[[3-(трифторметил)фенил]амино]-1H-1,2,4-триазол-1-пропанамида;
5-метил-N-[3-[5-(4-пиридинил)-3-[[3-(трифторметил)фенил]амино]-1H-1,2,4-триазол-1-ил]пропил]-3-изоксазолкарбоксамида;
его N-оксид, фармацевтически приемлемая аддитивная соль, сольват или четвертичный амин.
9. Применение соединение по любому из пп.1-8 в качестве лекарственного средства для лечения или профилактики психотических нарушений, нарушений в отношении интеллектуального ухудшения или заболеваний или состояний, в случае которых полезна модуляция никотинового α7-рецептора.
10. Применение соединения для получения лекарственного средства в целях предупреждения или лечения или профилактики психотических нарушений, нарушений в отношении интеллектуального ухудшения или заболеваний или состояний, в случае которых полезна модуляция никотинового α7-рецептора, где соединением является соединение по любому из пп.1-8.
11. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество соединения по любому из пп.1-8.
12. Способ получения композиции по п.11, отличающийся тем, что фармацевтически приемлемый носитель тщательно смешивают с терапевтически эффективным количеством соединения по любому из пп.1-8.
Текст
Настоящее изобретение относится к производным 3-анилин-5-арилтриазола и их аналогам или их фармацевтически приемлемым солям, способам их получения, содержащим их фармацевтическим композициям и их применению в терапии в соответствии с формулой (I). Данное изобретение, в частности, относится к положительным аллостерическим модуляторам никотиновых рецепторов ацетилхолина, таким как положительный аллостерический модулятор, обладающий способностью усиливать эффективность агонистов никотинового рецептора. Тюринг Йоханнес Вильхельмус Йохн Ф., Макдональд Грегор Джеймс,Лезаж Анн Симон Жозефин, Чжуан Вэй, Де Брюин Марсель Франс Леопольд, Ван Ден Кейбюс Франс Альфонс Мария, Ван Росбрук Ив Эмиль Мария, Динкло Теодорус (BE),Даффи Джеймс Эдвард Стюард (GB) Медведев В.Н. (RU) 016289 Настоящее изобретение относится к производным 3-анилин-5-арилтриазола и их аналогам или их фармацевтически приемлемым солям, способам их получения, содержащим их фармацевтическим композициям и их применению в терапии. Данное изобретение, в частности, относится к положительным аллостерическим модуляторам никотиновых рецепторов ацетилхолина, таким как положительные аллостерические модуляторы, обладающие способностью усиливать эффективность агонистов никотинового рецептора. Известный уровень техники В EP 1044970 описываются 3-алкиламино-1,2,4-триазолы в качестве лигандов нейропептидного Yрецептора. В статье Makara G.M. и др. (Organic Letters (2002), т. 4 (10), сс. 1751-1754) описывается твердофазный синтез 3-алкиламино-1,2,4-триазолов и приводится пример неудачного синтеза N-(4 метоксифенил)-1-метил-5-(4-метилфенил)-1H-1,2,4-триазол-3-амина [регистрационный номер по CAS 433710-55-5] и отсутствуют данные относительно потенциальных терапевтических применений этого соединения, в частности о его применении в качестве положительного аллостерического модулятора никотинового 7-рецептора ацетилхолина.Chen Chen и др. в BioorganicMedicinal Chemistry Letters, 11 (2001), сс. 3165-3168, описывают синтез 1-алкил-3-амино-5-арил-1H-[1,2,4]триазолов, в частности N-пропил-N-(2-метоксифенил)-1-метил-5(2,4-дихлорфенил)-1H-1,2,4-триазол-3-амина, и их применение в качестве антагониста кортикотропинвысвобождающего фактора-1 (CRF1). Предпосылки создания изобретения Холинергические рецепторы обычно связываются с ацетилхолином (Ach) эндогенного нейромедиатора, таким образом инициируя открытие ионных каналов. ACh-рецепторы центральной нервной системы у млекопитающих могут быть подразделены на мускариновые (mAChR) и никотиновые (nAChR) подтипы, базирующиеся на агонистических активностях мускарина и никотина соответственно. Никотиновые рецепторы ацетилхолина представляют собой управляемые лигандами ионные каналы, включающие пять субъединиц. Члены семейства генов с nAChR-субъединицей подразделяют на две группы, базирующиеся на их аминокислотных последовательностях; одна группа содержит так называемые субъединицы, а вторая группа содержит -субъединицы. Показано, что три типа -субъединиц, 7, 8 и 9, образуют функциональные рецепторы, когда экспрессируются индивидуально, и, таким образом,предполагают образование гомоолигомерных пентамерных рецепторов. Разработана модель аллостерического переходного состояния nAChR, которая включает, по меньшей мере, состояние покоя, активированное состояние и десенсибилизированное состояние закрытого канала, процесс, за счет которого рецепторы становятся нечувствительными к агонисту. Различные лиганды nAChR могут стабилизировать конформационное состояние рецептора, с которым они предпочтительно связаны. Например, агонисты ACh и (-)-никотина, соответственно, стабилизируют активное и десенсибилизированное состояния. Изменения активности никотиновых рецепторов вовлечены в ряд заболеваний. Некоторые из них,например астенический бульбарный паралич и аутосомно-доминантная ночная эпилепсия лобной доли(ADNFLE), ассоциируются с уменьшениями активности никотиновой трансмиссии либо вследствие уменьшения количества рецепторов, либо вследствие увеличения десенсибилизации. Также было предположено, что уменьшения в случае никотиновых рецепторов опосредуют когнитивные расстройства, наблюдаемые при заболеваниях, таких как болезнь Альцгеймера и шизофрения. Эффекты никотина из табака также опосредованы никотиновыми рецепторами, и так как воздействие никотина должно стабилизировать рецепторы в десенсибилизированном состоянии, увеличивающаяся активность никотиновых рецепторов может уменьшать желание курить. Соединения, которые связываются с nAChR, предлагаются для лечения ряда нарушений, включая ослабленную холинергическую функцию, как, например, дефицит в отношении обучения, когнитивное расстройство, дефицит внимания или потеря памяти. Полагают, что модуляция активности никотинового 7-рецептора полезна в случае ряда заболеваний, включая болезнь Альцгеймера, деменцию, ассоциированную с тельцами Леви, нарушение гиперактивности в отношении дефицита внимания, беспокойство,шизофрению, маниакальный синдром, маниакальную депрессию, болезнь Паркинсона, болезнь Хантингтона, болезнь Туретта, травму головного мозга или другие неврологические, дегенеративные или психиатрические нарушения, при которых происходит потеря холинергических синапсов, включая нарушение биологического ритма организма при перелете через несколько часовых поясов, пагубную привычку к никотину, боль. Однако обработка агонистами никотинового рецептора, которые воздействуют на тот же самый сайт, как и ACh, является проблематичной, потому что ACh не только активирует, но также блокирует активность рецептора за счет процессов, которые включают десенсибилизацию и неконкурирующую блокаду. Кроме того, оказывается, что пролонгированная активация вызывает персистирующую инактивацию. Следовательно, полагают, что агонисты ACh могут снижать активность, а также усиливать ее. Десенсибилизация никотиновых рецепторов вообще и в случае конкретного указания на никотиновый 7-рецептор ограничивает продолжительность действия используемого агониста.-1 016289 Описание данного изобретения Авторами настоящего изобретения неожиданно обнаружено, что некоторые новые соединения могут увеличивать эффективность агонистов никотиновых рецепторов ацетилхолина (nAChR). Соединения,обладающие этим типом воздействия (в дальнейшем упоминаемые как положительные аллостерические модуляторы), вероятно, должны быть особенно пригодны для лечения состояний, связанных со снижениями никотиновой трансмиссии. В терапевтическом плане такие соединения должны восстанавливать нормальную межнейронную коммуникацию без ухудшения преходящего профиля активации. Кроме того, полагают, что положительные аллостерические модуляторы не вызывают длительной инактивации рецепторов, как это может происходить при пролонгированном применении агонистов. Положительные nAChR-модуляторы согласно настоящему изобретению пригодны для лечения или профилактики психотических нарушений, нарушений в отношении интеллектуального ухудшения или заболеваний или состояний, в случае которых полезна модуляция никотинового 7-рецептора. Настоящее изобретение относится к производным 3-анилин-5-арилтриазола, обладающим свойствами положительного аллостерического модулятора, в частности, свойствами повышения эффективности агонистов никотинового 7-рецептора. Данное изобретение, далее, относится к способам их получения и содержащим их фармацевтическим композициям. Данное изобретение также относится к применению производных 3-анилин-5-арилтриазола для получения лекарственного средства в целях лечения или профилактики психотических нарушений, нарушений в отношении интеллектуального ухудшения или заболеваний или состояний, при которых полезна модуляция никотинового 7-рецептора. Соединения согласно настоящему изобретению отличаются структурно от соединений известного уровня техники и фармакологически своей активностью в качестве положительных аллостерических модуляторов никотинового 7-рецептора ацетилхолина. Настоящее изобретение относится к соединению формулы (I) включая все его стереохимически изомерные формы,где Z означает C1-6-алкил или C1-6-алкил, замещенный одним или более заместителями, независимо выбираемыми из группы, состоящей из гидрокси, циано, C1-6-алкил-O-, R1R2N-C(=O)-, R7-O-C(=O)-NR8-,R10-O-C(=O)-, R3-C(=O)-NR4-, HO-N-C-(=NH)-, галогена, оксо, полигалоген-C1-6-алкила и Het;Q означает фенил, пиридинил, индолинил, бензодиоксолил, 1,4-бензодиоксанил, бензофуранил, 2,3 дигидробензофуранил, изоксазолил, оксазолил, тиазолил, изотиазолил, пиримидинил или пиридазинил,где каждый радикал необязательно замещен одним, двумя или тремя заместителями, причем каждый независимо выбирают из группы, состоящей из галогена, гидроксила, циано, C1-6-алкила, C1-6-алкил-O-,C1-6-алкилтио, C1-6-алкил-O-C(=O)-, HO-C(=O)-C1-6-алкила, Het, полигалоген-C1-6-алкила, HO-C1-6-алкила,полигалоген-C1-6-алкил-O-, амино, амино-C1-6-алкила, C1-6-алкил-S(=O)2-, моно- или ди(C1-6-алкил)амино,формиламино, C1-6-алкил-C(=O)-NR11- и R12R13N-C(=O)-;L означает C1-6-алкил, необязательно замещенный одним или, где возможно, двумя или более заместителями, причем каждый независимо выбирают из группы, состоящей из галогена, C1-6-алкил-O-, C1-6 алкилтио, C1-6-алкил-O-C(=O)-, полигалоген-C1-6-алкила и полигалоген-C1-6-алкил-O-; или означает C3-6 циклоалкил, фенил, пиримидинил, пиридинил, пиримидазолил, пиридазинил, тетрагидропиранил, имидазотиазолил, бензодиоксолил, индолинил, изоиндолинил, бензофуранил, хинолинил, изохинолинил, бензоксазолил, 5,6,7,8-тетрагидрохинолинил, 5,6,7,8-тетрагидроизохинолинил, 2,3-дигидропирролопиридинил, фуропиридинил, 2,3-дигидробензофуранил, бензодиоксанил, дигидрофуропиридинил, 7 азаиндолинил и 3,4-дигидро-2H-1,4-бензоксазинил; где каждый из вышеуказанных радикалов необязательно замещен одним, или двумя, или более заместителями, причем каждый заместитель независимо выбирают из группы, состоящей из галогена, гидроксила, циано, C1-6-алкила, C1-6-алкил-O-, C1-6 алкилтио, C1-6-алкил-O-C(=O)-, HO-C(=O)-C1-6-алкила, Het1, полигалоген-C1-6-алкила, HO-C1-6-алкила,полигалоген-C1-6-алкил-O-, амино, амино-C1-6-алкила, C1-6-алкил-S(=O)2-, моно- или ди(C1-6-алкил)амино,формиламино, C1-6-алкил-C(=O)-NR14-, R15R16N-C(=O)-, морфолинила, CH3O-C1-6-алкил-NH-, HO-C1-6 алкил-NH-, бензилокси, C3-6-циклоалкила, C3-6-циклоалкил-NH-, C3-6-циклоалкил-C1-6-алкил-NH-, полигалоген-C1-6-алкил-C(=O)-NR14-, C1-6-алкил-C(=O)- и C1-6-алкил-O-C1-6-алкила;R1 и R2, каждый независимо, означают водород, C1-6-алкил, C3-6-циклоалкил, C1-4-алкил-O-C1-6 алкил, Het2, HO-C1-6-алкил, полигалоген-C1-6-алкил, C3-6-циклоалкил, замещенный C1-4-алкилом, C3-6 циклоалкил-C1-6-алкил, диметиламино-C1-4-алкил или 2-гидроксициклопентан-1-ил; или R1 и R2 вместе с атомом азота, к которому они присоединены, образуют гетероциклический радикал, выбираемый из группы, состоящей из пирролидинила, пиперидинила, пиперазинила, морфолинила, тиоморфолинила и пиразолидинила; где вышеуказанный гетероциклический радикал необязательно-2 016289 замещен 1, 2 или 3 заместителями, причем каждый независимо выбирают из группы, состоящей из галогена, гидрокси, амино, циано и C1-6-алкила;R3 означает водород, C1-6-алкил, C3-6-циклоалкил, Het3 или C1-6-алкил, замещенный одним или более заместителями, выбираемыми из группы, состоящей из гидрокси, циано, C1-4-алкил-O- и Het4;R4 и R8, каждый независимо, означают водород, C1-6-алкил или C3-6-циклоалкил; где каждый из этих алкильных радикалов может быть замещен одним или более заместителями, выбираемыми из группы,состоящей из гидрокси, циано и C1-4-алкил-O-;R6 означает водород, C1-6-алкил или, когда Q означает фенил, R6 также может означать C2-6 алкандиил, присоединенный к вышеуказанному фенильному циклу, образуя вместе с атомом азота, к которому он присоединен, и вышеуказанным фенильным циклом конденсированную бициклическую систему, содержащую 9-10 атомов цикла, такую как индолинил или тетрагидрохинолинил, причем каждый необязательно замещен трифторметилом;R7 и R10, каждый независимо, означают водород, C1-6-алкил или C3-6-циклоалкил; где каждый из этих алкильных радикалов может быть замещен одним или более заместителями, выбираемыми из группы, состоящей из гидрокси, циано, C1-4-алкил-O-, Het4 и NH2-C(CH3)=N-;R11 и R14, каждый независимо, означают водород, C1-6-алкил или C3-6-циклоалкил; где каждый из этих алкильных радикалов может быть замещен одним или более заместителями, выбираемыми из группы, состоящей из гидрокси, циано и C1-4-алкил-O-;R12 и R13, каждый независимо, означают водород, C1-6-алкил или C3-6-циклоалкил; где каждый из этих алкильных радикалов может быть замещен одним или более заместителями, выбираемыми из группы, состоящей из гидрокси, циано и C1-4-алкил-O-; или R12 и R13 вместе с атомом азота, к которому они присоединены, могут образовывать гетероциклический радикал, выбираемый из группы, состоящей из пирролидинила, пиперидинила, пиперазинила, морфолинила, тиоморфолинила и пиразолидинила; где вышеуказанный гетероциклический радикал необязательно замещен 1, 2 или 3 заместителями, причем каждый независимо выбирают из группы, состоящей из галогена, гидрокси, амино, циано, C1-6-алкила или полигалоген-C1-6-алкила;R15 и R16, каждый независимо, означают водород, C1-6-алкил или C3-6-циклоалкил; где каждый из этих алкильных радикалов может быть замещен одним или более заместителями, выбираемыми из группы, состоящей из гидрокси, циано и C1-4-алкил-O-; или R15 и R16 вместе с атомом азота, к которому они присоединены, могут образовывать гетероциклический радикал, выбираемый из группы, состоящей из пирролидинила, пиперидинила, пиперазинила, морфолинила, тиоморфолинила и пиразолидинила; где вышеуказанный гетероциклический радикал необязательно замещен 1, 2 или 3 заместителями, причем каждый независимо выбирают из группы, состоящей из галогена, гидрокси, амино, циано, C1-6-алкила и полигалоген-C1-6-алкила;Het и Het1, каждый независимо, означают пиперидинил, пиперазинил, пирролидинил, морфолинил,имидазолил, оксазолил, оксадиазолил, тиазолил, изоксазолил, изотиазолил, тиоморфолинил или пиразолил; где каждый радикал необязательно замещен 1, 2 или 3 заместителями, причем каждый заместитель независимо выбирают из группы, состоящей из галогена, гидрокси, амино, циано, C1-6-алкила и полигалоген-C1-6-алкила;Het2 означает пиперидинил, пиперазинил, пирролидинил, морфолинил, имидазолил, оксазолил, оксадиазолил, тиазолил, изоксазолил, изотиазолил, тиоморфолинил, пиразолил или тетрагидрофуранил; где каждый радикал необязательно замещен 1, 2 или 3 заместителями, причем каждый заместитель независимо выбирают из группы, состоящей из галогена, гидрокси, амино, циано, C1-6-алкила и полигалоген-C1-6 алкила;Het3 означает пиперидинил, пиперазинил, пирролидинил, морфолинил, имидазолил, оксазолил, оксадиазолил, тиазолил, изоксазолил, изотиазолил, тиоморфолинил или пиразолил; где каждый радикал необязательно замещен 1, 2 или 3 заместителями, причем каждый заместитель независимо выбирают из группы, состоящей из галогена, гидрокси, амино, циано, C1-6-алкила и полигалоген-C1-6-алкила;Het4 означает пиперидинил, пиперазинил, пирролидинил, морфолинил, имидазолил, оксазолил, оксадиазолил, тиазолил, изоксазолил, изотиазолил, тиоморфолинил или пиразолил; где каждый радикал необязательно замещен 1, 2 или 3 заместителями, причем каждый заместитель независимо выбирают из группы, состоящей из галогена, гидрокси, амино, циано или C1-6-алкила; его N-оксид, фармацевтически приемлемая аддитивная соль, сольват или четвертичный амин; при условии, что соединение не представляет собой N-пропил-N-(2-метоксифенил)-1-метил-5-(2,4 дихлорфенил)-1H-1,2,4-триазол-3-амин. Настоящее изобретение относится, в особенности, к соединению формулы (I)-3 016289 включая все его стереохимически изомерные формы,где Z означает C1-6-алкил или C1-6-алкил, замещенный одним или более заместителями, независимо выбираемыми из группы, состоящей из гидрокси, циано, C1-6-алкил-O-, R1R2N-C(=O)-, R7-O-C(=O)-NR8-,R10-O-C(=O)- и R3-C(=O)-NR4-;Q означает фенил, пиридинил, индолинил, бензодиоксолил, 1,4-бензодиоксанил, бензофуранил, 2,3 дигидробензофуранил, изоксазолил, оксазолил, тиазолил, изотиазолил, пиримидинил или пиридазинил,где каждый радикал необязательно замещен одним, двумя или тремя заместителями, причем каждый независимо выбирают из группы, состоящей из галогена, гидроксила, циано, C1-6-алкила, C1-6-алкил-O-,C1-6-алкилтио, C1-6-алкил-O-C(=O)-, HO-C(=O)-C1-6-алкила, Het, полигалоген-C1-6-алкила, HO-C1-6-алкила,полигалоген-C1-6-алкил-O-, амино, амино-C1-6 алкила, C1-6-алкил-S(=O)2-, моно- или ди(C1-6-алкил)амино,формиламино, C1-6-алкил-C(=O)-NR11- и R12R13N-C(=O)-;L означает C1-6-алкил, необязательно замещенный одним или, где возможно, двумя или более заместителями, причем каждый независимо выбирают из группы, состоящей из галогена, C1-6-алкил-O-, C1-6 алкилтио, C1-6-алкил-O-C(=O)-, полигалоген-C1-6-алкила и полигалоген-C1-6-алкил-O-; или означает C3-6 циклоалкил, фенил, пиримидинил, пиридинил, пиримидазолил, пиридазинил, тетрагидропиранил, имидазотиазолил, бензодиоксолил, индолинил, изоиндолинил, бензофуранил, хинолинил, изохинолинил, бензоксазолил, 5,6,7,8-тетрагидрохинолинил, 5,6,7,8-тетрагидроизохинолинил, 2,3-дигидропирролопиридинил, фуропиридинил или 2,3-дигидробензофуранил; где каждый из вышеуказанных радикалов необязательно замещен одним, или двумя, или более заместителями, причем каждый заместитель независимо выбирают из группы, состоящей из галогена, гидроксила, циано, C1-6-алкила, C1-6-алкил-O-, C1-6 алкилтио, C1-6-алкил-O-C(=O)-, HO-C(=O)-C1-6-алкила, Het1, полигалоген-C1-6-алкила, HO-C1-6-алкила,полигалоген-C1-6-алкил-O-, амино, амино-C1-6-алкила, C1-6-алкил-S(=O)2-, моно- или ди(C1-6-алкил)амино,формиламино, C1-6-алкил-C(=O)-NR14- и R15R16N-C(=O)-;R1 и R2, каждый независимо, означают водород, C1-6-алкил, C3-6-диклоалкил, C1-4-алкил-O-C1-6-алкил или Het2; или R1 и R2 вместе с атомом азота, к которому они присоединены, образуют гетероциклический радикал, выбираемый из группы, состоящей из пирролидинила, пиперидинила, пиперазинила, морфолинила, тиоморфолинила и пиразолидинила; где вышеуказанный гетероциклический радикал необязательно замещен 1, 2 или 3 заместителями, причем каждый независимо выбирают из группы, состоящей из галогена, гидрокси, амино, циано, C1-6-алкила и полигалоген-C1-6-алкила;R3 означает водород, C1-6-алкил, C3-6-циклоалкил, Het3 или C1-6-алкил, замещенный одним или более заместителями, выбираемыми из группы, состоящей из гидрокси, циано, C1-4-алкил-O- и Het4;R4 и R8, каждый независимо, означают водород, C1-6-алкил или C3-6-циклоалкил; где каждый из этих алкильных радикалов может быть замещен одним или более заместителями, выбираемыми из группы,состоящей из гидрокси, циано и C1-4-алкил-O-;R6 означает водород, C1-6-алкил или, когда Q означает фенил, R6 также может означать C2-6 алкандиил, присоединенный к вышеуказанному фенильному циклу, образуя вместе с атомом азота, к которому он присоединен, и вышеуказанным фенильным циклом конденсированную бициклическую систему, содержащую 9-10 атомов цикла, такую как индолинил или тетрагидрохинолинил;R7 и R10, каждый независимо, означают водород, C1-6-алкил или C3-6-циклоалкил; где каждый из этих алкильных радикалов может быть замещен одним или более заместителями, выбираемыми из группы, состоящей из гидрокси, циано, C1-4-алкил-O- и Het4;R11 и R14, каждый независимо, означают водород, C1-6-алкил или C3-6-циклоалкил; где каждый из этих алкильных радикалов может быть замещен одним или более заместителями, выбираемыми из группы, состоящей из гидрокси, циано и C1-4-алкил-O-;R12 и R13, каждый независимо, означают водород, C1-6-алкил или C3-6-циклоалкил; где каждый из этих алкильных радикалов может быть замещен одним или более заместителями, выбираемыми из группы, состоящей из гидрокси, циано или C1-4-алкил-O-; или R12 и R13 вместе с атомом азота, к которому они присоединены, могут образовывать гетероциклический радикал, выбираемый из группы, состоящей из пирролидинила, пиперидинила, пиперазинила, морфолинила, тиоморфолинила и пиразолидинила; где вышеуказанный гетероциклический радикал необязательно замещен 1, 2 или 3 заместителями, причем каждый независимо выбирают из группы, состоящей из галогена, гидрокси, амино, циано, C1-6-алкила или полигалоген-C1-6-алкила;R15 и R16, каждый независимо, означают водород, C1-6-алкил или C3-6-циклоалкил; где каждый из этих алкильных радикалов может быть замещен одним или более заместителями, выбираемыми из группы, состоящей из гидрокси, циано и C1-4-алкил-O-; или R15 и R16 вместе с атомом азота, к которому они присоединены, могут образовывать гетероциклический радикал, выбираемый из группы, состоящей из пирролидинила, пиперидинила, пиперазинила, морфолинила, тиоморфолинила и пиразолидинила; где вышеуказанный гетероциклический радикал необязательно замещен 1, 2 или 3 заместителями, причем каждый независимо выбирают из группы, состоящей из галогена, гидрокси, амино, циано, C1-6-алкила и полигалоген-C1-6-алкила;Het и Het1, каждый независимо, означают пиперидинил, пиперазинил, пирролидинил, морфолинил,имидазолил, оксазолил, оксадиазолил, тиазолил, изоксазолил, изотиазолил, тиоморфолинил или пиразо-4 016289 лил; где каждый радикал необязательно замещен 1, 2 или 3 заместителями, причем каждый заместитель независимо выбирают из группы, состоящей из галогена, гидрокси, амино, циано, C1-6-алкила и полигалоген-C1-6-алкила;Het2 означает пиперидинил, пиперазинил, пирролидинил, морфолинил, имидазолил, оксазолил, оксадиазолил, тиазолил, изоксазолил, изотиазолил, тиоморфолинил или пиразолил; где каждый радикал необязательно замещен 1, 2 или 3 заместителями, причем каждый заместитель независимо выбирают из группы, состоящей из галогена, гидрокси, амино, циано, C1-6-алкила и полигалоген-C1-6-алкила;Het3 означает пиперидинил, пиперазинил, пирролидинил, морфолинил, имидазолил, оксазолил, оксадиазолил, тиазолил, изоксазолил, изотиазолил, тиоморфолинил или пиразолил; где каждый радикал необязательно замещен 1, 2 или 3 заместителями, причем каждый заместитель независимо выбирают из группы, состоящей из галогена, гидрокси, амино, циано, C1-6-алкила и полигалоген-C1-6-алкила;Het4 означает пиперидинил, пиперазинил, пирролидинил, морфолинил, имидазолил, оксазолил, оксадиазолил, тиазолил, изоксазолил, изотиазолил, тиоморфолинил или пиразолил; где каждый радикал необязательно замещен 1, 2 или 3 заместителями, причем каждый заместитель независимо выбирают из группы, состоящей из галогена, гидрокси, амино, циано или C1-6-алкила; его N-оксиду, фармацевтически приемлемой аддитивной соли, сольвату или четвертичному амину; при условии, что вышеуказанное соединение не представляет собой N-пропил-N-(2-метоксифенил)1-метил-5-(2,4-дихлорфенил)-1H-1,2,4-триазол-3-амин и N-(4-метоксифенил)-1-метил-5-(4-метилфенил)1H-1,2,4-триазол-3-амин. Отдельным соединением согласно настоящему изобретению является соединение формулы (I) включая все его стереохимически изомерные формы,где Z означает C1-6-алкил или C1-6-алкил, замещенный одним или более заместителями, независимо выбираемыми из группы, состоящей из гидрокси, циано, C1-6-алкил-O-, R1R2N-C(=O)-, R7-O-C(=O)-NR8-,R10-O-C(=O)-, R3-C(=O)-NR4-, HO-N-C(=NH)-, галогена, оксо, полигалоген-C1-6-алкила и Het;Q означает фенил, пиридинил, бензодиоксолил, где каждый радикал необязательно замещен одним,двумя или тремя заместителями, причем каждый независимо выбирают из группы, состоящей из галогена, циано, C1-6-алкила, C1-6-алкил-O-, полигалоген-C1-6-алкила, полигалоген-C1-6-алкил-O- и моно- или ди(C1-6-алкил)амино;L означает фенил, пиридинил, бензодиоксолил, индолинил, хинолинил, 2,3-дигидропирролопиридинил, фуропиридинил, бензодиоксанил, дигидрофуропиридинил, 7-азаиндолинил, 3,4-дигидро-2H1,4-бензоксазинил; где каждый радикал необязательно замещен одним, или двумя, или более заместителями, причем каждый заместитель независимо выбирают из группы, состоящей из галогена, циано, C1-6 алкила, C1-6-алкил-O-, полигалоген-C1-6-алкила, HO-C1-6-алкила, полигалоген-C1-6-алкил-O-, амино-C1-6 алкила, моно- или ди(C1-6-алкил)амино, R15R16N-C(=O)-, морфолинила, CH3O-C1-6-алкил-NH-, HO-C1-6 алкил-NH-, бензилокси, C3-6-циклоалкила, C3-6-циклоалкил-NH-, C3-6-циклоалкил-C1-6-алкил-NH-, полигалоген-C1-6-алкил-C(=O)-NR14-, C1-6-алкил-C(=O)- и C1-6-алкил-O-C1-6-алкила;R1 и R2, каждый независимо, означают водород, C1-6-алкил, C3-6-циклоалкил, C1-4-алкил-O-C1-6 алкил, Het2, HO-C1-6-алкил, полигалоген-C1-6-алкил, C3-6-циклоалкил, замещенный C1-4-алкилом, C3-6 циклоалкил-C1-6-алкил, диметиламино-C1-4-алкил или 2-гидроксициклопентан-1-ил; или R1 и R2 вместе с атомом азота, к которому они присоединены, образуют гетероциклический радикал, выбираемый из группы, состоящей из пирролидинила и морфолинила;R4 и R8, каждый независимо, означают водород или C1-6-алкил;R6 означает водород или, когда Q означает фенил, R6 также может означать C2-6-алкандиил, присоединенный к вышеуказанному фенильному циклу, образуя вместе с атомом азота, к которому он присоединен, и вышеуказанным фенильным циклом индолинил, замещенный трифторметилом;R11 и R14, каждый независимо, означают водород или C1-6-алкил;R15 и R16, каждый независимо, означают водород или C1-6-алкил; или R15 и R16 вместе с атомом азота, к которому они присоединены, могут образовывать пирролидинил;Het3 означает оксазолил; его N-оксид, фармацевтически приемлемая аддитивная соль, сольват или четвертичный амин. Более конкретно соединениями согласно настоящему изобретению являются соединения формулы (I) включая все их стереохимически изомерные формы,где Z означает C1-6-алкил, замещенный гидрокси, R1R2N-C(=O)-, R3-C(=O)-NR4-;Q означает фенил, пиридинил или бензодиоксолил, где каждый радикал необязательно замещен одним, двумя или тремя заместителями, причем каждый независимо выбирают из группы, состоящей из галогена, C1-6-алкила, C1-6-алкил-O-, полигалоген-C1-6-алкила, полигалоген-C1-6-алкил-O- и моно- или ди(C1-6-алкил)амино;L означает фенил, пиридинил, бензодиоксолил, индолинил, 2,3-дигидропирролопиридинил, фуропиридинил, бензодиоксанил, дигидрофуропиридинил, 7-азаиндолинил или 3,4-дигидро-2H-1,4 бензоксазинил; где каждый радикал необязательно замещен одним или двумя или более заместителями,причем каждый заместитель независимо выбирают из группы, состоящей из галогена, C1-6-алкила, C1-6 алкил-O-, HO-C1-6-алкила, моно- или ди(C1-6-алкил) амино, C3-6-циклоалкила, C3-6-циклоалкил-NH-, C3-6 циклоалкил-C1-6-алкил-NH- и C1-6-алкил-O-C1-6-алкила;R4 означает водород или C1-6-алкил;R6 означает водород; их N-оксид, фармацевтически приемлемая аддитивная соль, сольват или четвертичный амин. Еще более конкретно соединением согласно настоящему изобретению является соединение формулы (I) включая все его стереохимически изомерные формы,где Z означает гидрокси-C2-3-алкил или R1R2N-C(=O)-C1-3-алкил;Q означает фенил или пиридинил; где каждый радикал необязательно замещен одним, двумя или тремя заместителями, причем каждый независимо выбирают из группы, состоящей из галогена, C1-6 алкила, C1-6-алкил-O-, полигалоген-C1-6-алкила, полигалоген-C1-6-алкил-O- и моно- или ди(C1-6 алкил)амино, или 2,2-дифтор-1,3-бензодиоксол-5-ила;L означает фенил, пиридинил, индолинил, 2,3-дигидропирролопиридинил, бензодиоксанил, дигидрофуропиридинил, 7-азаиндолинил или 3,4-дигидро-2H-1,4-бензоксазинил; где каждый радикал необязательно замещен одним или двумя или более заместителями, причем каждый заместитель независимо выбирают из группы, состоящей из фтора, хлора, C1-2-алкила, C1-2-алкил-O-, моно- или ди(C1-2-алкил)амино,циклопропила, циклопропил-NH-, циклопропилметил-NH- и метил-O-метила;R6 означает водород; его N-оксид, фармацевтически приемлемая аддитивная соль, сольват или четвертичный амин. В соответствии с отдельным воплощением данного изобретения Z выбирают из группы, состоящей из гидроксиэтила, 2-гидроксипропила, изопропилметил-NH-C(=O)-, метил-NH-C(=O)-метила, этил-NHC(=O)-метила, диметиламино-C(=O)-этила, пирролидинил-C(=O)-этила, изопропиламино-C(=O)-метила и изоксазолкарбоксамидпропила, где вышеуказанный изоксазольный цикл необязательно замещен метилом. В соответствии с другим отдельным воплощением данного изобретения, Q означает 2,2-дифтор-1,3 бензодиоксол-5-ил. В соответствии с другим отдельным воплощением данного изобретения L выбирают из группы, состоящей из фенила, пиридинила или 1,4-бензодиоксанила; где вышеуказанный L необязательно замещен одним или более метильными или этиламинозаместителями. В особенности, L выбирают из 1,4 бензодиоксанила и пиридинила; все из вышеуказанных радикалов, более конкретно 4-пиридинил, замещены одним метильным или одним этиламинозаместителем. Примерами соединений согласно настоящему изобретению являютсяN-(циклопропилметил)-2-3-[(2,2-дифтор-1,3-бензодиоксол-5-ил)амино]-5-(2-метил-4-пиридинил)1H-1,2,4-триазолил-1-ацетамид; включая все их стереохимически изомерные формы, N-оксиды, фармацевтически приемлемые аддитивные соли, сольваты или четвертичные амины. Другими примерами соединений согласно настоящему изобретению являютсяN,N-диметил-5-(4-пиридинил)-3-3-(трифторметил)фенил]амино]-1H-1,2,4-триазол-1-пропанамид; 5-(2,3-дигидро-1,4-бензодиоксин-6-ил)-N,N-диметил-3-3-(трифторметил)фенил]амино]-1H-1,2,4 триазол-1-пропанамид; 5-метил-N-[3-[5-(4-пиридинил)-3-3-(трифторметил)фенил]амино]-1H-1,2,4-триазол-1-ил]пропил]3-изоксазолкарбоксамид; включая все их стереохимически изомерные формы, N-оксиды, фармацевтически приемлемые аддитивные соли, сольваты или четвертичные амины. Как используется в данном контексте выше или в дальнейшем, C1-4-алкил, как группа или часть группы, означает насыщенные углеводородные радикалы с линейной или разветвленной цепью, имеющие 1-4 атомов углерода, такие как метил, этил, пропил, 1-метилэтил, бутил; C1-6-алкил, как группа или часть группы, означает насыщенные углеводородные радикалы с линейной или разветвленной цепью,имеющие 1-6 атомов углерода, такие как группы, описанные для C1-4-алкила, и пентил, гексил, 2 метилбутил и т.п.; C3-6-циклоалкил является общим термином для циклопропила, циклобутила, циклопентила и циклогексила. Радикал L или Q, как описано выше для соединений формулы (I), может быть присоединен к остатку молекулы согласно формуле (I) по любому атому углерода или гетероатому цикла соответственно. Например, когда L означает пиридинил, он может представлять собой 2-пиридинил, 3-пиридинил или 4 пиридинил. Линии, начерченные в циклических системах, указывают, что связь может быть присоединена к любому подходящему атому цикла. Когда циклическая система является бициклической системой, связь может быть присоединена к любому подходящему атому цикла одного из двух циклов. Как используется в данном контексте ранее, термин (=O) представляет собой карбонильный остаток, когда присоединен к атому углерода, сульфоксидный остаток, когда присоединен к атому серы, и сульфонильный остаток, где два из вышеуказанных терминов присоединены к атому серы. Термин галоген означает фтор, хлор, бром и йод. Как используется ранее и в дальнейшем, полигалоген-C1-6-алкил, как группа или часть группы, означает моно- или полигалогензамещенный C1-6-алкил,например метил с одним или более атомами фтора, например дифторметил или трифторметил, 1,1 дифторэтил и т.п. В данном случае более чем один атом галогена присоединен к алкильной группе в пределах определения полигалоген-C1-4-алкила или полигалоген-C1-6-алкила, причем они могут быть одинаковыми или различными. Подразумевают, что гетероциклы, указанные в вышеприведенных определениях и в дальнейшем,включают все их возможные изомерные формы, например пирролил также включает 2H-пирролил; триазолил включает 1,2,4-триазолил и 1,3,4-триазолил; оксадиазолил включает 1,2,3-оксадиазолил, 1,2,4 оксадиазолил, 1,2,5-оксадиазолил и 1,3,4-оксадиазолил; тиадиазолил включает 1,2,3-тиадиазолил, 1,2,4 тиадиазолил, 1,2,5-тиадиазолил и 1,3,4-тиадиазолил; пиранил включает 2H-пиранил и 4H-пиранил; бензодиоксанил включает 1,4- и 1,3-бензодиоксанил; тетрагидрохинолинил включает 1,2,3,4 тетрагидрохинолинил и 5,6,7,8-тетрагидрохинолинил. Когда любая переменная встречается более чем один раз в любом компоненте, каждое определение является независимым. Должно быть понятно, что некоторые из соединений формулы (I) и их N-оксиды, аддитивные соли,сольваты, четвертичные амины и стереохимически изомерные формы могут содержать один или более центров хиральности и существуют в виде стереохимически изомерных форм. Термин стереохимически изомерные формы, как используется ранее или в дальнейшем, означает все возможные стереоизомерные формы, которые могут иметь соединения формулы (I) и их N-оксиды,-7 016289 аддитивные соли, четвертичные амины или физиологически функциональные производные. За исключением иначе указанного или упомянутого, химическое название соединений обозначает смесь всех возможных стереохимически изомерных форм, причем вышеуказанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры, а также каждая из индивидуальных изомерных форм согласно формуле (I) и их N-оксидов, солей, сольватов, четвертичных аминов, по существу, свободна,т.е. ассоциирована менее чем с 10%, предпочтительно менее чем 5%, в особенности менее чем 2% и более предпочтительно менее чем 1% других изомеров. Подразумевают, что стереохимически изомерные формы соединений формулы (I) входят в рамки данного изобретения. Для терапевтического применения соли соединений формулы (I) являются такими, где противоион является фармацевтически приемлемым. Однако соли кислот и оснований, которые не являются фармацевтически приемлемыми, также могут находить применение, например, при получении или очистке фармацевтически приемлемого соединения. Все соли, фармацевтически приемлемые или нет, входят в рамки настоящего изобретения. Подразумевают, что фармацевтически приемлемые аддитивные соли кислот и оснований, как указано ранее или в дальнейшем, включают терапевтически активные нетоксические аддитивные солевые формы с кислотами и основаниями, которые способны образовывать соединения формулы (I). Фармацевтически приемлемые аддитивные соли кислот можно без труда получать обработкой основной формы такой соответствующей кислотой. Соответствующие кислоты включают, например, неорганические кислоты, такие как галогенводородные кислоты, например соляная кислота или бромводородная кислота,серная кислота, азотная кислота, фосфорная кислота и т.п. кислоты; или органические кислоты, такие как, например, уксусная кислота, пропановая кислота, гидроксиуксусная кислота, молочная кислота, пировиноградная кислота, щавелевая кислота (т.е. этандиовая кислота), малоновая кислота, янтарная кислота (т.е. бутандиовая кислота), малеиновая кислота, фумаровая кислота, яблочная кислота, винная кислота, лимонная кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, цикламеновая кислота, салициловая кислота, п-аминосалициловая кислота, памоевая кислота и т.п. кислоты. И наоборот, вышеуказанные солевые формы обработкой соответствующим основанием можно превращать в свободную основную форму. Соединения формулы (I), содержащие кислый протон, также можно превращать в их нетоксичные аддитивные солевые формы с металлом или амином обработкой соответствующими органическими и неорганическими основаниями. Соответствующие основные солевые формы включают, например, соли аммония, соли щелочных и щелочно-земельных металлов, например соли лития, натрия, калия, магния,кальция и т.п., соли с органическими основаниями, например с первичными, вторичными и третичными алифатическими и ароматическими аминами, такими как метиламин, этиламин, пропиламин, изопропиламин, четыре изомера бутиламина, диметиламин, диэтиламин, диэтаноламин, дипропиламин, диизопропиламин, ди-н-бутиламин, пирролидин, пиперидин, морфолин, триметиламин, триэтиламин, трипропиламин, хинуклидин, пиридин, хинолин и изохинолин; бензатин, N-метил-O-глюкамин, соли гидрабамина, и соли с аминокислотами, такими как, например, аргинин, лизин и т.п. И наоборот, солевые формы обработкой кислотой можно превращать в свободные кислотные формы. Термин сольваты относится к гидратам и алкоголятам, которые могут образовывать соединения формулы (I), а также их соли. Термин четвертичный амин, как используется ранее, означает четвертичные аммониевые соли,которые способны образовывать соединения формулы (I) взаимодействием основного атома азота соединения формулы (I) и соответствующего кватернизирующего агента, такого как, например, необязательно замещенный алкилгалогенид, арилгалогенид или арилалкилгалогенид, например метилиодид или бензилиодид. Также можно использовать другие реагенты с пригодным образом удаляемыми группами, как,например, алкилтрифторметансульфонаты, алкилметансульфонаты и алкил-п-толуолсульфонаты. Четвертичный амин обладает положительно заряженным атомом азота. Фармацевтически приемлемые противоионы включают, например, хлор, бром, иод, трифторацетат и ацетат. Выбираемый противоин можно получать, используя колонки с ионообменной смолой. Подразумевают, что N-оксидные формы соединений согласно настоящему изобретению включают соединения формулы (I), где один или несколько третичных атомов азота окислены до так называемогоN-оксида. Некоторые из соединений формулы (I) также могут существовать в их таутомерной форме. Подразумевают, что такие формы, хотя подробно и не указаны в вышеприведенной формуле, входят в рамки настоящего изобретения. Получение соединений Соединение согласно данному изобретению обычно можно получать путем последовательности стадий, каждая из которых известна квалифицированному специалисту в данной области. В особенности соединения согласно данной заявке на патент можно получать в соответствии с одним или более из следующих способов получения. На следующих схемах, и за исключением иначе указанного, используют все переменные, как описано в формуле (I). Соединения согласно данному изобретению можно получать любым из нескольких стандартных способов синтеза, обычно используемых квалифицированным специалистом в области органической химии, и, как правило, их получают в соответствии со схемой 0 превращением производного метилового эфира N-ацилкарбомимидотионовой кислоты общей формулы (V) в 1,2,4-триазолы формулы (I), используя соответствующий гидразин (VI), при известных условиях. Это превращение обычно осуществляют в протонном растворителе, таком как метанол или высший спирт, и требуется температура между комнатной температурой и температурой 150C. В конкретном воплощении высшим спиртом является третичный бутиловый спирт и температура реакции составляет от 70 до 120C, наиболее предпочтительно 100C. Для этих реакций, где гидразин (VI) используют в виде соли с HCl, предпочтительно добавление стехиометрического количества основания. Вышеуказанное основание может быть неорганическим основанием, таким как ацетат калия или карбонат калия, более предпочтительно, однако, вышеуказанное основание является третичным амином, таким как диизопропилэтиламин или т.п. (схема 0). Схема 1 Общий промежуточный продукт (V) в синтезе тризамещенных триазолов согласно настоящему изобретению обычно получают согласно протоколу, который состоит из 3 синтетических превращений(схема 1), исходя из ацилхлорида общей формулы (II). Хлорангидрид кислоты (II) можно получать обработкой карбоновой кислоты (VII) избытком оксалилхлорида, необязательно, в присутствии ДМФА в качестве катализатора, при повышенной температуре, в частности при температуре кипения. Вышеуказанное превращение также можно осуществлять в присутствии органического растворителя, такого как дихлорметан или т.п. На первой стадии ацилирующий агент, такой как ацилхлорид (II),смешанный или симметричный ангидрид, ацилфторид и т.п., вводят во взаимодействие с тиоцианатом одновалентного катиона (MNCS на схеме 1), таким как, например, тиоцианат калия или тиоцианат аммония, с получением соответствующего ацилизотиоцианата. Это взаимодействие, как правило, проводят,используя ацетон в качестве растворителя, и при температуре от 0 до 70C, предпочтительно при комнатной температуре. Промежуточный продукт ацилизотиоцианат не выделяют, а обрабатывают в подобной реакционной среде соответствующим амином (III), получая N-ацилтиомочевину общей формулы (IV). Эту реакцию превращения обычно проводят при температуре от 0 до 70C, предпочтительно при комнатной температуре. На конечной стадии S-метилирование N-ацилтиомочевины приводит к производному метиловому эфиру N-ацилкарбомимидотионовой кислоты общей формулы (V). Это конечное превращение требует присутствия сильного основания, предпочтительно сильного неорганического основания, такого какNaH, и оно должно проводиться в апротонном растворителе, таком как, например, ДМФА, ТГФ и т.п.,при температуре в диапазоне от -70C до комнатной температуры, предпочтительно при температуре 0C. Соединение общей формулы (I-a) можно гидролизовать до карбоновой кислоты общей формулы (Ib). Это превращение можно проводить использованием водного раствора сильной кислоты, как, например, водный раствор HCl, в присутствии смешивающегося с водой органического сорастворителя, такого как ТГФ, метанол или более предпочтительно 1,4-диоксан. Типичная температура реакции находится в диапазоне между комнатной температурой и 100C, предпочтительно составляет 50C. Альтернативно,вышеуказанный гидролиз можно проводить посредством омыления, обычно, в присутствии основания в виде гидроксида, такого как LiOH или NaOH или т.п., в растворяющей смеси из воды и смешивающегося с водой органического сорастворителя, такого как ТГФ, метанол, 1,4-диоксан или их смеси. Далее конверсию карбоновой кислоты в амиды формулы (I-c) проводят, используя известные в уровне техники способы, такие как, например, обработка с помощью первичного или вторичного амина, как описано выше, в присутствии HBTU (O-бензотриазол-N,N,N',N'-тетраметилуронийгексафторфосфат) или EDCI, в апротонном растворителе, подобном CH2Cl2, или более предпочтительно в полярном апротонном растворителе, подобном ДМФА, в присутствии добавки основания в виде амина, такого как диизопропилэтиламин. В некоторых случаях может быть преимущественным использование HOBt в качестве добавки. В конкретном осуществлении настоящего изобретения, когда n=1 в соединении общей формулы (I-a),образование амида (I-c) можно достигать, исходя непосредственно из соединения (I-a), введением его во взаимодействие с амином R1-NH-R2 в протонном растворителе, таком как этанол или т.п. Это взаимодействие можно осуществлять при температуре от 20 до 160C в зависимости от природы амина. Обычно используемая температура составляет 80C (схема 2). Альтернативно, когда Z включает цианогруппу, нитрил общей формулы (I-d) можно восстанавливать до первичного амина общей формулы (IX), используя условия, известные в уровне техники, такие как, например, газообразный водород в присутствии подходящего гетерогенного катализатора, такого как никель Ренея, в растворяющей системе, подобной метанол-аммиак и ТГФ. При ацилировании амина общей формулы (IX) с помощью ацилирующего агента (VIII), такого как, например, 3 изоксазолкарбонилхлорид или ангидрид, в присутствии основания в виде амина, такого как триэтиламин,в подходящем растворителе, таком как, например, ТГФ или CH2Cl2, получают ациламины формулы (I-c) Нуклеофильное ароматическое замещение атома фтора в положении 3 трифторированного анилинотриазола общей формулы (I-f) можно осуществлять путем растворения соединения (I-f) в спиртовом растворителе, таком как этанол или т.п., в присутствии первичного или вторичного алкиламина R-NH2 или R-NH-R', и путем нагревания при высоких температурах, таких как температура 160C, в микроволновой печи, с получением конечного соединения (I-g) (схема 4). Синтез (цикло)алкиламинопиридинов общей формулы (I-i1) или (I-i2) можно осуществлять обработкой соответствующего хлорпиридинильного предшественника (I-h1) или (I-h2) с помощью первичного (цикло)алкиламина R-NH2 в спиртовом растворителе, таком как этанол или 1-бутанол или т.п., необязательно в присутствии сорастворителя, такого как ТГФ или т.п., и при нагревании при высоких температурах, предпочтительно в диапазоне от 140 до 160C в микроволновой печи или при температуре 160180C в автоклаве. Вышеуказанное превращение можно осуществлять в мягких условиях (более низкая температура), исходя из дихлорпиридинильного соединения (I-h2), и в особенности является благоприятным, когда нуклеофильность алкиламина является низкой, такой как в случае циклопропиламина. Остающийся атом хлора можно удалять каталитически, в атмосфере водорода и при использовании Pd/C в качестве катализатора, в присутствии неорганического основания, такого как ацетат калия, или основания в виде амина, такого как триэтиламин или т.п. (схема 5). Когда соединением-мишенью является 3 алкиламинопиридин общей формулы (I-k), можно преимущественно выбирать соответствующий 3 фторпиридин общей формулы (I-j) в качестве исходного вещества. При вышеуказанном превращении требуется нагревание соединения (I-j) в присутствии избыточного количества алкиламина R-NH2 в спиртовом растворителе, таком как этанол, при температуре от 150 до 200C, такой как температура 180C В альтернативном воплощении настоящего изобретения, (цикло)алкиламинопиридины общей формулы (I-i1) можно получать из соответствующего хлорпиридинильного предшественника (I-h1) и соответствующего первичного или вторичного алкиламина R-NH2 или R-NH-R', используя катализаторы на основе переходного металла. В частности, в условиях Buchwald-Hartwig, при использовании Pd2(dba)3 и бидентатного фосфинового лиганда, такого как BINAP или т.п., в присутствии сильного неорганического основания, такого как трет-бутоксид калия или натрия, в ТГФ в качестве растворителя, можно получать соединения общей формулы (I-i1). Типичная температура реакции находится в диапазоне от 100 до 130C, которую можно достигать путем нагревания реакционной смеси в микроволновой печи (схема 5a). Схема 6 Пиридодигидрофуран (I-m) можно получать путем каталитического гидрирования пиридофуранового предшественника (I-l) при использовании Pd/C в качестве катализатора, в ацетоне в качестве растворителя или т.п. (схема 6). Схема 7 Алкил- или циклоалкилзамещенные пиридины общей формулы (I-o) можно необязательно получать обработкой 2-хлорпиридинильного предшественника (I-n) избытком (3-15 экв.) реактива Гриньяра, R'MgBr, в присутствии каталитического количества Fe(acac)3, в растворяющей системе, содержащей 85% ТГФ и 15% NMP. Вышеуказанное превращение можно осуществлять при температуре в диапазоне от 0 до 50C, более предпочтительно при температуре 0-25C (схема 7). Синтез 2-алкоксипроизводного пиридина (I-p) можно осуществлять обработкой соответствующего хлорпиридинильного предшественника (I-h1) алкоксидом натрия NaOR в спиртовом растворителе HOR,например этаноле, когда R=Et, и нагревания при высоких температурах, предпочтительно при температуре 100-130C, в трубке высокого давления или микроволновой печи (схема 8). Альтернативно, можно преимущественно использовать трет-бутоксид калия в качестве основания. Схема 9 Анилиноацилтиомочевину общей формулы (XXV) можно получать каталитическим гидрированием нитрофенильного предшественника (XXVI), используя Pd/C в качестве катализатора, в присутствии тиофена и оксида ванадия в ТГФ в качестве растворителя или т.п. (схема 9). Схема 10 Ацетилзащищенный азаиндолин общей формулы (XI) можно получать нагреванием предшественника общей формулы (X) в уксусном ангидриде, затем обработкой неорганическим основанием, таким как карбонат калия или т.п., в водной среде, предпочтительно в присутствии органического сорастворителя, такого как ТГФ или т.п., при температуре от 25 до 80C, предпочтительно при температуре 50C Азаиндолин общей формулы (I-t) можно получать обработкой ацетилзащищенного предшественни- 14016289 ка общей формулы (I-s) неорганическим основанием, таким как карбонат калия или т.п., в водной среде,предпочтительно в присутствии органического сорастворителя, такого как метанол или т.п., при температуре от 25 до 80C, предпочтительно при температуре 70C (схема 11). Схема 12 Пиридотриазол общей формулы (I-v) можно получать каталитическим гидрированием хлорпиридинильного предшественника (I-u), используя Pd/C в качестве катализатора, в присутствии тиофена и неорганического основания, такого как ацетат калия или т.п., или основания в виде амина, такого как триэтиламин или т.п., в растворителе, подобном метанолу или ТГФ или т.п. (схема 12). Альтернативно, когда или в случае заместителя Z, или в случае заместителя Q содержатся функциональные группы, которые несовместимы с условиями каталитического гидрирования, пиридин общей формулы (I-x) можно получать из хлорпиридина общей формулы (I-w) обработкой карбеноидными катализаторами, такими как катализатор на основе Pd, [1,3-бис[2,6-бис(1-метилэтил)фенил]-2-имидазолидинилиден]хлор(3-2 пропенил)палладий ([478980-01-7]), в присутствии сильного основания, такого как метоксид натрия, в смеси протонных растворителей, таких как метанол и 2-пропанол или т.п. Вышеуказанное взаимодействие можно осуществлять при повышенной температуре, такой как температура 120C, в микроволновой печи (схема 12a). Схема 13 Фторалкильное соединение общей формулы (I-bb) можно получать из соответствующего гидроксильного соединения (I-ba) обработкой фторирующим агентом, таким как DAST Nэтилэтанаминато)трифторсера), в галогенированном растворителе, таком как дихлорметан или т.п., при температуре от 0 до 25C (схема 13). Алкилкарбоксилат общей формулы (I-z) можно получать из хлорпиридинила общей формулы (I-y) реакцией введения CO. Подходящими условиями являются использование ацетата палладия в присутствии лиганда, такого как 1,3-бис(дифенилфосфино)пропан (DPPP), в атмосфере CO, при давлении, равном 50 атм, и неорганического основания, такого как ацетат калия или т.п. Для реакции далее требуется полярный растворитель, такой как ТГФ и т.п., и соответствующий спиртовой сорастворитель. Когда C1-6 алкилом является метил, сорастворителем может быть метанол. Реакция наилучшим образом протекает при высокой температуре, такой как температура 150C Синтез алкиламинокарбонилпиридинов общей формулы (I-aa) можно осуществлять обработкой соответствующего алкоксикарбонилпиридинового предшественника (I-z) (цикло)алкиламином R15R16NH, в полярном апротонном растворителе, таком как ТГФ или т.п., и при нагревании при высоких температурах, предпочтительно при температурах в диапазоне от 80 до 120C, в микроволновой печи (схема 15). Схема 16 Защищенный параметоксибензилом (PMB) вторичный амин общей формулы (XVI) можно получать восстановительным аминированием, используя анилин общей формулы (XIV) и параметоксибензальдегид (XV), в атмосфере водорода и в присутствии подходящего катализатора, такого как палладий-наугле. Реакция наиболее преимущественно протекает в присутствии раствора тиофена и в протонном растворителе, таком как метанол или т.п. (схема 16). Триазол общей формулы (XVIII) можно получать обработкой предшественника общей формулы(XVII) гидразингидратом, в протонном растворителе, таком как трет-бутанол, при температуре от 70 до 100C. Дизамещенный триазол общей формулы (XVIII) можно алкилировать, используя сильное основание, такое как гидрид натрия, в полярном апротонном растворителе, таком как ТГФ или т.п., и подходящий алкилирующий агент. Для получения триазола общей формулы (XIX), алкилирующим агентом может быть метил-4-иодбутират и температура реакции составляет 20C (схема 17). Предшественник общей формулы (XVII) получают в соответствии со схемой 1 при использовании вторичного амина общей формулы (XVI). Схема 18 Триазол общей формулы (I-ab) можно получать катализируемым кислотой удалением параметоксибензильной (PMB) защитной группы в триазоле общей формулы (XX). Вышеуказанное снятие защиты наилучшим образом осуществляют, используя ТФУК и протонный сорастворитель, такой как метанол или т.п. (схема 18). Схема 19 1,2,4-Оксадиазол общей формулы (I-ae), связанный в положении 3 с триазольным ядром, можно получать в 2 стадии из соответствующего нитрила общей формулы (I-ac). Первая стадия включает образование аминоксима общей формулы (I-ad). Этого можно достигать обработкой нитрила (I-ac) с помощью гидроксиламингидрохлорида в присутствии неорганического основания, такого как гидроксид натрия или т.п., в водной среде, предпочтительно в присутствии смешивающегося с водой органического сорастворителя, такого как этанол или т.п. Вторая стадия включает циклизацию, с получением оксадиазола общей формулы (I-ae), используя подходящий электрофил, такой как уксусный ангидрид или более предпочтительно ацетилхлорид, в полярном протонном растворителе, таком как ТГФ или т.п., в присутствии основания в виде амина, такого как диизопропилэтиламин. Вышеуказанное превращение наилуч- 17016289 шим образом осуществляют при использовании микроволнового нагрева при температуре в диапазоне от 120 до 170C, предпочтительно при температуре 150C (схема 19). Схема 20 1,2,4-Оксадиазол общей формулы (I-ai), связанный в положении 5 с триазольным ядром, можно получать в 3 стадии из соответствующего трет-бутилкарбоксилата общей формулы (I-af). Первая стадия включает удаление трет-бутильной сложноэфирной группы в соединении (I-af), с получением карбоновой кислоты общей формулы (I-ag). Это может быть осуществлено обработкой соединения (I-af) при использовании трифторуксусной кислоты в качестве растворителя при комнатной температуре. Вторая стадия включает конденсацию с амидоксимом, получая промежуточный продукт общей формулы (I-ah). Это может быть осуществлено, используя реагент конденсации, такой как диизопропилкарбодиимид(DIC) или т.п., в присутствии катализатора ацилирования, такого как гидроксибензотриазол (HOBt) или т.п. Подходящими растворителями являются дихлорметан и ДМФА или их смеси. Это превращение может быть осуществлено в диапазоне температур от -10 до 25C. Третья стадия включает циклизацию с получением оксадиазола общей формулы (I-ai). Подходящим способом является использование дегидратирующего агента, такого как DIC или т.п., в полярном апротонном растворителе, таком как ацетонитрил или т.п. Вышеуказанное превращение наилучшим образом осуществляют, используя микроволновый нагрев, при температуре в диапазоне от 120 до 170C, предпочтительно при температуре 150C (схема 20). Схема 21 Цианопиридин общей формулы (I-z) можно получать из хлорпиридинила общей формулы (I-y). Подходящими условиями являются использование цианида цинка и цинковой пыли при катализе с помощью Pd2(dba)3 в присутствии лиганда, такого как dppf (1,1'-бис(дифенилфосфино)ферроцен). Для осуществления реакции далее требуется полярный растворитель, такой как DMA или т.п., и наилучшим образом ее осуществляют при повышенной температуре, такой как температура 100C, в микроволновой печи. Нитрил общей формулы (I-z) можно превращать в амин общей формулы (I-aj), используя атмосферу водорода. Подходящим катализатором является никель Ренея, и реакцию наилучшим образом осуществляют в растворяющей смеси, содержащей метанол и аммиак (схема 21). Схема 22- 18016289 Трифторацетилированное соединение общей формулы (I-ak) можно получать путем нагревания первичного амина общей формулы (I-aj) в трифторуксусной кислоте (схема 22). Схема 23 Этилкарбамат общей формулы (I-an) можно получать в 2 стадии из защищенного амина общей формулы (I-al). На первой стадии защитную группу Boc (трет-бутоксикарбонил) удаляют обработкой соединения (I-al) избытком трифторуксусной кислоты и подходящим органическим сорастворителем,таким как дихлорметан или т.п. На второй стадии амин общей формулы (I-am) вводят во взаимодействие с этилхлорформиатом в присутствии основания в виде амина, такого как триэтиламин или т.п., в растворителе, таком как дихлорметан или т.п. Вышеуказанное взаимодействие наилучшим образом осуществляют при температуре от 0 до 25C. Амид общей формулы (I-ao) также можно получать через посредство амина общей формулы (I-am). Это превращение включает обработку амина (I-am) ацилирующим агентом, таким как уксусный ангидрид, когда R=метил, или хлорангидрид кислоты, в присутствии основания в виде амина, такого как триэтиламин или т.п., в галогенированном растворителе, таком как дихлорметан. Необязательно используют катализатор ацилирования, такой как диметиламинопиридин (OMAP) или т.п. (схема 23). Схема 24 Метоксиалкилтриазолы общей формулы (I-ar) можно получать в 2 стадии из соответствующих гидроксилалкилтриазолов общей формулы (I-ap). На первой стадии гидроксильную группу превращают в подходящую удаляемую группу, такую как мезилат общей формулы (I-aq). Более конкретно спирт (I-ap) обрабатывают мезилхлоридом в присутствии основания в виде амина, такого как триэтиламин или т.п., в галогенированном растворителе, таком как дихлорметан или т.п., при комнатной температуре. На второй стадии мезилат (I-aq) обрабатывают в метаноле в присутствии каталитического количества карбоновой кислоты, такой как уксусная кислота или т.п., и нагревают при повышенных температурах в микроволновой печи. Оптимальная температура реакции находится в диапазоне 140-180C, предпочтительно температура составляет 160C (схема 24). Гидразин общей формулы (XXII) можно получать из акриламида общей формулы (XXI) обработкой эквимолярным или избыточным количеством гидразингидрата в подходящем протонном растворителе,таком как метанол или т.п. (схема 25). Схема 26 Диалкилкетоны общей формулы (I-at) можно получать обработкой диметиламидного предшественника общей формулы (I-as) избытком (15 экв.) реактива Гриньяра, R'-MgBr, в присутствии каталитического количества Fe(acac)3, в растворяющей системе, содержащей 85% ТГФ и 15% NMP. Вышеуказанное превращение можно осуществлять при температуре в диапазоне от 0 до 50C, более предпочтительно при температуре от 0 до 25C (схема 26). Схема 27 Смесь кетона общей формулы (I-av) и карбинола общей формулы (I-aw) можно получать из сложного эфира общей формулы (I-au). Превращение включает обработку соединения (I-au) избытком алкиллитиевого реагента в апротонном растворителе, таком как ТГФ или т.п., при низкой температуре, предпочтительно при температуре -78C (схема 27). Схема 28 Карбоновая кислота (XXIV) может быть получена из хлорпиридинила (XXIII) реакцией введенияCO. Подходящими условиями являются использование ацетата палладия в присутствии лиганда, как например 1,3-бис(дифенилфосфино)пропан (DPPP), в атмосфере CO при давлении 50 атм, и неорганического основания, как, например, ацетат калия или т.п. Для осуществления реакции далее требуется вода и полярный органический сорастворитель, такой как ТГФ и т.п. Реакция лучше всего протекает при высокой температуре, такой как 150C (схема 28).- 20016289 Фармакология Обнаружено, что соединения согласно настоящему изобретению являются положительными аллостерическими модуляторами никотинового 7-рецептора. Никотиновый 7-рецептор (7 nAChR) принадлежит к надсемейству цис-петли ионотропических, управляемых лигандами ионных каналов, которое включает семейства 5HT3, GABAA и рецептора глицина. Он активируется ацетилхолином и его продуктом распада холином, и главной особенностью 7 nAChR является его быстрая десенсибилизация при постоянном присутствии агониста. Он представляет собой второй наиболее широко распространенный подтип никотинового рецептора в головном мозге и является важным регулятором высвобождения многих нейромедиаторов. Он обладает дискретным распределением в отдельных структурах головного мозга с релевантностью в отношении ассоциированных с вниманием и когнитивных процессов, как, например,гиппокамп и префронтальный кортекс, и принимает активное участие во множестве психиатрических и неврологических нарушений у людей. Генетический признак его ассоциации с шизофренией проявляется в форме прочной связи между маркером шизофрении (расстройство сенсорного воротного механизма) и 7-локусом в 15q13-14 и полиморфизмов в области корового промотора 7-гена. Патологические данные свидетельствуют о потере 7-иммунореактивности и -Btx-связывания в случае гиппокампа, фронтального и поясного кортекса головного мозга больных шизофренией, в случае болезни Паркинсона и болезни Альцгеймера и паравентрикулярном ядре и повторных слияниях ядер в случае аутизма. Фармакологические данные, такие как выраженная привычка к курению у больных шизофренией по сравнению с нормальными людьми, интерпретируют как попытку пациентов к самолечению для компенсации дефицита никотинергической 7-трансмиссии. Временную нормализацию дефектов в сенсорном воротном механизме (ингибирование препульсации PPI), в случае как животных моделей, так и человека, после введения никотина и временное восстановление нормального сенсорного воротного механизма у больных шизофренией, когда холинергическая активность переднего мозга низкая (например, сон фазы 2), оба, интерпретируют как результат временной активации никотинового 7-рецептора с последующей десенсибилизацией. Таким образом, имеется пригодный аргумент для предположения, что активация 7 nAChR может оказывать терапевтически полезные воздействия на ряд (психиатрических и неврологических) нарушений центральной нервной системы (CNS). Как уже указывалось, 7 nAChR быстро десенсибилизируется при постоянном присутствии природного нейромедиатора ацетилхолина, а также экзогенных лигандов, таких как никотин. В десенсибилизированном состоянии рецептор остается связанным с лигандами, но функционально неактивен. Это почти не является проблемой в случае природных нейромедиаторов, таких как ацетилхолин и холин, так как они представляют собой субстраты для механизмов очень сильного распада (ацетилхолинэстераза) и клиренса (транспортер холина). Эти нейромедиаторные механизмы распад/клиренс, вероятно, поддерживают баланс между активируемыми и десенсибилизированными 7 nAChR в физиологически пригодном диапазоне. Однако понятно, что синтетические агонисты, которые не являются субстратами для природных механизмов распада и клиренса, должны обладать потенциальной лабильностью как для сверхстимуляции, так и в отношении сдвига равновесия популяции 7 nAChR по направлению к постоянно десенсибилизированному состоянию, которое является нежелательным при нарушениях, в случае которых играют роль дефициты в отношении экспрессии или функции 7 nAChR. Агонисты вследствие своей природы должны иметь мишенью ACh-связывающий карман, который в высокой степени сохраняется за счет разных подтипов никотинового рецептора, приводя к потенциалу в отношении побочных реакций вследствие неспецифической активации других подтипов никотинового рецептора. Следовательно, для избежания этих потенциальных лабильностей альтернативной терапевтической стратегии в отношении 7-агонизма нужно усиливать реактивность рецептора до природных агонистов с помощью положительного аллостерического модулятора (PAM). PAM определяют как агент, который связывается с сайтом,отдельным от сайта связывания агониста, и, следовательно, предполагают, что не имеет агонистических или десенсибилизирующих свойств, но усиливает реактивность 7 nAChR до природного нейромедиатора. Значение этой стратегии заключается в том, что для данного количества нейромедиатора размеры ответа 7 nAChR увеличиваются вприсутствии PAM соотносительно к уровню трансмиссии, возможной в его отсутствие. Так, в случае нарушений, при которых имеется дефицит белка 7 nAChR, может быть полезным индуцируемое PAM увеличение никотинергической 7-трансмиссии. Так как PAM зависит от присутствия природного трансмиттера, потенциал в отношении сверхстимуляции ограничен механизмами распада/клиренса в случае природного трансмиттера. В соответствии с объектом настоящего изобретения оно относится к способам лечения, которые включают введение или положительного аллостерического модулятора в качестве единственного активного вещества, таким образом модулируя активность агонистов эндогенного никотинового рецептора,таких как ацетилхолин или холин, или введение положительного аллостерического модулятора вместе с- 21016289 агонистом никотинового рецептора. В конкретной форме этого аспекта изобретения способ лечения включает лечение с помощью положительного аллостерического модулятора никотинового 7 рецептора, как описывается в данном контексте, и агониста или частичного агониста никотинового 7 рецептора. Примеры подходящих соединений с агонистической активностью в отношении никотинового 7-рецептора включают моногидрохлорид 4-бромфенилового эфира 1,4-диазабицикло[3.2.2]нонан-4-карбоновой кислоты[N-[(3R)-1-азабицикло[2.2.2]окт-3-ил]-4-хлорбензамид-гидрохлорид] (PNU-282987). Положительные nAChR-модуляторы согласно настоящему изобретению пригодны для лечения или профилактики психотических нарушений, нарушений в отношении интеллектуального ухудшения или заболеваний или состояний, в случае которых модуляция активности никотинового 7-рецептора является полезной. Конкретным аспектом способа согласно данному изобретению является способ лечения нарушения в отношении обучения, когнитивного расстройства, дефицита внимания или потери памяти,причем полагают, что модуляция активности никотинового 7-рецептора должна быть полезной в случае ряда заболеваний, включая болезнь Альцгеймера, деменцию, ассоциируемую с тельцами Леви, нарушение гиперактивности в отношении дефицита внимания, страх, шизофрению, маниакальный синдром,маниакальную депрессию, болезнь Паркинсона, синдром Хантингтона, болезнь Туретта, травму головного мозга или другие неврологические, дегенеративные или психиатрические нарушения, при которых происходит потеря холинергических синапсов, включая нарушение биологического ритма организма при перелете через несколько часовых поясов, пагубную привычку к никотину, боль. Принимая во внимание вышеописанные фармакологические свойства, соединения согласно формуле (I) или их любая подгруппа, их N-оксиды, фармацевтически приемлемые аддитивные соли, четвертичные амины и стереохимически изомерные формы могут быть использованы в качестве лекарственного средства. В частности, соединения согласно настоящему изобретению могут быть использованы для получения лекарственного средства в целях лечения или профилактики психотических нарушений, нарушений в отношении интеллектуального ухудшения или заболеваний или состояний, в случае которых модуляция никотинового 7-рецептора является полезной. Принимая во внимание полезность соединений согласно формуле (I), предоставляется способ лечения теплокровных животных, включая людей, страдающих, или способ предотвращения теплокровных животных, включая людей, от страдания от заболеваний, в случае которых модуляция никотинового 7 рецептора является полезной, как, например, шизофрения, маниакальный синдром и маниакальная депрессия, страх, болезнь Альцгеймера, нарушение в отношении обучения, когнитивное расстройство, дефицит внимания, потеря памяти, деменция, ассоциируемая с тельцами Леви, нарушение гиперактивности в отношении дефицита внимания, болезнь Паркинсона, синдром Хантингтона, болезнь Туретта, травма головного мозга, нарушение биологического ритма организма при перелете через несколько часовых поясов, пагубная привычка к никотину и боль. Вышеуказанные способы включают введение, то есть системное или локальное введение, предпочтительно пероральное введение, эффективного количества соединения формулы (I), включая все его стереохимически изомерные формы, его N-оксидную форму,фармацевтически приемлемую аддитивную соль, сольват или четвертичный амин, теплокровным животным, включая людей. Специалисту в данной области понятно, что терапевтически эффективным количеством положительных аллостерических модуляторов (PAM) согласно настоящему изобретению является количество,достаточное для модуляции активности никотинового 7-рецептора, и что это количество изменяется,между прочим, в зависимости от типа заболевания, концентрации соединения в готовой лекарственной форме и состояния пациента. Вообще количество вводимого PAM в качестве терапевтического агента для лечения заболеваний, в случае которых модуляция никотинового 7-рецептора является полезной,как, например, шизофрения, маниакальный синдром и маниакальная депрессия, страх, болезнь Альцгеймера, нарушение в отношении обучения, когнитивное расстройство, дефицит внимания, потеря памяти,деменция, ассоциируемая с тельцами Леви, нарушение гиперактивности в отношении дефицита внимания, болезнь Паркинсона, синдром Хантингтона, болезнь Туретта, травма головного мозга, нарушение биологического ритма организма при перелете через несколько часовых поясов, пагубная привычка к никотину и боль, должно быть определено в зависимости от случая штатным врачом. Вообще, подходящей дозой является такая, которая приводит к концентрации PAM на участке лечения в диапазоне от 0,5 нМ до 200 мкМ и более обычно от 5 нМ до 50 мкМ. Для достижения этих концентраций в целях лечения пациенту, нуждающемуся в лечении, должно быть введено количество соединения, вероятно, от 0,01 до 2,50 мг/кг массы тела, в особенности от 0,1 до 0,50 мг/кг массы тела. Количество соединения согласно настоящему изобретению, также определяемого в данном контексте как активный ингредиент, которое необходимо для достижения терапевтического эффекта, должно, разумеется, варьироваться в зависимости от случая, изменяясь в зависимости от конкретного соединения, пути- 22016289 введения, возраста и состояния реципиента и конкретного нарушения или заболевания, подвергаемого лечению. Способ лечения также может включать введение активного ингредиента в режиме между одним и четырьмя приемами в сутки. В случае этих способов лечения соединения согласно настоящему изобретению предпочтительно используют для получения готовой лекарственной формы до приема. Как описывается в данном контексте выше, подходящие фармацевтические готовые лекарственные формы приготовляют известными способами, используя хорошо известные и легко доступные ингредиенты. Настоящее изобретение также относится к композициям для предотвращения или лечения заболеваний, в случае которых модуляция никотинового 7-рецептора является полезной, как, например, шизофрения, маниакальный синдром и маниакальная депрессия, страх, болезнь Альцгеймера, нарушение в отношении обучения, когнитивное расстройство, дефицит внимания, потеря памяти, деменция, ассоциируемая с тельцами Леви, нарушение гиперактивности в отношении дефицита внимания, болезнь Паркинсона, синдром Хантингтона, болезнь Туретта, травма головного мозга, нарушение биологического ритма организма при перелете через несколько часовых поясов, пагубная привычка к никотину и боль. Вышеуказанные композиции включают терапевтически эффективное количество соединения формулы (I) и фармацевтически приемлемый носитель или разбавитель. Хотя возможно введение активного ингредиента индивидуально, предпочтительным является введение его в виде фармацевтической композиции. Соответственно, настоящее изобретение относится далее к фармацевтической композиции, включающей соединение согласно настоящему изобретению вместе с фармацевтически приемлемым носителем или разбавителем. Носитель или разбавитель должен быть приемлемым в смысле совместимости с другими ингредиентами композиции и не вредным для его реципиента. Фармацевтические композиции согласно данному изобретению могут быть получены любыми способами, хорошо известными в фармации, например используя способы, описанные Gennaro и др. Remington's Pharmaceutical Sciences (18 изд., Mack Publishing Company, 1990, см., главным образом, ч. 8: Pharmaceutical preparations and their Manufacture). Терапевтически эффективное количество конкретного соединения в основной форме или в форме аддитивной соли в качестве активного ингредиента комбинируют при тщательном смешении с фармацевтически приемлемым носителем, который может иметь большое разнообразие форм в зависимости от формы препарата, желательного для введения. Эти фармацевтические композиции находятся желательно в унитарной лекарственной форме, подходящей предпочтительно для системного введения, такого как пероральное, чрескожное или парентеральное введение; или локального введения, такого как с помощью ингаляции, назального спрея, глазных капель или через крем, гель, шампунь или т.п. Например, при приготовлении композиций в пероральной лекарственной форме, может быть использована любая из обычных фармацевтических сред, такая как, например, вода, гликоли, масла, спирты и т.п., в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры и растворы; или твердые носители,такие как крахмалы, сахара, каолин, смазочные вещества, связующие вещества, дезинтегрирующие агенты и т.п., в случае порошков, пилюль, капсул и таблеток. Вследствие их легкости введения, таблетки и капсулы представляют собой наиболее благоприятную пероральную разовую лекарственную форму, в случае которой, очевидно, используют твердые фармацевтические носители. В случае парентеральных композиций носитель обычно включает стерильную воду, по меньшей мере, большей частью, хотя могут быть включены другие ингредиенты, например, для способствования растворимости. Могут быть приготовлены, например, растворы для инъекций, в случае которых носитель включает солевой раствор, раствор глюкозы или смесь солевого раствора и раствора глюкозы. Также могут быть приготовлены инъецируемые суспензии, в случае которых могут быть использованы соответствующие жидкие носители,суспендирующие агенты и т.п. В композициях, пригодных для подкожного введения, носитель необязательно включает усиливающий пенетрацию агент и/или пригодный смачиватель, необязательно комбинируемые с пригодными добавками любой природы в незначительных количествах, причем добавки не провоцируют каких-либо значительных вредных воздействий на кожу. Вышеуказанные добавки могут способствовать введению в кожу и/или могут быть полезны для получения желательных композиций. Эти композиции можно вводить различными путями, например, в виде трансдермального пластыря, в виде точечно наносимой капли или в виде мази. Это особенно благоприятно для получения вышеуказанных фармацевтических композиций в унифицированной разовой лекарственной форме для легкости их введения и единообразия дозировки. Унифицированная разовая лекарственная форма, как используется в описании и формуле изобретения данного контекста, относится к физически дискретным единицам, пригодным в виде унитарных доз, причем каждая единица содержит предопределенное количество активного ингредиента, рассчитанное для достижения желательного терапевтического эффекта, в сочетании с требующимся фармацевтическим носителем. Примерами таких унифицированных разовых лекарственных форм являются таблетки (включая таблетки с насечкой или таблетки с покрытием), капсулы, пилюли, пакетированные порошки, облатки,растворы или суспензии для инъекций, доза одной чайной ложки, доза одной столовой ложки и т.п. и их сегрегированные множества.- 23016289 Соединения согласно настоящему изобретению можно использовать для системного введения, такого как пероральное, подкожное или парентеральное введение; или локального введения, такого как посредством ингаляции, назального спрея, глазных капель или в виде крема, геля, шампуня или т.п. Соединения предпочтительно вводят перорально. Точная дозировка и частота введения зависят от используемого конкретного соединения формулы (I), конкретного состояния, которое подвергают лечению,тяжести состояния, которое подвергают лечению, возраста, массы тела, пола, степени нарушения и общего физического состояния конкретного пациента, а также от другого медикаментозного лечения индивидуума, которое может проводиться, что хорошо известно квалифицированному специалисту в данной области. Кроме того, очевидно, что вышеуказанное эффективное суточное количество можно уменьшать или увеличивать в зависимости от ответа подвергаемого лечению субъекта и/или в зависимости от оценки врача, прописывающего соединения согласно настоящему изобретению. Соединения формулы (I) также можно использовать в комбинации с другими обычными агонистами никотинового 7-рецептора, такими как, например, моногидрохлорид 4-бромфенилового эфира 1,4 диазабицикло[3.2.2]нонан-4-карбоновой кислоты (SSR18 0711A); (-)-спиро[1-азабицикло[2.2.2]октан 3,5'-оксазолидин]-2'-он; 3-[(2,4-диметокси)бензилиден]анабазеиндигидрохлорид (GTS-21); или [N-[(3R)1-азабицикло[2.2.2]окт-3-ил]-4-хлорбензамидгидрохлорид] (PNU-282987). Таким образом, настоящее изобретение также относится к комбинации соединения формулы (I) и агониста никотинового 7 рецептора. Такую комбинацию можно использовать в качестве лекарственного средства. Настоящее изобретение также относится к продукту, содержащему (a) соединение формулы (I) и (b) агонист никотинового 7-рецептора, в виде комбинированного лекарственного средства для совместного, раздельного или последовательного использования в случае лечения заболеваний, где полезно модулирование никотинового 7-рецептора. Различные лекарственные средства можно комбинировать в одном препарате вместе с фармацевтически приемлемыми носителями. Экспериментальная часть В дальнейшем, термин ТГФ (THF) означает тетрагидрофуран, EtOAc означает этилацетат,DIPE означает диизопропиловый эфир, CH2Cl2 означает дихлорметан, HOAc означает уксусную кислоту, KOAc означает ацетат калия, HBTU означает 1-[бис(диметиламино)метилен]-1Hбензотриазолийгексафторфосфат(1-)3-оксид, ДМФА означает N,N-диметилформамид, DIPEA означает N-этил-N-(1-метилэтил)-2-пропанамин, CH3CN означает ацетонитрил, CH3OH означает метанол,Na2CO3 означает динатриевую соль угольной кислоты, NaH означает гидрид натрия, NH4HCO3 означает моноаммониевую соль угольной кислоты, NH4OAc означает аммониевую соль уксусной кислоты, CH3NH2 означает метанамин, NH4Cl означает хлорид аммония, NaHCO3 означает мононатриевую соль угольной кислоты, t-BuOH означает 2-бутил-2-пропанол, HOBt означает 1-гидрокси-1Hбензотриазол, EDCI означает N'-(этилкарбонимидоил)-N,N-диметил-1,3-пропандиамин-моногидрохлорид, ТФУК (TFA) означает трифторуксусную кислоту, Pd(OAc)2 означает ацетат палладия,Et3N означает триэтиламин, Pd2(dba)3 означает трис-[-[(1,2-:4,5-)-(1E,4E)-1,5-дифенил-1,4 пентадиен-3-ондипалладий, CH3MgBr означает метилмагнийбромид, Et2O означает диэтиловый эфир. Ряд соединений очищали с помощью высокоэффективной жидкостной хроматографии с обращенными фазами, используя один из нижеприводимых способов (указываемых в составной методике как способ A и способ B). Способ A, ВЭЖХ. Продукт очищают с помощью высокоэффективной жидкостной хроматографии (Shandon Hyperprep C18 BDS (основной дезактивированный диоксид кремния), 8 мкм, 250 г, внутренний диаметр 5 см). Используют три подвижные фазы (фаза A: 0,25%-й раствор NH4HCO3 в воде; фаза B: CH3OH; фазаC: CH3CN). Сначала, 75% A и 25% B, при объемной скорости потока 40 мл/мин, удерживают в течение 0,5 мин. Затем используют градиент 50% B и 50% C в течение 41 мин, при объемной скорости потока 80 мл/мин. После этого используют градиент 100% C в течение 20 мин при объемной скорости потока 80 мл/мин и удерживают в течение 4 мин. Способ B, ВЭЖХ. Продукт очищают с помощью высокоэффективной жидкостной хроматографии (Shandon Hyperprep C18 BDS (основной дезактивированный диоксид кремния), 8 мкм, 250 г, внутренний диаметр 5 см). Используют три подвижные фазы (фаза A: 90% 0,5%-го раствора NH4OAc в воде + 10% CH3CN; фазаB: CH3OH; фаза C: CH3CN). Сначала, 75% A и 25% B, при объемной скорости потока 40 мл/мин, удерживают в течение 0,5 мин. Затем используют градиент 50% B и 50% C в течение 41 мин, при объемной скорости потока 80 мл/мин. После этого используют градиент 100% C в течение 20 мин, при объемной скорости потока 80 мл/мин и удерживают в течение 4 мин.a) Получение промежуточного продукта 1. Смесь аммониевой соли тиоциановой кислоты (0,0164 моль) в 2-пропаноне (50 мл) перемешивают при комнатной температуре. Затем в виде порций добавляют 2,3-дигидро-1,4-бензодиоксин-6-карбонилхлорид (0,015 моль). Реакционную смесь кипятят в течение 15 мин. Затем к реакционной смеси по каплям добавляют 3(трифторметил)бензоламин (0,0125 моль) в 2-пропаноне (достаточное количество) при температуре кипения с обратным холодильником. Реакционную смесь перемешивают при кипячении с обратным холодильником в течение 30 мин. После этого реакционную смесь выливают в смесь льда и Na2CO3 (достаточное количество). Осадок отфильтровывают и высушивают, получая 4,90 г (выход 100%) промежуточного продукта 1.b) Получение промежуточного продукта 2. Взаимодействие осуществляют в токе азота. Раствор 60%-го NaH (0,014 моль) в ТГФ (150 мл) перемешивают на ледяной бане. Затем в виде порций добавляют промежуточный продукт 1 (0,0125 моль). Реакционную смесь перемешивают в течение следующих 30 мин при температуре 0C. Затем к реакционной смеси добавляют по каплям иодметан (0,014 ммоль) в ТГФ (достаточное количество). Реакционную смесь оставляют нагреваться до комнатной температуры. Реакционную смесь разлагают с помощью воды и органический растворитель выпаривают. Водный концентрат экстрагируют с помощью CH2Cl2. Отделенный органический слой сушат, отфильтровывают и растворитель выпаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/CH3OH = 99/1 и 98/2). Фракции продукта собирают и растворитель выпаривают, получая 4,95 г (выход 100%) промежуточного продукта 2. Пример A2. Получение промежуточного продукта 3. Гидразин (H2O) (25 г) перемешивают в герметично закрытой пробирке при температуре 70C. Медленно добавляют (шприц) (2R)-2-(трифторметил)оксиран (2,0 г, 0,018 моль) в гидразине при температуре 60C. Реакционную смесь перемешивают в течение 4 ч при температуре 60C. Растворитель выпаривают (пониженное давление; 9 мм Hg/50C). Образуется твердое вещество белого цвета. Добавляют толуол и снова выпаривают (при температуре 50C), получая 2,6 г промежуточного продукта 3 (сырой,используется как таковой на следующей реакционной стадии). Пример A3.a) Получение промежуточного продукта 4. Смесь аммониевой соли тиоциановой кислоты (0,081 моль) в 2-пропаноне (120 мл) перемешивают в течение 1 ч. Затем добавляют 4-пиридинкарбонилхлоридгидрохлорид (0,074 моль). Реакционную смесь перемешивают в течение 15 мин при температуре кипения с обратным холодильником. После этого по каплям добавляют 3-(трифторметил)бензоламин (0,062 моль) в 2-пропаноне (достаточное количество) при температуре кипения с обратным холодильником и реакционную смесь кипятят с обратным холодильником в течение следующих 30 мин. Реакционную смесь выливают в смесь льда и Na2CO3. Осадок отфильтровывают и затем высушивают, получая 9,28 г (выход 46%) загрязненного промежуточного про- 25016289 дукта 4, который используют как таковой при последующих взаимодействиях.b) Получение промежуточного продукта 5. Взаимодействие осуществляют в токе азота. Раствор 60%-го NaH (0,03 моль) в ТГФ (300 мл) перемешивают на ледяной бане. Затем в виде порций добавляют промежуточный продукт 4 (0,027 моль). Реакционную смесь перемешивают в течение 30 мин при температуре 0C. Затем к реакционной смеси добавляют по каплям подметан (0,03 ммоль) в ТГФ (достаточное количество). Реакционную смесь оставляют нагреваться до комнатной температуры. После этого реакционную смесь выливают в воду и ТГФ выпаривают. Концентрат экстрагируют с помощью CH2Cl2. Отделенный органический слой сушат, отфильтровывают и растворитель выпаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/CH3OH = 99/1 и 98/2). Фракции продукта собирают и растворитель выпаривают, получая 4 г (выход 44%) загрязненного промежуточного продукта 5, который используют как таковой в последующих взаимодействиях. Пример A5.a) Получение промежуточного продукта 10. Аммониевую соль тиоциановой кислоты (0,0873 моль) перемешивают в 2-пропаноне (150 мл) при комнатной температуре. В виде порций добавляют 2-хлор-4-пиридинкарбонилхлорид (0,080 моль) и смесь перемешивают в течение 30 мин. По каплям добавляют раствор 3-(трифторметил)бензоламина(0,0727 моль) в небольшом количестве 2-пропанона и реакционную смесь перемешивают в течение 4 ч. Растворитель выпаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле(элюент: гексан/EtOAc = от 90/10 до 50/50). Фракции продукта собирают и растворитель выпаривают до получения осадка. Этот осадок отфильтровывают и высушивают, получая 12,630 г (выход 48,3%) промежуточного продукта 10.b) Получение промежуточного продукта 11. Взаимодействие осуществляют в токе азота. Перемешивают раствор 60%-го NaH (0,0410 моль) в ТГФ (достаточное количество) в течение 30 мин, все время охлаждая на ледяной бане. По каплям добавляют раствор промежуточного продукта 10 (0,0342 моль) в ТГФ (достаточное количество). Полученную реакционную смесь перемешивают в течение 30 мин при температуре 0C. Добавляют по каплям иодметан (0,0342 ммоль) в ТГФ (достаточное количество). Реакционную смесь перемешивают в течение 3 ч при комнатной температуре. Реакцию гасят добавлением воды. Органический растворитель выпаривают. Водный концентрат экстрагируют с помощью EtOAc. Используемый для экстракции растворитель выпаривают. Остаток перемешивают с DIPE, отфильтровывают и высушивают, получая 10,977 г (выход 85,9%) промежуточного продукта 11. Пример A6. Получение промежуточного продукта 12. Смесь соединения 64 (0,0006 моль) в смеси CH3OH/NH3 (40 мл) гидрируют при температуре 14C при использовании никеля Ренея (каталитические количества) в качестве катализатора. После поглощения водорода (2 экв.), катализатор отфильтровывают и содержащийся в фильтрате растворитель выпаривают, получая 0,2 г (выход 100%) промежуточного продукта 12, который используют, как таковой, на следующей реакционной стадии, без дальнейшей очистки. Пример A7.a) Получение промежуточного продукта 13.CH3OH (200 мл) вводят во взаимодействие при использовании 10%-го Pd/C (1 г) в качестве катализатора в присутствии раствора тиофена (1 мл; 4%-ный раствор в DIPE). После поглощения водорода (1 экв.),катализатор отфильтровывают и фильтрат выпаривают, получая 16,45 г (выход 100%) промежуточного продукта 13.b) Получение промежуточного продукта 14. Смесь аммониевой соли тиоциановой кислоты (0,07 моль) в 2-пропаноне (100 мл) перемешивают при комнатной температуре. Добавляют 2-хлор-4-пиридинкарбонилхлорид (0,063 моль) и смесь перемешивают в течение 2 ч при комнатной температуре. Добавляют промежуточный продукт 13 (0,06 моль) и смесь перемешивают в течение 1 ч при комнатной температуре. Смесь выливают на лед и затем экстрагируют с помощью CH2Cl2. Отделенный органический слой сушат (MgSO4), отфильтровывают и растворитель выпаривают. К остатку добавляют толуол и растворитель выпаривают, получая 29,8 г (выход 100%) промежуточного продукта 14.c) Получение промежуточного продукта 15. Смесь 60%-го NaH (0,07 моль) в ТГФ (200 мл) перемешивают в атмосфере азота на ледяной бане. Добавляют промежуточный продукт 14 (0,06 моль) и смесь перемешивают в течение 1 ч при температуре 0C. Затем добавляют иодметан (10 г, 0,07 моль) и ледяную баню отставляют. Добавляют воду и реакционную смесь выпаривают. К остатку добавляют воду и эту смесь экстрагируют с помощью CH2Cl2. Отделенный органический слой сушат (MgSO4), отфильтровывают и растворитель выпаривают, получая 30,7 г (выход 100%) промежуточного продукта 15.d) Получение промежуточного продукта 16. Смесь промежуточного продукта 15 (0,06 моль) и гидразинмоногидрата (0,12 моль) в t-BuOH (200 мл) перемешивают и кипятят с обратным холодильником в течение 1 ч. Растворитель выпаривают и остаток обрабатывают водой. Смесь экстрагируют с помощью CH2Cl2. Отделенный органический слой сушат (MgSO4), отфильтровывают и растворитель выпаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: сначала 1% CH3OH в CH2Cl2, затем 2% CH3OH в CH2Cl2). Чистые фракции собирают и растворитель выпаривают, получая 15 г (выход 52%) промежуточного продукта 16.e) Получение промежуточного продукта 17. Взаимодействие осуществляют в атмосфере азота. 60%-ный NaH (0,0057 моль) суспендируют в ТГФ (40 мл) при комнатной температуре. В виде порций добавляют промежуточный продукт 16 (0,0041 моль). Спустя 20 мин медленно добавляют метиловый эфир 4-иодмасляной кислоты (0,0136 моль) и раствор перемешивают при комнатной температуре в течение 1 недели. Затем смесь гасят насыщенным раствором NH4Cl и эту смесь экстрагируют с помощью EtOAc (2 раза). Отделенный органический слой промывают насыщенным солевым раствором, сушат (MgSO4), отфильтровывают и растворитель выпаривают. Остаток очищают на колонке Biotage 40M SiO2, элюируя смесью от 20% EtOAc/гептан до 30%EtOAc/гептан, наконец, 50% EtOAc/гептан (наибольшее количество продукта элюируется между 25 и 35%). Две фракции собирают (чистый согласно TCX, 30% EtOAc/гептан). Растворители обеих фракций выпаривают, получая 1,54 г нежелательного региоизомера и 0,638 г промежуточного продукта 17.f) Получение промежуточного продукта 18. Раствор промежуточного продукта 17 (0,0013 моль) и литийгидроксидмоногидрата (0,0062 моль) в ТГФ (20 мл), CH3OH (5 мл) и воде (5 мл) перемешивают при комнатной температуре в течение 6 ч. Смесь гасят 1 н. раствором HCl и осадок собирают фильтрацией, промывают водой и CH3CN и затем высушивают, получая 0,7 г промежуточного продукта 18 в виде бесцветного твердого вещества.a) Получение промежуточного продукта 19. К раствору промежуточного продукта 18 (0,00125 моль) в ДМФА (10 мл) добавляют N- 28016289 метилметанамингидрохлорид (0,00250 моль), HOBt (0,00375 моль), EDCI (0,00375 моль) и DIPEA(0,00500 моль). Полученный реакционный раствор перемешивают при комнатной температуре в течение 3 ч. Реакционную смесь гасят 1 н. раствором HCl и экстрагируют с помощью EtOAc. Органическую фазу отделяют, промывают насыщенным водным раствором NaHCO3 (2 раза) и сушат (Na2SO4), отфильтровывают и отфильтрованный растворитель выпаривают, получая 0,550 г промежуточного продукта 19 в виде бесцветного масла. Пример A8. Получение промежуточного продукта 21. Смесь 4-хлор-6,7-дигидро-5H-циклопента[b]пиридина (0,0520 моль), Pd(OAc)2 (0,1 г), 1,3-бис(диффосфино)пропана (0,4 г) и KOAc (10 г) в ТГФ (100 мл) и воде (20 мл) перемешивают при давлении 50 атм CO в течение 16 ч при температуре 150C. Смесь выпаривают и добавляют воду. Осадок отфильтровывают и высушивают, получая 9,20 г (выход 100%) промежуточного продукта 21. Пример A9. Получение промежуточного продукта 22.(0,036 моль) в ТГФ (300 мл) гидрируют при комнатной температуре при использовании 5%-го Pd/C и 0,5% V2O5 (4 г) в качестве катализатора в присутствии раствора тиофена (1 мл; 4%-ный раствор в DIPE). После поглощения водорода (3 экв.) катализатор отфильтровывают и фильтрат выпаривают, получая маслянистый остаток. Это масло кристаллизуют из 2-пропанола. Осадок отфильтровывают и высушивают, получая 8,0 г (выход 60%) промежуточного продукта 22. Пример A10. Получение промежуточного продукта 23. Раствор соединения 25 (0,0054 моль) в смеси CH3OH/NH3 (50 мл) гидрируют при температуре 14C при использовании никеля Ренея (1/4 ложки) в качестве катализатора. После поглощения водорода (2 экв.) катализатор отфильтровывают и фильтрат выпаривают. Затем добавляют воду. Смесь экстрагируют с помощью EtOAc. Отделенный органический слой сушат (MgSO4), отфильтровывают и растворитель выпаривают, получая 0,87 г промежуточного продукта 23. Пример A11.a) Получение промежуточного продукта 24. 2-Хлор-4-пиридинкарбонилхлорид (0,16 ммоль) по каплям добавляют к перемешиваемой смеси аммониевой соли тиоциановой кислоты (0,175 моль) в 2-пропаноне (250 мл) при комнатной температуре и полученную смесь перемешивают в течение 2 ч. Добавляют 2,2-дифтор-1,3-бензодиоксол-5-амин (25 г,0,145 моль) и реакционную смесь перемешивают в течение ночи при комнатной температуре. Затем смесь выливают на лед. Осадок отфильтровывают и высушивают, получая промежуточный продукт 24,который используют как таковой на следующей реакционной стадии.
МПК / Метки
МПК: C07D 401/04, A61P 25/00, A61K 31/4196, C07D 249/08, C07D 405/04
Метки: тризамещенные, 1,2,4-триазолы
Код ссылки
<a href="https://eas.patents.su/30-16289-trizameshhennye-124-triazoly.html" rel="bookmark" title="База патентов Евразийского Союза">Тризамещенные 1,2,4-триазолы</a>
Предыдущий патент: Подгузник одноразового использования
Следующий патент: Ветростанция
Случайный патент: Способ получения силилхроматного катализатора