2,4,5-тризамещенные производные тиазолила и их противовоспалительная активность
Номер патента: 7933
Опубликовано: 27.02.2007
Авторы: Дильс Гастон Станислас Марселла, Лав Кристофер Джон, Ван Вауве Жан Пьер Франс, Коиманс Людвиг Поль, Сиблей Энтони Вилльям, Гончаренко Михайло, Де Брабандер Марк Ж., Мозес Роджер Клайв, Ноула Катерина, Вандермасен Неле
Формула / Реферат
1. Применение соединения при получении лекарственного средства для предотвращения или лечения заболеваний, опосредованных TNF-a (фактор некроза опухоли альфа) и/или IL-12 (интерлейкин 12), где соединение представляет собой соединение формулы
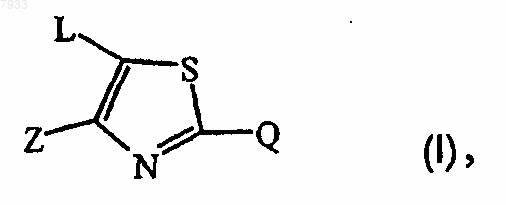
его N-оксид, фармацевтически приемлемую аддитивную соль, четвертичный амин и стереохимически изомерную форму,
где Z представляет собой галоген; С1-6алкил; С1-4алкилокси или аминокарбонил;
Q представляет собой фенил, пиридил, пирролил, пиразолил или тиенил, где каждая из указанных циклических систем может быть необязательно замещена вплоть до трех заместителями, каждый из которых независимо выбран из галогена; C1-6алкила или полигалоген-С1-6алкила;
L представляет собой пиримидинил, пиразолил, триазолил или триазинил, где каждая из указанных кольцевых систем может быть необязательно замещена вплоть до трех заместителями, каждый из которых независимо выбран из амино, C1-6алкилкарбониламино, галогена, Het1-NH-, гидрокси, C1-6алкилтио, С1-6алкилокси, C1-6алкила, С1-12алкиламино, моно- или ди(гидрокси-С1-12алкил)амино, где С1-12алкил может быть далее необязательно замещен гидрокси, Het1, аминокарбонила, циано, аминоС1-12алкиламино, гидроксиС1-12алкилокси, -NH-C(=NH)-NH2, карбоксиС1-12алкиламино или аминоС1-6алкилоксиС1-6алкил-оксиС1-6алкиламино;
Het1 представляет собой насыщенный 6-членный гетероцикл, выбранный из пиперидинила, морфолинила, пиперазинила, где указанный насыщенный 6-членный гетероцикл может быть необязательно замещен амино или С1-4алкилом, необязательно замещенным фенилом.
2. Применение соединения по п.1, где Q представляет собой фенил или пиридил, где каждое из указанных колец необязательно замещено вплоть до трех заместителями, каждый из которых независимо выбран из галогена, C1-6алкила или полигалоген-C1-6алкила;
Z представляет собой галоген, C1-6алкил или аминокарбонил;
L представляет собой пиримидинил, пиразолил, триазолил или триазинил, где каждая из указанных кольцевых систем может быть необязательно замещена вплоть до трех заместителями, каждый из которых независимо выбран из амино, C1-6алкилкарбониламино, галогена, гидрокси, C1-6алкилтио, C1-6алкилокси, С1-6алкила, C1-6алкиламино, аминокарбонила или циано.
3. Применение соединения по п.1 или 2, где L представляет собой триазинил или пиримидинил, где каждая из указанных кольцевых систем может быть необязательно замещена вплоть до трех заместителями, каждый из которых независимо выбран из амино, C1-6алкилкарбониламино, галогена, Het1-NH-, гидрокси, C1-6алкилтио, C1-6алкилокси, C1-6алкила, С1-12алкиламино, моно- или ди(гидрокси-С1-12алкил)амино, где С1-12алкил может быть далее необязательно замещен гидрокси, Het1, аминокарбонила, циано, аминоС1-12алкиламино, гидроксиС1-12алкилокси, -NH-C(=NH)-NH2, карбоксиС1-12алкиламино или аминоС1-6алкилоксиС1-6алкилоксиС1-6алкиламино.
4. Применение соединения по п.1, где Q представляет собой фенил, пиридил, пирролил, пиразолил или тиенил, где каждая из указанных кольцевых систем может быть необязательно замещена 1 или 2 заместителями каждый из которых независимо выбран из галогена или полигалогенС1-6алкила.
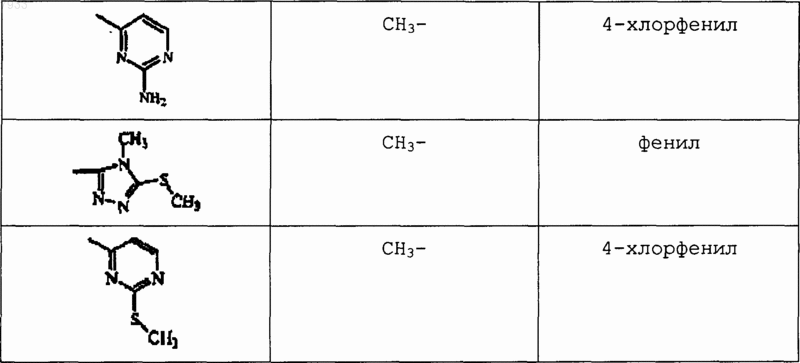
5. Применение соединения по любому из пп.1-4, при условии, что соединение отличается от
![]()
6. Применение любого соединения, как заявлено в пп.1-5, для приготовления лекарств для предотвращения или лечения заболеваний, опосредованных цитокинами TNF-a и/или IL-12.
7. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и терапевтически эффективное количество соединения по п.5 в качестве активного ингредиента.
8. Способ получения соединения по п.7, характеризующийся тем, что фармацевтически приемлемый носитель тщательно смешивают с терапевтически эффективным количеством соединения по п.5 или 6.
9. Соединение формулы
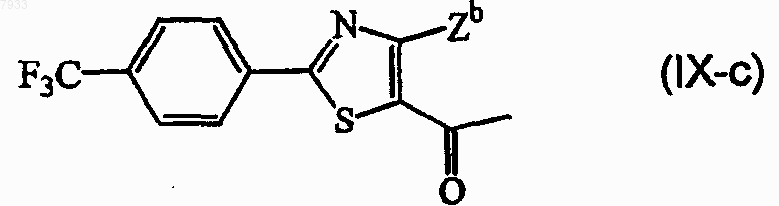
где Zb представляет собой галоген или С1-4алкил.
10. Соединение формулы
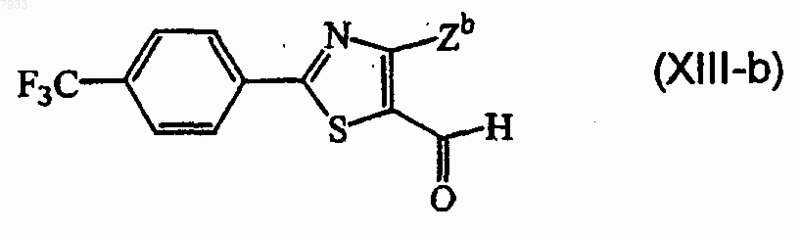
где Zb представляет собой галоген или С1-4алкил.
11. Продукт, содержащий соединение по пп.1-4 и другое противовоспалительное или иммуносупрессивное соединение в комбинированном препарате для совместного, раздельного или последовательного применения для лечения воспалительных или аутоиммунных заболеваний.
12. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и в качестве активных ингредиентов соединение по пп.1-4 и другое противовоспалительное или иммуносупрессивное соединение.
Текст
007933 Настоящее изобретение относится к 2,4,5-тризамещенным производным тиазолила, обладающим свойствами подавлять продукцию провоспалительных цитокинов. Кроме того, изобретение относится к содержащим их фармацевтическим композициям. Также изобретение относится к применению 2,4,5 тризамещенных производных тиазолила для изготовления лекарственных средств для предотвращения или лечения заболеваний, опосредованных TNF- и/или IL-12. В WO 00/35911 описаны ацетальные производные в качестве ингибиторов TNF-. В WO 96/03392 описаны сульфонильные производные для лечения воспаления. В WO 98/01449 описаны соединения, связанные с пиримидином в качестве противоаллергических и противовоспалительных средств. В US 5240929 описаны 2-гетероцикло-5-гидрокси-1,3-пиримидины, пригодные в качестве противовоспалительных средств. В Z. Chem., 1969, 9(5), 186-187 описаны тиазолилхинолины в качестве флуоресцентных индикаторов. В EP 117082 описаны тиазольные производные в качестве кардиотонических средств, средств, регулирующих кровяное давление, и противоязвенных средств. В Chem. Pharm. Bull., 1982, 30(6), 1974-1979 описаны исследования оксидов третичных аминов. В WO 97/05131 описаны гетероарилкарбоксамиды в качестве агрохимических и медицинских фунгицидов.Z. Naturforsch. В Chem. Sci. 1990, 45(12), 1695-1708 относится к реакциям добавления циклических соединений к 5-азидо-4-(трифторметил)-1,3-азолам. В Synthesis 1988, 3, 194-198 описаны способы региоселективного введения трифторметильных групп в гетероарены. В J. Med. Chem. 1988, 31(6), 1197-1204 описан синтез производных оксазола в качестве гиполипидемических, противохолестеринемических средств и средств, подавляющих агрегацию тромбоцитов.Chem. Ber. 1982, 115(7), 2494-2507 относится к синтезу 1,3-азолов. В DD 258165 описаны хиноксалиновые производные в качестве гербицидов и фунгицидов.Z. Chem. 1979, 19(1), 21-22 относится к замещенным гетероциклами тиазолам в качестве пестицидов.Indian J. Chem., Sect. В, 1976, 14 В (7), 552-555 относится к синтезу и противовоспалительной активности битиазолильных производных. В Justus Liebigs Ann. Chem. 1974, 8, 1195-1205 описан синтез соединений тиазола.GB 1189008 относится к производным бензоксазола в качестве флуоресцентных осветлителей. В JP 41012946 описаны производные бензоксазола и бензимидазола в качестве оптических осветляющих органических волокон. В Chem. Ber. 1967, 100(7), 2184-2187 описан синтез производных тиазола. В US 6231786 описаны фторированные азолы и их применение в жидкокристаллических смесях. В WO 01/30778 описаны тиазолы и имидазопиридины для лечения заболеваний, опосредованныхPDE IV. В WO 01/64674 описаны 2,4-двузамещенные производные тиазолила в качестве ингибиторов TNFи/или IL-12. Соединения по настоящему изобретению отличаются от предшествующих аналогов по своей структуре, фармакологической активности, эффективности или физико-химическим характеристикам (увеличенная химическая стабильность, улучшенная растворимость). Настоящее изобретение относится к применению соединения для изготовления лекарственного средства для предотвращения или лечения заболеваний, опосредованных TNF- (фактор некроза опухоли альфа) и/или IL-12 (интерлейкин 12), где соединение представляет собой соединение формулы его N-оксид, фармацевтически приемлемую аддитивную соль, четвертичный амин и стереохимически изомерную форму, гдеQ представляет собой фенил, пиридил, пирролил, пиразолил или тиенил, где каждая из указанных циклических систем может быть необязательно замещена вплоть до трех заместителями, каждый из которых независимо выбран из галогена; C1-6 алкила или полигалоген-С 1-6 алкила;L представляет собой пиримидинил, пиразолил, триазолил или триазинил, где каждая из указанных кольцевых систем может быть необязательно замещена вплоть до трех заместителями, каждый из которых независимо выбран из амино, С 1-6 алкилкарбониламино, галогена, Het1-NH-, гидрокси, C1-6 алкилтио,С 1-6 алкилокси, C1-6 алкила, С 1-12 алкиламино, моно- или ди(гидроксиС 1-12 алкил)амино, где С 1-12 алкил может быть далее необязательно замещен гидрокси, Het1, аминокарбонила, циано, аминоС 1-12 алкиламино,гидроксиС 1-12 алкилокси, -NH-C(=NH)-NH2, карбоксиС 1-12 алкиламино или аминоС 1-6 алкилоксиС 1-6 алкилоксиС 1-6 алкиламино;Het1 представляет собой насыщенный 6-членный гетероцикл, выбранный из пиперидинила, морфолинила, пиперазинила, где указанный насыщенный 6-членный гетероцикл может быть необязательно замещен амино или С 1-4 алкилом, необязательно замещенным фенилом, при условии, что соединение отличается от Как используется здесь выше или ниже, С 1-4 алкил в качестве группы или части группы обозначает прямолинейную или разветвленную цепь насыщенных углеводородных радикалов, содержащих от 1 до 4 атомов углерода, таких как метил, этил, пропил, 1-метилэтил, бутил, 2-метилпропил и т.п.; C1-6 алкил в качестве группы или части группы обозначает прямолинейную или разветвленную цепь насыщенных углеводородных радикалов, содержащих от 1 до 6 атомов углерода, таких как группы, определенные для С 1-4 алкила, и пентил, гексил, 2-метилбутил, 3-метилпентил и т.п.; С 1-12 алкил в качестве группы или части группы обозначает прямолинейную или разветвленную цепь насыщенных углеводородных радикалов,содержащих от 1 до 12 атомов углерода, таких как группы, определенные для C1-6 алкила, и гептил, октил, нонил, децил, 3-этилпентил и т.п.; C1-6 алкандиил обозначает прямолинейную или разветвленную цепь насыщенных двухвалентных углеводородных радикалов, содержащих от 1 до 6 атомов углерода,таких как метилен, 1,2-этандиил или 1,2-этилиден, 1,3-пропандиил или 1,3-пропилиден, 1,4-бутандиил или 1,4-бутилиден, 1,5-пентандиил, 1,6-гександиил и т.п.; С 2-6 алкенил в качестве группы или части группы обозначает прямолинейную или разветвленную цепь углеводородных радикалов, содержащих от 2 до 6 атомов углерода и имеющих 1 двойную связь, таких как этенил, пропенил, бутенил, пентенил, гексенил, 3-метилбутенил и т.п.; С 2-6 алкендиил в качестве группы или части группы обозначает прямолинейную или разветвленную цепь двухвалентных углеводородных радикалов, содержащих от 2 до 6 атомов углерода и имеющих 1 двойную связь, таких как этендиил, 2-бутен-1,4-диил и т.п.; С 2-6 алкинил в качестве группы или части группы обозначает прямолинейную или разветвленную цепь углеводородных радикалов, содержащих от 2 до 6 атомов углерода и имеющих 1 тройную связь, таких как этинил, пропинил,бутинил, пентинил, гексинил, 3-метилбутинил и т.п.; С 2-6 алкиндиил в качестве группы или части группы обозначает прямолинейную или разветвленную цепь двухвалентных углеводородных радикалов, содержащих от 2 до 6 атомов углерода и имеющих 1 тройную связь, таких как этиндиил, 3-пентин-1,5-диил и т.п.; С 3-6 циклоалкил является общим для циклопропила, циклобутила, циклопентила и циклогексила; моноциклический или бициклический частично замещенный гетероцикл представляет собой кольцевую систему, состоящую из 1 или 2 колец и содержащую по меньшей мере один гетероатом, выбранный из О,N или S и по меньшей мере одну двойную связь, при условии, что кольцевая система не является ароматической системой; моноциклический или бициклический ароматический гетероцикл представляет собой ароматическую кольцевую систему, состоящую из 1 или 2 колец и содержащую по меньшей мере один гетероатом, выбранный из О, N или S; термин ароматический хорошо известен специалистам в данной области и обозначает циклически сопряженные системы из 4n+2 электронов, включающие 6, 10, 14 и т.д.-электронов (правило Хюккеля). Радикал L или Q, как описано выше для соединений формулы (I), можно присоединять к остатку молекулы формулы (I) посредством любого подходящего кольцевого углерода или гетероатома. Напри-2 007933 мер, когда Q представляет собой пиридил, он может представлять собой 2-пиридил, 3-пиридил или 4 пиридил. Линии, нарисованные на кольцевых системах, означают, что связь можно образовывать с любым подходящим атомом цикла. Когда кольцевая система представляет собой бициклическую кольцевую систему, связь можно образовывать с любым подходящим атомом кольца из любого из двух колец. Как используется здесь выше, элемент (=O) образует карбонильную группу при присоединении к атому углерода, сульфоксидную группу при присоединении к атому серы, и сульфонильную группу при присоединении к атому серы двух из указанных элементов. Термин галоген является общим для фтора, хлора, брома и йода. Как используется здесь выше и ниже, полигалоген-С 1-6 алкил в качестве группы или части группы обозначает моно- или полигалогензамещенный C1-6 алкил, в частности, метил с одним или несколькими атомами фтора, например, дифторметил или трифторметил. Если в определении полигалоген-С 1-6 алкила к алкильной группе присоединено более чем одного атома галогена, они могут являться одинаковыми или различными. Когда любая переменная встречается более одного раза в любой составляющей части, каждое определение является независимым. При использовании здесь выше или ниже, где каждый из заместителей можно выбирать независимо из списка многочисленных определений, таких как, например, заместители для L или Q, подразумевают все возможные комбинации, которые возможны химически и которые приводят к химически стабильным молекулам. Когда к остатку молекулы посредством мостика, такого как, например, Het1-NH- присоединяют кольцевые системы, подразумевают все возможные комбинации кольцевых систем и мостиков,которые возможны химически и приводят к химически стабильным молекулам. Когда несколько последовательных заместителей в радикале формулы (с-1) представляют собой прямые связи, это можно интерпретировать как одну простую прямую связь. Например, когда X представляет собой прямую связь, C1 представляет собой СН 2, Y1, C2, Y2, С 3, Y3 и С 4 представляют собой прямую связь, a Z представляет собой водород, тогда указанный радикал формулы (с-1) представляет собой метил (СН 3). Понятно, что некоторые из соединений формулы (I) и их N-оксиды, аддитивные соли, четвертичные амины и стереохимически изомерные формы могут содержать один или несколько центров хиральности и существовать в виде стереохимически изомерных форм. Термин "стереохимически изомерные формы", как он используется здесь выше или ниже, обозначает все возможные стереоизомерные формы, которыми могут обладать соединения формулы (I) и их Nоксиды, аддитивные соли, четвертичные амины или физиологически функциональные производные. Если не указано или обозначено иначе, химическое название соединений обозначает смесь всех возможных стереохимически изомерных форм, при этом указанные смеси содержат все диастереоизомеры и энантиомеры основной молекулярной структуры, а также каждую из индивидуальных изомерных форм формулы (I) и их N-оксиды, соли, сольваты, четвертичные амины, которые являются, по существу, чистыми,то есть содержат менее чем 10%, предпочтительно менее чем 5%, в частности менее чем 2% и наиболее предпочтительно менее чем 1% других изомеров. Очевидно, что стереохимически изомерные формы соединений формулы (I) входят в объем данного изобретения. Для терапевтического применения, соли соединений формулы (I) представляют собой соли, где противоион является фармацевтически приемлемым. Однако соли кислот и оснований, которые не являются фармацевтически приемлемыми, также могут найти применение, например, для получения или очистки фармацевтически приемлемого соединения. Все соли, фармацевтически приемлемые или нет,являются включенными в объем настоящего изобретения. Подразумевается, что фармацевтически приемлемые аддитивные соли кислот и оснований, как указано здесь выше или ниже, включают терапевтически активные формы аддитивных солей нетоксичных кислот и оснований, которые могут образовывать соединения формулы (I). Фармацевтически приемлемые аддитивные соли кислот можно легко получить посредством обработки основной формы такой подходящей кислотой. Подходящие кислоты включают в себя, например, неорганические кислоты, такие как галогенводородные кислоты, например, хлористо-водородная или бромисто-водородная кислота, серная,азотная, фосфорная и подобные кислоты или органические кислоты, например, такие как уксусная, пропановая, гидроксиуксусная, молочная, пировиноградная, щавелевая (то есть этандиовая), малоновая, янтарная (то есть бутандиовая кислота), малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламиновая, салициловая,п-аминосалициловая, памовая и подобные кислоты. Наоборот, солевые формы можно преобразовать посредством обработки подходящим основанием в форму свободного основания. Соединения формулы (I), содержащие кислотный протон, можно также преобразовать в формы их аддитивных солей нетоксических металлов или аминов посредством воздействия подходящих органических или неорганических оснований. Подходящие формы основных солей включают, например, аммонийные соли, соли щелочных и щелочно-земельных металлов, например, соли лития, натрия, калия, магния, кальция и т.п., соли с органическими основаниями, например, первичными, вторичными или тре-3 007933 тичными алифатическими или ароматическими аминами, такими как метиламин, этиламин, пропиламин,изопропиламин, четыре изомера бутиламина, диметиламин, диэтиламин, диэтаноламин, дипропиламин,диизопропиламин, ди-н-бутиламин, пирролидин, пиперидин, морфолин, триметиламин, триэтиламин,трипропиламин, хинуклидин, пиридин, хинолин и изохинолин; бензатиновые, N-метил-Оглюкаминовые, гидрабаминовые соли и соли с аминокислотами, например, такими как аргинин, лизин и тому подобное. Наоборот, солевую форму можно преобразовать посредством обработки кислотой в форму свободной кислоты. Как используется здесь выше, термин аддитивная соль включает также сольваты, которые могут образовывать соединения формулы (I), а также их соли. Такие сольваты представляют собой, например,гидраты, алкоголяты и т.п. Как используется здесь выше, термин "четвертичный амин" обозначает четвертичные аммонийные соли, которые могут образовывать соединения формулы (I) путем взаимодействия между основным азотом соединения формулы (I) и подходящим агентом для образования четвертичных аминов, например,таким как необязательно замещенный алкилгалогенид, арилгалогенид или арилалкилгалогенид, например, метилйодид или бензилйодид. Также можно использовать другие реагенты с хорошо удаляемыми группами, такие как алкилтрифторметансульфонаты, алкилметансульфонаты и алкил-п-толуолсульфонаты. Четвертичный амин содержит положительно заряженный азот. Фармацевтически приемлемые противоионы включают в себя, например, хлор, бром, йод, трифторацетат и ацетат. Желаемый противоион можно получить с применением колонок с ионообменной смолой. Подразумевается, что формы N-оксидов по настоящему изобретению включают соединения формул(I), где один или несколько третичных атомов азота окислены до так называемого N-оксида. Некоторые из соединений формулы (I) могут также существовать в их таутомерной форме. Хотя такие формы явно не указаны в формуле выше, подразумевается, что включены в объем настоящего изобретения. Конкретными примерами моноциклических или бициклических частично насыщенных гетероциклов являются пирролинил, имидазолил, пиразолил, 2,3-дигидробензофуранил, 1,3-бензодиоксолил, 2,3 дигидро-1,4-бензодиоксинил, индолинил и тому подобное. Конкретными примерами моноциклических или бициклических ароматических гетероциклов являются азетил, оксэтилиденил, пирролил, фурил, тиенил, имидазолил, оксазолил, изоксазолил, тиазолил,изотиазолил, пиразолил, триазолил, тиадиазолил, оксадиазолил, тетразолил, пиридил, пиримидинил, пиразинил, пиридазинил, триазинил, пиранил, бензофурил, изобензофурил, бензотиенил, изобензотиенил,индолизинил, индолил, изоиндолил, бензокзазолил, бензимидазолил, индазолил, бензизоксазолил, бензизотиазолил, бензопиразолил, бензоксадиазолил, бензотиадиазолил, бензотриазолил, пуринил, хинолинил,изохинолинил, циннолинил, хинолизинил, фталазинил, хиноксалинил, хиназолинил, нафтиридинил, птеридинил, бензопиранил, пирролопиридинил, тиенопиридил, фуропиридил, изотиазолопиридил, тиазолопиридил, изоксазолопиридил, оксазолопиридил, пиразолопиридил, имидазопиридил, пирролопиразинил,тиенопиразинил, фуропиразинил, изотиазолопиразинил, тиазолопиразинил, изоксазолопиразинил, оксазолопиразинил, пиразолопиразинил, имидазопиразинил, пирролопиримидинил, тиенопиримидинил, фуропиримидинил, изотиазолопиримидинил, тиазолопиримидинил, изоксазолопиримидинил, оксазолопиримидинил, пиразолопиримидинил, имидазопиримидинил, пирролопиридазинил, тиенопиридазинил,фуропиридазинил, изотиазолопиридазинил, тиазолопиридазинил, изоксазолопиридазинил, оксазолопиридазинил, пиразолопиридазинил, имидазопиридазинил, оксадиазолопиридил, тиадиазолопиридил, триазолопиридил, оксадиазолопиразинил, тиадиазолопиразинил, триазолопиразинил, оксадиазолопиримидинил, тиадиазолопиримидинил, триазолопиримидинил, оксадиазолопиридазинил, тиадиазолопиридазинил, триазолопиридазинил, имидазооксазолил, имидазотиазолил, имидазоимидазолил, изоксазолотриазинил, изотиазолотриазинил, пиразолотриазинил, оксазолотриазинил, тиазолотриазинил, имидазотриазинил, оксадиазолотриазинил, тиадиазолотриазинил, триазолотриазинил. Наиболее предпочтительные соединения представляют собой соединения 9 (см. табл. 3), 34 (см. табл. 2), 58 (см. табл. 2) и 84 (см. табл. 3). Обычно, соединения формулы (I), где L представляет собой 4-пиримидинил, замещенный Ra в положении 2, где Ra представляет собой водород, амино, необязательно замещенный C1-6 алкилом, необязательно замещенным моно- или ди(С 1-12 алкил)амино, Het-NH- или Het1, причем указанные соединения представлены формулой (I-а), можно получить путем взаимодействия промежуточного соединения формулы (II) с промежуточным соединением формулы (III) или его подходящей солью, например, такой как формамидинацетат, гуанидингидрохлорид, гуанидинкарбонат (2:1), гуанидинсульфат, гуанидингемисульфат, N-(3-гидроксипропил)гуанидингемисульфат, 1-пиперазинкарбоксимидамидсульфат (2:1) и т.п.,в присутствии подходящего растворителя, например, такого как N,N-диметилформамид, диметилсульфоксид, спирт, например, такой как этанол, 2-этоксиэтанол, 2-метоксиэтанол и т.п., подходящего основания, например, метанолата натрия (метоксид натрия), этанолата натрия, (этоксид натрия), гидрида натрия и т.п. Также можно использовать натрий в присутствии подходящего спирта. Реакцию можно проводить при повышенной температуре. Соединения формулы (I-a), где Z представляет собой аминокарбонил, причем указанные соединения представлены формулой (I-а-1), можно получить путем взаимодействия промежуточного соединения формулы (II') с промежуточным соединением формулы (III) или его подходящей солью, например, такой как формамидинацетат, гуанидингидрохлорид гуанидинкарбонат (2:1), гуанидинсульфат, гуанидингемисульфат, N-(3-гидроксипропил)гуанидингемисульфат, 1-пиперазинкарбоксимидамидсульфат (2:1) и т.п.,в присутствии подходящего растворителя, например, такого как N,N-диметилформамид, диметилсульфоксид, спирт, например, такой как этанол, 2-этоксиэтанол, 2-метоксиэтанол и т.п., подходящего основания, например метанолата натрия (метоксид натрия), гидрида натрия и т.п. Также можно использовать натрий в присутствии подходящего спирта. Реакцию можно проводить при повышенной температуре. Соединения формулы (I), где L представляет собой 4-пиримидинил, замещенный Rb в положении 2,где Rb представляет собой -NH2, Het1-NH-; Het1; -NH-C(=NH)-N(Rz)2; С 1-12 алкилокси, необязательно замещенный одним, двумя или тремя гидроксигруппами; необязательно замещенный моно- или ди(С 1-12 алкил)амино, в частности, незамещенный моно- или ди(С 1-12 алкил)амино или моно- или ди(С 1-12 алкил)амино, где С 1-12 алкил замещен одним, двумя или тремя заместителями, выбранными из гидрокси,карбоксила, амино, амино-С 1-4 алкилокси-С 1-4 алкилокси, причем указанные соединения представлены формулой (I-b), можно получить путем взаимодействия промежуточного соединения формулы (IV) с промежуточным соединением формулы (V), необязательно при повышенной температуре и необязательно в присутствии подходящего растворителя, например, такого как N,N-диметилформамид, диметилсульфоксид, тетрагидрофуран, спирт, например, такой как 2-пропанол, метанол, метанол/метоксид натрия и т.п. и необязательно в присутствии подходящего основания, например, такого как карбонат натрия, для формирования, где возможно, соответствующей соли или подходящей кислоты, например, такой как хлористо-водородная или уксусная кислоты и т.п., и, необязательно, в присутствии гидрида натрия, например, когда H-Rb представляет собой гидроксиС 1-12 алкилокси, и, необязательно, под давлением. Аналогичную реакцию можно провести для преобразования промежуточного соединения формулы Соединения формулы (I), где L представляет собой 4-пиримидинил, замещенный циано в положении 2, причем указанные соединения представлены формулой (I-c), можно получить путем взаимодействия промежуточного соединения формулы (IV) с подходящей цианистой солью, например, такой как цианид калия, в присутствии подходящего растворителя, например, такого как N,N-диметилформамид. Реакцию можно проводить при повышенной температуре. Соединения формулы (I), где L представляет собой 4-пиримидинил, замещенный гидрокси в положении 2, причем указанные соединения представлены формулой (I-d), можно получить путем взаимодействия промежуточного соединения формулы (IV) с подходящим гидроксидным основанием, например, таким как гидроксид натрия, в присутствии подходящего растворителя, например, такого как вода,тетрагидрофуран. Соединения формулы (I), где L представляет собой 4-пиримидинил, замещенный CH3-S- в положении 2, причем указанные соединения представлены формулой (I-е), можно получить путем взаимодействия промежуточного соединения формулы (II) с тиомочевиной в присутствии подходящего растворителя, например, такого как спирт, например этанол и т.п., подходящего алкоголята, например этанолата натрия (этоксид натрия) и т.п., диметилсульфата и подходящего основания, например, такого как гидроксид натрия. Соединения формулы (I), где L представляет собой 4-пиримидинил, замещенный Ra в положении 2 и CH3-S- в положении 6, причем указанные соединения представлены формулой (I'-е), можно получить путем взаимодействия промежуточного соединения формулы (XXXV) с промежуточным соединением формулы (III) в присутствии подходящего растворителя, например, такого как N,N-диметилформамид. Реакцию можно проводить при повышенной температуре. Соединения формулы (I), где L представляет собой 3-пиразолил, причем указанные соединения представлены формулой (I-f), можно получить путем взаимодействия промежуточного соединения формулы (II) с гидразинмоногидратом в присутствии подходящей кислоты, например, такой как уксусная кислота. Соединения формулы (I), где L представляет собой триазолил, замещенный меркапто, причем указанные соединения представлены формулой (I-g), можно получить путем взаимодействия промежуточного соединения формулы (VII) с промежуточным соединением формулы (VIII), где Rc представляет собой водород или C1-6 алкил, в присутствии подходящего основания, например, такого как 1,8 диазобицикло[5,4,0]ундец-7-ен и подходящего растворителя, например, такого как спирт, например бутанол. Соединения формулы (I), где L представляет собой 4-пиримидинил, замещенный Ra в положении 2 и гидрокси в положении 6, причем указанные соединения представлены формулой (I-h), можно получить путем взаимодействия промежуточного соединения формулы (VI) с промежуточным соединением формулы (III) или его подходящей солью, например, такой как формамидинацетат, гуанидингидрохлорид,гуанидинкарбонат (2:1), гуанидинсульфат, гуанидингемисульфат, N-(3-гидроксипропил)гуанидингемисульфат, 1-пиперазинкарбоксимидамидсульфат (2:1) и т.п., в присутствии подходящего растворителя,например, такого как 2-этоксиэтанол/метоксид натрия. Реакцию можно проводить при повышенной температуре. Соединения формулы (I), где L представляет собой 1,3,5-триазин-4-ил, замещенный Ra в положении 2, причем указанные соединения представлены формулой (I-i), можно получить путем взаимодействия промежуточного соединения формулы (XXX) с промежуточным соединением формулы (III) или его подходящей солью, например, такой как формамидинацетат, гуанидингидрохлорид, гуанидинкарбонат (2:1),гуанидинсульфат, гуанидингемисульфат, N-(3-гидроксипропил)гуанидингемисульфат, 1-пиперазинкарбоксимидамидсульфат (2:1) и т.п., в присутствии 1,1-диметокси-N,N-диметилметанамина и в присутствии подходящего растворителя, например, такого как метанол/метоксид натрия. Соединения формулы (I) можно преобразовать друг в друга следуя известным в данной области реакциям перегруппировки функциональных групп, включающим те, которые описаны ниже. Соединения формулы (I) можно преобразовать в соответствующие формы N-оксида следуя известным в данной области способам преобразования трехвалентного азота в форму его N-оксида. Указанную реакцию N-окисления, как правило, можно проводить путем взаимодействия исходного вещества формулы (I) с подходящим органическим или неорганическим пероксидом. Подходящие неорганические пероксиды включают, например, пероксид водорода, пероксиды щелочных или щелочно-земельных металлов, например, пероксид натрия, пероксид калия; подходящие органические пероксиды могут включать пероксокислоты, например, такие как бензолкарбопероксокислота или замещенная галогеном бензолкарбопероксокислота, например, 3-хлорбензолкарбопероксокислота, пероксоалкановые кислоты, например, пероксоуксусная кислота, алкилгидропероксиды, например, трет-бутилгидропероксид. Подходящие растворители представляют собой, например, воду, низкомолекулярные спирты, например, этанол и т.п., углеводороды, например, толуол, кетоны, например, 2-бутанон, галогенированные углеводороды,например, дихлорметан и смеси таких растворителей. Соединения формулы (I), где L замещен амино, можно преобразовать в соединение формулы (I),где L замещен C1-6 алкилкарбониламино путем взаимодействия с C1-6 алкилкарбонилхлоридом в подходящем растворителе, например, таком как пиридин.(I), где Q или L замещен карбоксилом, путем взаимодействия с подходящей кислотой, такой как концентрированная хлористо-водородная кислота, в присутствии подходящего инертного в данной реакции растворителя, например воды. Соединения формулы (I), где Q или L замещен циано, можно преобразовать в соединение формулы(I), где Q или L замещен аминокарбонилом, путем взаимодействия с подходящей кислотой, например,такой как серная кислота, в присутствии воды. Соединения формулы (I), где L замещен C1-6 алкил-С(=O)-NH-, можно преобразовать в соединение формулы (I), где L замещен амино, путем взаимодействия с подходящей кислотой, такой как бромистоводородная кислота и т.п., в присутствии подходящего растворителя, такого как вода. Соединения формулы (I), где L замещен меркапто, можно преобразовать в соединение формулы (I),где L замещен C1-6 алкилтио, путем взаимодействия с подходящим алкилирующим средством, например,таким как С 1-6 алкил-I, например, СН 3I, в присутствии подходящего растворителя, например, такого как этанол. Соединения формулы (I), где L замещен фтором, можно получить из соединения формулы (I), где L не замещен фтором, путем взаимодействия с выбранным фторирующим агентом в присутствии 2,6-лутидина и подходящего растворителя, например, такого как N,N-диметилформамида. Соединения формулы (I), где L замещен хлором или бромом, можно получить из соединения формулы (I), где L не замещен хлором или бромом, путем взаимодействия с N-хлорсукцинимидом или N-бромсукцинимидом в присутствии подходящего растворителя, например, такого как тетрахлорид углерода. В последующих абзацах описаны несколько способов получения промежуточных продуктов указанных выше реакций. Ряд промежуточных продуктов и исходные вещества являются коммерчески доступными или являются известными соединениями, которые можно получить, следуя стандартным реакционным способам, как правило, известным в данной области. Промежуточные соединения формулы (II) можно получить путем взаимодействия промежуточного соединения формулы (IX) с (CH3)2N-СН(ОСН 3)2 при повышенной температуре, необязательно в присутствии подходящего растворителя, например, такого как N,N-диметилформамид или толуол. Промежуточные соединения формулы (IX), где Z представляет собой C1-6 алкил или C1-6 алкилоксикарбонил, причем указанный Z представлен Za и указанные промежуточные соединения представлены формулой (IX-a), можно получить путем взаимодействия промежуточного соединения формулы(X) с промежуточным соединением формулы (XI), где W1 представляет собой подходящую удаляемую группу, такую как галоген, например, хлор, бром, a Za представляет собой C1-6 алкил или C1-6 алкилоксикарбонил как описано выше, в присутствии подходящего растворителя, например, такого как спирт, например метанол, этанол и т.п., при повышенной температуре. Промежуточные соединения формулы (IX) также можно получить путем окисления промежуточного соединения формулы (XII) в присутствии подходящего окисляющего реагента, например, такого как хлорхромат пиридиния, в присутствии подходящего растворителя, например, такого как 1,2-дихлорэтан и при повышенной температуре. Промежуточные соединения формулы (XII) можно получить путем взаимодействия промежуточного соединения формулы (XIII) с СН 3MgCl в присутствии подходящего растворителя, например, такого как тетрагидрофуран. Промежуточные соединения формулы (XIII) можно получить путем взаимодействия промежуточного соединения формулы (XIV), где W2 представляет собой подходящую удаляемую группу, например,такую как галоген, например, хлор и т.п., с промежуточным соединением формулы (XV) в присутствии подходящего катализатора, например, такого как палладийтетрацистрифенилфосфина и походящего растворителя, например, такого как тетрагидрофуран и походящей соли, например, такой как карбонат натрия в воде. Промежуточные соединения формулы (IX), где Z представляет собой хлор, причем указанные промежуточные соединения представлены формулой (IX-b), или промежуточные соединения формулы(XIII), где Z представляет собой хлор, причем указанные промежуточные соединения представлены формулой (XIII-а), можно получить путем взаимодействия промежуточного соединения формулы (XVI) с N,N-диметилформамидом в присутствии РOСl3 при повышенной температуре. Промежуточные соединения формулы (XVI) можно получить путем взаимодействия промежуточного соединения формулы (X) с Сl-СН 2-С(=O)-Сl при повышенной температуре. Промежуточные соединения формулы (XIII-а), где Q представляет собой 1-пирролил, причем указанные промежуточные соединения представлены формулой (XIII-a-1), можно получить путем взаимодействия 2-амино-4-хлор-5-тиазолкарбоксальдегида (CAS 76874-79-8) с тетрагидро-2,5-диметоксифураном (CAS 696-59-3) в присутствии подходящей кислоты, например, такой как уксусная кислота. Аналогичным способом 2-амино-4-метил-5-тиазолилэтанон (CAS 106012-40-2) может быть подвергнут взаимодействию с тетрагидро-2,5-диметоксифураном в присутствии подходящей кислоты, например, такой как уксусная кислота для получения 2-пиррол-1-ил-4-метил-5-тиазолилэтанона.-9 007933 Промежуточные соединения формулы (XIII-а), где Q представляет собой 1-пиразолил, причем указанные промежуточные соединения представлены формулой (XIII-а-2), можно получить путем взаимодействия промежуточного соединения (XXXI) с кислотой, например, такой как уксусная кислота, в присутствии подходящего растворителя, например, такого как спирт, например метанол и т.п., при повышенной температуре. Промежуточные соединения формулы (XXXI) можно получить путем взаимодействия промежуточного соединения формулы (XXXII) с пиразолом в присутствии подходящего растворителя, например,такого как N,N-диметилформамид и в присутствии гидрида натрия. Промежуточные соединения формулы (XXXII) можно получить путем взаимодействия промежуточного соединения формулы (XXXIII) с этан-1,2-диолом в присутствии подходящей кислоты, например,такой как 4-толуолсульфоновая кислота и подходящего растворителя, такого как толуол. Промежуточные соединения формулы (II') можно получить путем взаимодействия промежуточного соединения формулы (XVII) с (СН 3)2N-CH(ОСН 3)2 при повышенной температуре. Промежуточные соединения формулы (XVII) можно получить путем взаимодействия промежуточного соединения формулы (XVIII) с NH3 в присутствии подходящего растворителя, например, такого как спирт, например метанол и т.п. Промежуточные соединения формулы (XVIII) можно получить путем взаимодействия промежуточного соединения формулы (X) с СН 3-С(=O)-СНСl-С(=O)-С(=O)-O-СН 2 СН 3 при повышенной температуре в присутствии подходящего растворителя, например, такого как спирт, например этанол и т.п. Промежуточные соединения формулы (IV) можно получить путем взаимодействия соединения формулы (I-е) с подходящим окисляющим реагентом, например, таким как 3-хлорпероксибензойная кислота, в присутствии подходящего растворителя, например, такого как метиленхлорид. Промежуточные соединения формулы (IV) можно получить путем взаимодействия соединения формулы (I'-е) с подходящим окисляющим реагентом, например, таким как 3-хлорпероксибензойная кислота, в присутствии подходящего растворителя, например, такого как хлороформ, и подходящего основания, например, такого как карбонат натрия и пиросульфит натрия. Промежуточные соединения формулы (VI) можно получить путем взаимодействия промежуточного соединения формулы (IX) с СН 3-С(=O)-O-С 1-4 алкилом при повышенной температуре в присутствии подходящего растворителя, например, такого как тетрагидрофуран, и в присутствии гидрида натрия. Промежуточные соединения формулы (IX), где Z представляет собой хлор, причем указанные промежуточные соединения представлены формулой (IX-b), можно преобразовать в промежуточный продукт формулы (IX), где Z представляет собой С 1-4 алкилокси, причем указанные промежуточные соединения представлены формулой (IX-c), путем взаимодействия при повышенной температуре с подходящим алкоголятом, например, таким как метанолат натрия (метоксид натрия) в присутствии подходящего растворителя, например, такого как спирт, например метанол. Промежуточные соединения формулы (VII) можно получить путем взаимодействия промежуточного соединения формулы (IXX) с гидразингидратом.- 11007933 Промежуточные соединения формулы (XXX) можно получить путем взаимодействия промежуточного соединения формулы (XXXIV) с подходящим ангидридом, например, таким как трифторуксусный ангидрид. Промежуточные соединения формулы (XXXIV) можно получить путем взаимодействия промежуточного соединения формулы (XXXV) с аммиаком в присутствии оксалилхлорида и подходящего растворителя, например, такого как метиленхлорид и N,N-диметилформамид. Промежуточные соединения формулы (XXXVI) можно получить путем взаимодействия промежуточного соединения формулы (IX) с дисульфидом углерода и метилиодидом в присутствии подходящего растворителя, например, такого как тетрагидрофуран, и подходящего основания, например, такого как трет-бутоксид калия. Промежуточные соединения формулы (IX), где Q представляет собой 4-трифторметилфенил и Z представляет собой галоген или С 1-4 алкил, где указанный Z представлен формулой Zb и указанные промежуточные соединения представлены формулой (IX-c), являются новыми и также составляют часть настоящего изобретения. Следовательно, настоящее изобретение также относится к соединению формулы где Zb представляет собой галоген или С 1-4 алкил. Предпочтительные соединения формулы (IX-с) представляют собой такие соединения, где Zb представляет собой галоген, в частности, хлор. Промежуточные соединения формулы (XIII), где Q представляет собой 4-трифторметилфенил и Z представляет собой галоген или С 1-4 алкил, где указанный Z представлен формулой Zb и указанные промежуточные соединения представлены формулой (XIII-b), являются новыми и также составляют часть настоящего изобретения. Следовательно, настоящее изобретение также относится к соединению формулы где Zb представляет собой галоген или С 1-4 алкил. Предпочтительные соединения формулы (XIII-b) представляют собой такие соединения, где Zb представляет собой галоген, в частности, хлор. Соединения по настоящему изобретению демонстрируют модулирующее действие на продукцию цитокинов, в частности, подавляющее действие на продукцию цитокинов, более конкретно подавляющее действие на продукцию провоспалительных цитокинов. Цитокин представляет собой любой секретируемый полипептид, который воздействует на функцию других клеток посредством модуляции взаимодействий между клетками при иммунном или воспалительном ответе. Примеры цитокинов включают с интерлейкина-1 (IL-1) до интерлейкина-23 (IL-23), фактор некроза опухоли альфа (TNF-), фактор некроза опухоли бета (TNF-). Настоящие соединения также демонстрируют подавляющее действие на продук- 12007933 цию хемотаксических цитокинов или хемокинов, ответственных за передвижение и активацию лейкоцитов. Продукция хемокинов, подавляемая посредством соединений формулы (I), представляет собой продукцию МСР-1 (белок хемотаксиса моноцитов 1). Продукция цитокинов, специфически подавляемая посредством соединений формулы (I), представляет собой продукцию TNF- и/или интерлейкина-12 (IL-12).TNF- первично продуцируют моноциты, макрофаги Т- и В-лимфоциты, нейтрофилы, тучные клетки, клетки опухолей, фибробласты, кератиноциты, астроциты, микроглиальные клетки, клетки гладкой мускулатуры и другие. Данный провоспалительный цитокин находится на вершине провоспалительных каскадов; он играет ключевую роль в цитокиновой сети в отношении патогенеза многих инфекционных, воспалительных и аутоиммунных заболеваний. Избыточная или нерегулируемая продукция TNFвовлечена в опосредование или обострение ряда заболеваний, включая ревматоидный артрит, ревматоидный спондилит, спондилоатропатии, системную красную волчанку, остеоартрит, подагрический артрит, ювенильный артрит и другие артритические состояния, полихондрию, склередему, гранулематоз Вегенера, дерматомиозит, синдром Стивена-Джонсона, идиопатическую спру, эндокринную офтальмопатию, базедову болезнь, альвеолит, хронический гиперчувствительный пневмонит, первичный биллиарный цирроз, увеит, сухой кератоконъюнктивит и весенний кератоконъюнктивит, аллергический ринит,пузырчатку, эозинофинофилию, синдром Лефлера, эозинофильную пневмонию, паразитическую инвазию, бронхолегочный аспергиллез, узелковый полиартериит, эозинофильную гранулему, расстройства,связанные с эозинофилами, воздействующие на воздухоносные пути, происходящие из-за реакций на лекарственное средство, сепсис, септический шок, эндотоксический шок, грамотрицательный сепсис,синдром токсического шока, церебральную малярию, респираторный дистресс-синдром взрослых, бронхит (острый, арахидный, катаральный, хронический, крупозный, фтиноидный бронхит), хронические болезни воздухоносных путей или легких, пневмосклероз, пневмокониоз (алюминоз, антракоз, асбестоз,халикоз, птилоз, сидероз, силикоз, табакоз, биссиноз), туберкулез, силикоз, обострение гиперреактивности воздухоносных путей при терапии другими лекарственными средствами (например, аспирин, терапия-агонистами), легочный саркоидоз, болезни резорбции кости, менингит, реперфузионную травму, реакцию трансплантат против хозяина, отторжения аллотрансплантата, отторжения трансплантата, лихорадку и миалгию вследствие инфекции, такую как грипп, кахексия (вследствие, например, бактериальной,вирусной или паразитической инфекции или потери или повреждения гуморальной или другой органической функции, или вторично из-за озлокачествления; малярийная и весенняя кахексия; кахексия, являющаяся результатом дисфункции гипофиза, щитовидной железы или тимуса, а также уремическая кахексия; вторичная кахексия при синдроме вторичного иммунодефицита (AIDS, AIDS, ARC (комплекс,связанный с AIDS), диабет, злокачественной опухоли, ангиогенез, лимфому, синдром Кавасаки, синдром Бегчета, ящурное изъязвление, кожные нарушения, такие как псориаз, экзему, ожоги, дерматит, формирование келоида, формирование рубцовой ткани, лепрозную узелковую эритему, болезнь Крона, язвенный колит, воспалительное заболевание кишечника, синдром раздраженного кишечника, жар, астму (инфекционно-аллергическая, внешняя, аллергическая, не атопическая, индуцированная нагрузкой и профессиональная и астма, индуцированная бактериальной инфекцией), синдром детских хрипов, рассеянный склероз, болезнь Паркинсона, панкреатит, болезнь сердца, застойную сердечную недостаточность,инфаркт миокарда, острую печеночную недостаточность, гломерулонефрит, синдромы, ассоциированные с лечением, включающие реакцию Яриша-Герксхаймера и синдромы, ассоциированные с инфузией IL-2,инфузией антител против CD3, гемодиализом, вакцинации против желтой лихорадки. Также показано, что TNF- активирует репликацию HIV (вирус иммунодефицита человека) в моноцитах и/или макрофагах. Следовательно, подавление продукции TNF- или активности помогает в ограничении прогрессии HIV. TNF- также играет роль при других вирусных инфекциях, таких как гепатит С, CMV (цитомегаловирус), грипп и инфекции вируса герпеса типа 2, включая вирус простого герпеса типа 1, вирус простого герпеса типа 2, вирус опоясывающей ветряной оспы, вирус Эпштейн-Барр,вирус герпеса человека 6, 7 и 8, псевдобешенство и ринотрахеит.IL-12 продуцируют моноциты, макрофаги и дендритные клетки в ответ на бактерии, бактериальные продукты (липополисахарид) и иммунные сигналы. Продукцию IL-12 регулируют другие цитокины и эндогенные медиаторы, продуцируемые в течение воспаления и иммунологических ответов. IL-12 играет центральную роль в иммунной системе. Доказательства, полученные на животных моделях и заболеваниях человека, наводят на мысль, что несоответствующая и затянувшаяся продукция IL-12 и способностьIL-12 индуцировать образование ответов Т-хелперов 1 клеточного типа может способствовать развитию и поддержанию хронических воспалительных заболеваний, таких как ревматоидный артрит, коллагениндуицированный артрит, аллергический энцефалит, колит, воспалительное заболевание кишечника,болезнь Крона и рассеянный склероз, и запуску аутоиммунных заболеваний, таких как диабет или болезней типа трансплантат против хозяина, шока или болезней скелетно-мышечной и соединительной тканей. Неблагоприятные эффекты также включают анемию (гемолитическая, апластическая, истинная эритроцитарная, идиопатическая тромбоцитопения), нейтропению, лимфопению, гепатоспленомегалию с инфильтрацией мононуклеарными клетками и отек легких с инфильтратами интерстициоцитами. Избы- 13007933 точная продукция IL-12 может ускорять прогресс воспаления при заболевании или начало заболевания,такого как ревматоидный артрит или также может увеличивать тяжесть заболевания. Подавление продукции TNF- и/или IL-12 соединениями формулы (I) может предложить интересную, потенциально менее токсичную альтернативу для неспецифической иммуносупрессии (например,кортикостероиды) при лечении хронических воспалительных и аутоиммунных заболеваний. Комбинированная модуляция продукции TNF- и IL-12 может улучшить подвергнутое лечению заболевание в большей степени, чем монотерапия. Терапевтический эффект комбинирования супрессии и иммунной и воспалительной ветви заболевания может предоставить дополнительные клинические преимущества. Настоящие соединения также предназначены для применения в качестве средств для совместной терапии для применения вместе с иммуносупрессивными и/или противовоспалительными лекарственными средствами, например, в качестве потенцирующих средств терапевтической активности указанных лекарственных средств, для уменьшения необходимого дозирования или, таким образом, также возможных побочных эффектов указанных лекарственных средств. Иммуносупрессивные и/или противовоспалительные лекарственные средства включают, например,циклопептидные, циклопептолидные или макролидные Иммуносупрессивные или противовоспалительные лекарственные средства, такие как лекарственные средства, принадлежащие классу циклоспоринов,например циклоспорин А или G, вещества такролимуса, аскомицин, рапамицин, глюкокортикостероидные лекарственные средства, например, будезонид, бекламетазон, флутиказон, мометазон. Соединения формулы (I) полезны для предотвращения или лечения заболеваний, опосредованных цитокинами и, как таковые, задерживают, подавляют или противодействуют продукции или активности провоспалительных цитокинов, таких как TNF- и/или IL-12. Расстройства, опосредованные TNF- и/или IL-12, относятся к любым и всем расстройствам и болезненным состояниям, при которых играют роль TNF- и/или IL-12, или посредством самого цитокина или посредством того, что цитокин индуцирует другой цитокин, например, такой как IL-1 или IL-6, или определенный медиатор для высвобождения. Вследствие их подавляющего действия на продукцию цитокинов, в частности их подавляющего действия на продукцию провоспалительных цитокинов, более конкретно их подавляющего действия наTNF- и/или IL-12, даже более конкретно их подавляющего действия на IL-12, соединения формулы (I),их N-оксиды, фармацевтически приемлемые аддитивные соли, четвертичные амины и стереохимически изомерные формы пригодны для лечения или предотвращения заболеваний или состояний, опосредованных цитокинами, в частности заболеваний или состояний, связанных с избыточной или нерегулируемой продукцией провоспалительных цитокинов, таких как TNF- и/или IL-12, включающих воспалительные заболевания или аутоиммунные заболевания. Заболевания или состояния, связанные с избыточной или нерегулируемой продукцией провоспалительных цитокинов включают ревматоидный артрит, ревматоидный спондилит, спондилоатропатии, системную красную волчанку, остеоартрит, подагрический артрит, ювенильный артрит и другие артритические состояния, полихондрию, склередему, гранулематоз Вегенера, дерматомиозит, синдром Стивена-Джонсона, идиопатическую спру, эндокринную офтальмопатию, базедову болезнь, альвеолит, хронический гиперчувствительный пневмонит, первичный биллиарный цирроз, увеит, сухой кератоконъюнктивит и весенний кератоконъюнктивит, аллергический ринит,пузырчатку, эозинофинофилию, синдром Лефлера, эозинофильную пневмонию, паразитическую инвазию, бронхолегочный аспергиллез, узелковый полиартериит, эозинофильную гранулему, расстройства,связанные с эозинофилами, воздействующие на воздухоносные пути, происходящие из-за реакций на лекарственное средство, сепсис, септический шок, эндотоксический шок, грамотрицательный сепсис,синдром токсического шока, церебральную малярию, респираторный дистресс-синдром взрослых, бронхит (острый, арахидный, катаральный, хронический, крупозный, фтиноидный бронхит), хронические болезни воздухоносных путей или легких, пневмосклероз, туберкулез, пневмокониоз (алюминоз, антракоз, асбестоз, халикоз, птилоз, сидероз, силикоз, табакоз, биссиноз), обострение гиперреактивности воздухоносных путей при терапии другими лекарственными средствами (например, аспирин, терапия-агонистами), силикоз, легочный саркоидоз, болезни резорбции кости, менингит, аллергический энцефалит, реперфузионную травму, реакцию трансплантат против хозяина, отторжения аллотрансплантата,отторжения трансплантата, заболевания скелетно-мышечной и соединительной тканей, лихорадку и миалгию вследствие инфекции, такую как грипп, кахексия (вследствие, например, бактериальной, вирусной или паразитической инфекции или потери или повреждения гуморальной или другой органической функции, или вторично из-за озлокачествления; малярийная и весенняя кахексия; кахексия, являющаяся результатом дисфункции гипофиза, щитовидной железы или тимуса, а также уремическая кахексия; вторичная кахексия при синдроме вторичного иммунодефицита (AIDS, AIDS, ARC (комплекс, связанный с- 14007933 и астма, индуцированная бактериальной инфекцией), синдром детских хрипов, рассеянный склероз, болезнь Паркинсона, панкреатит, болезнь сердца, застойную сердечную недостаточность, инфаркт миокарда, острую печеночную недостаточность, гломерулонефрит, синдромы, ассоциированные с лечением,включающие реакцию Яриша-Герксхаймера и синдромы, ассоциированные с инфузией IL-2, инфузией антител против CD3, гемодиализом, вакцинации против желтой лихорадки, HIV или другие вирусные инфекции, такие как гепатит С, CMV, грипп и инфекции вируса герпеса, псевдобешенство и ринотрахеит, ангиофолликулярную лимфоидную гиперплазию, анемию (гемолитическая, апластическая, истинная эритроцитарная, идиопатическая тромбоцитопения), нейтропению, лимфопению, гепатоспленомегалию с инфильтрацией мононуклеарными клетками и отек легких с инфильтратами интерстициоцитами; или для предотвращения данных заболеваний. В частности, соединения формулы (I) можно применять для лечения ревматоидного артрита, болезни Крона, болезни раздраженного кишечника, колита, псориаза или рассеянного склероза. Подавляющее действие на продукцию цитокинов соединений формулы (I), такое как подавление продукции TNF- и/или IL-12, можно продемонстрировать в тесте in vitro "Подавление продукции цитокинов в культурах цельной крови человека". Подходящие тесты in vivo представляют собой "Определение цитокина в сыворотке у мышей с провокацией иммунного ответа посредством LPS (липополисахарид) и антитела против CD3", "Подавление индуцированного LPS-галактозамином шока у мышей", "Подавление индуцированного коллагеном артрита у мышей". Соединения формулы (I) могут также подавлять интерлейкин-6 (IL-6). Настоящие соединения могут также действовать как промежуточные соединения для получения дальнейших тиазолильных производных. Ввиду описанных выше фармакологических свойств, соединения формулы (I) или любую их подгруппу, их N-оксиды, фармацевтически приемлемые аддитивные соли, четвертичные амины и стереохимически изомерные формы, можно применять как лекарственные средства. В частности, настоящие соединения можно применять для изготовления лекарственных средств для лечения или предотвращения заболеваний, опосредованных цитокинами, более конкретно, заболеваний, опосредованных TNF- и/илиIL-12, таких как воспалительные и аутоиммунные заболевания. Ввиду полезности соединений формулы (I), здесь представлены способ лечения теплокровных животных, включая людей, страдающих от заболеваний, опосредованных цитокинами, в частности опосредованных TNF- и/или IL-12, таких как воспалительные или аутоиммунные заболевания или способ предотвращения данных заболеваний у теплокровных животных, включая людей. Указанные способы включают введение, предпочтительно оральным способом, эффективного количества соединения формулы (I), его формы N-оксида, фармацевтически приемлемой аддитивной соли, четвертичного амина или возможной стереизомерной формы теплокровным животным, включая людей. Настоящее изобретение также относится к композициям для предотвращения или лечения заболеваний, опосредованных цитокинами, в частности TNF- и/или IL-12, включающим терапевтически эффективное количество соединение формулы (I) и фармацевтически приемлемый носитель или разбавитель. Соединения по настоящему изобретению, или любая их подгруппа, можно составлять в различные фармацевтические формы для целей введения. В качестве подходящих композиций можно привести все композиции, обычно применяющиеся для системно вводимых лекарственных средств. Для получения фармацевтических композиций по настоящему изобретению, эффективное количество конкретного соединения, необязательно в форме аддитивной соли, в качестве активного ингредиента объединяют в плотную примесь к фармацевтически допустимому носителю, который может принимать большое разнообразие форм в зависимости от формы препарата, желательной для введения. Данные фармацевтические композиции желательно находятся в единичных дозированных формах, особенно подходящих для введения оральным, ректальным, подкожным способами или посредством парентеральной инъекции. Например, в получении композиций в оральной дозированной форме можно применять любую из обычных, фармацевтических материалов, например, таких как вода, гликоли, масла, спирты и т.п., в случае оральных жидких препаратов, таких как суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, каолин, разбавители, смазочные вещества, связующие вещества, дезинтегрирующие средства и т.п., в случае порошков, пилюль, капсул и таблеток. По причине простоты их введения, таблетки и капсулы представляют собой наиболее преимущественные оральные формы дозированных единиц и в этом случае, очевидно, применяют твердые фармацевтические носители. Для парентеральных композиций, носители обычно включают стерильную воду, по меньшей мере, в большей части, хотя можно включать другие ингредиенты, например для улучшения растворимости. Можно получить инъецируемые растворы, например те, в которых носители включают солевой раствор,раствор глюкозы или смесь солевого раствора и раствора глюкозы. Также можно получить инъецируемые суспензии, в которых можно применять соответствующие жидкие носители, суспендирующие средства и т.п. Также включают препараты твердых форм, предназначенные для превращения в препараты жидких форм незадолго до применения. В композициях, подходящих для подкожного введения, носите- 15007933 ли необязательно включают средства для улучшения проникновения и/или подходящие смачивающие средства, необязательно объединенные с подходящими добавками любой природы в малых пропорциях,которые не оказывают значительных вредных эффектов на кожу. Указанные добавки могут облегчать введение в кожу и/или могут являться полезными для приготовления желательных композиций. Данные композиции можно ввести различными путями, например, такими, как трансдермальный пластырь, spoton, мазь. Соединения по настоящему изобретению также можно ввести посредством ингаляции или вдувания посредством способов и композиций, применяемых в данной области для введения данным путем. Таким образом, соединения по настоящему изобретению, как правило, можно ввести в легкие в форме раствора, суспензии или сухого порошка. Для введения настоящих соединений подходит любая система,разработанная для доставки растворов, суспензий или сухих порошков посредством оральной или назальной ингаляции или вдувания. Для облегчения растворимости соединения формулы (I) в композиции можно включать подходящие ингредиенты, например циклодекстрины. Подходящими циклодекстринами являются -, -,-циклодекстрины или их простые эфиры и смешанные простые эфиры, где один или несколько из гидроксильных групп дегидроглюкозных единиц циклодекстрина заменены C1-6 алкилом, в частности, метилом, этилом или изопропилом, например, случайным образом метилированные -CD; гидрокси-С 1-6 алкил, в частности, гидроксиэтил, гидроксипропил или гидроксибутил; карбокси-С 1-6 алкил, в частности,карбоксиметил или карбоксиэтил; C1-6 алкилкарбонил, в частности, ацетил. Особенно заслуживающими внимания как комплексообразователи и/или солюбилизаторы являются -CD, случайным образом метилированные -CD, 2,6-диметилCD, 2-гидроксиэтилСО, 2-гидроксиэтилCD, 2-гидроксипропил-CD и (2-карбоксиметокси)пропилCD и, в частности, 2-гидроксипропилCD (2-HPCD). Термин "смешанный эфир" означает производные циклодекстрина, где по меньшей мере две гидроксильные группы циклодекстрина этерифицированны различными группами, например, такими как гидроксипропил и гидроксиэтил. В качестве меры среднего числа молей алкокси-единиц на моль дегидроглюкозы применяют среднюю молярную замену (M.S.). Средняя степень замены (D.S.) относится к среднему числу замещенных гидроксилов на дегидроглюкозную единицу. Значения M.S. и D.S. можно определить различными аналитическими способами, такими как ядерный магнитный резонанс (NMR), масс-спектрометрия (MS) и инфракрасная спектроскопия (IR). В зависимости от применяющегося способа можно получить немного отличающиеся значения для одного данного производного циклодекстрина. Предпочтительно, при измерении посредством масс-спектрометрии, M.S. находится в интервале от 0,125 до 10, a D.S. находится в интервале от 0,125 до 3. Другие подходящие композиции для орального или ректального введения включают частицы, состоящие из твердой дисперсии, включающей соединение формулы (I) и один или несколько подходящих фармацевтически приемлемых водорастворимых полимеров. В случае соединения формулы (I) и водорастворимого полимера, где один компонент более или менее равномерно диспергирован во всем другом компоненте или компонентах (если включают дополнительные фармацевтически приемлемые формулирующие средства, как правило, известные в данной области, например, такие как пластификаторы, консерванты и т.п.), применяющийся здесь ниже термин"твердая дисперсия" определяет систему в твердом состоянии (в отличие от жидкого или газообразного состояния), содержащую по меньшей мере два компонента. Когда указанная дисперсная система компонентов такова, что система химически и физически однородны или гомогенна по всему объему или состоит из одной фазы, как определено в термодинамике, такие твердые дисперсии называют "твердые растворы". Твердые растворы представляют собой предпочтительные физические системы, так как их компоненты обычно являются легко биодоступными в организме, в который их ввели. Данное преимущество вероятно можно объяснить простотой, с которой указанные твердые растворы могут формировать жидкие растворы, когда контактируют с жидкой средой, такой как желудочно-кишечные соки. Простоту растворения можно приписать, по меньшей мере, отчасти, тому факту, что необходимая для растворения компонентов из твердого раствора энергия меньше, чем необходимо для растворения компонентов из кристаллической или микрокристаллической твердой фазы. Термин "твердая дисперсия" также включает дисперсии, которые менее гомогенны по всему объему, чем твердые растворы. Такие дисперсии не являются химически или физически однородными или содержат более чем одну фазу. Например, термин "твердая дисперсия" также относится к системам, обладающим доменами или малыми областями, где аморфное, микрокристаллическое или кристаллическое соединение формулы (I) или аморфный, микрокристаллический или кристаллический водорастворимый полимер или оба более или менее равномерно растворены в другой фазе, включающей водорастворимый полимер, или соединение формулы (I), или твердый раствор, включающий соединение формулы (I) и водорастворимый полимер. Указанные домены и области в твердом растворе отчетливо заметны по некоторым физическим свойствам, малы в размере и равномерно и случайным образом распределены по всему объему твердой дисперсии.- 16007933 Для получения твердых дисперсий существуют различные способы, включающие плавлениеэкструзию, распыление-сушку и растворение-испарение. Процесс растворения-испарения включает следующие стадии:a) растворение соединения формулы (I) и водорастворимого полимера в подходящем растворителе,необязательно при повышенных температурах;b) нагревание раствора, полученного на стадии а), необязательно в вакууме, пока на испарится растворитель. Раствор также можно вылить на большую поверхность так, чтобы сформировать тонкую пленку и оттуда испарять растворитель. При способе распыления-сушки два компонента также растворяют в подходящем растворителе и полученный раствор затем распыляют через форсунки распылительной сушилки с последующим испарением растворителя из полученных капель при повышенных температурах. Предпочтительный способ для получения твердых растворов представляет собой процесс плавления-экструзии, содержащий следующие стадии:a) смешивание соединения формулы (I) и подходящего водорастворимого полимера,b) необязательное смешивание добавок с полученной таким образом смесью,c) нагревание и смешивание полученной таким образом смеси до получения гомогенного расплава,d) вытеснение полученного таким образом расплава через одну или несколько форсунок и е) охлаждение расплава до его затвердевания. Термины "расплав" и "расплавление" можно интерпретировать широко. Данные термины означают не только изменение из твердого в жидкое состояние, но также относятся к переходу в стекловидное или каучукообразное состояния и к состояниям, в которых для одного компонента смеси возможно более или менее однородно внедриться в другой. В частных случаях один компонент расплавится, а другой(ие) компонент(ы) растворит(ят)ся в расплаве, формируя, таким образом, раствор, который при охлаждении может формировать твердый раствор, обладающий выигрышными свойствами растворимости. После получения твердых дисперсий, как описано здесь выше, полученные продукты можно необязательно измельчить и просеять. Продукт твердой дисперсии можно измельчить или перемолоть до частиц, обладающих размером менее чем 600 мкм, предпочтительно менее чем 400 мкм и наиболее предпочтительно менее чем 125 мкм. Частицы, полученные, как описано здесь выше, можно затем формировать посредством стандартных способов в фармацевтические дозированные формы, такие как таблетки и капсулы. Понятно, что специалисты в данной области способны оптимизировать параметры способов получения твердой дисперсии, описанные выше, такие как более подходящие растворители, рабочую температуру, вид применяемых устройств, скорость распыления-сушки, скорость прохождения при расплавлении-экструзии. Водорастворимые полимеры в частицах представляют собой полимеры, обладающие видимой вязкостью при растворении при 20 С в водном растворе до 2% (мас./об.) от 1 до 5000 мПас, более предпочтительно от 1 до 700 мПас и наиболее предпочтительно от 1 до 100 мПас. Например, подходящие водорастворимые полимеры включают алкилцеллюлозы, гидроксиалкилцеллюлозы, гидроксиалкилалкилцеллюлозы, карбоксиалкилцеллюлозы, соли щелочных металлов карбоксиалкилцеллюлоз, карбоксиалкилалкилцеллюлозы, сложные эфиры карбоксиалкилцеллюлоз, крахмалы, пектины, хитиновые производные,ди-, олиго- и полисахариды, такие как трегалоза, альгиновая кислота или ее соли с щелочными металлами или ее аммонийные соли, каррагенаны, галактоманнаны, трагакант, агар-агар, гуммиарабик, смолы гуара и смолы ксантана, полиакриловые кислоты и их соли, сополимеры метакрилата, поливиниловый спирт, поливинилпирролидон, сополимеры поливинилпирролидона и винилацетата, комбинации поливинилового спирта и поливинилпирролидона, полиалкиленоксиды и сополимеры этиленоксид и пропиленоксида. Предпочтительные водорастворимые полимеры представляют собой гидроксипропилметилцеллюлозы. Для получения указанных выше частиц в качестве водорастворимого полимера можно также использовать циклодекстрины как описано в WO 97/18 839. Указанные циклодекстрины включают фармацевтически приемлемые незамещенные или замещенные циклодекстрины, известные в данной области,более конкретно -, - или -циклодекстрины или их фармацевтически приемлемые производные. Замещенные циклодекстрины, которые можно использовать для получения описанных выше частиц, включают простые полиэфиры, описанные в патенте США 3459731. Дополнительные замещенные циклодекстрины представляют собой простые эфиры, где водород или одна или несколько гидроксильных групп заменены C1-6 алкилом, гидрокси-С 1-6 алкилом, карбокси-С 1-6 алкилом или C1-6 алкилкарбонилC1-6 алкилом, или их смешанные простые эфиры. В частности, такие замещенные циклодекстрины представляют собой простые эфиры, где водород или одна или несколько гидроксильных групп заменены C1-3 алкилом, гидрокси-С 2-4 алкилом, карбокси-С 1-2 алкилом или более конкретно метилом, этилом, гидроксиэтилом, гидроксипропилом, гидроксибутилом, карбоксиметилом или карбоксиэтилом.- 17007933 Особенно полезными являются простые эфиры -циклодекстринов, например диметил-циклодекстрин, как описано в Drugs of the Future, Vol. 9, No. 8, p. 577-578 by M. Nogradi (1984) и простые полиэфиры, например гидроксипропиловый -циклодекстрин и гидроксиэтиловый -циклодекстрин. Такой простой алкиловый эфир может представлять собой простой метиловый эфир при степени замещения примерно от 0,125 до 3, например, примерно от 0,3 до 2. Такой гидроксипропиловый циклодекстрин, например, можно получить по реакции между -циклодекстрином и пропиленоксидом и может обладать значением M.S. примерно от 0,125 до 10, например, примерно от 0,3 до 3. Другой тип замещенных циклодекстринов представляет собой сульфобутилциклодекстрины. Соотношение соединения формулы (I) и водорастворимого полимера может широко варьироваться. Например, можно применять отношения от 1/100 до 100/1. Предпочтительные соотношения соединения формулы (I) к циклодекстрину находятся в интервале примерно от 1/10 до 10/1. Более предпочтительные соотношения находятся в интервале примерно от 1/5 до 5/1. Кроме того, может быть удобным представлять соединения формулы (I) в виде наночастиц, которые обладают модификатором поверхности, абсорбированным на их поверхности в количестве, достаточном для поддержания эффективного среднего размера частиц менее чем 1000 нм. Полагают, что пригодные модификаторы поверхности включают такие модификаторы, которые физически сцепляются с поверхностью соединения формулы (I), но химически не связываются с указанным соединением. Подходящие модификаторы поверхности предпочтительно можно выбрать из известных органических и неорганических фармацевтических эксципиентов. Такие эксципиенты включают различные полимеры, олигомеры низкой молекулярной массы, природные продукты и поверхностно-активные вещества. Предпочтительные модификаторы поверхности включают неионные и анионные поверхностноактивные вещества. Еще один интересный путь представления соединений формулы (I) включает фармацевтическую композицию, где соединения формулы (I) включены в гидрофильные полимеры, и данную смесь наносят в качестве покрывающей пленки на многочисленные малые гранулы, таким образом, получая композицию, которую удобно изготавливать, и которая пригодна для получения фармацевтических дозированных форм для орального введения. Указанные гранулы включают центральное округленное или сферическое ядро, покрывающую пленку из гидрофильного полимера и соединения формулы (I) и необязательно покрывающий герметизирующий слой. Вещества, подходящие для применения в качестве ядра гранул, представляют собой большое разнообразие, при условии, что указанные вещества являются фармацевтически приемлемыми и обладают подходящими размерами и прочностью. Примеры таких веществ представляют собой полимеры, неорганические вещества, органические вещества и сахариды и их производные. Особенно удобно представлять указанные выше фармацевтические композиции в виде дозированных единиц для простоты введения и единообразия дозирования. Форма дозированной единицы как используется здесь относится к физическим дискретным единицам, подходящим в качестве единичных дозировок, где каждая единица содержит заранее определенное количество активного ингредиента, рассчитанное, чтобы произвести желательный терапевтический эффект, в объединении с необходимым фармацевтическим носителем. Примеры таких форм дозированных единиц представляют собой таблетки(включающие шероховатые или покрытые таблетки), капсулы, пилюли, пакетики с порошками, пластинки, суппозитории, инъецируемые растворы или суспензии и т.п. и раздельные их множества. Настоящие соединения представляют собой орально активные соединения и их предпочтительно вводят орально. Точная дозировка и частота введения зависят от конкретного применяемого соединения формулы(I), конкретного состояния, подлежащего лечению, тяжести состояния, подлежащего лечению, возраста,массы, пола, степени расстройства и общего физического состояния конкретного пациента, а также другого лекарственного средства, которое может принимать индивид, как хорошо известно специалистам в данной области. Кроме того, ясно, что указанное эффективное суточное количество можно уменьшить или увеличить в зависимости от ответа подвергнутого лечению субъекта и/или в зависимости от оценки врача, выписывающего соединения по настоящему изобретению. Соединения формулы (I) можно также применять в комбинации с другими традиционными противовоспалительными и иммуносупрессивными средствами, такими как стероиды, ингибиторами циклооксигеназы-2, нестероидными противовоспалительными лекарственными средствами, антителами к TNF-,например, такими как ацетилсалициловая кислота, буфексамак, диклофенак калия, сулиндак, диклофенак натрия, кеторолак трометамол, толметин, ибупрофен, напроксен, напроксен натрия, тиапрофеновая кислота, флурбипрофен, мефенамовая кислота, нифлуминовая кислота, меклофенамат, индометацин, проглуметацин, кетопрофен, набуметон, парацетамол, пироксикам, теноксикам, нимезулид, теноксикам, фенилбутазон, трамадол, беклометазон, дипропионат, бетаметазон, бекламетазон, будезонид, флутиказон,мометазон, дексаметазон, гидрокортизон, метилпреднизолон, преднизолон, преднизон, триамцинолон,- 18007933 целекоксиб, рофекоксиб, инфликсимаб, лефлуномид, этанерцепт, СРН 82, метотрексат, сульфасалазин,противолимфоцитарные иммуноглобулины, противотимоцитарные иммуноглобулины, азатиоприн, циклоспорин, вещества такролимуса, аскомицин, рапамицин, муромонаб-CD3. Таким образом, настоящее изобретение также относится к комбинации соединения формулы (I) с другим противовоспалительным или иммуносупрессивным средством. Указанную комбинацию можно применять в качестве лекарственного средства. Таким образом, настоящее изобретение также относится к продукту, содержащему (а) соединение формулы (I) и (b) другому противовоспалительному или иммуносупрессивному соединению, как комбинированному препарату для одновременного, раздельного или последовательного применения для лечения заболеваний, связанных с избыточной или нерегулируемой продукцией цитокинов. Другие лекарственные средства можно комбинировать в единственный препарат вместе с фармацевтически приемлемыми носителями. Экспериментальная часть. А. Получение промежуточных соединений Пример А 1 А. а) Получение промежуточного продукта 1 а К раствору 2-хлор-5-фторпиридина (0,01 моль) в тетрагидрофуране (100 мл) в автоклаве добавляли ацетат палладия (II) (0,0003 моль) и 1,3-бис(дифенилфосфино)пропан (0,0006 моль). Добавляли жидкий аммиак (0,6 моль) и монооксид углерода при принятом давлении 40 атм. Смесь нагревали при 150 С 16 ч. После охлаждения до комнатной температуры добавляли метанол (200 мл) и смесь перемешивали 1 ч. Смесь фильтровали и осадок промывали метанолом. Объединенные фильтраты выпаривали досуха при пониженном давлении, осадок растирали в диизопропиловом эфире и сушили при пониженном давлении. Выход: 0,56 г промежуточного продукта 1 а (40%).b) Получение промежуточного продукта 1b Смесь 5-хлор-2-пиридинкарбоксамида (0,004 моль), фосфористого пентасульфида (0,004 моль) и тетрагидрофурана (25 мл) 2 ч кипятили с обратным холодильником. Смесь охлаждали до комнатной температуры, фильтровали и осадок промывали тетрагидрофураном. Осадок суспендировали в воде (20 мл) и смесь кипятили 15 мин. После охлаждения экстрагировали смесью дихлорметан:метанол 9:1. Фазы разделяли, органический слой сушили (MgSO4) и при пониженном давлении удаляли растворитель. Выход: 0,57 г промежуточного продукта 1b (82%). Пример А 1 В. а) Получение промежуточного продукта 1 Смесь 3-хлор-2,4-пентандиона (0,098 моль) и 4-трифторметилфенилкарботиоамида (0,098 моль) в этаноле (160 мл) перемешивали и 16 ч кипятили с обратным холодильником. Смесь фильтровали, осадок промывали этанолом и сушили при пониженном давлении. Выход: 17 г промежуточного продукта 1b) Получение промежуточного продукта 2 Суспензию промежуточного продукта 1 (0,035 моль) в 1,1-диметокси-N,N-диметилметанамине (150 мл) нагревали 6 ч при 80 С. Растворитель удаляли при пониженном давлении и осадок растирали в диизопропиловом эфире. Смесь фильтровали, осадок промывали диизопропиловым эфиром и затем сушили при пониженном давлении. Выход: 11,0 г промежуточного продукта 2 (92%) (т. плавл. 147 С). Пример А 1 С. Получение промежуточного продукта 2 а К суспензии гидрида натрия (0,07 моль) в тетрагидрофуране (70 мл) добавляли диметилкарбонат(0,07 моль) и смесь нагревали при 60 С. По каплям добавляли раствор промежуточного продукта 1 (0,035- 19007933 моль) в тетрагидрофуране (50 мл). Реакционную смесь 45 мин кипятили с обратным холодильником, охлаждали до комнатной температуры и добавляли метанол для разрушения любого оставшегося гидрида натрия. Смесь нейтрализовали уксусной кислотой и при пониженном давлении удаляли растворитель. Осадок распределяли между этилацетатом и водой, фазы разделяли и водный слой дважды экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным раствором соли, сушили(MgSO4) и удаляли растворитель при пониженном давлении. Получившееся масло растирали в смеси диэтиловый эфир/гексан, смесь фильтровали и осадок промывали гексаном. Выход: 10,4 г промежуточного продукта 2 а (87%). Пример А 2. а) Получение промежуточного продукта 3Pd(PPh3)4 (0,002 моль) растворяли в тетрагидрофуране (120 мл). Добавляли 2,4-дихлор-5 тиазолкарбоксальдегид (0,02 моль). Реакционную смесь перемешивали 30 мин при комнатной температуре. Добавляли [4-(трифторметил)фенил]бороновую кислоту (0,021 моль) и Na2CO3/Н 2 О (11 г/80 мл). Реакционную смесь перемешивали и 3 ч кипятили с обратным холодильником. Реакционную смесь охлаждали, добавляли воду. Смесь экстрагировали CH2Cl2. Органический слой отделяли, сушили (MgSO4) и выпаривали растворитель. Осадок растирали в этаноле, промывали этанолом и сушили при пониженном давлении. Выход: 3,2 г промежуточного продукта 3 (55%).b) Получение промежуточного продукта 4-10 С. По каплям добавляли 3 М раствор метилмагнийхлорида в тетрагидрофуране (3,7 мл, 0,011 моль). Реакционную смесь 3 ч перемешивали при комнатной температуре. Добавляли воду (3 мл), с последующим добавлением СН 3 СООН (1 мл) (экзотермический процесс). Реакционную смесь экстрагировали этилацетатом, органический слой отделяли, сушили, фильтровали и растворитель выпаривали. Выход: 3,4 г промежуточного продукта 4 (100%). с) Получение промежуточного продукта 5 Промежуточный продукт 4 (0,01 моль) растворяли в 1,2-дихлорэтане (40 мл). К реакционной смеси добавляли хлорхромат пиридиния (0,02 моль). Реакционную смесь перемешивали 3 ч при 70 С, охлаждали до комнатной температуры, выливали на силикагелевую пробку и элюировали дихлорметаном. Элюент выпаривали при пониженном давлении и осадок сушили при пониженном давлении. Выход: 2,2 г промежуточного продукта 5 (72%) (т. плавл. 178 С).d) Получение промежуточного продукта 6 Промежуточный продукт 5 (0,004 моль) растворяли в 1,1-диметокси-N,N-диметилметанамине (50 мл) и перемешивали 16 ч при 80 С. Реакционную смесь охлаждали, добавляли воду и смесь фильтровали. Осадок промывали водой и сушили при пониженном давлении. Выход: 1,1 г промежуточного продукта 8 (76%) (т. плавл. 198 С). Пример А 3 А. а) Получение промежуточного продукта 7- 20007933 2-Амино-4-хлор-5-тиазолкарбоксальдегид (0,012 моль) растворяли в СН 3 СООН (80 мл) и нагревали. В горячий раствор по каплям добавляли тетрагидро-2,5-диметоксифуран (0,015 моль). Реакционную смесь 2 ч кипятили с обратным холодильником. Выпаривали растворитель. Осадок сушили при пониженном давлении. Выход: 2,0 г промежуточного продукта 7 (78%). Промежуточный продукт 7 трансформировали в промежуточный продукт 7' способом, аналогичным трансформации промежуточного продукта 3 в промежуточный продукт 6,как описано в примере А 2. Выход: 57% промежуточного продукта 7' (т. плавл. 201 С).b) Получение промежуточного продукта 7 а 2-Амино-4-метил-5-ацетилтиазол (0,030 моль) растворяли в СН 3 СООН (160 мл) и нагревали. В горячий раствор по каплям добавляли тетрагидро-2,5-диметоксифуран (0,035 моль). Реакционную смесь 2 ч перемешивали при кипячении с обратным холодильником. Выпаривали растворитель. Осадок сушили при пониженном давлении. Выход: 5,3 г промежуточного продукта 7 а(86%). Пример A3 В. а) Получение промежуточного продукта 7b 2,4-Дихлор-5-тиазолкарбокальдегид (0,027 моль), этан-1,2-диол и 4-толуолсульфоновую кислоту растворяли в толуоле (60 мл) и 16 ч нагревали в ловушке Дина-Старка. Растворитель удаляли при пониженном давлении и осадок хроматографировали на силикагеле, используя в качестве элюента дихлорметан. Выход: 2,0 г промежуточного продукта 7b (33%).b) Получение промежуточного продукта 7 с К перемешиваемой суспензии пиразола (0,009 моль) в N,N-диметилформамиде (20 мл) порциями добавляли гидрид натрия (0,009 моль). Перемешивание продолжали 1 ч и затем добавляли промежуточный продукт 7b (0,009 моль). Смесь перемешивали 72 ч и осторожно добавляли ледяную воду. Смесь фильтровали, осадок промывали водой и затем сушили при пониженном давлении. Выход: 1,7 г промежуточного продукта 7 с (74%). с) Получение промежуточного продукта 7d К раствору уксусной кислоты (5 мл) в воде (30 мл) добавляли промежуточный продукт 7 с (0,0058 моль) и достаточное количество метанола, чтобы вызвать растворение. Раствор 1 ч кипятили с обратным холодильником, охлаждали и затем фильтровали. Осадок промывали водой и сушили при пониженном давлении. Выход: 1,2 г промежуточного продукта 7d (97%).d) Получение промежуточного продукта 7 е Промежуточный продукт 7d (0,0052 моль) трансформировали в промежуточный продукт 7 е (0,0028 моль) способом, аналогичным трансформации промежуточного продукта 3 в промежуточный продукт 6,как описано в примере А 2. Выход: 0,8 г промежуточного продукта 7 е (54%) (т. плавл. 232 С). Пример А 4. а) Получение промежуточного продукта 8 Смешивали 4-фторфенилкарботиоамид (0,05 моль) и хлорацетилхлорид (0,2 моль) и перемешивали 10 мин при комнатной температуре. Температуру реакционной смеси медленно увеличивали до 60 С. Спустя 30 мин реакционную смесь охлаждали до комнатной температуры и летучие компоненты удаляли при пониженном давлении. Осадок растворяли в диэтиловом эфире, добавляли гексан и смесь фильтровали. Осадок промывали смесью диэтиловый эфир/гексан (1/4) и затем сушили при пониженном давлении. Выход: 8,9 г промежуточного продукта 8 (77%).b) Получение промежуточного продукта 9 Фосфористый оксихлорид (0,44 моль) по каплям добавляли к N,N-диметилформамиду (0,22 моль) при температуре между 0 и 5 С при быстром перемешивании. Реакционную смесь перемешивали 30 мин при 0 С и затем, давая смеси нагреться до комнатной температуры, добавляли промежуточный продукт 8(0,044 моль). Реакционную смесь 1 ч нагревали при 60 С и затем 90 мин кипятили с обратным холодильником. Осторожно добавляли воду, смесь фильтровали. Осадок растирали в диэтиловом эфире и сушили при пониженном давлении. Выход: 6,8 г промежуточного продукта 9 (64%). Пример А 5. а) Получение промежуточного продукта 11 4-Трифторметилфенилкарботиоамид (0,10 моль) растворяли в этаноле (150 мл) и добавляли этил-3 хлорацетопируват (0,11 моль), растворенный в этаноле (50 мл). Реакционную смесь 90 мин перемешивали при кипячении с обратным холодильником. Растворитель выпаривали при пониженном давлении и осадок распределяли между CH2Cl2 и насыщенным водным бикарбонатом натрия. Фазы разделяли и водную фазу дважды экстрагировали CH2Cl2. Объединенные органические слои промывали водой и затем насыщенным раствором соли, сушили (MgSO4) и концентрировали досуха. Неочищенный маслянистый осадок растирали в гексане, хроматографировали на силикагеле, используя в качестве элюента этилацетат:гексан (1:4) для получения промежуточного продукта 11. Выход: 8,2 г промежуточного продукта 11b) Получение промежуточного продукта 12 Раствор аммиака в метаноле (7 М, 80 мл) по каплям добавляли к охлажденной перемешиваемой суспензии промежуточного продукта 11 (0,01 моль) в метаноле (30 мл) при 0 С. Реакционную смесь перемешивали дополнительные 30 мин при 0 С и затем 16 мин перемешивали при комнатной температуре. Раствор удаляли при пониженном давлении, добавляли метанол и объем растворителя уменьшали при- 22007933 пониженном давлении. Раствор охлаждали до 0 С, фильтровали и осадок промывали холодным метанолом и затем гексаном. Неочищенный продукт перекристаллизовывали из смеси этанол:вода (3:1). Выход: 1,7 (54%) г промежуточного продукта 12 (т. плавл. 196-200 С). с) Получение промежуточного продукта 13(0,010 моль) и смесь нагревали 40 мин при 110 С. После охлаждения до комнатной температуры смесь фильтровали, осадок растирали в гексане и разделяли. Выход: 0,84 г промежуточного продукта 13 (95%). Пример А 6. Получение промежуточного продукта 14(3100 мл), затем водным карбонатом натрия (2100 мл). Реакционную смесь затем повторно промывали водой до тех пор пока водная промывная среда не достигала рН 7. Нерастворенные твердые вещества отфильтровывали. Фильтрат сушили (MgSO4) и выпаривали досуха при пониженном давлении для получения осадка, который объединяли с нерастворимыми твердыми веществами. Выход: 14 г промежуточного продукта 14 (100%) (т. плавл. 223 С). Промежуточный продукт 14 а получали из соединения 91, используя указанный выше способ для промежуточного продукта 14. Выход: 74% промежуточного продукта 14 а. Пример А 7. Получение промежуточного продукта 15(полученный из промежуточного продукта 7 аналогично примеру А 2 b) и с) (0,0044 моль) растворяли в метаноле (50 мл) и нагревали до полного растворения. Добавляли 30 мас.% раствор метоксида натрия в метаноле (0,02 моль). Реакционную смесь перемешивали, 4 ч кипятили с обратным холодильником и перемешивали в течение ночи при комнатной температуре. Растворитель удаляли при пониженном давлении. Осадок дважды промывали водой и сушили при пониженном давлении. Выход: 0,7 г промежуточного продукта 15 (71%). Пример А 8. а) Получение промежуточного продукта 16(0,039 моль) и N,N-диметилформамида (1 капля) в дихлорметане (200 мл) по каплям добавляли оксалилхлорид (0,039 моль) при 0 С. Смеси давали нагреться до комнатной температуры при перемешивании около 16 ч. Растворитель удаляли при пониженном давлении и добавляли дихлорметан (100 мл). Добавляли раствор аммиака в метаноле (7 М, 30 мл) и смесь перемешивали 8 ч. Смесь фильтровали, осадок промывали дихлорметаном и затем сушили при пониженном давлении. Выход: 10 г промежуточного продукта 16 (90%) (т. плавл. 213-216 С).b) Получение промежуточного продукта 17 К перемешиваемой суспензии промежуточного продукта 16 (0,0016 моль) и пиридина (0,010 моль) в 1,4-диоксане при 0 С по каплям добавляли трифторуксусный ангидрид (0,0063 моль). Перемешивание продолжали 30 мин, реакционной смеси давали нагреться до комнатной температуры и смесь перемешивали дополнительные 16 ч. Растворитель удаляли при пониженном давлении, осадок растирали в воде и сушили при пониженном давлении. Выход: 0,39 г промежуточного продукта 17 (91%) (т. плавл. 90 С). Пример А 9. Получение промежуточного продукта 18 К перемешиваемой суспензии трет-бутоксида калия (0,040 моль) в тетрагидрофуране (100 мл) при комнатной температуре по каплям добавляли раствор промежуточного продукта 1 (0,020 моль) в тетрагидрофуране (25 мл). Образовавшийся насыщенный красный раствор перемешивали дополнительно 30 мин. По каплям добавляли дисульфид углерода (1,5 мл) и спустя 30 мин добавляли метилиодид (4 мл). Реакционную смесь перемешивали 2 ч, затем выливали в воду (1 л) и фильтровали. Осадок промывали водой и сушили при пониженном давлении. Выход: 4,6 г промежуточного продукта 18 (59%), т. плавл. 164-166 С (разлож). Пример А 10. Получение промежуточного продукта 19 К перемешиваемой суспензии соединения 99 (0,0015 моль) в хлороформе (10 мл) при комнатной температуре порциями добавляли 3-хлорпероксибензойную кислоту (0,0045 моль). Перемешивание продолжали 16 ч. Добавляли хлороформ (50 мл) и затем насыщенный водный пиросульфит натрия (10 мл) и 15 мин продолжали быстрое перемешивание. По каплям добавляли насыщенный водный карбонат натрия до тех пор пока не прекращалось выделение газа. Смесь промывали водой и фазы разделяли. Органический слой сушили (Na2SO4) и растворитель удаляли при пониженном давлении. Выход: 0,60 г промежуточного продукта 19 (97%) (т. плавл. 155-158 С). В. Получение окончательных соединений Пример В 1. Получение соединения 9(0,045 моль) и смесь перемешивали до образования гомогенного раствора. Добавляли промежуточный продукт 2 (0,023 моль) и реакционную смесь 3 ч кипятили с обратным холодильником. После охлажде- 24007933 ния добавляли воду и смесь фильтровали. Осадок промывали водой и сушили при пониженном давлении. Выход: 5,9 г соединения 9 (76%). Альтернативные растворители представляют собой этанол, N,N-диметилформамид или диметилсульфоксид. Пример В 2. Смесь из(0,016 моль) (полученного по методике, описанной в примере А 1 В) и гидразинмоногидрата (0,018 моль) в уксусной кислоте (20 мл) перемешивали при кипячении с обратным холодильником в течение ночи. К горячей реакционной смеси добавляли кипящую воду (100 мл) и полученному раствору давали охладиться. Смесь фильтровали и осадок перекристаллизовывали из этанола. Выход: 2,2 г соединения 28(0,016 моль) (полученного по методике, описанной в примере А 1 В) добавляли к смеси метилгуанидингидрохлорида (0,024 моль) и метоксид натрия (0,026 моль) в N,Nдиметилформамиде (30 мл). Смесь 26 ч нагревали при 100 С. Смесь разбавляли водой (80 мл) и подкисляли уксусной кислотой (2 мл). Смесь фильтровали. Осадок сушили и перекристаллизовывали из смеси изооктан:толуол 3:1. Выход: 4,4 г соединения 17 (87%).(0,0073 моль) (полученного по методике, описанной в примере А 1 В) добавляли к смеси формамидинацетата (0,022 моль) и этоксида натрия (0,024 моль) в этаноле (20 мл) и смесь 24 ч кипятили с обратным холодильником. Добавляли смесь формамидинацетата (0,012 моль) и этоксида натрия (0,013 моль) в этаноле (10 мл) и смесь кипятили с обратным холодильником дополнительно 24 ч. Смесь разбавляли водой (30 мл) и подкисляли уксусной кислотой (3 мл). Растворитель удаляли при пониженном давлении. Осадок сушили при пониженном давлении и перекристаллизовывали из бутан-1-ола. Выход: 1,2 г соединения 22 (57%). с) Получение соединения 59 К смеси гемисульфата 3-гидроксипропилгуанидина (0,0014 ммоль) в 2-метоксиэтаноле добавляли метоксид натрия (0,0014 моль). Перемешивание продолжали 30 мин и затем добавляли промежуточный продукт 7' (0,0007 моль). Смесь перемешивали 16 ч при 100 С, охлаждали и растворитель выпаривали при пониженном давлении. Осадок хроматографировали на силикагеле, используя в качестве элюента дихлорметан. Осадок растирали в диизопропиловом эфире, фильтровали, промывали диизопропиловым эфиром и сушили при пониженном давлении. Выход: 0,013 г соединения 59 (6%). Пример В 4. Получение соединения 35 В 2-этоксиэтаноле (6 мл) суспендировали метоксид натрия (0,0041 моль) и добавляли ацетамидингидрохлорид (0,0041 моль). Смесь перемешивали 30 мин при комнатной температуре. Добавляли проме- 25007933 жуточный продукт 2 (полученный согласно примеру A1Bb) (0,0018 моль) и смесь 8 ч кипятили с обратным холодильником при перемешивании. Добавляли глинистую суспензию метоксида натрия (0,020 моль) и ацетамидингидрохлорида (0,0020 моль) в 2-этоксиэтаноле (2 мл). После перемешивания 1 ч при кипячении с обратным холодильником реакционную смесь охлаждали и выливали в ледяную воду (70 мл). Смесь фильтровали и осадок промывали водой. Выход: 0,59 г соединения 35 (98%). Пример В 5. Получение соединения 36 К раствору метоксида натрия (0,0054 моль) в этаноле (10 мл) добавляли гуанидингидрохлорид(0,0054 моль) и смесь перемешивали 30 мин. Добавляли раствор промежуточного продукта 13 (полученного согласно примеру А 5 с) (0,0018 моль) в этаноле (10 мл) и реакционную смесь 1 ч кипятили с обратным холодильником. После охлаждения добавляли воду, смесь фильтровали и осадок промывали смесью этанол-вода. Осадок сушили и перекристаллизовывали из 2-этоксиэтанола. Выход: 0,23 г соединения 36(35%) (т. плавл. 286-287 С). Пример В 6. К раствору гидроксида калия (0,009 моль) в этаноле (25 мл) добавляли промежуточный продукт 2(0,009 моль) и тиомочевину (0,010 моль) и образовавшуюся смесь 5 ч кипятили с обратным холодильником. Смесь охлаждали на ледяной бане, фильтровали и осадок промывали диэтиловым эфиром. Осадок сушили при пониженном давлении и затем растворяли в растворе гидроксида натрия (0,027 моль) в воде(40 мл). По каплям добавляли диметилсульфат (0,018 моль) при комнатной температуре. Спустя 2 ч добавляли воду (10 мл) и реакционную смесь экстрагировали диэтиловым эфиром (240 мл). Органические слои объединяли, промывали водой (10 мл) и затем насыщенным раствором соли (10 мл), затем сушили(MgSO4). Растворитель удаляли при пониженном давлении. Выход: 2,28 г соединения 37 (69%). Соединение 91 получали из промежуточного продукта 6, применяя указанный выше способ для соединения 37. Выход: 52% соединения 91. Пример В 7. а) Получение соединения 38 Промежуточный продукт 14 (полученный согласно А 6) (0,001 моль) суспендировали в пропан-1,3 диамине (2 мл) и смесь нагревали 15 мин при 130 С. После охлаждения добавляли воду при перемешивании и смесь оставляли на 16 ч. Смесь фильтровали и осадок промывали водой. Осадок сушили при пониженном давлении. Выход: 0,35 г соединения 38 (89%). В аналогичной реакции, если используемый амин не является жидким при 20 С, можно необязательно добавить подходящей N,N-диметилформамид.- 26007933 Промежуточный продукт 14 (полученный согласно А 6) (0,0005 моль), 3-аминопропионовую кислоту (0,001 моль) и карбонат натрия (0,001 моль) суспендировали в диметилсульфоксиде и смесь нагревали 3 ч при 120 С. Смесь охлаждали до комнатной температуры и добавляли воду (6 мл) при перемешивании. Перемешивание продолжали пока не завершалась кристаллизация, смесь фильтровали и осадок сушили при пониженном давлении. Выход: 0,2 г соединения 84 (93%). с) Получение соединения 83 К раствору промежуточного продукта 14 (полученного согласно А 6) (0,0002 моль) и метанола (0,8 мл) в тетрагидрофуране (4 мл) добавляли раствор метоксида натрия в метаноле (30 мас.%, 0,2 мл) и смесь перемешивали 16 ч при комнатной температуре. Растворитель удаляли при пониженном давлении и осадок перемешивали в ацетонитриле (2 мл) и воде (4 мл). Смесь фильтровали и осадок сушили при пониженном давлении. Выход: 0,051 г соединения 83 (73%). К раствору промежуточного продукта 14 (полученного согласно А 6) (0,0002 моль) и воды (0,6 мл) в тетрагидрофуране (4 мл) добавляли раствор гидроксида натрия в метаноле (1 М, 0,4 мл). Раствор кратковременно нагревали и затем перемешивали 72 ч при комнатной температуре. Растворитель удаляли при пониженном давлении и осадок перемешивали в ацетонитриле (2 мл), воде (2 мл) и водной хлористоводородной кислоте (1 М, 0,4 мл). Смесь фильтровали и осадок сушили при пониженном давлении. Выход: 0,058 г соединения 82 (86%). е) Получение соединения 40 Промежуточный продукт 14 (полученный согласно А 6) (0,0013 моль) суспендировали в N,Nдиметилформамиде (5 мл) и добавляли цианид калия (0,003 моль). Реакционную смесь нагревали 15 мин при 100 С, охлаждали до комнатной температуры и добавляли воду. Смесь фильтровали и осадок промывали водой. Осадок сушили при пониженном давлении. Выход: 0,43 г соединения 40 (96%). Промежуточный продукт 14 (полученный согласно А 6) (0,001 моль) суспендировали в ди(2 гидроксиэтил)амине (1 мл) и смесь нагревали 30 мин при 100 С. После охлаждения добавляли воду при перемешивании и смесь фильтровали. Осадок промывали водой и осадок сушили при пониженном давлении. Выход: 0,18 г соединения 70 (42%).- 27007933 Промежуточный продукта 14 а (полученный согласно А 6) (0,0001 моль) растворяли в тетрагидрофуране (4 мл) и добавляли 2-аминоэтанол (0,0002 моль). Раствор перемешивали 1 ч при комнатной температуре, растворитель удаляли при пониженном давлении и осадок растворяли в МеОН (2 мл). Раствор подкисляли 6 М раствором хлористого водорода в 2-пропаноле. Добавляли 2-пропанон (4 мл) и смесь перемешивали 16 ч. Смесь фильтровали и осадок сушили при пониженном давлении. Выход: 0,354 г соединения 87 (87%). К диметилсульфоксиду (5 мл) добавляли промежуточный продукт 14 (полученный согласно А 6)(0,0005 моль) и суспензию осторожно нагревали пока не завершалось растворение. Добавляли глицин(0,001 моль) и карбонат натрия (0,001 моль). Смесь перемешивали 4 ч при 120 С, охлаждали до 100 С и затем добавляли воду (5 мл). Раствор нейтрализовали 1 М хлористо-водородной кислотой. Добавляли воду (3 мл) и затем охлаждали при быстром перемешивании до 0 С. Смесь фильтровали и осадок сушили при пониженном давлении. Выход: 0,192 г соединения 90 (92%). К смеси гидрида натрия (60% в масле, 0,0005 моль) в N,N-диметилформамиде по каплям добавляли этан-1,2-диол (1 мл) и перемешивание продолжали 30 мин. Добавляли промежуточный продукт 14 а(0,0002 моль) и реакционную смесь перемешивали 20 ч. Растворитель удаляли при пониженном давлении, помещали в воду (5 мл) и нейтрализовали уксусной кислотой. Смесь осторожно нагревали и медленно добавляли ацетонитрил до завершения растворения. После охлаждения смесь фильтровали, осадок сушили при пониженном давлении и хроматографировали на силикагеле, используя в качестве элюента смесь дихлорметан:метанол 99:1. Выход: 0,023 г соединения 89 (29%). Пример В 8. Получение соединения 81 К перемешиваемому раствору промежуточного продукта 17 (0,0028 моль) (полученного по примеру А 8b) в метаноле (20 мл) добавляли метоксид натрия (0,0028 моль) и перемешивание продолжали 16 ч. В отдельной колбе суспендировали гуанидингидрохлорид (0,0028 моль) в метаноле (15 мл), добавляли метоксид натрия (0,0028 моль) и перемешивание продолжали 1 ч. Затем данный раствор добавляли к первому приготовленному раствору. Перемешивание продолжали 16 ч. Растворитель удаляли при пониженном давлении и добавляли 1,1-диметокси-N,N-диметилметанамин (0,0028 моль) с последующим добавлением раствора метоксида натрия (0,0028 моль) в метаноле (5 мл). Реакционную смесь перемешивали 16 ч. Растворитель удаляли при пониженном давлении, добавляли метанол (5 мл) и растворитель опять удаляли при пониженном давлении. Осадок суспендировали в горячем этаноле и смесь фильтровали пока она оставалась горячей. Холодный фильтрат фильтровали и осадок сушили при пониженном давлении. Выход: 0,080 г соединения 81 (7%). Пример В 9. Получение соединения 2- 28007933 К смеси соединения 32 (0,019 моль) в пиридине (30 мл) по каплям добавляли раствор ацетилхлорида (1,5 мл) в дихлорметане (10 мл). Смесь перемешивали 75 ч при комнатной температуре, добавляли воду и смесь фильтровали. Осадок промывали гексаном и перекристаллизовывали из уксусной кислоты. Выход: 3,55 г соединения 2 (54%). Пример В 10. а) Получение соединения 49N,N-диметилформамиде (5 мл) добавляли [бис(тетрафторборат) 1-(хлорметил)-4-фтор-1,4-диазониаби цикло[2.2.2]октана] "Selecfluor" (0,003 моль). Реакционную смесь перемешивали 48 ч при комнатной температуре и летучие компоненты удаляли при пониженном давлении. Осадок хроматографировали на силикагеле, используя в качестве элюента тетрагидрофуран:гексан 1:4. Выход: 0,093 г соединения 49 К раствору соединения 9 (0,0035 моль) (полученного согласно В 1) в тетрахлориде углерода (30 мл) добавляли N-хлорсукцинимид (0,0038). Смесь 5 ч кипятили с обратным холодильником и при пониженном давлении удаляли растворитель. Осадок суспендировали в воде, смесь кипятили 5 мин и смесь фильтровали. Осадок перекристаллизовывали из этанола. Выход: 0,81 г соединения 16 (62%). с) Получение соединения 11 К раствору соединения 6 (полученного согласно В 1) (0,0024 моль) в тетрахлориде углерода (3 мл) добавляли N-бромсукцинимид (0,0026). Смесь 4 ч кипятили с обратным холодильником и при пониженном давлении удаляли растворитель. Осадок перекристаллизовывали из смеси этанол:вода (4:1) и затем из этанола. Выход: 0,89 г соединения 11 (89%). Пример В 11. Получение соединения 42 Соединение 40 (полученное согласно В 7 е) (0,00087 моль) растворяли в концентрированной серной кислоте (98%, 28 мл) и смесь нагревали до 40 С. Медленно добавляли воду (0,35 мл). После перемешивания в течение 2 ч реакционную смесь выливали на лед и нейтрализовали холодным водным аммиаком. Смесь фильтровали, осадок промывали водой и затем смесью этанол:диэтиловый эфир (1:5). Выход: 0,25 г соединения 42 (79%). Пример В 12. Получение соединения 80 Смесь гуанидингидрохлорида (0,025 моль) и метоксида натрия (0,025 моль) в 2-этоксиэтаноле (20 мл) 15 мин кипятили с обратным холодильником и затем одной порцией добавляли промежуточный продукт 2 а (0,013 моль). Перемешивание продолжали 90 мин при кипячении с обратным холодильником,раствор охлаждали и разбавляли этанолом и водой. рН доводили до 3, используя уксусную кислоту. Смесь фильтровали, осадок промывали водой и затем сушили при пониженном давлении. Выход: 3,6 г соединения 80 (79%). Пример В 13. Получение соединения 99 К раствору гуанидингидрохлорида (0,020 моль) в N,N-диметилформамиде (10 мл) добавляли гидрид натрия (0,020 моль) и перемешивание продолжали 30 мин. Добавляли раствор промежуточного продукта 18 (0,014 моль) в N,N-диметилформамиде (10 мл) и реакционную смесь 2 ч кипятили с обратным холодильником. Раствор охлаждали до 0 С, добавляли воду (150 мл) и смесь фильтровали. Осадок сушили при пониженном давлении. Выход: 1,5 г соединения 99 (28%). Образец перекристаллизовывали из ацетонитрила для получения соединения 99 как желтого твердого вещества (т. плавл. 178-180 С). Пример В 14. Получение соединения 97 В тетрагидрофуране (10 мл) в автоклаве растворяли промежуточный продукт 20 (0,001 моль) и добавляли жидкий аммиак (0,6 моль). Автоклав закрывали и реакционную смесь перемешивали 16 ч при комнатной температуре. Смесь фильтровали и летучие компоненты удаляли из фильтрата при пониженном давлении. Осадок хроматографировали на силикагеле, используя в качестве элюента дихлорметан:метанол 99:1. Выход: 0,15 г соединения 97 (42%). Соединения 92, 93, 94, 95, 96 и 98 получали аналогично по способу, описанному в примере В 7 а) илиB7f). В табл. 1, 2 и 3 приведен список соединений формулы (I), которые получали по аналогии с одним из примеров и способов, описанных выше.
МПК / Метки
МПК: C07D 417/14, C07D 277/24, A61K 31/426, A61P 37/02, C07D 417/04, A61K 31/497, A61P 29/00, A61P 37/08, A61P 31/12, A61K 31/427, A61K 31/506
Метки: активность, 2,4,5-тризамещенные, производные, противовоспалительная, тиазолила
Код ссылки
<a href="https://eas.patents.su/30-7933-245-trizameshhennye-proizvodnye-tiazolila-i-ih-protivovospalitelnaya-aktivnost.html" rel="bookmark" title="База патентов Евразийского Союза">2,4,5-тризамещенные производные тиазолила и их противовоспалительная активность</a>
Предыдущий патент: Азабициклопроизводные в качестве антагонистов мускариновых рецепторов
Следующий патент: Кристаллическая форма эплеренона, обладающая повышенной скоростью растворения
Случайный патент: Способ обработки табака для снижения содержания нитрозоаминов и продукты, полученные этим способом