Производные хинолина и их применение в качестве ингибиторов микобактерий
Номер патента: 11277
Опубликовано: 27.02.2009
Авторы: Гийемон Жером Эмиль Жорж, Ланкуа Давид Франсис Ален, Паскье Элизабет Тереза Жанна
Формула / Реферат
1. Соединение общей формулы (Ia) или общей формулы (Ib)
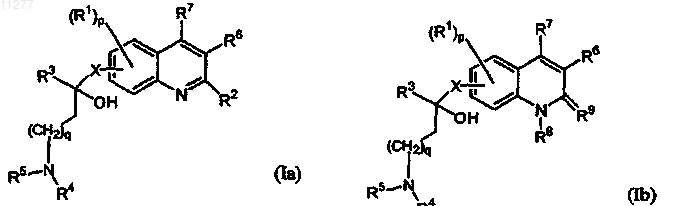
его фармацевтически приемлемые кислотно- или основно-аддитивные соли, четвертичные амины, стереохимически изомерные формы, таутомерные формы и N-оксиды, где
R1 означает водород, галоген, Ar, Het, С1-6алкил;
p означает целое число, равное 1, 2 или 3;
R2 означает водород; алкил; гидрокси; тио; алкилокси, необязательно замещенный аминогруппой, моно- или ди(алкил)аминогруппой или радикалом формулы  где Z означает CH2, CH-R10, O, S, N-R10, t означает целое число, равное 1 или 2, и пунктирная линия означает необязательную связь; алкилоксиалкилокси; алкилтио; моно- или ди(алкил)амино, где алкил может быть необязательно замещен одним или двумя заместителями, независимо выбираемыми, каждый, из алкилокси, Ar, Het, морфолинила или 2-оксопирролидинила; Ar; Het или радикал формулы
где Z означает CH2, CH-R10, O, S, N-R10, t означает целое число, равное 1 или 2, и пунктирная линия означает необязательную связь; алкилоксиалкилокси; алкилтио; моно- или ди(алкил)амино, где алкил может быть необязательно замещен одним или двумя заместителями, независимо выбираемыми, каждый, из алкилокси, Ar, Het, морфолинила или 2-оксопирролидинила; Ar; Het или радикал формулы 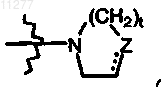 где Z означает CH2, CH-R10, O, S, N-R10; t означает целое число, равное 1 или 2; и пунктирная линия означает необязательную связь;
где Z означает CH2, CH-R10, O, S, N-R10; t означает целое число, равное 1 или 2; и пунктирная линия означает необязательную связь;
R3 означает алкил, Ar, Ar-алкил, Het или Het-алкил;
q означает целое число, равное 0, 1, 2, 3 или 4;
X означает прямую связь или CH2;
R4 и R5, каждый независимо, означают C1-6алкил;
R6 означает водород или радикал формулы 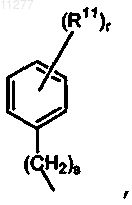 где s означает целое число, равное 0, 1, 2, 3 или 4; r означает целое число, равное 1, 2, 3, 4 или 5; и R11 означает водород, галоген, галогеналкил, гидрокси, Ar, алкил, алкилокси, алкилтио, алкилоксиалкил, алкилтиоалкил, Ar-алкил или ди(Ar)алкил; либо два вицинальных радикала R11 вместе с фенильным кольцом, к которому они присоединены, могут образовывать нафтил;
где s означает целое число, равное 0, 1, 2, 3 или 4; r означает целое число, равное 1, 2, 3, 4 или 5; и R11 означает водород, галоген, галогеналкил, гидрокси, Ar, алкил, алкилокси, алкилтио, алкилоксиалкил, алкилтиоалкил, Ar-алкил или ди(Ar)алкил; либо два вицинальных радикала R11 вместе с фенильным кольцом, к которому они присоединены, могут образовывать нафтил;
R7 означает водород или фенил;
R8 означает водород;
R9 означает оксо;
R10 означает водород, алкил, гидроксил, аминокарбонил, моно- или ди(алкил)аминокарбонил, Ar, Het, алкил, замещенный одним или двумя Het, алкил, замещенный одним или двумя Ar, Het-C(=O)-, Ar-C(=O)-;
алкил является линейным или разветвленным насыщенным углеводородным радикалом, содержащим 1-6 атомов углерода; циклическим насыщенным углеводородным радикалом, содержащим 3-6 атомов углерода; или циклическим насыщенным углеводородным радикалом, содержащим 3-6 атомов углерода, присоединенным к линейному или разветвленному насыщенному углеводородному радикалу, содержащему 1-6 атомов углерода; причем каждый атом углерода может быть необязательно замещен галогеном, гидрокси, алкилокси или оксо;
Ar является гомоциклом, выбираемым из группы, включающей фенил, нафтил, аценафтил, тетрагидронафтил, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбираемыми, каждый, из группы, включающей гидрокси, галоген, циано, нитро, амино, моно- или диалкиламино, алкил, галогеналкил, алкилокси, галогеналкилокси, карбоксил, алкилоксикарбонил, алкилкарбонил, аминокарбонил, морфолинил и моно- или диалкиламинокарбонил;
Het является моноциклическим гетероциклом, выбираемым из группы, включающей N-феноксипиперидинил, пирролил, пиразолил, имидазолил, фуранил, тиенил, оксазолил, изоксазолил, тиазолил, триазолил, изотиазолил, пиридинил, пиримидинил, пиразинил и пиридазинил; или бициклическим гетероциклом, выбираемым из группы, включающей хинолинил, изохинолинил, 1,2,3,4-тетрагидроизохинолинил, хиноксалинил, индолил, индазолил, бензимидазолил, бензоксазолил, бензизоксазолил, бензотиазолил, бензизотиазолил, бензофуранил, бензотиенил, 2,3-дигидробензо[1,4]диоксинил или бензо[1,3]диоксолил; причем каждый моноциклический и бициклический гетероцикл может быть необязательно замещен у атома углерода 1, 2 или 3 заместителями, выбираемыми из группы, включающей галоген, гидрокси, алкил или алкилокси;
галоген является заместителем, выбираемым из группы, включающей фтор, хлор, бром и йод; и
галогеналкил является линейным или разветвленным насыщенным углеводородным радикалом, содержащим 1-6 атомов углерода, или циклическим насыщенным углеводородным радикалом, содержащим 3-6 атомов углерода, в котором один или несколько атомов углерода замещены одним или несколькими атомами галогена;
при условии, что, когда R7 означает водород, в положении 3 хинолинового кольца может также находиться радикал 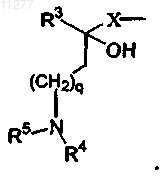
2. Соединение по п.1 при условии, что, когда R6 не является водородом, R7 означает водород, и когда R7 не является водородом, R6 означает водород.
3. Соединение по п.1 или 2, в котором R2 означает водород; алкил; алкилокси, необязательно замещенный аминогруппой, моно- или ди(алкил)аминогруппой или радикалом формулы 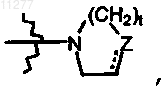 где Z означает CH2, CH-R10, O, S, N-R10, t означает целое число, равное 1 или 2, и пунктирная линия означает необязательную связь; моно- или ди(алкил)амино; Ar; Het или радикал формулы
где Z означает CH2, CH-R10, O, S, N-R10, t означает целое число, равное 1 или 2, и пунктирная линия означает необязательную связь; моно- или ди(алкил)амино; Ar; Het или радикал формулы 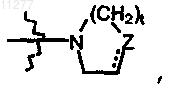 где Z означает CH2, CH-R10, O, S, N-R10; t означает целое число, равное 1 или 2; и пунктирная линия означает необязательную связь.
где Z означает CH2, CH-R10, O, S, N-R10; t означает целое число, равное 1 или 2; и пунктирная линия означает необязательную связь.
4. Соединение по любому из предшествующих пунктов, в котором R3 означает нафтил, фенил или Het, каждый из которых необязательно замещен 1 или 2 заместителями, представляющими собой галоген или галогеналкил.
5. Соединение по любому из предшествующих пунктов, в котором q равно 1.
6. Соединение по любому из предшествующих пунктов, в котором R6 означает водород или радикал формулы 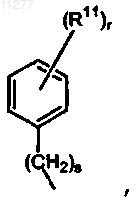 где s означает целое число, равное 0 или 1; r означает целое число, равное 1 или 2.
где s означает целое число, равное 0 или 1; r означает целое число, равное 1 или 2.
7. Соединение по п.1, в котором
R1 означает водород, галоген, C1-6алкил или Het;
R2 означает алкил, алкилокси, необязательно замещенный моно- или ди(алкил)аминогруппой или радикалом формулы 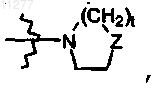 где Z означает CH2, CH-R10, O, N-R10, t означает целое число, равное 1 или 2, и R10 означает водород, алкил, гидроксил, алкил, замещенный одним или двумя Het, алкил, замещенный одним или двумя Ar, Het-C(=O)-; Ar; Het; радикал формулы
где Z означает CH2, CH-R10, O, N-R10, t означает целое число, равное 1 или 2, и R10 означает водород, алкил, гидроксил, алкил, замещенный одним или двумя Het, алкил, замещенный одним или двумя Ar, Het-C(=O)-; Ar; Het; радикал формулы 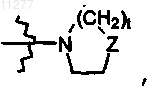 где Z означает CH2, CH-R10, O, N-R10; t означает целое число, равное 1 или 2, R10 означает водород, алкил, гидроксил, алкил, замещенный одним или двумя Het, алкил, замещенный одним или двумя Ar, Het-C(=O)-;
где Z означает CH2, CH-R10, O, N-R10; t означает целое число, равное 1 или 2, R10 означает водород, алкил, гидроксил, алкил, замещенный одним или двумя Het, алкил, замещенный одним или двумя Ar, Het-C(=O)-;
R3 означает Ar или Het, каждый из которых необязательно замещен 1 или 2 заместителями, представляющими собой галоген;
R4 и R5, каждый, означает алкил;
R6 означает водород, фенил, бензил или 4-метилбензил;
R7 означает водород или фенил;
R8 означает водород;
R9 означает оксо.
8. Соединение по п.1, в котором
R1 означает водород, галоген, Ar, Het, С1-6алкил;
р означает целое число, равное 1, 2 или 3;
R2 означает водород; алкил; гидрокси; тио; алкилокси, необязательно замещенный аминогруппой, моно- или ди(алкил)аминогруппой или радикалом формулы 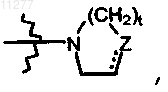 где Z означает CH2, CH-R10, O, S, N-R10, t означает целое число, равное 1 или 2, и пунктирная линия означает необязательную связь; алкилоксиалкилокси; алкилтио; моно- или ди(алкил)амино, где алкил может быть необязательно замещен одним или двумя заместителями, независимо выбираемыми, каждый, из алкилокси, Ar, Het, морфолинила шыш 2-оксопирролидинила; Het или радикал формулы
где Z означает CH2, CH-R10, O, S, N-R10, t означает целое число, равное 1 или 2, и пунктирная линия означает необязательную связь; алкилоксиалкилокси; алкилтио; моно- или ди(алкил)амино, где алкил может быть необязательно замещен одним или двумя заместителями, независимо выбираемыми, каждый, из алкилокси, Ar, Het, морфолинила шыш 2-оксопирролидинила; Het или радикал формулы 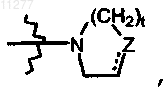 где Z означает CH2, CH-R10, O, S, N-R10; t означает целое число, равное 1 или 2; и пунктирная линия означает необязательную связь;
где Z означает CH2, CH-R10, O, S, N-R10; t означает целое число, равное 1 или 2; и пунктирная линия означает необязательную связь;
R3 означает алкил, Ar, Ar-алкил, Het или Het-алкил;
q означает целое число, равное 0, 1, 2, 3 или 4;
X означает прямую связь;
R4 и R5, каждый независимо, означают водород или C1-6алкил;
R6 означает радикал формулы 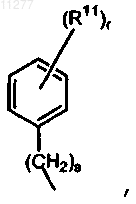 где s означает целое число, равное 0, 1, 2, 3 или 4; r означает целое число, равное 1, 2, 3, 4 или 5; и R11 означает водород, галоген, галогеналкил, гидрокси, Ar, алкил, алкилокси, алкилтио, алкилоксиалкил, алкилтиоалкил, Ar-алкил или ди(Ar)алкил; либо два вицинальных радикала R11 вместе с фенильным кольцом, к которому они присоединены, могут образовывать нафтил;
где s означает целое число, равное 0, 1, 2, 3 или 4; r означает целое число, равное 1, 2, 3, 4 или 5; и R11 означает водород, галоген, галогеналкил, гидрокси, Ar, алкил, алкилокси, алкилтио, алкилоксиалкил, алкилтиоалкил, Ar-алкил или ди(Ar)алкил; либо два вицинальных радикала R11 вместе с фенильным кольцом, к которому они присоединены, могут образовывать нафтил;
R7 означает водород или фенил;
R8 означает водород;
R9 означает оксо;
R10 означает водород, алкил, аминокарбонил, моно- или ди(алкил)аминокарбонил, Ar, Het, алкил, замещенный одним или двумя Het, алкил, замещенный одним или двумя Ar, Het-C(=O)-;
алкил является линейным или разветвленным насыщенным углеводородным радикалом, содержащим 1-6 атомов углерода; циклическим насыщенным углеводородным радикалом, содержащим 3-6 атомов углерода; или циклическим насыщенным углеводородным радикалом, содержащим 3-6 атомов углерода, присоединенным к линейному или разветвленному насыщенному углеводородному радикалу, содержащему 1-6 атомов углерода; причем каждый атом углерода может быть необязательно замещен галогеном, гидрокси, алкилокси или оксо;
Ar является гомоциклом, выбираемым из группы, включающей фенил, нафтил, аценафтил, тетрагидронафтил, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбираемыми, каждый, из группы, включающей гидрокси, галоген, циано, нитро, амино, моно- или диалкиламино, алкил, галогеналкил, алкилокси, галогеналкилокси, карбоксил, алкилоксикарбонил, алкилкарбонил, аминокарбонил, морфолинил и моно- или диалкиламинокарбонил;
Het является моноциклическим гетероциклом, выбираемым из группы, включающей N-феноксипиперидинил, пирролил, пиразолил, имидазолил, фуранил, тиенил, оксазолил, изоксазолил, тиазолил, изотиазолил, триазолил, пиридинил, пиримидинил, пиразинил и пиридазинил; или бициклическим гетероциклом, выбираемым из группы, включающей хинолинил, хиноксалинил, индолил, индазолил, бензимидазолил, бензоксазолил, бензизоксазолил, бензотиазолил, бензизотиазолил, бензофуранил, бензотиенил, 2,3-дигидробензо[1,4]диоксинил или бензо[1,3]диоксолил; причем каждый моноциклический и бициклический гетероцикл может быть необязательно замещен у атома углерода 1, 2 или 3 заместителями, выбираемыми из группы, включающей галоген, гидрокси, алкил или алкилокси;
галоген является заместителем, выбираемым из группы, включающей фтор, хлор, бром и йод; и
галогеналкил является линейным или разветвленным насыщенным углеводородным радикалом, содержащим 1-6 атомов углерода, или циклическим насыщенным углеводородным радикалом, содержащим 3-6 атомов углерода, в котором один или несколько атомов углерода замещены одним или несколькими атомами галогена.
9. Соединение по любому из предшествующих пунктов, которое является соединением формулы (Ia).
10. Соединение по любому из предшествующих пунктов, в котором алкил является линейным или разветвленным насыщенным углеводородным радикалом, содержащим 1-6 атомов углерода.
11. Композиция, содержащая фармацевтически приемлемый носитель и терапевтически эффективное количество соединения по любому из пп.1-10 в качестве активного ингредиента.
12. Применение соединения по любому из пп.1-10 или композиции по п.11 для получения лекарственного средства для лечения микобактериальных заболеваний.
13. Способ лечения пациента, страдающего или подверженного риску возникновения микобактериального заболевания, включающий введение указанному пациенту терапевтически эффективного количества соединения по любому из пп.1-10 или фармацевтической композиции по п.11.
14. Способ получения соединения по п.1, отличающийся тем, что:
а) промежуточное соединение формулы (II) подвергают взаимодействию с H-R2a или с подходящей солью H-R2a необязательно в присутствии подходящего растворителя и необязательно в присутствии подходящего основания
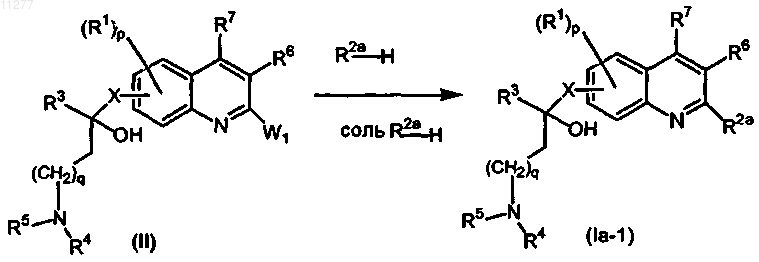
где W1 означает подходящую уходящую группу;
R2a означает алкокси; радикал формулы 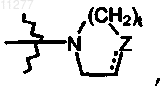 где t и Z имеют значения, указанные в п.1; алкилокси, замещенный радикалом формулы
где t и Z имеют значения, указанные в п.1; алкилокси, замещенный радикалом формулы 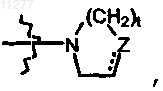 где t и Z имеют значения, указанные в п.1; моно- или ди(алкил)амино, где алкил может быть необязательно замещен одним или двумя заместителями, независимо выбираемыми, каждый, из алкилокси, Ar, Het, морфолинила или 2-оксопирролидинила;
где t и Z имеют значения, указанные в п.1; моно- или ди(алкил)амино, где алкил может быть необязательно замещен одним или двумя заместителями, независимо выбираемыми, каждый, из алкилокси, Ar, Het, морфолинила или 2-оксопирролидинила;
R1, R3-R7, p, q и X имеют значения, указанные в п.1;
b) промежуточное соединение формулы (II) подвергают взаимодействию с R2b-B(OH)2 в присутствии подходящего катализатора, подходящего растворителя и подходящего основания
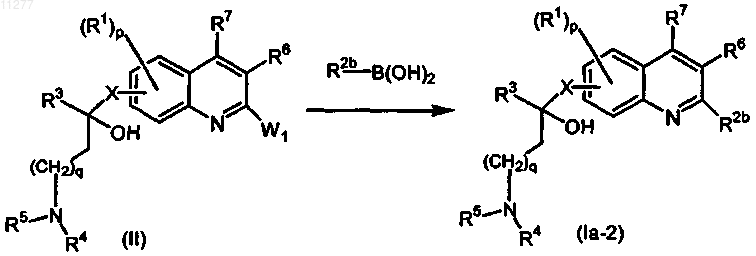
где W1 означает подходящую уходящую группу;
R2b означает Het или алкил;
R1, R3-R7, p, q и X имеют значения, указанные в п.1;
с) промежуточное соединение формулы (II) подвергают взаимодействию с 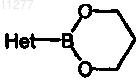 в присутствии подходящего катализатора, подходящего растворителя и подходящего основания
в присутствии подходящего катализатора, подходящего растворителя и подходящего основания
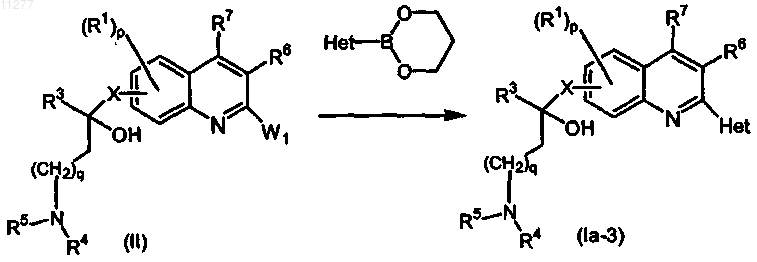
где W1 означает подходящую уходящую группу и R1, R3-R7, p, q и X имеют значения, указанные в п.1;
d) промежуточное соединение формулы (III) подвергают взаимодействию с промежуточным соединением формулы (IV) в присутствии подходящего конденсирующего агента, в присутствии подходящего растворителя и необязательно в присутствии подходящего основания
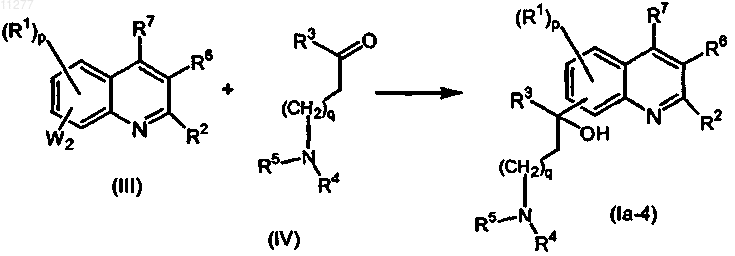
где W2 означает подходящую уходящую группу и R1-R7, p и q имеют значения, указанные в п.1;
е) промежуточное соединение формулы (II) подвергают взаимодействию с подходящей кислотой в присутствии подходящего растворителя

где W1 означает подходящую уходящую группу и R1, R3-R7, p, q и X имеют значения, указанные в п.1;
f) соединение формулы (Ia-5) превращают в соединение формулы (Ia-6), осуществляя взаимодействие с 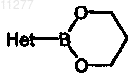 в присутствии подходящего катализатора, подходящего растворителя и подходящего основания
в присутствии подходящего катализатора, подходящего растворителя и подходящего основания

где R2-R7, p, q и X имеют значения, указанные в п.1;
g) соединение формулы (Ia-5) превращают в соединение формулы (Ia-7), осуществляя взаимодействие с Sn(CH3)4 в присутствии подходящего катализатора и подходящего растворителя
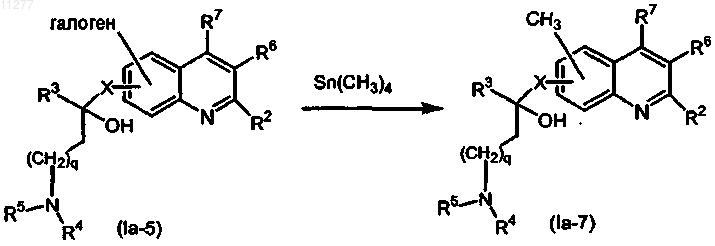
где R2-R7, p, q и X имеют значения, указанные в п.1;
или, при желании, соединения формулы (Ia) превращают в соединения формулы (Ib), или, наоборот, в соответствии с методами трансформации, известными в данной области, и далее, при желании, соединения формулы (Ia) или (Ib) превращают в терапевтически активную нетоксичную кислотно-аддитивную соль, производя обработку кислотой, или в терапевтичеёъш активную нетоксичную основно-аддитивную соль, производя обработку основанием, либо, наоборот, кислотно-аддитивную соль превращают в свободное основание, производя обработку щелочью, или основно-аддитивную соль превращают в свободную кислоту, производя обработку кислотой; и, при желании, получают стереохимически изомерные формы, четвертичные амины, таутомерные формы или N-оксиды.
Текст
011277 Настоящее изобретение относится к новым замещенным производным хинолина, пригодным для лечения микобактериальных заболеваний, в частности заболеваний, вызываемых патогенными микобактериями, такими как Mycobacterium tuberculosis (M.), M.bovis, M.avium и M.marinum. Уровень техникиMycobacterium tuberculosis является возбудителем туберкулеза (TB), тяжелого и потенциально смертельного инфекционного заболевания, распространенного во всем мире. По данным Всемирной организации здравоохранения ежегодно туберкулезом заболевают более 8 млн чел. и каждый год от туберкулеза умирают 2 млн чел. За последнее десятилетие заболеваемость туберкулезом выросла во всем мире на 20%, причем особенно тяжелая ситуация наблюдается в странах с наиболее низким уровнем жизни. Если данная тенденция сохранится, заболеваемость туберкулезом увеличится на 41% в течение следующих 20 лет. Спустя 50 лет после введения эффективной химиотерапии туберкулез все еще занимает второе место после СПИДа, который является главным инфекционным заболеванием, вызывающим смертность среди взрослого населения в мире. Борьба с эпидемией туберкулеза осложняется появлением лекарственно устойчивых штаммов и возникновением смертельного симбиоза с ВИЧ. У ВИЧположительных пациентов, инфицированных туберкулезом, вероятность возникновения активной формы туберкулеза в 30 раз выше, чем у ВИЧ-отрицательных пациентов, при этом в мире от туберкулеза умирает каждый третий человек, страдающий ВИЧ/СПИДом. Существующие методы лечения туберкулеза включают комбинированную терапию с применением многих лекарственных средств. Например, схема лечения, рекомендованная Службой общественного здравоохранения США, включает комбинированное введение изониазида, рифампицина и пиразинамида в течение 2 месяцев с последующим введением только изониазида и рифампицина в течение следующих 4 месяцев. ВИЧ-инфицированные пациенты продолжают принимать указанные лекарственные средства в течение еще 7 месяцев. При лечении пациентов, инфицированных лекарственно устойчивыми штаммамиM.tuberculosis, комбинированная терапия вышеуказанными лекарственными средствами дополняется такими средствами, как этамбутол, стрептомицин, канамицин, амикацин, капреомицин, этионамид, циклосерин, ципрофоксацин и офлоксацин. Не существует такого лекарственного средства, которое обеспечивало бы эффективное клиническое лечение туберкулеза, или любой комбинации лекарственных средств, которая позволила бы сократить 6-месячный курс лечения. В медицине существует насущная потребность в новых лекарственных средствах, которые позволили бы улучшить применяемые в настоящее время методы лечения благодаря созданию схем лечения,облегчающих соблюдение режима лечения как больным, так и лечащим врачом. Менее продолжительные схемы лечения, не требующие строгого надзора, лучше всего соответствуют достижению поставленной цели. Наиболее благоприятное воздействие лечение оказывает в первые 2 месяца, на протяжении интенсивной или бактерицидной фазы, когда пациент принимает четыре лекарственных средства; в данный период значительно уменьшается бактериальная нагрузка, и пациенты перестают быть заразными. Последующее лечение в течение 4-6 месяцев, или так называемая фаза стерилизации, необходима для уничтожения оставшихся бацилл и минимизации вероятности рецидива. Чрезвычайно полезным было бы сильнодействующее стерилизующее лекарственное средство, которое позволило бы сократить курс лечения до 2 месяцев или менее. Кроме того, необходимы лекарственные средства, облегчающие режим лечения благодаря осуществлению менее строгого надзора. Совершенно очевидно, что соединение, которое позволило бы сократить продолжительность лечения и частоту введения лекарственного средства,было бы особенно полезным. Эпидемическое распространение туберкулеза осложняется все более частым появлением лекарственно устойчивых штаммов или MDR-TB. До 4% всех случаев заболевания туберкулезом в мире обусловлено MDR-TB, т.е. штаммами, устойчивыми к наиболее эффективным лекарственным средствам,назначаемым во время основного курса лечения, осуществляемого четырьмя лекарственными средствами, а именно к изониазиду и рифампину. При отсутствии лечения MDR-TB является смертельным заболеванием, при этом данное заболевание нельзя эффективно лечить стандартными методами, поэтому лечение проводят "вспомогательными" лекарственными средствами в течение периода времени до 2 лет. Такие лекарственные средства часто являются токсичными, дорогими и малоэффективными. При отсутствии эффективного лечения пациенты, инфицированные MDR-TB, остаются переносчиками заболевания, заражая других людей штаммами MDR-TB. В медицине существует насущная потребность в новом лекарственном средстве с новым механизмом действия, которое обладало бы активностью против штаммов MDR. Термин "лекарственно устойчивый" в используемом здесь значении хорошо понятен специалисту в области микробиологии. Лекарственно устойчивой микобактерией является такая микобактерия, которая не поддается воздействию по меньшей мере одного ранее известного эффективного лекарственного средства; которая способна выдерживать антибиотическое действие по меньшей мере одного ранее известного эффективного лекарственного средства. Лекарственно устойчивый штамм может передавать возникшую устойчивость своему потомству. Указанная устойчивость может быть следствием произвольных генетических мутаций в бактериальной клетке, которые изменяют ее чувствительность к одному или нескольким лекарственным средствам.MDR-туберкулез является специфической формой лекарственно устойчивого туберкулеза, возникающей вследствие появления бактерии, устойчивой, по меньшей мере, к изониазиду и рифампицину(при наличии или отсутствии устойчивости к другим лекарственным средствам), которые в настоящее время являются двумя наиболее сильнодействующими лекарственными средствами против туберкулеза. Целью настоящего изобретения является создание новых соединений, в частности замещенных производных хинолина, которые способны ингибировать рост микобактерий, включая лекарственно устойчивые микобактерии, и поэтому пригодны для лечения микобактериальных заболеваний, в частности заболеваний, вызываемых патогенными микобактериями, такими как Mycobacterium tuberculosis,M.bovis, M.avium, M.smegmatis и M.marinum. Замещенные хинолины описаны в патенте США 5965572 для лечения устойчивых антибиотику инфекций и в WO 00/342 65 для ингибирования роста бактериальных микроорганизмов. В публикацииWO 2004/011436 описаны производные хинолина в качестве антимикобактериальных средств. Сущность изобретения Настоящее изобретение относится к новым замещенным производным хинолина формул (Ia) и (Ib) их фармацевтически приемлемым кислотно- или основно-аддитивным солям, четвертичным аминам,стереохимически изомерным формам, таутомерным формам и N-оксидам, гдеR2 означает водород, алкил, гидрокси, тио, алкилокси, необязательно замещенный аминогруппой,моно- или ди(алкил)аминогруппой или радикалом формулы где Z означает CH2, CH-R10, O, S,10N-R ; t означает целое число, равное 1 или 2; и пунктирная линия означает необязательную связь; алкилоксиалкилокси; алкилтио; моно- или ди(алкил)амино, где алкил может быть необязательно замещен одним или двумя заместителями, независимо выбираемыми, каждый, из алкилокси, Ar, Het, морфолинила или 2-оксопирролидинила; Ar; Het или радикал формулы где Z означает CH2, CH-R10, O, S,10N-R ; t означает целое число, равное 1 или 2; и пунктирная линия означает необязательную связь;X означает прямую связь или CH2;R4 и R5 каждый независимо означает C1-6 алкил;R6 означает водород или радикал формулы где s означает целое число, равное 0, 1, 2, 3 или 4; r означает целое число, равное 1, 2, 3, 4 или 5; и R11 означает водород, галоген, галогеналкил,гидрокси, Ar, алкил, алкилокси, алкилтио, алкилоксиалкил, алкилтиоалкил, Ar-алкил или ди(Ar)алкил; либо два вицинальных радикала R11 вместе с фенильным кольцом, к которому они присоединены, могут образовывать нафтил;R7 означает водород или фенил;R10 означает водород, алкил, гидроксил, аминокарбонил, моно- или ди(алкил)аминокарбонил, Ar,Het, алкил, замещенный одним или двумя Het, алкил, замещенный одним или двумя Ar, Het-C(=O)-,Ar-C(=O)-; алкил является линейным или разветвленным насыщенным углеводородным радикалом, содержащим 1-6 атомов углерода; циклическим насыщенным углеводородным радикалом, содержащим 3-6 атомов углерода; или циклическим насыщенным углеводородным радикалом, содержащим 3-6 атомов углерода, присоединенным к линейному или разветвленному насыщенному углеводородному радикалу, содержащему 1-6 атомов углерода; причем каждый атом углерода может быть необязательно замещен галогеном, гидрокси, алкилокси или оксо;Ar является гомоциклом, выбираемым из группы, включающей фенил, нафтил, аценафтил, тетрагидронафтил, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимоN-феноксипиперидинил, пирролил, пиразолил, имидазолил, фуранил, тиенил, оксазолил, изоксазолил,тиазолил, изотиазолил, триазолил, пиридинил, пиримидинил, пиразинил и пиридазинил; или бициклическим гетероциклом, выбираемым из группы, включающей хинолинил, изохинолинил, 1,2,3,4 тетрагидроизохинолинил, хиноксалинил, индолил, индазолил, бензимидазолил, бензоксазолил, бензизоксазолил, бензотиазолил, бензизотиазолил, бензофуранил, бензотиенил, 2,3-дигидробензо[1,4]диоксинил или бензо[1,3]диоксолил; причем каждый моноциклический и бициклический гетероцикл может быть необязательно замещен у атома углерода 1, 2 или 3 заместителями, выбираемыми из группы, включающей галоген, гидрокси, алкил или алкилокси; галоген является заместителем, выбираемым из группы, включающей фтор, хлор, бром и йод, и галогеналкил является линейным или разветвленным насыщенным углеводородным радикалом, содержащим 1-6 атомов углерода, или циклическим насыщенным углеводородным радикалом, содержащим 3-6 атомов углерода, в котором один или несколько атомов углерода замещены одним или несколькими атомами галогена; при условии, что, когда R7 означает водород, в положении 3 хинолинового кольца может также находиться радикал Соединения формул (Ia) и (Ib) взаимосвязаны друг с другом в том отношении, что, например, соединение формулы (Ib), в котором R9 означает оксо, является таутомерным эквивалентом соединения формулы (Ia), в котором R2 означает гидрокси (кетоенольная таутомерия). Изобретение также относится к композиции, содержащей фармацевтически приемлемый носитель и терапевтически эффективное количество соединения по изобретению в качестве активного ингредиента. Далее, изобретение относится к применению соединения или композиции по изобретению для получения лекарственного средства для лечения микобактериальных заболеваний, а также к способу лечения пациента, страдающего или подверженного риску возникновения микобактериального заболевания,включающему введение указанному пациенту терапевтически эффективного количества соединения или фармацевтической композиции по изобретению И, наконец, изобретение относится к способу получения соединений по изобретению. Подробное описание изобретения В соответствии с определением, используемым в настоящем описании, алкил является линейным или разветвленным насыщенным углеводородным радикалом, содержащим 1-6 атомов углерода; циклическим насыщенным углеводородным радикалом, содержащим 3-6 атомов углерода; или циклическим насыщенным углеводородным радикалом, содержащим 3-6 атомов углерода, который присоединен к линейному или разветвленному насыщенному углеводородному радикалу, содержащему 1-6 атомов углерода; причем каждый атом углерода может быть необязательно замещен галогеном, гидрокси, алкилокси или оксо. Алкил предпочтительно является метилом, этилом или циклогексилметилом. С 1-6 алкил в виде группы или части группы является линейным или разветвленным насыщенным углеводородным радикалом, содержащим 1-6 атомов углерода, таким как метил, этил, бутил, пентил, гексил, 2-метилбутил и т.п. В соответствии с определением, используемым в настоящем изобретении, Ar является гомоциклом,выбираемым из группы, включающей фенил, нафтил, аценафтил, тетрагидронафтил, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбираемыми, каждый, из группы, включающей гидрокси, галоген, циано, нитро, амино, моно- или диалкиламино, алкил, галогеналкил, алкилокси, галогеналкилокси, карбоксил, алкилоксикарбонил, аминокарбонил, морфолинил и моно- или диалкиламинокарбонил. Ar предпочтительно означает нафтил или фенил, каждый из которых необязательно замещен 1 или 2 заместителями, выбираемыми из галогена или алкила, предпочтительно галогена. В соответствии с определением, используемым в настоящем изобретении, Het является моноциклическим гетероциклом, выбираемым из группы, включающей N-феноксипиперидинил, пирролил, пиразолил, имидазолил, фуранил, тиенил, оксазолил, изоксазолил, тиазолил, изотиазолил, триазолил, пиридинил, пиримидинил, пиразинил и пиридазинил; или бициклическим гетероциклом, выбираемым из группы, включающей хинолинил, изохинолинил, 1,2,3,4-тетрагидроизохинолинил, хиноксалинил, индолил,индазолил, бензимидазолил, бензоксазолил, бензизоксазолил, бензотиазолил, бензизотиазолил, бензофуранил, бензотиенил, 2,3-дигидробензо[1,4]диоксинил или бензо[1,3]диоксолил; причем каждый моноциклический и бициклический гетероцикл может быть необязательно замещен у атома углерода 1, 2 или-3 011277 3 заместителями, выбираемыми из группы, включающей галоген, гидрокси, алкил или алкилокси. Het предпочтительно означает тиенил, фуранил, имидазолил, пиридил, триазолил, бензо[1,3]диоксолил, индазолил, изохинолинил, 1,2,3,4-тетрагидроизохинолинил, бензофуранил. В соответствии с определением, используемым в настоящем изобретении, галоген является заместителем, выбираемым из группы, включающей фтор, хлор, бром и йод, и галогеналкил является линейным или разветвленным насыщенным углеводородным радикалом, содержащим 1-6 атомов углерода,или циклическим насыщенным углеводородным радикалом, содержащим 3-6 атомов углерода, в котором один или несколько атомов углерода замещены одним или несколькими атомами галогена. Галоген предпочтительно является бромом, фтором или хлором и галогеналкил предпочтительно является трифторметилом. В соответствии с определением, используемым в настоящем изобретении, хинолиновое кольцо соединений формулы (Ia) или (Ib) имеет нижеследующую нумерацию: Радикал может находиться в любом подходящем положении хинолиновой части. В используемом здесь значении в определение термина "соединения формулы (Ia) или (Ib)" входят также их N-оксиды, соли, четвертичные амины, таутомерные формы и стереохимически изомерные формы. Особый интерес представляют стереохимически чистые соединения формулы (Ia) или (Ib). Интересный вариант осуществления настоящего изобретения относится к соединениям формулы(Ia) или (Ib), их фармацевтически приемлемым кислотно- или основно-аддитивным солям, стереохимически изомерным формам, таутомерным формам и N-оксидам,где R1 означает водород, галоген, Ar, Het, С 1-6 алкил; р означает целое число, равное 1, 2 или 3;R2 означает водород, алкил, гидрокси, тио, алкилокси, необязательно замещенный аминогруппой,где Z означает CH2, CH-R10, O, S,моно- или ди(алкил)аминогруппой или радикалом формулы 10N-R , t означает целое число, равное 1 или 2, и пунктирная линия означает необязательную связь; алкилоксиалкилокси; алкилтио; моно- или ди(алкил)амино, где алкил может быть необязательно замещен одним или двумя заместителями, независимо выбираемыми, каждый, из алкилокси, Ar, Het, морфолинила или 2-оксопирролидинила; Het или радикал формулы где Z означает CH2, CH-R10, O, S,10N-R ; t означает целое число, равное 1 или 2; и пунктирная линия означает необязательную связь;R11 означает водород, галоген, галогеналкил, гидрокси, Ar, алкил, алкилокси, алкилтио, алкилоксиалкил, алкилтиоалкил, Ar-алкил или ди(Ar)алкил либо два вицинальных радикала R11 вместе с фенильным кольцом, к которому они присоединены, могут образовывать нафтил;R7 означает водород или фенил;R8 означает водород или алкил;R10 означает водород, алкил, аминокарбонил, моно- или ди(алкил)аминокарбонил, Ar, Het, алкил,замещенный одним или двумя Het, алкил, замещенный одним или двумя Ar, Het-C(=O)-; алкил является линейным или разветвленным насыщенным углеводородным радикалом, содержащим 1-6 атомов углерода; циклическим насыщенным углеводородным радикалом, содержащим 3-6 атомов углерода; или циклическим насыщенным углеводородным радикалом, содержащим 3-6 атомов углерода, присоединенным к линейному или разветвленному насыщенному углеводородному радикалу, содержащему 1-6 атомов углерода; причем каждый атом углерода может быть необязательно замещен галогеном, гидрокси, алкилокси или оксо;Ar является гомоциклом, выбираемым из группы, включающей фенил, нафтил, аценафтил, тетрагидронафтил, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбираемыми, каждый, из группы, включающей гидрокси, галоген, циано, нитро, амино, моно- или диалкиламино, алкил, галогеналкил, алкилокси, галогеналкилокси, карбоксил, алкилоксикарбонил, алкилкарбонил, аминокарбонил, морфолинил и моно- или диалкиламинокарбонил;N-феноксипиперидинил, пирролил, пиразолил, имидазолил, фуранил, тиенил, оксазолил, изоксазолил,тиазолил, изотиазолил, триазолил, пиридинил, пиримидинил, пиразинил и пиридазинил; или бициклическим гетероциклом, выбираемым из группы, включающей хинолинил, хиноксалинил, индолил, индазолил, бензимидазолил, бензоксазолил, бензизоксазолил, бензотиазолил, бензизотиазолил, бензофуранил,бензотиенил, 2,3-дигидробензо[1,4]диоксинил или бензо[1,3]диоксолил; причем каждый моноциклический и бициклический гетероцикл может быть необязательно замещен у атома углерода 1, 2 или 3 заместителями, выбираемыми из группы, включающей галоген, гидрокси, алкил или алкилокси; галоген является заместителем, выбираемым из группы, включающей фтор, хлор, бром и йод, и галогеналкил является линейным или разветвленным насыщенным углеводородным радикалом, содержащим 1-6 атомов углерода, или циклическим насыщенным углеводородным радикалом, содержащим 3-6 атомов углерода, в котором один или несколько атомов углерода замещены одним или несколькими атомами галогена.R11 предпочтительно означает водород, галоген, галогеналкил, гидрокси, Ar, алкил, алкилокси, алкилтио, алкилоксиалкил, алкилтиоалкил, Ar-алкил или ди(Ar)алкил. Когда R6 не является водородом, R7 предпочтительно означает водород, и когда R7 не является водородом, R6 предпочтительно означает водород. Предпочтительно R6 не является водородом, и R7 означает водород. Предпочтительно R7 не является водородом, и R6 означает водород. В соединениях формул (Ia) и (Ib) R1 предпочтительно означает водород, галоген, C1-6 алкил или Het. Еще более предпочтительно R1 означает водород, галоген или Het. Наиболее предпочтительно R1 означает галоген, в частности бром. р предпочтительно равно 1.R2 предпочтительно означает водород; алкил; алкилокси, необязательно замещенный аминогрупгде Z означает CH2, CH-R10,пой, моно- или ди(алкил)аминогруппой или радикалом формулы 10O, S, N-R , t означает целое число, равное 1 или 2, и пунктирная линия означает необязательную связь; где Z означает CH2, CH-R10, O, S,моно- или ди(алкил)амино; Ar; Het или радикал формулы 10N-R ; t означает целое число, равное 1 или 2; и пунктирная линия означает необязательную связь. Более предпочтительно R2 означает алкилокси, Het, Ar, алкил, моно- или ди(алкил)амино, радикал формулы где Z означает CH2, CH-R10, O, N-R10; t означает целое число, равное 1 или 2; алкилокси, загде Z мещенный аминогруппой, моно- или ди(алкил)аминогруппой или радикалом формулы означает CH2, CH-R10, O, N-R10 и t означает целое число, равное 1 или 2. Наиболее предпочтительно R2 означает алкилокси, например метилокси; Het или радикал формулы где Z означает CH2, CH-R10, O, N-R10 и t означает целое число, равное 1 или 2.R предпочтительно означает нафтил, фенил или Het, каждый из которых необязательно замещен 1 или 2 заместителями, которые предпочтительно являются галогеном или галогеналкилом, наиболее предпочтительно галогеном. Более предпочтительно R3 означает нафтил, фенил, 3,5-дигалогенфенил, 1,6-дигалогенфенил, тиенил, фуранил, бензофуранил, пиридил. Наиболее предпочтительно R3 является необязательно замещенным фенилом, например 3,5-дигалогенфенилом или нафтилом.R4 и R5 предпочтительно, каждый независимо, означают алкил, более предпочтительно метил или этил, наиболее предпочтительно метил. 3R6 предпочтительно означает водород или радикал формулыR11 означает водород, галоген или алкил, предпочтительно водород или алкил. Более предпочтительно R6 Наиболее предпочтительно R6 означает бензил или фенил. Предозначает радикал формулы 11 почтительно r равно 1, и R означает водород.R10 предпочтительно означает водород, алкил, гидроксил, алкил, замещенный одним или двумя Het,алкил, замещенный одним или двумя Ar, Het-C(=O)-. Наиболее предпочтительно R10 означает гидроксил,Het, алкил, замещенный одним Het, алкил, замещенный одним Ar. Соединения по настоящему изобретению предпочтительно являются соединениями формулы (Ia),их фармацевтически приемлемыми кислотно- или основно-аддитивными солями, четвертичными аминами, стереохимически изомерными формами, таутомерными формами и N-оксидами.X предпочтительно означает прямую связь.X предпочтительно означает CH2. Интересную группу соединений составляют соединения формулы (Ia) или (Ib), предпочтительно формулы (Ia), их фармацевтически приемлемые кислотно- или основно-аддитивные соли, четвертичные амины, стереохимически изомерные формы, таутомерные формы и N-оксиды, в которых R1 означает водород, галоген, C1-6 алкил или Het, который предпочтительно является пиридилом; R2 означает алкил,алкилокси, необязательно замещенный моно- или ди(алкил)аминогруппой или радикалом формулы где Z означает CH2, CH-R10, O, N-R10, предпочтительно Z означает CH2, t означает целое число, равное 1 или 2, и R10 означает водород, алкил, гидроксил, алкил, замещенный одним или двумя Het,алкил, замещенный одним или двумя Ar, Het-C(=O)-, R10 предпочтительно означает водород; Ar; Het; радикал формулы где Z означает CH2, CH-R10, O, N-R10, t означает целое число, равное 1 или 2,10 где R означает водород, алкил, гидроксил, алкил, замещенный одним или двумя Het, алкил, замещенный одним или двумя Ar, Het-C(=O)-; R3 означает Ar, предпочтительно фенил, нафтил или Het, предпочтительно тиенил, фуранил, пиридил, бензофуранил, причем каждый Ar или Het необязательно замещен 1 или 2 заместителями, которыми предпочтительно является галоген; R4 и R5 означают, каждый, алкил,предпочтительно метил; R6 означает водород, фенил, бензил или 4-метилбензил; R7 означает водород или фенил; R8 означает водород; R9 означает оксо. Интересными промежуточными соединениями по настоящему изобретению являются промежуточные соединения формулы где W1 означает подходящую уходящую группу, такую как, например, галоген, в частности хлор, бром и т.п.;R1, R3-R7, X, q и р имеют указанные выше значения. В определение фармацевтически приемлемых кислотно-аддитивных солей входят терапевтически активные нетоксичные кислотно-аддитивные соли, которые могут быть образованы соединениями формулы (Ia) или (Ib). Указанные кислотно-аддитивные соли могут быть получены путем обработки основания соединений формулы (Ia) или (Ib) соответствующими кислотами, например неорганическими кислотами, такими как галогенводородные кислоты, в частности хлористо-водородная, бромисто-водородная,серная, азотная и фосфорная кислоты; органическими кислотами, такими как, например, уксусная, гидроксиуксусная, пропановая, молочная, пировиноградная, щавелевая, малоновая, янтарная, малеиновая,фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая,п-толуолсульфоновая, цикламовая, салициловая, п-аминосалициловая и памовая кислоты. Соединения формулы (Ia) или (Ib), содержащие кислотные протоны, можно также превратить в фармацевтически активные нетоксичные основно-аддитивные соли путем обработки соответствующими органическими и неорганическими основаниями. Соответствующие основные соли включают, например,соли аммония, соли щелочных и щелочно-земельных металлов, в частности соли лития, натрия, калия,магния и кальция, соли с органическими основаниями, например соли бензатина, N-метил-D-глюкамина,-6 011277 гибрамина, и соли с аминокислотами, например аргинином и лизином. Указанные кислотно- и основно-аддитивные соли могут быть превращены в свободные формы путем обработки соответствующим основанием или кислотой. Термин "аддитивная соль" в значении, используемом в настоящем изобретении, включает также сольваты, которые могут образовывать соединения формулы (Ia) или (Ib), а также их соли. Такими сольватами являются, например, гидраты и алкоголяты. Термин "четвертичный амин" в используемом здесь значении означает соли четвертичного аммония, которые могут образовывать соединения формулы (Ia) или (Ib) в результате взаимодействия основного атома азота соединения формулы (Ia) или (Ib) с соответствующим агентом, образующим четвертичное основание, таким как, например, необязательно замещенный алкилгалогенид, арилгалогенид или арилалкилгалогенид, в частности метилиодид или бензилиодид. Могут быть также использованы другие реагенты с хорошо уходящими группами, такие как алкилтрифторметансульфонаты, алкилметансульфонаты и алкил-п-толуолсульфонаты. Четвертичный амин содержит положительно заряженный атом азота. Фармацевтически приемлемые противоионы включают хлор, бром, йод, трифторацетат и ацетат. Выбранный противоион может быть введен при помощи ионообменных смол. Термин "стереохимически изомерные формы" в используемом здесь значении включает все возможные изомерные формы, в которых могут находиться соединения формулы (Ia) или (Ib). За исключением особо оговоренных случаев, химическое обозначение соединений включает смесь всех возможных стереохимически изомерных форм, причем указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. В частности, стереогенные центры могут иметь R- илиS-конфигурацию; заместители в двухвалентных циклических (частично) насыщенных радикалах могут иметь цис- или транс-конфигурацию. Стереохимически изомерные формы соединений формулы (Ia) или(Ib) входят в объем настоящего изобретения. В соответствии с правилами номенклатуры CAS, при наличии в молекуле двух стереогенных центров известной абсолютной конфигурации, обозначение R или S присваивается (на основании правила следования Кана-Ингольда-Прелога) хиральному центру с наименьшим номером, который является базовым центром. Конфигурацию второго стереогенного центра обозначают, используя относительные обозначения [R,R] или [R,S], где R всегда является базовым центром, [R,R] обозначает центры с одинаковой хиральностью и [R, S] обозначает центры с разной хиральностью. Например, если хиральный центр с наименьшим номером в молекуле имеет S-конфигурацию и второй центр имеетR-конфигурацию, обозначение стерео должно быть обозначено как S-[R,S]. При использовании символов и : положение заместителя с наивысшим приоритетом у асимметричного атома углерода в кольцевой системе с наименьшим номером в кольце всегда условно считается положением средней плоскости, определяемой кольцевой системой. Положение заместителя с наивысшим приоритетом у другого асимметричного атома углерода в кольцевой системе относительно положения заместителя с наивысшим приоритетом у базового атома обозначается символом , если оно находится с той же стороны средней плоскости, определяемой кольцевой системой, или символом , если оно находится с другой стороны средней плоскости, определяемой кольцевой системой. Соединения формулы (Ia) и (Ib) и некоторые промежуточные соединения неизменно имеют по меньшей мере один стереогенный центр в своей структуре, который позволяет получить по меньшей мере 2 стереохимически разные структуры. Соединения формулы (Ia) или (Ib), получаемые нижеописанными способами, могут быть синтезированы в форме рацемических смесей энантиомеров, которые могут быть отделены друг от друга следующими методами разделения, известными в данной области. Рацемические соединения формулы (Ia) или (Ib) могут быть превращены в соответствующие диастереомерные соли путем взаимодействия с подходящей хиральной кислотой. Указанные диастереомерные соли затем разделяют, например, путем селективной или фракционированной кристаллизации и при помощи щелочи выделяют из них энантиомеры. Альтернативный метод разделения энантиомерных форм соединений формулы (Ia) или (Ib) включает жидкостную хроматографию с использованием хиральной стационарной фазы. Указанные чистые стереохимически изомерные формы могут быть также получены из соответствующих чистых стереохимически изомерных форм соответствующих исходных веществ при условии осуществления стереоспецифической реакции. При желании получить конкретный стереоизомер указанное соединение предпочтительно синтезируют стереоспецифическими методами. При осуществлении указанных методов преимущественно используют энантиомерно чистые исходные вещества. Таутомерные формы соединений формулы (Ia) или (Ib) включают такие соединения формулы (Ia) или (Ib), в которых енольная группа преобразована в кетогруппу (кетоенольная таутомерия).N-оксиды соединений формулы (Ia) или (Ib) включают такие соединения формулы (Ia) или (Ib), в которых один или несколько атомов азота окислены с образованием так называемого N-оксида, в частности N-оксидов, в которых окислен атом азота радикала амина. Настоящее изобретение относится также к производным соединениям (обычно именуемым "проле-7 011277 карствами") фармакологически активных соединений по данному изобретению, которые расщепляютсяin vivo с образованием соединений по настоящему изобретению. Пролекарства обычно (но не всегда) оказывают менее сильное действие на рецептор-мишень, чем соединения, в которые они превращаются в результате расщепления. Пролекарства являются особенно полезными в тех случаях, когда требуемое соединение обладает химическими или физическими свойствами, затрудняющими его введение или делающими такое введение неэффективным. Например, требуемое соединение может быть плохо растворимым, может плохо проникать через эпителий слизистой оболочки или может характеризоваться нежелательно коротким периодом полувыведения из плазмы. Пролекарства описаны в публикациях Stella,V.J. et al., "Prodrugs", Drug Delivery Systems, 1985, p. 112-176 и Drugs, 1985, 29, p. 455-473. Пролекарственные формы фармакологически активных соединений по настоящему изобретению обычно представляют собой соединения формулы (Ia) или (Ib), их фармацевтически приемлемые кислотно- или основно-аддитивные соли, стереохимически изомерные формы, таутомерные формы иN-оксиды, содержащие этерифицированную или амидированную кислотную группу. Такими этерифицированными кислотными группами являются группы формулы -COORx, где Rx означает С 1-6 алкил, фенил,бензил или одну из нижеследующих групп: Амидированными группами являются группы формулы -CONRyRx, где Ry означает Н, C1-6 алкил,фенил или бензил и Rx означает -OH, H, C1-6 алкил, фенил или бензил. Из соединений по настоящему изобретению, содержащих аминогруппу, могут быть получены производные соединения с использованием кетона или альдегида, такого как формальдегид, с образованием основания Манниха. Данное основание гидролизуется в водном растворе в соответствии с кинетикой первого порядка. Установлено, что соединения по настоящему изобретению пригодны для лечения микобактериальных заболеваний, в частности заболеваний, вызываемых патогенными микобактериями, в том числе лекарственно устойчивыми микобактериями, такими как Mycobacterium tuberculosis, M.bovis, M.avium,M.smegmatis и M.marinum. Таким образом, настоящее изобретение также относится к вышеуказанным соединениям формулы (Ia) или (Ib), их фармацевтически приемлемым кислотно- или основноаддитивным солям, стереохимически изомерным формам, таутомерным формам и N-оксидам, предназначенным для применения в качестве лекарственного средства. Настоящее изобретение относится также к композиции, содержащей фармацевтически приемлемый носитель и терапевтически эффективное количество соединения по данному изобретению в качестве активного ингредиента. Соединения по настоящему изобретению могут входить в состав различных фармацевтических форм, предназначенных для введения нуждающимся пациентам. В качестве подходящих композиций можно привести все композиции, обычно используемые для системного введения лекарственных средств. Для получения фармацевтических композиций по настоящему изобретению эффективное количество определенного соединения, необязательно в форме аддитивной соли, используемого в качестве активного ингредиента, объединяют в виде гомогенной смеси с фармацевтически приемлемым носителем, который может быть использован в разных формах в зависимости от формы предназначенного для введения препарата. Указанные фармацевтические композиции желательно использовать в виде стандартной лекарственной формы, пригодной, в частности, для перорального или парентерального введения. Например, при получении композиций в виде лекарственной формы для перорального введения можно использовать любые обычно применяемые фармацевтические среды, такие как, например, вода,гликоли, масла, спирты и т.п., в случае жидких препаратов для перорального введения, таких как суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, каолин,разбавители, смазывающие вещества, связывающие вещества, вещества, улучшающие распадаемость, и т.п., в случае порошков, пилюль, капсул и таблеток. Благодаря легкости введения таблетки и капсулы являются наиболее подходящими стандартными лекарственными формами для перорального введения,при изготовлении которых обычно используют твердые фармацевтические носители. При получении композиций для парентерального введения носитель обычно представляет собой стерильную воду, по меньшей мере составляет большую часть, хотя в состав таких композиций могут также входить другие ингредиенты, например, улучшающие растворимость. Например, могут быть получены инъекционные растворы, в которых носителем является физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Кроме того, могут быть получены инъекционные суспензии,которые могут содержать соответствующие жидкие носители, суспендирующие агенты и т.п. В объем настоящего изобретения входят также твердые формы препаратов, преобразуемые непосредственно перед использованием в жидкие формы препаратов. В зависимости от способа введения фармацевтическая композиция предпочтительно содержит от 0,05 до 99 мас.%, более предпочтительно от 0,1 до 70 мас.% активного ингредиента формулы (Ia) или (Ib)-8 011277 и от 1 до 99,95 мас.%, более предпочтительно от 30 до 99,9 мас.% фармацевтически приемлемого носителя; все проценты указаны в расчете на общую массу композиции. Фармацевтическая композиция может дополнительно содержать различные другие ингредиенты,известные в данной области, например смазывающее вещество, стабилизатор, буфер, эмульгатор, вещество, регулирующее вязкость, поверхностно-активное вещество, консервант, ароматизатор или краситель. Вышеуказанные фармацевтические композиции особенно желательно использовать для получения стандартной лекарственной формы, которая характеризуется легкостью введения и однородностью дозы. Термин "стандартная лекарственная форма" в используемом здесь значении означает физически раздельные формы, пригодные для применения в качестве стандартных доз, так как каждая форма содержит заранее определенное количество активного ингредиента, рассчитанное на достижение желаемого терапевтического действия, в сочетании с требуемым фармацевтическим носителем. Примерами таких стандартных лекарственных форм являются таблетки (включая рифленые таблетки или таблетки с покрытием), капсулы, пилюли, пакетики с порошком, облатки, суппозитории, инъекционные растворы или суспензии и т.п., а также указанные препараты, разделенные на несколько частей. Суточная доза соединения по настоящему изобретению является разной в зависимости от используемого соединения, способа введения, требуемого лечения и конкретного микобактериального заболевания. Однако, как правило, удовлетворительные результаты достигаются при введении соединения по настоящему изобретению в виде суточной дозы, не превышающей 1 г, например, в пределах от 10 до 50 мг/кг массы тела. Кроме того, настоящее изобретение относится к применению соединения формулы (Ia) или (Ib), его фармацевтически приемлемых кислотно- или основно-аддитивных солей, стереохимически изомерных форм, таутомерных форм и N-оксидов, а также любых вышеуказанных фармацевтических композиций для приготовления лекарственного средства, предназначенного для профилактики или лечения микобактериальных заболеваний. Другим объектом настоящего изобретения является способ лечения пациента, страдающего или подверженного риску возникновения микобактериального заболевания, который включает введение указанному пациенту терапевтически эффективного количества соединения или фармацевтической композиции по данному изобретению. Соединения по настоящему изобретению могут быть также объединены с одним или несколькими другими антимикобактериальными средствами. Другие антимикобактериальные средства, которые могут быть объединены с соединениями формулы (Ia) или (Ib), включают, например, рифампицин (=рифампин); изониазид; пиразинамид; амикацин; этионамид; моксифлоксацин; этамбутол; стрептомицин; пара-аминосалициловую кислоту; циклосерин; капреомицин; канамицин; тиоацетазон; РА-824; хинолоны/фторхинолоны, такие как, например, офлоксацин, ципрофлоксацин, спарфлоксацин; макролиды, такие как, например, кларитромицин, клофазимин,амоксициллин с клавулановой кислотой; рифамицины; рифабутин; рифапентин. Соединения формулы (Ia) или (Ib) по настоящему изобретению предпочтительно объединяют с рифапентином и моксифлоксацином. Общий способ получения Соединения по настоящему изобретению можно получить путем последовательного выполнения стадий, каждая из которых известна специалисту в данной области. Соединения формулы (Ia), в которых R2 означает алкокси; радикал формулы имеют указанные выше значения; алкилокси, замещенный радикалом формулы где t и Z имеют указанные выше значения; моно- или ди(алкил)амино, где алкил может быть необязательно замещен одним или двумя заместителями, независимо выбираемыми, каждый, из алкилокси, Ar, Het, морфолинила или 2-оксопирролидинила, причем R2 обозначен как R2a и указанные соединения представлены формулой (Ia-1), могут быть получены путем взаимодействия промежуточного соединения формулы (II), гдеW1 означает подходящую уходящую группу, такую как, например, галоген, в частности хлор и т.п., сH-R2a или подходящей солью R2a-H необязательно в присутствии подходящего растворителя, такого как,например, спирт, в частности метанол и т.п., ацетонитрил, и необязательно в присутствии подходящего основания, такого как, например, KOH, дикалийкарбонат Соединения формулы (Ia), в которых R2 означает Het или алкил, причем R2 обозначен как R2b и указанные соединения представлены формулой (Ia-2), могут быть получены путем взаимодействия промежуточного соединения формулы (II) с R2b-B(OH)2 в присутствии подходящего катализатора, такого как,например, Pd(PPh3)4, подходящего растворителя, такого как, например, диметиловый эфир или спирт, в частности метанол и т.п., и подходящего основания, такого как, например, динатрийкарбонат или дикалийкарбонатHet и указанные промежуточные соединения представлены формулой (Ia-3), могут быть получены путем взаимодействия промежуточного соединения формулы (II) с в присутствии подходящего катализатора, такого как, например, Pd(PPh3)4, подходящего растворителя, такого как, например, диметиловый эфир или спирт, в частности метанол и т.п., и подходящего основания, такого как, например, динатрийкарбонат или дикалийкарбонат Соединения формулы (Ia), в которых X означает прямую связь и указанные промежуточные соединения представлены формулой (Ia-4), могут быть получены путем взаимодействия промежуточного соединения формулы (III), где W2 означает подходящую уходящую группу, такую как, например, галоген, в частности, бром, хлор и т.п., с промежуточным соединением формулы (IV) в присутствии подходящего конденсирующего агента, такого как, например, н-бутиллитий, втор-BuLi, в присутствии подходящего растворителя, такого как, например, тетрагидрофуран, и необязательно в присутствии подходящего основания, такого как, например, 2,2,6,6-тетраметилпиперидин, NH(CH2CH2CH3)2, N,N-диизопропиламин или триметилэтилендиамин Соединения формулы (Ib), в которых R9 означает оксо, могут быть получены путем взаимодействия промежуточного соединения формулы (II) с подходящей кислотой, такой как, например, HCl, в присутствии подходящего растворителя, такого как, например, тетрагидрофуран При выполнении вышеописанных реакций полученное соединение формулы (Ia) или (Ib) можно выделить и, при необходимости, очистить методами, известными в данной области, такими как, например, экстракция, кристаллизация, перегонка, растирание в порошок и хроматография. Соединение формулы (Ia) или (Ib), образовавшееся в результате кристаллизации, можно выделить фильтрованием. В противном случае кристаллизацию можно вызвать путем добавления соответствующего растворителя,такого как, например, вода, ацетонитрил, спирт, такой как, например, метанол, этанол, и комбинации указанных растворителей. Альтернативно, реакционную смесь можно также упарить досуха с последующей очисткой остатка хроматографией (например, ВЭЖХ с обращенной фазой, флэш-хроматография и т.п.). Реакционная смесь может быть также очищена хроматографией без предварительного выпаривания растворителя. Соединение формулы (Ia) или (Ib) можно также выделить, выпаривая растворитель, с последующей перекристаллизацией в соответствующем растворителе, таком как, например, вода, ацетонитрил, спирт, такой как, например, метанол, и комбинации указанных растворителей. Специалисту в данной области должно быть известно, какой метод следует использовать, какой растворитель является наиболее подходящим, или необходимо прибегнуть к обычному экспериментированию для определения наиболее подходящего метода выделения. Соединения формулы (Ia) или (Ib) могут быть также получены путем превращения соединений формулы (Ia) в соединения формулы (Ib) и, наоборот, при помощи известных в данной области реакций превращения групп. Соединения формулы (Ia) или (Ib) могут быть превращены в соответствующие N-оксиды при помощи известных в данной области методов превращения трехвалентного азота в его N-оксид. Указанную реакцию N-окисления можно выполнить, осуществляя взаимодействие исходного соединения формулы(Ia) или (Ib) с соответствующим органическим или неорганическим пероксидом. Соответствующие неорганические пероксиды включают, например, пероксид водорода, пероксиды щелочных металлов или щелочно-земельных металлов, например пероксид натрия, пероксид калия; соответствующие органические пероксиды могут включать перкислоты, такие как, например, бензолкарбопероксокислота или галогензамещенная бензолкарбопероксокислота, в частности 3-хлорбензолкарбопероксокислота, пероксоалкановые кислоты, в частности пероксоуксусную кислоту, алкилгидропероксиды, например трет-бутилгидропероксид. Подходящими растворителями являются, например, вода; низшие спирты, такие как этанол и т.п.; углеводороды, например толуол; кетоны, например 2-бутанон; галогенированные углеводороды, например дихлорметан; и смеси таких растворителей. Соединения формулы (Ia), в которых R1 означает галоген и которые представлены формулой (Ia-5),могут быть превращены в соединения формулы (Ia), в которых R1 означает Het, например пиридил, и которые представлены формулой (Ia-6), путем взаимодействия с в присутствии подходящего катализатора, такого как, например, Pd(PPh3)4, подходящего растворителя, такого как, например, диметиловый эфир или спирт, в частности метанол и т.п., и подходящего основания, такого как, например, динатрийкарбонат или дикалийкарбонат Соединения формулы (Ia-5) могут быть также превращены в соединения формулы (Ia), в которыхR1 означает метил и которые представлены формулой (Ia-7), путем взаимодействия с Sn(CH3)4 в присутствии подходящего катализатора, такого как, например, Pd(PPh3)4, подходящего растворителя, такого как, например, толуол Некоторые соединения формулы (I) и некоторые промежуточные соединения по настоящему изобретению могут представлять собой смесь стереохимически изомерных форм. Чистые стереохимически изомерные формы указанных соединений и указанных промежуточных соединений могут быть получены методами, известными в данной области. Например, диастереоизомеры могут быть разделены физическими методами, такими как селективная кристаллизация, или хроматографическими методами, такими как противоточное распределение, жидкостная хроматография и т.п. Энантиомеры могут быть получены из рацемических смесей путем первоначального превращения указанных рацемических смесей с использованием подходящих растворителей, таких как, например, хиральные кислоты, в смеси диастереомерных солей или соединений; физического разделения указанных смесей диастереомерных солей или соединений, например, селективной кристаллизацией или хроматографическими методами, в частности жидкостной хроматографией, и подобными методами; и последующего превращения указанных разделенных диастереомерных солей или соединений в соответствующие энантиомеры. Чистые стереохимически изомерные формы могут быть также получены из чистых стереохимически изомерных форм соответствующих промежуточных соединений и исходных веществ при условии стереоспецифического осуществления промежуточных реакций. Альтернативным методом разделения энантиомерных форм соединений формулы (I) и промежуточных соединений является жидкостная хроматография, в частности жидкостная хроматография с использованием хиральной стационарной фазы. Совершенно очевидно, что продукты реакций, используемые в вышеописанных или нижеследующих препаратах, могут быть выделены из реакционной среды и, при необходимости, очищены методами,известными в данной области, такими как, например, экстракция, кристаллизация, перегонка, растирание в порошок и хроматография. Некоторые промежуточные соединения и исходные вещества являются известными соединениями и могут быть приобретены коммерческим путем или получены методами, известными в данной области. Промежуточные соединения формулы (II), в которых X означает прямую связь и которые представлены формулой (II-а), могут быть получены путем взаимодействия промежуточного соединения формулы (V), в котором W1 имеет указанные выше значения, с промежуточным соединением формулы (IV) в присутствии подходящего связующего вещества, такого как nBuLi, втор-BuLi, в присутствии подходящего растворителя, такого как, например, тетрагидрофуран, и приемлемого основания, такого как, например, 2,2,6,6-тетраметилпиперидин, NH(CH2CH2CH3)2, N,N-диизопропиламин или триметилэтилендиамин Промежуточные соединения формулы (II), в которых X означает CH2 и которые представлены формулой (II-b), могут быть получены путем взаимодействия промежуточного соединения формулы (VI) с промежуточным соединением формулы (IV) в присутствии подходящего конденсирующего агента, такого как nBuLi, втор-BuLi, в присутствии подходящего растворителя, такого как, например, тетрагидрофуран, и подходящего основания, такого как, например, 2,2,6,6-тетраметилпиперидин, NH(CH2CH2CH3)2,N,N-диизопропиламин или триметилэтилендиамин Промежуточные соединения формулы (II), в которых R1 означает водород и которые представлены формулой (II-с), могут быть получены путем взаимодействия промежуточного соединения формулы (V),в котором R1 означает галоген и которые представлены формулой (V-a), с промежуточным соединением формулы (IV) в присутствии подходящего сильного основания, такого как, например, nBuLi, втор-BuLi,и в присутствии подходящего растворителя, такого как, например, тетрагидрофуран Промежуточные соединения формулы (V) являются соединениями, которые могут быть приобретены коммерческим путем или получены методами, известными в данной области. Например, промежуточные соединения формулы (V), в которых R7 означает водород, R6 означает радикал формулы(V-b), могут быть получены в соответствии со следующей схемой реакций 1. Схема 1 На схеме 1 все переменные величины имеют значения, указанные в формуле (Ia). Схема реакций 1 включает стадию (а), на которой должным образом замещенный анилин подвергают взаимодействию с соответствующим ацилхлоридом, таким как 3-фенилпропионилхлорид, 3-фтор-бензолпропионилхлорид или п-хлорбензолпропионилхлорид, в присутствии подходящего основания, такого как триэтиламин, и подходящего инертного растворителя, такого как метиленхлорид или этилендихлорид. Указанная реакция может быть выполнена при температуре в пределах от комнатной температуры до температуры кипячения с обратным холодильником. На следующей стадии (b) аддукт, полученный на стадии (а), подвергают взаимодействию с фосфорилхлоридом (POCl3) в присутствии подходящего растворителя, такого как, например, N,N-диметилформамид (формилирование Вильсмеера-Хаака с последующей циклизацией). Указанная реакция может быть выполнена при температуре в пределах от комнатной температуры до температуры кипячения с обратным холодильником. Очевидно, что продукты реакций, полученные в результате выполнения вышеописанных и нижеследующих реакций, можно выделить из реакционной- 13011277 среды и, при необходимости, подвергнуть дальнейшей очистке методами, известными в данной области,такими как экстракция, кристаллизация и хроматография. Кроме того, очевидно, что продукты реакций,существующие в нескольких энантиомерных формах, могут быть выделены из их смесей известными методами, в частности препаративной хроматографией, такой как препаративная ВЭЖХ. Обычно соединения формулы (Ia) и (Ib) могут быть разделены на изомерные формы. Промежуточные соединения формулы (V-a), в которых W1 означает хлор и которые представлены формулой (V-a-1), могут быть получены путем взаимодействия промежуточного соединения формулы Промежуточные соединения формулы (VII) могут быть получены путем взаимодействия промежуточного соединения формулы (VIII) с 4-метилбензолсульфонилхлоридом в присутствии подходящего растворителя, такого как, например, метиленхлорид, и подходящего основания, такого как, например,дикалийкарбонат Промежуточные соединения формулы (VIII) могут быть получены путем взаимодействия промежуточного соединения формулы (IX) с подходящим окислителем, таким как, например, 3-хлорбензолкарбопероксокислота, в присутствии подходящего растворителя, такого как, например, метиленхлорид Промежуточные соединения формулы (IX), в которых R6 означает водород и R7 означает фенил и которые представлены формулой (IX-а), могут быть получены путем взаимодействия промежуточного соединения формулы (X) с 3-хлор-1-фенил-1-пропаноном в присутствии подходящей кислоты, такой как,например, хлористо-водородная кислота, гексагидрат хлорида железа, хлорид цинка, и подходящего растворителя, такого как, например, диэтиловый эфир и подходящий спирт, например, этанол Промежуточные соединения формулы (IX), в которых R7 означает водород и R6 означает радикал где s означает целое число, равное 1, и которые представлены формулой (IX-b), могут формулы быть получены путем взаимодействия промежуточного соединения формулы (XI) в присутствии дифенилового эфира Промежуточные соединения формулы (XI) могут быть получены путем взаимодействия промежуточного соединения формулы (XII) с промежуточным соединением формулы (XIII) в присутствии подходящего основания, такого как, например, гидроксид натрия Промежуточные соединения формулы (IV) являются соединениями, которые могут быть приобретены коммерческим путем или получены методами, известными в данной области. Например, промежуточные соединения формулы (IV), в которых q равно 1 и которые представлены формулой (IV-a), могут быть получены в соответствии со схемой реакций 2. Схема 2 Схема реакций 2 включает стадию (а), на которой соответствующий элемент R3 подвергают взаимодействию по реакции Фриделя-Крафтса с соответствующим ацилхлоридом, таким как 3-хлорпропионилхлорид или 4-хлорбутирилхлорид, в присутствии подходящей кислоты Льюиса, такой как AlCl3, FeCl3, SnCl4, TiCl4 или ZnCl2, и подходящего инертного растворителя, такого как метиленхлорид или этиленхлорид. Указанная реакция может быть выполнена при температуре в пределах от комнатной температуры до температуры кипячения с обратным холодильником. На следующей стадии (b) в полученное соединение вводят аминогруппу (например, -NR4R5), осуществляя взаимодействие промежуточного соединения, полученного на стадии (а), с соответствующим амином. Промежуточные соединения формулы (IV-a) могут быть также получены путем взаимодействия промежуточного соединения формулы (XIV) с НС(=O)Н и подходящей аминогруппой HNR4R5, такой как, например, NH(CH3)2 HCl, в присутствии подходящего растворителя, такого как, например, спирт, в частности метанол, этанол и т.п., и подходящей кислоты, такой как, например, хлористо-водородная кислота Промежуточные соединения формулы (VI), в которых W1 означает хлор и которые представлены формулой (VI-а), могут быть получены путем взаимодействия промежуточного соединения формулы(XV) с POCl3 в присутствии хлорида бензилтриэтиламмония (агент фазового переноса) и подходящего растворителя, такого как, например, ацетонитрил Промежуточные соединения формулы (XV), в которых R6 означает радикал формулы гдеs означает целое число, равное 1, и которые представлены формулой (XV-a), могут быть получены путем взаимодействия промежуточного соединения формулы (XVI) с NH2-NH2 в присутствии подходящего Соединение которое является промежуточным соединением формулы (XVI), может быть получено путем взаимодействия 1-(2-аминофенил)этанона и этилового эфира -оксобензолпропановой кислоты. Промежуточные соединения формулы (III), в которых R2 означает C1-6 алкилокси и которые представлены формулой (III-а), могут быть получены путем взаимодействия промежуточного соединения формулы (XVII) с соответствующей C1-6 алкил-O-солью в присутствии подходящего растворителя, такого как, например, соответствующий C1-6 алкил-ОН Промежуточные соединения формулы (XVII) могут быть получены путем взаимодействия промежуточного соединения формулы (XVIII) с POCl3 Промежуточные соединения формулы (XVIII), в которых R7 означает водород и R6 означает ради где s означает целое число, равное 0, и которые представлены формулой кал формулы(XVIII-a), могут быть получены путем циклизации промежуточного соединения формулы (XIX) в присутствии AlCl3 и подходящего растворителя, такого как, например, хлорбензол В промежуточных соединениях формулы (III) заместитель R1 может означать галоген, который может занять место уходящей группы W2. Указанные промежуточные соединения формулы (III) представ лены формулой Нижеследующие примеры иллюстрируют настоящее изобретение, не ограничивая его объем. Экспериментальная часть В некоторых соединениях абсолютная стереохимическая конфигурация одного или нескольких стереогенных атомов углерода не была определена экспериментально. В таких случаях стереохимически изомерная форма, выделенная первой, обозначена как "A" и форма, выделенная второй, обозначена как"B" без последующей ссылки на действительную стереохимическую конфигурацию. Однако указанные изомерные формы "A" и "B" могут быть однозначно охарактеризованы специалистом в данной области при помощи методов, известных в данной области, таких как, например, дифракция рентгеновских лучей. Указанный метод выделения подробно описан ниже.- 16011277 В нижеследующем описании термин "т.пл. " означает температуру плавления, "DIPE" означает диизопропиловый эфир, "ДМФА" означает N,N-диметилформамид, "ТГФ" означает тетрагидрофуран,"EtOAc" означает этилацетат, "DCM" означает дихлорметан.A. Получение промежуточных соединений. Пример A1. Получение промежуточного соединения 1 Бензолпропаноилхлорид (0,488 моль) по каплям добавляли при комнатной температуре к раствору 4-бромбензоламина (0,407 моль) в Et3N (70 мл) и DCM (700 мл) и смесь перемешивали при комнатной температуре в течение ночи. Смесь выливали в воду и концентрированный раствор NH4OH и экстрагировали DCM. Органический слой сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток кристаллизовали из диэтилового эфира. Остаток (119,67 г) разводили DCM и промывали 1 н. растворомHCl. Органический слой сушили (MgSO4), фильтровали и растворитель выпаривали, получая 107,67 г промежуточного соединения 1 (87%). Пример A2. Получение промежуточного соединения 2 Трихлорид фосфора (1,225 моль) по каплям добавляли при 10 С к ДМФА (0,525 моль). Затем добавляли промежуточное соединение 1 (0,175 моль) при комнатной температуре. Смесь перемешивали в течение ночи при 80 С, выливали на лед и экстрагировали DCM. Органический слой сушили (MgSO4),фильтровали и растворитель выпаривали. Продукт использовали без дальнейшей очистки, получая 77,62 г промежуточного соединения 2 (67%). Пример A3. а) Получение промежуточного соединения 3 Смесь промежуточного соединения 2 (0,233 моль) в 30% растворе MeONa в MeOH (222,32 мл) иMeOH (776 мл) перемешивали и кипятили с обратным холодильником в течение ночи, затем выливали на лед и экстрагировали DCM. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток очищали хроматографией на колонке с силикагелем (элюент: DCM/циклогексан,20/80 и затем 100/0; 20-45 мкм). Чистые фракции собирали и растворитель выпаривали, получая 25 г промежуточного соединения 3 (33%). Вышеописанным способом было получено нижеследующее промежуточное соединение. Промежуточное соединение 29b) Получение промежуточного соединения 4 Смесь промежуточного соединения 2 (0,045 моль) в 21% растворе EtONa в EtOH (50 мл) и EtOH(150 мл) перемешивали и кипятили с обратным холодильником в течение 12 ч. Смесь выливали на лед и экстрагировали DCM. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали, получая 15,2 г промежуточного соединения 4 (98%). Пример A4. а) Получение промежуточного соединения 5 Хлорид алюминия (1,31 моль) добавляли при комнатной температуре к смеси N-(3-бромфенил)-(фенилметилен)бензолацетамида (0,1311 моль) в хлорбензоле (500 мл). Смесь перемешивали и кипятили с обратным холодильником в течение 3 ч, затем охлаждали до комнатной температуры, выливали в смесь воды со льдом и фильтровали. Фильтрат промывали H2O, затем циклогексаном и сушили, получая 35,5 г промежуточного соединения 5 (95%).b) Получение промежуточного соединения 6 и промежуточного соединения 7 Смесь промежуточного соединения 5 (0,2815 моль) в трихлориде фосфора (320 мл) перемешивали и кипятили с обратным холодильником в течение 1 ч, затем охлаждали до комнатной температуры и растворитель выпаривали досуха. Остаток разводили водой. Смесь экстрагировали DCM. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали досуха. Остаток (58,2 г) очищали хроматографией на колонке с силикагелем (элюент: толуол/циклогексан, 80/20; 15-35 мкм). Собирали две фракции и растворитель выпаривали, получая 21 г промежуточного соединения 6 и 34,5 г промежуточного соединения 7. с) Получение промежуточного соединения 8 Смесь промежуточного соединения 6 (0,0659 моль) и 30% раствора MeONa в MeOH (0,329 моль) вMeOH (300 мл) перемешивали и кипятили с обратным холодильником в течение 2 дней, затем охлаждали до комнатной температуры, выливали в смесь воды со льдом и фильтровали. Фильтрат промывали H2O и сушили, получая 19 г промежуточного соединения 8 (92%). Пример A5. а) Получение промежуточного соединения 9 Смесь 5-бром-1 Н-индол-2,3-диона (0,28 моль) в 3 н. растворе NaOH (650 мл) перемешивали и нагревали при 80 С в течение 30 мин, затем охлаждали до комнатной температуры. Добавляли бензолпропаналь (0,28 моль), смесь перемешивали и кипятили с обратным холодильником в течение ночи. Затем смеси давали охладиться до комнатной температуры и подкисляли до рН 5, добавляя HOAc. Осадок отфильтровывали, промывали H2O и сушили (вакуум), получая 50 г промежуточного соединения 9 (52%).b) Получение промежуточного соединения 10 Смесь промежуточного соединения 9 (0,035 моль) в 1,1'-оксибисбензоле (100 мл) перемешивали и нагревали при 300 С в течение 8 ч, затем давали охладиться до комнатной температуры. Указанную процедуру осуществляли четыре раза. Четыре смеси объединяли и очищали хроматографией на колонке с силикагелем (элюент: DCM/MeOH, 100/0, затем 99/1). Чистые фракции собирали и растворитель выпаривали, получая 25,6 г промежуточного соединения 10 (61%). Пример A6. а) Получение промежуточного соединения 11(250 мл) и смесь перемешивали в течение 30 мин. Затем добавляли гексагидрат хлорида железа(0,237 моль) и хлорид цинка (0,014 моль) и смесь перемешивали при 80 С в течение 30 мин. Добавляли 3-хлор-1-фенил-1-пропанон (0,146 моль) и смесь перемешивали при 80 С в течение одной ночи. Смесь выливали в воду и экстрагировали EtOAc. Органический слой промывали водой, затем 10% растворомK2CO3, сушили (MgSO4), отфильтровывали и упаривали. Остаток (25 г) очищали хроматографией на колонке с силикагелем (элюент: DCM/MeOH, 100/0 и затем 97/3) (35-70 мкм). Чистые фракции собирали и упаривали, получая 17,5 г промежуточного соединения 11 (44%).b) Получение промежуточного соединения 12 3-Хлорбензолкарбопероксокислоту (0,12 моль) добавляли порциями при комнатной температуре к раствору промежуточного соединения 11 (0,0598 моль) в DCM (200 мл) и смесь перемешивали при комнатной температуре в течение одной ночи. Затем добавляли 10% раствор K2CO3, органический слой декантировали, сушили (MgSO4), отфильтровывали и упаривали до 150 мл объема промежуточного соединения 12. с) Получение промежуточного соединения 13 4-Метилбензолсульфонилхлорид (0,075 моль) добавляли порциями при комнатной температуре к раствору промежуточного соединения 12 (0,0598 моль) в 10% растворе K2CO3 (150 мл) и DCM (150 мл) и смесь перемешивали при комнатной температуре в течение одной ночи. Затем добавляли диэтиловый эфир и отфильтровывали. Осадок промывали диэтиловым эфиром и упаривали досуха, получая 14 г промежуточного соединения 13 (78%).d) Получение промежуточного соединения 14 Смесь промежуточного соединения 13 (0,047 моль) в трихлориде фосфора (150 мл) перемешивали и кипятили с обратным холодильником в течение 48 ч. Смесь упаривали, остаток разводили NH4OH и экстрагировали DCM. Органический слой сушили (MgSO4), отфильтровывали и упаривали, получая 13 г промежуточного соединения 14 (87%). Пример A7. а) Получение промежуточного соединения 15(1,48 моль) перемешивали при 180 С в течение ночи. Затем смесь охлаждали до комнатной температуры. Осадок фильтровали, промывали диэтиловым эфиром и сушили. Остаток кристаллизовали из DIPE. Осадок отфильтровывали и сушили, получая 56,6 г промежуточного соединения 15 (58%).b) Получение промежуточного соединения 16 Смесь промежуточного соединения 15 (0,076 моль) и гидразина (0,76 моль) в 1,2-этандиоле (240 мл) перемешивали при 100 С в течение 1 ч. Добавляли KOH (0,266 моль). Смесь перемешивали при 180 С в течение ночи. Добавляли H2O. Смесь подкисляли и экстрагировали DCM. Органический слой отделяли,сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток (12,05 г) кристаллизовали из DIPE. Осадок отфильтровывали и сушили, получая 4,74 г промежуточного соединения 16. с) Получение промежуточного соединения 17 Трихлорид фосфора (0,057 моль) медленно добавляли при 80 С к смеси промежуточного соединения 16 (0,019 моль) и хлорида бензилтриэтиламмония (0,0532 моль) в ацетонитриле (50 мл). Смесь перемешивали в течение ночи. Растворитель выпаривали. Смесь выливали в смесь 10% раствора Na2CO3 со льдом и экстрагировали DCM. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали, получая 4,08 г промежуточного соединения 17.- 19011277 Пример A8. а) Получение промежуточного соединения 18 и промежуточного соединения 19 Смесь хлорида алюминия (0,257 моль) и 3-хлорпропаноилхлорида (0,234 моль) в 1,2-дихлорэтане(100 мл) перемешивали при 0 С. Добавляли раствор нафталина (0,234 моль) в 1,2-дихлорэтане (100 мл). Смесь перемешивали при 0 С в течение 1 ч и выливали в смесь воды со льдом. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток (56 г) очищали хроматографией на колонке с силикагелем (элюент: циклогексан/DCM, 60/40; 20-45 мкм). Собирали две фракции и растворитель выпаривали, получая 2 фракции: 31 г фракции 1 в виде промежуточного соединения 18(61%) и 14 г фракции 2. Фракцию 2 разводили DIPE, образовавшийся осадок отфильтровывали и сушили,получая 8,2 г промежуточного соединения 19.b) Получение промежуточного соединения 20 Смесь промежуточного соединения 18 (0,0137 моль), N-метилбензолметанамина (0,015 моль) иK2CO3 (2 г) в ацетонитриле (100 мл) перемешивали при 80 С в течение 2 ч. Добавляли H2O. Смесь экстрагировали DCM. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали, получая 4,2 г промежуточного соединения 20 (100%). Пример A9. Получение промежуточного соединения 21 Смесь 1-(3,5-дифторфенил)этанона (0,013 моль), формальдегида (0,05 моль) и гидрохлорида Nметилметанамина (0,052 моль) в концентрированном растворе HCl (0,1 мл) в EtOH (20 мл) перемешивали при 80 С в течение 20 ч, затем охлаждали до комнатной температуры. Растворитель выпаривали досуха. Остаток разводили 3 н. раствором HCl. Смесь промывали диэтиловым эфиром, подщелачивали K2CO3 и экстрагировали диэтиловым эфиром. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали, получая 2 г промежуточного соединения 21. Пример A10. а) Получение промежуточного соединения 22 и промежуточного соединения 23 1,6 М раствор бутиллития (0,12 моль) по каплям добавляли при -10 С в токе N2 к раствору 2,2,6,6-тетраметилпиперидина (0,12 моль) в ТГФ (200 мл). Смесь перемешивали при -10 С в течение 20 мин и затем охлаждали до -70 С. Добавляли смесь промежуточного соединения 2 (0,1 моль) в ТГФ(100 мл). Смесь перемешивали при -70 С в течение 45 мин. Добавляли раствор 3-(диметиламино)-1 фенил-1-пропанона (0,1 моль) в ТГФ (100 мл). Смесь перемешивали при -70 С в течение 1 ч, доводили до -50 С и гидролизовали. Добавляли H2O (100 мл) при -50 С. Смесь перемешивали при комнатной температуре в течение 30 мин и экстрагировали EtOAc. Органический слой отделяли, сушили (MgSO4),фильтровали и растворитель выпаривали. Остаток разводили EtOAc. Осадок отфильтровывали, промывали EtOAc и диэтиловым эфиром и сушили в вакууме, получая 4 г промежуточного соединения 23 (8%). Маточный раствор упаривали. Остаток (26 г) очищали хроматографией на колонке с силикагелем (элюент: DCM/MeOH/NH4OH, 97/3/0,1; 15-40 мкм). Требуемые фракции собирали и растворитель выпаривали. Остаток кристаллизовали из диэтилового эфира. Осадок отфильтровывали и сушили, получая 1 г промежуточного соединения 22. Вышеописанным способом были получены нижеследующие промежуточные соединения.b) Получение промежуточного соединения 24 1,6 М раствор бутиллития (0,0094 моль) по каплям добавляли при -20 С к смеси 2,2,6,6-тетраметилпиперидина (0,0094 моль) в ТГФ (20 мл) в токе N2. Смесь перемешивали при -20 С в течение 20 мин, затем охлаждали до -70 С. Добавляли раствор 6-бром-2-хлор-3-фенилхинолина(0,0062 моль) в ТГФ (40 мл). Смесь перемешивали при -70 С в течение 1 ч. Добавляли раствор промежуточного соединения 21 (0,0094 моль) в ТГФ (25 мл). Смесь перемешивали при температуре от -70 С до комнатной температуры в течение 18 ч. Добавляли H2O и EtOAc. Органический слой промывали насыщенным раствором NaCl, сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток (4,3 г) очищали хроматографией на колонке с силикагелем (элюент: DCM/MeOH/NH4OH, 97/3/0,1; 10 мкм). Чистые фракции собирали и растворитель выпаривали, получая 0,77 г промежуточного соединения 24(23%). Вышеописанным способом были получены нижеследующие промежуточные соединения. Промежуточное соединение 32- 21011277 с) Получение промежуточного соединения 28(0,029 моль) в ТГФ (50 мл) в токе N2. Смесь перемешивали в течение 20 мин, затем охлаждали до -70 С. Добавляли раствор промежуточного соединения 2 (0,024 моль) в ТГФ (30 мл). Смесь перемешивали при(20 мл). Смесь перемешивали при -70 С в течение 1 ч, затем доводили до -20 С и экстрагировали EtOAc. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток очищали хроматографией на колонке с силикагелем (элюент: DCM/MeOH/NH4OH, 96/4/0,1; 20-45 мкм). Чистые фракции собирали и растворитель выпаривали. Остаток (4,65 г) кристаллизовали из DIPE. Осадок отфильтровывали и сушили, получая 2,7 г промежуточного соединения 28 (т.пл.: 168 С). Маточный раствор упаривали, получая еще 1,7 г промежуточного соединения 28.d) Получение промежуточного соединения 25 1,6 М раствор бутиллития (0,0112 моль) по каплям добавляли при -20 С к растворуN-(1-метилэтил)-2-пропанамина (0,0112 моль) в ТГФ (20 мл) в токе N2. Смесь перемешивали при -20 С в течение 30 мин, затем охлаждали до -70 С. Добавляли раствор промежуточного соединения 17(0,0094 моль) в ТГФ (20 мл). Смесь перемешивали в течение 45 мин. Добавляли раствор промежуточного соединения 21 (0,0112 моль) в ТГФ (10 мл). Смесь перемешивали при -70 С в течение 2 ч, выливали вH2O при -30 С и экстрагировали EtOAc. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток (4 г) очищали хроматографией на колонке с силикагелем (элюент:DCM/MeOH, 98/2; 15-40 мкм). Чистые фракции собирали и растворитель выпаривали. Остаток (3 г) кристаллизовали из DIPE. Осадок отфильтровывали и сушили, получая 1,94 г промежуточного соединения 25 (43%) (т.пл.: 140 С). е) Получение промежуточного соединения 26 1,6 М раствор бутиллития (0,013 моль) по каплям добавляли при -30 С к смеси N-(1-метилэтил)-2 пропанамина (0,013 моль) в ТГФ (20 мл) в токе N2. Смесь перемешивали при -20 С в течение 30 мин,затем охлаждали до -70 С. Добавляли раствор 2-хлор-4-метил-3-фенилхинолина (0,011 моль) в ТГФ(20 мл). Смесь перемешивали в течение 45 мин. Добавляли раствор промежуточного соединения 21(0,013 моль) в ТГФ (10 мл). Смесь перемешивали при -70 С в течение 2 ч, выливали в H2O и экстрагировали EtOAc. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток (5 г) очищали хроматографией на колонке с силикагелем (элюент: DCM/MeOH, 98/2; 15-40 мкм). Чистые фракции собирали и растворитель выпаривали, получая 4 г промежуточного соединения 26 (78%).f) Получение промежуточного соединения 27 1,6 М раствор бутиллития в гексане (0,0075 моль) по каплям добавляли при -70 С к смеси промежуточного соединения 14 (0,0062 моль) в ТГФ (20 мл) в токе N2. Смесь перемешивали при -70 С в течение 1 ч. Добавляли раствор промежуточного соединения 21 (0,0075 моль) в ТГФ (10 мл) при -70 С. Смесь- 22011277 перемешивали при температуре от -70 С до комнатной температуры в течение 18 ч. Добавляли H2O. Смесь экстрагировали EtOAc. Органический слой промывали насыщенным раствором NaCl, сушили(MgSO4), фильтровали и растворитель выпаривали. Остаток (3 г) очищали хроматографией на колонке с силикагелем (элюент: DCM/MeOH/NH4OH, 97/3/0,1; 15-40 мкм). Чистые фракции собирали и растворитель выпаривали, получая 1,1 г промежуточного соединения 27 (39%). Вышеописанным способом были получены нижеследующие промежуточные соединения. Промежуточное соединение 35 1,6 М раствор бутиллития (0,0019 моль) по каплям добавляли при -70 С к смеси промежуточного соединения 8 (0,0016 моль) в ТГФ (5 мл) в токе N2. Смесь перемешивали при -70 С в течение 1 ч. Добавляли раствор промежуточного соединения 21 (0,0019 моль) в ТГФ (2 мл). Затем добавляли H2O. Смесь экстрагировали DCM. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток очищали хроматографией на колонке с силикагелем (элюент: DCM/MeOH/NH4OH,98/2/0,1; 10 мкм). Чистые фракции собирали и растворитель выпаривали, получая 0,2 г соединения 1- 23011277 Вышеописанным способом были получены нижеследующие конечные соединения. Соединение 18 (МН+: 463) Бутиллитий (0,0035 моль) по каплям добавляли при -20 С к раствору N-(1-метилэтил)-2 пропанамина (0,0034 моль) в ТГФ (10 мл) в токе N2. Смесь перемешивали при -20 С в течение 20 мин,затем охлаждали до -70 С. Добавляли раствор промежуточного соединения (0,0029 моль) в ТГФ (10 мл). Смесь перемешивали при -70 С в течение 2 ч. Затем добавляли раствор промежуточного соединения 21(0,0032 моль) в ТГФ (10 мл) при -70 С. Смесь перемешивали при -70 С в течение 3 ч, выливали в смесь воды со льдом и экстрагировали DCM. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток (1,4 г) очищали хроматографией на колонке с силикагелем (элюент:DCM/MeOH/NH4OH, 99/1/0,1; 15-40 мкм). Требуемую фракцию собирали и растворитель выпаривали. Остаток (0,968 г) очищали хроматографией на колонке с силикагелем (элюент: DCM/MeOH/NH4OH,98/2/0,2; 15-40 мкм). Чистые фракции собирали и растворитель выпаривали. Остаток сушили, получая 30% раствор MeONa (2 мл) добавляли при комнатной температуре к смеси промежуточного соединения 23 (0,002 моль) в MeOH (2 мл). Смесь перемешивали и кипятили с обратным холодильником в течение ночи, выливали на лед и экстрагировали DCM. Органический слой отделяли, сушили (MgSO4),фильтровали и растворитель выпаривали. Остаток (0,62 г) очищали хроматографией на колонке с силикагелем (элюент: DCM/MeOH/NH4OH, 95/5/0,5; 15-40 мкм). Чистые фракции собирали и растворитель выпаривали. Полученный остаток (0,39 г) кристаллизовали из DIPE. Осадок отфильтровывали и сушили,получая 0,15 г соединения 3 (т.пл.: 66 С). Вышеописанным способом были получены нижеследующие конечные соединения. Соединение 12 (т.пл.: 170 С) Соединение 24 (т.пл.: 215 С) в виде соли этандикислоты (1:1) Соединение 30 (т.пл.: 132 С) в виде соли этандикислоты (1:1) Смесь промежуточного соединения 25 (0,0004 моль) и пирролидина (0,0021 моль) перемешивали при 90 С в течение ночи, выливали в H2O и экстрагировали DCM. Органический слой отделяли, сушили(MgSO4), фильтровали и растворитель выпаривали. Остаток (0,18 г) очищали хроматографией на колонке с силикагелем (элюент: DCM/MeOH/NH4OH, 98/2/0,1; 10 мкм). Требуемую фракцию собирали и растворитель выпаривали, получая 0,043 г соединения 4 (20%, МН+: 516). Вышеописанным способом были получены нижеследующие конечные соединения. Соединение 31 (МН+: 532) Соединение 32 (т.пл.: 152 С) в виде соли этандикислоты (1:2) Соединение 36 (т.пл.: 158 С) в виде соли этандикислоты (1:3) Смесь промежуточного соединения 25, 2-фуранилбороновой кислоты (0,0012 моль),тетракис-(трифенилфосфин)палладия (0,0013 моль) и 2 М раствора Na2CO3 (0,002 моль) в диметиловом эфире (7 мл) перемешивали при 90 С в течение ночи, затем выливали в H2O и экстрагировали DCM. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток (0,2 г) очищали хроматографией на колонке с силикагелем (элюент: DCM/MeOH, 95/5; 15-40 мкм). Чистые фракции собирали и растворитель выпаривали. Остаток (0,12 г) очищали хроматографией на колонке с силикагелем (элюент: DCM/MeOH/NH4OH, 99/1/0,1; 20 мкм). Чистые фракции собирали и растворитель выпаривали, получая 0,06 г соединения 5 (28%, т.пл.: 130 С). Вышеописанным способом были получены нижеследующие конечные соединения. Смесь промежуточного соединения 35 (0,0005 моль), метилбороновой кислоты (0,0011 моль),тетракис-(трифенилфосфин)палладия (0,0005 моль) и 2 М раствора K2CO3 (0,0028 моль) в диметиловом эфире (10 мл) и MeOH (3 мл) перемешивали при 100 С в течение 24 ч, затем охлаждали до комнатной температуры. Добавляли H2O. Смесь экстрагировали EtOAc. Органический слой промывали насыщенным раствором NaCl, сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток (0,19 г) очищали хроматографией на колонке с кромасилом (элюент: DCM/MeOH/NH4OH 95/5/0,1; 10 мкм). Чистые фракции собирали и растворитель выпаривали, получая 0,06 г соединения 6 (28%, МН+: 387, масло). Вышеописанным способом было получено нижеследующее конечное соединение. Соединение 43 (МН+: 397) Смесь промежуточного соединения 23 (0,0019 моль), морфолина (0,0021 моль) и K2CO3 (0,3 г) в ацетонитриле (10 мл) перемешивали и кипятили с обратным холодильником в течение ночи, выливали на лед и экстрагировали DCM. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток (0,58 г) очищали хроматографией на колонке с силикагелем (элюент:DCM/MeOH/NH4OH, от 95/5/0,1 до 94/6/0,5; 15-40 мкм). Требуемую фракцию собирали и растворитель выпаривали. Полученный остаток (0,04 г) кристаллизовали из DIPE. Осадок отфильтровывали и сушили,получая 0,023 г соединения 7 (т.пл.: 70 С). Вышеописанным способом были получены нижеследующие конечные соединения. Соединение 44 (т.пл.: 136 С)
МПК / Метки
МПК: C07D 215/22, C07D 401/06, C07D 405/06, C07D 405/04, C07D 401/04, C07D 215/14, C07D 401/14, C07D 215/38, A61K 31/4709, C07D 401/12, A61K 31/47
Метки: микобактерий, ингибиторов, хинолина, применение, производные, качестве
Код ссылки
<a href="https://eas.patents.su/30-11277-proizvodnye-hinolina-i-ih-primenenie-v-kachestve-ingibitorov-mikobakterijj.html" rel="bookmark" title="База патентов Евразийского Союза">Производные хинолина и их применение в качестве ингибиторов микобактерий</a>
Предыдущий патент: Новые ингибиторы протеазы hiv
Следующий патент: Применение ротиготина для лечения и предупреждения синдрома “паркинсонизм – плюс”
Случайный патент: Способ характеристики полинуклеотидов












