Уретаны, мочевины, амиды и родственные ингибиторы фактора xa
Номер патента: 15918
Опубликовано: 30.12.2011
Авторы: Малахов Дмитрий Викторович, Товбин Дмитрий Геннадьевич, Тарасов Дмитрий Николаевич
Формула / Реферат
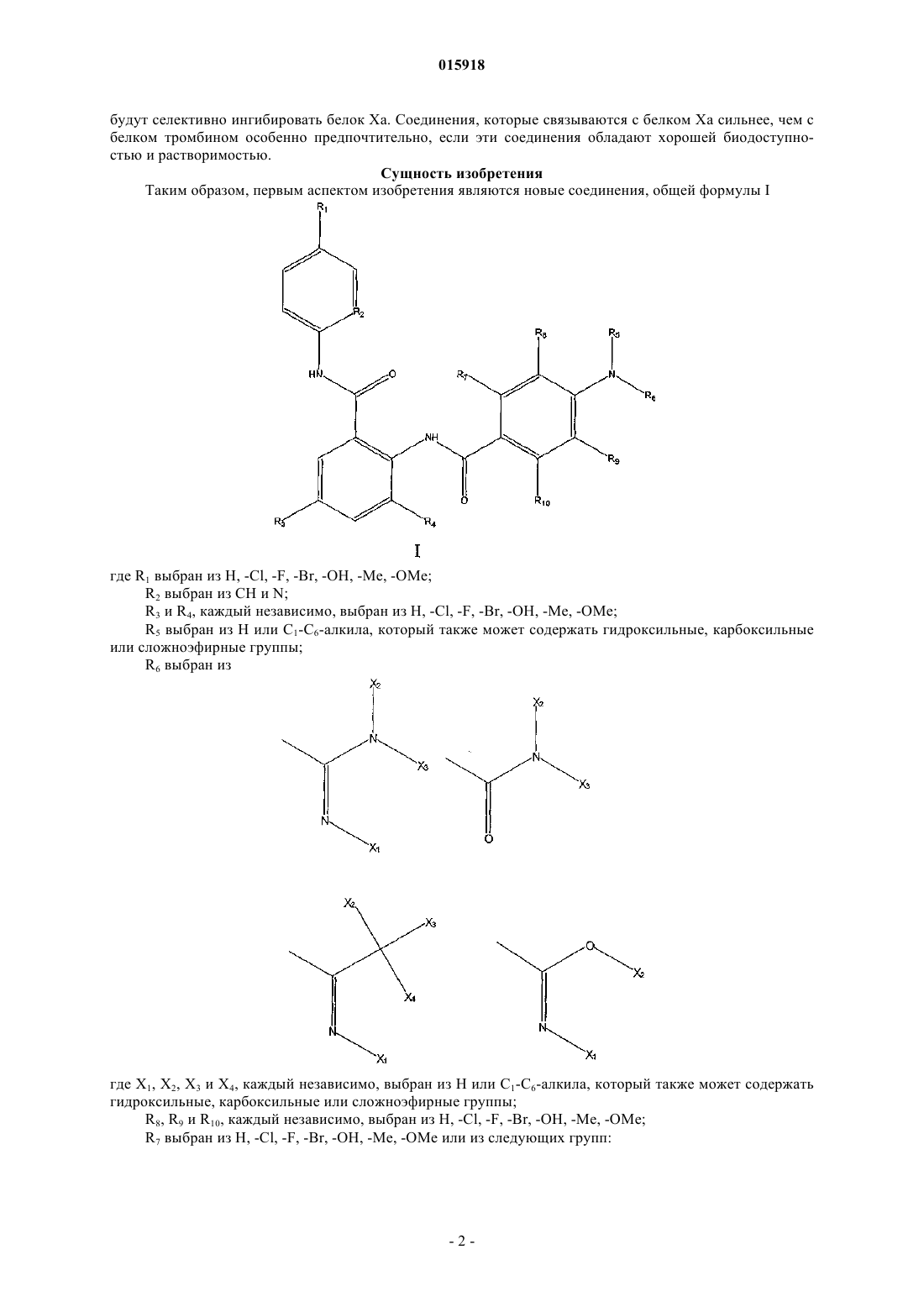
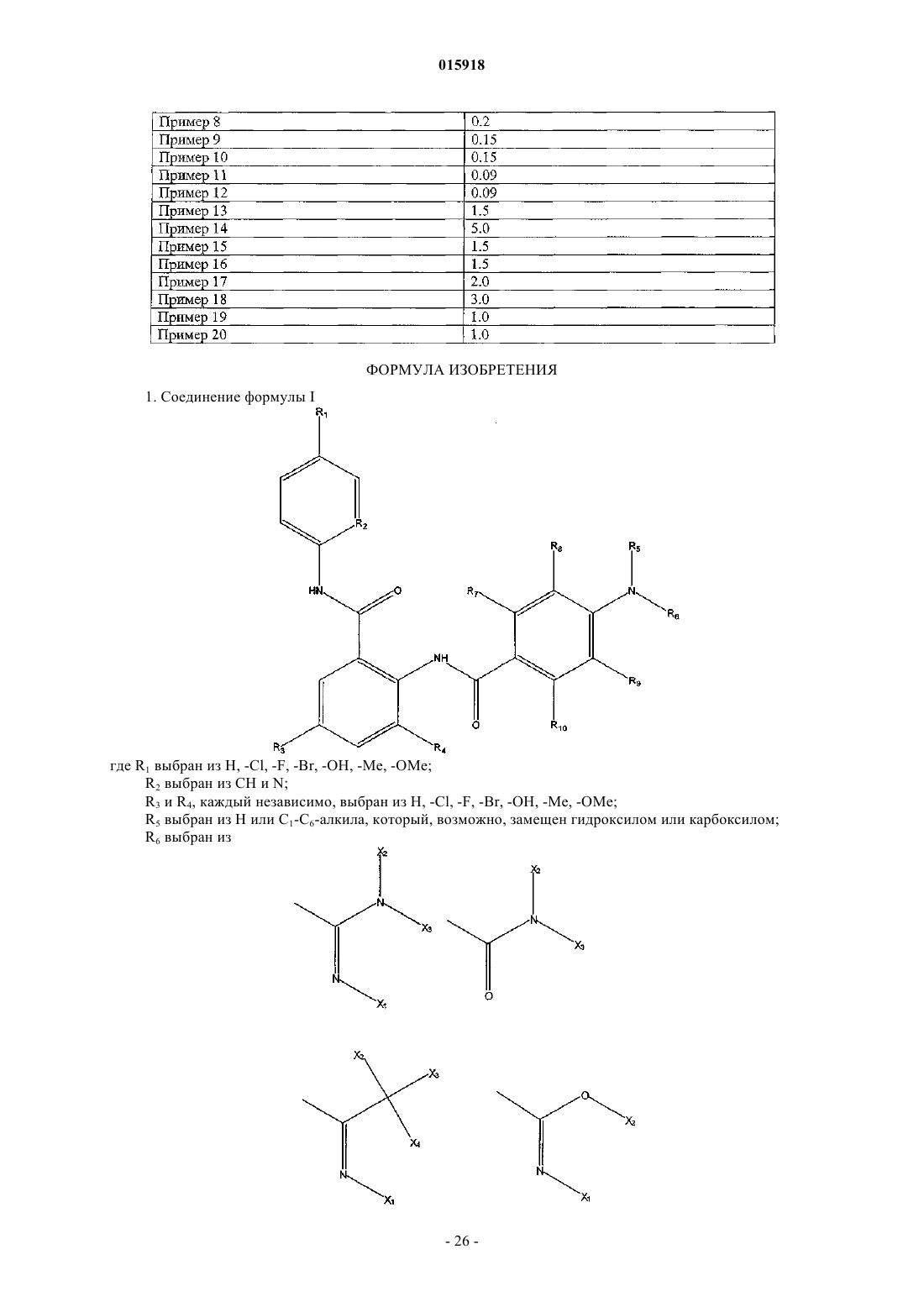
1. Соединение формулы I
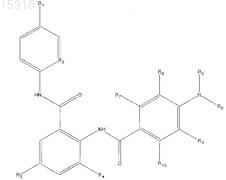
где R1выбран из Н, -Cl, -F, -Br, -ОН, -Me, -OMe;
R2 выбран из СН и N;
R3 и R4, каждый независимо, выбран из Н, -Cl, -F, -Br, -ОН, -Me, -OMe;
R5 выбран из Н или C1-С6-алкила, который, возможно, замещен гидроксилом или карбоксилом;
R6 выбран из
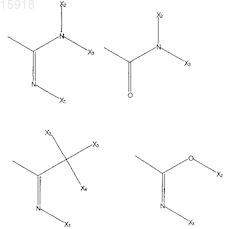
где X1, X2, Х3 и Х4, каждый независимо, выбран из Н или C1-С6-алкила, который, возможно, замещен гидроксилом или карбоксилом;
R8, R9и R10, каждый независимо, выбран из Н, -Cl, -F, -Br, -OH, -Me, -OMe;
R7 выбран из H, -Cl, -F, -Br, -OH, -Me, -OMe или из следующих групп:
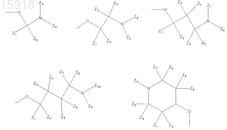
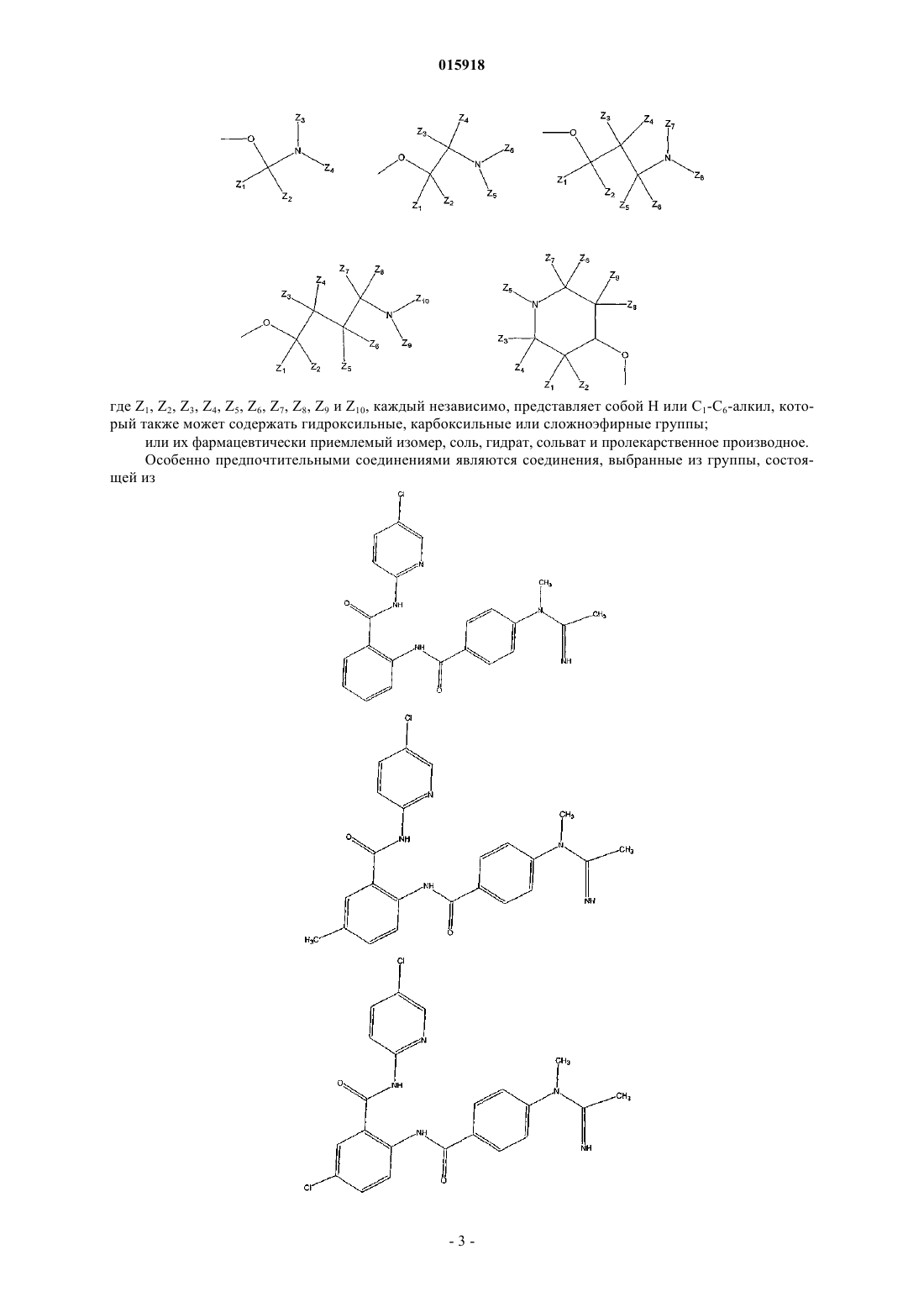
где Z1, Z2, Z3, Z4, Z5, Z6, Z7, Z8, Z9 и Z10, каждый независимо, представляет собой Н или C1-С6-алкил, который возможно замещен гидроксилом, или карбоксилом, или карбонилом;
или его фармацевтически приемлемые соль, гидрат, сольват.
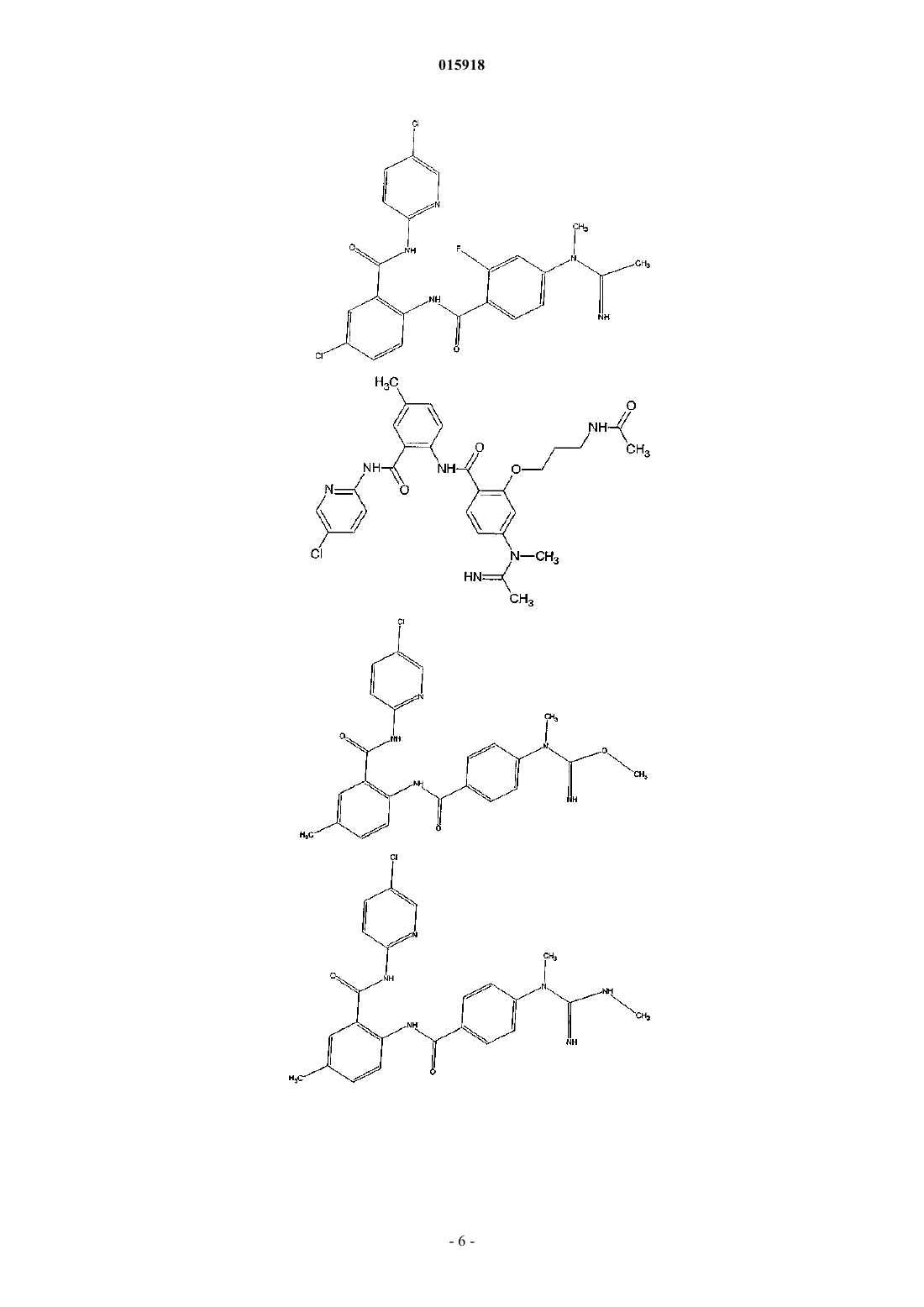
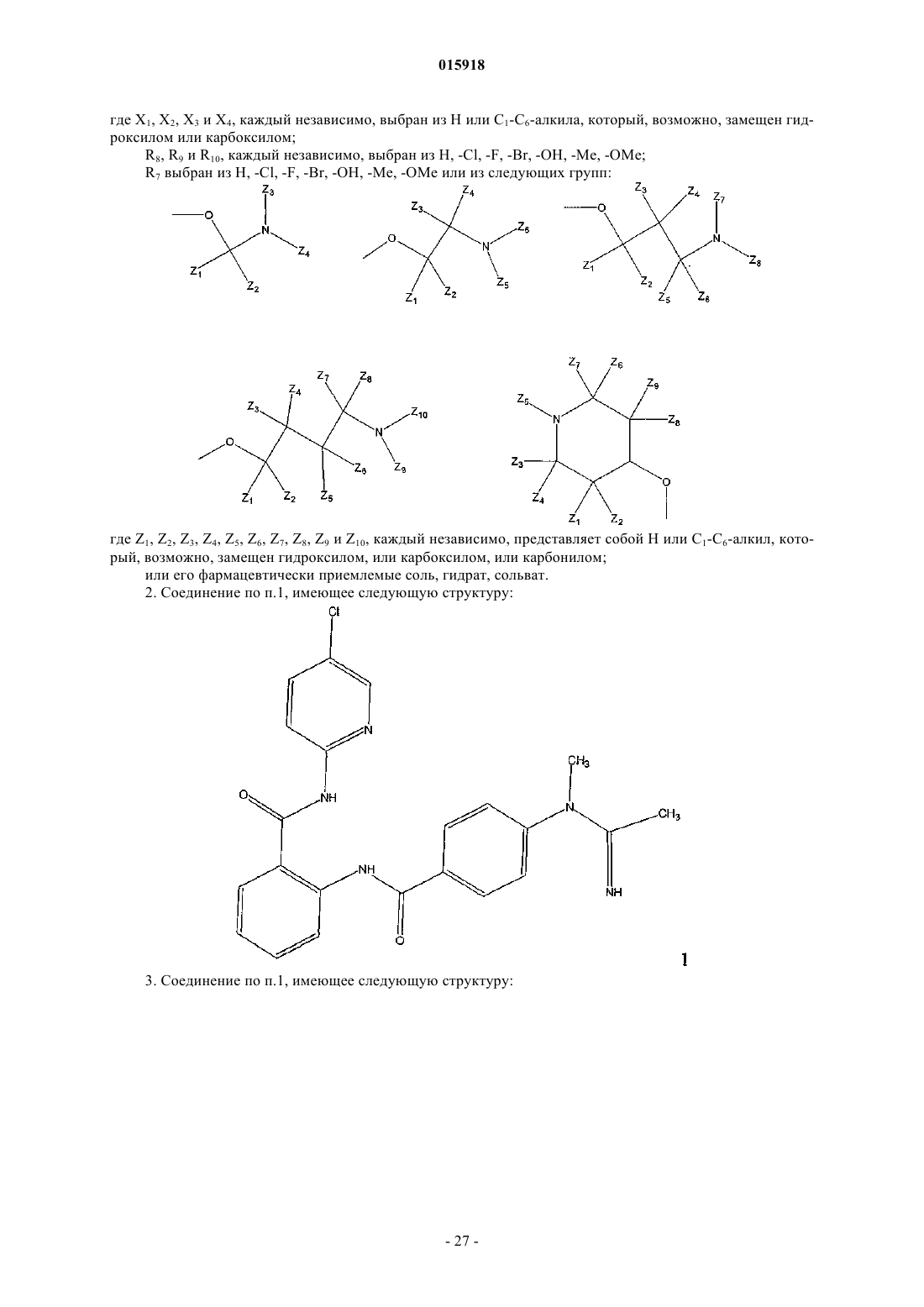
2. Соединение по п.1, имеющее следующую структуру:
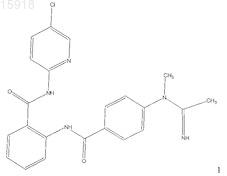
3. Соединение по п.1, имеющее следующую структуру:
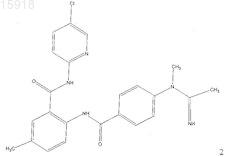
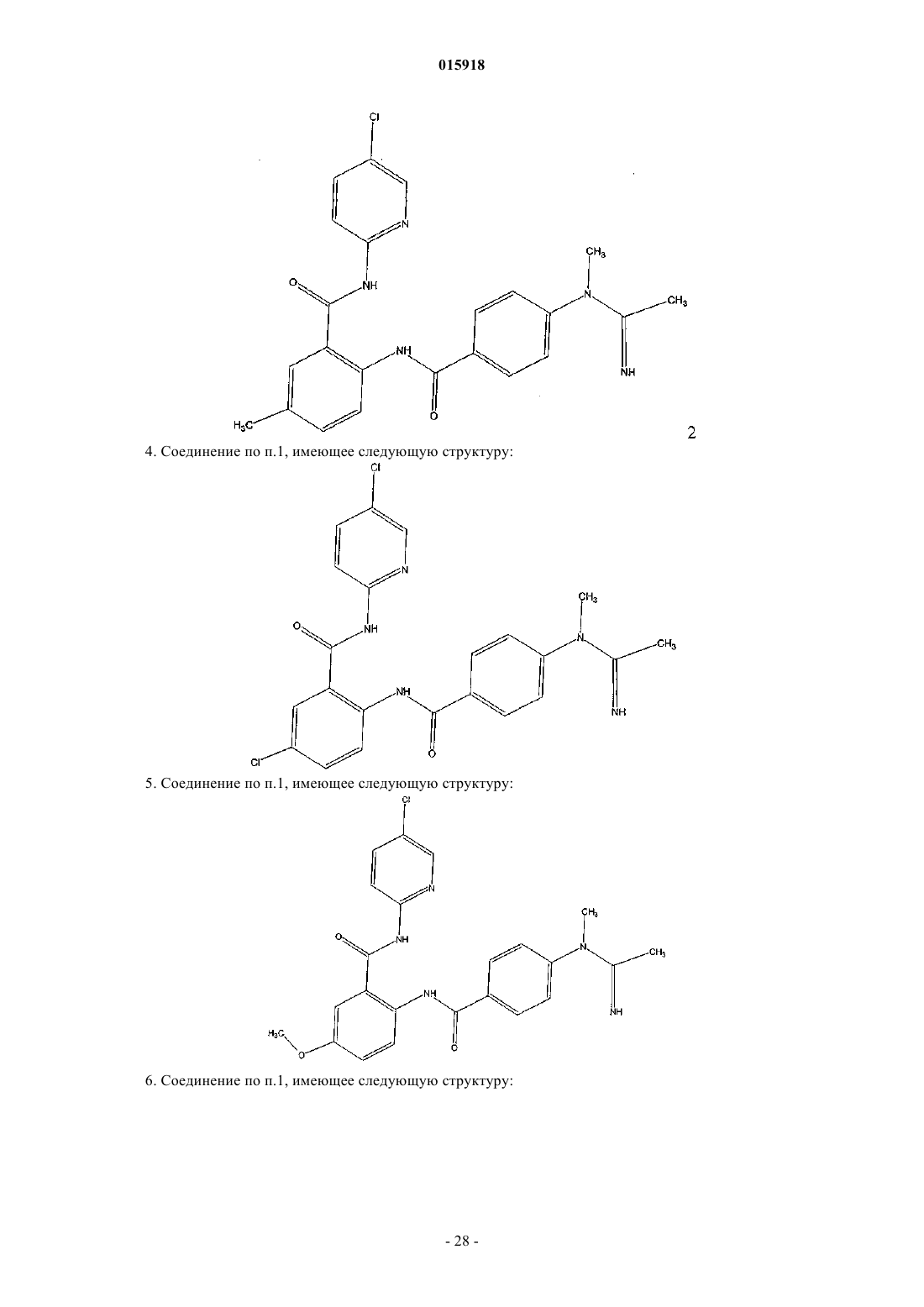
4. Соединение по п.1, имеющее следующую структуру:
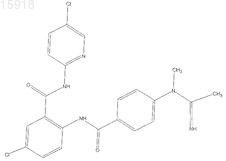
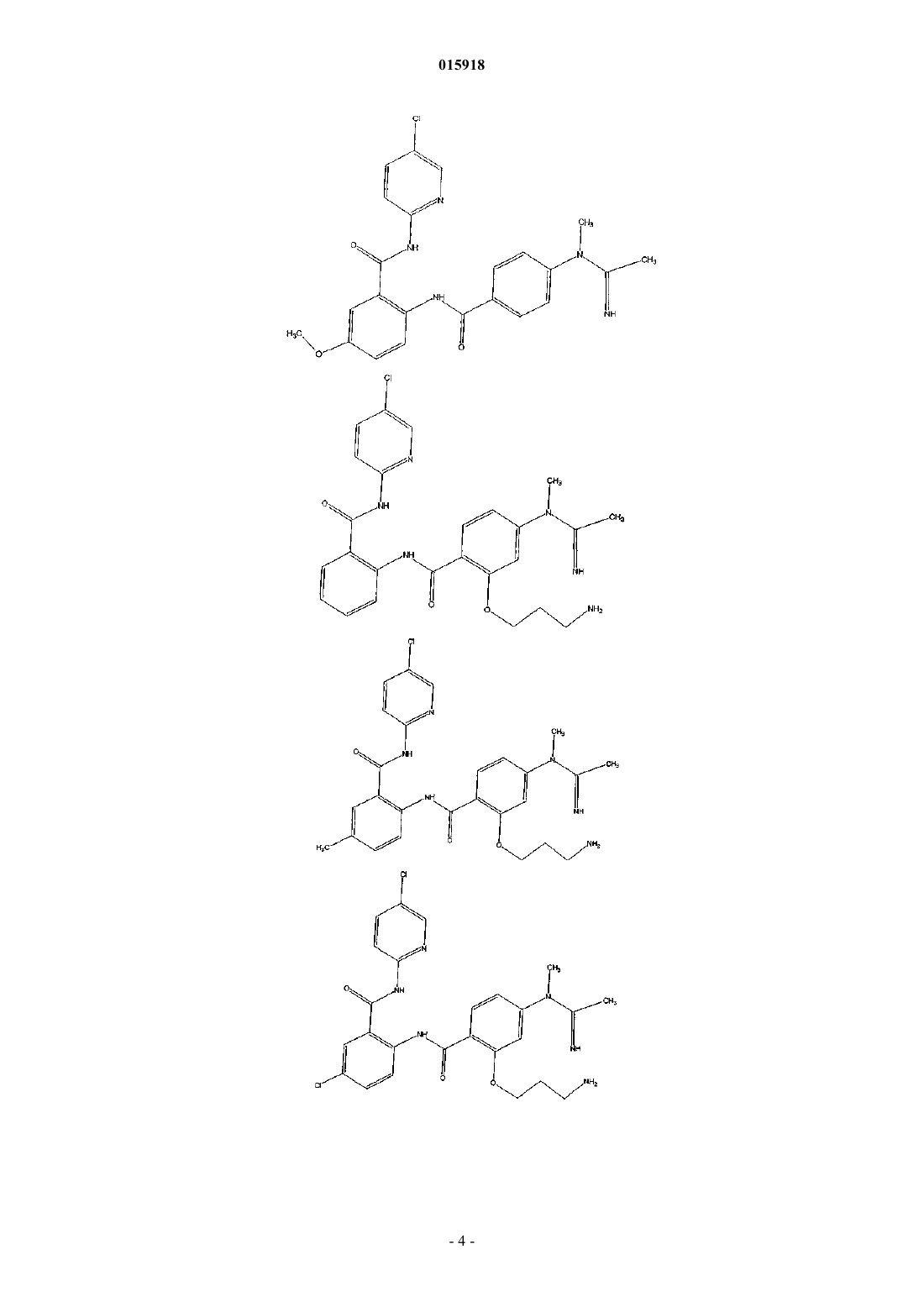
5. Соединение по п.1, имеющее следующую структуру:
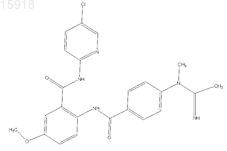
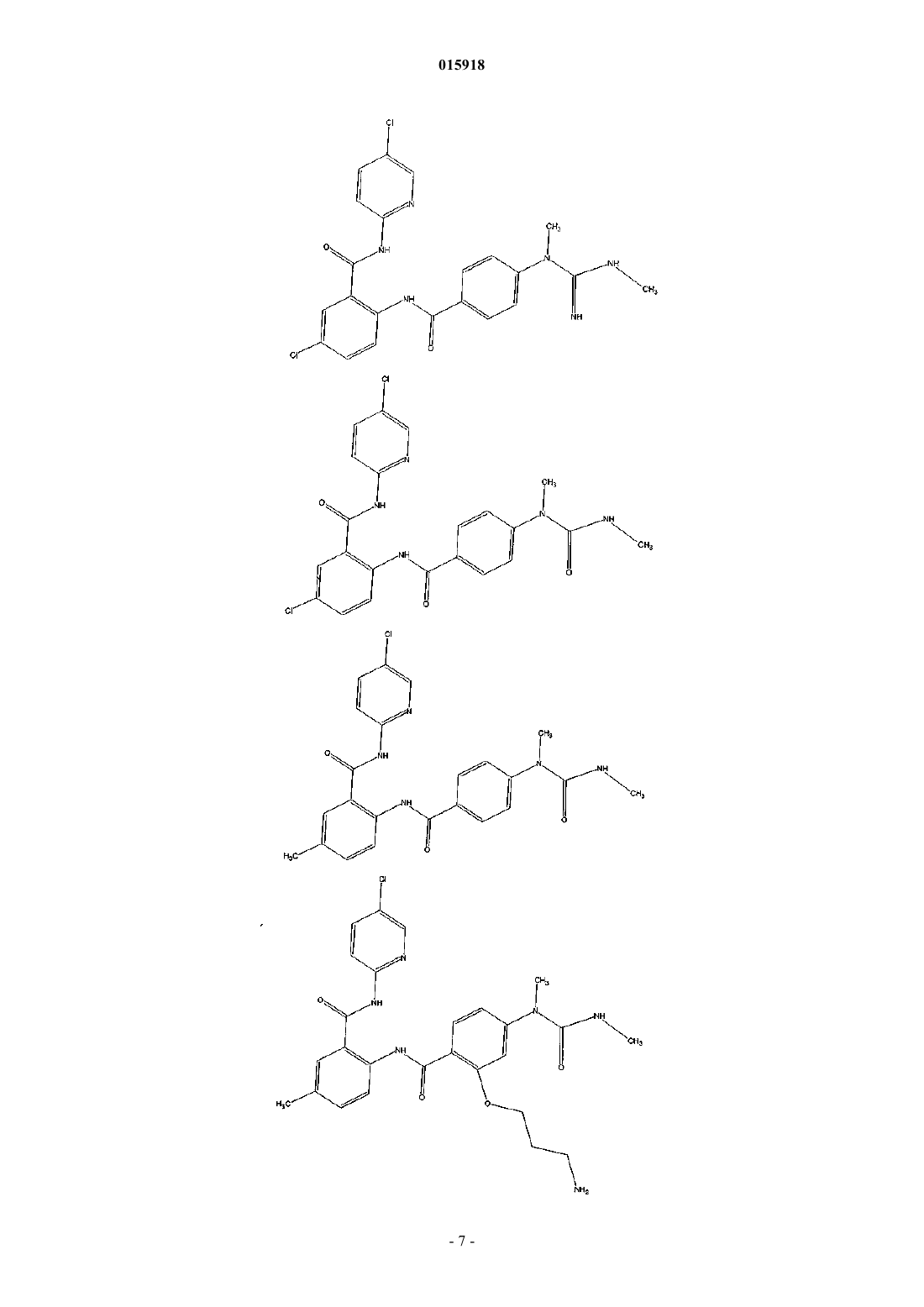
6. Соединение по п.1, имеющее следующую структуру:

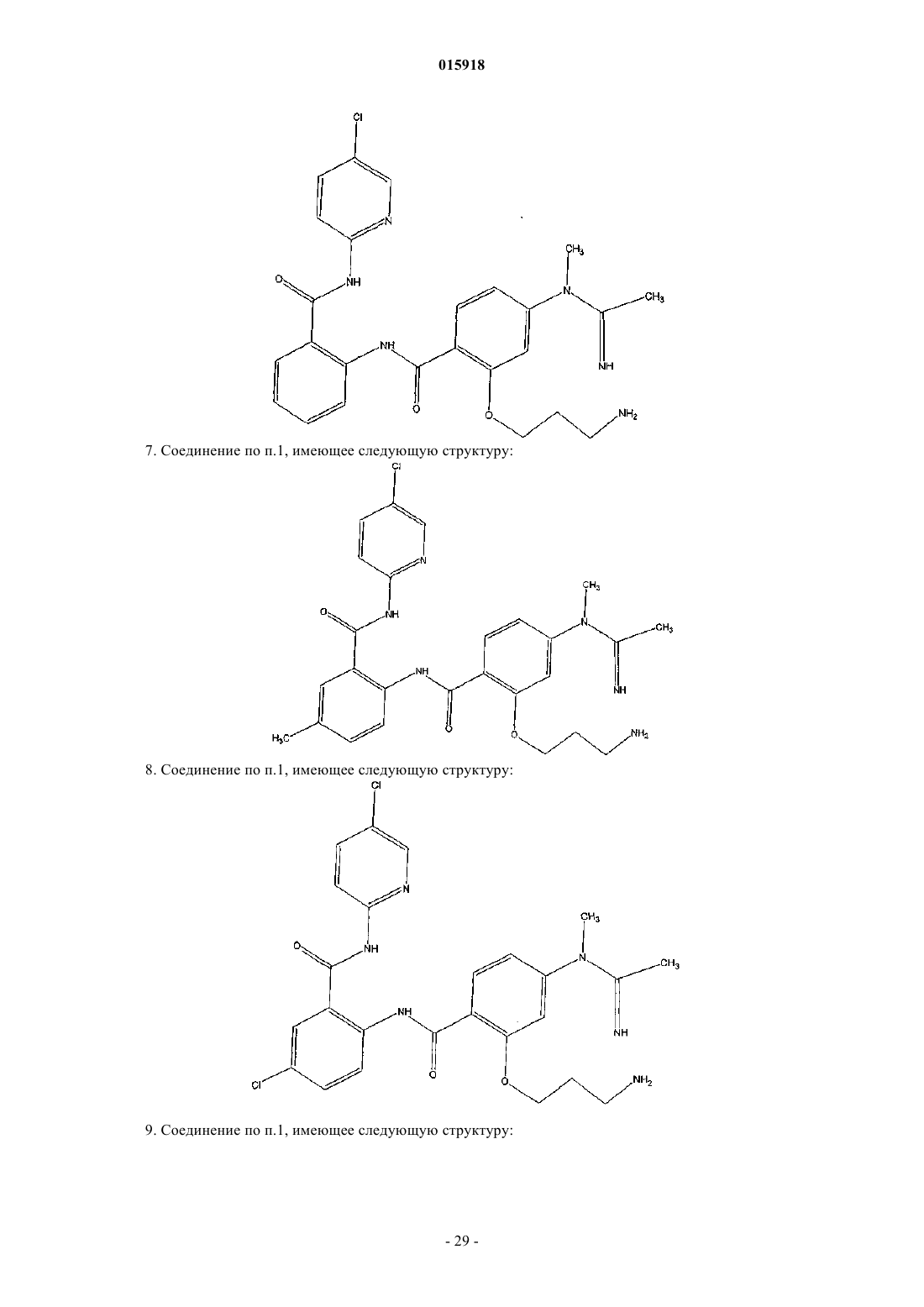
7. Соединение по п.1, имеющее следующую структуру:
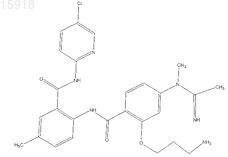
8. Соединение по п.1, имеющее следующую структуру:
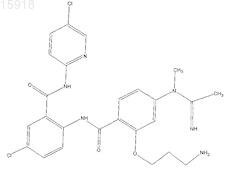
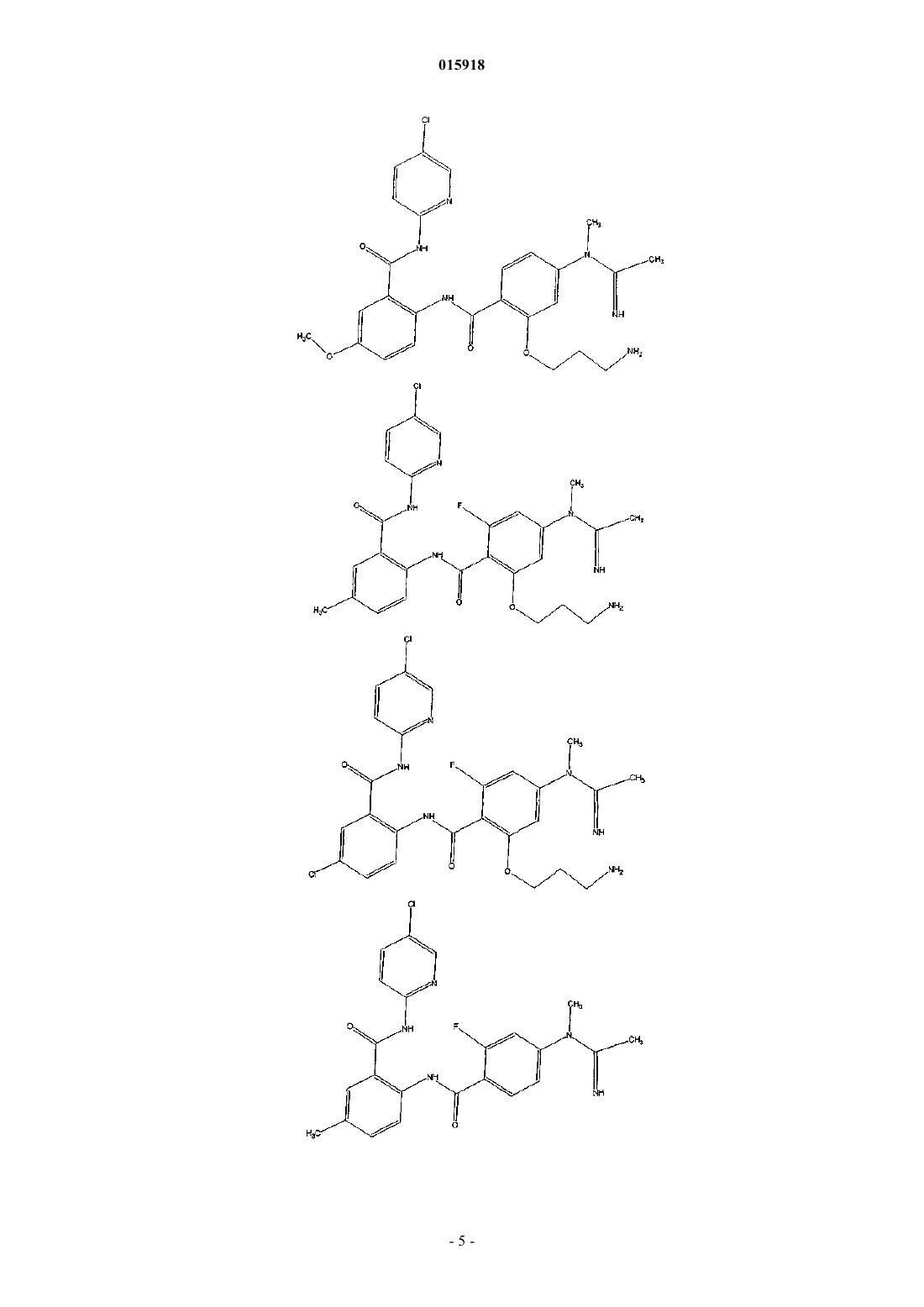
9. Соединение по п.1, имеющее следующую структуру:
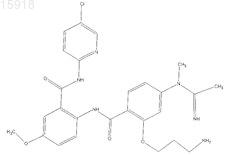
10. Соединение по п.1, имеющее следующую структуру:
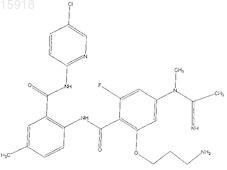
11. Соединение по п.1, имеющее следующую структуру:
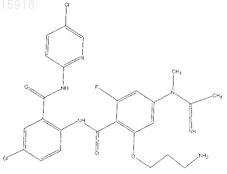
12. Соединение по п.1, имеющее следующую структуру:
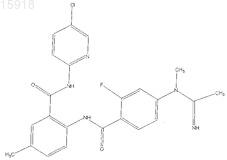
13. Соединение по п.1, имеющее следующую структуру:

14. Соединение по п.1, имеющее следующую структуру:
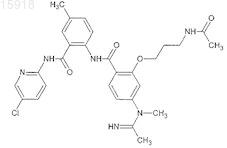
15. Соединение по п.1, имеющее следующую структуру:
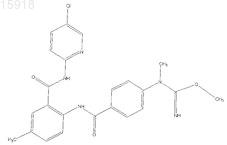
16. Соединение по п.1, имеющее следующую структуру:
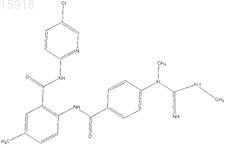
17. Соединение по п.1, имеющее следующую структуру:
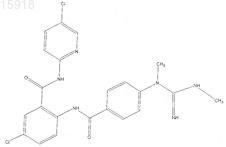
18. Соединение по п.1, имеющее следующую структуру:
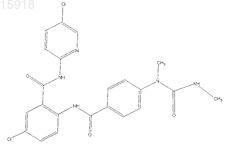
19. Соединение по п.1, имеющее следующую структуру:
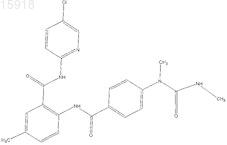
20. Соединение по п.1, имеющее следующую структуру:
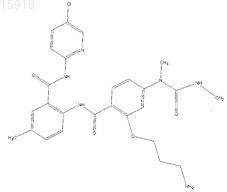
21. Соединение по п.1, имеющее следующую структуру:
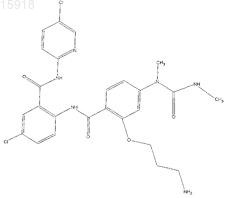
22. Фармацевтическая композиция для профилактики или лечения состояния млекопитающего, характеризующегося нежелательным тромбозом, содержащая терапевтически эффективное количество соединения по любому из пп.1-21.
23. Способ профилактики или лечения состояния млекопитающего, характеризующегося нежелательным тромбозом, включающий введение терапевтически эффективного количества соединения по любому из пп.1-21.
24. Способ по п.23, где указанное состояние представляет собой острый коронарный синдром, инфаркт миокарда, нестабильную стенокардию, рефрактерную стенокардию, тромбозы, вызванные посттромболитической терапией или коронарной ангиопластикой, острый ишемический цереброваскулярный синдром, эмболический инсульт, тромботический инсульт, преходящие ишемические приступы, венозный тромбоз, глубокий венозный тромбоз, тромбоэмболию легочной артерии, коагулопатию, рассеянную внутрисосудистую коагуляцию, тромбоцитопенический акроангиотромбоз, облитерирующий тромбангиит, тромбозные заболевания, связанные с гепариноиндуцированной тромбоцитопенией, тромбические осложнения, связанные с искусственным кровообращением, тромбические осложнения, связанные с протезными устройствами.
25. Способ ингибирования коагуляции фактора Ха в крови или плазме, включающий стадию введения в образец соединения по любому из пп.1-21.
Текст
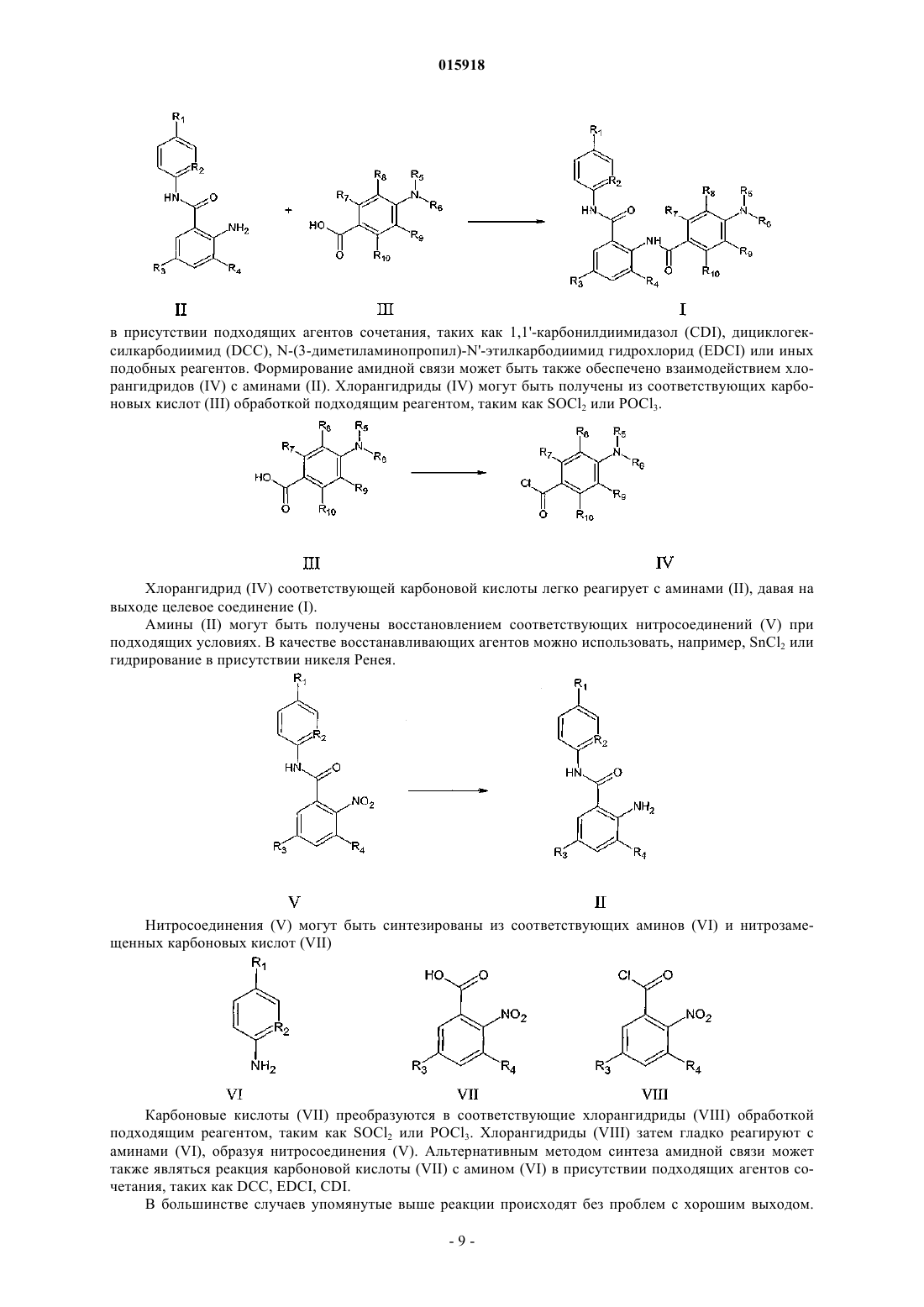
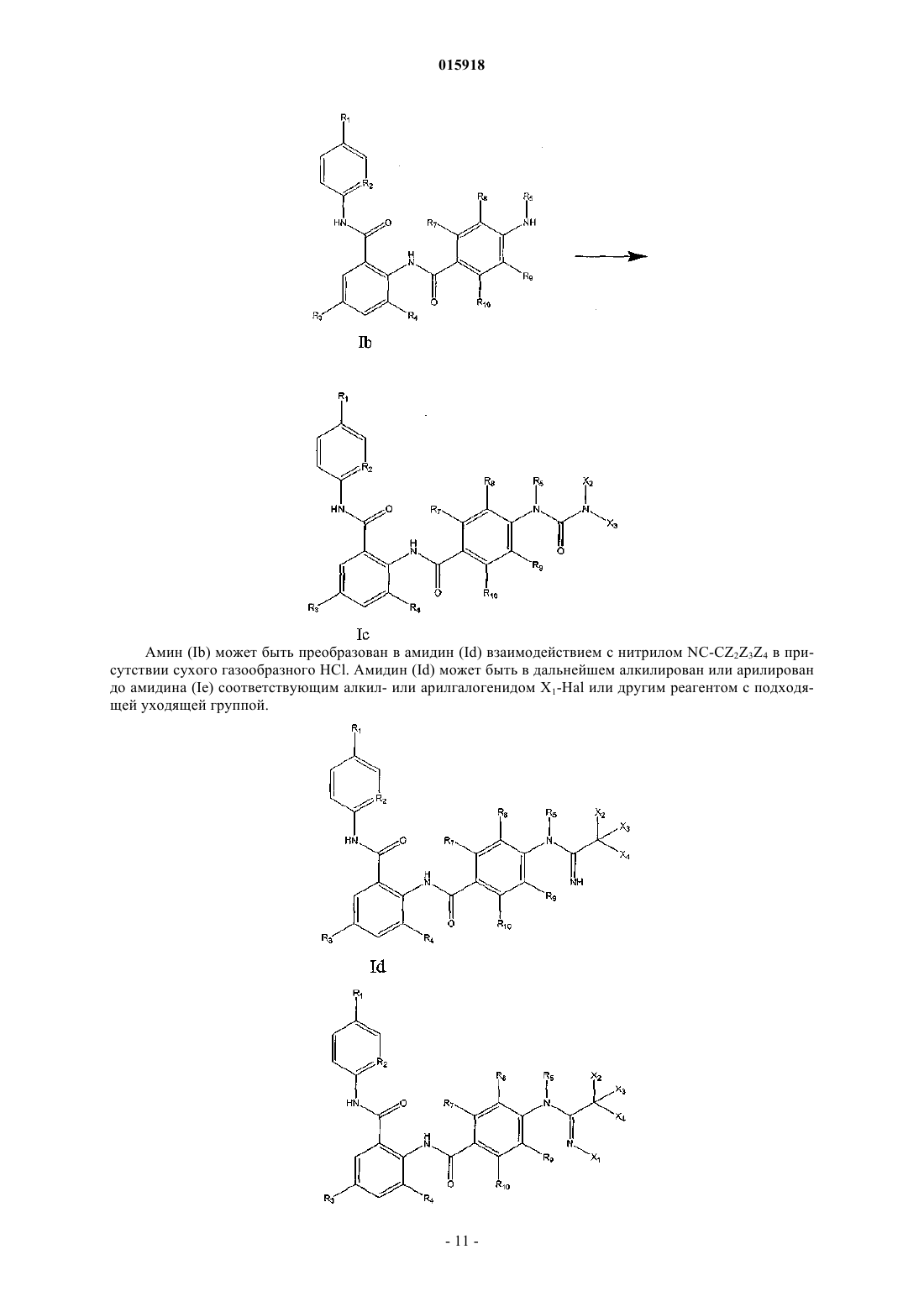
Дата публикации и выдачи патента Номер заявки УРЕТАНЫ, МОЧЕВИНЫ, АМИДЫ И РОДСТВЕННЫЕ ИНГИБИТОРЫ ФАКТОРА Xa(71)(73) Заявитель и патентовладелец: ТОВБИН ДМИТРИЙ ГЕННАДЬЕВИЧ (RU) Данное изобретение относится к новому классу соединений общей формулы I, их фармацевтически приемлемым солям и их фармацевтически приемлемым композициям, которые эффективны как селективные ингибиторы фактора Ха как в изолированном состоянии, так и в комплексе с другими белками. Новые соединения, описанные в изобретении, могут использоваться для лечения и профилактики болезней, таких как острый коронарный синдром,инфаркт миокарда, нестабильная стенокардия, рефрактерная стенокардия, тромбозы, вызванные посттромболитической терапией или коронарной ангиопластикой, острый ишемический цереброваскулярный синдром, эмболический инсульт, тромботический инсульт и ряда других болезней у человека и млекопитающих, связанных со свертываемостью крови. 015918 Область техники, к которой относится изобретение Данное изобретение относится к новому классу веществ, эффективных и селективных ингибиторов фактора Ха как в изолированном состоянии, так и в комплексе с другими белками. Данное изобретение также относится к новому классу веществ, их фармацевтически приемлемым солям, их фармацевтически приемлемым композициям, которые могут быть использованы как эффективные и селективные ингибиторы свертываемости крови у человека и других млекопитающих. Данное изобретение также относится к новым методам использования новых классов веществ для лечения болезней, связанных с нарушением свертываемости крови у человека и других млекопитающих. Уровень техники Контроль за кровотечением осуществляется либо хирургическими методами, либо воздействием на физиологическое состояние кровеносных сосудов, либо на свертываемость крови. Данное изобретение касается свертываемости крови и ее роли в поддержании работоспособности человеческого организма при повреждениях, воспалениях, болезнях, природных дефектах, дисфункциях и других проблемах. Тромбин - ключевой белок в процессе свертываемости крови. Тромбин играет главную роль в процессе тромбообразования благодаря своей возможности катализировать превращение фибриногена в фибрин. Прямые и косвенные ингибиторы тромбина до недавнего времени были объектами различных подходов к контролю свертываемости крови. Claeson, G.,"Synthetic Peptides and Peptidomimetics as Substratesand Inhibitors of Thrombin and Other Proteases in the Blood Coagulation System", Blood Coag. Fibrinol. 5,411-436 (1994). Некоторые классы лекарств антикоагулянтов, используемых в клинической практике,являются прямыми и косвенными ингибиторами тромбина (гепарин, низкомолекулярный гепарин, кумарины и т.д.). Протромбиназный комплекс, включающий в себя белок (фактор) Ха, преобразует профермент протромбин в активированный тромбин. Фактор Ха относится к классу сериновых протеаз и образуется активацией из белка (фактора) X. В отличие от тромбина, который действует на множество белковсубстратов и специфических рецепторов, белок Ха, по всей видимости, действует только на единственный субстрат, а именно на протромбин. Так как одна молекула белка Ха способна генерировать до 138 молекул тромбина, то прямые ингибиторы белка Ха, как ингибиторы образования тромбина, могут быть использованы как эффективный способ контроля свертываемости крови. Поэтому совершенно очевидно,что вещества, которые селективно ингибируют белок Ха, могут быть использованы для диагностики свертываемости крови in vitro, а также в качестве лекарств при заболеваниях, связанных со свертываемостью крови. Известно, что полипептиды, полученные из крови некоторых паразитов, могут быть эффективными и селективными ингибиторами фактора Ха. United States Patent 4, 588, 587 описывает антикоагулянтную активность слюны мексиканской пиявки, haementeria officinalis. Основное активное вещество слюны этой пиявки - полипептид антистатин, ингибитор фактора Ха. Другой эффективный и селективный ингибитор фактора Ха, называемый клещевой антикоагулянтный пептид (ТАР), был получен из экстракта туловища мягкого клеща ornithodoros moubata. Ингибиторы белка Ха, которые не являются полипептидами, были получены разными группами исследователей: Tidwell, R.R. et al.,"Strategies for Anticoagulation With Synthetic Protease Inhibitors. Xa Inhibitors Versus Thrombin Inhibitors", Thromb. Res., 19, 339-349 (1980); Turner, A.D. et al.,"p-Amidino Esters asof Synthetic Thrombin and Factor Xa Inhibitors", Thromb. Haemost, 63, 220-223 (1990) и т.д. Другие группы исследователей получили ингибиторы фактора Ха, которые являются небольшими органическими молекулами, такими как азотсодержащие гетероциклы, имеющие в своем составе замещенные амидиновые группы с двумя функциональными группами, способные связываться с белком Ха в двух активных сайтах белка. Например, WO 98/28269 описывает пиразол с концевыми C(=NH)-NH2 группами; WO 97/21437 описывает бензимидазол, замещенный группами, которые соединены с нафталиновой группой напрямую либо через цепь алкилов и -С(=О) или -S(=O)2 группы; WO 99/10316 описывает соединения, имеющие 4-фенил-n-алкиламидинопиперидин, соединенный с 3-амидинофениловой группой через карбоксиалкиленаминогруппу; а ЕР 798295 описывает соединения, имеющие в своем составе 4-фенокси-n-алкиламидино-пиперидиновую группу, соединенную с амидиновой группой через замещенные или не замещенные сульфонамиды. До сих пор существует необходимость в эффективных активных агента, регулирующих процесс свертываемости крови для предотвращения и лечения формирования тромбов и других патологических процесров в кровеносных сосудах, обусловленных формированием тромбина, таких как воспаление и сужение сосудов. На практике, по-прежнему, существует острая необходимость в соединениях, которые-1 015918 будут селективно ингибировать белок Ха. Соединения, которые связываются с белком Ха сильнее, чем с белком тромбином особенно предпочтительно, если эти соединения обладают хорошей биодоступностью и растворимостью. Сущность изобретения Таким образом, первым аспектом изобретения являются новые соединения, общей формулы IR2 выбран из СН и N;R5 выбран из Н или C1-С 6-алкила, который также может содержать гидроксильные, карбоксильные или сложноэфирные группы; где Х 1, Х 2, Х 3 и Х 4, каждый независимо, выбран из Н или C1-C6-алкила, который также может содержать гидроксильные, карбоксильные или сложноэфирные группы;R7 выбран из Н, -Cl, -F, -Br, -ОН, -Me, -OMe или из следующих групп: где Z1, Z2, Z3, Z4, Z5, Z6, Z7, Z8, Z9 и Z10, каждый независимо, представляет собой Н или C1-С 6-алкил, который также может содержать гидроксильные, карбоксильные или сложноэфирные группы; или их фармацевтически приемлемый изомер, соль, гидрат, сольват и пролекарственное производное. Особенно предпочтительными соединениями являются соединения, выбранные из группы, состоящей из Следующим аспектом изобретения является фармацевтическая композиция для профилактики или лечения состояния млекопитающего, характеризующегося нежелательным тромбозом, содержащая терапевтически эффективное количество соединения по изобретению. Фармацевтическая композиция помимо активного ингредиента, которым является соединение общей формулы (I), содержит фармацевтически приемлемый носитель, растворитель или разбавитель, которыми, в частности, могут быть те, что указаны у Ремингтон Научная и практическая фармацевтика(Remington's The Science and Practice of Pharmacy), Кирк Отмер Энциклопедия химической технологии (Kirk Othmer's Encyclopedia of Chemical Technology), монография Фармакологические основы терапии (The Pharmacological Basis of Therapeutics, 3 изд.). Еще одним аспектом изобретения является способ профилактики или лечения состояния млекопитающего, характеризующегося нежелательным тромбозом, включающий введение терапевтически эффективного количества соединения формулы (I). Состояния млекопитающего, характеризующиеся нежелательным тромбозом, являются хорошо известными, в частности они представляют собой острый коронарный синдром, инфаркт миокарда, нестабильную стенокардию, рефрактерную стенокардию, тромбозы,вызванные посттромболитической терапией или коронарной ангиопластикой, острый ишемический цереброваскулярный синдром, эмболический инсульт, тромботический инсульт, преходящие ишемические приступы, венозный тромбоз, глубокий венозный тромбоз, легочный эмбол, коагулопатию, рассеянную внутрисосудистую коагуляцию, тромбоцитопенический акроангиотромбоз, облитерирующий тромбангиит, тромбозные заболевания, связанные с гепариноиндуцированной тромбоцитопенией, тромбические осложнения, связанные с искусственным кровообращением, тромбические осложнения, связанные с протезными устройствами. Наконец, еще одним аспектом изобретения является способ ингибирования коагуляции биологических образцов, включающий стадию введения в образец соединения формулы (I). Раскрытие изобретения Синтез химических веществ Соединения, описываемые общей формулой (I), могут быть синтезированы любым подходящим методом, например присоединением соответствующего амина (II) к производному соответствующей карбоновой кислоты (III) в присутствии подходящих агентов сочетания, таких как 1,1'-карбонилдиимидазол (CDI), дициклогексилкарбодиимид (DCC), N-(3-диметиламинопропил)-N'-этилкарбодиимид гидрохлорид (EDCI) или иных подобных реагентов. Формирование амидной связи может быть также обеспечено взаимодействием хлорангидридов (IV) с аминами (II). Хлорангидриды (IV) могут быть получены из соответствующих карбоновых кислот (III) обработкой подходящим реагентом, таким как SOCl2 или POCl3. Хлорангидрид (IV) соответствующей карбоновой кислоты легко реагирует с аминами (II), давая на выходе целевое соединение (I). Амины (II) могут быть получены восстановлением соответствующих нитросоединений (V) при подходящих условиях. В качестве восстанавливающих агентов можно использовать, например, SnCl2 или гидрирование в присутствии никеля Ренея. Нитросоединения (V) могут быть синтезированы из соответствующих аминов (VI) и нитрозамещенных карбоновых кислот (VII) Карбоновые кислоты (VII) преобразуются в соответствующие хлорангидриды (VIII) обработкой подходящим реагентом, таким как SOCl2 или POCl3. Хлорангидриды (VIII) затем гладко реагируют с аминами (VI), образуя нитросоединения (V). Альтернативным методом синтеза амидной связи может также являться реакция карбоновой кислоты (VII) с амином (VI) в присутствии подходящих агентов сочетания, таких как DCC, EDCI, CDI. В большинстве случаев упомянутые выше реакции происходят без проблем с хорошим выходом.-9 015918 Тем не менее, замещенные карбоновые кислоты с некоторыми радикалами R5 и R6 (III) не реагируют с аминами (II). В этом случае для формирования амидной связи следует использовать соответствующие защитные группы, при этом заместители R5 и R6 вводятся в молекулу уже после осуществления формирования амидной связи. Замещенные производные мочевин (IIIa) могут быть синтезированы путем обработки соответствующих метиловых или этиловых эфиров аминоарилкарбоновой кислоты (XI) CDI и амином X2X3NH. Затем этиловый или метиловый эфиры гидролизуются в щелочной среде, что приводит к образованию желаемых соединений Альтернативным методом аминокислота (IIIb) может быть преобразована в соответствующее производное мочевины IIIc путем взаимодействия с соответствующим изоцианатом или цианатом натрия Следует отметить, что в случае, когда Х 2=Н, соответствующее производное мочевины (IIIc) не взаимодействует с амином (II), при действии DCC, CDI и EDCI, поэтому для формирования амидной связи необходимо сначала синтезировать защищенный амин (Ia) с защитной группой Y. В качестве защитной можно использовать, например, трифторацетильную группу. Защищенный амин (Ia) может быть синтезирован из соответствующей защищенной аминокислоты (IIId) взаимодействием с амином (II) в присутствии подходящего связывающего агента. Снятие защитной группы может осуществляться под действием подходящих реагентов, в случае трифторацетильной группы для этих целей можно использовать щелочной гидролиз. Амин (Ib) затем может быть трансформирован в соответствующее производное мочевины (Ic) подходящим способом, например последовательной обработкой амина (Ib) реагентом CDI и амином X2X3NH или в случае, когда Х 3=Н, обработкой соответствующим изоцианатом OCN-Z2. Амин (Ib) может быть преобразован в амидин (Id) взаимодействием с нитрилом NC-CZ2Z3Z4 в присутствии сухого газообразного HCl. Амидин (Id) может быть в дальнейшем алкилирован или арилирован до амидина (Ie) соответствующим алкил- или арилгалогенидом X1-Hal или другим реагентом с подходящей уходящей группой.- 11015918 Пример 1. Реакция 1. 1,9 г 2-нитробензойной кислоты кипятится в 20 мл SOCl2 с обратным холодильником с хлоркальциевой трубкой в течение 4 ч, после чего полученный раствор охлаждается, упаривается на роторном испарителе, дважды переупаривается с безводным ТГФ, остаток растворяется в 10 мл ТГФ, полученный раствор в течение 30 мин по каплям прибавляется к перемешиваемому раствору 1,5 г 2-амино-5 хлорпиридина в 20 мл ТГФ. Через 5 ч реакционная смесь упаривается, остаток растворяется в 30 мл хлороформа, промывается насыщенным водным раствором NaHCO3, хлороформенный экстракт упаривается, остаток наносится на колонку 40150 мм, наполненную 30-50 мкм силикагелем. Продукт элюируется хлороформом. Детектирование осуществляется с помощью УФ-ячейки на длине волны 280 нм. Поглощающие УФ-излучение фракции собираются, чистота продукта контролируется методом тонкослойной хроматографии в хлороформе. Rf продукта составляет 0,4, Rf исходного 2-амино-5-хлорпиридина составляет 0,7. 2-Нитробензойная кислота в хлороформе остается на старте (Rf0,1). Выход N-(5-хлорпиридин 2-ил)-2-нитробензамида составляет 2,4 г. Масс-спектр (МАЛДИ-ВП): М+Н 278, M+Na 300. Реакция 2. 1,5 г N-(5-хлорпиридин-2-ил)-2-нитробензамида растворяют в 20 мл этилацетата и смешивают с раствором 4 г SnCl2 в 20 мл воды, подкисленной 0,3 мл концентрированной HCl. Реакционную смесь интенсивно перемешивают в течение 1 ч, после чего нагревают до кипения и кипятят еще 3 ч. Далее реакционную смесь фильтруют, водную фракцию экстрагируют CHCl3, после чего к водной фракции добавляют при перемешивании 30 мл 10% водного раствора аммиака и оставляют на ночь для формирования осадка. На следующий день осадок отфильтровывают, промывают водой, хлороформом. Водную фракцию экстрагируют хлороформом, экстракты объединяют и упаривают. Остаток наносят на колонку 30150, наполненную силикагелем 40-60 мкм. Продукт элюируется хлороформом, детектирование - УФячейка 280 нм, контроль чистоты продукта - ТСХ в хлороформе. Rf=0,6. Выход 2-амино-N-(5 хлорпиридин-2-ил)бензамида - 650 мг. Масс-спектр (МАЛДИ-ВП): М+Н 248, M+Na 270. Реакция 3. 1 г 4-метиламинобензойной кислоты при охлаждении смешивается с 3 мл трифторуксусного ангидрида. Через 2 ч реакционная смесь упаривается и переупаривается с хлороформом. Остаток растворяется в хлороформе и наносится на колонку 35150, заполненную силикагелем 40-60 мкм. Побочные продукты элюируются хлороформом, а целевой продукт элюируется смесью хлороформ/изопропанол 9:1 с добавлением 1% уксусной кислоты. Выход трифторацетата 4-метиламинобензойной кислоты 700 мг. Rf=0,20,4. Масс-спектр (МАЛДИ-ВП) в отрицательных ионах: М-1 246. Реакция 4. 300 мг 2-амино-N-(5-хлорпиридин-2-ил)бензамида, 250 мг трифторацетата 4-метиламинобензойной кислоты и 250 мг EDCI смешивают в 1 мл ТГФ и перемешивают в течение 3 суток. После этого раствор упаривают и наносят на колонку 25150, заполненную силикагелем 40-60 мкм. Продукт элюируется хлороформом. Rf=0,5. Выход N-(5-хлорпиридин-2-ил)-2-[(4-метил(трифторацетил)аминофенилкарбонил) амино]бензамида 430 мг. Масс-спектр (МАЛДИ-ВП): М+Н 477, M+Na 499. Реакция 5. 400 мг N-(5-хлорпиридин-2-ил)-2-[(4-метил(трифторацетил)аминофенилкарбонил)амино]бензамида растворяют в 5 мл изопропанола и добавляют 2 мл 10% NaOH. Реакционную смесь перемешивают 3 ч,после чего избыток щелочи нейтрализуют 5% водным раствором HCl, реакционную смесь упаривают и наносят на колонку 25150, заполненную силикагелем 40-60 мкм. Продукт элюируется хлороформомRf=0,4. Выход N-(5-хлорпиридин-2-ил)-2-[(4-метиламинофенилкарбонил)амино]бензамида 320 мг. Массспектр (МАЛДИ-ВП): М+Н 381, M+Na 403. Реакция 6. 300 мг N-(5-хлорпиридин-2-ил)-2-[(4-метиламинофенилкарбонил)амино]бензамида при нагревании растворяют в 5 мл ацетонитрила. Полученный раствор охлаждают льдом, после чего через него пропускают сухой газообразный HCl. Через 30 мин раствор помещают в холодильник и выдерживают при 5 С в течение 48 ч. Далее к реакционной смеси добавляют NaHCO3 при тщательном перемешивании. Новые порции NaHCO3 добавляют до тех пор, пока не прекратится выделение газов. Обычно требуется около 0,5 г NaHCO3. Полученный после нейтрализации избытка HCl раствор разбавляют 5 мл воды и трижды экстрагируют хлороформом. Хлороформенные экстракты объединяют и упаривают. Остаток растворяют в воде и наносят на колонку 20250, заполненную обращенной фазой C2 (RP2). Колонку промывают 100 мл воды, после чего элюирование проводится градиентом этилового спирта от 0 до 50% на фоне 1% водной уксусной кислоты. Продукт выходит примерно на 30% этилового спирта. Контроль за чистотой продукта осуществляется с помощью ТСХ в системе диоксан/водный аммиак 9:1. Rf=0,2. Выход N-(5 хлорпиридин-2-ил)-2-[(4-этанимидоилметиламинофенилкарбонил)амино]бензамида 200 мг. Масс-спектр Пример 2. Аналогичен примеру 1, по методике, описанной для реакции 1 в примере 1, из 800 мг 5-метил-2 нитробензойной кислоты получается 650 мг N-(5-хлорпиридин-2-ил)-5-метил-2-нитробензамида. Rf=0,45(хлороформ). Масс-спектр (МАЛДИ-ВП): М+Н 292, M+Na 314. По методике, описанной для реакции 2 примера 1, из 600 мг N-(5-хлорпиридин-2-ил)-5-метил-2 нитробензамида получается 350 мг 2-амино-N-(5-хлорпиридин-2-ил)-5-метилбензамида. Rf=0,65 (хлороформ) Масс-спектр (МАЛДИ-ВП): М+Н 262, M+Na 284. По методике для реакции 4 примера 1 из 300 мг 2-амино-N-(5-хлорпиридин-2-ил)-5 метилбензамида и 250 мг трифторацетата 4-метиламинобензойной кислоты получается 430 мг N-(5 хлорпиридин-2-ил)-2-[(4-метил(трифторацетил)аминофенилкарбонил)амино]-5-метилбензамида. Rf=0,55(хлороформ). Масс-спектр в положительно заряженных ионах М+Н 491. Снятие трифторацетила осуществляется по методике, описанной в реакции 5 примера 1. Из 400 мгRf=0,5 (хлороформ). Масс-спектр (МАЛДИ-ВП): М+Н 395, M+Na 417. Синтез амидина осуществляется по методике, описанной для реакции 6 примера 1. В реакцию вводится 250 мг N-(5-хлорпиридин-2-ил)-2-[(4-метиламинофенилкарбонил)амино]-5-метилбензамида. В результате получается 130 мг N-(5-хлорпиридин-2-ил)-2-[(4-этанимидоилметиламинофенилкарбонил)амино]-5-метилбензамида. ТСХ в системе диоксан/водный аммиак 9:1. Rf=0,2. Масс-спектр (МАЛДИ-ВП): М+Н 436, M+Na 458. Пример 3. Аналогичен примеру 1, по методике, описанной для реакции 1 в примере 1, из 900 мг 5-хлор-2 нитробензойной кислоты получается 750 мг N-(5-хлорпиридин-2-ил)-5-хлор-2-нитробензамида. Rf=0,3(хлороформ). Масс-спектр (МАЛДИ-ВП): М+Н 312, M+Na 334. По методике, описанной для реакции 2, из 700 мг N-(5-хлорпиридин-2-ил)-5-хлор-2 нитробензамида получается 350 мг 2-амино-N-(5-хлорпиридин-2-ил)-5-хлорбензамида. Rf=0,6 (хлороформ). Масс-спектр (МАЛДИ-ВП): М+Н 282, M+Na 304. По методике, описанной для реакции 4 примера 1, из 300 мг 2-амино-N-(5-хлорпиридин-2-ил)-5 хлорбензамида и 250 мг трифторацетата 4-метиламинобензойной кислоты получается 430 мг N-(5 хлорпиридин-2-ил)-2-[(4-метил(трифторацетил)аминофенилкарбонил)амино]-5-хлорбензамида.(хлороформ). Масс-спектр (МАЛДИ-ВП): М+Н 511, M+Na 533. Снятие трифторацетила осуществляется по методике, описанной в реакции 5 примера 1. Из 400 мгRf=0,45 (хлороформ). Масс-спектр (МАЛДИ-ВП): М+Н 415, M+Na 437. Синтез амидина осуществляется по методике, описанной для реакции 6 примера 1. В реакцию вводится 250 мг N-(5-хлорпиридин-2-ил)-2-[(4-метиламинофенилкарбонил)амино]-5-хлорбензамида. В ре- 13015918 зультате получается 130 мг N-(5-хлорпиридин-2-ил)-2-[(4-этанимидоилметиламинофенилкарбонил)амино]-5-хлорбензамида. Rf=0,2 (диоксан/водн. аммиак 9:1). Масс-спектр (МАЛДИ-ВП): М+Н 456, M+Na 478. Пример 4. Аналогичен примеру 1, по методике, описанной для реакции 1 в примере 1, из 1,5 г 5-метокси-2 нитробензойной кислоты получается 1,1 г N-(5-хлорпиридин-2-ил)-5-метокси-2-нитробензамида. Rf=0,5(хлороформ). Масс-спектр (МАЛДИ-ВП): М+Н 308, M+Na 330. По методике, описанной для реакции 2 примера 1, из 1 г N-(5-хлорпиридин-2-ил)-5-метокси-2 нитробензамида получается 300 мг 2-амино-N-(5-хлорпиридин-2-ил)-5-метоксибензамида. Rf=0,7 (хлороформ). Масс-спектр (МАЛДИ-ВП): М+Н 278, M+Na 300. По методике для реакции 4 примера 1 из 250 мг 2-амино-N-(5-хлорпиридин-2-ил)-5 метоксибензамида и 220 мг трифторацетата 4-метиламинобензойной кислоты получается 310 мг N-(5 хлорпиридин-2-ил)-2-[(4-метил(трифторацетил)аминофенилкарбонил)амино]-5-метоксибензамида.Rf=0,6 (хлороформ). Масс-спектр (МАЛДИ-ВП): М+Н 507, M+Na 529. Снятие трифторацетила осуществляется по методике, описанной в реакции 5 примера 1. Из 280 мгN-(5-хлорпиридин-2-ил)-2-[(4-метил(трифторацетил)аминофенилкарбонил)амино]-5-метоксибензамида получается 200 мг N-(5-хлорпиридин-2-ил)-2-[(4-метиламинофенилкарбонил)амино]-5-метоксибензамида. Rf=0,5 (хлороформ). Масс-спектр (МАЛДИ-ВП): М+Н 411, M+Na 433. Синтез амидина осуществляется по методике, описанной для реакции 6 примера 1. В реакцию вводится 170 мг N-(5-хлорпиридин-2-ил)-2-[(4-метиламинофенилкарбонил)амино]-5-метоксибензамида. В результате получается 110 мг N-(5-хлорпиридин-2-ил)-2-[(4-этанимидоилметиламинофенилкарбонил) амино]-5-метоксибензамида. Rf=0,2 (диоксан/водн. аммиак 9:1). Масс-спектр (МАЛДИ-ВП): М+Н 452,M+Na 474. Пример 5. Реакция 1. 1 г 4-аминосалициловой кислоты растворяют в 20 мл водного диоксана. К раствору добавляют 900 мг ди-трет-бутилдикарбоната и 3 мл 10% водного раствора NaOH. Через сутки реакционную смесь упаривают, 4-трет-бутоксикарбониламиносалициловую кислоту очищают перекристаллизацией из этанола. Выход 1,1 г. Реакция 2. Смесь 0,5 г 4-трет-бутоксикарбониламиносалициловой кислоты, 0,6 г N-(3-хлорпропил)ацетамида и 0,5 г K2CO3 нагревают до 110 С, через 1 ч реакционную смесь охлаждают, разбавляют водой, экстрагируют хлороформом, экстракт упаривают и наносят на колонку 30150, заполненную силикагелем 40-60 мкм, продукт элюируют смесью хлороформ-этанол (9:1). Rf=0,5 (хлороформ/этанол 9:1). Выход 2-[3(ацетиламино)пропокси]-4-[(трет-бутоксикарбонил)амино]бензойной кислоты 400 мг. Реакция 3. 370 мг 2-[3-(ацетиламино)пропокси]-4-[(трет-бутоксикарбонил)амино]бензойной кислоты растворяют в 3 мл этанола и добавляют 100 мкл 10% водной HCl. Через 2 ч реакционная смесь упаривается и продукт очищается перекристаллизацией из этанола. Rf=0,45 (хлороформ/этанол 9:1). Выход 2-[3- 14015918(ацетиламино)пропокси]-4-аминобензойной кислоты 300 мг. Реакция 4. 270 мг 2-[3-(ацетиламино)пропокси]-4-аминобензойной кислоты смешивают с 300 мкл 40% формальдегида, раствором 400 мг NaOH в 2 мл воды и 400 мг порошка цинка. Реакционная смесь перемешивается и выдерживается при 60 С в течение 4 ч, после чего фильтруется, осадок промывается водным этанолом, фильтрат подкисляется водной HCl до рН 4-5, упаривается и остаток наносится на колонку 25150, заполненную силикагелем 40-60 мкм. Продукт элюируется в системе хлороформ/этанол 9:1.Rf=0,5. Выход 2-[3-(ацетиламино)пропокси]-4-(метиламино)бензойной кислоты 150 мг. Реакция 5. 130 мг 2-[3-(ацетиламино)пропокси]-4-(метиламино)бензойной кислоты растворяют в 2 мл водного этанола, содержащего 500 мг NaOH. Смесь запаивают в ампулу, которую нагревают до 100 С в течение 10 ч. Затем ампулу охлаждают, вскрывают, избыток щелочи нейтрализуют до рН 8-9 разбавленной HCl,после чего полученный раствор упаривают. Остаток наносят на колонку 2050, заполненную силикагелем 40-60 мкм. Продукт элюируется хлороформом. Rf=0,3. Выход 2-[3-аминопропокси]-4(метиламино)бензойной кислоты 100 мг. Реакция 6. 90 мг 2-[3-аминопропокси]-4-(метиламино)бензойной кислоты смешиваются с 1 мл трифторуксусного ангидрида. Через 1 ч реакционная смесь упаривается, остаток наносится на колонку 20150, заполненную силикагелем 40-60 мкм. Продукт элюируется в системе хлороформ/этанол 9:1. Выход 2-[3(трифторацетиламино)пропокси]-4-[трифторацетил(метил)амино]бензойной кислоты 100 мг. Реакция 7. 80 мг 2-амино-N-(5-хлорпиридин-2-ил)бензамида, 100 мг 2-[3-(трифторацетиламино)пропокси]-4[трифторацетил(метил)амино]бензойной кислоты и 80 мг EDCI смешивают в 1 мл ТГФ и перемешивают в течение 48 ч. Затем реакционную смесь упаривают, остаток наносят на колонку с силикагелем и продукт элюируют хлористым метиленом. Rf=0,5 (хлористый метилен). Выход N-(5-хлорпиридин-2-ил)-24-[трифторацетил(метил)амино]-2-[3-(трифторацетиламино)пропокси]фенилкарбониламинобензамида 80 мг. Реакция 8. 70 мг N-(5-хлорпиридин-2-ил)-2-4-[трифторацетил(метил)амино]-2-[3-(трифторацетиламино)пропокси]фенилкарбониламинобензамида растворяют в смеси 100 мкл 3 М NaOH и 1 мл этанола и перемешивают в течение 1 ч, после чего раствор нейтрализуют и остаток упаривают, продукт очищают хроматографией на силикагеле. Продукт элюируется хлористым метиленом. Rf=0,4. Выход N-(5-хлорпиридин 2-ил)-2-[4-метиламино-2-(3-аминопропокси)фенилкарбониламино]бензамида 55 мг. Реакция 9. 50 мг N-(5-хлорпиридин-2-ил)-2-[4-метиламино-2-(3-аминопропокси)фенилкарбониламино]бензамида при нагревании растворяют в 2 мл ацетонитрила. Полученный раствор охлаждают льдом, после чего через него пропускают сухой газообразный HCl. Через 30 мин раствор помещают в холодильник и выдерживают при 5 С в течение 48 ч. Далее к реакционной смеси добавляют NaHCO3 и тщательно перемешивают. Новые порции NaHCO3 добавляют до тех пор, пока не прекратится выделение газов. Полученный после нейтрализации избытка HCl раствор разбавляют 5 мл воды и трижды экстрагируют хлороформом. Хлороформенные экстракты объединяют и упаривают. Остаток растворяют в воде и титруют 1% водным NaOH до рН 9. Раствор выдерживают 3 ч при 25 С, после чего нейтрализуют, упаривают остаток и наносят на колонку 20250, заполненную обращенной фазой С 2 (RP2). Колонку промывают 100 мл воды, после чего элюирование проводится градиентом этилового спирта от 0 до 50% на фоне 1% водной уксусной кислоты. Продукт выходит примерно на 30% этилового спирта. Контроль за чистотой продукта осуществляется с помощью ТСХ в системе изопропанол/водный аммиак 8:2. Rf=0,5. Выход N-(5 хлорпиридин-2-ил)-2-[4-(этанимидоилметиламино)-2-(3-аминопропокси)фенилкарбониламино]бензамида 20 мг. Масс-спектр (МАЛДИ-ВП): М+Н 495, M+Na 517.- 15015918 Пример 6. Реакция 1. 95 мг 2-амино-N-(5-хлорпиридин-2-ил)-5-метилбензамида, 120 мг 2-[3-(трифторацетиламино)пропокси]-4-[трифторацетил(метил)амино]бензойной кислоты и 80 мг EDCI смешивают в 1 мл ТГФ и перемешивают в течение 48 ч. Затем реакционную смесь упаривают, остаток наносят на колонку с силикагелем и продукт элюируют хлористым метиленом. Rf=0,5 (хлористый метилен). Выход N-(5 хлорпиридин-2-ил)-2-[4-(трифторацетил(метил)амино)-2-(3-(трифторацетиламино)пропокси)фенилкарбониламино]-5-метилбензамида 85 мг. Реакция 2. 80 мг N-(5-хлорпиридин-2-ил)-2-[4-(трифторацетил(метил)амино)-2-(3-(трифторацетиламино)пропокси)фенилкарбониламино]-5-метилбензамида растворяют в смеси 100 мкл 3 М водного NaOH и 1 мл этанола и перемешивают в течение 1 ч, после чего раствор нейтрализуют и остаток упаривают, продукт очищают хроматографией на силикагеле. Продукт элюируется хлористым метиленом. Rf=0,4. Выход N-(5-хлорпиридин-2-ил)-2-[4-метиламино-2-(3-аминопропокси)фенилкарбониламино]-5-метилбензамида 65 мг. Реакция 3. 60 мг N-(5-хлорпиридин-2-ил)-2-[4-метиламино-2-(3-аминопропокси)фенилкарбониламино]-5 метилбензамида при нагревании растворяют в 2 мл ацетонитрила. Полученный раствор охлаждают льдом, после чего через него пропускают сухой газообразный HCl. Через 30 мин раствор помещают в холодильник и выдерживают при 5 С в течение 48 ч. Далее к реакционной смеси добавляют NaHCO3 и тщательно перемешивают. Новые порции NaHCO3 добавляют до тех пор, пока не прекратится выделение газов. Полученный после нейтрализации избытка HCl раствор разбавляют 5 мл воды и трижды экстрагируют хлороформом. Хлороформенные экстракты объединяют и упаривают. Остаток растворяют в воде и титруют 1% водным NaOH до рН 9. Раствор выдерживают 3 ч при 25 С, после чего нейтрализуют, упаривают остаток и наносят на колонку 20250, заполненную обращенной фазой С 2 (RP2). Колонку промывают 100 мл воды, после чего элюирование проводится градиентом этилового спирта от 0 до 50% на фоне 1% водной уксусной кислоты. Продукт выходит примерно на 30% этилового спирта. Контроль за чистотой продукта осуществляется с помощью ТСХ в системе изопропанол/водный аммиак 8:2. Rf=0,5. Выход Пример 7. Реакция 1. 95 мг 2-амино-N-(5-хлорпиридин-2-ил)-5-хлорбензамида, 90 мг 2-[3-(трифторацетиламино)пропокси]-4-[трифторацетил(метиламино)]бензойной кислоты и 80 мг EDCI смешивают в 1 мл ТГФ и перемешивают в течение 48 ч. Затем реакционную смесь упаривают, остаток наносят на колонку с силикагелем и продукт элюируют хлористым метиленом. Rf=0,5 (хлористый метилен). Выход N-(5-хлорпиридин-2 ил)-2-[4-(трифторацетил(метил)амино)-2-(3-(трифторацетиламино)пропокси)фенилкарбониламино]-5 хлорбензамида 85 мг. Реакция 2. 80 мг N-(5-хлорпиридин-2-ил)-2-[4-(трифторацетил(метил)амино)-2-(3-(трифторацетиламино)пропокси)фенилкарбониламино]-5-хлорбензамида растворяют в смеси 100 мкл 3 М водного NaOH и 1 мл этанола и перемешивают в течение 1 ч, после чего раствор нейтрализуют и остаток упаривают, продукт очищают хроматографией на силикагеле. Продукт элюируется хлористым метиленом. Rf=0,4. Выход N(5-хлорпиридин-2-ил)-2-[4-метиламино-2-(3-(ацетиламино)пропокси)фенилкарбониламино]-5-хлорбензамида 65 мг. 60 мгN-(5-хлорпиридин-2-ил)-2-[4-метиламино-2-(3-(ацетиламино)пропокси)фенилкарбониламино]-5-хлорбензамида при нагревании растворяют в 2 мл ацетонитрила. Полученный раствор охлаждают льдом, после чего через него пропускают сухой газообразный HCl. Через 30 мин раствор помещают в холодильник и выдерживают при 5 С в течение 48 ч. Далее к реакционной смеси добавляют NaHCO3 и тщательно перемешивают. Новые порции NaHCO3 добавляют до тех пор, пока не прекратится выделение- 16015918 газов. Полученный после нейтрализации избытка HCl раствор разбавляют 5 мл воды и трижды экстрагируют хлороформом. Хлороформенные экстракты объединяют и упаривают. Остаток растворяют в воде и титруют 1% водным NaOH до рН 9. Раствор выдерживают 3 ч при 25 С, после чего нейтрализуют, упаривают и остаток наносят на колонку 20250, заполненную обращенной фазой С 2 (RP2). Колонку промывают 100 мл воды, после чего элюирование проводится градиентом этилового спирта от 0 до 50% на фоне 1% водной уксусной кислоты. Продукт выходит примерно на 30% этилового спирта. Контроль за чистотой продукта осуществляется с помощью ТСХ в системе изопропанол/водный аммиак 8:2. Rf=0,5. Выход Пример 8. Реакция 1. 90 мг 2-амино-N-(5-хлорпиридин-2-ил)-5-метоксибензамида, 100 мг 2-[3-(трифторацетиламино) пропокси]-4-[трифторацетил(метиламино)]бензойной кислоты и 90 мг EDCI смешивают в 1 мл ТГФ и перемешивают в течение 48 ч. Затем реакционную смесь упаривают, остаток наносят на колонку с силикагелем и продукт элюируют хлористым метиленом. Rf=0,5 (хлористый метилен). Выход N-(5 хлорпиридин-2-ил)-2-[4-(трифторацетил(метил)амино)-2-(3-(трифторацетиламино)пропокси)фенилкарбониламино]-5-метоксибензамида 85 мг. Реакция 2. 80 мг N-(5-хлорпиридин-2-ил)-2-[4-(трифторацетил(метил)амино)-2-(3-(трифторацетиламино)пропокси)фенилкарбониламино]-5-метоксибензамида растворяют в смеси 100 мкл 3 М водного NaOH и 1 мл этанола и перемешивают в течение 1 ч, после чего раствор нейтрализуют и остаток упаривают, продукт очищают хроматографией на силикагеле. Продукт элюируется хлористым метиленом. Rf=0,4. Выход N-(5-хлорпиридин-2-ил)-2-[4 метиламино-2-(3-аминопропокси)фенилкарбониламино]-5-метоксибензамида 65 мг. 60 мг N-(5-хлорпиридин-2-ил)-2-[4-метиламино-2-(3-аминопропокси)фенилкарбониламино]-5 метоксибензамида при нагревании растворяют в 2 мл ацетонитрила. Полученный раствор охлаждают льдом, после чего через него пропускают сухой газообразный HCl. Через 30 мин раствор помещают в холодильник и выдерживают при 5 С в течение 48 ч. Далее к реакционной смеси добавляют NaHCO3 и тщательно перемешивают. Новые порции NaHCO3 добавляют до тех пор, пока не прекратится выделение газов. Полученный после нейтрализации избытка HCl раствор разбавляют 5 мл воды и трижды экстрагируют хлороформом. Хлороформенные экстракты объединяют и упаривают. Остаток растворяют в воде и титруют 1% водным NaOH до рН 9. Раствор выдерживают 3 ч при 25 С, после чего нейтрализуют, упаривают остаток и наносят на колонку 20250, заполненную обращенной фазой С 2 (RP2). Колонку промывают 100 мл воды, после чего элюирование проводится градиентом этилового спирта от 0 до 50% на фоне 1% водной уксусной кислоты. Продукт выходит примерно на 30% этилового спирта. Контроль за чистотой продукта осуществляется с помощью ТСХ в системе изопропанол/водный аммиак 8:2. Rf=0,5. Выход- 17015918 Пример 9. Реакция 1. 1,5 г 4-метиламино-6-фторсалициловой кислоты растворяют в 20 мл водного диоксана. К раствору добавляют 2 г ди-трет-бутилдикарбоната и 3 мл 10% водного раствора NaOH. Через сутки реакционную смесь упаривают, 4-трет-бутоксикарбонил(метиламино)-6-фторсалициловую кислоту очищают перекристаллизацией из этанола. Выход 1,6 г. Реакция 2. Смесь 1,5 г 4-трет-бутоксикарбонил(метиламино)-6-фторсалициловой кислоты, 1,6 г N-(3 хлорпропил)трифторацетамида и 1,5 г K2CO3 нагревают до 110 С, через 1 ч реакционную смесь охлаждают, разбавляют водой, экстрагируют хлороформом, экстракт упаривают и наносят на колонку 30150,заполненную силикагелем 40-60 мкм, продукт элюируют смесью хлороформ-этанол (9:1). Rf=0,5 (хлороформ/этанол 9:1). Выход 2-[3-(трифторацетиламино)пропокси]-4-[(трет-бутоксикарбонил)метиламино]6-фторбензойной кислоты 390 мг. Реакция 3. 370 мг 2-[3-(трифторацетиламино)пропокси]-4-[(трет-бутоксикарбонил)метиламино]-6-фторбензойной кислоты растворяют в 3 мл этанола и добавляется 100 мкл 10% водной HCl. Через 2 ч реакционная смесь упаривается и продукт очищается перекристаллизацией из этанола. Rf=0,45 (хлороформ/этанол 9:1). Выход 2-[3-(трифторацетиламино)пропокси]-4-метиламино-6-фторбензойной кислоты 280 мг. Реакция 4. 270 мг 2-[3-(трифторамино)пропокси]-4-метиламино-6-фторбензойной кислоты смешиваются с 1 мл трифторуксусного ангидрида. Через 1 ч реакционная смесь упаривается, остаток наносится на колонку 20150, заполненную силикагелем 40-60 мкм. Продукт элюируется в системе хлороформ/этанол 9:1. Выход 2-[3-(трифторацетиламино)пропокси]-4-[трифторацетил(метил)амино]-6-фторбензойной кислоты 280 мг. Реакция 5. 250 мг 2-амино-N-(5-хлорпиридин-2-ил)-5-метилбензамида, 280 мг 2-[3-(трифторацетиламино) пропокси]-4-[трифторацетил(метил)амино]-6-фторбензойной кислоты и 300 мг EDCI смешивают в 2 мл ТГФ и перемешивают в течение 48 ч. Затем реакционную смесь упаривают, остаток наносят на колонку с силикагелем и продукт элюируют хлористым метиленом. Rf=0,5 (хлористый метилен). Выход N-(5 хлорпиридин-2-ил)-2-[4-(трифторацетил(метил)амино)-2-(3-(трифторацетиламино)пропокси)-6-фторфенилкарбониламино]-5-метилбензамида 270 мг. Реакция 6. 250 мг N-(5-хлорпиридин-2-ил)-2-[4-(трифторацетил(метил)амино)-2-(3-(трифторацетиламино) пропокси)-6-фторфенилкарбониламино]-5-метилбензамида растворяют в смеси 300 мкл 3 М водногоNaOH и 2 мл этанола и перемешивают в течение 1 ч, после чего раствор нейтрализуют и остаток упаривают, продукт очищают хроматографией на силикагеле. Продукт элюируется хлористым метиленом.Rf=0,4. Выход N-(5-хлорпиридин-2-ил)-2-[4-метиламино-2-(3-аминопропокси)-6-фторфенилкарбониламино]-5-метилбензамида 160 мг. Реакция 7. 150 мг N-(5-хлорпиридин-2-ил)-2-[4-метиламино-2-(3-аминопропокси)-6-фторфенилкарбониламино]-5-метилбензамида при нагревании растворяют в 5 мл ацетонитрила. Полученный раствор охлаждают льдом, после чего через него пропускают сухой газообразный HCl. Через 30 мин раствор помещают в холодильник и выдерживают при 5 С в течение 48 ч. Далее к реакционной смеси добавляют NaHCO3 и тщательно перемешивают. Новые порции NaHCO3 добавляют до тех пор, пока не прекратится выделение газов. Полученный после нейтрализации избытка HCl раствор разбавляют 10 мл воды и трижды экстрагируют хлороформом. Хлороформенные экстракты объединяют и упаривают. Остаток растворяют в воде и титруют 1% водным NaOH до рН 9. Раствор выдерживают 3 ч при 25 С, после чего нейтрализуют, упаривают остаток и наносят на колонку 20250, заполненную обращенной фазой С 2 (RP2). Колонку промывают 100 мл воды, после чего элюирование проводится градиентом этилового спирта от 0 до 50% на фоне 1% водной уксусной кислоты. Продукт выходит примерно на 30% этилового спирта. Контроль за чистотой продукта осуществляется с помощью ТСХ в системе ацетонитрил/диоксан/водный аммиак 3:5:2. Rf=0,5. Выход N-(5-хлорпиридин-2-ил)-2-[4-(этанимидоилметиламино)-2-(3-аминопропокси)-6 фторфенилкарбониламино]-5-метилбензамида 70 мг. Масс-спектр (МАЛДИ-ВП): М+Н 527, M+Na 549. Пример 10. Реакция 1. 250 мг 2-амино-N-(5-хлорпиридин-2-ил)-5-хлорбензамида, 290 2-[3-(трифторацетиламино)пропокси]-4-[трифторацетил(метил)амино]-6-фторбензойной кислоты и 280 мг EDCI смешивают в 1 мл ТГФ и перемешивают в течение 48 ч. Затем реакционную смесь упаривают, остаток наносят на колонку с силикагелем и продукт элюируют хлористым метиленом. Rf=0,5 (хлористый метилен). Выход N-(5 хлорпиридин-2-ил)-2-[4-трифторацетил(метил)амино-2-(3-(трифторацетиламино)пропокси)-6-фторфенилкарбониламино]-5-хлорбензамида 270 мг. Реакция 2. 180 мг N-(5-хлорпиридин-2-ил)-2-[4-трифторацетил(метил)амино-2-(3-(трифторацетиламино)пропокси)-6-фторфенилкарбониламино]-5-хлорбензамида растворяют в смеси 400 мкл 3 М NaOH и 2 мл этанола и перемешивают в течение 1 ч, после чего раствор нейтрализуют и остаток упаривают, продукт очищают хроматографией на силикагеле. Продукт элюируется хлористым метиленом. Rf=0,4. Выход N(5-хлорпиридин-2-ил)-2-[4-метиламино-2-(3-аминопропокси)-6-фторфенилкарбониламино]-5-хлорбензамида 160 мг. Реакция 3. 150 мг N-(5-хлорпиридин-2-ил)-2-[4-метиламино-2-(3-аминопропокси)-6-фторфенилкарбониламино]-5-хлорбензамида при нагревании растворяют в 5 мл ацетонитрила. Полученный раствор охлаждают льдом, после чего через него пропускают сухой газообразный HCl. Через 30 мин раствор помещают в холодильник и выдерживают при 5 С в течение 48 ч. Далее к реакционной смеси добавляют NaHCO3 и тщательно перемешивают. Новые порции NaHO3 добавляют до тех пор, пока не прекратится выделение газов. Полученный после нейтрализации избытка HCl раствор разбавляют 10 мл воды и трижды экстрагируют хлороформом. Хлороформенные экстракты объединяют и упаривают. Остаток растворяют в воде и титруют 1% водным NaOH до рН 9. Раствор выдерживают 3 ч при 25 С, после чего нейтрализуют, упаривают остаток и наносят на колонку 20250, заполненную обращенной фазой С 2 (RP2). Колонку промывают 100 мл воды, после чего элюирование проводится градиентом этилового спирта от 0 до 50% на фоне 1% водной уксусной кислоты. Продукт выходит примерно на 30% этилового спирта. Контроль за чистотой продукта осуществляется с помощью ТСХ в системе ацетонитрил/диоксан/водный аммиак 3:5:2. Rf=0,5. Выход N-(5-хлорпиридин-2-ил)-2-[2-(3-аминопропокси)-6-фтор-4-(этанимидоилметиламино)фенилкарбониламино]-5-хлорбензамида 60 мг. Масс-спектр (МАЛДИ-ВП): М+Н 547, M+Na 569. Пример 11. Реакция 1. 0,5 г 4-метиламино-2-фторбензойной кислоты смешиваются с 1 мл трифторуксусного ангидрида. Через 1 ч реакционная смесь упаривается, остаток наносится на колонку 20150, заполненную силикагелем 40-60 мкм. Продукт элюируется в системе хлороформ/этанол 9:1. Выход 2-фтор-4[трифторацетил(метил)амино]бензойной кислоты 470 мг. Реакция 2. 450 мг 2-амино-N-(5-хлорпиридин-2-ил)-5-метилбензамида, 480 мг 2-фтор-4-[трифторацетил(метил)амино]бензойной кислоты и 500 мг EDCI смешивают в 3 мл ТГФ и перемешивают в течение 48 ч. Затем реакционную смесь упаривают, остаток наносят на колонку с силикагелем и продукт элюируют- 19015918 хлористым метиленом. Rf=0,5 (хлористый метилен). Выход N-(5-хлорпиридин-2-ил)-2-[2-фтор-4 трифторацетил(метил)аминофенилкарбониламино]-5-метилбензамида 470 мг. Реакция 3. 450 мг N-(5-хлорпиридин-2-ил)-2-[2-фтор-4-трифторацетил(метил)аминофенилкарбониламино]-5 метилбензамида растворяют в смеси 300 мкл 3 М водного NaOH и 3 мл этанола и перемешивают в течение 1 ч, после чего раствор нейтрализуют и остаток упаривают, продукт очищают хроматографией на силикагеле. Продукт элюируется хлористым метиленом. Rf=0,4. Выход N-(5-хлорпиридин-2-ил)-2-[2 фтор-4-метиламинофенилкарбониламино]-5-метилбензамида 380 мг. Реакция 4. 350 мг N-(5-хлорпиридин-2-ил)-2-[2-фтор-4-метиламинофенилкарбониламино]-5-метилбензамида при нагревании растворяют в 5 мл ацетонитрила. Полученный раствор охлаждают льдом, после чего через него пропускают сухой газообразный HCl. Через 30 мин раствор помещают в холодильник и выдерживают при 5 С в течение 48 ч. Далее к реакционной смеси добавляют NaHCO3 и тщательно перемешивают. Новые порции NaHCO3 добавляют до тех пор, пока не прекратится выделение газов. Полученный после нейтрализации избытка HCl раствор разбавляют 10 мл воды и трижды экстрагируют хлороформом. Хлороформенные экстракты объединяют и упаривают. Остаток растворяют в воде и титруют 1% воднымNaOH до рН 9. Раствор выдерживают 3 ч при 25 С, после чего нейтрализуют, упаривают, остаток и наносят на колонку 20250, заполненную обращенной фазой С 2 (RP2). Колонку промывают 100 мл воды,после чего элюирование проводится градиентом этилового спирта от 0 до 50% на фоне 1% водной уксусной кислоты. Продукт выходит примерно на 30% этилового спирта. Контроль за чистотой продукта осуществляется с помощью ТСХ в системе диоксан/водный аммиак 9:1. Rf=0,2. Выход N-(5 хлорпиридин-2-ил)-2-[2-фтор-4-(этанимидоил(метил)амино)фенилкарбониламино]-5-метилбензамида 160 мг. Масс-спектр (МАЛДИ-ВП): М+Н 454, M+Na 476. Пример 12. Реакция 1. 350 мг 2-амино-N-(5-хлорпиридин-2-ил)-5-хлорбензамида, 370 мг 2-фтор-4-[трифторацетил(метиламино)]бензойной кислоты и 390 мг EDCI смешивают в 2 мл ТГФ и перемешивают в течение 48 ч. Затем реакционную смесь упаривают, остаток наносят на колонку с силикагелем и продукт элюируют хлористым метиленом. Rf=0,5 (хлористый метилен). Выход N-(5-хлорпиридин-2-ил)-2-[2-фтор-4 трифторацетил(метил)аминофенилкарбониламино]-5-хлорбензамида 370 мг. Реакция 2. 350 мг N-(5-хлорпиридин-2-ил)-2-[2-фтор-4-трифторацетил(метил)аминофенилкарбониламино]-5 хлорбензамида растворяют в смеси 300 мкл 3 М водного NaOH и 3 мл этанола и перемешивают в течение 1 ч, после чего раствор нейтрализуют и остаток упаривают, продукт очищают хроматографией на силикагеле. Продукт элюируется хлористым метиленом. Rf=0,4. Выход N-(5-хлорпиридин-2-ил)-2-[2-фтор-4 метиламинофенилкарбониламино]-5-хлорбензамида 320 мг. Реакция 3. 300 мг N-(5-хлорпиридин-2-ил)-2-[2-фтор-4-метиламинофенилкарбониламино]-5-хлорбензамида при нагревании растворяют в 5 мл ацетонитрила. Полученный раствор охлаждают льдом, после чего через него пропускают сухой газообразный HCl. Через 30 мин раствор помещают в холодильник и выдерживают при 5 С в течение 48 ч. Далее к реакционной смеси добавляют NaHCO3 и тщательно перемешивают. Новые порции NaHCO3 добавляют до тех пор, пока не прекратится выделение газов. Полученный после нейтрализации избытка HCl раствор разбавляют 10 мл воды и трижды экстрагируют хлороформом. Хлороформенные экстракты объединяют и упаривают. Остаток растворяют в воде и титруют 1% воднымNaOH до рН 9. Раствор выдерживают 3 ч при 25 С, после чего нейтрализуют, упаривают остаток и наносят на колонку 20250, заполненную обращенной фазой С 2 (RP2). Колонку промывают 100 мл воды, после чего элюирование проводится градиентом этилового спирта от 0 до 50% на фоне 1% водной уксусной кислоты. Продукт выходит примерно на 30% этилового спирта. Контроль за чистотой продукта осуществляется с помощью ТСХ в системе диоксан/водный аммиак 9:1. Rf=0,2. Выход N-(5-хлорпиридин-2-ил)-2-[2-фтор-4-(этанимидоил(метил)амино)фенилкарбонил- 20015918 амино]-5-хлорбензамида 140 мг. Масс-спектр (МАЛДИ-ВП): М+Н 474, M+Na 496. Пример 13. Реакция 1. 90 мг 2-[3-(ацетиламино)пропокси]-4-(метиламино)бензойной кислоты смешиваются с 1 мл трифторуксусного ангидрида. Через 1 ч реакционная смесь упаривается, остаток наносится на колонку 20150, заполненную силикагелем 40-60 мкм. Продукт элюируется в системе хлороформ/этанол 9:1. Выход 2-[3-(ацетиламино)пропокси]-4-[трифторацетил(метил)амино)]бензойной кислоты 100 мг. Реакция 2. 90 мг 2-амино-N-(5-хлорпиридин-2-ил)-5-метилбензамида, 95 мг 2-[3-(ацетиламино)пропокси]-4[трифторацетил(метил)амино]бензойной кислоты и 80 мг EDCI смешивают в 1 мл ТГФ и перемешивают в течение 48 ч. Затем реакционную смесь упаривают, остаток наносят на колонку с силикагелем и продукт элюируют хлористым метиленом. Rf=0,5 (хлористый метилен). Выход N-(5-хлорпиридин-2-ил)-2-[4(трифторацетил(метил)амино)-2-(3-(ацетиламино)пропокси)фенилкарбониламино]-5-метилбензамида 80 мг. Реакция 3. 70 мг N-(5-хлорпиридин-2-ил)-2-[4-(трифторацетил(метил)амино)-2-(3-(ацетиламино)пропокси)фенилкарбониламино]-5-метилбензамида растворяют в смеси 100 мкл 3 М водного NaOH и 1 мл этанола и перемешивают в течение 1 ч, после чего раствор нейтрализуют и остаток упаривают, продукт очищают хроматографией на силикагеле. Продукт элюируется хлористым метиленом. Rf=0,4. Выход N-(5 хлорпиридин-2-ил)-2-[4-метиламино-2-(3-(ацетиламино)пропокси)фенилкарбониламино]-5-метилбензамида 55 мг. Реакция 4. 50 мгN-(5-хлорпиридин-2-ил)-2-[4-метиламино-2-(3-(ацетиламино)пропокси)фенилкарбониламино]-5-метилбензамида при нагревании растворяют в 2 мл ацетонитрила. Полученный раствор охлаждают льдом, после чего через него пропускают сухой газообразный HCl. Через 30 мин раствор помещают в холодильник и выдерживают при 5 С в течение 48 ч. Далее к реакционной смеси добавляют NaHCO3 и тщательно перемешивают. Новые порции NaHCO3 добавляют до тех пор, пока не прекратится выделение газов. Полученный после нейтрализации избытка HCl раствор разбавляют 5 мл воды и трижды экстрагируют хлороформом. Хлороформенные экстракты объединяют и упаривают. Остаток растворяют в воде и титруют 1% водным NaOH до рН 9. Раствор выдерживают 3 ч при 25 С, после чего нейтрализуют, упаривают остаток и наносят на колонку 20250, заполненную обращенной фазой С 2 (RP2). Колонку промывают 100 мл воды, после чего элюирование проводится градиентом этилового спирта от 0 до 50% на фоне 1% водной уксусной кислоты. Продукт выходит примерно на 30% этилового спирта. Контроль за чистотой продукта осуществляется с помощью ТСХ в системе диоксан/водный аммиак 9:1. Rf=0,3. Выход N-(5-хлорпиридин-2-ил)-2-[4-(этанимидоилметиламино)-2-(3-(ацетиламино)пропокси)фенилкарбониламино]-5-метилбензамида 20 мг. Масс-спектр (МАЛДИ-ВП): М+Н 551, M+Na 573. Пример 14. Реакция 1. 100 мг N-(5-хлорпиридин-2-ил)-2-[(4-метиламинофенилкарбонил)амино]-5-метилбензамида и 150 мг цианата натрия перемешивают в 1 мл ТГФ и добавляют 300 мкм уксусной кислоты. Реакцонную смесь оставляют перемешиваться в течение 24 ч. Далее реакционную смесь упаривают, остаток наносят на колонку с силикагелем и продукт элюируют хлороформом. Rf=0,25 (хлороформ). Выход N-(5- 21015918 хлорпиридин-2-ил)-2-[(4-карбамоил(метил)аминофенилкарбонил)амино]-5-метилбензамида 70 мг. Реакция 2. 60 мг N-(5-хлорпиридин-2-ил)-2-[(4-карбамоил(метил)аминофенилкарбонил)амино]-5-метилбензамида растворяют в 2 мл ТГФ, к раствору добавляют 200 мкл диметилсульфата. Реакционная смесь перемешивается в течение 24 ч, после чего упаривается, остаток подвергается хроматографическому разделению на силикагеле. N-(5-хлорпиридин-2-ил)-2-[(4-(имино(метокси)метил)(метил)аминофенилкарбонил)амино]-5-метилбензамид элюируется хлороформом. Выход 40 мг. Rf=0,4 (хлороформ). Массспектр (МАЛДИ-ВП): М+Н 452, M+Na 474. Пример 15. Реакция 1. 250 мг N-(5-хлорпиридин-2-ил)-2-[(4-метиламинофенилкарбонил)амино]-5-метилбензамида, 290 мг гидрохлорида 4-бензил-3,5-диметил-1 Н-пиразол-1-карбоксамидина и 130 мкл триэтиламина смешивают в ацетонитриле и выдерживают 24 ч при 60 С. Затем реакционную смесь упаривают и разделяют хроматографией на обращенной фазе С 2. Продукт элюируется градиентом этанола на фоне 1% водной уксусной кислоты. Выход 2-[(4-карбамимидоилметиламино)фенилкарбониламино]-N-(5-хлорпиридин-2-ил)-5 метилбензамида 150 мг. Реакция 2. 120 мг 2-[(4-карбамимидоилметиламино)фенилкарбониламино]-N-(5-хлорпиридин-2-ил)-5 метилбензамида растворяют в 2 мл ТГФ и добавляют 100 мкл йодистого метила и 150 мг K2CO3. Реакционную смесь нагревают до 50 С и выдерживают 10 ч. Затем реакционную смесь упаривают, остаток разделяют хроматографией на обращенной фазе С-2. Выход 2-[4-(метил(N-метилкарбамимидоил)амино)]фенилкарбониламино]-N-(5-хлорпиридин-2-ил)-5-метилбензамида 70 мг. Rf=0,3 (диоксан/водный аммиак 8:2). Масс-спектр (МАЛДИ-ВП): М+Н 451, M+Na 473. Пример 16. Реакция 1. 250 мг N-(5-хлорпиридин-2-ил)-2-[(4-метиламинофенилкарбонил)амино]-5-хлорбензамида, 290 мг гидрохлорида 4-бензил-3,5-диметил-1 Н-пиразол-1-карбоксамидина и 130 мкл триэтиламина смешивают в ацетонитриле и выдерживают 24 ч при 60 С. Затем реакционную смесь упаривают и разделяют хроматографией на обращенной фазе С 2. Продукт элюируется градиентом этанола на фоне 1% водной уксусной кислоты. Выход 2-[(4-карбамимидоилметиламино)фенилкарбониламино]-N-(5-хлорпиридин-2-ил)-5 хлорбензамида 150 мг. Реакция 2. 120 мг 2-[(4-карбамимидоилметиламино)фенилкарбониламино]-N-(5-хлорпиридин-2-ил)-5-хлорбензамида растворяют в 2 мл ТГФ и добавляют 100 мкл йодистого метила и 150 мг K2CO3. Реакционную смесь нагревают до 50 С и выдерживают 10 ч. Затем реакционную смесь упаривают, остаток разделяют хроматографией на обращенной фазе С-2. Выход 2-[4-(метил(N-метилкарбамимидоил)амино)]фенилкарбониламино]-N-(5-хлорпиридин-2-ил)-5-хлорбензамида 70 мг. Rf=0,3 (диоксан/водный аммиак 8:2). Масс-спектр (МАЛДИ-ВП): М+Н 471, M+Na 493. Пример 17. Реакция 1. К раствору 750 мг 4-метиламинобензойной кислоты в 10 мл ТГФ добавляют 700 мкл метилизоцианата. Реакционную смесь перемешивают при комнатной температуре 72 ч, после чего упаривают и переупаривают с водой. Продукт перекристаллизовывают из изопропанола. Выход 4-[метил(метилкарбамоил)амино]бензойной кислоты 700 мг. Реакция 2. 300 мг 4-[метил(метилкарбамоил)амино]бензойной кислоты, 250 мг 2-амино-N-(5-хлорпиридин-2 ил)-5-хлорбензамида и 300 мг EDCI в 2 мл ТФГ перемешивают 72 ч. Далее реакционную смесь упаривают, остаток разделяют хроматографией на силикагеле. Колонка сначала промывается хлороформом, затем хлороформ/этанол 9:1. Rf=0,5 (хлороформ). Выход N-(5-хлорпиридин-2-ил)-2-[(4-метил(метилкарбамоил)аминофенилкарбонил)амино]-5-хлорбензамида 280 мг. Rf=0,3 (диоксан/водный аммиак 8:2). Масс-спектр (МАЛДИ-ВП): М+Н 472, M+Na 494. Пример 18. 240 мг 4-[метил(метилкарбамоил)амино]бензойной кислоты, 220 мг 2-амино-N-(5-хлорпиридин-2 ил)-5-метилбензамида и 250 мг EDCI в 2 мл ТГФ перемешивают 48 ч. Затем реакционную смесь упаривают, остаток разделяют хроматографией. Выход N-(5-хлорпиридин-2-ил)-2-[(4-метил(метилкарбамоил) аминофенилкарбонил)амино]-5-метилбензамида 250 мг. Rf=0,55 (хлороформ). Масс-спектр (МАЛДИВП): М+Н 452, M+Na 474. Пример 19. Реакция 1. Смесь 0,5 г 4-[третбутоксикарбонил(метил)амино]салициловой кислоты, 0,6 г N-(3-хлорпропил) трифторацетамида и 0,5 г K2CO3 нагревают до 110 С, через 1 ч реакционную смесь охлаждают, разбавляют водой, экстрагируют хлороформом, экстракт упаривают и наносят на колонку 30150, заполненную силикагелем 40-60 мкм, продукт элюируют смесью хлороформ-этанол (9:1). Rf=0,5 (хлороформ/этанол 9:1). Выход 2-[3-(трифторацетиламино)пропокси]-4-[(трет-бутоксикарбонил)(метил)амино]бензойной кислоты 350 мг. Реакция 2. 320 мг 2-[3-(трифторацетиламино)пропокси]-4-[(трет-бутоксикарбонил)(метил)амино]бензойной кислоты растворяют в 2 мл этанола, добавляют 200 мкл 10% водной HCl, раствор перемешивают 3 ч,- 23015918 после чего реакционную смесь нейтрализуют, упаривают и остаток разделяют хроматографией на силикагеле в хлороформ/этаноле 9:1. Выход 2-[3-(трифторацетиламино)пропокси]-4-(метил)аминобензойной кислоты 250 мг. Реакция 3. 220 мг 2-[3-(трифторацетиламино)пропокси]-4-(метил)аминобензойной кислоты растворяют в 5 мл ТГФ и добавляют 300 мкл метилизоцианата. Через 78 ч реакционную смесь упаривают, остаток разделяют хроматографией на силикагеле в хлороформ/этаноле 9:1. Выход 4-[метил(метилкарбамоил)амино]-2[3-(трифторацетиламино)пропоксибензойной кислоты 230 мг. Реакция 4. 200 мг 4-[метил(метилкарбамоил)амино]-2-[3-(трифторацетиламино)]пропоксибензойной кислоты(377), 140 мг 2-амино-N-(5-хлорпиридин-2-ил)-5-метилбензамида (262) и 150 мг EDCI в 2 мл ТГФ перемешивают 48 ч. Затем реакционную смесь упаривают, остаток разделяют хроматографией. Выход N-(5 хлорпиридин-2-ил)-2-[4-метил(метилкарбамоил)амино]-2-[3-(трифторацетиламино)пропокси]фенилкарбониламино-5-метилбензамида 210 мг. Rf=0,5 (хлороформ). Реакция 5. 190 мг N-(5-хлорпиридин-2-ил)-2-[4-метил(метилкарбамоил)амино]-2-[3-(трифторацетиламино) пропокси]фенилкарбониламино]-5-метилбензамида растворяют в 2 мл этанола, добавляют 200 мл 10% водного NaOH. Через 2 ч реакционную смесь упаривают и разделяют хроматографией на силикагеле. Пример 20. Реакция 1. 200 мг 4-[метил(метилкарбамоил)амино]-2-[3-(трифторацетил-амино)]пропоксибензойной кислоты,140 мг 2-амино-N-(5-хлорпиридин-2-ил)-5-хлорбензамида и 150 мг EDCI в 2 мл ТГФ перемешивают 48 ч. Затем реакционную смесь упаривают, остаток разделяют хроматографией. Выход N-(5-хлорпиридин-2 ил)-2-[4-метил(метилкарбамоил)амино]-2-[3-(трифторацетиламино)пропокси]фенилкарбониламино-5 хлорбензамида 210 мг. Rf=0,5 (хлороформ). Реакция 2. 190 мг N-(5-хлорпиридин-2-ил)-2-[4-метил(метилкарбамоил)амино]-2-[3-(трифторацетиламино) пропокси]фенилкарбониламино]-5-хлорбензамида растворяют в 2 мл этанола, добавляют 200 мл 10% водного NaOH. Через 2 ч реакционную смесь упаривают и разделяют хроматографией на силикагеле. Активность веществ по отношению к белку factor Xa in vitro. Для некоторых соединений из примеров, приведенных выше, была измерена константа активности этих веществ по отношению к фактору Xa in vitro - Ki. Измерения проводились кинетически, по началь- 24015918 ной скорости расщепления белком субстрата S-2222. Измерения проводились при комнатной температуре в прямоугольных кварцевых кюветах объемом 2 мл. Для проведения реакции использовался раствор,50 мМ Tris-HCl, 150 мМ NaCl, 2,5 мМ CaCl2 и 0,1% ПЭГ 6000, рН 7,5, фактор Ха 0,04-1 нМ, S-2222 164 мкМ. Стандартный метод наименьших квадратов применялся для определения Km для определенной концентрации белка и субстрата. Перед реакцией белок и активное вещество в растворе термостатировались в течении 10 мин, затем добавлялся субстрат и реакция начиналась. Скорость реакции измерялась по изменению поглощения света на длине волны 405 нм на приборе Specord M80. Значения IC50 определялись из полученных экспериментально зависимостей начальных скоростей от концентрации ингибитора (активного вещества). Значения Ki вычислялись, исходя из значений концентраций белка, субстрата и ингибитора и значений IC50 по методике, описанной в работах 1) Jordan, S.P.; Waxman, L.; Smith, D.E.;Vlasuk, G.P. Biochemistry 1990, 29, 11095; 2) Morrison, J.F. Biochim. Biophys. Acta 1969, 185, 269. Результаты приведены в табл. 1. Таблица 1 Константа активности Ki соединений по отношению к белку Ха in vitro Активность веществ в плазме крови человека по отношению к протромбиновому времени in vitro. Для некоторых соединений из примеров, приведенных выше, была измерена концентрация этих соединений в плазме крови человека, при которой протромбиновое время плазмы увеличивается вдвое 2 РТ. Измерения проводились с помощью набора "Диагем П" компании НПО Ренам (www.renam.ru), по методике, описанной в инструкции к данному набору. Активное соединение растворялось в плазме крови из набора и инкубировалось в течении 3 мин. Измерения проводились на приборе "Sysmex CA 50". Для каждой концентрации измерение проводилось 3 раза и результат усреднялся. Результаты приведены в табл. 2. Таблица 2 Константа активности Ki веществ по отношению к белку Ха в плазме кровиR2 выбран из СН и N;R5 выбран из Н или C1-С 6-алкила, который, возможно, замещен гидроксилом или карбоксилом;- 26015918 где X1, X2, Х 3 и Х 4, каждый независимо, выбран из Н или C1-С 6-алкила, который, возможно, замещен гидроксилом или карбоксилом;R7 выбран из H, -Cl, -F, -Br, -OH, -Me, -OMe или из следующих групп: где Z1, Z2, Z3, Z4, Z5, Z6, Z7, Z8, Z9 и Z10, каждый независимо, представляет собой Н или C1-С 6-алкил, который, возможно, замещен гидроксилом, или карбоксилом, или карбонилом; или его фармацевтически приемлемые соль, гидрат, сольват. 2. Соединение по п.1, имеющее следующую структуру:
МПК / Метки
МПК: A61K 31/16, C07D 213/75, A61P 7/02, A61K 31/17, A61K 31/44
Метки: уретаны, амиды, родственные, фактора, мочевины, ингибиторы
Код ссылки
<a href="https://eas.patents.su/30-15918-uretany-mocheviny-amidy-i-rodstvennye-ingibitory-faktora-xa.html" rel="bookmark" title="База патентов Евразийского Союза">Уретаны, мочевины, амиды и родственные ингибиторы фактора xa</a>
Предыдущий патент: Проточный кожух батареи топливных элементов
Следующий патент: Метод и машина для уплотнения щебеночного балласта рельсового пути
Случайный патент: Способ приготовления очищенных конъюгатов лекарственных средств