Производные тиазола и их применение
Номер патента: 15628
Опубликовано: 31.10.2011
Авторы: Ковини Давид, Кваттропани Анна, Дефорж Гвенаэлль, Дорбэ Жером, Рюкле Томас
Формула / Реферат
1. Производное тиазола формулы (I)
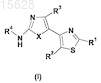
где R1выбран из -C(O)R5, необязательно замещенного C1-С6-алкила, включая цианометил, гидроксиметил; необязательно замещенного С2-С6-алкенила; необязательно замещенного С2-С6-алкинила; необязательно замещенного арил-С1-С6-алкила; необязательно замещенного гетероарил-С1-С6-алкила; необязательно замещенного С3-С8-циклоалкил-С1-С6-алкила и необязательно замещенного гетероциклоалкил-С1-С6-алкила;
R2 представляет собой Н;
R3 выбран из Н, галогена, C1-С6-алкила, С2-С6-алкенила и С2-С6-алкинила;
R4 выбран из -C(O)R6, арила, гетероарила, гетероциклоалкила и С3-С8-циклоалкила;
R5 выбран из Н, гидроксила, необязательно замещенного C1-С6-алкокси, включая этокси; необязательно замещенного амино, включая аллиламин, метоксиэтиламин, метоксипропиламин, гидроксиэтиламин, гидроксилпропиламин, цианоэтиламин, пропиламин, проп-2-иниламин, тетрагидрофуранметиламин, диметиламиноэтиламин, диметиламинопропиламин, тетразолиламин, аминобензойную кислоту, тетразолилфениламин, тиадиазолилфениламин, оксадиазолилфениламин, бензиламин, 1Н-1,2,3-бензотриазол-5-иламин; необязательно замещенного арила; необязательно замещенного гетероарила; необязательно замещенного С3-С8-циклоалкила; необязательно замещенного гетероциклоалкила, включая морфолинил, пиперазинил, пиперидинил, 1,4-диокса-8-азаспиро[4.5]декан-8-ил, 7-(гидроксиметил)-6,8-диокса-3-азабицикло[3.2.1]окт-3-ил, пирролидинил;
R6 выбран из Н, необязательно замещенного С1-С6-алкила, включая метил; необязательно замещенного С2-С6-алкенила; необязательно замещенного С2-С6-алкинила; необязательно замещенного арил-С1-С6-алкила; необязательно замещенного гетероарил-С1-С6-алкила и необязательно замещенного амино, включая необязательно замещенный C1-С6-алкиламин, такой как метоксиэтиламин, 2-амино-N,N-диметилацетамид, 3-аминопропионовая кислота и алкильный сложный эфир 3-аминопропионовой кислоты;
причем заместители в группах "алкенил", "алкинил", "арил", "гетероарил", "циклоалкил", "гетероциклоалкил" выбирают из группы, состоящей из "С1-С6-алкила", "С2-С6-алкенила", "С2-С6-алкинила", "циклоалкила", "гетероциклоалкила", "С1-С6-алкиларила", "С1-С6-алкилгетероарила", "С1-С6-алкилциклоалкила", "C1-С6-алкилгетероциклоалкила", "амино", "аммония", "ацила", "ацилокси", "ациламино", "аминокарбонила", "алкоксикарбонила", "уреидо", "арила", "карбамата", "гетероарила", "сульфинила", "сульфонила", "алкокси", "сульфанила", "галогена", "карбокси", тригалогенметила, циано, гидрокси, меркапто, нитро;
X выбран из S и О;
а также его геометрические изомеры, его оптически активные формы, такие как энантиомеры, диастереомеры, и его рацематные формы, а также их фармацевтически приемлемые соли.
2. Производное тиазола по п.1, в котором R1 представляет собой -C(O)R5.
3. Производное тиазола по п.1, в котором R1 выбран из C1-C6-алкила, С2-С6-алкенила, С2-С6-алкинила, арил-С1-С6-алкила, гетероарил-С1-С6-алкила, С3-С8-циклоалкил-С1-С6-алкила и гетероциклоалкил-С1-С6-алкила.
4. Производное тиазола по любому из предшествующих пунктов, в котором R2представляет собой Н.
5. Производное тиазола по любому из предшествующих пунктов, в котором R3представляет собой метил.
6. Производное тиазола по любому из предшествующих пунктов, в котором R4выбран из арила, гетероциклоалкила и С3-C8-циклоалкила.
7. Производное тиазола по любому из пп.1-5, в котором R4представляет собой -C(O)R6.
8. Производное тиазола по любому из предшествующих пунктов, в котором R5выбран из гидроксила и алкокси.
9. Производное тиазола по любому из пп.1-7, в котором R5представляет собой амино.
10. Производное тиазола по любому из пп.1-7, в котором R5выбран из арила, гетероарила, С3-С8-циклоалкила и гетероциклоалкила.
11. Производное тиазола по любому из предшествующих пунктов, в котором R6выбран из C1-С6-алкила, С2-С6-алкенила, С2-С6-алкинила, арил-С1-С6-алкила и C1-С6-алкила.
12. Производное тиазола по любому из пп.1-10, в котором R6представляет собой необязательно замещенный амино.
13. Производное тиазола по любому из предшествующих пунктов, в котором X представляет собой S.
14. Производное тиазола по любому из предшествующих пунктов, в котором R1представляет собой
-C(O)R5; R2 представляет собой Н и R3представляет собой метил.
15. Производное тиазола по любому из предшествующих пунктов, в котором R1выбран из C1-С6-алкила, С2-С6-алкенила, С2-С6-алкинила, арил-С1-С6-алкила и гетероарил-С1-С6-алкила; R2представляет собой Н и R3представляет собой метил.
16. Производное тиазола по любому из предшествующих пунктов, выбранное из следующей группы:
этил-2'-(ацетиламино)-4'-метил-4,5'-би-1,3-тиазол-2-карбоксилат;
2'-(ацетиламино)-N-аллил-4'-метил-4,5'-би-1,3-тиазол-2-карбоксамид;
N-[2-(цианометил)-4'-метил-4,5'-би-1,3-тиазол-2'-ил]ацетамид;
2'-(ацетиламино)-4'-метил-4,5'-би-1,3-тиазол-2-карбоновая кислота;
2'-(ацетиламино)-N-(2-метоксиэтил)-4'-метил-4,5'-би-1,3-тиазол-2-карбоксамид;
2'-(ацетиламино)-4'-метил-N-(тетрагидрофуран-2-илметил)-4,5'-би-1,3-тиазол-2-карбоксамид;
2'-(ацетиламино)-N-[2-(диметиламино)этил]-4'-метил-4,5'-би-1,3-тиазол-2-карбоксамид;
N-[4'-метил-2-(морфолин-4-илкарбонил)-4,5'-би-1,3-тиазол-2'-ил]ацетамид;
N-{4'-метил-2-[(4-метилпиперазин-1-ил)карбонил]-4,5'-би-1,3-тиазол-2'-ил}ацетамид;
2'-(ацетиламино)-N-[3-(диметиламино)пропил]-4'-метил-4,5'-би-1,3-тиазол-2-карбоксамид;
2'-(ацетиламино)-N-(2-гидроксиэтил)-4'-метил-4,5'-би-1,3-тиазол-2-карбоксамид;
2'-(ацетиламино)-N-(2-цианоэтил)-4'-метил-4,5'-би-1,3-тиазол-2-карбоксамид;
2'-(ацетиламино)-4'-метил-N-1Н-тетразол-5-ил-4,5'-би-1,3-тиазол-2-карбоксамид;
4-({[2'-(ацетиламино)-4'-метил-4,5'-би-1,3-тиазол-2-ил]карбонил}амино)бензойная кислота;
3-({[2'-(ацетиламино)-4'-метил-4,5'-би-1,3-тиазол-2-ил]карбонил}амино)бензойная кислота;
2'-(ацетиламино)-4'-метил-N-[3-(1Н-тетразол-5-ил)фенил]-4,5'-би-1,3-тиазол-2-карбоксамид;
2'-(ацетиламино)-N-бензил-4'-метил-4,5'-би-1,3-тиазол-2-карбоксамид;
2'-(ацетиламино)-4'-метил-N-пропил-4,5'-би-1,3-тиазол-2-карбоксамид;
2'-(ацетиламино)-4'-метил-N-[4-(1Н-тетразол-5-ил)фенил]-4,5'-би-1,3-тиазол-2-карбоксамид;
3-({[2'-(ацетиламино)-4'-метил-4,5'-би-1,3-тиазол-2-ил]карбонил}амино)-2-гидроксибензойная кислота;
1-{[2'-(ацетиламино)-4'-метил-4,5'-би-1,3-тиазол-2-ил]карбонил}пиперидин-3-карбоновая кислота;
5-({[2'-(ацетиламино)-4'-метил-4,5'-би-1,3-тиазол-2-ил]карбонил}амино)-2-гидроксибензойная кислота;
N-[4'-метил-2-(2Н-тетразол-5-илметил)-4,5'-би-1,3-тиазол-2'-ил]ацетамид;
1-{[2'-(ацетиламино)-4'-метил-4,5'-би-1,3-тиазол-2-ил]карбонил}пиперидин-4-карбоновая кислота;
2'-(ацетиламино)-N-[3-(5-амино-1,3,4-тиадиазол-2-ил)фенил]-4'-метил-4,5'-би-1,3-тиазол-2-карбоксамид;
N-{2-[(3-гидроксипиперидин-1-ил)карбонил]-4'-метил-4,5'-би-1,3-тиазол-2'-ил}ацетамид;
N-(2-{[4-(гидроксиметил)пиперидин-1-ил]карбонил}-4'-метил-4,5'-би-1,3-тиазол-2'-ил)ацетамид;
N-(2-{[4-(2-гидроксиэтил)пиперидин-1-ил]карбонил}-4'-метил-4,5'-би-1,3-тиазол-2'-ил)ацетамид;
N-{2-[(4-гидроксипиперидин-1-ил)карбонил]-4'-метил-4,5'-би-1,3-тиазол-2'-ил}ацетамид;
2'-(ацетиламино)-N-1H-1,2,3-бензотриазол-5-ил-4'-метил-4,5'-би-1,3-тиазол-2-карбоксамид;
4-({[2'-(ацетиламино)-4'-метил-4,5'-би-1,3-тиазол-2-ил]карбонил}амино)-2-гидроксибензойная кислота;
4-({[2'-(ацетиламино)-4'-метил-4,5'-би-1,3-тиазол-2-ил]карбонил}амино)-2-фторбензойная кислота;
2'-(ацетиламино)-N-[3-(5-гидрокси-1,3,4-оксадиазол-2-ил)фенил]-4'-метил-4,5'-би-1,3-тиазол-2-карбоксамид;
2'-(ацетиламино)-N-[4-(5-гидрокси-1,3,4-оксадиазол-2-ил)фенил]-4'-метил-4,5'-би-1,3-тиазол-2-карбоксамид;
N-[2-(гидроксиметил)-4'-метил-4,5'-би-1,3-тиазол-2'-ил]ацетамид;
N-(2-метоксиэтил)-N'-[4'-метил-2-(морфолин-4-илкарбонил)-4,5'-би-1,3-тиазол-2'-ил]мочевина;
этил-N-({[4'-метил-2-(морфолин-4-илкарбонил)-4,5'-би-1,3-тиазол-2'-ил]амино}карбонил)-бета-аланинат;
N-[2-(1,4-диокса-8-азаспиро[4.5]дец-8-илкарбонил)-4'-метил-4,5'-би-1,3-тиазол-2'-ил]ацетамид;
2'-(ацетиламино)-N-(2,3-дигидроксипропил)-4'-метил-4,5'-би-1,3-тиазол-2-карбоксамид;
N-[4'-метил-2-(морфолин-4-илкарбонил)-4,5'-би-1,3-тиазол-2'-ил]мочевина;
N-{4'-метил-2-[(3-оксопиперазин-1-ил)карбонил]-4,5'-би-1,3-тиазол-2'-ил}ацетамид;
N-{4'-метил-2-[(4-оксопиперидин-1-ил)карбонил]-4,5'-би-1,3-тиазол-2'-ил}ацетамид;
N-{2-[(3-гидроксипирролидин-1-ил)карбонил]-4'-метил-4,5'-би-1,3-тиазол-2'-ил}ацетамид;
2'-(ацетиламино)-4'-метил-N-проп-2-ин-1-ил-4,5'-би-1,3-тиазол-2-карбоксамид;
N-{2-[(4-ацетилпиперазин-1-ил)карбонил]-4'-метил-4,5'-би-1,3-тиазол-2'-ил}ацетамид;
N~1~-,N~1~-диметил-N~2~-({[4'-метил-2-(морфолин-4-илкарбонил)-4,5'-би-1,3-тиазол-2'-ил]амино}карбонил)глицинамид;
N-({[4'-метил-2-(морфолин-4-илкарбонил)-4,5'-би-1,3-тиазол-2'-ил]амино}карбонил)-бета-аланин;
N-{2-[(4-фторпиперидин-1-ил)карбонил]-4'-метил-4,5'-би-1,3-тиазол-2'-ил}ацетамид;
N-(2-{[(1S,5S,7S)-7-(гидроксиметил)-6,8-диокса-3-азабицикло[3.2.1]окт-3-ил]карбонил}-4'-метил-4,5'-би-1,3-тиазол-2'-ил)ацетамид;
этил-N-({[2-(цианометил)-4'-метил-4,5'-би-1,3-тиазол-2'-ил]амино}карбонил)-бета-аланинат;
N-(2-{[(1R,5R,7R)-7-(гидроксиметил)-6,8-диокса-3-азабицикло[3.2.1]окт-3-ил]карбонил}-4'-метил-4,5'-би-1,3-тиазол-2'-ил)ацетамид;
трет-бутил-N-({[2-(цианометил)-4'-метил-4,5'-би-1,3-тиазол-2'-ил]амино}карбонил)-бета-аланинат;
[4'-метил-2'-(пиразин-2-иламино)-4,5'-би-1,3-тиазол-2-ил]ацетонитрил;
этил-4'-метил-2'-(пиразин-2-иламино)-4,5'-би-1,3-тиазол-2-карбоксилат;
[4'-метил-2'-(1Н-пиразол-3-иламино)-4,5'-би-1,3-тиазол-2-ил]ацетонитрил;
N-[4'-метил-2-(2-морфолин-4-ил-2-оксоэтил)-4,5'-би-1,3-тиазол-2'-ил]ацетамид;
2-[2'-(ацетиламино)-4'-метил-4,5'-би-1,3-тиазол-2-ил]ацетамид;
трет-бутил-4-{[2-(цианометил)-4'-метил-4,5'-би-1,3-тиазол-2'-ил]амино}-4-оксобутаноат;
метил-5-{[2-(цианометил)-4'-метил-4,5'-би-1,3-тиазол-2'-ил]амино}-5-оксопентаноат;
метил-6-{[2-(цианометил)-4'-метил-4,5'-би-1,3-тиазол-2'-ил]амино}-6-оксогексаноат;
2'-(ацетиламино)-N,N,4'-триметил-4,5'-би-1,3-тиазол-2-карбоксамид;
2'-(ацетиламино)-4'-метил-4,5'-би-1,3-тиазол-2-карбоксамид;
4-{[2-(цианометил)-4'-метил-4,5'-би-1,3-тиазол-2'-ил]амино}-4-оксобутановая кислота;
5-{[2-(цианометил)-4'-метил-4,5'-би-1,3-тиазол-2'-ил]амино}-5-оксопентановая кислота;
трет-бутил-N-({[2-(цианометил)-4'-метил-4,5'-би-1,3-тиазол-2'-ил]амино}карбонил)глицинат;
трет-бутил-4-[({[2-(цианометил)-4'-метил-4,5'-би-1,3-тиазол-2'-ил]амино}карбонил)амино]бутаноат;
N~2~-({[2-(цианометил)-4'-метил-4,5'-би-1,3-тиазол-2'-ил]амино}карбонил)-N~1~-,N~1~-диметилглицинамид;
трет-бутил-N-({[4'-метил-2-(морфолин-4-илкарбонил)-4,5'-би-1,3-тиазол-2'-ил]амино}карбонил)-бета-аланинат;
N-[4'-метил-2-(морфолин-4-илкарбонил)-4,5'-би-1,3-тиазол-2'-ил]-N-(2-морфолин-4-ил-2-оксоэтил)мочевина;
N-[2-(цианометил)-4'-метил-4,5'-би-1,3-тиазол-2'-ил]-N-(2-морфолин-4-ил-2-оксоэтил)мочевина;
метил-N-({[2-(цианометил)-4'-метил-4,5'-би-1,3-тиазол-2'-ил]амино}карбонил)-бета-аланинат;
N~3~-({[2-(цианометил)-4'-метил-4,5'-би-1,3-тиазол-2'-ил]амино}карбонил)-N~1~-,N~1~-диизопропил-бета-аланинамид;
N~3~-({[2-(цианометил)-4'-метил-4,5'-би-1,3-тиазол-2'-ил]амино}карбонил)-N~1~-(2-гидрокси-1,1-диметилэтил)-бета-аланинамид;
N~1~-(трет-бутил)-N~3~-({[2-(цианометил)-4'-метил-4,5'-би-1,3-тиазол-2'-ил]амино}карбонил)-бета-аланинамид;
N-[2-(цианометил)-4'-метил-4,5'-би-1,3-тиазол-2'-ил]-N-[3-(2,2-диметил-1,3-тиазолидин-3-ил)-3-оксопропил]мочевина;
N-[2-(цианометил)-4'-метил-4,5'-би-1,3-тиазол-2'-ил]-N-[3-(4,4-диметил-1,3-оксазолидин-3-ил)-3-оксопропил]мочевина;
N~2~-({[2-(цианометил)-4'-метил-4,5'-би-1,3-тиазол-2'-ил]амино}карбонил)-N~1~-(2,2-диметилпропил)глицинамид;
N-(3-азокан-1-ил-3-оксопропил)-N-[2-(цианометил)-4'-метил-4,5'-би-1,3-тиазол-2'-ил]мочевина;
N-[2-(цианометил)-4'-метил-4,5'-би-1,3-тиазол-2'-ил]-N'-[2-(1-изопропил-1Н-имидазол-4-ил)этил]мочевина;
N-[2-(цианометил)-4'-метил-4,5'-би-1,3-тиазол-2'-ил]-N'-[2-(1-этил-1Н-имидазол-4-ил)этил]мочевина;
N-[2-(5-трет-бутил-1,2,4-оксидиазол-3-ил)этил]-N'-[2-(цианометил)-4'-метил-4,5'-би-1,3-тиазол-2'-ил]мочевина;
N-[2-(цианометил)-4'-метил-4,5'-би-1,3-тиазол-2'-ил]-N'-[2-(5-изопропил-1,2,4-оксидиазол-3-ил)этил]мочевина;
N-(4'-метил-2-{[5-(1-метилпиперидин-4-ил)-1,2,4-оксидиазол-3-ил]метил}-4,5'-би-1,3-тиазол-2'-ил)ацетамид.
17. Производное тиазола формулы (Ia)
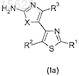
где R1выбран из -C(O)R5, необязательно замещенного C1-С6-алкила, включая цианометил, гидроксиметил; необязательно замещенного С2-С6-алкенила; необязательно замещенного С2-С6-алкинила; необязательно замещенного арил-С1-С6-алкила; необязательно замещенного гетероарил-С1-С6-алкила; необязательно замещенного С3-С8-циклоалкил-С1-С6-алкила и необязательно замещенного гетероциклоалкил-С1-С6-алкила;
R2 выбран из Н;
R3 выбран из Н, галогена, С1-С6-алкила, С2-С6-алкенила и С2-С6-алкинила;
R5 выбран из Н, гидроксила, необязательно замещенного C1-С6-алкокси, включая этокси; необязательно замещенного амино, включая аллиламин, метоксиэтиламин, метоксипропиламин, гидроксиэтиламин, гидроксилпропиламин, цианоэтиламин, пропиламин, проп-2-иниламин, тетрагидрофуранметиламин, диметиламиноэтиламин, диметиламинопропиламин, тетразолиламин, аминобензойную кислоту, тетразолилфениламин, тиадиазолилфениламин, оксадиазолилфениламин, бензиламин, 1Н-1,2,3-бензотриазол-5-иламин; необязательно замещенного арила; необязательно замещенного гетероарила; необязательно замещенного С3-С8-циклоалкила; необязательно замещенного гетероциклоалкила, включая морфолинил, пиперазинил, пиперидинил, 1,4-диокса-8-азаспиро[4.5]декан-8-ил, 7-(гидроксиметил)-6,8-диокса-3-азабицикло[3.2.1]окт-3-ил, пирролидинил;
причем заместители в группах "алкенил", "алкинил", "арил", "гетероарил", "циклоалкил", "гетероциклоалкил" выбирают из группы, состоящей из "С1-С6-алкила", "С2-С6-алкенила", "С2-С6-алкинила", "циклоалкила", "гетероциклоалкила", "C1-С6-алкиларила", "C1-С6-алкилгетероарила", "C1-С6-алкилциклоалкила", "C1-С6-алкилгетероциклоалкила", "амино", "аммония", "ацила", "ацилокси", "ациламино", "аминокарбонила", "алкоксикарбонила", "уреидо", "арила", "карбамата", "гетероарила", "сульфинила", "сульфонила", "алкокси", "сульфанила", "галогена", "карбокси", тригалогенметила, циано, гидрокси, меркапто, нитро;
X выбран из S и О;
а также его геометрические изомеры, его оптически активные формы, такие как энантиомеры, диастереомеры, и его рацематные формы, а также их фармацевтически приемлемые соли, при условии, что соединения формулы (Ia) не представляют собой следующие соединения:
2'-амино-4'-метил-[4,5'-битиазол]-2-ацетонитрил;
2'-амино-4'-метил-(фенилгидразоно)-[4,5'-битиазол]-2-ацетонитрил;
2'-амино-[(4-хлорфенил)гидразоно]-4'-метил-[4,5'-битиазол]-2-ацетонитрил или
этиловый эфир 2'-амино-2-метил-[4,5'-битиазол]-4'-карбоновой кислоты.
18. Производное тиазола по п.17, в котором R1 представляет собой -C(O)R5.
19. Производное тиазола по п.17, в котором R1 выбран из C1-С6-алкила, С2-С6-алкенила, С2-С6-алкинила, арил-С1-С6-алкила, гетероарил-С1-С6-алкила, С3-С8-циклоалкил-С1-С6-алкила и гетероциклоалкил-С1-С6-алкила.
20. Производное тиазола по п.17, в котором R2 представляет собой Н.
21. Производное тиазола по п.17, в котором R3 представляет собой метил.
22. Применение производного тиазола по пп.1-16 в качестве лекарственного средства.
23. Применение производного тиазола по пп.1-16, а также его изомеров и их смеси для приготовления лекарственного средства для профилактики и/или лечения заболеваний посредством модулирования активности PI3-киназы.
24. Применение по п.23, где модулирование активности PI3-киназы представляет собой ингибирование.
25. Применение по п.23 или 24, где указанная PI3-киназа представляет собой PI3-киназу g.
26. Применение по п.23, где указанное заболевание выбирают из аутоиммунных нарушений и/или воспалительных заболеваний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, бактериальных или вирусных инфекций, заболеваний почек, агрегации тромбоцитов, злокачественной опухоли, трансплантации, дефицита эритроцитов, отторжения трансплантата или повреждений легких.
27. Применение по п.26, где указанные заболевания выбраны из группы, включающей рассеянный склероз, псориаз, ревматоидный артрит, системную красную волчанку, воспалительное заболевание кишечника, воспаление легкого, тромбоз или инфекцию/воспаление головного мозга, такое как менингит или энцефалит.
28. Применение по п.27, где указанные заболевания выбраны из группы, включающей болезнь Альцгеймера, болезнь Гентингтона, травму ЦНС, инсульт или ишемические состояния.
29. Применение по п.28, где указанные заболевания выбраны из группы, включающей атеросклероз, гипертрофию сердца, дисфункцию кардиомиоцитов, повышенное кровяное давление или ангиоспазм.
30. Применение по п.26, где указанные заболевания выбраны из группы, включающей хроническое обструктивное заболевание легких, связанный с анафилактическим шоком фиброз, псориаз, аллергические заболевания, астму, инсульт или ишемические состояния, ишемию-реперфузию, агрегацию/активацию тромбоцитов, атрофию/гипертрофию скелетных мышц, рекрутинг лейкоцитов в ткани злокачественной опухоли, ангиогенез, инвазивный метастаз, меланому, саркому Капоши, острые и хронические бактериальные и вирусные инфекции, сепсис, отторжение трансплантата, гломерулосклероз, гломерулонефрит, прогрессивный фиброз почек, повреждения эндотелия и эпителия в легком или воспаление дыхательных путей легких.
31. Фармацевтическая композиция, содержащая по меньшей мере одно производное тиазола по любому из пп.1-16 и его фармацевтически приемлемый носитель, разбавитель или эксципиент.
Текст
Дата публикации и выдачи патента Номер заявки Настоящее изобретение относится к производным тиазола формулы (I), в частности, для лечения и/или профилактики аутоиммунных нарушений и/или воспалительных заболеваний, сердечнососудистых заболеваний, нейродегенеративных заболеваний, бактериальных или вирусных инфекций, заболеваний почек, агрегации тромбоцитов, злокачественной опухоли, трансплантации,отторжения трансплантата или повреждений легких. 015628 Область изобретения Настоящее изобретение относится к производным тиазола формулы (I) и их применению для лечения и/или профилактики заболеваний посредством модулирования, особенно ингибирования, активности или функции фосфоинозитид-3-киназ, PI3K. Предпосылки изобретения Фосфоинозитид-3-киназы (PI3K) играют центральную сигнальную роль в клеточной пролиферации,выживаемости клеток, васкуляризации, мембранном транспорте, транспорте глюкозы, росте нейритов,мембранном раффлинге, продукции супероксида, реорганизации актина и хемотаксисе (Cantley, 2000,Science, 296, 1655-1657 и Vanhaesebroeck et al., 2001, Annu. Rev. Biochem., 70, 535-602). Термином "PI3K" называют семейство киназ липидов, которое у млекопитающих состоит из восьми идентифицированных PI3K, которые подразделяют на три подсемейства в соответствии с их структурой и их специфичностью в отношении субстрата. Группа PI3K класса I состоит из двух подгрупп, класса IA и класса IB. Класс IA состоит из регуляторного элемента массой 85 кДа (ответственного за белок-белковые взаимодействия посредством взаимодействия Src-гомологичного домена 2 (SH2) с остатками фосфотирозина других белков) и каталитической субъединицы массой 110 кДа. Для этого класса существует три каталитические формы (р 100, р 110 и р 110) и пять регуляторных изоформ (р 85, p85, p55, p55 иp50). Класс IB стимулируется G-белковыми -субъединицами гетеродимерных G-белков. Единственным охарактеризованным членом класса IB является PI3K (каталитическая субъединица р 110 в комплексе с регуляторным белком массой 101 кДа, р 101). Класс II PI3K включает изоформы ,и , которые обладают массой приблизительно 170 кДа и характеризуются наличием С-концевого С 2-домена. Класс III PI3K включает фосфатидилинозитол-специфичные 3-киназы. Эволюционно консервативные изоформы p110 иэкспрессируются повсеместно, в то время какиболее специфично экспрессируются в системе гемопоэтических клеток, в гладкомышечных клетках,миоцитах и эндотелиальных клетках (Vanhaesebroeck et al., 1997, Trends Biochem. Sci., 22(7), 267-72). Их экспрессия также может регулироваться посредством индукции в зависимости от типа клетки и ткани и стимулов, а также от заболевания.PI3K представляют собой ферменты, вовлеченные в передачу сигналов фосфолипидов, и они активируются в ответ на различные внеклеточные сигналы, такие как факторы роста, митогены, интегрины(межклеточные взаимодействия), гормоны, цитокины, вирусы и нейротрансмиттеры, а также посредством внутриклеточной перекрестной регуляции другими сигнальными молекулами (перекрестное влияние сигналов, где первоначальный сигнал может активировать некоторые параллельные каскады, которые на втором этапе передают сигналы на PI3K посредством внутриклеточных процессов передачи сигнала),например, такими как малые ГТФ-азы, киназы или фосфатазы. Фосфатидилинозитол (PtdIns) представляет собой основной структурный элемент внутриклеточных инозитольных липидов в эукариотических клетках, состоящий из D-миоинозитол-1-фосфата (Ins1P), связанного через его фосфатную группу с диацилглицерином. Инозитольная концевая группа в PtdIns имеет пять свободных гидроксигрупп, и выявлено, что в клетках три из них являются фосфорилированными в различных сочетаниях. PtdIns и его фосфорилированные производные совместно называют инозитолфосфолипидами или фосфоинозитидами (PI). Для эукариотических клеток описано восемь видов PI(Vanhaesebroeck et al., 2001, выше). Все PI располагаются в мембранах и являются субстратами для киназ, фосфатаз и липаз.In vitro, PI3K фосфорилирует 3-гидроксильную группу инозитольного кольца трех различных субстратов: фосфатидилинозитола (PtdIns), фосфатидилинозитол-4-фосфата (PI(4)P) и фосфатидилинозитол 4,5-бифосфата (PI(4,5)Р 2) соответственно с образованием трех липидных продуктов, а именно фосфатидилинозитол-3-монофосфата (PI(3)Р), фосфатидилинозитол-3,4-бисфосфата (PI(3,4)Р 2) и фосфатидилинозитол-3,4,5-трисфосфата (PI(3,4,5)Р 3) (см. схему А). Предпочтительным субстратом для PI3K класса I является PI(4,5)P2. PIK II класса имеют строгое предпочтение в отношении PtdIns в качестве субстрата по сравнению с PI(4)Р и PI(4,5)Р 2.PI3K III класса в качестве субстрата in vivo могут использовать только PtdIns, и, вероятно, они являются ответственными за образование большей части PI(3)Р в клетках (Vanhaesebroeck et al., 2001, выше). Внутриклеточный каскад передачи сигнала фосфоинозитидов начинается со связывания сигнальной молекулы (внеклеточные лиганды, стимулы, димеризация рецепторов, трансактивация гетерологичным рецептором (например, рецепторной тирозинкиназой со связанным с G-белком трансмембранным рецептором, встроенным в плазматическую мембрану, что приводит к активации PI3K. После активации PI3K превращают мембранный фосфолипид PI(4,5)Р 2 в PI(3,4,5)Р 3, который, в свою очередь, может далее превращаться в другую 3'-фосфорилированную форму фосфоинозитидов посредством 5'-специфичных фосфоинозитидфосфатаз, таким образом, ферментативная активность PI3K либо прямо, либо косвенно приводит к образованию двух подтипов 3'-фосфоинозитидов, которые выполняют функцию вторичных посредников при внутриклеточной передаче сигнала (Toker et al., 2002,Cell. Mol. Life Sci. 59(5), 761-79). Роль действия фосфорилированных продуктов PtdIns в качестве вторичных посредников состоит в том, что они вовлечены во множество каскадов передачи сигнала, включая каскады, необходимые для клеточной пролиферации, клеточной дифференциации, роста клеток, установления размера клеток, выживаемости клеток, апоптоза, адгезии, подвижности клеток, миграции клеток, хемотаксиса, инвазии,перестройки цитоскелета, изменения формы клеток, транспорта везикул и метаболического каскада(Stein, 2000, Mol. Med. Today, 6(9), 347-57). Хемотаксис - направленное движение клеток по градиенту концентрации химических аттрактантов, также называемых хемокинами, вовлечен во множество имеющих значение заболеваний, таких как воспаление/аутоиммунитет, нейродегенерация, ангиогенез, инвазия/метастаз и заживление ран (Wyman et al., 2000, Immunol. Today, 21(6), 260-4; Hirsch et al., 2000,Science, 287(5455), 1049-53; Hirsch et al., 2001, FASEB J. 15(11), 2019-21 и Gerard et al., 2001, Nat.Immunol. 2(2), 108-15). Таким образом, полагают, что активация PI3-киназы вовлечена в ряд клеточных ответов, включая рост клеток, дифференциацию и апоптоз (Parker et al., 1995, Current Biology, 5, 577-99). Недавние биохимические исследования показали, что PI3K класса I (например, изоформа PI3K класса IB) представляют собой киназные ферменты с двойной специфичностью, т.е. они проявляют как киназную активность в отношении липидов (фосфорилирование фосфоинозитидов), так и киназную активность в отношении белков, поскольку они способны индуцировать фосфорилирование другого белка в качестве субстрата, включая аутофосфорилирование как внутримолекулярный регуляторный механизм. Оказалось, что PI3K вовлечены в ряд аспектов активации лейкоцитов. Было показано, что ассоциированная с р 85 активность PI3-киназы физически ассоциирована с цитоплазматическим доменом CD28,который представляет собой важную костимуляторную молекулу для активации Т-клеток в ответ на антиген. Эти эффекты связаны с повышением транскрипции ряда генов, включая ген интерлейкина-2(IL-2), важного фактора роста Т-клеток (Fraser et al., 1991, Science, 251, 313-16). Мутация CD28, связанная с его способностью более длительно взаимодействовать с PI3-киназой, приводит к отсутствию запуска продукции IL-2, что подтверждает критическую роль PI3-киназы в активации Т-клеток.PI3K была идентифицирована в качестве медиатора G-бета-гамма-зависимой регуляции активности JNK, где G-бета-гамма представляют собой субчастицы гетеротримерных G-белков. Недавно было описано, что PI3K переключает воспалительные сигналы посредством различных сопряженных с G(i) рецепторов (Laffargue et al., 2002, Immunity, 16(3), 441-51) и ее центральная для функционирования тучных клеток, с точки зрения стимулов для лейкоцитов, иммунология включает,например, цитокины, хемокины, аденозины, антитела, интегрины, факторы агрегации, факторы роста,вирусы или гормоны (Lawlor et al., 2001, J. Cell. Sci., 114 (Pt. 16), 2903-1). Специфичные ингибиторы определенных членов семейства ферментов являются ценными инструментами для расшифровки функций каждого фермента. В качестве ингибиторов PI3-киназы широко применяли два соединения, LY294002 и вортманнин(ср. далее в настоящем описании). Эти соединения представляют собой неспецифичные ингибиторыPI3K, поскольку они не отличают четыре члена PI3-киназ I класса. Значения IC50 для вортманнина в отношении каждой из различных PI3-киназ I класса находятся в диапазоне 1-10 нМ, и значения IC50 для LY294002 в отношении каждой из этих PI3-киназ составляют приблизительно 15-20 мкМ (Fruman et al., 1998, Ann. Rev. Biochem., 67, 481-507), а также 5-10 мМ в отношении протеинкиназы CK2, и существует некоторая ингибиторная активность в отношении фосфолипаз. Вортманнин представляет собой продукт метаболизма грибов, который необратимо ингибирует активность PI3K посредством ковалентного связывания каталитического домена этого фермента. Ингибирование активности PI3K вортманнином приводит к подавлению последующего клеточного ответа на внеклеточный фактор (Thelen et al., 1994, Proc. Natl. Acad. Sci. USA, 91, 4960-64). Эксперименты с вортманнином показывают, что активность PI3K в клетках гемопоэтического ростка, в частности нейтрофилов, моноцитов и других типов лейкоцитов, вовлечена во множество не связанных с памятью иммунных ответов, обусловленных острым и хроническим воспалением. Исходя из исследований с применением вортманнина, существуют доказательства того, что функционирование PI3-киназы также необходимо для некоторых аспектов передачи сигнала в лейкоцитах посредством сопряженных с G-белком рецепторов (Thelen et al., 1994). Более того, было показано, что вортманнин и LY294002 блокируют миграцию нейтрофилов и высвобождение супероксида. Однако, поскольку эти соединения не отличают различные изоформы PI3K, остается неясным, какая конкретно изоформа, или изоформы, PI3K вовлечена в эти эффекты. Некоторые результаты указывают на то, что ингибиторы PI3K, например LY294002, могут повышать противоопухолевую активность определенных цитотоксических средств (например, паклитаксела)in vivo (Grant, 2003, Current Drugs, 6(10), 946-948). Недавно в качестве ингибиторов PI3K были предложены производные тиазола (WO 2005/021519;WO 04/078754 и WO 04/096797). В WO 2005/021519 описаны производные тиазола следующей структуры: В WO 04/078754 описаны производные тиазола следующей структуры:-3 015628 В WO 04/096797 описаны производные тиазола следующей структуры: Высокое значение каскада PI3K при некоторых широко распространенных заболеваниях подчеркивает необходимость в разработке ингибиторов, в том числе селективных ингибиторов, PIK. Сущность изобретения В одном варианте осуществления это изобретение относится к производным тиазола формулы (I) где R1, R2, R3, R4 и X определены в подробном описании ниже,а также их геометрическим изомерам, оптически активным формам, таким как энантиомеры, диастереомеры, и их рацематным формам, а также их фармацевтически приемлемым солям. В другом варианте осуществления это изобретение относится к соединению формулы (Ia) где R1, R2, R3 и X определены в подробном описании ниже,а также их геометрическим изомерам, оптически активным формам, таким как энантиомеры, диастереомеры, и их рацематным формам, а также их фармацевтически приемлемым солям,и при условии, что соединения формулы (Ia) не представляют собой следующие соединения: 2' -амино-4'-метил-[4,5'-битиазол]-2-ацетонитрил; 2'-амино-4'-метил-(фенилгидразоно)-[4,5'-битиазол]-2-ацетонитрил; 2'-амино-[(4-хлорфенил)гидразоно]-4'-метил-[4,5'-битиазол]-2-ацетонитрил или этиловый эфир 2'-амино-2-метил-[4,5'-битиазол]-4'-карбоновой кислоты. В другом варианте осуществления это изобретение относится к применению соединения формулы(I) в качестве лекарственного средства. В другом варианте осуществления это изобретение относится к применению соединения формулы(I), а также его изомеров и их смеси для приготовления лекарственного средства для профилактики и/или лечения заболеваний посредством модулирования активности PI3-киназы. В еще одном варианте осуществления это изобретение относится к фармацевтической композиции,содержащей по меньшей мере одно соединение формулы (I) и его фармацевтически приемлемый носитель, разбавитель или эксципиент. Подробное описание изобретения Ниже представлены определения различных химических групп, которые образуют структуру соединений в соответствии с этим изобретением, и подразумевается их единообразное применение на протяжении описания и формулы изобретения, если нет иных явных определений, дающих более широкое определение."C1-С 6-алкил" относится к одновалентным алкильным группам, имеющим от 1 до 6 атомов углерода. Этот термин иллюстрируется такими группами, как метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, н-гексил и т.п."Арил" относится к ненасыщенной ароматической карбоциклической группе, состоящей из 6-14 атомов углерода, имеющей одно кольцо (например, фенил) или несколько конденсированных колец (например, нафтил). Арил включает фенил, нафтил, фенантренил и т.п."Гетероарил" относится к моноциклической гетероароматической группе или к бициклической или трициклической гетероароматической группе с конденсированными кольцами. Конкретные примеры гетероароматических групп включают необязательно замещенные пиридил, пирролил, пиримидинил,фурил, тиенил, имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил, 1,2,3-триазолил,1,2,4-триазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил,1,3,4-триазинил, 1,2,3-триазинил, бензофурил, [2,3-дигидро]бензофурил, изобензофурил, бензотиенил,бензотриазолил, изобензотиенил, индолил, изоиндолил, 3 Н-индолил, бензимидазолил, имидазо[1,2 а]пиридил, бензотиазолил, бензоксазолил, хинолизинил, хиназолинил, фталазинил, хиноксалинил, циннолинил, нафтиридинил, пиридо[3,4-b]пиридил, пиридо[3,2-b]пиридил, пиридо[4,3-b]пиридил, хинолил,изохинолил, тетразолил, 5,6,7,8-тетрагидрохинолил, 5,6,7,8-тетрагидроизохинолил, пуринил, птеридинил, карбазолил, ксантенил или бензохинолил."С 2-С 6-алкенил" относится к алкенильным группам, предпочтительно имеющим от 2 до 6 атомов углерода и имеющим по меньшей мере 1 или 2 участка алкенильной ненасыщенности. Предпочтительные алкенильные группы включают этенил (-СН=СН 2), н-2-пропенил (аллил, -СН 2 СН=СН 2) и т.п."С 2-С 6-алкинил" относится к алкинильным группам, предпочтительно имеющим от 2 до 6 атомов углерода и имеющим по меньшей мере 1-2 участка алкинильной ненасыщенности, предпочтительные алкинильные группы включают этинил (-ССН), пропаргил (-СН 2 ССН) и т.п."С 3-С 8-циклоалкил" относится к насыщенной карбоциклической группе из от 3 до 8 атомов углерода, имеющей одно кольцо (например, циклогексил) или несколько конденсированных колец (например,норборнил). С 3-С 8-циклоалкил включает циклопентил, циклогексил, норборнил и т.п."Гетероциклоалкил" относится к С 3-С 8-циклоалкильной группе в соответствии с приведенным выше определением, в которой вплоть до 3 атомов углерода заменены гетероатомами, выбранными из группы, состоящей из О, S, NR, где R определяется как водород или метил. Гетероциклоалкил включает пирролидин, пиперидин, пиперазин, морфолин, тетрагидрофуран и т.п."Ацилокси-С 1-С 6-алкил" относится к С 1-С 6-алкильным группам, имеющим заместитель ацилокси,включая этиловый эфир пропионовой кислоты и т.п."Алкокси" относится к группе -O-R, где R включает "C1-C6-алкил", или "арил", или "гетероарил",или "арил-С 1-С 6-алкил", или "гетероарил-С 1-С 6-алкил". Предпочтительные группы алкокси включают,например, метокси, этокси, фенокси и т.п."Аминокарбонил" относится к группе -C(O)NRR', где каждый из R, R' независимо включает водород, или С 1-С 6-алкил, или арил, или гетероарил, или "арил-С 1-С 6-алкил", или "гетероарил-С 1-С 6-алкил",включая N-фенилформамид."Ациламино" относится к группе -NRC(O)R', где каждый из R, R' независимо представляет собой водород, "С 1-С 6-алкил", "С 2-С 6-алкенил", "С 2-С 6-алкинил", "С 3-С 8-циклоалкил", "гетероциклоалкил", "арил", "гетероарил", "арил-С 1-С 6-алкил" или "гетероарил-С 1-С 6-алкил", "арил-С 2-С 6-алкенил","гетероарил-С 2-С 6-алкенил", "арил-С 2-С 6-алкинил", "гетероарил-С 2-С 6-алкинил", "циклоалкил-С 1-С 6 алкил", "гетероциклоалкил-С 1-С 6-алкил"."Уреидо" относится к группе -NRC(О)NR'R", где каждый из R, R', R" независимо представляет собой водород, "С 1-С 6-алкил", "С 2-С 6-алкенил", "С 2-С 6-алкинил", "С 3-С 8-циклоалкил", "гетероциклоалкил", "арил", "гетероарил", "арил-С 1-С 6-алкил" или "гетероарил-С 1-С 6-алкил", "арил-С 2-С 6-алкенил","гетероарил-С 2-С 6-алкенил", "арил-С 2-С 6-алкинил", "гетероарил-С 2-С 6-алкинил", "циклоалкил-С 1-С 6 алкил", "гетероциклоалкил-С 1-С 6-алкил" и где R' и R" вместе с атомом азота, к которому они присоединены, необязательно могут образовывать 3-8-членное гетероциклоалкильное кольцо."Карбамат" относится к группе -NRC(O)OR', где каждый из R, R' независимо представляет собой водород, "C1-С 6-алкил", "С 2-С 6-алкенил", "С 2-С 6-алкинил", "С 3-С 8-циклоалкил", "гетероциклоалкил", "арил", "гетероарил", "С 1-С 6-алкиларил" или "гетероарил-С 1-С 6-алкил", "арил-С 2-С 6-алкенил","гетероарил-С 2-С 6-алкенил", "арил-С 2-С 6-алкинил", "гетероарил-С 2-С 6-алкинил", "циклоалкил-С 1-С 6 алкил", "гетероциклоалкил-С 1-С 6-алкил"."Амино" относится к группе -NRR, где каждый из R, R' независимо представляет собой водород,или "C1-С 6-алкил", или "арил", или "гетероарил", или "C1-С 6-алкиларил", или "C1-C6-алкилгетероарил",или "циклоалкил", или "гетероциклоалкил" и где R и R' вместе с атомом азота, к которому они присоединены, необязательно могут образовывать 3-8-членное гетероциклоалкильное кольцо."Аммоний" относится к положительно заряженной группе -N+RR'R", где каждый из R, R', R" независимо представляет собой "C1-С 6-алкил", или "C1-С 6-алкиларил", или "C1-С 6-алкилгетероарил", или"циклоалкил", или "гетероциклоалкил" и где R и R' вместе с атомом азота, к которому они присоединены, необязательно могут образовывать 3-8-членное гетероциклоалкильное кольцо."Сульфанил" относится к группам -S-R, где R включает Н, "С 1-С 6-алкил", "C1-С 6-алкил", замещенный галогенами, например группу -SO-CF3, "С 2-С 6-алкенил", "С 2-С 6-алкинил", "С 3-С 8-циклоалкил", "гетероциклоалкил", "арил", "гетероарил", "арил-C1-С 6-алкил" или "гетероарил-С 1-С 6-алкил", "арил-С 2-С 6 алкенил", "гетероарил-С 2-С 6-алкенил", "арил-С 2-С 6-алкинил", "алкинилгетероарил-С 2-С 6", "циклоалкилС 1-С 6-алкил", "гетероциклоалкил-С 1-С 6-алкил". Предпочтительные сульфанильные группы включают метилсульфанил, этилсульфанил и т.п."Сульфониламино" относится к группе -NRSO2-R', где каждый из R, R' независимо включает водород, "C1-С 6-алкил", "С 2-С 6-алкенил", "С 2-С 6-алкинил", "С 3-С 8-циклоалкил", "гетероциклоалкил","арил", "гетероарил", "арил-С 1-С 6-алкил" или "гетероарил-С 1-С 6-алкил", "арил-С 2-С 6-алкенил","гетероарил-С 2-С 6-алкенил", "арил-С 2-С 6-алкинил", "гетероарил-С 2-С 6-алкинил", "циклоалкил-С 1-С 6 алкил", "гетероциклоалкил-С 1-С 6-алкил"."Аминосульфонил" относится к группе -SO2-NRR', где каждый из R, R' независимо включает водород, "C1-С 6-алкил", "С 2-С 6-алкенил", "С 2-С 6-алкинил", "С 3-С 8-циклоалкил", "гетероциклоалкил", "арил","гетероарил", "арил-С 1-С 6-алкил" или "гетероарил-С 1-С 6-алкил", "арил-С 2-С 6-алкенил", "гетероарил-С 2 С 6-алкенил", "арил-С 2-С 6-алкинил", "гетероарил-С 2-С 6-алкинил", "циклоалкил-С 1-С 6-алкил", "гетероциклоалкил-С 1-С 6-алкил"."Замещенный или незамещенный": если нет иных ограничений определением отдельных заместителей, указанные выше группы, такие как группы "алкенил", "алкинил", "арил", "гетероарил", "циклоалкил", "гетероциклоалкил" и т.д., необязательно могут быть замещены от 1 до 5 заместителями, выбранными из группы, состоящей из "С 1-С 6-алкила", "С 2-С 6-алкенила", "С 2-С 6-алкинила", "циклоалкила", " гетероциклоалкила","С 1-С 6-алкиларила","C1-C6-алкилгетероарила","C1-С 6-алкилциклоалкила","C1-C6-алкилгетероциклоалкила", "амино", "аммония", "ацила", "ацилокси", "ациламино", "аминокарбонила", "алкоксикарбонила", "уреидо", "арила", "карбамата", "гетероарила", "сульфинила", "сульфонила","алкокси", "сульфанила", "галогена", "карбокси", тригалогенметила, циано, гидрокси, меркапто,нитро и т.п."Фармацевтически приемлемые соли" относятся к солям определенных ниже соединений формулы(I), которые сохраняют требуемую биологическую активность. Примеры таких солей включают, но не ограничиваются ими, кислотно-аддитивные соли, образованные неорганическими кислотами (например,хлористо-водородной кислотой, бромисто-водородной кислотой, серной кислотой, фосфорной кислотой,азотной кислотой и т.п.), и соли, образованные органическими кислотами, такими как уксусная кислота,щавелевая кислота, виннокаменная кислота, янтарная кислота, яблочная кислота, фумаровая кислота,малеиновая кислота, аскорбиновая кислота, бензойная кислота, дубильная кислота, памовая кислота,альгиновая кислота, полиглутаминовая кислота, нафталинсульфоновая кислота, нафталиндисульфоновая кислота и полигалактуроновая кислота. Указанные соединения также можно вводить в качестве фармацевтически приемлемых четвертичных солей, известных специалистам в данной области, которые, в частности, включают четвертичную соль аммония формулы -NR, R', R"+Z-, где R, R', R" независимо представляют собой водород, алкил или бензил, C1-С 6-алкил, С 2-С 6-алкенил, С 2-С 6-алкинил, C1-С 6-алкиларил,C1-С 6-алкилгетероарил, циклоалкил, гетероциклоалкил и Z представляет собой противоион, включая хлорид, бромид, йодид, -О-алкил, толуолсульфонат, метилсульфонат, сульфонат, фосфат или карбоксилат (такой как бензоат, сукцинат, ацетат, гликолят, малеат, малат, фумарат, цитрат, тартрат, аскорбат,циннамоат, манделоат и дифенилацетат)."Фармацевтически активное производное" относится к любому соединению, которое при введении реципиенту способно обеспечивать, прямо или косвенно, активность, описанную в настоящем описании. Термин "косвенно" также охватывает пролекарства, которые могут превращаться в активную форму лекарственного средства с помощью эндогенных ферментов или посредством метаболизма. В настоящее время выявлено, что соединения по настоящему изобретению представляют собой модуляторы фосфатоинозитид-3-киназ (PI3K), включающих PI3Kи . При ингибировании фермента фосфатоинозитид-3-киназы (PI3K) соединениями по настоящему изобретению PI3K становится неспособной проявлять свои ферментативные, биологические и/или фармакологические эффекты. Соединения по настоящему изобретению, таким образом, пригодны для лечения и профилактики аутоиммунных нарушений и/или воспалительных заболеваний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, бактериальных или вирусных инфекций, аллергии, астмы, панкреатита,полиорганной недостаточности, заболеваний почек, агрегации тромбоцитов, злокачественной опухоли,трансплантации, подвижности сперматозоидов, дефицита эритроцитов, отторжения трансплантата или повреждений легких. Общая формула (I) в соответствии с настоящим изобретением также включает в себя ее таутомеры,ее геометрические изомеры, ее оптически активные формы, такие как энантиомеры, диастереомеры, и ее рацематные формы, а также их фармацевтически приемлемые соли. Предпочтительные фармацевтически приемлемые соли формулы (I) представляют собой кислотно-аддитивные соли, образованные фармацевтически приемлемыми кислотами, такие как гидрохлорид, гидробромид, сульфат или бисульфат, фосфат или гидрофосфат, ацетат, бензоат, сукцинат, фумарат, малеат, лактат, цитрат, тартрат, глюконат, метансульфонат, бензолсульфонат и паратолуолсульфонат. Соединения формулы (I) пригодны для модулирования, особенно ингибирования, активности фосфатоинозитид-3-киназ (PI3K). Таким образом, полагают, что соединения по настоящему изобретению также особенно пригодны для лечения и/или профилактики нарушений, опосредуемых PI3K, в частностиPI3K и/или PI3K. Указанное лечение включает модулирование, особенно ингибирование или отрицательную регуляцию фосфатоинозитид-3-киназ. Соединения формулы (I) пригодны для применения в качестве лекарственного средства. Один вариант осуществления настоящего изобретения относится к производным тиазола формулы (I)R6 выбран из Н, необязательно замещенного C1-С 6-алкила, включая метил; необязательно замещенного С 2-С 6-алкенила; необязательно замещенного С 2-С 6-алкинила; необязательно замещенного арил-С 1 С 6-алкила; необязательно замещенного гетероарил-С 1-С 6-алкила и необязательно замещенного амино,включая необязательно замещенный C1-С 6-алкиламин, такой как метоксиэтиламин, 2-амино-N,Nдиметилацетамид, 3-аминопропионовая кислота и алкильный сложный эфир 3-аминопропионовой кислоты; причем заместители в группах "алкенил", "алкинил", "арил", "гетероарил", "циклоалкил","гетероциклоалкил" выбирают из группы, состоящей из "C1-С 6-алкила", "С 2-С 6-алкенила","С 2-С 6-алкинила", "циклоалкила", "гетероциклоалкила", "C1-С 6-алкиларила", "C1-С 6-алкилгетероарила","С 1-С 6-алкилциклоалкила", "C1-С 6-алкилгетероциклоалкила", "амино", "аммония", "ацила", "ацилокси",-8 015628X выбран из S и О; а также к их геометрическим изомерам, их оптически активным формам, таким как энантиомеры, диастереомеры, и к их рацематным формам, а также к их фармацевтически приемлемым солям. Другой вариант осуществления настоящего изобретения относится к производным тиазола формулы (I), где R1 представляет собой -C(O)R5. Другой вариант осуществления настоящего изобретения относится к производным тиазола формулы (I), где R1 выбран из C1-С 6-алкила; С 2-С 6-алкенила; С 2-С 6-алкинила; арил-С 1-С 6-алкила; гетероарил-С 1-С 6-алкила; С 3-С 8-циклоалкил-С 1-С 6-алкила и гетероциклоалкил-С 1-С 6-алкила. Другой вариант осуществления настоящего изобретения относится к производным тиазола формулы (I), где R2 представляет собой Н. Другой вариант осуществления настоящего изобретения относится к производным тиазола формулы (I), где R3 представляет собой метил. Другой вариант осуществления настоящего изобретения относится к производным тиазола формулы (I), где R4 выбран из арила, гетероциклоалкила и С 3-С 8-циклоалкила. Другой вариант осуществления настоящего изобретения относится к производным тиазола формулы (I), где R4 представляет собой -C(O)R6. Другой вариант осуществления настоящего изобретения относится к производным тиазола формулы (I), где R5 выбран из гидроксила и алкокси. Другой вариант осуществления настоящего изобретения относится к производным тиазола формулы (I), где R5 представляет собой амино. Другой вариант осуществления настоящего изобретения относится к производным тиазола формулы (I), где R5 выбран из арила; гетероарила; С 3-С 8-циклоалкила и гетероциклоалкила. Другой вариант осуществления настоящего изобретения относится к производным тиазола формулы (I), где R6 выбран из C1-С 6-алкила, С 2-С 6-алкенила, С 2-С 6-алкинила, арил-С 1-С 6-алкила и С 1-С 6-алкила. Другой вариант осуществления настоящего изобретения относится к производным тиазола формулы (I), где R6 представляет собой амино. Другой вариант осуществления настоящего изобретения относится к производным тиазола формулы (I), где X представляет собой S. Другой вариант осуществления настоящего изобретения относится к производным тиазола формулы (I), где R1 представляет собой -C(O)R5; R2 представляет собой Н и R3 представляет собой метил. Еще один вариант осуществления настоящего изобретения относится к производным тиазола формулы (I), где R1 выбран из C1-С 6-алкила, С 2-С 6-алкенила, С 2-С 6-алкинила, арил-С 1-С 6-алкила и гетероарил-С 1-С 6-алкила; R2 представляет собой Н и R3 представляет собой метил.-9 015628 Соединения по настоящему изобретению включают, в частности, соединения группы, состоящей из- 14015628 Способ получения производных тиазола формулы (I) включает стадию взаимодействия амина формулы (Ia) с производным формулы ClC(O)R6 в присутствии основания, например пиридина, DEA, TEA и т.д. где R1, R2, R3, R6 и X определены в описании. Другой способ получения производных тиазола формулы (I) включает стадию нагревания амина формулы (Ia) в муравьиной кислоте или в любом алкилформиате, необязательно с сорастворителем. Еще один способ получения производных тиазола формулы (I) включает стадию взаимодействия амина формулы (Ia) с производным формулы R7R8NC(O) в присутствии основания, например DIEA,TEA, и т.д., где R7 и R8 выбраны из Н; необязательно замещенного С 1-С 6-алкила, такого как метоксиэтил(например, 2-метоксиэтил), алкилкарбоновая кислота (например, этил-3-карбоновая кислота), алкильный сложный эфир этил-3-карбоновой кислоты (например, этиловый эфир этил-3-карбоновой кислоты, третбутиловый эфир этил-3-карбоновой кислоты), аминокарбонилметил (например, N,N-диметиламинокарбонилметил). Еще один способ получения производных тиазола формулы (I) включает стадию взаимодействия амина формулы (Ia) с CDI, с последующим добавлением амина формулы R7R8NH, где R7 и R8 выбраны из Н; необязательно замещенного C1-С 6-алкила, такого как метоксиэтил (например, 2-метоксиэтил), алкилкарбоновая кислота (например, группа этил-3-карбоновая кислота), алкильный сложный эфир этил-3-карбоновой кислоты (например, этиловый эфир этил-3-карбоновой кислоты, трет-бутиловый эфир этил-3-карбоновой кислоты), аминокарбонилметил (например, N,N-диметиламинокарбонилметил). Еще один способ получения производных тиазола формулы (I) включает стадию взаимодействия производного формулы (Р 3) с амином формулы HNR9R10 в присутствии основания, например пиридина,DIEA, TEA и т.д. где R1, R2, R3, R4 и X определены в описании и R9 и R10 выбраны из Н; необязательно замещенного С 1-С 6-алкила, такого как аллил, метоксиэтил (например, 2-метоксиэтил), метоксипропил (например,3-метоксипропил), гидроксиэтил (например, 2-гидроксиэтил), гидроксилпропил (например,2,3-дигидроксипропил), цианоэтил (например, 2-цианоэтил), пропил (например, н-пропил), проп-2-инил,тетрагидрофуранметил (например, тетрагидрофуран-2-илметил), диметиламиноэтил (например,2-(диметиламино)этил), диметиламинопропил (например, 3-(диметиламино)пропил), тетразолил (например, 1 Н-тетразол-5-ил, 1 Н-тетразол-3-ил), бензойная кислота (например, 4-бензойная кислота,3-бензойная кислота, 2-гидрокси-3-бензойная кислота, 3-гидрокси-4-бензойная кислота, 3-фтор-4 бензойная кислота, 4-гидрокси-3-бензойная кислота), тетразолилфенил (например, 3-(1 Н-тетразол-5 ил)фенил, 3-(1 Н-тетразол-3-ил)фенил, 4-(1 Н-тетразол-5-ил)фенил, 4-(1 Н-тетразол-3-ил)фенил), тиадиазолилфенил (например, 3-(5-амино-1,3,4-тиадиазол-2-ил)фенил), оксадиазолилфенил (например,3-(5-гидрокси-1,3,4-оксидиазол-2-ил)фенил 4-(5-гидрокси-1,3,4-оксидиазол-2-ил)фенил), бензил (например, бензил, 1 Н-1,2,3-бензотриазол-5-ил); необязательно замещенного арила; необязательно замещенного гетероарила; необязательно замещенного С 3-С 8-циклоалкила; необязательно -NR9R10 может образовывать кольцо и может быть выбран из замещенного гетероциклоалкила, включая морфолинил (например,морфолин-4-ил), пиперазинил (например, 4-метилпиперазин-1-ил, 4-ацетилпиперазин-1-ил, 3-оксопиперазин-1-ил), пиперидинила (например, пиперидин-1-ил-3-карбоновой кислоты, пиперидин-1-ил-4 карбоновой кислоты, 4-(гидроксилметил)пиперидин-1-ил, 3-гидроксипиперидин-1-ил, 4-гидроксипиперидин-1-ил, 4-(2-гидроксиэтил)пиперидин-1-ил, 4-фторпиперидин-1-ил, 4-оксопиперидин-1-ил),1,4-диокса-8-азаспиро[4.5]декан-8-ил, 7-(гидроксиметил)-6,8-диокса-3-азабицикло[3.2.1]окт-3-ил, пирролидинил (например, 3-гидроксипирролидин-1-ил). Способ получения производных тиазола формулы (I) может также включать стадию восстановления производного формулы (Р 3) с добавлением гидрида, такого как три-трет-бутоксиалюминогидрид лития tBuO)3AlHLi).- 15015628 В другом варианте осуществления в соответствии с этим изобретением предусмотрены соединения формулы (Ia)X выбран из S и О; а также их геометрические изомеры, их оптически активные формы, такие как энантиомеры, диастереомеры, и их рацематные формы, а также их фармацевтически приемлемые соли, при условии, что соединения формулы (Ia) не представляют собой следующие соединения: 2'-амино-4'-метил-[4,5'-битиазол]-2-ацетонитрил; 2'-амино-4'-метил-(фенилгидразоно)-[4,5'-битиазол]-2-ацетонитрил; 2'-амино-[(4-хлорфенил)гидразоно]-4'-метил-[4,5'-битиазол]-2-ацетонитрил или этиловый эфир 2'-амино-2-метил-[4,5'-битиазол]-4'-карбоновой кислоты. В следующем варианте осуществления в соответствии с этим изобретением предусмотрены соединения формулы (Ia), где R1 представляет собой -C(O)R5. В следующем варианте осуществления в соответствии с этим изобретением предусмотрены соединения формулы (Ia), где R1 выбран из C1-С 6-алкила, С 2-С 6-алкенила, С 2-С 6-алкинила, арил-C1-С 6 алкила, гетероарил-С 1-С 6-алкила, С 3-С 8-циклоалкил-С 1-С 6-алкила и гетероциклоалкил-С 1-С 6-алкила. В следующем варианте осуществления в соответствии с этим изобретением предусмотрены соединения формулы (Ia), где R2 представляет собой Н. В следующем варианте осуществления в соответствии с этим изобретением предусмотрены соединения формулы (Ia), где R3 представляет собой метил. В следующем варианте осуществления в соответствии с этим изобретением предусмотрены соединения формулы (Ia), где R1 представляет собой -C(O)R5. В следующем варианте осуществления в соответствии с этим изобретением предусмотрены соединения формулы (Ia), где R1 выбран из C1-С 6-алкила, С 2-С 6-алкенила, С 2-С 6-алкинила, арил-C1-С 6 алкила, гетероарил-С 1-С 6-алкила, С 3-С 8-циклоалкил-С 1-С 6-алкила и гетероциклоалкил-С 1-С 6-алкила. В следующем варианте осуществления в соответствии с этим изобретением предусмотрены соединения формулы (Ia), где R2 представляет собой Н. В следующем варианте осуществления в соответствии с этим изобретением предусмотрены соединения формулы (Ia), где R3 представляет собой метил. В другом варианте осуществления в соответствии с этим изобретением предусмотрено применение производного тиазола формулы (I) в качестве лекарственного средства.- 16015628 В другом варианте осуществления в соответствии с этим изобретением предусмотрено применение производного тиазола формулы (I), а также его изомеров и их смеси для приготовления лекарственного средства для профилактики и/или лечения заболеваний посредством модулирования активности PI3 киназы. В одном из вариантов модулирование активности PI3-киназы представляет собой ингибирование. Еще в одном варианте применения указанная PI3-киназа представляет собой PI3-киназу . Еще в одном варианте применения указанное заболевание выбирают из аутоиммунных нарушений и/или воспалительных заболеваний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, бактериальных или вирусных инфекций, заболеваний почек, агрегации тромбоцитов, злокачественной опухоли, трансплантации, дефицита эритроцитов, отторжения трансплантата или повреждений легких. Еще в одном варианте применения указанные заболевания выбраны из группы, включающей рассеянный склероз, псориаз, ревматоидный артрит, системную красную волчанку, воспалительное заболевание кишечника, воспаление легкого, тромбоз или инфекцию/воспаление головного мозга, такое как менингит или энцефалит. Еще в одном варианте применения указанные заболевания выбраны из группы, включающей болезнь Альцгеймера, болезнь Гентингтона, травму ЦНС, инсульт или ишемические состояния. Еще в одном варианте применения указанные заболевания выбраны из группы, включающей атеросклероз, гипертрофию сердца, дисфункцию кардиомиоцитов, повышенное кровяное давление или ангиоспазм. Еще в одном варианте применения указанные заболевания выбраны из группы, включающей хроническое обструктивное заболевание легких, связанный с анафилактическим шоком фиброз, псориаз,аллергические заболевания, астму, инсульт или ишемические состояния, ишемию-реперфузию, агрегацию/активацию тромбоцитов, атрофию/гипертрофию скелетных мышц, рекрутинг лейкоцитов в ткани злокачественной опухоли, ангиогенез, инвазивный метастаз, меланому, саркому Капоши, острые и хронические бактериальные и вирусные инфекции, сепсис, отторжение трансплантата, гломерулосклероз,гломерулонефрит, прогрессивный фиброз почек, повреждения эндотелия и эпителия в легком или воспаление дыхательных путей легких. Кроме того, изобретение относится к фармацевтической композиции, содержащей по меньшей мере одно производное тиазола формулы (I) по изобретению и его фармацевтически приемлемый носитель,разбавитель или эксципиент. Производные тиазола, иллюстрирующие это изобретение, можно получать из доступных исходных материалов с использованием следующих основных способов и процессов. Следует понимать, что, когда приведены типичные или предпочтительные экспериментальные условия (т.е. температуры реакции,время, количество моль реагентов, растворители и т.д.), также можно использовать другие экспериментальные условия, если нет иных указаний. Оптимальные условия реакции могут различаться в зависимости от конкретных используемых участвующих в реакции веществ или растворителей, однако такие условия может определить специалист в данной области с использованием общепринятых способов оптимизации. При применении в качестве фармацевтических средств соединения по настоящему изобретению,как правило, вводят в форме фармацевтической композиции. Таким образом, фармацевтические композиции, содержащие соединение формулы (I) и фармацевтически приемлемый носитель, разбавитель или эксципиент, таким образом, также включены в объем настоящего изобретения. Специалист в данной области знает множество таких соединений носителей, разбавителей или эксципиентов, пригодных для составления фармацевтической композиции. Соединениям по этому изобретению, совместно с общепринятым используемым адъювантом, носителем, разбавителем или эксципиентом, можно придавать форму фармацевтических композиций и их стандартных доз и в такой форме их можно использовать в виде твердых форм, таких как таблетки или заполненные капсулы, или жидкостей, таких как растворы, суспензии, эмульсии, эликсиры, или капсулы,наполненные ими, для перорального применения, или в форме стерильных инъецируемых растворов для парентерального (в том числе подкожного) применения. Такие фармацевтические композиции и их единичные дозированные формы могут содержать ингредиенты в общепринятых соотношениях с дополнительными активными соединениями или компонентами или без них, и такие единичные дозированные формы могут содержать любое пригодное эффективное количество активного ингредиента, соответствующее предполагаемому диапазону суточной дозировки, подлежащему применению. Фармацевтические композиции, содержащие производные тиазола по этому изобретению, можно получать способами, хорошо известными в фармацевтической области, и они содержат по меньшей мере одно активное соединение. Как правило, соединения по изобретению вводят в фармацевтически эффективном количестве. Количество фактически вводимого соединения, как правило, будет определять врач с учетом соответствующих обстоятельств, включая подлежащее лечению состояние, выбранный способ введения, конкретное вводимое соединение, возраст, массу тела и ответ конкретного пациента, тяжесть симптомов пациента и т.п.- 17015628 Фармацевтические композиции по настоящему изобретению можно вводить множеством способов,включая пероральный, ректальный, чрескожный, подкожный, внутривенный, внутримышечный и интраназальный. Композиции для перорального введения могут находиться в форме жидких растворов или суспензий в резервуаре или нерасфасованных порошков. Более часто, однако, композиции представлены в виде стандартных дозированных форм для упрощения точного дозирования. Термин "стандартные дозированные формы" относится к физически дискретным единицам, пригодным для однократных дозировок для человека и других млекопитающих, и каждая единица содержит установленное количество активного вещества, вычисленное для достижения требуемого терапевтического эффекта, совместно с пригодным фармацевтическим эксципиентом. Типичные стандартные дозированные формы включают предварительно заполненные дозированные ампулы или шприцы в случае жидких композиций или пилюли,таблетки, капсулы или подобные им в случае твердых композиций. В таких композициях производное тиазола, как правило, представляет собой неосновной компонент (от приблизительно 0,1 до приблизительно 50 мас.% или предпочтительно от приблизительно 1 до приблизительно 40 мас.%), где оставшаяся часть представляет собой вещества для доставки или носители и технологические добавки, способствующие формированию требуемой дозированной формы. Жидкие формы, пригодные для перорального введения, могут включать пригодный водный или неводный носитель с буферами, суспендирующими и размельчающими средствами, красителями, вкусовыми добавками и т.п. Твердые формы могут включать, например, любой из следующих ингредиентов или сходные соединения: связующее вещество, такое как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; эксципиент, такой как крахмал или лактоза, дезинтегрирующее вещество, такое как альгиновая кислота, примогель или кукурузный крахмал; смазывающее вещество, такое как стеарат магния; вещество, способствующее скольжению, такое как коллоидный диоксид кремния; подсластитель, такой как сахароза или сахарин; или вкусовая добавка, такая как мята перечная, метилсалицилат или добавка со вкусом апельсина. В основе инъецируемых композиций, как правило, лежит инъецируемый стерильный физиологический раствор или фосфатно-солевой буфер или другие инъецируемые носители, известные в данной области. Как упомянуто выше, производные тиазола формулы (I) в таких композициях, как правило, представляют собой неосновной компонент, часто находящийся в диапазоне между 0,05 и 10 мас.%, а остальную часть составляет инъецируемый носитель и т.п. Описанные выше компоненты для перорально вводимых или инъецируемых композиций являются только репрезентативными. Дополнительные материалы, а также способы обработки и т.п. представлены в 5 разделе Remington's Pharmaceutical Sciences, 20-е изд., 2000, Marck Publishing Company, Истон, Пенсильвания, который включен в настоящее описание в качестве ссылки. Соединения по этому изобретению также можно вводить в форме систем для доставки лекарственного средства с замедленным высвобождением. Описание репрезентативных материалов для замедленного высвобождения также можно найти в материалах, включенных в Remington's PharmaceuticalSciences. Синтез соединений по этому изобретению Новые производные тиазола формулы (I) можно получать из доступных исходных материалов с помощью нескольких подходов синтеза с использованием как жидкофазных, так и твердофазных методов синтеза химии. Методы синтеза описаны далее. Следующие сокращения относятся соответственно к представленным ниже определениям:- ангстрем; экв. - эквивалент; ч - час; г - грамм; М - молярный; МГц - мегагерц; мкл - микролитр; мин - минута; мг - милиграмм; мл - миллилитр; мм - миллиметр; ммоль - миллимоль; мМ - миллимолярный; нм - нанометр;DMEM - модифицированная по способу Дульбекко среда Игла;THF - тетрагидрофуран; УФ - ультрафиолет. Производные тиазола, иллюстрирующие это изобретение, можно получать из доступных исходных материалов с использованием следующих основных способов и процессов. Следует понимать, что, когда приведены типичные или предпочтительные экспериментальные условия (т.е. температуры реакции,время, количество моль реагентов, растворители и т.д.), также можно использовать другие экспериментальные условия, если нет иных указаний. Оптимальные условия реакции могут различаться в зависимости от конкретных используемых участвующих в реакции веществ или растворителей, однако такие условия может определить специалист в данной области с использованием общепринятых способов оптимизации. В процессе, проиллюстрированном в следующих схемах, R1, R2, R3, R4, R5, R6, R7, R8, R9, R10 и X являются такими, как определено выше в описании. Главным образом, производные тиазола общей формулы (I) можно получать с помощью нескольких подходов синтеза с использованием как жидкофазных, так и твердофазных протоколов химии (Kodomariet al., 2002; Pirrung et al., 2001, выше), либо посредством общепринятых способов, либо посредством микроволновых способов. Фармацевтически приемлемые катионные соли соединений по настоящему изобретению легко получают проведением реакции кислых форм с соответствующим основанием, как правило одноэквивалентным, в сорастворителе. Типичные основания представляют собой гидроксид натрия, метоксид натрия, этоксид натрия, гидрид натрия, гидроксид калия, метоксид калия, гидроксид магния, гидроксид кальция, бензатин, холин, диэтаноламин, этилендиамин, меглумин, бенэтамин, диэтиламин, пиперазин и трометамин. Соль выделяют концентрированием досуха или добавлением осадителя. В некоторых случаях соли можно получать смешиванием раствора кислоты с раствором катиона (этилгексаноат натрия,олеат магния) с использованием растворителя, в котором требуемая катионная соль осаждается или в другом случае ее можно выделять концентрированием и добавлением осадителя. Способы получения промежуточных соединений для соединений формулы (I). В зависимости от структуры R1, R2, R3, R4, R5, R6, R7, R8, R9, R10 и X для синтеза соединений формулы (I) можно выбирать различные стратегии синтеза. Один подход для синтеза (схема 1) состоит в проведении реакции приблизительно эквимолярных количеств участвующего в реакции вещества -бромкетона (Р 1) с алкилтиооксаматом, таким как тиооксамат или тиоамид, такой как 2-цианотиоацетамид (Р 2), в растворителе, предпочтительно в полярном растворителе, таком как спиртовой растворитель, с получением соединения формулы (I). Температура реакции зависит от структуры (Р 1) и (Р 2) и находится в диапазоне между -20 С и температурой кипячения с обратным холодильником. Применение основания для улавливания высвобождающейся HBr, такого как DIEA или TEA, является необязательным. В случае, когда R4 представляет собой -C(O)R6, как определено выше, также для получения соединений формулы (I) можно использовать другой подход, как представлено на схеме 2. Он состоит в проведении реакции производного амина (Р 1 а) с алкилтиооксаматом, таким как этил тиооксамат или тиоамид, такой как 2-цианотиоацетамид (Р 2), с получением соответствующего бис-тиазола или оксазолтиазола формулы (Ia). Схема 2 Затем можно проводить функционализацию первичного амина (Ia) посредством -C(O)R6, как определено в описании выше, с использованием условий, известных специалисту в данной области, с получением соединения формулы (I). В случае, когда группа -C(O)R6 представляет собой ацильную группу, к промежуточному соединению (Ia) можно добавлять соответствующий ацилхлорид или ацилангидрид в присутствии основания,например пиридина, DIEA, TEA и т.д. Также можно добавлять соответствующую карбоновую кислоту в присутствии активирующего вещества, такого как DCC, EDC и т.д. Формильную группу, т.е. -С(О)R6=-C(О)Н, можно вносить путем нагревания промежуточного соединения (Ia) в муравьиной кислоте или в любом алкилформиате, с сорастворителем или без него. Замещенную мочевину можно получать посредством добавления изоцианата R7R8NC(O), где R7 и 8R определены выше, к промежуточному соединению (Ia) в присутствии основания, например DIEA,TEA и т.д. Последующее добавление к промежуточному соединению (Ia) CDI и замещенного первичного или вторичного амина HNR7R8 также может привести к получению соединения формулы (I), где-С(О)R6=-C(О)NR7R8, где R7 и R8 определены выше. Соединения формулы (I), где -С(О)R6=-C(О)NR7R8, как определено выше, можно превращать в альтернативные соединения формулы (I), посредством трансформации группы -NHC(O)NR7R8 в альтернативное соединение мочевины -NHC(О)NR7R8 с использованием пригодных способов взаимопревращения, хорошо известных специалисту в данной области. В зависимости от структуры R1 соединения формулы (I) можно превращать в альтернативные соединения формулы (I) посредством модификации группы R1, как определено выше. В случае, когда R1 представляет. собой сложный эфир (R1=-C(O)R5, где R5 представляет собой алкокси-OAlk, например этокси), соединения формулы (Ib) можно превращать в амид формулы (Ic), гдеR5=-NR9R10, как определено выше. Это превращение можно осуществлять посредством одной или двух стадий в зависимости от структуры амина HNR9R10, где R9 и R10 определены выше (схема 3). В случае аминов с низкими температурами кипения амид (Ic) можно получать нагреванием сложного эфира формулы (Ib) с амином HNR9R10, используемым в качестве растворителя, под действием микроволнового излучения, где R9 и R10 определены выше. Амид (Ic), как правило, можно получать через 10-30 мин при 80 С под действием микроволнового излучения. Альтернативный способ состоит в получении соответствующей карбоновой кислоты (Id), гдеR5=OH, в щелочных условиях, с последующим образованием амидной связи с амином HNR9R10, как определено выше. Для этой второй стадии можно использовать различные активирующие вещества, такие как DCC, EDC, HOBt и т.д. В зависимости от структуры участвующего в реакции конденсации вещества,может быть необходимым добавление основания, такого как TEA или DIEA. Растворители можно выбирать из DCM, DMF, MeCN или любых других растворителей, пригодных для трансформации. Карбоновую кислоту (Id) сначала можно превращать в хлорангидрид соответствующей кислоты(Р 3) с использованием пригодного реагента, такого как оксалилхлорид или тионилхлорид. Реакция полученного в результате хлорангидрида кислоты с амином HNR9R10 в присутствии основания, например пиридина, DIEA, TEA и т.д., может привести к получению соединений формулы (Ic), гдеR1=-C(O)R5=-C(O)NR9R10, как определено выше. Амины HNR9R10 могут быть коммерчески доступными из различных источников или их можно синтезировать, как подробно описано ниже в примерах, с использованием условий, известных специалисту в данной области. Спирт формулы (Ie) (R1=CH2OH) можно получать восстановлением промежуточного соединения(Р 3) с добавлением гидрида, такого как три-трет-бутоксиалюминогидрид лития (tBuO)3AlHLi). Соответствующий альдегид формулы (If), где R1=C(О)R5=C(О)Н, можно получать окислением спирта (Ie) с использованием условий, известных специалистам в данной области, таких как окисление Сверна или Десс-Мартина. В зависимости от структуры R1 для получения соединений формулы (I) можно использовать другой реагент (Р 2). В случае, когда R1 представляет собой -C(O)R5, где R5 представляет собой замещенный алкокси, например этокси, соединения формулы (Ib) можно получать проведением реакции приблизительно эквимолярных количеств -бромкетона (Р 1) с алкилтиооксаматом, таким как тиооксамат (Р 2 а) (см. схему 4). Схема 4- 21015628 В случае, когда R1 представляет собой замещенный C1-C6-алкил, например цианометил, соединения формулы (I) можно получать проведением реакции приблизительно эквимолярных количеств Соединения формулы (I) можно превращать в альтернативные соединения формулы (I). Например,в случае, когда R1=CH2CN, соединения формулы (Ig) можно превращать в тетразолилметилпроизводные,такие как 2 Н-тетразол-5-илметилпроизводные (Ih), в условиях, известных специалисту в данной области(схема 6). Например, соединения формулы (I), где R1 представляет собой -СН 2-тетразолил, т.е. соединение формулы (Ih), можно получать проведением реакции (Ig) с азидом, таким как азид натрия в присутствииBu3SnCl (4 экв.) или TMSN3 в присутствии каталитического количества Bu2SnO (Wittenberger et al., 1993,J. Org. Chem., 58, 4139). Схема 6-Бромкетон (P1) можно получать посредством -бромирования кетона (Р 4) (схема 7). Можно использовать различные вещества для бромирования, такие как Br2, необязательно в присутствии HBr илиNBS. В зависимости от структуры R4, перед проведением бромирования свободную группу NH можно первоначально защищать (схема 7). Затем защитную группу можно удалять с использованием условий,известных специалистам в данной области, с получением промежуточного соединения (P1). PG может представлять собой любую защитную группу, которую можно легко удалить, например ацетильную группу. Схема 7 В случае, когда R4 представляет собой -C(O)R6, -бромкетон (Р 1 с) можно получать посредством двух стадий из замещенного 5-ацил-2-аминотиазола (Р 5), как представлено на схеме 8. Сначала можно проводить функционализацию первичного амина в (Р 5), посредством -C(O)R6, как определено выше в описании, с получением (Р 4 а). В случае, когда -C(O)R6 представляет собой ацильную группу, к промежуточному соединению (Р 5) можно добавлять соответствующий ацилхлорид или ацилангидрид в присутствии основания, например пиридина, DIEA, TEA и т.д. Также можно добавлять соответствующую карбоновую кислоту в присутствии активирующего вещества, такого как DCC, EDC и т.д. Формильную группу, -С(О)R6=-C(О)Н, можно вводить посредством нагревания промежуточного соединения (Р 5) в муравьиной кислоте или в любом алкилформиате, с сорастворителем или без него. Замещенную мочевину можно получать добавлением к промежуточному соединению (Р 5) изоцианата R7R8NC(O) в присутствии основания, например DIEA, TEA и т.д., где R7 и R8 определены выше. Последующее добавление к промежуточному соединению (Р 5) CDI и замещенного первичного или вторичного амина HNR7R8 также может приводить к получению промежуточного соединения (Р 4 а), где-С(О)R6=-C(О)NR7R8, как определено выше. Соединения формулы (Р 4 а), где -С(О)R6=-C(О)NR7R8, можно превращать в альтернативные соединения формулы (Р 4 а) посредством превращения группы-NHC(O)NR7R8 в альтернативную группу мочевины -NHC(О)NR7R8, где R7 и R8 определены выше, с использованием пригодных способов взаимопревращения, известных специалисту в данной области. После этой первой стадии ацилирования может следовать -бромирование 5-ацильной группы с получением промежуточного соединения (Р 1 с) (схема 8). Эти две стадии можно проводить в обратном порядке (схема 8). Сначала можно проводить бромирование промежуточного соединения (Р 5) с получением промежуточного соединения (Р 1 а). Затем можно получать промежуточное соединение (Р 1 с) после введения группы -C(O)R6, как определено выше в описании, с использованием условий, описанных выше. В обоих методах синтеза можно использовать различные вещества для бромирования, такие как Br2,необязательно в присутствии HBr или NBS. Промежуточные соединения формулы (Р 4) и (Р 5) либо коммерчески доступны из различных источников, либо их можно получать посредством различных подходов для синтеза с использованием как жидкофазных, так и твердофазных методов синтеза. Примеры синтеза промежуточных соединений (Р 4) и (Р 5) представлены на схеме 9. Схеме 9- 23015628 Замещенный дикетон (Р 6) можно галогенировать с использованием, например, Br2 для бромирования или тионилхлорида для -хлорирования, с получением промежуточного соединения (Р 7). "Hal" в промежуточном соединении (Р 7) также может представлять собой группу тозилокси, которую можно вносить с помощью пригодных реагентов, таких как гидрокси(тозилокси)йодбензол. Затем промежуточное соединение (Р 7) можно добавлять в раствор тиомочевины или мочевины в пригодном растворителе,предпочтительно в полярном растворителе, например EtOH, с получением промежуточного соединения(Р 5). Конкретные условия реакции, температура, время и т.д. могут зависеть от структуры X и заместителей R2 и R3, в соответствии с литературой и как подробно описано ниже в примерах (Sayed et al., 1999,Heteroatom Chemistry, 10, 385-390). Промежуточное соединение (Р 4) можно непосредственно получать реакцией (Р 7) с пригодным соединением тиомочевины или мочевины (Р 8), замещенным группой -R4, как определено выше в описании. Соединения тиомочевины или мочевины (Р 8) либо коммерчески доступны, либо их получают с использованием условий, известных специалисту в данной области. Некоторые условия описаны ниже в примерах или в Herr et al., 2000, Synthesis, 2000, 1569-1574 иWilson et al., 2001, J. Bioorg. Med. Chem. Lett, 11, 915-918. В случае, когда R3=H, (Р 6 а) получают одностадийным методом в виде натриевой соли путем конденсации метилкетона с этилформиатом, как представлено на схеме 10. Затем его непосредственно бромируют с получением промежуточного соединения (Р 7 а), в соответствии с литературой и как подробно описано ниже в примерах. Схема 10 В соответствии со следующим общим способом соединения формулы (I) можно превращать в альтернативные соединения формулы (I) с использованием пригодных способов взаимопревращения, хорошо известных специалисту в данной области. Если представленный выше ряд общих способов синтеза не применим для получения соединений формулы (I) и/или промежуточных соединений, необходимых для синтеза соединений формулы (I), следует использовать пригодные способы получения, известные специалисту в данной области. Как правило, процессы синтеза любого конкретного соединения формулы (I) зависят от конкретных заместителей каждой молекулы и от доступности необходимых промежуточных соединений; такие факторы также учитывают специалисты в данной области. Для всех способов внесения и удаления защитной группы, см.Greene and Peter G.M. Wuts в "Protective Groups in Organic Synthesis", Wiley Interscience, 3-е изд., 1999. Соединения по изобретению можно выделять совместно с молекулами растворителя посредством кристаллизации при выпаривании соответствующего растворителя. Фармацевтически приемлемые кислотно-аддитивные соли соединений формулы (I), которые содержат основный центр, можно получать общепринятыми способами. Например, раствор свободного основания можно обрабатывать пригодной кислотой либо в чистом виде, либо в пригодном растворе и полученную соль выделять либо фильтрацией, либо выпариванием в вакууме растворителя реакционной смеси. Фармацевтически приемлемые основно-аддитивные соли можно получать аналогичным образом посредством обработки раствора соединения формулы (I) пригодным основанием. Оба типа солей можно получать или взаимопревращать, используя методики, в которых используется ионообменная смола. Представленное ниже настоящее изобретение можно проиллюстрировать посредством некоторых примеров, которые не следует рассматривать как ограничивающие объем этого изобретения. Использовали следующие коммерчески доступные исходные материалы: 5-ацетил-2-амино-4-метилтиазол (Flrochem),3-хлор-2,4-пентандион (Fluka),2-аминопиразин (Aldrich),3-аминопиразол (Aldrich),2-гидрокси-5-нитробензойная кислота (Aldrich),3-аминобензонитрил (Aldrich),4-аминосалициловая кислота (Aldrich),3-нитробензойная кислота (Aldrich),4-нитробензойная кислота (Aldrich),этилтиооксамат (Aldrich),аллиламин (Fluka),- 24015628 2-цианотиоацетамид (Aldrich),2-метоксиэтиламин (Fluka),тетрагидрофурфуриламин (Fluka),2-диметиламиноэтиламин (Fluka),морфолин (Fluka),1-метилпиперазин (Fluka),N,N-диметил-1,3-пропандиамин (Fluka),этаноламин (Fluka),N-(2-цианоэтил)амин (Lancaster),5-аминотетразол (Aldrich),4-аминобензойная кислота (Aldrich),3-аминобензойная кислота (Emkachem),5-(3-аминофенил)тетразол (Avocado),бензиламин (Fluka),N-пропиламин (Fluka),гидрохлорид 4-(2 Н-тетразол-3-ил)анилина (Asimex),3-аминосалициловая кислота (TCI-US),нипекотиновая кислота (Emkachem),изонипекотиновая кислота (Fluka),3-гидроксипиперидин (Fluka),4-(гидроксиметил)пиперидин (Maybridge),4-пиперидинэтанол (Aldrich),4-гидроксипиперидин (Fluka),5-аминобензотриазол (Aldrich),4-амино-2-фторбензойная кислота (Apollo),литий три-трет-бутоксиалюминогидрид (Aldrich),этил-2-изоцианатпропионат (Aldrich),1,4-диокса-8-азаспиро[4,5]декан (Aldrich),2,2-диметил-1,3-диоксолан-4-метанамин (Aldrich),пиперазин-2-он (Aldrich),моногидрат гидрохлорида 4-пиперидона (Aldrich),3-пирролидинол (Fluka),пропаргиламин (Fluka),1-ацетилпиперазин (Aldrich),ацетат диметиламида глицина (Chem-Impex),бета-аланин (Aldrich),4-фторпиперидин (Flrochem),гидрохлорид трет-бутилового эфира -аланина (Bachem).H-ЯМР: Bruker DPX-300 МГц. Очистку посредством препаративной ВЭЖХ проводят с помощью системы для ВЭЖХ Waters PrepLC 4000 System, оборудованной колонками Prep Nova-PakHR С 186 мкМ 60 А, 4030 мм (вплоть до 100 мг) или XTerra Prep MS C8, 10 мкМ, 50300 мм (вплоть до 1 г). Все процессы очистки проводят с помощью градиента MeCN/H2O 0,09% TFA. Полупрепаративную ВЭЖХ с обращенной фазой проводят с помощью системы Biotage Parallex Flex System, оборудованной колонками Supelcosil ABZ+Plus(25 см 21,2 мм, 12 мкМ); УФ-детекция при 254 и 220 нм; скорость потока 20 мл/мин (вплоть до 50 мг). Анализ TLC проводят на планшетах Merck Precoated 60 F254. Очистку флэш-хроматографией проводят с подложкой на основе SiO2 с использованием смесей циклогексан/EtOAc или DCM/MeOH в качестве элюентов.- 25015628 Химические реакции с помощью микроволнового излучения проводят на однорежимном микроволновом реакторе Emrys Optimiser от Personal Chemistry. Промежуточное соединение 1. Получение N-[5-(бромацетил)-4-метил-1,3-тиазол-2-ил]ацетамида,соль бромисто-водородной кислоты (промежуточное соединение (Р 1), где R2 представляет собой Н; R3 иR6 представляют собой метил и X представляет собой S). Стадия I. N-(5-Ацетил-4-метил-1,3-тиазол-2-ил)ацетамид (промежуточное соединение (Р 6), где R2 представляет собой Н; R3 и R4 представляют собой метил и X представляет собой S). 5-Ацетил-2-амино-4-метилтиазол (Р 5) (Flrochem) (12,4 г, 79 ммоль) суспендируют в смесиTHF/DCM 3:2 (150 мл). Смесь охлаждают до 0 С и добавляют пиридин (16 мл), а затем по каплям добавляют ацетилхлорид (8,43 мл, 119 ммоль, 1,5 экв.). Смесь перемешивают в течение 2 ч при 0 С. После прекращения ацетилирования реакцию гасят добавлением воды (70 мл) и реакционную смесь разбавляют посредством EtOAc (100 мл). Две фазы разделяют и органическую фазу промывают одной частью 10% раствора лимонной кислоты. Органический слой сушат над MgSO4, фильтруют и выпаривают. Полученную неочищенную массу очищают кристаллизацией из смеси EtOAc/циклогексан с получениемN-(5-ацетил-4-метил-1,3-тиазол-2-ил)ацетамида (Р 6) в виде бесцветного порошка (13,1 г, выход 83,6%). 1M-(ESI): 197,3; M+(ESI): 199,3. ВЭЖХ (способ A), Rt: 1,7 мин (чистота: 99,7%). Стадия II. N-[5-(Бромацетил)-4-метил-1,3-тиазол-2-ил]ацетамид, соль бромисто-водородной кислоты (промежуточное соединение 1). К раствору N-(5-ацетил-4-метил-1,3-тиазол-2-ил)ацетамида (Р 6), полученного на стадии I, как описано выше (10,40 г, 52,5 ммоль), в 200 мл диоксана по каплям добавляют раствор Br2 (3,35 мл,65,6 ммоль) в 75 мл диоксана. Полученную смесь нагревают при 50 С в течение 19 ч. Раствор меняется от темно-красного до бежевого и остается в виде гетерогенной смеси. С помощью аналитической ВЭЖХ выявляется только 2,8% исходного вещества. Суспензию фильтруют, промывают смесью EtOAc/гексаны 1:2 (50 мл) и сушат воздухом в течение 15 мин с получением промежуточного соединения 1 в качестве бежевого твердого вещества (11,2 г, 60%). После обработки в течение 5 мин Амберлистом А 21 в смесиH-ЯМР (ДМСО-d6) : 2,04 (с, 3 Н), 2,44 (с, 3 Н), 4,52 (с, 2 Н), 12,44 (ушир.с, 1 Н). М-(ESI): 276; M+(ESI): 278. ВЭЖХ (способ A), Rt: 2,2 мин (чистота: 97,4%). Промежуточное соединение 2. Получение 1-(2-амино-4-метил-1,3-тиазол-5-ил)-2-бромэтанона, соль бромисто-водородной кислоты (промежуточное соединение (Р 1 а), где R2 представляет собой Н; R3 представляет собой метил и X представляет собой S).HBr в воде (20 мл, 6,4 ммоль). Смесь нагревают при 60 С и по каплям добавляют раствор Br2 (0,262 мл,5,12 ммоль, 0,8 экв.) в диоксане (20 мл). Смесь перемешивают при 60 С в течение 3 ч. За ходом реакции наблюдают с помощью LC/MS. После ее прекращения растворители выпаривают и удаляют воду азеотропной дистилляцией с помощью толуола. Полученное твердое вещество перекристаллизовывают в смеси изопропанол/Et2O с получением промежуточного соединения 2 в виде бесцветного твердого вещества (890 мг, выход 74%). После обработки в течение 5 мин Амберлистом А 21 в смеси DCM/MeOH, его используют в синтезе бис-тиазола в виде соли HBr или в виде исходного вещества. 1- 26015628 Промежуточное соединение 3. Получение 2-бром-1-[4-метил-2-(пиразин-2-иламино)-1,3-тиазол-5 ил]этанона, соль бромисто-водородной кислоты (промежуточное соединение (Р 1), где R4 представляет собой 2-пиразинил; R2 представляет собой Н; R3 представляет собой метил и X представляет собой S). Стадия I. Получение N-пиразин-2-илтиомочевины. К раствору тиоцианата аммония (17,8 г, 0,234 моль) в сухом ацетоне (200 мл) при 0 С в атмосфере азота медленно добавляют бензоилхлорид (30 г, 0,213 моль) в течение 15 мин. Реакционную смесь перемешивают при комнатной температуре в течение 30 мин и фильтруют. К фильтрату по каплям добавляют 2-аминопиразин (16,2 г, 0,17 моль) и перемешивают в течение 3 ч при комнатной температуре. Растворитель удаляют в вакууме и осадок разбавляют водой. Осажденное твердое вещество фильтруют и сушат с получением N-[(пиразин-2-иламино)карбонотиоил]бензамида в виде твердого вещества (33 г; 76%).(200 мл) перемешивают при 80 С в течение 20 мин. Реакционную смесь охлаждают и растворитель удаляют в вакууме. Осадок подкисляют посредством 2 М HCl до рН 1, а затем подщелачивают гидроксидом аммония. Осажденное твердое вещество собирают фильтрацией и сушат в вакууме с получениемN-пиразин-2-илтиомочевины в виде твердого вещества (12 г; 80%). 1 Н-ЯМР (ДМСО-d6, 300 МГц) : 8,24 (ушир.с, 2 Н), 8,54 (с, 1 Н), 9,10 (м, 1 Н), 9,95 (м, 1 Н), 10,66TLC: хлороформ/метанол (9/1): Rf=0,25. Мр: 234-235 С. Стадия II. Получение 1-[4-метил-2-(пиразин-2-иламино)-1,3-тиазол-5-ил]этанона, соль хлористоводородной кислоты. К раствору N-пиразин-2-илтиомочевины (5 г, 0,032 моль) в абсолютном этаноле (50 мл) добавляют 3-хлор-2,4-пентандион (4,4 г, 0,032 моль). Смесь кипятят с обратным холодильником в течение 20 ч в атмосфере азота. Реакционную смесь охлаждают до комнатной температуры и полученный осадок фильтруют, промывают этанолом (25 мл) и сушат в вакууме с получением 1-[4-метил-2-(пиразин-2 иламино)-1,3-тиазол-5-ил]этанона, соль хлористо-водородной кислоты, в виде не совсем белого твердого вещества (7 г; 92%). 1 Н-ЯМР (ДМСО-d6, 300 МГц) : 2,47 (с, 3 Н), 2,57 (с, 3 Н), 8,21 (с, 1 Н), 8,41 (с, 1 Н), 8,48 (с, 1 Н), 12,2TLC: хлороформ/метанол (9/1): Rf=0,25. Mp: 224-229 С. Стадия III. Получение N-(5-ацетил-4-метил-1,3-тиазол-2-ил)-N-пиразин-2-илацетамида. В пробирке смешивают 1-[4-метил-2-(пиразин-2-иламино)-1,3-тиазол-5-ил]этанон, соль хлористоводородной кислоты (500 мг; 1,85 ммоль; 1 экв.), с уксусным ангидридом (2,16 мл; 22,90 ммоль; 12,40 экв.). Пробирку закрывают и нагревают при 150 С на масляной бане. Через 15 мин смесь становится желтой. Реакция прекращается. Растворители удаляют и N-(5-ацетил-4-метил-1,3-тиазол-2-ил)-Nпиразин-2-илацетамид используют в таком виде без дальнейшей очистки (510,3 мг; количественный выход). Стадия IV. 2-Бром-1-[4-метил-2-(пиразин-2-иламино)-1,3-тиазол-5-ил]этанон, соль бромистоводородной кислоты (промежуточное соединение 3).N-(5-Ацетил-4-метил-1,3-тиазол-2-ил)-N-пиразин-2-илацетамид (511,2 мг; 1,85 ммоль; 1 экв.) растворяют в АсОН (10 мл). Добавляют бромисто-водородную кислоту (32 мкл; 0,19 ммоль; 0,10 экв.), а затем раствор брома (95 мкл; 1,85 ммоль; 1 экв.) в АсОН (2 мл). Смесь перемешивают в течение 3 ч при комнатной температуре и 2 ч при 60 С. Для прекращения реакции добавляют раствор брома (95 мкл; 1,85 ммоль; 1 экв.) в АсОН (2 мл) и смесь перемешивают в течение 4 ч при 60 С. Растворители выпаривают и полученное твердое вещество темно-коричневого цвета суспендируют в THF, фильтруют и промывают циклогексаном с получением промежуточного соединения 3 в виде желтого твердого вещества(467,7 мг; 64%). После обработки в течение 5 мин Амберлистом А 21 в смеси DCM/MeOH его используют для синтеза бис-тиазола в виде соли HBr или в виде исходного вещества. 1 Н-ЯМР (ДМСО-d6, 300 МГц) : 2,60 (с, 3 Н), 4,64 (с, 2 Н), 8,24 (д, J=2,6 Гц, 1 Н), 8,43 (дд, J=1,5 Гц,J=2,6 Гц, 1 Н), 8,50 (д, J=1,5 Гц, 1 Н).R4 представляет собой 1-ацетил-1 Н-пиразол-3-ил; R2 представляет собой Н; R3 представляет собой метил и X представляет собой S). Стадия I. Получение N-1H-пиразол-3-илтиомочевины. К раствору тиоцианата аммония (17,8 г, 0,234 моль) в сухом ацетоне (200 мл) при 0 С в атмосфере азота добавляют бензоилхлорид (30 г, 0,213 моль) в течение 15 мин. Реакционную смесь перемешивают при комнатной температуре в течение 30 мин и фильтруют. К фильтрату по каплям добавляют 3-аминопиразол (14,1 г, 0,17 моль) и перемешивают в течение 3 ч при комнатной температуре. Растворители удаляют в вакууме и осадок очищают посредством флэш-хроматографии с использованием смеси хлороформ/метанол (9/1) в качестве элюента. N-[(1 Н-пиразол-3-иламино)карбонотиоил]бензамид выделяют в виде твердого вещества (22 г; 52%).NaOH (200 мл) перемешивают при 80 С в течение 45 мин. Реакционную смесь охлаждают до комнатной температуры и растворители удаляют в вакууме. Осадок подкисляют посредством 2 М HCl до рН 1, а затем подщелачивают гидроксидом аммония. Продукт экстрагируют дихлорметаном (4100 мл). Объединенные экстракты высушивают и выпаривают. Твердый осадок очищают флэш-хроматографией с использованием смеси хлороформ/метанол (9/1) в качестве элюента. N-1H-пиразол-3-илтиомочевину выделяют в качестве твердого вещества (9 г; 75%). 1 Н-ЯМР (ДМСО-d6, 300 МГц) : 5,88 (ушир.с, 1 Н), 7,64 (с, 1 Н), 8,44 (ушир.с, 1 Н), 9,02 (ушир.с, 1 Н),10,30 (ушир.с, 1 Н), 12,47 (ушир.с, 1 Н). ВЭЖХ (способ В), Rt: 3,88 мин (чистота: 99,4%).TLC: хлороформ/метанол (9/1): Rf=0,2. Мр: 130-132 С. Стадия II. Получение 1-[4-метил-2-(1 Н-пиразол-3-иламино)-1,3-тиазол-5-ил]этанона. К раствору N-1H-пиразол-3-илтиомочевины (5 г, 0,0352 моль) в абсолютном этаноле (50 мл) добавляют 3-хлор-2,4-пентандион (4,78 г, 0,0352 моль) и смесь кипятят с обратным холодильником в течение 20 ч в атмосфере азота. Реакционную смесь охлаждают до комнатной температуры и полученный осадок фильтруют, промывают этанолом (25 мл) и сушат в вакууме с получением требуемого продукта в виде соли хлористо-водородной кислоты. Его нейтрализуют 10% раствором бикарбоната натрия, фильтруют и сушат с получением 1-[4-метил-2-(1 Н-пиразол-3-иламино)-1,3-тиазол-5-ил]этанона в виде светлокоричневого твердого вещества (5 г, 64%). 1TLC: хлороформ/метанол (8/2): Rf=0,4. Мр: 224-227 С. Стадия III. N-(5-Ацетил-4-метил-1,3-тиазол-2-ил)-N-(1-ацетил-1 Н-пиразол-3-ил)ацетамид. В пробирке смешивают 1-[4-метил-2-(1 Н-пиразол-3-иламино)-1,3-тиазол-5-ил]этанон (500 мг; 2,25 ммоль; 1 экв.) и уксусный ангидрид (2,64 мл; 27,89 ммоль; 12,40 экв.). Пробирку закрывают и нагревают при 150 С на масляной бане. Через 10 мин реакция прекращается. Растворители выпаривают с получением N-(5-ацетил-4-метил-1,3-тиазол-2-ил)-N-(1-ацетил-1 Н-пиразол-3-ил)ацетамида, который используют на следующей стадии без дальнейшей очистки (689,1 мг; количественный выход). Стадия IV. 1-2-[(1-Ацетил-1 Н-пиразол-3-ил)амино]-4-метил-1,3-тиазол-5-ил-2-бромэтанон, соль бромисто-водородной кислоты (промежуточное соединение 4).(689,3 мг; 2,25 ммоль; 1 экв.) растворяют в АсОН (10 мл) в бромисто-водородной кислоте (39 мкл; 0,22 ммоль; 0,10 экв.). По каплям добавляют раствор брома (115 мкл; 2,25 ммоль; 1 экв.) в АсОН (2 мл). Реакционную смесь перемешивают в течение 3 ч при комнатной температуре и 2 ч при 60 С. Для остановки реакции добавляют раствор брома (58 мкл; 1,12 ммоль; 0,50 экв.) в АсОН (2 мл) и смесь перемешивают в течение 4 ч при 60 С. Ее охлаждают до комнатной температуры и полученный осадок фильтруют, промывают циклогексаном и сушат при пониженном давлении с получением промежуточного соединения 4(695,7 мг; 73%). После обработки в течение 5 мин Амберлистом А 21 в смеси DCM/MeOH его используют для синтеза бис-тиазола в виде соли HBr или в виде исходного вещества. К раствору 1-(2-амино-4-метил-1,3-тиазол-5-ил)-2-бромэтанона, соли промежуточного соединения 2 с бромисто-водородной кислотой (5340 мг; 16,9 ммоль; 1 экв.), в этаноле (150 мл), добавляют 2-цианотиоацетамид (1692,2 мг; 16,9 ммоль; 1 экв.). Реакционную смесь перемешивают при комнатной температуре в течение 20 ч. Образовавшийся осадок фильтруют с получением промежуточного соединения 5 в виде оранжевого твердого вещества (4400 мг; количественный выход). Его используют на следующей стадии без дальнейшей очистки. 1 В 250-мл флакон в атмосфере Ar к перемешиваемой суспензии промежуточного соединения 5(1000 мг; 3,15 ммоль; 1 экв.) и CDI (1372 мг; 8,46 ммоль; 2,68 экв.) в сухом DCM (65 мл) добавляют триэтиламин (0,65 мл; 4,69 ммоль; 1,49 экв.). Для повышения растворимости добавляют DMF (4 мл). Смесь перемешивают при 45 С в течение ночи. Посредством ВЭЖХ исходное вещество не выявляется. Реакционную смесь охлаждают до комнатной температуры. Полученный осадок выделяют фильтрацией, промывают диэтиловым эфиром и сушат в вакууме с получением промежуточного соединения 6 (822,8 мг; 79%). Его используют на следующей стадии без дельнейшей очистки. Промежуточное соединение 7. Получение N-[4'-метил-2-(морфолин-4-илкарбонил)-4,5'-би-1,3 тиазол-2'-ил]-1 Н-имидазол-1-карбоксамида Стадия I. Этил-2'-амино-4'-метил-4,5'-би-1,3-тиазол-2-карбоксилат. В 20-мл колбе для обработки микроволновым излучением суспендируют промежуточное соединение 2 (400 мг; 1,27 ммоль; 1 экв.) в EtOH (7 мл). Добавляют этилтиооксамат (168,6 мг; 1,27 ммоль; 1 экв.) и смесь нагревают под действием микроволнового излучения при 120 С в течение 15 мин. Реакционную смесь фильтруют с получением соли HBr указанного в заголовке соединения (201 мг; 45%). Соединение суспендируют в DCM/EtOH 2:1 (9 мл) и добавляют Амберлист А-21 (200 мг; 4,54 ммоль; 3,58 экв.). После встряхивания в течение 2 ч 30 мин при комнатной температуре смесь фильтруют и смолу смывают посредством DCM и EtOH с получением этил-2'-амино-4'-метил-4,5'-би-1,3-тиазол-2-карбоксилата, который используют на следующей стадии без дальнейшей очистки (146,2 мг; 43%). 1
МПК / Метки
МПК: A61K 31/553, A61K 31/433, C07D 491/10, A61K 31/496, A61K 31/497, A61K 31/454, C07D 277/48, A61P 9/00, C07D 417/14, C07D 277/56, C07D 493/08, A61K 31/5377, A61P 25/00, A61K 31/427, C07D 277/46
Метки: тиазола, производные, применение
Код ссылки
<a href="https://eas.patents.su/30-15628-proizvodnye-tiazola-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Производные тиазола и их применение</a>
Предыдущий патент: Соединения тетрагидроциклопента[b]индола в качестве модуляторов рецептора андрогенов
Следующий патент: Пептиды, используемые для лечения и диагностики аутоиммунных заболеваний
Случайный патент: Способ газификации углеродсодержащих веществ плазмой












