Содержащие диариловый эфир соединения мочевины
Номер патента: 15488
Опубликовано: 31.08.2011
Авторы: Мейерз Марвин Джей, Ванг Лицзюань Джейн, Кестен Сузанн Росс, Моррис Марк Энтони, Лазервит Скотт Эдвард, Стифф Кори Майкл, Фей Лоррейн Кэтлин, Джонсон Дуглас Скотт
Формула / Реферат
1. Соединение формулы I
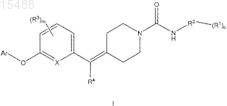
в которой каждый R1 независимо представляет собой водород, -OH, галоген, галогеналкил, -C1-C6-алкил, -O-C1-C6-алкил, -S-C1-C6-алкил, арил, гетероарил, -O-арил, -O-гетероарил, -NH2, -NHC(O)C1-C6-алкил, -(CH2)0-3-C3-C6-циклоалкил, -NHC(O)C3-C6-циклоалкил, -NHC1-C6-алкил, CN, -C(O)NR'R" или -C(O)C1-C6-алкил; причем каждая R1-C1-C6-алкильная группа необязательно замещена -O-C1-C6-алкильной группой или 1-3
-OH заместителями;
R' и R" независимо выбирают из H или C1-C6-алкила;
R2 представляет собой арил, гетероарил, -C(O)-арил или -C(O)-гетероарил;
каждый R3независимо представляет собой водород, галоген, галогеналкил, -C1-C6-алкил, -O-C1-C6-алкил,
-S-C1-C6-алкил, -(CH2)0-3-C3-C6-циклоалкил, -S-C3-C6-циклоалкил и -O-C3-C6-циклоалкил; причем упомянутые R3-C1-C6-алкильные, -O-C1-C6-алкильные, -S-C1-C6-алкильные, -(CH2)0-3-C3-C6-циклоалкильные, -S-C3-C6-циклоалкильные и -O-C3-C6-циклоалкильные группы необязательно замещены 1-4 галогенами, галогеналкилами, -O-галогеналкилами, -C1-C6-алкилами или -O(C1-C6-алкил);
R4 представляет собой водород, -C1-C6-алкил, фенил, -(CH2)0-3-C3-C6-циклоалкил или галоген; причем упомянутые R4-C1-C6-алкильные, фенильные и -(CH2)0-3-C3-C6-циклоалкильные группы необязательно замещены 1-4 галогенами, -C1-C6-алкилами или -O(C1-C6-алкил);
X представляет собой N, C или CH;
m равно 0, 1, 2, 3 или 4;
n равно 0, 1, 2, 3 или 4 и
Ar представляет собой арил, -CH2-арил или гетероарил, причем упомянутые арильные, -CH2-арильные и гетероарильные группы необязательно независимо замещены 1-4 заместителями, выбранными из водорода, -C1-C6-алкила, -C2-C6-алкенила, -C2-C6-алкинила, -(CH2)0-3-C3-C6-циклоалкила, галогена, галогеналкила, -O-галогеналкила, -C(O)C1-C6-алкила, -O-C1-C6-алкила, -S-C1-C6-алкила, -O-C2-C6-алкенила, -O-C2-C6-алкинила, CN, арила, гетероциклила или гетероарила; причем упомянутые -C1-C6-алкильные, -(CH2)0-3-C3-C6-циклоалкильные, -C(O)C1-C6-алкильные, -O(C1-C6-алкил), -S-C1-C6-алкильные, арильные, -CH2-арильные, гетероциклильные и гетероарильные заместители на Ar необязательно независимо замещены 1-4 -C1-C6-алкилами, -C1-C6-алкокси, -OH или галогенами;
где галогеналкил или -O-галогеналкил означают C1-C6-алкильные или C1-C6-алкоксигруппы соответственно, замещенные одним или несколькими галогенами;
арил и арилен означают моноциклические или бициклические одновалентные или двухвалентные ароматические карбоциклические группы;
гетероарил и гетероарилен означают одновалентные или двухвалентные ароматические группы соответственно, содержащие 1-4 кольцевых гетероатома, выбранных из O, S или N; и
гетероцикл и гетероциклил означают насыщенные или частично ненасыщенные или бициклические кольца, содержащие 3-7 или 7-11 кольцевых атомов соответственно, имеющие кольцевые атомы, которые представляют собой атомы углерода, и 1-4 гетероатома, которые независимо выбирают из азота, кислорода или серы, и могут включать любую бициклическую группу, в которой любой из определенных выше моноциклических гетероциклов конденсирован с бензольным кольцом и гетероатомы азота и серы могут быть необязательно окислены;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где
Ar представляет собой фенил, пиримидинил, пиридил, бензотиазол;
R2 представляет собой изоксазол, пиридил, пиразинил или пиридазинил;
m равно 0, 1 или 2;
n равно 0-2 и
X представляет собой C или CH;
или его фармацевтически приемлемая соль.
3. Соединение по п.1 формулы III
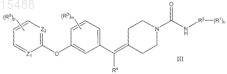
в которой каждый R1 независимо представляет собой водород, -C1-C6-алкил или -O(C1-C6-алкил);
R2 представляет собой изоксазольное кольцо или 6-членный ароматический гетероцикл, содержащий 1 или 2 кольцевых гетероатома азота;
каждый R3 независимо представляет собой водород, галоген, -C1-C6-алкил, -(CH2)0-3-C3-C6-циклоалкил или
-O-C1-C6-алкил;
R4 представляет собой водород, -C1-C6-алкил, фенил или галоген;
каждый R5 независимо представляет собой водород, галоген, галогеналкил, -O-галогеналкил, -C1-C6-алкил,
-C(O)C1-C6-алкил, -O-C1-C6-алкил, -S-C1-C6-алкил, -(CH2)0-3-C3-C6-циклоалкил, CN, арил и гетероарил; причем упомянутые -C1-C6-алкильные, -O(C1-C6-алкил), -(CH2)0-3-C3-C6-циклоалкильные, арильные и гетероарильные группы необязательно независимо замещены 1-4 -C1-C6-алкилами, -OH или галогенами;
m равно 0, 1, 2, 3 или 4;
n равно 0, 1, 2, 3 или 4;
p равно 0, 1, 2, 3 или 4 и
Z1 и Z2 независимо выбирают из N, C или CH;
или его фармацевтически приемлемая соль.
4. Соединение по п.3, где Z1 представляет собой N; Z2 представляет собой CH; p равно 1; R5 представляет собой CF3; и R1 представляет собой водород.
5. Соединение по п.1 или его фармацевтически приемлемая соль, которое представляет собой
N-пиридин-3-ил-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-(3,4-диметилизоксазол-5-ил)-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-(6-метилпиридин-3-ил)-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-пиразин-2-ил-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-пиридазин-3-ил-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-2,1-бензизоксазол-3-ил-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-(5-метилпиридин-3-ил)-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-(6-метоксипиридин-3-ил)-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-(пиридин-2-ил)-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-фенил-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-(6-цианопиридин-3-ил)-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-(5-метоксипиразин-2-ил)-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-1H-пирроло[2,3-b]пиридин-6-ил-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-1H-1,2,3-бензотриазол-6-ил-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-{[4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-ил]карбонил}пиридин-2-карбоксамид;
6-метил-N-{[4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-ил]карбонил}пиридин-2-карбоксамид;
4-[3-(бензилокси)бензилиден]-N-пиридин-3-илпиперидин-1-карбоксамид;
N-2,1-бензизоксазол-3-ил-4-[3-(4-фторфенокси)бензилиден]пиперидин-1-карбоксамид;
N-(3,4-диметилизоксазол-5-ил)-4-[3-(4-фторфенокси)бензилиден]пиперидин-1-карбоксамид;
4-[3-(4-фторфенокси)бензилиден]-N-пиридин-3-илпиперидин-1-карбоксамид;
N-(5-фенилпиразин-2-ил)-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-(5-метилпиразин-2-ил)-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-(6-метоксипиразин-2-ил)-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-(3-метилпиразин-2-ил)-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-(пиридазин-4-ил)-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-(6-метоксипиридазин-3-ил)-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-(6-хлорпиразин-2-ил)-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
4-(3-(5-(трифторметил)пиридин-2-илокси)бензилиден)-N-(6-бромпиридин-3-ил)пиперидин-1-карбоксамид;
4-(3-(5-(трифторметил)пиридин-2-илокси)бензилиден)-N-(2-фторфенил)пиперидин-1-карбоксамид;
4-(3-(5-цианопиридин-2-илокси)бензилиден)-N-(пиридин-3-ил)пиперидин-1-карбоксамид;
N-(пиридин-3-ил)-4-(3-{[фенил-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-(пиридазин-3-ил)-4-(3-{[фенил-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
4-{3-[(5-бромпиридин-2-ил)окси]бензилиден}-N-пиридин-3-илпиперидин-1-карбоксамид;
4-(3-(5-бромпиридин-2-илокси)бензилиден)-N-(пиридазин-3-ил)пиперидин-1-карбоксамид;
4-(3-(5-бромпиридин-2-илокси)бензилиден)-N-(3,4-диметилизоксазол-5-ил)пиперидин-1-карбоксамид;
4-(3-(5-бромпиримидин-2-илокси)бензилиден)-N-(пиридин-3-ил)пиперидин-1-карбоксамид;
4-(3-(5-бромпиримидин-2-илокси)бензилиден)-N-(пиридазин-3-ил)пиперидин-1-карбоксамид;
4-(3-(5-циклопропилпиридин-2-илокси)бензилиден)-N-(пиридин-3-ил)пиперидин-1-карбоксамид;
4-(3-(5-циклопропилпиридин-2-илокси)бензилиден)-N-(пиридазин-3-ил)пиперидин-1-карбоксамид;
4-(3-(6-метилпиридин-2-илокси)бензилиден)-N-(пиридин-3-ил)пиперидин-1-карбоксамид;
4-(3-(6-метилпиридин-2-илокси)бензилиден)-N-(пиридазин-3-ил)пиперидин-1-карбоксамид;
4-(3-(3-метилпиридин-2-илокси)бензилиден)-N-(пиридин-3-ил)пиперидин-1-карбоксамид;
4-(3-(3-метилпиридин-2-илокси)бензилиден)-N-(пиридазин-3-ил)пиперидин-1-карбоксамид;
4-(3-(5-метилпиридин-2-илокси)бензилиден)-N-(пиридин-3-ил)пиперидин-1-карбоксамид;
4-(3-(5-метилпиридин-2-илокси)бензилиден)-N-(пиридазин-3-ил)пиперидин-1-карбоксамид;
4-(3-(5-метилпиридин-2-илокси)бензилиден)-N-(3,4-диметилизоксазол-5-ил)пиперидин-1-карбоксамид;
4-(3-(5-этоксипиридин-2-илокси)бензилиден)-N-(пиридин-3-ил)пиперидин-1-карбоксамид;
4-(3-(5-этоксипиридин-2-илокси)бензилиден)-N-(пиридазин-3-ил)пиперидин-1-карбоксамид;
4-(3-(5-(2,2,2-трифторэтокси)пиридин-2-илокси)бензилиден)-N-(пиридин-3-ил)пиперидин-1-карбоксамид;
4-(3-(5-(2,2,2-трифторэтокси)пиридин-2-илокси)бензилиден)-N-(пиридазин-3-ил)пиперидин-1-карбоксамид;
4-(3-(5-изопропоксипиридин-2-илокси)бензилиден)-N-(пиридин-3-ил)пиперидин-1-карбоксамид;
4-(3-(5-изопропоксипиридин-2-илокси)бензилиден)-N-(пиридазин-3-ил)пиперидин-1-карбоксамид;
4-(3-(4-(трифторметил)фенокси)бензилиден)-N-(пиридин-3-ил)пиперидин-1-карбоксамид;
4-(3-(4-(трифторметил)фенокси)бензилиден)-N-(пиридазин-3-ил)пиперидин-1-карбоксамид;
4-(3-(4-(трифторметил)фенокси)бензилиден)-N-(3,4-диметилизоксазол-5-ил)пиперидин-1-карбоксамид;
4-(3-(4-(трифторметил)фенокси)бензилиден)-N-(6-метилпиридин-3-ил)пиперидин-1-карбоксамид;
4-(3-(6-(трифторметил)пиридин-3-илокси)бензилиден)-N-(пиридазин-3-ил)пиперидин-1-карбоксамид;
4-(3-этокси-5-(5-(трифторметил)пиридин-2-илокси)бензилиден)-N-(пиридин-3-ил)пиперидин-1-карбоксамид;
4-(4-хлор-3-(5-(трифторметил)пиридин-2-илокси)бензилиден)-N-(пиридин-3-ил)пиперидин-1-карбоксамид;
4-(4-метил-3-(5-(трифторметил)пиридин-2-илокси)бензилиден)-N-(пиридин-3-ил)пиперидин-1-карбоксамид;
4-(3-метил-5-(5-(трифторметил)пиридин-2-илокси)бензилиден)-N-(пиридин-3-ил)пиперидин-1-карбоксамид;
4-(3-бром-5-(5-(трифторметил)пиридин-2-илокси)бензилиден)-N-(пиридин-3-ил)пиперидин-1-карбоксамид;
4-(3-бром-5-(5-(трифторметил)пиридин-2-илокси)бензилиден)-N-(пиридазин-3-ил)пиперидин-1-карбоксамид;
4-(3-циклопропил-5-(5-(трифторметил)пиридин-2-илокси)бензилиден)-N-(пиридазин-3-ил)пиперидин-1-карбоксамид;
4-(3-фтор-5-(5-(трифторметил)пиридин-2-илокси)бензилиден)-N-(пиридин-3-ил)пиперидин-1-карбоксамид;
4-(бром-(3-(5-(трифторметил)пиридин-2-илокси)фенил)метилен)-N-(пиридин-3-ил)пиперидин-1-карбоксамид;
N-(пиридин-3-ил)-4-(1-(3-(5-(трифторметил)пиридин-2-илокси)фенил)этилиден)пиперидин-1-карбоксамид;
4-(фенил-(3-(5-(трифторметил)пиридин-2-илокси)фенил)метилен)-N-(пиридин-3-ил)пиперидин-1-карбоксамид;
4-(фтор-(3-(5-(трифторметил)пиридин-2-илокси)фенил)метилен)-N-(пиридин-3-ил)пиперидин-1-карбоксамид;
4-(фтор-(3-(5-(трифторметил)пиридин-2-илокси)фенил)метилен)-N-(6-метилпиридин-3-ил)пиперидин-1-карбоксамид;
4-(фтор-(3-(5-(трифторметил)пиридин-2-илокси)фенил)метилен)-N-(6-метоксипиридин-3-ил)пиперидин-1-карбоксамид;
4-{3-[(4-метилпиридин-2-ил)окси]бензилиден}-N-пиридин-3-илпиперидин-1-карбоксамид;
4-{3-[(4-метилпиридин-2-ил)окси]бензилиден}-N-пиридазин-3-илпиперидин-1-карбоксамид;
4-(3-этокси-5-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)-N-пиридин-3-илпиперидин-1-карбоксамид;
N-изоксазол-4-ил-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-пиридин-4-ил-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-(1-метил-1H-пиразол-3-ил)-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-(2-метил-2H-1,2,3-триазол-4-ил)-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-(3-гидроксипиридин-2-ил)-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-(3-этил-1H-пиразол-5-ил)-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-(1-этил-1H-1,2,4-триазол-5-ил)-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-[3-(гидроксиметил)фенил]-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-[4-(гидроксиметил)пиридин-2-ил]-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-(6-хлорпиридазин-3-ил)-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
4-(3-(5-(пирролидин-1-ил)пиридин-2-илокси)бензилиден)-N-(пиридазин-3-ил)пиперидин-1-карбоксамид;
4-(3-(5-(пирролидин-1-ил)пиридин-2-илокси)бензилиден)-N-(пиридин-3-ил)пиперидин-1-карбоксамид;
4-(3-(5-(азетидин-1-ил)пиридин-2-илокси)бензилиден)-N-(пиридазин-3-ил)пиперидин-1-карбоксамид;
4-(3-(5-(азетидин-1-ил)пиридин-2-илокси)бензилиден)-N-(пиридин-3-ил)пиперидин-1-карбоксамид;
4-(3-(5-(пент-4-инилокси)пиридин-2-илокси)бензилиден)-N-(пиридин-3-ил)пиперидин-1-карбоксамид;
4-(3-(5-(пент-4-инилокси)пиридин-2-илокси)бензилиден)-N-(пиридазин-3-ил)пиперидин-1-карбоксамид;
4-((6-феноксипиридин-2-ил)метилен)-N-(пиридазин-3-ил)пиперидин-1-карбоксамид;
4-((6-феноксипиридин-2-ил)метилен)-N-(пиридин-3-ил)пиперидин-1-карбоксамид;
4-{3-[(5-фторпиридин-2-ил)окси]бензилиден}-N-пиридазин-3-илпиперидин-1-карбоксамид;
N-(5-этил-1,3,4-тиадиазол-2-ил)-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-(5-циклопропил-1,3,4-тиадиазол-2-ил)-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-(5-ацетил-4-метил-1,3-тиазол-2-ил)-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
4-{3-[(6-метокси-2-метилпиридин-3-ил)окси]бензилиден}-N-пиридазин-3-илпиперидин-1-карбоксамид;
4-{3-[(6-метокси-2-метилпиридин-3-ил)окси]бензилиден}-N-пиридин-3-илпиперидин-1-карбоксамид;
N-пиридин- 3-ил-4-{3-[4-(2,2,2-трифторэтокси)фенокси]бензилиден}пиперидин-1-карбоксамид;
N-пиридазин-3-ил-4-{3-[4-(2,2,2-трифторэтокси)фенокси]бензилиден}пиперидин-1-карбоксамид;
4-{3-[(8-метоксихиназолин-2-ил)окси]бензилиден}-N-пиридазин-3-илпиперидин-1-карбоксамид;
N-пиридазин-3-ил-4-[3-(пиридо[2,3-d]пиримидин-2-илокси)бензилиден]пиперидин-1-карбоксамид;
N-пиридазин-3-ил-4-[3-(пиримидин-2-илокси)бензилиден]пиперидин-1-карбоксамид;
4-(3-{[5-(4-метоксифенил)пиримидин-2-ил]окси}бензилиден)-N-пиридазин-3-илпиперидин-1-карбоксамид;
N-пиридазин-3-ил-4-[3-(хиназолин-2-илокси)бензилиден]пиперидин-1-карбоксамид;
4-{3-[(5-циклопропилпиримидин-2-ил)окси]бензилиден}-N-пиридазин-3-илпиперидин-1-карбоксамид;
4-{3-[(5-этилпиримидин-2-ил)окси]бензилиден}-N-пиридазин-3-илпиперидин-1-карбоксамид;
4-{3-[(5-фторпиримидин-2-ил)окси]бензилиден}-N-пиридазин-3-илпиперидин-1-карбоксамид;
4-{3-[(5-метилпиримидин-2-ил)окси]бензилиден}-N-пиридазин-3-илпиперидин-1-карбоксамид;
4-(3-{[5-(3-хлорфенил)пиримидин-2-ил]окси}бензилиден)-N-пиридазин-3-илпиперидин-1-карбоксамид;
4-{3-[(5-пропилпиримидин-2-ил)окси]бензилиден}-N-пиридазин-3-илпиперидин-1-карбоксамид;
4-{3-[(4-изопропил-5-метилпиримидин-2-ил)окси]бензилиден}-N-пиридазин-3-илпиперидин-1-карбоксамид;
N-пиридазин-3-ил-4-(3-{[4-(трифторметил)пиримидин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
4-{3-[(2,7-диметил-5,6,7,8-тетрагидропиридо[3,4-d]пиримидин-4-ил)окси]бензилиден}-N-пиридазин-3-илпиперидин-1-карбоксамид;
4-(3-{[6-этил-2-(трифторметил)пиримидин-4-ил]окси}бензилиден)-N-пиридазин-3-илпиперидин-1-карбоксамид;
4-(3-{[6-метил-4-(трифторметил)пиридин-2-ил]окси}бензилиден)-N-пиридазин-3-илпиперидин-1-карбоксамид;
4-(3-{[5-(морфолин-4-илкарбонил)пиридин-2-ил]окси}бензилиден)-N-пиридазин-3-илпиперидин-1-карбоксамид;
4-{3-[(3-метилпиразин-2-ил)окси]бензилиден}-N-пиридазин-3-илпиперидин-1-карбоксамид;
4-{3-[(4-метилфталазин-1-ил)окси]бензилиден}-N-пиридазин-3-илпиперидин-1-карбоксамид;
4-{3-[(4,6-диметилпиримидин-2-ил)окси]бензилиден}-N-пиридазин-3-илпиперидин-1-карбоксамид;
4-{3-[(6-метоксипиримидин-4-ил)окси]бензилиден}-N-пиридазин-3-илпиперидин-1-карбоксамид;
N-пиридазин-3-ил-4-[3-(хиноксалин-2-илокси)бензилиден]пиперидин-1-карбоксамид;
4-[3-(пиразин-2-илокси)бензилиден]-N-пиридазин-3-илпиперидин-1-карбоксамид;
4-[3-(1,3-бензотиазол-2-илокси)бензилиден]-N-пиридазин-3-илпиперидин-1-карбоксамид;
4-{3-[(3-фенил-1,2,4-тиадиазол-5-ил)окси]бензилиден}-N-пиридазин-3-илпиперидин-1-карбоксамид;
N-[6-(трифторметил)пиридин-3-ил]-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-(2,6-диметоксипиридин-3-ил)-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-[6-(пиридин-3-илокси)пиридин-3-ил]-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-(2-метоксипиридин-3-ил)-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-(5-метоксипиридин-3-ил)-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-(5,6-диметилпиридин-3-ил)-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-[5-бром-3-(гидроксиметил)пиридин-2-ил]-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-(3,5-диметилизоксазол-4-ил)-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)-N-(1,3,5-триметил-1H-пиразол-4-ил)пиперидин-1-карбоксамид;
N-(4-метилпиридин-2-ил)-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-(5-метилизоксазол-4-ил)-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-(1-метил-1H-пиразол-4-ил)-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-1H-пиразол-4-ил-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-(5-метил-1H-пиразол-3-ил)-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-(6-метокси-2-метилпиридин-3-ил)-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-(4-этилпиридин-2-ил)-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид;
N-(6-гидроксипиридин-3-ил)-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид или
N-(5-гидрокси-1H-пиразол-3-ил)-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид
или их фармацевтически приемлемые соли.
6. Фармацевтическая композиция, содержащая соединение по п.1 и фармацевтически приемлемый наполнитель.
7. Способ лечения боли, недержания мочи, гиперактивного мочевого пузыря, тошноты, когнитивных нарушений, тревоги, депрессии, нарушений сна, нарушений питания, нарушений движения, глаукомы, псориаза, рассеянного склероза, цереброваскулярных нарушений, травмы головного мозга, желудочно-кишечных расстройств, гипертонии, ревматоидного артрита, остеоартрита или сердечно-сосудистого заболевания, который включает введение нуждающемуся в этом субъекту терапевтически эффективного количества соединения по п.1.
8. Соединение N-пиридазин-3-ил-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид или его фармацевтически приемлемая соль.
9. Фармацевтическая композиция, содержащая N-пиридазин-3-ил-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамид или его фармацевтически приемлемую соль и фармацевтически приемлемый наполнитель.
10. Способ лечения боли, недержания мочи, гиперактивного мочевого пузыря, тошноты, когнитивных нарушений, тревоги, депрессии, нарушений сна, нарушений питания, нарушений движения, глаукомы, псориаза, рассеянного склероза, цереброваскулярных нарушений, травмы головного мозга, желудочно-кишечных расстройств, гипертонии, ревматоидного артрита, остеоартрита или сердечно-сосудистого заболевания, который включает введение нуждающемуся в этом субъекту терапевтически эффективного количества N-пиридазин-3-ил-4-(3-{[5-(трифторметил)пиридин-2-ил]окси}бензилиден)пиперидин-1-карбоксамида или его фармацевтически приемлемой соли.
11. Соединение по п.1 формулы IV
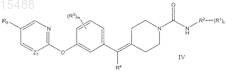
в которой каждый R1 независимо представляет собой водород, -C1-C6-алкил или -O(C1-C6-алкил);
R2 представляет собой пиридин, пиразин, пиридазин или пиримидин;
каждый R3 независимо представляет собой водород, галоген, -C1-C6-алкил, -(CH2)0-3-C3-C6-циклоалкил или
-O-C1-C6-алкил;
R4 представляет собой водород, -C1-C6-алкил, фенил или галоген;
R5 представляет собой водород, галоген, галогеналкил, -C1-C6-алкил или -(CH2)0-3-C3-C6-циклоалкил; и упомянутый -C1-C6-алкил необязательно замещен 1-4 -OH группами, -(CH2)0-3-C3-C6-циклоалкил необязательно замещен 1-4 галогенами или -OH группами;
m равно 0, 1 или 2;
n равно 0, 1, 2, 3 или 4;
Z1 выбирают из N или CH;
или его фармацевтически приемлемая соль.
12. Соединение по п.11, где R5выбирают из водорода, галогена, -C1-C6-алкила, -CF3или -C3-C6-циклоалкила; или его фармацевтически приемлемая соль.
Текст
Дата публикации и выдачи патента Номер заявки СОДЕРЖАЩИЕ ДИАРИЛОВЫЙ ЭФИР СОЕДИНЕНИЯ МОЧЕВИНЫ Настоящее изобретение относится к соединениям формулы (I) Фей Лоррейн Кэтлин, Джонсон Дуглас Скотт, Лазервит Скотт Эдвард, Моррис Марк Энтони, Ванг Лицзюань Джейн, Мейерз Марвин Джей, Кестен Сузанн Росс, Стифф Кори Майкл (US) или их фармацевтически приемлемой соли; способам получения соединений; промежуточным соединениям, использованным при получении соединений; композициям, содержащим соединения; и способам применения соединений при лечении заболеваний или состояний,ассоциированных с активностью гидролазы амидов жирных кислот (FAAH). 015488 Область техники, к которой относится изобретение Настоящее изобретение относится к содержащим диариловый эфир соединениям мочевины и фармацевтически приемлемым солям таких соединений. Изобретение также относится к способам получения соединений, промежуточным продуктам, использованным для их получения, композициям, содержащим такие соединения, и способам применения соединений при лечении заболеваний или состояний,ассоциированных с активностью гидролазы амидов жирных кислот (FAAH). Предпосылки создания изобретения Амиды жирных кислот представляют собой семейство биологически активных липидов с различными клеточными и физиологическими эффектами. Амиды жирных кислот гидролизуются до соответствующих жирных кислот ферментом, известным как гидролаза амидов жирных кислот (FAAH). FAAH представляет собой интегральную мембранную сериновую гидролазу млекопитающих, ответственную за гидролиз целого ряда первичных и вторичных амидов жирных кислот, включая нейромодуляторные соединения анандамид и олеамид. Было показано, что анандамид (арахидоноилэтаноламид) обладает сходными с каннабиноидами анальгезирующими свойствами и высвобождается стимулированными нейронами. Эффекты и эндогенное содержание анандамида возрастают при болевом раздражении, подразумевая его роль в подавлении нейротрансмиссии при болевом раздражении и при оценке аналгезии в поведенческих тестах. В подтверждение этому было показано, что ингибиторы FAAH, повышающие содержание анандамида в головном мозге, эффективны на животных моделях боли, воспаления, тревоги и депрессии (Lichtman A.H. et al. (2004), J. Pharmacol. Exp. Ther. 311, 441-448; Jayamanne A. et al. (2006), Br. J.Acad. Sci., 102, 18620-18625). Соединения по настоящему изобретению представляют собой ингибиторы FAAH, а потому применимы при лечении целого ряда нарушений, в особенности боли. Другие состояния, которые могут подвергаться лечению соединениями по настоящему изобретению, включают недержание мочи, гиперактивный мочевой пузырь, тошноту, когнитивные нарушения, тревогу, депрессию, нарушения сна, нарушения питания, нарушения движений, глаукому, псориаз, рассеянный склероз, цереброваскулярные нарушения,травму головного мозга, желудочно-кишечные расстройства, гипертонию или сердечно-сосудистое заболевание. Краткое описание сущности изобретения Настоящее изобретение относится к соединениям формулы I в которой каждый R1 независимо представляет собой водород, -OH, галоген, галогеналкил,-C1-C6-алкил, -O-C1-C6-алкил, -S-C1-C6-алкил, арил, гетероарил, -O-арил, -O-гетероарил, -NH2,-NHC(O)C1-C6-алкил, -(CH2)0-3-C3-C6-циклоалкил, -NHC(O)C3-C6-циклоалкил, -NHC1-C6-алкил, CN,-C(O)NR'R" или -C(O)C1-C6-алкил; причем каждая R1-C1-C6-алкильная группа необязательно замещенаR' и R независимо выбирают из H или C1-C6-алкила;R2 представляет собой арил, гетероарил, -C(O)-арил или -C(O)-гетероарил; каждый R3 независимо представляет собой водород, галоген, галогеналкил, -C1-C6-алкил, -O-C1-C6 алкил, -S-C1-C6-алкил, -(CH2)0-3-C3-C6-циклоалкил, -S-C3-C6-циклоалкил и -O-C3-C6-циклоалкил; причем упомянутыеR3-C1-C6-алкильные,-O-C1-C6-алкильные,-S-C1-C6-алкильные,-(CH2)0-3-C3-C6 циклоалкильные, -S-C3-C6-циклоалкильные и -O-C3-C6-циклоалкильные группы необязательно замещены 1-4 галогенами, галогеналкилами, -O-галогеналкилами, -C1-C6-алкилами или -O(C1-C6-алкил);R4 представляет собой водород, -C1-C6-алкил, фенил, -(CH2)0-3-C3-C6-циклоалкил или галоген; причем упомянутые R4-C1-C6-алкильные, фенильные и -(CH2)0-3-C3-C6-циклоалкильные группы необязательно замещены 1-4 галогенами, -C1-C6-алкилами или -O(C1-C6-алкил);Ar представляет собой арил, -CH2-арил или гетероарил, причем упомянутые арильные,-CH2-арильные и гетероарильные группы необязательно независимо замещены 1-4 заместителями,выбранными из водорода, -C1-C6-алкила, -C2-C6-алкенила, -C2-C6-алкинила, -(CH2)0-3-C3-C6-циклоалкила,галогена, галогеналкила, -O-галогеналкила, -C(O)C1-C6-алкила, -O-C1-C6-алкила, -S-C1-C6-алкила,-O-C2-C6-алкенила, -O-C2-C6-алкинила, CN, арила, гетероциклила или гетероарила; причем упомянутые-C1-C6-алкильные,-(CH2)0-3-C3-C6-циклоалкильные,-C(O)C1-C6-алкильные,-O(C1-C6-алкил),-S-C1-C6-алкильные, арильные, -CH2-арильные, гетероциклильные и гетероарильные заместители на Ar-1 015488 необязательно независимо замещены 1-4 -C1-C6-алкилами, -C1-C6-алкокси, -OH или галогенами; или их фармацевтически приемлемой соли. Изобретение также относится к отдельным группам соединений, каждое из которых определено формулой I, в которой Ar выбирают из группы, состоящей из пиридина, пиримидина, фенила, бензила,хиназолина, пиридо[2,3-d]пиримидина, хиноксалина, бензотиазола или тиадиазола, причем каждый независимо замещен согласно приведенному выше определению, и определения R1, R2, R3, R4, X, m и n приведены выше. В составе каждой из таких групп существуют подгруппы соединений и их фармацевтически приемлемые солевые формы, в которых R2 выбирают из группы, состоящей из пиридина, изоксазола,пиразина, пиридазина, бензизоксазола, фенила, пирроло[2,3-b]пиридина, бензотриазола, пиразола, триазола, тиадиазола или тиазола, причем каждый независимо замещен согласно приведенному выше определению для формулы I. Одна группа соединений представляет собой соединения, определенные формулой I, в которой Ar представляет собой фенил, пиримидинил, пиридил, бензотиазол; R2 представляет собой изоксазол, пиридил, пиразинил или пиридазинил; m равно 0, 1 или 2; n равно 0-2 и X представляет собой C или CH; или их фармацевтически приемлемую соль. В составе такой группы существуют соединения, в которых Ar замещен 1-3 группами, выбранными из галогеналкила, -O-галогеналкила, -C1-C6-алкила, -C2-C6-алкенила,-C2-C6-алкинила, -(CH2)0-3-C3-C6-циклоалкила, галогена или CN, или их фармацевтически приемлемая соль. Изобретение также, отчасти, относится к фармацевтическим композициям, содержащим терапевтически эффективное количество описанного здесь соединения и его фармацевтически приемлемых солей. Подразумевается, что ссылка на одно или несколько описанных здесь соединений включает соединения,описанные и/или конкретно перечисленные в настоящем описании, включая соединения, соответствующие формулам I и II, и конкретно перечисленные здесь соединения. Изобретение также относится, отчасти, к способам лечения опосредованных FAAH заболеваний или состояний, включая острую боль, хроническую боль, нейропатическую боль, ноцицептивную боль,воспалительную боль, недержание мочи, гиперактивный мочевой пузырь, тошноту, когнитивные нарушения, тревогу, депрессию, нарушения сна, нарушения питания, нарушения движений, глаукому, псориаз, рассеянный склероз, цереброваскулярные нарушения, травму головного мозга, желудочно-кишечные расстройства, гипертонию или сердечно-сосудистое заболевание, у субъекта путем введения нуждающемуся в этом субъекту терапевтически эффективного количества одного или нескольких описанных здесь соединений и их фармацевтически приемлемых солей. Подробное описание изобретения В настоящем описании используются представленные ниже определения. Некоторые из химических формул могут содержать черту (-) для указания связи между атомами или указания места присоединения."Замещенными" группами являются группы, в которых один или несколько атомов водорода были замещены одним или несколькими атомами или группами, отличными от атома водорода. Термин "алкил" относится к неразветвленным или разветвленным насыщенным углеводородным группам, содержащим, как правило, определенное число атомов углерода (т.е. C1-C6-алкил). Примеры алкильных групп включают метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил,трет-бутил, пент-1-ил, пент-2-ил, пент-3-ил, 3-метилбут-1-ил, 3-метилбут-2-ил, 2-метилбут-2-ил,2,2,2-триметилэт-1-ил, н-гексил и т.п. Термин "алкенил" относится к неразветвленным или разветвленным углеводородным группам,содержащим одну или несколько ненасыщенных углерод-углеродных двойных связей и содержащим определенное число атомов углерода (т.е. C2-C6-алкенил). Примеры алкенильных групп включают этенил, 1-пропен-1-ил, 1-пропен-2-ил, 2-пропен-1-ил, 1-бутен-1-ил, 1-бутен-2-ил, 3-бутен-1-ил,3-бутен-2-ил, 2-бутен-1-ил, 2-бутен-2-ил, 2-метил-1-пропен-1-ил, 2-метил-2-пропен-1-ил, 1,3-бутадиен-1 ил, 1,3-бутадиен-2-ил и т.п. Термин "алкинил" относится к неразветвленным или разветвленным углеводородным группам, содержащим одну или несколько углерод-углеродных тройных связей и содержащим определенное число атомов углерода (т.е. C2-C6-алкинил). Примеры алкинильных групп включают этинил, 1-пропин-1-ил,2-пропин-1-ил, 1-бутин-1-ил, 3-бутин-1-ил, 3-бутин-2-ил, 2-бутин-1-ил и т.п. Термин "алканоил" относится к алкил-C(O)- группам, где значение термина "алкил" определено выше. Примеры алканоильных групп включают формил, ацетил, пропионил, бутирил, пентаноил, гексаноил и т.п. Термин "алкокси" относится к алкил-O- группам, в которых алкильные фрагменты, которые могут быть неразветвленными или разветвленными, содержат 1-6 атомов углерода. Примеры алкоксигрупп включают метокси, этокси, н-пропокси, изопропокси, н-бутокси, втор-бутокси, трет-бутокси, н-пентокси,втор-пентокси и т.п. Термины "алкенилокси" и "алкинилокси" относятся к алкенил-O- и алкинил-Oгруппами соответственно, в которых алкенильный и алкинильный фрагменты содержат от 2 до 6 атомов углерода и каждый из них может быть неразветвленным или разветвленным.-2 015488 Термин "алкоксикарбонил" относится к алкил-O-C(O)-, алкенил-O-C(O)- и алкинил-O-C(O)- группам, где значения терминов "алкил", "алкенил" и "алкинил" определены выше. Примеры алкоксикарбонильных групп включают метоксикарбонил, этоксикарбонил, н-пропоксикарбонил, изопропоксикарбонил, н-бутоксикарбонил, втор-бутоксикарбонил, трет-бутоксикарбонил, н-пентоксикарбонил, вторпентоксикарбонил и т.п. Термины "галоид" или "галоген" могут использоваться взаимозаменяемо и представляют собой фтор, хлор, бром и йод. Термины "галогеналкил" или "-O-галогеналкил" относятся к C1-C6-алкильным или нескольким C1-C6-алкоксигруппам соответственно, замещенным одними галогенами. Примеры включают -CF3, -CH2-CF3, -CF2-CF3, -O-CF3 и -OCH2-CF3. Термин "циклоалкил" относится к насыщенным моноциклическим и бициклическим углеводородным кольцам, содержащим, как правило, определенное число атомов углерода,образующих кольцо (т.е. C3-C7-циклоалкил). Циклоалкильные группы могут содержать один или несколько заместителей. Применимые заместители включают алкил, алкенил, алкинил,галогеналкил, галогеналкенил, галогеналкинил, алкокси, алкоксикарбонил, алканоил и галоген, значения которых определены выше, и гидрокси, меркапто, нитро и амино. Примеры моноциклических циклоалкильных групп включают циклопропил, циклобутил, циклопентил, циклогексил и т.п. Примеры бициклических циклоалкильных групп включают бицикло[1.1.0]бутил, бицикло[1.1.1]пентил,бицикло[2.1.0]пентил,бицикло[2.1.1]гексил,бицикло[3.1.0]гексил,бицикло[2.2.1]гептил,бицикло[3.2.0]гептил,бицикло[3.1.1]гептил,бицикло[4.1.0]гептил,бицикло[2.2.2]октил,бицикло[3.2.1]октил,бицикло[4.1.1]октил,бицикло[3.3.0]октил,бицикло[4.2.0]октил,бицикло[3.3.1]нонил,бицикло[4.2.1]нонил,бицикло[4.3.0]нонил,бицикло[3.3.2]децил,бицикло[4.2.2]децил,бицикло[4.3.1]децил,бицикло[4.4.0]децил,бицикло[3.3.3]ундецил,бицикло[4.3.2]ундецил, бицикло[4.3.3]додецил и т.п. Термин "циклоалкенил" относится к моноциклическим и бициклическим углеводородным кольцам,содержащим одну или несколько углерод-углеродных двойных связей, содержащим, как правило, определенное число атомов углерода, образующих кольцо (т.е. C3-C7-циклоалкил). Применимые заместители включают алкил, алкенил, алкинил, галогеналкил, галогеналкенил, галогеналкинил, алкокси, алкоксикарбонил, алканоил и галоген, значения которых определены выше, и гидрокси, меркапто, нитро и амино и т.п. Термины "циклоалканоил" и "циклоалкеноил" относятся к циклоалкил-C(O)- и циклоалкенил-C(O)группам соответственно. Примеры циклоалканоильных групп включают циклопропаноил, циклобутаноил, циклопентаноил, циклогексаноил, циклогептаноил, 1-циклобутеноил, 2-циклобутеноил,1-циклопентеноил, 2-циклопентеноил, 3-циклопентеноил, 1-циклогексеноил, 2-циклогексеноил,3-циклогексеноил и т.п. Термины "циклоалкокси" и "циклоалкоксикарбонил" относятся к циклоалкил-O- и циклоалкенил-O группам и к циклоалкил-O-C(O)- и циклоалкенил-O-C(O)- группам соответственно, где значения терминов "циклоалкил" и "циклоалкенил" определены выше. Ссылки на "циклоалкокси" и "циклоалкоксикарбонил", как правило, включают определенное число атомов углерода, за исключением атома углерода карбонильной группы. Примеры циклоалкоксигрупп включают циклопропокси, циклобутокси, циклопентокси,циклогексокси, 1-циклобутенокси, 2-циклобутенокси, 1-циклопентенокси, 2-циклопентенокси,3-циклопентенокси, 1-циклогексенокси, 2-циклогексенокси, 3-циклогексенокси и т.п. Примеры циклоалкоксикарбонильных групп включают циклопропоксикарбонил,циклобутоксикарбонил, циклопентоксикарбонил, циклогексоксикарбонил, 1-циклобутеноксикарбонил,2-циклобутеноксикарбонил, 1-циклопентеноксикарбонил, 2-циклопентеноксикарбонил, 3-циклопентеноксикарбонил, 1-циклогексеноксикарбонил, 2-циклогексеноксикарбонил, 3-циклогексеноксикарбонил и т.п. Термины "арил" и "арилен" относятся к моноциклическим или бициклическим одновалентным или двухвалентным ароматическим карбоциклическим группам, таким как фенильная, бифенильная или нафтильная группы. Термины "гетероарил" и "гетероарилен" относятся к одновалентным или двухвалентным ароматическим группам соответственно, содержащим 1-4 кольцевых гетероатома, выбранных из O, S или N. Примеры моноциклических (и одновалентных) арильных групп включают пирролил, фуранил,тиофенил, пиразолил, имидазолил, изоксазолил, оксазолил, изотиазолил, тиазолил, 1,2,3-триазолил,1,3,4-триазолил, 1-окса-2,3-диазолил, 1-окса-2,4-диазолил, 1-окса-2,5-диазолил, 1-окса-3,4-диазолил,1-тиа-2,3-диазолил, 1-тиа-2,4-диазолил, 1-тиа-2,5-диазолил, 1-тиа-3,4-диазолил, тетразолил, пиридинил,пиридазинил, пиримидинил, пиразинил и т.п. Группы, определенные как -CH2-арил, включают бензил и-CH2-нафтил. Гетероарильные и гетероариленовые группы также включают бициклические группы, трициклические группы, включая конденсированные кольцевые системы, в которых по крайней мере одно кольцо является ароматическим.-3 015488 Примеры полициклических (и одновалентных) арильных групп включают пиренил, карбазолил,бензофуранил, бензотиофенил, индолил, бензоксазолил, бензодиоксазолил, бензимидазолил, индазолил,бензотриазолил, бензотиофуранил, бензотиазолил, бензотриазолил, бензотетразолил, бензизоксазолил,бензизотиазолил, бензоимидазолинил, пирроло[2,3-b]пиридинил, пирроло[2,3-c]пиридинил, пирроло[3,2c]пиридинил, пирроло[3,2-b]пиридинил, имидазо[4,5-b]пиридинил, имидазо[4,5-c]пиридинил, пиразоло[4,3-d]пиридинил, пиразоло[4,3-c]пиридинил, пиразоло[3,4-c]пиридинил, пиразоло[3,4-b]пиридинил,изоиндолил, индазолил, пуринил, индолизинил, имидазо[1,2-a]пиридинил, имидазо[1,5-a]пиридинил,пиразоло[1,5-a]пиридинил, пирроло[1,2-b]пиридинил и имидазо[1,2-c]пиридинил. Другие примеры включают хинолинил, изохинолинил, циннолинил, хиназолинил, хиноксалинил,фталазинил,1,6-нафтиридинил,1,7-нафтиридинил,1,8-нафтиридинил,1,5-нафтиридинил,2,6-нафтиридинил, 2,7-нафтиридинил, пиридо[3,2-d]пиримидинил, пиридо[4,3-d]пиримидинил, пиридо[3,4-d]пиримидинил, пиридо[2,3-d]пиримидинил, пиридо[2,3-b]пиразинил, пиридо[3,4-b]пиразинил,пиримидо[5,4-d]пиримидинил, пиразино[2,3-b]пиразинил, пиримидо[4,5-d]пиримидинил, фенантридинил, фенантролинил, феназинил, фенотиазинил, феноксатиинил, феноксазинил, акридинил, азоцинил,4aH-карбазолил, хроманил, хроменил, индоленил, индолинил, 3H-индолил, изобензофуранил, изохроманил, изоиндазолил, изоиндолинил, пиримидинил, птеридинил, фталазинил, пуринил, пиридазинил, пиразинил, пиридооксазол, пиридоимидазол, пиридотиазол, пиридил, пиридопиримидинил, хиноксалинил,хиназолинил, тиантренил, ксантенил и т.п. Арильные, ариленовые, гетероарильные и гетероариленовые группы могут содержать один или несколько заместителей. Применимые заместители включают алкил, алкенил, алкинил, галогеналкил, галогеналкенил, галогеналкинил, циклоалкил, циклоалкенил, алкокси, циклоалкокси, алканоил, циклоалканоил, циклоалкеноил, алкоксикарбонил, циклоалкоксикарбонил и галоген, значения которых определены выше, и гидрокси, меркапто, нитро, амино, алкиламино и т.п. Термины "гетероцикл" и "гетероциклил" относятся к насыщенным или частично ненасыщенным или бициклическим кольцам, содержащим 3-7 или 7-11 кольцевых атомов соответственно. Указанные группы состоят из кольцевых атомов, которые представляют собой атомы углерода и 1-4 гетероатома,которые независимо выбирают из азота, кислорода или серы, и могут включать любую бициклическую группу, в которой любой из определенных выше моноциклических гетероциклов конденсирован с бензольным кольцом. Гетероатомы азота и серы могут быть необязательно окислены. Применимые заместители включают алкил, алкенил, алкинил, галогеналкил, галогеналкенил, галогеналкинил, циклоалкил,циклоалкенил, алкокси, циклоалкокси, алканоил, циклоалканоил, циклоалкеноил, алкоксикарбонил, циклоалкоксикарбонил и галоген, значения которых определены выше, и гидрокси, меркапто, нитро, амино,алкиламино и т.п. Примеры гетероциклов включают оксиранил, тиаранил, азиридинил, оксетанил, тиатанил,азетидинил, тетрагидротиофенил, тетрагидропиран, тетрагидротиопиран, 1,4-диоксанил, 1,4-оксатианил,1,4-дитианил, 1,4-азатианил, оксепанил, тиепанил, азепанил, 1,4-диоксепанил, 1,4-оксатиепанил,1,4-оксазепанил, 1,4-дитиепанил, 1,4-тиазепанил, 1,4-диазепанил, 3,4-дигидро-2H-пиранил, 5,6-дигидро 2H-пиранил, 2H-пиранил, 1,2,3,4-тетрагидропиридинил, 1,2,5,6-тетрагидропиридинил, карболинил, декагидрохинолинил, 2H,6H-1,5,2-дитиазинил, дигидрофуро[2,3-b]тетрагидрофуранил, фуразанил, имидазолидинил, имидазолинил, морфолинил, октагидроизохинолинил, оксазолидинил, оксазолидинил, изоксазолидинил, пиперазинил, пиперидинил, пиранил, пиразолидинил, пиразолинил, пирролидинил, пирролинил, 2H-пирролил, 4H-хинолизинил, хинуклидинил, тетрагидрофуранил, тетрагидроизохинолинил, тетрагидрохинолинил, 6H-1,2,5-тиадиазинил, тиадиазолил, тиенотиазолил, тиенооксазолил, тиеноимидазолил, триазинил, 1,2,4-триазолил и 1,2,5-триазолил. Термины "гетероарил" и "гетероарилен" относятся соответственно к одновалентным или двухвалентным гетероциклам или гетероциклильным группам, значения которых определены выше, которые являются ароматическими. Гетероарильные и гетероариленовые группы представляют собой подмножество арильных и ариленовых групп соответственно. Термины "арилкарбонил" и "гетероарилкарбонил" относятся к арил-C(O)- и гетероарил-C(O)- группам соответственно, где значения терминов "арил" и "гетероарил" определены выше. Примеры включают фенилкарбонил, имидазол-2-илметилкарбонил и т.п. Термин "субъект" относится к млекопитающему, включая людей. Термин "лечение" относится к индукции обратного развития, смягчению, ингибированию развития или профилактике нарушения или состояния, к которому применяется такой термин, или к индукции обратного развития, смягчению, ингибированию развития или профилактике одного или нескольких симптомов такого нарушения или состояния. Термин "терапевтически эффективное количество" относится к количеству соединения, которое может использоваться для лечения субъекта, причем количество может зависеть, среди прочего, от веса и возраста субъекта и пути введения. Термины "наполнитель" или "адъювант" относятся к любому веществу в фармацевтическом составе, которое не является активным фармацевтическим ингредиентом (API).-4 015488 Термин "фармацевтическая композиция" относится к сочетанию одного или нескольких лекарственных вещества и одного или нескольких наполнителей. Термины "фармацевтический продукт", "фармацевтическая лекарственная форма", "лекарственная форма", "конечная лекарственная форма" и т.п., относятся к фармацевтической композиции, которую вводят нуждающемуся в лечении субъекту, и, как правило, может находиться в форме таблеток, капсул,жидких растворов или суспензий, пластырей, пленок и т.п. Таблица 1 Список сокращений-5 015488 Настоящее изобретение относится к соединениям формул I-III, конкретно перечисленным ниже соединениям и их фармацевтически приемлемым солям, которые эффективно ингибируют активностьFAAH. Настоящее изобретение также относится к материалам для получения и способам получения соединений, фармацевтически приемлемых солей, содержащих их фармацевтических композиций и их применению для лечения различных нарушений, таких как боль, депрессия или тревога. Изобретение также относится к соединениям формулы II в которой R2 представляет собой 5- или 6-членный гетероцикл, содержащий атом азота в качестве кольцевого гетероатома и необязательно содержащий второй кольцевой гетероатом, выбранный из O илиN; каждый R1 независимо представляет собой водород, галоген, галогеналкил, -C1-C6-алкил,-O-C1-C6-алкил, -S-C1-C6-алкил, арил, гетероарил, -NH2, -NHC(O)C1-C6-алкил, -NHC(O)C3-C6-циклоалкил,-NHC1-C6-алкил, CN или -C(O)C1-C6-алкил; каждый R3 независимо представляет собой водород, галоген, галогеналкил, -C1-C6-алкил,-O-C1-C6-алкил, -S-C1-C6-алкил, -(CH2)0-3-C3-C6-циклоалкил, -S-C3-C6-циклоалкил и -O-C3-C6-циклоалкил; причем упомянутые -C1-C6-алкильные, -O-C1-C6-алкильные, -S-C1-C6-алкильные, -(CH2)0-3-C3-C6 циклоалкильные, -S-C3-C6-циклоалкильные и -O-C3-C6-циклоалкильные группы необязательно замещены 1-4 галогенами, галогеналкилами, -O-галогеналкилами, -C1-C6-алкилами или -O(C1-C6-алкил);R4 представляет собой водород, -C1-C6-алкил, фенил, -(CH2)0-3-C3-C6-циклоалкил или галоген; причем упомянутые -C1-C6-алкильные, фенильные и -(CH2)0-3-C3-C6-циклоалкильные группы необязательно замещены 1-4 галогенами, -C1-C6-алкилами или -O(C1-C6-алкил); каждый R5 независимо представляет собой водород, галоген, галогеналкил, -O-галогеналкил,-C1-C6-алкил, -C(O)C1-C6-алкил, -O-C1-C6-алкил, -S-C1-C6-алкил, -(CH2)0-3-C3-C6-циклоалкил, CN, арил и гетероарил; причем упомянутые -C1-C6-алкильные, -O(C1-C6-алкил), -C3-C6-циклоалкильные, арильные и гетероарильные группы необязательно независимо замещены 1-4 -C1-C6-алкилами, -OH или галогенами;Z1 и Z2 независимо выбирают из N, C или CH; или к их фармацевтически приемлемой соли. Среди соединений формулы II существуют отдельные группы соединений и их фармацевтически приемлемые соли, в которых R2 выбирают из пиридина, пиримидина, пиридазина, пиразина, пиразола и изоксазола. R1, R3, R4, R5, Z1, Z2, m, n и p такие, как определены для формулы II, в которой каждая из этих групп указана в определении R2. В каждой из таких групп существуют подгруппы, в которых 6-членное кольцо, определенное Z1 и Z2 и необязательно замещенное (R5)p, выбирают из фенила, пиридина или пиримидина. В каждой из таких групп и подгрупп в рамках определений формулы II существуют дополнительные подгруппы соединений, в которых R4 представляет собой H или -C1-C6-алкил и R3 представляет собой H или -C1-C6-алкил; или их фармацевтически приемлемая соль. Изобретение также относится к соединениям формулы III в которой каждый R1 независимо представляет собой водород, -C1-C6-алкил или -O(C1-C6-алкил);R2 представляет собой изоксазольное кольцо или 6-членный ароматический гетероцикл, содержащий 1 или 2 кольцевых гетероатома азота; каждый R3 независимо представляет собой водород, галоген, -C1-C6-алкил, -(CH2)0-3-C3-C6 циклоалкил или -O-C1-C6-алкил;R4 представляет собой водород, -C1-C6-алкил, фенил или галоген; каждый R5 независимо представляет собой водород, галоген, галогеналкил, -O-галогеналкил,-C1-C6-алкил, -C(O)C1-C6-алкил, -O-C1-C6-алкил, -S-C1-C6-алкил, -(CH2)0-3-C3-C6-циклоалкил, CN, арил и-6 015488 гетероарил; причем упомянутые -C1-C6-алкильные, -O(C1-C6-алкил), -(CH2)0-3-C3-C6-циклоалкильные,арильные и гетероарильные группы необязательно независимо замещены 1-4 -C1-C6-алкилами, -OH или галогенами;Z1 и Z2 независимо выбирают из N, C или CH; или к их фармацевтически приемлемой соли. Примеры 6-членных ароматических гетероциклов, представленных R2 в соединениях формулы III,представляют собой пиридиновые, пиразиновые, пиридазиновые и пиримидиновые группы. Соединения формулы III включают соединения, в которыхR1 представляет собой водород иR2 выбирают из пиридина, пиридазина, пиразина и пиримидина; или их фармацевтически приемлемую соль. Изобретение также относится к соединениям формулы IV в которой каждый R1 независимо представляет собой водород, -C1-C6-алкил или -O(C1-C6-алкил);R2 представляет собой пиридин, пиразин, пиридазин или пиримидин; каждый R3 независимо представляет собой водород, галоген, -C1-C6-алкил, -(CH2)0-3-C3-C6 циклоалкил или -O-C1-C6-алкил;R5 представляет собой водород, галоген, галогеналкил, -C1-C6-алкил или -(CH2)0-3-C3-C6 циклоалкил; и упомянутый -C1-C6-алкил необязательно замещен 1-4 -OH группами, -(CH2)0-3-C3-C6 циклоалкил необязательно замещен 1-4 галогенами или -OH группами;Z1 выбирают из N или СН; или к их фармацевтически приемлемой соли. Соединения формулы IV включают соединения, в которых R5 выбирают из водорода, галогена,-C1-C6-алкила, -CF3 или -C3-C6-циклоалкила; или их фармацевтически приемлемую соль. Также включены соединения, в которых R5 выбирают из водорода, галогена, -C1-C6-алкила, -CF3 или циклопропила; или их фармацевтически приемлемая соль. Описанные здесь соединения и их фармацевтически приемлемые соли, которые включают соединения формулы I и формулы II, могут использоваться для лечения боли (включая нейропатическую боль,ноцицептивную боль и воспалительную боль); недержания мочи; гиперактивного мочевого пузыря; тошноты; нарушений движений; глаукомы; псориаза; рассеянного склероза; цереброваскулярных нарушений; травмы головного мозга; желудочно-кишечных расстройств; гипертонии; сердечно-сосудистого заболевания и расстройств центральной нервной системы, включая тревогу, депрессию, нарушения сна и нарушения питания. Физиологическая боль представляет собой важный защитный механизм, предназначенный для предупреждения об опасности, исходящей от потенциально опасных воздействий со стороны окружающей среды. Система функционирует посредством специфичного комплекса первичных чувствительных нейронов и активируется вредными стимулами через периферические механизмы трансдукции сигнала (для обзора см. Millan, 1999, Prog. Neurobiol., 57, 1-164). Такие чувствительные нервные волокна называют ноцицепторами, и характеристически они представляют собой аксоны малого диаметра с низкими скоростями проведения нервного импульса. Ноцицепторы определяют интенсивность, длительность и качество вредного стимула и посредством своего топографически организованного проецирования на спинной мозг локализацию стимула. Ноцицепторы обнаруживаются на ноцицептивных нервных волокнах, среди которых существует два основных типа, A-дельта-волокна (миелинизированные) и C-волокна (немиелинизированные). После комплекса преобразований в заднем роге спинного мозга активность, генерированная в результате стимула от ноцицептора, передается либо напрямую, либо через передаточные ядра-7 015488 ствола мозга к вентробазальному таламусу, а затем к коре головного мозга, где формируется ощущение боли. В общих чертах боль может быть классифицирована на острую и хроническую боль. Острая боль возникает внезапно и является кратковременной (обычно 12 недель или менее). Обычно острая боль ассоциирована с конкретной причиной, такой как определенное повреждение, и обычно является острой и сильной. Существует вид боли, который возникает после определенных повреждений в результате хирургического вмешательства, стоматологических процедур, деформации и растяжения. Острая боль, как правило, не приводит к какой-либо стойкой психологической реакции. В отличие от этого хроническая боль представляет собой продолжительную боль, обычно персистирующую на протяжении более чем 3 месяцев и приводящую к значительным психологическим и эмоциональным проблемам. Распространенными примерами хронической боли являются нейропатическая боль (например, болезненная диабетическая нейропатия, постгерпетическая невралгия), туннельный синдром запястья, боли в спине, головная боль, раковая боль, артритическая боль и хроническая послеоперационная боль. Если в результате заболевания или травмы в ткани организма возникает значительное повреждение,то характеристики активации ноцицепторов изменяются, и на периферии возникает сенсибилизация, локально расположенная вокруг повреждения и центрально в зоне окончаний ноцицепторов. Эти эффекты приводят к повышенной болевой чувствительности. При острой боли эти механизмы могут быть полезны для выработки защитного поведения, которое может лучше способствовать индукции процессов заживления. Обычно предполагается, что после заживления повреждения чувствительность вернется к норме. Однако при многих хронических болезненных состояниях повышенная чувствительность сохраняется намного дольше, чем занимает процесс заживления, зачастую вследствие повреждения нервной системы. Такое повреждение обычно приводит к аномалиям в работе чувствительных нервных волокон, ассоциированным с недостаточной приспособляемостью и измененной активностью (WoolfSalter, 2000,Science, 288, 1765-1768). Клиническая боль существует, если среди симптомов у пациента важной чертой являются дискомфорт и аномальная чувствительность. Пациенты обычно бывают совершенно разными, и у них могут присутствовать различные болевые симптомы. Такие симптомы включают: 1) спонтанную боль, которая может быть тупой, жгучей или колющей; 2) чрезмерно усиленные ответы на вредные стимулы (гипералгезия) и 3) боль, возникающая в ответ на обычно безвредные стимулы (аллодиния - Meyer et al., 1994,Textbook of Pain, 13-44). Хотя пациенты, страдающие от различных форм острой и хронической боли,могут иметь общие симптомы, лежащие в их основе механизмы могут быть различными, а потому могут потребоваться разные стратегии лечения. Поэтому боль можно разделить на целый ряд различных подтипов в соответствии с различиями в патофизиологии, включая ноцицептивную, воспалительную и нейропатическую боль. Ноцицептивная боль индуцируется повреждением ткани или интенсивными стимулами, способными вызвать повреждение. Болевые афференты активируются путем передачи стимула от ноцицепторов в очаге повреждения и активируют нейроны в спинном мозге на уровне их окончаний. Затем сигнал передается вверх по проводящим путям спинного мозга в головной мозг, где боль воспринимается (Meyer etal., 1994, Textbook of Pain, 13-44). Активация ноцицепторов активирует два типа чувствительных нервных волокон. Миелинизированные A-дельта-волокна передают сигнал быстро и отвечают за острые и колющие болевые ощущения, тогда как немиелинизированные C-волокна передают сигнал более медленно и передают тупую и ноющую боль. Острая ноцицептивная боль от средней до сильной является заметной чертой боли при травме центральной нервной системы, деформациях/растяжениях, ожогах,инфаркте миокарда и остром панкреатите, послеоперационной боли (боль после любого типа хирургического вмешательства), посттравматической боли, почечной колики, раковой боли и боли в спине. Раковая боль может быть хронической болью, такой как связанная с опухолью боль (например, костная боль, головная боль, лицевая боль или висцеральная боль) или боль, ассоциированная с терапией рака (например, постхимиотерапевтический синдром, хронический послеоперационный болевой синдром или пострадиационный синдром). Раковая боль может также возникать в ответ на химиотерапию, иммунотерапию, гормональную терапию или лучевую терапию. Боль в спине может возникать вследствие грыжи или разрушения межпозвонковых дисков или аномалий люмбальных суставных фасеток, крестцовоподвздошных сочленений, параспинальных мышц или задней продольной связки. Боль в спине может проходить естественным образом, но у некоторых пациентов, у которых она продолжается свыше 12 недель, она становится хроническим состоянием, которое может являться особенно ослабляющим здоровье. В настоящее время нейропатическую боль определяют как боль, вызванную или обусловленную первичным повреждением или дисфункцией нервной системы. Повреждение нерва может быть вызвано травмой или заболеванием, а потому термин "нейропатическая боль" охватывает многие нарушения различной этиологии. Они включают без ограничения периферическую нейропатию, диабетическую нейропатию, постгерпетическую невралгию, невралгию тройничного нерва, боль в спине, невропатию при раке, невропатию при ВИЧ-инфекции, фантомные боли в ампутированных конечностях, туннельный синдром запястья, центральную постинсультную боль и боль, ассоциированную с хроническим алкоголизмом, гипотиреозом, уремией, рассеянным склерозом, повреждением спинного мозга, болезнью Паркин-8 015488 сона, эпилепсией и авитаминозом. Нейропатическая боль является патологической, поскольку она не выполняет защитной роли. Она часто сохраняется значительно позже исчезновения начальной причины,обычно длясь годами, значительно ухудшая качество жизни пациента (Woolf and Mannion, 1999, Lancet,353, 1959-1964). Симптомы нейропатической боли трудно лечить, и часто они бывают гетерогенными,даже среди пациентов с одним и тем же заболеванием (WoolfDecosterd, 1999, Pain Supp., 6, S141-S147;Woolf and Mannion, 1999, Lancet, 353, 1959-1964). Они включают спонтанную боль, которая может быть непрерывной, и пароксизмальную или атипично индуцированную боль, такую как гипералгезия (повышенная чувствительность к вредному стимулу) и аллодиния (чувствительность к обычно безвредному стимулу). Воспалительный процесс представляет собой сложную серию биохимических и клеточных событий, активированных в ответ на повреждение ткани и присутствие чужеродных веществ, которые приводят к отеку и боли (Levine and Taiwo, 1994, Textbook of Pain, 45-56). Артритическая боль представляет собой наиболее частую воспалительную боль. Ревматоидное заболевание представляет собой одно из наиболее частых хронических воспалительных состояний в развитых странах, а ревматоидный артрит является частой причиной недееспособности. Точная этиология ревматоидного артрита не известна, но современные гипотезы предполагают, что могут быть важны как генетические, так и микробиологические факторы (GrennanJayson, 1994, Textbook of Pain, 397-407). По оценкам, почти у 16 миллионов американцев имеются симптомы остеоартрита (OA) или дегенеративного поражения суставов, большинство из которых старше 60 лет, и предполагается, что эта цифра вырастет до 40 миллионов по причине роста среднего возраста населения, что делает это проблемой огромной важности общественного здравоохранения (HougeMersfelder, 2002, Ann Pharmacother., 36, 679-686; McCarthy et al., 1994, Textbook ofPain, 387-395). Большинство пациентов с остеоартритом обращаются к врачу по причине связанной с заболеванием боли. Артрит оказывает значительное воздействие на психологическое и психическое состояние и известен как основная причина недееспособности в пожилом возрасте. Анкилозирующий спондилит также является ревматическим заболеванием, которое вызывает артрит межпозвонковых суставов и крестцово-подвздошных сочленений. Его течение варьирует от перемежающихся приступов боли в спине, которые происходят в процессе всей жизни, до тяжелого хронического заболевания, которое атакует спинной мозг, периферические суставы и другие органы человека. Другим типом воспалительной боли является висцеральная боль, которая включает боль, ассоциированную с воспалительным заболеванием кишечника (IBD). Висцеральная боль представляет собой боль, ассоциированную с внутренними органами, которые охватывают органы брюшной полости. Такие органы включают половые органы, селезенку и часть пищеварительной системы. Боль, ассоциированную с внутренними органами, можно разделить на висцеральную боль пищеварительных органов и висцеральную боль непищеварительных органов. Часто встречающиеся вызывающие боль желудочнокишечные (GI) расстройства включают функциональное расстройство кишечника (FBD) и воспалительное заболевание кишечника (IBD). Указанные желудочно-кишечные расстройства включают широкий ряд болезненных состояний, которые в настоящее время лишь отчасти контролируются, включая, что касается FBD, гастроэзофагеальную рефлюксную болезнь, диспепсию, синдром раздраженного кишечника (IBS) и функциональный абдоминальный болевой синдром (FAPS) и, что касается IBD, болезнь Крона, илеит и язвенный колит, каждое из которых регулярно вызывает висцеральную боль. Другие типы висцеральной боли включают боль, ассоциированную с дисменореей, циститом и панкреатитом, и тазовую боль. Следует отметить, что некоторые типы боли имеют множественную этиологию, а потому могут быть классифицированы более чем по одной области, например боль в спине и раковая боль заключают и ноцецептивный, и нейропатический компоненты. Другие типы боли включают боль в результате скелетно-мышечных нарушений, включая миалгию,фибромиалгию, спондилит, серонегативные (неревматоидные) артропатии, не-суставной ревматизм, дистрофинопатию, гликогенолиз, полимиозит и пиомиозит; боль в сердце и сосудах, включая боль, вызванную стенокардией, инфарктом миокарда, стенозом митрального клапана, перикардитом, феноменом Рейно, склередемой и ишемией скелетных мышц; головную боль, такую как мигрень (включая мигрень с предшественником и мигрень без предшественника), кластерные головные боли, тензионную головную боль, головную боль смешанного генеза и головную боль, ассоциированную с сосудистыми нарушениями; и боль в ротолицевой области, включая зубную боль, ушную боль, "синдром горящего рта" и височно-нижнечелюстную миофасциальную боль. Как описано выше, приведенные здесь соединения и их фармацевтически приемлемые соли могут использоваться для лечения нарушений ЦНС, включая шизофрению и другие психотические расстройства, расстройства настроения, тревожные расстройства, нарушения сна и когнитивные нарушения, такие как делирий, деменцию и амнестические расстройства. Стандарты диагностики указанных нарушений могут быть найдены в American Psychiatric Association's Diagnostic and Statistical Manual of MentalDisorders (4th ed., 2000), которое обычно называют DSM Manual.-9 015488 Для целей указанного описания изобретения шизофрения и другие психотические расстройства включают шизофреноформное расстройство, шизоаффективное расстройство, бредовое расстройство,кратковременное психотическое расстройство, разделенное психотическое расстройство, психотическое расстройство вследствие общего медицинского состояния пациента и вызванное веществом психотическое расстройство, а также вызванные введением лекарства нарушения движений, такие как вызванный введением нейролептиков паркинсонизм, злокачественный нейролептический синдром, вызванная введением нейролептиков острая дистония, вызванная введением нейролептиков острая акатизия, вызванная введением нейролептиков поздняя дискинезия и вызванный введением лекарства постуральный тремор. Расстройства настроения включают депрессивные расстройства, такие как большое депрессивное расстройство, дистимическое расстройство, предменструальное дисфорическое расстройство, малое депрессивное расстройство, рекуррентное кратковременное депрессивное расстройство, постпсихотическое депрессивное расстройство при шизофрении и большой депрессивный эпизод с шизофренией; биполярные расстройства, такие как биполярное расстройство I типа, биполярное расстройство II типа,циклотимия и биполярное расстройство с шизофренией; расстройства настроения вследствие общего медицинского состояния пациента и вызванные веществом расстройства настроения. Тревожные расстройства включают приступ паники, агорафобию, паническое расстройство без агорафобии, агорафобию без панического расстройства в анамнезе, специфическую фобию, социофобию(социальное тревожное расстройство), обсессивно-компульсивное расстройство, посттравматическое стрессовое расстройство, острое стрессовое расстройство, генерализованное тревожное расстройство,тревожное расстройство вследствие общего медицинского состояния пациента, вызванное веществом тревожное расстройство и смешанное тревожное-депрессивное расстройство. Нарушения сна включают первичные нарушения сна, такие как диссомнии (первичная бессонница,первичная гиперсомния, нарколепсия, связанное с дыханием нарушение сна, расстройство циркадного ритма сна, депривация сна, синдром беспокойных ног и периодические движения конечностей) и парасомнии (кошмарные сновидения, ночные страхи, сомнамбулизм, нарушение поведения, связанное с фазой быстрого сна, и сонный паралич); нарушения сна, связанные с другим психическим расстройством,включая бессонницу, связанную с шизофренией, депрессивными расстройствами или тревожными расстройствами, или гиперсомнию, ассоциированную с биполярными расстройствами; нарушения сна вследствие общего медицинского состояния пациента и вызванные веществом нарушения сна. Делирий, деменция и амнестические и другие когнитивные нарушения включают делирий вследствие общего медицинского состояния пациента, вызванный веществом делирий и делирий вследствие множественных этиологий; деменцию при болезни Альцгеймера, сосудистую деменцию, деменцию вследствие общего медицинского состояния пациента, деменцию вследствие ВИЧ-инфекции, деменцию вследствие травмы головы, деменцию вследствие болезни Паркинсона, деменцию вследствие болезни Гентингтона, деменцию вследствие болезни Пика, деменцию вследствие болезни Крейтцфельда-Якоба,деменцию вследствие других общих медицинских состояний пациента, вызванную веществом персистирующую деменцию, деменцию вследствие множественных этиологий; амнестические нарушения вследствие общего медицинского состояния пациента и вызванное веществом персистирующее амнестическое нарушение. Вызванные веществом нарушения относятся к нарушениям, возникающим в результате применения, злоупотребления одним или несколькими лекарствами или токсинами, включая среди прочих алкоголь, амфетамины или аналогично действующие симпатомиметики, кофеин, марихуану, кокаин, галлюциногены, вдыхаемые средства, никотин, опиоиды, фенциклидин или аналогично действующие арилциклогексиламины, и седативными средствами, снотворными средствами или анксиолитическими средствами, и зависимости или абстиненции от них. Недержание мочи включает непроизвольное или случайное мочеиспускание вследствие неспособности сдерживать или контролировать мочеиспускание. Недержание мочи включает смешанное недержание мочи, ночное недержание мочи, недержание мочи вследствие переполнения мочевого пузыря,стрессовое недержание мочи, преходящее недержание мочи и ургентное недержание мочи. Соединения формулы I, которые включают соединения, представленные формулой II, и конкретно перечисленные выше соединения, могут образовывать фармацевтически приемлемые комплексы, соли,сольваты и гидраты. Соли включают соли присоединения кислоты (включая дикислоты) и соли присоединения основания. Фармацевтически приемлемые соли присоединения кислоты включают соли, полученные из неорганических кислот, таких как соляная кислота, азотная кислота, фосфорная кислота, серная кислота,бромисто-водородная кислота, йодисто-водородная кислота, фтористо-водородная кислота и фосфористые кислоты, а также соли, полученные из органических кислот, таких как алифатические моно- и дикарбоновые кислоты, фенилзамещенные алкановые кислоты, гидроксиалкановые кислоты, алкандиовые кислоты, ароматические кислоты, алифатические и ароматические сульфоновые кислоты, и т.д. Такие соли включают ацетат, адипат, аспартат, бензоат, безилат, бикарбонат, карбонат, бисульфат, сульфат,борат, камзилат, цитрат, цикламат, эдизилат, эзилат, формиат, фумарат, глюцептат, глюконат, глюкуронат, гексафторфосфат, гибензат, гидрохлорид, хлорид, гидробромид, бромид, гидройодид, йодид, изе- 10015488 тионат, лактат, малат, малеат, малонат, мезилат, метилсульфат, нафтилат, 2-напзилат, никотинат, нитрат,оротат, оксалат, пальмитат, памоат, фосфат, гидрофосфат, дигидрофосфат, пироглютамат, сахарат, стеарат, сукцинат, таннат, тартрат, тозилат, трифторацетат и ксинафоат. Фармацевтически приемлемые соли присоединения оснований включают соли, полученные из оснований, включая катионы металлов, такие как катион щелочного или щелочно-земельного металла, а также амины. Примеры подходящих катионов металлов включают натрий (Na+), калий (K+), магний(Mg2+), кальций (Ca2+), цинк (Zn2+) и алюминий (Al3+). Примеры подходящих аминов включают аргинин,N,N'-дибензилэтилендиамин, хлорпрокаин, холин, диэтиламин, диэтаноламин, дициклогексиламин, этилендиамин, глицин, лизин, N-метилглюкамин, оламин, 2-амино-2-гидроксиметилпропан-1,3-диол и прокаин. Для обсуждения применимых солей присоединения кислоты и основания см. S.M. Berge et al.,"Pharmaceutical Salts", 66, J. Pharm. Sci., 1-19 (1977); а также Stahl and Wermuth, Handbook ofPharmaceutical Salts: Properties, Selection, and Use (2002). Фармацевтически приемлемые соли могут быть получены с использованием различных способов. Например, может быть осуществлено взаимодействие соединения с подходящей кислотой или основанием с получением требуемой соли. Также может быть осуществлено взаимодействие предшественника соединения с кислотой или основанием для удаления защитной для кислоты или основания группы или для раскрытия лактоновой или лактамной группы предшественника. Кроме того, соль соединения может быть преобразована в другую соль путем обработки подходящей кислотой или основанием или посредством контакта с ионообменной смолой. После осуществления взаимодействия соль может быть выделена путем фильтрации, если она выпадает в осадок из раствора, или путем упаривания с выделением соли. Степень ионизации соли может варьировать от полностью ионизированного состояния до полностью неионизированного состояния. Описанные здесь соединения и их фармацевтически приемлемые соли могут существовать в разнообразных формах твердых состояний, варьирующих от полностью аморфных форм до полностью кристаллических форм. Они также могут также существовать в несольватированных и сольватированных формах. Термин "сольват" описывает молекулярный комплекс, включающий соединение и одну или несколько молекул фармацевтически приемлемого растворителя (например, EtOH). Термин "гидрат" представляет собой сольват, в котором растворителем является вода. Фармацевтически приемлемые сольваты включают сольваты, в которых растворитель может содержать изотоп (например, D2O, d6-ацетон,d6-ДМСО). Принятая в настоящее время классификация сольватов и гидратов проводит различие между сольватами и гидратами с изолированными молекулами растворителя, сольватами с формированием каналов и сольватами с образованием координационных связей с ионом металла (см., например, K.R. Morris(H.G. Brittain ed.) Polymorphism in Pharmaceutical Solids (1995. Сольваты и гидраты с изолированными молекулами растворителя представляют собой сольваты и гидраты, в которых молекулы растворителя(например, воды) изолированы от прямого контакта друг с другом вследствие нахождения между ними молекул органического соединения. В сольватах с формированием каналов молекулы растворителя располагаются в решетчатых каналах, где они расположены рядом с другими молекулами растворителя. В сольватах с образованием координационных связей с ионом металла молекулы растворителя связаны с ионом металла. Если растворитель или вода крепко связаны, то комплекс может иметь четко определенную стехиометрию, независящую от влажности. Однако если растворитель или вода связано слабо, то в сольватах с образованными каналами и в гигроскопичных соединениях содержание воды или растворителя будет зависеть от влажности и условий сушки. В таких случаях нормой является отсутствие стехиометрии. Описанные здесь соединения и их фармацевтически приемлемые соли могут также существовать в виде многокомпонентных комплексов (отличных от солей или сольватов), в которых соединение и по крайней мере один другой компонент содержатся в стехиометрических или нестехиометрических количествах. Комплексы такого типа включают клатраты (комплексы включения типа "гость-хозяин") и сокристаллы. Последние обычно определяют как кристаллические комплексы нейтральных молекулярных составных частей, которые связаны вместе посредством нековалентных взаимодействий, но также могут представлять собой комплекс нейтральной молекулы и соли. Сокристаллы могут быть получены путем кристаллизации из расплава, путем перекристаллизации из растворителей или путем совместного физического размола компонентов (см., например, O. Almarsson and M.J. Zaworotko, Chem. Commun., 17:18891896 (2004); для общего обзора многокомпонентных комплексов см. J.K. Haleblian, J. Pharm. Sci. 64(8):1269-88 (1975. Термин "пролекарства" относится к соединениям, которые в результате метаболизма in vivo преобразуются в соединения, обладающие требуемой фармакологической активностью. Пролекарства могут быть получены путем замены подходящих функциональных групп, содержащихся в фармакологически активных соединениях, "профрагментами", как описано, например, вH. Bundgaar, Design of Prodrugs (1985). Примеры пролекарств включают сложноэфирные, эфирные и амидные производные соединений формул I, II, конкретно перечисленных выше соединений и их фармацевтически приемлемых солей (для дополнительного рассмотрения пролекарств см., например,- 11015488E.B. Roche ed., Bioreversible Carriers in Drug Design (1987. Термин "метаболиты" относится к соединениям, образованным in vivo после введения фармакологически активных веществ. Примеры включают гидроксиметил-, гидрокси-, втор-амино, первичный амино, фенол- и карбоксикислотные производные соединений формул I, II, конкретно перечисленных выше соединений и их фармацевтически приемлемых солей, содержащих метильную, алкокси, третичную амино, вторичную амино, фенильную и амидную группы соответственно. Геометрические (цис/транс) изомеры могут быть разделены традиционными методиками, такими как хроматография и фракционная кристаллизация. Термин "таутомеры" относится к структурным изомерам, которые являются взаимно превращаемыми вследствие низкого энергетического барьера. Таутомерная изомерия (таутомерия) может принимать форму таутомерии с перемещением протона, при которой соединение содержит, например, имино,кето или оксимную группу, или валентную таутомерию, при которой соединение содержит ароматический фрагмент. Описанные здесь соединения также включают все фармацевтически приемлемые содержащие изотоп варианты, в которых по крайней мере один атом заменен атомом с тем же самым атомным номером,но с атомной массой, отличной от атомной массы, обычно встречающейся в природе. Изотопы, подходящие для включения в описанные здесь соединения и их фармацевтически приемлемые соли, включают, например, изотопы водорода, такие как 2H и 3H; изотопы углерода, такие как 11C, 13C и 14C; изотопы азота, такие как 13N и 15N; изотопы кислорода, такие как 15O, 17O и 18O; изотопы серы, такие как 35S; изотопы фтора, такие как 18F; изотопы хлора, такие как 36Cl; и изотопы йода, такие как 123I и 125I. Использование содержащих изотоп вариантов (например, содержащих дейтерий 2H) может обеспечивать определенные терапевтические преимущества, которые выражаются в большей метаболической стабильности,например в увеличении времени полураспада in vivo или в снижении требуемой дозировки. Кроме того,некоторые содержащие изотоп варианты раскрытых здесь соединений могут содержать радиоактивный изотоп (например, тритий 3H или 14C), который может быть использован в исследованиях распределения лекарственного средства и/или субстрата в тканях. Замещение испускающими позитрон изотопами, такими как 11C, 18F, 15O и 13N, может использоваться при проведении позитрон-эмиссионной томографии(PET) для оценки заселенности субстратом рецепторов. Меченные изотопами соединения могут быть получены способами, аналогичными представленным где-либо еще в настоящем описании способам, с использованием подходящего меченного изотопом соединения вместо немеченого реагента. Описанные здесь соединения и их фармацевтически приемлемые соли могут вводиться в виде их кристаллической и аморфной форм, пролекарств, метаболитов, гидратов, сольватов, комплексов и таутомеров, а также в виде всех их меченных изотопами соединений. Они могут вводиться по отдельности или в сочетании с одним другим соединением или с одним или несколькими фармакологически активными соединениями, которые отличаются от соединений, описанных и конкретно перечисленных здесь, и их фармацевтически приемлемыми солями. Как правило, одно или несколько таких соединений вводят в виде фармацевтической композиции (состава) в сочетании с одним или несколькими фармацевтически приемлемыми наполнителями. Выбор наполнителей зависит, среди прочего, от конкретного способа введения, эффекта наполнителя на растворимость и стабильность и природы лекарственной формы. Применимые фармацевтические композиции и способы их приготовления могут быть найдены, например, вA.R. Gennaro (ed.), Remington: The Science and Practice of Pharmacy (20th ed., 2000). Описанные здесь соединения и их фармацевтически приемлемые соли могут вводиться перорально. Пероральное введение может включать проглатывание, при котором соединение поступает в кровоток через желудочно-кишечный тракт. В качестве альтернативы или дополнения, пероральное введение может включать такое введение через слизистую оболочку (например, трансбуккальное, подъязычное, супралингвальное введение), при котором соединение поступает в кровоток через слизистую оболочку полости рта. Составы, подходящие для перорального введения, включают твердые, полутвердые и жидкие системы, такие как таблетки; капсулы с мягкой и твердой оболочкой, содержащие множество частиц или наночастицы, жидкости или порошки; пастилки, которые могут быть заполнены жидкостью; жвачки; гели; быстро диспергируемые лекарственные формы; пленки; суппозитории; спреи и буккальные или мукоадгезивные пластинки. Жидкие составы включают суспензии, растворы, сиропы и эликсиры. Такие составы могут использоваться в качестве наполнителей капсул с мягкой и твердой оболочкой (сделанных, например, из желатина или гидроксипропилметилцеллюлозы) и обычно содержат носитель (например, воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или подходящее масло) и один или несколько эмульгаторов, суспендирующих агентов или и тех и других. Жидкие составы также могут быть получены путем восстановления твердого вещества (например, из саше). Описанные здесь соединения и их фармацевтически приемлемые соли могут также использоваться в виде быстро растворимых, быстро распадающихся лекарственных форм, таких как описанные в Liang- 12015488 В таблетированных лекарственных формах в зависимости от дозы содержание активного фармацевтического ингредиента (API) может составлять от приблизительно 1 до приблизительно 80 мас.% лекарственной формы или более обычно от приблизительно 5 до приблизительно 60 мас.% лекарственной формы. В дополнение к API таблетки могут содержать один или несколько разрыхлителей, связующих веществ, разбавителей, поверхностно-активных веществ, способствующих скольжению веществ, смазывающих вещества, антиоксидантов, красителей, ароматизаторов, консервантов и корригентов. Примеры разрыхлителей включают натрия крахмал гликолят, натрия карбоксиметилцеллюлозу, кальция карбоксиметилцеллюлозу, натрия кроскармеллозу, кросповидон, поливинилпирролидон, метилцеллюлозу, микрокристаллическую целлюлозу, C1-6-алкилзамещенную гидроксипропилцеллюлозу, крахмал, прежелатинизированный крахмал и альгинат натрия. Как правило, содержание разрыхлителя составляет от приблизительно 1 до приблизительно 25 мас.% или от приблизительно 5 до приблизительно 20 мас.% лекарственной формы. Связующие вещества, как правило, используют для придания таблетируемому составу связующих свойств. Подходящие связующие вещества включают микрокристаллическую целлюлозу, желатин, сахара, полиэтиленгликоль, натуральные и синтетические смолы, поливинилпирролидон, прежелатинизированный крахмал, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. Таблетки также могут содержать разбавители, такие как лактоза (моногидрат, высушенный распылением моногидрат, безводную), маннит, ксилит, декстроза, сахароза, сорбит, микрокристаллическая целлюлоза, крахмал и дигидрат двухосновного фосфата кальция. Таблетки также могут содержать поверхностно-активные вещества, такие как лаурилсульфат натрия и полисорбат 80, и способствующие скольжению вещества, такие как двуокись кремния и тальк. В случае их наличия содержание поверхностно-активных веществ может составлять от приблизительно 0,2 до приблизительно 5 мас.% таблетки и содержание способствующих скольжению веществ может составлять от приблизительно 0,2 до приблизительно 1 мас.% таблетки. Таблетки также могут содержать смазывающие вещества, такие как стеарат магния, стеарат кальция, стеарат цинка, стеарилфумарат натрия и смеси стеарата магния с лаурилсульфатом натрия. Содержание смазывающих веществ может составлять от приблизительно 0,25 до приблизительно 10 мас.% или от приблизительно 0,5 до приблизительно 3 мас.% таблетки. Таблетируемые смеси могут быть спрессованы непосредственно или при помощи уплотняющего ролика для формирования таблеток. Перед таблетированием таблетируемые смеси или части смесей могут быть в качестве альтернативы подвергнуты влажному гранулированию, сухому гранулированию или гранулированию из расплава, отверждению из расплава или экструзии. При желании, перед смешиванием один или несколько из компонентов могут быть разделены по размеру путем сортировки или размалывания или и тем и другим. Конечная лекарственная форма может содержать один или несколько слоев и может быть покрыта оболочкой, не покрыта оболочкой или инкапсулирована. Типичные таблетки могут содержать до приблизительно 80 мас.% API, от приблизительно 10 до приблизительно 90 мас.% связующего вещества, от приблизительно 0 до приблизительно 85 мас.% разбавителя, от приблизительно 2 до приблизительно 10 мас.% разрыхлителя и от приблизительно 0,25 до приблизительно 10 мас.% смазывающего вещества. Для рассмотрения смешивания, гранулирования, размалывания, сортировки, таблетирования, покрытия оболочкой, а также для описания альтернативных методик приготовления лекарственных препаратов, см. A.R. Gennaro (ed.), Remington: The Science and Practice of Pharmacy (20th ed.,2000); H.A. Lieberman et al. (ed.), Pharmaceutical Dosage Forms: Tablets, Vol. 1-3 (2nd ed., 1990) иD.K. ParikhC.K. Parikh, Handbook of Pharmaceutical Granulation Technology, Vol. 81 (1997). Пленки для перорального применения, пригодные для употребления в медицине и ветеринарии,представляют собой гибкие растворимые в воде или набухающие в воде тонкие пленочные лекарственные формы, которые могут быстро растворяться или адгезировать на поверхности слизистой оболочки. В дополнение к API обычная пленка содержит один или несколько образующих пленку полимеров, связующих веществ, растворителей, увлажнителей, пластификаторов, стабилизаторов или эмульгаторов,модификаторов вязкости и растворителей. Другие ингредиенты пленки включают антиоксиданты, красители, ароматизаторы и усилители вкуса, консерванты, стимуляторы слюноотделения, хладагенты, сорастворители (включая масла), мягчители, наполнители, пеногасители, поверхностно-активные вещества и корригенты. Некоторые компоненты состава могут выполнять более одной функции. Помимо требований к дозировке количество API в пленке может зависеть от его растворимости. В случае растворимого в воде API его содержание обычно составляет от приблизительно 1 до приблизительно 80 мас.% отличных от растворителя компонентов (растворенных веществ) в пленке или от приблизительно 20 до приблизительно 50 мас.% растворенных веществ в пленке. Содержание менее растворимого API в композиции может составлять большее значение, обычно до приблизительно 88 мас.% отличных от растворителя компонентов в пленке. Образующий пленку полимер может быть выбран из природных полисахаридов, белков или синтетических гидроколлоидов, и его содержание обычно составляет от приблизительно 0,01 до приблизительно 99 мас.% или от приблизительно 30 до приблизительно 80 мас.% пленки.- 13015488 Пленочные лекарственные формы обычно приготавливают путем сушки выпариванием тонких водных пленок, нанесенных на поверхность отслаивающейся подложки или бумаги, которая может проводиться в сушильной печи или камере (например, в комбинированном глазировочно-сушильном аппарате), на оборудовании для лиофилизации или в вакуумной печи. Применимые твердые составы для перорального введения могут включать составы с немедленным высвобождением и составы с модифицированным высвобождением. Составы с модифицированным высвобождением включают составы с отсроченным, замедленным, прерывистым, контролируемым, направленным и программируемым высвобождением. Для общего описания подходящих составов с модифицированным высвобождением см. патент США 6106864. Для подробностей других применимых методик высвобождения, таких так макроэргические дисперсии и частицы с осмотической оболочкой или покрытием, см. Verma et al., Pharmaceutical Technology On-line (2001), 25(2):1-14. Соединения формул I, II, конкретно перечисленные выше соединения и их фармацевтически приемлемые соли могут также вводиться непосредственно в кровоток, мышцу или внутренний орган субъекта. Подходящие методики парентерального введения включают внутривенное, внутриартериальное, интраперитонеальное,интратекальное, внутрижелудочковое, интрауретральное, внутригрудинное, интракраниальное, внутримышечное, внутрисуставное и подкожное введение. Подходящие устройства для парентерального введения содержат игольные инжекторы, включая микроигольные инжекторы, безыгольные инжекторы, и инфузионные устройства. Парентеральные составы обычно представляют собой водные растворы, которые могут содержать наполнители, такие как соли, углеводы и буферные вещества (например, со значением pH от приблизительно 3 до приблизительно 9). Однако для некоторых применений соединения формул I, II, конкретно перечисленные выше соединения и их фармацевтически приемлемые соли могут быть подходящим образом включены в состав в виде стерильного неводного раствора или в виде высушенной формы, подлежащей к использованию вместе с подходящим носителем, таким как стерильная апирогенная вода. Приготовление парентеральных составов в стерильных условиях (например, путем лиофилизации) может быть легко осуществлено с использованием стандартных в фармации методик. Растворимость соединений, которые используются при приготовлении парентеральных растворов,может быть увеличена посредством подходящих методик приготовления составов, таких как включение в состав усилителей растворимости. Могут быть приготовлены составы для парентерального введения,предназначенные для немедленного или модифицированного высвобождения. Составы с модифицированным высвобождением включают составы с отсроченным, замедленным, прерывистым, контролируемым, направленным и программируемым высвобождением. Таким образом, соединения формул I, II,конкретно перечисленные выше соединения и их фармацевтически приемлемые соли могут быть включены в состав в виде суспензии, твердого вещества, полутвердого вещества или тиксотропной жидкости для введения, в виде имплантированного депо, которое обеспечивает модифицированное высвобождение активного соединения. Примеры таких составов включают покрытые лекарственным средством стенты и полутвердые вещества и суспензии, содержащие покрытые лекарственным средством микросферы из поли(DL-молочной-когликолевой)кислоты (PGLA). Описанные здесь соединения и их фармацевтически приемлемые соли могут также местно, внутрикожно или чрескожно вводиться в кожу или слизистую оболочку. Обычные составы для этой цели включают гели, гидрогели, лосьоны, растворы, кремы, мази, пудры, повязки, пены, пленки, трансдермальные пластыри, облатки, имплантаты, губки, волокна, бинты и микроэмульсии. Также могут использоваться липосомы. Типичные носители могут включать спирт, воду, минеральное масло, вазелиновое масло, медицинский вазелин, глицерин, полиэтиленгликоль и пропиленгликоль. Местные составы могут также включать усилители проникновения (см., например, Finnin and Morgan, J. Pharm. Sci. 88(10):955-958(1999. Другие способы местного введения включают доставку путем электропорации, ионофореза, фонофореза, сонофореза и инъекции микроигольным или безыгольным инжектором. Могут быть приготовлены составы для местного введения с описанным выше немедленным или с модифицированным высвобождением. Описанные здесь соединения и их фармацевтически приемлемые соли также могут вводиться интраназально или путем ингаляции, обычно в форме сухого порошка, распыляемого аэрозоля или капель в нос. Ингалятор может использоваться для введения сухого порошка, который содержит только API, порошковую смесь API и разбавителя, такого как лактоза, или частиц из смеси компонентов, которые включают API и фосфолипид, такой как фосфатидилхолин. Для интраназального использования порошок может содержать биоадгезивное средство, например хитозан или циклодекстрин. Находящийся под давлением контейнер, насос, распылитель, мелкокапельный распылитель или небулайзер могут использоваться для получения аэрозольной струи раствора или суспензии, содержащих API, одно или несколько средств для диспергирования, солюбилизации или усиления высвобождения API (например, EtOH с добавлением или без добавления воды), выполняющие роль пропеллента один или несколько растворителей (например, 1,1,1,2-тетрафторэтан или 1,1,1,2,3,3,3-гептафторпропан) и необязательное поверхностноактивное вещество, такое как сорбитана триолеат, олеиновая кислота или олигомолочная кислота. Для- 14015488 получения мелкодисперсного облака может быть использован электрогидродинамический мелкокапельный распылитель. Перед использованием в сухом порошковом или суспензионном составе лекарственное средство обычно измельчают до размера частиц, подходящего для доставки путем ингаляции (обычно 90 об.% частиц имеют наибольший размер менее 5 мкм). Это может достигаться любым подходящим способом уменьшения размера, таким как измельчение на спиральной струйной мельнице, мельнице с псевдоожиженным слоем, обработка сверхкритической жидкости, гомогенизация высокого давления или сушка распылением. Для использования в ингаляторе или инсуффляторе могут быть получены капсулы, блистеры и картриджи (сделанные, например, из желатина или гидроксипропилметилцеллюлозы) с составом, содержащим порошковую смесь активного соединения, подходящего порошкового основания, такого как лактоза или крахмал, и модификатор характеристик, такой как L-лейцин, маннит или стеарат магния. Лактоза может быть безводной или моногидратированной. Другие подходящие наполнители включают декстран,глюкозу, мальтозу, сорбит, ксилит, фруктозу, сахарозу и трегалозу. Подходящий состав раствора для использования в электрогидродинамическом мелкокапельном распылителе для получения мелкодисперсного облака может содержать от приблизительно 1 мкг до приблизительно 20 мг API за одно срабатывание, а объем срабатывания может варьировать от приблизительно 1 до приблизительно 100 мкл. Обычный состав может содержать одно или несколько соединений формул I, II, конкретно перечисленные выше соединения и их фармацевтически приемлемые соли, пропиленгликоль, стерильную воду, EtOH и NaCl. Альтернативные растворители, которые могут использоваться вместо пропиленгликоля, включают глицерин и полиэтиленгликоль. С использованием, например, PGLA могут быть приготовлены составы для ингаляционного введения, интраназального введения или обоих типов введения с немедленным или модифицированным высвобождением. К составам, предназначенным для ингаляционного/интраназального введения, могут быть добавлены подходящие ароматизаторы, такие как ментол и левоментол, или подсластители, такие как сахарин или сахарин натрия. В случае сухих порошковых ингаляторов и аэрозольных распылителей объем дозировки определяется посредством работы клапана, отмеряющего заданное количество. Объемы обычно подбираются таким образом, что отмеренная доза или "puff" содержит от приблизительно 10 до приблизительно 1000 мкг API. Суммарная суточная доза, которая обычно варьирует от приблизительно 100 мкг до приблизительно 10 мг, может вводиться однократно или, что более часто, быть разделена на дозы в течение суток. Активные соединения могут вводиться ректально или вагинально, например в форме суппозитория,пессария или клизмы. Какао-масло представляет собой традиционную основу суппозитория, но при необходимости могут быть использованы различные альтернативы. Могут быть приготовлены составы для ректального или вагинального введения с описанным выше немедленным или с модифицированным высвобождением. Описанные здесь соединения и их фармацевтически приемлемые соли могут также вводиться непосредственно в глаз или ухо, обычно в форме капель или мелкодисперсной суспензии или раствора в изотоническом, отрегулированном по значению pH, стерильном солевом растворе. Другие составы, подходящие для глазного или ушного введения, включают мази, гели, биоразрушаемые имплантаты (например, абсорбирующие гель, коллаген), бионеразрушаемые имплантаты (например, силикон), облатки,линзы и взвешенные частицы или везикулы, такие как ниосомы или липосомы. Состав может содержать один или несколько полимеров и консервантов, таких как хлорид бензалкония. Типичные полимеры включают перекрестно-сшитую полиакриловую кислоту, поливиниловый спирт, гиалуроновую кислоту,целлюлозные полимеры (например, гидроксипропилметилцеллюлозу, гидроксиэтилцеллюлозу, метилцеллюлозу) и гетерополисахаридные полимеры (например, геллановую камедь). Такие составы могут также вводиться путем ионофореза. Могут быть приготовлены составы для глазного или ушного введения с описанным выше немедленным или с модифицированным высвобождением. Как отмечено выше, описанные здесь соединения, их фармацевтически приемлемые соли и их фармацевтически активные комплексы, сольваты и гидраты могут быть объединены с еще одним соединением или с одним или несколькими другими фармацевтически активными соединениями для лечения различных заболеваний,состояний или нарушений. В таких случаях активные соединения могут быть объединены в одну описанную выше лекарственную форму или могут предоставляться в форме набора, подходящего для совместного введения композиций. Набор содержит (1) две или более различные фармацевтические композиции, по крайней мере одна из которых содержит соединение формулы I; и (2) устройство для раздельного хранения двух фармацевтических композиций, такое как разделенная на части склянка или разделенный на части пакет из фольги. Примером такого набора является обычная блистерная упаковка, используемая для упаковки таблеток и капсул. Набор подходит для введения различных типов лекарственных форм (например, пероральной и парентеральной) или для введения различных фармацевтических композиций с интервалом между ними или для титрования различных фармацевтических композиций друг относительно друга. Для помощи в соблюдении пациентами режима лечения в- 15015488 наборе обычно содержатся инструкции по введению, и он может быть укомплектован памяткой. Для введения пациентам-людям общая суточная доза указанных в формуле изобретения и раскрытых в данном описании соединений обычно находится в диапазоне от приблизительно 0,1 до приблизительно 3000 мг в зависимости от пути введения. Например, для перорального введения может потребоваться общая суточная доза от приблизительно 1 до приблизительно 3000 мг, тогда как для внутривенного введения может потребоваться общая суточная доза лишь от приблизительно 0,1 до приблизительно 300 мг. Общая суточная доза может вводиться однократно или может быть разделена на дозы и на усмотрение врача может выходить за пределы представленных выше обычных рамок. Хотя указанные дозировки рассчитаны, исходя из среднестатистического человека с массой тела от приблизительно 60 до приблизительно 70 кг, врач способен определить подходящую дозу для пациента (например, ребенка),чья масса выходит за рамки указанного диапазона массы тела. Указанные в формуле изобретения и раскрытые в настоящем описании соединения могут быть объединены с одним или несколькими другими фармакологически активными соединениями для лечения одного или нескольких нарушений, причем фармакологически активные соединения могут быть выбранные из опиоидного анальгетика, например морфина, героина, гидроморфона, оксиморфона, леворфанола,леваллорфана, метадона, меперидина, фентанила, кокаина, кодеина, дигидрокодеина, оксикодона, гидрокодона, пропоксифена, налмефена, налорфина, налоксона, налтрексона, бупренорфина, буторфанола,налбуфина или пентазоцина; нестероидного противовоспалительного средства (NSAID), например,ацетаминофена, аспирина,диклофенака, дифлузинала, этодолака, фенбуфена, фенопрофена, флуфенизала, флурбипрофена, ибупрофена, индометацина, кетопрофена, кеторолака, меклофенамовой кислоты, мефенамовой кислоты,мелоксикама, набуметона, напроксена, нимесулида, нитрофлурбипрофена, олсалазина, оксапрозина, фенилбутазона, пироксикама, сульфасалазина, сулиндака, толметина или зомепирака; барбитуратного седативного средства, например амобарбитала, апробарбитала, бутабарбитала, бутабитала, мефобарбитала, метарбитала, метогекситала, пентобарбитала, фенобарбитала, секобарбитала,талбутала, тиамилала или тиопентала; бензодиазепина с седативным действием, например хлордиазепоксида, клоразепата, диазепама,флуразепама, лоразепама, оксазепама, темазепама или тиазолама; антагониста H1 с седативным действием, например, дифенилгидрамина, пириламина, прометазина,хлорфенирамина или хлорциклизина; седативного средства, такого как глутетимид, мепробамат, метаквалон или дихлоралфеназон; скелетно-мышечного миорелаксанта, например баклофена, карисопродола, хлорзоксазона, циклобензаприна, метокарбамола или орфренадина; антагониста рецептора NMDA, например декстрометорфана +)-3-гидрокси-N-метилморфинана) или его метаболита декстрорфана +)-3-гидрокси-N-метилморфинана), кетамина, мемантина,пирролохинолинхинина, цис-4-(фосфонометил)-2-пиперидинкарбоновой кислоты, будипина, EN-3231(2S,3S); антагониста мускариновых рецепторов, например оксибутинина, толтеродина, пропиверина, тропсия хлорида, дарифенацина, солифенацина, темиверина и ипратропия; селективного ингибитора COX-2, например целекоксиба, рофекоксиба, парекоксиба, вальдекоксиба, деракоксиба, эторикоксиба или лумиракоксиба; анальгетиков каменноугольной смолы, в частности парацетомола; нейролептика, такого как дроперидол, хлорпромазин, галоперидол, перфеназин, тиоридазин, мезоридазин, трифлуоперазин, флуфеназин, клозапин, оланзапин, рисперидон, зипрасидон, кветиапин, сертиндол, арипипразол, сонепипразол, блонансерин, илоперидон, пероспирон, раклоприд, зотепин, бифепрунокс, азенапин, лурасидон, амисульприд, белаперидон, палиндор, эпливансерин, осанетант, меклинер- 16015488 тант, Miraxion или саризотан; агониста ваниллоидного рецептора (VR1; также известного как канал транзиентного рецепторного потенциала, TRPV1) (например, резинфератоксина) или его антагониста (например, капсазепина);-адренергического средства, такого как пропранолол; местного анестетика, такого как мексилетин; кортикостероида, такого как дексаметазон; агониста или антагониста 5-HT рецептора, в частности агониста 5-HT1B/1D, такого как элетриптан,суматриптан, наратриптан, золмитриптан или ризатриптан; антагониста 5-HT2A рецептора, такого как R(+)(2,3-диметоксифенил)-1-[2-(4-фторфенилэтил)]-4 пиперидинметанол (MDL-100907); холинергического (никотинового) анальгетика, такого как испрониклин (TC-1734), (E)-N-метил-4(3-пиридинил)-3-бутен-1-амин (RJR-2403), (R)-5-(2-азетидинилметокси)-2-хлорпиридин (ABT-594) или никотин, или частичного агониста никотиновых рецепторов, такого как варениклин; трамадола; ингибитора PDEV, такого как 5-[2-этокси-5-(4-метил-1-пиперазинилсульфонил)фенил]-1-метил-3-н-пропил-1,6-дигидро-7Hпиразоло[4,3-d]пиримидин-7-он (силденафил),(6R,12aR)-2,3,6,7,12,12 а-гексагидро-2-метил-6-(3,4-метилендиоксифенил)пиразино[2',1':6,1]пиридо[3,4-b]индол-1,4-дион (IC-351 или тадалафил),2-[2-этокси-5-(4-этилпиперазин-1-ил-1-сульфонил)фенил]-5-метил-7-пропил-3H-имидазо[5,1f][1,2,4]триазин-4-он (варденафил),5-(5-ацетил-2-бутокси-3-пиридинил)-3-этил-2-(1-этил-3-азетидинил)-2,6-дигидро-7H-пиразоло[4,3d]пиримидин-7-он,5-(5-ацетил-2-пропокси-3-пиридинил)-3-этил-2-(1-изопропил-3-азетидинил)-2,6-дигидро-7Hпиразоло[4,3-d]пиримидин-7-он,5-[2-этокси-5-(4-этилпиперазин-1-илсульфонил)пиридин-3-ил]-3-этил-2-[2-метоксиэтил]-2,6 дигидро-7H-пиразоло[4,3-d]пиримидин-7-он,4-[(3-хлор-4-метоксибензил)амино]-2-[(2S)-2-(гидроксиметил)пирролидин-1-ил]-N-(пиримидин-2 илметил)пиримидин-5-карбоксамид,3-(1-метил-7-оксо-3-пропил-6,7-дигидро-1H-пиразоло[4,3-d]пиримидин-5-ил)-N-[2-(1 метилпирролидин-2-ил)этил]-4-пропоксибензолсульфонамид;-2-дельта лиганда, такого как габапентин, прегабалин, 3-метилгабапентин, (1,3,5)(3 аминометилбицикло[3.2.0]гепт-3-ил)уксусная кислота, (3S,5R)-3-аминометил-5-метилгептановая кислота, (3S,5R)-3-амино-5-метилгептановая кислота, (3S,5R)-3-амино-5-метилоктановая кислота, (2S,4S)-4-(3 хлорфенокси)пролин, (2S,4S)-4-(3-фторбензил)пролин, [(1R,5R,6S)-6-(аминометил)бицикло[3.2.0]гепт-6 ил]уксусная кислота, 3-(1-аминометилциклогексилметил)-4H-[1,2,4]оксадиазол-5-он, C-[1-(1H-тетразол 5-илметил)циклогептил]метиламин, (3S,4S)-(1-аминометил-3,4-диметилциклопентил)уксусная кислота,(3S,5R)-3-аминометил-5-метилоктановая кислота, (3S,5R)-3-амино-5-метилнонановая кислота, (3S,5R)-3 амино-5-метилоктановая кислота, (3R,4R,5R)-3-амино-4,5-диметилгептановая кислота и (3R,4R,5R)-3 амино-4,5-диметилоктановая кислота; лиганда каннабиноидного рецептора (CB1, CB2), агониста или антагониста, такого как римонабант; антагониста метаботропного глютаматного рецептора подтипа 1 (mGluR1); ингибитора обратного захвата серотонина, такого как сертралин, метаболит сертралина деметилсертралин, флуоксетин, норфлуоксетин (десметил-метаболит флуоксетина), флувоксамин, пароксетин,циталопрам, метаболит циталопрама десметилциталопрам, эсциталопрам, d,1-фенфлурамин, фемоксетин,ифоксетин, цианодотиепин, литоксетин, дапоксетин, нефазодон, церикламин и тразодон; ингибитора обратного захвата норадреналина (норэпинефрина), такого как мапротилин, лофепрамин, миртазепин, оксапротилин, фезоламин, томоксетин, миансерин, бупроприон, метаболит бупроприона гидроксибупроприон, номифензин и вилоксазин (вивалан), в особенности селективного ингибитора обратного захвата норадреналина, такого как ребоксетин, в частности (S,S)-ребоксетин; двойного ингибитора обратного захвата серотонина и норадреналина, такого как венлафаксин, метаболит венлафаксина O-десметилвенлафаксин, кломипрамин, метаболит кломепрамина десметилкломепрамин, дулоксетин, милнаципран и имипрамин; ингибитора индуцибельной NO-синтазы (iNOS), такого какS-[2-[(1-иминоэтил)амино]этил]-L-гомоцистеин,S-[2-[(1-иминоэтил)амино]этил]-4,4-диоксо-L-цистеин,S-[2-[(1-иминоэтил)амино]этил]-2-метил-L-цистеин,(2S,5Z)-2-амино-2-метил-7-[(1-иминоэтил)амино]-5-гептеновая кислота,2-(1R,3S)-3-амино-4-гидрокси-1-(5-тиазолил)бутил]тио]-5-хлор-3-пиридинкарбонитрил,2-(1R,3S)-3-амино-4-гидрокси-1-(5-тиазолил)бутил]тио]-4-хлорбензонитрил,(2S,4R)-2-амино-4-2-хлор-5-(трифторметил)фенил]тио]-5-тиазолбутанол,- 17015488 2-(1R,3S)-3-амино-4-гидрокси-1-(5-тиазолил)бутил]тио]-6-(трифторметил)-3 пиридинкарбонитрил,2-(1R,3S)-3-амино-4-гидрокси-1-(5-тиазолил)бутил]тио]-5-хлорбензонитрил,N-[4-[2-(3-хлорбензиламино)этил]фенил]тиофен-2-карбоксамидин или гуанидинэтилдисульфид; ингибитора ацетилхолинэстеразы, такого как донепезил; антагониста рецептора простагландина E2 подтипа 4 (EP4), такого как N-[(2-[4-(2-этил-4,6 диметил-1H-имидазо[4,5-c]пиридин-1-ил)фенил]этиламино)карбонил]-4-метилбензолсульфонамид или 4-[(1S)-1-([5-хлор-2-(3-фторфенокси)пиридин-3-ил]карбониламино)этил]бензойная кислота; антагониста рецептора лейкотриена B4, такого как 1-(3-бифенил-4-илметил-4-гидроксихроман-7 ил)циклопентанкарбоновая кислота (CP-105696), 5-[2-(2-карбоксиэтил)-3-[6-(4-метоксифенил)-5Eгексенил]оксифенокси]пентановая кислота (ONO-4057) или DPC-11870; ингибитора 5-липоксигеназы, такого как зилеутон, 6-[(3-фтор-5-[4-метокси-3,4,5,6-тетрагидро-2Hпиран-4-ил])феноксиметил]-1-метил-2-хинолон (ZD-2138) или 2,3,5-триметил-6-(3-пиридилметил)-1,4 бензохинон (CV-6504); блокатора натриевых каналов, такого как лидокаин; антагониста 5-HT3, такого как ондансетрон; или антител в отношении фактора роста нервов (NGF). Описанные здесь соединения и их фармацевтически приемлемые соли могут быть, в общем, получены с использованием методик, описанных ниже. Исходные материалы и реагенты могут быть получены из коммерческих источников или могут быть получены с использованием указанных в литературе способов, если иное не указано иначе. В некоторых из представленных ниже реакционных схем и примеров определенные соединения могут быть получены с использованием защитных групп, которые предотвращают нежелательную химическую реакцию в реакционно-способных в ином случае местах. Защитные группы могут также использоваться для улучшения растворимости или иной модификации физических свойств соединения. Для рассмотрения стратегии применения защитных групп, описания материалов и способов введения и снятия защитных групп и обобщения данных о применимых защитных группах для обычных функциональных групп, включая амины, карбоновые кислоты, спирты, кетоны, альдегиды и т.п., см. T.W. Greene and P.G.Wuts, Protecting Groups in Organic Chemistry (1999) и P. Kocienski, Protective Groups (2000). Как правило, описанные на всем протяжении настоящего описания химические реакции могут быть проведены с использованием, по существу, стехиометрических количеств соединений, хотя для некоторых реакций может быть полезно использование в избытке одного или нескольких из реагентов. Кроме того, многие из реакций, описанных на всем протяжении данного описания, могут быть проведены приблизительно при комнатной температуре и атмосферном давлении, но в зависимости от кинетики реакций, выходов реакции и т.п., некоторые реакции могут осуществляться в условиях повышенного давления или с использованием повышенных (например, при кипячении с обратным холодильником) или пониженных (например, от -70 до 0C) температур. Любая ссылка в описании на стехиометрический диапазон, диапазон температур, диапазон значений pH и т.п., независимо от использования в явной форме слова "диапазон", также включает указанные крайние значения. Во многих из химических реакций также могут использоваться один или несколько совместимых растворителей, которые могут влиять на скорость и выход реакции. В зависимости от природы реагентов один или несколько растворителей могут представлять собой полярные протонные растворители (включая воду), полярные апротонные растворители, неполярные растворители или некое сочетание. Характерные примеры растворителей включают насыщенные алифатические углеводороды (например, н-пентан, н-гексан, н-гептан, н-октан); ароматические углеводороды (например, бензол, толуол, ксилолы); галоидзамещенные углеводороды (например, хлористый метилен, хлороформ, четыреххлористый углерод); алифатические спирты (например, метанол, этанол, пропан-1-ол, пропан-2-ол, бутан-1-ол,2-метилпропан-1-ол, бутан-2-ол, 2-метилпропан-2-ол, пентан-1-ол, 3-метилбутан-1-ол, гексан-1-ол,2-метоксиэтанол, 2-этоксиэтанол, 2-бутоксиэтанол, 2-(2-метоксиэтокси)этанол, 2-(2-этоксиэтокси)этанол,2-(2-бутоксиэтокси)этанол); простые эфиры (например, диэтиловый эфир, диизопропиловый эфир, дибутиловый эфир,1,2-диметоксиэтан, 1,2-диэтоксиэтан, 1-метокси-2-(2-метоксиэтокси)этан, 1-этокси-2-(2-этоксиэтокси)этан, тетрагидрофуран, 1,4-диоксан); кетоны (например, ацетон, метилэтилкетон); сложные эфиры (метилацетат, этилацетат); азотсодержащие растворители (например, формамид, N,N-диметилформамид, ацетонитрил,N-метилпирролидон, пиридин, хинолин, нитробензол); серосодержащие растворители (например, сернистый углерод, диметилсульфоксид, тетрагидротиофен-1,1-диоксид) и фосфорсодержащие растворители (например, триамид гексаметилфосфорной кислоты).- 18015488 Соединения по настоящему изобретению могут быть получены, как описано ниже. В последующих реакционных схемах и обсуждении значения Ar, X, m, n, p, R1, R2, R3, R4 и R5 определены выше. Схема A Соединения формулы Ia могут быть получены в соответствии со схемой А. Путем осуществления взаимодействия соединения формулы 2 с фенилкарбаматом формулы 3a получают соединения формулыIa. Реакция может быть проведена в полярном апротонном растворителе, таком как диметилсульфоксид(ДМСО) или ацетонитрил. Температура реакции может варьировать приблизительно от температуры окружающей среды до приблизительно 60C. Реакция может быть также проведена с использованием трифторацетата или гидрохлорида соединения формулы 2 в присутствии основания, такого как триэтиламин или диизопропилэтиламин. В качестве альтернативы соединения формулы Ia получают путем осуществления взаимодействия соединения формулы 2 с карбаматом формулы 3b (R=Me или Et) при обработке микроволновым излучением. Реакция может быть проведена в растворителе, таком как ацетонитрил. Реакция может быть также проведена с использованием трифторацетата или гидрохлорида соединения формулы 2 в присутствии основания, такого как триэтиламин или диизопропилэтиламин. Кроме того, соединения формулы Ia могут быть получены путем осуществления взаимодействия соединений формулы 2 с изоцианатом формулы 3c. Реакцию обычно проводят в растворителе, таком как хлористый метилен, при температуре окружающей среды. Реакция может быть также проведена с использованием трифторацетата или гидрохлорида соединения формулы 2 в присутствии основания, такого как триэтиламин или диизопропилэтиламин. В качестве альтернативы может быть осуществлено взаимодействие соединений формулы 2 с фосгеном в присутствии основания, такого как триэтиламин или диизопропилэтиламин, и растворителя, такого как дихлорметан, при 0C с получением хлорформиатного производного формулы 2, которое может быть выделено в виде неочищенного вещества и приведено во взаимодействие с аминами формулы 3d в присутствии основания, такого как триэтиламин или диизопропилэтиламин, и катализатора, такого как 4-(диметиламино)пиридин, в подходящем растворителе, таком как ацетонитрил, дихлорметан и дихлорэтан. Температура реакционной смеси может варьировать приблизительно от температуры окружающей среды до приблизительно 70C. Схема B Соединения формулы 2 могут быть получены в соответствии со схемой B. Синтез начинается с нуклеофильного замещения в ароматическом ядре фенола формулы 6 электроноакцепторным арилгалогенидом формулы ArZ (где Z представляет собой F, Cl) с образованием диарилового эфира формулы 7 или 8. Эту реакцию предпочтительно проводят в присутствии основания, такого как карбонат калия, карбонат натрия, карбонат цезия, триэтиламин или диизопропилэтиламин. Используемым растворителем может являться диметилформамид (DMF), N-метилпирролидинон (NMP), диметилсульфоксид (ДМСО),ацетонитрил, тетрагидрофуран, диоксан или сочетание двух или более из указанных растворителей. Гидроксигруппу соединения формулы 7 преобразуют в уходящую группу (L) с использованием стандартных способов (например, с использованием тионилхлорида) с получением соответствующего соединения формулы 9, где L представляет собой галоген, такой как бромид, йодид или хлорид. В качестве альтернативы соединения формулы 8 могут быть бромированы по бензилу (N-бромсукцинимид, перекись бензоила, CCl4) с получением соединений формулы 9, где L=Br. Затем осуществляют взаимодействие полученных соединений формулы 9 с триэтилфосфитом с получением соответствующих фосфонатов формулы 10. Реакция может проводиться без разбавления или в растворителе, таком как толуол, ксилол или хлорбензол. Температура реакции может варьировать от приблизительно температуры окружающей среды до приблизительно температуры кипения используемого растворителя. Реакцию предпочтительно- 19015488 проводят с соединением формулы 9, где L=Cl или Br в триэтилфосфите при температуре кипения. Путем олефинирования по Хорнеру-Уодсворту-Эммонсу соединения формулы 10 1-Boc-4-пиперидоном в присутствии основания получают соединение формулы 11. Эту реакцию проводят в присутствии основания,такого как трет-бутоксид калия, трет-бутоксид натрия, гидрид натрия, гидрид калия, диизопропиламид лития, бис-(триметилсилил)амид лития, бис-(триметилсилил)амид калия, бис-(триметилсилил)амид натрия или бутиллитий. Реакция может проводиться в растворителе, таком как тетрагидрофуран (THF),2-метилтетрагидрофуран, диоксан, диметиловый эфир этиленгликоля, диметилформамид (DMF) илиN-метилпирролидинон (NMP), и температура реакции может варьировать от приблизительно температуры окружающей среды до приблизительно температуры кипения используемого растворителя. Для содействия осуществлению реакции может использоваться добавка, такая как 15-краун-5. С соединения формулы 11 удаляют защитную группу с использованием стандартных способов (например, с использованием HCl в диоксане, ацетилхлорида в этаноле или трифторуксусной кислоты) с получением соответствующего соединения формулы 2, которое может быть выделено в виде свободного основания или в виде соответствующей соли (гидрохлорид или трифторацетат). Схема C На схеме C проиллюстрирован способ получения соединений формулы 11. Осуществляют взаимодействие соединений формулы 12, в которой PG представляет собой тетрагидропиранил (THP), бензил(Bn), параметоксибензил, трет-бутилдиметилсилил (TBS), триизопропилсилил (TIPS) или трет-бутилдифенилсилил (TBDPS), с триэтилфосфитом с получением фосфоната формулы 13, как описано на схеме B. Путем олефинирования по Хорнеру-Уодсворту-Эммонсу соединения формулы 13N-Boc-4-пиперидоном в присутствии основания получают соединение формулы 14, как описано на схемеB. С соединений формулы 14, в которой PG представляет собой трет-бутилдиметилсилил, триизопропилсилил (TIPS) или трет-бутилдифенилсилил, может быть удалена защита с использованием стандартных способов, таких как обработка фторидом тетрабутиламмония в тетрагидрофуране, с получением соединений формулы 15. С соединений формулы 14, в которой PG представляет собой тетрагидропиранил(THP), может быть удалена защита с использованием стандартных способов, таких как обработка PPTS(паратолуолсульфонатом пиридиния) или паратолуолсульфоновой кислотой в этаноле, с получением соответствующих соединений формулы 15. Путем нуклеофильного замещения в ароматическом ядре фенола формулы 15 электроноакцепторным арилгалогенидом формулы ArZ (где Z представляет собой F,Cl) получают диариловый эфир формулы 11, как описано в схеме B. В качестве альтернативы путем катализируемого медью(II) сочетания фенола формулы 15 с бороновой кислотой формулы ArB(OH)2 получают диариловый эфир формулы 11. Реакцию предпочтительно проводят с 1 экв. ацетата меди(II) и 5-10 экв. триэтиламина в растворителе, таком как хлористый метилен, на 4 молекулярных ситах при температуре окружающей среды (Tetrahedron Let. 1998, 39, 2937). Схема D Соединения формулы Ia также могут быть получены в соответствии со схемой D. Вос-защитная группа соединения формулы 14 может быть удалена с использованием стандартных способов (например,с использованием HCl в диоксане, ацетилхлорида в этаноле или трифторуксусной кислоты) с получением соответствующего пиперидина, который обрабатывают соединением формулы 3 с получением мочевины формулы 16 в условиях, описанных на схеме A. С соединений формулы 16, в которой PG представляет- 20015488 собой трет-бутилдиметилсилил, триизопропилсилил или трет-бутилдифенилсилил, может быть снята защита с использованием стандартных способов, таких как обработка фторидом тетрабутиламмония в тетрагидрофуране, с получением соединений формулы 17. Путем нуклеофильного замещения в ароматическом ядре фенола формулы 17 электроноакцепторным арилгалогенидом формулы ArZ (где Z представляет собой F, Cl) получают диариловый эфир формулы Ia в условиях, сходных с описанными на схеме B. В качестве альтернативы путем катализируемого медью(II) сочетания фенола формулы 17 с бороновой кислотой формулы ArB(OH)2 получают диариловый эфир формулы Ia в условиях, сходных с описанными на схеме C. Схема E На схеме E проиллюстрирован другой способ получения соединений формулы 11. Необходимые промежуточные продукты могут быть получены следующим образом. Путем обработки N-Boc-4 пиперидона тетрабромидом углерода и трифенилфосфином получают дибромалкеновое соединение формулы 18. Путем избирательного восстановления одного из бромидов получают бромалкеновое соединение формулы 19a. Путем замещения металлом водорода в соединении формулы 18 с использованием н-бутиллития и последующего гашения алкилгалогенидом формулы R4-I получают соединения формулы 19b (Org. Lett. 2004, 6, 4467). Промежуточный сложный эфир бороновой кислоты формулы 21 может быть получен путем катализируемой палладием реакции кросс-сочетания сложного пинаконового эфира дибороновой кислоты с соединениями формулы 20 (J. Org. Chem. 1995, 60, 7508). Промежуточная бороновая кислота формулы 22 может быть получена путем обработки соединений формулы 21 перйодатом натрия и водным HCl (J. Org. Chem. 2001, 66, 7148). Может быть осуществлено взаимодействие соединений формулы 19 со сложным бороновым эфиром формулы 21 или бороновой кислотой формулы 22 в условиях катализируемого палладием кросссочетания по Сузуки (Chem. Rev. 1995, 95, 2457) с получением соответствующих соединений формулы 11. Например, сочетание может быть проведено с использованием каталитического количества тетракис(трифенилфосфин)палладия(0) в присутствии основания, такого как водный карбонат натрия, гидроксид натрия или этоксид натрия, в растворителе, таком как THF, диоксан, диметиловый эфир этиленгликоля,этанол или бензол. Температура реакции может варьировать от приблизительно температуры окружающей среды до приблизительно температуры кипения используемого растворителя. Схема F В качестве альтернативы соединения формулы 11 могут быть получены в соответствии со схемой F. Путем бромирования соединений формулы 11a с последующей обработкой основанием, таким как третбутоксид калия или гидроксид натрия, получают соединение формулы 11b. Может быть осуществлено взаимодействие соединений формулы 11b с бороновой кислотой формулы R4B(OH)2 в условиях катализируемого палладием кросс-сочетания по Сузуки с получением соответствующих соединений формулы- 21015488 11 в условиях, аналогичных описанным для схемы E. Примеры Последующие примеры предназначены для иллюстрации конкретных примеров осуществления настоящего изобретения и не предназначены для ограничения объема формулы изобретения. Для соединений последующих примеров получали спектры 1H ядерного магнитного резонанса(ЯМР). Характеристические химические сдвигипредставлены в миллионных долях (м.д.) в сторону слабого поля от тетраметилсилана с использованием традиционных сокращений для обозначения главных пиков: с (синглет), д (дублет), т (триплет), кв (квартет), м (мультиплет) и ушир (уширенный). Массспектры записывали с использованием ионизации электростатическим распылением (ES) или химической ионизации при атмосферном давлении (APCI). Для обычных растворителей используются следующие сокращения: CDCl3 (дейтерохлороформ), ДМСО-d6 (дейтеродиметилсульфоксид), CD3OD (дейтерометанол) и THF-d8 (дейтеротетрагидрофуран). Пример 1 а. СинтезN-пиридин-3-ил-4-(3-[5-(трифторметил)пиридин-2-ил]оксибензилиден)пиперидин-1 карбоксамида. Фенилпиридин-3-илкарбамат. К перемешанному раствору 3-аминопиридина (51,7 г, 0,549 моль) в THF (900 мл) при -10C потоком добавляли пиридин (52,1 г, 0,659 моль) в течение 10 мин, а затем по каплям в течение 20 мин добавляли фенилхлорформиат (90 г, 0,575 моль). Температура реакционной смеси возрастала до 5C. Во время добавления образовывался осадок. Полученную суспензию перемешивали в течение последующих 3 ч при температуре, постепенно возрастающей до температуры окружающей среды. Реакционную смесь распределяли между водой (2 л) и EtOAc (1,5 л). Водную часть экстрагировали EtOAc (1 л). Объединенные органические части сушили (MgSO4) и концентрировали в вакууме до влажного твердого остатка. Остаток суспендировали в EtOAc/эфире (1/1, 600 мл). Полученную суспензию перемешивали при -10C в течение 2 ч и фильтровали. Твердое вещество промывали EtOAc/эфиром (1/1, 100 мл) и сушили при прессовании под вакуумом. Путем дополнительной сушки в вакууме при 35C в течение 7 ч получали 104 г (88%) продукта. Элементный анализ для C12H10N2O2: Рассчитано:(7,31 г, 40,3 ммоль, от TCI America) и карбонат калия (6,96 г, 50,3 ммоль) суспендировали в диметилформамиде (80 мл) и нагревали до 95C. После перемешивания в течение 16 ч растворитель отгоняли в вакууме при 65C и распределяли остаток между водой и гептаном/этилацетатом (1/1). Органический слой разделяли и водный слой снова экстрагировали гептаном/этилацетатом (1/1). Объединенный органический слой сушили над сульфатом натрия, фильтровали и концентрировали с получением остатка. Остаток очищали хроматографией на силикагеле (10-60%, EtOAc/гептан) с получением требуемого продукта (5,70 г, выход 53%) в виде масла светло-желтого цвета. 1(ддд, J=8,67, 2,55, 0,50 Гц, 1H), 8,43 (тд, J=1,68, 0,84 Гц, 1H). Стадия 2. 2-(3-Хлорометилфенокси)-5-трифторметилпиридин. Полученный на стадии 1 [3-(5-трифторметилпиридин-2-илокси)фенил]метанол (4,68 г, 17,4 ммоль) в дихлорметане (46 мл) охлаждали до 0C и по каплям обрабатывали тионилхлоридом (1,40 мл,19,1 ммоль). Реакционную смесь оставляли нагреваться до температуры окружающей среды и перемешивали в течение 30 мин. Добавляли толуол (10 мл), и концентрировали реакционную смесь путем упаривания с образованием остатка. Остаток снова упаривали из толуола и сушили в условиях высокого вакуума с получением требуемого продукта (4,88 г, выход 98%) в виде масла. 1(дд, J=1,51, 0,90 Гц, 1H). Стадия 3. Сложный диэтиловый эфир [3-(5-трифторметилпиридин-2-илокси)бензил]фосфоновой кислоты. Полученный на стадии 2 2-(3-хлорометилфенокси)-5-трифторметилпиридин (4,88 г, 17,0 ммоль) обрабатывали неразбавленным триэтилфосфитом (4,36 мл, 25,4 ммоль) и нагревали до 150C. Спустя 6 ч реакционную смесь охлаждали, дополнительно обрабатывали 0,5 мл триэтилфосфита (2,9 ммоль) и повторно нагревали до 150C. Спустя 6 ч реакционную смесь снимали с нагрева и медленно обрабатывали гептаном (приблизительно 60 мл) при перемешивании с получением твердого вещества белого цвета. Твердое вещество собирали путем фильтрации, промывали гептаном и сушили в вакуумной печи в течение 16 ч при 45C с получением порошка белого цвета (5,99 г, выход 91%).H-ЯМР (400 МГц, CDCl3):м.д. 1,26 (т, J=7,02 Гц, 6H), 3,18 (д, J=21,83 Гц, 2H), 3,99-4,10 (м, 4H),7,01 (д, J=8,58 Гц, 1H), 7,03-7,08 (м, 1H), 7,12 (кв, J=2,21 Гц, 1H), 7,19-7,24 (м, 1H), 7,38 (т, J=7,90 Гц, 1H),7,90 (дд, J=8,58, 2,53 Гц, 1H), 8,43 (дд, J=1,66, 0,88 Гц, 1H). Стадия 4. Сложный трет-бутиловый эфир 4-[3-(5-трифторметилпиридин-2-илокси)бензилиден]пиперидин-1-карбоновой кислоты. Полученный на стадии 3 сложный диэтиловый эфир [3-(5-трифторметилпиридин-2 илокси)бензил]фосфоновой кислоты (2,3 г, 6,0 ммоль) и 1,4,7,10,13-пентаоксациклопентадекан(15-краун-5, 0,03 мл, 0,15 ммоль) объединяли в THF (10 мл). Смесь охлаждали до 0C и добавляли гидрид натрия (240 мг, 60% дисперсия в минеральном масле, 6,0 ммоль). Реакционную смесь нагревали до комнатной температуры, перемешивали в течение 30 мин, а затем обратно охлаждали до 0C. Добавляли раствор сложного трет-бутилового эфира 4-оксопиперидин-1-карбоновой кислоты (1,2 г, 6,0 ммоль) вTHF (6 мл) и реакционную смесь нагревали до комнатной температуры. Спустя 16 ч добавляли воду и слои разделяли. Водный слой экстрагировали EtOAc (2200 мл), объединенный органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали до густого масла. Путем обработки масла горячим изопропиловым эфиром (45 мл) получали указанное в заголовке соединение в виде твердого вещества белого цвета (1,88 г). 1(м, 1H), 8,08 (ддд, J=8,74, 2,59, 0,56 Гц, 1H) 8,42 (тд, J=1,73, 0,90 Гц, 1H). Стадия 5. 2-(3-Пиперидин-4-илиденметилфенокси)-5-трифторметилпиридина гидрохлорид. Полученный на стадии 4 сложный трет-бутиловый эфир 4-[3-(5-трифторметилпиридин-2 илокси)бензилиден]пиперидин-1-карбоновой кислоты (1,35 г, 3,11 ммоль) растворяли в CH2Cl2 (30 мл) и обрабатывали HCl в диэтиловом эфире (10 мл, 2,0 М, 20 ммоль). Спустя 16 ч реакционную смесь концентрировали в вакууме с образованием остатка и суспендировали остаток в ацетонитриле (10 мл) с получением твердого вещества. Путем фильтрации твердого вещества получали указанное в заголовке соединение в виде твердого вещества белого цвета (1,1 г). 1(800 мг,2,16 ммоль, полученный на стадии 5), фенилпиридин-3-илкарбамат (508 мг, 2,37 ммоль) и диизопропилэтиламин (0,75 мл, 4,52 ммоль) объединяли в ацетонитриле (10 мл) и перемешивали при комнатной температуре. Спустя 16 ч реакционную смесь концентрировали с образованием остатка и распределяли остаток между EtOAc и водой. Органический слой разделяли, промывали 5% NaOH (водн.), сушили над безводным сульфатом натрия, фильтровали и концентрировали. Путем обработки остатка горячим изопропиловым эфиром и очистки из изопропилового эфира/метанола получали указанное в заголовке соединение в виде твердого вещества белого цвета (574 мг).H-ЯМР (400 МГц, CD3OD):м.д. 2,46 (тд, J=5,86, 0,97 Гц, 2H), 2,58 (тд, J=5,82, 1,16 Гц, 2H), 3,513,60 (м, 2H), 3,61-3,70 (м, 2H), 6,46 (с, 1H), 6,98-7,07 (м, 2H), 7,09-7,19 (м, 2H), 7,34 (ддд, J=8,41, 4,81,0,65 Гц, 1H), 7,40 (тд, J=7,69, 0,74 Гц, 1H), 7,91 (ддд, J=8,38, 2,58, 1,44 Гц, 1H), 8,08 (ддд, J=8,73, 2,61,0,55 Гц, 1H), 8,16 (дд, J=4,84, 1,06 Гц, 1H), 8,43 (тд, J=1,74, 0,91 Гц, 1H) 8,58 (д, J=1,88 Гц, 1H). Пример 1b. Крупномасштабный синтез N-пиридин-3-ил-4-(3-[5-(трифторметил)пиридин-2-ил]оксибензилиден)пиперидин-1-карбоксамида. Стадия 1. Получение [3-(5-трифторметилпиридин-2-илокси)фенил]метанола. К раствору 5-трифторметил-2-хлорпиридина (150,0 г, 0,826 моль) в DMF (1,9 л) добавляли 3-гидроксифенилметанол (112,5 г, 0,906 моль) и карбонат калия (171,0 г, 1,237 моль). Твердые вещества промывали в колбе с DMF (100 мл). Перемешанную смесь нагревали до 95-105C в течение 5 ч. Смесь охлаждали до температуры окружающей среды, а затем вливали в 5 л смеси воды со льдом. Смесь экстрагировали эфиром/гексаном (2/1, 1,5 л, 1,0 л). Объединенные органические слои сушили над сульфатом магния и концентрировали в вакууме досуха с получением продукта (222,5 г, 100%). Стадия 2. Получение 2-(3-хлорметилфенокси)-5-трифторметилпиридина. К раствору [3-(5-трифторметилпиридин-2-илокси)фенил]метанола (281,0 г, 1,044 моль) в дихлорметане (2,0 л) в течение 25 мин при -5C по каплям добавляли тионилхлорид (136,6 г, 1,148 моль). Спустя несколько минут после добавления отделялось вещество белого цвета, которое спустя несколько минут переходило в раствор. Реакционную смесь перемешивали при температуре окружающей среды в течение 1 ч, а затем концентрировали в вакууме почти досуха (357 г). К остатку добавляли 200 мл толуола,и снова концентрировали раствор в вакууме почти досуха. Добавляли 200 мл толуола и отфильтровывали не 1- 23015488 которое количество твердого вещества (8 г). Фильтрат концентрировали в вакууме до 390 г жидкости темно-желтого цвета. Стадия 3. Получение сложного диэтилового эфира[3-(5-трифторметилпиридин-2 илокси)бензил]фосфоновой кислоты. Раствор 2-(3-хлорметилфенокси)-5-трифторметилпиридина (298 г, 1,036 моль), содержащего некоторое количество толуола, в триэтилфосфите (267,0 г, 1,551 моль) нагревали до 135-140C в течение 7 ч. Кипячение начинали при 110C и продолжали на протяжении всей реакции. Раствор оставляли отстаиваться при температуре окружающей среды в течение ночи, и он отвердевал. Твердое вещество суспендировали в эфире/гексане (1/2, 450 мл), суспензию перемешивали при температуре окружающей среды в течение 3 ч и фильтровали. Твердое вещество промывали эфиром/гексаном (1/2, 150 мл) и сушили при прессовании под вакуумом. Путем дополнительной сушки в вакууме при 32C в течение 7 ч получали 286,3 г (выход 71%; в 2 стадии из неочищенного хлорида) продукта. Фильтрат концентрировали в вакууме для удаления растворителей с низкой температурой кипения. Добавляли триэтилфосфит (36,0 г,0,217 моль) и нагревали раствор до 130C в течение 2 ч. Реакционную смесь охлаждали до 100C и медленно добавляли 300 мл гептана. Отделялось твердое вещество. По мере того как температура снижалась до 30C добавляли 150 мл эфира. Полученную суспензию оставляли отстаиваться при температуре окружающей среды в течение ночи и фильтровали. Твердое вещество промывали эфиром/гептаном (1/2,75 мл) и сушили при прессовании под вакуумом. Путем дополнительной сушки в вакууме при 32C в течение 7 ч дополнительно получали 35,7 г (9%) продукта. Общий выход=322 г (80%). Аналитически рассчитано для C17H19F3NO4P (389,31): C, 52,45; H, 4,92; N, 3,60; F, 14,64; P, 7,96. Обнаружено: C, 52,73; H, 5,04; N, 3,58; F, 14,35; P, 7,74; хлорид 0,10%. Стадия 4. Получение сложного трет-бутилового эфира 4-[3-(5-трифторметилпиридин-2 илокси)бензилиден]пиперидин-1-карбоновой кислоты. К перемешанной смеси сложного диэтилового эфира [3-(5-трифторметилпиридин-2 илокси)бензил]фосфоновой кислоты (155,7 г, 0,40 моль) в тетрагидрофуране (800 мл) в течение 5 мин при -10C по каплям добавляли 1,0 М t-BuOK в тетрагидрофуране (420,0 мл, 0,42 моль). В процессе добавления температура повышалась до -3C. Полученную смесь красного цвета перемешивали при температуре от -6 до -10C в течение 2,5 ч. В течение 5 мин по каплям добавляли раствор трет-бутил-4 оксопиперидин-1-карбоксилата (79,7 г, 0,40 моль) в тетрагидрофуране (300 мл). Температура возрастала до 2C. Полученную красную смесь перемешивали в течение последующих 16 ч, в процессе чего температура достигала 21C. По методу ТСХ обнаруживали продукт, не содержащий фосфоната. Смесь вливали в 3,5 л смеси воды со льдом. Полученную суспензию перемешивали при температуре окружающей среды в течение 2,5 ч, а затем экстрагировали последовательными порциями (1,0 и 0,6 л) дихлорметана. Объединенные экстракты промывали 500 мл солевого раствора, сушили над сульфатом магния и концентрировали в вакууме до густого полутвердого остатка. Добавляли 250 мл метил-трет-бутилового эфира. Суспензию перемешивали при -10C в течение 2 ч и фильтровали. Путем сушки в вакууме при 25C в течение 66 ч получали 85 г (49%) продукта. Фильтрат концентрировали в вакууме до влажного твердого остатка. Остаток поглощали 100 мл метил-трет-бутилового эфира. К перемешанной суспензии добавляли 300 мл гептана и перемешивали полученную суспензию при -10C в течение 2 ч. Твердое вещество отфильтровывали, промывали 50 мл метил-трет-бутилового эфира/гептана (1/3) и сушили при прессовании под вакуумом. Путем дополнительной сушки в вакууме при 34C в течение 6 ч дополнительно получали 34,2 г (19,5%) продукта. Общий выход = 119,2 г (68,5%). Стадия 5. Получение 2-(3-пиперидин-4-илиденметилфенокси)-5-трифторметилпиридина гидрохлорид. К смеси сложного трет-бутилового эфира 4-[3-(5-трифторметилпиридин-2-илокси)бензилиден]пиперидин-1-карбоновой кислоты (312 г, 0,718 моль) в этилацетате (2,8 л) при температуре от 0 до -5C в течение 20 мин потоком добавляли 4,0 М хлороводород в диоксане (800 мл, 3,2 моль). Значительного изменения температуры зарегистрировано не было. Полученную суспензию перемешивали в течение последующих 17 ч, в процессе чего температура достигала 22C. Суспензию фильтровали. Твердое вещество промывали EtOAc (500 мл) и сушили при прессовании под вакуумом. Влажное твердое вещество сушили в вакууме при 33C в течение 7 ч с получением 225 г (84%) продукта. Стадия 6. Получение N-пиридин-3-ил-4-(3-[5-(трифторметил)пиридин-2-ил]оксибензилиден)пиперидин-1-карбоксамида. К смеси 2-(3-пиперидин-4-илиденметилфенокси)-5-трифторметилпиридина (80,0 г, 0,216 моль) и фенилпиридин-3-илкарбамата (48,6 г, 0,227 моль) в ацетонитриле (650 мл) по каплям добавляли диизопропилэтиламин (55,8 г, 0,432 моль). Раствор образовывался спустя 45 мин перемешивания. Слегка мутный раствор перемешивали при температуре окружающей среды в течение 18 ч. Анализ методом ТСХ показал наличие главного пятна продукта со следами обоих исходных веществ и два других быстро движущихся пятна. Раствор концентрировали в вакууме до вязкого масла. Масло распределяли между- 24015488 дихлорметаном (600 мл) и водой (500 мл). Водный слой экстрагировали 200 мл дихлорметана. Объединенные органические слои последовательно промывали 500 мл 5% гидроксида натрия и 200 мл воды,затем сушили над сульфатом магния и концентрировали в вакууме до 139,5 г вязкого масла. Масло растворяли в 350 мл теплого (50C) метил-трет-бутилового эфира. Вскоре после образования раствора начинало отделяться твердое вещество. Кристаллизующуюся смесь выдерживали при -10C в течение 4 ч и фильтровали. Твердое вещество промывали 60 мл метил-трет-бутилового эфира и сушили при прессовании под вакуумом. Путем дополнительной сушки в вакууме при 28C в течение 16 ч, а затем при 35C в течение 6 ч получали 93,2 г (95%) продукта. Пример 2. СинтезN-(3,4-диметилизоксазол-5-ил)-4-(3-[5-(трифторметил)пиридин-2-ил]оксибензилиден)пиперидин-1-карбоксамида. Следуя методике, описанной для стадии 6 примера 1, и используя гидрохлорид 2-(3-пиперидин-4 илиденметилфенокси)-5-трифторметилпиридина (150 мг, 0,40 ммоль, полученный на стадии 5 примера 1) и фенил-3,4-диметилизоксазол-5-илкарбамат (94 мг, 0,40 ммоль, полученный из 5-амино-3,4 диметилизоксазола в соответствии с методикой, описанной в Synthesis, 1997, 1189-1194), получали указанное в заголовке соединение (187 мг).N-(6-метилпиридин-3-ил)-4-(3-[5-(трифторметил)пиридин-2-ил]оксибензилиден)пиперидин-1-карбоксамида. Следуя методике, описанной для стадии 6 примера 1, и используя гидрохлорид 2-(3-пиперидин-4 илиденметилфенокси)-5-трифторметилпиридина (150 мг, 0,40 ммоль, полученный на стадии 5 примера 1) и фенил-6-метилпиридин-3-илкарбамат (92 мг, 0,40 ммоль, полученный в соответствии с методикой,описанной в Synthesis, 1997, 1189-1194, из 3-амино-6-метилпиридина производства 3B Medical Systems,Inc.), получали указанное в заголовке соединение (184 мг).N-пиразин-2-ил-4-(3-[5-(трифторметил)пиридин-2-ил]оксибензилиден)пиперидин-1 карбоксамида. Следуя методике, описанной для стадии 6 примера 1, и используя гидрохлорид 2-(3-пиперидин-4 илиденметилфенокси)-5-трифторметилпиридина (150 мг, 0,40 ммоль, полученный на стадии 5 примера 1) и фенилпиразин-2-илкарбамат (261 мг, 1,2 ммоль, полученный из аминопиразина в соответствии с методикой, описанной в Synthesis, 1997, 1189-1194), получали указанное в заголовке соединение (24 мг).(500 мг,1,35 ммоль, полученный на стадии 5 примера 1), этилпиридазин-3-илкарбамат (248 мг, 1,48 ммоль, полученный из 3-аминопиридазина в соответствии с методикой, описанной в Synthesis, 1997, 1189-1194) и триэтиламин (0,376 мл, 2,7 ммоль) объединяли в ацетонитриле (4,5 мл) и нагревали в микроволновом реакторе при 180C в течение 40 мин. Реакционную смесь охлаждали до комнатной температуры и концентрировали с образованием остатка. Остаток очищали хроматографией на силикагеле (50-100% EtOAc в CH2Cl2) с получением указанного в заголовке соединения (340 мг).- 25015488 Пример 5b. Крупномасштабный синтез N-пиридазин-3-ил-4-(3-[5-(трифторметил)пиридин-2-ил]оксибензилиден)пиперидин-1-карбоксамида. К смеси гидрохлорида 2-(3-пиперидин-4-илиденметилфенокси)-5-трифторметилпиридина (37,1 г,0,10 моль, см. стадию 5 примера 1b) и фенилпиридазин-3-илкарбамата (21,5 г, 0,10 моль, см. стадии 1 и 2 примера 39) в ацетонитриле (400 мл) по каплям добавляли диизопропилэтиламин (25,8 г, 0,20 моль). Раствор образовывался спустя 2 ч перемешивания. Слегка мутный раствор перемешивали при температуре окружающей среды в течение 17 ч. Раствор вливали в 2,5 л смеси воды со льдом. Полученную смесь перемешивали в течение 1 ч. Твердое вещество отфильтровывали, промывали 300 мл воды и сушили при прессовании под вакуумом. Твердое вещество растворяли в 400 мл дихлорметана. Воду удаляли с использованием делительной воронки, а затем сушили раствор над сульфатом магния и концентрировали в вакууме до 50 мл. Вязкий раствор разбавляли 65 мл этилацетата, а затем 85 мл метил-трет-бутилового эфира. Получался раствор, а затем начинало отделяться твердое вещество. Кристаллизующуюся смесь поддерживали при -10C в течение 2 ч и фильтровали. Твердое вещество промывали EtOAc/MTBE(40 мл) и сушили при прессовании под вакуумом. Путем дополнительной сушки в вакууме при 40C в течение 7 ч получали 30,3 г (66%) продукта. Маточный раствор концентрировали в вакууме до 19 г вязкого масла. Масло растворяли в 15 мл этилацетата. Раствор разбавляли 60 мл метил-трет-бутилового эфира, вносили затравку и поддерживали при 5C в течение 18 ч. Кристаллизовавшееся твердое вещество отфильтровывали, промывали 10 мл метил-трет-бутилового эфира и сушили при прессовании под вакуумом. Дополнительно получали 9,0 г (20%) продукта. Общий выход=39,3 г (86%). Пример 6. СинтезN-2,1-бензизоксазол-3-ил-4-(3-[5-(трифторметил)пиридин-2-ил]оксибензилиден)пиперидин-1-карбоксамида. Следуя методике, описанной для стадии 6 примера 1, и объединяя гидрохлорид 2-(3-пиперидин-4 илиденметилфенокси)-5-трифторметилпиридина (150 мг, 0,40 ммоль, полученный на стадии 5 примера 1) и фенилбензо[c]изоксазол-3-илкарбамат (113 мг, 0,40 ммоль, полученный из 3-амино-2,1-бензизоксазола в соответствии с методикой, описанной в Synthesis, 1997, 1189-1194), получали указанное в заголовке соединение (168 мг).(с, 1H), 6,98-7,07 (м, 2H), 7,13 (ддд, J=8,75, 0,68, 0,56 Гц, 1H), 7,16 (д, J=7,77 Гц, 1H), 7,30 (ддд, J=8,05,6,80, 1,16 Гц, 1H), 7,41 (т, J=7,99 Гц, 1H), 7,49-7,66 (м, 2H), 7,85 (дт, J=8,13, 1,03 Гц, 1H), 8,09 (ддд,J=8,72, 2,67, 0,38 Гц, 1H), 8,43 (тд, J=1,82, 0,93 Гц, 1H). Пример 7. Синтез N-(5-метилпиридин-3-ил)-4-(3-[5-(трифторметил)пиридин-2-ил]оксибензилиден)пиперидин 1-карбоксамида. Раствор гидрохлорида 2-(3-пиперидин-4-илиденметилфенокси)-5-трифторметилпиридина (0,371 г,1,00 ммоль) (полученный на стадии 5 примера 1) и фенил-5-метилпиридин-3-илкарбамат (0,274 г,1,2 ммоль, полученный из 3-амино-5-метилпиридина в соответствии с методикой, описанной в Synthesis,1997, 1189-1194) в ДМСО (2,5 мл) обрабатывали диизопропилэтиламином (0,155 г, 1,2 ммоль) и смесь нагревали до 60C. Спустя 4 ч реакционную смесь распределяли между водой и этилацетатом. Органический слой разделяли и водный слой снова экстрагировали этилацетатом. Органические слои объединяли и промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали с образованием остатка. Остаток очищали хроматографией на силикагеле (10% 1 н. NH3 в MeOH, в дихлорметане) с получением указанного в заголовке соединения в виде пены белого цвета (300 мг, 64%).H-ЯМР (400 МГц, ДМСО):м.д. 2,34 (т, J=5,46 Гц, 2H), 2,46 (т, J=5,46 Гц, 2H), 3,29 (с, 3H), 3,46 (т,J=5,46 Гц, 2H), 3,54 (т, J=5,46 Гц, 2H), 6,38 (с, 1H), 7,03 (м, 2H), 7,13 (д, J=7,80 Гц, 1H), 7,21 (д, J=8,58 Гц,1H), 7,4 (дд, J=7,8, 2,0 Гц, 1H), 7,70 (с, 1H), 7,96 (д, J=2 Гц, 1H), 8,20 (дд, J=8,8, 2,5 Гц, 1H), 8,41 (д,J=2,2 Гц, 1H), 8,55 (с, 1H), 8,64 (с, 1H). Пример 8. Синтез N-(6-метоксипиридин-3-ил)-4-(3-[5-(трифторметил)пиридин-2-ил]оксибензилиден)пиперидин 1-карбоксамида Стадия 1. Фенил-6-метоксипиридин-3-илкарбамат. 3-Амино-5-метоксипиридин (5,00 г, 40,3 ммоль) растворяли в THF (80 мл), охлажденном до 0C,обрабатывали пиридином (4,07 мл, 50,4 ммоль), а затем фенилхлорформиатом (5,32 мл, 42,3 ммоль). Реакционную смесь медленно нагревали до комнатной температуры в течение нескольких часов и дополнительно перемешивали в течение 12 ч. Смесь распределяли между водой и EtOAc. Органический слой разделяли и водный слой снова экстрагировали. Объединенные органические экстракты сушили над сульфатом натрия, фильтровали и концентрировали с получением продукта в виде твердого вещества- 26015488 красноватого цвета (9,45 г, 96%), которое использовали без дополнительной очистки. Стадия 2. Раствор гидрохлорида 2-(3-пиперидин-4-илиденметилфенокси)-5-трифторметилпиридина (0,371 г,1,00 ммоль) (полученный на стадии 5 примера 1) и фенил-6-метоксипиридин-3-илкарбамата (0,244 г,1,00 ммоль, полученного на стадии 1) в ДМСО (2,5 мл) обрабатывали диизопропилэтиламином (0,155 г,1,2 ммоль) и нагревали до 50C. Спустя 3 ч реакционную смесь распределяли между водой и этилацетатом. Органический слой разделяли и водный слой снова экстрагировали этилацетатом. Объединенные органические слои промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали хроматографией на силикагеле (10% 1 н. NH3 в MeOH, в дихлорметане) с получением указанного в заголовке соединения (280 мг, 58%) в виде кристаллов белого цвета после растирания в диэтиловом эфире.N-(пиридин-2-ил)-4-(3-[5-(трифторметил)пиридин-2-ил]оксибензилиден)пиперидин-1 карбоксамида. Раствор гидрохлорида 2-(3-пиперидин-4-илиденметилфенокси)-5-трифторметилпиридина (0,371 г,1,00 ммоль, полученный на стадии 5 примера 1) и фенилпиридин-2-илкарбамата (0,254 г, 1,2 ммоль, полученного из 2-аминопиридина в соответствии с методикой, описанной в Synthesis, 1997, 1189-1194) в ДМСО (2,5 мл) обрабатывали диизопропилэтиламином (0,155 г, 1,2 ммоль) и нагревали до 60C. Спустя 4 ч реакционную смесь распределяли между водой и этилацетатом. Органический слой разделяли и водный слой снова экстрагировали этилацетатом. Объединенный органический слой промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали до твердого вещества белого цвета. Путем растирания с диэтиловым эфиром получали указанное в заголовке соединение в виде твердого вещества белого цвета (280 мг, 58%).(20 мл) обрабатывали диизопропилэтиламином (0,155 г, 1,2 ммоль) и перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь перемешивали с 10% K2CO3 в течение 1 ч, а затем распределяли после дополнительного разбавления дихлорметаном (200 мл). Объединенный органический слой промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали хроматографией на силикагеле (1% 1 н. NH3 в MeOH, в дихлорметане) с получением указанного в заголовке соединения (100 мг, 22%) в виде твердого вещества белого цвета после растирания с диэтиловым эфиром.Synthesis, 1997, 1189-1194) в ДМСО (2,5 мл) обрабатывали диизопропилэтиламином (0,155 г, 1,2 ммоль) и нагревали до 50C. Спустя 3 ч реакционную смесь распределяли между водой и этилацетатом. Органический слой разделяли и водный слой снова экстрагировали этилацетатом. Объединенный органический слой промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали с образованием остатка. Остаток очищали хроматографией на силикагеле (10% 1 н. NH3 в MeOH, в дихлорметане) с получением масла после концентрирования чистых фракций. Это масло растворяли в- 27015488 20 мл диэтилового эфира и обрабатывали 1 мл 1 н. HCl в диэтиловом эфире. Полученное твердое вещество собирали путем фильтрации с получением указанного в заголовке соединения (270 мг, 56%).N-(5-метоксипиразин-2-ил)-4-(3-[5-(трифторметил)пиридин-2-ил]оксибензилиден)пиперидин-1-карбоксамида. Раствор гидрохлорида 2-(3-пиперидин-4-илиденметилфенокси)-5-трифторметилпиридина (0,371 г,1,00 ммоль) (полученный на стадии 5 примера 1) и фенил-5-метоксипиразин-2-илкарбамата (0,254 г,1,2 ммоль, полученного из 2-амино-5-метоксипиразина в соответствии с методикой, описанной в Synthesis, 1997, 1189-1194) в ДМСО (2,5 мл) обрабатывали диизопропилэтиламином (0,155 г, 1,2 ммоль) и нагревали до 60C. Спустя 4 ч реакционную смесь распределяли между водой и этилацетатом. Органический слой разделяли и водный слой снова экстрагировали этилацетатом. Объединенный органический слой промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали до твердого вещества белого цвета. Путем растирания с диэтиловым эфиром получали указанное в заголовке соединение в виде твердого вещества белого цвета (365 мг, 75%).N-1H-пирроло[2,3-b]пиридин-6-ил-4-(3-[5-(трифторметил)пиридин-2-ил]оксибензилиден)пиперидин-1-карбоксамида. Стадия 1. Фенил-1H-пирроло[2,3-b]пиридин-5-илкарбамат. К раствору 1H-пирроло[2,3-b]пиридин-5-иламина (0,50 г, 3,7 ммоль, см. Synthesis, 2005, No. 15,2503-2506) в THF (4 мл) и CH3CN (6 мл) добавляли пиридин (0,36 мл, 4,4 ммоль), а затем медленно добавляли фенилхлорформиат (0,49 мл, 3,8 ммоль). Реакционную смесь перемешивали в течение ночи. Смесь распределяли между водой и EtOAc. Водный слой снова экстрагировали EtOAc. Объединенный органический слой сушили над сульфатом натрия, фильтровали и концентрировали. Путем очистки хроматографией (0-100% EtOAc/гексан) получали требуемый продукт в виде твердого вещества белого цвета (0,213 г, 23%).MC M+1: 254,15. Стадия 2. К раствору фенил-1H-пирроло[2,3-b]пиридин-5-илкарбамата (0,150 г, 0,60 ммоль, полученного на стадии 1) в ДМСО (5 мл) добавляли гидрохлорид 2-(3-пиперидин-4-илиденметилфенокси)-5 трифторметилпиридина (0,22 г, 0,60 ммоль) (полученный на стадии 5 примера 1), а затем добавляли триэтиламин (0,17 мл, 1,2 ммоль). Реакционную смесь перемешивали при 60C в течение ночи. Реакционную смесь охлаждали и добавляли EtOAc (30 мл). Органический слой промывали водой, насыщеннымNH4Cl и солевым раствором, сушили над Na2SO4, фильтровали и концентрировали. Путем очистки колоночной хроматографией (0-5% MeOH/CH2Cl2) получали пену. Добавляли диэтиловый эфир и образовывался осадок, который собирали путем фильтрации с получением указанного в заголовке соединенияCH3CN (8 мл) добавляли пиридин (1,34 мл, 16,6 ммоль), а затем медленно добавляли фенилхлорформиат(2,27 мл, 14,5 ммоль). Реакционную смесь перемешивали в течение ночи. Реакционную смесь концентрировали с получением масла, которое распределяли между CH2Cl2 и водой. Органический слой сушили с использованием фазоразделителя для SPE и концентрировали с получением твердого вещества. Твердое вещество поглощали CH2Cl2 и фильтровали осадок с получением требуемого продукта (2,0 г, 57%),- 28015488 который использовали без дополнительной очистки. МС (M+1): 256,06. Стадия 2. К раствору фенил-1H-бензо[d][1,2,3]триазол-5-илкарбамата (0,15 г, 0,62 ммоль, полученного на стадии 1) в ДМСО (5 мл) добавляли гидрохлорид 2-(3-пиперидин-4-илиденметилфенокси)-5 трифторметилпиридина (0,23 г, 0,62 ммоль) (полученный на стадии 5 примера 1), а затем триэтиламин(0,16 мл, 1,2 ммоль). Реакционную смесь перемешивали при 60C в течение ночи. Реакционную смесь охлаждали и добавляли EtOAc (30 мл). Органический слой промывали водой, насыщенным NH4Cl и солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали. Путем очистки колоночной хроматографией (0-5% MeOH/CH2Cl2) получали требуемое соединение в виде пены (144 мг).(т, 2H), 3,48 (т, 2H), 3,28-3,30 (м, 1H), 2,50-2,51 (м, 1H) 2,33-2,38 (м, 2H). Пример 15. Синтез N-[4-(3-[5-(трифторметил)пиридин-2-ил]оксибензилиден)пиперидин-1 ил]карбонилпиридин-2-карбоксамида. Стадия 1. Фенилпиколиноилкарбамат. Пиколинамид (0,500 г, 16 ммоль) растворяли в THF (25 мл) и охлаждали до -10C. К раствору по каплям добавляли диизопропиламид лития (5,1 мл, 2,0 М в гептане/THF/этилбензоле, 10 ммоль). Полученную смесь перемешивали при -10C в течение 15 мин, а затем обрабатывали фенилхлорформиатом(1,69 мл, 12,3 ммоль) в THF (5 мл). Спустя 20 мин реакционную смесь нагревали до комнатной температуры и перемешивали в течение 3 ч, после чего реакционную смесь гасили добавлением насыщенного водного хлорида аммония. Смесь экстрагировали EtOAc, объединенный органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали. Остаток очищали хроматографией на силикагеле (20-50% EtOAc в гептане) с получением требуемого продукта (0,504 г). 1(с, 1H). Стадия 2. Фенилпиколиноилкарбамат (145 мг, 0,599 ммоль, полученный на стадии 1), гидрохлорид 2-(3-пиперидин-4-илиденметилфенокси)-5-трифторметилпиридина (175 мг, 0,472 ммоль) (полученный на стадии 5 примера 1) и диизопропилэтиламин (0,16 мл, 0,92 ммоль) объединяли в ацетонитриле (5 мл) и нагревали до 50C. Спустя 3 ч смесь охлаждали до комнатной температуры и концентрировали с образованием остатка. Остаток очищали хроматографией на силикагеле (20-75% EtOAc в CH2Cl2) с получением указанного в заголовке соединения (0,152 г).H-ЯМР (400 МГц, CD3OD):м.д. 2,45-2,72 (м, 4H), 3,64 (м, 4H), 6,47 (с, 1H), 6,96-7,06 (м, 2H),7,08-7,20 (м, 2H), 7,40 (тд, J=7,65, 0,91 Гц, 1H), 7,63 (ддд, J=7,63, 4,76, 1,23 Гц, 1H), 8,02 (тд, J=7,75,1,69 Гц, 1H), 8,08 (ддд, J=8,71, 2,55, 0,61 Гц, 1H), 8,18 (дт, J=7,86, 1,08 Гц, 1H), 8,42 (тд, J=1,72, 0,80 Гц,1H), 8,67 (ддд, J=4,76, 1,69, 0,95 Гц, 1H). Пример 16. Синтез 6-метил-N-[4-(3-[5-(трифторметил)пиридин-2-ил]оксибензилиден)пиперидин-1 ил]карбонилпиридин-2-карбоксамида. Фенил-2-метилпиколиноилкарбамат (150 мг, 0,585 ммоль, полученный из 6-метилпиридин-2 карбоксамида в соответствии с методикой, описанной для стадии 1 примера 15), гидрохлорид 2-(3-пиперидин-4-илиденметилфенокси)-5-трифторметилпиридина (175 мг, 0,472 ммоль) (полученный на стадии 5 примера 1) и диизопропилэтиламин (0,16 мл, 0,92 ммоль) объединяли в ацетонитриле (5 мл) и нагревали до 50C. Спустя 3 ч смесь охлаждали до комнатной температуры и концентрировали. Остаток очищали хроматографией на силикагеле (10-75% EtOAc в CH2Cl2) с получением указанного в заголовке соединения (0,197 г).
МПК / Метки
МПК: C07D 413/12, C07D 401/10, A61P 29/02, C07D 471/04, C07D 401/12, A61K 31/444, C07D 401/14
Метки: содержащие, мочевины, диариловый, эфир, соединения
Код ссылки
<a href="https://eas.patents.su/30-15488-soderzhashhie-diarilovyjj-efir-soedineniya-mocheviny.html" rel="bookmark" title="База патентов Евразийского Союза">Содержащие диариловый эфир соединения мочевины</a>
Предыдущий патент: Запорное устройство системы водоснабжения пассажирского вагона
Следующий патент: Датирование предметов искусства
Случайный патент: Цепь для цепной завесы клинкерообжигательной вращающейся печи